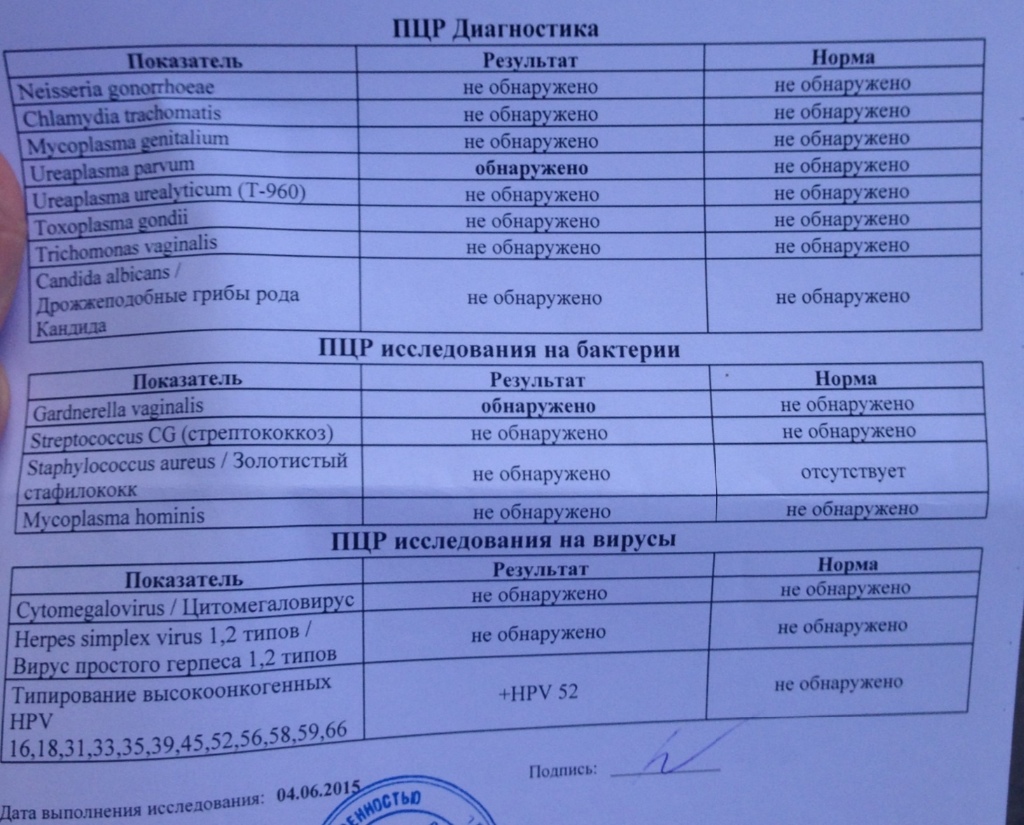
Лечение уреаплазмы в Санкт-Петербурге у женщин и мужчин. Симптомы и лечение уреаплазмоза, уреаплазмы парвум и уреаплазменной инфекции.
Мировое медицинское научное сообщество никак не может прийти к единому мнению — действительно ли это отдельная болезнь, или же своего рода последствие или осложнение другой патологии. Все потому, что эти бактерии исключительно миролюбивы в организме здоровой женщины, и только дисбаланс микрофлоры мочеполовой системы провоцирует стремительный рост их количества и воспаление.
В таких случаях лечение уреаплазмы важно методично проводить под контролем врача, чтобы исключить сопутствующие инфекции и устранить причину, нарушившую естественный физиологический барьер организма.
На самом деле уреаплазма — общее название для нескольких бактерий, и только две из них (уреалитикум и парвум) могут стать враждебными, вызвав воспаление. Нередко болезнь принимает хроническую форму, беспокоя человека лишь непродолжительными обострениями. Но как раз в этих случаях крайне важно проводить полноценное лечение уреаплазмы у женщин и мужчин.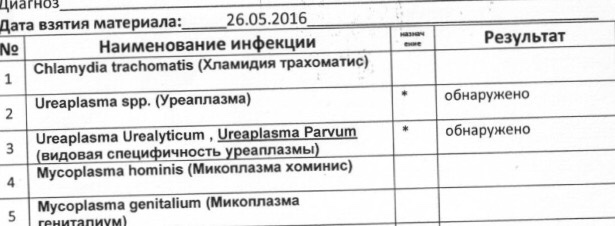
Именно продолжительное хроническое течение чревато осложнениями, способными привести к бесплодию (и у женщин, и у мужчин), импотенции, преждевременным родам, а также стать частью спускового механизма аутоиммунного процесса, в результате которого развиваются ревматические заболевания.
Симптомы и лечение уреаплазмы
Самым первым и самым ярким симптомом становится дискомфорт при мочеиспускании, нередко сопровождающийся выраженными сильными резями. Причин для воспаления уретры, конечно же, немало, но вероятность, что вам потребуется провести лечение уреаплазмоза, высока:
- Обратите внимание на выделения — они, как правило, слизистого характера и не слишком обильные. У женщин возможны кровянистые выделения из влагалища после коитуса;
- Проигнорировав первые признаки, можно позволить инфекции шире распространиться, о чем будут говорить уже другие симптомы и лечение уреаплазмы у женщин и мужчин станет сложнее;
- В частности, тяжесть в области яичек, также как будто распирающая боль, сигнализируют о развитии орхита.
 А появившиеся в промежности болезненные ощущения могут говорить уже о простатите;
А появившиеся в промежности болезненные ощущения могут говорить уже о простатите; - У женщин боль внизу живота сигнализирует о воспалении слизистых покровов матки и/или фаллопиевых труб, что практически неизбежно ведет к бесплодию или невозможности выносить ребенка.
Лечение уреаплазмоза у женщин и мужчин
Чаще всего практически незаметно для женщины ведет себя бактерия под названием «парвум», при этом провоцируя самое опасное длительное хроническое воспаление. Избежать нежелательных осложнений можно лишь проводя диагностику, что позволяют сделать регулярные осмотры гинеколога. В затянувшихся случаях лечение уреаплазмы парвум у женщин требует немалого времени и скрупулезного соблюдения всех врачебных рекомендаций.
Одно из главных правил успешной терапии — полноценная диагностика, способная выявить причину нарушения нормального состава микрофлоры. Только после этого индивидуально назначается адекватное лечение. Если у вас есть постоянный партнер, то курс будет назначен обоим одновременно.
Успешное лечение уреаплазменной инфекции не в полной мере зависит от антибактериальной терапии. Поскольку воспаление развивается лишь на фоне ослабленного иммунитета, позволяющего нарушить физиологический барьер, то не менее важно в терапии уделить внимание стимуляции иммунной системы.
Лечение уреаплазмоза в Санкт-Петербурге
Бактерия уреаплазмы является одноклеточным микробом, постоянно обнаруживаемым и размножающимся в организме человека, и является неотъемлемой частью его микрофлоры.
Отклонение, считающееся заболеванием, является исключительно чрезмерным размножением, превышающим нормальную концентрацию. Эта же особенность имеет фундаментальное значение для диагностики уреаплазмоза: такой диагноз будет сделан только в том случае, если не обнаружены другие патологии или воспалительные процессы в мочеполовой системе.
«Поэма здоровья»
Онлайн запись на прием
Телефоны:
+7 (812) 30-888-03
+7 (812) 242-53-50
Адреса клиник:
м. Пр. Просвещения/Озерки Ул. Асафьева, д. 9, к. 2.
Пр. Просвещения/Озерки Ул. Асафьева, д. 9, к. 2.
м. Звёздная Ул. Ленсовета д. 101, лит. Б, пом. 1Н
Причины
Уреаплазма urealyticum — микроорганизмы, которые являются частью общего бактериального фона слизистых оболочек, чаще всего выбирают среду влагалища, поэтому уреаплазмоз затрагивает главным образом женщин.
Статистика этой болезни не успокаивает: каждая 3-я девочка рождается с неестественно большим количеством этих бактерий в организме, получая инфекцию от матери. Любые факторы, связанные с нарушениями иммунной системы, использованием фармацевтических препаратов (особенно антибактериальных препаратов), перенесенными венерическими или инфекционными заболеваниями, могут стать факторами, вызывающими размножение.
В сочетании с внешними факторами, негативными условиями окружающей среды или климатическими особенностями региона поведение микроорганизмов становится непредсказуемым.
Мужской уреаплазмоз встречается реже и реже диагностируется. Это связано не только с особенностями гормонального и бактериального фона мужского организма, но и с бессимптомным течением заболевания. Поскольку действие уреаплазмоза опасно для женщин, кажется, что мужчине лечение не требуется. Это мнение ошибочно, поскольку мужчина-переносчик может стать средством распространения болезни для своих партнеров.
Это связано не только с особенностями гормонального и бактериального фона мужского организма, но и с бессимптомным течением заболевания. Поскольку действие уреаплазмоза опасно для женщин, кажется, что мужчине лечение не требуется. Это мнение ошибочно, поскольку мужчина-переносчик может стать средством распространения болезни для своих партнеров.
Уреаплазмоз — заболевание, передающееся половым путем, поэтому группа риска совпадает с категорией потенциальных пациентов в дерматовенеральном диспансере: лица, ведущие беспорядочную половую жизнь, практикующие незащищенные половые акты с частыми изменениями партнеров. Второй из наиболее частых принципов заражения делится на три типа:
- Поражение легких ребенка на стадии формирования эмбриона;
- Внутриматочная инфекция, которая проникает через пуповину;
- Инфекция ребенка при прохождении через слизистую оболочку родового канала.
- Ошибочное мнение о том, что инфекции такого рода могут быть заражены воздушным или домашним путем, не имеет подтверждения.
 Бактерия не приспособлена к существованию вне привычной среды. Даже использование общих санитарно-гигиенических принадлежностей с больным человеком или носителем считается безопасным, а также с ним в одном бассейне.
Бактерия не приспособлена к существованию вне привычной среды. Даже использование общих санитарно-гигиенических принадлежностей с больным человеком или носителем считается безопасным, а также с ним в одном бассейне.
Симптомы
Долгое время уреаплазма не может сигнализировать о себе, будучи неактивным в течение многих лет. Обострения чаще всего связаны с внутренними перестройками организма, например, с беременностью или с применением гормональных препаратов. Симптоматика аналогична многим ЗППП, поэтому вы не должны пытаться диагностировать себя сами. Причиной для посещения врача должно быть любое из признаков заболеваний, передающихся половым путем.
- Выделения, свидетельствующие об изменениях в структуре слизистых оболочек. Даже если они не имеют запаха и цвета, это является причиной тестов, так как ряд серьезных заболеваний начинается с перестройки женских половых органов. Появление запаха или зеленоватого оттенка является симптомом возникновения гнойного процесса, изменения уже могут быть необратимыми.
 То же самое можно сказать и о наличии в выделениях тромбов в межменструальный период.
То же самое можно сказать и о наличии в выделениях тромбов в межменструальный период. - Боль в нижней части живота, соответствующая расположению женских органов. Подобно болезненному переносу менструации, боли и резинга – это сигнал для срочного обращения к врачу, поскольку их появление свидетельствует о воспалительных разрушениях тканей матки, придатков или родового канала.
- Жжение и зуд. Воспалительный процесс, вызванный бактериями, проявляет болевые ощущения. В зависимости от области поражения это могут быть как генитальные области, так и другая локализация инфекции, например, горло. В последнем случае болезнь может быть ошибочно принята за стенокардию, так как гнойные включения на миндалинах свойственны этой группе инфекций. Поражения репродуктивной системы сопровождаются болезненными ощущениями при мочеиспускании.
- Болезненный секс даже при чрезмерной смазке влагалища.
Симптомы уреаплазмы у мужчин сходны, но появляются в более уплощенном виде: жжение при мочеиспускании и проблемы с эректильной функцией.
Следует помнить, что течение уреаплазмоза не является однородным, то есть заболевание может длиться долгое время, снова напоминать о себе с увеличением физических или эмоциональных нагрузок, снижать сопротивление организма или в период гормональных изменений, например , во время беременности.
последствия
- Хроническое воспаление половой системы;
- Цистит;
- Пиелонефрит;
- Мочекаменная болезнь у мужчин и женщин;
- Бесплодие как одного, так и второго партнера;
- Эректильная дисфункция и простатит у мужчин;
- импотенция;
- Различные патологии беременности, включая эктопическое развитие и выкидыши в любое время;
- Общее разрушение иммунной системы, провоцирующее развитие других заболеваний.
Методы и особенности диагностики
Диагноз «уреаплазмоз» осложняется тем, что бактерии Ureaplasma urealyticum в здоровом теле нормальны, и их само существование никоим образом не указывает на проблемы со здоровьем.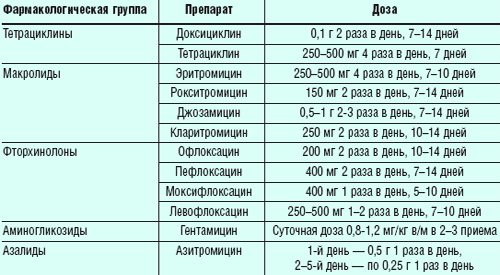
Основанием для медицинского вмешательства будет только превышение их нормального количества и нестандартной локализации. Часто несколько последовательных анализов дают значительно разные результаты. Кроме того, концентрация бактерий в организме, которая не мешает нормальной жизнедеятельности, индивидуальна для каждого человека.
Первой причиной для рассмотрения увеличения уровня бактериального заболевания являются жалобы пациента на соответствующие клинические симптомы, а подтверждение — данные лабораторного анализа. Уролог и гинеколог соответственно проводят весь комплекс анализов. Первой из них является полимерная цепная реакция (ПЦР), результат которой считается условным и предварительным, но по его результатам зависит дальнейшее прохождение диагностического курса.
Одной из причин, почему лечение не назначается сразу после прохождения ПЦР, является его неточность. Даже через 2-3 недели после курса лечения этот метод показывает наличие остаточной уреаплазмы в организме. Поэтому он не используется в качестве контрольного теста. Но этот метод считается наиболее точным с отрицательным результатом, поскольку он способен показать даже минимальный процент патологии.
Поэтому он не используется в качестве контрольного теста. Но этот метод считается наиболее точным с отрицательным результатом, поскольку он способен показать даже минимальный процент патологии.
Кроме того, по медицинским причинам может быть назначен серологический метод или иммунофлуоресцентный метод. Последнее становится все более популярным из-за минимальных условий получения результатов и относительно небольшой цены для процедуры.
Наиболее точный и базовый диагностический метод — посев — размещение биологического материала в оптимальной среде для его развития. Этот метод называется культурным.
Материал соскабливается со стен влагалища или уретры, выделения мочи или простаты, позволяет не только определять присутствие, локализацию и концентрацию микроорганизмов, но и определять их напряжение как можно точнее, а также как чувствительность к различным группам антибиотиков. Это необходимо для выбора наиболее эффективного препарата для лечения, исключая возможность привыкания и дегенерации бактерий.
В дополнение к анализу присутствия в образцах самого уреаплазмы urealyticum лабораторный техник обязательно выявит все сексуально активные бактерии, такие как микоплазмы, гонорея, хламидиоз и другие. Это необходимо для комплексного лечения всей группы микроорганизмов, действие которых не только похоже на симптомы, но и взаимно обостряет друг друга.
Основные формы заболевания
В зависимости от характера течения заболевания уреаплазмоз делится на острый и хронический. Острая форма связана с большим количеством симптомов и их очевидностью. Лечение этой формы намного быстрее и эффективнее. Доктора дополнительно предупреждают пациентов, которые склонны к самолечению, чтобы убедиться в полном исцелении, также необходимы лабораторными методами и, не фокусируясь только на внешних клинических симптомах. Приглушенная острая форма — самая частая причина пренебрежения болезнью. Несвоевременное лечение и неадекватная доза принимаемых препаратов способствуют дегенерации этого типа заболевания в хроническую форму.
Подготовка
Чтобы максимизировать точность результатов исследований, перед тем, как обратиться к врачу, требуется ряд препаратов:
- Исключать любые интимные контакты в течение 2-3 дней;
- В течение того же периода не используйте интимные средства гигиены и вагинальные фармацевтические препараты;
- Исключить очистку внутренних стенок влагалища: шприцы и использование тампонов;
- В течение дня исключить мыло, гели из процедур интимной гигиены;
- Не проводите такие процедуры в день лечения.
Все эти меры направлены на минимизацию искажения бактериальной среды слизистой оболочки, что дает максимальную точность исследований.
Лечение
Как и вся группа половых инфекций, которая характеризуется максимальной адаптируемостью и способностью к мутации, уреаплазма рассматривается индивидуально. При расчете берутся не только характеристики штамма и наличие сопутствующих заболеваний, но и возраст пациента. Лечение обязательно включает три основных этапа:
- Нормализация содержания оппортунистических организмов в микрофлоре;
- Устранение факторов, вызывающих их активацию;
- Восстановление иммунитета и стимуляция собственных защитных систем организма.

Первый этап, как правило, основан на назначении курса антибактериальных препаратов. Чтобы выбрать их конкретный тип, необходимо лечащему врачу, так как для многих видов препаратов отдельные штаммы нечувствительны. Например, лечение с помощью обычной серии пенициллинов не даст результата. Чаще всего для взрослых пациентов используются средства из группы антибиотиков тетрациклина, как наиболее полно решающие проблему. Для лечения детей эритромицин можно использовать, как самый безопасный из антибиотиков. Тем не менее, более точная картина покажет урожай для чувствительности к АВ.
Уреаплазмоз у беременных женщин
Женщины в «интересной ситуации» — наиболее частая категория пациентов, проходящих курс лечения уреаплазмоза. Это связано с особенностями перестройки организма, который готовится к родам и истощается зарождающимся эмбрионом. Измененная среда слизистых оболочек беременной женщины является наиболее благоприятным полем для размножения многих патогенных и оппортунистических бактерий, включая уреаплазму.
Опасность последствий заражения будущей матери связана не только с инфекцией плода, которая возникает более чем в 50% случаев, но с наименьшей вероятностью передачи плода до рождения. Наиболее распространенным результатом расширенного уреаплазмоза является выкидыш.
Сложность лечения уреаплазмоза у беременных женщин заключается в невозможности использования антибиотиков после 22-й недели. После этого периода такие препараты отрицательно влияют на развитие плода.
В поздние сроки все процедуры направлены только на профилактические меры и меры по сохранению плода. Вот почему врачи женской консультации настаивают на предварительном изучении микрофлоры в планируемой беременности и обязательной сдаче всех тестов в самые ранние сроки.
На ранних стадиях беременности лечение и восстановление беременной женщины после уреаплазмоза менее связаны с побочными эффектами, как для самой женщины, так и для плода. Имеются данные о том, что после курса такого лечения микрофлора организма восстанавливается искусственно.
Профилактика
Профилактические меры не только предупреждают болезнь, но также помогают устранить рецидивирующую инфекцию. Основными факторами, позволяющими избежать проблемы, являются:
- Постоянство интимных отношений и сексуальных партнеров;
- Регулярные профилактические осмотры и предоставление анализов обоими сексуальными партнерами;
- Использование противозачаточных средств;
- Гигиенические меры после незащищенных половых актов и орального секса;
- Общее укрепление иммунитета и отказ от вредных привычек.
Уреаплазмоз у женщин — причины, симптомы, диагностика и лечение
Уреаплазмоз у женщин — инфекционное воспалительное заболевание мочеполовых органов, вызванное патологической активностью уреаплазм. В 70-80% случаев заболевание протекает в форме бессимптомного носительства. Может проявляться неспецифическими дизурическими симптомами, увеличением количества прозрачных влагалищных выделений, тянущими болями в нижней части живота и нарушением репродуктивной функции.
Общие сведения
Впервые уреаплазма была выделена у пациента негонококковым уретритом в 1954 году. На сегодняшний день возбудитель считается условно-патогенным микроорганизмом, проявляющим патологическую активность только при наличии определённых факторов. Носительницами бактерий являются 40-50% сексуально активных здоровых женщин. Микроорганизм выявляется на половых органах у каждой третьей новорожденной девочки и у 5-22% школьниц, которые не живут половой жизнью. Хотя по результатам различных исследований уреаплазмы были единственными микроорганизмами, обнаруженными у части пациенток с бесплодием и хроническими заболеваниями урогенитальной сферы, уреаплазмоз не внесен как самостоятельное заболевание в действующую Международную Классификацию Болезней.
Уреаплазмоз у женщин
Причины уреаплазмоза у женщин
Возбудителем заболевания является уреаплазма — внутриклеточная бактерия без собственной клеточной мембраны, обладающая тропностью к цилиндрическому эпителию мочеполовых органов. Из 6 существующих видов уреаплазм патогенная активность выявлена у двух — Ureaplasma urealyticum и Ureaplasma parvum. Заражение происходит при незащищённом половом контакте или во время родов. Убедительных доказательств о контактно-бытовом способе передачи уреаплазмоза на сегодняшний день не существует.
В большинстве случаев носительство уреаплазм является бессимптомным. Основными факторами, способствующими развитию воспалительного процесса, являются:
- Дисгормональные состояния. Возбудитель может проявлять патогенную активность во время беременности, при нарушении эндокринной функции яичников.
- Снижение иммунитета. Воспаление урогенитального тракта чаще возникает у женщин при заболеваниях, снижающих иммунитет, и на фоне приёма иммуносупрессивных препаратов (при лечении онкопатологии).

- Вагинальный дисбактериоз. Нарушение нормальной микрофлоры влагалища при нерациональной антибактериальной терапии и гормональном дисбалансе активирует условно-патогенные микроорганизмы, в том числе уреаплазмы.
- Инвазивные вмешательства. Пусковым моментом для развития уреаплазмоза в ряде случаев становятся аборты, инструментальные лечебно-диагностические процедуры (гистероскопия, уретро- и цистоскопия, хирургические методы лечения эрозии шейки матки и др.).
- Частая смена половых партнёров. Бактерия активируется в ассоциации с другими возбудителями ИППП, проникающими в половые органы женщины во время незащищённого секса со случайными партнёрами.
Патогенез
Патогенез уроплазмоза у женщин основан на адгезивно-инвазивных и ферментообразующих свойствах микроорганизма. При попадании на слизистую мочеполовых органов бактерия прикрепляется к оболочке клетки цилиндрического эпителия, сливается с ней и проникает в цитоплазму, где и происходит её размножение. Микроорганизм продуцирует особый фермент, который расщепляет иммуноглобулин А, снижая таким образом иммунный ответ на инфекцию. При бессимптомном течении местные воспалительные и деструктивные изменения выражены слабо. Повышение патогенной активности возбудителя под действием провоцирующих факторов приводит к развитию воспаления — сосудистой реакции, повышению тканевой проницаемости, разрушению эпителиальных клеток.
Микроорганизм продуцирует особый фермент, который расщепляет иммуноглобулин А, снижая таким образом иммунный ответ на инфекцию. При бессимптомном течении местные воспалительные и деструктивные изменения выражены слабо. Повышение патогенной активности возбудителя под действием провоцирующих факторов приводит к развитию воспаления — сосудистой реакции, повышению тканевой проницаемости, разрушению эпителиальных клеток.
Классификация
Основными критериями выделения клинических форм уреаплазмоза у женщин являются характер течения и степень выраженности патологических проявлений. В частности, специалисты в области гинекологии различают:
- Носительство уреаплазм. У большинства женщин, при обследовании которых выявляется этот микроорганизм, никаких признаков воспалительных процессов нет.
- Острый уреаплазмоз. Наблюдается крайне редко, сопровождается клинически выраженными признаками поражения мочеполовых органов и общей интоксикацией.

- Хронический уреаплазмоз
Симптомы уреаплазмоза у женщин
В 70-80% случаев какие-либо клинические проявления, свидетельствующие об инфицировании организма уреаплазмами, отсутствуют. Заболевание не имеет специфических симптомов и в периоды обострений проявляется признаками, характерными для воспалительных процессов в мочеполовой системе. Женщина может жаловаться дискомфорт, рези, жжение, болезненные ощущения при мочеиспускании. Несколько увеличивается объём прозрачных влагалищных выделений. При восходящем развитии инфекции с поражением внутренних репродуктивных органов могут беспокоить ноющие или тянущие боли в нижней части живота. При остром течении и в периоды обострений температура повышается до субфебрильных цифр, пациентка отмечает слабость, утомляемость, снижение работоспособности. О хроническом уреаплазмозе могут свидетельствовать стойкие к лечению уретриты, вагиниты, эндоцервициты, аднекситы, невозможность забеременеть, самопроизвольное прерывание или патологическое течение беременности.
О хроническом уреаплазмозе могут свидетельствовать стойкие к лечению уретриты, вагиниты, эндоцервициты, аднекситы, невозможность забеременеть, самопроизвольное прерывание или патологическое течение беременности.
Осложнения
При длительном течении уреаплазмоз у женщин осложняется хроническими воспалительными процессами в матке и придатках, которые приводят к бесплодию, выкидышам и преждевременным родам. Ситуация усугубляется инфицированием партнёра, у которого на фоне заболевания может развиться мужское бесплодие. В некоторых случаях воспаление, сосудистые и аутоиммунные процессы в эндометрии становятся причиной первичной плацентарной и вторичной фетоплацентарной недостаточности с нарушением нормального развития плода, риском возникновения аномалий и повышением перинатальной заболеваемости. Поскольку беременность является провоцирующим фактором для активации микроорганизма, а лечение инфекционного заболевания предусматривает назначение препаратов, способных влиять на плод, при репродуктивном планировании важно своевременно выявить возбудителя.
Диагностика
Данные влагалищного осмотра, бимануального обследования и клиническая картина заболевания неспецифичны и, как правило, свидетельствуют о наличии воспалительного процесса. Поэтому ключевую роль в диагностике уреаплазмоза у женщин играют специальные методы исследования, позволяющие обнаружить возбудителя:
- Бак. посев на уреаплазму. При посеве биоматериала (выделений, мазков) на питательную среду выявляются колонии уреаплазм, после чего определяется их чувствительность к антибактериальным препаратам.
- ПЦР. С помощью полимеразной цепной реакции в биоматериале пациентки в течение суток можно обнаружить генетический материал возбудителя.
- Серологическое исследование . В ходе иммунофлюоресцентного анализа (ИФА) и при прямой флюоресценции (ПИФ) в крови женщины обнаруживаются антитела к бактерии, определяется их титр.
При дифференциальной диагностике необходимо исключить инфицирование другими возбудителями — хламидиями, трихомонадами, гонококками, микоплазмами и т. п. Основанием для постановки диагноза уреаплазмоза является наличие воспалительных процессов в мочеполовых органах женщины при отсутствии каких-либо других возбудителей ИППП, кроме уреаплазм. Наряду с гинекологом, к консультированию пациентки привлекают уролога.
п. Основанием для постановки диагноза уреаплазмоза является наличие воспалительных процессов в мочеполовых органах женщины при отсутствии каких-либо других возбудителей ИППП, кроме уреаплазм. Наряду с гинекологом, к консультированию пациентки привлекают уролога.
Лечение уреаплазмоза у женщин
Ключевыми задачами терапии при уреаплазменной инфекции являются уменьшение воспаления, восстановление иммунитета и нормальной влагалищной микрофлоры. Пациенткам с клиническими признаками уреаплазмоза рекомендованы:
- Этиотропная антибиотикотерапия. При выборе препарата необходимо учитывать чувствительность возбудителя. Обычно назначают 1-2-недельный курс тетрациклинов, макролидов, фторхинолонов.
- Санация влагалища. Введение свечей с антибиотиком и противогрибковым препаратом дополняет антибактериальное лечение.
- Иммунотерапия. Для восстановления иммунитета показаны иммуномодулирующие и иммуностимулирующие средства, в том числе растительного происхождения.

- Нормализация микробиоценоза влагалища. Применение пробиотиков местно и внутрь позволяет восстановить вагинальную микрофлору, которая угнетает патологическую активность уреаплазм.
- Ферментные препараты. Энзимы оказывают противовоспалительный эффект и усиливают процессы регенерации тканей.
- Витаминотерапия. С общеукрепляющей целью в комплексном лечении уреаплазмоза у женщин используют мультивитаминные и витаминно-минеральные комплексы.
Важно отметить, что показания для назначения этиотропного противоуреаплазменного лечения ограничены. Как правило, антибиотики применяют при обнаружении уреаплазм у пациенток с устойчивыми к лечению хроническими воспалительными процессами и нарушениями репродуктивной функции при отсутствии других возбудителей ИППП. Также антибактериальный курс рекомендован носительницам уреаплазмы, которые планируют беременность.
Прогноз и профилактика
Прогноз уреаплазмоза у женщин благоприятный. Этиотропное лечение позволяет полностью избавиться от бактерии, однако из-за отсутствия пассивного иммунитета и высокой распространённости возбудителя возможно повторное заражение. Поскольку уреаплазма является условно-патогенным микроорганизмом, для профилактики воспаления важны рациональный режим сна и отдыха, сезонное поддержание иммунитета, обоснованное назначение инвазивных методов диагностики и лечения заболеваний женской половой сферы, использование барьерной контрацепции. Для предупреждения патологической активации возбудителя во время планируемой беременности женщинам с носительством уреаплазм рекомендована профилактическая антибиотикотерапия.
Этиотропное лечение позволяет полностью избавиться от бактерии, однако из-за отсутствия пассивного иммунитета и высокой распространённости возбудителя возможно повторное заражение. Поскольку уреаплазма является условно-патогенным микроорганизмом, для профилактики воспаления важны рациональный режим сна и отдыха, сезонное поддержание иммунитета, обоснованное назначение инвазивных методов диагностики и лечения заболеваний женской половой сферы, использование барьерной контрацепции. Для предупреждения патологической активации возбудителя во время планируемой беременности женщинам с носительством уреаплазм рекомендована профилактическая антибиотикотерапия.
Половые инфекции — Практика Здоровья
По оценкам Всемирной организации здравоохранения (ВОЗ) каждый год в мире регистрируется 250 миллионов новых случаев заболеваний инфекций передающихся половым путём. Эти заболевания объедены в одну группу и названы, так в связи их с особенностью- основной путь передачи половой, иначе говоря, заразиться ими можно только при половом контакте с больным человеком или носителем инфекции.
Значительно увеличилось число сочетанных (смешанных) инфекций, причем как бактериальной (сифилис, гонорея, хламидиоз, микоплазмоз, уреаплазмоз) и вирусной (герпес, остроконечные кондиломы, гепатиты, ВИЧ) причины, что во многом осложняет диагностику и терапию таких заболеваний. Бессиптомные случаи инфекций передающихся половым путём являются резервуаром и способствуют их передачи половым партнёрам и новорожденным. Кроме того, наличие генитальной инфекции увеличивает риск приобретения и расспространения ВИЧ- инфекции.
Как распространяются такие инфекции?
Возбудители этих заболеваний находятся в выделяемом из половых путей больного человека. При половом контакте (вагинальном, оральном, анальном) выделения неизбежно попадают в половые органы здорового человека, таким образом, происходит передача инфекции от больного или носителя к здоровому. Даже малое количество возбудителя способно вызвать воспалительный процесс. Некоторые инфекции (ВИЧ, гепатит B, С, сифилис) передаются кроме того через кровь.
Некоторые инфекции (ВИЧ, гепатит B, С, сифилис) передаются кроме того через кровь.
Чем опасны заболевания передающиеся половым путём?
В большинстве случаев наибольшую опасность представляют не сами половые инфекции, а их осложнения. Например, хламидиоз, микоплазмоз и уреаплазмоз приводЯт к простатиту, а у женщин — к восполительным заболеваниям матки и прИдатков. С вирусом папилломы человека связывают возникновение рака шейки матки, влагалища, вульвы и полового члена, а с вирусом гепатита B- возникновение рака печени. Внутриутробное заражение вирусом герпеса, цитомегаловирусной инфекции может вызвать тяжелую поталогию плода. ВлияЮт на детородную функцию — мужское и женское бесплодие, выкидыши, мёртворождение плода.
Какие симптомы появляются у человека, который заразился инфекциями передаваемые половым путём?
Клинические симптомы большинства половых инфекций однотипны, то есть похожи между собой.
Больных беспокоят:
— выделения из влагалища, мочеиспускательного канала (обильные или умеренные, жёлто- зелёные или белые творожистые, неприятный запах), увелИчение паховых лимфАтических узлов.
— высыпания на половых органах: пузырЬки, язвочки, «потертости» — эрозии, пятна, отёчность, покраснение.
— зуд в области половых органов.
Не следует забывать, что признаков заболевания может и не быть, они могут быть стёртыми, не ярко выраженными. Всё зависит от стадии заболевания, силы иммунитета человека, приёма лекарств и многих других факторов. Например, такое заболевание как сифилис может протекать без симптомов ( отсутствие язвочек, эрозИй, увеличенных лимфАтических узлов, высыпаний на теле) и только анализы крови могут свидетельствовать о наличии в организме бледной трепонемы — возбудителя сифилиса.
МикОуреаплазмоз.
МикОплазмоз- заболевание вызываемое микоплазмами ( Mycoplasma hominis, и Mycoplasma genitalium), уреаплазмоз — заболевание вызванное уреаПлазмой ( Ureaplasma urealiticum). В последнее время, микоплазмы как и уреаплазмы стали рассматривать как условно-патогенные микроорганизмы, способных вызвать воспалительные заболевание мочеполовых органов лишь при определённых условиях или в сочетаНИИ с другимиусловно патОгенными микроорганизмами. Симптомы заболевания возникают через три-пять недель с момента заражения. При внедрении этих возбудителей возможно поражение мочеиспускательного канала, предстательной железы, шейки матки и слизистой влагалища.
В последнее время, микоплазмы как и уреаплазмы стали рассматривать как условно-патогенные микроорганизмы, способных вызвать воспалительные заболевание мочеполовых органов лишь при определённых условиях или в сочетаНИИ с другимиусловно патОгенными микроорганизмами. Симптомы заболевания возникают через три-пять недель с момента заражения. При внедрении этих возбудителей возможно поражение мочеиспускательного канала, предстательной железы, шейки матки и слизистой влагалища.
СимПтомы у мужчин:
— скудные прозрачные выделения из мочеиспускательного канала.
— умеренная боль и жжение при мочеиспускании.
— при поражении предстательной железы симптомы простАТита.
СимПтомы у женщин:
— скудные прозрачные выделения из влагалища.
— умеренная боль и жжение при мочеиспускании.
— боли внизу живота ( при воспалении матки, придатков).
Следует отметить, что болезни кожи, передающиеся половым путем (чесотка, лобковый педикулез, контагиозный моллюск) являются маркерами других заболеваний, передающихся половым путем. Поэтому при выявлении у человека, живущего половой жизнью, чесотки, лобкового педикулеза или контагиозного моллюска необходимо обследование на другие заболевания, передающиеся половым путем.
Поэтому при выявлении у человека, живущего половой жизнью, чесотки, лобкового педикулеза или контагиозного моллюска необходимо обследование на другие заболевания, передающиеся половым путем.
Чесотка – это заболевание кожи, вызываемое чесоточным клещом. Длина самки чесоточного клеща составляет 0,3-0,4 мм. Живет она около 1 мес. Самки проделывают ходы под роговым слоем эпидермиса, откладывая там ежедневно по 2-3 яйца. Из яиц вылупляются личинки. В течение 2 недель личинки, пройдя несколько стадий, превращаются во взрослые особи. Последние поднимаются на поверхность кожи и спариваются. Самцы, оплодотворив самку, вскоре погибают. Оплодотворенная самка внедряется в кожу прежнего или нового хозяина. Таким образом, клиническая картина заболевания вызвана исключительно самками. Вне организма человека при комнатной температуре чесоточный клещ способен прожить 2-3 сут. При температуре 60 С° клещи погибают в течение 1 ч, при кипячении или отрицательной температуре — гибнут почти сразу.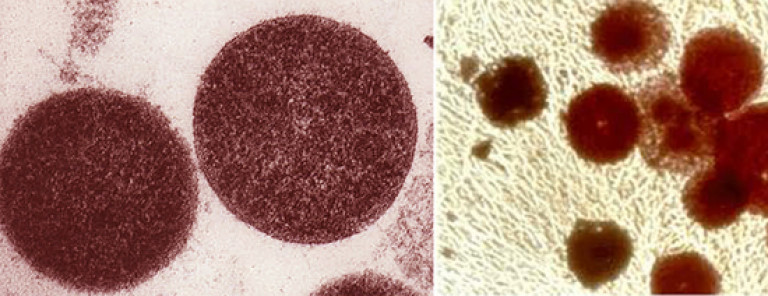
Как происходит заражение чесоткой?
Характерен контактный механизм передачи. Заражение происходит при половых контактах, а также бытовым путем — через одежду и постельное белье.
Как проявляется чесотка? (симптомы чесотки)
Чесотка проявляется главным образом зудом и следами расчесов. Характерно усиление зуда в вечернее и ночное время.
Зуд обусловлен не непосредственным действием клещей, а аллергической реакцией на клещей и их экскременты. Поэтому при первом заражении чесоткой зуд появляется через несколько недель; при повторном заражении — в первые сутки.
Какие участки кожи чаще всего поражаются при чесотке?
Излюбленная локализация высыпаний (в порядке убывания частоты): межпальцевые промежутки, запястья, тело полового члена, локтевые ямки, стопы, наружные половые органы, ягодицы, подмышечные впадины. Голова и шея при чесотке не поражаются (ислючение — грудные дети). Несмотря на характерную локализацию высыпаний, зуд при этом заболевании может возникать на любом участке тела.
Как проводится диагностика чесотки?
Диагностика основана на клинической картине (зуд, усиливающийся в вечернее и ночное время; характер локализации высыпаний). По возможности диагноз надо подтверждать выявлением чесоточных ходов и самих клещей.
Ваши половые партнеры
Рекомендуется лечение половых партнеро.
Как проводится диагностика?
По результатам общего мазка (как у мужчин, так и у женщин) можно лишь заподозрить уреаплазмоз, хламидиоз, МИКОплазмоз. При этом в общем мазке количество лейкоцитов может быть повышено незначительно или вообще не привышать нормы Для выявления возбудителя материал направляют в лабораторию для дополнительных исследований, которые включают метод прямой иммунофлюресценции (ПИФ) и ДНК — диагностику (ПЦР).
Мы упоминали выше, что может присутствовать и смешанная инфекция ( в 70- 80% случаев), по этому есть целесообразность обследоваться сразу на другие инфекции передаваемые половым путём.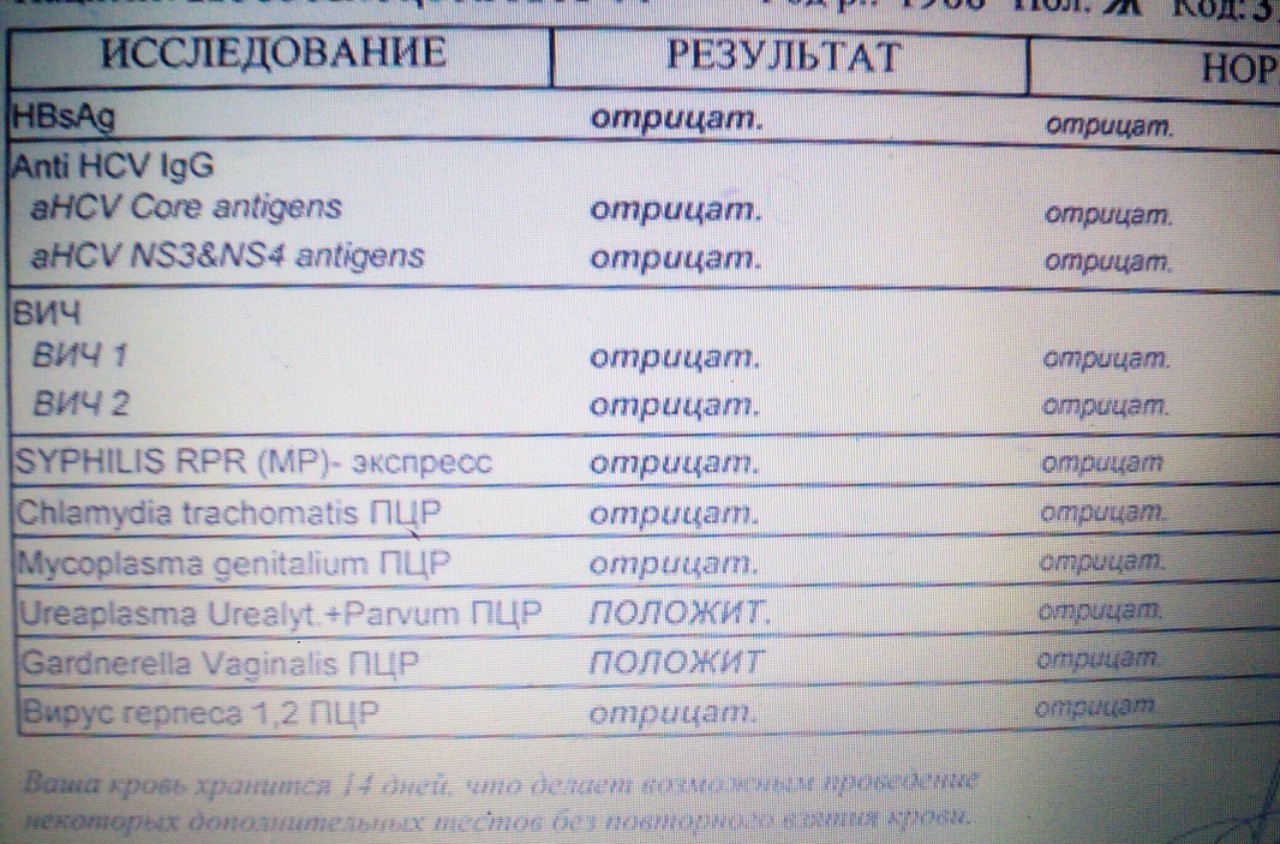 ИФА диагностика на сифилис, ВИЧ- инфекцию, ПЦР исследования на цитомегаловирусную и герпетическую инфекцию. БактериОлогические посевы на стафилококки, стрептококки, кишечные палочки, которые могут вызывать заболевания и создавать благоприятную среду для проникновения уреаплазм, хламидиЙ, трихомонад, гонореи. К сожалению, по одному анализу не возможно определить весь спектр возбудителей. Для каждого микроорганизма учитывая особенности возбудителя существуют определённые методики исследования, и по этому обследования полностью на инфекции передаваемые половым путём являются дорогостоящими. Но чёткая, полная диагностика таких инфкций позволяет точно поставить диагноз и назначить адекватное лечение.
ИФА диагностика на сифилис, ВИЧ- инфекцию, ПЦР исследования на цитомегаловирусную и герпетическую инфекцию. БактериОлогические посевы на стафилококки, стрептококки, кишечные палочки, которые могут вызывать заболевания и создавать благоприятную среду для проникновения уреаплазм, хламидиЙ, трихомонад, гонореи. К сожалению, по одному анализу не возможно определить весь спектр возбудителей. Для каждого микроорганизма учитывая особенности возбудителя существуют определённые методики исследования, и по этому обследования полностью на инфекции передаваемые половым путём являются дорогостоящими. Но чёткая, полная диагностика таких инфкций позволяет точно поставить диагноз и назначить адекватное лечение.
Что делать?
Если вы думаете, что заразились, обязательно обследуЙтесь как можно скорее. Не надейтесь, что заболеваниЕ пройдёт само по себе. Большинство иНфекций излечимы. Обязательно пройдите полный курс лечения. Необходимо поговорить со своим партнёром. Если вы оба не вылечитесь, вы можете заразить друг друга снова.
Если вы оба не вылечитесь, вы можете заразить друг друга снова.
Профилактика заболеваний передаваемых половым путём заключается не только в использовании качественных презервативов, индивидуальной профилактики после случайных половых связей В РАННЕМ ВЫЯВЛЕНИИ, ЛЕЧЕНИИ ЭТИХ ЗАБОЛЕВАНИЙ, но и в изменении сексуального поведения — на моногаммные отношения, что по сути является сто процентной гарантией защиты от инфекций передаваемых половым путём. Острое заболевание лечится на много легче, чем болезнь «с большим стажем». Хроническая инфекция может оставить в органах «следы» в виде спаек, стриктур, которые останутся даже тогда, когда микробов нет. Информированность по данным заболеваниям также является профилактикой половых инфекций. Если моногаммные отношения не удаются, вы в поиске своей половины желательно полное обследование, с учётом инкубационного периода заболеваний, перед вступлением в новую интимную связь. Берегите своё здоровье и половых партнеров, чем выше уровень сексуальной культуры, Тем меньше шансов приобрести половую инфекцию.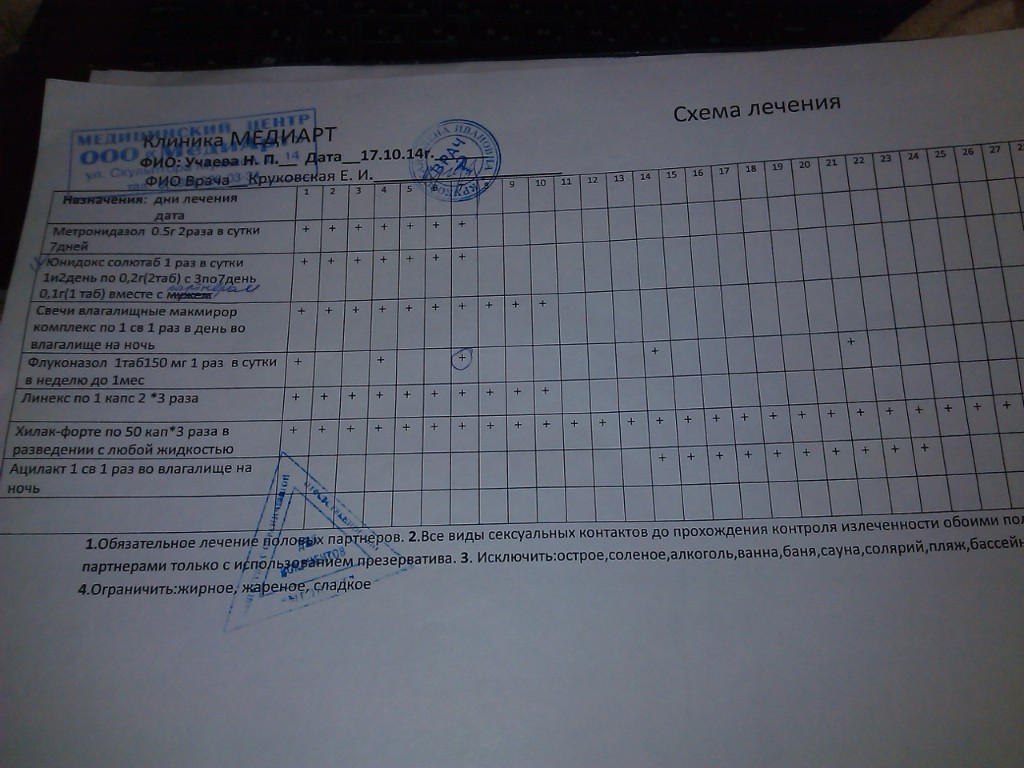
Уреаплазмоз: причины, симптомы, лечение | ПроМедицина Уфа
Уреаплазмоз – заболевание, вызываемое мельчайшими бактериями, которые по размерам занимают промежуточное место между вирусами и одноклеточными организмами.
Уреаплазма обладает уникальной способностью проникать внутрь клетки и размножаться в ней. По этой причине возбудитель становится недоступным для иммунной системы человека и наибольшего количества антибактериальных препаратов, так как защитные силы организма не уничтожают собственные клетки человека, а лекарства не распознают замаскированный уреаплазмоз.
При этом данный возбудитель входит в обязательную микрофлору мочевыводящих путей и может долгие годы не давать никаких симптомов. Причиной запуска патологического процесса может быть снижение иммунитета и приобретение сопутствующих заболеваний.
Уреаплазмоз относится к инфекциям, передающимся половым путем.Возможно также внутриутробное инфицирование и заражение плода в процессе родов при прохождении через родовые пути, в случае если мать инфицирована.
Причины и симптомы
Способствовать возникновению уреаплазмоза может множество внутренних и внешних факторов. К внутренним факторам следует отнести снижение иммунитета женщины, обострение других заболеваний мочеполовой сферы (вагинит, сальпингит и др.), а также наличие других инфекций, передаваемых половым путем (гонорея, трихомониаз). Риск заражения уреаплазмозом выше у женщин с большим количеством половых партнеров.Уреаплазмоз обнаруживается у женщин с частой молочницей. На фоне снижения защитных сил организма, наблюдается активизация патологического процесса. Заболевание может прогрессировать при стрессах, курсе приема антибиотиков, переохлаждении, после простудных инфекций.
После заражения симптомы могут проявиться как через несколько дней, так и через месяц. Исходя из этого, нельзя с уверенностью сказать, сколько будет длиться инкубационный период.
Пока женщина остается в неведении относительно того, что она стал носителем уреаплазмоза, болезнь прогрессирует. Бактерии размножаются с высокой скоростью и выделяются вместе с жидкостями организма. В этот период пациентка превращается из носителя в переносчика инфекции.
Первые симптомы проявляются на слизистой оболочке мочеиспускательного канала – это слабые болевые ощущения при мочеиспускании, которые усиливаются в начале процесса, или в конце. Появляются прозрачные выделения из уретры в небольших количествах, которые редко сопровождаются неприятным запахом. Также отмечается жжение в половых органах.
Диагностика
Бактериологическая диагностика заболевания основана на анализе мазка, который берется из слизистой оболочки мочевыводящих путей и шейки матки. Затем производится культуральный посев на питательные среды.
Если в материале присутствует возбудитель, то через несколько недель обнаруживается рост колонии. С помощью данного метода можно установить также чувствительность бактерии к антибактериальным препаратам. Для этих целей рядом с выросшенной культурой бактерии располагают диски с антибиотиками. В местах, где наблюдается чувствительность уреаплазмы к антибиотику, прослеживается отсутствие роста колонии.
Очень информативный метод диагностики — прямаяиммуннофлюоресценция (ПИФ).Она позволяет определить наличии антител к уреаплазме и оценить ориентировочные показатели.
Лечение
Терапия уреаплазмоза сводится к применению антибактериальных препаратов, обладающих активностью в отношении возбудителей болезни.Стоит отметить, что антибактериальное лечение при уреаплазмозе может быть как системным (с использованием капсул, таблеток), так и местным (подразумевающим применение свечей).
Также назначается прием иммуномодулирующих средств, витаминотерапия и диета (отказ от жареной, копченой, жирной, острой пищи, кетчупов, приправ и алкоголя). Сексуальные контакты на период лечения исключаются.
Если не лечить уреаплазмоз, то возникают серьезные осложнения. Хроническая форма не проявляется клиническими симптомами, но при ней наблюдаются серьезные последствия, такие как бесплодие, воспаление мочевого пузыря, нарушение менструального цикла и т.д.
Ассоциация хронических симптомов мочеиспускания у женщин и Ureaplasma urealyticum
ЗАДАЧИ. Определить заболеваемость Ureaplasma urealyticum у женщин, испытывающих хронические симптомы мочеиспускания, и определить, эффективна ли антибактериальная терапия, направленная на эти организмы.
Методы: Сорок восемь женщин подряд, направленных в наш академический медицинский центр по поводу симптомов хронического мочеиспускания и возможного интерстициального цистита, прошли урологическое обследование, включая скрининг посева на U.urealyticum и Mycoplasma hominis. Пациенты с положительными культурами получали азитромицин в дозе 1 г; стойкую инфекцию лечили доксициклином, офлоксацином или эритромицином в течение 7 дней. Пациенты сообщили о тяжести симптомов (0 — легкая; 3 — тяжелая) и частоте мочеиспускания до и через 6 месяцев после лечения.
Полученные результаты: Положительные культуры были получены у 23 (48%) из 48 пациентов; 22 имел U.urealyticum и у одного был M. hominis. У всех были отрицательные посевы после лечения. Средний балл тяжести симптомов улучшился с лечением (с 2,2 до 0,7, P <0,001), а средняя частота мочеиспускания снизилась (с 9,2 до 6,8 в день, P <0,001). У двоих из 23 пациентов улучшения не наблюдалось; у одного была нестабильность детрузора, у другого - частота мочеиспускания, связанная с медицинскими показаниями. Из 25 пациентов с отрицательными культурами интерстициальный цистит был установлен только у 9 (19% от общей выборки).
Выводы: Несмотря на то, что U.urealyticum и M. hominis могут составлять большую часть необъяснимых хронических симптомов мочеиспускания. Прежде чем проводить более дорогостоящие и инвазивные тесты, следует рассмотреть возможность культивирования и лечения.
Распространенность Ureaplasma urealyticum и Mycoplasma hominis у женщин с хроническими симптомами мочеиспускания
Цели: Оценить распространенность Ureaplasma urealyticum и Mycoplasma hominis у женщин с хроническими симптомами мочеиспускания.
Методы: Образцы мочи, влагалища и уретры, полученные от 153 женщин с хроническими симптомами мочеиспускания, были протестированы на наличие патогенов, включая U. urealyticum и M. hominis. Пациенты с положительными культурами на микоплазмы получали разовую дозу 1 г азитромицина и наблюдались через 1 месяц после терапии. Пациенты с хронической инфекцией получали 100 мг доксициклина перорально два раза в день в течение 7 дней в соответствии с результатами теста на чувствительность.Пациентов просили оценить тяжесть своих симптомов при первом посещении и после лечения.
Полученные результаты: U. urealyticum был обнаружен в> или = 1 месте у 81 женщины (52,9%), а M. hominis был обнаружен у 5 пациентов (3,3%), всегда в связи с U. urealyticum. При последующем наблюдении у 77 пациентов (95,1%), изначально положительных на Mycoplasma, были отрицательные посевы; культуры 4 (4.9%) оставались положительными на U. urealyticum и становились отрицательными после второй схемы лечения. После терапии у женщин с положительными культурами на микоплазмы наблюдалось значительное улучшение всех симптомов.
Выводы: Высокая распространенность U. urealyticum наблюдалась у женщин с необъяснимыми хроническими симптомами мочеиспускания. Исследование на наличие U. urealyticum и M.hominis в урогенитальном тракте может оказаться полезным для лечения значительного процента хронических симптомов мочеиспускания у женщин с помощью соответствующего лечения.
Симптомы уреаплазмы — PlushCare
Бактерии — это не всегда плохо. Фактически, у всех нас в организме присутствуют «хорошие» бактерии, которые помогают пищеварению и предотвращают определенные инфекции. У женщин, как правило, много «хороших» бактерий в области шейки матки, а у мужчин — в уретре.
Одной из таких бактерий является уреплазма. Это один из самых крошечных свободноживущих организмов в мире, и их даже трудно обнаружить в микроскоп. Этот вид имеет тенденцию разрастаться и заражать здоровые ткани тела, что приводит к инфекции.
Как это передается?
Большое количество уреаплазмы передается половым путем. Вот почему это заболевание часто встречается у сексуально активных взрослых, поскольку оно проникает в организм через влагалище или уретру.Он также может передаваться от матери к ребенку во время беременности.
Хорошая новость в том, что инфекция проходит через несколько месяцев и сама по себе не опасна для жизни.
Симптомы уреаплазмы
Люди с высоким уровнем уреаплазмы не испытывают никаких симптомов. Но эти большие колонии бактерий поражают здоровые ткани уретры, и это приводит к воспалению, называемому уретритом. Часто встречается как у женщин, так и у мужчин.
Симптомы, связанные с уреаплазмой:
- Сильная боль при мочеиспускании
- Чувство жжения в области уретры / влагалища
- Непрерывная разгрузка
- Боль в животе
- Припухлость возле отверстия уретры
- Боль или запах от выделений
Наличие большого количества уреаплазмы увеличивает вероятность других состояний, таких как:
- камни в почках
- Уретрит
- преждевременные роды
- Заболевания органов дыхания, особенно у новорожденных
- Бактериальный вагиноз (характеризуется водянистыми выделениями из влагалища и неприятным запахом в нем)
Кроме того, известно, что уреаплазма увеличивает количество осложнений во время беременности.Хотя он напрямую не вызывает ни одного из перечисленных ниже состояний, он может ускорить наступление этих состояний. - Разрыв плодной оболочки
- Низкая масса тела при рождении
- Фуниситис
- Амниотическая инфекция
- Преждевременные роды
- Послеродовой эндометрит
- Вторжение в плаценту
Поговорите с доктором
Если вы испытываете какие-либо из вышеперечисленных симптомов, немедленно обратитесь к врачу. Это особенно важно, если вы беременны, у вас слабая иммунная система, вы инфицированы ВИЧ или недавно перенесли трансплантацию органов.
В большинстве случаев врач не сразу назначает лабораторное исследование уреаплазмы. Только когда все другие возможные проблемы с этими симптомами будут исключены, врач назначит эти тесты.
Вы можете сразу же поговорить с врачом PlushCare. Наши врачи являются лучшими в своих областях и помогут вам преодолеть это заболевание, не выходя из дома. Они доступны через телефон, видеочат и мобильное приложение. В зависимости от вашего состояния они могут заказать тест, если это необходимо, и вы можете отправить результаты своему врачу.На основании этих результатов врач диагностирует ваше состояние и назначит необходимое лечение.
Есть вероятность, что при уреаплазме вам пропишут антибиотики. Ваш рецепт на антибиотики может быть отправлен в электронном виде в выбранную вами аптеку, так что вам будет легко и удобно.
Итак, запишитесь на прием к врачу PlushCare сейчас и начните лечение сегодня.
Подробнее об уреаплазме
границ | Инфекция Ureaplasma Urealyticum способствует развитию тазового эндометриоза через толл-подобный рецептор 2
Введение
Эндометриоз — хроническое гинекологическое заболевание, характеризующееся наличием эктопической ткани эндометрия вне полости матки; им страдают 6–10% женщин репродуктивного возраста (1).Кроме того, его частота у женщин с хронической тазовой болью или бесплодием колеблется от 35 до 50% (1).
Среди нескольких гипотез все еще применима теория ретроградной менструации Сэмпсона (2). Были постулированы некоторые другие теории, такие как изменение ответа на эстроген и прогестерон, имплантация эндометриальных стволовых клеток, аномалии мюллерова остатка и целомическая метаплазия (3, 4). Недавние исследования также показали важность взаимодействия между тканью эндометрия, брюшиной и иммунными клетками во время развития эндометриоза (5-7).На ранней стадии развития эндометриоза острые воспалительные реакции и разрушение тканей вызывались провоспалительными цитокинами, такими как интерлейкин (IL) -6, IL-1β, интерферон (IFN) -γ и фактор некроза опухоли (TNF). По мере прогрессирования воспаления, ремоделирование и восстановление тканей, пролиферация клеток эндометрия, ангиогенез, нейрогенез и фиброз отслеживаются под влиянием регуляторных Т-клеток и Т-хелперных клеток 2 (7-10).
Согласно недавним исследованиям, менструальная кровь женщин с эндометриозом чаще контаминирована Escherichia coli , чем контрольная кровь, что соответствует более высокому уровню эндотоксина в менструальной жидкости (11, 12).Кроме того, липополисахарид (LPS) способствует пролиферации и инвазии стромальных клеток эндометрия человека за счет активации циклооксигеназы-2 (COX-2) и простагландина E2 (PGE2), что может привести к развитию эндометриоза (13). Более того, согласно эпидемиологическому исследованию, проведенному на Тайване, эндометриоз чаще встречается у женщин с низкой инфекцией половых путей шейки матки, влагалища и вульвы, чем у женщин без заболевания (14).
Ureaplasma urealyticum — это грамотрицательная бактерия, принадлежащая к семейству Mycoplasmataceae, не имеющая клеточной стенки.Этот вид является важным условно-патогенным микроорганизмом, обычно обнаруживаемым в репродуктивных органах сексуально активных женщин, и его распространенность колеблется от 60 до 80% во всем мире (15–17). U. urealyticum участвует в различных инфекционных заболеваниях, таких как негонококковый уретрит, мужское бесплодие, бактериальный вагиноз, хронический эндометрит, воспалительные заболевания органов малого таза, самопроизвольный аборт, преждевременные роды и хориоамнионит (18–21). Однако роль этой бактерии в прогрессировании эндометриоза не описана.
Брюшина, обычное место имплантации эктопического эндометрия, состоит из широкого монослоя мезотелиальных клеток. Мезотелиальные клетки брюшины (PMC) покрывают серозную полость тела и внутренние органы (22). Эти PMC участвуют в различных клеточных процессах, включая адгезию опухолевых клеток, восстановление тканей, воспаление и защиту хозяина (22, 23). Чувствительность бактериальных патогенов в PMC опосредуется некоторыми Toll-подобными рецепторами (TLR), включая TLR2 (23), который распознает молекулярный паттерн U.urealyticum (15, 24, 25). Кроме того, у людей и мышей стимулированные PMC секретируют несколько хемокинов и цитокинов CC и CXC, включая CXCL1 / KC, CCL2 / MCP-1 и IL-6 (26–29).
Основываясь на этих предыдущих знаниях, мы предположили, что инфекция U. urealyticum может способствовать развитию эндометриоза, индуцируя продукцию медиаторов воспаления PMC, возможно, через TLR2. Следовательно, нашей целью было выяснить, связана ли инфекция PMC, вызванная U. urealyticum , с эндометриозом.Более того, мы стремились продемонстрировать молекулярный механизм, участвующий в развитии эндометриоза.
Материалы и методы
Мыши
Самок мышей C57BL / 6J дикого типа (WT) были приобретены у DBL (Eumseong, Южная Корея). Tlr2-дефицитные самки мышей на фоне C57BL / 6 были приобретены в Jackson Laboratories (Бар-Харбор, Мэн, США). Животных содержали в помещении для животных при постоянной температуре (22–24 ° C) и цикле свет-темнота с 14 часами света и 10 часами темноты.Пища и вода были доступны ad libitum . Перед экспериментом мышей акклиматизировали в лабораторной комнате за 1 неделю. Мышей умерщвляли смещением шейных позвонков; Для этого исследования использовали самок C57BL / 6J ( n = 92) и мышей с дефицитом Tlr2 ( n = 31) в возрасте 4-8 недель. Исследования на животных были одобрены и проведены в соответствии с правилами Институционального комитета по уходу и использованию животных (IACUC; утвержденный номер протокола: P-17-09-E-01) в Университете Коньян (Тэджон, Корея).
U. urealyticum КультураUreaplasma urealyticum (ATCC 27618) восстанавливали в среде 2616 Американской коллекции типовых культур в соответствии с инструкциями, предоставленными Американской коллекцией типовых культур. Бактерии инкубировали в анаэробных условиях при 37 ° C до тех пор, пока среда не изменилась с желтой на розово-красную. Изменение цвета указывает на рост U. urealyticum . Через 12 часов изменения цвета бактерии осторожно осаждали и ресуспендировали в питательной среде.Концентрации бактерий в суспензиях доводили до 1 × 10 4 КОЕ / мл с помощью набора Mycoplasma IST-2 (BioMerieux, Marcy l’Etoile, Франция) в соответствии с инструкциями производителя (30). Затем мы идентифицировали колонии, используя агар A7 Mycoplasma Agar (BioMerieux), чтобы определить точное количество бактерий. U. urealyticum инкубировали на агаре A7 Mycoplasma Agar в течение 24 ч в анаэробных условиях с использованием инкубации gaspak EZ large (BD Biosciences, Сан-Хосе, Калифорния, США). Рост U.urealyticum подтверждено микроскопически. Колонии U. urealyticum выглядели зернистыми и темно-коричневыми. В конце культивирования чашки с положительным результатом U. urealyticum изменили цвет с оранжевого на красный, и присутствие колоний U. urealyticum было морфологически подтверждено под микроскопом.
Мышиная модель эндометриоза
Мы разработали модель эндометриоза на животных, модифицировав метод Hirata et al. (31). Вкратце, как доноры в возрасте 6-8 недель (мыши WT, n = 48), так и самки мышей-реципиентов (WT, n = 24 и мыши с дефицитом Tlr2, n = 24) были примированы беременными гонадотропин сыворотки кобылы (PMSG) (Prospec, East Brunswick, NJ, USA) в дозе 5 МЕ / мышь в течение 48 часов для стимуляции роста эндометрия и синхронизации цикла течки.Через 48 часов донорскую мышь умерщвляли смещением шейки матки, удаляли рога матки и помещали в чашку, содержащую холодный PBS. После осторожного отделения серозной оболочки и миометрия ткань эндометрия измельчали лезвием бритвы. Фрагменты эндометрия суспендировали в 0,5 мл PBS и вводили в брюшную полость мышей-реципиентов с помощью иглы 18 размера в соотношении 1: 1 (донор к реципиенту). За три дня до индукции эндометриоза реципиенты (16 неинфицированных мышей: 8 мышей WT и 8 мышей Tlr2 — / — , каждая и 32 U.urealyticum инфицированных мышей: 16 мышей WT и 16 мышей Tlr2 — / — , каждая) инъецировали бактериями (1 × 10 6 /200 мкл / мышь) в полости брюшины. Эту инъекцию повторяли каждые 3 дня до 27-го дня после инъекции клеток эндометрия, всего 11 раз (рис. 1А). Мышей-реципиентов умерщвляли через 30 дней после индукции эндометриоза. Количество, расположение и размеры эктопических поражений оценивали под препарирующим микроскопом с последующей гистологической оценкой.Размеры эктопических поражений измеряли на основании двух перпендикулярных диаметров с помощью штангенциркуля. Объем поражения рассчитывали по формуле V = (4/3) πr 1 2 r 2 (r 1 и r 2 — радиусы, r 1
Рисунок 1 . Экспериментальный дизайн и характеристика эктопических поражений на мышиной модели эндометриоза, вызванного инфекцией U. urealyticum .Показан экспериментальный дизайн модели мышей с эндометриозом. Всего использовали шестнадцать неинфицированных мышей; По 8 мышей WT и 8 Tlr2 — / — мышей каждая. Также использовали 32 мышей, инфицированных U. urealyticum ; 16 мышей WT и 16 Tlr2 — / — , каждая (A) . На изображениях показаны эктопические поражения, полученные через 30 дней после индукции эндометриоза (B) . Пунктирными линиями обозначены эктопические поражения около матки (B) . Среднее количество и объем эктопических поражений показаны (C, D) .Также представлены изображения пятен H&E (40x и 400x) (E) . Концентрации IL-6, CXCL1 и CCL2 в супернатантах культур собранных внематочных эндометриоидных поражений измеряли с помощью ELISA (F) . Все эксперименты были проанализированы с помощью теста t и выражены как среднее значение ± стандартное отклонение. * P <0,05; ** P <0,01; *** P <0,001. — / — , выбивка; N.S, не имеет значения; Unf., незараженный; U. u, U.urealyticum .
Гистологическое окрашивание
Образцы, фиксированные формалином (ткани матки и эктопические поражения), полученные от моделируемых мышей, заливали парафином, разрезали на срезы размером 4 мкм и окрашивали гематоксилином и эозином (окрашивание H&E). Срезы исследовали на наличие гистологических признаков эндометриоза под микроскопом.
Получение и стимуляция перитонеальных мезотелиальных клеток мыши
PMC были выделены в основном из брюшины и некоторые из внешних поверхностей печени, селезенки и почек самок мышей 4-недельного возраста ( n = 12) и Tlr2-дефицитных ( n = 7), как описано ранее (27).Этот метод может уменьшить количество умерщвленных мышей-доноров PMC. Вкратце, у забитых мышей получали кусочки ткани, промывали путем инъекции ~ 50 мл фосфатно-солевого буфера (PBS; pH 7,4) и расщепляли 0,25% раствором трипсина / ЭДТА (Gibco, Базель, Швейцария) в течение 50 мин при 37 °. С. После удаления интактных тканей и тканевых остатков суспензию клеток центрифугировали при 500 × g в течение 5 мин. Осадок ресуспендировали в среде Игла, модифицированной Дульбекко (DMEM; Invitrogen, Grand Island, NY, USA), с добавлением 15% FBS (Invitrogen), 2 мМ L -глутамина (Gibco) и 1% пенициллина-стрептомицина (Gibco). и культивировали в течение ночи.На следующий день плавающие клетки удаляли и прилипшие клетки культивировали еще 3 дня. PMC высевали в 48-луночные планшеты в концентрации 2 × 10 5 клеток / лунку или в 6-луночные планшеты при концентрации 1 × 10 6 клеток / лунку и инкубировали в 5% CO 2 инкубатор при 37 ° C. На следующий день после посева клетки обрабатывали Pam 3 CSK 4 (InvivoGen, Сан-Диего, Калифорния, США), LPS (InvivoGen) или U. urealyticum при указанной множественности инфекции (MOI).
Иммуноферментный анализ, связанный с ферментом
Концентрации IL-6, CXCL1 и CCL2 в культуральных супернатантах PMC, стромальных клетках эндометрия (ESC) и эктопических поражениях определяли с помощью коммерческого набора для иммуноферментного анализа (ELISA) (R&D Systems, Миннеаполис, Миннесота, США, США). США) и планшет-ридер 450 нм (Bio Tek, Winooski, VT, USA).
Вестерн-блоттинг
PMC лизировали в ледяном буфере RIPA (Elpis Biotech, Daejeon, Корея), содержащем коктейль ингибиторов протеаз (Thermo Fisher Scientific, Waltham, Massachusetts, USA) и ингибитор фосфатазы (Thermo Fisher Scientific).Для клеточных лизатов выполняли стандартный вестерн-блоттинг (33), как описано, с использованием антител против MMP-2, а также к общему и фосфо-ERK, JNK и p-38 (Cell Signaling Technology, Беверли, Массачусетс, США). Иммунофлуоресцентно меченные антитела к кроличьему IgG (Cell Signaling Technology) использовали для визуализации вестерн-блоттинга с помощью Chemidoc Fusion solo S (Vilber, Collégien, France).
Проточная цитометрия
PMC засевали в 6-луночные планшеты в концентрации 1 × 106 клеток / лунку и инфицировали U.urealyticum (MOI 0,1) в течение 6, 12 и 24 часов. Клетки окрашивали следующими моноклональными антителами (mAb; BioLegend Inc., Сан-Диего, Калифорния, США): конъюгированные с флуоресцеинизотиоцианатом (FITC) молекулы анти-межклеточной адгезии-1 (ICAM-1; CD54) и антисосудистая клеточная адгезия. mAb к молекуле-1 (VCAM-1; CD106) (0,25 мкг / 10 6 клеток в 100 мкл для каждого). Контроли, соответствующие изотипу, запускали параллельно. Всего было подсчитано 10 000 клеток. Жизнеспособные лимфоциты были заблокированы на основании их профиля прямого и бокового рассеяния.Образцы были получены с использованием проточного цитометра BD FACSCalibur (BD Biosciences), а данные были проанализированы с использованием программного обеспечения BD CellQuest Pro (BD Biosciences).
Анализ прикрепления и конфокальная микроскопия
PMC, меченных CellTracker Orange (Molecular Probes, Юджин, Орегон, США) при 10 мкМ в течение 30 мин, высевали в 35-миллиметровые конфокальные чашки (SPL, размер отверстия; 20 мм) в концентрации 1,5 × 10 6 клеток / лунку и инкубировали в инкубаторе с 5% CO 2 при 37 ° C. На следующий день после посева клетки стимулировали ЕД.urealyticum при MOI 0,1 в течение 12 часов. PMC дважды промывали PBS для удаления неинфицированных бактерий. Для системы совместного культивирования ESC окрашивали CellTracker Green (Molecular Probes) при 10 мкМ в течение 30 минут и высевали в чашки с подготовленными PMC в концентрации 1 × 10 5 клеток / лунку. Затем эти клетки инкубировали в течение трех различных периодов времени, а именно 15, 30 и 60 минут. Клетки фиксировали 4% параформальдегидом (Sigma-Aldrich, Сент-Луис, Миссури, США) в течение 10 минут, а затем анализировали с использованием конфокального микроскопа LSM 700 (Zeiss, Jena, Германия) и программного обеспечения ZEN 2012 black edition.
Кроме того, мы выполнили анализ прикрепления с иммортализованной линией мезотелиальных клеток человека MeT-5A (любезный подарок доктора Д. Я. Кима из Сеульского национального университета, Сеул, Корея) и иммортализованной линией стромальных клеток эндометрия человека, T-HESC. (АТСС CRL-4003). Эти клетки окрашивали CellTracker Orange (MeT-5A) и CellTracker Green (T-HESC) соответственно. Мы обработали клетки MeT-5A Pam 3 CSK 4 (1 мкг / мл) вместо U. urealyticum . Клетки обрабатывали, как описано ранее в данном документе.
Выделение и культура стромальных клеток эндометрия мыши
Клетки эндометрия выделяли из матки самок мышей WT в возрасте 5-6 недель. Сначала удалили матку и разрезали ее продольно (34). Матки 8 мышей объединяли и инкубировали с 0,25% трипсином (Gibco) и 2,5% панкреатином (Sigma-Aldrich) в течение 60 минут при 4 ° C и 60 минут при 22 ° C. После переноса в 15 мл охлажденного льдом (4 ° C) сбалансированного солевого раствора Хэнка (HBSS; Gibco) переваренные матки встряхивали для высвобождения эпителиальных клеток.Ткани матки промывали и дополнительно трижды встряхивали, и полученные клеточные суспензии объединяли. После удаления эпителиальных клеток объединенные матки инкубировали в течение 30 минут при 37 ° C в HBSS с 0,02% EDTA, 0,05% трипсином и 400 ед / мл ДНКазы (Gibco). После добавления 2 мл FBS суспензию клеток фильтровали через нейлоновую сетку 40 микрон (Falcon) для удаления дебриса и центрифугировали при 500 × g в течение 10 мин. Клетки ресуспендировали в среде DMEM (без фенолового красного) / Hams F-12, смешанной 1: 1, с добавлением 20 мМ Hepes, 100 мг / мл стрептомицина, 100 Ед / мл пенициллина, 2 мМ L, -глутамина и 10 % FBS (все от Gibco).После 4 дней культивирования неприлипающие клетки удаляли путем смены среды с 48-часовыми интервалами, и эти прикрепленные ESC использовали для ELISA и исследований совместного культивирования.
Статистический анализ
Результаты ELISA, вестерн-блоттинга и проточной цитометрии были проанализированы с использованием повторных измерений ANOVA с последующими множественными сравнениями с использованием процедуры Тьюки. Среднее количество и объем эктопических поражений сравнивали между двумя группами с помощью теста t . Статистический анализ данных был выполнен с использованием GraphPad Prism версии 5.00 (GraphPad Software, Inc., Ла-Хойя, Калифорния, США). Данные представлены в виде среднего значения ± стандартное отклонение (SD). Статистически значимыми считались значения P <0,05 или меньше.
Результаты
U. urealyticum Инфекция усиливает развитие эктопических поражений у мыши, модельДля проверки гипотезы о том, что инфекция U. urealyticum в брюшной полости участвует в развитии эндометриоза, PMSG вводили в брюшную полость мышей-доноров и мышей-реципиентов, у которых синхронизированы их половые циклы. U. urealyticum вводили в брюшную полость мышей-реципиентов с 3-дневными интервалами за 3 дня до индукции эндометриоза (рис. 1А). При осмотре брюшной полости не было обнаружено признаков тяжелого острого воспаления, такого как спайки внутрибрюшинных органов и образование абсцесса. Повреждения, похожие на эндометриоз, развивались около матки (рис. 1В). Кроме того, в группе, инфицированной U. urealyticum , развилось больше эктопических поражений, чем в неинфицированной группе ( P <0.01), но не было никакой разницы между инфицированными мышами дикого типа и мышами с дефицитом Tlr2 (рис. 1C). Объем этих эктопических поражений был значительно больше в группе, инфицированной U. urealyticum , чем в неинфицированных группах, включающих мышей WT и Tlr2-дефицитных мышей ( P <0,001 и 0,01, соответственно; Рисунок 1D). В частности, объемы эктопических поражений были больше у мышей WT, чем у мышей с дефицитом Tlr2 ( P <0,01; Рисунок 1D).
Затем, чтобы дополнительно охарактеризовать эктопические поражения, полученные на нашей модели эндометриоза на мышах, поражения подвергали гистологическому исследованию с помощью окрашивания H&E.Как показано на рисунке 1E, эти поражения были заполнены воспалительными клетками и обломками люминальных эпителиальных клеток.
Таким образом, мы исследовали воспалительную реакцию при эктопических поражениях, вызванных инфекцией U. urealyticum . В результате инфицированные мыши WT продуцировали более высокие уровни CXCL1 и CCL2, чем неинфицированные мыши WT ( P <0,01 для каждого) и инфицированные Tlr2-дефицитные ( P <0,05 для каждой) мыши (рис. 1F). Однако не было значительных различий в продукции IL-6 инфицированных мышей WT по сравнению с таковыми у неинфицированных мышей WT и инфицированных мышей с дефицитом Tlr2.На этой модели эндометриоза мы также обнаружили, что внутрибрюшинная инфекция U. urealyticum приводит к развитию эктопических поражений.
U. urealyticum Индуцирует продукцию IL-6, CXCL1 и CCL2 в PMC и стромальных клетках эндометрияPMC стимулировали U. urealyticum при MOI 0,01, 0,05 и 0,1 в течение трех различных периодов времени (6, 12 и 24 ч), а цитокины и хемокины измеряли с помощью ELISA. Инфекция U. urealyticum приводила к дозозависимой продукции IL-6, CXCL1 и CCL2 в PMC в каждый момент времени ( P <0.01 или <0,001 при MOI 0,1) (дополнительный рисунок 1). Точно так же, когда ESC стимулировались различными MOI (0,01–0,1) U. urealyticum в течение 24 часов, продукция IL-6, CXCL1 и CCL2 была значительно увеличена дозозависимым образом по сравнению с неинфицированными ESC ( Дополнительный рисунок 2). Это указывает на то, что U. urealyticum может вызывать воспалительную реакцию со стороны PMC и ESC.
U. urealyticum Повышает секрецию IL-6, CXCL1 и CCL2 в PMC через TLR2-зависимый путьПредыдущие отчеты показали, что U.urealyticum обладает молекулярными структурами, которые могут распознаваться TLR2. Таким образом, мы исследовали, может ли U. urealyticum способствовать продукции цитокинов и хемокинов PMC посредством активации TLR2.
Во-первых, мы сравнили характеристики PMC, полученных от мышей WT и мышей с дефицитом Tlr2. WT и Tlr2-дефицитные PMC обрабатывали двумя типами лигандов TLR (лиганд TLR2, Pam 3 CSK 4 ; лиганд TLR4, LPS). Что касается продукции IL-6, CXCL1 и CCL2, Pam 3 CSK 4 увеличивал секрецию всех трех молекул из PMC WT, но не из PMC с дефицитом Tlr-2 ( P <0.001, для каждого). Напротив, не было значительной разницы в продукции IL-6, CXCL1 и CCL2 после стимуляции LPS между WT и PMC с дефицитом Tlr2 (рис. 2A). Эти результаты свидетельствуют о том, что PMC с дефицитом Tlr2 обладают недостаточностью в передаче сигналов TLR2, а PMC WT продуцируют значительные уровни медиаторов воспаления при стимуляции Pam 3 CSK 4 .
Рисунок 2 . U. urealyticum увеличивает продукцию цитокинов и хемокинов в PMC через TLR2.PMC с дефицитом WT и Tlr2 инкубировали с Pam 3 CSK 4 (100 нг / мл) и LPS (10 нг / мл) в течение 24 часов (A) . Применяли различные MOI U. urealyticum и инкубировали PMC в течение 6 часов (B) . Концентрации IL-6, CXCL1 и CCL2 в культуральном супернатанте измеряли с помощью ELISA. Данные представлены как среднее значение ± стандартное отклонение для трех образцов из одного эксперимента, представляющего три независимых эксперимента ( * P <0.05; ** P <0,01; *** P <0,001). — / — , выбивка; con, контроль; Unf., незараженный; N.S, не имеет значения.
Затем мы сравнили продукцию цитокинов и хемокинов между WT и Tlr2-дефицитными PMC при инфицировании U. urealyticum . После 6 часов инфицирования продукция IL-6, CXCL1 и CCL2 увеличивалась в PMC дикого типа, но не в PMC с дефицитом Tlr2 ( P <0,001 для каждого при MOI 0,05 и 0,1; рис. 2B). Далее по адресу U.urealyticum при MOI 0,01 продукция IL-6 и CCL2, но не CXCL1, была повышенной ( P <0,01 для каждого). Эти наблюдения показали, что инфекция U. urealyticum вызывает провоспалительный ответ в PMC через TLR2-зависимый путь.
U. urealyticum Активирует пути ERK и JNK в PMCВ ответ на бактериальную инфекцию TLR врожденной иммунной системы высвобождают медиаторы воспаления через сигнальные пути митоген-активируемой протеинкиназы (MAPK) (35).Чтобы исследовать, участвует ли передача сигналов MAPK, мы инфицировали WT и Tlr2-дефицитные PMC с помощью U. urealyticum с MOI 0,1. В PMC WT ERK фосфорилировался через 30, 60 и 120 минут, тогда как JNK фосфорилировался через 120 минут после заражения. Однако фосфорилирование ERK и JNK было значительно отменено в Tlr2-дефицитных PMC (Фигуры 3A, B). Не было значительных различий в фосфорилировании p38 между WT и Tlr2-дефицитными PMC в ответ на инфекцию U. urealyticum (рис. 3A).Затем мы провели анализ ингибиторов, чтобы определить, важны ли пути ERK и JNK для индукции провоспалительных состояний в PMC, подвергшихся воздействию U. urealyticum . Ингибиторы ERK (PD98059) и JNK (SP600125) подавляли продукцию IL-6, CXCL1 и CCL2 в PMC WT, инфицированных U. urealyticum (рис. 3C). Эти результаты показали, что U. urealyticum усиливает продукцию IL-6, CXCL1 и CCL2 через пути ERK и JNK в PMC.
Рисунок 3 . U. urealyticum усиливает активацию MAPK в PMC. PMC с дефицитом WT и Tlr2 инфицировали U. urealyticum с MOI 0,1, и белок экстрагировали в указанные моменты времени. Фосфорилирование ERK, JNK и p-38 анализировали вестерн-блоттингом (A) . Относительную плотность фосфорилирования ERK и JNK после инфицирования U. urealyticum сравнивали с таковой β-актина (B) . После предварительной обработки PMC дикого типа 40 мкМ ингибитора ERK (PD98059) и 20 мкМ ингибитора JNK (SP600125) в течение 2 часов клетки инфицировали U.urealyticum при MOI 0,1 в течение 6 ч (C) . Концентрации IL-6, CXCL1 и CCL2 в супернатантах культур измеряли с помощью ELISA. Данные представлены как среднее значение ± стандартное отклонение для трех образцов из одного эксперимента, представляющего три независимых эксперимента (*** P <0,001). — / — , выбивка; N.S, не имеет значения.
U. urealyticum Усиливает экспрессию ICAM-1 и VCAM-1Экспрессия молекул клеточной адгезии, таких как ICAM-1 и VCAM-1, играет жизненно важную роль в развитии эндометриоза, особенно на ранних стадиях патогенеза (36, 37).Соответственно, мы исследовали, влияет ли U. urealyticum на экспрессию этих маркеров в PMC. По сравнению с группой неинфицированных PMC WT, PMC WT увеличивали экспрессию ICAM-1 и VCAM-1 на U. urealyticum через 12 и 24 часа ( P <0,001 для каждой; Рисунки 4A, B). В инфицированных Tlr2-дефицитных PMC эти молекулы также были активированы через 24 часа по сравнению с уровнями в неинфицированной Tlr2-дефицитной группе PMC ( P <0,001 для каждой; рисунки 4A, B), но это увеличение было меньше по сравнению с наблюдаемыми для группы инфицированных WT PMC ( P <0.001, для каждого; Рисунки 4A, B). Эти результаты предполагают, что U. urealyticum значительно усиливает экспрессию ICAM-1 и VCAM-1 в PMC, и что несколько механизмов, включая путь TLR2, могут контролировать экспрессию этих молекул адгезии.
Рисунок 4 . Инфекция U. urealyticum увеличивает экспрессию молекул адгезии в PMC. ЧМК с дефицитом WT и Tlr2 инфицировали U. urealyticum (MOI 0,1) в течение 6–24 часов. Экспрессию ICAM-1 (A) и VCAM-1 (B) анализировали с помощью проточной цитометрии.Показаны репрезентативные графики экспрессии ICAM-1 (C) и VCAM-1 (D) . Все эксперименты проводили в трех повторностях. Данные представлены как среднее значение ± стандартное отклонение ( n = 3). *** P <0,001 по сравнению с соответствующими группами. N.S, не имеет значения; — / — , выбивка; Unf., незараженный; MFI, средняя интенсивность флуоресценции канала.
U. urealyticum Усиливает экспрессию MMP-2 в PMCМатричные металлопротеиназы (ММП) играют решающую роль в ремоделировании тканей, связанных с различными патологическими или физиологическими процессами, такими как инфильтрация и распространение злокачественных опухолей или трофобластов плаценты (38).Затем мы определили, модулирует ли U. urealyticum экспрессию MMP в PMC. Как показано на Фигуре 5, инфекция U. urealyticum значительно увеличивала уровни экспрессии MMP-2 в PMC дикого типа через 12 ( P <0,01) и 24 часа ( P <0,001) по сравнению с таковыми в Tlr2-дефицитных ЧВК. Однако экспрессия MMP-2 не усиливалась инфекцией U. urealyticum в Tlr2-дефицитных PMC. Наши результаты показывают, что U. urealyticum усиливает экспрессию активной MMP-2 в PMC и что она блокируется в PMC с дефицитом Tlr2.
Рисунок 5 . U. urealyticum усиливает экспрессию MMP-2 в PMC. PMC с дефицитом WT и Tlr2 были инфицированы U. urealyticum (MOI 0,1). Белок экстрагировали в указанные моменты времени. Экспрессию MMP-2 исследовали вестерн-блоттингом (A) . Относительную плотность активации MMP-2 после инфицирования U. urealyticum сравнивали с таковой β-актина (B) . Данные представлены как среднее значение ± стандартное отклонение ( n = 3).** P <0,01; *** P <0,001. — / — , выбивка.
Присоединению стромальных клеток эндометрия к мезотелиальным клеткам способствует
U. urealyticum Инфекция на основе системы совместного культивированияМы дополнительно исследовали, модулирует ли U. urealyticum адгезию ESC к PMC, используя нашу систему совместного культивирования. Для этого мы инфицировали мезотелиальные клетки U. urealyticum в течение 12 часов, чтобы вызвать экспрессию молекул адгезии и ММП, а затем совместно инкубировали стромальные клетки эндометрия с инфицированными мезотелиальными клетками.
В эксперименте с мезотелиальными клетками человека (MeT-5A) и стромальными клетками эндометрия (T-HESC) лиганд TLR2, Pam 3 CSK 4 , увеличивал прикрепление T-HESC к MeT-5A по сравнению с таковым. в группе, не получавшей лечения ( P <0,01; Фигуры 6A, B). Далее мы провели эксперимент по прикреплению с ESC и PMC, полученными от мышей. Прикрепление ESC было значительно увеличено при совместном культивировании с инфицированными PMC WT по сравнению с неинфицированными PMC WT ( P <0.05; Рисунок 6C). Более того, это прикрепление было увеличено в инфицированных клетках WT по сравнению с инфицированными PMC с дефицитом Tlr2 ( P <0,01; Фигуры 6C, D). Однако не было значительных различий для Tlr2-дефицитных PMC с или без инфекции U. urealyticum (Рисунок 6C). Наши результаты показали, что U. urealyticum облегчает прикрепление ESC к PMC посредством передачи сигналов TLR2.
Рисунок 6 . U. urealyticum способствует прикреплению стромальных клеток эндометрия к мезотелиальным клеткам через TLR2.MeT-5A и PMC стимулировались Pam 3 CSK 4 и U. urealyticum или без него. После 12-часового заражения T-HESC и ESC инкубировали в течение 15, 30 и 60 минут (A – D) . Присоединенные T-HESC и ESC были подсчитаны с использованием программного обеспечения ImageJ (A, C) . Изображения были получены через 60 мин с помощью объективов 100x (B) и 10x (D) с помощью конфокальной лазерной сканирующей микроскопии. Все эксперименты проводили в трех повторностях. Данные представлены как среднее значение ± стандартное отклонение ( n = 3). * P <0,05; ** P <0,01. N.S, не имеет значения; — / — , выбивка. Unf., незараженный.
Обсуждение
В этом исследовании мы исследовали, может ли инфекция таза вызывать эндометриоз и какой механизм в этом участвует. Многие предыдущие сообщения о патогенезе эндометриоза продемонстрировали аномальные особенности самого эндометрия, биосинтеза гормонов, иммунных клеток, ангиогенеза, нейрогенеза и гибели клеток (4, 5, 39).Однако роль ЧВК недооценивается (40). Кроме того, недавно возникло воспаление брюшины, вызванное бактериями, как новый возможный патогенез эндометриоза. Несколько исследований предположили связь между бактериальной инфекцией женских половых путей и эндометриозом (11, 14, 41, 42). Таким образом, новое понимание роли перитонеального микроокружения в бактериальных инфекциях позволит лучше понять эндометриоз. U. urealyticum — один из наиболее распространенных комменсальных микроорганизмов, обитающих в женских половых путях и вызывающий многие акушерские и гинекологические расстройства (15–17).Однако важность инфекции U. urealyticum с точки зрения эндометриоза до сих пор игнорируется. Таким образом, мы предположили, что воспаление брюшины и нарушение ее целостности, вызванное U. urealyticum , может способствовать инициации и прогрессированию тазового эндометриоза, вероятно, через TLR2.
На основе нашей недавно разработанной модели in vivo на мышах количество и размер эктопических поражений были значительно увеличены в U.urealyticum -инфицированные мыши по сравнению с контрольными мышами (рис. 1). Наши исследования in vitro представляли реакцию PMC на инфекцию U. urealyticum и взаимодействие между ESC и PMC на начальной стадии развития эндометриоза. Между тем, исследование in vivo на животных моделирует последующую стадию прогрессирования эндометриоза, поскольку эктопические поражения наблюдались через 30 дней после трансплантации. Недавно Azuma et al. (12) сообщили, что повторная внутрибрюшинная инъекция бактериального эндотоксина (ЛПС) может вызывать хроническое воспаление брюшины и воспроизводить эндометриоз у мышей.Однако это исследование вызвало эндометриоз эндотоксином, а не живыми бактериями. Насколько нам известно, это первая животная модель эндометриоза, вызванного внутрибрюшинной микробной инфекцией.
Здесь, при оценке взаимодействия между U. urealyticum и PMC, мы показали, что эта бактерия может увеличивать не только продукцию IL-6, CXCL1 и CCL2, но также экспрессию ICAM-1, VCAM-1, и MMP-2 от ЧВК. Существует множество доказательств, показывающих связь между воспалением при ПМК и развитием эндометриоза. Эксперименты in vitro продемонстрировали прикрепление фрагмента эндометрия только к участку поврежденной брюшины с обнажением базальной мембраны или внеклеточного матрикса (43). Более того, медиаторы воспаления (цитокины, хемокины и факторы роста) аномально экспрессируются в перитонеальной жидкости женщин с эндометриозом (44–48). Эта местная воспалительная микросреда способствует росту и поддержанию эктопических поражений за счет адгезии эндометрия и брюшины, инвазии, ангиогенеза и пролиферации за счет потери плотного соединения, ММП и эпителиально-мезенхимального перехода (40, 49).
Концентрации IL-1β, фермента, превращающего IL-1, IL-8 и регулируемых при активации нормальных Т-клеток, экспрессируемых и секретируемых (RANTES), увеличивались в перитонеальной жидкости пациентов с эндометриозом (45, 47). Аналогичным образом было обнаружено, что IL-1β, IL-6, TNF-α и простагландин E 2 (PGE2) богаты перитонеальной жидкостью у женщин с эндометриозом (44, 46).
Эти цитокины и хемокины играют определенную роль в развитии эндометриоза. IL-6 — провоспалительный цитокин, который активирует Т- и В-клетки и способствует привлечению макрофагов (5, 40).IL-8, хемоаттрактант для макрофагов и нейтрофилов, интенсивно секретируется из брюшины женщин с эндометриозом при стимуляции IL-1 и TNF-α (50). Поскольку у грызунов нет гомолога IL-8, предполагается, что мыши компенсируют отсутствие IL-8 лигандами CXCL1 и CXCL2 (51). CXCL1 обладает нейтрофильной хемоаттрактантной активностью через связывание CXCR2 (52), но мало изучен в отношении эндометриоза. CCL2 рекрутирует макрофаги и может участвовать в росте и поддержании эктопического эндометрия, секретируя цитокины и факторы роста и напрямую стимулируя пролиферацию клеток эндометрия (53).Ранее было обнаружено, что уровни CCL2 значительно коррелировали со стадией эндометриоза (54) и были выше у женщин с эндометриозом, чем у женщин с трубным бесплодием (55). Точно так же в перитонеальной жидкости женщин с эндометриозом было обнаружено, что уровни CXCL1, CXCL2, CCL2, MCP-3 и HGF значительно выше, чем у контрольных лиц (40, 53, 56).
Однако в большинстве клинических исследований измеряли цитокины из перитонеальной жидкости, на которые могли влиять различные компоненты, такие как PMC, иммунные клетки и эктопические поражения (40).В этом исследовании мы наблюдали увеличение продукции и секреции IL-6, CCL2 и CXCL1 из PMC в ответ на инфекцию U. urealyticum . Эти результаты согласуются с предположениями других ученых о том, что ЧМК могут активно участвовать в создании провоспалительной среды в брюшине (40, 49). Важным этапом развития эндометриоза является адгезия и прикрепление клеток эндометрия к мезотелию таза (57). Некоторые молекулы адгезии, такие как интегрины α2β1 и α3β1, P-кадгерин, ICAM-1 и VCAM-1, считаются ключевыми факторами, регулирующими прикрепление клеток эндометрия (40, 58, 59).Хотя известно, что провоспалительные цитокины активируют эти молекулы адгезии (40), неясно, увеличиваются ли эти молекулы, когда PMC инфицированы U. urealyticum . Мы наблюдали значительную активацию ICAM-1 и VCAM-1 в PMC после инфекции U. urealyticum . Их повышенная экспрессия может обеспечить подходящие сайты для прикрепления клеток эндометрия.
Затем мы исследовали продукцию ММП из PMC, поскольку инвазия клеток эндометрия в мезотелий таза считается важным фактором развития эндометриоза (40).В нескольких исследованиях сообщалось о более высокой экспрессии MMP-2, MMP-9, MMP-14 и MMP-24 в эутопическом эндометрии или внематочных поражениях у женщин с эндометриозом по сравнению с уровнями у женщин без эндометриоза (60–62). Также было показано, что перитонеальные жидкости и сыворотки пациентов с эндометриозом содержат более высокие уровни ММП-2, чем контрольные (63). В нашем исследовании экспрессия MMP-2 также была значительно увеличена в PMC из-за инфекции U. urealyticum . Эта перитонеальная экспрессия MMP может способствовать ремоделированию внеклеточного матрикса во время развития эндометриоза (40).
В ходе экспериментов по совместному культивированию мы обнаружили, что ESC, прикрепленные к PMC, и что инфицированные PMC U. urealyticum- показали значительно более сильное прикрепление к ESC по сравнению с неинфицированными PMC. Об аналогичном исследовании совместного культивирования без инфекции сообщили Nair et al. (64). Они заметили, что ESC прикрепляются к PMC через 1 час, а инвазия ESC происходит через 6 часов. Благодаря взаимодействиям между PMC и ESC в этой системе совместного культивирования несколько генов, связанных с эндометриозом, включая CD44, ERK, CSF-1 и c-Met, были активированы как в PMC, так и в ESC.Другое исследование совместного культивирования с человеческими ESC и человеческими PMC показало ослабление целостности PMC в начале инвазии ESC и потерю адгезии PMC к субстрату (65). Эти исследования показывают, что функциональные и морфологические изменения PMC потенцируют развитие эндометриоза, который может быть вызван U. urealyticum (15-17).
В качестве следующего шага мы исследовали, какой механизм задействован в активации PMC после инфекции U. urealyticum . U. urealyticum -производные липид-ассоциированные мембранные белки (LAMP), которые являются липопротеинами, считаются основным фактором активности TLR2 (66). В этом исследовании мы обнаружили, что U. urealyticum вызывает серию воспалительных реакций в PMC, главным образом через TLR2. Более того, Tlr2-дефицитные мыши секретировали более низкие уровни провоспалительного цитокина (IL-6) и хемокинов (CCL2 и CXCL1) и демонстрировали подавленную экспрессию молекулы адгезии (ICAM-1 и VCAM-1) и MMP-2 (рисунки 2–2). 5).Кроме того, прикрепление ESC к PMC, индуцированное инфекцией U. urealyticum , было значительно снижено в Tlr2-дефицитных PMC (рис. 6). Недавно сообщалось, что инфекция U. urealyticum усиливает TLR2-опосредованную продукцию IL-6 амниотическими эпителиальными клетками (15). Наши результаты показывают, что иммунный ответ хозяина против инфекции U. urealyticum в основном опосредуется через TLR2.
Мы дополнительно оценили транскрипционные факторы, активируемые в ответ на U.urealyticum . Фосфорилирование ERK и JNK наблюдали, когда U. urealyticum применяли к PMC. Однако эти сигнальные события были значительно уменьшены в PMC мышей с дефицитом Tlr2. Эти результаты также подтверждают, что передача сигналов TLR2 необходима для активации ERK и JNK MAP киназ в PMCs (Fig. 1-3).
У нашего исследования есть некоторые ограничения. Во-первых, он не проводился с клетками пациентов с эндометриозом. Однако, когда мы исследовали прикрепление клеток T-HESC к клеткам MeT-5A с использованием нашей системы совместного культивирования, лиганд TLR2 увеличивал прикрепление этих клеток.Этот эксперимент с человеческими клетками убедительно подтверждает наши результаты, полученные на мышах. Кроме того, мы не исследовали наличие перитонеальной инфекции U. urealyticum у женщин с тазовым эндометриозом. Если бы U. urealyticum можно было выделить из смыва или ткани брюшины, это могло бы продемонстрировать прямую связь между этими бактериями и заболеванием. Однако, по мнению Кобаяши и соавт. (67), тазовая инфекция, инициирующая адгезию и рост эктопической ткани эндометрия, подавляется врожденным иммунитетом хозяина и после стерильного воспаления может продолжаться и прогрессировать до эндометриоза.Поэтому выявление микроорганизмов в полости малого таза у женщин с развитым эндометриозом менее вероятно.
Таким образом, мы наблюдали, что инфекция U. urealyticum увеличивает воспалительные медиаторы, молекулы адгезии и экспрессию MMP-2 в PMC через передачу сигналов TLR2 и способствует эндометриозу. Мы представляем убедительные доказательства, которые могут поддержать теорию инфекции при развитии эндометриоза. Насколько нам известно, это первое исследование, предполагающее, что U.urealyticum может спровоцировать тазовый эндометриоз на животной модели. Кроме того, в этом исследовании мы разработали новую животную модель эндометриоза, вызванного инфекцией U. urealyticum . Благодаря нашим результатам мы представляем теорию о том, что воспаление тазовых органов, вызванное инфекцией, способствует возникновению и прогрессированию эндометриоза. В заключение, воспаление мезотелия, вызванное U. urealyticum , может быть одной из причин тазового эндометриоза. Профилактика тазовой инфекции может снизить распространенность эндометриоза.Для выяснения этой связи необходимы дальнейшие исследования.
Заявление о доступности данныхВсе наборы данных, созданные для этого исследования, включены в рукопись / дополнительные файлы.
Заявление об этикеИсследование на животных было рассмотрено и одобрено институциональным комитетом по уходу и использованию животных (IACUC; утвержденный номер протокола: P-17-09-E-01) Университета Коньян.
Авторские взносы
EN, DK и SL разработали и разработали исследование.EN выполнил сбор данных. EN, DK, JL, J-SK, JP и SL выполнили анализ и интерпретацию данных. EN, JH и SL составили рукопись. Все авторы участвовали в критической редакции рукописи.
Финансирование
Эта работа была поддержана грантами Корейского национального исследовательского фонда (NRF) (2016RIDIA3B03935549), Программы приоритетных исследовательских центров через Национальный исследовательский фонд Кореи (NRF), финансируемой Министерством образования, науки и технологий (NRF-2017R1A6A1A03015713). ) и Исследовательский фонд Мёнгок Университета Коньян (2014-04).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим К. Ли из Исследовательского института Мёнгок за техническую поддержку.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389 / fimmu.2019.02373 / полный # дополнительный материал
Сокращения
ESC, стромальные клетки эндометрия; ММП, матриксная металлопротеиназа; PMC, мезотелиальная клетка брюшины; WT, дикий тип.
Список литературы
2. Sampson JA. Метастатический или эмболический эндометриоз из-за менструального распространения ткани эндометрия в венозное кровообращение. Ам Дж. Патол . (1927) 3: 93–110.43.
Google Scholar
5. Мэй К.Э., Кондуит-Халберт С.А., Вильяр Дж., Кертли С., Кеннеди С.Х., Беккер С.М.Периферические биомаркеры эндометриоза: систематический обзор. Обновление Hum Reprod. (2010) 16: 651–74. DOI: 10.1093 / humupd / dmq009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Барч Э., Милевски Л., Дзюникз П., Камински П., Плоски Р., Малейчик Дж. Перитонеальные цитокины и образование адгезии при эндометриозе: обратная связь с концентрацией фактора роста эндотелия сосудов. Fertil Steril. (2012) 97: 1380–6.e1. DOI: 10.1016 / j.fertnstert.2012.03.057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Хан К.Н., Китадзима М., Хираки К., Ямагути Н., Катамине С., Мацуяма Т. и др. Escherichia coli Загрязнение менструальной крови и влияние бактериального эндотоксина на эндометриоз. Fertil Steril. (2010) 94: 2860–3.e1-3. DOI: 10.1016 / j.fertnstert.2010.04.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Адзума Ю., Танигучи Ф., Накамура К., Нагира К., Кхине Ю.М., Кияма Т. и др.Липополисахарид способствует развитию поражений, подобных эндометриозу у мышей, посредством пути ядерный фактор-каппа B. Am J Reprod Immunol. (2017) 77: e12631. DOI: 10.1111 / aji.12631
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Иба Y, Харада Т., Хори С., Деура I, Ивабе Т., Теракава Н. Пролиферация эндометриоидных стромальных клеток, стимулируемая липополисахаридами, посредством индукции фактора некроза опухоли альфа и экспрессии интерлейкина-8. Fertil Steril. (2004) 82 (Дополнение 3): 1036–42. DOI: 10.1016 / j.fertnstert.2004.04.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Lin WC, Chang CY, Hsu YA, Chiang JH, Wan L. Повышенный риск эндометриоза у пациентов с инфекцией нижних половых путей: общенациональное когортное исследование. Медицина. (2016) 95: e2773. DOI: 10.1097 / MD.0000000000002773
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Триантафилу М., Де Гланвиль Б., Абоклаиш А.Ф., Спиллер О.Б., Котеча С., Триантафилу К.Синергическая активация толл-подобных рецепторов (TLR) 2/6 и 9 в ответ на Ureaplasma parvum & urealyticum в амниотических эпителиальных клетках человека. PLoS ONE. (2013) 8: e61199. DOI: 10.1371 / journal.pone.0061199
CrossRef Полный текст | Google Scholar
16. Ли М.Й., Ким М.Х., Ли В.И., Кан С.И., Чон Ю.Л. Распространенность и чувствительность к антибиотикам Mycoplasma hominis и Ureaplasma urealyticum у беременных. Йонсей Мед Дж. (2016) 57: 1271–5. DOI: 10.3349 / ymj.2016.57.5.1271
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Дегучи Т., Йошида Т., Миядзава Т., Ясуда М., Тамаки М., Исико Х. и др. Ассоциация Ureaplasma urealyticum (биовар 2) с негонококковым уретритом. Sex Transm Dis. (2004) 31: 192–5. DOI: 10.1097 / 01.OLQ.0000114653.26951.71
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Ёсида Т., Дегучи Т., Меда С., Кубота Ю., Тамаки М., Ёкои С. и др.Количественное определение Ureaplasma parvum (биовар 1) и Ureaplasma urealyticum (биовар 2) в образцах мочи мужчин с уретритом и без него с помощью полимеразной цепной реакции в реальном времени. Sex Transm Dis. (2007) 34: 416–9. DOI: 10.1097 / 01.olq.0000243621.89212.40
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Kasprzykowska U, Elias J, Elias M, Maczynska B, Sobieszczanska BM. Колонизация нижних отделов урогенитального тракта с помощью Ureaplasma parvum может вызвать бессимптомное инфицирование верхних отделов репродуктивной системы у женщин: предварительное исследование. Arch Gynecol Obstet. (2014) 289: 1129–34. DOI: 10.1007 / s00404-013-3140-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Colmont CS, Raby AC, Dioszeghy V, Lebouder E, Foster TL, Jones SA, et al. Мезотелиальные клетки брюшины человека отвечают на бактериальные лиганды через специфическую подгруппу Toll-подобных рецепторов. Циферблатная трансплантация нефрола. (2011) 26: 4079–90. DOI: 10.1093 / ndt / gfr217
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Ромеро Р., Эспиноза Дж., Гонсалвес Л. Ф., Кусанович Дж. П., Фрил Л. А., Ниен Дж. К.. Воспаление при преждевременных и срочных родах. Semin Fetal Neonatal Med. (2006) 11: 317–26. DOI: 10.1016 / j.siny.2006.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Moco NP, Martin LF, Pereira AC, Polettini J, Peracoli JC, Coelho KI, et al. Экспрессия генов и локализация белков TLR-1, -2, -4 и -6 в амниохорионных мембранах беременностей, осложненных гистологическим хориоамнионитом. Eur J Obstet Gynecol Reprod Biol. (2013) 171: 12–7. DOI: 10.1016 / j.ejogrb.2013.07.036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Като С., Юдзава И., Цубои Н., Маруяма С., Морита Ю., Мацугути Т. и др. Эндотоксин-индуцированная экспрессия хемокинов в мезотелиальных клетках брюшины мышей: роль толл-подобного рецептора 4. J Am Soc Nephrol. (2004) 15: 1289–99.
PubMed Аннотация | Google Scholar
27. Пак Дж. Х., Ким Ю. Г., Шоу М., Каннеганти Т. Д., Фудзимото Ю., Фукасе К. и др.Передача сигналов Nod1 / RICK и TLR регулирует хемокиновый и противомикробный врожденный иммунный ответ в мезотелиальных клетках. J Immunol. (2007) 179: 514–21. DOI: 10.4049 / jimmunol.179.1.514
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Ким Т.Х., Ли КБ, Кан MJ, Пак Дж.Х. Критическая роль Toll-подобного рецептора 2 в иммунных ответах, опосредованных Bacteroides fragilis , в мезотелиальных клетках брюшины мыши. Microbiol Immunol. (2012) 56: 782–8.DOI: 10.1111 / j.1348-0421.2012.00505.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Сяо Дж, Гун И, Чен Й, Ю Д, Ван Х, Чжан Х и др. IL-6 способствует переходу мезотелиальных клеток брюшины человека из эпителия в мезенхиму, возможно, через сигнальный путь JAK2 / STAT3. Am J Physiol Renal Physiol. (2017) 313: F310 – F8. DOI: 10.1152 / ajprenal.00428.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Д’Инзео Т., Де Анжелис Дж., Фиори Б., Менчинелли Дж., Лиотти Ф.М., Морандотти Г.А. и др. Сравнение Mycoplasma IES, mycofast Revolution и Mycoplasma IST2 для выявления генитальных микоплазм в клинических образцах. J Infect Dev Ctries. (2017) 11: 98–101. DOI: 10.3855 / jidc.8039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Хирата Т., Осуга Ю., Йошино О., Хирота И., Харада М., Такемура Ю. и др. Разработка экспериментальной модели эндометриоза с использованием мышей, которые повсеместно экспрессируют зеленый флуоресцентный белок. Hum Reprod. (2005) 20: 2092–6. DOI: 10.1093 / humrep / dei012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Билотас М., Мересман Г., Стелла I, Суэльдо С., Баранао, Род-Айленд. Влияние ингибиторов ароматазы на эктопический рост эндометрия и перитонеальную среду на мышиной модели эндометриоза. Fertil Steril. (2010) 93: 2513–8. DOI: 10.1016 / j.fertnstert.2009.08.058
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Но EJ, Кан MJ, Jeong YJ, Lee JY, Park JH, Choi HJ и др. Витаферин А подавляет воспалительные реакции, индуцированные Fusobacterium nucleatum и Aggregatibacter actinomycetemcomitans в макрофагах. Mol Med Rep. (2016) 14: 983–8. DOI: 10.3892 / mmr.2016.5326
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Де Клерк К., Хеннес А., Вринс Дж. Выделение эпителиальных и стромальных клеток эндометрия мыши для децидуализации in vitro . J Vis Exp. (2017) 121: e55168. DOI: 10.3791 / 55168
CrossRef Полный текст | Google Scholar
37. О Й. К., Ха Й. Р., Йи К. В., Пак Х. Т., Шин Дж. Х., Ким Т. и др. Повышенная экспрессия резистина в эктопической ткани эндометрия у женщин с эндометриозом. Am J Reprod Immunol. (2017) 78: e12726. DOI: 10.1111 / aji.12726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Кодати В.Л., Говиндан С., Мовва С., Поннала С., Хасан К.Роль инфекции шигеллы в эндометриозе: новая гипотеза. Med Hypotheses. (2008) 70: 239–43. DOI: 10.1016 / j.mehy.2007.06.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Хан К.Н., Фудзишита А., Хираки К., Китадзима М., Накашима М., Фусики С. и др. Гипотеза бактериального заражения: новая концепция эндометриоза. Reprod Med Biol. (2018) 17: 125–33. DOI: 10.1002 / rmb2.12083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Харада Т., Йошиока Х., Йошида С., Ивабе Т., Онохара Ю., Таникава М. и др. Повышенный уровень интерлейкина-6 в перитонеальной жидкости у бесплодных пациентов с активным эндометриозом. Am J Obstet Gynecol. (1997) 176: 593–7. DOI: 10.1016 / S0002-9378 (97) 70553-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Берсингер Н.А., фон Ротен С., Вундер Д.М., Райо Л., Дреер Э., Мюллер М.Д. PAPP-A и остеопротегерин вместе с интерлейкином-8 и RANTES повышены в перитонеальной жидкости у женщин с эндометриозом. Am J Obstet Gynecol. (2006) 195: 103–8. DOI: 10.1016 / j.ajog.2005.12.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Sikora J, Mielczarek-Palacz A, Kondera-Anasz Z. Дисбаланс цитокинов из семейства интерлейкинов-1 — роль в патогенезе эндометриоза. Am J Reprod Immunol. (2012) 68: 138–45. DOI: 10.1111 / j.1600-0897.2012.01147.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Янг В.Дж., Ахмад С.Ф., Дункан В.С., Хорн А.В..Роль TGF-β в патофизиологии перитонеального эндометриоза. Обновление Hum Reprod. (2017) 23: 548–59. DOI: 10.1093 / humupd / dmx016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Wu M-H, Hsiao K-Y, Tsai S-J. Эндометриоз и возможные маркеры воспаления. Gynecol Minim Invasive Ther. (2015) 4: 61–7. DOI: 10.1016 / j.gmit.2015.05.001
CrossRef Полный текст | Google Scholar
51. Ли Дж., Какалано Дж., Камерото Т, Той К., Мур М.В., Вуд В.И.Связывание хемокинов и активность, опосредованная рецептором IL-8 мыши. Дж Иммунол . (1995) 155: 2158–64.
PubMed Аннотация | Google Scholar
52. Савант К.В., Полури К.М., Дутта А.К., Сепуру К.М., Трошкина А., Гарофало Р.П. и др. Хемокин CXCL1 опосредованный рекрутинг нейтрофилов: роль взаимодействий гликозаминогликанов. Научный доклад (2016) 6: 33123. DOI: 10.1038 / srep33123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Arici A, Oral E, Attar E, Tazuke SI, Olive DL.Концентрация хемотаксического белка-1 моноцитов в перитонеальной жидкости у женщин с эндометриозом и его модуляция экспрессии в мезотелиальных клетках. Fertil Steril. (1997) 67: 1065–72. DOI: 10.1016 / S0015-0282 (97) 81440-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Zeyneloglu HB, Senturk LM, Seli E, Oral E, Olive DL, Arici A. Роль хемотаксического белка-1 моноцитов в формировании внутрибрюшинной адгезии. Hum Reprod. (1998) 13: 1194–9.DOI: 10.1093 / humrep / 13.5.1194
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Tao Y, Zhang Q, Huang W, Zhu H, Zhang D, Luo W. Перитонеальный лептин, MCP-1 и TNF-α в патогенезе бесплодия, связанного с эндометриозом. Am J Reprod Immunol. (2011) 65: 403–6. DOI: 10.1111 / j.1600-0897.2010.00920.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Чен Й, Ван К., Сюй И, Го П, Хун Б., Цао И и др. Изменение клеток-супрессоров миелоидного происхождения, хронических воспалительных цитокинов и экзосомальной миРНК способствует развитию перитонеального иммунного расстройства у пациентов с эндометриозом. Reprod Sci. (2019) 26: 1130–8. DOI: 10.1177 / 193371
08923PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Чен Г.Т., Тай CT, Йе Л.С., Ян Т.С., Цай HD. Идентификация подтипов кадгерина, присутствующих в брюшине человека и эндометриоидных поражениях: потенциальная роль Р-кадгерина в развитии эндометриоза. Mol Reprod Dev. (2002) 62: 289–94. DOI: 10.1002 / mrd.10121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59.Шутт А.К., Аткинс К.А., Слэк-Дэвис Дж.К., Стовалл Д.В. VCAM-1 на брюшину и интегрин α4β1 в эндометрии и их значение при эндометриозе. Int J Gynecol Pathol. (2015) 34: 85–9. DOI: 10.1097 / PGP.0000000000000118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Chung HW, Lee JY, Moon HS, Hur SE, Park MH, Wen Y, et al. Матричная металлопротеиназа-2, мембранная матричная металлопротеиназа 1-го типа и тканевой ингибитор экспрессии металлопротеиназы-2 в эктопическом и эутопическом эндометрии. Fertil Steril. (2002) 78: 787–95. DOI: 10.1016 / S0015-0282 (02) 03322-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Хуанг Х. Ф., Хун ЛХ, Тан Й, Шэн Дж. З. Матрикс-металлопротеиназа 2 связана с изменениями стероидных гормонов в сыворотке крови и перитонеальной жидкости пациентов с эндометриозом. Fertil Steril. (2004) 81: 1235–9. DOI: 10.1016 / j.fertnstert.2003.10.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Наир А.С., Наир Х.Б., Люциди Р.С., Киршнер А.Дж., Шенкен Р.С., Текмал Р.Р. и др. Моделирование раннего эндометриоидного поражения: совместное культивирование клеток мезотелия и эндометрия увеличивает инвазию эндометрия и изменяет транскрипцию мезотелиальных и эндометриальных генов. Fertil Steril. (2008) 90 (4 доп.): 1487–95. DOI: 10.1016 / j.fertnstert.2007.09.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Chen Z, Dai Y, Dong Z, Li M, Mu X, Zhang R, et al. Совместное культивирование стромальных клеток эндометрия и мезотелиальных клеток брюшины для модели in vitro эндометриоза . Integr Biol. (2012) 4: 1090–5. DOI: 10.1039 / c2ib00172a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Ye GY, Wang KY, Gui QD, Wang M. Ureaplasma urealyticum -производные липидно-ассоциированные мембранные белки вводят цитокины IL-6, IL-8 и TNF-α в амниотические эпителиальные клетки человека через Toll-подобный рецептор 2. J Zhejiang Univ Sci B. (2018) 19: 654–61. DOI: 10.1631 / jzus.B1800005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67.Кобаяси Х., Хигашиура Й., Сигетоми Х., Кадихара Х. Патогенез эндометриоза: роль начальной инфекции и последующего стерильного воспаления (Обзор). Mol Med Rep. (2014) 9: 9–15. DOI: 10.3892 / mmr.2013.1755
PubMed Аннотация | CrossRef Полный текст | Google Scholar
(PDF) Ureaplasma urealyticum и Ureaplasma parvum у женщин репродуктивного возраста
отвечает на вопрос о симптомах мочеиспускания. Кроме того,
возможно, что у некоторых из них были урогенитальные жалобы
, связанные с симптомами атрофии влагалища или урогенией
—
одновременно.Проблема в постмено
—
паузальных женщинах состоит в том, чтобы отличить симптомы мочеиспускания от
симптомов урогенитального старения.
Частота НММП у наших пациентов была выше (58,8%,
144/245) по сравнению с Hextall et al.
20
, которые сообщили о
распространенности ИМП, связанных с дефицитом эстрогена, в диапазоне
от 20 до 30% в справочных материалах.
Согласно нашим результатам, у
высокий процентженщин (41.2%, 101/245) отсутствие инфекции не было подтверждено микробиологами
—
, несмотря на симптомы мочеиспускания. Кроме того,
не было значимой разницы между женщинами с mi
—
кробиологически подтвержденной инфекцией и женщинами с неподтвержденной инфекцией
(58,8%, 144/245 против 41,2%, 101/245).
Таким образом, микробиологический анализ необходим для индивидуальной обработки ap
—
и предотвращения ненужного использования антибиотиков
—
.
Вторая цель заключалась в оценке воздействия
регулярности использования ГТ (включая системные и локальные
—
дес) на LUTI. Согласно многочисленным исследованиям
21
, одним из
преимуществ ГТ является восстановление lactobacilli vagi
—
nal флоры, связанной с защитным эффектом против uro
—
генитальных инфекций.
В нашем исследовании значительно более низкий процент LUTI
был обнаружен у пользователей HT по сравнению с контрольной группой
(46.9%, 67/143 против 75,5%, 77/102, p <0,001). Этот результат
подчеркнул положительный эффект лечения ГТ на
НМП.
Хотя системная ЗГТ часто используется, роль пероральной гормональной терапии
в уменьшении инфекций мочевыводящих путей неясна. Многие исследователи показали, что только
местная ЗГТ снизила частоту НМП.
7,27
.Количество перорального гормона, которое достигает
слизистой оболочки влагалища, может быть слишком низким, чтобы повлиять на колонизацию
уропатогенов
28
. Наше исследование соответствует предыдущим
—
ранее упомянутым исследованиям. Сравнивая локальное использование HT и системное использование
, результат показал, что частота
LUTI была значительно снижена у местных пользователей HT:
по сравнению с системными пользователями (30,3%, 20/66 против 61,0%,
47/77 , p <0.001) или даже по сравнению с контролем (30,3%,
20/66 против 75,5%, 77/102, p <0,001). Хотя сравнение
—
между системными пользователями HT и контрольной группой также имеет статистически значимое различие (61,0%, 47/77,
по сравнению с 75,5%, 77/102, p = 0,049) , похоже, что локальное использование HT
чаще ассоциировалось с уменьшением LUTI.
Заместительные гормональные препараты должны вводиться регулярно.
Применять и назначать строго в соответствии с предписаниями врачей.
.В исследовании Fistoni et al.
14
, авторы
сообщили о плохой стойкости при длительной ГТ в
Хорватии. Согласно нашему исследованию, большинство из
пациентов регулярно принимали ГТ (74,12%, 106/143). В
—
re не было статистической разницы между локальными и системными группами HT
—
в отношении регулярности использования HT (51,9%,
55/106 против 48,1%, 51/106 p = 0,22) .
В нашем исследовании регулярное употребление привело к снижению LUTI,
как у местных, так и у системных пользователей HT.Более того, у постоянных
местных пользователей HT был значительно более низкий процент
LUTI, чем у системных регулярных пользователей HT (p = 0,003). Как
—
когда-либо у нерегулярных пользователей не было статистических различий между локальными и системными пользователями HT в отношении
LUTI (p = 0,670).
Возможная причина большого числа постоянных пользователей HT
заключается в том, что в исследовании участвовали женщины из метрополии
—
загребной области Загреба, где пациенты
лучше информированы о преимуществах HT, имеют более высокое социальное положение. -eco
—
Номинальный статус и лучший доступ к гинекологической практике.
Тем не менее, возможно, что основным ограничением нашего исследования
является обобщаемость данных из-за охвата
протестированной популяции мегаполисов.
В заключение, LUTI были микробиологически подтверждены
у 58,8% (144/245) женщин в постменопаузе с отсутствующими симптомами uri-
. Высокий процент пациентов с
немикробиологически подтвержденными НМП (41,2%, 101/245)
свидетельствует о значительной роли микробиологических тестов
в диагностике НМП.Следовательно, микробиологический анализ
необходим для соответствующего лечения и предотвращения ненужного использования антибиотиков
. Частота НММП была на
значительно ниже в обеих группах пользователей ЗГТ (локальная
,и системная), и подтвердила, что использование ЗГТ было связано
—
со снижением НМП в популяции постмено
—
паузально. женщины в Загребе.
Благодарности
Авторы выражают благодарность госпоже В.Александра @ mega ~
-Хорват за правку английского текста. Мы благодарим ap
—
за участие в этом исследовании
следующих коллег: С. Любин-Стернак, Загреб; З. Персич, Загреб;
Дж. Чедид, Загреб.
СПРАВОЧНАЯ ИНФОРМАЦИЯ
1. SCHAPERT SM, Национальное обследование амбулаторной медицинской помощи: 1992
резюме. Расширенные данные из статистики естественного движения населения и здоровья, № 253, MD:
Национальный центр статистики здравоохранения, публикация DHHS, Hyattsville,
1994.- 2. РОНАЛЬД А.Р., Curr Opin Infect Dis, 8 (1995) 1. DOI: 10.1097 /
00001432-199502000-00001. — 3. NYGAARD IE, JOHNSON JM, Am
Fam Physician, 53 (1996) 175. — 4. NICOLLE LE, J Antimicrob Che
—
мать, 33 (1994) 99. — 5. [KERK V, [KERK V, JAK [I] J, KOLUMBI] —
LAKO [A, MATRAPAZOVSKI M, MALEKOVI] G, ANDRA [EVI] —
TAMBI] A, RADO [EVI] V, MARKOTI] A, BEGOVAC J, Coll Antropol,
33 (2009) 625. — 6. Статистический ежегодник Республики Хорватия, 2001 г.
Центральное статистическое бюро Республики Хорватия, Загреб, 2001. —
7. RAZ R, STAMM WE, N Engl J Med, 329 (1993) 753. DOI: 10.1056 /
NEJM19930
. — 8. RAZ R, COLODNER R, ROHANA Y,BATTINO S, ROTTENSTERICH E, WASSER I, STAMM W, Clin Infect
Dis, 36 (2003) 1362. DOI: 10.1086 / 374341. — 9. FOLSSOM AR, NINK PJ,
SELLERS TA, HONG C, ZHENG, POTTER JD, Am J Public Health,
(1995) 1128. — 10. GRODSTEIN F, STAMPFER MJ, COLDITZ GA,
WILLETT WC , MANSON JA, JOFFE M, ROSNER B, FUCHS C, HAN
—
B.Hunjak et al.: Инфекции мочевыводящих путей у женщин в постменопаузе, Coll. Антрополь. 36 (2012) 3: 841–846
845
U: \ coll-antropolo \ coll-antro-3-2012 \ 10224 Hunjak.vp
26. rujan 2012 12:51:18
Цветовой профиль: Generic Профиль принтера CMYK
Составной экран по умолчанию
Генетический фон хозяина влияет на исход заболевания во время внутриутробного инфицирования Ureaplasma parvum
Abstract
Ureaplasma parvum, условно-патогенный микроорганизм урогенитального тракта человека, вносит свой вклад в развитие хориоамнионита, заболеваемости и смертности плода.Было высказано предположение, что генетический фон хозяина является критическим фактором неблагоприятного исхода беременности как последствия внутриамниотической инфекции U. parvum . Чтобы проверить эту гипотезу, мы оценили влияние внутриутробной инфекции U. parvum на прототипные линии мышей Th2 / M1 C57BL / 6 и Th3 / M2 BALB / c. Стерильную среду или U. parvum инокулировали в каждый рог матки, и животных оценивали на предмет внутриамниотической инфекции, инфекции плода, хориоамнионита и патологии плода через 72 часа после инокуляции.Исход заболевания оценивали с помощью микробной культуры, in situ , обнаружения U. parvum в тканях плода и матки-плаценты, определения степени хориоамнионита и экспрессии плацентарных генов IL-1α, IL-1β, IL-6, TNF- α, S100A8 и S100A9. Уровни плацентарной инфекции и колонизации у обоих штаммов были одинаковыми. Распределение in situ U. parvum в тканях плаценты также было сходным. Однако значительно большая часть плодов BALB / c была инфицирована (P <0.02). Животные, инфицированные C57BL / 6, в основном проявляли хориоамнионит от легкой до умеренной (P <0,0001) и значительное снижение плацентарной экспрессии IL-1α, IL-1β, IL-6, TNF-α, S100A8 и S100A9 по сравнению с фиктивным контролем ( P <0,02). Напротив, тяжелый затяжной хориоамнионит с клеточным некрозом был преобладающим фенотипом поражения у мышей BALB / c, которые также демонстрировали значительное увеличение плацентарной экспрессии IL-1α, IL-1β, IL-6, TNF-α, S100A8 и S100A9 ( P <0,01). Патология плода в BALB / c была мультиорганной и включала мозг, легкие, сердце, печень и кишечник, тогда как патология плода в C57BL / 6 выявлялась только в печени и кишечнике.Эти результаты подтверждают, что генетический фон хозяина является основным фактором, определяющим индуцированный уреаплазмой хориоамнионит с инфекцией плода и воспалительной реакцией плода.
Образец цитирования: von Chamier M, Allam A, Brown MB, Reinhard MK, Reyes L (2012) Генетический фон хозяина влияет на исход болезни во время внутриутробного инфицирования Ureaplasma parvum . PLoS ONE 7 (8): e44047. https://doi.org/10.1371/journal.pone.0044047
Редактор: Колетт Канеллопулос-Ланжевен, Институт Жака Моно — UMR 7592 CNRS — Парижский университет Дидро, Франция
Поступила: 25.04.2012; Принята к печати: 1 августа 2012 г .; Опубликовано: 29 августа 2012 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, надстраивать или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Финансирование: Этот проект финансировался Программой исследований и аспирантуры службы ухода за животными. A. Allam был поддержан дополнением к Закону о восстановлении и реинвестициях США к K08DK075651 от Национального института диабета, болезней органов пищеварения и почек (NIDDK). Публикация этой статьи была частично профинансирована Издательским фондом открытого доступа Университета Флориды. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Хориоамнионит, воспалительное заболевание плодных оболочек, является основным патологическим процессом осложненных беременностей, таких как преждевременный разрыв плодных оболочек (PROM), спонтанные преждевременные роды (PTL), синдром воспалительной реакции плода и гибель плода [1], [2], [3], [4]. Хотя CAM имеет несколько этиологий, микробная инвазия амниотической полости (MIAC) является наиболее частой причиной этого патологического процесса [3], [5]. Ureaplasma parvum и U. urealyticum являются наиболее распространенными бактериями, ассоциированными с САМ и его перинатальными последствиями [5], [6], [7], [8]. И U. urealyticum , и U. parvum были обнаружены в околоплодных водах [9], [10], [11], [12], [13], пуповинной крови плода [14], легких плода и новорожденного [ 15], [16], спинномозговая жидкость [8], [17] и желудочно-кишечные аспираты плода [18], [19]. Различные исследования на животных моделях продемонстрировали причинно-следственную связь между монотипической внутриутробной инфекцией, вызванной видами Ureaplasma , и спонтанными преждевременными родами [20], неонатальной бронхолегочной болезнью [21], [22], [23], [24], [25], антенатальная травма головного мозга [26] и дерматит плода [27].Однако патогенез хориоамнионита, вызванного уреаплазмой, и неблагоприятный исход беременности еще не выяснены. Например, вид или тип серовара Ureaplasma не является решающим фактором в том, останется ли внутриутробная инфекция неосложненной бессимптомной инфекцией или перейдет в тяжелый хориоамнионит с неблагоприятным исходом беременности [28], [29], [30]. Более того, недавние исследования, в которых основное внимание уделялось роли множественных полосовых антигенов Ureaplasma в патогенезе хориоамнионита, предполагают, что сами по себе уреаплазмы не являются вирулентными или вирулентными по своей природе, а скорее является иммунным ответом хозяина на присутствие бактерии в амниотической полости. преобладающий фактор в патогенезе болезни [31].
Патологические признаки хориоамнионита включают инфильтраты воспалительных клеток (нейтрофилы) с другими признаками воспаления, такими как отек, отложение фибрина и некроз нейтрофилов и амниотических эпителиальных клеток [3], [32]. При поражении плода воспалительные поражения также могут наблюдаться в пуповине [2], [32]. Повышенные концентрации IL-1β, IL-6, IL-8 и TNF-α обычно обнаруживаются в околоплодных водах пациентов с хориоамнионитом и / или фунизитом [1], [2], [33].Повышенные уровни калгранулинов S100A8, S100A9 и S100A12 также были обнаружены в амниотической жидкости пациентов с хориоамнионитом, страдающих PTL и / или синдромом воспалительной реакции плода [33], [34], [35]. Хотя децидуальные макрофаги не считаются признаком гистологического хориоамнионита, они также важны в процессе заболевания, поскольку они являются ранними инициаторами воспалительной реакции хозяина на бактериальную инвазию; они также регулируют прогрессирование или разрешение хориоамнионита [36].
Хорошо известно, что усиленное местное воспаление в ответ на внутриутробную инфекцию будет запускать PROM, PTL и / или синдром воспалительной реакции плода [4], а реакция хозяина на инфекцию может зависеть от генетических факторов хозяина [1]. Например, существуют расовые различия в воспалительной реакции, связанной с PTL, такие как чрезмерная продукция IL-6 и IL-8 у женщин европеоидной расы по сравнению с увеличением IL-1β и TNF-α у афроамериканок [37], [38] ]. Было обнаружено, что эти различия коррелируют с вариациями однонуклеотидных полиморфизмов (SNP), которые связаны с каждой расой [39], [40].Документально подтверждено, что полиморфизм в промоторной области гена TNF-α является фактором риска PTL при наличии бактериального вагиноза [41]. Таким образом, генетическая предрасположенность хозяина к реакции на инфекцию интенсивным воспалительным ответом, вероятно, будет значительным фактором развития неблагоприятных исходов беременности во время внутриутробного инфицирования уреаплазмой .
Мыши C57BL / 6 и BALB / c обладают генетически разными иммунологическими фенотипами, которые использовались для выяснения врожденных иммунных ответов, которые придают устойчивость или восприимчивость к инфекции и болезни.Помимо различных профилей цитокинов Th2 / Th3, мыши C57BL / 6 и BALB / c также демонстрируют функциональные различия в чувствительности к толл-подобным рецепторам и различия в реактивности макрофагов и нейтрофилов, которые, как было показано, влияют на исход заболевания во время инфекций, вызванных Trypanosoma cruzi, Leishmania major, и сепсис [42], [43], [44], [45], [46]. Поскольку эти врожденные иммунные реакции участвуют в патогенезе хориоамнионита и неблагоприятных исходах беременности, мы оценили влияние U.parvum внутриутробная инфекция у мышей C57BL / 6 и BALB / c. Несмотря на то, что оба штамма имели одинаковую микробную нагрузку, мыши BALB / c были более восприимчивы к инфекции плода, чем C57BL / 6. Кроме того, хориоамнионит был более тяжелым у мышей BALB / c.
Результаты
Мыши BALB / c более восприимчивы к инфицированию плода при приеме
U. parvumU. parvum Колонизацию тканей плода и плаценты оценивали на 17 день беременности (GD), то есть через 72 часа после инокуляции.Все ткани ложно инокулированных животных были отрицательными по культуре на U. parvum . Частота инфицирования плаценты у мышей C57BL / 6 составляла 100%, а у мышей BALB / c — 92%. Штамм мышей не оказывал влияния на микробную нагрузку U. parvum в тканях плаценты. Например, среднее значение ± SD log КОЕ U. parvum составило 3,46 ± 1,74 для инфицированных C57BL / 6 и 3,53 ± 1,05 для плацентарных тканей BALB / c. Микробная нагрузка в инфицированных тканях плода также была одинаковой для обоих штаммов.В C57BL / 6 log КОЕ U. parvum , выделенных из инфицированных плодов, составлял 3,75 ± 1,89 (среднее ± стандартное отклонение), а для плодов BALB / c — 2,31 ± 1,65. Однако частота инфицирования плодов у инокулированных самок значительно различалась между двумя линиями мышей (P <0,02 по критерию хи-квадрат). В частности, только 6 из 32 (18,8%) плодов C57BL / 6 были инфицированы, тогда как 18 из 38 (56%) плодов BALB / c были инфицированы через 72 часа после заражения.
Учитывая несоответствие в скорости колонизации плода между мышами C57BL / 6 и BALB / c, мы затем оценили местонахождение in situ U.parvum в их внутриматочных тканях и тканях плода с помощью иммунофлуоресцентной микроскопии (рисунок 1, контрольные изотипы можно просмотреть в файле S1). Независимо от статуса инфицирования плода, кластеры U. parvum были идентифицированы в хориональной пластинке, хориодецидуальном соединении плацентарных мембран, хориоамнионной и желточной мембранах у мышей C57BL / 6 и BALB / c (рис. 1). В некоторых секциях можно было обнаружить организмов U. parvum , поглощенных полиморфно-ядерными клетками (рис. 1A и B).В тканях плода организмов U. parvum были идентифицированы в легком плода одной мыши BALB / c и в просвете кишечника плодов BALB / c и C57BL / 6 (рис. 1C и D).
Рисунок 1. In situ обнаружение U. parvum в тканях плаценты и плода.
Типичные 2D проекционные изображения (увеличение 600 x) хориодецидуального соединения плаценты (A), желточной оболочки (B), кишечника плода (C) и легкого плода (D). Масштабные линейки эквивалентны 100 мкм. U. parvum (красный) изначально метили кроличьими поликлональными антителами, как описано ранее [69], [71]. Ядра клеток (синие) были помечены DAPI. Длинными стрелками (A и B) выделено U. parvum , захваченное полиморфно-ядерными клетками. Блок-стрелки (D и E) выделяют эпицлеточный U. parvum .
https://doi.org/10.1371/journal.pone.0044047.g001
МышиC57BL / 6 и BALB / c демонстрируют разные воспалительные реакции на внутриутробную инфекцию при введении
U.парвумЗатем мы оценили воспалительную реакцию матери и плода на U. parvum с помощью гистопатологии. Воспалительный ответ матери оценивали двумя методами. Первым была качественная оценка локализованного метрита в части ткани матки, прикрепленной к плаценте, и ткани матки, окружающей место имплантации (рис. 2). Второй подход использовал установленную систему баллов для измерения материнского вклада в хориоамнионит, как это определено Redline [3], [32] и обобщено в таблице 1.У большинства плотин C57BL / 6 обнаружен метрит, который характеризовался как скудные нейтрофильные инфильтраты в эндометрии и миометрии (рис. 2В). У большинства плотин BALB / c обнаружен обширный метрит, при котором в эндометрии и миометрии наблюдались плотные нейтрофильные инфильтраты (Рисунки 2C и D). Что касается хориоамнионита, преобладающим поражением, обнаруженным в плаценте C57BL / 6, был очаговый приток нейтрофилов в субхориональную пластинку или хориодецидуальное соединение плацентарных оболочек (стадия 1, рис. 3).Однако у мышей BALB / c преобладающим поражением плаценты был некротический хориоамнионит (стадия 3, рис. 3) с десквамацией эпителиальных клеток амниона (P <0,0001).
Рисунок 2. Репрезентативные изображения метрита.
Имитация прививки (контроль) и репрезентативные поражения у U. parvum инфицированных мышей C57BL / 6 (B, легкий метрит) и у U. parvum инфицированных мышей BALB / c (C и D, более обширный метрит). Масштабные линейки эквивалентны 100 мкм. Стрелками выделены нейтрофильные инфильтраты.
https://doi.org/10.1371/journal.pone.0044047.g002
Рис. 3. Воспалительная реакция матери, определяемая степенью хориоамнионита у U. parvum инфицированных маток BALB / c и C57BL / 6.
Распределение первичного воспалительного ответа матери (MIR) по плацентарной оценке с использованием критериев оценки Redline et al. [32] приведены в таблице 1. Медианные оценки отмечены горизонтальной линией на каждом графике. Данные представляют собой компиляцию 3 независимых экспериментов.Сопровождающие микрофотографии окрашенных H & E стадий 1–3 MIRS. Масштабные линейки эквивалентны 100 мкм. Стрелками выделены нейтрофильные инфильтраты.
https://doi.org/10.1371/journal.pone.0044047.g003
Воспалительные реакции плода (FIR) оценивались с использованием установленных критериев, которые суммированы в таблице 2 [32]. Кроме того, мы модифицировали эту систему оценки, чтобы включить такие поражения плода, как некроз плода, гепатит, некротический энтероколит и воспаление легких, которые являются поражениями, соответствующими синдрому воспалительной реакции плода или связанным с уреаплазмой заболеваниями плода / новорожденного, такими как энтерит, пневмонит и головной мозг. травмы [2], [8], [47], [48], [49].В целом, показатели FIR у мышей BALB / c были выше, чем у C57BL / 6 (рис. 4). В частности, мы наблюдали больше хорионического васкулита и пупочного васкулита в плаценте BALB / c, чем в плаценте C57BL / 6 (P <0,003). Более того, у большего количества плодов BALB / c выявлен более широкий спектр патологии, чем у плодов C57BL / 6. Например, 7 из 8 плодов BALB / c от 6 U. parvum инфицированных маток имели некоторую степень патологии. Из них у 2 плодов был обширный некроз, что сделало невозможным дальнейшую оценку патологии органа.У остальных плодов BALB / c обнаружено поражение полиорганной системы: энцефалит с пневмонитом, миокардит с гепатитом или некроз печени с энтеритом. В группе C57BL / 6 только 4 из 12 плодов, полученных от 5 инфицированных U. parvum самок, имели какие-либо признаки патологии. У одного плода C57BL / 6 был обширный некроз, а у 3 плодов был гепатит и / или энтерит.
Рисунок 4. Воспалительная реакция плода (FIR) у мышей BALB / c и C57BL / 6, инфицированных U. parvum .
Распределение необработанных оценок FIR, как описано в таблице 2. Медианные оценки отмечены горизонтальной линией на каждом графике. Данные представляют собой компиляцию 3 независимых экспериментов. Сопровождающие срезы, окрашенные H & E, представляют собой репрезентативные изображения патологии плода в пупочных сосудах, головном мозге, легких, печени и кишечнике. Масштабная линейка эквивалентна 100 мкм. Стрелками выделены нейтрофильные инфильтраты.
https://doi.org/10.1371/journal.pone.0044047.g004
Поскольку мыши BALB / c и C57BL / 6 производят разные цитокиновые ответы во время инфекции [43], [50], мы профилировали воспалительный ответ плаценты в обоих случаях. имитация прививки и U.parvum инфицированных животных с помощью количественной ОТ-ПЦР или ELISA. В наш анализ были включены медиаторы воспаления, которые, как сообщается, связаны с хориоамнионитом, преждевременными родами и синдромом воспалительной реакции плода, такие как IL-1α, IL-1β, IL-6, TNF-α, S100A8 и S100A9 [1], [20], [31], [34], [49], [51], [52]. Кроме того, мы оценили продукцию IL-10, поскольку он обладает противовоспалительными свойствами [53] и может индуцироваться кожей плода овцы в ответ на инфекцию U. parvum [54].
Сначала мы оценили специфические характеристики линии мышей, сравнив воспалительные профили имитационно инокулированных животных BALB / c и животных C57BL / 6 (рис. 5).У неинфицированных животных [55] экспрессия плацентарных генов IL-1α, IL-1β, IL-6, TNF-α, S100A8 и S100A9 была значительно выше у мышей C57BL / 6, чем у мышей BALB / c (P <0,0005, Рисунок 5А). Наиболее разительные различия наблюдались в экспрессии C57BL / 6 IL-1β, IL-6 и TNF-α, которая превышала уровни экспрессии во всех других группах лечения, включая U. parvum инфицированных тканей от обеих линий мышей (P <0,001). , данные не показаны). Плацентарные ткани животных C57BL / 6 также продуцировали больше IL-10, чем мыши BALB / c (Рисунок 5B, P <0.03).
Рисунок 5. Профили плацентарных медиаторов воспаления у ложно инокулированных мышей BALB / c и C57BL / 6. (
A) Нормализованные значения экспрессии генов выражаются как 2 — Δ Ct [72]. (B) Продукция IL-10, выраженная в виде среднего (пг / г веса ткани) ± стандартное отклонение. Значения представляют 5 биологических повторов из 3 независимых экспериментов.
https://doi.org/10.1371/journal.pone.0044047.g005
Чтобы определить, повлияла ли инфекция плода на воспаление плаценты, мы разделили U.parvum инфицированные плаценты попали в группы с положительной культурой плода и отрицательной культурой плода. U. parvum индуцировал дивергентные профили экспрессии гена плаценты у мышей BALB / c и C57BL / 6, как показано на фиг. 6A. В целом инфекция U. parvum дала провоспалительный профиль у мышей BALB / c. Например, в группе отрицательной культуры плода BALB / c U. parvum плацентарная инфекция увеличивала экспрессию всех провоспалительных медиаторов, кроме S100A9 (P <0.02). Продукция IL-10 в U. parvum инфицированных плацентах BALB / c от животных с отрицательной культурой плода также увеличивалась (фигура 6B, P <0,05). Хотя группа с положительной культурой плода BALB / c также показала значительное увеличение всех провоспалительных медиаторов (P <0,01), характер изменения был другим по сравнению с группой с отрицательной культурой плода. В частности, инфекция плода привела к ослаблению плацентарной экспрессии IL-1α, IL-1β и TNF-α, но экспрессия S100A8 и S100A9 была увеличена (P <0.005). Инфекция плода также снижает выработку плацентарного IL-10 (рис. 6B). На степень экспрессии плацентарного гена IL-6 не влияла инфекция плода у мышей BALB / c. Инфекция U. parvum вызвала противоположный эффект у мышей C57BL / 6. В этом штамме плацентарная экспрессия IL-1α, IL-1β, IL-6, TNF-α, S100A8 и S100A9 была значительно снижена в U. parvum инфицированных плацентах, полученных из маточно-плацентарных единиц, имевших неинфицированный плод (P < 0,001).Плацентарные ткани инфицированных плодов показали аналогичный эффект, но степень подавления IL-1β, IL-6, TNF-α и S100A9 была значительно снижена по сравнению с группой отрицательных культур плода (P <0,05). У мышей C57BL / 6 инфекция плода не влияла на экспрессию IL-1α или S100A8 в плаценте, инфицированной U. parvum . Инфекция U. parvum не оказала никакого влияния на продукцию плацентарного IL-10 у мышей C57BL / 6.
Рисунок 6. Профили воспаления плаценты в U.parvum инфицировали мышей BALB / c и C57BL / 6. (
A) Изменение складки (2 — ΔΔ Ct ) относительно нормализованных значений Ct для имитационно инокулированных контролей, которые были определены методом Шмиттгена и Ливака [72]. Значения представляют собой среднее значение 2 — ΔΔ Ct ± стандартное отклонение 5 биологических повторов из 3 независимых экспериментов. * Указывает на значительную разницу (P <0,01), которая была определена с помощью t-критерия Стьюдента с использованием 2 — Δ Ct данные.(B) Среднее значение IL-10 ± стандартное отклонение, выраженное в пг / г веса ткани в 5 биологических повторностях из 3 независимых экспериментов. ** Указывает на значительную разницу (P <0,03).
https://doi.org/10.1371/journal.pone.0044047.g006
Обсуждение
Уреаплазмы — одни из наиболее распространенных микробов, выделяемых из околоплодных вод у женщин в середине триместра, но только у подгруппы женщин с положительными культурами развиваются неблагоприятные исходы беременности, такие как PTL, PROM, инфекция плода и синдром воспалительной реакции плода. [49], [56], [57].Патогенез неблагоприятных исходов беременности, связанных с уреаплазмой, дополнительно осложняется тем фактом, что большинство плацентарных инфекций, связанных с уреаплазмами, являются полимикробными [55], [58]. Однако влияние смешанной бактериальной инфекции на патогенез уреаплазмы неясно, поскольку воспалительный фенотип, связанный с чистыми уреаплазменными инфекциями, неотличим от смешанных бактериальных инфекций, содержащих Ureaplasma [55]. Поскольку неотъемлемая часть ассоциированного с уреаплазмой заболевания включает сильную воспалительную реакцию хозяина, было высказано предположение, что реакция хозяина на присутствие микроба является основным детерминантом в развитии неблагоприятного исхода беременности [31].Используя генетически отличные линии мышей с различными врожденными иммунными ответами, мы предоставили доказательства, подтверждающие эту теорию (суммированные в таблице 3). Несмотря на то, что мыши C57BL / 6 и BALB / c имели одинаковую микробную нагрузку на плаценту, только мыши BALB / c демонстрировали большую долю инфицирования плода. Кроме того, поразительной особенностью мышей BALB / c было наличие обширных нейтрофильных инфильтратов, которых не было у мышей C57BL / 6. Такое преобладание нейтрофилов в тканях мышей BALB / c может объяснить повышенную частоту инфицирования плода наряду с более широким диапазоном патологии плода, которая наблюдалась в этом штамме.
Наш экспериментальный подход был разработан для того, чтобы вызвать воспалительные реакции как у матери, так и у плода и гарантировать высокий уровень инфицирования плаценты и плода. Таким образом, высокая доза U. parvum была депонирована в просвет матки, а не в амниотическую полость, что привело к распространению микробов, напоминающему восходящую инфекцию. Согласно нашим данным, у обеих линий мышей развивалась высокая частота инфицирования плацентой (более 90%), которая содержала микробные нагрузки (10 3 или более КОЕ), которые, как сообщалось, коррелировали с внутриутробными воспалительными реакциями, такими как хориоамнионит, PROM, заболеваемость плода и т. Д. смертность людей [12].Иммунодетекция U. parvum показала, что распределение in situ микроба в плаценте, амниотической полости и кишечнике плода также было одинаковым у обеих линий мышей. Следовательно, различная частота инфицирования плода у мышей C57BL / 6 и BALB / c не может быть объяснена различиями в микробной нагрузке.
Поскольку наш экспериментальный подход был разработан для имитации восходящей инфекции, мы не можем исключить возможность того, что могли быть некоторые различия во времени внутриамниотической инвазии между фетальными единицами в каждом роге матки.Тем не менее, наш экспериментальный план скорректировал эту потенциальную вариацию несколькими способами. Во-первых, естественные вариации были заблокированы в нашем анализе за счет использования всех тканей плода и плаценты в пределах каждого рога матки, включая те, которые наиболее удалены от места инокуляции. Во-вторых, исследования в нашей лаборатории показали, что скорость распространения U. parvum на все плодные единицы в матке происходит быстро. Например, пилотное исследование, включавшее 7 плотин C57BL / 6, показало, что 91% плаценты и 33% плодов были колонизированы U.parvum через 24 часа после инокуляции (неопубликованные данные). Таким образом, анализ тканей через 72 часа после инокуляции предоставил достаточно времени для адекватного распространения микробов в каждую фетоплацентарную единицу, что было подтверждено 100% -ной степенью колонизации плаценты у мышей C57BL / 6. Интересно, что в нашем пилотном исследовании мы наблюдали более высокий уровень инфицирования плода (45% через 24 часа против 18% через 72 часа), что означает, что у мышей C57BL / 6 может происходить некоторый микробный клиренс по мере увеличения продолжительности инфекции.
Поразительной особенностью дамб BALB / c была обширная нейтрофильная инфильтрация, которая присутствовала как в тканях матки, так и в тканях плаценты. Большинство нейтрофилов в тканях BALB / c, по-видимому, претерпевают некротическую смерть вместо апоптоза. Некротическая смерть продлевает активацию нейтрофилов и воспаление, задерживая клиренс нейтрофилов и репаративный ответ [59]. Другие особенности, поддерживающие продолжающееся воспаление в тканях BALB / c, включали повышенную экспрессию провоспалительных медиаторов, утолщение базальной мембраны амниотической жидкости и обширное десквамацию эпителиальных клеток.Взятые вместе, эти особенности согласуются с длительным воспалением, по крайней мере, от 36 до 48 часов и с нарушением барьера между матерью и плодом [32], что, возможно, способствовало увеличению частоты инфицирования плода, наблюдаемой у этой линии мышей.
Дивергентные воспалительные реакции плаценты, которые наблюдались у мышей C57BL / 6 и BALB / c, могут быть связаны с присущими им различиями в их нейтрофильной функции, чувствительности к толл-подобным рецепторам (TLR) [45], [50] и / или доминированию макрофагов. профили [46], [50].Эти специфические для хозяина факторы могут влиять на исход заболевания независимо от опосредованного U. parvum воздействия на хозяина. Например, Allenbach et al [42] продемонстрировали, что нейтрофилы C57BL / 6 подвергаются внешнему апоптозу во время ранней фазы инфекции L. major , что важно для снижения повреждающих эффектов воспаления во время инфицирования этим патогеном. В нашем исследовании мы наблюдали скудный приток нейтрофилов в U. parvum инфицированных тканях матки и плаценты мышей C57BL / 6 без признаков обширного некроза тканей, который может быть связан с нереактивным клиренсом нейтрофилов [59] у этой линии мышей.Кроме того, у мышей C57BL / 6 наблюдались более высокие уровни продукции плацентарного IL-10, которая не рассеивалась в значительной степени в присутствии инфекции. Это также поддержит разрешение воспаления и репаративный ответ [59]. И наоборот, мыши BALB / c, инфицированные L. major , имеют дефектный апоптоз внешних нейтрофилов в сочетании с тяжелым длительным нейтрофильным воспалением [42], [43], что аналогично тому, что мы наблюдали в инфицированных U. parvum тканях этой мыши. напряжение.Мыши BALB / c также имеют пониженную чувствительность к агонистам TLR или цитокинам [45], [50] и обычно вызывают супрессивный или доминирующий макрофаг M2 иммунный ответ [44], [46], [50]. В частности, макрофаги мышей BALB / c обычно продуцируют простагландин E 2 (PGE 2 ) при воздействии липополисахарида, который ингибирует ответ цитокинов Th2 у этих животных [44]. Мыши BALB / c также производят меньше TNF-α и IL-12 в ответ на MALP-2, белок микоплазмы, который является специфическим агонистом TLR2 / 6 [45].По сравнению с мышами C57BL / 6 плацентарные ткани ложно инокулированных мышей BALB / c демонстрировали пониженную экспрессию IL-1β, IL-6 и TNF-α, что больше соответствует поляризации макрофагов M2 [60]. Эта особенность может быть особенно критичной при неблагоприятных исходах беременности, связанных с уреаплазмами, поскольку уреаплазмы вырабатывают PGE 2, IL-1β, TNF-α и IL-10 из амниохориона человека и хориодецидуальных эксплантатов [61], [62], что не является ни одной характеристикой. цитокинового ответа Th2 или Th3. Таким образом, U.parvum у мышей BALB / c с доминантой M2 может вызвать ослабленный врожденный ответ, который не является микробицидным [45], но вместо этого приводит к пагубному воспалительному ответу.
Профили воспалительной реакции плода, наблюдаемые у мышей C57BL / 6 и BALB / c, также подразумевают, что степень инфицирования плода была различной в этих линиях. Например, патология была обнаружена только в печени и кишечнике плодов C57BL / 6, а U. parvum было выявлено только в просвете кишечника этих животных с помощью IFA.Это может свидетельствовать о том, что инфекция была локализована и, скорее всего, произошла в результате проглатывания плодом зараженных околоплодных вод. С другой стороны, наличие различной степени хорионического васкулита и / или пупочного васкулита [3], [32], обширный приток нейтрофилов в амниотическую полость в сочетании с патологией множественных органов плода (головной мозг, легкие, сердце, печень и др.). кишечник) у плодов BALB / c больше соответствовало сепсису плода и синдрому воспалительной реакции плода [2], [63], [64]. Другими показателями сепсиса плода и / или синдрома воспалительной реакции плода были повышенные уровни IL-6 и S100A8 в тканях плаценты [63], [64].Хотя поражения печени, наблюдаемые у плодов, инфицированных U. parvum , не являются признаком синдрома воспалительной реакции плода, поражения печени наблюдались во время инфицирования плода видов Ureaplasma [65], [66], а также на модели овец. U. parvum внутриамниотической инфекции [67].
Ограничения этого исследования включают 1) отсутствие более ранних временных точек, которые могли бы пролить свет на временную прогрессию воспалительных реакций матери и плода во время распространения микробов в амниотическую полость, 2) четкое различие лейкоцитов плода от лейкоцитов матери в амниотической полости, и 3 ) отсутствие культур, специфичных для органов плода, которые могли бы прояснить, если бы у плодов BALB / c действительно была полиорганная инфекция и сепсис.Несмотря на эти ограничения, это исследование продемонстрировало, что генетический фон хозяина значительно влияет на исход заболевания во время внутриутробного инфицирования U. parvum. Хотя наше исследование не может сделать вывод о том, что аналогичные эффекты могут наблюдаться при внутриутробных инфекциях, вызванных другими видами микробов, оно подчеркивает необходимость рассмотрения генетического фона хозяина как фактора патогенеза заболевания, особенно в исследованиях, в которых мышь используется в качестве модели инфекции.
Материалы и методы
Животные
Гнездовые колонии штаммов C57BL / 6 и BALB / c были созданы с животными, свободными от специфических патогенов, приобретенными в лаборатории Джексона (Бар-Харбор, Мэн).Отчеты о состоянии здоровья доступны по адресу http://jaxmice.jax.org/list/ahname.html. Со всеми животными обращались в соответствии с процедурами, утвержденными Комитетом по институциональному уходу и использованию животных Университета Флориды. С животными все время обращались и содержали в барьерных условиях. Сингенное разведение проводилось с первородящими самками в возрасте 10–16 недель с использованием гаремной системы размножения. Успешное размножение определялось наличием копулятивной пробки, что считалось днем беременности 0.Ложно инокулированные контрольные животные и животные, инокулированные U. parvum , содержались отдельно в статической клетке в условиях ABSL-2.
In vivo пассирование U. parvumШтамм U. parvum , который ранее был адаптирован на крысах Sprague Dawley [68], был in vivo , который был пассирован 5 раз подряд как у мышей BALB / c, так и у C57BL / 6, чтобы адаптировать штамм к этому виду. Вкратце, при каждом пассаже от одной до двух беременных мышей внутривенно инокулировали 10 5 -10 9 КОЕ ЕД.parvum в боковую хвостовую вену на 14 день беременности. Дополнительный посевной материал также вводили во влагалище каждого животного. Влагалищные культуры собирали через 24 часа после инокуляции (PI). Через 48 ч ИП животных умерщвляли и культивировали влагалище, матку и плодно-плацентарные единицы на U. parvum . Изолят U. parvum , который был выделен из плода и также хорошо рос в бесклеточной среде, был выбран для будущих экспериментов. Этот изолят размножали во втором пассаже in vitro, который стал рабочим материалом для последующих экспериментов.
U. parvum Приготовление и культивированиеДля всех экспериментов U. parvum культивировали и обрабатывали, как описано ранее [68], [69]. Для изучения инфекций 1 мл рабочего раствора выращивали в 45 мл бульона 10B до ранней стационарной фазы при 37 ° C. КОЕ каждого посевного материала определяли измерением оптической плотности и подтверждали посевом. Культивирование U. parvum из инокулятов и тканей мыши проводили, как описано ранее [68].Вкратце, для каждого образца определяли как единицы изменения цвета, так и единицы образования колоний (КОЕ). Однако образец считался положительным только в том случае, если на агаре A8 было идентифицировано U. parvum колоний.
Экспериментальные внутриматочные прививки
Во избежание перекрестного заражения фиктивные контроли инокулировали перед инфицированными животными и всегда обрабатывали перед инфицированными животными на протяжении всего исследования. Животные получали внутриматочные прививки стерильным носителем (контроль) или 10 7 КОЕ ЕД.parvum в день беременности (GD) 14, чтобы имитировать восходящую инфекцию. Хирургические вмешательства проводились под ламинарным вытяжным шкафом класса 2 с использованием асептической техники. Вкратце, вентральная часть живота была выбрита и место разреза было подготовлено в асептических условиях с чередованием скраба с 2% (масс. / Об.) Хлоргексидина ацетата (Nolvasan®, Fort Dodge) и теплым стерильным физиологическим раствором. Анестезию вызывали и поддерживали с помощью изотезии (Butler Shein Animal Health, Дублин, Огайо). Был сделан разрез по средней линии вентральной части на 1-2 см, проксимальные части рогов были выведены наружу, и 100 мкл инокулята было введено в полость матки каждого рога между шейкой матки и первым плодом каждого рога.Рога небеременных животных не инокулировали. Мышечный и подкожный слои закрывали рассасывающимся швом, а кожу закрывали зажимами для ран из нержавеющей стали (Autoclips®, Harvard Apparatus). Для периоперационной поддержки животные получали 1 мл теплого физиологического раствора подкожно (SC) для восполнения жидкости и гидрохлорид бупренорфина для обезболивания (Carpuject, Hospira, Inc., Lake Forest, IL), вводимый подкожно по 0,05–0,1 мг / кг каждые 12 часов в течение 48 часов. начиная до операции. Для каждого эксперимента прививали минимум одну мышь из каждого штамма.
Вскрытие трупа
После эвтаназии брюшную полость опрыскивали 95% этанолом и вскрывали. Органы брюшной полости были осмотрены на предмет грубых повреждений, и матка была удалена для обработки в асептических условиях. Шесть плодных единиц от каждой матери были обработаны для анализа экспрессии генов, микробной культуры и гистопатологии. Каждой фетальной единице назначали образец, соответствующий его плаценте, так что патология плаценты, статус культуры U. parvum и экспрессия гена плаценты могли быть коррелированы со статусом инфекции плода.Вкратце, плод в асептических условиях удаляли в отдельную чашку для культивирования; кожу дезинфицировали 70% этанолом перед культивированием на U. parvum , как уже описано [70]. Затем каждую плаценту рассекали пополам, так что одну половину использовали для гистопатологии, а другую половину обрабатывали для анализа экспрессии генов или культуры U. parvum . Ткани, сохраненные для анализа экспрессии генов, немедленно замораживали в жидком азоте и хранили при -80 ° C до дальнейшей обработки.Оставшиеся фетальные / плацентарные единицы были обработаны in toto для гистопатологии и in situ обнаружения U. parvum с помощью IFA.
In situ Обнаружение U. parvumТкани, залитые парафином, фиксированные формалином, обрабатывали, как описано ранее [69], [71], с одним исключением, что извлечение антигена выполняли при нагревании с использованием натрийцитратного буфера [10 мМ цитрат натрия, 0,05% Твин 20, pH 6,0].
Изображения были получены с помощью конфокального микроскопа Olympus IX81-DSU Spinning Disk с использованием программного обеспечения Slidebook (Olympus, Center Valley, PA).Во время захвата изображения настройки камеры были оптимизированы с использованием среза ткани с наивысшей степенью флуоресцентной передачи сигналов. После того, как настройки захвата изображения были установлены, одни и те же настройки были использованы для всех тканей в рамках конкретного эксперимента по маркировке . Контрольные изображения изотипа представлены во вспомогательном файле S1.
Гистопатология
Ткани фиксировали в 10% забуференном формалине в течение 24 часов, затем переносили в 95% этанол до обработки. Ткани были обрезаны и рассечены таким образом, чтобы был виден поперечный разрез плаценты и связанных с ней эндометрия и хориоамниона.Ткани обрабатывали в обычном порядке и окрашивали гематоксилином и эозином.
Чтобы разработать систему оценки повреждений, патолог знал, какие образцы были взяты от контрольных животных, но не имел возможности идентифицировать линию мышей. После разработки системы оценки повреждений все слайды были перекодированы так, чтобы патолог был не осведомлен о линии мышей и экспериментальном лечении (статус инфекции). Система оценки хориоамнионита была основана на критериях, ранее установленных и проверенных для тканей плаценты человека [3], [32].Наша модифицированная система баллов для оценки воспалительных реакций матери и плода обобщена в таблицах 1 и 2.
Профилирование воспаления плаценты с помощью количественной ОТ-ПЦР или ELISA
Ткани плаценты мышей были отобраны для анализа на основе лечения (контроль против инфицированных) и статуса культуры плода (положительный или отрицательный для U. parvum ). Было проанализировано не менее 5 биологических повторов из каждой группы. Суммарную РНК из тканей плаценты мыши экстрагировали с помощью TRIzol (Life Technologies ™) в соответствии с инструкциями производителя.Количественное определение мРНК TNF-α, IL-1α, IL-1β, IL-6, S100A8, S100A9 и GAPDH определяли с помощью анализов праймеров SABiosciences QPCR с детекцией SYBR green (Qiagen, Valecia, CA). Все реакции ПЦР выполняли в соответствии с инструкциями производителя на iCycler-IQ, версия 3.1 с использованием программного обеспечения оптической системы 3.1 (BioRad Laboratories, Hercules, CA). Значения порога цикла (Ct) для каждого образца были нормализованы с его соответствующим Ct GAPDH. Нормализованные значения были преобразованы в логарифмическую базу 2 до того, как данные были оценены статистическим анализом [72].
Ткани плаценты гомогенизировали в реагенте для экстракции белка T-PER (Pierce Biotechnology, Inc), который был дополнен коктейлем ингибиторов протеазы HALT в соответствии с инструкциями производителя. Экстракты белков плаценты анализировали на присутствие IL-10 мыши с помощью ELISA (Pierce Biotechnology, Inc.) в соответствии с инструкциями производителя. Концентрации ИЛ-10 нормализовали по массе плацентарной ткани в мг.
Анализ статистических данных
Данные нескольких экспериментов были сгруппированы вместе, чтобы сделать возможным статистический анализ.Когда анализ включал более двух сравнений, данные анализировали с помощью одностороннего дисперсионного анализа (ANOVA) с последующим тестом множественного сравнения Фишера, если ANOVA показывал значительную разницу между средними значениями групп. Непарный тест Стьюдента использовался для сравнения между 2 группами. Непараметрические данные анализировали с помощью анализа Краскалла-Уоллиса или хи-квадрат. Для всех анализов значимой считалась вероятность P≤0,05.
Благодарности
Мы благодарим доктора Августа Х.Сражения за наставническую поддержку доктора фон Шамьера. Мы также благодарим г-жу Александру Бёрн за ее техническую помощь.
Вклад авторов
Задумал и спроектировал эксперименты: MBB LR. Проведены эксперименты: MVC AA MKR LR. Проанализированы данные: AA MKR LR. Предоставленные реагенты / материалы / инструменты анализа: MVC AA MBB MKR LR. Написал статью: MVC AA MBB MKR LR.
Ссылки
- 1. Менон Р., Тейлор Р. Н., Фортунато С. Дж. (2010) Хориоамнионит — сложный патофизиологический синдром.Плацента 31: 113–120.
- 2. Gantert M, Been JV, Gavilanes AW, Garnier Y, Zimmermann LJ и др. (2010) Хориоамнионит: полиорганная болезнь плода? J Perinatol 30 Suppl: S21–30
- 3. Redline RW (2012) Воспалительный ответ при остром хориоамнионите. Semin Fetal Neonatal Med 17: 20–25.
- 4. Romero R, Gotsch F, Pineles B, Kusanovic JP (2007) Воспаление во время беременности: его роль в репродуктивной физиологии, акушерских осложнениях и повреждении плода.Nutr Rev 65: S194–202.
- 5. Ромеро Р., Эспиноза Дж, Чайворапонгса Т., Калаче К. (2002) Инфекция и недоношенность и роль профилактических стратегий. Semin Neonatol 7: 259–274.
- 6. Гольденберг Р.Л., Эндрюс В.В., Гёпферт А.Р., Фэй-Петерсен О., Кливер С.П. и др. (2008) Исследование преждевременных родов в Алабаме: культуры пуповинной крови Ureaplasma urealyticum и Mycoplasma hominis у очень недоношенных новорожденных. Am J Obstet Gynecol 198: 43 e41–45.
- 7.Sung TJ (2010) Инфекции уреаплазмы у недоношенных детей: последняя информация о роли видов уреаплазм как неонатальных патогенов. Korean J Pediatr 53: 989–993.
- 8. Viscardi RM, Hashmi N, Gross GW, Sun CC, Rodriguez A и др. (2008) Частота инвазивной уреаплазмы у детей с очень низкой массой тела: связь с тяжелым внутрижелудочковым кровоизлиянием. J Perinatol 28: 759–765.
- 9. Cassell GH, Waites KB, Watson HL, Crouse DT, Harasawa R (1993) Внутриутробная инфекция Ureaplasma urealyticum: роль в недоношенности и заболеваниях у новорожденных.Clin Microbiol Rev 6: 69–87.
- 10. Waites KB, Katz B, Schelonka RL (2005) Микоплазмы и уреаплазмы как патогены новорожденных. Clin Microbiol Rev 18: 757–789.
- 11. Хиллиер С.Л., Мартиус Дж., Крон М., Кивиат Н., Холмс К.К. и др. (1988) Исследование случай-контроль хориоамнионической инфекции и гистологического хориоамнионита у недоношенных. N Engl J Med 319: 972–978.
- 12. Каспер Д.К., Мехтлер Т.П., Райшер Г.Х., Витт А., Ланггартнер М. и др. (2010) Бактериальная нагрузка Ureaplasma parvum в околоплодных водах коррелирует с усилением внутриутробной воспалительной реакции.Диагностика Microbiol Infect Dis 67: 117–121.
- 13. Ким MJ, Romero R, Gervasi MT, Kim JS, Yoo W и др. (2009) Широко распространенная микробная инвазия хориоамниотических мембран является следствием, а не причиной внутриамниотической инфекции. Лаборатория Инвест 89: 924–936.
- 14. Эспиноза Дж., Чайворапонгса Т., Ромеро Р., Гомес Р., Ким Дж. К. и др. (2002) Доказательства участия растворимого CD14 в ответе хозяина на микробную инвазию амниотической полости и внутриамниотическое воспаление при доношенных и преждевременных сроках беременности.J Matern Fetal Neonatal Med 12: 304–312.
- 15. Крауз Д. Т., Одрезин Г. Т., Каттер Г. Р., Риз Дж. М., Хамрик В. Б. и др. (1993) Рентгенологические изменения, связанные с выделением Ureaplasma urealyticum трахеи новорожденных. Clin Infect Dis 17 Дополнение 1: S122–130.
- 16. Viscardi R, Manimtim W., He JR, Hasday JD, Sun CC и др. (2006) Нарушение распределения легочных миофибробластов и экспрессии эластина у недоношенных детей с пневмонией Ureaplasma urealyticum.Педиатр Дев Патол 9: 143–151.
- 17. Уэйтс К.Б., Радд П.Т., Крауз Д.Т., Канупп К.С., Нельсон К.Г. и др. (1988) Хронические инфекции Ureaplasma urealyticum и Mycoplasma hominis центральной нервной системы у недоношенных детей. Ланцет 1: 17–21.
- 18. Санчес П.Дж., Реган Дж.А. (1990) Вертикальная передача Ureaplasma urealyticum от матери к недоношенным детям. Pediatr Infect Dis J 9: 398–401.
- 19. Оуэ С., Хирои М., Огава С., Хира С., Хасегава М. и др.(2009) Связь микробов желудочного сока при рождении с тяжелой бронхолегочной дисплазией. Arch Dis Child Fetal Neonatal Ed 94: F17–22.
- 20. Novy MJ, Duffy L, Axthelm MK, Sadowsky DW, Witkin SS и др. (2009) Ureaplasma parvum или Mycoplasma hominis как единственные патогены вызывают хориоамнионит, преждевременные роды и пневмонию плода у макак-резусов. Reprod Sci 16: 56–70.
- 21. Viscardi RM, Atamas SP, Luzina IG, Hasday JD, He JR, et al. (2006) Антенатальная инфекция дыхательных путей Ureaplasma urealyticum стимулирует провоспалительные, профибротические реакции в легких недоношенных павианов.Pediatr Res 60: 141–146.
- 22. Коллинз Дж. Дж., Каллапур С. Г., Нокс С. Л., Ницос I, Полглаз Г. Р. и др. (2010) Воспаление плода овцы в результате внутриамниотической инъекции Ureaplasma parvum. Am J Physiol Lung Cell Mol Physiol 299: L852–860.
- 23. Мосс Т.Дж., Нокс С.Л., Каллапур С.Г., Ницос И., Теодоропулос С. и др. (2008) Экспериментальная инфекция околоплодных вод у овец: влияние сероваров 3 и 6 Ureaplasma parvum на недоношенных или доношенных плодов овец. Am J Obstet Gynecol 198: 122 e121–128.
- 24. Polglase GR, Dalton RG, Nitsos I, Knox CL, Pillow JJ и др. (2010) Развитие легочных сосудов и альвеол у недоношенных ягнят, хронически колонизированных Ureaplasma parvum. Am J Physiol Lung Cell Mol Physiol 299: L232–241.
- 25. Йодер Б.А., Коулсон Дж. Дж., Винтер В. Т., Силер-Ходр Т., Даффи Л. Б. и др. (2003) Влияние антенатальной колонизации ureaplasma urealyticum на заболевание легких у неполовозрелого павиана. Pediatr Res. 54: 797–807.
- 26.Normann E, Lacaze-Masmonteil T, Eaton F, Schwendimann L, Gressens P и др. (2009) Новая мышиная модель перинатального воспаления, вызванного уреаплазмой: влияние на легкие и повреждение головного мозга. Pediatr Res 65: 430–436.
- 27. Кемп М.В., Сайто М., Каллапур С.Г., Джоб А.Х., Килан Дж. А. и др. (2011) Воспаление кожи плода овцы после внутриутробного воздействия Ureaplasma parvum. Reprod Sci 18: 1128–1137.
- 28. Horowitz S, Mazor M, Horowitz J, Porath A, Glezerman M (1995) Антитела к Ureaplasma urealyticum у женщин с интраамниотической инфекцией и неблагоприятным исходом беременности.Acta Obstet Gynecol Scand 74: 132–136.
- 29. Horowitz S, Mazor M, Romero R, Horowitz J, Glezerman M (1995) Инфекция амниотической полости Ureaplasma urealyticum в середине триместра беременности. J Reprod Med 40: 375–379.
- 30. Сунг Т.Дж., Сяо Л., Даффи Л., Уэйтс К.Б., Ческо К.Л. и др. (2011) Частота сероваров уреаплазмы в респираторном секрете недоношенных детей с риском бронхолегочной дисплазии. Pediatr Infect Dis J 30: 379–383.
- 31.Dando SJ, Nitsos I., Kallapur SG, Newnham JP, Polglase GR, et al. (2012) Роль многополосного антигена Ureaplasma parvum во внутриамниотической инфекции: главный фактор вирулентности или приманка? PLoS One 7: e29856.
- 32. Redline RW (2006) Воспалительные реакции в плаценте и пуповине. Semin Fetal Neonatal Med 11: 296–301.
- 33. Buhimschi CS, Bhandari V, Han YW, Dulay AT, Baumbusch MA, et al. (2009) Использование протеомики в перинатальном и неонатальном сепсисе: надежды и проблемы на будущее.Curr Opin Infect Dis 22: 235–243.
- 34. Граветт М.Г., Томас А., Шнайдер К.А., Редди А.П., Дасари С. и др. (2007) Протеомный анализ цервикально-вагинальной жидкости: идентификация новых биомаркеров для выявления внутриамниотической инфекции. J Proteome Res 6: 89–96.
- 35. Romero R, Kusanovic JP, Gotsch F, Erez O, Vaisbuch E, et al. (2010) Изобарическое маркирование и тандемная масс-спектрометрия: новый подход к профилированию и количественной оценке белков, дифференциально экспрессируемых в околоплодных водах при преждевременных родах с внутриамниотической инфекцией / воспалением и без них.J Matern Fetal Neonatal Med 23: 261–280.
- 36. Nagamatsu T, Schust DJ (2010) Иммуномодулирующая роль макрофагов на границе раздела матери и плода. Reprod Sci 17: 209–218.
- 37. Менон Р., Уильямс С.М., Фортунато С.Дж. (2007) Концентрации интерлейкина-1бета и интерлейкина-8 в околоплодных водах: расовые различия в преждевременных родах. Reprod Sci 14: 253–259.
- 38. Менон Р., Торсен П., Фогель И., Якобссон Б., Морган Н. и др. (2008) Расовые различия в концентрациях фактора некроза опухоли (TNF) -альфа в околоплодных водах и растворимых рецепторов TNF при спонтанных преждевременных родах.Am J Obstet Gynecol 198: 533 e531–510.
- 39. Велес Д.Р., Фортунато С.Дж., Торсен П., Ломбарди С.Дж., Уильямс С.М. и др. (2008) Преждевременные роды у кавказцев связаны с вариантами генов путей коагуляции и воспаления. PLoS One 3: e3283.
- 40. Велес Д.Р., Фортунато С., Торсен П., Ломбарди С.Дж., Уильямс С.М. и др. (2009) Самопроизвольные преждевременные роды у афроамериканцев связаны с инфекцией и вариантами гена воспалительного ответа. Am J Obstet Gynecol 200: 209 e201–227.
- 41. Macones GA, Parry S, Elkousy M, Clothier B, Ural SH и др. (2004) Полиморфизм в промоторной области TNF и бактериальный вагиноз: предварительные доказательства взаимодействия генов и окружающей среды в этиологии спонтанных преждевременных родов. Am J Obstet Gynecol 190: 1504–1508; обсуждение 1503A.
- 42. Алленбах С., Цуффери С., Перес С., Лаунуа П., Мюллер С. и др. (2006) Макрофаги вызывают апоптоз нейтрофилов через мембранный TNF, процесс, усиленный Leishmania major.J Immunol 176: 6656–6664.
- 43. Чармой М., Мегнеку Р., Алленбах С., Цвайфель С., Перес С. и др. (2007) Leishmania major индуцирует различные фенотипы нейтрофилов у мышей, которые устойчивы или чувствительны к инфекции. J Leukoc Biol 82: 288–299.
- 44. Kuroda E, Yamashita U (2003) Механизмы повышенной опосредованной макрофагами продукции простагландина E2 и его подавляющая роль в активации Th2 у Th3-доминантных мышей BALB / c. J Immunol 170: 757–764.
- 45.Watanabe H, Numata K, Ito T, Takagi K, Matsukawa A (2004) Врожденный иммунный ответ у Th2- и Th3-доминантных линий мышей. Шок 22: 460–466.
- 46. Mills CD, Kincaid K, Alt JM, Heilman MJ, Hill AM (2000) Макрофаги M-1 / M-2 и парадигма Th2 / Th3. J Immunol 164: 6166–6173.
- 47. Окогбуле-Воноди AC, Gross GW, Sun CC, Agthe AG, Xiao L и др. (2011) Некротический энтероколит связан с колонизацией уреаплазмы у недоношенных детей. Pediatr Res 69: 442–447.
- 48. Schelonka RL, Waites KB (2007) Инфекция уреаплазмы и неонатальная болезнь легких. Семин Перинатол 31: 2–9.
- 49. Waites KB, Schelonka RL, Xiao L, Grigsby PL, Novy MJ (2009) Врожденные и условно-патогенные инфекции: виды Ureaplasma и Mycoplasma hominis. Semin Fetal Neonatal Med 14: 190–199.
- 50. Kuroda E, Kito T, Yamashita U (2002) Снижение экспрессии STAT4 и IFN-гамма в макрофагах мышей BALB / c. J Immunol 168: 5477–5482.
- 51. Салминен А., Паананен Р., Вуолтенахо Р., Метсола Дж., Ояниеми М. и др. (2008) Преждевременные роды у мышей, вызванные материнским эндотоксином: реакции плода в толл-подобных рецепторах, коллектинах и цитокинах. Pediatr Res 63: 280–286.
- 52. Gravett MG, Novy MJ, Rosenfeld RG, Reddy AP, Jacob T. и др. (2004) Диагностика внутриамниотической инфекции с помощью протеомного профилирования и идентификации новых биомаркеров. JAMA 292: 462–469.
- 53. Ли Й.Х., Браунер А., Йонссон Б., Ван дер Плоег И., Содер О. и др.(2001) Ингибирование экспрессии провоспалительных цитокинов макрофагами стероидами и рекомбинантным IL-10. Биология новорожденных 80: 124–132.
- 54. De Dooy JJ, Mahieu LM, Van Bever HP (2001) Роль воспаления в развитии хронического заболевания легких у новорожденных. Eur J Pediatr 160: 457–463.
- 55. Олому И.Н., Хечт Дж.Л., Ондердонк А.О., Оллред Э.Н., Левитон А. и др. (2009) Перинатальные корреляты Ureaplasma urealyticum в паренхиме плаценты при одноплодной беременности, завершившейся до 28 недель беременности.Педиатрия 123: 1329–1336.
- 56. Gerber S, Vial Y, Hohlfeld P, Witkin SS (2003) Обнаружение Ureaplasma urealyticum в околоплодных водах второго триместра с помощью полимеразной цепной реакции коррелирует с последующими преждевременными родами и родами. J Infect Dis 187: 518–521.
- 57. Перни С.К., Вардхана С., Корнеева И., Таттл С.Л., Параскевас Л.Р. и др. (2004) Mycoplasma hominis и Ureaplasma urealyticum в околоплодных водах среднего триместра: связь с уровнем цитокинов околоплодных вод и исходом беременности.Am J Obstet Gynecol 191: 1382–1386.
- 58. Ондердонк А.Б., Делани М.Л., Дюбуа А.М., Оллред Э.Н., Левитон А. и др. (2008) Обнаружение бактерий в тканях плаценты, полученных от новорожденных с очень низким гестационным возрастом. Am J Obstet Gynecol 198: 110 e111–117.
- 59. Bratton DL, Henson PM (2011) Очистка от нейтрофилов: когда вечеринка заканчивается, начинается очистка. Тенденции Immunol 32: 350–357.
- 60. Benoit M, Desnues B, Mege JL (2008) Поляризация макрофагов при бактериальных инфекциях.J Immunol 181: 3733–3739.
- 61. Эстрада-Гутьеррес Г., Гомес-Лопес Н., Зага-Клавеллина В., Гионо-Сересо С., Эспехель-Нуньес А. и др. (2010) Взаимодействие между патогенными бактериями и внутриматочными лейкоцитами запускает альтернативные молекулярные сигнальные каскады, ведущие к родам у женщин. Заражение иммунной 78: 4792–4799.
- 62. Aaltonen R, Heikkinen J, Vahlberg T, Jensen JS, Alanen A (2007) Местная воспалительная реакция в хориодециду, вызванная Ureaplasma urealyticum.BJOG 114: 1432–1435.
- 63. Бухимски CS, Бухимски И.А., Абдель-Разек С., Розенберг В.А., Тунг С.Ф. и др. (2007) Протеомные биомаркеры внутриамниотического воспаления: связь с фунизитом и ранним сепсисом у недоношенных новорожденных. Pediatr Res 61: 318–324.
- 64. Готч Ф., Ромеро Р., Кусанович Дж. П., Мазаки-Тови С., Пинелес Б. Л. и др. (2007) Синдром воспалительной реакции плода. Clin Obstet Gynecol 50: 652–683.
- 65. Dische MR, Quinn PA, Chegledy-Nagy E, Sturgess JM (1979) Инфекция генитальной микоплазмы.Внутриутробная инфекция: патологическое исследование плода и плаценты. Am J Clin Pathol 72: 167–174.
- 66. Волощук И.Н., Коган Е.А., Секамова С.М., Ширинская О.Г. (1994) [Внутриутробный микоплазмоз в сочетании с двусторонней ганглионейробластомой надпочечников]. Арх Патол 56: 76–79.
- 67. Knox CL, Dando SJ, Nitsos I., Kallapur SG, Jobe AH, et al. (2010) Тяжесть хориоамнионита у беременных овец связана с вариациями in vivo на поверхности многоканального антигена / гена Ureaplasma parvum.Биол Репрод 83: 415–426.
- 68. Reyes L, Reinhard M, O’Donell LJ, Stevens J, Brown MB (2006) Штаммы крыс различаются по восприимчивости к инфекции мочевыводящих путей, вызванной Ureaplasma parvum, и образованию струвитных камней. Infect Immun 74: 6656–6664.
- 69. Reyes L, Reinhard M, Brown MB (2009) Различные воспалительные реакции связаны с Ureaplasma parvum-индуцированными ИМП и образованием уролитов. BMC Infect Dis 9: 9.
- 70. Рейес Л., Шелтон М., Риггс М., Браун М.Б. (2004) Штаммы крыс различаются по восприимчивости к инфекции матери и плода Mycoplasma pulmonis.Am J Reprod Immunol 51: 211–219.
- 71. Allam AB, Alvarez S, Brown MB, Reyes L (2011) Инфекция Ureaplasma parvum изменяет динамику филамина А в клетках-хозяевах. BMC Infect Dis 11: 101
- 72. Шмитген Т.Д., Ливак К.Дж. (2008) Анализ данных ПЦР в реальном времени с помощью сравнительного метода C (T). Nat Protoc 3: 1101–1108.
Лечение негонококкового уретрита — NHS
Негонококковый уретрит (НГУ) обычно лечится коротким курсом антибиотиков для уничтожения бактерий, вызвавших инфекцию.
Медицинские работники клиники сексуального здоровья (также известной как клиника ГУМ) организуют ваше лечение.
Если ваш уретрит вызван гонореей, его можно лечить по-другому.
Антибиотики
Лечение антибиотиками можно начать до получения результатов анализов. Большинству людей с НГУ назначают таблетки или капсулы с антибиотиками.
Это может быть:
Обычно вам не нужно возвращаться в клинику, если вы:
- прошли курс лечения
- удостоверились, что все недавние партнеры прошли курс лечения
- не занимались сексом до через неделю после того, как все прошли курс лечения
Иногда для полного исчезновения симптомов может потребоваться 2 или 3 недели.
Не занимайтесь сексом, в том числе вагинальным, анальным и оральным, пока:
- вы не закончили курс доксициклина или не прошли 7 дней с момента приема азитромицина
- у вас нет симптомов
- ваш партнер или партнеры также проходили лечение
Побочные эффекты
Антибиотики могут вызывать некоторые побочные эффекты, такие как:
Информирование партнеров
Можно передать НГУ во время секса, поэтому имеет смысл рассматривать все случаи НГУ как передающиеся половым путем инфекции (ИППП) и убедитесь, что все недавние партнеры прошли курс лечения.
Вы также не должны заниматься сексом, пока не убедитесь, что состояние улучшилось.
Рекомендуется проинформировать любого человека, с которым вы занимались сексом в течение последних 3 месяцев, но этот срок может варьироваться. Медицинские работники клиники сексуального здоровья могут вам посоветовать.
Некоторые люди могут злиться, расстраиваться или смущаться, обсуждая ИППП со своим нынешним партнером или предыдущими партнерами.
Однако не бойтесь обсуждать свои проблемы с медицинскими работниками клиники сексуального здоровья.Они могут посоветовать вам, с кем связаться и как лучше с ними связаться.
С вашего разрешения клиника может организовать выдачу «контактных данных» вашему бывшему партнеру или партнерам.
В квитанции объясняется, что они могли заразиться ИППП, и рекомендуется пройти обследование. На нем нет вашего имени, и ваши данные останутся полностью конфиденциальными.
Никто не может заставить вас рассказать кому-либо из ваших партнеров о вашей ИППП, но мы настоятельно рекомендуем это сделать.Без лечения такие ИППП, как хламидиоз, могут иметь серьезные последствия для здоровья человека, особенно женщин.
Осложнения нелеченого хламидиоза включают:
Неудача лечения
Если у вас все еще сохраняются симптомы негонококкового уретрита (НГУ) после того, как вы закончили курс антибиотиков, вернитесь в клинику сексуального здоровья.
Вас могут спросить, правильно ли вы приняли лекарство и мог ли кто-либо с нелеченным НГУ передать вам инфекцию.
Вам могут потребоваться дополнительные анализы для подтверждения вашего диагноза и проверки на наличие ИППП.
В некоторых случаях вам могут выписать новый рецепт на различные антибиотики для лечения НГУ.
Последняя проверка страницы: 6 марта 2020 г.
Срок следующей проверки: 6 марта 2023 г.


 А появившиеся в промежности болезненные ощущения могут говорить уже о простатите;
А появившиеся в промежности болезненные ощущения могут говорить уже о простатите; Бактерия не приспособлена к существованию вне привычной среды. Даже использование общих санитарно-гигиенических принадлежностей с больным человеком или носителем считается безопасным, а также с ним в одном бассейне.
Бактерия не приспособлена к существованию вне привычной среды. Даже использование общих санитарно-гигиенических принадлежностей с больным человеком или носителем считается безопасным, а также с ним в одном бассейне. То же самое можно сказать и о наличии в выделениях тромбов в межменструальный период.
То же самое можно сказать и о наличии в выделениях тромбов в межменструальный период.