Способ лечения детей с проявлениями затяжной желтухи в периоде новорожденности
Изобретение относится к медицине и предназначено для лечения затяжных вариантов течения желтухи у новорожденных. Назначают препараты УДХК в дозе 20-30 мг/кг в сутки, терапию проводят не менее трех мес. Назначают свечи виферона ректально. Суточная доза 50 тыс. ед/кг. Схема приема 10 дней ежедневно, затем через день от трех до 9-12 мес. Цитомегаловирус подавляют применением препарата ацикловир-акри и его аналогов зовиракс, валтрекс в течение 21-30 дней. Для подавления возбудителей микоплазмоза, уреаплазмоза и хламидиоза назначают препараты из группы макролидов ровамицин и сумамед. Схема: ровамицин из расчета 100 тыс. ед/кг в сутки 7 дней, затем сумамед разовой дозой 10 мг/кг однократно, прерывистой схемой 1 раз в неделю, на 3 недели. Дополнительно применяют препараты, усиливающие фагоцитоз: ликопид, полиоксидоний, раствор димефосфона в возрастных дозах. Способ позволяет уменьшить сроки лечения и избежать осложнений.
Изобретение относится к медицине, разделу педиатрия и может быть применено педиатрами разных специальностей в практике врачевания затяжных вариантов течения желтухи у младенцев первого года жизни. В проведенных пилотных исследованиях затяжное течение желтухи отмечалось у 165 из 625 детей (26,4%), т.е. у каждого четвертого новорожденного ребенка.
Традиционная терапия направлена на лечение желтухи различными способами.
Известными методами лечения желтухи у новорожденных по-прежнему являются фототерапия и назначение препарата фенобарбитал [«Основы перинатологии» под ред. Н.П.Шабалова, Ю.В.Цвелева, 2004; «Гипербилирубинемии у новорожденных детей», авторы И.В.Александрович, И.М.Шатилло, 2006]. Данные способы лечения позволяют активизировать ферментные системы гепатоцитов, ускорить связывание и выведение токсичного для нервной системы новорожденного непрямого билирубина, иными словами, положительный эффект от лечения достигается только при нормально протекающей физиологической желтухе.
Недостатки фототерапии и применения препарата фенобарбитал следующие: они могут применяться короткими курсами не более 10 дней, при фототерапии необходимы капельницы вследствие потерь воды, фенобарбитал токсичен, как показывают наблюдения. Данные методы неэффективны при затяжной форме желтухи, при воспалении печени, при воздействии инфекционных факторов риска. Лечение затяжной формы желтухи у новорожденных проводят также такими лекарственными средствами, как хофитол, галстена, ЛИВ 52, эссенциале, гептрал [Проект протокола дифференциальной диагностики и лечения синдрома холестаза у новорожденных детей». А.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин, 2008; «Федеральное руководство для врачей по использованию лекарственных средств (формулярная система)», 2006]. ЛИВ 52 и хофитол — растительные препараты, галстена — гомеопатическое средство, все они обладают желчегонным и гепатопротективным действием. Эссенциале и гептрал обладают антитоксическим свойством, доказана их эффективность при токсических, алкогольных, лекарственных поражениях печени.
 А.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин, 2008; «Nenatal Cholestasis», авторы S.Venigalla, G.R.Gourley Э, 2005]. Недостатком этих методов коррекции желтухи является то, что они применяются как общие рекомендации, на практике затяжная форма желтухи данными методами не устраняется, у детей продолжается желтуха, увеличиваются размеры печени и селезенки, появляется активность ферментов и гепатит.
А.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин, 2008; «Nenatal Cholestasis», авторы S.Venigalla, G.R.Gourley Э, 2005]. Недостатком этих методов коррекции желтухи является то, что они применяются как общие рекомендации, на практике затяжная форма желтухи данными методами не устраняется, у детей продолжается желтуха, увеличиваются размеры печени и селезенки, появляется активность ферментов и гепатит.Ближайшим аналогом заявляемого способа является способ устранении желтухи и холестаза у новорожденных посредством применения урсодеоксихолевой кислоты (УДХК) [«Гипербилирубинемии у новорожденных детей», авторы И.В.Александрович, И.М.Шатилло, 2006; «Проект протокола дифференциальной диагностики и лечения синдрома холестаза у новорожденных детей». А.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин, 2008; «Применение препаратов урсодеоксихолевой кислоты (урсосана) в лечении острых и хронических вирусных гепатитов», авторы А.Р.Рейзис, Н.В.Матанина, Т.С.Никитина и др., 2006; «Nenatal Cholestasis», авторы S.Venigalla, G. R.Gourley Э, 2005]. Достоинства препаратов УДХК весьма высоки и хорошо обоснованы. Терапевтический эффект УДХК отмечен при лечении желчнокаменной болезни, позже была получена положительная динамика при лечении хронических холестатических гепатитов, прогрессирующих до цирроза печени. Было доказано, что в 100% случаев в пунктатах печени исчезают признаки холестаза. Были получены доказательства безопасности применения препаратов УДХК у детей с самого рождения, положительный эффект достигнут при лечении холестатических желтух и неонатальных гепатитов у детей. В публикациях показано антитоксическое свойство препарата. Наконец, в последние годы доказано антифибротическое и антиапоптотическое действие УДХК, что позволяет использовать ее в случае хронизации процесса. Проведенные исследования в педиатрии свидетельствуют о благотворном влиянии УДХК на клинико-биохимические и гистологические параметры при острых и хронических вирусных гепатитах, при желтухе и холестазе новорожденных. УДХК можно применять длительно, поскольку опасность ее передозирования не отмечена.
R.Gourley Э, 2005]. Достоинства препаратов УДХК весьма высоки и хорошо обоснованы. Терапевтический эффект УДХК отмечен при лечении желчнокаменной болезни, позже была получена положительная динамика при лечении хронических холестатических гепатитов, прогрессирующих до цирроза печени. Было доказано, что в 100% случаев в пунктатах печени исчезают признаки холестаза. Были получены доказательства безопасности применения препаратов УДХК у детей с самого рождения, положительный эффект достигнут при лечении холестатических желтух и неонатальных гепатитов у детей. В публикациях показано антитоксическое свойство препарата. Наконец, в последние годы доказано антифибротическое и антиапоптотическое действие УДХК, что позволяет использовать ее в случае хронизации процесса. Проведенные исследования в педиатрии свидетельствуют о благотворном влиянии УДХК на клинико-биохимические и гистологические параметры при острых и хронических вирусных гепатитах, при желтухе и холестазе новорожденных. УДХК можно применять длительно, поскольку опасность ее передозирования не отмечена.
Целью изобретения является разработка способа лечения новорожденных и детей первого года жизни, имеющих клинико-лабораторные проявления затяжной желтухи в периоде новорожденности.
Технический результат заключается в том, что заявляемый способ в отличие от ближайшего аналога позволяет проводить коррекцию затяжной формы желтухи у новорожденных путем реализации комбинированной программы лечения, направленной на устранение нескольких факторов риска, способствующих неблагоприятному течению и прогнозу.
1) Препараты УДХК урсосан или урсофальк назначаются в терапевтической дозе 20-30 мг/кг в сутки, поскольку доказана их безопасность, дозазависимый эффект, способность к устранению желтухи, холестаза, уменьшению размеров печени. Антифибротическое и антиапоптотическое действие УДХК открыто и доказано в последние годы, т.к. именно фиброз и апоптоз формируют механизм хронического воспаления в печени. Непременное условие применения — продолжительная терапия не менее 3 месяцев, можно на 6-12 мес.
2) Свечи виферона назначаются ректально в суточной дозе 50 тыс. ед/кг по схеме: 10 дней ежедневно — доза насыщения, затем через день не менее трех месяцев. Механизм действия виферона заключается в подавлении размножения вирусов, в стимуляции образования защитных антител.
Используется также способность виферона при длительном применении препятствовать фиброзу печени, назначая его при необходимости сроков на 6-12 месяцев.
3) Главной идеей в протоколе лечения желтухи является применение препаратов, целенаправленно воздействующих на подавление размножения вирусов и условно-патогенных возбудителей из группы урогенитальных инфекций, роль которых в затяжном проявлении желтухи и воспалении печени доказана:
— группа герпесвирусов, в том числе цитомегалонирус (ЦМВ) подавляются применением препарата ацикловир-акри и его аналогов зовиракс, валтрекс в течение 21-30 дней (1 цикл). Как правило, в аннотациях к применению данная группа препаратов рекомендуется продолжительностью не более 5-14 дней. Возможно применение 2-х циклов противовирусной защиты, все зависит от динамики показателей крови и вирусной активности. Препараты оказались эффективными, без побочного действии в виде нейтропении, могут использоваться длительно в амбулаторной практике врача, прием осуществляется через рот. За рубежом применяют весьма токсичный препарат для внутривенного введения — ганцикловир в течение 6 недель, он подавляет функцию почек и кровотворения, что является весьма серьезным недостатком, ограничивающим его использование в широкой педиатрической практике;
Как правило, в аннотациях к применению данная группа препаратов рекомендуется продолжительностью не более 5-14 дней. Возможно применение 2-х циклов противовирусной защиты, все зависит от динамики показателей крови и вирусной активности. Препараты оказались эффективными, без побочного действии в виде нейтропении, могут использоваться длительно в амбулаторной практике врача, прием осуществляется через рот. За рубежом применяют весьма токсичный препарат для внутривенного введения — ганцикловир в течение 6 недель, он подавляет функцию почек и кровотворения, что является весьма серьезным недостатком, ограничивающим его использование в широкой педиатрической практике;
— возбудители микоплазмоза, уреаплазмоза и хламидиоза, маркеры которых обнаруживаются в процессе обследования, погибают под действием препаратов из группы макролидов, наиболее оптимальными являются ровамицин и сумамед, которые применяются последовательно по схеме: сначала ровамицин из расчета 100 тыс. ед/кг в сутки 7 дней, затем сумамед разовой дозой 10 мг/кг однократно, прерывистой схемой 1 раз в неделю, 3 недели. В этой программе лечения дополнительно применяются препараты, усиливающие фагоцитоз, как-то: ликопид, полиоксидоний, раствор димефосфона в возрастных дозах;
В этой программе лечения дополнительно применяются препараты, усиливающие фагоцитоз, как-то: ликопид, полиоксидоний, раствор димефосфона в возрастных дозах;
— терапевтические схемы лечения токсоплазмоза разработаны и также успешно применяются в лечебной практике для устранения гепатита. Для лечения желтухи при токсоплазмозе используются препараты из группы макролидов, в частности ровамицин продолжительностью 3 недели, возможно повторение цикла. Затем применяются лекарственные средства с противопаразитарным механизмом действия — это пириметамин, у нас в РФ аналоги фансидар, дараприм, тиндурин в комбинации с группой сульфаниламидов (септрин, сульфадиметоксин), метронидазол (метрогил) и фолиниевая кислота для профилактики побочного действия препаратов;
— вирусные гепатиты В и С лечатся разработанными ранее протоколами.
Эффективность комбинированного протокола лечения желтухи подтверждают результаты 45 историй болезни детей первого года жизни, родители которых обратились на консультативный прием педиатра-инфекциониста с единственной жалобой: наличие затяжной желтухи в периоде новорожденности с последующим формированием активности ферментов в биохимическом анализе крови. Для статистического анализа данных использовался пакет прикладных программ Excel XP-Windows и Statistica, 6 версия. В качестве нормативных показателей состояния здоровья у новорожденных и детей первого года жизни принято пользоваться следующими значениями:
Для статистического анализа данных использовался пакет прикладных программ Excel XP-Windows и Statistica, 6 версия. В качестве нормативных показателей состояния здоровья у новорожденных и детей первого года жизни принято пользоваться следующими значениями:
— Уровень общего билирубина (ОБ) — 0,5-20,5 мкмоль/л
— Показатели ферментов АЛТ (АлАТ) и ACT (АсАТ) — до 40 ед/л
— Уровень щелочной фосфатазы (ЩФ) — до 350 ед/л
— Размеры печени и селезенки ниже края реберной дуги не пальпируются или 0,0 см.
В первые 14 дней жизни малыша желтуха ассоциируется с желтухой физиологической или грудного вскармливания. У 45 детей, имевших затяжной вариант течения желтухи, проведен ретроспективный анализ показателей состояния здоровья. Средняя продолжительность желтухи составила 69,3±24,6 дня, показатели общего билирубина к моменту выписки из роддома достигали 146,4±17,4 мкмоль/л, в динамике к возрасту одного месяца сохранялись на уровне 113,1±42,3 мкмоль/л, т.е превышали норму в 7-5 раз. Полная нормализация уровня билирубина и исчезновение желтухи отмечены только к пятому месяцу жизни.
Полная нормализация уровня билирубина и исчезновение желтухи отмечены только к пятому месяцу жизни.
Характерной чертой динамики показателей ОБ, АЛТ и ACT является тот момент, что на фоне общей тенденции нормализации уровня ОБ появляется активность ферментов, называемая гепатитом или воспалением печени. И тогда нормальная желтуха новорожденного принимает черты патологической затяжной желтухи. Продолжительность повышения уровня ферментов равна 7,5±3,7 мес., отмечена прямая связь между длительностью повышения трансаминаз и началом лечения воспаления печени, иными словами, педиатры и родители длительно лечат желтуху традиционными способами, не приводящими к успеху. На формирование затяжной формы желтухи может повлиять наличие инфицированности детей раннего возраста от матерей-носительниц инфекционных факторов риска. Дети были обследованы на TORCH-инфекции с учетом современной эпидемиологической ситуации в мире. TORCH — это общепринятая аббревиатура наиболее распространенных в современном мире инфекционных заболеваний: Т — токсоплазмоз, R — краснуха, С — цитомегаловирусная инфекция, Н — герпесвирусная инфекция, О — другие оппортунистические инфекции, такие как вирусные гепатиты В и С, хламидиоз, микоплазмоз, уреаплазмоз, инфекционный мононуклеоз. Какова доля инфицированности детей, формирующих затяжное течение желтухи, а вслед за этим и гепатит как воспаление печени?
Какова доля инфицированности детей, формирующих затяжное течение желтухи, а вслед за этим и гепатит как воспаление печени?
Разделение на две группы было осуществлено по принципу: дети 1-й группы (n. 29) получали традиционное лечение желтухи длительное время до 4-6 месяцев, во 2-й группе (n. 16) детям рано назначали комбинированное лечение с 1,5-2 месяцев. Пациенты сравниваемых групп имели одинаковые стартовые показатели на момент лечения: вес и рост были в пределах допустимой нормы, степень увеличения размеров печени и селезенки не различалась, продолжительность желтухи была одинаковой и составила в 1-й группе 70,9±32,1 дней, во 2-й группе — 68,6±30,3 дня. Таким образом, практически все дети с затяжной желтухой впоследствии развернули заболевание печени, у них в 100% случаев обнаружили маркеры TORCH-инфекций и многообразие вариантов, они «не ответили» положительно на традиционные методы лечения.
Показатели эффективности применения ранней комбинированной терапии, направленной на устранение желтухи во 2-й группе, следующие. На фоне рано проведенного комбинированного лечения у детей 2-й группы достоверно уменьшились размеры печени и селезенки, нормализовались показатели ОБ, АЛТ и ACT. Продолжительность лечения во 2-й группе была меньше и составила 4,2±1,03 месяца против 1-й группы 9,5±2,6 мес. 1-ая группа поздно стартовала в проведении полноценною лечения, что сказалось неблагоприятно на состоянии здоровья детей и способствовало затяжному течению процесса воспаления в печени.
На фоне рано проведенного комбинированного лечения у детей 2-й группы достоверно уменьшились размеры печени и селезенки, нормализовались показатели ОБ, АЛТ и ACT. Продолжительность лечения во 2-й группе была меньше и составила 4,2±1,03 месяца против 1-й группы 9,5±2,6 мес. 1-ая группа поздно стартовала в проведении полноценною лечения, что сказалось неблагоприятно на состоянии здоровья детей и способствовало затяжному течению процесса воспаления в печени.
В результате проведенных исследований можно сделать следующие выводы:
1) новорожденные с затяжной формой желтухи относятся к высокой группе риска инфицирования, в результате чего формируется заболевание гепатобилиарной системы в виде увеличения размеров печени и селезенки, повышения активности ферментов АЛТ и ACT,
2) риск инфицирования наблюдается в форме моноинфекции c частотой 51,7% в 1-й группе обследованных и 56,2% во 2-й, микст-инфекция встречается у 48,3% и 43,8% детей соответственно. Наиболее часто отмечаются клинические варианты активной цитомегаловирусной инфекции (65,5% в 1-й и 75% во 2-й), урогенитальные инфекции обнаруживаются в 31% и 12,5% случаев соответственно, герпесвирусные инфекции выявляются у 13,8% и 37,5% детей,
3) дети 2-й группы, рано начавшие комбинированную терапию, находятся в лучшем положении и в 2 раза быстрее выздоравливают по сравнению с детьми 1-й группы, длительное время получавшими традиционную терапию желтухи.
Таким образом, проведенные исследования доказывают целесообразность усовершенствования протокола лечения детей с проявлениями затяжной желтухи в периоде новорожденности. Клинические примеры, демонстрирующие эффективность нового протокола лечения, приводятся ниже.
Пример №1. Родители девочки П. обратились на консультативный прием в возрасте 4 месяцев с жалобами на затяжную форму желтухи. В возрасте 3-х недель показатели ОБ 81,3 мкмоль/л. При повторном исследовании биохимии крови в 1,5 мес. уровень ОБ повысился до 162,1 мкмоль/л, наросли значения АЛТ 51 ед/л. При осмотре печень увеличена на +4,5+2,5 см, селезенка на +1,5 см. Таким образом, у девочки сформировалось воспаление печени, в дебюте которого отмечалась затяжная форма желтухи. По результатам анализа крови диагностирована анемия 1 степени, т.к. уровень гемоглобина (Нв) составлял 92 г/л, лейкопения 5,1·10*, лимфомоноцитоз 82% и нейтропения 15%, в протеинограмме отмечается гипогаммаглобулинемия 8,8%. Девочка родилась доношенной, с нормальными весо-ростовыми показателями — М 3480 г. , L 54 см, Ангар 7/8б, привита в роддоме от гепатита В и БЦЖ. Параллельно с гепатитом и желтухой развивалось перинатальное поражение ЦНС, отмечались гнойный конъюнктивит и лимфадения, энтероколит, вызванный условнопатогенной флорой. Полиорганность клинических проявлений, гепатолиенальный синдром, лимфаденопатия, гинербилирубинемия, гиперферментемия, холестаз, анемия и показатели инфицированной крови стали основанием для проведения обследования на TORCH-инфекции. Маркеры гепатитов В и С отрицательные. Положительные антитела класса IgM к цитомегаловирусу в возрасте 3,5 мес, ДНК ЦМВ положительный анализ из крови методом ПЦР и положительные антитела к хламидиям в 4 мес позволили поставить диагноз активной острой цитомегаловирусной инфекции с синдромом гепатита, ассоциированной с хламидиозом. До 4-месячного возраста ребенок получал традиционную терапию по лечению желтухи, анемии, энтероколита, конъюнктивита, неврологии, выздоровления не отмечалось. С возраста 4 мес. был предложен комбинированный протокол лечения с целью устранения желтухи, гепатита.
, L 54 см, Ангар 7/8б, привита в роддоме от гепатита В и БЦЖ. Параллельно с гепатитом и желтухой развивалось перинатальное поражение ЦНС, отмечались гнойный конъюнктивит и лимфадения, энтероколит, вызванный условнопатогенной флорой. Полиорганность клинических проявлений, гепатолиенальный синдром, лимфаденопатия, гинербилирубинемия, гиперферментемия, холестаз, анемия и показатели инфицированной крови стали основанием для проведения обследования на TORCH-инфекции. Маркеры гепатитов В и С отрицательные. Положительные антитела класса IgM к цитомегаловирусу в возрасте 3,5 мес, ДНК ЦМВ положительный анализ из крови методом ПЦР и положительные антитела к хламидиям в 4 мес позволили поставить диагноз активной острой цитомегаловирусной инфекции с синдромом гепатита, ассоциированной с хламидиозом. До 4-месячного возраста ребенок получал традиционную терапию по лечению желтухи, анемии, энтероколита, конъюнктивита, неврологии, выздоровления не отмечалось. С возраста 4 мес. был предложен комбинированный протокол лечения с целью устранения желтухи, гепатита. Для лечения цитомегаловирусного гепатита назначен курс урсосана 20 мг/кг, суточная доза делится в 2 приема — на 4 мес.; зовиракс 50 мг/кг, суточная доза делится в 3 приема — на 4 недели; виферон 500 тысяч ед. по схеме на 3 мес.; для лечения хламидиоза — курс ровамицина 7 дней, затем сумамед в возрастных дозах, однократно — на 3 недели и ликопид на 14 дней. Мама также получала противовирусную терапию, т.к. доказанным является тот факт, что реактивированный вирус ЦМВ начинает выделяться с грудным молоком, отчего дети инфицируются в процессе грудного вскармливания, развивая инфекцию к возрасту одного месяца. Мониторинг клинико-биохимических и серологических показателей продемонстрировал положительную динамику, а именно: в 7 мес. размеры печени сократились до +1,0 см, селезенка не пальпируется, лимфузлы не увеличены, конъюнктивита нет, желтухи и холестаза нет, уровень ОБ 6,3 мкмоль/л, АЛТ 11,4 ед/л, ACT 20,4 ед/л, антитела IgM к ЦМВ отрицательные, ДНК ЦМВ в крови не определяется, показатель Нв 121 г/л при норме 110 г/л.
Для лечения цитомегаловирусного гепатита назначен курс урсосана 20 мг/кг, суточная доза делится в 2 приема — на 4 мес.; зовиракс 50 мг/кг, суточная доза делится в 3 приема — на 4 недели; виферон 500 тысяч ед. по схеме на 3 мес.; для лечения хламидиоза — курс ровамицина 7 дней, затем сумамед в возрастных дозах, однократно — на 3 недели и ликопид на 14 дней. Мама также получала противовирусную терапию, т.к. доказанным является тот факт, что реактивированный вирус ЦМВ начинает выделяться с грудным молоком, отчего дети инфицируются в процессе грудного вскармливания, развивая инфекцию к возрасту одного месяца. Мониторинг клинико-биохимических и серологических показателей продемонстрировал положительную динамику, а именно: в 7 мес. размеры печени сократились до +1,0 см, селезенка не пальпируется, лимфузлы не увеличены, конъюнктивита нет, желтухи и холестаза нет, уровень ОБ 6,3 мкмоль/л, АЛТ 11,4 ед/л, ACT 20,4 ед/л, антитела IgM к ЦМВ отрицательные, ДНК ЦМВ в крови не определяется, показатель Нв 121 г/л при норме 110 г/л. Т.о., данный клинический пример демонстрирует успех комбинированной схемы лечения.
Т.о., данный клинический пример демонстрирует успех комбинированной схемы лечения.
Пример №2. Мама обратилась на прием с девочкой в возраст 2,0 мес., у которой в момент осмотра наблюдалась желтуха. При осмотре ребенка выявлено увеличение задне-шейных и паховых лимфузлов, печень увеличена на +2,0 см, селезенка на +1,0 см отмечается рецидивирующий гнойный конъюнктивит с рождения, атопический дерматит, низкая прибавка в массе, анемия 1 степени с уровнем Нв 102 г/л. Динамика биохимии крови: ОБ на 5 день жизни 74,5 мкмоль/л, в 1 мес. нарастает до 153,9, в 2 мес. — 88,0. У девочки в момент выписки из роддома повышались показатели АЛТ и АСТ до 52 и 66 ед/л соответственно. При обследовании на TORCH-инфекции у ребенка были выявлены маркеры урогенитального микоплазмоза методом ПЦР из глаза и гениталий, более ничего не удалось обнаружить, гипотиреоз был исключен. У мамы урогенитальный микоплазмоз был санирован во время настоящей беременности, девочка родилась в срок, но с задержкой внутриутробного развития с М 2700 г. Согласно проведенным морфологическим исследованиям возбудители микоплазмоза могут поражать печень и вызывать гепатит, а клинический синдромокомлекс, перечисленный выше, позволяет поставить диагноз микоплазменной инфекции. До 2-х месяцев девочке эпизодически с целью устранения желтухи давали препарат урсофальк, лечение оказалось неэффективным из-за нерегулярного применения УДХК и наличия инфекции у ребенка. В 2,5 месяца был назначен новый протокол лечения: урсофальк дозой 20 мг/кг в сутки, непрерывно на 3 месяца, виферон 500 тыс. ед. через день на 2 месяца, ликопид в возрастных дозировках в комбинации с макролидом ровамицином на 7 дней с перерывом 10 дней с повторением курса еще раз. Наблюдение в динамике позволило выявить нормализацию уровня ОБ до 14,0 мкмоль/л и ферментов уже к 4 месяцу. Клиника вульвита и рецидивирующего конъюнктивита исчезла, печень и селезенка уменьшились до края реберной дуги, прошли явления атопического дерматита, нормализовались показатели гемоглобина без применения протокола лечения анемии, девочка стала хорошо прибавлять в весе, ПЦР контроль мазков показал отрицательные результаты.
Согласно проведенным морфологическим исследованиям возбудители микоплазмоза могут поражать печень и вызывать гепатит, а клинический синдромокомлекс, перечисленный выше, позволяет поставить диагноз микоплазменной инфекции. До 2-х месяцев девочке эпизодически с целью устранения желтухи давали препарат урсофальк, лечение оказалось неэффективным из-за нерегулярного применения УДХК и наличия инфекции у ребенка. В 2,5 месяца был назначен новый протокол лечения: урсофальк дозой 20 мг/кг в сутки, непрерывно на 3 месяца, виферон 500 тыс. ед. через день на 2 месяца, ликопид в возрастных дозировках в комбинации с макролидом ровамицином на 7 дней с перерывом 10 дней с повторением курса еще раз. Наблюдение в динамике позволило выявить нормализацию уровня ОБ до 14,0 мкмоль/л и ферментов уже к 4 месяцу. Клиника вульвита и рецидивирующего конъюнктивита исчезла, печень и селезенка уменьшились до края реберной дуги, прошли явления атопического дерматита, нормализовались показатели гемоглобина без применения протокола лечения анемии, девочка стала хорошо прибавлять в весе, ПЦР контроль мазков показал отрицательные результаты. В данном примере применение комбинированной и обоснованной схемы лечения позволило в предельно короткие сроки вылечить ребенка и устранить желтуху.
В данном примере применение комбинированной и обоснованной схемы лечения позволило в предельно короткие сроки вылечить ребенка и устранить желтуху.
Достоинство и преимущество нового способа лечения затяжной формы желтухи у детей раннего возраста подтверждаются следующими фактами: во-первых, программа лечения успешно прошла испытания в клинической практике и была доказана эффективность проводимой терапии статистическими методами анализа; во-вторых, продолжительная схема лечения апробирована в амбулаторно-поликлинической практике, что в современных условиях своевременно и востребовано.
Источники информации
1. Неонатология. Национальное руководство. Гл. редактор акад. РАМН Н.Н.Володин. — Москва. — «ГЭОТАР-Медиа». — 2007.
2. Основы перинатологии. Учебник под ред. проф. Н.П.Шабалова и проф. Ю.В.Цвелева. — Москва. — МЕДпресс-информ. — 2004.
3. Гипербилирубинемии у новорожденных детей. Пособие для врачей. И.В.Александрович, И.М.Шатилло. — СПб. — 2006.
4. Проект протокола дифференциальной диагностики и лечения синдрома холестаза у новорожденных детей. Л.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин. — Москва. — 2008.
Проект протокола дифференциальной диагностики и лечения синдрома холестаза у новорожденных детей. Л.В.Дегтярева, Ю.Г.Мухина, Н.Н.Володин. — Москва. — 2008.
5. Применение препаратов урсодеоксихолевой кислоты (урсосана) в лечении острых и хронических вирусных гепатитов. Информационное письмо. А.Р.Рейзис, Н.В.Матанина, Т.С.Никитина и др. — Москва. — Рекламно-издательская группа «МегаПро». — 2006.
6. Федеральное руководство для врачей по использованию лекарственных средств (формулярная система). Выпуск 7. — Москва. — 2006.
7. Nenatal Cholestasis. S.Venigalla, G.R.Gourley. — J. Arab Neonatal Forum. — 2005.
Способ лечения детей раннего возраста с проявлениями затяжной желтухи в периоде новорожденности с использованием препаратов УДХК урсосан или урсофальк, отличающийся тем, что реализуют комбинированную программу лечения, направленную на устранение нескольких факторов риска, способствующих неблагоприятному течению и прогнозу, препараты УДХК назначают в терапевтической дозе 20-30 мг/кг в сутки, суточную дозу делят на 2-3 приема, продолжительность лечения без коррекции дозы на снижение от 3 месяцев до 6-12 месяцев, свечи виферона вводят ректально и назначают в суточной дозе 50 тыс. ед./кг по схеме: 10 дней ежедневно, при этом герпесвирусы, в том числе цитомегаловирус, подавляют применением препарата ацикловир-акри и его аналогов зовиракс, валтрекс в течение 21-30 дней в 1 и/или 2 цикла, для подавления возбудителей микоплазмоза, уреаплазмоза и хламидиоза, назначают препараты из группы макролидов — ровамицин и сумамед, которые применяют последовательно по схеме: сначала ровамицин из расчета 100 тыс. ед./кг в сутки 7 дней, затем сумамед разовой дозой 10 мг/кг однократно, прерывистой схемой 1 раз в неделю в течение 3 недель, дополнительно применяют препараты, усиливающие фагоцитоз: ликопид, полиоксидоний, раствор димефосфона в возрастных дозах.
ед./кг по схеме: 10 дней ежедневно, при этом герпесвирусы, в том числе цитомегаловирус, подавляют применением препарата ацикловир-акри и его аналогов зовиракс, валтрекс в течение 21-30 дней в 1 и/или 2 цикла, для подавления возбудителей микоплазмоза, уреаплазмоза и хламидиоза, назначают препараты из группы макролидов — ровамицин и сумамед, которые применяют последовательно по схеме: сначала ровамицин из расчета 100 тыс. ед./кг в сутки 7 дней, затем сумамед разовой дозой 10 мг/кг однократно, прерывистой схемой 1 раз в неделю в течение 3 недель, дополнительно применяют препараты, усиливающие фагоцитоз: ликопид, полиоксидоний, раствор димефосфона в возрастных дозах.
— желтухи детей — Биохимия
Гемолитическая болезнь новорожденного
Причины
Несовместимость крови матери и плода по группе или по резус-фактору. Накопление гидрофобной формы билирубина в подкожном жире обусловливает желтушность кожи. Однако реальную опасность представляет накопление билирубина в сером веществе нервной ткани и ядрах ствола с развитием «ядерной желтухи» (билирубиновая энцефалопатия).
Клиническая диагностика
Проявляется сонливостью, плохим сосанием, умственной отсталостью, ригидностью затылочных мышц, тоническими судорогами, тремором конечностей, изменением рефлексов с возможным развитием глухоты и параличей.
Лабораторная диагностика
В крови выявляются выраженная анемия, ретикулоцитоз, эритро- и нормобластоз. Гипербилирубинемия за счет непрямой (свободной) фракции от 100 до 342 мкмоль/л, в дальнейшем присоединяется и прямая фракция. Уровень билирубина в крови быстро нарастает и к 3-5 дню жизни достигает максимума.
Основы лечения
- переливание крови,
- фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
- аскорбиновая кислота.
Физиологическая (транзиторная) желтуха новорожденных
Причины
- относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,
- абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни (недостаточный синтез фермента),
- дефицит лигандина,
- слабая активность желчевыводящих путей.

Клиническая диагностика
- окрашивание кожи на 3-4 день после рождения,
- гемолиза и анемии нет.
Симптомы исчезают спустя 1-2 недели после рождения.
Лабораторная диагностика
Увеличение концентрации свободного (непрямого) билирубина в сыворотке до 140-240 мкмоль/л.
Основы лечения
- фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
- аскорбиновая кислота, глюкоза,
- желчегонные средства.
Желтуха недоношенных
Причины
- относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,
- абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни (несинтез фермента),
- дефицит лигандина,
- слабая активность желчевыводящих путей.

Клиническая диагностика
- окрашивание кожи,
- гемолиза и анемии нет.
Исчезает спустя 3-4 недели после рождения.
Лабораторная диагностика
Увеличение концентрации свободного (непрямого) билирубина в сыворотке до максимума на 5-6 дни после рождения, более выражено по сравнению с физиологической желтухой.
Основы лечения
- фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
- аскорбиновая кислота, глюкоза,
- желчегонные средства,
- фототерапия — под влиянием света происходит образование «люмирубина» — изомерной формы билирубина, легко выводимой с мочой и желчью.
Негемолитическая гипербилирубинемия новорожденных, вызываемая молоком матери
Заболевание также носит названия «желтуха грудного молока» и «синдром Люцея-Ариаса». Встречается у 1% вскармливаемых грудью новорожденных.
Причины
Снижение конъюгации билирубина из-за подавления активности УДФ-глюкуронилтрансферазы эстрогенами материнского молока.
Клиническая диагностика
Проявляется желтухой, иногда с явлениями поражения ЦНС.
Лабораторная диагностика
Резкое увеличение концентрации свободного билирубина в сыворотке крови (в тяжелых случаях более 370 мкмоль/л).
Основы лечения
- фототерапия – под влиянием света происходит образование «люмирубина» – изомерной формы билирубина, легко выводимой с мочой и желчью,
- временный перевод (до 3-х суток) на искусственное питание,
- иногда фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
- в тяжелых случаях плазмаферез, гемосорбция, переливание крови.
АЛЛОХОЛ — помощник желчевыводящих путей и печени
История изучения заболеваний билиарной системы насчитывает столетия. Однако, долгие годы как причины, так и механизмы их развития оставались до конца не выясненными. Заболевания билиарной системы — одна из актуальных проблем современной медицины. Так, ранняя диагностика и лечение патологии желчевыводящих путей и печени имеют большое клиническое значение. Особое внимание среди лекарственных средств для лечения данных нарушений заслуживает желчегонный препарат Аллохол, с опытом применения у нескольких поколений, который успешно прошел проверку временем и не утратил своей актуальности.
Однако, долгие годы как причины, так и механизмы их развития оставались до конца не выясненными. Заболевания билиарной системы — одна из актуальных проблем современной медицины. Так, ранняя диагностика и лечение патологии желчевыводящих путей и печени имеют большое клиническое значение. Особое внимание среди лекарственных средств для лечения данных нарушений заслуживает желчегонный препарат Аллохол, с опытом применения у нескольких поколений, который успешно прошел проверку временем и не утратил своей актуальности.Заболевания печени и желчевыводящих путей, как правило, требуют комплексного лечения. Среди препаратов для лечения данных нарушений особое место занимают желчегонные препараты. Их назначают как терапевты, так и семейные врачи, гастроэнтерологи и даже хирурги.
Все желчегонные средства можно условно разделить на холеретики — препараты, усиливающие продукцию желчи печенью, и холекинетики — препараты, увеличивающие сокращение желчного пузыря и ускоряющие эвакуацию желчи из него в двенадцатиперстную кишку. Однако желчегонные препараты обычно обладают как холеретическими, так и холекинетическими свойствами. К таким средствам можно отнести и Аллохол (Губергриц Н.Б. и соавт., 2007).
Однако желчегонные препараты обычно обладают как холеретическими, так и холекинетическими свойствами. К таким средствам можно отнести и Аллохол (Губергриц Н.Б. и соавт., 2007).
Основными показаниями к применению желчегонных препаратов являются:
- нормализация процессов пищеварения при ряде физиологических и патологических состояний,
- первичные и вторичные дискинезии желчного пузыря;
- хронические некалькулезные холециститы вне обострения;
- дисфункция сфинктера Одди;
- гипомоторные дискинезии тонкой и толстой кишки;
- заболевания печени без признаков холестаза.
Роль желчегонных препаратов в лечении заболеваний гепатобилиарной системы невозможно переоценить. Среди этих препаратов особое место принадлежит АЛЛОХОЛУ — препарату с 50-летним опытом применения при различных нарушениях функции данной системы.
Аллохол — удачная композиция растительных и животных компонентов
Препарат Аллохол производится компанией «Борщаговский химико-фармацевтический завод» с 1964 г. Данное лекарственное средство довольно широко известно и в течение многих лет успешно назначается врачами для коррекции патологических нарушений гепатобилиарной системы.
Данное лекарственное средство довольно широко известно и в течение многих лет успешно назначается врачами для коррекции патологических нарушений гепатобилиарной системы.
Состав аллохола разработан группой ученых под руководством Н.Г. Беленького. Компоненты данного препарата тщательно подобраны в оптимальных пропорциях для возможности влияния на целый ряд симптомов, возникающих при заболеваниях гепатобилиарной системы. Так, Аллохол содержит активные компоненты растительного и животного происхождения: сухую желчь, порошок чеснока, измельченные листья крапивы и активированный уголь. Чем же так полезны биологически активные вещества, входящие в состав препарата?
ЖЕЛЧЬ принимает участие в процессе пищеварения посредством активации ферментов поджелудочной железы. В данном процессе велика роль желчных кислот, которые составляют большую часть желчи. Они способствуют растворению жирных кислот, а также обладают способностью влиять на обменные процессы в кишечной стенке, стимулируют моторную активность кишечника, подавляют развитие кишечных гельминтов. Также от желчных кислот зависит всасывание жирорастворимых витаминов — A, D, E, K (Маев И.В. и соавт., 2003).
Также от желчных кислот зависит всасывание жирорастворимых витаминов — A, D, E, K (Маев И.В. и соавт., 2003).
В народной медицине ЖЕЛЧЬ используют для лечения заболеваний печени, желудка, воспалений, а также для восстановления функции печени при злоупотреблении алкоголем (Беглецов О.А., Кайзер А.А., 2008).
ЧЕСНОК содержит широкий спектр биологически активных компонентов, которые характеризуются антимикробными, холестеринемическими и антитромботическими свойствами. Одной из наиболее важных групп активных веществ, входящих в состав ЧЕСНОКА, является группа серосодержащих веществ, одним из наиболее известных представителей которой считается аллицин (Кесаев А.Т., 2013).
В итоге активные компоненты чеснока, входящие в состав аллохола, подобно выделяемым в просвет кишечника желчным кислотам способствуют эмульгированию липидов в желудочно-кишечном тракте. Это, в свою очередь, приводит к ускорению их метаболизма и выведению из организма, препятствует повышению уровня липидов в крови и кумуляции в тканях (Мухаммед А. А. и соавт., 2013). Также компоненты чеснока могут способствовать угнетению процессов брожения в кишечнике, препятствию роста в нем патогенной микрофлоры, тем самым уменьшая метеоризм (Шульпекова Ю.О., 2003).
А. и соавт., 2013). Также компоненты чеснока могут способствовать угнетению процессов брожения в кишечнике, препятствию роста в нем патогенной микрофлоры, тем самым уменьшая метеоризм (Шульпекова Ю.О., 2003).
Широкое применение как в народной, так и в традиционной медицине получила крапива. В состав препарата Аллохол входят компоненты измельченных листьев данного растения. Активными веществами крапивы являются витамины К, В2, С, каротин, пантотеновая кислота, фитонциды, белки, сахара, хлорофилл, дубильные вещества, кремниевая и муравьиная кислоты, макро- и микроэлементы (железо, ванадий, марганец, хром, медь, алюминий), а также другие компоненты (Ушанова В.М. и соавт., 2001).
Биологически активные вещества крапивы обладают кровоостанавливающими и желчегонными свойствами, способствуют усилению деятельности органов пищеварения, уменьшению метеоризма, снижению уровня холестерина в крови (Рычкова Ю.В., 2008).
Также в состав аллохола включен активированный уголь — один из самых распространенных представителей энтеросорбентов. Он характеризуется дезинтоксикационными свойствами, которые проявляются в адсорбции токсических веществ до их всасывания в желудочно-кишечном тракте (Садовникова И.И., 2010).
Он характеризуется дезинтоксикационными свойствами, которые проявляются в адсорбции токсических веществ до их всасывания в желудочно-кишечном тракте (Садовникова И.И., 2010).
Таким образом, активные компоненты, входящие в состав аллохола, характеризуются широким спектром различных эффектов:
- улучшение секреторной функции клеток печени;
- стимулирование синтеза желчных кислот;
- ускорение тока желчи по желчевыводящим путям, вследствие чего улучшается пищеварение, в том числе устраняются атонические запоры;
- предупреждение распространения инфекции;
- снижение интенсивности воспалительного процесса;
- уменьшение возможности выпадения холестерина в осадок с последующим образованием камней.
Преимущества технологии производства аллохола
Компания «Борщаговский химико-фармацевтический завод» начала выпуск аллохола 50 лет назад, и за это время было произведено более 33,5 млрд известных многим людям желтых таблеток этого препарата.
Компанией-производителем проводился ряд технологических изменений для обеспечения гарантии качества препарата и сегодня Аллохол выпускается согласно требованиям стандартов GMP.
Технология производства препарата состоит в смешивании сухих компонентов, что исключает воздействие влаги и тепла на все ингредиенты препарата. В свою очередь, такая технология обеспечивает сохранность активных веществ чеснока, желчи, крапивы и сорбционной активности активированного угля.
С 2009 г. компания начала производство аллохола, который отличается от производимого ранее составом вспомогательных веществ и оболочки. Обновленный Аллохол сохранил все качественные характеристики и терапевтическое действие по отношению к ранее производимому препарату.
Замена сахарной оболочки препарата на пленочную позволила не только обеспечить целостность ядра таблетки и защитить его от воздействия влаги и света, но и способствует более быстрому высвобождению активных компонентов. Важно и то, что пленочная оболочка не содержит сахарозы, что позволяет длительно применять Аллохол больным сахарным диабетом.
С целью избавления от микробиологической загрязненности стерилизация растительного сырья, входящего в состав аллохола, производится особым методом без воздействия температуры и химических веществ, что позволяет сохранить активные компоненты.
Стоит отметить, что для удобства покупателей в 2014 г. Аллохол будет выпускаться в новой, более удобной упаковке.
Особенности применения аллохола
Аллохол известен многолетним опытом применения в комплексной терапии больных с хроническим холециститом, дискинезией желчного пузыря, постхолецистэктомическим синдромом, атоническим запором и неосложненным холестерозом желчного пузыря.
Данный препарат применяют у взрослых по 1–2 таблетки 3–4 раза в сутки после еды в течение 3–4 нед. Затем — по 1 таблетке 2–3 раза в сутки после еды в течение 1–2 мес. При необходимости курс лечения можно повторить 2–3 раза с перерывом в 3 мес. Желчегонные препараты, содержащие растительные компоненты, к которым относится Аллохол, оказывают постепенное мягкое действие на функции желчевыводящих путей и печени (Губергриц Н. Б. и соавт., 2007).
Б. и соавт., 2007).
Таким образом, Аллохол без стресса для организма нормализует функции желчевыводящих путей и печени, что проявляется в улучшении общего состояния пациента, уменьшении выраженности боли в правом подреберье, а также исчезновении диспептических явлений.
Также следует обратить внимание на возможное взаимодействие аллохола с различными лекарственными средствами: другими холеретиками синтетического или растительного происхождения, слабительными препаратами, антисептиками или химиотерапевтическими препаратами. Применение аллохола может способствовать улучшению всасывания жирорастворимых витаминов.
Аллохол можно применять в клинической практике для терапии различных нарушений желчевыводящих путей и печени. Многолетний опыт применения данного препарата свидетельствует о доверии к нему со стороны пациентов и врачей.
Так, в комплексной терапии запоров немаловажную роль играют препараты, содержащие желчные кислоты и оказывающие желчегонное действие, такие как Аллохол (Звягинцева Т.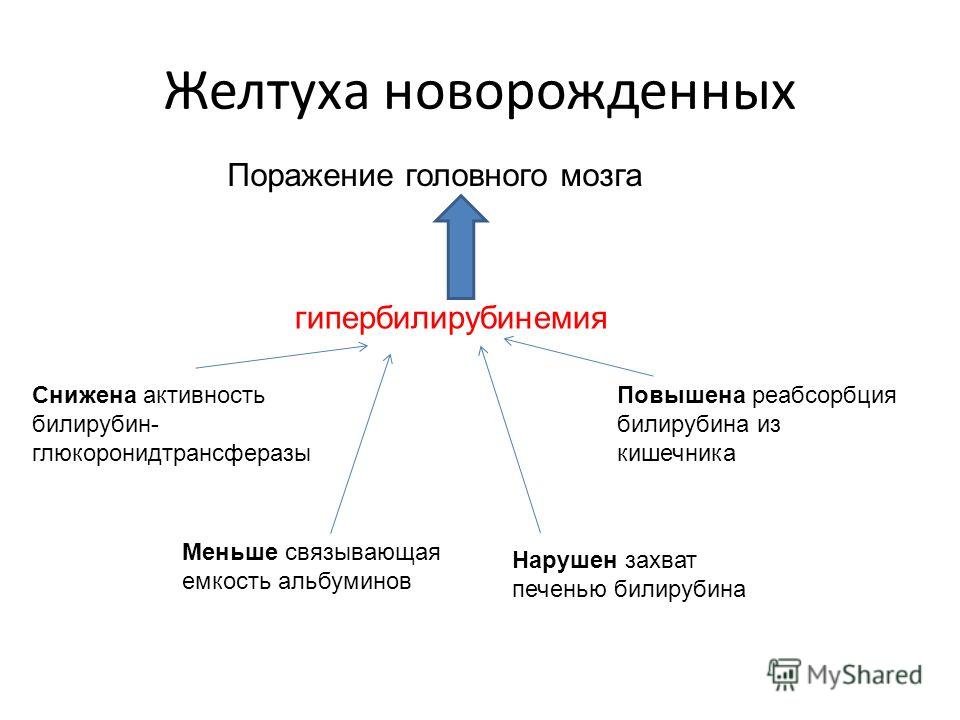 Д., Гриднева С.В., 2008). Для первичной профилактики желчнокаменной болезни у больных со склонностью к запорам после приема пищи целесообразно применять Аллохол по 3–4 таблетки в сутки (Григорьев П.Я. и соавт., 2002).
Д., Гриднева С.В., 2008). Для первичной профилактики желчнокаменной болезни у больных со склонностью к запорам после приема пищи целесообразно применять Аллохол по 3–4 таблетки в сутки (Григорьев П.Я. и соавт., 2002).
Известно применение аллохола для реабилитации больных в ранние сроки после холецистэктомии с целью профилактики постхолецистэктомического синдрома (Прибылова Н.Н. и соавт., 2008).
Применение холеретических препаратов, к которым относится Аллохол, обосновано при основных формах хронического холецистита, в фазах затихающего обострения или ремиссии в течение 3 нед. (Полунина Т.Е., Полунина Е.В., 2004).
При терапии хронического бескаменного холецистита в фазе затухающего обострения применяют желчегонные препараты, например Аллохол (Яковенко Э.П. и соавт., 2004).
При лечении гипомоторной дискинезии желчного пузыря применяются лекарственные средства, усиливающие его моторику. С этой целью могут использоваться холеретики, содержащие желчь, например, Аллохол (Минушкин О. Н., 2003).
Н., 2003).
Итак, известные многим «желтые таблетки» в течение многих лет применяют для терапии широкого спектра нарушений желчевыводящих путей и печени с целью нормализации их функций.
выбор, проверенный временем!
Сегодня полки аптек пестрят изобилием препаратов, появляется все больше новых продуктов, какому же средству отдать предпочтение? Несмотря на столь долгий путь аллохола на рынке желчегонных препаратов, за 50 лет применения он не только не утратил своей актуальности, а скорее наоборот — заслужил доверие, как со стороны потребителей, так и самих фармацевтов.
Стоит отметить, что популярности препарата способствует и то, что компания «Борщаговский химико-фармацевтический завод» идет в ногу со временем, проводит модернизацию производства и обновление самого препарата.
Производители позаботились и об удобстве для потребителя, и с мая нынешнего года Аллохол будет выпускаться в новой упаковке: картонная коробка с 5 блистерами по 10 таблеток, что позволит всегда иметь под рукой проверенные «желтые таблетки».
Доверие формируется на основании положительного опыта и времени. 50 лет успешного применения — весомый аргумент при выборе препарата.
Аллохол — помощник желчевыводящих путей и печени, которому доверяют уже несколько поколений.
Пресс-служба
«Еженедельника АПТЕКА»
Цікава інформація для Вас:
Необходимость лечения билирубина — Лампа Мед
Билирубин – это пигмент, который образуется в организме вследствие распада гемоглобина и других белков крови (при разрушении эритроцитов – красных кровяных телец). Постаревшие или поврежденные эритроциты разрушаются, и образуется так называемый непрямой билирубин, который не растворяется в воде (а соответственно, не может выводиться через мочевыделительную систему). В кровяном русле билирубин связывается с белком альбумином, транспортируется в печень, где в результате трансформации образуется билирубин прямой – связанная форма, которая может растворяться в воде и выводиться почками.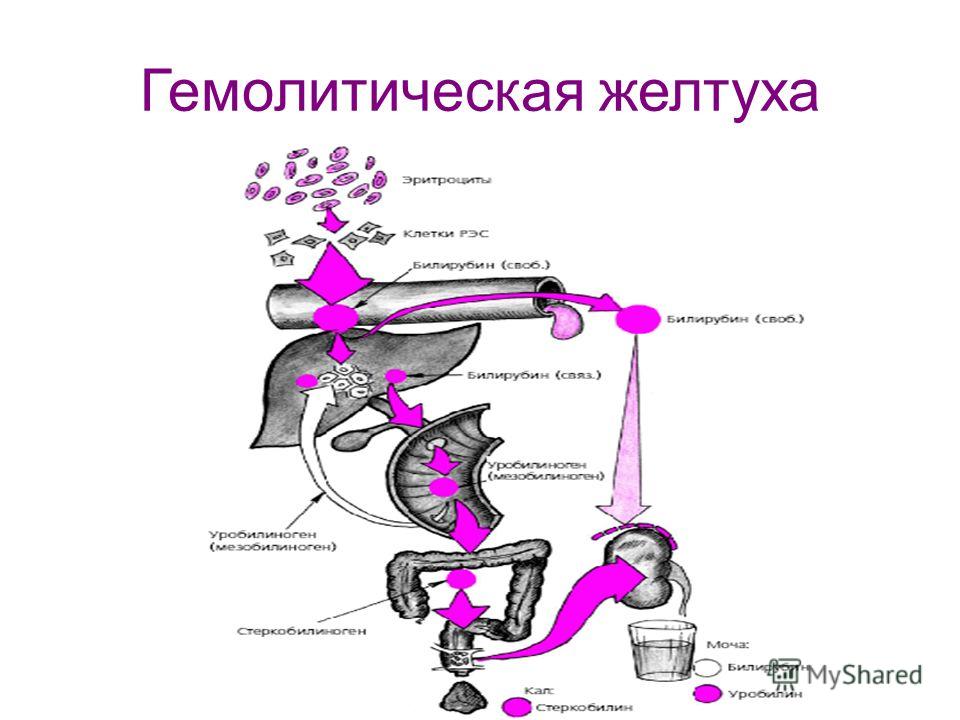
Однако в том случае, когда уровень распада эритроцитов достаточно высок, печень не справляется с нагрузкой и уровень билирубина в крови заметно возрастает. Особенно часто повышается билирубин у новорожденных, поскольку вскоре после родов в организме младенца начинает интенсивно разрушаться внутриутробный гемоглобин Б – это делается для того, чтобы организм мог синтезировать «взрослый» гемоглобин А. Печень новорожденного в таком раннем возрасте имеет слишком слабые связывающие способности, а поэтому заметно вырастает билирубин общий в крови – это совокупность прямого и непрямого билирубина.
Повышение билирубина – крайне тревожный симптом, поскольку непрямой билирубин является сильнейшим тканевым токсином, способным разрушать клетки головного мозга и внутренних органов. Наибольшую опасность билирубин представляет для центральной нервной системы. Поэтому лечение билирубина откладывать нельзя ни в коем случае – чем раньше оно начнется, тем будет более эффективным.
Специалисты расходятся во мнении о том, сколько должно быть билирубина в крови у доношенных и недоношенных детей – это связано с тем, что у недоношенного ребенка гематоэнцефалический барьер (защитный биологический барьер между кровеносными сосудами и мозгом – именно благодаря ему многие растворенные в крови вещества не попадают в мозг) более проницаем, а клетки мозга более чувствительны к воздействию токсинов. Поэтому если у доношенного ребенка показатель 65 мкмоль/л билирубина норма, то для недоношенного – это уже критический уровень.
Если билирубин повышен – начинает развиваться физиологическая желтуха у детей, первые проявления которой заметны уже на 2-4 день жизни ребенка. Желтуха у новорожденных, несмотря на то, что ее называют физиологической, – явление достаточно опасное именно из-за возможности поражения клеток нервной системы и головного мозга. Поэтому лечение желтухи новорожденного следует начинать немедленно после обнаружения высокого билирубина. Вот почему в роддомах врачи тщательно отслеживают у новорожденных билирубин – ведь повышенный билирубин у новорожденных может без надлежащего лечения нанести значительный ущерб развивающемуся организму ребенка.
Ранее лечение желтухи у детей предполагало следующие методы:
• внутривенное введение 5% раствора глюкозы — предшественника глюкуроновой кислоты, которая связывает в печени билирубин;
• введение фенобарбитала и аскорбиновой кислоты, которые повышают активность ферментов печени;
• применение адсорбентов, связывающих билирубин в кишечнике, и желчегонных препаратов, ускоряющих выведение билирубина с желчью.
Однако на сегодня специалистами доказано, что все эти громоздкие и подчас болезненные методы лечения могут быть заменены физиологичным и намного более эффективным методом фототерапии. Фототерапия новорожденных происходит следующим образом: кожу ребенка облучают при помощи специальной лампы фототерапии. Воздействие световой волны определенной длины преобразует билирубин в люмирубин – фотоизомер, который хорошо растворяется в воде и не является токсичным. Затем люмирубин выводится из организма ребенка естественным путем – с желчью и мочой. Такое лечение является полностью безболезненным для ребенка, и при этом у новорожденных желтуха вылечивается в течение короткого времени – обычно достаточно 3-5 дней.
Такое лечение является полностью безболезненным для ребенка, и при этом у новорожденных желтуха вылечивается в течение короткого времени – обычно достаточно 3-5 дней.
Причины, последствия и лечение желтухи у новорожденного
Что такое желтуха у новорожденных
Сегодня мы поговорим о желтушке новорожденных, как физиологической, так и патологической, ее причинах возникновения в первые дни жизни малыша, последствиях желтухи, симптомах и признаках, диагностике и, конечно, способах лечения.
Неонатальная желтуха новорожденных
— это довольно распространенное явление, которое бывает как у доношенных малышей, так и у тех, кто родился раньше положенного срока. Оно обусловлено распадом особого белка — фетального гемоглобина, который ребенку больше не нужен после появления на свет и начала дыхания легкими. Он заменяется на гемоглобин А, а в процессе распада образуется
билирубин
. При большом его скоплении кожа, слизистые оболочки и белки глаз начинают желтеть.
Врачи называют послеродовую желтуху не болезнью, а естественным физиологическим процессом, проходящим бесследно. Но бывают случаи патологической желтухи, когда дети подлежат госпитализации – такую желтуху необходимо вылечить.
Нормативные показатели билирубина
После того как кроха появляется на свет, билирубиновые показатели постоянно меняются в зависимости от возраста малыша. У доношенных и недоношенных детей билирубиновые нормы будут разными. Разобраться с ними поможет нижеприведенная таблица.
| Возрастная категория младенца | Нормативные показатели билирубинового индекса для доношенных детей | Нормативные показатели билирубинового индекса для недоношенных детей |
| сутки | до 85 мкмоль/л | до 97 мкмоль/л |
| 36 часов | до 150 мкмоль/л | до 120 мкмоль/л |
| двое суток | до 180 мкмоль/л | до 150 мкмоль/л |
| с третьих по пятые сутки | до 256 мкмоль/л | до 171 мкмоль/л |
| с шестых по седьмые сутки | до 145 мкмоль/л | до 145 мкмоль/л |
| восьмые — девятые сутки | до 110 мкмоль/л | до 97 мкмоль/л |
| с десятых по одиннадцатые сутки | до 80 мкмоль/л | до 50 мкмоль/л |
| двенадцатые — тринадцатые сутки | до 45 мкмоль/л | до 35 мкмоль/л |
| старше четырнадцати суток | до 20,5 мкмоль/л | до 18 мкмоль/л |
Этими показателями педиатры пользуются для определения нормы билирубинового индекса у новорожденных малышей.
youtube.com/embed/GUBUZFCMC54?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Желтуха у новорожденных: причины
- Аномалии в развитии селезенки, печени, протоков, по которым проходит желчь.
- Родовые травмы.
- Наследственные патологии.
- Застой желчи.
- Недоразвитие органов.
- Гепатиты.
- Несовместимость крови.
- Резус-конфликт.
- Гормональные сбои.
- Сахарный диабет матери.
- Заражение плода во внутриутробном периоде инфекциями, ведущими к патологиям печени и кровоснабжения.
- Прием матерью большого количества медикаментов при беременности или в родовой деятельности.
- Кефалогематомы.
- Позднее прикладывание к груди.
- Вскармливание смесью с первых часов жизни.
- Критичная потеря веса новорожденного.
Типы желтухи
- Физиологическая желтуха новорожденных (неонатальная желтуха или гипербилирубинемия)
Это естественное состояние, которое появляется при рождении и проходит у грудничка без медицинского вмешательства. Отличить физиологическую желтуху от патологической нужно доверить врачу. Первые симптомы желтушки обычно наблюдаются на 1-3 сутки жизни малыша (может и позже). Транзиторная (временная)желтуха развивается у 50— 70% новорожденных детей, в то время как повышение уровня непрямого билирубина обнаруживается у всех. Анемии и увеличения внутренних органов не диагностируется.
Отличить физиологическую желтуху от патологической нужно доверить врачу. Первые симптомы желтушки обычно наблюдаются на 1-3 сутки жизни малыша (может и позже). Транзиторная (временная)желтуха развивается у 50— 70% новорожденных детей, в то время как повышение уровня непрямого билирубина обнаруживается у всех. Анемии и увеличения внутренних органов не диагностируется.
Возможно окрашивание кожи в лимонный цвет.
При неонатальной желтухе довольно часто наблюдается повышенный уровень эстрогена в материнском молоке, передающийся малышу при грудном вскармливании. В таком случае сначала выводится эстроген, а потом билирубин.
Сколько держится желтуха у новорожденных? Если желтушка у младенца имеет только физиологические причины, то она держится 7-10 дней, если же она вызвана и гормональными нарушениями у матери ребенка, то это состояние более долгое и может сохраняться даже у месячных детей. Состояние может длиться до трех месяцев.
Прекращать грудное вскармливание не рекомендуется, если общее состояние новорожденного не нарушено – у него отличный сон, сосательный рефлекс активный, прибавка в весе не ниже нормы.
- Патологическая желтуха
Это критичное состояние, характеризующееся поражением клеток организма и угасанием рефлексов.
- Механическая — обусловлена закупоркой желчных протоков.
- Гемолитическая — такая врожденная желтуха встречается реже и диагностируется в первые часы жизни. Возникает по различным причинам, кроме механических – нефункциональность печени, резус-конфликт, вирусы, бактерии и прочее.
После выздоровления дети обязательно должны наблюдаться в течение последующего года у окулиста, невролога и ортопеда. Нужно соблюдать рекомендацию врача – не ставить прививки 1 год.
Профилактика
Предотвратить появление синдрома желтухи можно, если соблюдать профилактику в период вынашивания ребенка.
- Мама должна полноценно питаться, вести активный образ жизни, включить дневной отдых или сон.
- Ввести в рацион питания зерновые, овощи и фрукты.
- Женщины должны поддерживать качественное функционирование печени.
 Для этого можно курсами пропивать отвары расторопши, люцерны или корней одуванчиков.
Для этого можно курсами пропивать отвары расторопши, люцерны или корней одуванчиков. - Курсами пропивать витаминные комплексы.
- Следить за качественной работой кишечника.
- Как можно дольше кормить грудью.
Симптомы желтухи, группа признаков при патологическом типе
- Пожелтение кожи, слизистых оболочек вплоть до приобретения зеленого оттенка – так выглядит грудничок с желтухой. Фото проявления симптома можно посмотреть в свободном доступе.
- Увеличение внутренних органов (селезенка, часто печень).
- Кал становится белым, бесцветным.
- Моча темная.
- Беспричинное появление синяков.
Через 14 -20 дней симптомы становятся ярче и выраженнее, в затяжном состоянии ребенок чувствует себя хуже.
Патологическая желтуха вызывает множество осложнений и имеет различные формы, которые проявляются по-разному. Например, самым опасным и тяжелым состоянием является ядерная желтуха, при которой младенец должен обязательно находиться под круглосуточным наблюдением специалистов в условиях стационара.
Например, самым опасным и тяжелым состоянием является ядерная желтуха, при которой младенец должен обязательно находиться под круглосуточным наблюдением специалистов в условиях стационара.
- Сосательный рефлекс ослаблен.
- Сонливость.
- Крик малыша монотонный.
- Вялость.
- Взгляд становится блуждающим.
- Заторможенность.
- Тошнота, рвота, обильные частые срыгивания.
- Большой родничок становится выпуклым.
- Рефлексы ребенка угасают.
- Периодические всплески нервного возбуждения.
- Судороги.
Диагностика желтухи у новорожденных, код по МКБ 10
- Обнаружение признаков желтухи новорожденных происходит в роддоме или врачом педиатром во время первого патронажа.
- Из лабораторных методов проводят анализ крови, биохимию крови с определением уровня общего и непрямого билирубина, уровень гормонов в крови, ИФА и ПЦР на выявление инфекций.
- Из инструментальных — УЗИ, ФГДС, рентгенологическое исследование.

- Также рекомендован осмотр такими специалистами, как гастроэнтеролог и хирург.
Код неонатальной желтухи по МКБ 10 — P59.
Лечение желтухи
Терапия направлена на устранение первопричины, симптомов и улучшение состояния ребенка.
При физиологической желтухе малыш не нуждается в лечении, это лишь особенность организма. Но при интенсивности желтушности кожи иногда назначают светолечение. Это ускорит процесс превращения билирубина в водорастворимую форму и позволит ему покинуть организм с калом и мочой.
Патологическая желтуха подразумевает различные манипуляции и терапию медикаментами.
- Переливание крови. На сегодняшний момент это достаточно распространенный метод избавления маленького организма от отравляющих его веществ. Рассматривать мать малыша как донора возможно не ранее, чем через два месяца после родов. Ей необходимо восстановить кровопотери и не потерять лактацию. Объем «новой» крови составляет около 80 % всего кровотока ребенка, причем происходит замена только эритроцитов.

- Фототерапия или солнечные ванны. Под действием лучей билирубин подвергается быстрейшему распаду и выходу. Целесообразно применять данный метод только при легкой и средней форме течения болезни. Для лучшего эффекта ребенка постоянно поворачивают, подставляя под лампу солнечного света разными сторонами тела. Примерное проведение под лампой в сутки составляет 14-16 часов.
- Желчегонные средства. Урсофальк, Хофитол. Эти средства содержат витамины, органические кислоты, минеральные вещества и флавоноиды. Действие лекарств заключается в улучшении работы почек, печени и обмена веществ. Побочные явления встречаются крайне редко. Средства имеют хорошие отзывы.
- Сорбенты. Полисорб, Смекта. Они направлены на быстрейшее выведение билирубина из организма и красящего желтого пигмента из кровяного русла. Эти препараты не токсичны ими можно лечить с первого часа появления на свет.
- Глюкоза 5%. Пройти курс лечения глюкозой необходимо при низких показателях сахара в крови. В первые часы жизни уровень глюкозы снижается, но с течением некоторого времени показатели нормализуются.
 Но если глюкозы все же недостаточно, то ее восполнение происходит при помощи внутривенных вливаний, зонда или раствором в бутылочке. На распад и выведение билирубина глюкоза влияет незначительно. Поэтому применяется в качестве общеукрепляющей терапии. Часто принимается в комплексе с витаминами.
Но если глюкозы все же недостаточно, то ее восполнение происходит при помощи внутривенных вливаний, зонда или раствором в бутылочке. На распад и выведение билирубина глюкоза влияет незначительно. Поэтому применяется в качестве общеукрепляющей терапии. Часто принимается в комплексе с витаминами. - Плантекс. Это препарат, состоящий из плодов фенхеля. Он активизирует деятельность печени. Разрешен с самых первых дней жизни малыша.
- При очень тяжелом затяжном течении клинической желтухи у новорожденного, сопровождающимся судорогами можно лечиться препаратами Фенобарбитал и Паглюферал.
- Гомеопатия. Галстена. Это довольно распространенный препарат при описываемом состоянии. Он направлен на снятие спазма и воспаления, восстановление поврежденных клеток печени и активизацию работы поджелудочной железы. Основные компоненты Галстены — это одуванчик, расторопша и чистотел. Для новорожденных детей средство назначается в каплях, которые нужно развести перед приемом в кипяченой воде, молоке или смеси.

- Важным моментом, как для физиологической, так и для патологической желтухи является грудное вскармливание. Билирубин хорошо выводится при дефекации. А грудное молоко является слабительным «средством» для малыша.
- При невозможности естественного вскармливания выбор смеси должен быть тщательным и обдуманным. Она должна содержать необходимые компоненты и не провоцировать запоров.
- К тому же отвар плодов шиповника разрешен новорожденному и дополнит его организм полезными микроэлементами и витаминами, необходимыми в раннем детстве.
Механизм появления желтушки
Во время внутриутробного развития в крови ребенка накапливаются определенные виды белков: гемоглобин, миоглобин и цитохром. Их структура отличается от белков крови взрослого человека. Во время прохождения ребенка по родовым путям и в течение нескольких часов после рождения происходит распад гемоглобина и его замещение другими видами белков, имеющих другие свойства и функции.
Во время расщепления гемоглобина происходит высвобождение билирубина – основного компонента желчи, выполняющего функцию красящего пигмента. Органом, перерабатывающим билирубин и отвечающим за его выведение из организма, является печень. У только что родившегося ребенка печень не способна вырабатывать необходимое количество ферментов, разрушающих билирубин, поэтому он начинает накапливаться в организме и вызывать характерные симптомы: пожелтение глазных склер и кожных покровов.
Органом, перерабатывающим билирубин и отвечающим за его выведение из организма, является печень. У только что родившегося ребенка печень не способна вырабатывать необходимое количество ферментов, разрушающих билирубин, поэтому он начинает накапливаться в организме и вызывать характерные симптомы: пожелтение глазных склер и кожных покровов.
Что такое желтуха
Обратите внимание! Если женщина имеет гормональные проблемы, связанные с повышенным синтезом стероидных гормонов, относящихся к группе эстрогенов, вероятность развития желтухи у ребенка будет составлять более 85 %. Дело в том, что эстриол и эстрадиол способны накапливаться в грудном молоке и проникать в организм ребенка, который будет избавляться от них в первую очередь. Таким образом, избыточный билирубин будет задерживаться в крови, и желтуха будет протекать в несколько раз дольше по сравнению с младенцами, чьи матери не страдали эндокринными нарушениями.
Желтуха новорожденного, допаивание, ГВ — 22 ответов на Babyblog
Пока искала материал для «Викторины» перечитала очень много рассказов кормящих мам о том, что медперсонал в роддоме рекомендует пропаивать новорожденного, если у него желтушка. Странно, подумала я, в испанских роддомах кладут под лампу, рекомендуют гулять под солнцем и кормить грудью часто и по-немногу, объясняя тем что билирубин НЕ РАСТВОРЯЕТСЯ в воде, и выводится с калом и мочой, а значит ребенка надо просто кормить грудью. Может российский билирубин особенный? быстрорастворимый как рафинад? да вроде такой же как и во всем мире. Только медперсонал другой(((
Странно, подумала я, в испанских роддомах кладут под лампу, рекомендуют гулять под солнцем и кормить грудью часто и по-немногу, объясняя тем что билирубин НЕ РАСТВОРЯЕТСЯ в воде, и выводится с калом и мочой, а значит ребенка надо просто кормить грудью. Может российский билирубин особенный? быстрорастворимый как рафинад? да вроде такой же как и во всем мире. Только медперсонал другой(((
Желтуха новорожденного
Может ли желтуха у новорожденных быть физиологической – говоря по-другому, нормальной? И как быть, если у новорожденного иктеричные ( окрашенные желтым ) кожа и склера глаз?
Виды желтух у новорожденных
ЖЕЛТУХИ У НОВОРОЖДЕННЫХ бывают физиологические и патологические. Физиологическая желтуха бесследно исчезает в течение короткого промежутка времени. Паталогическая желтуха новорожденных вызывается заболеваниями и часто требует пристального медицинского контроля. Состояний, при которых у новорожденных малышей бывает желтушное прокрашивание кожи, белков глаз и видимых слизистых оболочек, в настоящее время насчитывают более 50!
Состояний, при которых у новорожденных малышей бывает желтушное прокрашивание кожи, белков глаз и видимых слизистых оболочек, в настоящее время насчитывают более 50!
И все же самая распространенная желтуха у детей, только что появившихся на свет, — физиологическая. Она встречается примерно у 60-70% малышей и появляется на 3-4 день после рождения. Это состояние – не болезнь и со временем проходит. Оно связано с незрелостью некоторых систем детского организма, отвечающих за обмен особого вещества – билирубина.
Билирубин у новорожденных
Билирубин образуется при разрушении эритроцитов – красных клеток крови, содержащих гемоглобин и обеспечивающих органы и ткани кислородом. До рождения, пока кроха не дышит самостоятельно, в его организме кислород переносят эритроциты с особым ( фетальным ) гемоглобином.
Эти эритроциты после рождения за ненадобностью разрушаются с образованием большого количества билирубина. Такой билирубин называют непрямым, или свободным. Он нерастворим, поэтому не может выделяться с мочой. Превращением его в растворимую форму и выведением с желчью занимается печень. Даже у здоровых детей сразу после рождения часто не хватает специального белка, который обеспечивает перенос билирубина в печеночные клетки, где он после ряда биохимических реакций соединяется с веществами, делающими его растворимым.
Такой билирубин называют непрямым, или свободным. Он нерастворим, поэтому не может выделяться с мочой. Превращением его в растворимую форму и выведением с желчью занимается печень. Даже у здоровых детей сразу после рождения часто не хватает специального белка, который обеспечивает перенос билирубина в печеночные клетки, где он после ряда биохимических реакций соединяется с веществами, делающими его растворимым.
Это нужно для того, чтобы билирубин не оказывал токсического действия и благополучно выводился из организма. Обеспечивают такое превращение сразу несколько ферментных систем. У многих новорожденных эти системы заканчивают свое созревание и начинают полноценно работать только через несколько дней после рождения.
Постепенно улучшается и работа системы выделения билирубина. Обычно через 1-2 недели желтушное прокрашивание кожи исчезает, не причиняя никакого вреда ребенку. Понятно теперь, почему желтуха новорожденных у недоношенных детей встречается чаще, более выражена и держится дольше, чем у доношенных малышей. И выраженность повышения уровня билирубина в крови у недоношенных зависит не от массы тела при рождении, а от степени зрелости плода и проблем мамы во время беременности. Чаще «желтеют» детки многоплодной беременности, новорожденные, у которых были родовые травмы, малыши, рожденные от мам с сахарным диабетом.
И выраженность повышения уровня билирубина в крови у недоношенных зависит не от массы тела при рождении, а от степени зрелости плода и проблем мамы во время беременности. Чаще «желтеют» детки многоплодной беременности, новорожденные, у которых были родовые травмы, малыши, рожденные от мам с сахарным диабетом.
Уровень билирубина новорожденных
При физиологической желтухе общее состояние детей, как правило, не страдает. Только если она сильно выражена, малыши становятся сонливыми, лениво сосут, иногда у них бывает рвота. О тяжести желтухи судят не по внешним проявлениям, а по уровню прямого билирубина в крови. Он достигает максимума на 3-й день жизни ребенка. Детский организм «борется» с избытком билирубина, связывая его с белком крови альбумином, тем самым, предотвращая его токсическое действие. Но так бывает не всегда.
При очень сильном повышении уровня билирубина альбумин не может «блокировать» его полностью, и тот проникает в нервную систему. Это может оказать токсическое действие, в первую очередь на жизненно важные нервные центры, головной мозг. Такое состояние называют «ядерной желтухой», или «билирубиновой энцефалопатией». Симптомы: выраженная сонливость, судороги, снижение сосательного рефлекса. Среди поздних проявлений – глухота, параличи, умственная отсталость.
Это может оказать токсическое действие, в первую очередь на жизненно важные нервные центры, головной мозг. Такое состояние называют «ядерной желтухой», или «билирубиновой энцефалопатией». Симптомы: выраженная сонливость, судороги, снижение сосательного рефлекса. Среди поздних проявлений – глухота, параличи, умственная отсталость.
Раньше в случае повышения уровня свободного билирубина использовали внутривенное вливание растворов глюкозы, аскорбиновую кислоту, фенобарбитал, желчегонные средства для ускорения его выведения. Сейчас все больше специалистов и клиник во всем мире отказываются от использования лекарств для лечения физиологической желтухи новорожденных. Более того, применение некоторых средств признано неэффективным.
Сегодня самый действенный и проверенный метод снижения токсичности билирубина при физиологической желтухе – фототерапия ( светолечение ). Кожу малыша освещают специальной установкой ( в среднем 96 часов на курс ).
Кожу малыша освещают специальной установкой ( в среднем 96 часов на курс ).
Под воздействием света билирубин превращается в нетоксичные производные, основное из которых носит название «люмирубин». У него другой путь выведения, и через 12 часов он выходит из организма с калом и мочой. Побочное явление при фототерапии возможно появление шелушения кожи и частого жидкого стула, а у некоторых детей наблюдаются сонливость.
После прекращения лечения все явления бесследно проходят. А после выписки из роддома стоит как можно чаще в течение дня подставлять малыша непрямым солнечным лучам.
Лучшая профилактика и лечение физиологической желтухи – ранние и частые кормления. Поскольку у детей с повышенным уровнем билирубина бывает повышенная сонливость, их надо обязательно будить для кормления.
Молозиво, или «раннее молоко» первых нескольких дней, действуют как слабительное и помогает быстрее выйти меконию ( первородному калу ). Билирубин, который преобразуется в печени, также выводится вместе с ним. Если меконий не выходит быстро, билирубин из кишечника может повторно попасть в кровоток, тем самым, усиливая уровень желтухи.
Билирубин, который преобразуется в печени, также выводится вместе с ним. Если меконий не выходит быстро, билирубин из кишечника может повторно попасть в кровоток, тем самым, усиливая уровень желтухи.
Даже при редко встречающейся желтухе, вызываемой молоком матери, не рекомендуют отказываться от грудного вскармливания. Отличить эту разновидность желтухи у новорожденных позволяют более поздние сроки появления ( после 1-й недели жизни ребенка ) . Такое состояние связано с содержанием в молоке матери веществ, снижающих активность ферментов, обеспечивающих «превращение» непрямого билирубина в растворимый прямой.
Паталогическая желтуха
Патологическая желтуха чаще проявляется в течение первых суток после рождения. Нередко при этом увеличиваются печень и селезенка, может обесцвечиваться кал, а моча приобретает темный цвет, иногда на коже новорожденного самопроизвольно появляются синяки и точечные кровоизлияния. В анализе крови отмечаются признаки усиленного распада эритроцитов ( гемолиза ) и анемии. При патологической желтухе лечением занимаются специалисты. Оно целиком зависит от причины этого состояния.
В анализе крови отмечаются признаки усиленного распада эритроцитов ( гемолиза ) и анемии. При патологической желтухе лечением занимаются специалисты. Оно целиком зависит от причины этого состояния.
При несовместимости матери и новорожденного по группам крови и/или по резус-фактору происходит массивное разрушение ( гемолиз ) эритроцитов. Выраженная желтуха часто бывает, если у мамы I группа крови, а у ребенка II или ( реже III ). Считается, что при каждой последующей беременности повышается риск таких осложнений. Именно по этой причине женщинам с отрицательным резус-фактором особенно опасно делать аборт.
Разрушение эритроцитов может быть вызвано и различными генетически обусловленными нарушениями, как, например, микросфероцитоз ( анемия Минковского-Шоффара ), нарушениями структуры гемоглобина ( например, при серповидно-клеточной анемии ), изменением формы и структуры самого эритроцита и пр. При лечении состояний, сопровождающихся разрушением эритроцитов, часто используют обменные переливания крови, чтобы «вымыть» билирубин и антитела, вызывающие гемолиз.
Большую группу составляют желтухи, возникающие в результате поражения печени вирусами, бактериями, простейшими. Понятно, что без лечения инфекционного процесса в таких случаях обойтись невозможно. К сожалению, в настоящее время не для всех врожденных инфекций существуют эффективные методы лечения. Это лишний раз подчеркивает необходимость тщательной подготовки к беременности, особенно при наличии инфекционных заболеваний, для снижения риска передачи инфекции малышу.
Так называемые механические желтухи возникают из-за нарушения оттока желчи при кисте желчного протока, кольцевидной поджелудочной железе, атрезии ( недоразвитии ) желчных ходов. При этом необходимо хирургическое вмешательство.
При пилоростенозе и обструкции кишечника причиной повышения уровня билирубина в крови является обратное всасывание его из кишечника. В таких ситуациях тоже могут помочь хирурги.
Конституциональная печеночная дисфункция ( синдром Жильбера-Мейленграхта ) – наследственное заболевание, очень сходное с физиологической желтухой новорожденных, — встречается довольно часто. Причина сбоя в обмене билирубина в этом случае – нарушение его связывания из-за наследственной неполноценности ферментных систем печени. Обычно это состояние требует лечения и наблюдается гастроэнтерологами.
Причина сбоя в обмене билирубина в этом случае – нарушение его связывания из-за наследственной неполноценности ферментных систем печени. Обычно это состояние требует лечения и наблюдается гастроэнтерологами.
Гормональные нарушения также вызывают желтуху у новорожденных деток. Так бывает, например, при гипотиреозе – снижении функциональной активности щитовидной железы. Сочетается такая форма желтухи с другими признаками недостаточной выработки гормонов щитовидной железы: крупными размерами живота, сухость кожи, низкой температурой тела, особым, хриплым криком, запорами, отеками лица, век, задержкой процессов окостенения и др. Возникает желтуха при гипотиреозе на 2-3-й день жизни, длится до 3-12 недель, а иногда и до 4-5 месяцев. Лечение проводят под наблюдением эндокринолога с использованием препаратов – гормонов щитовидной железы.
Не будучи специалистом, невозможно разобраться во всех тонкостях диагностики такой большой группы заболеваний, как желтухи у новорожденных детей ( желтушки ). Важно понять – длительное сохранение желтушного окрашивания кожи у маленького ребенка требует обязательного обследования. Оно непременно должно состоять из общего анализа крови, определения уровня общего билирубина и его фракций в сыворотке крови, показателей функции печени, пробы на гемолиз ( проба Кумбса ), ультразвукового исследования органов брюшной полости, при необходимости и консультации хирурга или другого специалиста для уточнения диагноза и своевременного проведения лечения.
Важно понять – длительное сохранение желтушного окрашивания кожи у маленького ребенка требует обязательного обследования. Оно непременно должно состоять из общего анализа крови, определения уровня общего билирубина и его фракций в сыворотке крови, показателей функции печени, пробы на гемолиз ( проба Кумбса ), ультразвукового исследования органов брюшной полости, при необходимости и консультации хирурга или другого специалиста для уточнения диагноза и своевременного проведения лечения.
ПС (если кратко)
Если желтушка небольшая, проявилась на третий день, то в течение месяца ребенка не трогают обычно. Потом, если не прошло, начинают разбираться, в чем же дело.
А дело может быть:
1. самый распространенный. В крови ребенка еще много эстрогенов, они ингибируют ферментную деятельность, поэтому билирубин связывается медленно. Проходит само. У кого быстрее, у кого медленнее.
2. желчные протоки не пропускают достаточное количество желчи. Может быть, просто узкие — тогда с ростом ребенка проблема исчезает. Может быть, желчь слишком вязкая. Нужны желчегонные.
Может быть, желчь слишком вязкая. Нужны желчегонные.
3. не вырабатывается достаточное количество желчи. Недостаточно ферментов. Принимают желчегонные и панкреатин. Постепенно все проходит.
4. в кровь ребенка постоянно поступает антиген (бывает, что и с молоком матери). Очень редко. Тогда — только смесь. Но это очень редко.
5. есть вероятность, что незрелая печень ребенка плохо среагировала на прививку от гепатита.
6. есть вероятность врожденного гепатита.
Желтуха (вылеченная) до 2.5 мс
хочу поведать мамочкам о нашем опыте желтухи новорожденного, о том что нам помогло и что нужно делать.
мой младший сынишка родился после сложнейшей беременности на сроке 37 недель и 4 дня. маловесным, но доношенным. на 4-5 сутки началась желтуха, по билитесту самый высокий показатель был 250-260. но так как это все-таки меньше 300, нас отправили домой с рекомендацией — кормить и поить, гулять. через 10 дней пройдет … но не прошло, ребенок был жутко желтый, и в почти три недели, я забила тревогу . ..
..
мы сдали кровь из вены на билирубин и наш показатель был 200, непрямого было больше прямого. непрямой билирубин опасен своей токсичностью и начитавшись ужастиков — мы помчались в нцзд нии педиатрии на консультацию к врачу, платную. ребенку было почти 20 дней, а показатель не низкий, мне было назначено снимать малыша с груди на 5 дней, поить глюкозой, и еще лекарства разные. да, и само собой в больницу под лампы и капельницы. больница к слову платная.
в общем, меня накрыла депрессуха, я оооочень хотела сама кормить малыша и все эти с трудом вливаемые лекарства, я себе представила, как от допаивания он будет меньше кушать и т.д. а больница меня пугала своими внутрибольничными инфекциями и не хотелось мучит ребенка капельницами в головные вены ..
и мы стали искать другие пути решения проблемы, других врачей, подняли всех знакомых и после того, как мне стали твердить что не нужна больница при таких показателях — я стала сомневаться в назаченном лечении и вообще в компетентности врача, позже нашла о ней не очень-то отзывы. в итоге ребенку месяц-полтора, билирубин упал только до 180 почти… все еще как апельсин, НО я никого не слушаю, не читаю страшилок с русских сайтов, изучаю мед.сайты на английском, и начинаю атаку. сдаем кровь из пальца на стандартные показатели плюс ретикулоциты!!!! далее делаем узи брюшной полости и мозга, дабы в первом случае исключить застои желчи (как возможную причину) и патологии во втором случае, как возможное следствие.
в итоге ребенку месяц-полтора, билирубин упал только до 180 почти… все еще как апельсин, НО я никого не слушаю, не читаю страшилок с русских сайтов, изучаю мед.сайты на английском, и начинаю атаку. сдаем кровь из пальца на стандартные показатели плюс ретикулоциты!!!! далее делаем узи брюшной полости и мозга, дабы в первом случае исключить застои желчи (как возможную причину) и патологии во втором случае, как возможное следствие.
далее сдаем кровь из вены на биохимию — белок, альбумин, креатинин, аст, холистаз-холистерин, щелочная среда. в гемотесте.
исходя из этого начинаем лечение — кормление-кормление грудью!!! только гв и никаких смесей, на гв желтуха имеет право быть до полугода, если показатели не выше 250; энтеросгель маме и малышу два раза в день, урсофальк на ночь для поддержания печенеи и самое главное — раздеваться дома до голыша и торчать на солнце насколько это возможно, гулять!!! в 2.5 месяца наши цифры резко упали до 22!!!!! после трех недель такого лечения (урсофальк правда был выписан сразу — пили с 19 дней жизни).
мамочки — можно обойтись без больниц!!! не пихайте в детей желчегонные (хеппель, фламин к примеру) пока не убедитесь что причина в этом, кормите грудью!!! как можно больше, солнце …. побольше … можно просто походить на фототерапию при поликлинике, сдавайте анализы и всем здоровья!!!
все эти советы имеют смысл при показателях ниже 300-350. если билирубин в этих цифрах — нужна фототерапия. а токсичен он только после 400 на самом деле! как мне объяснили та самая жуткая билир.энцефалопатия реееедкость и возможна только после 360-450 … не пугайте себя и спокойствие!
Желчегонный — обзор | ScienceDirect Topics
ЛЕЧЕНИЕ И РЕЗУЛЬТАТ
Несколько желчегонных, иммуносупрессивных и антифибротических средств использовались для лечения первичной СК у взрослых, но не было показано, что лекарство может изменить его естественное течение. Урсодезоксихолевая кислота (УДХК) представляет собой гидрофильную желчную кислоту, которая стабилизирует мембраны клеток печени, подверженных токсическим концентрациям природной хенодезоксихолевой кислоты. Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование у взрослых пациентов с первичной СК показало улучшение лабораторных тестов у пациентов, получавших 13-15 мг / кг / день УДХК, но это не сопровождалось долгосрочными положительными изменениями (Lindor, 1997 ).Было высказано предположение (Mitchell et al., 2001a) и представлены некоторые доказательства (Harnois et al., 2001), что более высокие дозы УДХК (25–30 мг / кг / день) могут быть полезными.
Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование у взрослых пациентов с первичной СК показало улучшение лабораторных тестов у пациентов, получавших 13-15 мг / кг / день УДХК, но это не сопровождалось долгосрочными положительными изменениями (Lindor, 1997 ).Было высказано предположение (Mitchell et al., 2001a) и представлены некоторые доказательства (Harnois et al., 2001), что более высокие дозы УДХК (25–30 мг / кг / день) могут быть полезными.
Несмотря на отдельные сообщения об улучшении с помощью глюкокортикоидов и азатиоприна у взрослых пациентов с первичной СК (Myers et al., 1970; Javett, 1971), их использование вызывает споры. Другие препараты, эффективность которых не доказана, включают пеницилламин, метотрексат, колхицин, циклоспорин, холестирамин, никотин и пентоксифиллин.Сообщалось, что такролимус улучшает функциональные тесты печени в небольшом пилотном исследовании, которое, однако, было неконтролируемым, непродолжительным и не имело гистологических и холангиографических данных (Van Thiel et al. , 1995).
, 1995).
Сообщалось, что при ювенильной форме СК, которая имеет сильные аутоиммунные особенности, лечение стероидами и азатиоприном, аналогичным тем, которые используются при АИГ, было благоприятным для ослабления паренхиматозного воспалительного поражения, но было менее эффективным в борьбе с желчью. заболевание протоков (Gregorio et al., 2001). Положительный ответ на иммуносупрессию, наблюдаемый у этих молодых пациентов, контрастирует с неутешительными результатами, полученными при первичной СК у взрослых, возможно, потому, что у последних наблюдается гораздо более запущенное заболевание.
Средняя зарегистрированная выживаемость взрослых пациентов с первичной СК составляет 10–12 лет с момента постановки диагноза (Wiesner et al., 1989; Farrant et al., 1991). Заболевание прогрессирует, и у большинства бессимптомных пациентов в конечном итоге развиваются симптомы хронического холестаза и билиарного цирроза печени (Porayko et al., 1990). Пожилой возраст, высокий уровень билирубина и АСТ в сыворотке, низкий уровень альбумина, гепатоспленомегалия, кровотечение из варикозно расширенных вен, наличие ВЗК и продвинутая гистологическая стадия являются независимыми предикторами плохого прогноза (Angulo and Lindor, 1999).
Для пациентов с поздней стадией СК трансплантация печени — единственный эффективный терапевтический вариант, и для достижения оптимальных результатов ее следует предлагать, когда болезнь еще не запущена. Текущая 3-летняя выживаемость составляет 85–90%. Интересно, что пациенты, которым трансплантировали СК, имеют значительно более высокий уровень развития неанастомотических стриктур желчных протоков после операции (Sheng et al., 1993; Feller et al., 1996). Это, вместе с частым обнаружением гистологических признаков, согласующихся с SC в посттрансплантационной биопсии (Harrison et al., 1994; Narumi et al., 1995), позволяет предположить, что болезнь может рецидивировать в трансплантате, хотя диагноз рецидива остается осложняется другими посттрансплантационными осложнениями, которые могут повлиять на желчные протоки. Определение рецидива SC было предложено клиникой Mayo (Graziadei et al., 1999) и включает: 1) диагностику SC до трансплантации; 2) холангиографические признаки SC менее чем через 90 дней после операции или гистологии, показывающие фиброзный холангит и / или фибро-облитерирующие поражения с дуктопенией, билиарным фиброзом или билиарным циррозом или без них; 3) исключение тромбоза печеночной артерии, хронического протокового отторжения, стриктуры анастомоза, неанастомотической стриктуры менее чем через 90 дней после операции, несовместимости донор / реципиент по системе ABO. Используя это определение, рецидив SC был зарегистрирован у 20% пациентов с трансплантацией (Graziadei et al., 1999). В целом, рецидивирующий СК не оказывает серьезного негативного влияния на выживаемость пациента или трансплантата в среднесрочной перспективе. Активность ВЗК после трансплантации непостоянна, но, как сообщается, она более серьезна, особенно в отделениях, где стероидная иммуносупрессия отменяется на ранней стадии (Papatheodoridis et al., 1998; Gow and Chapman et al., 2000). Колоректальный рак поражает 5–7% пациентов с первичным СК после трансплантации печени, в особенности тех, у кого в анамнезе долгая история язвенного колита и панколита (Loftus et al., 1998; MacLean et al., 2003; Вера и др., 2003). Для предотвращения этого опасного для жизни осложнения рекомендуется ежегодное наблюдение и колэктомия у отдельных пациентов из группы высокого риска с длительным тяжелым колитом (Loftus et al., 1998; Gow PJ, Chapman, 2000; Vera et al., 2003).
Используя это определение, рецидив SC был зарегистрирован у 20% пациентов с трансплантацией (Graziadei et al., 1999). В целом, рецидивирующий СК не оказывает серьезного негативного влияния на выживаемость пациента или трансплантата в среднесрочной перспективе. Активность ВЗК после трансплантации непостоянна, но, как сообщается, она более серьезна, особенно в отделениях, где стероидная иммуносупрессия отменяется на ранней стадии (Papatheodoridis et al., 1998; Gow and Chapman et al., 2000). Колоректальный рак поражает 5–7% пациентов с первичным СК после трансплантации печени, в особенности тех, у кого в анамнезе долгая история язвенного колита и панколита (Loftus et al., 1998; MacLean et al., 2003; Вера и др., 2003). Для предотвращения этого опасного для жизни осложнения рекомендуется ежегодное наблюдение и колэктомия у отдельных пациентов из группы высокого риска с длительным тяжелым колитом (Loftus et al., 1998; Gow PJ, Chapman, 2000; Vera et al., 2003).
Желчегонное — обзор | Темы ScienceDirect
Послеоперационные стероиды
Кортикостероиды используются в лечении БА более 30 лет. Первоначально назначенные из-за их противовоспалительного и желчегонного действия у пациентов с холангитом после HPE, профилактическое и использование высоких доз стероидов в послеоперационном периоде приобрело популярность в свете сообщений со ссылкой на такие преимущества, как длительное отсутствие желтухи, более низкие уровни билирубина в сыворотке, выживаемость без трансплантата. и улучшенный отток желчи (Dillon et al, 2001; Sokol et al, 2003; Escobar et al, 2006).Несмотря на эти многообещающие результаты, такие результаты не были универсальными и были в основном основаны на ретроспективном анализе, в котором участников исследования сравнивали с историческими контрольными группами.
Первоначально назначенные из-за их противовоспалительного и желчегонного действия у пациентов с холангитом после HPE, профилактическое и использование высоких доз стероидов в послеоперационном периоде приобрело популярность в свете сообщений со ссылкой на такие преимущества, как длительное отсутствие желтухи, более низкие уровни билирубина в сыворотке, выживаемость без трансплантата. и улучшенный отток желчи (Dillon et al, 2001; Sokol et al, 2003; Escobar et al, 2006).Несмотря на эти многообещающие результаты, такие результаты не были универсальными и были в основном основаны на ретроспективном анализе, в котором участников исследования сравнивали с историческими контрольными группами.
Недавний метаанализ не смог продемонстрировать значительную разницу в исходах у детей, подвергшихся хирургическому лечению, которые получали стероиды, от тех, кто не получал стероиды, хотя этот результат был поставлен под сомнение, учитывая ограниченный размер выборки исследований, включенных в анализ (Zhang etal, 2014).
Недавно было проведено многоцентровое двойное слепое рандомизированное исследование стероидов при атрезии желчных путей (START), в котором 140 младенцев с БА, прошедших HPE в одном из 14 центров США, были рандомизированы на 13-недельный курс послеоперационного лечения. стероиды или плацебо.Это исследование не продемонстрировало явного клинического улучшения у пациентов, получавших высокие дозы стероидов в послеоперационном периоде, при этом не было обнаружено статистически значимой разницы по нескольким ключевым конечным точкам, а именно по доле младенцев, у которых достигнута нормализация общего билирубина в сыворотке к 6 месяцам после операции, нативная печень выживаемость через 2 года и общий уровень билирубина в сыворотке крови на протяжении всего исследования (рис. 40.2) (Bezerra etal, 2014). Более того, у младенцев, получавших стероиды, было более короткое время до развития серьезных побочных эффектов по сравнению с контрольной группой, что подчеркивает нетривиальные риски терапии высокими дозами стероидов в этой популяции пациентов.
Неоднократно было продемонстрировано, что послеоперационные исходы для пациентов с БА ухудшаются, если хирургическое вмешательство проводится после развития цирроза печени, процесса, который развивается и ухудшается с возрастом. Таким образом, уже давно приветствуются ранняя диагностика и хирургическое вмешательство. Хотя, по-видимому, имеется достаточное количество доказательств, позволяющих предположить, что избавление от желтухи улучшается у пациентов, которые проходят раннюю HPE, как правило, в возрасте 45 дней или младше, эти результаты не универсальны, и другие сообщают об отсутствии различий у пациентов, которые проходят HPE , даже до 100 дней жизни (Chardot et al, 2013; Davenport et al, 2004; Wildhaber et al, 2008).Подобное несоответствие наблюдается в долгосрочных исследованиях, демонстрирующих улучшение выживаемости нативной печени на 30 лет после операции у пациентов, перенесших раннюю HPE, как показано на рис. 40.3 (Chardot etal, 2013; Lykavieris etal, 2005; Nio et al. , 2010).
, 2010).
Как и в случае более краткосрочных результатов, эти результаты не являются единодушными: другие центры не смогли продемонстрировать повышение выживаемости нативной печени с ранним хирургическим вмешательством у всех младенцев с БА, а скорее только у детей с конкретными формами, такими как кистозная БА и синдром билиарной атрезии селезеночной мальформации (Davenport et al, 2008).Более поздние данные также не смогли продемонстрировать худшую выживаемость нативной печени с увеличением возраста в HPE, вместо этого было обнаружено, что избавление от желтухи в течение первых 2 месяцев и предотвращение холангита в течение первых 3 месяцев после операции более предсказуемо для долгосрочной естественной печени. выживаемость (Кога и др., 2013). В конечном итоге различия, наблюдаемые как в этих исследованиях, так и в подгруппах, подчеркивают необходимость продолжения работы в этой области, чтобы лучше разграничить те группы, которым больше всего помогает раннее вмешательство, а также оптимальное лечение поздней диагностики БА.
Неонатальный холестаз: новые методы молекулярной диагностики и потенциальные новые методы лечения
Келли, Д. А. и Стэнтон, А. Желтуха у младенцев: значение для скрининга на предмет атрезии желчных протоков. BMJ 310 , 1172–1173 (1995).
CAS PubMed PubMed Central Google ученый
Bartlett, M. & Gourley, G. в Болезнь печени у детей 4-е изд. (Eds.Дж., Сокол, Р. Дж. И Балистрери, В. Ф.) 177–198 (Cambridge Univ. Press, 2014).
Fawaz, R. et al. Руководство по оценке холестатической желтухи у младенцев: совместные рекомендации Североамериканского общества детской гастроэнтерологии, гепатологии и питания и Европейского общества детской гастроэнтерологии, гепатологии и питания. J. Pediatr. Гастроэнтерол. Nutr. 64 , 154–168 (2017).
J. Pediatr. Гастроэнтерол. Nutr. 64 , 154–168 (2017).
CAS PubMed Google ученый
Фельдман, А. и Сухи, Ф. Дж. В Заболевание печени у детей 4-е изд. (Ред. Сухи, Ф. Дж., Сокол, Р. Дж. И Балистрери, У. Ф.) 101–110 (Cambridge Univ. Press, 2014).
Harpavat, S., Finegold, M.J. и Karpen, S.J. У пациентов с атрезией желчных путей повышен уровень прямого / конъюгированного билирубина вскоре после рождения. Педиатрия 128 , e1428 – e1433 (2011).
PubMed PubMed Central Google ученый
Харпават, С., Гарсия-Пратс, Дж. А. и Шнейдер, Б. Л. Скрининг билирубина новорожденных на атрезию желчных путей. N. Engl. J. Med. 375 , 605–606 (2016).
Л. Скрининг билирубина новорожденных на атрезию желчных путей. N. Engl. J. Med. 375 , 605–606 (2016).
PubMed Google ученый
Harpavat, S. et al. Прямые или конъюгированные измерения билирубина у новорожденных как потенциальный скрининг на атрезию желчевыводящих путей. J. Pediatr. Гастроэнтерол. Nutr. 62 , 799–803 (2016).
CAS PubMed Google ученый
Chardot, C. et al. Улучшение результатов атрезии желчных путей: французская национальная серия 1986–2009. J. Hepatol. 58 , 1209–1217 (2013).
PubMed Google ученый
Serinet, M.O. et al. Влияние возраста операции Касаи на ее результаты в позднем детстве и подростковом возрасте: рациональная основа для скрининга атрезии желчных путей. Педиатрия 123 , 1280–1286 (2009).
PubMed Google ученый
Schreiber, R.A. et al. Атрезия желчных путей: опыт Канады. J. Pediatr. 151 , 659–665 (2007).
PubMed Google ученый
Hussein, M., Howard, E. R., Mieli-Vergani, G. & Mowat, A.P. Желтуха в 14-дневном возрасте: исключить атрезию желчных протоков. Arch. Дис. Детский 66 , 1177–1179 (1991).
CAS PubMed PubMed Central Google ученый
Миели-Вергани, Г., Ховард, Э. Р., Портман, Б. и Моуат, А. П. Позднее направление к специалистам по поводу атрезии желчных путей — упущенные возможности для эффективной хирургии. Ланцет 1 , 421–423 (1989).
CAS PubMed Google ученый
Lee, W. S. Консультация перед госпитализацией и позднее направление младенцев с неонатальным холестазом. J. Paediatr. Здоровье ребенка 44 , 57–61 (2008).
PubMed Google ученый
Sokol, R.J. et al. Скрининг и исходы при атрезии желчных путей: резюме семинара Национальных институтов здоровья. Гепатология 46 , 566–581 (2007).
CAS PubMed PubMed Central Google ученый
Lien, T. H. et al. Влияние программы скрининга цветных карт детского стула на 5-летний исход атрезии желчных путей на Тайване. Гепатология 53 , 202–208 (2011).
PubMed Google ученый
Хопкинс, П. К., Язиги, Н. и Найлунд, К. М. Частота атрезии желчных протоков и сроки гепатопортоэнтеростомии в США. J. Pediatr. 187 , 253–257 (2017).
PubMed Google ученый
Herbst, S. M. et al. Сделаем следующий шаг вперед — диагностика наследственных детских холестатических расстройств с помощью секвенирования следующего поколения. Мол. Клетка. Зонды 29 , 291–298 (2015).
CAS PubMed Google ученый
Wang, N. L. et al. Специально разработанная мультигенная панель облегчает генетическую диагностику у детей с внутрипеченочным холестазом: одновременный тест известных крупных вставок / делеций. PLOS ONE 11 , e0164058 (2016).
PubMed PubMed Central Google ученый
Matte, U. et al. Анализ мутаций генов у детей с холестазом неустановленной этиологии. J. Pediatr. Гастроэнтерол. Nutr. 51 , 488–493 (2010).
PubMed PubMed Central Google ученый
Togawa, T. et al. Молекулярно-генетическая диссекция и внутрипеченочный холестаз новорожденных / младенцев с использованием целевого секвенирования следующего поколения. J. Pediatr. 171 , 171–177 (2016).
J. Pediatr. 171 , 171–177 (2016).
PubMed Google ученый
Karpen, S. et al. Использование комплексной панели из 66 генов для диагностики причин холестаза у> 700 человек [аннотация 1213]. Гепатология 66 (Приложение 1), 655A (2017).
Google ученый
Сухи, Ф. Дж. Неонатальный холестаз. Pediatr. Ред. 25 , 388–396 (2004).
PubMed Google ученый
Балистрери, В. Ф. и Безерра, Дж. А. Что бы ни случилось с «неонатальным гепатитом». Clin. Liver Dis. 10 , 27–53 (2006).
PubMed Google ученый
Yerushalmi, B. et al. Болезнь Ниманна-Пика типа C при холестазе новорожденных в центре Северной Америки. J. Pediatr. Гастроэнтерол. Nutr. 35 , 44–50 (2002).
PubMed Google ученый
Лу, Ю. Б., Пэн, Ф., Ли, М. Х., Кобаяши, К. и Сахеки, Т. [Прогресс и перспективы исследования дефицита цитрина]. Чжунхуа И Сюэ И Чуань Сюэ За Чжи 23 , 655–658 (2006).
CAS PubMed Google ученый
Satrom, K. & Gourley, G.Холестаз у недоношенных детей. Clin. Перинатол. 43 , 355–373 (2016).
PubMed Google ученый
Hoang, V. et al. Чрескожно вводимый центральный катетер для полного парентерального питания новорожденных: частота осложнений, связанных с введением верхней или нижней конечности. Педиатрия 121 , e1152 – e1159 (2008).
PubMed Google ученый
Hsieh, M. H. et al. Холестаз, связанный с парентеральным питанием, у недоношенных детей: факторы риска и предикторы. Pediatr. Неонатол. 50 , 202–207 (2009).
PubMed Google ученый
Ли, В. С. и Сокол, Р. Дж. Кишечная микробиота, липиды и патогенез заболеваний печени, связанных с кишечной недостаточностью.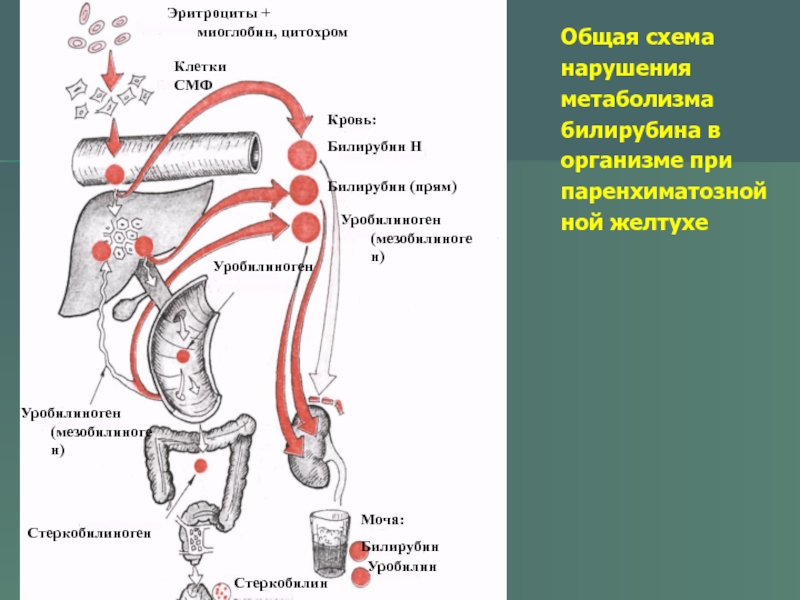 J. Pediatr. 167 , 519–526 (2015).
J. Pediatr. 167 , 519–526 (2015).
PubMed PubMed Central Google ученый
Balistreri, W. F. et al. Внутрипеченочный холестаз: краткое изложение конференции, посвященной одной теме Американской ассоциации по изучению заболеваний печени. Гепатология 42 , 222–235 (2005).
PubMed Google ученый
Gonzales, E. et al. Заболевания печени, связанные с дефицитом гена MDR3 (ABCB4). Фронт. Biosci. (Landmark Ed) 14, (4242–4256 (2009).
Google ученый
Liu, L.Y., Wang, X.H., Lu, Y., Zhu, Q.R., Wang, J. S. Ассоциация вариантов ABCB11 с преходящим неонатальным холестазом. Pediatr. Int. 55 , 138–144 (2013).
S. Ассоциация вариантов ABCB11 с преходящим неонатальным холестазом. Pediatr. Int. 55 , 138–144 (2013).
CAS PubMed Google ученый
Goldschmidt, M. L. et al. Повышенная частота двойных и тройных гетерозиготных вариантов генов у детей с внутрипеченочным холестазом. Hepatol. Res. 46 , 306–311 (2016).
CAS PubMed Google ученый
Бойер, Дж. Л. Образование и секреция желчи. Компр. Physiol. 3 , 1035–1078 (2013).
PubMed PubMed Central Google ученый
Вагнер М. и Траунер М. Последние достижения в понимании и лечении холестаза. F1000Res 5 , 705 (2016).
Последние достижения в понимании и лечении холестаза. F1000Res 5 , 705 (2016).
Google ученый
Ли, В. С. и Сокол, Р. Дж. Митохондриальные гепатопатии: достижения в генетике, терапевтические подходы и результаты. J. Pediatr. 163 , 942–948 (2013).
CAS PubMed PubMed Central Google ученый
Херцог Д., Чессекс П., Мартин С. и Альварес Ф. Преходящий холестаз у новорожденных с перинатальной асфиксией. Кан. J. Gastroenterol. 17 , 179–182 (2003).
CAS PubMed Google ученый

Stieger, B. Недавние исследования функции и регулирования насоса для отвода желчной соли (ABCB11). Curr. Opin. Липидол. 20 , 176–181 (2009).
CAS PubMed Google ученый
Фельдман А. и Сокол Р. Дж. Дефицит альфа-1-антитрипсина: важная причина заболеваний печени у детей. Здоровье легких Проф. Маг. 4 , 8–11 (2013).
PubMed PubMed Central Google ученый
Koo, K. A. et al. Билиатрезон, реактивный природный токсин из Dysphania glomulifera и D. littoralis: открытие токсичного фрагмента 1,2-диарил-2-пропенона. Chem. Res. Toxicol. 28 , 1519–1521 (2015).
CAS PubMed PubMed Central Google ученый
Waisbourd-Zinman, O. et al. Токсин билиатрезон вызывает повреждение внепеченочных холангиоцитов и фиброз из-за снижения глутатиона и SOX17. Гепатология 64 , 880–893 (2016).
CAS PubMed PubMed Central Google ученый
El Kasmi, K. C. et al. Фитостерины способствуют повреждению печени и активации клеток Купфера при заболеваниях печени, связанных с парентеральным питанием. Sci.Transl Med. 5 , 206ра137 (2013).
PubMed PubMed Central Google ученый
Berauer, J. P. et al. Идентификация вариантов гена PKD1L1 у детей с синдромом мальформации билиарной атрезии и селезенки. Гепатология https://doi.org/10.1002/hep.30515 (2019).
Артикул PubMed Google ученый
Феранчак, А.П. и Сокол, Р. Дж. Биология холангиоцитов и муковисцидоз печени. Семин. Liver Dis. 21 , 471–488 (2001).
CAS PubMed Google ученый
Chinsky, J. M. et al. Диагностика и лечение тирозинемии типа I: обзор и рекомендации консенсусной группы США и Канады. Genet. Med. 19 , 1380 (2017).
Google ученый
Demir, H. et al. Уровни альфа-фетопротеина в сыворотке крови при холестазе новорожденных. Turk. J. Pediatr. 55 , 152–157 (2013).
PubMed Google ученый
Сундарам, С. С., Бове, К. Э., Ловелл, М. А. и Сокол, Р. Дж. Механизмы заболевания: врожденные нарушения синтеза желчной кислоты. Nat. Clin. Практик. Гастроэнтерол. Гепатол. 5 , 456–468 (2008).
CAS PubMed PubMed Central Google ученый
Mittal, V. et al. Роль абдоминальной сонографии в предоперационной диагностике атрезии внепеченочных желчных протоков у детей младше 90 дней. AJR Am. J. Roentgenol. 196 , W438 – W445 (2011).
PubMed Google ученый
Kianifar, H. R. et al. Точность гепатобилиарной сцинтиграфии для дифференциации неонатального гепатита от атрезии желчных путей: систематический обзор и метаанализ литературы. Pediatr. Радиол. 43 , 905–919 (2013).
PubMed Google ученый
Янг, Дж. Г., Ма, Д. К., Пэн, Ю., Сонг, Л. и Ли, К. Л. Сравнение различных диагностических методов для дифференциации атрезии желчных путей от идиопатического неонатального гепатита. Clin. Изображения 33 , 439–446 (2009).
PubMed Google ученый
Liu, B. et al. Трехмерная магнитно-резонансная холангиопанкреатография для диагностики атрезии желчных путей у младенцев и новорожденных. PLOS ONE 9 , e88268 (2014).
PubMed PubMed Central Google ученый
Meyers, R. L. et al. Чрескожная холецистохолангиография в диагностике механической желтухи у детей раннего возраста. J. Pediatr. Surg. 39 , 16–18 (2004).
PubMed Google ученый
Jensen, M. K. et al. HIDA, чрескожная чреспеченочная холецистохолангиография и биопсия печени у младенцев со стойкой желтухой: может ли комбинация PTCC и биопсии печени уменьшить ненужную лапаротомию? Pediatr. Радиол. 42 , 32–39 (2012).
PubMed Google ученый
Шанмугам, Н.P. et al. Избирательное использование эндоскопической ретроградной холангиопанкреатографии в диагностике атрезии желчных протоков у детей младше 100 дней. J. Pediatr. Гастроэнтерол. Nutr. 49 , 435–441 (2009).
PubMed Google ученый
Zerbini, M.C. et al. Биопсия печени при холестазе новорожденных: обзор на статистических основаниях. Мод. Патол. 10 , 793–799 (1997).
CAS PubMed Google ученый
Russo, P. et al. Разработка и валидация системы гистологической оценки холестаза в младенчестве консорциума исследователей атрезии желчных путей. Clin. Гастроэнтерол. Гепатол. 9 , 357–362 (2011).
PubMed PubMed Central Google ученый
Russo, P. et al. Ключевые гистопатологические особенности биопсии печени, которые позволяют отличить атрезию желчных путей от других причин детского холестаза и их корреляция с исходом: многоцентровое исследование. Am. J. Surg. Патол. 40 , 1601–1615 (2016).
PubMed PubMed Central Google ученый
Хаафиз, А. Б. Фиброз печени при атрезии желчных путей. Эксперт Преп. Гастроэнтерол. Гепатол. 4 , 335–343 (2010).
PubMed Google ученый
Hanquinet, S. et al. Вклад эластографии в ультразвуковую диагностику атрезии желчевыводящих путей с помощью акустико-лучево-силовой импульсной (ARFI) эластографии. Pediatr. Радиол. 45 , 1489–1495 (2015).
PubMed Google ученый
Leschied, J. R. et al. Эластография сдвиговой волной помогает дифференцировать атрезию желчных протоков от других заболеваний печени новорожденных / младенцев. Pediatr. Радиол. 45 , 366–375 (2015).
PubMed Google ученый
Wu, J. F. et al. Транзиторная эластография полезна для диагностики атрезии желчных протоков и прогнозирования прогноза после гепатопортоэнтеростомии. Гепатология 68 , 616–624 (2018).
PubMed Google ученый
Метцкер, М. Л. Технологии секвенирования — новое поколение. Nat. Преподобный Жене. 11 , 31–46 (2010).
CAS PubMed PubMed Central Google ученый
Trauner, M., Fuchs, C. D., Halilbasic, E. & Paumgartner, G. Новые терапевтические концепции транспорта желчных кислот и передачи сигналов для управления холестазом. Гепатология 65 , 1393–1404 (2017).
PubMed Google ученый
Shneider, B. L. et al. Портальная гипертензия у детей и молодых людей с атрезией желчных путей. J. Pediatr. Гастроэнтерол. Nutr. 55 , 567–573 (2012).
PubMed PubMed Central Google ученый
Фельдман А.Г., Сокол Р.J. Неонатальный холестаз. Neoreviews https://doi.org/10.1542/neo.14-2-e63 (2013).
Артикул PubMed PubMed Central Google ученый
Язиги Н. А. Отдаленные результаты трансплантации печени у детей. Pediatr. Гастроэнтерол. Гепатол. Nutr. 16 , 207–218 (2013).
PubMed PubMed Central Google ученый
Мартин, С. Р., Аткисон, П., Ананд, Р., Линдблад, А. С. и Группа, С. Р. Исследования педиатрической трансплантации печени 2002: выживаемость и отторжение пациента и трансплантата у педиатрических реципиентов первой трансплантации печени в США и Канаде. Pediatr. Пересадка. 8 , 273–283 (2004).
CAS PubMed Google ученый
Heubi, J. E., Bove, K. E. & Setchell, K. D. R. Оральная холевая кислота эффективна и хорошо переносится пациентами с синтезом желчных кислот и расстройствами спектра Зеллвегера. J. Pediatr. Гастроэнтерол. Nutr. 66 , e57 – e59 (2018).
PubMed Google ученый
Сантра С. и Бауманн У. Опыт применения нитисинона в фармакологическом лечении наследственной тирозинемии типа 1. Мнение эксперта. Фармакотер. 9 , 1229–1236 (2008).
CAS PubMed Google ученый
Демирбас, Д., Брукер, В. Дж. И Берри, Г. Т. Врожденные нарушения метаболизма при гепатопатии: нарушения метаболизма галактозы, фруктозы и тирозина. Pediatr. Clin. North Am. 65 , 337–352 (2018).
PubMed Google ученый
Wang, K. S. et al. Анализ хирургического прерывания энтерогепатического кровообращения как метода лечения холестаза у детей. Гепатология 65 , 1645–1654 (2017).
CAS PubMed PubMed Central Google ученый
Лейн, Э. и Мюррей, К. Ф. Неонатальный холестаз. Pediatr. Clin. North Am. 64 , 621–639 (2017).
PubMed Google ученый
Сундарам, С. С., Мак, К. Л., Фельдман, А. Г. и Сокол, Р. Дж. Атрезия желчных путей: показания и сроки трансплантации печени и оптимизация предтрансплантационной помощи. Liver Transpl. 23 , 96–109 (2017).
PubMed PubMed Central Google ученый
Феранчак, А.П., Сухи, Ф.Дж. и Сокол, Р.Дж., Заболевание печени у детей, , 4-е изд. (Ред. Сухи, Ф.Дж., Сокол, Р.Дж. и Балистрери, ВФ) 111–140 (Cambridge Univ. Press, 2014 ).
Салливан, Дж. С., Сундарам, С. С., Пан, З. и Сокол, Р. Дж. Добавки для парентерального питания у пациентов с атрезией желчных путей, внесенных в список для трансплантации печени. Liver Transpl. 18 , 120–128 (2012).
PubMed PubMed Central Google ученый
Utterson, E.C. et al. Атрезия желчевыводящих путей: клинические профили, факторы риска и исходы 755 пациентов, перенесших трансплантацию печени. J. Pediatr. 147 , 180–185 (2005).
PubMed Google ученый
ДеРуссо, П.A. et al. Нарушение роста и исходы у младенцев с атрезией желчных путей: отчет Консорциума исследований атрезии желчных путей. Гепатология 46 , 1632–1638 (2007).
PubMed Google ученый
Кэмпбелл, А. Л. и Герольд, Б. С. Иммунизация педиатрических кандидатов на трансплантацию твердых органов: иммунизация кандидатов на трансплантацию. Pediatr. Пересадка. 9 , 652–661 (2005).
PubMed Google ученый
Центры по контролю и профилактике заболеваний. Рекомендуемый график иммунизации детей и подростков в возрасте 18 лет и младше. CDC https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf (2019).
Фельдман, А. Г., Фейдтнер, К. и Кемпе, А. Снижение недостаточной иммунизации реципиентов трансплантата. JAMA Pediatr. 172 , 111–112 (2017).
Google ученый
Фельдман А. Г., Сундарам С. С., Бити Б. Л. и Кемпе А. Госпитализации по поводу респираторно-синцитиального вируса и инфекций, предотвращаемых с помощью вакцин, в первые 2 года после трансплантации печени у детей. J. Pediatr. 182 , 232–238 (2017).
PubMed Google ученый
Алонсо, Э. М. и др. Факторы, прогнозирующие качество жизни, связанное со здоровьем, у педиатрических реципиентов трансплантата печени в группе функциональных исходов. Pediatr. Пересадка. 17 , 605–611 (2013).
PubMed PubMed Central Google ученый
de Vries, W. et al. Общее качество жизни взрослых, переживших атрезию желчных путей, с трансплантацией печени или без нее: результаты национальной когорты. Eur.J. Pediatr. Surg. 26 , 349–356 (2016).
PubMed Google ученый
Cai, S. Y. et al. Желчные кислоты инициируют холестатическое повреждение печени, вызывая воспалительную реакцию, специфичную для гепатоцитов. JCI Insight 2 , e
(2017).PubMed PubMed Central Google ученый
Lindor, K. D. et al. Урсодезоксихолевая кислота в лечении первичного билиарного цирроза. Гастроэнтерология 106 , 1284–1290 (1994).
CAS PubMed Google ученый
Heathcote, E.J. et al. Канадское многоцентровое двойное слепое рандомизированное контролируемое исследование урсодезоксихолевой кислоты при первичном билиарном циррозе. Гепатология 19 , 1149–1156 (1994).
CAS PubMed Google ученый
Combes, B. et al. Длительное наблюдение за пациентами в многоцентровом исследовании урсодезоксихолевой кислоты при первичном билиарном циррозе в США. Am. J. Gastroenterol. 99 , 264–268 (2004).
CAS PubMed PubMed Central Google ученый
Poupon, R.E., Balkau, B., Eschwege, E. & Poupon, R. Многоцентровое контролируемое испытание урсодиола для лечения первичного билиарного цирроза. Исследовательская группа UDCA-PBC. N. Engl. J. Med. 324 , 1548–1554 (1991).
CAS PubMed Google ученый
Pares, A. et al. Долгосрочные эффекты урсодезоксихолевой кислоты при первичном билиарном циррозе: результаты двойного слепого контролируемого многоцентрового исследования. UDCA-Cooperative Group Испанской ассоциации изучения печени. J. Hepatol. 32 , 561–566 (2000).
CAS PubMed Google ученый
Corpechot, C. et al. Биохимический ответ на урсодезоксихолевую кислоту и долгосрочный прогноз при первичном билиарном циррозе. Гепатология 48 , 871–877 (2008).
CAS PubMed Google ученый
Паумгартнер, Г. и Пусл, Т. Медикаментозное лечение холестатической болезни печени. Clin. Liver Dis. 12 , 53–80 (2008).
PubMed Google ученый
Zollner, G. et al. Экспрессия ферментов синтеза и детоксикации желчных кислот и альтернативный насос оттока желчных кислот MRP4 у пациентов с первичным билиарным циррозом. Liver Int. 27 , 920–929 (2007).
CAS PubMed Google ученый
Marschall, H.U. et al. Дополнительная стимуляция гепатобилиарного транспорта и систем детоксикации рифампицином и урсодезоксихолевой кислотой у людей. Гастроэнтерология 129 , 476–485 (2005).
PubMed Google ученый
Lindor, K. D. et al. Высокие дозы урсодезоксихолевой кислоты для лечения первичного склерозирующего холангита. Гепатология 50 , 808–814 (2009).
CAS PubMed PubMed Central Google ученый
Halilbasic, E. et al. Структура боковой цепи определяет уникальные физиологические и терапевтические свойства норрсодезоксихолевой кислоты у мышей Mdr2 — / — . Гепатология 49 , 1972–1981 (2009).
CAS PubMed PubMed Central Google ученый
Hohenester, S. et al. Билиарный HCO3-зонтик представляет собой защитный механизм против индуцированного желчной кислотой повреждения холангиоцитов человека. Гепатология 55 , 173–183 (2012).
CAS PubMed Google ученый
Fickert, P. et al. 24-норурсодезоксихолевая кислота превосходит урсодезоксихолевую кислоту при лечении склерозирующего холангита у мышей с нокаутом Mdr2 (Abcb4). Гастроэнтерология 130 , 465–481 (2006).
CAS PubMed Google ученый
Moustafa, T. et al. Изменения липидного обмена опосредуют воспаление, фиброз и пролиферацию на мышиной модели хронического холестатического поражения печени. Гастроэнтерология 142 , 140–151 (2012).
CAS PubMed Google ученый
Европейская ассоциация по изучению печени. Руководство EASL по клинической практике: диагностика и лечение пациентов с первичным билиарным холангитом. J. Hepatol. 67 , 145–172 (2017).
Google ученый
Али, А.Х., Кэри, Э. Дж. И Линдор, К. Д. Последние достижения в разработке агонистов фарнезоидных X-рецепторов. Ann. Transl Med. 3 , 5 (2015).
PubMed PubMed Central Google ученый
Kast, H. R. et al. Регулирование белка 2, связанного с множественной лекарственной устойчивостью (ABCC2), ядерными рецепторами, рецептором прегнана X, рецептором, активируемым фарнезоидом X, и конститутивным рецептором андростана. Дж.Биол. Chem. 277 , 2908–2915 (2002).
CAS PubMed Google ученый
Бойерс, У., Траунер, М., Янсен, П. и Поупон, Р. Новые парадигмы в лечении холестаза печени: от УДХК до FXR, PXR и других. J. Hepatol. 62 , S25–37 (2015).
CAS PubMed Google ученый
Хуанг Л.и другие. Рецептор Фарнезоида X активирует транскрипцию фосфолипидного насоса MDR3. J. Biol. Chem. 278 , 51085–51090 (2003).
CAS PubMed Google ученый
Moschetta, A., Bookout, A. L. & Mangelsdorf, D. J. Профилактика холестериновой желчнокаменной болезни агонистами FXR на мышиной модели. Nat. Med. 10 , 1352–1358 (2004).
CAS PubMed Google ученый
Halilbasic, E., Baghdasaryan, A. & Trauner, M. Ядерные рецепторы как мишени для лекарств при холестатических заболеваниях печени. Clin. Liver Dis. 17 , 161–189 (2013).
PubMed PubMed Central Google ученый
Тран, М., Лю, Ю., Хуанг, В. и Ван, Л. Ядерные рецепторы и заболевание печени: резюме симпозиума по фундаментальным исследованиям 2017 года. Hepatol. Commun. 2 , 765–777 (2018).
PubMed PubMed Central Google ученый
Shneider, B. L. et al. Плацебо-контролируемое рандомизированное исследование ингибитора кишечного транспорта солей желчи для лечения зуда при синдроме Алажиля. Hepatol. Commun. 2 , 1184–1198 (2018).
CAS PubMed PubMed Central Google ученый
Багдасарян А. и др. Ингибирование кишечной абсорбции желчных кислот улучшает холестатическое повреждение печени и желчных протоков на мышиной модели склерозирующего холангита. J. Hepatol. 64 , 674–681 (2016).
CAS PubMed Google ученый
Miethke, A. G. et al. Фармакологическое ингибирование апикального натрийзависимого переносчика желчных кислот изменяет состав желчи и блокирует прогрессирование склерозирующего холангита у мышей с нокаутом по множественной лекарственной устойчивости 2. Гепатология 63 , 512–523 (2016).
CAS PubMed Google ученый
Дин, Л., Ян, Л., Ван, З. и Хуанг, В. Ядерный рецептор желчных кислот FXR и заболевания пищеварительной системы. Acta Pharm. Грех. В 5 , 135–144 (2015).
PubMed PubMed Central Google ученый
Thompson, R.J. et al. Фаза 2 открытое исследование эффективности и безопасности апикального ингибитора транспортера желчных кислот мараликсибата, зависимого от натрия, у детей с прогрессирующим семейным внутрипеченочным холестазом: 48-недельный промежуточный анализ эффективности. Гепатология 66 , 57А (2017).
Google ученый
Shneider, B. L. et al. Результаты ITCH, многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования мараликсибата, апикального натрийзависимого ингибитора транспортера желчных кислот (ASBTi) для лечения зуда при синдроме Аладжилля (ALGS). Гепатология 66 , 84А (2017).
Google ученый
Slijepcevic, D. et al. Поглощение печенью конъюгированных желчных кислот опосредуется как полипептидом, транспортирующим таурохолат натрия, так и полипептидами, транспортирующими органические анионы, и модулируется кишечным зондированием уровней желчных кислот в плазме у мышей. Гепатология 66 , 1631–1643 (2017).
CAS PubMed PubMed Central Google ученый
Zema, M. J. Colesevelam гидрохлорид: доказательства его использования при лечении гиперхолестеринемии и сахарного диабета 2 типа с пониманием механизма действия. Core Evid. 7 , 61–75 (2012).
CAS PubMed PubMed Central Google ученый
Кортез, Л. и Сим, В. Терапевтический потенциал химических шаперонов при заболеваниях сворачивания белков. Прион 8 , 28938 (2014).
PubMed Google ученый
Hayashi, H. & Sugiyama, Y. 4-фенилбутират усиливает экспрессию на клеточной поверхности и транспортную способность насосов экспорта солей желчных кислот дикого типа и мутировавших. Гепатология 45 , 1506–1516 (2007).
CAS PubMed PubMed Central Google ученый
Hasegawa, Y. et al. Неизлечимый зуд, купируемый терапией 4-фенилбутиратом у пациентов с прогрессирующим семейным внутрипеченочным холестазом 1 типа. Orphanet J. Rare Dis. 9 , 89 (2014).
PubMed PubMed Central Google ученый
van der Velden, L.M. et al. Дефекты сворачивания АТФ 8B1 P-типа, связанные с наследственным холестазом, улучшаются 4-фенилбутиратом. Гепатология 51 , 286–296 (2010).
PubMed Google ученый
Gonzales, E. et al. Таргетная фармакотерапия при прогрессирующем семейном внутрипеченочном холестазе 2 типа: данные об улучшении холестаза с помощью 4-фенилбутирата. Гепатология 62 , 558–566 (2015).
CAS PubMed PubMed Central Google ученый
Verkade, H. J. et al. Атрезия желчевыводящих путей и другие холестатические детские заболевания: достижения и проблемы будущего. J. Hepatol. 65 , 631–642 (2016).
PubMed Google ученый
Bezerra, J. A. et al. Использование кортикостероидов после гепатопортоэнтеростомии для оттока желчи у младенцев с атрезией желчевыводящих путей: рандомизированное клиническое исследование START. JAMA 311 , 1750–1759 (2014).
PubMed PubMed Central Google ученый
Sokol, R.J. et al. Внутривенный иммуноглобулин (ВВИГ) после портоэнтеростомии у младенцев с атрезией желчных путей: испытание фазы 1 / 2A [аннотация LB-8]. Гепатология 64 (Дополнение), 1123A (2016).
Google ученый
Фридман, С.L. et al. Рандомизированное плацебо-контролируемое исследование ценикривирока для лечения неалкогольного стеатогепатита с фиброзом. Гепатология 67 , 1754–1767 (2018).
CAS PubMed PubMed Central Google ученый
Ван К.С. Скрининг новорожденных на атрезию желчных путей. Педиатрия 136 , e1663 – e1669 (2015).
PubMed PubMed Central Google ученый
Ценг, Дж. Дж., Лай, М. С., Лин, М. С. и Фу, Ю. С. Скрининг цветных карт стула на предмет атрезии желчных путей. Педиатрия 128 , e1209 – e1215 (2011).
PubMed Google ученый
Hsiao, C.H. et al. Универсальный скрининг на атрезию желчных путей с использованием цветовой карты детского стула на Тайване. Гепатология 47 , 1233–1240 (2008).
PubMed PubMed Central Google ученый
Могул, Д., Чжоу, М., Интихар, П., Шварц, К. и Фрик, К. Экономически эффективный анализ скрининга на атрезию желчных путей с помощью цветовой карты стула. J. Pediatr. Гастроэнтерол. Nutr. 60 , 91–98 (2015).
PubMed Google ученый
Woolfson, J. P. et al. Программа домашнего скрининга на атрезию желчных путей в Британской Колумбии: оценка первых 2 лет. J. Pediatr. Гастроэнтерол.Nutr. 66 , 845–849 (2018).
PubMed Google ученый
Franciscovich, A. et al. PoopMD, мобильное приложение для здоровья, точно определяет ахолический стул у младенцев. PLOS ONE 10 , e0132270 (2015).
PubMed PubMed Central Google ученый
Lertudomphonwanit, C. et al. Масштабная протеомика идентифицирует MMP-7 как дозор эпителиального повреждения и атрезии желчных протоков. Sci. Transl Med. 9 , eaan8462 (2017).
PubMed PubMed Central Google ученый
Желчегонные агенты, барбитураты, витамины, антагонисты опиоидов, смолы желчных солей, антибиотики, желудочно-кишечные агенты, прочие
Автор
Хишам Назер, MBBCh, FRCP, DTM & H Профессор педиатрии, консультант по детской гастроэнтерологии, гепатологии и клиническому питанию, Медицинский факультет Университета Иордании, Иордания
Хишам Назер, MBBCh, FRCP, DTM & H является членом следующих медицинских общества: Американская ассоциация врачей-лидеров, Королевский колледж педиатрии и детского здоровья, Королевский колледж хирургов в Ирландии, Королевское общество тропической медицины и гигиены, Королевский колледж врачей и хирургов Соединенного Королевства
Раскрытие: Ничего не разглашать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Главный редактор
Кармен Каффари, доктор медицины Адъюнкт-профессор кафедры педиатрии, отделение гастроэнтерологии / питания, Медицинская школа университета Джона Хопкинса
Кармен Каффари, доктор медицины, является членом следующих медицинских обществ: Американский колледж гастроэнтерологии, Американская гастроэнтерологическая ассоциация, Североамериканское общество детской гастроэнтерологии, гепатологии и питания, Королевский колледж врачей и хирургов Канады
Раскрытие информации: Получено гонорар от лабораторий Прометея за выступления и обучение; Получал гонорары от Abbott Nutritionals за выступления и преподавание.для: Abbott Nutritional, Abbvie, спикеры.
Дополнительные участники
Джаянт Деодхар, доктор медицины Адъюнкт-профессор педиатрии, Медицинский колледж Би Джей, Индия; Почетный консультант отделения педиатрии и неонатологии, Мемориальная больница короля Эдуарда, Индия
Раскрытие информации: нечего раскрывать.
Конъюгированная гипербилирубинемия (холестаз) — Советчик по терапии рака
Важно определить причины холестаза, которые требуют хирургического вмешательства.Хирургические вмешательства, соответствующие различным причинам холестаза, показаны в
Таблице II.
Таблица II
| Причина холестаза | Хирургическое вмешательство |
|---|---|
| Атрезия желчных путей | Гепатопортоэнтеростомия (процедура Касаи) |
| Киста холедоха | Холедохоэнтеростомия |
| Самопроизвольная перфорация общего желчного протока | Дренаж хирургический |
| Вдыхаемая желчь в общий желчный проток | Ирригация желчных путей |
Выбор времени для гепатопортоэнтеростомии у пациентов с атрезией желчных путей имеет решающее значение.Наибольшая вероятность восстановления оттока желчи возникает, если гепатопортоэнтеростомия выполняется до 60 дней жизни (показатель успеха 80%). Только 20% младенцев восстанавливают отток желчи, если гепатопортоэнтеростомия выполняется после 90 дней жизни.
Для всех младенцев с холестазом нутритивная поддержка является краеугольным камнем терапии. Уменьшение оттока желчи приводит к снижению доставки желчной кислоты в тонкий кишечник, что приводит к уменьшению образования смешанных мицелл, которые играют центральную роль в абсорбции жиров и жирорастворимых витаминов.У пациентов с холестазом также наблюдается нарушение метаболизма белков и углеводов. Пациенты с холестазом также могут иметь повышенные метаболические потребности вследствие воспаления и инфекции. Наконец, в результате органегалии и / или асцита у пораженных пациентов может быть рефлюкс, раннее насыщение и рвота, что приводит к анорексии и снижению потребления калорий.
Младенцы с холестазом должны получать смеси, содержащие триглицериды со средней длиной цепи (такие как Pregestimil и Alimentum), в которых 50-60% жировых калорий составляют триглицериды со средней длиной цепи.В отличие от длинноцепочечных триглицеридов, которым для абсорбции требуются желчные кислоты, среднецепочечные триглицериды всасываются непосредственно из кишечника. Кроме того, младенцы с холестазом часто имеют повышенную потребность в калориях, и им может потребоваться до 125% рекомендуемой нормы диеты плюс дополнительные калории для наверстывающего роста. Если они не могут потреблять необходимые калории орально, следует начать кормление через назогастральный капельный режим.
Всасывание в кишечнике жирорастворимых витаминов (A, D, E и K) также нарушено, и во избежание дефицита следует контролировать их уровень.Некоторым младенцам будет достаточно комбинированного препарата, такого как AquaADEK. Однако при более серьезном дефиците необходимо добавлять отдельные витамины. Дефицит витамина А, который может привести к ухудшению зрения, возникает, когда соотношение ретинол-связывающий белок ретинол составляет менее 0,8 и требует приема добавок перорально или внутримышечно.
Дефицит витамина D может привести к рахиту и остеомаляции и возникает, когда уровень витамина D в сыворотке 25, OH составляет менее 14 нг / мл.При его дефиците следует назначить пероральный прием витамина D. Дефицит витамина E может привести к неврологическим изменениям и гемолизу и возникает, когда соотношение витамина E к общему количеству липидов сыворотки падает до менее 0,6–0,8 мг / дл, и его следует лечить пероральным альфа-токоферолом. Дефицит витамина К может привести к коагулопатии и проявляется, когда ПВ становится продолжительным. В зависимости от тяжести дефицита витамин К можно вводить перорально или внутримышечно.
Урсодиол можно использовать для стимуляции оттока желчи у детей с холестазом.Неабсорбируемые ионообменные смолы (холестирамин и колестипол) можно использовать у пациентов с ПСВХ для лечения диареи. Пациенты с синдромом Алажиля и ПСВХ могут испытывать инвалидизирующий зуд. Некоторое облегчение можно получить с помощью рифампицина; однако пациентам с тяжелым зудом может потребоваться хирургическое удаление желчных путей для перенаправления потока солей желчных кислот из рециркуляции в энтерогепат. У пациентов с синдромом Алажиля часто проявляются гиперлипидемия и ксантомы, которые не реагируют на диеты с низким содержанием холестерина и насыщенных жиров.
Для пациентов с холестазом, у которых развивается терминальная стадия заболевания печени, трансплантация печени также может быть вариантом лечения.
Какие побочные эффекты связаны с каждым вариантом лечения?
Некоторые младенцы находят смеси, содержащие триглицериды со средней длиной цепи, менее вкусными, чем грудное молоко или стандартные смеси. Урсодезоксихолевая кислота может вызвать диарею или запор. Агенты, связывающие желчные кислоты, такие как холестирамин и колестипол, могут вызывать запор, диарею, гиперхлоремический ацидоз и связывание других лекарств.Избыток витамина А может привести к гепатотоксичности, псевдоопухоле мозга, поражению костей и гиперкальциемии. Избыток витамина D может привести к гиперкальциемии и образованию камней в почках. Избыток витамина E может привести к головной боли, слабости, диарее, нечеткости зрения и повышению уровня креатининкиназы.
Каковы возможные исходы холестаза?
Идиопатический неонатальный гепатит, одна из частых причин конъюгированной гипербилирубинемии, представляет собой гистологический диагноз, при котором пациенты имеют обширную гигантскую клеточную трансформацию гепатоцитов.Конъюгированная гипербилирубинемия разрешается примерно у 90% пораженных младенцев к 1 году жизни. Стойкая конъюгированная гипербилирубинемия у этих младенцев может отражать еще не выявленные клеточные дефекты метаболизма или путей транспорта субстрата.
Исход новорожденных с атрезией желчевыводящих путей определяется несколькими факторами, все из которых связаны с восстановлением оттока желчи. Возраст на момент гепатопортоэнтеростомии, вероятно, является самым важным фактором, с 80% успехом в восстановлении оттока желчи, если операция проводится на сроке менее 60 дней жизни.Напротив, только 20% успеха достигается, если операция проводится на сроке более 90 дней жизни.
Размер желчных протоков, присутствующих в воротах печени, степень цирроза печени во время операции, а также опыт и технические знания хирурга, выполняющего операцию, также влияют на результат. Если желтуха успешно проходит после гепатопортоэнтеростомии, 10-летняя выживаемость без трансплантации колеблется в пределах 75–90%; и наоборот, если желтуха сохраняется после процедуры Касаи, 3-летняя выживаемость без трансплантации составляет 20%.В конце концов, у подавляющего большинства пациентов с атрезией желчевыводящих путей заболевание прогрессирует, по крайней мере 80% из них требуют трансплантации печени к 20 годам.
Исход синдрома Алажиля во многом зависит от конкретных клинических проявлений человека. Для пациентов с заболеванием печени в младенчестве 20% -50% потребуют трансплантации печени к 20 годам. Пациенты с внутрисердечным заболеванием имеют гораздо более высокие показатели смертности, чем пациенты без внутрисердечных поражений (выживаемость 40% через 6 лет по сравнению с 95% выживаемостью через 6 лет).Дети с синдромом Алажиля также подвержены риску гепатоцеллюлярной карциномы, и их уровни альфа-фетопротеина должны проверяться ежегодно. Общая 20-летняя выживаемость пациентов с синдромом Алажиля составляет 75%. Показатели выживаемости ниже (60%) у пациентов, перенесших трансплантацию печени.
При дефиците альфа-1-антитрипсина у 8-10% пациентов проявляется клинически значимое заболевание печени в течение первых 40 лет жизни. У небольшого процента этих пациентов в младенчестве развивается терминальная стадия заболевания печени.Хотя обычно не проявляется до зрелого возраста, 60-65% пациентов будут иметь клинически значимое заболевание легких. Курение сигарет ускоряет повреждение легких и значительно увеличивает смертность от дефицита альфа-1-антитрипсина.
Что вызывает это заболевание и как часто оно встречается?
Неонатальный холестаз поражает примерно 1/2500 живорождений ежегодно. Тремя наиболее частыми причинами неонатального холестаза являются атрезия желчных путей, идиопатический неонатальный гепатит и дефицит альфа-1-антитрипсина.
Атрезия желчных путей встречается у 1/8–12 000 живорожденных, с небольшим преобладанием женского пола. Более высокая заболеваемость была описана у небелых.
Синдром Алажиля, аутосомно-доминантное заболевание, встречается примерно у 1/70000 живорождений. Эта частота может быть занижена, поскольку у некоторых больных нет холестаза новорожденных.
Дефицит альфа-1-антитрипсина, аутосомно-доминантное заболевание, затрагивает примерно 1/2000 живорожденных, при этом несколько более высокие показатели встречаются у лиц североевропейского происхождения.
Как эти патогены / гены / воздействия вызывают болезнь?
Некоторые холестатические расстройства имеют генетические ассоциации, и доступны клинические генетические исследования.
Альфа-1-антитрипсин представляет собой ингибитор сериновой протеазы, нацеленный на эластазу, катепсин G и протеиназу 3. Пациенты с нормальным фенотипом (PiMM) имеют нормальные сывороточные уровни альфа-1-антитрипсина. Однонуклеотидная замена (Lys на Glu), однако, приводит к аномально свернутому белку, который не может секретироваться из печени.Пациенты с фенотипами PiZZ и PiSZ имеют очень низкие уровни альфа-1-антитрипсина, и у 10-15% этих пациентов будет заболевание печени.
Пациенты с фенотипом PiMZ имеют промежуточные уровни альфа-1-антитрипсина без поражения печени. Однако они предрасположены к более тяжелым заболеваниям печени в сочетании с другими состояниями, такими как вирусный гепатит или муковисцидоз. Существует более 100 аллельных вариантов, не все из которых связаны с клиническим заболеванием.
Мутации в гене JAG1, который кодирует сигнальный путь Notch, выявляются более чем у 90% пациентов с синдромом Алажиля, половина из которых являются мутациями de novo.JAG1 имеет решающее значение в развитии печени, желчных протоков, сердечно-сосудистой системы и почек. Огромная клиническая изменчивость существует среди людей с одной и той же мутацией
JAG1, без выявленной корреляции генотип-фенотип.
Заболевания, вызванные ПСВХ, являются аутосомно-рецессивными и вызываются мутациями, которые влияют на канналикулярные переносчики желчных кислот. PFIC типа 1 вызывается мутациями в FIC1; ПСВС типа 2 вызывается мутациями в BSEP; а ПСВС типа 3 вызывается мутациями в MDR3.
Патогенез многих других причин холестаза, включая атрезию желчных путей, остается неизвестным.Предлагаемые теории для объяснения патогенеза атрезии желчных путей включают вирусные инфекции, аутоиммунно-опосредованное разрушение желчных протоков и аномальное развитие желчных протоков.
Другие клинические проявления, которые могут помочь в диагностике и лечении
Атрезия желчных путей — это прогрессирующее фиброоблитерирующее заболевание внепеченочного и внутрипеченочного билиарного дерева, которое приводит к циррозу печени. Младенец с классическим заболеванием выглядит здоровым и чувствует себя хорошо в возрасте 4-6 недель, только с легкой желтухой и ахолическим стулом.Эта обнадеживающая клиническая картина может отсрочить постановку диагноза атрезии желчных путей, если только клиническое подозрение не является высоким.
Менее распространенная форма атрезии желчных протоков у плода / эмбриона проявляется холестазом при рождении с высокой частотой сопутствующих пороков развития, включая асплению или полисплению, преддуоденальную воротную вену, мальротацию, обратное сидение и сердечно-сосудистые дефекты. По мере прогрессирования болезни возникают более тяжелые проявления, включая асцит, синтетическую дисфункцию печени и задержку развития.
Синдром Аладжиля или артериогепатическая дисплазия — мультисистемное заболевание. Традиционный диагноз ставится пациентам с недостаточностью желчных протоков плюс три из пяти клинических критериев, включая холестаз, сердечные аномалии (чаще всего периферический легочный стеноз), позвонки-бабочки, задний эмбриотоксон и характерные черты лица (треугольное лицо, широкий лоб, заостренный лоб). подбородок, нос продолговатый с выпуклым кончиком).
Спленомегалия может указывать на цирроз и портальную гипертензию, болезнь накопления или гемолиз.Глубокая коагулопатия, непропорциональная заранее установленному гепатоцеллюлярному повреждению, в первые дни жизни предполагает гемохроматоз новорожденного. Неврологические отклонения могут указывать на синдром Зеллвегера, митохондриальное заболевание, нарушение обмена веществ или тяжелую печеночную дисфункцию, ведущую к гипераммониемии и энцефалопатии. Катаракта и кальцификации головного мозга предполагают перинатальную инфекцию.
Какие осложнения вы можете ожидать от болезни или лечения болезни?
Отсутствие выведения билирубина и желчных кислот может привести к зуду.Снижение доставки солей желчных кислот в кишечник может привести к мальабсорбции жиров и жирорастворимых витаминов, что, в свою очередь, может привести к задержке роста и переломам костей. Гепатоцеллюлярное повреждение может привести к портальной гипертензии (с сопутствующей спленомегалией, тромбоцитопенией, асцитом и риском кровотечения из варикозно расширенных вен), циррозу и печеночной недостаточности. Кроме того, дети с холестатическими расстройствами со временем подвергаются повышенному риску гепатоцеллюлярной карциномы (ГЦК). Дети с ПСВС типа 2 подвергаются особому риску даже в первые 2 года жизни и должны проходить скрининг на ГЦК каждые 6 месяцев.
Дети с кистами холедоха подвержены повышенному риску холангиокарциномы. Восходящий холангит после гепатопортоэнтеростомии может развиться у пациентов с атрезией желчевыводящих путей, проявляющейся болью в правом верхнем квадранте живота, ухудшением желтухи, лихорадкой, ахолическим стулом и повышением уровня холестатических маркеров и уровней аминотрансфераз.
Пациенты с синдромом Алажиля часто имеют уровень холестерина выше 1000 мг / дл, при этом ксантомы обычно появляются после того, как уровень холестерина достигает 500 мг / дл.Они также могут испытывать сильный зуд, приводящий к потере трудоспособности, который мешает повседневной деятельности, сну и общему качеству жизни. Внутричерепное кровотечение из-за цереброваскулярных заболеваний, таких как аневризмы внутренней сонной артерии или болезнь моямоя, является важной причиной заболеваемости и смертности у пациентов с синдромом Алажиля.
Доступны ли дополнительные лабораторные исследования; даже те, которые не широко доступны?
Серологические тесты на специфические инфекции (поверхностный антиген гепатита B, TORCH (токсоплазмоз, другие возбудители, краснуха, цитомегаловирус, простой герпес), вирус Эпштейна-Барра, цитомегаловирус, парвовирус B19, вирус герпеса человека 6, грипп, вирус иммунодефицита человека, сифилис). используется в соответствующих клинических условиях.Аминокислоты в сыворотке и моче, органические кислоты в моче и уровни аммиака в сыворотке используются для оценки метаболических заболеваний.
Как можно предотвратить это заболевание?
Любой младенец с желтухой в возрасте 2 недель должен быть обследован на холестаз с измерением общего и прямого билирубина в сыворотке крови. Младенцы, находящиеся на грудном вскармливании, за которыми можно надежно наблюдать и у которых нет темной мочи, светлого стула или нарушения нормального развития, могут вернуться в возрасте 3 недель, и, если желтуха сохраняется, в это время можно фракционировать билирубин.
Какие доказательства?
Давенпорт, М., Стрингер, Мэриленд, Тиззард, С.А. «Рандомизированное двойное слепое плацебо-контролируемое исследование кортикостероидов после портоэнтеростомии Касаи по поводу атрезии желчных путей». Гепатология. об. 46. 2007. С. 1821-7. (Это рандомизированное плацебо-контролируемое испытание пероральных кортикостероидов после процедуры Касаи по поводу атрезии желчных путей у 73 младенцев показало большее снижение уровня билирубина через 1 месяц после процедуры у младенцев, получавших стероиды. Однако эта разница исчезла через 6 и 12 месяцев после процедуры Касаи. операция без долгосрочной пользы в отношении перехода к трансплантации.)
Davit-Spraul, A, Fabre, M, Branchereau, S. «Анализ ATP8B1 и ABCB11 у 62 детей с нормальным прогрессирующим семейным внутрипеченочным холестазом гамма-глутамилтрансферазой (PFIC): фенотипические различия между PFIC1 и PFIC2 и естественный анамнез». Гепатология. об. 51. 2010. С. 1645–55. (Это исследование с участием 62 детей с ПСВХ и нормальным уровнем GGT показало, что пациенты с ПСВХ 2 типа с большей вероятностью имеют неонатальный холестаз; более высокие уровни аминотрансферазы и альфа-фетопротеина и прогрессирование до ранней печеночной недостаточности и ГЦК по сравнению с пациентами с ПСВС типа 1 также показали, что сочетание урсодезоксихолевой кислоты, отведения желчных протоков и трансплантации печени позволило выжить 87% пациентов в среднем возрасте 10 лет.5 лет, половина с родной печенью.)
ДеРуссо, П., Йе, В., Шеперд, Р. «Нарушение роста и исходы у младенцев с атрезией желчных путей: отчет Консорциума отчетов об атрезии желчных путей». Гепатология. об. 46. 2007. pp. 1632-8. (Это многоцентровое исследование детей с атрезией желчных путей продемонстрировало плохие результаты, определяемые как трансплантация печени или смерть к 24-месячному возрасту, у 46 детей с плохим ростом после операции Касаи (оценка скорости роста и веса z) по сравнению с 54 детьми, которые не сделали этого. имеют плохой рост после процедуры Касаи.)
Emond, JC, Уайтингтон, Пенсильвания. «Избирательное хирургическое лечение прогрессирующего семейного внутрипеченочного холестаза (болезнь Байлера)». J Pediatr Surg. об. 30. 1995. pp. 1635-41. (В этом исследовании описывается использование частичного наружного отведения желчевыводящих путей в качестве первичной терапии ПСВХ у восьми детей, у шести из которых клинические симптомы полностью исчезли, а у двух пациентов с гистологическим мостовидным протезом / циррозом не наблюдалось никакого улучшения и потребовалась трансплантация печени.)
McElhinney, DB, Krantz, ID, Bason, L.«Анализ сердечно-сосудистого фенотипа и корреляции генотип-фенотип у лиц с мутацией JAG1 и / или синдромом Аладжиля». Тираж. об. 106. 2002. С. 267–74. (Это исследование показывает, что 94% (187) из 200 человек с мутацией JAG / синдромом Алажиля имели признаки сердечно-сосудистого поражения, 111 из которых имели стеноз / гипоплазию ветвей легочных артерий и 23 из которых страдали тетралогией Фалло.)
Мойер, В., Фриз, Дания, Уайтингтон, ЧП. «Руководство по оценке холестатической желтухи у младенцев: рекомендации Североамериканского общества детской гастроэнтерологии, гепатологии и питания». J Pediatr Gastroenterol Nutr. об. 39. 2004. С. 115–28. (В этом клинически важном документе представлены рекомендации по оценке холестатической желтухи, основанные на сочетании научной литературы и мнений экспертов в случаях, когда литература отсутствует.)
Сетчелл, К. Д., Сухи, Ф. Дж., Валлийский, МБ. «Дефицит дельта-4-3-оксостероид-5-бета-редуктазы описан у однояйцевых близнецов с неонатальным гепатитом. Новая врожденная ошибка синтеза желчных кислот ». J Clin Invest. об.82. 198. С. 2148-57. (В этом отчете описывается открытие того, что сейчас признано наиболее распространенной врожденной ошибкой синтеза желчной кислоты, проявляющейся как детский холестаз.)
Шнейдер, Б.Л., Браун, М.Б., Хабер, Б. «Многоцентровое исследование исходов атрезии желчных путей в США, 1997–2000 гг.». J Pediatr. об. 148. 2006. С. 467-74. (Это многоцентровое исследование 104 пациентов с атрезией желчных путей, перенесших операцию Касаи в среднем в возрасте 61 дня, показало, что выживаемость без трансплантации у пациентов с уровнем билирубина менее 2 мг / дл через 3 месяца после процедуры Касаи составила 84%. по сравнению с 16% у тех, у кого уровень билирубина оставался повышенным через 3 месяца.)
Сокол, Р.Дж., Мак, К. «Этиопатогенез атрезии желчных путей». Semin Liver Dis. об. 21. 2001. С. 517-24. (В этом обзоре обсуждаются потенциальные причины атрезии желчных путей, включая вирусные инфекции, такие как реовирус и ротавирус, иммуноопосредованное повреждение желчных протоков и аутоиммунное заболевание, с дополнительным потенциальным вкладом незрелой иммунной системы новорожденных и генетических факторов.)
Strautnieks, SS, Byrne, JA, Pawlikowska, L. «Тяжелая недостаточность экспортного насоса желчных солей: 82 различные мутации ABCB11 в 109 семьях». Гастроэнтерология. об. 134. 2008. С. 1203-14. (Это исследование выявило 82 новые мутации в 109 семьях с внутрипеченочным холестазом, свидетельствующим о ПСВХ типа 2.)
Свегер, Т., Эрикссон, С. «Печень у подростков с дефицитом альфа-1-антитрипсина». Гепатология. об. 22. 1995. С. 514-7. (В этом исследовании подробно рассказывается о долгосрочном наблюдении за 184 шведскими детьми с дефицитом альфа-1-антитрипсина, выявленным в результате скрининга. Ни у одного из этих пациентов не было клинически выраженного заболевания печени в возрасте 16-18 лет, хотя 12-15% имели аномальные результаты пробы печени.Из 22 пациентов с фенотипом PiZZ и клинически очевидным заболеванием печени в младенчестве 2 умерли в раннем детстве от цирроза и 2 умерли по не связанным причинам. Остальные дети здоровы.)
Продолжающиеся споры относительно этиологии, диагностики и лечения
Роль кортикостероидов у пациентов с атрезией желчных путей противоречива. Постулируется, что стероиды стимулируют отток желчи независимо от солей желчных кислот, обеспечивают противовоспалительный эффект и иммуномодулирующий эффект при повреждении желчных протоков.Стероиды также могут подавлять иммунную систему, увеличивая вероятность холангита. В современной медицинской литературе можно найти исследования, которые как поддерживают, так и опровергают использование стероидов при атрезии желчных путей, оставляя большинство клиницистов в противоречии. Большое многоцентровое проспективное плацебо-контролируемое исследование стероидов при атрезии желчных путей, спонсируемое Национальными институтами здравоохранения, близится к завершению и может предоставить окончательные данные для разрешения этой продолжающейся дискуссии.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Урсодезоксихолевая кислота – усиленная гепатобилиарная сцинтиграфия в оценке желтухи новорожденных
Реферат
Важна ранняя дифференциация атрезии внепеченочных желчных путей от внутрипеченочного холестаза.Гепатобилиарная сцинтиграфия — отличное неинвазивное исследование для исключения атрезии внепеченочных желчных путей. Это исследование было направлено на определение роли урсодезоксихолевой кислоты (УДХК), желчегонного средства, в сочетании с гепатобилиарной сцинтиграфией в дифференциации внепеченочной билиарной атрезии от неонатального гепатита. Методы: Пятьдесят один младенец (42 мальчика, 9 девочек) в возрасте 0,3–5,5 мес. (В среднем 2,9 мес.) С неонатальной желтухой подвергся гепатобилиарной сцинтиграфии 99 мес Tc-меброфенином.Для пациентов, у которых не было выведения индикатора в кишечник до 24 часов, исследование было повторено после перорального приема УДХК (20 мг / кг каждые 12 часов) в течение 48–72 часов. Для постановки окончательного диагноза использовались ультразвуковое исследование и, при необходимости, биопсия печени и интраоперационная холангиография с клиническими данными, такими как цвет стула, серологические и другие этиологические исследования. Результаты: Из 51 пациента у 19 в первом исследовании была выявлена экскреция желчных протоков, что исключило атрезию внепеченочных желчных путей.Последним диагнозом был неонатальный гепатит. Из оставшихся 32 пациентов 12 пациентов, не являющихся экскреторами, превратились в экскреторов после лечения УДХК, в то время как у 20 по-прежнему отсутствовал дренаж желчевыводящих путей. Четверо неэкскреторов при сцинтиграфии поставили окончательный диагноз неонатального гепатита с галактоземией; у остальных 16 была атрезия внепеченочных желчных путей. Специфичность гепатобилиарной сцинтиграфии в исключении атрезии внепеченочных желчных путей улучшилась с 54,3% до 88,6% ( P <0,001) после лечения УДХК.Ни один из пациентов не испытал каких-либо побочных эффектов от введения УДХК. Заключение: Предварительная обработка УДХК значительно улучшает специфичность гепатобилиарной сцинтиграфии в исключении внепеченочной билиарной атрезии как причины длительной желтухи новорожденных.
Ранняя дифференциация внепеченочной атрезии желчных путей от других причин неонатального холестаза важна, так как раннее хирургическое вмешательство при атрезии желчных протоков значительно улучшает исход пациентов (1–3).Гепатобилиарная сцинтиграфия — важное неинвазивное исследование при диагностике синдрома неонатального холестаза. Однако, в то время как чувствительность этого исследования для выявления атрезии желчных путей высока (близка к 100%), специфичность остается на уровне 75–80% в большинстве серий, о которых сообщалось до сих пор (4). Хотя в некоторых более мелких сериях (5,6) сообщалось о повышении точности гепатобилиарной сцинтиграфии после фенобарбитального прайминга, у значительного числа пациентов для установления окончательного диагноза все еще требовались биопсия и интраоперационная холангиография (7,8).
Урсодезоксихолевая кислота (УДХК), желчегонная, нетоксичная желчная кислота, оказалась безопасной и полезной для длительного лечения холестатических заболеваний печени у детей и для послеоперационного ведения пациентов с атрезией внепеченочных желчных путей (9–11). До сих пор УДХК использовалась в качестве первичного агента для гепатобилиарной сцинтиграфии младенцев с желтухой только в одном исследовании (12), в котором было обнаружено, что специфичность увеличивалась у небольшого числа изученных пациентов (7). Мы проспективно изучили роль УДХК в качестве первичного агента перед сцинтиграфией 99m Tc-меброфенин у большого числа детей с холестазом, чтобы оценить его способность дифференцировать атрезию желчных протоков от других причин желтухи новорожденных.
МАТЕРИАЛЫ И МЕТОДЫ
В это исследование были включеныпоследовательных младенцев с неонатальным холестазом, поступивших в отделение детской гастроэнтерологии нашего института с января по декабрь 2002 г. Исходное сцинтиграфическое исследование изначально проводилось без лекарств. Никаких седативных средств и ограничений на кормление младенцев до или в течение всего исследования не применялось. Каждый младенец сначала получил внутривенную инъекцию 37 МБк (1 мКи) 99m Tc-меброфенина.Затем были получены последовательные статические изображения для 500000 отсчетов на просмотр в течение до 6 часов на гамма-камеру с двумя головками (Ecam; Siemens) с использованием низкоэнергетического многоцелевого коллиматора, когда пациент лежал на спине. Задержанные передние и задние изображения (5 минут на просмотр) были получены через 24 часа. Боковые изображения также были получены, когда требовалось дифференцировать деятельность кишечника от почек или мочевого пузыря. Пациентам, у которых кишечная экскреция индикаторов не была обнаружена даже через 24 часа, сцинтиграфия была повторена после того, как мы дали им УДХК (UDILIV; Solve India Ltd.). УДХК вводили в дозе 20 мг / кг / сут в 2 приема (с интервалом 12 часов) в течение 48–72 часов перед вторым сканированием и продолжали до завершения второго сканирования. Все пациенты были обследованы с помощью ультразвукового исследования на предмет наличия желчного пузыря. Биопсия печени и ИОК использовались у пациентов, у которых не было обнаружено билиоэнтерического дренажа. Мы поставили окончательный диагноз, рассмотрев результаты всех этих тестов, а также клинические данные и результаты серологических и других этиологических исследований.
Это исследование было проведено после должного утверждения протокола межведомственной контрольной комиссией.
Результаты выражены как среднее ± стандартное отклонение. Для сравнения использовали критерий χ 2 и критерий Стьюдента t , при этом значение P <0,05 было принято в качестве значимого. Точность теста рассчитывалась следующим образом: точно диагностированные случаи / выполненные случаи × 100.
РЕЗУЛЬТАТЫ
51 младенец (42 мальчика, 9 девочек), средний возраст 2 года.9 мес. (Диапазон 0,3–5,5 мес.) Были изучены. У 16 человек обнаружена атрезия внепеченочных желчных путей, у 35 — гепатит новорожденных. Средний возраст младенцев с атрезией желчевыводящих путей был выше, чем у пациентов с неонатальным гепатитом (3,4 ± 1,5 против 2,5 ± 1,3, P <0,05), но соотношение мужчин и женщин было одинаковым в обеих группах (4,3: 1 по сравнению с 4,8: 1, P = статистически недостоверно). Само первоначальное сканирование показало экскрецию желчных путей у 19 пациентов, что исключило атрезию желчных путей. Этим пациентам был поставлен окончательный диагноз неонатального гепатита.Из оставшихся 32 пациентов 12 неэкскреторов превратились в экскреторов после лечения УДХК (рис. 1–3), тогда как у 20 по-прежнему не было дренажа желчевыводящих путей. Четверо неэкскреторов на гепатобилиарной сцинтиграфии с добавлением УДХК поставили окончательный диагноз неонатального гепатита с галактоземией; у остальных 16 была атрезия желчных путей. Гепатобилиарная сцинтиграфия показала значительное увеличение специфичности — с 54,3% до 88,6% ( P <0,001) - в диагностике атрезии желчных путей после лечения УДХК.Причины неонатального гепатита приведены в таблице 1. Ни один из пациентов не испытал каких-либо побочных эффектов от введения УДХК. Точность различных тестов в нашей исследуемой группе представлена в таблице 2.
РИСУНОК 1.99m Tc-Меброфенин сцинтиграфия 45-дневного младенца с желтухой новорожденных до (A) и после (B) премедикации УДХК . Дренаж индикатора в кишечник (стрелка) виден в исследовании после введения УДХК через 5 часов и позже. муравей = передний; пост = задний.
РИСУНОК 2.(A) Pre-UDCA 99m Гепатобилиарная сцинтиграфия с Tc-меброфенином у 2-месячного ребенка не выявляет кишечного клиренса метки в течение 24 часов. (B) Исследование после применения УДХК показывает очищение кишечника (стрелка) к 3 часам, которое увеличивается через 5 и 24 часа. муравей = передний; пост = задний.
РИСУНОК 3.(A) У 40-дневного младенца с тяжелой печеночной дисфункцией, исследование Tc-меброфенина до УДХК 99m показало высокую фоновую активность, при отсутствии определяемого клиренса метки в кишечник.(B) Пост-УДХК исследование того же младенца показывает, что трассер выводится в кишечник (стрелка) через 1 час. муравей = передний.
ТАБЛИЦА 1Причины неонатальной желтухи в исследуемой популяции
ТАБЛИЦА 2Точность диагностических тестов в исследуемой популяции ( n = 51)
ОБСУЖДЕНИЕ
У младенцев с конъюгированной гипербилирубинемией ультразвуковое исследование по-прежнему является первым исследовательским тестом, поскольку оно легко доступно, доступно и неинвазивно.Однако, хотя УЗИ чувствительно при обнаружении кист холедоха, оно сильно зависит от оператора. В нашем исследовании точность ультразвукового исследования была намного ниже, чем точность гепатобилиарной сцинтиграфии с добавлением УДХК. Недавние исследования показали, что признак «треугольной нити» на УЗИ специфичен для атрезии внепеченочных желчных протоков (13,14). Последовательное ультразвуковое исследование (после кормления) для оценки изменения размера желчного пузыря также было предложено в качестве диагностического метода для исключения атрезии внепеченочных желчных протоков.Некоторые исследования также предлагали дуоденальную интубацию и аспирацию желчи для определения проходимости билиоэнтерического пути. Однако эти процедуры являются инвазивными, требуют много времени и существенно не повышают точность диагностики. В сомнительных случаях по-прежнему рекомендуется биопсия или ИОК (15,16). Магнитно-резонансная холангиография (17), которая имеет лишь умеренную специфичность и точность в диагностике атрезии внепеченочных желчных путей, является дорогостоящей и труднодоступной для многих центров.Кроме того, для получения адекватного качества изображения в этой возрастной группе пациентов требуется тщательная подготовка пациента и седация.
Гепатобилиарная сцинтиграфия используется во многих центрах по всему миру для оценки функции печени и билиоэнтерального дренажа у новорожденных. Ранние сообщения, сделанные в 1980-х годах, предполагали, что сцинтиграфия 99m Tc-иминодиуксусной кислотой (IDA) после премедикации фенобарбиталом была хорошей неинвазивной процедурой для диагностики атрезии внепеченочных желчных протоков.Фенобарбитал является мощным индуктором печеночных ферментов и увеличивает конъюгацию билирубина и выведение компонентов с желчью, особенно тех, которые используют печеночную транспортную систему для органических анионов, одним из которых являются субстраты, меченные радиоактивной меткой IDA. Благодаря усилению поглощения и выведения индикатора 99m Tc-IDA пораженная печень лучше визуализируется, ее функция легче оценивается, а основная этиология желтухи новорожденных определяется более точно. В более раннем исследовании Majd et al.описали использование фенобарбитала для усиления выведения желчи. Из 16 пациентов без экскреции у 6 наблюдалось выделение через 3–6 дней приема фенобарбитала в дозе 5 мг / кг / день перорально в разделенных дозах до достижения уровня в крови 15 мг / дл. Специфичность исследования увеличилась с 68% до 94% (5).
Однако последующие исследования, проведенные различными группами, дали противоречивые данные о полезности премедикации фенобарбиталом. Герхольд и др. сообщили о 91% точности, 97% чувствительности и 82% специфичности для сцинтиграфии в диагностике внепеченочной билиарной атрезии без использования премедикации фенобарбиталом (18).Spivak et al. В небольшой группе (28 младенцев) с желтухой новорожденных продемонстрировали 100% чувствительность, но только 43% специфичность, используя только постфенобарбитальную сцинтиграфию. Они рекомендовали включить клинические критерии, такие как масса тела при рождении, для повышения специфичности исследования (19). Совсем недавно в более крупном исследовании (86 младенцев в возрасте до 4 мес.) Gilmour et al. показали улучшенную специфичность, 74%, а также предположили, что плохая экстракция индикатора из печени не является специфической для неонатального гепатита, и что хорошая экстракция печени также не исключает неонатальный гепатит (7).
С другой стороны, Ben-Haim et al. предположили, что индукция фенобарбитала может не потребоваться при использовании сцинтиграфии 99m Tc-меброфенин (метод, используемый в нашем исследовании). В их исследовании время визуализации кишечника не различается между группами пациентов с индукцией фенобарбитала и без нее (20). Gupta et al. сообщили о 36% ложноположительных результатах гепатобилиарной сцинтиграфии даже при премедикации фенобарбиталом. Интересно, что их исследование показало значительное снижение количества ложноположительных результатов с 36% до 18% при добавлении бетаметазона (2.2 мг / кг / сут в течение 7 дней) на фенобарбитал перед сцинтиграфией (21). В недавнем исследовании Charneanrad et al. Из Таиланда оценили большую группу младенцев (95, с холестазом), используя визуализацию 99m Tc-diisopropyl IDA. Сообщалось, что точность сцинтиграфии в этом исследовании составила 73% после премедикации фенобарбиталом и 100% без премедикации. Они пришли к выводу, что фенобарбитал может не потребоваться перед сцинтиграфией при оценке неонатального холестаза и что, таким образом, можно избежать задержки в диагностике и хирургическом лечении атрезии внепеченочных желчных протоков (22).Гепатобилиарную сцинтиграфию также комбинируют с уровнями гамма-глутамилтрансферазы в сыворотке для получения лучших результатов, чем с одной сцинтиграфией (23). Другие группы добавили дуоденальную аспирацию желчи или измерение количества радиоактивных веществ в дуоденальном соке в качестве дополнительных данных для повышения специфичности сцинтиграфии (15). Однако эта процедура подвергает пациента инвазивной интубации на время исследования. Поэтому большинство групп рекомендуют мультидисциплинарный подход, который включает корреляцию с клинической информацией, лабораторными данными и результатами ультразвукового исследования (визуализация желчного пузыря / признак треугольного пуповины) для повышения специфичности и точности этого исследования (24).
Эти дополнительные процедуры увеличивают время и затраты на диагностику; однако общая специфичность и точность в случае недренировочной сцинтиграфической картины остаются далекими от удовлетворительных. Специфичность диагностики внепеченочной атрезии желчных путей в таких случаях низкая, как было обнаружено в нашем исследовании, в котором специфичность составляла всего около 54%. Точность теста указывает на его эффективность для диагностики состояния. В нашем исследовании среди 3-х часто используемых тестов на желтуху новорожденных (УЗИ брюшной полости, гепатобилиарная сцинтиграфия и биопсия печени) биопсия печени была наиболее точной (100%).Биопсия печени позволила отличить атрезию внепеченочных желчных путей от гепатита новорожденных во всех случаях. В исследовании 126 младенцев с желтухой Lai et al. (15) также показали, что точность биопсии печени выше, чем точность сцинтиграфии или ультразвукового исследования. Интраоперационная холангиография (IOC) — золотой стандарт диагностики атрезии желчных путей. Однако частота отрицательных результатов лапаротомии без предоперационной биопсии печени намного выше, чем с предоперационной биопсией печени (28% vs.11%) (25). Биопсия и ИОК, как инвазивные процедуры, становятся важными в таких случаях для подтверждения диагноза (24). Среди трех часто используемых тестов при холестазе новорожденных (ультрасонография, гепатобилиарная сцинтиграфия и биопсия печени) биопсия печени является наиболее точным, но наиболее инвазивным тестом. На фоне нарушения функции печени с профилем замедленной коагуляции обе эти процедуры сопряжены со значительным риском для пациента.
УДХК представляет собой дигидроксил желчную кислоту с желчегонным действием.Он использовался в послеоперационном ведении детей с атрезией желчных путей (после портоэнтеростомии Касаи) и в течение нескольких месяцев без каких-либо побочных эффектов у детей с холестатической болезнью печени (9,10,26,27). Различные механизмы действия этой желчной кислоты включают прямую цитопротекцию, детергентное действие на дисфункциональные микротрубочки, иммуномодуляцию и индукцию гиперхолерезиса (28,29). На сегодняшний день только в 1 исследовании на небольшой группе младенцев УДХК в сочетании с меброфениновой сцинтиграфией использовалась для улучшения оттока гепатобилиарной системы у пациентов с неонатальным гепатитом и для дифференциации его от внепеченочной атрезии желчных путей (12).
Основываясь на улучшенной специфичности гепатобилиарной сцинтиграфии с УДХК, продемонстрированной этой группой, мы провели это проспективное исследование. Внутренней слабостью нашего исследования, конечно же, является то, что эффективность гепатобилиарной сцинтиграфии с УДХК не сравнивалась с эффективностью фенобарбитала в соответствии со стандартным в настоящее время протоколом. Однако наши результаты действительно демонстрируют значительно улучшенную чувствительность для выявления неонатального гепатита — то есть специфичность для исключения внепеченочной билиарной атрезии — благодаря лучшему обнаружению билиоэнтерического дренажа на сцинтиграфии 99m Tc-меброфенин после лечения УДХК.Повышение специфичности с 54,3% до 88,6% ( P <0,001) в исследовании после применения УДХК сопоставимо с результатами, описанными другими исследователями, использующими только премедикацию фенобарбиталом. Чувствительность гепатобилиарной сцинтиграфии для выявления атрезии внепеченочных желчных путей (на что указывает отсутствие экскреции индикатора) оставалась неизменной и составляла 100% как до, так и после вмешательства УДХК. Ни у одного из пациентов в нашем исследовании не было никаких побочных эффектов. Продолжительность премедикации УДХК составляла всего 2-3 дня по сравнению с 5-7 днями, которые все другие группы рекомендуют для фенобарбитала.Кроме того, полностью удалось избежать седативного действия фенобарбитала. Для этих исследований не требовалось седативных средств пациента или каких-либо других специальных мер предосторожности. Кормление разрешалось до и во время исследования, что обеспечивало более благоприятные условия как для младенцев, так и для их родителей. Используя сцинтиграфию с УДХК в нашем исследовании, мы смогли избежать инвазивных и потенциально рискованных процедур, таких как МОК, у значительного числа (12/32) пациентов.
Однако необходимо обеспечить надлежащие меры контроля качества как для подготовки радиоиндикатора, так и для получения и обработки сцинтиграфических изображений.При тяжелой дисфункции гепатоцитов 99m Tc-меброфенин выводится через почки, и при интерпретации результатов сканирования следует исключить загрязнение мочой брюшной полости. Напротив, компьютерное улучшение изображений может потребоваться для четкого определения минимального кишечного дренажа, наблюдаемого в некоторых случаях даже после вмешательства УДХК.
ЗАКЛЮЧЕНИЕ
УДХК, вводимая перорально в течение 2–3 дней до 99 мес. Сцинтиграфия Tc-меброфенина значительно улучшает специфичность этого исследования для исключения внепеченочной атрезии желчных протоков и помогает избежать ненужной лапаротомии у значительного числа младенцев с желтухой.Тем не менее, проспективное рандомизированное перекрестное исследование фенобарбитала и УДХК было бы полезно для сравнения повышающей эффективности этих двух препаратов с гепатобилиарной сцинтиграфией.
Благодарности
Авторы выражают благодарность Мадану Пармару за техническую помощь в получении и обработке сцинтиграфических данных.
Сноски
Поступила 6 ноября 2003 г .; исправление принято 12 марта 2004 г.
Для переписки или перепечатки обращайтесь: Аниш Бхаттачарья, DNB, Департамент ядерной медицины, PGIMER, Чандигарх, 160 012, Индия.
Эл. Почта: shalmoli {at} glide.net.in
ССЫЛКИ
- ↵
Mieli-Vergani G, Howard ER, Portman B, et al. Позднее направление по поводу атрезии желчных путей: упущенные возможности для эффективного хирургического вмешательства. Ланцет. 1989. 1 (8635): 421–423.
Мияно Т., Фудзимото Т., Охя Т. и др. Современная концепция лечения атрезии желчных путей. World J Surg. 1993. 17: 332–336.
- ↵
Луго Висенте HL.Атрезия желчных путей: обзор. Бол Асок Мед П. Р. 1995; 87: 147–153.
- ↵
Надель HR. Гепатобилиарная сцинтиграфия у детей. Semin Nucl Med. 1996; 26: 25–42.
- ↵
Majd M, Reba RC, Altman RP. Влияние фенобарбитала на сцинтиграфию 99m Tc-IDA при оценке желтухи новорожденных. Semin Nucl Med. 1981; 11: 194–204.
- ↵
Salvatori M, Valenza V, De Franco A, et al.Гепатобилиарная сцинтиграфия в исследовании холестаза печени новорожденных. Радиол Мед (Турин). 1989. 78: 638–644.
- ↵
Гилмор С.М., Хершкоп М., Райфен Р. и др. Исход гепатобилиарного сканирования при синдроме неонатального гепатита. J Nucl Med. 1997; 38: 1279–1282.
- ↵
Burton EM, Babcock DS, Heubi JE, et al. Желтуха новорожденных: клинические и ультразвуковые данные. Саут Мед Дж. 1990; 83: 294–302.
- ↵
Кардорф Р., Мелтер М., Родек Б. и др. Длительное лечение холестатических заболеваний печени в детстве урсодезоксихолевой кислотой: клинические и биохимические эффекты [на немецком языке]. Клин Падиатр. 1996. 208: 118–122.
- ↵
Dinler G, Kocak N, Yuce A, et al. Терапия урсодезоксихолевой кислотой у детей с холестатической болезнью печени. Turk J Pediatr. 1999; 41: 91–98.
- ↵
Левин А., Мааян А., Шамир Р. и др.Холестаз, связанный с парентеральным питанием, у недоношенных новорожденных: оценка лечения урсодезоксихолевой кислотой. J Pediatr Endocrinol Metab. 1999; 12: 549–553.
- ↵
Johnson K, Alton HM, Chapman S. Оценка меброфениновой гепатосцинтиграфии при желтухе новорожденных. Pediatr Radiol. 1998; 28: 937–941.
- ↵
Котб М.А., Котб А., Шиба М.Ф. и др. Оценка признака треугольного канатика при диагностике атрезии желчных путей.Педиатрия. 2001; 108: 416–420.
- ↵
Park WH, Choi SO, Lee HJ. Ультрасонографический «треугольный шнур» в сочетании с изображениями желчного пузыря в диагностическом прогнозе атрезии желчных путей от инфантильного внутрипеченочного холестаза. J Pediatr Surg. 1999; 34: 1706–1710.
- ↵
Lai MW, Chang MH, Hsu SC и др. Дифференциальный диагноз атрезии внепеченочных желчных протоков от гепатита новорожденных: проспективное исследование.J Pediatr Gastroenterol Nutr. 1994. 18: 121–127.
- ↵
Ларроса-Аро А., Каро-Лопес А.М., Коэльо-Рамирес П. и др. Проба двенадцатиперстной кишки в диагностике атрезии желчных путей. J Pediatr Gastroenterol Nutr. 2001. 32: 311–315.
- ↵
Нортон К.И., Гласс Р.Б., Коган Д. и др. МР-холангиография в оценке холестаза новорожденных: первые результаты. Радиология. 2002; 222: 687–691.
- ↵
Gerhold JP, Klingensmith WC, Kuni CC, et al.Диагностика атрезии желчных путей с помощью радионуклидной гепатобилиарной визуализации. Радиология. 1983; 146: 499–504.
- ↵
Спивак В., Саркар С., Винтер Д. и др. Диагностическая ценность гепатобилиарной сцинтиграфии с Tc99m DISIDA при холестазе новорожденных. J Pediatr. 1987; 110: 855–861.
- ↵
Бен-Хаим С., Сиболд Дж. Э., Као С. К. и др. Применение сцинтиграфии Tc99m-меброфенина в оценке желтухи новорожденных.Clin Nucl Med. 1995; 20: 153–163.
- ↵
Гупта Д.К., Чарльз А.Р., Шринивас М. и др. Бетаметазон в сочетании с фенобарбитоном перед гепатобилиарной сцинтиграфией повышает диагностическую точность у младенцев с желтухой. Индийский J Pediatr. 2001; 68: 1039–1041.
- ↵
Charearnrad P, Chongsrisawat V, Tepmongkol S, et al. Влияние фенобарбитала на точность гепатобилиарной сцинтиграфии с технецием-99m диизопропилиминодиуксусной кислотой при дифференциации атрезии желчных путей от синдрома неонатального гепатита.J Med Assoc Thai. 2003; 86 (приложение 2): S189 – S194.
- ↵
Арора Н.К., Кохли Р., Гупта Д.К. и др. Сканирование печеночного технеция-99m-меброфенина иминодиацетата и уровни гамма-глутамилтранспептидазы в сыворотке, интерпретированные последовательно для дифференциации атрезии внепеченочных желчных путей и неонатального гепатита. Acta Paediatr. 2001; 90: 975–981.
- ↵
Choi SO, Park WH, Lee HJ. Ультрасонографический «треугольный шнур»: наиболее точный результат для неинвазивной диагностики атрезии внепеченочных желчных протоков.Eur J Pediatr Surg. 1998; 8: 12–16.
- ↵
Яча СК. Консенсус по синдрому неонатального холестаза. Indian Pediatr. 2000; 37: 845–851.
- ↵
Stiehl A. Желчные кислоты при заболеваниях печени: современные показания [на немецком языке]. Ther Umsch. 1995. 52: 682–686.
- ↵
Nittono H, Tokita A, Hayashi M и др. Терапия урсодезоксихолевой кислотой в лечении атрезии желчных путей.Biomed Pharmacother. 1989. 43: 37–41.
- ↵
Джафри С., Пасрича П. Средства, используемые при диарее, запоре и воспалительных заболеваниях кишечника; средства, применяемые при заболеваниях желчевыводящих путей и поджелудочной железы. В: Hardman JG, Limberd LE, ред. Гудман и Гилман «Фармакологические основы терапии». 10-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 2001: 1037–1055.
- ↵
Альтман Д.Ф. Лекарства, применяемые при желудочно-кишечных заболеваниях.В: Кацунг Б.Г., изд. Фундаментальная и клиническая фармакология. 8-е изд. Нью-Йорк, штат Нью-Йорк: Lange Medical Books / McGraw-Hill; 2001: 1064–1075.
% PDF-1.4 % 54 0 obj> endobj xref 54 74 0000000016 00000 н. 0000002489 00000 н. 0000002582 00000 н. 0000002623 00000 н. 0000002897 00000 н. 0000003248 00000 н. 0000003447 00000 н. 0000003693 00000 н. 0000003794 00000 н. 0000003893 00000 п. 0000003947 00000 н. 0000004137 00000 п. 0000004637 00000 н. 0000004892 00000 н. 0000004990 00000 н. 0000005257 00000 н. 0000005357 00000 п. 0000010186 00000 п. 0000014547 00000 п. 0000018717 00000 п. 0000022955 00000 п. 0000027230 00000 н. 0000027361 00000 п. 0000027650 00000 п. 0000028004 00000 п. 0000028277 00000 п. 0000028977 00000 п. 0000029377 00000 п. 0000029670 00000 п. 0000030335 00000 п. 0000031002 00000 п. 0000031546 00000 п. 0000031916 00000 п. 0000032226 00000 п. 0000032523 00000 п. 0000036715 00000 п. 0000037117 00000 п. 0000037237 00000 п. 0000037701 00000 п. 0000037753 00000 п. 0000038407 00000 п. 0000038751 00000 п. 0000044248 00000 п. 0000049418 00000 п. 0000050343 00000 п. 0000052634 00000 п. 0000052864 00000 п. 0000056004 00000 п. 0000066967 00000 п. 0000071250 00000 п. 0000074562 00000 п. 0000075143 00000 п. 0000075340 00000 п.




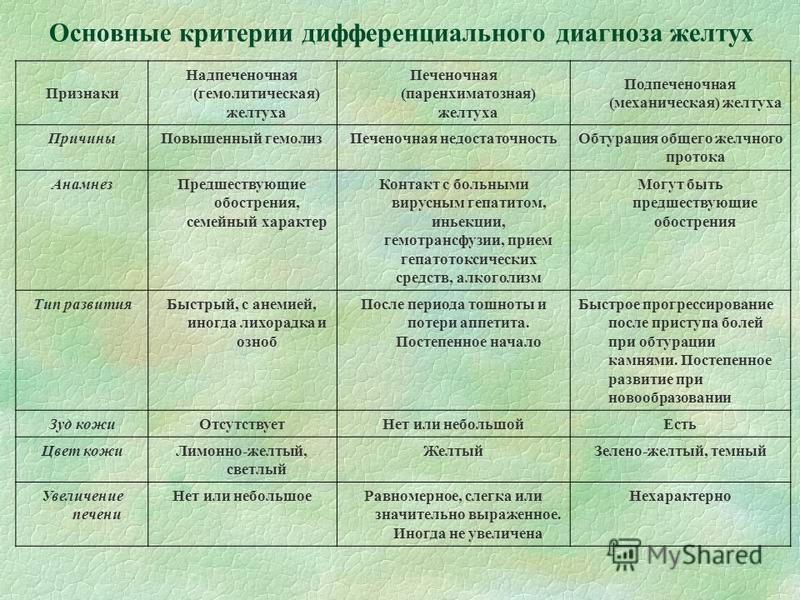 Для этого можно курсами пропивать отвары расторопши, люцерны или корней одуванчиков.
Для этого можно курсами пропивать отвары расторопши, люцерны или корней одуванчиков.

 Но если глюкозы все же недостаточно, то ее восполнение происходит при помощи внутривенных вливаний, зонда или раствором в бутылочке. На распад и выведение билирубина глюкоза влияет незначительно. Поэтому применяется в качестве общеукрепляющей терапии. Часто принимается в комплексе с витаминами.
Но если глюкозы все же недостаточно, то ее восполнение происходит при помощи внутривенных вливаний, зонда или раствором в бутылочке. На распад и выведение билирубина глюкоза влияет незначительно. Поэтому применяется в качестве общеукрепляющей терапии. Часто принимается в комплексе с витаминами.