Холера — Причины и патогенез
Причины холеры
Причина холеры — Vibrio cholerae относится к роду Vibrio семейства Vibrionaceae.
Холерный вибрион представлен двумя биоварами, сходными по морфологическим и тинкториальным свойствам (биовар собственно холеры и биовар Эль-Тор).
Возбудителями холеры являются вибрионы серогрупп 01 и 0139 вида Vibrio cholerae, который относится к роду Vibrio, семейства Vibrionaceae. Внутри вида Vibrio cholerae различают два основных биовара — biovar cholerae classic, открытый Р. Кохом в 1883 г., и biovar El Tor, выделенный в 1906 г. в Египте на карантинной станции Эль Тор Ф. и Е. Готшлихами.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Культуральные свойства
Вибрионы являются факультативными анаэробами, но предпочитают аэробные условия роста, поэтому на поверхности жидкой питательной среды образуют пленку. Оптимальная температура роста 37 °С при рН 8,5-9,0.
[11], [12], [13], [14], [15], [16]
Биохимические свойства
Возбудители холеры биохимически активны и оксидазопозитивны, обладают протеолитическими и сахаролити-ческими свойствами: продуцируют индол, лизиндекарбоксилазу. разжижают в воронковидной форме желатину, не продуцируют сероводород. Ферментируют глюкозу, маннозу, сахарозу лактозу (медленно), крахмал, не сбраживают рамнозу, арабийозу, дульцит, инозит, инулин. Обладают нитратредуктазной активностью.
Холерные вибрионы различаются по чувствительности к бактериофагам.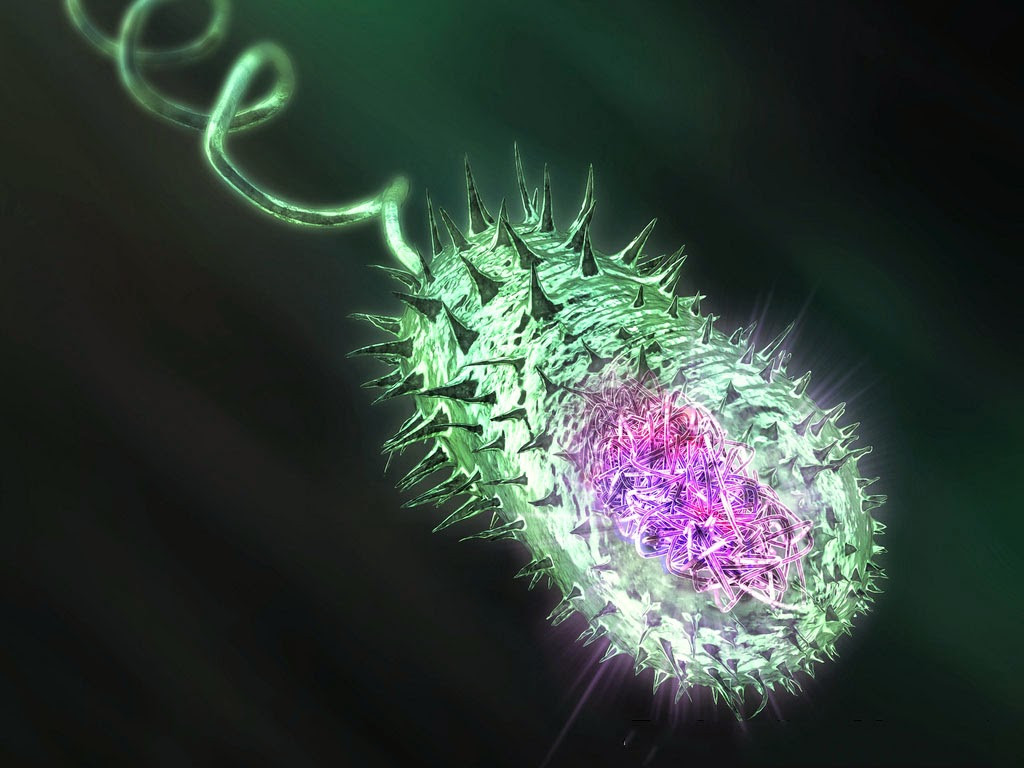
[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27]
Антигенная структура
Холерные вибрионы обладают О- и Н-антигенами. В зависимости от строения О-антигена различают более 150 серогрупп, среди которых возбудителями холеры являются серогруппы 01 и 0139. Внутри серогруппы 01 в зависимости от сочетания А-, В- и С- субъединиц происходит подразделение на серовары: Огава (АВ), Инаба (АС) и Гикошима (ABC).
[28], [29], [30], [31], [32], [33], [34], [35]
Отношение к факторам окружающей среды
Возбудители холеры чувствительны к УФ, высушиванию, дезинфектантам (за исключением четвертичных аминов), кислым значениям рН, нагреванию. Возбудители холеры, особенно биовар Эль-Тор, способны к существованию в воде в симбиозе с гидробионтами, водорослями, в неблагоприятных условиях могут переходить в некультивируемую форму. Эти свойства позволяют отнести холеру к антропосапронозным инфекциям.
[36], [37], [38], [39], [40], [41]
Факторы патогенности
Геном V. cholerae
состоит из двух циркулярных хромосом: большой и малой. Все гены, необходимые для жизнедеятельности и реализации патогенного начала, локализованы на большой хромосоме. Малая хромосома содержит интегрон, который захватывает и экспрессирует кассеты антибиотикорезистентности.
Главным фактором патогенности является холерный энтеротоксин (СТ). Ген, опосредующий синтез этого токсина, локализован в кассете токсигенности, расположенной на геноме нитчатого бактериофага СТХ. Вдобавок к гену энтеротоксина на этой же кассете находятся гены zot и асе. Продуктом гена zot является токсин, (zonula occludens toxin), а ген асе детерминирует синтез добавочного энтеротоксина (accessory cholerae enterotoxin). Оба эти токсина принимают участие в увеличении проницаемости стенки кишечника. На геноме фага находится также ген сер-адгезина и последовательность RS2, кодирующая репликацию фага и его интеграцию в хромосому.
Рецептором для фага СТХ являются токсинкорегулируемые пили (Тер). Они являются пилями 4 типа, которые, помимо того, что являются рецепторами для фага СТХ, необходимы для колонизации микроворсинок тонкого кишечника, а также принимают участие в образовании биопленки, в частности на поверхности панциря гидробионтов.
Тер координированно экспрессируются с геном СТ. На большой хромосоме также находится ген пап, определяющий синтез нейраминидазы, способствующей реализации действия токсина, и ген hap, определяющий синтез растворимой гемаллютининпротеазы, которая играет важную роль в выведении возбудителя из кишечника во внешнюю среду в результате ее деструктивного действия на рецепторы кишечного эпителия, ассоциированные с вибрионами.
Колонизация тонкого кишечника, осуществляемая токсинкорегулируемыми пилями, создает плацдарм для действия холерного энтеротоксина, который представляет белок с молекулярной массой 84000D, состоящий из 1 субъединицы А и 5 субъединиц В. Субъединица А состоит из двух полипептидных цепочек А1 и А2, связанных между собой дисульфидными мостиками. В субъединичном комплексе В пять одинаковых полипептидов соединены друг с другом нековалентной связью в виде кольца. В-субъединичный комплекс ответственен за связывание всей молекулы токсина с клеточным рецептором — моносиаловым ганглиозидом GM1, которым очень богаты эпителиальные клетки слизистой тонкой кишки. Для того чтобы субъединичный комплекс мог взаимодействовать с GM1, от него должна быть отщеплена сиаловая кислота, что осуществляется ферментом нейраминидазой, которая способствует реализации действия токсина. Субъединичный комплекс В после прикрепления к 5-ти ганглиозидам на мембране кишечного эпителия меняет свою конфигурацию так, что позволяет А1 отсоединиться от комплекса А1В5 и проникнуть в клетку. Проникнув в клетку, А1 пептид активирует аденилатциклазу. Это происходит в результате взаимодействия AI с НАД, следствием чего является образование АДФ-рибозы, которая переносится на ГТФ-связывающий белок регуляторной субъединицы аденилатциклазы. В результате происходит ингибиция функционально необходимого гидролиза ГТФ, приводящая к накоплению ГТФ в регуляторной субъединице аденилатциклазы, определяя активное состояние фермента, и как следствие — усиление синтеза ц-АМФ. Под влиянием Ц-АМФ в кишечнике изменяется активный транспорт ионов. В области крипт эпителиоцитами усиленно выделяются ионы С1-, а в области ворсинок затрудняется всасывание Na+ и Сl-, что составляет осмотическую основу для выделения в Просвет кишечника воды.
Для того чтобы субъединичный комплекс мог взаимодействовать с GM1, от него должна быть отщеплена сиаловая кислота, что осуществляется ферментом нейраминидазой, которая способствует реализации действия токсина. Субъединичный комплекс В после прикрепления к 5-ти ганглиозидам на мембране кишечного эпителия меняет свою конфигурацию так, что позволяет А1 отсоединиться от комплекса А1В5 и проникнуть в клетку. Проникнув в клетку, А1 пептид активирует аденилатциклазу. Это происходит в результате взаимодействия AI с НАД, следствием чего является образование АДФ-рибозы, которая переносится на ГТФ-связывающий белок регуляторной субъединицы аденилатциклазы. В результате происходит ингибиция функционально необходимого гидролиза ГТФ, приводящая к накоплению ГТФ в регуляторной субъединице аденилатциклазы, определяя активное состояние фермента, и как следствие — усиление синтеза ц-АМФ. Под влиянием Ц-АМФ в кишечнике изменяется активный транспорт ионов. В области крипт эпителиоцитами усиленно выделяются ионы С1-, а в области ворсинок затрудняется всасывание Na+ и Сl-, что составляет осмотическую основу для выделения в Просвет кишечника воды.
Холерные вибрионы хорошо выживают при низкой температуре; во льду сохраняются до 1 мес. в морской воде — до 47 сут, в речной воде — от 3-5 дней до нескольких недель, в почве — от 8 дней до 3 мес, в испражнениях — до 3 сут, на сырых овощах — 2-4 дня. на фруктах — 1-2 дня. Холерные вибрионы при 80 °С погибают через 5 мин, при 100 °С — моментально; высокочувствительны к кислотам, высушиванию и действию прямых солнечных лучей, под действием хлорамина и других дезинфектантов погибают через 5-15 мин, хорошо и долго сохраняются и даже размножаются в открытых водоёмах и сточных водах, богатых органическими веществами.
Холера – возбудитель, симптомы, лечение, профилактика
Интересный факт:Три четверти видов бактерий, живущих в кишечнике человека, еще не открыты.
Человеческий мозг активен во сне, как во время бодрствования. Ночью мозг перерабатывает и объединяет опыт дня, решает что запомнить, а что забыть.
По мнению калифорнийских ученых, люди, съедающие в неделю хотя бы 5 грецких орехов, в среднем по статистике живут на 7 лет дольше.
Глаз человека настолько чувствителен, что если бы Земля была плоской, человек мог бы заметить мерцающую в ночи свечу на расстоянии в 30 км.
Суммарное расстояние, которое преодолевает кровь в организме за сутки, составляет 97000 км.
Печень наиболее эффективно разлагает алкоголь между 18 и 20 часами.
Только люди и собаки могут болеть простатитом.
Самый тяжелый орган человека — кожа. У взрослого человека среднего телосложения она весит около 2,7 кг.
«Виагра» была изобретена случайно в процессе разработки лекарства для лечения сердечных заболеваний.
Диабет перестал быть смертельной болезнью только в 1922 году, когда двумя канадскими учеными был открыт инсулин.
В головном мозге человека за одну секунду происходит 100 000 химических реакций.
Самое распространенное инфекционное заболевание в мире — это зубной кариес.
Младенцы рождаются с 300 костями, но к взрослой жизни это число сокращается до 206.
Пиявок ставили еще египетские фараоны, в древнем Египте исследователи нашли высеченные на камнях изображения пиявок, а также сцен лечения ими.
В 2002 году румынские хирурги установили новый медицинский рекорд, удалив из желчного пузыря пациента 831 камень.
Статьи о здоровье
Холера – острое инфекционное заболевание, вызываемое холерными вибрионами, характеризующееся фекально-оральным механизмом передачи и протекающее с развитием деминерализации и дегидратации различной степени тяжести.
В этой статье речь пойдет о путях заражения и возбудителе холеры, симптомах заболевания, а также о современных методах диагностики холеры. Также в статье рассказывается о мероприятиях по профилактике холеры и способах лечения данной болезни.
Природа возникновения заболевания
Заболевание относится к числу карантинных инфекций ввиду способности к пандемическому распространению. В развитых странах встречается крайне редко, но возбудитель холеры довольно часто встречается в странах Африки, Южной и Юго-восточной Азии, Южной Америки.
Возбудитель холеры – холерный вибрион Vibrio cholerae, устойчивый к низким температурам и сохраняющий жизнеспособность в открытых водоемах на протяжении нескольких месяцев.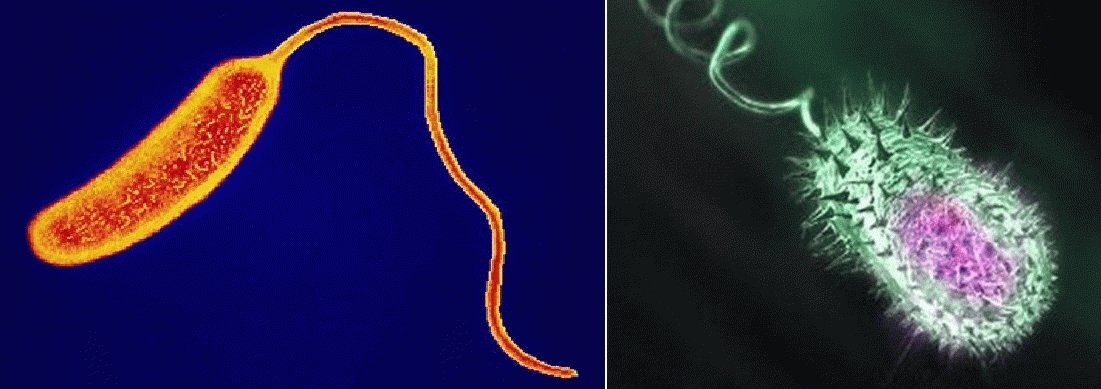 Во внешней среде и на пищевых продуктах возбудитель холеры выживает в течение 3-5 дней, а воздействие прямых солнечных лучей сокращает его жизненный цикл до 8-10 часов. Холерный вибрион погибает при кипячении и под воздействием различных средств дезинфекции, высокочувствителен к высушиванию, хлорсодержащим препаратам и кислой среде. Поэтому различные дезинфицирующие средства или кипячение нередко используются как меры профилактики холеры.
Во внешней среде и на пищевых продуктах возбудитель холеры выживает в течение 3-5 дней, а воздействие прямых солнечных лучей сокращает его жизненный цикл до 8-10 часов. Холерный вибрион погибает при кипячении и под воздействием различных средств дезинфекции, высокочувствителен к высушиванию, хлорсодержащим препаратам и кислой среде. Поэтому различные дезинфицирующие средства или кипячение нередко используются как меры профилактики холеры.
Источник возбудителя холеры – это всегда больной человек или бациллоноситель (человек, побывавший в неблагоприятном по холере регионе). Заражение происходит фекально-оральным путем. В неблагоприятных регионах большинство эпидемий напрямую связано с употреблением загрязненной бактериями воды. В быту возбудитель холеры нередко напрямую попадает в воду и на пищу с инфицированными рвотными массами и калом, которые при холере не имеют окраски и специфического запаха, не вызывают брезгливости у окружающих, чем и создают иллюзию безопасности. Поэтому, хотя и случаи передачи заболевания от человека к человеку крайне редки, каждому, кто находился в контакте с больным, в целях профилактики холеры следует придерживаться строгих правил личной гигиены.
Различают пищевые, водные, контактно-бытовые и смешанные эпидемии холеры. Восприимчивость человека к возбудителю холеры очень высока, но современные методы диагностики холеры позволяют выявить заболевание достаточно быстро и предотвратить развитие эпидемии.
Холера – возбудитель, симптомы, профилактика и диагностика
В статье речь пойдет о холере, возбудитель которой довольно стоек в окружающей среде. Это болезнь, известная человечеству достаточно давно. Причины ее появления были выявлены лишь недавно, чего не скажешь о существовании самого возбудителя. Чума, сибирская язва и холера относятся к особо опасным заболеваниям, которые отличаются высокой контагиозностью, тяжелым течением и высокой смертностью. Сегодня именно они являются основой для создания биологического оружия. И хотя современная статистика не дает оснований для беспокойства, минимальные знания об опасных болезнях и их возбудителях могут быть полезны.
Исторический очерк
Человечество на разных периодах своего существования переносило пандемии холеры. Об этом заболевании писал еще Гиппократ (460 год до нашей эры). Именно ему мы обязаны названием болезни – от древнегреческого слова «холе», что означает желчь. Врачи Александра Македонского (365-323 гг. до н. э.) описывали эту болезнь как бедствие, настигнувшее войска в его походе в Индию. Есть теория, что именно холера заставила великого полководца отказаться от своих планов и повернуть назад. До начала 19-го века болезнь была распространена в южной части Азии и Индии. С 1817 по 1975 год мир перенес семь пандемий холеры, которые унесли жизней больше, чем вспышки любой другой болезни.
Об этом заболевании писал еще Гиппократ (460 год до нашей эры). Именно ему мы обязаны названием болезни – от древнегреческого слова «холе», что означает желчь. Врачи Александра Македонского (365-323 гг. до н. э.) описывали эту болезнь как бедствие, настигнувшее войска в его походе в Индию. Есть теория, что именно холера заставила великого полководца отказаться от своих планов и повернуть назад. До начала 19-го века болезнь была распространена в южной части Азии и Индии. С 1817 по 1975 год мир перенес семь пандемий холеры, которые унесли жизней больше, чем вспышки любой другой болезни.
Именно с середины 19-го века начались масштабные исследования по определению возбудителя холеры. В Европу инфекция прорвалась с войнами и по торговым путям из Азии и Египта. Именно в Египет отправилась в 1881 году исследовательская экспедиция, в которую входил известный бактериолог Роберт Кох (1843-1910). Именно им были открыты возбудители холеры и туберкулеза (вибрионы и палочки Коха). Робертом Кохом были разработаны и первые профилактические рекомендации в отношении данного заболевания.
В соответствии с перечнем Всемирной организации здравоохранения, бактерии-возбудители чумы и холеры, а также сибирской язвы, отнесены к патогенам, вызывающим особо опасные заболевания.
Пандемии холеры
Первая пандемия началась в 1816-м в республике Бангладеш. Тысячи британских военных, миллионы индийцев и сто тысяч жителей острова Ява стали жертвами холеры. В России в 19-м веке холера отметилась «холерными бунтами». Затем она начала свое шествие во Франции, Германии, Великобритании, в каждой стране оставив после себя до 60 тысяч трупов. Попав в США и Канаду, она убила около 250 тысяч жителей.
Последняя пандемия была объявлена в 1962 году. Именно тогда на сцене появился вибрион Эль-Тор. К 1970 году пандемия охватила 39 стран. Она унесла жизни более 40 тысяч человек.
Мировая эпидемиологическая ситуация оставляет определенную настороженность. Так, эпидемия холеры в Японии в июне 1977 года распространилась уже к августу на Ближнем Востоке. Она стала самой большой эпидемией в данном регионе за предыдущие 20 лет. За один месяц холера охватила Сирию, Иорданию, Иран и еще 10 ближневосточных государств.
Рыцари борьбы с холерой
Как уже говорилось, Роберт Кох в 1883 году подробно описал холерный вибрион и симптомы болезни. В том же году будущий лауреат Нобелевской премии по исследованию иммунитета Илья Ильич Мечников (1845-1916) добровольно принял культуру холерного вибриона, чтобы на собственном опыте изучить течение болезни. Удивительно, но он не только выздоровел, но и после болезни у него улучшилось зрение и характер.
Однако звание первооткрывателя вакцины от холеры принадлежит бактериологу Николаю Федоровичу Гамалею (1859-1949), который работал в Одесском центре борьбы с бешенством. Свою вакцину он опробовал на себе и своей супруге. Его исследования продолжил ученик Владимир Аронович Хавкин (1860-1930), также проводивший апробацию своей вакцины на себе. Именно их вакцины оказались наиболее удачными «антихолерными противоядиями».
Бактерии или вирусы?
Возбудителями холеры являются холерные вибрионы (Vibrio cholerae) – грамотрицательные анаэробные бактерии. Вибрион имеет форму изогнутой палочки и снабжен жгутиком. Возбудитель холеры, микробиология которого изучена довольно хорошо, обладает геномом из двух хромосом и размножается в планктоне пресных и соленых водоемов. Известно более 150 серотипов холерного вибриона. Каждый серотип возбудителя холеры относится к условно-патогенным организмам и отличается по соматическому антигену. В зависимости от серотипа и пути попадания инфекции в организм, отличается и течение ее болезни. Но только два серотипа вызывают симптомы недуга.
«Классическая» холера вызывается вибрионом серогруппы О1, в которой выделяют два биотипа – классический (Vibrio cholerae biovar cholerae) и Эль-Тор (Vibrio cholerae biovar eltor). В 1993 году в Юго-Восточной Азии вспышка холеры была вызвана ранее неизвестным вибрионом, который назван Бенгал (серотип 0139). Эти данные говорят о возможной мутации вибриона холеры. Остальные серотипы холерного вибриона не вызывают заболевания у человека. Они часто обнаруживаются в открытых водоемах и называются холероподобными или псевдохолерными. Некоторые являются возбудителями болезней животных и единичных холероподобных заболеваний человека.
Бактерия-возбудитель холеры устойчива при темпе
Глава 25. Возбудители холеры
⇐ ПредыдущаяСтр 34 из 59Следующая ⇒
Вид Vibrio cholerae относится к семейству Vibrionaceae, роду Vibrio.
Возбудители холеры представлены двумя биоварами. Биовар V. cholerae выделен и изучен Р. Кохом (1883) и биовар eltor выделен Ф. Готшлихтом (1906). В течение длительного времени биовар Эль-Тор не считали возбудителем холеры. В 1962 г. по решению ВОЗ он был признан биоваром вибриона холеры.
В последнее время из воды и других объектов внешней среды выделены НАГ-вибрионы, которые еще не получили окончательного наименования, но их роль в острых кишечных заболеваниях установлена. Природа НАГвибрионов изучается. По морфологическим, культуральным и ферментативным свойствам они не отличаются от холерных вибрионов, имеют с ними общий Н-антиген. О-антигены у них разные. По О-антигену установлен 60 О-групп НАГ-вибрионов.
Морфология. Холерные вибрионы — небольшие (1-3 × 0,2-0,4 мкм) слегка изогнутые палочки, имеют вид запятой, очень полиморфны. На искусственных питательных средах, особенно в старых культурах, они могут иметь вид шаров, зерен, нитей, спиралей. Холерные вибрионы очень подвижны. Монотрихи — жгутик в несколько раз превышает длину клетки. Спор и капсул не образуют. Грамотрицательны. В окрашенных мазках располагаются в виде стаи рыб (см. рис. 51). При электронной микроскопии установлено, что между стенкой и цитоплазмой находятся вакуоли. Считают, что в этих вакуолях синтезируется экзотоксин.
Культивирование. Холерные вибрионы — факультативные анаэробы. К питательным средам неприхотливы. Щелочелюбивы. Размножаются при температуре 37-39° С и рН 8-9. Хорошо растут на МПА и МПБ. Элективной средой является щелочная 1% пептонная вода. На поверхности этой среды они образуют нежную голубоватую пленку. На плотной среде TBRS (тиосульфатцитратсахарозный агар с добавлением солей желчи) образуются колонии желтого цвета на фоне голубоватой среды. Размножаются быстро: в жидких питательных средах 6-8 ч, на плотных — 12-14 ч (на щелочных средах рост холерных вибрионов опережает рост других бактерий). Холерные вибрионы диссоциируют из S- в R-форму. Этот процесс сопровождается изменением антигенной структуры.
Ферментативные свойства. Холерные вибрионы биохимически активны. Они обладают сахаролитическими, протеолитическими и диастатическими свойствами. Сахаролитические свойства выражаются в расщеплении Сахаров до образования кислоты. Ферментация глюкозы, сахарозы, маннита, маннозы и отсутствие ферментации арабинозы являются важным диагностическим признаком. Протеолитические свойства: холерные вибрионы разжижают желатин, разлагают триптофан до образования индола, продуцируют оксидазу, восстанавливают нитраты в нитриты, свертывают молоко. Сероводород не образуют. Диастатические свойства выражаются в расщеплении растворимого крахмала.
Холерный вибрион продуцирует ферменты патогенности: фибринолизин, плазмокоагулазу, гиалуронидазу, лецитиназу, коллагеназу и др.
Токсинообразование. Холерные вибрионы продуцируют токсины трех типов. Токсин I типа — эндотоксин, выделяется при разрушении микробной клетки, термостабилен (липополисахарид). Считают, что он способствует развитию антибактериального иммунитета. Токсин И типа — экзотоксин (холероген) термолабилен, обладает энтеротоксическим действием и играет важную роль в патогенезе холеры (усиливает функцию секреторных клеток тонкого кишечника, что приводит к обезвоживанию организма). Токсин III типа термостабилен, считают, что он подавляет активный транспорт натрия через эпителий кишечника.
Антигенная структура. Холерные вибрионы имеют термостабильный соматический О-антиген и термолабильный Н-антиген. Н-антиген не специфический и является общим для всего рода Vibrio. О-антиген обладает видовой и типовой специфичностью. По О-антигену холерные вибрионы делят на 54 группы. Vibrio cholerae и Vibrio eltor относятся к О1 группе. Внутри О1 группы различают три компонента — А, В, С, по сочетанию которых выделяют три серовара. Сочетание АВ — серовар Огава, сочетание АС — серовар Инаба, сочетание ABC — серовар Гикокшима.
Устойчивость к факторам окружающей среды. При температуре 60° С холерные вибрионы погибают в течение 5 мин, при кипячении — мгновенно. Низкие температуры они переносят хорошо. Во льду сохраняются несколько месяцев, в морской и речной воде — несколько недель, в кишечнике мух — 4-5 дней. К высушиванию и солнечному свету холерные вибрионы очень чувствительны. Общепринятые концентрации дезинфицирующих веществ убивают их быстро. Однако при работе с возбудителем холеры пользуются дезинфицирующими растворами большей концентрации. Холерные вибрионы чувствительны к кислотам (хлороводородной кислоте и др.). Вибрион холеры Эль-Тор более устойчив.
Восприимчивость животных. В естественных условиях животные не болеют холерой. В экспериментальных условиях внутрибрюшинное введение холерных вибрионов кроликам и морским свинкам сопровождается выраженным токсикозом, который приводит их к гибели.
Источники инфекции и пути передачи. Единственным источником холеры является человек, который выделяет вибрион холеры во внешнюю среду в период заболевания либо носительства. При холере, вызванной вибрионом Эль-Тор, отмечается длительное носительство. Заражение человека происходит через продукты (овощи, фрукты), воду и другие объекты внешней среды.
Холера — это давно известная инфекция, которая периодически распространялась на многие страны и континенты и вызывала гибель миллионов людей. Известны несколько пандемий холеры. В 1917-1926 гг. было зарегистрировано 6 пандемий холеры. Эти пандемии вызывались классическим вибрионом Коха. В 60-х годах XX века начал распространяться возбудитель холеры вибрион Эль-Тор. В 70-х годах зарегистрированы случаи холеры, вызванные вибрионом Эль-Тор в некоторых городах Советского Союза.
Патогенез. Заражение происходит через рот. Попав в желудок, часть холерных бактерий гибнет в кислой среде желудка, а часть проникает в кишечник, где щелочная среда и обилие продуктов распада белков (в частности, пептон) способствуют их размножению.
На слизистой оболочке тонкой кишки накапливается большое количество холерных вибрионов и токсина, образующегося при их разрушении. Токсин нарушает функцию Слизистой оболочки, она гиперемируется, увеличивается проницаемость эпителия кишечника, нарушается секреторная и всасывающая функция его. Появляются профузные поносы, повторные рвоты, которые выводят из организма большое количество воды и солей (калия и натрия). Потеря большого количества жидкости и солей приводит к высушиванию ткани, сгущению крови, нарушению минерального обмена, поражению центральной и вегетативной нервных систем и других явлений интоксикации. От степени интоксикации зависит форма холеры, которая протекает в виде холерного энтерита, гастроэнтерита, альгидной и сухой формы (см. учебник инфекционных болезней).
Иммунитет. Стойкий, носит антимикробный и антитоксический характер, связанный с наличием агглютининов, вибриолизинов, антитоксинов и других антител. Кроме того, в иммунитете большое значение придают факторам местной защиты.
Профилактика. Проведение общих противоэпидемических мероприятий: раннее выявление больных, изоляция и госпитализация, дезинфекция, обсервация; охрана водоисточников, надзор за пищевыми продуктами, охрана границ при эпидемических вспышках и т. п. Для специфической профилактики используют убитую холерную вакцину (холероген-анатоксин в сочетании с Оантигеном холерного вибриона).
Лечение. Антибиотики тетрациклинового ряда, а также введение жидкости и электролитов (солей калия и натрия).
Контрольные вопросы
1. Какова морфологическая характеристика холерного вибриона? Какие Вы знаете биовары холерного вибриона?
2. Какая среда является элективной и средой накопления?
3. Каковы условия выращивания и культуральные свойства холерных вибрионов?
4. Каковы ферментативные свойства холерных вибрионов?
5. Какие токсины образуют холерные вибрионы?
Рекомендуемые страницы:
Общая характеристика холеры
Холера — острая антропонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, способная к массовому распространению. Характеризуется синдромом гастроэнтерита, приводящего к быстрому тяжелому обезвоживанию организма. Относится к особо опасным конвенционным (карантинным) болезням.История и распространение холеры
Холера известна с древних времен, однако еще в начале XIX в. она была эндемична в пределах полуострова Индостан. В течение XIX — начала XX вв. холера распространилась в большинстве стран мира, включая Россию, вызвав с 1817 по 1925 г. 6 опустошительных пандемий.
До 1960 г. холера вновь регистрировалась в пределах эндемичного района (Индия, Пакистан), а с 1961 г. началась 7-я пандемия холеры, вызванная холерным вибрионом Эль-Тор. Пик заболеваемости был достигнут в 1991 г., когда было зарегистрировано около 600 000 случаев болезни.
В последующие годы ситуация осложнилась появлением нового штамма возбудителя холерного вибриона — О139 (штамм бентал), вызвавшего необычайно тяжелые случаи болезни в ряде стран Азии. Возбудитель холеры описан несколькими учеными, однако в чистой культуре он был выделен и изучен Р.Кохом в 1883 г. В 1905 г. в Палестине Ф.Готшлих у паломников с диарейным заболеванием выделил на карантинной станции вибрион Эль-Тор, который рассматривался как холероподобный, и лишь в 1961 г., когда возникла пандемия, вызванная этим возбудителем, он был официально отнесен ВОЗ к классическому возбудителю холеры.
Этиология
Холерный вибрион относится к роду Vibrio семейства Vibrionaceae. По структуре соматического антигена холерный вибрион относится к серогруппе О1, которая в свою очередь подразделяется на 3 серовара: Инаба, Огава и редко встречающийся Гикошима. По биологическим и биохимическим различиям выделяют два биовара возбудителя — классический и Эль-Тор.
Холерный вибрион морфологически вариабелен. В типичных случаях имеет форму запятой. Благодаря полярно расположенному жгутику он обладает хорошей подвижностью; грамотрицателен, аэроб, спор не образует, оптимум роста 37 °С, обладает способностью к очень быстрому размножению. Способен образовывать L-формы. Хорошо растет на питательных средах, имеющих слабощелочную реакцию, лизируется специфическими фагами.
В окружающей среде устойчив (особенно вибрион Эль-Тор). Вибрион может длительно сохраняться в открытых водоемах, организме некоторых гидробионтов, даже может размножаться в теплой воде. Хорошо размножается в свежем молоке и мясных продуктах (студень, холодец). В то же время он быстро погибает при высушивании, под действием солнечного света, моментально гибнет при кипячении, чувствителен к хлорсодержащим дезинфицирующим средствам.
Эпидемиология холеры
Источником возбудителя инфекции является больной любой клинической формой холеры, а также вибрионоситель (реконвалесцентный, острый, хронический). Возбудитель выделяется в окружающую среду с испражнениями, особенно интенсивно больными типичной формой болезни в первые 4—5 дней. Больные стертыми, атипичными формами болезни особенно опасны благодаря активному образу жизни и многочисленным контактам с окружающими. В этом же состоит и эпидемиологическая опасность вибрионосителей.
Механизм передачи возбудителя — фекально-оральный, главный путь передачи — водный, реже пищевой и контактно-бытовой.
Восприимчивость человека к холере высокая, однако чаще всего при холере Эль-Тор инфекционный процесс протекает субклинически в форме носительства, и лишь у 1 из 100 заразившихся возникает клинически выраженная картина болезни. После перенесенной болезни вырабатывается типоспецифйческий антимикробный и антитоксический иммунитет, продолжительность которого достигает 1 года.
Патогенез
Возбудитель проникает в организм человека с водой и пищей, преодолевает кислотный барьер, чему способствуют заболевания желудка, сопровождающиеся пониженной кислотностью. В слабощелочной среде тонкой кишки вибрион интенсивно размножается, выделяя при этом экзотоксин (холероген), который представляет собой белок с молекулярной массой 84 000, состоящий из двух компонентов — А и В.
Компонент В связывается с рецептором мембраны энтероцитов и обеспечивает проникновение в клетку компонента А, содержащего активный центр, активирующий аденилатциклазу. В результате этого увеличивается внутриклеточное содержание цАМФ, который стимулирует секрецию энтероцитами жидкости в просвет кишки. При холере испражнения изотоничны, содержание натрия и хлора в них несколько ниже, а бикарбоната и калия выше, чем в плазме крови.
Потеря жидкости приводит к внеклеточному обезвоживанию и развитию гиповолемического дегидратационного шока; который и является основной причиной смерти. Для дегидратационного шока характерны гипоксемия, декомпенсированный метаболический ацидоз, сгущение крови с повышением содержания белка, развитием тромбогеморрагического синдрома, полиорганной и прежде всего острой почечной недостаточности. Потеря калия сопровождается нарушением функции миокарда и парезом кишечника. Для умерших от холеры характерны запавшие глаза, заострившиеся черты лица, землистый с цианотическим оттенком цвет кожи. Кожа дряблая, сморщенная.
Патоморфология
При патологоанатомическом исследовании обнаруживают переполнение жидкостью кишечника, признаки усиленной транссудации, но воспаление и повреждение слизистой оболочки отсутствуют. Кровь имеет дегтеобразную консистенцию, скапливается в крупных венах, в то же время капилляры запустевшие, почки уменьшены в размерах, клубочки полнокровны. В печени — дистрофические изменения. В головном мозге — венозный застой, дистрофические изменения в нейроцитах.Ющук Н.Д., Венгеров Ю.Я.
Опубликовал Константин Моканов
Холера — причины и патогенез
Причины холеры
Причина холеры — Vibrio cholerae принадлежит к роду Vibrio семейства Vibrionaceae.
Холерный вибрион представлен двумя биоварами, сходными по морфологическим и тинкториальным свойствам (биология собственно холеры и биолог Эль-Тор).
Возбудителями холеры являются вибрионы серогрупп 01 и 0139 видов Vibrio cholerae, , которые относятся к роду Vibrio, семейству Vibrionaceae.Внутри вида Vibrio cholerae различают два основных биовара — биовар классический холерный, открытый Р. Кохом в 1883 году, и биовар Эль Тор, выделенный в 1906 году в Египте на карантинной станции Ф. Эль Тор и Э. Готтшлихами.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Культурные объекты
Вибрионы являются факультативными анаэробами, но они предпочитают аэробные условия роста, поэтому на поверхности жидкой питательной среды образуется пленка. Оптимальная температура роста 37 ° C при pH 8.5-9.0. Для оптимального роста микроорганизмов необходимо присутствие в среде 0,5% хлорида натрия. Средой накопления является 1% щелочная пептонная вода, на которой они образуют пленку в течение 6-8 часов. Холерные вибрионы неприхотливы и могут расти на простых средах. Селективная среда представляет собой среду TCBS (агар, содержащий тиосульфат цитрат и сахарозу). Щелочной агар и триптон-соевый агар (ТСА) используются для субкультивирования.
[11], [12], [13], [14], [15], [16]
Биохимические свойства
Возбудители холеры биохимически активны и оксидазоположительны, обладают протеолитическими и сахаролитическими свойствами: продуцируют индол, лизиндекарбоксилазу.Сжиженный желатин в форме воронки, не выделяет сероводорода. Ферментируют глюкозу, маннозу, сахарозу, лактозу (медленно), крахмал, не ферментируют рамнозу, арабиозу, дульцит, инозит, инулин. Обладают нитратредуктазной активностью.
Холерные вибрионы различаются по чувствительности к бактериофагам. Классический холерный вибрион лизируется бактериофагами IV группы по Мукерджи, а вибрион биовара Эль Тор — бактериофагами группы V. Дифференциация возбудителей холеры осуществляется по биохимическим свойствам, по способности гемолизовать эритроциты барана. , агглютинируют эритроциты курицы, а также за счет чувствительности к полимиксину в отношении бактериофагов.Биовар Эль Тор устойчив к полимиксину, агглютинирует эритроциты курицы и гемолизирует эритроциты барана, имеет положительную реакцию Фогеса-Проскауэра и гексаминовую пробу. V. Cholerae 0139 по фенотипическим признакам обращается к биологу Эль Тор.
[17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27]
Антигенная структура
Холерные вибрионы обладают О- и Н-антигенами. В зависимости от структуры О-антигена различают более 150 серогрупп, среди которых серогруппы 01 и 0139 являются возбудителями холеры.Внутри серогруппы 01 в зависимости от комбинации субъединиц A, B и C происходит подразделение на серовары: Ogawa (AB), Inaba AC) и Gikoshima (ABC). Вибрионы сыворотки 0139 агглютинируются только сывороткой 0139. Н-антиген является обычным антигеном.
[28], [29], [30], [31], [32], [33], [34], [35]
Отношение к факторам окружающей среды
Возбудители холеры чувствительны к УФ, сушке, дезинфицирующим средствам (за исключением четвертичных аминов), кислым значениям pH, нагреванию.Возбудители холеры, особенно биолог Эль Тор, способны существовать в воде в симбиозе с гидробионтами, водоросли при неблагоприятных условиях могут переходить в некультивируемую форму. Эти свойства позволяют отнести холеру к антропосапронозным инфекциям.
[36], [37], [38], [39], [40], [41]
Факторы патогенности
Геном V. Cholerae состоит из двух кольцевых хромосом: большой и малой. Все гены, необходимые для жизнедеятельности и реализации патогенного происхождения, локализованы на большой хромосоме.Маленькая хромосома содержит интегрин, который захватывает и экспрессирует кассеты устойчивости к антибиотикам.
Основным фактором патогенности является холерный энтеротоксин (ХТ). Ген, опосредующий синтез этого токсина, локализован в кассете токсигена, расположенной в геноме нитчатого бактериофага CTX. Помимо гена энтеротоксина, на одной кассете находятся гены zot и ace. Продуктом гена zot является токсин (токсин zonula occludens), , и этот ген определяет синтез дополнительного энтеротоксина (дополнительный энтеротоксин холеры). Оба эти токсина участвуют в увеличении проницаемости кишечной стенки. Геном фага также содержит ген сер-адгезина и последовательность RS2, которая кодирует репликацию фага и его интеграцию в хромосому.
Рецептором фага CTX является регулирующий токсин пилинг (Ter). Это пили типа 4, которые помимо того, что являются рецепторами фага CTX, необходимы для колонизации микроворсинок тонкого кишечника, а также участвуют в образовании биопленок, в частности на поверхности оболочки карбионта.
Ter координированно экспрессируется с геном CT. На большой хромосоме также есть ген pope, который определяет синтез нейраминидазы, которая способствует действию токсина, и ген hap, который определяет синтез растворимой гемальтониновой протеиназы, которая играет важную роль в выделении возбудитель из кишечника во внешнюю среду в результате его деструктивного воздействия на рецепторы кишечного эпителия, связанные с вибрионами.
Колонизация тонкой кишки, осуществляемая пилилами, регулируемыми токсинами, создает плацдарм для действия энтеротоксина холеры, который представляет собой белок с молекулярной массой 84000D, состоящий из 1 субъединицы A и 5 субъединиц B. Субъединица A состоит из двух полипептидных цепей A1 и A2, соединенных дисульфидными мостиками. В субъединичном комплексе B пять идентичных полипептидов связаны друг с другом нековалентной связью в форме кольца. Комплекс B-субъединиц отвечает за связывание всей молекулы токсина с клеточным рецептором — моносиальным ганглиозидом GM1, которым очень много эпителиальных клеток слизистой оболочки тонкого кишечника.Чтобы комплекс субъединиц взаимодействовал с GM1, сиаловая кислота должна быть отщеплена от него, что осуществляется ферментом нейраминидазой, который облегчает действие токсина. Субъединичный комплекс B после присоединения к 5 ганглиозидам на мембране кишечного эпителия изменяет свою конфигурацию, так что A1 может отделиться от комплекса A1B5 и проникнуть в клетку. Проникая в клетку, пептид A1 активирует аденилатциклазу. Это происходит в результате взаимодействия AI с NAD, которое приводит к образованию ADP-рибозы, которая переносится на GTP-связывающий белок регуляторной субъединицы аденилатциклазы.В результате происходит ингибирование функционально необходимого гидролиза ГТФ, в результате чего происходит накопление ГТФ в регуляторной субъединице аденилатциклазы, определяющей активное состояние фермента, и, как следствие, усиление синтеза ц-АМФ. . Под действием C-AMP в кишечнике изменяется активный транспорт ионов. В области крипт эпителиальных клеток ионы C1- сильно изолированы, а в области ворсинок абсорбция Na + и Cl- затруднена, что является осмотической основой для выделения воды в кишечник.
Холерные вибрионы хорошо выживают при низких температурах; во льду сохраняются до 1 месяца. В морской воде — до 47 дней, в речной — от 3-5 дней до нескольких недель, в почве — от 8 дней до 3 месяцев, в кале — до 3 дней, на сырых овощах — 2-4 дня. На плоды — 1-2 дня. Холерные вибрионы при 80 ° С погибают через 5 минут, при 100 ° С — мгновенно; очень чувствительны к кислотам, сушке и действию прямых солнечных лучей, , убитые хлорамином и другими дезинфицирующими средствами через 5-15 минут, сохраняются хорошо и долго и даже размножаются в открытой воде и сточных водах, богатых органическими веществами.
Pathogenität — Википедия
Патоген ist eine Weiterleitung auf diesen Artikel. Zur Melodic-Death-Metal-Band siehe Pathogen (Группа).Pathogenität (retronymes Kofferwort aus griechisch πάθος pathos «Leiden, Krankheit» и γένεσις genesis «Erzeugung, Geburt», vgl. -Genezienke, vgl. Toxine), в bestimmten Organismen Erkrankungen hervorzurufen. [1] Das Adjektiv dazu lautet pathogen (krankheitserregend, потенциелл кранкмаченд), das Gegenteil ist apathogen (nicht krankheitserregend). Krankheitserreger werden auch mit dem Substantiv (das) Патоген bezeichnet. Das Ausmaß der Pathogenität (Vermehrungsfähigkeit der Krankheitserreger und Intensität der Toxinbildung) wird als Virulenz bezeichnet, ohne dass dafür ein einheitliches Maß Definiert ist. [2]
Pathogene werden nach ihrem Gefahrenpotential für den Menschen in vier Risikogruppen eingeteilt.Die Arbeit mit ihnen erfolgt in der entsprechenden biologischen Schutzstufe (англ. Biosafety Level ), mit BSL-1 für Tätigkeiten mit apathogenen bis hin zu BSL-4 für Tätigkeiten mit hochpathogenen Erregern.
Im engeren Sinne bezeichnet Pathogenität die Fähigkeit eines Pathogens (eines parasitären Organismus wie Bakterien, Pilze, Protozoen oder Parasiten) или паразитирующего Moleküle (Viren, Viroid schnee, Transposwerendendenbestnerbabs), ein zelede, Transposwerendendenbestner.Ihr Gegenteil ist die Apathogenität , d. час ein solcher Organismus или Stoff fügt dem Wirt keinen Schaden zu, er ist für diesen apathogen . Die Pathogenität ist zwar in erster Linie eine Eigenschaft des Pathogens, entsteht jedoch erst im Kontakt mit einem Wirt. [3] Die Pathogenität wird durch geschwächte Wirte, z. B. bei einer Infektion mit Pneumocystis carinii или Cryptosporidium в Patienten mit Immunsuppression, verstärkt. [3]
Weitere gelegentlich auftretende Eigenschaften sind Transmission (nicht aber bei Cryptococcus neoformans oder einigen Zoonosen), Adhäsion, Immunreaktionen des wirtseigenen Immunsurch, Immunologische Fluchtmenätmünungen.B. die Zerstörung der Lymphknoten bei HIV, Arthus-Reaktionen bei Streptokokkeninfektionen oder die Tyrosis bei der Tuberkulose) und auch Verhaltensänderungen des Wirtes (z. B. Yersinia pestis bei Ratings, , Flöxwäln, , Flöxwän, , der kleine Leberegel bei Ameisen или Polydnaviren bei Schlupfwespenbeute). Die Eigenschaft zu töten (siehe Letalität und Mortalität) ist nicht bei allen Pathogenen gegeben, einige Beispiele hierfür sind humane Papillomviren, Herpesviren, Adeno-assoziierte Viren oder Rhinoviren.
Die Virulenz von Bakterien ist unter anderem von der Existenz von Toxin-Proteinen abhängig, die auch Bestandteil eines Toxin-Antitoxin-Paars sein können. Eine Assoziation von Virulenz mit einer gesamten Bakterienspezies ist nur dann sinnvoll, wenn es keine Stämme ohne Virulenz gibt. [4]
Eine Beobachtung bei der Pathogenese in natürlichen Wirten ist, dass an den Wirt angepasste Krankheitserreger ihm meist nicht sehr schaden, da sie ihn für ihre eigene Entwicklung benötigen und das Immunsystemsenderworld, где была проведена иммунная система. [5] Die Vermeidung einer Immunreaktion erleichtert die Replikation und die Übertragung (синоним Transmission ) и weitere Wirte. Beispielsweise erreichen Herpes-simplex-Viren eine Infektionsprävalenz (синоним Durchseuchung ) von über 90% der deutschen Bevölkerung mit wenig ausgeprägten Symptomen. Das simiane Immundefizienz-Virus erzeugt in seinen natürlichen Wirten kein AIDS, im Gegensatz zu HIV im Menschen. Dagegen löschen sich Infektionen mit Ebola-Virus im Menschen, nicht aber in ihren natürlichen Wirten, gelegentlich durch ihre hohe Virulenz selbst aus, bevor eine effiziente Transmission erfolgt, da der Wirt stark undbrehwäschwädcht. des Virus beginzt.Ein schwerer Infektionsverlauf mit hohem Sterberisiko (siehe Letalität und Mortalität) ist zumeist ein Anzeichen dafür, dass der verursachende Erreger noch nicht an den betreffenden Organismus als seinen Reservoirwirt angepasst. Jedoch ist der Übergang von Pathogenen mit einer hohen Replikation (und erzeugten Schäden) zu einer dauerhaften Infektionsprävalenz (Заразить и сохранить, unter Vermeidung von Schäden) fließend. Андерс ausgedrückt, neigen angepasste infktiöse Objekte zur Persistenz und einerregierten Reproduktionsrate, während weniger angepasste Pathogene tendenziell zur vorzeitigen Beendigung der Infektionskette führen. [6] [7] [8] [9] Bakterien verwenden dazu unter anderem das Проверка кворума. [9] Ausnahmen sind z. B. H5N1-Viren в Vögeln, Yersinia pestis und humane Pockenviren im Menschen, welche trotz längerem Vorkommen vergleichsweise hohe Opferzahlen fordern. Ebenso erfolgt eine Evolution im Wirt als Reaktion auf ein Pathogen. Diese Evolution wird in der Gen-für-Gen-Hypothese beschrieben. Die Anpassung erfolgt jedoch meistens seitens des Wirts, da die Pathogene mit ihren Artgenossen in Konkurrenz um Ressourcen stehen und ein weniger воспроизводства Pathogen schneller untergehen würde. [10] Daher tritt eine Minderung der Pathogenität bei Pathogenen vor allem in Verbindung mit einer erhöhten Reproduktionsrate auf. [6]
Die Anpassung des Wirts an das Pathogen wird als Wirtsrestriktion или Wirtsresistenz bezeichnet. Zu den bekannten antiviralen und antibakteriellen Mechanismen gehören beim Menschen z. B. der Myxovirus-Resistenzfaktor Mx1, PAMP-Rezeptoren, der dsRNA-активный ингибитор трансляции DAI, das Melanom-Differenzierungs-Antigen 5 (MDA-5), олигоаденилатсинтаза OAS1, das лангерин 9000, домен SAM 9 HD-домен 1 -Протеин (SAMHD1), das RIG-I, das APOBEC3, das TRIM5alpha, протеинкиназа R и РНК-интерференция.Darüber hinaus erfolgt die Immunantwort. Ohne Pathogene wäre die Evolution des Immunsystems nicht erforderlich. Pflanzen haben andere Mechanismen zur Abwehr von Pathogenen entwickelt.
Im Falle der vertikalen Infektion wird nach der Kontinuumshypothese eine Abnahme der Virulenz bei Zunahme des Anteils einer vertikalen Infektion (также von Eltern zu Nachkommen) вермутет. [11]
Компромиссная гипотеза [Bearbeiten | Quelltext Bearbeiten]
Die Kompromisshypothese (англ. гипотеза компромисса ) geht davon aus, dass Virulenz eine unvermeidbare Folge der Transmission ist. [12] Bei dem Erreger der Malaria Plasmodium sp. wurde eine Abnahme der Transmission bei erhöhter Virulenz beobachtet. [13] [14]
Kurzsichtigkeitshypothese [Bearbeiten | Quelltext Bearbeiten]
Die Kurzsichtigkeitshypothese (англ. недальновидная эволюционная гипотеза ) beschreibt Virulenz als unvermeidbare Folge der Mutation und Selektion eines Pathogens bei der Anpassung an seinen direkten Wirt, ohne Bezugäu wirören zweiteren. [15] Als Beispiele werden Meningokokken, das Poliovirus und das HIV angeführt. [16]
Zufälligkeitshypothese [Bearbeiten | Quelltext Bearbeiten]
Die Zufälligkeitshypothese (англ. случайная эволюционная гипотеза ) vermutet eine Unabhängigkeit der Virulenz von der Transmission, d. час die Virulenz entsteht aus anderen Gründen und ist nur ein Nebeneffekt. [17] Beispiele sind die Toxin-bildenden Bodenbakterien Clostridium botulinum (bildet das Botulinumtoxin) и Clostridium tetani (bildet das Tetanustoxin), денен das токсин, содержащий токсин, содержащий нормальный токсин. [15]
Die Spezifizierung der Pathogenität kann durch die Art des Wirtes bezeichnet werden: Den Menschen Betreffende Krankheitserreger werden als humanpathogen , Tiere betreffende als zoopathogen (phenflanhogen). Je nach der Fähigkeit, im Einzelfall tatsächlich eine Erkrankung auszulösen, unterscheidet man eine fakultative Pathogenität (nicht in jedem Fall pathogen oder nur unter bestimmten Umständen) и ranset в обязательном патогенезе Fall .Der Ursprung eines Pathogens kann außerhalb des Wirts liegen (экзопатоген, die meisten Pathogene) или aus dem Wirt selbst stammen (эндопатоген, z. B. manche Prionen).
Seltener findet der Begriff Psychopathogenität im Zusammenhang mit umstrittenen Inhalten und Dogmen verschiedener Religionen und Ideologien Verwendung. В Аналогии zur Pathogenität bezeichnet der Begriff hier die Eigenschaft derartiger Inhalte, «schädigend» auf den Geist zu wirken.
Die Gruppe der unbelebten Pathogene umfasst Prionen, Transposons, Retroelemente, Viroid und Viren.Belebte Pathogene kommen als Einzeller (Bakterien, Pilze und Protisten) und Mehrzeller (Parasiten) vor.
Die Idee der Pathogenität von Mikroorganismen Entstand am Ende des 18. Jahrhunderts. Damals wurde der Streit zwischen Kontagionisten, а также Vertretern der Idee der ansteckenden Krankheiten, und Antikontagionisten zugunsten ersterer entschieden. Die Übertragbarkeit von Krankheiten durch pathogene Organismen wird seit dem Ende des 19. Jahrhunderts wissenschaftlich nicht mehr angezweifelt.
- Роберт Г. Вебстер, А. Гранофф (Hrsg.): Энциклопедия вирусологии. Academic Press Ltd., Сан-Диего 1996, ISBN 978-0-12-374410-4.
- Дж. Х. Штраус, Э. Г. Штраус: Вирусы и болезни человека. Academic Press Ltd., Сан-Диего 2002, ISBN 0-12-673050-4.
- Д. М. Книп, Питер М. Хоули, Д. Е. Гриффин (Hrsg.): Области вирусологии. 5. Auflage. Липпинкотт Уильямс и Уилкинс, Филадельфия 2007, ISBN 978-0-7817-6060-7.
- ↑ Б.Альбертс, А. Джонсон, Дж. Льюис: Введение в патогены . В: Molecular Biology of the Cell , 4th. Auflage, Garland Science, 2002, S. 1 (Абгеруфен, 26 апреля 2016 г.).
- ↑ Л. А. Пирофски, А. Касадеваль: Вопросы и ответы Что такое патоген? Вопрос, который напрашивается. В: BMC Biol. 10: 6 (2012). PMID 22293325. PMC 3269390 (бесплатный Volltext)
- ↑ a b R. Poulin, C. Combes: Концепция вирулентности: интерпретация и значение.В: Parasitol Today 15: 474–5 (1999). PMID 10557145.
- ↑ Каллиопи Георгиадес, Дидье Рауль: Сравнительные данные геномики, свидетельствующие о том, что только белковые токсины помечают плохие ошибки. In: Frontiers in Cellular and Infection Microbiology. 1, 2011, S., DOI: 10.3389 / fcimb.2011.00007
- ↑ Ф. фон Рейнбабен, M.H. Wolff: Handbuch der viruswirksamen Desinfektion. Springer-Verlag, 2013, ISBN 9783642563942, S. 7.
- ↑ a b V.J. Torres, D. L. Stauff и др.: Регуляторная система Staphylococcus aureus, которая реагирует на гем хозяина и модулирует вирулентность. В: Cell Host Microbe. Bd. 1, № 2, 2007, S. 109–19, PMID 18005689. PMC 2083280 (freier Volltext)
- ↑ Г. Сильвестри: Сажистые мангабеи, инфицированные естественным вирусом иммунодефицита человека: приблизились ли мы к пониманию того, почему у них не развивается СПИД? В: J Med Primatol. (2005) 34 (5-6): 243-52. PMID 16128919.
- ↑ М. Дж. Пантин-Джеквуд, Д. Э.Суэйн: Патогенез и патобиология инфекции вируса птичьего гриппа у птиц. В: Rev Sci Tech. (2009) 28 (1): 113-36. PMID 19618622.
- ↑ a b П. Н. Хименес, Г. Кох, Дж. А. Томпсон, К. Б. Ксавьер, Р. Х. Кул, В. Дж. Квакс: Множественные сигнальные системы, регулирующие вирулентность у синегнойной палочки. In: Microbiol Mol Biol Rev. (2012), Band 76, Nr. 1. С. 46–65. DOI: 10.1128 / MMBR.05007-11. PMID 223
- ; PMC 3294424 (бесплатный Volltext).
- ↑ К. Д. Мир, М. А. Гаспер, В. Сундараварадан, Д. Л. Содора: инфекция SIV у естественных хозяев: разрешение иммунной активации во время фазы перехода от острой к хронической. В: Microbes Infect. (2011), Bd. 13 (1), S. 14–24. PMID 20951225; PMC 3022004 (бесплатный Volltext).
- ↑ P. X. Kover, K. Clay: Компромисс между вирулентностью и вертикальной передачей и поддержанием вирулентного патогена растений. В: Американский натуралист. Band 152, номер 2, август 1998 г., S.165–175, DOI: 10.1086 / 286159, PMID 18811383.
- ↑ С. Ализон, А. Херфорд, Н. Мидео, М. Ван Баален: Эволюция вирулентности и гипотеза компромисса: история, текущее положение дел и будущее. В: Журнал эволюционной биологии. Band 22, Nummer 2, февраль 2009 г., S. 245–259, DOI: 10.1111 / j.1420-9101.2008.01658.x, PMID 1
- 83.
- ↑ М. Дж. Маккиннон, А. Ф. Рид: Вирулентность малярии: эволюционная точка зрения. In: Философские труды Лондонского королевского общества.Серия B, Биологические науки. Band 359, Nummer 1446, Juni 2004, S. 965–986, DOI: 10.1098 / rstb.2003.1414, PMID 15306410, PMC 1693375 (freier Volltext).
- ↑ Р. Э. Пол, Т. Лафонд, К. Д. Мюллер-Граф, С. Нитьютай, П. Т. Брей, Дж. К. Коэлла: Экспериментальная оценка взаимосвязи между летальной или нелетальной вирулентностью и успехом передачи при паразитарных инфекциях малярии. В: BMC Evolutionary Biology. Band 4, сентябрь 2004 г., S. 30, doi: 10.1186 / 1471-2148-4-30, PMID 15355551, PMC 520815 (freier Volltext).
- ↑ a b Б. Р. Левин: Эволюция и поддержание вирулентности у микропаразитов. В: Возникающие инфекционные болезни. Band 2, Nummer 2, 1996, апрель-июнь, S. 93–102, doi: 10.3201 / eid0202.960203, PMID 88, PMC 2639826 (freier Volltext).
- ↑ Б. Р. Левин, Дж. Дж. Булл: Близорукая эволюция и вирулентность патогенных микроорганизмов. В: Тенденции микробиологии. Band 2, Nummer 3, März 1994, S.76–81, PMID 8156275.
- ↑ С. Дж. Гулд, Р. К. Левонтин: Спандрели Сан-Марко и панглосская парадигма: критика адаптационистской программы. In: Proceedings of the Royal Society of London. Серия B, Биологические науки. Band 205, номер 1161, сентябрь 1979 г., S. 581–598, PMID 42062.
Патогенез холеры: последние перспективы быстрого выявления и профилактики холеры
1. Введение
Холера, инфекционное заболевание, передающееся через воду (также известное как «синяя смерть»), характеризуется опасной для жизни секреторной диареей, часто сопровождающейся многочисленные объемные водянистые стула и рвота, что в конечном итоге приводит к гиповолемическому шоку и ацидозу.Термин «синяя смерть» дается заболеванию, поскольку оно изменяет цвет кожи инфицированных людей до синего цвета из-за сильного обезвоживания [1, 2]. Это вызвано некоторыми представителями вида V. cholerae , которые также могут вызывать легкие или незаметные инфекции. Эти бактерии обнаруживаются в воде или пище, загрязненной фекалиями. Страны с плохой очисткой воды и сточных вод могут стать жертвами холеры. Маловероятно, что это заболевание передается от человека к человеку. История холеры началась в девятнадцатом веке, когда миллионы людей на всех континентах исчезли из-за шести последующих пандемий.В Южной Азии в 1961 г. произошла седьмая пандемия, в Африке в 1971 г. и в Северной и Южной Америке в 1991 г. [3]. Последствия гуманитарного кризиса, такие как переполненные лагеря, отсутствие систем водоснабжения и санитарии, являются одними из факторов, повышающих риск передачи холеры. Предположительное подтверждение холеры делается на основании первичного клинического исследования водянистого стула и сильного обезвоживания. В настоящее время использование наборов для быстрой идентификации облегчило обнаружение холеры в течение нескольких часов после получения образца в лаборатории [2, 3].Неспособность создать эффективную пероральную вакцину против холеры — это область, о которой беспокоятся профессионалы и исследователи. В этой главе более подробно обсуждаются различные испытания и попытки производства вакцины и исследуемых вакцин. Клиническая микробиология холеры, ее эпидемиология и лабораторные исследования подробно рассматриваются в этой главе.
2. Клинические особенности
2.1. Симптомы
Симптомы холеры обычно проявляются через 1–3 дня после приема зараженной пищи и / или воды.В большинстве случаев симптомы варьируются от легких до умеренных, но в 20% случаев появляются тяжелые, опасные для жизни состояния со смертельным исходом. Наиболее тяжелое проявление болезни, «холера гравис», поражает лишь меньшую часть пациентов, инфицированных CT-продуцирующими V. cholerae [1]. Было подсчитано, что классические штаммы более вирулентны, чем штаммы Эль Тор. Инкубационный период холеры зависит от размера инокулята и составляет от нескольких часов до 5 дней [2]. Началом клинических проявлений может быть внезапная обильная водянистая диарея, в некоторых случаях сопровождающаяся анорексией и дискомфортом в животе.Изначально стул будет темно-коричневого цвета с твердым характером; постепенно он превращается в безобидный беловатый водянистый стул, напоминающий рисовую воду [1]. Это характерная природа холеры, которая помогает диагностировать другие желудочно-кишечные инфекции. Обильная потеря жидкости через рвоту и чрезмерную диарею происходит из-за действия энтеротоксинов, продуцируемых V. cholerae [3]. Энтеротоксины цитотоксичны и изменяют проницаемость эпителиальных клеток кишечной стенки, создавая поры.В результате осмоса вода и другие жидкие вещества выводятся из организма, что приводит к массивной диарее и сильному обезвоживанию [4]. Также присутствует рвота, которая развивается после появления диареи. При холере гравис частота диареи достигает максимума 600–1000 мл / ч, что приводит к гипотензии, тахикардии и сосудистому коллапсу. Из-за сильного обезвоживания тургор кожи будет плохим, будет выглядеть сухая, с запавшими глазами. Пациент будет беспокоиться и пить, а на руках появятся морщины, как после длительного погружения, что часто называют «мыть руки женщины».«Сильный гиповолемический шок приводит к гипокалиемии, что приводит к болезненным мышечным спазмам и, в тяжелых случаях, гипокалиемической нефропатии и очаговому некрозу миокарда. Температура тела будет вполне нормальной, за исключением 20% инфицированных, у которых наблюдается небольшое повышение температуры [4, 5, 6].
Лактоацидоз и потери бикарбонатов стула, связанные с обезвоживанием, проявляются снижением pH крови и бикарбоната плазмы, а также увеличением анионного разрыва сыворотки (среднее значение 20,2 ммоль / л в исследовании).Несмотря на потерю калия, нелеченый ацидоз обычно приводит к высокому уровню калия в сыворотке крови. У детей может развиться гипогликемия, связанная с комой и судорогами [4, 6].
2.2. Механизм патогенеза
Лучшее понимание источника инфекции очень необходимо для лечения и эффективной профилактики любых заболеваний. В случае холеры загрязненная вода и фекалии людей, инфицированных V. cholerae , являются основными источниками инфекции.Планктон и зоопланктон, являющиеся носителями инфекционного агента, и определенные факторы окружающей среды, такие как изменение поверхности и сброс питательных веществ с суши, также входят в число факторов, косвенно ведущих к производству большего количества хозяев [7].
Механизм инвазии начинается, как только бактерия обосновывается в кишечнике, после колонизации эпителиального слоя тонкой кишки путем проникновения через слизистые. Проникновение в слизистую оболочку облегчается муколитическими ферментами, которые помогают разрушить целостность слизистой, а также длинный хвост инвазивного организма позволяет ему продвигаться через толстый слой слизистой оболочки.Прикреплению Vibrio к микроворсинкам тонкой кишки способствуют так называемые пили на бактериях, которые являются одним из основных факторов, влияющих на стремительную моторику [6, 8]. Производство эндотоксина бактериями, называемого СТ, является основным ключом к механизму вирулентности. Таким образом, доказано, что только токсикогенные штаммы Vibrio , то есть Vibrio , продуцирующие СТ, способны вызывать холеру. Исследования показывают, что этот CT кодируется нитчатым бактериофагом, который укрывается патогенными вибрионами [1].
Изготовленный СТ состоит из шести белковых субъединиц: одной субъединицы А и пяти копий субъединиц В, обычно обозначаемых как AB5. Субъединица B также известна как фактор связывания, который связывается с ганглиозидным рецептором GM1 эпителиальных клеток тонкой кишки. После связывания с клетками-мишенями он образует токсиновый комплекс, который затем эндоцитируется клеткой. Как только происходит процесс эндоцитоза, происходит ферментативная активация субъединицы А, что приводит к увеличению активности аденилатциклазы, тем самым увеличивая концентрацию цАМФ более чем в 120 раз.Это, в свою очередь, приводит к повышенной проницаемости хлоридных каналов, впоследствии опосредующей отток большего количества АТФ-опосредованных хлорид-ионов и секрецию простых H 2 O, Na + , K + и HCO 3 — в просвет кишечника [4, 5, 7]. Повышенное поглощение воды, а также электролитов вызывает сильное обезвоживание, ведущее к клиническим симптомам холеры. Краткий механизм патогенеза изображен на рисунке 1.
Рисунок 1.
Механизм патогенеза V. cholerae.
2.3. Дифференциальный диагноз
В местах эпидемии или эндемии холеры нельзя откладывать лечение из-за незавершенных лабораторных исследований; лабораторное подтверждение очень важно для профилактики, а также для лечения в эпидемически эндемичных районах.
Как указано выше, необходим окончательный диагноз, наиболее важным этапом которого является изоляция В.cholerae из стула инфицированных лиц. Для эпидемического исследования может не потребоваться дополнительная характеристика, а не выделение Vibri o. В других случаях изоляты следует типировать путем специфической агглютинации сыворотки для серотипов O139 и O1 [9].
2.4. Терапия
Ключом к терапии является адекватная регидратация до тех пор, пока болезнь не закончится (обычно 1–6 дней при отсутствии антибиотиков). Регидратация может быть достигнута путем пероральной регидратации раствором для пероральной регидратации (ПРС), как и в других случаях диареи и дизентерии.В тяжелых случаях потребуется внутривенное вливание жидкости. Антибиотики помогают снизить тяжесть заболевания и продолжительность выведения из организма. У детей гипогликемию лечат с помощью внутривенного введения 25 или 50% глюкозы [10].
2,5. Внутривенная регидратация
Для взрослых внутривенная регидратация проводится как можно быстрее; Вводится 2 литра в первые 30 минут. Если к этому моменту состояние пациента улучшится, скорость инфузии можно снизить до 100 мл / кг массы тела в течение первых 4 часов терапии.Дети должны получить 30 мл жидкости для внутривенного введения на 1 кг массы тела в течение первого часа и дополнительно 40 мл / кг в последующие 2 часа [10, 11]. И взрослые, и дети должны получать соответствующее количество ПРС во время болезни. Скорость и частота внутривенных инфузий могут варьироваться в зависимости от потери электролитов со стулом пациента. Всемирная организация здравоохранения (ВОЗ) рекомендует лактат Рингера как лучший раствор для регидратации. Изотонический солевой раствор корректирует только гиповолемию, поэтому для правильного восстановления после обезвоживания вместе с ним следует вводить калий и глюкозу [12, 13].
2.6. Пероральная регидратация
Пациенты с умеренным заболеванием и обезвоживанием могут получать восполнение жидкости перорально, чтобы компенсировать дефицит воды и электролитов. В легких случаях ВОЗ рекомендует вводить 50 мл ПРС / кг массы тела в первые 4 часа. При умеренном обезвоживании количество следует увеличить вдвое, то есть до 100 мл / кг [11, 14]. Следует постоянно контролировать выделение стула в зависимости от того, какая регидратационная терапия оптимизирована. Детям, склонным к высокой потере жидкости, его следует заменить 1: 1 на ПРС.Используемый пероральный раствор должен быть рекомендован ВОЗ [1]. Этот раствор состоит из соответствующего количества электролитов, чтобы сбалансировать потери жидкости и электролита из-за обезвоживания. Кроме того, он также содержит оптимальное количество глюкозы для облегчения усвоения натрия и воды.
Формула текущего раствора ВОЗ для пероральной регидратации: 2,6 грамма поваренной соли (NaCl), 2,9 грамма дигидрата тринатрийцитрата, 1,5 грамма (0,053 унции) хлорида калия (KCl) и 13,5 грамма безводной глюкозы (C6h22O6) на литр жидкости [ 1, 6, 12].
Домашний раствор для пероральной регидратации можно приготовить, когда готовый пакетик недоступен. В состав раствора ПРС входят примерно шесть чайных ложек сахара без горки и 1/2 чайной ложки поваренной соли на 1 литр воды. Молярное соотношение сахара к соли должно быть 1: 1, а раствор не должен быть гиперосмолярным [9, 12].
2.7. Антимикробная терапия
Лечение антибиотиками следует начинать только после начальной регидратационной терапии и коррекции ацидоза.Антибиотики играют второстепенную роль в лечении холеры, сокращая продолжительность холерного поноса, а также выведение вибрионов. Хотя большинство штаммов V. cholerae до сих пор не проявили какой-либо лекарственной устойчивости, штаммы O139 обладают внутренней устойчивостью к триметоприм-сульфаметоксазолу [14, 15]. Тетрациклин является обычным препаратом выбора [7]. Помимо возможности окрашивания зубов, тетрациклин не показал никаких противопоказаний для взрослых и детей. Помимо тетрациклина, антибиотики хинолоновой группы (ципрофлоксацин и норфлоксацин) показали отличную активность in vitro против Vibrio [10, 11].Широкое применение тетрациклина в качестве профилактического средства в настоящее время не рекомендуется в связи с появлением резистентности к нему в зонах эпидемии [14].
3. Эпидемиология
Холера является показателем распространенности антисанитарных условий, особенно среди растущего населения в развивающихся странах. Прискорбно, что ежегодно регистрируется около 3–5 миллионов случаев холеры благодаря достижениям здравоохранения и медицинских работников во всем мире [16]. Когда 52 страны сообщили о 236 896 случаях в 2006 году с уровнем летальности 2.7%, всего в 2011 г. было зарегистрировано 589 854 случая из 58 стран [7]. Эти цифры говорят о том, что холера является глобальной болезнью, угрожающей всему миру.
В развивающихся странах с высокой численностью населения холера является основной причиной эпидемической диареи. О глобальных вспышках пандемии также сообщают из Азии, Африки и Латинской Америки [17]. В Африке, как стране с ограниченными медицинскими учреждениями, за последние годы наблюдалось значительное снижение вспышек холеры. Когда в 2012 г. было зарегистрировано 117 570 случаев, в 2013 г. было зарегистрировано только 56 329 случаев [16].Это свидетельствует о значительном улучшении санитарных условий, а также о принятых в стране профилактических мерах. В 2013 году Мексика и другие страны Центральной Африки сообщили о вспышке болезни, а в 2014 году произошла вспышка холеры в Южном Судане. В 2012 г. было зарегистрировано 185 случаев вспышки на Кубе [18]. ВОЗ сообщает в среднем о 132 121 случае холеры в 2016 г. из 38 стран, включая 2420 сообщений о летальных исходах [13].
Учитывая эпидемиологию различных серотипов и биотипов V.cholerae, серогруппы O1 и O139 вызывают вспышки. Биотип EL Tor и серотип Огава являются основными причинами эпидемии холеры в развивающихся странах [18, 19]. Среди серогрупп V. cholerae , O1 является основной причиной недавних вспышек. O139 был впервые обнаружен во время массовой вспышки в Бангладеш в 1992 году, но на данный момент он наблюдается только в некоторых спорадических случаях [20]. За пределами Азии об этом не сообщалось. Штамм-возбудитель и серотип Vibrio , ответственные за первые четыре пандемии, неизвестны, тогда как возбудители пятой и шестой пандемий были идентифицированы как классические биотипы штаммов O1 и биотипа Эль-Тор соответственно [16].В 2010 году сообщалось о вспышке болезни на Гаити, завезенной Миротворческими силами Организации Объединенных Наций из Южной Азии. В отчете ООН говорится, что от него пострадали 788 000 человек и погибло 9200 человек [16]. Эта информация приводит нас к тому факту, что по мере развития эпидемий и пандемий продолжают появляться новые клоны токсигенных штаммов Vibrio , которые представляют собой одну из основных угроз для стран, пострадавших от опасного для жизни заболевания.
Vibrio , являющийся местным видом водной среды, не может быть полностью искоренен на земном шаре, как в случае оспы [13].Существует повышенный риск эпидемии и пандемии холеры при изменении экологических и климатических условий. В качестве профилактической меры требуются комплексные стратегии профилактики и междисциплинарные действия.
4. Иммунный ответ и вакцины
Более 75 лет исследований были проведены по разработке эффективной вакцины против холеры. Поскольку Vibrio не демонстрирует значительной степени антигенной изменчивости, очень реалистичная цель вакцины против холеры очень близка и достижима.Расширенные исследования кишечной иммунной системы и патогенности холеры приблизили понимание вакцины.
4.1. Иммунитет, вызванный инфекцией
Иммунитет, индуцированный инфекцией холеры, является штаммоспецифическим и серотипоспецифическим. Исследования показывают, что добровольцы, экспериментально инфицированные классическим биотипом V. cholerae O1, продемонстрировали 100% защиту от последующей инфекции против вибрионов классического биотипа [12]. Точно так же инфицирование биотипом Эль-Тор демонстрировало 90% иммунитета против вибрионов Эль-Тор [2].У аналогичного биотипа иммунитет сохраняется минимум 3 года. Первоначальное инфицирование серотипом Огава или Инаба обеспечивало защиту от обоих серотипов во время повторного заражения.
4.2. Компоненты иммунной системы
Инфекция Vibrio может варьироваться от фатальной диарейной болезни до легкого неклинического / неявного случая, когда возможен только серологический диагноз [1, 12]. Причина этого остается неясной. Но были определенные предположения относительно разницы в симптомах у инфицированных пациентов.Один из них — наличие у пациентов кишечных рецепторов токсинов и холерных вибрионов. После естественного заражения выявляются циркулирующие антитела против большинства антигенов холеры, включая жгутиковый (H) антиген, токсин и соматический (O) антиген [21, 22]. Антитела против вибрионов называются «вибриоцидными антителами», поскольку они лизируют бактерии в присутствии комплемента и других компонентов сыворотки. Парентеральное введение вакцин вызывает явный рост «вибриоцидных антител» [2, 12].Иммунный ответ состоит из антибактериального и антитоксического иммунитета, причем антибактериальный иммунитет является наиболее преобладающим. Пробная пероральная вакцина, содержащая убитый Vibrio , обладала большей устойчивостью, чем парентеральная вакцина, содержащая анатоксины. Синергетический иммунный ответ, состоящий как из токсинов, так и из бактериальных антигенов, показал заметный иммунный ответ, чем однокомпонентный [21].
Вероятно, что первичный иммунный ответ может быть основным детерминантом защиты от инфекции холеры, поскольку это, по сути, заболевание тонкой кишки.Более того, младенцы, находящиеся на грудном вскармливании, менее подвержены влиянию из-за присутствия секреторных антител в молоке [19, 21]. Секреторные IgA, IgM и IgG обнаруживаются в слизистой оболочке кишечника. Эти антитела обеспечивают защитный иммунитет в присутствии и в отсутствие комплементарных белков. Фактическая защита обеспечивается секреторными IgA и другими кишечными антителами, и именно вибриоцидные антитела в сыворотке служат маркером для антител IgA, направленных против тех же антигенов [12, 21]. V. cholerae — подвижная бактерия, которая является одним из основных факторов патогенности. Жгутиковые антитела могут предотвратить вторжение бактерий, обездвиживая их; а также соматические (O) и жгутиковые (H) антитела могут вызывать слипание и приводить к остановке движения клеток. В то же время антитоксины могут связываться со специфическими токсинами на поверхности эпителия и предотвращать связывание токсина [2, 12].
4.3. Vaccines
Наблюдение за тем, что естественная инфекция дает стойкий иммунитет, привело к разработке вакцин против холеры, которые могут вызывать защитный иммунитет.Первые попытки разработки вакцины начались в 1960 году, они были сосредоточены на получении цельноклеточной вакцины с парентеральным введением. Был получен 90-процентный иммунитет, но он был недолговечным, так как исходный титр антител уменьшился через год [21]. Также была предпринята попытка превращения холерного токсина в токсоид в присутствии глутаральдегида и формалина, но это вызвало очень низкий уровень защиты, поскольку токсин является плохим антигеном [12].
В последние годы важность кишечного иммунного ответа проложила новое направление в разработке вакцины, т.е.е. переход от парентеральных вакцин к пероральным. Парентеральное введение антигенов вызывает стимуляцию секреторных антител (IgA, IgG и IgM), но антитела имеют короткую продолжительность жизни и плохую память [21]. Вопреки этому, пероральное введение антигенов вызывает иммунный ответ с более длительным сроком хранения и хорошей памятью, что является хорошей вакциной. Сывороточные антитела не вносят большого вклада в инфекцию холеры, поскольку V. cholera не проникает в эритроциты в процессе инфекции, а только колонизирует поверхности слизистой оболочки кишечника.Следовательно, для стимуляции выработки секреторных антител введение пероральной вакцины играет жизненно важную роль по сравнению с парентеральными вакцинами [12, 21].
FDA одобрило однократную живую оральную вакцину против холеры под названием Vaxchora (лиофилизированная сердечно-сосудистая болезнь 103-HgR) для возрастной группы 18–64 лет [21]. Хотя это не рекомендуется в обычной категории иммунизации, ее назначают путешественникам, которые переезжают в регион, где активно распространяются токсигенные вибрионы. Согласно текущему сценарию, не существует вакцины против холеры, которая обеспечивала бы 100% защиту, и вакцинация не рекомендуется ВОЗ в качестве профилактической меры для предотвращения холеры.
Исследуемые вакцины состоят из живых аттенуированных цельноклеточных вакцин и суспензий убитых бактерий, которые вводятся перорально.
5. Лабораторные исследования
5.1. Выделение и биохимическая идентификация бактерий
На основе соматических О-антигенов в настоящее время насчитывается около 130 серогрупп V. cholerae . Однако только серогруппа O1 вовлечена в эпидемию и пандемию холеры [12]. Выделение и идентификация В.cholerae серогруппы O1 или O139 из образца кала инфицированных людей является золотым стандартом в диагностике заболевания. Идеальным средством передачи информации являются средства массовой информации Кэри Блэра; однако также рекомендуется среда с щелочной пептонной водой (APW) (pH 8,5) [1, 12]. Культуральная среда представляет собой кровяной агар и агар МакКонки, селективной средой является агар с тиосульфат-цитрат-желчными солями (TCBS). Быстрый и предполагаемый диагноз холеры является наиболее важным фактором при постановке диагноза, и, следовательно, образец стула сразу после его получения исследуется на влажный препарат для выявления подвижности, проявляемой исключительно у видов Vibrio [9, 12 , 23].Таким образом, делается предположительная идентификация или вероятность заражения холерой, и проводится дальнейшее лечение.
Ночной рост (18–24 часа) V. cholerae на TCBS дает большие (2–4 мм в диаметре) колонии желтого цвета, слегка уплощенные с непрозрачными центрами и полупрозрачными перифериями. Желтый цвет обусловлен ферментацией сахарозы в среде TCBS. Вибрионы, не ферментирующие сахарозу, такие как V. parahaemolyticus , образуют колонии от зеленого до сине-зеленого цвета.На агаре МакКонки колонии представляют собой колонии позднего ферментирования лактозы, изначально не являющиеся ферментерами лактозы [23]. Желтые колонии на агаре TCBS изображены на рисунке 2.
Рисунок 2.
Морфология колоний V. cholerae на TCBS — колонии желтого цвета.
Таблица 1 взята из «Лабораторные методы диагностики V. cholerae », Центры по контролю и профилактике заболеваний [12].
| Биохимические тесты | Реакция |
|---|---|
| Оксидаза Струнный тест Железный агар Клиглера Тройной сахарный железный агар Глюкоза (производство кислоты) (производство газа) Лизин Аргинин Орнитин Voges-Proskauer | Положительный Положительный K / A, без газа, без H 2 S A / A, без газа, без H 2 S Положительный Отрицательный Положительный Положительный Отрицательный Положительный Переменная * |
Таблица 1.
Биохимическая характеристика изолятов V. cholerae О1.
*Большинство изолятов V. cholerae серотипа O1 биотипа Эль Тор являются положительными в тесте Фогеса-Проскауэра, тогда как классические штаммы биотипа отрицательны.
5.2. Серологическая идентификация
Как обсуждалось ранее, существует более 130 серогрупп V. cholerae, среди которых серогруппа O1 является возбудителем большинства эпидемий и пандемий.Серологическая идентификация серогруппы V. cholera O1 проводится с помощью теста агглютинации со специфической антисывороткой. Это наиболее быстрый и специфический метод выявления V. cholerae O1 [16].
Изоляты серогруппы O1 подразделяются на три серотипа, а именно, Огава, Инаба и Хикодзима (редко). Штаммы, положительные по отношению к поливалентной антисыворотке к O1, дополнительно тестируются на агглютинацию с антисыворотками Ogawa и Inaba. В некоторых случаях могут быть штаммы, которые агглютинируют очень сильно и в равной степени с антисыворотками Огава и Инаба.Если когда-либо подозреваются такие редкие реакции, эти штаммы следует направить в референс-лабораторию для дальнейшего подтверждения и могут обозначаться как «возможный серотип Хикодзима» [9, 12].
Таблица 2 взята из «Лабораторные методы диагностики V. cholerae », Центры по контролю и профилактике заболеваний [12].
| Серотип | Основные присутствующие O-факторы | Агглютинация в абсорбированных сыворотках | ||||||
|---|---|---|---|---|---|---|---|---|
| Ogawa | Inaba | |||||||
| Инаба | A, C | — | + | |||||
| Hikojima | A, B, C | + | + | |||||
| Свойство | Реакция | ||
|---|---|---|---|
| Классический | El Tor | ||
| Voges-Proskauer (модифицированный с 1% NaCl) | Зона вокруг полимиксина В (50 ЕД) | + | — |
| Агглютинация эритроцитов цыплят | — | + | |
| V | + — | — + | |
| Гемолиз | — | Столик + | |
Дифференциация классических биотипов и биотипов Эльтора V. cholerae серогруппы О1.
5.4. Анализы на токсины
Вирулентность серогруппы O1 выражается в продукции токсина СТ. Молекула СТ включает одну субъединицу А (активную) и пять субъединиц В (связывающую). Субъединица B присоединяется к ганглиозидным рецепторам GM1 на эпителиальных клетках слизистой оболочки кишечника в процессе инфекции. После этого процесса между субъединицами происходит расщепление, чтобы облегчить проникновение компонента А в клетку.Компонент A1 отвечает за стимуляцию аденилатциклазы, которая, в свою очередь, продуцирует циклический АМФ (цАМФ) [3, 12]. Повышенное внутриклеточное производство цАМФ приводит к нарушению прохождения электролитов через клеточную мембрану, что приводит к секреции жидкости в тонком кишечнике. Когда жидкость, поступающая в кишечник, превышает ее реабсорбционную способность, это приводит к диарее [12, 23]. Токсин СТ похож на Escherichia coli ( E. coli) термолабильный токсин (LT) как по антигенам, так и по механизму.Таким образом, большинство анализов по выявлению токсинов являются общими для CT и LT. Механизм действия CT хорошо объяснен в разделе «Механизм патогенеза» и проиллюстрирован на рисунке 2.
Перед тестированием на токсин изолят должен быть подтвержден как штамм V.cholera O1. Серогруппы, не относящиеся к O1, также продуцируют СТ или другие токсины, подобные термолабильному энтеротоксину или токсину шига, но эти токсины не имеют диагностической ценности, поскольку они еще не были связаны с эпидемическими заболеваниями [12].
5.4.1. Биотесты
5.4.1.1. Методы на животных
Первым анализом энтеротоксина холеры был метод петли подвздошной кишки взрослого кролика в 1950-х годах, при котором энтеротоксин вводили в лигированные сегменты кишечника (петли подвздошной кишки) экспериментальных животных, таких как кролики, свиньи, собаки и телята, и это вызвало скопление жидкости. Этот механизм обычно используется для изучения механизма CT, термолабильного токсина E. coli и других токсинов. Бесклеточный супернатант вводят в каждую петлю подвздошной кишки после экстериоризации и лигирования тонкой кишки кролика, после чего брюшную полость закрывают на 18 часов.Количество жидкости, скопившейся из-за стимуляции токсином, измеряется путем измерения петель после удаления кишечника [12]. Недостатком этой модели является то, что она трудоемка, громоздка и трудна для стандартизации.
Другая модель была разработана в 1955 году, модель инфекции младенцев кролика, которая также использовалась для определения различных токсинов. Здесь 7-дневного младенца кролика заражают тестовой культурой либо путем желудочной интубации, либо путем внутрипросветной инъекции.Положительный результат теста приводит к водянистой диарее кролика и возможной смерти из-за обезвоживания. Тонкая кишка удаляется, и петли измеряются для количественного определения накопления избыточной жидкости [8]. Недостатком этой процедуры является требование одного животного на тестовый образец.
Анализ фактора проницаемости сосудов представляет собой кожный тест, в котором активность CT или LT определяется нейтрализацией стандартизованного количества специфической антисыворотки против CT. Здесь можно ввести 20–30 супернатантов на кролика.Бесклеточный супернатант вводят кролику внутрикожно, после чего внутривенно вводят синий краситель Эванса. Повышенная проницаемость капилляров, опосредованная КТ, приводит к перфузии красителя в коже, вызывая синюю окраску с локализованным уплотнением в месте инъекции. Диаметр изменения цвета и уплотнения измеряют с помощью отрицательного контроля [1, 12].
5.4.1.2. Методы культивирования тканей
Методы культивирования тканей в настоящее время широко используются в лабораториях для определения токсинов.Это требует наличия квалифицированных специалистов и оборудования в лаборатории с существующим оборудованием для культивирования тканей. Это очень чувствительный анализ с высокой воспроизводимостью. Помимо обнаружения токсинов, эти анализы также полезны для обнаружения нейтрализующих токсин антител.
Клеточные линии яичников китайского хомячка (СНО) и Y1 мышиных надпочечников (Y1) используются для анализа CT и LT, хотя также используются клетки почек обезьян Vero. Токсин, если он присутствует в бесклеточном супернатанте, увеличивает внутриклеточную продукцию цАМФ в клеточных линиях.Об этом можно судить по морфологическим изменениям в клеточных линиях (клетки Y1 округлые, а клетки CHO удлиненные) [7, 12].
5.4.2. Иммуноанализы
5.4.2.1. Elisa
Поскольку CT и LT иммуногенны как для людей, так и для животных, было разработано множество иммуногенных анализов для обнаружения присутствия токсинов in vitro. Как обсуждалось ранее, ганглиозид GM1 является естественным рецептором СТ. В методе ELISA этот ганглиозидный рецептор GM1 очищают и используют для подготовки иммуноферментного анализа с захватом ганглиозидов.Бесклеточный супернатант, в котором должна быть исследована токсичность, добавляют в лунки для микротитрования, покрытые ганглиозидом GM1. Затем на планшет добавляется антисыворотка против CT для обнаружения связывания токсина со связанным рецептором на планшете с последующим добавлением конъюгированного с ферментом антиглобулинового антитела [12].
5.4.2.2. Латексная агглютинация
В этом анализе высокоочищенные специфические анти-CT связываются с частицами латекса. На рынке доступна коммерческая версия набора, которая позволяет легко определять токсины холеры в лаборатории.
5.4.3. Анализ на основе ДНК
5.4.3.1. Полимеразная цепная реакция (ПЦР)
ПЦР — это молекулярный подход, основанный на конкретных последовательностях ДНК. В ПЦР фермент ДНК-полимераза используется для амплификации определенных специфических последовательностей ДНК (ампликонов), которые могут быть обнаружены на агарозном геле или с помощью специфических ДНК-зондов [23]. Токсигенность V. cholerae можно определить с помощью ПЦР и праймеров, которые специфически амплифицируют только гены CT. Преимущество ПЦР заключается в том, что для нее не требуется чистая культура или даже жизнеспособные штаммы.Токсигенность организма можно определить по инфицированным образцам стула, загрязненной воде или образцам пищи, таким образом определяя присутствие Vibrio даже без его культивирования. Метод ПЦР также имеет преимущество в обнаружении токсинов СТ, которые продуцируются в очень низких количествах определенными штаммами, путем выявления принадлежащих им генов СТХ [12, 23]. Технические проблемы, связанные с радиоизотопными метками, были решены с помощью нерадиоактивных меток ДНК, таких как биотин и дигоксигенин.Помимо того факта, что анализы на основе ДНК требуют квалифицированных профессионалов и сложных лабораторий, эти методы обеспечивают надежные, конкретные и быстрые результаты в отличие от традиционных методов.
Таблица 4 взята из «Лабораторных методов диагностики Vibrio cholerae », Центры по контролю и профилактике заболеваний [12].
| Анализ | Чувствительность (на мл) | Тип анализа | Конкретная цель анализа | Образец протестирован | ||||
|---|---|---|---|---|---|---|---|---|
| 905 905 905 902 905 905 902 902 | Стимуляция накопления жидкости | Супернатант культуры | ||||||
| Анализ на кроликах | 250–500 нг | Биотест | Стимуляция накопления жидкости | Кожный бульон / супернатант | Тест на кроликах | |||
| Биоанализ | Фактор проницаемости | Надосадочная жидкость культуры | ||||||
| Клетки надпочечников Y1 мыши | 10 пг | Биотест | Накопление цАМФ | |||||
| Накопление цАМФ | ||||||||
| Надосадочная жидкость | китайских клеток 10 пг | Биологический анализ | Накопление цАМФ | Супернатант культуры | ||||
| GM1-ELISA | 10 пг | Иммунный | Субъединица В | 905 905 905 905 905 905 | 905 905 905 905 215 Субъединица B | Супернатант культуры | ||
| Обратная пассивная латексная агглютинация | 1-2 нг | Иммунная | Субъединица B | Супернатант культуры | ||||
| Генетический ген | ||||||||
| Обнаруживает ген Ct325 905 | ДНК (колониальный блот) |
Таблица 4.
Обычно используемые анализы для обнаружения токсина холеры.
6. Заключение
V. cholerae — один из наиболее успешных возникающих и повторно появляющихся патогенов, в жизненном цикле которого присутствуют как человеческие, так и экологические компоненты. Эпидемия и пандемия V. cholerae , особенно V. cholerae O139, стали поворотным моментом в истории самой страшной диарейной болезни — холеры. Обычных методов скрининга и идентификации этих грамотрицательных подвижных бацилл недостаточно для быстрой диагностики холеры.Хотя молекулярные методы были разработаны для идентификации большинства серотипов и биотипов V. cholerae, наиболее важным фактором борьбы с эпидемией и пандемией страшного, смертельного и опасного для жизни заболевания является санитарная обработка пищевых продуктов и воды. как важнейшая профилактическая мера. Индия, Бангладеш и Шри-Ланка были жертвами эпидемий холеры, и теперь она поражает множество стран. Как развивающиеся страны, заинтересованные правительства вместе с медицинскими работниками должны разработать определенные меры безопасности и убедить всех людей в необходимости санитарной обработки и обеспечения чистоты систем питания и воды.Наряду с вышеуказанными профилактическими мерами, исследователи и медицинские работники находятся на пороге создания эффективной вакцины, которая позволит укрепить иммунную систему людей. Как упоминалось в этой главе, антигенная изменчивость и смещение организма являются препятствиями для производства эффективной вакцины. Если люди получают широкую иммунизацию, возникает коллективный иммунитет с уменьшением степени загрязнения окружающей среды.
6,1. Перспективы главы
Центры по контролю и профилактике заболеваний (CDC) всегда на шаг впереди в расследовании любых вспышек холеры по всему миру.У них есть обученные профессионалы и сложные лабораторные протоколы для выявления токсигенных вибрионов и появления любого нового антигенно-модифицированного штамма, как вспышка на Гаити. ВОЗ в сотрудничестве с CDC также предоставляет информацию общественности и должностным лицам здравоохранения о необходимости надлежащей санитарии и превентивных мер контроля для преодоления страшной болезни. Антигенная вариация штаммов V. cholerae является одним из основных ограничений и препятствий в разработке 100% защитной вакцинации против него.Успешное создание эффективной вакцины проложит путь к избавлению планеты от холеры, так что развитые и развивающиеся страны не смогут больше противостоять эпидемиям, подобным эпидемиям на Гаити и Западной Бенгалии O139.
Холера: как паразиты делают бактерии патогенными
близко- EN
- FR
Введите ваши ключевые слова
- Институт Пастера
- История
- Альфонс Лаверан (1845-1922)
- Андре Львов (1902–1994)
- Шарль Николь (1866-1936)
- Даниэль Бове (1907-1992)
- Франсуа Жакоб (1920-2013)
- Франсуаза Барре-Синусси, 1947 года рождения
- Илья Мечников, Эли Мечников на французском языке (1845-1916)
- Жак Моно (1910-1976)
- Жюль Борде (1870-1961)
- Люк Монтанье, 1932 г.р.
- Ранние годы 1847-1862 гг.
- Последние годы
- Средние годы 1862-1877
- Институт в цифрах
- Институт Пастера во всем мире
- Новости
- «Мы осуществили некоторые из наших мечтаний по развитию науки в Африке»
- В ближайшее время в Китае будет создана 4-летняя исследовательская группа
- A Глобальное картирование комаров-переносчиков вируса Зика
- Совместное подразделение Pasteur International по противодействию эволюции вирусов
- Обнародован новый механизм выживания туберкулезной палочки
- Проект по укреплению национальных комитетов по этике во франкоязычных странах Африки
- Микробиота кишечника комаров Aedes aegypti определена с экологической точки зрения
- Аньес Бузин, министр солидарности и здравоохранения посетила векторную площадку Института Пастера де ла Гайана
- Предвидение и быстрое реагирование на вспышки: консорциум выиграл премию Galien MedStartUp
- Птичий грипп: рынки Камбоджи под усиленным наблюдением
- Можем ли мы сделать человеческую чуму историей?
- Клод Фламанд: прогнозирование эпидемий с помощью спутниковых снимков
- Д-р Эми Кристин Бей возглавит новую четырехлетнюю исследовательскую группу по малярии в Дакаре
- Доктор.Дидье Кумави Экуеви выиграл премию Дедондер-Клейтон 2018
- Доктор Ричард Нджуом, лауреат Премии Дедондера-Клейтона 2017 г.
- Элизабет Карниэль назначена генеральным директором Центра Пастера в Камеруне
- Эллиот Ракотоманана, антрополог против недоедания на Мадагаскаре
- Пятеро молодых исследователей из Международной сети Института Пастера приняли участие в церемонии открытия докторантов 2017 года
- Пятеро молодых исследователей из Международной сети Института Пастера на церемонии открытия докторской степени в 2018 году
- Загрязнение пищевых продуктов в Камбодже, усугубляющее бремя устойчивости к антибиотикам
- Четыре молодых исследователя из Международной сети Института Пастера присутствуют на церемонии вручения аспирантов 2019 года
- Халима Майнассара: от полевого следователя до директора CERMES в Нигере
- Гепатит B: для более точного выявления пациентов, которым необходимо лечение в Африке
- Высокая частота неонатальных инфекций на Мадагаскаре
- В память о докторе Франсуа Руэ
- В память о докторе Ву Тхи Ку Хыонг
- Institut Pasteur и Университет Хамада бин Халифы будут сотрудничать в области обучения в области исследования генома, точной медицины и профилактики заболеваний
- Institut Pasteur de Dakar: 4-летняя исследовательская группа «Биостатистика, биоинформатика и моделирование» объединяет панафриканскую сеть биоинформатики h4ABioNet
- Международный семинар в Иране по усилению эпиднадзора и контроля над бешенством
- Малярия: белок MSP4 Plasmodium falciparum является потенциальной мишенью для вакцины
- Мамаду Алиу Барри, борец с эпидемиями в Сенегале
- MediLabSecure: 4 года повышения безопасности здоровья против трансмиссивных болезней в Средиземноморье и Черноморском регионах
- Медицинская энтомология для наблюдения за трансмиссивными болезнями, объяснение в моушн-дизайне
- Мерием Бен Али: лучший диагноз иммунодефицита в Тунисе
- Моритоши Ивагами выиграл премию Роберта Дешиенса 2018 года
- Многоцентровое исследование выявило бактерии Leptospira, циркулирующие в Уругвае
- Запущен проект Национальной лаборатории здравоохранения
- Новая научная платформа Pasteur-USP в Бразилии для борьбы с неврологическими расстройствами с помощью единого подхода к здоровью
- Международная сетевая ассоциация Пастера поддержала 3 заявления на Всемирной ассамблее здравоохранения 2018 г.
- Коклюш: прогресс, но отсутствие эпиднадзора
- Бешенство: более короткий и дешевый график вакцинации при подозрении на укус бешеной собаки
- Обновление статуса Международной сетевой ассоциации Пастера как «негосударственного субъекта, имеющего официальные отношения» с ВОЗ
- Отчет о 49-м заседании Совета директоров Международной сети Института Пастера в Абиджане
- Исследователи из Института Пастера во Французской Гвиане описывают сохранение вируса Зика в сперме
- Исследователи из Института Пастера в Иране и Французской Гвиане выиграли премию «Талант Пастера» 2018 года
- Деревня Рока в Камбодже: история ятрогенной ВИЧ-инфекции
- Турнир Романа Тибо с бактериальной броней
- Шесть организаций, входящих в международную сеть Institut Pasteur, участвуют в международной коалиции против эпидемий в Африке
- Спенсер Шорте назначен главным научным сотрудником Института Пастера, Корея
- Резкое повышение устойчивости к антибиотикам в Камбодже
- Успешный второй международный курс медицинской энтомологии во Вьентьяне, Лаос
- Премия «Князь Монако Альбер II — Институт Пастера» 2019 года присуждена Иоакиму Роклову.
- 49-й Совет директоров Международной сети Института Пастера состоится в Абиджане
- Посол Китая во Франции посещает Институт Пастера
- Трехстороннее соглашение FioCruz-Pasteur-USP приносит свои плоды
- Международная сеть Института Пастера вступает в альянс GloPID-R
- Международная сеть Института Пастера отдает дань уважения профессору Огобара Думбо
- Institut Pasteur de Guinée открывает свою первую лабораторию в Конакри
- Institut Pasteur de Nouvelle-Calédonie описывает 12 новых видов лептоспир и отдает дань уважения пастеровцам
- Институт Пастера во Французской Гвиане подтвердил случай желтой лихорадки
- Институт Пастера запускает научную платформу в Центре исследований и инноваций университета Сан-Паулу
- Первая награда «Международный талант Пастера» двум молодым ученым из Института Пастера в Гваделупе и Монтевидео
- Курсу медицинской энтомологии в Институте Пастера исполняется 30 лет
- Три проекта Института Пастера в Дакаре и Мадагаскаре, выбранные для финансирования AESA Grand Challenge Africa
- Двенадцать новых видов Leptospira обнаружены в почвах Новой Каледонии
- Вакцины: страхование жизни человечества
- Вирусный гепатит: проблема коммуникации в Африке
- Wolbachia, бактерии для борьбы с денге
- Вирус Зика в Тихом океане: влияние географического контекста на возникновение вспышки
- Международная сеть Института Пастера
- Миссии Международной сети Института Пастера
- Организация международной сети institut pasteur
- Полезные ресурсы
- Средства связи
- Отчеты международной сети Institut Pasteur
- Международные исследовательские программы
- Детское недоедание
- Болезнь кисти, стопы и рта
- Эпиднадзор и оповещения о состоянии здоровья
- Новости
- Музей
- Коллекции
- Документально-справочные материалы
- Коллекции
- Наши обязательства
- Оценка выбросов парниковых газов
- Соседский район
- Использование животных в исследовательских программах Института Пастера
- Конференц-центр
- История
- Наши миссии
- Исследования
- Клеточная биология и инфекции
- Центр ресурсов и исследований животных (C2RA)
- Центр глобального здравоохранения (CGH)
- Центр технологических ресурсов и исследований (C2RT)
- Кафедра вычислительной биологии
- Департамент глобального здравоохранения
- Биология развития и стволовых клеток
- Геномы и генетика
- Институт слуха
- Микробиология
- Микология
- Неврология
- Паразиты и насекомые-переносчики
- Структурная биология и химия
- Центр трансляционных наук
- Центр биоинформатики, биостатистики и интегративной биологии (C3BI)
- Отделение иммунологии
- Вирусология
- Образование
- Здоровье
- Инновации
- Стратегический план на 2019-2023 годы
- Благоприятная технологическая среда
- Устойчивость к противомикробным препаратам
- Бактерии
- Грибки
- Паразиты
- Поперечный
- Векторы
- Вирусы
- Мозговые связи и нейродегенеративные заболевания
- Инициатива рака в Институте Пастера
- Биология рака
- Рак и микробы
- Новые диагностические подходы и инновационные методы лечения
- Возникающие инфекционные болезни
- Взаимодействие патоген-хозяин (32 объекта)
- Динамика возникновения и передачи инфекционных заболеваний
- Новые подходы к диагностике, вакцинации и терапии (12 организаций)
- Биология патогенов (12 единиц)
- Геномика патогенов и микробиота (8 объектов)
- Взаимодействия вектор-патоген (4 объекта)
- Решение проблем здравоохранения 21 века
- Совместные действия в области вакцинологии
- Инициатива в области вакцинологии и иммунотерапии: клинические исследования
- Инициатива по вакцинологии и иммунотерапии: фундаментальные исследования
- Инициатива в области вакцинологии и иммунотерапии: инновации — вакцины-кандидаты
- Исследования
- Поддержите нас
- Как нас поддержать
- Завещание, пожертвования и страхование жизни
- Консультации для профессионалов
- Завещания
- Глоссарий
- Полисы страхования жизни
- Нотариально заверенные пожертвования
- Компании и фонды
- Индивидуальное партнерство
- Налог на ученичество
- На международном уровне
- В обмен на вашу поддержку
- Присоединяйтесь к Pasteurdon!
- Наши сторонники
- Sanofi — Institut Pasteur Awards
- Сбор средств для Института Пастера
- Наследие, нотариально заверенные пожертвования и полисы страхования жизни
- Программа крупных доноров
- Другие способы дачи
- Уменьшение ISF
- Обычная поддержка или разовый подарок
- Пожертвования, не облагаемые налогом
- Завещание, пожертвования и страхование жизни
- Как нас поддержать
Эбола, чума, холера, атипичная пневмония… Новые вирусы, непредсказуемая угроза — Новости Института Пастера
близко- EN
- FR
Введите ваши ключевые слова
- Институт Пастера
- История
- Альфонс Лаверан (1845-1922)
- Андре Львов (1902–1994)
- Шарль Николь (1866-1936)
- Даниэль Бове (1907-1992)
- Франсуа Жакоб (1920-2013)
- Франсуаза Барре-Синусси, 1947 года рождения
- Илья Мечников, Эли Мечников на французском языке (1845-1916)
- Жак Моно (1910-1976)
- Жюль Борде (1870-1961)
- Люк Монтанье, 1932 г.р.
- Ранние годы 1847-1862 гг.
- Последние годы
- Средние годы 1862-1877
- Институт в цифрах
- Институт Пастера во всем мире
- Новости
- «Мы осуществили некоторые из наших мечтаний по развитию науки в Африке»
- В ближайшее время в Китае будет создана 4-летняя исследовательская группа
- A Глобальное картирование комаров-переносчиков вируса Зика
- Совместное подразделение Pasteur International по противодействию эволюции вирусов
- Обнародован новый механизм выживания туберкулезной палочки
- Проект по укреплению национальных комитетов по этике во франкоязычных странах Африки
- Микробиота кишечника комаров Aedes aegypti определена с экологической точки зрения
- Аньес Бузин, министр солидарности и здравоохранения посетила векторную площадку Института Пастера де ла Гайана
- Предвидение и быстрое реагирование на вспышки: консорциум выиграл премию Galien MedStartUp
- Птичий грипп: рынки Камбоджи под усиленным наблюдением
- Можем ли мы сделать человеческую чуму историей?
- Клод Фламанд: прогнозирование эпидемий с помощью спутниковых снимков
- Д-р Эми Кристин Бей возглавит новую четырехлетнюю исследовательскую группу по малярии в Дакаре
- Доктор.Дидье Кумави Экуеви выиграл премию Дедондер-Клейтон 2018
- Доктор Ричард Нджуом, лауреат Премии Дедондера-Клейтона 2017 г.
- Элизабет Карниэль назначена генеральным директором Центра Пастера в Камеруне
- Эллиот Ракотоманана, антрополог против недоедания на Мадагаскаре
- Пятеро молодых исследователей из Международной сети Института Пастера приняли участие в церемонии открытия докторантов 2017 года
- Пятеро молодых исследователей из Международной сети Института Пастера на церемонии открытия докторской степени в 2018 году
- Загрязнение пищевых продуктов в Камбодже, усугубляющее бремя устойчивости к антибиотикам
- Четыре молодых исследователя из Международной сети Института Пастера присутствуют на церемонии вручения аспирантов 2019 года
- Халима Майнассара: от полевого следователя до директора CERMES в Нигере
- Гепатит B: для более точного выявления пациентов, которым необходимо лечение в Африке
- Высокая частота неонатальных инфекций на Мадагаскаре
- В память о докторе Франсуа Руэ
- В память о докторе Ву Тхи Ку Хыонг
- Institut Pasteur и Университет Хамада бин Халифы будут сотрудничать в области обучения в области исследования генома, точной медицины и профилактики заболеваний
- Institut Pasteur de Dakar: 4-летняя исследовательская группа «Биостатистика, биоинформатика и моделирование» объединяет панафриканскую сеть биоинформатики h4ABioNet
- Международный семинар в Иране по усилению эпиднадзора и контроля над бешенством
- Малярия: белок MSP4 Plasmodium falciparum является потенциальной мишенью для вакцины
- Мамаду Алиу Барри, борец с эпидемиями в Сенегале
- MediLabSecure: 4 года повышения безопасности здоровья против трансмиссивных болезней в Средиземноморье и Черноморском регионах
- Медицинская энтомология для наблюдения за трансмиссивными болезнями, объяснение в моушн-дизайне
- Мерием Бен Али: лучший диагноз иммунодефицита в Тунисе
- Моритоши Ивагами выиграл премию Роберта Дешиенса 2018 года
- Многоцентровое исследование выявило бактерии Leptospira, циркулирующие в Уругвае
- Запущен проект Национальной лаборатории здравоохранения
- Новая научная платформа Pasteur-USP в Бразилии для борьбы с неврологическими расстройствами с помощью единого подхода к здоровью
- Международная сетевая ассоциация Пастера поддержала 3 заявления на Всемирной ассамблее здравоохранения 2018 г.
- Коклюш: прогресс, но отсутствие эпиднадзора
- Бешенство: более короткий и дешевый график вакцинации при подозрении на укус бешеной собаки
- Обновление статуса Международной сетевой ассоциации Пастера как «негосударственного субъекта, имеющего официальные отношения» с ВОЗ
- Отчет о 49-м заседании Совета директоров Международной сети Института Пастера в Абиджане
- Исследователи из Института Пастера во Французской Гвиане описывают сохранение вируса Зика в сперме
- Исследователи из Института Пастера в Иране и Французской Гвиане выиграли премию «Талант Пастера» 2018 года
- Деревня Рока в Камбодже: история ятрогенной ВИЧ-инфекции
- Турнир Романа Тибо с бактериальной броней
- Шесть организаций, входящих в международную сеть Institut Pasteur, участвуют в международной коалиции против эпидемий в Африке
- Спенсер Шорте назначен главным научным сотрудником Института Пастера, Корея
- Резкое повышение устойчивости к антибиотикам в Камбодже
- Успешный второй международный курс медицинской энтомологии во Вьентьяне, Лаос
- Премия «Князь Монако Альбер II — Институт Пастера» 2019 года присуждена Иоакиму Роклову.
- 49-й Совет директоров Международной сети Института Пастера состоится в Абиджане
- Посол Китая во Франции посещает Институт Пастера
- Трехстороннее соглашение FioCruz-Pasteur-USP приносит свои плоды
- Международная сеть Института Пастера вступает в альянс GloPID-R
- Международная сеть Института Пастера отдает дань уважения профессору Огобара Думбо
- Institut Pasteur de Guinée открывает свою первую лабораторию в Конакри
- Institut Pasteur de Nouvelle-Calédonie описывает 12 новых видов лептоспир и отдает дань уважения пастеровцам
- Институт Пастера во Французской Гвиане подтвердил случай желтой лихорадки
- Институт Пастера запускает научную платформу в Центре исследований и инноваций университета Сан-Паулу
- Первая награда «Международный талант Пастера» двум молодым ученым из Института Пастера в Гваделупе и Монтевидео
- Курсу медицинской энтомологии в Институте Пастера исполняется 30 лет
- Три проекта Института Пастера в Дакаре и Мадагаскаре, выбранные для финансирования AESA Grand Challenge Africa
- Двенадцать новых видов Leptospira обнаружены в почвах Новой Каледонии
- Вакцины: страхование жизни человечества
- Вирусный гепатит: проблема коммуникации в Африке
- Wolbachia, бактерии для борьбы с денге
- Вирус Зика в Тихом океане: влияние географического контекста на возникновение вспышки
- Международная сеть Института Пастера
- Миссии Международной сети Института Пастера
- Организация международной сети institut pasteur
- Полезные ресурсы
- Средства связи
- Отчеты международной сети Institut Pasteur
- Международные исследовательские программы
- Детское недоедание
- Болезнь кисти, стопы и рта
- Эпиднадзор и оповещения о состоянии здоровья
- Новости
- Музей
- Коллекции
- Документально-справочные материалы
- Коллекции
- Наши обязательства
- Оценка выбросов парниковых газов
- Соседский район
- Использование животных в исследовательских программах Института Пастера
- Конференц-центр
- История
- Наши миссии
- Исследования
- Клеточная биология и инфекции
- Центр ресурсов и исследований животных (C2RA)
- Центр глобального здравоохранения (CGH)
- Центр технологических ресурсов и исследований (C2RT)
- Кафедра вычислительной биологии
- Департамент глобального здравоохранения
- Биология развития и стволовых клеток
- Геномы и генетика
- Институт слуха
- Микробиология
- Микология
- Неврология
- Паразиты и насекомые-переносчики
- Структурная биология и химия
- Центр трансляционных наук
- Центр биоинформатики, биостатистики и интегративной биологии (C3BI)
- Отделение иммунологии
- Вирусология
- Образование
- Здоровье
- Инновации
- Стратегический план на 2019-2023 годы
- Благоприятная технологическая среда
- Устойчивость к противомикробным препаратам
- Бактерии
- Грибки
- Паразиты
- Поперечный
- Векторы
- Вирусы
- Мозговые связи и нейродегенеративные заболевания
- Инициатива рака в Институте Пастера
- Биология рака
- Рак и микробы
- Новые диагностические подходы и инновационные методы лечения
- Возникающие инфекционные болезни
- Взаимодействие патоген-хозяин (32 объекта)
- Динамика возникновения и передачи инфекционных заболеваний
- Новые подходы к диагностике, вакцинации и терапии (12 организаций)
- Биология патогенов (12 единиц)
- Геномика патогенов и микробиота (8 объектов)
- Взаимодействия вектор-патоген (4 объекта)
- Решение проблем здравоохранения 21 века
- Совместные действия в области вакцинологии
- Инициатива в области вакцинологии и иммунотерапии: клинические исследования
- Инициатива по вакцинологии и иммунотерапии: фундаментальные исследования
- Инициатива в области вакцинологии и иммунотерапии: инновации — вакцины-кандидаты
- Исследования
- Поддержите нас
- Как нас поддержать
- Завещание, пожертвования и страхование жизни
- Консультации для профессионалов
- Завещания
- Глоссарий
- Полисы страхования жизни
- Нотариально заверенные пожертвования
- Компании и фонды
- Индивидуальное партнерство
- Налог на ученичество
- На международном уровне
- В обмен на вашу поддержку
- Присоединяйтесь к Pasteurdon!
- Наши сторонники
- Sanofi — Institut Pasteur Awards
- Сбор средств для Института Пастера
- Наследие, нотариально заверенные пожертвования и полисы страхования жизни
- Программа крупных доноров
- Другие способы дачи
- Уменьшение ISF
- Обычная поддержка или разовый подарок
- Пожертвования, не облагаемые налогом
- Завещание, пожертвования и страхование жизни
- Почему нас поддерживают?
- Ты нам нужен
- Часто задаваемые вопросы о донорах
- Донорская зона
- Как нас поддержать
- Медицинский центр
- Листы болезней
- Исследовательский журнал
- Найти в журнале
- Отчеты
- СПИД: прогресс и новая надежда
- Болезни Альцгеймера и Паркинсона — современное состояние исследований
- Болезнь Альцгеймера: новые пути диагностики и лечения
- Антибиотики: когда бактерии сопротивляются
- В сердце мозга
- Аутизм — следуя генетическому примеру
- Аутизм: уникальное событие в Институте Пастера
- Аутоиммунные заболевания: когда наша собственная защита обращается против нас
- Бросить вызов процессу старения
- Коронавирус SARS-CoV-2: взгляд назад на три месяца мобилизации против новой болезни (COVID-19)
- Эбола 2013-2016: извлеченные уроки и меры реагирования на новые эпидемии
- Эбола, чума, холера, атипичная пневмония… Новые патогены, непредсказуемая угроза
- Французский закон о биоэтике: оригинальный подход к участию в Национальной консультации по биоэтике
- От молекулярной биологии к стволовым клеткам
- Как большие данные революционизируют исследования в области здравоохранения
- Эволюционная генетика человека:
Холера: причины, симптомы и лечение
Холера — острая эпидемическая инфекционная болезнь.Он характеризуется водянистой диареей, сильной потерей жидкости и электролитов и сильным обезвоживанием. Это может быть фатальным.
Вызывается бактерией Vibrio cholera (V. cholera) .
Несмотря на простоту лечения, холера, по оценкам, ежегодно поражает от 3 до 5 миллионов человек и вызывает более 100 000 смертей во всем мире.
Из-за сильного обезвоживания высока летальность при отсутствии лечения, особенно среди детей и младенцев. У здоровых взрослых людей смерть может наступить в течение нескольких часов.Те, кто выздоравливает, обычно обладают долгосрочным иммунитетом против повторного заражения.
Холера была распространена в Соединенных Штатах в 1800-х годах, но сейчас она встречается редко, потому что там хорошо развиты санитарные системы и условия жизни.
Однако, путешествуя в Азию, Африку и некоторые части Латинской Америки, люди должны защитить себя от холеры, предварительно сделав соответствующие прививки, выпив только кипяченую воду или воду из запечатанных бутылок и соблюдая надлежащие методы мытья рук.
Причина холеры — инфицирование бактериями V. cholera . Эти бактерии были открыты в 1883 году.
Немецкий бактериолог Роберт Кох (1843-1910) изучал болезнь во время эпидемии в Египте. Он обнаружил бактерии в кишечнике умерших от холеры, но не смог ни изолировать организм, ни заразить животных.
Позже в том же году Кох отправился в Индию, где ему удалось изолировать бактерии. Он обнаружил, что они процветают во влажном, грязном белье и влажной земле, а также в стуле больных.
Бактерии V. cholera живут в мелкой соленой воде на микроскопических ракообразных. Они также могут существовать в виде колоний биопленок, покрывающих поверхность воды, растений, камней, раковин и тому подобного, и они могут жить среди яиц мошек, которые служат резервуаром для бактерий холеры.
Токсичные штаммы бактерий холеры производят яд, вызывающий у людей сильную диарею.
Когда бактерии попадают в районы проживания людей, они могут быстро вызвать серьезные эпидемии.Изменения погоды, убыль населения и улучшение санитарных условий могут положить конец вспышке.
Лишь около 1 из 20 случаев заражения холерой являются тяжелыми, и у большого процента инфицированных людей симптомы отсутствуют.
Если симптомы появятся, они появятся через 12 часов и 5 дней после заражения. Они варьируются от легких или бессимптомных до тяжелых.
Обычно они включают:
- большие объемы взрывоопасной водянистой диареи, иногда называемой «рисовым водяным стулом», потому что она может выглядеть как вода, которую использовали для мытья риса
- рвота
- судороги ног
Человек, больной холерой может быстро терять жидкость, до 20 литров в день, поэтому может возникнуть сильное обезвоживание и шок.
Признаки обезвоживания включают:
- дряблую кожу
- запавшие глаза
- сухость во рту
- снижение секреции, например, меньшее потоотделение
- учащенное сердцебиение
- низкое кровяное давление
- головокружение или легкомысленность
- быстрая потеря веса
Шок может привести к коллапсу кровеносной системы. Это опасное для жизни состояние, требующее неотложной медицинской помощи.
Бактерии холеры попадают в организм через рот, часто в пище или воде, загрязненной отходами жизнедеятельности человека, из-за плохих санитарных условий и гигиены.
Они также могут проникнуть сюда, поедая сырые или не полностью приготовленные морепродукты, в частности моллюсков, произрастающих в устьях рек, таких как устрицы или крабы.
Плохо очищенные овощи, орошаемые из загрязненных источников воды, являются еще одним распространенным источником инфекции.
В ситуациях, когда санитария серьезно затруднена, например, в лагерях беженцев или общинах с очень ограниченными водными ресурсами, одна пострадавшая жертва может загрязнить всю воду для всего населения.
Врач может заподозрить холеру, если у пациента сильная водянистая диарея, рвота и быстрое обезвоживание, особенно если он недавно побывал в месте, где недавно была холера или плохие санитарные условия, или если он недавно ел моллюсков.
Образец стула будет отправлен в лабораторию для анализа, но при подозрении на холеру пациент должен начать лечение еще до получения результатов.
Обычно к смерти от холеры приводит обезвоживание, поэтому наиболее важным лечением является введение раствора для пероральной гидратации (ПРС), также известного как пероральная регидратационная терапия (ПРТ).
Процедура состоит из больших объемов воды, смешанной со смесью сахара и солей.
Расфасованные смеси имеются в продаже, но их широкое распространение в развивающихся странах ограничено стоимостью, поэтому часто используются домашние рецепты ПРС с обычными домашними ингредиентами.
В тяжелых случаях холеры требуется внутривенное восполнение жидкости. Взрослому человеку с массой тела 70 кг потребуется не менее 7 литров жидкости для внутривенного введения.
Антибиотики могут сократить продолжительность болезни, но ВОЗ не рекомендует массовое использование антибиотиков при холере из-за растущего риска бактериальной устойчивости.
Противодиарейные лекарства не используются, поскольку они препятствуют вымыванию бактерий из организма.
При надлежащем уходе и лечении уровень летальности должен составлять около 1 процента.
Холера часто передается через пищу и из-за плохой гигиены. Некоторые простые меры могут снизить риск заражения холерой.
Путешествуя по местам, где болезнь носит эндемический характер, важно:
- Ешьте только очищенные от кожуры фрукты.
- Избегайте салатов, сырой рыбы и сырых овощей.
- Убедитесь, что пища тщательно приготовлена.
- Убедитесь, что вода разлита в бутылки или кипячена и безопасна для употребления.
- Избегайте уличной еды, так как она может переносить холеру и другие заболевания.
Путешественникам следует узнать о холере, прежде чем посещать страну, где она широко распространена.
Людям следует немедленно обратиться за медицинской помощью, если они испытывают такие симптомы, как судороги в ногах, рвота и диарея, в сообществе, где существует заболевание.
Вакцина против холеры
В настоящее время Всемирная организация здравоохранения (ВОЗ) рекомендует три вакцины против холеры. Это Дукорал, Шанчол и Эувичол.
Для полной защиты всех трех требуется две дозы.
Dukoral необходимо запивать чистой водой, и он обеспечивает примерно 65-процентную защиту в течение 2 лет. Шанчол и Эвихол не нужно запивать водой, они обеспечивают 65-процентную защиту в течение 5 лет. Все вакцины обеспечивают более высокий уровень защиты ближе ко времени их введения.
Люди, наиболее подверженные риску употребления пищи или воды, инфицированные вирусом V. cholera , включают:
- людей, которые работают в сфере здравоохранения и лечат больных холерой
- спасателей, которые реагируют на вспышки холеры
- человек, которые путешествуют в районы, где все еще может передаваться холера, без соблюдения правил гигиены и безопасности пищевых продуктов
Широко распространяющиеся эпидемии холеры часто возникают из-за водоснабжения, загрязненного человеческими отходами, и уличных торговцев продуктами питания.

