Цитомегаловирусная инфекция у беременных — причины, симптомы, диагностика и лечение
Цитомегаловирусная инфекция у беременных — это клинически манифестное или латентно протекающее инфекционное заболевание, вызванное цитомегаловирусом, возникшее до зачатия или во время гестации. Проявляется гипертермией, катаральными симптомами, шейным и подчелюстным лимфаденитом, сиалоаденитом, общей интоксикацией, беловато-голубыми белями, реже — гепатомегалией, спленомегалией, генерализованной лимфаденопатией. Диагностируется с помощью серологических и молекулярных лабораторных методов. Лечение проводится специфическим человеческим иммуноглобулином, рекомбинантным альфа-2-интерфероном, при тяжелом течении — синтетическими аналогами нуклеозидов.
Общие сведения
Цитомегаловирусная инфекция (цитомегалия, ЦМВИ) — одно из наиболее распространенных инфекционных заболеваний, внутриутробно поражающих плод и вызывающих различные врожденные аномалии. В зависимости от региона антитела к цитомегаловирусу определяются у 40-98% пациенток репродуктивного возраста. Цитомегалия чаще встречается в группах населения с низким уровнем социального и экономического развития. В России серопозитивными к ЦМВИ являются до 90% женщин, инфицированность среди беременных старше 30 лет достигает 97-98%. В европейских странах врожденная цитомегалия выявляется с частотой 3-5 случаев на 1000 родов, в других государствах этот показатель составляет от 0,2 до 2,2%.
В зависимости от региона антитела к цитомегаловирусу определяются у 40-98% пациенток репродуктивного возраста. Цитомегалия чаще встречается в группах населения с низким уровнем социального и экономического развития. В России серопозитивными к ЦМВИ являются до 90% женщин, инфицированность среди беременных старше 30 лет достигает 97-98%. В европейских странах врожденная цитомегалия выявляется с частотой 3-5 случаев на 1000 родов, в других государствах этот показатель составляет от 0,2 до 2,2%.
Цитомегаловирусная инфекция у беременных
Причины
Заболевание вызывается крупным ДНК-содержащим цитомегаловирусом (ЦМВ), принадлежащим к семейству герпес-вирусов. Специалисты выделяют три штамма возбудителя, каждый из которых может самостоятельно инфицировать организм одного и того же человека. Заражение происходит до зачатия либо во время беременности. Вирусы пожизненно персистируют в организме женщины, поражая практически все виды тканей. Часть инфекционистов считает ЦМВ условно-патогенным микроорганизмом, клинически значимая реактивация которого наблюдается только при значительном угнетении иммунитета.
Усиление патогенности цитомегаловируса в гестационном периоде связано с физиологической иммуносупрессией, защищающей генетически чужеродный плод от отторжения. Под влиянием эстрогенов, прогестерона, кортизола у беременной уменьшается абсолютное и относительное количество Т-лимфоцитов, непосредственно участвующих в элиминации вирусов и поврежденных клеток, снижается их цитотоксичность. В результате ускоряется репликация цитомегаловирусов, они быстрее распространяются по организму и при недостаточном уровне защитных антител преодолевают плацентарный барьер.
Патогенез
Особенностью цитомегаловирусной инфекции является множественность путей заражения. Вирус распространяется аэрогенным, контактным, фекально-оральным, гемотрансфузионным, половым, вертикальным способами, в том числе трансплацентарно от беременной к плоду. Из-за сравнительно низкой вирулентности для инфицирования важен тесный контакт с зараженным. Возбудитель ЦМВИ определяется практически во всех биологических средах: слюне, крови, моче, слезной жидкости, ликворе, грудном молоке, цервикальном, вагинальном, уретральном секрете, сперме, слизи из прямой кишки, околоплодных водах.
После попадания в организм цитомегаловирусы адсорбируются на поверхности клеток, проникают в них, проходят полный цикл репликации ДНК, после чего сформированные вирионы распространяются на соседние клетки, с кровью разносятся по организму. Наиболее чувствителен к вирионам протоковый эпителий слюнных желез, в первую очередь околоушных, других экзокринных желез.
После лимфогенной и гематогенной генерализации обычно наступает фаза непродуктивной инфекции (скрытого носительства) с длительным сохранением вирусной частицы внутри зараженной клетки и передачей при делении дочерним клеткам. У женщин с нормальным иммунитетом клиническая манифестация не происходит, заболевание сразу приобретает характер носительства. Цитомегаловирус может длительное время персистировать в неактивной форме в чувствительных клетках. Проникновение ЦМВ в лимфоциты и мононуклеары обеспечивает его защиту от противовирусных антител.
При падении иммунитета у беременных возможна реактивация цитомегаловирусной инфекции с разрушением ядер клеток, в которых персистировал вирус, гематогенной диссеминацией, поражением железистых органов, развитием васкулитов, индукцией специфического цитомегалического метаморфоза клеток разных тканей. При гестации вирусы из межворсинчатого пространства проникают через плаценту и гематогенно инфицируют плод. Установлено, что ЦМВ способен повреждать мембрану трофобласта.
При гестации вирусы из межворсинчатого пространства проникают через плаценту и гематогенно инфицируют плод. Установлено, что ЦМВ способен повреждать мембрану трофобласта.
Классификация
Систематизация основных форм цитомегаловирусной инфекции у беременных проводится с учетом выраженности клинической картины и времени манифестации патологического процесса. Такой подход наиболее оправдан с точки зрения прогнозирования возможных осложнений заболевания и выбора оптимальной тактики ведения беременности. Специалисты в сфере акушерства и гинекологии, инфекционных болезней различают следующие варианты инфекции:
- Первично-манифестная ЦМВИ. Самый неблагоприятный вариант течения патологии. Возникает в результате первичного инфицирования беременной, у которой отсутствуют специфические IgG. Отличается высокой вероятностью трансплацентарного переноса вируса (до 30-75%) и внутриутробного поражения плода. В период гестации выявляется не более чем у 4% пациенток.
 При заражении с острой симптоматикой в I триместре рекомендован аборт.
При заражении с острой симптоматикой в I триместре рекомендован аборт. - Носительство. Наиболее частая форма цитомегаловирусной болезни у беременных. Носительницами являются женщины, у которых до зачатия была активная форма заболевания или инфекция на фоне сильного иммунитета сразу перешла в непродуктивную фазу. Иммуноглобулины G, циркулирующие в крови пациентки, защищают плод от заражения ЦМВ. При исключении иммуносупрессорных воздействий риск патологического течения гестации минимален.
- Реактивация латентной инфекции. При значительном снижении иммунитета у носительниц цитомегаловируса развивается характерная клиническая картина. Заболевание в той или иной степени обостряется у 40-50% серопозитивных беременных. В 0,15-0,36% случаев вирус передается трансплацентарно ребенку. Наибольший риск врожденных аномалий наблюдается при обострении цитомегаловирусной болезни на 7-12 неделях гестационного срока.
Симптомы ЦМВИ у беременных
При латентном носительстве клиническая симптоматика отсутствует. У 4-5% беременных с ЦМВИ отмечается типичная первичная острая или реактивированная латентная инфекция с жалобами на слизистые выделения из носа, повышением температуры до 38-40°С, увеличением и болезненностью подчелюстных, шейных лимфатических узлов, околоушных слюнных желез. Обычно выражена общая интоксикация — слабость, разбитость, быстрая утомляемость, сонливость, головная боль, тошнота.
У 4-5% беременных с ЦМВИ отмечается типичная первичная острая или реактивированная латентная инфекция с жалобами на слизистые выделения из носа, повышением температуры до 38-40°С, увеличением и болезненностью подчелюстных, шейных лимфатических узлов, околоушных слюнных желез. Обычно выражена общая интоксикация — слабость, разбитость, быстрая утомляемость, сонливость, головная боль, тошнота.
Возможны беловато-голубые влагалищные выделения. При существенном снижении иммунитета определяется увеличение печени, селезенки с появлением тяжести, дискомфорта, распирания в правом и левом подреберьях, генерализованное увеличение лимфоузлов. Длительность острой фазы, как правило, составляет до 2-3 недель.
Осложнения
Осложненное течение гестации наблюдается преимущественно при острой или реактивированной инфекции. У таких пациенток чаще возникают спонтанные выкидыши, связанные с тяжелыми эмбрио- и фетопатиями, преждевременные роды, вызванные гипертонусом матки, замершие беременности, мертворождение. Из-за повреждения мембраны трофобласта ЦМВИ может осложниться приращением плаценты, гипертрофией и ранним старением плацентарной ткани, фетоплацентарной недостаточностью, внутриутробной гипоксией и задержкой развития плода.
Из-за повреждения мембраны трофобласта ЦМВИ может осложниться приращением плаценты, гипертрофией и ранним старением плацентарной ткани, фетоплацентарной недостаточностью, внутриутробной гипоксией и задержкой развития плода.
Во время родов возможна преждевременная отслойка плаценты, массивная кровопотеря из-за атонического кровотечения. В послеродовом периоде отмечаются латентные эндометриты. В последующем повышается вероятность развития дисменореи.
При острой первичной цитомегаловирусной болезни существенно возрастает риск трансплацентарного инфицирования плода и развития многоводия. Дети зачастую рождаются недоношенными, с низкой малой тела. Особенно опасно заражение ЦМВ в 1-м триместре, часто вызывающее микроцефалию, хориоретинит, нейросенсорную тугоухость, другие аномалии развития.
Врожденная цитомегалия после внутриутробного инфицирования может протекать бессимптомно, проявляться тяжело протекающими манифестными формами или в виде последствий поражения отдельных органов (гепатомегалии, затяжной желтухи, нарушений сосания и глотания, стойкого снижения мышечного тонуса, тремора, анемии, тромбоцитопении, отставания в умственном и моторном развитии, пневмонии, миокардита, панкреатита, колита, нефрита).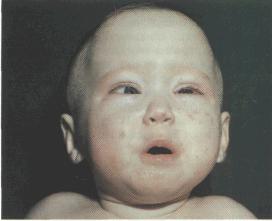 Отдаленными последствиями ЦМВИ у детей являются слепота, глухота, речевые нарушения, проявляющиеся на 2-5-м году жизни.
Отдаленными последствиями ЦМВИ у детей являются слепота, глухота, речевые нарушения, проявляющиеся на 2-5-м году жизни.
У беременных со значительной иммуносупрессией ЦМВИ протекает тяжелее, экстрагенитальные осложнения выявляются чаще. Неблагоприятными формами заболевания считаются цитомегаловирусные поражения легких (интерстициальная пневмония), мозга (менингит, энцефалит), периферической нервной системы (миелит, полирадикулоневрит), сердца (миокардит, перикардит), кроветворения (тромбоцитопения, гемолитическая анемия). Прямая угроза для жизни беременной возникает при быстрой генерализации инфекции с развитием сепсиса, инфекционно-токсического шока, ДВС-синдрома.
Диагностика
Сложность своевременного выявления ЦМВИ связана с отсутствием симптоматики у большинства беременных и полиморфностью клинической картины при манифестации. Учитывая повышенный риск перинатального заражения ребенка цитомегаловирусной инфекцией, в качестве скрининга рекомендовано проведение анализа на TORCH-комплекс.
- Иммуноферментный анализ. ИФА считается наиболее достоверным и информативным методом диагностики цитомегаловирусной болезни. Наличие активной инфекции подтверждает выявление IgM и более чем 4-кратное нарастание титра IgG. О давности инфицирования свидетельствуют данные об авидности иммуноглобулинов G (при показателе <30% процесс является первичным).
- ПЦР-диагностика. Цитомегаловирусные нуклеиновые кислоты определяют в биологических секретах, которые могут содержать возбудителя. Обычно для анализа берут кровь, мочу, цервикальный секрет, буккальные мазки. Обнаружение вирусной ДНК подтверждает инфицированность, а количественные методы исследования позволяют контролировать течение инфекции.

С учетом возможности реактивации цитомегаловирусного процесса на любом этапе гестации плановый вирусологический мониторинг носительницам рекомендован на 8-12, 23-25, 33-35 неделях беременности. При подозрении на внутриутробное поражение плода выполняется кордоцентез с определением IgM в пуповинной крови, амниоцентез с ПЦР-диагностикой возбудителя в амниотической жидкости.
Для оценки состояния плода, выявления фетоплацентарной недостаточности, возможных аномалий по показаниям проводятся:
Цитомегалию дифференцируют с ВИЧ-инфекцией, инфекционным мононуклеозом, токсоплазмозом, листериозом, герпесом, вирусными гепатитами, бактериальным сепсисом, лимфогранулематозом, острым лейкозом. При необходимости пациентку консультирует инфекционист, вирусолог, иммунолог, онколог, онкогематолог.
Лечение ЦМВИ у беременных
Выбирая тактику ведения гестации, учитывают клиническую форму ЦМВИ и срок инфицирования. Женщинам с цитомегалией, первично-манифестировавшей в период 1 триместра, рекомендовано проведение аборта. Прерывание беременности по медицинским показаниям также показано пациенткам с клинически и лабораторно подтвержденной первичной инфекцией при обнаружении до 22 недели УЗ-признаков пороков развития плода. В остальных случаях возможна пролонгация гестации.
Беременным с носительством медикаментозное лечение не назначается. При отсутствии клинических и лабораторных признаков реактивации цитомегаловирусной болезни требуется коррекция образа жизни, направленная на предотвращение значительной иммуносупрессии. Больным необходимы достаточные отдых и сон, исключение чрезмерных физических и психологических нагрузок, полноценное питание, прием витаминно-минеральных комплексов, профилактика ОРВИ, осторожность при назначении препаратов, снижающих иммунитет.
Беременным с активной формой инфекции проводится лечение, направленное на купирование обострения и прекращение экскреции цитомегаловируса. Сложность выбора адекватной медикаментозной терапии связана с фетотоксичностью большинства противовирусных средств. С учетом возможных показаний и противопоказаний для лечения ЦМВИ при гестации применяются:
- Антицитомегаловирусный человеческий иммуноглобулин. Гипериммунные препараты позволяют восстановить титр специфических IgG, блокировать репликацию возбудителя и ограничить его диссеминацию. Использование иммуноглобулина человека существенно снижает риск внутриутробного инфицирования вирусом цитомегалии.
- Рекомбинантный α-2-интерферон. Препарат стимулирует Т-хелперы и Т-киллеры, повышая уровень Т-клеточного иммунитета. Усиливает активность фагоцитов и скорость дифференцировки В-лимфоцитов. Угнетает репликацию цитомегаловирусов и способствует их инактивации различными иммунными агентами. Рекомендован в виде ректальных свечей.
- Синтетические аналоги нуклеозидов. Назначаются только при тяжелых генерализованных формах цитомегаловирусной инфекции, когда риск токсических эффектов препаратов оправдан спасением жизни беременной. Противовирусные препараты ингибируют ДНК-полимеразу вирусных частиц и за счет этого тормозят синтез цитомегаловирусной ДНК.
Индукторы интерфероногенеза, иммуномодуляторы применяют крайне редко из-за возможного преждевременного прерывания гестации. В качестве немедикаментозных методов допустимо проведение эндоваскулярного лазерного облучения крови и плазмафереза.
Роды при ЦМВИ
Предпочтительным методом родоразрешения являются естественные роды. Кесарево сечение выполняется при наличии абсолютных акушерских или экстрагенитальных показаний или при сочетании относительных (внутриутробном инфицировании цитомегаловирусом, хронической гипоксии плода, II-III степенях задержки его развития, первичном и вторичном бесплодии в анамнезе).
Прогноз и профилактика
Своевременное выявление латентной ЦМВИ и профилактика ее активации существенно улучшают исход беременности как для женщины, так и для плода. Прогноз неблагоприятен при генерализации первичной цитомегаловирусной инфекции. При установленном диагнозе цитомегалии показано планирование зачатия с учетом рекомендаций акушера-гинеколога, купирование активного процесса, прегравидарная иммунокоррекция с использованием пептидных иммуностимуляторов и рекомбинантных интерферонов.
Противовирусная терапия женщин с манифестной ЦМВИ на 75% снижает риск реактивации инфекции в наиболее опасном по возникновению осложнений 1 триместре. Общая профилактика заражения предполагает соблюдение правил личной гигиены с частым мытьем рук, отказ от близких прямых контактов с другими людьми.
Цитомегаловирусная инфекция у новорожденных: диагностика и лечение | #03/06
Цитомегаловирусная инфекция (ЦМВИ) относится к числу хрестоматийно латентных. Цитомегаловирус (ЦМВ) содержит ДНК, обладает способностью реактивироваться, тропностью к железистой ткани, где персистирует, оказывает цитопатическое действие, в результате которого образуются гигантские клетки, похожие на «совиный глаз».
В Западной Европе (Франция, ФРГ, Испания) от 50 до 70 % всего населения инфицированы ЦМВ. Точных статистических данных частоты распространения инфицированности по России и даже по Москве нет.
Большой толчок для изучения ЦМВИ дали успехи трансплантологии. Есть веские основания полагать, что причиной отторжения трансплантата является активация ЦМВИ. Частота инфицирования (наличие антител класса иммуноглобулина (Ig) G к ЦМВ) ЦМВ зависит от социально-экономических условий, степени повреждения иммунной системы и др. ЦМВ относятся к разряду «слабых антигенов». Изучение этих вирусов, их воздействия, например, на эндотелий сосудов, ряд других органов, кроме слюнных желез, продолжается.
Нами проводились многолетние систематические исследования (И. В. Орловская, А. В. Александровский, В. В. Зубков) различных аспектов развития этой инфекции. Было установлено, что это типичная социально значимая инфекция. Данные свидетельствуют о том, что в Москве за последние 15 лет ЦМВИ претерпела существенную эволюцию.
Так с 1988 по 1993 г. антитела класса IgG к ЦМВ у матерей и их новорожденных больных детей выявлялись лишь в 40–50 % случаев.
Выявлена зависимость от социальной принадлежности пациентов и ряда дополнительных факторов: наиболее часто (от 86 до 96 % случаев) инфекция выявляется у больных, перенесших пересадку почек, гомосексуалистов и больных СПИДом (Западная Европа, США).
По нашим данным, полученным на основании сероэпидемиологических исследований, проводившихся в 1995–1999 гг. и в 2000–2002 гг. у женщин репродуктивного возраста, родивших детей с внутриутробной инфекцией, частота циркуляции антител к ЦМВ класса IgG достигает высокого уровня (90 % от общего числа обследуемых) и не имеет тенденции к снижению.
Это свидетельствует об отсутствии и неэффективности контроля за инфекциями у женщин, передающимися половым путем, в том числе ЦМВИ. Установлено, что в 60 % случаев у больных имеются одновременно специфические антитела к нескольким перинатальным патогенам. Наиболее распространенными являются вирус простого герпеса (ВПГ), ЦМВ, хламидии и уреаплазма. Доля смешанных инфекций значительна и продолжает расти. Выявить лидирующего возбудителя сложно, это требует дополнительных исследований.
ЦМВИ — это инфекция плода. Эта инфекция особенно опасна для беременных женщин. Проявления ЦМВИ большей частью стертые, особенно часто у беременных женщин она протекает в виде острой респираторно-вирусной инфекции.
ЦМВИ после пубертатного периода распространяется в основном половым путем. У беременных женщин она проявляется чаще «под маской» другого заболевания. Поэтому своевременная диагностика заболевания затруднена. Специфически не проявляясь у женщины, у плода ЦМВИ вызывает врожденные нарушения центральной нервной системы, пороки развития сердца, почек.
Доказано, что ЦМВ являются причиной многоводия и одновременно развития водянки плода (A. Breinl, Lebmanu), угрозы и спонтанного прерывания беременности, фетоплацентарной недостаточности. Выявление ЦМВ у мертворожденных варьирует от 9 до 33 % (ФРГ, Франция). Инфекцию трудно выявить из-за несовершенства диагностики. Все проявления ЦМВИ у женщин и у плода развиваются на фоне иммунодефицита.
Одним из главных способов распространения инфекции является половой путь передачи. Об этом свидетельствует одновременное наличие у больных антител к ВПГ и ЦМВ.
Большое число беременных женщин, особенно в последних триместрах беременности, заражаются при орогенитальных контактах (до 20 % и более).
Заражение ЦМВИ может происходить после трансфузий инфицированной крови. В Западной Европе и США 15–70 % образцов крови содержат ЦМВ. Кроме того, проникновение в организм ЦМВ может иметь место при трансплантации инфицированных почек, костного мозга, сердца и других органов. В 20 % случаев причина реакции отторжения — активация ЦМВ (ФРГ, США). Несовершенство диагностики ЦМВИ зачастую не позволяет доказать значимость вирусной агрессии при формировании того или иного патологического процесса.
Как было сказано выше, все проявления ЦМВИ у женщин и плода развиваются на фоне иммунодефицита. Результаты многолетних исследований, проведенных в НЦАГиП РАМН, показали, что одной из ведущих причин реализации внутриутробной инфекции является состояние иммуносупрессии у матери в период беременности. Особенно четко это проявляется у женщин с гиперандрогенией, миастенией, лимфогранулематозом и др., которые получают стероидную терапию до и во время беременности.
ЦМВИ является эндемичной во всех популяциях человека. Пути заражения плода, новорожденного, взрослого человека различны.
Заражение плода может осуществляться гематогенно-трансплацентарным путем, особенно при наличии первичной инфекции у женщины и при повреждении плаценты с нарушением ее барьерной функции. В 10–15 % случаев у плода признаки ЦМВИ проявляются сразу после рождения. Гематогенно-трансплацентарный путь инфицирования плода ЦМВ является основным.
Восходящим путем заражение происходит при наличии ЦМВ в цервикальном и вагинальном секретах, а также через инфицированные околоплодные воды.
Интранатально заражаются до 5–7 % новорожденных, как путем непосредственного контакта с инфицированным материалом, так и при аспирации околоплодных вод, содержащих ЦМВ.
В постнатальном периоде новорожденный заражается в 30 % случаев (данные ВОЗ) от выделений матери, содержащих вирус: слюну, мочу, выделений из гениталий, грудное молоко, кровь. Наши исследования показали, что антиген ЦМВ можно выявить и в ликворе, особенно при наличии у ребенка генерализованной формы инфекции с церебральными повреждениями.
По данным Clive Smeet, гематогенным путем ЦМВ распространяется в различные органы, включая почки, печень, селезенку, сердце, мозг, сетчатку глаза, пищевод, внутреннее ухо, легкие, кишечник.
В период вирусемии ДНК ЦМВ можно обнаружить в моноцитах, лимфоцитах, нейтрофилах. Лейкоциты играют важную роль в диссеминации вируса по всему организму. ЦМВ более тропен к полинуклеарным фагоцитам, чем к мононуклеарным клеткам. Можно считать доказанным факт поражения эндотелия сосудов, сердца, желудочков мозга.
ЦМВИ может протекать в виде первичной (острой) инфекции с появлением и ростом специфических антител к ЦМВ класса IgM, а в дальнейшем и IgG. Эта форма инфекции характеризуется наличием вирусоспецифического антигена в крови, моче и ликворе. Первичная инфекция у беременных женщин особенно опасна. В этом случае очень легко происходит вертикальная трансмиссия (трансплацентарным путем) вируса плоду.
Эта инфекция может вызвать серьезные изменения у плода: микроцефалию, гепатоспленомегалию, тромбоцитопению, затянувшуюся желтуху, реже — потерю слуха, умственную отсталость и др. В этой ситуации у плода могут возникать вирусный интерстициальный пневмонит, ретинит, энцефалит, болезни желудочно-кишечного тракта.
При более раннем заражении ЦМВ могут иметь место пороки развития желудочно-кишечного тракта. Заражение плода при первичной инфекции во всех случаях происходит при отсутствии у беременной специфических IgG-антител, что является причиной тяжелого поражения плода.
Первичной формой ЦМВИ беременные женщины часто заражаются в результате орогенитальных контактов. Эта форма инфекции представляет наибольшую опасность для беременной женщины и плода, так как она развивается на фоне полного отсутствия специфических антител.
Под реактивацией понимают форму ЦМВИ, которая ранее протекала латентно, бессимптомно. Реактивация вируса происходит под влиянием терапии стероидными гормонами у беременных женщин (плода), иммуноскомпрометированных больных (реципиентов трансплантатов, лиц больных СПИДом). Так, у новорожденных, родившихся от женщин, в отношении которых применялись репродуктивные технологии, а также у самих женщин нами в 100 % случаев были выявлены антицитомегаловирусные IgG-антитела.
При реактивации ЦМВИ у беременной женщины может происходить подъем титров антител как класса IgG, так и IgM к ЦМВ. Однако у ряда пациентов нового появления антител IgM не происходит в связи с формированием вторичного иммунологического ответа, характеризующегося гиперпродукцией специфических IgG-антител. Именно этим объясняется то обстоятельство, что в этом случае может родиться как здоровый ребенок, так и новорожденный с серьезными проявлениями ЦМВИ.
ЦМВИ (первичная) может переходить в хроническую или латентную формы, которые могут реактивироваться.
Реинфекция — заражение пациента новым экзогенным вирусом — может сопровождаться иммунологическими сдвигами, повторным нарастанием титра специфических IgM, а в дальнейшем и IgG или (реже) только повышением титра специфических антител класса IgG. Серологических тестов, помогающих отличить первичную инфекцию от вторичной в таких ситуациях не существует.
У больных с иммунодефицитом, СПИДом и у новорожденных детей антитела при реактивации могут не выявляться. У них в процессе диагностики должно использоваться одновременно несколько методов.
Одновременного наличия антител класса IgG и положительного анализа (полимеразная цепная реакция — ПЦР) достаточно для подтверждения клинического диагноза.
По клиническим проявлениям врожденная ЦМВ и герпетическая инфекции имеют как сходные черты, так и значимые различия. Оба заболевания имеют склонность к хронизации процесса.
Частота внутриутробных повреждений различных органов и систем ЦМВ, по данным различных авторов, не одинакова. По уточненным патогистологическим данным, наиболее часто наблюдаются (в порядке их частоты выявления) поражения мозга (менингоэнцефалит, поражения желудочков мозга, кальцификаты, «кальцинация» мозговых сосудов). Все эти морфологические изменения сопровождаются различными неврологическими проявлениями: от легких церебральных изменений до серьезного судорожного, гипертензионно-гидроцефального синдромов и др.
Одним из распространенных проявлений ЦМВИ является блокада ликвороносных путей (до 7 % из числа перинатальных повреждений мозга вирусной этиологии). Другой «точкой приложения» ЦМВ часто является сосудистое сплетение с последующим образованием кист.
Наши наблюдения показали, что минерализационная васкулопатия («кальцификация» — по терминологии зарубежных авторов) мозговых сосудов, сопровождающая ЦМВИ, может быть причиной судорожного синдрома у новорожденного. Судорожный синдром в этом случае возникает с первых часов после родов и продолжается до 5 дней и больше. Это состояние требует тщательного специфического лечения цитотектом, антиконвульсантами и др. Изменения сосудов мозга, вызываемые ЦМВ, требуют дальнейшего изучения.
В этих случаях требуется исключить герпетическую инфекцию новорожденного ребенка. Внутриутробная гидроцефалия у плода часто связывается с ЦМВ (ФРГ, Австрия).
Довольно распространенным проявлением ЦМВИ является пневмония. Среди общего числа пневмоний (больше 1/3 всех больных, поступающих в отделение патологии новорожденных НЦАГиП) примерно в 10 % случаев этиологическим фактором является ЦМВ, что подтверждено при оценке эпидемиологического анамнеза матери: наличие эндоцервицита, кольпита, иммуносупрессивных факторов, носительство ВПГ и ЦМВ, а также обязательное наличие IgG и IgM и (реже) — положительная ПЦР у новорожденного.
Следует заметить, что рентгенологически при этом определялись очаговые воспалительные инфильтраты, реже — сегментарные тени. При гематологическом исследовании выявлялись лейкоцитоз с нейтрофильным сдвигом влево, реже — тромбоцитопения. Нет сомнения, что в генезе этих пневмоний участвует вторичная бактериальная флора, активация последней наступает позже. Заражение новорожденного в этом случае происходит как аспирационным (чаще), так и гематогенным путем. Вторичный иммунодефицит в этих случаях приводит к более длительному течению заболевания и требует одновременного проведения иммунотерапии.
Как указывают J. Frank и H. Fridman, ЦМВИ в виде пневмонии часто приводит к смертельным исходам у больных СПИДом, у пациентов после трансплантации почек и костного мозга, сердца. Причина тяжелого течения пневмонии при ЦМВИ — угнетение иммунных реакций.
Нередко проявлением ЦМВИ у новорожденных являются гепатоспленомегалия, затянувшаяся желтуха (до 32%). За последние 5 лет повысилось число больных с гипербилирубинемией, с незначительным изменением уровня трансаминаз. Этот факт требует дальнейшего изучения вопроса о роли ЦМВ.
Тромбоцитопения нами отмечалась (до 2–3 %) в основном на фоне генерализованных форм инфекции.
В 30 % случаев ЦМВИ может протекать без локальных изменений и проявляться только ухудшением общего состояния пациентов, наличием специфических антител IgM. Эта форма в ряде случаев протекает легко, но всегда требует исключения генерализации процесса, проведения иммунотерапии.
ЦМВИ может служить причиной: миокардитов, кардиомегалии, утолщения миокарда, увеличения предсердия, гидроперикарда (до 15 %), а также водянки плода.
В отдельных случаях могут отмечаться и поздние поражения, которые регистрируются только в 6–7 мес жизни: слепота, глухота, отставание в развитии и др.
Диагностика этой инфекции сложна и должна проводиться с учетом ее клинических проявлений.
- Оценка эпиданамнеза матери (вирусоносительство), наличие у нее эндоцервицита, аднексита, кольпита, наличие возможных иммуносупрессивных воздействий на нее и на плод, обследование пациентки.
- Учет соответствующей клиники у ребенка: наличие кальцификатов в мозгу, васкулопатии сосудов мозга, вентрикуломегалии, энцефалита, а также выявление пневмонии, гепатоспленомегалии, затянувшейся гипербилирубинемии и др.
- Эхоэнцефалография и УЗИ внутренних органов.
- Определение антител классов IgM и IgG к ЦМВ (метод иммуноферментного анализа — ИФА). Классический метод с использованием детекции нарастания в 4 и более раз специфических IgG-антител вначале и спустя 12–14 дней у новорожденных не применяется, хотя у взрослых он является наиболее достоверным и точным. У беременных этот серологический метод вполне может быть использован. Иммунная система новорожденного не способна синтезировать антитела класса IgG; последние переходят трансплацентарно от матери плоду.
- Выявление вирус-специфических антигенов (частей вирусов) в культуре клеток не применяется даже для научных целей из-за дороговизны методики. Вирус-специфический антиген можно выявить путем экспресс-метода иммунофлюоресценции; последний является точным, но, к сожалению, в последние годы почти не используется.
Широко применяются биотехнологические методы: ДНК-гибридизации и особенно ПЦР. Однако гибридизационная техника требует совершенствования, наличия качественных тест-систем и квалифицированных лаборантов.
Метод ПЦР, к сожалению, возложенных на него надежд не оправдал. По нашим данным, подтвердить диагноз этим методом можно не больше чем в 50 % случаев. Хотя за рубежом (ФРГ) многие авторы считают, что положительной ПЦР и наличия специфических IgG-антител достаточно для окончательной постановки диагноза.
Во всех случаях при выявлении антигена ЦМВ в моче, крови, ликворе новорожденного, в том числе при положительной ПЦР необходимо подтвердить инфицирование выявлением специфических противовирусных антител (IgG и IgM).
Следует упомянуть, что определение наличия в крови IgM-специфических антител является наиболее надежным и быстрым методом диагностики.
- Для выявления антигена применяются электронная микроскопия (ФРГ) и иммуногистология.
- Окончательная интерпретация иммуновирусологических результатов должна осуществляться с одновременной оценкой эпиданамнеза матери, возможных иммуносупрессивных воздействий на нее, особенно при использовании репродуктивных технологий с учетом клинических проявлений инфекции у ребенка.
Большое научно-практическое значение имеют результаты проводившихся недавно исследований по выяснению защитной роли специфических противовирусных IgG к антигенам ЦМВ, передающихся трансплацентарно от матери плоду.
Исследования, проводимые одновременно в лабораториях трех институтов (НЦАГиП, НИИ вирусных препаратов им. О. Г. Анджапаридзе, ГНИИ биологического приборостроения), дали возможность сделать следующие научно-практические выводы.
- В основе развития внутриутробной инфекции лежат иммуносупрессивные факторы, влияющие на состояние матери, плода и новорожденного — развитие у них вторичных иммунодефицитных состояний. Уникальным аргументом в пользу защитной роли специфических противовирусных иммуноглобулинов является тот факт, что больные новорожденные, родившиеся от матерей с первичной формой генитального герпеса (при отсутствии у них антител), заражаются в 10 раз чаще. Инфекционный процесс у них в 86 % случаев протекает в тяжелой генерализованной форме (с повреждениями мозга, пневмониями и др.) и часто заканчивается летально.
Установлено, что в 12 % случаев специфические противовирусные антитела от больной матери новорожденному передаются не полностью. Очевидно, что причина этого явления — нарушение функции плаценты вследствие развития в ней инфекционного процесса.
Убедительно показана роль угнетения иммунологических факторов в генезе реактивации ЦМВ и возникновении инфекции у новорожденных.
Дефицит противовирусных IgG у плода и новорожденного приводит к диссеминации вируса, развитию генерализованной формы инфекции и к тяжелому повреждению мозга, легких, надпочечников и др.
Отмечаются повреждения клеточного звена иммунитета; при этом реальная возможность их компенсации уменьшается. Выявлен дефицит клеток, принадлежащих к субпопуляции Т-клеток, обладающих цитотоксической активностью против клеток, инфицированных вирусами.
- Углубленные исследования противовирусного иммунитета дали возможность выявить группу новорожденных, больных внутриутробной инфекцией, с «транзиторными иммуносупрессивными состояниями», в терапии которых следует использовать препараты, воздействующие на гуморальное звено иммунитета.
- Нарушения в гуморальном звене иммунитета компенсируются внутривенным введением препаратов иммуноглобулина. Разработана специальная технология их применения. Для больных с внутриутробными вирусными инфекциями эти препараты являются средством как заместительной, так и специфической терапии из-за содержания в них противовирусных антител. Существуют убедительные доказательства их позитивной роли. Применение иммуноглобулинов способствует не только улучшению состояния больных, но и повышению в их крови содержания IgG. Из-за наличия в препаратах иммуноглобулинов антител различной специфичности одновременное их введение с зовираксом и антибиотиками обеспечивает их синергидное действие.
Это дает возможность создать необходимый компонент «терапевтической технологии» — иммунотерапию.
Способы терапии ЦМВИ: химиотерапия (ганцикловир, фоскарнет), интерферонотерапия (достоверных сведений о действии на ЦМВ нет) и иммунотерапия специфическим антицитомегаловирусным иммуноглобулином (цитотект).
Ганцикловир (цимевен) — противовирусный препарат, сходный с ацикловиром, оказывает воздействие на все виды вируса герпеса. Ганцикловир в 50 раз превосходит ацикловир по эффективности воздействия на ЦМВ.
Препарат был синтезирован в 1982 г. Он угнетает репликацию вируса за счет конкурентного ингибирования вирусной ДНК-полимеразы и нарушения удлинения цепи ДНК. Ганцикловир выводится из организма через почки. По данным вирусологических исследований, применение ганцикловира приводит к подавлению вируса у 87 % больных, отмечается исчезновение ЦМВ в крови и моче. Ганцикловир применялся в основном в США у больных ретинитом, пневмонией, которые развились у пациентов, страдающих СПИДом; у реципиентов костного мозга, почек, а также у лиц с цитомегаловирусным колитом. Препарат используется в дозе 10–20 мг/кг в неделю внутривенно. Во всех случаях была доказана его клиническая и вирусологическая эффективность.
После лечения ганцикловиром, однако, отмечались и осложнения в виде нейтропении, тромбоцитопении. По этой причине мы отказались от применения ганцикловира.
Таким образом, можно отметить, что химиотерапия ЦМВИ делает лишь первые шаги. В этом направлении необходимы дальнейшие исследования.
Фоскарнет, применявшийся у больных с ЦМВ-пневмонией, нефротоксичен. Поиски эффективных и безопасных противовирусных препаратов продолжаются.
В настоящее время единственным действенным методом терапии и неотложной профилактики ЦМВИ у новорожденных является использование иммуноглобулина для внутривенных вливаний, содержащего антитела класса IgG к ЦМВ.
Имеются веские научные доводы в пользу данного лечебного подхода. Во-первых, существуют обширные научно-практические доказательства эффективности применения иммуноглобулинов при инфекциях; во-вторых, не вызывает сомнений необходимость коррекции гуморального звена иммунитета, особенно при вторичных иммунодефицитах. Таким образом, при ЦМВИ иммуноглобулины являются средством как иммунозаместительной, так и этиотропной терапии. В-третьих, в последние годы доказано модулирующее влияние иммуноглобулинов при внутривенном введении на клеточное звено иммунитета. В-четвертых, активация ЦМВИ происходит всегда на фоне иммунодефицитов. Введение антицитомегаловирусных иммуноглобулинов воздействует не только на этиологический фактор, но и дает возможность влиять на различные патогенетические звенья заболевания.
Показано, что клеточный иммунный ответ у пациентов, инфицированных ЦМВ, «распознает» минимум один протеин «очень ранней» вирусной репликационной фазы на поверхности инфицированной клетки. Это приводит к разрушению инфицированной клетки вирусоспецифическими цитотоксическими Т-лимфоцитами. У пациентов с иммунодефицитом это невозможно, так как вирусоспецифических цитотоксических Т-лимфоцитов у них нет, или их количество недостаточно. ЦМВ-нейтрализующие антитела являются в этом случае единственными иммунологическими компонентами, которые предотвращают инфицирование клетки.
Механизмы воздействия иммуноглобулинов и синтетических вирусостатиков различаются, так как последние не могут проникать в клетку. Противовирусное действие развивается вне клетки. В результате связывания с гликопротеинами на поверхности вируса иммуноглобулины предотвращают инфицирование других клеток-хозяев. Нейтрализован может быть как свободный вирус, так и вирус во время выхождения из инфицированной клетки после репликации. Свободные, нейтрализованные вирусы выводятся почками. Если для терапии и профилактики ЦМВИ у пациентов с подавленным иммунитетом применяют препараты человеческого иммуноглобулина, то выраженных побочных эффектов не возникает, в отличие от терапии вирусостатиками.
Одним из препаратов, используемых для терапии серьезных форм ЦМВИ у беременных и новорожденных, является цитотект. С началом его применения активизировалась разработка новых методов диагностики этой инфекции.
Цитотект представляет собой гипериммунный иммуноглобулин для внутривенных вливаний, содержащий в 10 раз больше антител к ЦМВ, чем обычные иммуноглобулины. Препарат готовится из крови специально отобранных доноров, которые имеют высокий титр противоцитомегаловирусных антител. В 1 мл цитотекта содержится не менее 50 единиц антител против ЦМВ (единицы эталонного препарата Института Пауля Эрлиха). Иммуноглобулин соответствует евростандарту качества. Контроль за содержанием антител осуществляет Федеральное ведомство по вакцинам и сывороткам Германии (Paul Ehrliсh Institut). Одновременно в препарате содержится повышенный титр антител к антигенам вируса Эпштейн–Барр и к антигену ВПГ 1-го и 2-го типа. Кроме того, в цитотект входит широкий спектр антител к микробным возбудителям — перинатальным патогенам, вызывающим серьезные инфекции у новорожденных и женщин в послеродовом периоде. Эти антитела усиливают опсонизацию микроорганизмов, имеют близкое к физиологической норме распределение субклассов IgG (IgGI — IgGIV).
Производство цитотекта контролируется в соответствии со стандартами, разработанными Институтом Пауля Эрлиха. Забор плазмы проводится после тщательного отбора и тестирования доноров.
Кроме того, под контролем находится весь пул плазмы. Многоступенчатая подготовка, проверка безопасности цитотекта исключает передачу гепатитов и других инфекций, включая пока еще не идентифицированные.
Нами проводилось клинико-иммунологическое изучение цитотекта (Н. И. Кудашов, О. В. Орловская) у 56 больных с ЦМВИ. Диагноз был подтвержден во всех случаях путем выявления у больного антицитомегаловирусных IgM.
Одновременно в препаратах, вводимых детям, определялось наличие не только антител IgG к ЦМВ, но и к ВПГ. Было установлено, что во всех сериях используемых препаратов содержались специфические антитела к антигенам ЦМВ и ВПГ 1-го типа, при этом антител к ВПГ 2-го типа содержалось в 2 раза меньше. Было убедительно доказано, что цитотект оказывает в комплексе с традиционной терапией выраженный клинико-иммунологический эффект. Происходило не только улучшение общего состояния больных: через 7–8 дней IgM исчезал из крови пациентов, кроме того, существенно повышалось содержание в крови противоцитомегаловирусных IgG, одновременно повышалось и содержание противогерпетически
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения | #04/18
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
История
Исходя из теории ко-эволюции вирусов с их хозяевами, считается, что герпетические вирусы появились в кембрийский период. В человеческой популяции герпетические вирусы распространены на протяжении тысячелетий. 24 ноября 1974 г. американским антропологом Д. Джохансоном в Великой рифтовой долине был обнаружен скелет афарского австралопитека Люси — предполагается, что это ветвь прародителей Homo sapiens [1]. Возраст Люси определен как 3,2–3,5 млн лет. В «слюне» Люси найдены три герпетических вируса — ЦМВ, вирус Эпштейна–Барр (ВЭБ), вирус простого герпеса 1-го типа (ВПГ 1-го типа). «Современные» люди, мигрировавшие из Африки от 60 до 100 тысяч лет назад, были уже носителями ЦМВ, ВЭБ, ВПГ 1-го типа и ВПГ 2-го типа. Человек со времен афарского австралопитека инфицировался вирусами в раннем детстве в семьях с большим количеством детей; вирусы передавались контактным путем со слюной, в грудном молоке и пр. Под воздействием, в том числе, и герпетических вирусов как компонентов комменсальной микробиоты, передаваемой от матери, эволюционировала иммунная система человека [2].
Характеристика возбудителя
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Патогенез
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Клиника ЦМВИ
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
У новорожденного антенатальная ЦМВИ проявляется симптомами «тяжелой инфекции» с полисистемным поражением: задержкой внутриутробного развития, часто — недоношенностью, гепатоспленомегалией, затяжной неконъюгационной и конъюгационной желтухой, тромбоцитопенической пурпурой, анемией, ДВС-синдромом с кровоизлиянием во внутренние органы, прежде всего в мозг, пневмонией, микроцефалией, хориоретинитом, увеитом, кардитом, различными вариантами поражения центральной нервной системы, в том числе продуктивным вентрикулоэнцефалитом с прогрессирующей гидроцефалией, а также — кортикальными или мозжечковыми пороками развития [13]. В дальнейшем этим детям присущи недостаточная прибавка веса, задержки психического и моторного развития, мышечная слабость, часто — длительная субфебрильная температура, стойкая анемия и тромбоцитопения, длительный гепатит с холестатическим синдромом и высоким риском фиброза и цирроза печени, мальабсорбция.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес < 1000 г, срок гестации — < 30 недель) имеют более высокий риск инфицирования с риском развития острой ЦМВИ с полисистемным поражением (сепсис-подобные формы) и формированием распространенного эрозивно-язвенного поражения кишечника. Интересно, что отдаленные исходы ЦМВИ, приобретенных с грудным молоком матери, как правило, благоприятные — без когнитивных нарушений и нейросенсорной тугоухости.
Приобретенная ЦМВИ даже в раннем возрасте протекает чаще в виде субклинической (малосимптомной) формы или в виде бессимптомной сероконверсии. Считается, что только 10–15% детей развивают манифестные формы заболевания в виде локального или генерализованного лимфопролиферативного синдрома в сочетании с длительным катаральным синдромом и различными органными поражениями: гепатит, энтероколит, энцефалит, множественные мононейропатии, пневмония, кардит, ретинит и пр.
Независимо от возраста, в котором развивается приобретенная ЦМВИ в клинической картине, возможны длительная преимущественно субфебрильная лихорадка, стойкий астенический синдром, лимфаденопатия (чаще цервикальная), гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфомоноцитоз,
У пожилых пациентов ЦМВ может вызывать тяжелые инфекции с развитием стойкой лихорадки, экзантемы, гепатита, поражения желудочно-кишечного тракта, центральной и периферической нервной системы, органов дыхания, почек. В иностранной литературе принят диагноз «синдром лихорадящей бабушки» (Feverish granny syndrome) — ЦМВИ женщин старшего возраста, заражающихся от собственных внуков [14].
Диагностика ЦМВИ
Скрининг всех беременных для выявления ЦМВ серонегативных пациенток не является обязательным ни в одной стране мира, это связано с различными экономическими, практическими и юридическими причинами. Однако выборочные обследования отдельных беременных проводятся во всех странах. В случае наличия у беременной исходных данных серологического исследования до наступления беременности идеально провести сравнение данных иммуноферментным анализом (ИФА). Диагностика первичной инфекции у беременных женщин выполняется прежде всего с целью своевременного выявления и прогноза ЦМВИ плода. «Золотым стандартом» является определение анти-ЦМВ IgG с низкой авидностью в крови матери и обнаружение с количественной оценкой вируса в амниотической жидкости с помощью полимеразной цепной реакции (ПЦР) в реальном времени [15].
В последнее время много дискуссий вызывают рекомендации по определению анти-ЦМВ IgМ в крови матери и новорожденного, исследование ПЦР в материнской крови, моче и амниотической жидкости, а также сама инвазивная процедура амниоцентеза, которая может привести к разрыву мембран, внутриутробному инфицированию или выкидышу. Показано, например, что истинная первичная ЦМВИ диагностируется только у 20–25% беременных женщин с положительными результатами на анти-ЦМВ IgM. Это связано с тем, что анти-ЦМВ IgM могут сохраняться в течение 6–9 месяцев после первичной инфекции, а также могут быть обнаружены при латентной реактивации. На практике редко удается отследить и истинную сероконверсию. С другой стороны, результаты ПЦР и антигенных анализов в материнской крови и моче не коррелируют с риском врожденной инфекции или тяжестью заболевания плода. В 2016 г. японскими учеными предложен неинвазивный подход к прогнозированию врожденной ЦМВИ плода. Проанализировав данные лабораторного и инструментального обследования 300 анти-ЦМВ IgM позитивных беременных женщин, они установили, что наиболее результативным является выявление УЗИ признаков аномалий внутриутробного развития плода в сочетании с положительными результатами ПЦР секрета шейки матки беременной. В этом случае, по мнению исследователей, врачи имеют возможность начать раннее противовирусное лечение новорожденного и таким образом улучшить неврологический прогноз врожденной ЦМВИ.
Однако не вызывает сомнения факт, что одновременное использование анти-ЦМВ IgM вместе с анти-ЦМВ IgG с низкой авидностью улучшает раннюю диагностику первичной инфекции матери еще до появления УЗИ-признаков и при положительном результате указывает на более высокий риск развития врожденной ЦМВИ — это важно особенно в срок до 12–16 недель гестации [15–18].
Согласно Консенсусу 2017, обследование на анти-ЦМВ IgG, IgM и IgA должно быть предложено беременной женщине при наличии гриппоподобных симптомов (как правило, лихорадка, астения и головная боль), не связанных с какой-то конкретной инфекцией, или когда результаты визуализации (УЗИ или МРТ) подозрительны на врожденную инфекцию плода (уровень доказательности 3). Для ЦМВ-серонегативных беременных женщин диагностика первичной ЦМВИ должна включать обнаружение анти-ЦМВ IgG в сыворотке (уровень доказательности 2b). Когда иммунный статус до беременности неизвестен, диагноз первичной ЦМВИ матери должен основываться на обнаружении анти-ЦМВ IgM и анти-ЦМВ IgG с низкой авидностью (уровень доказательности 2b) [19].
Диагностика подтвержденной ЦМВИ плода, согласно Консенсусу 2017, может быть выполнена после 20–21 недели гестации или, по крайней мере, через 6 недель с момента диагностики материнской инфекции, путем тестирования амниотической жидкости на ДНК ЦМВ с помощью ПЦР в реальном времени (уровень доказательности 2b) [19].
Диагностика ЦМВИ новорожденного имеет свои особенности: серологические исследования информативны редко и особенно при манифестной клинике, так как врожденная иммунная система ко времени требуемого серологического ответа еще не эффективна, и отсутствие специфических фетальных IgM даже на фоне острой тяжелой ЦМВИ («серологическая ниша») — общая черта этого периода, они начинают продуцироваться только через несколько месяцев. Специфическая детекция инфекции у детей возможна только с помощью культуральных исследований или ПЦР. Диагноз врожденной ЦМВИ требует положительного результата слюны и/или мочи на ПЦР в первые 21 день жизни (пуповинную кровь не исследуют, так как она может быть контаминирована). Рекомендуется забирать материал на исследование так быстро, как возможно, идеально — в первые 24 часа жизни. При наличии признаков инфекции с полисистемным вовлечением этих данных ПЦР бывает достаточно для принятия решения о начале специфической противовирусной терапии. В диагностически сложных ситуациях, а также для мониторинга эффективности терапии ЦМВИ информативно выполнение ПЦР в реальном времени в стерильных средах (ликвор, кровь, биопсийный материал) с оценкой вирусной нагрузки ДНК ЦМВ в динамике.
В отличие от того, что в настоящее время не рекомендуется обязательный скрининг всех беременных женщин на ЦМВИ, международная группа экспертов считает необходимым проведение скрининга на ЦМВИ у всех новорожденных. И особенно важно проведение такого скрининга у всех детей с глухотой. Согласно Консенсусу 2017, диагноз врожденной ЦМВИ у новорожденных требует проведения ПЦР в реальном времени в слюне и/или моче как можно скорее после рождения, но не позднее первых 3 недель жизни, при этом предпочтительно исследование слюны (уровень доказательности 2b). У детей старше 3-недельного возраста отличить врожденную от постнатальной ЦМВИ с помощью ПЦР и ИФА практически невозможно [19–20].
В случае проведения серологического обследования ребенка требуется одновременное серологическое обследование и матери. Поступательное снижение уровня IgG и его исчезновение к 6–9-месячному возрасту при отрицательной ПЦР свидетельствуют об имевшихся у ребенка материнских трансплацентарных антителах (пассивный специфический транзиторный иммунитет) и неинфицированности.
Диагностика острой ЦМВИ в других возрастных группах проводится по общим принципам — выявление острофазовых анти-ЦМВ IgM, низкоавидных анти-ЦМВ IgG с последующей сероконверсией, а также детекция вирусного генома в ПЦР и/или антигенов вируса в ИФА в исследуемых материалах от больного.
Применение анти-ЦМВ-иммуноглобулина с целью предотвращения вертикальной передачи ЦМВ от инфицированной матери к плоду
Специфический анти-ЦМВ-иммуноглобулин неоднократно пытались использовать с целью профилактики ЦМВИ плода, однако результаты этих исследований не однозначные и не окончательные. Несмотря на сообщения о возможной эффективности, в настоящее время не определены ни оптимальные дозы, ни схемы лечения. Опубликованы результаты рандомизированного исследования, в котором не найдено никакой значимой пользы от введения иммуноглобулина, но выявлены акушерские осложнения (преждевременные роды, преэклампсия, задержка роста плода) у 7 (13%) из 53 женщин в группе, получавшей ЦМВ-иммуноглобулин (в сравнении с 1 (2%) из 51 женщины в группе плацебо). Рандомизированные исследования эффективности ЦМВ-иммуноглобулина у беременных в настоящее время в мире продолжаются. Согласно рекомендациям Консенсуса 2017, анти-ЦМВ-иммуноглобулин не следует вводить беременным женщинам с первичной ЦМВИ для профилактики врожденной инфекции плода в связи недостаточностью доказательств (уровень доказательности 2c). Если же такое лечение проводится, результаты следует отслеживать для дальнейшего понимания безопасности этого подхода [19, 21–23].
Преимущества и вред противовирусных препаратов для предотвращения вертикальной передачи у беременных женщин исследованы мало. В настоящее время в одном рандомизированном, двойном слепом клиническом исследовании продолжается оценка эффективности валацикловира для предотвращения вертикальной передачи ЦМВ при первичной инфекции матери. Результаты этого исследования могут предоставить доказательства безопасности и эффективности противовирусной терапии во время беременности. Согласно же современным рекомендациям Консенсуса 2017, противовирусная терапия для предотвращения врожденной ЦМВИ плода также не рекомендуется на основе недостаточности текущих данных (уровень доказательности 3) [19].
Антенатальное лечение врожденной ЦМВИ плода
Такие препараты, как ганцикловир, валганцикловир, фоскарнет, цидофовир, доказано эффективны в лечении ЦМВИ у пациентов с ослабленным иммунитетом. Однако фоскарнет и цидофовир непригодны для ле
Цитомегаловирусная инфекция — статьи об инфекционных болезнях
Цитомегаловирусная (ЦМВ) инфекция — вирусное заболевание, которое связано с заражением человека цитомегаловирусом. Этот возбудитель относят к герпесвирусам 5 типа, он широко распространен в популяции. 50–80% всех людей в мире инфицированы ЦМВ. Однажды заразившись, человек инфицирован навсегда, но для здоровых это не опасно. Вирус повышает свою активность, только если происходит снижение иммунитета. Это частая ситуация при ВИЧ-инфекции или при приеме иммунодепрессивных (снижающих иммунитет) препаратов.
Если женщина впервые заразилась цитомегаловирусной инфекцией во время беременности, это может привести к серьезной патологии плода.
Причины и факторы риска
Цитомегаловирус передается через близкий физический контакт человека с человеком. Это может происходить через жидкости организма:
- слюну
- кровь (в том числе при переливании крови и трансплантации органов)
- грудное молоко
- семенную жидкость и вагинальный секрет.
Во время беременности заражение происходит через плаценту или непосредственно во время родов.
Инфицирование возможно при поцелуе или при контакте с предметами, на которых есть частички слюны или мочи больного человека. Основная часть людей заражается в детстве, обычно в яслях или детском саду, т.е. там, где есть много контактов между детьми. Реже инфицирование происходит в возрасте 10-35 лет.
Что происходит при ЦМВ
Первая встреча с вирусом чаще всего протекает бессимптомно. Только в 2% случаев отмечают симптомы, похожие на ОРВИ (повышение температуры тела, лихорадка, боль в горле, боли в суставах и мышцах, увеличение лимфатических узлов). У людей с нормальным иммунитетом инфекция обычно не вызывает серьезных осложнений.
Гораздо опаснее врожденная цитомегаловирусная инфекция. Чаще всего беременные женщины получают ЦМВ от больных детей младшего возраста. Различные врожденные патологии диагностируют у 10% детей, инфицированных во время внутриутробного развития. Вирус существенно увеличивает риск преждевременных родов, задержки внутриутробного развития, спонтанного прерывания беременности.
ЦМВ относят к группе так называемых TORCH-инфекций, чаще всего связываемых с аномалиями развития плода и патологией беременности. Заражение вирусом может произойти до беременности или непосредственно во время внутриутробного развития ребенка. В первом случае нет клинических проявлений, а в крови выявляются только специфические «поздние» антитела. Такая ситуация не опасна ни для плода, ни для женщины, риск осложнений не превышает 1%.
Первичное инфицирование матери во время беременности связано с большим риском для плода (30–50%). В результате 10–15% детей могут иметь нарушения слуха или зрения, судороги, замедление внутриутробного развития, микроцефалию (уменьшение размера мозга). После рождения возможны неврологические симптомы, задержка умственного и физического развития, поражение печени, которое чаще всего проявляется желтухой, увеличение селезенки.
Симптомы ЦМВ
Существует несколько видов патологий, которые вызывает цитомегаловирусная инфекция. У здоровых людей заболевание может себя вообще ничем себя не проявлять и человек может даже не узнать, что заразился. Реже болезнь протекает в виде острой цитомегаловирусной инфекции, по симптомам напоминающей инфекционный мононуклеоз:
- увеличение лимфатических узлов
- температура тела выше 38 градусов
- слабость, утомляемость, отсутствие аппетита
- боль в мышцах и суставах
- сильная боль в горле, воспаление миндалин
- головная боль.
Как правило, выздоровление наступает за 2 недели.
В тяжелых случаях возможны поражение печени, желтуха, боли в грудной клетке, кашель, одышка, диарея, боли в животе.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает более тяжело, так как вирус быстро распространяется по организму и вызывает:
- поражение центральной нервной системы с возможными судорогами, возникновением комы
- тяжелую диарею
- пневмонию, затруднения дыхания
- ретинит (поражение сетчатки)
- гепатит (поражение печени).
У новорожденных, которые внутриутробно заразились ЦМВ, могут быть:
- желтуха
- пневмония
- мелкоточечная пурпурная сыпь
- увеличение печени и селезенки
- низкий вес при рождении
- маленький размер головы.
Диагностика ЦМВ
Заподозрить инфекцию можно по общему анализу крови, где уровень лимфоцитов превышает 50%, и атипичные лимфоциты составляют до десятой части всех этих клеток крови.
Точную диагностику цитомегаловирусной инфекции обычно проводят с помощью анализа биологических жидкостей методом ПЦР (полимеразной цепной реакции) или ИФА (иммуноферментного анализа). Другие способы диагностики, как, например, выращивание культуры ЦМВ, в настоящее время почти не применяют. ПЦР определяет наличие специфических для ЦМВ участков ДНК в образцах слюны, грудного молока и т.д. ИФА позволяет определить антитела к цитомегаловирусу в сыворотке крови. Как правило, оценивают наличие иммуноглобулинов — IgG и IgM. Высокий уровень IgM (иммуноглобулинов класса М) в крови больного обычно свидетельствует о первичном инфицировании. При реактивации вируса количество IgM также может расти, но не так сильно, как в первый раз. Если определяют иммуноглобулины класса G (IgG), то встреча организма с ЦМВ уже не первая; эти антитела остаются на всю жизнь. Их количество может расти при активации вируса. Расшифровка результатов анализов ведется врачом, так как появление специфичных антител к вирусу может отставать от заражения до 4 недель.
Цитомегаловирус относят к группе герпесвирусов, и, если в организме присутствует вирус Эпштейна-Барр (тоже из семейства герпесвирусов), результат может быть ложноположительным.
Для диагностики поражения печени проводят определение уровня билирубина, АСТ, АЛТ.
Лечение
Пациенты с нормальным иммунитетом специфического лечения не требуют. Болезнь проходит самостоятельно, как и ОРВИ, в течение нескольких недель.
Если беспокоит высокая температура, сильная боль в мышцах, то применяют противовоспалительные препараты: парацетамол или ибупрофен. Важно пить большое количество жидкости, это не только уменьшит симптомы болезни, но и позволит избежать обезвоживания.
Пациентам с иммунодефицитами назначают противовирусные препараты. Эти лекарства не могут полностью удалить ЦМВ из организма и вылечить от инфекции, но способны замедлить размножение вируса. Схема лечения цитомегаловирусной инфекции у больных с ослабленной иммунной системой может включать в себя:
- ганцикловир
- валганцикловир
- фоскарнет
- цидофовир (не зарегистрирован в РФ).
Противовирусные препараты имеют побочные эффекты, поэтому лечение требует медицинского контроля. Принимают противовирусные средства не менее 14 дней.
Новорожденных с ЦМВ-инфекцией лечат в специализированных отделениях перинатальных центров, где проводят противовирусную терапию ганцикловиром или валганцикловиром. После выписки таким малышам нужен постоянный контроль зрения и слуха, наблюдение у невролога.
Профилактика ЦМВ
Специфическая профилактика цитомегаловирусной инфекции отсутствует. Эффективной и безопасной вакцины против ЦМВ пока не существует. Вирус передается при половых контактах, поцелуях, совместном использовании столовых приборов, игрушек, зубных щеток. Поэтому соблюдение общих правил гигиены, мытье рук с мылом перед приготовлением еды, после похода в туалет или смены подгузника поможет предотвратить заражение. При контакте с биологическими жидкостями (спермой, мочой) необходимо использовать резиновые перчатки.
Уязвимым группам пациентов — например, принимающим иммунодепрессанты после пересадки органов или беременным — нужно более тщательно соблюдать гигиенические правила. По возможности нужно избегать контакта с маленькими детьми (особенно до 5 лет) и тем более не целовать их, не есть с ними из одной посуды.
Перед трансплантацией органов или переливанием крови проводят исследование ЦМВ-статуса потенциального донора.
Осложнения
Первичное заражение при беременности приводит к нарушению внутриутробного развития, микроцефалии, поражению печени, легких, центральной нервной системы плода. У новорожденных детей с симптомами поражения органов и систем в 30% случаев возможен летальный исход. У 40–90% из них имеются неврологические нарушения (задержка умственного развития, потеря слуха, нарушения зрения, эпилепсия).
У больных с ВИЧ-инфекцией цитомегаловирус может быть причиной следующих осложнений:
- хориоретинит (сочетанное воспаление сосудистой оболочки и сетчатки глаза)
- панкреатит, гепатит, колит
- синдром Гийена-Барре
- энцефалиты
- поражение периферических нервов
- воспаление легких вирусной природы
- поражение сердечной мышцы
- поражение кожи.
Редко осложнения бывают и у здоровых людей. Чаще всего это диарея, боль в животе и мышцах.
Цитомегаловирус и беременность — статьи о половых инфекциях
Заразившись им, вы от него не избавитесь. Иммунитет к цитомегаловирусу не формируется! Однако можно снизить количество обострений этой инфекции в организме.
Основным источником цитомегаловирусной инфекции является больной человек, у которого в данный момент идет обострение этого процесса. Пути передачи цитомегаловируса такие же, как и у вируса герпеса (они относятся к одному семейству), т.е.:
- воздушно-капельный,
- половой,
- контактный,
- внутриутробный (траснплацентарный).
Цитомегаловирус в период беременности
Опасность вируса для организма беременной, особенно для плода, представляет острое течение цитомегаловирусной инфекции, т.е. первичное заражение во время беременности.
Заражение от больного человека с острой инфекцией цитомегаловируса — для беременных является худшим вариантом, т.к. из-за отсутствия антител в крови, неослабленный вирус довольно легко проникает через плаценту, повреждающе воздействует на плод (инфицирование плода происходит в 40-50 % случаев)
Обострение скрытого вирусоносительства под воздействием факторов, ослабляющих иммунитет (например, наличие сопутствующих заболеваний, прием препаратов подавляющих иммунитет), является менее опасной ситуацией. Поскольку в борьбу с вирусом вступают уже имеющиеся антитела (IgG, которые имелись всегда при скрытом вирусоносительстве), сам вирус становится ослабленным, что снижает степень проникновения через плаценту и агрессивное воздействие на плод (инфицирование плода происходит лишь в 1-2 % случаев).
Существует определенная зависимость между степенью неблагоприятного воздействия вируса на плод и сроком беременности. Так, например, при инфицировании плода на ранних сроках беременности, существует большая вероятность самопроизвольного выкидыша или аномалии развития ребенка.
При инфицировании в более поздние сроки, пороков развития плода не наблюдается, но довольно часто возникает многоводие при беременности, отмечаются преждевременные роды и так называемая «врожденная цитомегалия» новорожденного.
Ребенок с цитомегалией
Для ребенка с врожденной цитомегалией характерно наличие желтухи, увеличение размеров печени, селезенки, сниженный гемоглобин (анемия) и другие изменения в анализе крови, также отмечаются, тяжелые поражения центральной нервной системы, поражение глаз и слуха.
Обнаружение у ребенка IgG, в первые три месяца после родов, не считается признаком врожденной цитомегалии, если у его мамы имеет место скрытое вирусоносительство, т.к. эти антитела ему достались от мамы при рождении и через три месяца они у него исчезнут самостоятельно. Обнаружение же у ребенка IgM, служит доказательством наличия острой стадии цитомегаловирусной инфекции.
Как проявляется
Острая фаза цитомегаловирусной инфекции может проявляться у беременной легкими гриппоподобными явлениями, с невысокой температурой, общим недомоганием, которые являются довольно распространенными и для многих других респираторных инфекций.
Диагностика и профилактика
После попадания возбудителя в организм, в организме сразу же начинают вырабатываться антитела (иммуноглобулины) на цитомегаловирус, что в большинстве случаев не дает инфекции вызвать острый процесс и приводит лишь к скрытому (бессимптомному) вирусоносительству, которое длительное время может ничем себя не проявлять. Выявление антител с определением специфических иммуноглобулинов IgM и IgG к цитомегаловирусу является основным методом выявления инфицированности. Для IgM в бланке заключения лаборатории дается качественная характеристика: «положительно» или «отрицательно», для IgG в результате указывают титр антител (количественная характеристика).
Иммуноглобулины класса М (IgM) указывают на текущую инфекцию — первичную или рецидивирующую. Если в результате анализа указано IgM – «положительно», это означает, что произошло первичное инфицирование или переход латентной (не активной) инфекции в активную, болезненную форму, в этом случае возможна внутриутробная инфекция — беременеть нельзя. Следовательно, необходимо определять уровень антител IgM количественным методом каждые 10-14 дней, чтобы узнать на каком этапе находится инфекция. Быстрое падение титров IgM означает недавнее инфицирование или обострение, медленное указывает на то, что активная фаза инфекции миновала.
Если в результате анализа указано IgM — «отрицательно», это означает, что заражение цитомегаловирусом произошло как минимум за 1 месяц до момента диагностики, однако совершенно не исключает переход инфекции из латентной стадии в активную. В этом случае внутриутробная инфекция маловероятна.
Иммуноглобулины класса G (IgG) выявляются как при латентном течении цитомегаловирусной инфекции, так и при ее обострении или первичной инфекции. Превышение значений, указанных в бланке лаборатории означает наличие ЦМВ-инфекции. Возможна внутриутробная инфекция, но вероятность ее возникновения неизвестна.
Если титры IgG находятся в пределах значений, указанных в бланке лаборатории, это означает, что ЦМВ-инфекция не обнаружена, либо инфицирование произошло в течение предыдущих 3 — 4 недель. Внутриутробная инфекция невозможна, за исключением случаев одновременного присутствия IgM.
Если человек никогда не был инфицирован цитомегаловирусом, то титр IgG будет ниже значения, указанного на бланке анализа. Это означает очень высокую вероятность заражения цитомегаловирусом во время беременности. Женщины, у которых отсутствует титр IgG, входят в группу риска.
После первичного заражения ЦМВ антитела IgG остаются в крови пожизненно. Переход цитомегаловирусной инфекции из латентной формы в активную на фоне ослабленного беременностью иммунитета возможен и при наличии IgG. После первичного инфицирования или активизации инфекционного процесса титры IgG растут (увеличение в 4 и более раз относительно начального уровня), потом очень медленно падают.
Вероятность заражения плода.
Вероятность заражения плода напрямую зависит от концентрации вируса в крови. А концентрация вируса определяется уровнем защитных антител: чем больше антител, тем ниже концентрация вируса. У людей, впервые инфицированных цитомегаловирусом, антител нет, поэтому концентрация вируса очень высока, следовательно, заражение плода наиболее вероятно. У носителей цитомегаловируса есть антитела, поэтому концентрация вируса в крови ниже.
Профилактикой передачи и заражения цитомегаловирусной инфекцией является изоляция больных с острой стадией процесса, как от новорожденных, так и от беременных.
ЦМВ-инфекция, одна из «поцелуйных» болезней
Цитомегаловирусная инфекция – это заболевание, передающееся половым путем, через слюну, материнское молоко, при беременности (от матери к ребенку), через общую мочалку, полотенце, посуду и т.д. К концу жизни инфицированными этим вирусом оказывается практически сто процентов людей. В большинстве случаев он никак себя не проявляет, но при снижении иммунитета активируется и вызывает болезнь. Вирус может начать действовать в любой части организма, поэтому четкой симптоматики у инфекции нет.
Искоренить вирус нельзя, можно лишь уменьшить его активность. Особенно внимательно к этому вирусу и к его поведению в организме нужно относиться женщинам беременным или планирующим зачать ребенка, поскольку цитомегаловирусная инфекция может вызвать повреждение плода.
Что это такое?
В старые добрые времена ее величали «поцелуйной болезнью», потому как думали, что она передается вместе со слюной. Нынешние медики доказали, что это не совсем так. Возбудитель болезни может находиться не только в слюне, но и в крови, моче, фекалиях, семенной жидкости, секрете шейки матки и материнском молоке. Разумеется, и поцелуя в губы достаточно, чтобы подхватить инфекцию от носителя вируса. Однако того же результата можно добиться, если заняться с ним сексом, выпить из его чашки или поесть из его тарелки, воспользоваться его носовым платком, полотенцем или мочалкой. Кроме того, цитомегаловирусом можно заразиться при переливании крови и пересадке органов, даже в животе у матери будущий ребенок от него не застрахован.
Неутешительные цифры : к 1 году заражен каждый пятый, к 35 годам — 40 процентов населения, а к 50 — все сто. Цитомегаловирусная инфекция считается одним из самых распространенных инфекционных заболеваний.
Возбудитель болезни — Cytomegalovirus hominis — вирус из того же семейства, что и вирус герпеса.
Цитомегаловирус — капризный и привередливый, жить и размножаться он может лишь в очень благоприятных условиях и в определенных клетках. Если ему «что-то не нравится», он ведет себя тихо, зараженный человек пока не болен, он просто является носителем вируса. Но как только организм ослабевает, возбудитель инфекции начинает действовать.
В переводе в греческого цитомегалия — болезнь, при которой «клетки становятся большими». Под влиянием цитомегаловируса клетки теряют способность делиться и одновременно сильно разбухают. Под микроскопом они становятся похожи на глаза совы.
Что происходит?
Оказавшись в клетках человека, цитомегаловирус остается в них навсегда. Независимо от того, каким путем произошло заражение, проявления болезни всегда будут примерно одинаковы. А точнее, никаких проявлений не будет. У большинства инфицированных болезнь протекает в скрытой форме.
Для того чтобы цитомегаловирус активизировался, необходимо снижение иммунитета. Иногда хватает банального авитаминоза, но чаще нужно что-нибудь экстраординарное. Например, СПИД) или прием особых лекарств, понижающих иммунитет (чаще всего они применяются для лечения онкологических заболеваний).
Если цитомегаловирус повреждает слизистые оболочки носа, появляется насморк. При повреждении внутренних органов появляется слабость, поносы-запоры и другие неясные признаки, с которыми, как правило, к врачу не ходят. Тем более, что они через несколько дней сами собой исчезают.
Бывает, что цитомегаловирус поселяется на мочеполовых органах. И тогда у женщин воспаляется матка (эндометрит), шейка матки (цервицит), влагалище (вагинит) и т.п. У мужчин инфекция мочеполовых органов обычно протекает бессимптомно.
Заражение цитомегаловирусом представляет опасность для беременных женщин, поскольку инфекция может передаться развивающемуся эмбриону. Впрочем, если женщина заразилась давно, и инфекция не обостряется, вероятность того, что вирус покалечит будущего ребенка, чрезвычайно низкая. Но при заражении во время беременности, эта вероятность возрастает.
Диагностика и лечение
Самому заподозрить у себя цитомегаловирусную инфекцию практически невозможно. Из всех существующих заболеваний эта болезнь больше всего похожа на банальное ОРЗ. Так же повышается температура, течет из носа и болит горло. Могут увеличиться лимфатические узлы, селезенка и печень. Правда, в отличие от ОРЗ цитомегаловирусная инфекция длится дольше: 1 — 1,5 месяца.
В некоторых случаях единственным признаком болезни является воспаление слюнных желез, в них цитомегаловирус чувствует себя комфортнее всего.
Поставить диагноз «цитомегаловирусная инфекция» может врач-дерматовенеролог. Для этого он вам назначит специальные исследования, которые помогут обнаружить вирус. В образцах крови, слюны, спермы, отделяемого из шейки матки и влагалища, околоплодных вод (при беременности) под микроскопом ищут гигантские клетки или выявляют вирус с помощью ПЦР (ДНК-диагностики). Еще один метод исследования — иммунный: выявление вируса в крови по реакции иммунной системы.
Анализ на цитомегаловирус необходимо делать женщинам, желающим забеременеть.
Цитомегаловирусная инфекция неизлечима. Однако существуют лекарства, позволяющие контролировать количество вируса в организме, сдерживать его развитие. Больным повышают иммунитет и назначают специальные противовирусные препараты.
Эти же мероприятия проводятся при обнаружении цитомегаловируса у беременной или собирающейся забеременеть женщины на протяжении всего периода вынашивания ребёнка и лактации. Используется весь комплекс препаратов, повышающих иммунитет, а также применяются подавляющие размножение вируса препараты интерферона. Инфицированная беременная женщина должна с интервалом 10-12 дней сдавать анализы. Также следует постоянно следить за состоянием эмбриона.
Тщательно подобранная мощная терапия и строгое выполнение рекомендаций врача позволяют значительно снизить риск передачи инфекции ребёнку, который впрямую зависит от активности вируса в организме матери.
Цитомегаловирусная инфекция — Советник по дерматологии
Уверены ли вы в диагнозе?
Симптоматическая инфекция цитомегаловирусом человека (CMV) может возникать у новорожденных или у лиц с ослабленным иммунитетом, включая инфицированных ВИЧ / СПИДом, реципиентов трансплантатов гемопоэтических стволовых клеток (HSCT) и реципиентов трансплантатов органов. Симптомы заражения ЦМВ в таких популяциях чрезвычайно разнообразны. У иммунокомпетентных людей редко проявляются какие-либо симптомы заболевания, кроме легкого синдрома, подобного мононуклеозу.В этой главе ЦМВ классифицируется следующим образом: цитомегалическая инклюзивная болезнь новорожденных, ЦМВ-мононуклеоз в иммунокомпетентной популяции, ЦМВ у реципиентов трансплантата и ЦМВ у больных СПИДом.
Врожденная ЦМВ-болезнь является наиболее частой причиной внутриутробной инфекции у людей, а врожденная инфекция является ведущей инфекционной причиной глухоты и умственной отсталости в США. Цитомегальная инклюзивная болезнь новорожденных возникает после первичного или рецидивирующего инфицирования беременной женщины с последующей вертикальной передачей болезни плоду.Поскольку у иммунокомпетентных взрослых ЦМВ обычно протекает бессимптомно, диагностика ЦМВ-инфекции у беременной женщины с использованием только клинических проявлений является довольно сложной задачей. Среди беременных женщин с первичной ЦМВ-инфекцией симптомы инфекции проявляются менее чем у 5%. Подозрение на инфекцию ЦМВ у плода может возникнуть при определенных результатах ультразвукового исследования, но только 5-25% плодов, инфицированных ЦМВ, обнаруживают такие результаты. Результаты включают эхогенный кишечник, асцит, гидропс плода, внутричерепные кальцификации или кальцификации печени, микроцефалию, плевральный выпот и раннее начало задержки внутриутробного развития.
Если первичная инфекция матери происходит во время беременности, особенно в первом триместре, скорость передачи составляет около 40% по сравнению с 1% после вторичной инфекции. От 10 до 15 процентов врожденно инфицированных младенцев будут иметь симптомы при рождении, включая задержку внутриутробного развития, микроцефалию, церебральную атрофию, желтуху, тромбоцитопению, судороги, гепатоспленомегалию, внутричерепные кальцификации, петехии и появление «черничного маффина» (вторичный по отношению к экстрамедропуллярной эритерии) 1).Около 5% этих младенцев умрут, прежде всего, от диссеминированного внутрисосудистого свертывания крови, дисфункции печени или бактериальной суперинфекции. Исследования показывают, что у 60-90% выживших разовьются долгосрочные неврологические последствия, включая нейросенсорную потерю слуха (одностороннюю и двустороннюю), умственную отсталость, церебральный паралич, парапарез, а также нарушение зрения или слепоту от хориоретинита.
Рисунок 1.
Детский кекс «Черничный кекс».
У большинства врожденно инфицированных младенцев (85–90%) отсутствуют признаки или симптомы при рождении.Однако у 7-15% клинически бессимптомных пациентов могут развиваться поздние осложнения, включая нейросенсорную потерю слуха, которая является наиболее частым осложнением. У плода наличие подозрительных на ЦМВ-инфекцию результатов ультразвукового исследования должно вызвать немедленное обследование плода.
ЦМВ-инфекция у иммунокомпетентных пациентов возникает в результате острой первичной инфекции ЦМВ, чаще всего в форме ЦМВ-индуцированного мононуклеоза. ЦМВ-инфекцию следует заподозрить у пациента с лихорадкой, утомляемостью и недомоганием без каких-либо результатов физикального обследования или исторических особенностей, указывающих на конкретный диагноз.Синдром клинически неотличим от инфекционного мононуклеоза вируса Эпштейна-Барра (EBV). При физикальном обследовании нет характерных результатов, которые окончательно устанавливают или предполагают диагноз ЦМВ-инфекции. Подобно EBV-инфекции, у 80-100% пациентов появляется пятнисто-папулезная патологическая сыпь при введении ампициллина (или других пенициллинов) во время болезни.
Другие возможные кожные высыпания, не зависящие от приема антибиотиков, включают узловатую эритему, многоформную эритему, кожный васкулит, васкулопатию и склеродермию без телец включения.Также как и инфекция ВЭБ, пациенты, инфицированные ЦМВ, могут иметь атипичные лимфоциты и легкие трансаминиты, но тест на гетерофильные пятна у пациентов с ЦМВ отрицательный. Течение болезни обычно доброкачественное и самоограничивается. В редких случаях могут развиваться осложнения, включая гемолитическую анемию, инфаркт селезенки, интерстициальную пневмонию, тромбоцитопению, синдром Гийена-Барре, менингоэнцефалит, миокардит, артрит, плеврит и синдромы, затрагивающие желудочно-кишечную или мочеполовую системы.
ЦМВ — одна из наиболее распространенных инфекций, возникающих у реципиентов после трансплантации органов и гемопоэтических стволовых клеток (HSCT). Без соответствующей профилактики до 30-80% (в зависимости от серологического статуса донора и реципиента) этих пациентов могут иметь инфекцию ЦМВ. Пациенты, перенесшие трансплантацию печени, почек или сердца, могут иметь либо ЦМВ-синдром, либо прогрессировать до тканевоинвазивного ЦМВ-заболевания, последнее приводит к повреждению конечного органа. Синдром ЦМВ проявляется преходящей лихорадкой и недомоганием, часто связанным с лейкопенией или тромбоцитопенией.Однако следует отметить, что у пациентов, получающих высокие дозы иммунодепрессантов, может отсутствовать лихорадка. Тканевоинвазивное ЦМВ заболевание связано с поражением конкретных органов (желудочно-кишечного тракта, пневмонита, нефрита, гепатита, энцефалита, миокардита, ретинита и т. Д.). Заболевания гепатитом, лейкопенией и пневмонитом называют «смертельной триадой», и эти пациенты часто умирают от бактериальных или условно-патогенных суперинфекций, которые чаще всего поражают легкие.
У пациентов, перенесших аллогенную трансплантацию костного мозга, начало развития ЦМВ происходит через 50-70 дней после трансплантации.Среди пациентов, инфицированных ЦМВ, наиболее серьезным осложнением является пневмония, летальность которой превышает 50%. Однако новые профилактические схемы снизили заболеваемость до менее 5% у реципиентов аллогенных ТГСК. Кроме того, благодаря профилактике ганцикловиром и превентивному лечению, болезнь ЦМВ стала более серьезной проблемой после 100-го дня трансплантации. У реципиентов как гемопоэтических, так и солидных органов инфекция ЦМВ является основным фактором риска инвазивных бактериальных и грибковых инфекций.В целом, ЦМВ увеличивает риск отторжения трансплантата и снижает способность иммунной системы хозяина защищаться от инфекции.
С момента появления высокоактивной антиретровирусной терапии (ВААРТ) заболеваемость ЦМВ-инфекцией среди людей, живущих со СПИДом, снизилась. Многие пациенты с ВИЧ инфицированы ЦМВ, однако заболевание ЦМВ обычно возникает только у лиц с тяжелым иммунодефицитом. Среднее количество CD4 при постановке диагноза составляет менее 25 / мм 3 .
ЦМВ-ретинит — наиболее частая форма ЦМВ-болезни у пациентов со СПИДом, составляющая 80-90% ЦМВ-болезни в этой популяции пациентов, за которой следует инфекция желудочно-кишечного тракта.Клинические симптомы ЦМВ-ретинита включают плавающие помутнения, нечеткое зрение и потерю пропорций поля зрения. Это безболезненное состояние, но может быстро прогрессировать до слепоты, если его не обследовать и не лечить вовремя. При осмотре глазного дна можно увидеть желто-белый экссудат с кровоизлиянием или белое зернистое поражение.
Инфекция желудочно-кишечного тракта может привести к ЦМВ-колиту с симптомами диареи, гематохезии и боли в животе, которые могут прогрессировать до перфорации кишечника.ЦМВ-эзофагит проявляется одинофагией. Включения ЦМВ обнаруживаются в эндотелиальных клетках при выполнении биопсии. ЦМВ может влиять на нервную систему в виде полирадикулопатии, вызывающей дисфункцию кишечника и мочевого пузыря, сопровождающуюся слабостью нижних конечностей или результатами МРТ, показывающими перивентрикулярное усиление. ЦМВ энцефалит обычно неотличим от энцефалита, вызванного ВИЧ.
У пациентов с ослабленным иммунитетом наиболее частыми кожными поражениями являются язвы (рис. 2), обычно в перианальной области и ягодицах.Эти кожные язвы являются результатом ЦМВ-инфекции эндотелия сосудов и последующего разрушения кровеносных сосудов. Другие кожные проявления, о которых сообщалось, включают пурпуру, петехии, морбиллиформную сыпь, макулопапулезную сыпь, везикулы, а также уплотненные бляшки и узелки (Рисунок 3, Рисунок 4, Рисунок 5).
Рисунок 2.
Язва у больного СПИДом с ЦМВ-инфекцией. Воспроизведено из Boldogh I, Patel JA, Tyring SK, Chonmaitree T. Cytomegalovirus.В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145–164, с разрешения.
Рисунок 3.
Кожные проявления ЦМВ у пациентов с ослабленным иммунитетом. Воспроизведено из Boldogh I, Patel JA, Tyring SK, Chonmaitree T. Cytomegalovirus. В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145-164, с разрешения.
Рисунок 4.
Кожные проявления ЦМВ у пациентов с ослабленным иммунитетом. Воспроизведено из Boldogh I, Patel JA, Tyring SK, Chonmaitree T. Cytomegalovirus. В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145-164, с разрешения.
Рисунок 5.
Кожные проявления ЦМВ у пациентов с ослабленным иммунитетом. Воспроизведено по материалам Boldogh I, Patel JA, Tyring SK, Chonmaitree T.Цитомегаловирус. В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145-164, с разрешения.
Тканевая диагностика ЦМВ-инфекции очень специфична, но не чувствительна. По гистологии ЦМВ имеет вид «совиного глаза», представляющий собой включения в инфицированных эндотелиальных клетках (рис. 6). Как следует из названия цитомегаловирус, клетки увеличены в 2-3 раза по сравнению с нормальным размером, содержат крупные внутриядерные включения и окружены четким ореолом.Может возникнуть путаница, потому что включения кажутся похожими на те, которые наблюдаются при инфекции вируса простого герпеса и вируса ветряной оспы.
Рисунок 6.
«Совиный глаз» появление ядерных телец включения в инфицированных эндотелиальных клетках. Воспроизведено из Boldogh I, Patel JA, Tyring SK, Chonmaitree T. Cytomegalovirus. В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145-164, с разрешения.
Самым точным методом тестирования на инфекцию плода ЦМВ является амниоцентез после 21 недели беременности с амплификацией полимеразной цепной реакции ЦМВ (ПЦР), которая является 90% чувствительной и специфичной. Обнаружение не может предсказать тяжесть заболевания. У новорожденных самый точный тест — выделение ЦМВ в моче. ЦМВ может выделяться с мочой детей, инфицированных в новорожденном возрасте до 8 лет.
Другие диагностические методы включают культивирование тканей, гистологическое-цитологическое обнаружение, иммунологические методы, тестирование нуклеиновых кислот и обнаружение антигена.Традиционное культивирование в значительной степени было заменено культивированием во флаконе с оболочкой с использованием антител, меченных флуоресцеином, из-за того, что оно дает результаты через несколько дней по сравнению с неделями при сопоставимой чувствительности. ЦМВ можно выделить для тканевых культур из мочи, слюны, грудного молока, стула, спермы, цервикального секрета и периферической крови, но чаще всего используются моча и слюна.
Другие диагностические методы включают иммунофлуоресценцию с использованием моноклональных антител, специфичных к антигену pp65 в лейкоцитах, и меченные радиоактивным изотопом или биотином зонды ДНК или РНК.В таких методах используются клетки периферической крови, ткани вскрытия, биопсии и амниотические клетки. Серологические методы включают фиксацию комплемента, твердофазный иммуноферментный анализ (ELISA), ингибирование гемагглютинации и анализ латексной агглютинации.
Кто подвержен риску развития этого заболевания?
Все люди подвержены риску развития ЦМВ-инфекции, но к группе риска развития заболевания относятся новорожденные, зародыши, люди с ослабленным иммунитетом и пациенты с ВИЧ / СПИДом. Вирус ЦМВ широко распространен во всем мире, а его серологическая распространенность варьируется географически.В развивающихся странах показатели распространенности серотипа могут приближаться к 100%, тогда как в развитых странах только около 50% взрослых имеют признаки инфекции. В США более высокие показатели связаны с пожилым возрастом, женским полом и более низким семейным доходом. От шестидесяти до восьмидесяти процентов инфицированных людей не проявляют никаких клинических симптомов. Приблизительно 0,2–2,5% новорожденных в США ежегодно имеют врожденную ЦМВ-инфекцию, но у 90% она протекает бессимптомно.
В США распространенность ЦМВ среди чернокожих латиноамериканцев и американцев мексиканского происхождения на 25-30% выше, чем среди белых неиспаноязычных.Распространенность ЦМВ на 15-20% выше в домохозяйствах с низким и средним доходом по сравнению с домохозяйствами с более высокими доходами. Новорожденные с врожденным ЦМВ также обнаруживают такую же распространенность серотипа, как упомянуто выше для населения в целом. У бедных, небелых матерей больше шансов иметь детей с врожденной ЦМВ-инфекцией.
Передача половым путем также играет роль в инфицировании ЦМВ, поскольку люди с факторами сексуального риска, включая нескольких партнеров, мужчин-гомосексуалистов и в анамнезе заболевания, передаваемые половым путем, с большей вероятностью будут инфицированы ЦМВ.Было показано, что женщины имеют более высокую серологическую распространенность по сравнению с мужчинами.
ЦМВ-инфекция, которая возникает в детстве, протекает бессимптомно и часто возникает в условиях дневного ухода, где более распространена передача слюны и других выделений. У иммунокомпетентных взрослых вирус передается через выделения, которые чаще возникают во время сексуальной активности или интимных физических взаимодействий. При переливании крови риск передачи ЦМВ составляет 3-4%; однако, поскольку ЦМВ переносится в полиморфноядерных лимфоцитах, использование крови с пониженным содержанием лейкоцитов или криоконсервированной крови снижает риск и особенно полезно, когда реципиентам трансплантата требуется переливание.
ВИЧ-инфицированных с низким уровнем CD4 более восприимчивы к ЦМВ-болезни. Как упоминалось ранее, среднее количество CD4 у пациентов с ВИЧ с диагнозом ЦМВ составляет менее 25 / мм 3 . Это следует отличать от положительности CMV, при которой у пациентов нет симптомов, и она может встречаться у пациентов с ВИЧ с любым числом CD4.
Реципиенты трансплантата подвержены риску развития ЦМВ-болезни, и существует три модели передачи. Девяносто пять процентов реципиентов трансплантата инфицированы ЦМВ, когда серопозитивные, латентно инфицированные донорские клетки передаются серонегативному реципиенту.Заболеваемость ЦМВ у этих пациентов составляет 50-65%. Второй тип инфекции — это когда серопозитивный реципиент подвергается реактивации латентной ЦМВ-инфекции. Частота симптоматического заболевания составляет 10-20%. Третий тип инфекции ЦМВ у реципиентов называется суперинфекцией. Это происходит, когда серопозитивный донорский аллотрансплантат трансплантируется серопозитивному реципиенту. Заболеваемость у этих пациентов составляет 15-25%.
Что является причиной болезни?
CMV, или вирус герпеса человека 5, представляет собой ДНК-вирус, принадлежащий к семейству Herpesviridae и подсемейству Betaherpesvirinae.Вирус проникает в организм человека-хозяина через слизистые оболочки верхних дыхательных путей, желудочно-кишечного тракта и урогенитального тракта. Таким образом, возможные источники инфекции включают выделения из полости рта, мочу, грудное молоко, сперму, а также выделения из шейки матки и влагалища. Косвенная передача может происходить через зараженные фомиты.
Вирус использует полиморфно-ядерные клетки для распространения по телу и может распространяться, заражая различные органы. У плода и новорожденного инфекция ЦМВ чаще всего поражает слюнные железы и нейроны.У иммунокомпетентных людей вирус обычно поражает лимфоидные ткани. У пациентов с ослабленным иммунитетом, инфицированных ЦМВ, вирус поражает легкие или другие органы.
При инфицировании клеток ЦМВ вызывает цитомегалию и конденсацию ядерной массы, в то время как инфицирование органов приводит к воспалению и, как следствие, дисфункции органов. Инфекция легких приводит к цитомегалии и тельцам включения ядер, сопровождающимся воспалением. при кожных изъязвлениях ядерные включения обнаруживаются в эндотелиальных клетках капилляров.В желудочно-кишечном тракте возникают язвы, которые могут привести к кровотечению и перфорации кишечника с последующим кишечным пневматозом. В печени ЦМВ-инфекция вызывает гепатит от легкой до умеренной степени тяжести у 30-50% пациентов, перенесших трансплантацию, и часто встречаются аномальные функциональные тесты печени. Цитомегалические клетки также обнаруживаются в эпителии желчных протоков новорожденных, инфицированных ЦМВ.
Возможно, что ЦМВ вызывает иммуносупрессию, уменьшая соотношение хелперных Т-лимфоцитов к супрессорным лимфоцитам.Кроме того, ЦМВ был обнаружен в различных опухолях человека, что указывает на его возможное участие в онкогенезе. У иммунокомпетентных взрослых ЦМВ исчезает в течение нескольких месяцев после первичной инфекции, ускользает от иммунной системы хозяина, чтобы оставаться в латентном состоянии и может реактивироваться в любое время.
Системные последствия и осложнения
У иммунокомпетентного пациента, инфицированного ЦМВ, как правило, нет системных осложнений. У больного СПИДом системные осложнения включают ЦМВ-ретинит, ЦМВ-колит и ЦМВ-эзофагит.Терапия предполагает раннюю диагностику и агрессивное лечение. ЦМВ-ретинит диагностируется при обследовании глазного дна, и его следует проводить, если клинические симптомы указывают на заболевание. Для офтальмологической оценки следует поддерживать низкий порог, поскольку ЦМВ-ретинит быстро вызывает слепоту.
ЦМВ-колит и эзофагит диагностируются при эндоскопии с биопсией, показывающей цитомегалические включения. У пациента, перенесшего трансплантацию, системные осложнения возникают в результате инфекции ЦМВ и включают тяжелую, опасную для жизни бактериальную, грибковую или условно-патогенную инфекцию.Терапия предполагает раннюю диагностику таких инфекций и агрессивное лечение.
Варианты лечения
Противовирусная терапия не рекомендуется для лечения врожденной ЦМВ-инфекции. Для лечения ЦМВ не существует хирургических процедур или физических методов. Варианты лечения в Таблице I предназначены для пациентов со СПИДом, инфицированных ЦМВ, и реципиентов трансплантата.
Таблица I.
| ЛЕКАРСТВА | ДОЗИРОВКА |
|---|---|
| Ганцикловир внутривенно | 5 мг / кг один раз в день (пероральная доза: 100 мг 3 раза в день во время еды — не так эффективно) |
| Валганцикловир для перорального применения | Лечение ЦМВ-ретинита: Индукция: 900 мг внутрь два раза в день во время еды.Поддерживающая терапия: 900 мг перорально один раз в день Профилактика ЦМВ-инфекции: 900 мг перорально один раз в день в течение 10 дней после трансплантации до 100 дней после трансплантации |
| Фоскарнет для внутривенного введения | Индукция: 180 мг / кг / день (скорректировать дозу в зависимости от клиренса креатинина) Поддерживающая: 120 мг / кг / день (скорректировать дозу в зависимости от клиренса креатинина) |
| Цидофовир внутривенно | Индукция: 330 мкг (одна инъекция каждые две недели x три дозы) Поддерживающая: 330 мкг (одна инъекция каждые 4 недели после индукционной терапии) |
| Фомивирсен | Индукция: 5 мг / кг еженедельно x 2 недели подряд (корректировка дозы в зависимости от клиренса креатинина) Поддерживающая терапия: 5 мг / кг один раз каждые 2 недели (корректировка дозы в зависимости от клиренса креатинина) |
| Интерферон (не одобрен FDA) | |
| Внутривенные иммуноглобулины (не одобрены FDA) |
Оптимальный подход к лечению этого заболевания
Терапевтический подход к ЦМВ-инфекции должен включать профилактику и лечение.
Профилактика ЦМВ-инфекции у еще не инфицированных пациентов с ослабленным иммунитетом начинается с выбора соответствующих продуктов крови. В этой популяции следует использовать донорскую кровь с отрицательными антителами к ЦМВ. Было показано, что профилактическое лечение лиц с ослабленным иммунитетом и пациентов с трансплантатом цитомегаловирусным иммуноглобулином (CMVIG) снижает частоту и тяжесть заболевания CMV и осложнений инфекции. Он не предотвращает первичное инфицирование ЦМВ. В настоящее время проходят клинические испытания две вакцины против ЦМВ: субъединичная вакцина CMV gB / MF59 и живая аттенуированная вакцина на основе штамма Таун с высокой пассажей.Обе вакцины индуцируют нейтрализующие антитела. Другие разрабатываемые вакцины включают ДНК-вакцину, несущую фосфопротеин 65 и гликопротеин B, а также вакцину CMV-MVA, которая помещает три небольших фрагмента ДНК CMV в ослабленный вирус, называемый MVA. Эти вакцины в настоящее время проходят фазы III и II испытаний соответственно.
Лечение первой линии при ЦМВ-инфекции, угрожающей жизни или зрению, представляет собой ганцикловир, который представляет собой ациклический нуклеозидный аналог гуанина.Он подавляет активную инфекцию за счет подавления синтеза ДНК, но не лечит инфекцию ЦМВ. Он более биодоступен при внутривенном введении, что лучше всего для начала лечения ЦМВ-болезни. Ганцикловир для приема внутрь менее эффективен, но чаще всего используется для длительного лечения. Лечение ганцикловиром рекомендуется пациентам с ослабленным иммунитетом, инфицированным ЦМВ, и профилактика ЦМВ у реципиентов трансплантата.
Валганцикловир, пролекарство ганцикловира, доступен перорально и имеет значительно повышенную биодоступность по сравнению с ганцикловиром с аналогичными профилями безопасности и эффективности.Валганцикловир был одобрен для лечения ЦМВ-ретинита у взрослых пациентов со СПИДом, а также для профилактики ЦМВ-болезни у реципиентов трансплантата органов. Это препарат выбора при ЦМВ-инфекции легкой и средней степени тяжести. Побочные эффекты ганцикловира включают тромбоцитопению, обратимую нейтропению, азооспермию, почечную недостаточность и симптомы центральной нервной системы (ЦНС).
Устойчивость ЦМВ к ганцикловиру, хотя и встречается редко. Средством второго ряда для лечения ЦМВ-инфекций, особенно ЦМВ-ретинита у больных СПИДом, является фоскарнет.Он также вирустатичен и подавляет репликацию ДНК, но имеет другой механизм действия, чем ганцикловир. Он эффективен против устойчивых к ганцикловиру штаммов ЦМВ и не токсичен для костного мозга. Его вводят внутривенно. Побочные эффекты включают почечную дисфункцию (ограничение дозы), электролитные нарушения, изъязвление половых органов в результате выделения с мочой (рис. 7), тошноту, рвоту, нарушения ЦНС и отложения в костях, зубах и хрящах.
Рисунок 7.
Изъязвление половых органов в результате выделения фоскамета с мочой.Воспроизведено из Boldogh I, Patel JA, Tyring SK, Chonmaitree T. Cytomegalovirus. В: Тайринг С.К., Мур А.Ю., Лупи О., редакторы. Кожно-слизистые проявления вирусных заболеваний (2-е издание). Соединенное Королевство: Informa; 2010. pp 145-164, с разрешения.
Цидофовир — это ациклический нуклеозидфосфонат, одобренный для лечения ЦМВ-ретинита у пациентов, которые не могут принимать ганцикловир или фоскарнет. Его вводят внутривенно с пробенецидом для защиты почек от отказа. Побочные эффекты включают нефротоксичность, нейтропению, метаболический ацидоз и глазную гипотонию.
Экспериментальные противовирусные препараты, разрабатываемые или рассматриваемые для использования при ЦМВ, устойчивом к ганцикловиру, включают фоскарнет, цидофовир, летермовир, CMX-001 (липидное пролекарство цидофовира, доступное перорально), циклопропавир, артесунат и лефлуномид.
Фомивирсен — олигонуклеотид, рекомендованный для лечения ЦМВ-ретинита у пациентов с ВИЧ / СПИДом путем интравитреальной инъекции пациентам, которые по какой-либо причине больше не могут получать другие методы лечения. Побочные эффекты включают воспаление глаз и повышение внутриглазного давления.
Управление пациентами
У иммунокомпетентных пациентов нет необходимости выходить за рамки объяснения естественного течения ЦМВ.
У родителей новорожденных, инфицированных ЦМВ, необходимо объяснение естественного течения болезни и заверение в том, что они не виноваты в развитии ЦМВ у их новорожденного. Также может быть полезно объяснение распространенности ЦМВ-серотипа. Необходимо проконсультировать родителей при подготовке к ребенку, у которого может быть задержка в развитии и потеря слуха.
В популяции ВИЧ следует подчеркнуть важность ВААРТ, потому что сохранение нормального числа CD4 предотвратит ЦМВ-болезнь. Когда у пациента снижается количество CD4, важно объяснить возможность заболевания ЦМВ, включая признаки и симптомы заболевания.
Для реципиентов трансплантата, помимо объяснения естественного происхождения ЦМВ, следует обсудить разработку вакцины, выбор подходящих донорских продуктов и варианты профилактической терапии.
Необычные клинические сценарии, которые следует учитывать при ведении пациентов
Необычный сценарий, с которым можно столкнуться, — это популяция СПИДа. У таких пациентов могут быть аногенитальные поражения, которые ошибочно принимают за инфекцию простого герпеса. Поражения обрабатываются как вирус простого герпеса, но не улучшаются. Биопсия выявляет ЦМВ или вирус простого герпеса, устойчивый к ацикловиру. Лечение цидофовиром обычно бывает успешным.
Какие доказательства?
Cannon, MJ.. «Эпидемиология и осведомленность о врожденном цитомегаловирусе (ЦМВ)». J Clin Virol. т. 46. 2009; Декабрь, стр. S6-S10. (Тщательный обзор недавней литературы, в которой подробно описывается эпидемиология ЦМВ-инфекции, включая серологическую распространенность и частоту передачи в США.)
Кэннон, М.Дж., Шмид, Д.С., Хайд, ТБ .. «Обзор серопространственности цитомегаловируса и демографические характеристики, связанные с инфекцией». Rev Med Virol. т. 20. 2010. С. 202-13. (Тщательный обзор литературы, в которой обсуждается распространенность серотипов и демографические данные беременных и небеременных женщин и их связь с врожденной ЦМВ-инфекцией.)
Фельдман Д.М., Тиммс Д., Боргида А.Ф. «Токсоплазмоз, парвовирус и цитомегаловирус при беременности». Clin Lab Med. т. 30. 2010. С. 709-20. (Третий раздел этой рукописи посвящен инфекции CMV матери и плода, включая обсуждение диагностики и лечения.)
Джеймс, В. Д., Бергер, Т. Г., Элстон, Д. М. Клиническая дерматология кожи при болезни Эндрюса. 2006. (Раздел, посвященный цитомегаловирусу в этом тексте, посвящен дерматологическим проявлениям.)
Boldogh, I., Patel, JA, Tyring, SK, Chonmaitree, T., Tyring, SK, Moore, AY, Lupi, O. «Cytomegalovirus». Кожно-слизистые проявления вирусных болезней. 2010. С. 145–64. (Подробное и краткое обсуждение цитомегаловируса с исключительными фотографиями проявлений болезни.)
Горбач, С.Л., Бартлетт, Дж. Г., Блэклоу, Н.Р. Инфекционные болезни.
(Полезная поисковая машина для определения одобренных FDA дозировок лекарств.)
Раманан, П, Разонабл, РР.. «Цитомегаловирусные инфекции при трансплантации твердых органов: обзор». Infect Chemother .. vol. 45. 2013 сентябрь, стр. 260–271. (Обзорная статья по эпидемиологии, профилактике, диагностике и лечению ЦМВ-инфекции у пациентов с трансплантатом.)
Бек, М., Гилберт, П.Б. «Продолжаются поиски вакцины против ЦМВ для реципиентов трансплантата». Ланцет. т. 3. Февраль 2016. С. 58–59. (Обсуждение ранее и разрабатываемых вакцин против ЦМВ при трансплантации.)
Ван, Д., Фу, Т. М. «Прогресс в области создания вакцин против цитомегаловируса человека для профилактики врожденных инфекций и болезней». Curr Opin Virol .. vol. 6. Июнь 2014 г., стр. 13–23. (Статья, в которой обсуждаются вакцины от врожденной ЦМВ-инфекции, а также информация об эпидемиологии и проявлениях врожденной ЦМВ-инфекции.)
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
Цитомегаловирус человека (HCMV) | Британское общество иммунологии
Болезнь, ассоциированная с HCMV
Цитомегаловирус человека (HCMV) — это бета-герпесвирус, вызывающий пожизненную инфекцию у людей. HCMV имеет распространенность 55-100% среди населения, в зависимости от различных социально-экономических и географических факторов. Первичная инфекция HCMV обычно протекает бессимптомно у здоровых хозяев, но может вызывать тяжелые, а иногда и смертельные заболевания у лиц с ослабленным иммунитетом и новорожденных.HCMV является ведущей инфекционной причиной врожденных аномалий в западном мире, поражая 1-2,5% из
.живорожденных. HCMV внутриутробная инфекция и может вызывать серьезные осложнения, включая низкий вес при рождении, потерю слуха, нарушение зрения, микроцефалию, гепатоспленомегалию и различные степени умственной отсталости.
HCMV также вызывает серьезные заболевания у реципиентов трансплантата органов и пациентов со СПИДом либо после первичного инфицирования, либо после реактивации скрытой инфекции.У лиц с ослабленным иммунитетом инфекция HCMV часто контролируется ранним лечением противовирусными препаратами, но существуют проблемы, такие как токсичность, появление устойчивых к противовирусным препаратам штаммов HCMV и доступность противовирусных препаратов в развивающихся странах.
Иммунный ответ на цитомегаловирус
Внеклеточные и внутриклеточные рецепторы распознавания патогенов, такие как Toll-подобные рецепторы (TLR), распознают компоненты вириона, которые запускают врожденный иммунный ответ на вирус.Это приводит к выработке воспалительных цитокинов, таких как интерфероны 1 типа (IFN), фактор некроза опухоли альфа (TNF-α) и интерлейкин-6 (IL-6). Эти воспалительные цитокины могут привлекать и активировать фагоцитарные клетки, такие как дендритные клетки, которые могут поглощать инфицированные HCMV клетки. Клетки-естественные киллеры (NK) также привлекаются к начальным участкам инфекции и уничтожают инфицированные HCMV клетки путем высвобождения цитотоксических белков, которые разрушают клетки-мишени. Кроме того, данные модели инфекции мышиного цитомегаловируса (MCMV) предполагают, что нейтрофилы вносят вклад в ранний контроль вирусной инфекции.
Адаптивный иммунный ответ способствует долгосрочному контролю HCMV. Инфекция HCMV приводит к чрезвычайно сильному цитотоксическому ответу Т-лимфоцитов CD8, который, по-видимому, имеет решающее значение для контроля первичной инфекции HCMV и реактивации после латентного периода. Кроме того, HCMV-специфические IFN-γ-секретирующие CD4 Т-клетки связаны со снижением выделения вируса в мочу, тем самым ограничивая его распространение среди новых хозяев. В-клетки также играют роль в контроле инфекции HCMV и могут также помочь предотвратить ее передачу новым хозяевам, поскольку материнские антитела могут обеспечивать защиту плода в утробе матери.
Сводная информация об иммунных ответах на HCMV представлена на рисунке 1.
Рисунок 1: Сводка иммунных ответов на ЦМВ-инфекцию
Иммунное уклонение от HCMV
HCMV эволюционировал вместе с людьми на протяжении миллионов лет. За это время он приобрел ряд различных механизмов, которые модулируют и уклоняются от иммунного ответа человека, что делает возможным более эффективное заражение и распространение в организме. HCMV выделяет большую часть своего генома на подавление активности NK-клеток.Белки UL16 и UL142 HCMV предотвращают экспрессию лигандов, активирующих NK-клетки, на поверхности инфицированных клеток, тогда как UL83 HCMV может напрямую связываться с NKp30, активирующим рецептором NK-клеток, и предотвращать активацию NK-клеток. Кроме того, белки US18 и US20 HCMV способствуют деградации MICA (основного стрессового белка), не позволяя NK-клетке распознавать стрессовые сигналы инфицированной клетки. HCMV приобрел вирусный гомолог IL-10, иммуномодулирующий цитокин, который, как было продемонстрировано, подавляет антицитомегаловирусный иммунитет.HCMV также нацелен на активацию адаптивного иммунного ответа. Белки US11, US2 и US3 HCMV подавляют экспрессию молекул главного комплекса гистосовместимости (MHC) класса I и II на клетках, таких как антигенпрезентирующие клетки, что предотвращает презентацию пептидов, полученных из HCMV, связанных с молекулами MHC, в нестимулированный T клетки, процесс, необходимый для активации Т-клеток.
Вирусная инфекция клеток может вызвать апоптоз клетки человека, механизм запрограммированной гибели клеток, который важен для ограничения распространения вируса.Эти апоптотические клетки затем очищаются фагоцитарными клетками, что предотвращает высвобождение новых вирионов. Однако HCMV выработал белки (UL36 и UL37), которые предотвращают апоптоз инфицированных клеток, способствуя его распространению в организме хозяина. Краткое описание механизма уклонения от иммунитета, используемого HCMV, показано на рисунке 2.
Рисунок 2: Краткое изложение механизмов уклонения от иммунитета HCMV
Несмотря на множество механизмов уклонения от иммунитета, разработанных HCMV, иммунная система человека по-прежнему вырабатывает устойчивый иммунный ответ в ответ на этот вирус.Это ясно демонстрируется тем фактом, что большинство первичных инфекций у иммунокомпетентных хозяев протекает бессимптомно и что заболевание HCMV возникает в основном у людей с ослабленной или незрелой иммунной системой. Текущие исследования нацелены на полное выяснение механизмов, с помощью которых HCMV манипулирует иммунной системой человека, чтобы улучшить противовирусную терапию и разработать вакцину, способную усиливать первоначальный противовирусный иммунный ответ, предотвращая, таким образом, развитие инфекции HCMV.
Цитомегаловирус человека | Bite-Sized Immunology © Авторские права на эту работу принадлежат автору
Инфекция цитомегаловирусом человека: биологические особенности, передача, симптомы, диагностика и лечение
1.Введение
Цитомегаловирус человека (ЦМВ), инфекционный агент, который повсеместно встречается в мировой популяции, является членом семейства вирусов герпеса человека, включая такие вирусы, как вирус Эпштейна-Барра, вирус простого герпеса и ветряная оспа. ЦМВ — самый крупный вирус семейства герпесных с размером 190 нм. Структура вируса включает сложную оболочку, состоящую из шипованной мембраны, полученной из клетки-хозяина, и икосаэдрического капсида, который содержит ДНК вириона. Слой тегумента, который описывает аморфную область между оболочкой и капсидом, вызывает сильные адаптивные иммунные ответы, включая ЦМВ-специфические CD8 + цитотоксические Т-лимфоциты, которые, как полагают, играют фундаментальную роль в контроле репликации ЦМВ в инфицированном хозяине.Люди являются единственным источником цитомегаловируса, и он может инфицировать людей всех рас, возрастов и полов.
Человеческий цитомегаловирус, условно-патогенный микроорганизм, передается при трансплантации твердых органов / костей, через плацентарный путь, половое сношение, переливание крови и при тесном контакте с людьми, распространяющими вирус. Подобно другим герпесвирусам, он приводит к первичной инфекции, вторичной инфекции, латентной инфекции и реактивации или повторному инфицированию. У пациентов с ослабленным иммунитетом цитомегаловирус вызывает серьезные клинические симптомы.После первичного инфицирования вирусный геном образует эписомальную кольцевую форму в миелоидных предшественниках и эндотелиальных клетках. Через TNF-альфа и интерферон типа II (IFN) латентный CMV превращается в активный CMV и мигрирует в воспаленную ткань, где они далее распространяются во время воспалительного процесса и в контексте активации иммунной системы. ЦМВ — это вирусный агент, который также вызывает внутриутробные инфекции и вызывает глухоту и неврологические аномалии у новорожденных. Цитомегаловирус ассоциирован с вариабельной распространенностью серотипа от 45 до 100% у женщин репродуктивного возраста и никогда не выводится из организма хозяина [1].У иммунокомпетентных взрослых первичные ЦМВ-инфекции обычно протекают бессимптомно. Реже лихорадка, лимфаденопатия и синдром, подобный мононуклеозу, сосуществуют с периферическим лимфоцитозом. Отсутствие лечения у людей с нарушенной иммунной функцией может привести к инфекциям с высокой смертностью [2].
2. Эпидемиология
Цитомегаловирусные инфекции человека передаются несколькими путями. ЦМВ обычно передается инфицированными жидкостями (например, слюной, грудным молоком, продуктами крови), контактом дома и в детских садах как контакт с населением.Также считается, что контакт с зараженной мочой может быть ролью передачи цитомегаловируса [3]. Среди послеродовых инфекций грудное вскармливание является наиболее частым течением ЦМВ-инфекции у младенцев младшего возраста, особенно в популяциях с высокой распространенностью ЦМВ-инфекции и высокими показателями грудного вскармливания от серопозитивных женщин в течение первых 6 месяцев грудного вскармливания, достигая пика через 4-8 недель после родов, но риск сохраняется во время кормления грудью. Хотя считается, что локальная реактивация в молочных железах матерей с латентной ЦМВ-инфекцией может вызвать передачу ребенку, но механизм передачи еще не определен четко [4].В качестве резервуара вируса эти младенцы выделяют вирус со слюной и мочой в течение продолжительных периодов времени другим младенцам, детям и взрослым. У детей дошкольного возраста ЦМВ может распространяться через стул, и они могут заразить своих родителей и учителей в детских учреждениях. В детстве и в раннем взрослом возрасте ЦМВ передается через слюну и мочу. В связи с тем, что вирус присутствует в семенной жидкости и жидкости шейки матки, он также может передаваться половым путем.
Врожденная ЦМВ-инфекция (присутствует при рождении) происходит в результате внутриутробной передачи вируса, который, как считается, передается развивающемуся плоду примерно у 30% женщин, перенесших первичную инфекцию во время беременности, или в результате реактивации у женщин, ранее иммунизированных для ЦМВ. порядка 1–2% (вертикальная дорога).В США, Канаде, Западной Европе и Австралии это обычная инфекция, которая, по оценкам, встречается примерно у 5–7 на 1000 живорождений [5]. Ставки были описаны как самые высокие — 2% в Азии и Африке. Врожденная ЦМВ-инфекция приводит к необратимым нарушениям, таким как потеря слуха, потеря зрения, церебральный паралич и / или когнитивные нарушения у детей. Примерно 90% новорожденных с врожденным ЦМВ протекают бессимптомно; однако новорожденные также подвержены риску инвалидности, связанной с ЦМВ [6].
Нозокомиальные инфекции, вызванные ЦМВ, возникают в результате контакта с продуктами крови, содержащими ЦМВ. ЦМВ-инфекции, полученные при переливании крови, часто вызывают симптоматические заболевания, включая гепатит и тромбоцитопению, у детей и взрослых. Смертельные инфекции могут развиться у новорожденных, рожденных от женщин без иммунитета к ЦМВ из-за отсутствия антител к ЦМВ. Тяжелая инфекция также может присутствовать у пациентов с ослабленным иммунитетом, которым была сделана кровь с ЦМВ. В последнее время при использовании продуктов крови от CMV-серонегативных доноров заболеваемость CMV-инфекциями, ассоциированными с переливанием крови, значительно снизилась.Инфекции, вызванные ЦМВ, перенесенным в аллотрансплантат, являются основными причинами заболеваемости в раннем и позднем периоде после трансплантации. Даже если применяется противовирусная терапия, ЦМВ-инфекция вызывает долговременную дисфункцию трансплантата и потерю трансплантата, особенно у реципиентов трансплантата сердца и легких [7].
3. Клинические проявления
Клинические проявления состоят из неспецифических симптомов или клинических проявлений. Однако у пациентов с острой ЦМВ-инфекцией симптомы обычно протекают бессимптомно.Во внутриутробном периоде дети, инфицированные ЦМВ, обычно не проявляют симптомов при рождении. Однако у 10–15% из них проявляются симптомы и проявляются симптомы на более поздней стадии младенчества. Распространенными клиническими проявлениями врожденной ЦМВ-инфекции являются нейросенсорная потеря слуха, петехии, желтуха при рождении, гепатоспленомегалия, малый размер для гестационного возраста, микроцефалия, летаргия и / или гипотония, плохое сосание, хориоретинит, судороги, гемолитическая анемия и пневмония [8] . Нейросенсорная тугоухость может быть обнаружена при рождении; однако примерно в 30% случаев наступление болезни отсрочено.В таблице 1 показаны клинические проявления, лечение и исходы врожденных ЦМВ-инфекций. Врожденный ЦМВ, связанный с потерей слуха, является двусторонним у 71% детей. Офтальмологическое обследование при симптоматическом врожденном ЦМВ включает хориоретинит, который является наиболее частой аномалией глаз, рубцы сетчатки, атрофию зрительного нерва, потерю центрального зрения и косоглазие. Эндокринологические проявления включают болезнь Грейвса, несахарный диабет и заболевание почек, такое как нефротический синдром. Врожденные ЦМВ-инфекции являются основной причиной других длительных нарушений развития нервной системы, а также могут поражать другие системы органов, такие как желудочно-кишечный тракт, включая болезнь Менетрие.Асцит, миокардит, кардиомиопатия, желудочковые трабекулы и энтероколит также встречаются среди проявлений врожденного ЦМВ у новорожденных с симптомами [9]. Несмотря на тот факт, что общий уровень смертности среди младенцев с врожденной ЦМВ-инфекцией составляет примерно 4-8% в течение первого года жизни, врожденная ЦМВ-инфекция может быть связана со смертностью у недоношенных детей и младенцев с первичными иммунными нарушениями Т-клеток или естественных киллеров. клетки. В редких случаях у многих младенцев без основного заболевания риск смерти достигает 30% в результате фульминантного течения.Смерть обычно вызывается вирусным гемофагоцитарным синдромом или тяжелым заболеванием органов-мишеней печени, легких, костного мозга или центральной нервной системы. Даже если младенцы с опасным для жизни заболеванием, связанным с врожденным ЦМВ, могут жить, неврологические последствия могут сохраняться на всю жизнь (например, микроцефалия, умственная отсталость, церебральный паралич и нарушения слуха) [10, 11]. Пневмонит, признаки вирусного сепсиса, тромбоцитопения и коинфекция более вероятны у недоношенных детей, чем у доношенных новорожденных [7].Кроме того, недоношенные дети также могут иметь классическую триаду апноэ, брадикардии и серой бледности, описывающую синдром, подобный ЦМВ-сепсису [12]. Случаи перинатальных инфекций, которые обычно не связаны с какими-либо клиническими проявлениями, могут быть приобретены во время родов или проглатывания грудного молока, содержащего ЦМВ. Распространенные инфекции, связанные с заболеванием органов-мишеней и смертью, могут наблюдаться у крайне недоношенных младенцев или младенцев, рожденных от неиммунных женщин.
| Клинические проявления | Лечение | Результат | |
|---|---|---|---|
| Врожденные ЦМВ-инфекции | При рождении, 90% случаев гепатохимические, гепатопротеиновые, , желтушные, сыпь, небольшой размер для гестационного возраста, тромбоцитопения, микроцефалия, внутричерепные кальцификаты, полимикрогирия, вентрикуломегалия, нейросенсорная тугоухость, хориоретинит, судороги | Бессимптомные младенцы не нуждаются в противовирусном лечении Общая Ганцикловир123 или валганцикловир 4–124 смертность от инфекций 4–124 8% Смертность от тяжелой фульминантной болезни достигает 30%.Долгосрочные последствия включают потерю слуха, церебральный паралич, умственную отсталость, нарушение зрения и судороги |
Таблица 1.
Клинические проявления, лечение и исход врожденных ЦМВ-инфекций.
Подавляющее большинство здоровых детей и подростков, инфицированных ЦМВ-инфекцией (приобретенная ЦМВ-инфекция), чаще всего протекает бессимптомно (таблицы 2 и 3). Однако у остальных пациентов (примерно 10%) могут появиться несколько легких или умеренных симптомов.Клиническое заболевание, называемое синдромом, подобным мононуклеозу, без титров гетерофильных антител или положительных тестов на моноспот, характеризуется лихорадкой, усталостью, фарингитом, аденопатией (особенно аденопатией шейки матки) и гепатитом. Головная боль, боль в животе с диареей, артралгиями и сыпью также могут наблюдаться при синдроме, подобном мононуклеозу, при приобретенной ЦМВ-инфекции. Лабораторные данные имитируют связанный с ВЭБ синдром мононуклеоза, такой как лимфоцитоз или лимфопения с тромбоцитопенией и повышенными трансаминазами [13].Необычные проявления или осложнения приобретенных ЦМВ-инфекций у здоровых людей включают пневмонит, миоперикардит, гемолитическую анемию, вирусный гемофагоцитарный синдром, гранулематозный гепатит, синдром Гийена-Барре и менингоэнцефалит [7].
| Клинические проявления | Лечение | Результат | |
|---|---|---|---|
| Ранняя постнатальная ЦМВ-инфекция | Доношенные младенцы: у большинства младенцев с патологией крови 902, гепатосимптоматические, у 902 г , аномальные тесты функции печени Недоношенные дети и новорожденные с очень низкой массой тела: Инфекция может быть тяжелой и опасной для жизни Сепсис-подобный синдром, гепатоспленомегалия, пневмонит, гепатит, НЭК, аномальные показатели крови | Большинству доношенных детей и бессимптомных недоношенных детей не требуется противовирусное лечение Ганцикловир или валганцикловир для лечения тяжелых симптоматических инфекций у недоношенных детей | Доношенные дети: без постоянных последствий.Недоношенные младенцы и младенцы с очень низкой массой тела: смертность от симптоматической инфекции составляет 5–10% По-видимому, повышенного риска потери слуха, церебрального паралича или других нарушений развития нервной системы не наблюдается; однако долгосрочные исходы четко не изучены. |
Таблица 2.
Клинические проявления, лечение и исход ранней постнатальной ЦМВ-инфекции.
| Клинические проявления | Лечение | Результат | ||
|---|---|---|---|---|
| ЦМВ-инфекция у иммунокомпетентных детей и подростков | , аденопатия, гепатит, головная боль, боль в животе, диарея, артралгии, сыпь, лимфоцитоз или лимфопения, тромбоцитопения, аномальные функциональные пробы печени, отрицательный тест на моноспотоксичность | Противовирусное лечение обычно не показано Поддерживающая терапия с постоянным контролем жидкости и лихорадки 9012 sequelae |
Таблица 3.
Клинические проявления, лечение и исходы ЦМВ-инфекции у иммунокомпетентных детей и подростков.
Когда реактивация эндогенного вируса и инфекция из трансплантированного органа или из-за переливания продуктов крови происходит у детей и подростков с ослабленным иммунитетом, может наблюдаться серьезное ЦМВ-заболевание, связанное с основным заболеванием, ответственным за иммуносупрессию (Таблица 4) . Неспецифические симптомы, такие как лихорадка, недомогание и лейкопения, могут наблюдаться у всех типов пациентов.Пациенты с трансплантатом почки теряют трансплантат; реципиенты печени чаще всего связаны с гепатитом и колитом. Ранний миокардит с последующим поздним атеросклерозом наблюдается у реципиентов трансплантата сердца. У реципиентов после трансплантации легких и костного мозга обычно наблюдается состояние пневмонии. Дети с коинфекцией вируса иммунодефицита человека (ВИЧ) и ЦМВ склонны к ретиниту, колиту, пневмониту и энцефалиту / энцефалопатии [14].
| Клинические проявления | Лечение | Результат | |
|---|---|---|---|
| ЦМВ-инфекция у детей и подростков с ослабленным иммунитетом | 90o Заражение может быть тяжелым и опасным для жизни. гепатит, пневмонит, колит, потеря трансплантата (у пациентов с трансплантатом органов), миокардит, ретинит, энцефалит / энцефалопатия (особенно у пациентов с ВИЧ) | Ганцикловир или валганцикловир | Высокий риск заболеваемости и смертности; частично зависит от основного состояния |
Таблица 4.
Клинические проявления, лечение и исходы ЦМВ-инфекции у детей и подростков с ослабленным иммунитетом.
4. Диагноз
Диагноз врожденной ЦМВ-инфекции следует рассматривать, если он обнаружен у новорожденных с признаками и симптомами, соответствующими врожденному ЦМВ-заболеванию, или с аномальными нейровизуальными данными, соответствующими ЦМВ, или новорожденным с задокументированной нейросенсорной тугоухостью (СНСН). . Новорожденных, рожденных от матери с положительной сероконверсией или с положительными антителами к ЦМВ-иммуноглобулину G (IgG) и ЦМВ-иммуноглобулину M (IgM), или с заболеванием, подобным мононуклеозу, во время беременности также следует обследовать на наличие врожденных ЦМВ-инфекций.При скрининге новорожденных младенцев с аномальным Т-клеточным рецептором следует подозревать на врожденную ЦМВ-инфекцию. Надежный диагноз врожденной ЦМВ-инфекции должен быть обнаружен с помощью источников вируса и вирусных нуклеиновых кислот в моче, слюне и крови у младенцев в течение первых 3 недель жизни. Новорожденных с подозрением на врожденную ЦМВ-инфекцию следует проанализировать с помощью вирусного посева, модифицированного посева (также называемого экспресс-посевом или анализом в оболочке флакона) и полимеразной цепной реакции (ПЦР) для диагностики.Определение ЦМВ с помощью ПЦР в образцах крови или плазмы более точное, чем другие диагностические тесты [15]. В связи с тем, что полимеразная цепная реакция дает количественные результаты, у новорожденных с подозрением на ЦМВ обычно оценивают мочу и слюну, содержащие высокие уровни ДНК ЦМВ.
Первичная инфекция ЦМВ у лиц без иммунодефицита требует доказательства реактивности IgM к ЦМВ в крови. Он может сохраняться в течение нескольких месяцев в зависимости от чувствительности конкретного анализа.В связи с тем, что инфицированные люди могут периодически выделять вирус, биологические жидкости, такие как слюна или моча, не позволяют диагностировать ЦМВ-инфекцию. Методы, основанные на полимеразной цепной реакции, также используются для диагностики мочи, слюны и крови, а также образцов тканей, полученных при биопсии. Комбинация с иммунофлуоресцентным обнаружением CMV-кодируемой и традиционной культуры CMV с использованием человеческих фибробластов кожи остается стандартом во многих учреждениях. Характерные ядерные (и цитоплазматические) включения (включения «совиный глаз») можно обнаружить с помощью гистологического окрашивания образцов тканей.
5. Лечение
Лечение рекомендуется начинать младенцам с симптоматической инфекцией, первичным иммунодефицитом или бессимптомной инфекцией с изолированной потерей слуха от врожденной ЦМВ-инфекции в течение первого месяца жизни. В качестве первой линии показаны ганцикловир для внутривенного введения и его пролекарство, доступное для перорального приема, валганцикловир, для лечения врожденного ЦМВ-заболевания. Рандомизированные клинические испытания Collaborative Antivirus Study Group показали, что 6 недель лечения ганцикловиром могут ограничить потерю слуха и улучшить исход развития у младенцев, инфицированных симптоматически.Кроме того, ганцикловиром можно лечить младенцев с тяжелой перинатальной ЦМВ-инфекцией, вызванной грудным молоком [7, 16].
При инфекциях здорового хозяина и в раннем постнатальном периоде у доношенных бессимптомных детей лечение приобретенных ЦМВ-инфекций не рекомендуется. Однако лечение необходимо проводить у недоношенных детей или детей с очень низкой массой тела при рождении (VLBW) с тяжелой инфекцией.
Хозяевам с ослабленным иммунитетом рекомендуется противовирусная терапия ганцикловиром у детей с активной ЦМВ-болезнью.Даже если у детей с ослабленным иммунитетом нет признаков или симптомов заболевания органов-мишеней, рекомендуется также применять противовирусную терапию из-за ЦМВ-виремии (например, положительная или возрастающая количественная ПЦР). Лечение ЦМВ-болезни у детей с ослабленным иммунитетом состоит из ганцикловира и перорального валганцикловира, как и у взрослых. Лечение обычно назначается в виде ганцикловира внутривенно или валганцикловира перорально в среднем в течение 4–6 недель [17]. Пациентам рекомендуется регулярно проверять противовирусное лечение с помощью определения количества лейкоцитов, АСТ и АЛТ.В некоторых случаях, когда противовирусная терапия не может улучшить клинический или вирусологический ответ в течение нескольких недель лечения ганцикловиром или валганцикловиром, фоскарнет может быть интегрирован в лечение. Другим специфическим средством против ЦМВ является цидофовир, который можно применять у детей при тщательном мониторинге функции почек и метаболического состояния при возникновении устойчивости к противовирусным препаратам.
6. Профилактика
6.1 Пассивная иммунопрофилактика
Внутриутробное заболевание можно предотвратить от инфицирования путем пассивной передачи антител к ЦМВ.Однако этот перенос не удается у реципиентов аллотрансплантата. Передача новорожденных от ЦМВ-инфекции предотвращается с помощью ЦМВ-серонегативной крови или крови с пониженным содержанием лейкоцитов для крайне недоношенных детей. Однако замораживание / размораживание или пастеризация устраняют риск заражения ЦМВ инфекцией грудного молока, связанной с переливанием крови; это может быть не полным. Пассивный перенос антител против ЦМВ рекомендуется для ограничения передачи и заболеваемости беременных женщин с первичной ЦМВ-инфекцией.
6.2 Активная иммунопрофилактика
Ряд различных платформ вакцин, которые будут доступны для профилактики ЦМВ-инфекции у новорожденных и пациентов с ослабленным иммунитетом, прошел клинические испытания. Однако ни один из них не лицензирован.
7. Заключительные замечания
Цитомегаловирус — распространенный агент, который можно увидеть во всем мире. Хотя ЦМВ обычно протекает бессимптомно у здоровых людей, у людей с иммунодефицитом он может привести к тяжелой инфекции.Во время беременности ЦМВ также вызывает серьезные нарушения у детей, у матери которых ЦМВ. После первичного заражения вирус остается в организме хозяина в неактивной форме на протяжении всей жизни. Рецидивирующие ЦМВ-инфекции могут возникать при реактивации «тихого» вируса. Поскольку врожденная ЦМВ-инфекция протекает бессимптомно, новорожденным настоятельно рекомендуется пройти проверку слуха.
Цитомегаловирусная инфекция | определение цитомегаловирусной инфекции в Медицинском словаре
Цитомегаловирусная инфекция
| Категория DRG: | 866 |
| Среднее значение LOS: | 3.4 дня |
| Описание: | МЕДИЦИНСКИЙ: Вирусное заболевание без основного вируса CC |
Цитомегаловирус (ЦМВ) является членом группы вирусов простого герпеса. Вирус, передаваемый при контакте с человеком, вызывает настолько легкую инфекцию, что ее обычно не замечают из-за отсутствия симптомов. Примерно 80% населения в целом заражаются ЦМВ-инфекцией к тому времени, когда они достигают среднего возраста. Однако пациенты с иммуносупрессией, и особенно пациенты, которым пересажены органы, очень чувствительны к ЦМВ: по оценкам, до 90% таких пациентов заражаются ЦМВ-инфекцией.Как правило, инфекция ЦМВ происходит через 4-6 недель после введения повышенных доз иммунодепрессантов для лечения отторжения. ЦМВ-инфекция также присутствует как минимум у 80% пациентов со СПИДом, вызывая серьезные проблемы, такие как энцефалит, ретинит, пневмония и эзофагит, у 30% из них.
Вирус обычно обитает в слюнных железах при латентной инфекции, которая реактивируется беременностью, переливанием крови или иммунодепрессантами. Доброкачественный для людей с нормальной иммунной системой, вирус может быть разрушительным для будущего плода или человека с иммунодепрессией.Вирус распространяется по всему телу лейкоцитами (лимфоцитами и мононуклеарными клетками) в такие органы, как печень, легкие, желудочно-кишечный тракт (ЖКТ) и центральная нервная система (ЦНС), что приводит к клеточному воспалению и, возможно, дисфункции органов.
Причины
ЦМВ передается при контакте с жидкостями, содержащими вирус, такими как слюна, моча, грудное молоко, цервикальная слизь и сперма. Он может передаваться во время беременности от первичной или реактивированной ЦМВ-инфекции.Он может передаваться во время родов при контакте с выделениями из шейки матки или после родов с грудным молоком. Вирус может присутствовать в течение многих лет после первичного заражения.
Генетические аспекты
Наследственные иммунные реакции могут быть защитными или повышать восприимчивость.
Гендерные, этнические / расовые аспекты и продолжительность жизни
Особому риску подвергаются плоды и младенцы, поскольку внутриутробная ЦМВ-инфекция является наиболее распространенной врожденной инфекцией; это происходит в 0.От 5% до 3% всех живорождений. Инфекция плода ЦМВ может не распознаваться до рождения или через несколько лет после рождения, поскольку у беременных женщин с ЦМВ-инфекцией могут не проявляться клинические симптомы. Младенцы, инфицированные ЦМВ во время беременности, могут иметь задержку внутриутробного развития, микроцефалию (небольшой размер головы) или гидроцефалию (повышенное содержание спинномозговой жидкости в головном мозге).
У взрослых ЦМВ может быть серьезным заболеванием и вызывать слепоту или инфекцию типа мононуклеоза. ЦМВ-мононуклеоз является наиболее распространенной формой ЦМВ-инфекции и возникает в возрасте от 25 до 30 лет.У взрослых, у которых нет проблем с иммуносупрессией, риск заражения увеличивается с возрастом. Примерно 50% взрослых людей старше 40 лет имеют антитела к ЦМВ, но у большинства из них не было инфекции. Оба пола и люди всех рас и этнических групп восприимчивы к ЦМВ. Американцы мексиканского происхождения и чернокожие / афроамериканцы, а также люди, родившиеся за пределами Соединенных Штатов, имеют более высокую распространенность ЦМВ, чем другие группы. Мужчины, практикующие секс с мужчинами, считаются группой высокого риска и имеют распространенность ЦМВ не менее 90%.К другим группам высокого риска относятся люди, которые проводят время в детских садах, занимаются сексом с несколькими половыми партнерами и получают переливание крови.
Соображения глобального здравоохранения
Глобальная распространенность ЦМВ сильно различается. Младенцы и дети в развитых странах, как правило, рано заболевают ЦМВ в развивающихся странах, но не в развитых странах, где половина молодых людей является серонегативной.
Оценка
История
Спросите об иммуносупрессивных состояниях, таких как недавняя травма, которая могла потребовать нескольких переливаний крови, трансплантации органов или ВИЧ-инфекции.Пациент может описать недавнюю вирусную инфекцию с такими симптомами, как боль в горле, усталость, боли в суставах и мышцах, а также головная боль. Некоторые пациенты помнят эпизод, который длился около 3 недель с высокой температурой в качестве единственного симптома. У пациента с ослабленным иммунитетом может быть поражение конкретных органов, таких как легкие (сухой кашель, затрудненное дыхание), желудочно-кишечный тракт (водянистая диарея, кровавая диарея, тошнота, рвота и спазмы) и ЦНС (помутнение зрения, головная боль. , ригидность шеи, тремор, летаргия и даже судороги и кома).
Медицинский осмотр
Общие признаки и симптомы включают лихорадку, боль в горле, утомляемость и утомляемость, а также головную боль . Младенцы могут проявлять признаки задержки развития и могут проявлять признаки желтухи, петехиальной сыпи, респираторной недостаточности и потери слуха.
У взрослых оцените все системы организма, но наиболее серьезные признаки и симптомы возникают при поражении ЦНС или печени. Обследуйте пациентов на предмет лихорадки, бледности, изменений в ткани лимфатических узлов и фарингита.Прослушайте легкие пациента, чтобы определить наличие потрескивания. Обратите внимание на снижение шума дыхания, кашель, одышку и симптомы пневмонии.
Пациенты могут также иметь изменения психического статуса, такие как раздражительность, летаргия и даже судороги и кома. У пациентов могут наблюдаться гиперактивные звуки кишечника, болезненность при пальпации желудка и возможное вздутие живота. Оцените жесткость шеи, изменения зрачка, двигательную слабость, положительный рефлекс Бабинского и тремор. Проведите осмотр глаз, чтобы выявить изменения в глазном дне, сначала с небольшими белыми ватными пятнами с неровными границами на сетчатке, которые увеличиваются до пушистого белого экссудата и видимых кровоизлияний, вызывая потерю зрения, прогрессирующую до слепоты.
Психосоциальный
Оценить способность пациента или его или ее родителей справиться с ситуацией. Отцу и матери еще не родившегося ребенка потребуется консультация и поддержка, чтобы справиться с возможным воздействием ЦМВ на их будущего ребенка.
Основные моменты диагностики
Общие комментарии: Посев на вирус является наиболее чувствительной лабораторной диагностической процедурой. Однако культивирование занимает от 3 до 7 дней и не позволяет отличить острую инфекцию от хронической.
| Тест | Нормальный результат | Отклонение от нормы при условии | Объяснение |
|---|---|---|---|
| Тест на антигены и полимеразная цепная реакция | Отрицательный для антигенов CVM или генетического материала ЦМВ | Обнаруживает наличие антигенов | или генетический материал вируса |
| Культура мочи, мокроты или мазка изо рта | Вирус не изолирован | Вирус изолирован | Наличие вируса подтверждает диагноз |
| Антитела IgM | Нет антител | ЦМВ-антитела присутствуют | Указывает на недавнюю инфекцию |
Другие тесты: Выделение вируса из образцов шейки матки, спермы, грудного молока, лейкоцитов и образцов биопсии; пробирка в оболочке флакона; поскольку культуры CMV могут расти медленно и требуют до 6 недель инкубации, этот анализ представляет собой адаптацию методики культивирования тканей, которая обеспечивает более быстрые результаты.Он описывается как метод культивирования моноклональных антител с усилением центрифугирования или анализ в виде оболочки-флакона. Тесты фиксации комплемента, тесты непрямых иммунофлуоресцентных антител (IFA).
Первичный медсестринский диагноз
Диагноз
Риск инфицирования (распространения или реактивации), связанный с подавлением иммунитетаРезультаты
Контроль риска; Лечебное поведение: болезнь или травма; Обнаружение рисковВмешательства
Защита от инфекций; Назначение лекарствПланирование и реализация
Совместная работа
Младенцы.
Младенцы с врожденными аномалиями требуют тщательного наблюдения за моделями роста и развития в младенчестве. Родителям может потребоваться направление для получения информации о специальном образовании, физиотерапии и социальных услугах.взрослых.
Лечение направлено на предотвращение осложнений и облегчение симптомов; лечение варьируется в зависимости от типа и степени инфекции. Пациенты с генерализованной инфекцией получают жаропонижающие средства от лихорадки и анальгетики от боли и боли в горле. Таким пациентам необходим отдых, полноценное питание и достаточное количество жидкости при хронической усталости.Другие, более серьезные инфекции обычно лечатся противовирусными препаратами. Количество и продолжительность приема лекарства зависят от тяжести инфекции. Осложнения системы органов управляются на основе симптомов.Основные фармакологические характеристики
| Лекарство или класс лекарств | Дозировка | Описание | Обоснование |
|---|---|---|---|
| Ганцикловир | 5 мг / кг каждые 12 часов внутривенно в течение 14–21 дня, затем 5 мг / кг каждые сутки в течение 7 дней, затем 1000 мг перорально три раза в день | Противовирусное | Подавляет продукцию ДНК при ЦМВ |
| Foscarnet | 60 мг / кг каждые 8 часов или 90 мг / кг каждые 12 часов в течение 2–3 недель, затем 90–120 мг / кг в день внутривенного введения | Противовирусное средство | Подавляет репликацию вируса |
Другие лекарственные средства: Иммуноглобулины могут также использоваться в качестве пассивной иммунизации для предотвращения заболевания ЦМВ.Валганцикловир используется для профилактики ЦМВ-инфекции у пациентов после трансплантации.
Независимый
Важными приоритетами являются поддержание адекватного уровня функционирования, предотвращение осложнений, поддержка восстановительного процесса и предоставление информации о процессе заболевания, прогнозе и лечении. Пациенты и лица, осуществляющие уход за младенцами, должны быть осведомлены о снижении риска распространения инфекции ЦМВ. Выделения, особенно у младенцев, могут содержать вирус.
Семьям младенцев с ЦМВ-инфекцией потребуется эмоциональная поддержка. Ответьте на вопросы о ЦМВ-инфекции, симптомах, осложнениях и лечении.
Расскажите взрослым пациентам о ЦМВ-инфекции, о необходимости адекватного отдыха, физических упражнений, правильного питания и приема жидкости.
Доказательная практика и политика в области здравоохранения
Ямамото, А.Ю., Мусси-Пинхата, М.М., Боппана, С.Б., Новак, З., Вагацума, В.М., Оливейра, П.,… Бритт, В.Дж. (2010). Повторное инфицирование цитомегаловирусом человека связано с внутриутробной передачей инфекции в популяции матерей с высоким иммунитетом к цитомегаловирусу. Американский журнал акушерства и гинекологии , 202 (3), 297e1 – e8.
- Исследователи сравнили 40 матерей младенцев с врожденной ЦМВ-инфекцией с подобранной выборкой из 109 матерей неинфицированных младенцев и обнаружили, что общая серологическая распространенность среди матерей составляет 96%.
- Однако инфекция двумя или более штаммами ЦМВ была более распространена среди матерей младенцев с ЦМВ-инфекцией (35%) по сравнению с матерями младенцев без ЦМВ-инфекции (15.6%) ( р = 0,009).
- Реактивность антител присутствовала при рождении у 17,5% матерей младенцев с ЦМВ-инфекцией по сравнению с 4,6% матерей младенцев без ЦМВ-инфекции ( p = 0,02).
Рекомендации по документации
- Физические изменения, такие как увеличение лимфатических узлов, симптомы со стороны желудочно-кишечного тракта, легочные симптомы, аномалии глазного дна
- Ответ на лекарства и лечение
- Осложнения, резистентность, повторение симптомов
Рекомендации по выписке и уходу на дому
профилактика.
Научите ухаживающего за пациентом осторожно обращаться с подгузниками и мыть руки, чтобы предотвратить распространение ЦМВ. В больнице женщинам детородного возраста необходимы универсальные меры предосторожности. У ВИЧ-инфицированных и больных СПИДом необходимо частое обследование глазного дна. Медицинские работники-женщины, пытающиеся забеременеть, могут пожелать определить титры ЦМВ, чтобы определить риск заболевания. Беременным женщинам, работающим в детских садах и яслях больниц, необходимо избегать ухода за инфицированными младенцами и применять универсальные меры предосторожности.лекарств.
Обучите пациента информации о предписанной дозировке, способе приема, действии и последующей лабораторной работе, необходимой для всех лекарств. Научите пациента правильному применению жаропонижающих средств при лихорадке и анальгетиков при боли и дискомфорте.осложнений.
Сообщите пациенту, что после первоначального улучшения могут появиться признаки рецидива или осложнений. Пациент должен быть проинструктирован сообщать о визуальных изменениях; изменения функции ЖКТ, такие как потеря веса, тошнота, рвота и анорексия; продолжающаяся лихорадка; и легочные симптомы (кашель, одышка, стеснение в груди).При возникновении этих осложнений научите пациента обращаться за медицинской помощью.Цитомегаловирусная инфекция | Статья о цитомегаловирусной инфекции в The Free Dictionary
Цитомегаловирусная инфекция
Распространенная бессимптомная инфекция, вызываемая цитомегаловирусом, которая может вызывать опасные для жизни заболевания у незрелого плода и у субъектов с иммунодефицитом.
Цитомегаловирус относится к группе вирусов герпеса, которые бессимптомно инфицируют 50–100% взрослого здорового населения.Такие инфекции обычно происходят в период новорожденности, когда вирус может передаваться от матери ребенку, если вирус присутствует в родовых путях или в грудном молоке. Малыши также могут заразиться инфекцией в детских садах. Позже вирус может передаваться при гетеросексуальных или мужских гомосексуальных контактах. После заражения цитомегаловирус остается в организме латентным, поскольку его невозможно полностью уничтожить даже компетентной иммунной системой. Он может активироваться и вызывать заболевания при нарушении иммунной системы.
Врожденная или трансплацентарная цитомегаловирусная инфекция также является довольно частым явлением. За редким исключением и оно обычно протекает бессимптомно. Врожденное цитомегаловирусное заболевание возникает в результате трансплацентарной передачи вируса, обычно от матери, перенесшей первичную или первичную цитомегаловирусную инфекцию во время беременности. Его проявления варьируются от тонкой сенсорной нейронной потери слуха, которую можно обнаружить только в более позднем возрасте, до молниеносной мультисистемной инфекции и возможной смерти новорожденного.Это важное врожденное заболевание встречается примерно у 1 из 1000 беременностей.
Единственное цитомегаловирусное заболевание, четко описанное у зрелых, иммунологически нормальных субъектов, — это цитомегаловирусный мононуклеоз. Это самоограничивающееся заболевание, подобное инфекционному мононуклеозу, основным проявлением которого является лихорадка. См. Инфекционный мононуклеоз
В противном случае цитомегаловирусные заболевания обычно наблюдаются только при недостаточности клеточного иммунитета. Они представляют собой наиболее серьезную инфекционную проблему после трансплантации костного мозга и органов.Проявления варьируют от самоограничивающегося цитомегаловирусного мононуклеоза до более серьезных поражений органов, таких как пневмония, гепатит, язвы желудочно-кишечного тракта и широкое распространение. Вирус, вызывающий эти заболевания, может возникать в результате активации собственной латентной инфекции пациента или передаваться из внешнего источника, обычно от латентного цитомегаловируса, заражающего трансплантат от донора. См. Иммунологический дефицит, Биология трансплантации
Цитомегаловирусные заболевания также являются серьезными, довольно частыми осложнениями синдрома приобретенного иммунодефицита (СПИД).Одна из причин заключается в том, что большинство людей, инфицированных вирусом иммунодефицита человека (ВИЧ), уже инфицированы цитомегаловирусом. Проявления болезни аналогичны тем, которые наблюдаются при трансплантации, за исключением того, что они могут быть более серьезными. Цитомегаловирусный ретинит — типичная проблема, связанная с запущенным СПИДом. Без лечения сетчатка постепенно разрушается, так что слепота одного или обоих глаз неизбежна. См. Синдром приобретенного иммунодефицита (СПИД)
Цитомегаловирусные заболевания можно лечить двумя противовирусными препаратами, ганцикловиром или фоскарнетом, с разной степенью успеха.Цитомегаловирусная пневмония у реципиента трансплантата костного мозга не может быть вылечена только противовирусными препаратами, поскольку она, вероятно, имеет иммунопатологический компонент. Цитомегаловирусные заболевания у людей со СПИДом можно сдержать, но нельзя вылечить с помощью специального лечения. Например, лечение цитомегаловирусного ретинита ганцикловиром эффективно только при продолжении поддерживающей терапии. См. Вирус животных
Макгроу-Хилл Краткая энциклопедия биологических наук. © 2002 г., компания McGraw-Hill Companies, Inc.
PPT — Презентация PowerPoint по цитомегаловирусу, скачать бесплатно
Цитомегаловирус Семинары по репродуктивным инфекционным заболеваниям 15 февраля 2005 г. Натали Азиз, доктор медицины, репродуктивные инфекционные заболевания и материнско-плодная медицина, научный сотрудник отделения акушерства и репродуктивной медицины Калифорнийского университета. , Сан-Франциско
Микробиология Патогенез Вирулентность Эпидемиология Врожденный ЦМВ Клинические проявления Иммунокомпетентные хозяева Хозяева с ослабленным иммунитетом Врожденные / перинатальные заболевания Диагностика Лечение Иммунокомпрометированная профилактика Вирус с двойным иммунитетом
066 9 -000 9 -000 9 -000 вакцинированный вирус
0 линейный Семейство Herpesviridae • Подсемейство альфа-герпесвирусов • ВПГ-1 и 2, VZV • Подсемейство бета-герпесвирусов • ЦМВ (HHV5), HHV6, HHV7 • Подсемейство гамма-герпесвирусов • EBV, HHV8 (KS) www.biosciences.bham.ac.uk
Микробиология • CMV • Икосаэдрический нуклеокапсид, содержащий вирусную структуру ДНК dS • 162 гексагональных белковых капсомера • Дополнительный слой окружающего белка (тегумент) • Оболочка внешней мембраны с гликопротеиновыми комплексами www.biografix.de
Самый большой член семейства herpesviridae 230-240 пар оснований Крупные цитомегалические клетки с увеличенными ядрами Фиалковые внутриядерные включения, окруженные четким ореолом Базофильная штриховка может присутствовать в цитоплазме Цикл репликации Непосредственно рано: 4 часа Ранняя: 4 часа h Поздно: 24 часа Геном класса E Уникальные и инвертированные повторы, которые включают наличие 4 изомеров генома, вызванное инверсией компонентов генома LS (класс E).Microbiology www.som.tulane.edu
Патогенез • Литический вирус с цитопатическим эффектом • Начальная инфекция • Эпителиальные клетки слюнной железы — стойкая инфекция и вирусное выделение • Мочеполовая система • Проксимальные канальцы вблизи кортикальных областей • В конечном итоге могут быть обнаруживается в нескольких тканях (слюнные железы, легкие, печень, почки, кишечник, надпочечники и ЦНС) • Другие патогенные механизмы • Гранулематозная реакция, особенно в печени • Образование иммунных комплексов • Васкулит • Вызывает скрытую инфекцию хозяина • Может реактивироваться в течение определенного периода иммуносупрессии на фоне приема лекарств или сопутствующей инфекции (например,ВИЧ)
Патогенез • Инкубационный период: 28-60 дней • Первичные симптомы инфекции: 9-60 дней • Виремия: 2-3 недели • Ответ IgM: 30-60 дней • Пиковые титры вируса: 4-7 недель постинфекция
Вирулентность • US2, US11, US3, US6 • Генные продукты влияют на функцию MHC класса I и процессинг антигена • UL33, US27, US28 • Подавляют нормальный воспалительный процесс • Способствуют распространению вируса в ткани • MHC класса I гомолог • Уклоняется от защиты хозяина • UL144 • Кодирует гомолог TNF и может тем самым избежать иммунного клиренса • Противовирусные препараты влияют на продукты ранних генов • Ганцикловир: нацелен на UL54 и фосфорилируется белком UL97 • Генетические различия между вирусами • Множественные штаммы ЦМВ быть связаны с различиями в вирулентности • Возможна двойная инфекция разными штаммами Schleiss and McVoy, 20004
Иммунитет плечевой кости Первичная инфекция ЦМВ Антитела IgM могут быть обнаружены уже через 4-7 недель Сохраняются в течение 16-20 недель после первоначального заражения Большая часть нейтрализующих антител, направленных против гликопротеина оболочки gB и gH> 50% нейтрализующей активности в выздоравливающей сыворотке, связанной с тегументными белками гликопротеина gB pp150, pp28 и pp65 вызывают сильные и стойкие реакции антител. Опосредованный клетками иммунитет. Самый важный фактор, контролирующий инфекцию. Иммунология CD4 и CD8. Гликопротеин B (gpUL55) — опосредованный морфогенез инфекционных частиц CMV www.biografix.de
Распространенность 50-85% в США к 40 годам В некоторых группах распространенность достигает 100% Распространенность ЦМВ увеличивается с возрастом Факторы риска Работа в дневном стационаре / контакт с детьми Переливание крови Несколько половых партнеров Незащищенный половой акт Равенство Аномальная цитология шейки матки Низкая СЭС / слаборазвитые страны Родились за пределами США Первая беременность до 15 лет Инфекция ИППП Передача: трансплантированный орган, грудное молоко, моча, слюна, слезы, стул, половой контакт, кровь, трансплацентарный Редко связано со смертностью у иммунокомпетентных хозяев (<1%) Значительная заболеваемость и смертность у пациентов с ослабленным иммунитетом (солидный трансплантат и трансплантат BM, СПИД и т.) Несмотря на противовирусную терапию, у пациентов с аллогенным BMT будет 15-75% интерстициальной смертности от ПНК Эпидемиология www.cdc.gov
Врожденный ЦМВ и беременность • Наиболее частая врожденная инфекция • Встречается у 0,2-2% всех новорожденных • Около 40 000 младенцев заражаются ежегодно в США • Основная причина врожденной потери слуха в США • Распространенность во время беременности • Серопозитивные: 50-80% • Первичная инфекция: 0,7-4% • Рецидивирующая инфекция: 13,5% • Выделение ЦМВ из шейки матки часто во время беременность • Отсутствие показаний для кесарева сечения • ЦМВ в грудном молоке • ЦМВ не является противопоказанием для грудного вскармливания • Вертикальная передача • Трансплацентарная инфекция: симптоматическая • Воздействие секреции половых путей: обычно бессимптомно • Кормление грудью: обычно бессимптомно • Ухудшение у недоношенных детей
Врожденный ЦМВ и беременность • Вертикальная передача максимальна в течение 3 триместра • Более серьезные последствия для плода wh en инфекция в 1 триместре • Вертикальная передача • Первичная материнская инфекция: 30-40% • Рецидивирующая материнская инфекция: 0.15–2% • Симптоматическая врожденная ЦМВ-инфекция менее вероятна у женщин с уже существующим иммунным ответом • Врожденная потеря слуха — наиболее серьезные последствия • У большинства младенцев с врожденной ЦМВ-инфекцией симптомы отсутствуют при рождении • У 10% младенцев, инфицированных внутриутробно, разовьются признаки ЦМВ и симптомы при рождении • Плохой прогноз • 30% серьезно инфицированных умирают • 80% выживших тяжелые неврологические последствия • 85-90% инфицированных младенцев не имеют симптомов при рождении • у 10-15% разовьются долгосрочные неврологические последствия, потеря слуха
Врожденный ЦМВ и беременность www.aafp.org
Врожденный ЦМВ и беременность
Врожденный ЦМВ и ВИЧ • Врожденный ЦМВ НЕ чаще встречается у младенцев ВИЧ-инфицированных матерей (Ковач 1999, Мусси-Пинхата 1998 г.) • Перинатальное приобретение ЦМВ выше среди ВИЧ-инфицированных младенцев (Ковач 1999) • Двойная инфекция, связанная с более высоким прогрессированием ВИЧ (ОР 2,59) и заболеванием ЦНС • ЦМВ и ВИЧ потенцируют друг друга in vitro (Скольник, 1988)
Клинические проявления • Иммунокомпетентный хозяин болезнь • Болезнь хозяина с ослабленным иммунитетом • Врожденное / перинатальное заболевание lbmi.org / patologyimages
Клинические проявления Иммунокомпетентность • Обычно бессимптомные или легкие гриппоподобные симптомы • Синдром мононуклеоза • Лихорадка / озноб, недомогание, миалгия • Легкий гепатит, лейкоцитоз, атипичные лимфоциты крови в 6 недель • , фарингит, чем EBV • Пожилые пациенты, более длительная лихорадка, меньшая цервикальная локализация • Отрицательные тесты на моноспот или гетерофил-агглютинин • Менингоэнцефалит, перикардит, миокардит, тромбоцитопения, гемолитическая анемия, макулопапулезная сыпь, язвы желудочно-кишечного тракта, пневмония возможна реже • Положительный IgM при наличии IgG • При сопутствующих инфекциях или стрессе www.crprc.ucdavis.edu
Клинические проявления С ослабленным иммунитетом • Серьезное заболевание у хозяина с ослабленным иммунитетом • Пневмония • Гепатит • Энцефалит • Колит / изъязвления желудочно-кишечного тракта • Увеит • Ретинит • Невропатия • ЦМВ-синдром Нормальный
Клинические проявления С ослабленным иммунитетом • Выделение ЦМВ с слюной и мочой часто • Самая высокая частота ЦМВ-инфекции у реципиентов ТКМ составляет 30-60 дней после трансплантации • Виремия у пациентов с трансплантацией органов • Маркер пневмонии у пациентов с аллогенной ТКМ • Виремия в / в 60-70% риск ПНК • Рентгенография: милиарный / интерстициальный инфильтрат, локализованные / узловые инфильтраты, реже ЦМВ Пневмония
Пациенты, перенесшие трансплантацию: Интерстициальный пневмонит, заболевание ЖКТ, ретинит, гепатит, энцефалит, миелорадиопатия ЦМВ-синдром Пациенты с ВИЧ-инфекцией Ретинит и поражение ЦНС чаще Клинические проявления I mmunocompromised ЦМВ-эзофагит ЦМВ-язва слепой кишки www.vh.org/
Клинические данные Петехии / пурпура (71-76%) Желтуха (67%) Гепатоспленомегалия (60%) Микроцефалия (53%) ВЗРП (50%) Ретинит Церебральные кальцификации Гепатит Неиммунная водянка Лаборатория Результаты Повышенные LFT (83%) Гипербилирубинемия (81%) Тромбоцитпения (77%) Повышенный уровень белка в спинномозговой жидкости (77%) Долгосрочные последствия Потеря слуха Умственная отсталость Неврологические проявления, связанные с более высокими уровнями IgM Клинические проявления Врожденные / перинатальные www.med.nagoya-u.ac
Клинические проявления Врожденные / перинатальные
Клинические проявления Врожденные / перинатальные Вентрикуломегалия и перивентрикулярные исследования • Посев на оболочечные клетки • Посевы на оболочечные клетки • Посевы на кожные клетки ЦМВ-антигенемия (стр. 65) • Молекулярные методы (ПЦР) Диплоидные фибробластные клетки человека, инфицированные цитомегаловирусом, в культуре. Модифицированное окрашивание акридиновым оранжевым [M.Battaglia, неопубликованный].
Диагностические исследования • Культивирование во флаконе из скорлупы • Раннее обнаружение антигена с помощью моноклональных антител • Доказано, что виремия является фактором риска ЦМВ пневмонии у пациентов, перенесших аллогенную трансплантацию костного мозга • Анализ флаконов Shell сократил время идентификации до 24 часов. 48 часов • Мониторинг анализа оболочки флакона до начала заболевания • Практический метод раннего начала противовирусного лечения • Использует разрешающую клеточную линию для ЦМВ • Центрифугируют на низкой скорости и помещают в инкубатор • Через 24 и 48 часов ткань культуральную среду удаляют, и клетки окрашивают с использованием меченых флуоресцеином антител к ЦМВ. • Клетки считывают с помощью флуоресцентного микроскопа. • В качестве альтернативы клетки окрашивают антителом против ЦМВ, а затем — меченным флуоресцеином анти-Ig.• Не такая чувствительная, как традиционная культура тканей.
Диагностические исследования forum.gardenweb.com • ЦМВ-антигенемия (стр. 65) • Антигенемия: относительно новый тест, разработанный в конце 1980-х • Распознавание раннего антигена ЦМВ смесью двух мышей моноклональные антитела, C-10 и C-1 • Система детектора представляет собой меченные флуоресцеином антимышиные Ig • Клетки подсчитываются с помощью флуоресцентного микроскопа • Любая положительная клетка подтверждает диагноз ЦМВ-виремии • В литературе высказывается предположение, что большее количество клеток соответствует риску заболевания.• Антигенемия использовалась для прогнозирования ЦМВ-пневмонии у пациентов, перенесших трансплантаты. • Положительный результат теста на антигенемию может быть использован в качестве спускового механизма для начала терапии ганцикловиром, если для профилактики ЦМВ-болезни у пациентов с трансплантатами используется упреждающая стратегия. • Доступно в 24 часов
Диагностические исследования • Молекулярные методы (ПЦР) • Качественная полимеразная цепная реакция • ПЦР использовалась для обнаружения ЦМВ в образцах крови и тканей • ПЦР-тест зависит от умножения праймеров, специфичных для части ЦМВ ген • Праймеры обычно связываются с областью вируса, которая кодирует ранний антиген • Тест чрезвычайно чувствителен • Положительный перед тестом на антигенемию у пациентов с виремией, которым была проведена трансплантация.• Результат ПЦР-теста обычно не является положительным у пациентов без ЦМВ-виремии. • Качественная ПЦР также использовалась для выявления ЦМВ в гистологических срезах
Диагностические исследования • Молекулярные методы (ПЦР) • Количественная полимеразная цепная реакция • Количественная ПЦР использовалась для обнаружения ЦМВ в плазме • Количественная ПЦР столь же чувствительна, как и качественная ПЦР и дает оценку количества геномов ЦМВ, присутствующих в плазме • Исследования • Определить, коррелирует ли количество геномов ЦМВ в плазме с риском заболевания в различных группах риска • Количество геномов ЦМВ (т. Е. Вирусная нагрузка) настоящее указывает на необходимость лечения, поскольку у пациентов ниже определенного порогового значения не разовьется ЦМВ-болезнь. • Однако уровень виремии, необходимый для возникновения ЦМВ-болезни, может варьироваться в зависимости от факторов организма и типа трансплантации органа, и это может потребоваться подлежит определению эмпирически • Литература по различным системам трансплантации органов предполагает, что этот метод может быть тестом, который различает низкоуровневые vel-виремия в сравнении с более высоким уровнем и ЦМВ-инфекцией
Сыворотка протестирована с интервалом 2-4 недели Сероконверсия IgG или четырехкратное увеличение (т.е.1: 4 — 1:16) IgG IgM полезный, но не всегда надежный признак первичной инфекции Может сохраняться в течение нескольких месяцев Появляется при повторной инфекции Ложноположительный, если RA> 30% значения IgG может указывать на активную инфекцию Диагноз матери Врожденный ЦМВ www.dpcweb.com
Результаты ультразвукового исследования Кальцификаты брюшной полости и печени Кальцификации боковых желудочков на боковой границе Водянки Эхогенный кишечник Асцит Гепатоспленомегалия Вентрикуломегалия? Утолщение затылочной прозрачности, не связанное с материнской инфекцией CMV (Sebire et al 1997) Ультразвуковое исследование может первоначально выявить поражение в околоплодных водах путем посева или ПЦР Чувствительность культуры: 50-69% Чувствительность ПЦР: 77-100% Комбинированная чувствительность: 80-100% Сопоставимые PPV и NPV Чувствительность анализа околоплодных вод заметно ниже, если оно проводится до 21 недели GA Степень тяжести не определяется околоплодными водами оценка жидкости Диагностика плода Врожденная ЦМВ
Терапия Нет c Текущие методы лечения ЦМВ-инфекции матери или плода Ганцикловир проникает через плаценту in vitro Сообщается об использовании ганцикловира и ЦМВ IgG постнатально для лечения врожденных заболеваний Предотвращение долгосрочных неврологических последствий не доказано Скрининг? Обычный скрининг не рекомендуется IgM не позволяет дифференцировать первичную инфекцию Материнский иммунитет не устраняет внутриутробную инфекцию Показания для скрининга Симптомы, указывающие на ЦМВ-инфекцию (мононуклеозоподобный синдром или повышенные LFT). и перинатальная инфекция • В исследовании фазы II изучали внутривенное введение ганцикловира в дозе 8 и 12 мг / кг в день, разделенное каждые 12 часов и вводимое в течение шести недель в каждом случае (Whitley 1997) • Снижение вирусной экскреции во время приема препарата • Вирурия вернулась после прекращение приема лекарств • 16% стабильный / улучшенный слух через 6 месяцев F / U • В возрасте двух лет восемь из 33 младенцев были признаны нормально развивающимися • Национальным институтом аллергии в настоящее время проводится плацебо-контролируемое исследование фазы III ганцикловира и группа совместных противовирусных исследований инфекционных заболеваний (Kimberlin 2000) • Предварительный Результаты предполагают улучшение / профилактику потери слуха в течение первых 6-12 месяцев жизни, и у недоношенных младенцев больше всего пользы
Лечение • Ганцикловир • Нацелен на белок UL54 • Мутации в фосфотрансферазе CMV, кодируемой UL97, и изменения в вирусной ДНК-полимеразе были связаны с резистентностью • Изменение ДНК-полимеразы, а также перекрестная резистентность к нуклеотидному аналогу цидофовиру • Валганцикловир • Фоскарнет • Цидофовир • Нуклеозидный аналог • Лечение, обычно не показано иммунокомпетентным пациентам • Показания • Лечение заболеваний с ослабленным иммунитетом: ретинит, ЖКТ болезнь, пневмонит, неврологические заболевания, виремия
Лечение: ЦМВ ретинит
Поведенческие изменения Предотвращение заражения слюной, мочой, биологическими жидкостями Тщательная гигиена Профилактика использования презервативов www.med.nagoya-cu.ac
Профилактика • Ганцикловир, используемый для профилактики ЦМВ у пациентов с трансплантацией твердых органов и аллогенного костного мозга после операции • Профилактика ЦМВ СПИДа • Уровень CD4 <50 • Ганцикловир не рекомендуется Министерством здравоохранения США из-за стоимости, отсутствие преимущества в выживаемости, нейтропения, большое количество таблеток • Офтосмотр Q 1-3 месяца • Восстановление иммунитета в ответ на АРВ • Профилактика противовирусными препаратами x 6 месяцев с CD4> 100
Разработана живая аттенуированная вакцина (Плоткин 1991) Крупнейшее исследование: штамм Towne 125 500 субъектов Частичная эффективность Экономически выгодные проблемы Реактивация и инфицирование хозяина Выделение вируса из шейки матки или грудного молока Возможный онкогенный потенциал вакцинного вируса Гликопротеиновая вакцина на модели морских свинок (Bourne 2001) Снижение передачи ЦМВ внутриутробно Улучшение исхода беременности Вакцины


 При заражении с острой симптоматикой в I триместре рекомендован аборт.
При заражении с острой симптоматикой в I триместре рекомендован аборт.