Побочные действия антибиотиков группы цефалоспоринов в Украине Итоги 2005 года
А.П. Викторов, К.А. Посохова, Е.В. Матвеева, И.А. Логвина, Государственный фармакологический центр МЗ Украины
Родственные пенициллинам цефалоспорины являются антибиотиками широкого спектра действия. Существует несколько «поколений» этих антибиотиков согласно времени их появления, а также специфической активности, особенно по отношению к грамотрицательным бактериям, что представлено в таблице 1.
В последнее время использование этих антибиотиков так резко возросло, что его можно сравнить с первоначальной реакцией в мире на появление пенициллина.
По мнению Американской Медицинской Ассоциации (АМА), хотя цефалоспорины в целом эффективны и широко используются, препараты первого и второго поколений обычно «не считаются антибиотиками первого выбора для лечения большинства инфекций, поскольку имеются равноэффективные и менее дорогие альтернативные средства». Что касается цефалоспоринов третьего поколения, «требуются дополнительные клинические исследования, чтобы показать, что они так же надежны, как уже проверенные терапевтические средства».
Цефалоспорины широко используются в хирургической практике, в частности для профилактики хирургических инфекций. Они не обязательно являются препаратами выбора при какой-либо педиатрической инфекции, хотя и обеспечивают полезные альтернативы лечения во многих ситуациях.
АМА вторит этим словам, говоря об общем использовании цефотаксима или других цефалоспоринов третьего поколения, а также подчеркивает, что «необходимы дополнительные клинические исследования, прежде чем можно будет дать конкретные рекомендации по использованию».
Для цефалоспоринов характерен ряд общих системных проявлений побочных действий (ПД):
1.
 Общие и токсические реакции концентрируются, в основном, вокруг нефротоксичности этих ЛС.
Общие и токсические реакции концентрируются, в основном, вокруг нефротоксичности этих ЛС.2. Реакции повышенной чувствительности проявляются преимущественно в виде анафилаксии и других проявлений лекарственной аллергии. Особое значение имеет перекрестная аллергия (табл. 2), поэтому больные, имевшие ранее аллергические реакции на пенициллины, не должны получать цефалоспорины.
3. Канцерогенное действие не описано.
4. ПД со стороны сердечно-сосудистой системы связаны преимущественно с развитием тромбофлебита и его фатальных осложнений.
6. Со стороны системы кроветворения наиболее значимыми и чаще всего встречающимися ПД являются агранулоцитоз, нейтропения; реже – тромбоцитопения, а также нарушение гемостаза.

7. Типичным осложнением со стороны печени является изменение уровня АсАТ и АлАТ при назначении цефалоспоринов.
8. Пероральное применение цефалоспоринов может приводить к развитию диспептических явлений, тошноты, рвоты, диареи. Описаны случаи развития псевдомембранозного колита и кандидоза.
9. Осложнения со стороны мочевыделительной системы проявляются в виде нефротоксичности.
10. Цефалоспорины не оказывают влияния на плод.
Наибольшее практическое значение из перечисленного выше имеют аллергические реакции, изменения кроветворения, нарушения функций печени и почек, дисбиоценоз и суперинфекция, местные реакции и влияние на ЦНС (К.А. Посохова, А.П. Викторов, 2005).
Аллергические реакции встречаются в 2-18% случаев, в соответствии со степенью риска их возникновения препараты цефалоспоринов можно расположить в следующем порядке: цефтриаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим. Чаще всего наблюдается макулопапулезные или кореподобные сыпи, лихорадка, реже – крапивница или сывороточноподобные реакции, анафилактический шок.
 Представители І и ІІ генерации вызывают ПД чаще, ІІІ и ІV поколения– реже.
Представители І и ІІ генерации вызывают ПД чаще, ІІІ и ІV поколения– реже.Дисбактериоз и суперинфекция считаются одними из наиболее опасных осложнений при применении (особенно внутреннем) цефалоспоринов.
Кроме того, цефалоспорины могут быть причиной развития гематурии и обратимой неолигурической почечной недостаточности.
Гепатотоксичность указанных антибиотиков проявляется повышением выхода печеночных ферментов (АсАТ, АлАТ, щелочной фосфатазы) в кровь, безжелтушного гепатоза и внутрипеченочного холестаза. У детей в возрасте до 1 года описаны случаи ядерной желтухи.
Большие дозы препаратов являются причиной энцефалопатии, что требует «прикрытия» данных осложнений транквилизаторами и седативными ЛС.

Назначение цефалоспоринов лицам, которые лечатся от хронического алкоголизма, может усиливать антабусоподобное, дисульфирамоподобное действие.
Цефалоспорины не противопоказаны ни в одном из триместров беременности, однако их применение должно быть всегда взвешено в соответствии с критерием польза/риск. Кормящим грудью женщинам назначение цефалоспоринов должно быть ограничено.
В своей структуре цефалоспорины, как и пенициллины, имеют β-лактамное кольцо, что обусловливает вероятность возникновения у 2-10% больных перекрестных аллергических реакций с пенициллинами. При этом могут развиваться анафилактический шок, крапивница, ангионевротический отек, генерализованная эритема, макулезно-папулезная экзантема, лихорадка, эозинофилия. У людей с повышенной чувствительностью к пенициллину аллергические реакции на цефалоспорины развиваются в 5-6 раз чаще. Из-за наличия перекрестных реакций с пенициллинами исключается применение этих препаратов при аллергии к пенициллину.
На цефалоспорины аллергические реакции (крапивница, отек Квинке, кореподобная сыпь, лекарственная лихорадка, эозинофилия, сывороточная болезнь, бронхоспазм, анафилактический шок) встречались реже, чем на антибиотики пенициллинового ряда (у 1-3% больных). В порядке снижения риска аллергических реакций препараты расположены следующим образом: цефтриаксон > цефоперазон > цефокситин > цефтазидим > цефотаксим > цефуроксим. Выявлена высокая вероятность развития перекрестных реакций на цефалоспорины у больных с аллергией на пенициллин, она наиболее высока (10-15%) для цефалоспоринов I поколения и минимальна (1-2%) для препаратов III-IV поколений. Тяжелые аллергические реакции на цефалоспорины встречались крайне редко.
По данным ГФЦ МЗ Украины (по состоянию на 01.09.2005 г.), в структуре ПД, которые вызывают антибиотики и другие противомикробные препараты, цефалоспориновые ЛС составляют 23,1% случаев. Среди основных представителей этих ЛС, разрешенных к медицинскому применению в Украине, наибольшее количество случаев зарегистрировано при назначении цефазолина (45,3%), цефтриаксона (34,5%) и цефотаксима (12,0%).
 Наибольшее количество ПД отмечалось при назначении препаратов отечественного производства, которые превосходят зарубежных производителей на украинском фармацевтическом рынке по показателям объемов продаж. В сравнении с представителями антибиотиков других групп, случаи ПД при применении цефалоспоринов занимают второе место (22,8%) после пенициллинов. Среди системных проявлений ПД при медицинском применении цефалоспоринов доминировали различные по клиническим проявлениям аллергические реакции (84,6%). Необходимо подчеркнуть, что причинно-следственная связь в среднем для препаратов этой группы была установлена в 71,7% случаев. В 54,9% – препарат был отменен, из них в 41,7% случаев необходимо было проведение дополнительной фармакотерапии.
Наибольшее количество ПД отмечалось при назначении препаратов отечественного производства, которые превосходят зарубежных производителей на украинском фармацевтическом рынке по показателям объемов продаж. В сравнении с представителями антибиотиков других групп, случаи ПД при применении цефалоспоринов занимают второе место (22,8%) после пенициллинов. Среди системных проявлений ПД при медицинском применении цефалоспоринов доминировали различные по клиническим проявлениям аллергические реакции (84,6%). Необходимо подчеркнуть, что причинно-следственная связь в среднем для препаратов этой группы была установлена в 71,7% случаев. В 54,9% – препарат был отменен, из них в 41,7% случаев необходимо было проведение дополнительной фармакотерапии. Поэтому соблюдение принципов использования ЛС, сформулированных в документах ВОЗ, как для масштабов национальных служб здравоохранения, так и повседневной практики врача, тщательный контроль за безопасностью – залог того, что качество жизни пациентов будет максимально обеспечено при применении лекарственных препаратов.
Поэтому соблюдение принципов использования ЛС, сформулированных в документах ВОЗ, как для масштабов национальных служб здравоохранения, так и повседневной практики врача, тщательный контроль за безопасностью – залог того, что качество жизни пациентов будет максимально обеспечено при применении лекарственных препаратов.Литература
1. Березняков И.Г. Клинико-фармакологическая характеристика аминогликозидов // Клин. антибиотикотерапия. – 2002. – № 5 (19). – С. 18-24.
3.Посохова К.А., Вікторов О.П. Побічна дія антибіотиків аміноглікозидов: сучасний погляд на проблему // Фармацевтичний журнал. – 2005. – № 2. – С. 57-58.
4. Посохова К.А., Вікторов О.П. Антибіотики (властивості, застосування, взаємодія): Навч. посібник. – Тернопіль: ТДМУ, 2005. – 296 с.
Что такое антибиотики. Досье — Биографии и справки
Что такое антибиотики?
- Антибиотики — особые вещества, подавляющие размножение бактерий и вызывающие их гибель.
 В качестве лекарственных средств они употребляются для борьбы с заболеваниями, которые вызваны болезнетворными микроорганизмами.
В качестве лекарственных средств они употребляются для борьбы с заболеваниями, которые вызваны болезнетворными микроорганизмами.
От каких болезней лечатся антибиотиками?
- Одно из основных применений антибиотиков — лечение таких распространенных болезней как пневмония (чаще всего вызывается бактериями семейства staphylococcaceae), сифилиса (treponema pallidum) и туберкулеза (mycobacterium tuberculosis, известная как палочка Коха). При этом антибиотики совершенно бесполезны при вирусных инфекциях: например, эти лекарства не помогут при гриппе, ОРВИ или гепатите A, B и C. Однако если грипп приводит к осложнениям, в том числе пневмонии, врач может выписать антибиотик.
Сколько антибиотиков существует в мире?
- Всего известно несколько тысяч разнообразных натуральных и синтетических веществ, применяемых в качестве антибиотиков, однако все они объединены в 16 крупных классов. Например, пенициллин, первый антибиотик, открытый в 1928 г.
 Александром Флемингом, относится к классу бета-лактамных антибиотиков. Из известных антибиотиков используется лишь малая часть, не более 5%, поскольку большинство из ранее открытых антибиотиков стали бесполезны из-за антибиотикорезистентности, т. е. сопротивления микроорганизмов к антибиотикам.
Александром Флемингом, относится к классу бета-лактамных антибиотиков. Из известных антибиотиков используется лишь малая часть, не более 5%, поскольку большинство из ранее открытых антибиотиков стали бесполезны из-за антибиотикорезистентности, т. е. сопротивления микроорганизмов к антибиотикам.
В чем проблема резистентности?
- Микроорганизмы эволюционируют и рано или поздно в результате мутаций приспосабливаются к действию антибиотика, и для них он становится безвредным. В настоящее время все больше опасений ученых и врачей вызывает тот факт, что болезнетворные бактерии начинают приспосабливаться к антибиотикам быстрее, чем изобретаются новые виды лекарств.
- Если так пойдет и дальше, любое воспаление легких или подхваченный туберкулез и сепсис снова станут заболеванием со смертностью близкой к 100%, как это было до изобретения пенициллина.
- Это может привести к появлению эпидемий, которые будут уносить миллионы человеческих жизней.

Почему возникает резистентность?
- Основная вина в этом лежит на самих врачах и пациентах. Если бы человек принимал антибиотик по правильному назначению врача до полного выздоровления, в его бы организме не оставалось никаких болезнетворных микроорганизмов, и проблемы не было. К сожалению, пациенты часто принимают антибиотики без указания врача, не заканчивают курс, пьют их в недостаточных концентрациях, поэтому часть болезнетворных организмов выживает после такого лечения, и их носитель остается заразным для окружающих, даже если временно не чувствует недомогания. Виноваты и врачи, иногда прописывая антибиотики без нужды, для профилактики. Все это ведет к увеличению числа микроорганизмов, которых простыми антибиотиками не взять.
Почему не изобретают новые антибиотики?
- Изобретают. Например, в 2015 г. было объявлено об обнаружении сразу нового класса антибиотиков — теиксобактина, с которым ученые связывают большие надежды, т.
 к. в лабораторных опытах еще ни разу не удалось выявить появления резистентности к нему у болезнетворных бактерий. Однако лечить им вряд ли начнут раньше, чем через 10 лет из-за необходимого цикла проверок. Кроме того, это первый открытый класс антибиотиков за последние несколько лет, и этого просто мало. Находить и испытывать новые антибиотики очень дорого, поэтому фармацевтические компании в настоящее время очень неохотно берутся за это дело. Исправить это можно только коренной реформой финансирования медицинской отрасли на мировом уровне.
к. в лабораторных опытах еще ни разу не удалось выявить появления резистентности к нему у болезнетворных бактерий. Однако лечить им вряд ли начнут раньше, чем через 10 лет из-за необходимого цикла проверок. Кроме того, это первый открытый класс антибиотиков за последние несколько лет, и этого просто мало. Находить и испытывать новые антибиотики очень дорого, поэтому фармацевтические компании в настоящее время очень неохотно берутся за это дело. Исправить это можно только коренной реформой финансирования медицинской отрасли на мировом уровне.
Как справиться с проблемой?
- Американо-индийский Центр контроля динамики заболеваний, экономики и политики (Center for Disease Dynamics, Economics & Policy, CDDEP) в отчете о применении антибиотиков в 2015 г. рекомендует несколько путей решения проблемы.
- Прежде всего, следует добиться правильного употребления антибиотиков, как от врачей, так и от пациентов. Поэтому одна из основных задач — снижение мирового потребления этого вида лекарств.

- Пока же оно продолжает расти, с 2000 г. по 2010 г. мировое потребление выросло с 50 до 70 млрд единиц, причем основной рост приходится на такие страны как Индия, Египет, Китай, Бразилия, страны Африки.
- Растет потребление антибиотиков и в России. В развитых странах, за исключением Нидерландов и Дании, потребление сокращается. Эксперты предлагают использовать антибиотики только в ситуациях угрожающих жизни, никогда не прописывая их, даже детям, при обычном кашле, простуде или диарее, если не имеется осложнений.
- Стоит также избегать ситуаций, когда эти лекарства могут понадобиться. Значительную часть болезней можно предотвратить, если регулярно мыть руки с мылом. В развивающихся странах опасные заболевания во многом возникают из-за отсутствия доступа к чистой воде и плохих санитарно-гигиенических условий. Наконец вакцинация от определенных болезней позволяет меньше использовать антибиотики.
- Также эксперты рекомендуют снизить применение антибиотиков в сельском хозяйстве.

История открытия пенициллина. Досье
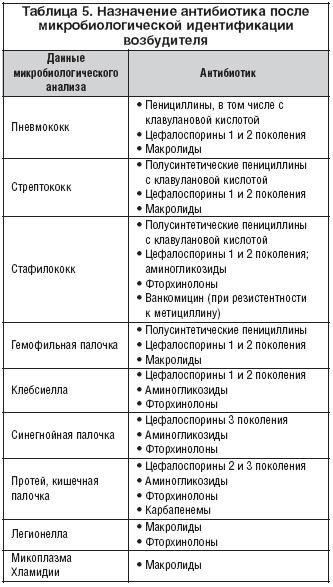
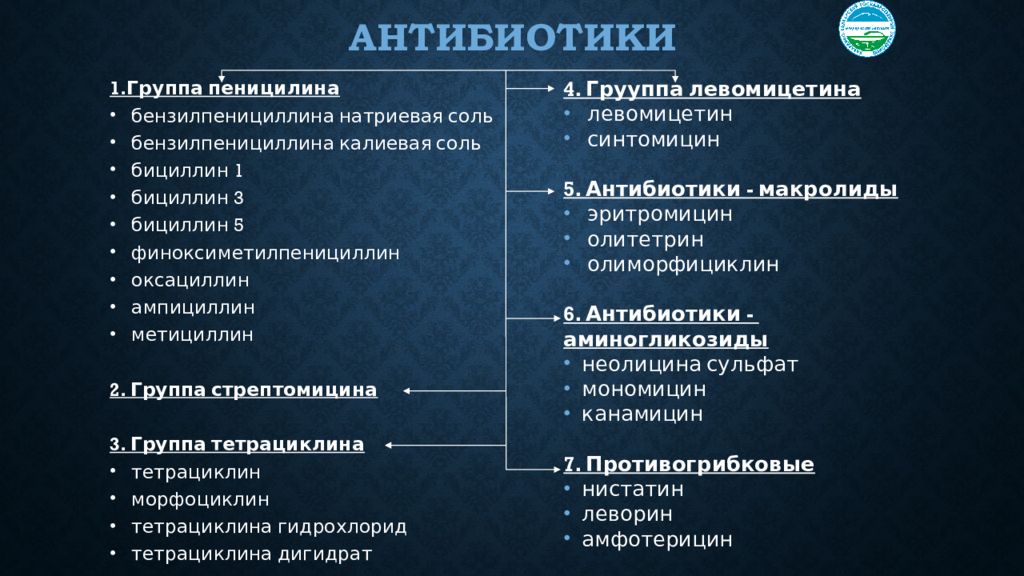
Антимикробные средства. Классификация антимикробных препаратов
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
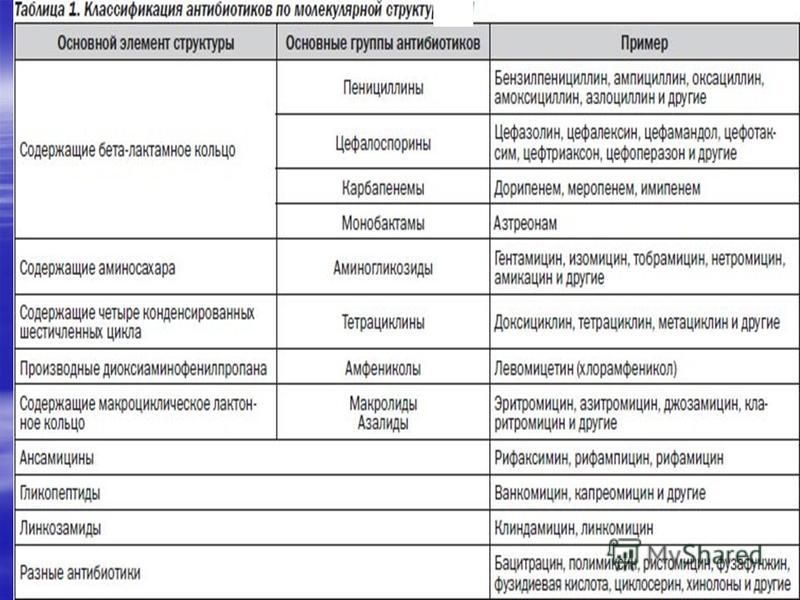
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.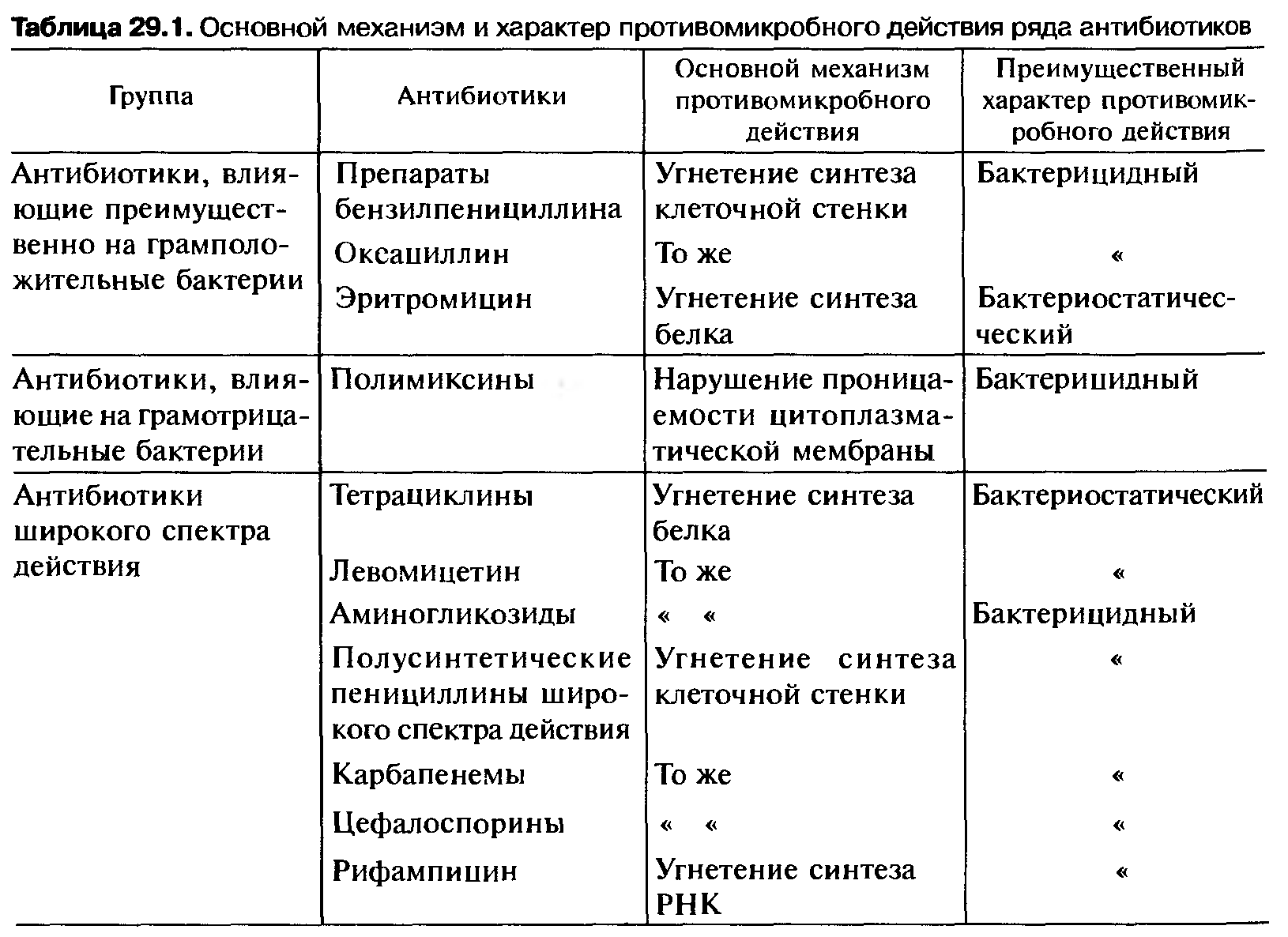 д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза./136.jpg) Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю — свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
— психозы при лечении левомицетином,
— парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
— головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
— судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
— судороги при применении имипенема,
— возбуждение при использовании фторхинолонов,
— менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
— нарушения зрения при лечении азтреонамом и левомицетином,
— периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
— взятие материала из области, максимально приближенной к очагу инфекции,
— предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой — предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Таблица 9.2.
Лактамные антибиотики.
|
Группа препаратов |
Название |
Характеристика препарата |
|||||
|
Пенициллины |
Природные пенициллины |
натриевая и калиевая соли бензилпени-циллина |
вводятся только парентерально, действуют 3-4 часа |
высоко эф-фективны в своем спек-тре действия, но этот спектр узок, кроме того, препараты неустойчивы к лактамазам |
|||
|
бициллин 1,3,5 |
вводятся только пар-ентерально, действуют от 7 до 30 суток |
||||||
|
феноксиметилпенициллин |
препарат для перорального применения |
||||||
|
Антистафило-кокковые |
оксациллин, метициллин, клоксациллин, диклоксациллин |
имеют меньшую антимикробную ак-тивность, чем природные пеницил-лины, но устойчивы к лактамазам ста-филококков, могут применяться per os |
|||||
|
Амино-пенициллины |
ампициллин, амоксициллин, бакампициллин |
препараты широкого спектра действия, могут применяться per os, но неустойчивы к бета-лактамазам |
|||||
|
Комбиниро-ванные |
Ампиокс — ампициллин+ +оксациллин |
препарат широкого спектра действия, устойчивый к бета-лактамазам, может применяться per os |
|||||
|
Антисине-гнойные |
карбенициллин, тикарциллин, азлоциллин, пиперациллин, мезлоциллин |
имеют широкий спектр действия, дей-ствуют на штаммы синегнойной палоч-ки, не вырабатывающие бета-лактамаз, в процессе лечения возможно быстрое развитие устойчивости к ним бактерий |
|||||
|
Защищенные от лактамаз — препараты с кла-вулановой кисло-той, тазобакта-мом,сульбактамом |
амоксиклав, тазоцин, тиментин, циазин, уназин |
препараты являются комбинацией пенициллинов широкого спектра действия и ингибиторов бета-лактамаз, поэтому действуют на штаммы бактерий, вырабатывающие бета-лактамазы |
|||||
|
Цефалоспорины |
1 поколения |
цефазолин |
антистафи-лококковый препарат для парентераль-ного прим. |
не устойчи-вы к лакта-мазам, име-ют узкий спектр действия |
с каждым поколе-нием цефало-споринов расширя-ется их спектр и снижает-ся ток-сичность, цефало-спорины хорошо перено-сятся и занимают первое место по частоте примене-ния в стацио-нарах |
||
|
цефалексин и цефаклор |
применяются per os |
||||||
|
2 поколения |
цефаклор, цефураксим |
применяются per os |
устойчивы к лактама-зам, спектр включает и грамполо-жительные, и грамотри-цательные бактерии |
||||
|
цефамандол, цефокситин, цефуроксим, цефотетан, цефметазол |
применяются только паренте-рально |
||||||
|
3 поколения |
цефтизоксим, цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефменоксим |
только для парентераль-ного приме-нения, обла-дают антиси-негнойной активностью |
устойчивы к лактамазам грамотрица-тельных бактений, не эффектив-ны при стафило-кокковых инфекциях |
||||
|
цефиксим, цефтибутен, цефподоксим, цефетамет |
применяются per os, обла-дают анти-анаэробной активностью |
||||||
|
4 поколения |
цефипим, цефпирон |
самый широкий спектр действия, применяются парентерально |
|||||
|
Цефалоспорины с ингибиторами бета-лактамаз |
сульперазон |
Имеет спектр действия цефоперазона, но действует и на лактамазо-продуцирующие штаммы |
|||||
|
Карбапенемы |
имипенем и его комбина-ция с цилоста-тином, предо-храняющая от разрушения в почках, — тиенам |
Более активен к грамположительным микроорганизмам |
имеют самый широкий из лактамных антибиотиков спектр действия, включа-ющий анаэробы и сине-гнойную палочку, и устой-чивы ко всем лактамазам, к ним практически не выра-батывается резистентность, они могут применяться практически при любых возбудителях, исключая метициллинрезистентные штаммы стафилококка, и в виде монотерапии даже при тяжелых инфекциях, обладают эффектом последействия |
||||
|
меропенем |
Более активен к грамотрицательным микроорганизмам |
||||||
|
эртапенем |
|||||||
|
Моно-бактамы |
азтреонам |
препарат узкого спектра, действует только на грамотрицательные палочки, но очень эффективен и устойчив ко всем лактамазам |
|||||
Таблица 9. 3.
3.
Антибиотики других групп.
|
Группа препа-ратов |
Название |
Характеристика препарата |
|
|
Глико-пептиды |
ванкомицин, тейкопламин |
имеют узкий грамположительный спектр, но в нем очень эффективны, в частности действуют на метициллинрезистентные стафилококки и на L-формы микроорганизмов |
|
|
Полимиксины |
Это самые токсичные антибиотики, используются только для местного применения, в частности per os, так как они не всасываются в ЖКТ |
||
|
Фузидин |
низкотоксичный, но и низкоэффективный антибиотик |
||
|
Левомицетин |
высоко токсичен, в настоящее время используется в основном при менингококковых, глазных и особо опасных инфекциях |
||
|
Линкоз-амины |
линкомицин, клиндамицин |
менее токсичны, действуют на стафилококк и анаэробные кокки, хорошо проникают в кости |
|
|
Тетра-цик-лины |
природные – тетрациклин, полусинтети-ческие – метациклин, синтетические – доксициклин, миноциклин |
антибиотики широкого спектра действия, включающего анаэробы и внутриклеточных возбудителей, токсичны |
|
|
Амино-глико-зиды |
1 поколения: стрептомицинканамицин мономицин |
высоко токсичны, ис-пользуются только мест-но для деконтаминации ЖКТ, при туберкулезе |
токсичные антибиотики достаточно широкого спектра действия, плохо действуют на грамположительные и анаэробные микроорганизмы, однако усиливают действие на них лактамных антибиотиков, в каждом последующем поколении снижается их токсичность |
|
2 поколения: гентамицин |
широко используется при хирургических инфекциях |
||
|
3 поколения: амикацин, сизомицин, нетилмицин, тобрамицин |
действуют на некото-рые микроорганизмы, устойчивые к гента-мицину, в отношении синегнойной палочки наиболее эффективным является тобрамицин |
||
|
Макро-лиды |
природные: эритромицин, олеандомицин |
низко токсичные, но и низко эффективные анти-биотики узкого спектра действия, действуют толь-ко на грамположительных кокков и внутрикле-точных возбудителей, могут применяться per os |
|
|
полусинтети-ческие: рок-ситромицин, кларитроми-цин, флури-тромицин |
тоже действуют на внутриклеточных возбудителей, спектр несколько шире, в частности включает геликобактер и моракселлу, хорошо проходят все барьеры в организме, проникают в различные ткани, обладают эффектом последействия до 7 суток |
||
|
азолиды: азитромицин (сумамед) |
обладают теми же свойствами, что и полусинтетические макролиды |
||
|
Рифампицин |
используется в основном при туберкулезе |
||
|
Противогриб-ковые антиби-отики |
флуконазол, амфотерицинВ |
амфотерицин В высокотоксичен, используется при отсутствии чувствительности возбудителей к флуконазолу |
|
Таблица 9. 4.
4.
Синтетические антибактериальные препараты.
|
Группа препаратов |
Название |
Характеристика препарата |
||
|
Сульфаниламиды |
Резорбтив-ного действия |
норсульфазол, стрептоцид, этазол |
препараты короткого действия |
препараты широкого спектра действия, у возбудителей часто вырабаты-вается перекрестная устойчивость ко всем препаратам этого ряда |
|
сульфадиметоксин, сульфапиридазин, сульфален |
препараты продолжительного действия |
|||
|
Действую-щие в просвете кишечника |
фталазол, сульгин, салазопиридазин |
салазопиридазин – используется при болезни Крона, неспецифическом язвенном колите |
||
|
Местного примене-ния |
сульфацил-натрий |
используется в основном в офтальмологии |
||
|
Производные нитрофурана |
фурагин, фуразолидон, нитрофурантоин |
обладают широким спектром действия, включающим клостридии и простейших, в отличие от большинства антибиотиков не угнетают, а стимулируют иммунитет, применяются местно и per os |
||
|
Производные хиноксалина |
хиноксидин, диоксидин |
обладают широким спектром действия, включающим и анаэробы, диоксидин применяется местно или парентерально |
||
|
Производные хинолона |
невиграмон, оксолиниевая и пипемидиновая кислота |
действуют на группу кишечных грамотрицательных микроорганизмов, используются в основном при уроло-гических инфекциях, к ним быстро развивается резистентность |
||
|
Фтор-хинолоны |
офлоксацин, ципрофлоксацин, пефлоксацин, ломефлоксацин, спарфлоксацин, левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин |
высокоэффективные препараты широ-кого спектра, действуют на синегнойную палочку и внутриклеточных воз-будителей, на многие штаммы, проду-цирующие лактамазы, хорошо перено-сятся, широко используются в хирургии, наибольшей антисинегнойной активностью обладает ципрофлоксацин, а наибольшей антианаэробной активностью — моксифлоксацин |
||
|
Производные 8-оксихинолина |
нитроксолин, энтеросептол |
действуют на многие микроорганизмы, грибы, простейших, применяются в урологии и при кишечных инфекциях |
||
|
Нитроимида-золы |
метронидазол, тинидазол |
действуют на анаэробные микроорганизмы, простейших |
||
|
Специфические противотуберкулезные, противосифилитические, противовирусные, противоопухолевые препараты |
применяются преимущественно в специализированных учреждениях |
|||
Источник:
Н. А.Кузнецов и соавт.
Основы клинической хирургии. Практическое руководство. Издание 2-е, переработанное и дополненное. — М.:ГЭОТАР-Медиа, 2009.
А.Кузнецов и соавт.
Основы клинической хирургии. Практическое руководство. Издание 2-е, переработанное и дополненное. — М.:ГЭОТАР-Медиа, 2009.
Статья добавлена 7 июня 2016 г.
Если заболевание имеет бактериальную природу…
В практике работы медицинских учреждений анализ на чувствительность к антибиотикам считается обязательным, если у врача появилось подозрение, что заболевание пациента имеет бактериальную природу. Анализ на чувствительность к антибиотикам – это лабораторный способ выявления препарата, который будет оказывать наибольшее действие на патогенную флору в данном конкретном случае болезни.
Как правило, в таких случаях речь идет о диско-диффузионном методе – одном из старейших в арсенале бактериологов, однако и сегодня остающемся наиболее распространенном при оценке антибиотикочувствительности. Прежде всего – потому, что он подходит для исследования большинства патогенов, в том числе и для наиболее распространенных бактерий со сложными питательными потребностями. Универсальным данный метод считается не только потому, что он оптимален для широкого круга антимикробных препаратов, но и потому, что не требует обязательного использования специального оборудования.
Универсальным данный метод считается не только потому, что он оптимален для широкого круга антимикробных препаратов, но и потому, что не требует обязательного использования специального оборудования.
Определение чувствительности микроорганизмов – возбудителей инфекционных заболеваний человека к антибактериальным препаратам приобретает все более важное значение в связи с появлением и широким распространением антибактикорезистентности у бактерий. В ходе повседневной деятельности в бактериологических лабораториях из различных биологических материалов и объектов внешней среды выделяют множество бактерий. Однако определение чувствительности выделенных микроорганизмов к антибактериальным препаратам показано далеко не во всех случаях.
Если говорить непосредственно о пациентах, то определение чувствительности нужно, чтобы избежать устойчивости бактерий к лечению. Если пациента недавно лечили антибиотиками, и теперь вновь необходим повторный курс, то требуется замена препарата.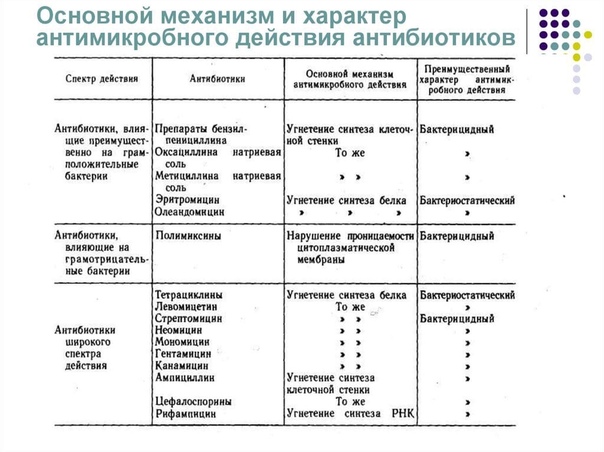 Это позволит использовать меньшие дозы лекарства и не вызывать мутации у возбудителя. В гнойных хирургических отделениях антибиотики меняют каждые два-три месяца.
Это позволит использовать меньшие дозы лекарства и не вызывать мутации у возбудителя. В гнойных хирургических отделениях антибиотики меняют каждые два-три месяца.
Данный анализ необходим еще в том случае, если на основную группу антибиотиков у больного возникает аллергическая реакция. На языке профессионалов обязательному исследованию на чувствительность к антибактериальным препаратам подлежат все микроорганизмы, выделенные из первично стерильных жидкостей, органов и тканей человека. В остальных случаях оценке чувствительности должна предшествовать оценка клинической значимости микроорганизма. Исследованию по оценке антибиотикочувствительности подлежат чистые культуры микроорганизмов или материал изолированных колоний с плотных питательных сред после первичного посева образца клинического материала с последующей идентификацией культуры.
Принцип диско-диффузионного метода состоит в том, что бумажные диски, пропитанные антибиотиками, в чашке Петри раскладывают поверх агара, на который нанесен исследуемый материал.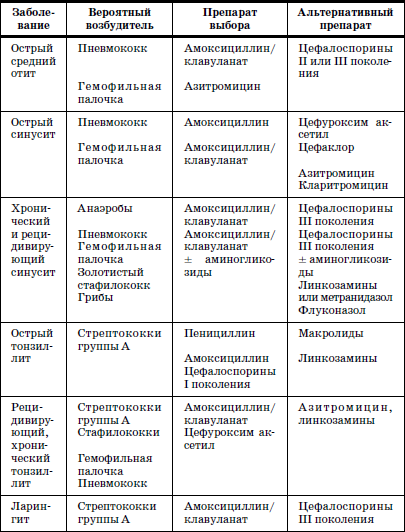 После чашку закрывают и ставят в термостат. Постепенно диск погружается в желатин, а антибиотик диффундирует в окружающее пространство. Вокруг бумаги образуется зона «подавления роста». Чашки проводят в термостате двадцать четыре часа, затем их вынимают и измеряют диаметр вышеуказанной зоны.
После чашку закрывают и ставят в термостат. Постепенно диск погружается в желатин, а антибиотик диффундирует в окружающее пространство. Вокруг бумаги образуется зона «подавления роста». Чашки проводят в термостате двадцать четыре часа, затем их вынимают и измеряют диаметр вышеуказанной зоны.
Выбранная питательная среда готовится в соответствии с рецептурой. Перед работой необходимо проконтролировать отсутствие конденсата жидкости на внутренней поверхности крышек чашек Петри.
Для определения чувствительности диско-диффузионным методом следует использовать только стандартизированные качественные диски. Чтобы результаты исследования были достоверными, важно строго соблюдать и правила хранения и использования коммерческих дисков – в противном случае содержание в них антибиотиков может оказаться ниже допустимого уровня еще до истечения срока годности.
Небольшие партии, которые используются в повседневной работе, можно хранить в холодильнике при температуре 4-8 градусов по Цельсию, плотно укупоренными так, чтобы гарантировать невозможность попадания во флаконы влаги, кроме того, для дополнительной защиты от влаги во флаконах с дисками коммерческого изготовления содержится специальный влагопоглотитель.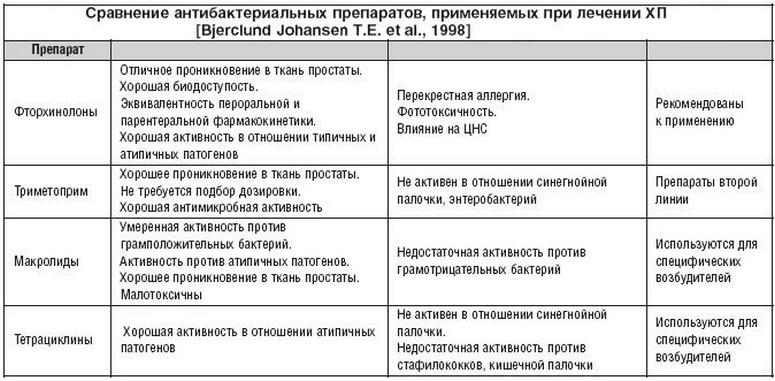 Флаконы с дисками следует извлекать из холодильника за 1 час до начала работы и выдерживать герметично закрытыми до достижения ими комнатной температуры.
Флаконы с дисками следует извлекать из холодильника за 1 час до начала работы и выдерживать герметично закрытыми до достижения ими комнатной температуры.
Общим и принципиально важным для всех методов тестирования является стандартизация суспензии исследуемого микроорганизма. Бактериальную суспензию готовят либо из бульонной, либо из агаровой культуры. Для приготовления инокулюма используют чистую суточную культуру микроорганизмов, выросших на плотных питательных средах. Отбирают несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах. Петлей переносят незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором или питательным бульоном, доводя плотность инокулюма точно до 0,5 по стандарту МакФарланда. Инокулюм следует использовать в течение 15 минут после приготовления.
Наиболее удобным способом инокуляции является использование стерильных ватных тампонов. Тампон необходимо погрузить в приготовленную суспензию микроорганизма, затем избыток инокулюма удалить, отжав тампон о стенки пробирки. Инокуляцию проводят равномерно штриховыми движениями на всю поверхность агара таким образом, чтобы штрихи плотно прилегали друг к другу, поворачивая чашку Петри на 60 градусов. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 минут.
Тампон необходимо погрузить в приготовленную суспензию микроорганизма, затем избыток инокулюма удалить, отжав тампон о стенки пробирки. Инокуляцию проводят равномерно штриховыми движениями на всю поверхность агара таким образом, чтобы штрихи плотно прилегали друг к другу, поворачивая чашку Петри на 60 градусов. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 минут.
Не позднее чем через 15 мин после инокуляции на поверхность питательной среды наносят диски с АБП. Аппликацию дисков проводят с помощью стерильного пинцета или автоматического диспенсера. Расстояние от диска до края чашки и между дисками должно быть 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков с АБП. Диски должны равномерно контактировать с поверхностью агара, для чего их следует аккуратно прижать пинцетом.
Непосредственно после аппликации дисков чашки Петри помещают в термостат кверху дном и инкубируют при температуре 35 °С в течение 18-24 ч (в зависимости от вида тестируемого микроорганизма). Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации (а соответственно – началом роста исследуемой культуры микроорганизма) приводит к «преддиффузии» АБП в агар и к увеличению диаметра зоны подавления роста.
Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации (а соответственно – началом роста исследуемой культуры микроорганизма) приводит к «преддиффузии» АБП в агар и к увеличению диаметра зоны подавления роста.
После окончания инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм.
При измерении зон задержки роста следует ориентироваться на зону полного подавления видимого роста. Не следует обращать внимания на очень мелкие колонии, выявляемые в пределах зоны задержки роста только при особых условиях освещения или увеличении, и едва заметный налет у края зоны. Исключение составляют случаи учета результатов определения чувствительности стафилококков к оксациллину, когда необходимо учитывать и самые мелкие колонии, выявляемые в пределах четкой зоны подавления роста.
Крупные колонии, выявляемые в пределах четкой зоны подавления роста, свидетельствуют о наличии посторонней микрофлоры или о гетерорезистентности популяции микроорганизмов, в этом случае необходимо повторить идентификацию микроорганизма, формирующего эту колонию, и определение чувствительности этого штамма.
Условно все микроорганизмы можно разделить на три группы. Деление основывается на устойчивости к антибиотику. Выделяют чувствительные возбудители, умеренно устойчивые возбудители и устойчивые возбудители. Антибиотикограмма (расшифровка латинских букв) говорит о следующем: R – возбудитель, устойчивый к препарату; I – микроорганизм проявляет умеренную устойчивость; S – бактерия, чувствительная к данному антибиотику.
Парентеральное введение (инъекция) в свиноводстве / Публикации / Новости и публикации / Ceva Russia
При профилактике и лечении болезней сельскохозяйственных животных применяется парентеральное введение (инъекция) антибактериальных препаратов, вакцин, витаминов и других медикаментов. В свиноводстве «инъекция» является повседневной процедурой, которой подвергаются животные в процессе всего периода содержания. Однако эта обработка будет эффективна только в случае, если проведена правильно, с соблюдением простейших правил. К сожалению, практика показывает, что зачастую в промышленных свиноводческих хозяйствах не уделяется должного внимания этой нехитрой процедуре, что закономерно ведет к финансовым потерям предприятия. Обусловлено это тем, что при неправильном парентеральном введении, в лучшем случае, снижается эффективность препарата, а в худшем, наблюдаются осложнения общего и местного характера (например, абсцессы) или даже гибель животного.
К сожалению, практика показывает, что зачастую в промышленных свиноводческих хозяйствах не уделяется должного внимания этой нехитрой процедуре, что закономерно ведет к финансовым потерям предприятия. Обусловлено это тем, что при неправильном парентеральном введении, в лучшем случае, снижается эффективность препарата, а в худшем, наблюдаются осложнения общего и местного характера (например, абсцессы) или даже гибель животного.
Парентеральным (от греч. para – рядом, вблизи, entern – кишечник) называется способ введения лекарственных веществ в организм, минуя пищеварительный тракт.
Рис. 1. Парентеральное введение лекарственных средств:
а – внутрикожно;
б – подкожно;
в – внутримышечно;
г – внутривенно.
| Преимущества | Недостатки |
|---|---|
Наиболее эффективный метод | Увеличение стресса при обработках |
Наиболее экономичный метод | Увеличение трудоемкости обработок |
Точная дозировка | Практические трудности для персонала |
Препарат начинает действовать немедленно после инъекции |
|
Не зависит от потребления воды/корма |
|
Индивидуальный подход к лечению |
|
Легко определяется период выведения |
|
Легко оценивается эффективность препарата |
|
Прежде чем приступить к инъецированию, необходимо убедиться в выборе правильного инструмента, соответствия дозы и пути (метода) предполагаемого введения, а также проверить срок годности препарата.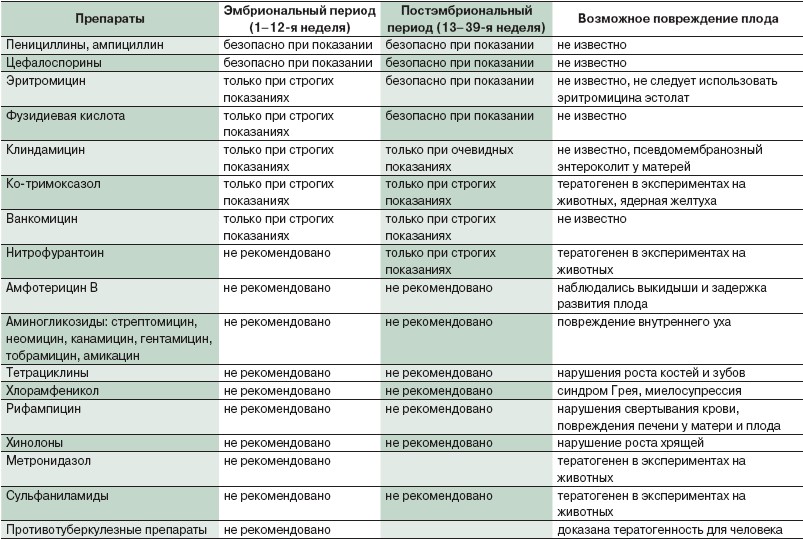 Важнейшими аспектами являются:
Важнейшими аспектами являются:
- Гигиена
- Дозировка
- Шприц и иглы
- Выполнение инъекции
- Регистрация обработок
1. Гигиена (асептика и антисептика)
Именно несоблюдение правил асептики и антисептики ведет к инфицированию места введения и развитию гнойных процессов (абсцесс, флегмона) на месте инъекции. При выполнении инъекции необходимо использовать стерильный инструментарий, обрабатывать места инъекции дезинфицирующим раствором. Идеальным вариантом является использование одноразовых шприцев и игл, однако на практике это может быть затруднительно. Поэтому в крупных промышленных хозяйствах идут на компромисс и используют методику регулярной замены инъекционных игл. Однако эта методика должна стать единственным компромиссом ветеринарного специалиста, если он является таковым.
Методика предусматривает замену инъекционных игл со следующей периодичностью:
- Свиноматки и хряки: каждое животное
- Доращивание/откорм: каждые 15-20 животных (один станок)
- Поросята (отъем/подсос): 1 помет/гнездо
Если используется многоразовый инструмент, необходимо после каждого применения провести очистку и стерилизацию с применением дезинфицирующих средств («Асептол») или кипячения.2010/35/1.png)
Для профилактики контаминирования препарата в многодозовых флаконах используйте различные иглы для набора лекарственного средства и проведения инъекции.
2. Дозировка
Правильная дозировка жизненно важна для эффективности продукта, особенно если это касается антибактериального препарата или вакцины.
Парентеральное введение избыточного количества препарата является экономически невыгодным и также может привести к осложнениям. При обработке животных необходимо строго соблюдать дозировки, указанные в наставлении (инструкции) по применению, непосредственно на упаковке (флаконе) или рекомендованные производителем препарата.
В некоторых случаях наблюдается несоответствие между заявленной длительностью действия инъекционного антибактериального средства и указанным периодом выведения. Пролонгированные формы препаратов не могут одновременно «длительно циркулировать в организме животного, оказывая антибактериальный эффект», и обладать коротким периодом выведения в 8-14 суток. При обнаружении подобного несоответствия в инструкции надо задуматься о честности производителя и качестве препарата. В тех случаях, когда период ожидания не указан, рекомендуется ориентироваться на период в 28 суток после последнего применения препарата.
При обнаружении подобного несоответствия в инструкции надо задуматься о честности производителя и качестве препарата. В тех случаях, когда период ожидания не указан, рекомендуется ориентироваться на период в 28 суток после последнего применения препарата.
При одновременном применении различных препаратов рекомендуется учитывать совместимость (химическую, фармакологическую). Известно, что одновременное использование антибактериальных препаратов бактерицидного и бактериостатического действия может привести к взаимному снижению эффективности (например, амоксициллин и тетрациклин). Сочетание же средств, оказывающих одинаковое действие на микробную клетку, позволяет значительно повысить антибактериальную активность и расширить спектр действия (например, дигидрострептомицин+пенициллин или спирамицин+окситетрациклин).
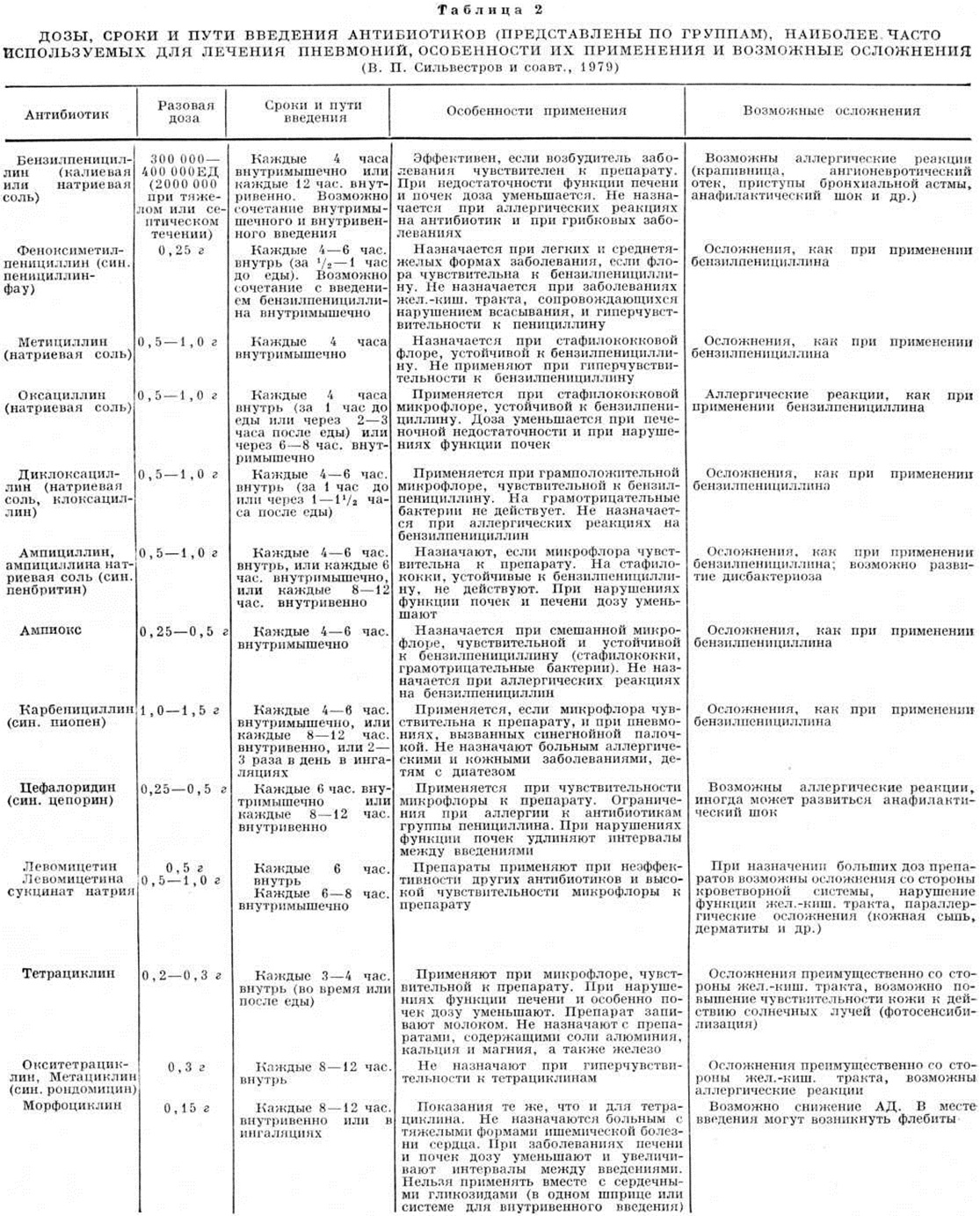
Дозы и период выведения некоторых часто используемых антибактериальных препаратов представлены в Таблице 1.
Таблица 1. Список антибактериальных препаратов, наиболее часто применяемых в ветеринарии посредством инъекции.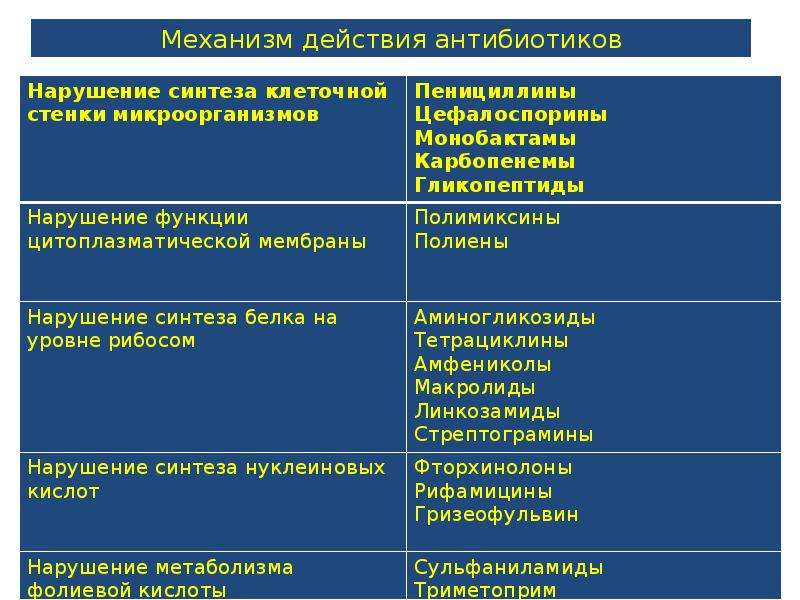
Действующее вещество | Концентрация, мг/мл | Доза мг/кг | Доза 1 мл /…кг ЖМ | Некоторые коммерческие препараты | Период ожидания 1 |
|---|---|---|---|---|---|
Амоксициллин | 150 | 15 | 10 | Ветримоксин LA | 28 |
Цефтиофур | 48 | 3 | 16 | Иноксел RTU | 5 |
Тилозин | 200 | 10 | 20 | Инотил 200 | 04.08.2015 |
Энрофлоксацин | 50 | 2,5 | 20 | Бактил 5% | 10 |
Окситетрациклин | 200 | 20 | 10 | Тетравет LA | 15-21 |
Окситетра 20% LA | |||||
Дигидрострептомицин | 200 | 20 | 10 | Интрамицин | 4-35 |
Пенициллин | 200 | 20 | |||
Спирамицин | 600000 МЕ | 8 | Спировет | 21 |
3.
 Шприцы и иглы
Шприцы и иглыВыбор шприца остается на усмотрение ветеринарного специалиста, однако применяемый инструмент должен обеспечивать возможность использования необходимого объема и дозировки препарата. Более критичным является размер инъекционной иглы, которая должна соответствовать размерам животного (свиньи) и пути введения (подкожно, внутримышечно и т.д.). Также важно не использовать поврежденные или затупленные иглы.
Российская номенклатура игл достаточно разветвленная и предполагает отображение многих параметров. Например: маркировка 1А1-06 х 40-1-15 означает инъекционную иглу к шприцу типа Рекорд, прямую, диаметром 0,6мм, длиной 40мм, кинжальной формы заточки, с углом заострения 15°.
Инъекционные иглы зарубежного производства идентифицируются калибром – номером, сопровождаемым прописной буквой «G» и целым числом или дробью (длина в дюймах 2). Например, игла калибра 16G11/2 означает: «16» – калибр иглы, зависит от её диаметра; дробь после буквы «G» является длиной иглы, измеренной в дюймах. Таким образом, 16G11/2 игла калибра 16 длиной один с половиной дюйма (~3,8 см). Хотелось бы обратить внимание на два основных момента:
Таким образом, 16G11/2 игла калибра 16 длиной один с половиной дюйма (~3,8 см). Хотелось бы обратить внимание на два основных момента:
- Увеличение номера калибра соответствует уменьшению размера иглы. Т.е. диаметр иглы 30G меньше чем 16G.
- Нумерация калибра не линейная, а это означает, что удваивание номера калибра не ведет к двукратной разнице в размере.
Выбор иглы зависит от пути введения, возраста, вида, а в некоторых случаях породы животного. Применение правильной иглы – обязательное условие эффективного введения лекарственного средства!
Несоответствующая длина иглы может привести к тому, что продукт будет инъецирован неправильно, например препарат, предназначенный для внутримышечного введения, попадет в подкожную или жировую ткань. Это снизит эффективность или даже сделает препарат полностью бесполезным (см. ниже). Применение слишком большой иглы причинит боль и возможно станет причиной последующих осложнений (например, абсцессов).
В Таблице 2 представлены рекомендуемые размеры/калибры игл для свиней различных возрастных групп.
Таблица 2Группа животных | Живая масса, кг | Вн/мыш. | Вн/мыш. | Вн/мыш. | Вн/мыш. | Подкожно | Подкожно | Подкожно | Подкожно |
|---|---|---|---|---|---|---|---|---|---|
Длина | Длина | Калибр | Калибр | Длина | Длина | Калибр | Калибр | ||
мм | дюймы | мм | G | мм | дюймы | мм | G | ||
Поросята (подсос) | 1-7 | 16 | 5/8 | 0,6-0,8 | 23-21 | — | — | — | — |
Поросята (отъем/доращивание) | 7-20 | 25 | 1 | 0,7-1,2 | 21-18 | — | — | — | — |
Подсвинки | 20-40 | 25 | 1 | 1,2 | 18 | — | — | — | — |
Свиньи на откорме | 40-120 | 38 | 11/2 | 1,4 | 16 | — | — | — | — |
Ремонтный молодняк | 100-140 | 50 | 2 | 1,4 | 16 | 25 | 1 | 1,2 | 18 |
Свиноматки/Хряки | 140+ | 50 | 2 | 1,4 | 16 | 25 | 1 | 1,2 | 18 |
 Выполнение инъекции
Выполнение инъекцииВ ветеринарной практике используются различные методы парентерального введения, однако в производственном процессе чаще всего применяется введение в мышечную ткань (внутримышечно), под кожу (подкожно) или непосредственно внутрь кровеносного русла (внутривенно).
Путь введения лекарственного средства зависит от цели, вида лекарственного препарата и применяемой дозировки. Например, препараты глюкозы инъецируют подкожно, а гормональные средства и антибиотики — внутримышечно. Некоторые препараты, можно применять различными способами, но некоторые лекарственные средства при подкожном введении вызывают боль и плохо рассасываются, что приводит к образованию инфильтратов, а при несоблюдении правил гигиены – развитию воспалительных реакций и гнойных процессов. При использовании таких препаратов, а также в тех случаях, когда хотят получить более быстрый эффект, используют внутримышечную инъекцию.
1. Область для подкожной (ПК) или внутримышечной (ВМ) инъекции
2, 3. Области для внутримышечной (ВМ) инъекции (только для поросят!)
Области для внутримышечной (ВМ) инъекции (только для поросят!)
4. Область ушной вены для внутривенного (ВВ) введения
5. Область яремной вены для внутривенного (ВВ) введения
6. Область верхней полой вены для внутривенного (ВВ) введения
Внутримышечное введение
Мышцы обладают более развитой сетью кровеносных и лимфатических сосудов, что создает условия для полного всасывания лекарств. При внутримышечной инъекции некоторых препаратов создается депо, из которого лекарственное средство всасывается в кровеносное русло, и это поддерживает необходимую его концентрацию в организме, что особенно важно применительно к антибиотикам и некоторым вакцинным препаратам. Производить внутримышечные инъекции следует в определенных местах тела, где имеется значительный слой мышечной ткани, и не будут травмированы крупные сосуды или нервные стволы. Например, маленькие поросята часто инъецируются в бедренную часть задней конечности, поскольку у таких животных еще недостаточно мышечной ткани в шейной области. Однако не рекомендуется проведение инъекции в эту область у поросят группы доращивания, подсвинков или откормочных свиней из-за высокой вероятности формирования абсцессов.
Однако не рекомендуется проведение инъекции в эту область у поросят группы доращивания, подсвинков или откормочных свиней из-за высокой вероятности формирования абсцессов.
У взрослых свиней внутримышечная инъекция выполняется в шею, если иное не предписано в инструкции к препарату. Наиболее часто используемым местом введения у отъемышей, подсвинков, откормочных свиней и взрослых животных является область, расположенная в 50-75мм позади основания уха, на границе кожной складки и кожи. Важным практическим моментом является угол введения иглы, который в этом случае должен составлять 90º по отношению к поверхности кожи. Т.е. когда животное стоит — положение шприца при ВМ инъекции должно быть горизонтальным. При избыточном каудальном3 смещении точки укола, повышается угроза введения препарата в жировую ткань. Если инъекция производится с вентральным4 смещением, присутствует риск того, что продукт будет введен в слюнную железу.
Подкожное введение
Подкожное введение более трудоемко в исполнении, по сравнению с внутримышечным и требует большей точности, поскольку препарат должен быть введен между кожей и нижележащими тканями. Идеальным местом введения для поросят является складка кожи на внутренней части бедра или позади плечевого сустава. Введение производится в основание треугольной кожной складки, сформированной сжатием большим и указательным пальцем. У подсвинков и взрослых свиней оптимальное место инъецирования расположено приблизительно в 25-75мм позади и на уровне основания уха. При этом инъекция производится с использованием 25мм иглы под углом 45º.
Идеальным местом введения для поросят является складка кожи на внутренней части бедра или позади плечевого сустава. Введение производится в основание треугольной кожной складки, сформированной сжатием большим и указательным пальцем. У подсвинков и взрослых свиней оптимальное место инъецирования расположено приблизительно в 25-75мм позади и на уровне основания уха. При этом инъекция производится с использованием 25мм иглы под углом 45º.
Внутривенное введение
Имеется три участка для инъецирования медикаментов непосредственно в кровяное русло: вены уха, яремная вена и верхняя полая вена, впадающая в правое предсердие. Самый распространенный метод — внутривенная инъекция в ушные вены. Особенно часто эта методика используется для анестезии и изредка для введения препаратов кальция. Кожа верхней части уха очищается с использованием ватного тампона, смоченного медицинским спиртом, что также способствует выявлению вен. Затем они кровенаполняются посредством сжатия у основания уха. Животное должно быть фиксировано носовым фиксатором, веревкой за верхнюю челюсть и/или предварительным введением седативных лекарственных средств, например ацепромазина (Ветранквил®).
Животное должно быть фиксировано носовым фиксатором, веревкой за верхнюю челюсть и/или предварительным введением седативных лекарственных средств, например ацепромазина (Ветранквил®).
5. Регистрация обработок
Регистрация всех проводимых медикаментозных обработок оговаривается нормативной документацией и законодательно закреплено во многих странах. В Российской Федерации производство, реализация и применение лекарственных средств регламентируется Законом РФ от 14 мая 1993 г. N 4979-1 «О ветеринарии», а также рядом других нормативных актов.
Ведение первичного учета проводимых ветеринарных мероприятий, заболеваемости и падежа животных является обязанностью всех ветеринарных специалистов, так как на его основе составляется обязательная государственная ветеринарная отчетность.
Кроме того, первичная документация является юридическим материалом, на основании которого выдаются свидетельства и сопроводительные документы, подтверждающие «безопасность в ветеринарно-санитарном отношении продуктов животноводства». Ветеринарная документация также лежит в основе некоторых зоотехнических и производственных мероприятий (выбраковка животного, использование на мясо или утилизация).
Ветеринарная документация также лежит в основе некоторых зоотехнических и производственных мероприятий (выбраковка животного, использование на мясо или утилизация).
Фиксация всех ветеринарных обработок и оформление соответствующих документов необходимы, в первую очередь, самому специалисту потому, что они позволяют вести учет заболеваемости животных и анализировать экономическую эффективность проведенных мероприятий. Зачастую только анализ первичной документации позволяет разобраться в сложившейся эпизоотической ситуации, найти ошибки и пути их исправления.
Заключение
На практике главные специалисты хозяйств, великолепно знающие свое дело, сталкиваются с техническими проблемами, обусловленными невнимательностью, незнанием или недобросовестностью подчиненных. В этом обзоре была сделана попытка обратить внимание ветеринарных специалистов всех уровней на общеизвестные, но часто игнорируемые тонкости парентерального введения лекарственных средств. Соблюдение простых и очевидных правил позволит значительно повысить экономическую эффективность проводимых ветеринарных мероприятий.
[1] Указан для мяса свиней. Зависит от вида животного, продукции и, целевого использования продукции[2] Дюйм — единица измерения расстояния в некоторых европейских неметрических системах мер. Сегодня под дюймом чаще всего понимают английский дюйм, равный 2,54 см.[3] Каудальный — лат. cauda, хвост. Термин, использующийся в анатомии для точного описания расположения какой-либо части тела животного по продольной оси ближе к хвосту.[4] Вентральный – лат. ventralis, от venter живот/брюхо. Термин, использующийся в анатомии для точного описания расположения какой-либо части тела животного по вертикальной оси ближе к брюшной стороне.Какие антибиотики можно при беременности
- Когда рекомендуется лечение антибиотиками при беременности?
- Какие антибиотики можно принимать при беременности?
- Что делать, если я принимала антибиотики во время зачатия?
- Когда антибиотики при беременности особенно опасны?
- Как принимать антибиотики при беременности?
Содержание:
С открытием антибиотиков мир стал другим. Когда почти против каждой опасной бактерии есть своя магическая таблетка, многие серьезные болезни больше не страшны. Мы привыкли к антибиотикам и не представляем жизнь без них. Но с началом 1-го триместра беременности все меняется. В инструкциях большинства знакомых препаратов прописаны ограничения на прием, а некоторые даже прямо запрещены во время вынашивания и кормления малыша. Так можно ли пить антибиотики при беременности? Есть ли среди них безопасные, которые не нанесут вреда ребенку? Обсудим эту важную тему.
Когда рекомендуется лечение антибиотиками при беременности?
Простой ответ звучит так: когда они прописаны вашим врачом. Предназначение антибиотиков — лечение воспалительных процессов в организме, вызванных вредными бактериями. Если заболевание представляет существенную угрозу для здоровья и жизни женщины или может серьезно ослабить ее организм, значит, оно грозит осложнениями и будущему малышу тоже. В таких случаях принимается решение о терапии антибиотиками. Другими словами, лечить сильными препаратами легкое кишечное расстройство не станет ни один врач, а вот при пневмонии организму не обойтись без медикаментозной поддержки.
Вот краткий список заболеваний, при которых рекомендовано применение антибиотиков во время беременности:
Острые заболевания дыхательных путей: пневмония, тяжелые формы бронхита и ангины.
Острые кишечные инфекции.
Тяжелые повреждения кожи: обширные ожоги, травмы, гнойные раны.
Системные воспалительные реакции, сепсис.
Пиелонефрит, холецистит и некоторые другие опасные заболевания мочевыводящей и пищеварительной систем.
Тяжелые инфекции, передающиеся человеку от животных: болезнь Лайма (клещевой боррелиоз), бруцеллез.
Серьезную опасность для будущей мамы представляют не только острые бактериальные заболевания, значительно нарушающие нормальную работу органов или имеющие тяжелые последствия. Опасны и вялотекущие генитальные инфекции — они поражают половые пути (которые вскоре станут родовыми) и способны привести к преждевременным родам1, преждевременному разрыву околоплодных оболочек и другим неприятным исходам. Если у женщины диагностировано такое заболевание на ранних сроках беременности, его обычно не лечат в 1-м триместре, а переносят терапию антибиотиками на 2-й или 3-й триместр, когда потенциальный риск воздействия препарата на плод снижается2.
Какие антибиотики можно принимать при беременности?
Для начала вам надо запомнить одно простое правило: антибиотики и беременность — нежелательное сочетание. Даже те из них, которые считаются безопасными для плода, рекомендовано принимать с осторожностью. Другими словами, будущая мама может пить только те лекарства, которые назначил ей врач с учетом всей доступной ему информации о препарате, здоровье женщины и течении беременности.
В таблице ниже мы собрали данные о самых распространенных группах антибиотиков и их возможном влиянии на плод.
Как видите, некоторые группы антибиотиков в период беременности полностью запрещены из-за тератогенного действия: доказано, что последствиями их приема могут стать различные пороки развития плода. Другие группы являются недостаточно изученными: по ним проводились тестирования на лабораторных животных, но нет достоверных данных для людей. Разрешенные антибиотики при беременности можно пересчитать по пальцам. Поэтому повторим еще раз: никакой самодеятельности, только по назначению врача!
Что делать, если я принимала антибиотики во время зачатия?
Во время подготовки к беременности желательно прекратить прием любых лекарственных препаратов, кроме тех, которые необходимы вам для терапии хронических заболеваний. Будет неплохо, если то же самое сделает будущий папа. Опасность представляют не только антибиотики, но и другие лекарства, причем иногда они демонстрируют самые неожиданные последствия. Например, широко известный бисептол14 успешно борется не только с бактериями, но и с фолиевой кислотой — витамином, критически важным на ранних этапах развития плода.
Если новость о том, что вы станете мамой, застала вас врасплох, необходимо немедленно прекратить прием антибиотиков и обратиться к врачу. На ранних сроках беременности, когда яйцеклетка еще путешествует к матке или только прикрепилась к ее стенке, антибиотики обычно не оказывают воздействия на плод. В таких случаях рекомендуется сохранить беременность и вести наблюдение с помощью стандартных методов — анализов и УЗИ. Скорее всего, на плановых скринингах не будет никаких отклонений, и вы родите здорового малыша.
Когда антибиотики при беременности особенно опасны?
Принимать любые лекарственные препараты наиболее рискованно в 1-м триместре2, когда плацента еще не сформировалась. Пока у плода нет защитного барьера, он открыт для всех вредных веществ, циркулирующих в организме мамы. Поэтому вам надо постараться ничем не заболеть в 1-м триместре.
Постарайтесь избегать мест массового скопления людей, особенно в сезон гриппа и других инфекционных заболеваний. Если без метро или автобуса не обойтись, попросите у начальства сместить ваш рабочий график так, чтобы не ездить в транспорте в час пик. Подвергайте рыбу и мясо тщательной термообработке, даже если обычно вы любите «с кровью». Смело выбрасывайте продукты из холодильника, если у вас появились сомнения в их свежести. Не ходите в лес, если там водятся клещи. Ну и вообще, соблюдайте разумные меры предосторожности.
Во 2-м и 3-м триместрах антибиотики для плода уже не так опасны. По крайней мере, те из них, которые не проникают через плацентарный барьер или преодолевают его в незначительных количествах. Именно поэтому, если врач обнаружил на ранних сроках беременности инфекцию, не представляющую угрозу здесь и сейчас, он постарается перенести терапию на более позднее время, чтобы свести к минимуму возможные последствия.
Как принимать антибиотики при беременности?
Следуйте рекомендациям врача и не забывайте о следующих важных правилах:
Соблюдайте дозировку и не пропускайте прием антибиотиков.
У некоторых женщин возникает соблазн уменьшить дозировку препарата, ничего не сказав врачу. Им кажется, что так они снижают вред для плода в 1-м и следующих триместрах беременности. Что ж, это примерно то же самое, как лить поменьше воды в огонь, чтобы не испортить вещи: когда пожар разгорится, воды понадобится еще больше. Если концентрация антибиотика в организме недостаточна, он просто не сможет победить инфекцию.
Доведите курс до конца.
Еще одно неверное решение при терапии антибиотиками — прекратить их прием, если наступило улучшение. Эта попытка уменьшить вред от препарата грозит тяжелыми последствиями. Битва с инфекцией не выиграна, пока она не побеждена до конца: отведете свои войска, и враг опять наберет силу.
Ищите отрицательные эффекты.
Прием некоторых антибиотиков во время беременности может привести к аллергическим реакциям. Обычно они возникают очень быстро — прямо в первые сутки. Если такое случилось, немедленно сообщите врачу.
Следите за динамикой.
Лечение антибиотиками должно дать результаты в течение первых 72 часов. Это не означает, что через три дня вы полностью выздоровеете, но положительная динамика должна присутствовать. Если этого не произошло, возможно, препарат подобран неверно, и его надо заменить другим. Расскажите об этом своему врачу.
Соблюдайте диету.
Нужно пить больше воды, употреблять меньше жирной и острой пищи. Впрочем, мы надеемся, что с началом 1-го триместра вы и так пересмотрели свои гастрономические пристрастия в сторону здорового питания.
Ссылки на источники:
Антибиотикопрофилактика во втором и третьем триместре беременности для уменьшения частоты неблагоприятных исходов беременности и заболеваемости. Линк: https://www.cochrane.org/ru/CD002250/PREG_antibiotikoprofilaktika-vo-vtorom-i-tretem-trimestre-beremennosti-dlya-umensheniya-chastoty
Errol R Norwitz, MD, PhD and James A Greenberg, MD. Antibiotics in Pregnancy: Are They Safe? Rev Obstet Gynecol. 2009 Summer; 2(3): 135–136. Линк: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2760892/
Ampicillin. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/pregnancy/ampicillin.html
Amoxicillin. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/monograph/amoxicillin.html
Czeizel AE, Rockenbauer M, Sørensen HT, Olsen J. Use of cephalosporins during pregnancy and in the presence of congenital abnormalities: a population-based, case-control study. Am J Obstet Gynecol. 2001 May;184(6):1289-96. Линк: https://pubmed.ncbi.nlm.nih.gov/11349204/
Meropenem Pregnancy and Breastfeeding Warnings. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/pregnancy/meropenem.html
Anat Bahat Dinur, Gideon Koren, Ilan Matok, Arnon Wiznitzer, Elia Uziel, Rafael Gorodischer, and Amalia Levy. Fetal Safety of Macrolides. Antimicrob Agents Chemother. 2013 Jul; 57(7): 3307–3311. Линк: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3697347/
Tetracycline Pregnancy and Breastfeeding Warnings. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/pregnancy/tetracycline.html
Merck Manual: Bacteria and Antibacterial Drugs: Aminoglycosides. Линк: https://www.merckmanuals.com/professional/infectious-diseases/bacteria-and-antibacterial-drugs/aminoglycosides#v1002159
Merck Manual: Glycopeptides and Lipoglycopeptides. Линк: https://www.merckmanuals.com/home/infections/antibiotics/glycopeptides-and-lipoglycopeptides#v368490411
Clindamycin Hydrochloride. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/monograph/clindamycin-hydrochloride.html
Lincomycin Pregnancy and Breastfeeding Warnings. The American Society of Health-System Pharmacists. Линк: https://www.drugs.com/pregnancy/lincomycin.html
Yefet E, Schwartz N, Chazan B, Salim R, Romano S, Nachum Z. The safety of quinolones and fluoroquinolones in pregnancy: a meta-analysis. BJOG. 2018 Aug;125(9):1069-1076. Линк: https://pubmed.ncbi.nlm.nih.gov/29319210/
«Bactrim, Bactrim DS (trimethoprim/sulfamethoxazole) dosing, indications, interactions, adverse effects, and more. Линк: https://reference.medscape.com/drug/bactrim-trimethoprim-sulfamethoxazole-342543#showall
Читай нас на Яндекс Дзен
Пищевая аллергия у собак: Симптомы и лечение (Фото)
Любые негативные реакции, так или иначе связанные с пищей, делятся на две группы: нежелательные пищевые реакции (когда иммунная система непосредственно не вовлечена в развитие заболевания, например, непереносимость лактозы или глютена у людей), и истинные пищевые аллергии. Нежелательные пищевые реакции у собак можно встретить довольно часто, к ним относят, например, появление острой рвоты и диареи в ответ на потребление шоколада (к слову, чем более горький шоколад, тем больше вероятность развития побочных реакций), непереносимость глютена (описана у ирландских сеттеров как генетическая аномалия).
Что такое пищевая аллергия?
Истинная пищевая аллергия – негативная реакций организма, обусловленная чрезмерной активностью иммунной системы и проявляющаяся некоторым набором неспецифических симптомов. Важно понимать, что пищевая аллергия, связанная с действием иммунной системы, развивается некоторое время – от нескольких месяцев до нескольких лет. Именно поэтому неверно полагать, что если собака питается одним и тем же кормом какое-то время, то у нее никак не может быть пищевой аллергии – как раз наоборот, вполне может. На форумах мы можем отыскать множество причин, вызывающих пищевую аллергию у собак, в том числе антибиотики из курицы, консерванты в кормах и даже жиры. Верно ли это? Вот, что говорят нам последние исследования ведущих зарубежных ветеринарных иммунологов об истинных причинах этого заболевания.
Основные «виновники» появления пищевой аллергии
Основной причиной истинной пищевой аллергии у собак и кошек являются белки, причем масса их должна быть более 10 кДа, чем тяжелее белок – тем больше у него шанс «не понравиться» иммунной системе. Именно поэтому наиболее часто виновниками развития аллергии у собак являются белки говядины, молочных продуктов, курицы и пшеничного глютена, а у кошек: молока, говядины, рыбы и курицы. Это совершенно не значит, что ваша собака не может развить пищевую аллергию, скажем, на индейку, но шансов на это гораздо меньше. В гуманной медицине много хороших исследований о том, какие факторы являются предрасполагающими к развитию пищевой аллергии у людей. Например, доказана роль дисбактериоза и сопутствующих воспалительных заболеваний кишечника. У собак таких исследований практически нет, однако ясно, что переболевшие парвовирусным гастроэнтеритом собаки, более подвержены развитию пищевой аллергии в дальнейшем. Итак, на какие же продукты наиболее часто развивается пищевая аллергия у собак? (данные исследований за 2019 год):
- Говядина
- Молочные (даже кисломолочные) продукты
- Курица
- Пшеничный (реже других злаков) глютен
Наиболее частые симптомы
Обсудим же наиболее частые клинические признаки (симптомы) пищевой аллергии у собак.
Как правило, это молодые собаки (до года) или собаки среднего и старшего возраста (6 лет и старше). Были выявлены даже предрасположенные породы: немецкие овчарки, вест-хайленд-уайт-терьеры, боксеры, родезийские риджбеки, мопсы. Как проявляется пищевая аллергия у собак? Заболевание может иметь как кожные поражения, так и расстройства в работе желудочно-кишечного тракта (хроническая рвота и диарея). Основные и наиболее заметные острые кожные симптомы пищевой аллергии у собак представлены на фото.
В начале они включают в себя зуд и самотравмирование (расчесы), далее на воспаленной и травмированной коже поселяются бактерии, которые могут вызывать более серьезные проблемы, например, гнойное воспаление различной степени выраженности (от поверхностных «прыщиков» до глубоких фурункулов), и конечно же воспаление ушей (отит). К слову, отит, в том числе протекающий давно, может быть симптомом пищевой аллергии, даже если в остальном собака чувствует себя хорошо.
Рис. 1 и 2. Острая и хроническая пищевая аллергия у собак
Если болезнь развивается долго, то можно наблюдать утолщение кожи, особенно в области подмышек, паху и под хвостом, воспаление кожи межу пальцами, выраженное гнойное воспаление кожи и ушей, снижение веса. Как выглядят симптомы хронической пищевой аллергии можно увидеть на фото.
Рис 3,4,5. Проявления пищевой аллергии у собак: малассезиозный дерматит, микробный отит, бактериальный фолликулит.
Что делать, если вы заподозрили, что у вашей собаки пищевая аллергия?
Конечно, в первую очередь, необходимо обратиться к ветеринарному врачу-дерматологу. Но, если по какой-то причине прямо сейчас это невозможно сделать, то мы обсудим основные аспекты лечения и диагностики пищевой аллергии у собак. Первоочередная задача – избавить собаку от зуда, который может индивидуально проявляться в довольно разной степени. Часто владелец сталкивается с такой сильной пищевой аллергией у собаки, что та не может спать по ночам и постоянно чешется. В таком случае необходим доступный и быстродействующий препарат, снимающий зуд, также очень важно, чтобы он хорошо переносился организмом собаки. Всем этим требованиям отвечает Апоквел® — оригинальный препарат, направленно действующий на механизмы развития зуда. Апоквел быстро (в течение нескольких часов) устраняет неприятные ощущения, связанные с зудом, краснотой, расчесами и отеками. Препарат рекомендован для длительного приема, в первые 2 недели важно давать его собаке 2 раза в сутки, затем переходить на прием 1 раз в сутки. Удобная таблица для расчета дозировки на вес собаки включена в инструкцию. Терапевтический эффект препарата в борьбе с зудом подтвержден многолетним опытом использования отечественными и зарубежными ветеринарными врачами, о его применении в лечении аллергических дерматитов у собак написано несколько сотен статей. Препарат не вызывает привыкания и «синдрома отмены», а также разрешен к применению с другими системными препаратами, например, таблетками от гельминтов, блох и клещей (не вызывает снижения их эффективности). Важно, однако, помнить, что самостоятельно не следует применять Апоквел собакам до года, массой тела менее 3х кг, лактирующим, беременным самкам, собакам в период вязки и имеющим опухолевые заболевания. Перед применением любого препарата рекомендована консультация с вашим ветеринарным врачом. Кроме того, при наличии симптомов кроме зуда: пододерматиты, бактериальные заболевания кожи, отиты, рекомендована дополнительная диагностика и терапия. В этом случае лекарства для лечения пищевой аллергии будут включать в себя антибактериальные шампуни, ушные капли, жирные кислоты, а возможно и системные антибиотики. Стоит напомнить, что самостоятельное назначение антибиотиков в любом виде (капли в уши, мази, таблетки, уколы) настоятельно не рекомендовано и может привести к ухудшению или искажению ситуации, а также вызвать нежелательные эффекты (рвота, диарея, лекарственные реакции, бактериальную устойчивость).
Кроме снятия зуда и воспаления в случае с пищевой аллергией важно понимать какой же продукт ее вызывает. Для того, чтобы выяснить это, необходимо прибегнуть к «золотому стандарту диагностики», а именно – исключающей диете. К сожалению, тестирование крови на пищевые аллергены у животных не нашло практического использования и не рекомендовано ведущими ветеринарными аллергологами в качестве диагностической методики. Для корректно проведенной диеты следует использовать корм с новым источником белка, поэтому просто сменить рацион на линейку «для чувствительной кожи» недостаточно. Идеальным вариантом будет являться назначение диеты ветеринарным врачом исходя из анамнеза кормления, ведь очень важно не назначать источники белка, которые собака ела менее 4х месяцев назад, а также важно учесть одну очень интересную особенность – перекрестную реакцию белков. Этот феномен был описан сравнительно недавно и касается мяса близкородственных видов животных. Например, если ваша собака проявляет симптомы пищевой аллергии предположительно к говядине, то назначение в качестве исключающей диеты мяса ягненка, буйвола, козы, оленя или лося будет неверным, так как эти животные близки генетически и реакция иммунной системы на их мясо также наиболее вероятна. Выбирайте для диеты мясо абсолютно других видов животных, к примеру, если собака долгое время ела курицу, то лучше выбрать свинину или рыбу в качестве диеты. Также немаловажную роль играет источник углеводов – лучше не выбирать корма, содержащие глютен, остановиться на овощах в качестве гарнира. Вы можете использовать промышленные монобелковые корма с выбранными ингредиентами, либо сбалансировать натуральный рацион своей собаке при помощи ветеринарного врача, обладающего знаниями диетологии. Хорошим планом будет использование гидролизованных диет. Их смысл состоит в том, что молекулы белка в их составе разбита на маленькие кусочки, молекулярная масса которых просто не позволит развиваться процессу аллергии, также, обычно, в составе таких диет используют непривычные нашим собакам белки (соя, перо), но это не должно пугать вас, потому что рецептура промышленного корма всегда сбалансирована по витаминам, макро- и микроэлементам.
Итак, для диагностики, а, следовательно, и для лечения пищевой аллергии у собак, можно использовать три варианта рационов:
- Монобелковый промышленный рацион (желательно без злаков)
- Монобелковый приготовленный дома рацион (гарнир – овощи) после консультации с диетологом
- Гидролизованный промышленный рацион
Диетологи советуют переходить на новые корма постепенно, в течение 5 дней, во избежание негативных симптомов со стороны кишечника. Хотя, даже если они и возникают, то проходят без лечения в течение нескольких дней. Вопрос о длительности исключающей диеты стоял довольно остро некоторое время назад, сейчас мы рекомендуем в среднем 8 недель придерживаться нового рациона для того, чтобы оценить его эффективность. При переходе на диету собаке для лечения симптомов пищевой аллергии может быть назначен Апоквел на срок от 14 до 21 дня, прием препарата не повлияет на длительность диеты и не снизит ее диагностическое значение. Также в рацион можно добавить жирные кислоты в виде лососевого масла, которое продается в зоомагазинах, оно улучшит состояние кожи и дополнительно поможет снять воспаление.
Чтобы диагностика пищевой аллергии была максимально результативной, владельцу собаки важно учитывать некоторые аспекты, а именно:
- Понимать важность диагностики (ведь только так ветеринарный врач сможет поставить диагноз), действительно придерживаться строгой диеты
- Исключить все «неожиданные» поступления белков в рацион собаки (витамины, «вкусняшки», угощения, в том числе со стола, препараты со вкусами мяса)
- Поддерживать связь с вашим ветеринарным доктором, это оказывается очень важным, если что-то в диагностике идет не так, как вы предполагали
Диагноз «истинная пищевая аллергия» считается установленным, если произошло выраженное улучшение состояния здоровья во время кормления исключающей диетой, а при провокации предыдущей едой ситуация вновь ухудшилась. Проводить провокацию очень важно, так как симптомы пищевой аллергии ровно такие же, как, например, сезонной. При отсутствии ухудшений в течение в среднем 14 дней после возвращения на привычную еду, диагноз «истинная пищевая аллергия» считают исключенным. Конечно, возможно частичное улучшение во время использования диеты, то есть симптомы пищевой аллергии исчезли, но не до конца. В этом случае, вероятно, ваша собака страдает ещё и сопутствующей аллергией, например, атопическим дерматитом или гиперчувствительностью к слюне блохи. В этом случае, как и в случае невозможности проведения исключающей диеты (иногда собаки отказываются есть новый корм, личные обстоятельства владельца могут не позволять провести диагностику), может обсуждаться вопрос о том, чем же длительно лечить пищевую аллергию у такой собаки без вреда для организма. Есть множество препаратов для долгосрочного контроля зуда в форме таблеток, капсул, спреев. Какой именно препарат назначить именно вашей собаке, решит доктор, исходя из её индивидуальных особенностей. В большинстве случаев препаратом выбора будет Апоквел, так как он хорошо контролирует симптомы аллергии, разрешён для длительного применения и хорошо переносится организмом собаки.
Заключение
В заключении хочется отметить, что истинная пищевая аллергия давно не является редким диагнозом у животных (она диагностируется у четверти собак с кожным зудом). Этот диагноз часто пугает владельцев, хотя для его контроля достаточно просто придерживаться рекомендованного питания. Диагностика и лечение пищевой аллергии у собак несколько сложнее простой смены корма, для консультации рекомендовано всегда обращаться к ветеринарному врачу.
Автор: Куприянова Лидия, к.в.н. член ESVD, руководитель отделения терапии СВК «Астин», ветеринарный врач дерматолог, эндокринолог.
Ингибирует синтез клеточной стенки | |||
Пенициллины | |||
| Класс / механизм | Наркотики | Показания (** Препарат выбора) | Токсичность |
| Пенициллин | Пенициллин G Водный пенициллин G Прокаин пенициллин G Бензатин пенициллин G Пенициллин V | Strep.pyogenes (Grp.A) ** | Реакция гиперчувствительности Гемолитическая анемия |
| Аминопенициллины | Ампициллин Амоксициллин | Выше + | Выше |
| Пенициллины, устойчивые к пенициллиназе | Метициллин Нафциллин Оксациллин Клоксациллин Диклоксациллин | Выше + ПЦНКаза-продуцент Staph.золотистый | Выше + Интерстициальный нефрит |
| Антипсевдомонадные пенициллины | Карбенициллин Тикарциллин Пиперациллин | Выше + Pseudomonas aeruginosa ** | Выше |
Цефалоспорины | |||
| 1-е поколение | Цефазолин Цефалексин | Staph.aureus ** Staph. epidermidis ** Некоторые грамотрицательные бактерии: E. Coli Klebsiella | Аллергическая реакция Анемия Кумбса (3%) |
| 2-е поколение | Цефокситин Цефаклор Цефуроксим | Выше + ↑ Грамотрицательные | Аллергическая реакция ЕТОН Дисульфирамовая реакция |
| 3-е поколение | Цефтриаксон Цефотаксим Цефтазидим Цефепим (4-го поколения) | Выше + ↑ Грамотрицательные Псевдомонады | Аллергическая реакция ЕТОН Дисульфирамовая реакция |
Другие ингибиторы клеточной стенки | |||
| Ванкомицин (бактерицидный: нарушает перекрестное связывание пептиогликанов) | Ванкомицин | MRSA ** | Синдром Красного человека Нефротоксичность Ототоксичность |
| Ингибиторы бета-лактамаз (бактерицидные: блокирование перекрестного связывания) | Клавулановая кислота Сульбактам Тазобактам | S aureus ** | Реакция гиперчувствительности Гемолитическая анемия |
| Карбапенемы | Имипенем (+ циластатин) Меропенем Дорипенем Эртапенем | Самая широкая активность любого антибиотика (кроме MRSA, Mycoplasma) | |
| Aztreonam | Азтреонам | Грамотрицательные палочки Аэробы Внутрибольничные инфекции | |
| Полимиксины | Полимиксин B Полимиксин E | Актуальные грамотрицательные инфекции | |
| Бацитрацин | Бацитрацин | Местные грамположительные инфекции | |
Ингибирование синтеза белка | |||
Рибосомная субъединица Anti-30S | |||
| Аминогликозиды (бактерицидный: необратимое связывание с 30S) | Гентамицин Неомицин Амикацин Тобрамицин Стрептомицин | Аэробные грамотрицательные препараты Enterobacteriaceae Pseudomonas | Нефротоксичность Ототоксичность |
| Тетрациклины (бактериостатические: блокирует тРНК) | Тетрациклин Доксициклин Миноциклин Демеклоциклин | Риккетсии | Гепатотоксичность Изменение цвета зубов Нарушение роста Не применять детям младше 12 лет |
Рибосомная субъединица Anti-50S | |||
| Макролиды (бактериостатические: обратимо связывает 50S) | Эритромицин Азитромицин Кларитромицин | Стрептококк H.influenzae Mycoplamsa pneumonia | Взаимодействие кумадина (цитохром P450) |
| Хлорамфеникол (бактериостатический) | Хлорамфеникол | H influenzae Бактериальный менингит Абсцессы головного мозга | Апластическая анемия Синдром серого ребенка |
| Линкозамид (бактериостатический: ингибирует пептидилтрансферазу, вмешиваясь в комплекс аминоацил-тРНК) | Клиндамицин | Bacteroides fragilis | Псевдомембранозный колит |
| Линезолид (переменная) | Линезолид | Грамположительные резистентные | |
| Стрептограмины | Квинупристин Дальфопристин | VRE ГАЗ и S.кожные инфекции aureus | |
Ингибиторы синтеза ДНК | |||
Фторхинолоны | |||
| 1-е поколение | налидиксовая кислота | Steptococcus Mycoplasma Аэробный грамм + | Фототоксичность |
| 2-е поколение | Ципрофлоксацин Норфлоксацин Эноксацин Офлоксацин Левофлоксацин | Как и выше + Pseudomonas | см. Выше |
| 3-е поколение | Гатифлоксацин | То же + грамположительные | см. Выше |
| 4-го поколения | Моксифлоксацин Гемифлоксацин | То же + грамположительные + анаэробы | см. Выше |
| Другие ингибиторы ДНК | |||
| Метронидазол (бактерицидный: биопродукты метаболизма разрушают ДНК) | Метронидазол (Флагил) | Анаэробика | Изъятия Кребелар дисфункция ЕТОН дисульфрамовая реакция |
Ингибиторы синтеза РНК | |||
| Рифампицин (бактерицидный: ингибирует транскрипцию РНК путем ингибирования РНК-полимеразы) | Рифампицин | Staphylococcus Mycobacterium (TB) | Изменение цвета жидкости организма Гепатоксичность (с INH) |
Ингибиторы синтеза миколиновых кислот | |||
| Изониазид | Isoniazidz | ТБ Скрытая ТБ | |
Синтез фолиевой кислоты Ингибиторы | |||
| Триметоприм / сульфаниламиды (бактериостатическое действие: ингибирование с помощью ПАБК) | Триметоприм / сульфаметоксазол (SMX) Сульфизоксазол Сульфадиазин | Микроорганизмы ИМП Proteus Enterobacter | Тромбоцитопения |
| Пириметамин | Пириметамин | Малярия T.gondii | |
Таблица классификации антибиотиков
Ингибиторы синтеза белка
Основные группы: аминогликозиды, тетрациклины, макролиды
Общий механизм действия: Антибиотики, ингибирующие синтез белка, в первую очередь нацелены на бактериальную рибосому (70S), которая состоит из небольшой 30S-субъединицы и большой 50S-субъединицы. Рибосома — это важная сложная молекула, состоящая из белков и РНК, которая отвечает за синтез белков.Аминогликозиды, макролиды и другие ингибиторы синтеза белка нацелены и предотвращают определенные стадии синтеза белка в определенных местах на 70S рибосомах. Гибель бактерий происходит из-за того, что клетка не может производить белки, необходимые для жизненно важных клеточных процессов.
Воздействие на людей — Люди и другие эукариотические клетки синтезируют белки с использованием рибосомы 80S (не 70S), на которую не действуют эти ингибиторы. (возможны другие побочные эффекты)
Щелкните любой продукт ниже для получения дополнительной информации.
Ингибиторы синтеза белка
Подблок 30S
Подблок 50S
EF-G
Аминогликозиды
(ингибиторы инициации)
Тетрациклиновые антибиотики
(связывание рРНК)
Пептидил
трансфераза
MLS
(транспептидация
/ транслокация)
Стероидные антибактериальные препараты
-мицин
( Streptomyces )
-мицин
( Micromonospora )
Тетрациклины
Глицилциклины
Амфениколы
Плевромутилин
Макролиды
Линкозамиды
Фузидиевая кислота
Ингибиторы синтеза нуклеиновых кислот
Основные группы: Антифолаты, ингибиторы топоизомеразы (флорхинолоны)
Общий механизм действия : Эти антибиотики нацелены на различные стадии и пути синтеза нуклеиновых кислот (ДНК, РНК…).Таким образом, антифолатов (включая сульфаниламиды) ингибируют ферменты, участвующие в синтезе фолиевой кислоты / фолиевой кислоты (витамина B9). Фолат является важным ингредиентом для синтеза пиримидина и пуринов, двух молекул, содержащихся в нуклеотидах, строительных блоках ДНК и других нуклеиновых кислотах. Ингибиторы топоизомеразы предотвращают репликацию ДНК, ингибируя активность топоизомеразы. Топозиомеразы — это ферменты, которые снимают стресс суперспирали ДНК во время репликации ДНК. Ингибируя активность топоизомеразы, значительно затрудняется репликация ДНК и снижается скорость деления клеток.
Воздействие на людей — Люди получают фолиевую кислоту из пищевых источников, у них нет пути синтеза фолиевой кислоты и на них не действуют антифолаты, как на бактерии. Топоизомеразы можно найти в клетках человека; однако молекулярный состав топоизомераз человека отличается от такового у бактерий. (возможны другие побочные эффекты)
Щелкните любой продукт ниже для получения дополнительной информации.
Антифолаты
Ингибиторы топоизомеразы и хинолоны
Ингибитор DHFR
Сульфаниламиды
(ингибитор DHPS)
1 поколение
Фторхинолоны
Короткого действия
Средний
длительного действия
2-е поколение
3-е поколение
4-е поколение
Связанные (DG)
Анаэробные ингибиторы ДНК
Синтез РНК
Производные нитроимидазола
Производные нитрофурана
Рифамицины / РНК-полимераза
Ингибиторы синтеза клеточной стенки
Основные группы: Бета-лактамы (цефалоспорины, пенициллины)
Общий механизм действия: Как следует из названия, эта группа антибиотиков подавляет определенные стадии синтеза клеточной стенки бактерий.Основным структурным компонентом стенки бактериальной клетки (особенно у грамположительных бактерий) является важный полимер, называемый пептидогликаном. Бета-лактамные антибиотики связываются с PBP или пенициллин-связывающими белками, которые участвуют в заключительных стадиях синтеза пептидогликана. Подавляя функцию PBP, пептидогликан не может быть синтезирован должным образом, и клетки лизируются.
Воздействие на человека — Человеческие клетки не используют и не синтезируют пептидогликан и поэтому не чувствительны к бета-лактамным антибиотикам.(возможны другие побочные эффекты)
Щелкните любой продукт ниже для получения дополнительной информации.
Антибактериальные средства: антибиотики клеточной оболочки
Внутриклеточное
Гликопептид
B-лактамы / (ингибируют сшивки PBP)
Пенициллины
(пенамы)
Бета-лактамаза чувствительная
Устойчивость к β-лактамазам
Пенемс
Карбапенемы
Цефалоспорины /
Цефамицины
(цефемы)
Монобактамы
Ингибиторы β-лактамаз
Комбинации
1-й
2-я
3-я
4-я
Ветеринарная
Какой антибиотик лучше всего подходит для лечения ангины?
Пенициллин или амоксициллин считаются лучшими препаратами первой линии для лечения стрептококковой инфекции горла.Согласно CDC (Центры по контролю и профилактике заболеваний) « Никогда не было сообщений о клиническом изоляте стрептококка группы А, устойчивом к пенициллину ».
Людям с аллергией на пенициллин следует лечить стрептококковую инфекцию горла цефалоспорином узкого спектра действия (например, цефалексином или цефадроксилом), клиндамицином, азитромицином или кларитромицином. Обратите внимание, что сообщалось о резистентности к азитромицину и кларитромицину.
Какие рекомендуемые дозы антибиотиков используются для лечения стрептококковой инфекции горла?
Дозировки антибиотика могут варьироваться в зависимости от возраста и веса.CDC рекомендует следующие дозы антибиотиков от стрептококковой инфекции горла для людей без аллергии на пенициллин. Следует выбрать один режим дозирования, подходящий для человека, которого лечат.
Пенициллин V для перорального применения
- Дети: 250 мг два раза в день или 250 мг три раза в день в течение 10 дней
- Подростки и взрослые: 250 мг четыре раза в день или 500 мг два раза в день в течение 10 дней
Амоксициллин пероральный
- Дети и взрослые: 50 мг / кг один раз в день (максимум 1000 мг один раз в день) в течение 10 дней
- Дети и взрослые: 25 мг / кг два раза в день (максимум 500 мг два раза в день) в течение 10 дней
Бензатин пенициллин G для внутримышечного введения
- Дети <27 кг: 600000 единиц в виде однократной дозы
- Дети и взрослые ≥27 кг: 1 200 000 единиц в виде однократной дозы
CDC рекомендует следующие дозы антибиотиков от стрептококковой инфекции горла для людей с аллергией на пенициллин.Следует выбрать один режим дозирования, подходящий для человека, которого лечат.
- Пероральный цефалексин 20 мг / кг два раза в день (максимум 500 мг два раза в день) в течение 10 дней
- Цефадроксил перорально 30 мг / кг один раз в сутки (максимум 100 мг один раз в сутки) в течение 10 дней
- Клиндамицин перорально 7 мг / кг три раза в день (максимум 300 мг три раза в день) в течение 10 дней
- Азитромицин перорально 12 мг / кг один раз в день в первый день (максимум 500 мг), затем 6 мг / кг один раз в день (максимум 250 мг один раз в день) в течение следующих 4 дней
- Кларитромицин пероральный 7.5 мг / кг два раза в день (максимум 250 мг два раза в день) в течение 10 дней.
Всегда ли необходимы антибиотики для лечения стрептококковой инфекции горла?
Хотя большинство стрептококковых инфекций в горле проходят сами по себе, существует риск возникновения острой ревматической лихорадки и других осложнений (таких как абсцессы полости рта или мастоидит [бактериальная инфекция сосцевидного отростка, выступающей за ухом]). CDC рекомендует всем пациентам, независимо от возраста, у которых есть положительный результат экспресс-теста на обнаружение антигена (RADT) (также известного как экспресс-тест на стрептококк, который обнаруживает наличие углеводов клеточной стенки GABHS из мазка) или посева из горла, получали антибиотики.
Антибиотики были показаны:
- Сократить продолжительность симптомов стрептококковой инфекции горла
- Снизить вероятность передачи инфекции членам семьи, друзьям и другим близким контактам
- Предотвратить развитие ревматической лихорадки и других осложнений.
Вирусные ангины не следует лечить антибиотиками. Лечение обычно длится десять дней, и детям, которые не могут глотать таблетки или капсулы, можно назначать жидкие антибиотики.Некоторым пациентам может быть полезна однократная внутримышечная инъекция пенициллина.
Каковы симптомы стрептококковой ангины?
Как правило, стрептококковая ангина бывает очень болезненной, а симптомы сохраняются намного дольше, чем ангина по другой причине. Глотание может быть особенно трудным и болезненным. Симптомы ангины могут включать:
- Внезапное начало боли в горле
- Очень красные и опухшие миндалины и задняя часть глотки
- Иногда на нёбе могут появляться полосы гноя или красные пятна
- Головная боль
- Лихорадка и озноб
- Опухшие и болезненные железы (лимфатические узлы) на шее.
Дети чаще чувствуют тошноту и рвоту.
У людей со стрептококковой ангиой обычно НЕ бывает кашля, насморка, охриплости голоса, язв во рту или конъюнктивита. Если возникают эти симптомы, более вероятно, что причина боли в горле — вирусная.
Некоторые люди (обычно дети в возрасте от 4 до 8 лет) восприимчивы к токсинам (ядам), вырабатываемым бактериями S. pyrogenes, и у них появляется ярко-красная сыпь, которая на ощупь напоминает наждачную бумагу.Сыпь, вызванная бактериями S. pyrogenes, известна как скарлатина (также называемая скарлатиной). Хотя обычно это происходит после ангины, она также может возникнуть после язв в школе (импетиго).
Как диагностируется стрептококковая ангина?
Мазок из горла, взятый врачом, а затем посев в лаборатории, — единственный способ окончательно определить, является ли боль в горле стрептококковой инфекцией в горле. Если результат положительный, ваш врач назначит антибиотики, чтобы предотвратить любые осложнения, уменьшить симптомы и предотвратить распространение среди других людей.
Стрептококковая ангина заразна?
Да, стрептококковая инфекция в горле заразна, и бактерии легко передаются и распространяются при кашле или чихании или после контакта с инфицированными каплями, а затем при прикосновении ко рту, носу или глазам. Передача бактерий также может происходить при контакте с людьми, больными скарлатиной или другими кожными инфекциями группы А.
Без лечения люди с стрептококковой инфекцией горла могут передавать бактерии другим в течение одной-двух недель после появления симптомов.Лучший способ предотвратить заражение — часто и всегда мыть руки перед едой или после контакта с инфицированным человеком. Не делитесь посудой, постельным бельем или личными вещами. Людям с стрептококковой инфекцией горла или скарлатиной следует оставаться дома не менее 24 часов после начала приема антибиотиков или до тех пор, пока они не почувствуют себя достаточно хорошо, чтобы вернуться в школу или на работу.
Что такое скарлатина?
Скарлатина — это название ярко-красной сыпи, которая появляется после стрептококковой инфекции горла, хотя она также может развиться после школьных язв (импетиго).
Скарлатина из-за использования антибиотиков встречается реже, чем сто лет назад, и встречается только у тех, кто чувствителен к токсинам, вырабатываемым стрептококковыми бактериями. Чаще всего встречается у детей в возрасте от 4 до 8 лет. К 10 годам более 80% детей вырабатывают пожизненные защитные антитела против стрептококковых токсинов, в то время как младенцы младше 2 лет все еще имеют антитела против токсина, полученные от матери. Это означает, что если у двух детей в одной семье развивается стрептококковая ангина, только у одного может развиться скарлатина.
Скарлатина — ярко-красная сыпь, на ощупь напоминающая наждачную бумагу. Сыпь обычно начинается на шее, подмышках или паху в виде небольших плоских красных пятен, которые постепенно превращаются в мелкие неровности и кажутся грубыми на ощупь. В складках тела (например, в подмышечных впадинах, локтях и паху) сыпь может иметь более ярко-красный цвет (так называемые линии Пастии). Покраснение лица является обычным явлением, хотя вокруг рта может оставаться бледная область. Через семь дней сыпь исчезает, и в течение следующего месяца или дольше может появиться некоторое шелушение кожи, особенно в области кончиков пальцев рук, ног и в области паха.
При отсутствии лечения скарлатина может прогрессировать до:
- Инфекции уха, носовых пазух и кожи
- Воспаление суставов
- Ревматическая лихорадка (воспалительное заболевание, которое может вызвать необратимое повреждение сердца, а также поражает мозг, суставы и кожу)
- Средний отит
- Пневмония
- Септицемия
- Гломерулонефрит
- Остеомиелит.
В доантибиотическую эпоху смерть наступала у 15-20% людей с скарлатиной.В настоящее время большинство людей полностью выздоравливают в течение четырех-пяти дней после приема антибиотиков.
Что такое ревматическая лихорадка?
Ревматическая лихорадка может развиться после инфекции горла или скарлатины. Хотя это заболевание встречается редко в континентальной части США, оно все еще распространено среди детей самоанского происхождения, проживающих на Гавайях, и жителей Американского Самоа.
Симптомы ревматической лихорадки обычно проявляются через 14–28 дней после стрептококковой инфекции. Поскольку бактерии заставляют иммунную систему организма атаковать здоровые ткани, болезнь может поражать сердце, суставы, кожу и мозг.
Симптомы ревматической лихорадки включают:
- Лихорадка
- Боль в животе
- Боль в груди или одышка
- Совместное опухание, боль, покраснение или тепло
- Носовое кровотечение
- Сыпь на верхней части рук или ног (обычно кольцеобразная или змеевидная)
- Узелки или шишки на коже
- Необычный плач или смех или быстрые отрывистые движения лица, рук или ног.
Ревматическая лихорадка может вызвать пожизненные проблемы с сердцем, если не лечить быстро и должным образом.Антибиотики эффективны для предотвращения заболевания, если их вводить в течение девяти дней после появления симптомов. Детям, у которых развивается ревматическая лихорадка, могут потребоваться регулярные инъекции пенициллина до 21 года или в течение 10 лет после постановки диагноза.
Устойчивость к антибиотикам: список 10 лучших
Медицинское заключение проведено Leigh Ann Anderson, PharmD. Последнее обновление: 29 июля 2019 г.
Вступление | FAQs | Таблицы резистентных бактерий и варианты лечения | Недавно одобренные антибиотики
Что такое устойчивость к антибиотикам?
Устойчивость к антибиотикам представляет собой серьезную угрозу для здоровья населения мира, и Центры США по контролю и профилактике заболеваний (CDC) считают это одной из своих главных проблем.Устойчивость к антибиотикам — это способность бактерий противостоять антимикробным свойствам антибиотиков. Другими словами, антибиотик, который ранее вылечил инфекцию, больше не работает или может вообще не работать, чтобы убить бактерии.
Уровень устойчивости к антибиотикам продолжает расти из-за чрезмерного использования антибиотиков, а разработка новых противомикробных препаратов идет медленно. Инфекции устойчивыми к лекарствам бактериями могут привести к более длительному и более дорогостоящему стационарному лечению и повысить риск смерти от инфекции.Сообщается об опасных, устойчивых бактериях, известных как «супербактерии».
Ежегодно 2 миллиона человек заболевают инфекцией, устойчивой к антибиотикам, и около 23 000 человек умирают. Ежегодные затраты на борьбу с устойчивыми бактериальными инфекциями в США оцениваются в пределах от 21 до 34 миллиардов долларов.
Часто задаваемые вопросы об устойчивости к антибиотикам включают:
Как бактерии становятся устойчивыми к антибиотикам?
Бактерии становятся устойчивыми к антибиотикам за счет адаптации своей структуры или функций в качестве защитного механизма.Антибиотик мог действовать эффективно до появления резистентности; однако это изменение помогает бактериям отражать убивающую активность антибиотика.
Эта адаптация может происходить несколькими способами. Бактерии банка:
- нейтрализует антибиотик до того, как он окажет «убивающий» эффект
- откачать антибиотик из клеток
- изменить место (или рецептор), где обычно действует антибиотик
- разделяет генетический материал с другими бактериями, что также делает их устойчивыми.
Выжившие устойчивые бактерии способны размножаться, распространяться и вызывать дальнейшие инфекции в отдельном человеке, семье, сообществе или в медицинских учреждениях. В свою очередь, эти инфекции более устойчивы к еще одному приему того же или подобного антибиотика.
Центры по контролю и профилактике заболеваний (CDC) опубликовали список 18 основных лекарственно-устойчивых угроз для США. Уровни опасности сгруппированы как срочные, серьезные и вызывающие беспокойство. К серьезным угрозам для здоровья человека относятся: Clostridium difficile , устойчивые к карбапенемам Enterobacteriaceae и лекарственно-устойчивые Neisseria gonorrhoeae .
Списки обычных бактерий с высокой устойчивостью к антибиотикам
Чтобы лучше понять устойчивость к антибиотикам, в следующих таблицах перечислены распространенные бактерии, которые приобрели высокую устойчивость, связанные с ними антибиотики с пониженной активностью и антибиотики, которые могут быть подходящими для лечения этих устойчивых бактерий.
Окончательный выбор схемы лечения лекарственно-устойчивыми бактериями антибиотиками всегда должен быть адаптирован для пациента в соответствии с результатами теста на чувствительность к противомикробным препаратам и опытом медицинского работника.Выбор лечения зависит от:
- тип и тяжесть заражения
- местные образцы лекарственной чувствительности
- Факторы, специфичные для пациента, такие как возраст, функция почек и печени
- лекарственная аллергия
- предыдущие процедуры
- проблем стоимости.
1. Метициллин-устойчивый
Staphylococcus aureus (MRSA)| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Метициллин-устойчивый Staphylococcus aureus «стафилококк» (MRSA) | Инфекции могут варьироваться от инфекций кожи и мягких тканей (целлюлит, абсцесс) до инфекций мочевыводящих путей, остеомиелита (кость), эндокардита (сердца), пневмонии (легких) и менингита (инфекция головного мозга). Может потребоваться разрез / дренаж или обработка раны. | MRSA стал устойчивым к обычным антибиотикам, таким как бета-лактамы, включая метициллин, амоксициллин, пенициллин, нафциллин, оксациллин и цефалоспорины. MRSA распространяется контактным путем. MRSA обычно поражает кожу, например, места хирургического вмешательства. MRSA также может вызывать инфекции легких или крови. Вспышки инфекции могут быть получены в сообществе (CA-MRSA) или в медицинских учреждениях, таких как дома престарелых, диализные центры или больницы (MRSA). CDC перечисляет MRSA как «серьезную» угрозу. | Антибиотики для лечения MRSA в домашних условиях (т. Е. Местной инфекции мягких тканей) могут включать 7-10-дневный курс перорального антибиотика, например: Пациентам с более сложными инфекциями могут потребоваться внутривенные антибиотики для лечения MRSA в больнице, такие как ванкомицин, линезолид или даптомицин. |
2. Ванкомицин-устойчивый
Staphylococcus aureus (VRSA)| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
Ванкомицин-промежуточный и устойчивый к ванкомицину Staphylococ cus aureus (VRSA и VISA) Контрольные точки MIC:
| Инфекции могут варьироваться от инфекций кожи и мягких тканей, инфекций мочевыводящих путей, пневмонии (легких) и менингита (инфекции головного мозга). | VRSA устойчив к антибиотику ванкомицину, антибиотику, используемому для лечения серьезных инфекций, включая MRSA. CDC перечисляет VRSA как «опасную» угрозу. | Оптимальные схемы лечения VRSA не определены. Возможные варианты: |
3. Лекарственная устойчивость
Streptococcus pneumoniae| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Лекарственно-устойчивый Streptococcus pneumoniae | С.pneumoniae вызывает пневмококковое заболевание. Типы инфекции могут включать инфекции уха и носовых пазух, внебольничные пневмонии (ВП), легочные инфекции, менингит и инфекции кровотока. | Лекарственная устойчивость к Streptococcus pneumoniae зависит от района, в котором вы живете. Когда эти бактерии устойчивы к пенициллину, они часто устойчивы ко многим другим классам антибиотиков. Сопротивление в США относительно высокое. CDC относит устойчивые к лекарствам S. pneumoniae как «опасные» угрозы. |
4. Ванкомицин-устойчивый
Энтерококк (VRE)| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Ванкомицин-устойчивый Энтерококк (VRE) | Энтероккокки — это бактерии, которые обычно присутствуют в организме человека, например в кишечнике и женских половых путях. ИнфекцииVRE устойчивы к антибиотику ванкомицину и часто возникают в больницах. ИнфекцияVRE может легко передаваться от человека к человеку. Типы инфекции могут включать менингит, инфекции мочевыводящих путей, инфекции кровотока, места хирургического вмешательства и инфекции, связанные с катетером. | Не всегда известен лучший режим лечения ВРЭ. Лабораторное тестирование VRE может определить, какие антибиотики работают лучше всего. CDC относит устойчивый к лекарствам VRE как «серьезную» угрозу. | Эти агенты использовались для VRE. Часто нужны комбинации. Другие агенты, которые могут использоваться для VRE, включают: |
5. Множественная лекарственная устойчивость
Pseudomonas aeruginosa| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Pseudomonas aeruginosa (штаммы с множественной лекарственной устойчивостью) | Тяжелые Pseudomonas инфекции могут возникать у людей с ослабленной иммунной системой или в больнице. Очаги инфекций могут возникать в кровотоке, легких (пневмония), коже и мягких тканях (ожоги), при осложненных ИМП и абдоминальных инфекциях, сердце, головном мозге, при катетеризации и в местах хирургического вмешательства. | Pseudomonas aeruginosa устойчив ко многим типам антибиотиков. Комбинированное лечение может потребоваться пациентам с более тяжелыми инфекциями. CDC перечисляет Pseudomonas aeruginosa с множественной лекарственной устойчивостью как «серьезную» угрозу. | |
6.
Clostridioides difficile| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Clostridioides difficile ( C. difficile или C.diff ) (ранее Clostridium difficile) | C. difficile вызывает опасную для жизни водянистую или кровянистую диарею и колит (воспаление толстой кишки), в первую очередь у пациентов, получивших как недавнюю медицинскую помощь, так и антибиотики. C. diff возникает, когда кто-то немытыми руками касается поверхностей и загрязняет их, или при передаче от пациента к пациенту в больнице. Пациенты должны быть изолированы в больнице, и дезинфицирующее средство для рук не убивает C.разн . | Те, кто принимает антибиотики, в 7-10 раз чаще получают C. diff во время приема лекарств или в течение месяца после него. Антибиотики часто назначают без необходимости. Исследования показали, что от 30% до 50% всех антибиотиков, назначаемых в больницах, либо не нужны, либо неправильны. CDC перечисляет инфекцию C. difficile как «неотложную» угрозу. | Как можно скорее прекратите прием антибиотика, вызывающего заболевание.Варианты лечения могут включать:
* В июне 2019 года FDA выпустило сообщение по безопасности, касающееся использования фекальной микробиоты для трансплантации (FMT) и риска серьезных или опасных для жизни инфекций из-за передачи организмов с множественной лекарственной устойчивостью (MDRO). |
7. Устойчивость к карбапенемам
Enterobacteriaceae (CRE)| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
Устойчивые к карбапенемам Enterobacteriaceae (CRE) включают:
| Может вызывать пневмонии (инфекции легких), инфекции кровотока, инфекции мочевыводящих путей (ИМП), инфекции верхних дыхательных путей, инфекции брюшной полости, фебрильную нейтропению, инфекции хирургических ран, менингит. | Enterobacteriaceae — нормальная, обычно безвредная часть бактерий нашего пищеварительного тракта, которая может стать устойчивой к классу антибиотиков, известных как карбапенемы. Карбапенемы представляют собой класс бета-лактамных антибиотиков с широким спектром действия, которые структурно связаны с пенициллинами. Примеры включают: меропенем, эртапенем и имипенем-циластатин (примаксин). Карбапенемы известны своей способностью ингибировать ферменты бета-лактамаз расширенного спектра и обычно используются при наиболее серьезных инфекциях или используются в качестве последнего средства лечения, когда другие антибиотики неэффективны. CDC перечисляет CRE как «неотложную» угрозу; наивысший уровень беспокойства. | Выбор лечения инфекций, вызванных устойчивостью к карбапенемам Enterobacteriaceae , должен производиться в индивидуальном порядке специалистом-инфекционистом. Агенты, одобренные FDA для этих типов инфекций, включают: |
8. Множественная лекарственная устойчивость
Mycobacterium tuberculosis (МЛУ-ТБ)| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| ТБ с множественной лекарственной устойчивостью Mycobacterium tuberculosis (МЛУ-ТБ) или ТБ с широкой лекарственной устойчивостью (ШЛУ-ТБ) | Туберкулез (ТБ) — инфекционное заболевание, вызываемое бактериями Mycobacterium tuberculosis . ТБ с множественной лекарственной устойчивостью (МЛУ-ТБ) приводит к туберкулезу (бактериальной инфекции легких), который устойчив к различным антибиотикам, включая как изониазид (INH), так и рифампицин, которые часто используются в качестве агентов первой линии. ТБ с широкой лекарственной устойчивостью (ШЛУ-ТБ) — это редкий тип МЛУ-ТБ с устойчивостью к изониазиду и рифампицину, а также к любому фторхинолону и по крайней мере к одному из трех инъекционных препаратов второго ряда (например, амикацину, канамицину или капреомицину). согласно CDC. | Выберите лечение на основе консультации со специалистом по инфекционным заболеваниям, имеющим опыт лечения МЛУ-ТБ. Лечение зависит от результатов тестирования лекарственной чувствительности, предшествующего употребления наркотиков, доступности лекарств, стоимости и других факторов, специфичных для пациента. В зависимости от восприимчивости используйте не менее четырех активных агентов против МЛУ-ТБ; Предлагаются более короткие или более длительные схемы в зависимости от факторов риска. Для лечения МЛУ-ТБ можно выбрать укороченные стандартные схемы или более длительные схемы лечения для конкретного пациента (см. Рекомендации ВОЗ от 2019 г.). CDC относит лекарственно-устойчивый ТБ к «серьезной» угрозе. | Выбранные препараты используются в комбинированных схемах лечения МЛУ-ТБ в течение различной продолжительности. Например, для лечения МЛУ-ТБ может использоваться комбинация лекарств (в соответствии с рекомендациями ВОЗ): |
9. Множественная лекарственная устойчивость
Acinetobacter| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Множественная лекарственная устойчивость Acinetobacter | Люди с ослабленной иммунной системой (с ослабленным иммунитетом), в том числе госпитализированные пациенты, более подвержены риску заражения инфекцией Acinetobacter , которая может быть устойчивой ко многим обычно назначаемым антибиотикам.Acinetobacter представляет небольшой риск для здоровых людей со здоровой иммунной системой. Acinetobacter часто устойчив ко многим обычно назначаемым антибиотикам. Типы инфекций, вызываемых Acinetobacter , могут включать: пневмонию (обычно связанную с ИВЛ), ИМП, сепсис, инфекции, связанные с катетером, инфекции травматических ран. | Acinetobacter может передаваться при прямом контакте и может быть обнаружен на коже, в пище, воде или почве.Он может передаваться из больниц и отделений интенсивной терапии (ОИТ). Acinetobacter baumannii очень заразен, и на его долю приходится около 80% случаев заражения Acinetobacter . CDC перечисляет Acinetobacter с множественной лекарственной устойчивостью как «серьезную» угрозу. | Устойчивость к лечению обычна для Acinetobacter ; может возникнуть резистентность к начальным препаратам, таким как бета-лактамы и карбапенемы. Дозирование следует подбирать индивидуально, принимая во внимание локализованный характер резистентности и тесты на чувствительность к противомикробным препаратам. Решения о лечении должны приниматься совместно со специалистом по инфекционным заболеваниям, имеющим опыт лечения лекарственно-устойчивого Acinetobacter . Опции могут включать: Также может быть предпочтительным добавление второго агента, такого как карбапенем, миноциклин, тигециклин (Tygacil) или рифампицин. |
10. Лекарственная устойчивость
Neisseria gonorrhoeae| Текущие / появляющиеся устойчивые бактерии | Типы инфекций | Примечания к сопротивлению | Варианты лечения |
| Лекарственная устойчивость Neisseria gonorrhoeae | Н.gonorrhoeae вызывает гонорею, передающуюся половым путем. Отсутствие эффективных методов лечения по крайней мере 95% населения, страдающего гонореей, может стать серьезной проблемой для общественного здравоохранения. Сексуальные партнеры также должны пройти обследование и лечение от гонореи. | Гонорея приобрела устойчивость к большинству антибиотиков, используемых для ее лечения. Эти бактерии теперь устойчивы к фторхинолоновым антибиотикам, таким как ципрофлоксацин (Cipro). CDC перечисляет лекарственно-устойчивую Neisseria gonorrhoeae как «неотложную» угрозу. |
У пациентов с аллергией на цефалоспорины исследования показывают, что использование гемифлоксацина (Factive) или гентамицина в сочетании с пероральным азитромицином (Zithromax) очень эффективно при лечении гонореи. |
* Примечание: Эти таблицы не являются исчерпывающим списком всех устойчивых бактерий и возможных методов лечения. Типы устойчивости к антибиотикам постоянно развиваются, и бактерии не всегда могут проявлять устойчивость к выбору антибиотиков у каждого пациента. Во всех случаях выбор антибиотика должен основываться на месте инфицирования и клинических проявлениях, оцененных медицинским работником, культуре / чувствительности и других необходимых лабораторных результатах, местных моделях резистентности / восприимчивости и характеристиках пациента.Во многих случаях может потребоваться помощь группы медицинских работников, включая специалиста по инфекционным заболеваниям.
Другие типы устойчивых бактерий
Другие типы бактерий, на которые может влиять устойчивость к антибиотикам, включают:
- Staphylococcus epidermidis (коагулазонегативные стафилококки, CoNS).
- Лекарственная устойчивость Campylobacter
- Устойчив к флуконазолу Candida
- Бета-лактамаза с расширенным спектром действия, продуцирующая Enterobacteriaceae
- Лекарственно-устойчивый нетифоидный Salmonella
- Лекарственная устойчивость Salmonella Серотип Typhi
- Лекарственная устойчивость Shigella
- Устойчивый к эритромицину Группа A Streptococcus
- Клиндамицин-резистентная группа B Streptococcus
Почему так важна устойчивость к антибиотикам?
Чрезмерное и неправильное использование антибиотиков во всем мире ведет к глобальной проблеме устойчивости к антибиотикам в области здравоохранения.Могут возникнуть инфекции, устойчивые к антибиотикам, а в худшем случае могут не остаться антибиотики, эффективные для лечения инфекции. Эта ситуация может быть опасной для жизни при серьезной инфекции.
Одна из причин, по которой бактерии становятся устойчивыми, заключается в том, что антибиотики часто неправильно используются для лечения болезни, вызванной вирусом. Антибиотики не убивают вирусные заболевания. Примеры болезней, вызываемых вирусами, включают:
- сильнейшая ангина (фарингит)
- кашель, простуда и насморк (ринит)
- Инфекции носовых пазух, инфекции дыхательных путей (синусит, бронхит)
- грипп (вирус гриппа)
Большинство вирусных заболеваний не требуют специальных лекарств и являются «самоограничивающимися», что означает, что собственная иммунная система пациента может бороться с болезнью.Пациент с вирусным заболеванием также может отдыхать, пить много жидкости и использовать симптоматическое лечение, например ацетаминофен или ибупрофен, для снятия лихорадки или болей в теле.
Иногда при сложных или длительных вирусных инфекциях бактерии также могут вторгаться и вызывать так называемую «вторичную инфекцию». В этих случаях практикующий врач может порекомендовать антибиотик, если он необходим.
Что могут сделать пациенты и медицинские работники, чтобы остановить распространение устойчивости к антибиотикам?
При заболевании, вызванном вирусом, например кашле, простуде или гриппе, пациенты не должны просить или требовать, чтобы их лечащий врач прописал антибиотик.Антибиотик не вылечит вирусную инфекцию, и у пациента могут возникнуть побочные эффекты от ненужных лекарств. Врач может посоветовать другие способы помочь пациентам чувствовать себя лучше, если у них вирусное заболевание.
Пациенты не должны принимать антибиотики, которые были прописаны кому-то другому, и они не должны делиться своими антибиотиками с другими. Кроме того, пациенты должны отказаться от любого антибиотика, который может остаться от предыдущей болезни, и не должны сохранять его для использования при другой инфекции.Почему?
- Возможно, это неподходящий антибиотик от инфекции.
- Может быть устаревшим и неэффективным
- Лекарств может не хватить на полный курс.
- Если новое заболевание вызвано вирусной инфекцией, антибиотик не требуется.
- Устойчивые к антибиотикам бактерии также могут передаваться другим людям, если инфекция не лечится правильно.
Все эти методы могут усугубить проблему устойчивости к антибиотикам.
Очень важно своевременно получать информацию о вакцинации. Некоторые вакцины могут предотвратить бактериальные заболевания, которые в противном случае могли бы потребовать применения антибиотиков. Противовирусные вакцины, такие как прививка от гриппа, могут помочь предотвратить первичное заболевание, которое может быть связано со вторичной бактериальной инфекцией (например, пневмонией), для которой в конечном итоге требуется антибиотик.
Когда пациент получает рецепт на антибиотик, он может предпринять дальнейшие шаги для борьбы с резистентностью и обеспечения безопасного употребления лекарств.Многие антибиотики могут быть дорогими. Поставщики медицинских услуг могут заказать и дать общий антибиотик, если он доступен для лечения конкретной бактериальной инфекции. Непатентованное лекарство может быть более доступным и лечить инфекцию так же хорошо, как и более дорогое фирменное лекарство. Если пациент не может позволить себе принимать антибиотик, важно сообщить об этом своему врачу или фармацевту, чтобы можно было заказать альтернативное, более дешевое лекарство.
Завершение полного курса лечения антибиотиками важно для предотвращения устойчивости к антибиотикам и предотвращения рецидива инфекции.Даже если пациенты чувствуют себя лучше или даже выздоравливают в первые несколько дней лечения, они все равно должны завершить весь курс лечения антибиотиками.
Что делается для улучшения устойчивости к антибиотикам в будущем?
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и Центры по контролю за заболеваниями (CDC) выступили с инициативами по борьбе с устойчивостью к антибиотикам. FDA издало правила маркировки лекарств и рекомендует разумное назначение антибиотиков поставщиками медицинских услуг.
FDA также поощряет новые исследования эффективных схем приема антибиотиков, вакцин и диагностических тестов. Фактически, за последнее десятилетие было одобрено несколько новых инновационных антибиотиков для борьбы с серьезными инфекциями. Многие из этих новых антибиотиков одобрены FDA в рамках программы квалифицированных препаратов для лечения инфекционных заболеваний (QIDP), чтобы стимулировать разработку антибиотиков. Программа предлагает производителям стимулы, такие как ускоренная проверка и пять дополнительных лет эксклюзивного права на маркетинг.
Недавно одобренные антибиотики для устойчивых инфекций- Recarbrio (имипенем, циластатин и релебактам) для внутривенных инъекций одобрен в июле 2019 г .: комбинация антибактериального препарата пенема, ингибитора почечной дегидропептидазы и ингибитора бета-лактамазы, используемого для лечения чувствительных бактерий у взрослых 18 лет и старше с осложненными инфекциями мочевыводящих путей ( cUTI), включая пиелонефрит и осложненные интраабдоминальные инфекции (CIAI), когда альтернативные варианты лечения ограничены или отсутствуют.Релебактам — это недавно одобренный ингибитор бета-лактамаз.
- Nuzyra (омадациклин), аминометилциклиновый тетрациклиновый антибиотик, одобренный в октябре 2018 года для взрослых с внебольничной бактериальной пневмонией (CABP) и острыми инфекциями кожи и кожных структур (ABSSSI). Нузыра — это антибиотик для внутривенного и перорального введения один раз в день, который проявляет широкую активность, включая грамположительные, грамотрицательные, атипичные и лекарственно-устойчивые бактерии.
- Arikayce (ингаляционная суспензия амикацина липосом), аминогликозидный антибиотик, одобренный в сентябре 2018 года для лечения резистентного заболевания легких, вызванного комплексом Mycobacterium avium (MAC), у ограниченного числа пациентов, которые не отвечают на традиционное лечение (рефрактерное заболевание).
- Xerava (эравациклин), тетрациклиновый антибиотик, одобренный в августе 2018 года для лечения осложненных внутрибрюшных инфекций (CIAI) у пациентов 18 лет и старше. Xerava — это фторциклиновый антибиотик из класса тетрациклинов, обладающий высокой активностью против патогенов с множественной лекарственной устойчивостью. В исследованиях Xerava достигла высоких показателей излечения у пациентов с грамотрицательными патогенами, включая резистентные изоляты.
- Крем Xepi (озеноксацин), 1%, нефторированный хинолон для местного применения, одобренный в декабре 2017 г. для лечения импетиго, вызванного Staphylococcus aureus или Streptococcus pyogenes у пациентов в возрасте двух месяцев и старше.В исследованиях фазы III Xepi показал отличную антибактериальную активность против S. aureus и S. pyogenes (90,8% пациентов, принимавших Xepi, по сравнению с 69,8% для плацебо), включая устойчивый к метициллину S. aureus (MRSA).
- Baxdela (делафлоксацин), фторхинолоновый антибиотик, одобренный в июне 2017 года для лечения острых бактериальных инфекций кожи и кожных структур (ABSSSI), вызванных чувствительными бактериями. Baxdela нацелена как на грамположительные, так и на грамотрицательные бактерии, включая серьезный патоген MRSA (устойчивый к метициллину Staphylococcus aureus ).
- Претоманид, пероральный антимикобактериальный препарат нитроимидазооксазина, был одобрен FDA в августе 2019 года для использования в сочетании с бедаквилином (сиртуро) и линезолидом (зивокс) для лечения взрослых с легочной широкой лекарственной устойчивостью (ШЛУ), непереносимостью лечения или невосприимчивый туберкулез с множественной лекарственной устойчивостью (МЛУ). МЛУ-ТБ и ШЛУ-ТБ трудно поддаются лечению из-за устойчивости к доступным лекарствам.
Устойчивость к антибиотикам — это эпидемия, которую каждый может помочь предотвратить: поставщики медицинских услуг, пациенты и лица, осуществляющие уход.Просвещение, разумное использование и назначение антибактериальных средств, а также стопроцентное соблюдение пациентом режима лечения являются ключевыми факторами, помогающими остановить распространение устойчивости к антибиотикам.
Для получения дополнительной информации см. : CDC: Будьте осведомлены об антибиотиках
См. Также
Источники
- Центры по контролю и профилактике заболеваний (CDC). Самые большие угрозы и данные. По состоянию на 29 июля 2019 г. https://www.cdc.gov/drugresistance/biggest_threats.html .
- Центры по контролю и профилактике заболеваний (CDC).Информационный бюллетень C. diff. По состоянию на 28 июля 2019 г., https://www.cdc.gov/cdiff/pdf/Cdiff-Factsheet-508.pdf .
- Суигард Х., Сена А., Коэн Н. и др. Лечение неосложненных инфекций Neisseria gonorrhoeae. Своевременно. https://www.uptodate.com/contents/treatment-of-uncomplicated-neisseria-gonorrhoeae-infections. Проверено 29 июля 2019 г.
- Центры по контролю и профилактике заболеваний (CDC). Об устойчивости к противомикробным препаратам. https://www.cdc.gov/antibiotic-use/community/about/index.html (дата обращения: 5 июля 2019 г.).
- Лю С., Байер А., Косгроув С.Е. и др. Руководство по клинической практике Американского общества инфекционистов по лечению метициллин-устойчивых инфекций Staphylococcus aureus у взрослых и детей. Clin Infect Dis. 2011; 52 (3): e18-55. Epub 2011 4 января
- Beibei L, Yun C, Mengli C и др. Линезолид против ванкомицина для лечения грамположительных бактериальных инфекций: метаанализ рандомизированных контролируемых исследований.Int J Antimicrob Agents. Проверено 29 июля 2019 г.
- Фридкин СК. Золотистый стафилококк с промежуточной и устойчивой к ванкомицину лекарственной формой: что необходимо знать специалисту по инфекционным заболеваниям. Clin Infect Dis. 2001; 32: 108-15. Epub 2000 13 декабря
- Центры по контролю и профилактике заболеваний (CDC). Пневмококковая инфекция. Устойчивость к лекарству. https://www.cdc.gov/pneumococcal/drug-resistance.html По состоянию на 29 июля 2019 г.
- Внебольничная пневмония у взрослых. Руководство Pocketcard.Взято из: Рекомендаций по консенсусу IDSA / ATS. Манделл Л.А., Вундерлинк Р.Г., Анзуэто А. и др. Clin Infect Dis. 2007: 44 (Приложение 2): S27-S72.
- Thornsberry C и др.: Противомикробная активность Streptococcus pneumoniae с множественной лекарственной устойчивостью, выделенных в США, 2001-2005 гг. Postgrad Med 2008; 120: 32.
- Джонс Р.Н., Кормикан М.Г., Вангер А: Устойчивость к клиндамицину среди устойчивых к эритромицину Streptococcus pneumoniae. Диагностика Microbiol Infect Dis. 1996 августа; 25 (4): 201-4.
- Prakash V, Lewis JS, Herrera ML, et al. Пероральные и парентеральные терапевтические возможности для амбулаторных инфекций мочевыводящих путей, вызванных энтеробактериями, продуцирующими бета-лактамазы расширенного спектра CTX-M. Антимикробные агенты Chemother. 2009; 53: 1278-80.
- Родригес-Баньо Дж. И др.: Инфекции в общинах, вызванные Escherichia coli, продуцирующей бета-лактамазы расширенного спектра действия. Arch Intern Med 2008; 168: 1897.
- Ландман Д., Куале Дж. М.. Управление инфекциями, вызванными резистентными энтерококками: обзор терапевтических возможностей.J Antimicrob Chemother. 1997; 40: 161-70.
- Arias CA. Contreras GA. Мюррей БЭ. Ведение энтерококковых инфекций с множественной лекарственной устойчивостью. Clin Microbiol Infect. 2010; 16 (6): 555-62.
- Месарос Н., Нордманн П., Плезиат П. и др. Pseudomonas aeruginosa: устойчивость и терапевтические возможности на рубеже нового тысячелетия. Clin Microbiol Infect. 2007; 13 (6): 560-78.
- Патерсон Д.Л., Ко В.С., Фон Готберг А. и др. Антибактериальная терапия бактериемии Klebsiella pneumoniae: последствия продукции бета-лактамаз расширенного спектра.Clin Infect Dis. 2004; 39: 31-7.
- Вудфорд Н., Тьерно П.М., Янг К. и др. Вспышка Klebsiella pneumoniae, продуцирующая новую гидролизирующую карбапенем бета-лактамазу класса A, KPC-3, в Медицинском центре Нью-Йорка. Антимикробные агенты Chemother. 2004; 48: 4793-9.
- Центры по контролю и профилактике заболеваний (CDC). Туберкулез: лечение лекарственно-устойчивого туберкулеза (ТБ). По состоянию на 29 июля 2019 г. https://www.cdc.gov/tb/publications/factsheets/treatment/drugresistanttreatment.htm
- Fishbain J, Peleg AY. Лечение инфекций, вызванных Acinetobacter. Clin Infect Dis. 1 июля 2010 г .; 51 (1): 79-84.
- Wood GC, Hanes SD, Croce MA, Fabian TC, Boucher BA. Сравнение ампициллин-сульбактама и имипенема-циластатина для лечения пневмонии, связанной с искусственной вентиляцией легких, вызванной acinetobacter. Clin Infect Dis. 2002; 34 (11): 1425-30.
- Липа ПК. Патерсон DL. Парентеральный и ингаляционный колистин для лечения вентилятор-ассоциированной пневмонии. Clin Infect Dis.2006, сентябрь 1; 43 Приложение 2: S89-94.
- Мюррей BE. Устойчивые к ванкомицину энтерококковые инфекции. N Engl J Med. 2000; 342 (10): 710-21.
- Арчер GL, Climo MW. Антимикробная чувствительность коагулазонегативных стафилококков. Антимикробные агенты Chemother. 1994; 38 (10): 2231-37.
- Uçkay I, Pittet D, Vaudaux P, et al. Инфекции инородного тела, вызванные Staphylococcus epidermidis. Ann Med. 2009; 41 (2): 109-19.
- Фей П.Д., Олсон Мэн. Современные концепции образования биопленок Staphylococcus epidermidis.Future Microbiol. 2010; 5 (6): 917–33.
- Ntziora F, Falagas ME. Линезолид для лечения пациентов с инфекциями центральной нервной системы. Энн Фармакотер. 2007; 41 (2): 296-308.
- Lowy F, et al. Метициллин-устойчивый золотистый стафилококк (MRSA) у взрослых: лечение инфекций кожи и мягких тканей. Своевременно. Проверено 29 июля 2019 г.
- Musher D, et al. Устойчивость Streptococcus pneumoniae к фторхинолонам, доксициклину и триметоприм-сульфаметоксазолу.Своевременно. Проверено 29 июля 2019 г.
- Муньос-Прайс, Л. Сильвия и др. Бета-лактамазы расширенного спектра действия. Своевременно. Октябрь 2016 г. Проверено 29 июля 2019 г.
- Мюррей Б. и др. Лечение энтерококковых инфекций. Своевременно. Октябрь 2016 г. Проверено 29 июля 2019 г.
- O’Driscoll T, et al. Устойчивые к ванкомицину энтерококковые инфекции: эпидемиология, клинические проявления и оптимальное лечение. Устойчивость к заражению лекарствами. 2015; 8: 217–230.
- Кандж С., Секстон Д. и др.Принципы антимикробной терапии инфекций Pseudomonas aeruginosa. Своевременно. Проверено 29 июля 2019 г.
- Yu, W., Chuang, Y, et al. Клинические особенности, диагностика и лечение инфекции Klebsiella pneumoniae. Своевременно. Доступ 29 июля 2019 г.
- Kanafani, ZA, Kanj MS, et al. Инфекция Acinetobacter: лечение и профилактика. Своевременно. Проверено 29 июля 2019 г.
- Туфариелло, Дж. М., Лоуи, Ф. Д. и др. Инфекция, вызванная коагулазонегативными стафилококками: клинические проявления.Своевременно. Инфекция, вызванная коагулазонегативными стафилококками: клинические проявления
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Действие и механизмы устойчивости антибиотиков: руководство для врачей
J Anaesthesiol Clin Pharmacol. 2017 июль-сентябрь; 33 (3): 300–305.
Гарима Капур
Департамент микробиологии, Медицинский колледж Ганди, Бхопал, Мадхья-Прадеш, Индия
Саураб Сайгал
1 Департамент травм и неотложной помощи, AIIMS, Бхопал, Мадхья-Прадеш, Индия
2 Отделение интенсивной терапии, Колумбийская больница Азии, Бангалор, Карнатака, ИндияОтделение микробиологии, Медицинский колледж Ганди, Бхопал, Мадхья-Прадеш, Индия
1 Отделение травм и неотложной помощи, AIIMS, Бхопал, Мадхья-Прадеш , Индия
2 Отделение интенсивной терапии, больница Колумбия Азия, Бангалор, Карнатака, Индия
Адрес для корреспонденции: Dr.Гарима Капур, Отделение микробиологии, Медицинский колледж Ганди, Бхопал, Мадхья-Прадеш, Индия. Электронная почта: [email protected] Авторские права: © 2017 Journal of Anaesthesiology Clinical PharmacologyЭто статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 3.0, которая позволяет другим делать ремиксы, настраивать и развивать работу в некоммерческих целях при условии, что автор указан и новые разработки лицензируются на идентичных условиях.
Эта статья цитируется в других статьях в PMC.Abstract
Инфекции являются основной причиной смерти во всем развивающемся мире. Это в основном связано с появлением новых инфекционных агентов и, в частности, с появлением устойчивости к противомикробным препаратам. Со временем бактерии стали умнее, и вместе с этим массовое неосмотрительное использование антибиотиков в клинической практике привело к устойчивости бактерий к противомикробным препаратам. Устойчивость к противомикробным препаратам считается основной проблемой при лечении микробных инфекций.Механизмы биохимической устойчивости, используемые бактериями, включают следующее: инактивация антибиотиками, модификация мишени, изменение проницаемости и «обход» метаболического пути. Полезно определение устойчивости бактерий к антибиотикам всех классов (фенотипов) и мутаций, ответственных за устойчивость бактерий к антибиотикам (генетический анализ). Лучшее понимание механизмов устойчивости к антибиотикам поможет клиницистам использовать антибиотики в различных ситуациях.В этом обзоре обсуждается механизм действия и развитие устойчивости у широко используемых противомикробных препаратов.
Ключевые слова: Антибиотики, устойчивость к противомикробным препаратам, клеточная стенка бактерий, механизм действия
Введение
Борьба человечества с инфекционными заболеваниями хорошо известна. Открытие антибиотиков вселило оптимизм в то, что инфекции можно контролировать и предотвращать. Однако инфекции по-прежнему являются основной причиной смерти в развивающихся странах.Это происходит из-за возникновения нового заболевания, повторного возникновения болезней, которые когда-то контролировались, и, в частности, из-за появления устойчивости к противомикробным препаратам. Похоже, что возникновение устойчивости к противомикробным препаратам неизбежно почти для каждого нового препарата, и это признано серьезной проблемой при лечении микробных инфекций как в больницах, так и в обществе. Этот обзор предназначен для обсуждения механизма действия и развития резистентности у широко используемых противомикробных препаратов. Для этого нам необходимо знать основную анатомию бактериальной клетки, классификацию антибиотиков на основе их механизма действия, механизмы устойчивости к антибиотикам и отдельные антибиотики с их общим механизмом устойчивости.
Основная анатомия бактериальной клетки
Грамположительные бактерии состоят из цитоплазматической мембраны, окруженной жесткой и жесткой сеткой, называемой клеточной стенкой. Напротив, грамотрицательные бактерии состоят из тонкой клеточной стенки, которая окружена второй липидной мембраной, называемой внешней мембраной (OM). Пространство между ОМ и цитоплазматической мембраной называется периплазмой []. ОМ является дополнительным защитным слоем у грамотрицательных бактерий и предотвращает попадание многих веществ в бактерии.Однако эта мембрана содержит каналы, называемые поринами, которые позволяют проникать различным молекулам, например лекарствам. [1] Клеточная стенка представляет собой прочный слой, который придает бактерии характерную форму и предохраняет ее от осмотических и механических нагрузок. Цитоплазматическая мембрана предотвращает попадание ионов внутрь или из клетки и удерживает цитоплазматические и бактериальные компоненты в определенном пространстве.
Структура оболочки бактериальной клетки
Классификация антибиотиков по механизму действия
Антибиотики классифицируются на основе механизма действия, как описано в.
Механизм действия антибиотиков
Антибиотики нацелены на клеточную стенку
Бактериальные клетки окружены клеточной стенкой из пептидогликана, который состоит из длинных полимеров сахара. Пептидогликан подвергается поперечному сшиванию цепей гликанов под действием трансгликозидаз, а пептидные цепи простираются от сахаров в полимерах и образуют поперечные связи, один пептид с другим. [2] D-аланил-аланинская часть пептидной цепи сшивается остатками глицина в присутствии связывающих пенициллин белков (PBP).[3] Это сшивание укрепляет клеточную стенку. β-лактамы и гликопептиды подавляют синтез клеточной стенки.
Бета-лактамные антибиотики
Основными мишенями β-лактамных агентов являются PBP. Была выдвинута гипотеза, что β-лактамное кольцо имитирует D-аланил-D-аланин часть пептидной цепи, которая обычно связана с PBP. PBP взаимодействует с β-лактамным кольцом и недоступен для синтеза нового пептидогликана. Нарушение пептидогликанового слоя приводит к лизису бактерий [].[4]
Механизм действия β-лактамных антибиотиков
Гликопептиды
Гликопептиды связываются с D-аланил-D-аланиновой частью боковой цепи пептида субъединицы пептидогликана-предшественника. Большая молекула лекарственного средства ванкомицин предотвращает связывание этой субъединицы D-аланила с PBP и, следовательно, ингибирует синтез клеточной стенки []. [4,5]
Ингибиторы биосинтеза белка
Сначала информация в бактериальной ДНК используется для синтеза Молекула РНК называется информационной РНК (м-РНК), а процесс известен как транскрипция [].Затем макромолекулярная структура, называемая рибосомой, синтезирует белки, присутствующие в м-РНК, и этот процесс называется трансляцией. Биосинтез белка катализируется рибосомами и цитоплазматическими факторами. Бактериальная 70S рибосома состоит из двух субъединиц рибонуклеопротеина, 30S и 50S субъединиц [6]. Противомикробные препараты подавляют биосинтез белка, воздействуя на 30S или 50S субъединицу бактериальной рибосомы. [7,8]
Сайт действия ингибиторов биосинтеза белка
Ингибиторы 30S субъединицы
Аминогликозиды
Положительные аминогликозиды (заряженные аминогликозиды) молекулы, которые прикрепляются к отрицательно заряженному ОМ, что приводит к образованию больших пор и, таким образом, способствует проникновению антибиотика внутрь бактерии.Основная цель действия — бактериальная рибосома; чтобы попасть туда, он должен пройти через цитоплазматическую мембрану, требуя энергозависимого активного бактериального транспортного механизма, который требует кислорода и активной движущей силы протонов. По этим причинам AG работают в аэробных условиях и имеют низкую активность против анаэробных бактерий. Эти АГ обладают синергизмом с теми антибиотиками, которые ингибируют синтез клеточной стенки (такими как β-лактам и гликопептиды), поскольку они обеспечивают большее проникновение АГ внутрь клетки и при низких дозировках.AG взаимодействуют с 16S р-РНК 30S субъединицы рядом с сайтом A через водородные связи. Они вызывают неправильное считывание и преждевременное прекращение трансляции мРНК.
Тетрациклины
Тетрациклины, такие как тетрациклин, хлортетрациклин, доксициклин или миноциклин, действуют на консервативные последовательности 16S р-РНК 30S рибосомной субъединицы, предотвращая связывание т-РНК с сайтом A. [6,9 ]
Ингибиторы 50S субъединицы
Хлорамфеникол
Он взаимодействует с консервативными последовательностями полости пептидилтрансферазы 23S р-РНК 50S субъединицы.Следовательно, он подавляет синтез белка, предотвращая связывание т-РНК с сайтом А рибосомы. [6,7]
Макролиды
Они влияют на раннюю стадию синтеза белка, а именно на транслокацию, воздействуя на консервативные последовательности пептидилтрансферазный центр 23S р-РНК 50S рибосомной субъединицы. [6,9] Это приводит к преждевременному отрыву неполных пептидных цепей. Макролиды, линкозамиды и стрептограмины B демонстрируют аналогичный механизм действия.
Оксазолидиноны
Линезолид — это недавно одобренный представитель нового класса антибиотиков этой группы, который является полностью синтетическим.Оксазолидиноны мешают синтезу белка на нескольких стадиях: (i) ингибируют синтез белка путем связывания с 23Sr РНК субъединицы 50S и (ii) подавляют ингибирование 70S и взаимодействуют с пептидил-т-РНК. [10,11]
Ингибиторы ДНК. репликация
Хинилоны
Фторхинолоны (FQ) ингибируют фермент бактериальную ДНК-гиразу, которая разрывает двухцепочечную ДНК, вводит отрицательные суперспирали и затем закрывает разорванные концы. Это необходимо для предотвращения чрезмерной положительной суперспирализации цепей, когда они разделяются, чтобы обеспечить репликацию или транскрипцию.ДНК-гираза состоит из двух субъединиц A и двух субъединиц B. Субъединица выполняет разрезание ДНК, субъединица В вводит отрицательные суперспирали, а затем субъединица А закрывает нити. FQ связываются с субъединицей A с высоким сродством и мешают ее функции разрезания и повторного запечатывания цепей. У грамположительных бактерий основной мишенью действия является топоизомераза IV, которая разрывает и отделяет дочернюю цепь ДНК после репликации ДНК. Большее сродство к этому ферменту может повысить эффективность против грамположительных бактерий.Вместо ДНК-гиразы или топоизомеразы IV клетки млекопитающих обладают топоизомеразой II, которая имеет очень низкое сродство к FQ и, следовательно, низкую токсичность для клеток. [6,9,12]
Ингибиторы метаболизма фолиевой кислоты
Сульфонамиды и триметоприм
Каждый из этих препаратов подавляет определенные этапы метаболизма фолиевой кислоты. Комбинация сульфатных препаратов и триметоприма, действующих на разных стадиях одного и того же биосинтетического пути, демонстрирует синергию и снижает частоту мутаций устойчивости. [6] Сульфонамиды конкурентно ингибируют дигидроптероатсинтазу с более высоким сродством к ферменту, чем природный субстрат, п-аминобензойная кислота.Такие агенты, как триметоприм, действуют на более поздней стадии синтеза фолиевой кислоты и ингибируют фермент дигидрофолатредуктазу. [6]
Механизмы устойчивости к противомикробным препаратам
Предотвращение накопления противомикробных препаратов путем уменьшения поглощения или увеличения оттока антимикробного вещества из клетки, т.е. изменения проницаемости внешней мембраны
Молекулы лекарственного средства в клетку могут передаваться путем диффузии через порины, диффузии через двухслойным и самозахватом. Пориновые каналы расположены в ОМ грамотрицательных бактерий.Небольшие гидрофильные молекулы (β-лактамы и хинолоны) могут пересекать ОВ только через порины. Уменьшение количества пориновых каналов приводит к снижению проникновения β-лактамных антибиотиков и FQ в клетку, следовательно, устойчивости к этим классам антибиотиков. Приобретенная устойчивость ко всем классам антибиотиков у Pseudomonas aeruginosa связана с низкой проницаемостью ОМ.
Насосы оттока
Мембранные белки, которые выводят антибиотики из клетки и поддерживают их низкие внутриклеточные концентрации, называются оттоком насосами.[4] С той же скоростью, с которой эти противомикробные препараты попадают в клетку, механизмы оттока снова откачивают их, прежде чем они достигнут своей цели. [9] Эти насосы присутствуют в цитоплазматической мембране, в отличие от поринов, присутствующих в ОМ. Антибиотики всех классов, кроме полимиксина, чувствительны к активации систем оттока. [13] Насосы для оттока могут быть специфичными для антибиотиков. Большинство из них являются переносчиками множественных лекарств, которые способны перекачивать широкий спектр неродственных антибиотиков — макролидов, тетрациклинов и FQ — и, таким образом, вносят значительный вклад в развитие организмов с множественной лекарственной устойчивостью.[4]
Модификация молекулы-мишени
Естественные вариации или приобретенные изменения в сайтах-мишенях противомикробных препаратов, которые предотвращают связывание лекарств, являются распространенным механизмом устойчивости. Изменения сайта-мишени часто возникают в результате спонтанной мутации бактериального гена в хромосоме. Поскольку взаимодействие антибиотика с молекулой-мишенью, как правило, довольно специфично, незначительное изменение молекулы-мишени может иметь важное влияние на связывание антибиотика.
Изменение 30S-субъединицы или 50S-субъединицы: рибосомы приводит к устойчивости к лекарствам, которые влияют на синтез белка, т.е.е., макролиды, тетрациклин, хлорамфеникол и АГ. AG связываются с 30S рибосомной субъединицей [13], тогда как хлорамфеникол, макролиды, линкозамиды и стрептограмин B связываются с 50S рибосомной субъединицей для подавления синтеза белка [14]
Изменение в PBP: модификация PBP является предпочтительным механизмом устойчивости к грамположительным бактериям, тогда как продукция β-лактамаз является механизмом развития устойчивости к грамотрицательным бактериям. Наличие мутации в пенициллин-связывающем белке приводит к снижению сродства к β-лактамным антибиотикам.Устойчивость Enterococcus faecium к ампициллину и Streptococcus pneumoniae к пенициллину обусловлена этим механизмом. Аналогичным образом, у Staphylococcus aureus устойчивость к метициллину и оксациллину связана с интеграцией мобильного генетического элемента — «хромосомы стафилококковой кассеты mec» — в хромосому S.aureus , которая содержит ген устойчивости mec A. [4, 15,16] ген mec A кодирует белок PBP2a, новый связывающий пенициллин белок, который необходим для изменения нативного стафилококкового PBP.PBP2a показывает высокую устойчивость к β-лактамным антибиотикам. Штаммы S. aureus , устойчивые к метициллину, могут обладать перекрестной устойчивостью ко всем β-лактамным антибиотикам, стрептомицину и тетрациклину и в некоторых случаях к эритромицину [5]
Измененные предшественники клеточной стенки: синтез клеточной стенки у грамположительных бактерий могут ингибироваться гликопептидами, например ванкомицином или тейкопланином, путем их связывания с остатками D-аланил-D-аланина предшественников пептидогликана. D-аланил-аланин превращается в D-аланил-лактат, в результате чего гликопептиды не сшиваются с ними, следовательно, к ним развивается устойчивость.[4,5] Штаммы E. faecium и Enterococcus faecalis обладают высокой устойчивостью к ванкомицину и тейкопланину (устойчивость типа Ван А). Устойчивость типов Van B и Van C проявляет устойчивость к ванкомицину, но чувствительна к тейкопланину [17]
Мутированная ДНК-гираза и топоизомераза IV приводит к устойчивости к FQ: хинолоны связываются с субъединицей ДНК-гиразы A. Механизм устойчивости включает модификацию двух ферментов: ДНК-гиразы (кодируется генами gyr A и gyr B) и топоизомеразы IV (кодируется генами par C и par E).[18] Мутации в генах gyr A и par C приводят к нарушению репликации, и в результате FQ не может связываться
Рибосомные механизмы защиты, придающие устойчивость к тетрациклинам
Мутации РНК-полимеразы, придающие устойчивость к рифампицину.
Инактивация антибиотиков
Существуют три основных фермента, инактивирующих антибиотики, такие как β-лактамазы, ферменты, модифицирующие аминогликозиды, и хлорамфениколацетилтрансферазы (AAC).[19]
Бета-лактамазы
β-лактамазы гидролизуют почти все β-лактамы, которые имеют сложноэфирную и амидную связь, например пенициллины, цефалоспорины, монобактамы и карбапенемы. На сегодняшний день известно около 300 β-лактамаз. β-лактамазы — широко распространенные ферменты, которые классифицируются с использованием двух основных систем классификации: Амблера (структурная) и Буша – Якоби – Медейроса (функциональная). [15] Система классификации Амблера описана ниже:
β-лактамазы класса A: Также упоминается как пенициллиназа; они чувствительны к клавулановой кислоте.Две часто встречающиеся β-лактамазы класса А, обнаруженные у представителей Enterobacteriaceae , обозначены как ТЕМ-1, SHV-1. Это пенициллиназы с небольшой активностью или без активности против цефалоспоринов [20]. Это предшественники β-лактамаз расширенного спектра действия (БЛРС). БЛРС представляют собой ферменты, которые изменили профиль субстрата из-за аминокислотной замены, позволяющей гидролизовать большинство цефалоспоринов. БЛРС устойчивы к пенициллинам, цефалоспоринам третьего поколения (например, цефтазидиму, цефотаксиму, цефтриаксону), азтреонаму, цефамандолу, цефоперазону, но чувствительны к метоксицефалоспоринам, например.g., цефамицины и карбапенемы и ингибируются ингибиторами β-лактамаз, например, клавулановой кислотой, сульбактамом или тазобактамом [21,22,23]
β-лактамазы класса B: это металло-β-лактамазы. Для этого требуются ферменты, такие как цинк или тяжелые металлы, для катализа, и их активность ингибируется хелатирующими агентами. Эти классы ферментов устойчивы к инактивации клавуланатом, сульбактамом, азтреонамом и карбапенемами. Например, металло-β-лактамаза Нью-Дели [24]
β-лактамазы класса C: Их также называют цефалоспориназами.Они продуцируются всеми грамотрицательными бактериями, за исключением Salmonella и Klebsiella . Класс C гидролизует цефалоспорины, включая цефалоспорины расширенного спектра, по сравнению с β-лактамазами класса A, они имеют большие полости, и в результате они способны связывать объемный пенициллин расширенного спектра. Примером этого типа являются β-лактамазы Amp C. Этот класс ферментов устойчив ко всем β-лактамам, кроме карбапенемов. Они не ингибируются клавуланатом [25,26]
β-лактамазы класса D: это ферменты, гидролизующие оксациллин, наиболее часто встречающиеся у Enterobacteriaceae и P.синегнойная . Ферменты, гидролизующие оксациллин, придают устойчивость к пенициллину, клоксациллину, оксациллину и метициллину. Они слабо ингибируются клавулановой кислотой, но ингибируются хлоридом натрия. [27]
Ферменты, модифицирующие аминогликозиды (AGE)
AG, нейтрализуются специфическими ферментами: фосфорилтрансферазами, нуклеотидилтрансферазами или аденилилтрансферазами и AAC. Эти ферменты, модифицирующие аминогликозиды (AME), снижают сродство модифицированной молекулы, препятствуют связыванию с 30S субъединицей рибосомы [28] и обеспечивают устойчивость расширенного спектра к AG и FQ.[29] AME идентифицированы у штаммов S. aureus , E. faecalis и S. pneumoniae .
Хлорамфениколацетилтрансферазы
Немногочисленные грамположительные и грамотрицательные бактерии и некоторые из штаммов Haemophilus influenzae устойчивы к хлорамфениколу и содержат фермент хлорамфеникол трансацетилазу, который ацетилирует гидроксильные группы хлорамфеникола. Модифицированный хлорамфеникол не может должным образом связываться с 50S-субъединицей рибосомы.[30]
Механизм устойчивости к различным антибиотикам описан в.
Таблица 1
Механизм резистентности отдельных антибиотиков
Заключение
Открытие антибиотиков привело к вздоху облегчения, что теперь бактерии на этой планете не обитают. Со временем бактерии стали умнее, и вместе с этим массовое использование антибиотиков в клинической практике привело к устойчивости бактерий к антимикробным препаратам. Бактериями используются следующие биохимические механизмы устойчивости: инактивация антибиотиков, модификация мишеней, изменение проницаемости и «обход» метаболического пути.Полезно определение устойчивости бактерий к антибиотикам всех классов (фенотипов) и мутаций, ответственных за устойчивость бактерий к антибиотикам (генетический анализ). Лучшее понимание механизмов устойчивости к антибиотикам поможет врачам в использовании антибиотиков в различных ситуациях.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликта интересов нет.
Список литературы
1.Хаузер А.Р., редактор. Конверт клетки. Базовый антибиотик для врачей. 2-е изд. Нью-Дели: Wolters Kluwer (India) Pvt. ООО; 2015. С. 3–5. [Google Scholar] 2. Кане Д., Леймкулер С., Лу В., Уолш С. Гликопептидные и липогликопептидные антибиотики. Chem Rev.2005; 105: 425–48. [PubMed] [Google Scholar] 3. Reynolds PE. Структура, биохимия и механизм действия гликопептидных антибиотиков. Eur J Clin Microbiol Infect Dis. 1989; 8: 943–50. [PubMed] [Google Scholar] 4. Джидич С., Шушкович Дж., Кос Б. Механизмы устойчивости бактерий к антибиотикам: биохимические и генетические аспекты.Food Technol Biotechnol. 2008; 46: 11–21. [Google Scholar] 5. Grundmann H, Aires-de-Sousa M, Boyce J, Tiemersma E. Возникновение и возрождение метициллин-устойчивого Staphylococcus aureus как угроза общественному здоровью. Ланцет. 2006; 368: 874–85. [PubMed] [Google Scholar] 6. Йонеяма Х., Кацумата Р. Устойчивость бактерий к антибиотикам и ее будущее для разработки новых антибиотиков. Biosci Biotechnol Biochem. 2006; 70: 1060–75. [PubMed] [Google Scholar] 7. Vannuffel P, Cocito C. Механизм действия стрептограминов и макролидов.Наркотики. 1996; 51 (Приложение 1): 20–30. [PubMed] [Google Scholar] 8. Джонстон, штат Нью-Джерси, Мухтар Т.А., Райт Г.Д. Стрептограминные антибиотики: механизм действия и резистентность. Curr Drug Targets. 2002; 3: 335–44. [PubMed] [Google Scholar] 9. Wise R. Обзор механизмов действия и устойчивости противомикробных средств. Кан Респир Дж. 1999; 6 (Дополнение A): 20A – 2A. [PubMed] [Google Scholar] 10. Ламберт PA. Устойчивость бактерий к антибиотикам: измененные участки-мишени. Adv Drug Deliv Rev.2005; 57: 1471–85. [PubMed] [Google Scholar] 11.Боздоган Б, Аппельбаум ПК. Оксазолидиноны: активность, механизм действия и механизм устойчивости. Int J Antimicrob Agents. 2004; 23: 113–9. [PubMed] [Google Scholar] 12. Хиггинс П.Г., Флюит А.С., Шмитц Ф.Дж. Фторхинолоны: структура и целевые сайты. Curr Drug Targets. 2003; 4: 181–90. [PubMed] [Google Scholar] 14. Теновер ФК. Механизмы устойчивости бактерий к противомикробным препаратам. Am J Med. 2006; 119 (6 Suppl 1): S3–10. [PubMed] [Google Scholar] 15. Алексшун М.Н., Леви С.Б. Молекулярные механизмы множественной лекарственной устойчивости к антибактериальным препаратам.Клетка. 2007; 128: 1037–50. [PubMed] [Google Scholar] 16. Хирамацу К., Цуй Л., Курода М., Ито Т. Возникновение и эволюция метициллин-устойчивого Staphylococcus aureus . Trends Microbiol. 2001; 9: 486–93. [PubMed] [Google Scholar] 17. Giedraitiene A, Vitkauskiene A, Naginiene R, Pavilonis A. Механизмы устойчивости к антибиотикам клинически важных бактерий. Медицина (Каунас) 2011; 47: 137–46. [PubMed] [Google Scholar] 18. Ким YH, Ча CJ, Чернилья CE. Очистка и характеристика эритромицинэстеразы из устойчивого к эритромицину Pseudomonas sp.FEMS Microbiol Lett. 2002; 210: 239–44. [PubMed] [Google Scholar] 19. Докрелл Х.М., Геринг Р.В., Ройтт I, Вакелин Д., Цукерман М. В: Атака врага: противомикробные агенты и химиотерапия. Медицинская микробиология. Mims C, Dockrell HM, Goering RV, Roitt I, Wakelin D, Zuckerman M, редакторы. Нидерланды: Эльзевьер Мосби; 2004. С. 473–507. [Google Scholar] 20. Рис LB, Sahm D, Bonomo R. Механизмы устойчивости к антибактериальным средствам. В: Мюррей PR, редактор. Руководство по клинической микробиологии. 8-е изд. Вашингтон, округ Колумбия: ASM Press; 2003 г.С. 1084–7. [Google Scholar] 21. Якоби Г.А., Муньос-Прайс Л.С. Новые бета-лактамазы. N Engl J Med. 2005; 352: 380–91. [PubMed] [Google Scholar] 22. Ма Л., Чанг Ф.Й., Фунг С.П., Чен Т.Л., Лин Дж.С., Лу П.Л. и др. Разнообразие бета-лактамаз TEM-, SHV- и CTX-M-типа присутствует в недавних клинических изолятах Escherichia coli , Klebsiella pneumoniae и Enterobacter cloacae из Тайваня. Microb Drug Resist. 2005; 11: 31–9. [PubMed] [Google Scholar] 25. Кричлоу Г.В., Кузин А.П., Нукага М., Маяма К., Савай Т., Нокс-младший.Структура бета-лактамазы класса С расширенного спектра действия Enterobacter cloacae GC1, природного мутанта с тандемной трипептидной вставкой. Биохимия. 1999; 38: 10256–61. [PubMed] [Google Scholar] 26. Лобковский Э., Биллингс Э.М., Moews PC, Рахил Дж., Пратт РФ, Нокс-младший. Кристаллографическая структура фосфонатного производного Enterobacter cloacae P99 цефалоспориназы: механистическая интерпретация аналога переходного состояния бета-лактамазы. Биохимия. 1994; 33: 6762–72.[PubMed] [Google Scholar] 27. Naas T, Nordmann P. Бета-лактамазы OXA-типа. Curr Pharm Des. 1999; 5: 865–79. [PubMed] [Google Scholar] 28. Стратева Т., Йорданов Д. Pseudomonas aeruginosa — феномен устойчивости бактерий. J Med Microbiol. 2009. 58 (Pt 9): 1133–48. [PubMed] [Google Scholar] 29. Морис Ф., Брутин И., Подглажен И., Бенас П., Коллатц Э., Дардель Ф. Структурная пластичность ферментов и появление устойчивости к антибиотикам широкого спектра. EMBO Rep. 2008; 9: 344–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Толмаский М.Е. Устойчивость бактерий к аминогликозидам и бета-лактамам: парадигма транспозона Tn1331. Передние биоски. 2000; 5: D20–9. [PubMed] [Google Scholar]Выбор референс-группы и результаты по устойчивости к антибиотикам
Emerg Infect Dis. 2004 июн; 10 (6): 1125–1128.
, * , * , † и ‡Кейт С. Кэй
* Медицинский центр Университета Дьюка, Дарем, Северная Каролина, США;
Джон Дж.Engemann
* Медицинский центр Университета Дьюка, Дарем, Северная Каролина, США;
Essy Mozaffari
† Pfizer, New York, New York, USA;
Иегуда Кармели
‡ Медицинский центр Бет Исраэль Диаконисса, Гарвардская медицинская школа, Бостон, Массачусетс, США
* Медицинский центр Университета Дьюка, Дарем, Северная Каролина, США;
† Pfizer, Нью-Йорк, Нью-Йорк, США;
‡ Медицинский центр Бет Исраэль Диаконисса, Гарвардская медицинская школа, Бостон, Массачусетс, США
Автор для переписки.Адрес для корреспонденции: Keith S. Kaye, Box 3152, Durham, NC 27710, США; факс: 919-684-3137; электронная почта: ude.ekud.cm@1000eyakЭта статья цитируется другими статьями в PMC.Abstract
Были сопоставлены два типа когортных исследований пациентов, инфицированных метициллин-устойчивым Staphylococcus aureus (MRSA) и ванкомицин-устойчивыми энтерококками (VRE), с использованием различных контрольных групп. Случаи сравнивали с неинфицированными пациентами и пациентами, инфицированными соответствующим чувствительным организмом.VRE и MRSA были связаны с неблагоприятными исходами. Эффект был больше, когда использовались неинфицированные контрольные пациенты.
Ключевые слова: исходов, устойчивость к противомикробным препаратам, методология, золотистый стафилококк, энтерококк, стоимость, вирулентность, ванкомицин, метициллин
Хотя несколько исследователей провели исследования исходов пациентов, инфицированных или колонизированных противомикробными устойчивыми бактериями, дизайн и интерпретация результатов различными методами не обсуждалась ( 1 ).Как правило, в этих исследованиях результатов используется когортный дизайн и изучаются пациенты, инфицированные резистентными бактериями (представляющая интерес экспозиция для случаев), которых сравнивают либо с пациентами без инфекции, выбранными из аналогичной популяции ( 2 — 6 ), либо для пациентов, инфицированных соответствующими чувствительными бактериями (например, сравнение пациентов с метициллин-резистентным Staphylococcus aureus [MRSA] с пациентами с метициллин-чувствительным S. aureus [MSSA]) ( 7 — 13 ) (Приложение).Когда случаи сравниваются с неинфицированной контрольной группой или «контрольной группой», оценивается эффект новой бактериальной инфекции, устойчивой к противомикробным препаратам. Когда больных сравнивают с контрольными пациентами или «контрольной группой», инфицированными соответствующими чувствительными бактериями, измеряется влияние приобретения детерминанты устойчивости. Оба типа сравнения действительны и важны, но они относятся к разным клиническим сценариям.
Мы изучили, как выбор контрольной группы может повлиять на результаты исследований исходов, относящихся к бактериям, устойчивым к противомикробным препаратам.Мы сравнили и сопоставили результаты когортных исследований исходов для резистентных бактерий с использованием двух различных контрольных групп, обсуждавшихся ранее. Мы использовали результаты оригинальных исследований MRSA и устойчивых к ванкомицину энтерококков (VRE) ( 9 , 10 ), в которых первоначально использовалась одна контрольная группа. В нашем исследовании мы выполнили дополнительные анализы, сравнивая пациентов с разными референтными пациентами, и сравнили результаты.
Исследование
Исследования MRSA и VRE были разработаны как когортные исследования и подробно обсуждаются в другом месте ( 9 , 10 ) (Приложение).Случаи определялись как пациенты с инфекцией области хирургического вмешательства (ИОХВ) MRSA (т. Е. Воздействием, представляющим интерес для исследования 1) и инфекцией раны VRE (т. Е. Воздействием, представляющим интерес для исследования 2). В каждом исследовании в отдельных анализах использовались две разные контрольные группы. В контрольную группу А вошли пациенты, у которых не было инфекции, вызванной целевым патогеном ( S. aureus или энтерококки). В контрольную группу B вошли пациенты с инфекцией, вызванной чувствительным фенотипом целевого патогена (т.е., MSSA и чувствительные к ванкомицину энтерококки [VSE]).
В обоих исследованиях были изучены три исхода: смерть, продолжительность пребывания в больнице и общие расходы на больницу. Больничные расходы представляли собой переменные прямые платежи, полученные из финансовых баз данных больниц, и являются суррогатом стоимости. Стоимость больницы была оценена с использованием отношения затрат к оплате 0,7 ( 14 ).
Результаты исследования устойчивости к противомикробным препаратам, как известно, сложно выполнить из-за смешанных переменных, связанных с основными сопутствующими условиями ( 1 ).Чтобы избежать искажения, мы проанализировали несколько переменных, включая индивидуальные сосуществующие состояния, оценку Чарлсона, оценку физического статуса Американского общества анестезиологов (ASA) и продолжительность госпитализации до инфицирования (Приложение). Эти переменные были проанализированы с помощью многомерного анализа. Каждый исход анализировался независимо. Значение обратного логарифма было рассчитано для коэффициентов β переменных, включенных в модели предикторов, и эти меры воздействия были описаны как отношение шансов (OR) для уровня смертности и мультипликативные эффекты (ME) на продолжительность пребывания и сборы.
При анализе, сравнивающем пациентов с SSI, вызванными MRSA, с неинфицированной контрольной группой, когорта исследования включала 314 пациентов: 121 случай MRSA SSI и 193 неинфицированных хирургических контроля (Приложение). В многофакторном анализе MRSA SSI был значимо связан со смертью (OR = 11,4, p <0,001). В анализе, сравнивающем пациентов с MRSA SSI с пациентами с SSI, вызванными MSSA, те же 121 пациент с MRSA сравнивали с 165 контрольными пациентами с MSSA SSI. В многофакторном анализе MRSA SSI значимо ассоциировался со смертью (OR = 3.4, p = 0,003). Дополнительные ковариаты, включенные в скорректированные модели смерти, перечислены в сносках и обсуждаются в Приложении. Влияние MRSA на смертность было примерно в три раза больше для анализа с использованием неинфицированных контролей, чем для анализа с использованием контролей MSSA.
Таблица 1
Результаты и скорректированные анализы для MRSA для исследования 1 a
| Результат | Случаи | Контроли | Скорректированные анализы | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| OR (95% ДИ 913) 9 | Приписывается MRSA | значение p | |||||||||
| Три анализа, сравнивающих случаи MRSA (n = 121) и неинфицированные контроли (n = 193) | |||||||||||
| Смертей | 48 925 20.7%2,1% | 11,4 (от 2,8 до 34,9) c | — | <0,001 | |||||||
| Количество дней пребывания в стационаре после операции, среднее значение на случай | 29,1 | 6,1 | 3,2 (от 2,7 до 3,7 ) d | 13,4 | <0,001 | ||||||
| Расходы ($), средние / случай | 118,414 | 34,395 | 2,2 (2,0 до 2,6) e | 41,274 | 10 <0,001 | 9009Три анализа, сравнивающих случаи MRSA (n = 121) и контрольные MSSA (n = 165) | |||||
| Смертей | 20.7% | 6,7% | 3,4 f | — | 0,003 | ||||||
| Число дней пребывания в стационаре после заражения, среднее значение на случай | 22,0 | 13,2 | 1,2 г | 2,6 | 925 0,11|||||||
| Расходы ($), среднее значение на случай | 118,414 | 73,165 | 1,2 ч | 13,901 | 0,03 | ||||||
При анализе сравнения пациентов с SSI, вызванным моделированием MRSA, с неинфицированными контролями, множественные параметры продемонстрировали, что MRSA SSI был значительно связан с увеличением продолжительности пребывания в стационаре (ME = 3.2, р <0,001). Наличие MRSA SSI было связано со средним скорректированным относимым увеличением на 13,4 дней в больнице на случай. В анализе, сравнивающем пациентов с MRSA SSI с контрольной группой с SSI из-за MSSA, была замечена тенденция к ассоциации между MRSA SSI и общим количеством дней в стационаре (ME = 1,20, p = 0,11). Устойчивость к метициллину была связана со средним скорректированным относимым увеличением на 2,6 дня на случай, хотя это не достигло статистической значимости. Дополнительные ковариаты, включенные в скорректированные модели продолжительности пребывания, перечислены в сносках и обсуждаются в Приложении.Влияние MRSA на продолжительность пребывания было примерно в три раза больше (11 дней) для анализа с использованием неинфицированных контролей, чем для анализа B с использованием контролей MSSA.
В анализе, сравнивающем пациентов с SSI, вызванным MRSA, с неинфицированной контрольной группой, многомерное моделирование показало, что MRSA SSI значительно ассоциировался с повышенными расходами в больнице (ME = 2,2, p <0,001). MRSA было связано со средними скорректированными дополнительными относимыми расходами в размере 41 274 долларов США на случай и соответствующими расходами в размере 28 891 долларов США на случай.В анализе, сравнивающем пациентов с SSI из-за MRSA с контрольной группой с SSI из-за MSSA, MRSA был значительно связан с увеличением расходов в больнице (ME = 1,2, p = 0,03). Устойчивость к метициллину была связана со средними скорректированными дополнительными относимыми расходами в размере 13 901 доллар США за случай MRSA SSI и соответствующими затратами в размере 9731 доллар США за случай. Дополнительные ковариаты, включенные в скорректированные модели затрат, перечислены в сносках и обсуждаются в Приложении. Влияние MRSA на стоимость было примерно в два раза больше (15 000 долларов США) для анализа с использованием неинфицированных контролей, чем для анализа с использованием контролей с SSI из-за MSSA.
При анализе, сравнивающем пациентов с раневой инфекцией, вызванной VRE, с неинфицированными контрольными пациентами, 99 пациентов с раневой инфекцией VRE сравнивали с 280 подобранными контрольными, которые не были инфицированы энтерококками (Приложение). В скорректированном анализе инфекция ран VRE не была независимым предиктором смерти (OR 2,0, p = 0,13). В анализе, сравнивающем пациентов с раневой инфекцией из-за VRE, с контрольными пациентами с раневой инфекцией из-за VSE, те же 99 случаев раневой инфекции VRE сравнивались с 213 контрольными пациентами с раневыми инфекциями VSE.В многофакторном анализе VRE значимо ассоциировался со смертностью (OR 2,5, p = 0,04). Дополнительные ковариаты, включенные в скорректированные модели коэффициентов смертности, перечислены в сносках и обсуждаются в Приложении. Величина влияния VRE на смертность была одинаковой для обоих анализов.
Таблица 2
Результаты и скорректированные анализы на ванкомицин-устойчивые энтерококки (VRE) в исследовании 2
| Результат | Случаи | Контроли | Скорректированные анализы | ||
|---|---|---|---|---|---|
| OR | 64 925 Приписывается VRE | p значение | |||
| Три анализа, сравнивающих пациентов с VRE (n = 99) и неинфицированную контрольную группу (n = 280) | |||||
| Смертей | 12.1% | 6,1% | 2,0 b | — | 0,13 |
| Длина пребывания (d), среднее значение на случай | 15,2 | 8,5 | 1,8 c | 6,2 | < 0,001 |
| Сборы ($), в среднем на случай | 46,660 | 27,224 | 1,5 d | 13,884 | <0,001 |
| Три анализа для сравнения пациентов с VRE (n = 99) и пациентов, восприимчивых к ванкомицину энтерококки (VSE) контрольные (n = 213) | |||||
| Смертных | 12.1% | 6,6% | 2,5 e | — | 0,04 |
| Длина пребывания (d), среднее значение на случай | 15,2 | 13,6 | 1,0 f | — | 0,5 |
| Расходы ($), в среднем на случай | 46,600 | 31,915 | 1,4 г | 12,766 | <0,001 |
В анализе сравнения пациентов с раневой инфекцией, вызванной VRE, с неинфицированными контролями , многопараметрическое моделирование показало значительно более длительную продолжительность госпитализации после включения в когорту для случаев VRE, чем для контрольной группы, не инфицированной энтерококками (ME 1.8, p <0,001, среднее скорректированное относимое увеличение продолжительности пребывания на 6,2 дня). В анализе, сравнивающем пациентов с раневой инфекцией, вызванной VRE, с контрольными пациентами с раневой инфекцией VSE, продолжительность пребывания после выделения энтерококков была одинаковой для случаев VRE и контрольной группы VSE (среднее значение 15,2 против 13,6 дней, p = 0,5) и различия продолжительность пребывания оставалась незначимой при многомерном анализе (ME = 1,0, p = 0,5). Дополнительные ковариаты, включенные в скорректированные модели продолжительности пребывания, перечислены в сносках и обсуждаются в Приложении.Влияние VRE на продолжительность пребывания было примерно в два раза больше (6 дней) для анализа с использованием неинфицированных контролей, чем для анализа, в котором использовались контроли VSE.
В анализе, сравнивающем пациентов с раневой инфекцией, вызванной VRE, с неинфицированной контрольной группой, многомерное моделирование показало, что случаи VRE генерировали значительно более высокие расходы на больницу, чем контрольные (скорректированный ME = 1,5, p <0,001, скорректированное среднее значение дополнительных относимых расходов в размере 13 884 долларов США за рану VRE инфекции и соответствующие затраты в размере 9 719 долларов США на одно заражение).В анализе, сравнивающем пациентов с раневой инфекцией, вызванной VRE, с контрольной группой с раневой инфекцией VSE, раневая инфекция VRE была связана с повышенными расходами в больнице (ME = 1,4, p <0,001, средние скорректированные дополнительные относимые расходы в размере 12766 долларов США на инфекцию и относимые затраты на 8 936 долларов США на инфекцию). Дополнительные ковариаты, включенные в скорректированные модели затрат, перечислены в сносках и обсуждаются в Приложении. Влияние VRE на стоимость было одинаковым в обоих анализах.
Выводы
Мы изучили, как критерии, использованные для выбора контрольной группы (т. Е. Группы сравнения или контрольной группы для случаев), повлияли на результаты исследования результатов. Были изучены два типа контрольных пациентов, и в обоих типах анализов VRE и MRSA были связаны со значительными неблагоприятными клиническими исходами. В общем, эффекты (то есть OR или ME) были более значительными, когда использовались контроли, не инфицированные целевым организмом (и, следовательно, представляющие случайную выборку исходной популяции).Это логично, поскольку анализы с использованием неинфицированных контролей оценивают эффект приобретения новой инфекции и устойчивого патогена. Когда пациенты, инфицированные чувствительным организмом, используются в качестве контроля, анализ количественно оценивает только эффект приобретения признака устойчивости.
Различия в результатах между двумя анализами были намного больше для исследования MRSA SSI, чем для исследования раневой инфекции VRE. Влияние на клинические исходы было в два-три раза больше, когда пациентов с MRSA SSI сравнивали с неинфицированной контрольной группой, в отличие от сравнения с контрольными пациентами, инфицированными MSSA SSI.Напротив, когда пациентов с раневой инфекцией VRE сравнивали с неинфицированными пациентами, были получены те же результаты, что и при использовании пациентов с раневой инфекцией VSE в качестве контроля. Мы полагаем, что величина различий в результатах двух анализов напрямую связана с вирулентностью инфекционного организма (Приложение).
Исследования проводились в двух разных географических регионах и с использованием немного разных аналитических методов. Хотя это ограничение в том, что результаты по стоимости нельзя напрямую сопоставить, мы считаем, что включение этих двух исследований улучшает обобщаемость наших результатов и укрепляет наши выводы.
Для исследований устойчивости к противомикробным препаратам контрольная группа должна выбираться на основе цели исследователей. С точки зрения общественного здравоохранения, результаты исследований исходов, относящиеся к устойчивости к противомикробным препаратам, часто используются для помощи в распределении ресурсов на мероприятия. Если целью исследования является изучение независимых эффектов признака устойчивости или фенотипа (например, устойчивости к метициллину), то наиболее подходящей контрольной группой будут пациенты, инфицированные соответствующим чувствительным организмом.Если цель состоит в том, чтобы оценить эффект новой инфекции, вызванной конкретным патогеном, неинфицированные контрольные пациенты будут предпочтительной группой сравнения. В качестве альтернативы полный анализ может включать оба типа контрольных групп; этот анализ позволит читателю оценить эффект приобретения только фенотипа устойчивости и влияние приобретения новой инфекции, вызванной устойчивыми бактериями.
Приложение
В нескольких исследованиях проанализированы приписываемые исходы у пациентов, инфицированных устойчивыми бактериями, которые сравниваются с контрольными пациентами, инфицированными соответствующими чувствительными бактериями (15–46).Мы провели два исследования, оба в учебных больницах. Исследование 1 (устойчивый к метициллину Staphylococcus aureus [MRSA]) было проведено в Медицинском центре Университета Дьюка, академическом медицинском центре третичного уровня на 900 коек, и региональной больнице Дарема, общественной больнице на 350 коек, расположенных в Дареме, Север Каролина. Исследование 2 (устойчивые к ванкомицину энтерококки [VRE]) было проведено в медицинском центре Beth Israel Deaconess, Западный кампус, городской больнице третичного уровня на 320 коек в Бостоне, Массачусетс.В обоих исследованиях данные были извлечены из различных источников, включая компьютеризированные базы данных больниц (например, базы данных бухгалтерского учета, административного контроля, инфекционного контроля и микробиологии) и медицинские карты пациентов, и были собраны в единый набор данных (Access, Microsoft Corp., Redmond, WA ). В обоих исследованиях организмы были идентифицированы из клинических образцов с использованием стандартных микробиологических методов, которые соответствуют руководящим принципам Национального комитета по клиническим лабораторным стандартам. Точные методы сбора данных и микробиологии описаны в другом месте ( 47 — 48 ).
Чтобы избежать искажений, мы использовали многомерный анализ, исследуя каждый из результатов независимо. Следующие переменные были проанализированы как потенциальные искажающие факторы: демографические данные пациента, установленный диагноз, сосуществующие условия и количество дней в больнице и интенсивной терапии до включения в когорту. Для исследования 2 также были проанализированы баллы предрасположенности к вероятности возникновения VRE ( 49 ), наличия серьезной хирургической процедуры и инфицирования Clostridium difficile или MRSA.
Статистический анализ проводился с использованием программного обеспечения Stata (Stata Corp., College Station, TX) и / или SAS 8.1 (Cary, NC). Возраст был проанализирован с помощью теста Student t . а другие непрерывные и порядковые переменные сравнивались с помощью двустороннего критерия суммы рангов Вилкоксона. Для анализа дихотомических переменных использовался точный критерий Фишера. Коэффициенты корреляции Спирмена были рассчитаны для выявления тенденций среди непрерывных переменных (например, между продолжительностью пребывания в больнице и непрерывными независимыми переменными, а также между стоимостью и непрерывными независимыми переменными).Соответствующие анализы использовались в исследовании 2 для анализа, сравнивающего инфекцию ран VRE с контрольными пациентами с инфекцией ран VSE ( 47 , 50 ).
Каждый результат был исследован независимо с многофакторным анализом. В обоих исследованиях показатели смертности анализировались с помощью логистической регрессии (условное максимальное правдоподобие в исследовании VRE для учета сопоставления), а расходы в больнице — с помощью линейной регрессии. Для исследования MRSA общее количество дней госпитализации после заражения анализировалось с помощью линейной регрессии.Что касается продолжительности пребывания в больнице, для анализа VRE использовались полупараметрические модели выживаемости с ускоренным временем отказа (Weibull).
Для многомерной линейной регрессии было выполнено следующее преобразование данных. В исследовании MRSA стоимость и продолжительность пребывания в больнице были преобразованы в журнал, а в исследовании VRE стоимость была преобразована в журнал. Логарифмическое преобразование не выполнялось для логистической регрессии и анализа выживаемости, а логарифмическое преобразование не выполнялось для одномерного или двумерного анализа.
Значение обратного логарифма было рассчитано для коэффициентов β переменных, включенных в модели предикторов, и эти меры воздействия были описаны как мультипликативные эффекты (МЭ) на продолжительность пребывания и стоимость. Все статистические тесты были двусторонними. Достоверным считали р <0,05.
Скорректированные средние исходы, относимые на одну резистентную инфекцию (VRE и MRSA), были рассчитаны следующим образом для дней и сборов в больнице. Плата за заражение VRE используется в качестве примера:
Средние начисленные расходы на заражение VRE = [(средние расходы для контрольных пациентов) x (обратный логарифм коэффициента β для скорректированной переменной VRE-инфекции)] — (средние расходы для контрольных пациентов)
Были изучены три группы: 121 случай инфекции области хирургического вмешательства (SSI) MRSA, 193 неинфицированных контрольных хирургических пациента и 165 контрольных пациентов с MSSA SSI.Описательная характеристика этих групп и результаты двумерного анализа представлены в.
В анализе, сравнивающем пациентов с MRSA SSI с неинфицированной контрольной группой, помимо MRSA, значимые предикторы смертности включали оценку физического статуса Американского общества анестезиологов (ASA)> 3 и возраст> 73 (). Когда пациентов с MRSA SSI сравнивали с контрольными пациентами с MSSA SSI, в дополнение к MRSA, значимые предикторы смерти включали балл по шкале ASA> 3 и возраст> 61 год.Эта модель контролировалась с учетом смешанных эффектов продолжительности операции ().
В анализе сравнения пациентов с MRSA SSI и неинфицированной контрольной группой, помимо MRSA, другие предикторы увеличения продолжительности пребывания в больнице включали оценку ASA, продолжительность операции и продолжительность пребывания в больнице до операции. Эта модель контролировалась с учетом смешанных эффектов госпитализации в больницу третичного уровня, диабета и почечной недостаточности (). Когда пациентов с MRSA SSI сравнивали с контрольными пациентами с MSSA SSI, значимыми предикторами увеличения продолжительности пребывания в больнице были оценка по шкале ASA, заболевание почек, продолжительность операции и продолжительность пребывания до инфекции.Эта модель контролировалась с учетом смешанных эффектов сахарного диабета и госпитализации в больницу третичного уровня ().
В анализе, сравнивающем пациентов с MRSA SSI с неинфицированным контролем, помимо MRSA, другие предикторы увеличения стоимости включали оценку ASA, госпитализацию в больницу третичного уровня, продолжительность операции, продолжительность пребывания в больнице и отделение интенсивной терапии (ICU). оставаться до операции. Эта модель контролировалась для смешивающего эффекта почечной недостаточности (). Когда пациентов с MRSA SSI сравнивали с контрольными пациентами с MSSA SSI, значимыми предикторами увеличения стоимости, помимо MRSA, были оценка по шкале ASA, продолжительность операции, продолжительность пребывания в больнице и отделении интенсивной терапии до инфекции и госпитализация в больницу третичного уровня.Эта модель контролировалась для смешанных эффектов почечной недостаточности и диабета ().
Были изучены три группы пациентов: 99 пациентов с VRE с раневой инфекцией, 280 соответствующих контрольных пациентов, которые не были инфицированы энтерококками, и 213 контрольных пациентов с VSE раневыми инфекциями. Описательные характеристики и результаты двумерного анализа представлены в.
При анализе, сравнивающем пациентов с раневой инфекцией VRE и неинфицированной контрольной группой, влияние раневой инфекции VRE на смертность контролировалось смешивающим влиянием количества сопутствующих заболеваний и поступления в отделение интенсивной терапии (ICU) ().Когда пациентов с раневой инфекцией VRE сравнивали с контрольными пациентами с раневой инфекцией VSE, значимые предикторы смерти включали поступление в отделение интенсивной терапии. Эта модель контролировалась на предмет смешанных эффектов хирургии и секса ().
В анализе, сравнивающем пациентов с раневой инфекцией VRE и неинфицированной контрольной группой, предикторами увеличения продолжительности пребывания в больнице, помимо VRE, были перевод из другого учреждения, заболевание почек, злокачественное новообразование и госпитализация в отделение интенсивной терапии.Эта модель контролировалась для смешивающего эффекта оценки предрасположенности (то есть вероятности наличия случая VRE)] (). Когда пациентов с раневой инфекцией VRE сравнивали с контрольными пациентами с раневой инфекцией VSE, значимыми предикторами увеличения продолжительности пребывания была госпитализация в отделении интенсивной терапии. Эта модель контролировалась на предмет смешанных эффектов продолжительности госпитализации до включения в когорту и злокачественных новообразований ().
В анализе, сравнивающем пациентов с раневой инфекцией VRE и неинфицированной контрольной группой, предикторами увеличения стоимости, помимо VRE, были перенесены операции до включения в когорту ().Эта модель контролировалась на предмет смешанных эффектов оценки предрасположенности (то есть вероятности быть случаем VRE) и продолжительности госпитализации до включения в когорту. Когда пациентов с раневой инфекцией VRE сравнивали с контрольными пациентами с раневой инфекцией VSE, значимыми предикторами увеличения стоимости, помимо VRE, были перенесенные операции до включения в когорту. Эта модель контролировалась по влиянию времени нахождения в больнице до включения в когорту.
Различия в результатах между двумя анализами намного больше для вирулентного первичного патогена, чем для невирулентного вторичного захватчика.При изучении вирулентного патогена (например, S. aureus ) инфицированная восприимчивая группа (MSSA) подвергается гораздо большему риску неблагоприятных клинических исходов, чем неинфицированная контрольная группа, и анализ сравнивает резистентные случаи (MRSA) с этими двумя контрольными случаями. группы дают заметно разные результаты. Энтерококки часто являются невирулентными вторичными захватчиками (например, колонизаторами) в раневых инфекциях и часто являются частью смешанной флоры инфекционных патогенов, а не настоящих первичных патогенов. Результаты, полученные при сравнении пациентов с раневой инфекцией VRE с пациентами, не инфицированными энтерококками, были аналогичны результатам, полученным, когда пациенты с раневой инфекцией VSE использовались в качестве контроля.По нашему мнению, при анализе резистентных патогенов с низкой вирулентностью (например, VRE в ранах) инфицированные восприимчивые (например, VSE) и неинфицированные контрольные группы приближаются друг к другу, и результаты анализов, сравнивающих устойчивые случаи с этими двумя контрольными группами, аналогичны .
Биография
•
Доктор Кэй — доцент медицины в Медицинском центре Университета Дьюка, где он является директором Госпитальной эпидемиологии и инфекционного контроля и председателем Комитета по оценке антибиотиков.Его исследовательские интересы включают устойчивость к противомикробным препаратам, использование противомикробных препаратов, селективное противомикробное давление, инфекции в области хирургического вмешательства, инфекции у пожилых людей и внутрибольничные инфекции.
Таблица A1
Исследование 1, характеристики пациента, метициллин-резистентный Staphylococcus aureus (MRSA), контроли, не инфицированные S. aureus , и контроли с метициллин-чувствительными S. aureus (MSSA) инфекции области хирургического вмешательства , двухфакторный анализ
| Переменная | Случаи, MRSA (%) (n = 121) | Контрольные, неинфицированные пациенты (%) (n = 193) | Значение p, (MRSA vs.неинфицированные контроли) | Контроли, MSSA (%) (n = 165) | значение p (MRSA по сравнению с MSSA) |
|---|---|---|---|---|---|
| Возраст, среднее ± SD, y | 63,9 ± 15,4 | 57,3 ± 18,3 | 0,001 | 55,1 ± 17,4 | <0,001 |
| Мужской пол | 55 (45,5) | 92 (42,7) | 0,73 | 90 (54,6) | 0,15 |
| Условия сосуществования | |||||
| Сахарный диабет | 59 (48.8) | 66 (34,2) | 0,01 | 57 (34,6) | 0,02 |
| Гематологическое расстройство | 1 (0,8) | 1 (0,5) | 1,00 | 2 (1,2) | 1,00 |
| ВИЧ-инфекция | 0 (0,0) | 1 (0,5) | 1,00 | 0 | 1,00 |
| Гипертония | 64 (52,9) | 75 (38,9) | 0,02 | 48 80 (48,5)0.48 | |
| Заболевание печени | 4 (3,3) | 1 (0,5) | 0,07 | 2 (1,2) | 0,25 |
| Злокачественность | 15 (12,4) | 14 (7,3) | 0,16 | 13 (7,9) | 0,23 |
| Ожирение | 10 (8,3) | 12 (6,2) | 0,50 | 18 (10,9) | 0,55 |
| Периферическое сосудистое заболевание | (9.9) | 3 (1,6) | 0,002 | 9 (5,5) | 0,17 |
| Болезнь легких | 21 (17,4) | 23 (11,9) | 0,19 | 32 (19,4) | 0,76 |
| Заболевание почек | 19 (15,7) | 9 (4,7) | 0,002 | 13 (7,9) | 0,06 |
| Трансплантат | 1 (0,8) | 0 | 0,39 | 48 00,42 | |
| Использование табака | 16 (13.2) | 20 (10,4) | 0,47 | 24 (14,6) | 0,86 |
| Злоупотребление алкоголем | 4 (3,3) | 2 (1,0) | 0,21 | 6 (3,6) | 1,00 |
| Факторы риска, связанные с больницей | |||||
| Лечение в академической больнице третьего уровня | 94 (77,8) | 125 (64,8) | 0,02 | 109 (66,1) | 0,04 |
| LOS до операции, медиана , IQR | 1, 0–4 | 0, 0–3 | 0.02 | 0, 0–2 | 0,01 |
| LOS до посева, медиана , IQR | 8, 5–14 | NA | NA | 5, 3–10 | <0,001 |
| Доля пациентов , находившихся в отделении интенсивной терапии до операции | 11 (9,1) | 13 (7,9) | 0,83 | 18 (9,3) | 1,0 |
| Оценка ASA, медиана, IQR | 3 , 3–4 | 3, 2–4 | 0.03 | 3, 2–4 | 0,15 |
| Продолжительность операции (мин), медиана, IQR | 240, 166–305 | 194, 113–276 | 0,004 | 202, 116–285 | 0,01 |
| Класс раны, медиана , IQR | 1, 1–1 | 1, 1–1 | 0,82 | 1, 1–1 | 0,36 |
| Индекс риска NNIS, медиана, IQR | 1, 1-2 | 1, 1-1 | 0,002 | 1, 1-2 | 0.06 |
Таблица A2
Исследование 1: Модели скорректированных результатов для метициллин-резистентной инфекции области хирургического вмешательства (SSI) Staphylococcus aureus (MRSA) по сравнению с неинфицированными контрольными пациентами a
| Смерть | Продолжительность пребывания b | Стоимость c | |
|---|---|---|---|
| OR (95% CI) | OR d (95% CI) | OR (95% CI) | |
| MRSA | 11.4 (от 2,8 до 34,9) | 3,2 (от 2,7 до 3,7) | 2,2 (2,0 до 2,6) |
| Оценка по ASA e, f | 1,3 (от 1,2 до 1,5) | Оценка по ASA = 4 3,7 (1,5–8,9) | |
| балл ASA = 2 2,0 (1,4–2,9) | |||
| балл ASA = 3 3,0 (2,1–4,3) | |||
| балл ASA = 4 4,1 (2,8–6,0) ) | |||
| > 73 лет | 4,8 (от 2,0 до 11,6) | ||
| Продолжительность работы (мин) г | |||
| 211–400 | (0.От 9 до 1,3) | 1,4 (от 1,2 до 1,7) | |
| 401–590 | 1,7 (от 1,2 до 2,4) | 2,2 (от 1,6 до 3,1) | |
| > 590 | 1,8 (от 1,1 до 2,9) | 2,6 (от 1,6 до 4,0) | |
| Продолжительность пребывания до операции ч | |||
| 7–13 дней | 1,6 (1,1 до 2,1) | 1,7 (1,3 до 2,3) | |
| 14 –20 d | 3,6 (1,4–9,6) | 5.6 (от 2,3 до 13,4) | |
| > 20 дней | 0,7 (от 0,2 до 2,6) | 1,2 (от 0,3 до 4,3) | |
| Пребывание в отделении интенсивной терапии до операции | 1,5 (1,2 до 2,0) | ||
| Больница высокоспециализированной медицинской помощи | 1,5 (от 1,2 до 1,7) | ||
Таблица A3
Исследование 1, модели скорректированных результатов для метициллин-устойчивого стафилококка .aureus (MRSA) инфекции области хирургического вмешательства (SSI) по сравнению с пациентами с метициллин-устойчивым S. aureus (MSSA) SSI a
| Смертных b | Продолжительность пребывания c | Стоимость d | |
|---|---|---|---|
| Переменная | OR (95% CI) | OR (95% CI) e | OR e (95% CI) |
| MRSA | 48 925 3.4 (от 1,5 до 7,7)1,2 (от 1,0 до 1,5) | 1,2 (от 1,0 до 1,4) | |
| Оценка по ASA f | Оценка по ASA = 4 5,1 (от 2,1 до 12,5) | Оценка по ASA = 2 0,9 (от 0,5 до 1,7) | баллов по ASA = 2 1,0 (от 0,7 до 1,5) |
| баллов по ASA = 3 1,6 (от 0,9 до 2,9) | баллов по ASA = 3 1,4 (от 1,0 до 2,1) | ||
| Оценка по ASA = 4 1,8 (от 1,0 до 3,5) | Оценка по ASA = 4 2,1 (от 1,4 до 3.2) | ||
| Возраст> 61 год | 3,0 (от 1,2 до 7,3) | ||
| Продолжительность работы, мин. г | |||
| 206–381 | 1,3 От 1,0 до 1,6) | 1,4 (от 1,1 до 1,6) | |
| 382–557 | 1,3 (от 0,8 до 2,1) | 1,8 (от 1,3 до 2,5) | |
| > 557 | 1,1 (от 0,5 до 2,6) | 1,6 (от 0,9 до 2,8) | |
| Продолжительность (d) пребывания до заражения ч | |||
| 11–20 | 1.4 (от 1,0 до 1,8) | 1,6 (от 1,3 до 2,0) | |
| 21–30 | 1,6 (от 1,0 до 2,7) | 1,7 (от 1,2 до 2,5) | |
| > 30 | 1,3 (от 0,5 до 3,1 ) | 1,8 (от 0,9 до 3,8) | |
| Заболевание почек | 1,5 (от 1,0 до 2,2) | ||
| Продолжительность (d) пребывания в отделении интенсивной терапии до заражения i | |||
| 8–14 | 1.8 (1,1, 2,8) | ||
| 15–21 | 2,1 (1,1, 8,8) | ||
| > 21 | 1,9 (0,4, 8,0) | ||
| Госпиталь третичного уровня | 1,3 ( 1.1, 1.6) |
Таблица A4
Исследование 2, характеристики пациентов, раневые инфекции, вызванные устойчивыми к ванкомицину энтерококками (VRE), контрольная группа, не инфицированная энтерококками, и контрольная группа с энтерококками, чувствительными к ванкомицину (VSE), ранние инфекции, двумерные анализы
| Переменная | Случаи, VRE рана (%) (n = 99) | Контроли, незараженные (%) (n = 280) | P Значение (VRE vs.контроли не инфицированы) | Контроли, VSE (%) (n = 213) | Значение p (VRE по сравнению с VSE) |
|---|---|---|---|---|---|
| Возраст, средний (г) | 60,3 | 63,6 | 0,09 | 59,1 | 0,51 |
| Пол (женский) | 46 (46) | 124 (44,3) | 0,7 | 127 (59,6) | 0,03 |
| Основной диагноз | 9934 | 000 | |||
| Ортопедическое состояние | 11 (11) | 30 (10.7) | 18 (8,4) | ||
| Сердечно-сосудистое состояние | 25 (25) | 117 (41) | 61 (28,6) | ||
| Эндокринное расстройство | 3 ( 3) | 6 (2,1) | 4 (1,9) | ||
| Желудочно-кишечное расстройство | 25 (25) | 60 (21,4) | 62 (29,1) | ||
| 6 (6) | 12 (4.2) | 9 (4,3) | |||
| Инфекционная болезнь | 16 (16) | 6 (2,1) | 20 (9,4) | ||
| Гематологическая болезнь | 0 ( 0) | 2 (.7) | 0 | ||
| Неврологическое заболевание | 11 (11) | 32 (11,4) | 34 (16) | ||
| Болезнь легких | 2 (2) | 14 (5) | 5 (2.4) | ||
| Условия сосуществования | |||||
| Сердечно-сосудистые заболевания | 73 (74) | 204 (72,9) | 0,86 | 1509 ( | |
| Заболевание легких | 11 (11) | 33 (11,7) | 0,9 | 26 (12,2) | 0,78 |
| Сахарный диабет | 67 (67,7) | 139 (49.6) | 0,002 | 127 (59,6) | 0,17 |
| Получатель трансплантата | 14 (14) | 21 (7,5) | 0,08 | 18 (8,4) | 0,12 |
| Почечная болезнь | 18 (18,2) | 39 (14) | 0,7 | 28 (13,2) | 0,24 |
| Злокачественность | 7 (7,1) | 27 (9,6) | 0,5 | 32 (15 ) | 0,05 |
| AIDS | 2 (2) | 2 (0.7) | 0,27 | 0 | 0,1 |
| Гепатобилиарная болезнь | 16 (16,6) | 40 (14,3) | 0,8 | 31 (14,5) | 0,71 |
| Оценка по Чарлсону, коморбидность | 3,17 | 2,66 | 0,07 | ||
| Факторы риска, связанные с больницей | |||||
| Перевод из другого учреждения | 34 (34.3) | 102 (36,4) | 0,5 | 34 (16) | <0,001 |
| Операция | 29 (29,3) | 94 (33,6) | 0,08 | 90 (42,3) | 0,03 |
| Поступление в ОИТ | 26 (26,2) | 58 (20,7) | 0,9 | 53 (33,3) | 0,8 |
Таблица A5
Исследование 2, скорректированные модели результатов для ванкомицина- резистентная энтерококковая раневая инфекция по сравнению с неинфицированными контрольными пациентами a
| Переменная | Смертей b | Продолжительность пребывания c | 10 d | 10 d | ||
|---|---|---|---|---|---|---|
| OR (95% CI) | Переменная | OR e (95% CI) | Переменная | OR e (95% CI) | Инфекция VRE | 2.0 (0,8–5,2) | Инфекция VRE | 1,8 (1,3–2,4) | Инфекция VRE | 1,5 (1,3, 1,8) |
| Перевод из другой больницы | 1,5 (1,2–1,9) | Операция e | 1,4 (1,1, 1,8) | |||
| Заболевание почек | 2,0 (1,5–2,7) | |||||
| Злокачественная опухоль | 7 (от 0,5 до 0,9) | |||||
| Пребывание в отделении интенсивной терапии f | 2,3 (1,6 до 3,3) |
Таблица A6
Исследование9000 скорректированные модели исходов для ванкомицин-резистентного энтерококка (VRE) раневой инфекции по сравнению с контрольными пациентами с раневой инфекцией, вызванной чувствительным к ванкомицину энтерококком (VSE) a
| Переменная | Смерть 925 b | Продолжительность пребывания c | Стоимость d | ||
|---|---|---|---|---|---|
| Отношение шансов (OR) (95% доверительный интервал [CI]) | Переменная | OR e (95% CI) | Переменная | OR e (95% ДИ) | |
| VRE | 2.5 (1,1, 6,1) | VRE | 1,1 (0,9, 1,4) | VRE | 1,4 (1,2, 1,6) |
| Пребывание в отделении интенсивной терапии (ICU) f | 9,0 (3,0, 27,4) | Пребывание в отделении интенсивной терапии f | 1.8 (1.3, 2.5) | Хирургия f | 1.2 (1.1, 1.3) |
Сноски
Рекомендуемая ссылка на эту статью : Kaye SK, Engemann JJ , Mozaffari E, Carmeli Y. Выбор контрольной группы и результаты исследования устойчивости к антибиотикам.Emerg Infect Dis [сериал в Интернете]. Июнь 2004 г. [, дата цитирования ]. http://dx.doi.org/10.3201/eid1006.020665
Ссылки
1. Cosgrove SE, Carmeli Y Влияние устойчивости к противомикробным препаратам на здоровье и экономические результаты. Clin Infect Dis. 2003; 36: 1433–7. 10.1086 / 375081 [PubMed] [CrossRef] [Google Scholar] 2. Chaix C, Дюран-Залески I, Альберти C, Брун-Бюиссон C Борьба с эндемичным метициллин-устойчивым Staphylococcus aureus : анализ затрат и выгод в отделении интенсивной терапии.ДЖАМА. 1999; 282: 1745–51. 10.1001 / jama.282.18.1745 [PubMed] [CrossRef] [Google Scholar] 3. Эдмонд МБ, Обер Дж.Ф., Доусон Дж.Д., Вайнбаум Д.Л., Венцель Р.П. Устойчивая к ванкомицину энтерококковая бактериемия: естественное течение и смертность. Clin Infect Dis. 1996; 23: 1234–9. 10.1093 / Clinids / 23.6.1234 [PubMed] [CrossRef] [Google Scholar] 4. Менон К.В., Уайтли М.С., Бёрден П., Галланд РБ Хирургические пациенты с метициллинорезистентной инфекцией Staphylococcus aureus : анализ результатов с помощью P-POSSUM.J R Coll Surg Edinb. 1999; 44: 161–3 [PubMed] [Google Scholar] 5. Монтекальво М.А., Джарвис В.Р., Уман Дж., Шай Д.К., Петрулло С., Горовиц Х.В. и др. Затраты и экономия, связанные с мерами инфекционного контроля, снижающими передачу устойчивых к ванкомицину энтерококков в эндемичных условиях. Инфекционный контроль Hosp Epidemiol. 2001; 22: 437–42. 10.1086 / 501931 [PubMed] [CrossRef] [Google Scholar] 6. Ньюэлл К.А., Миллис Дж.М., Арноу П.М., Брюс Д.С., Вудл Е.С., Кронин Д.К. и др. Частота и исход инфекции, вызванной устойчивым к ванкомицину Enterococcus после ортотопической трансплантации печени.Трансплантация. 1998; 65: 439–42. 10.1097 / 00007890-199802150-00027 [PubMed] [CrossRef] [Google Scholar] 7. Абрамсон М.А., Sexton DJ Нозокомиальная метициллин-резистентная и метициллин-чувствительная Staphylococcus aureus Первичная бактериемия: какой ценой? Инфекционный контроль Hosp Epidemiol. 1999; 20: 408–11. 10.1086 / 501641 [PubMed] [CrossRef] [Google Scholar] 8. Обуртин М., Порчер Р., Брюнель Ф., Сканвик А., Труйе Дж. Л., Бедос Дж. П. и др. Пневмококковый менингит в отделении интенсивной терапии: факторы прогноза клинического исхода в серии из 80 случаев.Am J Respir Crit Care Med. 2002; 165: 713–7 [PubMed] [Google Scholar] 9. Кармели Ю., Элиопулос Г., Мозаффари Е., Саморе М. Здоровье и экономические результаты устойчивых к ванкомицину энтерококков. Arch Intern Med. 2002; 162: 2223–8. 10.1001 / archinte.162.19.2223 [PubMed] [CrossRef] [Google Scholar] 10. Engemann JJ, Carmeli Y, Cosgrove SE, Fowler VG, Bronstein MZ, Trivette SL и др. Неблагоприятные клинические и экономические результаты, связанные с резистентностью к метициллину, у пациентов с инфекцией области хирургического вмешательства Staphylococcus aureus .Clin Infect Dis. 2003; 36: 592–8. 10.1086 / 367653 [PubMed] [CrossRef] [Google Scholar] 11. Харбарт С., Рутшманн О, Судре П., Питте Д. Влияние устойчивости к метициллину на исход пациентов с бактериемией, вызванной Staphylococcus aureus. Arch Intern Med. 1998; 158: 182–9. 10.1001 / archinte.158.2.182 [PubMed] [CrossRef] [Google Scholar] 12. Стозор В., Петерсон Л. Р., Постельник М., Носкин Г. А. Enterococcus faecium Бактериемия: имеет ли значение устойчивость к ванкомицину? Arch Intern Med.1998; 158: 522–7. 10.1001 / archinte.158.5.522 [PubMed] [CrossRef] [Google Scholar] 13. Vergis EN, Hayden MK, Chow JW, Snydman DR, Zervos MJ, Linden PK и др. Детерминанты устойчивости к ванкомицину и смертности при энтерококковой бактериемии. Проспективное многоцентровое исследование. Ann Intern Med. 2001; 135: 484–92 [PubMed] [Google Scholar] 14. Ховард Д., Корделл Р., Макгоуэн Дж. Э. мл., Паккард Р. М., Скотт Р. Д., Соломон С. Л. и др. Измерение экономических затрат на устойчивость к противомикробным препаратам в больницах: резюме семинара Центров по контролю и профилактике заболеваний — Эмори.Clin Infect Dis. 2001; 33: 1573–8. 10.1086 / 323758 [PubMed] [CrossRef] [Google Scholar] 15. Алсуб Х., Увайда А. К., Матар I, Зебейб М., Эльхаг К. М. Клиническое сравнение брюшного тифа, вызванного чувствительными штаммами с множественной лекарственной устойчивостью Salmonella typhi. Br J Clin Pract. 1997; 51: 8–10 [PubMed] [Google Scholar] 16. Ардити М., Мейсон Е.О. младший, Брэдли Дж. С., Тан Т. К., Барсон В. Дж., Шутце Г. Е. и др. Трехлетнее многоцентровое наблюдение за пневмококковым менингитом у детей: клинические характеристики и исходы, связанные с чувствительностью к пенициллину и применением дексаметазона.Педиатрия. 1998; 102: 1087–97. 10.1542 / peds.102.5.1087 [PubMed] [CrossRef] [Google Scholar] 17. Бхавнани С.М., Дрейк Дж. А., Форрест А., Дейнхарт Дж. А., Джонс Р. Н., Биденбах Д. Д. и др. Общенациональное многоцентровое исследование случай-контроль, сравнивающее факторы риска, лечение и исходы резистентной к ванкомицину и чувствительной к энтерококковой бактериемии. Диагностика Microbiol Infect Dis. 2000; 36: 145–58. 10.1016 / S0732-8893 (99) 00136-4 [PubMed] [CrossRef] [Google Scholar] 18. Buckingham SC, McCullers JA, Lujan-Zilbermann J, Knapp KM, Orman KL, English BK Пневмококковый менингит у детей: взаимосвязь устойчивости к антибиотикам с клиническими характеристиками и исходами.Pediatr Infect Dis J. 2001; 20: 837–43. 10.1097 / 00006454-200109000-00003 [PubMed] [CrossRef] [Google Scholar] 19. Чанг В.Н., Лу Ч., Ву Дж.Дж., Чанг Х.В., Цай Ю.С., Чен Ф.Т. и др. Staphylococcus aureus Менингит у взрослых: клиническое сравнение инфекций, вызванных метициллин-резистентными и метициллин-чувствительными штаммами. Инфекция. 2001; 29: 245–50. 10.1007 / s15010-001-1092-z [PubMed] [CrossRef] [Google Scholar] 20. Контерно ЛО, Вей С.Б., Каштелу А Факторы риска смерти при бактериемии Staphylococcus aureus .Инфекционный контроль Hosp Epidemiol. 1998; 19: 32–7. 10.1086 / 647704 [PubMed] [CrossRef] [Google Scholar] 21. Craven DE, Kollisch NR, Hsieh CR, Connolly MG Jr, McCabe WR Лечение ванкомицином бактериемии, вызванной оксациллин-резистентным Staphylococcus aureus : сравнение с лечением бета-лактамным антибиотиком бактериемии, вызванной оксациллин-чувствительным Staphylococcus aureus. J Infect Dis. 1983; 147: 137–43. 10.1093 / infdis / 147.1.137 [PubMed] [CrossRef] [Google Scholar] 22. Эйнарссон С., Кристьянссон М., Кристинссон К.Г., Кьяртанссон Г., Йонссон С. Пневмония, вызванная нечувствительными к пенициллину и чувствительными к пенициллину пневмококками у взрослых: исследование случай-контроль.Scand J Infect Dis. 1998; 30: 253–6. 10.1080 / 00365549850160882 [PubMed] [CrossRef] [Google Scholar] 23. Французский GL, Cheng AF, Ling JM, Mo P, Donnan S Гонконгские штаммы метициллин-резистентных и метициллин-чувствительных Staphylococcus aureus обладают сходной вирулентностью. J Hosp Infect. 1990; 15: 117–25. 10.1016 / 0195-6701 (90)[PubMed] [CrossRef] [Google Scholar] 38. Roghmann MC Прогнозирование устойчивости к метициллину и влияние неадекватной эмпирической терапии на выживаемость у пациентов с бактериемией Staphylococcus aureus .Arch Intern Med. 2000; 160: 1001–4 10.1001 / archinte.160.7.1001 [PubMed] [CrossRef] [Google Scholar] 39. Ромеро-Вивас Дж., Рубио М, Фернандес К., Пиказо Дж. Дж. Смертность, связанная с внутрибольничной бактериемией, вызванной устойчивостью к метициллину Staphylococcus aureus. Clin Infect Dis. 1995; 21: 1417–23. 10.1093 / Clinids / 21.6.1417 [PubMed] [CrossRef] [Google Scholar] 40. Роуленд К.Э., Тернидж Д.Д. Влияние устойчивости к пенициллину на исход инвазивной инфекции Streptococcus pneumoniae у детей.Aust N Z J Med. 2000; 30: 441–9. 10.1111 / j.1445-5994.2000.tb02049.x [PubMed] [CrossRef] [Google Scholar] 41. Селви Л.А., Уитби М., Джонсон Б. Нозокомиальная метициллин-резистентная Staphylococcus aureus бактериемия: хуже ли она, чем внутрибольничная метициллин-чувствительная Staphylococcus aureus бактериемия? Инфекционный контроль Hosp Epidemiol. 2000; 21: 645–8. 10.1086 / 501707 [PubMed] [CrossRef] [Google Scholar] 42. Сильверштейн М., Бачур Р., Харпер М.Б. Клинические последствия резистентности к пенициллину и цефтриаксону у детей с пневмококковой бактериемией.Pediatr Infect Dis J. 1999; 18: 35–41. 10.1097 / 00006454-199
Оценка качества стационарного лечения в национальной больнице при сепсисе (SEP-1): Рекомендации рабочей группы с участием многих заинтересованных сторон по подходящим антибиотикам для лечения сепсиса | Клинические инфекционные болезни
Аннотация
Центр услуг Medicare и Medicaid в июле 2015 года включил в Программу отчетности по качеству стационарных больных в больницах Пакет раннего лечения, тяжелый сепсис / септический шок (SEP-1), чтобы помочь решить проблему высокой смертности и высоких затрат, связанных с сепсисом.Показатель эффективности SEP-1 требует, помимо других критических вмешательств, своевременного назначения антибиотиков пациентам с сепсисом или септическим шоком. Рабочая группа с участием многих заинтересованных сторон признает необходимость SEP-1, но твердо убеждена в том, что несколько антибиотиков, перечисленных в таблицах антибиотиков для SEP-1, не подходят, и использование этих антибиотиков, как это предусмотрено мерой SEP-1, не согласуется с разумное использование противомикробных препаратов. Чтобы способствовать правильному использованию противомикробных препаратов и бороться с устойчивостью к противомикробным препаратам, рабочая группа предоставляет рекомендации по соответствующим антибиотикам для лечения сепсиса.
Согласно статистическому бюллетеню № 204 проекта «Стоимость и использование здравоохранения», сепсис был самым дорогостоящим лечением среди всех плательщиков и второй по частоте причиной госпитализации в 2013 г. [1]. Устойчивые к антибиотикам инфекции усугубили проблемы оптимального лечения сепсиса, вызывая 2 миллиона заболеваний и около 23000 смертей ежегодно в Соединенных Штатах [2]. Учитывая затраты, а также высокий уровень смертности (182 242 случая смерти от сепсиса в 2014 г.), необходимы целенаправленные усилия для улучшения результатов лечения сепсиса.
В историческом исследовании 2001 г. Rivers et al. Продемонстрировали, что ранняя целенаправленная терапия тяжелого сепсиса и септического шока в отделении неотложной помощи оказала значительное влияние на смертность [3]. В результате полученных результатов и при поддержке Кампании по борьбе с сепсисом доктор Риверс и его соответствующее учреждение, больница Генри Форда, сотрудничали с Обществом реаниматологии (SCCM), Американским обществом инфекционных болезней (IDSA) и врачами скорой помощи, чтобы разработать критерий качества «Тяжелый сепсис и септический шок: пакет управления» (SEP-1) [4].С целью поддержки действенного, действенного и своевременного оказания высококачественной помощи при сепсисе в июле 2015 года Центры медицинских услуг и услуг Medicaid ( CMS) со сроком исполнения с октября 2016 г. [5].
SEP-1 — это составная мера с абстрагированием из диаграммы, которая рассчитывает эффективность на основе завершения нескольких вмешательств в соответствии со спецификациями меры SEP-1, подробно описанными в Руководстве по спецификациям для национальных стационарных показателей качества стационарных пациентов, опубликованном Объединенной комиссией.Спецификации меры SEP-1 включают, среди других жизненно важных аспектов лечения сепсиса, своевременное введение определенного перечисленного антибиотика широкого спектра действия [6]. Это требование является серьезной проблемой для многих медицинских специализированных обществ и привело к совместному письму Американского колледжа врачей неотложной помощи (ACEP), SCCM и IDSA в CMS [7] в августе 2015 года, в котором подчеркивались непредвиденные последствия требования администрации конкретных перечисленных антибиотиков широкого спектра действия для пациентов с тяжелым сепсисом, у которых имеется известная инфекция, которая лучше реагировала бы на конкретный антибиотик или антибиотики, не указанные в прилагаемых таблицах.Решая эти проблемы, в июле 2016 года CMS внесла поправки в элемент данных SEP-1 «Выбор введения антибиотика широкого спектра действия или другого антибиотика», включив в него следующую формулировку:
«Если антибиотик внутривенно из таблицы 5.0 или соответствующая комбинация антибиотики из Таблицы 5.1 не начинаются и не назначаются в течение 3 часов после появления тяжелого сепсиса, но имеется отчет лаборатории или документация врача / APN / PA, указывающая, что возбудитель и чувствительность известны (см. исключение для Clostridium difficile ) и внутривенный антибиотик, определенный как подходящий для лечения возбудителя болезни, вводится в течение 3 часов после появления тяжелого сепсиса, выберите значение «1».”[6]
Мы ценим действия, предпринятые CMS, чтобы позволить врачам принимать индивидуальные клинические решения при лечении пациентов с сепсисом. Мы согласны с необходимостью SEP-1 и требованием к нему своевременного назначения соответствующих антибиотиков пациентам с сепсисом или септическим шоком. Однако мы полагаем, что не все антибиотики, перечисленные в SEP-1 (Таблица 5.0: Монотерапия антибиотиками, сепсис, Таблица комбинированной антибиотикотерапии; Таблица 5.1: Переход на универсальный антибиотик / торговое название), являются подходящими, и что использование антибиотиков описано меры SEP-1 не всегда соответствуют разумному контролю над противомикробными препаратами.Мы также осознаем сложность ситуации, которую CMS должна решить, чтобы снизить высокий уровень смертности и расходы, связанные с сепсисом. Необходимо найти тонкий баланс между использованием показателей клинического качества для стандартизации помощи в соответствии с передовой практикой, а также предоставлением врачам возможности применить свой клинический опыт для решения уникальных клинических ситуаций, с которыми они сталкиваются.
Хотя это исключение необходимо и не наказывает больницы или врачей за введение антибиотика, не указанного в таблицах антибиотиков SEP-1, необходимы дальнейшие усилия по продвижению практики использования противомикробных препаратов для борьбы с растущими проблемами устойчивости к антибиотикам, нежелательных лекарственных препаратов. события и повышенный риск C.difficile инфекции. Эта необходимость была подчеркнута в Национальном плане действий по борьбе с устойчивыми к антибиотикам бактериями, разработанном Белым домом в марте 2015 года [8], а также в предлагаемом правиле для условий участия в больницах Medicare и Medicaid, опубликованном в июне 2016 года [9].
МОДИФИКАЦИЯ ТАБЛИЦ АНТИБИОТИКОВ ДЛЯ ПРОЦЕССА И РЕЗУЛЬТАТОВ РАБОЧЕЙ ГРУППЫ SEP-1
Признавая необходимость содействия разумному использованию антибиотиков при лечении сепсиса, IDSA созвала в мае 2016 года рабочую группу с участием многих заинтересованных сторон для решения вышеупомянутых проблем.Модификация таблиц антибиотиков для рабочей группы SEP-1 (MATS WG) состояла из 1 представителя от ACEP, 2 от SCCM, 1 от Общества больничной медицины и 2 от IDSA с целью повышения безопасности пациентов путем содействия оптимальному использованию. антибиотиков. Конкретные цели рабочей группы MATS заключались в том, чтобы оценить и при необходимости пересмотреть содержание таблиц антибиотиков, приведенных в SEP-1, чтобы обеспечить соответствующее эмпирическое лечение сепсиса.
Чтобы оценить текущие таблицы антибиотиков, указанные для SEP-1 (Таблица 5.0: монотерапия антибиотиками, сепсис, таблица комбинированной антибиотикотерапии; Таблица 5.1: Пересечение дженериков / торговых наименований антибиотиков, Сепсис), членов Рабочей группы MATS попросили заполнить анкету, подтверждающую их одобрение или неодобрение для каждого антибиотика, перечисленного в Таблице 5.0, и каждой комбинации классов антибиотиков, перечисленных в Таблице комбинированной антибиотикотерапии. Помимо распространения опроса среди рабочей группы MATS, была запрошена обратная связь от заинтересованных сторон, не являющихся рабочими группами, в каждом соответствующем профессиональном сообществе.
Всего в опросе приняли участие 12 респондентов. В Таблице 5.0 было проанализировано 14 антибиотиков. Из 14 монотерапевтических антибиотиков 9 получили одобрение большинства респондентов, 3 антибиотика не были одобрены (ампициллин-сульбактам, левофлоксацин, моксифлоксацин) и 2 антибиотика (эртапенем, тикарциллин-клавуланат) получили одинаковое количество голосов как одобрение, так и неодобрение. Респонденты опроса указали на общую обеспокоенность высокой устойчивостью к антибиотикам, почему ампициллин-сульбактам, левофлоксацин и моксифлоксацин не были одобрены. Устойчивость Escherichia coli к ампициллин-сульбактаму наблюдалась в многочисленных исследованиях [10–13]. Было показано, что левофлоксацин эффективен против многих патогенов, а именно пневмонии, вызываемой видом Haemophilus [14]; однако устойчивость к левофлоксацину наблюдалась у Haemophilus influenzae [15, 16], Pseudomonas aeruginosa и E. coli [17]. Точно так же было показано, что моксифлоксацин имеет очень высокие показатели устойчивости у C.difficile [18]. Что касается антибиотиков, которые привели к ничьей, рабочая группа MATS снова была опрошена, чтобы достичь консенсуса только по эртапенему, поскольку тикарциллин-клавуланат (тиментин) был прекращен из-за проблем с безопасностью [19]. В конечном итоге Эртапенем был одобрен для включения рабочей группой. Респондентов также попросили предоставить предложения по монотерапии антибиотиками, не указанными в таблице 5.0. Рабочая группа MATS предложила 2 антибиотика для включения в пересмотренную Таблицу 5.0 (цефтазидим-авибактам, цефтолозан-тазобактам).
Таблица комбинированной антибиотикотерапии позволяет использовать в общей сложности 21 комбинацию класса антибиотиков. Из общего количества комбинаций 10 были одобрены большинством респондентов. Комбинации класса антибиотиков, не одобренные для эмпирического лечения сепсиса, состояли из любых комбинаций с макролидами или ципрофлоксацином, а также конкретных комбинаций азтреонама с цефалоспоринами и аминогликозидов с внутривенным клиндамицином. Макролидные антибиотики, которые преимущественно назначаются в качестве первой линии лечения внебольничных инфекций дыхательных путей, вызванных Mycoplasma pneumoniae , обладают высокой устойчивостью у M.pneumoniae в Азии и умеренный уровень резистентности в Европе и США [20]. Кроме того, устойчивость к макролидам у Streptococcus pneumoniae неуклонно растет с 1990-х годов [21]. Наконец, макролидный антибиотик телитромицин (Кетек), указанный в таблице 5.1 для SEP-1, был прекращен по коммерческим причинам [22]. У ципрофлоксацина также наблюдается увеличение клинической неэффективности, особенно при нозокомиальной грамотрицательной бактериемии [23]. Кроме того, как часть более крупного класса фторхинолонов к антибиотикам, устойчивость к ципрофлоксацину остается высокой среди многих изолятов, включая устойчивый к метициллину Staphylococcus aureus , P.aeruginosa , E. coli , анаэробы и другие патогены, обнаруженные в отделениях интенсивной терапии [24]. В связи с уменьшением эффективности доступных антибиотиков и нехваткой разработки новых антибиотиков ограничение использования эффективных антибиотиков с относительно низким уровнем резистентности является обязательным для сохранения эффективных антибиотиков. Обеспокоенность по поводу увеличения резистентности и адекватного охвата патогенов была названа причиной того, почему комбинации азтреонама [25] с цефалоспоринами [26] и аминогликозидов [27] с внутривенным (IV) клиндамицином [28] не были одобрены рабочей группой.Более того, комбинация аминогликозидов и клиндамицина IV была предложена как менее эффективная при лечении внутрибрюшных инфекций по сравнению с β-лактамными антибиотиками, а также опасения по поводу возможных побочных эффектов, включая нефротоксичность, ототоксичность и псевдомембранозный колит [29 ].
МОДИФИКАЦИЯ ТАБЛИЦ АНТИБИОТИКОВ ДЛЯ РЕКОМЕНДАЦИЙ РАБОЧЕЙ ГРУППЫ SEP-1
В результате работы Рабочей группы MATS мы с уважением даем свои рекомендации по Таблице 5.0: Монотерапия антибиотиками в Таблице 1, Таблица комбинированной антибиотикотерапии в Таблице 2 и Таблица 5.1: Пересечение родовых антибиотиков / торговых наименований в Таблице 3. Рекомендации рабочей группы MATS приведены рядом со спецификациями антибиотиков SEP-1, подробно описанными в Руководстве по спецификациям для показателей качества стационарных больных в национальных больницах Выписки с 1 июля 2016 г. (3 квартал 2016 г.) по 31 декабря 2016 г. (4 квартал 2016 г.) версия 5.1.
Таблица 1.Сравнение модификации таблиц антибиотиков для тяжелого сепсиса и септического шока: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для таблицы 5.0: Антибиотики для монотерапии, сепсис Версия 5.1
| Версия 5.1 Антибиотики для монотерапии для общего названия SEP-1 . | MATS WG Рекомендации Общее название . |
|---|---|
| Ампициллина / сульбакты | Удалены |
| Цефепят | Цефепит |
| Цефотаксит | Цефотаксит |
| Цефтаролина fosamil | Цефтаролина fosamil |
| Цефтазидит | цефтазидят |
| цефтриаксон | цефтриаксон |
| Дорипенем | Дорипенем |
| Эртапенем | Эртапенем |
| имипенем / циластатин | имипенем-циластатин |
| левофлоксацин | Удалены |
| Меропенем | Меропенем |
| Моксифлоксацин | Удален |
| Пиперациллин-тазобактам | Пиперациллин-тазобактам |
| Тикарциланин-клавуланин | Удалено |
| … | Цефтазидим-авибактам |
| … | Цефтолозан-тазобактам |
| Версия 5.1 Монотерапевтические антибиотики для общего названия SEP-1 . | MATS WG Рекомендации Общее название . |
|---|---|
| Ампициллина / сульбакты | Удалены |
| Цефепят | Цефепит |
| Цефотаксит | Цефотаксит |
| Цефтаролина fosamil | Цефтаролина fosamil |
| Цефтазидит | цефтазидят |
| цефтриаксон | цефтриаксон |
| Дорипенем | Дорипенем |
| Эртапенем | Эртапенем |
| имипенем / циластатин | имипенем-циластатин |
| левофлоксацин | Удалены |
| Меропенем | Меропенем |
| Моксифлоксацин | Удален |
| Пиперациллин-тазобактам | Пиперациллин-тазобактам |
| Тикарциланин-клавуланин | Удалено |
| … | Цефтазидим-авибактам |
| … | Цефтолозан-тазобактам |
Сравнение модификации таблиц антибиотиков для тяжелого сепсиса и септического шока: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для таблицы 5.0: Антибиотики для монотерапии, версия 5.1 для сепсиса
| Версия 5.1 Антибиотики для монотерапии для генерика SEP-1 Имя . | MATS WG Рекомендации Общее название . |
|---|---|
| Ампициллина / сульбакты | Удалены |
| Цефепят | Цефепит |
| Цефотаксит | Цефотаксит |
| Цефтаролина fosamil | Цефтаролина fosamil |
| Цефтазидит | цефтазидят |
| цефтриаксон | цефтриаксон |
| Дорипенем | Дорипенем |
| Эртапенем | Эртапенем |
| имипенем / циластатин | имипенем-циластатин |
| левофлоксацин | Удалены |
| Меропенем | Меропенем |
| Моксифлоксацин | Удален |
| Пиперациллин-тазобактам | Пиперациллин-тазобактам |
| Тикарциланин-клавуланин | Удалено |
| … | Цефтазидим-авибактам |
| … | Цефтолозан-тазобактам |
| Версия 5.1 Монотерапевтические антибиотики для общего названия SEP-1 . | MATS WG Рекомендации Общее название . |
|---|---|
| Ампициллина / сульбакты | Удалены |
| Цефепят | Цефепит |
| Цефотаксит | Цефотаксит |
| Цефтаролина fosamil | Цефтаролина fosamil |
| Цефтазидит | цефтазидят |
| цефтриаксон | цефтриаксон |
| Дорипенем | Дорипенем |
| Эртапенем | Эртапенем |
| имипенем / циластатин | имипенем-циластатин |
| левофлоксацин | Удалены |
| Меропенем | Меропенем |
| Моксифлоксацин | Удален |
| Пиперациллин-тазобактам | Пиперациллин-тазобактам |
| Тикарциланин-клавуланин | Удалено |
| … | Цефтазидим-авибактам |
| … | Цефтолозан-тазобактам |
Сравнение модификации таблиц антибиотиков для тяжелого сепсиса и септического шока: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для комбинированной антибиотикотерапии. Таблица Версия 5.1
| Версия 5.1 Таблица комбинированной антибиотикотерапии для SEP-1 . | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Колонка A | Колонка B | ||||||||
| Аминогликозиды OR | + | Цефалоспорины (первое и второе поколение) OR | |||||||
| Aztreonam OR | |||||||||
Aztreonam OR29 | 9troplocin | 000 9t ИЛИ||||||||
| Гликопептиды ИЛИ | |||||||||
| Линезолид ИЛИ | |||||||||
| Макролиды ИЛИ | |||||||||
| Пенициллины | |||||||||
| MATS WG Комбинированная антибиотикотерапия Столбец Рекомендации | 490000009000 ORКолонка A | Колонка B | |||||||
| Аминогликозиды | + | Цефалоспорины OR | Азтреонам | + | Даптомицин | Гликопептиды ИЛИ | Линезолид ИЛИ | ||
| Линезолид ИЛИ | Пенициллины ИЛИ | ||||||||
| Пенициллины | Клиндамицин IV | ||||||||
| Версия 50003 | .1 Таблица комбинированной антибиотикотерапии для SEP-1 . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Колонка A | Колонка B | ||||||||||||
| Аминогликозиды OR | + | Цефалоспорины (первое и второе поколение) OR | |||||||||||
| Aztreonam OR | |||||||||||||
Aztreonam OR29 | 9troplocin | 000 9t ИЛИ||||||||||||
| Гликопептиды ИЛИ | |||||||||||||
| Линезолид ИЛИ | |||||||||||||
| Макролиды ИЛИ | |||||||||||||
| Пенициллины | |||||||||||||
| MATS WG Комбинированная антибиотикотерапия Столбец Рекомендации | 490000009000 ORКолонка A | Колонка B | |||||||||||
| Аминогликозиды | + | Цефалоспорины OR | Азтреонам | + | Даптомицин | Гликопептиды ИЛИ | Линезолид ИЛИ | ||||||
| Линезолид ИЛИ | Пенициллины ИЛИ | ||||||||||||
| Пенициллины | Клиндамицин IV | ||||||||||||
Сравнение модификации таблиц антибиотиков для тяжелого сепсиса и септического шока: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для комбинированной антибиотикотерапии. Таблица Версия 5.1
| Версия 5.1 Таблица комбинированной антибиотикотерапии для SEP-1 . | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Колонка A | Колонка B | ||||||||
| Аминогликозиды OR | + | Цефалоспорины (первое и второе поколение) OR | |||||||
| Aztreonam OR | |||||||||
Aztreonam OR29 | 9troplocin | 000 9t ИЛИ||||||||
| Гликопептиды ИЛИ | |||||||||
| Линезолид ИЛИ | |||||||||
| Макролиды ИЛИ | |||||||||
| Пенициллины | |||||||||
| MATS WG Комбинированная антибиотикотерапия Столбец Рекомендации | 490000009000 ORКолонка A | Колонка B | |||||||
| Аминогликозиды | + | Цефалоспорины OR | Азтреонам | + | Даптомицин | Гликопептиды ИЛИ | Линезолид ИЛИ | ||
| Линезолид ИЛИ | Пенициллины ИЛИ | ||||||||
| Пенициллины | Клиндамицин IV | ||||||||
| Версия 50003 | .1 Таблица комбинированной антибиотикотерапии для SEP-1 . | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Колонка A | Колонка B | ||||||||||||
| Аминогликозиды OR | + | Цефалоспорины (первое и второе поколение) OR | |||||||||||
| Aztreonam OR | |||||||||||||
Aztreonam OR29 | 9troplocin | 000 9t ИЛИ||||||||||||
| Гликопептиды ИЛИ | |||||||||||||
| Линезолид ИЛИ | |||||||||||||
| Макролиды ИЛИ | |||||||||||||
| Пенициллины | |||||||||||||
| MATS WG Комбинированная антибиотикотерапия Столбец Рекомендации | 490000009000 ORКолонка A | Колонка B | |||||||||||
| Аминогликозиды | + | Цефалоспорины OR | Азтреонам | + | Даптомицин | Гликопептиды OR | Линезолид OR | ||||||
| Линезолид OR | Пенициллины OR | ||||||||||||
| Пенициллины | Клиндамицин IV | ||||||||||||
Сравнение модификации таблиц антибиотиков при тяжелом сепсисе и септическом шоке: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для таблицы 5.1: Переход на общий антибиотик / торговое название, версия 5.1 для сепсиса
| Версия 5.1 Общий переход на антибиотик для общего имени SEP-1 . | MATS WG Рекомендации Общее название . + | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Аминогликозиды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Амикацин | Амикацин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Garamycin | Удалены | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гентамицин | Гентамицин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| канамицин | канамицин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kantrex | Удалены | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nebcin | Удалены | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| тобрамицина | тобрамицина | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азтреонам | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azactam | Удалены | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азтреонам | Азтреонам | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефалоспорины | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Анцеф | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефазолин | Цефазолин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефотан | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефотетан | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефокситин | Цефокситин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефтин | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цефуроксим | Цефуроксим2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удалено | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciprobay | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ципрофлоксацин | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciproxin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciproxin | 9000 Clever | 9000 Cleans | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Клиндамицин | Клиндамицин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Даптомицин | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кубицин | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Даптомицин | Даптомицин в | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гликопептиды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таргоцид | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тейкопланин | Тейкопланин | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Телаванцин | Ремо | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
0003 | 00030005000300050003000500030005 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vibativ | Удалено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Линезолид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Линезолид | Линезолид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zyvox | cin12 Удалено| cin12 | Эритроцин | Удалено | Эритромицин | Удалено | Erythroped | Удалено | Ketek | Удалено | Сумамед | Удалено | Телитромицин | Удалено | Xithrone | 000 9 | Пенициллин | Ампициллин | Ампициллин | Нафциллин | Нафциллин | Оксациллин | Оксациллин | 90001 Общий переход антибиотика для общего названия SEP-1 . MATS WG Рекомендации Общее название
. + | Аминогликозиды | Амикацин | Амикацин | Garamycin | Удалены | Гентамицин | Гентамицин | канамицин | канамицин | Kantrex | Удалены | Nebcin | Удалены | тобрамицина | тобрамицина | Азтреонам | Azactam | Удалены | Азтреонам | Азтреонам | Цефалоспорины | Анцеф | Удалено | Цефазолин | Цефазолин | Цефотан | Удалено | Цефотетан | Удалено | Цефокситин | Цефокситин | Цефтин | Удалено | Цефуроксим | Цефуроксим | 2 Удалено | Ciprobay | Удалено | Ципрофлоксацин | Удалено | Ciproxin | Ciproxin | 9000 Clever | 9000 Cleans | Клиндамицин | Клиндамицин | Даптомицин | Кубицин | Удалено | Даптомицин | Даптомицин в | Гликопептиды | Таргоцид | Удалено | Тейкопланин | Тейкопланин | Телаванцин | Ремо | 0003 00030005000300050003000500030005 Vibativ | Удалено | Линезолид | Линезолид | Линезолид | Zyvox | cin12 Удалено | cin12 | Эритроцин | Удалено | Эритромицин | Удалено | Erythroped | Удалено | Ketek | Удалено | Сумамед | Удалено | Телитромицин | Удалено | Xithrone | 000 0 9 | Пенициллин | Ампициллин | Ампициллин | Нафциллин | Нафциллин | Оксациллин | Оксациллин 3121 | Сравнение модификации таблиц антибиотиков при тяжелом сепсисе и септическом шоке: пакет управления (SEP-1) Рекомендации рабочей группы со спецификациями антибиотиков для таблицы 5.1: Переход на общий антибиотик / торговое название, версия 5.1 для сепсиса
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 В качестве лекарственных средств они употребляются для борьбы с заболеваниями, которые вызваны болезнетворными микроорганизмами.
В качестве лекарственных средств они употребляются для борьбы с заболеваниями, которые вызваны болезнетворными микроорганизмами. Александром Флемингом, относится к классу бета-лактамных антибиотиков. Из известных антибиотиков используется лишь малая часть, не более 5%, поскольку большинство из ранее открытых антибиотиков стали бесполезны из-за антибиотикорезистентности, т. е. сопротивления микроорганизмов к антибиотикам.
Александром Флемингом, относится к классу бета-лактамных антибиотиков. Из известных антибиотиков используется лишь малая часть, не более 5%, поскольку большинство из ранее открытых антибиотиков стали бесполезны из-за антибиотикорезистентности, т. е. сопротивления микроорганизмов к антибиотикам.
 к. в лабораторных опытах еще ни разу не удалось выявить появления резистентности к нему у болезнетворных бактерий. Однако лечить им вряд ли начнут раньше, чем через 10 лет из-за необходимого цикла проверок. Кроме того, это первый открытый класс антибиотиков за последние несколько лет, и этого просто мало. Находить и испытывать новые антибиотики очень дорого, поэтому фармацевтические компании в настоящее время очень неохотно берутся за это дело. Исправить это можно только коренной реформой финансирования медицинской отрасли на мировом уровне.
к. в лабораторных опытах еще ни разу не удалось выявить появления резистентности к нему у болезнетворных бактерий. Однако лечить им вряд ли начнут раньше, чем через 10 лет из-за необходимого цикла проверок. Кроме того, это первый открытый класс антибиотиков за последние несколько лет, и этого просто мало. Находить и испытывать новые антибиотики очень дорого, поэтому фармацевтические компании в настоящее время очень неохотно берутся за это дело. Исправить это можно только коренной реформой финансирования медицинской отрасли на мировом уровне.