Дешевые аналоги дорогих антибиотиков: аналоги дорогих лекарств
Одной из самых дорогостоящих групп лекарственных препаратов, сильнее всего ударяющих по кошельку среднестатистического украинца, являются антибиотики. И если стоимость «старых» антибиотиков еще более или менее приемлема, то новые антибиотики широкого спектра действия стоят невероятно дорого, что неудивительно, ведь на разработку одного нового антибиотика тратиться приблизительно 1 млрд. долларов США.
А теперь, пораскинув немного, можно понять, что новых антибиотиков не так уж и много, ведь мало того, что на время разработки и клинические исследования уходят десятилетия, так еще и стоимость проекта равняется стоимости полета в космос. В связи с этим проводить столь дорогостоящие исследования могут лишь очень немногие фармацевтические компании США и Европы.
Так, последним из выпущенных на рынок антибиотиков является Линезолид (торговое название Зивокс), владельцем патента на него является Pfizer (для справки, эта та же компания, которая придумала и выпустила ВиаГру).
А чем же занимаются остальные фармкомпании, включая отечественные, которым не по карману такие расходы? Ответ прост – они выпускают дженерики, то есть аналоги уже давно известных антибиотиков под другим торговым названием. Стоимость данных препаратов зачастую ниже стоимости оригинального препарата, но бывают и противоположные случаи.
Еще раз разъясним, аналоги или дженерики – это препараты с тем же действующим веществом, что и оригинальный препарат, но с другим торговым названием, например ВиаГра и Дженагра.
Врачи, назначая терапию, включающую антибиотик, могут выписать как оригинальный препарат (случается реже), так и его аналог (в большинстве случаев). Причина этому – работа медицинских представителей фармкомпаний и фирм-дистрибьюторов.
Так что если врач выписал вам дорогостоящий антибиотик, не торопитесь его приобретать в ущерб бюджету. Скорее всего, у него есть более дешевый аналог, который вам может посоветовать и фармацевт в аптеке, если попросить его об этом.
Важно! При покупке аналога выписанного препарата обращайте внимание на дозу и лекарственную форму выписанного и приобретаемого вами препарата. Они должны совпадать! Исключением являются случаи, когда доза аналога препарата в таблетках (капсулах) в 2 раза меньше выписанного, тогда можно принимать по 2 таблетки (капсулы). Например, вам нужны таблетки Ципринол 500 мг, а в аптеке есть только Ципринол 250 мг.
Мы привели список аналого наиболее известных и широко используемых антибиотиков, имеющих, без преувеличения, десятки аналогов в Украине и тысячи по всему миру.
Антибиотики пенициллиновой группы
Флемоксин Солютаб, таблетки. Данный антибиотик применяется для лечения легких и неосложненных случаев бронхита, гайморита, пневмонии, язвенной болезни, цистита и др. В составе Флемоксина Солютаба содержится 125, 250, 500 или 1000 мг амоксициллина №20.
Средняя стоимость Флемоксина Солютаба таб. 250 мг №20 – 90-100 грн., 500 мг №20 – 120-160 грн. , таб. 1000 мг – 150-190 грн.
, таб. 1000 мг – 150-190 грн.
Дешевые аналоги: Оспамокс таб. 500 мг №12 и 1000 мг. №12. Средняя стоимость – 60-80 грн. и 80-110 грн. соответственно.
Амоксил таб. 250 мг №20 и 500 мг №20. Средняя стоимость – 25-35 грн. и 45-55 грн. соответственно.
Антибиотики группы ингибиторозащищенных аминопенициллинов
Флемоклав Солютаб, таблетки. Данный антибиотик применяется для лечения легких и неосложненных случаев бронхита, гайморита, пневмонии, язвенной болезни, цистита и др., вызванных вырабатывающими b-лактамазы бактериями. В составе Флемоклава Солютаба содержится 500 мг амоксициллина/125 мг клавулановой кислоты или 875 мг амоксициллина/125 мг клавулановой кислоты.
Средняя стоимость Флемоклава Солютаба таб. 500/125 мг №20 – 110-150 грн., 875/125 мг №14 – 120-150 грн.
Амоксил К-625 таб. 500/125 мг №14. Средняя стоимость – 55-70 грн.
Антибиотики группы цефалоспоринов
Эмсеф, порошок для приготовления раствора для внутримышечных инъекций. Широко применяемые инъекционный антибиотик широкого спектра действия. В составе одного флакона Эмсефа содержится 1000 мг цефтриаксона.
Широко применяемые инъекционный антибиотик широкого спектра действия. В составе одного флакона Эмсефа содержится 1000 мг цефтриаксона.
Средняя стоимость Эмсефа пор. д/приг. р-ра д/инф. 1 фл. 1000 мг – 65-85 грн.
Дешевые аналоги: Офрамакс пор. д/приг. р-ра д/инф. 1 фл. 1000 мг. Средняя стоимость – 30-50 грн.
Цефтриаксон пор. д/приг. р-ра д/инф. 1 фл. 1000 мг. Средняя стоимость – 6-10 грн.
Антибиотики группы макролидов
Сумамед, таблетки, порошок для приготовления суспензии для приема внутрь. Один из наиболее безопасных антибиотиков, разрешенный для использования детьми с 6-месяцев. В составе Сумамеда капс. содержится 250 мг азмитромицина, Сумамеда таб. содержится 500 мг азитромицина, Сумамеда порошок д/приг. сусп. д/перор. прим. содержится 100мг/5мл азитромицина.
Средняя стоимость Сумамеда капс. 250 мг №6 – 160-190 грн., Сумамеда таб. 500 мг №3 – 180-210 грн., Сумамеда порошок д/приг. сусп. д/перор. прим. 100мг/5мл – 120-140 грн.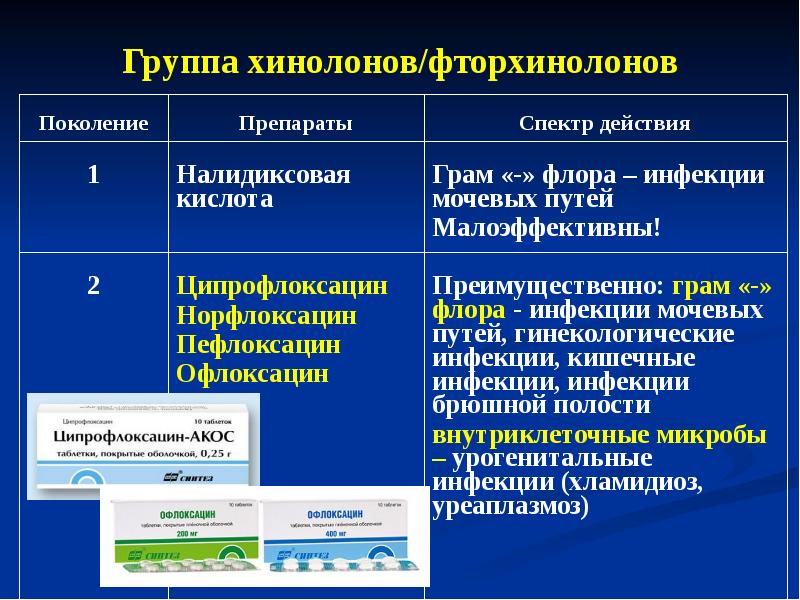
Дешевые аналоги: Ормакс порошок д/приг. сусп. д/перор. прим. 100мг/5мл. Средняя стоимость – 60-80 грн.
Азитромицин таб. 250 мг №6 и 500 мг №3. Средняя стоимость – 30-50 грн. и 35-50 грн. соответственно.
Фромилид, таблетки. Антибиотик, используемый для лечения инфекционных заболеваний дыхательных путей, отитов, инфекций кожи. В составе Фромилида таб. содержится 250 или 500 мг кларитромицина.
Средняя стоимость Фромилида таб. 250 мг №14 – 170-200 грн., Фромилида таб. 500 мг №14 – 280-330 грн.
Дешевые аналоги: Кларитромицин-Здоровье таб. 250 мг №10 и 500 мг №10. Средняя стоимость – 50-60 грн. и 90-110 грн. соответственно.
Антибиотики группы тетрациклинов
Доксибене, капсулы. Чаще всего данный антибиотик используется для лечения инфекций половых органов, вызванных хламидиями, микоплазмами и уреаплазмами. В составе Доксибене капс. содержится 100 мг доксициклина.
Средняя стоимость Доксибене капс. 100 мг №10 – 40-50 грн.
100 мг №10 – 40-50 грн.
Дешевые аналоги: Доксициклин (Борщаговский) 100 мг №10. Средняя стоимость – 7-10 грн.
Антибактериальные препараты группы фторхинолонов
Ципринол, таблетки. Синтетический антибактериальный препарат широкого спектра действия. В составе Ципринола содержится 250 или 500 мг ципрофлоксацина.
Средняя стоимость Ципринола таб. 250 мг №10 – 85-110 грн., Ципринола таб. 500 мг №10 – 90-110 грн.
Дешевые аналоги: Ципролет таб. 250 мг №10 и 500 мг №10. Средняя стоимость – 40-50 грн. и 75-90 грн. соответственно.
Ципрофлоксацин таб. 250 мг №10 и 500 мг №10. Средняя стоимость – 9-15 грн. и 20-25 грн. соответственно.
Антибактериальные препараты группы нитроимидазолов
Трихопол, таблетки. Антибактериальный синтетический препарат, применяемый в лечении бактериальных инфекций половых органов. В составе Трихопола таб. содержится 250 мг метронидазола.
Средняя стоимость Трихопола таб. 250 мг №20 – 70-90 грн
250 мг №20 – 70-90 грн
Дешевые аналоги: Метронидазол-Здоровье таб. 250 мг №20. Средняя стоимость – 20-30 грн.
Этот небольшой перечень аналогов поможет вам сэкономить средства, в случае если вам назначили приведенные выше антибиотики и антибактериальные препараты. Хотим обратить ваше внимание, что любые антибиотики назначаются исключительно врачом. После того, как они назначены, их можно легко найти и приобрести через наш интернет-сервис — сайт поиска лекарств. Однако внимание – прием антибиотиков без назначения врача строго запрещен!
В данном списке сознательно не приведены антибиотики для лечения тяжелых инфекционных процессов, так как они почти не имеют аналогов, и заменять их может лишь лечащий врач.
Байтрил, антибиотик широкого спектра действия
Байтрил, антибиотик широкого спектра действия
- Подробности
- Просмотров: 37339
Байтрил 2,5%
ИНСТРУКЦИЯ
по применению Байтрила (Baytril) 2,5% раствора для инъекций
СОСТАВ И ФОРМА ВЫПУСКА
В 1 мл инъекционного раствора содержится в качестве действующего вещества 25 мг энрофлоксацина и вспомогательные компоненты: калия гидроксид, н-бутанол, вода для инъекций.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Энрофлоксацин, входящий в состав препарата, относится к группе фторхинолонов, обладает широким спектром антибактериального и антимикоплазменного действия, подавляет рост и развитие грамположительных и грамотрицательных бактерий, в т. ч. эшерихий, гемофилюсов, сальмонелл, пастерелл, стафилококков, стрептококков, клостридий, псевдомонад, бордетелл, кампилобактерий, коринебактерий, протея, а также микоплазм. Механизм действия энрофлоксацина заключается в ингибировании активности фермента гиразы, влияющего на репликацию спирали ДНК в ядре бактериальной клетки. При парентеральном введении препарата энрофлоксацин хорошо и быстро всасывается из места инъекции и проникает во все органы и ткани организма. Максимальная концентрация энрофлоксацина в крови достигается через 20 – 40 минут, терапевтическая концентрация сохраняется в течение 24 часов после введения препарата.
ПОКАЗАНИЯ
Назначают собакам и кошкам с лечебной целью при болезнях органов дыхания, желудочно-кишечного тракта, мочеполовой системы, септицемии, колибактериозе, сальмонеллезе, стрептококкозе и других болезнях, вызванных микроорганизмами, чувствительными к фторхинолонам, а также при смешанных и вторичных инфекциях при вирусных болезнях.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Байтрил 2,5% инъекционный раствор вводят собакам и кошкам подкожно или внутримышечно в дозе 0,2 мл на 1 кг массы животного (5 мг энрофлоксацина на 1 кг массы) один раз в сутки в течение 3 – 10 дней. В связи с возможной болевой реакцией препарат не следует вводить животному в одно место в объеме, превышающем 2,5 мл. Если в течение 3 – 5 дней не произойдет заметного клинического улучшения, рекомендуется провести повторную проверку на чувствительность выделенных от больного животного микроорганизмов к фторхинолонам или заменить Байтрил на другой антибактериальный препарат.
В связи с возможной болевой реакцией препарат не следует вводить животному в одно место в объеме, превышающем 2,5 мл. Если в течение 3 – 5 дней не произойдет заметного клинического улучшения, рекомендуется провести повторную проверку на чувствительность выделенных от больного животного микроорганизмов к фторхинолонам или заменить Байтрил на другой антибактериальный препарат.
ПОБОЧНЫЕ ДЕЙСТВИЯ
В отдельных случаях возможно кратковременное нарушение функции желудочно-кишечного тракта. Может возникнуть покраснение в точке инъекции, исчезающее самопроизвольно.
ПРОТИВОПОКАЗАНИЯ
Повышенная чувствительность к энрофлоксацину и другим хинолонам. Запрещается назначать самкам в период беременности и лактации, при существенных нарушениях развития хрящевой ткани, поражениях нервной системы, сопровождающихся судорогами, а также при выделении от больного животного микроорганизмов, устойчивых к фторхинолонам. Не допускается одновременное применение Байтрила с левомицетином, макролидами, тетрациклинами, теофиллином и нестероидными противовоспалительными средствами.
ОСОБЫЕ УКАЗАНИЯ
Желательно не применять щенкам и котятам до окончания периода их роста.
УСЛОВИЯ ХРАНЕНИЯ
С предосторожностью (список Б). В сухом, темном, недоступном для детей и животных месте при температуре от 5 до 25 °С. Срок годности — 3 года. После вскрытия флакона препарат можно использовать в течение 28 дней.
Купить Байтрил в городе Днепр можно в ветеринарной клинике Котофей. Цена должна быть уточнена.
Стоит ли принимать антибиотики для профилактики?
Открытие антибиотиков в середине XX века и их массовое применение положило начало новой эре. Благодаря этим препаратам средняя продолжительность жизни человека значительно увеличилась. Если раньше миллионы людей не доживали до пожилого возраста из-за инфекционных заболеваний, которые не поддавались лечению, то открытие антибактериальных препаратов кардинально изменило ситуацию.
В переводе с греческого языка термин «антибиотик» означает «против жизни». И это правда – антибиотики способны уничтожать многих возбудителей заболеваний, которые опасны для человека. Но антибактериальные препараты не являются панацеей от всех заболеваний и тем более не показаны для самолечения, когда лекарства принимаются без рекомендации врача.
В каких же случаях можно принимать антибиотики, а когда лучше отказаться и заменить их другими лекарственными средствами? Давайте разберемся.
Как работают антибиотики?
Антибиотики – это сложные химические соединения, которые воздействуют на стенки бактерий. Антибактериальные препараты препятствуют размножению вредных микроорганизмов путем разрушения бактериальных клеточных стенок и способствуют выздоровлению человека. 1
При этом антибиотики не способны бороться с вирусами, так как у вирусов, в отличие от бактерий, клеточные стенки отсутствуют, а есть только цепочки ДНК и РНК. 2 Учитывая это, может быть неэффективным принимать антибиотики при вирусных простуде и гриппе. Не стоит сразу же после появления насморка и боли в горле бежать в аптеку покупать антибиотики «посильнее», они могут не оказать надлежащего эффекта, а только создать дополнительную нагрузку на организм.
Не стоит сразу же после появления насморка и боли в горле бежать в аптеку покупать антибиотики «посильнее», они могут не оказать надлежащего эффекта, а только создать дополнительную нагрузку на организм.
Прием антибиотиков при ОРВИ оправдан только при присоединении к вирусу бактериальной инфекции и развитии осложнений – например, при среднем отите, синусите, пневмонии. При распространенных заболеваниях горла (фарингит, ларингит, тонзиллит) антибиотики требуются только в том случае, если к развитию болезни привели стрептококки. 3 Установить вид возбудителя заболевания можно только путем проведения лабораторных исследований. Заподозрить наличие бактериальных причин может врач при обследовании пациента.
Когда может потребоваться профилактика антибиотиками?
Сразу стоит отметить, что профилактическое применение антибактериальных препаратов допустимо в очень редких случаях и только по назначению врача. Принимать антибиотики в начале развития ОРВИ в надежде предотвратить развитие осложнений – это большая ошибка. 4 Таким образом можно не снизить вероятность развития осложнений, а наоборот, повысить их. Ведь дополнительная лекарственная нагрузка на организм – это тяжело практически для любого организма, кроме того, у антибиотиков есть определенный спектр действия, то есть они воздействуют на определенные бактерии. При этом эти препараты могут быть неэффективными в отношении других бактерий.
4 Таким образом можно не снизить вероятность развития осложнений, а наоборот, повысить их. Ведь дополнительная лекарственная нагрузка на организм – это тяжело практически для любого организма, кроме того, у антибиотиков есть определенный спектр действия, то есть они воздействуют на определенные бактерии. При этом эти препараты могут быть неэффективными в отношении других бактерий.
Принимая антибиотики без консультации врача, вы можете способствовать развитию антибиотикорезистентности – устойчивости бактерий к препаратам. 5 Некоторые микроорганизмы способны мутировать и выживать в любых условиях, при воздействии на них самых современных антибиотиков. 6 Это значит, что прием препаратов «на всякий случай» может привести к тому, что однажды лекарство не поможет, когда на него будет вся надежда.
Несколько лет назад представитель американского Центра по контролю и предотвращению заболеваний (Center for Disease Control and Prevention) сказал, что человечеству грозит постантибиотическая эпоха, когда антибактериальные препараты станут бессильными. Чтобы избежать этого, принимать антибиотики необходимо строго по показаниям. 7
Чтобы избежать этого, принимать антибиотики необходимо строго по показаниям. 7
Профилактический прием антибиотиков показан только при плановых хирургических операциях, перед протезированием органов и в ряде других единичных случаев. Во всех подобных ситуациях решение о приеме антибиотиков принимает врач. ОРВИ и заболеваний горла в этом списке нет. 8
Противопоказания к приему антибиотиков и правила приема
Антибактериальные средства относятся к препаратам с разным уровнем токсичности. Но даже самые безопасные и широко распространенные из них имеют противопоказания, о которых указано в инструкции. Перед приемом обязательно подробно ознакомьтесь с этой инструкцией, ведь у каждого препарата имеется свой список противопоказаний.
Целесообразность применения антибактериальных препаратов определяет исключительно врач, он же рекомендует пациенту конкретное лекарственное средство. Если у вас аллергия или ранее наблюдались осложнения и побочные действия при лечении антибиотиками, обязательно сообщите об этом специалисту.
Для надлежащего лечения, необходимо придерживаться графика приема препаратов. Недопустимо самостоятельно прекращать курс антибиотиков, менять дозировку и препараты.
Чем лечить боль в горле?
Какие же лекарственные препараты лучше выбрать при боли в горле? Как выяснилось, с приемом антибиотиков спешить не стоит. Поэтому можно попробовать симптоматическое лечение – например, прием Стрепсилс® Интенсив, таблетки для рассасывания [медово-лимонные]. В состав этого препарата входит флурбипрофен – лекарственное средство, которое обладает обезболивающим действием.
Препарат Стрепсилс® Интенсив, таблетки для рассасывания [медово-лимонные] помогает лечитьвирусные, бактериальные и грибковые инфекционно-воспалительные заболевания полости рта и глотки. Препарат содержит натуральный мед, что приносит дополнительную пользу при лечении боли в горле.
Препарат направлен на уменьшение отека и затруднений при глотании, способствует облегчению боли и избавляет от ощущения раздражения в горле. Он оказывает местное обезболивающее и противовоспалительное действие на слизистую оболочку полости рта и горла. 9
Он оказывает местное обезболивающее и противовоспалительное действие на слизистую оболочку полости рта и горла. 9
Способ применения и дозировки
9Взрослые и дети старше 12 лет: медленно рассасывать по одной таблетке каждые 3-6 часов.
Максимальная суточная доза: 5 таблеток.
Продолжительность курса лечения – не более 3 дней.
Перед применением препарата ознакомьтесь с инструкцией. Если при приеме препарата в течение 3 дней симптомы сохраняются, необходимо прекратить лечение и обратиться к врачу.
Цервимицин — антибиотик из каменного века | Научные открытия и технические новинки из Германии | DW
Хотя историю антибиотиков принято вести от открытия британцем Александром Флемингом пенициллина в 1929 году, на самом деле она насчитывает уже более 120 лет. За это время эйфория ученых не раз сменялась скепсисом, надежда — отчаянием. Довольно долго медики пребывали в уверенности, что с помощью антибиотиков им удастся раз и навсегда покончить с такими опасными заболеваниями как чума и проказа, сепсис и дифтерит, пневмония и сифилис, туберкулез и холера. К сожалению, до сих пор этого не произошло, несмотря на то, что в арсенале медиков сегодня имеются уже сотни антибиотиков — как широкого, так и узкого спектра действия.
К сожалению, до сих пор этого не произошло, несмотря на то, что в арсенале медиков сегодня имеются уже сотни антибиотиков — как широкого, так и узкого спектра действия.
Мультирезистентность угрожает общественному здоровью
Оказалось, что бактерии обладают способностью вырабатывать резистентность, то есть устойчивость, невосприимчивость к антибактериальным препаратам. Такая резистентность возникает спонтанно в результате мутации и под воздействием антибиотика закрепляется в популяции. Сегодня медикам все чаще приходится сталкиваться со штаммами патогенных бактерий, устойчивыми уже не к одному, а к двум и более антибиотикам. В этих случаях принято говорить о множественной резистентности, она же поли- или мультирезистентность. Множественная резистентность патогенных бактерий является одной из наиболее серьезных угроз общественному здоровью, поэтому игра в кошки-мышки продолжается: бактериологи неустанно ищут все новые, более эффективные антибиотики, а бактерии столь же упорно мутируют, вырабатывая невосприимчивость к ним.
Археологи и микробиологи изучают пещеру
Очередного — хотя, безусловно, лишь временного — успеха в этом соревновании добились теперь немецкие ученые. Специалисты Института инфекционной биологии и изучения природных веществ имени Ханса Кнёлля (Hans Knöll) в Йене обнаружили новый мощный антибиотик в… одной из итальянских карстовых пещер. Эта пещера вблизи Отранто, города на тыльной стороне «каблука» итальянского «сапога», была открыта в 1970 году и вызвала восторг археологов, поскольку на ее стенах красовались сцены охоты, изображенные людьми каменного века 4 тысячи лет назад. Однако эта находка привлекла внимание и микробиологов, вспоминает профессор Йенского университета Кристиан Хертвек (Christian Hertweck), специалист в области химии природных веществ: «Оказалось, что в этой пещере, которая оставалась нетронутой на протяжении тысячелетий, сформировалась весьма необычная микрофлора. Мы решили присмотреться к ней повнимательнее и проверить, не синтезируют ли эти бактерии какие-то неизвестные пока науке субстанции».
Создавая свои наскальные рисунки, древние художники использовали охру как желтый пигмент и экскременты летучих мышей в качестве бурого красителя. Именно на этих бурых фрагментах неолитических рисунков исследователи и выявили новый вид бактерий рода стрептомицетов — Streptomyces tendae. Вид, производящий антибиотик, эффективно подавляющий целый ряд мультирезистентных патогенов, в том числе и столь опасного возбудителя сепсиса и пневмоний как метициллин-резистентный золотистый стафилококк. Поскольку в обнаруженных в пещере наскальных сценах охоты доминируют изображения оленей, местные археологи именуют ее Оленьей пещерой — по-итальянски Grotta dei Cervi. Соответственно, немецкие микробиологи назвали открытый ими антибиотик цервимицином (cervimycin). «Оказалось, что имеется несколько разновидностей этой субстанции с разной степенью бактерицидного воздействия, — говорит профессор Хертвек, — причем синтезируются они этими бактериями в разных количествах. Проблема состояла в том, что как раз самый эффективный антибиотик производился в самом ничтожном количестве».
Необычное поведение обычного фермента
Эта наиболее действенная из более чем десятка разновидностей антибиотика получила обозначение «цервимицин-К». Изучая процессы обмена веществ у «пещерного» стрептомицета, профессор Хертвек наткнулся на фермент, по структуре очень похожий на ферменты класса поликетидсинтаз. Представители этого класса ферментов обнаружены практически у всех живых организмов и везде выполняют сходную функцию, связанную с формированием длинных углеродных цепочек в процессе синтеза так называемых вторичных метаболитов — антибиотиков, токсинов, статинов. К немалому изумлению ученого, фермент «пещерной» бактерии (его назвали CerJ) катализировал совершенно иную реакцию — образование эфиров малоновой кислоты путем присоединения кислотного остатка к предшественнику цервимицина. Более того, оказалось, что если действие фермента CerJ заблокировать, то конечным продуктом биосинтеза цервимицина становится та самая наиболее действенная его разновидность — цервимицин-К.
Мутантные бактерии дают чистый продукт
Чтобы заставить бактерии усиленно производить именно ее, йенские ученые модифицировали в геноме микроорганизма ген, кодирующий фермент CerJ. В результате синтез этого фермента прекратился, предшественник цервимицина лишился кислотного остатка, и на выходе мы теперь имеем высокоэффективный антибиотик, причем практически в чистом виде, говорит Том Бретшнайдер (Tom Bretschneider), также активный участник исследования и один из соавторов статьи, опубликованной в журнале Nature Chemical Biology. «Созданные нами мутантные бактерии, — поясняет он, — вполне могут стать основой биосинтеза в промышленных масштабах. Особенно это касается процессов очистки: ведь если производится всего лишь одна разновидность вещества, то его очистка идет гораздо быстрее и обходится намного дешевле».
Итак, перспективы выглядят неплохо. Но как цервимицин проявит себя в борьбе с мультирезистентными патогенами не в чаше Петри, а в организме реального больного, пока неизвестно. Остается открытым и вопрос о возможных побочных действиях новой субстанции, о ее переносимости пациентами. Ясно одно: «Мы можем уже сегодня сказать, что этот антибиотик и по принципу действия, и по структуре весьма значительно отличается от прочих известных антибиотиков, имеющихся на рынке», — подчеркивает профессор Хертвек. Это может оказаться и преимуществом, и недостатком цервимицина. Пока же ученые продолжают его изучать — и искать новые антибиотики в самых труднодоступных и экзотических местах.
Остается открытым и вопрос о возможных побочных действиях новой субстанции, о ее переносимости пациентами. Ясно одно: «Мы можем уже сегодня сказать, что этот антибиотик и по принципу действия, и по структуре весьма значительно отличается от прочих известных антибиотиков, имеющихся на рынке», — подчеркивает профессор Хертвек. Это может оказаться и преимуществом, и недостатком цервимицина. Пока же ученые продолжают его изучать — и искать новые антибиотики в самых труднодоступных и экзотических местах.
Автор: Владимир Фрадкин
Редактор: Ефим Шуман
Ceva Интрамицин Антибиотик широкого спектра действия для животных
Ceva Интрамицин Антибиотик широкого спектра действия.
СОСТАВ И ФОРМА ВЫПУСКА
Интрамицин представляет собой суспензию для инъекций белого цвета, содержащую в качестве действующих веществ два антибиотика: бензилпенициллин-прокаин (20 миллионов МЕ в 100 мл) и дигидрострептомицин в виде сульфата (20 г в 100 мл), а также наполнители. Расфасовывают по 100 во флаконы из темного стекла, которые вкладывают в картонные коробки.
Расфасовывают по 100 во флаконы из темного стекла, которые вкладывают в картонные коробки.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Антибиотики, входящие в состав препарата, обладают синергидным действием на стрептококки, стафилококки и другие грамположительные микроорганизмы, пастереллы, эшерихии и сальмонеллы. Бензилпенициллин воздействует на клеточную стенку бактерий путем ингибирования синтеза пептидогликана. Дигидрострептомицин нарушает синтез белка в бактериальных рибосомах. При парентеральном введении бензилпенициллин и дигидрострептомицин быстро резорбцируются, и пик концентрации антибиотиков к плазме крови достигается в течение 1 часа. Антибиотики выводятся из организма преимущественно с мочой.
ПОКАЗАНИЯ
Назначают крупному рогатому скоту, мелкому рогатому скоту, лошадям, свиньям, собакам и кошкам для лечения инфекций дыхательных путей (пневмония, бронхит, трахеит), желудочно-кишечного тракта (энтерит, диарея), мочеполовой системы (цистит, метрит) и инфекционных заболеваний кожи и мягкий тканей (раны, абсцессы, инфекции копыт, гнойное воспаление суставов, пупочный сепсис). Интрамицин можно применять для лечения лептоспироза животных и рожистого воспаления свиней.
Интрамицин можно применять для лечения лептоспироза животных и рожистого воспаления свиней.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Интрамицин суспензию для инъекций вводят внутримышечно или подкожно из расчета: лошадям и крупному рогатому скоту: взрослым животным – 5 мл на 100 кг веса животного, молодняку (в возрасте до 6 месяцев) – 8 мл на 100 кг веса животного; овцам, козам и свиньям – 1 мл на 10 кг веса животного; собакам и кошкам – 0,5 мл на 5 кг веса животного 1 раз в день в течение 3 дней.
ПРОТИВОПОКАЗАНИЯ
Гиперчувствительность к пенициллину и стрептомицину. Интрамицин нельзя вводить внутривенно.
ПОБОЧНЫЕ ДЕЙСТВИЯ
При правильном использовании и дозировке побочные явления не наблюдаются.
ОСОБЫЕ УКАЗАНИЯ
Молоко, полученное о животных, подвергшихся лечению интрамицином, запрещается использовать в пищевых целях в течение 3 суток после последнего введения препарата. Такое молоко может быть использовано для кормления животных после термической обработки. Убой животных на мясо разрешается не ранее, чем через 30 суток после последнего применения препарата. Мясо животных, вынужденно убитых до истечения указанного срока, может быть использовано для производства мясокостной муки.
Убой животных на мясо разрешается не ранее, чем через 30 суток после последнего применения препарата. Мясо животных, вынужденно убитых до истечения указанного срока, может быть использовано для производства мясокостной муки.
УСЛОВИЯ ХРАНЕНИЯ
Хранить в сухом месте при температуре от 5 до 20 ºС. При хранении препарата допускается выпадение осадка, который при встряхивании образует равномерную взвесь. Срок годности – 2 года.
ПРОИЗВОДИТЕЛЬ
Ceva Sante Animale (Сева Санте Анималь), Франция.
Антибиотики широкого спектра действия | WMJ.ru
Аминогликозиды бактерицидно действуют на все микроскопические организмы независимо от фазы размножения, уничтожают даже те, которые находятся в фазе покоя. Это главное отличие группы аминогликозидов, ведь бета-лактамные антибиотики действуют бактерицидно лишь на размножающиеся бактерии. Этим объясняется то, что их терапевтическая эффективность не снижается при их назначении одновременно с бактериостатически действующими антибиотиками.
Важной особенностью является то, что для эффективного действия аминогликозидов необходимо наличие аэробных условий. Именно такая среда не только внутри бактериальной клетки-мишени, но и в тканях инфекционного очага. По мнению специалистов антибиотики этой группы практически не эффективны в мало кровоснабжаемых, некротизированных (омертвевших), гипоксемичных тканях. Нецелесообразно их применять в местах абсцессов и кавернах, поскольку антибактериальные медикаменты не действуют на анаэробные микроорганизмы.
Аминогликозиды успешно применяют для лечения фурункулеза и мочевыводящих путей. Антибиотики выбирают для уничтожения инфекции при острых бактериальных болезней почек и воспалении внутреннего уха, бактериального эндокардита, сепсиса, тяжелых пневмоний.
Фторхинолоны
К этой группе также как и к предыдущим 5, относятся антибиотики широкого спектра действия. Для них характерно сильное бактерицидное воздействие. Вещества, попадая внутрь клетки микроба-возбудителя, убивают их. Губительно действуют и на атипичную флору, грамотрицательные и грамположительные бактерии. Особенностью этих медикаментов является то, что фторхинолоны не принято назначать беременными женщинами и детям. Механизм действия заключается в ингибировании двух жизненно важных ферментов микробной клетки (ДНК-гираза и топоизомераза-4). Антибиотики разрушают синтез ДНК, тем самым вызывая гибель бактерий. Стоит заметить, что активность направлена также на РНК бактерий, воздействия на стабильность мембран, и влияя на другие жизненные процессы клеток бактерий.
Губительно действуют и на атипичную флору, грамотрицательные и грамположительные бактерии. Особенностью этих медикаментов является то, что фторхинолоны не принято назначать беременными женщинами и детям. Механизм действия заключается в ингибировании двух жизненно важных ферментов микробной клетки (ДНК-гираза и топоизомераза-4). Антибиотики разрушают синтез ДНК, тем самым вызывая гибель бактерий. Стоит заметить, что активность направлена также на РНК бактерий, воздействия на стабильность мембран, и влияя на другие жизненные процессы клеток бактерий.
Активные компоненты: налидиксовая и оксолиновая кислоты активны по отношению к большинству грамотрицательных бактерий (синегнойная, гемофильная и кишечная палочки, холерные вибрионы, шигеллы, сальмонеллы, менингококки, гонококки). Губительно воздействие они оказывают и к кампилобактерам, легионеллам, хламидиям, микоплазмам. От антибиотиков погибают также некоторые грамположительные бактерии: некоторые разновидности пневмококков и многие штаммы стафилококков, на анаэробные бактерии. Некоторые фторхинолоны эффективны по отношению микобактериям туберкулеза.
Некоторые фторхинолоны эффективны по отношению микобактериям туберкулеза.
(Антибиотики узкого спектра действия)
— лактамы – это большая группа антибиотиков, молекулы которых содержат -лактамное кольцо, они обладают высокой антимикробной активностью, однако у многих микроорганизмов быстро развивается устойчивость к ним, вследствие выработки специфических ферментов -лактамаз (пенициллиназ) и появлению резистентных штаммов микроорганизмов.
они обладают слабой антимикробной активностью, но в сочетании с антибиотиками вызывают необратимое ингибирование на -лактамазы, что вызывает увеличение антибактериального действия и спектр действия антибиотиков.
На их основе созданы такие препараты, как: сультамициллин, амоксиклав, тазоцин, тиментин.
Пенициллины
1. Природные пенициллины короткого действия:
бензилпенициллина натриевая соль:-
Показания к применению: Ангина, скарлатина, пневмония, сепсис, септический эндокардит, гнойный плеврит, перитонит, цистит, сибирская язва, газовая гангрена, лептоспироз, клещевой боррелиоз, раневая инфекция, остеомиелит, сифилис, менингит, гонорея, инфекции мочевыводящих путей, рожа, ревматизм.

Пути введения: внутримышечно, подкожно, при необходимости – внутривенно, интрабрюшино, интраплеврально, эндолюмбально, в виде аэрозоля и глазных капель
Побочные эффекты: головная боль, гипертермия, крапивница, аллергические реакции, дисбиоз, нейротоксичность.
Противопоказания: гиперчувствительность, аллергические болезни, эпилепсия.
бензилпенициллина калиевая соль:-
пути введения: внутримышечно, подкожно, местно.
Показания к применению, побочные эффекты, противопоказания, как у бензилпенициллина натриевой соли.
бензилпенициллина новокаиновая соль:-
пути введения: только внутримышечно.
Показания к применению, побочные эффекты, противопоказания, как у бензилпенициллина натриевой соли + повышенная чувсвительность к новокаину.

Феноксиметилпенициллин
пути введения: внутрь за 30 мин – 1 час до еды.
Показания к применению: бронхит, бронхопневмония, инфекции ЛОР-органов, кожи и полости рта, ботулизм, скарлатина, лептоспироз, профилактики рецидивов ревматизма.
Побочные эффекты, противопоказания, как у бензилпенициллина натриевой соли.
2. Природные пролонгированного действия –
бициллин – 1, бициллин – 3 бициллин – 5.
форма выпуска: порошок для инъекций во флаконах по 300000, 600000, 1200000, 1500000, 2400000 ЕД;
пути введения: только внутримышечно.
Показания к применению: профилактика рецидивов ревматизма, сифилис, рожа, скарлатина, тонзиллит, раневая инфекция.
Побочные эффекты, противопоказания, как у бензилпенициллина натриевой соли.
3. Полусинтетические антистафилококковые:
оксациллин,
клоксациллин, флуклоксациллин.
форма выпуска: таблетки 0,25 и 0,5 г, капсулы по 0,25г; порошок для инъекций по 0,25 и 0,5г. С растворителем.
пути введения: внутрь (за 1 час до еды или 2-3 часа после еды), внутримышечно и внутривенно.
Показания к применению: пневмония, эндокардит, менингит, сепсис, инфекции кожи, мягких тканей, костей и суставов, вызванных.
Побочные эффекты: аллергия, диспепсия.
Антибактериальные средства узкого спектра действия
Medchemcomm. 1 января 2018 г .; 9 (1): 12–21.
, a , b и aРоберта Дж. Меландер
a Кафедра химии , Государственный университет Северной Каролины , Роли , NC , СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ . Электронная почта: ude.uscn@dnalemcc
Даниэль В. Журавски
b Отделение раневых инфекций , Отделение бактериальных болезней , Армейский научно-исследовательский институт Уолтера Рида , Серебряная весна , Доктор медицины , СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ
Кристиан Меландер
a Кафедра химии
, Государственный университет Северной Каролины
,
Роли
, NC
, СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ
. Электронная почта: ude.uscn@dnalemcc
Электронная почта: ude.uscn@dnalemcc
б Отделение раневых инфекций , Отделение бактериальных болезней , Армейский научно-исследовательский институт Уолтера Рида , Серебряная весна , Доктор медицины , СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ
Автор, ответственный за переписку.Поступило 17.10.2017 г .; Принято 2 ноября 2017 г.
Авторские права Этот журнал принадлежит © Королевское химическое общество, 2018 г.Abstract
Хотя антибиотики широкого спектра действия играют неоценимую роль в лечении бактериальных инфекций, их использование имеет некоторые недостатки, а именно отбор и распространение устойчивости среди множества видов бактерий, а также пагубное влияние, которое они могут оказать на микробиом хозяина. . Если возбудитель инфекции известен, использование антибактериальных средств узкого спектра действия может смягчить некоторые из этих проблем. В этом обзоре описываются преимущества и проблемы антибактериальных средств узкого спектра действия, обсуждается прогресс, достигнутый в разработке диагностических средств, позволяющих их использовать, и описываются некоторые из антибактериальных средств узкого спектра действия, которые в настоящее время исследуются против некоторых из наиболее клинически важных бактерий. включая Clostridium difficile , Mycobacterium tuberculosis и несколько патогенов ESKAPE.
В этом обзоре описываются преимущества и проблемы антибактериальных средств узкого спектра действия, обсуждается прогресс, достигнутый в разработке диагностических средств, позволяющих их использовать, и описываются некоторые из антибактериальных средств узкого спектра действия, которые в настоящее время исследуются против некоторых из наиболее клинически важных бактерий. включая Clostridium difficile , Mycobacterium tuberculosis и несколько патогенов ESKAPE.
Введение
Противомикробные препараты, возможно, являются одним из величайших успехов в истории медицины, и наступление эры антибиотиков с появлением эффективных, нетоксичных антибиотиков широкого спектра действия принесло неизмеримые преимущества. Возможность лечить инфекции на ранних этапах без идентификации возбудителя привела к спасению бесчисленного количества жизней и открыла возможности для многих направлений современной медицины, таких как хирургия, уход за недоношенными детьми, трансплантация органов и химиотерапия рака. 1 Однако растущая устойчивость к антибиотикам быстро сводит на нет эти преимущества, и в 2014 году Всемирная организация здравоохранения (ВОЗ) предупредила, что наступление постантибиотической эры — вполне реальная возможность2. что к 2050 году инфекции, устойчивые к антибиотикам, будут приводить к более чем 10 миллионам смертей ежегодно и стоить мировой экономике до 100 триллионов долларов США.3,4 Решение проблемы кризиса устойчивости к антибиотикам потребует многогранного подхода, который включает в себя улучшения в управлении антибиотиками, 4 разработка новых антибиотиков, разработка альтернативных терапевтических средств, таких как терапия, направленная на хозяина, и противовирулентные препараты 5, а также разработка адъювантов, подавляющих механизмы устойчивости бактерий.6 Другая часть этой антибактериальной стратегии может включать разработку антибактериальных агентов узкого спектра действия, т.е. агентов, которые зависят от рода или вида. В этом обзоре мы обсуждаем преимущества и проблемы этой стратегии, резюмируем прогресс, достигнутый в разработке диагностических средств для реализации этой концепции, и описываем некоторые из направлений исследований, которые были исследованы для выявления узкоспектральных и специфичных для патогенов.
1 Однако растущая устойчивость к антибиотикам быстро сводит на нет эти преимущества, и в 2014 году Всемирная организация здравоохранения (ВОЗ) предупредила, что наступление постантибиотической эры — вполне реальная возможность2. что к 2050 году инфекции, устойчивые к антибиотикам, будут приводить к более чем 10 миллионам смертей ежегодно и стоить мировой экономике до 100 триллионов долларов США.3,4 Решение проблемы кризиса устойчивости к антибиотикам потребует многогранного подхода, который включает в себя улучшения в управлении антибиотиками, 4 разработка новых антибиотиков, разработка альтернативных терапевтических средств, таких как терапия, направленная на хозяина, и противовирулентные препараты 5, а также разработка адъювантов, подавляющих механизмы устойчивости бактерий.6 Другая часть этой антибактериальной стратегии может включать разработку антибактериальных агентов узкого спектра действия, т.е. агентов, которые зависят от рода или вида. В этом обзоре мы обсуждаем преимущества и проблемы этой стратегии, резюмируем прогресс, достигнутый в разработке диагностических средств для реализации этой концепции, и описываем некоторые из направлений исследований, которые были исследованы для выявления узкоспектральных и специфичных для патогенов. антибактериальные средства.Этот обзор не предназначен для того, чтобы быть исчерпывающим, а скорее для того, чтобы осветить некоторые из недавних достижений в этой области, в том числе: подходы с использованием малых молекул, использование бактериоцинов и антимикробных пептидов, а также затронуть разработку терапевтических препаратов с бактериофагами и моноклональными антителами.
антибактериальные средства.Этот обзор не предназначен для того, чтобы быть исчерпывающим, а скорее для того, чтобы осветить некоторые из недавних достижений в этой области, в том числе: подходы с использованием малых молекул, использование бактериоцинов и антимикробных пептидов, а также затронуть разработку терапевтических препаратов с бактериофагами и моноклональными антителами.
Преимущества антибактериальных агентов узкого спектра
Подавляющее большинство соединений, используемых для лечения бактериальных инфекций, обладают активностью против нескольких видов, и наряду с огромными преимуществами, которые это дает, существует ряд недостатков в использовании широкого спектра действия. антибиотики.Возможно, наиболее очевидным недостатком использования антибиотиков широкого спектра действия является отбор по устойчивости, которая может возникать как у возбудителя инфекции, которую лечат, так и у других бактерий, как патогенных, так и непатогенных, которые подвергаются воздействию антибиотик. Отбор на устойчивость непатогенных комменсальных бактерий может иметь пагубные последствия, поскольку эти бактерии могут действовать как резервуар для генов устойчивости, которые могут сохраняться годами и впоследствии передаваться патогенным бактериям.7
Отбор на устойчивость непатогенных комменсальных бактерий может иметь пагубные последствия, поскольку эти бактерии могут действовать как резервуар для генов устойчивости, которые могут сохраняться годами и впоследствии передаваться патогенным бактериям.7
Еще одним недостатком неизбирательного использования антибиотиков широкого спектра действия является вредное воздействие, которое они могут оказывать на микробиом хозяина. Эти эффекты не ограничиваются продолжительностью лечения антибиотиками, поскольку было показано, что даже кратковременное (семидневное) воздействие антибиотиков приводит к изменению состава микробиоты кишечника в течение двух лет после лечения. воздействие антибиотиков, возможно, что микробиота никогда не вернется к своему первоначальному составу.9 Нарушение микробиома может повлиять на жизненно важную роль, которую он играет во многих функциях, включая снабжение питательными веществами, выработку витаминов и защиту от патогенов.10 Некоторые из разрозненных проблем со здоровьем, связанных с нарушением этих функций, включают: повышенная восприимчивость к инфекционным заболеваниям11 (особенно колонизация Clostridium difficile ), 12 метаболических нарушений, таких как ожирение и диабет, 13,14 астмы, 14 синдрома раздраженного кишечника, 15 и иммунных расстройств, таких как аллергия. 16 Воздействие антибиотиков широкого спектра действия в младенчестве и раннем детстве особенно пагубно, поскольку ранней микробиоте не хватает разнообразия и стабильности, что делает ее уникально чувствительной к нарушениям, а развивающаяся иммунная система частично формируется микробиотой кишечника. микробиом кишечника, сложный микробиом полости рта также играет ключевую роль в поддержании как здоровья полости рта, так и общего здоровья, и его нарушение связано с множеством проблем со здоровьем, включая респираторные, сердечно-сосудистые и цереброваскулярные заболевания.18
16 Воздействие антибиотиков широкого спектра действия в младенчестве и раннем детстве особенно пагубно, поскольку ранней микробиоте не хватает разнообразия и стабильности, что делает ее уникально чувствительной к нарушениям, а развивающаяся иммунная система частично формируется микробиотой кишечника. микробиом кишечника, сложный микробиом полости рта также играет ключевую роль в поддержании как здоровья полости рта, так и общего здоровья, и его нарушение связано с множеством проблем со здоровьем, включая респираторные, сердечно-сосудистые и цереброваскулярные заболевания.18
Разработка антибиотиков узкого спектра действия, которые не отбираются по перекрестной резистентности у нецелевых патогенов и вызывают устранение или снижение побочного повреждения микробиома хозяина, поэтому является привлекательным подходом в борьбе за преодоление множественной лекарственной устойчивости ( MDR) бактериальные инфекции. Хотя такие агенты могут не заменять профилактическую терапию или начальную терапию широкого спектра действия в случае пациента с опасным для жизни состоянием, таким как сепсис или пневмония, переход на антибиотики узкого спектра действия может быть полезным после выявления возбудитель. Антибиотики узкого спектра действия также можно использовать для лечения таких инфекций, как инфекции мочевыводящих путей, абсцессы или инфекции кожи и мягких тканей, а также в других случаях, не угрожающих жизни, особенно при частых рецидивах.
Антибиотики узкого спектра действия также можно использовать для лечения таких инфекций, как инфекции мочевыводящих путей, абсцессы или инфекции кожи и мягких тканей, а также в других случаях, не угрожающих жизни, особенно при частых рецидивах.
Проблемы, возникающие при разработке антибактериальных средств узкого спектра действия
Конечно, существует много проблем, связанных с полезностью подхода узкого спектра действия. Возможно, наиболее серьезной проблемой является потребность в быстрых, точных и чувствительных диагностических анализах для идентификации бактериальных патогенов.Кроме того, клиническое внедрение антибиотиков узкого спектра действия будет зависеть от образования врачей, что позволит перейти от эмпирической терапии к более индивидуализированной 19. Идентификация и разработка новых антибиотиков узкого спектра действия также сталкивается с экономическими проблемами. Размер рынка лекарства, конечно, пропорционален распространенности заболевания1, и, по определению, антибактериальные агенты узкого спектра имеют более ограниченное применение по сравнению с их аналогами широкого спектра действия.Однако снижению доходов в результате меньшего числа инфекций, которые можно лечить антибактериальными средствами узкого спектра действия, может противодействовать потенциально более длительный срок хранения, обеспечиваемый сниженными показателями устойчивости. Потенциально можно было бы также привести более высокие цены на антибактериальные препараты узкого спектра действия, если эти агенты приведут к снижению смертности и заболеваемости наряду с сокращением продолжительности госпитализации. Действительно, в случае Acinetobacter baumannii , где уровень смертности в отделениях интенсивной терапии (ОИТ), как сообщалось, достигает 60%, уже приводятся доводы в пользу более высоких цен на препараты узкого спектра действия, разработанные против этого вида. .20
Переход к поиску антибактериальных средств узкого спектра действия или патоген-специфических антибактериальных средств также потребует изменения парадигмы в фармацевтической промышленности. Открытие антибиотиков в фармацевтической промышленности в течение многих лет было сосредоточено исключительно на поиске агентов широкого спектра действия против нескольких грамположительных и грамотрицательных бактерий, а соединения, не соответствующие этому показателю, были отобраны в рамках программ по обнаружению антибиотиков21. из этих ранее отвергнутых соединений потенциально могут теперь служить в качестве основы для новых узкоспектральных или специфичных для патогенов инициатив по открытию.Важное значение для этого сдвига имеют нормативные изменения22, и Европейское агентство по лекарственным средствам (EMA) и Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) недавно включили антибактериальные агенты, которые активны против узкого спектра возбудителей МЛУ, в список подходящих методов лечения. для более короткого пути к регистрации.23 С добавлением Закона GAIN и стимулов для ускоренного прохождения, использование этих соединений теперь может быть более целесообразным и прибыльным, чем в прошлом.
Диагностические тесты для выявления бактериальных патогенов
Доступность антибиотиков широкого спектра действия означала, что в течение многих лет врачи могли эффективно и безопасно лечить многие бактериальные инфекции без необходимости микробиологической диагностики.Возникшая в результате культура эмпиризма свела к минимуму важность диагностической клинической микробиологии, а разработка диагностических тестов с необходимой скоростью, точностью и чувствительностью для обеспечения эффективных методов лечения узкого спектра (даже тех, которые ранее были доступны, например, терапии антителами) не получила широкого распространения. 1,24 Кроме того, растущая распространенность патогенов, которые обладают детерминантами приобретенной устойчивости, такими как метициллин-устойчивый Staphylococcus aureus (MRSA) и устойчивый к карбапенему Enterobacteriaceae (CRE), в последнее время привела к еще более широким эмпирическим схемам лечения. годы.25 Такие схемы часто включают агенты «последней инстанции», такие как гликопептид, карбапенем и полимиксиновые антибиотики, что еще больше усугубляет возникновение и распространение микроорганизмов с множественной лекарственной устойчивостью.
Однако, учитывая постоянно сокращающееся количество эффективных противомикробных препаратов в результате роста устойчивости к антибиотикам в последние годы, стало очевидно, что разработка диагностических тестов, которые могут быстро идентифицировать конкретный патоген, имеет жизненно важное значение26. Методы, основанные на культуре, занимают много времени. Через определенные промежутки времени начальные посевы занимают 24–48 часов (в течение которых обычно назначают антибиотики широкого спектра действия), затем, после идентификации микроба, для определения чувствительности к противомикробным препаратам требуется еще 24–48 часов.27 В ходе опроса, проведенного в 2015 г. среди практикующих инфекционистов, 31% сообщили, что, по их мнению, пациентов лечат неправильными антибиотиками во время ожидания результатов посева крови28. -отрицательные результаты при отборе образцов после начала противомикробной терапии. Другие методы, которые традиционно использовались наряду с методами культивирования для помощи в идентификации микробов, включают: окрашивание по Граму, микроскопию, использование флуоресцентно меченных моноклональных антител, ELISA и радиометрическое обнаружение меченых метаболитов, как в примере 14 C-меченых. углекислый газ, продуцируемый при метаболизме пальмитиновой кислоты Mycobacterium tuberculosis .Хотя эти методы требуют меньше времени, чем методы культивирования, они не более чувствительны и не позволяют определять чувствительность к противомикробным препаратам26.
. Полимеразная цепная реакция (ПЦР) и секвенирование следующего поколения (NGS), а также внедрение дополнительных быстрых технологий с более высоким разрешением, таких как масс-спектрометрический снимок MALDI-TOF, в клиническую диагностику изменили подходы к идентификации патогенов.25
Основанные на NAAT подходы к обнаружению патогенов в настоящее время повсеместно используются в лабораториях клинической микробиологии, а недавнее внедрение коммерческих мультиплексных ПЦР-тестов позволило быстро и специфично обнаруживать патогены в одном образце. Эти подходы особенно перспективны для инфекций кровотока, поскольку в дополнение к ускорению обнаружения патогенов по сравнению с подходами, основанными на культуре (идентификация видов может быть достигнута в течение 3–6 часов), 25 подходов на основе ПЦР позволяют обнаруживать патогены в тех случаях, когда посев крови остается отрицательным. , случаи, в которых трудно получить адекватный объем крови для идентификации на основе посева, и случаи, в которых эмпирическое лечение антибиотиками уже применялось, 29 хотя прямой анализ крови с использованием подходов на основе ПЦР может быть затруднен из-за наличия ПЦР -ингибиторы, такие как железо, гепарин и иммуноглобулины.25 Кроме того, коммерчески доступны множественные анализы на основе ПЦР, которые могут обнаруживать определенные бактериальные патогены, причастные к инфекциям нижних дыхательных путей.25 Основным недостатком методов на основе ПЦР является то, что ДНК из организма может быть обнаружена даже после того, как организм был убит. или сброшен, поэтому есть вероятность ложных срабатываний. Кроме того, поскольку праймеры направлены против определенных генов, существует вероятность того, что во время инфекции может произойти мутация или потеря гена, особенно в детерминантах устойчивости к антибиотикам, которые находятся под эволюционным давлением, что, в свою очередь, может дать ложноотрицательный результат.
Традиционные методы секвенирования, такие как секвенирование с помощью капиллярного электрофореза или пиросеквенирование, уже давно сочетаются с подходами на основе NAAT для идентификации патогенов и могут обеспечить идентификацию на уровне рода более 90% и идентификацию на уровне видов для 65–85% протестированы изоляты (все микробы). NGS демонстрирует повышенную точность и может обнаруживать маркеры вирулентности, детерминанты устойчивости к противомикробным препаратам, но требует обширной биоинформатики для интерпретации данных.26 NGS также может иметь некоторые из тех же ограничений, что и тесты на основе ПЦР, поскольку ДНК может присутствовать в образце, когда самого живого организма больше нет.
MALDI-TOF MS отпечатков пальцев для идентификации бактериальных патогенов широко используется лабораториями клинической микробиологии по всему миру.30 Это быстрое (время обработки обычно сокращается по крайней мере на один рабочий день, до нескольких дней для более медленнорастущих видов), точный и экономичный.25,30 Идентификация может быть проведена с использованием прямого тестирования колоний, при котором бактериальная колония помещается непосредственно на планшет MALDI и полученный спектр сравнивается с базой данных эталонных спектров.Прямое тестирование клинических образцов в большинстве случаев невозможно из-за недостаточного предела обнаружения; однако некоторые клинические образцы, такие как моча (хотя она должна быть обработана перед тестированием) и спинномозговая жидкость, содержат достаточно большое количество бактерий, чтобы можно было проводить прямое тестирование.30 MALDI-TOF MS также может использоваться для идентификации микроорганизмов в культурах крови; это достигается либо путем пересева из флакона с положительной культурой крови на твердую среду и после короткого (2–4 ч) периода инкубации, анализа с помощью MALDI-TOF MS, либо путем прямого тестирования флаконов с культурой крови после удаления экзогенных макромолекул.Прямая идентификация патогенов из положительных культур крови приводит к сокращению времени обработки как минимум на один день по сравнению с традиционной обработкой и позволяет идентифицировать возбудителя на уровне видов в критической фазе септического заболевания.25
Ограничения MALDI-TOF дактилоскопия для идентификации бактериальных патогенов включает неспособность надежно идентифицировать полимикробные инфекции или надежно различать организмы со схожими спектральными профилями, например E.coli и Shigella нельзя надежно отличить с помощью доступных в настоящее время алгоритмов.30 Это также относится к некоторым видам Acinetobacter , 31 однако базы данных постоянно обновляются, поэтому эту проблему в конечном итоге можно решить. Другой недавний подход использует MALDI-TOF для обнаружения бактериальных липидов и полисахаридов и может лучше различать разные виды в смешанной культуре и может обеспечить лучшую точность и чувствительность по мере дальнейшего развития этой технологии.32
Другие подходы, которые использовались для идентификации бактерий, включают флуоресцентную гибридизацию in situ (FISH), электрохимические биосенсорные анализы и быстрое тестирование антигенов. Анализы на основе FISH использовались для диагностики инфекций кровотока в течение многих лет, и зонды, специфичные для бактериальной рибосомной РНК, были разработаны для более чем 95% патогенов, обычно связанных с такими инфекциями. В одном исследовании 115 положительных культур крови (как бактериальных, так и грибковых) идентификация 111 образцов на уровне семейства, рода или вида была достигнута в пределах 2.5 часов по сравнению с 1–3 днями при использовании традиционных методов культивирования.33
Были разработаны наборы электрохимических биосенсоров, позволяющие идентифицировать патогены инфекции мочевыводящих путей (ИМП). Рабочий электрод датчика содержит модифицированный биотином зонд захвата, который специфичен для клинически значимого бактериального патогена в моче, с которым гибридизируется бактериальная мишень 16S рРНК. Затем зонд-детектор, модифицированный флуоресцеином, гибридизуется с рРНК-мишенью, и обнаружение гибридов мишень-зонд достигается за счет связывания антитела против флуоресцеина, конъюгированного с пероксидазой хрена (HRP).Сообщалось, что видоспецифическое обнаружение патогенов в клинических образцах мочи может быть достигнуто менее чем за 6 часов, идентификация была продемонстрирована для 98% грамотрицательных бактерий, для которых были доступны видоспецифичные зонды, а возбудители полимикробных инфекций могли также быть идентифицированными.34,35
Экспресс-тестирование на антиген использует видимое считывание при связывании антитело-антиген и оказалось клинически успешным для идентификации бета-гемолитического стрептококка группы А (БГСА), наиболее распространенного возбудителя острого фарингита.Этот тест дает результаты примерно через 15 минут в месте оказания медицинской помощи по сравнению с периодом до двух дней для идентификации на основе посева, и имеет специфичность более 95% и чувствительность не менее 90% .36 , 37 Быстрое тестирование на антигены ограничено по объему и в настоящее время доступно только для небольшого числа избранных патогенов, но существуют возможности для расширения на дополнительные патогены, особенно для показаний, в которых клинические признаки указывают на конкретный тип инфекции.37
Наконец, есть компании, которые осознали, что использование агентов узкого спектра для определенных клинических показаний потребует видоспецифической идентификации, и они инвестировали в диагностические технологии. Например, в 2016 году MedImmune, Inc. стала партнером компании Cepheid, которая разработала тесты Xpert®, основанные на технологии ПЦР, для обнаружения Pseudomonas aeruginosa и S. aureus на ранней стадии у пациентов, чтобы можно было использовать моноклональные антитела для лечения (см. ниже).Другим примером является покупка GeneWEAVE BioSciences, Inc. компанией Roche Ltd. GeneWEAVE занимается разработкой патоген-специфической диагностики с использованием нереплицирующегося бактериофага38. Учитывая штамм-специфичность фага, эта технология является многообещающей, поскольку она может быть более чувствительной при обнаружении живые бактерии, чем современные методы. Недавно эта технология была использована для обнаружения M. tuberculosis в анализе на основе фага / ELISA39.
Идентификация антибактериальных агентов узкого спектра
. рода включают: нацеливание на белки и пути, специфичные для интересующих бактерий, использование бактериоцинов и других антимикробных пептидов, специфичных для конкретных бактерий, и фенотипический скрининг целых клеток.Ниже описывается прогресс в разработке антибактериальных агентов узкого спектра действия для борьбы с некоторыми из наиболее опасных патогенов человека, включая патогены ESKAPE, C. difficile и M. tuberculosis .
Антибактериальные средства узкого спектра действия против
M. tuberculosisM. tuberculosis является возбудителем туберкулеза (ТБ) и поражает примерно одну треть населения мира. В 2015 году туберкулез был ведущим убийцей инфекционных заболеваний, вызвав, по оценкам, 1 человека.8 миллионов смертей — это больше, чем от ВИЧ и малярии вместе взятых.40,41 Три из четырех противотуберкулезных препаратов первого ряда являются узкоспектральными, изониазид 1 , пиразинамид 2 и этамбутол 3 (), имеющие мало или отсутствие активности за пределами рода микобактерий.42,43 Однако даже лекарственно-чувствительный ТБ требует шести месяцев лечения комбинацией этих микобактериальных специфических антибиотиков вместе с антибиотиком широкого спектра действия рифампицином.43 В случае штаммов МЛУ, которые становятся все более распространенными, используются несколько антибиотиков широкого спектра действия, включая фторхинолоны и аминогликозиды, а схемы лечения штаммов с множественной лекарственной устойчивостью, требующие применения этих препаратов второго ряда широкого спектра действия, обычно длятся два года.40 Такая длительная продолжительность лечения представляет собой одно из наиболее значительных воздействий на человека антибиотиков, 43 и, несомненно, окажет значительное влияние на комменсальную микробиоту. Учитывая длительные схемы лечения, необходимые для лечения туберкулеза, разработка дополнительных противотуберкулезных агентов узкого спектра действия, которые потенциально могли бы снизить зависимость от антибиотиков широкого спектра действия, была бы особенно ценной.
Соединения, проявляющие антибактериальную активность узкого спектра против M.Туберкулез .
Диарилхинолон бедаквилин 4 (), который был одобрен FDA в 2012 году для лечения МЛУ ТБ, 44 проявляет антимикобактериальную активность узкого спектра в результате избирательного воздействия на микобактериальную АТФ-синтазу.45 Бедаквилин демонстрирует активность против как нереплицирующихся, так и реплицирующихся микобактерий, а также против изолятов, чувствительных к лекарственным средствам и устойчивых к лекарственным средствам. Однако бедаквилин подвергается метаболизму CYP3A4, 46 и проявляет сильное ингибирование каналов hERG, 47 и, как таковой, подлежит ограниченному применению у пациентов, для которых существует значительная неудовлетворенная потребность и положительный баланс пользы и риска.44
Микобактериальный мембранный белок большой 3 (MmpL3) является переносчиком, который необходим для транслокации миколиновой кислоты трегалозы-мономиколата (TMM), предшественника компонента внешней мембраны микобактерий, к внешней мембране. Этот переносчик необходим для микобактерий и специфичен для Actinobacteria , 40,48, что делает его многообещающей мишенью для разработки антибактериальных агентов узкого спектра действия для микобактериальных патогенов. Ряд индолсодержащих соединений был разработан в качестве ингибиторов этого переносчика и продемонстрировал сильную антибактериальную активность in vitro против M.tuberculosis 49 наряду с несколькими видами нетуберкулезных микобактерий (NTM), которые представляют собой растущую проблему здравоохранения. Ведущее соединение из этой серии, 5 (), проявляло сильную антибактериальную активность против M. tuberculosis , а также против группы патогенов NTM, которая включала патогенов комплекса M. avium (MAC), которые являются наиболее распространенными патогенами человека. Возбудители НТМ. Соединение 5 проявляет селективность в отношении микобактерий, при этом не наблюдается ингибирования роста бактерий ни в отношении P.aeruginosa или S. aureus в концентрациях до 160 мкг / мл –1 .40 Это соединение продемонстрировало дозозависимую активность при пероральном введении на мышиной модели инфекции M. tuberculosis , что позволяет предположить, что этот класс соединений имеет потенциал для развития в качестве антимикобактериальных агентов.50
Важнейший флаво-фермент декапренилфосфорил-β-d-рибоза 2′-эпимераза 1 (DprE1) играет роль в синтезе предшественника арабиногалактана, компонента клеточной стенки микобактерий, и был отмечен как многообещающая цель для идентификации новых селективных противотуберкулезных препаратов.46 Было описано несколько ингибиторов DprE1, первыми из которых была серия 1,3-бензотиазин-4-онов (бензотиазоны), включая BTZ043 6 и PBTZ169 7 (). 51,52 BTZ043 демонстрирует высокий антимикобактериальная селективность без активности против репрезентативных грамположительных ( S. aureus и Micrococcus luteus ) и грамотрицательных ( P. aeruginosa и A. baumannii) штаммов .53 Другой класс ингибиторов DprE1 — класс 1,4-азаиндолов, которые, в отличие от бензотиазонов, ингибируют DprE1 через нековалентным механизмом.Ведущие соединения из этой серии, 8 и 9 , демонстрируют in vivo эффективность как в моделях острого, так и хронического туберкулеза у мышей.54 TCA1 10 () — еще один ингибитор DprE1, который был идентифицирован с помощью фенотипического скрининга целых клеток. для ингибиторов образования биопленок, а также ингибирует MoeW, фермент, участвующий в биосинтезе кофактора молибдена (MoCo). TCA1 селективен в отношении микобактерий, не проявляя активности против E. coli , S.aureus или P. aeruginosa . Это соединение обладает активностью как против реплицирующихся, так и против репликационных M. tuberculosis , включая лекарственно-устойчивые штаммы, и продемонстрировало in vivo эффективность на моделях острого и хронического туберкулеза у мышей на грызунах, что делает многообещающим потенциальным лидером для разработки нового класс противотуберкулезных агентов узкого спектра.55
Антибактериальные средства узкого спектра действия для
C. difficileКак упоминалось ранее, использование антибиотиков широкого спектра действия, уничтожающих комменсальные кишечные бактерии, может привести к колонизации условно-патогенными микроорганизмами С.difficile . C. difficile является причиной примерно 250 000 инфекций, которые либо требуют госпитализации, либо поражают уже госпитализированных пациентов в год в США, 14 000 из которых заканчиваются смертельным исходом. Инфекции, вызываемые этой бактерией, также приводят к лишним медицинским расходам не менее 1 миллиарда долларов в год.56 C. difficile является спорообразующей бактерией, которая затрудняет удаление с поверхностей и позволяет ей быстро распространяться57. Дозировка увеличенной продолжительности лечения несколькими антибиотиками, обычно метронидазолом и ванкомицином, у 65% пациентов, у которых наблюдается колонизация C.difficile имеет рецидив, исход, который коррелирует с наличием микробиома с низким разнообразием.10 Кроме того, лечение как пероральным ванкомицином, так и метронидазолом было связано с колонизацией кишечника устойчивым к ванкомицину Enterococcus faecium (VRE). 58 Антибактериальные агенты узкого спектра будут чрезвычайно полезны при лечении инфекций, вызванных C. difficile , поскольку они позволят быстро восстановить комменсальную микробиоту кишечника, и было исследовано несколько различных каркасов.
Макролид узкого спектра действия фидаксомицин 11 () был одобрен FDA для лечения инфекций C. difficile в 2011 году. Фидаксомицин селективен в отношении грамположительных анаэробов, проявляя лишь ограниченную бактерицидную активность против грамположительных аэробов, включая стафилококки и энтерококки, а также отсутствие активности против грамотрицательных бактерий.59 Высокие концентрации фидаксомицина могут быть достигнуты в толстой кишке при очень небольшом сопутствующем системном воздействии.В дополнение к своей антибиотической активности фидаксомицин также ингибирует образование спор и выработку токсина C. difficile . Лечение фидаксомицином приводит к большему сохранению микробиоты кишечника, снижению накопления VRE, а также, как сообщается, к снижению рецидивов инфекций, вызванных C. difficile , по сравнению с лечением ванкомицином60. С. difficile .
Другие антибиотики узкого спектра действия, которые были исследованы для борьбы с C.difficile включают ридинилазол (ранее SMT19969) 12 , новый антибиотик, который действует по еще не полностью изученному механизму действия, который может включать нарушение клеточного деления.61 Ридинилазол проявляет сравнимую или большую антибактериальную активность in vitro против C. ..difficile по сравнению с фидаксомицином и обладает большей активностью, чем ванкомицин или метронидазол, он также проявляет длительный постантибиотический эффект и имеет низкую системную абсорбцию.61 Спектр активности ридинилазола особенно узок, и он проявляет меньшую активность против грамотрицательных анаэробов, чем ванкомицин и метронидазол, неактивен против грамположительных аэробов, включая S. aureus , E. faecium , Enterococcus faecalis , и несколько видов Streptococcus , и он более селективен, чем фидаксомицин, в отношении других грамположительных анаэробов, с активностью, наблюдаемой только против видов Clostridium innocuum и некоторых видов Lactobacillus .62 В модели хомяка индуцированной клиндамицином инфекции C. difficile , ридинилазол продемонстрировал повышенную эффективность по сравнению с ванкомицином и сравнимую с эффективностью фидаксомицина, с выживаемостью 90–100% на 28 день по сравнению с выживаемостью только 10% при лечении ванкомицином. На животных.61 Недавнее клиническое испытание фазы 2 (завершено в августе 2015 г.) подтвердило, что ридинилазол хорошо переносится, установил его не меньшую эффективность по сравнению с ванкомицином и продемонстрировал статистическое превосходство на уровне 10 %.63
Другой подход в поисках узкого спектра противомикробные препараты для лечения C.difficile представляет собой использование бактериоцинов — небольших пептидов, синтезируемых рибосомами, продуцируемых бактериями, которые подавляют рост других бактерий, часто близкородственных видов. Одним из многообещающих бактериоцинов является турицин CD, который продуцируется штаммом Bacillus thuringiensis . Турицин CD состоит из двух различных пептидов, Trn-α и Trn-β, 64 и проявляет сравнимую in vitro антимикробную активность с ванкомицином и метронидазолом в отношении клинически значимых штаммов и не оказывает значительного влияния на состав комменсальной микробиоты кишечника человека. модель дистального отдела толстой кишки.65,66
Антибактериальные средства узкого спектра действия против возбудителей ESKAPE
E. faecium , S. aureus , Klebsiella pneumoniae , A. baumannii , P. aeruginosa и Enterobacter вместе были названы патогенами ESKAPE 67 и составляют почти одну треть. всех внутрибольничных инфекций в Соединенных Штатах.68 Клинические изоляты видов ESKAPE, устойчивые ко всем доступным антибиотикам, в настоящее время изолированы 69, и отчаянно необходимы новые варианты лечения.
Энтерококки являются важными клиническими патогенами, которые обладают потенциалом резистентности практически ко всем клинически используемым антибиотикам за счет как внутренней, так и приобретенной устойчивости механизмов70. Этот род ответственен примерно за 66 000 инфекций, связанных со здравоохранением, в Соединенных Штатах каждый год, 20 000 из которых вызваны штаммами, устойчивыми к ванкомицину, что привело примерно к 1300 смертельным исходам.56 Устойчивость к ванкомицину E. faecium (VRE) составляет 25% инфекций энтерококками в отделениях интенсивной терапии, а устойчивость к обоим антибиотикам, одобренным FDA для Наблюдается лечение VRE (хинупристин-далфопристин и линезолид), что означает, что необходимы новые методы лечения этой бактерии.
Ряд 1,2,4-триазоло [1,5- a ] пиримидинов, которые проявляют сильную селективную активность против E. faecium , был идентифицирован из первоначального in silico скрининга 1,2 миллиона лекарственных препаратов. соединений для ингибиторов пенициллин-связывающего белка 2a (PBP 2a) .71 Этот первоначальный скрининг идентифицировал соединение 13 (), которое показало минимальную ингибирующую концентрацию 8 мкг / мл –1 против E. faecium и не содержало активность против всех других протестированных возбудителей ESKAPE.Синтез аналога вокруг этого каркаса ядра доставлял соединение 14 , которое обладало сопоставимой или повышенной антибактериальной активностью по сравнению с соединением 13 в панели клинических изолятов E. faecium . Было установлено, что механизм действия соединения 14 включает ингибирование биосинтеза пептидогликана, хотя, что интересно, это происходило не за счет ингибирования связывающих пенициллин белков, несмотря на то, что PBP 2a использовался в первоначальном скрининге, который выявил этот класс антибиотиков.Хотя конкретная цель еще предстоит выяснить, этот класс антибактериальных агентов узкого спектра имеет многообещающие возможности для борьбы с инфекциями, вызываемыми E. faecium ,71
Антибактериальные агенты, которые проявляют активность узкого спектра против патогенов ESKAPE .
Метициллин-резистентный S. aureus (MRSA) является причиной примерно 80 461 инфекции и 11 285 смертей ежегодно.56 В настоящее время для лечения инфекций MRSA используются ванкомицин, даптомицин или линезолид, хотя они сходны с VRE, резистентность к этим агентам не наблюдалось.72 Новый антимикробный пептид был исследован как потенциальное антибактериальное средство узкого спектра действия для лечения инфекций S. aureus . MP1106 был разработан на основе грибного плектазина дефенсина, который, как ранее было показано, обладает антибактериальной активностью в отношении ряда грамположительных патогенов через механизм , который включает связывание с промежуточным пептидогликановым липидом II.73 MP1106 продемонстрировал повышенную активность против S. y. aureus по сравнению с исходным пептидом, а также проявлял сильную активность против грамположительного патогена Streptococcus suis , а также умеренную активность против некоторых других грамположительных бактерий, включая некоторые виды Bacillus .Пептид не проявлял антимикробной активности против S. epidermidis или любого из протестированных грамотрицательных видов, 74 демонстрируя его потенциал в качестве отправной точки для разработки терапевтических средств узкого спектра для выбранных грамположительных патогенов, включая S. aureus .
Что касается A . baumannii , потребность в узкоспектральной диагностике и новых антибактериальных подходах может быть еще более очевидной из-за очень высокой смертности (> 60%), связанной с этим патогеном, и того факта, что пациенты могут умереть в течение 48–72 часов. .75–77 В США: A . baumannii составляет лишь 1,8% всех внутрибольничных инфекций и является причиной примерно 45 000–83 000 инфекций в год.20 Напротив, в Азии, Южной Америке и на Ближнем Востоке он является наиболее распространенным внутрибольничным инфекционным заболеванием. организм, ответственный за инфекции.45 Рост распространенности инфекции A. baumannii , наряду с увеличением лекарственной устойчивости, способствовал ускорению разработки как новых, так и новых A . baumannii маломолекулярные вмешательства и нетрадиционные подходы. Потому что А . baumannii имеет уникальную биохимию78 и уникальные компоненты мембраны54, по сравнению с другими грамотрицательными патогенами, такими как E. coli или P. aeruginosa , он может больше подходить для разработки антибактериальных агентов узкого спектра действия.
Одним из таких классов узкого спектра специфических антибиотиков A. baumannii является класс малых молекул 1,2,4-триазолидин-3-тионов, которые специфически нацелены на синтез / удлинение жирных кислот в A . baumannii .79 Эти соединения не проявляют активности против каких-либо других протестированных видов, включая E. coli , P. aeruginosa , K. pneumoniae и S. aureus , а также ведущее соединение из этой серии ( 15 ,), проявляет активность в отношении Galleria mellonella , инфицированных высоковирулентным штаммом A. baumannii (AB5075) .80
Следует также отметить, что немалые молекулы, нетрадиционные антибактериальные подходы с что касается A . baumannii инфекции также реанимируются. Например, сотрудничество армии и военно-морского флота США показало, что коктейль из бактериофагов может успешно воздействовать на один штамм A . baumannii в модели раны in vivo 81, и впоследствии коктейльный подход был успешно использован для лечения инфицированного пациента.82 Продукты фага, лизины, также оказались успешными в специфическом нацеливании на A . baumannii .83 Наконец, недавно было показано, что моноклональные антитела, другой нетрадиционный подход, уничтожают A . baumannii от инфекций кровотока у мышей.84 Мишенью антитела является капсула бактерии, которая, безусловно, является видоспецифичной, но также может быть в некоторой степени специфичной для штамма, что ограничивает полезность, если только другие капсулы из других штаммов также не могут быть нацелены на коктейль.
P. aeruginosa является частой причиной инфекций, связанных с оказанием медицинской помощи, примерно 51 000 из которых происходит ежегодно в Соединенных Штатах, что приводит примерно к 400 смертельным исходам.85 Растущее число штаммов P. aeruginosa обладают множественной лекарственной устойчивостью, и постоянно ведется поиск новых противомикробных стратегий. Одной из таких стратегий, которая была исследована, является использование бактериоцинов, высокая специфичность и активность которых в отношении клинически значимых патогенов делает их многообещающими отправными точками для разработки антибактериальных агентов узкого спектра.85 Одним из классов таких бактериоцинов являются бактериоцины LlpA, которые являются продуцируется несколькими видами бактерий, включая псевдомонады: P.putida , P. protegens и P. syringae , патоген растений Xanthomonas citri и человеческий патоген Burkholderia cenocepacia .86 Бактериоцины LlpA, такие как Pyocin L1 (PyoL1), проявляют высокое сродство к d-рамнозе. , который является составной частью обычного полисахаридного антигена (CPA), обнаруженного в клеточной мембране P. aeruginosa , что объясняет специфичность, проявляемую этим бактериоцином. PyoL1 проявил антибактериальную активность против большинства P.aeruginosa были протестированы изоляты и не проявили активности против других псевдомонад.86 Другой пиоцин, пиоцин S5, как сообщалось, проявлял антибактериальную активность против нескольких штаммов P. aeruginosa и был неактивен против E. coli и S. aureus даже при концентрациях до 2,16 мг / мл –1 0,87
Наконец, было бы упущением не упомянуть об этом, как это обсуждалось для A . baumannii , моноклональные антитела могут также обеспечивать лечение в узком спектре других бактериальных патогенов. Например, биспецифические антитела были разработаны для P.aeruginosa от ООО «МедИммун». MEDI3902 нацелен как на белок системы секреции типа III, PcrV, так и на полисахарид Psl, который играет роль в уклонении от иммунитета и формировании биопленок. MEDI3902 защищает мышей от смертельной инфекции P. aeruginosa 88 и в настоящее время проходит клинические испытания. Это также относится к человеческому иммуноглобулину G1 (κ) моноклонального антитела MEDI4893, которое нацелено на альфа-токсин S. aureus . Было показано, что MEDI4893 безопасен для людей89 и в настоящее время проходит II фазу испытаний на эффективность.Эти продукты, разработанные против этих двух патогенов ESKAPE, последовали вслед за безлотоксумабом, который недавно был одобрен FDA для профилактики инфекций C. difficile .90 Кроме того, возможно, что по мере развития большего количества моноклональных антител комбинации с узкими -спектральные небольшие молекулы также могут быть эффективным подходом.
Выводы
Для преодоления кризиса устойчивости к антибиотикам, с которым мы сейчас сталкиваемся, требуется множество новых подходов.Хотя антибиотики широкого спектра действия принесли обществу многочисленные преимущества, они также страдают недостатками, в первую очередь отбором по устойчивости и пагубным воздействием, которое они оказывают на микробиом хозяина. Разработка антибактериальных агентов узкого спектра, которые проявляют селективность в отношении определенного рода или вида, может решить некоторые из этих проблем. Антибактериальные агенты узкого спектра с активностью против некоторых из наиболее значимых с медицинской точки зрения бактериальных патогенов, в том числе нескольких патогенов ESKAPE, колонизатора условно-патогенного кишечника C.difficile и хронический инфекционный агент M. tuberculosis были представлены здесь. Существуют примеры антибактериальных агентов узкого спектра действия, которые недавно были внедрены в клинику в форме фидаксомицина для лечения инфекций C. difficile и бедаквилина для лечения МЛУ-ТБ. Хотя еще предстоит проделать большую работу по расширению области применения этого подхода с клинической точки зрения, преимущества, которыми обладают агенты узкого спектра действия, и улучшающийся диагностический ландшафт должны сделать антибактериальные средства узкого спектра действия более значимым игроком в антибактериальном арсенале.
Конфликты интересов
Конфликты отсутствуют.
Благодарности
Материал был рассмотрен Исследовательским институтом армии Уолтера Рида. Нет возражений против его презентации и / или публикации. Мнения или утверждения, содержащиеся в данном документе, являются частным мнением автора и не должны рассматриваться как официальные или отражающие истинные взгляды Министерства армии или Министерства обороны. Авторы также хотели бы поблагодарить Национальные институты здравоохранения за поддержку (GM055769, AI106733 и AI10721 для CM).
Ссылки
- Casadevall A. Expert Opin. Фармакотер. 2009; 10: 1699–1703. [PubMed] [Google Scholar]
- Всемирная организация здравоохранения, Устойчивость к противомикробным препаратам — Глобальный отчет по эпиднадзору, 2014 г.
- О’Нил Дж., Обзор AMR, Устойчивость к противомикробным препаратам: борьба с кризисом для здоровья и благосостояния наций, 2014 г.
- Гофф Д.А., Куллар Р., Гольдштейн Э.Дж., Гилкрист М., Натвани Д., Ченг А.С., Кернс KA, Escandon-Vargas K., Villegas M.В., Бринк А., ван ден Берг Д., Мендельсон М. Lancet Infect. Дис. 2017; 17: e56 – e63. [PubMed] [Google Scholar]
- Гилл Э. Э., Франко О. Л., Хэнкок Р. Э. Хим. Биол. Drug Des. 2015; 85: 56–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Меландер Р. Дж., Меландер К. ACS Infect. Дис. 2017; 3: 559–563. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Karam G., Chastre J., Wilcox M. H., Vincent J. L. Crit. Уход. 2016; 20: 136. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Jernberg C., Лофмарк С., Эдлунд К., Янссон Дж. К. ISME J. 2007; 1: 56–66. [PubMed] [Google Scholar]
- Райманн К., Шаффер З., Моран Н. А. PLoS Biol. 2017; 15: e2001861. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лэнгдон А., Крук Н., Дантас Г. Genome Med. 2016; 8: 39. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Убеда К., Памер Э. Г. Trends Immunol. 2012; 33: 459–466. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Стивенс В., Думяти Г., Файн Л. С., Фишер С. Г., ван Вейнгаарден Э.Clin. Заразить. Дис. 2011; 53: 42–48. [PubMed] [Google Scholar]
- Бурси Б., Мамтани Р., Хейнс К., Ян Й. X. Eur. J. Endocrinol. 2015; 172: 639–648. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Блазер М. Дж., Фалькоу С. Нат. Rev. Microbiol. 2009. 7: 887–894. [PubMed] [Google Scholar]
- Холтманн Г. Дж., Форд А. К., Талли Н. Дж. Ланцет Гастроэнтерол. Гепатол. 2016; 1: 133–146. [PubMed] [Google Scholar]
- Стефка А. Т., Фили Т., Трипати П., Цю Дж., Маккой К., Мазманян С.K., Tjota M. Y., Seo G. Y., Cao S., Theriault B. R., Antonopoulos D. A., Zhou L., Chang E. B., Fu Y. X., Nagler C. R. Proc. Natl. Акад. Sci. США, 2014; 111: 13145–13150. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шульфер А., Блазер М. Дж. PLoS Pathog. 2015; 11: e1004903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Стоун В. Н., Сюй П. Мол. Oral Microbiol. 2017 г. doi: 10.1111 / omi.12190. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Райс Л. Б. Клин. Заразить.Дис. 2011; 52 (Приложение 4): S357 – S360. [PubMed] [Google Scholar]
- Спеллберг Б., Рекс Дж. Х. Нат. Rev. Drug Discovery. 2013; 12: 963. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Томмази Р., Браун Д. Г., Уолкап Г. К., Манчестер Дж. И., Миллер А. А. Нат. Rev. Drug Discovery. 2015; 14: 529–542. [PubMed] [Google Scholar]
- Рекс Дж. Х., Голдбергер М., Эйзенштейн Б. И., Харни К. Энн. Акад. Sci. 2014; 1323: 11–21. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Bax R., Грин С. Дж. Антимикроб. Chemother. 2015; 70: 1281–1284. [PubMed] [Google Scholar]
- Casadevall A. Clin. Заразить. Дис. 2006; 42: 1414–1416. [PubMed] [Google Scholar]
- Maurer F. P., Christner M., Hentschke M., Rohde H. Infect. Дис. Отчет 2017; 9: 6839. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Caliendo AM, Gilbert DN, Ginocchio CC, Hanson KE, May L., Quinn TC, Tenover FC, Alland D., Blaschke AJ, Bonomo RA, Carroll KC, Ferraro MJ, Хиршхорн Л.Р., Джозеф В. П., Карчмер Т., Макинтайр А. Т., Реллер Л. Б., Джексон А. Ф., А. Общество инфекционных болезней Clin. Заразить. Дис. 2013; 57 (Приложение 3): S139 – S170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фаро Дж., Митчелл М., Чен Ю. Дж., Камаль С., Риддл Г., Фаро С. Инфекция. Дис. Акушерство. Гинеколь. 2016; 2016: 5293034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- She R. C., Alrabaa S., Lee S. H., Norvell M., Wilson A., Petti C. A. PLoS One. 2015; 10: e0121493. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Opota O., Jaton K., Greub G. Clin. Microbiol. Заразить. 2015; 21: 323–331. [PubMed] [Google Scholar]
- Патель Р. Клин. Chem. 2015; 61: 100–111. [PubMed] [Google Scholar]
- Мари-Альмиралл М., Косгайя К., Хиггинс П.Г., Ван Аше А., Телли М., Хьюс Г., Ливенс Б., Зейферт Х., Дейксхорн Л., Рока И. , Vila J. Clin. Microbiol. Заразить. 2017; 23: 210. [PubMed] [Google Scholar]
- Леунг Л. М., Фондри У. Э., Дои Й., Джонсон Дж. К., Стрикленд Д. К., Эрнст Р. К., Гудлетт Д. Р. Sci. Отчет 2017; 7: 6403.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кемпф В. А., Требезиус К., Аутенриет И. Б. Дж. Клин. Microbiol. 2000; 38: 830–838. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Liao JC, Mastali M., Gau V., Suchard MA, Moller AK, Bruckner DA, Babbitt JT, Li Y., Gornbein J., Landaw EM, McCabe ER , Черчилль BM, Haake DAJ Clin. Microbiol. 2006; 44: 561–570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Альтобелли Э., Мохан Р., Мах К. Э., Син М.L. Y., Anikst V., Buscarini M., Wong P. K., Gau V., Banaei N., Liao J. C. Eur. Урол. Сосредоточьтесь. 2016 doi: 10.1016 / j.euf.2015.12.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
- Леунг А. К., Ньюман Р., Кумар А., Дэвис Х. Д. Эксперт Преп. Мол. Диаг. 2006; 6: 761–766. [PubMed] [Google Scholar]
- Максон Т., Митчелл Д. А. Тетраэдр. 2016; 72: 3609–3624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Nat. Biotechnol. 2015; 33: 1012. [PubMed] [Google Scholar]
- Чжао Н., Спенсер Дж., Шмитт М.А., Фиск Дж. Д. Анал. Biochem. 2017; 521: 59–71. [PubMed] [Google Scholar]
- Франц Н. Д., Белардинелли Дж. М., Камински М. А., Данн Л. К., Каладо Ногейра де Моура В., Блаха М. А., Труонг Д. Д., Ли В., Джексон М., Норт Э. Дж. Биоорг. Med. Chem. 2017; 25: 3746–3755. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пай М., Корреа Н., Мистри Н., Джа П. Ланцет. 2017; 389: 1174–1176. [PubMed] [Google Scholar]
- Барду Ф., Куемар А., Дюпон М. А., Хорн К., Маршал Г., Даффе М. Противомикробные препараты. Агенты Chemother. 1996; 40: 2459–2467. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Випперман М.М. Ф.Ф., Фицджеральд Д. В., Джуст М. А. Дж., Таур Ю., Намасиваям С., Шер А., Бин Дж. М., Буччи В., Гликман М. С. Научные исследования. Отчет 2017; 7: 10767. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cox E., Laessig K. N. Engl. J. Med. 2014; 371: 689–691. [PubMed] [Google Scholar]
- Тантри С. Дж., Шинде В., Балакришнан Г., Маркад С. Д., Гупта А. К., Бхат Дж., Нараян А., Райчуркар А., Джена Л.К., Шарма С., Кумар Н., Нандури Р., Бхарат С., Редди Дж., Пандуга В., Прабхакар К.Р., Кандасвами К., Каур П., Динеш Н. , Гупта С., Саралайя Р., Панда М., Рудрапатна С., Малля М., Рубин Х., Яно Т., Мдлуили К., Купер CB, Баласубраманян В., Самбандамурти В.К., Рамачандран В., Шандил Р. , Кавана С., Нараянан С., Айер П., Мукерджи К., Хосаграхара В.П., Солапуре С., Хамид П.С., Равишанкар С. MedChemComm. 2016; 7: 1022–1032. [Google Scholar]
- Хогланд Д.Т., Лю Дж., Ли Р. Б., Ли Р. Е. Adv. Доставка лекарств Ред. 2016; 102: 55–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Amy PJC, Tong ST, Blaser A., Sutherland HS, Tsang SKY, Guillemont J., Motte M., Cooper CB, Andries K., Van den Broeck W. , Францблау С.Г., Аптон А.М., Денни В.А., Палмер Б.Д., Коноле Д. ACS Med. Chem. Lett. 2017; 8: 1019–1024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Degiacomi G., Benjak A., Madacki J., Boldrin F., Provvedi R., Palu G., Кордулакова Дж., Коул С. Т., Манганелли Р. Sci. Отчет 2017; 7: 43495. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Onajole OK, Pieroni M., Tipparaju SK, Lun S., Stec J., Chen G., Gunosewoyo H., Guo H., Ammerman NC, Bishai WR, Kozikowski APJ Med. Chem. 2013; 56: 4093–4103. [PubMed] [Google Scholar]
- Лун С., Го Х., Онайоле О. К., Пьерони М., Гуносевойо Х., Чен Г., Типпараджу С. К., Аммерман Н. С., Козиковски А. П., Бишай В. Р. Нат. Commun. 2013; 4: 2907. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Макаров В., Манина Г., Микусова К., Моллманн У., Рябова О., Сен-Жоанис Б., Дхар Н., Паска М.Р., Бурони С., Лукарелли А.П., Милано А., Де Росси Э., Беланова М., Бобовска А., Дианискова П., Кордулакова Дж., Сала К., Фуллам Э., Шнайдер П., МакКинни Дж. Д., Бродин П., Кристоф Т., Уоддел С., Бутчер П., Альбретсен Дж., Розенкрандс И. , Брош Р., Нанди В., Бхарат С., Гаонкар С., Шандил Р.К., Баласубраманиан В., Балганеш Т., Тьяги С., Гроссет Дж., Риккарди Г., Коул С.Т., Science. 2009; 324: 801–804. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Макаров В., Лечартье Б., Чжан М., Нерес Дж., Ван дер Сар А.М., Раадсен С.А., Харткоорн Р.К., Рябова О.Б., Вокат А., Декостерд Л.А., Видмер Н., Буклин Т., Биттер В., Андриес К., Pojer F., Dyson PJ, Cole ST EMBO Mol. Med. 2014; 6: 372–383. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Тивари Р., Миллер П. А., Чо С., Францблау С. Г., Миллер М. Дж. ACS Med. Chem. Lett. 2015; 6: 128–133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шируд П. С., Шандил Р., Сэдлер К., Наик М., Хосаграхара В., Хамид С., Шинде В., Батула К., Хумнабадкар В., Кумар Н., Редди Дж., Пандуга В., Шарма С., Амбади А., Хегде Н., Уайтакер Дж., Маклафлин Р.Э., Гарднер Х., Мадхавапедди П., Рамачандран В., Каур П., Нараян А., Гупта С., Авасти Д., Нараян К., Махадевасвами Дж., Вишвас К.Г., Ахуджа В., Шривастава А., Прабхакар KR, Bharath S., Kale R., Ramaiah M., Choudhury NR, Sambandamurthy VK, Solapure S., Iyer PS, Narayanan S., Chatterji MJ Med. Chem. 2013; 56: 9701–9708. [PubMed] [Google Scholar]
- Ван Ф., Самбандан Д., Гальдер Р., Ван Дж., Батт С.М., Вайнрик Б., Ахмад И., Ян П., Чжан Ю., Ким Дж., Хассани М., Хусар С., Трефзер К., Ма З. ., Канеко Т., Мдлули К.Е., Францблау С., Чаттерджи А.К., Джонссон К., Микусова К., Бесра Г.С., Футтерер К., Роббинс С.Х., Барнс С.В., Уокер-младший, Джейкобс-младший В.Р., Шульц П.Г. Proc. Natl. Акад. Sci. США, 2013 г .; 110: E2510 – E2517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- CDC, 2013.
- Leeds J. A. Cold Spring Harbor Perspect. Med.2016; 6: a025445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Жанель Г. Г., Уолкти А. Дж., Карловски Дж. А. Кан. J. Infect. Дис. Med. Microbiol. 2015; 26: 305–312. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Биденбах Д. Дж., Росс Дж. Э., Патнэм С. Д., Джонс Р. Н. Антимикроб. Агенты Chemother. 2010; 54: 2273–2275. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Шах Д. Н., Чан Ф. С., Качру Н., Гарсия К. П., Бальсер Х. Э., Дайер А. П., Эмануэль Дж. Э., Джордан М. Д., Лусарди К.Т., Наймик Г., Полисетти Р. С., Симан Л., Тайлер А. М., Джонсон М. Л., Гэри К. В. SpringerPlus. 2016; 5: 1224. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Викерс Р. Дж., Тиллотсон Г., Гольдштейн Э. Дж., Ситрон Д. М., Гэри К. В., Уилкокс М. Х. Инт. J. Antimicrob. Агенты. 2016; 48: 137–143. [PubMed] [Google Scholar]
- Гольдштейн Э. Дж., Цитрон Д. М., Тиррелл К. Л., Мерриам К. В. Противомикробные препараты. Агенты Chemother. 2013; 57: 4872–4876. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Vickers R.Дж., Тиллотсон Г.С., Натан Р., Хазан С., Пуллман Дж., Лукасти К., Дек К., Яцишин Б., Малиаккал Б., Песант Ю., Техура Б., Роблин Д., Гердинг Д. Н., Уилкокс MH, Co DSG Lancet Infect. Дис. 2017; 17: 735–744. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rea M. C., Sit C. S., Clayton E., O’Connor P. M., Whittal R.M., Zheng J., Vederas J. C., Ross R.P., Hill C. Proc. Natl. Акад. Sci. США, 2010; 107: 9352–9357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rea M. C., Алемайеху Д., Росс Р. П., Хилл К. Дж. Мед. Microbiol. 2013; 62: 1369–1378. [PubMed] [Google Scholar]
- Ри М. К., Добсон А., О’Салливан О., Криспи Ф., Фухи Ф., Коттер П. Д., Шанахан Ф., Кили Б., Хилл К., Росс Р. П. Proc. Natl. Акад. Sci. США, 2011 г .; 108 (Приложение 1): 4639–4644. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Райс Л. Б. Дж. Инфекция. Дис. 2008; 197: 1079–1081. [PubMed] [Google Scholar]
- Cei M., Pardelli R., Sani S., Mumoli N. Clin. Exp. Med. 2014; 14: 77–82.[PubMed] [Google Scholar]
- Чен Л., Тодд Р., Кильбаух Дж., Уолтерс М., Каллен А. MMWR Morb. Смертный. Wkly. Отчет 2017; 66: 33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Холленбек Б. Л., Райс Л. Б. Вирулентность. 2012; 3: 421–433. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ван Х., Ли М., Пэн З., Бласкес Б., Ласточкин Э., Кумарасири М., Боули Р., Чанг М., Mobashery S. J. Med. Chem. 2015; 58: 4194–4203. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Purrello S.M., Garau J., Giamarellos E., Mazzei T., Pea F., Soriano A., Stefani S. J. Glob. Противомикробный. Сопротивляться. 2016; 7: 178–186. [PubMed] [Google Scholar]
- Schneider T., Kruse T., Wimmer R., Wiedemann I., Sass V., Pag U., Jansen A., Nielsen AK, Mygind PH, Raventos DS, Neve S., Равн Б., Бонвин А.М., Де Мария Л., Андерсен А.С., Гаммельгаард Л.К., Сал Х.Г., Кристенсен Х.Х. Наука. 2010; 328: 1168–1172. [PubMed] [Google Scholar]
- Цао Х., Чжан Ю., Мао Р., Дэн Д., Ван Х., Ван Дж.Прил. Microbiol. Biotechnol. 2015; 99: 2649–2662. [PubMed] [Google Scholar]
- Ли Х. Й., Чен С. Л., Ву С. Р., Хуан С. В., Чиу К. Х. Крит. Care Med. 2014; 42: 1081–1088. [PubMed] [Google Scholar]
- Magret M., Lisboa T., Martin-Loeches I., Manez R., Nauwynck M., Wrigge H., Cardellino S., Diaz E., Koulenti D., Rello J. , Группа Е.-В. C. S. Crit. Уход. 2011; 15: R62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sinha N., Niazi M., Lvovsky D. Case Rep. Infect. Дис. 2014; 2014: 705279.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ваак У., Джонсон Т. Л., Чедид К., Си К., Симмонс Л. А., Мобли Х. Л. Т., Сандквист М. Фронт. Клетка. Заразить. Microbiol. 2017; 7: 380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кори Б. В., Томпсон М. Г., Хиттл Л. Э., Джейкобс А. С., Асафо-Адджей Э. А., Хаггинс В. М., Меландер Р. Дж., Меландер К., Эрнст Р. К., Зуравски Д. В. ACS Infect. Дис. 2017; 3: 62–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Хаггинс В. М., Минрович Б.М., Кори Б. В., Джейкобс А. К., Меландер Р. Дж., Соммер Р. Д., Зуравски Д. В., Меландер К. ACS Med. Chem. Lett. 2017; 8: 27–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Regeimbal JM, Jacobs AC, Corey BW, Henry MS, Thompson MG, Pavlicek RL, Quinones J., Hannah RM, Ghebremedhin M., Crane NJ, Zurawski DV, Teneza -Mora NC, Biswas B., Hall ER Antimicrob. Агенты Chemother. 2016; 60: 5806–5816. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Schooley R.Т., Бисвас Б., Гилл Дж.Дж., Эрнандес-Моралес А., Ланкастер Дж., Арендодатель Л., Барр Дж. Дж., Рид С.Л., Ровер Ф., Бенлер С., Сегалл А.М., Таплитц Р., Смит Д.М., Керр К. , Quinones J., Salka S., Bishop-Lilly KA, Young R., Hamilton T. Antimicrob. Агенты Chemother. 2017; 61: e00954-17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thandar M., Луд Р., Винер Б. Ю., Дойч Д. Р., Эйлер К. В., Фишетти В. А. Antimicrob. Агенты Chemother. 2016; 60: 2671–2679. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Nielsen TB, Pantapalangkoor P., Luna BM, Bruhn KW, Yan J., Dekitani K., Hsieh S., Yeshoua B., Pascual B., Vinogradov E. , Hujer KM, Domitrovic TN, Bonomo RA, Russo TA, Lesczcyniecka M., Schneider T., Spellberg BJ Infect. Дис. 2017; 216: 489–501. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cotter P.Д., Росс Р. П., Хилл С. Нат. Rev. Microbiol. 2013; 11: 95–105. [PubMed] [Google Scholar]
- Ghequire M. G., Dingemans J., Pirnay J. P., De Vos D., Cornelis P., De Mot R. MicrobiologyOpen. 2014; 3: 875–884. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ling H., Saeidi N., Rasouliha B.H., Chang M. W. FEBS Lett. 2010. 584: 3354–3358. [PubMed] [Google Scholar]
- ДиДжандоменико А., Келлер А. Э., Гао К., Рейни Г. Дж., Уорренер П., Камара М. М., Боннелл Дж., Флеминг Р., Безабех Б., Димаси Н., Селлман Б. Р., Хиллиард Дж., Гюнтер К. М., Датта В., Чжао В., Гао С., Ю X. К., Сузич Дж. А., Стовер К. К., Sci. Пер. Med. 2014; 6: 262ra155. [PubMed] [Google Scholar]
- Yu X. Q., Робби Г. Дж., Ву Y., Эссер М. Т., Дженсен К., Шварц Х. И., Беллами Т., Эрнандес-Иллас М., Джафри Х. С. Антимикробные препараты. Агенты Chemother. 2017; 61: e01020-16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wilcox M. H., Gerding D. N., Poxton I. R., Kelly C., Nathan R., Birch T., Cornely O.А., Рахав Г., Буза Э., Ли К., Дженкин Г., Дженсен В., Ким Ю.С., Йошида Дж., Габриельски Л., Педли А., Ив К., Типпинг Р., Гурис Д., Картсонис Н., Дорр М.Б., Модифай И., Следователи Мин. Англ. J. Med. 2017; 376: 305–317. [PubMed] [Google Scholar]
Сравнение антибиотиков широкого и узкого спектра действия для детей с инфекциями уха, носовых пазух и горла
Professional Abstract
Objective
Сравнить относительную эффективность антибиотиков узкого и широкого спектра действия при лечении острых респираторных инфекций (ОРТИ) у детей
Дизайн исследования
| Элементы дизайна | Описание |
|---|---|
| Дизайн | Наблюдательные: когортное исследование |
| Население | Ретроспективная когорта: 30 159 детей в возрасте от 6 месяцев до 12 лет с ОРТИ Проспективная когорта: 2472 ребенка в возрасте от 6 месяцев до 12 лет с ОРТИ |
| Вмешательства / Компараторы |
|
| Результаты | Ретроспективная когорта: неэффективность лечения (первичный), возникновение побочных эффектов в течение 30 дней после постановки диагноза Проспективная когорта: качество жизни (первичное), наличие симптомов после 72 часов лечения, возникновение побочных эффектов |
| Таймфрейм | Ретроспективная когорта: 30-дневное наблюдение для первичного результата Проспективная когорта: 20-дневное наблюдение для первичного результата |
В двух наблюдательных когортных исследованиях сравнивали влияние антибиотиков широкого и узкого спектра действия на неэффективность лечения, качество жизни и возникновение побочных эффектов у детей в возрасте от 6 месяцев до 12 лет с ОРТИ, включая острый средний отит, Группа A стрептококковый фарингит и острый синусит.
Для ретроспективного исследования исследователи изучили электронные медицинские карты 30 159 детей с ОРТИ, чтобы определить частоту неэффективности лечения и побочных эффектов в течение 30 дней после постановки диагноза. Среди детей в ретроспективной когорте 63% были белыми, 16% — смешанными или представителями другой расы, 12% — черными и 8% — латиноамериканцами. Средний возраст составлял 5 лет, 52% составляли мужчины.
Для проспективного исследования исследователи включили 2472 ребенка в возрасте от 6 месяцев до 12 лет с ОРВИ из 31 педиатрической клиники в Пенсильвании и Нью-Джерси.Среди детей в проспективном исследовании 59% были в то время как, 23% были чернокожими, 8% были представителями другой расы и 9% были латиноамериканцами. Средний возраст составлял 5 лет, 52% составляли мужчины. Исследователи опросили родителей и детей о качестве жизни, постоянстве симптомов и побочных эффектах.
Дети, родители и врачи помогли спланировать и провести исследование.
Результаты
- Частота неудач лечения: Частота неудач лечения не различалась между детьми, принимавшими антибиотики узкого или широкого спектра действия.
- Разрешение симптомов: Через 72 часа после постановки диагноза скорость исчезновения симптомов у детей, принимавших антибиотики узкого или широкого спектра действия, не различалась.
- Побочные эффекты: Риск побочных эффектов, включая диарею, кандидоз, аллергическую реакцию и рвоту, был значительно ниже у детей, принимавших антибиотики узкого спектра действия, по сравнению с детьми, принимавшими антибиотики широкого спектра действия ( p <0,001).
- Качество жизни. Антибиотики узкого спектра действия были связаны с более высоким качеством жизни, связанным со здоровьем, которое статистически ( p = 0,008), но клинически не отличалось от антибиотиков широкого спектра действия.
Ограничения
У некоторых детей могли быть вирусные инфекции, что может ограничивать способность выявлять межгрупповые различия.
Выводы и актуальность
Антибиотики широкого спектра действия не более эффективны, чем антибиотики узкого спектра действия при лечении ОРТИ у детей.Антибиотики узкого спектра действия были связаны с меньшим риском побочных эффектов.
Потребности в будущих исследованиях
Будущие исследования могут ограничить выборку для исследования детьми с подтвержденными бактериальными инфекциями.
Адъювант антибиотика широкого спектра действия обращает вспять грамотрицательные патогены с множественной лекарственной устойчивостью
Купфершмидт, К. Борцы с резистентностью. Наука 352 , 758–761 (2016).
CAS PubMed Google Scholar
Лакшминараян, Р., Шридхар, Д., Блазер, М., Ван, М., Вулхаус, М. Достижение глобальных целей по устойчивости к противомикробным препаратам. Наука 353 , 874–875 (2016).
CAS PubMed Google Scholar
Holmes, A.H. et al. Понимание механизмов и драйверов устойчивости к противомикробным препаратам. Ланцет 387 , 176–187 (2016).
CAS PubMed Google Scholar
Zowawi, H. M. et al. Возникающая угроза появления грамотрицательных бактерий с множественной лекарственной устойчивостью в урологии. Nat. Преподобный Урол. 12 , 570–584 (2015).
CAS PubMed Google Scholar
Peleg, A. Y. & Hooper, D. C. Внутрибольничные инфекции, вызванные грамотрицательными бактериями. N. Engl. J. Med. 362 , 1804–1813 (2010).
CAS PubMed PubMed Central Google Scholar
Stokes, J. M. et al. Пентамидин сенсибилизирует грамотрицательные патогены к антибиотикам и преодолевает приобретенную устойчивость к колистину. Nat. Microbiol. 2 , 17028 (2017).
PubMed PubMed Central Google Scholar
Li, X.-Z., Plésiat, P. & Nikaido, H. Проблема опосредованной оттоком устойчивости к антибиотикам у грамотрицательных бактерий. Clin. Microbiol. Ред. 28 , 337–418 (2015).
PubMed PubMed Central Google Scholar
Кодзима С. X. и Никайдо Х. Скорость проникновения пенициллинов указывает на то, что поринов Escherichia coli, поринов функционируют в основном как неспецифические каналы. Proc. Natl Acad. Sci. США 110 , E2629 – E2634 (2013).
CAS PubMed Google Scholar
Rabanal, F.& Cajal, Y. Последние достижения и перспективы в дизайне и разработке полимиксинов. Nat. Prod. Отчет 34 , 886–908 (2017).
CAS PubMed Google Scholar
Liu, Y.-Y. и другие. Появление плазмид-опосредованного механизма устойчивости к колистину MCR-1 у животных и людей в Китае: микробиологическое и молекулярно-биологическое исследование. Lancet Infect. Дис. 16 , 161–168 (2016).
PubMed Google Scholar
Wang, Y. et al. Всесторонний анализ резистомности показывает преобладание NDM и MCR-1 в птицеводстве Китая. Nat. Microbiol. 2 , 16260 (2017).
CAS PubMed Google Scholar
Wang, Y. et al. Распространенность, факторы риска, исходы и молекулярная эпидемиология mcr-1 -позитивных энтеробактерий у пациентов и здоровых взрослых из Китая: эпидемиологическое и клиническое исследование. Lancet Infect. Дис. 17 , 390–399 (2017).
CAS PubMed Google Scholar
Stoesser, N., Mathers, AJ, Moore, CE, Day, NP & Crook, DW Ген устойчивости к колистину mcr -1 и плазмида pHNSHP45 в человеческих изолятах Escherichia coli и Klebsiella pneumoniae . Lancet Infect. Дис. 16 , 285–286 (2016).
CAS PubMed Google Scholar
Рединг, К. и Коул, М. Клавулановая кислота: бета-лактам, ингибирующий бета-лактамазу, из Streptomyces clavuligerus . Антимикробный. Агенты Chemother. 11 , 852–857 (1977).
CAS PubMed PubMed Central Google Scholar
Скотт М.Г., Ян Х. и Хэнкок Р.Э. Биологические свойства структурно связанных альфа-спиральных катионных антимикробных пептидов. Заражение.Иммун. 67 , 2005–2009 (1999).
CAS PubMed PubMed Central Google Scholar
Ваара М. и Порро М. Группа пептидов, которые действуют синергетически с гидрофобными антибиотиками против грамотрицательных кишечных бактерий. Антимикробный. Агенты Chemother. 40 , 1801–1805 (1996).
CAS PubMed PubMed Central Google Scholar
Blondiaux, N. et al. Восстановление устойчивости к антибиотикам у Mycobacterium tuberculosis с помощью спироизоксазолина SMARt-420. Наука 355 , 1206–1211 (2017).
CAS PubMed Google Scholar
Райт, Г. Д. Адъюванты антибиотиков: спасение антибиотиков от устойчивости. Trends Microbiol. 24 , 862–871 (2016).
CAS PubMed Google Scholar
King, A. M. et al. Аспергилломаразмин А преодолевает резистентность к металло-β-лактамазе к антибиотикам. Nature 510 , 503–506 (2014).
CAS PubMed PubMed Central Google Scholar
Garcia-Fernandez, E. et al. Разборка микродомена мембраны подавляет устойчивость к антибиотикам MRSA. Cell 171 , 1354–1367 (2017).
CAS PubMed PubMed Central Google Scholar
Douafer, H., Andrieu, V., Phanstiel, O. & Brunel, J.M. Адъюванты антибиотиков: сделайте антибиотики снова великими! J. Med. Chem. 62 , 8665–8681 (2019).
CAS PubMed Google Scholar
Allen, R.C. & Brown, S.P. Модифицированные соотношения антибиотиков и адъювантов могут замедлять и регулировать эволюцию устойчивости: коамоксиклав в качестве примера. мБио 10 , e01831-19 (2019).
PubMed PubMed Central Google Scholar
Liu, Y., Ding, S., Dietrich, R., Märtlbauer, E. & Zhu, K. Гептапептид на основе биосурфактанта с повышенной специфичностью для уничтожения MRSA. Angew. Chem. Int. Эд. 56 , 1486–1490 (2017).
CAS Google Scholar
Лю Ю., Сонг, М., Динг, С. и Чжу, К. Открытие линейных низкокатионных пептидов для нацеливания на метициллин-устойчивый Staphylococcus aureus in vivo. ACS Infect. Дис. 5 , 123–130 (2019).
CAS PubMed Google Scholar
Huang, E., Yang, X., Zhang, L., Moon, S. H. & Yousef, A. E. Новый штамм paenibacillus продуцирует семейство линейных и циклических антимикробных липопептидов: циклизация не важна для их противомикробной активности. FEMS Microbiol. Lett. 364 , fnx049 (2017).
Google Scholar
Лю Ю., Дин С., Шен Дж. И Чжу К. Нерибосомные антибактериальные пептиды, нацеленные на бактерии с множественной лекарственной устойчивостью. Nat. Prod. Отчет 36 , 573–592 (2019).
CAS PubMed Google Scholar
Андерссон Д. И., Хьюз Д. и Кубичек-Сазерленд Дж. З. Механизмы и последствия устойчивости бактерий к антимикробным пептидам. Устойчивость к наркотикам. Обновлять. 26 , 43–57 (2016).
CAS Google Scholar
Ding, R. et al. Выделение и идентификация липопептидных антибиотиков из Paenibacillus elgii B69 с ингибирующей активностью против метициллин-резистентного Staphylococcus aureus . J. Microbiol. 49 , 942–949 (2011).
CAS PubMed Google Scholar
Raetz, C.Р. и Уитфилд, С. Липополисахаридные эндотоксины. Annu. Rev. Biochem. 71 , 635–700 (2002).
CAS PubMed Google Scholar
Нидхэм, Б. и Трент, М. Укрепление барьера: влияние ремоделирования липида А на бактериальный патогенез. Nat. Rev. Microbiol. 11 , 467–481 (2013).
CAS PubMed PubMed Central Google Scholar
Sage, V. L. et al. Протеаза внешней мембраны семейства омптинов предотвращает активацию двухкомпонентной системы Citrobacter rodentium PhoPQ антимикробными пептидами. Мол. Microbiol. 74 , 98–111 (2009).
PubMed Google Scholar
Zhang, Y. et al. Ауторегуляция PhoP / PhoQ и положительная регуляция комплекса белок-циклический AMP рецептор циклического АМФ с помощью PhoP у Yersinia pestis . J. Bacteriol. 195 , 1022–1030 (2013).
CAS PubMed PubMed Central Google Scholar
Горитяла Б.К. и др. Адъюванты на основе гибридных антибиотиков преодолевают устойчивость у Pseudomonas aeruginosa и повышают эффективность фторхинолона. Angew. Chem. Int. Эд. 55 , 555–559 (2016).
CAS Google Scholar
Sohlenkamp, C. & Geiger, O. Липиды бактериальных мембран: разнообразие структур и путей. FEMS Microbiol. Ред. 40 , 133–159 (2016).
CAS PubMed Google Scholar
Kamiya, K., Kawano, R., Osaki, T., Akiyoshi, K. & Takeuchi, S. Асимметричные липидные везикулы размером с клетку облегчают исследование асимметричных мембран. Nat. Chem. 8 , 881–889 (2016).
CAS PubMed Google Scholar
Johnston, C. W. et al. Сборка и кластеризация природных антибиотиков направляет идентификацию цели. Nat. Chem. Биол. 12 , 233–239 (2016).
CAS PubMed Google Scholar
Маланович Н. и Лонер К. Оболочки грамположительных бактериальных клеток: влияние на активность антимикробных пептидов. Biochim. Биофиз. Acta 1858 , 936–946 (2016).
CAS PubMed Google Scholar
Richter, M. F. et al. Правила прогнозирования накопления соединений позволяют получить антибиотик широкого спектра действия. Nature 545 , 299–304 (2017).
CAS PubMed PubMed Central Google Scholar
Vicari, G., Bauer, S.Р., Нойнер, Э. А. и Лам, С. В. Связь между дозой колистина и микробиологическими исходами у пациентов с грамотрицательной бактериемией с множественной лекарственной устойчивостью. Clin. Заразить. Дис. 56 , 398–404 (2012).
PubMed Google Scholar
Бринилдсен, М. П., Винклер, Дж. А., Спина, С. С., Макдональд, И. С. и Коллинз, Дж. Дж. Усиление антибактериальной активности за счет предсказуемого увеличения продукции эндогенных микробных АФК. Nat. Biotechnol. 31 , 160–165 (2013).
CAS PubMed PubMed Central Google Scholar
Флорес-Ким Дж. И Дарвин А. Дж. Фаговый шоковый белок. Annu. Rev. Microbiol. 70 , 83–101 (2016).
CAS PubMed Google Scholar
Хуанг, Ю., Лемье, М. Дж., Сонг, Дж., Ауэр, М., и Ван, Д.Структура и механизм транспортера глицерин-3-фосфата из Escherichia coli . Наука 301 , 616–620 (2003).
CAS PubMed Google Scholar
Yeh, J. I., Chinte, U. & Du, S. Структура глицерин-3-фосфатдегидрогеназы, важного монотопного мембранного фермента, участвующего в дыхании и метаболизме. Proc. Natl Acad. Sci. США 105 , 3280–3285 (2008).
CAS PubMed Google Scholar
Spoering, A., Vulić, M. & Lewis, K. GlpD и PlsB участвуют в образовании клеток-персистеров в Escherichia coli . J. Bacteriol. 188 , 5136–5144 (2006).
CAS PubMed PubMed Central Google Scholar
Курабаяси К., Танимото К., Фуэки С., Томита Х.& Hirakawa, H. Повышенная экспрессия GlpT и UhpT посредством активации FNR способствует увеличению чувствительности к фосфомицину у Escherichia coli в анаэробных условиях. Антимикробный. Агенты Chemother. 59 , 6352–6360 (2015).
CAS PubMed PubMed Central Google Scholar
M100: Стандарты эффективности тестирования на чувствительность к противомикробным препаратам (Институт клинических и лабораторных стандартов, 2017).
Monika, E. S. et al. Идентификация и частичная характеристика гена нерибосомальной пептид синтетазы, ответственного за продукцию цереулида в рвотных средствах Bacillus cereus . Заявл. Environ. Microbiol. 71 , 105–113 (2005).
Google Scholar
Li, H. et al. Молекулярное понимание функциональных различий между резистентностью к колистину, опосредованной mcr-3 и mcr-1 . Антимикробный. Агенты Chemother. 62 , e00036-18 (2018).
Google Scholar
Lam, S.J. et al. Борьба с грамотрицательными бактериями с множественной лекарственной устойчивостью с помощью антимикробных пептидных полимеров, созданных на основе нанотехнологий. Nat. Microbiol. 1 , 16162 (2016).
CAS PubMed Google Scholar
Антибиотик широкого спектра действия — обзор
Медицинское лечение
В случае подозрения или подтвержденного микробного кератита соскоб роговицы должен быть выполнен, чтобы определить, является ли состояние заразным, и, возможно, идентифицировать микроорганизм-нарушитель.
Протокол соскоба, как правило, заключается в инокуляции принадлежностей для сбора образцов в клинике. Образцы берутся с передней кромки и / или основания поражения с помощью иглы 26 размера или лезвия D15. Два предметных стекла обычно смазывают скребком в качестве исходных образцов, которые будут исследованы в микробиологической лаборатории с использованием установленных методов окрашивания. Также можно визуализировать морфологические особенности организма, такие как палочковидная или кокковая форма, гифы гриба или цисты Acanthamoeba .Другие образцы, собранные стерильным тампоном во время соскоба роговицы, могут быть взяты для молекулярного тестирования, такого как тест полимеразной цепной реакции. 23
Конфокальная микроскопия роговицы также может помочь дифференцировать бактериальную, протозойную или грибковую инфекцию. После того, как природа возбудителя будет определена с некоторой степенью уверенности, могут быть введены следующие методы лечения.
Бактериальный кератит
Антибиотики широкого спектра действия следует вводить до получения результата соскоба роговицы, поскольку такие эпизоды лучше всего предполагать заразными, если не доказано иное.Могут быть приняты два подхода:
- •
Двойная терапия — включающая комбинацию двух усиленных антибиотиков для лечения распространенных грамположительных и грамотрицательных патогенов в форме аминогликозида (тобрамицин или гентамицин) и цефалоспорин (цефазолин)
- •
Монотерапия — с фторхинолоном, таким как ципрофлоксацин 0,3% или офлоксацин 0,3% 62
К сожалению, результаты соскобов антибиотиками часто ( были закапаны в качестве необходимой меры предосторожности перед госпитализацией; (б) могут быть изолированы многочисленные микроорганизмы, что затрудняет определение истинного виновника; и (c) результат посева может случайно оказаться ложноотрицательным.Martins et al. 63 утверждал, что культуры контактных линз могут идентифицировать возбудители в большинстве случаев микробного кератита, связанного с контактными линзами.
Специальные усиленные антибиотики для местного применения, такие как гентамицин и цефазолин, могут быть прописаны, если возбудитель заболевания определен положительно. Эти агенты изначально вводятся с часовыми интервалами круглосуточно. Частота может быть уменьшена до двухчасового введения в часы бодрствования, если ответ благоприятный.Продолжающееся улучшение должно позволить заменить витаминизированные капли более слабыми коммерческими препаратами, которые затем уменьшаются и в конечном итоге прекращаются. Также может быть показан пероральный ципрофлоксацин для предотвращения непрерывного распространения на склеру. 62 Антибиотики можно вводить путем субконъюнктивальной инъекции или даже внутривенно, если возможна перфорация роговицы.
Хлорамфеникол — бактериостатическое средство широкого спектра действия, которое используется для лечения многих глазных инфекций. Однако Pseudomonas aeruginosa по своей природе устойчив к этому препарату.Следовательно, хлорамфеникол противопоказан при инфекциях, связанных с контактными линзами, поскольку в большинстве случаев возбудителем инфекции является Pseudomonas aeruginosa .
На ранней стадии бактериального кератита стероиды обычно не назначают (особенно, если язва положительная), потому что эти препараты подавляют метаболизм эпителия и замедляют реэпителизацию и другие процессы восстановления тканей. Стероиды могут быть назначены, но с особой осторожностью, на поздней стадии заживления, чтобы ослабить реакцию хозяина.Типичный режим — введение стероидов на 3-й день после 2-х дней интенсивной антибактериальной терапии. График приема стероидов одновременно с антибиотиками может составлять четыре раза в день в течение 1 недели, два раза в день в течение 1 недели и один раз в день в течение 1 недели и, наконец, прекращение курения. Снижение дозы стероидов необходимо, чтобы избежать эффекта отскока.
Протозойный кератит
Успешное лечение кератита Acanthamoeba лучше всего достигается при своевременной диагностике. Ранние признаки этого состояния, как правило, довольно неспецифичны, и кератит Acanthamoeba часто ошибочно принимают за простой герпес или кератит Pseudomonas .Кроме того, современные методы диагностики — помимо конфокальной микроскопии, которая не получила широкого распространения — ненадежны и обычно дают довольно высокий уровень ложноотрицательных результатов. Современные методы диагностики включают посев роговицы и биопсию стромы. Поскольку эти методы являются инвазивными, их часто откладывают до тех пор, пока не появится высокий индекс подозрения на заболевание, и к ним прибегают только в том случае, если нет ответа на лечение бактериального, вирусного и / или грибкового кератита. 51
Комбинация изетионата пропамидина 0.Капли 1% (Brolene) и полигексаметилен бигуанид 0,02% хорошо переносятся, нетоксичны и в значительной степени эффективны против видов Acanthamoeba . В качестве альтернативы комбинация бролена и неомицина или фторхинолона с хлоргексидином может дать хорошие результаты. 64 Актуальные стероиды можно использовать для контроля стойкого воспаления, но их следует прекратить до прекращения терапии против амебы. 62
Кумар и Ллойд 64 отметили, что инцистированная стадия жизненного цикла видов Acanthamoeba , по-видимому, вызывает трудноизлечимые проблемы и что многие биоциды неэффективны в уничтожении высокоустойчивых цист.Иммунологические методы исследуются как форма профилактики, и оральная иммунизация животных оказалась успешной в предотвращении кератита Acanthamoeba путем индукции иммунитета до того, как возникнет инфекция. 64 Однако маловероятно, что иммунизация будет использоваться для снижения частоты инфицирования людей Acanthamoeba , вызванной контактными линзами.
Грибковый кератит
Кератит Fusarium , связанный с ношением контактных линз, успешно лечится частым чередованием (ежечасно) натамицина (5%) и амфотерицина В (0.15%) противогрибковые глазные капли. 7,65,66 Натамицин для местного применения можно дополнить пероральным вориконазолом, хотя способность этого подхода улучшать результаты подвергается сомнению. 67 Например, Proenca-Pina et al. 68 описал клиническое течение кератита Fusarium , который не поддавался лечению системным и местным вориконазолом и прогрессировал до тяжелого кератита с эндофтальмитом, потребовавшего ранней терапевтической кератопластики. Через 8 месяцев наблюдения зрение восстановилось до 6/15.
Хлоргексидин, антисептик, обычно используемый для лечения кератита Acanthamoeba , 69 хорошо переносится 70 и может использоваться как альтернатива натамицину.
При дрожжевых инфекциях, таких как грибок Candida , который наиболее часто встречается при заболеваниях глазной поверхности и у пациентов с ослабленным иммунитетом, рекомендуется местный амфотерицин B. 71 Можно добавить эхинокандины (например, каспофугин и микафугин). 71 Есть некоторые свидетельства того, что фторхинолоны могут иметь синергетический эффект с амфотерицином. 72 Часто для обеспечения максимального покрытия используются несколько агентов. 71
Дополнительные медицинские стратегии
В зависимости от обстоятельств могут использоваться многие другие медицинские стратегии; Таким образом, это:
- •
мидриатики — (например, атропин) для предотвращения задней синехии;
- •
циклоплегики — для уменьшения боли при цилиарном спазме (атропин также обладает циклоплегическим действием) и стабилизации гемато-водного барьера;
- •
ингибиторы коллагеназы — для минимизации плавления стромы;
- •
нестероидные противовоспалительные средства — для уменьшения воспаления и ограничения инфильтративной реакции;
- •
анальгетики — для облегчения боли;
- •
тканевые адгезивы — применяются, когда строма стала очень тонкой или перфорированной;
- •
хирургическая обработка раны — для усиления проникновения лекарственных препаратов в глаз; и
- •
бандажная линза — для помощи в реэпителизации.
Хирургические вмешательства включают проникающий трансплантат, который может потребоваться в случае больших перфораций или незаживающих глубоких центральных язв; пластинчатый трансплантат; или двухслойная трансплантация амниотической мембраны. 73
Обзор антибиотикотерапии — Knowledge @ AMBOSS
Резюме
Антибиотики — это класс лекарств, используемых в основном против бактериальных инфекций. Некоторые антибиотики также используются против паразитарных инфекций.Антибиотики могут иметь бактериостатический (то есть останавливающий размножение бактерий), бактерицидный (то есть убивающий бактерии) или оба механизма действия. Антибиотики эффективны против небольшой группы бактерий (узкий спектр) или широкого спектра патогенов (широкий спектр). Большинство антибиотиков действуют путем ингибирования синтеза клеточной стенки, синтеза белка или определенных ферментов (например, ТГФ, РНК-полимеразы) у бактерий. Общие побочные эффекты лечения антибиотиками включают реакции гиперчувствительности, а также нефротоксические и гепатотоксические эффекты.Многие антибиотики противопоказаны определенным группам пациентов (например, детям, беременным и / или кормящим женщинам). В случае тяжелой инфекции можно назначить один или несколько антибиотиков, не дожидаясь микробиологического подтверждения (эмпирическая антибиотикотерапия), для воздействия на наиболее вероятные патогены. Антибиотики широко используются, потому что они помогают бороться с инфекционными заболеваниями; однако использование антибиотиков без обоснованных показаний, с несоответствующими дозировками и сроками привело к появлению устойчивых к антибиотикам патогенов (например,г., MRSA, Pseudomonas).
Обзор
Определения
- Антибиотики: противомикробные препараты, эффективные против бактерий
- Бактерицидный препарат: вещество, убивающее бактерии (например, β-лактамы, гликопептиды, эпоксиды)
- Некоторые антибиотики эффективны только при использовании:
- Бактериостатический препарат: вещество, которое замедляет рост бактерий или останавливает размножение бактерий (например, тетрациклины, глицилциклины, макролиды)
Как правило, агенты, ингибирующие синтез клеточной стенки, являются бактерицидными (кроме этамбутола), а те, которые ингибируют синтез белка, являются бактериостатический (кроме тигециклина, рифамицинов и аминогликозидов).
Обзор
[1] [2]ДЕЙСТВИЯ при 30, CELebrationS при 50: аминогликозиды и тетрациклины являются ингибиторами 30S; Хлорамфеникол / клиндамицин, макролиды (например, эритромицин), линезолид и стрептограмин являются ингибиторами 50S.
Все ингибиторы синтеза белка являются бактериостатическими, за исключением аминогликозидов (бактерицидных) и линезолида (могут быть бактерицидными или бактериостатическими в зависимости от концентрации).
Бета-лактамные антибиотики
Ингибиторы бета-лактамаз
CATS: клавуланат, авибактам, тазобактам, сульбактам являются ингибиторами β-лактамаз.
Пенициллины
- Примеры
- Клиническое применение
- Побочные эффекты
- Механизмы устойчивости
Пенициллины, устойчивые к пенициллиназе
- Примеры (перорально или внутривенно)
- Нафциллин
- Диклоксациллин
- Оксациллин
- Флоксациллин
- Метициллин
- Особые характеристики: внутренняя устойчивость к β-лактамазам за счет добавления объемных боковых цепей (например,g., изоксазолил), которые не позволяют бактериальной β-лактамазе гидролизовать β-лактамное кольцо
- Клиническое применение: узкий спектр
- Побочные эффекты
- Механизм устойчивости: изменение сайта связывания PBP; → пониженное сродство → патоген не связывается и не инактивируется β-лактамом; (измененный сайт-мишень PBP является одним из основных факторов вирулентности MRSA)
Используйте NAF (нафциллин) для STAPH (S. aureus).
- Примеры
- Перорально или внутривенно: амоксициллин (в сочетании с клавуланатом)
- Внутривенно или внутримышечно: ампициллин (с сульбактамом или без него)
- Особые характеристики
- Клиническое применение: более широкий спектр действия, чем у пенициллина (пенициллин расширенного спектра действия)
- Грамположительные аэробы
- Грамотрицательные палочки (не эффективны против Enterobacter spp.)
- Наиболее эффективен против:
- Побочные эффекты
- Механизмы устойчивости: расщепление β-лактамного кольца пенициллиназами.
Амоксициллин вводят перорально, а амПициллин вводят уколом!
Аминопенициллинотерапия HHEELPSSS против H. influenzae, H. pylori, E. coli, Enterococci, Listeria monocytogenes, Proteus mirabilis, Salmonella, Shigella, Spirochetes.
Антипсевдомонадные пенициллины
PIPER в своем АВТОМОБИЛЕ, полном TICks, наехал на Pseudomonas: PIPERacillin, CARbenicillin и TICarcillin — это антипсевдомонады.
Карбапенемы
- Примеры
- В / в имипенем (в сочетании с циластатином)
- Меропенем внутривенно
- В / в эртапенем
- В / в дорипенем
- Особые характеристики
- Имипенем всегда назначают с циластатином, который ингибирует человеческую дегидропептидазу I (фермент почечных канальцев, расщепляющий имипенем).
- Меропенем устойчив к дегидропептидазе I.
- Клиническое применение
- Лекарства в крайнем случае (используются только при опасных для жизни инфекциях или после того, как другие антибиотики не помогли) из-за значительных побочных эффектов
- Антибиотики широкого спектра действия с внутренней устойчивостью к бета-лактамазам
- Побочные эффекты
- Вторичные грибковые инфекции [11]
- Токсичность ЦНС: может снизить порог судорожных припадков при высоких концентрациях в сыворотке
- Желудочно-кишечные расстройства
- Сыпь
- Тромбофлебит [12]
- Механизм устойчивости: инактивация карбапенемазой
Получите длительное уничтожение с помощью имипенема плюс циластатин.
НЕ УМИРАЮТ НА МЕ: Дорипенем, Имипенем, Меропенем и Эртапенем являются карбапенемами и используются при опасных для жизни инфекциях.
Монобактамы
- Примеры: IV азтреонам
- Особые характеристики:
- Клиническое применение
- Побочные эффекты: редко
- Расстройство желудочно-кишечного тракта
- Инъекционные реакции
- Сыпь
Цефалоспорины
- Особые характеристики: менее восприимчив к пенициллиназам
- Побочные эффекты
- Механизмы сопротивления
- Инактивация цефалоспориназой (тип β-лактамазы)
- Изменение структуры транспептидазы (PBP)
1 PEcK: 1 цефалоспорины поколения покрывают Proteus mirabilis, E.coli, Klebsiella pneumoniae.
2 HENS PEcK: 2 цефалоспоринов поколения охватывают H. influenzae, Enterobacter aerogenes (теперь Klebsiella aerogenes), Neisseria, Serratia marcescens, Proteus mirabilis, E. coli, Klebsiella pneumoniae.
2 грейдеры и носят искусственный мех лисицы на чаепитиях: 2 Цефалоспорины -го поколения включают цефаклор, цефокситин, цефуроксим и цефотетан.
Цефалоспорины ХРАМНЫ: 1 -й –4 -й Цефалоспорины поколения не действуют против листерий, атипичных организмов (например.g., Chlamydia, Mycoplasma), MRSA и Enterococci (за исключением цефтаролина, который действительно действует против MRSA).
Гликопептиды
- Примеры
- Ванкомицин перорально или внутривенно
- Актуальный бацитрацин
- Механизм действия
- Проникновение в ЦНС: только при повышенной проницаемости менингеальных сосудов (например, при менингеальном воспалении)
- Путь выведения: почечный (через клубочковую фильтрацию)
- Клиническое применение: особенно эффективен против организмов с множественной лекарственной устойчивостью
- Побочные эффекты
- Внутривенное введение
- Пероральный прием: преимущественно дисгевзия и побочные эффекты со стороны желудочно-кишечного тракта.
- Противопоказания: используйте беременным женщинам только в том случае, если польза от него превышает риски. [21]
- Механизмы устойчивости
Ванкомицин в фургоне несет ТОННУ красных платьев: побочные эффекты ванкомицина — тромбофлебит, ототоксичность, нефротоксичность, синдром красного человека и синдром DRESS.
Штраф за VANdalism составляет один DALlAr в LACjac: устойчивость к VANкомицину вызывается модификацией аминокислот (от D-Ala-D-Ala до D-Ala-D-Lac).
Эпоксиды
Липопептиды
- Примеры: даптомицин
- Механизм действия: включить каналы K + в клеточную мембрану грамположительных бактерий → быстрая деполяризация мембраны; → потеря мембранного потенциала → ингибирование синтеза ДНК, РНК и белков → гибель клеток (бактерицидный эффект) [24]
- Путь выведения: почечный
- Клиническое применение
- Побочные эффекты
- Противопоказания: гиперчувствительность
- Механизмы устойчивости: отталкивание молекул даптомицина из-за изменения заряда бактериальной поверхности [26]
Dap-to-my-cin полезен для моей кожи: даптомицин используется для лечения кожных инфекций.
Полимиксины
- Примеры
- Механизм действия
- Проникновение в ЦНС: плохое
- Путь выведения: преимущественно почечный
- Клиническое применение: тяжелые инфекции, вызванные грамотрицательными бактериями с множественной лекарственной устойчивостью
- Побочные эффекты
- Противопоказания:
- Повышенная чувствительность к полимиксинам.
- Осторожное применение у пациентов с нарушением функции почек
Аминогликозиды
- Примеры
- Гентамицин внутривенно или внутримышечно
- В / в или в / м амикацин
- Тобрамицин внутривенно или внутримышечно
- Стрептомицин внутривенно или внутримышечно
- Пероральный неомицин
- Механизм действия
- Проникновение в ЦНС: плохое
- Путь выведения: почечный (через клубочковую фильтрацию).
- Клиническое применение [29]
- Побочные эффекты
- Противопоказания
- Механизмы устойчивости: инактивация посредством ацетилирования, фосфорилирования и / или аденилирования секретируемыми ферментами бактериальной трансферазы.
Я и мой новый AMIgA выполняем ОБЩИЕ ШАГИ, чтобы уменьшить потребление TOBacco, но безуспешно: NEomycin, AMIkAcin, GENtamicin, STrEPtomycin AMinoglycosides и TOBramycin неэффективны в уничтожении анаэробов.
Ах, Мичиган (y) ОТтер НЕФью продолжает терроризировать наш блок: побочные эффекты аминогликозидов включают НЕФротоксичность, ототоксичность, тератогенность и нервно-мышечную блокаду.
Тетрациклины
- Примеры
- Миноциклин перорально или внутривенно
- Тетрациклин перорально или внутривенно
- Пероральный доксициклин
- Демеклоциклин для перорального применения
- Механизм действия: связывание 30S субъединицы → аминоацил-тРНК блокируется от связывания с акцепторным сайтом рибосомы → ингибирование синтеза бактериального белка (бактериостатический эффект)
- Проникновение в ЦНС: слабое
- Путь ликвидации
- Клиническое применение
- Особые соображения
- Оральные тетрациклины не следует принимать с веществами, которые содержат большое количество Ca 2+ , Mg 2+ или Fe 2+ (например,g., молоко, антациды, добавки железа, соответственно), потому что двухвалентные катионы ингибируют всасывание тетрациклинов в кишечнике.
- Проникновение в ЦНС ограничено
- Побочные эффекты
- Противопоказания
- Механизмы устойчивости: транспортные насосы, кодируемые плазмидами, увеличивают отток из бактериальной клетки и снижают поглощение тетрациклинов.
Зубы: изменение цвета зубов — побочный эффект тетрациклинов.
Глицилциклины
- Примеры: тигециклин
- Механизм действия [35]
- Проникновение в ЦНС: плохое
- Путь выведения: преимущественно желчный
- Клиническое применение
- Особые соображения
- Побочные эффекты [4]
- Противопоказания [38]
- Дети в возрасте
- Беременные женщины
- Кормящие женщины
- Осторожное применение у пациентов с нарушением функции печени
Макролиды
- Примеры
- Перорально или внутривенно: эритромицин, азитромицин, кларитромицин.
- Механизм действия: связывание с молекулой 23S рибосомной РНК 50S субъединицы → блокирование транслокации → ингибирование синтеза бактериального белка; (бактериостатический эффект)
- Проникновение в ЦНС: плохое
- Путь выведения: желчный
- Клиническое применение
- Побочные эффекты
- Лекарственные взаимодействия
- Особые соображения
- Противопоказания [41] [42] [43]
- Механизмы устойчивости: Метилирование сайта связывания 23S рРНК предотвращает связывание макролида с рРНК.
Макролиды: макролиды ингибируют транслокацию во время синтеза белка, при котором рибосомы скользят по мРНК.
Побочные эффекты MACROlides включают нарушения моторики желудочно-кишечного тракта, аритмию (из-за удлиненного интервала QT), острый холестатический гепатит, сыпь и эозинофилию.
Линкозамиды
- Примеры: клиндамицин
- Механизм действия: связывается с субъединицей 50S → блокирование транслокации пептида (транспептидация) → ингибирование удлинения пептидной цепи → ингибирование синтеза бактериального белка (бактериостатический эффект)
- Проникновение в ЦНС: плохое
- Путь выведения: как почечный, так и желчный
- Клиническое применение
- Особые соображения: перекрестная резистентность с макролидами
- Побочные эффекты
- Противопоказания. Беременным женщинам в течение 1 -го триместра и кормящим грудью женщинам клиндамицин следует применять только в том случае, если польза от него превышает риски.
Стрептограмин
- Примеры: хинупристин-далфопристин внутривенно.
- Механизм действия [46]
- Путь выведения: желчный и почечный [48]
- Клиническое применение
- Особые указания: ингибирует CYP3A4 [50]
- Побочные эффекты
- Противопоказания: рассмотрите возможность использования в следующих группах населения только в том случае, если преимущества перевешивают риски, поскольку безопасность в них не установлена [50]
- Механизмы резистентности
Оксазолидиноны
- Примеры: линезолид
- Механизм действия
- Проникновение в ЦНС: хорошее
- Путь выведения: выведение с желчью и почками после метаболизма в печени
- Клиническое применение: грамположительные бактерии с множественной лекарственной устойчивостью (VRE, MRSA).
- Побочные эффекты
- Противопоказания
- Механизм устойчивости: точечная мутация 23S рРНК [52]
Амфениколс
- Примеры: хлорамфеникол
- Механизм действия: связывание субъединицы 50S → блокирование пептидилтрансферазы → ингибирование синтеза бактериального белка (бактериостатический эффект) [53]
- Проникновение в ЦНС: хорошее
- Путь выведения: выведение почками после метаболизма в печени
- Клиническое применение
- Особые соображения
- Сильное ингибирующее действие на изоформы цитохрома P450 CYP2C19 и CYP3A4 [53]
- Редко в США из-за побочных эффектов
- Наиболее часто используется в странах с ограниченными ресурсами из-за низкой стоимости лекарств
- Побочные эффекты
- Противопоказания
- Младенчество
- Беременность
- Осторожное применение у пациентов с нарушением функции почек и / или печени
- Механизмы устойчивости: инактивация лекарств с помощью ацетилтрансферазы, кодируемой плазмидой.
Фторхинолоны
Фторхинолоны повреждают прикрепления к вашим костям.
Нитроимидазолы
- Примеры
- Перорально или внутривенно: метронидазол
- Тинидазол перорально или внутривенно
- Механизм действия: образует свободные радикалы в бактериальной клетке → разрывает цепь ДНК; → гибель клеток (бактерицидный и противопротозойный эффект)
- Проникновение в ЦНС: хорошее
- Путь выведения: почечный
- Клиническое применение
- Побочные эффекты
- Противопоказания
- Рассмотрите возможность использования в следующих группах населения, если преимущества перевешивают риски, поскольку безопасность в этой группе населения не установлена
- Осторожное применение у пациентов с дисфункцией печени
ДОЛГОЙ БАК: Метронидазол лечит трихомонады, лямблии / Gardnerella, Bacteroides, Entamoeba, Clostridium и H.пилори.
Сульфонамиды и диаминопиримидин
- Классы наркотиков
- Примеры
- Механизм действия
- Проникновение в ЦНС: хорошее
- Путь выведения: преимущественно почечный (через канальцевую секрецию)
- Клиническое применение: Общие показания включают ИМП и острый средний отит.
- Побочные эффекты
- Противопоказания
- Детский возраст
- Беременные
- Кормящие женщины
- Осторожное применение у людей с
- Механизмы устойчивости
ТМП плохо лечит костный мозг.
ROCk, PAper, SCiSSors: наиболее важными сульфамидными препаратами являются фуросемид, (гидро) хлорталидон, пробенецид, ацетазоламид, сульфаметоксазол / сульфадиазин, целекоксиб, сульфасалазин и сульфонилмочевина).
Нитрофураны
- Примеры: нитрофурантоин
- Механизм действия: восстанавливается бактериальными нитроредуктазами до реактивных метаболитов → связывается с бактериальными рибосомами → нарушение метаболизма, нарушение синтеза белка, ДНК и РНК → гибель клеток (бактерицидный эффект) [7] [8]
- Путь выведения: преимущественно почек, в небольших количествах с калом
- Клиническое применение
- Возбудители мочевыводящих путей
- Грамположительные: энтерококки, Staphylococcus saprophyticus, стрептококки группы B, золотистый стафилококк, эпидермальный стафилококк
- Грамотрицательные: E.coli, Enterobacter spp., Shigella spp., Salmonella spp., Citrobacter spp, Neisseria spp, Bacteroides spp., Klebsiella spp.
- Не эффективен против Pseudomonas и / или Proteus
- Клинические показания включают:
- Возбудители мочевыводящих путей
- Побочные эффекты
- Противопоказания
Антимикобактериальные препараты
См. «Лечение» в «Туберкулез».
Рифамицины
- Примеры
- Механизм действия: ингибирует бактериальную ДНК-зависимую РНК-полимеразу → предотвращение транскрипции (синтез мРНК) → ингибирование синтеза бактериального белка → гибель клеток (бактерицидный эффект)
- Путь выведения: желчный
- Клиническое применение [35]
- Побочные эффекты
- Противопоказания
- Кормящие женщины
- Следует использовать во время беременности только в случае крайней необходимости
- Осторожное применение у пациентов с нарушением функции печени
- Механизмы устойчивости
6R рифампицина: красная или оранжевая моча, репрессия РНК-полимеразы, усиление активности цитохрома P450 и быстрое развитие резистентности при использовании отдельно.
Рифампицин действительно усиливает (индуцирует) цитохром P450, а рифабутин — нет.
Изониазид (INH)
- Механизм действия
- Проникновение в ЦНС: переменное
- Метаболизм: преимущественно печеночный
- INH превращается в различные метаболиты (например, посредством ацетилирования), некоторые из которых являются гепатотоксичными (например, гидразин, ацетилгидразин).
- Главный метаболический фермент: N-ацетилтрансфераза (NAT): участвует в образовании метаболитов и последующей нейтрализации.
- Скорость ацетилирования NAT определяется генетически.
- Лица с медленным ацетилированием: более высокий период полувыведения из-за отсутствия печеночного NAT → повышенный риск лекарственной токсичности
- Лица с быстрым ацетилированием: более низкий период полувыведения активного лекарственного средства → для достижения такой же концентрации в крови требуется введение более высокой дозы по сравнению с людьми с медленным ацетилированием [73] [74]
- Ингибирует изоформы цитохрома P450 (CYP1A2, CYP2A6, CYP2C19 и CYP3A4) [74]
- Путь выведения: выведение почками после метаболизма в печени
- Клиническое использование: [75]
- Побочные эффекты
- Противопоказания
- Следует использовать во время беременности только в случае крайней необходимости
- Осторожное применение у пациентов с почечной и / или печеночной дисфункцией
- Механизмы устойчивости: мутации, вызывающие снижение KatG → снижение экспрессии каталазы-пероксидазы → меньше / нет биологически активного INH
INH не является здоровым для нейронов и гепатоцитов.
Нейротоксичность можно предотвратить, добавив пиридоксин (витамин B6).
пиразинамид
- Механизм действия
- Не до конца изучен
- Пролекарство: преобразовано в активную форму пиразиновой кислоты
- Наиболее эффективно при кислом pH (например, в кислых фаголизосомах)
- Бактерицидное действие
- Не до конца изучен
- Проникновение в ЦНС: только при воспалении мозговых оболочек
- Путь выведения: выведение почками после метаболизма в печени
- Клиническое использование: М.туберкулез
- Побочные эффекты
- Противопоказания
- Рассматривать применение у беременных и кормящих женщин только в том случае, если преимущества перевешивают риски [76]
- Печеночная недостаточность [77]
- Острая подагра
- Механизмы устойчивости: мутации в гене RpsA, кодирующем рибосомный белок S1 [78]
Этамбутол
- Механизм действия: подавляет арабинозилтрансферазу → ↓ полимеризацию углеводов → предотвращает синтез клеточной стенки микобактерий (бактериостатический эффект)
- Проникновение в ЦНС: только при воспалении мозговых оболочек
- Путь выведения: преимущественно почечный
- Клиническое применение
- Побочные эффекты
- Противопоказания
- Противопоказано пациентам, которые не могут сообщить о визуальных изменениях
- Противопоказано пациентам с невритом зрительного нерва
- Рассмотрите возможность использования в следующих группах населения только в том случае, если преимущества перевешивают риски, поскольку безопасность в них не установлена
- Механизмы устойчивости: мутации гена EmbCAB, кодирующего арабинозилтрансферазу [80]
EY Этамбутол: Этамбутол вызывает оптическую невропатию.
Дапсон
- Механизм действия
- Путь выведения: преимущественно почечный
- Клиническое применение
- Побочные эффекты
- Противопоказания. Механизм устойчивости: мутации гена folP1, кодирующего дигидроптероатсинтазу [83]
Противопоказания
Для детей SAFe эти таблетки противопоказаны: детям противопоказаны сульфаниламиды, аминогликозиды, фторхинолоны, кларитромицин, тетрациклины и хлорамфеникол.
Разрежьте таблетки для безопасности вашего ребенка: хлорамфеникол, тетрациклины, кларитромицин, сульфаниламиды, аминогликозиды и фторхинолоны противопоказаны при беременности.
Перечислим наиболее важные противопоказания. Выбор не исчерпывающий.
Дополнительные соображения
Эмпирическая антибактериальная терапия
Эмпирическая антибиотикотерапия охватывает наиболее вероятный возбудитель (ы) до того, как станет известна структура резистентности и / или возбудителя.
Показания
- Бактериальная инфекция, которая потенциально опасна для жизни (например, менингит, сепсис) и / или может привести к тяжелым заболеваниям (например, септическому артриту), если лечение откладывается до окончательного определения возбудителя.
- Инфекции, которые обычно лечат эмпирически
- Мозг: менингит, абсцесс головного мозга
- Легкое: пневмония, абсцесс легкого
- Кожа: целлюлит, некротический фасциит, инфекции в области хирургического вмешательства.
- Кости и / или суставы: остеомиелит, септический артрит
- Дыхательные пути: бактериальный риносинусит, тонзиллит, фарингит
- Сердце: инфекционный эндокардит.
- Желудочно-кишечный тракт: дизентерия, спонтанный бактериальный перитонит.
- Область почек и половых органов: инфекции мочевыводящих путей (например,г., пиелонефрит, простатит, выделения из половых органов)
- Любая причина сепсиса
Выбор эмпирической антибактериальной терапии
Нацельтесь на наиболее вероятный возбудитель (ы), но при этом учитывайте факторы, которые могут повлиять на успех использования выбранного агента:
- Факторы-хозяева
- Обстоятельства инфекции
- Место заражения
- Специфические инфекции чаще вызываются определенными организмами (например, ИМП чаще всего вызываются E.coli
- Некоторые участки труднодоступны для антибиотиков и требуют использования более высоких / более частых доз, более длительной терапии, комбинаций антибиотиков и / или использования антибиотиков, проникающих через гематоэнцефалический барьер.
- Относительные противопоказания (см. «Противопоказания» выше)
- Дети, беременные, кормящие женщины
- Лица с ранее существовавшими заболеваниями и / или сопутствующими заболеваниями
- Предыдущая антибактериальная терапия
- Факторы лекарственные
- Путь введения
- Токсичность антибиотиков
- Лекарственные взаимодействия
- Стоимость антибиотика
Другие руководящие принципы
- Эскалация антибиотикотерапии
- Увеличение спектра охвата антибактериальной терапией, когда клинические симптомы не улучшаются и / или если возбудитель, вызывающий заболевание, сохраняется
- Антибиотики широкого спектра действия эффективны как против грамположительных, так и грамотрицательных бактерий.
- Примеры включают:
- Деэскалация антибактериальной терапии: более специфическая схема антибиотикотерапии узкого спектра начинается после того, как становится известен возбудитель, а также его паттерны резистентности и чувствительности.
Перед началом эмпирической антибактериальной терапии следует сделать посев крови.
Целевая антибактериальная терапия
- Таргетная антибактериальная терапия выбирается на основании результатов посева и теста на антибактериальную чувствительность.
- Направлен на снижение риска токсичности лечения, предотвращение развития устойчивости к противомикробным препаратам и снижение стоимости лечения
- Обычно используются агенты узкого спектра действия для максимизации эффективности и снижения риска побочных эффектов
Профилактика антибиотиками
- Антибиотики обычно используются для профилактики инфекций в следующих ситуациях:
13.1D: Спектр антимикробной активности
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
Спектр антибиотиков может быть широким или узким.
Цели обучения
- Сравнение антибиотиков узкого и широкого спектра действия
Ключевые моменты
- Антибиотики широкого спектра действия действуют против большей группы бактерий.
- Антибиотики узкого спектра нацелены на специфические бактерии, такие как грамположительные или грамотрицательные.
- Три новых класса антибактериальных антибиотиков введены в клиническое использование: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Ключевые термины
- Окрашивание по Граму : метод дифференциации видов бактерий на две большие группы (грамположительные и грамотрицательные).
- антибиотик узкого спектра действия : Тип антибиотика, который нацелен на определенные типы грамположительных или грамотрицательных бактерий.
- антибиотик широкого спектра действия : Тип антибиотика, который может поражать широкий спектр бактерий.
Спектр бактерий, на которые воздействует антибиотик, можно разделить на узкий и широкий спектр.Антибиотики узкого спектра действия действуют против ограниченной группы бактерий, грамположительных или грамотрицательных, например фузидат натрия действует только против стафилококковых бактерий. Широкий спектр действия — антибиотики действуют против грамположительных и грамотрицательных бактерий, например амоксициллина.
Окрашивание по Граму (или метод Грама; это метод разделения видов бактерий на две большие группы (грамположительные и грамотрицательные). Он основан на химических и физических свойствах их клеточных стенок.В первую очередь, он обнаруживает пептидогликан, который присутствует в толстом слое у грамположительных бактерий. Грамположительный результат дает пурпурный / синий цвет, а грамотрицательный — розовый / красный цвет. Окрашивание по Граму почти всегда является первым шагом в идентификации бактериального организма и является окрашиванием по умолчанию, выполняемым лабораториями над образцом, когда не указывается конкретная культура. Хотя окрашивание по Граму является ценным диагностическим инструментом как в клинических, так и в исследовательских целях, не все бактерии могут быть окончательно классифицированы с помощью этого метода, таким образом, образуя группы грамм-переменных и грамм-неопределенных групп.
Рисунок: Окраска по Граму : Это микроскопическое изображение окрашивания по Граму смешанных грамположительных кокков ( Staphylococcus aureus , фиолетовый) и грамотрицательных бацилл ( Escherichia coli , красный).Антибиотик широкого спектра действия действует как против грамположительных, так и грамотрицательных бактерий, в отличие от антибиотика узкого спектра действия, который эффективен против определенных семейств бактерий. Примером широко применяемого антибиотика широкого спектра действия является ампициллин. Антибиотики широкого спектра действия должным образом используются в следующих медицинских ситуациях: эмпирически (т.д., основанный на опыте практикующего врача), до формальной идентификации бактерий-возбудителей и когда существует широкий спектр возможных заболеваний и потенциально серьезное заболевание может привести к отсрочке лечения. Это происходит, например, при менингите, когда пациент может смертельно заболеть в течение нескольких часов, если не начать лечение антибиотиками широкого спектра действия. Антибиотики широкого спектра действия также используются для лекарственно-устойчивых бактерий, которые не реагируют на другие антибиотики более узкого спектра действия, а также в случае суперинфекций, когда существует несколько типов бактерий, вызывающих заболевание, что требует применения либо антибиотика широкого спектра действия, либо комбинированной антибиотикотерапии. .
После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид). .
Антибиотик широкого спектра действия не более эффективен, чем плацебо в предотвращении симптомов COVID-19
Исследование Калифорнийского университета в Сан-Франциско показало, что антибиотик азитромицин не более эффективен, чем плацебо, в предотвращении симптомов COVID-19 среди пациентов, не госпитализированных, и может увеличить их вероятность госпитализации, несмотря на широко распространенное назначение антибиотиков для лечения этого заболевания.
«Эти данные не подтверждают рутинное использование азитромицина для лечения инфекции SARS-CoV-2 в амбулаторных условиях», — заявила ведущий автор Кэтрин Э. Ольденбург, доктор медицинских наук, доцент Фонда Проктора UCSF. SARS-CoV-2 — это вирус, вызывающий COVID-19.
Азитромицин, антибиотик широкого спектра действия, широко назначается для лечения COVID-19 в США и во всем мире. «Гипотеза состоит в том, что он обладает противовоспалительными свойствами, которые могут помочь предотвратить прогрессирование, если лечить на ранней стадии заболевания», — сказал Ольденбург.«Мы не обнаружили, что это так».
Исследование, проведенное в сотрудничестве со Стэнфордским университетом, опубликовано 16 июля 2021 года в журнале Американской медицинской ассоциации .
В исследование были включены 263 участника, у которых все дали положительный результат на SARS-CoV-2 в течение семи дней до включения в исследование. На момент зачисления никто не был госпитализирован. В процессе случайного отбора 171 участник получил однократную пероральную дозу 1,2 грамма азитромицина, а 92 участника получили идентичное плацебо.
На 14-й день исследования у 50 процентов участников в обеих группах симптомы не наблюдались. К 21 дню пятеро участников, получавших азитромицин, были госпитализированы с тяжелыми симптомами COVID-19, и ни один из участников группы плацебо не был госпитализирован.
Исследователи пришли к выводу, что лечение однократной дозой азитромицина по сравнению с плацебо не привело к большей вероятности отсутствия симптомов.
Большинство исследований, проведенных до сих пор с азитромицином, были сосредоточены на госпитализированных пациентах с довольно тяжелым заболеванием.Наша статья — одно из первых плацебо-контролируемых исследований, показывающих отсутствие роли азитромицина у амбулаторных пациентов ».
Екатерина Э. Ольденбург, доктор медицинских наук, ведущий автор
Источник:
Калифорнийский университет — Сан-Франциско
Ссылка на журнал:
Ольденбург, К.



