Цефтриаксон и алкоголь: совместимость, последствия, побочные эффекты.
Цефтриаксон считается самым популярным антибиотиком антибактериального действия. Препарат чаще всего прописывается при лечении различных бактериальных и инфекционных заболеваний. Практически каждый препарат медицинского назначения, в частности и цефтриаксон, наносит серьезный удар всему человеческому организму, и в первую очередь удар на себя принимают печень и почки.
Так в чем опасность такого сочетания, как цефтриаксон и алкоголь? Можно ли позволить себе во время лечения небольшое количество спиртного? Обо всем этом расскажем далее.
Цефтриаксон: широкий спектр действия
Показанием к назначению препарата выступают различные заболевания и инфекции внутренних органов, вызванные множественными бактериями и вирусами. Это и:
- Перитонит;
- Пневмония;
- Эмпиема;
- Кожные инфекции;
- Инфекции мочеполовой системы;
- Сепсис;
- Тиф;
- Пиелонефрит;
- Гонорея и т.

Поскольку препарат эффективно снимает любой воспалительный процесс, цефтриаксон очень часто назначают для профилактики инфицирования после различных операций. Однако, как и любой другой препарат антибактериального действия, цефтриаксон обладает множественными противопоказаниями и рядом побочных эффектов.
Побочные действия:
- Кандидамикоз;
- Головокружение;
- Стоматит;
- Тошнота;
- Олигурия;
- Псевдохолелитиаз желчного пузыря и др.
Противопоказания:
- Энтерит, язвенный колит;
- Беременность и период лактации;
- Печеночная дисфункция и почечная недостаточность;
- Гипербиллирубинемия новорожденных;
- Высокая чувствительность к компонентам препарата;
В инструкции препарата также говориться о том, что антибиотик с эталоном и другими антибактериальными препаратами ни в коем случае сочетать нельзя. Такое сочетание в дальнейшем может вызвать достаточно сложные последствия, вплоть до смерти.
Именно поэтому, отвечая на вопрос, можно ли употреблять алкоголь после цефтриаксона, ответ однозначный: НЕТ! Двойной удар по организму может вызвать сложнейшие последствия, вплоть до смерти.
Однако удар по почкам и печени является не единственной причиной, которая не позволяет антибиотик и спиртное сочетать вместе. Уменьшение эффективности антибактериального средства и проявление побочных реакций, вот основная опасность такого совмещения.
Опасное сочетание
Так какие же негативные последствия, вызывает такое опасное сочетание:
- Головокружение;
- Со стороны пищеварительной системы — дисбактериоз, нарушение вкуса, рвотные рефлексы;
- Со стороны мочеполовой системы — снижение объема мочи;
- Со стороны органов кровеносной системы ; малокровие, тромбоцитоз, лейкопения;
- Проявление грибковых инфекций;
- Носовые кровотечения;
- Аллергические реакции.

Кроме этого, алкоголь после цефтриаксона может вызвать дисульфирамоподобную реакцию, характеризирующаяся снижением давления, сильнейшими болями в области живота, тошнотой и рвотой, а также отдышкой и тахикардией. Подобную реакцию могут вызвать даже несколько глотков слабоалкогольного напитка. Поэтому следует быть очень осторожным.
Когда же можно будет выпить?
Ответ на данный вопрос неоднозначный. Конечно, лучше вообще не сочетать. Достаточно сложно представить сочетание алкоголя и какого-либо антибиотика. Удержаться от употребления алкоголя не сможет только алкоголик, однако, как правило, именно такие люди и вовсе не обращаются за медицинской помощью.
Но все же, когда же можно выпить? По мнению специалистов, алкоголь можно употребить не ранее, чем через несколько суток после завершения лечения. Почему? Все очень просто. Антибиотик выводится из организма примерно через двое суток.
Даже если вы забылись, и ближе к вечеру позволили себе бокал вина, то такое сочетание вряд ли принесет значительный вред. Но все же не рекомендует повторять подобные эксперименты, поскольку алкоголь и цефтриаксон может вызвать различные нежелательные последствия, вплоть до смертельного исхода.
Но все же не рекомендует повторять подобные эксперименты, поскольку алкоголь и цефтриаксон может вызвать различные нежелательные последствия, вплоть до смертельного исхода.
ВАЖНО! Каждый материал сайта носит информационный характер и не является инструкцией к применению. Помните, что каждый человек уникален, а без консультации специалиста применять те или иные препараты не рекомендуется!
Цефтриаксон и алкоголь: совместимость и побочные эффекты
Цефтриаксон – популярный антибактериальный препарат широкого спектра действия. Медикамент применяют для устранения разного рода инфекций дыхательной системы и органов ЖКТ, а также при иных заболеваниях, чрезвычайно опасных для жизни. Активно применяют антибиотик в послеоперационном периоде с целью предупреждения сепсиса и воспалительных реакций со стороны организма.
Высокая эффективность Цефтриаксона и его доступность позволяют сделать вывод о том, что его могут применять практически все категории лиц, в том числе и страдающие от алкогольной зависимости.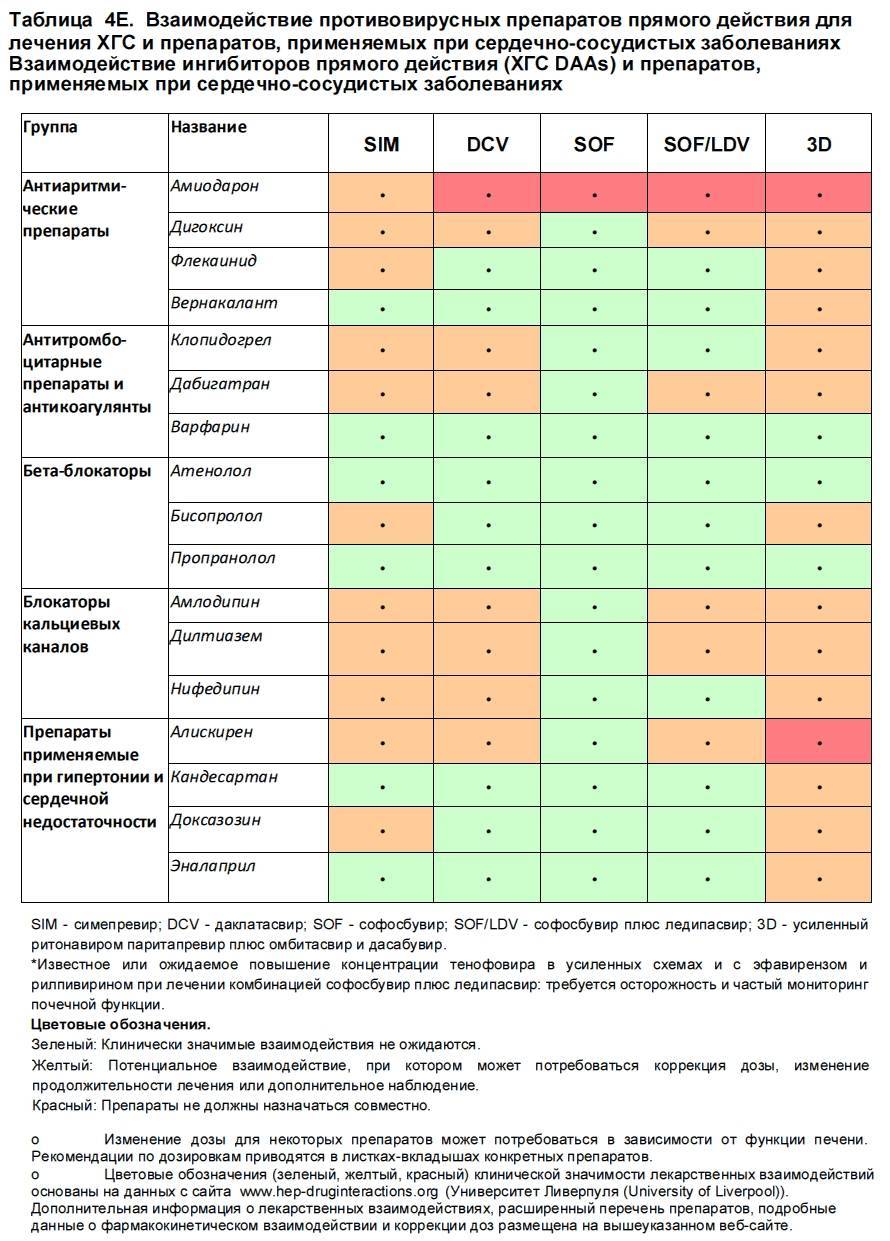 Опасно ли совмещать Цефтриаксон и алкоголь? Последствия опасных экспериментов с препаратами – тема настоящей статьи.
Опасно ли совмещать Цефтриаксон и алкоголь? Последствия опасных экспериментов с препаратами – тема настоящей статьи.
Показания к применению препарата
Цефтриаксон – современный антибиотик третьего поколения, который относят к группе цефалоспоринов и заслуженно признают одним из самым эффективных.
Обширный спектр действия препарата является следствием его высокой активности в отношении разнообразных бактерий, вызывающих распространенные соматические заболевания.
Для устранения каких инфекций применяется Цефтриаксон?
- Инфекции органов дыхательной системы – острый бронхит, пневмнония.
- Заболевания верхних дыхательных путей – гаймориты, риниты и прочие лор-инфекции
- Инфекции органов мочевыделительной системы и половых органов, в том числе венерические заболевания – цистит, гонорея, простатит.
- Заболевания органов брюшины.
- Раневые инфекции.
- Сепсис и прочие послеоперационные осложнения.
Как любой антибиотик, Цефтриаксон обладает мощным токсическим воздействием на некоторые органы и системы организма.
В связи с этим его запрещено назначать больному при наличии ряда противопоказаний:
- Заболевания печени и почек.
- Язва желудка.
- Желтуха новорожденных.
- Период беременности и кормления грудью.
- Индивидуальная непереносимость отдельных компонентов лекарства.
Эффективность Цефтриаксона
Любой медикамент, несмотря на его заявленную эффективность, способен не только не оказать должного воздействия на бактерии, но и нанести вред организму.Такой результат не исключен при условиях, когда пациент игнорирует рекомендации к применению препарата. Также побочные явления не исключены при физиологических особенностях пораженных органов и ряда прочих обстоятельств, не зависящих ни от кого.
Перечислим факторы, способные повлиять на эффективность Цефтриаксона:
- Степень тяжести заболевания.
- Состояние здоровья и уровень иммунной защиты пациента до болезни и непосредственно до начала приема медикамента.
- Гиперчувствительность к отдельным веществам, входящим в состав антибактериального средства.

- Состояние органов мочевыводящей и желчевыводящей системы.
- Взаимодействие препарата со спиртными напитками.
Последний пункт заслуживает отдельного внимания. Следует отметить, что в обязанности фармацевтических компаний не входит проверка Цефтриаксона и алкоголя на совместимость. Именно поэтому о реальных последствиях подобного взаимодействия можно лишь догадываться.
Именно поэтому нельзя точно сказать, через сколько можно пить алкоголь после Цефтриаксона, какие реакции и в какой степени проявятся, и как долго они будут держаться. Все следующие выводы основаны на умозаключениях специалистов и аналогиях, проведенных с остальными антибактериальными средствами. Достоверных данных о проявлении конкретных побочных явлений после приема алкоголя совместно с Цефтриаксоном не зафиксировано.
Цефтриаксон и алкоголь: совместимы ли они?
Совместимость препаратов и последствие их употребления с алкогольными напитками часто волнует людей, проходящих курс лечения. И дело тут не только в алкогольной зависимости, ведь праздники и мероприятия не редкость в любое время года, а выделяться из веселой компании совсем не хочется. Насколько сильно человек рискует здоровьем, употребляя одновременно Цефтриаксон и алкоголь?
И дело тут не только в алкогольной зависимости, ведь праздники и мероприятия не редкость в любое время года, а выделяться из веселой компании совсем не хочется. Насколько сильно человек рискует здоровьем, употребляя одновременно Цефтриаксон и алкоголь?
- Последствия опасного сочетания неизбежны – это факт. Как и любой антибиотик, Цефтриаксон достаточно мощно воздействует на организм, принося ему не только пользу в виде избавления от инфекций.
- Активные вещества в составе препарата оказывают сильное влияние на работу почек и печени, ослабляя их функции. Вред алкоголя для этих органов известен каждому. Стоит ли говорить о том, что с двойным ударом организм рискует попросту не справиться.
- Также существует мнение о том, что Цефтриаксон и алкоголь при взаимодействии способны вызвать дисульфирамоподобные реакции. Это своего рода интоксикация организма, вызывающая острое отвращение к спиртному. Такое состояние вызывается специальными медикаментами, предназначенными для лечения алкогольной зависимости.
 Некоторые специалисты считают, что Цефтриаксон оказывает аналогичный эффект. Однако при наличии аллергической реакции на один из компонентов – антибиотик или спиртной напиток – не исключена возможность анафилактического шока с летальным исходом.
Некоторые специалисты считают, что Цефтриаксон оказывает аналогичный эффект. Однако при наличии аллергической реакции на один из компонентов – антибиотик или спиртной напиток – не исключена возможность анафилактического шока с летальным исходом.
Цефтриаксон и алкоголь: последствия и побочные реакции
Какие побочные эффекты способен вызвать Цефтриаксон при взаимодействии с алкоголем?
Список довольно обширный, поэтому, даже перед тем как выпить бокал пива, стоит задуматься:
- Аллергические проявления – дерматиты, крапивницы, зуд и жжение, покраснения. Возможен отек гортани и анафилактический шок.
- Нарушения работы ЦНС – головокружения, потеря ориентации в пространстве, головные боли.
- Со стороны кровеносной системы – гематологические отклонения, в том числе тромбоцитоз, анемия, уменьшение содержания гранулоцитов.
- Дисфункция органов пищеварения – глоссит («глянцевый язык»), потеря аппетита, нарушения вкусовых привычек, тошнота и рвота, вздутие живота, повышенное газообразование, разжижение стула.

- Другое – болевая реакция при введении препарата внутривенно или внутримышечно, появление грибковых инфекций, сокращение количества мочи при мочеиспускании, кровотечения из носа.
Даже если все вышеперечисленные побочные эффекты обойдут больного стороной, совсем без последствий не обойтись. Цефтриаксон при взаимодействии с алкоголем влияет на бактерии не так эффективно, вследствие чего выздоровление не наступает и специалисту приходится прописывать новые препараты, обладающие еще более мощным действием.
Таким образом, накопление Цефтриаксона в организме, болезненные уколы и весь курс терапии оказывается впустую потерянным временем. Поэтому не стоит рисковать и совмещать Цефтриаксон и алкоголь при любых обстоятельствах.
Когда можно пить алкоголь после Цефтриаксона
Не стоит полагаться на тот факт, что реальные последствия взаимодействия алкоголя и Цефтриаксона не зафиксированы. Ни один специалист не пойдет на риск и не разрешит больному злоупотреблять спиртным во время приема антибиотика.
Более того, не следует принимать горячительные напитки даже в малых дозах, пока не закончится терапия с участием препарата Цефтриаксон. Можно ли пить алкоголь после того, как курс будет завершен?
Если принимать во внимание особенности выведения лекарства из организма, для полной уверенности в том, что алкоголь и цефтриаксон не навредят печени, следует выждать около двух дней. Именно такой срок требуется для полного очищения внутренних органов от токсичных веществ препарата.
Материалы, размещённые на данной странице, носят информационный характер и предназначены для образовательных целей. Посетители сайта не должны использовать их в качестве медицинских рекомендаций. Определение диагноза и выбор методики лечения остаётся исключительной прерогативой вашего лечащего врача.
совместимость, через сколько можно пить алкоголь после лечения цефтриаксоном, последствия употребления
Подумать только, еще каких-то 80 лет назад человечество не знало, что такое антибиотики. Сейчас же это наиболее часто используемая группа лекарственных препаратов. Одним из самых эффективных антибиотиков является цефтриаксон. Однако лечение цефтриаксоном требует соблюдения особых условий. В частности, во время лечения цефтриаксоном нужно воздержаться от употребления спиртного.
Сейчас же это наиболее часто используемая группа лекарственных препаратов. Одним из самых эффективных антибиотиков является цефтриаксон. Однако лечение цефтриаксоном требует соблюдения особых условий. В частности, во время лечения цефтриаксоном нужно воздержаться от употребления спиртного.
Оглавление: 1. Применение цефтриаксона 2. Совместимость цефтриаксона с алкоголем - Антабусный эффект 3. Через сколько можно пить алкоголь после цефтриаксона
Применение цефтриаксона
Цефтриаксон — это представитель цефалоспориновых антибиотиков. Цефтриаксон выпускается в виде флакона с порошком, из которого затем готовят раствор для инъекций. Разводят порошок как правило лидокаином или водой для инъекций. Препарат вводят внутримышечно и внутривенно.
К использованию цефтриаксона часто прибегают при тяжелых инфекционно-воспалительных заболеваниях. Препарат имеет широкий спектр действия и оказывается эффективным против многих бактерий.
Цефтриаксон назначают для лечения таких заболеваний:
После введения цефтриаксон быстро всасывается, а затем с током крови распределяется в ткани и биологические жидкости.
Совместимость цефтриаксона с алкоголем
В инструкции к цефтриаксону указано, что употребление антибиотика с алкоголем не допускается. Такое требование вполне обоснованно. Прежде всего, употребление алкоголя во время курса лечения цефтриаксоном попросту способно снизить терапевтический эффект лекарства, а это значит, что выздоровление может затянуться. К тому же от такой «гремучей смеси» могут проявиться множественные побочные эффекты медикамента. Кроме того, употребление цефалоспоринов с этанолом может привести к развитию антабусного эффекта, который очень тяжело переносится больными.
Антабусный эффект
Антабус (дисульфирам, тетурам) — это лекарственные вещества, которые используют в лечении больных алкоголизмом. Антабус особым образом взаимодействует с алкоголем. Происходит накопление токсического вещества ацетальдегида, что проявляется тяжелой интоксикацией.
Происходит накопление токсического вещества ацетальдегида, что проявляется тяжелой интоксикацией.
Больному алкоголизмом сначала дают принять антабус, а затем рюмку спиртного. И тут начинается самое страшное — человеку становится невыносимо плохо. Такой метод лечения предполагает вырабатывание отрицательной эмоции на алкоголь, в результате чего человек бросает пить.
Так вот, цефалоспорины и в частности цефтриаксон оказывают схожее с антабусом действие. Поэтому при употреблении цефтриаксона с алкоголем может возникнуть антабусный эффект, или, как еще его называют, дисульфирамоподобная реакция. Какими же симптомами проявляется антабусный эффект:
В некоторых ситуациях давление падает настолько, что развивается коллапс. Это проявляется резкой слабостью, бледностью и похолоданием конечностей. Возникают ощущения предобморочного состояния.
Обратите внимание
Антабусный эффект — это настолько бурная и болезненная реакция, что человеку кажется словно он умирает. Подобную реакцию больной запоминает на всю жизнь. Так стоит ли подвергать себя такому стрессу ради сомнительного удовольствия в виде бокала спиртного?
Подобную реакцию больной запоминает на всю жизнь. Так стоит ли подвергать себя такому стрессу ради сомнительного удовольствия в виде бокала спиртного?
Через сколько можно пить алкоголь после цефтриаксона?
В среднем цефтриаксон назначают курсом на пять-десять дней. Употреблять крепкие напитки во время лечения цефтриаксоном категорически запрещено, поскольку цефтриаксон и этанол несовместимы. Чтобы избежать побочных эффектов лекарства, нужно выждать определенное время перед употреблением алкоголя.
Период полувыведения лекарства у молодых людей составляет восемь часов. У пожилых больных и людей, страдающих заболеваниям печени этот период может увеличиваться в два-три раза. Молодой организм сможет полностью очиститься от антибиотика приблизительно через сутки. Таким образом, выпить алкоголь можно будет спустя одни-двое суток после последнего приема антибиотика.
Григорова Валерия, врач, медицинский обозреватель
46,950 просмотров всего, 68 просмотров сегодня
Загрузка. ..
.. Можно ли пить алкоголь при употреблении Цефтриаксона: последствия, отзывы
Народная мудрость гласит: «От тюрьмы да от сумы не убережешься». Сюда можно еще добавить — от болезни уберечься тоже не всегда возможно. Порой антибиотики приходится глотать, будучи в отпуске на море, где так много всяческих развлечений, сопряженных с непременной выпивкой. Однако, стоит помнить, что не все антибиотики можно совмещать с алкогольными увеселениями. Что же делать, если врач порекомендовал лечение цефтриаксоном?
Цефтриаксон — что за антибиотик?
Цефтриаксон относится к цефалоспоринам третьего поколения. Этот антибиотик отличается активностью в отношении многих патологических микроорганизмов: стафилококков, клебсиеллы, кишечной палочки, шигеллы и многих других. Антибиотик выпускается в единственной форме — стеклянных флакончиках с порошком, из которого изготавливается раствор для укола в мышцу.
Цефтриаксон можно использовать для лечения многих инфекционных заболеваний:
- менингита;
- лор-органов;
- органов брюшной полости, включая перитонит;
- половых органов;
- дыхательных путей;
- сальмонеллез;
- инфицированные раны, ожоги.

После введения укола Цефтриаксон быстро всасывается и через кровоток распределяется по организму, действуя именно там, где необходимо — проникает в суставы, дыхательные пути, кожу, кости и спинномозговую жидкость. Как правило, препарат довольно неплохо переносится большинством пациентов и редко вызывает вторичные негативные явления.
Тем не менее, при применении Цефтриаксона некоторыми больными отмечены традиционные для лечения антибактериальными препаратами расстройства желудка и кишечника, носовые кровотечения, стоматит, аллергическая сыпь, головные боли. Повышенная чувствительность компонентов препарата может вызвать анафилактический шок у ряда пациентов.
Укол Цефтриаксона считается достаточно болезненным, в особенности, если готовить раствор без применения лидокаина. В связи с этим могут возникнуть некоторые уплотнения в месте введения инъекции.
Цефтриаксон, несмотря на обширную сферу действия, имеет некоторые противопоказания. Так, препарат ни в коем случае не может быть показан лицам, имеющим гиперчувствительность к каким-либо из веществ, входящих в состав лекарства. Не стоит применять антибиотик и в первый триместр беременности, а также во время кормления грудью. Возможно рассмотрение альтернативного лечения, если у больного имеются патологии печени и почек.
Не стоит применять антибиотик и в первый триместр беременности, а также во время кормления грудью. Возможно рассмотрение альтернативного лечения, если у больного имеются патологии печени и почек.
Не стоит легкомысленно относиться к лечению антибиотиками, это серьезное лекарство, которое в сочетании с другими веществами, попадающими в организм, может повлечь за собой неприятные последствия.
Взаимодействие с алкоголем
Сейчас в обществе активно пропагандируется мнение по поводу того, что алкоголь в совместимости с антибиотиками никакого вреда для больного не принесет, а вовсе даже наоборот — спиртное усилит действие лекарства, и процесс выздоровления пойдет намного активнее. Но можно ли пить алкоголь во время употребления Цефтриаксона, совместимы ли они?В случае с Цефтриаксоном больному следует проявлять чрезвычайную осторожность при употреблении спиртного, а правильнее всего будет и вовсе исключить этанол из своего рациона. Дело в том, что некоторые цефалоспорины имеют такое побочное явление, которое в сочетании со спиртным вызывает реакцию, похожую на сильнейшее отравление. Это явление специалистами описано, как дисульфирамоподобная реакция.
Это явление специалистами описано, как дисульфирамоподобная реакция.
Такие проявления наблюдаются у больных алкоголизмом, находящихся под воздействием кодирования препаратами, содержащими дисульфирам.
Это средство блокирует расщепление алкоголя, и у выпившего человека наблюдается сильнейшая интоксикация:
- прилив крови к лицу;
- сильнейшая тахикардия;
- тошнота и рвота;
- резкие скачки давления;
- боли в животе.
Цефтриаксон также может вызвать подобные проявления в сочетании со спиртным, именно поэтому специалисты не советуют больным, проходящим курс лечения антибиотиком, употреблять алкоголь.
Последствия совмещения
Интоксикация, подобная той, которая встречается у закодированных пациентов, может вовсе и не проявится у проходящего терапию Цефтриаксоном пациента. Более того, многие из тех, кто пил говорят об отсутствии каких-либо последствий. Но при этом следует напомнить о том, что все химические препараты, включая и алкоголь, проходят детоксикацию в печени. Антибиотики — не исключение. Однократное употребление небольшого количества алкоголя, конечно, существенного вреда печени и почкам не принесет, но вот частое прикладывание к бутылке и в особенности прием спиртного большими порциями ни к чему хорошему точно не приведет. Формирование лекарственного гепатита, а впоследствии и цирроза печени — вот те отдаленные последствия, которые можно ожидать при частом сочетании лекарств и алкоголя.
Антибиотики — не исключение. Однократное употребление небольшого количества алкоголя, конечно, существенного вреда печени и почкам не принесет, но вот частое прикладывание к бутылке и в особенности прием спиртного большими порциями ни к чему хорошему точно не приведет. Формирование лекарственного гепатита, а впоследствии и цирроза печени — вот те отдаленные последствия, которые можно ожидать при частом сочетании лекарств и алкоголя.Также известно такая способность этанола, как усиление побочных проявлений. Вполне вероятно, что вечерняя выпивка после утреннего укола вызовет сильную диарею или головную боль. Пациент может списать эти реакции на похмельный синдром, но на самом деле отличить похмелье от отравления организма лекарствами в сочетании с алкоголем сможет только специалист. Имеющаяся интоксикация говорит о том, что печень и почки не справились с такой нагрузкой, и им требуется восстановительный период. Если в такой момент больной решит снять похмелье еще одной дозой спиртного, то последствия могут быть и вовсе плачевными.
Когда можно пить?
Ответ на этот вопрос однозначен — лучше вовсе не сочетать. Сложно представить такую ситуацию, при которой употребление алкоголя во время лечения является обязательным атрибутом. Удержаться от спиртного не сможет разве что больной алкоголизмом, но такие, как правило, редко обращаются к терапевту по поводу лечения инфекционных заболеваний.
И все же, через какое время можно немного выпить? Если пациент забылся и после утреннего укола ближе к вечеру позволил себе выпить бокал пива, то такое сочетание вряд ли принесет какой-либо существенный вред. Но повторять подобный эксперимент не следует слишком часто.
Предпочтительнее все-таки переждать курс лечения, тем более он составляет всего лишь 10 дней, а после него можно и побаловать себя вкусным вином или шампанским. Пару суток после окончания лечения – тот промежуток, через сколько можно будет без последствий выпить алкоголь.
Выводы
Несмотря на активную кампанию в последние годы, пропагандирующую отсутствие всякого вреда от сочетания антибиотиков и алкоголя, врачи-практики своими отзывами все же уберегают своих пациентов от подобного комбинирования. И это правильно — нездоровому организму нужно лечение и силы на восстановление после болезни, а не нагрузка на органы в виде нейтрализации токсинов алкоголя. Всему свое время!
И это правильно — нездоровому организму нужно лечение и силы на восстановление после болезни, а не нагрузка на органы в виде нейтрализации токсинов алкоголя. Всему свое время!
Совместим ли алкоголь с антибиотиками — Российская газета
Взгляд из Лондона
Английская BBC Future недавно опубликовала материал, в котором, по сути, развенчивается устойчивое мнение о том, что лечение антибиотиками абсолютно не совместимо с алкоголем.
«Спиртное не блокирует действие большинства лекарственных препаратов и обычно не вызывает побочных эффектов в сочетании с лекарствами, — со ссылкой на результаты недавних исследований, сообщается в материале. — Так нужно ли воздерживаться от спиртного в сочетании с курсом антибиотиков? Многие убеждены, что алкоголь может помешать лекарству оказывать нужное действие, а также что их сочетание увеличивает риск побочных эффектов. В одной из урогенитальных клиник в Лондоне опросили 300 пациентов — оказалось, что большинство (81%) согласны с первым утверждением и почти столько же (71%) — со вторым.
Но в случае с большинством антибиотиков не верно ни первое, ни второе, утверждает английское издание. Более того, с точки зрения врачей гораздо опаснее, когда пациент, верующий в один из этих мифов, решает не принимать лекарство, выпив бокал вина. Любой фактор, заставляющий пропускать дозу препарата, ухудшает эффективность лечения, а если подходить глобально — усугубляется серьезная проблема появления штаммов бактерий, устойчивых ко всем известным антибиотикам.
Впрочем, есть и исключения, оговаривается издание: так, препарат цефалоспориновой группы цефотетан замедляет процесс расщепления алкоголя, в результате чего в организме повышается уровень продуктов его распада. А это может привести к нежелательным последствиям в виде головокружения, рвоты, прилива крови к лицу, головных болей, одышки и болей в груди.
Похожие побочные эффекты дает лекарство дисульфирам. Это не антибиотик. Препарат применяется при лечении алкогольной зависимости. Его действие основано на том, что пациент, проходящий лечение, начинает чувствовать себя плохо, употребив спиртное, — и это должно заставить его отказаться от дальнейшей выпивки.
Но есть и антибиотик, обладающий сходными свойствами и потому плохо совместимый со спиртным, — это метронидазол. Его используют при лечении инфекций, вызванных многими видами простейших и бактерий, включая поражения нервной системы и даже некоторые венерические заболевания. В сочетании с алкоголем он дает такие же побочные эффекты, как и уже упоминавшиеся цефалоспорины.
Однако эта точка зрения была поставлена под сомнение после проведенного в 2003 году анализа фармакологических исследований. Кроме того, был поставлен опыт на небольшой контрольной группе финских мужчин, в ходе которого они в течение 5 дней употребляли алкоголь с метронидазолом без каких-либо неприятных последствий, пишет ВВС.
Тем не менее авторы исследования признают, что вероятность возникновения нежелательных эффектов нельзя полностью исключить, и сейчас медики по-прежнему не рекомендуют совмещать спиртное с метронидазолом.
Есть и еще несколько антибиотиков, при принятии которых лучше воздержаться от выпивки — среди них, к примеру, тинидазол, линезолид и эритромицин. Но о несочетаемости с алкоголем этих препапратов хорошо известно, и врачи специально предупреждают о ней пациентов, выписывая лекарство. «Таким образом, остается обширный список других антибиотиков, при приеме которых выпить не опасно. Конечно, спиртное вряд ли поможет лечению болезни: оно может сделать ваш организм обезвоженным и вялым, но это никак не связано с лекарствами», — заключает издание.
Но о несочетаемости с алкоголем этих препапратов хорошо известно, и врачи специально предупреждают о ней пациентов, выписывая лекарство. «Таким образом, остается обширный список других антибиотиков, при приеме которых выпить не опасно. Конечно, спиртное вряд ли поможет лечению болезни: оно может сделать ваш организм обезвоженным и вялым, но это никак не связано с лекарствами», — заключает издание.
«Возможно, миф о несочетаемости антибиотиков и алкоголя появился после каких-то отдельных неприятных случаев, но есть и две более интересные теории. Одна заключается в том, что антибиотики используются при лечении распространенных венерических заболеваний, и врачи якобы наказывали пациентов за распутное поведение, запрещая им выпить рюмку-другую.
Есть и другое объяснение, данное Джеймсом Бингемом, одним из авторов упоминавшегося выше опроса пациентов лондонской урогенитальной клиники. Он встречался с отставным бригадным генералом Иэном Фрейзером, который во время Второй мировой войны начал использовать пенициллин для лечения раненых солдат в северной Африке. В то время пенициллина было так мало, что после приема лекарства внутрь у пациентов брали мочу и вновь выделяли из нее препарат. Находившимся на излечении военным разрешалось пить пиво, но это приводило к увеличению объема производимой организмом мочи и, как следствие, осложняло добычу лекарства. По словам генерала Фрейзера, поэтому командование решило пиво запретить.
В то время пенициллина было так мало, что после приема лекарства внутрь у пациентов брали мочу и вновь выделяли из нее препарат. Находившимся на излечении военным разрешалось пить пиво, но это приводило к увеличению объема производимой организмом мочи и, как следствие, осложняло добычу лекарства. По словам генерала Фрейзера, поэтому командование решило пиво запретить.
Согласитесь, хорошая история, вне зависимости от того, повлияла ли она на распространение мифа о несочетаемости алкоголя и антибиотиков. Но развенчивание мифов — палка о двух концах. Когда пациент, не способный прожить без бокала вина, тем не менее прилежно пропивает курс антибиотиков — это хорошо, потому что помогает бороться с устойчивостью бактерий к лекарствам.
Но если широкая публика узнает всю правду, то женщинам, не желающим рассказывать о своей беременности, придется более изобретательно отказываться от спиртного на вечеринках».
Взгляд из Москвы
Как относиться к подобным публикациям? Стоит ли рисковать, сочетая лекарства с алкоголем, или лучше все же поберечься? Вот мнение кардиолога Ириной Летинской.
— Я с большой острожностью отношусь к подобным сообщениям, тем более когда они не содержат четких указаний на научные источники. Надо понимать, что совместимость тех или иных лекарств с этиловым спиртом при проведении клинических испытаний специально не проверяется. Поэтому противопоказания основаны на обнаружении побочных эффектов уже исходя из лечебной практики.
Конечно, есть препараты, в состав которых входит алкоголь: настойки лекарственных растений — боярышника, пиона, валерианы, пустырника. Но используют их в качестве седативных средств, а этиловый спирт сам по себе в небольших дозах успокаивает и расслабляет.
Что касается антибиотиков, тут я бы проявила большую осторожность. Это вообще очень «капризные» препараты. Они плохо сочетаются и друг с другом, и с другими лекарствами. Их вообще лучше принимать отдельно от всех прочих. Например, антибиотик эритромицин не сочетается с гипотензивными средствами, антидепрессантами, антиаритмическими препаратами, другими антибактериальными лекарствами.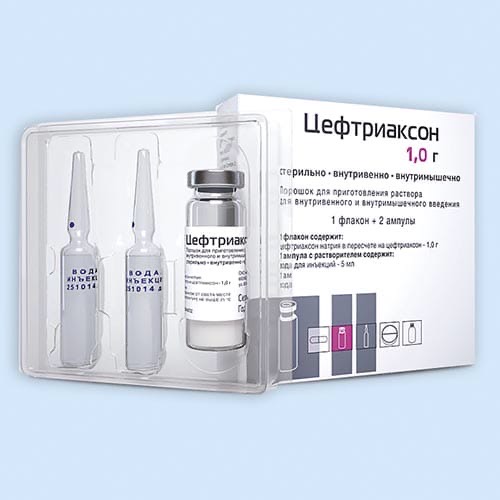 При смешении со спиртным результат еще более непредсказуем. Например, антибиотики левомицитин, доксициклин, метронидазол при одновременном приеме с алкоголем (и даже на следующий день после неумеренного возлияния) нередко вызывают тяжелые аллергические реакции, а эффективность их противобактериального действия снижается. И действующее вещество антибиотика, и этанол выводятся из организма с помощью ферментов, вырабатваемых, главным образом, в печени. Не случайно большинство этих лекарств с осторожностью применяют у пациентов при нарушении функций печени и почек. Так зачем же рисковать, нагружая печень еще больше за счет спиртного?
При смешении со спиртным результат еще более непредсказуем. Например, антибиотики левомицитин, доксициклин, метронидазол при одновременном приеме с алкоголем (и даже на следующий день после неумеренного возлияния) нередко вызывают тяжелые аллергические реакции, а эффективность их противобактериального действия снижается. И действующее вещество антибиотика, и этанол выводятся из организма с помощью ферментов, вырабатваемых, главным образом, в печени. Не случайно большинство этих лекарств с осторожностью применяют у пациентов при нарушении функций печени и почек. Так зачем же рисковать, нагружая печень еще больше за счет спиртного?
К слову, серьезные последствия бывают и при сочетании со спиртным других лекарств. Так, старый, проверенный анальгин замедляет расщепление алкоголя, усиливает интоксикацию. Смесь спиртного с клофелином приводит к тому, что человек «выключается», погружаясь в глубокий, тяжелый сон, у него нарушается память, чем не раз пользовались преступники.
Опасно сочетание алкоголя со снотворными и транквилизаторами. Алкоголь усиливает их действие, в результате может возникнуть передозировка и тяжелое отравление, вплоть до смертельного исхода.
Алкоголь усиливает их действие, в результате может возникнуть передозировка и тяжелое отравление, вплоть до смертельного исхода.
Антибиотики и алкоголь. Можно ли их совмещать?
Немного истории
Вопрос совместимости антибиотиков и алкоголя возник еще в 60-х годах прошлого века, когда в США стали активно назначать новый антибиотик широкого спектра действия метронидазол (флагил). Было замечено, что у пациентов, которые одновременно с метронидазолом принимали алкоголь, проявлялись очень неприятные симптомы: тошнота, рвота, диарея, повышенная потливость, покраснение кожных покровов, учащенное сердцебиение, головная боль, сонливость, головокружение, спутанность сознания и множество других.
Интересно, что эта клиническая картина напоминала другую, проявившую себя еще в 1880-х годах у людей, занятых на производстве резины, точнее ее вулканизации. Тогда, для ускорения этого процесса, использовали химическое вещество дисульфирам. И рабочие, которые после смены расслаблялись алкоголем (за день надышавшись парами дисульфирама), массово выходили из строя, демонстрируя вышеописанную симптоматику. В 1940-х годах об этом вспомнили, и у врачей даже возникла идея использовать дисульфирам при лечении алкоголизма. У пациентов, которые употребляли это вещество с алкоголем, развивалась такая непереносимость (тошнота, рвота, нарушение сердечной деятельности и т. д.), что многие забывали о спиртном навсегда. Кстати, сегодня дисульфирам запатентован как Antabuse и вполне себе продается.
В 1940-х годах об этом вспомнили, и у врачей даже возникла идея использовать дисульфирам при лечении алкоголизма. У пациентов, которые употребляли это вещество с алкоголем, развивалась такая непереносимость (тошнота, рвота, нарушение сердечной деятельности и т. д.), что многие забывали о спиртном навсегда. Кстати, сегодня дисульфирам запатентован как Antabuse и вполне себе продается.
Вернемся к антибиотику метронидазолу. Исходя из того, что при его употреблении с алкоголем проявлялись очень неприятные симптомы, антибиотик рассматривали как средство для лечения алкоголизма, но дальше пилотных исследований дело не пошло. Сегодня метронидазол используют только по прямому назначению — для лечения желудочно-кишечных инфекций, включая дивертикулит (воспалительное заболевание кишечника), а также для лечения гинекологических заболеваний и заболеваний, передающихся половым путем (ЗППП). Прием алкоголя во время курса метронидазола строго не рекомендуется.
С какими антибиотиками точно нельзя принимать алкоголь
С метронидазолом. На сайте Национальной службы здравоохранения Великобритании (National Health Service, NHS) сообщается, что производители метронидазола советуют избегать употребления алкоголя во время приема антибиотика и в течение следующих 48 часов (а лучше 72) после завершения курса. Это связано с тем, что метронидазол выводится из организма примерно 2 суток. В это время разумно избегать и употребления средств от кашля и простуды с содержанием спирта, а также средств для полоскания полости рта.
На сайте Национальной службы здравоохранения Великобритании (National Health Service, NHS) сообщается, что производители метронидазола советуют избегать употребления алкоголя во время приема антибиотика и в течение следующих 48 часов (а лучше 72) после завершения курса. Это связано с тем, что метронидазол выводится из организма примерно 2 суток. В это время разумно избегать и употребления средств от кашля и простуды с содержанием спирта, а также средств для полоскания полости рта.
С тинидазолом. Антибиотиком, который иногда используется для лечения тех же инфекций, что и метронидазол, а также для устранения патогенов Helicobacter pylori (H. pylori) при заболеваниях желудка (язва, гастрит).
С алкоголем плохо взаимодействует еще один класс антибиотиков широкого спектра действия — цефалоспорины. Хотя препаратов с этим действующим веществом немало, и сообщалось только о 78 случаях негативной реакции у пациентов (при внутривенном вливании), тем не менее, при приеме антибиотиков этого класса (цефотетан, цефотан) от употребления алкоголя лучше воздержаться.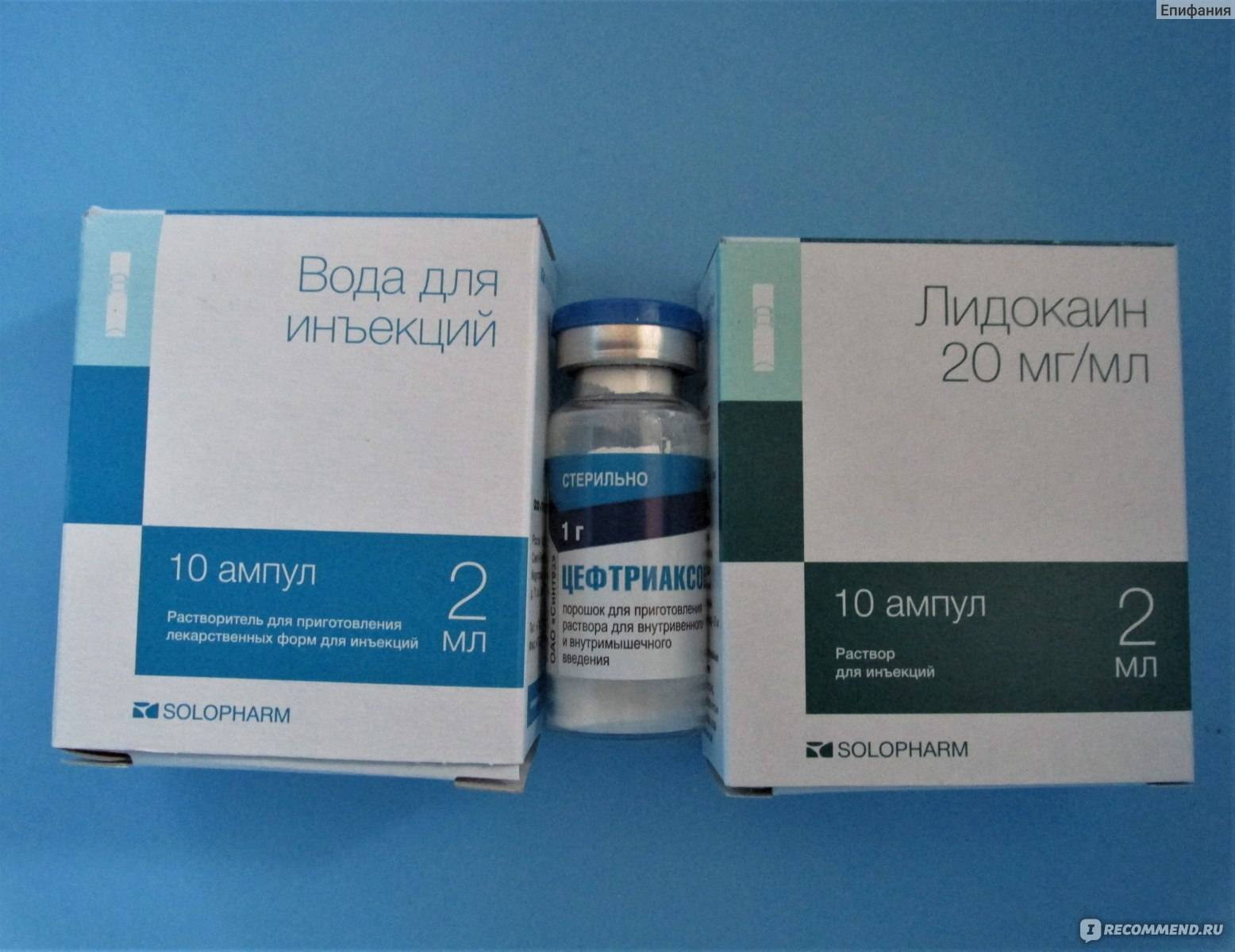
Точно не следует пить алкоголь при приеме сульфаметоксазола и триметоприма (бактрим).
Антибиотик линезолид иногда может взаимодействовать с дистиллированными (ферментированными) алкогольными напитками, такими как вино, пиво, херес и лагер, и вызывать повышение артериального давления.
При одновременном употреблении алкоголя и антибиотика доксициклина серьезные побочные эффекты могут проявиться у пациентов, которые регулярно употребляют спиртное или являются хроническими алкоголиками. Категорически не рекомендуется пить алкоголь во время приема доксициклина пациентам с заболеваниями печени.
Полная информация по антибиотикам, несовместимым с алкоголем, в таблице
С какими антибиотиками принимать алкоголь безопасно
Большинство антибиотиков не взаимодействует с алкоголем. В инструкциях к пяти наиболее часто назначаемым (в США, например) препаратам — амоксициллин/амоксил, азитромицин/зитромакс, амоксициллин-клавуланат/аугментин, цефалексин/кефлекс и ципрофлоксацин/ципро — противопоказания, связанные с алкоголем, не прописаны.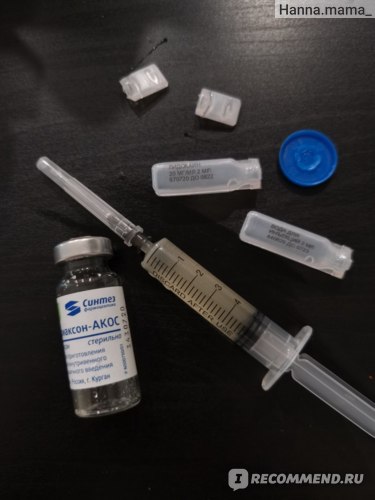 Аналогично не сопровождаются комментариями по взаимодействию с антибиотиками и инструкции к противопростудным препаратам и препаратам против кашля, которые содержат спирт.
Аналогично не сопровождаются комментариями по взаимодействию с антибиотиками и инструкции к противопростудным препаратам и препаратам против кашля, которые содержат спирт.
Серьезных исследований, которые бы подтверждали опасность совместного приема антибиотиков и алкоголя, не проводилось. Здесь можно ознакомиться с результатами исследования (проводилось только на крысах), которое показало, что эффективность азитромицина (антибиотик широкого спектра, лечит пневмонию, бронхит, заболевания уха, синусовые и венерические инфекции) при взаимодействии с алкоголем не снижается. Тем не менее, нужно понимать, что воздействие алкоголя и действующего вещества антибиотика может вызвать временные повреждения печени и в целом создать нежелательную нагрузку на все системы организма. В редких случаях сам азитромицин, являясь достаточно сильным препаратом, может вызывать повреждения печени и серьезные побочные эффекты. Так стоит ли смешивать?
Разумный подход
Итак, считается, что обычно алкоголь не влияет на эффективность антибиотиков. Однако их комбинация может вызвать неприятные побочные действия. Также существует вероятность снижения терапевтического эффекта антибиотика при изменении его концентрации в крови из-за влияния алкоголя. В долгосрочной перспективе может идти речь о развитии устойчивости к антибиотикотерапии.
Однако их комбинация может вызвать неприятные побочные действия. Также существует вероятность снижения терапевтического эффекта антибиотика при изменении его концентрации в крови из-за влияния алкоголя. В долгосрочной перспективе может идти речь о развитии устойчивости к антибиотикотерапии.
Употреблять алкоголь одновременно с антибиотиками или нет — дело ваше. Если по какой-то причине вы не можете без этого обойтись, проконсультируйтесь с врачом или проверьте совместимость препарата с алкоголем на сайте Drugs.com.
Разумно все же потерпеть неделю или две — закончить курс препарата и подождать, пока он выведется из организма. Тем более что алкоголь может взаимодействовать с другими лекарствами, которые вы принимаете, и раздражать слизистую желудка, которая и так воспалена. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration, FDA) рекомендует такие вещи обсуждать с врачом. Существует и специальное руководство по совместимости лекарств, продуктов и напитков (в том числе алкоголя), специально выпущенное FDA для пациентов. Если есть сомнения, а с врачом посоветоваться не получается, можно ориентироваться на него.
Источники:
Nytimes.com, Drugs.com, Nhs.uk, Mayoclinic.org
Присоединяйтесь к нам в соцсетях!
VK Instagram FB
Подписывайтесь на Telegram!
Взаимодействие между Цефтриаксон и Левомицетин при одновременном применении
Взаимодействует с- Хлорамфеникол, Антибиотик, Антибиотики, Противомикробные препараты для системного применения, антибактериальные
При одновременном применении высоких доз препарата и сильных диуретиков (например, фуросемид), нарушений функции почек не наблюдалось. Нет данных о повышении нефротоксичности аминогликозидов во время применения препарата. Употребление алкоголя при применении препарата не сопровождается протромбина. Цефтриаксон не содержит N-метилтиотетразольнои группы, могла вызвать несовместимость с этанолом и кровоточивость. Пробенецид не влияет на выведение препарата. In vitroбыл обнаружен антагонизм между хлорамфениколом и цефтриаксоном. Диклофенак стимулирует выведение с желчью цефтриаксона и снижает клиренс в моче.
Нельзя смешивать в одном инфузионном флаконе или в одном шприце с другим антибиотиком (химическая несовместимость).
Бактериостатические антибиотики снижают бактерицидный эффект цефтриаксона. Цефтриаксон и аминогликозиды обладают синергизмом в отношении многих грамотрицательных бактерий (в т.ч. Pseudomonas aeruginosa), препараты следует вводить раздельно в рекомендованных дозах.
Антагонизм с хлорамфениколом іn vitro.
При одновременном применении с «петлевыми» диуретиками и другими нефротоксичными лекарственными средствами возрастает риск развития нефротоксического действия. Фармацевтически несовместим с растворами, содержащими другие антибиотики.
Растворы цефтриаксона не следует смешивать или вводить одновременно с другими противомикробными препаратами. Цефтриаксон нельзя смешивать с растворами, содержащими кальций.
Фармацевтически несовместим с растворами, содержащими др. антибиотики.
Фармацевтически несовместим с растворами, содержащими другие антибиотики. Цефтриаксон нельзя смешивать с растворами, содержащими кальций.
Фармацевтически не совместим с растворами, содержащими другие антибиотики, в т.ч. с амсакрином, ванкомицином, флуконазолом и аминогликозидами.
Совместно с аминогликозидами обладает синергизмом в отношении многих грамотрицательных бактерий. Несовместим с алкоголем (возможно покраснения лица, спазм в животе и области желудка, тошнота, рвота, головная боль, снижение АД, тахикардия, отдышка). HПВС и другие ингибиторы агрегации тромбоцитов увеличивают вероятность кровотечения. При одновременном применении с петлевыми диуретиками и другими нефротоксичными препаратами возрастает риск развития нефротоксического эффекта. Фармацевтически несовместим с растворами других антибиотиков.
Бактериостатические антибиотики снижают бактерицидный эффект цефтриаксона. Антагонизм с хлорамфениколом in vitro.
In vitro был обнаружен антагонизм между хлорамфениколом и цефтриаксоном.
Фармацевтически не совместим с растворами др. антибиотиков; растворами, содержащими кальций.
Несмотря на подробный сбор анамнеза, что является правилом и для других цефалоспориновых антибиотиков, нельзя исключить возможность развития анафилактического шока, который требует немедленной терапии — сначала внутривенно вводят адреналин затем глюкокортикоиды.
В редких случаях при УЗИ желчного пузыря отмечаются затемнения, которые исчезают после отмены (даже если это явление сопровождается болями в правом подреберье, рекомендуют продолжение назначения антибиотика и проведение симптоматического лечения).
Во время лечения противопоказано применение этанола — возможны дисульфирамоподобные эффекты (покраснение лица, спазм в животе и в области желудка, тошнота, рвота, головная боль, снижение артериального давления, тахикардия, одышка). Несмотря на подробный сбор анамнеза, что является правилом и для других цефалоспориновых антибиотиков, нельзя исключить возможность развития анафилактического шока, который требует немедленной терапии — сначала внутривенно вводят эпинефрин, затем глюкокортикостероиды.
При применении препарата зарегистрированы случаи развития диареи, вызванной Clostridium difficile (псевдомембранозный колит), различной степени тяжести: от легкой до колита со смертельным исходом. Необходим тщательный сбор анамнеза, так как отмечены случаи возникновения диареи, вызванной Clostridium difficile, спустя более чем 2 месяца после терапии антибиотиками. В соответствии с клиническими показаниями должно быть назначено соответствующее лечение (показано возмещение потери жидкости, электролитов, белка, проведение антибиотикотерапии в отношении Clostridium difficile, хирургическое лечение). При развитии псевдомембранозного колита противопоказано назначение препаратов, тормозящих перистальтику кишечника.
Как и при лечении другими антибактериальными препаратами, может развиться суперинфекция.
Как и при применении других β-лактамных антибиотиков, были зарегистрированы тяжелые реакции гиперчувствительности, в том числе со смертельным исходом. При развитии тяжелой реакции гиперчувствительности терапию препаратом Цефтриаксон необходимо немедленно отменить и провести соответствующие неотложные лечебные мероприятия. Перед началом терапии препаратом Цефтриаксон необходимо установить наблюдались ли y пациента реакции гиперчувствительности к цефтриаксону, цефалоспоринам или тяжелые реакции гиперчувствительности к другим β-лактамным антибиотикам
Как и при применении большинства других антибактериальных препаратов, при лечении препаратом Цефтриаксоном зарегистрированы случаи развития диареи, вызванной Clostridium difiicile (C. difiicile), различной тяжести: от легкой диареи до колита со смертельным исходом. Лечение антибактериальными препаратами подавляет нормальную микрофлору толстой кишки и провоцирует рост С. dijficile. B свою очередь, С. difiicile образует токсины А и В, которые являются факторами патогенеза диареи, вызванной С. difiicile. Штаммы С. difficile, гиперпродуцирующие токсины, являются возбудителями инфекций с высоким риском осложнений и смертности, вследствие возможной их устойчивости к антимикробной терапии, лечение же может потребовать колэктомии. Необходимо помнить о возможности развития диареи, вызванной С. difiicile, y всех пациентов с диареей после антибиотикотерапии. Необходим тщательный сбор анамнеза, т.к. отмечены случаи возникновения диареи, вызванной С. difiicile, спустя более чем 2 месяца после терапии антибиотиками. При подозрении или подтверждении диареи, вызванной С. difiicile, возможно потребуется отмена текущей не направленной на C. difiicile антибиотикотерапии. В соответствии с клиническими показаниями должно быть назначено соответствующее лечение с введением жидкости и электролитов, белков, антибиотикотерапия в отношении С. difiicile, хирургическое лечение. Нельзя применять лекарственные средства, тормозящие перистальтику кишечника.
Как и при лечении другими антибактериальными препаратами, могут развиваться суперинфекции.
Бактериостатические антибиотики снижают бактерицидный эффект цефтриаксона. Антагонизм с хлорамфениколом in vitro.
потенциальная роль в модуляции уровней глутамата xCT и GLT1 у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправляйте корреспонденцию: доктору Юсефу Сари, Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 [email protected] Тел: 419-383 -1507 (Office) Окончательная отредактированная версия этой статьи издателем доступна на сайте J Mol Neurosci. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс. Данные свидетельствуют о том, что различные эффекты, связанные с изменением глутаматергической нейротрансмиссии, возникают после длительного употребления этанола.В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов крыс P. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первой внутрибрюшинной инъекции цефтриаксона) по 14-й день, , через 10 дней после последней инъекции .Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках парадигмы — хронического потребления . Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга.Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011, Sari et al., 2011, Bahi et al., 2012 ), как было показано, взаимодействуют с глутаматергической системой в различных областях мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c —, которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркомании (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, тем самым восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета штата Индиана (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, а средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию Университета Толедо, кампус медицинских наук, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели, потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылочек. Мы выбрали лечение животных в течение 5 дней, основываясь на предыдущих и недавних исследованиях в нашей лаборатории и других исследованиях, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, массы тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарственными препаратами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14 день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем вдыхания и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченые пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группы, получавшие цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± стандартная ошибка среднего.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов P крыс.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейротрансмиттеров, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую участвуют в формировании поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института по проблемам злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Динг З.М., Энглеман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверитт Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего вещества в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Kau KS, Madayag A, Mantsch JR, Grier MD, Abdulhameed O, Baker DA. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамата-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое подавление метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в подобластях прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Индуцированная цефтриаксоном повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зарриндаст М.Р., Мешкани Дж., Резайоф А., Бейгзаде Р., Ростами П. Никотиновые рецепторы ацетилхолина дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
потенциальная роль xCT и GLT1 в модуляции уровня глутамата у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправить корреспонденцию: Доктору Юсефу Сари Университет Толедо, Колледж фармации и фармацевтических наук Департамент фармакологии Медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 уд[email protected] Тел: 419-383-1507 (офис) Окончательная отредактированная версия этой статьи издателем доступна в J Mol Neurosci. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс.Данные свидетельствуют о том, что различные эффекты, связанные с изменением глутаматергической нейротрансмиссии, возникают после длительного употребления этанола. В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов крыс P. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первого i.п. инъекции цефтриаксона) до 14-го дня, , 10 дней после последней инъекции . Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках парадигмы — хронического потребления .Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга. Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011 , Sari et al., 2011, Bahi et al., 2012), как было показано, взаимодействуют с глутаматергической системой в различных областях вознаграждения мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c —, которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркомании (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, тем самым восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета штата Индиана (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, а средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию Университета Толедо, кампус медицинских наук, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели, потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылочек. Мы выбрали лечение животных в течение 5 дней, основываясь на предыдущих и недавних исследованиях в нашей лаборатории и других исследованиях, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, массы тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарственными препаратами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14 день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем вдыхания и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченые пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группы, получавшие цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± стандартная ошибка среднего.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов P крыс.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейротрансмиттеров, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую участвуют в формировании поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института по проблемам злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Динг З.М., Энглеман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверитт Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего вещества в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Kau KS, Madayag A, Mantsch JR, Grier MD, Abdulhameed O, Baker DA. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамата-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое подавление метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в подобластях прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Индуцированная цефтриаксоном повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зарриндаст М.Р., Мешкани Дж., Резайоф А., Бейгзаде Р., Ростами П. Никотиновые рецепторы ацетилхолина дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
потенциальная роль xCT и GLT1 в модуляции уровня глутамата у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправить корреспонденцию: Доктору Юсефу Сари Университет Толедо, Колледж фармации и фармацевтических наук Департамент фармакологии Медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 уд[email protected] Тел: 419-383-1507 (офис) Окончательная отредактированная версия этой статьи издателем доступна в J Mol Neurosci. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс.Данные свидетельствуют о том, что различные эффекты, связанные с изменением глутаматергической нейротрансмиссии, возникают после длительного употребления этанола. В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов крыс P. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первого i.п. инъекции цефтриаксона) до 14-го дня, , 10 дней после последней инъекции . Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках парадигмы — хронического потребления .Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга. Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011 , Sari et al., 2011, Bahi et al., 2012), как было показано, взаимодействуют с глутаматергической системой в различных областях вознаграждения мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c —, которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркомании (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, тем самым восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета штата Индиана (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, а средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию Университета Толедо, кампус медицинских наук, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели, потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылочек. Мы выбрали лечение животных в течение 5 дней, основываясь на предыдущих и недавних исследованиях в нашей лаборатории и других исследованиях, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, массы тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарственными препаратами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14 день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем вдыхания и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченые пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группы, получавшие цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± стандартная ошибка среднего.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов P крыс.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейротрансмиттеров, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую участвуют в формировании поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института по проблемам злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Динг З.М., Энглеман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверитт Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего вещества в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Kau KS, Madayag A, Mantsch JR, Grier MD, Abdulhameed O, Baker DA. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамата-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое подавление метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в подобластях прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Индуцированная цефтриаксоном повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зарриндаст М.Р., Мешкани Дж., Резайоф А., Бейгзаде Р., Ростами П. Никотиновые рецепторы ацетилхолина дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
потенциальная роль xCT и GLT1 в модуляции уровня глутамата у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправить корреспонденцию: Доктору Юсефу Сари Университет Толедо, Колледж фармации и фармацевтических наук Департамент фармакологии Медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 уд[email protected] Тел: 419-383-1507 (офис) Окончательная отредактированная версия этой статьи издателем доступна в J Mol Neurosci. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс.Данные свидетельствуют о том, что различные эффекты, связанные с изменением глутаматергической нейротрансмиссии, возникают после длительного употребления этанола. В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов крыс P. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первого i.п. инъекции цефтриаксона) до 14-го дня, , 10 дней после последней инъекции . Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках парадигмы — хронического потребления .Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга. Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011 , Sari et al., 2011, Bahi et al., 2012), как было показано, взаимодействуют с глутаматергической системой в различных областях вознаграждения мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c —, которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркомании (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, тем самым восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета штата Индиана (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, а средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию Университета Толедо, кампус медицинских наук, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели, потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылочек. Мы выбрали лечение животных в течение 5 дней, основываясь на предыдущих и недавних исследованиях в нашей лаборатории и других исследованиях, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, массы тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарственными препаратами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14 день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем вдыхания и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченые пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группы, получавшие цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± стандартная ошибка среднего.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов P крыс.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейротрансмиттеров, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую участвуют в формировании поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института по проблемам злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Динг З.М., Энглеман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверитт Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего вещества в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Kau KS, Madayag A, Mantsch JR, Grier MD, Abdulhameed O, Baker DA. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамата-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое подавление метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в подобластях прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Индуцированная цефтриаксоном повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зарриндаст М.Р., Мешкани Дж., Резайоф А., Бейгзаде Р., Ростами П. Никотиновые рецепторы ацетилхолина дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
потенциальная роль xCT и GLT1 в модуляции уровня глутамата у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправить корреспонденцию: Доктору Юсефу Сари Университет Толедо, Колледж фармации и фармацевтических наук Департамент фармакологии Медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 уд[email protected] Тел: 419-383-1507 (офис) Окончательная отредактированная версия этой статьи издателем доступна в J Mol Neurosci. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс.Данные свидетельствуют о том, что различные эффекты, связанные с изменением глутаматергической нейротрансмиссии, возникают после длительного употребления этанола. В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов крыс P. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первого i.п. инъекции цефтриаксона) до 14-го дня, , 10 дней после последней инъекции . Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках парадигмы — хронического потребления .Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга. Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011 , Sari et al., 2011, Bahi et al., 2012), как было показано, взаимодействуют с глутаматергической системой в различных областях вознаграждения мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c —, которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркомании (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, тем самым восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета штата Индиана (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, а средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по уходу за животными и их использованию Университета Толедо, кампус медицинских наук, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели, потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылочек. Мы выбрали лечение животных в течение 5 дней, основываясь на предыдущих и недавних исследованиях в нашей лаборатории и других исследованиях, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, массы тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарственными препаратами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14 день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем вдыхания и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченые пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группы, получавшие цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± стандартная ошибка среднего. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± стандартная ошибка среднего.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± стандартная ошибка среднего. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов P крыс.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейротрансмиттеров, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую участвуют в формировании поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института по проблемам злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Динг З.М., Энглеман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверитт Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего вещества в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Kau KS, Madayag A, Mantsch JR, Grier MD, Abdulhameed O, Baker DA. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамата-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое подавление метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в подобластях прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Индуцированная цефтриаксоном повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Зарриндаст М.Р., Мешкани Дж., Резайоф А., Бейгзаде Р., Ростами П. Никотиновые рецепторы ацетилхолина дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
Использование, побочные эффекты, дозы, меры предосторожности
Цефтриаксон — это разновидность антибиотиков, используемых для лечения бактериальных инфекций. Он принадлежит к классу препаратов, называемых цефалоспориновыми антибиотиками. Эти антибиотики третьего поколения используются для лечения штаммов бактерий, которые обычно устойчивы к другим типам антибиотиков.
Цефтриаксон вводят внутримышечно (в крупную мышцу) или внутривенно (в вену).Хотя цефтриаксон обычно хорошо переносится, он может вызывать сыпь, диарею и неблагоприятные изменения в количестве лейкоцитов.
Cravetiger / Getty ImagesЦефтриаксон, продаваемый под торговой маркой Роцефин и доступный в виде генерика, был впервые одобрен для использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1982 году.
использует
Цефтриаксон — антибиотик широкого спектра действия, что означает, что он может лечить множество различных типов бактерий. Цефтриаксон работает, расщепляя аминокислоты, составляющие клеточную стенку, непоправимо повреждая бактерии и приводя к быстрой гибели клеток.
Цефтриаксон в основном используется для лечения инфекций кожи, дыхательных путей, мягких тканей, мочевыводящих путей и уха / носа / горла, вызванных такими бактериями, как:
Это типы бактерий, которые, как правило, устойчивы к антибиотикам предыдущего поколения.
Устойчивость к антибиотикам может развиться при чрезмерном использовании антибиотика. Если бактерия становится устойчивой к антибиотику, этот антибиотик (и часто другие ему подобные) в меньшей степени способны вылечить инфекцию.
Есть некоторые типы бактерий, которые цефтриаксон не лечит.К ним относятся видов Enterobacter , Listeria monocytogenes , Pseudomonas aeruginosa и устойчивый к метициллину Staphylococcus aureus (MRSA). Для лечения этих инфекций могут использоваться цефалоспориновые антибиотики четвертого поколения, такие как цефепим.
Типы лечимых инфекций
Хотя цефтриаксон и другие цефалоспорины третьего поколения эффективны при лечении широкого спектра бактериальных инфекций, их, как правило, применяют в более сложных случаях.Это предотвращает чрезмерное использование препарата и может замедлить развитие устойчивости к цефтриаксону.
Среди инфекций, при которых часто используется цефтриаксон:
Цефтриаксон также иногда используется перед операцией, чтобы снизить риск послеоперационной инфекции. Это называется предоперационной профилактикой.
Использование не по назначению
Цефтриаксон и другие антибиотики не могут лечить вирусные, грибковые или паразитарные инфекции. Они используются только для лечения бактериальных инфекций.
С учетом сказанного, цефтриаксон, по-видимому, обладает нейропротекторными свойствами, которые могут помочь в лечении нейродегенеративных расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз (БАС). Другие исследования изучают, может ли цефтриаксон помочь в лечении алкогольной и опиоидной зависимости или помогает облегчить хроническую боль.
Неясно, может ли цефтриаксон помочь в лечении любого из этих состояний. До получения дополнительных доказательств цефтриаксон следует использовать только по указанию врача.
Перед приемом
Прежде чем назначить цефтриаксон, врач проведет анализы, чтобы определить, какая бактерия вызывает инфекцию. Они могут включать анализ крови или мочи (например, те, которые используются для диагностики гонореи) или культивирование бактерий (в том числе те, которые используются для диагностики стрептококковой инфекции в горле).
Другие более тяжелые инфекции, такие как сепсис или бактериальный менингит, могут потребовать тестирования на чувствительность к противомикробным препаратам (AST), чтобы определить , насколько устойчивых бактерий доступны антибиотические препараты.
Лаборатория может использовать различные методы, в том числе анализы крови, мочи, мокроты, стула и спинномозговой жидкости, которые помогают определить генотип (генетический состав) бактерии, и тесты на основе культуры, которые определяют фенотип (физический состав) бактерии. .
Эти сведения могут помочь патологу с высокой степенью точности предсказать, чувствительны ли бактерии к цефтриаксону или для лечения лучше подходят другие антибиотики.
Меры предосторожности и противопоказания
Единственным абсолютным противопоказанием к применению цефтриаксона является известная аллергия на сам антибиотик и любой неактивный ингредиент в составе.
Наличие аллергии на другие цефалоспорины третьего поколения не означает, что у вас будет аллергия на цефтриаксон. Тем не менее, цефтриаксон следует использовать с осторожностью. К ним относятся антибиотики цефалоспоринового ряда, такие как:
- Цефазолин
- Цефаклор
- Цефдинир
- Цефуроксим
- Цефалексин
- Дурицеф (цефадроксил)
- Максипим (цефепим)
- Супракс (цефиксим)
- Тефларо (цефтаролин фозамил)
Существует риск перекрестной аллергии на цефтриаксон, если у вас аллергия на пенициллин.Если в прошлом у вас была тяжелая аллергическая реакция на пенициллин, вам никогда не следует использовать цефтриаксон.
Цефтриаксон не следует применять у новорожденных с гипербилирубинемией (высокий билирубин). Это может вызвать билирубиновый энцефалит — воспалительное заболевание мозга, которое может привести к потере слуха, повреждению мозга или смерти.
Цефтриаксон никогда не следует применять с внутривенными препаратами кальция (включая раствор Рингера) новорожденным младше 28 дней.Это может привести к смертельному исходу для легких и почек.
Цефтриаксон относится к категории B для беременных, что означает, что он обычно считается безопасным для использования. Тем не менее, поговорите со своим врачом, чтобы понять преимущества и риски лечения, если вы беременны, планируете забеременеть или кормите грудью.
Дозировка
Цефтриаксон выпускается либо в виде стерильного порошка, который восстанавливается жидкостью, либо в виде замороженного раствора-премикса, который размораживают перед использованием.Затем лекарство можно ввести в крупную мышцу или ввести внутривенно в вену. Из двух составов:
- Цефтриаксон для внутримышечных инъекций бывает двух дозировок: 250 миллиграммов на миллилитр (мг / мл) или 350 мг / мл.
- Раствор цефтриаксона для внутривенного введения готовят в концентрации 100 мг / мл.
Рекомендуемая доза может варьироваться в зависимости от возраста и типа инфекции, которую лечат.
Взрослые
Цефтриаксон используется для лечения как сложных, так и неосложненных бактериальных инфекций у взрослых.Рекомендуемая доза цефтриаксона для взрослых составляет от 250 мг до 2 граммов в день в виде разовой дозы или двух поровну разделенных доз с интервалом в 12 часов. При необходимости можно использовать до 4 граммов в день.
Дозировка и продолжительность лечения могут варьироваться в зависимости от инфекции, которую лечат. Некоторым, таким как гонорея, требуется только однократная внутримышечная инъекция 250 мг. Другим может потребоваться длительная внутривенная терапия.
Как правило, прием цефтриаксона следует продолжать не менее двух дней после исчезновения симптомов инфекции.Обычно это занимает от четырех до 14 дней. Осложненные инфекции могут занять больше времени.
Если цефтриаксон используется для предоперационной профилактики, его следует вводить однократно внутривенно в дозе 1 грамм за период от 30 минут до двух часов до операции.
Дети
Цефтриаксон обычно показан для лечения тяжелых бактериальных инфекций у младенцев, детей ясельного и младшего возраста.
- Для серьезных инфекций, отличных от менингита, рекомендуемая суточная доза рассчитывается от 50 до 75 мг на килограмм (мг / кг) и вводится двумя поровну разделенными дозами с интервалом 12 часов.Общая суточная доза не должна превышать 2 грамма в сутки.
- При бактериальном менингите рекомендуемая суточная доза рассчитывается как 100 мг / кг и вводится двумя поровну разделенными дозами с интервалом 12 часов. Ежедневно следует употреблять не более 4 граммов.
- При бактериальном среднем отите следует сделать однократную внутримышечную инъекцию из расчета 50 мг / кг.
Подростков с определенными бактериальными инфекциями, такими как гонорея или сифилис, можно лечить так же, как и взрослых.
Модификации
Цефтриаксон выводится из организма как почками, так и печенью. Хотя дозу не нужно корректировать для людей с заболеваниями почек или печени, общая суточная доза никогда не должна превышать 2 грамма в день.
Как брать и хранить
Лечение цефтриаксоном нельзя проводить самостоятельно. Лечение проводит квалифицированный медицинский работник в кабинете врача, клинике или больнице.
Внутримышечные инъекции можно вводить в ягодицы, бедра или другие крупные мышцы.Внутривенные инъекции можно вводить непосредственно в вену или вводить через внутривенную (IV) линию в течение 30 минут или более.
Побочные эффекты
Как и все лекарства, цефтриаксон может вызывать побочные эффекты. Общие побочные эффекты цефтриаксона аналогичны побочным эффектам других инъекционных или внутривенных антибиотиков.
Обычный
Цефтриаксон вызывает симптомы не у всех, но более вероятно, что это произойдет при более высоких дозах. Побочные эффекты, затрагивающие не менее 1% пользователей, включают:
- Боль и покраснение в месте инъекции
- Тепло, стянутость и затвердение кожи после внутривенного введения
- Диарея, от легкой до тяжелой
- Сыпь (обычно широко распространенная на плоских красных участках кожи, покрытых крошечными бугорками)
- Аномальное количество лейкоцитов, чаще всего эозинофилия (высокий уровень эозинофилов) и лейкопения (низкий уровень лейкоцитов)
- Аномальное количество эритроцитов, в первую очередь тромбоцитоз (избыточное количество тромбоцитов)
Менее распространенные побочные эффекты включают головные боли, головокружение, зуд, лихорадку, тошноту, рвоту, воспаление влагалища (вагинит) и молочницу (кандидоз).У детей иногда могут образовываться камни в желчном пузыре из-за гиперпродукции желчи.
Тяжелая
В редких случаях цефтриаксон может вызывать тяжелую и потенциально опасную для жизни лекарственную реакцию, известную как синдром Стивенса-Джонсона (SJS) или токсический эпидермальный некролиз (TEN). Оба характеризуются быстрым и широко распространенным образованием пузырей и расслоением (шелушением) кожи.
SJS и TEN обычно начинаются с симптомов гриппа, включая высокую температуру, боль в горле, затрудненное глотание, кашель, ломоту в теле и красные опухшие глаза.В течение нескольких часов или дней может появиться нежная или болезненная сыпь, которая начинается от туловища и распространяется к лицу и конечностям. Вскоре появятся пузыри, за которыми последует повсеместное шелушение кожи простынями.
Если не лечить как неотложную медицинскую помощь, SJS и TEN могут вызвать сильное обезвоживание, сепсис, шок, пневмонию, полиорганную недостаточность и смерть.
Когда звонить 911
Позвоните в службу 911 или обратитесь за неотложной помощью, если после инъекции или внутривенного введения цефтриаксона у вас развиваются следующие симптомы:
- Внезапная и широко распространенная кожная боль
- Быстро распространяющаяся красная или пурпурная сыпь
- Болезненные язвы во рту, затрудняющие глотание
- Болезненные волдыри на коже, глазах и половых органах (но обычно не на коже черепа, ладонях или подошвах)
- Загорелая кожа, шелушащаяся листами
Цефалоспориновые антибиотики и пенициллин являются двумя наиболее частыми лекарственными средствами, вызывающими SJS и TEN.
Предупреждения и взаимодействия
Сообщалось о тяжелых случаях гемолитической анемии у людей, получающих цефтриаксон. Это форма анемии, при которой красные кровяные тельца разрушаются быстрее, чем могут вырабатываться. Следует немедленно прекратить лечение любого, у кого развивается анемия на фоне приема цефтриаксона, и прекратить его до тех пор, пока не будет выявлена основная причина.
Сообщалось о Clostridium difficile -ассоциированной диарее практически со всеми антибактериальными средствами, вызванной тем, что лекарство изменяет естественную флору кишечника и допускает появление C.difficile для размножения. Если во время терапии цефтриаксоном развивается диарея, лечение следует прекратить.
При необходимости можно использовать антибиотики, такие как Flagyl (метронидазол) или Dificid (фидаксомицин), для лечения инфекции, вызванной C. difficile . В редких случаях диарея, связанная с C. difficile-, может привести к псевдомембранозному колиту, потенциально смертельному. воспаление толстой кишки.
Лекарственные взаимодействия
Цефтриаксон не следует использовать с любыми следующими растворами, содержащими кальций, у людей любого возраста (и не применять без исключения новорожденным):
- Ацетат кальция
- Хлорид кальция
- Глюцепат кальция
- Глюконат кальция
- Раствор Рингера с лактатом
Бывают случаи, когда эти кальцийсодержащие растворы могут быть необходимы, например, во время беременности или хирургического вмешательства.В таком случае дозу цефтриаксона можно отделить от дозы кальцийсодержащего продукта, чтобы минимизировать риск.
Другие препараты, которые могут взаимодействовать с цефтриаксоном, включают:
- Амсакрин , химиотерапевтический препарат, используемый для лечения некоторых типов лимфомы
- Аминогликозидные антибиотики , включая Гентак (гентамицин) и Тобрекс (тобрамицин)
- Дифлюкан (флуконазол) , противогрибковый препарат
- Ванкоцин (ванкомицин) , гликопептидный антибиотик
Чтобы избежать взаимодействия, всегда сообщайте своему врачу о любом лекарстве, которое вы принимаете, будь то рецептурный, отпускаемый без рецепта, травяной или рекреационный.
Слово Verywell
Цефтриаксон — важный и эффективный антибиотик, но у него есть свои ограничения. Неправильно его использовать, это может принести больше вреда, чем пользы.
Чтобы снизить риск причинения вреда, сообщите своему врачу о любой аллергической реакции, которую вы имели на антибиотик, и убедитесь, что она занесена в вашу электронную медицинскую карту (EMR). Если у вас когда-либо была серьезная реакция на цефтриаксон, пенициллин или любой антибиотик, включая SJS, TEN или анафилаксию, подумайте о том, чтобы получить медицинский браслет, чтобы медицинский персонал знал об этом в случае возникновения чрезвычайной ситуации.
Насколько безопасно это делать?
Наконец-то! Наступили выходные, и вы готовы расслабиться, сделав несколько возлияний. Но подождите — вы все еще проходите курс антибиотиков, который вам прописал врач на прошлой неделе после вашего (вставьте название надоедливой инфекции) диагноза. Безопасно ли употребление алкоголя? Или вам следует подождать, пока вы завершите схему и станете официально свободными от инфекции?
Влияние алкоголя на инфекцииРади вашего выздоровления, вероятно, лучше просто пропустить вино и вместо этого пойти добровольцем на работу назначенного водителя, — говорит Брайан Верт, Фарм.D., доцент Фармацевтической школы Вашингтонского университета в Сиэтле.
«Алкоголь обладает иммунодепрессивным действием и может снизить вашу способность бороться с инфекцией, от которой вы принимаете антибиотики», — говорит доктор Верт. «И это может усугубить некоторые побочные эффекты антибиотиков».
Он говорит о побочных эффектах, таких как расстройство желудка, тошнота, рвота, диарея и обезвоживание, которые являются обычными побочными эффектами среди большинства, если не всех, антибиотиков.
«Если вы добавляете в смесь алкоголь… вы можете получить нечто среднее между этими проблемами», — говорит он, добавляя, что это в конечном итоге может продлить ваше выздоровление.
Кроме того, по данным Национального фонда сна, употребление алкоголя может влиять на качество сна. А поскольку сон так важен для процесса заживления, вероятно, лучше избегать всего, что может помешать вам получить достаточное количество ZZZ, пока ваша иммунная система работает над борьбой с этой бактериальной инфекцией.
Безопасно ли смешивать антибиотики и алкоголь?С точки зрения реальной безопасности, хорошая новость заключается в том, что нет прямого противопоказания между употреблением алкоголя и большинством антибиотиков.Однако ключевое слово здесь больше всего . Обычные антибиотики, такие как, например, амоксициллин и азитромицин, не противопоказаны (по данным Центров по контролю за заболеваниями, из 270,2 миллиона рецептов на антибиотики, выписанных в 2016 году, 56,7 миллиона приходились на амоксициллин и 44,9 миллиона — на азитромицин). Но есть и другие, и смешивать их с алкоголем может быть опасно, говорит доктор Верт.
С какими антибиотиками можно не употреблять алкоголь?«Существуют определенные антибиотики, которые напрямую взаимодействуют с метаболизмом алкоголя», — говорит он.«И это те, которые представляют наибольший риск прямого негативного воздействия при совместном приеме с алкоголем».
Рассматриваемые препараты? Основными нарушителями являются флагил (метронидазол; сюда входят рецепты на вагинальные формы, а также таблетки для перорального приема), тиндамакс (тинидазол), бактрим (сульфаметоксазол-триметоприм) и зивокс (линезолид). Вам следует избегать употребления алкоголя и продуктов, содержащих алкоголь, пока вы принимаете эти лекарства, плюс в течение нескольких дней после приема метронидазола или тинидазола.
Обязательно проверьте этикетки на предмет скрытых источников алкоголя; жидкости для полоскания рта или лекарства от кашля могут содержать алкоголь. Если вам нужна помощь, ваш фармацевт — отличный помощник!
Побочные действия алкоголя с антибиотикамиОднако, если вы или получите рецепт на один из них, имейте в виду, что смешивание этих антибиотиков и алкоголя может вызвать серьезные лекарственные взаимодействия, которые могут привести к: повреждению печени, высокому кровяному давлению, учащенному сердцебиению. скорость, гиперемия кожи, сонливость, головокружение и головные боли.Некоторые антибиотики, такие как зивокс, могут хуже реагировать на определенные виды алкоголя, такие как разливное пиво или красное вино. По этим причинам, согласно клинике Майо, следует полностью избегать употребления любого количества алкоголя при приеме этих лекарств.


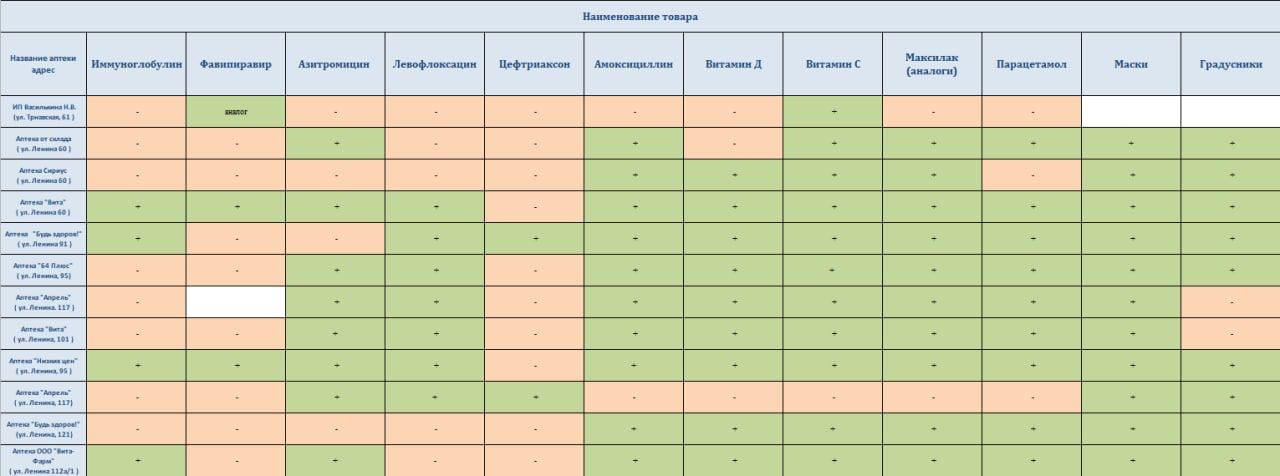


 Некоторые специалисты считают, что Цефтриаксон оказывает аналогичный эффект. Однако при наличии аллергической реакции на один из компонентов – антибиотик или спиртной напиток – не исключена возможность анафилактического шока с летальным исходом.
Некоторые специалисты считают, что Цефтриаксон оказывает аналогичный эффект. Однако при наличии аллергической реакции на один из компонентов – антибиотик или спиртной напиток – не исключена возможность анафилактического шока с летальным исходом.
