Как антибиотики и другие препараты влияют на микробиоту кишечника
Мы получили много вопросов об антибиотиках и решили подготовить материал о том, как на микробиоту влияют разные лекарства. Рассказываем о самых популярных.
Антибиотики
Антибиотики — вид препаратов, которые уничтожают бактерии, уменьшают их размножение и распространение. Их используют для лечения бактериальных инфекций и только в тех случаях, когда без них не обойтись. По типу действия антибиотики можно разделить на два вида: бактерицидные и бактериостатические. Первые убивают микроорганизмы, а вторые не дают им размножаться.
Также антибиотики бывают широкого спектра и узконаправленные. В первом случае они бьют по разным видам микроорганизмов, во втором — только по определенным штаммам. Как правило, если неизвестно, какая бактерия привела к развитию симптомов — применяют антибиотики широкого спектра.
Исследование семи разных антибиотиков на мышах показало, что с высоким ростом патогена C. difficile связаны цефоперазон, метронидазол и стрептомицин. А наибольший рост бактерии ассоциирован с приемом ампицилина.
difficile связаны цефоперазон, метронидазол и стрептомицин. А наибольший рост бактерии ассоциирован с приемом ампицилина.
Часто для лечения заболеваний используется комплекс из нескольких антибиотиков. Чтобы изучить влияние терапии в этом случае, исследователи Университета Копенгагена отобрали 12 мужчин после 4-дневного лечения меропенемом, гентамицином и ванкомицином.
Лечение привело почти к полному уничтожению микробиоты. Спустя 6 месяцев большинство видов смогло восстановиться и вернуться к прежним уровням, однако участникам все равно не хватало 9 полезных представителей микробиоты, которые были в кишечнике до лечения.
Не все бактерии восстанавливаются после бомбардировки антибиотиками. Некоторые виды пропадают навсегда.
Антибиотики по-разному воздействуют на микробиоту в зависимости от способа поступления в организм. Пероральный прием антибиотиков гораздо сильнее стимулирует развитие устойчивости, чем введение препарата в вену.
Ответ микробиоты на лечение антибиотиками зависит еще от индивидуальных особенностей, таких как возраст, образ жизни и состав бактерий в кишечнике. Например, их применение у новорожденных и младенцев приводит к нарушениям развития разнообразной и сбалансированной микробиоты. Также антибиотики ослабляют микробиоту внутриутробно, когда беременная женщина проходит терапию.
Например, их применение у новорожденных и младенцев приводит к нарушениям развития разнообразной и сбалансированной микробиоты. Также антибиотики ослабляют микробиоту внутриутробно, когда беременная женщина проходит терапию.
Исследователи приходят к тому, что антибиотики должны подбираться индивидуально, как химиотерапия для лечения рака. Уже сегодня разрабатываются алгоритмы, которые смогут по образцу микробиоты предсказать, как бактерии отреагируют на лечение антибиотиками. Для восстановления кишечника после терапии применяют пробиотические бактерии.
Видео о том, как бактерии становятся устойчивыми к антибиотикам, и почему это ведет к кризису в лечении заболеваний. Есть русские субтитры.Обезболивающее
Нестероидные противовоспалительные средства (НПВС), или по-простому обезболивающие, применяются для избавления от боли, уменьшения воспаления и снижения температуры. К обезболивающим относится ибупрофен, аспирин, напроксен, диклофенак, мефенамовая кислота, индометацин и другие препараты. Несмотря на похожие свойства, парацетамол не относится к НПВС.
К обезболивающим относится ибупрофен, аспирин, напроксен, диклофенак, мефенамовая кислота, индометацин и другие препараты. Несмотря на похожие свойства, парацетамол не относится к НПВС.
Исследование образцов микробиоты 155 взрослых, которые за последние 30 дней приняли обезболивающие препараты хотя бы один раз, показало, что на изменения сильнее влияет тип лекарства, а не количество. Кетопрофен, напроксен и кеторолак агрессивнее действуют на желудочно-кишечный тракт, чем ибупрофен и целекосиб.
Кроме того состав микробиоты отличался, когда НПВС применяли вместе с другими лекарствами, например антидепрессантами, слабительными и ингибиторами протонной помпы.
В недавнем исследовании на мышах выяснилось, что обезболивающий препарат индометацин усугубляет течение инфекции C. difficile. Ученые предполагают, что ибупрофен и аспирин работают так же, потому что у этих лекарств схожий механизм действия. Однако нужно больше исследований, чтобы это выяснить.
Асперин вероятно уменьшает представленность бактерий, связанных с развитием рака прямой кишки. Низкие дозы этого препарата часто назначают принимать регулярно тем, у кого высокий риск болезней сердца и сосудов. С другой стороны, прием аспирина увеличивает риск кровотечений в ЖКТ.
Низкие дозы этого препарата часто назначают принимать регулярно тем, у кого высокий риск болезней сердца и сосудов. С другой стороны, прием аспирина увеличивает риск кровотечений в ЖКТ.
Антидепрессанты
Антидепрессанты — препараты, которые применяются для лечения депрессии. Есть разные виды этих лекарств, но самые распространенные — ингибиторы обратного захвата серотонина и/или норэпинефрина. Известно, что микробиота кишечника влияет на производство серотонина, гамма-аминомасляной кислоты (ГАМК) и дофамина — нейромедиаторов, от которых зависит наше настроение и самочувствие.
Сравнение образцов микробиоты пациентов с депрессией и здоровых взрослых показало, что у первых было больше бактерии Flavonifractor. В другом исследовании выяснили, что микробиота людей с депрессией, которые принимали антидепрессанты, содержит меньше бактерий Coprococcus и Dialister.
Исследования в пробирке (in vitro) показывают, что лекарства от депрессии обладают и антибактериальными свойствами. Влияние антидепрессантов изучали также на мышах. У них препараты ухудшали разнообразие и меняли состав бактерий кишечника.
Влияние антидепрессантов изучали также на мышах. У них препараты ухудшали разнообразие и меняли состав бактерий кишечника.
Предполагается, что часть положительного эффекта от приема антидепрессантов происходит из-за изменений микробиоты.
Однако к этому исследованию стоит относиться осторожно: антидепрессанты вводили прямо в брюшко, чтобы добиться определенных концентраций, поэтому на результат мог повлиять стресс, который испытывали животные. Исследователи предполагают, что часть положительного эффекта антидепрессантов обусловлена воздействием на микробиоту.
Видео, как наш организм переваривает лекарства. Есть русские субтитры.Ингибиторы протонной помпы
Ингибиторы протонной помпы (ИПП) используются для лечения заболеваний желудочно-кишечного тракта. Часто их назначают при язвенной болезни желудка и двенадцатиперстной кишки, диспепсии, хроническом гастрите, дуодените и панкреатите.
Часто их назначают при язвенной болезни желудка и двенадцатиперстной кишки, диспепсии, хроническом гастрите, дуодените и панкреатите.
Каждая клетка желудка содержит так называемую протонную помпу, от активности которой зависит производство кислоты для переваривания пищи. Иногда кислоты становится много, и она начинает разрушать здоровые клетки. Ингибиторы подавляют ее производство.
В другом исследовании сравнивали изменения микробиоты до и после курса приема ИПП. Оказалось, что у пациентов после лечения была выше представленность Lactobacillus — пробиотической бактерии, которая обычно связана со здоровьем кишечника. Исследователи отмечают, что большая представленность Lactobacillus встречается у пациентов с сахарным диабетом 2 типа и болезнью Паркинсона. Поэтому остается неясным, полезно ли в этом случае увеличение доли бактерии.
Разнообразие бактерий после приема ИПП уменьшается. Ученые предполагают, что это главная причина повышения риска инфекций и воспаления после приема препаратов.
От состояния микробиоты может зависеть, насколько хорошо или плохо будет действовать тот или иной препарат.
Сейчас доступно множество лекарств, и каждая микробиота может реагировать на них по-разному, уменьшая или улучшая свойства препарата. В будущем мы сможем подбирать более эффективные препараты в зависимости от состава бактерий кишечника (как по вариантам генов в фармакогенетике), но до этого еще далеко. Большую часть взаимодействий между организмом, бактериями и лекарствами еще предстоит изучить.
Узнать свой состав бактерий кишечника можно с помощью Теста микробиоты. Мы анализируем ДНК бактерий кишечника, что позволяет получить гораздо больше данных в сравнении с обычным посевом в питательной среде.
- Palleja, A., Mikkelsen, K. H., Forslund, S. K., Kashani, A., Allin, K. H., Nielsen, T., Hansen, T. H., Liang, S., Feng, Q., Zhang, C., Pyl, P. T., Coelho, L. P., Yang, H., Wang, J., Typas, A., Nielsen, M. F., Nielsen, H.
 B., Bork, P., Wang, J., … Pedersen, O. (2018). Recovery of gut microbiota of healthy adults following antibiotic exposure. Nature Microbiology, 3(11), 1255–1265
B., Bork, P., Wang, J., … Pedersen, O. (2018). Recovery of gut microbiota of healthy adults following antibiotic exposure. Nature Microbiology, 3(11), 1255–1265 - Zhang, L., Huang, Y., Zhou, Y., Buckley, T., & Wang, H. H. (2013). Antibiotic Administration Routes Significantly Influence the Levels of Antibiotic Resistance in Gut Microbiota. Antimicrobial Agents and Chemotherapy, 57(8), 3659–3666..
- Ianiro, G., Tilg, H., & Gasbarrini, A. (2016). Antibiotics as deep modulators of gut microbiota: between good and evil. Gut, 65(11), 1906–1915.
- Rogers, M. A. M., & Aronoff, D. M. (2016). The influence of non-steroidal anti-inflammatory drugs on the gut microbiome. Clinical Microbiology and Infection, 22(2), 178.e1-178.e9.
- Common pain relievers may worsen C. difficile infection
- Jiang, H., Ling, Z., Zhang, Y., Mao, H., Ma, Z., Yin, Y., Wang, W., Tang, W., Tan, Z., Shi, J., Li, L., & Ruan, B. (2015). Altered fecal microbiota composition in patients with major depressive disorder.
 Brain, Behavior, and Immunity, 48, 186–194.
Brain, Behavior, and Immunity, 48, 186–194. - Munoz-Bellido, J. ., Munoz-Criado, S., & Garcı̀a-Rodrı̀guez, J. . (2000). Antimicrobial activity of psychotropic drugs. International Journal of Antimicrobial Agents, 14(3), 177–180.
- Lukić, I., Getselter, D., Ziv, O., Oron, O., Reuveni, E., Koren, O., & Elliott, E. (2019). Antidepressants affect gut microbiota and Ruminococcus flavefaciens is able to abolish their effects on depressive-like behavior. Translational Psychiatry, 9(1).
- Prizment, A. E., Menk, J., Staley, C., Vivek, S., Onyeaghala, G., Thyagarajan, B., … Church, T. (2019). Abstract 5060: Effect of aspirin on gut microbiome in a pilot randomized double-blind trial. Epidemiology. Presented at the Proceedings: AACR Annual Meeting 2019; March 29-April 3, 2019; Atlanta, GA.
Ученые нашли вещество для создания антибиотиков нового поколения
https://ria.ru/20210526/dgtu-1733837438.html
Ученые нашли вещество для создания антибиотиков нового поколения
Ученые нашли вещество для создания антибиотиков нового поколения — РИА Новости, 26. 05.2021
05.2021
Ученые нашли вещество для создания антибиотиков нового поколения
Натуральное вещество, легко устраняющее одну из главных причин устойчивости микробов к антибиотикам, исследовали ученые Донского государственного технического… РИА Новости, 26.05.2021
2021-05-26T09:00
2021-05-26T09:00
2021-05-26T12:59
наука
донской государственный технический университет
навигатор абитуриента
университетская наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/07e5/05/19/1733848539_0:160:3072:1888_1920x0_80_0_0_4571a6dba65cc966812d36df3e5d0301.jpg
МОСКВА, 26 мая — РИА Новости. Натуральное вещество, легко устраняющее одну из главных причин устойчивости микробов к антибиотикам, исследовали ученые Донского государственного технического университета (ДГТУ) в составе международного коллектива. По словам авторов, биоактивные соединения кардамона зеленого (Elettaria cardamomum) препятствуют формированию биопленок, благодаря чему будут полезны при создании новых антимикробных препаратов. Результаты опубликованы в журнале Frontiers in Microbiology.Бактериальная биопленка — многослойная структура, формируемая микробным сообществом для защиты от агрессивной среды, а также от действия лекарств. «Щитом» для бактерий служит слой полимеров, встроенных в клеточный матрикс. Они обеспечивают устойчивость микроорганизмов как к антибиотикам, так и к действию иммунной системы человека.Бактерии сегодня становятся все более устойчивыми к часто употребляемым антибиотикам, и способность к образованию биопленок, по словам ученых, играет в этом процессе важную роль. Поиск новых препаратов, способных бороться даже с устойчивыми штаммами микробов без риска для организма в целом, — это ключевое направление фармакологии, уверены ученые.Новое исследование специалистов ДГТУ показало, что эфирные масла кардамона зеленого (Elettaria cardamomum) — отличное средство борьбы с биопленками. Ученые выявили высокий потенциал биоактивных соединений на основе этого растения в борьбе с целым рядом бактериальных патогенов, среди которых кишечная палочка, стрептококк, сальмонелла и другие.
Результаты опубликованы в журнале Frontiers in Microbiology.Бактериальная биопленка — многослойная структура, формируемая микробным сообществом для защиты от агрессивной среды, а также от действия лекарств. «Щитом» для бактерий служит слой полимеров, встроенных в клеточный матрикс. Они обеспечивают устойчивость микроорганизмов как к антибиотикам, так и к действию иммунной системы человека.Бактерии сегодня становятся все более устойчивыми к часто употребляемым антибиотикам, и способность к образованию биопленок, по словам ученых, играет в этом процессе важную роль. Поиск новых препаратов, способных бороться даже с устойчивыми штаммами микробов без риска для организма в целом, — это ключевое направление фармакологии, уверены ученые.Новое исследование специалистов ДГТУ показало, что эфирные масла кардамона зеленого (Elettaria cardamomum) — отличное средство борьбы с биопленками. Ученые выявили высокий потенциал биоактивных соединений на основе этого растения в борьбе с целым рядом бактериальных патогенов, среди которых кишечная палочка, стрептококк, сальмонелла и другие.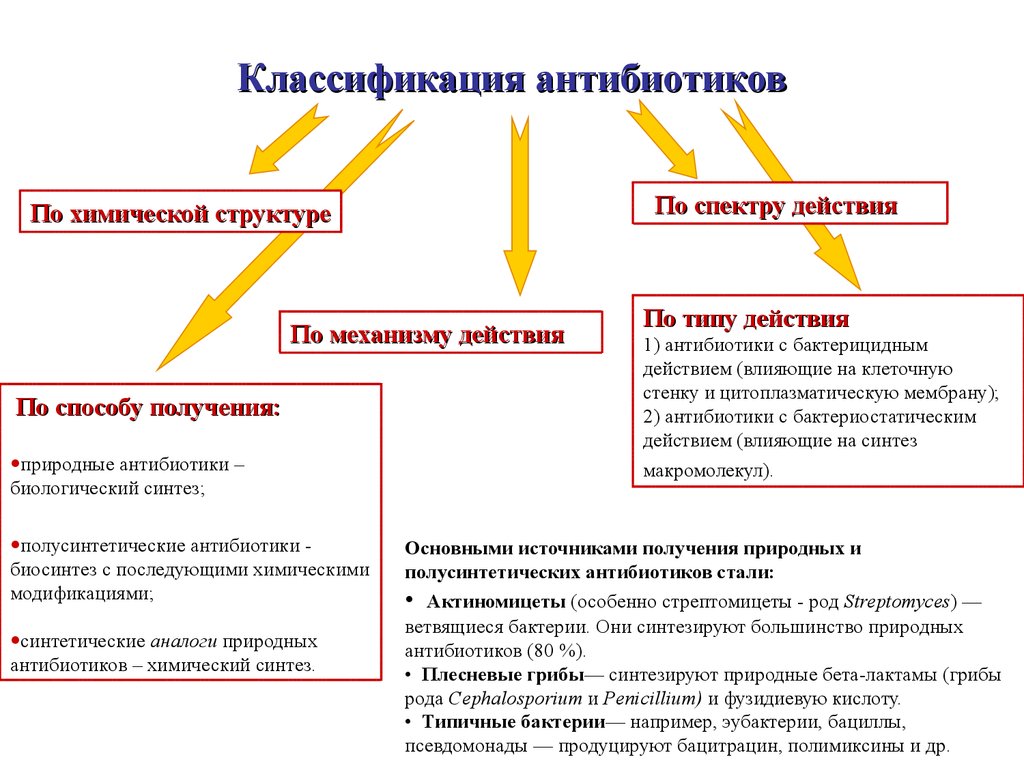 «По данным Национального института здоровья США, не менее 80 процентов инфекционных болезней вызываются бактериями, способными к образованию биопленки. Эфирное масло зеленого кардамона поможет дать отпор микроорганизмам с множественной лекарственной устойчивостью: уже при концентрации в 0,125 процента, что на порядок ниже смертельной для бактерий концентрации, оно эффективно подавляет формирование биопленок у грамотрицательных патогенов человека и животных», — рассказал руководитель НИЛ «Центр агробиотехнологий» ДГТУ, профессор кафедры пищевой науки государственного университета штата Нью-Джерси Михаил Чикиндас.Эффект, как объяснили ученые, достигается за счет подавления у бактерий так называемого чувства кворума — химического «языка» микроорганизмов. Чувство кворума регулирует жизнь сообщества бактерий, в частности, формируя сигнал к образованию биопленок как реакцию на условия среды обитания.Соединения, дающие Кардамону зеленому антимикробные свойства, — α-терпинилацетат, 1,8-цинеол, линалоола ацетат, сабинен и некоторые другие, сообщили ученые.
«По данным Национального института здоровья США, не менее 80 процентов инфекционных болезней вызываются бактериями, способными к образованию биопленки. Эфирное масло зеленого кардамона поможет дать отпор микроорганизмам с множественной лекарственной устойчивостью: уже при концентрации в 0,125 процента, что на порядок ниже смертельной для бактерий концентрации, оно эффективно подавляет формирование биопленок у грамотрицательных патогенов человека и животных», — рассказал руководитель НИЛ «Центр агробиотехнологий» ДГТУ, профессор кафедры пищевой науки государственного университета штата Нью-Джерси Михаил Чикиндас.Эффект, как объяснили ученые, достигается за счет подавления у бактерий так называемого чувства кворума — химического «языка» микроорганизмов. Чувство кворума регулирует жизнь сообщества бактерий, в частности, формируя сигнал к образованию биопленок как реакцию на условия среды обитания.Соединения, дающие Кардамону зеленому антимикробные свойства, — α-терпинилацетат, 1,8-цинеол, линалоола ацетат, сабинен и некоторые другие, сообщили ученые. Кардамон применяется в пищевой промышленности как функциональная добавка, безопасный усилитель вкуса и консервант. Также экстракт этого растения обладает антиоксидантными свойствами, что повышает его ценность в качестве добавки к пище.Ученые уверены, что кардамон может быть использован при разработке новых органических препаратов для борьбы с микробами с множественной лекарственной устойчивостью. Соединения, полученные из кардамона зеленого, могут также стать альтернативой химическим консервантам и помочь в разработке продуктов с увеличенным сроком хранения, считают авторы исследования.Исследование проводилось в сотрудничестве со специалистами из Китая, США, Пакистана и Ирака.
Кардамон применяется в пищевой промышленности как функциональная добавка, безопасный усилитель вкуса и консервант. Также экстракт этого растения обладает антиоксидантными свойствами, что повышает его ценность в качестве добавки к пище.Ученые уверены, что кардамон может быть использован при разработке новых органических препаратов для борьбы с микробами с множественной лекарственной устойчивостью. Соединения, полученные из кардамона зеленого, могут также стать альтернативой химическим консервантам и помочь в разработке продуктов с увеличенным сроком хранения, считают авторы исследования.Исследование проводилось в сотрудничестве со специалистами из Китая, США, Пакистана и Ирака.
https://ria.ru/20200923/tyumgu-1577597692.html
https://ria.ru/20201211/mifi-1588368048.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/07e5/05/19/1733848539_171:0:2902:2048_1920x0_80_0_0_5a9b1b712904dd4d698208a993798225.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
донской государственный технический университет, навигатор абитуриента, университетская наука
МОСКВА, 26 мая — РИА Новости.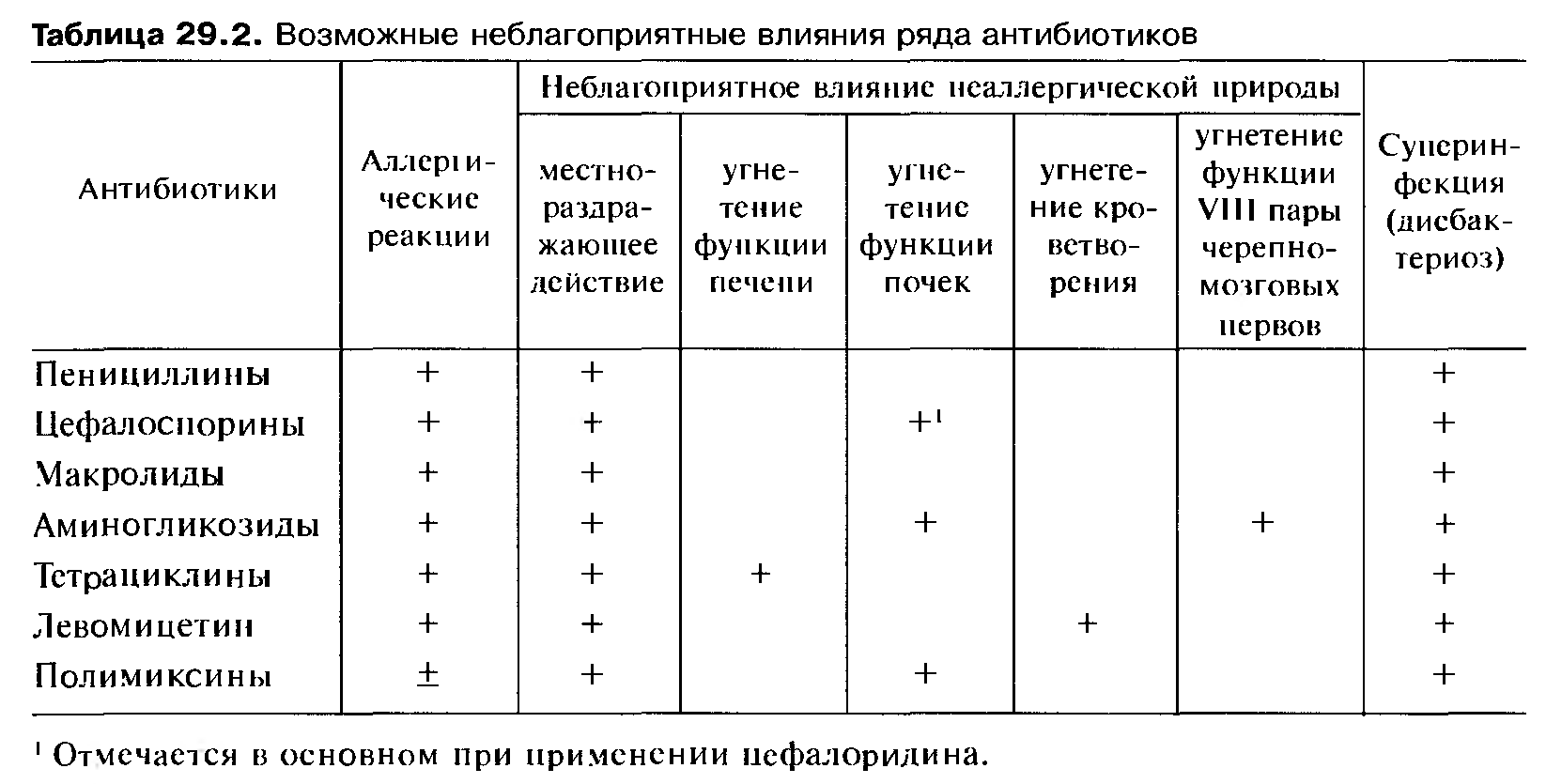 Натуральное вещество, легко устраняющее одну из главных причин устойчивости микробов к антибиотикам, исследовали ученые Донского государственного технического университета (ДГТУ) в составе международного коллектива. По словам авторов, биоактивные соединения кардамона зеленого (Elettaria cardamomum) препятствуют формированию биопленок, благодаря чему будут полезны при создании новых антимикробных препаратов. Результаты опубликованы в журнале Frontiers in Microbiology.
Натуральное вещество, легко устраняющее одну из главных причин устойчивости микробов к антибиотикам, исследовали ученые Донского государственного технического университета (ДГТУ) в составе международного коллектива. По словам авторов, биоактивные соединения кардамона зеленого (Elettaria cardamomum) препятствуют формированию биопленок, благодаря чему будут полезны при создании новых антимикробных препаратов. Результаты опубликованы в журнале Frontiers in Microbiology.Бактериальная биопленка — многослойная структура, формируемая микробным сообществом для защиты от агрессивной среды, а также от действия лекарств. «Щитом» для бактерий служит слой полимеров, встроенных в клеточный матрикс. Они обеспечивают устойчивость микроорганизмов как к антибиотикам, так и к действию иммунной системы человека.
Бактерии сегодня становятся все более устойчивыми к часто употребляемым антибиотикам, и способность к образованию биопленок, по словам ученых, играет в этом процессе важную роль. Поиск новых препаратов, способных бороться даже с устойчивыми штаммами микробов без риска для организма в целом, — это ключевое направление фармакологии, уверены ученые.
Поиск новых препаратов, способных бороться даже с устойчивыми штаммами микробов без риска для организма в целом, — это ключевое направление фармакологии, уверены ученые.
Новое исследование специалистов ДГТУ показало, что эфирные масла кардамона зеленого (Elettaria cardamomum) — отличное средство борьбы с биопленками. Ученые выявили высокий потенциал биоактивных соединений на основе этого растения в борьбе с целым рядом бактериальных патогенов, среди которых кишечная палочка, стрептококк, сальмонелла и другие.
«По данным Национального института здоровья США, не менее 80 процентов инфекционных болезней вызываются бактериями, способными к образованию биопленки. Эфирное масло зеленого кардамона поможет дать отпор микроорганизмам с множественной лекарственной устойчивостью: уже при концентрации в 0,125 процента, что на порядок ниже смертельной для бактерий концентрации, оно эффективно подавляет формирование биопленок у грамотрицательных патогенов человека и животных», — рассказал руководитель НИЛ «Центр агробиотехнологий» ДГТУ, профессор кафедры пищевой науки государственного университета штата Нью-Джерси Михаил Чикиндас.
Эффект, как объяснили ученые, достигается за счет подавления у бактерий так называемого чувства кворума — химического «языка» микроорганизмов. Чувство кворума регулирует жизнь сообщества бактерий, в частности, формируя сигнал к образованию биопленок как реакцию на условия среды обитания.
Соединения, дающие Кардамону зеленому антимикробные свойства, — α-терпинилацетат, 1,8-цинеол, линалоола ацетат, сабинен и некоторые другие, сообщили ученые. Кардамон применяется в пищевой промышленности как функциональная добавка, безопасный усилитель вкуса и консервант. Также экстракт этого растения обладает антиоксидантными свойствами, что повышает его ценность в качестве добавки к пище.
Ученые уверены, что кардамон может быть использован при разработке новых органических препаратов для борьбы с микробами с множественной лекарственной устойчивостью. Соединения, полученные из кардамона зеленого, могут также стать альтернативой химическим консервантам и помочь в разработке продуктов с увеличенным сроком хранения, считают авторы исследования.
Исследование проводилось в сотрудничестве со специалистами из Китая, США, Пакистана и Ирака.
11 декабря 2020, 09:00НаукаСвет, убивающий бактерии. Альтернативу антибиотикам создают в РоссииЗдоровье: Наука и техника: Lenta.ru
Немецкие исследователи проанализировали эффект от 144 антибиотиков на наиболее распространенных в человеческом кишечнике микробах. Статья ученых опубликована в журнале Nature.
Потребление антибиотиков наносит серьезный вред микробиоте кишечника — сообществу микробов и вирусов, помогающих переваривать пищу и бороться с патогенными бактериями. Антибиотикотерапия может нарушить баланс в составе микробиоты и привести к дисбиозу, долгосрочным последствием которого могут стать астма, пищевые аллергии и ожирение. Однако изучение вреда антибиотиков для микробов кишечника до сих пор не было систематичным.
Ученые из Европейской молекулярно-биологической лаборатории оценили, как 144 различных антибиотика влияют на рост и выживание 27 бактериальных штаммов, обитающих в кишечнике. Исследователи определили концентрации, при которых тот или иной антибиотик будет влиять на тот или иной микроб для более чем 800 сочетаний «антибиотик-штаммов». Ученые выяснили, что тетрациклины и макролиды — две наиболее распространенные группы антибиотиков — не только останавливали рост бактерий, но и вызывали их смерть. Их воздействия не пережило более половины бактериальных штаммов.
Исследователи определили концентрации, при которых тот или иной антибиотик будет влиять на тот или иной микроб для более чем 800 сочетаний «антибиотик-штаммов». Ученые выяснили, что тетрациклины и макролиды — две наиболее распространенные группы антибиотиков — не только останавливали рост бактерий, но и вызывали их смерть. Их воздействия не пережило более половины бактериальных штаммов.
«Мы изучили, сможет ли второй препарат нивелировать вредные эффекты от антибиотиков для кишечных микробов, позволяя первым в то же время сохранять свою активность против патогенов», — рассказал руководитель научной группы Анастасиос Типас. Исследователи изучили сочетания эритромицина и доксициклина — одних из наиболее широко используемых антибиотиков — с более чем 1200 лекарствами. Ученым удалось обнаружить несколько препаратов с необходимыми свойствами.
В ходе экспериментов исследователи показали, что этот подход может работать на практике — комбинация эритромицина с лекарством-антидотом сократила потерю распространенных кишечных бактерий у мышей.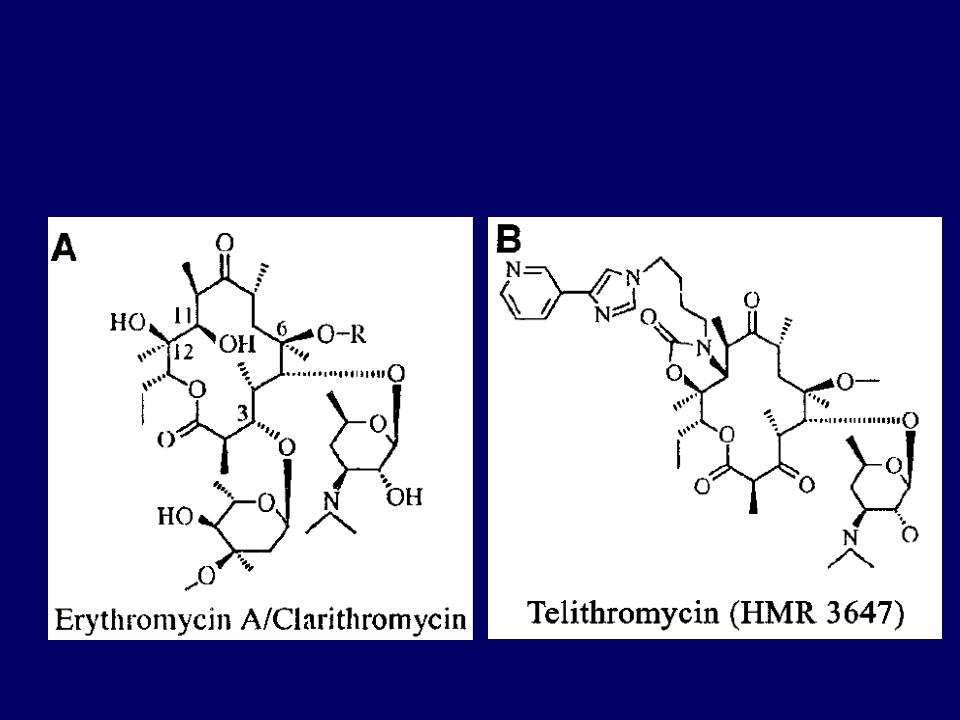 В то же время, признают ученые, им предстоит еще много работы по выявлению оптимальных комбинаций и дозировок таких сочетаний, равно как и по выявлению долгосрочных эффектов от их применения.
В то же время, признают ученые, им предстоит еще много работы по выявлению оптимальных комбинаций и дозировок таких сочетаний, равно как и по выявлению долгосрочных эффектов от их применения.
Комитет по охране здоровья поддержал законопроект о контроле за назначением антибиотиков ветеринарами
«На заседании Комитета по охране здоровья поддержали этот законопроект. Считаю, что он станет важным шагом сторону сохранения здоровья наших граждан», — сказал Дмитрий Хубезов Хубезов
Дмитрий Анатольевич
Депутат Государственной Думы избран по избирательному округу № 157 (Скопинский – Рязанская область)
.
Он пояснил, что врачи все чаще наблюдают случаи выявления устойчивых к действию антибиотиков микроорганизмов.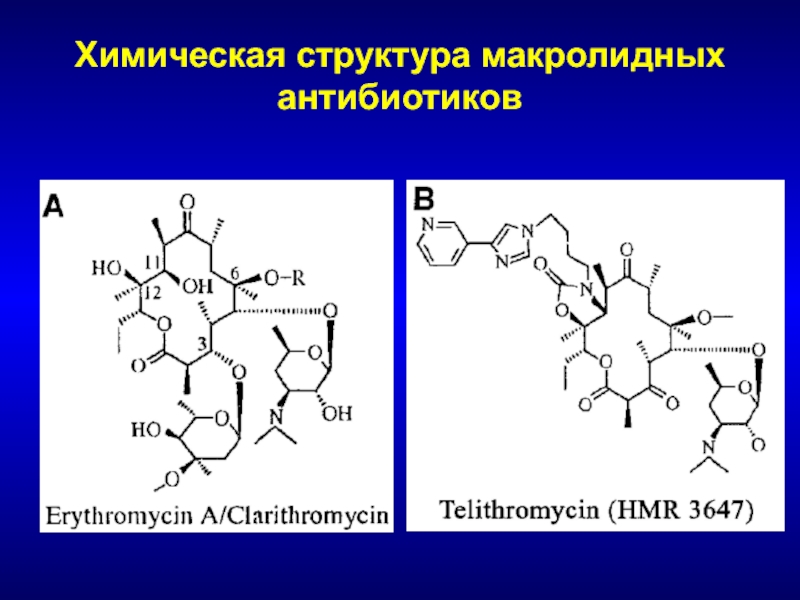
«В таких случаях мы говорим о резистентности, то есть, устойчивости организма к этим лекарствам. Одной из причин резистентности можно рассматривать употребление мяса или молока от животных, которым добавляли в корм антибиотики», — рассказал Председатель Комитета.
По его словам, комбикорм с антибиотиками дают свиньям, коровам, лошадям и курам, чтобы улучшить их здоровье, а в итоге получается сельхозпродукция, которая может быть вредна для людей.
«Разработка новых антибиотиков превратилась в гонку: успеть выпустить лекарство, к которому еще не приспособились микробы. Эта проблема актуальна не только в нашей стране. Во всем мире врачи сталкиваются с микроорганизмами, которые устойчивы ко всем известным видам антибиотиков», — сказал Дмитрий Хубезов.
«Именно поэтому считаю очень важным внести изменения в Закон Российской Федерации «О ветеринарии» и в статьи 4 и 13 Федерального закона «Об обращении лекарственных средств» (в части обеспечения контроля за назначением и применением лекарственных препаратов для ветеринарного применения). Изменения помогут упорядочить назначения антибиотиков ветеринарами», — добавил депутат.
Изменения помогут упорядочить назначения антибиотиков ветеринарами», — добавил депутат.
✅ Применение препарата Амоксициллин Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности Описание активных компонентов препарата Амоксициллин (Amoxicillin)  Дата обновления: 2021.04.12 Владелец регистрационного удостоверения:Лекарственная форма
Форма выпуска, упаковка и состав препарата АмоксициллинГранулы для приготовления суспензии для приема внутрь в виде гранулированного порошка от белого до белого с желтоватым оттенком цвета; при добавлении воды образуется суспензия желтоватого цвета с характерным фруктовым запахом.
Вспомогательные вещества: натрия сахарината дигидрат — 3.25 мг, симетикон S184 — 7.75 мг, камедь гуаровая — 21 мг, натрия бензоат — 25 мг, натрия цитрата дигидрат — 27 мг, сахароза — 1642.5 мг, ароматизатор страстоцвета съедобного — 1.75 мг, ароматизатор малиновый — 5 мг, ароматизатор клубничный — 16.75 мг. 40 г (для приготовления 100 мл суспензии) — флаконы темного стекла (1) в комплекте с мерной ложкой объемом 5 мл и с риской для объема 2.5 мл — пачки картонные. Фармакологическое действиеАнтибиотик группы полусинтетических пенициллинов широкого спектра действия. Представляет собой 4-гидроксильный аналог ампициллина. Оказывает бактерицидное действие. Активен в отношении аэробных грамположительных бактерий: Staphylococcus spp. К амоксициллину устойчивы микроорганизмы, продуцирующие пенициллиназу. В комбинации с метронидазолом проявляет активность в отношении Helicobacter pylori. Полагают, что амоксициллин ингибирует развитие резистентности Helicobacter pylori к метронидазолу. Между амоксициллином и ампициллином существует перекрестная резистентность. Спектр антибактериального действия расширяется при одновременном применении амоксициллина и ингибитора бета-лактамаз клавулановой кислоты. В этой комбинации повышается активность амоксициллина в отношении Bacteroides spp., Legionella spp., Nocardia spp., Pseudomonas (Burkholderia) pseudomallei. Однако Pseudomonas aeruginosa, Serratia marcescens и множество других грамотрицательных бактерий остаются резистентными. ФармакокинетикаПри приеме внутрь амоксициллин быстро и полностью абсорбируется из ЖКТ, не разрушается в кислой среде желудка. Связывание амоксициллина с белками плазмы составляет около 20%. Широко распределяется в тканях и жидкостях организма. Сообщается о высоких концентрациях амоксициллина в печени. T1/2 из плазмы составляет 1-1.5 ч. Около 60% дозы, принятой внутрь, выводится в неизмененном виде с мочой путем клубочковой фильтрации и канальцевой секреции; при дозе 250 мг концентрация амоксициллина в моче составляет более 300 мкг/мл. Некоторое количество амоксициллина определяется в кале. У новорожденных и лиц пожилого возраста T1/2 может быть более длительным. При почечной недостаточности T1/2 может составлять 7-20 ч. В небольших количествах амоксициллин проникает через ГЭБ при воспалении мягкой мозговой оболочки. Амоксициллин удаляется путем гемодиализа. Показания активных веществ препарата АмоксициллинДля применения в виде монотерапии и в комбинации с клавулановой кислотой: инфекционно-воспалительные заболевания, вызванные чувствительными микроорганизмами, в т.ч. бронхит, пневмония, ангина, пиелонефрит, уретрит, инфекции ЖКТ, гинекологические инфекции, инфекционные заболевания кожи и мягких тканей, листериоз, лептоспироз, гонорея. Для применения в комбинации с метронидазолом: хронический гастрит в фазе обострения, язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения, ассоциированные с Helicobacter pylori. Открыть список кодов МКБ-10
Режим дозированияСпособ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования. Индивидуальный. Для приема внутрь разовая доза для взрослых и детей старше 10 лет (с массой тела более 40 кг) составляет 250-500 мг, при тяжелом течении заболевания — до 1 г. При лечении острой неосложненной гонореи — 3 г однократно (в комбинации с пробенецидом). У пациентов с нарушением функции почек при КК 10-40 мл/мин интервал между приемами следует увеличить до 12 ч; при КК меньше 10 мл/мин интервал между приемами должен составлять 24 ч. При парентеральном применении взрослым в/м — по 1 г 2 раза/сут, в/в (при нормальной функции почек) — 2-12 г/сут. Детям в/м — 50 мг/кг/сут, разовая доза — 500 мг, частота введения — 2 раза/сут; в/в — 100-200 мг/кг/сут. Пациентам с нарушением функции почек, дозу и интервал между введениями необходимо корректировать в соответствии со значениями КК. Побочное действиеАллергические реакции: крапивница, эритема, отек Квинке, ринит, конъюнктивит; редко — лихорадка, боли в суставах, эозинофилия; в единичных случаях — анафилактический шок. Эффекты, связанные с химиотерапевтическим действием: возможно развитие суперинфекций (особенно у пациентов с хроническими заболеваниями или пониженной резистентностью организма). При длительном применении в высоких дозах: головокружение, атаксия, спутанность сознания, депрессия, периферические невропатии, судороги. Преимущественно при применении в комбинации с метронидазолом: тошнота, рвота, анорексия, диарея, запор, боли в эпигастрии, глоссит, стоматит; редко — гепатит, псевдомембранозный колит, аллергические реакции (крапивница, ангионевротический отек), интерстициальный нефрит, нарушения гемопоэза. Преимущественно при применении в комбинации с клавулановой кислотой: холестатическая желтуха, гепатит; редко — многоформная эритема, токсический эпидермальный некролиз, эксфолиативный дерматит. Противопоказания к применениюИнфекционный мононуклеоз, лимфолейкоз, тяжелые инфекции ЖКТ, сопровождающиеся диареей или рвотой, респираторные вирусные инфекции, аллергический диатез, бронхиальная астма, сенная лихорадка, повышенная чувствительность к пенициллинам и/или цефалоспоринам. Для применения в комбинации с метронидазолом: заболевания нервной системы; нарушения кроветворения, лимфолейкоз, инфекционный мононуклеоз; повышенная чувствительность к производным нитроимидазола. Для применения в комбинации с клавулановой кислотой: указания в анамнезе на нарушения функции печени и желтуху, связанные с приемом амоксициллина в комбинации с клавулановой кислотой. Применение при беременности и кормлении грудьюАмоксициллин проникает через плацентарный барьер, в небольших количествах выделяется с грудным молоком. При необходимости применения амоксициллина при беременности следует тщательно взвесить ожидаемую пользу терапии для матери и потенциальный риск для плода. С осторожностью применять амоксициллин в период лактации (грудного вскармливания). Применение при нарушениях функции печени Амоксициллин в комбинации с метронидазолом не следует применять при заболеваниях печени. Применение при нарушениях функции почекПациентам с нарушением функции почек, дозу и интервал между введениями необходимо корректировать в соответствии со значениями КК. Применение у детейПрименение у детей возможно согласно режиму дозирования. Амоксициллин в комбинации с метронидазолом не рекомендуют применять у пациентов моложе 18 лет. Особые указанияС осторожностью применяют у пациентов, склонных к аллергическим реакциям. Амоксициллин в комбинации с метронидазолом не рекомендуют применять у пациентов моложе 18 лет; не следует применять при заболеваниях печени. На фоне комбинированной терапии с метронидазолом не рекомендуется употреблять алкоголь. Лекарственное взаимодействиеАмоксицилин может уменьшать эффективность контрацептивов для приема внутрь. При одновременном применении амоксициллина с бактерицидными антибиотиками (в т.ч. аминогликозидами, цефалоспоринами, циклосерином, ванкомицином, рифампицином) проявляется синергизм; с бактериостатическими антибиотиками (в т.ч. макролидами, хлорамфениколом, линкозамидами, тетрациклинами, сульфаниламидами) — антагонизм. Амоксициллин усиливает действие непрямых антикоагулянтов подавляя кишечную микрофлору, снижает синтез витамина К и протромбиновый индекс. Амоксициллин уменьшает действие лекарственных средств, в процессе метаболизма которых образуется ПАБК. Пробенецид, диуретики, аллопуринол, фенилбутазон, НПВС уменьшают канальцевую секрецию амоксициллина, что может сопровождаться увеличением его концентрации в плазме крови. Антациды, глюкозамин, слабительные средства, аминогликозиды замедляют и уменьшают, а аскорбиновая кислота повышает абсорбцию амоксициллина. При комбинированном применении амоксициллина и клавулановой кислоты фармакокинетика обоих компонентов не меняется. Сохраните у себя Поделиться с друзьями Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности |
Российские химики очистят сточные воды от антибиотиков
Сегодня в животноводстве широко применяются антибиотики тетрациклинового ряда. Они неизбежно попадают в окружающую среду вместе с продуктами жизнедеятельности животных. Присутствие в воде антибиотиков в различной, порой высокой концентрации приводит к размножению опасных бактерий.
Сорбент, созданный российскими химиками, ускорит и удешевит процесс очистки сточных вод. Это поможет снизить число устойчивых к антибиотикам супербактерий в почве и воде.
Разработка учёных экологически безопасна. В качестве основы для сорбента был взят биоразлагаемый материал гидроксиапатит. Также благодаря новой методике время синтеза этого материала значительно сократилось.
Чтобы этот материал мог сорбировать (поглощать) антибиотики в больших количествах, химики прикрепили к поверхности наночастиц гидроксиапатита молекулы модификаторов.
Эти модификаторы могут не только захватить больше молекул загрязняющих веществ, но и «отпустить» их при определённых условиях. Эта особенность позволяет позднее вернуть сорбент в работу в первоначальной форме.
Кроме того, такой механизм позволяет выделять антибиотики в высоких концентрациях, что облегчает их идентификацию в сточных водах.
Также новый метод синтеза и модификации наночастиц сорбента, основанный на компьютерном моделировании, позволяет учёным уменьшать затраты на исследования и сокращать химические отходы лаборатории.
Исследование, поддержанное грантом Российского научного фонда, было опубликовано в научном издании Journal of Hazardous Materials.
К слову, ранее мы рассказывали о том, что благотворной средой для возникновения супербактерий является микропластик. Также мы писали о разработке учёных из МГУ: сорбенте, который позволяет с высокой точность определять состав напитков.
Школьники «Сириуса» обнаружат антибиотики в продуктах питания
Новые наноматериалы для экспресс-анализа, разрабатываемые в Образовательном центре, помогут быстро определять, есть ли в составе продуктов токсичные вещества, в первую очередь антибиотики тетрациклинового ряда. Над проектом работают юные исследователи в рамках направления «Нанотехнологии» программы «Большие вызовы», которое реализуется при поддержке Фонда инфраструктурных и образовательных программ (Группа РОСНАНО).
Экспресс-тест будет доступен и прост в обращении. Для проверки качества продуктов достаточно загрузить в мобильный телефон специальное приложение, установить гаджет над тест-полоской с покрытием из специального композиционного наноматериала и капнуть на нее образец продукта, например, молока. Уже через несколько минут система подтвердит или опровергнет ваши сомнения о наличии в составе антибиотиков.
«Некоторые производители добавляют в продукты антибиотики тетрациклинового ряда для увеличения срока годности, – поясняет участница проекта, одиннадцатиклассница Александра Андриянцева. – Но чем чаще человек потребляет антибиотики, тем устойчивее к ним становятся бактерии в его организме. Поэтому сегодня так строго регламентируется их продажа. Наш тест создан из недорогих реагентов, поэтому он будет доступен широкой общественности в отличие от существующих аналогов. Любой человек сможет проверить качество продуктов и выбрать безопасный».
Над проектом работают школьники из Липецкой, Московской, Орловской и Воронежской областей. Ребята – финалисты Всероссийского конкурса научно-технологических проектов «Большие вызовы». Перед очной программой юные исследователи сначала прошли дистанционный образовательный курс на платформе «Сириус.Курсы», где вместе с экспертами и кураторами изучили теоретическую часть и приступили к работе над своим проектом. После чего приехали в «Сириус» на интенсивную десятидневную оффлайн-сессию. В современных научных лабораториях школьники смогли проверить свои гипотезы и расчеты. Экспериментальную модель оптических систем участники проекта напечатали на 3D-принтере.
«Именно здесь, в «Сириусе», школьники погружены в настоящую проектную работу по разработке инновационной продукции от идеи до действующего прототипа. Это исследовательская работа серьезного университетского уровня. И наши участники смогут опубликовать ее результаты в российских и международных научных журналах», – рассказывает руководитель проекта, доцент Института естественных наук и биотехнологии Орловского государственного университета имени И.С. Тургенева Евгений Грибанов.
Кроме сенсорных оптических систем школьники разрабатывают эффективные катализаторы для ликвидации последствий техногенных катастроф. В частности, юные исследователи создают материал, который позволит трансформировать под воздействием естественного солнечного света нефтепродукты в более безопасные соединения. Технологическим партнером этого исследования выступил зеленоградский «Завод Протон», ведущий российский производитель микроэлектронной аппаратуры, средств вычислительной техники и систем управления.
антибиотиков | DermNet NZ
Автор: Ванесса Нган, штатный писатель. 2005.
Что такое антибиотики?
Антибиотики — это химические соединения, используемые для уничтожения или подавления роста бактерий. Строго говоря, антибиотики — это подгруппа органических противоинфекционных агентов, полученных из бактерий или плесени, которые токсичны для других бактерий. Однако сейчас термин «антибиотик» используется в широком смысле, включая противоинфекционные средства, полученные из синтетических и полусинтетических соединений.
Термин «антибиотик» может использоваться взаимозаменяемо с термином «антибактериальный». Однако неправильно использовать термин «антибиотик» в отношении противовирусных, противопротозойных и противогрибковых средств.
История антибиотиков
Пенициллин был первым антибиотиком, успешно использовавшимся при лечении бактериальных инфекций. Сэр Александр Флеминг впервые открыл его в 1928 году, но его потенциал для лечения инфекций не был признан до тех пор, пока более десяти лет спустя Эрнст Би Чейн, сэр Ховард Флори и Норман Хитли произвели достаточно очищенного пенициллина для лечения пациентов.К 1950-м годам было обнаружено и произведено большое количество антибиотиков для лечения заболеваний, вызванных инфекционными бактериями. За последние 50 лет антибиотики изменили стереотипы болезней и смерти.
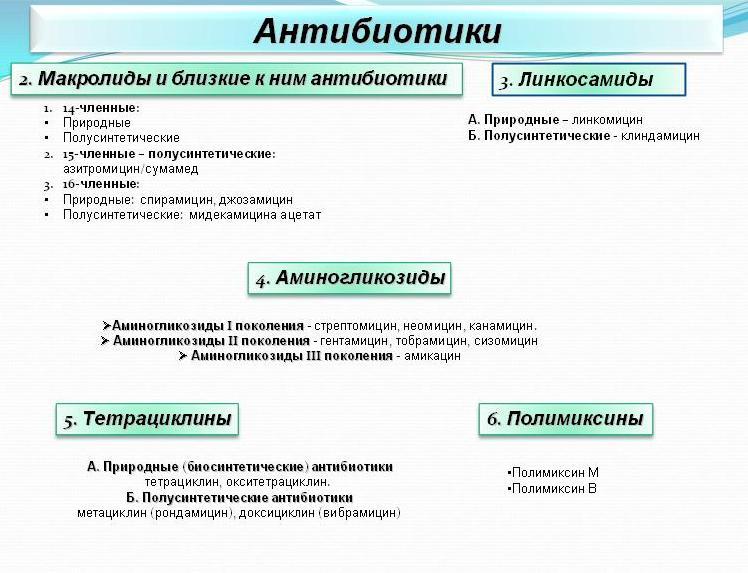
Классификация антибиотиков
Антибиотики можно классифицировать несколькими способами. Наиболее распространенный метод классифицирует их в соответствии с их химической структурой, поскольку антибиотики с одинаковой или схожей химической структурой обычно демонстрируют аналогичные образцы антибактериальной активности, эффективности, токсичности и аллергического потенциала.
B-лактамные антибиотики подавляют синтез клеточной стенки бактерий. К ним относятся:
Пенициллины
- Пенициллин G
- Амоксициллин
- Флуклоксациллин
Цефалоспорины
- Цефокситин
- Цефотаксим
- Цефтриаксон
Карбапенем
Макролиды подавляют синтез бактериального белка.
Тетрациклины подавляют синтез бактериального белка.
- Тетрациклин
- Миноциклин
- Доксициклин
- Лаймециклин
Фторхинолоны подавляют синтез бактериальной ДНК.
- Норфлоксацин
- Ципрофлоксацин
- Эноксацин
- Офлоксацин
Сульфаниламиды блокируют метаболизм бактериальных клеток, ингибируя ферменты.
- Триметоприм + сульфаметоксазол
Аминогликозиды подавляют синтез бактериального белка.
Имидазольные антибиотики подавляют синтез бактериальной ДНК.
Пептиды подавляют синтез клеточной стенки бактерий.
Линкозамиды подавляют синтез бактериального белка.
Следующие препараты подавляют синтез бактериального белка.
Использование антибиотиков
Антибиотики действуют только против инфекций, вызванных бактериями. Бактериальные инфекции встречаются гораздо реже, чем вирусные. Большинство видов кашля и простуды имеют вирусное происхождение, поэтому антибиотики при них не назначаются. Антибиотики следует использовать только в случае крайней необходимости, потому что:
- Растет устойчивость бактерий к лечению
- Устойчивые бактерии отбираются с помощью антибиотиков
- У некоторых людей антибиотики могут вызывать серьезные побочные эффекты
К некоторым распространенным бактериальным инфекциям, требующим антибактериальной терапии, относятся:
Если эти инфекции не лечить, возникшее в результате заболевание может быть серьезным и даже смертельным.
При тяжелых бактериальных инфекциях, когда пациенты могут быть госпитализированы, часто для начала лечения назначают внутривенный антибиотик широкого спектра действия (тот, который активен против многих различных бактерий). Как только лабораторные исследования подтвердят наличие инфекционных бактерий, следует заменить антибиотик на тот, который активен против определенных бактерий. После 48 часов внутривенного лечения, если есть клиническое улучшение, пациента можно переключить на пероральную форму антибиотика.
Устойчивость к антибиотикам
Чрезмерное и ненадлежащее использование антибиотиков привело к устойчивости к антибиотикам.Бактерии, которые когда-то были восприимчивы к антибиотикам, разработали способы выжить с помощью лекарств, которые должны были убить или ослабить их. Это также известно как устойчивость к антибактериальным препаратам или лекарствам. Некоторые болезни, такие как туберкулез, гонорея и детские бактериальные инфекции уха, которые когда-то легко лечились антибиотиками, теперь снова становятся трудными для лечения, поскольку бактерии стали устойчивыми к этим лекарствам. Около 70% бактерий, вызывающих инфекции в больницах, устойчивы по крайней мере к одному из антибиотиков, наиболее часто используемых для лечения инфекций.Метициллин (метициллин) устойчивый Staphylococcus aureus (MRSA) представляет собой особую проблему для пациентов с кожными заболеваниями, язвами и хирургическими ранами.
Ответственность врача
- Назначать антибиотики только при наличии бактериальной инфекции
- Назначьте утвержденную дозу и продолжительность или в соответствии с рекомендациями экспертов
- Объясните пациенту важность завершения курса антибиотиков в соответствии с инструкциями
Ответственность за пациента
- Помните, что не все инфекции являются бактериальными и что не все бактериальные инфекции излечиваются с помощью антибиотиков (например, фолликулит)
- Принимайте антибиотики точно в соответствии с инструкциями (т. Е. С едой или без и т. Д.).
- Обязательно закончите курс антибиотиков
Побочные эффекты антибиотиков
Антибиотики связаны со многими побочными эффектами, включая кожные побочные реакции.Некоторые побочные эффекты связаны с классом, но большинство реакций специфичны для данного агента.
Некоторые общие проблемы с антибиотиками перечислены ниже:
- Аллергия на определенные антибиотики или классы антибиотиков (например, аллергия на пенициллин)
- Многие антибиотики вызывают проблемы с желудочно-кишечным трактом (например, диарею, рвоту, тошноту)
- Антибиотики убивают не только свои мишени, но и другие полезные микроорганизмы, которые живут в нашем теле и на нем (флора), чтобы предотвратить другие заболевания (например, молочницу полости рта и / или влагалища)
- Могут возникать различные кожные высыпания, которые могут быть легкими (например, крапивница) или разрушительными (например, токсический эпидермальный некролиз).
Таблицы данных, утвержденные Новой Зеландией, являются официальным источником информации об этих рецептурных лекарствах, включая информацию об одобренных применениях и рисках. Ознакомьтесь с индивидуальным техническим описанием Новой Зеландии на веб-сайте Medsafe.
Изобилие антибиотиков, генов устойчивости к антибиотикам и состав бактериального сообщества в сточных водах из различных больниц Румынии
Устойчивость к противомикробным препаратам представляет собой растущую и значительную угрозу общественному здоровью, которая требует глобальных ответных мер для разработки эффективных стратегий и смягчения возникновения и распространения этого явления в клинических условиях и в условиях окружающей среды.Поэтому мы исследовали наличие и распространенность нескольких антибиотиков и генов устойчивости к антибиотикам (ARG), а также состав бактериального сообщества в сточных водах из различных больниц, расположенных в округе Клуж, Румыния. Концентрации антибиотиков варьировались от 3,67 до 53,05 мкг / л -1 , а наиболее распространенными классами антибиотиков были β-лактамы, гликопептиды и триметоприм. Среди обнаруженных ARG 14 генов придают устойчивость к β-лактамам, аминогликозидам, хлорамфениколу, антибиотикам макролид-линкозамид-стрептограмин B (MLSB), сульфонамидам и тетрациклинам.Также были обнаружены гены, кодирующие устойчивость к четвертичному аммонию и элемент, связанный с транспозоном. Гены sul I и qac EΔ1, которые придают устойчивость к сульфонамидам и четвертичному аммонию, имели самую высокую относительную распространенность со значениями в диапазоне от 5,33 × 10 -2 до 1,94 × 10 -1 и 1,94 × 10 . От −2 до 4,89 × 10 −2 копий / 16 копий гена рРНК соответственно. Доминирующими типами, обнаруженными в образцах сточных вод больниц, были Proteobacteria , Bacteroidetes , Firmicutes и Actinobacteria .Среди выбранных больниц одна из них применила процесс дезинфекции активным илом и хлором перед сбросом сточных вод в муниципальный коллектор. Эта обычная очистка сточных вод показала умеренную эффективность удаления исследуемых загрязнителей, со снижением концентраций антибиотиков на 55–81%, относительной численностью АРГ на 1–3 порядка меньше, но с небольшим увеличением количества некоторых потенциально патогенных бактерий. Учитывая это, больничные сточные воды (неочищенные или очищенные) могут способствовать распространению этих появляющихся загрязнителей в принимающей среде.Насколько нам известно, это исследование впервые количественно оценило изобилие антибиотиков и ARG в сточных водах из различных румынских больниц.
Химический состав, антимикробная и антибиотическая потенцирующая активность эфирных масел из 10 тропических лекарственных растений Маврикия
https://doi.org/10.1016/j.hermed.2016.02.002Получить права и содержаниеОсновные
- •
Эфирные масла (ЭМ) из 10 тропических лекарственных растений были экстрагированы гидродистилляцией.
- •
Восемнадцать микроорганизмов были использованы для оценки антимикробного потенциала ЭО, а также их способности усиливать действие обычных антибиотиков.
- •
ЭО проявили сильную бактерицидную, фунгицидную и усиливающую антибиотики активность.
- •
Двадцать восемь основных соединений были идентифицированы с помощью ГХ-МС, состоящих из монотерпеновых углеводородов.
- •
Исследованные ЭО могут использоваться в качестве дополнительных и альтернативных методов лечения инфекционных заболеваний.
Реферат
Инфекционные болезни и устойчивость к антибиотикам становятся все более серьезной проблемой общественного здравоохранения. Открытие и разработка новых противомикробных средств из фитотерапии для решения этой проблемы привлекли большое внимание и должны получить высокий приоритет. Это исследование было разработано для оценки антимикробных свойств эфирных масел (ЭМ), полученных из 10 распространенных лекарственных растений Маврикия. Восемнадцать микроорганизмов (изоляты бактерий и грибов) были использованы для оценки антимикробного потенциала ЭО, а также их способности усиливать действие обычных антибиотиков.Фитохимический профиль был установлен методом газовой хроматографии-масс-спектрометрии. Антибактериальную активность регистрировали с низкой минимальной ингибирующей концентрацией для 4 ЭО с использованием анализа разведения микробов. Синергетический эффект ЭО Citrus hystrix D.C., Citrus reticulate (Blanco) и Melaleuca quinquenervia S.T. Blake (Cav.) Наблюдались против Escherichia coli (ATCC 25922) и Staphylococcus epidermidis (ATCC 12228) в сочетании с гентамицином.Фунгицидные и фунгистатические эффекты ЭМ наблюдались среди всех грибов независимо от семейства, за исключением Trichophyton mentagrophytes . Было идентифицировано 28 основных соединений, которые преимущественно состоят из монотерпеновых углеводородов в дозах от 0,68 до 88,58%. Это исследование предоставило ключевую информацию об антимикробных свойствах и фитохимическом составе некоторых тропических лекарственных растений. Следовательно, ЭО, изучаемые в настоящем исследовании, могут рассматриваться как потенциальные лекарственные кандидаты, которые могут быть использованы в качестве дополнительных и альтернативных методов лечения для лечения и ведения инфекционных заболеваний.
Ключевые слова
Эфирное масло
Противомикробное
Лекарственные растения
Усиливающий антибиотик
Маврикий
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст© 2016 Elsevier GmbH. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Краткий обзор классов антибиотиков — сложные проценты
Нажмите для увеличенияКогда мы страдаем от бактериальной инфекции, посещение врачей для прописывания антибиотиков является обычным делом.Однако существует широкий спектр доступных антибиотиков, и они различаются как по применению, так и по механизму действия. Этот рисунок суммирует основные классы, а также дает краткое представление о том, как они борются с бактериальными инфекциями; мы также рассмотрим по очереди каждую из групп, а также устойчивость бактерий к каждой из них.
Сами бактерии можно разделить на два широких класса — грамположительные и грамотрицательные. Классы получили эти названия из теста Грама, который включает добавление фиолетового красителя к бактериям.Грамположительные бактерии сохраняют цвет красителя, а грамотрицательные — нет, а окрашиваются в красный или розовый цвет. Грамотрицательные бактерии более устойчивы к антителам и антибиотикам, чем грамположительные бактерии, потому что у них в значительной степени непроницаемая клеточная стенка. Бактерии, ответственные за MRSA и угри, являются примерами грамположительных бактерий, в то время как бактерии, ответственные за болезнь Лайма и пневмонию, являются примерами грамотрицательных бактерий.
Бета-лактамы
Бета-лактамы — это широкий спектр антибиотиков, первым из которых был открыт пенициллин, идентифицированный Александром Флемингом в 1928 году.Все бета-лактамные антибиотики содержат бета-лактамное кольцо; они включают пенициллины, такие как амоксициллин, и цефалоспорины. Они действуют, препятствуя синтезу пептидогликана, важного компонента клеточной стенки бактерий, и в основном используются против грамположительных бактерий. Однако бактерии могут развить устойчивость к бета-лактамам несколькими путями, включая производство ферментов, расщепляющих бета-лактамное кольцо. В NHS пенициллины — это наиболее часто назначаемые антибиотики, причем амоксициллин является наиболее распространенным в этом классе.
Сульфаниламиды
Пронтозил, сульфонамид, был первым коммерчески доступным антибиотиком, разработанным в 1932 году. Впоследствии было разработано значительное количество сульфонамидных антибиотиков, определяемых как антибиотики широкого спектра действия, способные действовать как на грамположительные, так и на грамотрицательные бактерии. В отличие от бета-лактамов, они действуют не путем прямого уничтожения бактерий, а путем подавления бактериального синтеза фолиевой кислоты витамина B, тем самым предотвращая рост и размножение бактерий.В настоящее время сульфаниламиды используются редко, частично из-за развития резистентности бактерий, но также из-за опасений по поводу нежелательных эффектов, таких как гепатотоксичность.
Аминогликозиды
Аминогликозиды подавляют синтез белков в бактериях, что в конечном итоге приводит к гибели клеток. Они эффективны только против определенных грамотрицательных бактерий, а также некоторых грамположительных бактерий, но не всасываются во время пищеварения, поэтому их нужно вводить инъекционно. Стрептомицин был первым эффективным лекарством при лечении туберкулеза; однако из-за проблем с токсичностью аминогликозидов их использование в настоящее время ограничено.
Тетрациклины
Тетрациклины — это антибиотики широкого спектра действия, активные в отношении как грамположительных, так и грамотрицательных бактерий. Как и сульфаниламиды, они подавляют синтез белка, подавляя рост и размножение бактерий. Их использование сокращается из-за увеличения числа случаев резистентности бактерий; тем не менее, они все еще находят применение при лечении акне, инфекций мочевыводящих и дыхательных путей, а также хламидиозов. Их следует принимать отдельно, часто за два часа до или после еды, поскольку они легко связываются с пищей, уменьшая их всасывание.
Хлорамфеникол
Другой антибиотик широкого спектра действия, хлорамфеникол, также действует, подавляя синтез белка и, следовательно, рост и размножение бактерий. Однако он также обладает бактерицидным действием против ограниченного числа бактерий. Из-за возможности серьезных токсических эффектов в развитых странах он обычно используется только в тех случаях, когда инфекции считаются опасными для жизни, хотя иногда он также используется для лечения глазных инфекций.Несмотря на это, это гораздо более распространенный антибиотик в развивающихся странах из-за его низкой стоимости и доступности, и он рекомендован Всемирной организацией здравоохранения в качестве эффективного средства первой линии для лечения менингита в странах с низким уровнем дохода.
Макролиды
Как и бета-лактамы, макролиды в основном эффективны против грамположительных бактерий; однако они действуют бактериостатически, предотвращая рост и размножение, подавляя синтез белка.Их эффективность немного шире, чем у пенициллинов, и было показано, что они эффективны против нескольких видов бактерий, к которым пенициллины не относятся. Хотя у некоторых видов бактерий развилась устойчивость к макролидам, они по-прежнему являются вторыми наиболее часто назначаемыми антибиотиками в NHS, причем эритромицин является наиболее часто назначаемым в этом классе.
Гликопептиды
Гликопептиды включают препарат ванкомицин, который обычно используется как «лекарство последней инстанции», когда другие антибиотики не помогли.Хотя раньше это была последняя линия защиты от инфекций, особенно MRSA, недавняя разработка новых антибиотиков других классов предоставила другие возможности. Тем не менее, остаются строгие правила относительно обстоятельств, при которых ванкомицин может быть использован для лечения инфекций, чтобы задержать развитие резистентности. Бактерии, против которых действуют гликопептиды, в остальном несколько ограничены, и в большинстве случаев они подавляют рост и размножение, а не непосредственно убивают бактерии.
Оксазолидиноны
Оксазолидиноны активны против грамположительных бактерий и действуют, подавляя синтез белка и, следовательно, рост и размножение. Линезолид, одобренный для использования в 2000 году, был первым продаваемым антибиотиком этого класса, хотя циклосерин использовался в качестве средства лечения туберкулеза второй линии с 1956 года. Хотя линезолид дорог, резистентность, кажется, развивается относительно медленно с момента его появления.
Ансамицины
Этот класс антибиотиков эффективен против грамположительных бактерий, а также некоторых грамотрицательных бактерий.Они подавляют производство РНК, которая играет важную биологическую роль в клетках бактерий, и, как таковая, приводит к гибели бактериальных клеток. Подкласс антибиотиков, рифамицинов, используется для лечения туберкулеза и проказы. В редких случаях ансамицины также могут проявлять противовирусную активность.
Хинолоны
Хинолоны — это бактерицидные соединения, которые препятствуют репликации и транскрипции ДНК в клетках бактерий. Это антибиотики широкого спектра действия, которые широко используются при инфекциях мочевыводящих путей, а также при других внутрибольничных инфекциях, когда подозревается резистентность к старым классам антибиотиков.Кроме того, широко распространено их использование в ветеринарных целях; использование, которое подвергалось критике в некоторых кругах за ускорение развития сопротивления. Резистентность к хинолонам может развиваться особенно быстро; в США они были наиболее часто назначаемыми антибиотиками в 2002 году, и их назначение при нерекомендуемых состояниях или вирусных инфекциях также считается значительным фактором развития резистентности.
Стрептограмины
Стрептограмины необычны тем, что их обычно вводят в виде комбинации двух антибиотиков из разных групп внутри класса: стрептограмина А и стрептограмина В.Сами по себе эти соединения проявляют только ингибирующую рост активность, но в совокупности они обладают синергетическим эффектом и способны напрямую убивать клетки бактерий, ингибируя синтез белков. Их часто используют для лечения устойчивых инфекций, хотя развилась и устойчивость к самим стрептограминам.
Липопептиды
Обнаруженные в 1987 году липопептиды являются новейшим классом антибиотиков и обладают бактерицидным действием против грамположительных бактерий.Даптомицин — наиболее часто используемый член этого класса; он обладает уникальным механизмом действия, нарушая несколько аспектов функции клеточных мембран у бактерий. Этот уникальный механизм действия также кажется преимуществом в том, что в настоящее время случаи резистентности к препарату кажутся редкими, хотя о них сообщалось. Он вводится в виде инъекций и обычно используется для лечения инфекций кожи и тканей.
Устойчивость к антибиотикам
Устойчивость бактерий к антибиотикам растет настолько, что в этом году она была в центре внимания премии Longitude Prize.Приз предлагает призовой фонд в размере 10 миллионов фунтов стерлингов на разработку дешевого и простого в использовании набора для тестирования на бактериальные инфекции в надежде, что это позволит врачам назначать правильные антибиотики в нужное время для пациентов, а также предотвратить их назначение. антибиотиков при вирусных инфекциях. Есть надежда, что обе эти меры помогут замедлить развитие устойчивости бактерий к антибиотикам.
Изображение в этой статье находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия. См. Рекомендации по использованию содержания сайта.
Ссылки и дополнительная литература
Повторное употребление антибиотиков изменяет состав полезных микробов в кишечнике | Центр новостей
Дэвид Релман
Как выяснили исследователи из Медицинской школы Стэнфордского университета, неоднократное использование антибиотика, который считается в целом безвредным, поскольку у пользователей редко возникают явные побочные эффекты, вызывает кумулятивные и стойкие изменения в составе полезных видов микробов, населяющих кишечник человека.
По самым скромным подсчетам, около 1000 различных разновидностей микробов гармонично сосуществуют в кишечнике типичного здорового человека, — сказал Дэвид Релман, доктор медицины, профессор медицины, микробиологии и иммунологии медицинского факультета и руководитель отдела инфекционных заболеваний в Ветеранах. Дела Пало-Альто Система здравоохранения. Релман — старший автор статьи, опубликованной в Интернете 13 сентября в журнале Proceedings of the National Academy of Sciences .
В исследовании изучалось действие ципрофлоксацина (торговое название Cipro), антибиотика, который широко назначают при кишечных, мочевых и различных системных инфекциях.В более раннем краткосрочном исследовании группа Релмана пришла к выводу, что кишечные микробные сообщества людей, похоже, достаточно хорошо восстанавливаются в течение нескольких недель после пятидневного режима приема ципрофлоксацина. Это новое исследование включало два курса приема антибиотиков с интервалом в шесть месяцев, и оно выявило более тонкие, долгосрочные эффекты использования ципрофлоксацина, такие как замена нескольких резидентных видов бактерий другими, близкородственными разновидностями и случайное полное искоренение бактерий. вид.
Редкое проявление легко видимых побочных эффектов, таких как вздутие живота и диарея, от использования ципрофлоксацина привело к предположению, что это лекарство избавляет от большинства полезных кишечных бактерий. Общее сходство между штаммами кишечных бактерий до введения режима и их заменами после введения режима объясняет, почему такие побочные эффекты обычно не наблюдаются после приема ципрофлоксацина. Тем не менее, более тонкие различия между ранее существовавшими сообществами и теми, которые появляются в результате этого повторяющегося нарушения, представляют собой новый набор проблем, сказал Релман, который также является Томасом К.и Джоан М. Мериган профессор медицинской школы. Вид бактерий, присутствие которых было утрачено или уменьшилось, возможно, выполняло ценную работу — например, выделяло белок, токсичный для определенного патогена, — от которого уклоняется его замена. Заброшенная функция может быть незамечена, возможно, спустя годы, когда рассматриваемый патоген не проникнет в кишечник человека.
Хотя результаты исследования не следует интерпретировать как означающие, что ципрофлоксацин опасен и его следует избегать, по словам Релмана, они поднимают вопросы о возможных долгосрочных эффектах приема антибиотиков, в дополнение к опасениям по поводу ускорения развития лекарственной устойчивости. организмы.Новые результаты подчеркивают желательность поиска способов точно определить не только, какие бактерии были потеряны или количество которых было уменьшено антибиотиком, но и какие важные полезные функции, выполняемые микробным сообществом кишечника пациента в целом, были нарушены, например, передача сигналов. клетки слизистой оболочки кишечника, которые постоянно переворачиваются, чтобы поддерживать соответствующий барьер против проглоченных токсичных соединений или секретирования противовоспалительных веществ, которые могут предотвратить аллергические или аутоиммунные заболевания.
Для этого исследования ученые из Стэнфорда собрали более 50 образцов стула у каждой из трех здоровых взрослых женщин в течение 10 месяцев. Затем они использовали передовые молекулярные методы для подсчета количества различных видов микробов, представленных в каждом образце, а также относительных размеров популяции различных видов в этом образце.
Дважды за этот 10-месячный период исследователи нарушили экосистему кишечника своих испытуемых, дав им пятидневный курс ципрофлоксацина в стандартной дозе.Во время первого курса общая бактериальная популяция у каждого субъекта — которая ранее увеличивалась и уменьшалась, но в целом была довольно стабильной — резко упала и оставалась подавленной около недели. Примерно от одной трети до половины популяции местных видов сократилось, а некоторые полностью исчезли. Число нескольких первоначально менее распространенных видов увеличилось, поскольку они заполнили экологическую нишу, оставленную насекомыми, на которые оказал отрицательный эффект препарат.
В течение недели после завершения первого курса внутренние микробные экосистемы двух из трех субъектов в значительной степени вернулись к состоянию, довольно сходному с состоянием до введения режима, если судить по широким классам, к которым принадлежали микробные составляющие.Однако общая экосистема одного субъекта все еще не восстановилась даже с помощью этого грубого измерения шесть месяцев спустя.
Второй курс приема антибиотиков дал более сильный эффект. «Даже тот субъект, у которого кишечное бактериальное сообщество полностью восстановилось после первого курса ципрофлоксацина, испытал неполное выздоровление после второго курса», — сказал Релман. Сообщества по двум другим предметам частично восстановились после второго курса, но так и не вернулись в исходное состояние.По сути, сообщество кишечных микробов каждого субъекта перешло в новое, «альтернативное» состояние и оставалось в этом состоянии не менее двух месяцев после завершения второго курса антибиотиков. Таким образом, все три субъекта испытали значительные и устойчивые изменения в конкретном составе своих внутренних микробных сообществ в конце 10-месячного периода исследования.
«Экологи обнаружили, что экосистема, такая как заповедник дикой природы, которая вполне способна восстанавливаться даже после огромных случайных потрясений — лесного пожара, извержения вулкана, вредителей, — все же может быть уничтожена слишком быстрой серией таких возмущений», — сказал он. Лес Детлефсен, доктор философии, научный сотрудник лаборатории Релмана и первый автор исследования.«Точно так же повторяющееся использование антибиотиков может иметь кумулятивный эффект на наши внутренние микробные экосистемы с потенциально изнурительными, хотя и непредсказуемыми последствиями».
«Как будто ваши полезные бактерии« помнят »плохое, что с ними делали в прошлом, — сказал Релман. «Клинические признаки и симптомы могут появиться в последнюю очередь».
Точный подсчет микробов, обитающих в кишечнике, в этом исследовании стал возможным благодаря новой методике, впервые примененной в последние годы Релманом и другими.Старый метод — выращивание микробов в культуре — просто не работает для многих видов, и даже когда он работает, редкие виды часто вытесняются более обычными и не учитываются. Новый метод считывает короткие контрольные фрагменты ДНК, которые позволяют отличить микробы как от клеток человека, так и друг от друга. Это позволило исследователям из Стэнфорда оценить как общее количество различных разновидностей микробов, так и относительный размер популяции каждой разновидности.
Подобные методы теперь позволяют оценить, до и после введения антибиотиков, количество в кишечнике пациента микробных генов, которые, как известно, кодируют важные функции, выполняемые одним или несколькими членами кишечного сообщества пациента, сказал Релман.В будущем, если станет известно, что ключевая функция нарушена, врачи, возможно, смогут восстановить эту функцию, назначив определенные пробиотики или питательные вещества, которые будут способствовать возвращению соответствующих полезных микробов.
Исследование было поддержано Пионерской премией Национального института здравоохранения и Благотворительным фондом Дорис Дьюк. Информация о кафедрах медицины, микробиологии и иммунологии, которые также поддерживали исследование, доступна по адресу http: // медицина.stanford.edu и http://microimmuno.stanford.edu.
Влияние антибиотиков на состав микробиоты кишечника
Цель: Антибиотики вызывают изменения микробиоты кишечника. Масштабы воздействия антибиотиков на микробиоту и то, являются ли эффекты краткосрочными или сохраняются в долгосрочной перспективе, остаются неясными. В этом обзоре мы суммируем исследования, в которых изучали влияние антибиотиков на состав кишечной микробиоты человека.Методы. Был проведен систематический поиск для выявления оригинальных исследований, в которых изучали влияние системных антибиотиков на кишечную микробиоту у людей. Результаты: мы нашли 129 исследований с участием 2076 участников и 301 контрольной группы. Во многих исследованиях сообщалось об уменьшении бактериального разнообразия при лечении антибиотиками. Пенициллин оказывал незначительное влияние на кишечную микробиоту. Амоксициллин, амоксциллин / клавуланат, цефалоспорины, липополигликопептиды, макролиды, кетолиды, клиндамицин, тигециклин, хинолоны и фосфомицин увеличивают численность Enterobacteriaea, за исключением E.coli (в основном Citrobacter spp., Enterobacter spp. и Klebsiella spp.). Амоксциллин, цефалоспорины, макролиды, клиндамицин, хинолоны и сульфаниламиды снижали количество E. coli, в то время как амоксциллин / клавуланте, в отличие от других пенициллинов, увеличивал количество кишечной палочки. Амоксикллин, пиперациллин и тикарциллин, цефалоспорины (за исключением цефалоспоринов пятого поколения), карбапенемы и липогликопептиды были связаны с увеличением численности Enterococcus spp., В то время как макролиды и доксициклин снижали их количество.Пиперациллин и тикарциллин, карбапенемы, макролиды, клиндамицин и хинолоны сильно снижали численность анаэробных бактерий. В исследованиях, посвященных настойчивости, наибольшая продолжительность изменений наблюдалась после лечения ципрофлоксацином (один год), клиндамицином (два года) и кларитромицином плюс метронидазол (четыре года). Многие антибиотики были связаны с уменьшением количества бутират- или бутират-продуцирующих бактерий. Заключение: антибиотики оказывают глубокое, а иногда и стойкое воздействие на микробиоту кишечника, характеризующееся уменьшением количества полезных комменсалов и увеличением количества потенциально вредных организмов.Понимание этих эффектов поможет адаптировать лечение антибиотиками, чтобы минимизировать этот «побочный ущерб».
Состав колистина | EPASG
Колистин производится путем ферментации и состоит из смеси не менее 30 полимиксинов, которые являются близкородственными декапептидами. Активные ингредиенты дополнительно модифицируются химическими процессами для получения лекарственного препарата колистиметат (CMS). Основные подкомпоненты колистин А и колистин В различаются по жирнокислотному и аминокислотному составу.Потенциальное влияние вариаций содержания субкомпонентов на фармакокинетику, токсичность, бактериологические и клинические исходы и развитие резистентности колистина еще предстоит выяснить (AJ Brink et al, 2013).
По сравнению с синтетическими процессами, производство путем ферментации более трудно контролировать, поэтому оно может привести к образованию более разнообразных антибиотических продуктов с более сложным и менее предсказуемым составом и примесью. В Европе только один производитель поставляет активный ингредиент колистин или фармацевтический препарат CMS.Таким образом, высокая вариабельность производителей по всему миру не является проблемой для Европы, но все же не предотвращает вариабельность от партии к партии и, следовательно, потенциальную вариабельность фармакокинетических профилей.
Европейская фармакопея, а также другие монографии по CMS не определяют пределы для различных подкомпонентов колистина. Эта проблема была представлена на недавней встрече в Прато и также признана Европейской комиссией. EMA было предложено высказать мнение о том, являются ли существующие методы контроля CMS и колистина подходящими и соответствующими современному уровню развития, или следует ли пересмотреть фармакопейные стандарты.
Во всем мире существует по крайней мере четыре коммерчески доступных парентеральных продукта CMS, которые могут различаться по своему химическому составу и, следовательно, фармакокинетическим характеристикам.
Средняя (± SD) концентрация в плазме — временные профили (а) ЦМС и (б) образованного колистина у крыс (
n = 4) после внутривенной дозы ЦМС (28,1 мг / кг) (H.He et al 2013 ):Хотя все продукты были стандартизированы микробиологически in vitro , воздействие образовавшегося колистина in vivo различается, несмотря на согласованные профили CMS.Результаты этого исследования имеют важное значение для интерпретации фармакокинетических, фармакодинамических и токсикодинамических исследований CMS, проведенных в различных частях мира (H.He et al, 2013).
.

 B., Bork, P., Wang, J., … Pedersen, O. (2018). Recovery of gut microbiota of healthy adults following antibiotic exposure. Nature Microbiology, 3(11), 1255–1265
B., Bork, P., Wang, J., … Pedersen, O. (2018). Recovery of gut microbiota of healthy adults following antibiotic exposure. Nature Microbiology, 3(11), 1255–1265 Brain, Behavior, and Immunity, 48, 186–194.
Brain, Behavior, and Immunity, 48, 186–194.
 (за исключением штаммов, продуцирующих пенициллиназу), Streptococcus spp.; аэробных грамотрицательных бактерий: Neisseria gonorrhoeae, Neisseria meningitidis, Escherichia coli, Shigella spp., Salmonella spp., Klebsiella spp.
(за исключением штаммов, продуцирующих пенициллиназу), Streptococcus spp.; аэробных грамотрицательных бактерий: Neisseria gonorrhoeae, Neisseria meningitidis, Escherichia coli, Shigella spp., Salmonella spp., Klebsiella spp. Cmax амоксициллина в плазме крови достигается через 1-2 ч. При увеличении дозы в 2 раза концентрация также увеличивается в 2 раза. В присутствии пищи в желудке не уменьшает общую абсорбцию. При в/в, в/м введении и приеме внутрь в крови достигаются сходные концентрации амоксициллина.
Cmax амоксициллина в плазме крови достигается через 1-2 ч. При увеличении дозы в 2 раза концентрация также увеличивается в 2 раза. В присутствии пищи в желудке не уменьшает общую абсорбцию. При в/в, в/м введении и приеме внутрь в крови достигаются сходные концентрации амоксициллина.
 0
0 0
0 ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки)
ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки) Для детей в возрасте 5-10 лет разовая доза составляет 250 мг; в возрасте от 2 до 5 лет — 125 мг. Интервал между приемами — 8 ч. Для детей с массой тела менее 40 кг суточная доза в зависимости от показаний и клинической ситуации может составлять 20-100 мг/кг в 2-3 приема.
Для детей в возрасте 5-10 лет разовая доза составляет 250 мг; в возрасте от 2 до 5 лет — 125 мг. Интервал между приемами — 8 ч. Для детей с массой тела менее 40 кг суточная доза в зависимости от показаний и клинической ситуации может составлять 20-100 мг/кг в 2-3 приема.