причины, симптомы, диагностика, лечение, профилактика
Представляет собой хроническое воспалительное поражение бронхов, которое сопровождается бронхиальной гиперрактивностью и обструкцией и обусловленное сочетанием признаков атопической и неатопической бронхиальной астмы.
ПричиныЗаболевание может развиваться на основе экзогенных и эндогенных факторов. Одним из самых мощных предрасполагающих факторов, способных вызывать бронхиальную астму, считается генетическая предрасположенность, основанная на повышенной выработке IgE, нарушении иннервации бронхов, наследованной предрасположенности, этнических и половых особенностей. Экзогенными факторами, инициирующими развитие заболевания, является инфекции, аллергены, переохлаждение и резкие температурные колебания. Чаще всего смешанный тип бронхиальной астмы развивается из атопической формы посредством развития инфекционной сенсибилизации.
Вызвать приступ бронхоспазма могут стресс, психоэмоциональные и физические нагрузки, острые респираторные инфекции, аллергические агенты, резкие запахи, табачный дым и аэрополлютанты. У большинства лиц, страдающих смешанной бронхиальной астмой, имеются очаги хронической инфекции и аллергические заболевания.
У большинства лиц, страдающих смешанной бронхиальной астмой, имеются очаги хронической инфекции и аллергические заболевания.
Основными патогенными причинами возникновения бронхиальной астмы являются воспалительное поражение стенок бронхов, а также бронхоспастические реакции, возникающие в ответ на различные специфические и неспецифические аллергические стимуляторы.
СимптомыКлиническая картина смешанной бронхиальной астмы похожа на инфекционно-аллергическую реакцию, которая протекает в средне-тяжелой и тяжелой форме. Такие больные жалуются на развитие приступообразного кашля и приступы удушье, экспираторную одышку, свистящие хрипы, которые слышны на расстоянии и ощущение сдавления в грудной клетке. Приступы развиваются внезапно, иногда даже в ночное время. Частота возникновения приступов зависит от тяжести течения недуга. После окончания пароксизма у больного отмечается отхождение незначительного количества густой слизистой мокроты.
Заболевание характеризуется прогрессирующим течение, возникновением частых и длительных периодов обострения, которые тяжело поддаются купированию.
У больных, страдающих смешанной бронхиальной астмой, довольно часто отмечается появление легочных осложнений, таких как пневмоторакс, эмфизема, ателектазы, сердечно-легочная недостаточность. Иногда у таких пациентов могут возникать и внелегочные патологии, усугубляющие состояние пациента, такие как легочное сердце или миокардиодистрофия.
В том случае, если развитие смешанной бронхиальной астмы отмечается у ребенка, то может вывялятся отставание в интеллектуальном либо физическом развитии, обусловленное наличием у малыша хронической гипоксии и интоксикации.
ДиагностикаДиагностирование бронхиальной астмы во время приступа не представляет затруднений. Гораздо сложнее выявить клинико-патогенетические причины недуга. Выявить причины возникновения заболевания поможет консультация аллерголога, иммунолога и пульмонолога.
Также таким больным потребуется назначение лабораторных анализов крови, мокроты, смывов с бронхов, рентгенологического и бронхологического обследований, исследование параметров функции внешнего дыхания.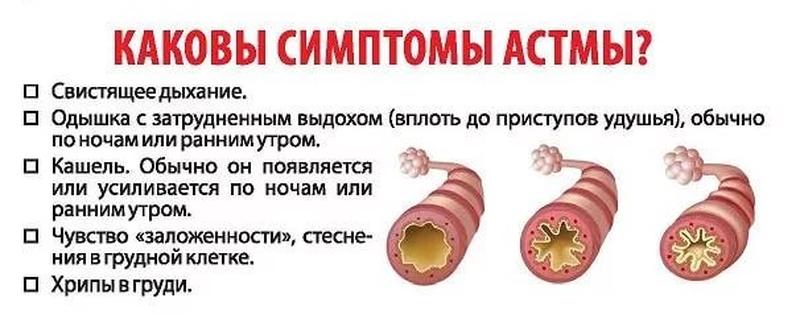
Во время сбора анамнеза особое внимание уделяют изучению аллергической настроенности, наличию у больного очагов хронической инфекции, взаимосвязи с некоторыми триггерными агентами. При аускультации у таких больных выслушиваются сухие хрипы, удлинение фазы вдоха, а также свистящие, слышимые на расстоянии хрипы.
Больному назначается проведение скарификационных и внутрикожных тестов с предполагаемыми аллергенами, определение специфического IgE в сыворотке крови.
ЛечениеЛечение смешанной бронхиальной астмы связано с некоторыми трудностями в связи с необходимостью воздействия на эндогенные и на экзогенные причины, способные вызвать данное заболевание. Таким больным в обязательной прядке назначаются мероприятия направленные на устранение предполагаемого аллергена, санацию очагов хронического воспаления, а также исключение контакта с провоцирующими обострение факторами.
Больные со смешанной бронхиальной астмы получают лечение бронходилататорами, противовоспалительными, противоастматическими, отхаркивающими, антигистаминными и другими препаратами. Базисная терапия этого заболевания основывается на назначении глюкокортикостероидов, стабилизаторов мембран тучных клеток, антагонистов рецепторов лейкотриенов.
Базисная терапия этого заболевания основывается на назначении глюкокортикостероидов, стабилизаторов мембран тучных клеток, антагонистов рецепторов лейкотриенов.
Профилактика развития смешанной бронхиальной астмы основана на устранении экзогенных влияний, повышении неспецифической резистентности к аллергенам, санации инфекционных очагов.
Роль воспаления 2 типа у пациентов с бронхиальной астмой — Новости Видаль
Астма – это хроническое воспалительное заболевание, которое сохраняется в течение всей жизни с разной степенью тяжести проявления.1-3 В среднем астма встречается у 1-18% населения мира.
Изучение механизмов развития бронхиальной астмы позволило выяснить, что развитие неконтролируемых персистирующих симптомов обусловлено особым типом воспаления, которое называют воспалением 2-го типа или Т2-воспалением (от англ. Type 2).7 В 50-70% случаев астма вызвана воспалением 2 типа5, в остальных случаях проявления обусловлены другими патогенетическими механизмами. 6
6
Большинство людей с бронхиальной астмой, вызванной воспалением 2 типа, могут быть классифицированы на такие фенотипы, как «аллергическая астма» (сопровождается высоким уровнем белка IgE в крови), «эозинофильная астма» (характеризуется высокой активностью эозинофилов) и «астма с сочетанием аллергического и эозинофильного фенотипов» (смешанная).9,10
Термин «воспаление 2-го типа» или Т2-воспаление происходит от названия двух клеток иммунной системы, которые участвуют в реализации обозначенного воспалительного ответа – T-хелперов 2-го типа (Th3) и врожденных лимфоидных клеток 2-го типа (ILC2). 7 К некоторым биологическим признакам воспаления 2-го типа относятся: повышение содержания в крови белка, который называется иммуноглобулин Е (IgE), высокая активность иммунных клеток, именуемых эозинофилами, и/или высокий уровень оксида азота в выдыхаемом воздухе [показатель называется «фракция оксида азота в выдыхаемом воздухе (FeNO)»].
Воспаление 2-го типа – это чрезмерный ответ иммунной системы на действие сигнальных белков: интерлейкина-4 (ИЛ-4) и ИЛ-13, – которые могут усиливать и вызывать как клинические проявления астмы, так и непредсказуемые и иногда угрожающие жизни обострения. 8 Цитокины ИЛ-4 и ИЛ-13 синтезируются и выделяются различными клетками иммунной системы, включая обозначенные выше Th3 и ILC2, и играют ключевую роль в воспалении 2-го типа, они влияют на переключение В-лимфоцитов на синтез иммуноглобулина Е и привлечение эозинофилов в ткани легких и бронхов. Кроме того, ИЛ-13, стимулирует избыточное образование слизи в бронхах, сокращение гладких мышц и увеличение их толщины. Указанные эффекты лежат в основе таких клинических проявлений бронхиальной астмы, как приступы удушья, чувство заложенности в грудной клетке, свистящее дыхание и кашель с вязкой мокротой.
8 Цитокины ИЛ-4 и ИЛ-13 синтезируются и выделяются различными клетками иммунной системы, включая обозначенные выше Th3 и ILC2, и играют ключевую роль в воспалении 2-го типа, они влияют на переключение В-лимфоцитов на синтез иммуноглобулина Е и привлечение эозинофилов в ткани легких и бронхов. Кроме того, ИЛ-13, стимулирует избыточное образование слизи в бронхах, сокращение гладких мышц и увеличение их толщины. Указанные эффекты лежат в основе таких клинических проявлений бронхиальной астмы, как приступы удушья, чувство заложенности в грудной клетке, свистящее дыхание и кашель с вязкой мокротой.
Генетическая предрасположенность к развитию аллергических реакций и воспаления 2-го типа объясняет возможность развития сопутствующих заболеваний разной степени тяжести. Например, у человека с тяжелым течением атопического дерматита также может быть астма7, а у человека со среднетяжелым течением астмы также может развиться хронический риносинусит с назальными полипами.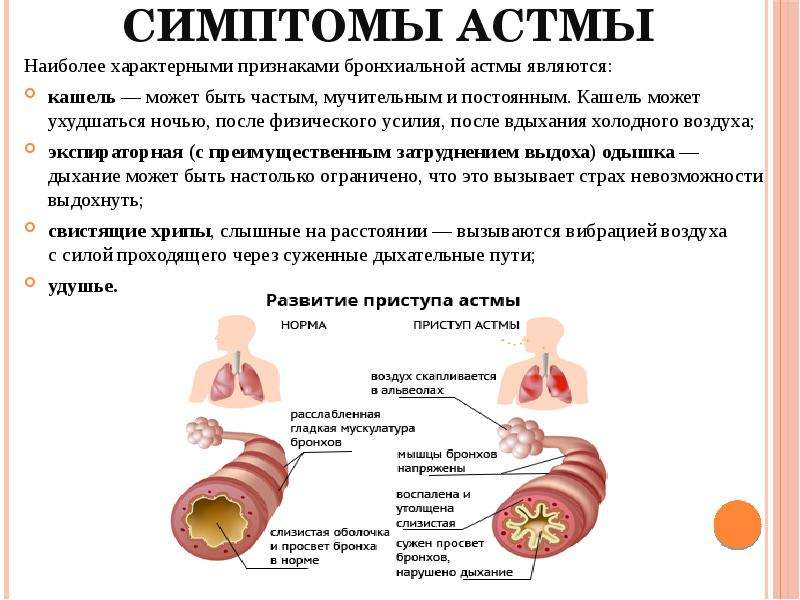 Кроме того, аллергический ринит и назальные полипы могут отягощать течение бронхиальной астмы за счёт нарушения основных функций носа. 12
Кроме того, аллергический ринит и назальные полипы могут отягощать течение бронхиальной астмы за счёт нарушения основных функций носа. 12
Важно отметить, что вероятность развития сопутствующих заболеваний и общего влияния астмы на организм с возрастом значительно увеличивается (это происходит у более 50%16 людей с астмой).13
Появление биологической терапии на основе моноклональных антител (МАТ) – это новая эпоха в лечении заболеваний, вызванных воспалением 2-го типа. Моноклональные антитела направленно воздействуют на ключевые механизмы воспаления и снижают активность провоспалительных цитокинов, благодаря чему может быть достигнуто улучшение и стойкий контроль клинических проявлений. Биологическая терапия направлена на снижение риска обострений астмы, улучшение функций легких и повышение качества жизни, связанного с состоянием здоровья.14,15
Источники:
1 Global Initiative for Asthma (GINA): Global strategy for asthma management and prevention.
2 Braman SS. The global burden of asthma. Chest. 2006;130(1 Suppl):4–12. doi:10.1378/chest.130.1_suppl.4S. (Неофициальный перевод. Браман С.С., «Всемирное бремя бронхиальной астмы,» Журнал Чест. 2006;130(1 выпуск):4–12. doi:10.1378/chest.130.1_suppl.4S)
3 Bjermer L. Time for a paradigm shift in asthma treatment: From relieving bronchospasm to controlling systemic inflammation. J Allergy Clin Immunol. 2007;120(6):1269–1275. (Неофициальный перевод. Бъермер Л. «Время изменения подхода к лечению астмы: От снятия спазма бронхов к контролю системного воспаления,» журнал Аллергии и клинической иммунологии. 2007;120(6):1269–1275.)
4 Masoli M, Fabian D, Holt S, Beasley R, Global initiative for asthma (GINA) Program The global burden of asthma: executive summary of the GINA dissemination committee report. Allergy. 2004;59:469–478. doi: 10.1111/j.1398-9995.2004.00526.x. (Неофициальный перевод. Масоли М., Фабиан Д., Хольт С., Бисли Р «Глобальная инициатива по астме: Программа Всемирного бремени бронхиальной астмы: резюме отчета» Журнал Аллергологии. 2004;59:469–478. doi: 10.1111/j.1398-9995.2004.00526.x.)
Allergy. 2004;59:469–478. doi: 10.1111/j.1398-9995.2004.00526.x. (Неофициальный перевод. Масоли М., Фабиан Д., Хольт С., Бисли Р «Глобальная инициатива по астме: Программа Всемирного бремени бронхиальной астмы: резюме отчета» Журнал Аллергологии. 2004;59:469–478. doi: 10.1111/j.1398-9995.2004.00526.x.)
5 Woodruff P., Modrek B., Choy D. et al., “T-helper Type 2-driven Inflammation Defines Major Subphenotypes of Asthma,” Am J Respir Crit Care Med, vol. 180, no. 5, pp. 388-395, 2009. (Неофициальный перевод. Вудруф Р., Модрек Б, Чой Д. и др. «Т-хелпер Воспаления 2 типа определяет большую часть субфенотипов астмы,» Американский журнал респираторной и клинической терапии vol. 180, no. 5, pp. 388-395, 2009.)
6 Anderson GP. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease. Lancet 2008;372: 1107–111 (Неофициальный перевод. Андерсон Дж.П. «Подтипы астмы: новые открытия в основных патогенный механизмах сложных гетерогенных заболеваний,» Лансет 2008;372: 1107–111)
7 Gandhi NA, Bennett BL, Graham NM, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2016;15(1):35-50. (Неофициальный перевод. Ганди Н.А., Беннетт Б.Л., Грахам Н.М и др. «Направленная борьба с драйверами воспаления 2 типа в ходе болезни,» Обзор природы новейших лекарственных средств 2016;15(1):35-50.)
Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2016;15(1):35-50. (Неофициальный перевод. Ганди Н.А., Беннетт Б.Л., Грахам Н.М и др. «Направленная борьба с драйверами воспаления 2 типа в ходе болезни,» Обзор природы новейших лекарственных средств 2016;15(1):35-50.)
8 Hankin C., Bronstone A., Wang Z. et al., “Estimated prevalence and economic burden of severe, uncontrolled asthma in the United States,” J Allergy Clin Immunol, vol. 131, p. AB126– AB100, 2013 (Неофициальный перевод. Ханкин Ц., Вронстоун А., Ванг З. и др. «Оценка распространенности и экономического бремени бронхиальной астмы с тяжелым неконтролируемым течением в США,» журнал Аллергии и клинической иммунологии vol. 131, p. AB126– AB100, 2013)
9 Masako Matsusaka et. al. Subphenotypes of type 2 severe asthma in adults. 2017 American Academy of Allergy, Asthma & Immunology http://dx.doi.org/10.1016/j.jaip.2017.06.015 (Неофициальный перевод. Масако Матсусака и др. «Подфенотипы воспаления 2 типа при тяжелом течении бронхиальной астмы у взрослых,» 2017 Американская Академия Аллергии, Астмы и Иммунологии http://dx.doi.org/10.1016/j.jaip.2017.06.015)
«Подфенотипы воспаления 2 типа при тяжелом течении бронхиальной астмы у взрослых,» 2017 Американская Академия Аллергии, Астмы и Иммунологии http://dx.doi.org/10.1016/j.jaip.2017.06.015)
10 Corren J. Asthma Phenotypes and Endotypes: An Evolving Paradigm for Classification. Discovery Medicine 2013;15(83):243-9 (Неофициальный перевод. Коррен Дж. «Фенотипы и эндотипы бронхиальной астмы: развитие подходов в классифицировании,» Открытия Медицины 2013;15(83):243-9)
11 The European Severe Asthma Survey, 2005. URL: http://www.efanet.org/wp-content/documents/SASSurveyFactSheet.pdf (accessed 23 March 2019). (Неофициальный перевод. Европейское исследование тяжелого течения бронхиальной астмы,» 2005 URL: http://www.efanet.org/wp-content/documents/SASSurveyFactSheet.pdf (дата доступа: 23 марта 2019)
12 Fokkens WJ, Lund VJ, Mullol L, et al. European Position Paper on Rhinosinusitis and Nasal Polyps: ERS/EAACI guidelines for acute and chronic rhinosinusitis with and without nasal polyps based on systematic review. Rhinology. 2012;50(suppl 23):115. (Неофициальный перевод. Фоккенс В.Дж., Лунд В.Дж., Муллол Л. и др. «Европейский программный документ о риносинусите и полипах носа: ERS/EAACI рекомендации по острому и хроническому риносинуситу с и без полипов носа, основанные по системном исследовании,» Ринология 2012;50(выпуск 23):115.)
Rhinology. 2012;50(suppl 23):115. (Неофициальный перевод. Фоккенс В.Дж., Лунд В.Дж., Муллол Л. и др. «Европейский программный документ о риносинусите и полипах носа: ERS/EAACI рекомендации по острому и хроническому риносинуситу с и без полипов носа, основанные по системном исследовании,» Ринология 2012;50(выпуск 23):115.)
13 Braman SS. Asthma in the elderly. Clin Geriatr Med. 2003;19:57–75. doi: 10.1016/S0749-0690(02)00052-6. (Неофициальный перевод. Браман С.С. «Астма у пожилых людей,» Клиническая медицина престарелых 003;19:57–75. doi: 10.1016/S0749-0690(02)00052-6.)
14 Simpson E et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2017 Mar 16;376(11):1090. (Неофициальный перевод. Симпсон Е. и др. «Вторая фаза 3 этапа исследования Дупилумаб в сравнении с Плацебо при атипическом дерматите,» Журнал Медицины Новая Англия2017 Март 16;376(11):1090)
15 Gandhi NA, Pirozzi G, Graham NMH. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Review of Clinical Immunology 2017; 13:5, 425-437 (Неофициальный перевод. Ганди Н.А., Пироцци Дж., Грахам Н.М.Х. «Общность действия ИЛ-4 и ИЛ-13 при атопическом дерматите,» Экспертное мнение в области Клинической иммунологии. 2017; 13:5, 425-437)
Expert Review of Clinical Immunology 2017; 13:5, 425-437 (Неофициальный перевод. Ганди Н.А., Пироцци Дж., Грахам Н.М.Х. «Общность действия ИЛ-4 и ИЛ-13 при атопическом дерматите,» Экспертное мнение в области Клинической иммунологии. 2017; 13:5, 425-437)
16 Fletcher M et al. Continuing discrepancy between patient perception of asthma control and real-world symptoms: a quantitative online survey of 1,083 adults with asthma from the UK Prim Care Respir J 2013; 22(4): 431-438 http://dx.doi.org/10.4104/pcrj.2013.00091 (Неофициальный перевод. Флетчер М. и др. «Сохраняющиеся несоответствие между представлением пациентов о контроле бронхиальной астмы и реальной картиной симптомов: количественное онлайн опрос 1,083 пациентов с бронхиальной астмой в Великобритании,» Журнал Первичная медико-санитарная помощь 2013; 22(4): 431-438 http://dx.doi.org/10.4104/pcrj.2013.00091)
Бронхиальная астма. Наша задача — разобраться в ее нюансах и взять болезнь под контроль
Бронхиальная астма… В историях болезни пациентов отделения хронических воспалительных и аллергических болезней легких Научно-исследовательского клинического института педиатрии имени академика Ю. Е. Вельтищева это – самый распространенный диагноз. И один из лидирующих по числу родительских заблуждений и страхов, которые на поверку не имеют под собой оснований.
Е. Вельтищева это – самый распространенный диагноз. И один из лидирующих по числу родительских заблуждений и страхов, которые на поверку не имеют под собой оснований.
Из-за таких заблуждений многие родители поздно обращаются к врачу, оттягивая своевременную диагностику заболевания, а значит и начало адекватного лечения этой самой распространенной хронической болезни легких у детей.
Рассказывает руководитель отделения, доктор медицинских наук, профессор Юрий Мизерницкий.
— Юрий Леонидович, с какими заблуждениями по поводу бронхиальной астмы вам и вашим коллегам чаще всего приходится сталкиваться в своей работе? — Одно из самых распространенных и досадных – о том, что астма – это приговор. На самом деле, это заболевание, с которым нужно и можно научиться жить. И жить вполне полноценно. Доказательство тому – не один десяток олимпийских чемпионов, больных бронхиальной астмой. Главное – держать эту болезнь в узде.
И наоборот, если легкие формы бронхиальной астмы не лечить, они постепенно становятся тяжелыми и, в конце концов, могут даже привести к инвалидности. Родителям наших маленьких пациентов я не перестаю повторять: «Не нужно бояться диагноза, нужно бояться неконтролируемого течения болезни», которую нужно вовремя диагностировать и лечить.
— Диагностика бронхиальной астмы – сложная задача?
— Не такая простая, как кажется. Главное для врача – разобраться во всех нюансах, механизмах болезни, которые очень многообразны. Подчас нам приходится быть настоящими криминалистами и во время сбора анамнеза расспрашивать у родителей пациентов о таких нюансах, о которых они даже не задумываются. Астма – болезнь многоликая.
— Какие ее формы преобладают?
— У детей преобладает аллергическая форма бронхиальной астмы с реакцией на самые разные аллергены (шерсть животных, пыль, пыльца растений и т.д.) и неспецифические стимулы (реакция на перепад температуры, резкие запахи, эмоциональную, физическую нагрузку и т. д.). Однако немало и смешанных форм этой болезни.
д.). Однако немало и смешанных форм этой болезни.
— Что входит в план обследования пациентов с бронхиальной астмой, которые поступают к вам в отделение?
— План обследования таких пациентов может включать самые разнообразные подходы. Прежде всего, мы проводим исследование функции внешнего дыхания, различных маркеров (биохимических, иммунологических), аллергологическое обследование (определение чувствительности к тем или иным аллергенам). При этом наша задача – исключить другие болезни, которые могут маскироваться под бронхиальную астму.
— А как вы подбираете лечение?
— Существуют уже отработанные, общепринятые схемы. Недавно уже вышло пятое издание «Национальных клинических рекомендаций по лечению бронхиальной астмы», которое, кстати, разрабатывалось и с участием сотрудников нашего отделения.
Однако нам нередко приходится выходить за рамки трафаретных схем, так как бронхиальная астма, нередко, требует индивидуального подхода к подбору терапии.
— Говорят, в борьбе с астмой в последнее время достигнут большой прогресс?
— Да. Это так. Сегодня арсенал противоастматических средств существенно расширился. При этом нам постоянно приходится преодолевать еще одно распространенное предубеждение родителей наших маленьких пациентов – боязнь гормональных препаратов, которые раньше широко применялись в виде таблеток для купирования острых приступов астмы и от которых было немало побочных эффектов, развивалась зависимость.
— Но разве не гормональные препараты составляют основу противоастматического лечения?
— Сейчас мы их внутрь практически не используем (за исключением самых запущенных, тяжелых случаев). Основной упор сегодня делается на ингаляционную, небулайзерную терапию с минимальнейшей дозой этих гормональных препаратов, что предотвращает побочные эффекты и удобно в применении.
Но даже успешно подобранное лечение не принесет успеха, если не убрать из жизни ребенка факторы, провоцирующие обострение болезни, приступы. И вот здесь нам, врачам, порой, приходится становиться настоящими психологами, убеждая родителей наших пациентов отказаться от противопоказанного им домашнего питомца, а то и поменять непригодное для ребенка жилье, или сменить климат.
И вот здесь нам, врачам, порой, приходится становиться настоящими психологами, убеждая родителей наших пациентов отказаться от противопоказанного им домашнего питомца, а то и поменять непригодное для ребенка жилье, или сменить климат.
— Неужели родители этому сопротивляются?
— Мы с пониманием относимся к родительским сомнениям. Не всегда что-то изменить в их силах. Но попытаться надо. Без этого не будет успеха в лечении.
Непросто бывает и с детьми, которым мы пытаемся рассказывать об их болезни в доступной для них форме, самым маленьким — в виде сказки, а то и кукольного театра. Окружающим детей взрослым и подросткам мы в рамках астма-школы объясняем суть болезни и предписываемых назначений. Осознанное их отношение к лечению – залог успеха.
Ведь астма – не просто болезнь, это определенный образ жизни, придерживаясь которого, а также четко соблюдая наши врачебные рекомендации, ребенок может жить такой же полноценной жизнью, как и его сверстники. А при удачном стечении обстоятельств эта болезнь может остаться в далеком детстве, долгое время даже не напоминать о себе.
Беседовала Татьяна Громова
Бронхиальная астма — это… Что такое Бронхиальная астма?
Бронхиа́льная а́стма (от др.-греч. ἆσθμα — «тяжёлое дыхание, одышка») — хроническое воспалительное заболевание дыхательных путей с участием разнообразных клеточных элементов. Ключевым звеном является бронхиальная обструкция (сужение просвета бронхов), обусловленная специфическими иммунологическими (сенсибилизация и аллергия) или неспецифическими механизмами, проявляющаяся повторяющимися эпизодами свистящих хрипов, одышки, чувства заложенности в груди и кашля.[1](недоступная ссылка). Бронхиальная обструкция обратима частично или полностью, спонтанно или под влиянием лечения. Распространённость в мире составляет от 4 до 10 %[2]. Для лечения используются симптоматические препараты, предназначенные для купирования приступа, и препараты базисной терапии, воздействующие на патогенетический механизм заболевания. Грозное осложнение заболевания — астматический статус[3]. Основополагающим документом является GINA — глобальная стратегия лечения и профилактики бронхиальной астмы[1].
История изучения
Слова ἆσθμα и ἀσθμαίνω в значениях «тяжёлое дыхание» и «задыхаться» встречаются в древнегреческой литературе начиная с поэм Гомера и продолжали использоваться в этом значении у Гиппократа, однако в Corpus Hippocraticum слово ἆσθμα употреблялось и как общее название заболеваний, сопровождающихся затруднением дыхания[4] — включая затруднения, сопровождающиеся сильным сердцебиением (сердечная астма) и заболевания дыхательных путей с выделением вязкой мокроты. Гиппократ также описал вынужденное «выпрямленное» положение больного во время приступов удушья — ортопноэ (др.-греч. ὀρθόπνοια), поместив описание симптомов астмы в своём труде об эпилепсии «О священной болезни» [5] — из-за спастического характера приступов эпилепсии и астмы.
В дальнейшем в греческой медицине были выделены три формы удушья: лёгкая хроническая форма — диспноэ (др.-греч. δύσπνοια), тяжёлая, сопровождающаяся приступами — астма и тяжёлая с приступами и усилением удушья в лежачем положении — ортопноэ. В этой форме описания вошли и в римскую медицину: Авл Корнелий Цельс в своём труде «О медицине» описывал эти формы, ссылаясь на греков и используя греческие термины[6].
Более подробную и точную клиническую картину астмы описал Аретей Каппадокийский (I век н. э.) в своём сочинении «О причинах и симптомах хронических болезней», посвятив ей отдельную главу. Аретей в своём сочинении описал две формы болезни, сопровождающейся затруднением дыхания, отметив, что одна из них, характеризующаяся ортопноэ, связана с болезнью сердца; вторая же, провоцируемая холодным влажным воздухом и сопровождающаяся спастическим затруднением дыхания и хрипами, является заболеванием лёгких[7] — т.о. Аретей разделил астму на две формы: сердечную и бронхиальную. Клавдий Гален, написавший среди прочих сочинений работу «О затруднениях дыхания» (лат. De difficultate respirationis), придерживался гиппократова подхода к объяснению причин астмы, объясняя их накоплением в бронхах вязкой мокроты и, вслед за Аретеем, приняв разделение астмы на две формы.
Ибн Сина (X—XI вв.) в «Каноне врачебной науки» дал описание астмы близкое к гиппократовому — как хроническую болезнь, сопровождающуюся внезапными приступами удушья, сходными своим спастическим характером с приступами эпилепсии, «Канон» Ибн Сины в переводе Герарда Кремонского на латынь получил распространение в средневековой Европе и стал одним из основных текстов, использовавшихся для обучения медиков в Италии на протяжении средневековья и Возрождения.
Первым отошёл от традиции Гиппократа основатель пневмохимии Ван Гельмонт (XVII век), выделивший в две формы затрудненного дыхания: «мокрую», сопровождающуюся отхаркиванием флегмы, и «сухую». Он также отметил, что приступы астмы провоцируются пылью и «жареной на масле рыбой» и впервые провел параллель между одновременной подверженностью приступами астмы и дерматитам — то есть, в современной терминологии, различными клиническими проявлениями аллергической реакции [8].
Данному заболеванию до середины XVIII века уделялось довольно мало внимания, по-видимому, врачи того времени не выделяли приступы удушья у больных в какую-то одну болезнь. Большой вклад в новое время в изучение астмы внесли немецкие учёные Куршман и Лейден. Именно они систематизировали и описали клинические проявления астмы выделив ряд случаев внезапного удушья в отдельную болезнь. К сожалению технический уровень того времени не позволял эффективно бороться с болезнью, и однозначно установить её причину.
В начале XX века произошло создание аллергической теории бронхиальной астмы. Принадлежала она учёным Манойлову и Голубеву. Параллельно с ними изучением бронхиальной астмы занимались и западные клиницисты А. Д. Адо и П. К. Булатов, которые первыми предложили классификацию бронхиальной астмы по причинам её возникновения. Относительно эффективной терапия заболевания стала только в начале XX века когда были синтезированы искусственные глюкокортикостероидные гормоны.[9]
Определение
Согласно глобальной стратегии GINA 2006, бронхиальная астма — «хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам и ранним утром. Эти эпизоды обычно связаны с распространённой, но изменяющейся по своей выраженности обструкции дыхательных путей в лёгких, которая часто бывает обратима либо спонтанно, либо под действием лечения».[1]
По определению экспертов ВОЗ, бронхиальная астма — «хроническое заболевание, основой которого является воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов, включая тучные клетки, эозинофилы и Т-лимфоциты. У предрасположенных лиц этот процесс приводит к развитию генерализованной бронхиальной обструкции различной степени выраженности, полностью или частично обратимой спонтанно или под влиянием лечения. Воспалительный процесс вызывает также содружественное усиление ответа дыхательных путей в виде бронхиальной обструкции на различные внешние и внутренние стимулы».[2]
В конце XX века в СССР и России была популярна формулировка Г. Б. Федосеева (1982), согласно которому бронхиальная астма — «самостоятельное хроническое, рецидивирующее заболевание, основным и обязательным патогенетическим механизмом которого является изменённая реактивность бронхов, обусловленная специфическими иммунологическими (сенсибилизация и аллергия) или неспецифическими механизмами, а основным (обязательным) клиническим признаком — приступ удушья вследствие бронхоспазма, гиперсекреции и отёка слизистой оболочки бронхов».[10]
Эпидемиология
Мировая распространённость астмы (2003 год).[11]■: >10,1
■: 7,6—10,0
■: 5,1—7,5
■: 2,5—5,0
■: 0—2,4
■: Нет стандартизированных данных
Заболеваемость бронхиальной астмой в мире составляет от 4 до 10 % населения.[2] В России, по разным данным, распространённость среди взрослого населения колеблется от 2,2[11] до 5—7 %, а в детской популяции этот показатель составляет около 10 %.[12] Заболевание может возникнуть в любом возрасте; примерно у половины больных бронхиальная астма развивается до 10 лет, ещё у трети — до 40 лет. Среди детей, больных бронхиальной астмой, мальчиков в два раза больше, чем девочек. К 30 годам соотношение полов выравнивается.[10]
В исследованиях отмечаются относительно высокие показатели заболеваемости в Новой Зеландии, Великобритании, на Кубе. Это связывают с тем, что над островами повышается концентрация аллергенов как благодаря местной флоре, так и за счёт аллергенов, приносимых океаническими воздушными потоками.[10]
С середины 1980-х годов отмечается рост заболеваемости бронхиальной астмой. Согласно проведённому анализу 34-х исследований заболеваемости в Европе, в Австрии с 1992 по 2002 годы заболеваемость среди детей увеличилась в 4 раза, в Италии с 1974 по 1998 — выросла с 7 до 13 %, во многих странах Европы (Великобритания, Финляндия, Швейцария) — росла до середины 1990-х годов, а в последнее время несколько снизилась. Напротив, в Германии с 1992 по 2001 годы этот показатель остался на уровне 5 %. Рост заболеваемости связывают с загрязнением окружающей среды, малоактивным образом жизни, а снижение её в последние годы объясняют успехами базисной терапии. Так, внедрение профилактического лечения и обучения больных в Ирландии повлекло за собой снижение более чем в 5 раз заболеваемости школьников тяжёлой астмой за период с 1992 по 2002 годы.[13]
Этиология
Факторы развития заболевания
Существует целый ряд факторов риска, способствующих возникновению и развитию бронхиальной астмы у определённых лиц.
Наследственность. Генетическому фактору уделяется большое внимание. Описаны случаи конкордантности, то есть когда оба из однояйцевых близнецов болели бронхиальной астмой. Часто в клинической практике встречаются случаи астмы у детей, матери которых больны астмой; или случаи в нескольких поколениях одной и той же семьи. В результате клинико-генеалогического анализа обнаружено, что у 1/3 больных заболевание носит наследственный характер. Существует термин атопическая бронхиальная астма — аллергическая (экзогенная) бронхиальная астма, имеющая наследственный характер. В этом случае, при наличии астмы у одного из родителей, вероятность астмы у ребёнка составляет 20—30 %, а если больны оба родителя, эта вероятность достигает 75 %.[10]
Исследование PASTURE, в рамках которого наблюдали за формированием атопии у новорождённых в семьях фермеров и у монозиготных близнецов показало, что, несмотря на генетическую предрасположенность, развитие заболевания можно предотвратить исключая провоцирующие аллергены и путём коррекции иммунного ответа в период беременности. Норвежскими учеными (Matthias Wjst et al.) установлено, что место и время рождения не влияют на формирование аллергических реакций и бронхиальной астмы.[13]
Профессиональные факторы. Влияние биологической и минеральной пыли, вредных газов и испарений на возникновение респираторных заболеваний исследовалось у 9144 человек в 26 центрах в исследовании ECRHS. Женщины в основном контактировали с биологической пылью, а мужчины в 3—4 раза чаще, чем женщины, — с минеральной пылью, вредными газами и испарениями. Хронический кашель с выделением мокроты чаще возникал у лиц, контактировавших с вредными факторами, именно в этой популяции зарегистрированы случаи впервые возникшей бронхиальной астмы. С течением времени неспецифическая гиперреактивность бронхов у лиц с профессиональной астмой не исчезает, даже при уменьшении контакта с вредным профессиональным фактором. Установлено, что тяжесть профессиональной астмы в основном определяется продолжительностью заболевания и выраженностью симптомов, не зависит от возраста, пола, вредного профессионального фактора, атопии, курения.[13]
Экологические факторы. 9-летнее эпидемиологическое исследование ECRHS-II, включившее 6588 здоровых лиц, подвергавшихся в течение указанного периода воздействию ряда неблагоприятных факторов (выхлопные газы, дым, повышенная влажность, вредные испарения и др.), показало, что у 3 % наблюдаемых в конце исследования возникли жалобы, соответствующие поражению дыхательной системы. После статистического анализа демографических, эпидемиологических и клинических данных был сделан вывод, что от 3 до 6 % новых случаев заболевания провоцируются воздействием поллютантов.[13]
Питание. Исследования во Франции, Мексике, Чили, Великобритании, Италии по влиянию характера питания на течение заболевания показали, что лица, употребляющие продукты растительного происхождения, соки, богатые витаминами, клетчаткой, антиоксидантами, имеют незначительную тенденцию к более благоприятному течению бронхиальной астмы, в то время как употребление продуктов животного происхождения, богатых жирами, белками и рафинированными легкоусвояемыми углеводами, связано с тяжёлым течением заболевания и частыми обострениями.[13]
Алкоголь. Согласно исследованию датских учёных, членов Европейского респираторного общества (ERS), умеренное употребление алкоголя снижает риск заболеть астмой. Согласно исследования еженедельное употребление 10-60 мл алкоголя нивелирует шансы «заработать» астму, вдыхая пыльцу цветковых растений, белковые вещества кошек и собак, домашнюю пыль и даже кухонных тараканов. Десять «кубиков» алкоголя — это стандартный зарубежный «дринк», соответствующий бутылке лёгкого пива или же неполному бокалу вина. При этом совcем непьющие люди, а также личности, злоупотребляющие алкоголем, имеют повышенные шансы развития астмы.[14][неавторитетный источник?]
Моющие средства. 10-летнее исследование ECRHS в 10 странах Евросоюза показало, что моющие средства для пола и чистящие аэрозоли содержат вещества, провоцирующие астму у взрослых; с применением этих средств связывают около 18 % новых случаев.[13]
Микроорганизмы. Долгое время существовало представление о существовании астмы инфекционно-аллергической природы (классификация Адо и Булатова).
Триггеры
Триггерами, то есть факторами, вызывающими приступы удушья и обострения заболевания являются аллергены для экзогенной бронхиальной астмы и НПВП для аспириновой бронхиальной астмы, а также холод, резкие запахи, физическое напряжение, химические агенты.
Домашний клещАллергены. Большинство аллергенов содержатся в воздухе. Это пыльца растений, микроскопические грибы, домашняя и библиотечная пыль, слущивающийся эпидермис клещей домашней пыли, шерсть собак и кошек и др. Степень реакции на аллерген не зависит от его концентрации.[10] В некоторых исследованиях показано, что взаимодействие с аллергенами клеща, домашней пыли, перхоти кошек и собак и грибка рода Aspergillus вызывает сенсибилизацию к этим аллергенам у детей до 3 лет. Связь между контактом с аллергеном и сенсибилизацией зависит от вида аллергена, дозы, длительности контакта, возраста ребёнка, а возможно, и от генетической предрасположенности.[1]
Нестероидные противовоспалительные препараты. У некоторых больных приём НПВП вызывает удушье. Если непереносимость аспирина сочетается с рецидивирующими синуситами и полипозом носа, то говорят об астматической триаде. У этих больных можно наблюдать крапивницу, отёк Квинке, пищевую непереносимость, но поиски специфических антител реагиновой природы оказались безуспешными.[10]
Патогенез
Воспаление и обструкция дыхательных путей при астме. Бронхиальная обструкция способствует появлению хриповКлючевое звено бронхиальной астмы любого генеза — повышенная реактивность бронхиального дерева. Она обусловлена нарушением вегетативной регуляции тонуса гладких мышц и действием медиаторов воспаления и приводит к периодической обратимой обструкции бронхов, которая проявляется повышением сопротивления дыхательных путей, перерастяжением лёгких, гипоксемией, вызванной очаговой гиповентиляцией и несоответствием между вентиляцией и перфузией лёгких, гипервентиляцией.[15]
Роль вегетативной нервной системы.
На гладкомышечных клетках находятся β1-, β2— и α- адренорецепторы. Преобладают β2-адренорецепторы, по сравнению с ними β1-адренорецепторов в 3 раза меньше. Стимуляция β2-адренорецепторов снижает реактивность бронхов у больных бронхиальной астмой, однако блокада β-адренорецепторов у здоровых лиц не вызывает заметного изменения реактивности бронхов, стимуляция α-адренорецепторов почти не влияет на тонус гладких мышц бронхов.[15]
В норме тонус бронхиальной гладкой мускулатуры регулируют преимущественно парасимпатические волокна блуждающего нерва. Использование препаратов, блокирующих проведение возбуждения по парасимпатическим волокнам, приводит к расширению бронхов, а стимуляция этих волокон вызывает бронхоспазм. Тонус гладких мышц бронхов меняется и под действием афферентных волокон, идущих от рецепторов бронхов и входящих в состав блуждающего нерва. Симпатическая нервная система в норме играет незначительную роль в регуляции бронхиальной мускулатуры, но при бронхиальной астме её роль возрастает. Стимуляция немиелинизированных волокон (афферентных волокон типа C, расположенных в стенке бронхов и альвеол) медиаторами воспаления приводит к высвобождению нейропептидов, например вещества P, которые вызывают сужение бронхов, отёк слизистой и увеличение секреции слизи.[15]
Биохимические факторы
Кальций играет важную роль в сокращении бронхиальной мускулатуры, так как АТФ-зависимый кальциевый насос, выводящий кальций из клетки, участвует в поддержании мембранного потенциала покоя гладкомышечных клеток. Повышение концентрации кальция внутри клетки приводит к сокращению, а уменьшение — к расслаблению гладкомышечной мускулатуры. Кроме того, повышение внутриклеточной концентрации кальция вызывает высвобождение гистамина, анафилактического фактора хемотаксиса эозинофилов и анафилактического фактора хемотаксиса нейтрофилов из тучных клеток. Предполагается, что в регуляции уровня кальция в тучных клетках участвуют адренорецепторы.
Циклические нуклеотиды (цАМФ и цГМФ) участвуют в регуляции сокращения гладкомышечных клеток бронхов и дегрануляции тучных клеток. Выброс медиаторов тучными клетками под действием M-холиностимуляторов и простагландина F2α опосредован повышением уровня цГМФ. Стимуляция α-адренорецепторов приводит к снижению уровня цАМФ, что также вызывает дегрануляцию тучных клеток. Стимуляция β-адренорецепторов приводит к повышению уровня цАМФ и, как следствие, к угнетению дегрануляции тучных клеток. Полагают, что блокада аденозиновых рецепторов также угнетает дегрануляцию.
В патогенезе экзогенной бронхиальной астмы также участвуют гепарин, тромбоксаны, серотонин, свободные радикалы кислорода, кинины, нейропептиды, протеазы и цитокины.[15]
Участие клеток воспаления
Тучные клетки. Активация тучных клеток происходит при взаимодействии аллергенов с IgE, фиксированными на поверхности тучных клеток при экзогенной бронхиальной астме. В случае эндогенной астмы активация тучных клеток может происходить под влиянием осмотических стимулов, как например при астме физического усилия. Будучи активированными, они высвобождают медиаторы (гистамин, цистеиниловые лейкотриены, простагландин D2), вызывающие бронхоспазм.[1] Параллельно с этим из фосфолипидов мембраны тучных клеток образуются арахидоновая кислота и фактор активации тромбоцитов. Из арахидоновой кислоты в свою очередь образуются лейкотриены и простагландины.[15]
Эозинофилы. Количество эозинофилов в дыхательных путях повышено. Эти клетки выделяют основные белки, повреждающие бронхиальный эпителий, а также участвуют в высвобождении факторов роста и ремоделировании дыхательных путей.[1]
T-лимфоциты. Их количество в дыхательных путях также повышено. Они высвобождают специфические цитокины (IL-4, IL-5, IL-9 и IL-13 и др.), влияющие на процесс эозинофильного воспаления и выработку IgE B-лимфоцитами. Регуляторные T-клетки угнетают Th2-лимфоциты, поэтому повышение активности Th2-клеток может происходить при снижении количества регуляторных T-клеток. Возможно увеличение числа inKT-клеток, выделяющих Th1— и Th2-цитокины в большом количестве.[1]
Дендритные клетки захватывают аллергены с поверхности слизистой бронхов и приносят их в региональные лимфатические узлы, где взаимодействуя с регуляторными T-клетками стимулируют дифференцировку T-лимфоцитов в Th2-клетки.[1]
Макрофаги. Количество макрофагов, как эозинофилов и T-лимфоцитов, повышено в дыхательных путях. Они могут активироваться при взаимодействии аллергенов с IgE с низкой аффинностью, в результате высвобождаются медиаторы воспаления и цитокины.[1]
Нейтрофилы. Количество их в дыхательных путях и мокроте повышено у больных тяжёлой БА и курящих больных. Роль этих клеток в патогенезе не выяснена. Возможно повышение их количества является следствием терапии глюкокортикостероидами.[1]
Медиаторы воспаления
Гистамин и лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа. В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм. К медиаторам поздней фазы аллергической реакции немедленного типа относят факторы хемотаксиса и фактор активации тромбоцитов. Последние вызывают хемотаксис, активацию клеток воспаления в слизистой бронхов и стимулируют синтез лейкотриенов в этих клетках. Бронхоспазм, вызываемый ими, возникает через 2—8 часа после начала аллергической реакции и может длиться несколько суток.[15]
Участие структурных клеток дыхательных путей
Структурные клетки дыхательных путей также вносят свой вклад в развитие воспаления. Так клетки бронхиального эпителия при распознавании своего механического окружения экспрессируют различные белки и высвобождают цитокины, хемокины и липидные медиаторы. Аналогичные воспалительные белки продуцируются гладкомышечными клетками. Эндотелиальные клетки участвуют в процессах миграции клеток воспаления в дыхательные пути. Фибробласты и миофибробласты, за счёт выработки коллагена, протеогликанов и других компонентов соединительной ткани, участвуют в ремоделировании дыхательных путей.[1]
Бронхиальная обструкция
Патологические изменения, приводящие к обструкции бронхов, затрагивают слизистую оболочку, подслизистый слой и мышечную оболочку бронхиального дерева. Патологический процесс распространяется от трахеи и крупных бронхов к терминальным бронхиолам. К сужению бронхов приводят следующие причины:
- Образование слизистых пробок. При астме образуется густая, вязкая слизь, содержащая слущенный эпителий бронхов, эозинофилы, кристаллы Шарко-Лейдена. Слизь может частично или полностью закупоривать просвет бронхов. С длительностью и тяжестью приступа из-за дегидратации слизь становится более вязкой.
- Изменения стенки бронхов. При астме количество клеток мерцательного эпителия уменьшается, а бокаловидные клетки, секретирующие слизь, количественно увеличиваются и подвергаются гиперплазии. Возникают также эозинофильная инфильтрация, отёк и утолщение базальной мембраны, в подслизистом слое наблюдаются инфильтрация эозинофилами, нейтрофилами, лимфоцитами и макрофагами, гипертрофия и отёк желёз. Мышечная оболочка бронхов гипертрофируется.
- Спазм гладкой мускулатуры бронхов является наиболее вероятной причиной острых кратковременных приступов. Длительность приступов и невосприимчивость к лечению обусловлены закупоркой бронхов слизистыми пробками и отеком слизистой бронхов.
Обструкция усиливается на выдохе, так как в этом случае происходит динамическое сужение дыхательных путей.
Из-за обструкции бронхов часть воздуха задерживается в альвеолах, что приводит к перерастяжению лёгких и удлинению выдоха. Избыточное сопротивление дыхательных путей приводит к увеличению работы дыхания, что ведет к включению вспомогательных мышц, одышке. В процесс могут быть вовлечены крупные и средние бронхи, однако чаще на первый план выступает обструкция мелких бронхов. Шумное, свистящее дыхание — признак обструкции крупных бронхов, а приступы одышки и кашля чаще возникают при обструкции мелких бронхов. Обструкция ведет к увеличению остаточного объёма, уменьшению ЖЕЛ и повышению общей емкости лёгких. Вследствие обструкции дыхательных путей снижается их вентиляция. В норме снижается перфузия плохо вентилируемых участков, но при астме это происходит далеко не всегда, равновесие между вентиляцией и перфузией нарушается, что приводит к снижению paO2. При лёгких и среднетяжелых приступах бронхиальной астмы возникает гипервентиляция, которая приводит к уменьшению paCO2 и дыхательному алкалозу. При тяжелых и длительных приступах развивается гиповентиляция, повышается paCO2 и возникает дыхательный ацидоз. Перерастяжение лёгких и снижение paO2 в альвеолах вызывают капилляроспазм альвеол и повышение давления в лёгочной артерии.[15]
Клиническая картина
Основными симптомами бронхиальной астмы являются эпизоды одышки, свистящие хрипы, кашель и заложенность в грудной клетке. Существенное значение имеет появление симптомов после контакта с аллергеном, сезонная вариабельность симптомов и наличие родственников с бронхиальной астмой или другими атопическими заболеваниями. При сочетании с ринитом симптомы астмы могут либо появляться только в определённое время года, либо присутствовать постоянно с сезонными ухудшениями. У некоторых пациентов сезонное увеличение уровня в воздухе определённых аэроаллергенов (например пыльца Alternaria, берёзы, травы и амброзии) вызывает развитие обострений.
Указанные симптомы могут также развиваться при контакте с неспецифическими ирритантами (дымом, газами, резкими запахами) или после физической нагрузки, могут обостряться в ночные часы и уменьшаться в ответ на базисную терапию.[1]
Приступ удушья — наиболее типичный симптом астмы. Характерно вынужденное положение (часто сидя, держась руками за стол) поза больного с приподнятым верхним плечевым поясом, грудная клетка приобретает цилиндрическую форму. Больной делает короткий вдох и без паузы продолжительный мучительный выдох, сопровождаемый дистанционными хрипами. Дыхание происходит с участием вспомогательной мускулатуры грудной клетки, плечевого пояса, брюшного пресса. Межреберные промежутки расширены, втянуты и расположены горизонтально. Перкуторно определяется коробочный лёгочный звук, смещение вниз нижних границ лёгких, экскурсия лёгочных полей едва определяется.
Часто, особенно при затяжных приступах, возникает боль в нижней части грудной клетки, связанная с напряженной работой диафрагмы. Приступу удушья может предшествовать аура приступа, проявляющаяся чиханием, кашлем, ринитом, крапивницей, сам приступ может сопровождаться кашлем с небольшим количеством стекловидной мокроты, также мокрота может отделяться в конце приступа. При аускультации определяется ослабленное дыхание, сухие рассеянные хрипы. Сразу же после кашлевых толчков слышно увеличение количества свистящих хрипов, как в фазе вдоха, так и на выдохе, особенно в задненижних отделах, что связано с секрецией мокроты в просвет бронхов и её пассажем. По мере отхождения мокроты количество хрипов уменьшается и дыхание из ослабленного становится жёстким.[10]
Хрипы могут отсутствовать у больных с тяжелыми обострениями вследствие тяжёлого ограничения воздушного потока и вентиляции. В период обострения отмечаются также цианоз, сонливость, затруднения при разговоре, тахикардия. Вздутая грудная клетка является следствием повышенных лёгочных объёмов — необходимо обеспечивать «расправление» дыхательных путей и раскрытие мелких бронхов. Сочетание гипервентиляции и бронхиальной обструкции значительно увеличивает работу дыхательных мышц.[1]
Между приступами у больных может не наблюдаться никаких признаков болезни. В межприступный период у пациентов чаще всего выявляются свистящие хрипы при аускультации, подтверждающие наличие остаточной бронхиальной обструкции. Иногда (и порой одновременно с выраженной обструкцией бронхов) свистящие хрипы могут отсутствовать или обнаруживаться только во время форсированного выдоха.[1]
Особым клиническим вариантом является кашлевой вариант астмы, при котором единственным проявлением заболевания является кашель. Этот вариант чаще распространён у детей, наиболее выраженные симптомы обычно отмечаются в ночное время при частом дневном отсутствии симптомов. Важность в диагностике имеет исследование вариабельности показателей функции дыхания или бронхиальной гиперреактивности, а также эозинофилия мокроты. Кашлевой вариант астмы следует различать с эозинофильным бронхитом, при котором отмечаются кашель и эозинофилия мокроты, однако показатели функции дыхания и бронхиальная реактивность остаются в норме.[1]
Бронхиальная астма физического усилия. У некоторых пациентов единственным триггером приступа является физическая активность. Приступ обычно развивается через 5—10 мин после прекращения нагрузки и редко — во время нагрузки. Пациенты иногда отмечают длительный кашель, который самостоятельно проходит в течение 30—45 мин. Приступы чаще провоцируются бегом, имеет значение при этом вдыхание сухого холодного воздуха. В пользу диагноза бронхиальной астмы говорит прекращение приступа после ингаляции β2-агонистов или предотвращение симптомов благодаря ингаляции β2-агонистами до нагрузки. Основной метод диагностики — тест с 8-минутным бегом.[1]
Исследование функции внешнего дыхания
Для определения функции внешнего дыхания повсеместно у пациентов в возрасте старше 5 лет используются спирометрия (позволяющая выявить объём форсированного выдоха за 1-ю секунду (ОФВ1) и форсированную жизненную емкость лёгких (ФЖЕЛ)) и пикфлоуметрия (позволяющая выявить пиковую скорость выдоха (ПСВ)).
Существуют т. н. должные показатели ОФВ1, ФЖЕЛ и ПСВ, которые были получены в результате проведения популяционных исследований. Они зависят от возраста, пола и роста исследуемого. Эти показатели постоянно пересматриваются. Показатели, полученные у конкретного пациента выражаются в процентном соотношении к должным величинам. Для ПСВ характерны очень широкие границы колебаний должных значений.
Термином «обратимость» обозначается прирост ОФВ1 (или реже ПСВ) через несколько минут после ингаляции бронхолитика быстрого действия (200—400 мкг сальбутамола, или беротека). Иногда под обратимостью понимают улучшение функции лёгких, развивающееся через несколько дней или недель после назначения или коррекции базисной терапии.
Спирометрия является методом выбора для оценки выраженности и обратимости бронхиальной обструкции. Показатели ОФВ1 и ФЖЕЛ измеряют с использованием спирометра при форсированном выдохе. Общепринятым критерием диагностики бронхиальной астмы служит прирост ОФВ1 на 12 % и более по сравнению со значением до ингаляции бронхолитика. Чувствительность теста низкая, особенно когда пациент получает какую-то (бронхолитическую или базисную) терапию. Пациентов необходимо обучить правильности выполнения форсированного выдоха, требуется провести дыхательный манёвр трижды и зафиксировать лучший из полученных результатов. Для дифференцирования бронхиальной обструкции от других заболеваний лёгких, сопровождающихся изменением ОФВ1 важно определять отношение ОФВ1/ФЖЕЛ, называемое индексом Тиффно (ИТ). В норме ИТ >0,75—0,80, а у детей может быть >0,9. Снижение этого отношения ниже указанных значений позволяет заподозрить бронхиальную обструкцию, характерную для ХОБЛ и бронхиальной астмы.
Пикфлоуметры ПикфлоуметрПикфлоуметрия, позволяющая определить пиковую скорость выдоха, является важным методом диагностики и оценки эффективности лечения.
Современные пикфлоуметры недорого стоят, портативные, они являются идеальным выбором для ежедневной оценки выраженности бронхиальной обструкции пациентами в домашних условиях. Измерением ПСВ нельзя подменять определение других показателей функции лёгких, при определении ПСВ без ОФВ1 возможна недооценка тяжести обструкции, особенно при нарастании тяжести бронхиальной обструкции и появлении «воздушных ловушек». Так как использование разных пикфлоуметров может приводить к разнице значений ПСВ (учитывая также, что диапазон должных значений ПСВ очень широк), предпочтительно сравнивать результаты ПСВ у конкретного пациента с его собственными лучшими показателями с использованием личного пикфлоуметра пациента. Лучший показатель обычно регистрируют в период ремиссии заболевания. Так как результаты зависят от усилия выдоха пациента, следует тщательно инструктировать пациента. ПСВ обычно измеряют утром (после пробуждения и до приема препаратов) и вечером (перед сном). Суточную вариабельность ПСВ определяют следующим образом, где A — суточная вариабельность ПСВ, V1 — ПСВ утром, V2 — ПСВ вечером:
Чем выше вариабельность ПСВ, тем хуже контролируется астма. Определяют также отношение разности ПСВ за сутки к усредненной ПСВ за 1—2 недели. Другой способ определения вариабельности ПСВ является определение минимальной за 1 неделю ПСВ в процентах от самого лучшего в этот же период показателя. Этот способ возможно является лучшим для оценки лабильности просвета бронхов в клинической практике, поскольку полученный показатель проще рассчитать, и он лучше других параметров коррелирует с бронхиальной гиперреактивностью, и требует измерение ПСВ только один раз в день. Определение ПСВ и различных вариантов её вариабельности используют для оценки проводимой терапии, выявления провоцирующих факторов, прогноза обострений.[1]
Диагностика
При постановке диагноза бронхиальной астмы учитываются следующие ключевые моменты:
- Жалобы (кашель, одышка, приступы удушья, затруднение при выполнении физической нагрузки), анамнез заболевания, клинические проявления (прерывистая речь, положение ортопноэ).
- Результаты физикального обследования (ускорение или замедление ЧСС, одышка, сухие свистящие хрипы, усиливающиеся на выдохе).
- Исследование функции внешнего дыхания (снижение значений ОФВ1, и увеличении ОФВ1 после пробы с броходилятаторами более чем на, 12 %, от начального, уменьшение ФЖЕЛ, снижение ПСВ и увеличение её суточной вариабельности).
- Наличие эозинофилов в мокроте или бронхиальном секрете, эозинофилия крови, мокрота вязкая, трудноотделяемая, чаще двухслойная, с большим количеством эозинофилов, спиралей Куршмана (переплетения мелких бронхов), кристаллов Шарко-Лейдена (некротизированные нейтрофилы, ранее инфильтрировавшие стенку бронха).
- Аллергологический статус: кожные (аппликационные, скарификационные, внутрикожные) пробы, назальные, конъюнктивальные, ингаляционные пробы, радиоаллергосорбентный тест, определение общего и специфического IgE.[2]
Очень часто врач может поставить диагноз бронхиальной астмы на основе клинической картины.
При подозрении на наличие у больного бронхиальной астмы оценивают следующие клинические критерии:
- Возникают ли у пациента эпизоды свистящих хрипов, в том числе и повторяющиеся.
- Беспокоит ли пациента кашель по ночам.
- Возникают ли у пациента свистящие хрипы и кашель, через 10—20 минут после физической нагрузки.
- Бывают ли у пациента эпизоды кашля, сухих хрипов, одышки, после встречи с провоцирующими факторами (аллергенами, поллютантами).
- Отмечает ли пациент переход инфекции на нижние дыхательные пути, если ОРВИ длится более 10 дней.
- Уменьшается ли выраженность жалоб после приема специфических противоастматических препаратов.
Наличие одного или нескольких данных симптомов, позволяют врачу убедиться в необходимости дальнейшего обследования для окончательного уточнения диагноза.[1]
Клинически бронхиальная астма, вне обострения может не проявлять себя, или протекать по кашлевому варианту, когда единственным признаком заболевания будет кашель с отхождением незначительного количества мокроты. Зачастую кашлевой вариант бронхиальной астмы, без проведения инструментально — лабораторных методов исследования диагностируется как бронхит. На первый план в таких случаях выходят функциональные дыхательные пробы с бронходилятаторами, и лабораторные исследования крови и мокроты.[1]
Постановка диагноза бронхиальная астма, особенно на ранних этапах, при слабо выраженной клинике требует проведения функциональных проб с бронходилятаторами, которые позволяют выявить наличие клинически не выраженного бронхоспазма и определить степень обратимой бронхиальной обструкции.
У пациентов с характерными жалобами, с нормальными показателями функции лёгких, для достоверной постановки диагноза проводится исследование бронхиальной реактивности, что включает исследование функции внешнего дыхания с проведением фармакологических проб с гистамином, метахолином (англ.)русск. или бронходилататорами.[1] У большинства больных с атопической астмой имеется аллергия, которую можно выявить с помощью кожных скарификационных тестов. Они также позволяют обнаружить провоцирующий фактор.
У некоторых больных с бронхиальной астмой можно найти гастроэзофагеальную рефлюксную болезнь. Другие исследования (например рентгенография грудной клетки или компьютерная томография) могут понадобиться для исключения других заболеваний лёгких.
Классификация
Бронхиальная астма классифицируется в зависимости от происхождения, тяжести заболевания, выделяются также особые формы бронхиальной астмы.
Этиологическая классификация
В зависимости от причин, вызывающих приступы, выделяют:
- экзогенную бронхиальную астму — приступы вызываются при воздействии на дыхательные пути аллергена, поступающего из внешней среды (пыльца растений, плесневые грибки, шерсть животных, мельчайшие клещи, находящиеся в домашней пыли). Особым вариантом является атопическая бронхиальная астма, вызванная наследственно-обусловленной предрасположенностью к аллергическим реакциям
- эндогенную бронхиальную астму — приступ вызывают такие факторы, как инфекция, физическая нагрузка, холодный воздух, психо-эмоциональные раздражители
- бронхиальную астму смешанного генеза — приступы могут возникать как при воздействии на дыхательные пути аллергена, так и при воздействии перечисленных выше факторов
| Признаки | Атопический вариант | Инфекционно-зависимый вариант |
|---|---|---|
| Аллергические заболевания в семье | Часто | Редко (кроме астмы) |
| Атопические болезни у пациента | Часто | Редко |
| Связь приступа с внешним аллергеном | Часто | Редко |
| Особенности приступа | Острое начало, быстрое развитие, обычно малая длительность и лёгкое течение | Постепенное начало, большая длительность, часто тяжёлое течение |
| Патология носа и придаточных пазух | Аллергический риносинусит или полипоз без признаков инфекции | Аллергический риносинусит, часто полипоз, признаки инфекции |
| Бронхолёгочный инфекционный процесс | Обычно отсутствует | Часто хронический бронхит, пневмония |
| Эозинофилия крови и мокроты | Как правило, умеренная | Часто высокая |
| Специфические антитела IgE к неинфекционным аллергенам | Присутствуют | Отсутствуют |
| Кожные пробы с экстрактами неинфекционных аллергенов | Положительные | Отрицательные |
| Тест с физической нагрузкой | Чаще отрицательный | Чаще положительный |
| Элиминация аллергена | Возможна, часто эффективна | Невозможна |
| Бета-адреностимуляторы | Очень эффективны | Умеренно эффективны |
| Холинолитики | Малоэффективны | Эффективны |
| Эуфиллин | Очень эффективен | Умеренно эффективен |
| ИнталТайлед | Очень эффективен | Эффективен реже |
| Кортикостероиды | Эффективны | Эффективны |
Стратификация тяжести
При оценке тяжести заболевания учитывают
- количество ночных симптомов в месяц, неделю, сутки
- количество дневных симптомов в неделю, день
- выраженность нарушений физической активности и сна
- лучшие показатели ОФВ1 и ПСВ за сутки
- суточные колебания ОФВ1 и ПСВ
В стратификации астмы по степени тяжести имеется понятие ступени, соответствующей определённым градациям признаков симптомокомплекса астмы. Выделяют четыре ступени, если пациент не принимает базисных препаратов, то каждая из этих ступеней соответствует одной из четырёх степеней тяжести:[17]
Ступень 1. Интермиттирующая астма
- Приступы болезни возникают редко (менее одного раза в неделю)
- Короткие обострения
- Ночные приступы болезни возникают редко (не чаще двух раз в месяц)
- ОФВ1 или ПСВ более 80 % от нормы
- Разброс ПСВ менее 20 %
Ступень 2. Лёгкая персистирующая астма
- Симптомы болезни возникают чаще 1 раза в неделю, но реже 1 раза в день
- Обострения могут нарушать сон больного, угнетать физическую активность
- Ночные приступы болезни возникают, по меньшей мере, 2 раза в месяц
- ОФВ1 или ПСВ более 80 % от нормы
- Разброс ПСВ 20—30 %
Ступень 3. Персистирующая астма средней тяжести
- Приступы астмы возникают практически ежедневно
- Обострения нарушают сон больного, снижают физическую активность
- Ночные приступы болезни случаются очень часто (чаще 1 раза в неделю)
- ОФВ1 или ПСВ снижаются до показателей от 60 % до 80 % от нормальной величины
- Разброс ПСВ более 30 %
Ступень 4. Тяжёлая персистирующая астма
- Приступы болезни возникают ежедневно
- Ночные приступы астмы случаются очень часто
- Ограничение физической активности
- ОФВ1 или ПСВ составляют около 60 % от нормы
- Разброс ПСВ более 30 %
Если пациент находится на базисной терапии, степень тяжести заболевания определяется ступенью и дозировкой базисного препарата (о низких, средних и высоких дозах смотрите в разделе ИГКС):[17]
| Ступень | низкие дозы | средние дозы | высокие дозы |
|---|---|---|---|
| Ступень 1 | Интермиттирующая | Лёгкая персистирующая | Персистирующая средней тяжести |
| Ступень 2 | Лёгкая персистирующая | Персистирующая средней тяжести | Тяжёлая персистирующая |
| Ступень 3 | Персистирующая средней тяжести | Тяжёлая персистирующая | Тяжёлая персистирующая |
| Ступень 4 | Тяжёлая персистирующая | Тяжёлая персистирующая | Тяжёлая персистирующая |
Классификация тяжести обострения астмы
Обострения бронхиальной астмы — это эпизоды прогрессивного нарастания одышки, кашля, свистящих хрипов, чувства сдавления грудной клетки. В это время просвет бронхов сужается, что сопровождается снижением пиковой скорости выдоха (ПСВ), объёма форсированного выдоха за 1 секунду (ОФВ1), форсированной жизненной емкости лёгких (ФЖЕЛ). Для оценки тяжести обострения проводят физикальное обследование, исследование функции внешнего дыхания, исследование газов артериальной крови, ЭКГ, рентгенографию органов грудной клетки.[3]
| Признаки | Лёгкое обострение | Среднетяжёлое обострение | Тяжёлое обострение | Угроза апноэ |
|---|---|---|---|---|
| Ограничение двигательной активности | Нет | Есть (предпочитают сидеть) | Выраженное (двигаются с трудом) | |
| Разговор | Не затруднён (предложения) | Короткие фразы | Отдельные слова | |
| Сознание | Возможно возбуждение | Обычно возбужден | Обычно возбужден | Спутанность |
| ЧДД | Норма или повышена (До 30 % от N) | Повышена на 30—50 % от N | Более 30 в мин (на 50 % превышает норму) | |
| Участие вспомогательной мускулатуры в акте дыхания, втяжение яремной ямки | Обычно нет | Обычно есть | Есть, резко выражено | Парадоксальные торакоабдоминальные движения |
| Свистящее дыхание | Умеренное, в конце выдоха | Громкое, весь выдох | Обычно громкое, на вдохе и выдохе | Отсутствие свистов |
| Аускультация | Сухие хрипы на выдохе | Дыхание мозаичное, хрипы на вдохе и выдохе | Ослабленное дыхание | «Немое лёгкое» |
| Пульс | Менее 100 | 100—120 | Более 120 | Брадикардия |
| Парадоксальный пульс | Отсутствует, <10 мм рт. ст. | Может быть, 10—25 мм рт.ст. | Часто бывает, >25 мм рт. ст. | Отсутствует (свидетельство мышечного утомления) |
| ПСВ после приема бронходилятатора | Более 80 % от должной | 60—80 % от должной | Менее 60 % от должной или ПСВ менее 100 л в минуту, или улучшение сохраняется менее 2 часов | |
| Газы артериальной крови: кислород, РаО2 | Норма (95 мм рт. ст) | Более 60 мм рт. ст. | Менее 60 мм рт.ст., возможен цианоз | |
| Газы артериальной крови: двуокись углерода, РаСО2 | Менее 45 мм рт.ст (в норме — 40 мм рт.ст.) | Менее 45 мм рт.ст. | Более 45 мм рт.ст. Возможно дыхательное утомление | |
| Насыщение крови кислородом, SaO2 | Более 95 % | 91—95 % | Менее 90 % |
Особые формы бронхиальной астмы
Существует несколько обособленных клинико-патогенетических вариантов: рефлюкс-индуцированная бронхиальная астма, аспириновая бронхиальная астма, бронхиальная астма физического усилия, профессиональная астма, ночная астма.
Рефлюкс-индуцированная бронхиальная астма
Приступ удушья, связанный с аспирацией желудочного содержимого, впервые описал канадский врач Уильям Ослер (1849—1919) в 1892 году. В дальнейшем был предложен термин рефлюкс-индуцированная астма. Особый интерес представляет патологический гастроэзофагеальный рефлюкс (ГЭР), рассматриваемый в качестве причины приступов астмы, чаще всего в ночное время. Гастроэзофагеальный рефлюкс имеется у 50—60 % детей и более, страдающих бронхиальной астмой.[18]
Согласно современным представлениям, патогенез лёгочных заболеваний, в том числе и бронхиальной астмы, возникающих на фоне ГЭРБ, связан с двумя механизмами. Первый — аспирационный, когда развитие бронхоспазма происходит в результате заброса желудочного содержимого в просвет бронхиального дерева; второй — рефлекторный, когда агрессивные компоненты рефлюксата, попадая в пищевод при рефлюксе, стимулируют вагусные рецепторы пищевода, индуцируя, в результате, приступы удушья.
Микроаспирация в результате ГЭР может стать причиной развития таких состояний, как хронический бронхит, повторные пневмонии, лёгочный фиброз, эпизоды удушья, апноэ сна. Микроаспирация кислого содержимого ведет к формированию воспалительных процессов в бронхиальном дереве, повреждению слизистой оболочки дыхательных путей, ведущее к развитию бронхоспазма, увеличению выработки секрета бронхиального дерева.
При подозрении на рефлюксную природу бронхиальной астмы проводят диагностику ГЭРБ (суточную рН-метрию) и, если диагноз подтверждается, лечение ГЭРБ.[19]
Формулировка диагноза
Диагноз бронхиальной астмы выставляется по следующей схеме:
Бронхиальная астма, <происхождение>, <степень тяжести>, <ремиссия или обострение с указанием степени тяжести обострения>
В случае необходимости эта схема уточняется эпитетами, такими как «аспириновая», «стероидозависимая» и т. п. Далее формулируются сопутствующие синдромы и заболевания.[20]
Примеры диагнозов:
- Бронхиальная астма, экзогенная, интермиттирующее течение, ремиссия. Аллергический интермиттирующий ринит, вне обострения.
- Бронхиальная астма, смешанная, лёгкое течение, обострение средней степени тяжести. Аллергический персистирующий риноконъюнктивит, обострение. Хронический бронхит, обострение
- Бронхиальная астма, экзогенная, средней степени тяжести, лёгкое обострение. Аллергическая реакция по типу острой крапивницы.
- Бронхиальная астма, эндогенная, стероидозависимая, тяжёлое течение, тяжёлое обострение. ХОБЛ II стадии, средней степени тяжести, смешанный тип с преобладанием эмфиземы, обострение II типа по N. Anthonisen. ВН III. ДН I.
- Аспириновая бронхиальная астма, эндогенная, средней степени тяжести, тяжёлое обострение. Хронический полипозный гаймороэтмоидит с полипами в носу. Непереносимость препаратов пиразолонового ряда.
Лечение
Для лечения бронхиальной астмы используются препараты базисной терапии, воздействующие на механизм заболевания, посредством которых пациенты контролируют астму, и симптоматические препараты, влияющие только на гладкую мускулатуру бронхиального дерева и снимающие приступ.
К препаратам симптоматической терапии относят бронходилятаторы:
К препаратам базисной терапии относят
Если не принимать базисную терапию, со временем будет расти потребность в ингаляции бронходилататоров (симптоматических средств). В этом случае и в случае недостаточности дозы базисных препаратов рост потребности в бронходилататорах является признаком неконтролируемого течения заболевания.[21]
Кромоны
К кромонам относят кромогликат натрия (Интал) и недокромил натрия (Тайлед). Эти средства показаны в качестве базисной терапии бронхиальной астмы интермиттирующего и лёгкого течения. Кромоны уступают по своей эффективности ИГКС.[22] Так как существуют показания для назначения ИГКС уже при лёгкой степени бронхиальной астмы[17], кромоны постепенно вытесняются более удобными в использовании ИГКС. Не оправдан также переход на кромоны с ИГКС при условии полного контроля над симптомами минимальными дозами ИГКС.[23]
Глюкокортикостероиды
При астме применяются ингаляционные глюкокортикостероиды, которым не свойственно большинство побочных действиев системных стероидов. При неэффективности ингаляционных кортикостероидов добавляют глюкокортикостероиды для системного применения.
Ингаляционные глюкокортикостероиды (ИГКС)
Ингалятор Беклазон ЭКОИГКС — основная группа препаратов для лечения бронхиальной астмы. Ниже представлена классификация ингаляционных глюкокортикостероидов в зависимости от химической структуры:
- Негалогенированные
- будесонид (Пульмикорт, Бенакорт, Буденит Стери-Неб)
- циклесонид (Алвеско)
- Хлорированные
- Фторированные
Противовоспалительный эффект ИГКС связан с подавлением деятельности клеток воспаления, уменьшением продукции цитокинов, вмешательством в метаболизм арахидоновой кислоты и синтез простагландинов и лейкотриенов, снижением проницаемости сосудов микроциркуляторного русла, предотвращением прямой миграции и активации клеток воспаления, повышением чувствительности b-рецепторов гладкой мускулатуры. ИГКС также увеличивают синтез противовоспалительного белка липокортина-1, путём ингибирования интерлейкина-5 увеличивают апоптоз эозинофилов, тем самым снижая их количество, приводят к стабилизации клеточных мембран. В отличие от системных глюкокортикостероидов, ИГКС липофильны, имеют короткий период полувыведения, быстро инактивируются, обладают местным (топическим) действием, благодаря чему имеют минимальные системные проявления. Наиболее важное свойство — липофильность, благодаря которому ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Лёгочная биодоступность ИГКС зависит от процента попадания препарата в лёгкие (что определяется типом используемого ингалятора и правильностью техники ингаляции), наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях.
До недавнего времени главенствующией концепцией назначения ИГКС была концепция ступенчатого подхода, что означает что при более тяжелых формах заболевания назначаются более высокие дозы ИГКС.
| Эквивалентные дозы ИГКС, мкг | ||||
|---|---|---|---|---|
| Международное название | Низкие дозы | Средние дозы | Высокие дозы | |
| Беклометазона дипропионат | 200—500 | 500—1000 | 1000 | |
| Будесонид | 200—400 | 400—800 | 800 | |
| Флунизолид | 500—1000 | 1000—2000 | 2000 | |
| Флутиказона пропионат | 100—250 | 250—500 | 500 | |
| Триамсинолона ацетонид | 400—1000 | 1000—2000 | 2000 | |
Основой терапии для длительного контроля воспалительного процесса являются ИГКС, которые применяются при персистирующей бронхиальной астме любой степени тяжести и по сей день остаются средствами первой линии терапии бронхиальной астмы. Согласно концепции ступенчатого подхода: «Чем выше степень тяжести течения БА, тем большие дозы ингаляционных стероидов следует применять». В ряде исследований показано, что у пациентов, начавших лечение ИГКС не позже 2 лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы, по сравнению с начавшими такую терапию по прошествии 5 лет и более.[17]
Комбинации ИГКС и пролонгированных β
2-адреномиметиков Симбикорт ТурбухалерСуществуют фиксированные комбинации ИГКС и пролонгированных β2-адреномиметиков, сочетающие в себе средство базисной терапии и симптоматическое средство. Согласно глобальной стратегии GINA, фиксированные комбинации являются наиболее эффективными средствами базисной терапии бронхиальной астмы, так как позволяют снимать приступ и одновременно являются лечебным средством.[1] В России наибольшей популярностью пользуются две такие фиксированные комбинации:
- салметерол + флутиказон (Серетид 25/50, 25/125 и 25/250 мкг/доза, Серетид Мультидиск 50/100, 50/250 и 50/500 мкг/доза, Тевакомб 25/50, 25/125 и 25/250 мкг/доза)
- формотерол + будесонид (Симбикорт Турбухалер 4,5/80 и 4,5/160 мкг/доза)
В состав препарата Серетид входит салметерол в дозе 25 мкг/доза в дозированном аэрозольном ингаляторе и 50 мкг/доза в аппарате «Мультидиск». Максимально-допустимая суточная доза салметерола — 100 мкг, то есть максимальная кратность применения Серетида составляет 2 вдоха 2 раза для дозированного ингалятора и 1 вдох 2 раза для приспособления «Мультидиск». Это даёт Симбикорту преимущество в том случае, если необходимо увеличить дозу ИГКС. Симбикорт содержит формотерол, максимально-допустимая суточная доза которого составляет 24 мкг, делает возможным ингалироваться Симбикортом до 8 раз в сутки. В исследовании SMART выявлен риск, связанный с применением салметерола по сравнению с плацебо. Кроме того, бесспорным преимуществом формотерола является и то, что он начинает действовать сразу после ингаляции, а не через 2 часа, как салметерол.[24]
Концепция гибкого дозирования препарата
Недостатком концепции ступенчатого подхода является то, что он чётко не подразумевает достижение цели (снижение частоты приступов, ночных симптомов, снижение частоты обострений, облегчение физической активности), а просто диктует определённую дозу базисной терапии при той или иной степени выраженности симптомокомплекса. Исследования в Европе и Америке показали, что уровень контроля над симптомами астмы даже в странах с развитой системой здравоохранения невысок.
Концепция гибкого дозирования проверялась в исследованиях с препаратом симбикорт (будесонид 80 или 160 мкг + формотерол 4,5 мкг). Безопасно ингалироваться симбикортом до 8 раз в сутки, поэтому если возникает необходимость увеличить дозу ИГКС, можно просто увеличить число ингаляций препарата. Ингаляция симбикорта обеспечивает незамедлительный бронхолитический эффект и увеличение дозы ИГКС. Пациент после обучения может сам регулировать свою дозу ИГКС, применяя симбикорт то чаще, то реже — от 1 до 8 раз в день. Таким образом концепция гибкого дозирования заключается в том, что пациент начинает лечение со средних доз симбикорта и затем, исходя из собственного самочувствия, повышает или снижает дозу с помощью одного и того же ингалятора.
Авторы концепции гибкого дозирования выдвигают следующие тезисы:
- Гибкое дозирование более удобно для больного.
- Можно уменьшить общую дозу ИГКС, так как после улучшения состояния больной быстро уменьшает число ингаляций, а значит, можно снизить риск НЛР при использовании ИГКС.
- Снижается общая стоимость лечения.
- Снижается количество обострений, поскольку временное увеличение дозы симбикорта позволяет предотвратить их развитие.
Проведённые рандомизированные клинические исследования, посвящённые гибкому дозированию симбикорта, свидетельствуют, что применение гибкого дозирования позволяет быстрее достичь контроля над симптомами астмы по сравнению с фиксированными дозами препаратов, существенно снизить частоту обострений астмы, уменьшить материальные затраты на лечение. В ряде исследований сравнивали симбикорт в режиме гибкого дозирования и серетид, лучшие результаты принадлежат симбикорту. Так же теоретически для гибкого дозирования могут быть использованы и другие препараты, но в настоящее время не имеется данных независимых многоцентровых рандомизированых исследований, об эффективности их применения.[24]
Глюкокортикостероиды для системного применения
Глюкокортикостероиды для системного применения или системные глюкокортикостероиды (СГКС) могут применяться внутривенно небольшими дозами при обострениях астмы, перорально короткими курсами или длительно. Значительно реже используется внутривенное введение больших доз СГКС (пульс-терапия).
СГКС могут применяться длительно при неэффективности ингаляционных глюкокортикостероидов. При этом бронхиальная астма характеризуется как стероидозависимая и присваивается тяжёлое течение заболевания.
Побочные действия СГКС включают остеопороз, артериальную гипертензию, сахарный диабет, подавление функциональной активности гипоталамо-гипофизарно-надпочечниковой системы, катаракту, глаукому, ожирение, истончение кожи с образованием стрий и повышенной капиллярной проницаемостью, мышечную слабость. С момента назначения СГКС следует начать терапию по предупреждению остеопороза. Для перорального применения используются преднизон, преднизолон, метилпреднизолон (Метипред), гидрокортизон. Эти препараты обладают меньшими, чем другие ГКС, минералокортикоидной активностью, нерезко выраженным действием на поперечнополосатую мускулатуру и относительно коротким периодом полувыведения. Длительный прием препарата триамцинолон (Полькортолон) чреват побочными эффектами, такими как развитие мышечной дистрофии, похудание, слабости, поражения желудочно-кишечного тракта. Дексаметазон не применяется длительно перорально при бронхиальной астме из-за выраженного подавления функции коры надпочечников, способности задерживать жидкости и низкого сродства к лёгочным рецепторам ГКС.
Важным является установление причин, приведших к необходимости данного вида лечения. Вот перечень наиболее важных из них:
- ятрогенные
- неназначение ИГКС
- недооценка степени тяжести на предшествующих этапах
- попытка контроля воспаления в период обострения низкими дозами ГКС, что приводит к назначению системных ГКС на длительный срок
- применение неселективных и слабоселективных β-блокаторов (пропранолол, атенолол)
- неправильный подбор системы доставки для ИГКС
- некорректный диагноз бронхиальной астмы, где респираторные симптомы являются следствием другой патологии (системные васкулиты, системная склеродермия, дерматомиозит, бронхолёгочный аспергиллез, гастроэзофагеальная рефлюксная болезнь, истерия и т. д.)
- низкий комплайнс
- продолжающаяся экспозиция аллергенов
В 5 % случаев встречается стероидорезистентность (резистентность стероидных рецепторов к стероидным препаратам). Выделяют два типа пациентов:
- тип II — больные с истинной стероидной резистентностью, не имеющие побочных эффектов при длительном приеме высоких доз системных глюкокортикоидов
- тип I — пациенты с приобретённой резистентностью, имеющие побочные эффекты от приема системных стероидов; в этом случае резистентность скорее всего можно преодолеть повышением дозы ГКС и назначением препаратов, имеющих аддитивный эффект
При снижении дозы СГКС врач должен правильно оценить клиническую картину заболевания, предположить возможные причины стероидозависимости и назначить максимальные дозы высокоэффективных ИГКС. Обязателен контроль функций дыхания, ежедневная пикфлоуметрия и учет приема β2-агонистов по потребности. Следует снижать СГКС постепенно на фоне приема максимальных доз ИГКС, например уменьшая дозу не ранее чем каждые 3—4 нед, во избежание развития осложнений. Целесообразно при каждом уменьшении дозы проводить анализ крови (нарастание СОЭ и эозинофилии может свидетельствовать о проявлении системного заболевания, в том числе васкулита), исследовать базальный уровень кортизола, так как после прекращения длительной терапии подавляющими дозами СГКС возможно развитие надпочечниковой недостаточности. Снижать дозы ИГКС допускается только после полной отмены СГКС.[17]
Антилейкотриеновые препараты
В настоящее время известны следующие антагонисты лейкотриенов:
Препараты этой группы быстро устраняют базальный тонус дыхательных путей, создаваемый лейкотриенами вследствие хронической активации 5-липоксигеназной ферментной системы. Благодаря этому широкое применение эта группа препаратов получила при аспириновой бронхиальной астме, в патогенезе которой имеет место усиленная активация 5-липоксигеназной системы и повышенная чувствительность рецепторов к лейкотриенам. Антагонисты лейкотриенов особенно эффективны при этой форме астмы, терапия которой нередко вызывает трудности.
Зафирлукаст способствует достоверному улучшению по сравнению с плацебо показателей ОФВ1, ПСВ и устранению симптомов при добавлении к ИГКС.[25]
Применение монтелукаста в сочетании с ИГКС и пролонгированными β2-агонистами, особенно при наличии аллергического ринита, позволяет быстрее улучшить контроль над заболеванием, снизить дозу ИГКС.[13]
Недавно проведённое в Великобритании исследование показало, что антагонисты рецепторов к лейкотриенам также эффективны, как и ингаляторы, содержащие глюкортикостероиды. Антилейкотриеновые препараты, такие как Монтелукаст (Сингуляр) и Зафирлукаст (Аколат), подвергнулись рандомизированному контролируемому исследованию в группе из 650 больных бронхиальной астмой в течение 24 месяцев. Результаты исследования опубликованы в New England Journal of Medicine. Авторы исследования полагают, что применение антилейкотриеновых препаратов возможно у 4-х из 5 больных бронхиальной астмой, в особенности у тех пациентов, которые не хотят применять ГКС-ингаляторы из-за их побочных эффектов или из-за стероидофобии. [26]
Моноклональные антитела
Сравнительно недавно был разработан новый препарат — Омализумаб (фирмой Novartis производится под торговым названием Ксолар), представляющий концентрат антител к IgE. Ксолар связывает свободный IgE в крови, тем самым препятствуя дегрануляции и выходу БАВ, которые запускают ранние аллергические реакции.
Ксолар может применяться у лиц старше 12 лет со средней и тяжёлой формами персистирующей бронхиальной астмы, с аллергической астмой, триггерами которой являются круглогодичные аллергены, подтвержденной кожными тестами или исследованием специфического IgE.[1]
Препарат исследован в Study 1 и Study 2 с общим количеством пациентов 1071 в возрасте от 12 до 76 лет, получавших беклометазона дипропионат, разделённых на 2 группы (получавших подкожно ксолар или плацебо). Добавление Ксолара к имеющейся терапии ИГКС позволяют значительно снизить дозу ИГКС, сохранив при этом контроль над симптомами астмы. По данным Study 3, где в качестве ИГКС был выбран флутиказона пропионат, разрешалось добавлять к терапии длительнодействующие бронходилататоры, и в котором принимали участие более тяжелые пациенты, разницы между ксоларом и плацебо выявлено не было.[27]
β
2-адреномиметики длительного действияК β2-адреномиметикам длительного действия в настоящее время относят:
- формотерол (Оксис, Форадил)
- салметерол (Серевент)
- индакатерол
По данным исследования SMART определяется небольшое, но статистически значимое увеличение смертельных случаев в группе салметерола, связанных с респираторными осложнениями (24 по сравнению с 11 в группе плацебо; относительный риск [RR]=2,16; 95 % доверительный интервал [CI] составил 1,06—4,41), случаев смерти, обусловленных астмой (13 по сравнению с 3 в группе плацебо; RR=4,37; 95 % CI составил 1,25—15,34), а также комбинированных случаев смерти, связанных с астмой (37 по сравнению с 22 в группе плацебо; RR=1,71; 95 % CI составил 1,01—2,89).[28] При этом ряд исследований, в которых участвовал формотерол, демонстрировали безопасность формотерола в суточной дозе до 24 мкг как в отношении респираторных, так и сердечно-сосудистых осложнений.[29] В исследовании FACET, где использовался Оксис, выяснилось, что добавление формотерола снижает частоту лёгких и тяжелых приступов бронхиальной астмы как к низком дозам будесонида (на 26 % для тяжелых приступов и на 40 % для лёгких приступов), так и к высоким (высокие дозы будесонида без формотерола снижали частоту тяжелых приступов на 49 % и лёгких на 39 %, с формотеролом — соответственно на 63 и 62 %).[30]
β
2-адреномиметики короткого действия Беротек — короткодействующий β2-агонистАссортимент β2-адреномиметиков короткого действия представлен следующими препаратами:
Являются наиболее эффективными из существующих бронхолитиков, и поэтому им принадлежит первое место среди препаратов купирования острых симптомов астмы в любом возрасте. Предпочтителен ингаляционный путь введения, так как он обеспечивает более быстрый эффект при более низкой дозе и меньших побочных эффектах. Ингаляция β2-агониста обеспечивает выраженную защиту от бронхоспазма на фоне физической нагрузки и других провоцирующих факторов, в течение 0,5-2 ч.[1]
Ксантины
К ксантинам относят эуфиллин, используемый для экстренного купирования приступа и теофиллин с длительным действием, принимаемый перорально. Эти препараты использовались до β2-адреномиметиков и в некоторых ситуациях используются в настоящее время. Показана эффективность теофиллина в качестве монотерапии и терапии, назначаемой в дополнение к ИГКС или даже СГКС у детей в возрасте старше 5 лет. Он эффективнее плацебо, устраняет дневные и ночные симптомы и улучшает функцию лёгких, а поддерживающая терапия им обеспечивает защитный эффект при нагрузке. Добавление теофиллина у детей с тяжёлой астмой, позволяет улучшить контроль и снизить дозу ГКС. Предпочтение отдается препаратам замедленного высвобождения с изученным всасыванием и полной биодоступностью вне зависимости от приема пищи (Теопек, Теотард). В настоящее время терапия производными ксантинов имеет вспомогательное значение, как метод купирования приступов при малой эффективности, или отсутствии других групп препаратов.[1]
Препараты других групп
Отхаркивающие препараты улучшают отделение мокроты. Они, особенно при применении их через небулайзер, снижают вязкость мокроты, способствуют разрыхлению слизистых пробок и замедлению их образования. Для усиления эффекта при вязкой мокроте рекомендуется прием жидкости в объёме 3—4 л жидкости в сутки. Имеет эффект после приема отхаркивающих препаратов через небулайзер проведение постурального дренажа, перкуссионного и вибрационного массажа грудной клетки. В качестве основных отхаркивающих препаратов используют препараты йода, гвайфенезин, N-ацетилцистеин, амброксол.
Антибиотики используют при осложнении астмы бактериальными инфекциями, чаще всего это синуситы, бронхит и пневмония. У детей до 5 лет астма чаще осложняется вирусной инфекцией, в этих случаях антибиотики не назначают. В возрасте от 5 до 30 лет может быть микоплазменная пневмония, при этом назначают тетрациклин или эритромицин. Наиболее распространённый возбудитель пневмонии у лиц старше 30 лет — Streptococcus pneumoniae, против которого эффективны пенициллины и цефалоспорины. При подозрении на пневмонию обязательно проводят микроскопию мазка мокроты, окрашенного по Граму, и её посев.[15]
Аллергенспецифическая иммунотерапия (АСИТ)
Один из традиционных способов лечения бронхиальной астмы, влияющий на её иммунологическую природу. АСИТ обладает таким терапевтическим действием, которое распространяется на все этапы аллергического процесса и отсутствует у известных фармакологических препаратов. Действие АСИТ охватывает собственно иммунологическую фазу и приводит к переключению иммунного ответа с Th2-типа на Th1-тип, тормозит как раннюю, так и позднюю фазы IgE-опосредованной аллергической реакции, угнетает клеточную картину аллергического воспаления и неспецифическую тканевую гиперреактивность. Проводится пациентам от 5 до 50 лет при экзогенной бронхиальной астме. Через определённые промежутки времени вводят подкожно аллерген, постепенно увеличивая дозу. Продолжительность курса — не менее 3 месяцев. Наиболее эффективна АСИТ с аллергенами домашних клещей, тогда как АСИТ с аллергенами домашней пыли малоэффективна. Допускается одновременное использование не более 3 видов аллергенов, вводимых с интервалом не менее 30 минут.
Кроме аллергенов для лечения бронхиальной астмы также используются введения гистаглобулина. В течение последнего десятилетия вводятся в практику назальный и сублингвальный способы введения аллергенов. К настоящему времени в России зарегистрировано несколько видов оральных аллергенов для проведения АСИТ (пыльца деревьев, грибы, клещи).[31][32]
Использование небулайзеров
При бронхиальной астме важным моментом в осуществлении успешной терапии является доставка лекарственного препарата к очагу воспаления в бронхах, чтобы добиться этого результата нужно получить аэрозоль заданной дисперсности. Для этого применяются специальные аппараты, называемые небулайзерами, по сути представляющие собой ингалятор, производящий аэрозоль с частицами заданного размера. Общий принцип работы аппарата состоит в создании мелкодисперсного аэрозоля введённого в него вещества, который за счёт малых размеров частиц проникнет глубоко в мелкие бронхи, которые преимущественно и страдают от обструкции.
В России наиболее распространены 2 типа небулайзеров — ультразвуковые и компрессорные. Каждый из них имеет как свои достоинства, так и недостатки.
Ультразвуковые, более компактные и малошумные, пригодны для ношения с собой, с их помощью можно вводить масляные растворы. Компрессорные за счёт воздушного насоса относительно велики, они требуют стационарного питания от сети переменного тока, за счёт работы того же компрессора довольно шумные, но они обладают немаловажным достоинством, с их помощью можно вводить суспензии , и они примерно на 40—50 % дешевле аналогичных ультразвуковых моделей.[33]
Устранение факторов риска
Элиминация (устранение) факторов риска позволяет значительно улучшить течение заболевания. У пациентов с аллергической астмой в первую очередь имеет значение устранение аллергена. Имеются данные, что в городских районах у детей с атопической бронхиальной астмой индивидуальные комплексные мероприятия по удалению аллергенов в домах привели к снижению болезненности бронхиальной астмой.
Домашние клещи живут и размножаются в различных частях дома, поэтому полное их уничтожение невозможно. В одном из исследований показано, что использование чехлов для матрацев позволило несколько уменьшить бронхиальную гиперреактивность у детей. Использование чехлов, удаление пыли и уничтожение очагов обитания клещей показало уменьшение частоты симптомов в популяциях детей в детских домах.
Домашние животные. При наличии повышенной реактивности к шерсти животных следует удалить животных из дома, однако полностью избежать контакта с аллергенами животных невозможно. Аллергены проникают во многие места, в том числе в школы, транспорт и здания, в которых никогда не содержали животных.
Курение. Пассивное курение увеличивает частоту и тяжесть симптомов у детей, поэтому необходимо полностью исключить курение в комнатах, где бывают дети. Помимо увеличения выраженности симптомов астмы и ухудшения функции лёгких в отдалённом периоде, активное курение сопровождается снижением эффективности ИГКС, поэтому всем курящим пациентам следует настоятельно советовать бросить курить.
Грипп и другие инфекции. Необходимо проводить по возможности ежегодную вакцинацию против гриппа. Инактивированные гриппозные вакцины редко осложняются побочными эффектами и обычно безопасны у лиц с астмой старше 3 лет, даже при трудно поддающейся лечению астме. Больным следует обезопасить себя и от других инфекций (риниты, синуситы), особенно в холодное время года.
Лекарственные препараты. Больным с аспириновой астмой следует остерегаться приема аспирина и НПВП. Также нежелателен прием β-блокаторов, особенно неселективных.[1]
Немедикаментозное
Метод Бутейко — специально разработанный комплекс упражнений.
Сторонниками данного метода считается, что одна из причин, ведущих к развитию и усугублению симптомов бронхиальной астмы является снижение альвеолярной вентиляции углекислого газа. Основной задачей при лечении бронхиальной астмы с помощью дыхательной гимнастики Бутейко является постепенное повышение процентного содержания углекислого газа в воздухе лёгких, что позволяет за очень короткий срок уменьшить гиперсекрецию и отёк слизистой оболочки бронхов, снизить повышенный тонус гладких мышц стенки бронхов и тем самым устранить клинические проявления болезни. Метод включает применение дыхательных упражнений, направленных на уменьшение альвеолярной гипервентиляции и/или дозированную физическую нагрузку. Во время дыхательных упражнений пациенту предлагают с помощью различных дыхательных техник постепенно уменьшить глубину вдоха до нормы.[34]
Спелеотерапия (греч. speleon — пещера) — метод лечения длительным пребыванием в условиях своеобразного микроклимата естественных карстовых пещер, гротов, соляных копей, искусственно пройденных горных выработок металлических, соляных и калийных рудников.
Галотерапия (греч. hals — соль) метод лечения пребыванием в искусственно созданном микроклимате соляных пещер, где основным действующим фактором является высокодисперсный сухой солевой аэрозоль (галоаэрозоль).
Галотерапию широко применяют как в курортных, так и городских медицинских центрах. Аэрозоли солей тормозят размножение микрофлоры дыхательных путей, предотвращая развитие воспалительного процесса. Адаптация организма к специфическому микроклимату спелеокамеры сопровождается активацией симпатико-адреналовой системы, усилением выработки гормонов эндокринными органами. Увеличивается количество фагоцитирующих макрофагов и Т-лимфоцитов, уменьшается содержание иммуноглобулинов A, G и E, повышается лизоцимная активность сыворотки крови. У пациентов с бронхиальной астмой галотерапия способствует удлинению периода ремиссии и переходу пациента на более низкую степень тяжести, что влечёт за собой и возможность перехода к меньшим дозам и более щадящим средствам базисной медикаментозной терапии. [35]
Прогноз
Характер и отдалённый прогноз заболевания определяются возрастом, когда возникло заболевание. У подавляющего большинства детей с аллергической астмой болезнь протекает относительно легко, однако возможно возникновение тяжёлых форм бронхиальной астмы, выраженных астматических статусов и даже летальные исходы, особенно при недостаточной дозе базисной терапии. Отдалённый прогноз бронхиальной астмы, начавшейся в детском возрасте, благоприятен. Обычно к пубертатному периоду дети «вырастают» из астмы, однако, у них сохраняется ряд нарушений лёгочной функции, бронхиальная гиперреактивность, отклонения в иммунном статусе. Описаны случаи неблагоприятного течения бронхиальной астмы, начавшейся в подростковом возрасте.
Если заболевание началось в зрелом и пожилом возрасте, то характер развития и прогноз его более предсказуем. Тяжесть течения заболевания определяется, в первую очередь, его формой. Аллергическая астма протекает легче и прогностически более благоприятна. «Пыльцевая» астма как правило протекает легче, чем «пылевая». У заболевших в пожилом возрасте отмечается первично тяжёлое течение, особенно у больных с аспириновой бронхиальной астмой.
В целом заболевание является хроническим и медленно прогрессирующим, адекватное лечение может полностью устранять симптомы, но не влияет на причину их возникновения. Прогноз для жизни и трудоспособности при адекватной терапии условно благоприятный. Периоды ремиссии могут продолжаться в течение нескольких лет.[36]
Для того чтобы оценить, достигнут ли контроль над астмой, можно использовать Тест по контролю над астмой (ACT). В России этот тест одобрен Российским респираторным обществом, Союзом педиатров России, Российской ассоциацией аллергологов и клинических иммунологов. Тест разработан для регулярной оценки состояния, чтобы проверить, есть ли необходимость обратиться за консультацией к специалисту и изменить терапию. Существует как взрослый (с 12 лет), так и детский вариант Теста (с 4 до 11 лет). Представляет собой несколько вопросов в зависимости от ответа на которые начисляются баллы, их сумма указывает на уровень контроля заболевания.[37]
Альтернативная медицина и новые исследования
Гигиеническая гипотеза
Данная гипотеза была сформулирована в 1989 году Strachan D.P. (Hay fever, hygiene, and household size). Согласно гигиенической гипотезе, уменьшение контакта с бактериальными антигенами уменьшает возможность переключения сформировавшегося в антенатальном и неонатальном периоде Th2-клеточного иммунного ответа с преобладанием его над Th1-клеточным ответом в направлении сбалансированного соотношения Th1— и Th2-ответов, что способствует персистированию аллергического ответа. В менее развитых странах меньше астмы, чем в западном мире, потому что там ниже уровень гигиены и больше случаев инфекции. В западном мире, наоборот, всеобщая озабоченность чистотой ведёт к уменьшению подверженности детей микробам, и их иммунной системе не приходится справляться с потенциальными инфекциями.[38][39]
Генетическая гипотеза
В одном из исследований была показана ассоциация более ста генов с предрасположенностью к развитию астмы [40]. В конце 2005 было показано, что 25 генов ассоциируются с астмой в шести и более популяциях [40]. К ним относятся, например, гены интерлейкинов 4, 10, 13; фактора некроза опухолей и другие. Многие из них кодируют белки иммунной системы или модулируют воспаление. Однако даже для этих генов результаты исследований не имеют достаточной воспроизводимости среди всех исследованных популяций. Это указывает на то, что данные гены не ассоциированы с развитием астмы при всех условиях. Есть гипотеза, что астма — несколько различных заболеваний, и разные гены играют роль в разных типах. Например, было показано, что одно из генетических различий (однонуклеотидный полиморфизм 17q21) ассоциировано с развитием астмы в детстве [41].
Лечение с помощью антиконвульсантов
Показано, что противоэпилептические средства, такие как карбамазепин и вальпроаты при длительном применении могут предотвращать приступы астмы [42][43]. В связи с этим грузинской исследовательской группой под руководством Мераба Ломиа выдвигается теория о схожести патогенеза астмы и пароксизмальных расстройств (эпилепсия, невралгия тройничного нерва и мигрень) [44] и предлагается использовать эти препараты для поддерживающего лечения астмы.
Возможности раннего прогнозирования риска развития бронхиальной астмы
Одним из способов уменьшения распространённости, и тяжести течения бронхиальной астмы является доклиническая диагностика и первичная профилактика. Так как, задачей первичной профилактики является выявление лиц с признаками угрозы возникновения астмы, в рамках развития предиктивной медицины, ведутся многочисленные генетические исследования с целью выявления генов, ответственных за развитие астмы. Внедрение скриниговых методов исследования позволит выявить людей из группы высокого риска, в отношении которых, рационально, проводить более углубленное, в частности, генетическое обследование. По результатам проведённых исследований, станет возможным проведение всего спектра мер по первичной профилактике этого заболевания в отношении этих лиц[45] До настоящего времени, способа доклинической диагностики, основанного на анамнестическом методе исследования и оценивающего риск развития заболевания количественно, не существовало[46] В связи с этим, на созданный диагностический алгоритм был выдан патент на изобретение № 2275863 «Способ прогнозирования риска возникновения БА». Заявка № 2004136347. Приоритет изобретения 15 декабря 2004 года. Зарегистрировано в Государственном реестре изобретений Российской Федерации 10 мая 2006 года. Алгоритм обладает более высокой чувствительностью в случаях аллергической астмы, а также он высокочувствителен в отношении лиц, имеющих функциональные маркеры предрасположенности к БА, а также имеющих клинические проявления аллергии. Созданный алгоритм позволяет проводить обследования не только в семьях больных бронхиальной астмой, но может быть использован в качестве скринингового метода. Алгоритм прогнозирования риска возникновения бронхиальной астмы имеет практическую ценность для доклинической диагностики:
- алгоритм прост и удобен в применении;
- может использоваться не только «узкими» специалистами, но и врачами общей практики;
- может использоваться средним медицинским персоналом в кабинетах доврачебного осмотра;
- может использоваться при диспансерных и профилактических осмотрах;
- позволяет из большого числа опрашиваемых выделить группу лиц с высоким риском развития и субклиническими признаками астмы.
Алгоритм расчета вероятности возникновения астмы на основе опроса пациента.[47]
| N | Признак | «Да» |
| Присвоить результату значение «1» | ||
| 1 | Есть ли родственники, страдающие БА? | Умножить на 9 |
| 2 | Число больных родственников больше двух? | Умножить на 6 |
| 3 | Подверженность респираторным инфекциям (болеет 2 и более раз в году)? | Умножить на 4 |
| 4 | Страдает ли вазомоторным ринитом? | Умножить на 7 |
| 5 | Есть ли атопический дерматит, экзема, крапивница или другие аллергические синдромы? | Умножить на 3 |
| 6 | Есть ли заболевания ЖКТ или печени? | Умножить на 2 |
| 7 | Имеются ли пыльцевая или пылевая аллергия? | Умножить на 20 |
| 8 | Имеется ли пищевая аллергия? | Умножить на 6 |
| 9 | Имеется ли непереносимость антибиотиков? | Умножить на 2 |
| 10 | Имеется ли непереносимость анальгетиков или аспирина? | Умножить на 15 |
| 11 | Имеется ли профессиональная вредность? | Умножить на 3 |
| 12 | Результат умножить на 0,0526 | |
| 13 | Результат разделить на (результат+1) | |
| 14 | Результат умножить на 100% | |
| Полученное число является оценкой вероятности заболеть БА (в %), без учета этиологии | ||
Всемирный день борьбы с астмой
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 25 февраля 2012. |
Всемирный день борьбы с астмой учрежден Всемирной организацией здравоохранения и проводится ежегодно в первый вторник мая под эгидой GINA (Global Initiative for Asthma) — Глобальной инициативы по бронхиальной астме. Основной задачей дня борьбы с астмой является улучшение осведомленности врачей, пациентов и населения об этом заболевании, привлечение внимания общественности к решению проблем, связанных с астмой, и повышение качества медицинской помощи пациентам с астмой.
Впервые данный день стал отмечаться в 1998 году в более чем 35 странах и был приурочен ко Всемирному совещанию по бронхиальной астме (Барселона, Испания).
См. также
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 Глобальная стратегия лечения и профилактики бронхиальной астмы = Global Initiative for Asthma. — 2006. — 106 с.
- ↑ 1 2 3 4 Овчаренко С. И. Бронхиальная астма: диагностика и лечение. — РМЖ, 2002. — Т. 10. — № 17.
- ↑ 1 2 3 Т. В. Барановская. Лечение обострений бронхиальной астмы. Архивировано из первоисточника 18 августа 2011. Проверено 27 ноября 2008.
- ↑ Hippocrates. Aphorisms III.26
- ↑ Hippocrates. De Morbo Sacro 9
- ↑ De Medicina, Liber IV, 8
- ↑ De causis et signis diuturnorum morborum, I.XI
- ↑ Jackson Mark Asthma: the biography. — Oxford University Press. — ISBN 9780199237951
- ↑ Архив рубрики ‘История болезни астма’ (рус.). Архивировано из первоисточника 18 августа 2011. Проверено 1 ноября 2010.
- ↑ 1 2 3 4 5 6 7 Чучалин А. Г. Бронхиальная астма. — 1985.
- ↑ 1 2 M. Masoli, D. Fabian, S. Holt, R. Beasley. Global Burden of Asthma. — 2003. — 20 с.
- ↑ Б. А. Черняк, И. И. Воржева. Агонисты beta2-адренергических рецепторов в терапии бронхиальной астмы: вопросы эффективности и безопасности // Consilium Medicum. — 2006. — Т. 8. — № 10.
- ↑ 1 2 3 4 5 6 7 Бронхиальная астма – проблемы и достижения. По материалам 15-го ежегодного конгресса европейского респираторного общества // «Клиническая иммунология. Аллергология. Инфектология». Издательский дом «Здоров’я України». — 2005. — № 1.
- ↑ Употребление алкоголя снижает риск заболевания астмой, исследование учёных Европейского респираторного общества.
- ↑ 1 2 3 4 5 6 7 8 Г. Лолор-младший, Д. Тэшкин. Клиническая иммунология и аллергология. Глава 7. Бронхиальная астма.. Официальный сайт иммунологической службы Тверской области. Архивировано из первоисточника 18 августа 2011. Проверено 24 ноября 2008.
- ↑ В. Е. Ноников Антибактериальная терапия при инфекционно-зависимой бронхиальной астме // Consilium Medicum. — 2002. — Т. 4. — № 9.
- ↑ 1 2 3 4 5 Н. П. Княжеская, М. О. Потапова Глюкокортикостероидная терапия бронхиальной астмы // Consilium-Medicum. — 2003. — Т. 5. — № 4.
- ↑ Sontag S.J. Gastroesophageal reflux disease and asthma. J. Clin. Gastroenterol. 2000 Apr; 30 (3 Suppl): p. 9-30. (англ.)
- ↑ Бейтуганова И. М., Чучалин А. Г. Рефлюкс-индуцированная бронхиальная астма // РМЖ. — 1998. — Т. 6. — № 17.
- ↑ Г. Б. Федосеев Классификация бронхиальной астмы. Вклад академика А. Д. Адо и профессора П. К. Булатова в формирование представления о бронхиальной астме. Архивировано из первоисточника 18 августа 2011. Проверено 4 декабря 2008.
- ↑ Ю. И. Фещенко Основные принципы современного лечения бронхиальной астмы.
- ↑ ИГКС — ингаляционные глюкокортикостероиды.
- ↑ С. Ю. Терещенко, Н. А. Смирнов, С. В. Бычковская, С. Н. Буйнова, Т. Г. Голосова, И. В. Петрова Эффективность различных режимов поддерживающей противовоспалительной терапии при легком/среднетяжёлом течении бронхиальной астмы у детей. Результаты проспективного многоцентрового рандомизированного исследования кадет (контролируемая астма у детей) // Аллергология. — 2006. — № 2.
- ↑ 1 2 А. Н. Цой, В. В. Архипов Бронхиальная астма. Комбинированная терапия бронхиальной астмы: перспективы гибкого дозирования препарата. // Consilium-Medicum. — 2004. — Т. 6. — № 10.
- ↑ Княжеская Н. П. Аспириновая бронхиальная астма и антагонисты лейкотриенов // РМЖ. — 2000. — Т. 8. — № 12.
- ↑ Asthma Pill As Effective As Inhalers And Easier To Use
- ↑ XOLAIR. Omalizumab for subcutaneal use. Архивировано из первоисточника 18 августа 2011. Проверено 3 декабря 2008.
- ↑ Harold S. Nelson, MD; Scott T. Weiss, MD, MS; Eugene R. Bleecker, MD; Steven W. Yancey, MS; Paul M. Dorinsky, MD; the SMART Study Group The Salmeterol Multicenter Asthma Research Trial // Chest. — 2006.
- ↑ Н. П. Княжеская, М. О. Потапова Пролонгированный бета2-агонист формотерол (Форадил) в терапии бронхиальной астмы и хронической обструктивной болезни лёгких // Medlinks.ru.
- ↑ Pauwels R. A., Löfdahl C. G., Postma D. S., et al. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group. Effect of inhaled formoterol and budesonide on exacerbations of asthma // N Engl J Med. — 1997; 337:1405—11.
- ↑ Аллерген-специфическая иммунотерапия. Medlinks.ru. Архивировано из первоисточника 18 августа 2011. Проверено 3 декабря 2008.
- ↑ М. М. Маркатун Аллерген-специфическая иммунотерапия при аллергии и бронхиальной астме. Аллерголог.ру — Аллергия и Астма. Архивировано из первоисточника 18 августа 2011. Проверено 3 декабря 2008.
- ↑ Небулайзерная терапия
- ↑ А. Е. Новожилов Описание метода Бутейко. Клиника Бутейко. Архивировано из первоисточника 18 августа 2011. Проверено 4 декабря 2008.
- ↑ А. В Червинская,А.Я. Накатис Современные стандарты применения соляных пещер в реабилитационной и восстановительной медицине. Курортные ведомости. Архивировано из первоисточника 18 августа 2011. Проверено 2005 №.4(31) — С.48-49..
- ↑ Г. Б. Федосеев, М. А. Петрова Бронхиальная астма. Современные представления. Мир Медицины. Архивировано из первоисточника 18 августа 2011. Проверено 3 декабря 2008.
- ↑ Тест по контролю над астмой. Архивировано из первоисточника 18 августа 2011.
- ↑ Астма. Лечение астмы. Киевский городской аллергоцентр.(недоступная ссылка — история)
- ↑ Инфекционные заболевания, перенесённые в раннем детском возрасте, не предотвращают развитие аллергии. Antibiotic.ru. Архивировано из первоисточника 18 августа 2011.
- ↑ 1 2 Ober C,Hoffjan S (2006). «Asthma genetics 2006: the long and winding road to gene discovery». Genes Immun 7 (2): 95–100. DOI:10.1038/sj.gene.6364284. PMID 16395390.
- ↑ Bouzigon E, Corda E, Aschard H, et al (October 2008). «Effect of 17q21 Variants and Smoking Exposure in Early-Onset Asthma». The New England journal of medicine. DOI:10.1056/NEJMoa0806604. PMID 18923164.
- ↑ Bronchial asthma as neurogenic paroxysmal inflammatory disease: A randomized trial with carbamazepine Respiratory Medicine Volume 100, Issue 11 , Pages 1988-1996, November 2006
- ↑ Bronchial asthma as neurogenic paroxysmal inflammatory disease: Do some antiepileptic drugs have antiasthmatic properties? Medical Hypotheses Volume 69, Issue 4 , Pages 858-859, 2007
- ↑ Бронхиальная астма как нейрогенное воспалительное пароксизмальное заболевание: теория и практика
- ↑ Федосеев Б. Г., Петрова М. А., Трофимов В. И., Углева Е. М. Возможности доклинической диагностики и математического прогнозирования риска возникновения бронхиальной астмы. — 2005. — № 2. — С. 35-40.
- ↑ Углева Е. М., Петрова М. А., Разумовская Т. С. Возможности математического прогнозирования риска возникновения бронхиальной астмы. — 2004. — № 2. — С. 63-68.
- ↑ Углева, Елена Михайловна. Возможности раннего прогнозирования риска развития бронхиальной астмы. Диссертация на соискание звания кандидата медицинских наук. 14.00.43. — ГОУВПО «Санкт-Петербургский государственный медицинский университет», 2007. — 172 с.
Литература
- Исаев Ю., Мойсюк Л. Бронхиальная астма. Конвенциональные и неконвенциональные методы лечения. — М.: «КУДИЦ-ПРЕСС», 2008. — С. 168.
- под ред. Чучалина. Глобальная стратегия лечения и профилактики бронхиальной астмы. — М.: «Атмосфера», 2007. — С. 104.
- Солопов В. Н. Астма. Истинная причина болезни. — М.: «Европолиграфик», 2006. — С. 160.
Ссылки
| Болезни органов дыхания (J00—J99), респираторные заболевания | |
|---|---|
| Болезни верхних дыхательных путей (также Инфекции верхних дыхательных путей, Простуда) | |
| Голова | Придаточные пазухи носа: Синусит Нос: Ринит (Вазомоторный ринит, Атрофический ринит, Сенная лихорадка) · Полип носа · Искривление носовой перегородки Миндалины: Тонзиллит (острый, хронический) · Аденоиды · Паратонзиллярный абсцесс · Ангина Людвига |
| Шея | Глотка: Фарингит (Острый фарингит) Гортань: Ларингит · Круп · Ларингоспазм Голосовые связки: Узелки голосовых связок Надгортанник: Эпиглоттит Трахея: Трахеит · Стеноз трахеи |
| Болезни нижних дыхательных путей | |
| Болезни бронхов | острые: Острый бронхит хронические: Хронический бронхит · ХОБЛ · Эмфизема лёгких · Диффузный панбронхиолит · Бронхиальная астма (Астматический статус, Аспириновая бронхиальная астма, Бронхиальная астма тяжелого течения) · Бронхоэктатическая болезнь неуточнённые: Бронхит · Бронхиолит (Облитерирующий бронхиолит) |
| Пневмония | по возбудителю: Вирусная (ТОРС) · Бактериальная (Пневмококковая) · Микоплазменная · Лёгочные микозы (Аспергиллёз) · Паразитическая (Пневмоцистная) по механизму возникновения: Химическая пневмония (Синдром Мендельсона) · Аспирационная пневмония · Госпитальная пневмония · Внебольничная пневмония |
| Интерстициальные болезни лёгких | Саркоидоз · Идиопатический фиброзирующий альвеолит · Экзогенный аллергический альвеолит · Лёгочный альвеолярный протеиноз · Альвеолярный микролитиаз |
| Пневмокониоз (Асбестоз, Баритоз, Бокситный фиброз, Бериллиоз, Синдром Каплана, Халикоз, Лёгкое угольщика, Сидероз, Силикоз) Гиперсенситивный пневмонит (Багассоз, Биссиноз, Лёгкое птицевода, Лёгкое фермера) | |
| Другие болезни лёгких | ОРДС · Отёк лёгких · Эозинофильная пневмония · Аллергический бронхолёгочный аспергиллёз · Ателектаз · Лёгочная эмболия · Лёгочная гипертензия |
| Болезни плевры и средостения | |
| Гнойные заболевания | Абсцесс лёгкого · Эмпиема плевры |
| Болезни плевры | Плеврит · Пневмоторакс · Лёгочный выпот (Гидроторакс, Гемоторакс, Хилоторакс) |
| Болезни средостения | Медиастинит · Опухоли средостения · Эмфизема средостения (Спонтанная эмфизема средостения) |
Основные трудные и нерешенные вопросы клиники и лечения бронхиальной астмы
Информация только для специалистов в сфере медицины, фармации и здравоохранения!
- определение бронхиальной астмы
- классификация и индивидуальная диагностика бронхиальной астмы
- распространенность и регистрируемая заболеваемость бронхиальной астмой
- базисная и индивидуальная терапия бронхиальной астмы.
От определения бронхиальной астмы (БА) зависит ее нозологическая диагностика и выбор оптимальной терапии. В соответствии с международным консенсусом в докладе ВОЗ «Глобальная стратегия по лечению и профилактике астмы» (1993) дается следующее определение БА: «Астма представляет собой хроническое заболевание, основой которого является воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов, в особенности тучных клеток, эозинофилов и Т-лимфоцитов.
У предрасположенных лиц этот процесс вследствие связанного с ним усиления реакции дыхательных путей на различные раздражители вызывает, преимущественно в ночное и/или раннее утреннее время, рецидивирующие эпизоды свистящих хрипов, затруднения дыхания, кашля и заложенности в груди. Эти симптомы, как правило, обусловлены распространенной, разной степени выраженности бронхиальной обструкцией, полностью или частично обратимой либо спонтанно, либо под воздействием лечения».
Хотя это определение и содержит основные характеристики, присущие БА, но оно не пригодно для целей практической диагностики, так как в нем отсутствуют клинические критерии, определяющие наличие у больного БА. Пользуясь этим определением, можно поставить диагноз «бронхиальная астма» при самых различных патологических состояниях, таких, как хронический бронхит, туберкулез легких, бронхоэктатическая болезнь и др.
Признавая соответствие приведенного выше определения современному научному представлению о БА, мы считаем, что его хорошо расшифровывает для клинической практики определение, одобренное на IV Всероссийском конгрессе по болезням органов дыхания (Москва, 1994г.): «Бронхиальная астма — самостоятельное заболевание, в основе которого лежит хроническое воспаление дыхательных путей, сопровождающееся изменением чувствительности и реактивности бронхов, которые вызваны специфическими (иммунологическими) и/или неспецифическими, врожденными или приобретенными механизмами, и проявляющееся приступами удушья, астматическим статусом или, при отсутствии таковых, симптомами дыхательного дискомфорта (приступообразный кашель, дистантные хрипы и одышка), сопровождающегося обратимой бронхиальной обструкцией на фоне наследственной предрасположенности к аллергическим заболеваниям, внелегочных признаков аллергии, эозинофилии крови и/или эозинофилов в мокроте».
Следующий вопрос касается классификации и индивидуальной диагностики БА. В Х пересмотре международной классификации болезней (МКБ-10) ВОЗ (Женева, 1992) приводится классификация БА:
45. Астма
- 0. Преимущественная аллергическая астма
- Аллергический бронхит
- Аллергический ринит с астмой
- Атопическая астма
- Экзогенная аллергическая астма
- Сенная лихорадка с астмой
- 1. Неаллергическая астма
- Идиосинкразическая астма
- Эндогенная неаллергическая астма
- 8. Смешанная астма
- 9. Неуточненная астма
- Астматический бронхит
- Поздно возникшая астма
46. Астматический статус
-
Острая тяжелая астма
- Этапы развития бронхиальной астмы
- Биологические дефекты у практически здоровых людей
- Состояние предастмы
- Клинически выраженная бронхиальная астма
- Биологические дефекты у практически здоровых людей
- Клинико-патогенетические варианты бронхиальной астмы
- Атопический
- Инфекционно-зависимый
- Аутоиммунный
- Дисгормональный (гормонозависимый)
- Дизовариальный
- Выраженный адренергический дисбаланс
- Холинергический
- Нервно-психический
- Аспириновый
- Первично-измененная реактивность бронхов
- Атопический
- Тяжесть течения бронхиальной астмы
- Легкое течение
- Течение средней тяжести
- Тяжелое течение
- Легкое течение
- Фазы течения бронхиальной астмы
- Обострение
- Нестабильная ремиссия
- Ремиссия
- Стойкая ремиссия (более 2 лет)
- Обострение
- Осложнения
- Легочные: пневмоторакс, ателектаз, легочная недостаточность и др.
- Внелегочные: легочное сердце, сердечная недостаточность и др.
- Легочные: пневмоторакс, ателектаз, легочная недостаточность и др.
В клинике госпитальной терапии СПбГМУ им. акад. И.П.Павлова и ГНЦП МЗ России было проведено тщательное исследование 260 больных БА, в результате которого удалось выделить 26 групп, объединяющих больных с однотипными комбинациями клинико-патогенетических вариантов течения заболевания.
Из полученных при этом данных могут быть сделаны следующие выводы: больные бронхиальной астмой по характеру течения болезни очень разнородны; у большинства больных имеется сочетание нескольких клинико-патогенетических вариантов; анализ диагностических приемов, необходимых для выявления клинико-патогенетических вариантов, убеждает в возможности диагностики в условиях общеврачебной практики.
Клинико-патогенетические варианты БА могут быть при необходимости распределены по рубрикам международной классификации: атопическая астма с указанием причиннозначимых аллергенов может быть отнесена в рубрику 45.0, все остальные клинико-патогенетические — в рубрику 45.1. Сочетание вариантов относится к рубрике 45.8. В тех случаях, когда клинико-патогенетический вариант диагностировать не удается, используется рубрика 45.9.
Следующий вопрос — распространенность и регистрируемая заболеваемость БА. Распространенность БА, изученная на основании рекомендованных ВОЗ вопросников, колеблется в разных странах по данным разных авторов в широких пределах: 1% до 12,2% (А.Г.Чучалин, 1997).
В Ленинграде и в Санкт-Петербурге в течении ряда дет изучались показатели заболеваемости аллергическими болезнями по данным обращаемости и по данным эпидемиологического исследования. Было установлено, что только около 20% больных бронхиальной астмой, 2,5% больных крапивницей, 20% аллергическим ринитом обращаются за врачебной помощью в свои поликлиники. Отсутствие своевременного и полноценного лечения приводит к тому, что к моменту обращения за врачебной помощью БА приобретает тяжелое течение у 20% больных и течение средней тяжести — у 50% больных (Ю.В. Лишукович, 1996). БА сокращает среднюю продолжительность жизни у мужчин на 6,6 года и женщин — на 13,5 лет.
Для проверки возможности успешного лечения больных бронхиальной астмой в поликлинических условиях в 5 поликлиниках в разных районах Санкт-Петербурга в течении двух лет был проведен организационно-клинический эксперимент. В каждой поликлинике был выделен один территориальный терапевтический участок для проведения намеченного исследования. Общая численность взрослого населения экспериментальных участков составляла 9057 человек. Для организации и постоянной курации больных бронхиальной астмой были выделены высококвалифицированные врачи — преподаватели кафедры госпитальной терапии СПбГМУ им. акад. И.П.Павлова, которые были прикреплены к участковым терапевтам. Все больные бронхиальной астмой были поставлены на диспансерный учет и регулярно наблюдались по индивидуальной программе.
Полученные в процессе эксперимента результаты представляют несомненный интерес. За год активного, квалифицированного лечения больных показатель экстренной госпитализации сократился в 2,1 раза. За второй год эксперимента общий показатель экстренной госпитализации сократился еще на 12%. Существенно улучшились показатели, характеризующие временную нетрудоспособность. Так, если до начала число случаев временной нетрудоспособности в расчете на 100 работающих больных бронхиальной астмой составляло 100, а средняя продолжительность 1 случая временной нетрудоспособности была 23 дня, то через 2 года эксперимента общее число случаев временной нетрудоспособности на 100 работающих больных составляло 47,5, а средняя продолжительность 1 случая сократилась до 19,6 дней.
Интересные данные в ходе эксперимента были получены в отношении больных с бесприступным течением бронхиальной астмы. До начала эксперимента на всех участках было зарегистрировано только 5 таких больных. К концу первого года работы по программе эксперимента число больных с бесприступным течением бронхиальной астмы составило 32 человека, а к концу второго года — 67 человек. Таким образом, истинная распространенность бесприступного течения бронхиальной астмы в 13 раз превышает зарегистрированную до эксперимента.
Результаты проведенного организационно-клинического эксперимента убедительно свидетельствуют о том, что и в условиях врачебного поликлинического участка высокопрофессиональная работа врача может приводить к ощутимым положительным результатам в деле лечения больных бронхиальной астмой.
Врачи рассказывают, могут ли прививаться от COVID-19 люди с астмой и страдающие сезонной аллергией
Весеннее солнце, долгожданное тепло, первая зелень — душа радуется. Но не у всех. Сезонные аллергии. Миллионы людей им подвержены. А в нынешние времена проблема двойная. Обострение аллергии и COVID-19, который, благодаря массовой вакцинации, отступает. но ведь угроза все еще острая. В общем, весна испытывает на прочность.
Первое, что слышат врачи после: «Доктор, здравствуйте». В кабинетах аллергологов по всей стране тысячи пациентов, и у каждого свои причины привиться от коронавируса.
В профильных диагностических центрах больше, чем рядовые консультации. Врачи против интернета и слухов о том, что аллергикам или астматикам категорически противопоказана вакцина от COVID-19.
«Высокое заблуждение, что аллергические реакции являются противопоказанием для проведения вакцинации. Это не является противопоказанием. Но есть единственное условие — вакцинацию мы проводим вне периода обострения любого заболевания. И вне сезона цветения аллергенов», — говорит зав. отделением Центра аллергологии и иммунологии ГКБ №52 Москвы Елена Бобрикова.
Аллергия у Марины Лебедкиной обострилась сейчас, но прививку она успела сделать зимой. Медики успокоили: никакой дополнительной угрозы нет. После уколов разве что чуть дольше провела под наблюдением врачей.
«К моему удивлению, у меня не было ничего, побочных явлений. Ни после первого, ни после второго компонента. Я чувствовала себя прекрасно. Хотелось обезопасить себя и своих близких от такой напасти», — поясняет Марина Лебедкина.
От этой напасти уже защитили себя многие россияне. И медики делятся наблюдениями о возможной аллергической реакции у группы риска.
«И аллергики, и с крапивницей хорошо переносили вакцинацию», — отмечает врач аллерголог-иммунолог Центра аллергологии и иммунологии ГКБ №52 Москвы Елена Ковалькова.
Когда прививаться — вопрос, конечно, индивидуальный. Многие изучают сводки с аллергического фронта.
«Ольха, сейчас самый высокий период идет, скоро должна закончиться, потом начнется береза сразу», — говорит Максим Макеев.
Максим пока что отбивает атаки одну за другой. И ждет, когда можно будет сделать прививку.
«Организм направлен на борьбу с другими симптомами, с другой болезнью, поэтому иммунитет ослаблен. Ближе к лету, может быть, там посмотрю», — полагает он.
В Москве, казалось бы, весна задерживается, но ученые уже фиксируют начало сезона аллергенов.
«Сезон в этом году опаздывает недели на две. Состав тот же самый, стабильный. Ольха и орешник сейчас пылят», — рассказывает ведущий научный сотрудник биологического факультета МГУ им. М.В. Ломоносова Светлана Полевова.
Как сегодня обезопасить себя? На шквал таких вопросов уральские медики решили ответить в духе времени — курсы для аллергиков и астматиков на удаленке. Пульмонологи, аллергологи, иммунологи выходят с лекциями онлайн.
Заявки на участие приходят со всей страны, от Владивостока до Астрахани. Нигде ведь нет точной инструкции по вакцинации аллергиков. Но есть врачи, которые делятся опытом.
«С каждым прожитым днем эпидемии у нас накапливается все больше и больше мнений. В этом нам помогали наши же пациенты, задавая нам вопросы на приеме. И именно из этого такое получилось, сформировалось понимание, чего же хочет пациент, и чем мы ему можем быть полезны», — рассказывает зав. отделением аллергологии и иммунологии ЦГКБ № 6 г. Екатеринбурга Анна Петухова.
За год пандемии врачи и ученые вообще накопили удивительные знания. Пациенты с аллергией и астмой раньше опасались, что с их заболеваниями гарантирован COVID-19 в тяжелой форме.
«Уже доказано, что та терапия, которая назначается при аллергическом заболевании, оказывает положительный эффект на течение коронавирусной инфекции. Инфекция может присоединяться намного меньше и намного благоприятнее исход заболевания», — говорит зав. лабораторией НИИ вакцин и сывороток имени И.И. Мечникова Михаил Костинов.
Это, конечно, не повод чихать на коронавирус, тем более когда все вокруг цветет и пахнет. Но по крайней мере понятно, что можно не бояться, и вакцинация для людей с аллергией или астмой вопрос времени.
Бронхиальная астма
Бронхиальная астма.
За последние два десятка лет заболеваемость по бронхиальной астме выросла, и на сегодняшний день в мире около 300 миллионов людей, которые страдают ею. Это одно из самых распространенных хронических заболеваний, которому подверженные все люди, вне зависимости от пола, возраста и социальной группы. Наиболее подвержены болезни дети. Смертность среди больных бронхиальной астмой достаточно высока. Тот факт, что в последние двадцать лет заболеваемость бронхиальной астмой у детей постоянно растет, делает бронхиальную астму не просто болезнью, а социальной проблемой, на борьбу с которой направляется максимум сил.
Бронхиальная астма – это хроническое неинфекционное заболевание дыхательных путей воспалительного характера. Хронические воспалительные процессы в органах дыхания ведут к их гиперактивности, в результате которой при контакте с аллергенами или раздражителями, мгновенно развивается обструкция бронхов, что ограничивает скорость потока воздуха и вызывает удушье. Приступы удушья наблюдаются с разной периодичностью.
Несмотря на сложность, бронхиальная астма хорошо поддается лечению, благодаря которому можно добиться стойкой и длительной ремиссии. Постоянный контроль над своим состоянием позволяет пациентам полностью предотвратить наступление приступов удушья, снизить или исключить прием препаратов для купирования приступов, а так же вести активный образ жизни. Это помогает поддержать функции легких и полностью исключить риск осложнений.
Самыми распространенными аллергенами являются бытовые аллергены – это домашняя и книжная пыль, корм для аквариумных рыбок и перхоть животных, аллергены растительного происхождения и пищевые аллергены, которые еще называют нутритивными. У 20-40% больных бронхиальной астмой выявляется сходная реакция на лекарственные препараты, а у 2% болезнь получена вследствие работы на вредном производстве или же, например, в парфюмерных магазинах.
Классификация бронхиальной астмы
По происхождению:
• бронхиальная астма аллергическая
• бронхиальная астма неаллергическая
• бронхиальная астма смешанная
• бронхиальная астма неуточненная
По состоянию:
• обострение
• ремиссия
• нестабильная ремиссия
• стабильная ремиссия
По уровню контроля:
• контролируемая
• частично контролируемая
• неконтролируемая
Симптоматика бронхиальной астмы
Приступ удушья при бронхиальной астме делится на три периода: период предвестников, период разгара и период обратного развития. Период предвестников наиболее выражен у пациентов с инфекционно-аллергической природой БА, он проявляется вазомоторными реакциями со стороны органов носоглотки (обильные водянистые выделения, непрекращающееся чихание). Второй период (он может начаться внезапно) характеризуется ощущением стесненности в грудной клетке, которое не позволяет дышать свободно. Вдох становится резким и коротким, а выдох наоборот продолжительным и шумным. Дыхание сопровождается громкими свистящими хрипами, появляется кашель с вязкой, трудно отхаркиваемой мокротой, что делает дыхание аритмичным.
Во время приступа положение пациента вынужденное, обычно он старается принять сидячее положение с наклоненным вперед корпусом, и найти точку опоры или опирается локтями в колени. Лицо становится одутловатым, а во время выдоха шейные вены набухают. В зависимости от тяжести приступа можно наблюдать участие мышц, которые помогают преодолеть сопротивление на выдохе.
Осложнения бронхиальной астмы
В зависимости от тяжести и интенсивности приступов удушья бронхиальная астма может осложняться эмфиземой легких и присоединением вторичной сердечно-легочной недостаточности. Передозировка бета-адреностимуляторов или быстрое снижение дозировки глюкокортикостероидов, а так же контакт с массивной дозой аллергена могут привести к возникновению астматического статуса, когда приступы удушья идут один за другим и их практически невозможно купировать. Астматический статус может закончиться летальным исходом.
Поскольку бронхиальная астма является хроническим заболеванием вне зависимости от частоты приступов, то основополагающим моментом в терапии является исключение контакта с возможными аллергенами, соблюдение элиминационных диет и рациональное трудоустройство. Если же удается выявить аллерген, то специфическая гипосенсибилизирующая терапия помогает снизить реакцию организма на него.
Для купирования приступов удушья применяют лекарственные препараты в форме аэрозоля, для того чтобы быстро увеличить просвет бронхов и улучшить отток мокроты. Доза в каждом случае подбирается индивидуально.
Особенность лечения бронхиальной астмы в том, что нужно использовать лекарственные препараты в минимальной эффективной дозе и добиваться еще большего снижения дозировок. Для лучшего отхождения мокроты показаны отхаркивающие и муколитические препараты. Так же необходимо проводить своевременно лечение сопутствующих заболеваний – хронических бронхитов, бронхопневмоний.
Профилактика и прогноз при бронхиальной астме
Течение бронхиальной астмы состоит из череды обострений и ремиссий, при своевременном выявлении можно добиться устойчивой и длительной ремиссии, прогноз же зависит в большей степени от того, насколько внимательно пациент относится к своему здоровью и соблюдает предписания врача.
Большое значение имеет профилактика бронхиальной астмы, которая заключается в санации очагов хронической инфекции, борьбе с курением, а так же в минимизации контактов с аллергенами. Это особенно важно для людей, которые входят в группу риска или имеют отягощенную наследственность.
Назад
Тяжелая астма | Американская ассоциация легких
Ваш врач должен обсудить с вами тесты и варианты лечения, чтобы вместе вы могли принять решение, основанное на том, что, по вашему мнению, будет наиболее эффективным для вас.
Ниже представлена диаграмма, в которой описаны биомаркеры тяжелой астмы, метод тестирования, тип (или фенотип) и возможные варианты лечения для таргетной терапии.
Биомаркер | Метод тестирования | Фенотип | Доступные методы лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
IgE * Кровь | Кожа раннее начало) | Омализумаб | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Эозинофил | Кровь | Эозинофильный (позднее начало) | Мепс ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нейтрофил | Мокрота | Нейтрофильный | Антибиотики Изменения образа жизни |
| Случай 1 | Случай 2 | Случай 3 | Случай 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Пол | Мужчина | Женщина | Мужчина | Мужчина | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Возраст (лет) 66 | 54 | 63 | 83 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Курение (количество лет) | Exsmoker (50) | Exsmoker (12) | Exsmoker (160) | Exsmoker (30) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Предыдущее диагноз астмы | Да, в возрасте 20 лет | Да, в возрасте 12 лет | Нет | Нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История аллергии | Аллергия на пыльцу, клещей, грибок, эпителий собак и кошек | Непереносимость НПВП.Полипоз носа. Аллергия на домашнюю пыль клещи | № | № | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IgE (Ед / мл) | 434 | 124 | 22 | 1978 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FVC, мл FVC,% FEV1, мл FEV1, % ОФВ1 / ФЖЕЛ% BDT | 3160 88 1430 51 45 Положительный, 12% и 220 мл 3 раза | 2260 87 1320 61 58 Положительный, 14% и 210 мл 2 раза | 3150 71 1700 53 54 Положительный, 21% и 300 мл | 2350 77 1550 68 65 Положительный, 14% и 440 мл 2 раза | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Одышка (mMRC) | 2 степень | 1 степень | 3 степень | 1 степень | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История атопии | Да | Да | Нет | Нет Да | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периферическая эозинофилия,% (абсолютное значение в ячейка / мм 3 ) | 0.3% (0) | 9,4% (610) | 1,4% (120) | 2,9% (210) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Респираторные симптомы | Кашель, одышка, хрипы, риноконъюнктивит | Кашель, одышка, хрипы | Одышка, свистящее дыхание, тяжелый бронхоспазм | Одышка, риноконъюнктивит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обострения в предыдущем году | Два обострения, требующие госпитализации | Одно амбулаторное обострение | 92Два обострения | 92Два обострения | 92 наблюдения
| ХОБЛ: | Хроническая обструктивная болезнь легких |
| NS: | Несущественно |
| PFT: | Тест легочной функции |
| DL CO : | диффузия углерода вместимость|
| UCAN: | Калифорнийский университет, сеть клиники астмы Дэвиса |
| UCDMC: | Калифорнийский университет, Медицинский центр Дэвиса |
| AHR: | Гиперреактивность дыхательных путей |
| FEV 1 : | Объем форсированного выдоха в первую секунду |
| ФЖЕЛ: | Форсированная жизненная емкость легких |
| ICS: | Вдыхаемый кортикостероид |
| LABA: | Бета-агонист длительного действия |
| LAMA : | Мускариновый антагонист длительного действия |
| TGF β : | Трансформирующий бета-фактор роста |
| MMP: | Матричная металлопротеиназа |
| «: | Т-хелперы 1, 2 или 17 |
| GWA: | Общегеномная ассоциация |
| ATS: | Американское торакальное общество |
| ERS: | Европейское респираторное общество |
| GINA: | Глобальная инициатива по астме |
| GOLD: | Глобальная инициатива для Хроническая обструктивная болезнь легких |
| ГЭРБ: | Гастроэзофагеальная рефлюксная болезнь |
| VCD: | Дисфункция голосовых связок. |
Благодарности
Авторы хотели бы поблагодарить профессоров Джерольда Ласта, доктора философии, и Николаса Кеньона, доктора медицины, за полезные обсуждения темы синдрома перекрытия. Они также благодарят доктора Ласта за то, что он побудил их изучить собственные когорты пациентов UCDMC, которые помогли контекстуализировать этот анализ и обзор.
Смешанный воспалительный паттерн Th3 и не-Th3 при наложении астмы и ХОБЛ:
Луис Перес де Льяно, 1, * Borja G Cosío, 2,3, * Amanda Iglesias, 3 Natividad de las Cuevas , 4 Хуан Хосе Солер-Каталония, 3,5 Хосе Луис Искьердо, 6 Хосе Луис Лопес-Кампос, 3,7 Кармен Калеро, 7 Висенте Плаза, 3,8–10 Марк Miravitlles, 3,11 Alfons Torrego, 8–10 Eva Martinez-Moragon, 12 Joan B Soriano, 13 Antolin Lopez Viña, 14 Irina Bobolea 15
903Медицина, Госпиталь Лукус Августи, Луго, Испания; 2 Отделение респираторной медицины, Больница Университарио Сон Эспасес-ИдИСБа, Пальма-де-Майорка, Испания; 3 CIBER de Enfermedades Respiratorias, Instituto de Salud Carlos III, Мадрид, Испания; 4 Отделение аллергии, Госпиталь 12 октября, Мадрид, Испания; 5 Отделение респираторной медицины, больница Арнау де Виланова, Валенсия, Испания; 6 Отделение респираторной медицины, Университетская больница Гвадалахары, Гвадалахара, Испания; 7 Отделение респираторной медицины, Госпиталь Вирхен-дель-Росио, Севилья, Испания; 8 Отделение респираторной медицины, Госпиталь Санта-Креу-и-Сант-Пау, Барселона, Испания; 9 Institut d’Investigació Biomédica Sant Pau, IIB Sant Pau, Барселона, Испания; 10 Медицинский факультет Автономного университета Барселоны, Барселона, Испания; 11 Отделение респираторной медицины, Университетская больница Валл д’Эброн, Барселона, Испания; 12 Отделение респираторной медицины, Больница Dr Peset, Валенсия, Испания; 13 Больница Института расследований де ла Принсеса, Автономный университет Мадрида, Мадрид, Испания; 14 Отделение респираторной медицины, Госпиталь Пуэрта-де-Йерро, Мадрид, Испания; 15 Servei de Pneumologia i Alergia, Госпитальная клиника, Барселона, Испания
Введение: Наложение астмы и хронической обструктивной болезни легких (ХОБЛ) — это клиническое состояние, которое сочетает в себе черты этих двух заболеваний, а именно трудно определить из-за непонимания основных механизмов.Определение системных медиаторов может помочь уточнить природу воспаления у пациентов с ОКО.
Цели: Мы стремились изучить роль и взаимодействие общих маркеров системного воспаления (IL-6, IL-8 и фактор некроза опухоли-α), Th3-связанных маркеров (периостина, IL-5 и IL- 13) и IL-17 при астме, ХОБЛ и ОКО.
Методы: Это поперечное исследование пациентов в возрасте ≥40 лет с постбронходилататорным форсированным объемом выдоха в первую секунду / форсированной жизненной емкостью <0.70 набрано из поликлиник в больницах третичного уровня с клиническим диагнозом астма, ХОБЛ или ОКО. ОКО определяли по курению в анамнезе> 10 пач-лет у пациента с предыдущим диагнозом астмы или по наличию эозинофилии у пациента с предыдущим диагнозом ХОБЛ. Клинические, функциональные и воспалительные параметры сравнивались между категориями с использованием дискриминантного и сетевого анализа.
Результаты: Всего было включено 109 пациентов с ОКО, 89 пациентов с ХОБЛ и 94 пациента с астмой.Сывороточные уровни (медиана [межквартильный размах]) IL-5 были выше у пациентов с астмой, чем у пациентов с ХОБЛ (2,09 [0,61–3,57] против 1,11 [0,12–2,42] пг / мл, соответственно; p = 0,03), и Уровни IL-8 (медиана [межквартильный размах]) были выше у пациентов с ХОБЛ, чем у пациентов с астмой (9,45 [6,61–13,12] против 7,03 [4,69–10,44] пг / мл, соответственно; p <0,001). Их значения в ACO были промежуточными между значениями при астме и ХОБЛ. Анализ основных компонентов и сетевой анализ показали смешанный воспалительный паттерн в ОКО между астмой и ХОБЛ.Ил-13 был самым подключенным узлом в сети с разным весом среди трех состояний.
Заключение: Астма и ХОБЛ — это два разных воспалительных состояния, которые у некоторых пациентов могут частично совпадать, что приводит к смешанному воспалительному паттерну. IL-13 может играть центральную роль в регуляции воспаления в этих условиях.
Ключевые слова: механизмы астмы, механизмы ХОБЛ, воспалительные цитокины, перекрытие, сетевой анализ, IL-13
Введение
Астма и хроническая обструктивная болезнь легких (ХОБЛ) — распространенные хронические воспалительные заболевания дыхательных путей с различными основными механизмами. 1 Однако они характеризуются сложной гетерогенностью и наличием различных перекрывающихся фенотипов, которые влияют на реакцию на лечение. В результате иногда трудно определить, страдает ли пациент астмой, ХОБЛ или наложением обоих состояний. Это противоречие привело к теории — так называемой «голландской гипотезе», которая постулирует, что хроническая обструктивная болезнь дыхательных путей (ХОБЛ) может возникать непрерывно, причем «чистые» формы астмы и ХОБЛ представляют собой крайности одного и того же заболевания и различные формы COAD являются разными выражениями одного заболевания. 2 Чтобы еще больше усложнить ситуацию, клиницисты давно признали существование группы пациентов с COAD, у которых проявляются характеристики как астмы, так и COPD. Это состояние недавно вновь привлекло внимание в медицинской литературе, и в конечном итоге оно было названо ACO (перекрытие астмы и ХОБЛ). 3,4 ACO — это общий термин, который охватывает пациентов с ХОБЛ и эозинофильным воспалением, а также курящих астматиков с преимущественно нейтрофильным воспалением и необратимой обструкцией дыхательных путей.Следовательно, вся картина COAD размыта, с различными и перекрывающимися фенотипами, которые трудно клинически отличить друг от друга из-за отсутствия точного биомаркера, который мог бы различать эти сущности. Недавно мы показали, что наличие сигнатуры Th3, определяемой эозинофилами в мокроте> 3% или эозинофилами крови> 300 клеток / мкл, может помочь идентифицировать и лечить пациентов с COAD. 5
В клиническом сценарии с большой неоднородностью разбивка сложных данных на составные части и нанесение их на график, чтобы показать их взаимозависимость и взаимосвязь, поможет нам прояснить пестрый характер COAD.Целью этого исследования было изучить системный «молекулярный отпечаток пальца» различных клинических фенотипов COAD. При этом основная цель заключалась в оценке неоднородности воспаления у пациентов с COAD с помощью дискриминантного и сетевого анализа. Сравнение сетей корреляции может дать новое понимание сложности и неоднородности ACO. В качестве вторичных конечных точек мы оценили способность этих биомаркеров прогнозировать клинический фенотип COAD, паттерн Th3-high и связь между этими биомаркерами и клинически значимыми исходами: обострениями и симптомами.
Материалы и методы
Дизайн исследования
Это перекрестное обсервационное многоцентровое исследование было проведено в 23 амбулаторных клиниках третичных больниц Испании под руководством опытных респираторных врачей. Дизайн исследования описан в другом месте. 5 Как подробно описано ранее, 5 «пациенты мужского и женского пола в возрасте ≥40 лет с хронической обструкцией воздушного потока (объем форсированного выдоха после бронходилататора в первую секунду (FEV 1 ) / форсированная жизненная емкость легких (FVC) < 0.70) и анамнез диагностированной врачом астмы, ХОБЛ или ОКО (как определено ниже), подписавших форму информированного согласия. Пациенты должны были находиться в стабильном состоянии и не иметь обострений не менее 3 месяцев. Критерии исключения включали первичный бронхоэктаз, активный рак, другие хронические воспалительные заболевания и низкую работоспособность (определяемую как ожидаемая продолжительность жизни <3 месяцев) ».
Образец крови был получен для определения количества и процентного содержания эозинофилов в крови и количественного определения иммуноглобулина Е, а сыворотка была сохранена при -80 ° C для последующего определения периостина и цитокинов.Степень соблюдения режима ингаляторов оценивалась по тесту на соблюдение режима приема ингаляторов. 6
Исследование было одобрено Комитетом по этике исследований Балеарских островов (код: IB2499 / 15). Кроме того, окончательный протокол был утвержден независимым комитетом по этике или институциональным наблюдательным советом каждого учебного центра.
Протокол исследования
Всех исследователей попросили набрать 12 последовательных пациентов с хронической обструктивной болезнью дыхательных путей: четырех некурящих астматиков, четырех с ХОБЛ, двух курящих астматиков и двух с ХОБЛ с эозинофилией.Период набора проводился с октября 2015 года по март 2016 года. Блок-схема набора в соответствии с заявлением STROBE («Укрепление отчетности по обсервационным исследованиям в эпидемиологии») была опубликована ранее. 5
Исследование проводилось за один визит, в ходе которого исследователи получали и записывали информацию в электронную базу данных клинических исследований: антропометрические данные; история курения; наличие в анамнезе атопии, ринита, полипоза носа и сопутствующих заболеваний; обострения в прошлом году; симптомы оцениваются с помощью утвержденной испанской версии оценочного теста на ХОБЛ и контрольного теста на астму; фармакологические методы лечения; и степень соответствия ингаляторам оценивается по тесту на приверженность к ингаляторам.
Доля оксида азота в выдыхаемом воздухе измерялась с помощью хемилюминесцентного анализатора (NIOX; Aerocrine, Стокгольм, Швеция) при скорости потока 50 мл / с в соответствии с рекомендациями целевой группы Американского торакального общества / Европейского респираторного общества.
Индукция мокроты
Перед отведением мокроты пациенты вдохнули 400 мкг сальбутамола. Вкратце, оценивали объем всей мокроты и добавляли равный объем дитиоэритрита (Sigma, Мюнхен, Германия).Общее количество клеток и жизнеспособность были получены одновременно в модифицированной счетной камере Neubauer (Hausser Scientific, Horsham, PA, USA). Дифференциальное количество клеток выражали как процент неплоскоклеточных клеток, а клетки со значительной плоскоклеточной контаминацией (> 80%) исключались из анализа.
Расчет размера выборки
Размер выборки априори был рассчитан с учетом статистической мощности 80% и 5% ошибки альфа. Для выявления статистически значимых различий ≥15% по сравнению с любой из контрольных групп по большинству переменных в диапазоне от 10% и выше будет достаточно минимум 100 пациентов с частично совпадающими формами астмы и ХОБЛ (ACO) и 200 других пациентов с хроническими заболеваниями дыхательных путей. до 80% в ACO.
Определения
Астма
Астма с хронической обструкцией воздушного потока (ОФВ после приема бронходилататора 1 / ФЖЕЛ <0,70) была диагностирована в соответствии с международными рекомендациями, 7 , и они либо никогда не курили, либо бывшие курильщики с историей курения ≤10 пачек. годы.
ХОБЛ
ХОБЛ была диагностирована в соответствии с международными рекомендациями 3 по наличию постбронходилататорного ОФВ 1 / ФЖЕЛ <0,70 у пациентов с анамнезом курения ≥10 пач-лет при отсутствии клинического подозрения на астму.
ACO
Как подробно описано ранее, 5 мы определили ACO как общий термин, который охватывает два связанных — со схожим основным смешанным (Th3 и не Th3) воспалительным паттерном и хронической обструкцией воздушного потока — но разные сущности: курящие астматики (SA; астма с хронической обструкцией воздушного потока и курением ≥20 пач-лет в анамнезе) и ХОБЛ с эозинофилией (ХОБЛ-е; пациенты с ХОБЛ с количеством эозинофилов ≥200 клеток / мкл в крови). Мы выбрали этот порог, потому что согласно опубликованным данным у пациентов ниже этого порогового значения эозинофилия мокроты маловероятна. 8
COAD с Th3-high
Пациенты с хроническим ограничением воздушного потока продемонстрировали ОФВ после приема бронходилататора 1 / FVC <0,70 и признак воспаления Th3, как описано ранее 5 (количество эозинофилов ≥300 эозинофилов / мкл в крови или ≥3% в мокроте).
COAD с Th3-low
Пациенты с хроническим ограничением воздушного потока продемонстрировали ОФВ после приема бронходилататора 1 / ФЖЕЛ <0,70 и отсутствие признаков воспаления Th-2, как описано ранее 5 (количество эозинофилов ≤300 эозинофилов / мкл в крови и ≤3% в мокроте).
Соотношение Th3 / Th2
Соотношения IL-13 / IL-8 или IL-5 / IL-8 были рассчитаны для выявления преобладающего профиля Th3.
Измерения
Более подробную информацию об управлении данными, тестах функции легких, измерении фракционного выдыхаемого оксида азота (FeNO) и количестве воспалительных клеток в индуцированной мокроте можно найти в другом месте. 5 Уровни периостина измеряли с использованием коммерческого набора для твердофазного иммуноферментного анализа (ELISA) стрептавидин-пероксидазы хрена (DuoSet ® ELISA; R&D Systems, Inc., Миннеаполис, Миннесота, США) в соответствии с инструкциями производителя. Специфичность анализа периостина составила 100%, предел обнаружения — 180 нг / мл. У всех пациентов уровни периостина в сыворотке измеряли дважды.
Концентрации ИЛ-5, ИЛ-13, ИЛ-8, ИЛ-6, фактора некроза опухоли-α (TNF-α) и ИЛ-17 в сыворотке анализировали с использованием панели с магнитными шариками для цитокинов человека (Merck Millipore , Billerica, MA, USA) в соответствии с инструкциями производителя. Чувствительность анализа по данным производителя была следующей: 0.23 пг / мл для IL-13, 0,33 пг / мл для IL-17, 0,12 пг / мл для IL-5, 0,11 пг / мл для IL-6, 0,13 пг / мл для IL-8 и 0,16 пг / мл для TNF-α.
Сетевой анализ
Сетевой макет системного воспалительного паттерна (инфламмом) в трех группах участников был построен с использованием ранее проверенного метода. 9 Каждый узел сети представляет один биомаркер, его размер пропорционален проценту от медианы относительно максимальных значений для каждой переменной.Узлы связаны, если была обнаружена статистически значимая корреляция (Spearman p <0,05).
Статистический анализ
Данные выражены как среднее (SD) для непрерывных нормально распределенных переменных: одномерные попарные сравнения были выполнены с использованием теста Стьюдента t , в то время как односторонний дисперсионный анализ использовался для сравнения более двух групп (поправка Бонферрони была применяется для парных апостериорных тестов). Непрерывные переменные с ненормальным распределением были выражены как медиана (межквартильный размах [P25 – P75]), а сравнения между группами проводились с использованием теста Манна-Уитни U или теста Краскала-Уоллиса с апостериорным тестом Неменьи. .Для категориальных переменных количество и процентное соотношение были даны в каждой категории, и группы сравнивались с помощью тестов × 2 с поправкой Бонферрони для парных сравнений. Корреляции между непрерывными переменными оценивались с помощью теста Спирмена.
Для изучения ассоциации биомаркеров с категориями COAD (астма, ХОБЛ и ACO) и для оценки соответствующей способности различения был проведен дискриминантный анализ (DA) с подбором линейных комбинаций биомаркеров, который позволил наилучшим образом классифицировать пациентов. в диагностические группы.Результаты были визуально обобщены с помощью карты классификации, основанной на оценках DA.
Надежность концентрации биомаркеров для диагностики различных категорий COAD и профилей Th3 оценивалась путем оценки соответствующих кривых рабочих характеристик приемника (ROC) с соответствующими 95% доверительными интервалами. Индекс Юдена использовался для определения оптимальных значений отсечки биомаркеров. Чувствительность и специфичность также оценивались для каждого порога.
Все статистические анализы были выполнены с использованием программного обеспечения SPSS (версия 19.0; IBM Corporation, Армонк, Нью-Йорк, США).
Результаты
Характеристика населения
Как подробно описано ранее, в исследование были включены 5 292 пациента с ХОБЛ: 94 астматика, 89 пациентов с ХОБЛ и 109 пациентов с ОКО (44 СА и 65 ХОБЛ-е). На рисунке 1 показана блок-схема набора пациентов. В таблице 1 представлены демографические, клинические и функциональные характеристики всей выборки.Вкратце, пациенты демонстрировали умеренную степень обструкции бронхов и умеренный или умеренный уровень симптомов, как оценивали с помощью опросников по тесту на ХОБЛ (CAT) и тесту контроля астмы (ACT). Среднее количество обострений за последние 12 месяцев составило 1,0. Исходное лечение основывалось на β 2 -агонисте пролонгированного действия и ингаляционных кортикостероидах (ICS; 80%) и мускариновом антагонисте длительного действия (71%). Все пациенты с астмой, 66,3% пациентов с ХОБЛ и 75% пациентов с ОКО лечились с помощью ИКС.Ни один пациент из группы ХОБЛ или ОКО не получал пероральные кортикостероиды, тогда как их принимали 6,4% астматиков. Интересно, что 17,5% пациентов с астмой и 8,6% пациентов с ОКО получали омализумаб.
Рисунок 1 Блок-схема процесса найма. |
Таблица 1 Характеристики пациентов в соответствии с исходным диагнозом |
Значения цитокинов и периостинов среди различных диагностических категорий
В таблице 2 и на рисунке 2 показаны результаты измерения маркеров воспаления по трем диагностическим категориям. Связанные с Th3 цитокины (IL-13 и IL-5) показали самые высокие медианные значения при астме и самые низкие медианные значения при ХОБЛ, тогда как они показали промежуточные результаты при ACO. Единственная статистически значимая разница была в уровнях ИЛ-5 между астмой и ХОБЛ (2,09 против 1,11 пг / мл; p = 0.03). Уровни IL-17 и TNF-α в группах были одинаковыми. Уровни периостина в трех категориях не различались. Было обнаружено, что цитокины, не связанные с Th3, такие как IL-8, повышены при ХОБЛ и ОКО по сравнению с астмой ( p <0,001).
Таблица 2 Значения биомаркеров в соответствии с исходным диагнозом |
Рисунок 2 Концентрации цитокинов при астме, ОКО и ХОБЛ. |
Соотношения Th3 / Th2 (IL-5 / IL-8 и IL-5 / IL-13) были выше при астме (0,25 и 0,43 соответственно), чем в других категориях, без различий между ACO (0,14 и 0,14) и ХОБЛ (0,12 и 0,15).
Дискриминантный и сетевой анализ
В целом корреляция между цитокинами была плохой. Стоит подчеркнуть, что корреляция между IL-5 и IL-13 была равна 0.489 ( p <0,0001), а IL-17 умеренно коррелировал с IL-5 (r = 0,553; p <0,0001), IL-13 (r = 0,550; p <0,0001) и IL-6. (r = 0,579; p <0,0001). IL-8 и TNF-α показали слабую корреляцию между ними (r = 0,207; p <0,0001) и отсутствие статистически значимой корреляции с IL-5, IL-13 и IL-17. IL-6 умеренно коррелировал с другими цитокинами. Эозинофилы крови слабо коррелировали с ИЛ-5 (r = 0,122; p = 0,40) и периостином (r = 0.211; p <0,0001). Периостин достоверно не коррелировал с цитокинами крови.
Были определены два основных компонента (линейная комбинация маркеров), объясняющих около 60% общей дисперсии данных. Первая дискриминантная оценка (DS1) в основном характеризовалась значениями IL-5, IL-13, IL-6 и TNF-α, в то время как IL-8 имел больший вес во второй дискриминантной оценке (DS2). На рисунке 3 показан график разброса индивидуальных значений, вычисленных для каждого пациента на основе DS1 и DS2, с указанием диагностической категории пациента (астма, ХОБЛ и ОКО).Пациенты из разных категорий имели очень похожие значения DS, так что нельзя было наблюдать четкую и четкую картину цитокиновой взаимосвязи. Менее половины пациентов (42,8%) были правильно классифицированы по двум оценочным DS, что подтверждает ограниченные возможности распознавания этих маркеров.
Рис. 3 Диаграмма рассеяния комбинации значений из дискриминантных оценок 1 и 2 по сравнению с категорией COAD каждого пациента. |
Сетевое представление веса и взаимодействия воспалительных маркеров (инфламмома) в трех категориях дало два разных сценария: IL-13 и IL-17 — наиболее связанные узлы, но с разным весом узлов, показывая IL-5. и ИЛ-8 с наиболее выраженными различиями в весе узлов.Инфламмом ACO представлял собой смесь двух предыдущих сетей, причем IL-5 и IL-8 были одинаково важными, а IL-13 и IL-17 все еще находились в середине сети (Рисунок 4).
Рис. 4 Схема сети воспаления при астме, ХОБЛ и ОКО. |
Диагностическая точность потенциальных биомаркеров для идентификации различных диагностических категорий или воспалительных фенотипов Th3-high и Th3-low
Ни один цитокин, ни соотношение Th3 / Th2 не показали достаточной чувствительности и специфичности, чтобы точно идентифицировать различные диагностические категории COAD (астма, ХОБЛ и ACO).Площадь под кривой ROC (AUC) во всех случаях была <0,7. Таблица S1 отображает AUC для каждого цитокина или периостина и диагностические категории COAD.
Некоторые цитокины были более высоко экспрессированы в группе Th3-high по сравнению с группой Th3-low (Таблица 3), медианы (межквартильные диапазоны): IL-5 (1,96 [0,87–3,34] против 1,51 [0,29–2,88] пг / г / г). мл; p = 0,025), TNF-α (4,32 [3,20–6,16] против 3,95 [2,91–5,32] пг / мл; p = 0,055) и периостин (39,73 [28,05–54,40] против 34.20 [26,94–41,43] нг / мл; р = 0,005). Не было обнаружено статистически значимых различий между двумя группами в других проанализированных цитокинах, отдельно или в комбинации (Таблица 3).
Таблица 3 Биомаркеры крови у пациентов с Th3-высоким и Th3-низким уровнем |
Опять же, поскольку AUC была <0,7 в каждом случае, ни один цитокин, ни периостин, ни какая-либо их комбинация не давали достаточной чувствительности и специфичности для точного прогнозирования фенотипа Th3-high и Th3-low молекулярного типа. Пороговое значение FeNO> 17 частей на миллиард показывает лучшую AUC (0,707 [0,642–0,772], p <0,001), чем цитокины или периостин в крови (Таблица 4).
Таблица 4 Биомаркер ROC и лучшая точка отсечения для прогнозирования моделей Th3-high или Th3-low |
Связь цитокинов или периостина с клиническими исходами
Значения различных цитокинов или периостина (по отдельности или в комбинации) не различались между пациентами с (n = 144) и без (n = 148) обострениями, между плохо контролируемыми (ACT <20 [n = 85]) и хорошо контролируемые астматики (ACT ≥20 [n = 137]), между симптоматическими (CAT ≥10 [n = 163]) и слабосимптоматическими пациентами с ХОБЛ (CAT <10 [n = 81]) и между пациентами с FEV 1 выше медианного значения для всего населения (1.505 мл) и те, у которых ОФВ на 1 ниже медианы.
Обсуждение
В этом исследовании мы обнаружили, что различные воспалительные механизмы, участвующие в астме и ХОБЛ, могут перекрываться у некоторых пациентов, что приводит к смешанной экспрессии цитокинов Th3 и не-Th3. Таким образом, ОКО демонстрирует гетерогенный воспалительный процесс, который перекрывает характеристики обоих состояний: астмы и ХОБЛ; следовательно, он не может считаться специфическим фенотипом какого-либо из них. Как и ожидалось, связанные с Th3 цитокины (IL-13 и IL-5) показали самые высокие медианные значения при астме и самые низкие медианные значения при ХОБЛ с промежуточными результатами при ОКО.Напротив, было обнаружено, что уровень ИЛ-8 значительно повышен у пациентов с курением в анамнезе (ХОБЛ и ОКО) по сравнению с астмой. Уровни периостина не были полезны для различения категорий, но они были повышены у пациентов с более предсказуемой «сигнатурой Th3-high» (астма и ОКО) в отношении ХОБЛ. Интересно, что IL-13 был наиболее связанным узлом воспаления в трех условиях. Взятые вместе, эти результаты согласуются с гетерогенным воспалительным фоном пациентов с COAD, вероятно, континуумом между не-Th3 и Th3-воспалением со значительным совпадением в высокой доле случаев.
Поскольку в настоящее время проходят испытания несколько биологических методов лечения астмы и ХОБЛ, идентификация биологических маркеров, отражающих основной процесс заболевания, кажется, имеет особое значение для реализации более персонализированных подходов к терапевтическим решениям при заболеваниях дыхательных путей. Однако на сегодняшний день очень мало исследований посвящено основным механизмам воспаления при ОКО. Китагучи и др., 10 , в ретроспективном исследовании с небольшой выборкой обнаружили, что пациенты с ХОБЛ с астматическими симптомами имели высокое количество эозинофилов в периферической крови и мокроте и лучшую обратимую реакцию на лечение с помощью ИКС.С другой стороны, Gao et al. 11 стремились найти биомаркеры мокроты, способные дифференцировать пациентов с ОКО, ХОБЛ и астмой. Они обнаружили, что только уровни липокалина, ассоциированного с желатиназой нейтрофилов мокроты, были значительно увеличены у пациентов с ОКО по сравнению с группами астмы и ХОБЛ. В этом исследовании уровень IL-13 в мокроте был повышен при астме, ХОБЛ и ОКО по сравнению со здоровыми людьми и курильщиками, что могло поддерживать центральную роль в воспалении, которое мы обнаружили в нашем исследовании.Однако, поскольку определения различных диагностических категорий несколько произвольны и основаны на неспецифических клинических особенностях, дизайн этого исследования подвергался тем же ограничениям, что и все ранее опубликованные исследования по этой теме. Теоретически можно ожидать обнаружения некоторых признаков воспаления Th2 (характерного, но не патогномоничного для ХОБЛ) и некоторых признаков воспаления Th3 (характерного, но не патогномоничного для астмы) у пациентов с ОКО. 12 К сожалению, надежных биомаркеров Th2 не хватает; следовательно, мы должны полагаться на предположение, что людей с историей курения и «фиксированной бронхиальной обструкцией», которые демонстрируют некоторые признаки воспаления Th3, можно точно классифицировать как ОКО. 13 Наше открытие промежуточных уровней ИЛ-5 и ИЛ-13 в категориях ОКО по сравнению с астмой и ХОБЛ может дать некоторую поддержку этой гипотезе.
Основываясь на результатах DA, мы не смогли найти значимых кластеров ассоциации между различными биомаркерами, и, как следствие, мы не смогли продемонстрировать связь между тремя клиническими категориями COAD (астма, ХОБЛ и ACO) с четко определенными различные воспалительные паттерны. Однако сетевое представление взаимодействия между воспалительными маркерами дало две четко разные сети, которые перекрываются в ACO.Это подтверждает гипотезу о том, что воспалительный паттерн, наблюдаемый при ОКО, представляет собой смесь компонентов ХОБЛ и астмы.
В целом корреляция между биомаркерами была плохой. Слабая корреляция, обнаруженная между эозинофилами крови и цитокинами с высоким уровнем Th3 (IL-5 и IL-13), представляла особый интерес, поскольку она противоречит результатам, полученным Agache et al, 14 , которые наблюдали почти идеальную (r> 0,90) ассоциацию. между этими переменными у 64 взрослых астматиков. Наши результаты не изменились, когда мы проанализировали отдельно корреляцию этих биомаркеров в группе астмы, хотя следует принимать во внимание, что все наши пациенты показали «фиксированную бронхиальную обструкцию», тогда как эта особенность присутствовала только у 6% Agache et al. al, что может отражать заметные различия в изученных популяциях.
Две причины могут помочь объяснить наблюдаемое отсутствие связи между клиническими категориями и предполагаемыми биомаркерами. Во-первых, сообщалось, что астма и ХОБЛ демонстрируют значительное перекрытие в профиле цитокинов дыхательных путей, что предполагает сосуществование различных фенотипов COAD, разделяющих общую сеть цитокинов. 15,16 Центральная роль IL-13 и IL-17 в сети будет соответствовать этому результату. Более того, мы должны иметь в виду, что астма и ХОБЛ сами по себе являются гетерогенными заболеваниями с различными воспалительными фенотипами.Solleiro-Villavicencio et al. 17 наблюдали, что воспалительная реакция, вызванная воздействием дыма биомассы, сильно отличается от реакции, вызванной курением табака, а Khurana et al. 18 обнаружили, что «стойкие продуценты мокроты при ХОБЛ» имеют повышенные концентрации некоторых воспалительных веществ. медиаторов в дыхательных путях по сравнению с непостоянными продуцентами мокроты. С другой стороны, Seys et al. 19 обнаружили пять различных кластеров астмы на основе экспрессии цитокинов в мокроте, что подчеркивает гетерогенность воспаления дыхательных путей у разных пациентов с астмой.Взятые вместе, эти исследования указывают на вариабельность воспалительных маркеров у пациентов с COAD. Во-вторых, по-видимому, нет четкой корреляции между биомаркерами в системном и легочном отделах. Хотя сывороточные цитокины продемонстрировали достаточную надежность и повторяемость с течением времени, некоторые авторы наблюдали лишь незначительные и слабые ассоциации между биомаркерами легких и сыворотки крови как у пациентов с ХОБЛ , 20,21, , так и у пациентов с астмой. 22 Таким образом, возможно, что измерение цитокинов сыворотки недостаточно отражает воспалительные процессы в дыхательных путях.
Как подробно описано ранее, 5 «наша работа имеет несколько ограничений, которые заслуживают комментария. Во-первых, мы использовали произвольные точки отсечения эозинофилов крови для набора пациентов и определения профиля Th3, но мы использовали доступную опубликованную информацию, которая поддерживает эту точку зрения. Однако мы были более строгими в определении Th3, используя порог в 300 клеток / мкл, что является общепринятым. 23 Кроме того, большое количество пациентов получали ИКС, и некоторые из них лечились пероральными кортикостероидами или омализумабом, которые могли маскировать различия между группами и изменять экспрессию биомаркеров Th3, таких как эозинофилы крови / мокроты. и цитокины сыворотки.В-третьих, предел 20-летнего курения для астматиков может быть слишком искусственно завышен. Тем не менее, поступая так, мы гарантируем, что этот фенотип будет перекрывать характеристики воспаления, связанного с курением, над базовым астматическим воспалением ».
Заключение
Гетерогенность астмы и ХОБЛ индуцирует различные воспалительные пути, которые сосуществуют в ACO, являясь общим узлом IL-13, управляющим воспалением в этих условиях. Тем не менее, ни сывороточные цитокины, не связанные с Th3 или не связанные с Th3, или периостин (по отдельности или в сочетании) не позволяли различать категории COAD или прогнозировать воспалительный паттерн с высоким уровнем Th3.
Благодарности
Авторы благодарны всем пациентам, принявшим участие в исследовании. Ряд исследователей внесли свой вклад в логистику исследования, и они перечислены в дополнительных материалах. Проект был одобрен Советом по исследованию ХОБЛ и астмы (PII de EPOC y asma) Испанского общества пневмологии и торакальной хирургии (SEPAR). Проект частично финансировался Fondo de Investigaciones Sanitarias, Instituto de Salud Carlos III, Ministerio de Economia y Competitividad (FIS 15/01263) за счет средств FEDER Европейского Союза и неограниченного гранта Chiesi España S.А.У.
Вклад авторов
Все авторы внесли существенный вклад в концепцию и дизайн, сбор данных или анализ и интерпретацию данных; подготовил статью и критически отредактировал ее на предмет важного интеллектуального содержания; дал окончательное одобрение версии, которая будет опубликована; и согласился нести ответственность за все аспекты работы, обеспечивая надлежащее расследование и решение вопросов, связанных с точностью или целостностью любой части работы.В частности, BGC и LPL разработали исследование, набрали пациентов, проанализировали результаты и написали рукопись. AI, NdC и CC провели анализ цитокинов. ALV, AT, JLLC, JBS, EMM, JLI, IB, VP, MM и JJSC набирали пациентов и рецензировали рукопись. Остальная часть исследовательской группы CHACOS набрала пациентов.
Раскрытие информации
Д-р Перес де Льяно сообщает о грантах от SEPAR во время проведения исследования, а также о грантах и личных гонорарах от Novartis, Chiesi, AstraZeneca и Pfizer, помимо представленных работ.Доктор Косио сообщает о грантах от SEPAR во время проведения исследования и личных гонорарах от AstraZeneca, грантах от Boehringer Ingelheim, грантах и личных гонорарах от Novartis, Chiesi, Rovi, Menarini и Esteve, помимо представленных работ. Доктор Искьердо отчитывается и получает средства на консультационные советы и лекции от Almirall, AstraZeneca, Bayer, GlaxoSmithKline, Novartis, Pfizer, Boehringer Ingelheim, Takeda, Chiesi и Menarini. Д-р Soler-Cataluña сообщает о грантах SEPAR во время проведения исследования, а также о грантах и личных гонорарах от AstraZeneca, Boehringer Ingelheim, Novartis, Chiesi, Rovi, Menarini и Esteve, помимо представленных работ.Доктор Миравитлес сообщает о личных гонорарах от Almirall, Boehringer Ingelheim, AstraZeneca, Chiesi, GlaxoSmithKline, Menarini, Teva, Grifols и Novartis, помимо представленных работ. Авторы не сообщают о других конфликтах интересов в этой работе.
Список литературы
1. | Barnes PJ. Иммунология астмы и хронической обструктивной болезни легких. Нат Рев Иммунол . 2008. 8 (3): 183–192. | |
2. | Орие Н.Г., Slutter HJ, de Vries, Tammeling GJ. [Хронические неспецифические респираторные заболевания]. Нед Тийдшр Генеескд . 1961; 105: 2136–2139. Нидерландский язык. | |
3. | Vogelmeier CF, Criner GJ, Martinez FJ, et al. Отчет о Глобальной стратегии диагностики, ведения и профилактики хронической обструктивной болезни легких за 2017 г .: Краткое изложение GOLD. Арочный бронконеумол . 2017; 53 (3): 128–149. Английский испанский. | |
4. | Cosio BG, Soriano JB, Lopez-Campos JL, et al. Определение синдрома перекрытия астмы и ХОБЛ в когорте ХОБЛ. Сундук . 2016; 149 (1): 45–52. | |
5. | Cosio BG, Pérez de Llano L, Lopez Viña A, et al. Сигнатура Th-2 при хронических заболеваниях дыхательных путей: к исчезновению синдрома наложения астмы и ХОБЛ? Eur Respir J . 2017; 49 (5): pii: 1602397. | |
6. | Plaza V, Fernandez-Rodriguez C, Melero C, et al. Валидация «Теста на приверженность к ингаляторам» (TAI) для пациентов с астмой и ХОБЛ. J Aerosol Med Pulm Drug Deliv . 2016; 29 (2): 142–152. | |
7. | Глобальная инициатива по астме (GINA). Глобальная стратегия лечения и профилактики астмы; обновлено в 2017 г. Доступно по адресу: http: // ginasthma.org / 2017-gina-report-global-strategy-for-asthma-management-and-профилактика / Глава 1, стр. 14. По состоянию на 17 января 2018 г. | |
8. | Negewo NA, McDonald VM, Baines KJ, et al. Эозинофилы периферической крови: суррогатный маркер эозинофилии дыхательных путей при стабильной ХОБЛ. Int J Chron Obstruct Pulmon Dis . 2016; 11: 1495–1504. | |
9. | Агусти А., Эдвардс Л.Д., Реннард С.И. и др.Стойкое системное воспаление связано с плохими клиническими исходами при ХОБЛ: новый фенотип. PLoS One . 2012; 7 (5): e37483. | |
10. | Китагучи Y, Komatsu Y, Fujimoto K, Hanaoka M, Kubo K. Эозинофилия мокроты может предсказать реакцию на лечение ингаляционными кортикостероидами у пациентов с синдромом наложения ХОБЛ и астмы. Int J Chron Obstruct Pulmon Dis . 2012; 7: 283–289. | |
11. | Гао Дж., Ивамото Х., Коскела Дж. И др. Характеристика биомаркеров мокроты для синдрома перекрытия астмы и ХОБЛ. Int J Chron Obstruct Pulmon Dis . 2016; 11: 2457–2465. | |
12. | Перес де Льано, Лос-Анджелес, Косио, Б. Астма, хроническая обструктивная болезнь легких и другие сочетания. Арочный бронконеумол . 2016; 52 (10): 499–500. Английский испанский. | |
13. | Miravitlles M, Alvarez-Gutierrez FJ, Calle M, et al. Алгоритм выявления совпадения астмы и ХОБЛ: консенсус между испанскими рекомендациями по ХОБЛ и астмой. Eur Respir J . 2017; 49 (5): pii: 1700068. | |
14. | Агаче И., Штрассер Д.С., Кленк А. и др. ИЛ-5 и ИЛ-13 в сыворотке неизменно служат лучшими предикторами фенотипа эозинофилии в крови у взрослых астматиков. Аллергия .2016; 71 (8): 1192–1202. | |
15. | Гебре М.А., Бафадель М., Десаи Д. и др. Биологическая кластеризация поддерживает как «голландскую», так и «британскую» гипотезы об астме и хронической обструктивной болезни легких. J Allergy Clin Immunol . 2015; 135 (1): 63–72. | |
16. | Паплинска-Горица М., Нейман-Грыз П., Горска К., Бялек-Госк К., Германович-Саламон Дж., Кренке Р. Экспрессия медиаторов воспаления в индуцированной мокроте: сравнительное исследование при астме и ХОБЛ. Ад Эксп Мед Биол . Epub 2016 14 октября | |
17. | Solleiro-Villavicencio H, Quintana-Carrillo R, Falfan-Valencia R, Vargas-Rojas MI. Хроническая обструктивная болезнь легких, вызванная воздействием дыма биомассы, связана с профилем продукции цитокинов Th3. Клин Иммунол . 2015; 161 (2): 150–155. | |
18. | Хурана С., Рави А., Сутула Дж. И др.Клиническая характеристика и профиль воспаления дыхательных путей у продуцентов стойкой мокроты при ХОБЛ. Респир Мед . 2014. 108 (12): 1761–1770. | |
19. | Seys SF, Scheers H, Van den Brande P, et al. Кластерный анализ профилей с высоким содержанием цитокинов в мокроте показывает разнообразие пациентов с астмой с высоким уровнем T (h) 2. Respir Res . 2017; 18 (1): 39. | |
20. | Ropcke S, Holz O, Lauer G, et al.Повторяемость и взаимосвязь между потенциальными биомаркерами ХОБЛ в бронхоальвеолярном лаваже, биопсии бронхов, сыворотке и индуцированной мокроте. PLoS One . 2012; 7 (10): e46207. | |
21. | Nunez B, Sauleda J, Garcia-Aymerich J, et al. Отсутствие корреляции между маркерами легочного и системного воспаления у пациентов с хронической обструктивной болезнью легких: одновременный двухкомпонентный анализ. Арочный бронконеумол .2016; 52 (7): 361–367. Английский испанский. | |
22. | Мукерджи М., Наир П. Эозинофилы крови или мокроты для лечения астмы? Ланцет Респир Мед . 2015; 3 (11): 824–825. | |
23. | Christenson SA, Steiling K, van den Berge M, et al. Астма-ХОБЛ накладываются друг на друга. Клиническая значимость геномных признаков воспаления 2 типа при хронической обструктивной болезни легких. Am J Respir Crit Care Med . 2015; 191 (7): 758–766. |
Дополнительные материалы
Авторство
Члены исследовательской группы CHACOS
DUE Росио Кордова, Университетская больница Сон Эспасес-ИдИСПа, Сиберес, Пальма-де-Майорка, Испания; Д-р Сержи Паскуаль, Dra Mireia Admetlló, Госпиталь дель Мар, Барселона, Испания; Дра Салуд Сантос, доктор Джанлука Котта Рамузино, Университетская больница Бельвитге, Барселона, Испания; Дра Кармен Гомес Нейра, Дра Ирен Карла Мартин Роблес, Университетская больница Лукуса Аугусти, Луго, Испания; Д-р Альберто Фернандес-Вильяр, Dra Cristina Represas, больница Dra Ana Priegue Carreracon Xeneral de Vigo, Виго, Испания; Госпиталь Дра Андреа Трисан Алонсо Пуэрта дель Йерро, Мадрид, Испания; Д-р Франсиско Гарсиа Рио, д-р Рауль Галера Мартинес, Дра Ракель Каситас Матео, Дра Элизабет Мартинес Серон, Госпиталь Ла-Пас, Мадрид, Испания; Дра Саграрио Майоралас, доктор Адальберто Пачеко Гальван, Университетская больница Рамон-и-Кахаль, Мадрид, Испания; Д-р Луис Пуэнте Маэсту, Дра Хулия Гарсиа де Педро, Дра Пилар Санс, Больница Университарио Грегорио Мараньон, Мадрид, Испания; Д-р Хосе Бельда Рамирес, д-р Фернандо Санчес-Торил Лопес, д-р Рафаэль Перис Карделлс, больница Арнау де Виланова, Валенсия, Испания; Дра Мария Климент Грегори, Университетская больница доктора Песета, Валенсия, Испания; Дра Патрисия Гарсиа-Сидро, Госпиталь Кастельон-де-ла-Плана, Кастельон, Испания; Дра Клеофе Фернандес, Дра Мария Энкарнасьон Баррозо Медель, Больница общего университета Аликанте, Аликанте, Испания; Дра Мария Абад Арранс, доктор Эдуардо Маркес Мартин, доктор Франсиско Ортега, больница Руиса Вирхен-дель-Росио, Севилья, Испания; Д-р Бернардино Алькасар, Больница Альта Резолюсьон де ла Лоха, Гранада, Испания; Д-р Хавьер Каллеха, Рауль Годой Майораль, Хавьер Крус Руис, Больница общего университета Альбасете, Альбасете, Испания; Дра Нурия Марина Маланда, доктор Хуан Баутиста Гальдис Итурри, Дра Елена Лопес де Санта Мария Миро, Университетская больница Крусес, Бильбао, Испания; Д-р Хуан Луис Гарсиа Риверо, Дра Рут Валери Ален Мбессекг, Госпиталь Ларедо, Ларедо, Испания; Дра Кристина Мартинес, Дра Розирис Мерседес Гусман Таверас, Дра Ана Фернандес Тена, Дра Росарио Мадьедо де ла Ллера, Дра Анхелес Энкарнасьон Мальмиерка де Диос, Национальный институт силикоза, Овьедо, Испания; Д-р Хосе Антонио Рос Лукас, др. М. Кармен Сото Фернандес, д-р Рубен Андухар Эспиноса, Университетская больница Вирхен-де-ла-Арриксака, Мерсия, Испания; Дра Мириам Барречегурен, Дра Кристина Эскинас, Университетская больница Валль д’Эброн, Барселона, Испания.
Таблица S1 AUC биомаркера в ROC для диагностики различных категорий COAD, отдельно и в комбинации |
Точность диагностики астмы и ХОБЛ в общей врачебной практике Австралии: исследование смешанными методами
Основные выводы
Это одно из относительно немногочисленных исследований по диагностике хронических респираторных заболеваний, проводимых в общей врачебной практике Австралии, и первое, которое использовалось смешанные методы исследования.Мы обнаружили, что взрослые пациенты обычно точно сообщали об астме, диагностированной врачом. Тем не менее, пациенты сильно занижали данные о ХОБЛ и врачи занижали диагноз. Некоторые расхождения между пациентами и врачами могли возникнуть из-за проблем со связью и / или недопонимания во время медицинских консультаций. Средняя консультация терапевта в Австралии длится всего 6 минут. Хотя рекомендации по ХОБЛ-X были впервые опубликованы 8 лет назад 2 , а Австралийский фонд легких провел маркетинговую кампанию, термин ХОБЛ все еще недостаточно понятен широким сообществом.
Хотя любую хроническую обструкцию дыхательных путей, которая плохо обратима, можно отнести к категории ХОБЛ, это неспецифическое физиологическое проявление, которое может быть конечным результатом множества и часто очень разных состояний. Хроническая астма, 17 туберкулез, бронхоэктазия, кистозный фиброз, саркоидоз и множество других патологий могут привести к необратимой обструкции дыхательных путей, но обозначение их как ХОБЛ из-за этого может считаться диагностической двойственностью. 18 Это не единственный диагностический критерий для этого состояния, поскольку полное определение Глобальной инициативы по хронической обструктивной болезни легких (GOLD) признает, что ограничение воздушного потока при ХОБЛ обычно прогрессирует и связано с аномальной воспалительной реакцией легких на вредные частицы. или газы. 19 Кроме того, также признаются значительные внелегочные эффекты, которые влияют на тяжесть ХОБЛ у отдельных пациентов. У некоторых пациентов могут быть симптомы хронического бронхита без фиксированного ограничения воздушного потока, но у них вряд ли будет значительная ХОБЛ. 20 Тем не менее, фиксированное ограничение воздушного потока было хорошо воспроизводимым в течение 12 месяцев в нашем испытании.
Небольшое количество пациентов, у которых больше не было фиксированного ограничения воздушного потока, вероятно, страдали астмой, которая либо реагировала на усиленное лечение, либо улучшалась спонтанно.
Хотя использование фиксированного отношения FEV 1 / FVC для определения обструкции воздушного потока было предметом значительных дискуссий в медицинской литературе, хотя и продвигалось как часть рекомендаций GOLD и COPD-X по диагностике. Хорошо известно, что соотношение FEV 1 / FVC снижается с увеличением возраста и роста даже у здоровых некурящих людей, у которых нижний предел нормы (LLN) падает ниже отношения 0,7 примерно с 45 лет. Следовательно, использование фиксированного соотношения может привести к чрезмерной диагностике или неправильной классификации детей старше этого возраста.Кроме того, взрослые курильщики с подозрением на ХОБЛ не подвергаются повышенному риску респираторных симптомов, респираторных заболеваний или общей смертности до тех пор, пока это соотношение не упадет ниже пятого перцентиля диапазона LLN с поправкой на возраст. 21 Использование значений LLN для FEV 1 / FVC, которые основаны на нормальном распределении, и отнесение нижних 5% здорового населения к аномальным было поэтому предложено в качестве альтернативного способа минимизировать потенциальную ошибочную классификацию. 22
Отсутствие каких-либо существенных различий между диагностическими группами по обратимости бронходилататора было неожиданным.Всем участникам было рекомендовано воздержаться от приема β 2 -агонистов короткого действия в течение 4 часов и LABA, комбинированных ингаляторов или холинолитиков в течение 12 часов до тестирования. Спирометрия проводилась обученным специалистом по респираторным заболеваниям в соответствии с рекомендациями ATS / ERS. Поэтому мы не думаем, что это открытие возникло в результате ошибки измерения или артефакта. У некоторых пациентов обратимость могла быть затруднена из-за хорошего контроля астмы. Однако наиболее вероятным объяснением является то, что диагноз хронических респираторных заболеваний был неточным в общей практике, участвовавшей в исследовании.Канадское исследование показало, что астма была диагностирована чрезмерно и могла быть исключена у 29% субъектов с нормальным весом и 32% субъектов с ожирением с диагнозом астмы, диагностированной врачом. 23
Качественные данные
В свете интервью с терапевтами одно из возможных объяснений этой неточности состоит в том, что некоторые терапевты могут быть слишком уверены в своих диагностических навыках для дифференциации хронических респираторных заболеваний. Кроме того, большинство рассматривало использование спирометрии преимущественно как средство улучшения лечения («убедить пациента в том, что его легкие не так хороши и что ему нужно бросить курить»), а не как стандартное средство диагностики.
В ходе этого исследования модель «мобильной лаборатории функции легких» была проверена на практике с уделением особого внимания калибровке оборудования, контролю качества и оперативной интерпретации специалистами. Были опробованы альтернативные модели для проведения спирометрии в учреждениях первичной медико-санитарной помощи. Уолтерс и др. сравнили посещающих обученных медсестер с обычной помощью терапевтов в Тасмании. 24 Медсестры протестировали значительно большее количество подходящих пациентов и выполнили спирометрию более высокого качества, чем врачи общей практики, оказывающие обычную помощь.Однако не было никакой разницы в доле пациентов, у которых впервые диагностирована ХОБЛ. Рандомизированное контролируемое исследование голландских семейных практик показало, что спирометрия привела к изменению диагноза примерно у половины всех пациентов. 25 Однако не было большой разницы между спирометрией, интерпретируемой врачом-терапевтом, экспертным программным обеспечением или терапевтом. Alliance Project исследовал телеспирометрию в общей врачебной практике Италии с оперативным сообщением легочного специалиста. 26 В рамках этого проекта была обнаружена серьезная обструкция у некоторых пациентов с недиагностированными симптомами, а также неправильный диагноз ХОБЛ у пациентов с нормальной спирометрией.
В нескольких предыдущих исследованиях использовались качественные или смешанные методы исследования. Однако Roberts et al. исследовал, почему спирометрия недостаточно используется в диагностике пациентов с одышкой, проводя фокус-группы с британскими студентами-медиками, младшими врачами больниц, терапевтами и стажерами-специалистами в области респираторной медицины. 27 Только врачи общей практики и специалисты-стажеры спонтанно упомянули спирометрию как диагностический инструмент. Младшие врачи считали, что им не хватает поддержки, подкрепления или базовой информации о спирометрии. Студенты-медики не знали, как можно проводить спирометрию. Хотя врачи общей практики считали, что у них был лучший доступ к спирометрии, чем в прошлом, они увидели необходимость в дальнейшем обучении.
Из нашего исследования австралийских врачей общей практики ясно, что существуют и другие социальные детерминанты использования спирометрии, которые выходят за рамки простого улучшения знаний и / или навыков использования спирометрии.Условия финансирования, временные ограничения и чрезмерная уверенность в диагностических навыках без использования технологий (за исключением подтверждающего инструмента), по-видимому, также повлияли на использование спирометрии в практике, изученной в этом исследовании. Ключевые темы, очевидные в нашем анализе интервью, предполагают, что, хотя улучшенное обучение может быть полезным, другие факторы не менее важны. Если не в сочетании с изменениями отношения врачей общей практики к оптимальному управлению диагностической неопределенностью, регулярному использованию в управлении и улучшенному финансированию практик для борьбы с реальным дефицитом усвоения, маловероятно, что спирометрия в общей практике улучшится или поможет в постановке более точных диагнозов. астма и ХОБЛ.
Ограничения этого исследования
Наше исследование имеет некоторые ограничения. Спирометрия не проводилась у всех пациентов, поскольку в ходе исследования девять практик были рандомизированы для оказания обычной медицинской помощи. Некоторые другие данные также отсутствовали, и у 27 пациентов не удалось установить диагноз. Набор был ограничен Мельбурном и прилегающими регионами. Приемлемые практики должны были использовать электронные системы назначения лекарств и быть готовы к поиску пациентов, которым были прописаны ингаляционные лекарства. Вполне вероятно, что те врачи, которые участвовали в исследовании, были более заинтересованы в лечении респираторных заболеваний, чем многие их коллеги.С другой стороны, практики, которые уже обычно использовали спирометрию, были исключены. Так что также возможно, что наши результаты отражают менее точный диагноз, чем может иметь место в такой практике. В целом, нам нужно быть немного осторожными при экстраполяции результатов на общую практику Австралии в целом.
Выводы
Результаты этого исследования подтверждают более широкое использование спирометрии в общей практике. Мы продемонстрировали, что модель «мобильной лаборатории функции легких» возможна и может производить высококачественные данные о функции легких.Мобильные лаборатории можно было бы эффективно использовать в Австралийских объединениях первичной медико-санитарной помощи (www.apcc.org.au/ about_the_APCC). Это позволит определить действия, необходимые для устранения пробелов в надлежащем использовании спирометрии при диагностике астмы / ХОБЛ в каждой местности. Потребности в обучении врачей общей практики могут быть удовлетворены с помощью частых структурированных семинаров для членов каждого коллектива. Финансирование мобильных подразделений должно быть интегрировано с подходящей схемой стимулирующего финансирования. Между рекомендуемым лечением астмы и ХОБЛ у взрослых есть некоторые важные различия, в том числе место применения комбинированных ингаляторов, письменные планы действий, антихолинергические препараты длительного действия и легочная реабилитация.Остается надеяться, что более точный диагноз приведет к лучшему лечению, уменьшению количества симптомов, лучшей функции легких и лучшему качеству жизни пациентов с хроническими респираторными заболеваниями.
Смешанные результаты с применением биопрепаратов против интерлейкина при астме
Два моноклональных антитела, направленных на разные мишени интерлейкина (ИЛ), дали совершенно разные результаты в рандомизированных исследованиях фазы II с участием астмы.
Положительным моментом является то, что ингибитор IL-33 под названием итепекимаб помогает пациентам контролировать астму лучше, чем плацебо, сообщил Майкл Векслер, доктор медицины из Национального еврейского здравоохранения в Денвере, и его коллеги.
Хотя это и есть минус, ризанкизумаб (Скиризи) — блокатор ИЛ-23, одобренный в настоящее время для лечения псориаза, — не только не показал положительных результатов, но и у пациентов с астмой, получавших его, на самом деле оказался хуже, чем в группе плацебо. Кристофер Брайтлинг, доктор медицинских наук, из Лестерского университета в Англии.
Оба исследования были опубликованы в журнале New England Journal of Medicine ( NEJM ).
Открытие ризанкизумаба было особенно неожиданным, учитывая, что препарат показал хорошие результаты в испытаниях, связанных с другими воспалительными состояниями — не только псориазом, но и воспалительным заболеванием кишечника.
«Таким образом, наши результаты бросают вызов нынешнему пониманию роли, которую опосредованные Th27 и интерлейкином-23 пути играют в патогенезе астмы», — написали Брайтлинг и соавторы.
В частности, оказывается, что IL-23 не является злодеем астмы, а в худшем случае — нейтральным свидетелем, как предполагалось в сопутствующей редакционной статье NEJM двух австралийских исследователей.
«[B] поскольку интерлейкин-23 жизненно важен для эффективного иммунитета слизистых оболочек, ризанкизумаб мог предрасполагать пациентов к более тяжелым или более частым обострениям, вызванным вирусом», — написал Филип Бардин, доктор философии из Университета и больницы Монаша в Мельбурне. и Пол Фостер, доктор наук из Университета Ньюкасла.
И хотя результаты испытаний итепекимаба были положительными, они также подняли вопросы о роли интерлейкинов и других воспалительных / иммунных медиаторов при астме.
Это исследование включало четыре группы лечения: итепекимаб в качестве монотерапии и в комбинации с блокатором IL-4 дупилумабом (Dupixent), только дупилумабом и плацебо. Удивительно, но результаты в комбинированной группе были не лучше, а, возможно, и хуже, чем у пациентов, получавших только один из этих препаратов.
Следователи отказались уточнить причины; Бардин и Фостер утверждали, что воспалительные процессы при астме могут быть слишком сложными, чтобы биологические препараты могли полностью подавить их даже в сочетании.
«В этом контексте другие эпителиальные алармины, такие как интерлейкин-25 и стромальный лимфопоэтин тимуса, действующие независимо от интерлейкина-33, способствуют воспалению 2 типа», — писали они. «Комбинированная терапия итепекимабом и дупилумабом могла потерпеть неудачу, потому что эти пути обходят интерлейкин-33».
Исследование ризанкизумаба
Названное фазой IIa, исследование рандомизировало 214 взрослых пациентов с тяжелой астмой, которым вводили рисанкизумаб или плацебо путем подкожных инъекций каждые 4 недели в течение 6 месяцев.Все пациенты пережили по крайней мере одно тяжелое обострение в прошлом году (но не за 6 недель до скрининга) и принимали ингаляционные кортикостероиды и, по крайней мере, одно дополнительное лекарство от астмы.
Первичным критерием оценки было время до первого обострения астмы, определяемое как любой из нескольких индикаторов увеличения сужения дыхательных путей, таких как уменьшение пикового потока выдоха или увеличение использования лекарств.
Пациенты, получавшие рисанкизумаб, продемонстрировали ухудшение состояния намного раньше, чем пациенты, получавшие плацебо: в среднем 40 дней по сравнению с 86 днями при соотношении рисков 1.46 (95% ДИ 1,05–2,04). Уже к 4 неделе почти у 40% группы ризанкизумаба обострение астмы по сравнению с примерно 25% группы плацебо. Разница была еще больше у пациентов с количеством эозинофилов 200 / мм 903 · 10 3 или более. Соотношение частоты тяжелых обострений для ризанкизумаба по сравнению с плацебо во время исследования составляло 1,13, но это не было статистически значимым.
Одно из объяснений неожиданно отрицательной эффективности ризанкизумаба заключалось в данных биомаркеров, указывающих на то, что препарат подавляет транскрипцию Th27 и хелперного Т типа 1, наряду с цитотоксическими Т-клетками и естественными клетками-киллерами в образцах мокроты.«Эти данные подтверждают мнение о том, что рисанкизумаб оказывает биологическое действие на иммунитет дыхательных путей, что, возможно, способствовало плохому клиническому исходу», — писали Векслер и его коллеги.
Однако, помимо снижения контроля симптомов астмы, никаких проблем с безопасностью ризанкизумаба в исследовании не наблюдалось, а частота нежелательных явлений была аналогична таковой в группе плацебо.
Исследование Itepekimab
В этом исследовании фазы II рандомизировано 296 взрослых пациентов (средний возраст около 50 лет) с астмой средней и тяжелой степени тяжести в равных количествах с вышеупомянутыми четырьмя группами лечения.Лекарства и плацебо вводили в виде инъекций каждые 2 недели. Первичным результатом было «событие, указывающее на потерю контроля над астмой», определения которого во многом совпадали с определениями обострения астмы в исследовании ризанкизумаба.
Этот результат был достигнут у 41% группы плацебо в течение 12-недельного исследования, по сравнению с 22% в группе монотерапии итепекимабом, 19% в группе монотерапии дупилумабом и 27% в группе комбинированной терапии. В то время как оба препарата в качестве монотерапии продемонстрировали статистически значимое превосходство над плацебо, комбинация этого не показала (OR 0.52, 95% ДИ 0,26–1,06).
Более того, комбинированная группа не показала значительного улучшения по сравнению с плацебо в 1-секундном объеме форсированного выдоха (0,10 л, 95% ДИ от -0,03 до 0,23), в то время как каждое лекарство по отдельности показало (0,14-0,16 л, оба P < 0,05). Аналогичная картина наблюдалась и для других вторичных конечных точек, таких как показатели качества жизни.
Несмотря на то, что полученные данные служат хорошим предзнаменованием для итепекимаба в качестве терапии астмы, коммерческое будущее этого показания остается туманным. Разработчики препарата, Санофи и Регенерон, также нацелены на лечение хронической обструктивной болезни легких, и в настоящее время проходят два испытания фазы III.В опубликованных планах компаний по итепекимабу обсуждается только ХОБЛ без упоминания астмы, и на ClinicalTrials.gov не указано ни одного исследования фазы III по астме.
Санофи и Регенерон также продают дупилумаб, который приносит большие деньги. Похоже, что компании делали ставку на итепекимаб в качестве дополнения к дупилумабу и не видели в нем прибыли как в отдельном продукте.
Джон Гевер был управляющим редактором с 2014 по 2021 год; теперь он постоянный участник.
Раскрытие информации
Исследование итепекимаба финансировалось Sanofi и Regeneron. Исследование ризанкизумаба финансировалось AbbVie и Boehringer Ingelheim. Многие авторы этих исследований сообщили об отношениях с соответствующими компаниями; В исследовании итепекимаба некоторые из них были сотрудниками Санофи.
Бардин сообщил о своих отношениях с GlaxoSmithKline, AstraZeneca и Sanofi; Фостер заявил, что у него нет соответствующих финансовых интересов.
Пожалуйста, включите JavaScript, чтобы просматривать комментарии от Disqus.Ингаляторы флутиказона: лекарство для облегчения астмы и ХОБЛ
Обычная доза для ингалятора составляет 1 или 2 вдоха два раза в день.
Важно регулярно использовать ингалятор или небулайзер с флутиказоном, чтобы контролировать свои симптомы.Используйте его регулярно, даже если у вас нет никаких симптомов. После использования ингалятора всегда закрывайте крышку, чтобы он оставался чистым.
Ингаляторы флутиказона бывают разной силы. Ваш врач, астматик или медсестра подскажут, какая дозировка вам подходит. Всегда следуйте их инструкциям. Они могут посоветовать вам делать более двух затяжек из ингалятора за раз. Это зависит от того, насколько плохо у вас дыхание и какой ингалятор вы используете.
Обычная доза для небулайзера составляет 1 или 2 небулайзера, вдыхаемых из небулайзера два раза в день.Ваш врач или медсестра дадут вам четкие инструкции по использованию небулайзера.
Различные типы ингаляторов
Существуют различные типы ингаляторов флутиказона. Очень важно правильно пользоваться ингалятором. Это необходимо для того, чтобы вы получили нужное количество флутиказона в легкие и получили максимальную пользу от вашего лекарства.
Перед использованием ингалятора прочтите информационный буклет, который прилагается к нему. В этом буклете содержатся инструкции и схемы, показывающие, как пользоваться ингалятором, как содержать его в чистоте и как долго его использовать до замены.
Проверьте технику использования ингалятора
Чтобы получить максимальную отдачу от ингалятора, важно регулярно проверять свою технику.
Если вы не знаете, как использовать ингалятор, или ваша техника не проверялась в течение года, попросите своего врача, медсестру или фармацевта посмотреть, как вы его используете.
Очень важно правильно пользоваться ингалятором. Это необходимо для того, чтобы вы получили нужное количество флутиказона в легкие и получили максимальную пользу от вашего лекарства.
Использование ингалятора со спейсером
Если вам или вашему ребенку сложно пользоваться ингалятором, ваш врач или медсестра могут дать вам спейсер для использования с ним.Прокладки могут снизить риск побочных эффектов лекарства, влияющих на вашу полость рта и горло. Они особенно полезны при назначении флутиказона маленьким детям.
Спейсер — это большой пластиковый контейнер с мундштуком и отверстием для ингалятора. При использовании с ингалятором это облегчает попадание нужного количества флутиказона в легкие.
Ваш врач, медсестра или фармацевт могут показать вам, как использовать спейсер с вашим ингалятором.
Будет ли моя доза увеличиваться или уменьшаться?
Ваша доза может увеличиваться или уменьшаться в зависимости от того, насколько плохо ваше дыхание.Вам пропишут самую низкую дозу, контролирующую ваши симптомы.
Если вы согласовали личный план действий со своим врачом или медсестрой, следуйте своему плану действий.
Что делать, если я забуду его использовать?
Используйте ингалятор или небулайзер, как только вспомните. Если пришло время принять следующую дозу, пропустите пропущенную дозу и примите следующую дозу как обычно.
Не принимайте двойную дозу, чтобы восполнить пропущенную дозу.
Если вы часто забываете дозы, может быть полезно установить будильник, чтобы напомнить вам.Вы также можете спросить у фармацевта совета о других способах помочь вам не забыть принимать лекарство.
Не прекращайте прием флутиказона внезапно, даже если вы чувствуете себя лучше, не посоветовавшись предварительно со своим врачом или медсестрой.
Что делать, если я возьму слишком много?
Случайный прием слишком большого количества флутиказона вряд ли нанесет вам вред.

