Синдром Эдвардса: причины, признаки, диагностика, лечение
Синдром Эдвардса – заболевание, обусловленное спонтанной мутацией генов и появлением дополнительной 18 хромосомы. Подобные патологические изменения происходят в организме плода во время эмбриогенеза. Трисомия по 18-ой аутосоме сопровождается разнообразными пороками развития, приводящими к инвалидности или смерти ребенка. Синдром Эдвардса распространен по всему земному шару без четкой зависимости от местности или расы.
У больных детей изменяется внешний вид, поражается опорно-двигательная, пищеварительная, сердечно-сосудистая, нервная и мочеполовая системы. Следствием количественной хромосомной аберрации является своеобразный фенотип — длинная голова; недоразвитые уши, глаза и челюсти; короткая верхняя губа; косолапость. Синдром Эдвардса проявляется глубокой умственной отсталостью и многочисленными врожденными пороками внутренних органов: сердца, мозга, почек.
дети с синдромом Эдвардса
Впервые патологию описал ученый-генетик J.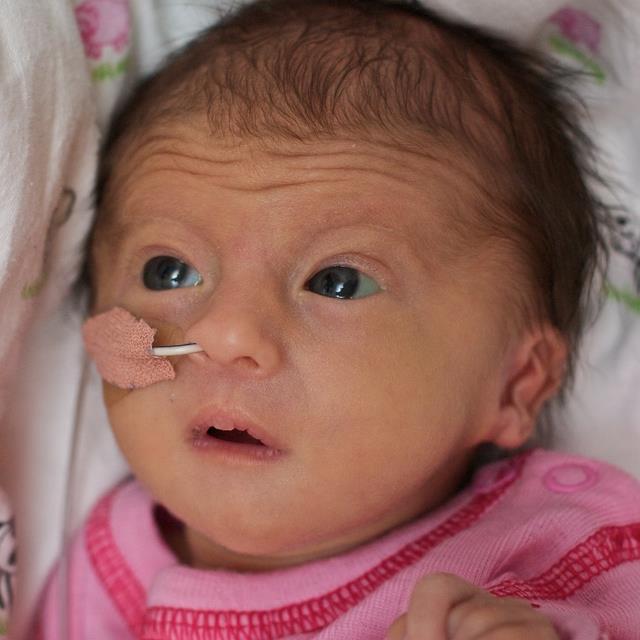
Согласно статистики, болеют синдромом Эдвардса преимущественно девочки. Женщины, носящие под сердцем плод мужского пола, обычно не вынашивают беременность – она заканчивается самопроизвольным абортом. Риск развития синдрома возрастает в случае беременности после 40 лет. Болезнь негативно сказывается на течении беременности: отмечается многоводие, недостаточная активность плода и поздние роды – после 42 недель.
Диагностика синдрома состоит из трех этапов — до зачатия, до родов и после рождения ребенка. Проводят ультразвуковое и цитогенетическое исследования плода, а также используют инвазивные методы, позволяющие выявить недуг пренатально. Новорожденных детей осматривают специалисты в области неонтологии, детской кардиологии, неврологии, хирургии, ортопедии, урологии. Им делают ЭКГ, УЗИ почек, исследование органов брюшной полости. Синдром Эдвардса — генетическое заболевание, вылечить которое невозможно. Больным детям требуется симптоматическая терапия и тщательный уход. Современные методы лечения способны поддержать жизнь ребенка на оптимальном уровне и добиться определенного прогресса в его развитии.
Проводят ультразвуковое и цитогенетическое исследования плода, а также используют инвазивные методы, позволяющие выявить недуг пренатально. Новорожденных детей осматривают специалисты в области неонтологии, детской кардиологии, неврологии, хирургии, ортопедии, урологии. Им делают ЭКГ, УЗИ почек, исследование органов брюшной полости. Синдром Эдвардса — генетическое заболевание, вылечить которое невозможно. Больным детям требуется симптоматическая терапия и тщательный уход. Современные методы лечения способны поддержать жизнь ребенка на оптимальном уровне и добиться определенного прогресса в его развитии.
Большинство детей с синдромом Эдвардса погибают внутриутробно. Новорожденные девочки редко доживают до 8-10 месяцев, а мальчики — до 2-3- месяцев. Только 10% рожденных детей способны прожить год. Взрослыми становятся лишь единицы. Больные дети умирают от сердечной дисфункции, воспаления легких, удушья, кишечной непроходимости. Эти осложнения обусловлены врожденные пороками развития.
Синдром Эдвардса – показание к прерыванию беременности. Рождение больных деток является осознанным выбором родителей. Чаще всего так происходит у женщин, которые не становились на учет по беременности и не проходили рекомендуемых исследований. Обычно родители отказываются от больного ребенка, практически обреченного на гибель.
Причины
Кариотип здорового ребенка состоит из 46 хромосом: по 23 от обоих родителей. У лиц с синдромом Эдвардса под влиянием не установленных наукой факторов происходит дублирование генетического материала, и появляется дополнительная 47 хромосома, которая является «лишней». Обычно мутации подвергается 18 хромосома. Так формируется название – трисомия 18. Хромосомные нарушения происходят в процессе образования гамет или дробления зиготы. В большинстве случаев возникает простая трисомия 18, крайне редко – мозаичная или транслокационная форма. Причины синдрома Эдвардса в настоящее время остаются неизвестными.
- Полная трисомия – три 18 хромосомы в каждой клетке плода. Патология обусловлена нерасхождением хромосом в процессе мейоза. Почти всегда лишняя хромосома передается по материнской линии. Этот вариант синдрома Эдвардса протекает довольно тяжело по сравнению с другими формами, встречается намного чаще и практически всегда имеет неблагоприятный прогноз.
- Мозаицизм связан с нерасхождением хромосом после слияния половых клеток на ранней стадии дробления зиготы. Обе гаметы изначально имеют нормальный набор хромосом, но в результате удвоения генетического материала и формирования зародыша происходит сбой. При этом только часть клеток плода получит лишнюю хромосому. Доля патологических клеток никогда не превышает 50%. Их число зависит от того, на каком этапе деления начальной клетки произошел сбой. Чем позже это происходит, тем меньше будет доля дефектных клеток.

- Частичная трисомия или транслокация – добавление фрагмента третьей хромосомы в результате дефекта деления генетического материала. Транслокационная перестройка ведет к избыточности информации и нарушению генетической последовательности в двух хромосомах. Гены 18 хромосомы переходят с одного участка на другой. Для пациентов с частичной трисомией 18 прогноз лучше, чем для детей с полной формой, но все равно остается неблагоприятным.
Клинически все 3 варианта данного синдрома протекают по одному типу, но первый вариант все же может отличаться более тяжелой формой.
Факторы, способствующие развитию патологии:
- неблагоприятная экология,
- облучение,
- воздействие химикатов и прочих токсинов,
- прием алкоголя беременной женщиной,
- активное и пассивное курение,
- воздействие некоторых лекарств,
- кровное родство супругов,
- заболевания половой сферы,
- возраст матери старше 40 лет.

Вышеперечисленные факторы лишь повышают риск развития данной мутации, а не являются ее непосредственными причинами.
Передача измененного набора хромосом последующим поколениям невозможна. Большинство больных не доживают до репродуктивного возраста. Репродуктивные органы, как и репродуктивные способности у них недоразвиты. Синдром Эдвардса не передается по наследству.
Симптомы
Избыток генетической информации в клетках приводит к появлению соответствующих симптомов болезни, которые объединены под названием «синдром Эдвардса».
Первые признаки патологии появляются во время беременности:
- Многоводие,
- Слабая активность плода,
- Гипоплазия плаценты,
- Аномальное строение пуповины.
Новорожденные дети имеют низкую массу тела – около 2 кг, а также признаки гипотрофии при доношенной или переношенной беременности. У них нарушен процесс дыхания, сосания и проглатывания молока. Им требуется питание через зонд и длительная вентиляция легких.
Фенотипические признаки новорожденных с синдромом Эдвардса:
- Долихоцефалия — длинноголовость,
- Непропорционально маленькая голова,
- Низкий лоб,
- Выступающий затылок,
- «Готическое» небо,
- Узкие глазные щели,
- Узкий и вдавленный нос,
- Микрогнатия — маленькая челюсть,
- Микрофтальмия — мелкие глазные яблоки,
- «Заячья губа» и «волчья пасть»,
- Вертикальная складка на внутреннем уголке глаза,
- Патологически неправильный прикус,
- Искаженные черты лица,
- Опущение верхнего века,
- Стробизм,
- Короткая шея,
- Деформация ушных раковин,
- Низкая посадка ушей.
Характерные деформации скелета:
- синдактилия кистей,
- укороченная и расширенная грудина,
- косолапость,
- искривление позвоночника,
- гипо- и атрофия мышц,
- «стопа-качалка»,
- полное слияние или перепончатость пальцев на нижних конечностях,
- аномальное сгибание и разгибание суставов,
- флексорное положение кисти.

Тяжелые аномалии со стороны внутренних органов:
- врожденные пороки сердца,
- грыжи,
- меккелев дивертикул,
- сужение привратника,
- отсутствие анального отверстия,
- удвоение мочеточника,
- почка в форме подковы,
- расширение чашечно-лоханочного комплекса,
- выпячивание стенки мочевого пузыря,
- неопущение яичка в мошонку,
- двурогая матка,
- клиторомегалия,
- атрофия или сглаживание извилин мозга,
- микроцефалия,
- менингомиелоцеле,
- водянка головного мозга,
- субарахноидальные кисты,
- недоразвитие мозжечка и мозолистого тела.
Нарушения психической сферы:
- умственная отсталость,
- олигофренизм,
- имбицилизм,
- идиотизм,
- задержка нервно-психического развития.
Тяжелейшие пороки фактически не дают больным шанса на выживание. Даже качественное лечение не спасает детей от гибели на первом году жизни.
Перечисленные клинические признаки синдрома Эдвардса довольно специфичны и разнообразны. Они позволяют заподозрить у пациента данный недуг и поставить предварительной диагноз. Сочетание наиболее частых симптомов с высокой вероятностью говорит о наличии у ребенка тяжелой патологии.
Диагностика
Поскольку синдром Эдвардса характеризуется довольно большим количеством ярко выраженных отклонений, его довольно просто диагностировать даже по внешним проявлениям. Однако этого недостаточно, чтобы поставить окончательный диагноз.
Диагностика синдрома Эдвардса складывается из трех этапов — обследование супружеских пар до момента зачатия, беременной женщины до родов и ребенка после появления на свет.
Диагностика до зачатия ребенка — идеальный вариант, но не всегда применимый. Специалисты-генетики могут лишь предположить, каков риск рождения ребенка с хромосомным заболеванием в данной семье.
- До момента зачатия врачи собирают семейный анамнез, опрашивая родителей об их родословной.

- Большое внимание специалисты уделяют факторам риска: возрасту матери, перенесенным инфекционным заболеваниям, хроническим болезням, вредным привычкам.
- Генетический анализ родителей – полноценное исследование, с помощью которого составляется их кариотип и обнаруживаются участки ДНК с дефектными генами.
Диагностика в период внутриутробного развития дает более точные результаты, поскольку обследуют организм плода. Пренатальная диагностика — важный этап в процессе выявления хромосомных нарушений.
- Ультразвуковое исследование плода и допплерография маточно-плацентарного кровотока – неинвазивные методы, полностью безопасные и рекомендованные всем беременным. Признаки синдрома Эдвардса: отставание плода в размерах и массе, большое количество околоплодных вод, видимые аномалии развития черепа и костей, агенезия пупочной артерии, малая величина плаценты, многоводие, брадикардия, отсутствие носовых костей, 2 артерии в пуповине, кисты сосудистых сплетений.
 Диагностика с помощью ультразвукового исследования является достоверной на 100%.
Диагностика с помощью ультразвукового исследования является достоверной на 100%. - Стандартный пренатальный скрининг включает анализ крови на сывороточные маркеры. Полученные результаты соотносят с возрастом беременной женщины и сроком гестации. При отклонении показателей от нормы ставят высокий риск синдрома Эдвардса. В таких случаях показано искусственное прерывание беременности по медицинским показаниям.
- Амниоцентез – клеточный анализ околоплодных вод. Инвазивная методика, осуществляемая путем забора амниотической жидкости шприцем. Ее клетки содержат образцы ДНК плода, которые проверяют на наличие генетических заболеваний.
- Кордоцентез — исследование пупочной крови плода, позволяющее определить генетические аномалии с высокой точностью.
- Биопсия хориона представляет собой пункцию матки через переднюю брюшную стенку и забор ткани для анализа – стандартного генетического исследования.
Беременным, попадающим в группу высокого риска, предлагается проведение инвазивной дородовой диагностики с последующим кариотипированием плода. Инвазивные методы считаются самыми точными и надежными, но требующими оперативного вмешательства и проникновения в оболочку плода. Диагноз подтверждается при помощи определения кариотипа малыша путем КФ-ПЦР.
Инвазивные методы считаются самыми точными и надежными, но требующими оперативного вмешательства и проникновения в оболочку плода. Диагноз подтверждается при помощи определения кариотипа малыша путем КФ-ПЦР.
Диагностика синдрома Эдвардса после рождения самая легкая, быстрая и точная. После выявления некоторых врожденных дефектов проводят генетический анализ для подтверждения диагноза. Основной задачей при рождении ребенка с этой патологией является обнаружение аномалий в развитии внутренних органов, которые обычно приводят к смерти в первые месяцы жизни. Именно на их поиск направлено большинство диагностических процедур непосредственно после рождения. Наиболее важными диагностическими исследованиями, которые должны быть выполнены ребенку с синдромом Эдвардса в первые часы жизни, являются эхокардиография, УЗИ органов брюшной полости и УЗИ почек.
Видео: синдром Эдвардса на УЗИ у плода, расширение воротниковой зоны
Лечение
Синдром Эдвардса, как и все хромосомные аномалии, неизлечим.
Патология в большинстве случаев несовместима с жизнью. Больным детям показана симптоматическая терапия, направленная на поддержание физиологических функций организма, продление жизни и улучшение ее качества.
Коррекция патологических процессов, опасных для жизни, заключается в назначении противовоспалительного и антибактериального лечения при наличии пневмонии, восстановлении проходимости пищеварительного тракта при атрезии кишечника, кормлении через зонд, использовании пеногасителей при метеоризме, слабительных средств при запоре. Для поддержания жизнеспособности всего организма проводится коррекция работы дыхательной и пищеварительной систем, а также нормализация сердечной деятельности. Больным необходимо создать стерильные условия, чтобы избежать развития различных инфекционных заболеваний. Дети с данным синдромом требуют тщательного ухода и регулярного прохождения медицинского обследования.
Пупочные и паховые грыжи, пороки сердца и прочие аномалии лечат хирургическим путем, если состояние больного ребенка остается удовлетворительным. Оперативное вмешательство несет неоправданный риск. Хирурги, исправив внешние дефекты, могут потерять пациента из-за сбоя в работе сердечно-сосудистой системы и развития прочих серьезных осложнений.
Оперативное вмешательство несет неоправданный риск. Хирурги, исправив внешние дефекты, могут потерять пациента из-за сбоя в работе сердечно-сосудистой системы и развития прочих серьезных осложнений.
Все дети с синдромом Эдвардса без исключения имеют отклонения в психофизическом развитии. Им требуется специальная программа воспитания, включающая комплекс обучающих методик. Она не восстановит нарушенные функции, но поможет привить некоторые элементарные бытовые навыки.
Прогноз и профилактика
Прогноз при синдроме Эдвардса крайне неблагоприятный. Больные дети погибают на первом году жизни. Только единицы доживают до юных и зрелых лет. При этом они имеют значительные умственные отклонения и нуждаются в постоянном уходе. Выжившие дети страдают от умственной отсталости и различных заболеваний, связанных с аномалиями строения. Только легкая форма мозаичного синдрома Эдвардса поддается коррекции. Больные дети начинают общаться с ограниченным кругом людей и приобретают элементарные навыки самообслуживания.
Если обеспечить необходимый уход, ребенок может научиться самостоятельно поднимать голову и есть.
Чтобы предотвратить рождение больного ребенка, необходимо своевременно выявлять хромосомные патологии у плода. Для этого всем беременным женщинам не следует пренебрегать антенатальным скринингом.
В настоящее время в нашей стране работают специальные центры, в которых ухаживают за детьми с врожденными заболеваниями и развивают их интеллект. Если больной ребенок живет в таком центре больше года под наблюдением врачей, он начинает улыбаться, реагировать на движение, самостоятельно поддерживать положение тела и питаться.
Синдром Эдвардса – патология, которую фактически невозможно ни прогнозировать, ни лечить, ни корректировать. Данный диагноз является показанием к аборту.
Видео: о детях с синдромом Эдвардса
youtube.com/embed/6Ige1TBpqec» frameborder=»0″ allowfullscreen=»allowfullscreen»>
Синдром Эдвардса — причины, симптомы, диагностика и лечение
Синдром Эдвардса — хромосомное заболевание, обусловленное трисомией по 18-ой хромосоме и сопровождающееся множественными пороками развития. Для синдрома Эдвардса характерны своеобразные фенотипические признаки (долихоцефалическая форма черепа, микрофтальмия, недоразвитие ушных раковин, микроретрогнатия и др.), аномалии опорно-двигательной, сердечно-сосудистой, пищеварительной, мочеполовой системы, ЦНС. Синдром Эдвардса может быть диагностирован на этапе беременности (УЗИ-скрининг, инвазивная пренатальная диагностика) либо уже после рождения ребенка на основании внешних признаков и цитогенетического исследования. Дети с синдромом Эдвардса нуждаются в симптоматическом лечении и хорошем уходе.
Общие сведения
Синдром Эдвардса – количественная хромосомная аберрация, при которой имеет место частичная или полная трисомия по 18 аутосоме. Синдром получил название по имени генетика J. Edwards, подробно описавшего заболевание в 1960 г. и выделившего свыше 130 характерных для данной патологии симптоматических дефектов. Синдром Эдвардса – второе по распространенности хромосомное заболевание после синдрома Дауна; частота рождения детей с синдромом Эдвардса составляет 1:5000-7000. Примерно три четверти всех больных синдромом Эдвардса – девочки; предполагается, что большая часть беременностей плодом мужского пола заканчивается внутриутробной гибелью и самопроизвольным абортом.
Синдром получил название по имени генетика J. Edwards, подробно описавшего заболевание в 1960 г. и выделившего свыше 130 характерных для данной патологии симптоматических дефектов. Синдром Эдвардса – второе по распространенности хромосомное заболевание после синдрома Дауна; частота рождения детей с синдромом Эдвардса составляет 1:5000-7000. Примерно три четверти всех больных синдромом Эдвардса – девочки; предполагается, что большая часть беременностей плодом мужского пола заканчивается внутриутробной гибелью и самопроизвольным абортом.
Синдром Эдвардса
Причины синдрома Эдвардса
Развитие синдрома Эдвардса объясняется хромосомными нарушениями, происходящими на стадии гаметогенеза (овогенеза или сперматогенеза) либо дробления зиготы и приводящими к увеличению числа хромосом 18-й пары. В 80-90% случаев цитогенетические варианты синдрома Эдвардса представлены простой трисомией 18, реже — мозаичной формой или несбалансированными перестройками (транслокациями).
Причиной полной трисомии служит мейотическое нерасхождение хромосом. Практически во всех случаях лишняя хромосома является материнской по происхождению. Этот вариант синдрома Эдвардса является наиболее тяжелым по своим проявлениям и неблагоприятным в плане прогноза. Возникновение мозаицизма связано с нерасхождением хромосом на ранней стадии дробления зиготы. В этом случае лишнюю хромосому будут содержать не все клетки плода, а лишь их часть. Транслокация – присоединение части 18-ой хромосомы к другой паре может произойти как в процессе созревания гамет, так и после оплодотворения. При этом клетки организма содержат две гомологичные 18-е хромосомы и ее дополнительную часть, прикрепленную к другой хромосоме.
Как и в случае с синдромом Дауна, возраст матери является наиболее значимым риск-фактором рождения ребенка с синдромом Эдвардса. В редких случаях у родителей может выявляться носительство сбалансированной транслокации.
Симптомы синдрома Эдвардса
Во время беременности наблюдается многоводие, слабая активность плода, маленькая плацента, единственная пупочная артерия. Ребенок с синдромом Эдвардса рождается с низкой массой тела (около 2170 г) и пренатальной гипотрофией при доношенной или даже переношенной беременности. У части детей определяется состояние асфиксии при рождении.
Ребенок с синдромом Эдвардса рождается с низкой массой тела (около 2170 г) и пренатальной гипотрофией при доношенной или даже переношенной беременности. У части детей определяется состояние асфиксии при рождении.
У новорожденных с синдромом Эдвардса имеются характерные фенотипические признаки, позволяющие предположить данную хромосомную патологию. В первую очередь обращает на себя внимание долихоцефалическая форма черепа с преобладанием продольного размера над поперечным, низкий лоб, выступающий затылок, микрогнатия, маленький рот, микрофтальмия. У детей с синдромом Эдвардса часто встречаются расщелины верхней губы и нёба, эпикант, птоз, экзофтальм, косоглазие, короткая шея с избыточной кожной складкой. Типичные деформации ушных раковин включают маленькие мочки, отсутствие козелков, узкие слуховые проходы, низкое расположение ушей.
Внешний облик детей дополняется характерными для синдрома Эдвардса деформациями скелета — скрещенными пальцами кистей, укороченной грудиной, аномалиями ребер, врожденным вывихом бедра, косолапостью, «стопой-качалкой», синдактилией стоп и пр. У многих детей имеются гемангиомы и папилломы кожи.
У многих детей имеются гемангиомы и папилломы кожи.
При синдроме Эдвардса имеются множественные тяжелые аномалии со стороны практически всех систем организма. Врожденные пороки сердца могут быть представлены дефектами межжелудочковой и межпредсердной перегородок, коарктацией аорты, транспозицией магистральных сосудов, дисплазией клапанов, тетрадой Фалло, аномальным дренажом легочных вен, декстракардией и др. При синдроме Эдвардса может выявляться патология развития желудочно-кишечного тракта: диафрагмальные, пупочные и паховые грыжи, дивертикул Меккеля, трахеопищеводные свищи, пилоростеноз, атрезия подвздошной кишки и ануса. Наиболее частыми аномалиями мочеполовой системы у детей с синдромом Эдвардса служат подковообразная почка, гидронефроз, дивертикулы мочевого пузыря, гипоспадия и крипторхизм (у мальчиков), двурогая матка, внутриматочная перегородка и гипертрофия клитора (у девочек).
Пороки развития центральной нервной системы характеризуются наличием микроцефалии, менингомиелоцеле, гидроцефалии, аномалии Арнольда-Киари, кист арахноидального сплетения, гипоплазии мозжечка и мозолистого тела. У всех выживших детей с синдромом Эдвардса имеются интеллектуальные нарушения — олигофрения в степени глубокой имбецильности или идиотии.
У всех выживших детей с синдромом Эдвардса имеются интеллектуальные нарушения — олигофрения в степени глубокой имбецильности или идиотии.
Новорожденные с синдромом Эдвардса испытывают трудности с сосанием, глотанием и дыханием, из-за чего им требуется зондовое питание или длительная ИВЛ. Дети с синдромом Эдвардса, как правило, погибают на первом году жизни из-за тяжелых врожденных пороков развития и связанных с ними осложнений (сердечно-сосудистой и дыхательной недостаточности, пневмонии, кишечной непроходимости и т. д.).
Диагностика синдрома Эдвардса
Важнейшей задачей диагностики служит антенатальное выявление синдрома Эдвардса у плода, поскольку данная патология является медицинским показанием для искусственного прерывания беременности. Заподозрить наличие синдрома Эдвардса можно в процессе УЗИ плода и допплерографии маточно-плацентарного кровотока по косвенным признакам (множественным аномалиям развития плода, агенезии пупочной артерии, малой величине плаценты, многоводию и пр. ).
).
Наибольшую диагностическую значимость имеет стандартный пренатальный скрининг, включающий анализ крови на сывороточные маркеры: βХГЧ и PAPP на 11-13 неделе беременности; βХГЧ, альфа-фетопротеин и свободный эстриола на 20-24 неделе гестации.
При оценке степени риска рождения ребенка с синдромом Эдвардса учитываются данные биохимического и ультразвукового скрининга, срок беременности, возраст и масса тела женщины. Беременным, попадающим в группу высокого риска, предлагается проведение инвазивной дородовой диагностики (биопсии хориона, амниоцентеза, кордоцентеза) с последующим кариотипированием плода.
В случае рождения живого ребенка с синдромом Эдвардса необходимо как можно более раннее всестороннее обследование, направленное на выявление тяжелых пороков развития. Новорожденный с синдромом Эдвардса должен быть осмотрен неонатологом, детским кардиологом, детским неврологом, детским хирургом, детским ортопедом, детским урологом и др. Наиболее важными диагностическими исследованиями, которые должны быть выполнены ребенку с синдромом Эдвардса в первые часы жизни, служат эхокардиография, УЗИ органов брюшной полости и УЗИ почек.
Наиболее важными диагностическими исследованиями, которые должны быть выполнены ребенку с синдромом Эдвардса в первые часы жизни, служат эхокардиография, УЗИ органов брюшной полости и УЗИ почек.
Лечение синдрома Эдвардса
Поскольку в большинстве случаев аномалии развития оказываются несовместимыми с жизнью, лечение детей с синдромом Эдвардса сводится к оказанию симптоматической помощи, направленной на поддержание физиологических функций, продление жизни и улучшение ее качества. Хирургическая коррекция врожденных пороков, как правило, является рискованной и неоправданной.
Поскольку дети с синдромом Эдвардса ослаблены и подвержены частой заболеваемости инфекциями мочевыводящих путей, средним отитом, конъюнктивитом, синуситами, пневмониями и пр., они нуждаются в тщательно организованном уходе, полноценном питании, регулярном наблюдении со стороны педиатра.
Прогноз и профилактика синдрома Эдвардса
Во всех случаях прогноз при синдроме Эдвардса крайне неблагоприятный: в среднем мальчики живут 2-3 месяца, девочки – 10 месяцев. До 1 года доживает лишь 10% больных, до 10 лет – не более 1%. Относительно благоприятные шансы в отношении выживания имеют дети с мозаичной формой синдрома Эдвардса.
До 1 года доживает лишь 10% больных, до 10 лет – не более 1%. Относительно благоприятные шансы в отношении выживания имеют дети с мозаичной формой синдрома Эдвардса.
Риск рождения ребенка с синдром Эдвардса теоретически существует в любой супружеской паре; известно, что такая вероятность выше у возрастных родителей (для женщин старше 45 лет – 0,7%). С целью своевременного выявления хромосомной патологии у плода не следует пренебрегать антенатальным скринингом, входящим в программу введения беременности.
что это. Симптомы, причины, диагностика и лечение синдрома Эдвардса
access_time0 мин
Лечением данного заболевания занимается генетик.
МКБ-10: Q91 — Синдром Эдвардса и синдром Патау.
Синдром Эдвардса получил название по фамилии ученого Джона Эдвардса, впервые описавшего трисомию. Синдром Эдвардса представляет собой хромосомную патологию, которая характеризуется наличием дополнительной хромосомы (трисомия) в 18 паре. Это тяжелая врожденная патология, вторая по частоте после синдрома Дауна, характеризующаяся тяжелыми аномалиями в развитии внутренних органов с неблагоприятным прогнозом. Согласно статистическим данным, частота болезни во всем мире находится в пределах 0,015—0,02%. На три-четыре больных девочки приходится один мальчик.
Содержание статьи
- Причины синдрома Эдвардса
- Признаки и симптомы синдрома Эдвардса
- Диагностика синдрома Эдвардса
- Лечение синдрома Эдвардса
- Профилактика синдрома Эдвардса
Синдром Эдвардса — причины, риски, признаки на УЗИ
Большинство женщин хорошо знают, что такое синдром Дауна. И во время беременности многие узнают, что очень редко, но встречается и другое хромосомное нарушение, называемое Синдром Эдвардса. И многие обеспокоены, как узнать насколько высок риск рождения ребенка с синдромом Эдвардса и как диагностируется такая патология при беременности?
И во время беременности многие узнают, что очень редко, но встречается и другое хромосомное нарушение, называемое Синдром Эдвардса. И многие обеспокоены, как узнать насколько высок риск рождения ребенка с синдромом Эдвардса и как диагностируется такая патология при беременности?
Что такое Синдром Эдвардса?
Синдром Эдвардса — это генетическое заболевание, характеризующееся дублированием (трисомией) ХVIII хромосомы и проявляющееся целым рядом характерных пороков развития у плода во время беременности, часто приводящих к смерти ребенка или его инвалидизации. То есть у ребенка вместо 46 хромосом образуется 47, эта лишняя хромосома дает другое название болезни — трисомия 18. Синдром был назван в честь исследователя Джона Эдвардса, который впервые описал его в 1960 году.
Почему возникает синдром Эдвардса — причины патологии
Даже если родители здоровы, и в семейном анамнезе нет такой патологии, ребенок с 18 хромосомой может родиться у любой женщины.
Как известно, в каждой человеческой клетке находится 46 хромосом, а в женских и мужских половых клетках по 23 хромосомы, которые, соединяясь при оплодотворении яйцеклетки, также дают в сумме 46 хромосом. Если говорить о синдроме Эдвардса, причины его появления неизвестны.
В настоящее время известно только то, что в результате определенных генетических мутаций появляется лишняя 47–я хромосома (дополнительная хромосома в 18–й паре хромосом, которых таким образом становится не 2, а 3).
В 95% всех случаев развития синдрома Эдвардса в клетках находится именно лишняя 18–я хромосома (трисомия), однако в 2% наблюдается только «удлинение» 18–й хромосомы (транслокация), когда общее число хромосом остается нормальным и равняется 46.
В 3% случаев синдрома Эдвардса имеет место «мозаичная трисомия», когда дополнительная 47–я хромосома обнаруживается в организме не во всех клетках, а лишь определенной его части. Клинически все 3 варианта синдрома Эдвардса протекают практически одинаково, однако первый вариант может отличаться более тяжелым течением заболевания.
Как часто встречается эта патология?
Дети с синдромом Эдвардса погибают на этапе внутриутробного развития приблизительно в 60% случаев. Несмотря на это, среди генетических заболеваний данный синдром у выживших младенцев является достаточно распространенным, по частоте встречаемости уступая только синдрому Дауна. Распространенность синдрома Эдвардса составляет 1 случай на 3 — 8 тысяч детей.
Считается, что у девочек данное заболевание встречается в 3 раза чаще, а риск синдрома Эдвардса значительно возрастает, если беременной женщине 30 и более лет.
Смертность при синдроме Эдвардса на первом году жизни составляет около 90%, причем средняя продолжительность жизни при тяжелом течении заболевания у мальчиков — 2–3 месяца, а девочек — 10 месяцев, а до взрослого состояния доживают лишь единицы. Чаще всего дети с синдромом Эдвардса умирают от удушья, пневмонии, сердечно–сосудистой недостаточности или кишечной непроходимости — осложнений, вызванных врожденными пороками развития.
Как проявляется синдром у ребенка?
Признаки синдрома Эдвардса можно разделить на несколько больших групп:
К первой группе относятся симптомы, характерные для внешнего вида ребенка:
- При рождении низкая масса тела (около 2 100 – 2200 граммов)
- Непропорционально маленькая голова
- Дефекты развития верхней или нижней челюстей (микрогнатия)
- Искажение формы лица и формирование неправильного прикуса
- «Волчья пасть» (расщелина твердого неба) или «заячья губа» (расщелина верхней губы)
- Пальцы кисти сжаты, в кулаке располагаются неровно
- Низкая посадка ушей
- Перепончатость или полное слияние пальцев нижних конечностей
- Врожденная косолапость
- «Стопа–качалка»
- Относительно малых размеров ротовая щель (микростомия)
Ко второй группе можно отнести признаки нарушения работы внутренних органов, моторики и нервно–психического развития:
- Наличие врожденных пороков сердца, например, открытого овального отверстия, дефекта межжелудочковой перегородки, открытого артериального протока и т.
 п.
п. - Развитие паховых или пупочных грыж.
- Органы пищеварения: гастроэозофагиальная рефлюксная болезнь, нарушение глотательного и сосательного рефлекса, атрезия пищевода или заднего прохода, меккелев дивертикул, нарушение расположения кишечника.
- Центральная нервная система: задержка нервно–психического развития, умственная отсталость, недоразвитость мозжечка, мозолистого тела, сглаживание или атрофия мозговых извилин.
- Мочеполовая система: крипторхизм, гипоспадия у мальчиков, гипертрофия клитора, недоразвитость яичников у девочек, независимо от пола — подковообразная или сегментированная почка, удвоение мочеточников.
- Косоглазие, сколиоз, атрофия мышц.
Как узнать патологию во время беременности — диагностика
Синдром Патау, Эдвардса и другие трисомии лучше всего выявить до рождения малыша. Как правило, пренатальная диагностика данного синдрома проводится в 2 этапа:
- На сроке в 11–13 недель (скрининг, в основе которого — проведение различных биохимических анализов у женщины).

- Определение кариотипа плода у беременных их группы риска.
В 11–13 недель в крови женщины определяется уровень некоторых белков крови: β–ХГЧ (β–субъединица хорионического гормона человека) и плазменного протеина А ассоциированного с беременностью. Затем с учетом этих данных, возраста беременной женщины рассчитывается риск рождения ребенка с синдромом Эдвардса, и формируется группа риска беременных.
Далее в группе риска на более позднем сроке берется материал у плода для постановки точного диагноза: в 8–12 недель это биопсия ворсин хориона, в 14–18 — амниоцентез (изучение околоплодных вод), спустя 20 недель — кордоцентез (внутриутробное взятие крови из пуповины плода с УЗИ–контролем). После этого в полученном материале определяют наличие или отсутствие дополнительной 18–й хромосомы с помощью КФ–ПЦР (количественной флуоресцентной полимеразной цепной реакции).
Если беременная не прошла генетическое скрининг–обследование, то на более поздних сроках предварительная диагностика синдрома Эдвардса осуществляется с помощью УЗИ. Прочие косвенные признаки, на основании которых можно заподозрить синдром Эдвардса на более поздних сроках:
Прочие косвенные признаки, на основании которых можно заподозрить синдром Эдвардса на более поздних сроках:
- Наличие аномалий развития костей и мягких тканей головы («волчья пасть», микроцефалия, низкая посадка ушных раковин, «заячья губа» и т.п.).
- Обнаружение пороков со стороны сердечно–сосудистой , мочеполовой системы, а также опорно–двигательного аппарата.
Диагностические признаки синдрома у ребенка
После рождения ребенка опорными диагностическими признаками наличия синдрома Эдвардса являются следующие:
- Микроцефалия, малый вес при рождении
- Наличие «заячьей губы» или «волчьей пасти»
Признаки характерной дерматографической картины:
- неразвитая на пальцах дистальная сгибательная складка
- наличие в 1/3 случаев поперечной ладонной борозды
- дуги на подушечках пальцев рук
- изменение кожного рисунка ладони: дистальное расположение осевого трирадиуса и увеличение гребневого счета.

Далее диагноз также подтверждается с помощью определения кариотипа ребенка методом КФ–ПЦР.
Синдром Эдвардса на УЗИ — кисты сосудистых сплетений
На ранних сроках синдром Эдвардса на УЗИ заподозрить крайне трудно, однако в 12 недель беременности уже выявляют характерные для него симптомы косвенного характера:
- Признаки задержки развития плода
- Брадикардия (снижение у плода частоты сердечных сокращений)
- Омфалоцеле (наличие грыжи брюшной полости)
- Отсутствие визуализации косточек носа
- В пуповине одна, а не 2 артерии
Также на УЗИ могут быть обнаружены кисты сосудистых сплетений, представляющих собой полости с содержащейся в них жидкостью. Сами по себе они не несут угрозу для здоровья и исчезают к 26–недельному сроку беременности. Однако такие кисты очень часто сопровождают различные генетические заболевания, например, синдром Эдвардса (в данном случае кисты обнаруживаются у 1/3 детей, страдающих этой патологией), поэтому при обнаружении таких кист врач направит беременную женщину на обследование в генетическую консультацию.
Лечение
Так как дети с синдромом Эдвардса редко доживают до года, то сначала лечение направлено на коррекцию тех пороков развития, которые опасны для жизни:
- восстановление прохода пищи при атрезии кишечника или анального отверстия
- кормление через зонд в случае отсутствия глотательного и сосательного рефлексов
- антибактериальная и противовоспалительная терапия при воспалении легких
При относительно благоприятном течении заболевания происходит коррекция некоторых аномалий и пороков развития: хирургическое лечение «волчьей пасти», пороков сердца, паховой или пупочной грыжи, а также симптоматическое медикаментозное лечение (назначение слабительных при запорах, «пеногасителей» при метеоризме и т.п.).
Дети с синдромом Эдвардса склонны к таким заболеваниям, как:
- средний отит
- рак почки (опухоль Вильмса)
- пневмония
- конъюнктивит
- легочная гипертензия
- апноэ
- повышенное артериальное давление
- фронтиты, синуситы
- инфекции мочеполовой системы
Поэтому лечение больных с синдромом Эдвардса включает своевременную диагностику и терапию данных заболеваний.
Прогноз для ребенка
В большинстве случаев прогноз неблагоприятный. Единицы детей с синдромом Эдвардса, которые доживают до взрослого возраста, имеют серьезные умственные отклонения и постоянно требуют постороннего ухода и контроля. Однако при соответствующих занятиях они способны реагировать на утешение, улыбаться, самостоятельно принимать пищу, а также взаимодействовать с воспитателями, приобретая различные умения и навыки.
синдром эдвардса признаки по узи — 23 рекомендаций на Babyblog.ru
Репродуктивные гормоны и маркеры ФПКФолликуло-стимулирующий гормон, лютеинизирующий гормон
ФСГ и ЛГ секретируются гонадотропными клетками передней доли гипофиза. Гонадотропины ФСГ и ЛГ, хориогонадотропин ХГ и тиротропин ТТГ являются гликопротеинами, молекулы которых состоят из двух ковалентно связанных субъединиц, а и ß . а-субъединицы ФСГ, ЛГ, ТТГ и ХГ идентичны, а ß-субъединицы специфичны для каждого гормона и определяют их биологическую активность. Небольшое количество свободных субъединиц могут циркулировать в крови, однако возможность любого из биологических эффектов реализуется лишь при условии ассоциации а-цепи с ß-цепью. Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
а-субъединицы ФСГ, ЛГ, ТТГ и ХГ идентичны, а ß-субъединицы специфичны для каждого гормона и определяют их биологическую активность. Небольшое количество свободных субъединиц могут циркулировать в крови, однако возможность любого из биологических эффектов реализуется лишь при условии ассоциации а-цепи с ß-цепью. Секреция ФСГ и ЛГ гонадотропными клетками передней доли гипофиза контролируется следующими факторами:
а) Гонадотропин-рилизинг гормон ( Gn — RH ), известным также как ЛГ-рилизинг гормоном ( LH — RH ), или как люлиберин. LH — RH является декапептидом, секретируемым гипоталамусом. LH — RH и его синтетические химические аналоги широко используются в терапевтических и диагностических целях (LH-RH-тест). LH — RH секретируется в портальную венозную систему гипофиза, где он стимулирует образование и пульсирующую секрецию ЛГ и, в меньшей степени, ФСГ.
б) стероидными гормонами, вырабатываемыми половыми железами. Именно эстрогены и гестагены контролируют секрецию гонадотропина по принципу положительной или отрицательной обратной
в) ингибином (гликопротеином, синтезируемым клетками Сертолли в процессе сперматогенеза и специфически ингибирующим секрецию ФСГ).
Эффект гонадотропинов реализуется через специфические рецепторы на поверхности клеточной мембраны. В этом процессе участвует важный межклеточный медиатор циклический аденозин монофосфат (цАМФ, сАМР).
Гонадотропины выводятся из организма с мочой. Так как их биологическая активность и иммунологические свойства в значительной мере остаются неизменными, концентрация этих гормонов в моче здоровых людей соответствует их концентрации в периферической крови.
Функции гонадотропинов у детей
У детей препубертатного периода уровни гонадотропинов и половых стероидов очень низкие. Во время пубертатного периода чувствительность гипофиза к LH — RH возрастает, в результате чего увеличивается секреция гонадотропинов, секреция половых стероидов и развиваются вторичные половые признаки.
Функции гонадотропинов у мужчин
У мужчин ЛГ стимулирует синтез тестостерона в клетках Лейдига, ФСГ стимулирует сперматогенез, синтез ингибина и андроген-связывающего белка в семенных канальцах, а также превращение тестостерона в 17- ß-эстрадиол в клетках сертоли. И тестостерон, и эстрогены оказывают ингибирующий эффект на секрецию гонадотропина посредством гипоталамического подавления L Н- RH.
И тестостерон, и эстрогены оказывают ингибирующий эффект на секрецию гонадотропина посредством гипоталамического подавления L Н- RH.
Функции гонадотропинов у женщин
а) У женщин детородного периода секреция гонадотропинов является наиболее важным условием поддержания менструального цикла. В последние несколько дней предыдущего цикла снижение концентрации стероидных гормонов повышает секрецию ФСГ, что стимулирует рост нескольких граафовых пузырьков. Один из фолликулов развивается более интенсивно, остальные — атрофируются. Растущий созревающий фолликул продуцирует повышающиеся количества эстрогенов, которые оказывают мягкий ингибирующий эффект на секрецию ФСГ. В конце фолликулярной фазы секреция эстрогенов резко возрастает и достигает максимума непосредственно перед овуляцией. Обратная связь концентраций гормонов из отрицательной становится положительной, что выражает ся в овуляторных пиках уровней ЛГ и ФСГ. Овуляция, завершающаяся разрывом фолликула и превращением его в желтое тело, приводит также к падению уровней гонадотропинов и эстрогенов на фоне повышающегося уровня прогестерона. Лютеинизация гранулезных клеток наступает при вторичном подъеме концентрации эстрогенов параллельно с возрастанием уровня прогестерона до максимума в середине лютеиновой фазы. Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.
Лютеинизация гранулезных клеток наступает при вторичном подъеме концентрации эстрогенов параллельно с возрастанием уровня прогестерона до максимума в середине лютеиновой фазы. Желтое тело рассасывается, и уровень стероидных гормонов падает к концу цикла, что приводит к отмене ингибирования секреции LH — RH гипоталамусом. Секреция гонадотропинов возрастает и начинается новый цикл.б) В перименопаузе циклическая активность яичников снижается вплоть до полного угасания. Циклы в перименопаузе часто бывают ановуляторными и характеризуются значительной флюктуацией уровней стероидных и гипофизарных гормонов. В последствии все примордиальные фолликулы перестают реагировать на гонадотропную стимуляцию под воздействием стероидных гормонов.
в) В менопаузе исчезает отрицательная обратная связь и уровни гонадотропинов, в частности, ФСГ, значительно повышаются по сравнению с детородным периодом.
Рис.1. Динамика концентраций гонадотронпинов (ГТ), эстрадиола (Е2) и прогестерона (Пр) в крови на протяжении менструального цикла и при наступлении беременности.
Патология женщины детородного периода
Если исключается возможность гиперпролактинемии, определение ФСГ представляет собой первую часть исследований нарушений менструального цикла. Рекомендуется проводить одно временное определение ФСГ, ЛГ и пролактина в первой пробе крови. Повышенные уровни ФСГ обычно являются индикатором необратимой недостаточности функции яичников (за исключением очень редкого синдрома резистентности яичников). Пониженная или нормальная концентрация ФСГ при пониженной концентрации ЛГ имеет место при нарушении функции гипофиза или гипоталамуса. Если секреция эстрогенов понижена (при отрицательном анализе на прогестерон), овуляцию можно индуцировать гонадотропинами (Прегонал) или пульсирующим введением LH — RH . Если секреция эстрогенов в норме, лечение нужно начать с кломифена. Незначительное повышение концентрации ЛГ при нормальной концентрации ФСГ может наблюдаться при синдроме поликистозных яичников (РСО, синдром Штейна-Левенталя). Возникновение синдрома связано с гиперсекрецией андрогенов и замедленным синтезом эстрогенов яичниками, что компенсируется их ускоренным синтезом в периферии. Таким образом, уровень эстрогенов в сыворотке крови остается в норме. Довольно часто в этом случае наблюдается незначительная гиперпролактинемия.
Возникновение синдрома связано с гиперсекрецией андрогенов и замедленным синтезом эстрогенов яичниками, что компенсируется их ускоренным синтезом в периферии. Таким образом, уровень эстрогенов в сыворотке крови остается в норме. Довольно часто в этом случае наблюдается незначительная гиперпролактинемия.
У женщин с анорексией уровень гонадотропинов понижен. При стимуляции LH — RH наблюдается повышение содержания ФСГ, уровень ЛГ остается неизменным или незначительно возрастает.
Девочки пубертатного периода
При замедленном половом развитии диагностика проводится по схеме, приведенной для случаев недостаточности яичников. При повышенном уровне ФСГ необходимо провести полное эндокринологическое и генетическое обследование.
В случаях преждевременного созревания концентрация гонадотропинов часто бывает повышен ной по сравнению с нормальными для данного возраста уровнями. Диагностический тест с LH — RH часто приводит к резкому повышению секреции ЛГ.
У женщин в менопаузе пониженное содержание гонадотропинов наблюдается при проведении заместительной терапии ( HRT ) или у пациенток с эстроген-продуцирующими опухолями. Низкие уровни гонадотропинов также обнаруживаются при гипофизарной недостаточности.
Мужчины
Определение ФСГ проводят в случае подозрения на недостаточность половых желез в результате обнаружения азооспермии или олигоспермии. Высокий уровень ФСГ указывает на первичную тестикулярную недостаточность.
Показания к проведению исследований:Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Недостаточность яичников
• Синдром поликистоза яичников
• Анорексия
• Гипофизарная недостаточность
Девочки пубертатного периода:
• Гипофизарная недостаточность
• Преждевременное половое созревание
• Замедленное половое созревание
• Недостаточность яичников
• Анорексия
Женщины в менопаузе:
• Гипофизарная недостаточность
• Метроррагия
• Гормональная заместительная терапия ( HRT )
Мужчины:
• Гипофизарная недостаточность
• Азооспермия, олигоспермия
Подготовка проб для анализа и содержание гонадотропинов в норме.
Уровни гонадотропинов не имеют циркадного ритма. Пульсирующий характер секреции с интервалами в 1-2 часа особенно характерен для ЛГ, поэтому результаты единичных анализов следует считать приблизительными. Образцы сыворотки или плазмы крови после образования сгустков и/или отделения эритроцитов стабильны в течение времени, достаточного для пересылки образцов по почте. Замороженные образцы можно хранить в течение длительного периода времени.
Не рекомендуется использовать гемолизированные, липемические или иктерические образцы, так как это может оказать влияние на результаты анализа. Снижение уровня гормонов может наблюдаться при приеме оральных контрацептивов, фенотиазинов, эстрогенов.
Современные иммуноанализы ЛГ и ФСГ основаны на использовании моноклональных антител, которые не имеют перекрестной реакции с ХГ.
ФСГ, (мМЕ/л)
ЛГ, (мМЕ/л)
Мужчины
0,7-1,1
0,8-7,6
Женщины
Фолликулярная фаза
2,8 — 11,3
1,1-11,6
Овулятрный пик
5,8-21
17-77
Лютеиновая фаза
1,2-9,0
0-14,7
Постменопауза
21,7-153
11,3-40
Препубертатные дети
<1
<1
Биологический материал :
• сыворотка крови
• гепаринизированная плазма крови
ПролактинПролактин человека — полипептид с молекулярной массой около 23 000 Да. В циркулирующей крови он находится в мономерной форме или в форме полимеров с различной биологической активностью. Количественное соотношение этих форм меняется при различных физиологических состояниях. По своей структуре пролактин имеет высокую степень подобия с гормоном роста и плацентарным лактогеном, возможно из-за их общего эволюционного происхождения. Биологический период полу-жизни пролактина около 15-20 мин. О способе выведения его из организма до настоящего времени известно немного.
В циркулирующей крови он находится в мономерной форме или в форме полимеров с различной биологической активностью. Количественное соотношение этих форм меняется при различных физиологических состояниях. По своей структуре пролактин имеет высокую степень подобия с гормоном роста и плацентарным лактогеном, возможно из-за их общего эволюционного происхождения. Биологический период полу-жизни пролактина около 15-20 мин. О способе выведения его из организма до настоящего времени известно немного.
Физиологические функции пролактина
Пролактин секретируется лактотропными клетками передней доли гипофиза Его секрецию гипотапамусом контролирует сложная система, в которой преобладает ингибирование (в результате перерезания ножки гипофиза секреция пролактина увеличивается). Дофамин — наиболее важное эндогенное соединение, ингибирующее секрецию пролактина, которое, возможно, идентично так называемому пролактин-ингибирующему фактору (PIF). Адреналин, норадреналин, ацетилхолин, соматостатин и простагландины не оказывают такого сильного влияния на секрецию пролактина.
Тиреолиберин (TRH) стимулирует секрецию пролактина, но не является физиологическим триггерным фактором. Другими эндогенными стимуляторами секреции пролактина являются: гамма -амино масляная кислота ( GAВA ), серотонин и мелатонин.
На секрецию пролактина влияет также уровень эстрогенов. Высокие уровни эстрогенов стимулируют секрецию пролактина посредством ингибирования синтеза дофамина, а низкие их уровни, вероятно, ингибируют секрецию пролактина посредством увеличения чувствительности гипофиза к дофамину.Основной физиологической функцией пролактина является запуск и поддержание процесса лактации.
Во время беременности секреция пролактина постоянно возрастает в результате ускоренного синтеза эстрогенов в фето-плацентарной системе. Эстрогены и пролактин подготавливают молочную железу к лактации, воздействуя на процесс дифференциации альвеол и протоков.
Уровень пролактина повышен в амниотической жидкости и оболочках плода. Возможно, пролактин играет важную роль в формировании легочной ткани эмбриона. Новорожденные имеют относительно высокий уровень пролактина, который снижается в течение нескольких первых месяцев жизни, пока не достигнет уровня, характерного для детского возраста.
Если женщина не кормит грудью, уровень пролактина после родов приходит в норму в течение 4 недель. У кормящих женщин уровень пролактина снижается медленнее, так как кормление стимулирует его секрецию.
Существует теория, что физиологический уровень пролактина необходим для нормального функционирования репродуктивной системы у обоих полов. Однако физиологическая роль пролактина у мужчин пока не доказана.
Патология: Гиперпролактинемия ослабляет функцию гонад обоих полов. У женщин она вызывает нарушения менструального цикла вследствие недостаточности лютеиновой фазы, олигоменорею, аменорею, которая может сочетаться с галактореей. У мужчин она сопровождается потерей либидо или импотенцией. Механизм этого не совсем ясен, но, возможно, он сходен с ингибированием циклической функции яичников у кормящих грудью женщин.Наиболее распространенные причины гиперпролактиемии следующие:
• секретирующие пролактин опухоли гипофиза, так называемые пролактиномы.
• расположенные над турецким седлом опухоли гипофиза, тормозящие выработку и транспорт дофамина.
• повреждения ножки гипофиза, приводящие к такому же эффекту.
• эктопический синтез пролактина
Кроме того повышение уровня пролактина может быть при:
• первичном гипотиреозе
• поликистозе яичников
• почечной недостаточности
Однако уровень пролактина не является единственным фактором, ответственным за возникновение клинических проявлений гиперпролактинемии. Изменение соотношения форм пролактина с различной биологической активностью или изменение количества рецепторов к пролактину могут также быть причиной возникновения данного заболевания. Именно поэтому в литературе описаны отдельные случаи нормального менструального цикла и беременности при наличии выраженной гиперпролактинемии, а с другой стороны, у бесплодных женщин с нормальным уровнем пролактина отмечен хороший терапевтический эффект при применении препаратов, подавляющих секрецию пролактина. Отдельным клиническим случаем является так называемая «латентная гиперпролактинемия», которая подтверждается в тесте стимуляции метоклопрамидом.
Если гиперпролактинемия подтверждается при анализе нескольких проб крови и исключена фармакологическая причина повышения уровня пролактина, необходимо провести тщательную проверку на наличие опухолей гипофиза ( RTG обследование турецкого седла, СТ области седла проверка угла зрения, тесты на стимуляцию и подавление и т.п.). Вероятность наличия опухоли тем выше, чем выше уровень пролактина.
Рис.2. Содержание пролактина в сыворотке крови здоровых женщин и пациенток с гиперпролактинемией.
Определение уровня пролактина является важным моментом для оценки эффективности проведенного оперативного или консервативного лечения у пациентов с опухолями гипофиза. Лечение таких больных должно всегда проводится под наблюдением эндокринолога.
Показания к проведению исследований:Женщины детородного периода:
• Нарушения менструального цикла и аменорея
• Бесплодие
• Нарушения лактации
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Мужчины:
• Тестикуляная недостаточность
• Азооспермия, олигоспермия
• Галакторрея
• Синдром гиперфункции гипофиза
• Недостаточность гипофиза
• Заместительная терапия после удаления опухоли гипофиза
Подготовка проб для анализа и содержание пролактина в нормеИнформация, приведенная выше для гонадотропинов, справедлива и по отношению к пролактину. Однако, пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Поэтому кровь для анализа берут утром, не ранее, чем через 3 часа после пробуждения.
Рис.3. Суточный ритм секреции пролактина (индивидуальные графики).
Кроме того, уровень пролактина может повышаться в результате физического или эмоционального стресса, воздействий на молочные железы или операций на грудной клетке, после пребывания в сауне, а также после принятия спиртных напитков. Секрецию пролактина стимулирует ряд лекарственных препаратов: фенотиазиды, трициклические антидепрессанты, метилдофа, галоперидол, хлорпромазин, резерпин, циметидин и другие.
Концентрация пролактина выражается в нг/мл. Для перевода концентрации в мкМЕ/мл необходимо использовать следующее соотношение: 1 нг/мл = 30,3 мкМЕ/мл
Пролактин
нг/мл
мкМЕ/л
Мужчины
2,5-17
53-360
Женщины
Фолликулярная фаза
4,5- 33
98-784
Середина цикла
6,3-49
134-975
Лютеиновая фаза
4,9- 40
104-848
Биологический материал:
• сыворотка крови
• гепаринизированная плазма крови
ß- Эстрадиол (Е2)17 ß-Эстрадиол — наиболее активный эстроген в периферической крови, секретируемый, в основном, яичниками, а также в меньшем количестве плацентой, надпочечниками и яичками. С точки зрения биосинтеза эстрадиол представляет собой производное холестерина, а его непосредственными пред шественниками являются андростендион и тестостерон. Более 98 % эстрадиола циркулирует в связанном с белками сыворотки крови состоянии, в основном с ГСПГ . Только небольшая часть эстрадиола находится в свободной форме и является носителем гормональной биологической активности. Эстрадиол быстро трансформируется в эстрон с меньшей биологической активностью, а затем в сульфат эстрона. Образование в организме сульфатов и глюкуронидов снижает эффективность метаболизма производных эстрадиола.
Физиологические функции эстрадиола у женщин
Наиболее значительное воздействие эстрогены оказывают на эндометрий, слизистую влагалища и шейку матки. Они также влияют на развитие молочных желез и тормозят выработку гонадотропинов как у мужчин, так и у женщин Биологический эффект эстрогенов осуществляется путем связывания с цитоплазматическими рецепторами эстрогенов в клетках тканей-мишеней.
Половое созревание
Эстрогены играют ключевую роль в формировании и развитии женских половых органов, а также вторичных половых признаков. Они также ускоряют рост трубчатых костей в длину, а затем, воз действуя на эпифиз, вызывают остановку дальнейшего роста.
Детородный период
Эстрадиол поступающий в периферическое кровообращение, почти исключительно секретируется яичниками. Под воздействием ЛГ в поверхностных клетках фоликулов происходит синтез предшественников андрогенов, андростендиона и тестостерона, из которых в гранулезных клетках, стимулированных ФСГ, образуются эстрогены. Изменение уровней эстрадиола в нормальном менструальном цикле описано в разделе, посвященном гонадотропинам.
Менопауза
В менопаузе синтез эстрогенов затухает, и их уровень в сыворотке крови снижается до очень низких значений.
Физиологические функции эстрадиола у мужчин
У мужчин часть эстрогенов синтезируется яичками, а другая часть образуется в периферических тканях путем ароматизации тестикулярных и надпочечниковых андрогенов. У мужчин в возрасте до 50 лет 20 % эстрадиола секретируется яичками, 60 % образуется в процессе ароматизации тесто стерона, а остальные 20 % — при восстановлении эстрона. В возрасте между 50 и 60 годами доля эстрадиола, синтезируемая яичками, относительно возрастает вследствие резкого снижения секреции андрогенов корой надпочечников.
Патология:Девочки пубертатного периода и женщины детородного возраста:
• Гиперэстрогенемия
• Феминизация у детей
• Гормонсекретирующие опухоли яичника
• Гиперплазия надпочечников
• Гипоэстрогенемия
• Гипоганадизм
• Центральная анорексия (за счет снижения уровня гонадотропинов и нарушения синтеза эстрогенов)
• Прием гормональных контрацептивов
Женщины в менопаузе:
Гиперсекреция эстрогенов (т.е. менопаузальная метроррагия) может быть вызвана двумя причинами:
• повышенным периферическим синтезом
• секрецией эстрогенов опухолевыми тканями.
Мужчины:
Гиперсекреция эстрогенов :
• повышенная периферическая ароматазная активность,
• изменения в метаболизме эстрогенов, возникшие из за нарушений функции печени (напр., по причине алкоголизма)
• эстрогенсекретирующие опухоли (в том числе тестикулярные).
Кроме того, гиперэстрогенемия может наблюдаться при гипертиреозе. Показания к проведению исследований:Девочки пубертатного периода:
• Замедленное половое созревание
• Ментальная анорексия
• Овариальная недостаточность
Женщины детородного периода:
• Овариальная недостаточность
• Нарушения менструального цикла
• Бесплодие
• Контроль за процессом индуцированной овуляции
• Мониторинг при экстракорпоральном оплодотворении
• Предупреждение синдрома гиперстимуляции
• Поликистоз яичников
• Гипофизарная недостаточность
Женщины в менопаузе:
• Гипофизарная недостаточность
• При назначении гормональной заместительной терапии ( HRT ) и во время ее мониторинга
• Менопаузальная метроррагия
• Опухоли яичников и надпочечников
Мониторинг терапии тамоксифеном (уровень эстрадиола может служить индикатором эстрогенного статуса и помочь в оценке содержания рецепторов к прогестерону в опухолевых тканях).
Мужчины:
• Опухоли
• Азооспермия, олигоспермия
• Заболевания печени
Уровни эстрадиола в нормеКонцентрации эстрадиола выражаются в пг/мл или пмоль/л. Для перевода пг/мл в пмоль/л необходимо использовать следующее соотношение: 1 пг/мл = 0,0037 пмоль/л. Нужно иметь в виду, что на фоне приема пероральных контрацептивов показатели эстрадиола могут быть занижены.
Эстрадиол
пг/мл
пмоль/л
Мужчины
<56
<206
Женщины
Фолликулярная фазф
0 –160
0-587
Предовуляторная фаза
34 – 400
124-1468
Лютеиновая фаза
27 – 246
101-905
Менопауза
<30
<110
Препубертатные дети старше 5 лет
<30
<110
Биологический материал:• Сыворотка крови
• Гепаринизированная плазма крови
Прогестерон Прогестерон — природный гестаген, принадлежащий к группе С21 -стероидов. У небеременных женщин основное количество прогестерона синтезируется яичниками и, в меньшей степени, корой надпочечников. Около 97 % прогестерона находится в связанном состоянии с альбумином и другими транспортными белками: тироксинсвязывающим глобулином и кортикостероидсвязывающим глобулином. Период биологической полужизни прогестерона очень короткий. На 2/3 он метаболизируется в печени и выводится с мочой в виде сульфата или глюкуронида прегнадиола. Некоторые из 5 ß-восстановленных метаболитов прогестерона вызывают повышение базальной температуры тела во время лютеиновой фазы. Физиологическая функция прогестеронаУровень секретируемого яичниками прогестерона остается низким во время фолликулярной фазы. Под воздействием структурных и биохимических изменений в фолликуле, достигающих пика
при овуляции, лютеинизация гранулезных клеток завершается разрывом фолликула и образованием желтого тела. Это приводит к значительному увеличению синтеза прогестерона, уровень которого достигает максимума примерно за 7 дней до начала менструации. Биологическая роль прогестерона заключается в подготовке стимулированного эстрогенами эндометрия к имплантации оплодотворенной яйцеклетки.
Синтез прогестерона желтым телом возрастает при воздействии ЛГ и хорионического гонадотропина (ХГ). Только что образовавшееся желтое тело содержит наибольшее количество рецепторов, специфичных к ХГ. После имплантации яйцеклетки ХГ стимулирует синтез прогестерона желтым телом беременности до появления плаценты на 8 неделе развития плода. На этом этапе прогестерон начинает синтезироваться плацентой и его главной функцией становится снижение сократительной способности матки для сохранения беременности.
Патология:- Повышение концентрации прогестерона: • Врожденная гиперплазия надпочечников, обусловленная дефицитом 21- ß-, 17- ß- и 11- ß-монооксигенов • Хорионэпителиома яичника • Липидоклеточная опухоль яичника
- Снижение концентрации: • Угроза выкидыша • Синдром галактореи-аминореи • Прием гормональных контрацептивов
• Овариальная недостаточность
• Нарушения менструального цикла и аменорея
• Карцинома молочной железы (параллельно с определением рецепторов прогестерона)
Уровни прогестерона в нормеВлияние на результаты анализа связывающих белков устраняется использованием соответству ющих блокирующих агентов. Результаты выражаются в нмоль/л и нг/мл (1 нг/мл = 0,3145 нмоль/л).
Прогестерон
(нг/мл)
(нмоль/л)
Мужчины (20 — 70 лет)
0 – 0,75
0 – 2,4
Женщины
Фолликулярная фаза
0 — 1,13
0 -3,6
Овуляторный пик
0,48- 1,72
1,52 – 5,36
Лютеиновая фаза
0,95 — 21
3,02 –66,8
Менопауза
0 — 1
0 – 3,18
Биологический материал:• сыворотка крови
• гепаринизированная плазма крови
ТестостеронТестостерон является наиболее важным андрогенным и природным анаболическим гормоном мужчин и женщин. Его предшественниками являются дельта-5-прегненолон и прогестерон; важными промежуточными продуктами являются дегидроэпиандростерон и андростендион. У мужчин он синтез ируется преимущественно в семенниках клетками Лейдига; у женщин — корой надпочечников и яичниками, а также в результате периферического метаболизма.
97- 98 % тестостерона циркулирует в крови в связанном состоянии. Основными связывающими белками являются ГСПГ и альбумин. Только свободный тесто стерон (около 2 % у мужчин и 1 % у женщин) обладает биологической активностью.
Физиологическая функция тестостеронаНормальная секреция тестостерона необходима для поддержания функции воспроизведения у мужчин. Тестостерон контролирует сперматогенез, функцию простаты и потенцию. У обоих полов тестостерон стимулирует либидо, влияет на рост волос и голос.
Секрецию тестостерона клетками Лейдига стимулирует ЛГ. По принципу обратной связи тестостерон, а также образующийся из него эстрадиол, модулируют секрецию гонадотропинов гипофизом. Андрогенный компонент оказывает воздействие только на ЛГ, а эстрогенный — на ФСГ, поэтому нарушения функции семенников влекут за собой повышение уровня гонадотропинов в сыворотке крови. Синтез ФСГ подавляется ингибином семенных канальцев.
У женщин тестостерон секретируют яичники и кора надпочечников. Около половины тестостерона непосредственно секретируется стромой яичников, другая половина образуется в результате периферического метаболизма. Секреция тестостерона надпочечниками резко снижается у обоих полов после 50-60 лет. Патология:Маленькие дети и дети пубертатного периода
Мужчины:
• Недостаток андрогенов может вызвать замедленное половое созревание, бесплодие и импотенцию.
• Низкий уровень тестостерона в сочетании с высоким уровнем гонадотропинов указывает на первичную тестикулярную недостаточность. Однако в некоторых случаях (например; при синдроме Клайнфельтера) уровень тестостерона может быть в норме.
• Низкий уровень тестостерона в сочетании с низким или нормальным уровнем ЛГ указывает на вторичную тестикулярную недостаточность. В этом случае проводят тест стимуляции LH — RH . Пациенту назначают гонадотропины, кломифен или пульсирующее введение LH — RH . Мониторинг проводится с помощью измерения уровня тестостерона и исследования эякулята.
Женщины:
а) повышенные уровни тестостерона и DHEAS указывают на избыток андрогенов надпочечникового происхождения. В качестве дополнительного исследования проводят определение циркадного цикла кортизола, тест на подавление дексаметазоном и тест на стимуляцию АСТН.
б) повышенный уровень тестостерона при нормальном или слегка повышенном уровне DHEAS указывает на избыток андрогенов овариального происхождения. У женщин с поликистозом яичников уровень тестостерона часто незначительно повышен; повышаются также уровни ЛГ, андростендиона и эстрона в сыворотке крови. Диагностический тест с LH — RH обычно приводит к повышению уровня ЛГ, но не ФСГ. При очень высокой концентрации тестостерона необходимо исключить наличие опухоли яичника, продуцирующей андрогены.в) нормальные уровни тестостерона и DHEAS при клинически выраженном гиперандрогенизме указывают на повышение содержания свободного тестостерона вследствие снижения связы вающей емкости ГСПГ.
В случае тестикулярной феминизации пациенты имеют женский фенотип, слабый рост волос на лобке, хорошо развитые яички, расположенные либо в брюшной полости, либо в паху, и XY кариотип. Уровень тестостерона при этом соответствует нормальному мужскому уровню. Причиной заболевания является отсутствие рецепторов андрогенов в тканях-мишенях.
Показания к проведению исследований:Пубертатный период:
• Тестикулярные нарушения у мальчиков
• Овариальные нарушения у девочек
• Нарушения деятельности надпочечников у обоих полов
• Замедленное половое созревание
Мужчины:
• Тестикулярная недостаточность
• Наблюдение за ходом лечения тестикулярной недостаточности
• Бесплодие
• Импотенция
• Гинекомастия
Женщины:
• Гирсутизм
• Тестикулярная феминизация
• Опухоли яичника, продуцирующие тестостерон
• Поликистоз яичников
• Нарушения менструального цикла
• Аменорея
• Бесплодие
Уровни тестостерона в норме
Изменяющийся уровень тестостерона объясняется эпизодической секрецией ЛГ. У женщин отмечен циркадный ритм тестостерона, что объясняется значительным вкладом надпочечников в синтез андрогенов. Поэтому уровень тестостерона у женщин достигает своего максимума в ранние утренние часы.
Повышение концентрации тестостерона может наблюдаться при приеме барбитуратов, кломифена, эстрогенов, пероральных контрацептивов. У мужчин причинами низкого уровня тестостерона могут быть длительный алкоголизм, стресс и физическое истощение.
Уровень тестостерона приводится в нмоль/л (1 нг/мл = 3,47 нмоль/л).
нг/мл
нмоль/л
Мужчины
2,9 – 15,1
9,9 – 52,4
Женщины
0,65 – 1,19
2,3 – 4,1
Примечание:
С возрастом уровень тестостерона постепенно снижается.
Биологический материал:• сыворотка крови
• плазма крови.
Глобулин, связывающий половые гормоны (ГСПГ)ГСПГ связывает циркулирующие в крови половые гормоны (тестостерон и эстрогены), переводя их в не активную фракцию. ГСПГ синтезируется в печени. Его уровень повышается под действием эстрогенов и тиреоидных гормонов, при беременности, неврогенной анорексии, циррозе печени. Снижение уровня ГСПГ наблюдается при гипотиреозе, гиперандрогенемии, ожирении, заболеваниях печени, ведущих к снижению синтетической способности.
Так как половые гормоны, связанные с ГСПГ выбывают из активного пула, снижение его уровня у женщин приводит к явлениям гиперандрогении без повышения уровня общих андрогенов. У мужчин повышение уровня ГСПГ приводит к клинике гипоандрогении при нормальном уровне общего тестостерона.
Содержание ГСПГ в норме
нмоль/л
Мужчины
13-71
Женщины
18-114
Дегидроэпиандростерон сульфат ( DHEAS ) DHEAS является надпочечниковым андрогеном, относящимся к группе 17-кетостероидов. DHEAS образуется из сульфата холестерола. Основное количество DHEAS катаболизируется организмом и только 10 % его выделяется с мочой. Ежесуточно в кровяное русло выделяется 10 — 20 мг DHEAS (35 — 70 моль) у мужчин и 3,5 — 10 мг (12 — 35 моль) у женщин. Секреция DHEAS не имеет циркадного ритма, для этого стероида нет также специфических стероидсвязывающих сывороточных белков, поэтому концентрация DHEAS не зависит от изменения содержания этих белков в сыворотке крови. Однако DHEAS способен связываться с альбумином сыворотки крови человека.
Помимо DHEAS в крови циркулирует DHEA (дегидроэпиандростерон) DHEA синтезируется в основном корой надпочечников и, частично, половыми железами. Он образуется в 4 раза медленнее, чем DHEAS , у мужчин и в 2 раза медленнее у женщин. Скорость его метаболизма значительно выше, поэтому концентрация циркулирующего DHEA может быть в 1 000 раз ниже, чем DHEAS . Высокая концентрация в крови, длинный период полу-жизни и высокая стабильность делают DHEAS отличным индикатором андрогенсекретирующей функции надпочечников.
Повышенный уровень тестостерона у женщин может иметь надпочечниковое или овариальное происхождение. Результаты определения DHEAS позволяют выявить причину гиперандрогении.
Патология:• Значительное повышенная концентрация DHEAS (наблюдается только при гиперандрогении надпочечникового происхождения):
• андрогенсекретирующих опухолях надпоче-чников,
• двусторонней врожденной гиперплазии надпочечников с гиперандрокортицизмом (дефект 21-гидроксилазы и 11- ß-гидроксилазы)
• гирсутизме надпочечникового происхождения
• синдром Кушинга
• эктопический синтез АКТГ.
• Умеренное повышение может быть при поликистозе яичников.
• Снижение наблюдается при недостаточности коры надпочечников
Показания к проведению исследований:• Опухоли надпочечников
• Дифференциальная диагностика овариальных нарушений
• Остеопороз
• Задержка полового развития
Содержание DHEAS в норме
мкг/дл
мкмоль/л
Мужчины
80 – 560
2,2 – 15,2
Женщины
35 – 430
0,9 – 11,7
Биологический материал:• Кровь
• Гепаринизированная плазма крови
17-гидрокси-прогестерон 17-гидроксипрогестерон – это промежуточный продукт синтеза стероидов в корковом слое надпочечников и гонадах. Основное клиническое значение определения 17ОН-прогестерона состоит в выявлении дефицита 21-гидроксилазы (фермента, под действием которого 17ОН-прогестерон превращается в11-дезоксикортизол в каскаде стероидогенеза).Дефицит 21-гидроксилазы является самой распространенной формой (90% случаев) врожденной гиперплозии коры надпочечников (ВГКН, адрено-генитальный синдром). Нарушение синтеза 11-дезоксикортизола приводит к дефициту кортизола и альдостерона, повышению уровня АКТГ, гиперплазии коры надпочечников и усилению секреции надпочечниковых андрогенов. Дефицит альдостерона приводит к формированию синдрома потери соли, который проявляется кризами у 75% новорожденных с ВГКН, в более старшем возрасте кризы могут провоцироваться интеркурентными заболеваниями. Избыточная продукция андрогенов, особенно андростендиона, вызывает вирилизацию, которая служит характерным признаком этой формы ВГКН. У девочек вирилизация начинается еще во внутриутробном периоде и к моменту рождения может достигнуть разной степени от клиторомегалии до полного сращения губно-мошоночных складок и формирования уретры, открывающейся в тело полового члена. После рождения у мальчиков и девочек наблюдается увеличение полового члена/ клитора, угри, ускоренный рост, раннее оволосение лобка. Рост детей 3-10 лет опережает сверстников, в 11-12 лет происходит закрытие эпифизарных зон, поэтому нелеченные дети остаются низкорослыми. Характерны нарушение полового развития и бесплодие, однако, лечение может обеспечить нормальное формирование вторичных половых признаков и фертильность. Особое внимание следует обратить на женщин с невыраженными проявлениями ВГКН, которые обращаются к гинекологам-эндокринологам с жалобами на нарушение менструального цикла, гирсутизм и бесплодие.
Содержание 17ОН-прогестерона в норме:
нг/мл
новорожденные
5-30 дней
0,7-2,5
31-60 дней
мальчики
0,8-5,0
девочки
0,5-2,3
дети
3-14 лет
0,7-1,7
мужчины
0,5-2,1
женщины
фоликулиновая фаза
0,1-0,8
овуляция
0,3-1,4
лютеиновая фаза
0,6-2,3
постменопауза
0,13-0,5
беременные 3 триместр2,0-12,0
Биологический материал:• Кровь
• Гепаринизированная плазма крови
Антитела к спермеОколо 15% всех семейных пар, желающих иметь детей, страдают бесплодием. Предполагают, что у 10 из 100 бесплодных пар бесплодие имеет иммунологические причины. Одной из таких причин может быть выработка специфических антител к поверхностным белкам сперматозоидов, которые влияют на подвижность и функции мужских половых клеток. Метод иммуноферментного определения антител к сперме может быть использован для проведения скрининговых обследований по выявлению бесплодия, обусловленного иммунологическими механизамами. В случае бесплодия неясной этиологии рекомендуется проводить исследование на наличие антител к сперме обоим супругам. Показано, что тесты на выявление антител к сперме могут так же применяться для контроля за проводимой терапией. Пограничная концентрация антиспермальных антител в сыворотке 75 Е/мл. Пробы с концентрацией превышающей 75 Е/мл считаются положительными.
Хорионический гонадотропин (ХГЧ)Хорионический гонадотропин — наиболее важный из гестационных гормонов. ХГЧ продуцируется клетками синцитиотрофобласта плаценты и некоторыми опухолями.
Подобно гипофизарным гонадотропинам, ХГЧ является гликопротеином с молекулярной массой 40 кДа, который состоит из двух субъединиц. ß-субъединица ХГ содержит значительную часть аминокислотной последовательности ß-субъединицы ЛГ, а также 30 аминокислот на С-конце молекулы. В результате такой молекулярной гомологии возможность иммунохимической дифференциации ХГЧ и ЛГ зависит от способности антител определять небольшую часть молекулы ХГЧ, структурно отличающуюся от ЛГ. Использование моноклональных антител или специально обработанных поликлональных антител в ряде случаев делает возможным разрабатывать методы определения ХГЧ с пренебрежимо малой перекрестной реакцией с ЛГ, ФСГ и ТТГ.
Физиологические функции ХГЧОпределяемые количества ХГЧ появляются в крови матери уже на 8-9 день после оплодотворения яйцеклетки. Во время первого триместра беременности уровень ХГЧ быстро возрастает, удваиваясь каждые 2-3 дня. Концентрация ХГЧ достигает своего максимума на 8-10 неделе беременности, после чего несколько снижается и остается постоянной в течение второй половины беременности. Быстрое возрастание концентрации ХГЧ в периферической крови и моче делает определение ХГЧ идеальным видом анализа для быстрой диагностики беременности. Физиологическая роль ХГЧ в ранние сроки беременности состоит в стимуляции синтеза прогестерона желтым телом. Считается также, что ХГЧ стимулирует синтез тестостерона половыми железами плода мужского пола, а также оказывает воздействие на кору надпочечников эмбриона.
При удалении матки, после родов или аборта ХГЧ детектируется в течение более длительного периода, чем это следует из периода его полу-жизни. Уровень ХГЧ возвращается в норму в течение 2-3 недель после хирургического вмешательства; если уровень ХГЧ не снижается, это указывает на неполное удаление матки или эктопическую беременность. Высокий уровень ХГЧ после миниаборта указывает на продолжающуюся беременность.
Патология:Беременные женщины:
При внематочной беременности уровень ХГЧ в сыворотке крови и моче значительно ниже, чем при нормальной беременности в соответствующие сроки, либо его уровень повышается медленнее. Однако в случае имплантации эмбриона в достаточно благоприятном месте, уровень ХГЧ может повышаться, до значений, характерных для нормальной беременности. Таким образом, определение ХГЧ можно проводить в целях диагностики внематочной беременности. В случае положительного анализа на ХГЧ проводят дальнейшие исследования, в том числе эхографию, для дифференциации маточной и внематочной, физиологической и патологической беременности.
Пониженная концентрация гормона наблюдается при угрожающем или несостоявшемся выкидыше. Для подтверждения диагноза рекомендуется проводить повторные измерения уровня ХГЧ в динамике и ультразвуковое обследование.В последние годы при повышенном уровне ХГЧ проводят определение альфа-фетопротеина (АФП) и других независимых маркеров для пренатальной диагностики синдрома Дауна. Кроме того, при повышении уровня ХГЧ необходимо исключать внутриматочную инфекцию.
При пузырном заносе (хорионаденоме) происходят изменения в хориальных ворсинах. Возрастает активность клеток синцитиотрофобласта, что влечет за собой гиперсекрецию ХГЧ. Если в случае нормальной беременности уровень ХГЧ снижается после 10 недели беременности, то при хорионаденоме он продолжает возрастать и может достигнуть миллиона МЕ/л. Оптимальная диагностическая информация достигается при использовании ультразвуковой эхографии.
Повышенные уровни у больных со злокачественными заболеваниями
• опухоли трофобласта или терминального происхождения
• рак яичек
• рак яичников
• хорионкарцинома
• пузырный занос
• рак желудка
• рак печени
• рак тонкой кишки
• рак толстой кишки
• рак почек
• мелкоклеточный бронхогенный рак легких (эктопическая секреция)
• рак яичников
• рак молочных желез (эктопическая секреция)
• рак матки
Женщины:
Злокачественные опухоли трофобласта. Злокачественные новообразования возникают у 5-10 % пациенток с хорионаденомой. Поэтому после удаления хорионаденомы необходимо проводить регулярное обследование пациенток до тех пор, пока уровень ХГЧ не перестанет детектироваться. В течение, как минимум, полугода анализ ХГЧ должен проводиться ежемесячно, в течение 2 последующих лет анализ проводят через более длительные промежутки времени. Определение ХГЧ при лечении пролиферирующих опухолей и хориокарцином цитостатическими агентами позволяет оценить эффективность терапии. Три отрицательных анализа с интервалами в три недели свидетельствуют о ремиссии. В дальнейшем мониторинг проводится, как в случаях беременности с пузырным заносом. Определение а-субъединицы ХГЧ имеет прогностическое значение, так как увеличение ее уровня свидетельствует об ухудшении состояния больной.
Мужчины:
Уровень ХГЧ определяют в случае злокачественных новообразований (например, тератом и других тестикулярных опухолей). Хотя уровень ХГЧ не всегда повышается до минимально детектируемого, или повышается только уровень свободных субъединиц, анализ ХГЧ позволяет оценить эффективность проводимой терапии.
Показания к проведению исследований:Беременные женщины:
• Детекция беременности
• Внематочная беременность
• Диагностика угрожающего выкидыша
• Пузырный занос (хорионаденома)
• Злокачественные опухоли трофобласта
• Диагностика врожденных злокачественных опухолей плода
• Хромосомные аберрации плода
Мужчины и небеременные женщины:
• Тестикулярные опухоли
• Тератомы и тератобластомы
Содержание ХГЧ в норме
( МЕ/л )
Мужчины
0-2,5
Небеременные женщины
0-5,3
Беременность:Гестационный возраст (недели)
Медиана (интервал значений)
2-3
300 (150-600)
3-4
700 (360-1400)
4-5
14000. (9000 –21000)
5-6
80000 (40000 –120000.)
6-7
155000 (130000 –200000)
7-8
185000 (150000 –220000)
9
175000 (140000 –210000)
10
170000 (135000 – 205000)
11
140000 (120000 –160000)
12
115000 (100000 -130000)13
100000 (90000 – 110000)
14 90000 (80000 – 100000) 15 31700 (15900-63400) 16 27100 (13500-54100) 17 23100 (11000-46200) 18 21600 (10800-43200) 19 18200 (9100 – 36400) 20 16400 (8200-32800) 21 14600 (7300-29200) 22 12500 (6300-23000) 23 11000 (5500 – 22000) >24 7000 (3500 – 14000) Биологический материал:• сыворотка крови
• гепаринизированная плазма крови
• моча
• амниотическая жидкость.
Альфафетопротеин (АФП )
АФП является специфическим фетальным а-глобулином с молекулярной массой 65-70 кДа. Первоначально АФП вырабатывается желтым телом. Начиная с 13 недели беременности, когда его уровень достигает максимума в сыворотке крови плода (3 мг/мл), он начинает синтезироваться печенью плода, и его уровень постепенно снижается до 0,08 мг/мл к моменту родов. В течение первого года жизни уровень АФП снижается до очень низких значений, характерных для взрослого человека.
Диагностическое значение АФП во время беременности
Во время физиологической беременности уровень АФП в амниотической жидкости снижается, а в материнской сыворотке, напротив, возрастает. Увеличение уровня АФП всегда служит показателем наличия серьезных нарушений.
Возможность определять дефекты незаращения нервной трубки плода (расщелину позвоночника, анэнцефалию) на базе повышенного уровня АФП в амниотической жидкости, полученной при отхождении околоплодных вод на 15-20 месяце, была показана в 1970г. Затем повышенный уровень АФП в амниотической жидкости стали связывать с наличием других аномалий развития плода.
Диагностика врожденных аномалий по уровню АФП в материнской сыворотке (MC АФП) основывается на тех же принципах. Так как физиологический уровень АФП зависит от срока беременности, результаты анализа МС АФП наиболее часто оценивают по отношению к среднему значению уровня АФП, характерному для данного срока Повышение уровня МС АФП в 2,5 и более раз выше нормы наблюдается при серьезных патологических состояниях, угрожающем выкидыше или гибели плода.
Понижение уровня АФП по сравнению с уровнем нормально развивающейся беременности может свидетельствовать о риске рождения ребенка с трисомией по 21 хромосоме. Однако, поскольку уровень АФП при патологической беременности (при трисомии) составляет лишь 0,7 от его уровня при физиологической беременности, рекомендуется анализ АФП комбинировать с определением других независимых маркеров, например, ХГЧ или его субъединиц, свободного эстирола и др.
Некоторые авторы советуют использовать анализ МС АФП в качестве дополнительного анализа при осложненной беременности.
Патология:Повышенные уровни у больных со злокачественными опухолевыми заболеваниями:
• первичный рак печени (за исключением анапластической формы, при которой АФП — отрицательный)
• метастазы злокачественных опухолей в печень(при бронхогенной карциноме, раке молочной железы и раке прямой и сигмовидной кишки).
• опухоли терминального происхождения
• рак яичника
• рак яичка
• рак желудка
• рак толстой кишки
• рак поджелудочной железы
• рак молочной железы
• бронхиальные опухоли
Повышенные уровни при заболеваниях доброкачественной этиологии :
• цирроз печени
• острый вирусный гепатит
• хронический гепатит
• хроническая почечная недостаточность
Показания к проведению анализа:Беременные женщины :
• Контроль за ходом 1-ого триместра беременности
• Угроза выкидыша
• Диагностика врожденных пороков развития
• Диагностика хромосомных аберраций
Пациенты с опухолями :
• Гепатоцеллюлярная карцинома
&bull
синдром эдвардса у плода — 25 рекомендаций на Babyblog.ru
Некоторые, особенно страстно желающие стать мамой, бегут сдавать анализ на ХГЧ чуть ли не при первых кажущихся признаках беременности, а другие преспокойно наслаждаются жизнью и ждут назначений врача.
Действительно, показатель ХГЧ может много сказать о вашей беременности, да что тут говорить, именно благодаря ХГЧ вы о ней и узнаете, когда делаете самый обычный тест на беременность.
Что такое ХГЧ — расшифровка
ХГЧ — это гормон, вырабатываемый хорионом зародыша сразу после прикрепления плодного яйца к стенке матки.
Поэтому гормон этот и называется Хорионическим гонадотропином человека. Хорион — это такая группа клеток зародыша, которая затем трансформируется в плаценту плода.
То есть буквально на 5-7 день после оплодотворения (зачатия), когда происходит имплантация плодного яйца в матку, эмбрион дает знать вашему организму о том, что вы беременны.
И сразу начинается перестройка всей гормональной системы: ХГЧ дает сигнал желтому телу вырабатывать большое количество прогестерона, гормона, поддерживающего беременность и не позволяющего начаться менструации.
Под действием ХГЧ при беременности желтое тело не погибает через 2 недели, как это положено в обычном менструальном цикле, а продолжает свою работу до 12 недель, пока его роль не возьмет на себя плацента.
В этот период желтое тело вырабатывает настолько большое количество прогестерона и других гормонов, что это дает женскому телу невероятные способности. А именно, принять и выносить внутри себя нового человека, а не отторгнуть как чужеродное тело, противостоять стрессу, каким является беременность.
Итак, ХГЧ появляется в крови сразу после имплантации плодного яйца в матку, то есть на 7-8 день после зачатия, и его концентрация удваивается каждые два дня, достигая своего пика на 7-11 неделе беременности.
Именно поэтому узнать о наступившей беременности по анализу крови можно еще до задержки менструации.
Спустя несколько дней после имплантации, ближе ко дню задержки, ХГЧ появляется уже в моче женщины, и его может обнаружить аптечный тест на беременность.
Но ХГЧ нам нужен не только для того, чтобы раньше всех узнать о наступлении интересного положения.
ХГЧ по неделям беременности (норма)
Как уже было сказано ранее, уровень ХГЧ в крови беременной женщины удваивается каждые 2 дня на первых неделях. Именно благодаря этому принципу можно судить о том, правильно ли развивается беременность.
Через 1 неделю после зачатия ХГЧ только на пару единиц отличается от небеременного, и еще ничего невозможно по нему сказать.Исходя из этой таблицы получается, что концентрация ХГЧ начинает расти через 1 неделю после предполагаемого зачатия, но это еще не значит, что в это время уже можно сдавать анализ.
Обратите внимание, что в этой таблице указансрок от зачатия, то есть реальный срок беременности, а не акушерский.Благодаря этому знанию были установлены нормы ХГЧ при беременности, по которым можно даже определить ее срок.
Так, нормы ХГЧ начинаются с 25 мМЕ/мл. При этом врачи при оценке результатов анализов на очень раннем сроке придерживаются следующего правила:
при ХГЧ до 5 мМЕ/мл — беременности нет, при ХГЧ от 5 до 25 мМЕ/мл — беременность под сомнением. И только при ХГЧ выше 25 мМЕ/мл могут поставить срок 1-2 недели от зачатия (или 3-4 акушерские недели).
Кроме того, в отдельно взятой лаборатории единицы измерения ХГЧ могут отличаться, поэтому ориентироваться нужно именно на нормы конкретной лаборатории.
Как видно, анализ крови на ХГЧ может показать наличие и срок беременности еще до УЗИ. А если делать данный анализ в динамике, станет видно, что беременность развивается хорошо.
Низкий ХГЧ
В то же время, на раннем сроке беременности по замедлению роста ХГЧ или его низкому показателю можно судить о:
замершей беременности
внематочной беременности
угрозе прерывания беременности
ХГЧ при замершей беременности или при угрозе прерывания перестает расти или начинает резко снижаться, хотя до этого его рост был нормальным.
При угрозе прерывания беременности ХГЧ снижается до 50 процентов, а при замершей — почти перестает вырабатываться.
Только по уровню ХГЧ нельзя своевременно поставить правильный диагноз, поэтому как только ХГЧ перестает расти или снижается врач назначает УЗИ.
ХГЧ при внематочной беременности
Внематочная беременность означает прикрепление и развитие эмбриона в не предусмотренном для этого месте, например, в маточной трубе. Ткани маточной трубы не предназначены для развития беременности и не обеспечивают должное кровообращение.
Поэтому при внематочной беременности ХГЧ изначально растет медленно, в результате его уровень в предположительный срок беременности не дотягивает до положенных норм.
Но о внематочной беременности по этим признакам можно заподозрить только в том случае, если вы с самого начала регулярно сдавали ХГЧ и он всегда был ниже положенных норм.
Если же вы впервые сдали ХГЧ и он оказался ниже нормы, это может говорить также о замершей беременности или об угрозе прерывания, а также об индивидуальных особенностях вашей беременности. Поставить в этом случае диагноз можно только при помощи УЗИ.
При отсутствии плодного яйца в матке при внематочной беременности ХГЧ должен быть больше 1500 мМЕ/мл.
Необходимо отметить, что для выявления всех вышеперечисленных процессов нужно сдавать ХГЧ в динамике. Так, при отклонении показателя ХГЧ от нормы около 20% обычно назначают повторный анализ. Если показатель будет ухудшаться, то есть вероятность патологического процесса.
А если отклонения так и остаются на уровне 20%, при этом женщина себя хорошо чувствует, скорее всего это индивидуальные особенности организма женщины.
Все отклонения от нормы выше 50%, полученные в результате нескольких исследований, принято во врачебной практике считать признаком патологического процесса.
Роль ХГЧ в исследованиях на возможные патологии плода
Исследование уровня ХГЧ на сроке 11-12 недель может помочь при выявлении различных генетических отклонений плода. Так, превышение уровня ХГЧ может натолкнуть врача на подозрение о синдроме Дауна или иных хромосомных патологиях, сахарном диабете у будущей мамы. А снижение уровня ХГЧ, помимо прочего, может говорить о развитии синдрома Эдвардса.
Однако исследования данного вида и на этом сроке являются очень неточными и даже если какие-то показатели отклоняются от нормы, это всего лишь является поводом для отнесения беременной женщины к группе риска.
Более точные результаты можно получить только в совокупности с результатами УЗИ и другими анализами крови.
Более внимательно стоит отнестись к биохимическому исследованию крови во втором триместре на сроке 16-20 недель.
На этом сроке исследование уровня ХГЧ входит в группу из 3-х анализов: ХГЧ, альфафетопротеина (АФП) и эстриола, это называется тройной тест.
Только в сочетании с этими тремя показателями вместе повышенный или пониженный гормон ХГЧ может указать на:
— Синдром Дауна
— Синдром Патау
— Синдром Эдвардса
И даже этот скрининг не может с точностью показать, что с ребенком что-то не так. Положительный результат тройного теста является лишь поводом для более серьезных и детальных исследований.
Сейчас врачи далеко не всем назначают этот тест, а сами говорят о 80% ложноположительных результатов, которые могут быть при неправильном определении срока беременности, лишнем или недостаточном весе у мамы, заболевании ее сахарным диабетом.
Если результаты анализов незначительно повышены или понижены, это просто может быть лабораторной ошибкой.
Поэтому если вам врач назначил биохимический скрининг, нужно спокойно его пройти и убедиться лишний раз в том, что у вас все хорошо. А при положительном результате не волноваться, а сдать все анализы повторно и обратиться к хорошему специалисту для их расшифровки.
Другие случаи отклонения ХГЧ от нормы
Если на самом раннем сроке еще до УЗИ ваш ХГЧ показывает уж очень высокий результат, не стоит подозревать страшные диагнозы, возможно, просто вы стали обладательницей двойного или тройного счастья!
Обычно при многоплодной беременности ХГЧ в крови увеличивается сразу вдвое, но это не значит что у вас точно два плода. Если их больше, по ХГЧ это трудно определить, надежнее всего будет немного подождать и сделать УЗИ.
По принятым нормам ХГЧ при беременности видно, что с 21 по 39 неделю его уровень остается примерно неизменным.
Но бывают случаи, когда ХГЧ резко снижается в этот период, и тогда это может означать развитиефетоплацентарной недостаточности. Это означает, что плацента или детское место, питающее плод и связывающее его с кровообращением матери, изменяется в структуре и плохо справляется со своей функцией. Из-за этого плод может страдать от нехватки кислорода и питательный веществ, то есть испытывать гипоксию.
Особенно важное значение ХГЧ для определения такой патологии приобретает после 30 недели беременности и, что самое интересное, ХГЧ может показать гипоксию плода еще до клинического ее проявления.
Но дело в том, что врачи практически никогда не назначают анализ на ХГЧ на таком позднем сроке. Поэтому обычно гипоксию плода определяют на УЗИ или КТГ (кардиотокография сердечной деятельности плода).
Также низкий уровень ХГЧ на приближенном к родам сроке может указывать на то, что срок был поставлен неправильно и женщина перенашивает ребенка.
Источник: http://moe1.ru/priznaki-beremennosti/hgch-pri-beremennosti
Синдром Эдвардса — Большая химическая энциклопедия
Синдром Эдвардса Это генетическое заболевание с 3 хромосомами в хромосоме 18, вызванное аномалией в яйцеклетке или сперме до зачатия. Большинство плодов не выживают, около 50% умирают в утробе матери, а из рожденных только 5-10% выживают более одного года. У младенцев неправильная форма головы и другие физические характеристики. Кроме того, у людей, страдающих синдромом Эдвардса, есть пороки сердца. [Pg.407]Трисомия 18 (синдром Эдвардса) вызвана событием нерасхождения во время мейоза, которое приводит к появлению у плода дополнительной копии хромосомы 18.Хотя это происходит только у 1 из 8000 рождений, это, вероятно, самый распространенный хромосомный дефект во время зачатия. Резкое изменение распространенности связано с очень высоким уровнем потери плода как до 8 недель (80%), так и во втором и третьем триместрах (-70%). Примерно 25% пораженных плодов имеют … [Pg.2166]
Эдвардс Г., Гросс М.М. Алкогольная зависимость Предварительное описание клинического синдрома. Br MedJ 1 1058-1061, 1976 … [Pg.44]
ROM, полученные из фагоцитов, вовлечены в патогенез ряда заболеваний легких, включая эмфизему, острый респираторный дистресс-синдром и различные экологические заболевания, такие как асбест. связанный с фиброзом и раком (Mossman and Marsh, 1985).Относительно высокое давление кислорода в легочной ткани делает легкие склонными к окислительному стрессу (Edwards and Lloyd, 1988). [Pg.249]
Уокер BR, Эдвардс CRW. Вызванная солодкой гипертензия и синдромы очевидного шахтерского … [Pg.744]
Анеуплоидия при рождении живыми и абортах возникает из-за анеуплоидных гамет во время мейоза зародышевых клеток. Трисомия или моносомия больших хромосом приводит к ранней гибели эмбриона. Трисомия меньших хромосом позволяет выжить, но пагубно сказывается на здоровье пострадавшего, например, синдром Дауна (трисомия 21), синдром Патау (трисомия 13) и синдром Эдварда (трисомия 18).Трисомия половых хромосом (синдромы Клайнфельтера и XXX) и моносомия половых хромосом (XO), известная как синдром Тернера, также совместимы с выживанием. [Стр.191]
Тинселло Д.Г., Сондерс П.Т., Ходгинс М.Б., Симпсон Н.Б., Эдвардс С.Р., Харгривз Т.Б., Ву ФК. Корреляция клинических, эндокринных и молекулярных аномалий с реакциями in vivo на высокие дозы тестостерона у пациентов с синдромом частичной нечувствительности к андрогенам. Clin Endocrinol (Oxford) 1997 46 (4) 497-506. [Стр.100]
Сильверштейн Ф.С., Джонсон М.В., Хатчинсон Р.Дж., Эдвардс Н.Л. (1985) Синдром Леша-Найхана аномалии нейротрансмиттеров спинномозговой жидкости.Неврология 35 907-911. [Pg.297]
Sanz EJ, De Las-Cuevas C, Bate A, Edwards R. Селективные ингибиторы обратного захвата серотонина у беременных женщин и неонатальный абстинентный синдром анализ базы данных. Ланцет 2005 365 482-87. [Стр.51]
Билграми С.Ф., Метерски М.Л., МакНалли Д., Накви Б.Х., Капур Д., Райбл Д., Бона Р.Д., Эдвардс Р.Л., Фейнголд Дж. М., Клайв Дж. М., Тутчка П. Дж.. Синдром идиопатической пневмонии после миелоаблативной химиотерапии и аутотрансплантации. Энн Фармакотер 2001 35 (2) 196-201.[Pg.580]
Кожно-слизистая сыпь (1999) Edwards SG +, Postgrad Med J 75, 680 (1993) Konishi T +, Eur J Pediatr I 52, 605 Синдром кожно-слизистых лимфатических узлов (синдром Кавасаки) … [Стр. 92]
Эдвардс CR. Синдромы первичного минералокортикоидного избытка. В Besser M, Burger HG, Jameson JL, eds. Эндокринология, 3-е изд. Филадельфия WB Saunders Co, 1995 1775-803. [Pg.2045]
Бергер, П. Б., Даффи, Дж., Ридер, Г. С., Карон, Б. Л. и Эдвардс, В. Д., Рестриктивная кардиомиопатия, связанная с синдромом эозинофилии-миалгии, Mayo Clin.Proc., 69, 162, 1994. [Pg.246]
Ингибирование синдрома отмены морфина ингибитором синтазы оксида азота, метиловым эфиром NG-нитро-L-аргинина Adams, Michael L. Kalicki, Joelle M. Meyer, Эдвард Р. Цицеро, … [Pg.121]
Эдвардс, MJ, и др .. Синдром обратимой задней лейкоэнцефалопатии после химиотерапии CHOP для диффузной большой B-клеточной лимфомы. Энн Онкол, 2001. 12 (9) с. 1327-9. [Pg.173]
Эдвардс Р.Д., Робертсон И.Р., et al. (1993) История болезни с синдромом тазовой боли — успешное лечение случая эмболизацией яичниковой вены.Clin Rad 47 429-430 … [Pg.211]
Эдвардс JM, Финни ES, Тейлор IMJr, Керман EJ, Портер JM. Различия альфа-2-адренорецепторов при вазоспастическом и обструктивном синдроме Рейно. 7 Vase Surg 1987 5 38. [Pg.21]
Macdonald S, Gan 1, McKay AJ, Edwards RD (2000) Эндоваскулярное лечение синдрома острого выброса сонной артерии. J Vase Interv Radiol 11 1184-1188 … [Pg.291]
Дональд К.Дж., Эдвардс Р.Л., Макэвой Д.Д. Поражения базальной мембраны альвеолярных капилляров при синдроме Гудпасчера и идиопатическом легочном гемосидерозе.Am J Med 1975 59 (5) 642 9. [Pg.692]
Синдром Эдвардса (трисомия 18) | healthdirect
Синдром Эдвардса — это генетическое заболевание младенцев, которое вызывает тяжелую инвалидность. Это вызвано дополнительной копией 18 хромосомы, и дети, рожденные с этим заболеванием, обычно не живут дольше недели.
Как возникает синдром Эдвардса?
У детей с синдромом Эдвардса есть три копии части или всей хромосомы 18 вместо обычных двух копий.Ее еще называют Трисомия 18.
Это может быть вызвано ошибкой в формировании яйцеклетки или сперматозоидов, либо проблема может возникнуть во время развития ребенка в утробе матери.
Младенцы с синдромом Эдвардса либо выкидыши, либо мертворождены, либо рождаются с серьезными физическими отклонениями. Очень редко ребенок с синдромом Эдвардса доживает до первого года жизни, и большинство из них умирает в течение недели после рождения.
Синдром Эдвардса гораздо чаще встречается у девочек.
Симптомы и признаки синдрома Эдвардса
У большинства детей с синдромом Эдвардса:
- Проблемы с кормлением
- затрудненное дыхание
- умственная отсталость
- Аномальный рост и развитие
- неопущенных семенников (у мальчиков)
У некоторых младенцев также есть:
- необычное лицо и голова
- необычные кисти и ступни с перекрывающимися пальцами и перепончатыми пальцами ног
- Мелкие кости таза и грудной клетки
- Проблемы с такими органами, как сердце, легкие и почки
Диагностика синдрома Эдвардса
Синдром Эдвардса можно заподозрить или даже диагностировать во время беременности.
Некоторые родители обнаруживают, что вероятность синдрома Эдвардса у них повышается после ультразвукового исследования беременности. Также можно пройти скрининговый тест во время беременности — его обычно предлагают женщинам старше 35 лет, поскольку шансы родить ребенка с синдромом Эдвардса возрастают с возрастом матери.
Но единственный надежный способ диагностировать синдром Эдвардса — это генетическое тестирование. Это можно сделать, пока ребенок находится в утробе матери, с помощью биопсии ворсин хориона (CVS) или амниоцентеза.Оба этих теста имеют риск выкидыша. Вы можете поговорить об этом со своим акушером или акушеркой.
Иногда синдром Эдвардса не подозревается во время беременности и обнаруживается только при рождении ребенка.
Посетите веб-сайт «Беременность, роды и ребенок» для получения дополнительной информации о пренатальном скрининге.
Лечение синдрома Эдвардса
Не существует эффективного длительного лечения младенцев с синдромом Эдвардса. Родители в этой ситуации сталкиваются с очень тяжелым выбором.Они могут оставить своих младенцев живыми в отделении интенсивной терапии новорожденных. Или они могут выбрать, чтобы их ребенок получал паллиативную помощь до тех пор, пока он или она не умрет.
Дополнительная информация
Посетите наш справочник по генетическим заболеваниям, чтобы узнать больше о генах, типах генетических нарушений, а также о том, куда обратиться за помощью и получить дополнительную информацию.
синдром Эдвардса Википедия
Хромосомное заболевание, при котором имеются три копии хромосомы 18
Синдром Эдвардса , также известный как трисомия 18 , является генетическим заболеванием, вызванным наличием третьей копии всей или части хромосомы 18. [3] Поражены многие части тела. [3] Младенцы часто рождаются маленькими и имеют пороки сердца. [3] Другие особенности включают маленькую голову, маленькую челюсть, сжатые кулаки с перекрытием пальцев и тяжелую умственную отсталость. [3]
Большинство случаев синдрома Эдвардса возникает из-за проблем во время формирования репродуктивных клеток или во время раннего развития. [3] Уровень заболеваемости увеличивается с возрастом матери. [3] В редких случаях дела могут передаваться по наследству от родителей человека. [3] Иногда не все клетки имеют дополнительную хромосому, известную как мозаичная трисомия, и симптомы в этих случаях могут быть менее серьезными. [3] Ультразвук во время беременности может усилить подозрение на заболевание, что может быть подтверждено амниоцентезом. [2]
Лечение поддерживающее. [2] После рождения одного ребенка с этим заболеванием риск рождения второго обычно составляет около одного процента. [2] Это второе по распространенности состояние, связанное с появлением третьей хромосомы при рождении, после синдрома Дауна. [4]
Синдром Эдвардса встречается примерно у 1 из 5 000 живорождений. [3] Некоторые исследования показывают, что больше детей, доживающих до рождения, составляют девочки. [2] Многие из пострадавших умирают до рождения. [3] Выживаемость после года жизни составляет около 5–10%. [3] Он назван в честь английского генетика Джона Хилтона Эдвардса, который впервые описал синдром в 1960 году. [5]
Признаки и симптомы []
Сжатая рука и пальцы перекрывают друг друга: указательный палец перекрывает третий палец, а пятый палец перекрывает безымянный палец, что характерно для трисомии 18.Это вызвано врожденной контрактурой сустава. [6]Дети, рожденные с синдромом Эдвардса, могут иметь некоторые или все следующие характеристики: пороки развития почек, структурные дефекты сердца при рождении (например, дефект межжелудочковой перегородки, дефект межпредсердной перегородки, открытый артериальный проток), кишечник, выступающий за пределы тела (омфалоцеле), атрезия пищевода. умственная отсталость, задержка развития, дефицит роста, трудности с кормлением, затрудненное дыхание и артрогрипоз (мышечное заболевание, которое вызывает множественные контрактуры суставов при рождении). [7] [8]
Некоторые физические пороки развития, связанные с синдромом Эдвардса, включают маленькую голову (микроцефалия), сопровождающуюся выступающей задней частью головы (затылок), низко посаженные уродливые уши, аномально маленькая челюсть (микрогнатия) ), расщелина губы / неба, вздернутый нос, узкие веки (блефарофимоз), широко расставленные глаза (глазной гипертелоризм), опущение верхних век (птоз), короткая грудная кость, сжатые руки, кисты сосудистого сплетения, недоразвитые большие пальцы и / или ногти, отсутствие лучевой кости, перепонка на втором и третьем пальцах, косолапость или коромысло ступней, а у мужчин неопущенные яички. [7] [8]
In utero наиболее частой характеристикой являются сердечные аномалии, за которыми следуют аномалии центральной нервной системы, такие как аномалии формы головы. Наиболее распространенной внутричерепной аномалией является наличие кист сосудистого сплетения, которые представляют собой карманы жидкости в головном мозге. Сами по себе они не вызывают проблем, но их наличие может быть маркером трисомии 18. [9] [10] Иногда наблюдается избыток околоплодных вод или многоводие. [7] Хотя синдром Эдвардса встречается редко, он вызывает большую часть пренатальных случаев уродства Денди-Уокера. [11] [12]
Генетика []
Синдром Эдвардса — это хромосомная аномалия, характеризующаяся наличием дополнительной копии генетического материала на 18-й хромосоме либо полностью (трисомия 18), либо частично (например, из-за транслокаций). Дополнительная хромосома обычно возникает до зачатия. Эффекты дополнительной копии сильно различаются в зависимости от степени дополнительной копии, генетической истории и случайности.Синдром Эдвардса встречается во всех популяциях человека, но чаще встречается у потомства женского пола. [13]
Здоровая яйцеклетка и / или сперматозоид содержат отдельные хромосомы, каждая из которых вносит вклад в 23 пары хромосом, необходимых для образования нормальной клетки с типичным человеческим кариотипом из 46 хромосом. Численные ошибки могут возникать на любом из двух мейотических делений и вызывать неспособность хромосомы сегрегировать в дочерние клетки (нерасхождение). Это приводит к появлению дополнительной хромосомы, что делает гаплоидное число 24, а не 23.Оплодотворение яйцеклеток или оплодотворение спермой, содержащей дополнительную хромосому, приводит к трисомии или трем копиям хромосомы, а не двум. [14]
Трисомия 18 (47, XX, + 18) вызвана событием мейотического нерасхождения. При нерасхождении гамета (, т.е. , сперматозоид или яйцеклетка) производится с дополнительной копией 18 хромосомы; Таким образом, гамета имеет 24 хромосомы. В сочетании с нормальной гаметой от другого родителя у эмбриона 47 хромосом с тремя копиями 18 хромосомы.
Небольшой процент случаев возникает, когда только некоторые клетки организма имеют дополнительную копию хромосомы 18, что приводит к смешанной популяции клеток с различным числом хромосом. Такие случаи иногда называют мозаичным синдромом Эдвардса. Очень редко кусок 18 хромосомы прикрепляется к другой хромосоме (перемещается) до или после зачатия. У больных есть две копии 18-й хромосомы плюс дополнительный материал 18-й хромосомы, прикрепленный к другой хромосоме.При транслокации у человека возникает частичная трисомия по 18 хромосоме, и аномалии часто менее серьезны, чем при типичном синдроме Эдвардса.
Диагноз []
Ультразвук может усилить подозрение на заболевание, что может быть подтверждено амниоцентезом. [2]
Уровни PAPP-A, AFP, uE3, свободного β-ХГЧ, все из которых обычно снижаются во время беременности. [15]
Прогноз []
Около 95% затронутых беременностей не заканчиваются рождением живого ребенка. [13] Основные причины смерти включают апноэ и сердечные аномалии. Предсказать точный прогноз при беременности или в периоде новорожденности невозможно. [13] Половина живых младенцев не доживает до первой недели жизни. [16] Средняя продолжительность жизни составляет от пяти до 15 дней. [17] [18] Около 8–12% младенцев живут дольше 1 года. [19] [20] [ нужен лучший источник ] Один процент детей доживает до 10 лет, [13] , хотя ретроспективное канадское исследование 254 детей с трисомией 18 продемонстрировало десятилетнюю выживаемость 9.8%. [20]
Эпидемиология []
Синдром Эдвардса встречается примерно у одного из 5000 живорожденных, но этот синдром затрагивает большее количество зачатий, потому что большинство из тех, у кого это заболевание диагностировано пренатально, не доживают до рождения. [3] Хотя женщины в возрасте от 20 до 30 лет могут зачать детей с синдромом Эдвардса, риск зачать ребенка с этим синдромом увеличивается с возрастом женщины. a b c d f h i j k l 9011 9011 9011 9011 9011 9011 9011 o p q r s «Распространенность и заболеваемость синдромом Эдвардса». Болезни Синдром Центра-Эдвардса . Adviware Pty Ltd. 4 февраля 2008 г. Архивировано 25 июня 2004 года. Проверено 17 февраля 2008. средний возраст матери для этого расстройства 32½



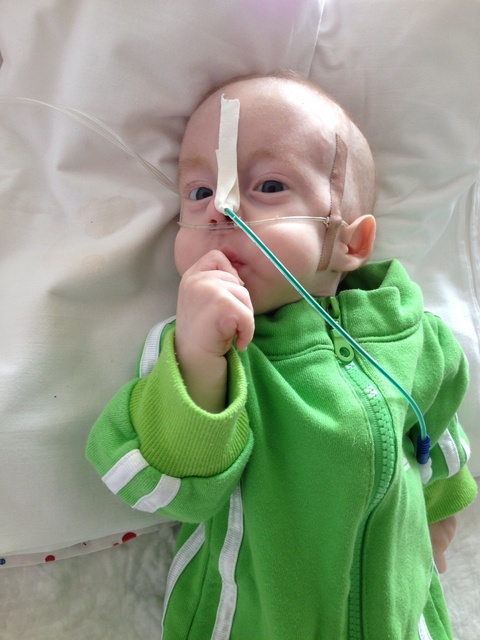



.jpg) Диагностика с помощью ультразвукового исследования является достоверной на 100%.
Диагностика с помощью ультразвукового исследования является достоверной на 100%. Патология в большинстве случаев несовместима с жизнью. Больным детям показана симптоматическая терапия, направленная на поддержание физиологических функций организма, продление жизни и улучшение ее качества.
Патология в большинстве случаев несовместима с жизнью. Больным детям показана симптоматическая терапия, направленная на поддержание физиологических функций организма, продление жизни и улучшение ее качества. Если обеспечить необходимый уход, ребенок может научиться самостоятельно поднимать голову и есть.
Если обеспечить необходимый уход, ребенок может научиться самостоятельно поднимать голову и есть.
 п.
п.
