Рецидивирующая тромбоэмболия легочной артерии. Способы диагностики и лечение
Библиографическое описание:Фролов, И. А. Рецидивирующая тромбоэмболия легочной артерии. Способы диагностики и лечение / И. А. Фролов, А. С. Нагорняк. — Текст : непосредственный // Молодой ученый. — 2016. — № 29.2 (133.2). — С. 25-27. — URL: https://moluch.ru/archive/133/37379/ (дата обращения: 02.03.2021).
Тромбоэмболия лёгочной артерии — закупорка лёгочной артерии или её ветвей тромбами, которые образуются в венах большого круга кровообращения. Тромбоэмболия легочных артерий имеет множество вариантов течения, проявлений, выраженности симптомов и т. д. Поэтому классификация данной патологии осуществляется на основании различных факторов: места закупорки сосуда; величины закупоренного сосуда; объема легочных артерий, кровоснабжение которых прекратилось в результате эмболии; протекания патологического состояния; наиболее выраженных симптомов.
Рецидивирующая тромбоэмболия легочной артерии — это повторяющаяся закупорка мелких легочных артерий. Этой форме заболевания подвержены 10–30 % больных, перенесших тромбоэмболию легочной артерии. Обычно один человек может переносить различное количество эпизодов тромбоэмболии легочной артерии, варьирующее от 1 до 20. Большое количество перенесенных эпизодов тромбоэмболии легочной артерии обычно представлено закупоркой мелких ветвей легочной артерии.
Рецидивирующая тромбоэмболия легочной артерии обычно не имеет четких клинических признаков, что обуславливает ее стертое течение. Поэтому данное состояние редко верно диагностируется, поскольку в большинстве случаев невыраженные признаки принимают за симптомы других заболеваний. Диагностика рецидивирующей тромбоэмболии легочной артерии достаточно затруднительна.
Значение рецидивирующей тромбоэмболии легочной артерии можно разобрать на следующем клиническом случае.
Больная З. 51 год, поступила в хирургическое отделение с жалобами на боли, покраснение и инфильтрацию в правой голени, выраженную боль при пальпации в этой зоне, фебрильную температуру, общую слабость. Жалобы появились за 4 дня до поступления в отделение. При осмотре в приемном отделении состояние больной описывается как тяжелое; пульс аритмичный, слабого наполнения и напряжения, 100 ударов в минуту; АД 110/60 мм.рт.ст; по передней поверхности правой голени определяется участок гиперемии и инфильтрации кожи, пальпация в этой зоне болезненна, подвижность сохранена, чувствительность не нарушена. При расспросе кардиологом жаловалась на периодические боли в сердце, иррадиирующие под левую лопатку, в левую руку; повышения АД не отмечала, ощущала «чувство нехватки воздуха при физической нагрузке», наблюдала слабость, головокружение. Данные ЭКГ — фибрилляция предсердия с ЧСЖ 164–188. Был выставлен диагноз: острый восходящий поверхностный тромбофлебит на фоне ИБС; стенокардия напряжения ФК 3; нарушение ритма по типу фибрилляции предсердий, постоянная форма, тахивариант. На 2-ые сутки, в связи с ухудшением состояния, была переведена в отделение АРО, где сразу была заподозрена тромбоэмболия легочной артерии, наблюдались отеки нижних конечностей, ЧДД составляло 26 в минуту, АД 80/50 мм.
При осмотре в приемном отделении состояние больной описывается как тяжелое; пульс аритмичный, слабого наполнения и напряжения, 100 ударов в минуту; АД 110/60 мм.рт.ст; по передней поверхности правой голени определяется участок гиперемии и инфильтрации кожи, пальпация в этой зоне болезненна, подвижность сохранена, чувствительность не нарушена. При расспросе кардиологом жаловалась на периодические боли в сердце, иррадиирующие под левую лопатку, в левую руку; повышения АД не отмечала, ощущала «чувство нехватки воздуха при физической нагрузке», наблюдала слабость, головокружение. Данные ЭКГ — фибрилляция предсердия с ЧСЖ 164–188. Был выставлен диагноз: острый восходящий поверхностный тромбофлебит на фоне ИБС; стенокардия напряжения ФК 3; нарушение ритма по типу фибрилляции предсердий, постоянная форма, тахивариант. На 2-ые сутки, в связи с ухудшением состояния, была переведена в отделение АРО, где сразу была заподозрена тромбоэмболия легочной артерии, наблюдались отеки нижних конечностей, ЧДД составляло 26 в минуту, АД 80/50 мм.
 Дыхание жесткое, ослаблено в задне-базальных отделах, там же выслушиваются крепетирующие хрипы. ЧДД 26 в минуту, на кардиомониторе — фибрилляция предсердий тахисистолическая форма, ЧСС 160 в минуту, АД 60/40 мм.рт.ст. Осмотрена кардиологом, который не исключил повторную тромбоэмболию мелких ветвей легочной артерии. Несмотря на проводившуюся терапию, состояние больной ухудшалось — через 5 часов ЧДД составило 36 в минуту, пациентка «металась» в постели, отмечала чувство «нехватки воздуха», сильные боли в правой ноге. Еще через 2 часа состояние резко ухудшилось — появился цианоз губ, одышка до 44 в минуту, АД 50/0 мм.рт.ст., больная была переведена на ИВЛ. Через полчаса наступила клиническая смерть. Далее констатирована биологическая смерть.
Дыхание жесткое, ослаблено в задне-базальных отделах, там же выслушиваются крепетирующие хрипы. ЧДД 26 в минуту, на кардиомониторе — фибрилляция предсердий тахисистолическая форма, ЧСС 160 в минуту, АД 60/40 мм.рт.ст. Осмотрена кардиологом, который не исключил повторную тромбоэмболию мелких ветвей легочной артерии. Несмотря на проводившуюся терапию, состояние больной ухудшалось — через 5 часов ЧДД составило 36 в минуту, пациентка «металась» в постели, отмечала чувство «нехватки воздуха», сильные боли в правой ноге. Еще через 2 часа состояние резко ухудшилось — появился цианоз губ, одышка до 44 в минуту, АД 50/0 мм.рт.ст., больная была переведена на ИВЛ. Через полчаса наступила клиническая смерть. Далее констатирована биологическая смерть. На вскрытии выявлено увеличение легочных артерий, наличие тромба в ушке левого предсердия; в просвете крупных и мелких ветвей легочной артерии матовые, темно-красные шероховатые с трудом выделяющиеся тромбы; в S8,S9,S10 сегментах правого легкого множество безвоздушных плотных темно-красных участков с мелкозернистой поверхностью размерам 2х2 см, В S6 сегменте правого легкого под плеврой плотноватый тёмно-красный участок треугольной формы, основанием обращенный к плевре, а верхушкой к корню легкого.
На основании этих данных поставлен патологоанатомический диагноз: хронический тромбофлебит глубокой бедренной вены правой нижней конечности. Осложнение: рецидивирующая тромбоэмболия легочной артерии.
В данном случае, рецидивирующая тромбоэмболия легочной артерии привела к гипертензии малого круга кровообращения, с прогрессирующей правосердечной недостаточностью или «легочным сердцем» что привело к сердечным жалобам больной, ошибочно расцененных как стенокардия напряжения. Помимо этого, фибрилляция сердца, вызванная сердечной недостаточностью, стала причиной образования тромбов не только в венах правой нижней конечности, но и в полостях сердца.
Литература:
1. Струков А. И. Патологическая анатомия / Струков А. И., Серов В. В. // Патологическая анатомия, тромбоэмболия — М.: Литтерра, 2010.
2. Яковлев В. Б. Тромбоэмболия легочной артерии / Яковлев В. Б., Яковлев М. В. // Тромбоэмболия легочной артерии: патофизиология, диагностика, лечебная тактика — Consiliummedicum, том 7, 2005.
3. Qaseem A., Deep Venous Thrombosis, Pulmonary Embolism / Qaseem A., Snow V., Barry P., Hornbake E. R., Rodnick J. E., Tobolic T., Ireland B., Segal J., Bass E., Weiss K. B., Green L. // Deep Venous Thrombosis, Pulmonary Embolism (Current diagnosis of venous thromboembolism in primary care) — Ann Fam Med. 2007 Jan-Feb;5(1):57–62.
Основные термины (генерируются автоматически): легочная артерия, правая нижняя конечность, тромбоэмболия, ветвь, глубокая бедренная вена, малый круг кровообращения, поверхностная бедренная вена, правая голень, сегмент правого легкого, ухудшение состояния.
Рецидивирующая ТЭЛА как клиническая маска саркомы правого желудочка с обтурационным поражением легочной артерии Текст научной статьи по специальности «Клиническая медицина»
СЛУЧАИ ИЗ ПРАКТИКИ
© ЧЕРНЯВСКИЙ А.М., САКОВИЧ В. А., ЧЕРДАНЦЕВ Д.В., ДРОБОТ Д.Б., ОСАДЧАЯ А.И., КРЫЖАНОВСКАЯ Е.А.
РЕЦИДИВИРУЮЩАЯ ТЭЛА КАК КЛИНИЧЕСКАЯ МАСКА САРКОМЫ
ПРАВОГО ЖЕЛУДОЧКА С ОБТУРАЦИОННЫМ ПОРАЖЕНИЕМ ЛЕГОЧНОЙ
АРТЕРИИ
А.М. Чернявский, В.А. Сакович, Д.В. Черданцев, Д.Б. Дробот, А.И.
Осадчая, Е.А. Крыжановская
Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина, директор — чл.-корр. РАМН А.М.
акад. Е.Н. Мешалкина, директор — чл.-корр. РАМН А.М.
Караськов; Красноярский государственный медицинский университет им.
проф. В.Ф. Войно-Ясенецкого, ректор — д.м.н., проф. И.П. Артюхов; Центр интенсивной кардиологии и сердечно-сосудистой хирургии ГУЗ ККБ г.
Красноярска, гл. врач — Засл. врач РФ Б.П. Маштаков.
Резюме. В статье представлены клинические примеры обструктивного опухолевого поражения ствола и ветвей легочной артерии, клинически протекающих под маской рецидивирующей тромбоэмболии легочной артерии.
Ключевые слова: фибросаркома сердца, лейомиосаркома сердца,
тромбоэмболия легочной артерии.
Чернявский Александр Михайлович — д. м.н., проф., зам. директора ФГУ «Новосибирский научно-исследовательский институт патологии
м.н., проф., зам. директора ФГУ «Новосибирский научно-исследовательский институт патологии
кровообращения им. акад. Е.Н. Мешалкина»; e-mail: [email protected].
Сакович Валерий Анатольевич — д.м.н., профессор каф. Хирургических болезней № 2 им. проф. А.М. Дыхно; тел. S (391)2201559.
Черданцев Дмитрий Владимирович — д.м.н., проф., зав. каф. хирургических болезней №2 им. A.M. Дыхно КрасГМУ, тел. S(391)2201559; e-mail: [email protected].
В связи с относительной редкостью онкологической патологии сердца к настоящему времени продолжается накопление клинического опыта, что находит свое отражение в ряде публикаций. Материалы ряда работ касаются, как правило, наиболее известных и распространенных форм патологии.
Распознавание опухолей сердца и перикарда чрезвычайно затруднено в связи с отсутствием патогномоничных признаков и возможностью бессимптомного течения болезни. Именно поэтому правильный диагноз при первичном обращении больного к врачу устанавливался до недавнего времени только в 3-10% случаев [2, 8, 9]. В преобладающем большинстве случаев пациенты наблюдались в терапевтических стационарах с подозрением на ревмокардит, ревматический митральный или трикуспидальный порок сердца, аномалию Эбштейна, сдавливающий перикардит, рецидивирующую тромбоэмболию легочной артерии, инфекционный эндокардит, кардиомиопатии и многие другие заболевания [1, 2, 4, 14].
Именно поэтому правильный диагноз при первичном обращении больного к врачу устанавливался до недавнего времени только в 3-10% случаев [2, 8, 9]. В преобладающем большинстве случаев пациенты наблюдались в терапевтических стационарах с подозрением на ревмокардит, ревматический митральный или трикуспидальный порок сердца, аномалию Эбштейна, сдавливающий перикардит, рецидивирующую тромбоэмболию легочной артерии, инфекционный эндокардит, кардиомиопатии и многие другие заболевания [1, 2, 4, 14].
И все же можно выделить следующие клинические проявления при опухолевом поражении сердца и перикарда: клиника быстро развивающейся и прогрессирующей сердечной недостаточности, в ряде случаев сочетающаяся с нарушениями ритма сердца, проявлениями тромбоэмболического и паранеопластического синдромов [2, 7, 8, 9].
Среди первичных злокачественных опухолей сердца по частоте саркомы занимают ведущее место. Прежде всего, следует отметить, что в миокарде теоретически могут развиваться все виды сарком [13].
Прежде всего, следует отметить, что в миокарде теоретически могут развиваться все виды сарком [13].
Фибросаркома (миксосаркома, фибромиксосаркома) — злокачественная опухоль из соединительной ткани и ее производных. Характеризуется инфильтративным и внутриполостным ростом, может приводить к окклюзии атриовентрикулярных отверстий [3, 5, 11].
Лейомиосаркома — злокачественная опухоль мышечной ткани (преимущественно гладкомышечной). Первичная лейомиосаркома встречается менее чем в 0,2% случаев всех опухолей сердца [15]. Развивается обычно в предсердиях, может петрефицироваться, при поверхностном некрозе покрываться тромбом. Растет эндофитно в миокард, может распространяться на клапаны сердца, иногда врастает в соседние органы (легкие) [15]. Лейомиосаркомы рано и широко метастазируют
преимущественно гематогенным путем, давая множественные метастазы в печень, легкие, нередко — в головной мозг. Очень часто метастазы клинически проявляются раньше, чем основная опухоль [6, 10, 15].
Очень часто метастазы клинически проявляются раньше, чем основная опухоль [6, 10, 15].
Первичные саркомы сердца имеют локальный агрессивный рост в одну или более камер сердца и чаще всего поражают правые отделы. Они отличаются быстрым инфильтративным ростом и метастазированием в средостение, легкие, лимфатические узлы, надпочечники и головной мозг. Это приводит к тому, что к моменту верификации диагноза в 70 — 80% случаев у больных уже имеются метастазы [7]. Первичные саркомы могут располагаться эпикардиально, не проникая в полости сердца, а также эндокардиально и интрамурально, поражая при этом миокард. Злокачественные новообразования могут вызывать окклюзию клапанных отверстий и выходных отделов желудочков сердца, сдавливать или прорастать в коронарные сосуды, крупные артерии и вены [9].
Для злокачественных новообразований сердца наиболее характерным является паранеопластический синдром — лихорадка, анемия, высокая СОЭ,
изменение состава белков сыворотки крови, снижение массы тела, общая слабость, быстрая утомляемость. Быстрое развитие сердечной недостаточности может быть обусловлено фактором обструкции опухолью отверстий атриовентрикулярных клапанов или выходных трактов желудочков сердца, замещением контрактильного миокарда опухолевой тканью, а также развитием тампонады сердца. Так по данным ряда авторов, гемоперикард наблюдается в 30 — 50% всех случаев злокачественных неоплазм сердца, выпот в перикарде наблюдается в 66,8%. По данным Н.Д. Стражеско и В.Х. Василенко, недостаточность кровообращения 2Б — 3 ст. имеют до 75% больных, паранеопластический синдром в той или иной степени проявляется у 90 — 100% пациентов [2, 7, 8, 9].
Быстрое развитие сердечной недостаточности может быть обусловлено фактором обструкции опухолью отверстий атриовентрикулярных клапанов или выходных трактов желудочков сердца, замещением контрактильного миокарда опухолевой тканью, а также развитием тампонады сердца. Так по данным ряда авторов, гемоперикард наблюдается в 30 — 50% всех случаев злокачественных неоплазм сердца, выпот в перикарде наблюдается в 66,8%. По данным Н.Д. Стражеско и В.Х. Василенко, недостаточность кровообращения 2Б — 3 ст. имеют до 75% больных, паранеопластический синдром в той или иной степени проявляется у 90 — 100% пациентов [2, 7, 8, 9].
На поверхности опухоли, выступающей в полости сердца, нередко появляются тромботические массы, зачастую, приводящие к тромбоэмболическому синдрому. Причиной эмболий, частота которых может достигать 5-45%, может быть и фрагментация опухоли [2, 8, 9].
Проблема хирургии злокачественных опухолей сердца, ввиду небольшого числа успешных операций, относится к малоизученному разделу кардиохирургии, что объясняется, во-первых, небольшим числом клинических наблюдений, и, во-вторых, трудностью дифференциальной диагностики злокачественных новообразований сердца [2, 7]. В большинстве случаев диагноз первичного злокачественного поражения сердца устанавливается посмертно, но использование ЭхоКГ, КТ, МРТ делают возможность диагностировать это заболевание при жизни. Считается, что наиболее информативный метод исследования при опухолевом поражении сердца — двухмерная ЭхоКГ [15].
В большинстве случаев диагноз первичного злокачественного поражения сердца устанавливается посмертно, но использование ЭхоКГ, КТ, МРТ делают возможность диагностировать это заболевание при жизни. Считается, что наиболее информативный метод исследования при опухолевом поражении сердца — двухмерная ЭхоКГ [15].
Естественный прогноз, без операции, у больных с первичными злокачественными новообразованиями сердца, как правило, плохой: больные умирают в течение 6 — 12 месяцев после выявления первых клинических симптомов злокачественной опухоли [2, 7, 9].
Считается, что хирургическое лечение первичных злокачественных опухолей сердца в большинстве случаев малоэффективно и пока не вносит принципиальных изменений в прогноз у больных с этой патологией. Главное объяснение тому — до сих пор остается поздняя диагностика заболевания: в 26,9 — 80% случаев к моменту диагностики первичных злокачественных опухолей сердца уже имеются региональные и (или) отдаленные метастазы
[3].
Приводим собственные наблюдения:
Больная Г., 49 лет.
В июне 2005 года больной была выполнена надвлагалищная ампутация матки по поводу лейомиомы. После этого периодически стала беспокоить одышка при обычной физической нагрузке, постепенно нарастала слабость.
В сентябре 2006 года одышка усилилась, больная обследовалась в поликлинике Красноярской краевой клинической больницы, где была диагностирована перенесенная тромбоэмболия легочной артерии (ТЭЛА).
С 10.10.2006 года состояние и самочувствие больной с отрицательной динамикой: нарастала слабость, усилилась одышка, отмечался подъем температуры до 38,00, в течение следующих двух недель появилась кровь в мокроте. 11.11.2006 г. — 12.11.2006 г. одышка усилилась, чувство «нехватки» воздуха стало постоянным. Больная была госпитализирована для проведения ангиопульмонографии (АПГ).
Больная была госпитализирована для проведения ангиопульмонографии (АПГ).
При АПГ 13.11.2006 г. (рис. 1) выявлена массивная тромбоэмболия правой и левой легочных артерий, окклюзия верхнедолевых артерий справа и слева, окклюзия среднедолевых артерий справа, нижнедолевых артерий слева (давление в стволе легочной артерии 112/4 мм. рт. ст.). Перфузия сохранена в нижних отделах с обеих сторон. Принято решение провести попытку реканализации (РЭД) ветвей легочной артерии. Поочередно выполнена балонная ангиопластика стенозов правой и левой легочных артерий. На контрольных АПГ отмечено увеличение просветов главных легочных
артерий и восстановление просвета в зоне стенозов (рис. 2). После РЭД легочной артерии клинически состояние больной улучшилось, давление в ЛА снизилось (от 112 до 70 мм. рт. ст. по результатам АПГ).
При ЭХО-КГ (Аорта 2,7см; ЛП 2,8см; КДР 3,8см; КСР 1,7см; КДО 62; КСО 86; ФВ 86%; ПЖ 2,9см; ЗСЛЖд 1,0см; МЖПд 0,9см; СДЛА 100 мм. рт.ст.). Значительно расширены правые отделы сердца. Сократительная способность миокарда — гиперкинетический тип. Перикардиальный выпот до 0,5 — 0,8 см. Недостаточность трикуспидального клапана III ст. Выраженная легочная гипертензия. В стволе легочной артерии (под бифуркацией) гетерогенные эхоплотные образования (организованный тромб).
рт.ст.). Значительно расширены правые отделы сердца. Сократительная способность миокарда — гиперкинетический тип. Перикардиальный выпот до 0,5 — 0,8 см. Недостаточность трикуспидального клапана III ст. Выраженная легочная гипертензия. В стволе легочной артерии (под бифуркацией) гетерогенные эхоплотные образования (организованный тромб).
УЗИ вен нижних конечностей — данных о тромбозе глубоких вен нижних конечностей нет, выявлен неокклюзивный тромбоз наружных подвздошных вен.
Рентгенография органов грудной клетки: на верхушке правого легкого -остаточные изменения после перенесенного воспалительного процесса в виде фиброзных изменений. Инфильтративных изменений в легких не выявлено. Легочный рисунок умеренно усилен и деформирован. Правый корень подтянут вверх. Границы сердца расширены влево.
В анализах крови обращает внимание лейкоцитоз (12,5 х 109 г/л), СОЭ 35 мм/час; выраженное снижение факторов протромбинового комплекса, нарушение конечного этапа свертывания.
Больная готовилась к оперативному лечению в НИИ патологии кровообращения, Новосибирск — тромбэндартерэктомии из легочной артерии.
22.01.07 с диагнозом двусторонняя пневмония больная повторно госпитализирована в Красноярскую краевую клиническую больницу. При поступлении состояние больной крайне тяжелое — не исключался рецидив ТЭЛА, а также двухсторонняя пневмония. Рентгенографически диагноз пневмонии подтвержден. 24.01.07 г. состояние больной осложнилось легочным кровотечением. В течение недели по данным серии Я — грамм
(24.01.07г. — 28.02.07г.) сформировалась полость распада, сухая, с
дальнейшем разрешением в пневмосклероз.
При ЭхоКГ аорта обычная, значительно расширены правые отделы сердца и умеренно левое предсердие. Гиперкинетический тип, сдавление левого желудочка. В выходном отделе правого желудочка лоцируется дополнительное гетерогенное образование с эффектом стенозирования, с градиентом давления 35 — 40 мм рт. ст. В полости правого желудочка дополнительное гетерогенное образование. В бифуркации ствола легочной артерии с заходом в устье правой легочной артерии гетерогенно -пристеночное образование. Переднее эхосвободное пространство 1,5 см; заднее — 2,0 см.
В выходном отделе правого желудочка лоцируется дополнительное гетерогенное образование с эффектом стенозирования, с градиентом давления 35 — 40 мм рт. ст. В полости правого желудочка дополнительное гетерогенное образование. В бифуркации ствола легочной артерии с заходом в устье правой легочной артерии гетерогенно -пристеночное образование. Переднее эхосвободное пространство 1,5 см; заднее — 2,0 см.
Учитывая прогрессирующее ухудшение состояния больной, которое трактовалось как нарастание клиники сдавления сердца, принято решение о проведении пункции и дренировании полости перикарда. Во время проведения которой, произошла остановка сердечной деятельности с безуспешными реанимационными мероприятиями.
При секционном исследовании выявлена опухоль сердца с локализацией на задней створке клапана легочной артерии, гистологически имеющая строение злокачественного мягкотканого новообразования. Фенотипирование с использованием иммуногистохимического метода исследования обнаружило фибросаркому с выраженной пролиферативной активностью опухолевых клеток и высокой степенью васкуляризации. Имплантационный и инфильтративный характер роста в стенке ствола легочной артерии, а также в ее сегментарных ветвях с прорастанием в переднее и заднее средостение и ростом в виде муфты вокруг ствола привел к стенозу просвета легочной артерии, с развитием выраженной легочной гипертензии (рис. 3). Кроме того, выявлен инвазивный рост в долевые и сегментарные бронхи, паренхиму верхней доли левого легкого, переднее и заднее средостение, лимфогенные метастазы в бифуркационные лимфатические узлы (рис. 4).
Фенотипирование с использованием иммуногистохимического метода исследования обнаружило фибросаркому с выраженной пролиферативной активностью опухолевых клеток и высокой степенью васкуляризации. Имплантационный и инфильтративный характер роста в стенке ствола легочной артерии, а также в ее сегментарных ветвях с прорастанием в переднее и заднее средостение и ростом в виде муфты вокруг ствола привел к стенозу просвета легочной артерии, с развитием выраженной легочной гипертензии (рис. 3). Кроме того, выявлен инвазивный рост в долевые и сегментарные бронхи, паренхиму верхней доли левого легкого, переднее и заднее средостение, лимфогенные метастазы в бифуркационные лимфатические узлы (рис. 4).
Обтурация просвета легочной артерии привела к перегрузке правых отделов сердца с развитием подострой правожелудочковой недостаточности. Данная патогенетическая цепочка проявила себя рядом осложнений: прогрессирующая правожелудочковая недостаточность, спаечно-выпотной опухолевый перикардит, по поводу которого произведена пункция и катетеризация перикарда, в результате которой развилась тампонада сердца кровью, которая явилась в данном случае непосредственной причиной смерти.
Больная Я., 67лет.
В анамнезе гипертоническая болезнь в течение 15 лет. Симптомы стенокардии, ФП тахивариант, постоянная форма около 10 лет. Со времени первой беременности варикозная болезнь нижних конечностей (около 40 лет). Первые симптомы ТЭЛА с весны 2008 года с постепенным прогрессированием симптомов. С сентября 2008 года нарастает одышка, 22 сентября доставлена в Красноярскую краевую клиническую больницу с подозрением на ТЭЛА. Выполнена АПГ — нижнедолевая правосторонняя ТЭЛА, установлен кава-фильтр, проведен тромболизис стрептокиназой.
При ЭхоКГ ближе к бифуркации легочной артерии турбулентный поток с градиентом давление 64 мм рт. ст. СДЛА — 90 мм рт. ст. В легочной артерии (ЛА) протяженный тромб с флотацией в левую ветвь легочной артерии, с окклюзией правой ветви легочной артерии. Проксимальный край тромба в выносящем тракте правого желудочка.
УЗИ: гепатомегалия, признаки застоя по нижней полой вене (НПВ).
В анализах крови обращает внимание СОЭ 28 мм / час, выраженная тромбинемия, тенденция к гиперкоагуляции.
Больная направлена на оперативное лечение в НИИ патологии кровообращения Новосибирск — тромбэндартерэктомии из легочной артерии.
При поступлении одышка в покое усиливается при незначительной нагрузке; боль за грудиной давящего характера, возникающая при незначительной нагрузке, эмоциональном волнении.
Рентгенография (22.12.08 г.) — слева среднеинтенсивное затемнение легочного поля от переднего отрезка 3 ребра до диафрагмы, признаки свободной жидкости в левой плевральной полости, нельзя исключить воспалительный процесс в левом легком. Правый синус свободен. Легочный рисунок усилен в прикорневых отделах. Сердце — СЛК 64%, расширены все отделы.
Легочный рисунок усилен в прикорневых отделах. Сердце — СЛК 64%, расширены все отделы.
ЭхоКГ (левый желудочек — КДР 4,3; КСР 2,8; КДО 82; КСО 28; УО 54; ФВ 66; ЛП — 8,4 х 4,7; ПП — 7,9 х 5; правый желудочек — КДР 3,3; КДО 86; аорта -3,6) дилятация полостей обеих предсердий и правого желудочка. Показатели глобальной систолической функции миокарда левого желудочка в норме. Нарушений локальной сократимости миокарда левого желудочка не выявлено. Сократительная способность миокарда правого желудочка снижена (ББ = 36%). Ствол легочной артерии при ЦДК заполняется неравномерно. Поток в легочной артерии ускорен. Пиковый систолический градиент ПЖ/ЛА = 71 — 76 мм. рт. ст. В инфраренальном отделе НПВ лоцируется тень кава-фильтра, тромбоз не выявлен.
При ангиопульмонографии и коронарографии выявлен тромбоз ствола ЛА, окклюзия левой нижнедолевой артерии и пристеночный тромбоз правой нижнедолевой артерии — хроническая массивная тромбоэмболия ствола ЛА, патологии коронарного русла не выявлено.
При перфузионной сцинтиграфии легких — нарушения перфузии в бассейне левой легочной артерии (признаки массивной тромбоэмболии ЛА).
На операции (А.М. Чернявский) в условиях искусственного кровообращения, гипотермии (19,5 градусов), антеградной кардиоплегии кустодиолом после продольного вскрытия ствола легочной артерии — в просвете новообразования серо-желтого цвета плотно-эластической консистенции с кровоизлияниями на поверхности, полностью обтурирующее
просвет ствола легочной артерии, распространяется от выходного отдела правого желудочка до левой ветви легочной артерии и врастающее в левую нижнедолевую ветвь. Опухоль удалена единым блоком вместе с подлежащей стенкой легочного ствола, из которой опухоль и произрастает. При дальнейшей ревизии обнаружены имплантационные метастазы и опухолевые эмболы в левой верхнедолевой и левой нижнедолевой артерии. Выполнено их иссечение и удаление. Правая легочная артерия интактна. Целостность ствола легочной артерии восстановлена путем протезирования трехстворчатым ксенокондуитом «БиоЛАБ» № 27. По данным «cito» -гистологического исследования удаленного материала — лейомиосаркома ствола легочной артерии.
Выполнено их иссечение и удаление. Правая легочная артерия интактна. Целостность ствола легочной артерии восстановлена путем протезирования трехстворчатым ксенокондуитом «БиоЛАБ» № 27. По данным «cito» -гистологического исследования удаленного материала — лейомиосаркома ствола легочной артерии.
Ближайший послеоперационный период протекал с явлениями нарастающей сердечно-легочной и острой почечной недостаточности, которые и стали непосредственной причиной смерти на 2-е сутки после операции.
Патолого-анатомический диагноз: злокачественное новообразование
ствола легочной артерии (лейомиосаркома) с метастазами в устье и ствол левой верхнедолевой и левой нижнедолевой артерии, большой и малый сальник.
В данных клинических примерах мы встретились с ситуацией, когда окклюзионное поражение злокачественной опухолью ствола и ветвей легочной артерии имитировали клинику ТЭЛА. При этом проведение ангиографических и ультразвуковых исследований подтверждали этот диагноз. Предпринимались соответствующие лечебные манипуляции, планировалось оперативное лечение по поводу хронической ТЭЛА. В обоих случаях верификация диагноза была произведена только после визуального морфологического и гистологического исследования. При ретроспективном изучении клинического материала считаем, что возможно было заподозрить опухолевую этиологию заболевания.
При этом проведение ангиографических и ультразвуковых исследований подтверждали этот диагноз. Предпринимались соответствующие лечебные манипуляции, планировалось оперативное лечение по поводу хронической ТЭЛА. В обоих случаях верификация диагноза была произведена только после визуального морфологического и гистологического исследования. При ретроспективном изучении клинического материала считаем, что возможно было заподозрить опухолевую этиологию заболевания.
И, хотя, теоретически патогенез данной клинической ситуации понятен, в литературе крайне мало сообщений о возможности подобного развития злокачественных новообразований с обтурационным поражением ЛА, протекающих под маской хронической ТЭЛА [12]. Можно предположить, что при дальнейшем развитии кардиохирургии ЛА хирурги чаще будут сталкиваться с подобными проблемами.
RELAPSE PULMONARY EMBOLISM AS A CLINICAL MASK OF RIGHT VENTRICULAR SARCOMA WITH OBTURATION INJURY OF
PULMONARY TISSUE
A. M. Chernyavskiy, V.A. Sakovich, D.V. Cherdantsev, D.B. Drobot,
M. Chernyavskiy, V.A. Sakovich, D.V. Cherdantsev, D.B. Drobot,
A.I. Osadchaya, S.A. Kryzhanovskaya Research Institute of Circulation Pathology, Ministry of Health, Russia
Krasnoyarsk State Medical University named after prof. Voino-Yasenetsky Krasnoyarsk Regional Clinical Hospital Abstract. The paper presents clinical examples of obstructive tumor injury of trunk and branches of pulmonary artery which clinically looks like the relapse pulmonary embolism.
Key words: fibrosarcoma, leuko-sarcoma of the heart, pulmonary embolism.
Литература
1. Акимов О. В. Первичная опухоль сердца — лейомиосаркома // Кардиология. — 1988. — Т. 28, № 3. — С. 103-104.
2. Бокерия Л.А., Малашенков А. И., Кавсадзе В.Э. и др. Кардиоонкология. — М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2003. — 254с.
И., Кавсадзе В.Э. и др. Кардиоонкология. — М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2003. — 254с.
3. Дмитрук И. М., Кокошко В. П., Григорук А. В. Клиникоморфологический анализ первичных и метастатических опухолей сердца // Архив патологии. — 1988. — Т. 50, № 12. — С. 36-41.
4. Кармилов В.А. Первичная саркома левого предсердия сердца под
маской пневмонии // Врачебное дело. — 1984. — № 5. — С. 75-76.
5. Кириченко О.П., Середюк З.Г. Фибросаркома сердца // Врачебное дело. — 1991. — № 1. — С. 99-101.
6. Лейба В.И. Лейомиосаркома левого предсердия // Архив патологии. — 1981 — Т.43, №6. — С. 71-73.
7. Петровский Б. В. Кардиоонкология — новая глава современной хирургии // Грудная хирургия. — 1988. — № 6. — С. 5-10.
— 1988. — № 6. — С. 5-10.
8. Петровский Б.В., Константинов Б. А., Нечаенко М. А. Первичные опухоли сердца. — М.: Медицина, 1997. — 152с.
9. Цукерман Г.И., Малашенков А.И., Кавсадзе В.Э. Опухоли сердца.
— М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 1999. — 269с.
10. Antunes M. J., Vanderdock K. M. et al. Primary cardiac leiomyosarcomas // Ann. Thorac. Surg. — 1991. — Vol. 51, № 4. -P. 9991001.
11. Basso C., Stefani A., Calabrese F. et al. Primary right atrial fibrosarcoma diagnosed by endocardial biopsy // Ibid. — 1996. — Vol. 131. — P. 399-402.
12. Calderon M., Galvan J., Negri V. et al. Right Ventricular Bypass for Palliation of Cardiac Sarcoma // Tex. Heart Inst. J. — 1996. — Vol. 23. — P. 178179.
J. — 1996. — Vol. 23. — P. 178179.
13. Grebens M. L., Rosado de Christenson M. L. et al. Primary cardiac and pericardial neoplasms: radiolologic-pathologic correlation // Radiographics.
— 2000. — Vol. 20. — P. 1073 — 1103.
14. Hall R. I., Cooley D. A. Neoplastic heart disease. Malignant primary tumors of the heart // In: Hurst J. W., The Heart, 6th ed. — New York, McGraw-Hill, 1986. — P. 1294-1305.
15. Kono T., Takemura T., Hagino I. et al. Complete resection of cardiac leiomyosarcoma extending into the pulmonary trunk and right pulmonary artery // Ann. Thorac. Surg. — 2000. — Vol. 70. — P. 1412-1414.
ДВУХЛЕТНЕЕ НАБЛЮДЕНИЕ ЗА ПАЦИЕНТКОЙ С РЕЦИДИВИРУЮЩЕЙ ТРОМБОЭМБОЛИЕЙ ЛЕГОЧНОЙ АРТЕРИИ ПОСЛЕ УСПЕШНОГО КОМБИНИРОВАННОГО ЛЕЧЕНИЯ | Баранова
1. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология 2010;4(1 Вып. 2):2–37. [Russian clinical practice guidelines for diagnostics, management and prevention of venous thromboembolic events. Flebologiya = Phlebology 2010;4(1 Suppl 2):2–37. (In Russ.)]. 1. Laporte S., Mismetti P., Decousus H. et al. Clinical predictor for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) registry. Circulation 2008; 117(13):1711–6.
Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология 2010;4(1 Вып. 2):2–37. [Russian clinical practice guidelines for diagnostics, management and prevention of venous thromboembolic events. Flebologiya = Phlebology 2010;4(1 Suppl 2):2–37. (In Russ.)]. 1. Laporte S., Mismetti P., Decousus H. et al. Clinical predictor for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) registry. Circulation 2008; 117(13):1711–6.
2. Dalen J.E. Pulmonary embolism: what have we learned since Virchow? Natural history, pathophysiology, and diagnosis. Chest 2002;122(4):1440–56.
3. Kearon C. Natural history of venous thromboembolism. Circulation 2003;107 (23 Suppl 1):122–30.
4. Dalen J.E., Alpert J.S. Natural history of pulmonary embolism. Prog Cardiovasc Dis 1975;17 (4):259–70.
5. Diebold J., Löhrs U. Venous thrombosis and pulmonary embolism: a study of 5039 autopsies. Pathol Res Pract 1991;187 (2–3):260–6.
6. Pengo V., Lensing A.W., Prins M.H. et al. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Engl J Med 2004; 350(22):2257–64.
7. Becattini C., Agnelli G., Pesavento R. et al. Incidence of chronic thromboembolic pulmonary hypertension after a first episode of pulmonary embolism. Chest 2006;130(1):172–5.
8. Squizzato А., Moja L. , Gensini G.F. et al. Is thrombolysis for intermediate-risk pulmonary embolism beneficial? The case of Emeritus Professor Crow. Intern Emerg Med 2009;4(4):339–41.
, Gensini G.F. et al. Is thrombolysis for intermediate-risk pulmonary embolism beneficial? The case of Emeritus Professor Crow. Intern Emerg Med 2009;4(4):339–41.
9. Berghaus T.M., Thilo C., Bluethgen A. et al. Effectiveness of thrombolysis in patients with intermediate-risk pulmonary embolism: influence on length of hospital stay. Adv Ther 2010;27(9):648–54.
10. Konstantinides S.V., Torbicki A., Agnelli G. et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014;35(43):3033–69, 3069a–3069k.
11. Meyer G., Vicaut E., Danays T. et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014;370(15):1402–11.
12. Marti C., John G., Konstantinides S. et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J 2015;36(10):605–14.
Marti C., John G., Konstantinides S. et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J 2015;36(10):605–14.
13. Engelberger R.P., Kucher N. Catheterbased reperfusion treatment of pulmonary embolism. Circulation 2011;124(19):2139–44.
14. Kucher N., Boekstegers P., Muller O.J. et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation 2014;129(4):479–86.
15. Mizoguchi H., Ogawa A., Munemasa M. et al. Refined balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension. Circ Cardiovasc Interv 2012;5(6):748–55.
16. Inami T., Kataoka M., Shimura N. et al. Pulmonary edema predictive scoring index (PEPSI), a new index to predict risk of reperfusion pulmonary edema and improvement of hemodynamics in percutaneous transluminal pulmonary angioplasty. JACC Cardiovasc Interv 2013;6(7):725–36.
Inami T., Kataoka M., Shimura N. et al. Pulmonary edema predictive scoring index (PEPSI), a new index to predict risk of reperfusion pulmonary edema and improvement of hemodynamics in percutaneous transluminal pulmonary angioplasty. JACC Cardiovasc Interv 2013;6(7):725–36.
17. Sugimura K., Fukumoto Y., Satoh K. et al. Percutaneous transluminal pulmonary angioplasty markedly improves pulmonary hemodynamics and long-term prognosis in patients with chronic thromboembolic pulmonary hypertension. Circ J 2012;76(2):485–8.
18. Feinstein J.A., Goldhaber S.Z., Lock J.E. et al. Balloon pulmonary angioplasty for treatment of chronic thromboembolic pulmonary hypertension. Circulation 2001;103(1):10–3.
19. Piazza G., Goldhaber S. Chronic thromboembolic pulmonary hypertension. N Engl J Med 2011;364 (4):351–60.
N Engl J Med 2011;364 (4):351–60.
20. Holzer R.J., Gauvreau K., Kreutzer J. et al. Balloon angioplasty and stenting of branch pulmonary arteries: adverse events and procedural characteristics: results of a multi-institutional registry. Circ Cardiovasc Interv 2011;4(3):287–96.
21. Schmitz-Rode T., Verma R., Pfeffer J.G. et al. Temporary pulmonary stent placement as emergency treatment of pulmonary embolism: first experimental evaluation. J Am Coll Cardiol 2006;48(4):812–6.
Комплексное лечение рецидивирующей тромбоэмболии легочных артерий
Назад к программеНемирова С.В.1, Медведев А.П.2, Широкова О.Р., Пичугин В.В., Калинина М.Л., Шитова С.Г., Демарин О.И.
1Нижегородская государственная медицинская академия; 2Специализированная кардиохирургическая клиническая больница, Нижний Новгород, Россия;
Цель:показать возможности комплексного лечения пациентов с рецидивирующей тромбоэмболией легочных артерий (ТЭЛА).

Материалы.
Обследовано 102 пациента клиники госпитальной хирургии им. Б.А. Королева с легочной гипертензией (ЛГ), сформировавшейся в результате рецидивирующей ТЭЛА; средний возраст составил 62,3±12,15 лет.
Всем больным выполнялось лабораторное обследование, ЭКГ, ФВД, полипозиционная рентгенография грудной клетки, эхокардиографию, ультразвуковое исследование (УЗИ) вен нижних конечностей. Также проводили УЗИ легких, компьютерную томографию, ангиопульмонографию.
В комплексе лечения применяли тромболитические (урокиназа, тромбовазим) и антикоагулянтные (клексан) препараты, простагландины (вазапростан), блокаторы кальциевых каналов и другие препараты, улучшающие микроциркуляцию (пентоксифилин, флебодиа 600). Тромбэмболэндартерэктомия в условиях искусственного кровообращения выполнена 37 пациентам. При сохранении высокого риска рецидива ТЭЛА производили тромбэктомию из пораженной вены, ее пликацию или лигирование или имплантацию кава-фильтра.
Результаты.
В случае длительно существующей ЛГ при распространенном периферическом типе поражения ЛА у 32 больных комплексная терапия позволила снизить и стабилизировать уровень ЛГ, однако нормализация показателей не была достигнута ни в одном случае. У 11 пациентов при наличии множественной сопутствующей патологии улучшение достигнуто не было, они погибли на фоне прогрессирующей ХЛГ.
В 19 случаях при недавнем последнем эпизоде ТЭЛА введение тромболитиков в комплексе терапии позволило достичь регресса ЛГ, пациенты выписаны на амбулаторное лечение в удовлетворительном состоянии (со средним ДЛА 23-32). У 14 пациентов тромболизис был не- или малоэффективен, что, наряду с наличием противопоказаний к тромболитической терапиии при центральной форме поражения стало основанием для выполнения ТЭАЭ (n=40). В этой группе в госпитальные сроки погибла 1 пациентка с формированием множественных варфариновых некрозов, связанных с длительным бесконтрольным приемом препарата на догоспитальном этапе. Рецидив тромбоэмболии легочных артерий после операции зафиксирован у 1 больной; ей имплантирован перманентный кава-фильтр. Состояние 38 пациентов через 8-35 месяцев после оперативного лечения остается удовлетворительным, расчетное давление в ЛА сохраняется на уровне в среднем 22,04±3,9 мм рт. ст.
Состояние 38 пациентов через 8-35 месяцев после оперативного лечения остается удовлетворительным, расчетное давление в ЛА сохраняется на уровне в среднем 22,04±3,9 мм рт. ст.
Выводы.
Комплексная терапия при раннем обращении позволяет улучшить состояние больного. При ее неэффективности и центральной локализации поражения легочных артерий эффективным методом купирования легочной гипертензии и нормализации гемодинамики является оперативное лечение.
Наименование нозологических форм заболеваний (шифр по МКБ-10) | Объемы оказания медицинской помощи | Исход заболевания | ||||
Диагностика | Профилактика | |||||
Обязательная | Кратность | Дополнительная (требует обоснования) | Необходимое | Средняя длительность | ||
АКУШЕРСТВО | ||||||
До беременности | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей2. Клинический минимум (Общий анализ крови, Биохимический анализ крови, Общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ВТЭО (Приложение 1) | При первом обращении | 1. Венозная сонография нижних конечностей 2. Скрининг на АФС и наследственные тромбофилии | Медикаментозная профилактика не проводится | Профилактика ТЭЛА | |
Во время беременности с однократным ВТЭО в анамнезе | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей 2. Клинический минимум (общий анализ крови, коагулограмма, общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ВТЭО (Приложение 1) 5. | При постановке на учет по беременности, Контрольное исследование по показаниям | 1. Венозная сонография нижних конечностей 2. Скрининг на АФС и наследственные тромбофилии | 1. Наличие однократного ВТЭО, ассоциированного с тромбофилией высокого риска в анамнезе: -как можно раньше низкомолекулярные гепарины (НМГ) (Приложение №2) -эластическая компрессия нижних конечностей 2. Наличие однократного ВТЭО, не ассоциированного с тромбофилией высокого риска в анамнезе, или с наличием ВТЭО у родственников первой линии: -как можно раньше НМГ (Приложение №2) -эластическая компрессия нижних конечностей 3. В случае однократного ВТЭО, ассоциированного с транзиторными факторами риска, которые больше не присутствуют, и отсутствие других факторов риска, возможно ведение беременности без НМГ, однако послеродовый период обязательно с назначением НМГ | 1. На протяжении всей беременности, в родах и в послеродовом периоде | Профилактика ТЭЛА |
Во время беременности с многократным ВТЭО в анамнезе | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей2. Клинический минимум (общий анализ крови, коагулограмма, общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ВТЭО (Приложение 1) 5. Консультация акушера-гинеколога в КДО перинатального центра | При постановке на учет по беременности, Контрольное исследование по показаниям | 1. Венозная сонография нижних конечностей 2. Скрининг на АФС и наследственные тромбофилии | — НМГ (Приложение №2) в случае отсутствия предшествующей терапии Варфарином — Заменить терапию Варфарином профилактикой НМГ как можно быстрее для избегания эмбрио- и фетотоксического действия Варфарина -эластическая компрессия нижних конечностей | 1. Начать профилактику НМГ как можно раньше 2. На протяжении всей беременности, в родах и 6 недель послеродового периода | Профилактика ТЭЛА |
Во время беременности на фоне наследственной тромбофилии | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу2. Клинический минимум (общий анализ крови, коагулограмма, общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ТЭЛА (Приложение 1) 5. Консультация акушера-гинеколога в КДО перинатального центра | При постановке на учет по беременности, Контрольное исследование по показаниям | 1. Венозная сонография нижних конечностей 2. Скрининг на АФС и наследственные тромбофилии | 1. При наличии наследственной тромбофилии высокого риска возникновения ВТЭО вне зависимости от клинической симптоматики, а также других видов бессимптомной наследственной тромбофилии при наличии других факторов риска (Приложение №3) — НМГ (Приложение №2) как можно раньше при установлении факта беременности 2. В случае других видов бессимптомной наследственной тромбофилии при отсутствии других факторов риска, возможно ведение беременности без НМГ, однако послеродовый период обязательно с назначением НМГ | 1. Начать профилактику НМГ как можно раньше Начать профилактику НМГ как можно раньше2. На протяжении всей беременности, в родах и 6 недель послеродового периода | Профилактика ТЭЛА |
Во время беременности на фоне приобретенной тромбофилии — АФС | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание уделить аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 2. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ТЭЛА (Приложение 1) 5. Консультация акушера-гинеколога в КДО перинатального центра | При постановке на учет по беременности, Контрольное исследование по показаниям | 1. Обследование на АФС | 1. В случае клинических проявлений АФС в анамнезе — НМГ (Приложение №2) как можно раньше при установлении факта беременности 2. | 1. Начать профилактику НМГ как можно раньше 2. На протяжении всей беременности, в родах и 6 недель послеродового периода | Профилактика ТЭЛА |
Профилактика ВТЭО во время родов, в том числе при использовании регионарной анестезии и аналгезии в родах и в послеродовом периоде | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 2. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ТЭЛА (Приложение 1) | При поступлении на роды, Контрольное исследование по показаниям | 1. Венозная сонография нижних конечностей Венозная сонография нижних конечностей | 1. При появлении наружного кровотечения или при начале родовой деятельности — прекращение введения НМГ 2. При появлении признаков преждевременных родов в сроках беременности ≤35-36 нед. пациенткам, ранее получавшим антагонисты витамина К в терапевтических или профилактических дозах, показана их отмена и переход на НМГ или нефракционированный гепарин (НФГ) 3. При появлении признаков преждевременных родов в сроках беременности ≤35-36 нед. пациенткам, ранее получавшим НМГ в терапевтических или профилактических дозах, продолжить их применение или переход на НФГ, как препарат, обладающий более коротким периодом полувыведения 4. При наличии массивной кровопотери, гемотрансфузии начинать и возобновлять профилактику ВТЭО сразу после снижения риска кровотечения. 5. При наличии высокого риска кровотечения (Приложение 4) использовать для профилактики ВТЭО НФГ или ношение градуированного компрессионного трикотажа и/или применение пневмокомпрессии. 6. В случае получения пациенткой НМГ стимуляцию родов, кесарево сечение, регионарные методики анестезии и анальгезии отложить на как минимум 24 часа после введения последней терапевтической дозы НМГ или 12 часов после введения последней профилактической дозы НМГ. 7. В случае получения пациенткой НФГ стимуляцию родов, кесарево сечение, регионарные методики анестезии и анальгезии отложить на как минимум 4-6 часов после введения НФГ. 8. Удаление эпидурального катетера проводить не раньше, чем через 12 часов после введения профилактических доз НМГ или 4 часа после введения профилактических доз НФГ. 9 Введение НМГ и НФГ возобновлять не раньше, чем через 4-6 часов после применения спинномозговой анестезии или после удаления эпидурального катетера. 10. В случае невозможности прекращения введения НМГ или НФГ в родах (например, у женщин с самопроизвольными родами в течение 12 часов после введения последней дозы НМГ), не назначать методики регионарной анальгезии, а использовать альтернативные методы анальгезии, например, управляемую внутривенную анальгезию на основе опиатов. 11. В случае изолированного применения нестероидных противовоспалительных средств (НПВС) (например, аспирина) проводить регионарную анестезию и анальгезию без предварительной отмены препаратов (применение НПВС не является противопоказанием к регионарным методикам). 12. В случае изолированного применения нестероидных противовоспалительных средств (НПВС) (например, аспирина) назначать спинальную анестезию как более предпочтительную методику по сравнению с эпидуральной анестезией. | 1. Начать профилактику НМГ как можно раньше 2. На протяжении всего периода родов | Профилактика ТЭЛА |
Профилактика ВТЭО после родов | ||||||
| I26 — Легочная эмболия | 1. Провести документированную оценку факторов риска в отношении ВТЭО после родов. 2. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 3. 4. Количество тромбоцитов | При переводе в послеродовое отделение | 1.При проведении антикоагулянтной терапии во время беременности возобновить ее не ранее чем через 4–6 часов после самопроизвольных родов и через 8–12 часов после операции кесарева сечения для минимизации геморрагических осложнений. 2. Во время периода лактации прием варфарина. 3. Во время периода лактации продолжить прием низких доз Аспирина в случае его приема до родов по сердечно-сосудистым показаниям. При наличии ожирения 3 степени (ИМТ выше 40 кг/м2) применять НМГ в профилактических дозах в течение 7 дней после родов. 4. При наличии дополнительных факторов риска, сохраняющихся более 7 дней после родов (Приложение 2), таких как длительная иммобилизация, или раневая инфекция, проводить профилактику ВТЭО до 6 недель после родов или до момента, когда дополнительные факторы риска будут полностью устранены. | В случае высокого риска послеродовых ВТЭО (Приложение 3) проводить профилактику ВТЭО в течение 6 недель после родов; в случае умеренного риска ВТЭО проводить профилактику ВТЭО в течение 1 недели после родов. Во время периода лактации проводить профилактику ВТЭО НМГ или НФГ или Варфарином как препаратами, безопасными для новорожденного. | ||
Профилактика ВТЭО в послеродовом периоде у женщин с ВТЭО анамнезе | ||||||
| I26 — Легочная эмболия | 1. Провести документированную оценку факторов риска в отношении ВТЭО после родов. 2. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 3. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 4. Количество тромбоцитов | При переводе в послеродовое отделение | 1. Назначить НМГ или варфарин в течение 6 недель после родов независимо от способа родоразрешения. 2. При назначении варфарина контроль МНО с целевым уровнем МНО от 2.0 до 3.0. | 6 недель послеродового периода | ||
Профилактика ВТЭО в послеродовом периоде у женщин с наследственной или приобретенной тромбофилией | ||||||
| I26 — Легочная эмболия | 1. Провести документированную оценку факторов риска в отношении ВТЭО после родов. 2. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 3. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 4. Количество тромбоцитов | При переводе в послеродовое отделение | 1. Назначить НМГ в течение по меньшей мере 7 дней после родов независимо от способа родоразрешения, даже если профилактика ВТЭО не проводилась в дородовом периоде. 2. В случае наличия ВТЭО у родственников первой линии или других факторов риска продлить профилактику ВТЭО до 6 недель после родов. | От 7 дней до 6 недель послеродового периода | ||
Профилактика ВТЭО при родоразрешении путем кесарева сечения | ||||||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей. Особое внимание уделить семейному анамнезу 2. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ТЭЛА (Приложение 1) | При поступлении на родоразрешение | 1. В случае кесарева сечения в экстренном порядке проводить профилактику ВТЭО НМГ в течение 7 дней после родов в сочетании с компрессионным трикотажем и/или перемежающейся пневматической компрессией. 2. В случае кесарева сечения в плановом порядке при наличии одного и более дополнительных факторов риска (Приложение 2) или высокого риска ВТЭО (Приложение 3) проводить профилактику ВТЭО НМГ в течение 7 дней после родов в сочетании с компрессионным трикотажем и/или перемежающейся пневматической компрессией. 3. В случае кесарева сечения в плановом порядке проводить профилактику ВТЭО проводить механическую профилактику ВТЭО (компрессионный трикотаж или перемежающуюся пневматическую компрессию). 4. При наличии высокого риска кровотечения (Приложение 4) проводить механическую профилактику ВТЭО (компрессионный трикотаж или перемежающуюся пневматическую компрессию). | 7 дней после родоразрешения | ||
ГИНЕКОЛОГИЯ | ||||||
Наименование нозологических форм заболеваний (шифр по МКБ-10) | Объемы оказания медицинской помощи | Исход заболевания | ||||
Диагностика | Профилактика | |||||
Обязательная | Кратность | Дополнительная (требует обоснования) | Необходимое | Средняя длительность | ||
| I26 — Легочная эмболия | 1. Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей Анамнез и физикальное обследование. Особое внимание аускультации и осмотру нижних конечностей2. Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи) 3. Количество тромбоцитов 4. На основании полученных результатов определить группу риска ТЭЛА (Приложение 6) | При поступлении, Контрольное исследование по показаниям | 1. Венозная сонография нижних конечностей | 1. При наличии очень низкого риска ВТЭО не использовать никаких специальных фармакологических или механических средств профилактики кроме ранней активизации после операции. 2. При наличии низкого риска ВТЭО применять механическую профилактику ВТЭО в виде компрессионного трикотажа или пневмокомпрессии. 3. При наличии умеренного риска ВТЭО при отсутствии высокого риска развития кровотечения, применять НМГ, НФГ или механическую профилактику ВТЭО в виде компрессионного трикотажа или пневмокомпрессии. 4. При наличии умеренного риска ВТЭО и высокого риска развития кровотечения применять механическую профилактику ВТЭО в виде компрессионного трикотажа или пневмокомпрессии. 5. При наличии высокого риска ВТЭО при отсутствии высокого риска развития кровотечения применять фармакологическую профилактику НМГ или НФГ совместно с механической профилактикой в виде компрессионного трикотажа или пневмокомпрессии. 6. При наличии высокого риска ВТЭО и высокого риска кровотечения применять механическую профилактику в виде компрессионного трикотажа или пневмокомпрессии, пока риск кровотечения не уменьшится, и можно будет начать фармакологическую профилактику. 7. При наличии оперативного вмешательства по поводу злокачественного новообразования при отсутствии высокого риска развития кровотечения применять фармакологическую профилактику НМГ большей продолжительности (4 недели). 8. При наличии высокого риска развития ВТЭО и противопоказаний к назначению НМГ и НФГ при отсутствии высокого риска развития кровотечения применять Аспирин в низких дозах, Фондапаринукс или механическую профилактику в виде компрессионного трикотажа или пневмокомпрессии. 9. Не использовать фильтр нижней полой вены для первичной профилактики ВТЭО. 10. Не выполнять периодическое наблюдение с помощью компрессионной ультрасонографии. 11. Из методов механической профилактики назначать пневмокомпрессию как более эффективный метод профилактики ВТЭО. | Первая доза гепарина должна быть введена не позднее начала оперативного вмешательства. Продолжительность гепаринопрофилактики не менее 7 суток. При необходимости продления свыше 10 суток – перевод на низкомолекулярные гепарины или непрямые антикоагулянты. | Профилактика ТЭЛА |
Анализ качества диагностики и лечения тромбоэмболии легочной артерии в ГУ РК “Кардиологический диспансер”
Мишенева Е.А.1 , Епифанова Е.А.1 , Ильиных Е.И.2
1 — ГУ РК “Кардиологический диспансер”, г. Сыктывкар 2 – Медицинский институт ФГБОУ ВО СГУ им. Питирима Сорокина, г. Сыктывкар
Актуальность. Тромбоэмболия легочной артерии (ТЭЛА) остается одной из серьезных и сложных диагностических проблем современной кардиологии с высокими показателями летальности. Цель работы – проанализировать качество диагностики и лечения пациентов с ТЭЛА в условиях реальной клинической практики в ГУ РК “Кардиологический диспансер”. Материал и методы. Проведен анализ за 3-летний период (2014-2016 гг.) результатов лечения пациентов с ТЭЛА в отделении кардиологии 4 ГУ РК “Кардиологический диспансер”. Отделение кардиологии 4 является профильным по лечению ТЭЛА в г. Сыктывкаре и Республике Коми. За анализируемый период в отделении пролечено 185 пациентов с ТЭЛА, из которых 20% имели ТЭЛА высокого риска, 51% — ТЭЛА промежуточного риска и 29% — ТЭЛА низкого риска. Средний возраст пациентов с ТЭЛА составил 54,6 года. Соотношение мужчин и женщин было по 50%. Средний койко-день составил 21 день. Госпитальная летальность среди пациентов с ТЭЛА высокого риска составила 10% (умерло 4 пациента из 38), по литературным данным госпитальная летальность при ТЭЛА высокого риска составляет 30-32%. Диагностика и лечение ТЭЛА в отделении проводится согласно рекомендациям ESС. У всех пациентов диагноз ТЭЛА был верифицирован на МС КТ ангиопульмонографии.
Цель работы – проанализировать качество диагностики и лечения пациентов с ТЭЛА в условиях реальной клинической практики в ГУ РК “Кардиологический диспансер”. Материал и методы. Проведен анализ за 3-летний период (2014-2016 гг.) результатов лечения пациентов с ТЭЛА в отделении кардиологии 4 ГУ РК “Кардиологический диспансер”. Отделение кардиологии 4 является профильным по лечению ТЭЛА в г. Сыктывкаре и Республике Коми. За анализируемый период в отделении пролечено 185 пациентов с ТЭЛА, из которых 20% имели ТЭЛА высокого риска, 51% — ТЭЛА промежуточного риска и 29% — ТЭЛА низкого риска. Средний возраст пациентов с ТЭЛА составил 54,6 года. Соотношение мужчин и женщин было по 50%. Средний койко-день составил 21 день. Госпитальная летальность среди пациентов с ТЭЛА высокого риска составила 10% (умерло 4 пациента из 38), по литературным данным госпитальная летальность при ТЭЛА высокого риска составляет 30-32%. Диагностика и лечение ТЭЛА в отделении проводится согласно рекомендациям ESС. У всех пациентов диагноз ТЭЛА был верифицирован на МС КТ ангиопульмонографии. У пациентов с ТЭЛА высокого риска при невозможности быстрого проведения МС КТ ангиопульмонографии, решение о начале антитромботического лечения принималось после экстренной ЭхоКГ. 2 Отсутствие специфичных симптомов при ТЭЛА приводит к тому, что часть пациентов с ТЭЛА госпитализируется с другими диагнозами, так 15% пациентов при поступлении имели диагноз ОКС, но после проведения экстренной коронароангиографии, ЭХО-КГ и отсутствии значимых коронарных поражений была заподозрена и подтверждена ТЭЛА. Три пациента (1,6%) поступили с подозрением на миокардит. Тромболитическая терапия (ТЛТ) у пациентов с ТЭЛА высокого риска была проведена у 21 из 38 больных (в 55% случаях от пациентов с ТЭЛА высокого риска). В остальных ситуациях ТЛТ была противопоказана или же пациенты переводились из других стационаров, где лечение ТЭЛА высокого риска проходило без ТЛТ, а больные поступали в кардиодиспансер гемодинамически стабильными. Из ТЛТ применялась альтеплаза, режим 100 мг за 2 часа. Тяжелых геморрагических осложнений ТЛТ не наблюдалось.
У пациентов с ТЭЛА высокого риска при невозможности быстрого проведения МС КТ ангиопульмонографии, решение о начале антитромботического лечения принималось после экстренной ЭхоКГ. 2 Отсутствие специфичных симптомов при ТЭЛА приводит к тому, что часть пациентов с ТЭЛА госпитализируется с другими диагнозами, так 15% пациентов при поступлении имели диагноз ОКС, но после проведения экстренной коронароангиографии, ЭХО-КГ и отсутствии значимых коронарных поражений была заподозрена и подтверждена ТЭЛА. Три пациента (1,6%) поступили с подозрением на миокардит. Тромболитическая терапия (ТЛТ) у пациентов с ТЭЛА высокого риска была проведена у 21 из 38 больных (в 55% случаях от пациентов с ТЭЛА высокого риска). В остальных ситуациях ТЛТ была противопоказана или же пациенты переводились из других стационаров, где лечение ТЭЛА высокого риска проходило без ТЛТ, а больные поступали в кардиодиспансер гемодинамически стабильными. Из ТЛТ применялась альтеплаза, режим 100 мг за 2 часа. Тяжелых геморрагических осложнений ТЛТ не наблюдалось. При лечении пациентов с ТЭЛА невысокого риска в отделении в течение первых 10 дней используются низкомолекулярные гепарины (НМГ) в лечебной дозе, рассчитываемой по массе тела пациента, далее пациент переводится на оральные антикоагулянты (ОАК). После 10 дней лечения НМГ пациенты чаще переводятся на новые оральные антикоагулянты (ривароксабан, апиксабан или дабиатран). При возможности контроля МНО в дальнейшем и предпочтении пациента вместо НОАК назначался варфарин. Фатальных кровотечений и внутричерепных кровотечений при использовании антикоагулянтов у пациентов с ТЭЛА не отмечалось. Всего за 3 года рецидивы ТЭЛА после первичного лечения в отделении развились только у 5 (2,7%) больных. В четырех случаях рецидивы ТЭЛА произошли из-за нарушения пациентами режима приема антикоагулянтов. Одной их серьезных проблем перенесенной ТЭЛА является развитие хронической тромбоэмболической легочной гипертензии (ХТЛГ). Из 185 пациентов ХТЛГ развилась у 5 (2,7%). В трех случаях это было связано с рецидивами ТЭЛА из-за самостоятельной отмены антикоагулянтов.
При лечении пациентов с ТЭЛА невысокого риска в отделении в течение первых 10 дней используются низкомолекулярные гепарины (НМГ) в лечебной дозе, рассчитываемой по массе тела пациента, далее пациент переводится на оральные антикоагулянты (ОАК). После 10 дней лечения НМГ пациенты чаще переводятся на новые оральные антикоагулянты (ривароксабан, апиксабан или дабиатран). При возможности контроля МНО в дальнейшем и предпочтении пациента вместо НОАК назначался варфарин. Фатальных кровотечений и внутричерепных кровотечений при использовании антикоагулянтов у пациентов с ТЭЛА не отмечалось. Всего за 3 года рецидивы ТЭЛА после первичного лечения в отделении развились только у 5 (2,7%) больных. В четырех случаях рецидивы ТЭЛА произошли из-за нарушения пациентами режима приема антикоагулянтов. Одной их серьезных проблем перенесенной ТЭЛА является развитие хронической тромбоэмболической легочной гипертензии (ХТЛГ). Из 185 пациентов ХТЛГ развилась у 5 (2,7%). В трех случаях это было связано с рецидивами ТЭЛА из-за самостоятельной отмены антикоагулянтов. В двух случаях развитие ХТЛГ было связано с поздней госпитализацией. Двум 3 пациентам с было проведено успешное оперативное лечение ХТЛГ в федеральных центрах (г. Санкт-Петербург и Новосибирск). У 151 (88%) пациентов с ТЭЛА были выявлены инструментальные признаки тромбоза глубоких вен. У 55 пациентов (36% от пациентов с ТГВ) отсутствовали клинические признаки ТГВ. У 34 больных (18%) ТЭЛА произошла при отсутствии инструментальных признаков ТГВ. На тромбофилии обследовались, как правило, пациенты моложе 50 лет, с рецидивирующей ТЭЛА или при отягощенной наследственности. У всех из 81 обследованных пациентов выявлялись маркеры генетической тромбофилии и/или антифосфолипидного синдрома. У 11% пациентов ТЭЛА развилась на фоне онкопатологии. Среди провоцирующих факторов ТЭЛА имели место следующие: длительные переезды или перелеты – 9% пациентов, обездвиженность — 7%, прием заместительной гормональной терапии – 7%, недавняя операция — 6,5%, травмы — 6%, декомпенсация ХСН — 4%, ХОБЛ или СОАС – 3% и беременность — 2%.
В двух случаях развитие ХТЛГ было связано с поздней госпитализацией. Двум 3 пациентам с было проведено успешное оперативное лечение ХТЛГ в федеральных центрах (г. Санкт-Петербург и Новосибирск). У 151 (88%) пациентов с ТЭЛА были выявлены инструментальные признаки тромбоза глубоких вен. У 55 пациентов (36% от пациентов с ТГВ) отсутствовали клинические признаки ТГВ. У 34 больных (18%) ТЭЛА произошла при отсутствии инструментальных признаков ТГВ. На тромбофилии обследовались, как правило, пациенты моложе 50 лет, с рецидивирующей ТЭЛА или при отягощенной наследственности. У всех из 81 обследованных пациентов выявлялись маркеры генетической тромбофилии и/или антифосфолипидного синдрома. У 11% пациентов ТЭЛА развилась на фоне онкопатологии. Среди провоцирующих факторов ТЭЛА имели место следующие: длительные переезды или перелеты – 9% пациентов, обездвиженность — 7%, прием заместительной гормональной терапии – 7%, недавняя операция — 6,5%, травмы — 6%, декомпенсация ХСН — 4%, ХОБЛ или СОАС – 3% и беременность — 2%. Для оптимального использования в практической работе сложных алгоритмов диагностики и лечении было разработано приложение «ТЭЛА». Его можно бесплатно скачать на Play Маркете, оно доступно для устройств на платформе Android. Автор приложения — Мишенева Екатерина Александровна – врач отделения кардиологии 4. Приложение основано на последних Европейских и Российских рекомендациях по ТЭЛА и помогает врачу быстро выбрать оптимальную тактику диагностики и лечения. Выводы. В условиях Коми республиканского кардиодиспансера при создании профильного отделения и внедрения МС КТ ангиопульмонографии стало возможным эффективно использовать современные алгоритмы диагностики и лечения ТЭЛА, что привело к низкому показателю летальности у пациентов с ТЭЛА высокого риска и низкой частоте формирования ХТЛГ.
Для оптимального использования в практической работе сложных алгоритмов диагностики и лечении было разработано приложение «ТЭЛА». Его можно бесплатно скачать на Play Маркете, оно доступно для устройств на платформе Android. Автор приложения — Мишенева Екатерина Александровна – врач отделения кардиологии 4. Приложение основано на последних Европейских и Российских рекомендациях по ТЭЛА и помогает врачу быстро выбрать оптимальную тактику диагностики и лечения. Выводы. В условиях Коми республиканского кардиодиспансера при создании профильного отделения и внедрения МС КТ ангиопульмонографии стало возможным эффективно использовать современные алгоритмы диагностики и лечения ТЭЛА, что привело к низкому показателю летальности у пациентов с ТЭЛА высокого риска и низкой частоте формирования ХТЛГ.
Диагностика и хирургическая профилактика тромбоэмболии легочной артерии у больных с флотирующими тромбами глубоких вен инфраингвинальной зоны
Тромбоэмболия легочной артерии (ТЭЛА) по праву считается одним из тяжелейших и катастрофически протекающих острых сосудистых заболеваний, сопровождающихся высокой летальностью, большим количеством осложнений. С ТЭЛА неизбежно сталкиваются представители как хирургических, так и терапевтических специальностей, поскольку она может возникнуть в самых различных клинических ситуациях. Смертность от ТЭЛА в общей популяции колеблется от 2,1 до 6,2% [3]. ТЭЛА прочно удерживает 2-3-е место в структуре летальности в стационарах хирургического профиля [6].
С ТЭЛА неизбежно сталкиваются представители как хирургических, так и терапевтических специальностей, поскольку она может возникнуть в самых различных клинических ситуациях. Смертность от ТЭЛА в общей популяции колеблется от 2,1 до 6,2% [3]. ТЭЛА прочно удерживает 2-3-е место в структуре летальности в стационарах хирургического профиля [6].
В США ежегодно наблюдается не менее двух миллионов больных, перенесших ТЭЛА, в Европе она зарегистрирована более чем у 700 000 пациентов. Однако подобная ситуация характерна не только для западных стран, но и стран Азии, поэтому можно сделать заключение, что ТЭЛА — это проблема мирового здравоохранения [11]. Являясь третьим, наиболее часто встречающимся сердечно-сосудистым заболеванием после ишемической болезни сердца и инфаркта, ТЭЛА служит причиной тяжелых страданий и смертности и рассматривается как одна из главных проблем здавоохранения, а также общих экономических затрат.
В большинстве наблюдений причиной развития ТЭЛА является тромбоз в системе нижней полой вены (HПB). Чаще всего он локализуется в глубоких венах нижних конечностей и магистральных венах таза. По данным разных авторов, до 85% наблюдений ТЭЛА обусловлена острым венозным тромбозом в системе НПВ [4].
Чаще всего он локализуется в глубоких венах нижних конечностей и магистральных венах таза. По данным разных авторов, до 85% наблюдений ТЭЛА обусловлена острым венозным тромбозом в системе НПВ [4].
Тромбоз глубоких вен — распространенное заболевание, ежегодная частота его возникновения составляет 100 на 100 000 населения. По мнению J. Helt [9], тромбоз глубоких вен нижних конечностей ежегодно возникает у 160 человек на 100 000 населения.
Тромбоз глубоких вен нижних конечностей может протекать бессимптомно. Иногда первое и единственное его проявление — массивная ТЭЛА [2].
По данным некоторых авторов, приблизительно 80% всех наблюдений тромбоза глубоких вен протекают бессимптомно и главным его проявлением может быть только ТЭЛА [10].
Анализ большого патологоанатомического материала показал, что у половины как оперированных, так и неоперированных хирургических больных ТЭЛА не была диагностирована при жизни [1], основным источником эмболии был тромбоз в системе НПВ, при этом у большинства больных тромб локализовался в бедренной, подвздошной и нижней полой венах [5]. При тромбозе подвздошно-бедренного сегмента риск ТЭЛА составляет 40-50%, при тромбозе вен голеней — 1-5% [13].
При тромбозе подвздошно-бедренного сегмента риск ТЭЛА составляет 40-50%, при тромбозе вен голеней — 1-5% [13].
Риск развития ТЭЛА остается часто недооцененным клиницистами в связи с бессимптомным течением заболевания [7]. Только у 20% умерших от ТЭЛА больных симптомы заболевания могут быть замечены до летального исхода [6].
Правильная профилактика, ранний диагноз и правильное лечение тромбоза глубоких вен — это эффективное предотвращение ТЭЛА [12, 14].
В связи с недостаточным использованием имеющихся эффективных профилактических методов частота ТЭЛА в течение последних 20 лет остается практически неизменной [2, 6].
Основные задачи лечения при флотирующем тромбе магистральных вен инфраингвинальной зоны предусматривают предотвращение распространения тромбоза и развития ТЭЛА. В качестве базовых терапевтических средств в подобных ситуациях используют прямые антикоагулянты [3, 8].
При наличии противопоказаний к проведению антикоагулянтной терапии, а также тромба в просвете бедренной и подколенной вен с вероятностью фрагментации антикоагулянтная терапия может быть неэффективной и высок риск развития ТЭЛА.
При таких обстоятельствах, когда медикаментозное лечение неэффективно, альтернативой антикоагулянтной терапии, предотвращающей ТЭЛА, остаются хирургические методы.
Цель настоящей работы — определить хирургические методы профилактики ТЭЛА и оценить их эффективность у больных с флотирующими тромбами глубоких вен инфраингвинальной зоны.
Материал и методы
В работе использованы результаты хирургического лечения и обследования 25 больных с флотирующими тромбами глубоких вен инфраингвинальной зоны (в работу не были включены пациенты, получавшие консервативное лечение), находившихся на лечении в отделении хирургии сосудов РНЦХ им. акад. Б.В. Петровского с 2006 по 2010 г. Среди них были 12 (48%) мужчин и 13 (52%) женщин. Средний возраст составил 57±4,6 года. Правая нижняя конечность была поражена у 14 (56%), левая — у 11 (44%) больных.
Все пациенты при поступлении проходили общеклиническое обследование, которое включало обязательное ультразвуковое дуплексное сканирование сосудов бассейна НПВ, при котором оценивали состояние подкожных, глубоких и перфорантных вен обеих нижних конечностей, определяли протяженность тромботического процесса и степень фиксации тромбов к венозной стенке. Ультразвуковое дуплексное сканирование вен нижних конечностей проводили на аппарате Logic 7 фирмы «General Electric» (США) линейным датчиком с частотой 7-14 МГц.
Ультразвуковое дуплексное сканирование вен нижних конечностей проводили на аппарате Logic 7 фирмы «General Electric» (США) линейным датчиком с частотой 7-14 МГц.
По данным дуплексного сканирования локализация тромбов была следующая: в общей бедренной вене (ОБВ) — у 11 (44%), в поверхностной бедренной вене (ПБВ) — у 5 (20%) и в подколенной вене — у 9 (36%) больных.
У 22 (88%) больных флотирующий тромб был 4 см и более и у 3 (12%) пациентов имелся пристеночный тромб. Показанием к хирургическому лечению больных с пристеночным тромбом явился прогрессирующий рост тромба на фоне антикоагулянтной терапии (у 2) и наличие рецидивирующей ТЭЛА (у 1).
Во всех наблюдениях после постановки диагноза в целях профилактики тромбоэмболических осложнений применяли активную хирургическую тактику. Показанием к операции считали следующие состояния:
— наличие флотирующего тромба размером 4 см и более в бедренной и подколенной венах, а также пристеночных тромбов в этих сосудах с эпизодами ТЭЛА;
— прогрессирующий рост флотирующего тромба до 4 см в берцовых венах в проксимальном направлении на фоне адекватного консервативного лечения;
— тромбоз глубоких вен с непрерывно-рецидивирующей ТЭЛА независимо от эмбологенности тромба бедренной, подколенной или берцовых вен;
— противопоказания к антикоагулянтной терапии или невозможность ее проведения.
Оперативное вмешательство выполняли под спинальной анестезией, внутривенным наркозом или местной анестезией. Характер оперативных вмешательств в соответствии с локализацией тромбоза представлен в табл. 1.
У 11 (44%) больных тромб локализовался выше устья глубокой вены бедра, т.е. в ОБВ, что потребовало проведения тромбэктомии флотирующей головки из ОБВ с последующей перевязкой или пликацией ПБВ. Тромбэктомию производили на высоте пробы Вальсальвы.
Результаты и обсуждение
В ближайшем послеоперационном периоде все пациенты отмечали положительную динамику. Осложнений после операции не наблюдалось, распространения тромбоза выше уровня перевязки или пликации не было ни у одного больного. Летальных исходов не отмечено.
Всем больным в послеоперационном периоде проводилась антикоагулянтная терапия: подкожно фраксипарин по 0,3 мл 2 раза в день или клексан по 0,4 мл 1 раз в день на протяжении 5-7 дней с дальнейшим переходом на дезагреганты (аспирин кардио, тромбо АСС) в течение 1 мес и осуществлялась адекватная эластическая компрессия конечности.
После операции у 6 (24%) больных отмечалось незначительное увеличение отека нижней конечности в пределах 1 см, который регрессировал у большинства больных на фоне консервативного лечения.
У большинства пациентов (21, или 84%) на момент выписки из стационара симптомы венозного стаза регрессировали с небольшими остаточными явлениями, характеризующимися невыраженным отеком, усиливающимся в конце дня или после физической нагрузки.
Усиления симптомов нарушения венозного оттока и стойкого сохранения симптомов венозного стаза у пациентов данной группы не было.
У 4 (16%) пациентов в ближайшем послеоперационном периоде наблюдалось стойкое сохранение симптомов венозного стаза, у них глубокая вена бедра была небольшого диаметра, что, возможно, и повлияло на сохранение симптомов заболевания.
У 1 (4%) пациента имела место лимфорея и у 2 (8%) — гематома.
У 1 (4%) пациента наблюдались эпизоды ТЭЛА. Источником эмболии явились пристеночные тромбы глубоких вен.
Ближайшие результаты лечения больных представлены в табл. 2. Срок госпитализации больных составил в среднем 9±3,2 дня.
Полученные нами данные свидетельствуют о том, что больных с клинической картиной тромбоза магистральных вен или подозрением на него следует тщательно обследовать с использованием ультразвукового дуплексного сканирования для верификации диагноза и определения оценки эмбологенности.
Хирургические методы лечения больных с флотирующими тромбами глубоких вен инфраингвинальной зоны эффективны в плане предупреждения и профилактики рецидивов ТЭЛА.
При эмболоопасных тромбах глубоких вен инфраингвинальной зоны использование хирургического метода для профилактики ТЭЛА является эффективным, малотравматичным и сравнительно безопасным.
Таким образом, проведение ультразвукового дуплексного сканирования достаточно для диагностики и определения лечебной тактики у больных с тромбозом глубоких вен инфраингвинальной зоны. Хирургические методы лечения больных с флотирующими тромбами глубоких вен инфраингвинальной зоны являются основополагающими в профилактике ТЭЛА.
повторных инфекций PIDD | AAAAI
Ваша иммунная система постоянно находится под защитой от микробов, которые могут вызвать инфекции. Иногда побеждает «микроб», но в чем разница между случайным проигрышем в битве и повторяющимися инфекциями? Сколько это слишком много?
Вы или ваши дети…
• Вам нужно более четырех курсов лечения антибиотиками в год (для детей) или более двух раз в год (для взрослых)?
• За один год после 4-летнего возраста переболели более чем четырьмя новыми ушными инфекциями.
• Заболевание пневмонией дважды за любое время?
• У вас более трех эпизодов бактериального синусита за год или возникновение хронического синусита?
• Нужны профилактические антибиотики для уменьшения числа инфекций?
• Разрабатывать необычно тяжелые инфекции, которые начинались как обычные бактериальные инфекции?
Если да, то эти рецидивирующие инфекции могут быть признаком иммунодефицитного расстройства.
Иммунная система умна и способна узнавать «лицо» микроба и запоминать его.После того, как ваша иммунная система успешно сразится с этим, большинство людей станут менее восприимчивыми к повторяющимся инфекциям, вызываемым этим микробом.
Иммунодефицит возникает, когда ваше тело не может вырабатывать антитела, которые прикрепляются к микробам и уничтожают их. Вторичные иммунодефициты возникают в результате различных состояний, включая лечение рака, трансплантацию костного мозга и иммуномодулирующие препараты, используемые для лечения различных аутоиммунных состояний.
Первичные иммунодефицитные заболевания (PIDD) включают группу из более чем 250 заболеваний, вызванных дефектами иммунной системы организма.Эти болезни поражают тысячи младенцев, детей и взрослых в Соединенных Штатах.
Большинство PIDD передаются по наследству в наших генах, поэтому они присутствуют при рождении. Тем не менее, они могут проявиться или диагностироваться только в позднем детстве или даже во взрослой жизни. Часто для того, чтобы заподозрить ПИДЗ, требуется время, прежде чем появится картина рецидивирующих инфекций или других симптомов.
Часто для того, чтобы заподозрить ПИДЗ, требуется время, прежде чем появится картина рецидивирующих инфекций или других симптомов.
Если вы считаете, что у вас PIDD, поговорите с аллергологом / иммунологом, педиатром или терапевтом, прошедшим от двух до трех лет дополнительного обучения по вопросам лечения аллергии, астмы и иммунодефицитов.Некоторые PIDD могут имитировать другие состояния, включая аллергию, астму или экзему, и наоборот, поэтому оценка аллергологом / иммунологом чрезвычайно полезна для постановки диагноза и разработки эффективного плана лечения.
Наиболее распространенные формы иммунодефицита часто лечат инфузиями антител, называемых внутривенными иммуноглобулинами (ВВИГ). ВВИГ заменяет антитела, которые ваше тело не может вырабатывать.
Знаете ли вы?
• Первые линии защиты от инфекции — это ваша кожа и мембраны, выстилающие дыхательную и пищеварительную системы.
• Если у вас круглогодичная аллергия на пылевых клещей, пыльцу и плесень, у вас могут быть некоторые повреждения слизистых оболочек, что увеличивает вероятность заражения.
В точку
Люди с иммунодефицитом заражаются такими же инфекциями, как и другие люди, уха, синуситом и пневмонией. Разница в том, что их инфекции возникают чаще, часто более серьезны и имеют больший риск осложнений.
Дополнительная информация о PIDD.
Podcats: Дети с рецидивирующими инфекциями: что нормально и когда беспокоиться
В этом выпуске Вивиан Эрнандес-Трухильо, доктор медицины, FAAAAI, дает учебник по оценке детей, которые кажутся больными больше, чем средний ребенок. Внимание, спойлер: прежде чем даже думать о тестировании, необходимо рассмотреть подробную историю болезни, сопутствующие заболевания и факторы окружающей среды, а также широкий спектр дифференциальной диагностики. Также подробно рассматривается тестирование, особенно то, какие типы тестов следует учитывать.
Щелкните здесь, чтобы прослушать подкаст.
Прочтите стенограмму разговора.
Эта статья была отрецензирована Эндрю Муром, MD, FAAAAI
Проверено: 28. 09.20
09.20
Определение, симптомы, причины и лечение
Что такое воспаление?
Воспаление — это процесс борьбы вашего тела с вещами, которые причиняют ему вред, такими как инфекции, травмы и токсины, в попытке излечить себя.Когда что-то повреждает ваши клетки, ваше тело выделяет химические вещества, которые вызывают реакцию вашей иммунной системы.
Этот ответ включает высвобождение антител и белков, а также усиление кровотока к поврежденному участку. Весь процесс обычно длится несколько часов или дней в случае острого воспаления.
Хроническое воспаление возникает, когда эта реакция задерживается, оставляя ваше тело в постоянном состоянии тревоги. Со временем хроническое воспаление может негативно сказаться на ваших тканях и органах.Некоторые исследования показывают, что хроническое воспаление также может играть роль в ряде состояний, от рака до астмы.
Читайте дальше, чтобы узнать больше о хроническом воспалении, включая общие причины и продукты, которые с ним борются.
Острое воспаление часто вызывает заметные симптомы, такие как боль, покраснение или отек. Но симптомы хронического воспаления обычно менее заметны. Это позволяет их легко не заметить.
Общие симптомы хронического воспаления включают:
- усталость
- лихорадку
- язвы во рту
- высыпания
- боль в животе
- боль в груди
Эти симптомы могут варьироваться от легких до тяжелых и продолжаться в течение нескольких месяцев или лет.
Несколько вещей могут вызвать хроническое воспаление, в том числе:
- невылеченные причины острого воспаления, такие как инфекция или травма
- аутоиммунное заболевание, при котором ваша иммунная система ошибочно атакует здоровые ткани
- длительное воздействие раздражителей, например, промышленные химикаты или загрязненный воздух
Имейте в виду, что они не у всех вызывают хроническое воспаление. Кроме того, в некоторых случаях хронического воспаления нет явной первопричины.
Эксперты также считают, что ряд факторов также может способствовать хроническому воспалению, например:
Когда у вас хроническое воспаление, воспалительная реакция вашего организма может в конечном итоге привести к повреждению здоровых клеток, тканей и органов. Со временем это может привести к повреждению ДНК, отмиранию тканей и внутреннему рубцеванию.
Все это связано с развитием нескольких заболеваний, в том числе:
Воспаление — естественная часть процесса заживления. Но когда болезнь переходит в хроническую, важно взять ее под контроль, чтобы снизить риск долгосрочного ущерба.Некоторые из вариантов, которые были изучены для управления воспалением, включают:
- Нестероидные противовоспалительные препараты (НПВП). НПВП, отпускаемые без рецепта, такие как аспирин, ибупрофен (Адвил) и напроксен (Алив), эффективно уменьшают воспаление и боль. Но длительное употребление связано с повышенным риском нескольких состояний, включая язвенную болезнь и заболевание почек.

- Стероиды. Кортикостероиды — это разновидность стероидных гормонов. Они уменьшают воспаление и подавляют иммунную систему, что полезно, когда она начинает атаковать здоровые ткани.Но длительный прием кортикостероидов может привести к проблемам со зрением, высокому кровяному давлению и остеопорозу. При назначении кортикостероидов ваш врач взвесит с вами преимущества и риски.
- Дополнения. Некоторые добавки могут помочь уменьшить воспаление. Рыбий жир, липоевая кислота и куркумин уменьшают воспаление, связанное с заболеваниями, включая рак и болезни сердца. Некоторые специи, в том числе имбирь, чеснок и кайенский перец, также могут помочь при хронических воспалениях и воспалительных заболеваниях.Узнайте больше о специях, которые борются с воспалениями.
То, что вы едите, может играть как положительную, так и отрицательную роль в лечении хронического воспаления.
Продукты питания
Разнообразные продукты питания обладают противовоспалительными свойствами. К ним относятся продукты с высоким содержанием антиоксидантов и полифенолов, такие как:
К ним относятся продукты с высоким содержанием антиоксидантов и полифенолов, такие как:
- оливковое масло
- листовая зелень, такая как капуста и шпинат
- помидоры
- жирная рыба, такая как лосось, сардины и скумбрия
- орехи
- фрукты, особенно вишня, черника и апельсины
Если вы хотите переосмыслить свои привычки в еде, подумайте о средиземноморской диете.Исследование 2018 года показало, что участники, соблюдающие эту диету, имели более низкие маркеры воспаления. Это добавляет преимуществ для здоровья, обнаруженных в других исследованиях средиземноморской диеты.
Хотите попробовать? Ознакомьтесь с нашим руководством по средиземноморской диете для новичков.
Продукты, которых следует избегать
Следующие продукты могут усилить воспаление у некоторых людей:
- рафинированные углеводы, такие как белый хлеб и выпечка
- жареные продукты, такие как картофель фри
- красное мясо
- обработанное мясо, например горячее собаки и колбаса
Если вы пытаетесь уменьшить воспаление, постарайтесь уменьшить потребление этих продуктов. Не обязательно полностью их устранять, но старайтесь есть их только изредка. Узнайте больше о воспалительных продуктах.
Не обязательно полностью их устранять, но старайтесь есть их только изредка. Узнайте больше о воспалительных продуктах.
Хроническое воспаление увеличивает риск нескольких серьезных заболеваний. Ваш врач может диагностировать воспаление с помощью анализов крови. Лекарства, пищевые добавки и соблюдение противовоспалительной диеты могут помочь вам снизить риск воспаления. Отказ от курения и алкоголя и поддержание здорового веса тела также могут помочь снизить риск и снизить уровень стресса.
Определение, симптомы, причины и лечение
Что такое воспаление?
Воспаление — это процесс борьбы вашего тела с вещами, которые причиняют ему вред, такими как инфекции, травмы и токсины, в попытке излечить себя. Когда что-то повреждает ваши клетки, ваше тело выделяет химические вещества, которые вызывают реакцию вашей иммунной системы.
Этот ответ включает высвобождение антител и белков, а также усиление кровотока к поврежденному участку.Весь процесс обычно длится несколько часов или дней в случае острого воспаления.
Хроническое воспаление возникает, когда эта реакция задерживается, оставляя ваше тело в постоянном состоянии тревоги. Со временем хроническое воспаление может негативно сказаться на ваших тканях и органах. Некоторые исследования показывают, что хроническое воспаление также может играть роль в ряде состояний, от рака до астмы.
Читайте дальше, чтобы узнать больше о хроническом воспалении, включая общие причины и продукты, которые с ним борются.
Острое воспаление часто вызывает заметные симптомы, такие как боль, покраснение или отек. Но симптомы хронического воспаления обычно менее заметны. Это позволяет их легко не заметить.
Общие симптомы хронического воспаления включают:
- усталость
- лихорадку
- язвы во рту
- высыпания
- боль в животе
- боль в груди
Эти симптомы могут варьироваться от легких до тяжелых и продолжаться в течение нескольких месяцев или лет.
Несколько вещей могут вызвать хроническое воспаление, в том числе:
- невылеченные причины острого воспаления, такие как инфекция или травма
- аутоиммунное заболевание, при котором ваша иммунная система ошибочно атакует здоровые ткани
- длительное воздействие раздражителей, например, промышленные химикаты или загрязненный воздух
Имейте в виду, что они не у всех вызывают хроническое воспаление. Кроме того, в некоторых случаях хронического воспаления нет явной первопричины.
Кроме того, в некоторых случаях хронического воспаления нет явной первопричины.
Эксперты также считают, что ряд факторов также может способствовать хроническому воспалению, например:
Когда у вас хроническое воспаление, воспалительная реакция вашего организма может в конечном итоге привести к повреждению здоровых клеток, тканей и органов. Со временем это может привести к повреждению ДНК, отмиранию тканей и внутреннему рубцеванию.
Все это связано с развитием нескольких заболеваний, в том числе:
Воспаление — естественная часть процесса заживления.Но когда болезнь переходит в хроническую, важно взять ее под контроль, чтобы снизить риск долгосрочного ущерба. Некоторые из вариантов, которые были изучены для управления воспалением, включают:
- Нестероидные противовоспалительные препараты (НПВП). НПВП, отпускаемые без рецепта, такие как аспирин, ибупрофен (Адвил) и напроксен (Алив), эффективно уменьшают воспаление и боль. Но длительное употребление связано с повышенным риском нескольких состояний, включая язвенную болезнь и заболевание почек.

- Стероиды. Кортикостероиды — это разновидность стероидных гормонов. Они уменьшают воспаление и подавляют иммунную систему, что полезно, когда она начинает атаковать здоровые ткани. Но длительный прием кортикостероидов может привести к проблемам со зрением, высокому кровяному давлению и остеопорозу. При назначении кортикостероидов ваш врач взвесит с вами преимущества и риски.
- Дополнения. Некоторые добавки могут помочь уменьшить воспаление. Рыбий жир, липоевая кислота и куркумин уменьшают воспаление, связанное с заболеваниями, включая рак и болезни сердца.Некоторые специи, в том числе имбирь, чеснок и кайенский перец, также могут помочь при хронических воспалениях и воспалительных заболеваниях. Узнайте больше о специях, которые борются с воспалениями.
То, что вы едите, может играть как положительную, так и отрицательную роль в лечении хронического воспаления.
Продукты питания
Разнообразные продукты питания обладают противовоспалительными свойствами. К ним относятся продукты с высоким содержанием антиоксидантов и полифенолов, такие как:
К ним относятся продукты с высоким содержанием антиоксидантов и полифенолов, такие как:
- оливковое масло
- листовая зелень, такая как капуста и шпинат
- помидоры
- жирная рыба, такая как лосось, сардины и скумбрия
- орехи
- фрукты, особенно вишня, черника и апельсины
Если вы хотите переосмыслить свои привычки в еде, подумайте о средиземноморской диете.Исследование 2018 года показало, что участники, соблюдающие эту диету, имели более низкие маркеры воспаления. Это добавляет преимуществ для здоровья, обнаруженных в других исследованиях средиземноморской диеты.
Хотите попробовать? Ознакомьтесь с нашим руководством по средиземноморской диете для новичков.
Продукты, которых следует избегать
Следующие продукты могут усилить воспаление у некоторых людей:
- рафинированные углеводы, такие как белый хлеб и выпечка
- жареные продукты, такие как картофель фри
- красное мясо
- обработанное мясо, например горячее собаки и колбаса
Если вы пытаетесь уменьшить воспаление, постарайтесь уменьшить потребление этих продуктов. Не обязательно полностью их устранять, но старайтесь есть их только изредка. Узнайте больше о воспалительных продуктах.
Не обязательно полностью их устранять, но старайтесь есть их только изредка. Узнайте больше о воспалительных продуктах.
Хроническое воспаление увеличивает риск нескольких серьезных заболеваний. Ваш врач может диагностировать воспаление с помощью анализов крови. Лекарства, пищевые добавки и соблюдение противовоспалительной диеты могут помочь вам снизить риск воспаления. Отказ от курения и алкоголя и поддержание здорового веса тела также могут помочь снизить риск и снизить уровень стресса.
Причины хронической боли
Обзор
Каждый человек время от времени испытывает боли. Фактически, внезапная боль — важная реакция нервной системы, которая помогает предупредить вас о возможных травмах. Когда происходит травма, болевые сигналы проходят от травмированной области вверх по спинному мозгу и к головному мозгу.
Боль обычно уменьшается по мере заживления травмы. Однако хроническая боль отличается от типичной боли. При хронической боли ваше тело продолжает посылать болевые сигналы в мозг даже после заживления травмы. Это может длиться от нескольких недель до лет. Хроническая боль может ограничить вашу подвижность и снизить гибкость, силу и выносливость. Это может затруднить выполнение повседневных задач и занятий.
Это может длиться от нескольких недель до лет. Хроническая боль может ограничить вашу подвижность и снизить гибкость, силу и выносливость. Это может затруднить выполнение повседневных задач и занятий.
Хроническая боль — это боль, которая длится не менее 12 недель. Боль может ощущаться острой или тупой, вызывая жжение или боль в пораженных участках. Он может быть постоянным или прерывистым, приходить и уходить без видимой причины. Хроническая боль может возникать практически в любой части тела.Боль может ощущаться по-разному в разных пораженных участках.
К наиболее распространенным типам хронической боли относятся:
- головная боль
- послеоперационная боль
- посттравматическая боль
- боль в пояснице
- боль при раке
- боль при артрите
- нейрогенная боль (боль, вызванная повреждением нерва )
- психогенная боль (боль, не вызванная болезнью, травмой или повреждением нервов)
По данным Американской академии медицины боли, более 1. 5 миллиардов человек во всем мире страдают хронической болью. Это наиболее частая причина длительной инвалидности в Соединенных Штатах, от которой страдают около 100 миллионов американцев.
5 миллиардов человек во всем мире страдают хронической болью. Это наиболее частая причина длительной инвалидности в Соединенных Штатах, от которой страдают около 100 миллионов американцев.
Хроническая боль обычно вызвана первоначальной травмой, например растяжением спины или растяжением мышц. Считается, что хроническая боль возникает после повреждения нервов. Повреждение нерва делает боль более интенсивной и продолжительной. В этих случаях лечение основной травмы может не избавить от хронической боли.
Однако в некоторых случаях люди испытывают хроническую боль без каких-либо предшествующих травм.Точные причины хронической боли без травм не совсем понятны. Боль иногда может быть результатом основного состояния здоровья, например:
Хроническая боль может поражать людей любого возраста, но чаще всего встречается у пожилых людей. Помимо возраста, к другим факторам, которые могут увеличить риск развития хронической боли, относятся:
- травма
- операция
- женщина
- избыточный вес или ожирение
Основная цель лечения — уменьшить боль и повысить мобильность.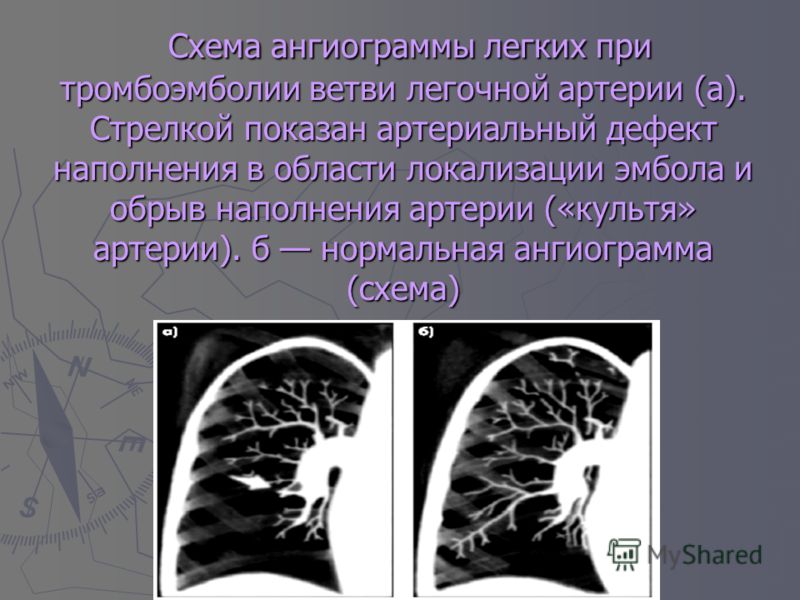 Это поможет вам вернуться к повседневной деятельности без дискомфорта.
Это поможет вам вернуться к повседневной деятельности без дискомфорта.
Степень и частота хронической боли могут различаться у разных людей. Таким образом, врачи составляют планы лечения боли, индивидуальные для каждого человека. Ваш план обезболивания будет зависеть от ваших симптомов и любых основных состояний здоровья. Для лечения хронической боли могут использоваться медицинские методы лечения, средства защиты от образа жизни или комбинация этих методов.
Лекарства от хронической боли
Доступны несколько типов лекарств, которые могут помочь в лечении хронической боли.Вот несколько примеров:
- безрецептурных обезболивающих, включая парацетамол (тайленол) или нестероидные противовоспалительные препараты (НПВП), такие как аспирин (буферин) или ибупрофен (адвил).
- опиоидные болеутоляющие средства, включая морфин (MS Contin), кодеин и гидрокодон (Tussigon)
- адъювантные анальгетики, такие как антидепрессанты и противосудорожные средства
Медицинские процедуры при хронической боли
Некоторые медицинские процедуры также могут облегчить хроническую боль . Примером некоторых из них являются:
Примером некоторых из них являются:
- электрическая стимуляция, которая уменьшает боль, посылая легкие электрические разряды в ваши мышцы
- нервный блок, который представляет собой инъекцию, которая не позволяет нервам посылать болевые сигналы в ваш мозг
- иглоукалывание, которое включает легкую прокалывание кожи иглами для облегчения боли
- Операция, направленная на исправление травм, которые, возможно, зажили неправильно и которые могут способствовать возникновению боли
Образ жизни средств от хронической боли
Кроме того, существуют различные средства, облегчающие образ жизни, чтобы помочь облегчить хроническую боль .Примеры включают:
- физиотерапия
- тай-чи
- йога
- искусство и музыкальная терапия
- петотерапия
- психотерапия
- массаж
- медитация
Нет лекарства от хронической боли, но есть состояние можно успешно управлять. Чтобы облегчить симптомы, важно придерживаться плана обезболивания.
Физическая боль связана с эмоциональной болью, поэтому хроническая боль может повысить уровень стресса.Развитие эмоциональных навыков поможет вам справиться со стрессом, связанным с вашим состоянием. Вот несколько шагов, которые вы можете предпринять, чтобы уменьшить стресс:
Позаботьтесь о своем теле: Правильное питание, достаточное количество сна и регулярные упражнения могут сохранить ваше тело здоровым и уменьшить чувство стресса.
Продолжайте участвовать в повседневных делах: Вы можете улучшить свое настроение и уменьшить стресс, участвуя в занятиях, которые вам нравятся, и общаясь с друзьями.Хроническая боль может затруднить выполнение определенных задач. Но изоляция может дать вам более негативное отношение к своему состоянию и повысить вашу чувствительность к боли.
Обратитесь за поддержкой: Друзья, семья и группы поддержки могут протянуть вам руку помощи и утешить в трудные времена. Если у вас проблемы с повседневными задачами или вы просто нуждаетесь в эмоциональном подъеме, близкий друг или любимый человек может оказать вам необходимую поддержку.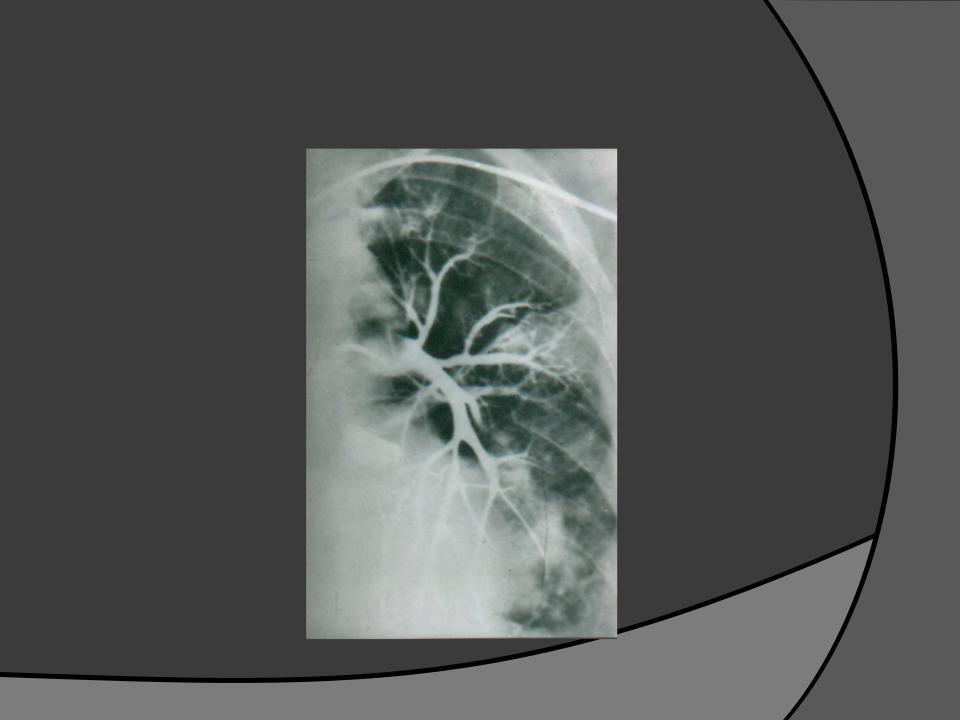
Для получения дополнительной информации и ресурсов посетите веб-сайт Американской ассоциации хронической боли theacpa.орг.
Как справиться с рецидивом рака | Cancer.Net
Рецидив возникает, когда рак возвращается после лечения. Это может произойти через несколько недель, месяцев или даже лет после лечения первичного или исходного рака. Ваш врач не может знать наверняка, повторится ли рак. Вероятность рецидива зависит от типа первичного рака. Ваш врач может предоставить вам дополнительную информацию о вашем риске рецидива.
Почему и как рецидив рака
Рак рецидивирует, потому что небольшие участки раковых клеток могут оставаться в организме после лечения.Со временем эти клетки могут размножаться и становиться достаточно большими, чтобы вызывать симптомы или проводить тесты для их обнаружения. Когда и где возникает рецидив рака, зависит от типа рака. Некоторые виды рака имеют ожидаемую закономерность рецидивов. Рак может рецидивировать следующими способами:
В той же части тела, что и первичный рак, называемый местным рецидивом
Рядом с местом локализации первичного рака, так называемый региональный рецидив
В другой части тела, называемой отдаленным рецидивом
Рецидивирующий рак назван в честь места, где начался первичный рак, даже если он рецидивирует в другой части тела. Например, если рак груди рецидивирует дистанционно в печени, он по-прежнему называется раком груди, а не раком печени. Врачи называют это метастатическим раком груди. Метастатический означает, что рак распространился на другую часть тела.
Например, если рак груди рецидивирует дистанционно в печени, он по-прежнему называется раком груди, а не раком печени. Врачи называют это метастатическим раком груди. Метастатический означает, что рак распространился на другую часть тела.
Диагностика рецидива рака
После лечения от первичного рака вы получите план последующего лечения. Этот план включает график посещений врача, тщательного медицинского осмотра и, возможно, других анализов. Эти посещения и анализы важны для того, чтобы убедиться, что вы здоровы, и следить за рецидивом.В зависимости от типа рака вам могут потребоваться анализы крови или сканирование изображений. Но в большинстве случаев единственным последующим уходом будет тщательный осмотр и беседа. Ваш врач может посоветовать вам следить за конкретными признаками или симптомами рецидива.
Если есть подозрение на рецидив рака, вам, вероятно, потребуются другие диагностические тесты, чтобы узнать больше. Эти тесты могут включать лабораторные тесты, визуализационные исследования или биопсию.
Выбор метода лечения рецидива рака
Если тестирование подтвердит, что у вас рецидив рака, ваша медицинская бригада обсудит с вами варианты лечения.Этот процесс похож на планирование лечения первичного рака. Ваш врач учтет следующие факторы:
Ваши личные цели лечения
Тип рака, при котором в организме он вернулся, и размер
Ваше общее состояние здоровья
Тип лечения, который вы изначально получали, и насколько хорошо оно помогло
Побочные эффекты, которые вы испытали при использовании оригинального лечения
Сколько времени прошло с момента окончания обработки
Ваш врач может также предложить клиническое испытание.При выборе лечения важно учитывать следующее:
Цели и ожидаемые преимущества каждого лечения
Возможные риски и побочные эффекты
Как каждое лечение может повлиять на качество вашей жизни
Во время лечения облегчение симптомов и побочных эффектов остается важной частью вашего ухода. Это также может называться паллиативной или поддерживающей терапией. Поговорите со своим лечащим врачом о своих симптомах, включая любые новые симптомы или изменение симптомов.
Это также может называться паллиативной или поддерживающей терапией. Поговорите со своим лечащим врачом о своих симптомах, включая любые новые симптомы или изменение симптомов.
Как справиться с рецидивирующим раком
Вы можете испытать во многом те же чувства, что и при первом диагнозе рака. Шок, неверие, беспокойство, страх, гнев, горе и чувство потери контроля — обычные эмоции. Все эти чувства — нормальная реакция на этот тяжелый опыт. Некоторых людей этот диагноз может даже расстроить больше, чем первый.
Многие люди с рецидивирующим раком также испытывают неуверенность в своих первоначальных решениях или выборе лечения после лечения.Помните, что вы и ваша медицинская бригада основывали свой выбор лечения на информации, доступной на тот момент. Ни вы, ни ваша медицинская бригада не можете предсказать будущее.
Понятно, что вы можете беспокоиться о том, что у вас хватит сил выдержать еще один раунд тестов и лечения. Но многие люди обнаруживают, что предыдущий опыт лучше готовит их к решению проблем. Например, у людей с рецидивирующим раком есть следующие ресурсы:
Например, у людей с рецидивирующим раком есть следующие ресурсы:
Знания о раке, которые помогают уменьшить страх и беспокойство, связанные с неизвестностью
Предыдущие отношения с врачами, медсестрами и персоналом клиники или больницы
Понимание медицинской системы, общеупотребительных слов и медицинского страхования
Знания о методах лечения рака и их побочных эффектах, а также о стратегиях борьбы с побочными эффектами
Куда обращаться за поддержкой, включая семью и друзей, группы поддержки и профессионалов, обученных оказанию эмоциональной поддержки
Опыт применения методов снижения стресса, таких как упражнения, медитация или времяпрепровождение с друзьями
Переживание эмоционального стресса после постановки диагноза рецидива рака — это нормально.Но обратитесь за профессиональной помощью, если стресс длится долго и мешает вам выполнять повседневные дела. Консультации могут помочь вам несколькими способами, в том числе:
Консультации могут помочь вам несколькими способами, в том числе:
Изучение способов справиться с трудными чувствами
Управление симптомами рака и побочными эффектами лечения
Изучение значения вашего опыта рака
Это также может быть подходящее время, чтобы подумать о том, чтобы присоединиться к личной группе поддержки или онлайн-сообществу, чтобы поделиться своими чувствами и опытом с другими в той же ситуации.
Связанные ресурсы
Принятие решений о лечении рака
Как справиться с метастатическим раком
Что такое второй рак?
Онкологические онлайн-сообщества и вы: 4 вопроса, которые стоит задать
Понимание затрат, связанных с лечением рака
Синдром хронической боли: симптомы, причины, диагностика, лечение
Боль — это нормальная реакция вашего организма на травму или болезнь, предупреждение о том, что что-то не так. Когда ваше тело заживает, вы обычно перестаете болеть.
Но у многих людей боль продолжается еще долго после того, как ее причина исчезла. Когда она длится от 3 до 6 месяцев и более, это называется хронической болью. Когда вы изо дня в день болеете, это может сказаться на вашем эмоциональном и физическом здоровье.
Около 25% людей с хронической болью будут иметь состояние, называемое хроническим болевым синдромом (ХБС). Именно тогда у людей появляются симптомы, помимо боли, такие как депрессия и беспокойство, которые мешают их повседневной жизни.
CPS может быть трудно лечить, но это возможно.Сочетание таких методов лечения, как консультирование, физиотерапия и релаксация, может помочь облегчить вашу боль и другие симптомы, которые с ней связаны.
Что вызывает хронический болевой синдром?
Врачи точно не знают, что вызывает CPS. Часто это начинается с травмы или болезненного состояния, например:
Продолжение
CPS имеет как физические, так и психические корни. Некоторые эксперты считают, что у людей с этим заболеванием проблемы с системой нервов и желез, которые организм использует для борьбы со стрессом.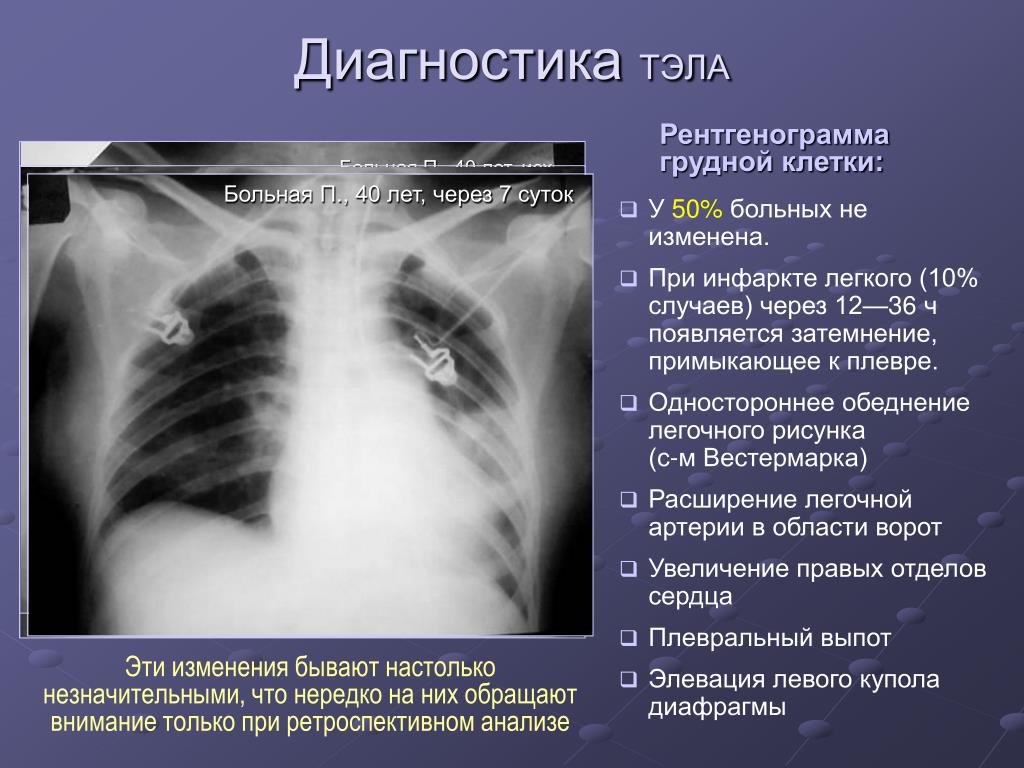 Это заставляет их по-другому чувствовать боль.
Это заставляет их по-другому чувствовать боль.
Другие эксперты говорят, что CPS — это выученный ответ. Когда вам больно, вы можете начать повторять некоторые плохие поступки даже после того, как боль утихнет или уменьшится.
CPS может поражать людей любого возраста и обоих полов, но чаще всего встречается у женщин. Люди с большой депрессией и другими психическими расстройствами более склонны к CPS.
Симптомы
CPS со временем влияет на ваше физическое здоровье, ваши эмоции и даже вашу социальную жизнь.Боль может приводить к другим симптомам, например:
Некоторым людям с CPS необходимо принимать все больше и больше лекарств, чтобы справиться с болью, что может сделать их зависимыми от этих препаратов.
Получение диагноза
Ваш врач спросит вас о любых заболеваниях или травмах, которые могли вызвать боль. Они также зададут другие вопросы, чтобы узнать больше о типе боли, которую вы чувствуете, и о том, как долго вы ее испытывали:
- Когда началась боль?
- Где на теле болит?
- На что похожа боль? Это пульсирующая, колющая, стреляющая, острая, щипающая, жалящая, жгучая и т.
 Д.?
Д.? - Насколько сильна ваша боль по шкале от 1 до 10?
- Что, кажется, усиливает или усиливает боль?
- Облегчило ли это лечение?
Визуализирующие тесты могут показать, есть ли у вас повреждение суставов или другие проблемы, вызывающие боль:
- КТ или компьютерная томография. Это мощный рентгеновский снимок, который делает детальные снимки внутри вашего тела.
- МРТ или магнитно-резонансная томография. Он использует магниты и радиоволны для создания изображений внутренних органов и структур.
- Рентген. Он использует радиацию в малых дозах для создания изображений структур вашего тела.
Лечение
Для снятия боли вы можете посетить:
- Ваш основной лечащий врач
- Специалист по заболеванию, которое вызывает вашу боль — например, ревматолог для лечения артрита
- Клиника боли или center
Ваш врач подберет терапию в зависимости от источника вашей боли. Вы можете получить одно или несколько из следующих методов лечения:
Вы можете получить одно или несколько из следующих методов лечения:
Когда обращаться к врачу по поводу боли
Некоторая боль может быть нормальной, особенно если вы недавно перенесли травму, болезнь или операцию.Позвоните своему врачу, если боль сильная, не прекращается или мешает вам заниматься повседневными делами.
Что такое острое и хроническое воспаление
Правильный вид воспаления важен для системы исцеления вашего тела. Но хроническое воспаление может быть проблемой.Поговорка «слишком много хорошего» применима к большей части жизни, но особенно к воспалениям.
«Люди думают, что воспаление нужно устранять постоянно, но оно играет важную роль в заживлении и восстановлении травм, чтобы ваше тело оставалось в безопасности и здоровом», — говорит доктор.Роберт Х. Шмерлинг, медицинский редактор журнала Understanding Inflampting из Harvard Health Publishing и адъюнкт-профессор медицины в Гарвардской медицинской школе. «Некоторое воспаление — это хорошо. Слишком много — часто плохо. Цель состоит в том, чтобы распознать, когда воспаление просто выполняет свою работу, а когда оно потенциально может вызвать проблемы».
«Некоторое воспаление — это хорошо. Слишком много — часто плохо. Цель состоит в том, чтобы распознать, когда воспаление просто выполняет свою работу, а когда оно потенциально может вызвать проблемы».
Признаки возгорания похожи на свет двигателя на приборной панели автомобиля. Он говорит вам, что что-то не так. Но ваш ответ — не вынимать лампочку, потому что проблема не в этом.Вместо этого вы смотрите на то, что заставило свет включиться. «То же самое и с воспалением», — говорит доктор Шмерлинг. «Это говорит вам о том, что происходит нечто большее, требующее внимания».
Острая и хроническая
Есть два типа воспаления: острое и хроническое. Людям больше всего знакомо острое воспаление. Это покраснение, тепло, отек и боль вокруг тканей и суставов, возникающие в ответ на травму, например, когда вы порезаетесь. Когда тело травмировано, ваша иммунная система высвобождает белые кровяные тельца, которые окружают и защищают эту область.
«Острое воспаление — это то, как ваше тело борется с инфекциями и помогает ускорить процесс заживления», — говорит доктор Шмерлинг. «Таким образом, воспаление — это хорошо, потому что оно защищает тело». Этот процесс работает так же, если у вас есть вирус, такой как простуда или грипп.
«Таким образом, воспаление — это хорошо, потому что оно защищает тело». Этот процесс работает так же, если у вас есть вирус, такой как простуда или грипп.
Напротив, когда воспаление становится слишком сильным и сохраняется в течение длительного времени, а иммунная система продолжает вырабатывать лейкоциты и химические вещества, которые продлевают процесс, это называется хроническим воспалением.«С точки зрения организма, он постоянно подвергается атакам, поэтому иммунная система продолжает бороться бесконечно», — говорит доктор Шмерлинг.
Когда это происходит, белые кровяные тельца могут атаковать близлежащие здоровые ткани и органы. Например, если у вас избыточный вес и у вас больше висцеральных жировых клеток — глубокого типа жира, окружающего ваши органы, — иммунная система может рассматривать эти клетки как угрозу и атаковать их с помощью белых кровяных телец. Чем дольше у вас избыточный вес, тем дольше ваше тело может оставаться в состоянии воспаления.
Исследования показали, что хроническое воспаление связано с сердечными заболеваниями, диабетом, раком, артритом и заболеваниями кишечника, такими как болезнь Крона и язвенный колит.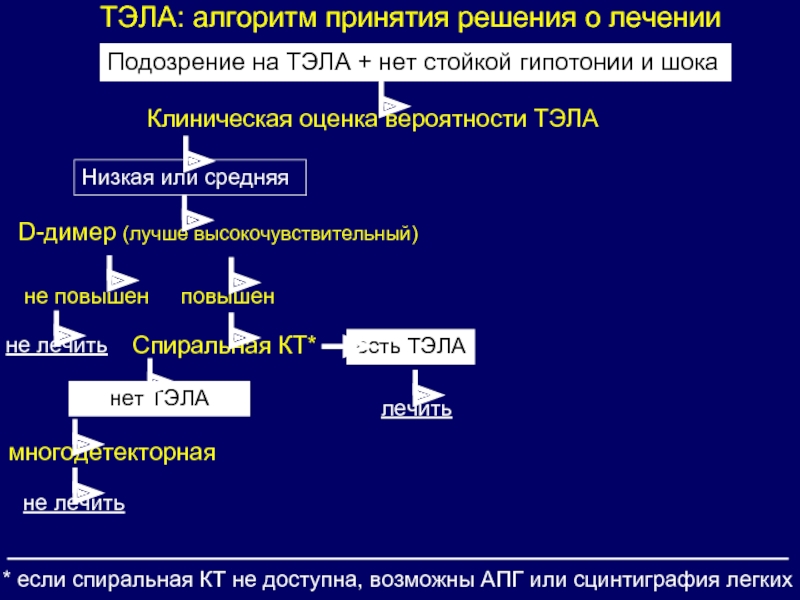
Тем не менее, поскольку хроническое воспаление может продолжаться долгое время, определить его точное влияние непросто. «Это сценарий с курицей и яйцом», — говорит доктор Шмерлинг. «Увеличивает ли хроническое воспаление риск этих заболеваний или это побочный продукт? Это не всегда ясно».
Внести изменения в образ жизниВот еще несколько шагов, которые вы можете предпринять для предотвращения и уменьшения хронического воспаления:
|
Когда волноваться
«В большинстве случаев вам не нужно слишком беспокоиться об остром воспалении», — говорит д-р. Шмерлинг. Вы можете принять безрецептурное обезболивающее, чтобы облегчить симптомы, или приложите холодные компрессы, чтобы уменьшить отек. «В противном случае, как правило, лучше позволить воспалению сделать свою работу, чтобы помочь в заживлении», — говорит доктор Шмерлинг.
Шмерлинг. Вы можете принять безрецептурное обезболивающее, чтобы облегчить симптомы, или приложите холодные компрессы, чтобы уменьшить отек. «В противном случае, как правило, лучше позволить воспалению сделать свою работу, чтобы помочь в заживлении», — говорит доктор Шмерлинг.
Конечно, причина острого воспаления может нуждаться в лечении. Например, бактериальная инфекция может потребовать приема антибиотиков, поэтому, если у вас жар или серьезные симптомы, такие как сильная боль или одышка, обратитесь к врачу.
С хроническим воспалением бороться сложнее.Проблема в том, что хроническое воспаление часто «невидимо», поскольку оно не проявляет явных физических признаков, как при остром воспалении.
Итак, как можно предотвратить или уменьшить воспаление, которое вы не можете видеть или чувствовать?
Единственный способ обнаружить хроническое воспаление — это пройти обследование у врача. Он или она рассмотрит ваши симптомы, проведет физический осмотр и, возможно, проверит вашу кровь на наличие признаков воспаления. (См. «Тест на воспаление».)
(См. «Тест на воспаление».)
В противном случае лучший подход — предотвратить состояния, связанные с хроническим воспалением.«Это восходит к основам: поддержание здорового веса, выбор хорошей диеты, много сна и регулярные упражнения», — говорит доктор Шмерлинг.
Тест на воспалениеКак узнать, есть ли у вас хроническое воспаление? Анализ крови измеряет белок, вырабатываемый печенью, С-реактивный белок (СРБ), который повышается в ответ на воспаление. Уровень CRP от 1 до 3 миллиграммов на литр крови часто свидетельствует о низком, но хроническом уровне воспаления.Скорость оседания эритроцитов — еще один анализ крови на воспаление. Он используется для людей с воспалительными заболеваниями, такими как ревматоидный артрит. |
Правильно питайтесь, больше двигайтесь
Диета и упражнения особенно сильно влияют на лечение хронического воспаления, поскольку они также могут помочь контролировать вес и улучшить сон.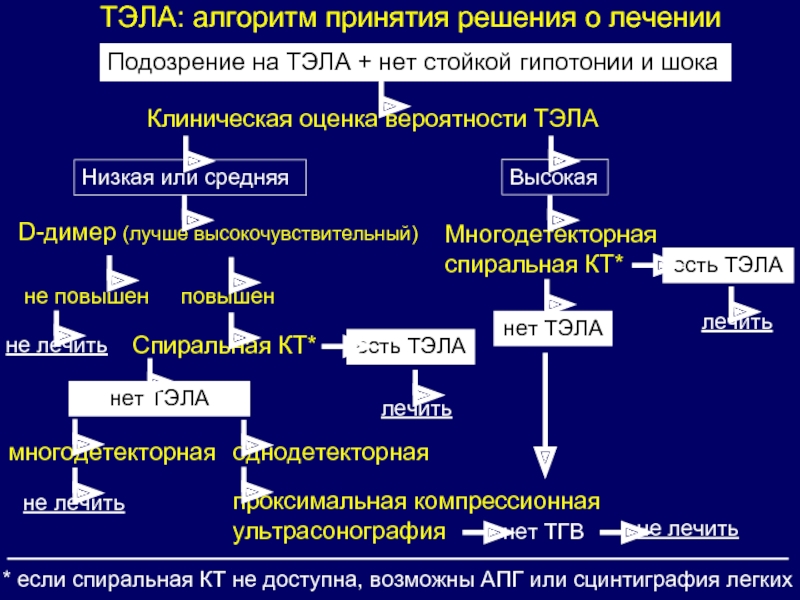
Доказательства того, что конкретный тип диеты может предотвратить хроническое воспаление, неясны. Однако некоторые продукты связаны либо со стимулированием, либо с подавлением воспалительной реакции.Эти продукты также связаны с более низким риском проблем, связанных с хроническим воспалением, таких как болезни сердца, увеличение веса и рак.
Например, сократите или исключите продукты с высоким содержанием простых сахаров, такие как газированные напитки, фруктовые соки с добавлением сахара, спортивные напитки, обработанное мясо и рафинированные углеводы, такие как белый хлеб и макаронные изделия. «Эти продукты могут поднять уровень сахара в крови, что может привести к перееданию и увеличению веса», — говорит доктор Шмерлинг.
Кроме того, ешьте больше продуктов с высоким содержанием антиоксидантов, известных как полифенолы, которые могут уменьшить воспаление.Примеры включают все виды ягод, вишни, сливы, красного винограда, лука, куркумы, зеленого чая и темно-зеленых листовых овощей, таких как шпинат и капуста.
Регулярные упражнения могут помочь защитить от состояний, связанных с хроническим воспалением, особенно от болезней сердца и ожирения. Исследование, проведенное в 2017 году в исследовании Brain, Behavior and Immunity , показало, что всего 20 минут упражнений средней интенсивности (в данном случае ходьба на беговой дорожке) могут иметь противовоспалительный эффект.
Изображение: © Mingirov / Getty Images
Поделиться страницей:
Заявление об ограничении ответственности:
В качестве услуги для наших читателей Harvard Health Publishing предоставляет доступ к нашей библиотеке заархивированного содержимого.Обратите внимание на дату последнего обзора или обновления всех статей. Никакой контент на этом сайте, независимо от даты, никогда не должен использоваться вместо прямых медицинских рекомендаций вашего врача или другого квалифицированного клинициста.


 Консультация акушера-гинеколога КДО перинатального центра
Консультация акушера-гинеколога КДО перинатального центра В случае отсутствия клинических проявлений АФС при наличии персистенции антифосфолипидных антител возможно ведение беременности без НМГ, однако послеродовый период обязательно с назначением НМГ
В случае отсутствия клинических проявлений АФС при наличии персистенции антифосфолипидных антител возможно ведение беременности без НМГ, однако послеродовый период обязательно с назначением НМГ

 Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи)
Клинический минимум (Общий анализ крови, коагулограмма, Общий анализ мочи)



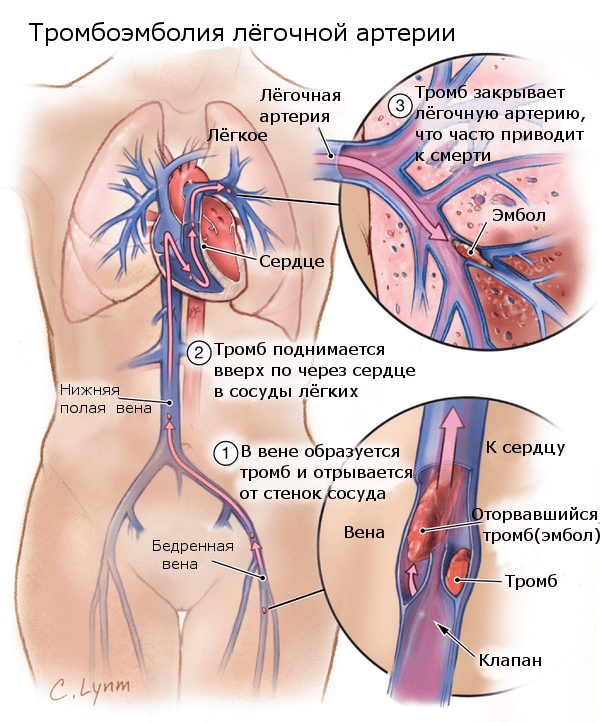


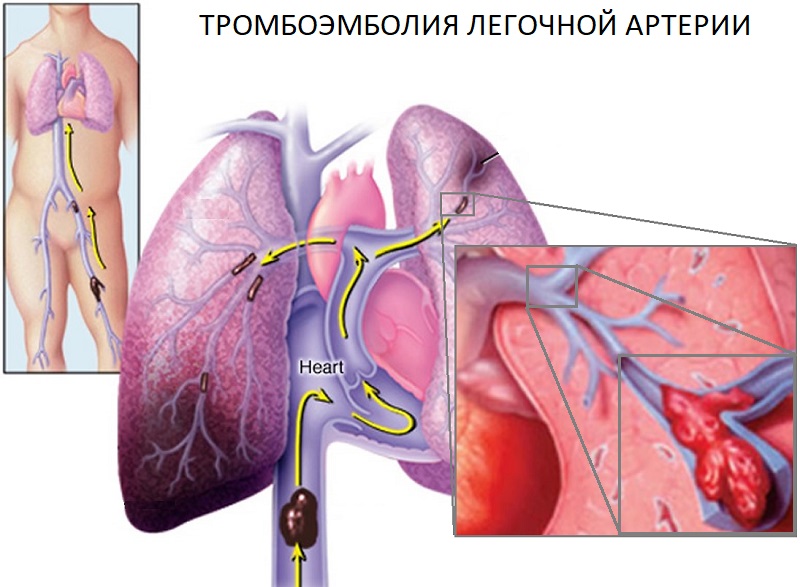 Д.?
Д.?