Прогноз при раке поджелудочной железы
Заведующая онкологическим отделением в клинике Ихилов.
Онколог с 20-летним стажем.
Задать вопрос
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
Может ли онколог сообщить пациенту точно, каков прогноз его заболевания? Как подготовить пациента и его близких к беседе с врачом? Какова статистика выживаемости при раке поджелудочной железы? Мы попытаемся ответить на все эти вопросы.
Прогноз заболевания: психологические аспекты
Диагноз «рак поджелудочной железы» обычно является для пациента неожиданностью, т.к. его чаще всего ставят в случае какого-либо острого нарушения. Пациент либо неделями страдает от дискомфорта в области живота либо вдруг обнаруживает, что у него пожелтели белки глаз. При этом диагноз, как правило, ставят лишь спустя несколько дней – или даже неделю – после обследования. Пациент сначала просто понимает, что он чем-то болен, а потом вдруг слышит, что у него рак, причем трудноизлечимый: он занимает 4-е место в списке самых смертоносных онкологических заболеваний взрослых. Человеку требуется время, чтобы прийти в себя. Обычно он еще не готов слушать ответы онколога на вопросы родственников.
При этом диагноз, как правило, ставят лишь спустя несколько дней – или даже неделю – после обследования. Пациент сначала просто понимает, что он чем-то болен, а потом вдруг слышит, что у него рак, причем трудноизлечимый: он занимает 4-е место в списке самых смертоносных онкологических заболеваний взрослых. Человеку требуется время, чтобы прийти в себя. Обычно он еще не готов слушать ответы онколога на вопросы родственников.Вот несколько советов, которые онкологи дают близким людям больного:
- Членам семьи надо собраться до врачебной консультации и обсудить все ее нюансы.
- Пациент не должен идти к врачу один – у него должен быть хотя бы один сопровождающий, и у этого сопровождающего должны быть при себе ручка и бумага.
- До посещения клиники нужно обсудить с больным все вопросы и убедиться, что он готов выслушать возможные ответы врача.
Может ли врач точно предсказать исход болезни?
Ни один врач не в силах предсказать, сколько пациенту осталось жить. Онкологи могут предложить только среднестатистические данные – общие сведения о выживаемости в зависимости от стадии рака.
Онкологи могут предложить только среднестатистические данные – общие сведения о выживаемости в зависимости от стадии рака.Например, если за медицинской помощью обращается пациент с локализованным раком поджелудочной железы и определенным шансом на полное выздоровление, врачи делают все возможное, чтобы он выздоровел. Цель лечения рака в Израиле в этом случае – полное устранение патологии.
Получить программу лечения бесплатно
Если же у пациента настолько крупная первичная опухоль, что ее невозможно удалить хирургически, но при этом она не распространилась в другие органы, у него диагностируется рак поджелудочной железы 3-й стадии. Средняя выживаемость в таком случае составляет от 1 года до 1,5 лет. С другой стороны, у некоторых пациентов дела обстоят гораздо хуже. А некоторым, напротив, удается достичь прекрасных результатов. Поэтому врач не может сказать больному, что ему осталось жить только 12 месяцев. Это неправильно.
Если рак поджелудочной железы распространился через кровоток в другие внутренние органы – например, в печень или легкое, – средняя выживаемость пациентов составит от 6 до 8 месяцев.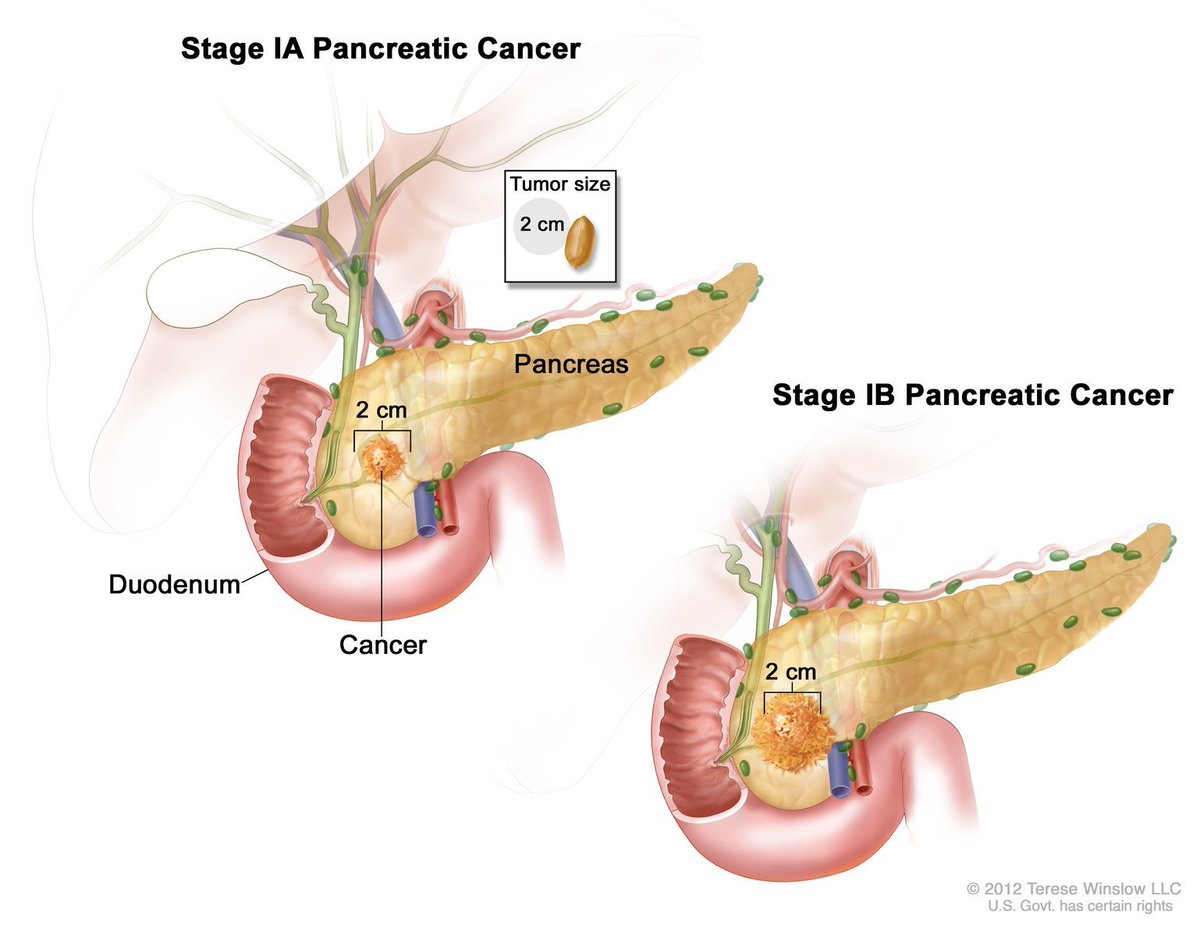 Однако средняя цифра может оказаться в корне неверной в отношении одного, конкретного человека. Поэтому не один врач не может ответить на вопрос о том, сколько осталось жить пациенту.
Однако средняя цифра может оказаться в корне неверной в отношении одного, конкретного человека. Поэтому не один врач не может ответить на вопрос о том, сколько осталось жить пациенту.
Стоимость диагностики и лечения рака поджелудочной железы в Израиле
Для удобства пациентов из-за рубежа приведем цены в долларах на некоторые диагностические и лечебные процедуры, которые назначаются в онкоцентре Ихилов при раке поджелудочной железы.
Чтобы узнать точную стоимость вашего лечения, заполните заявку. В ближайшие 2 часа в сами свяжется врач онкоцентра. Он задаст вам необходимые вопросы и сообщит точную стоимость лечения. Получить информацию вы можете также по телефону: +972-3-376-03-58 в Израиле и +7-495-777-6953 в России.
| Процедуры лечения рака поджелудочной железы | Стоимость |
|---|---|
| Биопсия поджелудочной железы под контролем эндоскопического ультразвука | $3742 |
| ПЭТ-КТ | $1673 |
| Компьютерная томография органов живота | $416 |
| Консультация абдоминального хирурга | $572 |
Лечение рака поджелудочной железы по стадиям
Доктор Вадим Бережной Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Медицинский эксперт, Заведующий отделением врачей-координаторов.
Время чтения – 11 минут
Рак поджелудочной железы – это опасное онкологическое заболевание, которое встречается у 4-5 людей на 100,000. В 95% случаев у людей диагностируют аденокарциному поджелудочной железы – рак, происходящий из экзокринных клеток органа. Факторы риска, симптомы, диагностика, прогноз и лечение этого заболевания отличается от других типов опухолей поджелудочной железы.
Одним из главных определяющих факторов при подборе схемы лечения рака поджелудочной железы является стадия заболевания. В этой статье мы подробнее расскажем о том, какие методы лечения доступны пациентам в иностранных клиниках и о возможностях доступа к ним.
Можно ли вылечить рак поджелудочной железы?
Болезнь трудно выявить на ранних стадиях даже во время медицинских чек-апов. Симптомы рака поджелудочной железы появляются уже тогда, когда опухоль достигла крупных размеров или дала метастазы, что связано с неблагоприятным прогнозом.
Стадия – это степень развития, а именно распространенности опухолевого процесса. Размер злокачественной опухоли, степень ее прорастания в область соседних органов и наличие удаленных онкоклеток определяют стадию рака поджелудочной железы. Для стадирования рака поджелудочной необходимо осуществить обследование пациента. Информацию о процессе распространения онкологии получают посредством проведения КТ с контрастом, УЗИ или эндоскопического УЗИ с биопсией, ЭРХПГ, ПЭТ-КТ (если есть потребность уточнения стадии).
Родственники пациентов с раком поджелудочной находятся в группе риска возникновения заболевания. Им рекомендуется проходить более тщательную диагностику, что позволяет обнаружить онкологию раньше, чем при стандартном обследовании. Наиболее эффективные методы – это эндоскопическое УЗИ и МРТ. Эти методы способны в 99% случаев обнаружить опухоль размером менее 2 см. Для сравнения, при стандартном КТ чувствительность теста составляет только 55%.
Однако, даже на поздних стадиях есть шанс вылечить рак поджелудочной железы. Врачи используют агрессивные протоколы химиотерапии и современные таргетные препараты в дополнение к хирургии, чтобы максимально повысить шансы больного на выживание. Также существуют дополнительные факторы, влияющие на прогноз лечения.
Чем больше рака возможно удалить хирургическим путем, тем лучший прогноз для пациента;
Степень злокачественности опухоли – менее злокачественные опухоли медленнее развиваются, что дает врачам лучший шанс одолеть болезнь;
Если после операции в крови падает онкомаркер СА 19-9 – это хороший знак.
Скрининг рака поджелудочной железы
Чтобы записаться на диагностику рака поджелудочной железы за границу, нажмите на кнопоку ниже и заполните форму. Наши врачи-координаторы перезвонят Вам в течение 30 минут. Они предоставят всю необходимую информацию и помогут с организацией поездки.
Записаться на диагностику
Лечение рака поджелудочной железы 1 стадии
Размер новообразования – до 2 см (стадия ІA онкологии поджелудочной железы) или же более 2 см (стадия ІB рака поджелудочной железы). Опухоль находится в области железы и не выходит за ее границы. Лимфоузлы чисты, метастазы не выявлены (N0M0).
Опухоль находится в области железы и не выходит за ее границы. Лимфоузлы чисты, метастазы не выявлены (N0M0).
При раке головки поджелудочной железы на 1 стадии показана операция Уиппла. Опухоль именно с такой локализацией диагностируется в преобладающем количестве случаев. Во время хирургического вмешательства удаляется часть железы, две трети желудка, желчный пузырь и двенадцатиперстная кишка. При локализации новообразования в хвосте железы на начальной стадии осуществляют дистальную панкреатэктомию с резекцией хвоста и тела поджелудочной.
Меньше чем 1 из 5 случаев аденокарциномы на момент обнаружения ограничивается поджелудочной железой. Даже в этом случае не все эти опухоли возможно вылечить хирургическим путем. Иногда после того, как хирург начинает операцию, становится ясно, что рак вырос слишком далеко, чтобы его можно было полностью удалить. В этом случае операция может быть прекращена, или хирург может продолжить операцию меньшего объема с целью облегчения или предотвращения симптомов. Это связано с тем, что запланированная операция вряд ли вылечит рак и может привести к серьезным побочным эффектам. Кроме того, это удлинит время восстановления, что может отсрочить другие виды лечения.
Это связано с тем, что запланированная операция вряд ли вылечит рак и может привести к серьезным побочным эффектам. Кроме того, это удлинит время восстановления, что может отсрочить другие виды лечения.
На этом этапе также возможно лечение с помощью абляции – уничтожения опухоли ультразвуком, очень высокими или низкими температурами. Процедура относится к нехирургическим и не требует госпитализации. Однако, абляция проводится только для лечения опухолей размером до 2 см.
Более высокие шансы на успешный исход – если операция проводится опытным хирургом. Такие сложные процедуры, как операцию Уиппла, рекомендуется проводить в центрах, где проводят более 15-20 таких вмешательств в год. Врачи-координаторы MediGlobus могут порекомендовать такие больницы и организовать лечение в них.
Найти клинику для лечения рака поджелудочной
Как лечат рак поджелудочной железы 2 стадии?
На этом этапе аденокарцинома поджелудочной железы пересекает границы органа и затрагивает двенадцатиперстную кишку, а также желчевыводящий проток. В лимфоузлах и отдаленных органах клетки рака не обнаруживаются (N0M0). 2B: Злокачественное новообразование, кроме всего, затрагивает ближайшие лимфоузлы (N1M0). Размеры опухоли могут варьироваться.
В лимфоузлах и отдаленных органах клетки рака не обнаруживаются (N0M0). 2B: Злокачественное новообразование, кроме всего, затрагивает ближайшие лимфоузлы (N1M0). Размеры опухоли могут варьироваться.
При раке головки поджелудочной железы на 2 стадии также возможна операция Уиппла. На данном этапе, помимо всего упомянутого выше, удаляются затронутые опухолевым процессом окружающие лимфоузлы.
При операбельном раке хвоста поджелудочной на 2 стадии специалисты также рекомендуют проводить дистальную панкреатэктомию.
При этой операции хирург удаляет хвост и часть тела поджелудочной железы, а также селезенку. Этот орган помогает организму бороться с инфекциями, поэтому при его удалении повышается риск заражения определенными бактериями. Чтобы это предотвратить, врачи рекомендуют пациентам сделать определенные прививки перед операцией. После панкреатэктомии также нужно пожизненно принимать инсулин и ферменты поджелудочной железы.
Как лечат 3 стадию рака поджелудочной железы?
В область локализации опухоли входят также селезенка, желудок и толстый кишечник. Аденокарцинома поджелудочной железы 3 стадии может затрагивать ближайшие лимфоузлы (N0/1,M0). Есть вероятность распространения опухоли на важные для жизни нервы и сосуды.
Аденокарцинома поджелудочной железы 3 стадии может затрагивать ближайшие лимфоузлы (N0/1,M0). Есть вероятность распространения опухоли на важные для жизни нервы и сосуды.
При раке головки поджелудочной на 3 стадии операция Уиппла возможна при условии, что не задеты важные для жизни сосуды и нервы. Особенностью дистальной панкреатэктомии на 3 стадии является проведение резекции, в том числе пораженной раком селезенки. Химиотерапия при раке поджелудочной железы 3 стадии используется как основной метод терапии при нерезектабельной опухоли, либо же в дополнение к операции для минимизации рисков возвращения заболевания.
При частично резектабельных опухолях может проводиться лучевая терапия вместе с химиотерапией до операции, чтобы попытаться уменьшить опухоль и облегчить ее полное удаление. Лучевая терапия в сочетании с химиотерапией также может использоваться как часть основного лечения метастаз и нерезектабельных опухолей.
Лечение рака поджелудочной железы на 4 стадии
Начинается процесс метастазирования. Раковые клетки попадают в легкие пациента, его печень и другие важные для нормального функционирования организма органы. Ближайшие лимфоузлы могут быть не затронуты (N0/1,M1). Также часто рак поджелудочной классифицируют, используя параметр операбельности. Таким образом, онкология поджелудочной делится на резектабельный рак (в основном 1-2 стадии, 15% случаев), локально-распространенный рак (3 стадия, может быть операбельная или нет), а также стадию с метастазами (нерезектабельная опухоль, 4 стадия, 55% случаев).
Раковые клетки попадают в легкие пациента, его печень и другие важные для нормального функционирования организма органы. Ближайшие лимфоузлы могут быть не затронуты (N0/1,M1). Также часто рак поджелудочной классифицируют, используя параметр операбельности. Таким образом, онкология поджелудочной делится на резектабельный рак (в основном 1-2 стадии, 15% случаев), локально-распространенный рак (3 стадия, может быть операбельная или нет), а также стадию с метастазами (нерезектабельная опухоль, 4 стадия, 55% случаев).
Для лечения метастаз печени возможно применение абляции или эмболизации. Эти процедуры не вылечат рак, но позволят избавить от симптомов заболевания, повысить качество и потенциально продолжительность жизни.
На последней стадии рака поджелудочной операция Уиппла применяется исключительно как паллиативная терапия (для минимизации болевых ощущений и улучшения общего состояния больного). Лечение рака поджелудочной железы без операции возможно благодаря установке Нано-Нож. На 4 стадии онкологии поджелудочной врачи используют этот аппарат для разрушения злокачественного новообразования с помощью тока. Однако всего несколько хирургов в мире владеют сертификатом на проведение такого лечения.
На 4 стадии онкологии поджелудочной врачи используют этот аппарат для разрушения злокачественного новообразования с помощью тока. Однако всего несколько хирургов в мире владеют сертификатом на проведение такого лечения.
ЗАПИСЬ НА НАНО-НОЖ ОПЕРАЦИЮ
MediGlobus сотрудничает с передовыми онкоцентрами мира, которые используют технонологию Нано-нож. Мы поможем вам быстро получить ответ от клиники и приступить к лечению рака. Чтобы получить бесплатную консультацию нашего специалиста по медицинскому туризму, нажмите на кнопку ниже и заполните форму.
Записаться на лечение
Передовые методы лечения рака поджелудочной железы
При лечении рака поджелудочной железы часто назначают передовые методы онкологии – таргетную терапию и иммунотерапию. Это – современные лекарства, которые отличаются за своим механизмом действия от стандартной химиотерапии. Они более избирательно воздействуют на ткани организма и вызывают меньше побочных эффектов. Кроме того, препараты обладают синергическим эффектом – одновременное принятие нескольких лекарств различных групп, например, химиотерапия и таргетная терапия, повышает их общую эффективность.
Среди таргетных препаратов, которые используют в лечении рака поджелудочной железы:
ингибиторы EGFR;
ингибиторы PARP;
ингибиторы NTRK.
Среди препаратов иммунотерапии, которые используют в лечении рака поджелудочной железы:
Ингибиторы иммунных чекпойнтов;
ингибиторы PD-1.
Прогноз выживаемости при раке поджелудочной железы по стадиям
Прогноз 5-летней выживаемости на 1, 2, 3, 4 стадиях рака поджелудочной железы:
| Стадия | Пятилетняя выживаемость |
|---|---|
| Нерезектабельный рак поджелудочной железы 1 стадии | 1A 14%, 1B 12% |
| Резектабельный рак поджелудочной железы 1 стадии | 61% |
| Нерезектабельный рак поджелудочной железы 2 стадии | 2A 7%, 2B 5% |
| Резектабельный рак поджелудочной железы 2 стадии | 52% |
| Нерезектабельный рак поджелудочной железы 3 стадии | 3% |
| Резектабельный рак поджелудочной железы 3 стадии | 41% |
| Нерезектабельный рак поджелудочной железы 4 стадии | 1% |
| Рак поджелудочной железы 4 стадии (Нано-Нож) | 16% |
Клиники для лечения рака поджелудочной железы клиники по лечению рака поджелудочной
Если вы ищете клинику для лечения рака поджелудочной, первое, на что стоит обратить внимание, опыт специалиста. В разных случаях важны навыки проведения сложных хирургических операций, наличие сертификата на использование Нано-Ножа при неоперабельном раке. Среди ТОП-специалистов в проведении операции Уиппла стоит выделить: израильского хирурга Йозефа Клаузнера (клиника Ихилов), немецкого профессора Карла Олдхафера (клиника Асклепиос), турецкого доктора Кемаля Долай (клиника Лив).
В разных случаях важны навыки проведения сложных хирургических операций, наличие сертификата на использование Нано-Ножа при неоперабельном раке. Среди ТОП-специалистов в проведении операции Уиппла стоит выделить: израильского хирурга Йозефа Клаузнера (клиника Ихилов), немецкого профессора Карла Олдхафера (клиника Асклепиос), турецкого доктора Кемаля Долай (клиника Лив).
Уникальные сертификаты, позволяющие проводить терапию онкологии поджелудочной с помощью установки Нано-Нож, имеет врачи Юрий Голдис (больница Шиба), Риад Хадад и Марат Хайкин (медцентр Ассута), а также Маттиас Бирт (клиники Хелиос).
Среди других клиник, лидирующий по показателям выживаемости пациентов с этим видом онкологии, стоит выделить: Венскую частную клинику и больницу Дёблинг в Австрии, медцентры Самсунг, Анам и Северанс в Южной Корее, турецкие медучреждения Лив, Мемориал и Коч.
Отзывы о лечении рака поджелудочной железы
Где проводилось: Клиника Ассута
Какая процедура: Лечение рака поджелудочной железы
Возраст пациента: 58 лет
Пациент из: Тбилиси
Михаил: “У моего старшего брата нашли 3 стадию рака поджелудочной железы. У нас в России отказались помочь и фактически отправили умирать. Спасибо нашим друзьям, которые рассказали об аппарате Нано-Нож, и что даже на такой стадии можно снять боль и даже продлить жизнь. Мы отправили свои документы в разные клиники, но в результате выбрали Ассуту. Понравилось, что врачи говорили по факту, не обещали невозможного в плане полного выздоровления. Сказали как есть. Попали к профессору уже на следующий день после прилета. Нас вел проф. Моше Инбар. Сначала провели диагностику. Дальше лечили нано-Ножом+облучение+комбинацией химиотерапии. Уже после лучевой брат стал заметно лучше себя чувствовать. Провели опять анализы – результаты продемонстрировали улучшение. Еще доктор предложил новый препарат иммунотерапии. Он помогает организму бороться с злокачественными клетками и улучшает общее состояние. В принципе мы получили то, на что рассчитывали. Сейчас мы дома и продолжаем лечение тут. Если бы не израильские врачи, мы давно бы потеряли надежду… Спасибо вам от всей нашей семьи!!!”
У нас в России отказались помочь и фактически отправили умирать. Спасибо нашим друзьям, которые рассказали об аппарате Нано-Нож, и что даже на такой стадии можно снять боль и даже продлить жизнь. Мы отправили свои документы в разные клиники, но в результате выбрали Ассуту. Понравилось, что врачи говорили по факту, не обещали невозможного в плане полного выздоровления. Сказали как есть. Попали к профессору уже на следующий день после прилета. Нас вел проф. Моше Инбар. Сначала провели диагностику. Дальше лечили нано-Ножом+облучение+комбинацией химиотерапии. Уже после лучевой брат стал заметно лучше себя чувствовать. Провели опять анализы – результаты продемонстрировали улучшение. Еще доктор предложил новый препарат иммунотерапии. Он помогает организму бороться с злокачественными клетками и улучшает общее состояние. В принципе мы получили то, на что рассчитывали. Сейчас мы дома и продолжаем лечение тут. Если бы не израильские врачи, мы давно бы потеряли надежду… Спасибо вам от всей нашей семьи!!!”
Где проводилось: Клиника Асклепиос
Какая процедура: Лечение рака поджелудочной железы
Возраст пациента: 72 года
Пациент из: Киева
Галина: “У моего деда 4 стадия. Понятное дело, на родине нас лечить никто не взялся. Нашли врача в Германии. Операция конечно очень дорогая – 28 тысяч. Собирали всей семьей. Но твердо решили, что время, которое ты можешь провести с родным человеком, стоит любых денег. Прошло уже полгода и дедуля чувствует себя намного лучше, чем только когда мы приехали на лечение. Спасибо доктору и всем, кто нам помогал морально и финансово. Всем здоровья”
Понятное дело, на родине нас лечить никто не взялся. Нашли врача в Германии. Операция конечно очень дорогая – 28 тысяч. Собирали всей семьей. Но твердо решили, что время, которое ты можешь провести с родным человеком, стоит любых денег. Прошло уже полгода и дедуля чувствует себя намного лучше, чем только когда мы приехали на лечение. Спасибо доктору и всем, кто нам помогал морально и финансово. Всем здоровья”
Резюме
Аденокарцинома поджелудочной железы – это опасное онкологическое заболевание, которое трудно диагностируется и лечится. Наиболее высокие шансы для пациентов доступны в специализированных онкологических центрах, где доступны наилучшие специалисты и оборудование для лечения рака поджелудочной железы.
Прогноз при раке поджелудочной железы зависит от нескольких факторов – стадии заболевания, степени злокачественности опухоли, ее резектабельности (возможности полностью удалить хирургическим путем). Пятилетняя выживаемость пациентов с раком поджелудочной железы колеблется от 1% до 61%. Для того, чтобы максимизировать шансы пациента выжить, иностранные врачи сочетают несколько методов лечения рака – химиотерапию, хирургию, лучевую терапию, таргетную терапию, иммунотерапию, абляцию и эмболизацию опухоли.
Для того, чтобы максимизировать шансы пациента выжить, иностранные врачи сочетают несколько методов лечения рака – химиотерапию, хирургию, лучевую терапию, таргетную терапию, иммунотерапию, абляцию и эмболизацию опухоли.
Одна из основных процедур, которые проводятся для лечения рака поджелудочной железы – это операция Уиппла. Она относится к сложным и рискованным процедурам, и для ее проведения рекомендуется обращаться только к опытным врачам.
Среди клиник, лидирующий по показателям выживаемости пациентов с этим видом онкологии, стоит выделить: Венскую частную клинику, медцентры Самсунг, Анам и Северанс в Южной Корее, турецкие медучреждения Лив, Мемориал и Коч, клиники Ихилов и Шиба в Израиле, университетскую клинику Кельна в Германии.
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Editor
Более 2 лет пишет медицинские тексты. Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Похожие посты
Как лечить агрессивный перстневидноклеточный рак желудка?
Читать дальшеЧто важно знать о раке поджелудочной железы
К врачу обязательно!Эксперты: Федор Ветшев, профессор кафедры факультетской хирургии Сеченовского университета, д. м. н.
Алексей Трякин, главный научный сотрудник отделения клинической фармакологии и химиотерапии НМИЦ онкологии им. Н. Н.Блохина, член правления российского общества клинической онкологии (RUSSCO), д. м. н.
Рак поджелудочной железы (РПЖ) — одно из самых агрессивных онкологических заболеваний.
Статистика продолжительности жизни больных с этим диагнозом остается одной из самых летальных. Как правило, рак поражает саму железу или ее протоки. И быстро прогрессирует. Но делает это тихо, никак не выдавая себя. Тем и опасна злокачественная опухоль поджелудочной железы — она бессимптомна, почти неуловимая. Только треть случаев заболевания выявляется на третьей стадии, когда метастазы еще не проросли в соседние органы, но уже затронули кровеносные сосуды. В остальном болезнь проявляется, когда лечение становится практически неэффективным. И изменить ситуацию не помогут никакие деньги. В списке жертв коварного недуга мировые знаменитости, обладатели крупных капиталов, в том числе основатель компании Apple Стив Джобс, королева блюза Арета Франклин, великий тенор Лучано Паваротти.
Несмотря на то что ранних признаков РПЖ не существует и шансов поймать болезнь в начальной стадии практически никаких, врачи советуют быть внимательными к своему организму и насторожиться, если вдруг пропал аппетит, чувствуете неприятные ощущения в области желудка и поджелудочной или вдруг стал беспричинно снижаться вес. Начало заболевания может быть связано даже с такими банальными симптомами, как запор, слабость, общее недомогание, вздутие живота. Все это — повод пойти к врачу. Обычно так и бывает, пациент приходит с жалобами на боль в желудке или другие неприятные симптомы, при этом он, конечно, далек от мысли, что у него рак. Но врач-диагност проводит МРТ или КТ и случайно находит узел в поджелудочной железе. Когда так происходит, этот случай можно считать почти счастливым. Чаще к врачу попадают пациенты уже с явно выраженной желтухой, когда опухоль распространилась в желчные протоки. Кстати, боль и желтуха считаются наиболее характерными симптомами рака поджелудочной железы. Их отмечают у 90 % больных. Как правило, они сопровождаются при этом светлым калом, темной мочой. В такой момент говорят о распространенном онкологическом процессе.
Начало заболевания может быть связано даже с такими банальными симптомами, как запор, слабость, общее недомогание, вздутие живота. Все это — повод пойти к врачу. Обычно так и бывает, пациент приходит с жалобами на боль в желудке или другие неприятные симптомы, при этом он, конечно, далек от мысли, что у него рак. Но врач-диагност проводит МРТ или КТ и случайно находит узел в поджелудочной железе. Когда так происходит, этот случай можно считать почти счастливым. Чаще к врачу попадают пациенты уже с явно выраженной желтухой, когда опухоль распространилась в желчные протоки. Кстати, боль и желтуха считаются наиболее характерными симптомами рака поджелудочной железы. Их отмечают у 90 % больных. Как правило, они сопровождаются при этом светлым калом, темной мочой. В такой момент говорят о распространенном онкологическом процессе.
Главный фактор риска РПЖ — генетический. «Если в семье четко прослеживается наследственность, не обязательно рака поджелудочной железы, но и рака желудка, молочной железы, толстой и тонкой кишки — повод сходить к медицинскому генетику, — предупреждает Алексей Трякин.
Причем здесь витамин D?
Онкологам известно о связи РПЖ не только с генетикой, но и с образом жизни. Железа, которая не переносит ни никотин, ни алкоголь, жестоко мстит за вредные привычки и еще за неумеренность в пище, а именно избыточное потребление красного мяса, жареного и копченого. «К факторам риска рака поджелудочной железы вполне обоснованно можно отнести хронический панкреатит, сахарный диабет, цирроз печени, ожирение — говорит наш эксперт Федор Ветшев. — Согласно последним данным, выявлена связь между длительным недостатком витамина D. Низкий уровень инсоляции и дефицит витамина в купе с другими факторами может приводить к определенному состоянию в организме, которое способно спровоцировать развитие рака поджелудочной железы. Это не говорит о том, что если выявлен недостаток витамина (а его выявляют у большинства людей нашей страны), у всех будет рак поджелудочной железы. Но это еще один из потенциально возможных факторов риска, признанных целым рядом ученых. И его надо учитывать, особенно при наследственной предрасположенности».
Это не говорит о том, что если выявлен недостаток витамина (а его выявляют у большинства людей нашей страны), у всех будет рак поджелудочной железы. Но это еще один из потенциально возможных факторов риска, признанных целым рядом ученых. И его надо учитывать, особенно при наследственной предрасположенности».
В истории мировой онкологии пока еще не было случаев полного излечения от рака поджелудочной железы. Сложности лечения связаны с биологической особенностью опухоли и анатомической особенностью самой поджелудочной железы. Даже если хирургам удастся прооперировать опухоль и радикально все убрать, метастазы все равно проникают в печень. Если процесс находится на первой и второй стадии, то лечение, как правило, начинается с выполнения радикальной операции, а после назначают послеоперационную химиотерапию. Если процесс распространился и захватил уже и крупные сосуды, проходящие в этой зоне, то лечение включает в себя химиотерапию и иногда лучевую терапию, чтобы уменьшить размер опухоли и сделать операцию возможной.
Новое в лечении
Онкологическая наука не стоит на месте, и сегодня специалисты выполняют такие манипуляции, которые еще лет десять назад казались просто фантастикой. Именно они позволяют максимально повысить шанс на выживаемость пациентов с раком поджелудочной железы. И шансы на излечение РПЖ действительно возрастают, если сделать операцию в самом начале заболевания, пока метастазы не пошли дальше. «В настоящее время, когда невозможно удалить опухоль поджелудочной железы хирургически, применяют новый метод необратимой электропорации, — говорит Алексей Трякин. — В опухоль вставляют электроды и таким образом создают электромагнитное поле, которое убивает живые клетки. Но и этот метод не панацея, потому что вопрос не в локальном контроле опухоли, а в том, что она рано дает метастазы, которые, собственно, и убивают.
Среди последних мировых новостей борьбы с раком поджелудочной железы — разработка специалистов Института биологических исследований Солка (США). Ученые обещают победить болезнь даже на четвертой стадии. Так называемые звездчатые клетки поджелудочной железы при РПЖ начинают вырабатывать белки, которые создают вокруг опухоли защитную оболочку. Также они вырабатывают сигнальный белок LIF, который стимулирует рост опухоли. Эксперименты на мышах показали, что, если заблокировать работу LIF, рост опухоли возможно замедлить даже с помощью химиотерапии. Кроме того, LIF может стать более эффективным маркером рака поджелудочной железы, чем используемый сейчас (СА-19-9), он точнее отражает и рост опухоли, и реакцию ее клеток на химиотерапию.
Так называемые звездчатые клетки поджелудочной железы при РПЖ начинают вырабатывать белки, которые создают вокруг опухоли защитную оболочку. Также они вырабатывают сигнальный белок LIF, который стимулирует рост опухоли. Эксперименты на мышах показали, что, если заблокировать работу LIF, рост опухоли возможно замедлить даже с помощью химиотерапии. Кроме того, LIF может стать более эффективным маркером рака поджелудочной железы, чем используемый сейчас (СА-19-9), он точнее отражает и рост опухоли, и реакцию ее клеток на химиотерапию.
Еще одно научное открытие связано с экспериментом по выращиванию «в пробирке» островков поджелудочной железы. Однако о выращивании самого органа речь пока не идет. Также врачи отвергают и метод трансплантации. «В первую очередь надо понимать, что рак поджелудочной железы — это системное заболевание, а не болезнь одного органа, поэтому пересадкой здесь все не закончится, — считает Федор Ветшев. — Даже если вспомнить историю Стива Джобса, то ему пересаживали печень уже после операции на поджелудочной железе, поскольку метастазы добрались в печень, а химиотерапия была не эффективна.
 Тем не менее Стив Джобс более восьми лет боролся с болезнью и смог прожить дольше, чем прогнозировали врачи, но не смог победить рак. Безусловно трансплантация не является панацеей, поскольку не позволяет избавиться от рака. Тем не менее в целом ряде случаев трансплантация, вероятно, может рассматриваться как один из вариантов лечения пациентов с раком поджелудочной железы в будущем»
Тем не менее Стив Джобс более восьми лет боролся с болезнью и смог прожить дольше, чем прогнозировали врачи, но не смог победить рак. Безусловно трансплантация не является панацеей, поскольку не позволяет избавиться от рака. Тем не менее в целом ряде случаев трансплантация, вероятно, может рассматриваться как один из вариантов лечения пациентов с раком поджелудочной железы в будущем»Источник: KIZ.RU
от зарождения рака поджелудочной железы до смерти больного проходит много лет
Новости Центра медицинских исследований имени Джонса Хопкинса
В новом исследовании Johns Hopkins было показано, что рак поджелудочной железы развивается много медленнее, чем принято считать. Доказано наличие довольно длительного периода от появления раковой клетки до явных клинических признаков, в который можно диагностировать и успешно лечить злокачественную опухоль.
«Впервые у нас появилась возможность измерить период роста раковой опухоли и определить оптимальное время для лечебного вмешательства», – считает доктор философии и медицины, адъюнкт-профессор патологии и онкологии Johns Hopkins’ Sol Goldman Pancreatic Cancer Research Center доктор Christine lacobuzio-Donahue.
Профессор и директор Центра генетических исследований рака Ludwig, главный специалист Johns Hopkins Kimmel Cancer Center, исследователь медицинского института Howard Hughes доктор Bert Vogelstein считает, что «во многих случаях рака есть период, когда имеющиеся диагностические тесты не могут обнаружить опухоль, и этот период достаточно продолжительный. Нам необходимо разработать более чувствительные диагностические процедуры, которые позволят нам выявить опухоль на самых ранних стадиях и вмешаться».
В работе, опубликованной 28 октября в журнале Nature, отмечено, что от первой мутации до развития ракового перерождения нормальной панкреатической клетки проходит десятилетие. В этот период перерождения клетка и должна удаляться, подобно тому, как общепринято удаление полипов толстой кишки в качестве профилактики рака.
В этот период перерождения клетка и должна удаляться, подобно тому, как общепринято удаление полипов толстой кишки в качестве профилактики рака.
После появления первой раковой клетки проходит в среднем 7 лет до развития той клетки, которая обладает достаточным агрессивным потенциалом, чтобы дать жизнь миллиарду клеток (формирующим опухоль размером со сливу), из коих хотя бы одна клетка оказывается способной к метастазированию. От появления первого метастаза до смерти пациент в среднем живет около 2,5 лет. «Конечно, результаты исследования опровергают тезис о том, что рак поджелудочной железы очень рано начинает метастазировать», – говорит доктор Iacobuzio-Donahue.
Для исследования были взяты образцы тканей у семи умерших от рака поджелудочной железы с метастазами в другие органы. Так как материал забирался в первые 6 часов после смерти, оказалось возможным достаточно долго поддерживать жизнь некоторых клеток, извлечь из них ДНК и изучить химическую структуру генов.
У всех пациентов имелись метастазы хотя бы двух локализаций, чаще всего в печени, легких и брюшине. В первичной опухоли и метастатических образованиях ученые обнаружили однотипные мутации. Идентифицированы и классифицированы все типы мутаций, обнаруженные как до появления метастазов, так и после диссеминации опухоли. Все обнаруженные варианты мутаций присутствовали в первичной опухоли за годы до развития клинически определяемых метастазов.
С помощью математической модели изучения прогрессии панкреатического рака, было подсчитано, что требуется в среднем около 11,7 лет до того периода, когда раковая клетка обретёт способность к агрессивному росту. После, чтобы выросла определяемая опухоль, проходит ещё 6,8 лет и до смерти больного 2,7 лет.
Специалисты Johns Hopkins считают, что для ранней диагностики необходимо разработать метод скрининга, подобно протоколам выявления рака молочной железы и кишечника. Хоть ранние стадии рака поджелудочной железы и не имеют клинических симптомов, как считает доктор Iacobuzio-Donahue, с определённого возраста какой-то когорте необходимо проводить эндоскопическое исследование с целью выявления патологии железы.
Другое исследование британских ученых – сотрудников Wellcome Trust Sanger Institute – в соавторстве с Iacobuzio-Donahue, также опубликованное в этом выпуске Nature, для выявления генетических перестановок изучало клетки и образцы тканей тех же больных, что и Johns Hopkins. Они нашли, что во всех метастазах и первичной опухоли почти половина генетических изменений была идентичной.
Работа поддержана Национальным институтом здоровья, Фондом Билла и Мелинды Гейтс, Мемориальным Фондом Уехара, Фондом AACR-Barletta, Фондом Джона Темплетона, Центром исследования панкреатического рака Sol Goldman, Фондом рака поджелудочной железы Михаэля Рольфа, Центром исследования рака поджелудочной железы Джоржа Рубиса, Фондом исследования рака поджелудочной железы Джозефа С. Монастра, Мемориального фонда Альфреда Скатена, Обществом Сигма Бета, Фондом Skip Viragh, Фондом Исследования Рака Вирджинии и Д.K. Людвиг, Программой Математической Биологии и Ж. Эпштейном.
В исследовании участвовали сотрудники Johns Hopkins: Shinichi Yachida, Sian Jones, Rebecca Leary, Baojin Fu, Mihoko Kamiyama, Ralph H. Hruban, James R. Eshleman, Victor E. Velculescu, Kenneth W. Kinzler; специалисты Гарвардского Университета Кембриджа Ivana Bozic и Martin A. Nowak.
Перевод Натальи Мещеряковой
16.11.2010 г.
« Назад к списку новостей
Эксперты: раковые больные стали жить дольше
- Адам Бримлоу
- Корреспондент Би-би-си по медицинским вопросам
Эксперты проанализировали данные за 40 лет о выживаемости больных при 20 различных видах рака
За последние 40 лет средняя продолжительность жизни британцев, у которых был диагностирован рак, увеличилась с одного года до почти шести лет, свидетельствуют данные британского благотворительного фонда по оказанию поддержки онкологическим больным – Macmillan Cancer Support.
Эксперты пришли к такому выводу, проанализировав прогнозы выживаемости и реальные сроки продолжительности жизни при 20 видах рака в течение четырех десятилетий, зарегистрированные в рамках исследований Лондонского института гигиены и тропической медицины.
Вместе с тем сотрудники Macmillan Cancer Support указывают, что по ряду заболеваний прогресс не наблюдается: в частности, речь идет о случаях рака легких, желудка, пищевода, головного мозга и поджелудочной железы.
Представители британского министерства здравоохранения заявляют, что основное внимание сейчас уделяется именно тем видам, которые еще плохо поддаются лечению.
Победы и поражения
Подпись к фото,Эксперты указывают, что хотя сейчас больше больных раком живут дольше, многие из них страдают от тяжелых последствий лечения
Показатель выживаемости при раке обычно вычисляется при подсчете числа людей, проживших год, пять или десять лет после того, как у них была диагностирована болезнь.
Эксперты Macmillan Cancer Support подсчитали среднюю выживаемость – то есть срок, при котором выживает половина всех пациентов.
«Именно показатель средней выживаемости дает наиболее точное представление о том, как долго могут прожить люди с разными видами рака, – указал глава организации Киран Дивейн. – Наконец, мы можем ответить на самый больной вопрос онкологического пациента: «Сколько мне осталось жить»?
Полученные данные показывают, что при шести видах рака выживаемость превышает 10 лет. Самый большой прогресс достигнут в сдерживании рака толстой кишки. На втором месте – лимфома (кроме лимфомы Ходжкина).
42-летней Дине Хатчинс из города Шеффилд диагностировали рак почти пять лет назад. Несмотря на тяжелую химиотерапию, она считает, что ей повезло.
«Это мог быть гораздо худший вид рака, но, к счастью для меня, это оказалась лимфома – один из видов рака, которые лучше всего поддаются лечению», – говорит она.
Однако, как свидетельствуют данные, для девяти отдельных видов рака выживаемость не превышает трех лет.
За последние 40 лет не было достигнуто почти никакого прогресса при раке легких, головного мозга и поджелудочной железы.
40-летнему Адриану Антвису тоже из Шеффилда весной диагностировали рак легких, и врачи сказали, что ему осталось жить меньше года. Он надеется, что полученные данные придадут новый импульс исследованиям именно таких неподдающихся лечению видов рака, как у него.
«Я бы охотно согласился на длительное и мучительное лечение, зная, что у меня есть шанс. Но этот рак не лечится совсем, и с этим нужно смириться», – говорит он.
Эксперты Macmillan Cancer Support указывают, что хотя сейчас все больше больных раком живут дольше, многие из них страдают от тяжелых последствий лечения, таких, как, например, бесплодие, поражение легких и сердца. Многие больные нуждаются в психологической поддержке.
Представитель британского минздрава Пол Берстоу сообщил, что правительство сотрудничает с организацией Macmillan Cancer Support в оказании помощи больным раком.
«Очень важно, чтобы раковые больные получали полную поддержку, необходимую для того, чтобы справиться с долговременными последствиями этой болезни», – указал он.
НМИЦ онкологии им. Н.Н. Блохина
Вот уже почти 70 лет Онкоцентр – это уникальный симбиоз науки и клинической практики, мультидисциплинарный подход к лечению онкологических больных, хирургическая школа, известная далеко за пределами России. Здесь изучаются и совершенствуются морфологические, иммунологические и генетические методы диагностики.Специалисты Блохина – авторы клинических рекомендаций по онкологии.
Ежегодно в Онкоцентре противоопухолевое лечение проходят более 35 тысяч пациентов всех возрастов. Еще почти 6 000 граждан России получают помощь дистанционно – посредством телемедицинских консультаций.
Онкоцентр – это:
- Комбинированное лечение пациентов
- Собственное производство химио- и радиофармацевтических препаратов
- Собственные методы иммунотерапии опухолей
- Передовые технологии реабилитации онкопациентов
- «Центры компетенций» по различным нозологиям, в том числе первый в России центр компетенций по лечению пациентов с опухолями без выявленного первичного очага
- Собственное отделение переливания крови, доноры которого снабжают кровью и ее компонентами исключительно пациентов Онкоцентра
- Первый и единственный онкологический центр, имеющий в своем составе специализированное отделение реабилитации для онкопациентов
- Крупнейшая педагогическая школа в области онкологии в России
На протяжении многих лет Онкоцентр является членом Международного Противоракового Союза (UICC) при Всемирной организации здравоохранения (ВОЗ) и членом Ассоциации Европейских Онкологических Институтов (OECI) в Женеве.
В 2019 году НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н. Блохина стал полноправным членом ведущей мировой организации, которая объединяет трансплантационные центры Европы и мира — Европейской группы по трансплантации крови и костного мозга (EBMT).
НМИЦ онкологии им. Н.Н. Блохина:
- Онкологическая помощь мирового уровня, доступная каждому
- Инновации в онкологии
- Уникальный опыт для коллег
Прогнозирование течения рака поджелудочной железы в зависимости от местного распространения и регионарного метастазирования
На правах рукописи МЕЛЕХИНА ОЛЬГА ВЯЧЕСЛАВОВНА
ПРОГНОЗИРОВАНИЕ ТЕЧЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ В ЗАВИСИМОСТИ ОТ МЕСТНОГО РАСПРОСТРАНЕНИЯ И РЕГИОНАРНОГО МЕТАСТАЗИРОВАНИЯ
14.00.27 — хирургия
¡1 5 ОКТ
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
Москва — 2009
003479878
Работа выполнена в ФГУ «Институт хирургам им. А.В.Вишневского Росмедтехпологий»
Научный руководитель:
доктор медицинских наук Егоров Вячеслав Иванович Научный консультант:
Кандидат биологических наук Копанцева Марина Робертовна Официальные оппоненты:
Член корреспондент РАМН, доктор медицинских наук, профессор Кубышкин Валерий Алексеевич
доктор медицинских наук, профессор Емельянов Сергей Иванович
Ведущая организация — ФГУ «Московский научно-исследовательский онкологический институт им. П.А.Герцена Росмедтехнологий»
Защита состоится « »_200_г. в_часов
на заседании диссертационного совета Д 208.124.01 при ФГУ «Институт хирургии им. А.В.Вишневского Росмедтехнологий»
Адрес: 117997, г. Москва, ул. Б. Серпуховская, д.27
С диссертацией можно ознакомиться в библиотеке Института хирургии им. А.В.Вишневского
Автореферат разослан «__»_200_г.
Ученый секретарь диссертационного совета
доктор медицинских наук Шаробаро В.И.
Актуальность проблемы
Рак поджелудочной железы составляет 3% от всех ежегодно выявляемых злокачественных опухолей и является одной из самых частых причин онкологической летальности. Смертность практически равна заболеваемости и составляет для России около 13 тыс. (Кубышкин В.А., 2003; Давыдов М.И., 2006; Патютко Ю.И., 2007), а для мира — около 230 тыс. случаев в год (Lohr J-М., 2005; Lowenfels А. В., 2008).
Большая часть злокачественных опухолей поджелудочной железы происходит из протокового эпителия и 80% рака поджелудочной железы представлено протоковой аденокарциномой, имеющей наиболее неблагоприятный прогноз. В 80% случаев опухоль локализуется в головке поджелудочной железы.
К моменту постановки диагноза опухоль резектабельна у 10% пациентов, медиана выживаемости (MB) которых после стандартной панкреатодуо-денальной резекции (ПДР) равна 15 -19 Mec.(Saif M.W., 2007).
Пятилетняя выживаемость после стандартной ПДР по поводу протоковой аденокарциномы (ПА) головки поджелудочной железы (ПЖ) варьирует от 0 до 41% (Патютко Ю.И., 2004; Wanebo Н., 1996, Trede М., 1997), что зависит от многих факторов: стадии заболевания, использования разных классификаций, различной химиотерапии и методов расчета 5-летней выживаемости. Тем не менее, различия в показателях выживаемости в различных странах и клиниках не имеют простого объяснения, что требует дальнейшего изучения прогностических факторов, комплексная оценка которых способствует выбору адекватной лечебной тактики.
Использование стандартной ПДР не позволило существенно улучшить результаты хирургического лечения ПА головки ПЖ. С целью повышения эффективности этой операции в 80-х годах было предложено расширение-объема ПДР за счет забрюшинной лимфодиссекции (Ishikawa О., 1988; Trede М., 1993; Neoptolemos J.P., 1997). В различных клиниках мира были выполнены проспективные рандомизированные исследования эффективности этих вмешательств (Pedrazzoli S., 1998; Yeo C.J., 2002, Farneil М.В., 2005;). В большинстве работ было показано, что расширенная лимфаденэктомия при ПДР не увеличивает частоту послеоперационных осложнений и летальность (Henne-Bruns D., 2003; Nagino М., 2006). Несмотря на то, что достоверное
влияние расширенных ПДР на выживаемость было отмечено лишь Рес1гаггоН Б. (1998) при опухолях с метастазами в регионарные лимфатические узлы, степень влияния расширенной лимфодиссекции на продолжительность жизни определенных категорий больных остается неясной, ровно как и значение факторов прогноза при стандартных и расширенных ПДР. Исследованию этого вопроса и посвящена настоящая работа.
Цель работы: улучшение диагностики и результатов лечения больных раком головки поджелудочной железы.
Задачи исследования:
1. Оценить возможность прогнозирования течения рака головки поджелудочной железы на основании данных патогистологического исследования после стандартных и расширенных панкреатодуоденальных резекций.
2. Оценить точность определения стадии заболевания при выполнении стандартных и расширенных панкреатодуоденальных резекций.
3. Оценить ближайшие и отдаленные результаты стандартных и расширенных панкреатодуоденальных резекций.
4. Оценить клиническую значимость обнаружения изолированных опухолевых клеток в костном мозге при раке головки поджелудочной железы с использованием методики их выявления методом иммуноцитохимии и исследовать новые маркёры для их выявления.
5. Оценить значимость факторов прогноза при стандартных и расширенных панкреатодуоденальных резекциях.
Научная новизна
В представленной работе на значимом клиническом материале проведено сравнение результатов стандартных и расширенных панкреатодуоденальных резекций при протоковой аденокарциноме головки поджелудочной железы.
Проведен анализ осложнений стандартных и расширенных ПДР и предложены методы их профилактики.
Оценены факторы прогноза при протоковой аденокарциноме головки поджелудочной железы на основании изучения патогистологических отчетов и отдаленных результатов лечения после расширенных и стандартных ПДР.
Впервые в отечественной практике предпринята попытка оценить клиническое значение выявления изолированных опухолевых клеток в костном мозге больных протоковой аденокарциномой поджелудочной железы.
2
Исследована возможность применения эмбриональных маркёров для выявления изолированных опухолевых клеток методами иммунофлюорес-центной микроскопии и полимеразной цепной реакции (ОТ-ПЦР).
Обнаружены ростовые факторы, вызывающие эпителио-мезснхимальный переход в первичных культурах опухолей поджелудочной железы.
Практическая значимость
В рамках данной работы проведен сравнительный анализ морфологических характеристик удаленных препаратов при стандартных и расширенных операциях и сопоставление их с отдаленными результатами лечения пациентов с протоковой аденокарциномой поджелудочной железы. Определены факторы риска развития осложнений при стандартных и расширенных ПДР.
На основании полученных данных обоснованы практические рекомендации, направленные на уменьшение вероятности выполнения нерадикальных вмешательств.
Охарактеризованы отдаленные результаты лечения больных протоковой аденокарциномой поджелудочной железы с оценкой структуры рецидивов при стандартных и расширенных панкреатодуоденальных резекциях.
Оценены факторы, влияющие на прогноз при стандартных и расширенных операциях, а также оценена эффективность, целесообразность и клиническая значимость использования имуноцитохимии для определении изолированных опухолевых клеток в костном мозге при протоковой аденокар-циноме поджелудочной железы. Основные положения, выносимые на защиту
1. Летальность и число осложнений после расширенной и стандартной ПДР сопоставимы.
2. Расширенная ПДР позволяет более точно сталировать и оценивать прогноз протоковой аденокарциномы поджелудочной железы по сравнению со стандартной.
3. При расширенных ПДР значимо ниже число нерадикальных операций и местных рецидивов заболевания, чем при стандартных.
4. У пациентов с размером опухоли от 2 до 4 см, а также при локализации опухоли в крючковидном отростке большая продолжительность жизни отмечена после расширенных ПДР.
3
5. Определение ИОК в костном мозге при помощи антител к цитокератинам не является специфичной методикой. Для достижения этой цели требуется поиск новых маркеров и новых способов выявления ИОК.
Апробация работы
Основные положения и результаты проведенного исследования доложены на следующих научных конференциях и симпозиумах: «Хирургическое лечение рака поджелудочной железы». П-я Международная научно-практическая конференция хирургов и урологов «Высокие технологии в медицине», г. Нижний Новгород, 15 -16 мая 2008; «Непосредственные результаты расширенных и стандартных панкреатодуоденальных резекций» Международный конгресс по онкохирургии, г. Краснодар, 28 мая -1 июня 2008 г. ;«Рак поджелудочной железы или локальная форма аутоиммунного панкреатита. Можно ли поставить диагноз до операции?». Международный конгресс по онкохирургии, г. Краснодар, 28 мая -1 июня 2008 г.; «Безопасно ли расширение границ панкреатодуоденальной резекции при опухолях билиопан-креатодуоденалыюй зоны?» VIII межрегиональная научно — практическая конференция «Актуальные вопросы интервенционной радиологии», г. Владикавказ, 26 — 27 июня 2Ó08 г.; «Непосредственные результаты стандартных и расширенных панкреатодуоденальных резекций», Межрегиональная научно — практическая конференция «Актуальные проблемы хирургического лечения заболеваний печени, желчных путей и поджелудочной железы», г. Рязань, 25 сентября 2008 г.; «Непосредственные результаты расширенных и стандартных панкреатодуоденальных резекций при протоковой аденокарци-номе поджелудочной железы»ХУ Международный Конгресс хирургов — ге-патологов стран СНГ «Актуальные проблемы хирургической гепатологии», г. Казань, 17-19 сент 2008 г.; «Непосредственные результаты стандартных и расширенных панкреатодуоденальных резекций». Научно — практическая конференция хирургов Московской области «Хирургия 21 века: актуальные вопросы диагностики и лечения»,г. Раменское, 10 октября 2008 г.
Публикации
По теме диссертации опубликовано 19 научных работ.
Структура диссертации Диссертационная работа изложена на 160 страницах машинописного текста. Состоит из введения, 4 глав, выводов, практических рекомендаций и списка
литературы, который включает 52 отечественных и 219 зарубежных источников. Диссертация иллюстрирована 35 таблицами, 36 рисунками.
ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ОБСЛЕДОВАНИЯ
В основу клинического раздела работы положен сравнительный анализ хирургического лечения 60 пациентов с гистологически доказанной протоко-вой аденокарциномой головки поджелудочной железы, госпитализированных в отдел абдоминальной хирургии ФГУ Институт хирургии им. А.В.Вишневского за период с 2004 по 2008 год.
План исследования предполагал анализ ближайших и отдаленных результатов 30 стандартных и 30 расширенных последовательно выполненных панкреатодуоденальных резекций. Набор больных был прекращен после достижения их запланированного количества в анализируемых группах. Группы были сопоставимы по полу и возрасту. Средний возраст пациентов в группе пациентов со стандартной лимфаденэктомией составил 58,7±8,9 лет (от 36 до 76 лет), в группе радикальных и расширенных радикальных ПДР 55,8±6,39 (от 45 до 74 лет).
Стадирование рака поджелудочной железы проводили по TNM классификации Международного противоракового Союза (UICC 2002 г). Всем пациентам до операции определена стадия II (А -В) в связи с невозможностью дифференцировать неспецифическую и опухолевую лимфаденопатию. При обследовании ни в одном случае не выявлено признаков вовлечения в опухоль артериальных стволов.
Дооперационная комплексная диагностика включала определение уровня онкомаркера СА 19-9, ультразвуковое исследование брюшной полости, компьютерную томографию, эндоскопические методы. Всем пациентам с желтухой при уровне билирубина более 150 мкмоль/л первым этапом выполнялась декомпрессия желчных путей.
Объем вмешательства определялся до операции в зависимости от размеров опухоли, вовлечения сосудов и окружающих тканей, и окончательное решение принималось интраоперационно, исходя из возможности выполнения RO-резекции. Лимфодиссекция по ходу висцеральных артерий выполнялась после удаления панкреатодуоденального комплекса.
Использовались несколько модификаций панкреатодигестивного анастомоза (ПДА). Все анастомозы накладывались на одной петле и не стенти-ровались.
При ограниченном вовлечении сосудов в опухолевый процесс выполнялась их резекция. В группе расширенных операций резекция сосудов выполнена у 9 пациентов, при стандартной ПДР — у 1 пациента.
Таблица 1
Вид ПДР Стандартные Расширенные Всего
ГПДР 11(36,7%) 15(50%) 26 (43,3%)
пПДР 19(63,3%) 15 (50%) 34 (56,7%)
Всего 30 30 60 (100%)
Во время операции производилась макроскопическая оценка удаленного препарата оперирующим хирургом и ассистентами для исключения 112-резекции. Морфологические исследования удаленных препаратов и био-псийного материала проводилось в отделе патоморфологии Института хирургии им. А.В.Вишневского. Для срочного гистологического исследования описывалась макроскопическая картина, маркировались границы резекции и участки, подозрительные на наличие опухоли. Удаляемые лимфатические узлы маркировались по группам (6-16). Отдельно исследовались задняя поверхность и срезы поджелудочной железы, желчного протока, двенадцатиперстной кишки и край’ препарата, прилежащий к правой стороне верхней брыжеечной артерии.
Определение изолированных опухолевых клеток в костном мозге Характеристика пациентов и метода
У 27 пациентов с подозрением на рак поджелудочной железы производилась пункция костного мозга с целью обнаружения изолированных опухолевых клеток. Нозология заболеваний этой группы больных представлена в
таблице 2.
Таблица 2
Заболевания, при которых был исследован костный мозг_
Нозология Количество пациентов
Протоковая аденокарциномаПЖ 15 (55,6%)
Аденокарцинома БДС 2 (7,4%)
Солидно-псевдопапиллярная карцинома 3(11,1%)
Хронический панкреатит 2 (7,4%)
НЭО 2 (7,4%)
Внугрипротоковая муцинозно-папиллярн опухоль 2(7,4%)
Серозная цистаденома 1 (3,7%)
Всего 27 (100%)
При протоковой адеиокарциноме ПЖ шести (40%) пациентам выполнены паллиативные операции в связи с диссеминацией процесса и 9 -расширенные радикальные вмешательства.
Для выделения из костного мозга клеток, экспрессирующих цитокера-тины, использован набор «Carcinoma Cell Enrichment and Detection Kit» фирмы Miltenyi Biotec. Для получения первичных культур использовали метод ферментативного переваривания тканей коллагеназой с последующим культивированием в среде Дульбеко-Хэм F12. Исследования морфологии клеток культур и маркёров их дифференцировки проводили методами фазово-контрастной и флюоресцентной микроскопии с использованием микроскопов Nikon Eclipse TE2000U и Zeiss Axiophot с цифровой камерой Micromax (Princeton Instruments, США). Для иммуногистохимического исследования использовали парафиновые срезы толщиной 3-4 мкм. Определение уровня цитокинов и ростовых факторов в кондиционированных средах проводили на приборе GENios Pro (Тесап, Австрия) с помощью коммерческих ELISA наборов Quantikine компании R&D Systems (США). Препараты суммарной РНК из полученных культур стромальных клеток и аспирата костного мозга получали с помощью стандартного метода с использованием Trizol реагента (Invitrogen, США). Синтез первых цепей кДНК проводился согласно стандартному протоколу, используя гексануклеотидный праймер («Promega», США) и обратную транскриптазу PowerScript («Clontech», США). Продукты PCR анализировали электрофорезом. Различия в уровне транскрипции оценивали минимальным числом циклов, достаточных для надежного определения продукта PCR.
Для статистической обработки информации использовали пакет статистических программ STATISTICA фирмы StatSoft Inc. (USA). Результаты гистологического исследования препаратов после стандартных и расширенных ПДР
Группы были сопоставимы по степени дифференцировки опухоли (табл. 3). Среднее количество удаленных лимфатических узлов (л/у) составило 28±3 при расширенной операции и 16±4 при стандартной (р=0,04).
После стандартных ПДР метастазы в л/у выявлены у 21 пациента (70%), после расширенных у 25 пациентов (83,3%)(р=0,2). В группе стандартных операций при обнаружении метастазов в регионарных л/у, изменения происходили только внутри II стадии заболевания (переход IIa во IIb стадию).
7
Таблица 3
Степень дифференцировки опухоли в исследуемых группах
Вид ПДР Высоко Дифференцированные (Gl) Умеренно дифференцированные (02) Низко-дифферен цирован ные (G3) Недиф-ференци-рован пые (G4) Смешанный рак (СР) Итого
Стандартные ПДР 4 (13,3%) 18 (60%) 4 (13,3%) 2 (6,6%) 2 (6,6%) 30
Расширенные ПДР 4 (13,3%) 19 (63,3%) 6 (20%) 0 1 (3,3%) 30
Всего 8 (13,3%) 37 (61,7%) 10 (16,7%) 2 (3,3%) 3 (5%) 60 (100%)
Из 25 пациентов с метастатическим поражением л/у в группе расширенных операций у 14 (46,6%) метастазы выявлены только в регионарных л/у (т.е. произошло изменение внутри II стадии заболевания), у 9 (30%) больных помимо регионарных выявлены метастазы в парааортальных л/у (что изменило стадию заболевания на четвертую), и у 2 (6,6%) выявлены метастазы в регионарных и в юкстарегионарных л/у, что также изменило стадию заболевания на четвертую. Стадии заболевания установленные после операции указаны в таблице 4.
Таблица 4
Распределение по стадиям в исследуемых rpynnax((AJCC) 2002)
Стадия Стандартные Расширенные всего
Стадия IA 5(16,7%) 0 5 (8,3%)
Стадия IB 0 1 (3,3%) 1 (1,7%)
Стадия НА 3 (10%) 5 (16,7%) 8(13,3%)
Стадия IIB 22(73,3%) 13 (43,3%) 35 (58,4%)
Стадия III 0 0 0
Стадия IV 0 11(36,7%) 11(18,3%)
Всего 30 (100%) 30(100%) 60 (100%)
В отношении распределения по стадиям группы стали достоверно различаться после операции по IIЬ и IV стадии (р=0,0005).
При стандартных операциях резекции 110 была выполнена у 18(60%) пациентов, при расширенных — у 25 (83,3%) (р=0,04), 112- резекций не было, так как при вовлечении вен всегда производилась их резекция, и в одном случае потребовалась резекция ВБА.
Средний размер опухоли в группе стандартных операций составил 37,3±16,1 мм (от 15 до 80мм), в группе радикальных 42±11,9 мм (от 25 до
70мм) (р=0,2). Размер опухоли до 2 см (Т1) при стандартных операциях встретился в 5(16,6%) случаях, в группе радикальных операций опухолей до 2 см в диаметре не было.
При стандартных операциях экстрапанкреатическая периневральная инвазия (ЭПИ) выявлена у 19 (63,3%), а при расширенных — у 20 (66,6%) больных (р=0,7).
Результаты гистологического исследования опухоли у пациентов, которым проводилось исследование костного мозга
При протоковой аденокарциноме 9 пациентам выполнены резекции поджелудочной железы и 6 — паллиативные вмешательства в связи с отдаленными метастазами. У 5 пациентов аденокарцинома была низко — и у 4 — уме-реннодифференцированной. При паллиативных операциях диагноз аденокар-циномы подтвержден без указания степени дифференцировки опухоли. При солидно-псевдопапиллярной карциноме у двух пациенток были множественные метастазы в печени, у одной — опухолевый тромбоз селезеночной вены и прорастание в желудок и ворота селезенки. При этом поражения л/у не отмечено ни в одном случае.
При раке большого дуоденального сосочка, аденокарцинома в одном случае была высоко-, а во втором — умереннодифференцированной, метастазов в л/у не выявлено. В двух случаях выявлена высокодифференцированная нейроэндокринная карцинома без метастатического поражения л\у. Непосредственные результаты лечения
Непосредственные результаты расширенных и стандартных операций сравнивались по следующим параметрам: время операции, объем кровопоте-ри и трансфузии препаратов крови, резекция сосудов, уровень летальности и послеоперационных осложнений, послеоперационный койко-день, а также до- и послеоперационная концентрация альбумина и псевдохолинэстеразы.
Для определения влияния периоперационного уровня альбумина на частоту послеоперационных осложнений определялась его концентрация в первые 5 дней после операции. Уровень альбумина и общего белка достоверно не отличался в обеих группах до- и после операции, равно как и уровень псевдохолинэстеразы, как при осложненном, так и при неосложненном послеоперационном периоде.
Объем кровопотери, перелитой эритроцитарной массы и плазмы достоверно не отличался в обеих группах, а продолжительность расширенных операций была значимо больше (р=0,00007) (табл. 5.)
Таблица 5
Периоперационные параметры в исследуемых группах
Вид ПДР Время операции (мин) Кровопотеря (мл) Трансфузия эр.массы (мл) Трансфузия плазмы (мл)
Расширенная ПДР 511± 73 1445±1043 557±445 1169±698
Стандартная ПДР 405±115 1225±818 412±313 988±465
Р 0,00007 0,36 ОД 0,14
В послеоперационном периоде умерло 3 (10%) пациента в группе расширенных операций и 4 (13,3%) — в группе стандартных (р>0,05). При резекции вен умерли 2 пациента (20%). Общий уровень послеоперационной летальности составил 11,6%. Летальность, послеоперационные осложнения и послеоперационный койко-день не различались в обеих группах (табл. 6 и 7).
Таблица 6
Летальность и осложнения в исследуемых группах
Показатели Стандартная ПДР Расширенная ПДГ Р Всего
Летальность 4(13,3%) 3 (10%) >0,05 7(11,6%)
Осложнения 24 (80%) 21 (70%) 0,5 45 (75%)
Хирургические осложнения 23 (76,6%) 18(60%) 0,4 41(68,3%)
Таблица 7
Хирургические осложнения в исследуемых группах
Осложнения Стандартная ПДР Расширенная ПДР Р Всего
Хирургические осложнения 23 (76,6%) 18 (60%) >0,05 40 (66,6%)
Несостоятельность ПДА 7 (23,3%) 0 0,004 7(11,6%)
Несостоятельность БДА 2 (6,6%) 1(3,3%) >0,05 3 (5%)
Гастростаз 15 (50%) 5 (16,6%) 0,006 20 (33,3%)
Панкреатит 5 (16,6%) 1 (3,3%) 0,08 6(10%)
Внутрибрюшное кровотечение 1 (3,3%) 3 (10%) >0,05 4 (6,6%)
Внугрибрюшной абсцесс 1 (3,3%) 0 >0,05 1 (1,6%)
Жидкостное скопление 3(10%) 2 (6,6%) >0,05 5 (8,3%)
Нагноение раны 2 (6,6%) 0 >0,05 2 (3,3%)
Диарея 0 7 (23,3%) 0,004 7(11,6%)
Лимфорея 1 (3,3%) 7 (23,3%) >0,05 8 (13,3%)
Перфоративная язва желудка 0 1 (3,3%) >0,05 1 (1,6%)
Ранняя спаечная непроходимость 0 1 (3,3%) >0,05 1 (1,6%)
ЖКК(о.эрозии) 2 (6,6%) 3 (10%) >0,05 5 (8,3%)
Несостоятельность ПДА была самой частой причиной хирургических послеоперационных осложнений в группе стандартных ПДР, где она выявлена у 7 пациентов (23,3%). В то же время, в группе расширенных ПДР несостоятельность ПДА не выявлена.
При унивариантном анализе несостоятельность ПДА не зависела от диаметра ГПП (р=0,08), состояния паренхимы остающейся части ПЖ (р=0,8), дооперационного уровня общего белка и альбумина. Только техника наложения анастомоза в нашем исследовании оказывала достоверное влияние на частоту развития несостоятельности ПДА (р=0,001). При использовании 2-х рядного терминолатерального панкреатоеюноанастомоза с прецизионным вшиванием протока и однорядного инвагинационного анастомоза конец-в-конец не отмечено ни одного случая несостоятельности анастомоза.
Гастростаз отмечен в 5 (16,6%) случаях после расширенной и в 14 (46,6%) — после стандартной ПДР, после ППДР у 12 (34,2%) больных и после ГПДР — у 8 (32%) (р=0,85). При несостоятельности ПДА и панкреатите гастростаз зарегистрирован у 5 пациентов (41,6%). При отсутствии панкреатита и несостоятельности ПДА при ППДР гастростаз отмечен у 7(20%) пациентов, а при ГПДР — у 8 (32%). Среди пилоросохраняющих операций 41,6% случаев гастростаза развилось на фоне несостоятельности ПДА (р=0,02). Из этого следует, что сохранение привратника не увеличивает риск развития гастростаза.
Таблица 8
Причины релапаротомни в исследуемых группах
Причина релапаротомии Стандартная ПДР Расширенная ПДР Итого
Внутрибрюшное кровотечение 1(3,3%) 3 (10%) 4 (6,7%)
Несостоятельность ПДА 1 (3,3%) 0 1(1,7%)
Желчный перитонит 1 (3,3%) 0 1 (1,7%)
Перфорация острой язвы 0 1 (3,3%) 1 (1,7%)
Ранняя спаечная непроходимость 0 1 (3,3%) 1 (1,7%)
Эксплоративная лапаротомия 0 1 (3,3%) 1 (1,7%)
Всего 3 (10%) 6 (20%) 9(15%)
Длительность послеоперационного пребывания в стационаре в анализируемых группах достоверно не отличалась (табл.9).
Таблица 9
Средний послеоперационный койко-день в исследуемых группах _
К/д при различных параметрг Стандартная Расширенная В целом
Средний к/д 21,8±10,9 21,9±6,9 21,9±9,1
Осложненное течение 23,7±11,4 24±7Д 23,9±9,6
Неосложненное течение 14,1±2,7 17,3±2,9 16±ЗД
При несостоятельности ПДА 28,1±15,7 28,1±15,7
При отсутствии несостоятельности 19,9£8,5 21±7,6
При гастростазе 26,4±12,5 23±8,2 25,5±11,4
Без гастростаза 17,3±6,9 21,7±6,7 20±7
Специфическими осложнениями расширенных операций были диарея и лимфорся. Диарея и лимфорея при расширенных операциях отмечены в 7 случаях (23,3%), для каждого осложнения. После стандартных операций только у одного пациента наблюдалась лимфорея в течение 2-х недель.В группе расширенных ПДР релапаротомия потребовалась шести пациентам (20%), а в группе стандартных — двум (6,6%) (табл. 8). Отдаленные результаты стандартных и расширенных ПДР. Оценка значимости факторов прогноза при стандартных и расширенных ПДР
Мы проследили результаты лечения 53 пациентов в сроки от 6 до 68 мес. При анализе отдаленных результатов 3-х и 5-тилетняя актуриальная выживаемость в общей группе составила 12%, 1-летняя 45%, 2-х летняя 34%, медиана выживаемости (МВ) 13,4 мес. (рисунок 1)
:9с
о ю га за 40 50
продолжительность жизни ■ ме
Рис. 1. Актуриальная выживаемость в общей группе. При оценке актуальной(фактической выживаемости) 1 летняя выживаемость составила 43,3%, 2-х летняя — 21,6%, 3-х летняя — 5%, 5-летняя -1,6%, и еще
13 пациентов находятся в процессе наблюдения на разных сроках после операции без признаков рецидива. Несмотря на то, что достоверного влияния расширенной лимфодиссекции на выживаемость в общей группе не выявлено (р=0,3, МВ при расширенных операциях составила 12 мес., при стандартных -10 мес.), 3-х и 5-ти летняя выживаемость достигнута только после расширенных ПДР.
Влияние объема операции на выживаемость в зависимости от стадии заболевания. Обнаружено, что при II стадии лимфодиссекция значимо влияет на выживаемость (р=0,007), Общая МВ 11,5 мес., при стандартных операциях — 9 мес., при расширенных — 19 мес.
Расширение объема лимфодиссекции достоверно влияло на выживаемость при II Ь стадии (р=0,006): МВ при расширенных операциях составила 16,5 мес., и 9 мес,- при стандартных. Это может быть связано как с преимуществами лимфодиссекции, так и со скрытой IV стадией среди пациентов в группе стандартных операций.
Анализ внутри I и IV стадии не проводился из-за малого количества пациентов в каждой группе. Первая стадия установлена 6 (10%) больным. У 5 (8,3%) из них диагностирована 1а, и у одного (1,6%) — 1Ь стадия. Пациенту с 1Ь стадией выполнена расширенная операция. По данным на февраль 2009 года он жив спустя 68 месяцев после операции без признаков рецидива. Пациенты с I а стадией живы в сроки от 18 до 22 мес. без признаков рецидива. Следует отметить, что у 4 (66,6%) пациентов с I стадией опухоль была высоко-, и у 2 (33,3%) умереннодифференцированной. Ни у одного из этих больных не выявлено ЭПИ.
После операции IV стадия заболевания диагностирована у 11 пациентов после расширенных ПДР, вследствие обнаружения метастазов в отдаленных л/у. Максимальная продолжительность жизни этих больных составила 13 мес., и 9 (81,8%) пациентов умерли в течении года. Два пациента, при появившихся в последствии метастазах в печени, живы спустя 6 и 10 мес. после операции. При IV стадии не выявлено высокодифференцированных форм опухоли, у 4 (36,3%) больных обнаружена низко-, у 6 (54,5%) — умеренно- и у одного(9%) — низкодифференцированная аденокарцинома и недифференцированный полиморфноклеточный рак (диморфный рак). ЭПИ выявлена у 9 (81,8%) пациентов с IV стадией.
В общей группе экстрапанкреатическая периневральная инвазия
достоверно влияла на продолжительность жизни (р=0,001), МВ без ЭПИ (п=20) составила 19,5 мес., при ее наличии (п=31) — 10 мес. В группе расширенных операций ЭПИ также достоверно влияла на выживаемость (р=0,001). МВ при ее наличии (п=17) составила 11 мес., без нее (п=10) — 24 мес. В группе стандартных операций достоверного влияния ЭПИ на выживаемость не отмечено (р=0Д), что может быть связано с недостаточным удалением тканей вокруг головки и ВБА.
По данным литературы, чаще всего причиной Ш резекций является именно экстрапанкреатическая периневральная инвазия (Макао А, 2004; §акашаТ, 1992; Ыакао А, 1996). В нашем исследовании при корреляционном анализе в общей группе отмечена достоверная связь между статусом Я и ЭПИ (р=0,0003). У всех пациентов с Ш резекцией выявлена ЭПИ. При наличии ЭПИ резекция 110 при расширенных операциях выполнена у 60% больных, а при стандартных только у 38,8%. Это объясняется скелетированием висцеральных артерий и удалением забрюшинной клетчатки, нейро- и лим-фодиссекцией. Можно было бы предположить, что при Ш будет преобладать местный рецидив заболевания. Однако, оказалось, что это предположение подтверждается только в случаях расширенных ПДР (табл. 10).
Таблица 10
Частота местного рецидива заболевания в исследуемых группах
Статус резекции Общая группа Стандартные Расширенные
ЯО 29,7% 60% 9%
Я1 54,4% 57% 50%
Р Р=0,03 РХ),05 Р=0,004
Это, вероятнее всего, свидетельствует о более радикальном удалении пораженных тканей при расширенных операциях, а так же о неадекватной оценке краев резекции при стандартных операциях.
Если статус Я зависит преимущественно от ЭПИ, то частота местного рецидива при ЭПИ и Ш -резекции должна иметь близкие значения. Однако, по нашим данным развитие местного рецидива не зависело от ЭПИ (табл. 10 и 11): при стандартных ПДР рецидив возникал в 66-69% случаев, при расширенной в 11-17% случаев. Это может объясняться удалением большего массива перипанкреатических и перивазальных тканей при расширенных ПДР, а так же невозможностью адекватной оценки ЭПИ при стандартных ПДР.
Корреляционный анализ показал, что при экстрапанкреатической пери-невральной инвазии значимо чаще выявлялся отдаленный рецидив заболевания (табл. 12). Очевидно, это связано с естественным развитием опухоли, что подтверждает анализ зависимости частоты ЭПИ от размеров опухоли (р=0,001). ЭПИ выявлена в 62,5% случаев при размере опухоли от 2 до 4 см, в 82,6%- при размерах более 4 см и отсутствовала при опухолях менее 2 см. Кроме того, ЭПИ выявлена у 78,2% пациентов с метастазами в л/у, и не обнаружена у 78,5% пациентов без метастазов в л/у.
Таблица 11
Частота местного рецидива в зависимости от ЭПИ
ЭПИ Общая группа Стандартные ПДР | Расширенные ПДР
Есть ЭПИ 40% 69,2% 17,6%
Нет ЭПИ 27,7% 66,6% 11,1%
Таблица 12
Частота отдаленного рецидива в зависимости от ЭПИ
ЭПИ Общая группа Стандартные ПДР Расширенные ПДР
Есть ЭПИ 70% 69,9% 70,5%
Нет ЭПИ 33,3% 33,3% 33,3%
Веские аргументы в пользу того, что периневральная инвазия и лимфо-генное метастазирование являются независимыми процессами (Капе Н. 1986: ТакаЬазЫ Т, 1997), не нашли подтверждения в нашей работе. Мы объясняем это прогрессированием ЭПИ, связанной с развитием опухоли, в т.ч. ее лим-фогенным метастазированием. Это подтверждает достоверная корреляция размеров опухоли с метастатическим поражением л/у (р=0,003) (табл. 13). То есть ЭПИ и метастазы в л\у могут развиваться независимо друг от друга, но
оба этих фактора зависят от размера опухоли.
Таблица 13
Взаимосвязь между размером опухоли и метастатическим поражением л/у_
Размер опухоли Общая грл ■ппа Стандартная ПДР Расширенная ПДР
N0 N1 N0 N1 N0 N1 N2
До 2 см 100% — 100% —— — —
2-4 см 28,1% 71,8% 25% 75% 31,2% 43,7% 25%
Более 4 см 0% 100% 0% 100% 0% 50% 50%
Р 0,003 0,0003 0,03
Размер опухоли
Как и в других работах, в нашем исследовании размер опухоли оказывал достоверное влияние на выживаемость (р=0,03). МВ в общей группе при опухолях Т1 составила 20 мес.ргазоЬсЬа! в., 2008; МапаЬе Т., 1988). При размере опухоли от 2 до 4 см и более 4 см различий в отношении степени диффе-ренцировки не выявлено. Высокодифференцированные опухоли составили 9,3% и 8,7%, соответственно, умереннодифференцированные -62,5% и 65,2%, низко- и недиференцированные — 21,8% и 21,7%, смешанный рак -6,2% и 4,3%.
Степень дифференцировки опухоли. Продолжительность жизни при высо-кодифференцированных опухолях была достоверно выше чем при менее дифференцированных(р=0,01): МВ — 24 и 11 мес. Сравнение выживаемости при опухолях с различной степенью дифференцировки не выявило преимуществ расширенной лимфодиссекции(р=0,4).
Таблица 14
Соотношение между размером опухоли и степенью диф< »еренцировки
Степень дифференцировки До 20 мм От 20 до 40 мм Более 40 мм Всего
Высокодифференцированные 3 (37,5%) 3 (37,5%) 2 (25%) 8 (13,3%)
Умереннодифференцированщ 2 (5,5%) 20 (54%) 15 (40,5%) 37 (61,7%)
Низкодифференцированные 0 5 (50%) 5 (50%) 10(16,7%)
Недифференцированные 0 2 (100%) 0 2 (3,3%)
Смешанные 0 2 (66,7%) 1 (33,3%) 3 (5%)
Всего 5 (8,3%) 32 (53,3%) 23 (38,3%) 60(100%)
Из таблицы 14 видно, что, несмотря на то, что 60% опухолей размером менее 2 см были высокодифференцированными, они примерно с одинаковой частотой встречались и при других размерах. При высокодифференцированных опухолях размер ее не оказывал влияния на выживаемость (р=0,4), что может говорить о том, что степень дифференцировки новообразования может оказаться более важным фактором прогноза чем его размер. При высоко-дифференцированных опухолях статистически реже отмечалась ЭПИ, метастазы в л/у и отдаленный рецидив заболевания (табл. 15 и 16).
Таблица 15
Взаимосвязь между степенью дифференцировки опухоли, поражением л/у и пери-невралышй инвазией___
Степень дифференцировки опухолей Поражение регионарных л/у Экстрапанкреатическая периневральная инвазия
Высоко дифференцированные 37,5% 37,5%
Умереннодифференцированные 81% 62,1%
Низкодифференцированные 90% 100%
Недифференцированные 100% 100%
Смешанные 66,6% 33,3%
Таблица 16
Взаимосвязь между степенью дифференцировки опухоли и структурой рецидива заболевания
Степень дифференцировки опухолей Нет рецидива Местный Отдаленный Комбинированный
Высокодифференцированные 42,8% 28,5% 14,2% 14,2%
Умереннодифференцированные 32,1% 17,8% 39,2% 10,7%
Низкодифференцирован ные 12,5% — 50% 37,5%
Недифференцированные — 50% — 50%
Смешанные — — 66,6% 33,3%
В нашем исследовании поражение регионарных л/у оказывало досто-
верное влияние на выживаемость (р=0,0005): МВ при N0 составила 22 мес., при N1 — 10,5 мес. Как было показано, частота поражения л/у связана с размером и степенью дифференцировки опухоли (р=0,06). Поражение л/у выявлено в 37,5% наблюдений при высокодифференцированных, в 81% — при умеренно -, в 90% — при низко-, в 100% — при недифференцированных опухолях и при смешанном раке — в 66,6%.
Поражение л/у одинаково достоверно влияло на продолжительность жизни как при стандартных, так и при расширенных операциях (р=0,01). Однако МВ при отсутствии метастазов в л/у в группе стандартных операций составила 19 мес., а в группе расширенных 40 мес. (р=0,3). При выявлении по-
ражения л/у вообще (без разделения на регионарные и отдаленные), не выявлено различий в продолжительности жизни после стандартных (МВ 8,5 мес.) и расширенных (МВ 11,5 мес) ПДР (р=0,1). В то же время, при поражении только регионарных лимфоузлов продолжительность жизни после расширенных операций была значимо больше. Это может объясняться как преимуществами расширенной лимфодиссекции при поражении регионарных л\у, так и неадекватным стадированием при стандартных операциях.
Метастазы в отдаленные л/у оказались значимым фактором прогноза в группе расширенных операций, так как при стандартных операциях они не оценивались. МВ при поражении отдаленных л/у составила 11 мес, и 81,8% пациентов умерли в течении года. Это соответствует данным, полученным другими авторами (УовЫёа Т., 2004; Оо1 Я., 2007).
Локализация опухоли. По данным некоторых авторов локализация опухоли в крючковидном отростке является неблагоприятным прогностическим фактором (Коханенко Н.Ю., 2001). В нашем исследовании ни при стандартных, ни при расширенных ПДР это не подтвердилось. Оказалось также, что при локализации опухоли в крючковидном отростке отмечена большая продолжительность жизни после расширенных операций (р=0,02). Это, вероятно, объясняется тем, что при поражении крючковидного отростка достаточно рано развивается экстрапанкреатическая периневральная инвазия, которая распространяется, инфильтрируя связку крючковидного отростка, вдоль ВБА. Нейро- и лимфодиссекция вдоль ВБА, выполняемая при расширенных ПДР, может объяснить полученные результаты.
Нами не получено достоверных отличий в выживаемости при сравнении ГПДР и ППДР, МВ при ППДР составила 12 мес., при ГПДР — 11 мес. (р=0,б). В группе стандартных операций МВ при ГПДР была 8 мес., при ППДР — 12мес.(р=0,1). При расширенных операциях разницы в выживаемости при ГПДР и ППДР также не получено (р=0,6): МВ при ГПДР и ППДР составила 12 мес.
Не отмечено влияния на выживаемость «больших» послеоперационных осложнений (р=0,5): несостоятельность анастомозов, панкреонекроз, га-сгростаз, тяжелая диарея и других осложнений, повлекших за собой тяжелые функциональные нарушения и увеличение сроков пребывания в стационаре. МВ у пациентов с послеоперационными осложнениями составила 12 мес., без них- 11,5 мес.
Всем больным была рекомендована адъювантная химиотерапия (ХТ). Однако, в силу различных обстоятельств, не зависящих от исследователей, химиотерапию гемзаром получили только 80% больных, при значительных колебаниях времени проведения и дозы. ХТ оказывала достоверное влияние на выживаемость в группе расширенных операций с тенденцией к увеличению продолжительности жизни при выполнении более 2 курсов ХТ(р=0,005; МВ при использовании адъювантной ХТ составила 13 мес., при отсутствии 7 мес.), в то время как при стандартных операциях достоверного влияния ХТ на выживаемость не получено (р=0,4; МВ при проведении ХТ(п=16) составила 10,5 мес., без ХТ (п=6) 10 мес.).
Это может говорить о возможно большей эффективности ХТ после расширенных операций, что связано с более полным удалением опухолевой ткани при расширенных операциях. Это подтверждают данные, полученные при оценке эффективности ХТ в зависимости от радикальности выполненной операции: МВ при КО составила 14 мес., при Ш-10 мес. (р=0,01). Такие же данные получены при оценке эффективности ХТ в зависимости экстрапанкреатической периневральной инвазии: МВ при ЭПИ МВ составила 11 мес., без нее 22 мес.(р=0,005).
Из-за малого количества наблюдений оценить степень влияния ХТ на выживаемость при I и II а стадии было невозможно. Не выявлено достоверного влияния ХТ на выживаемость при II Ь стадии (р=0,1), в то время как при 4 стадии это влияние зафиксировано (р=0,04). МВ при проведении ХТ составила 11 мес., без нее — 3 мес. В общем, малая выборка больных не позволяет сделать вывод об эффективности адъювантной химиотерапии.
Объем перелитой эритроцитарной массы в нашем исследовании не оказывала влияние на продолжительность жизни (р=0,9), ровно как и объем кровопотери (р=0,4).
Резекция вен, вовлеченных в опухоль, также не оказывала достоверного влияния на выживаемость после ГЩР (р=0,4) при сравнении с ПДР при опухолях той же стадии, но без вовлечения вен. Большинство таких резекций было выполнено при расширенных операциях. Резекции вен были выполнены у 9 пациентов, артерии (ВБА) — у одного. У 3 пациентов диагностирована IV стадия (поражение парааортальных л/у), у 6 — IIЬ и у одного — II а стадия. МВ составила 10,5 мес., два пациента живут 24 мес. без признаков рецидива.
Прорастание интимы выявлено у 3 пациентов. Одна пациентка умерла в послеоперационном периоде на фоне полиорганной недостаточности, два пациента с 4 стадией (метастазы в парааортальных л/у) прожили 2 и 3 мес. и у обоих через месяц после операции выявлены метастазы в печень. После резекции ВБА (прорастание до мышечного слоя) пациентка прожила 13 мес., несмотря на метастатическое поражение парааортальных л/у, и умерла на фоне комбинированного рецидива. Резекция вены при ПДР (при отсутствии прорастания интимы) не влияла на частоту отдаленного рецидива
(Р=0,4).
Стадия заболевания в общей группе достоверно влияла на выживаемость: МВ при IV стадии составила 11 мес., при других стадиях — 13,5 мес. (р=0,03 ). В группе расширенных операций МВ при 4 стадии составила 11 мес., при остальных стадиях — 21,5 мес. (р=0,001).
При анализе структуры рецидивов последние разделялись: на местные (куда включали и регионарные), отдаленные и комбинированные. Структура рецидивов достоверно различалась при стандартных и расширенных операциях (р=0,01). В группе стандартных операций местный рецидив выявлен в 59% случаях, по сравнению с 15,3% — в группе расширенных операций. Отдаленный рецидив выявлен у 54,5% в группе стандартных, и у 57,6% в группе расширенных операций. Из этих пациентов комбинированный рецидив зарегистрирован у 31,8% в группе стандартных и у 7,6% в группе расширенных ПДР.
Мультивариантный анализ показал, что только ЭПИ (р=0,05) и ХТ (р=0,003) влияли на выживаемость.
В процессе исследования мы выявили закономерность клинической картины заболевания, которую считаем необходимым отметить: у 90% больных первым симптомом рака головки ПЖ были дискомфорт или боли в эпигастрии, а механическая желтуха в большинстве случаев появлялась спустя несколько недель или месяцев. При размере опухоли 2 см и менее механическая желтуха была выявлена у 20% пациентов, а при размере опухоли более 2 см — у 85,5%. Это говорит о том, что безболевая желтуха не является первым и ранним симптомом рака головки ПЖ. Ранними симптомами следует считать постоянный или рецидивирующий дискомфорт или боль в эпигастрии, и на них есть смысл ориентироваться для выявления раннего рака ПЖ.
Анализ клинической значимости определения ИОК в костном мозге
Костный мозг исследован у 27 больных, у 15 из которых была диагностирована ПА ПЖ. Изолированные опухолевые клетки (ИОК) в костном мозге (КМ) были выявлены у всех пациентов с ПА.
Шести больным выполнены паллиативные операции в связи с диссе-минацией и девяти выполнены радикальные вмешательства. У б пациентов была диагностирована IIb и у 9 -IV стадия. Анализ выявил корреляцию между количеством определяемых ИОК и стадией заболевания (критерий Пирсона: р=0,03).
Только у одного пациента со II b стадией было выявлено менее 10 ИОК. Этот пациент живет без рецидива 15 месяцев. В группу с количеством ИОК от Юдо 20 входят больные как с II b стадией, так и с IV стадией. Более 20 ИОК в КМ обнаружено только при IV стадии.
Продолжительность жизни больных с количеством ИОК более 10, включая тех, у которых была установлена II b стадия, не превысила 1 года после операции, и в последующем у всех были выявлены отдаленные метастазы. У 5 пациентов с IV стадией, установленной до операции, количество ИОК в костном мозге колебалось от 17 до 50 в 2 мл биоптата. Максимальная продолжительность жизни после паллиативных вмешательств в этой группе составила 3 месяца. У 3 пациентов IV стадия была установлена после расширенных радикальных ПДР на основании выявленного метастатического поражения отдаленных л/у. Количество выявленных ИОК в костном мозге у этих больных колебалось от 5 до 20 и максимальная продолжительность жизни составила 11 мес. Достоверной корреляции между количеством выявленных ИОК и появлением в течение полугода отдаленных метастазов не выявлено (критерий Пирсона: р=0,08). Продолжительность жизни у в группе с количеством ИОК от 10 до 20 оказалась приблизительно одинаковой, несмотря на то, что в нее входили больные как с IV так и с IIb стадией. Это может говорить о большей чувствительности метода для стадирования и прогноза заболевания.
При хорошей чувствительности метода ложноположительные результаты отмечены в двух случаях хронического панкреатита, где были выявлены 20 — 30 цитокератинпозитивных клеток в КМ.
Таким образом, наличие цитокератинпозитивных ИОК в КМ может быть прогностическим фактором при ПА. Однако, специфичность метода яв-
21
ляется серьезной проблемой, поскольку даже в малой выборке отмечаются ложнопозитивные результаты. Работа носит поисковый характер в отношении новых подходов к выявлению диссеминации. Одним из таких подходов является определение альтернативного маркёра, относящегося к эмбриональным факторам транскрипции — гена PDX -1. Выбор этого гена основан на литературных данных, свидетельствующих о том, что метастазам более свойственны эмбриональные белки, чем белки терминальной дифференцировки, к которым относятся цитокератины. В нашем исследовании ИОК выявляли с помощью иммунофлюоресцентной микроскопии во всём биоптате костного мозга после лизиса эритроцитов, для чего нами был разработан специальный протокол. Мы обнаружили, что клетки, содержащие ген PDX -1, были значительно меньше по размеру цитокератин-позитивных. Экспрессия гена PDX -1 в клетках костного мозга также подтверждена методом RT-PCR.
Нами также было показано иммуногистохимически на парафиновых срезах, что активация экспрессии гена PDX -1 происходит во всех исследованных нами случаях аденокарцином, а также при панкреатите, но при панкреатите белок локализован в цитоплазме дифференцированных протоков, а при аденокарциноме — в ядрах мальформированных недиференциированных протоков, а также в отдельных клетках, расположенных в стромальном окружении опухоли. Такое же распределение PDX -1 было обнаружено и в отдалённых метастазах. Клетки с ядерной локализацией существенно меньше дифференцированных эпителиальных клеток по размеру, и их значительно больше в более агрессивных низкодифференцированных опухолях. Т.е., было показано, что клетки, выявленные в первичных опухолях аденокарцином поджелудочной железы и в отдалённых метастазах, обнаруживаются также в костном мозге этих больных, что характеризует ген PDX -1как маркёр мета-стазирования.
Исследование ростовых факторов в кондиционированных средах первичных культур, приготовленных из опухолей оперированных больных, показало. что наиболее значимыми для аденокарцином являются факторы роста TGFbl, HGF и IGF. Эти ростовые факторы известны как индукторы эпите-лио-мезенхимального перехода при добавлении их в культуру клеток, поэтому их обнаружение в кондиционированных средах может свидетельствовать о спонтанном эпителио-мезенхимальном переходе в культурах аденокарцином, способствующем приобретению эпителиальными клетками инвазивных
22
свойств. Процент РБХ -1 позитивных клеток в первичных культурах на первых пассажах был достаточно высок, что показано как иммунофлюорес-центным методом, так и методом ЛТ-РСЯ- Это свидетельствует о влиянии опухолевой стромы не только на регуляцию пролиферативной активности опухолевого эпителия, но и на метастазирование через индукцию мезенхи-малыюго фибробластоподобного фенотипа и дедифференцировку. Выводы
1. Выполнение расширенных ПДР при раке головки поджелудочной железы не увеличивает числа послеоперационных осложнений и летальность по сравнению со стандартными вмешательствами.
2. После расширенных ПДР возможно более точное стадирование прото-ковой аденокарциномы головки поджелудочной железы, чем это происходит после стандартных ПДР
3. Точность прогноза рака при протоковой аденокарциноме поджелудочной железы возрастает после выполнения расширенных ПДР, что обусловлено более детальной оценкой таких прогностических факторов как поражение лимфатических узлов и периневральная инвазия.
4. Расширенная ПДР при протоковой аденокарциноме головки поджелудочной железы позволяет значимо уменьшить число местных рецидивов и увеличить продолжительность жизни при размере опухоли от 2 до 4 см и при ее локализации в крючковидном отростке.
5. Выявляемые в костном мозге при помощи имуноцитохимического окрашивания цитокератин-позитивные клетки могут говорить о метастатическом потенциале опухоли, однако специфичность метода недостаточна для использования в клинической практике.
6. Выживаемость после ПДР с резекцией воротной и (или) верхней брыжеечной вен при их изолированном прорастании опухолью не отличается от выживаемости после ПДР, не потребовавших резекции вен при протоковой аденокарциноме поджелудочной железы той же стадии.
Практические рекомендации
1. При выборе способа ПДА в ходе реконструктивного этапа ПДР предпочтение следует отдавать 2-х рядному терминолатеральному панкреатоеюноа-настомозу с прецизионным вшиванием протока и однорядному инвагинаци-онному анастомозу конец в конец.
2. При опухолях, не распространяющихся на желудок и 12п.к и расположенных вне верхнего полюса головки ПЖ, рекомендуются пилоросохраняющие операции, которые онкологически оправданны и не увеличивают числа послеоперационных осложнений.
3. При размере опухоли от 2 до 4 см и при ее локализации в крючковидном отростке показано выполнение расширенных ПДР.
4. Скелетизация правой стенки ВБА должна стать стандартной процедурой при ПДР по поводу протоковой аденокарциномы головки поджелудочной железы.
5. При вовлечении в опухоль поджелудочной железы воротной и верхней брыжеечной вен показана резекция пораженного участка при отсутствии признаков нерезектабельности.
6. Для выявления рака головки поджелудочной .железы на ранних стадиях всем пациентам старше 40 лет, при болях и (или) дискомфорте в эпигаст-рии или правом подреберье в течение нескольких недель, при отсутствии значимых изменений на УЗИ и ЭГДС, показана четырехфазная KT брюшной полости с в/в контрастированием.
Список опубликованных работ по теме диссертации
1. Егоров В.И., Вишневский В.А., Козлов И.А., Кригер А.Г., Шевченко Т.В., Мелехина О.В. Непосредственные результаты стандартных и расширенных панкреатодуоденальных резекций по поводу протоковой аденокарциномы поджелудочной железы //Анналы хирургической гепатологии.- 2009. — № 1.-С. 24-28
2. Копанцев Е.П., Мелёхина О.В., Копанцева М.Р., Егоров В.И., Сборовская И.Б., МочальниковаВ.В., Виноградова Т.В., Фёдоров A.B., Свердлов Е.Д. Секретируемые ростовые факторы стромальных фибробластов опухолей лёгкого и поджелудочной железы человека //Доклады академии наук. — 2009 (принято в печать)
3. Егоров В.И., Вишневский В.А., Козлов И.А., Кригер А.Г., Шевченко Т.В., Мелехина О.В., Козырин И.А. Непосредственные результаты расширенных резекций поджелудочной желе зы // Материалы V съезда онкологов и радиологов СНГ, 14-16 мая, Ташкент, 2008.- С. 296.
4. Егоров В.И., Вишневский В.А., Икрамов Р.З., Щеголев А.И., Шевченко Т.В., Ефанов М.Г., Дубова Е.А., Мелехина О.В., Козырин И.А. Солидно -
псевдопапиллярные опухоли поджелудочной железы. //Материалы V съезда онкологов и радиологов СНГ, 14-16 мая 2008. Ташкент, 2008,- С. 296.
5. Егоров В.И., Вишневский В.А., Щеголев А.И., Кармазановский Г.Г., Яшина Н.И., Павлов К.А., Пугачева О.Г., Дубова Е.А., Свитина К.А., Мелехина О.В. Можем ли мы дифференцировать рак поджелудочной железы и локальную форму аутоиммунного панкреатита до операции? // Материалы первой международной конференции по торако- абдоминальной хирургии, Москва 5-6 июня 2008, М., 2008,- С.106
6. Егоров В.И., Козлов И.А., Вишневский В.А., Кригер А.Г., Мелехина О.В. Стандартные и расширенные панкреатодуоденальные резекции. Ближайшие послеоперационные результаты. // Материалы первой международной конференции по торако — абдоминальной хирургии, Москва 5-6 июня 2008, М. 2008,-С.106
7. Егоров В.И., Козлов И.А., Вишневский В.А., Кригер А.Г., Мелехина О.В. Непосредственные результаты стандартных и расширенных панкреатодуо-денальных резекций. // Материалы международного конгресса по онкохирур-гии, Краснодар 2008г. 28 мая -1 июня, Краснодар, 2008.- С. 87
8. Егоров В.И., Вишневский В А., Щеголев А.И., Кармазановский Г.Г., Яшина Н.И., Павлов К.А., Пугачева О.Г., Дубова Е.А., Свитина К.А., Мелехина О.В. Рак поджелудочной железы или локальная форма аутоиммунного панкреатита? Можно ли поставить диагноз до операции? //Материалы международного конгресса по онкохирургии, Краснодар 28 мая — 1 июня 2008, Краснодар, 2008,- С. 87
9. Егоров В.И., Вишневский В.А., Щастный А.Т., Шевченко Т.В., Ефанов М.Г., Мелехина О.В., Козырин И.А.Опыт применения двухрядного инваги-национного панкреатоэнтероанастомоза при панкреатодуоденальной резекции. // Материалы XV международного конгресса хирургов — гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии» 17-19 сент., г. Казань, Ж. Анналы хирургической гепатологии, 2008,13.- 3.- С. 161
10. Егоров В.И., Вишневский В.А., Икрамов Р.З., Кармазановский Г.Г., Щеголев А.И., Шевченко Т.В., Ефанов М.Г., Яшина Н.И., Дубова Е.А., Мелехина О.В., Козырин И.А. Солидно — псевдопапиллярные карциномы поджелудочной железы. // Материалы XV международного конгресса хирургов — гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии»
17-19 сент., г. Казань, Ж. Анналы хирургической гепатологии, 2008, 13 — 3.-С.227
11. Егоров В.И., Вишневский В.А., Кармазановский Г.Г., Яшина Н.И., Щего-лев А.И., Дубова Е.А., Шевченко Т.В., Мелехина О.В., Козырин И.А. Возможности методов визуализации для определения объема резекции поджелудочной железы при неинвазивной внутрипротоковой папиллярной муциноз-ной опухоли ветвей главного панкреатического протока. //Материалы XV международного конгресса хирургов — гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии» 17-19 сент., г. Казань, Анналы хирургической гепатологии, 2008.- 13.- З.-С. 226
12. Егоров В.И., Козлов И.А., Вишневский В.А., Кригер А.Г., Икрамов Р.З., Шевченко Т.В., Мелехина О.В., Козырин И.А. Непосредственные результаты расширенных и стандартных резекций поджелудочной железы. //Материалы XV международного конгресса хирургов — гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии» 17-19 сент., г. Казань, Анналы хирургической гепатологии, 2008.- 13.- 3.- С. 226 -227
13. Копанцева М.Р., Фёдоров A.B., Егоров В.И., Кригер А.Г., Копанцев Е.П., Мелехина О.В. Факторы транскрипции в культурах стромальных клеток опухолей поджелудочной железы. //Материалы XV международного конгресса хирургов — гепатологов стран СНГ «Актуальные проблемы хирургической гепатологии» 17-19 сент., г. Казань, Ж. Анналы хирургической гепатологии, 2008.- 13.-3,- С. 57
14. Is it possible to differentiate local forms of autoimmune pancreatitis from pancreatic cancer before surgery? Egorov V.l., Vishnevsky V.A., Schegolev A.I., Karmazanovski G.G., Iashina N.I., Pavlov K.A., Dubova EA., Melehina O.V. Thesis. International Conference on Pancreatology «Pancreatology «From bench to bedside». September 28-29,2007, Tashkent
15. Егоров В.И., Вишневский BA., Мелехина O.B Опыт применения инваги-национного панкреатоэнтероанастомоза после резекций поджелудочной железы. International Conference on Pancreatology «Pancreatology «From bench to bedside». September 28-29,2007.P.71
16. Егоров В.И., Кочатков A.B., Гришанков С.А., Мелехина O.B. Однорядный непрерывный шов в хирургии хронического панкреатита. // Материалы XIV Международного конгресса хирургов-гепатологов России и стран СНГ. — С.Петербург, 19-21 сентября 2007. С-Пб. 2007. -С.66-67
26
17. Молекулярный анализ етромальных фибробластов опухолей поджелудочной железы. Федоров А.В., Копанцева М.Р., Копанцев Е.П., Егоров В.И., Мелехина О.В.// Материалы XIV Международного конгресса хирургов-гепатологов России и стран СНГ. — С.-Петербург, 19-21 сентября 2007. СПб. 2007. -С.78
18. Short-Term Results of Pancreaticodudenectomies Extended at the Expence of Lymphadenectomy, Vascular and Extensive Pancreatic Body Resection. V. Ego-rov, V. Vishnevsky, I. Kozlov, T. Shevchenko, O. Melekhina.// Thesis. Pancrea-tology 2009-Vol. 9, — P. 520
19. Short-Term Results of Pancreaticodudenectomies Extended at the Expence of Lymphadenectomy, Vascular and Extensive Pancreatic Body Resection. V. Egorov, V. Vishnevsky, I. Kozlov, T. Shevchenko, O. Melekhina// Thesis. HPB.-2009-Vol.ll;-P. 118
Подписано в печать:
25.09.2009
Заказ № 2587 Тираж — 100 экз. Печать трафаретная. Типография «11-й ФОРМАТ» ИНН 7726330900 115230, Москва, Варшавское ш., 36 (499) 788-78-56 www.autoreferat.ru
Прогноз рака поджелудочной железы | Johns Hopkins Medicine
Пятилетний коэффициент выживаемости доступен для каждой стадии, но для пациентов и их семей важно понимать, что эти числа представляют собой среднее значение. Все пациенты разные, и то, что работает для одного человека, может не работать для другого, и наоборот.
Безусловно, есть пациенты, которые намного пережили свой прогноз или даже избавились от болезней. И общая выживаемость, хотя и намного ниже, чем при других формах рака, с годами постепенно улучшалась.
Следующая информация о прогнозе относится к прогнозу экзокринного рака поджелудочной железы, в частности аденокарциномы поджелудочной железы, на которые приходится более 90 процентов диагнозов. Другие, менее распространенные типы рака поджелудочной железы могут отличаться. Например, плоскоклеточная аденокарцинома поджелудочной железы связана с очень плохими результатами, а нейроэндокринные опухоли, как правило, имеют лучший прогноз.
Прогноз зависит от стадии диагноза
Долгосрочный прогноз рака поджелудочной железы зависит от размера и типа опухоли, поражения лимфатических узлов и степени метастазирования (распространения) на момент постановки диагноза.Чем раньше будет диагностирован и вылечен рак поджелудочной железы, тем лучше прогноз.
К сожалению, рак поджелудочной железы обычно практически не проявляется или не проявляет никаких симптомов, пока не разовьется и не распространился. Поэтому большинство случаев (до 80 процентов) диагностируются на более поздних, более трудных для лечения стадиях.
Подробнее о стадировании рака поджелудочной железы.
Пятилетняя выживаемость
По сравнению со многими другими видами рака, комбинированная пятилетняя выживаемость при раке поджелудочной железы — процент всех пациентов, которые живут пять лет после постановки диагноза — очень низка и составляет всего 5-10 процентов.Это связано с тем, что гораздо большему количеству людей диагностируется стадия IV, когда болезнь дала метастазы.
Прогноз 4 стадии
Пятилетняя выживаемость рака поджелудочной железы IV стадии составляет 1 процент. Средний пациент, у которого диагностирована поздняя стадия рака поджелудочной железы, будет жить около 1 года после постановки диагноза.
Потенциально излечимо при очень раннем выявлении
Несмотря на общий плохой прогноз и тот факт, что болезнь в большинстве случаев неизлечима, рак поджелудочной железы может быть излечим, если его выявить на очень ранней стадии.До 10 процентов пациентов , которым поставлен ранний диагноз , избавляются от болезней после лечения. Для пациентов, которым поставлен диагноз до того, как опухоль сильно вырастет или распространится, средняя продолжительность жизни при раке поджелудочной железы составляет от 3 до 3,5 лет.
Лучший прогноз при резектабельных опухолях
Пациенты, опухоли которых были обнаружены до того, как они дали метастазы или стали местнораспространенными, как правило, в среднем имеют более длительную выживаемость, поскольку их опухоли обычно можно резецировать (удалять хирургическим путем).
От 15 до 20 процентов всех опухолей поджелудочной железы резектабельны. К ним относятся опухоли стадии I и стадии II. Редко местнораспространенные опухоли стадии III, которые обычно считаются неоперабельными (не подходят для хирургического вмешательства), характеризуются как «пограничные» и могут быть удалены, если у пациента есть доступ к опытному, высококвалифицированному хирургу.
Опухоли все еще могут расти у многих пациентов. Таким образом, в среднем пациенты, опухоли которых были удалены, живут в течение 2,5 лет после постановки диагноза и имеют пятилетнюю выживаемость от 20 до 30 процентов.
Дополнительные факторы, влияющие на выживание
Лечение опухолей
Правильное лечение определенного типа опухоли может повлиять на выживаемость пациента. Большинство крупных центров по лечению рака поджелудочной железы полагаются на команду патологов для определения индивидуального подтипа опухоли и анализа генетической истории пациента. Некоторые химиотерапевтические и иммунотерапевтические препараты могут быть особенно эффективными при одних типах опухолей, но совершенно неэффективными при других.
Подробнее о лечении рака поджелудочной железы.
Физическое состояние после лечения
Правильное питание и поддержание максимальной физической активности в сложившихся обстоятельствах действительно могут повлиять на то, как пациент переносит побочные эффекты лечения и симптомы рака поджелудочной железы.
Более молодые пациенты, как правило, чувствуют себя лучше, потому что у них меньше других состояний, которые могут ограничить выздоровление, но даже пожилые пациенты могут положительно повлиять на свой прогноз, сосредоточив внимание на питании и физических упражнениях.
Поговорите со своим врачом о том, чего ожидать после лечения и что вы можете сделать, чтобы получить наилучший прогноз.
Подробнее о выживаемости при раке поджелудочной железы.
Рак поджелудочной железы: Статистика | Cancer.Net
НА ЭТОЙ СТРАНИЦЕ: Вы найдете информацию о количестве людей, у которых ежегодно диагностируется рак поджелудочной железы. Вы также прочтете общую информацию о том, как пережить болезнь. Помните, что выживаемость зависит от нескольких факторов.Используйте меню для просмотра других страниц.
Каждый человек, страдающий раком поджелудочной железы, индивидуален и имеет разные факторы. Важно обсудить со своим врачом любые вопросы, которые у вас есть относительно общей статистики, представленной ниже, и то, что они могут означать для вас индивидуально.
В этом году примерно у 60 430 взрослых (31 950 мужчин и 28 480 женщин) в Соединенных Штатах будет диагностирован рак поджелудочной железы. Заболевание составляет примерно 3% всех онкологических заболеваний. Рак поджелудочной железы является восьмым по распространенности раком у женщин и десятым по распространенности у мужчин.Уровень заболеваемости раком поджелудочной железы с 2000 года увеличивался ежегодно примерно на 1%.
По оценкам, в этом году произойдет 48 220 случаев смерти (25 270 мужчин и 22 950 женщин) от этой болезни. Это четвертая по значимости причина смерти от рака как у мужчин, так и у женщин. На его долю приходится 7% всех смертей от рака. С 2000 года уровень смертности рос с каждым годом очень медленно.
Как объяснялось во введении, большинство видов рака поджелудочной железы (90%) являются экзокринной аденокарциномой.
Пятилетняя выживаемость показывает, какой процент людей живет не менее пяти лет после обнаружения рака.Процент означает, сколько из 100. Общая 5-летняя выживаемость для людей с раком поджелудочной железы составляет 10%. Показатели выживаемости и индивидуальные исходы зависят от многих факторов, включая конкретную стадию заболевания на момент его диагностирования. Нейроэндокринные опухоли поджелудочной железы (ПНЭО) часто имеют лучший прогноз, что является шансом на выздоровление.
Рак поджелудочной железы часто трудно диагностировать. Это связано с тем, что не существует проверенных специальных скрининговых тестов, которые могут легко и надежно обнаружить рак поджелудочной железы на ранней стадии у людей, не имеющих симптомов.Это означает, что его часто не обнаруживают на более поздних стадиях, когда рак больше не может быть удален хирургическим путем и / или распространился из поджелудочной железы на другие части тела.
Если рак обнаружен на ранней стадии, когда возможно хирургическое удаление опухоли, 5-летняя выживаемость составляет 39%. На этом этапе диагностируется около 11% людей. Если рак распространился на окружающие ткани или органы, 5-летняя выживаемость составляет 13%. Для 52% людей, которым поставлен диагноз после того, как рак распространился на отдаленную часть тела, 5-летняя выживаемость составляет 3%.
Важно помнить, что статистика выживаемости людей с раком поджелудочной железы является приблизительной. Оценка основана на ежегодных данных, основанных на количестве людей с этим раком в Соединенных Штатах. Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет. Поговорите со своим врачом, если у вас есть какие-либо вопросы по поводу этой информации. Узнайте больше о статистике.
Статистика адаптирована из публикации Американского онкологического общества (ACS), Cancer Facts & Figures 2021, веб-сайта ACS и программы по надзору, эпидемиологии и конечным результатам (SEER) Национального института рака (данные доступны в феврале 2021 г.).
Следующий раздел в этом руководстве — Медицинские иллюстрации . Предлагает рисунки частей тела, часто поражаемых раком поджелудочной железы. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Анналы онкологии
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
. Если адрес совпадает с действующей учетной записью, на адрес __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
.Анналы онкологии
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
. Если адрес совпадает с действующей учетной записью, на адрес __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
.Анналы онкологии
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
. Если адрес совпадает с действующей учетной записью, на адрес __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
.Анналы онкологии
Если вы не помните свой пароль, вы можете сбросить его, введя свой адрес электронной почты и нажав кнопку «Сбросить пароль».Затем вы получите электронное письмо, содержащее безопасную ссылку для сброса пароля
. Если адрес совпадает с действующей учетной записью, на адрес __email__ будет отправлено электронное письмо с инструкциями по сбросу пароля
.ученых прогнозируют рост смертности от рака поджелудочной железы и рака прямой кишки с ранним началом
Колоректальный рак становится все более распространенным среди молодых людей и, по прогнозам, станет причиной… [+] ведущая причина смерти от рака у людей в возрасте от 20 до 49 лет к 2040 году.
gettyНовый отчет предсказывает, что колоректальный рак станет ведущей причиной смерти от рака у людей в возрасте от 20 до 49 к 2040 году. Рак поджелудочной железы также станет второй ведущей причиной смерти от рака в целом к 2030 году, обогнав колоректальный рак. за раком легких в первую очередь.
В работе, опубликованной в журнале JAMA Network Open , прогнозируется, что заболеваемость некоторыми видами рака и причина смерти от рака в США в 2040 году будут сильно отличаться от нынешних.К 2040 году в отчете прогнозируется большее число людей с меланомой и больше смертей от рака поджелудочной железы и рака печени. Из лучших новостей следует отметить, что в отчете прогнозируется сокращение числа людей с раком простаты и снижение смертности от рака груди.
Итак, как эти прогнозы могут быть использованы для подготовки к будущему онкологии и онкологической помощи?
«Мы надеемся, что эти оценки привлекут внимание и стимулируют исследовательские усилия к множеству типов рака, особенно к более смертоносным видам рака, таким как рак поджелудочной железы, печени и колоректального рака в более молодой когорте», — сказала Лола Рахиб, доктор философии, ведущий автор отчета и директор Научные и клинические вопросы в Cancer Commons в Маунтин-Вью, Калифорния.
Прогнозы были рассчитаны путем объединения прогнозов роста населения с тенденциями заболеваемости раком и смертностью во всех расовых и этнических группах.
«Прогнозы заболеваемости и смертности от рака чрезвычайно полезны, помогая онкологическому сообществу определить, как оптимально направить свои ресурсы в наиболее нуждающиеся области», — сказал Джеймс М. Клири, доктор медицинских наук, онколог из онкологического института Дана-Фарбер в Бостоне. Массачусетс. «Эти статистические данные помогают руководителям академических кругов, промышленности и финансовых агентств принимать решения о распределении ресурсов и установлении приоритетов на предстоящие годы», — добавил Клири.
Отчет предсказывает, что больше молодых людей умрут от колоректального рака
Одним из наиболее тревожных прогнозов в новом отчете является быстрый рост заболеваемости и смертности от колоректального рака среди людей в возрасте от 20 до 49 лет. После смерти Черной пантеры осведомленность о молодых людях с колоректальным раком неуклонно растет. актеру Чедвику Боузману от болезни 43 года в 2020 году, но исследователи до сих пор не знают, почему растет число молодых людей с этим заболеванием.
«Эти оценки вызывают тревогу, и мы призываем онкологическое сообщество объединиться и работать с защитниками для повышения осведомленности и финансирования исследований, чтобы в конечном итоге добиться прогресса как в терапии, так и в программах скрининга для этой более молодой когорты», — сказал Рахиб.
Возраст скрининга колоректального рака недавно был снижен с 50 до 45 лет, и Рахиб надеется, что это может означать, что фактические цифры окажутся не такими плохими, как прогнозировалось.
«Поскольку этот [более ранний скрининг] будет реализован в ближайшие несколько лет и с повышенным вниманием со стороны этого исследования, мы надеемся, что наши оценки как диагнозов, так и смертей от колоректального рака будут иметь меньшую тенденцию», — сказал Рахиб.
Актер Чедвик Боузман умер от колоректального рака в прошлом году в возрасте 43 лет (Фото Мэтта… [+] Winkelmeyer / Getty Images для CinemaCon)
Getty Images для CinemaCon«В соответствии с другими недавними данными, этот отчет демонстрирует тревожный рост заболеваемости колоректальным раком с ранним началом. Эти статистические данные показывают, что к 2040 году колоректальный рак станет основной причиной смерти от рака у пациентов в возрасте от 20 до 49 лет. Причина увеличения числа случаев заболевания колоректальным раком с ранним началом все еще очень неясна, и в настоящее время ведутся интенсивные широкомасштабные исследования ». — сказал Клири.
Смертность от рака поджелудочной железы и печени будет продолжать расти
«По оценкам, в следующие два десятилетия значительный рост смертности от рака поджелудочной железы и печени продолжится. Увеличение смертности от рака поджелудочной железы является результатом нескольких факторов: Рак поджелудочной железы обычно диагностируется на поздней стадии, когда операция невозможна. Стандартных инструментов скрининга нет, а лечение ограничено. Даже когда пациенты подвергаются хирургическому вмешательству, рак поджелудочной железы часто рецидивирует », — сказал Рахиб.
Показатели выживаемости при раке поджелудочной железы оставались ужасно низкими в течение нескольких десятилетий, и даже новые иммунотерапевтические препараты, которые существенно повлияли на такие заболевания, как меланома, еще не привели к улучшению выживаемости при раке поджелудочной железы.
«К сожалению, подавляющее большинство случаев рака поджелудочной железы и колоректального рака устойчивы к доступным в настоящее время иммунотерапевтическим средствам. По этой причине разработка эффективных иммунотерапевтических стратегий, направленных против «иммунологически холодных» злокачественных новообразований, таких как рак поджелудочной железы и колоректальный рак, широко считается одним из святых Граалей современной онкологии », — сказал Клири.
Смертность от рака груди будет продолжать снижаться, несмотря на то, что это самый распространенный вид рака
В отчете прогнозируется, что рак груди по-прежнему будет самым распространенным типом рака: ежегодно выявляется 364 000 случаев. Тем не менее, он станет пятой по частоте причиной смерти от рака с 30 000 смертей в год, по сравнению с 44 130, которые, как прогнозировалось, произойдут в этом году.
Окленд, Калифорния — 12 мая: Выжившие после рака груди до бейсбольной игры регулярного сезона между… [+] Окленд Атлетикс и Кливленд Индианс, 12 мая 2019 г., в O.co Coliseum в Окленде, штат Калифорния. (Фото Сэмюэля Стрингера / Icon Sportswire через Getty Images)
Значок Sportswire через Getty ImagesВыживаемость от рака груди в целом увеличивается с 2007 года, но прогноз для некоторых людей с раком груди все еще оставляет желать лучшего. Это включает людей, которым поставлен диагноз на более поздних стадиях заболевания, и людей с метастатическим раком груди, который распространился на другие части тела.У чернокожих женщин с раком груди шансы на выживание по-прежнему примерно на 10% меньше, чем у белых женщин.
.

 Статистика продолжительности жизни больных с этим диагнозом остается одной из самых летальных. Как правило, рак поражает саму железу или ее протоки. И быстро прогрессирует. Но делает это тихо, никак не выдавая себя. Тем и опасна злокачественная опухоль поджелудочной железы — она бессимптомна, почти неуловимая. Только треть случаев заболевания выявляется на третьей стадии, когда метастазы еще не проросли в соседние органы, но уже затронули кровеносные сосуды. В остальном болезнь проявляется, когда лечение становится практически неэффективным. И изменить ситуацию не помогут никакие деньги. В списке жертв коварного недуга мировые знаменитости, обладатели крупных капиталов, в том числе основатель компании Apple Стив Джобс, королева блюза Арета Франклин, великий тенор Лучано Паваротти.
Статистика продолжительности жизни больных с этим диагнозом остается одной из самых летальных. Как правило, рак поражает саму железу или ее протоки. И быстро прогрессирует. Но делает это тихо, никак не выдавая себя. Тем и опасна злокачественная опухоль поджелудочной железы — она бессимптомна, почти неуловимая. Только треть случаев заболевания выявляется на третьей стадии, когда метастазы еще не проросли в соседние органы, но уже затронули кровеносные сосуды. В остальном болезнь проявляется, когда лечение становится практически неэффективным. И изменить ситуацию не помогут никакие деньги. В списке жертв коварного недуга мировые знаменитости, обладатели крупных капиталов, в том числе основатель компании Apple Стив Джобс, королева блюза Арета Франклин, великий тенор Лучано Паваротти.