Этапы и принципы лечения острых лейкозов
Начало химиотерапии (XT) острых лейкозов (ОЛ) относится к 1946 г., когда проводилось лечение уретаном.Позже в лечебную практику были введены метотрексат, глюкокортикоиды, циклофосфан, 6-Меркаптопурин (1953 г.), винкристин (1960 г.), цитозар (1966 г.). Применение полихимиотерапии (ПХТ) в терапии ОЛ относится к началу 70-х годов ХХ-го века.
Основными целями лечения острых лейкозов является эрадикация лейкозного клона, восстановление нормального кроветворения и в результате этого — достижение длительной безрецидивной ремиссии или выздоровления больных.
Вследствие применения противоопухолевых препаратов развивается глубокая аплазия костного мозга (КМ). В период аплазии возникает т.н. состояние клональной конкуренции, когда пролиферативное преимущество получают клетки нормального кроветворного клона, которые и репопулируют КМ, восстанавливая здоровое поликлональное кроветворение.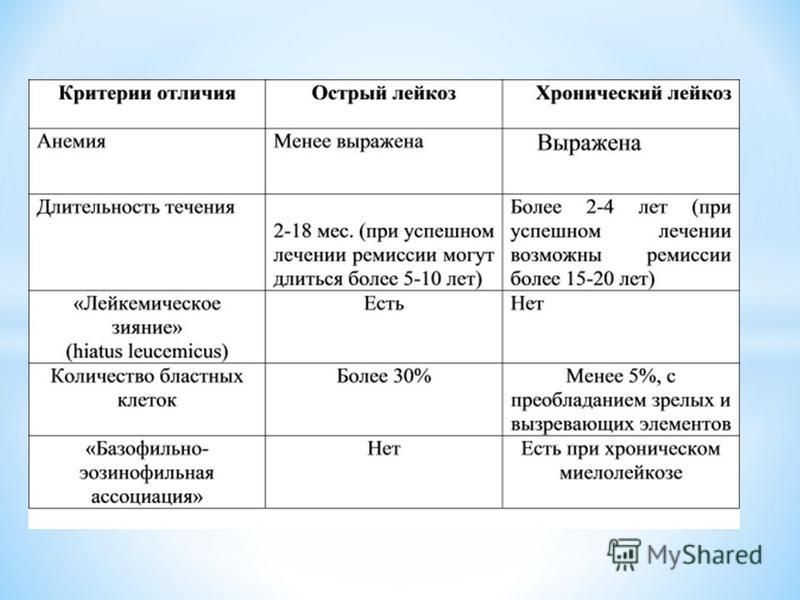
В своем развитии острые лейкозы проходят несколько стадий:
— первый острый период (развернутая стадия, атака 1),
— полная ремиссия (клинико-гематологическая, цитогенетическая, молекулярная; первая, вторая и т.д.),
— выздоровление — наличие полной ремиссии более 5 лет,
— рецидив (первый, второй, и т.д.) — необходимо указывать локализацию рецидива: (костномозговой, экстрамедуллярный; нейролейкемия, поражение яичек, селезенки), даже при отсутствии изменений в анализах периферической крови и/или миелограмме,
— терминальная стадия.
Лечение острых лейкозов — многоэтапный и многокомпонентный процесс.
Но при всех ОЛ существует несколько основных этапов терапии:
— индукция ремиссии — максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии;
— консолидация ремиссии — закрепление достигнутого противоопухолевого эффекта; задачей этого периода является дальнейшее уменьшение числа остающихся после индукции ремиссии лейкемических клеток;
— поддерживающая терапия — продолжение цитостатического воздействия в малых дозах на возможно остающийся опухолевой клон; следует отметить, что при проведении некоторых программ интенсивной консолидационной терапии поддерживающая терапия не предусматривается;
— профилактика нейролейкемии — проводится при остром лимфобластном, монобластном, миеломонобластном, промиелоцитарном (на фоне терапии ATRA) лейкозах, а также при всех формах острого миелоидного лейкоза (ОМЛ) с исходным уровнем лейкоцитов выше 30,0х109/л; при уровне лейкоцитов менее 1,0х109/л и тромбоцитов менее первая люмбальная пункция проводится после первого курса индукции ремиссии при нормализации показателей периферической крови.
Вторым основополагающим принципом лечения ОЛ является необходимость проведения полноценной вспомогательной терапии, которая подразделяется на два направления — профилактику осложнений и их лечение.
К основным профилактическим методам относятся:
— обеспечение сосудистого доступа,
— профилактика синдрома массивного лизиса опухоли,
— профилактика геморрагических осложнений с помощью заместительных трансфузий тромбоцитов при их уровне менее 20,0х109/л,
— профилактика флебита, если не используется центральный венозный катетер,
— профилактика анемического синдрома — заместительные трансфузии эритромассы. В отсутствие признаков кислородной недостаточности при уровне гемоглобина 75-80 г/л не требуется трансфузии эритроцитов
— профилактика электролитных нарушений,
— профилактика коагуляционных нарушений (свежезамороженная плазма (СЗП), гепарин при гиперкоагуляции, ингибиторы протеолиза),
— профилактика инфекционных осложнений (селективная деконтаминация, обработка полости рта и т.
Практически у 80-90% больных ОЛ в период индукции ремиссии возникают те или иные инфекционные осложнения. Главный принцип лечения всех инфекций — эмпирическая поэтапная антибиотикотерапия с дальнейшим изменением спектра используемых антибиотиков в соответствии с результатами тестов. Модифицированный алгоритм лечения больных ОЛ в периоде глубокой цитопении (рис. 3).
Рис. 3. Алгоритм лечения фебрильной нейтропении
Поскольку целью терапии ОЛ является полная эрадикация лейкозного клона, для оценки эффективности терапии вводится понятие ремиссии острых лейкозов.
Различают несколько типов ремиссии, причем значение имеет только наличие полной ремиссии:
— клинико-гематологическая ремиссия: при нормо- или умеренно-клеточном костном мозге количество бластов в нем менее 5% при нормальном соотношении других ростков кроветворения; в периферической крови уровень гемоглобина (Hb) выше 100 г/л, количество тромбоцитов более 100,0х10
— цитогенетическая ремиссия: в идеале у больных должен отсутствовать лейкозный клон, т.е. не должны обнаруживаться кроветворные клетки с патологически измененным геномом, которые существовали в дебюте заболевания;
Однако при ОЛ в момент достижения полной клинико-гематологической ремиссии могут существовать три типа кроветворения:
а) восстановление нормального кроветворения,
б) сосуществование нормального и лейкемического (клонального) кроветворения, что соответствует понятию минимальной остаточной болезни, при которой рецидив неизбежен,
в) кроветворение восстанавливается в рамках лейкемического клона — ПХТ убирает лейкемический быстро прогрессирующий клон (фактически убирает субклоны) и позволяет предлейкемическому клону дифференцироваться до морфологически нормальных кроветворных клеток;
— молекулярная ремиссия: у больного ОЛ не определяются молекулярные маркеры — например, белки, синтезируемые химерными генами в результате транслокаций, которые характеризовали лейкемические клетки больного в дебюте заболевания.
Программа терапии любого варианта острых лейкозов по протоколам проводится с обязательным учетом факторов риска, причем эти факторы различны для острого лимфобластного лейкоза (ОЛЛ) и ОМЛ.
При ОЛЛ выделяют следующие группы риска:
1. Группа стандартного риска:
— вариант общего острого лимфобластного лейкоза (CD10+),
— возраст 15-35 лет,
— уровень лейкоцитов периферической крови менее 30,0х109/л,
— достижение ремиссии на 4-й неделе полихимиотерапии,
— отсутствие в бластах филадельфийской (Ph) хромосомы и химерного гена BCR/ABL с отсутствием продукции фузионного белка р190 или р185 кДа.
2. Группа высокого риска
— ранний пре-В- или зрелый В-клеточный ОЛЛ,
— наличие Ph-хромосомы или химерного гена BCR/ABL,
— возраст 36-50 лет или менее 2 лет,
— уровень лейкоцитов периферической крови более 30,0х109/л,
— достижение ремиссии позже 4-й недели ПХТ,
— уровень лактатдегирогеназы (ЛДГ) более 1000 Ед/л,
— мужской пол,
— наличие Т-клеточного острого лимфобластного лейкоза (у больных детского возраста).
При ОМЛ выделяют следующие факторы риска:
— неадекватная ПХТ в начале лечения,
— возраст больного старше 60 лет,
— уровень лейкоцитов периферической крови более 30,0х109/л,
— уровень ЛДГ более 700 Ед/л,
— наличие миелодисплазии трех ростков кроветворения в момент установления диагноза ОМЛ,
— высокие показатели креатинина,
— тяжелый геморрагический синдром в дебюте ОМЛ,
— наличие очага инфекции до начала полихимиотерапии,
— отсутствие достижения ремиссии на 4-й неделе полихимиотерапии.
Кроме того, прогностически неблагоприятными факторами при ОМЛ являются наличие хромосомных аберраций — трисомия 8, моносомия 5,7, делеции Хр5,7, t (10; 11). Наличие t (8; 21), t (15; 17), inv 16 позволяет отнести данных больных при отсутствии других факторов риска к группе с благоприятным прогнозом.
Следует отметить, что, если у пациента с кариотипом лейкозных клеток, отнесенного к неблагоприятному прогностическому варианту, ремиссия сохраняется в течение года, то признак теряет свое прогностическое значение. Поэтому наличие неблагоприятных прогностических факторов требует проведения более интенсивной терапии.
Ниже приводятся наиболее распространенные и эффективные протоколы ПХТ острых лейкозов. Дозы препаратов приводятся из расчета на один квадратный метр (м ) поверхности тела. Интервалы между курсами полихимиотерапии составляют 28 дней (от первого дня предыдущего цикла).
Программы полихимиотерапии острый миелобластный/миелоидный лейкоз «7+3»
Индукция ремиссии:цитозин-арабинозид — 100 мг/м в/венно 2 раза в сутки, 1-7 дни, даунорубицин (рубомицин) — 45 (60) мг/м в/венно 1 раз в сутки, 1-3 дни или митоксатрон — 10 мг/м в\венно 1 раз в сутки, 1-3 дни, или идарубицин — 12 мг/м в/венно 1 раз в сутки, 1-3 дни.
Проводится два курса индукции ремиссии, затем — два курса консолидационной терапии этими же препаратами в тех же дозах. При условии достижения полной ремиссии (по всем трем вариантам) начинаются курсы поддерживающей ротационной терапии, которые проводятся последовательно ежемесячно в течение трех лет:
«5 + 2»
Цитозин-арабинозид — 100 мг/м2 в/венно 2 раза в сутки, 1-5 дни, или подкожно по 50 мг/м2 4 раза в сутки, 1-5 дни. Даунорубицин (рубомицин) — 45 мг/м в/венно 1 раз в сутки, 1-2 дни.
«5 + ЦФ»
Цитозин-арабинозид — 100 мг/м2 в/венно 2 раза в сутки, 1-5 дни, или подкожно по 50 мг/м2 4 раза в сутки, 1-5 дни. Циклофосфан — 650 мг/м2 в/венно, 1 день.
«5 + 6-МП»
Цитозин-арабинозид — 100 мг/м2 в/венно 2 раза в сутки, 1-5 дни, или подкожно по 50 мг/м2 4 раза в сутки, 1-5 дни. 6-Меркаптопурин — 60 мг/м2 внутрь 2 раза в сутки, 1-5 дни, или 6-Тиогуанин — 50 мг/м2 внутрь 2 раза в сутки, 1-5 дни.
«5 + VCR + PRED»
Цитозин-арабинозид — 100 мг/м2 в/венно 2 раза в сутки, 1-5 дни, винкристин 1,4 мг/м2 в/венно, 1 день, преднизолон 60 мг/м внутрь ежедневно, 1-5 дни.
«7 + 3 + VP — 16»
Стандартная схема «7+3» дополняется введением этопозида в/венно в дозе 120 мг/м2 1 раз в сутки, 17-21 дни. Поддерживающая терапия проводится по схеме, приведенной выше. Следует отметить, что добавление вепезида в схему «7+3» статистически достоверно не отражается на 5-летней безрецидивной выживаемости больных.
Протокол CALGB
Индукция ремиссии:«7+3» — 1 курс.
Консолидация: HD-ARA-C — 4 курса:
цитозин-арабинозид — 3 г/м2 2 раза в сутки в/венно, 1, 3, 5, 7 дни.
Поддерживающая терапия:
«5+2» — 4 курса.
Далее поддерживающая терапия не проводится.
Протокол FLAG-Ida
Флюдарабин — 30 мг/м2, 30-минутная инфузия, 1-5 дни, цитарабин — 2 г/м2, 4-часовая инфузия через 4 часа после флюдарабина, 1-5 дни, идарубицин — 10 мг/м2 в сутки в/венно, 1-3 дни.За день до введения флюдарабина начинают введение гранулоцитарного колониестимулирующего фактора (Г-КСФ) в дозе 300 мкг/м ежедневно до дня восстановления показателей периферической крови.
Дальнейшая терапия может включать либо проведение аналогичного курса, либо выполнение другого курса по схеме:
идарубицин — 10 мг/м2 в/венно, 1-2 дни, цитарабин — 2 г/м2 в/венно, 1-2 дни.
При наличии резистентности протокол дополняется введением гентузумаба озогамина (GO) в дозе 9 мг/м в 8-й день цикла (протокол FLAG-I +GO).
Все пациенты с указанными формами ОМЛ, у которых достигнута ремиссия, должны рассматриваться как потенциальные кандидаты на выполнение трансплантации костного мозга (аллогенной или аутологичной).
«TAD — 9»Цитозин-арабинозид — 100 мг/м2 круглосуточно в/венно, 1-2 дни, цитозин-арабинозид — 100 мг/м2 в/венно 2 раза в сутки, 3-9 дни, даунорубицин — 60 мг/м2 в/венно 1 раз в сутки, 3-5 дни, 6-Тиогуанин — 100 мг/м2 внутрь 2 раза в сутки, 3-9 дни.
Обычно применяемая схема лечения по протоколу TAD-9 -программа двойной индукции. Второй индукционный курс каждому пациенту проводят на 21 день от начала терапии независимо от глубины цитопении и результатов первого курса. В последние годы программа была интенсифицирована, и второй курс TAD-9 был заменен программой НАМ.
Протокол НАМ
Цитозин-арабинозид — 3 г/м2 в/венно 2 раза в сутки, 1-3 дни, митоксантрон — 10 мг/м2 в/венно 1 раз в сутки, 3-5 дни.Российской исследовательской группой по изучению ОЛ рекомендуется следующий протокол терапии ОМЛ:
В качестве индукции ремиссии проводится 1 курс «7+3», далее, независимо от того, достигнута ремиссия или нет, проводятся 2 курса НАМ-терапии и два курса терапии цитозин-арабинозидом в высоких дозах (HiDAC) — цитарабин 3 г/м2 в/венно 2 раза в сутки 1, 3, 5, 7 дни, проводимые через две недели после восстановления показателей периферической крови. В дальнейшем поддерживающая терапия не проводится.
Перед курсом индукции ремиссии у больных с гиперлейкоцитозом (особенно выше 100,0х109/л) необходимо проведение предфазы циторедукционной терапии, рассчитанной на снижение числа лейкоцитов периферической крови приблизительно до 50,0х109/л.
Это позволяет уменьшить раннюю летальность больных вследствие предупреждения развития у них синдрома массивного лизиса опухоли (предупреждение легочного дистресс-синдрома, блокады функции почек). Терапию в предфазе проводят обычно гидроксимочевиной в дозе 60-100 мг на 1 кг веса в сутки на фоне гидратационной терапии (до 3 л/м2 в сутки) и приема аллопуринола (600-1200 мг/сутки) с целью профилактики блокады почечных канальцев солями мочевой кислоты.
При необходимости проводится форсированный диурез. Возможно проведение лейкоцитафереза на фоне приема гидроксимочевины. Данный подход может быть полезен при наличии симптомов лейкостаза в плане уменьшения объема циркулирующих опухолевых клеток.
Интралюмбальные пункции при ОМЛ проводятся в следующем режиме. Первая — до первого курса индукции; вторая/третья — перед следующими курсами индукции/консолидации; четвертая/пятая — перед третьим/шестым курсом ротационной терапии, все последующие — один раз в три месяца в течение одного года. Возможно более компактное проведение профилактических пункций: 4 пункции (по 2 в неделю) перед вторым курсом индукции/консолидации, затем — перед каждым вторым курсом поддерживающей терапии.
Применение ростовых факторов было связано с необходимостью сокращения сроков периода миелотоксического агранулоцитоза. Однако в больших рандомизированных исследованиях не выявлено статистически значимых отличий в отношении процента ремиссий, их продолжительности, частоте инфекционных осложнений и длительности антибиотикотерапии.
Более того, имеются данные о четкой тенденции к увеличению частоты рецидивов у больных, которым Г-КСФ вводился в период индукции ремиссии. Поэтому в рутинной практике можно не рекомендовать назначение Г-КСФ при лечении ОМЛ. Но если речь идет о высокодозных программах, то показано его применение в дозе 5 мкг/кг/сутки либо сразу после завершения курса индукции ремиссии, либо с первого дня развития агранулоцитоза.
Программы полихимиотерапии ОЛЛ
В лечении В-клеточных ОЛЛ взрослых применяется протокол CALGB 8811 (терапия без учета иммунофенотипа бластных клеток и групп риска — полная клинико-гематологическая ремиссия в 82%, 3-летняя безрецидивная выживаемость — в 41% случаев. Протокол практически идентичен применяемому в РБ протоколу Минск-98. Для лечения больных Т-клеточным ОЛЛ применяются другие протоколы ПХТ.Схема протокола CALGB 8811
Курс 1-й: индукция ремиссии (4 недели):циклофосфан — 1200 мг/м в/венно, 1-й день (800 мг/м2 для больных старше 60 лет), винкристин — 2 мг в/венно 1, 8, 15, 22 дни, даунорубицин — 45 мг/м в/венно, 1-3 дни (30 мг/м2 для больных старше 60 лет), преднизолон — 60 мг/м2 внутрь, 1-21 дни (1-7 дни для больных старше 60 лет), L-аспарагиназа — 6000 Ед/м2 подкожно, 1, 8, 11, 15, 18, 22 дни.
Курс 2-й: ранняя интенсификация: проводится два курса (8 недель):
метотрексат интратекально — 15 мг, 1-й день, циклофосфан — 1000 мг/м2 в/венно, 1-й день, 6-Меркаптопурин — 60 мг/м2 внутрь, 1-14 дни, цитарабин — 75 мг/м2 подкожно, 1-4, 8-11 дни, винкристин — 2 мг в/венно, 15, 22 дни, L-аспарагиназа — 6000 Ед/м подкожно, 15, 18, 22, 25 дни.
Курс 3-й: профилактика нейролейкемии и межкурсовая поддерживающая терапия (12 недель):
краниальное облучение — 2400 рад, 1-12 дни, метотрексат интратекально — 15 мг, 1, 8, 15, 22, 29 дни, 6-Меркаптопурин — 60 мг/м внутрь, 1-70 дни, метотрексат — 20 мг/м2 внутрь, 36, 43, 50, 57, 64 дни.
Курс 4-й: поздняя интенсификация (8 недель):
доксорубицин — 30 мг/м2 в/венно, 1, 8, 15 дни, винкристин — 2 мг в/венно, 1,8,15 дни, дексаметазон — 10 мг/м2 внутрь, 1-14 дни, циклофосфан — 1000 мг/м2 в/венно, 29-й день, 6-Тиогуанин — 60 мг/м2 внутрь, 29-12 дни, ццитарабин — 75 мг/м2 подкожно, 29-32, 36-39 дни.
Курс 5-й: длительная поддерживающая терапия (до 24 мес. от дня установления диагноза):
винкристин — 2 мг в/венно, 1-й день каждого 4-недельного цикла, преднизолон — 60 мг/м2 внутрь, 1-5 дни каждого 4-недельного цикла, 6-Меркаптопурин — 60 мг/м2 внутрь, 1-28 дни, метотрексат — 20 мг/м2 внутрь, 1, 8, 15, 22 дни.
В настоящее время для лечения ОЛЛ у взрослых рекомендуется следующий протокол:
Индукция ремиссии, фаза 1 (1-4 недели): даунорубицин — 60 мг/м2 в/венно, 1, 8, 15, 22 дни, винкристин — 1,4 мг/м2 в/венно, 1, 8, 15, 22 дни, дексаметазон — 10 мг/м2 внутрь, 1-5, 11-14 дни, ПЭГ-аспарагиназа — 2000 ед/м2 в/венно 2, 16 дни, метотрексат — 12,5 мг интратекально 14 день.
Фаза 2 (5-8 недели), при достижении уровня лейкоцитов 3,0х109/л:
циклофосфан — 650 мг/м2 в/венно 1, 15, 29 дни, цитарабин — 75 мг/м2 в/венно 6-9, 13-16, 20- 3, 27-30, 6-меркаптопурин — 60 мг/м2 внутрь 1-30 дни, метотрексат — 12,5 мг интратекально 1, 8, 15, 22 дни.
Интенсификация/таофилактика нейролейкемии: метотрексат — 3 г/м2 в/венно 1, 8 дни, ПЭГ-аспарагиназа — 2000 ед/м2 в/венно 2-й день. Постремиссионная терапия заключается в проведении поддерживающей терапии метотрексатом и 6-меркаптопурином в течение 24 месяцев с момента установления диагноза.
У пациентов с наличием ФНП решается вопрос об алло-ТГСК.
Для терапии рецидивов и рефрактерных форм ОЛЛ ГНЦ РАМН рекомендуется протокол РАЦОП. Протокол может быть использован в качестве консолидации у больных из группы риска.
Протокол RACOP/D-2005
Предфаза:преднизолон — 60 мг/м2 внутрь 1-7 дни или дексаметазон — 10 мг/м2 внутрь 1-7 дни.
Индукция ремиссии:
даунорубицин — 45 мг/м2 в/венно, 1-3 дни, цитарабин — 100 мг/м2 в/венно 2 раза в сутки, 1-7 дни, циклофосфамид — 400 мг/м2 в/венно 1 раз в сутки, 1-7 дни, винкристин — 2 мг в/венно, 1, 7 дни, преднизолон — 60 мг/м2 внутрь, 1-7 дни.
Профилактика нейролейкемии:
В период I фазы индукции ремиссии выполняется шесть ин-тратекальных пункций с введением метотрексата, цитарабина и преднизолона в стандартных дозах.
Терапия консолидации:
После проведения двух полнодозных курсов проводят один идентичный курс, но с дозой циклофосфана 200 мг/м и одним введением винкристина.
Терапия поддержания ремиссии по схеме чередования курсов 5-дневного RACOP — COAP — COMP с интервалом в один месяц в течение 3 лет от момента начала терапии.
В период поддерживающей терапии интратекальные пункции выполняются один раз в три месяца в течение всего периода лечения. Облучение головы в дозе 24 Гр выполняется только как этап лечения нейролейкемии.
5-дневный RACOP:
даунорубицин — 45 мг/м2 в/венно, 1-2 дни, цитарабин -100 мг/м2 в/венно 2 раза в сутки, 1-5 дни, циклофосфамид — 200 мг/м2 1 раз в сутки, 1-5 дни, винкристин — 2 мг в/венно, 1-й день, преднизолон — 60 мг/м2 внутрь, 1-5 дни.
COAP:
циклофосфан — 400 мг/м2 в/венно 1 раз в 1-й день, винкристин — 2 мг в/венно в 1-й день, цитарабин — 60 мг/м2 в/венно 2 раза в сутки, 1-5 дни, преднизолон — 40 мг/м2 внутрь, 1-5 дни.
СОМР:
циклофосфан — 1000 мг/м2 в/венно в 1-й день, винкристин — 2 мг в/венно в 1-й день, метотрексат — 12,5 мг/м2 в/мышечно или внутрь 1 раз в сутки, 3-4 дни, преднизолон — 100 мг внутрь, 1-5 дни.
Терапия острого лимфобластного лейкоза взрослых по протоколу MRC UCALL XII/ECOG E2993
Индукция ремиссии, фаза 1; 1-4 недели. даунорубицин — 60 мг/м2 в/венно 1, 8, 15, 22 дни винкристин — 1,4 мг/м2 в/венно 1, 8, 15, 22 дни, L-аспарагиназа — 10000 Ед в/венно или в/мышечно 17-28 дни,преднизолон — 60 мг/м2 внутрь 1-28 дни метотрексат -12,5 мг интратекально, 15 день. фаза 2; 5-8 недели.
Циклофосфамид — 650 мг/м2 в/венно 1, 15, 22 дни, цитарабин — 75 мг/м2 в/венно 1-1, 8-11, 15-18, 22-25 дни, 6-меркаптопурин — 60 мг/м2 внутрь, 1-28 дни, метотрексат — 12,5 мг интратекально, 1, 8, 15, 22 дни. Диагностическая люмбальная пункция выполнялась у всех пациентов.
Если нейролейкемия выявлялась в начале заболевания, метотрексат вводился интратекально или в цистерну Омайя каждую неделю до санации спинномозговой жидкости (в 1-й фазе). Дополнительно во время 2-й фазы проводилось облучение головного мозга в суммарной очаговой дозе (СОД) 24 Гр и спинного мозга в СОД 12 Гр, при этом метотрексат во 2-й фазе не вводился.
Терапия интенсификации:
• метотрексат — 3 г/м2 в/вено, 1, 8, 22 дни,
• L-аспарагиназа — 10000 Ед в/венно, 2, 9, 23 дни + стандартная доза лейковорина.
Консолидационный предтрасплантационный режим перед алло- или ауто-трансплантации гемопоэтических стволовых клеток (ТГСК) включал тотальное облучение тела в СОД 13,2 Гр (дважды в день по 2,2 Гр шесть раз) в дни 6-1 до трансплантации, дополненный введением этопозида в дозе 60 мг/кг в/венно в 3 день.
У пациентов, не подлежащих алло- или ауто-ТГСК, если нейролейкемии не было в дебюте заболевания, проводилась профилактика нейролейкемии:
• цитарабин — 50 мг в/вено, в 1-й день недели, всего 4 раза,
• краниальное облучение в СОД 24 Гр, цитарабин — 50 мг и/текально в таком же режиме спустя 3 месяца, всего 4 раза.
Терапия консолидации проводилась на фоне поддерживающей терапии.
1-й цикл: цитарабин — 75 мг/м2 в/венно 1-5 дни, этопозид — 100 мг/м2 в/венно 1-5 дни, винкристин — 1,4 мг/м2 в/венно 1, 8, 15, 22 дни, дексаметазон — 10 мг/м2 внутрь 1-28 дни.
2-й цикл: (начинается через 4 недели после 1-го цикла): цитарабин — 75 мг/м2 в/венно 1-5 дни, этопозид — 100 мг/м2 в/венно 1-5 дни.
3-й цикл: (начинается через 4 недели после 2-го цикла): даунорубицин — 25 мг/м2 в/венно 1, 8, 15, 22 дни, циклофосфамид — 650 мг/м в/венно в 29 день, цитарабин — 75 мг/м2 в/венно 31-34, 38-й дни, тиогуанин — 60 мг/м2 внутрь 29-12 дни.
4-й цикл идентичен 2-му циклу и начинается через 8 недель после окончания 3-го цикла.
Поддерживающая терапия (проводится в течение 2,5 лет после начала терапии интенсификации):
винкристин — 1,4 мг/м2 в/венно каждые 3 месяца, преднизолон — 60 мг/м2 внутрь 5 дней каждые 3 месяца, 6-меркаптопурин — 75 мг/м2 внутрь ежедневно постоянно, метотрексат — 20 мг/м2 внутрь или в/венно 1 раз в неделю. ФНП являлись: возраст старше 35 лет, отсутствие клинико-гематологической ремиссии на 4-й неделе или лейкоцитоз выше 30,0х109/л для В-ОЛЛ и выше 100,0×10% для Т-ОЛЛ, наличие Ph+ хромосомы.
Отдельно следует остановиться на программе лечения острого промиелоцитарного лейкоза (ОПЛ).
В связи с включением в схему терапии ОПЛ полностью трансретиноевой кислоты (all-trans retinoic acid — ATRA) клинико-гематологическая и цитогенетическая ремиссии констатируются уже после индукционного курса почти у 100% больных ОПЛ, однако молекулярно-генетическая ремиссия (отсутствие транскрипта PML/RARA-promyelocytic leukemia/retinoic acid receptor alpha) отмечена после второго курса постремиссионной терапии. Поэтому центральное место в оценке эффективности противолейкемической терапии занял мониторинг молекулярного рецидива.
В настоящее время общепринятыми являются следующие протоколы терапии ОПМ.
Протокол ОПЛ-2003
Индукция ремиссии:ATRA (весаноид) в дозе 25 мг/м2 в два приема в день по установлению диагноза до достижения полной ремиссии (не более 90 дней).
Курс «7+3» терапии в полных дозах с третьего дня приема ATRA с разовой дозой даунорубицина 60 мг/м2.
Постремиссионная консолидация: в течение трех месяцев проводится три курса терапии по схеме «7+3» с разовой дозой даунорубицина 45 мг/м2.
Интенсификация (один курс после восстановления показателей анализов крови):
ATRA — 25 мг/м2 в два приема в день — 1-14 дни,
цитарабин — 1 г/м2 2 раза в сутки в/венно — 3-6 дни,
даунорубицин — 30 мг/м2 в сутки в/венно — 1-3 дни.
Поддерживающая терапия постоянно в течение двух лет:
6-Меркаптопурин — 90 мг/м2 в сутки внутрь, метотрексат — 15 мг/м внутрь 1 раз в неделю.
Поздняя интенсификация: ATRA 25 мг/м2 в сутки в течение 15 дней каждые три месяца на фоне поддерживающей терапии.
Протокол PETHEMA
Индукция ремиссии:ATRA 45 мг/м2 в два приема в день до достижения полной ремисии (максимум в течение 90 дней).
Для пациентов моложе 20 лет доза уменьшена до 25 мг/м2, Идарубицин 12 мг/м в день в/венно в 2, 4, 6, 8 дни.
У пациентов старше 70 лет идарубицин в 8-й день не вводился.
Постремиссионная консолидация:
В течение трех месяцев проводятся следующие курсы монохимиотерапии:
1) идарубицин — 5 мг/м2 в день в/венно 1-4 дня, (1-й месяц),
2) митоксантрон — 10 мг/м2 в день в/венно 1-5 дней, (2-й месяц),
3) идарубицин — 12 мг/м2 в/венно 1-й день, (3-й месяц).
В группе пациентов промежуточного и высокого риска ежемесячно в сочетании с курсом монохимиотерапии проводился прием ATRA в дозе 45 мг/м2 1-15 дня.
Поддерживающая терапия (проводится в течение двух лет): 6-Меркаптопурин — 50 мг/м2 внутрь ежедневно, метотрексат — 15 мг/м2 внутримышечно 1 раз в неделю, ATRA 45 мг/м2 внутрь в два приема 1-15 дни каждого третьего месяца на фоне поддерживающей терапии.
Гематологическая ремиссия констатируется при нормализации гемограммы и содержания атипичных промиелоцитов в миелограмме менее 5%; молекулярная ремиссия — при наличии критериев гематологической ремиссии и отсутствии транскрипта PML/RARA в КМ.
Гематологическим рецидивом считается появление любого количества атипичных промиелоцитов в периферической крови или более 20% в миелограмме, или более 5% атипичных промиелоцитов в миелограмме при молекулярно-биологическом подтверждении наличия транскрипта PML/RARA в костного мозга на основании данных полимеразной цепной реакции (ПЦР).
Вторым препаратом в лечении ОПЛ, показавшим свою активность как в лечении первичных больных, так и при рецидивах, является триоксид мышьяка (Трисенокс), позволяющий получить полные ремиссии у 70-90% больных. Препарат не обладает цитостатическим действием, но способствует дифференцировке атипичных промиелоцитов до зрелых форм.
Триоксид мышьяка назначают в дозе 0,15 мг/кг в сутки в виде 1-2-часовой инфузии, лечение проводится до достижения ремиссии, но не более 50 дней. При получении ремиссии проводится консолидация: введение препарата в той же дозе по 5 дней в неделю на протяжении 5 недель. Безрецидивная выживаемость значительно выше при проведении повторных курсов терапии в сочетании триоксида мышьяка и цитостатических препаратов.
При наличии факторов риска рекомендуется аллотрансплантация гемопоэтических стволовых клеток в первой ремиссии.
А.Т. Фиясь
Опубликовал Константин Моканов
| Губка гемостатическая |
| Азацитидин (Azacitidine) |
| Аллопуринол (Allopurinol) |
| Амброксол (Ambroxol) |
| Амикацин (Amikacin) |
| Аминокапроновая кислота (Aminocaproic acid) |
| Амлодипин (Amlodipine) |
| Амфотерицин B (Amphotericin B) |
| Анидулафунгин (Anidulafungin) |
| Антиингибиторный коагулянтный комплекс (Antiingibitorny coagulant complex) |
| Ацикловир (Acyclovir) |
| Бупивакаин (Bupivacaine) |
| Ванкомицин (Vancomycin) |
| Вориконазол (Voriconazole) |
| Ганцикловир (Ganciclovir) |
| Гентамицин (Gentamicin) |
| Гепарин (Heparin) |
| Гидроксикарбамид (Hydroxycarbamide) |
| Даунорубицин (Daunorubicin) |
| Дексаметазон (Dexamethasone) |
| Децитабин (Decitabine) |
| Дротаверин (Drotaverinum) |
| Идарубицин (Idarubicin) |
| Имипенем (Imipenem) |
| Иммуноглобулин человека нормальный (IgG+IgA+IgM) (Immunoglobulin human normal (IgG+IgA+IgM)) |
| Итраконазол (Itraconazole) |
| Каптоприл (Captopril) |
| Каспофунгин (Caspofungin) |
| Колистиметат натрия (Colistimethate sodium) |
| Концентрат тромбоцитов (КТ) |
| Лактулоза (Lactulose) |
| Левофлоксацин (Levofloxacin) |
| Лидокаин (Lidocaine) |
| Лизиноприл (Lisinopril) |
| Линезолид (Linezolid) |
| Меркаптопурин (Mercaptopurine) |
| Меропенем (Meropenem) |
| Метотрексат (Methotrexate) |
| Метронидазол (Metronidazole) |
| Микафунгин (Micafungin) |
| Митоксантрон (Mitoxantrone) |
| Надропарин (Nadroparin) |
| Омепразол (Omeprazole) |
| Ондансетрон (Ondansetron) |
| Офлоксацин (Ofloxacin) |
| Пиперациллин (Piperacillin) |
| Плазма свежезамороженная |
| Повидон (Povidone) |
| Позаконазол (Posaconazole) |
| Прокаин (Procaine) |
| Спиронолактон (Spironolactone) |
| Сульбактам (Sulbactam) |
| Сульфаметоксазол (Sulphamethoxazole) |
| Тобрамицин (Tobramycin) |
| Торасемид (Torasemide) |
| Трамадол (Tramadol) |
| Триметоприм (Trimethoprim) |
| Фамотидин (Famotidine) |
| Филграстим (Filgrastim) |
| Флударабин (Fludarabine) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Фуросемид (Furosemide) |
| Хлоргексидин (Chlorhexidine) |
| Цефепим (Cefepime) |
| Цефоперазон (Cefoperazone) |
| Цефтазидим (Ceftazidime) |
| Циклофосфамид (Cyclophosphamide) |
| Ципрофлоксацин (Ciprofloxacin) |
| Цитарабин (Cyta |
Лейкемия — международные протоколы лечения
Лечение заболеваний крови за рубежом
Лейкемия (лейкоз) – злокачественное заболевание системы кроветворения, проявляющееся замещением дифференцированных форменных элементов крови их незрелыми предшественниками (бластами). Бластные клетки не могут выполнять функции, предназначенные зрелым клеткам крови. Из-за произошедшей мутации бласты непрерывно размножаются и долго не погибают на фоне патологического бездействия программы самоуничтожения (апоптоза) клеток. Так они распространяются по всему организму, образуя вторичные очаги в костях, лимфатических узлах, центральной нервной системе и других органах.
Именно этими обстоятельствами объясняются многочисленные симптомы лейкемии:
- общая слабость;
- повышение температуры тела;
- снижение веса;
- наружные кровотечения и кровоизлияния в мягкие ткани и внутренние органы;
- увеличение размеров печени и селезенки;
- анемия;
- склонность к инфекционным заболеваниям из-за снижения иммунитета;
- боли в костях;
- патологические переломы;
- нейролейкемия с опухолевым менингитом, парезами, эпилептическим синдромом.
Лейкозы представляют собой большую группу заболеваний, отличающихся, в первую очередь, строением и происхождением патологически изменившихся клеток.
Выделяют лимфобластный и миелобластный лейкоз. Кроме того, каждый из них может быть острым или хроническим. Причем это не переходные формы, а принципиально разные заболевания. При остром лейкозе опухолевой трансформации подвергаются недифференцированные клетки, а при хроническом – в значительной степени дифференцированные. Каждая из этих форм имеет по семь-десять подтипов.
Диагностика лейкоза
Принадлежность лейкоза к определенному виду имеет огромное практическое значение, так каждый из них имеет разное течение, прогноз, и требует разных терапевтических подходов. Поэтому детальной диагностике лейкоза в специализированных гематологических центрах придается огромное значение. С целью уточнения диагноза проводится:
- клинический анализ крови с микроскопией мазка. Он выявляет повышенный уровень лейкоцитов с большим количеством атипичных клеток, анемию и снижение числа тромбоцитов;
- биопсия костного мозга. Необходима для определения вида и подтипа лейкоза, его стадии, процентного содержания бластных клеток;
- лабораторная диагностика крови и пунктата костного мозга с использованием цитохимического, иммуногистологического анализов, метода флуоресцентной гибридизации для определения генетических характеристик опухолевых клеток;
- люмбальная пункция с последующим анализом спинномозговой жидкости для ранней диагностики нейролейкемии;
- ультразвуковые, эндоскопические исследования, компьютерная и магнитно-резонансная томография, позитронно-эмиссионная компьютерная томография – все эти методы визуализации позволяют оценить распространение бластных клеток и масштабы вторичного поражения внутренних органов и костей.
Методы лечения
Лечение лейкозов в ведущих клиниках мира проводится в соответствии с международными стандартами, однако в каждом случае учитываются индивидуальные особенности пациентов. Каждый из них получает уникальную терапию, программа которой разрабатывается консилиумом специалистов по результатам всестороннего обследования.
Химиотерапия составляет основу лечения пациентов, страдающих лейкозом. Она проводится в несколько этапов:
- индукционный этап. Продолжается 1-1,5 месяца и является для пациента самым трудным, так как в нем используются высокие дозы и многоступенчатые комбинации химиопрепаратов. Они нужны для массированного подавления не менее 95% бластных клеток. Для нивелирования токсичных эффектов агрессивной хиимиотерапии на этом этапе все пациенты получают поддерживающее лечение;
- консолидирующий этап. Проводится для закрепления достигнутого на первом этапе результата и достижения полной нормализации лабораторных показателей, включая отсутствие опухолевых маркеров. В это время также проводят профилактику нейролейкоза. Химиопрепараты вводятся непосредственно в спинномозговой канал, чтобы создать достаточную концентрацию, минуя гематоэнцефалический барьер;
- поддерживающий этап. Продолжается несколько лет, направлен на предупреждение рецидива заболевания.
Химиотерапия часто комбинируется с иммунными препаратами, так как они:
- удлиняют ремиссии в несколько раз;
- обладают иммуномодулирующими качествами, позволяющими предотвращать инфекционные осложнения на фоне подавленного химиопрепаратами иммунитета.
В зависимости от иммунного статуса пациента применяется пассивная или активная иммунная терапия. В первом случае это вакцины, содержащие антитела, во втором – иммунные препараты, направленные на стимуляцию собственного противолейкозного иммунитета.
Трансплантация костного мозга является важнейшей частью лечения лейкоза у многих пациентов. Она проводится после высокодозной химиотерапии, а иногда – и лучевой терапии, направленных на максимальное подавление пораженной опухолью системы кроветворения, поэтому является сложнейшим вмешательством с высокой степенью риска.
В крупных гематологических клиниках организована отлаженная, безупречно функционирующая система трансплантации костного мозга, начиная от типирования образцов при подборе донора и заканчивая применением новейших средств для предупреждения отторжения трансплантата и инфекционных осложнений. Ежегодно в каждой из развитых стран успешно проводятся тысячи подобных вмешательств.
Лучевая терапия при лейкозах не имеет первостепенного значения. Однако она нередко применяется в виде:
- фокусированного внешнего облучения скоплений бластных клеток в головном мозге, костях, лимфатических узлах;
- тотального облучения – в случаях особо тяжелого течения заболевания, трудно преодолимой резистентности к химиотерапии, перед трансплантацией костного мозга.
В ведущих гематологических центрах мира созданы идеальные условия не только для достижения первичной ремиссии (это выполнимо в большинстве случаев и в России), но и для противорецидивного лечения и даже полного выздоровления. В них строго выдерживаются международные протоколы химиотерапии самыми современными средствами, дополненные таргетными и иммунобиологическими препаратами.
В итоге, в зарубежных гематологических клиниках достигают многолетней ремиссии и выздоровления в 75-90% случаев у пациентов с различными формами лейкемии.
Как лечится острый миелобластный лейкоз?
Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children’s Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children’s Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi’de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований — основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения — эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап — индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент — профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе — цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты — цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
Классически индукцию ремиссии острого миелобластного лейкоза проводят семидневным курсом. В течение всех 7 дней пациент получает цитозин-арабинозид в дозе 100-200 мг/(м2хсут), который в течение трёх дней комбинируют с даунорубицином в дозе 45-60 мг/(м2хсут). Большинство протоколов основано на этой классической схеме «7+3», к которой могут быть добавлены тиогуанин, этопозид или другие препараты. При применении таких терапевтических схем ремиссии достигают у 90% больных.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы — AML-10 — включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата — этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации — из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы — по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым — 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м2), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней — ADE, в другой группе — состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м2 в одно введение). Дополнительные препараты — этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации — аллогенная и аутологичная.
Аллогенная трансплантация гемопоэтических стволовых клеток — эффективный, но высокотоксичный метод антилейкемическои терапии. Антилеикемический эффект алло-ТТСК обеспечивается кондиционированием с аблативной химиотерапией и иммунологическим эффектом «трансплантат против лейкемии» — оборотной стороной синдрома «трансплантат против хозяина». С 1990 года отмечено улучшение результатов терапии у детей, получивших стандартную индукцию ремиссии, основанную на применении цитозин-арабинозида и антрациклинов, консолидирующую терапию и, при наличии родственного HLA-идентичного донора, аллогенную ТГСК. Аллогенная трансплантация гемопоэтических стволовых клеток — наиболее эффективный метод профилактики рецидива, однако в первую ремиссию острого миелобластного лейкоза он показан только пациентам из группы высокого риска.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ — особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае — около трети, а среди латиноамериканской популяции — до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза — транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы — инициальный лейкоцитоз (количество лейкоцитов превышает 10х109/л) и экспрессия CD56 на лейкемических промиелоцитах.
В течение последних 20 лет прогноз для пациентов с острым промиелоцитар-ным лейкозом изменился с «фатального в высокой вероятности» на «выздоровление в высокой вероятности». Наибольший вклад в эти перемены внесло введение в терапию all-транс-ретиноевой кислоты (ATRA). ATRA — патогномоничный дифференцирующий агент, подавляющий транскрипцию PML-RARa, обрывающий путь леикемогенеза и инициирующий дозревание атипичных промиелоцитов до гранулоцитов in vivo и in vitro. Применение ATRA в индукции позволяет достичь ремиссии у 80-90% пациентов с развившимся de novo острым промиелоцитарным лейкозом. ATRA нивелирует проявления коагулопатии и не вызывает аплазии кроветворения, что снижает вероятность кровотечений и сепсиса в раннем периоде лечения. Стандартная доза ATRA 45 мг/(м2хсут). Показана возможность снижения дозы препарата без изменения эффективности.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия — комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Паллиативная помощь при остром лейкозе у взрослых, лечение острого лейкоза
Лейкозы — это большая группа заболеваний, при которой происходит поражение системы кроветворения (гемопоэза). Чтобы лучше понять, что происходит с организмом при лейкозе, сначала нужно понимать, как организована система гемопоэза.
Клетки крови образуются из полипотентных (которые дают начало нескольким типам клеток) гемопоэтических (кровеобразующих) стволовых клеток (ГСК). Они проходят несколько стадий развития и в конце концов достигают зрелого состояния, при котором уже способны выполнять свои функциональные обязанности. Пока клетки незрелые, они не выходят в кровоток, а располагаются в органах кроветворения, главным образом в костном мозге, где и проходят свою дифференцировку и «обучение».
ГСК может пойти развиваться по двум направлениям:
- Миелопоэтическому, при котором образуются миелоидные клетки. Они названы так из-за того, что основную дифференцировку проходят в костном мозге (myelos — мозг, отсюда и название). В эту группу входят эритроциты, гранулоциты (нейтрофилы, базофилы и эозинофилы), моноциты и тромбоциты.
- Лимфопоэтическому, при котором образуются лимфоидные клетки. В процессе развития, они помимо костного мозга проходят дифференцировку в лимфатических узлах, селезенке и тимусе.
Итак, ГСК в процессе развития проходит несколько стадий:
- Стволовая клетка (СК) — она может пойти по любому пути развития в зависимости от потребностей организма.
- Частично детерминированная СК — на этой стадии она уже определилась, в каком направлении будет развиваться, миелоидном или лимфоидном.
- Унипотентная стволовая клетка — здесь уже начинают закладываться признаки дифференцировки внутри своего направления. Например, миелоидные клетки могут пойти в направлении эритропоэза, тромбопоэза или гранулопоэза, а лимфоидные клетки дифференцируются в направлении предшественников Т- и В-лимфоцитов.
- Бласты — это уже определившиеся клетки, в которых можно определить характерные для каждого типа клеток признаки, например, набор ферментов и рецепторов.
- Незрелые клетки, например, промиелоциты, пролимфоциты и др. Они способны выполнять какие-то функции, но не в полной мере. Тем не менее, при особой потребности организм использует и их ресурсы, выпуская их в общий кровоток.
- Зрелые клетки — они уже полноценные «бойцы».
В зависимости от того, на каком этапе развития происходит сбой, выделяют острые и хронические лейкозы. При острых лейкозах сбой происходит на уровне незрелых клеток — бластов. Поэтому их еще называют бластными лейкозами. Они имеют агрессивное течение, поскольку опухолевые клетки не могут выполнять свои функции, что без лечения быстро приводит к гибели больного. При хронических лейкозах сбой дифференцировки происходит уже на стадии зрелых клеток, поэтому они имеют более доброкачественное течение.
В зависимости от того, какой росток кроветворения поврежден, выделяют следующие виды острых лейкозов:
- Острый миелобластный лейкоз — опухоль из миелоидного ростка кроветворения. Более характерен для пожилых людей, но может встречаться и у молодых пациентов.
- Острый промиелоцитарный лейкоз — это особый тип миелобластного лейкоза, при котором сбой происходит на уровне незрелых гранулоцитов — промиелобластов. Раньше это была фатальная форма лейкоза, при которой пациенты погибали в течение нескольких недель после постановки диагноза. Но сейчас, при появлении трансретиноевой кислоты, лечение этой формы патологии достигло колоссальных успехов.
- Острый монобластный лейкоз — поражается моноцитарная линии кроветворения.
- Эритромиелоз — поражается красный росток кроветворения — эритроцитарный.
- Острый мегакариобластный лейкоз — очень редкая форма миелоцитарного лейкоза. При нем происходит поражение тромбоцитарного ростка.
- Острый лимфобластный лейкоз — это форма лимфопоэтичекого лейкоза. При нем поражается лимфоцитарный росток кроветворения. Заболевание в больше мере характерно для детского возраста.
Причины возникновения острого лейкоза
Лейкозы возникают из-за мутации ГСК. При этом разные мутации проявляются на разных этапах гемопоэза. Следует сказать, что одного факта наличия мутации недостаточно. Вообще генетические поломки в клетках, в том числе и гемопоэтических, возникают регулярно, но существуют механизмы, которые либо уничтожают такие клетки, либо блокируют ее дальнейшее развитие. Чтобы развился лейкоз, нужны особые обстоятельства:
- Повторные мутации в уже мутировавшей ГСК.
- Ослабление иммунной защиты, при которой мутировавшая клетка остается нераспознанной и начинает активно размножаться. Такие промахи иммунитета могут возникнуть как в период внутриутробного развития, так и в процессе жизни взрослого человека.
Таким образом, к факторам риска развития острого лейкоза относят следующие:
- Наследственная предрасположенность.
- Вторичные и первичные иммунодефициты.
- Воздействие ионизирующего излучения — рентген, лучевая терапия и др.
- Некоторые химикаты.
- Некоторые лекарственные препараты, например, цитостатики, которые применяются для лечения злокачественных новообразований.
- Вирусы. В частности, доказана этиологическая роль вируса Эпштейна-Барр.
Методы лечения острых лейкозов
Лечение острых лейкозов проводится в соответствии с утвержденными протоколами и проходит в несколько стадий. Целью лечения является достижение стойкой полной ремиссии. В среднем, полный курс лечения занимает около 2-х лет. При развитии осложнений этот срок может увеличиваться.
Для подбора оптимальной схемы терапии, необходимо знать вид острого лейкоза, его молекулярно-генетический профиль и группу риска для пациента. При стандартной группе риска, лечение проводится в соответствии со следующей схемой:
- Индукция ремиссии — это самый сложный этап, который предполагает назначение многокомпонентных химиотерапевтических схем, чтобы уничтожить как можно больше лейкозных клеток. При этом организм испытывает мощное токсическое действие. С одной стороны, его оказывают химиотерапевтические препараты, а с другой — продукты распада опухолевых клеток. В этот период пациент должен находиться под круглосуточным наблюдением врачей, поэтому требуется госпитализация в стационар.
- Консолидация ремиссии. Индукционная терапия, какой бы мощной она не была, не может полностью уничтожить опухолевые клетки, поскольку часть из них находится в «спящем» состоянии и активируется через некоторое время. Чтобы уничтожить и их, проводится консолидация ремиссии. Для этого могут использоваться те же препараты, что и на первом этапе или другие схемы химиотерапии. Это зависит от вида лейкоза.
- Реиндукция ремиссии. По сути этот этап представляет собой повторение индукционного этапа — интенсивные курсы химиотерапии с высокими дозами цитостатиков. Цель этого этапа уничтожить оставшиеся злокачественные клетки, которые на момент лечения могли находиться в неактивном состоянии. Этот этап длится от нескольких недель до нескольких месяцев.
- Поддерживающая терапия. Это заключительный этап. Его цель — уничтожение оставшихся опухолевых клеток. С этой целью длительное время назначаются низкие дозы цитостатиков, которые уничтожат клетки, оставшиеся после курса лечения. Этот этап проходит амбулаторно, и, если состояние здоровья пациента позволяет, он может работать или получать образование.
В ряде случаев при неблагоприятном прогнозе или возникновении рецидива, обычных курсов химиотерапии бывает недостаточно. В связи с этим, используются дополнительные методы лечения.
Профилактика нейролейкоза — поражение головного и спинного мозга лейкозными клетками. С этой целью в спинномозговой канал вводят цитостатики и проводят лучевую терапию на область головного мозга.
Трансплантация гемопоэтических стволовых клеток. В ряде случае пациентам требуется проведение высокодозной полихимиотерапии. Ее назначают для преодоления опухолевой резистентности, при возникновении многократных рецидивов и др. Такое лечение очень мощное и позволяет уничтожить даже устойчивые опухолевые клетки. Однако такая терапия опустошает костный мозг (фабрику кровяных клеток), и он не может в быстрые сроки полноценно восстановить кроветворение. Чтобы преодолеть это состояние, производят трансплантацию гемопоэтических стволовых клеток. Их могут взять у пациента после этапа индукции или консолидации ремиссии. В этом случает трансплантация называется аутологичной. Если стволовые клетки берутся от донора, это называется аллогенной трансплантацией. В этом случае пациент получает иммунитет другого, здорового человека. Иммунные клетки будут атаковать оставшиеся опухолевые клетки, оказывая дополнительный лечебный эффект. Недостатком аллогенной трансплантации является риск развития реакции трансплантат против хозяина, когда иммунные клетки начинают атаковать организм реципиента, приводя к развитию различных осложнений.
Последствия (ремиссия и рецидив)
Еще несколько десятилетий назад острые лейкозы приводили к смерти пациента в течение 2-3 месяцев после постановки диагноза. На сегодняшний день ситуация кардинально изменилась благодаря появлению новых препаратов для лечения.
На данный момент в клинике острых лейкозов выделяют следующие стадии:
- Первая атака — в этот период происходит активное размножение опухолевых клеток в костном мозге и выход их в кровь. Именно на данном этапе происходит постановка диагноза. Симптомы заболевания будут определяться тем, какой кроветворный росток поражен. Как правило, это упорные инфекции, анемии, общая слабость, увеличение лимфатических узлов и др.
- Период ремиссии. Если острый лейкоз ответил на химиотерапию, опухолевые клетки уничтожаются, и кроветворение восстанавливается. Количество бластов в костном мозге приходит в норму и не превышает 5% от общего количества клеток. Выделяют несколько видов ремиссии, в зависимости от того, насколько полно подавлен опухолевый клон. В настоящее время целью лечения является достижение полной ремиссии в течение 5 лет. По истечении этого срока, пациент считается полностью здоровым.
- Рецидив. У некоторых пациентов возникает рецидив, при котором опять увеличивается количество бластов. Они опять выходят в кровоток и могут образовывать внекостномозговые очаги инфильтрации. Рецидивов может быть несколько, и с каждым разом их все сложнее ввести в ремиссию. Тем не менее, у многих пациентов удается добиться полной пятилетней ремиссии, даже после нескольких рецидивов.
- Терминальная стадия. О ней говорят, когда все используемые методы лечения острых лейкозов теряют свою эффективность и сдерживать опухолевый рост уже невозможно. Происходит полное угнетение кроветворной системы организма.
Паллиативная помощь
Для терапии острого лейкоза имеется большое количество методов лечения. Это может быть химиотерапия, таргетная терапия, иммунотерапия. Все эти методы могут привести к ремиссии даже после многократных рецидивов. Поэтому как таковая, паллиативная терапия назначается редко и, как правило, у возрастных пациентов, которые не могут перенести тяжелое лечение.
В этом случае используется химиотерапия, медикаментозная терапия и лучевая терапия.
Химиотерапия
Химиотерапия при паллиативном лечении проводится не с целью достижения ремиссии, а для удержания опухолевого клона от стремительного размножения. На этом этапе могут применяться стандартные цитостатические препараты в меньших дозировках, иммунотерапия, таргетная терапия и другие методы противоопухолевого лечения.
Лучевая терапия
Лучевая терапия может применяться для облегчения болевого синдрома при сильном поражении костей, а также при наличии внекостномозговых очагов.
Сопроводительная медикаментозная терапия
Устранение болевого синдрома
Для помощи пациентам с болевым синдромом применяют различные обезболивающие препараты, начиная от нестероидных противовоспалительных препаратов (тот же ибупрофен) и заканчивая легкими и/или тяжелыми наркотическими средствами. Уменьшить выраженность болевого синдрома помогает и лучевая терапия.
Профилактика инфекций
На терминальных стадиях у больных серьезно нарушено кроветворение, и, как следствие, нет полноценной защиты от всех видов инфекций — бактериальной, грибковой, вирусной, что может привести к гибели пациента. Инфекционные осложнения являются одной из ведущих причин смерти при терминальных стадиях лейкозов.
Для предотвращения заражения, рекомендуется тщательно соблюдать принципы гигиены — уход за полостью рта, антисептическая обработка рук как самого больного, так и ухаживающего персонала, назначение профилактических антибактериальных и противогрибковых препаратов.
Трансфузионная поддержка
При сильном угнетении кроветворения, развивается тяжелая анемия и тромбоцитопения. Для купирования этих состояний могут применяться трансфузии эритроцитарной и тромбоцитарной массы.
Тромбоцитарные трансфузии
Раньше тромбомассу переливали при снижении количества тромбоцитов ниже 20*109/л. Но потом появились рекомендации, согласно которым тромбоцитарные трансфузии проводят при падении уровня тромбоцитов ниже 10*109/л. При более высоких цифрах назначение тромбомассы не приводит к снижению риска развития кровотечения.
При появлении признаков геморрагического синдрома, тромбоцитарную трансфузию начинают немедленно и при необходимости увеличивают ее объем. Признаки геморрагического синдрома:
- Наличие петехиальных высыпаний, особенно в полости рта и других слизистых.
- Повышение температуры при отсутствии очагов инфекции.
- Наличие кровотечения.
- Возникновение инфекции.
Трансфузии эритроцит-содержащих сред
У терминальных больных желательно поддерживать целевой уровень гемоглобина не ниже 80 г/л. Особое внимание уделяется пациентам с тромбоцитопениями. При развитии тяжелых анемий показано переливание эритромассы до достижения целевого уровня.
В настоящее время во всем мире принят принцип — если больного нельзя вылечить, это не значит, что ему нельзя помочь!
диагностика и лечение в Европейской клинике
Хронический лимфоцитарный лейкоз — это злокачественная опухоль, произрастающая из малых В-лимфоцитов. Она характеризуется накоплением опухолевого клона клеток в костном мозге, лимфоидных тканях (лимфоузлы, селезенка) и крови. К этому же виду заболевания относится лимфома из малых лимфоцитов (ЛМЛ). Биологически она идентична ХЛЛ, но отличается клинической картиной. При хроническом лейкозе поражается костный мозг, и, как следствие, в крови повышается уровень лимфоцитов, а при ЛМЛ в основном поражаются лимфатические узлы и селезенка. Содержание опухолевого клона в крови менее 5×10 9 /л.
Классификация ХЛЛ
Хронический лейкоз классифицируется по стадиям и по группам риска.
Стадия заболевания определяется на основании клинического обследования и результатах анализа крови:
- Стадия А — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено менее 3 областей лимфатических узлов.
- Стадия В — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено более 3 областей лимфатических узлов.
- Стадия С уровень гемоглобина менее 100 г/л или уровень тромбоцитов менее 100 × 10 9 /л.
Классификация по группам риска
Для данной классификации был разработан международный прогностический индекс, учитывающий следующие параметры:
- мутация TP53 (17p).
- мутация IGHV.
- Уровень β2-микроглобулина >3,5 мг/л.
- Стадия B/С.
- Возраст старше 65 лет.
Каждому из этих параметров присваивается определенное количество баллов, при их суммировании пациент определяется в одну из 4 групп риска:
- 0-1 балл — группа с низким риском прогрессирования.
- 2-3 балла — промежуточный риск прогрессирования.
- 4-6 баллов — высокий риск прогрессирования.
- 7-10 баллов — очень высокий риск прогрессирования.
Симптомы ХЛЛ
Первоначально заболевание протекает бессимптомно, каких-то четких жалоб нет, но отмечаются частые респираторные инфекции, потливость, слабость. Может наблюдаться некоторое увеличение лимфатических узлов. Иными словами, ничего конкретного. На этой стадии хронический лейкоз обнаруживают случайно, когда пациент сдает общий анализ крови по поводу рутинного обследования или при диагностике другого заболевания. При доброкачественном течении такое состояние может продолжаться годами, но потом неизбежно наступает прогрессирование и наступает развернутая стадия процесса.
При развернутой стадии заболевания пациенты предъявляют следующие жалобы:
- Общая слабость.
- Снижение работоспособности.
- Ночная потливость.
- Резкое похудение без особых причин.
- Повышение температуры без признаков инфекции.
- Лимфаденопатия.
Развернутая стадия сменяется терминальной. Здесь уже наблюдается истощение, выраженная интоксикация, тяжелые генерализованные инфекции, нарушение работы внутренних органов (почечная недостаточность, кардиомиопатии и др). При инфильтрации головного мозга опухолевыми клетками, происходит нарушение сознания, вплоть до комы.
Причины возникновения хронического лимфоцитарного лейкоза
Причины возникновения хронического лимфолейкоза до конца не ясны. Многие факторы риска, которые имеют ключевое значение при развитии других злокачественных новообразований и гемобластозов, здесь не актуальны (воздействие ионизирующего излучения, химических канцерогенов, хронических инфекций). В то же время обнаружено увеличение заболеваемости среди лиц, занятых в обслуживании высоковольтных линий электропередач. Также доказана роль наследственной предрасположенности. Риски развития ХЛЛ при наличии в семье родственника с такой патологий увеличиваются в 30 раз по сравнению со среднепопуляционными показателями.
Диагностика хронического лимфолейкоза
Всем пациентам с подозрением на хронический лейкоз, а также с уже подтвержденным диагнозом во время каждого визита к гематологу проводят опрос и уточнение жалоб. Это важно не только для оценки текущего статуса, но и для прогнозирования тактики дальнейшего ведения больного. Особое внимание уделяется наличию неспецифических симптомов интоксикации (повышение температуры более 38 градусов в течение более, чем 2-х недель, ночная потливость и снижение массы тела более, чем на 10% за последние 6 месяцев). Также проводится физикальный терапевтический осмотр, включающий определение размеров печени и селезенки, а также пальпацию доступных лимфатических узлов. Для постановки диагноза назначается ряд специальных тестов:
- Иммунофенотипирование лимфоцитов. Диагноз хронический лимфоцитарный лейкоз выставляется, если уровень В-лимфоцитов в крови превышает 5000/мкл.
- При подозрении на ЛМЛ, когда нет специфической клинической симптоматики и увеличения лимфоцитов в крови, проводят биопсию увеличенного лимфатического узла с последующим морфологическим и иммуногистохимическим исследованием полученного материала.
- Для того чтобы оценить степень поражения костного мозга и отследить динамику изменений после терапии, проводят исследование его пунктата и биоптата. Аналогичные исследования проводят при подозрении на трансформацию лейкоза.
Для подбора терапии выполняются молекулярно-генетические исследования методом FISH для определения делеций 17р, мутаций ТР 53, а также других генетических аномалий.
После окончания терапии необходимо провести исследование крови методом проточной цитометрии для определения минимальной остаточной болезни. Полученные результаты позволят спрогнозировать время до рецидива и общую выживаемость. Например, уровень злокачественных клеток в крови, превышающий 1%, свидетельствует о высокой вероятности раннего рецидива и требует пересмотра протокола лечения. Если уровень опухолевых клеток находится в пределах 0.01-0.9%, ожидаемая продолжительность жизни без прогрессирования составляет 3 года. И при уровне опухолевых клеток менее 0.01% высока вероятность длительной безрецидивной выживаемости (более 5 лет).
Лечение хронического лимфоцитарного лейкоза
Лечение хронического лимфоцитарного лейкоза начинается только по показаниям. Это связано с тем, что около трети всех больных имеют вялотекущую форму заболевания, которая практически не сказывается на продолжительности их жизни.
Показаниями к назначению специфической терапии являются:
- Наличие симптомов интоксикации — повышение температуры более 38 градусов в течение 2 недель, снижение веса на 10% и более за пол года, ночные поты в течение месяца.
- Прогрессирующая анемия и/или тромбоцитопения.
- Прогрессирующее увеличение лимфатических узлов.
- Увеличение количества лимфоцитов в 2 раза и более в течение полугода.
- Увеличение селезенки (более 6 см по краю реберной дуги).
Цели лечения будут зависеть от возраста пациента и наличия у него сопутствующих заболеваний. В этой связи все пациенты с ХЛЛ делятся на три группы:
- 1 группа — пациенты младше 65 лет, у которых нет других серьезных заболеваний, и которые имеют благоприятный молекулярно-генетический профиль лейкоза. В этом случае ставится задача достижения полной ремиссии и редукции минимальной остаточной болезни.
- 2 группа — пациенты старше 65 лет либо молодые пациенты, у которых есть болезни, ограничивающие применение некоторых химиопрепаратов. Целью лечения данной группы является контроль над течением болезни при минимальной токсичности лечения.
- Третья группа — это пациенты с неблагоприятным молекулярно-генетическим профилем лейкоза (наличие делеции 17р, мутации ТР 53), независимо от возраста и общего статуса. Главным компонентом их лечения является ибрутиниб. Сохранным больным без тяжелых сопутствующих патологий может быть показана трансплантация аллогенных стволовых клеток (ТГСК).
Терапия первой линии пациентов первой группы
Стандартом лечения таких больных является режим FCR, включающий ритуксимаб, флударабин и циклофосфамид. Эта схема дает хорошие результаты, но сопряжена с высоким риском токсических и нейтропенических осложнений.
Пациентам, которым такой режим лечения провести невозможно, назначается схема RB — ритуксимаб и бендамустин. Этот режим менее токсичен, но вместе с тем и отличается чуть меньшей эффективностью. Также в качестве варианта лечения для достижения ремиссии может применяться ибрутиниб в качестве монотерапии.
Лечение пациентов второй группы
При терапии пациентов второй группы применяются менее токсические режимы и лечение таргетными препаратами. Могут использоваться следующие схемы:
- BR.
- FCR-lite.
- Хлорамбуцил + ритуксимаб.
- Монотерапия хлорамбуцилом.
- Хлорамбуцил + обинутузумаб.
- Монотерапия ибрутинибом.
Пациентам старше 80 лет, у которых ожидается невысокая продолжительность жизни, применяются максимально щадящие схемы. Как правило, это монотерапия хлорамбуцилом, ритуксимабом или ибрутинибом.
Лечение пациентов третьей группы
Пациентам из группы высокого риска может быть рекомендовано следующее лечение:
- Терапия ибрутинибом как в монорежиме, так и в составе полихимиотерапии с ритуксимабом или бендамустином. Лечение проводят до прогрессирования заболевания или развития токсических осложнений.
- Комбинированное лечение венетоклаксом и обинутузумабом в течение 12 месяцев.
- Молодым пациентам без сопутствующей патологии проводят лечение ибрутинибом до достижения объективного ответа, а затем рассматривается вариант донорской ТГСК для консолидации ремиссии.
- Пациентам, которым по каким-либо причинам невозможно назначение ибрутиниба, проводят монотерапию венетоклаксом.
Лечение рецидивов
При определении схемы лечения рецидива учитываются следующие данные:
- Схема лечения, выбранная для терапии первой линии.
- Время развития рецидива.
- Особенности течения рецидива.
Пациентам, у которых рецидив развился через 2 года после последней терапии (поздний рецидив), можно повторить выбранный режим, использовавшийся при предыдущем лечении или рассмотреть другой вариант ХТ первой линии, предусмотренной для лечения.
Пациентам с ранним рецидивом, который развился менее, чем через 2 года после окончания последней терапиии, не получавшим лечение ибрутинибом, рекомендовано назначать схемы лечения, содержащие этот препарат. Если они получали ибрутиниб, назначается схема венетоклакс+ритуксимаб. Пациентам младше 65 лет, при невозможности назначения ибрутиниба и неэффективнсти венетоклакса и ритуксимаба необходимо рассматривать аллогенную трансплантацию гемопоэтических стволовых клеток.
Лечение сопутствующих осложнений
Одной из основных причин смерти больных хроническим лимфоцитарным лейкозом являются инфекции. Их причиной является замещение нормальных иммунокомпетентных клеток опухолевым клоном и снижение уровня иммуноглобулинов. В этой связи пациентам с хроническим лимфолейкозом при уровне Ig G ниже 5 г/л рекомендуется заместительная терапия иммуноглобулином. Его вводят внутривенно раз в месяц в течение года. Также показана вакцинация против сезонных инфекций: гриппа, пневмококка, гемофильной инфекции, менингококковой инфекции.
Последствия хронического лимфоцитарного лейкоза
У 3-10% больных хроническим лимфоцитарным лейкозом возможна трансформация заболевания в крупноклеточную иммунобластную лимфому. Для подтверждения диагноза необходимо проведение биопсии пораженных лимфоузлов. Также возможна трансформация ХЛЛ в острый лимфобластный лейкоз. Вероятность такого события составляет менее 2%. Очень редко хронический лимфоцитарный лейкоз трансформируется в миеломную болезнь.
Прогноз при хроническом лимфоцитарном лейкозе
Хронический лимфоцитарный лейкоз на сегодняшний день является неизлечимым заболеванием. Однако возможности современной терапии позволяют существенно продлить жизнь таких больных, сохранив ее качество на приемлемом уровне. В целом продолжительность жизни таких пациентов стремится к общепопуляционным показателям.
В Европейской клинике лечение хронического лимфолейкоза проводится согласно современным стандартам с использованием новейших препаратов. Пациентами занимаются опытные врачи, в сложных случаях решение принимается коллегиально консилиумом специалистов. Благодаря такому подходу в каждом случае нам удается достичь максимально возможных результатов.
Схемы лечения лейкемии: острый лимфобластный лейкоз (ALL)
Репрезентативные схемы
• Терапия на основе дазатиниба
Индукционная терапия:
1-2 недели: все пациенты прошли первые 2 недели индукционной терапии в предварительном исследовании COG или DCFI ALL
.3-4 недели:
День 1,8 режима AALL0622 или 15,22 день режима индукции: Винкристин 1,5 мг / м2 внутривенно / доза (максимальная доза: 2 мг)
День 1,8 режима AALL0622 или 15,22 день режима индукции: Даунорубицин 25 мг / м2 в / в / доза
15-й день режима AALL0622 или 29-й день индукционной терапии: тройная интратекальная терапия
Примечание: Пациенты с CNS3g также получали тройную интратекальную терапию в дни 1,8 режима AALL0622 или дни 15 и 22 режима индукции
День 1-14 или 1-21: дазатиниб 60 мг / м2 перорально два раза в день.
Консолидационная терапия — Блок I (6-8 недели)
День 1-5: этопозид 100 мг / м2 в / в
День 1-5: Ифосфамид 1800 мг / м2 с Месной
День 1: Тройная интратекальная терапия
Примечание. До внесения поправок в исследование все пациенты получали дозу тройной интратекальной терапии в 1-й день, который является 36-м днем протокола терапии. После внесения поправок в исследование пациенты не получали тройную интратекальную терапию в 1-й день консолидации. Пациенты, которые были классифицированы как ЦНС 2a, 2b или 2cg, и пациенты с травматическим постукиванием, которые не получали 2 тройных интратекальных доз при индукции, также получали дозы на 8,15 дни.
Консолидационная терапия — Блок II
День 1: высокие дозы метотрексата 500 мг / м2 в течение 30 минут, затем 4500 мг / м2 в течение оставшихся 24 часов
День 1: Тройная интратекальная терапия (см. Примечание выше)
День 2,3: Цитарабин 3000 мг / м2 / доза в / в более 3 часов каждые 12 часов x 4 дозы
Начало в день 4: Филграстим (Г-КСФ) 5 мкг / кг / доза подкожно / в / в продолжалась до АНК> 1500 / мкл.
День 1-14 или 1-21: дазатиниб 60 мг / м2 перорально два раза в день.
Реиндукционная терапия — Блок I (12-14 недели; пациенты, не выполняющие ТГСК):
День 1,8,15: Винкристин 1,5 мг / м2 внутривенно (максимальная доза: 2 мг)
День 1,2: Даунорубицин 45 мг / м2 в / в
День 3,4: Циклофосфамид 250 мг / м2 внутривенно каждые 12 часовf
День 4: ПЭГ-аспарагиназа 2500 МЕ / м2 в / м или в / в
День 1,15: Тройная интратекальная терапия
дни 1-7, 15-21: дексаметазон 6 мг / м2 перорально, разделенный два раза в день
День 5: Филграстим (Г-КСФ): 5 мкг / кг подкожно или внутривенно и продолжалось до тех пор, пока АНК> 1500 / мкл
День 1-14 или 1-21: дазатиниб 60 мг / м2 перорально два раза в день.
Интенсифицирующая терапия — Блок I (15-23 недели; пациенты, не выполняющие ТГСК):
1,15 день: высокая доза метотрексата 500 мг / м2 внутривенно в течение 30 минут, затем 4500 мг / м2 в течение оставшихся 24 часов
День 1,22: Тройная интратекальная терапия
дни 22-26: этопозид 100 мг / м2 в течение 1 часа
День 22-26: Циклофосфамид 300 мг / м2 внутривенно в течение 1 часа с Месной
День 27: Филграстим (Г-КСФ) 5 мкг / кг подкожно или внутривенно и продолжается до АНК> 1500 / мкл
День 43,44: Цитарабин 3000 мг / м2 внутривенно каждые 12 часов × 4 дозы
День 44: L-аспарагиназа 6000 МЕ / м2, вводимая через 6 часов после завершения курса цитарабина
дни 1-14, 22-35, 43-56 или дни 1-63: дазатиниб 60 мг / м2 перорально два раза в день.
Реиндукционная терапия — Блок II (24-26 недели; пациенты, не выполняющие ТГСК):
День 1,8,15: Винкристин 1,5 мг / м2 внутривенно (максимальная доза: 2 мг)
День 1,2: Даунорубицин 45 мг / м2 в / в
День 3,4: Циклофосфамид 250 мг / м2 внутривенно каждые 12 часов × 4 дозыf
День 4: ПЭГ-аспарагиназа 2500 МЕ / м2 внутримышечно после последней дозы циклофосфамида
1,15 день: тройная интратекальная терапия
дни 1-7, 15-21: дексаметазон 6 мг / м2 перорально, разделенный два раза в день
Начало 5-го дня: Филграстим (Г-КСФ) 5 мкг / кг подкожно или внутривенно
День 1-14 или 1-21: дазатиниб 60 мг / м2 перорально два раза в день.
Интенсифицирующая терапия — Блок II (27-35 недели; пациенты, не выполняющие ТГСК):
1,15 день: высокая доза метотрексата 500 мг / м2 внутривенно в течение 30 минут, затем 4500 мг / м2 в течение оставшихся 24 часов
День 1,22: Тройная интратекальная терапия
дни 22-26: этопозид 100 мг / м2 в / в в течение 1 часа
День 22-26: Циклофосфамид 300 мг / м2 внутривенно в течение 1 часа с Месной
Начало 27-го дня: Филграстим (Г-КСФ) 5 мкг / кг подкожно или внутривенно
День 43,44: Цитарабин 3000 мг / м2 внутривенно каждые 12 часов x 4 дозы
День 44: L-аспарагиназа 6000 МЕ / м2 внутримышечно через 6 часов после завершения курса цитарабина
дни 1-14, 22-35, 43-56 или дни 1-63: дазатиниб 60 мг / м2 перорально два раза в день.
Поддерживающая терапия — циклы 1-4 (36-67 недели; пациенты, не выполняющие ТГСК):
День 1: высокая доза метотрексата 500 мг / м2 внутривенно в течение 30 минут, затем 4500 мг / м2 внутривенно в течение оставшихся 24 часов
День 1,29: Тройная интратекальная терапия
День 1,29: Винкристин 1,5 мг / м2 внутривенно (максимальная доза: 2 мг)
дни 1-5, 29-33: дексаметазон 6 мг / м2 перорально, разделенный два раза в день
День 8-28: Меркаптопурин 75 мг / м2 перорально
День 8,15,22: Метотрексат 20 мг / м2 перорально натощак
29-33 дни: этопозид 100 мг / м2 в / в в течение 1 часа
День 29-33: Циклофосфамид 300 мг / м2 внутривенно сразу после этопозида с Меснафом
Начало 34-го дня: Филграстим (Г-КСФ) 5 мкг / м2 и продолжать до АНК> 1500 / мкл
дни 1-14, 29-42 или дни 1-49: дазатиниб 60 мг / м2 перорально два раза в день.
Поддерживающая терапия — цикл 5 (68-75 недели; пациенты, не переходящие на ТГСК):
Начало 1-го дня: Черепное облучение
День 1,29: Винкристин 1,5 мг / м2 внутривенно (максимальная доза: 2 мг)
дни 1-5, 29-33: дексаметазон 6 мг / м2 перорально, разделенный два раза в день
Первый день после завершения краниального облучения: Меркаптопурин 75 мг / м2 перорально ежедневно
День 8,15,22,29,36,43,50: Метотрексат 20 мг / м2 перорально
дни 1-14, 29-42 или дни 1-49: дазатиниб 60 мг / м2 перорально два раза в день.
Поддерживающая терапия — циклы 6-12 (76-131 недели; пациенты, не переходящие на ТГСК)
День 1,29: Винкристин 1,5 мг / м2 внутривенно (максимальная доза: 2 мг)
дни 1-5, 29-33: дексаметазон 6 мг / м2 перорально, разделенный два раза в день
День 1-56: Меркаптопурин 75 мг / м2 перорально натощак
дней 1,8,15,22,29,36,43,50: метотрексат 20 мг / м2 перорально
дни 1-14, 29-42 или дни 1-49 или 1-21: дазатиниб 60 мг / м2 перорально два раза в день.
• Терапия на основе иматиниба
Индукционная терапия:
День 1: Циклофосфамид 1200 мг / м2 внутривенно в течение 3 часовf
День 1-3: Даунорубицин 60 мг / м2 в / в в течение 1 часа
Дни 1,8,15,22: Винкристин 1.3 мг / м2 в / в болюс
День 1-21: Преднизолон 60 мг / м2 перорально
День 8-63: Иматиниб 600 мг перорально
День 29: Метотрексат 15 мг интратекально
День 29: Цитарабин 40 мг интратекально
День 29: Дексаметазон 4 мг интратекально.
Консолидационная терапия — цикл I:
День 1: Метотрексат 1000 мг / м2 внутривенно в течение 24 часов
День 2,3: Цитарабин 2000 / м2 в течение 3 часов × 2
День 1-3: Метилпреднизолон 50 мг внутривенно в течение 1 часа × 2
День 1: Метотрексат 15 мг интратекально
День 1: Цитарабин 40 мг интратекально
День 1: Дексаметазон 4 мг интратекально.
Администрирование в течение 4 циклов, чередующихся с циклом II.
Консолидационная терапия — цикл II:
1-28 дни: Иматиниб 600 мг перорально
День 1: Метотрексат 15 мг интратекально
День 1: Цитарабин 40 мг интратекально
День 1: Дексаметазон 4 мг интратекально.
Администрирование в течение 4 циклов, чередующихся с циклом I.
Поддерживающая терапия:
День 1: Винкристин 1,3 мг / м2 внутривенно (болюс) (максимум 2 мг)
День 1-5: Преднизолон 60 мг / м2 перорально
1-28 дни: Иматиниб 600 мг перорально.
Поддерживающая терапия назначается каждые 4 недели до 2 лет с момента полной ремиссии.
• Терапия на основе нилотиниба
Индукционная терапия:
День 1-3: Даунорубицин 90 мг / м2 внутривенно, непрерывная 24-часовая инфузия
День 1,8: Винкристин 2 мг внутривенно, пушистый
День 1-14: Преднизолон 60 мг / м2 перорально или 48 мг / м2 внутривенно
День 8 до начала кондиционирования для алло-HCT или до конца 2 лет поддерживающей терапии: Нилотиниб 400 мг перорально два раза в день.
Консолидация — цикл A:
День 1,2: Даунорубицин 45 мг / м2 внутривенно, непрерывная 24-часовая инфузия
День 1-8: Винкристин 2 мг внутривенно
День 1-14: Преднизолон 60 мг / м2 перорально
Нилотиниб 400 мг перорально два раза в день.
Администрирование на 1 цикл.
Консолидация — цикл B:
День 1-4: Цитарабин 2000 мг / м2 в / в более 2 часов
День 1-4: этопозид 150 мг / м2 в / в более 3 часов
Нилотиниб 400 мг перорально два раза в день.
Администрирование в течение 2 циклов, чередующихся с циклом C.
Консолидация — цикл C:
1-2, 15-16 дни: метотрексат 220 мг / м2 в / в болюс, затем 60 мг / м2 в час в течение 36 часов
лейковорин с последующим внутривенным введением 50 мг / м2 каждые 6 часов 3 дозы; затем лейковорин перорально до концентрации метотрексата в сыворотке <0,05 мкмоль / л
Нилотиниб 400 мг перорально два раза в день.
Администрирование в течение 2 циклов, чередующихся с циклом Б.
Поддерживающая терапия:
Нилотиниб 400 мг перорально два раза в день в течение 2 лет.
Профилактика ЦНС:
До 10 доз метотрексата 15 мг интратекально, с:
Гидрокортизон 50 мг во время или после индукционной терапии.
Если острый миелоидный лейкоз (ОМЛ) не помогает или возвращается после лечения
Чаще всего острый миелоидный лейкоз (ОМЛ) переходит в ремиссию после начального лечения. Но иногда он не проходит полностью или возвращается (рецидивирует) после периода ремиссии. Если это произойдет, можно попробовать другие методы лечения, если человек для них достаточно здоров.
Лечение большинства типов ОМЛ
Если ОМЛ не проходит полностью с помощью индукционного лечения, иногда можно попробовать второй аналогичный курс химиотерапии (химиотерапии), часто называемый повторная индукция . Если это не помогает, можно попробовать лечение другими химиопрепаратами или более интенсивными дозами химиотерапии, если человек может их переносить. Трансплантация стволовых клеток может быть вариантом для некоторых людей, поскольку она позволяет использовать более высокие дозы химиотерапии. Клинические испытания новых подходов к лечению также могут быть вариантом.
Если лейкоз прошел и теперь вернулся, варианты лечения зависят от возраста и состояния здоровья пациента, а также от того, как долго лейкоз находился в стадии ремиссии. ОМЛ чаще всего рецидивирует в костном мозге и крови. Мозг или спинномозговая жидкость (СМЖ) редко является первым местом, где он рецидивирует, но если это происходит, его часто лечат химиотерапией, вводимой непосредственно в СМЖ.
Если ремиссия длилась не менее года, иногда можно снова перевести лейкоз в ремиссию с помощью дополнительной химиотерапии, хотя это вряд ли будет продолжительным.Для более молодых пациентов (обычно моложе 60 лет) большинство врачей порекомендуют пересадку стволовых клеток, если можно найти подходящего донора. Клинические испытания новых подходов к лечению также могут быть вариантом.
Если ОМЛ возвращается раньше, чем через 12 месяцев, большинство врачей по возможности рекомендуют пересадку стволовых клеток более молодым пациентам. Другой вариант — участие в клиническом исследовании.
Другим вариантом лечения ОМЛ, который не проходит или возвращается после лечения, может быть целевой препарат гемтузумаб озогамицин (Mylotarg) .
Если лейкоз снова возвращается или не проходит, дальнейшее химиотерапевтическое лечение, вероятно, будет не очень полезным. Если трансплантация стволовых клеток невозможна, пациент может рассмотреть возможность участия в клинических испытаниях новых методов лечения.
Для ОМЛ с мутацией в гене FLT3
Если лейкозные клетки имеют мутацию в гене FLT3 и лейкоз не проходит или возвращается позже, одним из вариантов может быть лечение гильтеритинибом (Xospata), который является разновидностью таргетный препарат.
Для AML с мутацией в гене IDh2 или IDh3
Если лейкозные клетки имеют мутацию гена IDh2 или IDh3 , одним из вариантов, если лейкемия не проходит или она возвращается позже, может быть лечение целевым препаратом, называемым ингибитором IDH , таким как ивосидениб. (Tibsovo) для AML с мутацией IDh2 или энасидениб (Idhifa) для AML с мутацией IDh3 . Другие варианты могут включать химиотерапию или трансплантацию стволовых клеток.
Лечение острого промиелоцитарного лейкоза (APL)
Варианты лечения APL, которые не проходят при начальном лечении или рецидивы зависят от того, какие методы лечения использовались ранее, а также от других факторов.
Для пациентов, которые вначале лечились нехимиотерапевтическими препаратами, полностью транс-ретиноевой кислотой (ATRA) и триоксидом мышьяка (ATO) и у которых рано рецидивирует (обычно в течение примерно 6 месяцев), лечение, скорее всего, будет проводиться с использованием тех же химиотерапевтических препаратов препараты, применяемые для лечения других видов ОМЛ.Если ремиссия длится дольше, ATO можно использовать снова, возможно, вместе с другими видами лечения, такими как ATRA, химиотерапия и таргетный препарат Mylotarg.
Если первоначальное лечение было ATRA плюс химиотерапия, ATO часто бывает очень эффективным.
В какой-то момент пересадка стволовых клеток может оказаться хорошим вариантом, если человек достаточно здоров. Другой вариант — участие в клиническом исследовании.
Поддерживающая терапия от лейкемии, которая не исчезнет
Если дальнейшее лечение или клинические испытания невозможны, основное внимание в лечении может быть направлено на контроль симптомов, вызванных лейкемией, а не на попытки ее лечения.Это называется паллиативным лечением или поддерживающей терапией. Например, врач может посоветовать менее интенсивную химиотерапию, чтобы попытаться держать лейкоз под контролем, вместо того, чтобы пытаться вылечить его.
По мере роста лейкемии в костном мозге может возникнуть боль. Важно, чтобы вам было максимально комфортно. Лечение, которое может быть полезным, включает лучевую терапию и соответствующие обезболивающие. Если такие лекарства, как аспирин и ибупрофен, не помогают при боли, могут оказаться полезными более сильные опиоидные препараты, такие как морфин.Некоторые люди могут беспокоиться о приеме более сильных лекарств из-за страха постоянной сонливости или привыкания к ним. Но многие люди получают очень эффективное обезболивающее от этих лекарств без серьезных побочных эффектов.
Другими распространенными симптомами лейкемии являются низкие показатели крови и утомляемость. Для решения этих проблем могут потребоваться лекарства или переливание крови. Тошноту и потерю аппетита можно лечить с помощью лекарств и высококалорийных пищевых добавок. Возникающие инфекции можно лечить антибиотиками.
Очень важно сообщить вашей команде по лечению рака, если у вас есть боль или какие-либо другие симптомы, чтобы их можно было вылечить.
Подтипы острого миелоидного лейкоза (AML) и прогностические факторы
Для большинства видов рака очень важно определение стадии (степени) рака. Этап зависит от размера основной опухоли и того, насколько далеко распространился рак. Это может быть полезно при прогнозировании настроения человека и выборе лечения.
Острый миелоидный лейкоз (ОМЛ), с другой стороны, обычно не приводит к образованию опухолей.Обычно он широко распространен в костном мозге, а в некоторых случаях распространился на другие органы, такие как печень и селезенка. Следовательно, ОМЛ не является стадийным, как большинство других видов рака. Прогноз для человека с ОМЛ зависит от другой информации, такой как подтип ОМЛ (определяемый лабораторными тестами), возраст пациента и результаты других лабораторных тестов.
Знание подтипа ОМЛ может быть очень важным, поскольку иногда оно влияет как на внешний вид пациента, так и на лучшее лечение. Например, подтип острого промиелоцитарного лейкоза (APL) часто лечится с использованием лекарств, отличных от тех, которые используются для других подтипов AML.Если вы не уверены, какой у вас подтип ОМЛ, спросите об этом своего врача и о том, как он может повлиять на ваше лечение.
Две из основных систем, которые использовались для классификации AML на подтипы, — это франко-американско-британская классификация (FAB) и более новая классификация Всемирной организации здравоохранения (ВОЗ).
Французско-американо-британская (FAB) классификация AML
В 1970-х годах группа французских, американских и британских экспертов по лейкемии разделила ОМЛ на подтипы, от M0 до M7, в зависимости от типа клетки, из которой развивается лейкоз, и степени зрелости этих клеток.Это было во многом основано на том, как лейкозные клетки выглядели под микроскопом после стандартного окрашивания.
FAB подтип | Имя |
M0 | Недифференцированный острый миелобластный лейкоз |
M1 | Острый миелобластный лейкоз с минимальным созреванием |
M2 | Острый миелобластный лейкоз с созреванием |
M3 | Острый промиелоцитарный лейкоз (ОПЛ) |
M4 | Острый миеломоноцитарный лейкоз |
M4 eos | Острый миеломоноцитарный лейкоз с эозинофилией |
M5 | Острый моноцитарный лейкоз |
M6 | Острый эритроидный лейкоз |
M7 | Острый мегакариобластный лейкоз |
Подтипы от M0 до M5 начинаются с незрелых форм лейкоцитов.M6 AML начинается в очень незрелых формах эритроцитов, тогда как M7 AML начинается в незрелых формах клеток, которые производят тромбоциты.
Классификация AML по классификации Всемирной организации здравоохранения (ВОЗ)
Система классификации FAB может быть полезной, но она не принимает во внимание многие факторы, которые, как сейчас известно, влияют на прогноз (перспективы). Система Всемирной организации здравоохранения (ВОЗ), последняя обновленная в 2016 году, включает некоторые из этих факторов, чтобы попытаться лучше классифицировать AML.
Система ВОЗ делит AML на несколько групп:
ОМЛ с определенными генетическими аномалиями (изменения генов или хромосом)
- ОМЛ с транслокацией между хромосомами 8 и 21 [t (8; 21)]
- AML с транслокацией или инверсией в хромосоме 16 [t (16; 16) или inv (16)]
- APL со слитым геном PML-RARA
- ОМЛ с транслокацией между хромосомами 9 и 11 [t (9; 11)]
- AML с транслокацией между хромосомами 6 и 9 [t (6: 9)]
- AML с транслокацией или инверсией хромосомы 3 [t (3; 3) или inv (3)]
- AML (мегакариобластный) с транслокацией между хромосомами 1 и 22 [t (1:22)]
- AML с гибридным геном BCR-ABL1 ( BCR-ABL ) *
- AML с мутированным геном NPM1
- AML с двуаллельными мутациями гена CEBPA (то есть мутациями в обеих копиях гена)
- AML с мутированным геном RUNX1 *
* Это все еще «временная сущность», то есть еще не ясно, достаточно ли доказательств того, что это уникальная группа.
ОМЛ с изменениями, связанными с миелодисплазией
ОМЛ, связанный с предыдущей химиотерапией или лучевой терапией
AML, не указано иное (Сюда входят случаи AML, которые не попадают в одну из вышеуказанных групп и аналогичны классификации FAB.)
- AML с минимальной дифференциацией (FAB M0)
- ОМЛ без созревания (FAB M1)
- ОМЛ с созреванием (FAB M2)
- Острый миеломоноцитарный лейкоз (FAB M4)
- Острый монобластный / моноцитарный лейкоз (FAB M5)
- Чистый эритроидный лейкоз (FAB M6)
- Острый мегакариобластный лейкоз (FAB M7)
- Острый базофильный лейкоз
- Острый панмиелез с фиброзом
Миелоидная саркома (также известная как гранулоцитарная саркома или хлорома)
Миелоидные пролиферации, связанные с синдромом Дауна
Недифференцированные и бифенотипические острые лейкозы не являются строго ОМЛ, но представляют собой лейкозы, которые имеют как лимфоцитарные, так и миелоидные особенности.Иногда их называют острыми лейкозами со смешанным фенотипом (MPAL) .
Факторы прогноза ОМЛ
Подтип AML может иметь важное значение для определения прогноза (перспектив) человека. Но другие факторы также могут повлиять на то, почему у некоторых пациентов с ОМЛ прогноз лучше, чем у других. Это так называемые прогностические факторы . Факторы прогноза помогают врачам определить риск рецидива лейкемии после лечения и, следовательно, необходимость более или менее интенсивного лечения.Некоторые из них включают:
Хромосомные (цитогенетические) аномалии
Клетки AML могут иметь много видов хромосомных изменений, некоторые из которых могут влиять на прогноз человека. Перечисленные ниже — одни из самых распространенных, но есть и многие другие. Эти нарушения есть не у всех лейкозов. Пациенты, у которых нет ни одного из этих признаков ОМЛ, обычно имеют прогноз между благоприятным и неблагоприятным.
Благоприятные отклонения от нормы:
- Транслокация между хромосомами 8 и 21 (чаще всего наблюдается у пациентов с M2)
- Транслокация или инверсия хромосомы 16
- Транслокация между хромосомами 15 и 17 (чаще всего наблюдается у пациентов с M3)
Неблагоприятные отклонения от нормы:
- Делеция (потеря) части хромосомы 5 или 7
- Транслокация или инверсия хромосомы 3
- Транслокация между 6 и 9 хромосомами
- Транслокация между 9 и 22 хромосомами
- Аномалии хромосомы 11 (в точке q23)
- Потеря хромосомы, поэтому у клетки есть только 1 копия вместо обычных 2 (так называемая моносомия)
- Сложные изменения (с участием 3 и более хромосом)
Мутации генов
Люди, лейкозные клетки которых имеют определенные генные мутации, могут иметь лучшее или худшее прогнозирование.
Например, люди с ОМЛ, у которых есть мутация в гене FLT3 , как правило, имеют худшие перспективы, хотя новые лекарства, нацеленные на клетки с этим аномальным геном, могут привести к лучшим результатам. Мутации в генах TP53 , RUNX1 и ASXL1 также связаны с худшими перспективами.
С другой стороны, люди, лейкозные клетки которых имеют изменения в гене NPM1 (и никаких других отклонений), по-видимому, имеют лучший прогноз, чем люди без этого изменения.Изменения в обеих копиях гена CEBPA также связаны с лучшим результатом.
Маркеры лейкозных клеток
Если лейкозные клетки имеют на своей поверхности белок CD34 и / или Р-гликопротеин (продукт гена MDR1 ), это связано с худшими перспективами.
Возраст
Как правило, люди старше 60 не справляются так хорошо, как молодые люди. Отчасти это может быть связано с тем, что у них более высокая вероятность неблагоприятных хромосомных аномалий.Иногда у них также есть другие заболевания, из-за которых им становится труднее выдерживать более интенсивные режимы химиотерапии.
Количество лейкоцитов
Высокое количество лейкоцитов (> 100 000 / мм 3 ) на момент постановки диагноза связано с худшим прогнозом.
Предыдущее заболевание крови, приведшее к ОМЛ
Наличие ранее перенесенного заболевания крови, такого как миелодиспластический синдром, связано с худшим прогнозом.
ОМЛ, связанный с лечением
AML, который развивается после лечения человека от другого рака, связан с худшим прогнозом.
Инфекция
Наличие системной (кровяной) инфекции, когда вам поставлен диагноз, связано с худшим прогнозом.
Лейкозные клетки центральной нервной системы
Лейкоз, который распространился на область вокруг головного и спинного мозга, трудно поддается лечению, поскольку большинство химиотерапевтических препаратов не достигают этой области.
Статус ОМЛ после лечения
Насколько хорошо (и как быстро) лейкоз поддается лечению, также влияет на долгосрочный прогноз.Лучшая первоначальная реакция была связана с лучшими долгосрочными результатами.
Ремиссия (полная ремиссия) обычно определяется как отсутствие признаков заболевания (NED) после лечения. Это означает, что в костном мозге содержится менее 5% бластных клеток, количество клеток крови находится в пределах нормы, а признаки или симптомы лейкемии отсутствуют. A полная молекулярная ремиссия означает, что нет никаких доказательств наличия лейкозных клеток в костном мозге, даже при использовании очень чувствительных тестов, таких как ПЦР (полимеразная цепная реакция).
Минимальная остаточная болезнь (MRD) — это термин, используемый после лечения, когда лейкозные клетки не могут быть обнаружены в костном мозге с помощью стандартных тестов (таких как просмотр клеток под микроскопом), но более чувствительных тестов (таких как проточная цитометрия). или ПЦР) обнаруживают доказательства того, что в костном мозге все еще есть лейкозные клетки.
Активное заболевание означает, что либо есть доказательства того, что лейкоз все еще присутствует во время лечения, либо что болезнь вернулась после лечения (рецидив).Чтобы у пациента случился рецидив, в его костном мозге должно быть более 5% бластных клеток.
Выживаемость лейкемии по возрасту
Лейкемия — это широкая категория рака, поражающего лейкоциты. Шансы на выживание зависят от множества факторов, включая возраст человека и реакцию на лечение.
По оценкам Американского онкологического общества, в 2018 году в США будет зарегистрировано около 60 300 новых случаев лейкемии, что приведет к 24 370 смертельным исходам.
Есть много разных типов лейкемии.Тип, который развивается у человека, зависит от того, какие лейкоциты поражены, а также от некоторых других факторов.
Лейкоз может препятствовать борьбе лейкоцитов с инфекциями и вызывать их неконтролируемое размножение. Этот чрезмерный рост может вызвать скопление здоровых клеток крови, что приведет к серьезным проблемам во всем организме.
Лейкозом может быть:
- Острый , когда большинство пораженных лейкоцитов не могут нормально функционировать, вызывая быструю дегенерацию.
- Хронический , который возникает, когда только некоторые из пораженных клеток крови не могут нормально функционировать, вызывая более медленную дегенерацию.
Последние данные показывают, что 5-летняя выживаемость для всех подтипов лейкемии составляет 61,4 процента.
Пятилетняя выживаемость показывает, сколько людей еще живы через 5 лет после постановки диагноза.
Лейкоз чаще всего встречается у людей старше 55 лет, средний возраст диагноза — 66 лет.
Это также одно из наиболее распространенных онкологических заболеваний у людей младше 20 лет.Выживаемость выше у молодых людей.
По данным Национального института рака, процент смертей по возрастным группам следующий:
| Возрастная группа | % смертей |
| Моложе 20 лет | 2,2 |
| 2,6 | |
| 35–44 | 2,4 |
| 45–54 | 5,5 |
| 55–64 | 12.6 |
| 65–74 | 23,1 |
| 75–84 | 30,0 |
| > 84 | 21,6 |
На вероятность выживания лейкемии влияет ряд факторов.
Факторы включают:
- возраст
- время постановки диагноза
- прогрессирование и распространение рака
- тип лейкемии
- семейный анамнез состояния крови и лейкемии
- степень повреждения костей
- воздействие определенных химических веществ , например, бензол и некоторые нефтехимические продукты
- воздействие определенных видов химиотерапии и лучевой терапии
- мутации хромосом
- реакция организма на лечение
- количество клеток крови
- употребление табака
Хотя в настоящее время лекарства от лейкемии не существует, можно вылечить рак, чтобы предотвратить его повторное появление.
Успех лечения зависит от ряда факторов. Лечение может включать:
Лечение может длиться несколько месяцев или даже лет в зависимости от типа и тяжести состояния.
Поделиться на Pinterest Больному лейкемией следует искать эмоциональной поддержки у друзей и семьи.Постановка диагноза лейкемия меняет жизнь и является сложной задачей как для человека, так и для его близких.
Обычно после постановки диагноза «рак» возникает смесь эмоций, но все реагируют по-разному в этих ситуациях.Некоторые могут попытаться сделать смелое лицо, чтобы защитить своих близких, в то время как другие будут открыто искать поддержки.
Важно помнить, что поддержка доступна каждому из самых разных источников, включая:
Врач : вопросы о лейкемии, ее симптомах, вариантах лечения, стадиях и выживаемости могут помочь человеку понять их состояние.
Друзья и семья : Друзья и семья могут оказать интимную и эмоциональную поддержку.Они также могут помочь человеку с повседневными задачами, которые могут стать слишком сложными из-за симптомов лейкемии или лечения.
Группы поддержки : Эти группы полезны для встреч с другими людьми, которые могут предложить совет и поддержку на основе их собственного жизненного опыта или знаний. Группы поддержки существуют как для людей, больных лейкемией, так и для их близких.
Благотворительные организации : Такие организации, как Общество лейкемии и лимфомы, занимаются оказанием поддержки людям с диагнозом рака.
Также могут существовать местные благотворительные организации и онлайн-ресурсы, которые могут помочь человеку понять свое состояние и управлять им.
Обновленная информация о лейкемии при беременности
1. Введение
Во время беременности в организме матери происходят определенные физиологические изменения, которые могут затруднить диагностику лейкемии. Таким образом, диагностика лейкемии может быть отложена, поскольку неспецифические проявления лейкемии, такие как усталость, слабость и одышка, могут быть связаны с беременностью.Кроме того, сама беременность может быть связана с анемией и лейкоцитозом, которые также часто встречаются при лабораторных исследованиях у пациентов с лейкемией [1].
Для диагностики лейкемии необходимо провести морфологическое, иммунофенотипическое и цитогенетическое исследование образцов костного мозга. Однако биопсию костного мозга можно безопасно проводить под местной анестезией у беременных женщин без какого-либо вреда для плода [1]. Сама по себе лейкемия часто представляет собой неотложную медицинскую помощь, которая требует немедленного начала соответствующей терапии.Кроме того, диагностика лейкемии во время беременности — довольно исключительное событие, которое может порождать сложные этические и терапевтические дилеммы. Поэтому многопрофильная команда, в которую помимо пациента входят гематологи, акушеры, неонатологи, психологи и социальные работники, должна участвовать в принятии терапевтических решений [2].
Решение о начале химиотерапии во время беременности необходимо взвесить с учетом последствий задержки лечения для выживаемости матери.В общем, терапевтические решения должны приниматься на основании данных, полученных в ходе проспективных клинических испытаний, но, к сожалению, имеющиеся в литературе данные о лечении большинства лейкозов, диагностированных во время беременности, получены из ретроспективных отчетов о случаях, серий случаев и нескольких метаанализов [1] .
Этот обзор литературы будет охватывать следующее: последствия воздействия цитотоксической химиотерапии, лучевой терапии и таргетной терапии на мать и плод; подробное описание сосуществования различных типов лейкемии и беременности; и конкретные данные, полученные в ходе крупных исследований, и важные отчеты о случаях беременности при различных типах лейкемии.
2. Физиологические и гематологические изменения во время беременности
Беременность связана со следующими физиологическими изменениями, которые могут изменить метаболизм лекарств: (1) медленное опорожнение желудка, (2) увеличение объема плазмы на 50%, (3) увеличение плазмы белков и снижение сывороточного альбумина, (4) усиление окисления в печени и (5) увеличение клубочковой фильтрации и почечного плазменного потока [3]. Кроме того, беременность связана с несколькими гематологическими осложнениями, которые включают: (1) анемию с дефицитом железа из-за кровопотери и нарушений питания, которая является наиболее распространенным гематологическим заболеванием; (2) тромбоцитопения, которая может быть: гестационной из-за идиопатической тромбоцитопенической пурпуры, микроангиопатической гемолитической анемии, преэклампсии, синдрома антифосфолипидных антител или системной эритроматоза волчанки, развивающейся во время беременности; (3) панцитопения, вызванная: острой жировой дегенерацией печени, недостаточностью костного мозга, вызванной апластической анемией или врожденными причинами, лейкемией, лимфомой или метастатическим раком, развивающимся во время беременности; (4) наследственные или приобретенные нарушения свертываемости крови, такие как болезнь фон Виллебранда; и (5) венозная тромбоэмболия [4-6].
3. Воздействие на мать во время беременности
Воздействие на мать следующих агентов во время беременности может повысить риск лейкемии у новорожденных: потребление алкоголя матерью, курение сигарет, использование антибиотиков, воздействие бензола, воздействие эстрогенов, диэтилстильбэстрола и другие гормоны, бактериальные инфекции, пищевой или респираторный материнский IgE и иммуноглобулин G Helicobacter pylori [7-14]. Однако прием беременными женщинами следующих продуктов может иметь защитный эффект от развития лейкемии у новорожденных: витаминные и фолиевые добавки и диета, богатая овощами [15-17].
4. Облучение диагностическим и терапевтическим излучением
Связь между внутриутробным облучением и повышенным риском злокачественных новообразований у детей изучается с 1950-х годов [18]. Потенциальные пагубные последствия ионизирующего излучения для плода включают следующее: (1) прерывание беременности; мертворождение или выкидыш, (2) врожденные пороки развития, (3) нарушения роста или развития; рост и умственная отсталость, а также (4) мутагенные и канцерогенные эффекты [19].Лучевая терапия в первом триместре связана с тератогенными эффектами и повышением риска злокачественных новообразований у детей [20]. Лучевая терапия, проводимая во втором и третьем триместрах беременности, связана с: (1) повышенным риском развития лейкемии и солидных опухолей в течение первого десятилетия жизни и (2) повышенным риском задержки психического развития [20].
Диагностическое облучение матери во время беременности увеличивает риск острого лимфобластного лейкоза (ОЛЛ) у детей.Кроме того, есть некоторые свидетельства того, что воздействие на отца рентгеновских лучей брюшной полости или внутривенных пиелограмм до зачатия увеличивает частоту ОЛЛ у потомства [21]. Пренатальное рентгеновское облучение связано с 40-80% увеличением заболеваемости раком у детей [22]. Пренатальное воздействие ионизирующего излучения было связано со статистически значимым увеличением заболеваемости всеми видами рака, в частности лейкемией, у новорожденных [18]. Однако средняя доза облучения от индивидуальных диагностических и терапевтических процедур исторически снижалась из-за совершенствования техники и безопасности оборудования [18].Послеродовое рентгеновское облучение также связано с небольшим повышением риска всех видов рака в детстве [22]. При дозах <0,05 Гр нет свидетельств повышенного риска: умственной отсталости, аномалий плода, потери беременности или задержки роста [19]. В течение первых 14 дней после оплодотворения: неповрежденное выживание или смерть являются наиболее вероятным результатом радиационного облучения ≥ 0,05 Гр (5 рад). Консервативная оценка порога внутриутробной гибели плода составляет> 1 Гр (10 рад) [19]. После первых 14 дней беременности лучевая нагрузка ≥ 0.5 Гр может быть связано с повышенным риском врожденных пороков развития, задержки роста и умственной отсталости [19]. Всего 10–20 Гр излучения при введении во время органогенеза считается пороговой дозой для тяжелых врожденных пороков развития [20].
Нет сообщений о побочных эффектах на плод диагностических доз радиоактивного йода. Однако радиоактивный йод не следует вводить беременным женщинам, поскольку есть опасения, что он может вызвать рак щитовидной железы у потомства [19].Дородовое воздействие ультразвука не связано с увеличением риска рака у детей, поэтому оно безопасно на всех этапах беременности [19,22,23]. Магнитно-резонансная томография (МРТ) обычно предпочтительнее других методов визуализации, которые включают ионизирующее излучение. Однако гадолиний не рекомендуется применять беременным женщинам [19]. Компьютерное сканирование аксиального и позитронного излучения противопоказано во время беременности, особенно в первых двух триместрах. Обе процедуры можно проводить после родов, но следует соблюдать осторожность при кормлении грудью [23].
5. Воздействие цитотоксической химиотерапии в утробе матери
Действие цитотоксической химиотерапии на развивающийся плод зависит от срока беременности, на котором проводится такое лечение. В предэмбриональной фазе, которая длится от оплодотворения до 17 дней после зачатия, значительное повреждение клеток концептуса приводит к выкидышу [24]. В эмбриональной фазе или фазе органогенеза, которая происходит между 2-8 неделями после зачатия, химиотерапия может вызвать необратимое повреждение вновь сформированных органов тела плода, тогда как в фазе плода, которая длится между 8-й и 38-й неделями после зачатия, желудочно-кишечный и почечный тракты. а также кора головного мозга остаются чувствительными к токсичности, вызванной химиотерапией [24].
В ретроспективном исследовании, в котором участвовали 84 матери с различными гематологическими злокачественными новообразованиями, которые получали цитотоксическую химиотерапию во время беременности, 38 плодов подверглись цитотоксической химиотерапии внутриутробно в течение первого триместра беременности [25]. Родившие дети наблюдались в среднем 18,7 лет (от 6 до 29 лет). У детей, подвергшихся химиотерапии в утробе матери, не было зарегистрировано рака или острого лейкоза, поэтому беременные женщины с агрессивными гематологическими злокачественными новообразованиями, включая лейкоз, могут получать цитотоксическую химиотерапию в полных дозах даже в первом триместре беременности [25].В другом ретроспективном исследовании, включавшем 21 беременность у 18 пациенток с гематологическими злокачественными новообразованиями, 8 младенцев подверглись цитотоксической химиотерапии внутриутробно [26]. Из 4 детей, получавших химиотерапию в первом триместре беременности, у 3 был низкий вес при рождении, а один родился здоровым, но умер через три месяца из-за гастроэнтерита. Четвертый ребенок прошел курс химиотерапии в течение 3 триместров беременности, ребенок родился преждевременно и впоследствии умер от внутричерепного кровоизлияния.Из 3 детей, получавших химиотерапию во втором и третьем триместрах беременности: один умер в утробе матери, один имел низкий вес при рождении и один родился живым, но позже умер от легочного кровотечения. [26]. Побочные эффекты цитотоксической и таргетной терапии у беременных женщин и новорожденных обобщены в Таблице 1 [3,27-30]. Побочные эффекты цитотоксической химиотерапии и лучевой терапии у беременных женщин и плодов включены в Таблицу 2 [30]. Генотоксические и тератогенные эффекты различных цитотоксических агентов показаны в таблице 3 [31-33].Рекомендуемые методы лечения, которые относительно безопасны при лечении беременных женщин с лейкемией, кратко изложены в Таблице 4 [1,2,20,23,34-39].
| Препарат (класс) | Общие побочные эффекты у беременных | Общие побочные эффекты у новорожденных | Тератогенный эффект897 аналог) | — Миелосупрессия — Диарея — Кожные высыпания — Лихорадка — Гепатотоксичность | — Миелосуппрессия — Инфекции — Гепатопатия — Синдром менингеального кровоизлияния и хромодистрессия — Хромодистресс-синдром — Респираторные нарушения — Дыхательные расстройства . — Дефекты роста и врожденные пороки развития. | — Тератогин для животных. — Ожидается проникновение через гемато-плацентарный барьер. — Измерения плаценты человека не проводились. | |
| Даунорубицин (антрациклин) | — Миелосупрессия — Острая и хроническая кардиотоксичность — Мукозит — Алопеция — Тошнота и рвота | — Миелосупрессия; панцитопения и анемия. — Гепатопатия и повышенный уровень КК — Судороги и инфекции дыхательных путей — Самопроизвольные аборты, преждевременные роды и мертворождения. — Хромосомные аномалии и врожденные пороки развития | — Тератогенное действие у мышей — Менее тератогенное, чем доксорубицин | ||||
| Идарубицин (антрациклин) | — Миелосупрессия — Кардиомиопатия — Гепатопатия и повышенный уровень КК — Акроцианоз и гипербилирубинемия — Внутриутробная смерть плода и задержка роста — Врожденные пороки развития: короткие конечности и макрогнатия | — Липарубиклинический рост больше, чем у других липидов. концентрация, проникающая через плаценту | |||||
| Доксорубицин (антрациклин) | — Миелосупрессия — Кардиотоксичность — Мукозит и алопеция — Тошнота и рвота | — Отсутствие серьезных побочных эффектов. — Преходящая миелосупрессия — Болезнь гиалиновых мембран — Менингеальное кровоизлияние — Преждевременные роды и дистресс плода — Неперфорированный задний проход и ректовагинальный свищ | — Пересекает плаценту — Может распространяться в ткани плода, включая печень, легкие и почки. | ||||
| Этопозид (ингибитор топоизомеразы) | — Миелосупрессия — Продление ПВ и МНО — Гипотония — Лихорадка и алопеция | — Преходящая панцитопения — Лейкопения | |||||
| Митоксантрон (антрацендион) | — Кардиотоксичность — Гепатоксичность — Алопеция | — Не сообщалось о серьезных побочных эффектах | |||||
| Флударабин (аналог пурина) | — Миелосупрессия — Аутоиммунные эффекты — Прогрессирующая мультифокальная лейкоэнцефалопатия, вызванная вирусом JC. | — Не сообщалось о побочных эффектах на плод. | — Тератогенный эффект у крыс и кроликов. — Повышенная частота пороков развития скелета у крыс. | ||||
| Циклофосфамид (алкилирующий агент) | — Геморрагический цистит — Кардиотоксичность — Миелосупрессия — Алопеция, тошнота и рвота | — Миелосупрессия и задержка в области грудного пузыря 8 , лицевые аномалии, единственная левая коронарная артерия и грыжи. | — Тератогенный у животных — Может проникать через плаценту у мышей -Тератогенный у мышей, крыс и кроликов. | ||||
| Винкристин (алкалоид барвинка) | — Нейротоксичность — Алопеция — SIADH | — Анемия и тяжелая панцитопения — Сдвиг влево лейкоцитов и легкие инфекции — Гиалиновая болезнь при рождении — Низкая масса тела при рождении гидроцефалия и заячья губа | — Винкристин сильно связывается с белками. — Может быть ограничено проникновение через барьеры, такие как гемато-плацентарный барьер. | ||||
| Hydroxyurea (антиметаболит) | — Миелосупрессия | — Мертворождение без серьезных аномалий — Преждевременные роды без врожденных дефектов — Внутриутробная смерть плода и задержка роста | — Не сообщалось о | 68 | — Миелосупрессия — Острая почечная недостаточность | — Самопроизвольные аборты с низкой массой тела при рождении — Панцитопения — Синдром аминоптеринового типа | — Не сообщалось |
| ATRA (PML-RARA 908 или таргетная терапия) Синдром дифференцировки — DIC — Лихорадка | — Выкидыш и гибель плода — Легочная гиперплазия и респираторный дистресс — Тромбоцитопения — Задержка внутриутробного развития | — Когда дают в первом триместре: тяжелые неврологические и сердечно-сосудистые осложнения. — Риск тератогенности: 85% | |||||
| Интерферон альфа | — Усталость — Гриппоподобное заболевание — Бесплодие | — Пороки развития плода в 1 случае из 8 зарегистрированных пациентов (одновременно с применением гидроксимочевины). | — | ||||
| Иматиниб (TKI; первое поколение) | — Усталость — Задержка жидкости | — Плановые аборты, сделанные из-за врожденных пороков развития. — Экзофтальм и аномалии головного мозга — Сердечные и почечные аномалии — Гипоспадия и аномалии костей | — Тератогенный эффект у животных: экзэнцефалия, энцефалоцеле, отсутствие или уменьшение лобных или теменных костей | I Dasatin2 | I Dasatin2 | I Dasatin2 | I Задержка жидкости | — Самопроизвольные аборты — Плановые аборты | — |
| Ритуксимаб (анти-CD20 моноклональные антитела) | — Инфузионные реакции — Миелосупрессия | во всех отчетах о безопасности за все триместры — Сообщалось о временном истощении β-клеток | — |
Таблица 1.
показывает побочные эффекты цитотоксической и таргетной терапии у беременных женщин и новорожденных
| (A) цитотоксическая химиотерапия, проводимая в течение первого триместра беременности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Риск 3 врожденных пороков развития | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цитозина арабинозид | 1: 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Циклофосфамид | 1: 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метотрексат | 903 Лейкоз является наиболее частым злокачественным новообразованием среди всех онкологических заболеваний у детей и связан с низкой выживаемостью у взрослых пациентов.С 1995 года программа национального медицинского страхования (NHI) на Тайване предлагает страховое покрытие для традиционной китайской медицины (TCM) наряду с традиционной западной медициной (WM). В этом исследовании анализируется статус использования традиционной китайской медицины в Тайване как среди детей, так и среди взрослых пациентов с лейкемией. Ретроспективное когортное исследование было проведено с использованием популяционной базы данных Национального реестра катастрофических заболеваний по исследованиям в области здравоохранения, включая данные о пациентах с 2001 по 2010 год и данные последующего наблюдения до 2011 года.Была оценена эффективность использования ТКМ. Соответствующие социально-демографические данные показали, что как педиатрические, так и взрослые пациенты, которые принимали ТКМ за год до постановки диагноза лейкемии, с большей вероятностью использовали услуги ТКМ для лечения рака. Большая часть медицинских расходов пользователей традиционной китайской медицины была ниже, чем у лиц, не употребляющих традиционную китайскую медицину, за исключением небольшого расхождения в оплате лекарств для взрослых пациентов. Выживаемость также выше у пользователей TCM. В целом, эти данные показывают, что традиционная китайская медицина может служить в качестве адъювантной терапии в сочетании с традиционным WM при лечении пациентов с лейкемией. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

