Анемия при беременности
Под анемией понимают снижение уровня гемоглобина в крови.
Во время беременности в организме женщины увеличивается количество жидкости, а значит, и объем циркулирующей крови. За счет этого кровь «разжижается» и доля гемоглобина в ее общем объеме падает. Это считается нормальным явлением, в связи с чем нижняя граница количества гемоглобина при беременности установлена на уровне 110 г/л (при норме для небеременной женщины в 120–140 г/л). Но дальнейшее падение уровня гемоглобина является опасным для здоровья и даже жизни будущей матери.
В зависимости от значений этого показателя анемия при беременности может быть:
- легкой степени тяжести — 110–90 г/л;
- умеренно выраженной — 89–70 г/л;
- тяжелой — 69–40 г/л.
Наиболее частыми осложнениями при анемии во время беременности считаются:
- угроза прерывания беременности;
- гестоз;
- пониженное артериальное давление;
- преждевременная отслойка плаценты;
- задержка развития плода;
- преждевременные роды;
- анемия в первый год жизни ребенка.

Так что анемия при беременности — отнюдь не безобидное состояние. Оно имеет серьезные последствия и для матери, и для плода.
Во время беременности железо расходуется не только на кроветворение матери, но и на нужды плода. Особенно активно этот расход возрастает на 16–20-й неделях, когда запускается процесс кроветворения у плода. К концу беременности запасы железа истощаются у любой женщины и для их полного восстановления необходимо 2–3 года.
Другими причинами анемии при беременности являются:
- дефицит железа в пище главным образом из-за недостаточного количества мяса в рационе;
- дефицит витаминов группы B и C, необходимых для нормального усвоения железа;
- болезни, при которых возникает недостаток белков, участвующих в обмене железа, включая тяжелый гестоз;
- ранний гестоз (токсикоз), мешающий полноценно питаться;
- частые роды с небольшим интервалом.
Если же говорить о группах риска развитии анемии во время беременности, то к ним можно причислить женщин: с многоплодной беременностью и многорожавших; имевших до наступления беременности менструации длительностью более 5 дней; у которых были симптомы анемии во время предыдущей беременности; с гестозом; с хроническими заболеваниями желудочно-кишечного тракта, печени, хроническими инфекциями; вегетарианок. Все, попавшие в группу риска, должны особенно тщательно следить за своим состоянием и по возможности позаботиться о профилактике анемии во время беременности.
Все, попавшие в группу риска, должны особенно тщательно следить за своим состоянием и по возможности позаботиться о профилактике анемии во время беременности.
Учитывая, что во время беременности потребность организма женщины в микроэлементе возрастает на 15–33%, на передний план обычно выходят симптомы, указывающие на гипоксию: слабость, быстрая утомляемость; нарушение сна: днем — сонливость, ночью — бессонница; головные боли; головокружения, шум в ушах; одышка; сердцебиение; обмороки.
Переносимость симптомов анемии индивидуальна: кто-то падает в обморок при относительно высоких значениях гемоглобина, кто-то отказывается от госпитализации с гемоглобином на уровне около 70 г/л, искренне не понимая всей тяжести анемии и ее опасности при беременности. Именно поэтому клинический анализ крови во время беременности проводится обязательно и несколько раз. Имеет значение и падение значений железа в сыворотке крови и сывороточного ферритина. Снижение количества последнего до 12 мкг/л говорит о дефиците железа, даже если гемоглобин еще в норме.
Лечение анемии в период ожидания малыша включат в себя диетотерапию. Одна из основ как профилактики, так и лечения анемии при беременности — правильное питание. Питание для профилактики анемии при беременности должно содержать в достаточном количестве вещества, необходимые для нормального кроветворения, — это мясо, рыба. В этих продуктах железо изначально двухвалентное, поэтому легко всасывается. Но одной диеты может быть недостаточно даже для профилактики.
Для лечения анемии назначаются препараты железа. Обычно ограничиваются средствами для перорального приема (т.е. внутрь) — препараты железа в инъекциях рекомендуют только в тяжелых случаях и только в условиях стационара.
Как российские, так и зарубежные эксперты отмечают, что профилактика анемии у беременных эффективней, чем ее лечение, и чем выше уровень гемоглобина, тем проще привести его к норме. Впрочем, о том же говорит и здравый смысл. Поэтому, планируя беременность и тем более уже ожидая ребенка, лучше заняться профилактикой анемии не дожидаясь, пока недостаток железа станет заметен.
Врач-гематолог (заведующий),
консультационным отделением Рачкова Т.А.
Эффективность трансфузий донорских эритроцитов у больных гемобластозами с анемией
Н.А. Романенко, Р.А. Головченко, С.С. Бессмельцев, Н.А. Потихонова, А.В. Чечеткин, К.М. Абдулкадыров
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико биологического агентства России», г. Санкт-Петербург
Трансфузиология №2, 2015
Резюме
В статье представлен анализ результатов коррекции анемии с помощью трансфузий эритроцитов (ТЭ) у 190 пациентов с различными формами гемобластозов. Эффективность ТЭ определялась уменьшением клинической симптоматики анемии и приростом содержания гемоглобина на одну перелитую дозу эритроцитов. Полный ответ на ТЭ в виде прироста содержания гемоглобина на 10 г/л (11,4 ± 0,6 г/л) констатирован у 57 (30%) пациентов, концентрация Hb у которых увеличилась с 70,4 ± 1,7 до 103,4 ± 0,9 г/л после переливания 2,9 ± 0,2 доз эритроцитов.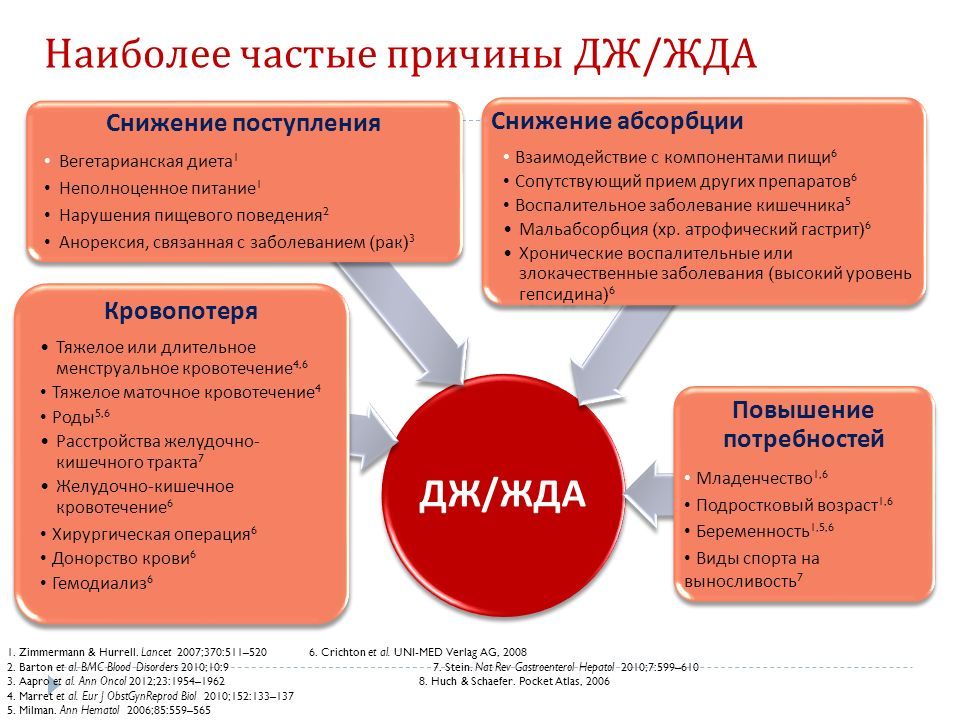

Ключевые слова: анемия, эритроциты, трансфузии эритроцитов, содержание гемоглобина, гематокрит, гемобластозы, донорские эритроциты.
Введение
Анемический синдром при онкогематологических заболеваниях является частым проявлением болезни, ухудшает ее прогноз и качество жизни пациентов. Указанный синдром характеризуется многочисленной клинической симптоматикой, приводящей к дезадаптации пациента в эмоциональной, социальной, семейной сферах [1, 2]. Частота анемии варьирует в зависимости от варианта, а также фазы опухолевого процесса и колеблется от 20 до 90%, а в период проведения химиотерапии (ХТ) может возрастать в 1,5–2 раза [3–7].
Основным методом коррекции анемии у больных опухолевыми заболеваниями системы крови являются трансфузии эритроцитов (ТЭ), позволяющие обеспечить адекватное функционирование органов и систем организма и качество жизни больных. Однако переливания донорских компонентов крови нередко осложняются иммунными реакциями с гемолизом, трансмиссивными инфекциями, тромбозами сосудов, а многократные ТЭ могут приводить к гемосидерозу внутренних органов [8–12].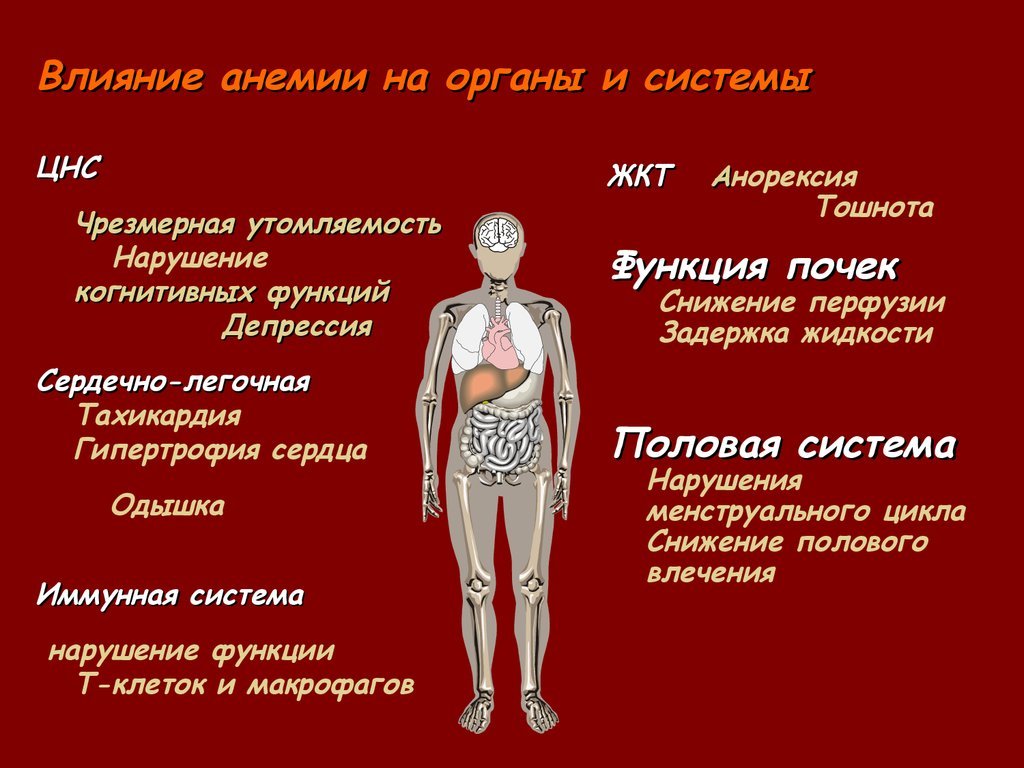

Однако у пациентов с онкогематологическими заболеваниями в период проведения химиотерапии содержание гемоглобина в крови нередко снижается на 10–40 г/л, усугубляя имеющуюся анемию и функции жизненно важных органов и систем. Течение анемии также усугубляют гемолиз эритроцитов, гипоплазия костного мозга (КМ), интоксикация за счет распада опухолевых клеток [16]. Кроме того, хроническая анемия может нередко приводить к дистрофическим изменениям в миокарде с развитием сердечной недостаточности, что отражается в том числе на прогнозе заболевания и качестве жизни больного [2]. Поэтому таким пациентам необходимо обеспечить адекватную газотранспортную функцию крови, позволяющую избежать осложнений со стороны сердечно-сосудистой системы. Оптимальным ответом на каждую перелитую дозу донорских эритроцитов, содержащую 180–260 мл эритроцитов, принято считать увеличение в периферической крови содержания Hb на 10 г/л у пациента с массой тела 70–80 кг [16–18]. Однако у больных с дефектом эритропоэза, гипоплазией КМ, гемолизом эритроцитов не всегда удается достичь оптимального ответа, что ставит задачу по выявлению причин низкой эффективности ТЭ и влияние ее на общую выживаемость (ОВ) больных гемобластозами.
Материалы и методы
Исследована эффективность ТЭ у 190 пациентов (в возрасте от 18 до 81 года) с гемобластозами, находившихся в гематологической клинике ФГБУ «РосНИИ ГТ» на лечении в период 2006–2013 гг. Среди исследуемых были 39 пациентов с миелодиспластическим синдромом (МДС), 28 – острым миелоидным лейкозом (ОМЛ), 21 – первичным миелофиброзом (ПМФ), 10 – хроническим миелолейкозом (ХМЛ) в фазе бластного криза, 42 – множественной миеломой (ММ) в III стадии, 19 – неходжкинскими лимфомами (НХЛ) в III–IV стадиях, 22 – хроническим лимфолейкозом (ХЛЛ) в стадии C (по J.L. Binet), 9 – острым лимфобластным лейкозом (ОЛЛ). В исследуемую группу входили молодые пациенты со стабильным статусом и больные по- жилого возраста (старше 65 лет) с наличием сопутствующей сердечной, легочной недостаточности, а также больные с нестабильным течением основного заболевания (сепсис, неустойчивые показатели периферической крови, геморрагический синдром, гемолиз). По степени тяжести анемии (по классификации ВОЗ) были выделены 3 группы больных: с умеренной анемией (n = 49), с выраженной анемией (n = 61) и с анемией угрожающей степени тяжести (n = 80).
Переливания донорских эритроцитов и оценка их эффективности проводились в соответствии с «Инструкцией по применению компонентов крови» [15]: после каждой гемотрансфузии эритроцитов исследовали гемограмму, общий анализ мочи. Назначались ТЭ при наличии жалоб на выраженную слабость, сердцебиение, одышку при минимальной физической активности, резкое снижение работоспособности, тахикардию, а также при содержании
гемоглобина <80 г/л, гематокрита <25%. Прекращали трансфузии эритроцитов при достижении содержания гемоглобина 85–95 г/л и выше. Показания расширяли (содержание гемоглобина <95 г/л и гематокрита <30%) у пациентов пожилого возраста с сердечной или легочной недостаточностью. Эффективность ТЭ оценивали по уменьшению клинической симптоматики анемии и приросту концентрации гемоглобина. В зависимости от прироста концентрации Hb на одну дозу перелитых донорских эритроцитов пациентов подразделили на три группы: с положительным (полным) ответом (прирост уровня Hb 10 г/л), частичным (на 5–9,9 г/л) и минимальным (на <5 г/л).
Для коррекции анемии назначали фильтрованную эритроцитную массу (ФЭМ), отмытые эритроциты (ОЭ), размороженные и отмытые эритроциты (РЭМ), а также эритроцитную массу (ЭМ). Учитывая, что часть пациентов получала многократные переливания донорских эритроцитов (в течение >2 мес.), им исследовали кровь на наличие алло- и аутоантиэритроцитарных антител и при наличии подозрения на возможную несовместимость (n = 16) ТЭ производили после индивидуального подбора донорских эритроцитов с учетом комплекса антигенов по системе Резус.
При коррекции анемии учитывались не только симптомы анемии, показатели гемограммы, но и генез развития анемии. Так, в ходе исследования выявлено, что основными причинами анемии были опухолевая инфильтрация КМ и уменьшение плацдарма эритроидного ростка (у 41 пациента число эритроидных предшественников в стернальном пунктате составляло от 0,2 до 9,8%), гемолиз эритроцитов (у 25 больных – повышение непрямой фракции билирубина от 19,2 до 41,9 мкмоль/л), иногда выявлялся дефицит железа (у 24 пациентов сывороточное железо составляло от 4,0 до 8,8 мкмоль/л), наблюдался геморрагический синдром (у 16 больных, включая желудочнокишечные и носовые кровотечения), обусловленный ДВС-синдромом или тромбоцитопенией. При наличии дефицита железа помимо ТЭ назначали препараты железа. Для остановки кровотечения применялись свежезамороженная плазма, концентрат тромбоцитов в терапевтических дозах в комплексе с гемостатическими препаратами.
При наличии дефицита железа помимо ТЭ назначали препараты железа. Для остановки кровотечения применялись свежезамороженная плазма, концентрат тромбоцитов в терапевтических дозах в комплексе с гемостатическими препаратами.
Статистическую обработку полученных результатов выполняли с использованием прикладных программ Microsoft Windows (Microsoft Excel, Ver. 2007) и STATISTICA 7.0 for Windows. Различия считали достоверными при p < 0,05.
Результаты исследования
В ходе проведенного анализа выявлено, что самой востребованной оказалась фильтрованная эритроцитная масса (табл. 1), которая применялась в 5,5 раза чаще по сравнению с ОЭ или РЭМ (p < 0,02) и в 15 раз чаще, чем ЭМ (p < 0,0001).
На фоне ТЭ у пациентов отмечалась положительная клиническая динамика – существенно уменьшилась симптоматика анемии и улучшились показатели периферической крови (табл. 2). При этом содержание гемоглобина в целом по группе увеличилось с 70,4 ± 0,9 до 98,6 ± 1,0 г/л (p < 0,001), а его прирост констатирован в среднем 28,9 ± 1,2 г/л, что соответствовало 8,0 ±0,4 г/л (1–30 г/л) из расчета на каждую перелитую дозу эритроцитов. Аналогично отмечалось и повышение количества эритроцитов в среднем на 0,92 ± 0,03×10¹²/л и уровня гематокрита в среднем на 8,3 ± 0,3%.
Аналогично отмечалось и повышение количества эритроцитов в среднем на 0,92 ± 0,03×10¹²/л и уровня гематокрита в среднем на 8,3 ± 0,3%.
При сравнительном анализе выявлено, что число доз эритроцитов в зависимости от возраста больных существенно не различалось; так, молодым пациентам (от 18 до 65 лет) и пациентам старшего возраста (от 66 до 81 года) для коррекции анемии потребовалось в среднем 5,1 ± 0,5 и 4,3 ± 0,4 дозы соответственно (p > 0,05).
Однако на фоне ТЭ не у всех пациентов одинаково повышались показатели периферической крови, что позволило разделить пациентов на группы в зависимости от увеличения уровня Hb на одно переливание эритроцитов (табл. 3).
Группа больных с полным ответом на ТЭ составила 30,0% (n = 57). Уровень Hb повышался на 10 г/л (в среднем на 11,4 ± 0,6 г/л) после каждого переливания эритроцитов, уменьшалась симптоматика анемии (одышка, слабость, головокружение, сердцебиение, гипотония, гиподинамия и т. д.). В данную группу вошли пациенты с онкогематологическими заболеваниями с благоприятным прогнозом по основному заболеванию и хорошо реагировавшие на противоопухолевую терапию. Этим больным переливались в среднем 2,9 ± 0,2 (1–7) дозы эритроцитов. В результате содержание гемоглобина увеличилось (рис. 1) с 70,4 ± 1,7 до 103,4 ± 0,9 г/л. Необходимо подчеркнуть, что у 41 пациента после трансфузий эритроцитов быстро выросли показатели эритрона (Hb >100 г/л, Ht >30%) не только благодаря высокой эффективности ТЭ, но и регенеративной активности КМ больных. В этой группе пациентов в течение четырех месяцев после ТЭ общая выживаемость составила 94,7%. Летальных исходов в этой группе констатировано 3 (5,3%) из 57 больных; при этом у 2 больных ММ развилась острая почечная недостаточность (1 пациентка с ММ III ст. В) и острая сердечная недостаточность (1 пациентка с ММ III ст. А), и у 1 – с ХЛЛ С стадией по J.L. Binet – развилась тяжелая двусторонняя пневмония.
Этим больным переливались в среднем 2,9 ± 0,2 (1–7) дозы эритроцитов. В результате содержание гемоглобина увеличилось (рис. 1) с 70,4 ± 1,7 до 103,4 ± 0,9 г/л. Необходимо подчеркнуть, что у 41 пациента после трансфузий эритроцитов быстро выросли показатели эритрона (Hb >100 г/л, Ht >30%) не только благодаря высокой эффективности ТЭ, но и регенеративной активности КМ больных. В этой группе пациентов в течение четырех месяцев после ТЭ общая выживаемость составила 94,7%. Летальных исходов в этой группе констатировано 3 (5,3%) из 57 больных; при этом у 2 больных ММ развилась острая почечная недостаточность (1 пациентка с ММ III ст. В) и острая сердечная недостаточность (1 пациентка с ММ III ст. А), и у 1 – с ХЛЛ С стадией по J.L. Binet – развилась тяжелая двусторонняя пневмония.
Группа пациентов с частичным ответом на ТЭ составила 37,4% (n = 71). У этих больных после каждого переливания эритроцитов отмечалось повышение содержания гемоглобина на 5,0–9,7 г/л (в среднем на 6,6 ± 0,2 г/л), уменьшение симптомов анемии, а при отмене переливаний через 10–15 дней наблюдалось умеренное снижение показателей эритрона, как правило, не требующее повторных трансфузий. В данную группу вошли преимущественно пациенты с благоприятным прогнозом (n = 47) и с рецидивами и рефрактерными формами заболевания: МДС (n = 8) – рефрактерная анемия с избытком бластов (РАИБ I и II), ОМЛ из предшествующего МДС (n = 5) и ОМЛ, вызванный предшествующим лечением (n = 3), ХМЛ бластный криз (n = 3), ММ, резистентная к химиотерапии (n = 4), синдром Рихтера при хроническом лимфолейкозе (n = 1). Этим больным переливались в среднем по 4,5 ± 0,3 (1–10) дозы эритроцитов. За время гемотрансфузий содержание гемоглобина повысилось с 68,7 ± 1,4 до 97,6 ± 1,2 г/л. ОВ в пределах 4 месяцев составила 84,5%. Летальные исходы больных (11 из 71, или 15,5%) были обусловлены рефрактерностью к проводимой противоопухолевой терапии и прогрессией основного заболевания.
В данную группу вошли преимущественно пациенты с благоприятным прогнозом (n = 47) и с рецидивами и рефрактерными формами заболевания: МДС (n = 8) – рефрактерная анемия с избытком бластов (РАИБ I и II), ОМЛ из предшествующего МДС (n = 5) и ОМЛ, вызванный предшествующим лечением (n = 3), ХМЛ бластный криз (n = 3), ММ, резистентная к химиотерапии (n = 4), синдром Рихтера при хроническом лимфолейкозе (n = 1). Этим больным переливались в среднем по 4,5 ± 0,3 (1–10) дозы эритроцитов. За время гемотрансфузий содержание гемоглобина повысилось с 68,7 ± 1,4 до 97,6 ± 1,2 г/л. ОВ в пределах 4 месяцев составила 84,5%. Летальные исходы больных (11 из 71, или 15,5%) были обусловлены рефрактерностью к проводимой противоопухолевой терапии и прогрессией основного заболевания.
Группа пациентов с минимальным ответом на переливания эритроцитов составила 32,6% (n = 62). Больные этой группы, как правило, нуждались через 10–14 дней в повторных гемотрансфузиях. Прирост гемоглобина после каждого переливания эритроцитов не превышал 4,9 г/л (в среднем 2,6 ± 0,2 г/л). Повышение концентрации гемоглобина отмечено с 72,5 ± 1,6 до 89,2 ± 1,8 г/л. Низкий прирост уровня Hb в этой группе, а в последующем и быстрое его снижение после ТЭ обусловлены преимущественно гемолизом (повышение общего билирубина 20,5 мкмоль/л – у 19 больных), выраженным угнетением кроветворения (снижение эритроидных элементов КМ менее 5% – у 17 пациентов) за счет рефрактерности заболевания к противоопухолевой терапии, а также токсическим эффектом ХТ (гематологическая токсичность III–IV ст.). Этим пациентам для улучшения состояния в последующем было перелито существенно большее количество доз донорских эритроцитов – в среднем 6,4 ± 0,8 (2–32), за счет чего удалось повысить уровень гемоглобина и гематокрит. В данную группу вошли пациенты с рефрактерными формами гемобластозов. ОВ в течение 4 месяцев составила 66,1%. Летальные исходы пациентов в течение четырех месяцев в этой группе больных (21 из 62 – 33,9%) были обусловлены рефрактерностью к ХТ и прогрессией основного заболевания.
Повышение концентрации гемоглобина отмечено с 72,5 ± 1,6 до 89,2 ± 1,8 г/л. Низкий прирост уровня Hb в этой группе, а в последующем и быстрое его снижение после ТЭ обусловлены преимущественно гемолизом (повышение общего билирубина 20,5 мкмоль/л – у 19 больных), выраженным угнетением кроветворения (снижение эритроидных элементов КМ менее 5% – у 17 пациентов) за счет рефрактерности заболевания к противоопухолевой терапии, а также токсическим эффектом ХТ (гематологическая токсичность III–IV ст.). Этим пациентам для улучшения состояния в последующем было перелито существенно большее количество доз донорских эритроцитов – в среднем 6,4 ± 0,8 (2–32), за счет чего удалось повысить уровень гемоглобина и гематокрит. В данную группу вошли пациенты с рефрактерными формами гемобластозов. ОВ в течение 4 месяцев составила 66,1%. Летальные исходы пациентов в течение четырех месяцев в этой группе больных (21 из 62 – 33,9%) были обусловлены рефрактерностью к ХТ и прогрессией основного заболевания.
В ходе сравнительного анализа выявлено, что прирост уровня гемоглобина существенно отличался, достигая соответственно 103,4 ± 0,9; 97,6 ± 1,2 г/л (p = 0,004) и 89,2 ± 1,8 г/л (p < 0,001), хотя исходные концентрации Hb были практически одинаковые (70,4 ± 1,7; 68,7 ± 1,4 г/л и 72,5 ± 1,6 г/л; p > 0,3). Значительно отличалась и общая выживаемость (рис. 2) в пределах 4 месяцев (с начала гемотрансфузий).
Значительно отличалась и общая выживаемость (рис. 2) в пределах 4 месяцев (с начала гемотрансфузий).
Так, если в 1-й группе общая выживаемость составила 94,7% (из 57 умерло 3 больных), во 2-й – 84,5% (из 71 умерло 11 пациентов) – без статистически значимой разницы (p = 0,12), то в 3-й – 66,1% (из 62 умерло 21), что существенно различалось c 1-й и 2-й группами (p = 0,0003 и p = 0,023 соответственно). Однако за исследуемый период медиана ОВ не достигнута.
Была исследована связь общей выживаемости с рядом факторов. Методом множественной регрессии установлено влияние объема (R = 0,183; p = 0,036; n = 130) и числа перелитых доз (R = 0,162; p = 0,029; n = 190) донор ских эритроцитов, а также низкого прироста уровня гемоглобина (R =–0,180; p = 0,017; n = 190) на общую выживаемость пациентов. Это указывает на тот факт, что чем более длительно купируется анемия у больного и чем выше потребность в переливаниях донорских эритроцитов для адекватной коррекции анемии, тем хуже прогноз основного заболевания, что позволяет стратифицировать больных на группы риска. В группе больных низкого риска (с полным ответом на переливания донорских эритроцитов – уровень гемоглобина повышался на ×10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ – уровень Hb повышался на 5–9,9 г/л) общая выживаемость констатирована в 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) общая выживаемость – 66,1%.
В группе больных низкого риска (с полным ответом на переливания донорских эритроцитов – уровень гемоглобина повышался на ×10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ – уровень Hb повышался на 5–9,9 г/л) общая выживаемость констатирована в 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) общая выживаемость – 66,1%.
В то же время не выявлено связи общей выживаемости в течение 4 месяцев ни с возрастом пациентов (R = 0,05; p = 0,51; n = 190), ни с полом (R = 0,011; p = 0,89; n = 186), ни с исходным содержанием гемоглобина (R = 0,017;
p = 0,81; n = 190).
Обсуждение
Анемия при гемобластозах нередко выступает ведущим симптомом заболевания (в 20–98% случаев), снижает противоопухолевый эффект химиотерапии, ухудшает прогноз и качество жизни пациентов [2–7, 19]. В период постановки диагноза при лимфогранулематозе анемия выявляется у 22% больных, увеличиваясь на фоне противоопухолевого лечения до 54,5%; при НХЛ – у 34,9%, увеличиваясь на фоне ХТ до 73,7%; при ХЛЛ – у 30,1%, повышаясь до 72,9%; при ММ – у 56%, возрастая до 77,4% [6, 7]. Еще чаще анемию выявляют у пациентов с острыми миелоидными и лимфоидными лейкозами, МДС. При первичной диагностике ПМФ анемия встречается у 38% пациентов с постепенным возрастанием частоты в процессе прогрессирования заболевания; при эссенциальной тромбоцитемии в фазе бластного криза – у 74% больных; при ХМЛ на фоне терапии ингибиторами тирозинкиназы – от 40 до 83% [5, 19–23]. Причем анемия у больных индолентными формами лимфопролиферативных заболеваний нередко расценивается в качестве «индикатора» для начала ХТ [24].
Еще чаще анемию выявляют у пациентов с острыми миелоидными и лимфоидными лейкозами, МДС. При первичной диагностике ПМФ анемия встречается у 38% пациентов с постепенным возрастанием частоты в процессе прогрессирования заболевания; при эссенциальной тромбоцитемии в фазе бластного криза – у 74% больных; при ХМЛ на фоне терапии ингибиторами тирозинкиназы – от 40 до 83% [5, 19–23]. Причем анемия у больных индолентными формами лимфопролиферативных заболеваний нередко расценивается в качестве «индикатора» для начала ХТ [24].
При выборе тактики корригирующего анемию лечения таких больных необходимо учитывать риск развития опасных для жизни осложнений, возникающих вследствие действия хронической гипоксии из-за неадекватной оксигенации жизненно важных органов, прежде всего мозга, сердца, печени, а также механизмы развития анемии, с учетом которых можно купировать анемию или значительно улучшить общее состояние пациента. У больных онкогематологическими заболеваниями в генезе анемии могут принимать участие сразу несколько факторов: а) опухолевая инфильтрация КМ с вытеснением эритроидных элементов; б) гемолиз эритроцитов; в) супрессия эритроидного ростка провоспалительными цитокинами; г) низкая продукция эндогенного эритропоэтина; д) функциональный дефицит железа вследствие повышения продукции гепсидина; е) свободнорадикальное окисление фосфолипидов клеточных мембран во время проведения ХТ; ж) геморрагический синдром [3, 25–30]. С учетом выявления факторов, участвующих в развитии анемии, в настоящее время возможна ее коррекция патогенетическими методами, например, назначением препаратов эритропоэтина [1, 3]. Однако не для всех пациентов патогенетическая терапия может быть приемлема, ввиду того что эффективность ее, как правило, не превышает 60–70%, а ответ на терапию ожидается через 2–3 месяца [25, 31]. Выжидательная тактика для больных гемобластозами не всегда оправдана вследствие опасности прогрессирования опухолевого процесса и риска для жизни пациента от гипоксии миокарда и других жизненно важных органов, особенно в пожилом возрасте с наличием сопутствующей ишемической болезни сердца. В то же время ТЭ являются универсальным и срочным методом коррекции анемии, независимо от нозологической формы болезни. Следовательно, заместительная гемокомпонентная терапия остается приоритетной, тем более при угрозе жизни больного, так как она позволяет в кратчайшие сроки добиться улучшения общего состояния пациента.
С учетом выявления факторов, участвующих в развитии анемии, в настоящее время возможна ее коррекция патогенетическими методами, например, назначением препаратов эритропоэтина [1, 3]. Однако не для всех пациентов патогенетическая терапия может быть приемлема, ввиду того что эффективность ее, как правило, не превышает 60–70%, а ответ на терапию ожидается через 2–3 месяца [25, 31]. Выжидательная тактика для больных гемобластозами не всегда оправдана вследствие опасности прогрессирования опухолевого процесса и риска для жизни пациента от гипоксии миокарда и других жизненно важных органов, особенно в пожилом возрасте с наличием сопутствующей ишемической болезни сердца. В то же время ТЭ являются универсальным и срочным методом коррекции анемии, независимо от нозологической формы болезни. Следовательно, заместительная гемокомпонентная терапия остается приоритетной, тем более при угрозе жизни больного, так как она позволяет в кратчайшие сроки добиться улучшения общего состояния пациента.
Показаниями для ТЭ служат выраженная клиническая картина анемии и снижение содержания гемоглобина и гематокрита. В настоящее время существуют две тактики: рестриктивная, при которой переливания донорских эритроцитов проводят при содержании гемоглобина менее 70 г/л, поддерживая его в пределах 70–90 г/л, и либеральная – переливания эритроцитов осуществляют при содержании гемоглобина менее 100 г/л [32]. Выбирая одну или другую тактику коррекции хронической анемии у больных гемобластозами, необходимо тщательно взвесить потенциальный риск и выгоду от гемотрансфузий. Так, несмотря на возросшие требования к отбору доноров, использованию высокотехнологичных методов диагностики трансмиссивных инфекций, индивидуальному подбору доноров, тем не менее сохраняется риск передачи инфекций (вирусные гепатиты В, С, ВИЧ и др.) от донора реципиенту, аллоиммунизация пациента антигенами, а также риск перегрузки организма железом с развитием гемосидероза внутренних органов [8–12, 14, 15]. В связи с этим в последние годы у пациентов с хронической анемией донорские эритроциты переливают только для коррекции важнейших симптомов анемии, не поддающихся основной патогенетической терапии [15].
В настоящее время существуют две тактики: рестриктивная, при которой переливания донорских эритроцитов проводят при содержании гемоглобина менее 70 г/л, поддерживая его в пределах 70–90 г/л, и либеральная – переливания эритроцитов осуществляют при содержании гемоглобина менее 100 г/л [32]. Выбирая одну или другую тактику коррекции хронической анемии у больных гемобластозами, необходимо тщательно взвесить потенциальный риск и выгоду от гемотрансфузий. Так, несмотря на возросшие требования к отбору доноров, использованию высокотехнологичных методов диагностики трансмиссивных инфекций, индивидуальному подбору доноров, тем не менее сохраняется риск передачи инфекций (вирусные гепатиты В, С, ВИЧ и др.) от донора реципиенту, аллоиммунизация пациента антигенами, а также риск перегрузки организма железом с развитием гемосидероза внутренних органов [8–12, 14, 15]. В связи с этим в последние годы у пациентов с хронической анемией донорские эритроциты переливают только для коррекции важнейших симптомов анемии, не поддающихся основной патогенетической терапии [15].
Однако при онкогематологических заболеваниях больные отличаются нестабильностью общего соматического состояния и вариабельностью течения основного опухолевого процесса, они получают цитостатическую терапию, обладающую токсичностью не только на гемопоэз, но и на другие жизненно важные органы и системы, включая сердечно-сосудистую, что приводит к снижению толерантности организма к гипоксии [2, 16]. Поэтому рестриктивная тактика в отношении переливаний эритроцитов у такой категории пациентов, особенно в пожилом возрасте с наличием сопутствующей сердечной недостаточности, небезопасна.
В проведенной работе продемонстрировано, что у 30% онкогематологических больных получен полный ответ на переливания эритроцитов, а прирост содержания Hb составил более 10 г/л; у них быстро происходило восстановление собственного гемопоэза после курсов противоопухолевой терапии и сохранялся эффект от переливаний эритроцитов на длительный период. У таких пациентов без признаков сердечной недостаточности коррекцию анемии проводили при уровне Hb <80 г/л. Стабильного состояния достигали после переливания 2,9 ± 0,2 дозы эритроцитов. У 37,4% больных с частичным ответом также отмечался удовлетворительный эффект от ТЭ с приростом гемоглобина на одну перелитую дозу эритроцитов 5–9,7 г/л. Улучшение состояния в этой группе больных достигалось за счет переливания 4,5 ± 0,3 дозы эритроцитов. Как в первой, так и во второй группе пациентов содержание гемоглобина через 10–14 дней снижалось незначительно. В то же время недостаточная эффективность от переливаний донорских эритроцитов наблюдалась в третьей группе с минимальным ответом. Прирост уровня Hb на одну перелитую дозу эритроцитов констатирован менее 5 г/л. Улучшение состояния и повышение концентрации Hb >80 г/л у таких пациентов удавалось достичь лишь после переливания 6,4 ± 0,8 дозы донорских эритроцитов. У этих больных выявлялись не только продвинутая стадия заболевания с депрессией эритропоэза, обусловленной прогрессированием опухолевого процесса и токсическим эффектом цитостатической терапии, но нередко и гемолиз эритроцитов, как проявление основного заболевания.
Стабильного состояния достигали после переливания 2,9 ± 0,2 дозы эритроцитов. У 37,4% больных с частичным ответом также отмечался удовлетворительный эффект от ТЭ с приростом гемоглобина на одну перелитую дозу эритроцитов 5–9,7 г/л. Улучшение состояния в этой группе больных достигалось за счет переливания 4,5 ± 0,3 дозы эритроцитов. Как в первой, так и во второй группе пациентов содержание гемоглобина через 10–14 дней снижалось незначительно. В то же время недостаточная эффективность от переливаний донорских эритроцитов наблюдалась в третьей группе с минимальным ответом. Прирост уровня Hb на одну перелитую дозу эритроцитов констатирован менее 5 г/л. Улучшение состояния и повышение концентрации Hb >80 г/л у таких пациентов удавалось достичь лишь после переливания 6,4 ± 0,8 дозы донорских эритроцитов. У этих больных выявлялись не только продвинутая стадия заболевания с депрессией эритропоэза, обусловленной прогрессированием опухолевого процесса и токсическим эффектом цитостатической терапии, но нередко и гемолиз эритроцитов, как проявление основного заболевания.
При определении тактики заместительной гемокомпонентной терапии следует учитывать также возраст пациентов и наличие сердечной или дыхательной патологии в связи с риском гипоксических осложнений. У пациентов пожилого возраста, даже при более высоких показателях периферической крови (содержание гемоглобина 80–100 г/л, гематокрита 26–30%), чаще наблюдались тахикардия (пульс свыше 90–110 уд/мин), гипотония (артериальное давление менее 120/70 мм рт. ст.), одышка при умеренной нагрузке, а иногда и в покое. В то же время после переливания эритроцитов у них отмечалось значительное улучшение общего состояния и купирование или значительное уменьшение клинической симптоматики. Поэтому для коррекции анемии у пожилых больных, а также у пациентов с наличием сердечной или легочной недостаточности, с признаками неэффективного эритропоэза, переливания эритроцитов необходимо проводить при содержании Hb <90–95 г/л и уровне гематокрита <30%.
При заместительной терапии анемии с помощью гемотрансфузий мы учитывали не только показатели периферической крови, но и генез ее развития. В ходе исследования выявлено, что основными причинами анемии были опухолевая инфильтрация КМ, нарушение гемопоэза, гемолиз эритроцитов, а также токсическое действие ХТ. В то же время у некоторых больных выявлялся дефицит железа, геморрагический синдром, обусловленный ДВС-синдромом и/или тромбоцитопенией. Поэтому таким пациентам помимо переливаний донорских эритроцитов назначали препараты железа; для остановки кровотечения больные получали свежезамороженную плазму, концентрат тромбоцитов в комплексе с гемостатическими препаратами. В последние годы для коррекции анемии, прежде всего обусловленной токсическим эффектом противоопухолевой терапии, а также отрицательным действием опухолевых клеток на эритропоэз, большое внимание уделяется патогенетической терапии с назначением эритропоэзстимулирующих агентов. Их применение позволяет добиться положительного результата у 24–85% больных [1, 25, 31]. Эритропоэзстимулирующая терапия особенно эффективна, если анемия обусловлена низким синтезом эндогенного эритропоэтина [1, 3, 31].
В ходе исследования выявлено, что основными причинами анемии были опухолевая инфильтрация КМ, нарушение гемопоэза, гемолиз эритроцитов, а также токсическое действие ХТ. В то же время у некоторых больных выявлялся дефицит железа, геморрагический синдром, обусловленный ДВС-синдромом и/или тромбоцитопенией. Поэтому таким пациентам помимо переливаний донорских эритроцитов назначали препараты железа; для остановки кровотечения больные получали свежезамороженную плазму, концентрат тромбоцитов в комплексе с гемостатическими препаратами. В последние годы для коррекции анемии, прежде всего обусловленной токсическим эффектом противоопухолевой терапии, а также отрицательным действием опухолевых клеток на эритропоэз, большое внимание уделяется патогенетической терапии с назначением эритропоэзстимулирующих агентов. Их применение позволяет добиться положительного результата у 24–85% больных [1, 25, 31]. Эритропоэзстимулирующая терапия особенно эффективна, если анемия обусловлена низким синтезом эндогенного эритропоэтина [1, 3, 31]. Тем не менее больные, имеющие тяжелую степень анемии с уровнем Hb <80 г/л, Ht <25%, нуждаются в ТЭ, даже если им проводится терапия препаратами рекомбинантного эритропоэтина.
Тем не менее больные, имеющие тяжелую степень анемии с уровнем Hb <80 г/л, Ht <25%, нуждаются в ТЭ, даже если им проводится терапия препаратами рекомбинантного эритропоэтина.
Анемия, трудно поддаваемая коррекции с помощью переливаний донорских эритроцитов, часто была вызвана гемолизом, не позволяющим добиться повышения уровня гемоглобина и гематокрита до необходимых цифр. У этих больных наблюдалось повышение непрямого билирубина (19,2–41,9 мкмоль/л). В качестве патогенетической терапии таким пациентам показано назначение кортикостероидных гормонов и иммуносупрессивных препаратов, что ранее было показано нами у пациента с НХЛ с синдромом Эванса, получившего более 60 переливаний донорских эритроцитов и пролеченного глюкокортикоидными гормонами без эффекта. Однако был получен положительный ответ на применение анти-CD20 моноклональных антител (ритуксимаба) с последующей длительной ремиссией [33].
Необходимо также отметить, что общая выживаемость в течение 4 месяцев от начала трансфузионной терапии существенно отличалась в группе с минимальным ответом на переливания донорских эритроцитов (рис. 2), составляя 66,1% против 94,7 и 84,5% соответственно в группах с полным и частичным ответами. Это подтверждает ту версию, что чем труднее купируется анемия у пациента, т. е. чем ниже эффективность ТЭ, тем хуже прогноз основного заболевания, что позволяет стратифицировать больных на группы риска. В группе больных низкого риска (с полным ответом на ТЭ – уровень гемоглобина повышался на 10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ — уровень Hb повышался на 5–9,9 г/л) ОВ – 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) ОВ – 66,1%. Стратификация пациентов на группы риска может быть взята в качестве
2), составляя 66,1% против 94,7 и 84,5% соответственно в группах с полным и частичным ответами. Это подтверждает ту версию, что чем труднее купируется анемия у пациента, т. е. чем ниже эффективность ТЭ, тем хуже прогноз основного заболевания, что позволяет стратифицировать больных на группы риска. В группе больных низкого риска (с полным ответом на ТЭ – уровень гемоглобина повышался на 10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ — уровень Hb повышался на 5–9,9 г/л) ОВ – 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) ОВ – 66,1%. Стратификация пациентов на группы риска может быть взята в качестве
прогностического маркера.
Таким образом, основными причинами анемии у проанализированных больных явились выраженная депрессия эритропоэза, обусловленная проявлением опухолевого заболевания, токсическим действием химиотерапии, гемолизом эритроцитов, а также дефицитом железа и геморрагическим синдромом. Заместительные переливания эритроцитов позволяют корригировать анемию, восстановить уровень гемоглобина и гематокрита у большинства пациентов. Однако после прекращения переливаний возможно снижение уровня гемоглобина, что требует повторных трансфузий. Стратификация пациентов на группы риска в зависимости от эффективности пере-
Заместительные переливания эритроцитов позволяют корригировать анемию, восстановить уровень гемоглобина и гематокрита у большинства пациентов. Однако после прекращения переливаний возможно снижение уровня гемоглобина, что требует повторных трансфузий. Стратификация пациентов на группы риска в зависимости от эффективности пере-
ливания донорских эритроцитов позволяет прогнозировать течение основного заболевания и дифференцированно подходить к терапии анемии при гемобластозах.
Литература
1. Бессмельцев С.С., Романенко Н.А., Абдулкадыров К.М. Современные подходы к лечению анемии у больных с онкогематологическими заболеваниями // Современная онкология. – 2010. – Т. 12, № 1. – С. 70–75.
2. Oliva E.N., Dimitrov B.D., Benedetto F. et al. Hemoglobin level threshold for cardiac remodeling and quality of life in myelodysplastic syndrome // Leuk. Res. – 2005. – Vol. 29. – P. 1217–1219.
3. Романенко Н.А. Патогенез и терапия анемии препаратами рекомбинантного эритропоэтина у онкогематологических больных (обзор литературы) // Онкогематология. – 2012. – № 3. – С. 20–29.
– 2012. – № 3. – С. 20–29.
4. Moullet I., Salles G., Ketterer N. et al. Frequency and significance of anemia in non-Hodgkin’s lymphoma patients // Ann Oncol. – 1998. – Vol. 9. – P. 1109–1115. 5. Santos F.P., Alvarado Y., Kantarjian H. et al. Long-term prognostic impact of the use of erythropoietic-stimulating agents in patients with chronic myeloid leukemia in chronic phase treated with imatinib // Cancer. 2011. – Vol. 117, № 5. – P. 982–991.
6. Steurer M., Wagner H., Gastel G. Prevalence and management of anaemia in haematologic cancer patients receiving cyclic nonplatinum chemotherapy: results of a prospective national chart survey // Wien. Klin. Wochenschr. – 2004. – Vol. 116, № 11–12. – P. 367–372.
7. Truong P.T., Parhar T., Hart J. et al. Population-based analysis of the frequency of anemia and its management before and during chemotherapy in patients with malignant lymphoma // Am. J. Clin. Oncol. – 2010. – Vol. 33, № 5. – P. 465–468.
8. Грицаев С. В., Даваасамбуу Б., Романенко Н.А., Абдулкадыров К.М. Отбор больных для терапии хелаторами железа // Клин. онкогематология. – 2013. – Т. 6, № 2. – С. 204–209.
В., Даваасамбуу Б., Романенко Н.А., Абдулкадыров К.М. Отбор больных для терапии хелаторами железа // Клин. онкогематология. – 2013. – Т. 6, № 2. – С. 204–209.
9. Brecher M.E., Hay S.N. Bacterial contamination of blood components // Clin. Microbiol. Rev. – 2005. – Vol. 18, № 1. – P. 195–204.
10. Dreyfus F. The deleterious of iron overload in patients with myelodysplastic syndromes // Blood Rev. – 2008. – Vol 22, Suppl. 2 – S. 29–34.
11. Khorana A.A., Francis C.W., Blumberg N. et al. Blood Transfusions, Thrombosis, and Mortality in Hospitalized Patients With Cancer // Arch. Intern. Med. – 2008. – Vol. 168, № 21. — P. 2377–2381.
12. Leitch H.A., Vickars L.M. Supportive care and chelation therapy in MDS: are we saving lives or just lowering iron? // Hematology Am. Soc. Hematol. Educ. Program. – 2009. – P. 664–672.
13. Жибурт Е.Б., Караваев А.В., Шестаков Е.А. и др. Правила переливания эритроцитов, основанные на доказательствах // Трансфузиология. – 2012. – Т. 13, № 3. – C. 55.
13, № 3. – C. 55.
14. Правила клинического использования донорской крови и (или) ее компонентов // Приказ от 2 апреля 3013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов» [Электронный ресурс] // http://www.transfusion. ru/2013/08-29-1.pdf.
15. Инструкция по применению компонентов крови (Утверждена Приказом Минздрава РФ от 25 ноября 2002 года № 363 «Об утверждении Инструкции по применению компонентов крови») // [Электронный ресурс]// http://www.zdrav.ru/library/regulations/detail.php?ID = 26150.
16. Романенко Н.А. Терапия и профилактика анемии и перегрузки железом у больных миелодиспластическим синдромом // Биомедицинский журнал. – WWW.Medline.ru. – 2013. – Т. 13. – С. 967–986.
17. Техническое руководство американской ассоциации банков крови / Под ред. Ю.Н. Токарева. – Милан: Европейская школа трансфузионной медицины, 2000. – 1056 с.
18. Romanenko N.A. Study of efficacy red cell transfusions and their influencing on quality of life in hematological malignancies patients with anemia // Haematologica – The Hematology journal. – 2012. – Vol. 97, Suppl. 1. – P. 163.
– 2012. – Vol. 97, Suppl. 1. – P. 163.
19. Quintás-Cardama A., De Souza Santos F.P., Kantarjian H. et al. Dynamics and management of cytopenias associated with dasatinib therapy in patients with chronic myeloid leukemia in chronic phase after imatinib failure // Cancer. – 2009. – Vol. 115, № 17. – P. 3935–3943.
20. Tefferi A., Lasho T.L., Jimma T. et al. One thousand patients with primary myelofibrosis: the mayo clinic experience // Mayo Clin. Proc. – 2012. – Vol. 87, № 1. – P. 25–33.
21. Passamonti F., Rumi E., Arcaini L. et al. Blast phase of essential thrombocythemia: A single center study // Am. J. Hematol. – 2009. – Vol. 84, № 10. – P. 641–644.
22. Романенко Н.А., Абдулкадыров К.М., Бессмельцев С.С. Эффективность коррекции анемии у больных хроническим миелолейкозом, развившейся на фоне терапии иматинибом // Биомедицинский журнал. – WWW.Medline.ru. – 2010. – Т. 11. – С. 376–389.
23. Cortes J., O’Brien S., Quintas A. et al. Erythropoietin is effective in improving the anemia induced by imatinib mesylate therapy in patients with chronic myeloid leukemia in chronic phase // Cancer. – 2004. –Vol. 100, № 11. – P. 2396–2402. 24. Samuelsson J. Long-standing resolution of anemia in symptomatic low-grade non-Hodgkin’s lymphoma patients treated with recombinant human erythropoietin as sole therapy // Med. Oncol. – 2002. – Vol. 19, № 1. – P. 69 72.
– 2004. –Vol. 100, № 11. – P. 2396–2402. 24. Samuelsson J. Long-standing resolution of anemia in symptomatic low-grade non-Hodgkin’s lymphoma patients treated with recombinant human erythropoietin as sole therapy // Med. Oncol. – 2002. – Vol. 19, № 1. – P. 69 72.
25. Романенко Н.А., Абдулкадыров К.М. Патогенетическая коррекция анемии эритропоэзстимулирующими препаратами у больных лимфопролиферативными заболеваниями // Онкогематология. – 2011. – № 3. – С. 39–49.
26. Рукавицын О.А. Актуальные вопросы диагностики и лечения анемии при хронических заболеваниях // Клинич. онкогематол. – 2012. – Т. 5, № 4. – С. 296–304.
27. Eve H.E., Rule S.A. Autoimmune haemolytic anaemia associated with mantle cell lymphoma // Int. J. Hematol. – 2010. – Vol. 91, № 2. – P. 322–325.
28. Romanenko N.A., Rozanova O.E., Glazanova T.V., Abdulkadyrov K.M. Role of cytokines in resistance to erythropoiesis stimulating agents treatment of anaemia in patients with lymphoproliferative disorders // Haematologica. – 2012. – Vol. 97, Suppl. 1. – P. 550–551.
– 2012. – Vol. 97, Suppl. 1. – P. 550–551.
29. Tsopra O.A., Ziros P.G., Lagadinou E.D. et al. Disease-related anemia in chronic lymphocytic leukemia is not due to intrinsic defects of erythroid precursors: a possible pathogenetic role for tumor necrosis factor-alpha // Acta Haematol. – 2009. – Vol. 121, № 4. – P. 187–195.
30. Zupanić-Krmek D., Lang N., Jurcić D. et al. Analysis of the influence of various factors on anemia in patients with lymphoid malignancies // Acta Clin. Croat. – 2011. – Vol. 50, № 4. – P. 495–500.
31. Романенко Н.А., Бессмельцев С.С., Беркос М.В. и др. Прогностическая значимость ряда лабораторных показателей крови при использовании препаратов, стимулирующих эритропоэз у больных лимфопролиферативными заболеваниями с анемией // Тер. архив. – 2013. – Т. 85, № 8. – С. 81–86.
32. Жибурт Е.Б., Шестаков Е.А. Внедрение правил назначения компонентов крови в клиническую практику // Трансфузиология. – 2007. – Т. 8, № 3–4. – С. 47–59.
33. Романенко Н. А., Бессмельцев С.С., Абдулкадыров К.М. Патогенетическое лечение пациентки с неходжкинской лимфомой маргинальной зоны селезенки, осложненной синдромом Эванса // Каз. мед. журн. – 2012. – Т. XCIII, № 5. – С. 843–846.
А., Бессмельцев С.С., Абдулкадыров К.М. Патогенетическое лечение пациентки с неходжкинской лимфомой маргинальной зоны селезенки, осложненной синдромом Эванса // Каз. мед. журн. – 2012. – Т. XCIII, № 5. – С. 843–846.
Анемия у пожилых людей | Здоровье наших родителей
Не менее 40% людей старше 60-ти лет страдают от анемии, болезни при которой организм человека испытывает дефицит эритроцитов и гемоглобина в крови, из-за чего кровь не получает достаточного количества кислорода. Несмотря на то, что анемия столь распространена среди людей пожилого возраста, это заболевание вовсе не является неизбежным явлением связанным исключительно с возрастом. Практика показывает, что причину анемии в большинстве случаев удаётся установить, а саму болезнь своевременно вылечить.
Наиболее частыми симптомами анемии являются: слабость, головокружение, вялость, спутанность сознания, обмороки, кожные покровы и слизистые оболочки при анемии приобретают бледный оттенок. Развитие анемии приводит к значительному ухудшению качества жизни пожилых людей, быстрой утомляемости, подавленному настроении. , снижению физической и умственной активности. При анемии существенно снижаются когнитивные функции человека, снижается память и теряется концентрация внимания.
, снижению физической и умственной активности. При анемии существенно снижаются когнитивные функции человека, снижается память и теряется концентрация внимания.
Перечисленные выше симптомы анемии люди зачастую принимают за проявления общего ухудшения состояния здоровья или приписывают это обострившимся хроническим заболеваниям. Между тем при появлении данных симптомов необходимо сдать анализ крови, чтобы своевременно диагностировать или опровергнуть наличие анемии у пожилого человека. В соответствии с полученными показателями гемоглобина врач может диагностировать степень анемии, а по характеристикам эритроцитов определить её вид.
Выделяют следующие причины возникновения и развития анемии в пожилом возрасте:
- Анемия вследствие хронических заболеваний. Обычно, в пожилом возрасте у людей наличествует сразу несколько хронических заболеваний. Анемия данного вида, как правило, не бывает выраженно тяжелой. Лечение этого вида анемии несомненно подразумевает лечение одного или нескольких заболеваний, которые её вызывают. В этом случае один лишь приём препаратов для увеличения уровня железа в организме будет неэффективным.
- Железодефицитная анемия, когда в организме возникает существенный недостаток железа из-за несбалансированного питания или из-за кровотечений в желудочно-кишечном тракте. Причиной такого кровотечения могут быть язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит, дивертикулит кишечника, различные опухоли в ЖКТ.
- Анемия, вызванная недостатком витамина В12. Данный вид анемии сложен для диагностирования, потому что основные симптомы: слабость и головокружение свойственны для очень большого круга различных заболеваний. Обычно данный вид анемии также связан с имеющимся хроническим заболеванием желудочно-кишечного тракта. Только регулярные исследования крови у пожилого человека значительно облегчают возможность выявления недостатка витамина В12 в организме.
- Анемия, вызванная недостаточностью фолиевой кислоты. Поступление фолиевой кислоты в организм происходит непосредственно с принятием пищи. Поэтому некачественное и несбалансированное питание приводит к недостатку этой необходимой для нормальной жизнедеятельности человека кислоты.
Каждому виду анемии соответствует свой комплекс мер по лечению. Кроме того, при лечении анемии в пожилом возрасте необходимо учитывать имеющиеся у человека сопутствующие заболевания, чтобы не привести к их осложнению.
Особое значение, как для профилактики анемии, так и для её лечения имеет правильная диета. В рационе пожилого человека страдающего анемией должно быть достаточное количество белков животного происхождения (телятина, говядина, печень, субпродукты), которые способствуют синтезу гемоглобина и эритроцитов. Для профилактики и при лечении анемии следует также употреблять богатые железом фрукты и овощи: яблоки, гранаты, хурму, финики, чернослив, шпинат, петрушка, цветная капуста и другие.
Инфекционные осложнения у больных апластической анемией
На правах рукописи
Виноградова Мария Алексеевна
Инфекционные осложнения у больных апластической анемией
14.00.29. — гематология и переливание крови 03.00.07. — микробиология
диссертации на соискание ученой степени кандидата медицинских наук
Автореферат
Москва — 2009
003472113
Работа выполнена в Учреждении Российской Академии Медицинских Наук Гематологический Научный Центр РАМН
Научные руководители:
доктор медицинских наук Е.А.Михайлова
кандидат медицинских наук Г.А.Клясова
Официальные оппоненты:
Чл.-корр. РАЕН, доктор медицинских наук, профессор Голенков А.К. доктор медицинских наук, Пхакадзе Т.Я.
Ведущее научное учреждение:
Федеральное государственное учреждение «Федеральный научно-клинический центр гематологии, онкологии и иммунологии» Росздрава
Защита состоится « » _2009г. в — час.
на заседании диссертационного совета Д 001.042.01 в Учреждении Российской Академии Медицинских Наук Гематологический Научный Центр РАМН (125167, Москва, Новозыковский проезд, дом 4а)
С диссертацией можно ознакомиться в библиотеке Гематологического Научного Центра Российской Академии Медицинских Наук
Автореферат разослан «-^С*^» /^А-З_2009 года
Ученый секретарь диссертационного совета кандидат медицинских наук Е.Е.Зыбунова
Актуальность темы
Апластическая анемия (АА) — заболевание, характеризующееся панцитопенией вследствие угнетения костномозгового кроветворения. Наряду с геморрагическим и анемическим синдромами клиническую картину болезни определяют различные инфекционные осложнения. Известно, что при снижении количества нейтрофилов до 1,0х109/л значительно возрастает риск инфекционных осложнений, тяжесть которых определяется глубиной и продолжительностью нейтропении (Dale D.C. et al. 2006). При АА наблюдается длительный период гранулоцитопении. В течение нескольких месяцев, даже при максимально эффективной терапии АА, у пациентов отмечается состояние глубокой нейтропении, обусловленной аплазией костного мозга. Кроме того, длительное применение иммуносупрессивных препаратов, используемых при терапии АА, повышает восприимчивость больных к инфекциям.
Эффективная иммуносупрессивная терапия (ИСТ) обеспечивает постепенное восстановление количества нейтрофилов в периферической крови, что приводит к активации фагоцитоза, постепенному снижению частоты бактериальных и грибковых инфекций. За последние годы на фоне программной ИСТ 5-летняя выживаемость больных АА увеличилась до 70 — 80%. Однако, не всем больным удается своевременно начать комбинированную ИСТ или провести лечение в необходимом объеме. Основной причиной невозможности проведения ИСТ являются инфекционные осложнения. Инфекции остаются главной причиной смерти больных АА на ранних этапах течения заболевания (Михайлова Е. А., 2008).
От своевременной диагностики инфекционных осложнений и назначения рациональной антимикробной терапии зависит своевременность проведения этапов программного лечения АА, а, следовательно, и прогноз заболевания. Развитию тяжелых инфекционных осложнений, несомненно, способствует необоснованное назначение в дебюте заболевания стероидных гормонов, ранее составлявших основу терапии АА. Характер инфекционных процессов и спектр их возбудителей изменяются по мере течения болезни. На фоне сочетанной антибактериальной терапии все большее значение приобретают так называемые условно патогенные микроорганизмы, возрастает роль грибов как причины инфекции (Клясова Г. А., 2003, Масчан A.A., 2008).
В связи с этим изучение частоты и характера инфекционных осложнений, а также анализ микрофлоры, вызывающей эти осложнения в условиях современной программной ИСТ является крайне актуальным.
Цель исследования — изучить характер инфекционных осложнений у больных апластической анемией в условиях современной программной терапии.
Задачи исследования.
1. проанализировать частоту и характер инфекционных осложнений у больных апластической анемией до начала и на ранних этапах программной терапии;
2. определить факторы риска возникновения инфекционных осложнений при апластической анемии;
3. изучить спектр возбудителей инфекций у этой категории больных;
4. установить причины ранней летальности больных апластической анемией;
5. исследовать влияние тяжелых инфекционных осложнений в дебюте заболевания на общую выживаемость больных апластической анемией;
6. изучить колонизацию микроорганизмами слизистых оболочек зева и прямой кишки больных АА процессе программного лечения.
Научная новизна
На основании проведенных исследований выявлены особенности инфекционных осложнений у взрослых больных АА в процессе современной программной терапии. Доказано, что у большинства больных АА как до начала, так и на ранних этапах ИСТ, развиваются инфекционные осложнения, факторами риска которых являются: применение глюкокортикоидных гормонов в дебюте АА, длительная нейтропения, госпитализация из другого стационара. Установлено, что тяжелые инфекционные осложнения в дебюте АА являются фактором неблагоприятного прогноза и оказывают отрицательное влияние на общую выживаемость больных АА. В результате проспективного исследования показано, что при колонизации слизистых оболочек желудочно-кишечного такта (ЖКТ) больных АА грамотрицательными микроорганизмами возрастает риск грамотрицательной бактериемии после начала ИСТ. Научно — практическая ценность работы
Выявленные факторы риска развития инфекционных осложнений у больных АА диктуют необходимость исключения из терапии АА глюкокортикоидных
гормонов и госпитализации больных АА в кратчайшие сроки в специализированный стационар для установления диагноза и начала программной ИСТ. Характер и особенности инфекционных осложнений при АА требуют проведения в максимально ранние сроки комплекса диагностических мероприятий с целью установления возбудителя инфекции и назначения прецизионной антибиотической терапии. Положения, выносимые на защиту
1. Инфекционные осложнения развиваются у большинства больных АА как до начала, так и в процессе программной ИСТ. Вероятность их развития определяется в первую очередь глубиной и продолжительностью нейтропении. Наиболее высокая частота инфекционных осложнений отмечается при тяжелой форме АА (ТАА, гранулоциты <0,5х109/л). Инфекции чаще возникают у больных АА, получавших терапию глюкокортикоидами и в случаях пребывания до начала программной терапии в разных стационарах.
2. До начала и в процессе программного лечения среди бактериологически доказанных инфекций превалировали эпизоды бактериемии. У большинства больных в дебюте АА в качестве возбудителей первого эпизода бактериемии выявлялись грамположительные кокки, в процессе ИСТ- превалировали грамотрицательные бактерии. Инвазивные микозы, пневмоцистная пневмония развивались у больных ТАА на фоне других инфекций и длительной сочетанной антибактериальной терапии. Основным фактором риска развития инвазивного грибкового или пневмоцистного процесса была длительная критическая нейтропения.
3. Тяжелые инфекционные осложнения, возникающие до начала иммуносупрессивной терапии, рецидивируют в процессе лечения у большинства больных и являются неблагоприятным прогностическим фактором.
Внедрение в практику
Полученные результаты и алгоритмы обследования больных апластической
анемией применяются в гематологических отделениях ГНЦ РАМН.
Публикации. По теме диссертации опубликовано 6 печатных работ.
Апробация диссертации
Основные положения работы доложены на Международной Гематологической школе «Лейкозы и лимфомы. Терапия и фундаментальные исследования» (Москва, 2006г, 2008г), на Всероссийском Конгрессе по Медицинской Микологии (Москва, 2006г), на Всероссийском Декаднике по гематологии (Москва, 2007г, 2008г).
Объем и структура работы
Диссертация изложена на 139 страницах, состоит из введения, обзора литературы, материалов и методов, 4 глав собственных исследований, заключения, выводов, указателя литературы, двух приложений. Работа иллюстрирована 42 таблицами и 16 рисунками.
Диссертация выполнена в отделении высокодозной химиотерапии гемобластозов и трансплантации костного мозга ГНЦ РАМН (руководитель — чл-корр. РАМН, проф. В.Г.Савченко) и лаборатории клинической бактериологии, микологии и антибиотической терапии ГНЦ РАМН (заведующая лабораторией к.м.н. Г.А.Клясова), при участии сотрудников отделения хирургии ГНЦ РАМН (руководитель — д.м.н. С.Р.Карагюлян), реанимации и интенсивной терапии ГНЦ РАМН (руководитель- член-корр. РАМН В.М.Городецкий), клинико-вирусологической диагностики гепатитов и СПИД ГНЦ РАМН (зав.- д.б.н. Ф.П.Филатов), а также сотрудников других подразделений ГНЦ РАМН (директор — академик А.И.Воробьев).
Содержание работы Общая характеристика больных
В исследование было включено 120 больных АА (52 мужчин, 68 женщин), наблюдавшихся в отделении высокодозной химиотерапии гемобластозов и трансплантации костного мозга ГНЦ РАМН (директор — академик А.И.Воробьев) под руководством директора НИИ ТКМ и молекулярной гематологии чл.-корр. РАМН проф. В.Г.Савченко (заведующая отделением — к.м.н. Е.Н Устинова) за период с 09.2001 по 08.2006 гг. Медиана возраста больных составила 23 года (от 13 до 74). Диагностика АА и программная ИСТ осуществлялись согласно протоколу,
включающему антитимоцитарный глобулин (АТГ), циклоспорин А, спленэктомшо (СЭ)(Михайлова Е.А., 2003, 2006, 2008).
Анализ инфекционных осложнений до начала терапии проведен 120 больным АА, из них 82 (68,3%) пациента страдали ТАА и 38 (31,7%) больных — нетяжелой формой АА (НАА). Изучение инфекционных осложнений на ранних этапах комбинированной ИСТ было ограничено 4 месяцами с момента начала терапии и проведено у 112 больных (до начала ИСТ умерли 8 больных).
Мониторинг колонизации микроорганизмами слизистых оболочек желудочно-кишечного тракта (ЖКТ) в процессе ИСТ (в дебюте АА, на старте ИСТ, через 15-20 дней после начала ИСТ), проведен 22 больным с впервые выявленной ТАА. Этим же больным выполнено проспективное исследование сывороточного уровня маннана (антигена Candida) и антиманнановых антител, а также антител к Toxoplasma gondii. Методы исследования
Эпизодом инфекции считали выявленный инфекционный очаг с поражением одной анатомической области, сопровождающийся или не сопровождающийся лихорадкой. Инфекционные эпизоды были разделены на три группы (Link Н., 2003). Первая- лихорадка с неясным инфекционным очагом (фебрильный эпизод, не сопровождающийся клиническим или микробиологическим доказательством инфекции). Вторая — клинически доказанная инфекция (инфекционный очаг, при котором патогены не выявлены). Третья — микробиологически доказанная инфекция (выделение микроорганизма из очага инфекции).
Для изучения колонизации микрофлорой слизистых оболочек ЖКТ в динамике проводился забор материала со слизистых зева и прямой кишки стерильными, ватными тампонами. Микробиологические исследования осуществляли согласно приказу № 535 МЗ РФ от 22.04.1985 года. Посевы проводили на агар, содержащий 5% кровь барана, агар Эндо, маннитоловый агар и агар Сабуро.
Исследование уровня антигена Candida в сыворотке крови проводилось при помощи набора PLATELIA® Candida Ag (BIO-RAD Laboratories, Франция) методом одностадийного иммуноферментного анализа в соответствии с рекомендациями производителя. Интерпретация результатов проводилась при помощи построения калибровочной кривой (абсцисса — концентрация в нг/мл, ордината — оптическая
плотность). Менее 0,25 нг/мл — отрицательный результат. От 0,25 нг/мл до 0,5 нг/мл -промежуточный результат. Более чем 0,5 нг/мл — положительный результат.
Исследование уровня антител против Candida в сыворотке крови проводили при помощи набора PLATELIA® Candida Ab (SANOFI DIAGNOSTICS PASTEUR) методом двухстадийного иммуноферментного анализа согласно рекомендациям производителя. Интерпретация результатов проводилась при помощи построения калибровочной кривой (абсцисса — концентрация в AU/ml, ордината — оптическая плотность). Определение концентраций в тестируемых и стандартных сыворотках: менее чем 5.0 AU/ml — отрицательный результат, от 5.0 AU/ml до 10 AU/ml -промежуточный результат, более чем 10 AU/ml — положительный результат, более чем 20 AU/ml — сильно положительный результат.
Исследование IgA, IgM, IgG антител к Toxoplasma gondii в сыворотке крови проводили при помощи наборов PLATELIA® Тохо IgA, PLATELIA® Тохо IgM, PLATELIA® Тохо IgG (SANOFI DIAGNOSTICS PASTEUR) согласно рекомендациям производителя. PLATELIA® Тохо IgA PLATELIA® Тохо IgM, PLATELIA® Тохо IgG являются иммуноферментными диагностическими системами для качественного определения IgA, IgM, количественного определения IgG антител против T.gondii в сыворотке человека. Тесты основаны на принципе двойного иммуноферментного метода.
Результаты исследования Инфекционные осложнения до начала ИСТ
С момента госпитализации в ГНЦ до начала ИСТ инфекционные осложнения отмечались у 74 из 120 (61,7%) больных. Инфекционные эпизоды чаще всего сопровождались фебрильной лихорадкой — 52 из 74 (70,3%) больных. Инфекции преимущественно возникали у больных ТАА (77% в сравнении с 23% при НАА, р<0,001).
До начала ИСТ у 74 больных было зафиксировано 178 эпизодов инфекций. Общая характеристика инфекции представлена в таблице 1. В целом, инфекционные осложнения достоверно чаще развивались у больных с предшествующей терапией глюкокортикоидами (86%), в сравнении с пациентами, у которых они отсутствовали (40%) (р=0,001). Среди инфекционных осложнений преобладали клинически
доказанные инфекции (65,2%). Доля лихорадки с неуточненным очагом была сравнительно невелика (17,4%), а бактериологически доказанные инфекции, такие как бактериемия и инвазивные микозы, были диагностированы в 17,4% случаев. Лихорадка с неуточненным очагом инфекции чаще наблюдалась при НАА, в то время как при ТАА превалировали клинически и бактериологически доказанные инфекции. Инвазия грибами отмечалась только у больных ТАА.
Таблица 1. Характеристика инфекции у больных АА до начала ИСТ (п=74).
Характеристика Инфекции Число больных Частота инфекционных эпизодов
ТАА (п=110) НАА (п=68) Всего (п=178)
Лихорадка с неуточненным очагом 27 (36,5%) 13 (11,8%) 18 (26,5%) 31 (17,4%)
Клинически доказанные инфекции 52 (70,3%) 71 (64,5%) 45 (66,2%) 116 (65,2%)
Бактериологически доказанные инфекции 19(25,7%) 26 (23,6%) 5 (7,4%) 31 (17,4%)
У большинства больных (71,6%) первый инфекционный эпизод был зафиксирован в течение первых двух суток пребывания в ГНЦ. Частота инфекционных осложнений была значимо выше, если больной поступал из другого стационара, а не из дома (62,3% в сравнении с 19,4%, р<0.001). У больных ТАА, находившихся в других стационарах, зафиксировано больше инфекционных осложнений, чем у подобных больных НАА (71,1% в сравнении с 40%, р=0,04). Не было выявлено существенных различий в частоте инфекций у больных ТАА и НАА, если они были госпитализированы из дома. Только у больных ТАА, поступивших из других стационаров, развились такие тяжелые осложнения, как бактериемия, инвазивный аспергиллез, парапроктит. Соответственно, больным, поступившим из других стационаров, чаще и в более ранние сроки назначались антибиотики в сравнении с пациентами, поступившими из дома (45,3% против 7,5%, р=0,004).
Редко инфекционный процесс у больных АА проявлялся одним очагом инфекции или только лихорадкой. Чаще имело место сочетанное поражение различных органов, что значительно усугубляло тяжесть состояния больного, диктовало необходимость
применения комбинированной антибиотической терапии и не позволяло своевременно начать программную ИСТ. Частота и характеристика эпизодов клинически доказанной инфекции у больных АА до начала ИСТ представлены в таблице 2.
Таблица 2. Эпизоды клинически доказанной инфекции у больных АА до начала
ИСТ
Локализация инфекции Частота инфекционных эпизодов
ТАА (п=71) НАА (п=45) Всего (п=116)
Hoco- и ротоглотка 28 (39,4%) 24 (53,3%) 52 (44,8%)
Пищевод 1 (1,4%) 1 (2,2%) 2(1,7%)
Глаза 2 (2,8%) 0 (0%) 2(1,7%)
Кости 3 (4,2%) 1 (2,2%) 4 (3,4%)
Придаточные пазухи носа 1 (1,4%) 0 (0%) 1 (0,9%)
Кишечник 6 (8,5%) 3 (6,6%) 9 (7,8%)
Перианальная область 6 (8,5%) 2 (4,4%) 8 (6,9%)
Легкие 13(18,3%) 7 (15,5%) 20(17,2%)
Матка 1 (1,4%) 1 (2,2%) 2(1,7%)
Мочевыводящие пути 2 (2,8%) 0 (0%) 2(1,7%)
Кожа 3 (4,2%) 2 (4,4%) 5 (4,3%)
Суставы 1 (1,4%) 0 (0%) 1 (0,9%)
Герпетическая инфекция 4 (5,6%) 4 (8,9%) 8 (6,9%)
В период до начала ИСТ у больных АА преобладали поражения слизистой оболочки полости рта и глотки (44,9%), отмечена высокая частота возникновения пневмонии (17,2%).
Среди бактериологически доказанных инфекций основную часть составили эпизоды бактериемии, которые возникли у 18 (24,3%) больных. В качестве возбудителей первого эпизода бактериемии до начала ИСТ превалировали грамположительные кокки, которые выявлены у 12 из 18 (66,6%) больных.
Таблица 3. Этиология первого эпизода бактериемии у больных АА с момента госпитализации до начала ИСТ (п=18).
Микроорганизм Число больных %
Грамотрицательные палочки, из них: Pseudomonas aeruginosa Escherichia coli 5 2 3 27,9
Грамположительные кокки, из них: Staphylococcus CN Enterococcus spp. Streptococcus pneumonia 12 6 5 1 66,6
Сочетанная микрофлора Pseudomonas aeruginosa + Enterococcus faecalis + Enterobacter cloacae 1 5,5
У 4 из 18 (22,2%) больных отмечалось повторное выделение микроорганизмов из крови на фоне терапии антибиотиками. Повторная бактериемия была обусловлена грамотрицательной микрофлорой: у 1 больного Stenotrophomonas maltophilia, у 1 -Pseudomonas aeruginosa, у 2 — Escherichia coli, у 1 -ассоциация Escherichia coli и Enterococcus faecium.
Поражение мицелиальными грибами было выявлено у 5 (6,8%) больных, из них у 4 диагностирован инвазивный аспергиллез (в одном случае в сочетании с пневмоцистной пневмонией), у 1 больного инфекция была обусловлена грибами рода Acremonium spp. Пневмоцистная пневмония диагностирована у 3 (4,1%) больных. Данные осложнения возникали у больных ТАА. Всем больным с инвазивными микозами и пневмоцистной пневмонией в дебюте АА проводилась терапия преднизолоном. Медиана продолжительности нейтропении с момента диагностики АА до развития инвазивного грибкового или пневмоцистного процесса составила 72 дня (36-116). Во всех случаях проводилась сочетанная антибиотическая терапия, медиана длительности которой составила 19 дней (9-37).
Антибиотическая терапия (таблица 4) назначалась всем больным с инфекционными осложнениями.
Таблица 4. Антибиотическая терапия у больных АА до начала ИСТ (п=74)
Исследуемые параметры ТАА (п=57) НАА (п=17) Всего (п=74)
Число больных, у которых был получен эффект от «стартовой» антибактериальной терапии (%) 4 (7%)* 9 (52,9%)* 13(17,6%)
Число больных, у которых проводилась модификация терапии (%) 53 (93%)* 8(47,1%)* 61 (82,4%)
Число модификаций терапии Медиана (разброс) 8(1-19) 2(1-5) 3(1-19)
Суммарная длительность терапии, дни медиана (разброс) 39 (7-88) 9 (4-26) 14 (4-88)
*-р< 0,001
Антибиотиками первого этапа удалось купировать проявления инфекции только у 17,6% больных, среди них преобладали больные НАА. Остальным больным потребовалось модифицировать лечение (присоединение препаратов или смена их). В целом, антибиотическая терапия оказалась эффективной у 67 (90,5%) больных с инфекционными осложнениями до начала ИСТ. Эффекта от антибиотической терапии достичь не удалось у 7 (9,5%) больных, они умерли от рефрактерных инфекционных осложнений. Непосредственной причиной смерти всех 7 больных явился септический шок. Этиологическим фактором фатальной бактериемии преимущественно были грамотрицательные микроорганизмы: у 3 больных Р. aeruginosa, у 1 — S. malthophilia, у 2 — Enterococcus spp., у 1 — сочетание Е. coli и Enterococcus spp. Инвазивные микозы диагностированы у 4 умерших больных (1 -инвазивный аспергиллез легких, 1 — инвазивный аспергиллезный риносинусит, 1 -пневмоцистная пневмония, 1 — поражение легких грибами рода Acremonium spp.). Всего до начала ИСТ умерли 8 (6,7%): 7 больных — смерть от инфекционных осложнений, 1- кровоизлияние в головной мозг.
Инфекционные осложнения на ранних этапах ИСТ
Программная терапия начата 112 больным. Без инфекционных осложнений первые этапы терапии проведены 36 (32,1%) больным (25 больных ТАА, 11 НАА). У
76 из 112 (67,9%) больных за 4 месяца ИСТ зарегистрировано 294 эпизода инфекции. Подавляющее большинство инфекционных эпизодов выявлено у больных ТАА (79,9% в сравнении с 20,1% у больных НАА, р<0,005). У большинства больных ТАА с инфекционными осложнениями на данном этапе (87,8%) были зафиксированы эпизоды инфекции и до начала ИСТ. У больных ТАА чаще диагностировались повторные эпизоды инфекции, чем у больных НАА (44,9% в сравнении с 26%, р<0,05). Инфекции чаще рецидивировали после комплексной ИСТ (57,9%), чем после монотерапии АТГ (29,4%) или СЭ (32,5%). Общая характеристика инфекции на ранних этапах ИСТ представлена в таблице 5.
Таблица 5. Характеристика инфекции у больных АА на ранних этапах ИСТ (п=76).
Характеристика инфекции Число больных (п=76) Частота инфекционных эпизодов
ТАА (п=235) НАА (п=59) Всего (п=294)
Лихорадка с неуточненным очагом 42 (55,3%) 35 (14,9%) 15 (25,4%) 50 (17%)
Клинически доказанные инфекции 66 (86,8%) 160 (68,1%) 44 (74,6%) 204 (69,4%)
Бактериологически доказанные инфекции 16(21,1%) 40(17%) 0 (0%) 40(13,6%)
Отмечено, что у больных ТАА инфекционные эпизоды возникали чаще, чем при НАА. Также как до начала ИСТ, среди инфекционных эпизодов на данном этапе преобладали клинически доказанные (69,4%). Более чем у половины больных (55,3%) имела место лихорадка с неуточненным очагом, но доля ее в общей структуре инфекционных эпизодов на раннем этапе ИСТ остается небольшой (17%). Бактериологически доказанные инфекции возникали только у больных ТАА в связи длительным периодом глубокой нейтропении.
Медиана возникновения первого инфекционного эпизода после начала ИСТ была 10 дней (с 1 по 106 день). Отмечено, что независимо от объема проведенной ИСТ, наиболее критический период развития инфекционных осложнений — 2,5 — 3 месяца
от начала лечения при отсутствии хотя бы минимального эффекта от проведенного лечения, что указывает на необходимость интенсификации ИСТ в эти сроки.
После выполнения СЭ инфекционные осложнения развивались раньше, чем после курса АТГ, так после СЭ медиана развития первого инфекционного эпизода -5-й день (с 1 по 33 день), тогда как медиана развития инфекции после курса АТГ -15-й день (с 4 по 106 день).
У 66 из 76 (86,8%) больных с инфекционными осложнениями отмечено возникновение 204 эпизодов клинически доказанной инфекции. Частота и характеристика эпизодов клинически доказанной инфекции у больных АА на раннем этапе ИСТ представлены в таблице 6.
Таблица 6. Эпизоды клинически доказанной инфекции у больных АА на раннем этапе ИСТ в зависимости от тяжести АА (п=66).
Локализация инфекции Частота инфекционных эпизодов
ТАА (п=160) НАА (п=44) Всего (п=204)
Hoco- и ротоглотки 55 (34,4%) 13 (29,6%) 68 (33,3%)
Бронхи 1 (0,6%) 5(11,4%) 6 (2,9%)
Пищевод 3(1,9%) 1 (2,3%) 4 (2%)
Глаза 2(1,2%) 0 2 (1%)
Придаточные пазухи носа 5 (3,1%) 2 (4,5%) 7 (3,4%)
Кишечник 17 (10,6%) 6(13,6%) 23(11,3%)
Перианальная область 4 (2,5%) 2 (4,5%) 6 (3%)
Легкие 34(21,2%) 4(9,1%) 38 (18,6%)
Желчевыводящие пути 3 (1,9%) 4 (9,1%) 7 (3,4%)
Мочевыводящие пути 8 (5%) 1 (2,3%) 9 (4,4%)
Кожа 10 (6,3%) 2 (4,5%) 12 (5,9%)
Суставы 3 (1,9%) 1 (2,3%) 4 (2%)
Герпетическая инфекция 15(9,4%) 3 (6,8%) 18(8,8%)
После начала ИСТ у больных так же преобладали поражения слизистой оболочки полости рта и глотки.
Среди бактериологически доказанных инфекций основную часть составили эпизоды бактериемии, возникшие у 13 (17,1%) больных. В таблице 7 представлена характеристика эпизодов бактериемии у больных АА после начала лечения. Таблица 7. Этиология первого эпизода бактериемии у больных АА после начала ИСТ (п=13).
Микроорганизм Число больных %
Грамположительные кокки, из них: 4 30,8
Staphylococcus CN 1
Enterococcus spp. 3
Грамотрицательные палочки, из них: 8 61,5
Pseudomonas aeruginosa 1
Acinetobacter baumanii 2
Klebsiella pneumoniae 2
Escherichia coli 3
Сочетанная микрофлора 1 7,7
E. coli + Enterococcus faecalis +
Stenotrophomonas maltophilia
Бактериемия возникала только у больных ТАА. В качестве возбудителей первого эпизода бактериемии после начала ИСТ превалировали грамотрицательные бактерии, которые выявлены у 8 из 13 (61,5%) больных Грамположительные кокки были выделены у 4 из 13 (30,8%) больных.
В 4 случаях диагностирован инвазивный аспергиллез, у 3 больных пневмоцистная пневмония, у 3 больных — инвазивный аспергиллез и пневмоцистная пневмония. Данные осложнения, так же как и до начала ИСТ, возникали только у больных тяжелой формой АА. Роль назначения преднизолона в дебюте АА как фактора риска развития инвазивного грибкового или пневмоцистного процесса на данном этапе практически нивелировалась: только 3 из 10 (30%) больным программному лечению предшествовала терапия глкжокортикоидами. Основным фактором риска развития инвазивного аспергиллеза или пневмоцистной пневмонии была длительная нейтропения: медиана ее продолжительности на момент диагностики процесса
составляла 195 дней (от 92 до 303 дней). После начала ИСТ инвазивный аспергиллез и пневмоцнстиая пневмония возникали в среднем на 65-й день (7-121 день).
Антибиотическая терапия проводилась всем больным с инфекционными осложнениями. 18 (16,1%) больным первый этап ИСТ был проведен на фоне антибактериальной терапии широкого спектра действия (11 больным выполнена СЭ, 7 больным проведен курс АТГ). Вызвано это было рецидивирующими тяжелыми инфекционными осложнениями до начала ИСТ. Подавляющее большинство этих больных страдали ТАА — 16 (88,9%).
Таблица 8. Антибиотическая терапия у больных АА на раннем этапе ИСТ
Исследуемые параметры ТАА (п=49) НАА (п=27) Всего (п=76)
Эффект от использования «стартовой» антибактериальной терапии (%) 3(6,1%)* 5(18,5%)* 8 (10,5%)
Модификация терапии (%) 46 (93,9%) 22 (81,5%) 68 (89,5%)
Число модификаций терапии, медиана (разброс) 9(1-31) 2(1-3) 4(1-31)
Суммарная длительность терапии, дни медиана (разброс) 39 (8-101) 9(3-42) 3-101(19)
*-р< 0,001
Антибиотиками первого этапа удалось купировать проявления инфекции только у 8 (10,5%) больных, что еще меньше, чем до начала ИСТ (17,6%). Большинству больных потребовалось модифицировать лечение. Антибиотическая терапия оказалась эффективной у 65 (85,5%) больных с инфекционными осложнениями на раннем этапе ИСТ. У 11 (14,5%) больных эффекта достичь не удалось, они умерли от инфекционных осложнений. Еще 5 больных умерли на раннем этапе ИСТ: 2 от кровоизлияния в головной мозг, у 1 больной причиной смерти была острая сердечнососудистая недостаточность, 2 пациентов умерли дома, и причина их смерти достоверно неизвестна. У всех умерших больных была диагностирована ТАА. У всех умерших больных из крови были выделены бактерии: у 3 больных Klebsiella spp., у 3 -P. aeruginosa, у 2 — Enterococcus spp., у 2 — Е. coli и у 1 — Acinetobacter spp. Инвазивные микозы, вызванные преимущественно мицелиальными грибами, диагностированы у 8 умерших больных (4 — инвазивный аспергиллез легких, 2 -
аспергиллез и пневмоцистная пневмония, 2 — пневмоцистная пневмония). У всех умерших больных имели место сочетанные рецидивирующие тяжелые инфекционные осложнения, но многокомпонентная антибиотическая терапия не позволила достичь эффекта.
Динамика инфекционных осложнений у больных ¡¡пластической анемией в
процессе шшуносупрессшной терапии
У 21 из 112 (18,8%) больных АА, которым удалось начать иммуносупрессивную терапию, до начала лечения зафиксированы тяжелые инфекционные осложнения (ТИО), которые удалось купировать. Тяжелыми инфекционными осложнениями считали бактериемию, пневмонию, парапроктит, некротическую энтеропатию, сопровождающуюся фебрильной лихорадкой, а также сочетание этих инфекционных эпизодов с какими-либо иными. Таким образом, на старте ИСТ было выделено две группы больных: 1 — с ТИО в дебюте, 2 — без ТИО в дебюте. Проведен анализ инфекционных осложнений, развившихся у больных 1-й и 2-й группы в процессе ИСТ (таблица 9). На основании проведенного анализа можно говорить, что у большинства больных ТАА с тяжелыми инфекциями до ИСТ наблюдался рецидив инфекционных осложнений после начала программной терапии АА, причем смертность в этой категории больных очень высока. У больных НАА редко регистрируются тяжелые инфекции в дебюте заболевания.
Большинство больных с тяжелыми инфекциями в дебюте АА поступили в ГНЦ из других стационаров, ранее получали лечение глюкокортикоидами и имели в анамнезе инфекционные осложнения на догоспитальном этапе. У всех больных ТАА с ТИО в дебюте АА зафиксированы инфекционные осложнения на ранних этапах программной терапии, тогда как в группе больных ТАА без ТИО в дебюте аплазии частота инфекции составила 72,2%. Необходимо отметить, что частота тяжелых инфекций в процессе ИСТ значимо превалировала в группе больных ТАА с ТИО в дебюте (75% в сравнении с 27,8%). Обращает на себя внимание высокая частота бактериемии в группе больных ТАА с ТИО в дебюте АА по сравнению с теми больными ТАА, у которых ТИО до начала ИСТ не было (46,7% и 26,7% соответственно). Как следствие, в группе больных ТАА с ТИО в дебюте АА выше смертность на ранних этапах ИСТ, чем в группе больных ТАА без ТИО в дебюте (35% в сравнении с 7,4%).
Тяжелые инфекционные осложнения до начала программной ИСТ являются фактором неблагоприятного прогноза для больных ТАА.
Таблица 9. Характеристика инфекционных осложнений в процессе ИСТ у больных в зависимости от наличия тяжелых инфекций в дебюте АА.
Исследуемые ТИО в дебюте А А Без ТИО в дебюте АА
параметры (в ТАА НАА Всего ТАА НАА Всего
процессе ИСТ) (п=20) (п=1) (п=21) (п=54) (п=37) (п=91)
Инфекции 20/20 0/1 20/21 39/54 17/37 56/91
(100%) (95,2%) (72,2%) (45,9%) (61,5%)
ТИО: 15/20 0/1 15/21 15/54 11/37 26/91
(75%)* (71,4%) (27,8%)* (29,7%) (28,6%)
Пневмония 15/15 0 15/15 14/15 4/11 18/26
(100%) (100%) (93,3%) (36,4%) (69,2%)
Некротическая 12/15 0 12/15 5/15 6/11 11/26
энтеропатия (80%) (80%) (33,3%) (54,5%) (42,3%)
Парапроктит 4/15 0 4/15 0 2/11 2/26
(26,7%) (26,7%) (18,2%) (7,7%)
Бактериемия 7/15 1/1 8/15 4/15 1/11 5/26
(46,7%)** (53,3%) (26,7%)** (9,1%) (19,2%)
Инвазивный 4/2 О1 0 4/21 1/54 0 1/91
аспергиллез (20%) (19%) (1,9%) (1,1%)
Пневмоцистная 1/20 (5%) 0 1/21 2/54 0 2/91
пневмония (4,8%) (3,7%) (2,2%)
ИАЛ+ПП 1/20 (5%) 0 1/21 2/54 0 2/91
(4,8%) (3,7%) (2,2%)
Назначение а/б 20/20 1/12 21/21 48/54 26/37 74/91
(100%) (100%) (88,9%) (70,3%) (81,3%)
Смерть в 7/20 0 7/21 4/54 0 4/91
процессе ИСТ (35%)*** (33,3%) (7,4%)*** (4,4%)
— еще 1 пациент не включен — ИАЛ диагностирован до начала ИСТ и рецидивировал после СЭ
антибактериальная терапия назначена после спленэктомии
* — Р<0,005 ** — Р<0,05 ***-Р<0,005
Пятилетняя выживаемость среди больных ТАА в группе больных без тяжелых инфекций в дебюте АА значимо выше, чем среди больных с тяжелыми инфекциями в дебюте АА (74% в сравнении с 47%, р<0,05). Таким образом, тяжелые инфекции до начала программной иммуносупрессивной терапии являются неблагоприятным прогностическим фактором для больных ТАА.
Kaplan-Meier Cum. Survival
1 ,8 ,6 ,4 ,2 О
Time
Рис.1 Общая выживаемость больных ТАА в зависимости от наличия инфекционных осложнений в дебюте АА
Мониторинг микрофлоры слизистой оболочки зева у больных АА
У 22 больных АА было проведено 110 исследований микрофлоры слизистой оболочки зева. Выявлено 18 видов микроорганизмов (Таблица 10).
Колонизация грамотрицательными микроорганизмами слизистой оболочки ЖКТ на разных этапах определялась у всех обследованных 22 больных АА. Частота колонизации как до начала ИСТ, так и на ранних этапах терапии составляла более 80%.
Time
Таблица 10. Спектр микроорганизмов, выявленных из зева у больных АА.
Спектр микроорганизмов, выявленных из зева
до начала ИСТ 10-15 дней 28-30 дней
Микроорганизмы п=22 после начала после начала
ИСТ (п=18) ИСТ (п=14)
Число микроорганизмов 61 47 43
Грамположительные кокки, 41/61 (67,2%) 33/47(70,2%) 25/43(58,1%)
Streptococci группы viridans 18/41 (43,9%) 13/33 (39,4%) 8/25 (32%)
Staphylococcus coagulase-negative 9/41 (21,9%) 6/33 (18,2%) 6/25 (24%)
Staphylococcus aureus 2/41 (4,9%) 2/33 (6,1%) 0/25 (0%)
Enterococcus spp. 12/41 (29,3%) 12/33 (36,4%) 11/25 (44%)
Грамотрицательные палочки 8/61 (13,1%) 9/47(19,1%) 12/43 (27,9%)
E. coli 2 4 2
Enterobacter spp. — — 2
Klebsiella spp. — 1 -
Proteus spp. — — 1
Acinetobacter spp. 1 1 2
S. maltophilia 2 — 1
Chryseomonas spp. 1 — 1
P. aeruginosa 2 3 3
Дрожжевые грибы 12/61 (19,7%) 5/47 (10,6%) 6/43 (14%)
Проведено 65 исследований микрофлоры слизистой оболочки кишечника и выделено 17 видов микроорганизмов. В 26 случаях ранее выявленные микроорганизмы персистировали при повторных исследованиях (Таблица 11).
На момент начала ИСТ частота колонизации снижалась до 47,4%, по-видимому, в результате применения деконтаминации кишечника ципрофлоксацином при проведении курса АТГ.
Обращает на себя внимание тот факт, что у 40% больных после начала ИСТ колонизующий слизистые вид грамотрицательного микроорганизма становится этиологическим фактором бактериемии
Таблица 11. Спектр микроорганизмов, выявленных из кишечника у больных АА.
Микроорганизмы Спектр микроорганизмов, выявленных из кишечника
до начала 10-15 дней 28-30 дней
ИСТ после начала после начала
п=22 ИСТ п=18 ИСТ п=10
Число микроорганизмов 53 38 27
Грамположнтельные бактерии: 22/53(41,5%) 15/38 (39,5%) 10/27 (37%)
Enterococcus spp. 15/22(68,2%) 8/15(53,3%) 8/10(80%)
Staphylococcus coagidase-negative 5/22 (22,7%) 6/15(40%) 2/10(20%)
Staphylococcus aureus 2/22 (9,1%) — -
Coiynebacterium spp. — 1/15 (6,7%) -
Грамотрицательные палочки, 25/53 (47,2%) 11/38 (28,9%) 13/27(48,1%)
E. coli 16 10 5
Enterobacter spp. 2 — 1
Klebsiella spp. 2 — 3
Citrobacter spp. 2 — 1
Morganella spp. — — 1
P. aeruginosa 1 — 2
Acinetobacter spp. 2 1 -
Дрожжевые грибы: 6/53 (11,3%) 12/38 (31,6%) 4/27 (14,8%)
Заключение.
Таким образом, инфекционные осложнения у больных АА являются одной из самых серьезных проблем на ранних этапах течения болезни. Этиология инфекций у данной категории больных весьма разнообразна, при этом отмечается увеличение доли осложнений, для которых необходима прецизионная терапия. В этой связи крайне важным становится активное проведение диагностических мероприятий, направленных как на поиск очага инфекции, так и на идентификацию патогена. Прецизионная терапия позволит не только успешно излечить инфекцию, но и снизить стоимость всего объема терапии. А главное, эффективная антибиотическая терапия у данного крайне тяжелого контингента больных дает возможность в полном объеме и
своевременно проводить все этапы комплексной ИСТ, позволяющей значимо повысить выживаемость больных АА.
Выводы
1. Инфекционные осложнения развиваются у большинства больных апластической анемией как в дебюте заболевания или до начала программной иммуносупрессивной терапии (61,7%), так и в процессе комбинированного иммуносупрессивного лечения (67,9%).
2. Вероятность развития инфекционных осложнений определяется в первую очередь глубиной и продолжительностью нейтропении. Наиболее высокая частота инфекционных осложнений отмечается при тяжелой форме апластическои анемии (гранулоциты <0,5 х 109/л) -77% (р<0,001).
3. Доказано статистически достоверное повышение вероятности развития инфекционных осложнений у больных, получавших терапию глюкокортикоидами — 66,2% (р=0,0002 ) и в случаях пребывания больных до начала программной терапии в разных стационарах — 62,3% (р<0.001).
4. Установлено, что до начала и в процессе программного лечения в структуре клинически доказанных инфекционных осложнений преобладали поражения слизистой оболочки ротоглотки (44,8% и 33,3%), отмечена высокая частота пневмонии (17,2% и 18,6%), некротической энтеропатии (7,8% и 11,3%), парапроктита и поражений слизистой оболочки дистальных отделов прямой кишки (6,9% и 3%).
5. Обнаружено, что до начала и в процессе программного лечения среди бактериологически доказанных инфекций превалировали эпизоды бактериемии (24,3% и 17,1%). У большинства больных в дебюте заболевания в качестве возбудителей первого эпизода бактериемии выявлялись грамположительные кокки (66,6%), в то время как повторные эпизоды бактериемии (в 22,2% случаев) были обусловлены грамотрицательной микрофлорой. В процессе ИСТ в качестве возбудителей бактериемии превалировали грамотрицательные бактерии (61,5%).
6. Выявлено, что инвазивные микозы и пневмоцистная пневмония развивались у больных ТАА на фоне других существующих инфекций и длительной интенсивной антибиотической терапии в до начала ИСТ у 9,5%, в процессе
ИСТ у 13,2%. Основным фактором риска развития инвазивного грибкового или пневмоцистного процесса была длительная критическая нейтропения : ее суммарная продолжительность на момент диагностики составляла от 92 до 303 дней (медиана 195 дней)
7. Отмечено, что независимо от объема проведенной ИСТ, наиболее критический период развития инфекционных осложнений — 2,5 — 3 месяца от начала лечения при отсутствии хотя бы минимального эффекта от проведенного лечения.
8. Доказано, что тяжелые инфекционные осложнения в дебюте заболевания, возникающие до начала ИСТ, рецидивируют в процессе лечения у большинства больных (71,4%) и являются неблагоприятным прогностическим фактором: пятилетняя выживаемость в группе больных АА с ТИО до начала программной терапии составляет 41%, в группе больных без ТИО до начала лечения — 79% (р<0.05)
9. На фоне ИСТ повышается риск грамотрицательной бактериемии (15,8% — до начала ИСТ, 46,7% — в период ИСТ), в том числе повышается риск инфицирования кровотока колонизующим видом микроорганизма (10,5% и 40% соответственно, р<0,05).
Список опубликованных работ по теме диссертации
1. Е.А.Михайлова, В.Г.Савченко, Е.Н.Устинова, А.В.Кохно, Н.Г.Тюрина, Ш.З.Арчуадзе, М.А.Виноградова и соавт. Результаты программной терапии взрослых больных апластической анемией. Проблемы гематологии и переливания крови. — 2003, №3, с.14-22.
2. Е.А.Михайлова, В.Г.Савченко, Е.Н.Устинова, М.А.Виноградова и соавт. Спленэктомия в программной терапии апластической анемии. Тер.Архив, 2006, №8, с.52-57
3. М.А.Виноградова, Г.А.Клясова, Е.А.Михайлова, Е.Н.Устинова, В.Г.Савченко. Инвазивный аспергиллез у больных апластической анемией Успехи медицинской микологии. Том VIII, глава 6, с. 118-119. (Материалы 4-го Всероссийского Конгресса по медицинской микологии. Москва, Национальная Академия Микологии, 2006.)
4. T.V.Petrova, D.A.Svinareva, I.N.Nifontova, M.A.Vinogradova, E.A.Michaylova, N.J.Drize.Alterations of gene expression in pth (1-34) treated long-term bone marrow cultures from patients with aplastic anemia. 11-th Congress of the European hematology association. Amsterdam, The Netherlands, june 15-18, 2006. Abstract book, p.393.
5. М.А.Виноградова, Г.А.Клясова, Е.Е.Трушина, Е.Н.Устинова, Е.А.Михайлова. Инфекционные осложнения в дебюте апластической анемии. Гематол. и трансфузиол., 2007, т.52, №4, с. 16-21.
6. Петрова Т. В., Нифонтова И. Н., Свинарева Д. А., Виноградова М. А., Михайлова Е. А., Дризе Н. И. Нарушения экспрессии генов, регулирующих гомеостаз стволовых кроветворных клеток, в стромальных клетках больных апластической анемией. Тер. архив, 2008, №1, с.61-65.
Заказ № 89/05/09 Подписано в печать 21.05.2009 Тираж 80 экз. Усл. п.л. 1,5
ООО «Цифровичок», тел. (495) 797-75-76; (495) 649-83-30 , Г®’j) www. cfr. ru; e-mail: info@cfr. m
Тяга и жевание льда: признак анемии?
Постоянное желание и жевание льда — признак анемии?
Ответ от Раджива К. Прути, M.B.B.S.Возможно. Врачи используют термин «pica» для описания тяги и жевания веществ, не имеющих питательной ценности, таких как лед, глина, почва или бумага. Тяга и жевание льда (пагофагия) часто связаны с дефицитом железа, с анемией или без нее, хотя причина неясна. По крайней мере, одно исследование показывает, что жевание льда может повысить бдительность у людей с железодефицитной анемией.
Реже другие проблемы с питанием могут вызвать у вас желание жевать лед. А у некоторых людей пика является признаком эмоциональных проблем, таких как стресс, обсессивно-компульсивное расстройство или нарушение развития.
Тщательное медицинское обследование может помочь определить, вызвана ли пика основным заболеванием. Если причиной pica является эмоциональная проблема или проблема развития, может быть полезна когнитивно-поведенческая терапия.
с
Раджив К.Прути, M.B.B.S.
Получите самые свежие советы по здоровью от клиники Мэйо. в ваш почтовый ящик.
Зарегистрируйтесь бесплатно и будьте в курсе новостей достижения, советы по здоровью и актуальные темы о здоровье, например, COVID-19, плюс советы экспертов по поддержанию здоровья.
Узнайте больше о нашем использовании данныхЧтобы предоставить вам наиболее актуальную и полезную информацию и понять, какие Информация выгодно, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с другими информация, которая у нас есть о вас.Если вы пациент клиники Мэйо, это может включать в себя защищенную медицинскую информацию (PHI). Если мы объединим эту информацию с вашей PHI, мы будем рассматривать всю эту информацию как PHI, и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о конфиденциальности. практики. Вы можете отказаться от рассылки по электронной почте. в любое время, нажав ссылку «Отказаться от подписки» в электронном письме.
Подписывайся!
Спасибо за подписку
Наша электронная рассылка Housecall будет держать вас в курсе на последней информации о здоровье.
Сожалеем! Наша система не работает. Пожалуйста, попробуйте еще раз.
Что-то пошло не так на нашей стороне, попробуйте еще раз.
Пожалуйста, попробуйте еще раз
- У меня тяжелые месячные. Стоит ли принимать железные таблетки?
- Клигман Р.М. и др. Поведенческие и психические расстройства. В: Учебник педиатрии Нельсона. 20-е изд.Филадельфия, Пенсильвания: Эльзевир; 2016 г. https://www.clinicalkey.com. По состоянию на 23 февраля 2018 г.
- Hunt MG, et al. Пагофагия улучшает скорость нейропсихологической обработки при железодефицитной анемии. Медицинские гипотезы. 2014; 83: 473.
- Пауэрс Дж. М. и др. Дефицит железа у младенцев и детей младше 12 лет: скрининг, профилактика, клинические проявления и диагностика. https://www.uptodate.com/contents/search. По состоянию на 23 февраля 2018 г.
Продукты и услуги
- Книга: Книга здоровья семьи клиники Мэйо, 5-е издание
- Информационный бюллетень: Письмо клиники Мэйо о здоровье — цифровое издание
.
Тест на ферритин — Клиника Мэйо
Обзор
Тест на ферритин измеряет количество ферритина в крови. Ферритин — это белок крови, содержащий железо. Тест на ферритин помогает вашему врачу понять, сколько железа хранится в вашем организме.
Если тест на ферритин показывает, что уровень ферритина в крови ниже нормы, это указывает на то, что в вашем организме низкие запасы железа и у вас дефицит железа. В результате у вас может развиться анемия.
Если тест на ферритин показывает уровень выше нормы, это может указывать на то, что у вас есть состояние, при котором в вашем организме накапливается слишком много железа. Это также может указывать на заболевание печени, ревматоидный артрит, другие воспалительные состояния или гипертиреоз. Некоторые виды рака также могут вызывать повышенный уровень ферритина в крови.
Продукты и услуги
Показать больше продуктов от Mayo ClinicПочему это делается
Если ваш врач подозревает, что в вашем организме слишком много или слишком мало железа, он может предложить тест на ферритин.Тест может диагностировать или предложить:
- Железодефицитная анемия
- Гемахроматоз — состояние, при котором ваше тело усваивает слишком много железа из пищи, которую вы едите
- Болезнь печени
- Болезнь Стилла у взрослых
Ваш врач может также предложить тест на ферритин, если у вас диагностировано заболевание, которое приводит к слишком большому содержанию железа в организме, например гемохроматоз. Ваш врач может использовать тест на ферритин, чтобы контролировать ваше состояние и назначать лечение.
Как вы готовитесь
Если ваш образец крови проверяется только на ферритин, вы можете нормально есть и пить перед анализом. Если ваш образец крови будет использоваться для других анализов, вам, возможно, придется некоторое время голодать перед обследованием. Ваш врач проинструктирует вас.
Что вас может ожидать
Во время теста на ферритин член вашей медицинской бригады берет образец крови, вводя иглу в вену на вашей руке.Образец крови отправляется в лабораторию для анализа. Вы можете немедленно вернуться к своим обычным занятиям.
Результаты
Нормальный диапазон содержания ферритина в крови:
- Для мужчин, от 24 до 336 мкг на литр
- Для женщин, от 11 до 307 мкг на литр
Результаты ниже нормы
Это означает, что у вас дефицит железа. У вас также может быть анемия. Если у вас низкий уровень ферритина, ваш врач определит причину.
Результаты выше нормы
Уровень ферритина выше нормы можно увидеть в нескольких условиях. Однако для диагностики этих состояний может потребоваться дополнительное тестирование, основанное на ваших симптомах и физическом осмотре.
- Гемохроматоз
- Порфирия — группа заболеваний, вызванных дефицитом ферментов, поражающих нервную систему и кожу
- Ревматоидный артрит или другое хроническое воспалительное заболевание
- Болезнь печени
- Гипертиреоз
- Лейкемия
- Лимфома Ходжкина
- Множественные переливания крови
- Злоупотребление алкоголем
- Прием слишком большого количества добавок железа
Если ваш уровень ферритина выше нормы, вашему врачу может потребоваться оценить результаты с результатами других тестов, чтобы определить следующие шаги.
Чтобы получить подробные сведения о результатах анализа на ферритин, обратитесь к врачу.
28 ноября 2019 г.
Тест на гематокрит — Mayo Clinic
Обзор
Тест на гематокрит (he-MAT-uh-krit) измеряет долю красных кровяных телец в вашей крови. Красные кровяные тельца переносят кислород по всему телу.Слишком мало или слишком много эритроцитов может быть признаком определенных заболеваний.
Тест на гематокрит, также известный как тест на объем упакованных клеток (PCV), представляет собой простой анализ крови.
Зачем это нужно
Анализ гематокрита является частью общего анализа крови. Измерение доли эритроцитов в крови может помочь врачу поставить диагноз или контролировать вашу реакцию на лечение.
Гематокрит ниже нормы может означать:
- Недостаточное снабжение здоровыми эритроцитами (анемия)
- Большое количество лейкоцитов в результате длительного заболевания, инфекции или нарушения лейкоцитов, например лейкемии или лимфомы
- Недостаток витаминов или минералов
- Недавняя или длительная кровопотеря
Гематокрит выше нормы может означать:
- Обезвоживание
- Заболевание, такое как истинная полицитемия, при котором в организме вырабатывается слишком много красных кровяных телец
- Болезнь легких или сердца
Как вы готовитесь
Гематокрит — это простой анализ крови.Вам не нужно голодать перед обследованием или делать другие приготовления.
Что можно ожидать?
Образец крови обычно берут иглой из вены на руке. Вы можете почувствовать некоторую нежность на месте, но после этого сможете вернуться к нормальной деятельности.
Результаты
Результаты вашего теста на гематокрит сообщаются как процент кровяных телец, являющихся эритроцитами. Нормальные диапазоны существенно различаются в зависимости от расы, возраста и пола.Определение нормального процентного содержания красных кровяных телец также варьируется от одной медицинской практики к другой.
Обычно нормальным считается диапазон:
- Для мужчин, от 38,3 до 48,6%
- Для женщин, от 35,5 до 44,9 процента
Для детей в возрасте 17 лет и младше нормальный диапазон зависит от возраста и пола.
Ваш гематокритный тест предоставляет только одну информацию о вашем здоровье. Поговорите со своим врачом о том, что означает ваш результат теста на гематокрит в свете симптомов, которые вы испытываете, и результатов других диагностических тестов.
Точность результатов теста
Ряд факторов может повлиять на результат теста на гематокрит и дать неточные или вводящие в заблуждение результаты, в том числе:
- Жизнь на большой высоте
- Беременность
- Значительная недавняя кровопотеря
- Недавнее переливание крови
- Сильное обезвоживание
Ваш врач примет во внимание возможные осложняющие факторы при интерпретации результатов вашего гематокритного теста.Ваш врач может захотеть повторить тест на гематокрит и сделать другие анализы крови, если результаты дают противоречивую или неожиданную информацию.
22 июля 2021 г.
Показать ссылки- Сандовал С. Обращение к ребенку с анемией. http://www.uptodate.com/home. По состоянию на 24 марта 2016 г.
- Schrier SL. Подходите к взрослому больному анемией.http://www.uptodate.com/home. По состоянию на 24 марта 2016 г.
- Виды анализов крови. Национальный институт сердца, легких и крови. http://www.nhlbi.nih.gov/health/health-topics/topics/bdt/types. По состоянию на 24 марта 2016 г.
- Теффери А. Диагностический подход к пациенту с полицитемией. http://www.uptodate.com/home. По состоянию на 24 марта 2016 г.
- Hoffman R, et al. Полицитемии. В кн .: Гематология: основные принципы и практика. 6-е изд. Филадельфия, Пенсильвания: Сондерс Эльзевьер; 2013.http://www.clinicalkey.com. По состоянию на 24 марта 2016 г.
- Общий анализ крови с дифференциалом, кровь. Медицинские лаборатории Мэйо. http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/9109. По состоянию на 24 марта 2016 г.
Симптомы, типы, причины, риски, лечение и ведение
Обзор
Что такое анемия?
Анемия возникает, когда у вас недостаточно эритроцитов.Клетки путешествуют с железом и гемоглобином, который является белком, который помогает переносить кислород через кровоток к вашим органам по всему телу. Когда у кого-то развивается анемия, его называют «анемичным». Анемия может означать, что вы чувствуете себя более уставшим или холодным, чем обычно, или ваша кожа кажется слишком бледной. Это связано с тем, что ваши органы не получают кислород, необходимый им для работы. Некоторые люди обнаруживают, что у них мало железа, когда они идут сдавать кровь.
Существуют ли разные виды анемии?
Существует несколько различных типов анемии, но каждый из них вызывает снижение количества эритроцитов в кровотоке.Уровень эритроцитов низкий по одной из следующих причин:
- Ваше тело не может вырабатывать достаточное количество гемоглобина (низкий гемоглобин).
- Ваше тело вырабатывает гемоглобин, но гемоглобин работает неправильно.
- Ваше тело не вырабатывает достаточно красных кровяных телец.
- Ваше тело слишком быстро расщепляет эритроциты.
Некоторые типы анемии, о которых вы, возможно, слышали, включают железодефицитную анемию и серповидно-клеточную анемию.
Насколько распространена анемия?
Анемия поражает более двух миллиардов человек во всем мире, что составляет более 30% всего населения.Это особенно распространено в странах с ограниченными ресурсами, но также затрагивает многих людей в промышленно развитом мире. В США анемия является наиболее распространенным заболеванием крови. Примерно три миллиона американцев страдают этим расстройством.
У кого, скорее всего, разовьется анемия?
Любой может заболеть анемией, хотя следующие группы имеют более высокий риск:
- Женщины: Кровопотеря во время месячных и при родах может привести к анемии. Это особенно верно, если у вас тяжелые месячные или такое состояние, как миома.
- Дети в возрасте от 1 до 2 лет: Организму требуется больше железа во время всплесков роста.
- Младенцы: Младенцы могут получать меньше железа при переходе от грудного молока или смеси к твердой пище. Железо из твердой пищи не так легко усваивается организмом.
- Люди старше 65 лет: Люди старше 65 с большей вероятностью будут придерживаться диеты с низким содержанием железа и некоторых хронических заболеваний.
- Люди, принимающие препараты для разжижения крови: Эти лекарства включают в себя такие препараты, как аспирин, клопидогрель (Плавикс®), варфарин (Кумадин®), препараты гепарина, апиксабан (Эликвис®), бетриксабан (BevyxXa®), дабигатран (Прадакса®), эдоксабан ( Савайса®) и ривароксабан (Ксарелто®).
Каковы признаки и симптомы анемии?
При всех типах анемии проявляется несколько признаков и симптомов, например усталость, одышка и чувство холода. Другие включают:
- Головокружение или слабость.
- Головная боль.
- Болезненный язык.
- Бледная кожа, сухая кожа или кожа, на которой легко появляются синяки.
- Непреднамеренное движение в голени (синдром беспокойных ног).
- Учащенное сердцебиение.
Как анемия влияет на организм?
Анемия может иметь и другие последствия для вашего тела, помимо чувства усталости или холода.Другие признаки того, что вам может не хватать железа, включают ломкие ногти или ногти в форме ложки и возможное выпадение волос. Вы можете обнаружить, что ваше чувство вкуса изменилось, или вы можете почувствовать звон в ушах.
Различные типы анемии могут привести к другим серьезным проблемам. У людей с серповидноклеточной анемией часто возникают сердечные и легочные осложнения.
Если у вас анемия, которую не лечить, это может привести к аритмии (нерегулярному сердцебиению), увеличению сердца или сердечной недостаточности.Вы также подвергаетесь большему риску заражения и депрессии.
Возможно, вы слышали, что дефицит железа связан с жеванием льда, что действительно случается. Жевание льда является признаком пика, состояния, которое включает в себя употребление в пищу того, что на самом деле не является едой, например, мела или грязи. Так что пика также является признаком дефицита железа. Часто наблюдается у детей с анемией.
Как еще анемия поражает детей?
Детям важно, чтобы в их рационе было достаточно железа и других питательных веществ, чтобы предотвратить анемию и связанные с ней проблемы с недостатком внимания, задержкой развития моторики и проблемами с обучением.У детей старшего возраста нужно уделять больше внимания признакам анемии во время скачков роста и менструальных циклов.
Как анемия влияет на пожилых людей?
У пожилых людей анемия может в еще большей степени вызывать спутанность сознания или депрессию. Слабость может затруднить ходьбу. Анемия может сократить продолжительность вашей жизни, если вы старше и не лечитесь.
Может ли анемия повлиять на мой вес?
Наличие достаточного количества железа также может быть фактором проблем с весом. Исследования показали, что люди с избыточным весом могут похудеть, если решат проблему низкого содержания железа в крови.У вас может возникнуть непреднамеренная потеря веса наряду с анемией, если у вас есть другие заболевания, например рак. Люди, перенесшие операцию по снижению веса, могут заболеть анемией из-за дефицита витаминов и минералов.
Как анемия влияет на беременность?
Дефицит железа во время беременности увеличивает вероятность осложнений, таких как преждевременные роды. Исследования показали, что дети, рожденные женщинами с низким уровнем железа, после рождения имеют более высокий риск низкой массы тела при рождении и проблем с их собственным уровнем железа.
Если вы беременны, у вас более высока вероятность развития железодефицитной анемии. Ваш будущий ребенок получает от вас железо и другие питательные вещества. Многие беременные женщины принимают таблетки железа, чтобы предотвратить анемию. Чтобы убедиться, что у вас достаточно железа для вас и вашего ребенка, ешьте хорошо сбалансированную пищу, в которую входят продукты, богатые железом, и продукты, содержащие витамины B12 и B9. Следуйте инструкциям врача по приему витаминов и добавлению железа в свой рацион.
Выяснить, что у вас анемия, — это только начало.Выявление причины анемии приведет вас к лучшему лечению.
Симптомы и причины
Что вызывает анемию?
Самая частая причина анемии — низкий уровень железа в организме. Этот тип анемии называется железодефицитной анемией . Вашему организму необходимо определенное количество железа для производства гемоглобина — вещества, которое перемещает кислород по вашему телу. Однако железодефицитная анемия — это всего лишь один тип. Другие типы вызваны:
- Диеты, в которых не хватает витамина B12, или вы не можете использовать или усваивать витамин B12 (например, при злокачественной анемии).
- Диеты, в которых не хватает фолиевой кислоты, также называемой фолиевой кислотой, или ваш организм не может правильно использовать фолиевую кислоту (например, фолиевая анемия).
- Унаследованные заболевания крови (например, серповидноклеточная анемия или талассемия).
- Состояния, при которых эритроциты разрушаются слишком быстро (например, гемолитическая анемия).
- Хронические состояния, при которых вашему организму не хватает гормонов для образования красных кровяных телец. К ним относятся гипертиреоз, гипотиреоз, запущенная болезнь почек, волчанка и другие хронические заболевания.
- Кровопотеря, связанная с другими состояниями, такими как язвы, геморрой или гастрит.
Что вызывает железодефицитную анемию?
Вы можете заразиться железодефицитной анемией от:
- Кровотечение, вызванное быстрой потерей большого количества крови (например, при серьезной аварии) или потерей небольшого количества крови в течение длительного периода времени. При кровопотере организм теряет больше железа, чем может восполнить с пищей. Это может случиться с женщинами с обильными менструациями или с воспалительными заболеваниями кишечника.
- Недостаточное количество железа в рационе.
- Вам нужно больше железа, чем раньше (например, во время беременности или болезни).
Некоторые типы железодефицитной анемии называются другими названиями, связанными с причиной, например, анемия хронического заболевания (также называемая анемией воспаления) или анемией с острой кровопотерей.
Какие типы анемии не являются железодефицитной анемией?
Злокачественная анемия
Строго говоря, злокачественная анемия возникает, когда человеку не хватает того, что называется внутренним фактором, который позволяет ему усваивать витамин B12.Без витамина B12 организм не может вырабатывать здоровые эритроциты. Другие типы анемии, связанные с недостатком витаминов группы B, такие как B9 (фолиевая кислота), также часто относятся к злокачественной анемии. Это название может относиться к другим состояниям, включая анемию, вызванную недостаточностью фолиевой кислоты и анемию Аддисона, даже при отсутствии внутреннего дефицита фактора.
Гемолитическая анемия
Этот тип анемии может быть вызван наследственными или приобретенными заболеваниями, которые заставляют организм вырабатывать деформированные эритроциты, которые слишком быстро отмирают.(Приобретенное заболевание — это болезнь, которой у вас не было при рождении.) Если она не является генетической, гемолитическая анемия может быть вызвана вредными веществами или реакциями на определенные лекарства.
Серповидно-клеточная анемия
Эта генетическая форма анемии возникает из-за неправильной формы красных кровяных телец. Они имеют форму серпа, что означает, что они могут закупоривать кровеносные сосуды и вызывать повреждения. Гемоглобин работает неправильно. Этот тип анемии чаще всего, но не всегда, встречается у афроамериканцев.
Анемия Даймонда-Блэкфана
Это редкое заболевание крови, которое может передаваться по наследству или приобретаться. При этом типе анемии костный мозг не вырабатывает достаточно красных кровяных телец. Анемия Даймонда-Блэкфана диагностируется в течение первого года жизни почти у 90% людей.
Апластическая анемия
Это тип анемии, вызванный повреждением костного мозга, который не может производить достаточное количество эритроцитов. Он также может быть врожденным или приобретенным.Другое название апластической анемии — аплазия костного мозга (недостаточность). Некоторые люди могут подумать об этом заболевании как о раке, но это не так.
Есть что-то, что некоторые называют миелодиспластической анемией. Однако миелодипластические синдромы (МДС) относятся к настоящему раку и являются результатом аномальных клеток в костном мозге.
Анемия Фанкони
Этот тип анемии также встречается редко и является генетическим. Это происходит потому, что костный мозг не вырабатывает достаточно красных кровяных телец.Есть физические признаки этого состояния, такие как аномальная структура костей и ненормальный цвет кожи. Около 50% людей с этим заболеванием диагностируются к тому времени, когда им исполняется 10 лет.
Средиземноморская анемия
Это состояние также известно как анемия Кули и фактически относится к большой бета-талассемии. Талассемия — это наследственное заболевание, при котором ваше тело не вырабатывает нужное количество гемоглобина. В дополнение к недостаточному производству этих клеток, красные кровяные тельца не живут так долго, как у человека без этого заболевания.
Вегетарианская или веганская анемия
Этот термин относится к идее о том, что вегетарианцам или веганам сложно получать достаточно железа, потому что они не едят мясо, птицу или морепродукты. Однако тщательное планирование питания делает это утверждение ложным. Есть много способов получить достаточное количество железа с помощью растительной диеты.
Ваш лечащий врач может также использовать термины для обозначения анемии, которые относятся к размеру красных кровяных телец. Эти слова включают такие термины, как макроцитарная анемия (больше нормальных клеток) или микроцитарная анемия (меньше нормальных клеток).
Диагностика и тесты
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия. Основной тест — это общий анализ крови, также называемый CBC. Общий анализ крови может сказать вам, сколько у вас эритроцитов, насколько они велики и какой формы. Анализы крови также могут сказать вам, если у вас низкий уровень витаминов B12 и B9 и сколько железа хранится в вашем организме.
Тип и количество анализов крови и других анализов будут зависеть от того, какой тип анемии у вас есть, по мнению вашего поставщика медицинских услуг.
- Анализы крови и мочи могут указать, есть ли у вас гемолитическая анемия.
- Для обнаружения желудочно-кишечного кровотечения могут быть предложены колоноскопия или анализ кала на скрытую кровь стула.
- В некоторых редких случаях ваш врач может заказать биопсию костного мозга (удаление ткани костного мозга).
Тип анемии и ее причина позволят вашему лечащему врачу выбрать правильный вид лечения.
Ведение и лечение
Как лечится анемия?
Сначала ваш лечащий врач выяснит, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.Тогда вы сможете лечить как анемию, так и ее причину. Железодефицитная анемия лечится с помощью:
- Добавки железа, принимаемые внутрь.
- Продукты с высоким содержанием железа и продукты, которые помогают вашему организму усваивать железо (например, продукты с витамином С).
- Железо вводится внутривенно (IV). (Это часто выбор, если у вас хроническая болезнь почек или ХБП.)
- Переливание эритроцитов.
Если ваша анемия вызвана внутренним кровотечением, вашему врачу может потребоваться операция, чтобы остановить его.Хирургическое лечение использовалось для лечения анемии у людей с параэзофагеальной грыжей пищеводного отверстия диафрагмы, с язвами или без них (так называемые язвы Камерона).
Другие виды анемии могут потребовать другого лечения. Например, генетические нарушения (такие как бета-талассемия и серповидноклеточная анемия) могут потребовать пересадки костного мозга.
Если ХБП вызывает анемию, в дополнение к добавкам железа (пероральным или внутривенным путем) лечение может также включать инъекции эритропоэтина (ЭПО).ЭПО — это гормон, который заставляет костный мозг вырабатывать красные кровяные тельца.
Анемия в некоторых случаях также связана с раком — как с точки зрения симптома анемии, так и с точки зрения лечения рака. И лучевая, и химиотерапия могут вызвать анемию. Возможно, потребуется приостановить дальнейшее лечение рака до тех пор, пока анемия не исчезнет с помощью железа, переливания крови, приема необходимых витаминов группы В и / или приема лекарств, стимулирующих выработку ЭПО в организме.
Смертельна ли анемия?
Хотя большинство видов анемии поддается лечению, анемия все же может быть смертельной.По данным Центров по контролю и профилактике заболеваний, в США в 2017 г. было 1,7 смертей на 100 000 из-за анемии.
Профилактика
Как предотвратить анемию?
Некоторые виды анемии, например, наследственные, предотвратить невозможно. Однако вы можете предотвратить анемию, вызванную дефицитом железа, дефицитом витамина B12 и дефицитом витамина B9, правильно питаясь. Это включает в себя диету с достаточным количеством продуктов, содержащих железо и эти витамины, а также пищевые источники витамина С, которые помогают усвоению.Убедитесь, что вы пьете достаточно воды. Некоторые исследования показали, что это помогает поддерживать высокий уровень гемоглобина.
Как лечить анемию?
В то время как некоторые виды анемии являются краткосрочными и легкими, другие могут длиться в течение всей жизни. Есть несколько способов помочь справиться с анемией, в том числе:
- Соблюдение здорового питания.
- Пить достаточно воды, чтобы избежать обезвоживания.
- Регулярно занимается спортом. Однако, если вы были слабыми, вам следует начать тренировку осторожно.Посоветуйтесь со своим врачом о том, как безопасно заниматься спортом.
- Избегать воздействия химических веществ, вызывающих анемию.
- Часто мыть руки, чтобы избежать заражения.
- Заботьтесь о зубах и регулярно посещайте стоматолога.
- Обсудить с врачом любые изменения симптомов.
- Отслеживайте свои симптомы, записывая их.
Какие продукты мне следует есть и каких продуктов следует избегать, если у меня анемия?
При анемии важно правильно выбирать пищу.Употребление нездоровой пищи означает, что вы получаете калории без питательных веществ. Вы также должны учитывать другие заболевания, которые у вас есть, когда вы выбираете пищу.
Было показано, что некоторые вещества ухудшают усвоение железа. Вы не должны одновременно принимать препараты кальция и железа. Кроме того, вы можете избежать или ограничить следующие элементы:
- Таниносодержащие продукты, такие как кофе, чай и некоторые специи.
- Молоко.
- Яичные белки.
- Волокно.(Однако вы не захотите исключать всю клетчатку, потому что прием добавок железа может вызвать запор.)
- Соевый белок.
Как правило, вы должны есть продукты, богатые железом, и продукты, содержащие витамины B12, B9 и C. Это означает, что вы можете наслаждаться большим количеством хорошей еды, независимо от того, едите вы мясо или нет. Вы можете получить железо из растительных источников, таких как чечевица, шпинат и фисташки. Вы можете получить железо из источников белка, таких как нежирная говядина и индейка. Цельнозерновые и темные листовые овощи являются хорошими источниками витамина B.Некоторые продукты даже обогащены железом.
Цитрусовые, ягоды и другие продукты, содержащие витамин С, такие как перец и помидоры, улучшают потребление железа. Рекомендуется получить совет от врача или, возможно, от диетолога о том, как лучше всего питаться при анемии. Также убедитесь, что грейпфрут не мешает принимать лекарства.
Важно знать, что вы можете делать, чтобы заботиться о себе наилучшим образом.Также важно, чтобы вы и ваш лечащий врач вместе принимали решения о том, что лучше всего подходит для вас. Воспользуйтесь возможностью, чтобы попросить направление к зарегистрированному диетологу, если вам нужна помощь в составлении диеты, которая поможет с потреблением железа. Убедитесь, что вы задаете все вопросы, которые у вас есть, чтобы быть уверенным в движении вперед.
Ресурсы
Есть ли ресурсы для людей с анемией?
В зависимости от того, какой тип анемии у вас есть или вы хотите узнать больше, вам могут быть полезны следующие ресурсы.
Симптомы, типы, причины, риски, лечение и ведение
Обзор
Что такое анемия?
Анемия возникает, когда у вас недостаточно эритроцитов. Клетки путешествуют с железом и гемоглобином, который является белком, который помогает переносить кислород через кровоток к вашим органам по всему телу. Когда у кого-то развивается анемия, его называют «анемичным». Анемия может означать, что вы чувствуете себя более уставшим или холодным, чем обычно, или ваша кожа кажется слишком бледной.Это связано с тем, что ваши органы не получают кислород, необходимый им для работы. Некоторые люди обнаруживают, что у них мало железа, когда они идут сдавать кровь.
Существуют ли разные виды анемии?
Существует несколько различных типов анемии, но каждый из них вызывает снижение количества эритроцитов в кровотоке. Уровень эритроцитов низкий по одной из следующих причин:
- Ваше тело не может вырабатывать достаточное количество гемоглобина (низкий гемоглобин).
- Ваше тело вырабатывает гемоглобин, но гемоглобин работает неправильно.
- Ваше тело не вырабатывает достаточно красных кровяных телец.
- Ваше тело слишком быстро расщепляет эритроциты.
Некоторые типы анемии, о которых вы, возможно, слышали, включают железодефицитную анемию и серповидно-клеточную анемию.
Насколько распространена анемия?
Анемия поражает более двух миллиардов человек во всем мире, что составляет более 30% всего населения. Это особенно распространено в странах с ограниченными ресурсами, но также затрагивает многих людей в промышленно развитом мире.В США анемия является наиболее распространенным заболеванием крови. Примерно три миллиона американцев страдают этим расстройством.
У кого, скорее всего, разовьется анемия?
Любой может заболеть анемией, хотя следующие группы имеют более высокий риск:
- Женщины: Кровопотеря во время месячных и при родах может привести к анемии. Это особенно верно, если у вас тяжелые месячные или такое состояние, как миома.
- Дети в возрасте от 1 до 2 лет: Организму требуется больше железа во время всплесков роста.
- Младенцы: Младенцы могут получать меньше железа при переходе от грудного молока или смеси к твердой пище. Железо из твердой пищи не так легко усваивается организмом.
- Люди старше 65 лет: Люди старше 65 с большей вероятностью будут придерживаться диеты с низким содержанием железа и некоторых хронических заболеваний.
- Люди, принимающие препараты для разжижения крови: Эти лекарства включают в себя такие препараты, как аспирин, клопидогрель (Плавикс®), варфарин (Кумадин®), препараты гепарина, апиксабан (Эликвис®), бетриксабан (BevyxXa®), дабигатран (Прадакса®), эдоксабан ( Савайса®) и ривароксабан (Ксарелто®).
Каковы признаки и симптомы анемии?
При всех типах анемии проявляется несколько признаков и симптомов, например усталость, одышка и чувство холода. Другие включают:
- Головокружение или слабость.
- Головная боль.
- Болезненный язык.
- Бледная кожа, сухая кожа или кожа, на которой легко появляются синяки.
- Непреднамеренное движение в голени (синдром беспокойных ног).
- Учащенное сердцебиение.
Как анемия влияет на организм?
Анемия может иметь и другие последствия для вашего тела, помимо чувства усталости или холода.Другие признаки того, что вам может не хватать железа, включают ломкие ногти или ногти в форме ложки и возможное выпадение волос. Вы можете обнаружить, что ваше чувство вкуса изменилось, или вы можете почувствовать звон в ушах.
Различные типы анемии могут привести к другим серьезным проблемам. У людей с серповидноклеточной анемией часто возникают сердечные и легочные осложнения.
Если у вас анемия, которую не лечить, это может привести к аритмии (нерегулярному сердцебиению), увеличению сердца или сердечной недостаточности.Вы также подвергаетесь большему риску заражения и депрессии.
Возможно, вы слышали, что дефицит железа связан с жеванием льда, что действительно случается. Жевание льда является признаком пика, состояния, которое включает в себя употребление в пищу того, что на самом деле не является едой, например, мела или грязи. Так что пика также является признаком дефицита железа. Часто наблюдается у детей с анемией.
Как еще анемия поражает детей?
Детям важно, чтобы в их рационе было достаточно железа и других питательных веществ, чтобы предотвратить анемию и связанные с ней проблемы с недостатком внимания, задержкой развития моторики и проблемами с обучением.У детей старшего возраста нужно уделять больше внимания признакам анемии во время скачков роста и менструальных циклов.
Как анемия влияет на пожилых людей?
У пожилых людей анемия может в еще большей степени вызывать спутанность сознания или депрессию. Слабость может затруднить ходьбу. Анемия может сократить продолжительность вашей жизни, если вы старше и не лечитесь.
Может ли анемия повлиять на мой вес?
Наличие достаточного количества железа также может быть фактором проблем с весом. Исследования показали, что люди с избыточным весом могут похудеть, если решат проблему низкого содержания железа в крови.У вас может возникнуть непреднамеренная потеря веса наряду с анемией, если у вас есть другие заболевания, например рак. Люди, перенесшие операцию по снижению веса, могут заболеть анемией из-за дефицита витаминов и минералов.
Как анемия влияет на беременность?
Дефицит железа во время беременности увеличивает вероятность осложнений, таких как преждевременные роды. Исследования показали, что дети, рожденные женщинами с низким уровнем железа, после рождения имеют более высокий риск низкой массы тела при рождении и проблем с их собственным уровнем железа.
Если вы беременны, у вас более высока вероятность развития железодефицитной анемии. Ваш будущий ребенок получает от вас железо и другие питательные вещества. Многие беременные женщины принимают таблетки железа, чтобы предотвратить анемию. Чтобы убедиться, что у вас достаточно железа для вас и вашего ребенка, ешьте хорошо сбалансированную пищу, в которую входят продукты, богатые железом, и продукты, содержащие витамины B12 и B9. Следуйте инструкциям врача по приему витаминов и добавлению железа в свой рацион.
Выяснить, что у вас анемия, — это только начало.Выявление причины анемии приведет вас к лучшему лечению.
Симптомы и причины
Что вызывает анемию?
Самая частая причина анемии — низкий уровень железа в организме. Этот тип анемии называется железодефицитной анемией . Вашему организму необходимо определенное количество железа для производства гемоглобина — вещества, которое перемещает кислород по вашему телу. Однако железодефицитная анемия — это всего лишь один тип. Другие типы вызваны:
- Диеты, в которых не хватает витамина B12, или вы не можете использовать или усваивать витамин B12 (например, при злокачественной анемии).
- Диеты, в которых не хватает фолиевой кислоты, также называемой фолиевой кислотой, или ваш организм не может правильно использовать фолиевую кислоту (например, фолиевая анемия).
- Унаследованные заболевания крови (например, серповидноклеточная анемия или талассемия).
- Состояния, при которых эритроциты разрушаются слишком быстро (например, гемолитическая анемия).
- Хронические состояния, при которых вашему организму не хватает гормонов для образования красных кровяных телец. К ним относятся гипертиреоз, гипотиреоз, запущенная болезнь почек, волчанка и другие хронические заболевания.
- Кровопотеря, связанная с другими состояниями, такими как язвы, геморрой или гастрит.
Что вызывает железодефицитную анемию?
Вы можете заразиться железодефицитной анемией от:
- Кровотечение, вызванное быстрой потерей большого количества крови (например, при серьезной аварии) или потерей небольшого количества крови в течение длительного периода времени. При кровопотере организм теряет больше железа, чем может восполнить с пищей. Это может случиться с женщинами с обильными менструациями или с воспалительными заболеваниями кишечника.
- Недостаточное количество железа в рационе.
- Вам нужно больше железа, чем раньше (например, во время беременности или болезни).
Некоторые типы железодефицитной анемии называются другими названиями, связанными с причиной, например, анемия хронического заболевания (также называемая анемией воспаления) или анемией с острой кровопотерей.
Какие типы анемии не являются железодефицитной анемией?
Злокачественная анемия
Строго говоря, злокачественная анемия возникает, когда человеку не хватает того, что называется внутренним фактором, который позволяет ему усваивать витамин B12.Без витамина B12 организм не может вырабатывать здоровые эритроциты. Другие типы анемии, связанные с недостатком витаминов группы B, такие как B9 (фолиевая кислота), также часто относятся к злокачественной анемии. Это название может относиться к другим состояниям, включая анемию, вызванную недостаточностью фолиевой кислоты и анемию Аддисона, даже при отсутствии внутреннего дефицита фактора.
Гемолитическая анемия
Этот тип анемии может быть вызван наследственными или приобретенными заболеваниями, которые заставляют организм вырабатывать деформированные эритроциты, которые слишком быстро отмирают.(Приобретенное заболевание — это болезнь, которой у вас не было при рождении.) Если она не является генетической, гемолитическая анемия может быть вызвана вредными веществами или реакциями на определенные лекарства.
Серповидно-клеточная анемия
Эта генетическая форма анемии возникает из-за неправильной формы красных кровяных телец. Они имеют форму серпа, что означает, что они могут закупоривать кровеносные сосуды и вызывать повреждения. Гемоглобин работает неправильно. Этот тип анемии чаще всего, но не всегда, встречается у афроамериканцев.
Анемия Даймонда-Блэкфана
Это редкое заболевание крови, которое может передаваться по наследству или приобретаться. При этом типе анемии костный мозг не вырабатывает достаточно красных кровяных телец. Анемия Даймонда-Блэкфана диагностируется в течение первого года жизни почти у 90% людей.
Апластическая анемия
Это тип анемии, вызванный повреждением костного мозга, который не может производить достаточное количество эритроцитов. Он также может быть врожденным или приобретенным.Другое название апластической анемии — аплазия костного мозга (недостаточность). Некоторые люди могут подумать об этом заболевании как о раке, но это не так.
Есть что-то, что некоторые называют миелодиспластической анемией. Однако миелодипластические синдромы (МДС) относятся к настоящему раку и являются результатом аномальных клеток в костном мозге.
Анемия Фанкони
Этот тип анемии также встречается редко и является генетическим. Это происходит потому, что костный мозг не вырабатывает достаточно красных кровяных телец.Есть физические признаки этого состояния, такие как аномальная структура костей и ненормальный цвет кожи. Около 50% людей с этим заболеванием диагностируются к тому времени, когда им исполняется 10 лет.
Средиземноморская анемия
Это состояние также известно как анемия Кули и фактически относится к большой бета-талассемии. Талассемия — это наследственное заболевание, при котором ваше тело не вырабатывает нужное количество гемоглобина. В дополнение к недостаточному производству этих клеток, красные кровяные тельца не живут так долго, как у человека без этого заболевания.
Вегетарианская или веганская анемия
Этот термин относится к идее о том, что вегетарианцам или веганам сложно получать достаточно железа, потому что они не едят мясо, птицу или морепродукты. Однако тщательное планирование питания делает это утверждение ложным. Есть много способов получить достаточное количество железа с помощью растительной диеты.
Ваш лечащий врач может также использовать термины для обозначения анемии, которые относятся к размеру красных кровяных телец. Эти слова включают такие термины, как макроцитарная анемия (больше нормальных клеток) или микроцитарная анемия (меньше нормальных клеток).
Диагностика и тесты
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия. Основной тест — это общий анализ крови, также называемый CBC. Общий анализ крови может сказать вам, сколько у вас эритроцитов, насколько они велики и какой формы. Анализы крови также могут сказать вам, если у вас низкий уровень витаминов B12 и B9 и сколько железа хранится в вашем организме.
Тип и количество анализов крови и других анализов будут зависеть от того, какой тип анемии у вас есть, по мнению вашего поставщика медицинских услуг.
- Анализы крови и мочи могут указать, есть ли у вас гемолитическая анемия.
- Для обнаружения желудочно-кишечного кровотечения могут быть предложены колоноскопия или анализ кала на скрытую кровь стула.
- В некоторых редких случаях ваш врач может заказать биопсию костного мозга (удаление ткани костного мозга).
Тип анемии и ее причина позволят вашему лечащему врачу выбрать правильный вид лечения.
Ведение и лечение
Как лечится анемия?
Сначала ваш лечащий врач выяснит, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.Тогда вы сможете лечить как анемию, так и ее причину. Железодефицитная анемия лечится с помощью:
- Добавки железа, принимаемые внутрь.
- Продукты с высоким содержанием железа и продукты, которые помогают вашему организму усваивать железо (например, продукты с витамином С).
- Железо вводится внутривенно (IV). (Это часто выбор, если у вас хроническая болезнь почек или ХБП.)
- Переливание эритроцитов.
Если ваша анемия вызвана внутренним кровотечением, вашему врачу может потребоваться операция, чтобы остановить его.Хирургическое лечение использовалось для лечения анемии у людей с параэзофагеальной грыжей пищеводного отверстия диафрагмы, с язвами или без них (так называемые язвы Камерона).
Другие виды анемии могут потребовать другого лечения. Например, генетические нарушения (такие как бета-талассемия и серповидноклеточная анемия) могут потребовать пересадки костного мозга.
Если ХБП вызывает анемию, в дополнение к добавкам железа (пероральным или внутривенным путем) лечение может также включать инъекции эритропоэтина (ЭПО).ЭПО — это гормон, который заставляет костный мозг вырабатывать красные кровяные тельца.
Анемия в некоторых случаях также связана с раком — как с точки зрения симптома анемии, так и с точки зрения лечения рака. И лучевая, и химиотерапия могут вызвать анемию. Возможно, потребуется приостановить дальнейшее лечение рака до тех пор, пока анемия не исчезнет с помощью железа, переливания крови, приема необходимых витаминов группы В и / или приема лекарств, стимулирующих выработку ЭПО в организме.
Смертельна ли анемия?
Хотя большинство видов анемии поддается лечению, анемия все же может быть смертельной.По данным Центров по контролю и профилактике заболеваний, в США в 2017 г. было 1,7 смертей на 100 000 из-за анемии.
Профилактика
Как предотвратить анемию?
Некоторые виды анемии, например, наследственные, предотвратить невозможно. Однако вы можете предотвратить анемию, вызванную дефицитом железа, дефицитом витамина B12 и дефицитом витамина B9, правильно питаясь. Это включает в себя диету с достаточным количеством продуктов, содержащих железо и эти витамины, а также пищевые источники витамина С, которые помогают усвоению.Убедитесь, что вы пьете достаточно воды. Некоторые исследования показали, что это помогает поддерживать высокий уровень гемоглобина.
Как лечить анемию?
В то время как некоторые виды анемии являются краткосрочными и легкими, другие могут длиться в течение всей жизни. Есть несколько способов помочь справиться с анемией, в том числе:
- Соблюдение здорового питания.
- Пить достаточно воды, чтобы избежать обезвоживания.
- Регулярно занимается спортом. Однако, если вы были слабыми, вам следует начать тренировку осторожно.Посоветуйтесь со своим врачом о том, как безопасно заниматься спортом.
- Избегать воздействия химических веществ, вызывающих анемию.
- Часто мыть руки, чтобы избежать заражения.
- Заботьтесь о зубах и регулярно посещайте стоматолога.
- Обсудить с врачом любые изменения симптомов.
- Отслеживайте свои симптомы, записывая их.
Какие продукты мне следует есть и каких продуктов следует избегать, если у меня анемия?
При анемии важно правильно выбирать пищу.Употребление нездоровой пищи означает, что вы получаете калории без питательных веществ. Вы также должны учитывать другие заболевания, которые у вас есть, когда вы выбираете пищу.
Было показано, что некоторые вещества ухудшают усвоение железа. Вы не должны одновременно принимать препараты кальция и железа. Кроме того, вы можете избежать или ограничить следующие элементы:
- Таниносодержащие продукты, такие как кофе, чай и некоторые специи.
- Молоко.
- Яичные белки.
- Волокно.(Однако вы не захотите исключать всю клетчатку, потому что прием добавок железа может вызвать запор.)
- Соевый белок.
Как правило, вы должны есть продукты, богатые железом, и продукты, содержащие витамины B12, B9 и C. Это означает, что вы можете наслаждаться большим количеством хорошей еды, независимо от того, едите вы мясо или нет. Вы можете получить железо из растительных источников, таких как чечевица, шпинат и фисташки. Вы можете получить железо из источников белка, таких как нежирная говядина и индейка. Цельнозерновые и темные листовые овощи являются хорошими источниками витамина B.Некоторые продукты даже обогащены железом.
Цитрусовые, ягоды и другие продукты, содержащие витамин С, такие как перец и помидоры, улучшают потребление железа. Рекомендуется получить совет от врача или, возможно, от диетолога о том, как лучше всего питаться при анемии. Также убедитесь, что грейпфрут не мешает принимать лекарства.
Важно знать, что вы можете делать, чтобы заботиться о себе наилучшим образом.Также важно, чтобы вы и ваш лечащий врач вместе принимали решения о том, что лучше всего подходит для вас. Воспользуйтесь возможностью, чтобы попросить направление к зарегистрированному диетологу, если вам нужна помощь в составлении диеты, которая поможет с потреблением железа. Убедитесь, что вы задаете все вопросы, которые у вас есть, чтобы быть уверенным в движении вперед.
Ресурсы
Есть ли ресурсы для людей с анемией?
В зависимости от того, какой тип анемии у вас есть или вы хотите узнать больше, вам могут быть полезны следующие ресурсы.
Симптомы, типы, причины, риски, лечение и ведение
Обзор
Что такое анемия?
Анемия возникает, когда у вас недостаточно эритроцитов. Клетки путешествуют с железом и гемоглобином, который является белком, который помогает переносить кислород через кровоток к вашим органам по всему телу. Когда у кого-то развивается анемия, его называют «анемичным». Анемия может означать, что вы чувствуете себя более уставшим или холодным, чем обычно, или ваша кожа кажется слишком бледной.Это связано с тем, что ваши органы не получают кислород, необходимый им для работы. Некоторые люди обнаруживают, что у них мало железа, когда они идут сдавать кровь.
Существуют ли разные виды анемии?
Существует несколько различных типов анемии, но каждый из них вызывает снижение количества эритроцитов в кровотоке. Уровень эритроцитов низкий по одной из следующих причин:
- Ваше тело не может вырабатывать достаточное количество гемоглобина (низкий гемоглобин).
- Ваше тело вырабатывает гемоглобин, но гемоглобин работает неправильно.
- Ваше тело не вырабатывает достаточно красных кровяных телец.
- Ваше тело слишком быстро расщепляет эритроциты.
Некоторые типы анемии, о которых вы, возможно, слышали, включают железодефицитную анемию и серповидно-клеточную анемию.
Насколько распространена анемия?
Анемия поражает более двух миллиардов человек во всем мире, что составляет более 30% всего населения. Это особенно распространено в странах с ограниченными ресурсами, но также затрагивает многих людей в промышленно развитом мире.В США анемия является наиболее распространенным заболеванием крови. Примерно три миллиона американцев страдают этим расстройством.
У кого, скорее всего, разовьется анемия?
Любой может заболеть анемией, хотя следующие группы имеют более высокий риск:
- Женщины: Кровопотеря во время месячных и при родах может привести к анемии. Это особенно верно, если у вас тяжелые месячные или такое состояние, как миома.
- Дети в возрасте от 1 до 2 лет: Организму требуется больше железа во время всплесков роста.
- Младенцы: Младенцы могут получать меньше железа при переходе от грудного молока или смеси к твердой пище. Железо из твердой пищи не так легко усваивается организмом.
- Люди старше 65 лет: Люди старше 65 с большей вероятностью будут придерживаться диеты с низким содержанием железа и некоторых хронических заболеваний.
- Люди, принимающие препараты для разжижения крови: Эти лекарства включают в себя такие препараты, как аспирин, клопидогрель (Плавикс®), варфарин (Кумадин®), препараты гепарина, апиксабан (Эликвис®), бетриксабан (BevyxXa®), дабигатран (Прадакса®), эдоксабан ( Савайса®) и ривароксабан (Ксарелто®).
Каковы признаки и симптомы анемии?
При всех типах анемии проявляется несколько признаков и симптомов, например усталость, одышка и чувство холода. Другие включают:
- Головокружение или слабость.
- Головная боль.
- Болезненный язык.
- Бледная кожа, сухая кожа или кожа, на которой легко появляются синяки.
- Непреднамеренное движение в голени (синдром беспокойных ног).
- Учащенное сердцебиение.
Как анемия влияет на организм?
Анемия может иметь и другие последствия для вашего тела, помимо чувства усталости или холода.Другие признаки того, что вам может не хватать железа, включают ломкие ногти или ногти в форме ложки и возможное выпадение волос. Вы можете обнаружить, что ваше чувство вкуса изменилось, или вы можете почувствовать звон в ушах.
Различные типы анемии могут привести к другим серьезным проблемам. У людей с серповидноклеточной анемией часто возникают сердечные и легочные осложнения.
Если у вас анемия, которую не лечить, это может привести к аритмии (нерегулярному сердцебиению), увеличению сердца или сердечной недостаточности.Вы также подвергаетесь большему риску заражения и депрессии.
Возможно, вы слышали, что дефицит железа связан с жеванием льда, что действительно случается. Жевание льда является признаком пика, состояния, которое включает в себя употребление в пищу того, что на самом деле не является едой, например, мела или грязи. Так что пика также является признаком дефицита железа. Часто наблюдается у детей с анемией.
Как еще анемия поражает детей?
Детям важно, чтобы в их рационе было достаточно железа и других питательных веществ, чтобы предотвратить анемию и связанные с ней проблемы с недостатком внимания, задержкой развития моторики и проблемами с обучением.У детей старшего возраста нужно уделять больше внимания признакам анемии во время скачков роста и менструальных циклов.
Как анемия влияет на пожилых людей?
У пожилых людей анемия может в еще большей степени вызывать спутанность сознания или депрессию. Слабость может затруднить ходьбу. Анемия может сократить продолжительность вашей жизни, если вы старше и не лечитесь.
Может ли анемия повлиять на мой вес?
Наличие достаточного количества железа также может быть фактором проблем с весом. Исследования показали, что люди с избыточным весом могут похудеть, если решат проблему низкого содержания железа в крови.У вас может возникнуть непреднамеренная потеря веса наряду с анемией, если у вас есть другие заболевания, например рак. Люди, перенесшие операцию по снижению веса, могут заболеть анемией из-за дефицита витаминов и минералов.
Как анемия влияет на беременность?
Дефицит железа во время беременности увеличивает вероятность осложнений, таких как преждевременные роды. Исследования показали, что дети, рожденные женщинами с низким уровнем железа, после рождения имеют более высокий риск низкой массы тела при рождении и проблем с их собственным уровнем железа.
Если вы беременны, у вас более высока вероятность развития железодефицитной анемии. Ваш будущий ребенок получает от вас железо и другие питательные вещества. Многие беременные женщины принимают таблетки железа, чтобы предотвратить анемию. Чтобы убедиться, что у вас достаточно железа для вас и вашего ребенка, ешьте хорошо сбалансированную пищу, в которую входят продукты, богатые железом, и продукты, содержащие витамины B12 и B9. Следуйте инструкциям врача по приему витаминов и добавлению железа в свой рацион.
Выяснить, что у вас анемия, — это только начало.Выявление причины анемии приведет вас к лучшему лечению.
Симптомы и причины
Что вызывает анемию?
Самая частая причина анемии — низкий уровень железа в организме. Этот тип анемии называется железодефицитной анемией . Вашему организму необходимо определенное количество железа для производства гемоглобина — вещества, которое перемещает кислород по вашему телу. Однако железодефицитная анемия — это всего лишь один тип. Другие типы вызваны:
- Диеты, в которых не хватает витамина B12, или вы не можете использовать или усваивать витамин B12 (например, при злокачественной анемии).
- Диеты, в которых не хватает фолиевой кислоты, также называемой фолиевой кислотой, или ваш организм не может правильно использовать фолиевую кислоту (например, фолиевая анемия).
- Унаследованные заболевания крови (например, серповидноклеточная анемия или талассемия).
- Состояния, при которых эритроциты разрушаются слишком быстро (например, гемолитическая анемия).
- Хронические состояния, при которых вашему организму не хватает гормонов для образования красных кровяных телец. К ним относятся гипертиреоз, гипотиреоз, запущенная болезнь почек, волчанка и другие хронические заболевания.
- Кровопотеря, связанная с другими состояниями, такими как язвы, геморрой или гастрит.
Что вызывает железодефицитную анемию?
Вы можете заразиться железодефицитной анемией от:
- Кровотечение, вызванное быстрой потерей большого количества крови (например, при серьезной аварии) или потерей небольшого количества крови в течение длительного периода времени. При кровопотере организм теряет больше железа, чем может восполнить с пищей. Это может случиться с женщинами с обильными менструациями или с воспалительными заболеваниями кишечника.
- Недостаточное количество железа в рационе.
- Вам нужно больше железа, чем раньше (например, во время беременности или болезни).
Некоторые типы железодефицитной анемии называются другими названиями, связанными с причиной, например, анемия хронического заболевания (также называемая анемией воспаления) или анемией с острой кровопотерей.
Какие типы анемии не являются железодефицитной анемией?
Злокачественная анемия
Строго говоря, злокачественная анемия возникает, когда человеку не хватает того, что называется внутренним фактором, который позволяет ему усваивать витамин B12.Без витамина B12 организм не может вырабатывать здоровые эритроциты. Другие типы анемии, связанные с недостатком витаминов группы B, такие как B9 (фолиевая кислота), также часто относятся к злокачественной анемии. Это название может относиться к другим состояниям, включая анемию, вызванную недостаточностью фолиевой кислоты и анемию Аддисона, даже при отсутствии внутреннего дефицита фактора.
Гемолитическая анемия
Этот тип анемии может быть вызван наследственными или приобретенными заболеваниями, которые заставляют организм вырабатывать деформированные эритроциты, которые слишком быстро отмирают.(Приобретенное заболевание — это болезнь, которой у вас не было при рождении.) Если она не является генетической, гемолитическая анемия может быть вызвана вредными веществами или реакциями на определенные лекарства.
Серповидно-клеточная анемия
Эта генетическая форма анемии возникает из-за неправильной формы красных кровяных телец. Они имеют форму серпа, что означает, что они могут закупоривать кровеносные сосуды и вызывать повреждения. Гемоглобин работает неправильно. Этот тип анемии чаще всего, но не всегда, встречается у афроамериканцев.
Анемия Даймонда-Блэкфана
Это редкое заболевание крови, которое может передаваться по наследству или приобретаться. При этом типе анемии костный мозг не вырабатывает достаточно красных кровяных телец. Анемия Даймонда-Блэкфана диагностируется в течение первого года жизни почти у 90% людей.
Апластическая анемия
Это тип анемии, вызванный повреждением костного мозга, который не может производить достаточное количество эритроцитов. Он также может быть врожденным или приобретенным.Другое название апластической анемии — аплазия костного мозга (недостаточность). Некоторые люди могут подумать об этом заболевании как о раке, но это не так.
Есть что-то, что некоторые называют миелодиспластической анемией. Однако миелодипластические синдромы (МДС) относятся к настоящему раку и являются результатом аномальных клеток в костном мозге.
Анемия Фанкони
Этот тип анемии также встречается редко и является генетическим. Это происходит потому, что костный мозг не вырабатывает достаточно красных кровяных телец.Есть физические признаки этого состояния, такие как аномальная структура костей и ненормальный цвет кожи. Около 50% людей с этим заболеванием диагностируются к тому времени, когда им исполняется 10 лет.
Средиземноморская анемия
Это состояние также известно как анемия Кули и фактически относится к большой бета-талассемии. Талассемия — это наследственное заболевание, при котором ваше тело не вырабатывает нужное количество гемоглобина. В дополнение к недостаточному производству этих клеток, красные кровяные тельца не живут так долго, как у человека без этого заболевания.
Вегетарианская или веганская анемия
Этот термин относится к идее о том, что вегетарианцам или веганам сложно получать достаточно железа, потому что они не едят мясо, птицу или морепродукты. Однако тщательное планирование питания делает это утверждение ложным. Есть много способов получить достаточное количество железа с помощью растительной диеты.
Ваш лечащий врач может также использовать термины для обозначения анемии, которые относятся к размеру красных кровяных телец. Эти слова включают такие термины, как макроцитарная анемия (больше нормальных клеток) или микроцитарная анемия (меньше нормальных клеток).
Диагностика и тесты
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия. Основной тест — это общий анализ крови, также называемый CBC. Общий анализ крови может сказать вам, сколько у вас эритроцитов, насколько они велики и какой формы. Анализы крови также могут сказать вам, если у вас низкий уровень витаминов B12 и B9 и сколько железа хранится в вашем организме.
Тип и количество анализов крови и других анализов будут зависеть от того, какой тип анемии у вас есть, по мнению вашего поставщика медицинских услуг.
- Анализы крови и мочи могут указать, есть ли у вас гемолитическая анемия.
- Для обнаружения желудочно-кишечного кровотечения могут быть предложены колоноскопия или анализ кала на скрытую кровь стула.
- В некоторых редких случаях ваш врач может заказать биопсию костного мозга (удаление ткани костного мозга).
Тип анемии и ее причина позволят вашему лечащему врачу выбрать правильный вид лечения.
Ведение и лечение
Как лечится анемия?
Сначала ваш лечащий врач выяснит, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.Тогда вы сможете лечить как анемию, так и ее причину. Железодефицитная анемия лечится с помощью:
- Добавки железа, принимаемые внутрь.
- Продукты с высоким содержанием железа и продукты, которые помогают вашему организму усваивать железо (например, продукты с витамином С).
- Железо вводится внутривенно (IV). (Это часто выбор, если у вас хроническая болезнь почек или ХБП.)
- Переливание эритроцитов.
Если ваша анемия вызвана внутренним кровотечением, вашему врачу может потребоваться операция, чтобы остановить его.Хирургическое лечение использовалось для лечения анемии у людей с параэзофагеальной грыжей пищеводного отверстия диафрагмы, с язвами или без них (так называемые язвы Камерона).
Другие виды анемии могут потребовать другого лечения. Например, генетические нарушения (такие как бета-талассемия и серповидноклеточная анемия) могут потребовать пересадки костного мозга.
Если ХБП вызывает анемию, в дополнение к добавкам железа (пероральным или внутривенным путем) лечение может также включать инъекции эритропоэтина (ЭПО).ЭПО — это гормон, который заставляет костный мозг вырабатывать красные кровяные тельца.
Анемия в некоторых случаях также связана с раком — как с точки зрения симптома анемии, так и с точки зрения лечения рака. И лучевая, и химиотерапия могут вызвать анемию. Возможно, потребуется приостановить дальнейшее лечение рака до тех пор, пока анемия не исчезнет с помощью железа, переливания крови, приема необходимых витаминов группы В и / или приема лекарств, стимулирующих выработку ЭПО в организме.
Смертельна ли анемия?
Хотя большинство видов анемии поддается лечению, анемия все же может быть смертельной.По данным Центров по контролю и профилактике заболеваний, в США в 2017 г. было 1,7 смертей на 100 000 из-за анемии.
Профилактика
Как предотвратить анемию?
Некоторые виды анемии, например, наследственные, предотвратить невозможно. Однако вы можете предотвратить анемию, вызванную дефицитом железа, дефицитом витамина B12 и дефицитом витамина B9, правильно питаясь. Это включает в себя диету с достаточным количеством продуктов, содержащих железо и эти витамины, а также пищевые источники витамина С, которые помогают усвоению.Убедитесь, что вы пьете достаточно воды. Некоторые исследования показали, что это помогает поддерживать высокий уровень гемоглобина.
Как лечить анемию?
В то время как некоторые виды анемии являются краткосрочными и легкими, другие могут длиться в течение всей жизни. Есть несколько способов помочь справиться с анемией, в том числе:
- Соблюдение здорового питания.
- Пить достаточно воды, чтобы избежать обезвоживания.
- Регулярно занимается спортом. Однако, если вы были слабыми, вам следует начать тренировку осторожно.Посоветуйтесь со своим врачом о том, как безопасно заниматься спортом.
- Избегать воздействия химических веществ, вызывающих анемию.
- Часто мыть руки, чтобы избежать заражения.
- Заботьтесь о зубах и регулярно посещайте стоматолога.
- Обсудить с врачом любые изменения симптомов.
- Отслеживайте свои симптомы, записывая их.
Какие продукты мне следует есть и каких продуктов следует избегать, если у меня анемия?
При анемии важно правильно выбирать пищу.Употребление нездоровой пищи означает, что вы получаете калории без питательных веществ. Вы также должны учитывать другие заболевания, которые у вас есть, когда вы выбираете пищу.
Было показано, что некоторые вещества ухудшают усвоение железа. Вы не должны одновременно принимать препараты кальция и железа. Кроме того, вы можете избежать или ограничить следующие элементы:
- Таниносодержащие продукты, такие как кофе, чай и некоторые специи.
- Молоко.
- Яичные белки.
- Волокно.(Однако вы не захотите исключать всю клетчатку, потому что прием добавок железа может вызвать запор.)
- Соевый белок.
Как правило, вы должны есть продукты, богатые железом, и продукты, содержащие витамины B12, B9 и C. Это означает, что вы можете наслаждаться большим количеством хорошей еды, независимо от того, едите вы мясо или нет. Вы можете получить железо из растительных источников, таких как чечевица, шпинат и фисташки. Вы можете получить железо из источников белка, таких как нежирная говядина и индейка. Цельнозерновые и темные листовые овощи являются хорошими источниками витамина B.Некоторые продукты даже обогащены железом.
Цитрусовые, ягоды и другие продукты, содержащие витамин С, такие как перец и помидоры, улучшают потребление железа. Рекомендуется получить совет от врача или, возможно, от диетолога о том, как лучше всего питаться при анемии. Также убедитесь, что грейпфрут не мешает принимать лекарства.
Важно знать, что вы можете делать, чтобы заботиться о себе наилучшим образом.Также важно, чтобы вы и ваш лечащий врач вместе принимали решения о том, что лучше всего подходит для вас. Воспользуйтесь возможностью, чтобы попросить направление к зарегистрированному диетологу, если вам нужна помощь в составлении диеты, которая поможет с потреблением железа. Убедитесь, что вы задаете все вопросы, которые у вас есть, чтобы быть уверенным в движении вперед.
Ресурсы
Есть ли ресурсы для людей с анемией?
В зависимости от того, какой тип анемии у вас есть или вы хотите узнать больше, вам могут быть полезны следующие ресурсы.
Симптомы, типы, причины, риски, лечение и ведение
Обзор
Что такое анемия?
Анемия возникает, когда у вас недостаточно эритроцитов. Клетки путешествуют с железом и гемоглобином, который является белком, который помогает переносить кислород через кровоток к вашим органам по всему телу. Когда у кого-то развивается анемия, его называют «анемичным». Анемия может означать, что вы чувствуете себя более уставшим или холодным, чем обычно, или ваша кожа кажется слишком бледной.Это связано с тем, что ваши органы не получают кислород, необходимый им для работы. Некоторые люди обнаруживают, что у них мало железа, когда они идут сдавать кровь.
Существуют ли разные виды анемии?
Существует несколько различных типов анемии, но каждый из них вызывает снижение количества эритроцитов в кровотоке. Уровень эритроцитов низкий по одной из следующих причин:
- Ваше тело не может вырабатывать достаточное количество гемоглобина (низкий гемоглобин).
- Ваше тело вырабатывает гемоглобин, но гемоглобин работает неправильно.
- Ваше тело не вырабатывает достаточно красных кровяных телец.
- Ваше тело слишком быстро расщепляет эритроциты.
Некоторые типы анемии, о которых вы, возможно, слышали, включают железодефицитную анемию и серповидно-клеточную анемию.
Насколько распространена анемия?
Анемия поражает более двух миллиардов человек во всем мире, что составляет более 30% всего населения. Это особенно распространено в странах с ограниченными ресурсами, но также затрагивает многих людей в промышленно развитом мире.В США анемия является наиболее распространенным заболеванием крови. Примерно три миллиона американцев страдают этим расстройством.
У кого, скорее всего, разовьется анемия?
Любой может заболеть анемией, хотя следующие группы имеют более высокий риск:
- Женщины: Кровопотеря во время месячных и при родах может привести к анемии. Это особенно верно, если у вас тяжелые месячные или такое состояние, как миома.
- Дети в возрасте от 1 до 2 лет: Организму требуется больше железа во время всплесков роста.
- Младенцы: Младенцы могут получать меньше железа при переходе от грудного молока или смеси к твердой пище. Железо из твердой пищи не так легко усваивается организмом.
- Люди старше 65 лет: Люди старше 65 с большей вероятностью будут придерживаться диеты с низким содержанием железа и некоторых хронических заболеваний.
- Люди, принимающие препараты для разжижения крови: Эти лекарства включают в себя такие препараты, как аспирин, клопидогрель (Плавикс®), варфарин (Кумадин®), препараты гепарина, апиксабан (Эликвис®), бетриксабан (BevyxXa®), дабигатран (Прадакса®), эдоксабан ( Савайса®) и ривароксабан (Ксарелто®).
Каковы признаки и симптомы анемии?
При всех типах анемии проявляется несколько признаков и симптомов, например усталость, одышка и чувство холода. Другие включают:
- Головокружение или слабость.
- Головная боль.
- Болезненный язык.
- Бледная кожа, сухая кожа или кожа, на которой легко появляются синяки.
- Непреднамеренное движение в голени (синдром беспокойных ног).
- Учащенное сердцебиение.
Как анемия влияет на организм?
Анемия может иметь и другие последствия для вашего тела, помимо чувства усталости или холода.Другие признаки того, что вам может не хватать железа, включают ломкие ногти или ногти в форме ложки и возможное выпадение волос. Вы можете обнаружить, что ваше чувство вкуса изменилось, или вы можете почувствовать звон в ушах.
Различные типы анемии могут привести к другим серьезным проблемам. У людей с серповидноклеточной анемией часто возникают сердечные и легочные осложнения.
Если у вас анемия, которую не лечить, это может привести к аритмии (нерегулярному сердцебиению), увеличению сердца или сердечной недостаточности.Вы также подвергаетесь большему риску заражения и депрессии.
Возможно, вы слышали, что дефицит железа связан с жеванием льда, что действительно случается. Жевание льда является признаком пика, состояния, которое включает в себя употребление в пищу того, что на самом деле не является едой, например, мела или грязи. Так что пика также является признаком дефицита железа. Часто наблюдается у детей с анемией.
Как еще анемия поражает детей?
Детям важно, чтобы в их рационе было достаточно железа и других питательных веществ, чтобы предотвратить анемию и связанные с ней проблемы с недостатком внимания, задержкой развития моторики и проблемами с обучением.У детей старшего возраста нужно уделять больше внимания признакам анемии во время скачков роста и менструальных циклов.
Как анемия влияет на пожилых людей?
У пожилых людей анемия может в еще большей степени вызывать спутанность сознания или депрессию. Слабость может затруднить ходьбу. Анемия может сократить продолжительность вашей жизни, если вы старше и не лечитесь.
Может ли анемия повлиять на мой вес?
Наличие достаточного количества железа также может быть фактором проблем с весом. Исследования показали, что люди с избыточным весом могут похудеть, если решат проблему низкого содержания железа в крови.У вас может возникнуть непреднамеренная потеря веса наряду с анемией, если у вас есть другие заболевания, например рак. Люди, перенесшие операцию по снижению веса, могут заболеть анемией из-за дефицита витаминов и минералов.
Как анемия влияет на беременность?
Дефицит железа во время беременности увеличивает вероятность осложнений, таких как преждевременные роды. Исследования показали, что дети, рожденные женщинами с низким уровнем железа, после рождения имеют более высокий риск низкой массы тела при рождении и проблем с их собственным уровнем железа.
Если вы беременны, у вас более высока вероятность развития железодефицитной анемии. Ваш будущий ребенок получает от вас железо и другие питательные вещества. Многие беременные женщины принимают таблетки железа, чтобы предотвратить анемию. Чтобы убедиться, что у вас достаточно железа для вас и вашего ребенка, ешьте хорошо сбалансированную пищу, в которую входят продукты, богатые железом, и продукты, содержащие витамины B12 и B9. Следуйте инструкциям врача по приему витаминов и добавлению железа в свой рацион.
Выяснить, что у вас анемия, — это только начало.Выявление причины анемии приведет вас к лучшему лечению.
Симптомы и причины
Что вызывает анемию?
Самая частая причина анемии — низкий уровень железа в организме. Этот тип анемии называется железодефицитной анемией . Вашему организму необходимо определенное количество железа для производства гемоглобина — вещества, которое перемещает кислород по вашему телу. Однако железодефицитная анемия — это всего лишь один тип. Другие типы вызваны:
- Диеты, в которых не хватает витамина B12, или вы не можете использовать или усваивать витамин B12 (например, при злокачественной анемии).
- Диеты, в которых не хватает фолиевой кислоты, также называемой фолиевой кислотой, или ваш организм не может правильно использовать фолиевую кислоту (например, фолиевая анемия).
- Унаследованные заболевания крови (например, серповидноклеточная анемия или талассемия).
- Состояния, при которых эритроциты разрушаются слишком быстро (например, гемолитическая анемия).
- Хронические состояния, при которых вашему организму не хватает гормонов для образования красных кровяных телец. К ним относятся гипертиреоз, гипотиреоз, запущенная болезнь почек, волчанка и другие хронические заболевания.
- Кровопотеря, связанная с другими состояниями, такими как язвы, геморрой или гастрит.
Что вызывает железодефицитную анемию?
Вы можете заразиться железодефицитной анемией от:
- Кровотечение, вызванное быстрой потерей большого количества крови (например, при серьезной аварии) или потерей небольшого количества крови в течение длительного периода времени. При кровопотере организм теряет больше железа, чем может восполнить с пищей. Это может случиться с женщинами с обильными менструациями или с воспалительными заболеваниями кишечника.
- Недостаточное количество железа в рационе.
- Вам нужно больше железа, чем раньше (например, во время беременности или болезни).
Некоторые типы железодефицитной анемии называются другими названиями, связанными с причиной, например, анемия хронического заболевания (также называемая анемией воспаления) или анемией с острой кровопотерей.
Какие типы анемии не являются железодефицитной анемией?
Злокачественная анемия
Строго говоря, злокачественная анемия возникает, когда человеку не хватает того, что называется внутренним фактором, который позволяет ему усваивать витамин B12.Без витамина B12 организм не может вырабатывать здоровые эритроциты. Другие типы анемии, связанные с недостатком витаминов группы B, такие как B9 (фолиевая кислота), также часто относятся к злокачественной анемии. Это название может относиться к другим состояниям, включая анемию, вызванную недостаточностью фолиевой кислоты и анемию Аддисона, даже при отсутствии внутреннего дефицита фактора.
Гемолитическая анемия
Этот тип анемии может быть вызван наследственными или приобретенными заболеваниями, которые заставляют организм вырабатывать деформированные эритроциты, которые слишком быстро отмирают.(Приобретенное заболевание — это болезнь, которой у вас не было при рождении.) Если она не является генетической, гемолитическая анемия может быть вызвана вредными веществами или реакциями на определенные лекарства.
Серповидно-клеточная анемия
Эта генетическая форма анемии возникает из-за неправильной формы красных кровяных телец. Они имеют форму серпа, что означает, что они могут закупоривать кровеносные сосуды и вызывать повреждения. Гемоглобин работает неправильно. Этот тип анемии чаще всего, но не всегда, встречается у афроамериканцев.
Анемия Даймонда-Блэкфана
Это редкое заболевание крови, которое может передаваться по наследству или приобретаться. При этом типе анемии костный мозг не вырабатывает достаточно красных кровяных телец. Анемия Даймонда-Блэкфана диагностируется в течение первого года жизни почти у 90% людей.
Апластическая анемия
Это тип анемии, вызванный повреждением костного мозга, который не может производить достаточное количество эритроцитов. Он также может быть врожденным или приобретенным.Другое название апластической анемии — аплазия костного мозга (недостаточность). Некоторые люди могут подумать об этом заболевании как о раке, но это не так.
Есть что-то, что некоторые называют миелодиспластической анемией. Однако миелодипластические синдромы (МДС) относятся к настоящему раку и являются результатом аномальных клеток в костном мозге.
Анемия Фанкони
Этот тип анемии также встречается редко и является генетическим. Это происходит потому, что костный мозг не вырабатывает достаточно красных кровяных телец.Есть физические признаки этого состояния, такие как аномальная структура костей и ненормальный цвет кожи. Около 50% людей с этим заболеванием диагностируются к тому времени, когда им исполняется 10 лет.
Средиземноморская анемия
Это состояние также известно как анемия Кули и фактически относится к большой бета-талассемии. Талассемия — это наследственное заболевание, при котором ваше тело не вырабатывает нужное количество гемоглобина. В дополнение к недостаточному производству этих клеток, красные кровяные тельца не живут так долго, как у человека без этого заболевания.
Вегетарианская или веганская анемия
Этот термин относится к идее о том, что вегетарианцам или веганам сложно получать достаточно железа, потому что они не едят мясо, птицу или морепродукты. Однако тщательное планирование питания делает это утверждение ложным. Есть много способов получить достаточное количество железа с помощью растительной диеты.
Ваш лечащий врач может также использовать термины для обозначения анемии, которые относятся к размеру красных кровяных телец. Эти слова включают такие термины, как макроцитарная анемия (больше нормальных клеток) или микроцитарная анемия (меньше нормальных клеток).
Диагностика и тесты
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия. Основной тест — это общий анализ крови, также называемый CBC. Общий анализ крови может сказать вам, сколько у вас эритроцитов, насколько они велики и какой формы. Анализы крови также могут сказать вам, если у вас низкий уровень витаминов B12 и B9 и сколько железа хранится в вашем организме.
Тип и количество анализов крови и других анализов будут зависеть от того, какой тип анемии у вас есть, по мнению вашего поставщика медицинских услуг.
- Анализы крови и мочи могут указать, есть ли у вас гемолитическая анемия.
- Для обнаружения желудочно-кишечного кровотечения могут быть предложены колоноскопия или анализ кала на скрытую кровь стула.
- В некоторых редких случаях ваш врач может заказать биопсию костного мозга (удаление ткани костного мозга).
Тип анемии и ее причина позволят вашему лечащему врачу выбрать правильный вид лечения.
Ведение и лечение
Как лечится анемия?
Сначала ваш лечащий врач выяснит, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.Тогда вы сможете лечить как анемию, так и ее причину. Железодефицитная анемия лечится с помощью:
- Добавки железа, принимаемые внутрь.
- Продукты с высоким содержанием железа и продукты, которые помогают вашему организму усваивать железо (например, продукты с витамином С).
- Железо вводится внутривенно (IV). (Это часто выбор, если у вас хроническая болезнь почек или ХБП.)
- Переливание эритроцитов.
Если ваша анемия вызвана внутренним кровотечением, вашему врачу может потребоваться операция, чтобы остановить его.Хирургическое лечение использовалось для лечения анемии у людей с параэзофагеальной грыжей пищеводного отверстия диафрагмы, с язвами или без них (так называемые язвы Камерона).
Другие виды анемии могут потребовать другого лечения. Например, генетические нарушения (такие как бета-талассемия и серповидноклеточная анемия) могут потребовать пересадки костного мозга.
Если ХБП вызывает анемию, в дополнение к добавкам железа (пероральным или внутривенным путем) лечение может также включать инъекции эритропоэтина (ЭПО).ЭПО — это гормон, который заставляет костный мозг вырабатывать красные кровяные тельца.
Анемия в некоторых случаях также связана с раком — как с точки зрения симптома анемии, так и с точки зрения лечения рака. И лучевая, и химиотерапия могут вызвать анемию. Возможно, потребуется приостановить дальнейшее лечение рака до тех пор, пока анемия не исчезнет с помощью железа, переливания крови, приема необходимых витаминов группы В и / или приема лекарств, стимулирующих выработку ЭПО в организме.
Смертельна ли анемия?
Хотя большинство видов анемии поддается лечению, анемия все же может быть смертельной.По данным Центров по контролю и профилактике заболеваний, в США в 2017 г. было 1,7 смертей на 100 000 из-за анемии.
Профилактика
Как предотвратить анемию?
Некоторые виды анемии, например, наследственные, предотвратить невозможно. Однако вы можете предотвратить анемию, вызванную дефицитом железа, дефицитом витамина B12 и дефицитом витамина B9, правильно питаясь. Это включает в себя диету с достаточным количеством продуктов, содержащих железо и эти витамины, а также пищевые источники витамина С, которые помогают усвоению.Убедитесь, что вы пьете достаточно воды. Некоторые исследования показали, что это помогает поддерживать высокий уровень гемоглобина.
Как лечить анемию?
В то время как некоторые виды анемии являются краткосрочными и легкими, другие могут длиться в течение всей жизни. Есть несколько способов помочь справиться с анемией, в том числе:
- Соблюдение здорового питания.
- Пить достаточно воды, чтобы избежать обезвоживания.
- Регулярно занимается спортом. Однако, если вы были слабыми, вам следует начать тренировку осторожно.Посоветуйтесь со своим врачом о том, как безопасно заниматься спортом.
- Избегать воздействия химических веществ, вызывающих анемию.
- Часто мыть руки, чтобы избежать заражения.
- Заботьтесь о зубах и регулярно посещайте стоматолога.
- Обсудить с врачом любые изменения симптомов.
- Отслеживайте свои симптомы, записывая их.
Какие продукты мне следует есть и каких продуктов следует избегать, если у меня анемия?
При анемии важно правильно выбирать пищу.Употребление нездоровой пищи означает, что вы получаете калории без питательных веществ. Вы также должны учитывать другие заболевания, которые у вас есть, когда вы выбираете пищу.
Было показано, что некоторые вещества ухудшают усвоение железа. Вы не должны одновременно принимать препараты кальция и железа. Кроме того, вы можете избежать или ограничить следующие элементы:
- Таниносодержащие продукты, такие как кофе, чай и некоторые специи.
- Молоко.
- Яичные белки.
- Волокно.(Однако вы не захотите исключать всю клетчатку, потому что прием добавок железа может вызвать запор.)
- Соевый белок.
Как правило, вы должны есть продукты, богатые железом, и продукты, содержащие витамины B12, B9 и C. Это означает, что вы можете наслаждаться большим количеством хорошей еды, независимо от того, едите вы мясо или нет. Вы можете получить железо из растительных источников, таких как чечевица, шпинат и фисташки. Вы можете получить железо из источников белка, таких как нежирная говядина и индейка. Цельнозерновые и темные листовые овощи являются хорошими источниками витамина B.Некоторые продукты даже обогащены железом.
Цитрусовые, ягоды и другие продукты, содержащие витамин С, такие как перец и помидоры, улучшают потребление железа. Рекомендуется получить совет от врача или, возможно, от диетолога о том, как лучше всего питаться при анемии. Также убедитесь, что грейпфрут не мешает принимать лекарства.
Важно знать, что вы можете делать, чтобы заботиться о себе наилучшим образом.Также важно, чтобы вы и ваш лечащий врач вместе принимали решения о том, что лучше всего подходит для вас. Воспользуйтесь возможностью, чтобы попросить направление к зарегистрированному диетологу, если вам нужна помощь в составлении диеты, которая поможет с потреблением железа.


