Пациент с раком предстательной железы Ристо Лайтинен выбрал лучевую терапию вместо операции
Инженер автоматизации, в недавнем прошлом активный спортсмен Ристо Лайтинен решил поделиться своей историей в поддержку мужчин с раком предстательной железы.
Перед тем, как у Ристо выявили рак предстательной железы, он систематически сдавал анализ на уровень ПСА в рамках медицинского обслуживания от работодателя. В течение года уровень ПСА Ристо продолжал медленно расти. ”В какой-то момент у меня появились проблемы с предстательной железой, но они были незначительными. В 2008 году анализ на уровень ПСА я пропустил, и вот, в марте 2009 мой показатель ПСА взлетел. Меня направили на дополнительные исследования. Сначала взяли биопсию, после чего со мной связался уролог и озвучил заключение патологов – у меня обнаружили рак простаты. Новый прием врача мне назначили только через 3 недели”.
”Я как чувствовал, что у меня что-то есть. Когда я услышал диагноз меня накрыла волна сомнений.
”Мой уролог сообщил, что в моем случае необходимо проведение робот-ассистированной операции. Я попробовал уточнить другие возможные формы лечения, но уролог утверждал, что единственным решением является операция. Врач заверил меня, что сексуальная функция после операции останется прежней. Это была очень короткая консультация врача. С этого момента я решил изучить вопрос досконально и выяснил, что существуют другие варианты лечения. Я записался на прием к другому урологу для получения второго мнения. Его рекомендация оказалось той же – операция. Тогда я связался с руководителем Сообщества по раку простаты PROPO Ханну Тавио. Он задал вопрос, рассматриваю ли я лечение лучевой терапией? Но мне ее никто не предлагал.
МРТ – лучшее обследование для определения местного распространения рака предстательной железы
”На приеме Тимо Йоенсуу мы изучили всю динамику моего уровня ПСА, что очень важно при диагностировании и наблюдении рака простаты. Поведение ПСА уникально, но оно рассказывает далеко не обо всем. Тимо подозревал, что скорость повышения показателя ПСА говорит о раке простаты высокого риска – более высоком, чем показали результаты биопсии. На результат биопсии мог повлиять процесс установки игл при ее проведении. Тимо предупредил меня, возможно речь идет о раке с типом Т-3, показателем 8-10 по шкале Глисона и возможно рак выходит за пределы капсулы предстательной железы”, – объясняет Ристо.
”В 2009 году в Дократес мне провели МРТ предстательной железы с эндоректальной катушкой. Как сейчас я помню, тогда я пришел в совершенно новый медицинский центр в Руохолахти.
После прохождения диагностики в Дократес Ристо еще много раз беседовал с Тимо Йоенсуу о лечении, и принял решение пройти лечение в Дократес.
”В конце мая у меня начался курс гормональной терапии, а в конце июня курс наружной лучевой терапии. Тогда в Дократес еще не проводили высокодозную внутритканевую HDR-брахитерапию, которая является новым эффективным методом лечения, подходящим к раку предстательной железы с определенными критериями. Гормональное лечение продолжалось еще 6 месяцев. В конце лечения специалисты Дократес наблюдают за моими показателями ПСА”, – рассказывает Лайтинен.
”Тимо заверил меня, что сделает все, что в его силах. Я поверил своему врачу и не сомневался в его профессионализме. Я приезжал в Дократес каждый день. Мне давали возможность выбрать удобное для меня время процедуры. Самое начало лучевой терапии осталось в моей памяти. У меня начал падать ПСА, и тогда Тимо сказал, что это хороший показатель – быстрое снижение ПСА прогнозирует хороший ответ на лечение. В целях предотвращения возможного распространения рака, мне облучили область лимфоузлов”, – вспоминает Ристо.
Последующее наблюдение играет огромную роль
 У пациентов после оперативного лечения ПСА должен приближаться к нулевой отметке.
У пациентов после оперативного лечения ПСА должен приближаться к нулевой отметке.Из побочного воздействия лечения и поведения ПСА Ристо Лайтинен помнит следующее: ”Примерно год спустя после лучевой и гормональной терапии у меня потихоньку начал расти показатель ПСА. Позже, в 2012 году, пару раз ПСА заметно повышался. По моему убеждению, это было вызвано приемом антибиотиков и приемом вирусных препаратов. При прохождении гормональной терапии, у меня проявилось повышенное потоотделение и мне приходилось чаще посещать туалет. Это продолжалось несколько месяцев. Потихоньку ситуация стабилизировалась. Единственное, я немного поправился и у меня осталось пару лишних килограмм”.
Счастливый мужчина
”Когда я определился и принял решение пройти лучевую терапию вместо операции, я впервые почувствовал облегчение. Весной 2009 года мне сообщили, что я попадаю в очередь на новую роботизированную операцию, но временной промежуток совпал с сезоном отпусков. Вероятно поэтому и по ряду других причин конкретное время мне не предлагали.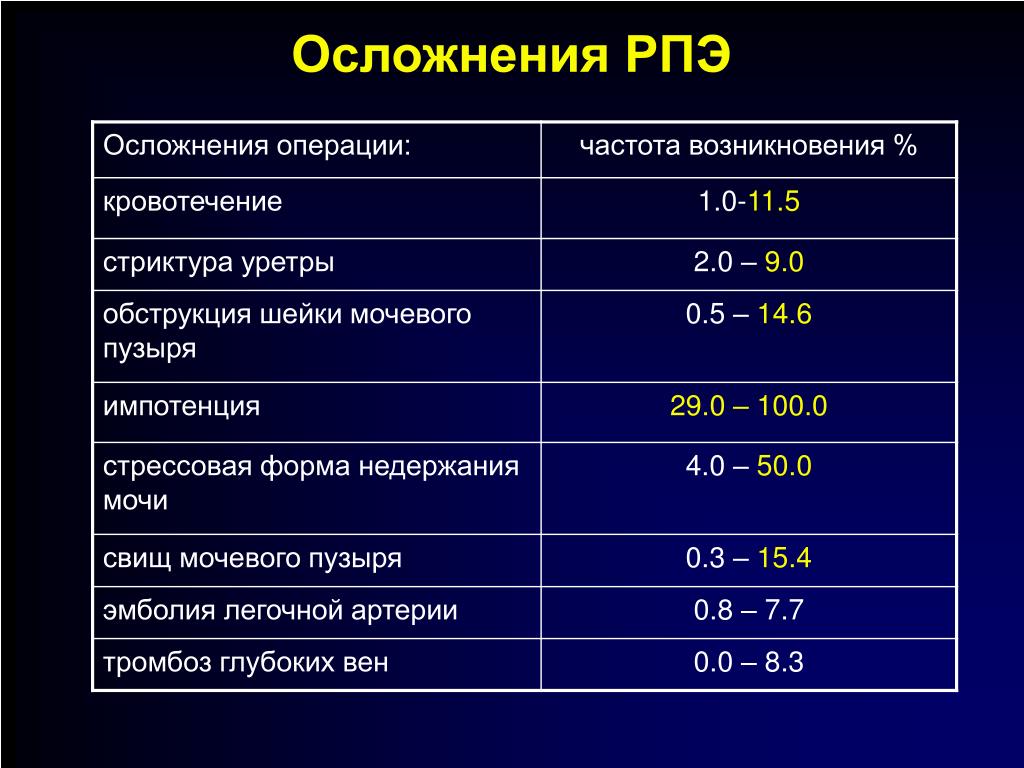 Возникла какая-то неопределенность. Плюс еще врачи придерживались разных мнений по поводу предстоящего лечения”, – вспоминает Ристо.
Возникла какая-то неопределенность. Плюс еще врачи придерживались разных мнений по поводу предстоящего лечения”, – вспоминает Ристо.
”Я очень надеюсь, что моя история вселит в людей, столкнувшимся с онкологией, надежду и веру в то, что рак можно пережить. И еще раз я хочу поблагодарить всех, кто принимал участие в моем лечении”. Ристо Лайтинен.
В Дократес Ристо попал на лечение сразу. ”Гайдлайн и лечение в Дократес были гибкими. Я остался очень довольным полученным лечением”, – подытоживает Ристо.
В молодости Ристо увлекался активными видами спорта. По его мнению, спорт заряжает энергией. В 1964 году Ристо принимал участие в молодежных соревнованиях по прыжкам с шестом.
В 2009 году, столкнувшись с нехваткой достоверной информации и поддержки онкологических пациентов, Ристо решил присоединиться к деятельности Общества по борьбе с раком предстательной железы PROPO. ”В силу своего характера я хочу быть осведомленным и получать факты. В группе PROPO помимо поддержки мы стремимся получать больше информации, к примеру, о всех возможных видах лечения рака предстательной железы.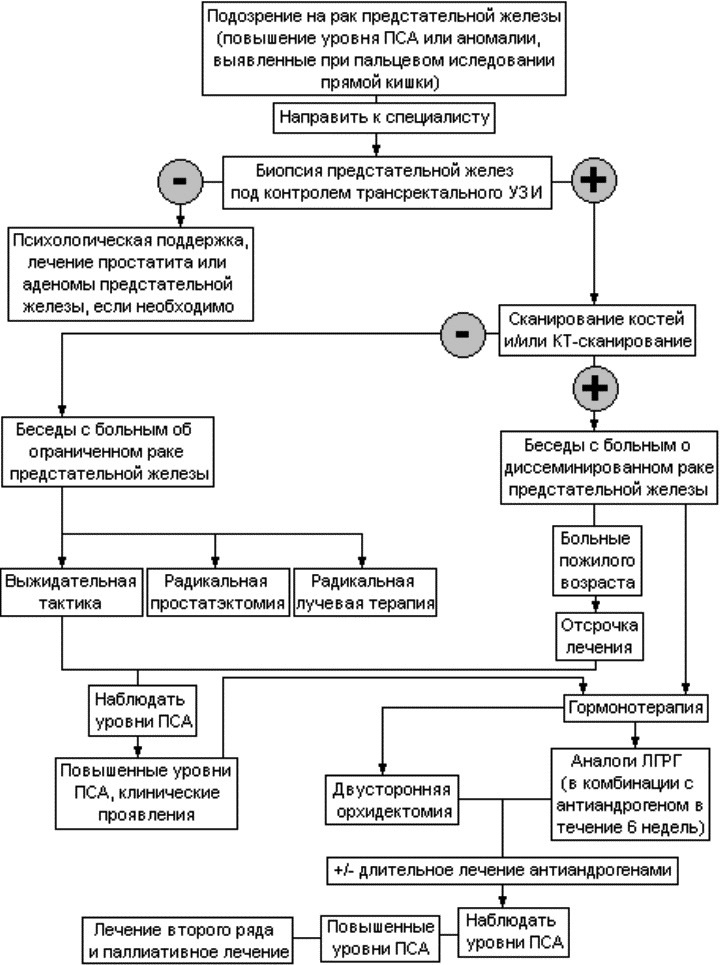 В свое время я сам не получил нужной помощи, поэтому мне нравится помогать другим людям”, – говорит Ристо.
В свое время я сам не получил нужной помощи, поэтому мне нравится помогать другим людям”, – говорит Ристо.
Сейчас Ристо является активным участником Общества PROPO. ”Все участники Общества очень довольны его деятельностью. Здесь мужчины получают полезную информацию и необходимую поддержку. Принимая участия во встречах группы поддержки Общества, пациент чувствует, что он не один на один со своей болезнью”, – заключает Ристо.
Рак предстательной железы
Рак предстательной железы – это злокачественная опухоль из клеток предстательной железы. Предстательная железа (простата) представляет собой небольшую железу в форме грецкого ореха, расположенную ниже мочевого пузыря. Она вырабатывает семенную жидкость, которая питает сперматозоиды и позволяет им перемещаться.
Рак предстательной железы является одним из самых распространенных видов рака у мужчин. Рак простаты, как правило, развивается медленно, оставаясь в пределах железы и не вызывая никаких симптомов.
Синонимы русские
- Рак простаты
- Aденокарцинома предстательной железы
Синонимы английские
- Prostate сancer
- Prostate adenocarcinoma
Симптомы
На ранних стадиях рак предстательной железы может протекать бессимптомно. Развиваясь, рак может вызывать следующие симптомы:
Развиваясь, рак может вызывать следующие симптомы:
- проблемы с мочеиспусканием;
- ослабление и прерывистость испускаемой струи мочи;
- кровь в моче;
- кровь в сперме;
- дискомфорт в области малого таза;
- боль в костях – данный симптом связан с распространением рака в кости.
Некоторые симптомы рака предстательной железы сходны с симптомами аденомы простаты.
Общая информация о заболевании
Рак предстательной железы (простаты) – это образование злокачественной опухоли в области предстательной железы.
Простата представляет собой небольшую железу в форме грецкого ореха, расположенную ниже мочевого пузыря. Она вырабатывает семенную жидкость, питающую сперматозоиды и обеспечивающую их перемещение.
Рак предстательной железы развивается, когда здоровые клетки железы превращаются в раковые. Здоровые клетки, появляясь в определенном количестве, в положенный срок отмирают, уступая место новым. Раковые клетки, в отличие от здоровых, начинают бесконтрольно расти, не отмирая в нужное время. Скопление этих клеток и образует раковую опухоль.
Раковые клетки, в отличие от здоровых, начинают бесконтрольно расти, не отмирая в нужное время. Скопление этих клеток и образует раковую опухоль.
Причины рака простаты на данный момент не установлены. Чаще всего он развивается у мужчин пожилого возраста, у мужчин, страдающих ожирением, у людей с наследственной предрасположенностью к раку предстательной железы.
Основные типы рака предстательной железы:
- Мелкоклеточный рак простаты. Данный тип рака особо агрессивен, он быстро развивается и вызывает широкое метастазирование.
- Плоскоклеточный рак. Этот тип рака также очень агрессивен.
Стадии развития рака предстательной железы:
1) Раковые клетки находятся в пределах предстательной железы, поражая ее небольшие области.
2) Раковая опухоль находится в пределах предстательной железы, полностью поражая все ее области.
3) Рак распространяется за пределы предстательной железы, поражая близлежащие ткани.
4) Рак распространяется за пределы предстательной железы, поражая лимфатические узлы, кости, легкие и другие органы.
Рак простаты может вызывать осложнения:
- Образование метастазов. Рак предстательной железы может распространяться на другие органы и ткани организма, вызывая нарушение функций пораженных органов. Чаще всего рак предстательной железы метастазирует в кости.
- Недержание мочи. Рак предстательной железы и его лечение могут вызывать недержание мочи.
- Эректильную дисфункцию (расстройство половой функции мужчины, предполагающее невозможность совершения полового акта). Эректильная дисфункция может являться результатом рака предстательной железы или его лечения – хирургической операции, лучевой или гормональной терапии.
Кто в группе риска?
- Лица пожилого возраста. Риск развития рака простаты увеличивается с возрастом.
 Он наиболее распространен среди мужчин после 65 лет.
Он наиболее распространен среди мужчин после 65 лет. - Лица с наследственной предрасположенностью к раку предстательной железы. У мужчин, родственники которых перенесли рак простаты, риск развития этого заболевания увеличивается.
- Лица, страдающие ожирением.
Диагностика
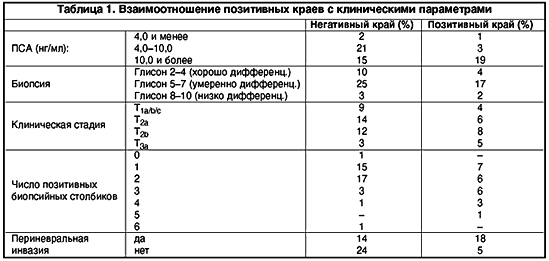
Диагноз «рак предстательной железы» предполагается на основании ректального пальцевого обследования или определения концентрации простатспецифического антигена (ПСА) в крови. Подтверждается диагноз данными биопсии.
После 50 лет всем мужчинам рекомендуется плановое определение концентрации ПСА в крови, повышенный уровень которого указывает на возможность наличия рака предстательной железы.
Лабораторные исследования:
При раке предстательной железы уровень ПСА может быть повышен. Чем он выше, тем более является показательным в отношении рака. Тем не менее следует учитывать, что при раке простаты уровень ПСА повышается не у всех больных. Примерно у половины пациентов с аденомой предстательной железы уровень ПСА может быть умеренно повышен.
Примерно у половины пациентов с аденомой предстательной железы уровень ПСА может быть умеренно повышен.
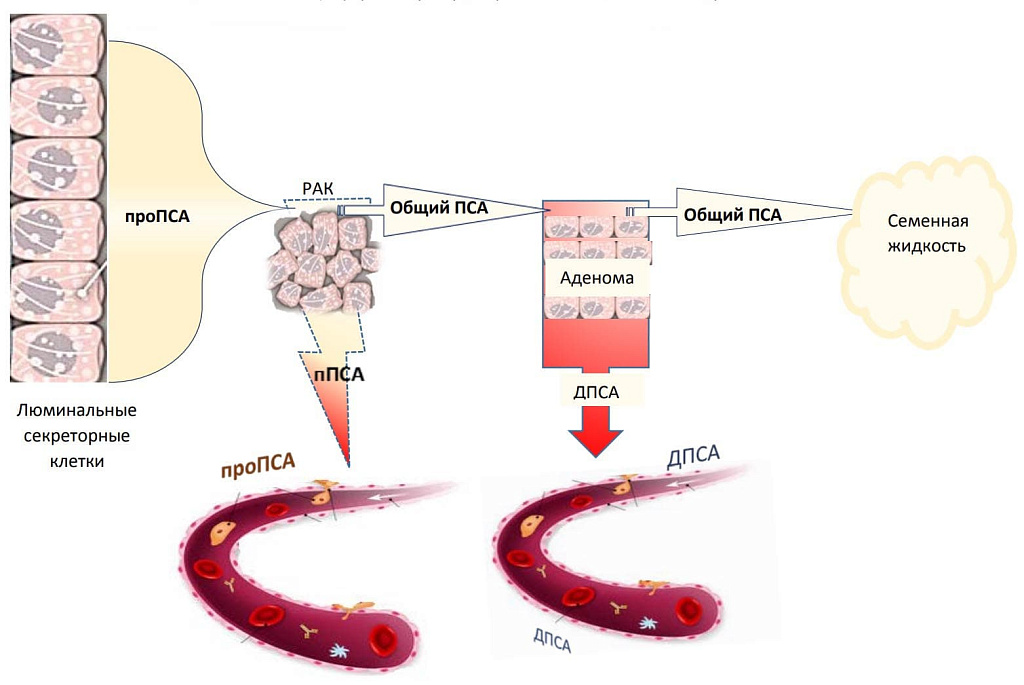
В сыворотке крови ПСА существует в виде нескольких форм, одна из которых – свободный простатспецифический антиген (ПСА свободный). Необходимость сдачи двух анализов в комплексе связана со значительным повышением достоверности результатов такого «двойного» анализа по сравнению с определением только общего ПСА. Расчет соотношения свободного ПСА к общему значительно повышает чувствительность исследования и позволяет отличить рак простаты от других заболеваний.
Другие методы обследования:
- Пальцевое ректальное обследование. Во время проведения обследования врач изучает предстательную железу посредством введения пальца в прямую кишку. Позволяет выявить наличие раковой опухоли, определить ее размер, глубину распространения.
- Трансректальное ультразвуковое исследование. В ходе исследования в прямую кишку вводится небольшой зонд. Позволяет выявить наличие рака предстательной железы, определить участок для проведения биопсии – забора клеток или тканей простаты для последующего изучения под микроскопом.

- Биопсия. Предполагает забор клеток или тканей предстательной железы для последующего изучения. Именно биопсия помогает определить тип рака простаты и окончательно подтвердить диагноз.
После выявления рака предстательной железы уточняется его стадия, локализация, выявляется расположение метастазов, для этого проводятся следующие исследования:
- Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Они позволяют определить размеры, глубину распространения раковой опухоли, выявить метастазы.
- Денситометрия (сканирование костей) выявляет метастазирование рака в кости.
Лечение
С учетом стадии и типа раковой опухоли, степени повышения простатспецифического антигена и особенностей состояния больного определяется стратегия лечения. Могут использоваться следующие методы лечения:
- Хирургия. Радикальная простатэктомия – хирургическая операция по удалению предстательной железы, окружающих тканей и близлежащих лимфатических узлов.
 Данный метод является самым эффективным при его использовании на ранней стадии заболевания у пациентов до 70 лет. Раковые клетки предстательной железы зависят от гормона тестостерона, который необходим для их роста.
Данный метод является самым эффективным при его использовании на ранней стадии заболевания у пациентов до 70 лет. Раковые клетки предстательной железы зависят от гормона тестостерона, который необходим для их роста.
Дополнительно могут быть удалены яички (орхиэктомия). Удаление яичек снижает уровень тестостерона в организме.
- Лучевая терапия. В этом случае используется излучение, направленное на уничтожение раковых клеток. Может быть наружной и внутренней.
Наружная лучевая терапия предполагает воздействие излучения снаружи, внутренняя (брахитерапия) предполагает помещение устройств, наполненных радиоактивным материалом, в область предстательной железы.
- Гормональная терапия. Направлена на уменьшение производства мужского гормона тестостерона. Может замедлить развитие рака предстательной железы. В некоторых случаях используется после операции или после лучевой терапии.
- Криодеструкция – разрушение раковых клеток предстательной железы путем замораживания.
 Данный метод лечения изучен недостаточно.
Данный метод лечения изучен недостаточно. - Химиотерапия. Применение препаратов, уничтожающих раковые клетки.
Различные методы лечения могут применяться одновременно.
Профилактика
Факторы, способствующие снижению риска развития рака предстательной железы:
- Здоровое питание. Рекомендуется употреблять фрукты, овощи и цельные злаки в большом количестве, избегать чрезмерного употребления жирной пищи.
- Физическая активность. Необходимо уделять физическим упражнениям не меньше 30 минут в день в течение каждого дня.
- Поддержание здорового веса. Необходимо поддерживать оптимальный вес, при наличии излишнего веса избавляться от него с помощью физических упражнений и здорового питания.
Рекомендуемые анализы
НМИЦ онкологии им. Н.Н. Блохина
Вот уже почти 70 лет Онкоцентр – это уникальный симбиоз науки и клинической практики, мультидисциплинарный подход к лечению онкологических больных, хирургическая школа, известная далеко за пределами России. Здесь изучаются и совершенствуются морфологические, иммунологические и генетические методы диагностики.
Здесь изучаются и совершенствуются морфологические, иммунологические и генетические методы диагностики.Специалисты Блохина – авторы клинических рекомендаций по онкологии.
Ежегодно в Онкоцентре противоопухолевое лечение проходят более 35 тысяч пациентов всех возрастов. Еще почти 6 000 граждан России получают помощь дистанционно – посредством телемедицинских консультаций.
Онкоцентр – это:
- Комбинированное лечение пациентов
- Собственное производство химио- и радиофармацевтических препаратов
- Собственные методы иммунотерапии опухолей
- Передовые технологии реабилитации онкопациентов
- «Центры компетенций» по различным нозологиям, в том числе первый в России центр компетенций по лечению пациентов с опухолями без выявленного первичного очага
- Собственное отделение переливания крови, доноры которого снабжают кровью и ее компонентами исключительно пациентов Онкоцентра
- Первый и единственный онкологический центр, имеющий в своем составе специализированное отделение реабилитации для онкопациентов
- Крупнейшая педагогическая школа в области онкологии в России
На протяжении многих лет Онкоцентр является членом Международного Противоракового Союза (UICC) при Всемирной организации здравоохранения (ВОЗ) и членом Ассоциации Европейских Онкологических Институтов (OECI) в Женеве.
В 2019 году НИИ детской онкологии и гематологии НМИЦ онкологии им. Н.Н. Блохина стал полноправным членом ведущей мировой организации, которая объединяет трансплантационные центры Европы и мира — Европейской группы по трансплантации крови и костного мозга (EBMT).
НМИЦ онкологии им. Н.Н. Блохина:
- Онкологическая помощь мирового уровня, доступная каждому
- Инновации в онкологии
- Уникальный опыт для коллег
День профилактики рака предстательной железы
День профилактики рака предстательной железы
Одним из наиболее распространенных онкологических заболеваний у мужчин является рак предстательной железы. Как правило, он обнаруживается у мужчин старше 50 лет, но начинает формироваться в возрасте около 40 лет. Развитие данного заболевания является результатом комплексного воздействия ряда факторов (возраст, генетические особенности, воспалительные и инфекционные заболевания предстательной железы, питание, курение и образ жизни).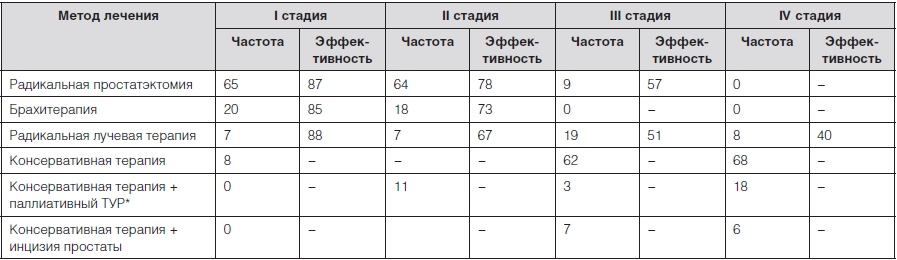
Заболевание может протекать многие годы бессимптомно. Даже самая маленькая опухоль простаты обладает способностью давать метастазы ( мигрировать в другие органы). Чаще ими оказываются кости таза, бедер и позвоночник.
Каковы клинические проявления (симптомы) рака предстательной железы?
В начальных стадиях — рак предстательной железы не проявляется и больные в основном не предъявляют жалоб. По мере увеличения размеров опухоли возможно проявление симптомов нарушения мочеиспускания (учащенное и затрудненное мочеиспускание, вялая струя мочи). Часто эти клинические проявления могут быть приняты за симптомы аденомы предстательной железы, так как у большинства пациентов в возрасте старше 60 лет имеется доброкачественная гиперплазия предстательной железы.
Когда и кому нужно проводить профилактическое обследование?
Чтобы у вас был шанс выявить рак предстательной железы на излечимой стадии, необходимо регулярно проходить профилактическое обследование, даже, если Вас ничего не беспокоит. Несмотря на улучшение методов диагностики и внедрение системы скрининга рака предстательной железы, каждый второй мужчина имеет запущенную форму рака простаты. Связано это с тем, что мужчины часто обращаются к врачу только в случае появления симптомов заболевания.
Несмотря на улучшение методов диагностики и внедрение системы скрининга рака предстательной железы, каждый второй мужчина имеет запущенную форму рака простаты. Связано это с тем, что мужчины часто обращаются к врачу только в случае появления симптомов заболевания.
Что включает в себя профилактическое обследование?
На ранних этапах выявить рак предстательной железы возможно только с помощью анализа крови на простатспецифический антиген (ПСА). Определение ПСА входит в программу скрининга взрослого мужского населения после 50 лет с обследованием 1 раз в три года.
Что такое ПСА?
ПСА (простатический специфический антиген) не является раковоспецифическим маркером. Уровень ПСА может быть повышен при доброкачественной гиперплазии предстательной железы, простатите и других доброкачественных заболеваниях. Однако ПСА может указывать на возможность наличия рака простаты — чем больше значение, тем выше вероятность существования рака предстательной железы.
Излечим ли рак простаты?
Лечение рака зависит от стадии заболевания, возраста, и общего состояния организма. На ранних стадиях возможно полное излечение от рака простаты. При распространении опухоли далеко за пределы простаты и наличии метастазов полное излечение невозможно.
Какое лечение может быть предложено Вам на ранних стадиях?
Это могут быть альтернативные методы лечения:
· хирургический (радикальная простатэктомия),
· лучевая терапия (дистанционная или брахитерапия),
· активное наблюдение.
У каждого метода есть свои преимущества и недостатки, показания и противопоказания. Поэтому метод лечения должен обсуждаться с врачом специалистом.
Какое лечение может быть предложено Вам на поздних стадиях заболевания?
Лечение рака простаты на далеко зашедших стадиях направлено, в первую очередь, на улучшение качества жизни пациентов за счет снижения выраженности болей в костях и улучшения мочеиспускания. Большинство видов терапии основано на снижение воздействия мужских половых гормонов (тестостерона) на клетки опухоли, что приводит к замедлению её роста. Вам может быть предложен приём препаратов, блокирующих выработку или действие мужских гормонов на предстательную железу.
Большинство видов терапии основано на снижение воздействия мужских половых гормонов (тестостерона) на клетки опухоли, что приводит к замедлению её роста. Вам может быть предложен приём препаратов, блокирующих выработку или действие мужских гормонов на предстательную железу.
Как Вы можете оценить эффективность лечения?
В первую очередь она проявится в уменьшении или исчезновении болей и улучшения мочеиспускания. Так же будет отмечаться снижение ПСА.
ВАЖНО ПРИДЕРЖИВАТЬСЯ ЗДОРОВОГО ОБРАЗА ЖИЗНИ
Меняем характер питания: едим меньше животных жиров. Включаем в свой ежедневный рацион крестоцветные овощи: брюссельская капуста, брокколи, цветная капуста.
Следует отказаться или хотя бы ограничить курение и употребления алкоголя, а также — повысить уровень физической активности, выделив немного времени в ежедневном графике для физических упражнений.
МУЖЧИНЫ! СЛЕДИТЕ ЗА СВОИМ ЗДОРОВЬЕМ!
Автор статьи: врач ГБУЗ «ПКОД» Загрутдинова О. М.
М.
Материалы для скачивания:
Буклет
Памятка
применимость, проведение, последствия. Организация лечения
Брахитерапия, как один из видов радионуклидной терапии, являет собой высокоэффективный метод, при котором внутрь пораженного органа (злокачественная опухоль) помещается изотоп радия, цезия, кобальта.
То есть, очаг опухоли подвергается облучению максимально возможными дозами непосредственно изнутри, при этом воздействие на окружающие здоровые ткани минимизируется. Первая брахитерапия предстательной железы была проведена в 1910 году – американскими учеными P.Degrais и D.Pasteau через уретру в предстательную железу были введены капсулы радия-226, в дальнейшем метод активно развивался.
В 1981 году G. Gammergaard и H.H.Holm предложили новую методику, при которой микроисточники йода-125 имплантируются в ткань под контролем ТРУЗИ (трансректальное ультразвуковое сканировании). При этой методике положение радиоактивных источников в простате прекрасно визуализировалось, эта процедура легла в основу современной методики брахитерапии. В 1990 году P.Koutrouvelis предложил использование трехмерной стереотактической приставки к компьютерному томографу для лечения больных РПЖ, когда брахитерапия под контролем ТРУЗИ невозможна.
В 1990 году P.Koutrouvelis предложил использование трехмерной стереотактической приставки к компьютерному томографу для лечения больных РПЖ, когда брахитерапия под контролем ТРУЗИ невозможна.
Сегодня брахитерапия рака предстательной железы дает очень высокий процент выздоровления по сравнению с методом дистанционной лучевой терапии, более низкий процент осложнений и может быть показана в тех случаях, когда нельзя проводить хирургическое лечение и наружную лучевую терапию. Брахитерапия назначается после тщательного обследования, на котором выясняется стадия рака, операция назначается на стадиях Т1 и Т2, в редких случаях на стадии Т3. То есть, при обнаружении не пальпируемых опухолей и пальпируемых опухолей небольшого диаметра, когда окружающие ткани не задеты, нет метастаз.
Во время самой процедуры брахитерапии в ткань предстательной железы имплантируется титановая микрокапсула с изотопами радиоактивного йода I-125. Датчик УЗИ, введенный в прямую кишку, постоянно выводит изображение простаты на монитор, также контроль может осуществляться с помощью КТ. Зерна с изотопами, зафиксированные на специальной нити во избежание «свободного» перемещения при помощи специальных игл вводятся в пораженную ткань. Иглы выводятся, оставшиеся зерна выдают радиоактивное излучение нужной интенсивности в течение назначенного времени.
Зерна с изотопами, зафиксированные на специальной нити во избежание «свободного» перемещения при помощи специальных игл вводятся в пораженную ткань. Иглы выводятся, оставшиеся зерна выдают радиоактивное излучение нужной интенсивности в течение назначенного времени.
Наши хирурги постоянно проводят подобные операции, использую аппаратуру последнего поколения. Пациент выписывается домой очень скоро, после брахитерапии обычно не возникает никаких осложнений, процедура показана людям с сопутствующими заболеваниями и пожилым. Специалисты нашей клиники, проводившие операцию, в течение определенного времени обязательно наблюдают за пациентом, оценивая качество имплантации путем дозиметрии (измерения излучения). Общие результаты брахитерапии таковы, что снижается уровень ПСА, улучшается общее самочувствие.
Современные методы визуализации рецидивов рака предстательной железы и перспективы их развития
М. А.Рыбалов, С.Х. Аль-Шукри, С.Ю. Боровец
Кафедра урологии Первого Санкт-Петербургского государственного медицинского университета им.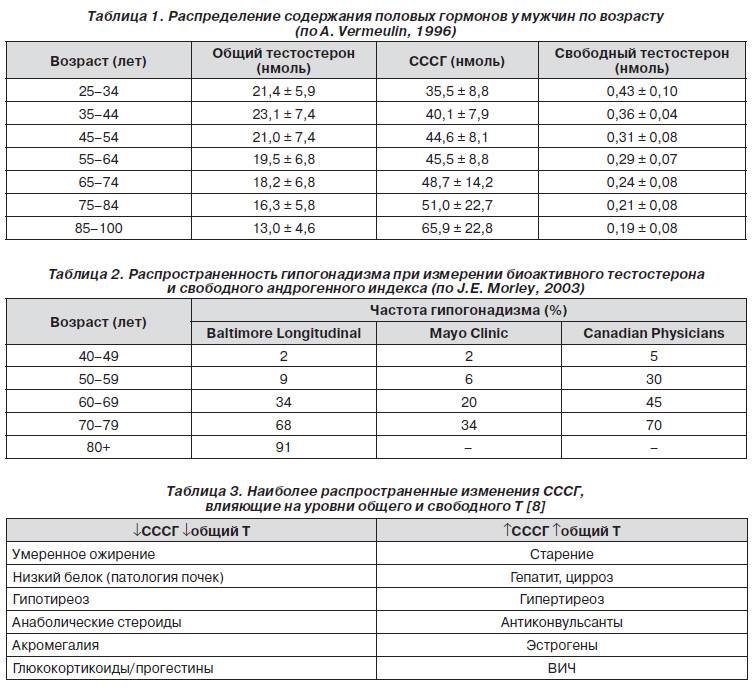 акад. И. П. Павлова
акад. И. П. Павлова
В данном обзоре рассматриваются современные методы визуализации рецидивов рака предстательной железы и рекомендации по их применению. Оцениваются перспективы развития данных технологий, возможные пути повышения эффективности диагностики.
Ключевые слова: методы визуализации; рецидивы рака предстательной железы; диагностика.
Выявление и определение стадии рецидивов рака предстательной железы (РПЖ) остаются одними из наиболее важных клинических вопросов онкоурологии. Повышение уровня ПСА после проведенной терапии или биохимический рецидив является самым ранним признаком развития рецидива РПЖ. Несмотря на то, что ПСА остаётся наиболее чувствительным методом в диагностике рецидивов, он не позволяет дифференцировать локализованную форму от метастатической. В настоящее время проводятся исследования с целью разработки новой диагностической технологии для визуализации рецидивов РПЖ. Наиболее перспективными методами являются функциональные технологии МРТ (диффузионная МРТ, МР-спектроскопия, динамическая МРТ с повышением контраста) и позитронно-эмиссионная томография (ПЭТ). ПЭТ уже зарекомендовала себя одной из перспективных технологий для выявления рецидивов РПЖ после радиотерапии. пС-холин — один из наиболее часто применяемых радиофармпрепаратов для визуализации РПЖ. С повышением интереса к методам локальной терапии рецидивов РПЖ, таким как сфокусированное ультразвуковое излучение высокой интенсивности (УИВИ) и криотерапия, отбор пациентов может быть значительно улучшен, если локализация рецидива и его границы будут видны, и станет возможным проведение операций с наблюдением в режиме реального времени.
ПЭТ уже зарекомендовала себя одной из перспективных технологий для выявления рецидивов РПЖ после радиотерапии. пС-холин — один из наиболее часто применяемых радиофармпрепаратов для визуализации РПЖ. С повышением интереса к методам локальной терапии рецидивов РПЖ, таким как сфокусированное ультразвуковое излучение высокой интенсивности (УИВИ) и криотерапия, отбор пациентов может быть значительно улучшен, если локализация рецидива и его границы будут видны, и станет возможным проведение операций с наблюдением в режиме реального времени.
ПЭТ/КТ с холином является эффективной технологией для диагностики рецидивов РПЖ, особенно для тех пациентов, у которых стандартные
методы (КТ, МРТ и сцинтиграфия костей) не позволили определить наличие рецидива. Вероятность положительного результата по данным ПЭТ/КТ непосредственно связана с уровнем ПСА во время сканирования. Понятие пограничного уровня ПСА при биохимическом рецидиве, начиная с которого необходимо проводить ПЭТ/КТ сканирование пациента, является спорным. Проведение сканирования при низком уровне ПСА имеет высокую вероятность ложноотрицательного результата и не будет эффективной для пациента. По данным Picchio et al. [1], 80 % результатов по данным ПЭТ/КТ с холином будут негативными при уровне ПСА < 1 нг/мл, поэтому авторы не рекомендуют проводить ПЭТ/КТ сканирование при биохимическом рецидиве после радикальной простатэктомии при уровне ПСА < 1 нг/мл. К сожалению, еще меньше рекомендаций имеется относительно уровня ПСА, при котором необходимо проводить сканирование у пациентов, ранее получавших лучевую терапию. У таких пациентов биохимический рецидив обычно диагностируется устойчивым ростом ПСА в течение времени. При отборе пациентов должны учитываться минимальный уровень ПСА (>1 нг/мл), короткое время удвоения ПСА (<3 мес., максимум до 6 мес.) и первичная стадия (>pT3b или pN1). Чувствительность ПЭТ/КТ значительно повышается при скорости нарастания ПСА > 2 нг/мл/год и времени удвоения ПСА < 3 месяцев.
Проведение сканирования при низком уровне ПСА имеет высокую вероятность ложноотрицательного результата и не будет эффективной для пациента. По данным Picchio et al. [1], 80 % результатов по данным ПЭТ/КТ с холином будут негативными при уровне ПСА < 1 нг/мл, поэтому авторы не рекомендуют проводить ПЭТ/КТ сканирование при биохимическом рецидиве после радикальной простатэктомии при уровне ПСА < 1 нг/мл. К сожалению, еще меньше рекомендаций имеется относительно уровня ПСА, при котором необходимо проводить сканирование у пациентов, ранее получавших лучевую терапию. У таких пациентов биохимический рецидив обычно диагностируется устойчивым ростом ПСА в течение времени. При отборе пациентов должны учитываться минимальный уровень ПСА (>1 нг/мл), короткое время удвоения ПСА (<3 мес., максимум до 6 мес.) и первичная стадия (>pT3b или pN1). Чувствительность ПЭТ/КТ значительно повышается при скорости нарастания ПСА > 2 нг/мл/год и времени удвоения ПСА < 3 месяцев.
Данные мета-анализа von Eyben et al.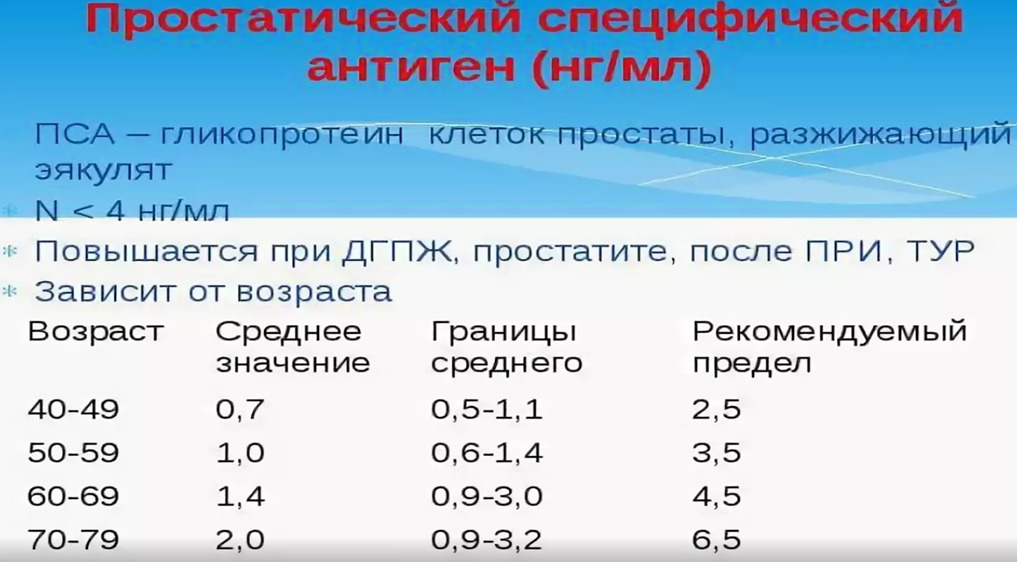 F-ФДГ ПЭТ/КТ.
F-ФДГ ПЭТ/КТ.
Результаты исследований демонстрируют, что 11С-холин ПЭТ/КТ имеет высокую общую чувствительность для обнаружения местных рецидивов рака предстательной железы после проведенной дистанционной лучевой терапии. Таким образом, этот метод диагностики может быть полезен при отборе пациентов с биохимическим рецидивом РПЖ после лучевой терапии для проведения криоабляции предстательной железы.
Ceci et. al. [3] продемонстрировали значимость 11С-холин ПЭТ/КТ для выбора метода терапии у пациентов с рецидивами РПЖ. Результаты ПЭТ/КТ привели к коррекции терапии у 46,7 % пациентов и к с полному изменению метода лечения у 18 %.
Большинство радиофармпрепаратов, применяемых для визуализации РПЖ, не являются канцероспецифичными. Проводится разработка радиофармпрепаратов, направленных на специфические клетки-мишени. Для РПЖ наиболее перспективным в данном направлении считается простатический специфический мембранный антиген (ПСМА).
ПСМА или глутаматкарбоксипептидаза II — это цинксодержащий металлофермент, принадлежащий к мембранным гликопротеинам 2-го класса. -фторметилхолин ПЭТ/КТ даже при низких уровнях ПСА [5].
-фторметилхолин ПЭТ/КТ даже при низких уровнях ПСА [5].
Развитие технологий МРТ способствует повышению эффективности диагностики рецидивов РПЖ. Функциональные технологии МРТ считаются перспективными методами диагностики, позволяющими оптимизировать визуализацию рецидивов. Комбинация диффузионной МРТ, МР-спектроскопии и динамической МРТ с повышением контраста позволяет лучше идентифицировать подозрительные на опухоль участки. Наиболее привлекающим аспектом этих методов МРТ является возможность проводить одно комплексное мультимодальное МРТ исследование, при котором станет возможным интеграция всех полученных данных, которые важны для постановки диагноза, стадирования и описания характеристик рака. В перспективе их могут дополнить диффузионная тензорная томография, многокомпонентный диффузионный анализ, MR-эласто-графия или новые спектроскопические методы, которые в настоящее время находятся на стадии доклинических исследований [6].
Akin et al. [7] продемонстрировали, что функциональные технологии МРТ были значительно точнее в выявлении рецидивов РПЖ у пациентов после лучевой терапии, чем морфологические снимки в режиме Т2 усиления. Добавление диффузионной МРТ и динамической МРТ с повышением контраста к МРТ в режиме T2 усиления значительно повысило точность локализации рецидивов как для опытного, так и для неопытного рентгенолога. Результаты также показывают, что количественный анализ мультимодального МРТ может играть важную роль в выявлении местного рецидива РПЖ.
Добавление диффузионной МРТ и динамической МРТ с повышением контраста к МРТ в режиме T2 усиления значительно повысило точность локализации рецидивов как для опытного, так и для неопытного рентгенолога. Результаты также показывают, что количественный анализ мультимодального МРТ может играть важную роль в выявлении местного рецидива РПЖ.
В исследовании Donati et al. [8] сочетание диффузионной МРТ с МРТ в режиме T2 усиления было наиболее эффективным в диагностике локальных рецидивов РПЖ, и добавление динамической МРТ с повышением контраста не принесло явного преимущества при сравнении с результатами данной комбинации. Тем не менее, использование динамической МРТ с повышением контраста может быть полезно, особенно у пациентов после брахитерапии, так как диффузионная МРТ в таких случаях склонна к образованию артефактов и искажений. Не было выявлено никакой значимой связи между оценками по шкале Глисона и количественными параметрами мультимодального МРТ при обследовании предстательных желез после лучевой терапии.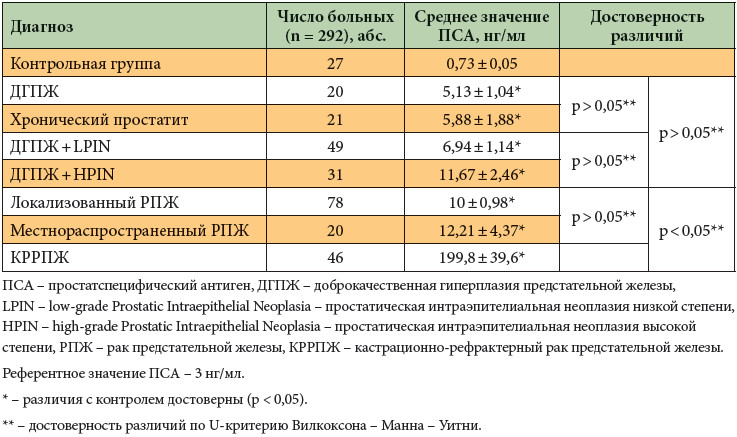
Анализ Kitajima et al. [9] 115 пациентов с повышением уровня ПСА после проведенной радикальной простатэктомии, которые были обследованы с помощью мультимодального МРТ и 11С-холин ПЭТ/КТ, продемонстрировал взаимодополняющую роль обеих технологий при визуализации рецидивов заболевания. Мультимодальный МРТ показал высокую чувствительность и точность обнаружения местно-распространенных очагов опухоли в ложе простаты, превосходящую ПЭТ/КТ. ПЭТ/КТ превзошел МРТ в диагностике метастазов в лимфатических узлах. ПЭТ/КТ и МРТ показали одинаково высокую точность в выявлении метастазов в кости таза. В целом, в случаях несогласованных результатов между 2 методами, на результатах МРТ следует основываться для интерпретации местного рецидива, в то время как на результаты ПЭТ/КТ следует использовать при интерпретации метастазов в лимфатические узлы.
В настоящее время ПЭТ/КТ становится широкодоступным методом обследования на наличие рецидивов РПЖ. Данный метод позволяет за одно обследование получить информацию об анатомическом строении и метаболических процессах. Обращает на себя внимание появление другой совмещенной технологии — ПЭТ/МРТ. Уже активно проводятся научные исследования с целью выявить возможные преимущества данного диагностического метода. Очевидным преимуществом пока является только более низкая доза облучения, получаемая при обследовании с помощью ПЭТ/МРТ. Предполагается, что ПЭТ/МРТ может повысить точность выявления рецидивов благодаря более высокому разрешению визуализации морфологических данных. Одними из первых сравнение этих двух технологий в диагностике рецидивов РПЖ провели Afshar-Oromieh et al. [10] с использованием лигандов ПСМА, меченных 68Ga. По результатам исследования ПЭТ/МРТ выявил наличие рецидивов РПЖ в большем количестве случаев по сравнению с ПЭТ/КТ. Однако это преимущество не было статистически значимым, так как выражалось лишь в 4 случаях, когда ПЭТ/МРТ уточнил неясный результат по данным ПЭТ/КТ. В то же время изображения ПЭТ при ПЭТ/МРТ часто сопровождались наличием артефактов пониженного сигнала вокруг мочевого пузыря и на уровне почек, что не наблюдалось при ПЭТ/КТ.
Обращает на себя внимание появление другой совмещенной технологии — ПЭТ/МРТ. Уже активно проводятся научные исследования с целью выявить возможные преимущества данного диагностического метода. Очевидным преимуществом пока является только более низкая доза облучения, получаемая при обследовании с помощью ПЭТ/МРТ. Предполагается, что ПЭТ/МРТ может повысить точность выявления рецидивов благодаря более высокому разрешению визуализации морфологических данных. Одними из первых сравнение этих двух технологий в диагностике рецидивов РПЖ провели Afshar-Oromieh et al. [10] с использованием лигандов ПСМА, меченных 68Ga. По результатам исследования ПЭТ/МРТ выявил наличие рецидивов РПЖ в большем количестве случаев по сравнению с ПЭТ/КТ. Однако это преимущество не было статистически значимым, так как выражалось лишь в 4 случаях, когда ПЭТ/МРТ уточнил неясный результат по данным ПЭТ/КТ. В то же время изображения ПЭТ при ПЭТ/МРТ часто сопровождались наличием артефактов пониженного сигнала вокруг мочевого пузыря и на уровне почек, что не наблюдалось при ПЭТ/КТ. Необходимы дальнейшие исследования с соответствующими радиофармпрепаратами, ориентированными на специфические антигены РПЖ для выбора наиболее эффективного метода визуализации.
Необходимы дальнейшие исследования с соответствующими радиофармпрепаратами, ориентированными на специфические антигены РПЖ для выбора наиболее эффективного метода визуализации.
Список литературы
1. Picchio M., Briganti A., Fanti S. et al. The role of choline positron emission tomography/computed tomography in the management of patients with prostate-specific antigen progression
after radical treatment of prostate cancer // Eur. Urol. 2011. Vol. 59, N 1. P. 51-60.
2. von Eyben F. E., Kairemo K. Meta-analysis of (11)C-choline and (18)F-choline PET/CT for management of patients with prostate cancer // Nucl. Med. Commun. 2014. Vol. 35, N 3. P. 221-230.
3. Ceci F., Herrmann K., Castellucci P. et al. Impact of 11C-choline PET/CT on clinical decision making in recurrent prostate cancer: results from a retrospective two-centre trial // Eur. J. Nucl. Med. Mol. Imaging. 2014. Vol. 41, N 12. P. 2222-2231.
4. Bouchelouche K., Choyke P. L., Capala J. Prostate specific membrane antigen-A target for imaging and therapy with radionuclides // Discov. Med. 2010. Vol. 9, P. 55-61.
Prostate specific membrane antigen-A target for imaging and therapy with radionuclides // Discov. Med. 2010. Vol. 9, P. 55-61.
5. Afshar-Oromieh A., Zechmann C. M., Malcher A. et al. Comparison of PET imaging with a (68)Ga-labelled PSMA ligand and (18) F-choline-based PET/CT for the diagnosis of recurrent prostate cancer//Eur. J. Nucl. Med. Mol. Imaging. 2014. Vol. 41, N 1. P. 11-20.
6. Hegde J. V., Mulkern R. V., Panych L. P. et al. Multiparametric MRI of prostate cancer: an update on state-of-the-art techniques and their performance in detecting and localizing prostate cancer // J. Magn. Reson. Imaging. 2013. Vol. 37, N 5. P. 1035-1054.
7. Akin O., Gultekin D. H., Vargas H. A. et al. Incremental value of diffusion weighted and dynamic contrast enhanced MRI in the detection of locally recurrent prostate cancer after radiation treatment: preliminary results // Eur. Radiol. 2011. Vol. 21, N 9. P. 1970-1978.
8. Donati O. F., Jung S. I., Vargas H. A. et al. Multiparametric prostate MR imaging with T2-weighted, diffusion-weighted, and dynamic contrast-enhanced sequences: are all pulse sequences necessary to detect locally recurrent prostate cancer after radiation therapy? // Radiology. 2013. Vol. 268, N 2 P. 440-450.
2013. Vol. 268, N 2 P. 440-450.
9. Kitajima K., Murphy R. C., Nathan M. A. et al. Detection of recurrent prostate cancer after radical prostatectomy: comparison of 11C-choline PET/CT with pelvic multiparametric MR imaging with endorectal coil // J. Nucl. Med. 2014. Vol. 55, N 2. P. 223-232.
10. Afshar-Oromieh A., Haberkorn U., Schlemmer H. P. et al. Comparison of PET/CT and PET/MRI hybrid systems using a 68Ga-labelled PSMA ligand for the diagnosis of recurrent prostate cancer: initial experience // Eur. J. Nucl. Med. Mol. Imaging. 2014. Vol. 41, N 5. P. 887-897.
Мodern techniques for recurrent prostate cancer imaging and perspective of their development
Al-Shukri S. Kh., Rybalov M. A. Borovets S. Yu.
С 13 по 17 сентября Неделя борьбы с раком предстательной железы
Важная мужская тема
Одним из наиболее распространенных онкологических заболеваний у мужчин является рак предстательной железы. Как правило, он обнаруживается у мужчин старше 50 лет, но начинает формироваться в возрасте около 40 лет. Развитие данного заболевания является результатом комплексного воздействия ряда факторов ( возраст, генетические особенности, воспалительные и инфекционные заболевания предстательной железы, питание, курение и образ жизни).
Как правило, он обнаруживается у мужчин старше 50 лет, но начинает формироваться в возрасте около 40 лет. Развитие данного заболевания является результатом комплексного воздействия ряда факторов ( возраст, генетические особенности, воспалительные и инфекционные заболевания предстательной железы, питание, курение и образ жизни).
Заболевание может протекать многие годы бессимптомно. Даже самая маленькая опухоль простаты обладает способностью давать метастазы ( мигрировать в другие органы). Чаще ими оказываются кости таза, бедер и позвоночник.
Каковы клинические проявления (симптомы) рака предстательной железы?В начальных стадиях — рак предстательной железы не проявляется и больные в основном не предъявляют жалоб. По мере увеличения размеров опухоли возможно проявление симптомов нарушения мочеиспускания (учащенное и затрудненное мочеиспускание, вялая струя мочи).Часто эти клинические проявления могут быть приняты за симптомы аденомы предстательной железы, так как у большинства пациентов в возрасте старше 60 лет имеется доброкачественная гиперплазия предстательной железы.
Чтобы у вас был шанс выявить рак предстательной железы на излечимой стадии, необходимо регулярно проходить профилактическое обследование, даже, если Вас ничего не беспокоит. Несмотря на улучшение методов диагностики и внедрение системы скрининга рака предстательной железы, каждый второй мужчина имеет запущенную форму рака простаты. Связано это с тем, что мужчины часто обращаются к врачу только в случае появления симптомов заболевания.
Что включает в себя профилактическое обследование?На ранних этапах выявить рак предстательной железы возможно только с помощью анализа крови на простатспецифический антиген (ПСА). Определение ПСА входит в программу скрининга взрослого мужского населения после 50 лет с обследованием 1 раз в три года.
Что такое ПСА?ПСА (простатический специфический антиген) не является раковоспецифическим маркером.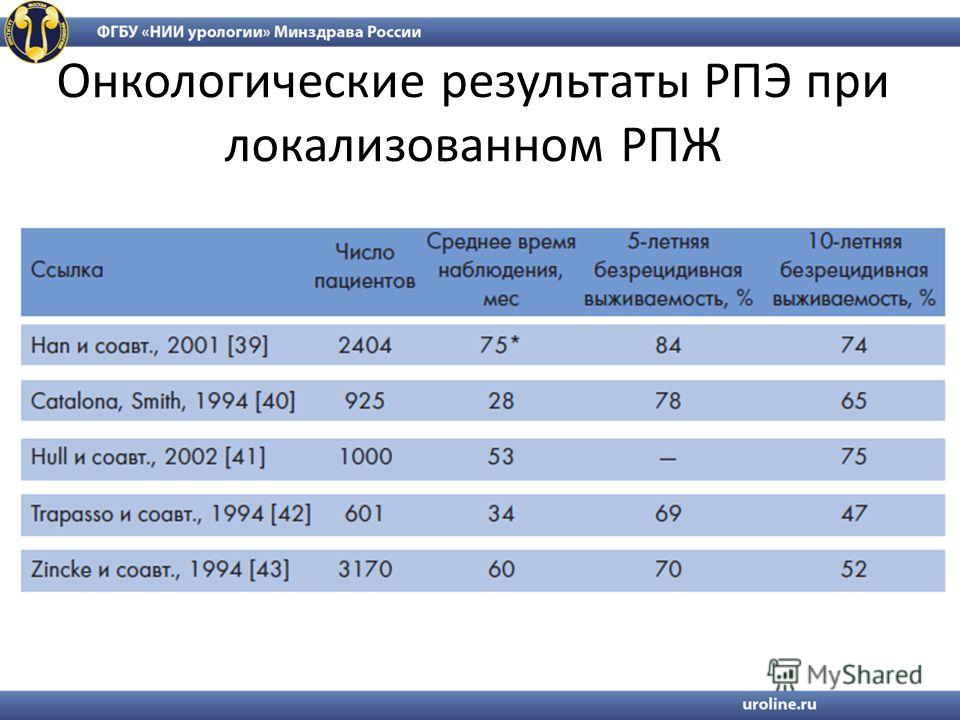 Уровень ПСА может быть повышен при доброкачественной гиперплазии предстательной железы, простатите и других доброкачественных заболеваниях. Однако ПСА может указывать на возможность наличия рака простаты — чем больше значение, тем выше вероятность существования рака предстательной железы.
Уровень ПСА может быть повышен при доброкачественной гиперплазии предстательной железы, простатите и других доброкачественных заболеваниях. Однако ПСА может указывать на возможность наличия рака простаты — чем больше значение, тем выше вероятность существования рака предстательной железы.
Лечение рака зависит от стадии заболевания, возраста, и общего состояния организма. На ранних стадиях возможно полное излечение от рака простаты. При распространении опухоли далеко за пределы простаты и наличии метастазов полное излечение невозможно.
Какое лечение может быть предложено Вам на ранних стадиях?Это могут быть альтернативные методы лечения:
— Хирургический (радикальная простатэктомия),
-лучевая терапия (дистанционная или брахитерапия),
-активное наблюдение.
У каждого метода есть свои преимущества и недостатки, показания и противопоказания. Поэтому метод лечения должен обсуждаться с врачом специалистом.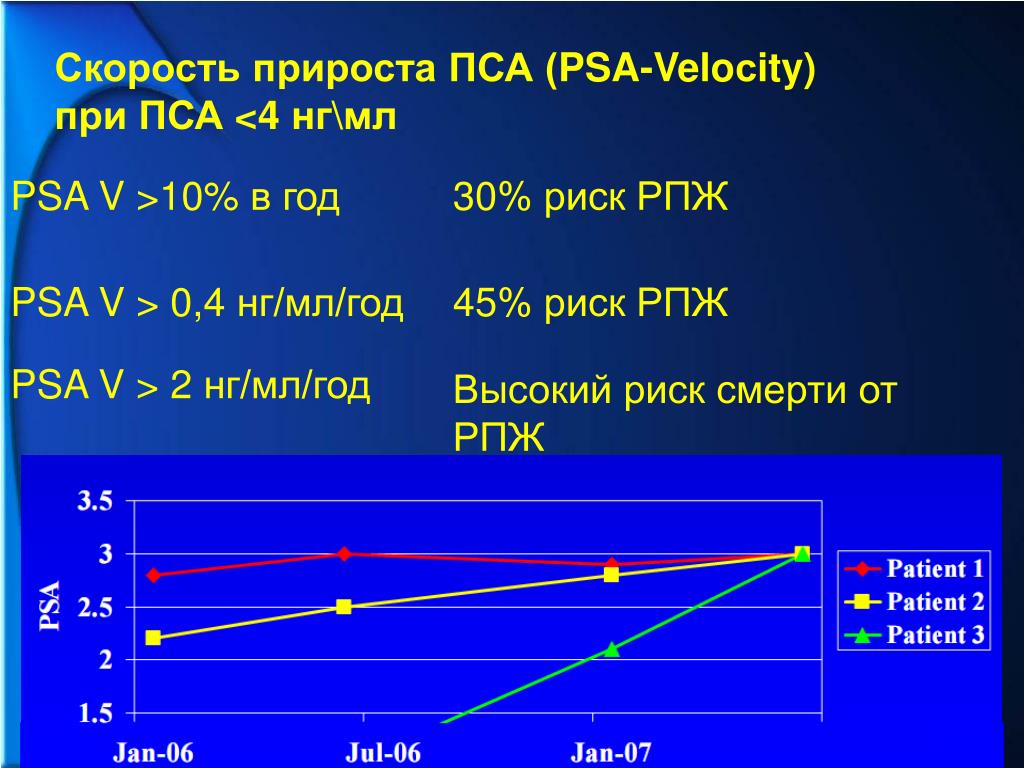
Лечение рака простаты на далеко зашедших стадиях направлено, в первую очередь, на улучшение качества жизни пациентов за счет снижения выраженности болей в костях и улучшения мочеиспускания. Большинство видов терапии основано на снижение воздействия мужских половых гормонов (тестостерона) на клетки опухоли, что приводит к замедлению её роста. Вам может быть предложен приём препаратов, блокирующих выработку или действие мужских гормонов на предстательную железу.
Как Вы можете оценить эффективность лечения?В первую очередь она проявится в уменьшении или исчезновении болей и улучшения мочеиспускания. Так же будет отмечаться снижение ПСА.
ВАЖНО ПРИДЕРЖИВАТЬСЯ ЗДОРОВОГО ОБРАЗА ЖИЗНИ
Меняем характер питания: едим меньше животных жиров. Включаем в свой ежедневный рацион крестоцветные овощи: брюссельская капуста, брокколи, цветная капуста.
Следует отказаться или хотя бы ограничить курение и употребления алкоголя, а также — повысить уровень физической активности, выделив немного времени в ежедневном графике для физических упражнений.
МУЖЧИНЫ! СЛЕДИТЕ ЗА СВОИМ ЗДОРОВЬЕМ!
Что должен предпринять мужчина при подозрении на рак простаты
Срочно обратиться к врачу – урологу или врачу — онкологу!
Какие обследования можно пройти
- Анализ крови на уровень ПСА.
- Пальцевое ректальное обследование у врача – уролога.
- УЗИ или МРТ предстательной железы
Предупреждение рака простаты
Отказ от вредных привычек. Употребление в пищу фруктов и овощей (до 5 раз в день). Снижение употребления продуктов, содержащих животные жиры и кальций. Увеличение физических нагрузок. Прохождение плановых обследований.
Ранняя диагностика рака простаты (РП)
Что такое рак простаты? — Это злокачественное новообразование, возникающее в железистой ткани предстательной железы.
Факторы, способствующие возникновению рака предстательной железы
- Наследственная предрасположенность.
- Гормональные изменения в организме, вызванные возрастом.
- Неправильное питание – увеличение употребления продуктов с животными жирами.
- Вредные привычки.
На что должен обратить внимание мужчина
Ранние стадии рака простаты, как правило, протекают без симптомов. Именно поэтому мужчинам после 40 лет нужно регулярно сдавать анализы и проходить осмотр. У рака простаты нет характерных симптомов. Очень часто болезнь обнаруживается совершенно случайно.
Симптомы рака на более поздних стадиях:
- Расстройства мочеиспускания:
- — Частое мочеиспускание, в том числе ночью.
- — Слабый напор струи и перерывы во время мочеиспускания.
- — Жжение во время мочеиспускания.
- — Ощущение неполного опорожнения мочевого пузыря.
- Боли внизу живота, в промежности, в пояснице.

- Появление крови в моче и в сперме.
- Снижение потенции.
- Неспецифические (характерные для многих заболеваний) симптомы: снижение массы тела, отсутствие аппетита, слабость.
Что такое скрининг — Это использование простых тестов для выявления людей, у которых болезнь уже развилась, но симптомы не проявляются. В нашей стране скрининг проводят во время диспансеризации населения.
Для выявления предраковых изменений в области простаты необходимо ежегодное обследование мужчин старше 40 лет у уролога.
Периодичность осмотров определяет врач-уролог в зависимости от:
- возраста,
- наследственной предрасположенности,
- результатов предыдущих тестов.
Памятки и буклеты:
- Памятка по раку предстательной железы Скачать
- Буклет Профилактика рака предстательной железы 1 Скачать
- Буклет Профилактика рака предстательной железы 2 Скачать
- Памятка с Так здорово онко Скачать
- Что такое ПСА Скачать
2021
ответов на общие вопросы по радиационной безопасности
Сводка
Лучевая терапия — один из наиболее распространенных и эффективных способов уничтожения раковых клеток и уменьшения размеров опухолей. В Memorial Sloan Kettering примерно половина взрослых онкологических больных проходят лучевую терапию в качестве основного лечения или в рамках более широкого подхода, который включает химиотерапию, хирургическое вмешательство или другие виды лечения. Для многих видов рака лучевая терапия может быть всем, что необходимо для лечения болезни.
В Memorial Sloan Kettering примерно половина взрослых онкологических больных проходят лучевую терапию в качестве основного лечения или в рамках более широкого подхода, который включает химиотерапию, хирургическое вмешательство или другие виды лечения. Для многих видов рака лучевая терапия может быть всем, что необходимо для лечения болезни.
Есть разные способы проведения лучевой терапии. При дистанционной лучевой терапии лечение осуществляется с помощью аппарата, расположенного вне тела. При внутреннем облучении (брахитерапия) закрытые источники радиоактивности размещаются рядом с опухолью или внутри нее. Реже лучевая терапия также может проводиться с использованием жидких материалов в капсулах перорально или инфузией через вену (системное облучение).
Хотя лучевая терапия широко используется на протяжении десятилетий, до сих пор существует путаница и недопонимание относительно ее безопасности.Мы попросили клинического физика MSK Лоуренса Дауэра и медицинского физика Мэтью Уильямсона рассказать нам о проблемах, которые они чаще всего слышат от пациентов и их семей, а также об ответах и заверениях, которые они предоставляют.
Сделает ли меня радиоактивным получение внешнего лучевого излучения или возможность подвергнуть других воздействию излучения?
Наружная лучевая терапия, наиболее распространенный вид лучевой терапии, никоим образом не делает человека радиоактивным. Чаще всего применяется в виде рентгеновских лучей на линейном ускорителе.Терапия предназначена для доставки точного количества энергии к опухолевым клеткам при сохранении здоровых тканей. Излучение присутствует только при работе линейного ускорителя. Когда вы получаете внешнее лучевое излучение, вы не можете заразить или передать это излучение другому человеку.
Когда вы получаете внешнее лучевое излучение, вы не можете заразить или передать это излучение другому человеку.
Лоуренс Т. Дауэр клинический физик Вернуться наверхКак я могу быть уверен, что аппарат внешнего луча не повреждает нормальные, здоровые ткани в моем теле?
Мы тщательно разработали методы калибровки пучков излучения, чтобы гарантировать, что они достигают тех областей, на которые они предназначены. Даже когда близлежащие нормальные ткани получают небольшое количество радиации, длительные повреждения возникают редко. Наши врачи и физики также знают, сколько радиации может получить здоровая ткань, не нанеся значительного ущерба. Они используют эту информацию для разработки лечения для конкретного пациента. Мы часто используем специальные маски, формы или слепки частей тела, чтобы вы оставались полностью неподвижными во время лечения, чтобы мы могли направить лучи излучения точно на область, которую необходимо лечить.
Даже когда близлежащие нормальные ткани получают небольшое количество радиации, длительные повреждения возникают редко. Наши врачи и физики также знают, сколько радиации может получить здоровая ткань, не нанеся значительного ущерба. Они используют эту информацию для разработки лечения для конкретного пациента. Мы часто используем специальные маски, формы или слепки частей тела, чтобы вы оставались полностью неподвижными во время лечения, чтобы мы могли направить лучи излучения точно на область, которую необходимо лечить.
Существует ли риск того, что внутренние радиационные имплантаты (брахитерапия) выйдут из строя или вырвутся из того места, где они установлены, и будут перемещаться по моему телу?
В брахитерапии мы используем иглу или катетер для введения радиоактивного материала, содержащегося в закрытом источнике, таком как семя, шарик, проволока или капсула.Поскольку радиоактивный материал внутри имплантатов естественным образом разлагается с течением времени, он испускает излучение, которое выделяет энергию для лечения близлежащих раковых клеток.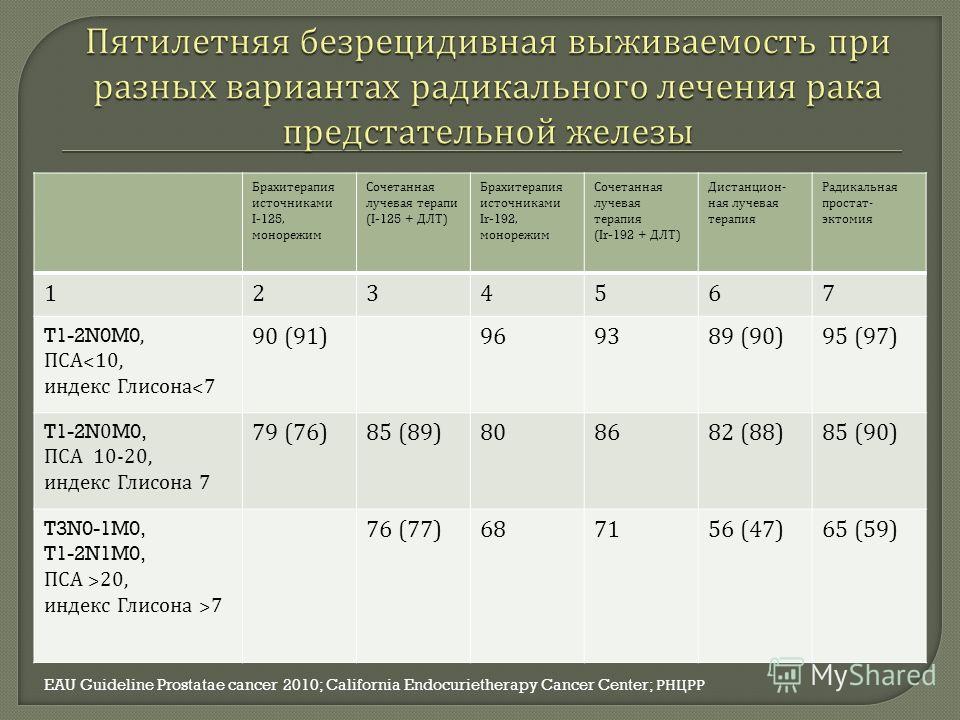 Эта радиоактивность распространяется только на определенное расстояние за имплант. Через несколько недель или месяцев имплант перестанет излучать излучение. Имплантаты проходят специальные испытания и герметизируются, чтобы гарантировать отсутствие утечки инкапсулированного радиоактивного материала, и мы размещаем их таким образом, чтобы маловероятно, что они сдвинутся. Мы принимаем особые меры предосторожности, чтобы свести к минимуму воздействие имплантированного радиоактивного материала на других.
Эта радиоактивность распространяется только на определенное расстояние за имплант. Через несколько недель или месяцев имплант перестанет излучать излучение. Имплантаты проходят специальные испытания и герметизируются, чтобы гарантировать отсутствие утечки инкапсулированного радиоактивного материала, и мы размещаем их таким образом, чтобы маловероятно, что они сдвинутся. Мы принимаем особые меры предосторожности, чтобы свести к минимуму воздействие имплантированного радиоактивного материала на других.
Следует ли мне ограничивать контакт с кем-либо, пока имплантаты для брахитерапии находятся внутри моего тела?
Большинство наших опасений по поводу безопасности связаны с физическим контактом с детьми в течение продолжительных периодов времени, потому что их тела претерпевают такие быстрые изменения и рост. Поскольку мы варьируем дозу облучения для каждого имплантата, а также количество вставляемых имплантатов в зависимости от вашего конкретного рака, мы даем вам конкретные рекомендации о мерах предосторожности, которые следует соблюдать при тесном контакте с детьми.
Вернуться наверхМогут ли имплантаты семян простаты подвергать риску моего сексуального партнера или человека, с которым я сплю?
Семена простаты — закрытые источники. Вы не можете заразить другого человека, находясь в непосредственной близости от него, во время полового акта или посредством любой другой формы интимного контакта. Ваш врач или сотрудник службы радиационной безопасности обсудит любые особые меры предосторожности, которые вам следует предпринять во время сна, прежде чем вы покинете больницу.Например, исходя из таких факторов, как ваш возраст и возраст вашего партнера, мы можем попросить вас на короткое время не обнимать партнера со спины в позе «ложкой» в течение ночи.
Вернуться наверхПредставляю ли я опасность для окружающих после лечения рака щитовидной железы радиоактивным йодом?
Лечение радиоактивным йодом включает проглатывание капсулы или жидкой формы радиоактивного йода, который все клетки щитовидной железы поглощают (поглощают), разрушая их.Это эффективно, потому что другие здоровые клетки организма обычно не поглощают радиоактивный йод.
В течение нескольких дней после этой терапии радиоактивные вещества могут выделяться через жидкости организма, такие как слюна, моча и пот. Мы отправляем пациентов домой с подробными инструкциями по уходу за собой в первые несколько дней — от ограничения контактов с маленькими детьми и домашними животными до использования отдельной посуды и полотенец.
Вернуться наверхЯ прохожу визуализацию с использованием радиоактивных материалов.Стану ли я радиоактивным после теста?
Врачи иногда используют небольшие количества радиоактивных материалов для диагностики заболеваний. Это называется ядерной медициной. Радиоактивное вещество вводится в ваше тело, обнаруживая определенные клетки или ткани, включая раковые клетки, и связывается с ними. Радиоактивный материал будет оставаться в вашем теле в течение нескольких часов или дней, в зависимости от типа, который используется. В конце концов, материал разлагается, и ваше тело естественным образом вымывает его с мочой, потом и другими формами биологического удаления.Мы удостоверяемся, что перед тестом вам понятны все подробности, и мы также можем выпустить информационную карточку с объяснением вашего лечения в случае, если вас, например, допросит кто-то из службы безопасности аэропорта. Вы можете узнать больше о подходах к ядерной медицине здесь.
Вернуться наверхБрахитерапия (внутренняя лучевая терапия)
Брахитерапия — это вид лучевой терапии, применяемый для лечения рака. Он помещает внутрь пациента радиоактивные источники, убивающие раковые клетки и уменьшающие опухоли.Это позволяет вашему врачу использовать более высокую общую дозу радиации для лечения меньшей площади и избежать попадания радиации на некоторые окружающие органы.
Ваш врач расскажет вам, как подготовиться и потребуется ли вам медицинское обследование. Ваш врач может использовать компьютерную программу для планирования вашего лечения.
Что такое брахитерапия и как ее применяют?
Брахитерапия, также называемая внутренней лучевой терапией, помещает радиоактивный материал непосредственно внутрь опухоли или рядом с ней.Он использует более высокую общую дозу излучения для лечения меньшей площади, чем внешняя лучевая лучевая терапия (ДЛТ), которая направляет высокоэнергетические рентгеновские лучи на опухоль извне.
Брахитерапия лечит рак по всему телу, в том числе:
Брахитерапия у детей применяется редко. Однако преимущество брахитерапии заключается в использовании высоко локализованной дозы излучения. Это означает, что к окружающим тканям доставляется меньше излучения. Это значительно снижает риск вторичных злокачественных новообразований, вызванных радиацией, что является серьезной проблемой для детей.Чаще всего это лечение применяется при редких формах рака у детей (рабдомиосаркома). Ежегодно в США
диагностируют эти редкие виды рака у 250 детей.Брахитерапия может быть временной или постоянной. Обсудите со своим онкологом-радиологом особенности вашего лечения.
При временной брахитерапии радиоактивный материал помещается внутрь катетера на определенное время, а затем удаляется. Его дают с низкой мощностью дозы (LDR) или высокой мощностью дозы (HDR).
Постоянная брахитерапия также называется имплантацией семян.Он навсегда помещает радиоактивные семена (размером с рисовое зерно) в опухоль или рядом с ней. Через несколько месяцев семена теряют свою радиоактивность. Иногда активные семена могут срабатывать детекторы излучения на контрольно-пропускных пунктах. Вам может потребоваться справка от врача, чтобы объяснить вашу ситуацию сотрудникам службы безопасности. Бездействующие семена безвредны и редко срабатывают с помощью металлоискателей.
начало страницы
Кто будет задействован в этой процедуре?
Для брахитерапии требуется бригада врачей.В эту команду входят онколог-радиолог, медицинский физик, дозиметрист, лучевой терапевт, медсестра, а иногда и хирург. Онколог-радиолог — это высококвалифицированный врач, специализирующийся на лечении рака с помощью лучевой терапии. Онколог оценивает пациента, определяет лечение и определяет подходящую терапию и дозу облучения. В некоторых случаях хирург может помочь, поместив лечебные приспособления в пациента. Медицинский физик, дозиметрист и онколог определяют, как доставить излучение и сколько пациент может переносить.Затем физик и дозиметрист производят подробные расчеты лечения. Радиотерапевт, специально обученный технолог, может помочь провести лечение. Медсестра предоставит информацию о лечении и возможных побочных эффектах. Медсестра также помогает управлять лечебными катетерами.
начало страницы
Какое оборудование используется?
Тип используемого радиоактивного материала (йод, палладий, цезий или иридий) зависит от типа обработки. Во всех типах источник излучения герметизирован.Это означает, что он заключен в нерадиоактивную металлическую капсулу, которую часто называют «семенем». Это помогает предотвратить перемещение материала к другим частям тела пациента.
Постоянные имплантаты помещают радиоактивные семена непосредственно в опухоль с помощью специального устройства доставки. Обычно это делается с помощью ультразвука и / или рентгеновского снимка, чтобы гарантировать точное размещение.
Для временных имплантатов используются иглы, катетеры или специальные аппликаторы. После подтверждения точного положения устройства вставляются источники излучения.Это называется «постзагрузка». Онколог может вставлять и удалять материал вручную после размещения устройства доставки. Или онколог может использовать управляемую компьютером дистанционную машину для последующей загрузки, чтобы вставить материал. Медицинская визуализация помогает расположить материал для наиболее эффективного лечения опухоли. Компьютер вычисляет положение источника и время, необходимое для доставки желаемой дозы излучения.
начало страницы
Кто эксплуатирует оборудование?
Медицинский физик, лицензированный дозиметрист или онколог-радиолог управляет оборудованием.Онколог составляет общий план лечения.
начало страницы
Требуется ли специальная подготовка к процедуре?
Ваш врач расскажет вам, как подготовиться к лечению. Эти препараты могут включать:
- Подготовка кишечника
- Ультразвук перед лечением, МРТ или КТ
- Анализы крови
- Электрокардиограмма (ЭКГ)
- Рентген грудной клетки
Ваш врач может также использовать компьютер для планирования лечения перед самой процедурой.
начало страницы
Как проходит процедура?
Постоянная брахитерапия:
При постоянной брахитерапии в опухоль вводятся иглы, предварительно заполненные радиоактивными семенами. Врач удалит иглу и оставит семена. Семена также можно имплантировать с помощью устройства, которое вставляет их по отдельности через равные промежутки времени. В процедуре может использоваться медицинское изображение, чтобы помочь расположить семена. Позже врач может провести дополнительные визуализационные тесты, чтобы проверить заделку семян.
Временная брахитерапия:
При временной брахитерапии в опухоль вводится устройство доставки, например катетер, игла или аппликатор. Медицинская визуализация помогает расположить источники излучения. Врач может ввести устройство для доставки в полость тела, такую как влагалище или матка (внутриполостная). Или врач может ввести аппликатор (иглу или катетер) в ткани тела (интерстициальные).
Лечение с высокой мощностью дозы (HDR) обеспечивает излучение в течение 10–20 минут за сеанс.Лечение с низкой мощностью дозы (LDR) обеспечивает излучение в течение 20–50 часов. При лечении с использованием импульсной мощности дозы (PDR) излучение доставляется периодическими импульсами.
ЛечениеHDR обычно проводится в амбулаторных условиях. Тем не менее, некоторые пациенты помещаются в больницу на один-два дня, чтобы пройти несколько процедур HDR с использованием одного и того же аппликатора. Обработка HDR доставляет определенную дозу радиации к опухоли за короткий промежуток времени с помощью удаленного устройства для последующей нагрузки. В машине хранится мощный источник радиоактивных изотопов (иридий-192), который защищает персонал от ненужного радиационного облучения.Обработка HDR длится от 10 до 20 минут. Вся процедура (включая размещение устройства доставки) может занять до нескольких часов. Это можно повторить пару раз в день, прежде чем устройство доставки будет удалено. Пациенты могут пройти до 10 отдельных процедур HDR в течение одной или нескольких недель.
ЛечениеLDR обеспечивает непрерывное облучение в течение одного-двух дней. Это требует ночевки в больнице. Это позволяет устройству доставки оставаться на месте в течение всего периода лечения.Лечение PDR обеспечивает излучение аналогичным образом с использованием периодических импульсов (обычно один раз в час). Врач может вручную ввести материал через устройство доставки и удалить его позже, когда лечение будет завершено.
По окончании лечения врач снимает с пациента устройство доставки.
начало страницы
Что я буду чувствовать во время этой процедуры?
Перед началом лечения врач может ввести вам в руку или кисть внутривенную (IV) трубку для введения лекарства.В зависимости от локализации опухоли и рекомендаций врача вам могут назначить общую анестезию и / или седативное средство, чтобы вызвать сонливость. Если используется анестезия или сильная седация, после этого вас переведут в палату восстановления. В зависимости от типа лечения вы можете вернуться домой в тот же день или быть переведены в больничную палату.
Пациенты, у которых для временной брахитерапии установлен имплантат после нагрузки, могут слышать щелчки или жужжание лечебного аппарата. Это происходит, когда аппарат проталкивает радиоактивный материал в лечебное устройство, ранее помещенное на место опухоли.Вы будете одни во время процедуры. Однако вы сможете поговорить со своей терапевтической бригадой через микрофон. Команда будет находиться рядом, где они могут вас видеть и слышать. Лечение PDR позволит вам принимать посетителей между импульсами лечения. Лечение LDR потребует от вас пребывания в больнице. Посещения обычно ограничиваются примерно 30 минутами на посетителя в день. Дети и беременные женщины посещать не могут. После временной брахитерапии в вашем теле не остается радиации, поэтому нет никакого риска для окружающих.
Для некоторых процедур LDR, PDR и HDR требуется один или несколько дней пребывания в больнице, что может вызвать дискомфорт. Это может быть связано с тем, что катетеры или аппликаторы должны оставаться относительно неподвижными в течение длительного периода. Ваш врач пропишет вам лекарство для снятия боли.
После постоянной брахитерапии радиоактивность имплантированных семян со временем уменьшается, в зависимости от того, какой радиоактивный изотоп используется. Спросите своего врача, следует ли вам ограничить тесный контакт с другими людьми, например с беременными женщинами или детьми.С помощью временных имплантатов врач удаляет все радиоактивные материалы, прежде чем вы вернетесь домой. Риск облучения отсутствует после того, как врач извлечет устройство доставки и источники излучения.
Ваш врач и / или лечащая бригада дадут вам конкретные инструкции по уходу на дому. У вас может появиться болезненность и припухлость в области лечения или другие симптомы. Это будет зависеть от вашего конкретного лечения. Большинство пациентов могут вернуться к нормальной деятельности в течение нескольких дней или недель. Однако у вас могут быть долгосрочные побочные эффекты.Поговорите со своей терапевтической бригадой о том, как с ними справиться.
Ваш врач может порекомендовать серию контрольных осмотров после лечения. Они могут включать в себя медицинский осмотр, визуализацию, анализ крови или другие лабораторные анализы.
Эти посещения помогут вашему врачу увидеть, стабильно ли ваше состояние или изменилось ли оно. Они также позволяют обсудить с врачом любые побочные эффекты лечения.
начало страницы
Дополнительная информация и ресурсы
RTA ответов.org: Брахитерапия
Эта страница была просмотрена 30 июля 2021 г.
Постоянная брахтерапия семян | Рак простаты, Великобритания
Каковы побочные эффекты?
Как и все методы лечения, перманентная брахитерапия с семенами может вызывать побочные эффекты. Они повлияют на каждого человека по-разному, и вы можете не получить все возможные побочные эффекты.
Побочные эффекты обычно начинают проявляться примерно через неделю после лечения, когда начинает действовать радиация от семян.Обычно они находятся в худшем состоянии через несколько недель или месяцев после лечения, когда опухоль максимальна и доза облучения максимальна. Они часто хуже у мужчин с большой простатой, поскольку во время их лечения используется больше семян и игл. Побочные эффекты должны улучшиться в течение следующих месяцев, поскольку семена теряют свою радиацию и опухоль уменьшается.
У вас могут быть более серьезные побочные эффекты, если вы будете проходить постоянную брахитерапию семян вместе с дистанционной лучевой терапией и гормональной терапией.
У вас также может появиться больше побочных эффектов, если у вас были проблемы до лечения. Например, если у вас уже были проблемы с мочеиспусканием, эрекцией или кишечником, они могут ухудшиться после постоянной брахитерапии семенами.
После лечения вы можете получить что-то из следующего:
- окрашенная кровью моча или сперма ржавого или коричневого цвета в течение нескольких дней или недель
- синяк и боль в области между яичками и задним ходом, которые могут распространиться на внутреннюю поверхность бедер и половой член — исчезнут через неделю или две
- дискомфорт при мочеиспускании и потребность в более частом мочеиспускании, особенно ночью, и более срочно.
Развитие некоторых побочных эффектов может занять несколько недель и длиться дольше. К ним могут относиться проблемы с мочеиспусканием, проблемы с эрекцией, проблемы с кишечником и усталость.
Иногда проблемы с кишечником, мочеиспусканием и сексуальные отношения после лучевой терапии называют лучевой болезнью органов малого таза. Ассоциация тазовых лучевых заболеваний имеет дополнительную информацию.
Курение
Исследователи изучали, увеличивает ли курение вероятность долгосрочных проблем с кишечником и мочеиспусканием после лучевой терапии рака простаты.На данный момент проведено лишь небольшое количество исследований, поэтому нам нужно больше исследований в этом направлении. Если вы думаете о том, чтобы бросить курить, на веб-сайте NHS можно найти много информации и поддержки.
Проблемы с мочеиспусканием
Постоянная брахитерапия семенами может вызвать раздражение мочевого пузыря и уретры. Вы можете услышать, что это называется лучевым циститом. Симптомы включают:
- Чаще или срочно требуется мочеиспускание
- затрудненное мочеиспускание
- дискомфорт или чувство жжения при мочеиспускании
- кровь в моче.
У некоторых мужчин постоянная брахитерапия с семенами может вызвать набухание простаты, сужение уретры и затруднение мочеиспускания.
Некоторые мужчины обнаруживают, что они внезапно и болезненно перестают мочиться в первые несколько дней или недель после лечения. Это называется острой задержкой мочи. В этом случае немедленно обратитесь к врачу или медсестре или как можно скорее в ближайшее отделение неотложной помощи (A&E). Возможно, им потребуется установить катетер для слива мочи.Возможно, вам потребуется установить катетер на несколько недель, пока симптомы не исчезнут.
Проблемы с мочеиспусканием могут усиливаться в первые несколько недель после брахитерапии, особенно у мужчин с большой простатой, но обычно они начинают улучшаться через несколько месяцев.
Лекарства, называемые альфа-блокаторами, могут помочь при проблемах с мочеиспусканием. Вы также можете помочь себе, регулярно выпивая жидкость (два литра или три-четыре пинты в день) и избегая напитков, которые могут раздражать мочевой пузырь, таких как алкоголь, газированные напитки, искусственные подсластители и напитки с кофеином, такие как чай и кофе. .
Постоянная брахитерапия семенами также может вызвать рубцевание уретры, со временем сужая ее. Это называется стриктурой, которая может затруднить мочеиспускание. Это редко и может произойти через несколько месяцев или лет после лечения. Если это произойдет, вам может потребоваться операция по расширению уретры или открытию мочевого пузыря.
У некоторых мужчин наблюдается истечение мочи (недержание мочи) после постоянной брахитерапии семенами, но это нечасто. Это может быть более вероятно, если вы ранее перенесли операцию по лечению увеличенной простаты, которая называется трансуретральной резекцией простаты (ТУРП).Проблемы с утечкой мочи могут со временем исчезнуть, и есть способы их решить.
Узнайте больше о проблемах с мочеиспусканием и о том, как с ними справиться, или посетите наше интерактивное онлайн-руководство, чтобы получить больше советов.
Проблемы с кишечником
Ваш кишечник и задний проход находятся близко к простате. Постоянная брахитерапия семенами может вызвать раздражение слизистой оболочки кишечника и заднего прохода, что может вызвать проблемы с кишечником. Риск проблем с кишечником после постоянной брахитерапии семенами низок. Но у вас больше шансов столкнуться с проблемами, если вы также будете проходить дистанционную лучевую терапию.
Проблемы с кишечником могут включать:
- жидкий и водянистый стул (диарея)
- ветер сильнее обычного
- Необходимость более частого опорожнения кишечника
- Требуется срочное опорожнение кишечника
- кровотечение из заднего прохода
- ощущение, что вам нужно опорожнить кишечник, но вы не можете идти.
Проблемы с кишечником, как правило, легкие и встречаются реже, чем после дистанционной лучевой терапии. Со временем они часто поправляются, но у некоторых мужчин возникают проблемы через несколько лет после лечения.Постарайтесь не стесняться рассказывать своему врачу или терапевту о проблемах с кишечником. Есть методы лечения, которые могут помочь.
У небольшого количества мужчин может быть кровотечение из заднего прохода после брахитерапии. Это также может быть признаком других проблем, таких как геморрой (геморрой), или более серьезных проблем, таких как рак кишечника, поэтому сообщите медсестре или терапевту о любом кровотечении. Они могут провести тесты, чтобы выяснить, что его вызывает. Они также могут рассказать вам о способах лечения, которые могут помочь.
Использование ректального спейсера для защиты заднего прохода
Ваш врач или рентгенолог может посоветовать использовать ректальный спейсер, чтобы защитить внутреннюю часть заднего прохода от радиационного поражения.Прокладка помещается между простатой и задним ходом. Это означает, что меньше радиации достигает вашего заднего прохода, что может помочь снизить риск проблем с кишечником.
Ректальные спейсеры не используются только в постоянной брахитерапии с семенами. Но он может быть у вас, если вы также проходите дистанционную лучевую терапию. Если в вашей больнице не используются ректальные спейсеры, вы можете получить их в частном медицинском учреждении или в ходе клинических испытаний. За дополнительной информацией обратитесь к своему врачу, медсестре или рентгенологу.
Скрининг рака кишечника
Если вас пригласили принять участие в программе обследования кишечника NHS вскоре после брахитерапии, тест может выявить немного крови при дефекации, даже если вы сами не видите ее. Ваш врач, медсестра или рентгенолог могут посоветовать вам отложить обследование кишечника на несколько месяцев, если вы недавно проходили брахитерапию. Это поможет убедиться, что вы не получите неверных результатов.
У небольшого числа мужчин в кишечнике появляется кровь после постоянной брахитерапии семенами, и это не должно вызывать беспокойства.Но если вы заметили кровь, вы всегда должны сообщить об этом своему врачу, медсестре или рентгенологу.
Сексуальные побочные эффекты
Брахитерапия может воздействовать на кровеносные сосуды и нервы, контролирующие эрекцию. Это может вызвать проблемы с получением или сохранением эрекции (эректильная дисфункция). Проблемы с эрекцией могут возникнуть не сразу после лечения, но иногда развиваются спустя некоторое время.
Риск долгосрочных проблем с эрекцией после брахитерапии варьируется от мужчины к мужчине. У вас может быть больше шансов иметь проблемы, если у вас были проблемы с эрекцией до лечения, или если вы также проходите гормональную терапию или дистанционную лучевую терапию.
Если вы занимаетесь анальным сексом и предпочитаете быть проникающим партнером (вверху), вам обычно нужна сильная эрекция, поэтому проблемы с эрекцией могут быть особой проблемой.
Существуют способы решения проблем с эрекцией, в том числе методы лечения, которые могут помочь сохранить эрекцию достаточно твердой для анального секса. Спросите об этом своего врача или медсестру или поговорите с нашими медсестрами-специалистами.
Вы можете производить меньше спермы, чем до лечения, или вообще не производить. Это может быть постоянным побочным эффектом брахитерапии.Ваш оргазм может быть другим, или вы можете почувствовать некоторую боль в половом члене во время оргазма. Вы также можете заметить небольшое количество крови в сперме. Обычно это не проблема, но если это произойдет, сообщите об этом своему врачу или медсестре. Некоторые мужчины испытывают более слабый оргазм, чем до лечения, и небольшое количество мужчин больше не могут испытывать оргазм после этого.
Если вы занимаетесь анальным сексом и являетесь восприимчивым партнером (внизу), существует риск того, что ваш партнер может подвергнуться некоторому воздействию радиации во время секса в первые несколько месяцев после лечения.Ваш врач или рентгенолог может посоветовать вам избегать анального секса в течение первых шести месяцев. Маловероятно, что анальная игра выведет семена брахитерапии из простаты, но обратитесь к своему врачу, медсестре или рентгенологу за дополнительной информацией о том, как заниматься анальным сексом после постоянной брахитерапии. Они могут дать вам конкретный совет о том, как долго ждать до секса, с учетом вас и вашего лечения.
Если вы предпочитаете быть восприимчивым партнером во время анального секса, то проблемы с кишечником или чувствительный задний проход после постоянной брахитерапии с семенами могут повлиять на вашу сексуальную жизнь.Даже когда риск радиации для вашего партнера миновал, подождите, пока не исчезнут какие-либо проблемы с кишечником, прежде чем пробовать анальную игру или секс.
Узнайте больше о побочных эффектах сексуального характера после лечения рака простаты. У нас также есть конкретная информация, если вы гей или бисексуал. А в нашем интерактивном онлайн-руководстве есть много советов по решению сексуальных проблем.
Имеет детей
Брахитерапия может сделать вас бесплодным, а это значит, что вы не сможете иметь детей естественным путем.Но некоторые мужчины все же могут забеременеть после брахитерапии.
Вполне возможно, что радиация может изменить вашу сперму, и это может повлиять на всех детей, которых вы зачали. Риск этого очень низок, но используйте противозачаточные средства в течение как минимум года после лечения, если есть вероятность, что вы можете забеременеть. За дополнительной информацией обратитесь к своему врачу или клиническому онкологу.
Если вы планируете иметь детей в будущем, вы можете сохранить свою сперму до начала лечения, чтобы вы могли использовать ее позже для лечения бесплодия.Если это важно для вас, спросите своего врача, медсестру или рентгенолога, доступно ли хранилище спермы на месте.
Усталость (утомляемость)
Вы можете чувствовать усталость в первые несколько дней после лечения, когда оправляетесь от наркоза. Воздействие радиации на тело может вызывать более длительное чувство усталости, особенно если вы также проходите дистанционную лучевую терапию или гормональную терапию. Если вы часто встаете ночью, чтобы помочиться, это также может вызывать у вас усталость днем.
Усталость — это сильная усталость, которая может повлиять на вашу повседневную жизнь. Это может повлиять на ваш уровень энергии, мотивацию и эмоции. Усталость может продолжаться после завершения лечения и может длиться несколько месяцев.
Есть вещи, которые помогут вам справиться с усталостью. Например, вы планируете свой день так, чтобы получать максимальную отдачу от того, когда у вас появляется больше энергии. Узнайте больше об утомляемости или получите советы по борьбе с утомляемостью в нашем интерактивном онлайн-руководстве. Наши медсестры-специалисты также предлагают услуги поддержки при утомлении, которые со временем помогут вам уменьшить усталость.
Должны ли мы прекратить выполнение спасательной гистерэктомии после химиолучевой терапии и брахитерапии при местнораспространенном раке шейки матки?
Abstract
Предпосылки / цель: Мы оценили пациентов, перенесших спасительную гистерэктомию после брахитерапии (BT) после сопутствующей химиолучевой терапии (CRT) по поводу местнораспространенного рака шейки матки (LACC), когда предполагалось остаточное заболевание. Пациенты и методы: С 2004 по 2013 год 29 пациентам была проведена радикальная гистерэктомия в Gustave Roussy по поводу подозрения на клиническую и / или радиологическую резидуальную болезнь.Оценивались исходы, заболеваемость и точность оценки ответа на СРТ и БТ. Результаты. Частота осложнений> IIIa степени составила 24%, без разницы между 14 пациентами с гистологическим резидуальным заболеванием и 15 пациентами с полным ответом. Магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография-компьютерная томография (ПЭТ-КТ) показали чувствительность 92% и 100%, но низкую специфичность менее 40%. Три рецидива произошли у пациентов с остаточным заболеванием (головной мозг, ректосигмовидная кишка, брюшина и легкое).Заключение: Клиническое обследование, МРТ и ПЭТ-КТ не оптимальны для диагностики остаточной болезни после ХРТ и БТ. Заболеваемость адъювантной гистерэктомией высока и не предотвращает рецидивов.
Брахитерапия (BT) после сопутствующей химиолучевой терапии (CRT) является стандартным методом лечения местнораспространенного рака шейки матки (LACC: стадия ≥IB2 по классификации Международной федерации гинекологии и медицины [FIGO]). Из-за сопутствующей ЭЛТ и адаптивной БТ под управлением 3D-изображений возможно повышение дозы, обеспечивающее отличный локальный контроль при одновременном экранировании органов, подверженных риску (1, 2).Адъювантная гистерэктомия не влияет на пациентов с полным ответом после БТ после СРТ (3-8), но продолжает вызывать споры при подозрении на остаточное заболевание (8). Оценка остаточного поражения шейки матки сомнительна. Магнитно-резонансная томография (МРТ) не является оптимальным методом для прогнозирования ответа на начальное лечение из-за риска ложноположительных результатов (9, 10). Помимо трудностей, возникающих при оценке ответа на СРТ и БТ, спасительная гистерэктомия вызывает высокий уровень послеоперационных осложнений (~ 25%) (11, 12).Цели этого исследования заключались в оценке исходов и заболеваемости у пациентов, перенесших спасительную гистерэктомию по поводу подозрения на остаточную LACC после CRT с последующей BT. Также оценивалась точность клинической и радиологической оценки ответа на CRT и BT.
Пациенты и методы
Все эксперименты проводились ретроспективно и в соответствии с французским Законом о биоэтике 2004-800, Хартией этики Французского национального института рака (INCa) и после одобрения наблюдательным советом и этическим комитетом Гюстава Русси.Во французском правовом контексте наш институциональный наблюдательный совет отказался от письменного информированного согласия участников. Данные были проанализированы анонимно. Мы ретроспективно идентифицировали пациентов, получавших BT после сопутствующей CRT с 2004 по 2013 год по поводу местнораспространенного рака шейки матки (LACC) в Gustave Roussy. Также были обследованы пациенты, направленные из других центров после CRT для BT и завершающей операции. Плоскоклеточные карциномы и аденокарциномы были включены, тогда как мелкоклеточные и светлоклеточные карциномы были исключены.Включения были ограничены стадиями, превышающими IB2 согласно классификации FIGO. После первоначального лечения была проведена клиническая и радиологическая оценка. Были включены только пациенты, перенесшие спасительную гистерэктомию из-за клинического и / или радиологического подозрения на остаточную болезнь.
Таблица I.Классификация диндо (19).
Первичное лечение. Всем пациентам была проведена конформная лучевая терапия тазовых органов (ДЛТ) с дозой 45-50,4 Гр в 25-28 долях от 1.8 Гр в течение 5 недель (13). Систематически применялась сопутствующая химиотерапия цисплатином (40 мг / м 2 ). Последовательные узловые бустеры проводились после завершения БТ на основе размеров и характеристик узлов на начальных МРТ / КТ или положительных результатах ПЭТ-КТ. Целью было доставить общую дозу 60 Гр на все положительные узлы. После EBRT была проведена адаптивная BT с визуальным контролем в соответствии с рекомендациями GEC-ESTRO (Groupe Européen de Curiethérapie — Европейское общество радиационной онкологии) (14, 15).Персонализированный вагинальный слепок использовался почти во всех случаях (16). Интересующие структуры были очерчены в соответствии с рекомендациями GEC-ESTRO (14). Дозиметрию начинали со стандартного рецепта 15 Гр.
Оценка после лечения. Пациенты прошли клиническое обследование, по крайней мере, через 3 недели после окончания брахитерапии. У некоторых пациентов были взяты цитологические и биопсийные образцы. Клиническая категоризация гинекологического осмотра была ретроспективно основана на отчете о консультации по окончании лечения.Радиологическая оценка остаточного заболевания также проводилась на той же неделе клинического обследования с помощью МРТ органов малого таза и / или ПЭТ-КТ. Чувствительность, специфичность, а также положительные и отрицательные прогностические значения каждого обследования были рассчитаны путем сравнения результата обследования с гистологическим анализом образца восстановленной гистерэктомии.
Парааортальная стадия и радикальная гистерэктомия. Гистерэктомию обычно назначают через 8-12 недель после завершения БТ.До 2007 года стадия парааортального узла (PAN) выполнялась во время спасительной гистерэктомии. С 2007 года пациентам с отрицательными результатами МРТ и ПЭТ-КТ на уровне PAN проводилась лапароскопическая стадия, и решение о расширении полей лучевой терапии было основано на гистологических результатах (17). Поскольку положительная прогностическая ценность ПЭТ-КТ высока, лапароскопическая стадия не проводилась у пациентов с положительным результатом сканирования PAN, и была проведена лучевая терапия с расширенным полем (18).
Результаты. После гистерэктомии ширина микроскопического резидуального поражения не превышала 1 см. Пациенты наблюдались каждые 4 месяца в течение 3 лет, затем каждые 6 месяцев в течение 2 лет, а затем ежегодно. Никакого специального обследования в дополнение к клиническому обследованию не рекомендовалось. КТ, МРТ и / или ПЭТ-КТ выполнялись только в зависимости от симптомов. Локальные рецидивы определялись как любые рецидивы во влагалищной манжете, влагалище и параметрии. Время и выживаемость определялись с момента постановки диагноза (первая биопсия).Заболеваемость оценивалась по классификации Dindo (19) (таблица I).
Результаты
Тридцать один пациент с клиническим и / или радиологическим подозрением на остаточное заболевание подвергся спасительной гистерэктомии. Два пациента были исключены из-за гистологического типа (мелкоклеточная карцинома и нейроэндокринная опухоль соответственно), и 29 пациентов соответствовали критериям включения. Характеристики пациентов суммированы в таблице II, а также описаны в соответствии с типом ответа после BT после CRT (остаточное заболевание или полный ответ).Данные по обеим группам были схожими. Средний возраст постановки диагноза рака составил 45,8 года. Пациенты имели клинические стадии IB2 (n = 8), IIA (n = 2), IIB (n = 18) и III (n = 1) по классификации FIGO. У 22 пациентов был плоскоклеточный рак, а у 7 пациентов — аденокарцинома. У четырех пациентов была инвазия тазовых лимфатических узлов при начальной рентгенологической стадии. Девяти пациентам была выполнена парааортальная лимфаденэктомия для хирургической стадии, а у одного пациента было поражение узлов. Другим пациентам была выполнена парааортальная лимфаденэктомия во время спасительной гистерэктомии.Средняя продолжительность СРТ с последующей БТ составила 47,4 дня, а средний интервал от БТ до спасительной гистерэктомии — 76 дней. Согласно классификации Querleu, радикальная гистерэктомия относилась к типу A у 19 пациентов, типу B у 5 и типу C у 5. Пять пациентов прошли лапароскопию, остальные — лапаротомия. У четырнадцати пациентов была гистологически подтвержденная остаточная болезнь (микроскопическая у 5 и макроскопическая у 9).
Таблица II.Характеристики пациента.
Двум пациентам была выполнена тазовая лимфаденэктомия с поражением узлов у обоих.У трех пациентов были положительные парааортальные лимфатические узлы, все макрометастазы (> 5 мм). Среди этих трех пациентов одному была проведена парааортальная лимфаденэктомия для хирургической стадии и, следовательно, была проведена парааортальная лучевая терапия (45 Гр). Двум другим пациентам была выполнена парааортальная лимфаденэктомия во время спасительной гистерэктомии без дополнительной лучевой терапии. У одного из этих двух пациентов были положительные лимфатические узлы таза.
Обследование после БТ после сопутствующей ЭЛТ. Клиническое обследование, МРТ и ПЭТ-КТ выявили чувствительность 93%, 92% и 100% соответственно. Специфичность каждого метода составила 40%, 0% и 33% соответственно.
В одном случае был достигнут полный ответ на МРТ, но ПЭТ-КТ выявила остаточное заболевание, что было подтверждено гистологическим анализом. У семи пациентов была отрицательная биопсия шейки матки (n = 3) или цитология (n = 4), но у всех из них была подтверждена остаточная болезнь на МРТ и после гистологического анализа (таблицы III, IV, V, VI).
Послеоперационные осложнения. Частота осложнений, превышающих степень IIIa, составила 24%, без разницы между 14 пациентами с гистологически подтвержденным остаточным заболеванием и 15 пациентами с полным ответом (21% и 27% соответственно) (Таблица VII). Типы хирургических вмешательств в двух группах были схожими. Наиболее частыми осложнениями были: связанные с лимфореей: одному пациенту была сделана пункция тазового абсцесса, другому — пункция лимфоцеле под контролем КТ, вызвавшая почечную обструкцию, и еще один пациент имел хилезный асцит, требующий лапаротомии по поводу хирургического лимфостаза.У одного пациента был свищ мочеточника с односторонней обструкцией почек, который лечили с помощью стента с двойной косичкой. У трех пациентов был ректовагинальный свищ, который был связан со свищом мочевого пузыря у одного из них. В трех случаях колостомия была выполнена.
Таблица III.Обследование после БТ после сопутствующей CRT (клиническое обследование).
Таблица IV.Обследование после БТ после сопутствующей CRT (цитология шейки матки или биопсия).
Таблица V.Оценка после БТ после сопутствующей СРТ (МРТ).
Таблица VI.Обследование после БТ после сопутствующей CRT (ПЭТ-КТ).
Пациенты с остаточной болезнью. У четырнадцати пациентов была гистологически подтвержденная остаточная болезнь (микроскопическая в 5 и макроскопическая у 9) с инвазией лимфоваскулярного пространства (LVSI) в 50% случаев (n = 2 для микроскопических и n = 5 для макроскопических остаточных заболеваний). Средний размер опухоли составлял 19 мм (диапазон = 6-40 мм). У двух пациентов хирургический край был положительным. У одного пациента была инвазия только в тазовые лимфатические узлы (но не была проведена парааортальная лимфаденэктомия), у одного была инвазия только в парааортальные лимфатические узлы (но без тазовой лимфаденэктомии) и у одного была инвазия в тазовые и парааортальные лимфатические узлы.Все пациенты с положительными лимфатическими узлами имели LVSI.
Рецидивы после хирургических вмешательств. Три рецидива возникли у пациентов с гистологически подтвержденной резидуальной болезнью и LVSI. Подробности представлены в Таблице VIII. У двух пациентов была микроскопическая остаточная болезнь, а у одного — макроскопическая остаточная болезнь. Местами рецидива были головной мозг, ректосигмовидная кишка, брюшина ( карциноз ) с пораженными тазовыми лимфатическими узлами и метастазы в легкие.
Таблица VII.Послеоперационные осложнения.
Обсуждение
Лишь небольшому числу пациентов с LACC требуется завершающая операция. Сочетание ЭЛТ и адаптивной технологии BT под управлением 3D-изображения обеспечивает превосходное локальное управление. В литературе полный ответ наблюдается у 80-95% пациентов (20, 21). За время нашего длительного периода исследования (10 лет) только 32 пациента имели клиническое или радиологическое подозрение на остаточное заболевание после БТ после СРТ.
В нашем исследовании послеоперационные осложнения ≥ 3 степени возникали часто (24%).Частота была схожей в случаях остаточной болезни или полных ответов, а типы хирургических вмешательств, согласно классификации Querleu, были одинаковыми в обеих группах. Частота наших осложнений была такой же, как и у Touboul et al . у 140 пациентов, пролеченных по поводу LACC: 25% пациентов испытали 55 послеоперационных осложнений. Риск осложнений был выше при наличии остаточной болезни ( p = 0,01) (12). В исследовании, опубликованном Азрией и др. .Спасательная гистерэктомия была выполнена 10 пациентам с резидуальной опухолью большого размера (> 2 см) и у 4 пациентов возникли осложнения 3 степени (5). Таким образом, уровень заболеваемости этой процедуры остается высоким даже при проведении малоинвазивных операций. Colombo et al . Сообщили о 28,3% осложнений при лапароскопическом доступе (22). В нашем исследовании только пяти пациентам был проведен лапароскопический доступ, но частота осложнений была аналогичной: 24% против 28,3%. Более того, не было различий в послеоперационных осложнениях ≥ 3 степени в зависимости от гистологического статуса: 27% для отсутствия гистологически подтвержденного заболевания и 21% для гистологически подтвержденного заболевания.Даже для пациентов с гистологически подтвержденным остаточным заболеванием польза спасительной гистерэктомии кажется сомнительной. И наоборот, уровень заболеваемости (около 25%) определен даже для пациентов без гистологически подтвержденной резидуальной болезни, у которых эта операция не принесла никакой пользы. Актуальный вопрос заключается в том, как мы можем идентифицировать пациентов, у которых определенно есть остаточная болезнь, чтобы продолжить операцию только у этих пациентов и избежать бессмысленных операций у пациентов без остаточной болезни. К сожалению, точность оценки ответа на лечение до операции оставляет желать лучшего.ПЭТ-КТ и клиническое обследование выявили лучшую чувствительность в нашей серии. Но специфичность МРТ, ПЭТ-КТ и клинического обследования никогда не превышала 50%. Это согласуется с серией, описанной Винсенсом и др. ., Относительно 44 пациентов, перенесших гистерэктомию после СРТ и БТ по поводу рака шейки матки стадии IB2 / II. Чувствительность и специфичность МРТ при оценке остаточной болезни составляли 80% и 55% соответственно (10). Оценка объема опухоли после CRT и BT может быть затруднена из-за нормальных изменений тканей, окружающих остаточную опухоль.МРТ и ПЭТ с диффузионным взвешиванием могут быть многообещающими (23, 24). Лин и др. . определили объем опухоли с помощью FDG-PET в проспективном исследовании 32 пациентов. Они показали эту опухоль уменьшение объема произошло в течение 20 дней после начала терапии (23). Fanfani et al ., Оценили биопсию конуса после неоадъювантной сопутствующей CRT у 74 пациентов с LACC (25). Авторы сообщили об отрицательной прогностической ценности 100%, но осуществимость составила около 75%. Действительно, 15 пациентов были исключены из-за «невозможности проведения биопсии конуса».Следовательно, при подозрении на остаточное заболевание, биопсия конуса может быть вариантом (если это возможно), чтобы избежать хирургического вмешательства, если результаты биопсии отрицательны.
Таблица VIII.Характеристика больных с рецидивом.
В нашей ретроспективной серии произошло три рецидива, все они у пациентов с остаточной болезнью. Не было различий в характере рецидива (локально-региональный против отдаленного) среди пациентов с макроскопической остаточной болезнью по сравнению с пациентами с микроскопической остаточной опухолью.Mazeron et al ., Показали, что сопутствующая ЭЛТ с последующей БТ с трехмерным изображением дает отличную скорость локорегионального контроля (13). Даже у пациентов с остаточным заболеванием после сочетанной ХРТ и БТ эффективность спасительной гистерэктомии с точки зрения выживаемости не доказана (8, 26).
Это моноцентрическое ретроспективное исследование. Невозможно было провести анализ выживаемости, и размер нашей популяции был небольшим. Из-за эффективности CRT с последующим BT, остаточное заболевание не характерно для LACC, и ожидался высокий уровень наблюдаемых полных ответов.Тем не менее, наше исследование позволило нам определить основные проблемы для LACC. Основная проблема заключается не в завершающей операции, а в ведении пациентов с неполным ответом на БТ после СРТ. Одно исследование продемонстрировало значительную пользу адъювантной химиотерапии после СРТ. Пациенты с LACC (стадии IIB-IV), получавшие цисплатин-гемцитабин как во время, так и после лучевой терапии, достигли лучшей выживаемости без прогрессирования и общей выживаемости (27). Неоадъювантная химиотерапия перед лучевой терапией может быть вариантом.Обзор 18 исследований с участием 2074 пациентов, опубликованный в 2006 г., продемонстрировал, что время и интенсивность дозы неоадъювантной химиотерапии на основе цисплатина до лучевой терапии могут иметь прогностический эффект. Однако данные неоднородны и требуют подтверждения (28). Недавние исследования были сосредоточены на новых системных стратегиях, которые могут улучшить выживаемость пациентов с персистирующим, рецидивирующим или метастатическим раком шейки матки. В рандомизированном исследовании III фазы Группы гинекологической онкологии (GOG 240) оценивалась эффективность комбинированной химиотерапии бевацизумабом и неплатиновой терапией у пациентов с рецидивирующим, персистирующим или метастатическим раком шейки матки (29).В этом испытании участвовали 452 пациента с LACC, которые получали 1 из 4 возможных комбинированных схем: цисплатин / паклитаксел; топотекан / паклитаксел; цисплатин / паклитаксел / бевацизумаб; или топотекан / паклитаксел / бевацизумаб. Результаты показали значительное улучшение общей выживаемости среди пациентов, получавших антиангиогенное средство (17,0 против 13,3 месяцев; p = 0,004). Топотекан / паклитаксел не превосходил цисплатин / паклитаксел. Основываясь на этих данных, FDA недавно одобрило бевацизумаб в качестве компонента комбинированной терапии с паклитакселом и цисплатином или топотеканом для лечения стойкого, рецидивирующего или метастатического рака шейки матки (30).В случае подозрения на резидуальную болезнь эту стратегию с использованием адъювантной химиотерапии и бевацизумаба следует оценить в испытании. Совсем недавно в исследовании NRG Oncology / GOG было проанализировано прогностическое влияние бевацизумаба в соответствии с категориями риска на основе критериев Мура (черная раса, рабочий статус 1, заболевание тазовых органов, предшествующий цисплатин и интервал без прогрессирования <365 дней). Авторы пришли к выводу, что польза от бевацизумаба была наибольшей в подгруппах умеренного (2-3 фактора) и высокого риска (4-5 факторов) (a 5.8-месячное увеличение медианы ОС). Однако преимущество в выживаемости было небольшим для пациентов с низким риском (фактор 0–1), и опасения по поводу токсичности могут оправдать отказ от бевацизумаба в этом случае (31).
Заключение
Клиническое обследование, МРТ и ПЭТ-КТ остаются неоптимальными для диагностики остаточной болезни после сопутствующей CRT и BT при LACC. Заболеваемость, вызванная адъювантной гистерэктомией, высока, и эта хирургическая процедура не предотвращает местные или отдаленные рецидивы. Судя по литературе и нашим результатам, основной проблемой является не завершающая операция.Нам необходимо точно идентифицировать пациентов с остаточным заболеванием после ХРТ и БТ и определять для них наилучшее лечение.
Сноски
Вклад авторов
Все авторы вносят существенный вклад в концепцию и дизайн, и / или сбор данных, и / или анализ и интерпретацию данных: C.C, A.L. и C.G. собраны кейсы. М.Г. заполнены все данные. С.Г. и М.Г. разработал исследование и проанализировал данные. С.Г., М.Г. и П. соавтор статьи.C.C. и А.Л. переработали материалы и методы. ЯВЛЯЮСЬ. и Э. критически переработана статья. Все Авторы и дали окончательное одобрение версии, которая будет представлена.
Эта статья находится в свободном доступе в Интернете.
Конфликт интересов
Авторы не заявляют о конфликте интересов, и это исследование не получало финансовой поддержки.
- Поступила 19 апреля 2019 г.
- Доработка получена 21 мая 2019 г.
- Принята 24 мая 2019 г.
Vol. 197, No. 2 (AJR)
Метод брахитерапии с использованием высокой мощности дозы (HDR) 192 Метод постнагрузки Ir недавно был разработан для преодоления неоднородного распределения дозы при брахитерапии с интерстициальными семенами и был предложен в качестве лечебное лечение локализованного рака простаты [1–5].Более того, ожидалось, что HDR-брахитерапия улучшит качество жизни пациентов после терапии [1–5]. С другой стороны, недавние исследования показали, что клиническая неудача в виде местных или систематических рецидивов возникает примерно у 6,1–30% пациентов после лечения HDR-брахитерапией [1–5]. Местный рецидив после HDR-брахитерапии может быть устранен при помощи простатэктомии, брахитерапии, термотерапии или криотерапии, аналогично местному рецидиву после дистанционной лучевой терапии (ДЛТ) или брахитерапии с низкой мощностью дозы [6–8].Поскольку повышение уровня простатоспецифического антигена (ПСА) не является надежным маркером для дифференциации местного рецидива от отдаленного рецидива [9, 10], полезность методов визуализации, таких как МРТ [11–16], 11 C-ацетат Сообщалось о ПЭТ [17] и 111 В Prosta-Scint SPECT [18] при обнаружении местного рецидива после ДЛТ.
В диагностике локально рецидивирующих участков после ДЛТ с использованием МРТ, полезность Т2-взвешенной МРТ [11], динамической МРТ с контрастным усилением (DCE-MRI) [15, 16], МРТ-спектроскопической визуализации (MRSI) [12– 14], и диффузионно-взвешенная визуализация (DWI) [11].Кроме того, полезность DWI с кажущимся коэффициентом диффузии (ADC) не только в диагностике рака простаты, возникающего в периферической зоне (PZ) и переходной зоне (TZ), но также в оценке дифференциации опухоли рака простаты. сообщается в последние годы в ряде предварительных исследований. Это привело к большим ожиданиям клинического применения в качестве дополнительного метода, дополняющего Т2-взвешенную визуализацию, DCE-MRI и MRSI [11, 19–27]. Соответственно, можно ожидать, что эти методы МРТ покажут высокую выявляемость опухоли даже при местном рецидиве после HDR-брахитерапии.Однако, насколько нам известно, не сообщалось об исследованиях, оценивающих обнаружение местного рецидива после HDR-брахитерапии с использованием МРТ. Таким образом, целью этого исследования было ретроспективно оценить T2-взвешенную МРТ, DCE-MRI и DWI в выявлении и локализации локально рецидивирующего рака простаты после HDR-брахитерапии.
Характеристики пациентаМатериалы и методы Выбирать К началу страницыABSTRACTМатериалы и методы << РезультатыОбсуждениеСсылки ЦИТИРУЮЩИЕ СТАТЬИ Все протоколы исследования были одобрены наблюдательным советом учреждения.От пациентов отказались от необходимости получать информированное согласие.
Для включения в исследование у пациента должна быть диагностирована биохимическая недостаточность (текущий надир уровня ПСА плюс 2 нг / мл) после HDR-брахитерапии при раке простаты [28], общая ожидаемая продолжительность жизни должна превышать 5 лет. и прошли МРТ простаты перед систематической биопсией простаты под ультразвуковым контролем для гистопатологического исследования рецидивирующего рака простаты. В результате в исследование были включены 16 последовательных пациентов (средний возраст 69 лет; диапазон 59–79 лет), которым проводилась МРТ в период с декабря 2006 г. по сентябрь 2007 г.Общее количество пациентов, получивших HDR-брахитерапию за тот же период (с мая 2003 г. по сентябрь 2005 г.), что и эта популяция исследования, составило 206.
Средний уровень ПСА при первоначальном диагнозе составлял 27,57 нг / мл (диапазон 4,50–139,00 нг / мл. ), а средний балл по шкале Глисона для опухоли составлял 7 (диапазон 6–9). Клиническая стадия до лечения этих пациентов была T1 ( n = 3), T2 ( n = 8) или T3 ( n = 5). Ни у одного из пациентов до лучевой терапии не наблюдалось клинического или патологического поражения лимфатических узлов или отдаленных метастазов.Эти пациенты получали лечение с использованием как EBRT, так и HDR-брахитерапии ( n = 11) для пациентов с факторами риска от среднего до высокого (исходный уровень ПСА ≥ 10 нг / мл; оценка Глисона ≥ 7; или стадия заболевания T2b – T3. ) или только HDR-брахитерапия ( n = 5) для пациентов с низкими факторами риска (исходный уровень ПСА <10 нг / мл; оценка Глисона <7; и стадия болезни T1c – T2a).
Лечение HDR-брахитерапией и EBRT состояло из HDR-брахитерапии с использованием Afterloader (microSelectron HDR, Nucletron) в четырех фракциях по 6.0 Гр в течение 30 часов для общей дозы 24,0 Гр и ДЛТ (четыре порта) на простату в 16 фракциях по 2,3 Гр для общей дозы 36,8 Гр. Лечение только с помощью HDR-брахитерапии включало HDR-брахитерапию с использованием Afterloader в пяти фракциях по 7,5 Гр в течение 30 часов с общей дозой 37,5 Гр. Иглы аппликатора оставались вставленными в течение 30-часового периода облучения, а затем были удалены. Семь пациентов с объемом простаты более 30 см 3 прошли неоадъювантную гормональную терапию для уменьшения размера простаты перед лучевой терапией.После лучевой терапии ни один из пациентов не получал адъювантную гормональную терапию. Средний интервал от лучевой терапии до МРТ составлял 30 месяцев (диапазон от 15 до 51 месяца), а от МРТ до последующей биопсии — 9 дней (от 1 до 31 дня). Средний уровень ПСА до МРТ составлял 7,42 нг / мл (диапазон 2,93–26,59 нг / мл).
МРТМРТ выполняли с использованием 1,5-Т МРТ сканера (Signa EXCITE, GE Healthcare; максимальная амплитуда градиента 33 мТл / м; максимальная скорость нарастания 77 мТл / м / с). Катушка тела использовалась для возбуждения сигнала, с многоканальной катушкой с фазированной решеткой для приема сигнала.После внутримышечного введения глюкагона для уменьшения перистальтики кишечника визуализация проводилась у всех пациентов натощак.
Протоколы МРТ включали T1-взвешенное быстрое спин-эхо (FSE) в поперечной плоскости, T2-взвешенное FSE-изображение в поперечной и корональной плоскостях, T2-взвешенное эхопланарное изображение (EPI) в поперечной плоскости, DWI в поперечной плоскости. поперечная плоскость, DCE-MRI в поперечной плоскости и T1-взвешенное изображение FSE с усилением контраста в поперечной плоскости.Поперечное T1-взвешенное изображение FSE было выполнено для оценки кровоизлияния в предстательной железе. Поперечная Т2-взвешенная визуализация ФСЭ выполнялась через предстательную железу и семенные пузырьки. В дополнение к T2-взвешенным последовательностям также выполнялся поперечный T2-взвешенный EPI. Поперечный DWI был выполнен с использованием многосекционной одноразовой EPI-последовательности спин-эхо. Карты АЦП были восстановлены путем вычисления АЦП в каждом пикселе каждого среза. Поперечная DCE-MRI была выполнена с использованием последовательности FSE с техникой подавления жира, охватывающей простату от верхушки до основания, в дополнение к семенным пузырькам.Сбор данных для DCE-MRI начался одновременно с началом внутривенной инъекции гадопентетата димеглумина (Magnevist, Bayer Schering Pharma) в концентрации 0,1 ммоль / кг массы тела в течение 10 секунд через периферическую внутривенную канюлю с последующей промывкой 40 мл физиологического раствора. Многофазные изображения DCE (пять фаз) получали каждые 30 секунд в течение 2 минут 30 секунд без задержки дыхания пациентами. Технические параметры последовательностей импульсов МРТ перечислены в таблице 1.
ТАБЛИЦА 1: Последовательности МРТ, используемые для визуализации простаты
Интерпретация изображений и анализ данныхДва радиолога с 8 и 4 годами опыта в МРТ простаты провели согласованный обзор МРТ для всех 16 пациентов.Авторы обзора знали, что пациентам был поставлен диагноз биохимической недостаточности после HDR-брахитерапии по поводу рака простаты, но не знали обо всех других клинических и гистопатологических данных.
Т1-взвешенных изображений были оценены, чтобы подтвердить, что ни у одного из субъектов не было признаков кровоизлияния в простату. Кровоизлияние считалось присутствующим, когда на T1-взвешенных изображениях определялась область гиперинтенсивности сигнала в предстательной железе [22].
Рецензенты оценили степень нечеткости зоны после облучения и степень диффузного снижения интенсивности сигнала Т2 в железе как отсутствующую, промежуточную или выраженную, используя методы, описанные Coakley et al.[12]. Зональная нечеткость считалась отсутствующей, если простата имела зональную дифференцировку, аналогичную той, которая наблюдается в необлученной предстательной железе, и считалась заметной, если PZ и TZ были почти неразличимы. Все остальные степени зональной нечеткости считались промежуточными. Диффузно сниженная интенсивность сигнала T2 считалась отсутствующей, если интенсивность сигнала T2-взвешенных изображений в предстательной железе напоминала интенсивность сигнала в необлученной предстательной железе, и считалась отмеченной, если интенсивность сигнала T2 в предстательной железе была такой же или ниже, чем у близлежащих необлученных. мышца.Все остальные степени диффузно сниженной интенсивности сигнала Т2 считались промежуточными.
Чтобы различать PZ и TZ, обозреватели использовали Т2-взвешенное МРТ, потому что зональная анатомия простаты видна только на этих изображениях [29]. Ориентирами для различения PZ и TZ были уретра и капсула предстательной железы. Любая хирургическая псевдокапсула, разделяющая TZ и PZ, также использовалась в качестве ориентира. В PZ срезы шейки мочевого пузыря и проксимального отдела простатической уретры рассматривались как основа, тогда как верхушка предстательной железы определялась по форме пончика дистальной части простатической уретры.Остальная часть ПЗ считалась средней [30].
Восемь областей на снимках МРТ (описанных далее в статье) были индивидуально оценены на предмет выявления рака простаты. Рак простаты был локализован независимо в каждом исследовании МРТ в соответствии со стандартными критериями. Каждая МРТ одного и того же пациента просматривалась с минимальным интервалом в 3 недели. На снимках МРТ поражения, удовлетворяющие следующим критериям, считались раком простаты: на Т2-взвешенных изображениях (FSE или EPI или оба), область однородной гипоинтенсивности сигнала с масс-эффектом в PZ, область ограниченной круглой или треугольной формы. локализованная гипоинтенсивность сигнала в PZ [31] или область в TZ с гомогенной гипоинтенсивностью сигнала, нечеткими краями и отсутствием капсулы, с линзовидной формой или без линзообразной формы и инвазией передней фибромускулярной стромы [29]; на картах DWI и ADC — область с гиперинтенсивностью фокального сигнала на DWI и с гипоинтенсивностью фокального сигнала на карте ADC относительно фоновой паренхимы простаты; или на DCE-MRI, область с фокальным ранним усилением, большим, чем фоновая паренхима предстательной железы, до третьей фазы (60 секунд после введения контрастного вещества) и вымывания или пролонгированного улучшения в отсроченной фазе (четвертая и пятая фазы).При интерпретации изображений из DWI и DCE-MRI использовалась T2-взвешенная визуализация, чтобы подтвердить анатомические положения после оценки каждого изображения. В многопараметрической МРТ, когда положительный результат в соответствии с вышеупомянутыми критериями был признан по крайней мере для одного из трех модальностей в каждой области для каждого пациента, считалось, что область содержит рак простаты.
Справочный стандартВсего у каждого пациента было взято 12 образцов (восемь из PZ и четыре из TZ) во время трансректальной систематической биопсии простаты под контролем УЗИ урологом с 13-летним опытом проведения биопсии простаты под контролем УЗИ.Сайты биопсии включали правую основу, правую середину, правую верхушку, дальнюю боковую правую часть, левое основание, левую середину, левую верхушку и дальние боковые области слева в PZ, а также двусторонние вентральные и дорсальные области в TZ. Согласно участкам биопсии, предстательная железа была разделена на восемь областей на снимках МРТ: то есть основание справа в PZ, среднее справа и дальнее латеральное справа в PZ, верхушка справа в PZ, вентральная и дорсальная справа в TZ, основание слева в PZ, средний левый и дальний латеральный левый в PZ, верхушка слева в PZ, а также вентральная и дорсальная левая в TZ были обозначены как правое основание, правое срединное, правое верхушечное, правое TZ, левое основание, левое среднее, левое вершина и TZ. слева соответственно.Участок опухоли на каждом МРТ-сканировании считался соответствующим гистологическим данным радиолога с 8-летним опытом в МРТ простаты, если опухоль присутствовала в той же области простаты, как указано в отчетах о патологии для образцов биопсии под ультразвуковым контролем.
Статистический анализДиагностическая чувствительность, специфичность, точность, положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) были рассчитаны для Т2-взвешенной визуализации, DWI, DCE-MRI и комбинации всех трех методов МРТ (многопараметрическая МРТ). ).Различия в чувствительности, специфичности, PPV и NPV между любыми двумя методами МРТ проверяли с помощью теста Макнемара. Точный тест Фишера использовался для определения значительных различий в чувствительности многопараметрической МРТ, чтобы обнаружить рецидив опухоли между PZ и TZ. Статистический анализ проводился с использованием программного обеспечения SPSS (версия 11.5 J для Windows, SPPS). Значение p менее 0,05 считалось показателем статистически значимых различий.
Местоположение рецидивирующей опухоли при биопсии предстательной железыРезультаты Выбирать К началу страницыABSTRACTMМатериалы и методыРезультаты << ОбсуждениеСсылки ЦИТИРУЮЩИЕ СТАТЬИ После лучевой биопсии локально рецидивирующий рак простаты был выявлен у девяти из 16 пациентов (56%) и в 22 из 128 регионов (17.2%) в одностороннем порядке у восьми пациентов. Частота рецидивов у пациентов, получавших HDR-брахитерапию в тот же период, что и исследуемая популяция, составила 4,4% (9/206 пациентов). Статус риска до лечения в исследуемой популяции был низким ( n = 3), промежуточным риском ( n = 2) и высоким риском ( n = 4), что указывает на то, что количество пациентов с рецидивирующей опухолью равномерно распределены среди групп риска рака простаты. Эти повторяющиеся регионы были расположены в ПЗ в 17 регионах (77%) и в ПЗ в пяти регионах (23%).Поражения PZ включали семь в основании, семь в середине и три в вершине. Ни у одного из пациентов после лучевой терапии не было метастазов в лимфатические узлы или кости.
Консенсусное прочтениеВ консенсусном обзоре МРТ-сканирований не было обнаружено разногласий между двумя читателями.
Степень кровоизлиянияНа Т1-взвешенных изображениях ни у кого из субъектов не наблюдалось внутрижелезистого кровоизлияния.
Влияние лучевой терапии на Т2-взвешенную визуализацию предстательной железыРецензенты оценили зональную нечеткость как отсутствие у одного пациента, промежуточную у семи пациентов и отмеченную у восьми пациентов.Рецензенты оценили степень гипоинтенсивности диффузного сигнала Т2 как отсутствующую у одного пациента, промежуточную у 13 пациентов и отмеченную у двух пациентов (рис. 1).
Выявление рецидивирующего рака предстательной железыЧувствительность, специфичность, точность, PPV и NPV показаны в таблице 2. Чувствительность была самой высокой для многопараметрической МРТ (77%), за которой в порядке убывания следовали DWI (68%), DCE-MRI (50 %) и Т2-взвешенное изображение (27%). Специфичность была несколько ниже для многопараметрической МРТ (92%) по сравнению с отдельными последовательностями (диапазон 95–99%).Эти различия были статистически значимыми только для сравнения чувствительности между Т2-взвешенной визуализацией и DWI ( p = 0,004), между T2-взвешенной визуализацией и многопараметрической МРТ ( p = 0,001), а также между DCE-MRI и многопараметрической МРТ. ( p = 0,031), а также для сравнений специфичности между T2-взвешенной визуализацией и многопараметрической МРТ ( p = 0,016) и между DCE-MRI и многопараметрической МРТ ( p = 0,031) (рис. 2A, 2B , 2C, 2D, 2E, 3A, 3B, 3C и 3D).Ни одно из оставшихся парных сравнений не было статистически значимым ( p = 0,219–1,000). Чувствительность многопараметрической МРТ для выявления рецидива опухоли была значительно ниже в TZ (3/5 пациентов [60%]), чем в PZ (14/17 пациентов [82%]), хотя и без существенной разницы ( p = 0,548).
Посмотреть увеличенную версию (224K)Рис. 1 — Мужчина 62 года. Поперечное T2-взвешенное быстрое спин-эхо-изображение было получено через 15 месяцев после брахитерапии высокой мощностью дозы при раке простаты.Степень зональной нечеткости считалась выраженной, а степень диффузно сниженной интенсивности сигнала Т2 — промежуточной.
ТАБЛИЦА 2: Различия в выявлении рецидивирующего рака простаты с помощью методов МРТ
Увеличить версию (122K)6432 904-32 904-32 904-32 904-32 904-32-904-904-32 пожилой мужчина с повышенным уровнем простат-специфического антигена (5,27 нг / мл) через 28 месяцев после брахитерапии высокой мощностью дозы по поводу рака простаты и положительных результатов трансректальной биопсии, показывающих 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ). A, На поперечном T2-взвешенном эхопланарном изображении простаты отклонений от нормы не наблюдалось.
Посмотреть увеличенную версию (105K)Рис. 2B — Мужчина 64 лет с повышенным уровнем простат-специфического антигена (5,27 нг / мл) через 28 месяцев после брахитерапия с высокой мощностью дозы при раке простаты и положительные результаты трансректальной биопсии, показывающие 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ). B, Поперечное диффузионно-взвешенное изображение с b-факторами 0 и 800 с / мм 2 показывает рак PZ ( стрелка ), выявленный как повышенная интенсивность фокального сигнала в правой PZ.
Посмотреть увеличенную версию (125K)Рис. 2C — Мужчина 64 лет с повышенным уровнем простат-специфического антигена (5,27 нг / мл) через 28 месяцев после брахитерапия с высокой мощностью дозы при раке простаты и положительные результаты трансректальной биопсии, показывающие 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ). C, Поперечный динамический МРТ с контрастным усилением первой фазы ( C ), третьей фазы ( D ) и пятой фазы ( E ) показывает рак PZ ( стрелка , D и E ), видимое как очаговое раннее усиление и позднее вымывание в правой PZ.
Посмотреть увеличенную версию (150K)Рис.2D — Мужчина 64 лет с повышенным уровнем простат-специфического антигена (5.27 нг / мл) через 28 месяцев после брахитерапии высокой мощностью дозы по поводу рака простаты и положительных результатов трансректальной биопсии, указывающих на 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ). D, Поперечная динамическая МРТ с контрастным усилением первой фазы ( C ), третьей фазы ( D ) и пятой фазы ( E ) показывает рак PZ ( стрелка , D и E ), видимое как очаговое раннее усиление и позднее вымывание в правой PZ.
Увеличенная версия (144K)Рис.2E — Мужчина 64 лет с повышенным уровнем простат-специфического антигена (5,27 нг / мл) через 28 месяцев после высокодозовой брахитерапии по поводу рака простаты и положительных результатов трансректальной биопсии, показывающих 7 баллов по шкале Глисона в середине справа область периферической зоны (ПЗ). E, Поперечная МРТ с динамическим контрастированием первой фазы ( C ), третьей фазы ( D ) и пятой фазы ( E ) показывает рак PZ ( стрелка , D и E ), видимое как очаговое раннее усиление и позднее вымывание в правой PZ.
Обсуждение Выбирать К началу страницыABSTRACTМатериалы и методыРезультатыОбсуждение << Ссылки ЦИТИРУЮЩИЕ СТАТЬИ В среднем через 30 месяцев после HDR-брахитерапии (диапазон 15–51 месяцев) влияние лучевой терапии на Т2-взвешенное изображение наблюдалось у большинства пациентов (15 / 16 пациентов [94%]). Этот результат согласуется с предыдущими исследованиями с использованием эндоректальной МРТ [12].Coakley et al. [12] сообщили, что, поскольку радиационно-индуцированные анатомические изменения, такие как диффузная гипоинтенсивность сигнала T2 в железе и нечеткость нормальной зональной анатомии, ограничивают полезность обычных морфологических оценок с помощью T2-взвешенной МРТ, MRSI (которая обеспечивает метаболические, а не анатомические, информация) может быть полезным при оценке рецидива опухоли после ДЛТ. С другой стороны, ни у одного пациента не было внутрижелезистого кровоизлияния, вызывающего какое-либо нарушение точного обнаружения опухоли в функциональных последовательностях, таких как DWI и DCE-MRI.Более того, этот факт предполагает, что пониженная интенсивность диффузного сигнала и нечеткая зональная анатомия на Т2-взвешенной МРТ не могут быть связаны с кровотечением.
Посмотреть увеличенную версию (158K)Рис. 3A — Мужчина 65 лет с повышенным уровнем ПСА (4,09 нг / мл) через 43 месяца после брахитерапии с высокой дозой для рака простаты и положительных результатов трансректальной биопсии, указывающих на 7 баллов по Глисону в средней правой области периферической зоны (PZ) и правой области переходной зоны (TZ). A, Поперечное T2-взвешенное быстрое спин-эхо-изображение показывает рак PZ ( стрелка ) как однородное сигнальное гипоинтенсивное поражение с масс-эффектом в правой PZ.
Посмотреть увеличенную версию (125K)Рис. 3B — Мужчина 65 лет с повышенным уровнем ПСА (4,09 нг / мл) через 43 месяца после приема высокой дозы -скоростная брахитерапия при раке простаты и положительные результаты трансректальной биопсии, показывающие 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ) и правой области переходной зоны (TZ). B, Поперечное диффузионно-взвешенное изображение с b-факторами 0 и 800 с / мм 2 показывает рак PZ и TZ ( стрелки ), видимый как повышенная интенсивность фокального сигнала в правой PZ и правой TZ.
Посмотреть увеличенную версию (119K)Рис. 3C — Мужчина 65 лет с повышенным уровнем ПСА (4,09 нг / мл) через 43 месяца после приема высокой дозы -скоростная брахитерапия при раке простаты и положительные результаты трансректальной биопсии, показывающие 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ) и правой области переходной зоны (TZ). C, На поперечной динамической МРТ с контрастным усилением первой фазы ( C ) или третьей фазы ( D ) не наблюдались области очагового раннего усиления, представляющие рак простаты.
Увеличенная версия (131K)Рис. 3D — Мужчина 65 лет с повышенным уровнем ПСА (4,09 нг / мл) через 43 месяца после приема высокой дозы -скоростная брахитерапия при раке простаты и положительные результаты трансректальной биопсии, показывающие 7 баллов по шкале Глисона в средней правой области периферической зоны (PZ) и правой области переходной зоны (TZ). D, На поперечной динамической МРТ с контрастным усилением первой фазы ( C ) или третьей фазы ( D ) не наблюдались области очагового раннего усиления, представляющие рак простаты.
Все методы МРТ, оцененные в этом исследовании, показали хорошую специфичность, но низкую чувствительность для выявления локально рецидивирующего рака простаты после брахитерапии HDR. В частности, чувствительность Т2-взвешенного изображения была ниже, чем у двух других методов, хотя значительная разница наблюдалась только с DWI.Низкая чувствительность Т2-взвешенной визуализации может быть связана с влиянием лучевой терапии, как упоминалось ранее в этой статье. Другими словами, при Т2-взвешенной визуализации низкая интенсивность сигнала с нечеткой зональной анатомией ткани предстательной железы уменьшает контраст между рецидивирующей опухолевой массой и окружающей доброкачественной тканью.
В отличие от низкой чувствительности Т2-взвешенной визуализации, DCE-MRI, как сообщается, хорошо коррелирует с результатами биопсии пациентов с биохимической недостаточностью после EBRT [15, 16].Поскольку усиление контраста в фиброзной области после лучевой терапии происходит медленно и незначительно, рецидивирующая опухоль, обычно гиперваскулярная, может показать хороший контраст, что приводит к высокой диагностической чувствительности DCE-MRI [32]. Однако чувствительность (52%) DCE-MRI в текущем исследовании не была особенно высокой по сравнению с результатами из предыдущих отчетов (70–74%) и существенно не отличалась от T2-взвешенной визуализации. Чувствительность, вероятно, была низкой в нашем исследовании, потому что и PZ, и TZ были оценены у всех пациентов.Фактически, наш результат показал более низкое выявление рецидивов опухоли в TZ, чем в PZ, как это видно при первичном раке [29]. Кроме того, по неясным причинам лучевая терапия с использованием HDR-брахитерапии вместо EBRT также может быть связана с низкой чувствительностью T2-взвешенного изображения.
По сравнению с этими двумя методами, DWI показал высокую чувствительность для выявления рецидива рака простаты после брахитерапии HDR. DWI основан на различиях в диффузии молекул воды, в основном связанных с различиями в плотности клеток.Недавние исследования показали высокую степень дифференциации между нормальной и злокачественной тканью простаты, включая как первичные опухоли, так и местно-рецидивирующую опухоль после ДЛТ [11, 19–27]. Высокая диагностическая эффективность DWI для рецидива опухоли после EBRT могла бы объяснить высокую чувствительность рецидива опухоли после HDR-брахитерапии в настоящем исследовании. Кроме того, наши результаты предполагают, что интенсивность сигнала облученной предстательной железы с фиброзом относительно низка по сравнению с рецидивирующим раком, который изображается как гиперинтенсивный сигнал из-за уменьшения диффузии молекул воды.
В предыдущем сообщении [33] описано увеличение доли стромальных компонентов (например, гладких мышц и соединительной ткани) в железистом эпителии, проявляющееся в виде увеличения значений ADC, которые не вызывают увеличения интенсивности сигнала на DWI. Мы думаем, что ткань предстательной железы после длительного периода (в среднем 30 месяцев; диапазон от 15 до 51 месяца) после лучевой терапии, такой как брахитерапия HDR, мало влияет на обнаружение опухоли в DWI, и что сохраняется высокий контраст между раковой тканью и окружающей средой. доброкачественная ткань.Однако необходимы дальнейшие исследования для выяснения пострадиационных эффектов при различных модальностях МРТ.
Текущее исследование имеет некоторые ограничения. Во-первых, наше исследование было ограничено относительно небольшим количеством пациентов. Однако, насколько нам известно, это единственное на сегодняшний день исследование с МРТ локально рецидивирующего рака простаты после HDR-брахитерапии и изучения патологических корреляций. Во-вторых, в наше исследование были включены пациенты, которые получали различные протоколы лечения, такие как только брахитерапия HDR и брахитерапия как EBRT, так и HDR, с неоадъювантной гормональной терапией или без нее, до лучевой терапии.Эти различия в лечении могли оказать некоторое влияние на результаты этого исследования. В-третьих, гистопатология ступенчатого сечения не использовалась для определения корреляции между МРТ и гистопатологическими данными в этом исследовании. Таким образом, результаты МРТ могли быть занижены по сравнению с оценкой с использованием гистологических образцов всей простаты после радикальной простатэктомии. В-четвертых, МРТ выполнялась только с катушкой с фазированной решеткой, а не с комбинацией катушки с фазированной решеткой и эндоректальной катушки.Использование эндоректальной катушки приводит к значительному увеличению отношения сигнал / шум, но это также приводит к дискомфорту для пациента и дополнительным затратам [26]. На самом деле, поскольку плохие результаты Т2-взвешенной визуализации для выявления локально рецидивирующего рака простаты после HDR-брахитерапии, по-видимому, в основном являются результатом уменьшения контраста между рецидивирующей опухолью и окружающей фиброзной тканью, индуцированной радиацией, использование эндоректальной катушки может увеличить отношение сигнал / шум при Т2-взвешенной визуализации, что приведет к улучшению выявляемости опухоли.Действительно, недавнее проспективное исследование с использованием 3-Т МРТ, сравнивающее катушку массива тела и эндоректальную катушку, показало, что Т2-взвешенное изображение с эндоректальной катушкой дает значительно более высокое качество изображения и соотношение сигнал / шум, а также обнаруживаемость опухоли по сравнению с корпусной катушкой [34]. В-пятых, анализ изображений в этом исследовании проводился путем согласованного чтения, а не слепого чтения; следовательно, вариабельность между наблюдателями не может быть оценена. В-шестых, в статистическом анализе, поскольку мы предположили, что несколько наблюдений для каждого субъекта были независимыми, мы не учли возможную внутрипредметную корреляцию между различными регионами.Наконец, последовательные оценки МРТ до и после HDR-брахитерапии не проводились в исследованиях влияния HDR-брахитерапии на предстательную железу и возможность выявления рецидива рака простаты. Необходимы дальнейшие проспективные исследования с участием больших групп субъектов, такие как многоцентровые исследования, чтобы прояснить клиническую применимость МРТ простаты для выявления рецидивов опухоли после HDR-брахитерапии.
В заключение, текущее исследование показывает, что МРТ простаты является чувствительным методом для выявления местного рецидива после HDR-брахитерапии и что DWI должен быть включен в протокол МРТ для пациентов после HDR-брахитерапии.Комбинация Т2-взвешенной визуализации, DCE-MRI и DWI может дать разумную диагностическую точность не только в PZ (89/96 областей [93%]), но и в TZ (26/32 областей [81%]), даже если они выполняются после брахитерапии HDR.
Радиация от лечения рака простаты представляет небольшую опасность для семьи
28 ноября 2000 г. (Чикаго) — Десятки тысяч мужчин с раком простаты возвращаются домой с радиоактивными гранулами, навсегда имплантированными в маленькую железу в паху — но Новое исследование показывает, что супругам этих мужчин нечего опасаться, что радиация, испускаемая этими семенами, нанесет им вред.
И ни дети, которые обнимают своих отцов или дедушек, ни младенцы, которые сидят у них на коленях … ни даже семейная собака, говорят исследователи здесь, на собрании радиологов.
«Теперь мы можем сказать женщине:« Количество радиации, которое вы получите от своего мужа за один год, меньше, чем вы получили бы, прожив в Денвере три или четыре месяца », — говорит Джефф Михалски, доктор медицины, доцент. радиологии в Медицинской школе Вашингтонского университета в Сент-Луисе.
Около 38 000 мужчин вводят радиоактивные гранулы йода-125 или палладия-103 в ходе процедуры, известной как брахитерапия, говорит Михальски.Еще 100 000 мужчин подвергаются радикальной простатэктомии, хирургическому удалению органа, если обнаружен рак. Однако Михальски говорит, что выживаемость при брахитерапии эквивалентна таковой при хирургии.
«Но есть много членов семьи, которые обеспокоены радиацией», — сказал Фэн Мин Конг, доктор медицины, резидент Вашингтонского университета. «Они хотят знать, повлияет ли на них радиация. Девять из 10 пациентов скажут, что их беспокоит воздействие радиации на других.Они хотят знать: «Могу ли я подержать внучку на коленях?» «Можно ли навещать мою беременную дочь?» — один на воротнике, а другой на талии. Им дали четыре бирки, которые можно было разместить по всему дому — например, рядом с их любимым стулом в гостиной, ночным столиком в спальне, кухней и ванной.
Значки носили и другие члены семьи. В некоторых случаях значки носили даже домашние собаки.
«Мы не знаем, каков здоровый порог радиации», — пояснил Михальски во время брифинга для прессы. Но он говорит, что уровень радиации, зарегистрированный на значках, варьировался от необнаруживаемого — менее одного миллибэр радиации в течение трехнедельного периода исследования — до в среднем 10 миллибэр. Михальски говорит, что фоновое излучение, которому каждый человек подвергается из-за естественных источников, в Соединенных Штатах составляет в среднем около 300 миллибэр в год.
Фактически, он сказал, что полет туда и обратно из Нью-Йорка в Токио подвергнет человека большему воздействию радиации, чем гранулы.
«Эти исследования показывают, что супруг или член семьи подвергаются не большему риску радиационного облучения, чем человек, который летит туда и обратно из Нью-Йорка в Сан-Франциско», — говорит Хедвиг Хрикак, доктор медицинских наук, председатель отделения радиологии Memorial Sloan-Kettering Cancer. Центр в Нью-Йорке.
«Это не должно беспокоить людей, которым имплантированы семена.Реальность такова, что вы можете жить нормальной жизнью. «Вам не обязательно помещать пациента в подвал и держать его подальше от других людей», — говорит Хричак. осторожно для мужчин с гранулами, особенно в первые дни после лечения, чтобы не держать домашних животных или маленьких детей на коленях в течение длительного времени.
Лучевая терапия — клиническая патология и процедуры
Ветеринарная лучевая терапия сегодня практикует почти использовать исключительно линейные ускорители в качестве источника ионизирующего излучения, используемого для лечения новообразований и иногда конкретных доброкачественных заболеваний.Эти машины производят мощные рентгеновские лучи и электронные лучи с энергией 4–20 миллионов электрон-вольт. Рентгеновские лучи используются для лечения глубоко расположенных опухолей, тогда как электронные лучи обычно используются для лечения опухолей кожи и подкожного слоя. Линейные ускорители — это сложные машины, которые требуют поддержки медицинского физика для обеспечения безопасного и эффективного использования. Эта повышенная опорная нагрузка компенсируется гибкостью и скоростью машины, что необходимо, поскольку методы лечения становятся все более изощренными и сложными.Отсутствие необходимости в периодической замене источников цезия-137 и кобальта-60 — еще одно существенное преимущество.
Компьютеризированные системы планирования лечения, которые точно моделируют распределение энергии излучения в организме, используются ветеринарными онкологами-радиологами для улучшения локализации и распределения терапевтического луча внутри пациента. Это снижает дозу, поступающую в нормальные ткани, по сравнению с дозой, поступающей в опухолевую ткань, улучшая темпы контроля при одновременном снижении тяжести осложнений для нормальной ткани.Эти программы используются вместе с изображениями КТ или МРТ, которые определяют положение и степень опухоли в организме, а также ее положение по отношению к нормальным структурам.
Может потребоваться несколько часов работы за компьютером онколога-радиолога или дозиметриста, чтобы тщательно очертить опухоль и каждую из нормальных структур, подверженных риску, чтобы составить план лечения большой сложной опухоли. Компьютерная система способна быстро генерировать профили доз для предлагаемых конфигураций лечения и определять, соответствует ли план определенным ограничениям лечения, установленным онкологом-радиологом.
После того, как план лечения составлен, пациента обрабатывают точно в том же положении, в котором он находился при КТ или МРТ. Повторяемость позиционирования имеет первостепенное значение, и для этого используются специальные устройства позиционирования в сочетании с тщательной разметкой. Это требует, чтобы пациент сканировался точно в том же положении, в котором он будет лечиться, что требует тесного взаимодействия между диагностическими и терапевтическими радиологами.
Для этого выполняется компьютерная томография, когда пациент находится в том положении, в котором он будет проходить лечение.Затем правильное положение пациента подтверждается с помощью системы визуализации, интегрированной с линейным ускорителем, до начала лечения. После подтверждения правильного расположения можно начинать лечение. Во время этой части процесса необходимо пристальное внимание к деталям, потому что даже небольшие изменения положения могут иметь сильное влияние на распределение доставленной дозы облучения. Это особенно верно в отношении опухолей центральной нервной системы, где диаметр поражения может быть только порядка 1 см или меньше.
За исключением редких случаев, все процедуры лучевой терапии с использованием внешних источников излучения должны проводиться при иммобилизации пациента под общей анестезией . Поскольку требуемый уровень анестезии невелик, а процедуры обычно относительно короткие, повторная анестезия переносится хорошо, а осложнений мало при надлежащем наблюдении и контроле со стороны обученных и опытных технологов. Это требование анестезии редко, если вообще когда-либо, является противопоказанием для проведения курса лучевой терапии.
Типичный курс лучевой терапии состоит из нескольких доз облучения в разные дни. Это делается для того, чтобы здоровые ткани немного зажили между приемами. Здоровые ткани обладают большей способностью восстанавливать радиационные повреждения, чем опухолевые ткани; следовательно, использование нескольких небольших доз радиации, которые имеют кумулятивный эффект, способствует выживанию здоровых тканей, а не опухолевых.
В большинстве схем лучевой терапии, разработанных с лечебной целью, используется 15–20 индивидуальных доз (фракций) излучения.Каждая доза излучения может быть доставлена с использованием нескольких различных пучков излучения разного размера, формы и интенсивности. IMRT, или лучевая терапия с модуляцией интенсивности , представляет собой новую адаптацию лучевой терапии, в которой каждый из лучей первичной лучевой терапии разбивается на ряд меньших лучей, чтобы жестко контролировать отложение лучевого поражения в ткани, тем самым улучшая не только контроль опухоли, но частота осложнений с нормальными тканями.
В последнее десятилетие развивается еще одно направление внешней лучевой терапии.Это называется стереотаксической радиохирургией (SRS) или стереотаксической лучевой терапией тела . В этом типе лучевой терапии лечебная, интенсивная доза лучевой терапии доставляется к опухоли за 1–4 сеанса лечения в последовательные или чередующиеся дни в течение одной недели. Это заметно сокращает время пребывания пациента в больнице и неудобства для владельца, но часто не снижает стоимость.
Есть много ограничений для использования этого типа протокола лучевой терапии.Используемые дозы облучения довольно высоки на дозу и для периода времени, в течение которого проводится лечение. Это требует предельной точности при введении луча излучения, чтобы избежать попадания в нормальные ткани и облучить только опухолевые ткани. Для достижения этой точности требуется не только способность выполнять введение радиации типа IMRT, но и способность изменять план лечения для каждой фракции и контролировать доставку дозы радиации в реальном времени во время введения радиации.Оборудование, необходимое для этого, хрупкое и дорогое.
Хотя SRS имеет ряд преимуществ, он также может привести к серьезным побочным эффектам на нормальные ткани, если происходит неправильное введение или если большие количества опухоли подвергаются острому некрозу. По этим и ряду других причин, связанных с физикой излучения, SRS может не подходить для больших опухолей (> 4 см в диаметре), особенно если опухоль расположена в анатомической области высокого риска, такой как горло.
В случаях, когда опухоль слишком развита, чтобы ее можно было контролировать с помощью радиации, можно использовать паллиативную терапию с более высокими дозами и меньшими фракциями радиации для замедления роста опухоли или уменьшения связанной с ней боли. Это делается для улучшения качества жизни пациента или для того, чтобы хозяин мог проводить больше времени со своим животным. Паллиативные протоколы предназначены не для лечения, а для лечения. Это существенное различие между SRS и паллиативными протоколами. Паллиативные протоколы имеют гораздо более низкую интенсивность дозы, чем SRS.Такой паллиативный подход может также использоваться, когда это предусмотрено финансами собственника. Такие методы лечения имеют низкую вероятность того, что приведут к устойчивому контролю над раком, и они несут больший риск поздних радиационных эффектов, если действительно осуществляется надежный контроль, что происходит в довольно небольшом проценте случаев.
Лучевая терапия, даже в сочетании с хирургическим вмешательством и химиотерапией, может быть неизлечимой. Однако во многих случаях это может замедлить развитие или распространение болезни. Онкологи-радиологи обычно говорят скорее о степени контроля, чем о лечении.Иногда контроль может быть относительно недолговечным, и рецидив опухоли происходит в течение нескольких месяцев после завершения схемы лечения. В других случаях контроль может длиться несколько лет или даже до тех пор, пока другое заболевание не вытеснит новообразование. К сожалению, даже в рамках индивидуального типа опухоли редко возможно предсказать, какие пациенты получат хороший контроль, а какие — нет.


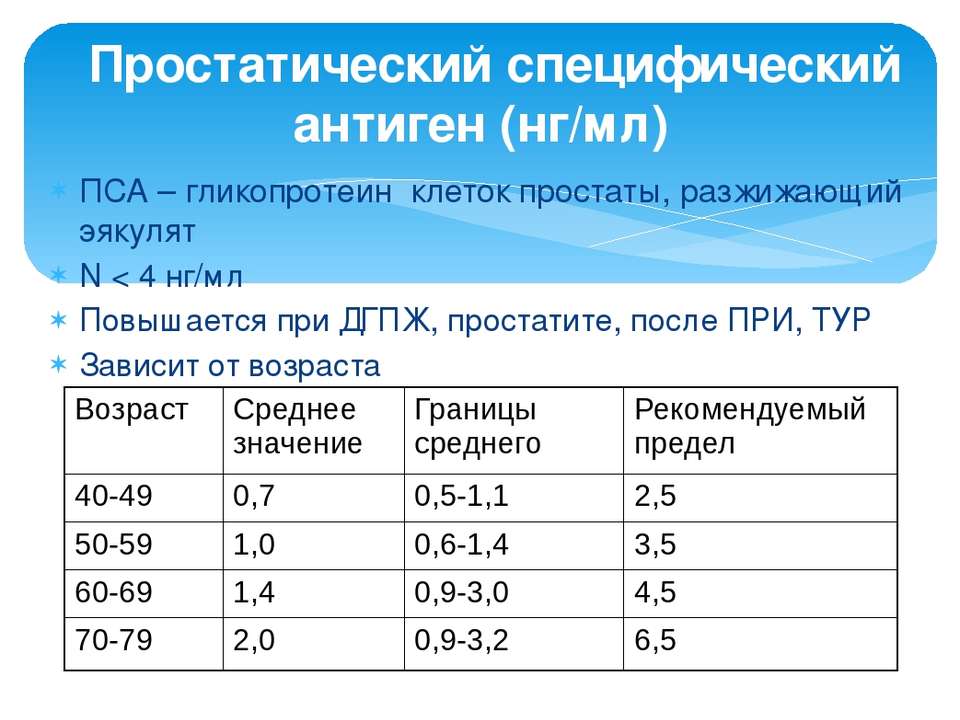 Он наиболее распространен среди мужчин после 65 лет.
Он наиболее распространен среди мужчин после 65 лет.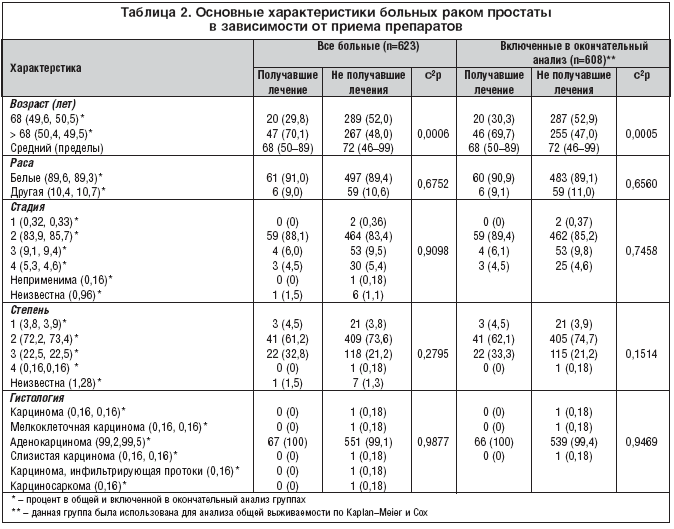
 Данный метод является самым эффективным при его использовании на ранней стадии заболевания у пациентов до 70 лет. Раковые клетки предстательной железы зависят от гормона тестостерона, который необходим для их роста.
Данный метод является самым эффективным при его использовании на ранней стадии заболевания у пациентов до 70 лет. Раковые клетки предстательной железы зависят от гормона тестостерона, который необходим для их роста. Данный метод лечения изучен недостаточно.
Данный метод лечения изучен недостаточно.