Невусы Подробнее | Криодеструкция рака
ОПАСНЫЕ НЕВУСЫ
Какие родинки опасны ?
В науке доброкачественные новообразования кожи с пороком развития меланинообразующих элементов принято назвать меланоцитарными невусами. Многие из них способны трансформироваться в злокачественную опухоль, а значит такие родинки опасны и требуют особой онкологической настороженности.
Давайте рассмотрим меланоцитарные невусы поподробней:
I. Меланоцитарные невусы эпидермального меланоцитарного происхождения
II. Меланоцитарные невусы дермального меланоцитарного происхождения
III. Меланоцитарные невусы дермального и эпидермального происхождения (смешанный тип)
IV. Меланоцитарные невусы (предшественники меланомы)
I. Меланоцитарные невусы эпидермального меланоцитарного происхождения могут быть как врожденными, так и приобретенными. Это доброкачественные пигментные образования,
Это доброкачественные пигментные образования,
как правило, равномерно окрашенные, с гладкой поверхностью и правильными очертаниями. Однако любые изменения таких невусов требуют онкологического наблюдения.
Существуют следующие типы эпидермальных меланоцитарных невусов:
1. Пограничный невус / пигментный невус (юнкциональный)
Это плоский узелок коричневого или черного цвета (в зависимости от количества меланина в клетках), округлой или овальной формы, равномерно окрашенный; имеет гладкую, сухую поверхность, четкие очертания, с размерами от 1 до 10 мм.
Более крупные (до 40-50 мм) внутриэпидермальные родинки встречаются редко. Чаще всего они располагается одиночно, а не в группе. Это врожденные новообразования, также они могут проявляться в юном и подростковом возрасте.
Главной особенностью такой родинки является отсутствие волосяного покрова на ее поверхности, а также ее пигментация, которая со временем может изменяться и приобретать более темный оттенок.
Такие родинки могут располагаться на руках, лице, шее, спине, подошве ног или любой другой части тела, поэтому они чаще других могут подвергаться регулярным микротравмам.
Вариантами пограничного невуса считаются:
кокардный невус и пятнистый пигментный невус.
Пограничный невус является меланомоопасным, особенно после полового созревания, а значит любые изменения состояния такой родинки (от размера, формы до появления зуда, жжения или кровоточивости) могут быть связаны с рисками перерождения в злокачественную опухоль и поэтому требуют незамедлительной диагностики у онколога/дерматолога.
2. Внутридермальный пигментный невус
(интрадермальный невус)
Это один из наиболее часто встречаемых невусов.
Такой невус чаще всего появляется к 10-30 годам.
Имеет вид купола (бородавчатое, папилломатозное, полиповидное новообразование) от светлого коричневого и до темно-коричневого оттенка, с четкими границами и мягкой консистенцией.
На его поверхности может присутствовать волосяной покров.
Размер таких невусов колеблется от 0,3 мм до 50 мм в диаметре. Такой невус может соединяться с кожей ножкой.
Внутридермальный невус — доброкачественное новообразование, но может легко травмироваться, а значит кровоточить и вызывать дискомфорт. В этом случае за родинкой следует следить особенно внимательно и по возможности обращаться к лечащему дерматологу/онкологу.
Такие родинки чаще всего растут на коже лица, шеи и горла, в паховой и подмышечной области, в области груди у женщин. Если такие невусы начинают вас беспокоить (менять цвет, зудеть, расти), то в обязательном порядке они подлежат удалению.
3. Папилломатозный невус (Внутридермальный)
Такой невус является подвидом приобретенного меланоцитарного, или пигментного, невуса.
Такой невус виузально очень похож на крупную бугристую папиллому, структурно напоминающую цветную капусту, так как состоит из отростков эпидермиса удлиненной формы.
Данное новообразование имеет произвольную форму и четкие границы. Оттенок родинки может вариьироваться от светлого до почти черного (в зависимости от количества меланина в клетках). Часто на нём растут волоски.
Может быть как одиночным, так и множественным новообразованием. Чаще всего папилломатозный невус находится на коже задней части шеи, на волосистой части головы, на поверхности туловища и рук.
Такие родинки могут диагностироваться как у новорожденных детей, так и у людей более взрослого возраста. Растет вместе со своим обладателем. В диаметре может быть больше 10 мм.
Из-за сильного возвышения над поверхностью кожи и неровной поверхности такой невус очень подвержен частому травмированию. Если такой невус поврежден и кровоточит, то необходимо незамедлительно проконсультироваться у онколога и, возможно, удалить невус.
4. Cмешанный (сложный) невус (невус дермоэпидермальный)
Это переходный вид развития меланоцитарного невуса от пограничного невуса к внутридермальному невусу.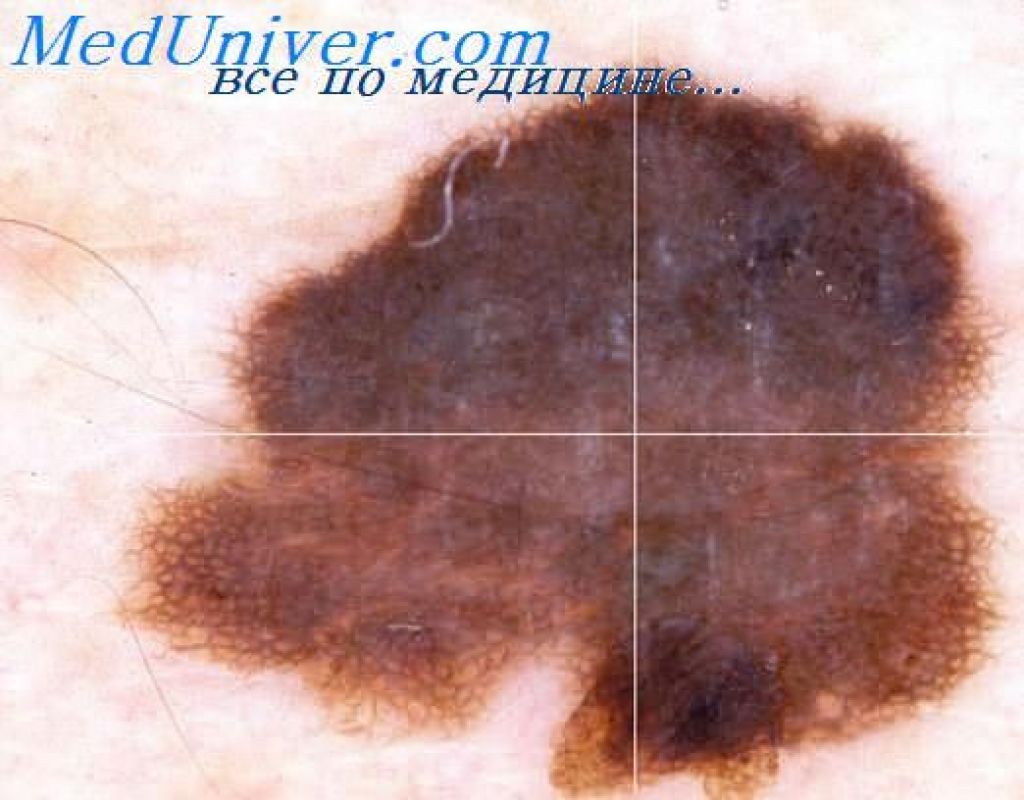
Смешанный невус имеет плотную консистенцию, куполообразную или шарообразную форму (напоминающую бородавку), возвышающуюся над поверхностью кожи.
Цвет может варьироваться от светло-коричневого до черного.
Поверхность такого невуса гладкая, реже бородавчатая, может присутствовать щетинистый волосяной покров. Размеры смешанного невуса обычно не превышают более 10 мм.
Часто преобразуется во внутридермальный невус.
Обычно такие невусы удалают с косметической целью, так как они являются доброкачественными.
5. Гало невус, или невус Сеттона (невус окаймленный)
Невусы Сеттона — это доброкачественные новообразования, пигментные невусы, в виде коричневых, возвышающихся над кожей коричневых узелков.
Главная особенность такого невуса — проявление гиперпигментации в виде обесцвеченного участка кожи вокруг родинки. В таком светлом участке находятся лейкоциты, которые атакуют пигметные клетки.
Основной особенностью такого светлого следа вокруг невуса Сеттона является его способность постепенно со временем исчезать. Чаще всего невусы Сеттона появляются в детстве и молодом возрасте.
Нередки случаи появления такой родинки у беременных женщин. Локализация невуса различна. При верной диагностике онколога и снятии подозрения на меланому невусы Сеттона не представляют опасности, однако необходимо наблюдение за динамикой любых визуальных изменений.
6. Невус Шпица (юношеская меланома) / Невус веретеноклеточный
Кругое или куполообразное новообразование, напоминающее розовую шишку на коже.
Цвет — обычно розовый, светло-желтый или коричневый. Диаметр до 10-20 мм. Характеризуется внезапным появлением и быстрым ростом (вырастает в течение одного месяца).
Обычно встречается у детей, но в редких случаях у взрослых до 40 лет. Обычно невус Шпица располагается на лице (в особенности, в области щёк) и на ногах. Гистологические исследования показывают очень большую схожесть с меланомой, однако это не меланома, хотя риск перерождения в злокачественную опухоль всё-таки существует.
Гистологические исследования показывают очень большую схожесть с меланомой, однако это не меланома, хотя риск перерождения в злокачественную опухоль всё-таки существует.
Если Вы не уверены в правильности диагноза, то данный невус рекомендуется удалить у врача онколога, хирурга.
7. Невус из баллонообразующих клеток
Это очень редкий невус, который практически не имеет характерных клинических особенностей. Иногда его описывают, как бугорок или пятно коричневого цвета с тонким желтым ободком. Обычно он встречается у людей молодого возраста. Данный вид родинок практически никогда не перерождается в злокачественную опухоль, но его динамика развития требует обязательного медицинского наблюдения.
II. Меланоцитарные невусы дермального меланоцитарного происхождения.
Существуют следующие типы эпидермальных меланоцитарных невусов:
1. Невус Ота
Это большой пигментный невус, обычно встречающийся у представителей азиатских народов.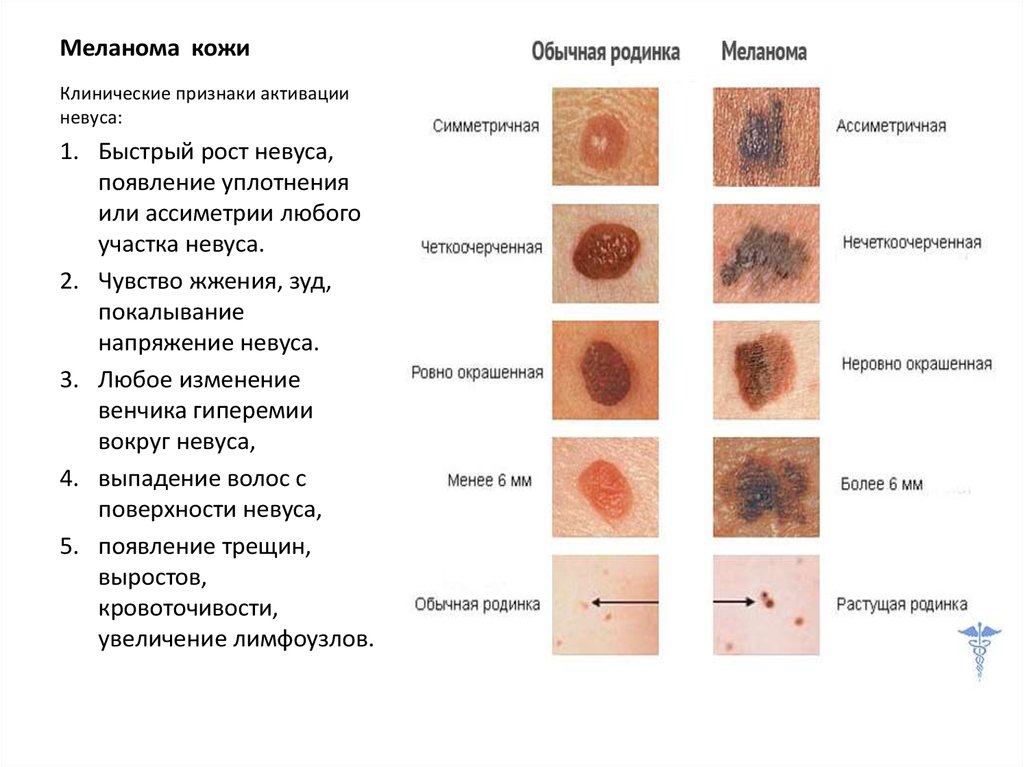 Может быть врожденным или появиться в детстве или подростковом возрасте. Пигментации больше подвержены женщины.
Может быть врожденным или появиться в детстве или подростковом возрасте. Пигментации больше подвержены женщины.
Цвет невуса Ота варьируется от темно-синего до черно-синего.Обычно пигментация располагается в области лица: на скулах, щеках, верхней части челюсти, в области виска, нижнего века. Может быть как одиночным пятном, так и состоять сразу из несколько пятен. Злокачественные перерождения невуса возможны, но происходят очень редко.
2. Монгольское пятно
Этот невус считается врожденным. Его цвет может быть от серо-синего до темно-синего, бывает с коричневой окраской.
Обычно такие пятна бывают единичными, овальной, округлой или неправильной формы, с размерами до 50-100 мм в диаметре. Это врожденные пятна, которые присутствуют почти у 80 % детей монголоидной и негроидной расы, и почти не встречается у детей европейской расы.
Когда ребенок рождается, цвет пятна резко усиливается, но к 10-12 годам пятно, как правило, полностью исчезает. Обычно такой невус локализуется в пояснично-крестцовой области, но также может раполагаться на коже спины, ягодицах, задней части голени. Иногда происходит миграция пятна от его начального положения в другую локализацию.
Обычно такой невус локализуется в пояснично-крестцовой области, но также может раполагаться на коже спины, ягодицах, задней части голени. Иногда происходит миграция пятна от его начального положения в другую локализацию.
Монгольское пятно относится к меланомонеопасным невусам. Трансформации в злокачесвтенную опухоль практически не наблюдается.
3. Голубой невус (синий невус Ядассона-Тиче)
Это пигментное новообразование кожи, напоминающее узелок голубого, синего или темно-синего цвета.
Размер узелка — до 50 мм в диаметре. Форма — округлая или полусферическая, выступает над уровнем кожи. Поверхность — гладкая, симметричная.
Не имеет на своей поверхности волосков. Чаще всего невус локализуется в области головы, шеи, крестца, на поверхности туловища и слизистых рта, носа и влагалища.
Встречается во всех возрастных группах. Это приобретенное пигментное новообразование, проявляется обычно впервые после полового созревания. Женщины подвержены такой пигментации чаще мужчин.
Женщины подвержены такой пигментации чаще мужчин.
Данный невус является доброкачественным, однако при травмировании может стать меланомоопасным.
4. Невус Ито
Невус Ито клинически и патоморфологически очень напоминает невус Ота, но локализуется на коже области лопатки, дельтовидных мышц и на шее. Злокачественные перерождения невуса возможны.
III. Меланоцитарные невусы дермального и эпидермалъного происхождения (смешанный тип)
Комбинированный невус
Когда один невус накладывается на другой, возникает так называемый комбинированный невус.
Количество таких сочетаний очень разнообразно. Однако наиболее часто встречаемой комбинацией является наложение пограничного невуса на голубой невус.
Такие невусы должны быть исследованы в обязательном порядке на предмет меланомы, так как их клиническая и дерматоскопическая картина очень схожа с меланомной.
При возникновении затруднений в постановке точного диагноза следует такую родинку удалить.
IV. Меланоцитарные невусы
(предшественники меланомы)
1. Врожденный меланоцитарный невус
(конгенитальный невус)
Такой невус встречается у 1 % новорожденных. Выглядит невус, как пятнистое, бугристое образование с узловатыми и/или бородавчатыми элементами.
Цвет невуса варьируется от коричневого до синего, черного. На его поверхности могут расти жесткие волоски. Размеры могут быть самыми разными, от маленьких — до 150 мм — до 20 см в диаметре.
Чаще других встречаются маленькие невусы, и до двухлетнего возраста они обычно очень бледные и не сразу проявляются. Локализуются врожденные невусы на поверхности кожи предплечий, груди, спине и нижней части туловища.
Стоит отметить, что данный невус является меланомоопасным и требует обязательной диагностики у онколога.
Разновидностью врожденного меланоцитарного невуса считается гигантский врожденный невус.
Его цвет может постепенно меняться от серого до темно-черного, иногда с синим оттенком.
Его поверхность может быть бородавчатой, бугристой, с трещинами. Локализуются такие невусы обычно на бедрах, на нижней части спины, на волосистой части головы. Клинические наблюдения показывают, что гигантский врожденный невус может сочетаться с другими пороками развития — такими, как эпилепсия, гидроцифалия, другими неврологическими расстройствами.
Врожденный гигантский невус имеет высокий риск озлокачествления и трансформации в меланому (около 10 % случаев). Поэтому требуется незамедлительное обращение к онкологу для клинического заключения и решения о методе удаления этой опасной родинки.
2. Диспластический невус (атипичный невус), или
Невус Кларка
Это приобретенное пигментное новообразование, чаще всего в дестве или побертатном возарсте.
Его цвет может быть разниться (все оттенки от розового, светло-коричневого до темного). Это неравномерная, «пестрая» окраска. Границы новообразования асимметричны, с неровными неправильными границами и неравномерной пигментацией.
Такие невусы обычно бывают множественными (их диаметр более 5 мм). Чаще всего они локализуются на нижних конечностях, в области груди, на ягодицах, на половых органах, на волосистой части головы, на спине.
Важно знать, что диспластический невус является предшественником меланомы (почти в 100 % случаев).
При постановке точного диагноза диспластические невусы настоятельно рекомендованы к удалению. Таким образом, диспластический невус с уверенностью можно отнести к опасным родинкам.
3. Меланоз Дюбрея (лентигинозная меланоцитарная дисплазия либо злокачественное лентиго)
Это новообразование, характеризующееся коричневым пигментным пятном с довольно ровными краями; поверхность может быть гладкой или папилломатозной. Невусы чаще всего локализуется на поверхности кожи лица и шеи, имеют размеры от 2 до 20 мм.
Этот невус растет медленно, чаще всего диагностируются у пожилых людей со светлой кожей, особенно у женщин после 55 лет.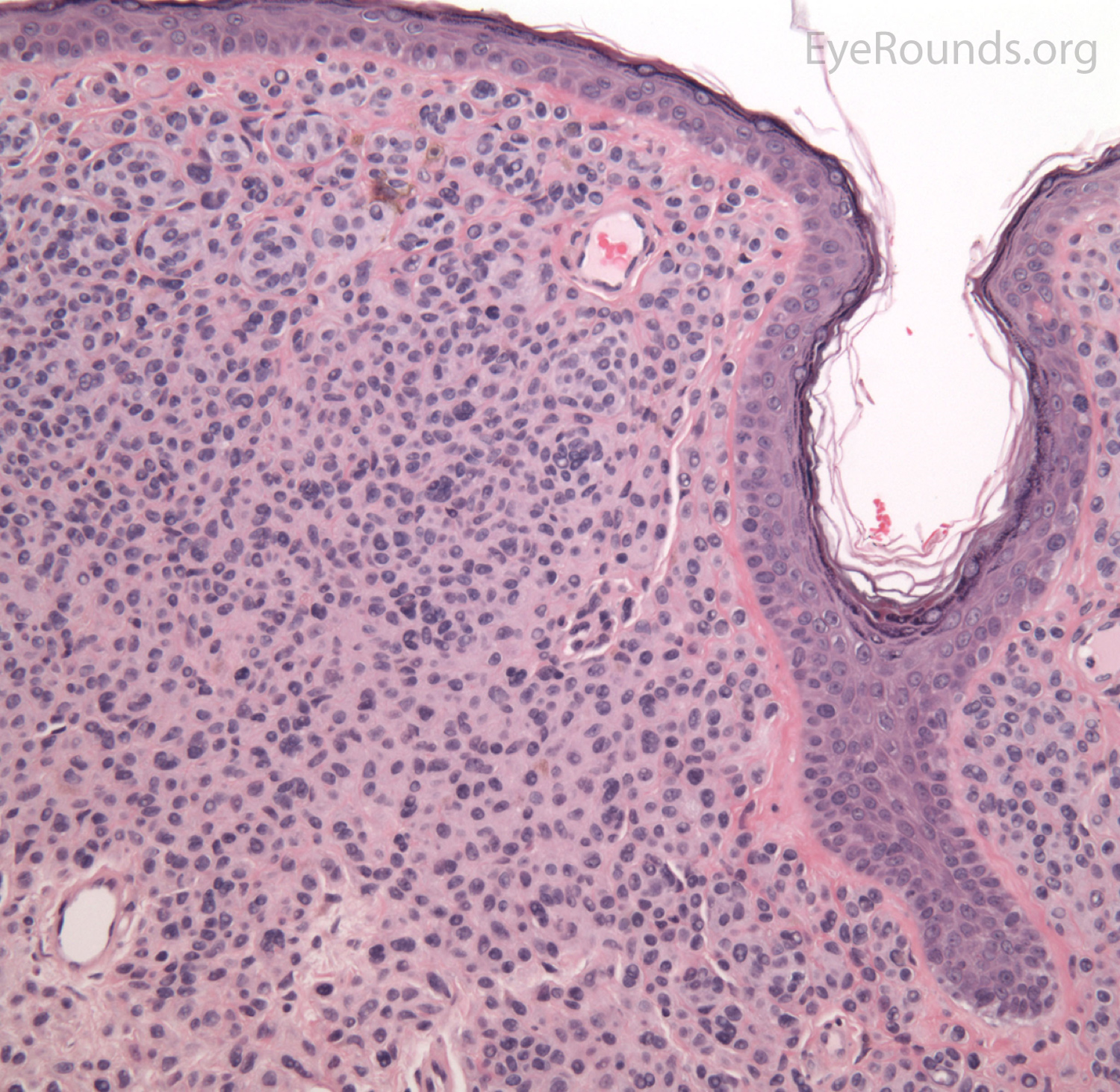 Меланоз Дюбрея, как и болезнь Боуэна, является облигатным предраковым заболеванием, а значит требует незамедлительной диагностики у онколога.
Меланоз Дюбрея, как и болезнь Боуэна, является облигатным предраковым заболеванием, а значит требует незамедлительной диагностики у онколога.
О превращении невуса в меланому может свидетельствовать сразу несколько фактов:
изменение формы/размера новообразования; могут появляться волнитстые контуры, края перестают быть четко очерченными, усиливается шелушение поверхности
В большинстве случаев пациенты обращаются к врачу с просьбой — удалить родинку исключительно с косметологической целью, т.к. эти родинки, с точки зрения пациентов, портят их внешний вид. Однако хочу подчеркнуть, что прежде всего пациенты с невусами (новообразованиями кожи) в обязательном порядке должны наблюдаться у дерматолога/онколога на предмет исключения риска выявления или разваития злокачественных опухолей кожи и слизистых.
НАШИ РЕЗУЛЬТАТЫ 18+
Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи
Журнал «Стационарозамещающие технологии: Амбулаторная хирургия» №3–4/2020
DOI: 10. 21518/1995-1477-2020-3-4-66-72
21518/1995-1477-2020-3-4-66-72
Н.Г. Артемьева, ORCID: 0000-0001-7996-0415, О.А. Романова*, ORCID: 0000-0003-2381-6478, Центральная поликлиника Литфонда; 125319, Россия, Москва, ул. 1-я Аэропортовская, д. 5
Введение. В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, т. е. умирает каждый третий заболевший. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15%. Данная статистика объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку.
Цель исследования – подтвердить целесообразность удаления прогрессирующего диспластического невуса (ЛМД 3-й ст.) в целях профилактики и ранней диагностики меланомы кожи.
Материалы и методы. В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» с 2009 г. по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
по март 2020 г. авторы удалили 180 пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус». Больные были направлены в хирургическое отделение терапевтами, дерматологами и другими специалистами поликлиники. После консультации онколога под местной анестезией выполнялась эксцизионная биопсия невуса.
Результаты. При гистологическом исследовании выявлено 29 (16%) диспластических невусов с ЛМД 3-й ст. и 18 (10%) ранних меланом.
Выводы. Если эксцизионная биопсия диспластического невуса станет рутинной в практике поликлинического хирурга, то это приведет к увеличению ранней выявляемости меланомы и значительно уменьшит смертность от этого заболевания. При эксцизионной биопсии авторы рекомендуют отступление от границ образования 0,5–1,0 см, поскольку клинически отличить прогрессирующий диспластический невус от ранней меланомы не представляется возможным.
Для цитирования: Артемьева Н.Г., Романова О.А. Эксцизионная биопсия диспластического невуса в условиях районной поликлиники – путь к раннему выявлению меланомы кожи. Амбулаторная хирургия. 2020;(3-4):66-72. https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma
Nadezhda G. Artemeva, ORCID: 0000-0001-7996-0415, Olga A. Romanova*, ORCID: 0000-0003-2381-6478, Central Polyclinic of Literary Fund; 5, 1st Аeroportovskaya St., Moscow, 125319, Russia
Introduction. Russia has a high mortality rate of cutaneous melanoma – 2.5 per 100,000 population whereas the incidence rate is 7.7 per 100,000 population, i.e. one in every three patients dies. In the foreign countries (the USA, Australia), melanoma mortality rate is 10-15%. Such high rates are explained by the fact that patients with early-stage disease do not seek medical advice, as in early stages a tumour does not cause inconvenience to a patient and looks like an ordinary mole.
The purpose of the study was to confirm the advisability of removing a progressive dysplastic nevus (grade 3 lentiginous melanocytic dysplasia) with a view to prevent and make early diagnosis of cutaneous melanoma.
Materials and methods. The authors removed 180 pigmented lesions that were clinically diagnosed as a progressive dysplastic nevus in the Surgery Department of Central Polyclinic of Literary Fund from 2009 to March 2020. The patients were referred to the Surgery Department by physicians, dermatologists and other specialists of the polyclinic. Following an oncologist consultation, excisional biopsy of a nevus was performed under local anesthesia.
Results. Histological examination revealed 29 (16%) dysplastic nevi with grade 3 LMD and 18 (10%) early-stage melanomas.
Conclusions. If excisional biopsy of a dysplastic nevus becomes routine in Ambulatory Surgery practice, it will increase the early diagnosis of melanoma and significantly reduce mortality rates of this disease. For excisional biopsy, the authors recommend to excise at a distance of 0.5 to 1.0 cm from the lesion boundaries, since it is not possible to clinically distinguish a progressive dysplastic nevus from early melanoma.
For citation: Artemeva N.G., Romanova O.A. Excisional biopsy of a dysplastic nevus in a district polyclinic is a path to early detection of skin melanoma. Ambulatornaya khirurgiya = Ambulatory Surgery (Russia). 2020;(3-4):66-72. (In Russ.) https://doi.org/10.21518/1995-1477-2020-3-4-66-72
Conflict of interest: the authors declare no conflict of interest.
Введение
В 1969 г. W.H. Clark выделил 3 основные формы меланомы кожи, которые отличаются характером развития, темпом прогрессирования и прогнозом [1]. Узловая форма, которая составляет 20% опухолей, отличается быстрым ростом и плохим прогнозом, 2 другие формы – лентиго-меланома и поверхностно-распространяющаяся меланома имеют 2 фазы развития – фазу горизонтального и вертикального роста. Диагностика меланомы в фазе горизонтального роста обеспечивает излечение в 90–98% случаев, наступление 2-й фазы резко ухудшает прогноз. Лентиго-меланома развивается на фоне меланоза Дюбрея и имеет длительную фазу горизонтального роста 15–20 лет (злокачественное лентиго). Поверхностно-распространяющаяся меланома возникает на фоне диспластического невуса или на неизмененной коже, фаза горизонтального роста у нее намного короче – от нескольких месяцев до 5–10 лет.
Актуальность проблемы
В России отмечается высокая смертность от меланомы кожи – 2,5 на 100 000 населения при заболеваемости 7,7 на 100 000 населения, то есть умирает каждый третий заболевший [2]. В зарубежных странах – в США, Австралии смертность от меланомы составляет 10–15% [3]. Такая ситуация объясняется тем, что пациенты в ранней стадии заболевания к врачам не обращаются, поскольку опухоль в начальной стадии не беспокоит больного и напоминает обычную родинку. Поводом для обращения к врачу является, как правило, изъязвление и кровотечение опухоли, что свидетельствует о поздней стадии заболевания. Ранняя меланома должна выявляться врачом активно, при эксцизионной биопсии подозрительного пигментного образования, которое выявляется врачом при осмотре кожи больных, обратившихся по поводу различных заболеваний. Поверхностно-распространяющаяся меланома, которая имеет фазу горизонтального роста, составляет 60–70% меланом и может развиваться как на неизмененной коже, так и на фоне диспластического невуса.
Диспластический невус (невус Кларка, лентигинозная меланоцитарная дисплазия) – это приобретенное меланоцитарное образование, которое отличается от обычного невуса наличием пролиферативной активности незрелых меланоцитов, что может привести к развитию меланомы. Диспластический невус впервые бал описан W.H. Clark et al. в 1978 г. [4]. Авторы документально показали переход данного невуса в меланому. В 1980 г. D.E. Elder ввел понятие лентигинозная меланоцитарная дисплазия (ЛМД), что является синонимом диспластического невуса [5]. Подобные невусы были описаны нами в 1982 г. в статье «Лентигинозная меланоцитарная дисплазия как предшественник злокачественной меланомы» [6]. В данной статье профессор МНИОИ им. П.А. Герцена З.В. Гольберт впервые выделила 3 степени ЛМД и показала, что 3-я степень дисплазии приближается к картине меланомы in situ. В настоящее время зарубежные авторы выделяют легкую, умеренную и тяжелую меланоцитарную дисплазию (mild, moderate, severe) [7]. Высокий риск развития меланомы на фоне тяжелой меланоцитарной дисплазии в настоящее время отмечают многие авторы [8–11].
Цель исследования – определить выявляемость диспластического невуса с тяжелой меланоцитарной дисплазией (ЛМД 3-й ст.) и ранней меланомы при эксцизионной биопсии пигментных образований с клиническим диагнозом «прогрессирующий диспластический невус».
Материалы и методы
В хирургическом отделении ЗАО «Центральная поликлиника Литфонда» мы с 2009 г. удаляем пигментные образования с клиническим диагнозом «прогрессирующий диспластический невус», что обозначает тяжелую меланоцитарную дисплазию (3-я ст.). Диспластические невусы находят врачи первичного контакта – терапевты, дерматологи и другие специалисты поликлиники при осмотре кожных покровов пациента и направляют его к онкологу. При установлении диагноза «прогрессирующий диспластический невус» пациент направляется к хирургу для выполнения эксцизионной биопсии. Диагноз устанавливается на основании клинико-анамнестических данных, т. е. по признакам ABCDE: неправильная форма невуса (А), неровные края (В), неоднородная окраска (С), диаметр более 0,4 см (D), изменение невуса (E) [12–14]. Эти признаки видны на рис. 1–4.
Рисунок 1. Диспластический невус грудной стенки у женщины 45 лет с лентигинозной меланоцитарной дисплазией 2-й ст.
Рисунок 2. Поверхностно-распространяющаяся меланома брюшной стенки у женщины 34 лет
Рисунок 3. Лентигинозный невус поясничной области у мужчины 77 лет, с очаговой лентигинозной меланоцитарной дисплазией 3-й ст.
Рисунок 4. Меланома in situ на фоне диспластического невуса у женщины 35 лет
В литературе отмечено, что при малых размерах пигментного образования признаки ABCD могут отсутствовать [15, 16]. В этих случаях решающую роль играет признак E – изменение невуса. На рис. 5 и 6 представлено пигментное образование без явных признаков ABCD, однако из анамнеза было известно, что оно существовало длительно, а в последний месяц значительно увеличилось.
Рисунок 5, 6. Меланома правой голени у мужчины 34 лет, 2-й уровень инвазии по Кларку, толщина по Бреслоу 0,75 мм
На рис. 7 также представлено образование без явных признаков ADCD, однако оно появилось 3 мес. назад на неизмененной коже и быстро увеличилось. Эксцизионная биопсия невусов выполняется под местной анестезией, иссекается лоскут кожи с подкожной клетчаткой до фасции, отступление от видимых границ составляет 0,5–1,0 см. Гистологическое исследование проводится в ОАО «Медицина», все препараты диспластических невусов и меланом консультируются в МНИОИ им. П.А. Герцена к.м.н. Э.А. Ягубовой.
Рисунок 7. Поверхностно-распространяющаяся меланома левого предплечья 0,4 см в диаметре у женщины 52 лет
Результаты
Всего с 2009 г. по март 2020 г. было удалено 180 образований с клиническим диагнозом «прогрессирующий диспластический невус». При гистологическом исследовании в 134 случаях выявлен диспластический невус. В 29 случаях установлена тяжелая меланоцитарная дисплазия (ЛМД 3-й ст.), таким образом, диагноз «прогрессирующий диспластический невус» был подтвержден в 16%. В 18 случаях выявлена ранняя меланома, что составило 10%. В 7 случаях из 18 установлена меланома in situ, в остальных – ранняя инвазивная меланома, толщиной по Бреслоу – 1 мм и менее, с уровнем инвазии по Кларку 2–3. В 8 случаях из 18 (44%) установлено развитие меланомы на фоне ЛМД, т. е. из диспластического невуса.
Обсуждение результаты
В наших наблюдениях отмечен довольно высокий процент выявляемости диспластического невуса с тяжелой меланоцитарной дисплазией и ранней меланомы при удалении образований с клиническим диагнозом «прогрессирующий диспластический невус». Это говорит о том, что выявление диспластических невусов врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении может значительно повысить раннюю выявляемость меланомы. К такому же выводу в настоящее время приходит ряд отечественных авторов [17, 18]. Мы полагаем, что следует значительно увеличить число эксцизионных биопсий диспластических невусов, выполняемых хирургами поликлиник. Для этого необходимо, чтобы все врачи первичного звена при осмотре больных обращали внимание на пигментные невусы с признаками ABCDE и направляли пациентов к хирургу для выполнения эксцизионной биопсии. Удаление диспластических невусов должно стать рутинным в практике поликлинического хирурга, который должен удалять 20–30 диспластических невусов в год. При удалении диспластического невуса хирургам необходимо иметь ввиду, что прогноз меланомы определяется толщиной опухоли, определяемой при гистологическом исследовании, которая измеряется не в сантиметрах, как при других опухолях, а в миллиметрах. Так, при толщине опухоли 1 мм и менее пятилетняя выживаемость составляет 95–98%, при толщине 3 мм и более – 40–50%. Учитывая вышесказанное, хирург, удаляя диспластический невус, должен убедиться, что пигментное пятно не возвышается над уровнем кожи более чем на 1 мм. В этом случае при выявлении меланомы опухоль будет иметь толщину 1 мм и менее, что определяет хороший прогноз. Если пальпаторно установлено, что диспластический невус возвышается над уровнем кожи более чем на 0,1 см, необходимо направлять пациента к онкологу, так как при выявлении меланомы опухоль будет иметь толщину 2–4 мм и потребует дополнительного лечения. В зарубежной практике при выполнении эксцизионной биопсии диспластического невуса рекомендовано отступать от видимых границ образования 0,2–0,3 см, а при выявлении меланомы производить реоперацию [19].
Некоторые авторы считают, что реоперацию необходимо производить также и при тяжелой меланоцитарной дисплазии, если имеется положительный край резекции [20]. В случае выявления меланомы in situ ВОЗ считает радикальным отступ от границ образования 0,5 см, при удалении ранней инвазивной меланомы – 1,0 см. Многие авторы отмечают, и мы с ними согласны, что отличить прогрессирующий диспластический невус от ранней меланомы, даже при использовании дерматоскопии, не представляется возможным, точный диагноз устанавливается только при эксцизионной биопсии [10, 19]. Учитывая этот факт, мы считаем предпочтительным отступ от границ образования не менее 0,5 см, а в ряде случаев 1,0 см, чтобы не потребовалась реоперация при выявлении инвазивной меланомы.
В наших исследованиях у 17 больных меланомой из 18 образование было иссечено с отступом 1,0 см, в одном случае – 0,5 см, после чего больной с ранней инвазивной меланомой был направлен к онкологу по месту жительства (рис. 5, 6) После проведенной консультации в онкодиспансере реоперация не была рекомендована. Пациент наблюдается 4,5 года без признаков заболевания. На рис. 1, 3 представлены пигментные образования, которые были иссечены с отступом 1,0 см, при гистологическом исследовании выявлены диспластические невусы 2-й и 3-й ст. дисплазии (рис. 1, 3), меланома in situ (рис. 4) и ранняя инвазивная меланома (рис. 2, 7). В случае обнаружения диспластического невуса (рис. 1, 3) такой отступ не требовался, однако после предупреждения, что при меньшем отступе может потребоваться реоперация в случае обнаружения меланомы, больные давали согласие на отступ 1,0 см. Необходимо отметить, что гистологическое исследование удаленного диспластического невуса должен проводить патоморфолог с достаточным опытом диагностики меланоцитарных образований, так как отличить тяжелую меланоцитарную дисплазию (3-й ст.) от меланомы in situ представляет определенные трудности [21, 22]. Следует подчеркнуть, что установление 3-й ст. ЛМД является важным для клинициста, поскольку свидетельствует о высоком риске развития опухоли у данного пациента.
Заключение
Наш десятилетний опыт эксцизионной биопсии диспластических невусов в хирургическом отделении Центральной поликлиники Литфонда показывает, что выявление прогрессирующих диспластических невусов в поликлинике врачом первичного контакта с последующей эксцизионной биопсией в хирургическом отделении приводит не только к профилактике, но и к раннему выявлению меланомы. Распространение этой практики по всей России позволит снизить смертность от меланомы кожи в нашей стране до уровня зарубежных стран. Эксцизионная биопсия диспластического невуса в поликлинике должна стать рутинной практикой поликлинического хирурга. Чем больше будет выполнено эксцизионных биопсий диспластических невусов, тем больше будет выявлено ранних меланом.
Список литературы / References
- Clark W.H., From L., Bernardino E., Mihm C.M. The histogenesis and Biologic Behavior of Primary Human Malignant Melanoma of Skin. Cancer Research. 1969;29(3):705-726. Available at: https://cancerres.aacrjournals.org/content/29/3/705.full-text.2. pdf.
- Каприн А.Д., Старинский В.В., Петрова Г.В. (ред.) Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.; 2019. 250 с. Available at: https://glavonco.ru/cancer_register/Забол_2018_Электр.pdf.
- Меланома. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.
- Clark W.H., Reimer R.R., Greene M., Ainsworth A.M., Mastrangelo M.J. Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. “The B-K mole Syndrom”. Arch Dermatol. 1978;114(5):732-739. Available at: https://pubmed.ncbi.nlm.nih.gov/646394
- Elder D.E., Goldman L.I., Goldman S.C., Green N.M., Clark W.H. Jr. Displastic nevus syndrome: A phenotypic assotiation of sporadic cutaneous melanoma. Cancer. 1980;46(8):1787-1794. https://doi.org/10.1002/1097-0142(19801015)46:8<1787::aidcncr2820460816>3.0.co;2-s.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии. 1982;(12):36-41.
- Hale C.S. Dysplastic nevus. PathologyOutlines.com. 2020. Available at: http://www.pathologyoutlines.com/topic/skintumormelanocyticdysplasticnevus.html.
- Меньшикова Н.В., Шишкина Ю.В., Григоренко А.А., Макаров И.Ю., Левченко Н.Р., Ефимцева А.Ф. и др. Лентигиозная меланоцитарная дисплазия. В: Клиническая и патоморфологическая диагностика редко встречающихся повреждений и заболеваний. Случаи из практики. Благовещенск; 2015.
- Артамонова И.И., Малютина Е.В. Клинико-морфологические особенности невусов. Известия Российской Военно- медицинской академии. 2019;1(S1):16-18. Режим доступа: https://elibrary.ru/item.asp?id=38164229.
- Damjanov I., Dotlic´ S., Fenderson B.A., Gatalica Z., Morovic A., Nola M. What are dysplastic nevi? In: Damjanov I. (ed.) Pathology Secrets. 3rd ed. Mosby; 2009. https://doi.org/10.1016/B978-0-323-05594-9.X0001-3.
- Hurt M.A., Weedon D. Weedon D. Weedon’s Skin Pathology. 3rd ed. London: Churchill Livingstone Elsevier; 2010. Dermatol Pract Concept. 2012;2(1):79-82. https://doi.org/10.5826/dpc.0201a15.
- Романова О.А., Артемьева Н.Г. Хирургическая профилактика меланомы кожи. Онкохирургия. 2013;(3):12-18. Режим доступа: http://oncosurgery.oncology.ru/archive/2013/03/3.htm.
- Романова О.А., Артемьева Н.Г., Ягубова Э.А., Рудакова И.М., Марычева В.Н., Вещевайлов Э.А. Тактика ведения пациента с диспластическим невусом. Клиническая дерматология и венерология. 2015;14(2):92-97. https://doi.org/10.17116/klinderma201514292-97.
- Романова О.А., Артемьева Н.Г., Солохина М.Г., Марычева В.Н., Вещевайлов А.А., Купчиков С.А. Клинико-морфологические параллели в диагностике прогрессирующего диспластического невуса и ранней меланомы кожи. Онкология. Журнал им. П.А. Герцена. 2019;(1):26-31. https://doi.org/10.17116/onkolog2019801126.
- Сергеев Ю.Ю., Мордовцева В.В. Опыт диагностики меланомы кожи диаметром менее 6 мм. Клиническая дерматология и венерология 2018;17(4):97-105. https://doi.org/10.17116/klinderma20181704197.
- Соколова А.В., Малишевская Н.П. Ошибки в диагностике меланоцитарных новообразований кожи. Современные проблемы науки и образования. 2018;(2). Режим доступа: https://science-education.ru/ru/article/view?id=27502.
- Гаранина О.Е., Лебедева О.Е., Шливко И.Ф., Клеменова И.А., Донченко Е.В., Дардык М.В. и др. Ранняя диагностика злокачественных новообразований кожи: новый взгляд на решение проблемы. Клиническая дерматология и венерология. 2018;17(5):101-108. https://doi.org/10.17116/klinderma/201817051101.
- Эберт М.А., Гафтон Г.И., Зиновьев Г.В., Гафтон И.Г. Современный взгляд на диагностику меланомы кожи. Вопросы онкологии. 2019;65(5):638-644. Режим доступа: https://elibrary.ru/item.asp?id=41271925.
- Диспластический невус. В: Усатине Р.П., Смит М.A., Мэйе Э.Дж., Шамли Х., Тайсингер Дж. Атлас-справочник практикующего врача. Дерматология. М.: Изд-во Панфилова; БИНОМ. Лаборатория знаний; 2012. 536 с.
- Reddy K.K., Farber M.J., Bhavan J., Geronemus R.G., Rogers G.S. Atypical (dysplastic) nevi. Outcomes of surgical excision and association with melanoma. JAMA Dermatol. 2013;149(8):924-934. https://doi.org/10.1001/jamadermatol.2013.4440.
- Червонная Л.В. Пигментные опухоли кожи. М.: ГЭОТАР-Медиа; 2016. 81 с.
- Gerami P. 31 — Clinical, Dermoscopic, Pathologic and Molecular Correlation. In: Busam K., Gerami P., Scolyer R. Pathology of Melanocytic Tumors. Elsevier; 2019, pp. 374-384. https://doi.org/10.1016/B978-0-323-37457-6.00031-6.
Меланома в нашем медицинском центре в Москве
ВНИМАНИЕ! АКЦИЯ!
ЧАС МЕЛАНОМЫ С 14:00 ДО 15:00 ПО ЧЕТВЕРГАМ 2 РАЗА В МЕСЯЦ! ПОДРОБНОСТИ И ЗАПИСЬ НА ПРИЕМ — У АДМИНИСТРАТОРОВ!
Мелано́ма – злокачественная опухоль, развивающаяся из меланоцитов – пигментных клеток, продуцирующих меланины. Она относится к злокачественным опухолям кожи наряду с плоскоклеточным и базальноклеточным раком кожи. Локализуется преимущественно в коже, реже — сетчатке глаза, на слизистых оболочках.
Меланома – одна из наиболее опасных злокачественных опухолей человека. Она часто рецидивирует и метастазирует почти во все органы. Ее особенностью является слабая ответная реакция организма или её отсутствие, из-за чего меланома часто стремительно прогрессирует.
По данным ВОЗ, в 2000г. во всем мире было диагностировано более 200 000 случаев заболевания меланомой и произошло 65 000 связанных с меланомой случаев смерти. В РФ прирост заболеваемости меланомой в период с 1998г. по 2008г. составил 38,17%, а стандартизированный показатель заболеваемости вырос с 4,04 до 5,46 на 100000 населения. В 2008 г. в РФ количество новых случаев меланомы кожи составило 7744 человека. Смертность от меланомы в РФ в 2008г. составила 3159 человек, а стандартизированный показатель смертности 2,23 человека на 100000 населения. Средний возраст больных меланомой с впервые жизни установленным диагнозом в 2008г. в РФ составил 58,7 лет. Наибольшая заболеваемость отмечена в возрасте 75—84 лет.
В 2005 г. США зарегистрированы 59580 новых случаев меланомы и 7700 смертельных случаев, обусловленных этой опухолью. В программе SEER (The Surveillance, Epidemiology, and End Results) отмечается, что заболеваемость меланомой возросла на 600 % с 1950 по 2000 гг.
Факторы риска
- Ультрафиолетовое излучение: естественное (солнечное) и из искусственных источников (оборудование для загара). Является ведущим фактором риска.
- Фенотип — белая кожа, светлые (голубые) глаза, светлые волосы и розовые веснушки.
- Наличие в анамнезе солнечных ожогов. При этом даже те из них (ожоги), которые были получены в детском, подростковом и юношеском возрасте могут сыграть роковую роль в развитии опухоли в последующие годы.
- Меланоформный невус (диспластический меланоцитарный невус, синдром атипического невуса). Относится к доброкачественным новообразованиям кожи.
- Наследственность — семейный анамнез меланомы.
- Невусы — По данным НИИ онкологии им. проф. Н. Н. Петрова, среди больных с установленным фоном для развития меланомы были названы следующие типы невусов: сложный (45 %), пограничный (34 %), интрадермальный (16 %), голубой невус (3,2 %). При этом 70 % невусов были расценены как врожденные, а 30 % — как приобретенные.
- Фактор множественности невусов (более 50) увеличивает риск развития меланомы.
- Пигментная ксеродерма
- Уже ранее перенесённая меланома.
- Возраст старше 50 лет.
- Мужской пол.
%d0%bd%d0%b5%d0%b2%d1%83%d1%81+%d0%bf%d0%b8%d0%b3%d0%bc%d0%b5%d0%bd%d1%82%d0%bd%d1%8b%d0%b9+%d0%bf%d0%be%d0%b3%d1%80%d0%b0%d0%bd%d0%b8%d1%87%d0%bd%d1%8b%d0%b9 — с русского на все языки
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАнглийскийНемецкийНорвежскийКитайскийИвритФранцузскийУкраинскийИтальянскийПортугальскийВенгерскийТурецкийПольскийДатскийЛатинскийИспанскийСловенскийГреческийЛатышскийФинскийПерсидскийНидерландскийШведскийЯпонскийЭстонскийТаджикскийАрабскийКазахскийТатарскийЧеченскийКарачаевскийСловацкийБелорусскийЧешскийАрмянскийАзербайджанскийУзбекскийШорскийРусскийЭсперантоКрымскотатарскийСуахилиЛитовскийТайскийОсетинскийАдыгейскийЯкутскийАйнский языкЦерковнославянский (Старославянский)ИсландскийИндонезийскийАварскийМонгольскийИдишИнгушскийЭрзянскийКорейскийИжорскийМарийскийМокшанскийУдмурдскийВодскийВепсскийАлтайскийЧувашскийКумыкскийТуркменскийУйгурскийУрумскийЭвенкийскийБашкирскийБаскский
Муж и жена: распределение пигмента
Данные пациентаЦвет кожи:
III смуглаяАнамнез жизниВредные привычки:
Нет вредных привычекАнамнез заболеванияПродолжительность заболевания:
не указаноStatus localisОписание сыпи:
Патологический кожный процесс асимментричен, ограничен, локализован. Лентигинозный невус у 27 летней женщины: Представлен единственным элементом в проекции паравертебральной линии и 11-12 реберной дуги справа, овоидной формы, вдоль линии Лангера, светло-коричневого цвета, с четкими границами, фестончатыми краями, размером 2,5*6,0 см. Лентигинозный невус у 34 летнего мужчины в проекции средней лопаточной линии ит 11-12 реберной дуги с четкими границами, округлой формы. Размеры 2,0* 3,0 см.
Первичные элементы сыпи:
ПятноВторичные элементы сыпи:
ПигментацияГруппировка элементов сыпи:
Сетчатая / РетикулярнаяЛокализация высыпаний:
СпинаРаспространение сыпи:
Единственный элемент сыпиХарактер расположения сыпи:
Одностороннее расположениеОбщие клинические данныеЖалобы при обращении:
Активно не предъявляются.
Категории жалоб:
Сыпь на кожеОсмотр больного:
По соматическим органам и системам без патологических отклонений.
ДиагнозКлинический диагноз:
Лентигинозный (меланоцитарный) невусНевус лентигинозный чаще обнаруживается в возрастном промежутке от 20 до 40 лет. Половых различий нет. Невус представляет собой плоское продолговатое пятно размером до 4—5 мм. Возможно незначительное шелушение на поверхности. Центральная часть очага поражения имеет темно-коричневый или черный цвет. По краю невус имеет светло-коричневую полосу. Локализуется преимущественно в области туловища и бедер. При гистологическом исследовании в краевом участке невуса отмечается увеличение количества и удлинение эпидермальных выростов (лентигинозная гиперплазия эпидермиса), что напоминает простое лентиго. Источник: http://meduniver.com/Medical/Dermat/nevus_lentiginoznii.html MedUniver Являясь, как правило, приобретенными, меланоцитарные невусы эпидермального и дермального меланоцитарного происхождения в течение жизни подвергаются эволюции Пограничный невус, возникающий у младенцев в результате пролиферации невусных клеток вдоль границы эпидермиса и дермы, по мере продолжающейся пролиферации и продвижения их в дерму становится смешанным; а после исчезновения пограничного компонента — интрадермальным. Подавляющее большинство приобретенных меланоцитарных невусов являются доброкачественными и растут пропорционально росту тела. Количество их достигает максимума на 2-3-м десятилетии, а исчезают они к 7-9-му десятилетию жизни. Регресс меланоцитарного невуса происходит путем дегенерации и постепенного замещения фиброзной или жировой тканью. Внезапный же регресс наступает редко Источник: http://meduniver.com/Medical/Dermat/71.html MedUniver
Меланоцитарный невус: разновидности, удаление
Доброкачественное новообразование, которое образуется в результате патологического накопления в клетках кожи меланоцита, называется пограничный меланоцитарный невус. Существуют и другие разновидности меланоцитарной патологии кожных покровов, каждая из которых имеет отличительные характеристики и причины возникновения. Рассмотрим, какие есть виды меланоцитарного невуса, как диагностируется патология и какое лечение потребуется в случае, когда невус станет потенциально опасным?
Меланоцитарный невус образуется по причине чрезмерного скопления пигментных клеток в определённых участках кожи.Что это за патология?
Пигментное, или меланоцитарное образование — ограниченные, видоизмененные участки кожи, что образовались в результате сбоя выработки пигмента меланина. Несмотря на то, что невусы изначально имеют доброкачественную этиологию, при стечении неблагоприятных факторов есть риск перехода новообразования в злокачественную опухоль. Невус появляется одинаково у мужского и женского пола. Образования могут быть врожденными или приобретенными, но в случае изменения поведения невусов, и те и другие требуют тщательного изучения, диагностирования и удаления.
Вернуться к оглавлениюРазновидности
Пограничный
Родинка, состоящая из пигментных клеток, находящихся посредине эпидермиса и дермы, называется пограничной. Из-за массового скопления пигмента на коже образуется темное пятно, которое выступает над поверхностью дермы. Цветовой окрас может колебаться от светло-рыжего до коричнево-черного. Образование формируется в детском возрасте, по мере взросления ребенка, родинка увеличивается в размерах. При неблагоприятных обстоятельствах невус трансформируется в злокачественное образование, но такие ситуации случаются редко.
Внутридермальный меланоцитарный невус часто путают с бородавками, а из-за своей формы он чаще повреждается.Вернуться к оглавлениюВнутридермальный
Доброкачественное образование, которое по внешнему виду похоже на бородавку. Поверхность мягкая, цветовой окрас колеблется от светло-коричневого до коричневого насыщенного. Образование возвышается над кожным покровом, частое место локализации — лицо, шея, зона декольте. Если родинка постоянно травмируется, есть опасность перерождения в онкологическое заболевание, поэтому врач посоветует удалить такой невус.
Вернуться к оглавлениюСмешанный
Смешанный невус — переходная форма между пограничным и внтуридермальным невусами. Новообразование может быть как чисто пограничным, так и чисто внутридермальным. Образование на вид похоже на шаровидный нарост плотной консистенции, диаметром не более 10 мм. Цветовой окрас варьируется от светло-коричневого до черного. При неблагоприятных условиях высока вероятность перерождения смешанного невуса в злокачественную опухоль.
Галоневусам больше подвержены женщины, а его наличие несёт ограничени на солнечные ванны.Вернуться к оглавлениюГалоневус
Образование приобретенное, вызвано сбоями в работе иммунной системы. Родинка имеет общие черты со сложным невусом, но отличается тем, что галоневус как будто окантован более темным чем середина ободком. Проблема чаще возникает у женской половины. При образовании такого пятна, стоит ограничить пребывание на солнце, проверить свой организм и сдать анализы. Невус не требует лечения, и при улучшении состояния здоровья, самостоятельно исчезает, но все-таки встречаются случаи злокачественного перерождения.
Вернуться к оглавлениюВеррукозный
Веррукозный, или бородавчатый невус выглядит как бородавка, цветовой окрас колеблется от темно-коричневого до телесного цвета. Форма чаще неправильная, если образовался системный веррукозный невус, на коже это выглядит как гирлянда, которая занимает много места. Такая разновидность меланоцитарного невуса образуется чаще вдоль обширных сосудов и нервных стволов.
Вернуться к оглавлениюИнтрадермальный
Интрадермальный — самая распространенная разновидность меланоцитарного невуса, образуется на коже в любом месте. Меланоцитарные клетки, из которых он состоит, находятся в верхнем слое кожных покровов, а само новообразование не возвышается над кожей. Чаще образование находится в стабильном состоянии и крайне редко перерождается в опасное заболевание.
Невусы так же могут быть врождённым явлением на коже человека.Вернуться к оглавлениюВрожденный
Врожденный невус — доброкачественное новообразование, формируется на коже человека в утробе матери. Родимые пятна различный формы, а окрас колеблется от светлого до коричневого темного. Образования располагаются на уровне кожи, или немного выступают, размер бывает с горошину, а может достигать гигантских диаметров. При неблагоприятных условиях, есть риск перерождения врожденного невуса в меланому, поэтому обладателям новообразования стоит регулярно быть под контролем у онкодерматолога.
Вернуться к оглавлениюПигментный
Меланоцитарное образование, которое возвышается над кожей, похоже на папулу, из-за обильного кровоснабжения новообразования, на нем усиленно растет волос. Состоит из меланоцитарных клеток, которые скапливаются в дерме и эпидермисе. Окрас пигментного невуса может быть светло-коричневый, встречаются и черные родинки. Если невус повредить, есть вероятность преобразования в злокачественную опухоль.
Вернуться к оглавлениюПятнистый
Пятнистый невус образовывается еще в материнской утробе, или на протяжении жизни человека. Образование возвышается над кожей, очертания могут иметь неправильные формы. Цветовой окрас колеблется от светлого до коричневого темного. Если новообразование изменило форму, болит, кровоточит, стоит обратиться за консультацией к онкодерматологу.
Диспластический невус – опасное явление, которое всегда осложняется в раковую болезнь кожи.Вернуться к оглавлениюДиспластический
Меланоцитарная дисплазия — опасное пигментное новообразование, вероятность преобразования в раковую опухоль — 100%. Формируется на дерме в подростковый период, если в семье были случаи образования такого невуса и преобразование в злокачественную болезнь, носителю стоит обратиться к доктору, который посоветует, как правильно поступить с новообразованием. Основное место локализации диспластического невуса — волосистая часть тела и закрытые участки, образования бывают единичными и множественными.
Вернуться к оглавлениюСложный невус
Сложный меланоцитарный невус — доброкачественное новообразование, переходная разновидность меланоцитарного невуса. Пигментированное новообразование выглядит как папула, максимальный размер которой может быть — 10 мм. Тело родинки начинает прорастать в верхних слоях кожных покровов, постепенно разрастаясь в глубинные ткани. Хоть новообразование изначально имеет доброкачественную этиологию, при неблагоприятных обстоятельствах высок риск перерождения в онкологическое заболевание.
Вернуться к оглавлениюЛентигинозный
Лентиго — пигментная макула, округлой формы с однородной поверхностью, которая имеет коричневый или черный окрас. Пигмент локализован в эпидермисе, затронут и роговой слой. Такой вид новообразования считается как предраковая патология, которая при стечении неблагоприятных обстоятельств, перерождается в меланому. Поэтому, если у человека обнаружена такая разновидность меланоцитарных новообразований, стоит регулярно посещать онкодерматолога и следить за поведением макул.
Вернуться к оглавлениюПапилломатозный
Образование, которое является доброкачественным, шансы перерождения в рак равны нулю. Родинка может формироваться в период развития в утробе, а может появиться в течении жизни человека. Родинка выступает над уровнем кожи, верхнее тело бугристое, форма неправильная. Самое распространенное место локализации —голова, лицо, шея, реже туловище и конечности. Если родинка располагается в месте, где она постоянно травмируется, врач посоветует удалить образование, ведь регулярное повреждение провоцирует опасное воспалительное осложнение.
Вернуться к оглавлениюНевус «кофейные пятна»
Невус такой разновидности встречается у темнокожих представителей, образуется в детском возрасте, бывают множественными и единичными. Размеры новообразования увеличиваются по мере взросления, некоторые достигают диаметра 25 см. Невус имеет четкие очертания, окрас равномерный, цвет колеблется от светло- до темно-коричневого оттенка.
Синий невус требует наблюдения, а при осложнении потребуется удаление данного образования.Вернуться к оглавлениюГолубой или синий
Опасное новообразование, риск перерождения которого в меланому крайне высок. Родинка имеет характерный голубой или темный синий окрас, появляется в любом возрасте, преимущественно у женской половины. Образование немного возвышается над дермой, выглядит как мешочек овальной формы, диаметром до 30 мм. Основное место локализации — голени, плечи, внутренняя сторона кистей или стоп, редко образуется на лице. Если родинка не беспокоит, врач посоветует наблюдать за ней, но при патологических симптомах стоит немедленно удалить.
Вернуться к оглавлениюИнволюционный
Приобретенное, доброкачественное новообразование, которое выглядит как куполообразный, возвышающийся над кожными покровами узел или папула. Образование упругой консистенции, мягкое, плотное. Если образование травмировать, оно долго заживает и часто воспаляется. Перерождение в злокачественное заболевание происходит редко, но все равно за образованием стоит наблюдать.
Вернуться к оглавлениюДиагностика меланоцитарного невуса
Во время диагностирования стоит обратить внимание на схожесть некоторых новообразований с другими кожными патологиями, поэтому важно отличить меланоцитарную родинку от других образований. При подозрении на злокачественность, доктор посоветует сдать образец на гистологию. При визуальном осмотре врач оценит состояние образования, его разновидность и опасность, и если возникли подозрения, пациенту посоветуют избавиться от патологии.
Вернуться к оглавлениюУдаление патологии
| Виды | Суть |
| Лазерное иссечение | Пучок лазерного луча локализовано направляется на образование, уничтожая его. Процедура безболезненная, после не остается никаких шрамов и рубцов, но она эффективна только если родинка маленькая и расположена на поверхности. |
| Криодеструкция | Применяется низкотемпературный азот, при помощи которого клетки родинки замораживаются, это приводит к ее исчезновению. Процедура малоинвазивна и безболезненная. |
| Электрокоагуляция | Проводится с применением электрического тока, который локализовано воздействует на патологические участки и прижигает ткани образования. Процедура болезненная, после нее может остаться шрам. |
| Радиохирургическое удаление | Во время операции применяется радионож, который способствует деструкции патологических тканей. Но если невус гигантский, операция малоэффективна. |
| Хирургическая операция | Проводится под местным наркозом, при помощи скальпеля врач иссекает тело новообразования, захватывая окружающие здоровые ткани. После процедуры остаются шрамы и рубцы, от которых потом можно избавиться при помощи пластической хирургии. |
Профилактика перерождения
Чтобы риск перерождения был минимальным, стоит следить за выступающими и легкотравмируемыми родинками. Если врач предлагает удалить образование, стоит прислушаться, это поможет избежать осложнений. Обладателям больших родинок стоит ограничить пребывание на солнце, а при возникновении нехарактерных симптомов, обращаться к врачу.
Меланоформный невус неуточненный — Вопрос онкологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 71 направлению: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.47% вопросов.
Оставайтесь с нами и будьте здоровы!
границ | Глубоко проникающий невус и пограничный глубокопроникающий невус: обзор литературы
Введение
Термин глубоко проникающий невус (DPN) был впервые введен Сибом и др. В 1989 г., когда автор описал серию случаев, которые изначально были ошибочно диагностированы как злокачественная меланома (1). Из-за своего клинического и, в частности, гистопатологического вида, ДПН сложно отличить от клеточных голубых невусов, невусов Шпица и злокачественной меланомы (2).Клинически проявляясь в виде одиночных пигментированных папул или узелков, ДПН чаще встречается у молодых людей с преобладанием в области головы и шеи (3, 4). Гистологически он характеризуется как хорошо разграниченные клиновидные поражения, доходящие до ретикулярной дермы / подкожной клетчатки, с эпителиоидными / веретеновидными меланоцитарными гнездами с цитологической атипией низкой степени и возможными митотическими фигурами (1, 2, 5, 6). Несмотря на заметный гистопатологический вид, ДПН имеют хороший прогноз, демонстрируя доброкачественное поведение (1, 2, 5, 6).Однако описано распространение на регионарные лимфатические узлы (7), и в литературе можно найти даже случаи метастазов от ДПН с атипичными признаками, классифицируемыми как «пограничные» (B-DPN) (7–10). Являясь диагностической проблемой даже для специалистов в области дерматопатологии и патологии (7), правильный диагноз имеет первостепенное значение для эффективного клинического лечения и результата. Рекомендации по терапевтическому ведению и последующему наблюдению непоследовательны и не основаны на достаточных клинических данных. Недостаточное и избыточное лечение, включая длительное наблюдение, часто встречается у пациентов с этими опухолями (2, 6, 8, 9, 11, 12).Мы стремились предоставить обзор литературы по DPN и B-DPN для оценки клинического ведения, включая лечение и последующую оценку.
Материалы и методы
Мы провели обзор наборов данных Medline, Scopus и Embase для клинических исследований, опубликованных с 1989 г. по 30 июля 2019 г. на DPN и B-DPN.
Слова «глубокопроникающий невус» и «глубокий невус» использовались для идентификации исследований, в которых изучались пациенты с этим заболеванием, содержащих данные клинических и лабораторных обследований, которым они подверглись.Комбинации терминов MeSH (Медицинский предметный заголовок) и логических операторов, использованные в нашем поиске по включенному в Medline, перечислены ниже: глубокопроникающий невус ИЛИ глубокопроникающий невус ИЛИ темно-синий невус ИЛИ темно-синий невус ИЛИ глубокий невус ИЛИ глубокий невус. Поиск в Scopus проводился с использованием следующих комбинаций терминов MeSH и логических операторов: [(невус) ИЛИ (невус) ИЛИ (невус) ИЛИ (невус)] И [(глубокий) ИЛИ (синий) ИЛИ (проникающий)]. Комбинации терминов MeSH и логических операторов, использованные в нашем поиске на Embase, включали следующее: [невус / невус И ((синий) ИЛИ (глубокий)].Мы рассматривали для дальнейшего рассмотрения только статьи, опубликованные на английском или немецком языке, и исключали дубликаты. Чтобы устранить ожидаемую общую нехватку хорошо спланированных исследований в больших популяциях пациентов с ДПН и Б-ДПН, мы включили проспективные исследования любого дизайна, ретроспективный когортный анализ, а также отчеты о случаях. Однако, чтобы иметь возможность оценить устойчивые эффекты клинического ведения и прогностические исходы, мы включили только те исследования, которые содержали данные последующего наблюдения.Статьи были отобраны на основе названия и аннотации, чтобы определить право на участие в нашем обзоре. Целые статьи были просмотрены и извлечены для оценки приемлемости. Кроме того, мы вручную провели поиск библиографий включенных статей.
Результаты
Первоначальный поиск выявил в общей сложности 3 513 исследований, а в процессе обзора еще три статьи были идентифицированы путем ручного поиска в списках литературы. После удаления дублирующих статей в общей сложности осталось 3 369 статей.Статьи были сужены по названию, аннотации и полнотекстовому обзору. Всего критериям включения соответствовали 15 статей (рис. 1). Все 15 работ, соответствующих критериям включения, перечислены в таблицах 1A, B. Исследования были разделены на статьи о клиническом ведении DPN и статьи о B-DPN. Включенные исследования состоят из 10 когортных исследований и пяти клинических случаев, включая в общей сложности 355 пациентов с ДПН и 48 пациентов с В-ДПН. Клинические характеристики и данные последующего наблюдения включенных исследований показаны в таблицах 1A, B.
Рисунок 1 . Блок-схема выбора исследования.
Таблица 1A . Клинические данные пациентов, входящих в группу ДПН.
Таблица 1B . Клинические данные пациентов, входящих в группу Б-ДПН.
Клинические характеристики
Для группы глубоко проникающих невусов возрастной диапазон в исследованиях, без учета клинических случаев, варьировал от 3 месяцев до 64 лет со средним возрастом 30 лет, аналогично группе B-DPN, где возрастной диапазон составлял 4–62 года с средний возраст во всех исследованиях был моложе 30 лет.Гендерное распределение было одинаковым для обеих групп с немного большим количеством женщин, 203 (57,1%) в ДПН и 25 (54,1%) в Б-ДПН, чем мужчины, 152 (42,8%) в ДПН и 22 (45,8%) ) в Б-ДПН. Расположение невуса было разделено на шесть категорий: голова и шея, туловище, верхняя конечность, нижняя конечность (включая ягодицы), другое и неизвестное. Большинство невусов в группе ДПН было расположено в области головы и шеи — 117 (32,9%), а также на верхней и нижней конечностях — 111 (31,2%). Из 111 невусов на конечностях больше невусов было диагностировано на верхней конечности, чем на нижней, 61 против.44 соответственно. Среди необычных мест расположения невусов — конъюнктива (34 случая ДПН) (19), а также слизистая оболочка щеки и мягкое небо в одном случае (17). В группе B-DPN наиболее частая локализация была аналогична группе DPN, голова и шея с 16 случаями, затем туловище и верхняя конечность, каждая с 14 случаями, а в остальных четырех случаях локализация была нижней конечностью.
Менеджмент
Информация о тактике лечения для группы DPN не была доступна для всех включенных исследований.Простое иссечение без каких-либо дополнительных хирургических вмешательств было основным лечением, которое получали большинство пациентов. В нескольких случаях было выполнено повторное иссечение, в случаях, когда невус не был полностью удален с первого раза, а некоторым пациентам было выполнено широкое иссечение без дальнейших указаний по этому поводу. Для группы B-DPN лечение варьировалось от иссечения / широкого иссечения до биопсии сторожевых лимфатических узлов (SLNB) и системного лечения. В исследование 2010 года, проведенное Magro et al., Было включено 32 пациента с пограничными меланоцитарными опухолями, из которых 7 пациентов имели диагноз B-DPN (9).У четырех из этих пациентов была положительная биопсия сторожевого лимфатического узла (SLNB). У одного из этих пациентов изначально был диагностирован ДПН, и через 1,5 года поражение рецидивировало, показывая гистологические характеристики глубоко инвазивной меланомы. Повторная оценка исходной биопсии диагностировала поражение как B-DPN, что, по мнению авторов, должно было иметь показания для широкого иссечения и SLNB. У пациента развился последующий мультиорганный метастаз, и он умер. Другим пациентам с положительным SLB была выполнена завершающая лимфаденэктомия без дальнейших признаков заболевания, и они получали адъювантную терапию интерфероном.У пациентов не было дальнейших рецидивов или метастазов в течение 4-летнего периода наблюдения. Второе исследование Magro et al. (8) включили 40 пациентов с ДПН-подобной пограничной опухолью. В 35 случаях было выполнено повторное иссечение, и в 23 из этих случаев процедура представляла собой широкое повторное удаление, остаточная пограничная опухоль присутствовала в 11 образцах. Из 23 пациентов с широким повторным иссечением 19 перенесли SLNB, из которых 7 были положительными. Авторы сообщили, что в большинстве этих положительных случаев SLNB опухолевые отложения были субкапсулярными и небольшими, в то время как у одного пациента, у которого после лечения был рецидив через 1 год, наблюдались обширные паренхиматозные отложения.Полная лимфаденэктомия была выполнена четырем пациентам с положительным SLNB без дальнейших доказательств заболевания, а двое пациентов получали адъювантную терапию интерфероном альфа. В двух из 40 случаев первоначальным диагнозом был диспластический невус и клеточный голубой невус, пациенты получали небольшое консервативное повторное удаление или без повторного удаления, соответственно. У обоих пациентов развилась плексиформная меланома в непосредственной близости от предыдущего поражения с метастатическим заболеванием, из-за которого оба пациента умерли.В эту группу был включен один случай болезни: 4-летний мальчик с поражением на шее с диагнозом ДПН, у которого через 4 месяца после лечения появился видимый и пальпируемый лимфатический узел. В SLNB были обнаружены пигментированные атипичные клетки, и мальчику было выполнено комплексное модифицированное радикальное вскрытие шеи II типа с удалением 39 лимфатических узлов, все отрицательные. Постановка не выявила никаких дальнейших доказательств метастазирования. Повторная оценка первичной биопсии привела к повторному диагнозу поражения как злокачественной меланоме.
Продолжение
Срок наблюдения пациентов в группе ДПН составил от 4 месяцев до 23 лет.В пяти исследованиях наблюдение за некоторыми пациентами длилось более 10 лет. Из 12 исследований местные рецидивы были зарегистрированы только у двух пациентов из двух разных исследований, и ни одного случая метастазирования не наблюдалось. Срок наблюдения в группе Б-ДПН составил от 5 месяцев до 5 лет. Наблюдалось в общей сложности четыре рецидива и три случая смерти, все три случая изначально были неправильно диагностированы, что привело к недостаточному лечению пациентов.
Обсуждение
Гистологическая диагностика атипичных меланоцитарных опухолей может быть очень сложной задачей даже для опытных дерматопатологов и патологов (7), а дифференциация доброкачественных и злокачественных новообразований имеет терапевтические и прогностические последствия.Несмотря на то, что ДПН широко описывается как доброкачественное меланоцитарное поражение (1, 6, 11, 13, 18, 19), его злокачественный потенциал активно обсуждается (5, 7), и сообщалось о случаях поражения регионарных лимфатических узлов ( 2, 5, 12). Тем не менее, Международная группа по изучению патологии меланомы в 2009 году согласилась с тем, что отдаленное заболевание за пределами регионарных узлов встречается редко и что в отсутствие митотической активности, ядерного плеоморфизма и обширного роста <2% поражений распространяются на лимфатический узел (5).Во время «XXIX симпозиума Международного общества дерматопатологов в Граце» в 2008 году эксперты-дерматопатологи и патологи рассмотрели 57 случаев MELTUMP (меланоцитарные опухоли с неопределенным злокачественным потенциалом), которые включали атипичные опухоли шпица (AST) и атипичные эпителиоидные / веретенообразные синие невусы. категория, включающая ДПН (7). Пациенты были разделены на три группы: благоприятная (отсутствие метастазов в течение 5-летнего наблюдения), неблагоприятная (смерть, связанная с опухолью и / или лимфатические узлы и / или висцеральные метастазы) и пограничная (отложения узловых опухолевых клеток ≤ 0). .2 мм), и авторы отметили, что неблагоприятная группа чаще проявляла три гистопатологических признака, а именно наличие митоза, митоза у основания и воспалительной реакции. Кроме того, авторы отметили сложность достижения консенсуса в отношении доброкачественного или злокачественного диагноза поражений. О случаях метастатической ДПН сообщали и другие группы, в которых упоминалось, что эти поражения имели «пограничные» или «атипичные» признаки (8–10), что указывает на неопределенный злокачественный потенциал этих поражений, диагностика и терапевтическое лечение которых затруднены.В настоящем обзоре мы разделили включенные исследования на две группы: DPN и B-DPN. Всего в группу DPN были включены 355 пациентов, и в течение периода наблюдения от 4 месяцев до 23 лет было зарегистрировано только два местных рецидива и не было метастазов. Во вторую группу, B-DPN, были включены 48 пациентов, из которых 24 пациента подверглись SLNB и пятиблочной лимфодиссекции после положительного SLNB, а некоторые пациенты даже получали впоследствии адъювантную терапию интерфероном альфа. В этой группе «высокого риска» частота рецидивов была низкой, у четырех пациентов развивались местные рецидивы, и у трех широко распространенных метастатических заболеваний.Тот факт, что ни у одного из пациентов в группе ДПН не развилось метастатическое заболевание и что хотя у 12 пациентов из группы Б-ДПН были положительные SLNB, только у трех, двое из которых изначально были неправильно диагностированы, развилось широко распространенное метастатическое заболевание, подчеркивает доброкачественное поведение этого меланоцитарного поражения. . Однако на основании двух исследований Magro et al. (8, 9) следует дополнительно оценить и исследовать, если более широкий первоначальный хирургический подход не окажется полезным для пациентов с пограничным / атипичным ДПН.
Несмотря на то, что возраст при постановке диагноза ДПН и Б-ДПН находился в широком диапазоне от 3 месяцев до 64 лет, в нашем обзоре поражения обычно диагностировались у молодых людей в возрасте до 30 лет (1, 6, 8, 9 ). О врожденных ДПН ранее сообщалось в литературе (6), но большинство ДПН являются приобретенными поражениями (3). В одном случае, включенном в наш обзор, авторы сообщают о развитии ДПН при врожденном невусе правой подколенной ямки у 3-месячного мальчика (14). Первоначальное иссечение поражения показало положительные глубокие края, из-за чего пациенту было выполнено повторное удаление, после чего не было никаких дальнейших доказательств рецидива или метастазов в течение 15-месячного периода наблюдения.Самым молодым обнаруженным случаем B-DPN стал 4-летний мальчик, которому первоначально был поставлен диагноз DPN, но спустя 4 месяца был диагностирован повторный диагноз как меланома после метастазирования в лимфатический узел. У мальчика не было дальнейших метастазов, однако ему была проведена модифицированная радикальная диссекция шеи III типа с иссечением 39 лимфатических узлов, все гистологические отрицательные. Дифференциальный диагноз между ДПН и злокачественной меланомой у детей может быть затруднен, поскольку ДПН может демонстрировать цитологическую атипию и наличие митотической активности, вызывая подозрение на злокачественное новообразование (2).Авторы упомянули, что они рассматривали диагноз пигментной эпителиоидной меланоцитомы, но поскольку не все гистологические критерии были соблюдены, диагноз был изменен на меланому (20). Было бы интересно переоценить поражение и определить, можно ли с применением критериев, упомянутых в более поздних исследованиях (7–9), лучше классифицировать поражение как пограничное / атипичное ДПН.
В недавней публикации, посвященной генетике меланоцитарных поражений с гистологическими аспектами ДПН, были сделаны наблюдения, позволяющие отличить это образование от других меланоцитарных опухолей (21).Помимо мутаций, активирующих путь киназы MAP (например, MAP2K1 или BRAF ), также наблюдаемых в других невусах, выяснилось, что DPN часто имеют параллельные мутации CTNNB1 . Это приводит к непрерывной активации сигнального пути бета-катенина. Это также наблюдалось гистологически. В обычных невусах меланоциты становятся меньше («зрелыми») и демонстрируют более низкую экспрессию CTNNB1 и CCND1 по данным иммуногистохимии в более глубоких слоях дермы. В DPN клетки не становятся меньше («созревают») и сохраняют экспрессию CTNNB1 и CCND1 в нижней части дермы.Авторы также определили, что злокачественные DPN (меланомы, возникающие в DPN) демонстрируют дополнительные генетические изменения (в отношении активации киназы MAP и мутаций CTNNB1 и ). Эти выводы имеют ряд важных последствий. Иммуногистохимия CTNNB1 может быть полезна для выявления повреждений DPN (19, 22). Кроме того, профиль мутации может помочь дифференцировать голубые невусы (которые имеют мутации GNAQ или GNA11 (23)) от DPN, что может быть затруднено исключительно на основании гистологических критериев.Наконец, наличие дополнительных генетических событий, таких как промотор TERT, , CDKN2A, TP53 или другие мутации, свидетельствует в пользу злокачественной опухоли и плохого прогноза.
Недавно описанные генетические данные могут существенно помочь в правильно диагностированном DPN и B-DPN. Эти генетические данные были включены в последнюю систему классификации ВОЗ для меланоцитарных опухолей, в которой DPN и B-DPN помещены между обычными невусами и меланомами в промежуточные группы / группы меланоцитом, с DPN, помеченным как низкосортная, а B-DPN — дисплазия высокой степени ( 24).Подробные последующие исследования с применением генетических критериев, представленных Yeh et al. в настоящее время отсутствуют. Особую ценность, конечно, будет иметь более крупное проспективное исследование. Эти данные потенциально могут способствовать дальнейшему уточнению модели, предложенной Yeh et al. и позволяют более точную оценку поведения опухолей на генетической основе в тех случаях, когда их трудно классифицировать только на основании гистопатологической оценки.
Сила нашего обзора подчеркивает существенное отсутствие проспективных когортных исследований, сочетающих клиническую и гистопатологическую корреляцию с генетической оценкой для определения эффективных стратегий клинического лечения DPN и B-DPN.В то же время небольшое количество включенных исследований является ограничением для соответствующего статистического анализа при ведении ДПН и пограничных / атипичных ДПН.
Авторские взносы
IC и TS внесли свой вклад в концепцию исследования. IC, TS, AT и LU внесли свой вклад в дизайн исследования. Сбор и анализ данных были выполнены IC и KG. IC, AT, KG, LU и TS подготовили и рассмотрели рукопись.
Финансирование
Выражаем благодарность за поддержку со стороны фондов публикаций открытого доступа SLUB / TU Dresden.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа является частью магистерской программы по клиническим исследованиям, Центр клинических исследований и управленческого образования, Отделение медицинских наук, Дрезденский международный университет, Дрезден, Германия.
Список литературы
2.Робсон А., Морли-Кванте М., Хемпель Х, Макки PH, Калонье Е. Глубокий проникающий невус: клинико-патологическое исследование 31 случая с дальнейшим определением гистологических особенностей, позволяющих отличить его от других пигментных доброкачественных меланоцитарных поражений и меланомы. Гистопатология. (2003) 43: 529–37. DOI: 10.1111 / j.1365-2559.2003.01730.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Лузар Б., Калонье Э. Глубокий проникающий невус: обзор. Arch Pathol Lab Med. (2011) 135: 321–6. DOI: 10.1043 / 2009-0493-RA.1
CrossRef Полный текст | Google Scholar
5. Барнхилл Р.Л., Серрони Л., Кук М., Элдер Д.Е., Керл Х., Лебойт П.Е. и др. Современное состояние, номенклатура, точки согласия и разногласия относительно доброкачественных меланоцитарных поражений: результат международного семинара. Adv Anat Pathol. (2010) 17: 73–90. DOI: 10.1097 / PAP.0b013e3181cfe758
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Серрони Л., Барнхилл Р., старейшина Д., Готтлиб Г., Хинан П., Кутцнер Х. и др. Меланоцитарные опухоли с неопределенным злокачественным потенциалом: результаты учебного курса, проведенного на XXIX симпозиуме международного общества дерматопатологов в Граце, октябрь 2008 г. Am J Surg Pathol. (2010) 34: 314–26. DOI: 10.1097 / PAS.0b013e3181cf7fa0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Магро С.М., Абрахам Р.М., Го Р., Ли С., Ван Х, Пропер С. и др. Глубоко проникающие невусоподобные пограничные опухоли: уникальная подгруппа неоднозначных меланоцитарных опухолей со злокачественным потенциалом и нормальной цитогенетикой. Eur J Dermatol. (2014) 24: 594–602. DOI: 10.1684 / ejd.2014.2393
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Магро С.М., Кроусон А.Н., Михм М.К. младший, Гупта К., Уокер М.Дж., Соломон Г. Пограничная меланоцитарная опухоль на коже: категориальный подход. J Am Acad Dermatol. (2010) 62: 469–79. DOI: 10.1016 / j.jaad.2009.06.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Авраам Р.М., Мин М.Э., старейшина Д.Э., Сюй X.Атипичное меланоцитарное поражение без геномных аномалий показывает локорегиональные метастазы. Дж. Кутан Патол. (2012) 39: 21–4. DOI: 10.1111 / j.1600-0560.2011.01849.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Барнхилл Р.Л., Михм М.С. младший, Магро С.М. Плексиформный невус веретенообразных клеток: отличительный вариант плексиформного меланоцитарного невуса. Гистопатология. (1991) 18: 243–7. DOI: 10.1111 / j.1365-2559.1991.tb00832.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Высокий WA, Аланен KW, Голиц LE. Является ли меланоцитарный невус с очаговыми атипичными эпителиоидными компонентами (клональный невус) поверхностным вариантом глубоко проникающего невуса? J Am Acad Dermatol. (2006) 55: 460–6. DOI: 10.1016 / j.jaad.2006.04.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Мерфи М.Дж., Джен М., Чанг М.В., Грант-Келс Дж. М., Маккар Х. Молекулярная диагностика доброкачественного пролиферативного узелка, развивающегося в врожденном меланоцитарном невусе у 3-месячного младенца. J Am Acad Dermatol. (2008) 59: 518–23. DOI: 10.1016 / j.jaad.2008.05.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Абрахам Р.М., Каракусис Дж., Ас Дж., Зиобер А.Ф., Серрони Л., Михм М.С. младший и др. Лимфатическая инвазия предсказывает агрессивное поведение при меланоцитарных опухолях с неопределенным злокачественным потенциалом (MELTUMP). Am J Surg Pathol. (2013) 37: 669–75. DOI: 10.1097 / PAS.0b013e318288ff47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Веронезе Ф., Селаско М., Мели Ф., Заваттаро Э., Рампони А., Мерло Э и др. Глубокий проникающий невус подошвенной поверхности: отчет о случае с дерматоскопическими особенностями. J Dtsch Dermatol Ges. (2016) 14: 517–8. DOI: 10.1111 / ddg.12718
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Чо Э.С., Чо Х.М., Нам В., Ким Х.С. Множественные оральные глубоко проникающие невусы, распространяющиеся на жевательную подушечку и щечную жировую подушечку. J Oral Maxillofac Surg. (2017) 75: 2579–92. DOI: 10.1016 / j.joms.2017.05.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ли Дж. Дж., Вилэйн Р. Э., Грантер С. Р., Ху Н. Р., Бреслер С. К., Сюй С. и др. 5-гидроксиметилцитозин является ядерным биомаркером для оценки биологического потенциала гистологически неоднозначных сильно пигментированных меланоцитарных новообразований. Дж. Кутан Патол. (2017) 44: 249–55. DOI: 10.1111 / чашка.12880
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Шекоранья Д., Вергот К., Хавлина Г., Пикем Дж.Комбинированные глубоко проникающие невусы конъюнктивы являются относительно частыми поражениями, характеризующимися мутацией BRAFV600E и активацией пути бета-катенина: клинико-патологический анализ 34 поражений. Br J Офтальмол . (2019). DOI: 10.1136 / bjophthalmol-2019-314807. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Рида Х., Ахмед С., Тикер Дж. М., Хорлок Н. Злокачественная меланома и глубоко проникающий невус — трудности в диагностике у детей. J Plast Reconstr Aesthet Surg. (2007) 60: 1252–5. DOI: 10.1016 / j.bjps.2006.05.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Yeh I, Lang UE, Durieux E, Tee MK, Jorapur A, Shain AH и др. Комбинированная активация пути киназы MAP и передачи сигналов β-катенина вызывает глубоко проникающие невусы. Nat Commun. (2017) 8: 644. DOI: 10.1038 / s41467-017-00758-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.de la Fouchardiere A, Caillot C, Jacquemus J, Durieux E, Houlier A, Haddad V и др. Экспрессия β-катенина в ядре отличает глубоко проникающие невусы от других кожных меланоцитарных опухолей. Virchows Archiv. (2019) 474: 539–550. DOI: 10.1007 / s00428-019-02533-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Гриванк К.Г., Мюллер Х., Жакет Л.А., Эмбергер М., Моллер И., ван де Нес Дж.А. и др. Мутации SF3B1 и BAP1 в меланоме, подобной голубому невусу. Mod Pathol. (2017) DOI: 10.1038 / modpathol.2017.23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Старейшина Д.Е., Масси Д., Сколайер Р.А., Виллемзе Р. (ред.). Классификация кожных опухолей ВОЗ . 4-е изд. Лион: МАИР (2018).
Google Scholar
Диагностика и обсуждение — Дело 1078
Диагностика и обсуждение — Дело 1078ОКОНЧАТЕЛЬНАЯ ДИАГНОСТИКА
Пигментная узловатая злокачественная меланома с веретенообразными и эпителиоидными клетками.
ОБСУЖДЕНИЕ
Глубокопроникающий невус (DPN) — это отдельная гистологическая категория со специфической генетической сигнатурой (включена в ВОЗ, 2016 г.). Впервые об этом сообщили Сиб и его коллеги в 1989 г. (1). Это один из сложных диагнозов из-за многих сходств и перекрывающихся черт между другими меланоцитарными поражениями, такими как плексиформные и пигментированные опухоли шпица, голубые невусы и пигментные эпителиоидные меланоцитомы (PEM). Кроме того, у них отсутствует цитологический градиент невомеланоцитов (2).
Тем не менее, классический ДПН не следует ошибочно принимать за злокачественную меланому (3). ДПН обычно представляет собой асимметричную клиновидную меланоцитарную пролиферацию, при которой его кончик простирается до ретикулярной дермы (4). Опухолевые клетки представляют собой веретенообразные, а эпителиоидные меланоцитарные клетки расположены в вертикально ориентированных пучках, демонстрирующих меланизацию цитоплазмы. Изредка встречаются однократно увеличенные клетки с гиперхроматическими ядрами, содержащими цитоплазматические псевдо-внутриядерные включения (3).
Определенная подгруппа меланоцитарных поражений демонстрирует особенности ДПН, но с усиленной цитологической и архитектурной атипией, которая превосходит обычные признаки ДПН.Эта подгруппа обычно показывает области инфильтративного или узлового расширяющегося типа роста и более высокую частоту метастазов в регионарные лимфатические узлы. Эта категория меланоцитарных поражений известна как пограничные ДПН-подобные опухоли или ДПН-подобная меланома. Они разделяют некоторые критерии плексиформной меланомы, которая может эволюционировать в более агрессивный тип меланомы (3).
В нашем случае были обнаружены морфологические особенности ДПН-подобной меланомы в дополнение к особенностям пигментных эпителиоидных меланоцитом и голубых невусов.Сохраненная экспрессия BAP1 в сочетании с экспрессией ядерного бета-катенина в опухолевых клетках наводила на мысль о DPN-подобном диагнозе меланомы в нашем случае, однако в таких случаях рекомендуется проводить молекулярные исследования для лучшей категоризации.
DPN недавно характеризуется специфической генетической сигнатурой, сочетающей мутации путей β-catenin и MAPK. Это происходит из-за множества комбинаций событий, часто сочетания мутаций BRAF V600E и экзона 3 CTNNB1. Yeh et al. Сообщили, что DPN, которые возникают из обычного приобретенного невуса, показали активацию пути киназы MAP как DPN, так и компонентов обычного приобретенного невуса, в то время как мутация CTNNB1 ограничивается только компонентом DPN.В том же исследовании выявлены дополнительные онкогенные мутации в DPN-подобной меланоме, включая промоторные области TERT C250T и C228T, мутации TP53 и двуаллельную потерю CDKN2A (5).
Целевое секвенирование ДНК / РНК с помощью Next Generation Sequencing (NGS) было выполнено в нашем случае и показало мутации BRAF V600K, CTNNB1 S45F и TERT промоторной области C250T. Эта генетическая подпись подтверждает диагноз ДПН-подобной меланомы.
Наш случай представляет собой классический случай меланомы, подобный ДПН, с типичными ИГХ и генетическими аномалиями.Обычно такие случаи показывают хороший прогноз и ответ на иммунотерапию, несмотря на большую опухолевую нагрузку (3).
ССЫЛКИ
- Сиб Дж. А. Младший, Грэм Дж. Х., Хельвиг Е.Б. Глубокопроникающий невус. Am J Surg Pathol 1989; 13: 39-44.
- Robson A, Morley-Quante M, Hempel H, McKee PH, Calonje E. Глубокий проникающий невус: клинико-патологическое исследование 31 случая с дальнейшим определением гистологических особенностей, позволяющих отличить его от других пигментных доброкачественных меланоцитарных образований и меланомы.Гистопатология. 2003; 43: 529-37.
- Магро С.М., Абрахам Р.М., Го Р., Ли С., Ван Х, Пропер С., Кроусон А.Н., Михм М. Глубоко проникающие невусоподобные пограничные опухоли: уникальная подгруппа неоднозначных меланоцитарных опухолей со злокачественным потенциалом и нормальной цитогенетикой. Eur J Dermatol 2014; 24 (5): 594-602.
- Magro CM, Crowson AN, Mihm MC Jr., et al. Пограничная меланоцитарная опухоль кожного происхождения: категориальный подход. J Am Acad Dermatol 2010; 62: 469-79.
- Yeh I, Lang UE, Durieux E, Tee MK, Jorapur A, Shain AH, Haddad V, Pissaloux D, Chen X, Cerroni L, Judson RL, LeBoit PE, McCalmont TH, Bastian BC, de la Fouchardire.Комбинированная активация пути киназы MAP и передачи сигналов β-катенина вызывает глубокое проникновение невусов. Nat Commun 2017; 8: 644.
Предоставлено Shaymaa Hegazy, MD и Arivarasan Karunamurthy, MD
Неопределенные меланоцитарные пролиферации конъюнктивы | Патология и лабораторная медицина | JAMA Офтальмология
Цель Проверить гипотезу о существовании подмножества пролифераций меланоцитов конъюнктивы, которые нельзя воспроизводимо классифицировать как доброкачественные, злокачественные или неопределенные.
Методы Три группы образцов эксцизионной биопсии меланоцитарной пролиферации конъюнктивы были оценены группой из 5 патологов-офтальмологов. Эти группы включали поражения, которые мы считали доброкачественными (группа 1 [n = 5]), злокачественными (группа 2 [n = 5]) и неопределенными меланоцитарными пролиферациями (группа 3 [n = 5]). Панель классифицировала одни и те же разделы во всех 3 группах рандомизированным, замаскированным способом, сначала без, а затем с историей болезни пациента, включая возраст, пол и расу.Статистика κ использовалась для количественной оценки степени согласия между наблюдателями.
Результаты Наблюдалась сильная согласованность между членами группы как для группы 1 (доброкачественная [κ = 0,76]), так и для группы 2 (злокачественная [κ = 0,70]) пролиферации меланоцитов. Не было согласования панели для поражений группы 3 (неопределенные) (κ = -0,045). Соответствие для групп 1 и 2 и несоответствие для поражений группы 3 не зависело от знания истории болезни, возраста, пола и расы.
Заключение Существует подмножество меланоцитарных разрастаний конъюнктивы, которые патологи не могут воспроизводимо классифицировать как доброкачественные, злокачественные или неопределенные.
КЛАССИФИКАЦИЯ меланоцитарной пролиферации конъюнктивы — это процесс, при котором каждое поражение считается доброкачественным, злокачественным или неопределенным. Концептуальная основа этой системы основана на предположении, что гистопатологический диагноз пролиферации меланоцитов является точным и точным (воспроизводимым).Хотя гистопатологические признаки доброкачественных пролифераций меланоцитов конъюнктивы 1 и злокачественных 2 хорошо определены, существует подмножество неопределенных пролифераций, которые нелегко классифицировать. 3
Эта группа неопределенных разрастаний имеет признаки как доброкачественных, так и злокачественных новообразований. Когда эти поражения рассматриваются и интерпретируются разными патологами, единого мнения нет. 3 Проблемы, возникающие, когда опытные патологи не могут прийти к единому мнению о биологическом потенциале меланоцитарного поражения, значительны, потому что прогноз и клиническое лечение сильно различаются для доброкачественных и злокачественных новообразований.Мы идентифицировали группу неопределенных разрастаний меланоцитов конъюнктивы, которые имели признаки как доброкачественных, так и злокачественных новообразований. Мы разработали эксперимент, чтобы проверить гипотезу о том, что патологи не могут воспроизводимо классифицировать подмножество разрастаний меланоцитов конъюнктивы как доброкачественные, злокачественные или неопределенные.
Чтобы проверить гипотезу о том, что существует подмножество неопределенных пролифераций меланоцитов конъюнктивы, для которых последовательная гистологическая классификация невозможна, мы идентифицировали по 5 случаев невуса конъюнктивы (группа 1), меланомы (группа 2) и неопределенной пролиферации меланоцитов (группа 3). .Мы согласовали классификацию каждого случая до включения в исследование. Подробное обсуждение гистопатологических особенностей поражений групп 1, 2 и 3 приведено в разделе «Комментарии» этой статьи. Слайд каждого случая оценивался рандомизированным скрытым способом 5 патологами-офтальмологами, которых попросили классифицировать поражения как доброкачественные, злокачественные или неопределенные до и после предоставления клинической информации.
Каждый член комиссии патологов-офтальмологов был сертифицирован по анатомической патологии, а 2 члена комиссии также были сертифицированы по офтальмологии.На момент исследования члены комиссии активно занимались офтальмологической патологией в медицинских центрах в разных географических регионах США. Каждый член комиссии просмотрел одни и те же слайды поражений группы 1, 2 и 3.
Коэффициент κ рассчитывался как наблюдаемое согласие между 3 возможными диагностическими категориями (переменными) минус случайное согласие, деленное на 1 минус случайное согласие. 4 При полном соответствии измеренных переменных коэффициент κ равен 1.Для чисто случайного согласия (т. Е. Случайного распределения) коэффициент κ равен 0. Отрицательное значение коэффициента κ означает, что отсутствие согласия было хуже, чем ожидалось при случайном распределении переменных.
Возраст, пол и раса пациентов в 3 группах суммированы в таблице 1. Все случаи были односторонними. Средний возраст пациентов в группах 1, 2 и 3 составлял 30, 58 и 17 лет соответственно. Во всех трех группах женщин было больше, чем мужчин.Классификация членов комиссии обобщена в таблице 2. Не было поражений группы 1, классифицированных как злокачественные, и поражений группы 2, классифицированных комиссией как доброкачественные. Если интерпретация была изменена после раскрытия анамнеза, все поражения у пациентов в возрасте 40 лет и младше были понижены, а для пациентов в возрасте 41 года и старше все были улучшены. Наблюдалось сильное согласие между членами группы для доисторической и постисторической группы 1 (κ, 0,58 и 0,76, соответственно) и группы 2 (κ, 0.70 и 0,70 соответственно) очагов поражения. Не было согласования для доисторических и постисторических поражений группы 3 (κ, -0,075 и -0,045, соответственно). Статистически значимой разницы между доисторической и постисторической интерпретацией случаев не было.
Меланома конъюнктивы, хотя и встречается редко, 5 является вторым по распространенности злокачественным новообразованием конъюнктивы после плоскоклеточного рака. 6 -8 Меланома конъюнктивы, смертность от которой составляет около 40%, 9 — злокачественное новообразование более высокой степени злокачественности, чем плоскоклеточный рак конъюнктивы, которое редко метастазирует. 10 Таким образом, меланома является наиболее распространенным злокачественным новообразованием конъюнктивы высокой степени, и точный диагноз важен для лечения и прогноза.
Представления о патогенезе меланомы конъюнктивы в последние годы изменились. 11 Ранние теории предполагали, что меланома конъюнктивы возникла de novo из уже существующих невусов с соединительным компонентом или из первичного приобретенного меланоза (PAM). 6 В настоящее время постулируется, что приблизительно 75% меланом конъюнктивы возникают из-за PAM, а остальные быстро развиваются без предшествующего PAM, что примерно аналогично узловой меланоме кожи. 5 Первичный приобретенный меланоз с атипией имеет характерные гистологические особенности, 2 , 5 , хотя в некоторых случаях ПАМ с атипией может быть гистологически неотличима от узлового невуса. 5 , 11 В этих случаях клиническая информация относительно возраста, пола, расы и латеральности пациента помогает отличить ПАМ с атипией от узлового невуса. 5 , 11
Исследования меланомы конъюнктивы, ее предшественников, 2 и доброкачественных меланоцитарных поражений 1 были в основном ограничены взрослыми пациентами. 1 , 2,6 Крупнейшее на сегодняшний день исследование пролиферации меланоцитов конъюнктивы у детей включало 71 пациента. 12 У трех пациентов была ПАМ, у 3 — меланома, у остальных — невусы. 12 Хорошо известно, что болезненные процессы со схожими гистопатологическими особенностями могут протекать по-разному у детей и взрослых. 13 По крайней мере, в одном опубликованном случае группа опытных патологов-офтальмологов не могла определить, является ли пролиферация меланоцитов конъюнктивы у ребенка доброкачественной или злокачественной. 3 В этом случае 3 , как и в других известных нам случаях, первоначальной гистологической классификацией поражения была меланома, а когда был известен возраст пациента, классификация была понижена до невуса с атипией. Мы отметили множество результатов в этих сложных случаях, от излечения после биопсии до прогрессирования метастатической меланомы и смерти (A. Proia, MD, PhD, неопубликованные данные, 9 мая 1999 г.).
Доброкачественные меланоцитарные пролиферации конъюнктивы (группа 1) в этом исследовании включали то, что мы интерпретировали как составные невусы, наиболее распространенный тип невусов конъюнктивы. 6 Во всех поражениях группы 1 были обнаружены плотно связанные соединительные и субэпителиальные гнезда клеток с созреванием от поверхности до основания поражения (рис. 1). Эпителиальные кистозные инвагинации присутствовали во всех поражениях группы 1, и ни одно из этих поражений не показало клеточную атипию. Мы считали, что злокачественные меланоцитарные пролиферации конъюнктивы (группа 2) представляют собой меланому. Все поражения группы 2 содержали слабо когерентные плеоморфные клетки и имели выраженную соединительную активность и отсутствие созревания от поверхности до основания поражения (рис. 2).В поражениях группы 2 наблюдалась митотическая активность, и все эти поражения явно вторгались в собственное вещество. Неопределенные пролиферации меланоцитов конъюнктивы (группа 3) были всеми случаями, в которых мы не могли согласиться, представляло ли поражение PAM, невус, меланому или любую комбинацию из трех. Все случаи группы 3 имели соединительную активность пролиферации меланоцитов (рис. 3, рис. Рисунок 4 и Рисунок 5). Эти поражения демонстрировали распространение плеоморфных клеток в собственное вещество с некоторой степенью потери созревания от поверхности до основания поражения (Рисунок 5).Поражения группы 3 также демонстрировали интраэпителиальное распространение почти до полной толщины эпителия в некоторых областях. Все поражения группы 3 были расположены на бульбарной конъюнктиве и имели разную степень пигментации (Рисунок 3, Рисунок 4 и Рисунок 5).
Число митозов на 40 полей микроскопии с большим увеличением составило 0 случаев для группы 1, 2 из 2 случаев для группы 2 и 1 из 1 случая для группы 3. Оценка митотической активности полезна, но не является абсолютным критерием для доброкачественное новообразование по сравнению со злокачественным новообразованием и должно рассматриваться наряду с другими параметрами, включая общую конфигурацию поражения и цитологические особенности.Кроме того, иммуноокрашивание на меланоцитарную активность и пролиферацию с помощью HMB-45, 14 оценка областей ядрышкового организатора, 15 и электронно-микроскопическое исследование 16 , по-видимому, выявляют пограничные результаты при неопределенной пролиферации меланоцитов конъюнктивы, так же как гистологические данные являются пограничными. .
Описано по меньшей мере 20 различных типов доброкачественных меланоцитарных разрастаний конъюнктивы. 1 Некоторые из этих образований могут вызывать цитологическое беспокойство, например, воспаленный невус и невус Шпица. 1 Сообщалось о необычных вариантах невусов конъюнктивы, включая эпителиоидный невус, веретеновидный невус и диспластический невус. 17 В нашей группе 3 неопределенные поражения не имели гистологических признаков шпица, эпителиоида, веретено-клеточного или диспластического невуса. Хотя случайные лимфоциты присутствовали в некоторых из наших неопределенных поражений, это было второстепенным признаком, и мы чувствовали, что ни один из них не дает оснований для диагноза воспаленного невуса. Напротив, лимфоциты в этих неопределенных случаях часто были организованы в виде пятен или полос у основания поражения, что больше указывает на меланому, чем на невус. 18
Представление о том, что меланома возникает при ПАМ с атипией, которая может быть связана с невусами, заслуживает рассмотрения в отношении нашей неопределенной категории. Первичный приобретенный меланоз с атипией подразумевает цитологическую атипию и атипичные образцы пролиферации меланоцитов. 2 Атипичные типы клеток включают мелкие эпителиоидные, веретеновидные, дендритные и большие эпителиоидные и атипичные паттерны, такие как базилярная гиперплазия, базилярные гнезда, интраэпителиальные гнезда, пагетоидное распространение и полное замещение эпителия. 2 Часто в одном поражении встречаются комбинации этих цитологических признаков и паттернов роста. Когда эти плеоморфные клетки проникают в собственное вещество, поражение классифицируется как меланома. Первичный приобретенный меланоз с атипией можно увидеть в сочетании с невусом, 18 , и то, что ранее интерпретировалось как меланома, возникающая в невусе, теперь постулируется как меланома, возникающая при PAM, связанном с невусом. 5
Первичный приобретенный меланоз обычно бывает односторонним, возникает у белых пациентов среднего и пожилого возраста и чаще встречается у женщин, чем у мужчин. 2 , 19 Все наши неопределенные поражения (группа 3) были односторонними, и все, кроме одного, возникли у пациентов в возрасте 21 года и младше. Поражения группы 3 содержали мелкие и большие эпителиоидные клетки и полиэдрические клетки, расположенные в соединительных и интраэпителиальных гнездах с редкими пагетоидными клетками. Не было доказательств базилярной гиперплазии или полного замещения эпителия в этих поражениях. Хотя эти особенности соответствуют PAM с атипией, атипичные клетки в собственном веществе во всех поражениях группы 3 показали много признаков меланомы (рис. 5).По нашему мнению, степени плеоморфизма и несвязности было недостаточно для однозначного диагноза меланомы. Полезными особенностями при гистологической диагностике меланомы являются активность узлов, потеря созревания от поверхности до основания поражения, инвазия в собственное вещество, дискогезивность и потеря симметрии всего поражения. Мы не можем исключить возможность того, что эти поражения содержат PAM с атипией или невус с атипией, хотя мы также не можем исключить возможность того, что эти поражения являются меланомой.Следовательно, используется термин неопределенная пролиферация меланоцитов .
Все пациенты 3-й группы наблюдались не менее 2 лет. Поражение было не полностью иссечено у пациентов 11 и 12 и полностью удалено у пациентов с 13 по 15. Поражение рецидивировало 3 раза у пациента 11 и однозначно было классифицировано как меланома при третьем рецидиве. Повреждение не рецидивировало у пациентов с 12 по 15. Таким образом, естественная история неопределенной пролиферации меланоцитов конъюнктивы неизвестна, биологическое поведение непредсказуемо, а возможные исходы варьируются от регресса после неполного удаления до прогрессирования меланомы.
Имеются и другие сообщения о случаях неопределенной пролиферации меланоцитов конъюнктивы, главным образом у детей. 3 , 12 Марго и сотрудники признали это лицо 3 у 13-летней девочки. Гистологические особенности в этом случае были очень похожи на наши 5 неопределенных очагов поражения. McDonnell и соавторы 12 отметили в своей серии из 71 разрастания меланоцитов конъюнктивы у пациентов в возрасте 20 лет и младше, что первоначальным диагнозом в 6 случаях был атипичный невус.Их обзор этих 6 случаев показал, что 1 случай был невусом шпица, 1 был клеточным синим невусом и 1 имел несвязность соединительных гнезд. 12 Мы, вероятно, классифицируем последний случай как неопределенную пролиферацию меланоцитов. В остальных трех случаях авторы не обнаружили тревожных особенностей. 12 Три меланомы конъюнктивы в серии, проведенной McDonnell и соавторами 12 , имели гистологические особенности, однозначные для меланомы. Случай, описанный Margo et al. 3 , и по крайней мере один из случаев в исследовании McDonnell с соавторами соответствовали бы нашим критериям неопределенной пролиферации меланоцитов.
Тот факт, что в исследовании McDonnell et al. 12 имелось несоответствие между первоначальным диагнозом и обзорным диагнозом, по крайней мере, у 5 пациентов. Фермер и соавторы 20 обнаружили лишь умеренное согласие между наблюдателями в замаскированном исследовании 37 классических кожных невусов и меланом. Наша серия показала сильную предысторию и постисторическую согласованность между наблюдателями для классических невусов конъюнктивы (группа 1: κ, 0,58 и 0,76, соответственно) и классической меланомы конъюнктивы (группа 2: κ, 0.70 и 0,70 соответственно). В нашей неопределенной категории (группа 3: κ, -0,075 и -0,045 соответственно) не было абсолютно никакого доисторического и постисторического соответствия. Фактически, отрицательная статистика κ для группы 3 означает, что совпадение было меньше, чем ожидалось, если наблюдатели случайным образом выбирали диагноз доброкачественный, злокачественный или неопределенный. Знание истории болезни не повлияло на это несоответствие. Мы полагаем, что комиссия представляла группу хорошо обученных, опытных патологов-офтальмологов, которые могут столкнуться с этим спектром поражений.
Практическое рассмотрение состоит в том, как лечить пациентов с этими неопределенными поражениями. Поскольку биологическое поведение является неопределенным, а данное неопределенное поражение может представлять развивающуюся меланому, необходимо полное хирургическое удаление. 3 Нет достоверных данных относительно адекватности хирургических границ иссечения при пролиферации меланоцитов конъюнктивы. Если клиническое подозрение на меланому велико, мы рекомендуем отступ от 3 до 5 мм. У детей и молодых людей с гормональными изменениями может оказаться достаточным запас в 1 мм.Эти рекомендации должны сопровождаться клинической информацией, включая состояние здоровья пациента и степень поражения. В отдельных случаях можно рассмотреть альтернативные методы лечения, такие как криотерапия, 21 .
Существует разновидность пролиферации меланоцитов конъюнктивы, которую опытные квалифицированные патологи-офтальмологи не могут последовательно классифицировать как доброкачественные или злокачественные и, таким образом, предсказать биологическое поведение.Диагноз неопределенной или пограничной меланоцитарной пролиферации подходит для этого объекта, потому что невозможно отнести эти поражения к существующим схемам дихотомической классификации.
Признание существования неопределенной группы меланоцитарных поражений имеет концептуальное и практическое значение. Во-первых, без неопределенной категории поражения, попадающие в эту группу, будут регулярно диагностироваться неправильно. Поскольку среди патологов не было согласия относительно диагноза случаев в неопределенной подгруппе, назначение диагноза доброкачественного или злокачественного в диахотомической системе было бы случайным.Во-вторых, признание неопределенной группы потребует от онкологов-окулистов разработки соответствующих протоколов ведения. Поскольку последствия недостаточного лечения злокачественной опухоли потенциально хуже, чем чрезмерное лечение доброкачественной, необходимо будет разработать протоколы удаления или разрушения опухоли и последующего наблюдения, подходящие для опухоли с неизвестным биологическим потенциалом. В-третьих, неопределенная категория — это, по сути, признание того, что гистопатологическая классификация не является абсолютной и что необходимы улучшенные методы прогнозирования биологического поведения опухолей.Хотя большинство патологов понимают ограничения гистопатологической интерпретации, многие клиницисты ошибочно полагают, что этот процесс является абсолютным. Неопределенная категория меланоцитарных поражений должна помочь улучшить общение с клиницистами, поскольку она более четко передает отсутствие уверенности в диагнозе, чем такие термины, как атипичный невус или пограничная меланома .
Принята к публикации 23 июня 1999 г.
Это исследование было частично поддержано основным грантом EY06030, Национальный институт глаз, Национальные институты здравоохранения, Бетесда, Мэриленд (д-р Гроссниклаус), и неограниченным ведомственным грантом от Research to Prevent Blindness Inc, Нью-Йорк, штат Нью-Йорк.
Представлено на 135-м ежегодном собрании Американского офтальмологического общества, Санта-Барбара, Калифорния, 24 мая 1999 г.
Мы благодарим Гарри Х. Брауна, доктора медицины, Арканзасский университет, Литл-Рок; Р. Джин Кэмпбелл, доктор медицины, клиника Мэйо, Рочестер, Миннесота; Бен Глазго, доктор медицины, Калифорнийский университет в Лос-Анджелесе; Алан Д. Пройа, доктор медицинских наук, Университет Дьюка, Дарем, Северная Каролина; и Дебре Дж. Шетлар, доктору медицины, Медицинский колледж Бейлора, Хьюстон, Техас, за участие в исследовательской группе.
Отпечатки: Ганс Э. Гроссниклаус, доктор медицины, лаборатория офтальмологической патологии Л. Ф. Монтгомери, BT428, Глазной центр Эмори, 1365 Clifton Rd NE, Atlanta, GA 30322 (электронная почта: ophtheg@emory.edu).
1.Фольберг Р.Якобец FABernandino В.Б.Ивамото T Доброкачественные меланоцитарные поражения конъюнктивы: клинико-патологические особенности. Офтальмология. 1989; 96436-461Google ScholarCrossref 2.Jakobiec Ф.А.Фольберг РИвамото T Клинико-патологическая характеристика предраковых и злокачественных меланоцитарных поражений конъюнктивы. Офтальмология. 1989; 96147-166Google ScholarCrossref 3. Марго CERoper DLHidayat А.А. Пограничная меланоцитарная опухоль конъюнктивы: диагностические и терапевтические аспекты. J Pediatr Ophthalmol Strabismus. 1991; 28268-270 Google Scholar4.Kelsey JLThompson WDEvans AS Ошибка измерения. Методы и наблюдения в эпидемиологии Нью-Йорк, NY Oxford University Press 1986; 290-291 Google Scholar5.Folberg РФ Меланоцитарные поражения конъюнктивы.Спенсер WHed. Офтальмологическая патология. Атлас и учебник. Филадельфия, Пенсильвания. WB Saunders Co, 1996; 125–155. HEGreen WRLuckenbach MChan CC Поражения конъюнктивы у взрослых: клинический и гистопатологический обзор. Роговица. 1987; 678-116Google ScholarCrossref 7. Ash JE Эпибульбарные опухоли. Am J Ophthalmol. 1950; 331203-1219Google Scholar8.Ni CSearl С.С.Кригштейн HJWu BF Эпибульбарная карцинома. Int Ophthalmol Clin. 1982; 221-33Google Scholar 9. Серебро DJakobiec FAFreeman Т и другие. Меланома конъюнктивы: клинико-патологическое исследование. Якобец FAed. Опухоли глаз и придатков Birmingham, Ala Aesculapius1978; 583-599Google Scholar11.Grossniklaus HECameron JD Eye. Hensen DEAlbores-Saavedra Джеды. Патология зарождающейся неоплазии 2-е изд. Филадельфия, Пенсильвания, WB Saunders Co, 1993; 544–556.Макдоннелл JMCarpenter JDJacobs PWan У.Л.Гилмор JG Меланоцитарные поражения конъюнктивы у детей. Офтальмология. 1989; 96986-993Google ScholarCrossref 13.Bove KEMcAdams AJ Комплекс нефробластоматоза и его связь с опухолью Вильмса: клинико-патологический трактат. Розенберг HSBolande РПедс. Perspectives in Pediatric Patology Vol 3 Chicago, Ill Year Book Medical Publishers Inc, 1976; 185–223 Google Scholar14.Глазго BJMcCall LCFoos Реактивность антител RY HMB-45 при пигментных поражениях конъюнктивы. Am J Ophthalmol. 1990; 109696-700 Google Scholar 15. Саорнил MAMarcus DM Doepner DApolone GTorre Валберт DM Ядрышковые области-организаторы в определении злокачественности пигментных поражений конъюнктивы. Am J Ophthalmol. 1993; 115800-805Google Scholar16.Jakobiec Ф.А. Ультраструктура меланоцитарных опухолей конъюнктивы. Trans Am Ophthalmol Soc. 1984; 82599-752Google Scholar17.Jakobiec Ф.А.Цукерман BDBerlin AJ и другие. Необычные меланоцитарные невусы конъюнктивы. Am J Ophthalmol. 1985; 100100–113. 18 Фольберг. RMcLean И. В. Циммерман LE Злокачественная меланома конъюнктивы. Hum Pathol. 1985; 16136-143Google ScholarCrossref 19.McLean IBurnier М. Н. Циммерман LEJakobiec FA Опухоли конъюнктивы. Атлас патологии опухолей Опухоли глаза и придатков глаза Вашингтон, Округ Колумбия Институт патологии вооруженных сил 1994; 3 ((пт 12)) 78-82Google Scholar20.Farmer Э.Р.Гонин Ранна MP Несоответствие в гистопатологической диагностике меланомы и меланоцитарных невусов между экспертами-патологами. Hum Pathol. 1996; 27528-531Google ScholarCrossref 21. Браунштейн SJakobiec Ф.А.Уилкинсон RDLombardo JJackson WB Криотерапия предракового меланоза (атипичной меланоцитарной гиперплазии) конъюнктивы. Arch Ophthalmol. 1981; 9-1231Google ScholarCrossrefМой подход к атипичным меланоцитарным образованиям
Меланоцитарная патология — одно из самых сложных направлений хирургической патологии. Проблемы делятся на две широкие категории, а именно: распознавание редких, но характерных объектов и гораздо более распространенная проблема — где разместить необычное поражение в спектре меланоцитарных поражений. Большое количество меланоцитарных поражений попадает в пограничную зону, которая может нервировать даже самых опытных патологоанатомов.Эти общие и неприятные диагностические проблемы и являются предметом настоящего обзора.
Сюда входят:
митотическая активность в банальных на первый взгляд невусах
клональные невусы
меланома, возникающая при невусе и меланоме невуса
Шпиц невус
диспластический невус
атипичный генитальный невус
атипичный акральный невус
родинок новорожденных
меланоцитарных пролиферации с пагетоидным распространением.
Митотически активные неви
И патологоанатом, и дерматопатолог ежедневно сталкиваются с обычными приобретенными внутрикожными и сложными невусами. Обычно такие невусы митотически неактивны. Однако иногда, особенно после особенно энергичных поисков, обнаруживается митотическая фигура. Проблема в том, как с этим бороться. Следует ли игнорировать это, искать больше или бросаться на иммуногистохимию? Не должно вызывать удивления случайное обнаружение митотической фигуры в растущем сложном невусе.
Есть четыре основных момента:
Митоз является спорадическим и случайным в доброкачественном невусе и поэтому не оказывает клинического воздействия.
Митоз указывает на лежащий в основе «клональный» компонент.
Митоз присутствует в условиях меланомы, возникающей в обычном приобретенном невусе.
Поражение само по себе представляет собой невоидную меланому.
В общем, обнаружение митотической фигуры должно побудить к поиску дополнительных митозов и тщательной оценке архитектурных и цитоморфологических особенностей. Если идентифицирован только один митоз, а невус симметричен, созревает с глубиной и лишен плеоморфизма или выступающих ядрышек, то можно не принимать во внимание митотическую фигуру (рис. 1). Предыдущая травма невуса иногда может приводить к случайному митозу поверхностного кожного компонента (рецидивирующий невус).
Рисунок 1Банальный кожный невус с единственной митотической фигурой. Ядра однородные.
«Большое количество меланоцитарных поражений попадает в пограничную зону, которая может нервировать даже самых опытных патологов»
Клональный невус
Редко, иначе банальные невусы могут содержать очаговый пигментированный атипичный эпителиоидный компонент, внутри которого могут быть идентифицированы очень редкие митозы.Болл и Голиц назвали их «клональными невусами». 1 В клинических условиях обычно возникает новая темная область внутри невуса. В верхней половине невуса находится небольшая дискретная совокупность эпителиоидных клеток с пыльным пигментом меланина, которые цитологически отличаются от остальной части невуса (рис. 2). Меланофаги внутри и вокруг агрегата являются обычными и вносят вклад в более темную область, которая оценивается клинически. Существует некоторое морфологическое совпадение между клональным невусом и перевернутым невусом типа А и глубоко проникающим невусом.Клональный невус отличается от этих двух последних поражений расположением агрегата в верхней части дермы. Для уверенного исключения меланомы, возникающей в сочетании с невусом, может потребоваться либеральное обследование на нескольких уровнях (см. Ниже).
Рисунок 2(A, B) Клональный невус. Обратите внимание на отчетливую популяцию бледно окрашенных клеток невуса и заметных меланофагов в ретикулярной дерме.
Меланома, возникающая в области невуса и меланомы невуса
Меланома, возникающая в невусе, отличается от клонального невуса несколькими способами.Меланома обычно демонстрирует инфильтративный или, чаще, расширяющийся паттерн роста (рис. 3) (трансформация внутри очага поражения) по сравнению с хорошо вложенной конфигурацией клонального невуса. Меланомы стирают окружающий невус, тогда как клональное поражение обычно не затрагивает окружающий невус. В целом меланома имеет более многочисленные митозы и большую цитологическую атипию (с выступающими ядрышками) (рис. 4), в отличие от редких митозов и легкой цитологической атипии клонального невуса.
Рисунок 3Меланома (левая часть поля), возникающая в результате врожденного невуса на волосистой части головы.
Рисунок 4(A) Увеличенный вид ограниченного расширяющегося опухолевого узла (слева). (B) Обратите внимание на большие везикулярные ядра, выступающие ядрышки и митозы.
Как правило, обычные невусы поддаются диагностике на малом увеличении; Тем не менее, важно исключить возможность возникновения меланомы наивной ткани. Это редкий вариант, который имитирует доброкачественные невусы и его трудно распознать; правильный диагноз часто ставится только ретроспективно, после того, как у пациента развились метастазы.Zembowicz и др. недавно рассмотрели особенности наэвоидной меланомы. 2 При малом увеличении невоидная меланома может иметь бородавчатую 3 или узловую архитектуру и проявлять другие черты обычного банального невуса, включая очертание и, по крайней мере, относительную симметрию (рис. 5). Наэвоидная меланома лишена заметной соединительной активности и пагетоидного распространения, обычно связанного с поверхностной распространяющейся меланомой. Обычный внутрикожный невус «созревает» (то есть происходит общее уменьшение размера гнезда, а также размера клеток и ядер с увеличением глубины).При беглом осмотре может показаться, что наэвоидная меланома созревает с глубиной, но при более внимательном рассмотрении выясняется, что клетки в основании поражений аналогичны по размеру клеткам поверхностного кожного компонента. 4 Только при более высоком увеличении можно оценить тонкие отличительные характеристики невозной меланомы. К ним относятся монотонная популяция маленьких круглых клеток с выступающими ядрышками и от нескольких до многочисленных митозов (рис. 6). Другие признаки, которые могут присутствовать, включают некроз отдельных клеток и атипичные митозы.
Рисунок 5Наевоидная меланома из груди молодой женщины. Пунктирные области с большим увеличением показаны на рис. 6.
Рисунок 6(A, B) Ядра кажутся банальными и банальными. Однако обратите внимание на множественные митозы.
«Только при более высоком увеличении можно оценить тонкие отличительные характеристики невоидной меланомы»
В руках опытного патолога гистологических характеристик обычно достаточно, чтобы классифицировать поражение как наевоидную меланому; однако иммуногистохимия может быть ценным дополнением в сложных случаях.В невусах менее 5% клеток экспрессируют Ki-67 (MIB-1), и большинство реактивных клеток присутствует в поверхностной дерме. 5 В меланоме реактивные клетки MIB-1 более многочисленны и распределены на всех уровнях дермального компонента (рис. 7). Важное предостережение заключается в том, что лимфоциты, гистиоциты и иногда эндотелиальные клетки также могут быть MIB-1-положительными, и поэтому необходимо учитывать морфологию клеток, чтобы определить, действительно ли иммунореактивные клетки являются меланоцитами.Дифференциальное окрашивание также можно увидеть с HMB-45 6 и циклином D1 7 ; банальные невусы проявляют реактивность в отношении этих иммуномаркеров в поверхностном кожном компоненте. Окрашивание HMB-45 и циклина-1 при меланоме наблюдается по всему дермальному компоненту (в различной степени). Однако следует отметить, что не все невусы или меланомы окрашиваются HMB-45. Кроме того, необходимо помнить, что циклин D1 является ядерным антигеном; следовательно, цитоплазматическая реактивность не информативна.
Рисунок 7Этот препарат MIB-1 образует пунктирные области, показанные на рис. 5.
Шпиц невус
Spitz naevi — доброкачественные меланоцитарные образования, состоящие из крупных эпителиоидных и / или веретенообразных меланоцитов с обильной эозинофильной цитоплазмой. Большинство этих поражений возникает у детей, и их можно с уверенностью диагностировать. Хотя они были описаны для всех возрастных групп, следует проявлять большую осторожность при постановке этого диагноза у пожилых людей; с возрастом увеличивается вероятность ошибочно принять меланому за невус шпица. 8 Критерии отличия меланомы от невуса шпица не всегда надежны, особенно у пожилых пациентов. Сообщается, что поражения с признаками невуса шпица дали метастазы и привели к смерти. 9, 10
«С возрастом увеличивается вероятность ошибочно принять меланому за невус шпица»
Поражения, которые отклоняются от установленных критериев и вызывают неопределенность в отношении их биологического потенциала, получили название «атипичный невус шпица» или «шпиццеидная опухоль с неопределенным биологическим потенциалом».К сожалению, некоторые патологи склонны применять эти термины к гистологически доброкачественным невусам шпица в целях безопасности (либо безопасность пациента, либо патолог считает, что такая терминология снижает его / ее собственный медицинско-правовой риск), потенциально подвергая пациента ненужному широкому иссечению. или биопсия сторожевого узла. Напротив, поражение, которое некоторые сочтут явной меланомой, может быть «понижено» до промежуточного поражения из-за молодого возраста пациента. 11 Знание о том, что случайные пациенты с поражениями, диагностированными как невусы шпица (даже экспертами), имеют плохой результат, еще больше усугубляет диагностическую неопределенность.Несмотря на недостатки таких терминов, как «атипичный невус шпица» и «шпиццеидная опухоль с неопределенным биологическим потенциалом», следует признать, что не все шпицеподобные опухоли, особенно у взрослых, можно точно классифицировать, и их использование иногда неизбежно.
Важное значение имеет оценка атипичных признаков у шпицеподобных поражений (таблица 1). С особой осторожностью следует рассматривать чрезмерную митотическую активность, глубокие митозы, атипичные митозы, явное отсутствие созревания и «толкающую», а не инфильтративную нижнюю границу (рис. 8 и 9).Монс проиллюстрировал поражения у детей препубертатного возраста с силуэтом, напоминающим невусы шпица, которые при более внимательном рассмотрении демонстрируют злокачественные черты. 11 Изъязвление не является общепринятым признаком невуса шпица, хотя истинное изъязвление следует отличать от травматического изъязвления, которое проявляется паракератозом, кровотечением и чешуйчатой коркой. Меланоцитарные поражения со шпицеподобными чертами у взрослых, особенно если они присутствуют на спине у мужчин и на ногах у женщин, требуют тщательного обследования для исключения меланомы.
Стол 1Сообщается о некоторых нетипичных особенностях, наблюдаемых у шпица «naevi».
Рисунок 8Атипичный невус шпица при сканирующем увеличении.
Рисунок 9(A) Изображение средней мощности на рис. 8, показывающее большие гнезда на глубокой окраине. (B) Множественные митозы присутствовали на всех уровнях невуса.
Как и в случае невоидной меланомы, профиль иммуногистохимических пятен иногда помогает в диагностически сложных случаях.К часто используемым иммуномаркерам относятся HMB-45, MIB-1, циклин D1 и p53. HMB-45 окрашивает большинство невусов шпица, обычно стратифицированным образом, маркируя преимущественно соединительные и верхние дермальные компоненты, с уменьшением количества реактивных клеток с глубиной. 6 Напротив, меланомы показывают пятнистое или диффузное окрашивание по всему поражению. Однако, как это часто бывает с иммуногистохимическими окрашиваниями, этот метод не является надежным; Сообщалось, что у некоторых шпицев нет пятен по всему кожному компоненту. 18
Spitz naevi демонстрируют в среднем 4% ядерных меток MIB-1, тогда как более 9–25% клеток являются положительными в большинстве меланом. 19 У Spitz naevi положительные ядра обычно сконцентрированы на поверхности, хотя разбросанные клетки могут быть обнаружены по всему поражению. 5 Напротив, меланома показывает общее неравномерное распределение окрашивающих MIB-1 клеток, хотя экспрессия обычно наблюдается в основании поражения.Небольшой процент как меланом, так и невусов шпица будет демонстрировать более низкую и более высокую пролиферативную активность, что подчеркивает важность корреляции иммуногистохимических результатов с морфологическим контекстом и клиническими условиями. Следует иметь в виду, что выраженная реактивность может наблюдаться в лимфоцитах, сопровождающих воспаленные невусы шпица. Следовательно, необходимо проявлять осторожность, чтобы отличить иммунореактивность лимфоцитов от меланоцитов.
Циклин D1 иногда бывает положительным в самых поверхностных аспектах сложного невуса и очень положительным при меланоме.Spitz naevi может быть положительным на циклин D1; однако, как и в случае с MIB-1, окрашивание имеет зональный характер, при этом большинство положительных клеток находится в поверхностной дерме. 7 Зональный рисунок окрашивания не является признаком меланомы.
«Достижения в молекулярных методах, вероятно, предоставят более точный инструмент для улучшенной характеристики шпицеподобных поражений»
Белок p53 обычно отрицательный у Spitz naevi, но показывает положительное ядерное окрашивание в большинстве узловых меланом. 20, 21
Достижения в молекулярных методах, вероятно, предоставят более точный инструмент для улучшенной характеристики шпицеподобных поражений. Недавно увеличение 11p, сопровождающееся мутациями в HRAS, было зарегистрировано у некоторых шпиц-невусов, но не у меланомы. 22, 23 Эти невусы были больше и толще и демонстрировали отличительные характеристики, такие как более крупные клетки с ядерным плеоморфизмом, отличные от прототипных невусов шпица.
Как и в случае других меланоцитарных поражений, следует избегать постановки диагноза на основании неполной биопсии, особенно такой, которая не позволяет исследовать всю толщину поражения на предмет созревания и глубоких кожных митозов. Твердый диагноз патолог должен поставить только после того, как будет обследовано все поражение.
Диспластический невус
Диспластические невусы — это поражения, гистологические признаки которых находятся на промежуточном уровне между банальным обычным невусом и меланомой.Несколько групп продемонстрировали молекулярные различия между банальными невусами, диспластическими невусами и меланомой, подтверждая точку зрения, что диспластические невусы являются частью биологического спектра, который показывает прогрессирование до меланомы (всесторонний обзор Хусейна и Вуда 24 ). Они являются маркером повышенного риска меланомы (степень которого зависит от клинических условий — общее количество родинок, семейный анамнез и т. Д.) И, в некоторых случаях, являются предшественником меланомы.
Природа генетического дефекта (CDKN2A, CDK4 или ни один из них), по-видимому, не влияет на клинические или гистологические проявления диспластического невуса или меланомы в семьях с синдромом диспластического невуса. 25 Кроме того, нет значительных гистологических различий между спорадическими и семейными диспластическими невусами. 26 Таким образом, значимость диспластического невуса для данного пациента зависит от клинического контекста.
Диспластические невусы демонстрируют совокупность архитектурных и цитологических особенностей, которые отличают их от других невусов и, как правило, от меланомы. В заявлении о консенсусе, опубликованном Национальным институтом здравоохранения в 1992 г., для постановки диагноза диспластического невуса требуется только архитектурное расстройство (а не цитологическая атипия). 27 Однако, по нашему мнению, цитологическая атипия также должна присутствовать в соответствии с консенсусной статьей Clark et al . 28 В остальном определение Национального института здравоохранения слишком широкое, и существует значительный риск включения в эту категорию большинства невусов, диспластических или иных. Фактически, незначительный элемент архитектурного нарушения или небольшой очаг легкой цитологической атипии можно найти у большинства невусов, если поискать достаточно внимательно. Но это не обязательно означает диагноз диспластического невуса.
Диспластические невусы имеют выраженный лентигинозный компонент, асимметричны, плохо очерчены и, если они составные, имеют переходное плечо (определяемое как внутриэпидермальный компонент, выходящий за пределы дермального компонента) (рис. 10). Мы классифицируем поражения как имеющие легкую, среднюю или тяжелую цитологическую атипию (таблица 2; рис. 11). Цитологическая атипия при диспластическом невусе обычно случайна и неоднородна, с атипичными клетками на фоне клеток с минимальной атипией или без нее.Наличие монотонной популяции сильно атипичных клеток (в одной области или по всему поражению) вызывает беспокойство при меланоме.
Стол 2Оценка диспластических невусов
Рисунок 10Диспластический невус с хорошо развитым плечом с левой стороны.
Рисунок 11(A) Пыльный пигмент — типичный признак диспластического невуса.(B) Легкая цитологическая атипия с увеличенными гиперхроматическими ядрами. (C) Умеренная цитологическая атипия с очаговой миграцией вверх в диспластическом невусе. (D) Диспластический невус с выраженной цитологической атипией и выступающими ядрышками.
«Мы соблюдаем стандартную рекомендацию о пределах 5 мм для всех сильно атипичных невусов, которые включают край»
Хотя классификация атипии основана на цитоморфологии, архитектура поражения способствует общей оценке невуса. 30 Например, образование мостовидных протезов (слияние меланоцитов между соседними ребрами сетчатки) является критерием, используемым в диагностике диспластического невуса. Его наличие или отсутствие не влияет на цитологическую степень поражения. Тем не менее, сливное соединение с участием трех или более смежных ребер ретейнера может вызывать беспокойство при меланоме. Точно так же эрозия дермоэпидермального перехода может быть поводом для беспокойства. Ограниченная миграция меланоцитов в нижние слои эпидермиса (пагетоидное распространение) допустима при диспластических невусах; однако распространения большого количества меланоцитов или распространения в верхний остистый слой нет, и это вызывает подозрение на меланому.В этих примерах архитектурный беспорядок влияет на общую оценку.
Мы не включаем рекомендации по лечению слабоатипичных диспластических невусов, которые, по-видимому, полностью иссечены или локально присутствуют на краях. Мы предлагаем умеренное повторное удаление диспластических невусов с умеренной атипией, которая простирается до края. Если край сильно поражен, необходимо рекомендовать полное иссечение, особенно у пациентов старше 30 лет. 31 Мы придерживаемся стандартной рекомендации о пределах 5 мм для всех сильно атипичных невусов, затрагивающих край.Мы включаем в наши отчеты измерение с точностью до предела для сильно атипичных невусов, которые полностью иссечены.
Почему на самом деле мы классифицируем цитологическую атипию диспластических невусов? Если мы примем, что диспластические невусы, демонстрирующие различные степени атипии, образуют континуум риска прогрессирования меланомы, важная роль заключается в передаче информации клиницисту, указывающей, насколько близок конкретный невус к меланоме in situ. В одном исследовании Pozo и др. провели критический анализ 15 гистологических переменных, чтобы оценить надежность классификации. 26 Сильно атипичные диспластические невусы надежно отличались от невусов с легкой или умеренной атипией; однако не было постоянно воспроизводимых признаков, которые могли бы надежно дифференцировать легкую и умеренную атипию. Основываясь на полученных данных, они предложили двухуровневую систему классификации (низкая и высокая) для классификации диспластических невусов.
Есть ли биологические доказательства в пользу двухклассной системы по сравнению с трехклассной системой? Представляет ли невус с атипией средней степени больший риск, чем с атипией легкой степени? Оба могут вызвать меланому, но неясно, что одно хуже другого.Есть некоторые свидетельства того, что существуют генетические различия между степенями. Анализируя микросателлитные изменения как маркер генетической нестабильности в генах, связанных с меланомой (среди прочего, 1p и 9p), Hussein и др. обнаружили микросателлитную нестабильность как в диспластических невусах, так и в меланоме, но не в банальных невусах. 32 Кроме того, существует значимая корреляция между частотой микросателлитной нестабильности и степенью атипии диспластических невусов.В частности, распространенность микросателлитной нестабильности была намного выше у невусов, отнесенных к категории умеренных и тяжелых, по сравнению с невосприимчивыми к легким, что позволяет предположить, что существует рациональная молекулярная основа для двухуровневой диагностической системы.
«Существует значительная корреляция между частотой микросателлитной нестабильности и степенью атипии диспластических невусов»
Важно отметить, что не все цитологически атипичные невусы являются диспластическими невусами.Например, генитальные невусы, акральные невусы и невусы новорожденных или детей могут иметь цитологическую атипию, но они не относятся к категории диспластических невусов. Точно так же банальные невусы могут иногда показывать очаги цитологической атипии.
Атипичный меланоцитарный невус генитального типа
Хотя случайные атипичные невусы из промежности являются диспластическими, другие попадают в категорию атипичных меланоцитарных невусов генитального типа. Чаще всего они наблюдаются у пациентов женского пола, обычно у молодых женщин, но иногда они наблюдаются у детей.Для них характерна бородавчатая архитектура. Крупные соединительные гнезда, окруженные хорошо развитым ретракционным артефактом, являются диагностическим признаком (рис. 13). Они могут демонстрировать выраженную цитологическую атипию (рис. 14) и случайные кожные митозы, но не демонстрируют архитектуру диспластического невуса. Хотя фиброз кожи часто является признаком этих поражений, эозинофильная и пластинчатая фиброплазия отсутствуют.
Рисунок 12Атипичный генитальный невус с папилломатозом и большими соединительными гнездами с отчетливым артефактом ретракции.
Рисунок 13Атипичный генитальный невус с цитологической атипией.
Рисунок 14Атипичный акральный невус с большими расширяющимися овальными соединительными гнездами.
Подобные поражения могут встречаться на других участках изгиба, включая пупок, пах, субмаммарную область и подмышечные впадины — отсюда их альтернативные названия — невусы изгиба и невусы молочной линии.
Биологический потенциал этих тревожных поражений плохо документирован, а их гистология часто вызывает тревогу. Поэтому важно отметить, что меланома вульвы в значительной степени является заболеванием пожилых людей и что эти атипичные невусы чаще всего возникают у молодых.
Согласно нашей политике, повторное иссечение поражений, присутствующих на краях, является целесообразным при диспластическом невусе с такой же степенью атипии.
Атипичные акральные невусы
Атипичные акральные невусы характеризуются аномальной архитектурой и цитологической атипией, и их можно принять за диспластические невусы.У них обычно есть переходное плечо, а гнезда часто расположены внутри супрапапиллярных пластинок в дополнение к боковым сторонам сетки, что придает поражению неорганизованный вид. Эккриновые потовые протоки также часто поражаются. Цитологическая атипия — обычное явление, и у многих невусов присутствует центральное пагетоидное распространение. Полезной гистологической подсказкой является наличие больших овальных вертикально ориентированных соединительных гнезд, окруженных артефактом ретракции (рис. 14 и 15). Отсутствуют лентигинозная архитектура диспластических невусов, лимфоцитарная инфильтрация, недержание пигмента и фиброз кожи.
Рисунок 15Атипичный акральный невус. (A) Изображение с большим увеличением, показывающее артефакт ретракции. (B) Обратите внимание на цитологическую атипию и распространение пагетоидов.
В некоторых случаях бывает трудно отличить от меланомы, особенно в старших возрастных группах. В целом, однако, эпидермис при меланоме часто демонстрирует нерегулярный акантоз, а степень атипии гораздо более выражена. При акральных атипичных невусах распространение пагетоидов ограничено центральной частью невуса, а атипия дермы и значительная митотическая активность не характерны.Если есть какие-либо сомнения, целесообразно повторное иссечение для обеспечения полного удаления.
Ноги новорожденного
Неонатальные невусы и невусы у детей также могут быть проблематичными, особенно если возраст пациента неизвестен. Пагетоидное распространение и цитологическая атипия являются обычными явлениями, иногда могут наблюдаться кожные митозы. Меланома в детском возрасте встречается редко, но встречается редко. По нашему опыту, основанному на большом количестве направлений, диагностика меланомы у детей редко бывает сложной; эти поражения обычно имеют черты, похожие на меланому у взрослых.По сравнению с неонатальными или детскими невусами, плеоморфизм обычно более выражен, митозы часто заметны и присутствуют по всей толщине опухоли, и часто наблюдается расширенный характер роста. Точно так же серьезно нарушается созревание с глубиной, и может присутствовать некроз.
Меланоцитарные пролиферации с пагетоидным распространением
Использование термина «пагетоид» для описания разброса меланоцитов по всем уровням эпидермиса, первоначально полученного в результате болезни Педжета сосков, а затем было применено к меланоме, распространяющейся по поверхности.Этот паттерн имеет значительное количество немеланоцитарных имитаторов (таблица 3). Каждое из немеланоцитарных образований часто можно отличить по морфологии, но для окончательного диагноза иногда требуется иммуногистохимия. Кроме того, наличие пагетоидных клеток должно побуждать к тщательному поиску соседней кожной карциномы или более отдаленной опухоли происхождения.
Стол 3Немеланоцитарные причины распространения пагетоидов в эпидермисе
Многие доброкачественные меланоцитарные поражения могут иметь очаговую восходящую миграцию меланоцитов внутри эпидермиса, и следует проявлять осторожность, чтобы они не классифицировались автоматически как меланома только на основании этого признака.Меланоцитарные поражения, которые могут проявлять супрабазальное расположение меланоцитов, включают врожденные невусы, акральные невусы, 39 акральные невусы, 40 генитальные невусы и диспластические невусы. 41 Рецидивирующие невусы и те невусы, недавно подвергшиеся облучению ультрафиолетом, демонстрируют реактивные меланоциты с атипичной цитологией. 42 В этих двух последних ситуациях точная и полная клиническая информация имеет первостепенное значение. В доброкачественных невусах с внутриэпидермальным распространением меланоцитов клетки преимущественно локализуются в базальном и остистом слоях в центральной части поражения и являются цитологически доброкачественными.
Обычно мы встречаем узловые меланоцитарные пролиферативные поражения без связанного невуса или значительного вложенного компонента. Эти поражения были названы Mihm и соавторами «внутриэпидермальной эпителиоидной меланоцитарной дисплазией de novo». 43 Они состоят из плохо выраженной лентигинозной пролиферации эпителиоидных меланоцитов разного размера и переменного пагетоидного распространения (рис. 16). У них отсутствует клеточная плотность и атипия, которых можно было бы ожидать от полностью развившейся меланомы in situ.Тем не менее, мы рассматриваем их как потенциальные предшествующие поражения, которые могут представлять развивающуюся меланому in situ, и рекомендуем их полное удаление.
Рисунок 16Дисплазия De novo, показывающая атипичные эпителиоидные меланоциты с очень редкими супрабазальными формами. Это важное предшествующее поражение, которое необходимо полностью удалить.
Клинические аспекты, включая аспекты лечения
Перед постановкой диагноза невуса или меланомы необходимо рассмотреть несколько важных клинических особенностей: продолжительность поражения, предыдущая биопсия / травма (например, экскориация) на этом участке, недавний солнечный ожог / пребывание на солнце, личный анамнез предыдущей меланомы, семейный анамнез меланомы и возраст пациента.Сайт также является важным фактором. Атипичное поражение на спине у мужчины или на икре женщины всегда следует рассматривать как потенциальную меланому, пока не будет подтверждено иное. К сожалению, предоставляемая клиническая информация часто ограничивается «поражением на ноге». При столкновении с атипичным поражением необходим телефонный звонок клиницисту для выяснения клинического контекста.
«Атипичное поражение на спине у мужчины или на икре женщины всегда следует рассматривать как потенциальную меланому, пока не будет подтверждено иное»
Возраст пациента имеет особое значение.Геллер и его коллеги проанализировали данные за 2002 год, опубликованные Национальным центром статистики здравоохранения США, и показали, что у мужчин и женщин в возрасте 45 лет и старше по-прежнему наблюдается рост заболеваемости и смертности от меланомы 44 . Особому риску подвержены мужчины в возрасте 65 лет и старше; в этой группе смертность от меланомы увеличилась на 157%, а заболеваемость меланомой — в пять раз с 1969 по 1999 год. Хотя заболеваемость меланомой увеличивалась у обоих полов во всех возрастных группах, темпы роста были ниже у мужчин и женщин в возрасте от 20 до 20 лет. 44 года, и смертность за тот же период времени в этой возрастной группе фактически снизилась.
Патолог должен сообщить о продолжительности поражения и его стабильности размера, формы и цвета. Большинство меланом возникает de novo, тогда как только 25% развиваются в связи с уже существующим невусом. 45 Новое меланоцитарное поражение вызывает тревогу у 60-летнего ребенка, но вряд ли так у 6-летнего. Недавнее пребывание на солнце (загар / солнечный ожог в области биопсии невуса) может повлиять на «активность» и появление новых невусов. 46
Информация о предыдущей биопсии или травме невуса также важна для отличия рецидивирующего явления невуса от меланомы.В сложных случаях всегда полезно пересмотреть предыдущую патологию. Даже незначительная травма, например, от экскориации, может вызвать цитологические и кожные изменения, которые могут имитировать меланому или регресс.
С повышенным вниманием к косметическим результатам и из-за постоянно растущей рабочей нагрузки в лечении и диагностике атипичных невусов был внедрен ряд «более быстрых и менее травматичных» методов, включая биопсию с помощью удара, бритья и «совкового бритья». . Основным ограничением этих альтернатив является то, что часто только часть поражения доступна для гистологического исследования, что не позволяет провести окончательную оценку (рис. 17).Коэн и др. обнаружили остаточный невус в 24,9% повторных иссечений атипичных меланоцитарных невусов, которые первоначально были взяты на биопсию с использованием техники бритья или удара. 47 Особенно досадным ограничением биопсий после бритья и перфорации является то, что они часто содержат только центральную часть поражения, а область контакта между меланоцитарным поражением и нормальной кожей отсутствует. Это проблематично, поскольку достоверная оценка архитектуры (наличие или отсутствие ограниченности и симметрии) невозможна.Биопсии бритья, в которых исследуется только поверхностный аспект поражения, не позволяют оценить созревание.
Рисунок 17Диспластический невус, показывающий атипию соединительных и кожных компонентов с вовлечением краев, покрытых чернилами.
Поверхностная биопсия после бритья часто не позволяет точно оценить уровень Кларка и толщину опухоли меланом; эта неопределенность может привести к рекомендации к биопсии сторожевого лимфатического узла.
Полное иссечение скальпелем всех клинически атипичных невусов позволяет провести гистологическую оценку всего поражения и для большинства образцов избавляет пациента от необходимости дальнейшего хирургического вмешательства. Если бы мы смогли убедить наших коллег-клиницистов полностью удалить клинически атипичные невусы, уход за пациентами можно было бы улучшить, и многие из наших диагностических проблем стали бы в значительной степени академическими.
Лучшей и наиболее практичной иллюстрацией необходимости достижения клинически чистой границы 2 мм является диспластический невус.В сложных диспластических невусах соединительный компонент часто выходит за пределы нижележащего дермального компонента («плеча») и проходит через несколько гребней ретейна. Это соответствует клиническому виду центральной папулы с блеклыми краями, которые сливаются с нормальной кожей. Чтобы гарантировать полное удаление, эти поражения должны быть иссечены с клинически чистыми краями 2 мм, чтобы гарантировать полное иссечение сужающегося соединительного компонента. В исследовании Коэна остаточный невус чаще ассоциировался с перфорацией, чем с биопсией после бритья, вероятно, потому, что «плечо» более эффективно иссекается при биопсии после бритья.Кроме того, недавнее исследование Барра и его коллег показало, что 35,9% атипичных невусов демонстрируют вариации степени атипии от одной области к другой. 31 Таким образом, клиницист, который не полностью исследует диспластический невус с легкой атипией, которая распространяется до краев, не может быть уверен в том, что остаточное поражение не более высокой степени. В статье Коэна и соавторов одно поражение (у пожилого пациента) имело меланому в образце повторного удаления. Представляется разумным, что стандарт лечения должен быть изменен на достижение четких клинических границ 2 мм для любых родинок, обозначенных как клинически атипичные.Полное первичное иссечение избавляет пациентов от процедуры повторного иссечения, а также снижает риск рецидива. Мы считаем, что эксцизионная биопсия с помощью скальпеля — безусловно лучший подход при лечении клинически атипичных / диспластических невусов.
«Полное иссечение скальпелем всех клинически атипичных невусов позволяет провести гистологическую оценку всего поражения и для большинства образцов избавляет пациента от необходимости дальнейшего хирургического вмешательства»
Lentigo maligna — заметное исключение из рекомендации первоначального полного удаления, поскольку клинические размеры и анатомическое расположение часто не позволяют проводить эксцизионную биопсию.В таких случаях необходимы множественные пункционные биопсии различных регионов или, в качестве альтернативы, веретенообразная биопсия после разреза, поскольку одиночная биопсия может не отражать наихудшую область поражения в 40% случаев. 48
Помимо потенциального риска, который представляет для пациента частичная биопсия, следует также учитывать возможность судебного разбирательства. Когда мы получаем частичную биопсию диспластического невуса, мы, как правило, довольно тупо рекомендуем полное и адекватное повторное удаление и часто указываем точный край в миллиметрах.Некоторые дерматологи считают, что мы без надобности связываем им руки; мы придерживаемся противоположной точки зрения, потому что именно мы в конечном итоге понесем вину, когда что-то пойдет не так!
В заключение, остерегайтесь атипичных невусов; у них может быть меланома. Сообщая о неви, не игнорируйте тот, который выглядит немного странно или бросается в глаза. Возможно, он пытается вам что-то сказать! Не сообщайте о меланоцитарных поражениях в конце дня, придерживайтесь себорейного кератоза и эпидермоидных кист.Наконец, иногда может спасти вторая пара глаз или даже третья.
Кожные меланоцитомы: варианты и предупреждения
Austin J Cancer Clin Res 2015; 2 (3): 1035.
* Автор для переписки: Piérard GE, Отдел дерматопатологии, Университетская больница Льежа, B-4000 Льеж, Бельгия.
Аннотация
Наблюдается регулярное улучшение раннего клинического выявления различных атипичных меланоцитарных новообразований (АМН).Гистопатологическое исследование AMN остается обязательным для установления их диагноза и надлежащего лечения. Группы экспертов по диагностике AMN сообщают лишь об умеренном согласии по множеству загадочных случаев. Некоторые AMN по-разному обозначаются в литературе, включая атипичную опухоль шпица, метастазирующую опухоль шпица, пограничную и промежуточную меланоцитарную опухоль, злокачественный невус шпица и пигментную эпителиоидную меланоцитому или меланому животного типа. Были предложены некоторые сокращения, такие как MELTUMP (от «меланоцитарная опухоль с неопределенным злокачественным потенциалом») и STUMP (от «Spitzoid melanocytic опухоль с неопределенным злокачественным потенциалом»).В этом обзоре такие АМН, за исключением вариантов кожной злокачественной меланомы (ММ), сгруппированы под предварительным общим заголовком кожная меланоцитома. Эти поражения обычно протекают безболезненно, хотя проявляют нетипичные и иногда вызывающие беспокойство картины или цитологические аспекты. В редких случаях меланоцитомы кожи прогрессируют до локорегиональных скоплений поражений (агминатные поражения) и даже до регионарных лимфатических узлов. Иногда различие между кожной меланоцитомой и ММ остается проблематичным и даже оказывается просто невозможным.Однако многоаспектная иммуногистохимия помогает оценить риск злокачественного новообразования.
Ключевые слова: Злокачественная меланома; Кожная меланоцитома; Проностический фактор; Стратификация риска; Шпицоидная опухоль; Иммуногистохимия; Клеточная пролиферация
Введение
За последние десятилетия заболеваемость спорадической кожной злокачественной меланомой (SCMM) во всем мире значительно увеличилась среди европейцев [1-4]. С этой точки зрения, существует растущая потребность в улучшении диагностических процедур, поддерживающих раннее лечение и снижающих заболеваемость и смертность от SCMM.
SCMM частично классифицируются в соответствии с его клинической скоростью роста. Для быстрорастущих SCMM обычно характерен вертикальный рост. У них худший прогноз по сравнению с медленно растущими SCMM, которые обычно ограничены поверхностно [5,6].
В большинстве случаев гистопатологическое представление SCMM несложно для специалистов в данной области [7]. SCMM классифицируют в соответствии с общей толщиной первичной опухоли, пролиферативной активностью, наличием язвы, уровнем проникновения в ткань и идентификацией метастазов.Однако из-за широкого спектра гистологических особенностей ситуация иногда оказывается неоднозначной [8,9]. Например, при меланоцитарных поражениях небольшого размера все классические гистологические критерии пограничного SCMM или бесспорного SCMM не всегда соблюдаются, или они не позволяют уверенно провести различие. Эти новообразования предварительно классифицируются по спектру атипичных меланоцитарных новообразований (AMN), охватывающему промежуточные категории [10-19], которые по-разному называются кожными меланоцитомами, меланоцитарной дисплазией, меланомами с минимальным отклонением, пограничными меланомами, меланоцитарными опухолями с неопределенным злокачественным потенциалом (MELTUMP). спицоидные меланоцитарные опухоли с неопределенным злокачественным потенциалом (STUMP) [20].
Хотя традиционная гистология является опорой для диагностики AMN, клинические особенности, в частности дерматоскопические аспекты, по-прежнему имеют центральное значение. Кожная меланоцитома в строгом этимологическом смысле относится к доброкачественной опухоли меланоцитов [10,19]. Этот термин включает меланоцитарные новообразования, которые не соответствуют обычным гистологическим критериям какого-либо конкретного типа обычных меланоцитарных невусов и SCMM [15,19]. Часто они развиваются поодиночке, но иногда возникают множественные кожные меланоцитомы.Некоторые из них сгруппированы вместе (агминатный тип) и потенциально рецидивируют после удаления одиночного поражения [14,21]. Термин меланоцитома аналогичным образом используется в других областях патологии человека (лептоменинги, глаза) и патологии животных (кожа) для различения своеобразных и обычно доброкачественных меланоцитарных новообразований [22-24].
Распознавание промежуточных наборов AMN и лучшая молекулярная стадия типов SCMM выиграли от успехов в иммуногистохимии [25,26]. Используя такой подход, можно с уверенностью идентифицировать самые необычные варианты SCMM [9,12,13].Признано, что молекулярные изменения SCMM и их соответствующие иммунологические ответы сопровождают прогрессирование опухоли от начальной до поздней стадии. В этой области можно использовать маркеры пролиферации, дифференцировки меланоцитов и иммуномодуляции. Кроме того, идентификация сигнальных молекул, факторов роста нервов и рецепторов потенциально полезна, особенно в вариантах SCMM веретенообразных клеток.
Триггерные меланоцитарные невусы и кожные меланоцитомы
В ряде эндогенных и экзогенных состояний запускаются меланоцитарные невусы, и некоторые из них проявляются как кожные меланоцитомы.В этой области был выявлен набор конкретных внутренних сообщений и факторов окружающей среды. Примерами являются кожные меланоцитомы, развившиеся на врожденных невусах, диспластические невусы [27], невусы, измененные беременностью или гормональной контрацепцией [28], невусы субъектов, получающих гормональную терапию [11], невусы под воздействием ультрафиолетового излучения [29,30]. Следует отметить, что некоторые из этих поражений имитируют SCMM или имеют риск развития MM. Возможность кожной меланоцитомы следует указывать в каждом отдельном случае.В этом обзоре термин «кожная меланоцитома» включает в себя широкую категорию меланоцитарных новообразований, которые дополнительно различаются в соответствии с идентифицированным происхождением и клинико-патологической конфронтацией.
В глобальном масштабе класс кожной меланоцитомы гистологически распознается по комбинации некоторых критериев, включая архитектурную дезорганизацию и асимметрию, дискретную ядерную атипию и анизокариоцитоз, а также возможное сопоставление вспомогательной очаговой или диффузной воспалительной клеточной реакции.Однако вариабельная комбинация и степень таких признаков в различных поражениях не позволяют установить какой-либо простой набор основных критериев, идентифицирующих отдельные специфические подмножества кожных меланоцитом, за исключением, однако, общего типа меланоцитомы Шпица (невуса).
Другой особый тип кожной меланоцитомы представляет собой атипичный кожный узелок в меланоцитарном невусе, который в остальном выглядит нормально. Такие атипичные узелки предполагают трансформацию внутри очага поражения, которую некоторые патологи считают признаком злокачественного новообразования, хотя другие признаки агрессивного поведения не проявляются.Увеличение размера этого типа меланоцитарного поражения в основном связано с более обильной бледной цитоплазмой в каждой отдельной клетке. Ядра показывают лишь незначительное увеличение в размерах и не демонстрируют плеоморфизма. Возможно, происходит инвагинация ядра цитоплазмой, что дает вакуолизированный вид. Митозы практически не встречаются.
После исключения связанных с беременностью изменений меланоцитарных поражений, общее гендерное соотношение меланоцитомы кожи (F / M) составляет около 1,6 [19].Распределение по возрасту одинаково в обеих гендерных группах. Распространенность всех меланоцитом достигает пика в течение 3–4 десятилетий жизни, а резкое снижение происходит после 50 лет. Такое распределение по возрасту и полу напоминает SCMM [15].
Различие между кожными меланоцитомами и SCMM в идеале предполагает, что все члены каждой группы будут вести себя либо полностью доброкачественно, либо полностью злокачественно. Эта концепция, вероятно, не совсем верна. Вариабельность гистопатологических представлений SCMM и кожных меланоцитом создает диагностические трудности, а клинические признаки иногда остаются тревожными.Любая ошибка в этом дифференциальном диагнозе имеет серьезные последствия, включая уродливое чрезмерное лечение или, наоборот, опасное для жизни лечение. В настоящее время существуют разногласия относительно диагнозов, которые следует ставить при определенных новообразованиях, и их прогнозируемой эволюции, ведущей к потенциальному причастности к юридической ответственности.
Микроскопия меланоцитом кожи
Различие между кожными меланоцитомами и SCMM предполагает, что все члены каждой группы являются либо полностью доброкачественными, либо полностью злокачественными.Такая концепция, вероятно, неверна. Гистопатологическая изменчивость кожных меланоцитом создает диагностические трудности, особенно в различии с SCMM. В некоторых случаях клинические аспекты вызывают такое же беспокойство. Выделение, с одной стороны, SCMM, включая его необычные варианты, маскирующиеся под другие объекты, и, с другой стороны, доброкачественные образования, имитирующие SCMM, является одной из самых сложных диагностических головоломок. Ошибка в этом дифференциальном диагнозе приводит к серьезным последствиям, включая чрезмерное лечение увечий или, наоборот, угрозу жизни при лечении.В настоящее время существуют разногласия относительно диагнозов некоторых новообразований и их прогнозируемого развития. В результате существует потенциальная ответственность за юридическую ответственность.
Очевидно, существует консенсус относительно неадекватности некоторых текущих клинико-патологических классификаций и необходимости дополнительных исследований в этой области. Любые эмпирические утверждения и догматические мнения в области нозологии некоторых типов кожных меланоцитом, по-видимому, сильно различаются. Даже определение злокачественности оспаривается в области AMN.Некоторые АМН, особенно с атипичным спицоидным аспектом, не ограничиваются первичным сайтом. Они проявляют склонность к региональному распространению по коже (агминатный тип) и, возможно, к региональным лимфатическим узлам [17], но не к более отдаленным участкам. На выживаемость такая региональная прогрессия не влияет.
Интерпретация регионального распространения вызывает разногласия. Некоторые авторы рассматривают это как формальное доказательство злокачественности, рассматривая вторичные поражения как сателлитоз или транзитные метастазы.Напротив, другие утверждают, что такая позиция представляет собой чрезмерное толкование. Тем не менее, любое региональное распространение кожных и узловых кожных меланоцитом не похоже на отдаленные метастазы во внутренние органы и не является окончательным доказательством злокачественности.
Для серии AMN текущие гистопатологические критерии доброкачественности или злокачественности не выполняются полностью или не позволяют с уверенностью провести различие между этими двумя основными состояниями. Некоторые маркеры дифференцировки обычно используются при обнаружении атипичного меланоцитарного новообразования.Иммуногистохимия используется в качестве дополнения для различения SCMM и кожных меланоцитом или других новообразований. Общие антитела направлены на белок S100, gp100 / HMB45, мелан A / MART-1, CD63 / NKi-C3 и тирозиназу [31].
В целом, обычные доброкачественные меланоцитарные новообразования структурированы упорядоченным образом, демонстрируя симметрию и так называемое созревание с более глубоким расположением более мелких клеток по направлению к основанию поражения. В целом, чувствительность маркеров дифференцировки снижается или становится неоднородной в SCMM с увеличением клинической стадии, включая метастатические поражения [32].Такой особенности не наблюдается при созревании меланоцитом кожи. Следует отметить, что иммуногистохимия оказалась очень полезной для отслеживания микросателлитов SCMM [33], которые являются предикторами метастазов в сторожевые лимфатические узлы и безрецидивной выживаемости [34].
Фракция роста, пролиферация и апоптоз кожных меланоцитом
Нарушение автономных регуляторных путей роста в меланоцитомах и SCMM, по-видимому, имеет первостепенное значение.Атипичные триполярные митотические фигуры были показателем SCMM, а не кожных меланоцитом. Авторадиография после включения меченного тритием тимидина [33] выявила положительную корреляцию между индексом мечения 3H-TdR и толщиной SCMM. Метастазы оставались с высоким индексом иммунной метки, в то время как доброкачественные меланоцитарные поражения показали очень низкую долю клеток в S-фазе. Поскольку процедуру радиоавтографии было практически невозможно применять в обычном порядке, метод был переключен на иммуномаркировку Ki67, которая принесла аналогичную информацию.Эти маркеры были изучены для двух клинических применений, а именно для отличия меланоцитарных невусов от SCMM и для оценки клинического прогноза для пациентов с SCMM.
Наиболее широко используемым маркером пролиферации является Ki67, ядерный антиген, присутствующий во всех активных фазах пролиферации клеточного цикла (G1, S, G2 и M), но отсутствующий в фазе покоя (G0) [34]. Иммуномечение Ki67 оказалось положительным в <5% клеток в большинстве меланоцитарных невусов.При кожных меланоцитомах может быть обнаружено до 15% положительных результатов [35,36]. Количественная потеря экспрессии Ki67 с глубиной коррелирует с созреванием и меньшим количеством атипичных поражений [12,37]. Высокая скорость митоза или индекс Ki67 не является общим признаком кожных меланоцитом, а скорее предполагает SCMM. Наиболее тонкие SCMM, по-видимому, находятся в фазе задержки роста, демонстрируя скорее аккретивное, чем пролиферативное формирование гнезд. Более толстые SCMM и их метастазы имеют более высокий индекс Ki67. В целом, индекс Ki67 достигает 15-30% клеток SCMM, хотя в некоторых отдельных случаях обнаруживается гораздо большая ядерная положительность.Индекс Ki67 сам по себе не является надежным отличительным признаком между SCMM и кожными меланоцитомами, если он перекрывается на 10-20%. Присутствие стволовых клеток SCMM (низкий индекс Ki67) [38] и клональных событий [39] еще больше усложняют процесс [40].
По нашему опыту, индекс Ki67 кератиноцитов часто выше, чем у опухолевых клеток при кожных меланоцитомах. Обратная ситуация наблюдается в SCMM толщиной более 0,4 мм.
Апоптоз отличается от некротической гибели клеток и представляет собой один из основных механизмов, участвующих в снижении экспансивного роста меланоцитарных новообразований.Как функциональный аналог митоза, апоптоз играет решающую роль и обычно жестко регулируется. Апоптоз нарушается в меланоцитарных новообразованиях, когда компоненты и регуляторы клеточного апоптотического аппарата мутируют или присутствуют в несоответствующих количествах. Проапоптотические факторы включают, среди прочего, Bax, Bid, Fas / FasL, IFN, c-Kit / SCF, Noxa, p53, PITSLRE, PUMA, TNF и TRAIL. Антиапоптотические факторы включают Bcl-2, Bcl-XI, ливин, Mcl-1, ML-LAP, NFkB и сурвивин. Альтернативно, другие молекулы, включая эндотелины, интегрины, c-Myc и TRAF-2, проявляют либо про-, либо антиапоптотические эффекты [41].
Апоптоз обычно проявляется довольно активно при кожных меланоцитомах. Так называемые тельца Камино при меланоцитоме шпица, вероятно, являются результатом такого процесса. В настоящее время сложный механизм апоптоза при кожных меланоцитомах недостаточно изучен.
Микроваскуляризация меланоцитом кожи
В тонком ММ плотность микрососудов показывает широкий диапазон развития среди различных поражений. Общая стохастическая взаимосвязь, по-видимому, присутствует между размером микрососудов и размером прорастающего компартмента.
Сообщается, что микрососудов меньше при кожных меланоцитомах, чем при SCMM. Фактор роста эндотелия сосудов (VEGF) часто обнаруживается в SCMM, в отличие от обычного негатива в кожных меланоцитомах.
Степень ангиогенеза может помочь отличить кожные меланоцитомы от SCMM. Однако следует отметить, что некоторые SCMM с задержкой роста обнаруживают слабый ангиогенез [42]. Напротив, описаны ангиоматоидные кожные меланоцитомы [43].Следовательно, различия в SCMM и ангиогенезе кожной меланоцитомы кажутся более статистически значимыми, чем клинически полезными, из-за значительного перекрытия в степени от любого случая к случаю.
Заключение
Меланоцитарные новообразования кожи неоднородны по своей природе и внешнему виду. В SCMM описано огромное количество генетических изменений, но основные из них четко не определены. Кожные меланоцитомы представляют собой доброкачественные меланоцитарные новообразования с атипичными признаками при гистологическом исследовании.Однако не существует единого критерия, определяющего меланоцитомы кожи. Различие между злокачественной меланомой и меланоцитомой кожи имеет первостепенное значение для ведения пациентов. Комбинация умеренно повышенной клеточной пролиферации и неоднородной пятнистой дифференцировки является ключом к разгадке кожных меланоцитом независимо от их типа. Большинство кожных меланоцитом возникает в результате действия некоторых внутренних или внешних триггерных факторов.
Традиционные системы классификации для SCMM сосредоточены на клинико-патологических корреляциях.Хотя некоторые конкретные подтипы SCMM клинически и гистологически различаются, многочисленные исследования показывают, что текущие параметры для классификации не имеют независимой прогностической ценности. Действительно, некоторые маркеры потенциальной клинической пользы, которые выглядят многообещающими в небольших исследованиях, не могут оказаться клинически полезными в более крупных исследованиях. Такие неутешительные особенности, по-видимому, связаны с неоднородной природой SCMM в процессе ее эволюции. По сравнению с меланоцитами, в продвинутой SCMM действительно присутствует огромное количество молекулярных изменений.Различные мутации раскрыты из сравнительного профилирования экспрессии генов SCMM на разных стадиях. Трудно выделить, что является центральным для злокачественного новообразования и типичным для SCMM. Поэтому в широком диапазоне молекулярных изменений трудно точно определить, когда данное меланоцитарное новообразование становится злокачественным. В этом контексте кожные меланоцитомы являются частью развивающейся парадигмы классификации меланоцитарных новообразований.
Кожные меланоцитомы образуют промежуточную категорию меланоцитарных новообразований между обычными невусами и SCMM.Они ведут себя как доброкачественные образования, но их гистологические проявления могут вызывать беспокойство или беспокойство. Иммуногистохимия, оценивающая маркеры дифференциации и маркеры пролиферации, помогает отличить кожные меланоцитомы от SCMM. Для достижения высокого уровня диагностической точности следует проводить многоаспектный иммуногистохимический анализ.
Мы подчеркиваем недавние исследования, которые предоставили понимание разнообразия меланоцитарных новообразований. Мы ожидаем, что эти исследования и последующие аналогичные исследования дадут информацию исследователям меланомы и дерматологам о новых способах лечения пациентов с атипичными меланоцитарными новообразованиями.
Список литературы
- Gandini S, Sera F, Cattaruzza MS, Pasquini P, Picconi O, Boyle P, et al. Мета-анализ факторов риска меланомы кожи: II. Воздействие солнца. Eur J Cancer. 2005; 41: 45-60.
- Thompson JF, Scolyer RA, Kefford RF. Кожная меланома. Ланцет. 2005; 365: 687-701.
- Чанг Ю.М., Ньютон-Бишоп Дж. А., Епископ Д. Т., Армстронг Б. К., Батай В., Бергман В. и др. Объединенный анализ фенотипа меланоцитарного невуса и риска кожной меланомы на разных широтах.Int J Cancer. 2009; 124: 420-428.
- Hermanns-Lê T, Piérard S. Оптимизация меланомы кожи у молодых женщин из бельгийского региона Мосан. Biomed Res Int. 2014; 2014: 320767.
- Липскер Д. Скорость роста, раннее обнаружение и профилактика меланомы: новый взгляд на эпидемиологию меланомы и будущие проблемы. Arch Dermatol. 2006; 142: 1638-1640.
- Лю В., Доулинг Дж. П., Мюррей В. К., МакАртур Г. А., Томпсон Дж. Ф., Вулф Р. и др. Скорость роста меланом: характеристики и ассоциации быстрорастущих меланом.Arch Dermatol. 2006; 142: 1551-1558.
- Smoller BR. Гистологические критерии диагностики первичной злокачественной меланомы кожи. Мод Pathol. 2006; 19 Приложение 2: S34-40.
- Brochez L, Verhaeghe E, Grosshans E, Haneke E, Piérard G, Ruiter D, et al. Различия между наблюдателями в гистопатологической диагностике клинически подозрительных пигментных поражений кожи. J Pathol. 2002; 196: 459-466.
- Повар MG. Диагностические подводные камни при меланоцитарных опухолях. Curr Diagn Pathol. 2004; 10: 463-472.
- Эйнсворт AM, Фолберг Р., Рид Р. Дж., Кларк У. Меланоцитарные невусы, меланоцитомы, меланоцитарные дисплазии и необычные формы меланомы. В кн .: Злокачественная меланома человека, монографии по клинической онкологии. Кларк У.Х., Гольдман К.И., Мастранджело MJ, редакторы. Grune & Stratton, Нью-Йорк. 1979; 167-208.
- Bourguignon JP, Piérard GE, Ernould C, Heinrichs C, Craen M, Rochiccioli P, et al. Влияние терапии гормоном роста человека на меланоцитарные невусы. Ланцет. 1993; 341: 1505-1506.
- Barnhill RL.Поражение шпицами: переосмысление опухолей шпица, атипичные варианты, «шпиццеидная меланома» и оценка риска. Мод Pathol. 2006; 19 Дополнение 2: С21-33.
- Ли JB. Невус шпица против меланомы: выявленные ограничения диагностической методологии. Eur J Dermatol. 2006; 16: 223-224.
- Sabroe RA, Vaingankar NV, Rigby HS, Peachey RD. Невидимый шпиц у взрослой особи после удаления одного невуса шпица — отчет о случае и обзор литературы. Clin Exp Dermatol. 1996; 21: 197-200.
- Piérard GE, Piérard-Franchimont C, Hermanns-Lê T., Delvenne P. Кожные меланоцитомы: концептуальный кластер атипичных и вялотекущих меланоцитарных новообразований. Эксперт Rev Dermatol. 2013; 8: 185-194.
- Хунг Т., Ян А., Михм М.С., Барнхилл Р.Л. Плексиформные веретено-клеточные невусы и атипичные варианты: 128 случаев. Hum Pathol. 2014; 45: 2369-2378.
- Маккормак С.Дж., Коньерс Р.К., Сколайер Р.А., Кирквуд Дж., Спикман Д., Вонг Н. и др. Атипичные спицоидные новообразования: обзор потенциальных маркеров биологического поведения, включая биопсию сторожевого узла.Melanoma Res. 2014; 24: 437-447.
- Kaltoft B, Hainau B, Lock-Andersen J. Меланоцитарная опухоль с неизвестным злокачественным потенциалом — датское исследование с участием 67 пациентов. Melanoma Res. 2015; 25: 64-67.
- Piérard GE, Piérard-Franchimont C, Delvenne P. Симуляторы злокачественной меланомы. Мир J Clin Oncol. [под давлением].
- Abraham RM, Karakousis G, Acs G, Ziober AF, Cerroni L, Mihm MC Jr и др. Лимфатическая инвазия предсказывает агрессивное поведение при меланоцитарных опухолях с неопределенным злокачественным потенциалом (MELTUMP).Am J Surg Pathol. 2013; 37: 669-675.
- Онсун Н., СараÃшоŸлу С., Демиркесен С., Курал Ю. Б., АтилганоŸлу У. Широко распространенные шпицевые невусы с извержением: может ли беременность быть стимулирующим фактором? J Am Acad Dermatol. 1999; 40: 866-867.
- Турхан Т., Онер К., Юрцевен Т., Акалин Т., Овул И. Меланоцитома спинномозговой менингеальной оболочки. Отчет о двух случаях и обзор литературы. J Neurosurg. 2004; 100: 287-290.
- О’Брайен Д.Ф., Крукс Д., Маллуччи С., Джавадпур М., Уильямс Д., дю Плесси Д. и др. Менингеальная меланоцитома.Childs Nerv Syst. 2006; 22: 556-561.
- Semin MO, Serra F, Mahe V, Deviers A, Regnier A, Raymond-Letron I. Меланоцитома хориоидеи у кошки. Вет офтальмол. 2011; 14: 205-208.
- Фехер Л.А., Каммингс С.Д., Киф М.Дж., Алани Р.М. К молекулярной классификации меланомы. J Clin Oncol. 2007; 25: 1606-1620.
- Plaza JA, Suster D, Perez-Montiel D. Экспрессия иммуногистохимических маркеров при первичной и метастатической злокачественной меланоме: сравнительное исследование у 70 пациентов с использованием метода тканевого микрочипа.Appl Immunohistochem Mol Morphol. 2007; 15: 421-425.
- Piérard GE, Al Rustom K. Диспластические невусы и концепция запущенной меланоцитарной системы. Em Med J. 1989; 7: 3-6.
- Aktürk AS, Билен Н., Байрамгюрлер Д., Демирсой Е.О., Эрдоган С., Киран Р. и др. Дерматоскопия — подходящий метод для наблюдения за изменениями меланоцитарных невусов, связанными с беременностью. J Eur Acad Dermatol Venereol. 2007; 21: 1086-1090.
- Tronnier M, Wolff HH. Облученные УФ-излучением меланоцитарные невусы, имитирующие меланому in situ.Am J Dermatopathol. 1995; 17: 1-6.
- Анна Б., Блейзей З., Жаклин Г., Эндрю С.Дж., Джеффри Р., Анджей С. и др. Механизм канцерогенеза, связанного с УФ-излучением, и его вклад в развитие невусов / меланомы. Эксперт Rev Dermatol. 2007; 2: 451-469.
- Орчард GE. Сравнение иммуногистохимического мечения антител к дифференцировке меланоцитов мелан-А, тирозиназы и HMB 45 с белком NKIC3 и S100 при оценке доброкачественных невусов и злокачественной меланомы. Histochem J. 2000; 32: 475-481.
- Shaikh L, Sagebiel RW, Ferreira CM, Nosrati M, Miller JR 3rd, Kashani-Sabet M, et al. Роль микросателлитов как прогностического фактора при первичной злокачественной меланоме. Arch Dermatol. 2005; 141: 739-742.
- Pierard GE, Pierard-Franchimont C. Пролиферативная активность клеток злокачественных меланом. Am J Dermatopathol. 1984; 6 Дополнение: 317-323.
- Soyer HP. Иммуноокрашивание Ki 67 при меланоцитарных опухолях кожи. Корреляция с гистологическими параметрами. Дж. Кутан Патол.1991; 18: 264-272.
- Фоллмер РТ. Использование правила Байеса и индекса пролиферации MIB-1 для отличия невуса шпица от злокачественной меланомы. Am J Clin Pathol. 2004; 122: 499-505.
- Капур П., Селим М.А., Рой Л.К., Егаппан М., Вайнберг А.Г., Хоанг М.П. и др. Невусы шпица и атипичные невусы / опухоли шпица: гистологический и иммуногистохимический анализ. Мод Pathol. 2005; 18: 197-204.
- Беннетт округ Колумбия. Как сделать меланому: что мы знаем о первичных клональных событиях? Pigment Cell Melanoma Res.2008; 21: 27-38.
- Hussein MR, Haemel AK, Wood GS. Апоптоз и меланома: молекулярные механизмы. J Pathol. 2003; 199: 275-288.
- Piérard GE, Piérard-Franchimont C. Стохастическая взаимосвязь между фракцией роста и васкуляризацией тонких злокачественных меланом. Eur J Cancer. 1997; 33: 1888-1892.
- Piérard-Franchimont C, Henry F, Heymans O, Piérard GE. Сосудистая задержка при скрытых злокачественных меланомах с задержкой роста. Int J Mol Med. 1999; 4: 403-406.
- Марковал Дж., Морено А., Грэллс Дж., Видал А., Эскрипа Дж. М., Гарсия-Рамирес М. и др.Ангиогенез и злокачественная меланома. Ангиогенез связан с развитием вертикальной (канцерогенной) фазы роста. Дж. Кутан Патол. 1997; 24: 212-218.
- Heymans O, Blacher S, Brouers F, Piérard GE. Фрактальная количественная оценка неоднородности микрососудов при меланоме кожи. Дерматология. 1999; 198: 212-217.
- Diaz-Cascajo C, Borghi S, Weyers W. Ангиоматоидный невус шпица: отдельный вариант десмопластического невуса шпица с выраженной сосудистой сетью. Am J Dermatopathol.2000; 22: 135-139.
Невус или меланома? Неадекватная парадигма для небольшого количества клинически значимых поражений
Бенджамин Эндрю Вуд
Натан Тобиас Харви
Подавляющее большинство пролифераций меланоцитов, подвергающихся эксцизионной биопсии, легко классифицируются как доброкачественные меланоцитарные невусы или злокачественная меланома при обычном гистологическом исследовании. Однако есть небольшая группа поражений, которые не подходят для этого дихотомического подхода. 1 Это неудивительно, поскольку гистологический диагноз включает субъективную идентификацию и интерпретацию множества, а иногда и несопоставимых архитектурных и цитологических особенностей, почти все из которых индивидуально показывают несовершенную связь с истинной биологической природой новообразования. В целом, эти проблемные меланоцитарные поражения делятся на две (иногда перекрывающиеся) группы:
- Поражения, которые имеют противоречивые морфологические критерии, из-за чего трудно решить, является ли поражение доброкачественной меланомой или доброкачественным невусом с атипичными гистологическими особенностями ограниченного биологического значения. 2 Некоторые примеры многочисленных диагностических меток, которые могут быть нанесены на такие поражения, включают тяжелую диспластическую опухоль, раннюю / развивающуюся меланому, возникающую в диспластическом невусе, поверхностную атипичную меланоцитарную пролиферацию неопределенного значения и атипичную опухоль / невус шпица.
- Поражения, которые обладают действительно промежуточным биологическим потенциалом, во многих случаях с удивительно высокой скоростью распространения на региональные лимфатические узлы, но нечастым широким распространением и прогнозом намного лучше, чем у обычной меланомы с аналогичными стадиями. 3 Некоторые примеры номенклатуры, которая может быть использована для таких поражений, включают атипичную опухоль шпица / шпицоидную опухоль с неопределенным злокачественным потенциалом, шпицоидную меланому в детстве, меланоцитарную опухоль с неопределенным злокачественным потенциалом и атипичный клеточный синий невус.
Есть понятная тенденция среди некоторых клиницистов относиться к «неопределенному» диагнозу со степенью беспокойства или скептицизма. Могут возникнуть опасения, что такая интерпретация отражает отсутствие патологической экспертизы или убеждение, что другой практикующий врач может дать более определенную интерпретацию.В этом случае важно не смешивать диагностическую достоверность с диагностической точностью. Несмотря на то, что консультации с экспертами ценны и к ним почти всегда обращаются, существует достаточно доказательств того, что даже среди экспертов существует очень значительная вариативность интерпретации поражений в этих сложных группах между наблюдателями. 4 Более того, биологический результат не всегда точно предсказывается даже мнением значительного «большинства»; то есть злокачественное клиническое поведение может наблюдаться в поражениях, которые, по мнению большинства экспертов, имеют доброкачественные признаки, и наоборот. 4
Иногда возникает давление, чтобы обозначить поражение как злокачественное, если есть какие-либо сомнения. Причина этого понятна — злокачественный диагноз не может быть доказан как ошибочный, так как хороший результат может быть связан с эффективностью лечения, тогда как неблагоприятный результат после доброкачественного диагноза доказывает ошибку. Однако очевидно, что в последние десятилетия наблюдается определенная степень патологической гипердиагностики меланомы. 5 Чрезмерная диагностика и избыточное лечение связаны с множеством затрат, которые здесь не требуют повторения.
Во-вторых, поскольку такие неопределенные диагнозы встречаются нечасто, у многих практикующих врачей будет ограниченный опыт работы с этой группой поражений. Клиницист может столкнуться с трудностями при объяснении диагноза и его значимости для пациента или при определении того, как лечить такое поражение. Подробное обсуждение управленческого подхода выходит за рамки данной статьи; Однако следует упомянуть несколько простых принципов. 6 Для всех поражений, которые попадают в категорию «неопределенных», терапевтическое удаление с гистологически чистыми краями является основой лечения.Для поражений, которые полностью внутриэпидермальные, и для подавляющего большинства «тонких» поражений (<1 мм толщиной) полное удаление будет излечивающим, независимо от «истинного» биологического диагноза. После полного удаления пациентов в этой группе можно успокоить и провести клиническое наблюдение, что наиболее важно для развития отдельных и потенциально более значительных меланоцитарных поражений. Для более толстых поражений, когда обсуждение более обширной резекции, биопсии сторожевого лимфатического узла или более агрессивного мониторинга может быть проблемой, уместно лечение мультидисциплинарной командой, имеющей опыт в этой области.Откровенное обсуждение этих вопросов с пациентами возможно, обычно хорошо принимается и необходимо для получения информированного согласия.
В последние годы была проделана значительная работа по сокращению (и без того небольшого) количества поражений, для которых трудно прогнозировать биологический потенциал. Они включают использование флуоресцентной гибридизации in situ (FISH) или сравнительной геномной гибридизации, которые в настоящее время используются в клинической практике, для оценки вариабельности числа генетических копий. Вероятно, что в ближайшем будущем эти дополнительные тесты будут дополнены подходами, основанными на секвенировании.Однако не следует ожидать, что эти тесты полностью устранят группу поражений с неопределенным биологическим потенциалом. Действительно, становится все более очевидным, что поражения, которые трудно классифицировать под микроскопом, демонстрируют промежуточные генетические аномалии, в некоторых случаях представляющие частичное прогрессирование в многоступенчатом пути. 7
В заключение мы хотели бы подчеркнуть, что зрелая клиническая практика требует понимания того, что упрощенная концепция патологического диагноза «доброкачественная и злокачественная» не может полностью охватить трудности морфологической интерпретации или биологические сложности меланоцитарной патологии человека.Неопределенный диагноз при меланоцитарной патологии — редкое, но хорошо изученное явление. Установлен соответствующий клинический подход к этому сценарию. Такие диагнозы не свидетельствуют о недостатке диагностической компетентности и не представляют собой непреодолимого препятствия для надлежащего общения с пациентом или ведения пациента. Во всех таких случаях консультация с опытным дерматопатологом и / или соответствующей многопрофильной командой приведет к разработке соответствующего плана ведения и, возможно, к уменьшению беспокойства пациента и врача первичной медико-санитарной помощи.
Авторы
Бенджамин А. Вуд, BMed, FRCPA, патолог-консультант, отделение анатомической патологии, группа дерматопатологии лабораторной медицины PathWest, Медицинский центр QEII, Недлендс, Вашингтон; Клинический адъюнкт-профессор школы патологии и лабораторной медицины Университета Западной Австралии, Кроули, Вашингтон. benjamin.wood@health.wa.gov.au
Натан Т. Харви Бакалавр наук, MBBS (с отличием), патолог-консультант FRCPA, отделение анатомической патологии, группа дерматопатологии лаборатории PathWest, Медицинский центр QEII, Недлендс, Вашингтон; Старший преподаватель клинической практики, Школа патологии и лабораторной медицины, Университет Западной Австралии, Кроули, Вашингтон.
Конкурирующие интересы: Нет.
Происхождение и экспертная оценка: Не заказан, независимая экспертная оценка.
Список литературы
- Scolyer RA, Murali R, McCarthy SW, Tompson JF. Гистологически неоднозначные («пограничные») первичные кожные меланоцитарные опухоли: подходы к ведению пациентов, включая роль молекулярного тестирования и биопсии сторожевого лимфатического узла. Arch Pathol Lab Med 2010; 134 (12): 1770–77.
- McCalmont TH.Карточный домик. Дж. Кутан Патол 2012; 39 (8): 739–40.
- Zembowicz A, Scolyer RA. Невус / меланоцитома / меланома: новая парадигма классификации меланоцитарных новообразований? Arch Pathol Lab Med 2011; 135 (3): 300–06.
- Герами П., Бусам К., Кокран А. и др. Гистоморфологическая оценка и диагностическая воспроизводимость атипичных спицоидных меланоцитарных новообразований между наблюдателями с долгосрочным наблюдением. Am J Surg Pathol 2014; 38 (7): 934-40.
- Glusac EJ. «Эпидемия» меланомы, взгляд дерматопатолога.Дж. Кутан Патол 2011; 38 (3): 264–67.
- Старейшина DE, Xu X. Подход к пациенту с тяжелым меланоцитарным поражением. Патология 2004; 36 (5): 428–34.
- Шаин А.Х., Йе И., Ковалишин И. и др. Генетическая эволюция меланомы от предшественников поражений. N Engl J Med 2015; 373 (20): 1926–36
Переписка afp@racgp.org.au
Открытие или сохранение файлов
Файлы на веб-сайте можно открывать, загружать и сохранять на свой компьютер или устройство.
Чтобы открыть, щелкните ссылку, ваш компьютер или устройство попытается открыть файл с помощью совместимого программного обеспечения.
Чтобы сохранить файл, щелкните ссылку правой кнопкой мыши или щелкните ссылку и выберите «Сохранить как …». Следуйте подсказкам, чтобы выбрать место.
Типы файлов
PDF Большинство документов на веб-сайте RACGP имеют формат Portable Document Format (PDF). Эти файлы будут иметь «PDF» в скобках вместе с размером файла для загрузки. Чтобы открыть файл PDF, вам потребуется совместимое программное обеспечение, такое как Adobe Reader.Если у вас его нет, вы можете бесплатно загрузить Adobe Reader.
DOC Некоторые документы на этом сайте представлены в формате Microsoft Word. Они будут иметь «DOC» в скобках вместе с размером файла для загрузки. Для просмотра этих документов вам понадобится программа, которая может читать формат Microsoft Word. Если у вас ничего нет, вы можете бесплатно скачать MS Word Viewer.
MP3 Большинство веб-браузеров воспроизводят аудио в формате MP3 в браузере
Меланома, возникающая в меланоцитарном невусе
ВведениеВ 1967 году Мисима1 предсказал, что меланома в конечном итоге будет рассматриваться как 2 отдельных образования, которые он назвал злокачественной меланоцитомой, возникающей из лентиго сенилиса, и злокачественной невоцитомой, возникающей из меланоцитарного невуса.С тех пор были достигнуты большие успехи в понимании молекулярной биологии меланоцитарных новообразований. Гипотеза Мисимы, которая еще не была опровергнута, способствовала подчеркиванию важности потенциальных предшественников меланомы, наиболее заметными из которых являются меланоцитарные невусы.
Одна теория, поддерживаемая несколькими авторами, заключается в том, что меланоцитарные невусы — это доброкачественные опухоли, которые возникают в результате клональной экспансии меланоцитов. Это преобразование может происходить либо спонтанно, либо в ответ на внешние триггеры (например,ж., воздействие солнца), вызывая гистологически симметричную, в основном однородную, пролиферацию клеток с гомогенными мутациями, затрагивающими большинство составляющих клеток2. Результаты многочисленных исследований подтверждают эту клональную экспансию клеток невуса3–5 (хотя противоречивые результаты имеют сообщалось) 6,7 и позволили определить меланоцитарные невусы как клоны меланоцитов, которые подверглись чувствительности.5,8,9 Генетические мутации, которым приписывается ключевая роль в развитии меланомы, также были обнаружены в некоторых невусах, что указывает на то, что эти поражения могут быть истинными предшественниками меланомы, которая со временем разовьется после накопления дополнительных мутаций.10 В серии из 37 случаев меланомы с соседними меланоцитарными поражениями Bastian et al. 11 наблюдали градиент количества и типов мутаций, присутствующих в доброкачественных, промежуточных, но, вероятно, доброкачественных, промежуточных, но, вероятно, злокачественных и злокачественных опухолях.
Приведенные выше данные предполагают эволюционную траекторию, по которой меланоцит будет подвергаться клональной экспансии перед переходом в меланоцитарный невус и, в конечном итоге, в меланому. Эта предложенная модель меланоцитов-невусов-меланом, однако, может быть применима только к определенным случаям, поскольку меланомы также возникают de novo, т.е.е., при отсутствии прилегающего меланоцитарного поражения. Этот эволюционный процесс особенно очевиден в случае двух гистологических подтипов меланомы: меланомы злокачественного лентиго и акральной лентигинозной меланомы. Наконец, связанная с невусом меланома не всегда может быть гистологически продемонстрирована у пациентов с историей болезни, предполагающей наличие ранее существовавшего невуса.
Дивергентные пути развития меланомыПатогенная модель, которая предполагает, что меланомы возникают из меланоцитарного невуса после накопления генетических событий, по-видимому, согласуется с путем пролиферации меланоцитов или нестабильности клеточного пигмента, который является одним из двух путей, предложенных Whiteman за развитие меланомы кожи.Этот двойной или дивергентный путь был впервые предложен в 1998 году, но впоследствии он был подтвержден в различных исследованиях (включая исследование группы Уайтмана 12 и метаанализ 13). Согласно этой модели, существует по крайней мере 2 этиологических пути, которые играют ключевую роль в развитии неакральной кожной меланомы (рис. 1).
Первый — это путь хронического пребывания на солнце, при котором накопление индуцированных УФ-излучением мутаций в меланоцитах может привести к развитию меланомы.Это характерно для пожилых пациентов с более высокой конституциональной чувствительностью к вредным воздействиям солнца (то есть с низким типом кожи по Фитцпатрику) и в анамнезе значительным солнечным повреждением и немеланомным раком кожи. Подавляющее большинство меланом, вызываемых этим путем, поражает лицо, шею и нижние конечности.
Второй «невогенный» путь или путь нестабильности пигментных клеток характеризуется большей генетически детерминированной тенденцией к пролиферации меланоцитов.В этом случае пребывание на солнце в детстве и, в меньшей степени, во взрослом возрасте, в конечном итоге будет ответственным за производство новых мутаций и пролиферацию генетически предрасположенных меланоцитов к опухолевым клеткам.12,14 Этот путь повлияет на более молодых пациентов с генетическая предрасположенность к пролиферации меланоцитов, т. е. пациенты с большим количеством невусов. Меланомы в таких случаях обычно поражают участки, которые периодически подвергаются воздействию солнца.
От меланоцитарного невуса к меланоме: генетические и молекулярные факторыНаши знания о генетических, эпигенетических и молекулярных факторах, участвующих в неогенезе и развитии меланомы, значительно продвинулись в последние годы, что привело не только к большему пониманию биологии и естественной истории этих заболеваний. поражений, но также и к разработке таргетных методов лечения, которые показали беспрецедентный успех.
Меланоцитарные новообразования характеризуются генетическими изменениями, которые принимают форму первичных онкогенных событий (обычно активация протоонкогенов в онкогенах) или вторичных онкогенных событий (обычно подавление экспрессии генов, участвующих в пигментации кожи или клеточном старении) .2 Постоянное взаимодействие между агрегатами. меланоцитов и эпителиального микроокружения будут способствовать дальнейшему развитию этих поражений. Такие факторы, как воспалительные явления, 15 гипоксия, 16 и паракринные обмены, например, все участвуют в прогрессировании меланомы.17 Это взаимодействие между меланоцитами и микросредой может быть дополнительно изменено другими факторами, такими как УФ-излучение.18
После анализа генетических изменений меланомы, Curtain et al. 19 заявили, что мутационный профиль меланоцитов может быть определен солнечным светом. шаблоны экспозиции. Авторы предложили классифицировать меланомы на 4 группы в зависимости от локализации опухоли и увеличения уровня хронических повреждений, вызванных солнцем, с первой по четвертую группу. Критерии для третьей и четвертой групп также предполагали наличие предшественников или промежуточных поражений.Предлагаются 4 группы:
- 1)
Меланомы слизистой оболочки, встречающиеся на слизистых оболочках и характеризующиеся отсутствием солнечного света.
- 2)
Акральные меланомы, возникающие в акральных областях и характеризующиеся ограниченным пребыванием на солнце.
- 3)
Меланомы на коже без хронических повреждений, вызванных солнечными лучами (отсутствие гистологических свидетельств солнечного эластоза), включая спицоидные меланомы. Curtain et al. считают, что некоторые из меланом в этой группе могут возникать в результате доброкачественных или промежуточных предшественников, таких как приобретенные невусы, диспластические невусы, невусы Шпица и атипичные опухоли Шпица.
- 4)
Меланомы на коже с хроническим повреждением, вызванным солнцем (солнечный эластоз), включая десмопластические меланомы, возможно, возникающие при нестабильных солнечных лентиго. 19,20
Инициирующие или управляющие мутации описаны для всех вышеупомянутых меланом . Два основных задействованных пути — путь митоген-активируемой протеинкиназы (MAPK) и путь фосфоинозитид-3-киназы / протеинкиназы B / млекопитающих — путь рапамицина (PI3K / AKT / mTOR) — показаны на рисунке 2.
BRAF и NRASПротоонкоген B-Raf, ген серин / треонинкиназы (BRAF) и протоонкоген NRAS, ген GTPase (NRAS) кодируют белки-активаторы на разных уровнях пути MAPK. Белки регулируют передачу сигнала с поверхности меланоцитов для транскрипции факторов, регулирующих пролиферацию, рост, выживаемость и апоптоз клеток.19,23 Доля соматических активирующих мутаций BRAF и NRAS, сообщаемых для меланоцитарных поражений, значительно варьируется от серии к серии.
Мутации BRAF являются наиболее частыми мутациями, связанными с путем нестабильности пигментных клеток24, и были обнаружены более чем в 80% обычных меланоцитарных невусов.10,25–27 Они также были идентифицированы примерно в 40–50% первичных меланом и чаще встречаются в связанных с невусами меланомах и меланомах поверхностного распространения в зонах периодического пребывания на солнце.27,28
Мутации NRAS менее распространены и наблюдаются до 56% врожденных меланоцитарных невусов27 и менее чем в 5% приобретенных невусы.27,29 Тем не менее, результаты, полученные на сегодняшний день, могли быть искажены трудностью различения приобретенных общих невусов и небольших врожденных невусов. 30 Мутации NRAS наблюдались в 20-30% меланом и особенно часто встречаются в узловых меланомах, расположенных в областях хроническое пребывание на солнце 28,31
Мутации BRAF и NRAS могут играть роль в инициировании пролиферации составляющих меланоцитов пигментных поражений8 и на ранних стадиях развития меланомы.10 Однако для развития злокачественной трансформации потребуются дополнительные мутации. .10,25–27
NF1Ген супрессора опухоли нейрофибромина 1 (NF1) выполняет регуляторную функцию в пути MAPK. Присутствие соматических инактивирующих мутаций NF1 при различных типах рака вызывает устойчивость к РАС за счет негативной регуляции, вызывая вторичную активацию ERK. Мутации NF1 участвуют в инициации развития меланомы, а также, как полагают, оказывают негативную регуляторную функцию, которая приводит к устойчивости к ингибиторам RAF.32,33
TERTГен обратной транскриптазы теломеразы (TERT) необходим для предотвращения укорочения теломер в соматических и теломерах. зародышевые ткани, а также играет роль в старении и канцерогенезе.Экспрессия теломеразы подавляется в большинстве клеток после рождения, но раковые клетки проявляют повышенную активность теломеразы. Мутации соматического промотора TERT обычно имеют характерный признак мутаций, вызванных УФ-излучением (образование димеров пиримидина) .34,35 Они были идентифицированы примерно в 40% меланом, большинство из которых возникают на участках, подверженных воздействию солнца. 36 с худшим прогнозом, поскольку они обладают более агрессивными характеристиками, которые определяют более короткую выживаемость без болезней и меланомы.37 Они также связаны с более быстрым ростом, особенно когда они сопровождаются мутациями BRAF или NRAS.38
KIT и PTENГен тирозинкиназы рецептора протоонкогена KIT (KIT), который играет роль в росте и пролиферации эмбриональных меланобластов. , 39 участвует в путях PI3KT / AKT и MAPK40 (Fig. 2). PI3K генерирует фосфатидилинозитол-3,4,5-трифосфат, фосфолипид, который активирует как белки AKT (которые играют регулирующую роль в клеточном цикле, пролиферации, выживании и неопластической трансформации), так и белки mTOR (которые участвуют в онкогенезе).41 В рамках пути PI3K / AKT / mTOR следует особо упомянуть ген-супрессор опухоли, гомолог фосфатазы и тензина, PTEN, основной функцией которого является ингибирование активации AKT путем разложения фосфатидилинозитол-3,4,5-трифосфата через его активность фосфатазы.42
Мутации KIT и PTEN в пути PI3K / AKT / mTOR гетерогенны, влияют на разные гены и могут сосуществовать с мутациями BRAF (17%) или NRAS (9%). 43 соматические мутации KIT обнаружены в 2 % меланом. Они, по-видимому, особенно часто встречаются при акральных меланомах (40% акральных лентигинозных меланом имеют мутации KIT) и меланомах слизистой оболочки (23%).41 Наконец, соматические мутации PTEN были обнаружены почти в 22% меланом.43
CDKN2AГен ингибитора циклин-зависимой киназы 2A (CDKN2A) расположен на коротком плече хромосомы 9 и кодирует 2 белка-супрессора опухоли, которые имеют ключевая роль в пролиферации и старении клеток. Первый — это p14-ARF, который регулирует пролиферацию клеток посредством стабилизации p53, индуцируя экспрессию ингибитора циклин-зависимой киназы p21. Второй, p16-INK4A, играет ту же роль, ингибируя ассоциацию между циклин-зависимыми киназами (CDK4 / 6) и циклином D1 (CCND1).44–46CDKN2A — наиболее известный локус семейной меланомы. Были идентифицированы мутации CDKN2A зародышевой линии, которые изменяют функцию 1 или 2 белков, кодируемых CDKN2A. В наших условиях мутации CDKN2A обнаруживаются примерно в 15% семейных меланом.47,48 Соматические изменения CDKN2A, приводящие к нарушению или утрате функции (гомозиготные делеции, мутации или эпигенетическое молчание, вызванное метилированием ДНК), были описаны почти в 90% случаев. melanomas49 и связаны с инвазивной способностью.10,33 Соматические мутации не обнаруживаются в обычных меланоцитарных невусах, но были идентифицированы в 10% диспластических невусов.49
Одно исследование секвенирования всего экзома диспластических меланоцитарных невусов и меланомы показало, что меланоцитарные невусы имеют относительно стабильные геномы и это прогрессирование меланоме, по-видимому, требует наличия мутаций в ключевых генах-супрессорах опухоли.50 Аналогичным образом, модель поражений на определенных участках предполагала существование генетико-молекулярного континуума меланоцитарных новообразований, на которых доброкачественные поражения после накопления мутаций в генах, кодирующих субъединицы SWI / SNF и p53 (e.g., BRAF, NRAS, TERT, CDKN2A), будут переходить в промежуточные поражения и, в конечном итоге, в меланому in situ или инвазивную или метастатическую меланому.11
Меланоцитарные невусы и меланомы, следовательно, будут иметь общие генетические изменения, которые будут накапливаться в этом континууме от предшественников поражений. (доброкачественные или промежуточные злокачественные новообразования) в новообразования с метастатическим потенциалом. Основные мутации, которые в настоящее время считаются вовлеченными в этот процесс, приведены в Таблице 1.33.
Меланома, связанная с невусом. Несмотря на растущее признание того, что динамическая эволюционная модель меланоцитарных новообразований может объяснить развитие некоторых меланом, мы не можем игнорировать тот факт, что большинство меланом являются опухолями de novo и что только различная часть меланом содержит гистологические остатки меланоцитарного невуса (меланома, связанная с невусом).
Доля меланом, связанных с невусомРиск перехода невуса в меланому обычно считается низким. Совокупный риск трансформации любого отдельного невуса в меланому в течение 80 лет оценивается в 0,03% (1 на каждые 3164 невуса) у мужчин и 0,009% (1 на каждые 10 800 невусов) у женщин.52
Предполагаемая распространенность кожных меланом, клинически или гистологически связанных с ранее существовавшим меланоцитарным невусом, колеблется от 4% до 85%, в зависимости от серии.Частота обычно ниже, если во внимание принимаются только меланомы с гистологическими остатками предыдущего невуса (4–72%). 53–82 и выше, когда пациенты сообщают о клинически очевидном невусе в анамнезе (42–85%). 83, 84 Наше обсуждение связанной с невусом меланомы в следующем разделе основано только на случаях с объективными гистологическими доказательствами предыдущего невуса.
В 1988 году Акерман заявил, что меланомы de novo встречаются чаще, чем меланомы, связанные с невусом. Это утверждение было основано на анализе более 75 000 меланом у белых пациентов, только 20% из которых были связаны с предыдущим невусом.85 Результаты, однако, не были применимы к темнокожим или азиатским пациентам, у большинства из которых были опухоли de novo, поражающие ладони или подошвы, или ногтевой аппарат85. вероятно, более распространен, чем первоначально предполагалось, и затрагивает не только белых пациентов.86 Различия в оценках можно частично объяснить прогрессом в нашем понимании биологии меланоцитарных невусов и улучшением диагностических критериев, особенно в случае пограничных поражений.Разумеется, методологические различия также могут привести к систематическим ошибкам. Учитывая низкий уровень согласия между наблюдателями, наблюдаемый при гистопатологической диагностике клинически подозрительных пигментных поражений87 и меланом in situ, некоторые дерматопатологи рекомендуют рассматривать только инвазивные поражения при исследовании меланом, связанных с невусом.88
В метаанализе, опубликованном в 2015 году, сообщается о приблизительных оценках. распространенность невус-ассоциированной меланомы составила 36% у 10 102 пациентов, но эта оценка упала до 32%, когда были исключены исследования, в которых рассматривались только поверхностные распространяющиеся меланомы.80 Однако у метаанализа были некоторые ограничения. В него вошли, например, исследования, в которых не было четко указано количество пациентов с меланомой или доля пациентов с меланомой, ассоциированной с невусом.85,89,90 Кроме того, хотя в нем логически не учитывались некоторые из недавних исследований. проведенных исследований, он также упустил некоторые соответствующие более ранние публикации. В попытке дать более точную оценку доли меланом, гистологически связанных с невусами, мы провели исчерпывающий обзор литературы, который включал исследования, не проанализированные в метаанализе 2015 года.Мы использовали аналогичную методологию 80, которая заключалась в поиске в базе данных PubMed с использованием терминов меланома, невусы, предшественник и патология. В результате поиска было найдено 169 исследований, опубликованных до 7 февраля 2017 г. Были просмотрены отрывки всех найденных статей. Обзорные статьи и редакционные статьи, в которых не были представлены новые данные, были исключены, но их списки литературы были просмотрены для выявления оригинальных статей, в названии или аннотации которых упоминается меланома, связанная с невусом. Предполагаемая распространенность меланомы, связанной с невусом, была рассчитана с использованием данных 29 исследований с участием 16 162 пациентов (таблица 2).
Характеристики меланомы, ассоциированной с невусомТекущие данные показывают, что связанные с невусом меланомы, независимо от типа доброкачественного меланоцитарного поражения, в котором они возникли, обладают некоторыми характерными чертами (Таблица 3).
Меланомы, содержащие гистологические остатки ранее существовавшего невуса, связаны с более молодым возрастом на момент постановки диагноза, 66,76,78,80 высоким числом невусов74,81 (или плотностью) 77 и наличием солнечных ожогов в анамнезе74. туловище и в областях периодического солнечного воздействия58,68,72,74–76,78,80 (что объясняет, почему у них меньше клинических77 и гистологических66 признаков хронического солнечного повреждения).Связанные с невусом меланомы — это в основном меланомы поверхностного распространения69,71,72,76–78 и имеют гистологические характеристики, связанные с лучшим прогнозом (меньшая глубина Бреслоу62,66,71,77,81 и отсутствие язв) .80,82
Вышеуказанные характеристики контрастируют с теми, которые обычно наблюдаются при меланомах с клиническими, а не гистологическими признаками ранее существовавшего невуса. В исследовании 377 пациентов с меланомой глубина по Бреслоу была больше в подгруппе пациентов с клинической историей предыдущего пигментного поражения (42%), хотя это не было связано с худшей выживаемостью.84 Эта связь между толщиной опухоли и меланомой, которая клинически связана с предыдущим невусом, однако, не была подтверждена более поздним испанским исследованием, в котором с использованием аналогичной методологии было проанализировано 165 пациентов с меланомой, 49% из которых сообщили о предыдущем невусе.83
Меланомы с гистологическими признаками ранее существовавшего невуса, таким образом, оказывается, что он имеет более благоприятные клинические и гистопатологические признаки. Хотя в большинстве публикаций, в которых конкретно изучались меланомы, связанные с невусом, не было обнаружено значительных различий в показателях выживаемости по сравнению с меланомами de novo, результаты показывают, что эти более благоприятные прогностические характеристики могут быть связаны с более длительной выживаемостью.Например, одно исследование 1983 года, в котором проанализировано 557 пациентов с меланомой, показало более высокую выживаемость без признаков заболевания в подгруппе из 130 пациентов с невус-ассоциированной меланомой.62 Более позднее исследование, проведенное в 2016 году, с участием 2 когорт пациентов с меланомой из 2 разных стран. Периоды времени (1024 и 1125 пациентов, из которых 198 [19,3%] и 349 [31,0%] имели ассоциированную с невусом меланому) показали, что пациенты с гистологическими признаками предыдущего невуса имели лучшую общую выживаемость, даже после поправки на классические прогностические факторы.82 Наконец, недавнее многоцентровое исследование 2184 пациентов с меланомой (в котором специально не изучалась меланома, связанная с невусом) показало, что пациенты с множественными невусами, по-видимому, имеют лучшую выживаемость, специфичную для меланомы.92
ВыводыНа основании нашего объединенного анализа 16 162 пациентов из 29 различных исследований, мы можем сделать вывод, что около 30% меланом гистологически связаны с меланоцитарным невусом. Хотя связанные с невусом меланомы, по-видимому, имеют более благоприятные прогностические характеристики, в большинстве статей не было обнаружено значительных различий в выживаемости после поправки на обычные прогностические факторы.
Как обсуждалось выше, оценочная доля связанных с невусом меланом значительно варьируется от серии к серии, и, кроме того, в этих случаях существует низкое согласие между гистологическим и клиническим диагнозом. У этих расхождений может быть несколько объяснений:
- —
Вероятное существование медленно растущих меланом с доброкачественной клинической картиной.93
- —
Возможность полного уничтожения всех остатков невуса растущей меланомой.В соответствии с ранее высказанными предположениями, 84 мы полагаем, что это может особенно относиться к более крупным опухолям, подразумевая, что серия более тонких меланом будет иметь более высокую частоту возникновения меланомы, связанной с невусом.
- —
Рассмотрение атипичной пролиферации меланоцитов на периферии меланом в ранних публикациях, что могло бы объяснить относительное увеличение доли связанных с невусом меланом в более поздних сериях.
- —
Возможность пропуска гистологических остатков ранее существовавшего невуса, поскольку анализ 100% образцов биопсии не является стандартной практикой.Ориентация образцов во время обработки также может привести к заниженной диагностике.
Какой бы ни была ситуация, текущие данные свидетельствуют о том, что пациенты с меланомами, ассоциированными с невусами, моложе и имеют поражения, которые преимущественно затрагивают туловище, солнечные ожоги в анамнезе и более высокое количество или плотность невусов. Поэтому было бы разумно рекомендовать уделять особое внимание любым изменениям в невусах у пациентов с множественными невусами, что является стандартной практикой при лечении пигментных поражений в наших условиях.
Остается много вопросов о биологическом поведении меланомы и ее предшественников, а также о том, как это влияет на выживаемость. Хотя большинство исследований предполагают, что связанные с невусом меланомы менее агрессивны, чем их аналоги de novo, не совсем ясно, связано ли это с их кажущимися более благоприятными гистологическими особенностями или с их биологическими характеристиками.

