HE4
Определение концентрации человеческого эпидидимального протеина 4 (HE4), которое может быть использовано для диагностики, оценки прогноза и контроля лечения рака яичника и эндометрия.
Синонимы русские
- Человеческий эпидидимальный протеин 4
- Человеческий эпидидимальный секреторный белок 4
Синонимы английские
- Human epididymis protein 4
- WFDC2
Метод исследования
Электрохемилюминесцентный анализ.
Диапазон определения: 15 — 30000 пмоль/л.
Единицы измерения
Пмоль/л (пикомоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Усиленный синтез HE4 характерен для некоторых злокачественных опухолей (мезотелиомы, рака легкого, почек, молочной железы, эндометрия, злокачественных образований желудочно-кишечного тракта), что позволяет использовать этот белок в качестве онкомаркера. Показано, что HE4 обладает свойствами, способствующими опухолевой прогрессии, например, усиливает миграцию и адгезию клеток рака яичника. Наибольшее значение HE4 имеет в диагностике, оценке прогноза и контроле лечения опухолей яичника и эндометрия.
- HE4 для дифференциальной диагностики образований малого таза.
Одной из наиболее сложных диагностических задач является дифференциальная диагностика доброкачественных и злокачественных образований малого таза. Часто для этого используется онкомаркер CA-125. Существенным недостатком CA-125 является его недостаточная специфичность, так как он может быть повышен и при доброкачественных заболеваниях. По сравнению с CA-125 онкомаркер HE4 реже повышен при доброкачественных новообразованиях (в 8 % случаев против 29 %). СА 125 также повышен в 67 % случаев эндометриоза, тогда как HE4 – только в 3 %. Таким образом, преимуществом HE4 является более высокая специфичность в отношении злокачественных образований.
При использовании комбинации онкомаркеров СА 125 и HE4 удается более точно дифференцировать злокачественные и доброкачественные образования малого таза, чем при использовании каждого маркера в отдельности. Комбинация этих онкомаркеров в сочетании с менопаузальным статусом пациентки используется в алгоритме риска рака яичников ROMA.
- HE4 для скрининга рака яичников и эндометрия.
На сегодняшний день не существует анализа или метода, который бы позволял эффективно выявлять рак яичника на ранней стадии. Наиболее часто для этих целей используется СА 125. Этот онкомаркер, однако, не достаточно чувствителен и выявляется только в 30-50 % рака яичника на ранних стадиях. Показано, что HE4 может быть обнаружен в 32 % случаев рака яичника, отрицательных по СА 125 и, поэтому, дополняет СА 125.
HE4 входит в большинство панелей тестов, которые предлагается использовать для скрининга рака яичников. Наилучший результат показан при использовании комбинации HE4, CA-125, раково-эмбрионального антигена CEAи молекулы адгезии сосудистого эндотелия 1 типа VCAM-1: комбинация этих онкомаркеров выявляет рак яичника на ранних стадиях с чувствительностью 86 % и специфичностью 98 %.
Важно подчеркнуть, что онкомаркер HE4, так же, как и онкомаркер CA-125, способен выявлять только злокачественные образования яичника эпителиального происхождения и не выявляет герминогенные опухоли или опухоли стромы полового тяжа.
В некоторых исследованиях также было показано, что HE4 может быть использован для скрининга рака эндометрия.
- HE4 для оценки прогноза рака яичников и эндометрия.
Повышенный уровень HE4 ассоциирован с более высокой степенью злокачественности и более выраженной стадией рака яичников по классификации FIGO. Высокий уровень HE4 чаще наблюдается при более агрессивных вариантах рака яичника и указывает на менее благоприятный прогноз.
Так же, как и при раке яичника, повышенный уровень HE4 ассоциирован с более агрессивным фенотипом рака эндометрия, а высокая концентрация этого онкомаркера говорит о плохом прогнозе заболевания.
- HE4 для контроля лечения и диагностики рецидива рака яичника и эндометрия.
Исследование на HE4 может быть использовано для оценки эффективности лечения. Так, концентрация HE4 существенно отличается у пациентов при постановке диагноза рака яичника и пациентов, достигших полной клинической ремиссии (324,1 против 23,3 пикомоль).
Анализ на HE4 также может применяться для диагностики рецидива рака яичника. Показано, что HE4 начинает определяться примерно за 4,5 месяца до возникновения клинических признаков рецидива этого заболевания. На этом основании анализ на HE4 используют для мониторинга эффективности лечения. В некоторых случаях повышение HE4 предшествует повышению CA-125. В одном из исследований показано, что онкомаркер HE4 способен выявлять рецидив рака яичника с чувствительностью 74 % и специфичностью 100 % при концентрации более 70 пикомоль/л. Использование комбинации онкомаркеров HE4 и CA-125 позволяет увеличить чувствительность до 76 %.
Повышенный уровень HE4 обнаруживается в 80 % случаев рецидива рака эндометрия. Показано, что онкомаркер HE4 способен выявлять рецидив рака эндометрия с чувствительностью 81 % и специфичностью 64 % при концентрации более 70 пикомоль/л.
При интерпретации результата исследования необходимо помнить, что HE4 может быть повышен при некоторых других заболеваниях, в том числе при раке легкого, почечной недостаточности и почечном фиброзе. С возрастом концентрация HE4 в норме значительно возрастает (в отличие от CA-125, который в норме с возрастом снижается). Например, 95 процентиль распределения концентраций HE4 составляет 128 пикомоль у постменопаузальных женщин и 89 пикомоль у пременопаузальных женщин. Беременные женщины имеют значительно более низкую концентрацию HE4, чем небеременные женщины. Такие факторы, как фаза менструального цикла, эндометриоз и использование эстроген- и прогестерон-содержащих противозачаточных средств не влияют на уровень HE4.
Результаты анализа оценивают с учетом всех значимых анамнестических, клинических и других лабораторных данных.
Для чего используется исследование?
- Для диагностики, оценки прогноза и контроля лечения опухолей яичника и эндометрия.
Когда назначается исследование?
- При подозрении на рак яичника или эндометрия.
Что означают результаты?
Изолированное использование исследования в целях скрининга и диагностики онкологических заболеваний недопустимо. Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. Диагностика любого заболевания строится на основании разностороннего обследования с использованием различных, не только лабораторных методов и осуществляется исключительно врачом.
Референсные значения:
Пременопауза:
Постменопауза:
Причины повышения:
- рак яичника;
- рак эндометрия;
- рак легкого;
- почечная недостаточность;
- почечный фиброз.
Причины понижения:
- контроль заболевания на фоне лечения.
Что может влиять на результат?
- Возраст;
- беременность.
Важные замечания
- Результаты исследования оценивают с учетом дополнительных анамнестических, клинических и лабораторных данных;
- для получения точного результата необходимо следовать рекомендациям по подготовке к тесту.
Также рекомендуется
Кто назначает исследование?
Акушер-гинеколог, врач общей практики.
Литература
- Simmons AR, Baggerly K, Bast RC Jr.The emerging role of HE4 in the evaluation of epithelial ovarian and endometrial carcinomas. Oncology (Williston Park). 2013 Jun;27(6):548-56.
- Brennan DJ, Hackethal A, Mann KP, Mutz-Dehbalaie I, Fiegl H, Marth C, Obermair A. Serum HE4 detects recurrent endometrial cancer in patients undergoing routine clinical surveillance. BMC Cancer. 2015 Feb 6;15:33.
- Li J, Dowdy S, Tipton T, Podratz K, Lu WG, Xie X, Jiang SW. HE4 as a biomarker for ovarian and endometrial cancer management. Expert Rev Mol Diagn. 2009 Sep;9(6):555-66.
расшифровка, норма у женщин, что показывает
В медицине под онкомаркерами понимается сочетание биохимических веществ и элементов, увеличение которых в организме человека показывает и сигнализирует о злокачественном, доброкачественном новообразовании либо о наличии воспалительного процесса. Организм реагирует на появление раковых клеток повышенным производством онкомаркеров. Человек не подозревает, что в теле развиваются патологические процессы, начало болезни протекает бессимптомно либо на признаки не обращется внимание. Обнаружение симптомов заболевания на этапе возникновения – нередко дело случая, целиком зависит от внимательности пациента и терапевта. Задача врача – своевременно выявить возможное отклонение во внутренней среде организма на ранних стадиях при помощи обследования, анализов и тестов.
Онкомаркер HE-4 – это принадлежащий к семейству кислых четырёхдисульфидных белков человека протеин. В нормальном состоянии белок представлен в органах мочеполовой системы, поджелудочной железе и верхних дыхательных путях. Присутствует у мужчин и женщин. Функциональная нагрузка маркера НЕ-4 не изучена до конца. Учёные предполагают, что маркер участвует в нормальной работе эпителия и поддерживает функционирование местного иммунитета полости рта и дыхательного тракта. Увеличенное производство НЕ-4 – это особенность некоторых видов раковых клеток, что даёт возможность применять его в роли онкомаркера. Исследователи нашли ещё одно свойство НЕ-4 – усиление перемещения и сцепление раковых клеток яичников. Следовательно, маркер целесообразно использовать в диагностических и прогностических целях при опухолях яичника и эндометрия.
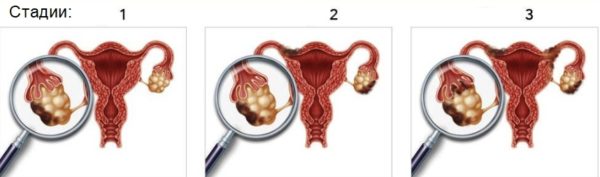

Стадии развития рака яичника
Преимущества маркера НЕ-4
Развитие диагностической медицины ещё не достигло уровня, при котором возможно гарантированное и безошибочное выявление онкологии яичника на раннем этапе отклонения. Традиционно для определения присутствия онкологической болезни в органах половой системы у женщин применяется онкомаркер СА 125. Проблематика его использования заключается в слабой способности различения доброкачественных образований от злокачественных опухолей.
В отличие от СА 125 маркер НЕ-4 точнее выявляет злокачественную онкологию. При назначении обследований врачи-онкологи отдают предпочтение сочетанию маркеров СА 125 и НЕ-4 при диагностике раковых клеток в яичниках. Разработан алгоритм выявления риска рака яичников RОМА. Повышенный уровень белка НЕ-4 выявляется совокупностью клинических методов количественного определения концентрации вещества в крови. Лабораторные исследования подтвердили повышенную чувствительность маркера НЕ-4 к распознанию раковых клеток женских половых органов на ранней стадии болезни по сравнению с другими маркерами.
По данным многочисленных зарубежных исследований, если рак яичников выявляется на первоначальных стадиях, то вариант полной ремиссии составляет 94%, тогда как обнаружение опухоли на поздних сроках снижает шанс выживаемости (45%).
Низкий риск развития онкологии яичников отображается вышеупомянутым показателем ROMA, который делится на два диагностических параметра:
RОМА1 (во время предменопаузы) – менее 7,4%.
ROMA 2 (в период наступления менопаузы) – менее 25,3%.
Если показатели выше или равны представленным значениям, речь идёт о повышенном риске онкологических образований, распространении метастазов и отсутствии эффекта лечения болезни. При таких результатах обследуемой назначаются дополнительные исследования для локализации возможного патологического процесса и корректировки лечения. Всеми диагностическими процедурами и назначением лечения занимаются врачи. Самолечением и нетрадиционными практиками без заключения терапевта заниматься опасно для жизни и здоровья!


О каких видах отклонений сигнализирует онкомаркер НЕ-4?
Проведённые клинические исследования показали способность НЕ-4 к ранней диагностике рака яичников и эндометрия.
Рак яичников (карцинома яичников) – злокачественное образование. Он занимает пятое место по частоте причин смерти от рака у женщин в мире. При ранней диагностике и лечении 5-летняя выживаемость составляет 94%. Причина развития болезни до конца не изучена. По данным исследователей, карциноме яичника больше предрасположены нерожавшие женщины. Также роль играет возраст пациентки и наследственная предрасположенность. На развитии болезни может сказаться увеличение количества животных жиров, получаемых с пищей, а также гинекологические расстройства различной этиологии.
Рак эндометрия (карцинома эндометрия) – злокачественная опухоль эпителия тела матки. Выделения с кровью из влагалища – основной симптомом заболевания. Симптомы рака эндометрия совпадают с признаками других заболеваний органов малого таза. Среди факторов риска, которые могут спровоцировать болезнь, перечислены: гиперплазия ткани матки, избыточная масса тела, бесплодие, нарушения в менструальных циклах, приём некоторых гормональных контрацептивов, наследственная предрасположенность.
Также маркер сигнализирует о развитии онкологических процессов в следующих органах:
- лёгкие;
- толстая кишка;
- молочные железы.
Маркер менее чувствителен к доброкачественным образованиям и эндометриозам женских половых органов, что даёт возможность дифференцировать диагнозы. НЕ-4 применяется в диагностике следующих болезней, не связанных со злокачественными новообразованиями:
- Киста яичника представляет собой новообразование доброкачественного происхождения. Имеет форму пузыря, заполненного жидкостью. Протекает в отсутствии симптоматики, обнаруживается при диагностических и профилактических осмотрах. На кисту яичника могут указывать неприятные ощущения внизу живота, нарушения здорового функционирования кишечника, частые позывы к мочеиспусканию и другие. Уровень НЕ-4 при кисте повышен. Целесообразно применять другие процедуры диагностики для постановки диагноза.
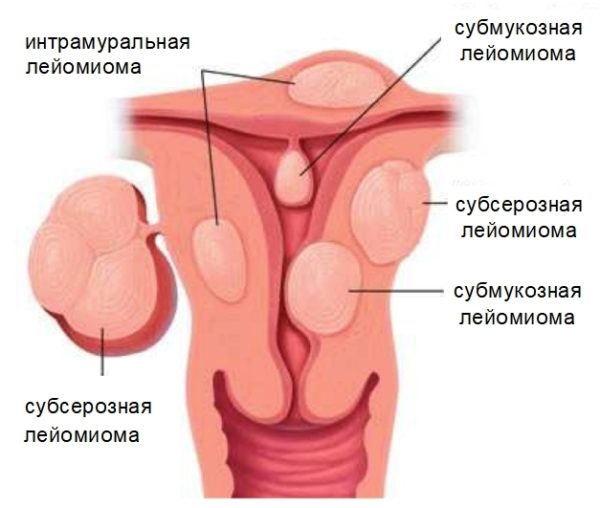

Разновидности лейомиом матки
- Миома представляет доброкачественное образование мышц матки. Распространённое заболевание у женщин старше тридцати лет. Одна из причин миомы матки – гормональный дисбаланс. Как и киста, миома не имеет явных признаков отклонения. Боли в пояснице и внизу живота, нарушение нормального цикла менструаций могут свидетельствовать о наличии заболевания. Повышение показателя онкомаркера при миоме является дополнительным триггером для проведения специализированного осмотра в гинекологическом кабинете.
- Эндометриоз – это патология матки, при которой клетки ткани эндометрия распространяются за пределы органа. Заболеванию подвержены женщины репродуктивного возраста. Симптоматика эндометриоза выражается болями и сильными выделениями во время месячных, бесплодием. Показатель маркера при эндометриозе не превышает пороговых значений либо незначительно повышен.
При почечной недостаточности и болезнях печени онкомаркер НЕ-4 сдвинут в сторону повышения. Для постановки диагноза пациент должен испытывать симптомы, указывающие на отклонения в указанных органах.
Также при помощи диагностики онкомаркером НЕ-4 происходит контроль результатов лечения при выявленных онкологических заболеваниях. К примеру, концентрация НЕ-4 у больных раком яичника на начальных стадиях лечения составляла 300 пмоль, в результате удачного лечения и в период ремиссии показатель снижался до 20 пмоль.
Маркер НЕ-4 неэффективен в диагностике мукоидной и герминогенной форм рака яичников, так как не экспрессируется в клетках указанных типов новообразований.
Сдача анализов
Для диагностических целей используют кровь из вены. Для повышения точности результатов анализа перед сдачей образцов крови на исследование необходимо соблюдение следующих правил:


- Не курить минимум за 30 минут до сдачи крови на анализ.
- Прекратить приём пищи и жидкости, кроме кипяченой воды, за 8 часов до процедуры.
- За двое суток не принимать лекарственные препараты, если это возможно и не навредит организму.
- За два дня исключить половые контакты.
- За неделю до анализов исключить алкогольные напитки.
- Не допускать стрессовых нагрузок, в том числе физических.
- Ограничить употребление жирной, жареной и острой пищи.
Результат анализов в среднем готов в течение двух суток. Исследование происходит в лабораторных условиях. При помощи специального катализатора запускается реакция свечения в изъятых образцах, после чего определяется и подсчитывается уровень необходимого онкомаркера НЕ-4.
Интерпретация анализов
Расшифровка результата строится с учетом возможности повышения порогового значения маркера НЕ-4 при иных заболеваниях, в том числе, при раке лёгких, почечной недостаточности, фиброзе почек. По данным исследователей в сфере диагностики рака, фаза менструального цикла на уровень НЕ-4 влияния не оказывает. Если уровень онкомаркера НЕ-4 ниже нормы, это не критично. Внимания требуют повышенные показатели, которые могут означать наличие патологических процессов в организме женщины.
Норма
У женщин в крови содержится онкомаркер НЕ-4. Уровень нормального количества зависит от возраста пациенток. Норма у женщин до 40 лет в пределах 60 пикомоль на литр. В период наступления менопаузы нормальный показатель не должен превышать уровень 140 пикомоль, по другим данным 104 пикомоль. Значение маркера у беременных пациенток ниже, чем показатели небеременных.


Таблица показателей нормального уровня онкомаркера НЕ-4 у женщин:
| Возраст, лет | Норма, пикомоль |
| До 40 | Не больше 60 |
| 40 – 49 | Не больше 76 |
| 50 – 59 | Не больше 74 |
| 60 – 69 | Не больше 83 |
| После 70 | Не больше 104 |
Отклонения
Однозначный диагноз о наличии заболевания ставит лечащий врач по результатам проведения ряда дополнительных диагностических процедур и изучения комплексного анамнеза пациентки. После проведения диагностических исследований и подтверждения положительной динамики роста раковых клеток врачи разрабатывают индивидуальную стратегию борьбы с болезнью. Основным методом лечения рака является химиотерапия. Если положительного эффекта не достигнуто, применяется операционное вмешательство и послеоперационная реабилитирующая терапия. После того, как показатели придут в норму, проводятся регулярные профилактические обследования с контролем уровня онкомаркера НЕ-4 и других показателей.
Ошибки диагностики
Как и в другой сфере, в диагностической медицине могут быть погрешности, неточности и ошибки. Не исключена вероятность ложноположительных и ложноотрицательных результатов из-за технических сбоев в диагностическом оборудовании, несоблюдение требований при подготовке к сдаче анализов, ошибка лаборанта или диагноста.


Профилактические мероприятия
Для того чтобы свести к минимуму риск заболевания онкологией яичников, необходимо соблюдение следующих правил:
- Периодические обследования у врачей-гинекологов.
- Регулярная сдача крови на анализ (общий, биохимия). Также данная процедура показана лицам, проходящим реабилитацию при кисте яичника.
- Соблюдение гигиены половых органов.
- Приём гормональных и противозачаточных препаратов только после консультаций с терапевтом.
- В зимний период выбирать гардероб с теплыми вещами, а не в угоду моде. Держать органы малого таза в тепле.
- Полный отказ от употребления спиртных напитков и курения.
- Соблюдение режима и сбалансированного рациона питания. Увеличение потребления растительных антиоксидантов (овощи, фрукты, сухофрукты).
- Избавление от лишнего веса. По данным американских исследователей, женщины с избыточным весом входят в группу риска развития рака яичников. Причем превышение веса может быть небольшим. Также прослеживается прямая связь между избыточными килограммами и такими заболеваниями, как рак молочных желёз, толстой кишки, эндометрия, рак почек и др.
При должном уровне заботы об организме, своевременном и регулярном прохождении обследований и изучении исследований международных научных организаций в области борьбы с онкологическими заболеваниями можно преодолеть болезнь и жить полноценной жизнью.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди:
Онкомаркер НЕ 4 — сдать анализ на онкомаркеры органов малого таза в CMD
Метод исследования: ИХЛА
Секреторный белок 4 эпидидимиса человека (HE 4) — гликопротеин, в небольших количествах вырабатывается клетками эпителия репродуктивных органов, органов верхних дыхательных путей, поджелудочной железы.
Высокие концентрации НЕ 4 отмечают у больных раком яичников, НЕ 4 превосходит СА 125 по чувствительности, в т.ч. на ранних стадиях заболевания. Сочетанное определение обоих маркеров дает более высокую диагностическую чувствительность при выявлении рака яичников.
С целью разделения пациенток на подгруппы с высоким и низким риском рака яичников предложен алгоритм риска (Risk of Ovarian Malignancy Algorithm, ROMA), основанный на определении обоих этих онкомаркёров.
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Дифференциальная диагностика опухолей малого таза;
- Мониторинг с целью ранней диагностики рецидивов рака яичников.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Референсные значения | Единицы измерения |
|---|---|---|
| HE 4 (Секреторный белок эпидидимиса человека 4, Human epididymis protein 4) | Женщины в пременопаузе — <70, в постменопаузе — <140 | пмоль/л |
Дискриминационный уровень*: женщины (пременопауза)
Дискриминационный уровень (ДУ) – верхняя допустимая граница концентраций у здорового человека.
ВНИМАНИЕ! Следует помнить, что незначительное повышение концентрации многих онкомаркёров возможно при различных доброкачественных и воспалительных заболеваниях, физиологических состояниях. Поэтому выявление повышенного содержания того или иного онкомаркёра ещё не является основанием для постановки диагноза злокачественной опухоли, а служит поводом к дальнейшему обследованию.
| Повышение значений |
|---|
|
Примечание: Пациентки с подтвержденным раком яичников могут иметь HE 4 в пределах дискриминационного уровня. Определенные более редкие типы рака яичников (например, герминативноклеточные, муцинозные опухоли) редко экспрессируют HE 4.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом ФЗ № 323 «Об основах охраны здоровья граждан в Российской Федерации», должны производиться врачом соответствующей специализации.
что это за показатель, его расшифровка и норма
Онкологические маркеры ‒ это комплекс химических элементов, которые образуются в человеческом организме. Их содержание может увеличиваться в процессе развития злокачественного новообразования, при прогрессировании доброкачественных опухолей и во время воспалительных процессов. Для определения количества онкологических маркеров в крови, проводятся исследования, выявляющие новообразования, либо для мониторинга качества терапии. На начальных этапах определить злокачественные опухоли помогают маркеры. He4 онкомаркер, что это понятие обозначает и как правильно подготовиться к исследованию?

Результаты анализов могут подтвердить или опровергнуть наличие онкологии
Суть понятия
Онкологические маркеры – это группа биологических молекул. Они имеют разное происхождение, но все однозначно определяют очень важные показатели – наличие их в большом количестве в крови свидетельствует о том, что в организме развивается доброкачественное или злокачественное новообразование. Это определенные показатели наличия и прогрессирования онкоболезни в человеческом организме.
Онкологические маркеры в зависимости от уровня их содержания в крови помогают определять, есть ли злокачественная опухоль, а также ее локализацию.
Диагностика крови назначается для двух основных функций – выявить и подтвердить наличие опухоли либо же опровергнуть диагноз.
На данный момент известно большое количество маркеров. Их количество превышает 200 единиц. Но лаборатории определяют из них только 15-20, потому что именно они являются информативными. Все остальные могут дать неправильный результат, так как их уровень в организме меняется и в случае иных болезней, не только при развитии онкологии.
Существуют различные виды белка, которые говорят о различных типах онкологических образований. Все они имеют определенное название. Благодаря этому врач после проведения оценки сможет определить тип новообразования, какой орган заражен.
Ни один маркер, к сожалению, не может определить специфичность к органу со 100%-й вероятностью. Это свидетельствует о том, что один вид маркера способен говорить об онкологии множества органов. Несмотря на это, благодаря онкологическим маркерам можно определить примерный перечень пораженных органов и не теряться в догадках, какой именно орган болеет. Когда исследование на онкологические маркеры покажет повышенный уровень специфичности, используются дополнительные способы оценки состояния органов, попавших под сомнение.
Зачем следует проводить подобное исследование
Для чего определяется концентрация онкомаркеров?
- Чтобы следить за тем, эффективный ли вид терапии выбран для лечения данной опухоли. Если терапия не дает никаких результатов, ее можно заменить на другую, при этом не потеряв драгоценного времени.
- Для определения рецидива либо метастазов после проведения терапии. В случае повышения показателей после проведенной терапии можно говорить о рецидиве. Это свидетельствует о том, что терапия, проведенная ранее, не убила все раковые клетки, и после определения белков можно снова начать лечение, пока опухоль небольшая по размерам.
- Для определения вида терапии, необходимой для лечения. Благодаря уровню белков можно определить, насколько поражен орган, как быстро растет опухоль и есть ли результаты после проведения лечения. Изучив все эти данные, врач назначит терапию, наиболее подходящую для данного конкретного случая, – радио- либо химиотерапию.
- Для прогнозирования дальнейшей жизни, а также состояния здоровья. Опираясь на показатели роста или ремиссии можно определить дальнейшее состояние и развитие опухоли.
Когда и кому сдавать анализы
В современном мире значительно возросла частота онкозаболеваний не только у людей старших возрастных категорий, но и у молодого населения.
Онкологические маркеры дают возможность определить наличие, уровень опухоли в самом начале ее развития либо в момент ее развития без явных симптомов. Несмотря на это, каждому человеку необязательно сдавать анализ.
Консультация израильского специалиста
Прежде всего, группу риска составляют те, кто склонен к онкологическим болезням. Это люди, кровные родственники которых имели злокачественные опухоли разных стадий. Для таких людей проводятся скрининговые тесты обязательно 1-2 раза в год. Также 1-2 раза в год такие тесты должны проходить люди, у которых определили наличие доброкачественных образований (например, миома), или при наличии опухолеподобных образований (например, при кисте). Людям, которые находились в ситуациях, имеющих возможность активировать развитие новообразований, при неблагоприятной экологической обстановке, при пережитых сильных душевных потрясениях или иных болезнях стоит проводить тесты единожды в два-три года.
Существует специальная схема сдачи проб на онкомаркеры для людей, прошедших успешное лечение рака. Чтобы исключить возможность рецидива, на протяжении 3 лет после прохождения терапии нужно сдавать пробы:
- по истечении 1 года – ежемесячно;
- по истечении 2 лет – один раз в два месяца;
- по истечении 3 лет – 1 раз в триместр.
По истечении 3 лет пробы рекомендуется сдавать каждые полгода-год для выявления рецидива на ранних этапах и незамедлительного лечения.

Сдавать анализы необходимо регулярно на протяжении нескольких лет
Люди с подозрением на наличие злокачественного новообразования должны незамедлительно сделать анализ, дабы опровергнуть или подтвердить свои опасения на ранних этапах.
Также стоит сдать пробу, если имеются жалобы на:
- неудовлетворительное самочувствие без явных причин;
- болезненные ощущения в тазовой области;
- сбои в менструальном цикле;
- потеря массы;
- снижение аппетита.
Подведем итоги, кто все-таки должен пройти исследования на онкологические маркеры:
- люди, родственники которых имели раковые болезни;
- люди, которые перенесли терапию от онкозаболевания;
- люди, страдающие предраковыми заболеваниями;
- люди, работающие на вредных производствах либо находящиеся во вредной экологической обстановке;
- если вы заметили ни с чем не связанные симптомы.
Что представляет собой антиген
Онкомаркер HE4 – это показатель, благодаря которому есть возможность на ранних этапах определить опухоль яичника.
Один из самых высокочувствительных маркеров ‒ это онкомаркер HE4, что показывает наличие эпителиального рака яичника и имеет самую большую специфичность.
He4 – это кислый гикопротеин, имеющий отношение к верхним дыхательным путям и поджелудочной железе, но наиболее ‒ к органам половой системы. Именно этот маркер используют при проведении исследования на выявление онкологии яичников у женщин. Он используется исключительно для выявления онкозаболевания, потому как при наличии доброкачественных образований, а также других заболеваний, его уровень не повышается. Для более точного результата исследований совместно с маркером HE4 используют СА125, но сам он имеет отличные показатели чувствительности и специфичности.
Внимание! Особенность онкомаркера He4‒ это то, что его показатели имеют свойство увеличиваться исключительно при злокачественных образованиях. Но при этом его показатели возрастают на самых ранних этапах.
Важно, что данный маркер используется не только для определения болезни, но и для мониторинга результативности терапии. Женщины, проходящие лечение онкологии яичников, вынуждены систематически делать анализ, дабы контролировать результативность лечения. При отсутствии маркера можно сказать, что лечение выбрано верно, следствием чего может быть абсолютное выздоровление. Помимо этого, он помогает определить наличие метастаз или рецидивов.
Как сделать анализ на антиген
Существуют определенные рекомендации для сдачи анализов, чтобы они показали правильный результат.
- Данный анализ следует делать утром натощак.
- За 3 суток до сдачи не стоит употреблять лекарственные средства.
- Перед сдачей запрещается курить.
- Откажитесь от спиртного за пять суток до сдачи анализа.
- Необходимо перед анализом дать врачу информацию по поводу вашего менструального цикла.
При несоблюдении данных правил исследование может дать ложный результат. Также причиной неправдивого результата может быть некачественное оборудование либо наличие других заболеваний.
Расшифровка и норма показателей анализа
Результаты готовятся на протяжении двух дней после сдачи.
Кровь стоит сдать при появившихся болях в нижней области живота, таза, при сбоях менструального цикла, снижении аппетита.
Если показатели ниже нормы – это не критично, поводом для волнения является повышение показателей.
После получения результатов анализа на онкомаркер He4 расшифровка должна проводиться специалистом. Для расшифровки анализа врач учитывает все факторы, которые могли на него повлиять, ‒ менструальный цикл, гормональное состояние и другие.
Расшифровка и норма онкомаркера He4 ‒ показатели, которые помогают врачу определить вид дальнейшего лечения. Данный анализ является скрининговым тестом, он должен сдаваться несколько раз повторно для проверки результатов.
В крови у всех женщин обнаруживается онкомаркер He4, норма показателей которого зависит от возраста женщины.
- У молодых девушек в детородный период нормальный показатель не превышает 70 пмоль/л.
- Онкомаркер He4 – норма у женщин, у которых наступила менопауза, может увеличиться до 140 пмоль/л.
Именно по причине того, что меняются показатели на онкомаркеры He4, расшифровка должна проводиться высококвалифицированным специалистом, который примет во внимание все показатели и особенности женщины.
Внимание! В случае если анализ на онкомаркер HE4 показал превышающие норму результаты, это еще не означает, что имеется злокачественное новообразование. В таком случае врач назначает дополнительные обследования: рентген, УЗИ или МРТ.
При постановке диагноза врач не может брать во внимание только анализ крови ‒ он не является 100%-м показателем. Женщинам, у которых He4 онкомаркер норма превышает допустимые показатели, назначается множество дополнительных проб и диагностик. Только после комплексного обследования врач может точно поставить диагноз.
При расшифровке анализа у взрослых низкие показатели не берутся во внимание. Для определения наличия новообразований важны только повышенные показатели.
Если поставили диагноз

При любых болезненных симптомах нужно обратиться к специалисту
После того как женщина прошла все назначенные обследования, несколько раз сдала анализ на онкологические маркеры, врачи оценили динамику роста, и у них не осталось сомнений по поводу диагноза, они разрабатывают индивидуальный комплекс процедур. В первую очередь, в большинстве случаев назначается химиотерапия. Если рост онкомаркера He4 во время химиотерапии не прекращается и лечение не дает нужного эффекта, врачи назначают операцию и дальнейшую постоперационную терапию.
Если правильно назначено лечение, показатели онкомаркеров должны падать и достигнуть отметок нормы. Если показатели не пришли в норму, это может привести к проявлению рецидива. В таком случае врач должен назначить альтернативные методы лечения.
Важно! При начальных стадиях рака яичника врачи дают больше 90% вероятности положительного результата лечения. Но даже если лечение дало позитивный результат, женщина должна периодически сдавать анализы, для того чтобы в случае рецидива определить его на начальном этапе.Если вы сдали кровь на онкомаркер He4 и он показал повышенный результат, не стоит впадать в панику ‒ это совсем не значит, что у вас рак. Как показывает практика, любой анализ, в том числе на онкологические маркеры, из-за наличия тех или иных факторов может дать ложный результат. В ошибке могут быть виновны как неисправное оборудование и ошибка лаборанта, так и несоблюдение правил сдачи анализа и сторонние заболевания.
Среди сторонних заболеваний, из-за которых может повышаться рост маркеров, рассматривают такие:
- воспалительные процессы;
- эндометриоз;
- заболевания почек;
- фибромы и миомы матки и др.
У многих женщин возникает вопрос, увеличивается ли онкомаркер He4 при кисте? По наблюдениям врачей, действительно, при кисте показатели могут увеличиваться.
Если после сдачи всех проб и прохождения обследований вам все-таки поставили диагноз, стоит придерживаться рекомендаций врача ‒ это приведет к положительному результату. Рак ‒ не приговор, особенно на начальных стадиях.
Онкомаркер He4: расшифровка, норма, проведение
Анализ на онкомаркер HE4 проводится с целью лабораторного исследования на наличие специфического белка в крови. Этот метод диагностики способен подтвердить или опровергнуть диагноз рака яичников, матки и маточных труб у женщин. Злокачественные процессы в легких также могут привести к повышению этого показателя. По сравнению со сложными инструментальными методами обследования анализ имеет меньше противопоказаний и побочных эффектов и его можно применять неограниченное количество раз.
Описание анализа
Онкомаркер НЕ4 в норме ингибирует фермент протеиназу и его концентрация в крови незначительная. Он синтезируется эпителиальными клетками внутренних половых органов и легкими. При развитии злокачественного процесса количество НЕ4 возрастает в несколько десятков раз, поскольку в пораженном органе происходит неконтролируемое деление клеток. Это лежит в основе лабораторной диагностики рака яичников, матки, труб и легких.
Вернуться к оглавлениюВ журнале «Здоровье женщины» опубликованы результаты исследований, подтверждающие, что комплексное определение НЕ4 и СА-125 повышают информативность исследования.
Когда назначают анализ на определение?
Анализ НЕ 4 показан в таких случаях:
 Сдача анализов на определение онкомаркеров делается с профилактической целью, а также в случае рецидива заболевания.
Сдача анализов на определение онкомаркеров делается с профилактической целью, а также в случае рецидива заболевания.- для диагностики рака определенных органов;
- с профилактической целью;
- при появлении признаков развития злокачественного процесса;
- мониторинг эффективности противоракового лечения;
- выявление рецидива опухоли;
- дифференциальная диагностика доброкачественного образования со злокачественным;
- определение прогрессирования карциномы.
Как готовиться?
Онкомаркеры НЕ 4 являются очень чувствительными веществами к факторам внешней и внутренней среды. Чтобы свести к минимуму ошибки в результатах, рекомендуется придерживаться определенных правил. Они включают следующие предписания:
- За 3—4 дня до исследования исследуемый должен следовать диете: не употреблять жирную, жареную, копченую пищу, легкоусвояемые углеводы, спиртные напитки.
- Ужин должен быть не менее, чем за 8 часов до сдачи, поскольку анализ выполняется натощак. Можно лишь пить воду без газа.
- Необходимо отказаться от курения за 3—4 часа до диагностического мероприятия.
- За неделю нужно остановить прием препаратов, влияющий на гормональный фон или работу органов, синтезирующих этот маркер. Если это способно повлиять на состояние пациента, необходимо сообщить об этом врачу.
- За сутки до сдачи крови нужно отказаться от половых контактов.
- Не заниматься тяжелой физической работой за 24 часа.
- Запрещается проводить обследование в период менструации. Рекомендуется исследоваться на 12—13 день цикла. Онкомаркер эпителиального рака яичников HE4 может показать ложный положительный результат, если проигнорировать это правило.
Проведение
 Процедура забора крови проводится в первой половине дня, при этом до ее осуществления нельзя принимать пищу.
Процедура забора крови проводится в первой половине дня, при этом до ее осуществления нельзя принимать пищу.Анализ крови на специфический опухолевый маркер органов малого таза, легких проводится в первой половине дня натощак. Для этого берется венозная кровь, которую помещают в стерильную пробирку и отправляют в лабораторию. С помощью специальных реактивов выделяют специфический белок и определяют его концентрацию в 1 мл исследуемого материала, переводя полученное значение в литры для удобства вычисления. Длительность проведения анализа на этот онкомаркер составляет 2—3 дня.
Вернуться к оглавлениюРасшифровка
Какая норма?
Онкологический маркер НЕ4 у здоровых людей составляет:
| Категория населения | Показатели (пмоль/л) |
|---|---|
| Девушки и женщины до периода менопаузы | До 60 |
| Женщины в период климакса | До 140 |
Такой результат показывает, что исследуемое вещество выделяется в пограничных количествах и атипического деления клеток не наблюдается. Но стоит понимать, что на первых стадиях развития злокачественного процесса уровень онкологического маркера НЕ4 может приближаться к границе нормы, но не превышать ее. Это может привести к неправильной интерпретации результатов анализа, а это чревато дальнейшим развитием рака.
Расшифровка нормального результата после проведенного хирургического вмешательства по тотальной или частичной резекции означает благоприятный исход операции и удаление всех раковых очагов. Эпителиальные клетки быстро восстанавливаются, поэтому уже через 2—3 недели показатели должны нормализоваться. Нормальные онкомаркеры после облучения или химиотерапии также свидетельствует о результативности проведенного лечения.
Вернуться к оглавлениюОтклонение от нормы
 Если результаты, полученные в ходе исследования, отклоняются от нормы, это свидетельствует о развитии злокачественного процесса.
Если результаты, полученные в ходе исследования, отклоняются от нормы, это свидетельствует о развитии злокачественного процесса.Превышение допустимых границ говорит о развитии злокачественного процесса в органах, где НЕ4 может синтезироваться — в яичнике, матке, маточных трубах, легких. Если значения отклоняются незначительно, можно диагностировать ранние стадии рака. Выявление опухолевого процесса на 1—2 этапах развития положительно сказывается на дальнейшем лечении.
3—4 стадии опухоли, распространение раковых клеток в соседние органы, появление множества метастазов выявляются превышением специфических онкомаркеров в несколько раз. Получение такого уровня НЕ4 имеет неблагоприятный прогноз. Если после операции, химии или лучевой терапии уровень онкомаркера остается высоким, это обозначает, что в организме присутствуют онкологические клетки. Они или не были удалены, или имеют настолько небольшие размеры, что выявить их локализацию невозможно.
Вернуться к оглавлениюДля подтверждения или опровержения диагноза после лабораторных методов исследования диагносты применяют высокотехнологические инструментальные методики.
Причины ошибочных результатов
НЕ4 может повышаться при доброкачественных новообразованиях органов, кистозных изменениях, воспалительных процессах, муковисцидозе, хронической недостаточности почек. Эти состояния характеризуются изменениями результатов, поэтому для чистоты исследования рекомендуется сдавать кровь после их нормализации или следует оповестить об этом врача. Важно помнить, что для подтверждения диагноза можно использовать дополнительные методы диагностики.
Расшифровка онкомаркера НЕ4 — норма у женщин, что показывает, зачем нужен
Рак яичников занимает второе место по распространенности среди всех онкологических заболеваний женской половой сферы. Это делает актуальным раннее выявление болезни, и в этом оказывают помощь специальные маркеры: повышение их значений у женщин помогает определить наличие опухоли.
Онкомаркер НЕ4: новый стандарт в выявлении рака
В течение многих лет основное внимание уделялось онкомаркеру СА 125: повышен он или понижен, означало для женщины плохие или хорошие новости. Так, рост значений этого маркера свидетельствовал о рецидиве рака, а снижение — об эффективности проведенного лечения и ремиссии или полной победе над онкологией.
Правильную расшифровку онкомаркера НЕ4 может провести только врачНо основной проблемой было то, что при диагностике рака на ранних стадиях этот анализ был непригоден. Он мог давать ложно-положительные результаты при наличии неонкологических заболеваний яичников: кист и других доброкачественных новообразований. Вследствие этого выявление рака яичников в большинстве случаев происходило на поздних стадиях, что показывает низкую чувствительность теста и его недостаточную эффективность.
На помощь пришел белок НЕ4. Концентрация этого вещества резко возрастает уже на первой стадии злокачественного процесса в яичниках, и при этом его значения остаются в норме при наличии доброкачественных опухолей. Благодаря тесту с определением этого онкомаркера стало возможным выявление злокачественных процессов в яичниках на том этапе, когда они еще не проявляются клиническими симптомами и лучше всего поддаются терапии.
Особенности проведения анализа
Для исследования необходима венозная кровь. Точность результатов во многом зависит от правильной подготовки к сдаче анализа:
- Забор крови должен происходить в первой половине дня, предпочтительно в утренние часы.
- Перед сдачей крови нельзя завтракать или употреблять любые напитки, кроме воды.
- За 12-24 часа до сдачи крови следует полностью отказаться от курения, употребления алкоголя и исключить повышенные физические и эмоциональные нагрузки.
Кроме того, важно отказаться от приема любых лекарственных препаратов за 7-10 дней до забора крови. Если это по каким-то причинам невозможно — например, вы проходите курс медикаментозного лечения, который нельзя прерывать, — обязательно сообщите своему врачу. Следует перечислить названия всех принимаемых препаратов и их дозировку. Такая информация позволит скорректировать результаты анализа с учетом новых обстоятельств и избежать неправильной интерпретации теста.
Что показывает результат анализа, зависит от нескольких факторовЛюбые другие диагностические мероприятия должны назначаться после сдачи анализа, так как они потенциально способны исказить картину крови, что даст врачу ложные сведения.
Расшифровка результатов
При расшифровке анализа на онкомаркер НЕ4 используются референсные значения. Они означают средние показатели, выявленные у здоровых людей, которые проходили такое обследование.
Норма у женщин связана с возрастом пациентки и выглядит следующим образом:
- младше 40 лет — ниже 60,5 пмоль/л;
- 40-49 лет — ниже 76,2 пмоль/л;
- 50-59 лет — ниже 74,3 пмоль/л;
- 60-69 лет — ниже 82,9 пмоль/л;
- от 70 лет и старше — до 104,0 пмоль/л.
Превышение этих значений с высокой степенью вероятности указывает на злокачественные процессы в яичниках и/или эндометриальном слое матки. Но наибольшую диагностическую точность демонстрирует комбинация анализов на онкомаркеры НЕ4, СА125 и ROMA.
Кроме того, важно знать, что некоторые обстоятельства могут искусственно завышать уровень НЕ4 или изменять формулу, вследствие чего достоверность результатов становится сомнительной. К таким факторам относятся прием оральных контрацептивов, беременность, перенесенное хирургическое вмешательство и пр. Поэтому при повышении уровня НЕ4 может потребоваться котрольное исследование.
Показания к анализу на онкомаркер НЕ4
Пройти это исследование рекомендуется при таких заболеваниях и состояниях:
- выявленное новообразование в органах малого таза и необходимость определить его характер;
- контроль над доброкачественными опухолями матки и яичников с целью раннего выявления их озлокачествления;
- уже диагностированное онкологическое заболевание молочных желез: рак яичников может развиваться параллельно, и важно выявить его вовремя.
- наследственная предрасположенность к онкологическим процессам;
- вредные условия работы, контакт с канцерогенными веществами и другие обстоятельства, переводящие женщину в группу повышенного риска по развитию рака яичников.
На усмотрение врача этот анализ может назначать и по другим показаниям, если специалист считает такое тестирование целесообразным. Но даже если концентрация гена НЕ4 повышена, не следует воспринимать это как приговор. На ранних стадиях онкологические заболевания успешно поддаются лечению, что практически гарантирует вам долгую и счастливую жизнь.
Смотрите далее: норма СА 125 онкомаркера у женщин
Онкомаркер HE4: расшифровка и норма показателя
Онкология – опасная проблема. Каждый год из-за этой болезни умирает много людей. Четвертой известной причиной смертности является рак яичников. Причем смертность самая высокая в экономически развитых областях. Рак можно излечить, если выявить его на ранних этапах развития. В этом поможет онкомаркер эпителиального рака яичников HE4. Какая норма этого показателя, будет описано ниже.
О данном виде рака
Признаки болезни часто распознать довольно сложно, так как они напрямую связаны с опухолевидным образованием в придатках и поэтому нечеткие. По информации, предоставленной Международным агентством по изучению рака, пятилетняя выживаемость заболевших раком яичников на последних этапах примерно 46 %. Но если выявлять болезнь на начальных этапах, то выживаемость увеличится до 94 %. Современные исследования дают людям шанс на борьбу с этим заболеванием. Выявляют начало злокачественного процесса на начальных этапах при изучении онкомаркеров. С повышением их уровня медики бьют тревогу. В данной статье рассмотрим онкомаркер HE4.
Определение онкомаркера
В человеческом организме имеются вещества в малом объеме, которые называются онкомаркеры. Они участвуют в разных физиологических и биохимических образованиях и не опасны в количественной норме. Все будет по-другому, если их объем начнет увеличиваться. Это свидетельствует о вероятности злокачественного образования. К примеру, чтобы определить рак яичников, чаще всего применяют онкомаркер СА-125. Но позднее выяснилось, что онкомаркер HE4 более точно определяет онкологию.
Это серозный белок, блокирующий фермент протеиназ, в переводе значится «белок человека – четыре придатка». В необходимом небольшом количестве он находится в яичках и функционирует при выработке спермы. Также он есть в дыхательной структуре, маточной трубе и в слизистых оболочках. Но как именно он функционирует и как воздействует на отдельные пепсины, до сих пор не понятно.
Показания к назначению анализа
В небольшом объеме онкомаркер HE4 может быть у любой женщины. Объем его увеличивается при таких заболеваниях как:
— Рак яичников.
— Онкология эндометрия.
— Рак молочных желез.
— Рак легких.
Преимущества HE4
При этом онкомаркер HE4 означает уже злокачественный процесс. Его нельзя определить при доброкачественном процессе или воспалении яичников. Это говорит о том, насколько HE4 эффективен.
Его предшественник, онкомаркер СА-125, также направлен на распознавание рака, но у него небольшая точность определения. То есть объем СА-125 становится больше на последних стадиях при правильной диагностике. А объем HE4 увеличивается примерно за три года до точного определения болезни.
Соответственно, при помощи исследования рак можно выявить на раннем этапе, пока еще не проявились симптомы. Несмотря на это, расшифровка онкомаркера HE4 не используется для исследования образований в области яичников. Он не может распознавать герминогенную и мукоидную форму рака.
HE4 применяют для наблюдения уже начавших лечение женщин. Соответственно, если этот анализ при лечении перестанут делать, значит используемая терапия успешно проходит.
По количеству данного онкомаркера можно определить процесс образования вторичных очагов опухолевого роста в результате расхождения клеток из изначального очага в соседние ткани или его возобновления.
Сдача анализов на HE4
Причинами большой смертности из-за онкологических заболеваний является определение болезни на последних этапах ее развития. При помощи анализа на HE4 можно на раннем сроке определить рак, сокращая тем самым вероятность смерти. Онкомаркер можно выявить в крови, взятой из вены. Для правильной сдачи анализа необходимо:
- Сдать кровь строго натощак или через четыре-пять часов после еды. Можно выпить воды, но не рекомендуется кофе или соки.
- По возможности за несколько дней (дня за 3-4) до сдачи анализа не принимать никаких лекарств.
- Перед сдачей анализа не пить и не курить.
- Начавшие лечение женщины сдают анализ каждые три месяца. В дальнейшем хватит одного – двух раз для проверки.
В некоторых случаях обследование назначают детям. Им необходимо пить кипяченую воду в течение получаса до сдачи анализа. Средний объем выпитой воды должен составлять 150-200 мл.
Женщинам сдавать анализ следует, если появились боли в районе таза, нарушен менструальный цикл, понижен аппетит.
При исследовании важно выявить высокий уровень онкомаркера.
Онкомаркер HE4: расшифровка
Норма зависит от пола, возраста пациента. После того, как кровь на анализ сдана, необходимо ждать. Результат будет готов уже спустя пару дней.
Объем HE4 распознают при помощи специального хемолюминесцентного исследования.
Суть состоит в следующем: происходит определенная реакция меченых соединений и искомого 4-го белка. Затем происходит смена всех присущих им свойств. Катализатор запускает реакцию свечения. Вот теперь при помощи инструментальных методов определяют и подсчитывают уровень онкомаркера.
Нормы мужчин и женщин
Нормальный объем белка-4 у женщин в период пременопаузы не больше 70 Пмоль/л, а после менопаузы — чуть меньше или равняется 140 Пмоль/л. Чем больше эти показания, тем больше вероятность онкологической болезни яичников.
Но стоит обязательно знать, что есть возрастные нормы, то есть в зависимости от возраста данные изменяются. Поэтому лучше всю информацию узнать у своего врача. Вот что показывает онкомаркер HE4.
Имеется следующий интересный факт. Когда проводилась расшифровка HE4, то получили такие данные: третья часть женской половины населения имеет повышенные показатели данного онкомаркера, а вот СА-125 чаще всего остается в допустимой норме.
Какова же норма этого показателя у мужчин? Она находится на уровне 4 нг/мл и ниже. Следует насторожиться в том случае, если обнаружатся очень высокие показатели. Это может говорить о развитии в организме опасной онкологической болезни.
Происходит изменение нормы с возрастом. После сорока лет у мужчин норма составит 2-2,5 нг/мл, после шестидесяти лет – 4,5-6,5 нг/мл.
Статистические данные говорят о том, что все больше мужчин разных возрастов обращаются за медицинской помощью. У них повышены онкомаркеры в крови и имеется патология предстательной железы.
Ошибка анализа
Стоит учитывать, что сам анализ на онкомаркер не является основанием для подтверждения или опровержения онкологии. Правильнее все же HE4 применять и с иными анализами. Лучше всего исследовать его вместе с СА-125. А также проводить разнообразные виды диагностики, как лабораторные, так и инструментальные.
Иногда высокое значение онкомаркеров HE4 вызвано не злокачественным процессом. У анализа будет ложный положительный результат при:
- наличии системного наследственного заболевания, которое объясняется изменением гена трансмембранного регулятора;
- наличии других воспалений мочеполовой структуры;
- хронической почечной недостаточности;
- кисте яичника;
- миоме.
Как распознать симптомы рака?
При малейших нарушениях в организме необходимо обращаться к врачу. Он назначит анализ на онкомаркер эпителиального рака яичников HE4. Норму или отклонение от нее выявят быстро. Первое время симптомы могут полностью отсутствовать. Но в любом случае анализ стоит провести при:
- нарушениях в яичниках и проблемах с менструациями у женщин;
- остром болевом синдроме в тазовой области;
- ухудшении общего самочувствия со сниженным аппетитом;
- резкой и беспричинной утрате веса;
- апатии.
При подтверждении диагноза не нужно поддаваться панике, ведь рак сейчас успешно лечится. Конечно, это испытание, но с ним можно справиться и выйти из борьбы победителем.
Самолечение недопустимо, полагаться стоит только на рекомендации специалиста.
Потребуется терпение и силы, ведь терапия – это тяжелый труд, имеющий длительный и неприятный характер.
Заключение
Ошибочный результат может быть, если опухоль не вырабатывает HE4 или он имеется в недостаточном количестве для определения.
Несмотря на то, что покажет анализ, не стоит раньше времени расстраиваться и устанавливать для себя какой-либо диагноз. Медицинские специалисты могут определить заболевание и прописать курс лечения, но только после полного обследования.
тестов на онкомаркеры | Cancer.Net
Онкомаркер — это вещество, обнаруженное в крови, моче или тканях тела. Термин «опухолевые маркеры» может относиться к белкам, которые вырабатываются как здоровыми клетками, так и раковыми клетками в организме. Это также может относиться к мутациям, изменениям или паттернам в ДНК опухоли. Онкомаркеры также называют биомаркерами.
Врачи могут использовать тесты на онкомаркеры, чтобы узнать, есть ли у вас рак. Эти тесты также могут помочь врачам узнать больше о вашем раке и помочь спланировать лечение.
Как используются тесты на онкомаркеры?
Высокий уровень опухолевых маркеров может быть признаком рака. Наряду с другими тестами, тесты на онкомаркеры могут помочь врачам диагностировать определенные типы рака и спланировать лечение. Чаще всего используются тесты на онкомаркеры:
Узнайте, есть ли у человека рак. Более высокие уровни опухолевых маркеров могут указывать на определенный тип рака. Тест на онкомаркеры может использоваться как часть вашего первоначального диагноза.
Руководство по лечебным решениям. Некоторые тесты на онкомаркеры говорят врачам, следует ли им проводить химиотерапию или иммунотерапию. Другие помогают врачам выбрать наиболее эффективные препараты.
Следите за ходом лечения. Изменения уровня опухолевых маркеров могут показать, насколько эффективно лечение.
Предскажите шанс выздоровления. Онкомаркеры могут помочь врачам предсказать поведение рака и реакцию на лечение. Они также могут предсказать ваши шансы на выздоровление.
Предскажите или проследите за повторением . Рецидив — это рецидив рака после лечения. Тесты на онкомаркеры могут помочь предсказать, насколько это вероятно. Вот почему эти тесты могут быть частью вашего ухода после окончания лечения. Они могут помочь обнаружить рецидив раньше, чем другие тесты.
Тесты на онкомаркеры также могут использоваться для выявления рака у людей с высоким риском заболевания. Или вы можете пройти эти тесты, чтобы узнать больше о раке, когда врачи впервые его обнаружат.
Пределы тестов на онкомаркеры
Тесты на онкомаркеры не идеальны.Они часто неспецифичны для рака и могут быть недостаточно чувствительными, чтобы выявить рецидив рака. Одного наличия онкомаркеров недостаточно для диагностики рака. Возможно, вам потребуются другие тесты, чтобы узнать больше о возможном раке или рецидиве. Некоторые ограничения для тестов на онкомаркеры перечислены ниже.
Состояние или заболевание, не являющееся раком, может повышать уровень онкомаркеров.
У людей без рака может быть высокий уровень онкомаркеров.
Уровни маркеров опухолей могут изменяться со временем. Тесты могут не каждый раз давать одинаковый результат.
Уровни опухолевых маркеров могут не повышаться, пока рак не ухудшится. Это не помогает обнаружить рак на ранней стадии или у людей с высоким риском. Это также не помогает найти повторение.
Некоторые виды рака не вырабатывают опухолевые маркеры, обнаруженные в крови. А у некоторых видов рака нет известных онкомаркеров.
Уровень ваших онкомаркеров может не повыситься, даже если ваш тип рака обычно вырабатывает онкомаркеры.
Как проводится анализ на онкомаркеры?
Член вашей медицинской бригады возьмет образец вашей крови или мочи. Образец отправляется в лабораторию для тестирования. Некоторые тесты необходимо делать более одного раза, потому что уровни онкомаркеров могут регулярно меняться.
Вам также понадобятся другие тесты, чтобы найти рак и пройти курс лечения. Это связано с тем, что результаты по опухолевым маркерам имеют ограничения (см. Выше) и иногда неверны. Они могут:
Показать, что опухоль присутствует или растет, когда ее нет.
Покажите, что опухоли нет, когда она есть, или покажите, что лечение работает, когда ее нет.
Ни один тест не идеален. Поэтому ваш врач, вероятно, назначит несколько видов анализов, чтобы найти ответы.
Тесты на онкомаркеры и специфические виды рака
Врачи используют разные тесты на онкомаркеры для разных видов рака. Однако у многих видов рака еще нет онкомаркеров, которые могли бы помочь в лечении.
Спросите у своего медицинского работника, нужно ли вам пройти тестирование на онкомаркеры.Вы также можете найти информацию о онкомаркерах в разделах, посвященных различным видам рака, на сайте Cancer.Net.
Вопросы, которые следует задать бригаде здравоохранения
Вы можете задать эти вопросы своей медицинской бригаде.
Как вы думаете, мне нужны тесты на онкомаркеры? Какие и почему?
Вы уже искали онкомаркеры? Какие?
Как проходят эти тесты? Как часто я должен их принимать?
Кто может объяснить мне результаты?
Если у меня аномальный уровень онкомаркера, что это означает? Как этот результат может повлиять на мой план лечения?
Потребуются ли мне тесты на онкомаркеры после окончания лечения рака?
Где я могу узнать больше о онкомаркерах и тестировании?
Связанные ресурсы
Что такое тесты на онкомаркеры для выявления рака? 8 вещей, которые вам нужно знать
Общие сведения о целевом лечении
Лечение рецидива рака
Дополнительная информация
Лабораторные тесты онлайн: онкомаркеры
Национальный институт рака: онкомаркеры
.Обеспечивает ли алгоритм риска злокачественного новообразования яичников лучшую диагностическую эффективность, чем HE4 и CA125, в дооперационной дифференциации опухолей придатков у польских женщин?
Цель . В этом исследовании сравнивали диагностическую эффективность алгоритма риска злокачественных новообразований яичников (ROMA) и HE4 и CA125 для дооперационной дифференциации опухолей придатков. Материалы и методы . В проспективное исследование были включены 302 пациента, поступивших на хирургическое лечение по поводу опухолей придатков.ROMA рассчитывался в зависимости от CA125, HE4 и статуса менопаузы. Результаты . У пятидесяти пациентов диагностировано злокачественное заболевание. При дифференциации злокачественных опухолей придатков от доброкачественных, площадь под кривой (AUC) была выше для ROMA и HE4, чем для CA125, как в подгруппах в пременопаузе, так и в постменопаузе. При дифференцировке злокачественных новообразований стадии I FIGO и эпителиального рака яичников от доброкачественных патологий AUC HE4 и ROMA была выше, чем у CA125.ROMA показал себя значительно лучше, чем CA125, в дифференцировке всех злокачественных новообразований и дифференцировке злокачественных новообразований стадии I по FIGO от незлокачественных патологий (и, соответственно). Существенных различий между ROMA и онкомаркерами для любых других вариантов не было. Выводы . ROMA более полезен, чем CA125, для дифференциации злокачественных (включая стадию I FIGO) от доброкачественных опухолей придатков. Он также полезен, как HE4 и CA125, для дифференциации эпителиального рака яичников от доброкачественных опухолей придатков.
1. Введение
Опухоли придатков представляют собой широкий спектр заболеваний, которые могут поражать яичники и / или маточные трубы. Опухоли соседних структур, например миома матки, могут имитировать опухоли придатков. Опухоли яичников могут быть функциональными, доброкачественными или злокачественными. Злокачественные новообразования яичников могут быть первичными или вторичными, причем первичные опухоли происходят из эпителиальных клеток, половых тяжей или зародышевых клеток [1, 2]. Неоднородный характер придаточных образований является одной из причин предоперационных трудностей при этих опухолях [3, 4].Рак яичников (ОК) занимает пятое место среди злокачественных новообразований среди женщин (5% всех раковых заболеваний) и четвертое место среди причин смертности от злокачественных новообразований в Польше [5].
Онкомаркер CA125, первоначально описанный Bast et al., Широко используется для рутинной диагностики образований придатков [6]. Он также используется для мониторинга реакции на лечение, последующего наблюдения за заболеванием и выявления рецидива заболевания [7]. Этот опухолевый маркер может быть повышен при некоторых гинекологических и негинекологических заболеваниях, что снижает диагностическую точность выявления рака яичников [8–11].
Эндометриоз является основной причиной повышения CA125 [12]. В 1991 году Kirchoff et al. идентифицировали основную кДНК, специфичную для придатка яичка человека, которая кодирует белок с гомологией последовательности с ингибиторами внеклеточной протеиназы. Нозерн-блоттинг и гибридизация транскриптов in situ специфически локализовали мРНК HE4 (продукт гена придатка яичка человека) в дистальном участке эпителиальных клеток в протоке придатка яичка [13]. Последующие исследования показали, что HE4 повышен в 90% случаев серозного рака яичников и в большинстве случаев эндометриоидного и светлоклеточного рака, тогда как муцинозные и половые опухоли редко экспрессируют HE4 [14].Маркер HE4 значительно повышен при раке яичников и эндометрия, но не при эндометриозе [12]; кроме того, он реже повышается по сравнению с СА125 у пациентов с доброкачественными заболеваниями, особенно у пациентов в пременопаузе [15]. HE4 может быть увеличен при негинекологических злокачественных новообразованиях [16].
Было создано несколько различных математических моделей и систем оценки, основанных на клинических характеристиках, результатах ультразвукового исследования и / или уровне маркеров опухоли в сыворотке крови, направленных на повышение диагностической эффективности каждого отдельного параметра [3].Одной из таких моделей является алгоритм риска злокачественных новообразований яичников (ROMA), созданный Муром и соавт. ROMA объединяет онкомаркеры CA125 и HE4 с использованием двух формул с учетом менопаузального статуса каждой пациентки. ROMA может классифицировать пациентов как имеющих низкий и высокий риск развития эпителиального рака яичников (EOC), и 93,8% случаев в исследовании Moore et al. Были правильно отнесены к категории высокого риска [17]. В 2010 году Мур и др. пришли к выводу, что ROMA достиг более высокой чувствительности, чем индекс риска злокачественности (RMI) для выявления EOC в проспективном многоцентровом исследовании с участием 457 пациентов.Авторы предположили, что исследования радиологической визуализации без центрального обзора могут более точно отражать реальную клиническую практику. Напротив, уровни опухолевых маркеров в сыворотке дают объективные результаты, которые показали большую полезность, большую согласованность и воспроизводимость между центрами и регионами [18]. Анализ Nolen et al. подтвердили превосходство оценки комбинации HE4 / CA125 для диагностики ОК [19]. В 2011 году использование ROMA было проверено на популяции женщин с низким уровнем риска с опухолями придатков, которые обратились к терапевту.Несмотря на низкую частоту злокачественных новообразований в этом исследовании (15% всех случаев и 10% для EOC), ROMA разделил пациентов на группы высокого и низкого риска с чувствительностью 93,8% и специфичностью 74,9% для прогнозирования ОК [20].
Мета-анализ Li et al. в 2012 году проанализировали эффективность HE4, CA125 и ROMA в 11 исследованиях и данные 7792 тестов. Авторы пришли к выводу, что HE4 не лучше, чем CA125 для предсказания EOC или OC, тогда как ROMA был многообещающим предсказателем EOC, который мог заменить CA125.Общие оценки ROMA для прогноза EOC были следующими: чувствительность 89% (95% ДИ: 84–93%), специфичность 83% (95% ДИ: 77–88%) и AUC 0,93 ( 95% ДИ: 0,90–0,95). Однако авторы пришли к выводу, что использование ROMA требует дальнейшей оценки [21].
Мета-анализ Dayyani et al. в 2016 году проанализировали пять исследований с участием 1975 пациентов с опухолями придатков. На основании данных AUC (95% доверительный интервал) для всех пациентов авторы пришли к выводу, что ROMA (0.921 [0,855–0,960]) продемонстрировал более высокую диагностическую эффективность, чем CA125 (0,883 [0,771–0,950]) и HE4 (0,899 [0,835–0,943]). Аналогичные результаты были показаны в каждой из популяций подгрупп, в частности, у пациенток в постменопаузе и у пациентов с ранним ОК. В метаанализ использовались строгие критерии отбора для включения [22]. В нескольких исследованиях сравнивали ROMA с CA125 и HE4 с противоречивыми результатами, которые можно отнести к анализируемым подгруппам, изученным популяциям, онкологическому профилю исследовательского центра, предельным уровням диагностических тестов и выбору определенных патологий яичников [23–26] .
Оптимальный диагноз злокачественного новообразования важен, так как он облегчает отбор пациентов со злокачественными новообразованиями, которым требуется срочное направление в гинекологические онкологические центры, и, следовательно, повышает общую выживаемость пациентов с раком яичников [27].
Целью исследования было сравнение диагностической эффективности ROMA с онкомаркерами HE4 и CA125 в выбранной польской популяции. Сравнение проводилось для всех пациенток, а также для подгрупп в пременопаузе и постменопаузе.Кроме того, диагностическая ценность ROMA сравнивалась с диагностической ценностью опухолевых маркеров для дифференциации злокачественной опухоли придатков I стадии согласно FIGO и доброкачественных опухолей придатков и дифференциации EOC от других доброкачественных опухолей придатков.
2. Материалы и методы
Это было проспективное исследование 302 пациентов с опухолями придатков, направленных в нашу клинику для операции в период с октября 2012 г. по апрель 2015 г. Пациенты были направлены врачами с разным уровнем опыта.Направление пациентов рассматривалось в амбулаторных отделениях согласно местным рекомендациям этих отделений в зависимости от анамнеза, клинического обследования, онкомаркеров и ультразвукового исследования. Были использованы следующие критерии включения: возраст старше 18 лет, измерение сывороточной концентрации онкомаркеров CA125 и HE4 менее чем за пять дней до хирургического вмешательства, гистопатологические результаты для поражения придатков и получение согласия. Критерии исключения включали беременность, почечные заболевания, злокачественный анамнез, химиотерапию и / или лучевую терапию, миомы> 5 см и отсутствие гистологической оценки опухоли придатков.Уровни HE4 и CA125 в сыворотке измеряли для каждого пациента одновременно с помощью одного и того же устройства (Cobas 8000-e602) с использованием электрохемилюминесцентного иммуноанализа. Две формулы логистической регрессии, описанные Moore et al. были использованы для расчета ROMA. Эти формулы включают натуральный логарифм (ln) значений CA125 и HE4. Индекс прогноза (PI) рассчитывался для подгрупп в пременопаузе и постменопаузе. Для подгруппы пременопаузы использовалась следующая формула: индекс прогноза.Формула для подгруппы постменопаузы была следующей: индекс прогноза. Следующая формула была применена для расчета риска злокачественного новообразования на основе ROMA (%): [17]. Пороговый уровень, рекомендованный производителем для CA125, составлял 35 Ед / мл, а пороговый уровень для HE4 составлял 70 и 140 пмоль / л для пациентов в пременопаузе и постменопаузе, соответственно. Пороговые уровни ROMA для пациентов с высоким риском составляли 11,4% и 29,9% для пациентов в пременопаузе и постменопаузе, соответственно. Окончательное решение об операции принимали индивидуально, по крайней мере, два гинеколога в зависимости от классического индекса риска злокачественности, уровней онкомаркеров и субъективной оценки опухолей придатков с учетом предпочтений пациентки.Окончательный диагноз придаточного образования был установлен при гистопатологическом исследовании придаточного образования. Пограничные опухоли при статистическом анализе считались злокачественными. Злокачественные новообразования были определены в соответствии с рекомендациями Международной федерации гинекологии и акушерства (FIGO). Менопауза определялась как отсутствие менструации не менее одного года [17]. Описательный анализ проводился для пациентов с различной патологией придатков. Тест Манна – Уитни U использовался для оценки статистической разницы между средними уровнями HE4 и CA125 в сыворотке.Чувствительность, специфичность, положительные и отрицательные прогностические значения, а также точность онкомаркеров и ROMA были рассчитаны для различения различных патологий придатков у разных групп пациентов. Область рабочих характеристик приемника под кривой (ROC-AUC) строилась для каждого диагностического теста. AUC этих тестов сравнивали друг с другом с использованием методов Хэнли и МакНила. Значение менее 0,05 считалось статистически значимым. Протокол исследования был одобрен местным этическим комитетом (№ KB / 192/2012).
3. Результаты
Всего в исследование были включены 302 пациента. Возраст пациентов составлял 18–85 лет, средний возраст — 48,7 года и стандартное отклонение (SD) — 16,79 года. Пациенты в пременопаузе составили большинство ([62,3%]), и только 114 (37,7%) пациенток находились в постменопаузе. При итоговом гистопатологическом исследовании выявлено 252 (83,4%) незлокачественных и 50 (16,6%) злокачественных патологий придатков. Подавляющее большинство ([96%]) злокачественных опухолей имеют яичниковое происхождение; два были злокачественными новообразованиями маточных труб.Число пациенток с каждой стадией злокачественной патологии яичников по FIGO было следующим: стадия IA — 9; IC, 6; IIA, 4; IIC, 1; IIIA, 1; IIIB, 2; IIIC, 24; и IVB, 1. Большинство случаев злокачественных новообразований яичников имели эпителиальное происхождение (). Злокачественные новообразования маточных труб включали один случай стадии IC и один случай IIIA. Распределение окончательных гистологических диагнозов придаточных образований представлено в таблице 1.
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Сывороточный уровень HE4 и CA125 среди всей группы, подгруппы в пременопаузе и подгруппы в постменопаузе представлен в таблице 2.Тест Mann-Whitney U показал, что оба онкомаркера показали значительно более высокие уровни в сыворотке крови у пациентов со злокачественными образованиями придатков.
| |||||||||||||||||||||||||||||||||||||||||||||||
Чувствительность, специфичность, положительные и отрицательные прогностические значения и точность HE4, CA125 и ROMA с учетом менопаузального статуса представлены в таблице 3. Диагностическая эффективность этих тестов для дифференциации злокачественных опухолей придатков FIGO I стадии и EOC от доброкачественных опухолей придатков представлена в таблице 4.
| |||||||||||||||||||||||||||||||
Клинически значимое использование маркеров опухоли крови в онкологии
До появления современных методов визуализации и недавних разработок в области молекулярной диагностики онкомаркеры (ТМ) были одними из немногих доступных диагностических инструментов для ведения онкологических больных. Легко получаемые из образцов сыворотки или плазмы, ТМ минимально инвазивны и удобны, а связанные с этим затраты невысоки. Традиционно использовались одиночные TM, но они подверглись тщательной проверке из-за их низкой чувствительности и специфичности при использовании, например, в условиях скрининга.Однако недавние исследования показали превосходную производительность при использовании комбинации нескольких TM в качестве панели для оценки или как часть проверенных алгоритмов, которые также включают другие клинические факторы. Кроме того, были обнаружены новые TM, которые имеют повышенный профиль чувствительности и специфичности для определенных злокачественных новообразований. Цель этого обзора — предоставить краткий обзор надлежащего использования как традиционных, так и новых ТМ и их роли в диагностике, прогнозе и мониторинге пациентов в текущей клинической практике.Мы также смотрим на будущее направление ТМ и их интеграцию с другими диагностическими методами и другими появляющимися биомаркерами на основе сыворотки, такими как циркулирующие нуклеиновые кислоты, чтобы в конечном итоге улучшить диагностические характеристики и улучшить ведение пациентов.
1. Введение
Термин опухолевый маркер (ТМ) традиционно относится к веществам, главным образом белкам, которые либо непосредственно продуцируются злокачественными клетками, либо продуцируются другими клетками в ответ на определенные злокачественные или другие незлокачественные состояния.ТМ могут быть связаны со злокачественными новообразованиями конкретного органа (например, поверхностный антиген простаты [ПСА] при раке простаты и тиреоглобулин при раке щитовидной железы), но часто ТМ, например раковый антиген 19-9 (СА 19-9), может быть повышается при различных формах рака (например, при раке поджелудочной железы, гепатобилиарного рака и аденокарциноме желудка) [1]. Кроме того, уровни TM не всегда повышаются у всех пациентов с диагнозом определенного злокачественного новообразования (например, карциноэмбриональный антиген [CEA] при колоректальной карциноме [CRC]) [2].Несмотря на эти ограничения и до появления современных методов визуализации и достижений в области молекулярной диагностики, ТМ были одними из немногих доступных диагностических инструментов для ведения онкологических пациентов. Их легко измерить в жидкостях организма, в основном в образцах сыворотки или плазмы; результаты доступны быстро, а связанные с этим затраты на тестирование ТМ относительно невелики [3]. Таким образом, при многих злокачественных новообразованиях ТМ стали неотъемлемой частью ведения пациентов, а также включены в ряд клинических руководств [4–11].Отсутствие диагностических альтернатив и плохие варианты лечения пациентов с запущенными формами рака подчеркнули необходимость раннего выявления и побудили медицинское сообщество провести несколько исследований, в которых тестировались отдельные ТМ для скрининга нескольких солидных опухолей. Однако различные причины их повышения в крови были связаны с недостаточной чувствительностью и специфичностью у бессимптомных пациентов, что делало использование единственной ТМ для скрининга большинства солидных опухолей чрезвычайно сложной задачей.Даже в редких исключениях, таких как рак простаты, где для скрининга изначально рекомендовался конкретный ТМ, а именно ПСА, предполагаемое использование маркера в последнее время подверглось тщательной проверке, поскольку сам по себе ПСА не может определить наличие клинически значимых форм агрессивного рака от более вялотекущих вариантов болезни, что привело к гипердиагностике и чрезмерному лечению [12]. Тем не менее, в случае подозрительных образований исследования показали, что новые TM обеспечивают улучшенные профили чувствительности и специфичности для определенных злокачественных новообразований, таких как прогастрин-высвобождающий пептид (ProGRP) для мелкоклеточного рака легкого [13] и белок эпидидимиса 4 человека (HE4) для рак яичников [14].
ТМ были обнаружены в эпоху, предшествовавшую появлению доказательной медицины, основанной на рекомендациях, и многие исследования, изучающие полезность ТМ, были либо недостаточно эффективными, либо использовались для сопоставления уровней ТМ с тем, что сейчас является устаревшими «золотыми стандартами» ( такие как обычные рентгеновские снимки для оценки ответа опухоли), или не продемонстрировали строгий дизайн, необходимый в настоящее время для окончательной демонстрации клинически полезной конечной точки [15, 16].
За последнее десятилетие успехи в молекулярной и клеточной биологии привели к появлению новых диагностических инструментов в онкологии, которые измеряют циркулирующие опухолевые клетки или выявляют молекулярные события опухолей на уровне отдельного пациента, что привело к изменению парадигмы в том, как противоопухолевые препараты разрабатываются методы лечения, и пациенты отбираются для конкретной таргетной терапии [17–19].Повышенное внимание к характеристике опухолевой ткани за последнее десятилетие с использованием массивов генов, полимеразной цепной реакции (ПЦР), флуоресцентной гибридизации in situ (FISH), иммуногистохимии (IHC) и секвенирования следующего поколения (NGS) изменило онкологию и сделали точную медицину реальностью для многих пациентов [17]. Только совсем недавно мы смогли измерить общее количество и мутированную бесклеточную нуклеиновую кислоту, специфичную для опухоли пациента, в периферической крови, что откроет огромные новые возможности для диагностики и принятия решений о лечении в ближайшем будущем [20–27].
Учитывая впечатляющие достижения в области молекулярной диагностики, возникает вопрос: будут ли традиционные ТМ в будущем играть какую-либо роль в онкологии? Хотя исследования молекулярных маркеров в опухолевой ткани и крови уже показывают большой прогресс в создании и валидации новых технологий, все еще присутствуют многие внутренние биологические ограничения, включая гетерогенность опухолей, преобладание опухолеспецифических мутаций только в подгруппах рака. пациентов, и неоднородные ответы на таргетную терапию у тех же (например,g., положительные по мутации) подгруппы пациентов [28].
Поэтому мы предполагаем, что оптимальный поток ведения пациентов в будущем будет включать в себя новые и устоявшиеся инструменты, в том числе TM, и будет крайне важно выбрать правильный маркер в правильной обстановке, не только для оптимизации результатов на уровне пациента, но и для содержать сопутствующие расходы на здравоохранение для общества в целом.
Основная цель этого краткого обзора — концептуально обрисовать, как «традиционные» ТМ все еще могут быть клинически ценными.
2. Роль ТМ в современной клинической практике
Несмотря на достижения в диагностике онкологии, использование ТМ в лечении пациентов с солидными опухолями имеет несколько установленных показаний, а также возможности для более широкого использования. В этом разделе мы кратко резюмируем, как ТМ можно использовать на каждом этапе по всему спектру ведения пациентов. В центре внимания здесь не углубленное обсуждение новых биомаркеров, таких как циркулирующие опухолевые клетки, циркулирующие нуклеиновые кислоты или новые подходы к протеомике, поскольку это выходит за рамки данного обзора.Тем не менее, авторы определят сохраняющуюся роль ТМ в контексте растущей важности новых биомаркеров.
2.1. Дифференциальный диагноз
У людей с подозрением на рак ТМ могут быть очень полезны для сужения потенциальных дифференциальных диагнозов и для фокусировки дальнейшего обследования. Например, хотя только антиген карциномы 125 (CA125) не рекомендуется для скрининга рака яичников [29], Lokich et al. может показать, что комбинация CA125 с HE4 с использованием алгоритма риска злокачественных новообразований яичников (ROMA) может более точно определить риск эпителиальной карциномы яичников, что потребует более агрессивных диагностических исследований (например,g., лапароскопия) по сравнению с более консервативной стратегией наблюдения за женщинами низкого риска [30]. Более того, недавние данные по скринингу на рак легких у лиц с высоким риском с использованием компьютерной томографии низкого разрешения показали улучшение смертности в популяционном отношении [31]. Однако многие легочные узелки среднего размера не поддаются четкому диагнозу, основанному только на визуализации, и могут быть слишком маленькими для проведения КТ или трансбронхиальной биопсии. Эти пациенты в настоящее время будут наблюдаться с помощью краткосрочной визуализации, что является дорогостоящим и подвергает их дополнительному облучению [32].Панель из шести ТМ (CEA, раковый антиген 15-3 [CA15-3], антиген плоскоклеточной карциномы [SCCA], фрагмент цитокератина 19 [CYFRA 21-1], нейрон-специфическая энолаза [NSE] и ProGRP) была недавно Показано, что он более точен в прогнозировании наличия рака легких, чем одна только ТМ или клинические факторы, такие как размер опухоли и статус курения [33]. Таким образом, эти TM могут использоваться для соответствующей сортировки неопределенных узелков в легких. Более того, было показано, что структура CEA, SCCA, CYFRA 21-1, NSE и ProGRP очень полезна для различения подтипов мелкоклеточного и немелкоклеточного рака легкого (SCLC и NSCLC, соответственно.) [33]. Это весьма актуально, учитывая, что значительная часть биопсии легких может быть недиагностической [34]. Другой пример улучшения диагностических характеристик комбинирования ТМ — это скрининг рака простаты. У мужчин без пальпируемого узелка простаты и со скрининговым значением ПСА в так называемой серой зоне, то есть с ПСА от 2 до 10 нг / мл, клиницист не может надежно отличить рак простаты от доброкачественной гиперплазии простаты без инвазивной биопсии простаты. . В этой ситуации измерение, помимо общего ПСА, уровней свободного ПСА и вычисление их соотношения (% fPSA) может быть полезным для диагностики основного рака простаты [35].Чем ниже% fPSA, тем выше вероятность рака простаты. В основополагающем исследовании Catalona et al., Тестирование% fPSA сократило количество ненужных биопсий на 20%, при этом сохранив 95% уровень выявления рака простаты [36]. Стокгольмская модель, которая объединяет свободный ПСА с массивом других данных оценки риска, недавно была показана как более чувствительный и специфический скрининговый тест, чем один только ПСА [37].
У пациентов с диагностированным неопознанным первичным раком (CUP) использование нескольких TM является частью диагностического процесса, как указано в таких руководствах, как Национальная комплексная сеть рака (NCCN) [38].В зависимости от того, какие ТМ повышены, целенаправленное диагностическое обследование может быть направлено на определенные органы и, таким образом, могут быть снижены заболеваемость, временная задержка и стоимость дальнейших инвазивных диагностических процедур (например, бронхоскопии). Хотя тканевая диагностика почти всегда требуется для принятия решения о лечении в онкологии, два заметных исключения в значительной степени зависят от наличия ТМ. У пациентов мужского пола с опухолью яичек и повышенными ТМ (альфа-фетопротеин [AFP] и хорионический гонадотропин человека [ХГЧ] по отдельности или в комбинации) биопсия не требуется, и орхиэктомия является следующим терапевтическим и диагностическим шагом.Точно так же у пациентов с циррозом печени повышенный уровень АФП вместе с характерными данными многофазной визуализации достаточен для постановки диагноза гепатоцеллюлярной карциномы (ГЦК), а биопсия не рекомендуется.
2.2. Стадия / прогноз
ТМ также полезны после установления диагноза злокачественного новообразования. Хотя несколько групп исследовали прогностическую роль геномных и иммунологических сигнатур биомаркеров на ранней стадии НМРЛ, Muley et al.продемонстрировали относительно простую комбинацию предоперационных уровней CEA и CYFRA-21, которые могут быть прогностическими для безрецидивной выживаемости в этой когорте пациентов стадии I-IIIA [39]. Другое недавнее исследование продемонстрировало, что у пациентов с МРЛ как уровни до лечения, так и абсолютные уровни ProGRP в конце первого цикла химиотерапии являются прогностическими для общей выживаемости [40]. При первичном раке молочной железы CA15-3, отдельно или в комбинации с другими ТМ, был показан в нескольких работах [41–44] как прогностический.Другим примером является CA19-9, уровень которого может быть повышен при гепатобилиарной карциноме, и он давно признан независимым прогностическим фактором у пациентов с запущенной аденокарциномой поджелудочной железы и, таким образом, был включен в качестве фактора стратификации в недавних крупных клинических исследованиях [45, 46 ].
При клинически ограниченном раке простаты уровень ПСА 10–20 нг / мл определяет промежуточный риск, а ПСА> 20 нг / мл означает высокий риск, независимо от классификации Т и шкалы Глисона [47]. При метастатических несеминоматозных половых клетках яичка опухоли ТМ также используются для определения пациентов с хорошим, промежуточным и низким риском, независимо от размера и расположения опухоли [48, 49].
Эти примеры показывают, что ТМ могут быть ценным инструментом для прогнозирования в определенных когортах пациентов, несмотря на наличие более сложных и дорогостоящих тестов.
2.3. Мониторинг лечения
Пожалуй, наиболее распространенным и наиболее распространенным применением ТМ является мониторинг заболевания во время лечения. Связь многих ТМ с различными солидными опухолями была признана несколько десятилетий назад, и с тех пор их использование в качестве маркеров мониторинга стало признанным компонентом ведения пациентов.В таблице 1 представлен список часто используемых ТМ со связанными злокачественными новообразованиями. Более подробный обзор ТМ с их рекомендуемым клиническим использованием в соответствии с различными руководствами можно найти в другом месте [50]. Привлекательность ТМ для мониторинга заболеваний основана на основном принципе наличия инструмента, который быстро информирует онколога об успехе лечения (в большинстве центров в течение нескольких часов) при относительно низкой стоимости (большинство ТМ стоят менее 40 долларов США [51]). с минимальными неудобствами для пациента (т. е. забор крови по сравнению с инвазивной биопсией или визуализацией).Кроме того, важно отметить, что специфичность не так важна для пациентов, у которых уже диагностирована определенная злокачественная опухоль, что еще больше увеличивает полезность ТМ в этой ситуации. Наконец, TM, такой как CA125, может указывать при желудочно-кишечном и других раках брюшной полости наличие карциноматоза сальника, когда визуализация часто не позволяет выявить какое-либо измеримое заболевание, а в некоторых случаях мониторинг уровней CA125 остается единственным средством оценки успеха лечения. [52].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AC, аденокарцинома; SCC, плоскоклеточный рак; ХЛЛ, хронический лимфолейкоз; HNSCC, плоскоклеточный рак головы и шеи; ГКТ, опухоль зародышевых клеток; GI, желудочно-кишечный тракт; NET, нейроэндокринные опухоли; ТК, тимидинкиназа; ТГ, тиреоглобулин. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Однако для значимой клинической интерпретации кинетики ТМ использование тех же методов измерения маркеров имеет первостепенное значение. Кроме того, дополнительные лабораторные параметры, такие как уровни креатинина, трансаминаз и С-реактивного белка (СРБ), полезны для контроля потенциально влияющих состояний, таких как почечная и печеночная недостаточность или воспаления. Мониторинг терапии может быть наиболее эффективным, когда забор крови проводится в определенные моменты времени во время лечения, например, перед каждым применением нового химиотерапевтического цикла, и когда биохимический ответ или прогрессирование осуществляется на основе определенных изменений ТМ по отношению к индивидуальные базовые значения, а не фиксированные пороговые уровни, такие как эталонное значение любой контрольной группы.Таким образом, соответствующие изменения маркеров могут значительно варьироваться из-за разного времени половины или удвоения маркеров. Хотя эти факты кажутся логичными, значимые изменения TM плохо определены, а четкие графики определения маркеров пока редко используются для оценки ответа в клинической практике.
Следующая волна диагностических достижений в мониторинге терапии сосредоточена на обнаружении нуклеиновых кислот из опухоли индивидуума в периферической крови после конкретной мутации у этого конкретного пациента [53].Несомненно, эта разработка является еще одним шагом к точной медицине и станет важным дополнением к концепции «лечения правильного пациента правильными лекарствами». Однако означает ли это, что в этом случае TM станут устаревшими? Скорее всего, нет. Молекулярная диагностика будет очень ценной на этапах принятия решения во время ведения пациента: при постановке диагноза для определения правильного лечения и при прогрессировании для определения конкретной мутации устойчивости (рис. 1). Это будет определять следующую линию терапии, но между точками принятия решения, во время циклов химиотерапии, будет очень трудно показать преимущество молекулярной диагностики перед традиционными ТМ в мониторинге заболеваний.Даже сегодня ранний рост ТМ может предвещать будущее рентгенологическое прогрессирование, но не обязательно при первом росте может привести к смене лечения. Клинические исследования, сравнивающие циркулирующую опухолевую ДНК (цтДНК) с ТМ, показывают, что цтДНК лучше всего использовать у пациентов с не повышенным уровнем ТМ [54–57]. Никаких дополнительных преимуществ при сочетании с ТМ не выявлено. Это продемонстрировало бы, что обнаружение «молекулярной прогрессии» связано с улучшенными результатами по сравнению с прогрессией, основанной на TM, и, таким образом, оправдало бы более высокие затраты и время обработки.Этот подход может быть полезен при выборе высокоагрессивных видов рака с использованием нескольких направлений высокоэффективной терапии, но в большинстве случаев этот метод «высокой чувствительности» вряд ли сможет заменить устоявшуюся ТМ. Кроме того, для молекулярных маркеров необходимо определять клинически значимые изменения на уровне отдельного пациента, чтобы избежать ложноположительных (или отрицательных) результатов. Кроме того, необходимо учитывать непрерывность метода, а также контролировать преаналитические и влияющие факторы.Это в принципе похоже на введение визуализации с помощью компьютерной томографии (КТ) позитронно-эмиссионной томографии (ПЭТ) по сравнению с обычными КТ-сканированиями. По разным причинам, включая стоимость, ПЭТ-сканирование не могло регулярно заменять компьютерную томографию во время регулярных интервалов мониторинга заболевания. Таким образом, в будущем, в то время как молекулярная диагностика будет становиться все более важной для сортировки пациентов в точках принятия решений, промежуточная ТМ между этими точками будет по-прежнему использоваться в качестве спускового механизма для дальнейших сложных и более дорогостоящих тестов (например,g., визуализация или молекулярное тестирование на наличие новых мутаций).
Не следует забывать, что, несмотря на фрагментацию и подклассификацию гистологических диагнозов в онкологии на генотипическом уровне для назначения лучшего лечения (например, KRAS, NRAS или BRAF при мутированном CRC [58]), большинство из них являются захвачены под зонтиком нескольких ТМ на основе крови на фенотипическом уровне (например, CEA и CA19-9 в CRC). Проще говоря, это означает, что один биомаркер можно использовать для многих молекулярно различных заболеваний, чтобы сказать нам, гибнут опухолевые клетки или нет.Это клинически актуально, поскольку молекулярные паттерны точно предсказывают ответ на лечение только у части пациентов, в то время как значительное число пациентов (до 50% у пациентов с рецидивирующим раком легких) не отвечает на подходы таргетной терапии, несмотря на положительный эффект рецептора эпидермального фактора роста (EGFR). анализ мутаций [59, 60]. Кроме того, многие пациенты не подходят для молекулярного мониторинга, поскольку у них нет «лекарственно-зависимых» мутаций. Поскольку молекулярное профилирование показывает большие различия между отдельными людьми, нам не нужно создавать определенный набор праймеров для каждого пациента, чтобы отслеживать его реакцию на лечение, но для большинства из них можно использовать одну и ту же ТМ.Таким образом, мониторинг заболеваний во время системного лечения запущенных форм рака останется одним из основных показателей, по которым ТМ будут играть важную роль в будущем.
2.4. Наблюдение и мониторинг рецидивов
При неметастатических формах рака, которые лечатся с лечебной целью, и при запущенных формах рака с хорошим ответом на химиотерапию первой линии рекомендуется наблюдение за пациентами на срок до пяти лет для выявления раннего рецидива. В некоторых случаях время наблюдения даже больше, например, при опухолях из половых клеток [61, 62].Основная гипотеза здесь заключается в том, что раннее обнаружение рецидива увеличит вероятность наличия ограниченного объема заболевания и, таким образом, либо (а) сможет вылечить рецидив с помощью окончательной местной терапии (хирургия и / или лучевая терапия), либо (b) иметь лучший ответ. к системному лечению из-за меньшей опухолевой нагрузки. Следовательно, при многих распространенных формах рака, которые поддаются скринингу и, таким образом, обнаруживаются на неметастатической стадии у большинства пациентов (например, простаты, CRC или груди), использование ТМ для наблюдения после лечения либо уже включено в руководящие принципы, либо / или часть общей клинической практики [63–66].Из приведенных выше показаний для наблюдения за пациентами на предмет рецидива можно увидеть, что обычно спасательное лечение, особенно местное лечение (например, хирургическое или лучевое), основано на анатомической локализации рецидива. Таким образом, ТМ сама по себе не инициирует лечение, а скорее будет следующим диагностическим тестом, который в конечном итоге подскажет лучшую стратегию лечения. Этот подход успешно применялся при раке груди с использованием CEA и CA 15-3 для наблюдения после оказания медицинской помощи [43, 67].Следует отметить, что принципы мониторинга маркеров (поддержание тех же методов, определенные временные графики определения TM, интерпретация в соответствии с изменениями маркеров по отношению к индивидуальным базовым значениям, а не в соответствии с фиксированными пороговыми значениями) были предпосылками для разработать наиболее эффективную процедуру мониторинга [68]. Более того, запуск чувствительной визуализационной диагностики и терапевтических вмешательств имел первостепенное значение для получения преимущества во времени за счет раннего обнаружения рецидивов.
Другие рандомизированные испытания по мониторингу рецидивов с ТМ, например, при раке яичников с использованием CA125, не показали улучшения выживаемости и не были включены в рекомендации [69, 70]. Было выявлено несколько причин неутешительных результатов, таких как неблагоприятный отбор пациентов с плохим прогнозом, неудовлетворительные хирургические результаты с слишком большим количеством опухолевых положительных границ, интерпретация уровней CA125 на основе фиксированных высоких пороговых значений, которые не привели к раннее выявление рецидивов и недостаточное количество препаратов второго ряда [71, 72].Таким образом, если обнаружение рецидива с помощью ТМ в этих случаях не рекомендуется, тогда трудно представить себе, что даже более сложные маркеры крови, такие как внеклеточная ДНК, широко использовались бы в качестве маркеров наблюдения, учитывая более высокие затраты и несоблюдение процедурных графиков. с маркерами, доступными в настоящее время.
Однако выживаемость может быть не лучшим критерием для оценки роли TM в этой ситуации. Чтобы полностью изучить это, потребуются крупные и долгосрочные рандомизированные исследования.Учитывая тот факт, что ТМ существуют уже несколько десятилетий и уже включены в ведение пациентов, было бы очень сложно найти ресурсы для проведения этих испытаний сегодня. Альтернативными более непосредственными конечными точками для исследования может быть количество контрольных компьютерных томографов, сохраненных с помощью мониторинга ТМ, или доля пациентов, которые проходят лечебное лечение с целью спасения. Primrose et al. недавно продемонстрировал в большом проспективном исследовании, что мониторинг рецидива CRC только с помощью CEA не хуже, чем обычная компьютерная томография [73].Можно представить себе, что молекулярные тесты на основе крови для мониторинга рецидива опухоли будут конкурировать с ТМ в будущем, учитывая вероятность того, что они покажут серологический рецидив без какой-либо рентгенологической корреляции, и, следовательно, отсутствие фактической цели для местного лечения спасения может привести к частым , дорогостоящее повторное тестирование до тех пор, пока не будет выявлено обнаруживаемое поражение.
3. Будущие направления
Ясно, что ТМ могут быть очень полезными инструментами в ведении пациентов при правильном использовании.Но также очевидно, что требуется дополнительная работа для оптимизации клинического использования ТМ в повседневной практике.
3.1. Повышение диагностической эффективности
Традиционно TM использовались как отдельные маркеры, что вызывало опасения по поводу их низкой чувствительности или низкой специфичности. Это особенно верно для опухолей, которые не экспрессируют в подавляющем большинстве специфический TM, например, NSCLC [74]. В этой популяции пациентов ни одна отдельная TM не повышена у большой части пациентов. Тем не менее, панель из нескольких ТМ в большинстве случаев идентифицирует по крайней мере одну повышенную ТМ, которая затем может использоваться для мониторинга лечения.Важно отметить, что некоторые TM коррелируют с гистологическим подтипом, что может в дальнейшем определять выбор TM. Другие примеры включают CRC (CA19-9 в дополнение к CEA [75]) и рак яичников (HE4 в CA125-отрицательных опухолях [76]). Комбинация двух или более ТМ может также повысить прогностическую эффективность, например, с CEA и CYFRA 21-1 при NSCLC [39].
Кроме того, в будущих исследованиях, оценивающих диагностическую эффективность ТМ, исследователи должны не только сосредоточиться на одной временной точке, но и оценивать тенденцию ТМ в течение определенного периода времени, например, внедрение кинетики ТМ с учетом риска рака яичников. алгоритма (ROCA) [77] или при оценке времени удвоения ПСА у пациентов с раком простаты [78].
Наконец, продолжаются исследования по поиску новых ТМ, которые по отдельности или в комбинации улучшат диагностические характеристики при определенных показаниях, например, комбинации ProGRP, NSE, CYFRA 21-1 и CEA при подтипах рака легких [33] . Кроме того, последние данные показывают, что мониторинг лечения пациентов с SCLC может быть оптимизирован с использованием ProGRP и NSE в качестве TM [40]. Основываясь на той же концепции, добавление нуклеиновых кислот (например, ctDNA) может помочь закрыть диагностический пробел в опухолях без известных TM (например,g., саркомы) или в комбинации улучшают мониторинг злокачественных новообразований с менее установленными ТМ (например, S-100B при меланомах [79, 80]). Надеемся, что дальнейшие текущие исследования новых маркеров пополнят наш текущий арсенал доступных ТМ.
3.2. Создание более надежных данных и обучение
Многие широко используемые TM, такие как CEA, CA125 и AFP, были описаны более 20 лет назад, и их внедрение в клиническую практику предшествовало появлению доказательной медицины [81–83]. Таким образом, было бы очень сложно, если не почти невозможно, найти ресурсы для восстановления клинических данных в отдельных клинических испытаниях, чтобы продемонстрировать полезность этих ТМ.Однако есть и другие возможности для сбора высококачественных данных для поддержки использования TM. Можно взять уже опубликованные данные и проанализировать несколько статей вместе в форме метаанализа, который предоставит больше доказательств использования ТМ в определенных показаниях. Для целей мониторинга заболевания можно проспективно собирать образцы крови у последовательных пациентов, которых лечат от конкретных опухолей стандартной терапией вне терапевтического клинического исследования, и сопоставить изменения TM с задокументированными реакциями опухоли.Хотя этот вариант, безусловно, дешевле, чем проведение специализированных проспективных клинических испытаний ТМ, всегда есть проблемы с систематической ошибкой, установлением изменений ТМ с ответом и исходом, а также с различными точками времени сбора образцов. Следовательно, мы полагаем, что путь вперед для получения более надежных данных для существующих (и тестирования новых биомаркеров) будет ретроспективно на доступных образцах из крупных и хорошо аннотированных клинических испытаний. В качестве следующего шага предполагаемые коллекции образцов могут быть включены в будущие терапевтические клинические испытания.Более тщательная оценка новых маркеров в проспективных клинических испытаниях, которые имеют достаточную мощность и четкие конечные точки (например, оценка ответа с помощью критериев оценки ответа в солидных опухолях [RECIST] [84]), вероятно, повысит принятие этих ТМ в клиническую практику. Это особенно верно для менее широко используемых TM (например, HE4), которые следует включить в будущие терапевтические испытания, чтобы продемонстрировать их полезность в качестве вторичной конечной точки. Эти подходы позволят решить многие из проблем, связанных с образцами, взятыми у пациентов вне испытаний, например, преимущество наличия жесткой временной корреляции сбора образцов с вмешательством и четко определенных критериев ответа.Наконец, подходящими конечными точками для определения роли ТМ в клинической практике не всегда должна быть общая выживаемость, как уже указывалось выше. ТМ могут использоваться в качестве недорогого и быстрого диагностического метода для запуска последующих тестов, и, следовательно, их полезность должна быть проверена в контексте экономических исследований здравоохранения, то есть изменения в управлении пациентами и экономии на лечении и затратах на расширенную диагностику, скорее чем чисто клинические конечные точки, такие как общая выживаемость.
Использование товарных знаков за пределами уже установленных целей (например,(например, опухоли половых клеток, колоректальные опухоли, опухоли простаты, яичников, поджелудочной железы, гепатоцеллюлярные и нейроэндокринные опухоли) также будут зависеть от повышения уровня образования врачей. Это будет происходить посредством публикаций и презентаций на конференциях, но также должно начинаться на ранних этапах обучения стажеров-онкологов под руководством их ведущих врачей. Как и многие другие аспекты клинической практики, использование ТМ, вероятно, коррелирует с уровнем воздействия этих ТМ во время медицинского обучения.
Таблица 2 концептуально резюмирует, как сбор ТМ может быть включен в будущие проспективные исследования.TM будут нарисованы в различные моменты времени, указанные в таблице 2 (a), с рутинной визуализацией и последующим наблюдением за пациентом, как указано в соответствующем протоколе. Различные расчеты с использованием уровней TM в моменты времени, указанные в таблице 2 (a), затем будут выполнены в соответствии с таблицей 2 (b) для определения диагностической эффективности TM для различных клинических конечных точек. Эти результаты будут способствовать более рациональному использованию ТМ, основанному на данных, на основе предоставленных данных.
| (a) Схематичное проспективное исследование | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| (б) Использование ТМ в различных клинических конечных точках | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| T0 — T5, различные моменты времени для взятия крови и / или визуализации; ВБП — выживаемость без прогрессирования заболевания; RFS — безрецидивная выживаемость; ОС, общая выживаемость. | ||||||||||||||||||||||||||||||||||||||||||||||||
4. Заключение
ТМ представляют собой удобный и экономичный диагностический инструмент для лечения различных злокачественных новообразований. Комбинирование нескольких TM, последовательных измерений и включение новых TM может улучшить их диагностические характеристики. При оценке их полезности следует понимать их роль в определенных показаниях (например, мониторинг болезни) в качестве теста первой линии для надлежащего запуска дальнейшего обследования и более инвазивной диагностики, а не ТМ как отдельного теста, который напрямую повлияет на результаты пациенты.Эта фундаментальная концептуальная структура также приведет к их дальнейшему использованию, несмотря на новые методы диагностики, такие как бесклеточное тестирование ДНК, или в качестве важного дополнения к ним. Текущие исследования и улучшенные платформы будущих открытий будут способствовать развитию ТМ и добавят новые маркеры в уже имеющийся арсенал.
Конкурирующие интересы
Фаршид Дайяни был сотрудником Roche Diagnostics International Ltd, когда была инициирована эта проверка. Дэвид Моргенштерн — сотрудник компании Roche Diagnostics International Ltd.Стефан Холденридер получил гранты / исследовательскую поддержку от Roche Diagnostics. Лэнс Пальяро не заявляет о конфликте интересов. Редакционную поддержку оказывала Ким Браун из Roche Diagnostics International Ltd.
.границ | Маркеры мочевого пузыря при раке мочевого пузыря: обновление
- 1 Лаборатория иммунопатологии, Фармацевтический факультет, Университет Камерино, Камерино, Италия
- 2 Лаборатория иммунопатологии, Школа биологических наук, биотехнологии и ветеринарной медицины, Университет Камерино, Камерино, Италия
- 3 Онкологическое отделение, Больница Мачерата, Мачерата, Италия
Рак мочевого пузыря (РМЖ) — один из самых распространенных онкологических заболеваний в мире.Он подразделяется на мышечно-инвазивный (MIBC) и мышечный неинвазивный (NMIBC) BC. NMIBC часто рецидивируют и переходят в MIBC с пониженной выживаемостью и частыми отдаленными метастазами. Обнаружение РМЖ требует неприятных и дорогостоящих цистоскопии и биопсии, которые часто сопровождаются несколькими побочными эффектами. Таким образом, существует острая необходимость в разработке новых диагностических методов для первоначального выявления и наблюдения как в MIBC, так и в NMIBC. В продаже имеются многочисленные тесты на основе мочи, одобренные FDA для обнаружения и наблюдения РМЖ.Однако в настоящее время чувствительность, специфичность и диагностическая точность этих анализов на основе мочи все еще неоптимальны, и, чтобы улучшить их, новые молекулярные маркеры, а также множественные анализы должны быть переведены в клинику. В настоящее время появляется все больше свидетельств в пользу использования минимально инвазивной «жидкой биопсии» для выявления биомаркеров злокачественных урологических заболеваний. Маркеры на основе ДНК и РНК в жидкостях организма, таких как кровь и моча, являются многообещающими потенциальными маркерами для диагностики, прогноза, прогнозирования и мониторинга урологических злокачественных новообразований.Таким образом, в образцах мочи оценивали циркулирующую внеклеточную ДНК, метилирование и мутации ДНК, циркулирующие опухолевые клетки, miRNA, IncRNA и мРНК, внеклеточные белки и пептиды, а также экзосомы. Однако протеомные и геномные данные должны быть подтверждены в хорошо спланированных многоцентровых клинических исследованиях, прежде чем их можно будет использовать в клинической онкологии.
Введение
Рак мочевого пузыря (BC) занимает 9-е и 4-е место по распространенности рака в мире и у мужчин в США, соответственно (1, 2).Его основной гистологический тип — уротелиальная карцинома (ЯК). Около 70–80% РМЖ диагностируется как немышечно-инвазивный РМЖ (NMIBC), а 20-30% — как мышечно-инвазивный (MIBC). Поскольку 10–30% пациентов с NMIBC прогрессируют до инвазивного заболевания (3–8), ранняя диагностика и раннее выявление рецидивов очень важны. Диагностика РМЖ требует цистоскопии и биопсии, которые являются неприятными и дорогостоящими процедурами (9). Необходимо разработать новые методы диагностики, менее инвазивные и дорогие для диагностики РМЖ и наблюдения.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование нескольких коммерчески доступных тестов на основе мочи. Однако ни один из этих тестов не применялся в повседневной практике и не был включен в клинические рекомендации Американской урологической ассоциации или Европейской ассоциации урологов по лечению РМЖ (10). В этом мини-обзоре мы обсуждаем клиническую реализацию с использованием новых молекулярных подходов и жидкостной биопсии при РМЖ.
В настоящее время золотым стандартом диагностики РМЖ являются цитология мочи и цистоскопия.Цитопатология образцов мочи — широко используемый неинвазивный тест для обнаружения и наблюдения РМЖ (11–13). Цитология очень специфична (около 86%), но она низкочувствительна (48%), что ограничивает ее использование при РМЖ низкой степени злокачественности (14–16). Диагностическая точность цитологического исследования мочи является субъективной и зависит от опыта цитопатолога (17). Таким образом, необходимы новые молекулярные тесты мочи для уменьшения или замещения частоты эндоскопии у пациентов с рецидивом РМЖ (18, 19).
Передовая технология использует мочу пациентов в качестве образцов вместо первичных тканей РМЖ для выявления новых прогностических биомаркеров.В настоящее время основная проблема заключается в том, чтобы перевести обширные протеомные и геномные данные в клиническую практику и подтвердить экспрессию этих биомаркеров в хорошо спланированных многоцентровых клинических исследованиях (20).
Протеомный и пептидомный анализ
Протеомные анализы открыли новые горизонты для открытия биомаркеров рака (21). В настоящее время доступно семь тестов: FDA одобрило шесть по семи из этих тестов, а последний соответствует стандартам Закона об улучшении клинических лабораторий.NMP22, NMP22 BladderChek и UroVysion имеют одобрение FDA для диагностики и наблюдения РМЖ; иммуноцитология (uCyt +), BTA-TRAK и BTA-STAT одобрены только для надзора (22–26).
Для повышения чувствительности, специфичности и диагностической точности при диагностике РМЖ новые белковые маркеры, ожидающие утверждения, используются экспериментально. BCLA-1 и BCLA-4 представляют собой белки ядерного матрикса, специфически нацеленные на ткани РМЖ, не влияющие на инфекции, курение, катетеризацию или цистит (27).У пациентов с гематурией киназа Aurora A (AURKA) различает РМЖ низкой степени и нормальных пациентов (28). Тест Aura Tek FDP Test ™ в моче может выявить рецидив РМЖ (29). Активированная молекула адгезии лейкоцитарных клеток (ALCAM), молекула клеточной адгезии (30), положительно коррелирует со стадией опухоли и общей выживаемостью (OS) после корректировки с учетом пациентов, клинических особенностей и лечения Bacillus Calmette-Guerin (31). Никотинамид-N-метилтрансфераза высока у пациентов с РМЖ и коррелирует с гистологическим уровнем (32).Уровни апуриновой / апиримидиновой эндонуклеазы 1 / окислительно-восстановительного фактора-1 (APE / Ref-1) выше в РМЖ по сравнению с не РМЖ и коррелируют со степенью и стадией опухоли; кроме того, он высок также у пациентов с рецидивом РМЖ (33). Анализ мочи с цитокератином-20 (CK20) ОТ-ПЦР показывает чувствительность 78–87% и специфичность 56–80% для обнаружения уротелиального РМЖ с повышенной диагностической точностью при прогрессировании опухоли (34), но имеет низкую эффективность для опухолей низкой степени злокачественности. Более высокие уровни CK8 и CK18 были обнаружены в моче с помощью экспресс-теста UBC при РМЖ высокой и низкой степени (35).
В качестве множественных маркеров для обнаружения РМЖ в РМ были обнаружены повышенные уровни аполипопротеина A1, A2, B, C2, C3, E (APOA1, APOA2, APOB, APOC2, APOC3, APOE) в моче по сравнению со здоровыми людьми (36, 37). Сигнатура из 4 мочевых фрагментов уромодулина, коллагена α-1 (I), коллагена α-1 (III) и связанного с мембраной рецептора прогестерона компонента 1, по-видимому, отличает MIBC от NMIBC (38). Другая панель использует IL-8, MMP-9/10, ANG, APOE, SDC-1, α1AT, PAI-1, VEGFA и CA9 для диагностики РМЖ, начиная с образцов мочи (39).Преимущество этих биомаркеров белков мочи было очевидным при заболеваниях высокой и низкой степени, а также высокой и низкой стадии заболевания (39). Комбинация маркеров мочи, таких как мидкин (MDK) и синуклеин G или MDK, ZAG2 и CEACAM1 (40), ангиогенин и кластерин (41), оцениваемых с помощью иммуноанализа и цитологического исследования мочи, повышает чувствительность и специфичность диагностики NMIBC (40). Повышенные уровни CK20 и инсулиноподобного фактора роста II (IGFII) были обнаружены в осадках мочи пациентов с NMIBC по сравнению с контрольной группой (42).Повышенные уровни HAI-1 и Epcam в моче, оцененные с помощью ELISA, являются прогностическими биомаркерами у пациентов с высоким риском NMIBC (43). Сурвивин в моче, оцениваемый с помощью иммуноферментного анализа хемилюминесценции, коррелирует со стадией опухоли, лимфатическим узлом и отдаленными метастазами и представляет собой потенциальный маркер предварительного BC
.
