Примеры доз облучения — stuk-ru
| Величина дозы | Последствия дозы |
|---|---|
| 6000 мЗв | Доза, получаемая организмом в течение суток, вызывает лучевую болезнь и может привести к смерти |
| 1000 мЗв | Доза, получаемая организмом в течение суток, вызывает симптомы лучевой болезни (например, усталость и тошнота) |
| 20 мЗв | Допустимая доза персонала радиационно-опасных объектов в течение одного года |
| 5,9 мЗв | Средняя доза облучения (радон в помещениях, рентгеновская диагностика, и т.д.) жителей Финляндии в течение одного года |
| 2 мЗв | Доза от космического излучения для экипажей самолетов в течение одного года |
| 0,1 мЗв | Доза облучения пациента при рентгене легких |
| 0,01 мЗв | Доза облучения пациента при проведении рентгенологического обследования зубов |
Примеры мощности дозы облучения
| Мощность дозы | Пример |
|---|---|
| 100 мкзв/ч | Необходимо укрыться в помещении. Нужны дополнительные меры, например ограничение доступа к опасной зоне |
| 30 мкзв/ч | Допустимая мощность дозы на расстоянии 1 м от тела пациента радиотерапии при его выписке |
| 10 мкзв/ч | Необходимо применять некоторые защитные меры. Например, избегать ненужного пребывания на улице. |
| 5 мкзв/ч | Наибольшая мощность дозы в Финляндии во время Чернобыльской аварии. |
| 5 мкзв/ч | Мощность дозы во время полета на самолете на высоте 10 км |
| 0,2–0,4 мкзв/ч | Автоматический дозиметр сети радиационного контроля Финляндии выдает сигнал тревоги, когда мощность дозы превышает указанную. У каждой измерительной станции в Финляндии есть свой предел тревоги, который зависит от уровня радиации окружающей среды вокруг станции. Пределы тревоги с 0,2 по 0,4 мкзв/ч. В основном различия между станциями вытекают из уровня природной радиоактивности почвы около датчика. |
| 0,04-0,30 мкзв/ч | Естественный радиационный фон в Финляндии |
Доза облучения означает вред здоровью от радиации. Единицей измерения является зиверт (Зв). При измерении излучения часто используется такие меры дозы, как миллизиверт (мЗв) и микрозиверт (мкЗв). Один мЗв — это одна тысячная зиверта и мкЗв — одна миллионная зиверта.
Мощность дозы указывает величину дозы за единицу времени. Единицей измерения является зиверт в час (Зв/час).
Обновлено 5.6.2020
Аварии на АЭС — Муниципальное образование Литейный округ (№79)
Радиоактивность – совсем не новое явление, как до сих пор считают некоторые, связывая ее со строительством АЭС и появлением ядерных боеприпасов. И радиоактивность, и сопутствующие ей ионизирующие излучения существовали на Земле задолго до зарождения на ней жизни.
Менее чем за полувековую историю развития ядерной энергетики произошло три крупных аварии на АЭС, вызвавшие тяжелые последствия. Первая – в 1957 г., вторая – в 1979 г., третья – в 1986 г. и четвертая – в 2011 г. А всего в 15 странах мира произошло более 200 инцидентов и аварий различной степени сложности и опасности.
Если бы такая частота катастроф сохранилась в ближайшем будущем, то это бы означало, что на АЭС мира, которых более 400, будут возникать еще чрезвычайные ситуации, связанные с расплавлением активной зоны реактора. Вероятность такого события – один раз в 4 — 5 лет составит примерно 70%.
Чернобыльская катастрофа (26 апреля 1986 г.) представляет собой событие века, которое почувствовали не только в России, на Украине, в Белоруссии, но и в других странах. Еще в 1990 году в Постановлении Верховного Совета СССР говорилось: «Авария на Чернобыльской АЭС по совокупности последствий является самой крупной катастрофой современности, обще народным бедствием, затронувшим судьбы миллионов людей, проживающих на огромных территориях».
Информации об аварии не было. Ее попросту по началу скрывали. Население понятия не имело о случившемся. Эвакуация началась лишь спустя 36 часов. Следует сказать о расхлябанности, неумелых и нерешительных действиях персонала в чрезвычайной ситуации.
Какой огромный объем работ пришлось проводить. Только в течение первых двух лет (на апрель 1988 г.) дезактивировано 21 млн. кв. м поверхности, оборудования, захоронено 500 тыс. м2 грунта, обеззаражено 600 деревень и сел. Свыше 5 млн. человек охвачено профилактическим медицинским контролем. Для эвакуированных построено более 21 тыс. домов и 800 объектов социально бытового и культурного назначения. В кратчайшие сроки выделено 15 тыс. квартир.
Работы, хотя и с меньшим размахом, но продолжаются и поныне.
Нельзя забывать о том, что из народнохозяйственного оборота исключены пашни, сенокосы, луга, остановились многие предприятия. Из 30 километровой зоны вокруг Чернобыля произведено отселение. По сути дела это пространство стало необитаемым.
Еще долго ждать: не один десяток лет для постепенного восстановления жизнедеятельности этого региона.
Представляют интерес цифры о профессиональном риске работающих в различных отраслях промышленности. А колеблются они в довольно больших пределах.
| Вид деятельности | Число смертных случаев на 10 тыс.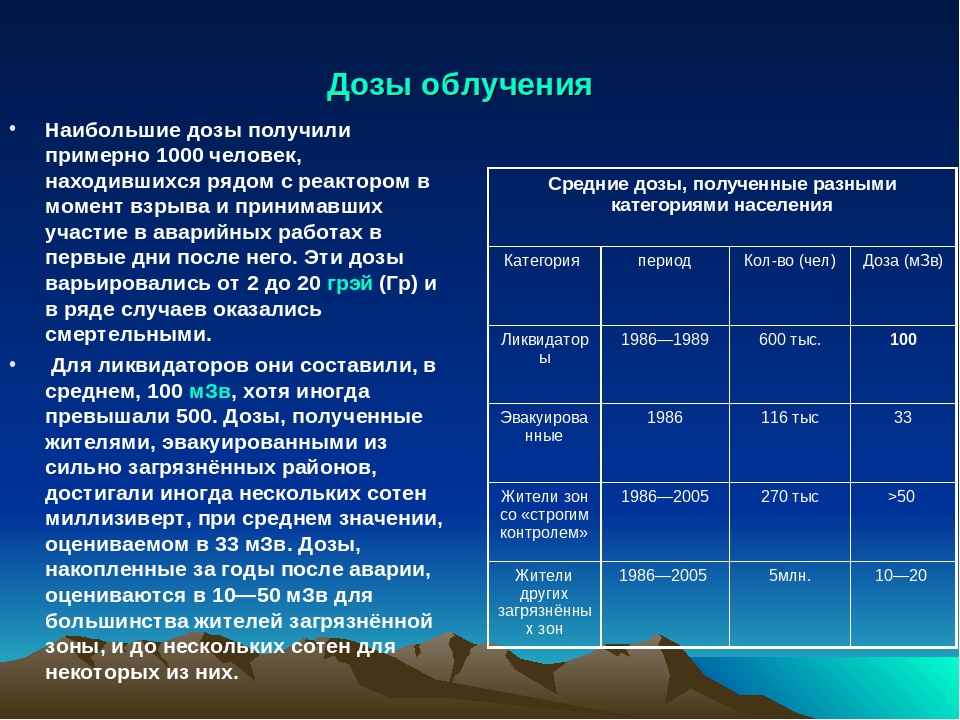 работающих в год работающих в год |
| Легкая промышленность | 0,15 |
| Ядерная энергетика | 2 |
| Химическая промышленность | 4 |
| Металлургическая промышленность | 8 |
| Сельское хозяйство | 10 |
| Угольная промышленность | 14 |
| Рыболовство | 36 |
Как видим самая опасная сфера деятельности рыболовство и угольная промышленность, а вовсе не ядерная энергетика.
В принципе нет абсолютной безопасности чего-либо. В каждом деле, которым мы занимаемся, есть своя доля риска. Например, в Англии ежегодно погибает у себя дома от бытовых аварий один человек из 9 тыс. Это могут быть взрывы газа, пожары, поражение электрическим током, отравления химическими веществами и лекарствами, утонул в ванне, угорел или упал с высоты.
Загрязнение местности
Радиоактивное загрязнение (заражение) местности происходит в двух случаях: при взрывах ядерных боеприпасов или при аварии на объектах с ядерными энергетическими установками.
На АЭС реактор является мощным источником накопления радио активных веществ. В качестве ядерного топлива применяются, главным образом, двуокись урана 238, обогащенная ураном 235. Топливо размещается в тепловыделяющих элементах – твэлах, а точнее в металлических трубках диаметром 6 – 15 мм, длиной до 4 м.
В активной зоне реактора, где находятся твэлы, происходит реакция деления ядер урана 235. В результате торможения осколков деления, их кинетическая энергия разогревает реактор. Это тепло затем используется для получения пара, вращения турбин и выработки электрической энергии.
Во время реакции в твэлах накапливаются радиоактивные продукты деления. Если в бомбе процесс деления идет мгновенно, то в твэлах длится несколько месяцев и более. За этот срок короткоживущие изотопы распадаются. Поэтому идет накопление радионуклидов с большим периодом полу распада.
Поэтому идет накопление радионуклидов с большим периодом полу распада.
Таким образом, идет процесс накопления радиоактивных веществ с длительными периодами полураспада. Все они, как правило, являются бета гамма излучателями.
На фоне тугоплавкости большинства радионуклидов такие как: теллур, йод, цезий обладают высокой летучестью. Вот почему аварийные выбросы реакторов всегда обогащены этими радионуклидами, из которых йод и цезий имеют наиболее важное воздействие на организм человека и животный мир. Как видим, состав аварийного выброса продуктов деления существенно отличается от состава продуктов ядерного взрыва. При ядерном взрыве преобладают радионуклиды с коротким периодом полураспада. Поэтому на следе радиоактивного облака происходит быстрый спад мощности дозы излучения. При авариях на АЭС характерно, во- первых, радиоактивное заражение атмосферы и местности легколетучими радионуклида ми (йод, цезий и стронций), а, во вторых, цезий и стронций обладают длительными периодами полураспада – до 30 лет. Поэтому такого резкого уменьшения мощности дозы, как это имеет место на следе ядерного взрыва, не наблюдается.
И еще одна особенность. При ядерном взрыве и образовании следа для людей главную опасность представляет внешнее облучение (90-95% от общей дозы). При аварии на АЭС с выбросом активного материала картина иная. Значительная часть продуктов деления ядерного топлива находится в парообразном и аэрозольном состоянии. Вот почему доза внешнего облучения здесь составляет 15%, а внутреннего – 85%.
Загрязнение местности от чернобыльской катастрофы происходило в ближайшей зоне (80 км) в течение 4 — 5 суток, а в дальней зоне примерно 15 дней. Наиболее сложная и опасная радиационная обстановка сложилась в 30 км зоне от АЭС, в Припяти и Чернобыле.
Из- за этого от туда было эвакуировано все население. К началу 1990 г. во многих районах мощность дозы уменьшилась и приблизилась к фоновым значениям 12 – 18 мкР/ч. Припять и Чернобыль и на сегодня представляют опасность для жизни.
Дозы облучения. Лучевая болезнь
При радиоактивном загрязнении местности от ядерных взрывов или при авариях на ядерных энергетических установках трудно создать условия, которые бы полностью исключали облучение. Поэтому при действии на местности, загрязненной радиоактивными веществами, устанавливаются определенные допустимые дозы облучения на тот или иной промежуток времени. Все это направлено на то, чтобы исключить радиационные поражения людей.
Давно известно, что степень лучевых (радиационных) поражений зависит от полученной дозы и времени, в течение которого человек подвергался облучению. Надо понимать: не всякая доза облучения опасна для человека. Вам делают флюорографию, рентген зуба, желудка, сломанной руки, вы смотрите телевизор, летите на самолете, проводите радиоизотопное исследование – во всех этих случаях подвергаетесь дополнительному облучению. Но дозы эти малы, а потому и не опасны. Если она не превышает 50 Р, то лучевая болезнь исключается. Доза в 200 – 300 Р, полученная за короткий промежуток времени, может вызвать тяжелые радиационные поражения. Но если эту дозу получить в течение нескольких месяцев – это не приведет к заболеванию. Организм человека способен вырабатывать новые клетки и взамен погибших при облучении появляются свежие. Идет процесс восстановления.
Доза облучения может быть однократной и многократной. Однократным считается облучение, полученное за первые четверо суток. Если оно превышает четверо суток – считается многократным. Однократное облучение человека дозой 100 Р и более называют острым облучением.
Соблюдение правил поведения и пределов допустимых доз облучения позволит исключить массовые поражения в зонах радиоактивного заражения местности.
Ниже в таблице приводятся возможные последствия острого, однократного и многократного облучения человека в зависимости от дозы.
| Доза облучения | Признаки поражения |
| 50 | Признаков поражения нет |
| 100 | При многократном облучении (10 – 30 суток) внешних признаков нет.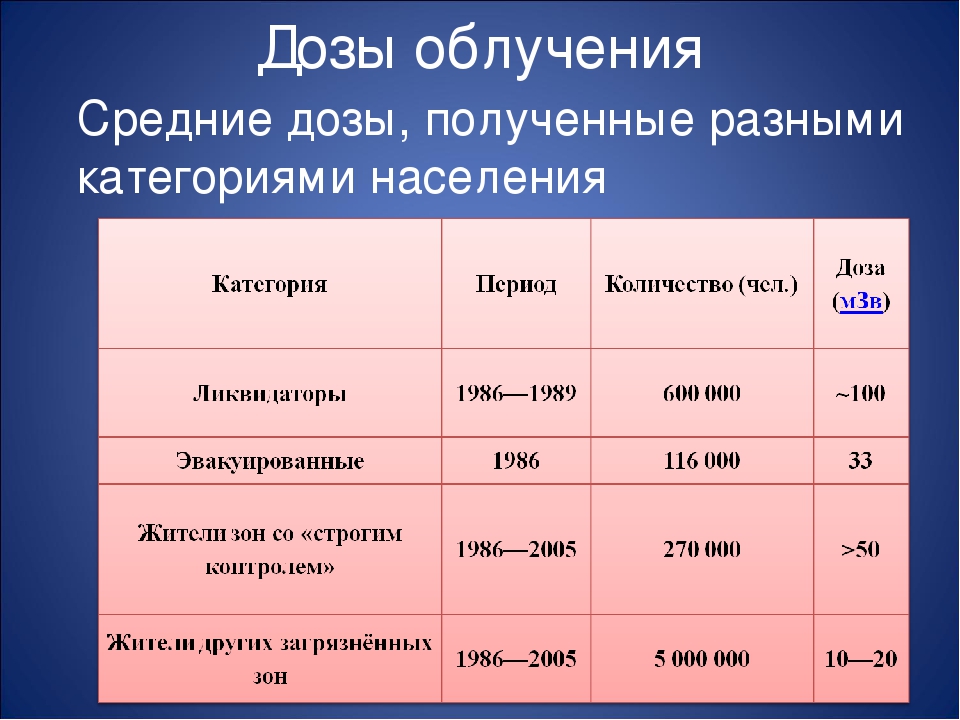 При остром (однократном) облучении у 10% тошнота, рвота, слабость При остром (однократном) облучении у 10% тошнота, рвота, слабость |
| 200 | При многократном — в течение 3 мес. – внешних признаков нет. При остром (однократном) — появляются признаки лучевой болезни I степени |
| 300 | При многократном – первые признаки лучевой болезни. При остром облучении – лучевая болезнь II степени. В большинстве случаев можно выздороветь |
| 400 – 700 | Лучевая болезнь III степени. Головная боль, температура, слабость, тошнота, рвота, кровоизлияние внутрь, изменение состава крови. При отсутствии лечения – смерть |
| Более 700 | В большинстве случаев смертельный исход |
| Более 1000 | Молниеносная форма лучевой болезни, гибель в первые сутки |
В мирное время все страны, использующие атомную энергию на производстве, в медицине и науке, имеют национальные нормы и правила радиационной безопасности, основанные на рекомендациях Международной комиссии по радиационной защите (МКРЗ).
С 1976 г. у нас действуют Нормы радиационной безопасности (НРБ – 1976/87), уточненные в 1987 г. (после Чернобыля). Их цель – предупредить переоблучение людей при авариях на ядерных энергетических установках (ЯЭУ).
Для этого все население условно разбито на три категории.
Категория А – персонал радиационных объектов, АЭС, радиологи,
рентгенологи и др.
Категория Б – население, проживающее вблизи радиационных объектов.
Категория В – все население.
Для категорий А и Б разработаны и действуют нормы, для категории В – норм нет. На население воздействует тот радиационный фон, среди которого оно живет. У нас в России этот фон колеблется в пределах от 6 до 18 мкР/ч.
В зонах, подверженных радиационному воздействию, после Чернобыля защитные мероприятия проводятся только в том случае, если уровень дозы облучения населения в год более 0,1 бэр (биологический эквивалент рентгена), если меньше, то население проживает по обычному режиму жизнедеятельности.
Нормативы загрязнения
В ходе ликвидации последствий аварии на Чернобыльской АЭС было разработано большое количество нормативных документов, инструкций, рекомендаций по индивидуальной защите личного состава, а также населения проживающего в загрязненных районах. Среди них на первом месте – документы, регламентирующие допустимые уровни радиационного загрязнения кожи человека и поверхностей различных объектов. Разработанные ранее нормы радиационной безопасности (НРБ 7б) к такой аварийной ситуации мирного времени не подходили, поэтому потребовалось внести соответствующие корректуры.
В связи с этим 11 мая 1990 г. Главным государственным санитарным врачом СССР были утверждены новые временные нормативы радиоактивного загрязнения кожи человека и поверхностей различных объектов в населенных пунктах контролируемых районов России, Украины, Белоруссии.
На другие районы эти нормативы не распространяются. Там используются допустимые уровни загрязнения, установленные нормами радиационной безопасности НРБ 76/87.
Следует помнить, что некоторые естественные радиоактивные элементы в определенных количествах содержатся в продуктах питания и питьевой воде. Иными словами – все продукты, как и сам человек, радиоактивны.
Например, в 1 кг свежего картофеля содержится около 2,9 х 10-9 кюри (Ки) радиоактивного калия, а природная радиоактивность воды не превышает 5 х 10-11 Кил (кюри литр). Такая их естественная радиоактивность не оказывает вредного влияния на организм человека.
При крупных радиационных авариях происходит загрязнение внешней среды и дополнительное поступление радионуклидов в продукты питания и воду. В этих случаях они могут оказывать неблагоприятное влияние на здоровье человека.
В целях исключения необоснованного облучения организма Министерством здравоохранения устанавливаются временные нормативы содержания радионуклидов. В настоящее время действуют «Временно допустимые уровни (ВДУ) содержания радионуклидов цезия и стронция 90 в пищевых продуктах и питьевой воде, установленные в связи с аварией на Чернобыльской АЭС (ВДУ 91)». Приводим некоторые из них.
Приводим некоторые из них.
Эти нормы введены в действие с 22 января 1991 г. В последующем они могут быть пересмотрены, но только в сторону уменьшения.
нормы и правила безопасности – Москва 24, 22.05.2013
Фото: ИТАР-ТАСС
В Москве может появиться закон о радиационной безопасности. Угрожает ли радиация москвичам, как можно самостоятельно измерить уровень радиации, и так ли она вообще опасна, как говорят, рассказывает M24.ru.
В прошлом веке к природным катаклизмам добавился новый вид катастроф – техногенные аварии. Порой они оказываются даже страшнее, чем землетрясения, смерчи и цунами. Самой страшной техногенной катастрофой в истории человечества считается авария на заводе по производству удобрений в индийском городе Бхопал в 1984 году, когда выброс ядовитых газов стал причиной смерти по меньшей мере 18 тысяч человек. Не менее ужасные последствия для природы имела Чернобыльская авария, после которой человечество пострадало от «мирного атома». Люди начали бояться радиации.
Между тем радиация является вещью вполне обыденной. Большая часть излучения, получаемого нами ежегодно, является не техногенной, а природной. Причем в ряде стран мира радиационный фон повышен, например в Бразилии или Индии.
В целом доза радиации, получаемой нами при просмотре футбольного или хоккейного матча по телевизору, – 0,01 микрозиверт– нанести вред здоровью не может. Обычный радиационный фон, которому подвергаются все люди в повседневной жизни, составляет 0,22-0,23 микрозиверт в час.
Чернобыль. Фото: ИТАР-ТАСС
А вот фон в 0,7 микрозиверт в час уже считается повышенным и основанием для того, чтобы вызывать соответствующих специалистов. Впрочем, это касается повседневной жизни. Для работников атомной промышленности действуют совсем другие правила – 2,28 микрозиверт в час являются границей допустимой дозы облучения.
При полученной разовой дозе облучения в 0,5 зиверт у человека наблюдаются кратковременные изменения состава крови, 1 зиверт в половине случаев приводит к развитию лучевой болезни, 4,5 зиверт приводит к смерти половине облученных, а 6 зиверт является смертельной дозой.
Правда, получить такое облучение в повседневной жизни практически невозможно. Единственной процедурой, которой не рекомендуется злоупотреблять, является рентгеновское обследование. Врачи всегда спрашивают, делали ли вы рентген в этом году и если делали, то когда именно. Это не пустые вопросы, а забота о вашей безопасности. Рентген рентгену рознь – при обследовании зубов доза облучения намного ниже, чем при исследовании внутренних органов. А наиболее «радиоактивной» процедурой является флюорография. Но стоит отметить, что никакого риска быть облученным при однократном и двукратном флюорографическом обследовании нет.
Если же вы все-таки желаете снизить дозу облучения, получаемого ежегодно, то нужно сменить монитор и телевизор с лучевыми трубками на более современные модели, которые гораздо менее радиоактивны, а также не ставить их близко к кровати.
Дозиметр. Фото: ИТАР-ТАСС
Радиация коварна тем, что «на глазок» определить, какую дозу излучения вы получаете, практически невозможно. Именно из-за этого ее свойства люди так и боятся радиации. Проживая в Москве, можно практически не беспокоиться о вероятности радиационного заражения, но все же помните, что узнать уровень радиационного фона можно только при помощи дозиметра. Никаких косвенных признаков и народных примет не существует.
Дозиметры давно не являются редкостью, ведь процедуры радиационного контроля ежедневно проводятся на предприятиях и банках. Прибор может приобрести любой желающий.
По сути, самый лучший способ обезопасить себя от радиации – не находиться в местах с повышенным радиационным фоном. Как природных, например, некоторых курортов Бразилии, Индии и Мадагаскара, так и тех, которые приобрели такие «способности» под влиянием деятельности человека – Чернобыль и Фукусима.
Фото: ИТАР-ТАСС
Если говорить о продуктах питания, то от воздействия радиации защищают свежие овощи и фрукты, а также красное вино. Оно содержит природный антиоксидант, который способен предотвратить некоторые повреждения, причиняемые организму большими дозами радиации.
А вот опасным продуктом для тех, кто желает снизить дозу радиационного излучения, является оленина. В мясе оленей радиоактивные изотопы вроде свинца и полония присутствуют в достаточно больших количествах.
В целом вероятность радиационного заражения в Москве стремится к нулю. Но все же уменьшить дозу излучения, получаемого вами, никогда не будет лишним.
Самостоятельная защита от радиации | Information for Individuals with Limited English Proficiency
Радиоактивное излучение является частью нашей жизни. Вокруг нас постоянно присутствует фоновая радиация, излучаемая в основном природными минералами. К счастью, ситуации, в которых среднестатистический индивид подвергается воздействию неконтролируемых источников радиации, превышающей фоновую, очень редки. Тем не менее, целесообразно подготовиться и знать, как действовать в случае подобной ситуации.
Лучший способ подготовиться — это понять принципы защиты от радиации с помощью времени, расстояния и экранирования. Во время радиологической аварийной ситуации (большого выброса радиоактивных веществ в окружающую среду) мы можем воспользоваться этими принципами для самозащиты и защиты своих семей.
Содержание страницы:
Время, расстояние и экранирование
Время, расстояние и экранирование снижают воздействие радиации примерно так же, как они защищают вас от чрезмерного солнечного воздействия:
- Время: для тех, кто подвергается дополнительному воздействию радиоактивного излучения помимо естественной фоновой радиации, ограничение или сокращение времени воздействия снижает дозу радиации.
- Расстояние: точно так же, как тепло от огня ослабевает по мере того, как вы отдаляетесь от него, доза радиации значительно снижается по мере увеличения расстояния от источника излучения.
- Экранирование: барьеры из свинца, бетона или воды обеспечивают защиту от проникающих гамма-лучей и рентгеновского излучения.
 По этой причине некоторые радиоактивные вещества хранятся под водой или в облицованных бетоном или свинцом помещениях, а стоматологи кладут свинцовое одеяло на пациентов, делая рентгеновские снимки зубов. Следовательно, установка надежного экрана между вами и источником радиоактивного излучения значительно снизит или устранит получаемую дозу облучения.
По этой причине некоторые радиоактивные вещества хранятся под водой или в облицованных бетоном или свинцом помещениях, а стоматологи кладут свинцовое одеяло на пациентов, делая рентгеновские снимки зубов. Следовательно, установка надежного экрана между вами и источником радиоактивного излучения значительно снизит или устранит получаемую дозу облучения.
Верх страницы
Радиационные аварийные ситуацииНа практике было подтверждено, что при крупномасштабном выбросе радиации, например, вследствие аварии на атомной электростанции или в результате террористического акта, нижеследующие рекомендации обеспечивают максимальную защиту.
В случае радиационной аварии, вы можете принять следующие меры для защиты себя, своих близких и ваших домашних животных: Зайди в укрытие, Оставайся в укрытии и Будь на связи. Выполняйте рекомендации аварийной бригады и представителей спасательных служб.
Зайди в укрытие
В случае радиационной опасности вас могут попросить войти в помещение и укрыться там на некоторое время.
- Данное действие называется «Обеспечение локального убежища».
- Находитесь в центре здания или подвала, подальше от дверей и окон.
- Возьмите с собой в укрытие домашних животных.
Оставайся в укрытии
Здания способны обеспечить ощутимую защиту от радиоактивного излучения. Чем больше стен между вами и внешним миром, тем больше барьеров между вами и радиоактивным веществом снаружи. Своевременное укрытие в помещениях и пребывание в них после радиологического инцидента способно ограничить воздействие радиации и, возможно, спасет вам жизнь.
- Закройте окна и двери.
- Примите душ или протрите открытые части тела влажной тканью.
- Пейте бутилированную воду и принимайте пищу из герметично закрывающейся тары.
Будь на связи
Сотрудники экстренных служб обучены реагировать на аварийные ситуации и будут принимать конкретные меры для обеспечения безопасности людей. Оповещение может осуществляться через социальные сети, системы экстренного оповещения, телевидение или радио.
Оповещение может осуществляться через социальные сети, системы экстренного оповещения, телевидение или радио.
- Получайте оперативную информацию с помощью радио, телевидения, интернета, мобильных устройств и т. д.
- Сотрудники экстренных служб предоставят информацию о том, куда следует обратиться для проверки на радиоактивное заражение.
Если вы обнаружили источник радиоактивного излучения или соприкасались с ним, свяжитесь с ближайшим к вам государственным управлением радиационного контроля [вы покидаете сайт EPA].
Верх страницы
Куда обращаться в случае радиационной аварийной ситуации
Переместитесь в подвальное помещение или в центр прочного здания. Радиоактивное вещество оседает снаружи зданий, поэтому лучше всего держаться как можно дальше от стен и крыши. Оставайтесь внутри здания по крайней мере в течение суток, пока сотрудники аварийно-спасательной службы не оповестят вас о том, что выходить наружу безопасно.
Верх страницы
Подготовка к радиационной аварийной ситуации
На случай любой чрезвычайной ситуации важно иметь действующий план, для того, чтобы вы и ваша семья знали, как реагировать при возникновении реальной чрезвычайной ситуации. Чтобы подготовить себя и свою семью, уже сейчас выполните следующие этапы:
- Защитите себя: в случае возникновения радиационной аварийной ситуации, зайдите в укрытие, оставайтесь в укрытии и будьте на связи. Повторяйте эту рекомендацию членам вашей семьи в период отсутствия чрезвычайных ситуаций, чтобы они знали, как действовать в случае радиационной аварии.
- Составьте семейный план связи в экстренных случаях: поделитесь семейным планом связи с вашими близкими и отрабатывайте его, чтобы ваша семья знала, как реагировать в чрезвычайной ситуации. Для получения дополнительной информации о создании плана, включая шаблоны, посетите раздел «Make a Plan» на сайте Ready.gov/plan (на английском языке).

- Соберите комплект на случай чрезвычайных ситуаций: Данный комплект может использоваться в любой чрезвычайной ситуации и включает в себя нескоропортящиеся продукты питания, радио с питанием от батареек или генератора с ручным приводом, воду, фонарик, батарейки, средства первой медицинской помощи и копии важных для вас документов, если вам предстоит эвакуация. Для получения дополнительной информации о том, что входит в комплект, см. раздел «Basic Disaster Supplies Kit» на сайте Ready.gov/kit (на английском языке).
- Ознакомьтесь с планом действий при радиационных чрезвычайных ситуациях в вашей общине: проконсультируйтесь с местными должностными лицами, со школой вашего ребенка, по месту вашей работы и т.д., чтобы выяснить, насколько они готовы к радиологической чрезвычайной ситуации.
- Ознакомьтесь с Системой сигнализации и оповещения населения о возникновении аварийных ситуаций: Эта система будет использоваться для оповещения населения в случае возникновения радиологического инцидента. Во многих общинах для экстренных уведомлений есть системы оповещения текстовыми сообщениями или электронной почтой. Чтобы узнать, какие оповещения доступны в вашем регионе, введите в Интернете в строке поиска название вашего поселка, города или округа и слово «оповещение» (“alerts”).
- Определите достоверные источники информации: уже сейчас определите для себя надежные источники информации и вернитесь к этим источникам в случае возникновения чрезвычайной ситуации для получения сообщений и инструкций. К сожалению, из прошлых бедствий и чрезвычайных ситуаций, мы знаем, что немногочисленные группы лиц могут воспользоваться возможностью распространять ложную информацию.
Верх страницы
Йодид калия (KI)
Не принимайте йодид калия (KI) и не давайте его другим, за исключением случаев, когда это специально рекомендовано отделом здравоохранения, сотрудниками спасательных служб или вашим врачом.
КI предписывается только в случаях попадания в окружающую среду радиоактивного йода и защищает только щитовидную железу. КI работает путем заполнения щитовидной железы человека стабильным йодом, тогда как вредный радиоактивный йод из выброса не поглощается, тем самым снижая риск развития рака щитовидной железы в будущем.
Ниже приведены вопросы и ответы со страницы Йодистый калий (KI) на веб-сайте Центров по контролю и профилактике заболеваний (CDC) (на английском).
Что такое йодид калия?
KI (йодид калия) не удерживает радиоактивный йод от попадания в организм и не способен устранить последствия для здоровья, вызванные радиоактивным йодом при повреждения щитовидной железы.
KI (йодид калия) защищает от радиоактивного йода только щитовидную железу, но не другие части тела.
KI (йодид калия) не способен защитить организм от других радиоактивных элементов, кроме радиоактивного йода— при отсутствии радиоактивного йода прием KI не обеспечивает защиту и может нанести вред.
Поваренная соль и продукты, богатые йодом, не содержат достаточного количества йода, необходимого для предотвращения попадания радиоактивного йода в щитовидную железу. Не используйте поваренную соль или продукты питания в качестве замены KI.
Как работает KI (йодид калия)?
Щитовидная железа не способна отличать стабильный йод от радиоактивного. Она абсорбирует оба вида йода.
KI (йодид калия) предотвращает попадание радиоактивного йода в щитовидную железу. Когда человек принимает KI, стабильный йод в препарате поглощается щитовидной железой. Поскольку KI содержит очень много стабильного йода, щитовидная железа «переполняется» и более не может абсорбировать йод—ни стабильный, ни радиоактивный— на ближайшие 24 часа.
KI (йодид калия) не может обеспечить 100% защиты от радиоактивного йода. Защищенность будет возрастать в зависимости от трех факторов.
- Время после радиоактивного заражения: чем скорее человек примет KI, тем больше времени будет у щитовидной железы, чтобы «заправиться» стабильным йодом.

- Абсорбция: количество стабильного йода, который попадает в щитовидную железу, зависит от того, как быстро KI всасывается в кровь.
- Доза радиоактивного йода: сведение к минимуму общего количества радиоактивного йода, полученного человеком, снижает количество вредного радиоактивного йода, который поглощается щитовидной железой.
Как часто следует принимать KI (йодид калия)?
Прием более сильной дозы KI (йодида калия) или же прием KI чаще, чем рекомендуется, не обеспечивает большей защиты и может вызвать тяжелую болезнь или смерть.
Разовая доза KI (йодида калия) защищает щитовидную железу в течение 24 часов. Для защиты щитовидной железы, как правило, вполне достаточно одноразовой дозы в установленных размерах.
В некоторых случаях люди могут подвергаться воздействию радиоактивного йода более суток. Если это случится, сотрудники органов здравоохранения или спасательных служб могут порекомендовать вам принимать одну дозу KI (йодида калия) каждые 24 часа в течение нескольких дней.
Каковы побочные эффекты KI (йодида калия)?
Побочные эффекты KI (йодида калия) могут включать расстройство желудка или желудочно-кишечного тракта, аллергические реакции, сыпь и воспаление слюнных желез.
При приеме в соответствии с рекомендациями KI (йодид калия) изредка может оказать вредное воздействие на здоровье, связанное со щитовидной железой.
Эти редкие побочные эффекты более вероятны в тех случаях, если человек:
- принимает дозу KI выше, чем рекомендуется
- принимает препарат несколько дней подряд
- уже имеет заболевание щитовидной железы
Новорожденные младенцы (в возрасте до 1 месяца), получающие более одной дозы KI (йодида калия), подвергаются риску развития состояния, известного как гипотиреоз (слишком низкий уровень гормонов щитовидной железы). при отсутствии лечения гипотиреоз может привести к повреждению головного мозга.
- Младенцы, получающие более одной дозы KI, должны проходить проверку уровня гормонов щитовидной железы и находиться под наблюдением врача.
- Избегайте повторного введения KI новорожденным.
Верх страницы
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕТРАДИЦИОННОЕ ФРАКЦИОНИРОВАНИЕ ДОЗЫ
А.В. Бойко, Черниченко А.В., С.Л. Дарьялова, Мещерякова И.А., С.А. Тер-Арутюнянц
МНИОИ им. П.А. Герцена, Москва
Использование ионизирующих излучений в клинике основано на различиях в радиочувствительности опухоли и нормальных тканей, именуемых радиотерапевтическим интервалом. При воздействии ионизирующих излучений на биологические объекты возникают альтернативные процессы: повреждение и восстановление. Благодаря фундаментальным радиобиологическим исследованиям, выяснилось, что при облучении в культуре ткани степень лучевого повреждения и восстановления опухоли и нормальных тканей равнозначны. Но ситуация резко меняется при облучении опухоли в организме больного. Первичное повреждение остается равнозначным, но не равнозначно восстановление. Нормальные ткани за счет стойких нейрогуморальных связей с организмом-носителем восстанавливают лучевые повреждения быстрее и полнее, чем опухоль в силу присущей ей автономии. Используя эти различия и управляя ими, можно добиться тотального разрушения опухоли, сохранив нормальные ткани.
Нетрадиционное фракционирование дозы представляется нам одним из самых привлекательных способов управления радиочувствительностью. При адекватно подобранном варианте дробления дозы без каких-либо дополнительных затрат можно добиться существенного повышения повреждения опухоли с одновременной защитой окружающих тканей.
Обсуждая проблемы нетрадиционного фракционирования дозы, следует определить понятие «традиционных» режимов лучевой терапии. В разных странах мира эволюция лучевой терапии привела к появлению различных, но ставших «традиционными» для этих стран режимов фракционирования дозы. Например, в соответствии с Манчестерской школой, курс радикального лучевого лечения состоит из 16 фракций и проводится более 3 недель, в то время как в США 35-40 фракций подводятся в течение 7-8 недель. В России в случаях радикального лечения традиционным считается фракционирование по 1,8-2 Гр один раз в день, 5 раз в неделю до суммарных доз, которые определяются морфологической структурой опухоли и толерантностью нормальных тканей, расположенных в зоне облучения (обычно в пределах 60-70 Гр).
В разных странах мира эволюция лучевой терапии привела к появлению различных, но ставших «традиционными» для этих стран режимов фракционирования дозы. Например, в соответствии с Манчестерской школой, курс радикального лучевого лечения состоит из 16 фракций и проводится более 3 недель, в то время как в США 35-40 фракций подводятся в течение 7-8 недель. В России в случаях радикального лечения традиционным считается фракционирование по 1,8-2 Гр один раз в день, 5 раз в неделю до суммарных доз, которые определяются морфологической структурой опухоли и толерантностью нормальных тканей, расположенных в зоне облучения (обычно в пределах 60-70 Гр).
Дозолимитирующими факторами в клинической практике служат либо острые лучевые реакции, либо отсроченные постлучевые повреждения, которые в значительной мере зависят от характера фракционирования. Клинические наблюдения за пациентами, подвергнутыми лечению в традиционных режимах, позволили лучевым терапевтам установить ожидаемую связь между степенью выраженности острых и отсроченных реакций (другими словами, интенсивность острых реакций коррелирует с вероятностью развития отсроченного повреждения нормальных тканей). По-видимому, наиболее важным следствием разработки режимов нетрадиционного фракционирования дозы, имеющим многочисленные клинические подтверждения, является тот факт, что описанная выше ожидаемая вероятность появления лучевых повреждений уже не является корректной: отсроченные эффекты более чувствительны к изменениям разовой очаговой дозы, подводимой за фракцию, а острые реакции более чувствительны к колебаниям уровня суммарной дозы.
Итак, толерантность нормальных тканей определяется дозозависимыми параметрами (суммарная доза, общая продолжительность лечения, разовая доза за фракцию, количество фракций). Два последних параметра определяют уровень аккумуляции дозы. Интенсивность острых реакций, развивающихся в эпителии и других нормальных тканях, в чью структуру входят стволовые, созревающие и функциональные клетки (например, костный мозг), отражает равновесие между уровнем клеточной гибели под влиянием ионизирующего излучения и уровнем регенерации выживших стволовых клеток. Это равновесие в первую очередь зависит от уровня аккумуляции дозы. Тяжесть острых реакций определяет также и уровень дозы, подводимой за фракцию (в пересчете на 1 Гр крупные фракции оказывают большее повреждающее действие, чем мелкие).
Это равновесие в первую очередь зависит от уровня аккумуляции дозы. Тяжесть острых реакций определяет также и уровень дозы, подводимой за фракцию (в пересчете на 1 Гр крупные фракции оказывают большее повреждающее действие, чем мелкие).
После достижения максимума острых реакций (например, развитие влажного либо сливного эпителиита слизистых) дальнейшая гибель стволовых клеток не может привести к нарастанию интенсивности острых реакций и проявляется лишь в увеличении времени заживления. И только если количество выживших стволовых клеток не будет достаточно для репопуляции тканей, то острые реакции могут перейти в лучевые повреждения (9).
Лучевые повреждения развиваются в тканях, характеризующихся медленной сменой клеточной популяции, таких, например, как зрелая соединительная ткань и клетки паренхимы различных органов. В связи с тем, что в таких тканях клеточное истощение не проявляется ранее окончания стандартного курса лечения, то в процессе последнего регенерация невозможна. Таким образом, в отличие от острых лучевых реакций, уровень аккумуляции дозы и общая длительность лечения не оказывают существенного влияния на тяжесть поздних повреждений. В то же время, поздние повреждения зависят главным образом от суммарной дозы, дозы за фракцию, и интервала между фракциями особенно в случаях, когда фракции подводятся за короткий промежуток времени.
С точки зрения противоопухолевого эффекта более эффективен непрерывный курс облучения. Однако это не всегда возможно из-за развития острых лучевых реакций. Одновременно стало известно, что гипоксия опухолевой ткани связана с недостаточной васкуляризацией последней, и было предложено после подведения определенной дозы (критической по развитию острых лучевых реакций) делать перерыв в лечении для реоксигенации и восстановления нормальных тканей. Неблагоприятным моментом перерыва является опасность репопуляции сохранивших жизнеспособность опухолевых клеток, поэтому при использовании расщепленного курса не наблюдается увеличения радиотерапевтического интервала. Первое сообщение о том, что по сравнению с непрерывным курсом лечения расщепленный дает худшие результаты в случае отсутствия коррекции разовой очаговой и общей дозы для компенсации перерыва в лечении, было опубликовано Million et Zimmerman в 1975 (7). Позднее Budhina et al (1980) подсчитали, что доза, необходимая для компенсации перерыва, составляет примерно 0,5 Гр в день (3). В более позднем сообщении Overgaard et al (1988) утверждается: для того, чтобы достичь равной степени радикальности лечения, 3-х недельный перерыв в терапии рака гортани требует увеличения РОД на 0,11-0,12 Гр (т.е. 0,5-0,6 Гр в день) (8). В работе показано, что при величине РОД 2 Гр для сокращения фракции выживающих клоногенных клеток за 3х-недельный перерыв количество клоногенных клеток удваивается в 4-6 раз, при этом время их удвоения приближается к 3,5-5 дням. Наиболее детальный анализ дозового эквивалента для регенерации в процессе фракционированной лучевой терапии был произведен Withers et al и Maciejewski et al (13, 6). Исследования показывают, что после различной продолжительности отставания во фракционированном лучевом лечении выживающие клоногенные клетки развивают настолько высокие темпы репопуляции, что для их компенсации каждый дополнительный день лечения требует прибавки примерно 0,6 Гр. Данная величина дозового эквивалента репопуляции в процессе лучевой терапии близка к таковой, полученной при анализе расщепленного курса. Тем не менее, при расщепленном курсе улучшается переносимость лечения, особенно в случаях, когда острые лучевые реакции препятствуют проведению непрерывного курса.
Первое сообщение о том, что по сравнению с непрерывным курсом лечения расщепленный дает худшие результаты в случае отсутствия коррекции разовой очаговой и общей дозы для компенсации перерыва в лечении, было опубликовано Million et Zimmerman в 1975 (7). Позднее Budhina et al (1980) подсчитали, что доза, необходимая для компенсации перерыва, составляет примерно 0,5 Гр в день (3). В более позднем сообщении Overgaard et al (1988) утверждается: для того, чтобы достичь равной степени радикальности лечения, 3-х недельный перерыв в терапии рака гортани требует увеличения РОД на 0,11-0,12 Гр (т.е. 0,5-0,6 Гр в день) (8). В работе показано, что при величине РОД 2 Гр для сокращения фракции выживающих клоногенных клеток за 3х-недельный перерыв количество клоногенных клеток удваивается в 4-6 раз, при этом время их удвоения приближается к 3,5-5 дням. Наиболее детальный анализ дозового эквивалента для регенерации в процессе фракционированной лучевой терапии был произведен Withers et al и Maciejewski et al (13, 6). Исследования показывают, что после различной продолжительности отставания во фракционированном лучевом лечении выживающие клоногенные клетки развивают настолько высокие темпы репопуляции, что для их компенсации каждый дополнительный день лечения требует прибавки примерно 0,6 Гр. Данная величина дозового эквивалента репопуляции в процессе лучевой терапии близка к таковой, полученной при анализе расщепленного курса. Тем не менее, при расщепленном курсе улучшается переносимость лечения, особенно в случаях, когда острые лучевые реакции препятствуют проведению непрерывного курса.
В последующем величину интервала сократили до 10-14 дней, т.к. репопуляция выживших клоновых клеток начинается в начале 3-й недели.
Толчком к развитию «универсального модификатора» — нетрадиционных режимов фракционирования — послужили данные, полученные при изучении конкретного радиосенсибилизатора ГБО. Еще в 60-х годах было показано, что применение крупных фракций при лучевой терапии в условиях ГБО более эффективно по сравнению с классическим фракционированием даже в контрольных группах на воздухе (2). Безусловно, эти данные способствовали развитию и введению в практику нетрадиционных режимов фракционирования. Сегодня таких вариантов огромное количество. Вот некоторые из них.
Безусловно, эти данные способствовали развитию и введению в практику нетрадиционных режимов фракционирования. Сегодня таких вариантов огромное количество. Вот некоторые из них.
Гипофракционирование: применяются более крупные, по сравнению с классическим режимом, фракции (4-5 Гр), общее количество фракций уменьшено.
Гиперфракционирование подразумевает собой применение небольших, по сравнению с «классическими», разовых очаговых доз (1-1,2 Гр), подведенных несколько раз в день. Общее число фракций увеличено.
Непрерывное ускоренное гиперфракционирование как вариант гиперфракционирования: фракции более приближены к классическим (1,5-2 Гр), но подводятся несколько раз в день, что позволяет уменьшить общее время лечения.
Динамическое фракционирование: режим дробления дозы, в котором подведение укрупненных фракций чередуется с классическим фракционированием либо подведением доз меньше 2 Гр несколько раз в день и т.д.
В основу построения всех схем нетрадиционного фракционирования положена информация о различиях в скорости и полноте восстановления лучевых повреждений в различных опухолях и нормальных тканях и степень их реоксигенации.
Так, опухоли, характеризующиеся быстрым темпом роста, высоким пролиферативным пулом, выраженной радиочувствительностью, требуют подведения укрупненных разовых доз. Примером может служить метод лечения больных мелкоклеточным раком легкого (МКРЛ), разработанный в МНИОИ им. П.А. Герцена (1).
При этой локализации опухоли разработаны и изучены в сравнительном аспекте 7 методик нетрадиционного фракционирования дозы. Наиболее эффективной из них оказалась методика дневного дробления дозы. С учетом клеточной кинетики этой опухоли облучение ежедневно проводилось укрупненными фракциями 3,6 Гр с дневным дроблением на три порции по 1,2 Гр, подводимые с интервалом 4-5 часов. За 13 лечебных дней СОД составляет 46,8 Гр, эквивалентных 62 Гр. Из 537 больных полная резорбция опухоли в локо-региональной зоне составила 53-56% против 27% при классическом фракционировании. Из них 23,6% с локализованной формой пережили 5-летний рубеж.
За 13 лечебных дней СОД составляет 46,8 Гр, эквивалентных 62 Гр. Из 537 больных полная резорбция опухоли в локо-региональной зоне составила 53-56% против 27% при классическом фракционировании. Из них 23,6% с локализованной формой пережили 5-летний рубеж.
Методика многократного дробления суточной дозы (классической или укрупненной) с интервалом 4-6 часов находит все более широкое применение. В связи с быстрым и более полным восстановлением нормальных тканей при использовании этой методики имеется возможность увеличение дозы в опухоли на 10-15% без возрастания опасности повреждения нормальных тканей.
Сказанное нашло подтверждение в многочисленных рандомизированных исследованиях ведущих клиник мира. Примером могут служить несколько работ, посвященных изучению немелкоклеточного рака легкого (НМРЛ).
В исследовании RTOG 83-11 (II фаза) изучали режим гиперфракционирования, где сравнивались различные уровни СОД (62 Гр; 64,8 Гр; 69,6 Гр; 74,4 Гр и 79,2 Гр), подводимые фракциями по 1,2 Гр дважды в день. Наибольшая выживаемость больных отмечена при СОД 69,6 Гр. Поэтому в III фазе клинических испытаний изучали режим фракционирования с СОД 69,6 Гр (RTOG 88-08). В исследование были включены 490 больных местно-распространенным НМРЛ, которые были рандомизированы следующим образом: 1 группа — по 1,2 Гр два раза в день до СОД 69,6 Гр и 2 группа — по 2Гр ежедневно до СОД 60 Гр. Однако, отдаленные результаты оказались ниже ожидаемых: медиана выживаемости и 5-летняя продолжительность жизни в группах составила 12,2 мес., 6% и 11,4 мес., 5% соответственно.
Fu XL et al. (1997) исследовали режим гиперфракционирования по схеме 1,1 Гр 3 раза в день с интервалом 4 часа до СОД 74,3 Гр. 1-, 2-, и 3- летняя выживаемость составила 72%, 47%, и 28% в группе больных, получавших ЛТ в режиме гиперфракционирования, и 60%, 18%, и 6% в группе с классическим фракционированием дозы (4). При этом «острые» эзофагиты в изучаемой группе наблюдались достоверно чаще (87%) по сравнению с контрольной группой (44%). В то же время не отмечено увеличения частоты и тяжести поздних лучевых осложнений.
В то же время не отмечено увеличения частоты и тяжести поздних лучевых осложнений.
В рандомизированном исследовании Saunders NI et al (563 больных) сравнивались две группы больных (10). Непрерывное ускоренное фракционирование (1,5 Гр 3 раза в день в течение 12 дней до СОД 54 Гр) и классическая лучевая терапия до СОД 66 Гр. Больные, пролеченные в режиме гиперфракционирования, имели значительное улучшение показателей 2-летней выживаемости (29%) по сравнению со стандартным режимом (20%). В работе не отмечено также увеличения частоты поздних лучевых повреждений. В то же время в изучаемой группе тяжелые эзофагиты наблюдались чаще, чем при классическом фракционировании (19% и 3% соответственно), хотя они и отмечались преимущественно после окончания лечения.
Другое направление исследований представляет метод дифференцированного облучения первичной опухоли в локорегиональной зоне по принципу «поле в поле», при котором к первичной опухоли подводится большая доза, чем к регионарным зонам, за тот же промежуток времени. Uitterhoeve AL et al (2000) в исследовании EORTC 08912 с целью повышения дозы до 66 Гр добавляли 0,75 Гр ежедневно (boost — объем). 1 и 2 годичная выживаемость составили 53% и 40% при удовлетворительной переносимости (12).
Sun LM et al (2000) подводили дополнительно ежедневно локально к опухоли 0,7 Гр, что позволило, наряду с уменьшением общего времени лечения, достичь в 69,8% случаев ответов опухоли по сравнению с 48,1% при использовании классического режима фракционирования (11). King et al (1996) использовали режим ускоренного гиперфракционирования в сочетании с увеличением очаговой дозы до 73,6 Гр (boost) (5). При этом медиана выживаемости была 15,3 мес.; среди 18 пациентов НМРЛ, подвергшихся контрольному бронхоскопическому исследованию, гистологически подтвержденный локальный контроль составил около 71% при сроках наблюдения до 2 лет.
При самостоятельной лучевой терапии и комбинированном лечении хорошо зарекомендовали себя различные варианты динамического фракционирования дозы, разработанные в МНИОИ им. П.А. Герцена. Они оказались эффективнее, чем классическое фракционирование и монотонное подведение укрупненных фракций при использовании изоэффективных доз не только при плоскоклеточном и аденогенном раке (легкое, пищевод, прямая кишка, желудок, гинекологический рак), но и при саркомах мягких тканей.
П.А. Герцена. Они оказались эффективнее, чем классическое фракционирование и монотонное подведение укрупненных фракций при использовании изоэффективных доз не только при плоскоклеточном и аденогенном раке (легкое, пищевод, прямая кишка, желудок, гинекологический рак), но и при саркомах мягких тканей.
Динамическое фракционирование существенно повысило эффективность облучения за счет увеличения СОД без усиления лучевых реакций нормальных тканей.
Так, при раке желудка, традиционно рассматриваемом как радиорезистентная модель злокачественных опухолей, использование предоперационного облучения по схеме динамического фракционирования позволило увеличить 3-летнюю выживаемость больных до 78% по сравнению с 47-55% при хирургическом лечении или при комбинированном с применением классического и интенсивно-концентрированного режима облучения. При этом у 40% больных отмечен лучевой патоморфоз III-IV степени.
При саркомах мягких тканей применение дополнительно к операции лучевой терапии с использованием оригинальной схемы динамического фракционирования позволило снизить частоту местных рецидивов с 40,5% до 18,7% при увеличении 5-летней выживаемости с 56% до 65%. Отмечено достоверное повышение степени лучевого патоморфоза (III-IV степень лучевого патоморфоза у 57% против 26%), и эти показатели коррелировали с частотой локальных рецидивов (2% против 18%).
Сегодня отечественная и мировая наука предлагает использовать различные варианты нетрадиционного фракционирования дозы. Такое многообразие в определенной мере объясняется тем, что учет репарации сублетальных и потенциально летальных повреждений в клетках, репопуляции, оксигенации и реоксигенации, продвижения по фазам клеточного цикла, т.е. основных факторов, определяющих ответ опухоли на облучение, для индивидуального прогнозирования в клинике практически невозможен. Пока мы располагаем лишь групповыми признаками для подбора режима фракционирования дозы. Такой подход в большинстве клинических ситуаций при обоснованных показаниях выявляет преимущества нетрадиционного фракционирования перед классическим.
Такой подход в большинстве клинических ситуаций при обоснованных показаниях выявляет преимущества нетрадиционного фракционирования перед классическим.
Таким образом, можно заключить, что нетрадиционное фракционирование дозы позволяет одновременно альтернативно влиять на степень лучевого повреждения опухоли и нормальных тканей, при этом достоверно улучшает результаты лучевого лечения при сохранности нормальных тканей. Перспективы развития НФД связаны с поиском более тесных корреляций между режимами облучения и биологическими характеристиками опухоли.
Список литературы:
1. Бойко А.В., Трахтенберг А.X. Лучевой и хирургический методы в комплексной терапии больных с локализованной формой мелкоклеточного рака легкого. В кн.: «Рак легкого».-М.,1992, с.141-150.
2. Дарьялова С.Л. Гипербарическая оксигенация в лучевом лечении больных злокачественными опухолями. Глава в кн.: «гипербарическая оксигенация», М., 1986.
3. Budhina M, Skrk J, Smid L, et al: Tumor cell repopulating in the rest interval of split-course radiation treatment. Stralentherapie 156:402, 1980
4. Fu XL, Jiang GL, Wang LJ, Qian H, Fu S, Yie M, Kong FM, Zhao S, He SQ, Liu TF Hyperfractionated accelerated radiation therapy for non-small cell lung cancer: clinical phase I/II trial. //Int J Radiat Oncol Biol Phys; 39(3):545-52 1997
5. King SC, Acker JC, Kussin PS, et al. High-dose hyperfractionated accelerated radiotherapy using a concurrent boost for the treatment of nonsmall cell lung cancer: unusual toxicity and promising early results. //Int J Radiat Oncol Biol Phys. 1996;36:593-599.
6. Maciejewski B, Withers H, Taylor J, et al: Dose fractionation and regeneration in radiotherapy for cancer of the oral cavity and oropharynx: Tumor dose-response and repopulating. Int J Radiat Oncol Biol Phys 13:41, 1987
7. Million RR, Zimmerman RC: Evaluation of University of Florida split-course technique for various head and neck squamous cell carcinomas. Cancer 35:1533, 1975
Million RR, Zimmerman RC: Evaluation of University of Florida split-course technique for various head and neck squamous cell carcinomas. Cancer 35:1533, 1975
8. Overgaard J, Hjelm-Hansen M, Johansen L, et al: Comparison of conventional and split-course radiotherapy as primary treatment in carcinoma of the larynx. Acta Oncol 27:147, 1988
9. Peters LJ, Ang KK, Thames HD: Accelerated fractionation in the radiation treatment of head and neck cancer: A critical comparison of different strategies. Acta Oncol 27:185, 1988
10. Saunders MI, Dische S, Barrett A, et al. Continuous hyperfractionated accelerated radiotherapy (CHART) versus conventional radiotherapy in non-small-cell lung cancer: a randomized multicentre trial. CHART Steering Committee. //Lancet. 1997;350:161-165.
11. Sun LM, Leung SW, Wang CJ, Chen HC, Fang FM, Huang EY, Hsu HC, Yeh SA, Hsiung CY, Huang DT Concomitant boost radiation therapy for inoperable non-small-cell lung cancer: preliminary report of a prospective randomized study. //Int J Radiat Oncol Biol Phys; 47(2):413-8 2000
12. Uitterhoeve AL, Belderbos JS, Koolen MG, van der Vaart PJ, Rodrigus PT, Benraadt J, Koning CC, Gonzalez Gonzalez D, Bartelink H Toxicity of high-dose radiotherapy combined with daily cisplatin in non-small cell lung cancer: results of the EORTC 08912 phase I/II study. European Organization for Research and Treatment of Cancer. //Eur J Cancer; 36(5):592-600 2000
13. Withers RH, Taylor J, Maciejewski B: The hazard of accelerated tumor clonogen repopulating during radiotherapy. Acta Oncol 27:131, 1988
однократное облучение
При однократном тотальном -облучении превышение указанных ниже доз может привести к появлению признаков лучевого отравления с соответственной интенсивностью реакции организма на воздействие облучения. [ …]
[ …]
Люди могут подвергаться однократному или неоднократному (повторному) облучению. При этом суммарная доза облучения может превысить допустимую, установленную для данного контингента. Важным фактором является время облучения: успевает ли организм «ликвидировать» последствия своего радиационного поражения. Считается, что при 10%-ном радиационном поражении организм не может полностью себя восстановить, так как это порог, вызывающий отдаленные последствия облучения.[ …]
Планируемое повышение уровня облучения дозой не более 100 мЗв в год допускается в экстренных случаях (спасение жизни людей, предотвращение развития аварии или облучения большого числа людей) с разрешения территориальных органов санитарно-эпидемиологического надзора, а дозой не более 200 мЗв в год только с разрешения органов санитарно-эпидемиологического надзора РФ. Лица, подвергшиеся облучению дозой, превышающей 100 мЗв, в дальнейшей работе не должны подвергаться облучению дозой свыше 20 мЗв в год. Однократное облучение дозой свыше 200 мЗв в год должно рассматриваться как потенциально опасное.[ …]
Проявления лучевой болезни при однократном облучении в зависимости от полученной дозы и дозы облучения от искусственных источников радиации приведены в табл. 2.3 и 2.4 [61].[ …]
В ультрафиолетовом диапазоне волн при однократном воздейст- ! вии в широком диапазоне длительностей облучения 10-9…104с ПДУ ! энергетической экспозиции Н определяются из табл. 8.1.[ …]
Степень чувствительности различных тканей к облучению неодинакова. Особенно велика чувствительность к радиации кроветворных органов. Так, при однократном облучении всего тела че-ловекадозой 0,5 Гр1 через сутки после облучения резко сокращается число лимфоцитов (продолжительность жизни которых меньше суток). По истечении двух недель после облучения уменьшается также и количество эритроцитов (красных кровяных телец). Продолжительность жизни эритроцитов примерно 100 суток. У здорового человека насчитывается порядка 1014 красных кровяных телец (при ежедневном воспроизводстве 1012), у больного лучевой болезнью такое соотношение нарушается, и в результате организм погибает. [ …]
[ …]
Различают острую форму лучевой болезни, возникающую под влиянием однократного интенсивного облучения, и хроническую, развивающуся под влиянием долговременного, иногда многолетнего облучения малыми дозами радиации.[ …]
Острое действие излучения сильно зависит от мощности по глощенной дозы (интенсивности облучения) и, как правило, имее явно выраженный дозовый порог. При прочих равных условия: доза, полученная в результате однократного облучения, приводи-к гораздо более интенсивным проявлениям лучевой болезни, чел доза, накопленная в течение продолжительного времени. В случас медленного накопления поглощенной дозы радиационные повреждения тканей частично восстанавливаются за счет естественной регенерирующей способности организма.[ …]
В диапазоне видимого и ближнего инфракрасного излучения (длина волны от 380 нм до 1400 нм) нормы ПДУ устанавливаются различными для глаз и для кожи. При однократном воздействии на глаза коллимированного лазерного излучения при длительности облучения менее 1 с нормируется энергия излучения и/, Дж, попадающая в глаза. Значения пду М0ГУТ быть определены из графика на рис. 8.2. При длительности облучения более 1 с нормируется мощность излучения Р, Вт, попадающая в глаза. Значения Яццу определяются из графику на рис. 8.3.[ …]
Ионизирующая способность у-лучей характеризуется экспозиционной дозой (единица измерения — рентген, Р). Дозе 1 Р соответствует поглощение одним граммом биологической ткани энергии 93 эрг, или 1 Р = 9,3 • 10 3 Дж/кг = 10 2 Гр. В зависимости от экспозиционной дозы (начиная от 100 Р) определяется степень поражения человека и животных лучевой болезнью. Различные органы живого организма имеют свою чувствительность к облучению. При ежедневном воздействии дозы 0,002—0,005 Гр наступают изменения в крови, способные отразиться не только на данном живом организме, но и на его потомстве (генетический эффект). При установлении допустимых доз излучения учитывают, что облучение может быть однократным или многократным. Однократным считается облучение, полученное за первые четверо суток (после четырех суток в организме начинается процесс выздоровления). Если время облучения более четырех суток, то такое облучение является многократным.[ …]
Однократным считается облучение, полученное за первые четверо суток (после четырех суток в организме начинается процесс выздоровления). Если время облучения более четырех суток, то такое облучение является многократным.[ …]
Есть еще и другие соображения, говорящие против употребления аэроионизаторов с радиоактивными веществами. Известно, что если ионизирующее действие альфа-лучей, несмотря на его интенсивность, легко устранить, закрыв активное вещество тонким экраном (бумажным или металлическим листком толщиной около ОД мм, так как альфа-лучи не могут пройти сквозь него), то бета-лучи, наоборот, могут проходить сквозь слой алюминия толщиной в несколько миллиметров, а гамма-лучи проникают сквозь несколько сантиметров такого плотного вещества, как свинец. Только полоний и ионий являются чистыми альфа-излучателями. Но и это не спасает положения. Доказано, что большая часть (80%) поражений, нанесенных организму высших животных альфа-излучателя-ми, необратима. Продолжительность жизни животных и дозы альфа-лучей связаны линейной зависимостью. На графиках Стэннарда, Блэра и Бекстера (рис. 23 и 24) видно, что «продолжительность жизни сокращается примерно одинаково при облучении дробными дозами данной величины и такими же однократными дозами» .[ …]
На Всемирной выставке в Брюсселе (1958) демонстрировался листок из лабораторной тетради Марии Кюри, датированный 30 апреля 1902 г. Этот листок “непрерывно движется то к счетчику, то от него. И как только он начинает приближаться, счетчик со все возрастающим беспокойством отмечает попадание в него элементарных частиц из атомов радия, оставшихся полвека назад на листке от рук ученого и по сей день свидетельствующих о беспримерном подвиге этого великого человека-героя» (А. Буянов). Даже если бы с помощью какой-либо портативной защиты, а не толстых свинцовых пластин, полностью обезвредить радиевый аэроионизатор от альфа-, бета-, и гама-из-лучений, то и в этом случае следовало бы протестовать против такого рода прибора. Радиевые излучатели должны всегда находиться под самым бдительным контролем особых органов и запираться в сейфы на часы бездействия. Известно, что лучевая болезнь или рак иногда возникают спустя много лет (10—30) после окончания воздействия радием или другими радиоактивными веществами даже после однократного облучения. Число печатных работ о вредности радиоактивных запылений в последнее время достигло многих тысяч. Эти работы говорят лишь об одном — именно о том, что мы должны, по возможности, изолировать наш организм от радиоактивного излучения.[ …]
Радиевые излучатели должны всегда находиться под самым бдительным контролем особых органов и запираться в сейфы на часы бездействия. Известно, что лучевая болезнь или рак иногда возникают спустя много лет (10—30) после окончания воздействия радием или другими радиоактивными веществами даже после однократного облучения. Число печатных работ о вредности радиоактивных запылений в последнее время достигло многих тысяч. Эти работы говорят лишь об одном — именно о том, что мы должны, по возможности, изолировать наш организм от радиоактивного излучения.[ …]
доз в нашей повседневной жизни
В среднем американцы получают дозу радиации около 0,62 бэр (620 миллибэр) каждый год. Половина этой дозы поступает от естественного радиационного фона. Большая часть этого фонового облучения происходит от радона в воздухе, в меньшем количестве — от космических лучей и самой Земли. (На диаграмме справа показаны эти дозы облучения в перспективе.) Другая половина (0,31 бэр или 310 мбэр) приходится на искусственные источники радиации, включая медицинские, коммерческие и промышленные источники.В целом, ежегодная доза в 620 миллибэр от всех источников излучения не причиняет вреда людям.
На этой странице:
Дозы от медицинских процедур
| На медицинские процедуры приходится почти все (96%) облучение человека техногенной радиацией. Среди этих медицинских процедур рентген, маммография и компьютерная томография используют излучение или выполняют функции, аналогичные функциям радиоизотопов. Однако они не содержат радиоактивных материалов и, следовательно, не регулируются Комиссией по ядерному регулированию США (NRC). Вместо этого большинство этих процедур регулируются государственными агентствами здравоохранения.Фактически, среди этих процедур СРН и его государства-участники только лицензируют и регулируют владение и использование радиоактивных материалов для ядерной медицины. | ||||||||||||||||||||||||||||
Радиоактивность пищевых продуктов
| Все органические вещества (как растения, так и животные) содержат небольшое количество радиации от радиоактивного калия-40 ( 40 K), радия-226 ( 226 Ra) и других изотопов. Кроме того, вся вода на Земле содержит небольшое количество растворенного урана и тория.В результате средний человек получает среднюю внутреннюю дозу около 30 миллибэр этих материалов в год с пищей и водой, которые мы едим и пьем, как показано в следующей таблице. (Суммы указаны в пикокюри на килограмм.) |
| ||||||||||||||||||||||||||||||
Калькулятор персональной годовой дозы излучения
Мы живем в радиоактивном мире, и радиация всегда была вокруг нас как часть нашей естественной среды. Как объяснялось выше, среднегодовая доза на человека из всех источников составляет около 360 мбэр, но нередко кто-либо из нас получает больше этой средней дозы в конкретный год (в основном в результате медицинских процедур). Чтобы узнать свою личную годовую дозу облучения, используйте интерактивный калькулятор персональной годовой дозы облучения или эту удобную для печати таблицу.
Страница Последняя редакция / обновление 20 марта 2020 г.
Эритема — общие проблемы | МАГАТЭ
»Какие кожные эффекты возможны при разных дозах?
Кожа, жир под кожей (подкожный жир), мышцы и волосы — это поверхностные ткани, на которые воздействует радиация во время медицинского облучения. Тяжесть радиационных эффектов зависит от пациента (основные дефекты репарации ДНК, целостности кожи до облучения, состояния здоровья, как указано выше) и от параметров воздействия (фракционирование дозы, общая доза, размер поля облучения).В зависимости от времени появления после облучения кожные повреждения можно разделить на ранние (от нескольких часов до нескольких дней), ранние (от нескольких дней до недель), среднесрочные (от нескольких недель до месяцев) или долгосрочные (месяцы). За исключением факторов, специфичных для пациента, тяжесть травм зависит от дозы облучения кожи.
При дозах на кожу до приблизительно 2 Гр не ожидается никаких вредных эффектов, если не было предварительного облучения кожи. В диапазоне доз 2-5 Гр преходящая эритема может быть быстрой реакцией на радиационное воздействие.Также может наблюдаться заживающая в среднесрочной перспективе эпиляция (выпадение волос).
Эпиляция между 5 и 10 Гр появляется как ранняя реакция. Для доз на верхнем пределе диапазона постоянная частичная эпиляция может наблюдаться в среднесрочной перспективе. Возможна также длительная атрофия или уплотнение дермы.
Для доз на верхнем пределе диапазона постоянная частичная эпиляция может наблюдаться в среднесрочной перспективе. Возможна также длительная атрофия или уплотнение дермы.
При дозах от 10 до 15 Гр может развиться сухое или влажное шелушение (потеря кожи) как ранний симптом. Длительная эритема и стойкая эпиляция в среднесрочной перспективе могут сопровождаться телеангиэктазией (ненормальным скоплением мелких кровеносных сосудов), атрофией кожи или уплотнением в долгосрочной перспективе.При дозах, превышающих 15 Гр, отек (отек кожи) и острые изъязвления могут проявляться как быстрые реакции. Эпиляция и влажная десквамация происходят сразу после облучения. В среднесрочной перспективе, если шелушение не заживает, может возникнуть вторичная язва.
Кожный некроз, требующий хирургического вмешательства, появляется при более высоких дозах. В долгосрочной перспективе вероятны телеангиэктазии, атрофия или уплотнение дермы и вторичное разрушение кожи. Хирургическое лечение может потребоваться, если стойкая рана перерастает в более глубокое поражение.
Очень серьезные реакции могут возникнуть при очень высоких дозах на кожу, превышающих 80 Гр.
Goshen Health | Однодозовое облучение
Лечение рака
Если вам поставили диагноз рака груди на ранней стадии, ваш лечащий врач может предложить комплексный вариант лечения, который сэкономит ваше время и даст вам душевное спокойствие.
Интраоперационная лучевая терапия, или ИОЛТ, обеспечивает однократную высокую дозу радиации одновременно с лампэктомией.Это точное целевое лучевое лечение, которое, как было доказано, так же эффективно, как и обычная наружная лучевая терапия.
ИОРТ спасает здоровые ткани от воздействия радиации. Это также устраняет необходимость в многократных сеансах традиционного лучевого лечения после операции. Это означает меньше нарушений повседневного распорядка, меньше времени в пути и меньше стресса, обычно связанного с лечением рака.
Прицельное облучение во время операции
Наши хирургические онкологи и радиологи онкологического центра Гошен работают вместе, чтобы совместить лучевую терапию с удалением опухоли.Во время операции бригада онкологов направляет локализованное целевое облучение непосредственно в область, где была удалена опухоль. Процедура значительно сводит к минимуму воздействие радиации на окружающие здоровые ткани. Это также снижает риск рецидива, поскольку излучение направлено на область груди, которая больше всего подвержена риску рецидива рака.
Преимущества ИОРТ
Часто пациенты с раком груди получают радиацию в той или иной форме в рамках лечения.Для пациентов, которые соответствуют критериям ИОЛТ, эта инновационная терапия предлагает множество преимуществ.
- Экономит время за счет исключения нескольких недель внешней лучевой терапии после операции
- Снижает побочные эффекты по сравнению со стандартным излучением
- Защищает здоровые ткани , окружающие грудь и близлежащие органы, от радиационного воздействия
Критерии для получения права на IORT
Мы следуем рекомендациям Американского общества радиационной онкологии, чтобы определить, является ли ИОЛТ подходящим вариантом лечения для пациента.Критерии включают:
- Возраст пациента — старше 50
- Размер опухоли — не более 2 см
- Тип рака груди — положительный по рецепторам эстрогена
IORT разработан только для пациентов с раком груди на ранней стадии, перенесших операцию в центре лечения рака Гошен. Для пациентов, у которых рак распространился на лимфатические узлы, мы следуем другому курсу лечения, который может включать традиционную лучевую терапию или даже химиотерапию, чтобы сначала уменьшить опухоль, а затем хирургическое вмешательство и облучение.
Инновационные методы лечения, не имеющие аналогов
Наш комплексный подход выходит за рамки стандартов лечения пациентов с раком груди. Мы предлагаем широкий спектр вариантов лечения, которые мы используем отдельно или в сочетании с традиционными и комплексными лекарствами.
- Хирургия предлагает наилучшие возможности для диагностики и лечения первичного и метастатического рака груди.
- Химиотерапия и другие методы лечения онкологии в медицине уничтожают раковые клетки, часто с помощью целенаправленных подходов, которые наносят меньший ущерб нормальным здоровым клеткам.
- Направленное излучение убивает раковые клетки и уменьшает опухоли, избегая при этом здоровых тканей.
- Интегративная терапия снижает стресс, укрепляет иммунную систему и уменьшает побочные эффекты определенных заболеваний и традиционных методов лечения.
- Диагностические услуги помогают нам обнаружить рак, определить его стадию и определить варианты лечения
Беспрецедентный опыт в одном центре
Наша команда из онкологов занимается исключительно лечением больных раком.Эти признанные на национальном уровне хирургические, медицинские и онкологи-радиологи, а также специалисты по интервенционной лучевой и интегративной медицине работают вместе в одной группе, чтобы составить план лечения специально для вас. Это означает, что вы окажетесь в одном месте для получения полного и всестороннего лечения рака от диагностики до лечения и поддержки на протяжении всего пути.
Мы можем помочь
Если вам только что поставили диагноз или вы ищете другое мнение, вы можете найти помощь — и надеяться — здесь.
Узнайте больше о нашем подходе к лечению рака. Позвоните по телефону (888) 492- (НАДЕЖДА) , чтобы поговорить с нашей онкологической справочной.
Предел дозы— обзор
Публикация 26 МКРЗ; Отчет NCRP No.
 91
91Рекомендации в Публикации 26 МКРЗ (ICRP, 1977) включают два важных события. Во-первых, ограничения на эквивалент дозы для всего тела, гонад и кроветворных органов были заменены пределами на эффективный эквивалент дозы, определяемый как средневзвешенное значение эквивалентов дозы для шести органов или тканей, а остальная категория включает пять других органов. или ткани, получающие самые высокие эквиваленты дозы.Благодаря этому изменению дозы для многих органов или тканей могут быть учтены в ограничении рисков стохастических эффектов, особенно когда произошло неравномерное облучение всего тела от внутреннего облучения.
Весовой коэффициент ткани ( w T ) для органа или ткани, используемый при расчете эквивалентов эффективной дозы как средневзвешенное значение эквивалентов дозы, был предназначен для представления дробного вклада воздействия на этот орган или ткань в общий риск. смертности от рака или тяжелых наследственных эффектов, когда все тело было облучено равномерно.Используя эффективный эквивалент дозы, дозы от внешнего и внутреннего облучения, будь то от равномерного или неоднородного облучения всего тела, могут быть объединены на основе общего риска.
Во-вторых, МКРЗ больше не считала генетическую опасность главной проблемой радиационной защиты. Приняв w T для гонад 0,25, риск серьезных наследственных эффектов от равномерного облучения всего тела был принят на уровне одной трети риска смертности от рака.Снижение значимости генетической опасности было основано в основном на радиобиологических данных, полученных на мышах, и на потомках японских выживших после атомной бомбардировки.
МКРЗ также разработала оценки коэффициентов риска (риски на Зв) для стохастических эффектов. Коэффициенты риска для органов и тканей, кроме гонад, были основаны главным образом на данных о смертности от рака у японцев, переживших атомную бомбу. МКРЗ предположила, что номинальный коэффициент риска смертности от рака от равномерного облучения всего тела составляет 10 — 2 Св — 1 .
Стандарты для рабочих
Рекомендуемые пределы дозы для обычного облучения рабочих в Публикации 26 МКРЗ (ICRP, 1977) включали:
- •
годовой эквивалент эффективной дозы 50 мЗв для ограничения стохастических эффектов;
- •
эквивалента годовой дозы 0,3 Зв на хрусталик глаза и 0,5 Зв на все другие органы и ткани для предотвращения тканевых реакций;
- •
после постановки диагноза беременности годовая эффективная доза, эквивалентная 15 мЗв для матери, для защиты эмбриона / плода.
Предел годового эквивалента эффективной дозы соответствовал предыдущему пределу кумулятивного эквивалента дозы на все тело в возрасте N 50 (N – 18) мЗв. Однако МКРЗ больше не рекомендовал ограничение кумулятивной дозы.
Для планового специального облучения, которое случается нечасто, МКРЗ рекомендовала предельные значения эффективного эквивалента дозы 100 мЗв в единичном событии и 250 мЗв в течение срока службы.
Основываясь на данных по другим безопасным профессиям, ICRP пришла к выводу, что риски для рабочих будут приемлемыми, если среднегодовой риск смертности не превышает 10 — 4 .При номинальном коэффициенте риска смерти от рака МКРЗ 10 -2 Зв -1 предел годового эквивалента эффективной дозы в 50 мЗв соответствовал годовому риску смертности примерно на порядок выше среднего риска, признанного приемлемым. . Однако годовой лимит в 50 мЗв был оправдан на том основании, что применение принципа ALARA привело к средним годовым дозам для рабочих около 5 мЗв, поэтому риск смерти для среднего рабочего был бы приемлемым.
Рекомендуемые пределы дозы для обычного облучения работников в отчете NCRP № 91 (NCRP, 1987) включали:
- •
годовой эквивалент эффективной дозы 50 мЗв;
- •
общая эффективная эквивалентная доза в возрасте N 10 × N мЗв;
- •
эквивалента годовой дозы 0,15 Зв на хрусталик глаза и 0,5 Зв на все другие органы или ткани;
- •
общая доза, эквивалентная эмбриону / плоду (без учета медицинского облучения) 5 мЗв, и эквивалент дозы 0.
 5 мЗв в любой месяц после того, как стало известно о беременности.
5 мЗв в любой месяц после того, как стало известно о беременности.Предел общей эффективной эквивалентной дозы, который заменил предыдущий предел в 50 (N – 18) мЗв, был предназначен для ограничения пожизненного риска фатальных стохастических эффектов до <10 — 2 .
NCRP также рекомендовал, чтобы (1) эффективный эквивалент дозы от редких запланированных специальных облучений не превышал 100 мЗв в единичном событии и в течение срока службы и (2) только действия, связанные со спасением жизни, оправдывали острое облучение> 100 мЗв в экстренных ситуациях.
Стандарты для населения
Рекомендуемые пределы дозы для обычного облучения населения в Публикации 26 МКРЗ (ICRP, 1977) включали (1) годовой эквивалент эффективной дозы 5 мЗв и (2) годовой эквивалент дозы на любой орган или ткань 50 мЗв. При разработке предела годового эквивалента эффективной дозы МКРЗ пришла к выводу, что риск стохастических эффектов от облучения населения не должен превышать другие риски, которые население принимает в повседневной жизни, то есть годовой риск смерти в диапазоне 10 — 6 до 10 -5 .При номинальном коэффициенте риска смертности от рака МКРЗ 10 — 2 Зв — 1 предел годового эквивалента эффективной дозы для населения должен был составлять около 1 мЗв. Однако годовой предел в 5 мЗв был принят на основании суждения о том, что среднегодовые дозы облучения населения обычно должны быть менее 0,5 мЗв.
В более поздних пояснениях МКРЗ (1985) подчеркнула, что:
- •
основной предел дозы для населения был годовым эффективным эквивалентом дозы 1 мЗв;
- •
дополнительный предел в 5 мЗв может применяться в некоторые годы, если годовой эффективный эквивалент дозы, усредненный за весь срок службы, не превышает 1 мЗв.
Рекомендуемые пределы дозы для обычного облучения населения в отчете NCRP № 91 (NCRP, 1987) включали:
- •
годовые эквиваленты эффективной дозы 1 мЗв для непрерывного или частого облучения и 5 мЗв для нечастого контакт;
- •
годовая доза, эквивалентная 50 мЗв для хрусталика глаза, кожи и конечностей.

NCRP также рекомендовал уровень корректирующих действий для радона в жилых помещениях, который, как предполагалось, соответствует годовой эффективной дозе, эквивалентной 20 мЗв, и, как ожидалось, ограничит годовой риск рака легких примерно до 4 × 10 -4 .
Исходя из предполагаемого снижения важности тяжелых наследственных эффектов, МКРЗ и НСРЗ не сохранили свои предыдущие рекомендации по ограничению генетически значимой дозы для всей популяции примерно на уровне одной трети предела дозы для отдельных лиц.
Обеспечение качества доз радиации: вопросы и ответы
FDA рекомендует учреждениям работать с физиками-медиками, чтобы определить, соответствуют ли обычно дозы облучения их протоколам.
- падают ниже порога повреждения кожи, а
- соответствуют значениям, широко представленным в медицинской литературе. 1
1. Может ли доза вызвать какие-либо детерминированные эффекты, такие как покраснение кожи, выпадение волос или катаракта?
Наибольшая доза облучения, резко накапливающаяся в одном месте на коже пациента, называемая «пиковая доза на коже» (PSD), является важным параметром при оценке риска эритемы (покраснения кожи) и эпиляции (выпадения волос). 2 Пороговый диапазон для преходящей эритемы и временной эпиляции составляет 2–5 Гр PSD; длительная эритема и стойкая частичная эпиляция имеют пороговые значения 5-10 Гр PSD; а тяжелое повреждение кожи связано с более высокими значениями PSD. 3
Катаракта вызывает особую озабоченность, если глаз попадает в область прямого облучения, и современные сканеры могут наклоняться, чтобы избежать прямого попадания в глаз. Хотя в других авторитетных источниках 4 , 5 указаны дозы для хрусталика глаза от 2 Гр (при однократном воздействии) до 5 Гр (при фракционированном воздействии) в качестве пороговых значений для индукции катаракты, эти значения сомнительны: они были основано на исследованиях 6 , 7 , 8 с относительно ограниченными объемами эпидемиологического наблюдения данных радиационно-ассоциированной катаракты с момента воздействия. Более поздние исследования показывают, что самая низкая катарактогенная доза у людей намного меньше этих значений, статистически совместима с отсутствием порогового значения вообще, и что увеличение дозы связано с увеличением распространенности катаракты. 9 , 10 , 11 , 12
Более поздние исследования показывают, что самая низкая катарактогенная доза у людей намного меньше этих значений, статистически совместима с отсутствием порогового значения вообще, и что увеличение дозы связано с увеличением распространенности катаракты. 9 , 10 , 11 , 12
Важно отметить, что оценка PSD требует оценки «точечной дозы», то есть оценки, локализованной в пространстве. Оценки точечной дозы не эквивалентны ни одному из стандартизованных индексов, используемых для характеристики дозы в компьютерной томографии, а именно: CTDI 100 периферийных, CTDI 100 центральных, CTDI-взвешенных (CTDI w ), CTDI vol или другие индексы, такие как произведение дозы на длину (DLP) на основе значений CTDI 100 .При типичном сканировании перфузии головного мозга стол пациента неподвижен или переключается вперед и назад в диапазоне менее 100 мм. Кроме того, рентгеновское поле вдоль центральной оси (оси z) коллимируется до ширины менее 100 мм. В этих условиях периферийное устройство CTDI , 100, имеет тенденцию переоценивать PSD на величину, которая зависит от конкретных условий работы во время сканирования. 13 , 14
2. Попадают ли обычно значения индекса дозы в диапазон, который можно вывести из медицинской и научной литературы?
В то время как в литературе сообщается о диапазоне значений индекса дозы, 15 имеет значение 0.Значение 5 Гр может служить полезным индикатором порядка величины среднего CTDI vol для сканирования перфузии мозга. Протоколы, определенные производителем, следует использовать в качестве отправных точек, которые могут потребовать пересмотра, чтобы они соответствовали конкретному пациенту или учреждению.
1 Энтони Сиберт, 2009, «Соображения по оценке клинических доз КТ для пациентов».
2 Дональд Л. Миллер и др., «Дозы радиации в процедурах интервенционной радиологии: исследование RAD-IR.Часть II: Кожная доза », J. Vasc. Интерв. Радиол. Т. 14. С. 977-990, 2003.
Миллер и др., «Дозы радиации в процедурах интервенционной радиологии: исследование RAD-IR.Часть II: Кожная доза », J. Vasc. Интерв. Радиол. Т. 14. С. 977-990, 2003.
3 Стивен Балтер и др., «Интервенционные процедуры под рентгеноскопическим контролем: обзор воздействия радиации на кожу и волосы пациентов», Радиология Vol. 254, No. 2, pp. 326-341, February 2010.
.4 Международная комиссия по радиологической защите, Публикация 60 МКРЗ, Рекомендации Международной комиссии по радиологической защите 1990 г., Pergamon Press, Oxford UK, 1991.
5 Национальный совет по радиационной защите и измерениям, Отчет NCRP 116, Ограничение воздействия ионизирующего излучения , NCRP, Bethesda MD, 1993.
6 М. Отаке и У. Шулл, «Связь гамма- и нейтронного излучения с помутнением задней части хрусталика у выживших после атомных бомбардировок в Хиросиме и Нагасаки», Radiat. Res. Т. 92, стр. 574-595, 1982.
7 R.J. Миллер, Т. Фуджино и М.Д. Нефзгер, «Результаты исследования линз у выживших после атомной бомбардировки: обзор основных офтальмологических исследований Комиссии по несчастным случаям при атомной бомбардировке (1949–1962), Arch. Офтальмол. Т. 78, pp. 697-704, 1967.
8 M.D. Nefzger, R.J. Миллер и Т. Фуджино, «Глазные открытия выживших после атомной бомбардировки Хиросимы и Нагасаки: 1963–1964, Am. J. Epidemiol. Т. 89, стр. 129–138, 1969.
9 Э. Накашима, К. Нерииси и А. Минамото, «Повторный анализ данных о катаракте атомной бомбы, 2000–2002: пороговый анализ», Health Phys. Т. 90, стр. 154–160, 2006.
10 Казуо Нериши и др., «Случаи послеоперационной катаракты у выживших после атомной бомбы: реакция на дозу облучения и пороговые значения», Radiat. Res. Т. 168, стр. 404-408, 2007.
11 Габриэль Чодик, «Риск катаракты после воздействия низких доз ионизирующего излучения: 20-летнее перспективное когортное исследование среди американских радиологических технологов», Американский журнал эпидемиологии Vol. 168, No. 6, pp.620-631, 2008.
168, No. 6, pp.620-631, 2008.
12 E. A. Ainsbury et al., «Радиационный катарактогенез: обзор последних исследований», Radiation Research Vol. 172, стр. 1-9, 2009.
13 J. A. Bauhs, T. J. Vrieze, A. N. Primak, M. R. Bruesewitz и C. H. McCollough, «CT-дозиметрия: сравнение методов и устройств измерения», RadioGraphics Vol. 28, pp. 245-253, 2008 г., доступно по адресу http://radiographics.rsna.org/content/28/1/245.full.pdf+html.
14 Для обсуждения оценки дозы КТ, связанной с геометрией облучения конусным пучком, см. Отчет Американской ассоциации физиков в медицине (AAPM) No.111, Комплексная методология оценки дозы излучения в рентгеновской компьютерной томографии , AAPM, февраль 2010 г. (http://www.aapm.org/pubs/reports/RPT_111.pdf).
15 Примеры доз, связанных с исследованиями перфузии мозга при компьютерной томографии, см. В следующих статьях: Yoshimasa Imanishi et al., «Радиационно-индуцированная временная потеря волос как лучевое повреждение, возникающее только у пациентов, у которых была комбинация MDCT и DSA « евро. Радиол. Т. 15, стр.41-46, 2005; M Cohnen et al., «Радиационное облучение пациентов в комплексной компьютерной томографии головы при остром инсульте», AJNR Am. J. Neuroradiol. Т. 27, pp. 1741-1745, сентябрь 2006 г .; Сунг Вон Юн и др., «Перфузионная КТ головного мозга с использованием детектора шириной 40 мм и методики с переключением стола для первоначальной визуализации острого инсульта», AJR Vol. 191, стр. W120-W126, сентябрь 2008 г .; Аниса Мнюсивалла, Ричард И. Авив и Шон П. Саймонс, «Доза облучения от многодетекторной компьютерной томографии для острого инсульта», Neuroradiology Vol.51, No. 10, pp. 635-640, October 2009.
Однодозовая лучевая терапия так же эффективна, как и обычная терапия для пациентов с раком груди
Для женщин с ранним раком груди разовая доза направленной лучевой терапии так же эффективна, как и обычная лучевая терапия, которая требует нескольких посещений больницы после операции, согласно исследование, опубликованное BMJ . 1
1
Интраоперационная лучевая терапия, комбинация таргетной терапии, проводимой после операции, связана с примерно 80% шансом избежать полного курса традиционной терапии, меньшим количеством побочных эффектов и отсутствием разницы в выживаемости или вероятности рецидива рака.
«Ранние результаты использования однократной дозы TARGIT-IORT во время лампэктомии были многообещающими, и было установлено, что лечение имело преимущества для пациента, такие как удобство, снижение затрат на поездки и личные расходы, улучшение качества жизни и уменьшение побочных эффектов» написали исследователи. 2
В ходе исследования было проанализировано почти 2300 женщин в возрасте 45 лет и старше, которым была назначена операция по сохранению груди. В период с марта 2000 г. по июнь 2012 г. 1140 женщин были рандомизированы для получения целевой интраоперационной лучевой терапии (TARGIT-IORT), а 1158 женщин прошли дистанционную лучевую терапию (EBRT).
Результаты показали, что TARGIT-IORT не хуже EBRT. В частности, после 5 лет наблюдения риск местного рецидива составил 2,11% для TARGIT-IORT по сравнению с 0,95% для EBRT, но разница не считалась статистически значимой.
Более того, в первые 5 лет после операции данные выявили 13 дополнительных местных рецидивов (24 из 1140 против 11 из 1158), но на 14 летальных исходов меньше (42 из 1140 против 56 из 1158) по сравнению с TARGIT-IORT. в ЕБРТ. Исследователи также обнаружили, что смертность от других причин была значительно ниже (45 случаев против 74) с TARGIT-IORT, чем с EBRT.
«Мы считаем, что долгосрочные данные, представленные в этой статье, вместе со многими преимуществами для пациента, предоставляют убедительные доказательства в пользу TARGIT-IORT как эффективной альтернативы для этой большой группы пациентов с ранним раком груди, которые подходят для сохранение груди », — написали исследователи. 2
Сильные стороны исследования включали рандомизированный стиль дизайна, большую выборку с большой продолжительностью и высокий уровень полного наблюдения.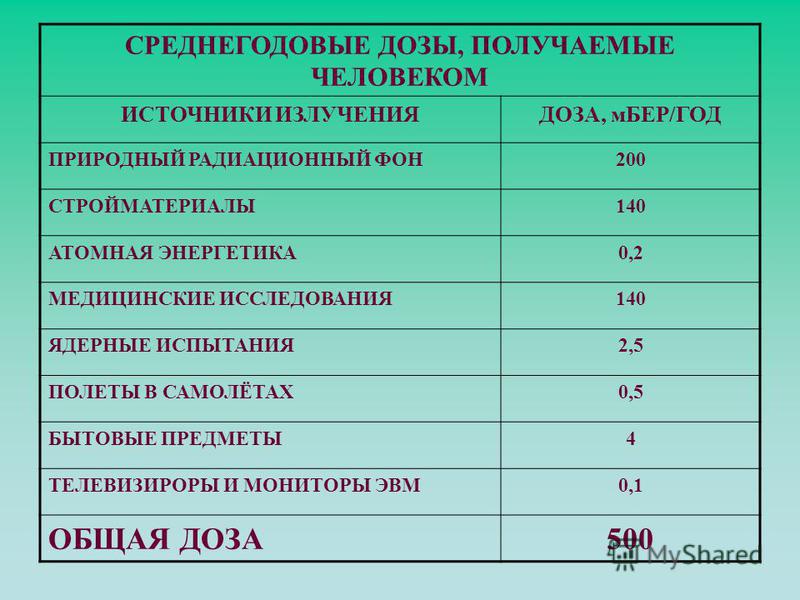 Обычно это говорит о том, что результаты надежны и надежны.
Обычно это говорит о том, что результаты надежны и надежны.
Что касается ограничений исследования, результаты могут включать в себя возможную гипердиагностику неинвазивного местного рецидива и отсутствие сбора фоновых факторов риска смерти от причин, не связанных с раком груди.
«В конечном итоге пациенты должны выбирать лечение, и им должны быть предоставлены данные в прозрачном, понятном и понятном формате», — пишут исследователи. 2
Ссылки:
1. Радиотерапия однократной дозой не уступает традиционной терапии для большинства женщин с ранним раком груди [пресс-релиз]. Опубликовано 19 августа 2020 г. https://www.eurekalert.org/pub_releases/2020-08/b-sdr081720.php. По состоянию на 14 сентября 2020 г.
2. Vaidya JS, Bulsara M, Baum M, et al. Долгосрочная выживаемость и результаты местного контроля при интраоперационной интраоперационной лучевой терапии однократной дозой во время лампэктомии (TARGIT-IORT) при раннем раке груди: рандомизированное клиническое исследование TARGIT-A BMJ . DOI: https://doi.org/10.1136/bmj.m2836.
Дозировка лучевой терапии
Когда лучевая терапия используется для лечения раковых клеток в организме, важно правильно измерить дозу, чтобы избежать ненужного повреждения нормальных клеток в организме. Радиация не является избирательной по отношению к опухолевым клеткам и нацелена на любые клетки, которые находятся в процессе репликации при применении терапии, что объясняет важность правильной дозы для обеспечения оптимальной эффективности с минимальными побочными эффектами.
Стандартная доза
Серый (Гр) — это единица измерения общего радиационного облучения, которому подвергается пациент. Это также может быть записано как сантигрей (сГр), что составляет 0,01 одной единицы серого .
Дозы адъювантной терапии обычно составляют от 45 до 60 Гр при раке груди, головы и шеи, которые делятся на несколько меньших доз, вводимых в течение периода от одного до двух месяцев. Конкретная доза для каждого пациента зависит от локализации и тяжести опухоли и остается на усмотрение онколога, ответственного за терапевтические решения.
Конкретная доза для каждого пациента зависит от локализации и тяжести опухоли и остается на усмотрение онколога, ответственного за терапевтические решения.
Дозовое фракционирование
Общая доза облучения обычно делится на несколько долей. Для большинства пациентов, которым требуется лучевая терапия, общая доза делится на суточные дозы пять раз в неделю в течение периода от пяти до восьми недель. Однако некоторые виды рака требуют лечения чаще, чем один раз в день.
Каждая фракция содержит небольшое количество радиации, которое постепенно накапливается, образуя общую дозу. Этот метод позволяет эффективно лечить раковые клетки, в то же время уменьшая повреждение нормальных тканей.
Частота дозы
Гиперфракционированное излучение делит суточную дозу на две процедуры каждый день, что означает, что пациент подвергается меньшим, но более частым дозам радиации в течение того же периода времени.
И наоборот, гипофракционированное излучение разбивает общую дозу на более высокие дозы, часто давая дозу меньше, чем один раз в день.
Продолжительность лечения
Стандартное лечение лучевой терапией длится от пяти до восьми недель, в зависимости от конкретного типа рака, который лечится, и по усмотрению онколога, наблюдающего за терапией.
Ускоренное облучение — это когда общая доза вводится в течение более короткого периода времени, чем обычно. Это включает более частые дозы, обычно чаще, чем один раз в день, чтобы вводить эквивалентную общую дозу в течение более короткого периода времени. Это может быть полезно при некоторых типах рака, когда требуется более агрессивный режим лечения.
Изменения в частоте доз и продолжительности лечения не влияют на общее облучение, и, как следствие, долгосрочные эффекты остаются аналогичными.Однако различное фракционирование лечения и ускоренное лечение часто связаны с более быстрым началом воздействия как на нормальные, так и на раковые клетки.



 По этой причине некоторые радиоактивные вещества хранятся под водой или в облицованных бетоном или свинцом помещениях, а стоматологи кладут свинцовое одеяло на пациентов, делая рентгеновские снимки зубов. Следовательно, установка надежного экрана между вами и источником радиоактивного излучения значительно снизит или устранит получаемую дозу облучения.
По этой причине некоторые радиоактивные вещества хранятся под водой или в облицованных бетоном или свинцом помещениях, а стоматологи кладут свинцовое одеяло на пациентов, делая рентгеновские снимки зубов. Следовательно, установка надежного экрана между вами и источником радиоактивного излучения значительно снизит или устранит получаемую дозу облучения.

 Например, рентген грудной клетки обычно дает дозу около 0,01 бэр (10 миллибэр), а КТ всего тела дает дозу 1 бэр (1000 мбэр), как показано в таблице слева.
Например, рентген грудной клетки обычно дает дозу около 0,01 бэр (10 миллибэр), а КТ всего тела дает дозу 1 бэр (1000 мбэр), как показано в таблице слева. 17
17 5 мЗв в любой месяц после того, как стало известно о беременности.
5 мЗв в любой месяц после того, как стало известно о беременности.