Патология полости матки. Причины.
Главная » Лечение бесплодия » Патология полости матки. Причины.Матка – это мышечный орган грушевидной формы, располагающийся в малом тазу. Матка представлена тремя слоями – внутренний (эндометрий, слизистая полости матки), средний (миометрий, мышечный слой матки), наружный (серозный, висцеральная брюшина, покрывающая матку со стороны брюшной полости).
Матка состоит из тела матки и шейки матки. Тело матки сообщается с влагалищем через цервикальный канал шейки матки и с брюшной полостью через маточные трубы. Из всех трех слоев матки циклические изменения претерпевает только внутренняя оболочка тела матки – слизистая полости матки – эндометрий.
Эндометрий делится на 2 слоя функциональный (верхний) и базальный (нижний). В первый день менструации происходит резкое снижение уровня прогестерона и происходит отторжение функционального слоя эндометрия, что проявляется менструальным кровотечением. В первой фазе менструального цикла (с 1 по 14-16 день цикла) под действием эстрадиола происходит пролиферация (утолщение) эндометрия до 11-13 мм.
Как врожденные аномалии развития матки, так и приобретенные заболевания полости матки являются причиной бесплодия.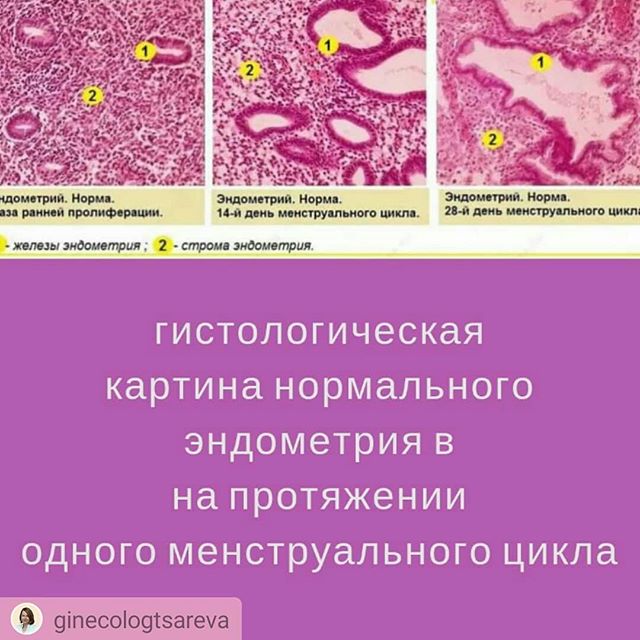
К таким аномалиям развития и заболеваниям относятся следующие заболевания:
- Однорогая и двурогая матка.
- Гипоплазия (недоразвитие) матки, рудиментарная матка.
- Полная и неполная перегородка полости матки.
- Патология полости матки (гиперплазия эндометрия, полипоз эндометрия, полип эндометрия).
- Эндометриоз матки.
- Интрамуральная миома матки с центрипетальным ростом.
- Подслизистая миома матки.
Вышеперечисленная патология встречается в 10 % случаев бесплодия и невынашивания беременности.
Маточное бесплодие связано с наличием патологии не только в эндометрии, но и в миометрии (мышечном слое матки).
Наиболее частые причины маточного бесплодия
- Полип эндометрия – патологическое очаговое разрастание слизистой полости матки вследствие перенесенных воспалительных заболеваний полости матки (эндометрит), гормональные нарушения (гиперандрогения, гиперэстрогениемия, гиперпролактинемия), опухоли яичников (кисты яичников), опухоли матки (миома матки).
 Полип эндометрия является патологической структурой в полости матки, препятствующий имплантации эмбриона. Иногда образование полипа эндометрия происходит без на то явных причин. В этом случае образование полипа эндометрия обусловлено наличием патологического рецепторного аппарата, извращенно воспринимающего нормальный уровень женских половых гормонов. При выявленном полипе эндометрия у женщин, планирующих беременность, оперативное лечение должно выполняться строго с помощью гистерорезектоскопии. Гистерорезектоскопия – метод оперативного лечения внутриматочной патологии с использованием электрической петли. Только выполнение гистерезектоскопии у пациенток репродуктивного возраста позволяет избежать рецидива полипа эндометрия и вернуться к вопросам планирования беременности через 2 месяца. При гистерорезектоскопии выполняется обработка ножки полипа высокочастотной энергией, что позволяет предотвратить рецидив полипа эндометрия ввиду выполнения под визуальным контролем с большим увеличением.
Полип эндометрия является патологической структурой в полости матки, препятствующий имплантации эмбриона. Иногда образование полипа эндометрия происходит без на то явных причин. В этом случае образование полипа эндометрия обусловлено наличием патологического рецепторного аппарата, извращенно воспринимающего нормальный уровень женских половых гормонов. При выявленном полипе эндометрия у женщин, планирующих беременность, оперативное лечение должно выполняться строго с помощью гистерорезектоскопии. Гистерорезектоскопия – метод оперативного лечения внутриматочной патологии с использованием электрической петли. Только выполнение гистерезектоскопии у пациенток репродуктивного возраста позволяет избежать рецидива полипа эндометрия и вернуться к вопросам планирования беременности через 2 месяца. При гистерорезектоскопии выполняется обработка ножки полипа высокочастотной энергией, что позволяет предотвратить рецидив полипа эндометрия ввиду выполнения под визуальным контролем с большим увеличением. Выполнение удаления полипа путем выскабливания полости матки у женщин, планирующих беременность, недопустимо, так как это приводит к лишней травматизации здорового эндометрия вокруг полипа с развитием бесплодия и невынашивания беременности.
Выполнение удаления полипа путем выскабливания полости матки у женщин, планирующих беременность, недопустимо, так как это приводит к лишней травматизации здорового эндометрия вокруг полипа с развитием бесплодия и невынашивания беременности. - Гиперплазия эндометрия – это диффузное утолщение эндометрия с изменением структуры, не соответствующей дню менструального цикла. Причиной развития гиперплазии эндометрия является гиперэстрогения, дисфункция гипоталамо-гипофизарной системы, заболевания щитовидной железы и надпочечников. Как сама гиперплазия эндометрия, так и причины, приводящие к ней, вызывают бесплодие. Лечение гиперплазии эндометрия складывается из двух этапов – хирургического и противорецидивного гормонального. При хирургическом лечении гиперплазии эндометрия обязательно сначала выполняется диагностическая гистероскопия, подтверждается или опровергается диагноз гиперплазии эндометрия и только потом решается вопрос с целесообразностью выполнения лечебно-диагностического выскабливания полости матки.

- Внутриматочные синехии (спайки в полости матки) — сращения передней и задней стенки матки с ограничением объема полости матки. В таком случае имплантация и последующее вынашивание беременности становится невозможным. Чаще всего причиной развития внутриматочных синехий является воспаление в полости матки, травматизация полости матки при аборте или выскабливании полости матки, эндометриоз матки. Разрушение внутриматочных синехий производят путем гистерорезектоскопии – в водной среде под визуальным контролем с применением электрической петли производится рассечение сращений в полости матки. При выраженных синехиях в полости матки рассечение может производиться в два этапа под контролем лапароскопии.

- Хронический эндометрит – это воспаление слизистой полости матки после перенесенной инфекции или травматичных вмешательств в полость матки (осложненные роды, сопровождающиеся внутриматочным вмешательством, – ручное обследование полости матки, выскабливание полости матки при остатках плацентарной ткани). Острый эндометрит всегда сопровождается повышением температуры тела, гноевидными выделениями из полости матки, резкими острыми болями внизу живота. При хроническом эндометрите подобной клинической картины не отмечено — беспокоят незначительные тянущие или ноющие боли внизу живота и скудные мажущие кровянистые выделения до и после менструации. Основным симптомом эндометрита является бесплодие и невынашивание беременности. Очень часто при наличии хронического эндометрита по данным УЗИ малого таза отмечается тонкий эндометрий. Эндометрий при хроническом эндометрите не только не достигает нормальной толщины, но и не претерпевает циклических изменений.
 С целью коррекции эндометрита до зачатия рекомендуется наряду с антибактериальной и противовоспалительной терапией провести гормональное и физиотерапевтическое лечение.
С целью коррекции эндометрита до зачатия рекомендуется наряду с антибактериальной и противовоспалительной терапией провести гормональное и физиотерапевтическое лечение. - Эндометриоз матки – это проникновение и разрастание эндометрия в мышечный слой матки. Различают диффузную и диффузно-узловую форму аденомиоза. Основными клиническими симптомами при наличии эндометриоза матки являются маточные кровотечения и изнуряющие боли внизу живота. При наличии эндометриоза, приводящее к деформации полости матки проводится хирургическое лечение с последующим гормональным лечением.
- Миома матки – доброкачественная опухоль из мышечного слоя матки. Как и подслизистая миома матки, миома больших размеров препятствует наступлению беременности и вынашиванию. Точного механизма влияния миомы матки на эмбрион не уточнено. При наличии миомы матки больших размеров и подслизистом расположение перед планированием беременности требуется ее удаление. Планирование беременности после удалении миом матки должно проводиться только через 12 месяцев со дня оперативного лечения.

- Полная и неполная перегородка полости матки — врожденное анатомическое изменение чаще всего мешающее осуществлять полноценное вынашивание беременности. При прикреплении беременности на перегородке матки на ранних сроках происходит гибель эмбриона в силу неполноценного кровоснабжения. При планировании беременности осуществляется рассечение внутриматочной перегородки с помощью гистерорезектоскопии с последующим назначением гормонотерапии.
 Планирование беременности после рассечения полной или неполной внутриматочной перегородки должно осуществляться строго через 6 месяцев.
Планирование беременности после рассечения полной или неполной внутриматочной перегородки должно осуществляться строго через 6 месяцев. - Тонкий эндометрий может отмечаться как индивидуальная особенность пациентки на протяжении всего менструального цикла или развиваться вследствие перенесенного эндометрита, эндометриоза матки. Также тонкий эндометрий может быть причиной нарушения кровоснабжения матки или неполноценности рецепторного аппарата матки. При наличии тонкого эндометрия снижается вероятность наступления беременности. При планировании беременности тонкий эндометрий корректируется применением гормональных и сосудистых препаратов.
- Патология полости матки выявляется и лечится методом гистероскопии. Этот метод делится на два вида: диагностический (для подтверждения или опровержения заболевания) и хирургический (лечебный). К диагностической гистероскопии относится офисная гистероскопия, не требующая общей анестезии. Проводится амбулаторно. Стоимость операции по удалению полипа и миомы матки зависит от выбранной методики лечения, количества и размеров образований, их локализации, сопутствующей патологии и многих других факторов.

Ответы на вопросы пациентов
Наталья, 38 лет, Москва
Доброго времени суток!
На протяжении 2,5 лет не наступает беременность, мне 38 лет. Думаю, о проведении ЭКО и хотела бы узнать Ваше мнение. С момента начала планирования проведено следующее.
Июль 2012 года — раздельное диагност.выскабливание цервикального канала и полости матки. Заключение: железистый полип эндометрия. Вне полипа эндометрий гиперпластический смешанный (простая форма гиперплазии без атипии). Назначен дюфастон по 20 мг с 15 по 25 день цикла на 6 месяцев, фол.кислота.
Март 2013 года — Лапароскопия (при осмотре без видимой патологии). ВХГТ (обе маточные трубы свободно проходимы). Консервативная миомэктомия без вхождения в полость матки (удален субсерозный миоматозный узел 1 типа диаметр 20 мм, ложе коагулировано). Гистероскопия, раздельное диагност.выскабливание цервикального канала и полости матки. Гистология: железистая гиперплазия эндометрия, хр.эндометрит, узел лейомиома. Назначена противовоспал.терапия (ципролет, орнидазол, флуканазол, затем сумамед, метронидазол, флуканазол) и 3 месяца уколы бусерелин депо 3,75.
Гистология: железистая гиперплазия эндометрия, хр.эндометрит, узел лейомиома. Назначена противовоспал.терапия (ципролет, орнидазол, флуканазол, затем сумамед, метронидазол, флуканазол) и 3 месяца уколы бусерелин депо 3,75.
Март 2014 года – Гистероскопия диагност.выскабливание полости матки. Заключение: морфологические признаки обратного развития эндометрия вследствие неполного отторжения в фазу десквамации. Морфологические признаки хр.эндометрита. Назначена противовоспал.терапия (юнидокс, линекс, свечи генферон, вобензим, витамины тайм фактор, утрожестан 200 мг с 15 по 25 день цикла на 6 месяцев).
Сентябрь 2014 года – УЗИ гинекологическое на 20 день цикла:
Тело матки положение по центру. Форма шаровидная. Размеры 64*48*55 мм. Структура миометрия диффузно неоднородная. По передней стенке в средней трети на границе эндо и миометрия линейное анэхогенное включение 6*2 мм.
Эндометрий граница четкая, не ровная. Толщина 12 мм Секреторного типа. Структура эндометрия однородная. Кровоток не нарушен. ИР=0,68.
Кровоток не нарушен. ИР=0,68.
Полость матки не расширена, не деформирована.
Шейка матки обычных размеров. Длина 30 мм, ширина 36 мм. Строение изменено за счет множественных анэхогенных включений размерами 5-7-9 мм. Форма обычная. Эндоцервикс не изменен толщина 2 мм.
Правый яичник не увеличен. Размеры длина 30 мм, ширина 29 мм, толщина 28 мм, объем 13,6 мл. Определяется желтое тело 26 мм с непрерывным кольцевым кровотоком. Антральных фолликулов до 3 в поле зрения диаметра 3-5 мм.
Левый яичник не увеличен. Размеры длина 24 мм, ширина 18 мм, толщина 20 мм, объем 4,7 мл. Антральных фолликулов до 5 в поле зрения диаметра 5-7 мм. По нижнему полюсу рядом с яичником анэхогенное включение 11 мм. Жидкость в малом тазу не определяется.
Заключение: диффузные изменения миометрия по типу внутреннего эндометриоза. Хронический эндоцервикоз. Гипертрофия шейки матки. Параовариальная киста левого яичника.
Октябрь 2014 года – Биопсия эндометрия. Гистологическое исследование – хр. эндометрит. Иммуногистохимическое исследование – в исследуемом материале CD138-позитивные клетки (плазмоциты) ВЫЯВЛЕНЫ. Назначено лечение флемоклав 625 мг по 1т 3 раза 7 дней, дифлюкан 150 одноразово, генферон 1000000 2 раза в день, дюфастон по 1т 2 раза в день с 16 по 25 день цикла. После приема антибиотиков магнитотерапия на низ живота 10 сеансов. С 23 октября начала лечение.
эндометрит. Иммуногистохимическое исследование – в исследуемом материале CD138-позитивные клетки (плазмоциты) ВЫЯВЛЕНЫ. Назначено лечение флемоклав 625 мг по 1т 3 раза 7 дней, дифлюкан 150 одноразово, генферон 1000000 2 раза в день, дюфастон по 1т 2 раза в день с 16 по 25 день цикла. После приема антибиотиков магнитотерапия на низ живота 10 сеансов. С 23 октября начала лечение.
Также в октябре взяли биоматериал из цервикального канала посевы на микрофлору, результат:
Посев на флору УТЖ с опр.чув.к осн.сп-ру АБ – рост микроорганизмов не обнаружен
МО группы Enterobacteriaceae – не обнаружено
МО группы Staphylococcus – не обнаружено
МО группы Streptococcus – не обнаружено
МО группы Enterococcus – не обнаружено
Неферм.грамотрицательные бактерии – не обнаружено
Дрожж.грибы рода Candida и др. – не обнаружено
Прочие микроорганизмы – не обнаружено
Ноябрь 2014 года – Цитологическое исследование соскоба шейки матки:
кол-во препарата — адекватный
цитограмма (описание) – соответствует воспалительному процессу слизистой оболочки с реактивными изменениями эпителия
лейкоцинтарная реакция – умеренно выраженная
специфический инфекционный агент – не обнаружен
цитограмма соответствует – воспалительному процессу – экзоцервициту
в пол. матер.клетки с признаками злокачественности – не обнаружены
матер.клетки с признаками злокачественности – не обнаружены
дополнительные уточнения — отсутствует
Диагнозы: бесплодие вторичного сочетанного генеза, хронический эндометрит, аутоимунный фактор бесплодия (антиспермальные антитела в цервикальной слизи +++, АМГ 2013 год — 4,04; 2014 год – 1,36; гормоны все в норме, овуляция своя есть).
1. Скажите, пожалуйста, по цитологическому исследованию соскоба шейки матки (экзоцервициту) необходимо лечение (с результатами не была еще у врача)?
2. Какие еще пройти обследования и сдать анализы, а также пройти лечение для вступления в протокол (хотелось бы ближайшее время)?
3. Можно ли с таким эндометрием вступать в протокол (один врач торопит, другой говорит, что с таким эндометрием имплантация не произойдет)?
4. Какой протокол предпочтительней в моей ситуации, длинный или короткий и на каких препаратах? Я боюсь упустить время повторения гиперплазии, и не вылечивающегося эндометрита. А также не могу понять почему в апреле-мае пролеченный хронический эндометрит, опять дает о себе знать. Получается заколдованный круг.
Получается заколдованный круг.
Заранее благодарна Вам за ответ!
Любой активный воспалительный процесс в шейке матки требует проведения противовоспалительной терапии, поскольку даже проведение цитологического исследования не может быть адекватным для исключения атипичных клеток;
вопрос о проведении дополнительного обследования решается при клиническом обследовании, перечень регламентированного обследования перед ЭКО представлен на сайте;
по описанию последнего Вашего гистологического исследования нет признаков гиперплазии эндометрия, нет необходимости проводить повторно гормональную терапию перед проведением стимуляции, признаки хр.
 эндомиометрита могут выявляться даже после проведения противовоспалительной терапии,поскольку эти изменения являются результатом перенесенной активной воспалительной реакции, так, некоторые исследователи считают, что это вялотекущий иммунный процесс, перед проведение ЭКО мы рекомендуем проведение подготовки эндометрия с учетом признаков хр. эндомиометрита; нет единого мнения насколько влияет хр. эндомиометрит на эффективность ЭКО, вынашивание беременности, кто-то из клиницистов не принимает во внимание эти данные, др. уделяют большое внимание подготовке;
эндомиометрита могут выявляться даже после проведения противовоспалительной терапии,поскольку эти изменения являются результатом перенесенной активной воспалительной реакции, так, некоторые исследователи считают, что это вялотекущий иммунный процесс, перед проведение ЭКО мы рекомендуем проведение подготовки эндометрия с учетом признаков хр. эндомиометрита; нет единого мнения насколько влияет хр. эндомиометрит на эффективность ЭКО, вынашивание беременности, кто-то из клиницистов не принимает во внимание эти данные, др. уделяют большое внимание подготовке;Вопрос о выборе препаратов, режимов использования зависит от многих клинических параметров, В Вашем случае последний результат антимюллерового гормона позволяет рассчитывать на возможность достаточного ответа на стимуляцию. однако нужно обратить внимание на снижение по сравнению с предыдущим, безусловно есть др. важные критерии для оценки овариального резерва и выбора дозы, которые мы учитываем;
ощущение заколдованного круга у Вас присутствует из-за того, что не на все вопросы Вы получили ответ на приеме, стоит задать вопросы Вашему лечащему врачу, уточнить, понять информацию, принять решение, Вам обязательно объяснят позицию по подготовке к проведению ЭКО, обсудят целесообразность обследования, какие препараты, какие побочные эффекты с ними связаны, как использовать;
обозначение длинный или короткий протокол относится к разным режимам использования только 1 группы препаратов, современная фармацевтическая индустрия дает широкие возможности использования разных групп препаратов, в Вашей ситуации кто-то может использовать и длинный и короткий протокол, если будет выбран именно определенный препарат, к которому относится эта формулировка, на современном уровне нет единых подходов, единственное однозначное мнение отказаться от длинного и короткого протокола существует при риске СГЯ.
Хочется пожелать решить для себя все вопросы и обязательно получить результат.
тел 84959252200
С Уважением, Камилова Дилором
Гиперплазия эндометрия — симптомы и лечение, причины, диагностика, профилактика
Внутренняя оболочка матки у женщины репродуктивного возраста подвержена изменениям под действием половых гормонов – эстрогенов. При их чрезмерной стимуляции возникает гиперплазия эндометрия – его избыточное разрастание, увеличение толщины и изменение клеток. Это состояние является доброкачественным, но в некоторых случаях может привести к раку матки. Заболевание чаще встречается у женщин с нарушениями менструального цикла, а также в постменопаузальном периоде.
Гиперплазия эндометрия: причины и классификация
Основной причиной заболевания является нарушение баланса между двумя половыми гормонами – эстрогеном и прогестероном. Активная эстрогенная стимуляция при недостатке гестагенов приводит к разрастанию клеток эндометрия, как это происходит в первую фазу менструального цикла, но к более выраженному.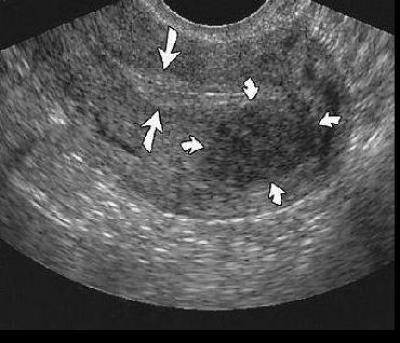
Факторы, способные вызвать гормональный дисбаланс:
- синдром поликистозных яичников;
- состояние постменопаузы;
- избыточный вес.
Другие причины гиперплазии эндометрия:
- эндокринные заболевания – диабет, ожирение;
- заболевания яичников;
- прием тамоксифена по поводу рака молочной железы.
В России часто используется такая классификация заболевания:
- эндометриальные полипы;
- простая железистая гиперплазия эндометрия;
- железистокистозная очаговая гиперплазия эндометрия;
- диффузная железистокистозная гиперплазия эндометрия;
- атипическая гиперплазия эндометрия (аденоматоз), очаговая или диффузная, в том числе аденоматозные полипы.
Согласно ВОЗ, различают 2 основных вида этой патологии – без атипии и атипическую. Каждый из них может быть простым и сложным. Клетки, образующие железы эндометрия, претерпевают изменения разной степени выраженности – от незначительных до предраковых.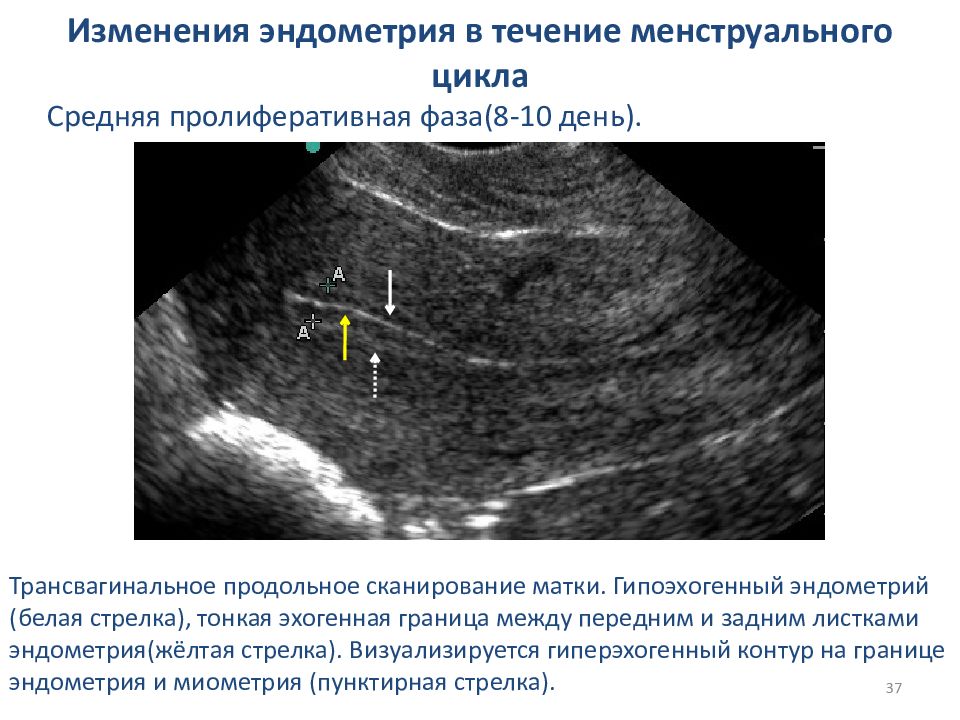 Эта классификация полезна тем, что показывает связь заболевания с развитием злокачественных новообразований.
Эта классификация полезна тем, что показывает связь заболевания с развитием злокачественных новообразований.
Эндометрий при железистой гиперплазии разрастается, но его клетки не подвергаются изменениям. Кистозная перестройка – формирование из некоторых желез округлых образований (кист). Это наименее опасная из всех форм заболевания, она хорошо поддается гормональной терапии.
Простая атипичная гиперплазия эндометрия сопровождается изменением свойств клеток на отдельном участке. Она поддается гормональной терапии и имеет низкий риск озлокачествления. Сложная форма этой разновидности патологии – наиболее опасная и часто трансформируется в рак эндометрия. Лечение нередко состоит в удалении матки.
Гиперплазия эндометрия – симптомы
Наиболее частые признаки гиперплазии эндометрия связаны с изменениями менструального цикла. Они могут наблюдаться ежедневно или в определенные фазы цикла, их выраженность тоже может быть разной.
Основные симптомы гиперплазии эндометрия:
- нерегулярные менструации;
- угревая сыпь на коже;
- сухость во влагалище;
- кровянистые выделения между менструациями;
- боль во время полового акта;
- приливы жара;
- отсутствие менструации;
- учащенное сердцебиение, утомляемость;
- нестабильность настроения;
- усиление роста волос на теле;
- слишком обильные или длительные менструации;
- боль в нижней части живота.

При появлении таких симптомов необходимо обратиться к гинекологу. Специалисты клиники на Барклая, расположенной в Москве, окажут таким пациенткам квалифицированную помощь в диагностике и лечении этого серьезного заболевания.
Диагностика и лечение гиперплазии эндометрия
Главная задача диагностики заболевания – подтвердить утолщение эндометрия и наличие в нем измененных клеток. Это может быть сделано на УЗИ и путем взятия биопсии.
Материал для микроскопического исследования может быть получен в ходе диагностического выскабливания полости матки. Также выполняется аспирационная биопсия – забор материала с помощью зонда, введенного в матку, из которого удаляется воздух и таким образом создается вакуум. Многим пациенткам с этим заболеванием требуется гистероскопия – осмотр внутренней поверхности матки с помощью оптического инструмента; во время процедуры можно взять биопсию или удалить полип.
Для выяснения толщины эндометрия применяется УЗИ. Большей информативностью обладает трансвагинальный метод, когда датчик вводится во влагалище. Врач оценивает эхопризнаки заболевания, в том числе и с точки зрения возможного развития рака.
Врач оценивает эхопризнаки заболевания, в том числе и с точки зрения возможного развития рака.
Лечение железистой гиперплазии эндометрия и простой формы атипической гиперплазии проводится с помощью гормональных препаратов. Обычно это средства на основе гестагенов, которые принимают внутрь, или регулярно в форме инъекций, либо путем введения внутриматочной гормональной спирали. Во время такого курса беременность невозможна.
Применяются и другие группы лекарств – антигонадотропные препараты и агонисты гонадотропин-рилизинг гормона.
Также врачи используют кюретаж стенок матки для удаления разросшихся тканей. Лечение гиперплазии эндометрия без выскабливания возможно при легких формах заболевания и включает абляцию (удаление) эндометрия путем диатермокоагуляции или лазерного воздействия.
В тяжелых случаях, не поддающихся медикаментозному лечению, при постоянных кровотечениях, рецидивирующей гиперплазии или при комплексной атипичной форме патологии может быть рекомендовано хирургическое лечение гиперплазии эндометрия – удаление матки.
Удаление полиповидных образований производится с помощью гистероскопии.
Профилактика гиперплазии эндометрия
Для снижения риска этой патологии необходимо:
- в перименопаузальном периоде назначать женщинам эстрогены только в комбинации с гестагенными препаратами;
- при нерегулярных менструациях по назначению врача использовать оральные контрацептивы, нормализующие цикл;
- поддерживать нормальный вес.
Лечение в клинике на Барклая
Терапия гиперплазии эндометрия довольно сложна и зависит от возраста пациентки, тяжести заболевания, выраженности его признаков, возможности принимать препараты, их переносимости и многих других факторов. Такая женщина нуждается в регулярном наблюдении и лечении у гинеколога.
Клиника на Барклая предлагает:
- консультации и лечение у квалифицированных врачей;
- тщательное диагностическое обследование;
- динамическое наблюдение и оценку эффективности лечения;
- подбор наиболее современного и эффективного гормонального препарата;
- психологический комфорт для пациенток, внимательное отношение всего персонала;
- доступные цены на услуги.

Запишитесь на прием к гинекологу по телефону клиники. Помните, что при правильном лечении все пациентки с гиперплазией эндометрия избегают злокачественной трансформации этого заболевания.
причины, симптомы, диагностика и методы лечения на сайте «Альфа-Центр Здоровья»
Доброкачественное разрастание внутренней слизистой оболочки матки, сопровождается нарушением менструального цикла, ановуляторными маточными кровотечениями, бесплодиемПризнаки гиперплазии эндометрия отмечаются у 5-25% женщин. Этим термином обозначают патологическое увеличение эндометрия – внутреннего слизистого слоя полости матки. В норме он растет каждый месячный цикл. Утолщаясь под влиянием половых гормонов эстрогена и прогестерона, слизистая готовится принять яйцеклетку. Если зачатие не наступает, то снижение уровней гормонов вызывает отторжение ткани. После менструации процесс начинается заново. При гормональном сбое, повышается уровень эстрогенов, что и запускает процесс патологического роста эпителия.
Причины и симптомы гиперплазии эндометрия
Выделяют формы гиперплазии:
- железистая – утолщается железистая ткань слизистой;
- железисто-кистозная – образуются доброкачественные кисты;
- очаговая – появляются железистые и фиброзные полипы;
- атипичная (аденоматозная) – появляются измененные клетки, опасна перерождением в онкологическую форму (аденокарциному).
Основные причины заболевания гормональные сбои. Вероятность столкнуться с признаками гиперплазии эндометрия в периоде полового созревания и в начале климакса, когда в женском организме происходит гормональная перестройка. Ряд смежных проблем усиливают риски появления патологии:
- воспаления в мочеполовой системе;
- аборты, гинекологические операции на матке;
- наследственность;
- лишний вес;
- эндокринные заболевания;
- заболевания маки и придатков – миома, поликистоз яичников;
- неблагоприятная экологическая обстановка;
- гормональная терапия.
Определить патологию только по жалобам пациента сложно. Многие гинекологические заболевания проявляются похожим образом. К основным симптомам гиперплазии эндометрия относятся:
- нерегулярные, частые (чаще, чем 21 день), длительные менструации, с мажущими выделениями между ними;
- боли схваткообразного типа в животе;
- кровянистые выделения в период менопаузы.
Заболевание может протекать бессимптомно, особенно при климаксе.
Как лечить гиперплазию эндометрия
Лечение начинается с постановки точного диагноза. Для этого потребуются:
- гинекологический осмотр;
- УЗИ для оценки размеров, толщины, структуры слизистой матки, кист, полипов;
- гистологическое исследование ткани;
- гистероскопия – осмотр матки специальным датчиком;
- лабораторные тесты на гормоны.
Как лечат гиперплазию эндометрия решает врач. При простых формах эффективно гормональное лечение с применением:
- гестагенов – гормонов яичников и надпочечников;
- внутриматочной спирали;
- оральных контрацептивов, которые нормализуют циклический рост и отторжение ткани;
- гормональную терапию при менопаузе.
Если форма очаговая, то лечить гиперплазию эндометрия придется хирургическим путем, для удаления полипов. При аденоматозной форме – матку удаляют из-за риска появления раковой опухоли.
Лечение гиперплазии эндометрия не эффективно с применением народных методов. Откладывание терапии на «потом» могут привести к необратимым последствиям: бесплодию, анемии, онкологии. При раннем выявлении и соблюдении рекомендаций, шансы на выздоровление высоки.
ПАТОЛОГИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ У ЖЕНЩИН С ХРОНИЧЕСИМ ЭНДОМЕТРИТОМ
1Михалёва Л.М. Болтовская М.Н. Старосветская Н.А. Михалёв С.А.
Вопросы бесплодия остаются чрезвычайно актуальными и приоритетными в современном акушерстве и гинекологии, и в настоящее время представляют собой как серьезную как медицинскую, так и социальную проблему.
Для успешной имплантации и наступления беременности необходимо нормальное развитие эндометрия и его изменения в течение лютеиновой фазы менструального цикла. Среди возможных патологических изменений эндометрия, препятствующих успешной имплантации, является его хроническое воспаление. Хронический эндометрит встречается у женщин репродуктивного возраста в 80-90 % случаев и характеризуется длительным и малосимптомным течением, а также нередко приводящим к бесплодию, невынашиванию беременности, осложненному течению беременности и родов.
Характерными признаками хронического эндометрита является снижение чувствительности рецепторов эндометрия к действию половых гормонов и неполноценность циклических превращений, даже при удовлетворительном синтезе гормонов.
Целью настоящего исследования явилось изучение экспрессии гликоделина, одного из основных секреторных белков эндометрия, а также рецепторов эндометрия к эстрогенам и прогестерону у женщин с хроническим эндометритом.
Материалом исследования явились аспираты и соскобы из полости матки, полученных от 26 пациенток репродуктивного возраста в среднюю стадию фазы пролиферации (8-11 дни менструального цикла) и 7 пациенток того же возраста в ранней, средней и поздней стадиях фазы секреции. Из 22 пациенток, поступивших на обследование по поводу ациклических маточных кровотечений и бесплодия, морфологически был выявлен хронический эндометрит. Остальным 11 пациенткам было проведено pipell-диагностика в качестве обследования. В данной группе пациенток хронический эндометрит выявлен не был. Материал после фиксации в 10 %-ном нейтральном формалине и гистологической проводки был залит в парафин. Полученные гистологические срезы были окрашены гематоксилином и эозином, а также по ван Гизону. Гликоделин выявляли методом непрямого иммуноокрашивания с использованием оригинальных антител и системы визуализации ULtra Vision TL-015-YD (Lab Vision). Для оценки характера экспрессии рецепторов эндометрия к эстрогенам и прогестерону использовали моноклональные антитела: рецепторы к эстрогенам типа альфа и прогестерону типа А и В (Novocastra Lab Ltd).
Морфологически ХЭ был диагностирован в случае выявления умеренной или выраженной лимфоцитарно-макрофагальной инфильтрации, преимущественно очагового характера с примесью плазматических клеток, умеренного очагового фиброза стромы, склеротически измененных стенок кровеносных сосудов, включая спиральные артерии, наличия лимфоидных фолликулов как в базальном, так и функциональном слое эндометрия.
В образцах эндометрия, соответствующего средней стадии фазы пролиферации, без морфологических признаков хронического эндометрита гликоделин в эндометриальных железах не выявлялся, что соответствует его нормальной циклической динамике — отсутствие синтеза и секреции в пролиферативной фазе. В образцах эндометрия, соответствующих средней и поздней стадиях фазы секреции, без морфологических признаков хронического эндометрита гликоделин в эндометриальных железах выявлялся в средней стадии фазы секреции (имплантационное окно) с достижением пика секреции на 22-24 дни цикла. В эндометрии, соответствующем средней стадии фазы пролиферации, с признаками хронического эндометрита экспрессия гликоделина в эпителиоцитах желез была обнаружена с интенсивностью от умеренной до сильной в 83,3 %. Отсутствие секреции гликоделина в периовуляторном периоде является принципиально важным для регуляции репродуктивной функции, т.к. этот белок обладает контрацептивной активностью, блокируя связывание сперматозоидов с zona pelluccida яйцеклетки. Следовательно, обнаруженная нами продукция гликоделина в фазе пролиферации цикла у пациенток с хроническим эндометритом может быть одним из патогенетических механизмов его развития.
Динамика рецепции с стероидными гормонами при хроническом эндометрите следующая: в среднюю стадию фазы пролиферации уровень экспрессии рецепторов к эстрогенам эпителиоцитов желез и элементов стромы не отличался от контрольного уровня. В ранней стадии фазы секреции отмечено значительное снижение экспрессии рецепторов к эстрогенам. Экспрессия рецепторов к прогестерону у эпителиоцитов желез и элементов стромы была существенно снижена как в средней стадии фазы пролиферации, так и ранней стадии фазы секреции. Т.е. наиболее выраженные отличия от нормальных показателей имели место со стороны рецепторов к прогестерону. А именно, наибольшие отклонения экспрессии рецепторов к прогестерону отмечается в те периоды менструального цикла, когда она наиболее выражена — в ранней стадии фазы секреции.
Данное обстоятельство объясняет низкую восприимчивость эндометрия к прогестерону, что приводит к неподготовленности эндометрия к имплантации бластоцисты и для ее взаимодействия с эндометрием.
Таким образом, проведенное исследование объясняет патогенетические механизмы развития бесплодия, невынашивания и осложненной беременности и родов у женщин с хроническим эндометритом.
Библиографическая ссылка
Михалёва Л.М., Болтовская М.Н., Старосветская Н.А., Михалёв С.А. ПАТОЛОГИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ У ЖЕНЩИН С ХРОНИЧЕСИМ ЭНДОМЕТРИТОМ // Успехи современного естествознания. – 2011. – № 3. – С. 53-54;URL: https://natural-sciences.ru/ru/article/view?id=15963 (дата обращения: 08.08.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Эндометрия матки у женщин — что это такое в гинекологии?
Эндометрий – это особый слой, который выстилает внутреннюю поверхность матки. Его разделяют на функциональный (который отторгается при менструации) и базальный (который восстанавливается после месячных). Основная задача эндометрия матки – это создание наиболее благоприятных условий для имплантации эмбриона внутри матки.
Если его структура утолщается или становится более тонкой, то возникает реальная опасность того, что женщина не сможет выносить плод. Любые патологические процессы внутреннего слоя матки должны устраняться врачами на основании проведенных диагностических исследований.
Функции эндометрия
Эндометрий – это слизистый слой, который находится внутри матки, который меняет свою толщину в процессе периода менструации. В начале цикла она минимальна, достигая максимального размера к концу месячных. Если зачатия не произошло, то отслаивается участок эпителия и вместе с яйцеклеткой выводится естественным путем, т.е. вместе с менструальными выделениями. И так повторяется каждый цикл.
Существуют различные патологии эндометрия матки. При этом возникать они могут в разном возрасте – им подвержены женщины репродуктивного возраста и находящиеся в периоде менопаузы.
Гипоплазия
Гипоплазия эндометрия матки – это патологическое состояние, при котором толщина слизистого слоя становится меньше. Это состояние негативно влияет на закрепление яйцеклетки после оплодотворения. Такая патология возникает из-за следующих причин:
- Прерывание беременности (медикаментозное, инструментальное).
- Гормональные нарушения.
- Воспалительные процессы.
- Патологии мочеполовой системы.
- Наследственная предрасположенность.
- Хирургическое вмешательство.
- Проблемы с кровообращением.
Такое состояние может быть достаточно опасным. Здесь можно отметить не только проблемы с нормальным течением беременности, но и риск полного бесплодия женщины. Поэтому крайне важно выявлять патологию на ранних стадиях.
Проблема в том, что на этом этапе отсутствуют яркие симптомы, которые бы могли беспокоить пациентку. Выход один – проходить регулярные обследования у гинеколога, который может вовремя заметить истончение слизистого слоя матки в ходе УЗИ органов малого таза.
Симптомы гипоплазии
При гипоплазии эндометрия матки у женщин могут встречаться следующие симптомы:
- Беременность не наступает в течение длительного периода времени.
- Нарушения менструального цикла (нерегулярность, скудность или обильность выделений).
- Выкидыш.
- Недостаточно развитый волосяной покров наружных половых органов.
- Низкая чувствительность, что приводит к неудовлетворению сексуальной жизнью.
- Позднее появление первых месячных – после 16 лет.
- Боль внизу живота во время менструального цикла.
Вся эта симптоматика может быть причиной для обращения к врачу, но не должна использоваться для постановки 100% диагноза. Важно провести полное обследование, чтобы понять точную причину этих проявлений.
Гиперплазия
Под гиперплазией понимается утолщение эндометрия матки, при котором происходит изменение соотношения железистой ткани и стромы. Есть 2 типа этого патологического состояния:
- Простая гиперплазия. Морфологическая структура клеток сохраняется, но наблюдается увеличение числа желез. Относительно неопасное состояние, при котором риск злокачественного течения не превышает 2%.
- Сложная гиперплазия. При таком состоянии уже меняется структура тканей. Риск злокачественного перерождения – 20%.
В период менструации происходит обновление эндометрия и изменение гормонального фона. Все это сопровождается изменением концентрации эстрогена и прогестерона. Действие эстрогена приводит к утолщению слоя, а изменение уровня прогестерона приводит к разрушению эндометрия матки, если яйцеклетка не оплодотворена. Если все эти процессы протекают в нормальном режиме, то и менструальный цикл протекает без сбоев.
Появление гиперплазии обусловлено следующими факторами:
- Неправильное соотношение гормонов. Когда количество прогестерона уменьшается, а количество эстрогена, напротив, увеличивается. Такое состояние является следствием приема определенных медикаментов, неправильного образа жизни и других факторов.
- Процедуры, в ходе которых был поврежден эндометрий. Это может быть аборт, выскабливание тканей с целью диагностики и т.д.
- Нарушение структуры ДНК.
Симптомы гиперплазии
У многих женщин изменения в слизистой оболочке матки протекают бессимптомно. Но если эндометрий увеличен, то это может привести к нарушению менструального цикла, которое характеризуется болями и достаточно сильным маточным кровотечением.
К дополнительной симптоматике относится:
- Общая слабость.
- Задержка менструального цикла.
- Головокружение.
- Выделение сгустков крови.
- Бледность.
- Боль в области половых органов, что мешает нормальной сексуальной жизни.
- Проблемы с зачатием при активной половой жизни.
Какие еще есть заболевания эндометрия?
В современной медицине есть различные заболевания эндометрия, каждые из которых имеют свои определенные причины возникновения, симптоматику и способы терапии. Вот основные из них:
- Эндометрит. Заболевание, которое характеризуется воспалительным процессом в слизистой оболочке матки. Патология появляется из-за проникновения разного рода инфекций, в том числе и половых. Может быть спровоцировано хирургическими операциями. Симптомы: кровянистые гнойные выделения, интоксикация и интенсивные боли, локализованные в нижней части живота. Если патология возникла после аборта, то проводится выскабливание. В остальных случаях проводится медикаментозная терапия.
- Эндометриоз. Патология провоцируется гормональными нарушениями. Приводит к возникновению эндометрия в тех тканях и органах, где его быть не должно. Симптоматика достаточно яркая: кровянистые выделения после окончания месячных, боли в пояснице. В некоторых случаях может наблюдаться кровь в моче и анальном отверстии.
- Онкология. Опасность в том, что появившиеся метастазы могут привести к смерти. Рак часто проявляется только на поздних стадиях, поэтому врачи настоятельно рекомендуют каждые 6 месяцев проводить гинекологический осмотр.
- Полипы. Эти образовании располагаются на эндометрии, нарушая его толщину. Ярких симптомов нет, но лечение все равно проводится медикаментозными способами.
Как диагностируются патологии эндометрии?
При появлении у женщины симптоматики, характерной при поражениях эндометрии матки, нужно немедленно обратиться к врачу. Для начала пациентку направляют на стандартные лабораторные исследования – анализ мочи и крови. Проводится гинекологический осмотр, в ходе которого врач определяет изменения формы матки, проверяет толщину эндометрия – увеличен или истончен этот слой.
Есть и другие методы диагностики:
- Гистологический анализ.
- Эхография. Изучается фактическая толщина эндометрия, структура и плотность. С его помощью можно диагностировать гипоплазию, гиперплазию и другие заболевания.
- Гистероскопия. Обследование проводится при помощи специального эндоскопа. В ходе процедуры изучается слой матки (истончен или нет). Данная методика позволяет выявить полипы.
- Анализ крови на гормоны. Определяется уровень эстрогена и прогестерона для выявления гормонального дисбаланса.
Изменение толщины эндометрия у женщин в период менопаузы
У женщины в период менопаузы должна быть определенная толщина эндометрия. Если она увеличивается, то есть риск развития ряда заболеваний. Для этого периода нормально, если в ходе УЗИ диагностируется сильное истончение слизистого слоя. Допустимая норма – не более 5 мм. Если толщина увеличивается до 6-7 мм, то за пациенткой должен осуществляться постоянный контроль, чтобы определить динамику этих изменений.
Изменения гормонального фона в период климакса – это абсолютно нормальное явление. Они влияют на работу множества внутренних органов, включая матку. Одним из наиболее часто встречающихся заболеваний является именно гиперплазия эндометрия. В этом возрасте она может проявляться следующей симптоматикой:
- Появление волос в тех местах, где их раньше не было.
- Специфические выделения (бурого или коричневого цвета).
- Голос становится более грубым.
- Кровяные выделения во время сексуального контакта.
- Длительный и достаточно болезненный менструальный цикл (если еще не наступила постменопауза).
Причины изменения толщины эндометрия в период менопаузы
Чем старше становится женщина, тем больше изменений происходит в ее организме. С возрастом выработка эстрогена постепенно снижается, что сказывается на структуре эндометрия, который начинает атрофироваться. Истончается не только слизистый слой, но и уменьшается в размерах сама матка.
В климактерический период достаточно часто происходят гормональные сбои, которые приводят к тому, что слой продолжает увеличивать в размерах. Опасность этой ситуации в том, что своевременного отторжения эпителия не происходит (как при нормальном менструальном цикле). На утолщение слизистого слоя матки косвенно влияет:
- Заболевания гипофиза.
- Ожирение. Объясняется это тем, что жировые клетки – это источник эстрогена.
- Заболевания поджелудочной железы.
- Опухолевые образования на яичниках.
- Нестабильная работа иммунной системы.
- Неединичное количество абортов.
- Неконтролируемый прием гормональных контрацептивов.
Способы лечения
Лечение различных патологий, происходящих в эндометрии матки, проводится двумя способами – консервативным или хирургическим. Такие кардинальные меры, как операция, проводятся в крайних случаях, когда медикаментозное лечение не дает нужного результата, либо оно изначально неэффективно.
Консервативное лечение женщин с заболеваниями эндометрия матки основывается на нескольких факторах. Важен возраст пациентки, фактическая стадия заболевания и то, планирует ли она в дальнейшем иметь детей.
Один из способов лечения – заместительная гормонотерапия. Здесь важно, чтобы прием этих средств был под контролем лечащего врача. Препараты для наращивания эпителия матки: «Дивигель», «Прогинова», «Дюфастон» и т.д.
Хирургическое лечение назначается в следующих случаях:
- Проведение медикаментозной терапии не имеет смысла.
- Есть противопоказания к приему гормональных препаратов.
- Диагностирована атипическая гиперплазия в климактерический период.
- Повторная предраковая гипоплазия.
Изменение толщины и структуры эндометрия в матке – это потенциально опасное состояние, которое влияет на нормальное течение беременности. Возможны ситуации, при которых женщина и вовсе не может выносить ребенка.
Это состояние опасно и для пациенток не репродуктивного возраста, поэтому при появлении первой симптоматики нужно обратиться к врачу. Универсальный совет – это плановые посещения гинекологического кабинета, особенно если вы планируете беременность.
Гистероскопия, мануальная вакуумная аспирация эндометрия, диагностическое выскабливание цервикального канала
Гистероскопия, мануальная вакуумная аспирация эндометрия, диагностическое выскабливание цервикального канала
Гистероскопия, мануальная вакуумная аспирация эндометрия, диагностическое выскабливание цервикального канала.
Гистероскопия– малоинвазивная лечебно-диагностическая манипуляция для выявления и удаления патологии эндометрия (внутренней оболочки матки), с последующим гистологическим исследованием удаленного материала. Гистероскопия не предусматривает использование каких-либо разрезов и образование шрамов. Через видеокамеру изображение передается на монитор, хирург-гинеколог проводит все манипуляции строго под контролем изображения. Таким образом риск осложнений сводится к нулюМануальная вакуумная аспирация эндометрия, диагностическое выскабливание цервикального канала.
Вакуумная аспирация полости матки (вакуум-аспирация) – это удаление ее содержимого вместе с функциональным слоем слизистой оболочки (эндометрия). Для проведения манипуляции используется прибор, называющийся «вакуум-аспиратор». Он представляет собой канюлю, или аспирационный наконечник, соединенный гибкой трубкой с аспиратором. Механизм при помощи усилий хирурга-гинеколога создает отрицательное давление. Мощный всасывающий эффект, созданный аспиратором, позволяет собрать и вывести накопившуюся кровь, частицы содержимого полости матки. !!!Основной плюс в проведении данной процедуры — это минимальное повреждение стенки матки и цервикального канала, что особенно важно для пациенток планирующих беременность и возрастных пациенток, у которых истончены стенки матки.
Диагностическое выскабливание цервикального канала обязательно проводится пациенткам с патологией шейки матки, и в возрасте более 40 лет, для исключения онкологических заболеваний шейки матки.Данная манипуляция проводится металическим инструментом(кюреткой) небольшого размера, которым хирург-гинеколог соскабливает внутренний слой цервикального канала.
В Нашем МЦ Парацельс для проведения гистероскопии используется оборудование фирмы Karl Storz (производитель №1 в мире эндоскопии).
Показания для гистероскопии, мануальной вакуумной аспирации эндометрия, диагностического выскабливания цервикального канала.:
- маточное кровотечение
- полип цервикального канала
- полип полости матки
- гиперплазия эндометрия
- синехии полости матки
- субмукознаямиома матки c целью диагностики.
- наличие гиперплазии энометрия при сопутствующей терапии других заболеваний, например при использовании гормональной терапии при раке молочной железы.
- Регрессирующая беременность.
- Состояние после неполного самопроизвольного выкидыша.
- Остатки плодных тканей после процедуры прерывания беременности.
- Подготовка к ЭКО, бесплодие.
Противопоказания:
- Острая инфекция мочеполовой системы.
- Острые инфекционные и воспалительные процессы любых органов и систем.
- Обильное кровотечение.
- Желаемая беременность.
- Рак матки.
Обезболивание:В целях безболезненности и снижения дискомфорта процедура проводится под общей внутривенной анестезией.
Обследование на оперативное вмешательство и сроки действия результатов обследования:Все необходимые обследования Вы можете пройти в Нашем МЦ Парацельс за один день и в день обращения!
- кольпоскопия-12мес
- УЗИ органов малого таза-1 мес
- УЗИ вен нижних конечностей — 3мес
- Мазок на флору-10дн
- онкоцитология с шейки матки — 6мес
- Общий анализ мочи-10 дн, Общий анализ крови и ретикулоциты -10 дн,
- Электрокардиограмма с расшифровкой -14дн,
- Кровь на ВИЧ, Гепатит В, Гепатит С, Сифилис 3мес.
- Биохимический анализ крови: общий, прямой, непрямой Билирубин, Общий Белок, альбумин,
- мочевина, глюкоза, креатинин, мочевая кислота, АСТ,АЛТ, натрий и калий крови,холестерин -10дн
- Коагулограмма — 10дн
- Группа Крови и резус фактор
- Флюрография — 6мес.
- Маммография -24мес (после 36 лет), 12мес( после 50лет)УЗИ молочных желез -12мес(до 36лет)
- Консультация Терапевта, анестезиолога и других специалистов по показаниям.По показаниям могут быть добавлены другие обследования.
Перед проведением данного оперативного вмешательства, пациентке необходимо обратиться на прием хирурга-гинеколога.На приеме врач подробно объяснит суть процедуры, альтернативные методы лечения и ответит на все вопросы пациентки.
Данная процедура требует госпитализации в стационар на несколько часов.При необходимости, выдается больничный лист.После получения результатов гистологического исследования в Нашем МЦ Парацельс Вы можете продолжить наблюдение и лечения у хирург-гинеколога, который проводил Вам операцию.
Оценка и лечение повторной неудачной имплантации (RIF)
Тромбофилия
Хотя тромбофилическое состояние, наследственное или приобретенное, в основном связано с повторной потерей беременности, несколько исследователей сообщили о связи между RIF и тенденцией к состояниям гиперкоагуляции [ 7, 43]. Предполагается, что механизм неудачной имплантации аналогичен механизму потери беременности, а именно нарушается кровоток к эндометрию и плаценте.Нарушение кровотока может, с одной стороны, препятствовать нормальной восприимчивости эндометрия, а с другой — вызвать выкидыш. Было показано, что для пациентов с РИФ, у которых диагностирована тромбофилия, лечение гепарином значительно улучшает имплантацию, а также снижает частоту клинической беременности при последующих попытках ЭКО [16, 78]. Тем не менее, связь между состоянием гиперкоагуляции и RIF все еще остается спорной, поскольку другие исследователи не обнаружили более высокой распространенности тромбофилии у пациентов с RIF по сравнению с контрольной группой [62, 96].Таким образом, точный механизм такой ассоциации, если она существует, неясен. Тем не менее, при суммировании всех исследований, посвященных полиморфизму генов и признаку тромбофилии, кажется, что протромботические расстройства более распространены у пациентов с РИФ, чем в контрольной группе [106].
В то время как пациенты с РИФ, страдающие протромботическим расстройством, могут получить пользу от лечения гепарином, для тех, у кого нет этого отклонения, эмпирическое лечение гепарином неоправданно [13, 87, 108]. В целом рекомендуется обследовать пациентов с диагнозом РИФ на предмет приобретенных, а также наследственных тромбофилий (рис.) и относиться к ним соответственно.
Иммунологические факторы
Ряд исследований указывает на важную роль иммунологической системы в процессе имплантации и в последующем поддержании беременности [21, 89, 97].
Зачатие должно быть признано несамостоятельным, чтобы запустить иммунологический процесс, не позволяющий материнской иммунной системе отторгать его. Система совместимости HLA, очевидно, играет роль в этом признании. Пары, которые имеют общие аллели HLA, могут испытывать повторную потерю беременности [20] или, как было предложено Elram et al.[34], может пострадать от РИФ. Точный молекулярный механизм, объясняющий, почему общие аллели HLA среди пар связаны с повторяющейся потерей беременности или RIF, все еще неясен. Однако имел место неадекватный ответ материнской иммунной системы на стимуляцию отцовскими антигенами из-за совместного использования HLA. Такой неадекватный ответ может включать дисбаланс ответа Т-хелпер 1: Т-хелпер 2 (Th2: Th3), в результате чего материнская система становится более цитотоксичной или снижается экспрессия менее полиморфных HLA-E, HLA-F и HLA-G, который демонстрирует иммунорегуляторную функцию, связанную с толерантностью матери к плоду [28].
Лечение с помощью иммунизации отцовскими лейкоцитами, как предлагалось ранее [20], больше не рекомендуется из-за возможных побочных эффектов для матери и плода из-за непредсказуемого иммунного ответа на аутологические или аллогенные компоненты крови [19, 73, 103 ]. С другой стороны, введение высоких доз ИГВВ сопряжено с меньшим риском и, как было обнаружено, приносит пользу пациентам с РИФ, которые имеют общие аллели HLA со своим партнером [34]. Хотя количество общих аллелей, оправдывающих назначение лечения IVIg, не было определено, мы успешно лечили пациентов с одним общим аллелем.Лечение состоит из 30 г внутривенного иммуноглобулина перед переносом эмбриона (ЭТ) и второй аналогичной дозы, когда отмечается частота сердечных сокращений плода [34].
Лечение внутривенным иммуноглобулином в основном назначается при повторном невынашивании беременности, которое определяется как необъяснимое или связанное с общими аллелями HLA у пары. Польза от такого лечения все еще сомнительна, а данные противоречивы [4, 24]. Elram et al. [34] были первыми, кто предположил, что пациенты с общими аллелями RIF и HLA могут получить пользу от лечения IVIg.Тем не менее, из-за высоких затрат как на тестирование HLA, так и на лечение ИГВВ, мы предлагаем проводить оценку вклада иммунной системы в RIF в последнюю очередь и только после того, как все другие причины будут исследованы, устранены или исключены.
Недавно сообщалось, что инфузия 20% раствора интралипида улучшает исходы у женщин с РИФ [68]. В нерандомизированном исследовании, представленном на научном совещании в Соединенном Королевстве [68], частота наступления беременности 50% и частота клинической беременности 46% были достигнуты у пациентов с РИФ, у которых был повышенный цитокиновый ответ Th2.Инфузия интралипида вводилась один раз между 4 и 9 днями стимуляции яичников и снова в течение 7 дней после положительного теста на беременность. Во всех случаях ( n = 50) соотношение активности Th2: Th3 снижалось после лечения интралипидом. Это изменение активности цитокинов было признано ответственным за успешный результат. Обычно используемый для парентерального питания интралипид представляет собой жировую эмульсию, которая, как сообщается, подавляет аномальную цитотоксическую активность NK в периферических NK-клетках у женщин с рецидивирующей репродуктивной недостаточностью как in vitro, так и in vivo [81].Русев и др. [81] показали, что инфузия 2–4 мл 20% раствора интралипида в 250 мл физиологического раствора может эффективно подавлять активность естественных киллеров (NK) у пациентов с аномальной цитолитической активностью NK, превышающей 11%. Эта модуляция иммунной системы, достигаемая однократным введением интралипида и продолжающаяся в течение нескольких недель, является основой для лечения интралипидом у пациентов с RIF, у которых была обнаружена повышенная цитотоксическая активность NK. Точный механизм, с помощью которого интралипид модулирует иммунную систему, до сих пор неясен.Тем не менее, было высказано предположение, что жирные кислоты в эмульсии служат лигандами для активации рецепторов, активируемых пролифератором пероксисом (PPAR), экспрессируемых NK-клетками. Было показано, что активация таких ядерных рецепторов снижает цитотоксическую активность NK, что, следовательно, может усиливать имплантацию и поддерживать беременность [81]. Возможность того, что интралипид может модулировать иммунную систему, положительно повлиять на имплантацию и поддержание беременности, является многообещающей. Однако после оценки соответствующих доступных данных Шрив и Садек [92] пришли к выводу, что эти результаты следует рассматривать с осторожностью и что необходимы крупномасштабные подтверждающие исследования, чтобы доказать эффективность интралипида, прежде чем его следует рекомендовать для рутинного использования.Кроме того, многие программы ЭКО, в том числе наша, выполняют извлечение яйцеклеток под общей анестезией, применяя пропофол в качестве снотворного средства короткого действия. Раствор пропофола содержит те же компоненты эмульсии интралипида (10% соевого масла и 1,2% очищенного яичного фосфолипида с 2,25% глицерина) с добавлением 1% пропофола. Хотя пропофол широко используется и в объемных дозах, превышающих рекомендованные для лечения RIF, проблема необъяснимого RIF остается проблемой, требующей решения.
Эндометрий
Функционирующий и восприимчивый эндометрий имеет решающее значение для имплантации эмбриона. Во время менструального цикла эндометрий претерпевает как морфологические, так и биологические изменения, которые подготавливают его к взаимодействию с эмбрионом и, в конечном итоге, к успешной имплантации. Как только происходят все биологические изменения, эмбрион может прикрепиться, проникнуть в эндометрий и, наконец, имплантироваться. Этот решающий этап длится несколько дней и называется «окном имплантации». Для возникновения «окна имплантации» эндометрий должен разрастаться, увеличиваться в толщине, а затем, после овуляции, адекватно реагировать на прогестерон и становиться восприимчивым.Ультразвуковое исследование толщины и внешнего вида эндометрия является легко выполняемым средством оценки морфологических изменений, происходящих в эндометрии во время фолликулярной фазы, и, таким образом, используется в качестве меры для прогнозирования успешной имплантации. Действительно, в нескольких исследованиях сообщается о тесной связи между толщиной эндометрия и успешной имплантацией [12, 23, 32, 41, 69, 91]. Однако другим не удалось подтвердить такую связь [39, 53, 71, 115]. Минимальная адекватная толщина эндометрия для успешной имплантации, измеренная на поздней стадии пролиферации, варьируется между исследованиями в диапазоне 6–8 мм.Однако, хотя и редко, некоторые исследователи сообщают об успешной имплантации в эндометрий толщиной не более 5 мм [33, 102].
Тонкий и нечувствительный эндометрий, особенно после хирургических вмешательств в полости матки [94], трудно поддается лечению и, очевидно, способствует неудачам имплантации. Было реализовано несколько подходов для увеличения толщины эндометрия и, предположительно, для подготовки его к «окну имплантации». Лечение высокими дозами эстрогена перорально или вагинальным введением эстрадиола, направленное на повышение уровня эстрадиола в сыворотке, а также вблизи эндометрия, продемонстрировало лишь незначительный успех [22, 107].Точно так же лечение низкими дозами аспирина [114] или вагинальным силденафилом [90], которые предположительно увеличивают приток крови к матке и, следовательно, улучшают реакцию на эстрадиол, было довольно разочаровывающим [86]. Наш подход состоит в том, чтобы заморозить эмбрионы при обнаружении тонкого эндометрия и, если возможно, передать их в естественном цикле; или, в качестве альтернативы, в искусственном цикле при применении повышенных доз эстрадиола в течение трех недель до добавления прогестерона. После добавления прогестерона дозу лечения эстрадиолом можно снизить или снова переключить с вагинального на пероральный путь введения.Тем не менее, если все методы лечения не помогают, следует предложить суррогатное материнство в качестве варианта.
Как упоминалось ранее, «окно имплантации» характеризуется морфологическими и гистологическими изменениями эндометрия, которые связаны с интенсивной биологической активностью, исходящей от материнской иммунной системы, эндометрия и самого эмбриона. Взаимодействие между эндометрием и развивающимся эмбрионом опосредуется многими веществами, включая цитокины (IL1, IL6 и его продукт LIF), интегрины, молекулы адгезии, металлопротеины, факторы роста, простагландины и гормоны, такие как ХГЧ, все из которых поддерживают процесс аппозиции, адгезии и инвазии [1].
Исследование стадий сложного процесса имплантации вдохновило исследователей на использование некоторых медиаторов для облегчения имплантации. Когда Саймон и др. [95] использовали гиалуроновую кислоту в среде для переноса, чтобы заменить альбумин в качестве макромолекулы, они не обнаружили увеличения частоты наступления беременности. Аналогичным образом, та же группа [11] сообщила о сопоставимых показателях беременности между пациентами, которым вводили ХГЧ во время секреторной фазы гормонально-модулированного цикла переноса замороженных размороженных эмбрионов, и пациентами, не получавшими лечения.Осознавая, что секреция LIF эндометрием может быть низкой у пациентов с RIF [46], другие исследователи протестировали системное введение LIF пациентам с RIF. Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование не смогло продемонстрировать, что введение r-hLIF после переноса эмбриона улучшает показатели имплантации и наступления беременности по сравнению с плацебо [17]. Однако, поскольку в последних исследованиях и ХГЧ, и LIF применялись системно, их прямое местное влияние на эндометрий неясно.С другой стороны, когда полость матки промывалась средой с добавлением ХГЧ непосредственно перед переносом эмбриона, частота наступления беременности, а также частота имплантации увеличивались по сравнению с контролем [60]. Хотя это многообещающе, еще предстоит определить, увеличивает ли местная доставка до переноса эмбриона веществ, участвующих в процессе имплантации, эффективность имплантации. Gleicher et al. [38] предполагают, что местная доставка различных медиаторов путем промывания полости матки может принести реальную пользу пациентам с РИФ.Они использовали перфузию эндометрия с гранулоцитарным колониестимулирующим фактором (G-CSF), чтобы вызвать утолщение эндометрия. Успешное увеличение толщины эндометрия как минимум до 7 мм после перфузии матки G-CSF наблюдалось у четырех пациенток, ранее резистентных к лечению эстрогенами и вазодилататорами. Тот факт, что все четыре пациентки забеременели, хотя одна беременность потребовала прерывания из-за интрамурального эктопического расположения роговицы, предполагает, что перфузия эндометрия с помощью G-CSF может улучшить имплантацию.
В отдельном исследовании G-CSF, системно вводимый пациентам с RIF, принес пользу только пациентам с дефицитом трех критически важных генов активирующих иммуноглобулиноподобных рецепторов (KIR) клеток-киллеров [119]. У этих пациентов взаимодействие между эмбриональным трофобластом через его экспрессию HLA-C и естественными клетками-киллерами матки (uNK) было затруднено, что привело к неудаче имплантации или выкидышу. Воздействие G-CSF на NK-клетки до конца не выяснено. Однако недавние данные предполагают, что G-CSF может быть сильным ингибитором активности NK-клеток [85].Вопрос о том, зависит ли эффект G-CSF на uNK-клетки от присутствия или отсутствия специфических рецепторов NK-клеток у пациентов с RIF, еще предстоит изучить [106].
Некоторые исследователи предположили, что пациентам с РИФ может быть полезна стимуляция эндометрия, вызванная местным повреждением в результате катетера для биопсии эндометрия матки в цикле, предшествующем фактическому циклу лечения [9, 58, 66, 80]. В рандомизированном контролируемом исследовании, включавшем 100 пациентов с диагнозом РИФ, Narvekar et al.[66] выполнили два забора эндометрия, один в фолликулярной фазе, а другой в лютеиновой фазе цикла, предшествовавшего циклу переноса эмбриона. Авторы сообщили о значительном улучшении частоты клинической беременности (32,7% против 13,7%), частоты живорождений (22,4% против 9,8%) и частоты имплантации (13,07% против 7,1%) у пациенток, перенесших вмешательство, по сравнению с те, кто этого не сделал. Точный механизм такого благодарного эффекта до конца не изучен. Однако постулируется, что выполнение биопсии вызывает воспалительную реакцию, которая может облегчить подготовку эндометрия к имплантации.Повышенные провоспалительные цитокины, а также повышенная экспрессия MIP-1B в регенеративном эндометрии могут играть роль в имплантационной компетентности [40]. Интересно, что этот положительный воспалительный эффект длится, по крайней мере, еще один месяц, что улучшает имплантацию в последующем цикле. Точный механизм такого положительного воздействия на имплантацию после отбора образцов эндометрия, а также количество таких стимуляций эндометрия и их время в течение цикла, предшествующего переносу эмбриона, еще предстоит определить [67].
Клинические признаки необратимого отторжения после аллогенной трансплантации матки у яванских макак
Важной целью UTx является улучшение качества жизни (QOL) женщин с бесплодием с маточным фактором, позволяя этим женщинам иметь ребенка, в отличие от трансплантации жизни -опорные органы. UTx дал большие надежды парам, не имеющим детей из-за бесплодия маточного фактора. Однако трансплантация органов сопряжена с различными рисками, и отторжение вызывает особую озабоченность.Антигенность пересаженного органа зависит от типа органа и неясна для матки. Беременная матка позволяет инородному организму развиваться внутри и, таким образом, можно предположить, что она поддерживает иммунную толерантность. С другой стороны, такие органы, как кожа, тонкий кишечник и легкие, которые контактируют с внешней средой, имеют хорошо развитые иммунные механизмы, которые могут вызывать отторжение. Матка также контактирует с внешней средой через влагалище, и это может объяснить высокий потенциал отторжения пересаженной матки.
Некоторые случаи UTx у человека приводили к отторжению матки 4,5,6,7,8,9 , но ни в одном из них не потребовалась гистерэктомия из-за рефрактерного отторжения. Удаление органа из-за отторжения после трансплантации жизнеобеспечивающего органа обычно приводит к летальному исходу. Поскольку UTx не поддерживает жизнь, а направлен на улучшение качества жизни, особое внимание следует уделять безопасности здорового реципиента. Клинические признаки необратимого отторжения после UTx неизвестны, включая потенциальную смертность, которая возникает при трансплантации других органов, и важна подготовка к неожиданным событиям после UTx.Таким образом, в этом исследовании мы исследовали шесть макак cynomolgus, у которых произошло необратимое отторжение в нашей экспериментальной серии аллогенной UTx, чтобы прояснить клинические особенности необратимого отторжения. Основными обнаруженными особенностями были временное повышение уровня лейкоцитов, ЛДГ и СРБ до и после необратимого отторжения, опухшая матка во время необратимого отторжения, которая затем со временем сжимается, и хорошее общее состояние. При лапаротомии матка без маточного кровотока была сильно адгезивной с окружающими тканями.Патологические данные матки показали гиалинизацию интерстиция во всех слоях матки с дефицитом эндометрия.
Повышение уровня лейкоцитов и СРБ указывает на воспалительную реакцию, а повышенный уровень ЛДГ предполагает распад клеток из-за отторжения. При обычных трансплантациях органов жизнеобеспечения вместо биопсии можно использовать клинические симптомы и биохимические данные для мониторинга отторжения. Напротив, матка не является органом жизнеобеспечения, и отторжение не представляет немедленной угрозы для жизни и часто протекает бессимптомно; следовательно, не было зарегистрировано никаких явных данных, свидетельствующих об отторжении у человека UTx.Приведенные выше биохимические данные могут быть одним из индикаторов; однако эти результаты часто вызваны необратимым отторжением, и, вероятно, будет трудно восстановить функцию матки после того, как они возникнут. Таким образом, мониторинг отторжения с помощью альтернативных биопсии средств сложнее при UTx, чем при трансплантации поддерживающих жизнь органов.
Набухание матки во время отторжения показывает воспалительный отек из-за отторжения, а последующее сокращение отражает повреждение клеток, некротическую гибель клеток, а также гиалинизацию и образование грануляционных тканей из-за ишемии с течением времени, что приводит к атрофии.Матки в случаях 4 и 5 все еще были опухшими при вскрытии, но вполне вероятно, что эти матки впоследствии станут атрофическими, поскольку в этих случаях не удалось преодолеть отторжение матки. Эти процессы также происходят в органах жизнеобеспечения, таких как трансплантация почек и печени.
Основная проблема при UTx заключается в том, следует ли удалять матку с необратимым отторжением. Такая матка вряд ли вызовет серьезные проблемы после отторжения и последующей атрофии матки и потери функции, потому что матка не является жизненно важным органом.Это исследование также показало, что общее состояние макак, у которых произошло необратимое отторжение, оставалось хорошим. Аналогичным образом хорошее общее состояние сохраняется у макак с атрофированной маткой после теплой ишемии в течение 8 часов, что мы использовали для изучения допустимого времени теплой ишемии и ишемического реперфузионного повреждения матки у яванских макак 15 . Таким образом, жизненно важные органы в случае потери их функции приводят к опасным для жизни состояниям, но матка не имеет решающего значения для выживания.Это отличие от других жизнеобеспечивающих органов является преимуществом трансплантации не поддерживающих жизнь органов.
При трансплантации почки хроническая дисфункция аллотрансплантата — это хроническое, прогрессирующее и необратимое состояние пересаженной почки и одна из основных причин потери аллотрансплантата среди реципиентов трансплантата почки. В таком случае гемодиализ вводится в качестве альтернативного метода спасения жизни. Трансплантат будет постепенно атрофироваться, если его оставить в брюшной полости, и вопрос о том, следует ли удалять бессимптомный неэффективный почечный аллотрансплантат перед повторной трансплантацией, все еще остается спорным.Сообщаемая частота хирургической нефрэктомии с аллотрансплантатом после несостоятельности трансплантата колеблется от 20 до 80% и в основном зависит от политики центра 16 . Некоторые исследователи выступают против удаления бессимптомного неудачного аллотрансплантата из-за заболеваемости и смертности, связанных с нефрэктомией после трансплантации. 17,18 . Напротив, другие утверждали, что отказавший аллотрансплантат является источником сепсиса или хронического воспаления, которое может привести к осложнениям, и поэтому его следует регулярно удалять.Нет единого мнения о сроках и показаниях для нефрэктомии с использованием аллотрансплантата.
Неудивительно, что продолжение иммуносупрессии после отказа трансплантата приводит к увеличению инфекционных осложнений. Поэтому после ранней неудачи трансплантата трансплантат часто удаляют, чтобы предотвратить острое отторжение и обеспечить быстрое сокращение или полную отмену иммунодепрессантов. При вспомогательной частичной ортотопической трансплантации печени (APOLT) частичный трансплантат печени имплантируется в ортотопическом положении после того, как остается часть собственной печени, что имеет потенциальное преимущество отмены иммуносупрессии при острой печеночной недостаточности 19 .В этом методе отмена иммунодепрессантов может быть постепенной, так что трансплантат подвергается медленному отторжению и в конечном итоге становится атрофическим и фиброзным, в то время как собственная печень продолжает регенерировать, чтобы компенсировать потерю объема трансплантата. Однако атрофический трансплантат, возможно, придется удалить после отмены иммуносупрессии, если он инфицирован 20 .
С учетом этого неясно, следует ли оставить атрофическую матку после необратимого отторжения в тазу или удалить.Постоянное отторжение под действием иммунодепрессантов приводит к развитию инфекции, поскольку полость матки контактирует с внешней частью тела через влагалище, тогда как почки и печень не контактируют напрямую с внешней средой. В первом шведском исследовании UTx у пациентки была повторная внутриутробная инфекция после UTx, и матку пришлось резецировать. 5 . Мы также испытали эту ситуацию у макак cynomolgus, у которых были абсцессы, временно присутствующие в полости матки после аллогенной UTx, в которой происходило постоянное отторжение 14 .Поскольку реципиенты трансплантата получают иммунодепрессанты, у них выше риск инфицирования, чем у обычных пациентов. Иногда интраабдоминальная инфекция приводит к летальному исходу, и гистерэктомия должна быть лучшим выбором для обеспечения безопасности реципиента в такой ситуации.
Одна из проблем, связанных с гистерэктомией, заключается в том, что отторгнувшаяся матка, вероятно, будет сильно прилипать к окружающим тканям из-за воспаления, что приводит к большему количеству операционных осложнений, чем при обычной гистерэктомии.Кроме того, если не произойдет инфицирование матки, трансплантат будет атрофирован естественным образом. Это естественное течение поддерживает мнение о том, что повторная операция по удалению трансплантата не нужна и может создать риски и обременить пациента. В сообщениях на людях обычно выполнялись послеродовые операции, чтобы можно было отменить иммунодепрессанты для снижения риска инфекции. Вопрос о том, проводить ли гистерэктомию при необратимом отторжении матки, атрофированной матке или трансплантированной матке после родов, явно требует дальнейшего обсуждения.Более того, это исследование имеет ограничение, заключающееся в том, что эти результаты у яванских макак не всегда могут быть экстраполированы на людей, даже если нечеловеческие модели приматов имеют анатомическое и физиологическое сходство их репродуктивных органов и иммунной системы с людьми.
В заключение, необратимое отторжение после аллогенной UTx у яванских макак было связано с увеличением лейкоцитов, LDH и CRP и уменьшением матки после временного набухания. Общее состояние было хорошим даже после отказа матки из-за отторжения, что говорит о том, что отторжение трансплантации матки не является фатальным, в отличие от отторжения органов жизнеобеспечения.
Границы | Иммунное профилирование эндометрия может положительно повлиять на ведение рецидивирующей потери беременности
Введение
Рецидивирующая потеря беременности (RPL) — одна из самых неприятных и сложных областей в репродуктивной медицине, поскольку этиология часто неизвестна, а диагностика и лечение основаны на доказательствах. стратегии немного. РРЛ определяется как три последовательных выкидыша на сроке до 20 недель беременности. Эпидемиологические исследования показали, что 1-2% женщин страдают РПН (1, 2).В 2018 году руководство ESHRE сократило до двух количество самопроизвольных выкидышей, необходимых для начала исследования.
Документированные причины этого многофакторного гетерогенного заболевания включают параметры ооцитов и сперматозоидов, родительскую хромосомную структуру, анатомическую структуру, иммунологические факторы и факторы тромбофилии (антифосфолипидный синдром, фактор V Лейдена, носители гомозиготной мутации фактора II), гормональные состояния и образ жизни, что подразумевает, что Для ведения RPL требуется мультидисциплинарный подход (3–15).
Необъяснимая RPL определяется при отсутствии известной причины и составляет 50% всех RPL (16).
Считается, что значительная, хотя и не точно определенная количественно, доля RPL связана с иммунной этиологией (17) (18) и что в этих случаях выкидыши могут происходить из-за стойких нарушений в нескольких иммунных путях (19). В этом контексте большую роль может играть эндометрий (20). Новые данные свидетельствуют о том, что нарушение регуляции эндометрия в окружающей среде связано с некоторыми важными репродуктивными нарушениями, в том числе с повторной неудачей имплантации (RIF) и RPL (21-24).Иммунное профилирование эндометрия — это новая концепция, основанная на анализе местной иммунной реакции, происходящей в эндометрии во время имплантации эмбриона (25) (26) (27). Период восприимчивости матки, называемый окном имплантации, наступает через пять-девять дней после овуляции (28). В этот конкретный период должен происходить фундаментальный иммунный переключатель не только для предотвращения отторжения полуаллогенного эмбриона, но и для стимулирования его роста и питания (29) (30). Синхронизированные изменения в иммунной среде эндометрия важны для адекватной имплантации эмбриона и плацентации (31).
Наша основная гипотеза состоит в том, что некоторые выкидыши могут быть следствием ранних нарушений иммунной регуляции матки (21–24), которые, когда-то задокументированные, можно исправить с помощью индивидуализированной терапии. Иммунное профилирование матки за счет лучшего понимания среды эндометрия позволяет найти оптимальный локальный баланс для успешной имплантации и беременности. Понимание местной иммунной среды матки направлено на то, чтобы предвидеть будущее взаимодействие между эндометрием и эмбрионом. Недостаточно активная иммунная среда может не вызвать псевдовоспалительную реакцию, необходимую для успешной имплантации.И наоборот, сверхактивная иммунная среда может привести к отторжению эмбриона. Первоначально иммунное профилирование эндометрия было разработано, чтобы помочь бесплодным пациентам с РИФ в анамнезе (27). По аналогии мы здесь описываем клинические результаты, наблюдаемые у пациентов со спонтанной репродуктивной функцией, но с RPL.
Основная цель исследования состояла в том, чтобы проанализировать связь иммунных нарушений эндометрия с LBR у женщин с RPL в анамнезе. Вторичной целью было выявить основные прогностические факторы живорождений.
Материалы и методы
Утверждение протокола и согласие пациента
В 2011 году институциональный наблюдательный совет и этический комитет больницы Сент-Луиса одобрили перспективное наблюдение когорты после иммунного профилирования, чтобы задокументировать их результаты и потенциальная выгода (исх. 2011- A00994-37).
Пациенты, перенесшие биопсию эндометрия, предоставили письменное информированное согласие на проведение иммунного анализа матки и последующее наблюдение. Все пациенты, включенные в программу АРТ, дали свое информированное согласие перед любым лечением бесплодия (ЭКО / ИКСИ / перенос замороженных эмбрионов).Мы использовали эту базу данных для достижения нашей основной цели.
Пациенты и стандартные обследования
Это был наблюдательный ретроспективный анализ 104 пациенток с RPL, определяемых как минимум три последовательных выкидыша после спонтанной беременности, которым в период с января 2012 года по декабрь 2019 года была сделана биопсия эндометрия. Пациенты первоначально прошли стандартный скрининг RPL . Если аномалия была выявлена, ее исправляли до проведения биопсии эндометрия после рецидива нового выкидыша.
Критерии включения: не менее трех выкидышей после спонтанной беременности, полный скрининг, включая трехмерное ультразвуковое сканирование, иммунное профилирование матки и последующее наблюдение в течение не менее 6 месяцев с индивидуальным уходом, если это будет показано после оценки.
Критерии исключения были следующими: пациент отказывается от терапевтической стратегии после взятия пробы эндометрия или пациент с неполным скринингом. Собранные данные включали: возраст матери, ИМТ (индекс массы тела), курение во время беременности, предыдущее количество выкидышей, наличие эндометриоза, аденомиоза (диагностированного с помощью визуализации, УЗИ или МРТ) или патологии маточных труб, параметры яичникового резерва (ФСГ ( МЕ / л), ЛГ (МЕ / л), эстрадиол (пг / мл), AFC (антральный фолликулярный подсчет), уровень АМГ (нг / мл)) и оценка полости матки.С другой стороны, мы собрали информацию об их партнере-мужчине и, в частности, о качестве их спермы. Низкий овариальный резерв определялся в этом исследовании как уровень АМГ ниже 1 нг / мл и возраст матери старше 41 года.
Пациенты прошли следующие стандартные обследования: скрининг на наследственную тромбофилию (мутации фактора V и II, анализ белка S, мутация метилентетрагидрофолатредуктазы (MTHRF), антифосфолипидные, антикардиолипиновые и бета-2 гликопротеиновые антитела I, родительские антитела к гликопротеину I). скрининг щитовидной железы, яичниковый резерв, гистероскопия или гистеросонография, оценка спермы с определением степени фрагментации ДНК.
После подтверждения анатомической целостности эндометрия мы специально оценили эндометрий с помощью трехмерного сканирования органов малого таза в сочетании с биопсией эндометрия в середине лютеиновой фазы. Трехмерное сканирование органов малого таза детализировало пролиферацию эндометрия и васкуляризацию матки. Мы рассматривали как тонкий эндометрий, толщиной менее 7 мм или объемом менее 2 мл.
Биопсия эндометрия: сбор и анализ
Биопсия эндометрия выполнялась в середине лютеиновой фазы по замещенному циклу через 5–9 дней приема прогестерона или в контролируемом цикле.Образцы эндометрия осторожно аспирировали, вращая трубку Pipelle de Cornier в полости эндометрия. Контент Pipelle был разделен на две части. Первую часть помещали в 4% формальдегид (QPath Formol 4% buffered, VWR Chemicals, Fontenay-sous-Bois, Франция) для гистологического исследования эндометрия и иммуномечения CD56, а вторую часть помещали в раствор для стабилизации РНК для дальнейшего иммунологического исследования. анализ методом RT-qPCR. Образцы были отправлены почтовыми службами при комнатной температуре.
После подтверждения средней лютеиновой фазы гистологическим анализом, РНК была извлечена и подвергнута обратной транскрипции с помощью ОТ-ПЦР. Первоначально мобилизацию uNK-клеток оценивали с помощью иммунохимического маркирования положительных клеток CD56, а теперь оценивают с помощью ПЦР в реальном времени. Мы количественно определили с помощью количественной ПЦР в реальном времени семь целевых биомаркеров (IL-18, IL-15, TWEAK, Fn-14, CD56 и эталонные гены) с помощью смеси Light Cycler 480 SYBR Green I Master Mix (Roche). Отношения мРНК IL-15 / Fn-14 и IL-18 / TWEAK использовали для документирования иммунной среды эндометрия, в которую будет перенесен эмбрион.В патенте без названия «Способ повышения успешности имплантации при вспомогательном оплодотворении» настоящее изобретение описывается как способ определения профиля восприимчивости матки с целью повышения успешности имплантации при вспомогательном оплодотворении ((PCT / EP2013 / 065355). В патенте мы определили нормы экспрессии наших биомаркеров в фертильной когорте и документально подтвердили, что иммунный профиль воспроизводился от одного цикла к другому в течение шести месяцев, если за это время не было ни хирургического вмешательства, ни беременности.
Определение иммунного профиля эндометрия
Иммунный профиль эндометрия определяли в соответствии с локальным балансом экспрессии мРНК IL-18 / TWEAK, IL-15 / Fn-14 и иммуноокрашивания CD56 или экспрессии мРНК (25, 26). Таким образом, были определены четыре типа профилей:
1. Сбалансированный / нормальный профиль иммунной активации, характеризующийся соотношениями мРНК IL-18 / TWEAK и IL-15 / Fn-14 и количеством клеток CD56 + в том же диапазоне, который ранее был определен в плодородная когорта.
2.Низкий профиль иммунной активации, характеризующийся низкими соотношениями мРНК для IL-15 / Fn-14 (отражающих незрелые клетки uNK) или IL-18 / TWEAK, или отсутствие мобилизации uNK.
3. Профиль высокой иммунной активации характеризуется высоким соотношением мРНК IL-18 / TWEAK или IL-15 / Fn-14 или высоким количеством клеток CD56 +.
4. Смешанный профиль характеризуется высоким соотношением мРНК IL-18 / TWEAK (избыток цитокинов Th-1) одновременно с низким соотношением IL-15 / Fn-14 (отражающим незрелые NK).
Терапевтические вмешательства
Терапевтические вмешательства были следующими:
— Все пациенты с ИМТ более 30 прошли диетическую консультацию и наблюдение
— Все пациенты с ТТГ более 2.5 МЕ / мл были заменены левотироксином
-Пациентам с наследственной тромбофилией и высокой гомоцистеинемией была полезна добавка витамина B9
-Если диагностическая гистероскопия выявила синехию, полип, миому или порок развития, то была проведена оперативная операция
-Если были обнаружены аутоиммунные антитела, пациент направлялся в бригаду внутренних болезней для расширенного обследования и разработки плана лечения
-Если фрагментация сперматозоидов превышала 20%, пациента заменяли антиоксидантом и контролировали
— Если толщина эндометрия была менее 7 мм или объем эндометрия менее 2 мл, назначали длительное лечение токоферолом и пентоксифиллином с последующим наблюдением более 6 месяцев
После коррекции вышеуказанных параметров выполнялась биопсия эндометрия:
— Что касается иммунного профиля эндометрия, предложения были разделены на шесть разделов следующим образом (Таблица 1):
Таблица 1 Краткое изложение предлагаемых терапевтических средств в зависимости от профиля эндометрия.
а. Расчесывание эндометрия в середине лютеиновой фазы цикла, предшествующего циклу лечения
Расчесывание эндометрия рекомендовалось в случае низкого соотношения мРНК IL-15 / Fn-14, интерпретируемого как незрелость uNK-клеток. Расчесывание эндометрия может ускорить созревание uNK-клеток, что сильно зависит от адекватной экспрессии IL-15 (32). Любой тип локальных повреждений (например, биопсия эндометрия), выполняемый во время средней лютеиновой фазы цикла, стимулирует в течение следующего цикла последующую экспрессию молекул адгезии и IL-15, через пути толл-подобных рецепторов (33). .Незрелость uNK-клеток может вносить вклад в RPL за счет индуцированного плохого ангиогенеза, необходимого для адекватной плацентации.
г. Иммунотерапия
Было предложено сочетание иммунотерапии с гиперактивным и смешанным профилями либо для снижения цитокинов Th-1, либо для контроля рекрутирования или сверхактивации uNK-клеток в клетки-киллеры посредством IL-15. В данном контексте RPL цель состоит в том, чтобы избежать отказа от беременности.
В качестве лечения первой линии рекомендовался прием глюкокортикоидов (ГК) (34).Пациенты получали 20 мг преднизолона и витамина Е (антиоксидант, 1 г в день) с 3 дня стимуляции яичников до теста на беременность. Если наступила беременность, ГК продолжали принимать полную дозу до 8 недель после переноса эмбриона, затем постепенно снижали и прекращали через 10 недель.
В повседневной практике до сих пор отсутствуют точные показания к его применению, основанные на объективном тестировании (35) (36, 37). Следовательно, только нормализация иммунного профиля при ГК может свидетельствовать о его положительном эффекте.
Обоснование использования GC в таких иммунных профилях основано на предыдущих отчетах, связывающих их с:
-сниженными уровнями цитокинов Th-1, цитотоксичностью NK и гиперактивацией в лимфокин-активированных клетках-киллерах (38).
— ограничивают последствия сверхэкспрессии мРНК IL-15 (39).
-модулируют баланс Th2 / Th3, когда в нем преобладают цитокины Th2 (40).
Наша команда заметила, что GC увеличивал экспрессию иммунорегуляторов, таких как TWEAK и Fn-14, которые, как было показано, предотвращают цитотоксичность uNK (41)
В случае устойчивости к GC, низкомолекулярный гепарин (LMWH) был альтернативный вариант, учитывая их ранее задокументированный эффект против комплемента (42, 43).НМГ был инициирован после овуляции введением прогестерона в изодозе. В случае наступления беременности прием НМГ продолжали до 10 недель и прекращали.
В качестве второго направления лечения мы также оценили эффективность медленной внутривенной перфузии интралипидов ® . Предыдущие авторы сообщали о своем интересе контролировать гиперактивацию циркулирующих NK-клеток и регулировать баланс цитокинов с преобладанием Th-1 (44) (45). Наша команда наблюдала и сообщила о снижении цитокинов Th-1 эндометрия, а также о лучшем контроле мобилизации uNK-клеток после этой перфузии (41).
Эта перфузия (однократная медленная перфузия 4% разбавленного интралипида ® , Fresenius-Kabi) систематически выполнялась под медицинским наблюдением в больнице на 8-10 дни цикла переноса эмбриона. Если наступила беременность, проводили еще одну медленную перфузию через 3 недели после переноса эмбриона и снова через 7 недель.
На данном этапе в отношении типа иммунотерапии только нормализация профиля матки при терапии может указывать на эффективность любого препарата, поскольку мы не можем предсказать ответ на терапию.
г. Изменение лютеиновой поддержки
Гормональная адаптация лютеиновой фазы была рекомендована в случае сверхактивного и смешанного профиля. Прогестерон, помимо своей эндокринной роли, является важным медиатором иммунной толерантности эндометрия, необходимой для успешной беременности.
Прогестерон влияет на материнскую иммунную систему различными путями:
— Включая выработку прогестерон-индуцированного блокирующего фактора (PIBF), который ингибирует активность NK-клеток (46) и приводит к выработке Th-2-доминантных цитокинов материнскими лимфоцитами ( 47).
-Индукция галектина-1, молекулы, индуцированной прогестероном, необходимой для толерогенных дендритных клеток, которые, в свою очередь, способствуют росту регуляторных Т-клеток, секретирующих IL-10 (48).
В случае обнаружения сверхактивного профиля мы, следовательно, рекомендовали высокую лютеиновую поддержку с введением вагинального прогестерона 1200 мг в день из-за его иммунодепрессивных свойств. Когда экспрессия IL-18 была повышена, мы также рекомендовали пероральный прием 4 мг эстрадиола в день для подавления его локальной экспрессии, как описано ранее, после овуляции (49).Более высокая лютеиновая поддержка начиналась после овуляции (естественный цикл) или в день получения ооцитов в случае ЭКО. Это продолжалось до 8 недель после переноса эмбрионов беременным женщинам.
г. Добавление хорионического гонадотропина (ХГЧ) во время лютеиновой фазы
Предыдущие авторы продемонстрировали, что ХГЧ запускает как пролиферацию, так и созревание клеток uNK (50) и способствует локальному ангиогенезу (51, 52). Физиологически продуцируемый эмбрионом, ХГЧ принимает непосредственное участие в местной реакции посредством индукции адекватного ангиогенеза, контролируя активацию клеток uNK на границе раздела матери и плода (53, 54).Мы рекомендовали прием ХГЧ во время лютеиновой фазы в случае низкой мобилизации или незрелости уНК. Дозу, эквивалентную 1500 МЕ, вводили подкожно через 4, 6 и 8 дней после начала прогестероновой поддержки во время окна имплантации.
эл. Половой акт после ЕТ
Вызывая экспрессию провоспалительных цитокинов и хемокинов и рекрутирование иммунных клеток, семенная плазма может играть положительную роль в подготовке эндометрия к имплантации (55–57).Поэтому мы рекомендовали половой акт во время лютеиновой фазы в случае низкой иммунной активации, но не рекомендовали воздействие семенной плазмы в сверхактивированном и смешанном профиле.
Определение результатов
Исход был разделен на три категории: живорождение (определяемое как рождение жизнеспособного ребенка на сроке гестации 22 недели или более), потеря беременности на ранних сроках (определяемая как спонтанная гибель плода на сроке гестации менее 22 недель). ), и никакой беременности.
Для оценки эффективности применяемого индивидуального ухода мы определяем успех, если пациентки родили, и неудачу, если пациентка не забеременела или перенесла новую потерю беременности.
Сбор данных
Все процедуры, выполненные в исследованиях с участием людей, соответствовали этическим стандартам институционального и национального исследовательского комитета, Хельсинкской декларации 1964 года и более поздним поправкам к ней или сопоставимым этическим стандартам. Данные были анонимно извлечены из базы данных Matricelab, включая 1778 пациентов с успешным иммунным анализом эндометрия и проспективным наблюдением после иммунного профилирования. Эти данные были извлечены для расширенного анализа когорты женщин, наблюдаемых в нашем отделении репродуктивной медицины (больница Les Bluets — Париж) и которым был поставлен диагноз RPL.
После глобальных обследований, включая определение иммунного профиля матки, была определена терапевтическая стратегия, и каждая пациентка находилась под наблюдением в течение 6 месяцев.
Мы подтвердили, что применялась индивидуальная терапевтическая стратегия, задокументировали тип потенциально используемой АРТ (контролируемый естественный цикл, ВМИ, ЭКО, ФЭТ) и результат.
В случае ЭКО или переноса замороженных эмбрионов мы собрали результаты первого последующего переноса эмбрионов после анализа. В случае IUI мы получили результат после 3 попыток.Если ЭКО или ВМИ не требовались, мы собирали результаты в течение следующих шести месяцев после оценки с использованием предложенной стратегии.
Статистический анализ
Анализ данных проводился с помощью R studio 1.3.1056. Непрерывные переменные представлены в виде среднего значения ± стандартное отклонение (SD) или медианы. Категориальные переменные анализировали с помощью критерия хи-квадрат Пирсона или хи-квадрат с поправкой Йетса, когда это было необходимо. Непрерывные данные были проанализированы с помощью t-критерия Стьюдента (для нормально распределенных) и U-критерия Манна-Уитни (для ненормально распределенных данных).Результаты считались статистически значимыми при значении p ниже 0,05. Мы провели первый одномерный анализ, сравнив группу небеременных и живорожденных по характеристикам матери и результатам проведенного первоначального полного обследования. Второй одномерный анализ проводился по тем же переменным, но сравнивал три группы: отсутствие беременности, потеря беременности на ранних сроках и рождение живого ребенка.
Чтобы оценить влияние терапии на достижение беременности у этих женщин, мы провели одномерный сравнительный анализ между группой без беременности и группой с беременностью живорождением по этим методам лечения (лечение, связанное с MAP, и лечение, связанное с аномалии эндометрия).Мы также провели этот анализ с поправкой на возраст и АМГ, основные известные факторы, влияющие на успех беременности.
Результаты
Характеристики когорты
В целом за период с января 2012 г. по декабрь 2019 г. 1778 пациентам была выполнена биопсия эндометрия по поводу RIF или RPL с перспективным последующим наблюдением. В исследование были включены 104 пациента со спонтанной репродуктивной функцией, но у которых произошел RPL (по крайней мере, 3 выкидыша подряд) при полном первоначальном скрининге. Процесс отбора нашей когорты подробно описан на Рисунке 1.Данные были собраны ретроспективно.
Рисунок 1 Процесс отбора нашей когорты.
Клинические и биологические характеристики сравнивались в этих трех разных группах (отсутствие беременности, рецидив невынашивания беременности, живорождение) (Таблица 2). Как и ожидалось, тремя основными факторами, значительно влияющими на исход, были возраст матери (p <0,03), количество предыдущих выкидышей (p = 0,008) и наличие низкого резерва яичников (p = 0,01). Для женщин старше 41 года риск нового выкидыша был в 4 раза выше, чем шанс живорождения (73% против 17%).
Таблица 2 Характеристика пациенток по исходу беременности.
Несмотря на спонтанную фертильность, в общей сложности 52 пациента имели по крайней мере один элемент субфертильности (50%), вероятно, под влиянием нашего набора в отделение репродуктивной медицины. У 13 пациентов была непроходимость маточных труб, у 15 — эндометриоз или аденомиоз, у 34 — низкий яичниковый резерв, а у 7 партнеров-мужчин были обнаружены аномалии сперматозоидов (астенозооспермия, тератозооспермия или тератоастенозооспермия).Низкий резерв яичников с АМГ ниже 1 нг / мл и возраст матери старше 41 года были основными факторами, способствующими снижению фертильности.
Результаты обычного скрининга
Результаты первичного обследования представлены в таблице 3. Сбалансированная транслокация и перицентрическая инверсия были обнаружены у 2 пациентов. Гетерозиготная мутация гена MTHFR и повышенная гомоцистеинемия выявлены у 8 пациентов. У 9 пациентов мы обнаружили наличие аутоантител. Напротив, все исследования матки (гистероскопия, трехмерное ультразвуковое исследование и иммунное профилирование матки), фрагментация сперматозоидов и исследование функции щитовидной железы были очень прибыльными для определения последующей стратегии.Уровень ТТГ выше 2,5 мМЕ / л был обнаружен у 89 пациентов (85,5% когорты). В 32% случаев фрагментация ДНК была патологической. 30% пациентов потребовалась оперативная гистероскопия по поводу ретенции трофобластов, синехий, полипов или миомы. 31% имели тонкий эндометрий в середине лютеиновой фазы.
Таблица 3 Факторы прогноза исходов беременности, связанные с глобальным обследованием.
Результат оценки иммунитета эндометрия
В этой когорте 75% пациентов страдали иммунной дисрегуляцией эндометрия.Среди пациентов с иммунным дисбалансом эндометрия 31% имели низкий иммунный профиль матки, 50% имели противоположный паттерн с повышенной локальной иммунной активацией и 19% имели смешанный паттерн.
Чтобы оценить, были ли установленные стратегии, определенные после нашего глобального скрининга, успешными или неудачными, мы разделили их на две основные группы: тех, кто родил живым (группа успеха n = 51), и тех, кто не смог забеременеть. или перенес новый выкидыш (группа неудач n = 53) (таблицы 3 и 4).
Таблица 4 Факторы прогноза исхода беременности, связанные с лечением эндометрия.
Иммунный профиль матки был связан с более высоким LBR, если нарушение регуляции было выявлено и соответственно лечили (55% против 45%, p = 0,01) (Таблица 3). Напротив, нормальный иммунный профиль (приводящий к очевидно сбалансированной иммунной среде) был связан с более высоким риском нового выкидыша.
В таблице 3 показаны исходы беременности, связанные с профилем эндометрия, с скорректированными результатами в соответствии с возрастом матери и уровнем АМГ.По сравнению с пациентами с нормальным профилем, пациенты с нарушенным иммунным профилем имели более высокий уровень живорождений (OR 3,4 ДИ 95% 1,27–9,84) (OR = 5 ДИ 95% 1,65–16,5).
Результат при использовании АРТ
АРТ применялась у 86,5% (45 пациентов из 52) пар с хотя бы одним фактором субфертильности и у 32% пациентов без выявленных факторов субфертильности. У 7 пациенток хотя бы с одним фактором субфертильности наступила самопроизвольная беременность. Использование АРТ было достоверно связано с более низким LBR независимо от наличия фактора субфертильности (p = 0.012). Фактически, персонализация медицинского обслуживания с использованием их естественного цикла или простой гормональной стимуляции связана со значительно более высоким LBR, чем персонализация, включая АРТ, независимо от возраста матери и уровня AMH (OR = 2,9 CI 95% 1,03-8,88). Если было выполнено ЭКО, фактором прогноза было, как и ожидалось, количество собранных зрелых ооцитов. Сбор ниже 4 ооцитов был связан с более низким шансом LBR (p = 0,03). Эти результаты представлены в таблице 5.
Таблица 5 Факторы прогноза, связанные с характеристиками лечения АРТ.
Обсуждение
Основные выводы
Роль эндометрия оказалась недооцененной при лечении РПЛ. Исследование эндометрия в средней лютеиновой фазе не упоминалось в рекомендациях ESHRE (58). В нашем исследовании 75% пациентов с RPL имели дисрегулируемый иммунологический профиль эндометрия. После глобального скрининга иммунное профилирование эндометрия было единственным исследованием, которое было значительно связано с более высоким LBR, если было выявлено нарушение регуляции и было проведено соответствующее лечение.Независимо от возраста и уровня АМГ, нарушение регуляции иммунного профиля достоверно связано с в три раза большим LBR, чем нормальные профили (OR = 3,4 CI 95% 1,27-9,84) или в пять раз при гиперактивации и лечении иммунотерапией после теста на чувствительность (OR = 5 ДИ 95% 1,65-16,5).
Интерпретация
Оценка целостности полости матки и ультразвукового развития эндометрия
До оценки в средней лютеиновой фазе 29% когорты потребовалось хирургическое вмешательство с помощью оперативной гистероскопии.После контроля целостности полости матки у 35,6% пациентов при трехмерном сканировании, проведенном в середине лютеиновой фазы, был тонкий эндометрий, и они прошли курс лечения. Как описано ранее, оценка объема эндометрия в средней лютеиновой фазе более чувствительна, чем двухмерная оценка толщины эндометрия для выявления трофических проблем эндометрия (59–61). Тонкий эндометрий (менее 7 мм) коррелирует с более низкой частотой беременностей и более высокой частотой выкидышей (60, 62–64). Используя 3-D сканирование, пороги 2 мл (65, 66) и 2.5 мл (61, 67) указывают на плохое развитие эндометрия, связанное с более низкой частотой наступления беременности. Мы не обнаружили какой-либо существенной разницы в результатах у пациенток с предыдущими операциями на матке или тонким эндометрием, но все они получали лечение до биопсии эндометрия.
Оценка и коррекция иммунитета эндометрия
Иммунный вклад эндометрия оказался недооцененным при лечении RPL. Предыдущие авторы задокументировали с помощью проточной цитометрии или иммуногистохимии аномальную мобилизацию или экспрессию иммунных клеток у пациентов с RIF или RPL, предполагая, что местные нарушения иммунной регуляции эндометрия могут способствовать неудачам имплантации (68) (24) (69).
Иммунное профилирование эндометрия основано на анализе RT-qPCR экспрессии мРНК CD56, соотношении IL-15 / Fn-14 (молекула, индуцируемая интерлейкином-15 / фактором роста фибробластов) и соотношениях IL-18 / TWEAK (интерлейкин-18 / Фактор некроза опухоли — слабый индуктор апоптоза), все известные факторы, которые непосредственно участвуют в дифференцировке секреторного эндометрия в рецептивное состояние.
Документируя местный иммунный ответ, который должен возникать в период восприимчивости матки, мы стремимся обнаружить дисбаланс, который можно изменить, чтобы способствовать дальнейшей имплантации эмбриона.В нашей когорте иммунное профилирование эндометрия было действительно единственным исследованием, которое было значительно связано со значительно более высоким LBR, если было выявлено нарушение регуляции и было проведено соответствующее лечение. 75% пациентов имели нарушенный иммунологический профиль, и 55% из них родили живого ребенка после лечения этого нарушения. У 84,3% живорожденных был нарушен регулируемый иммунный профиль и был пролечен иммунный профиль. Независимо от возраста и уровня АМГ, нарушение регуляции иммунного профиля достоверно связано с 3-кратным увеличением живорождений по сравнению с нормальным профилем (OR = 3.4 ДИ 95% 1,27–9,84) и более при гиперактивации и лечении иммунотерапией (ОШ = 5 ДИ 95% 1,65–16,5). Предыдущие исследования предположительно считали, что некоторые случаи RPL связаны с иммунной этиологией (17). Были проведены обширные исследования для документирования механизмов восприимчивости эндометрия к эмбриону, что позволяет предположить, что эндометрий играет важную роль в RPL (20). Новые данные свидетельствуют о том, что нарушение регуляции окружающей среды эндометрия связано с некоторыми важными репродуктивными нарушениями, среди которых RIF и RPL.
Наша гипотеза состоит в том, что восстановление баланса первоначального диалога между эмбрионом и эндометрием может спасти некоторые жизнеспособные беременности. У пациентов с локальной низкой активацией стимуляция созревания, мобилизации, экспрессии uNK посредством расчесывания матки, добавление лютеина ХГЧ и воздействие семенной плазмы нацелены на улучшение механизмов ангиогенеза и иммунотропизма (33, 34, 51, 52, 55). , 57). В этом случае механизмом, приводящим к выкидышу, будет локальный дефицит ангиогенеза и иммунотрофизма.У пациентов с чрезмерной активацией иммунной системы механизм, приводящий к потере беременности, будет заключаться в прямом отторжении эмбриона через чрезмерную активацию иммунных клеток, а введение иммунотерапии, включая персонализированную лютеиновую поддержку, направлено на то, чтобы обратить вспять пагубную активность иммунных клеток. прекратить отклонение (38–49).
Смешанный профиль характеризуется высоким соотношением мРНК IL-18 / TWEAK, механизм отторжения может быть комбинацией локальной гиперактивации, ведущей к дефектному ангиогенезу для плацентации.
Клэр Ларсен и соавторы (2) представили теорию биосенсоров, согласно которой эндометрий играет роль в контроле качества эмбриона, что у некоторых женщин может быть менее разборчивым. Спорадический выкидыш можно рассматривать как проявление природной системы контроля качества, предотвращающей развитие эмбрионов с серьезными аномалиями в большинстве случаев после периимплантационного периода. Если этот контроль качества будет нарушен, таким эмбрионам может быть разрешена имплантация достаточно долго, чтобы представить как клиническую беременность, прежде чем наступит неудача, что приведет к клиническому выкидышу.Первое исследование, демонстрирующее биосенсорную функцию децидуализированных стромальных клеток эндометрия (ЭСК), показало, что совместное культивирование с арестованным человеческим эмбрионом вызывает снижение продукции ключевых цитокиновых регуляторов имплантации, включая интерлейкин (ИЛ) -1β, гепарин-связывающий фактор роста эпидермиса. -подобный фактор роста (HB-EGF), IL-6 и IL-10 (70). Женщинам с RPL разрешена имплантация эмбрионов низкого качества, которые будут отвергнуты для беременности, в отличие от нормально фертильных женщин, у которых эндометрий более избирательный (71, 72).Эти теории приводят к концепции гиперфертильности пациентов с RPL с невозможностью отбирать эмбрионы с потенциалом живорождения (59, 73, 74).
Другими словами, женщины, у которых наблюдается RPL, могут не отвергать здоровые эмбрионы, а скорее позволяют эмбрионам с низкой жизнеспособностью имплантироваться достаточно долго, чтобы их можно было представить как клиническую беременность, вместо потери на доклинической стадии.
Мы можем предположить, что восстановление баланса среды эндометрия с помощью метода иммунного профилирования и индивидуализированной терапии может положительно повлиять на способность отбора эндометрия и могло бы избежать повторения ПРЛ с серьезным психологическим воздействием на пару.
Персонализация с ART или нет?
Эмоциональное воздействие RPL и срочность зачатия часто побуждают пары рассматривать различные методы лечения бесплодия. Ввиду невозможности определить причину RPL лечение часто ориентировано на АРТ.
По данным нашей когорты, 33% пар получали АРТ без ассоциированного фактора субфертильности, и АРТ была вариантом почти в 80% случаев.
Однако персонализация для оптимизации иммунной среды матки во время спонтанных контролируемых циклов или с помощью простой гормональной стимуляции была значительно связана с более высоким LBR, чем в подгруппе, которая выиграла от персонализации и АРТ, и это независимо от возраста матери и уровня АМГ ( ИЛИ = 2.9 ДИ 95% 1,03-8,88).
Поскольку возраст и овариальный резерв явно отрицательно влияют на RPL, АРТ может показаться решением для пациентов, но также и для врачей, пытающихся сократить время до зачатия. В 2019 году обзор, проведенный Киршенбаумом и Орвието, подтвердил, что эти эмпирические методы лечения не улучшают LBR у пациентов с RPL (75). В частности, для молодых фертильных пациентов с RPL Perfetto et al. (76) пришли к выводу, что лечение АРТ не имело положительного воздействия и не способствовало сокращению времени до беременности (71).
Материнский возраст играет решающую роль в ведении RPL с явным негативным влиянием на последующий шанс LBR. Анеуплоидия, вероятно, является одной из причин RPL, потому что она увеличивается с возрастом женщины, а частота анеуплоидии в бластоцистах достигает 58% в возрасте 40 лет (77). Но даже PGT-A, доимплантационный генетический тест на анеуплоидию, не был показан как строго эффективный в предотвращении выкидышей в пожилом материнском возрасте (78). Оптимизация среды матки может представлять собой еще одну стратегию для этих пациентов, столкнувшихся с неудачей, несмотря на использование эуплоидных эмбрионов.Также может быть интересно провести рандомизированное контрольное исследование для оценки пользы или отсутствия АРТ у спонтанно фертильных пациентов с RPL, связанной с индивидуальным уходом в соответствии с их иммунным профилем эндометрия.
Заключение
В заключение, наше исследование предполагает, что иммунное профилирование эндометрия и управление RPL в соответствии с дисрегуляциями эндометрия, по-видимому, эффективны для увеличения последующего LBR с помощью простых и неинвазивных терапевтических вариантов. Такое лечение, по-видимому, эффективно независимо от АРТ, которая отрицательно связана с LBR.Поскольку материнский возраст и недостаточность яичников являются хорошо известными основными причинами RPL, нам необходимо установить, является ли АРТ вредной или нет, когда эта терапевтическая персонализация применяется в соответствии с иммунным профилированием эндометрия.
Заявление о доступности данных
Исходные материалы, представленные в исследовании, включены в статью / дополнительный материал. Дальнейшие запросы можно направить соответствующему автору.
Заявление об этике
В 2011 г.Госпиталь Луи одобрил проспективное последующее наблюдение когорты после иммунного профилирования, чтобы задокументировать их результат и потенциальную пользу (ref. 2011- A00994-37).
Вклад авторов
AK выбрал пациентов с RPL, находящихся на лечении в период с 2012 по 2019 год, выполнил иммунное профилирование и написал рукопись с MC. MC собрал соответствующие клинические данные, построил таблицы и написал рукопись. LC проведен с помощью иммунного анализа. LP-e и GD выполнили биопсию эндометрия и трехмерное УЗИ.AP и GK провели статистический анализ. NL разработала исследование с GK и MR, интерпретировала иммунные профили матки для определения индивидуального ухода. Н.Л., Г.К. и М.Р. руководили обсуждениями и написанием рукописи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование было поддержано MatriceLab Innove для диагностических тестов и проспективного сбора данных для последующего наблюдения.
Конфликт интересов
NL создала компанию MatriceLAB Innove SARL и имеет патент на тест иммунной оценки эндометрия и прилагаемые рекомендации (PCT / EP2013 / 065355).Авторы AK и LC также работали в MatriceLAB Innove SARL.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Ларсен Е.К., Кристиансен О.Б., Колте А.М., Маклон Н. Новое понимание механизмов, лежащих в основе выкидыша. BMC Med (2013) 2611: 154. doi: 10.1186 / 1741-7015-11-154
CrossRef Полный текст | Google Scholar
3.Costedoat-Chalumeau N, Guettrot-Imbert G, Leguern V, Leroux G, Le Thi Huong D, Wechsler B, et al. Беременность и антифосфолипидный синдром. Rev Med Interne (2012) 33 (4): 209–16. doi: 10.1016 / j.revmed.2012.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Стефаниду Е.М., Карамеллино Л., Патриарка А., Менато Г. Потребление кофеина матерью и повторяющийся выкидыш с синусоидальной причиной. Eur J Obstet Gynecol Reprod Biol (2011) 158 (2): 220–4. DOI: 10.1016 / j.ejogrb.2011.04.024
PubMed Реферат | CrossRef Полный текст | Google Scholar
6. Trout SW, Seifer DB. Имеют ли женщины с необъяснимым повторным невынашиванием беременности более высокие значения ФСГ и эстрадиола в сыворотке на третий день? Fertil Steril (2000) 74 (2): 335–7. DOI: 10.1016 / S0015-0282 (00) 00625-7
PubMed Реферат | CrossRef Полный текст | Google Scholar
7. Робинсон Л., Галлос И.Д., Коннер С.Дж., Раджхова М., Миллер Д., Льюис С. и др. Влияние фрагментации ДНК сперматозоидов на частоту выкидышей: систематический обзор и метаанализ. Hum Reprod (2012) 27 (10): 2908–17. doi: 10.1093 / humrep / des261
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Зини А., Боман Дж. М., Белзиле Э., Чампи А. Повреждение ДНК сперматозоидов связано с повышенным риском потери беременности после ЭКО и ИКСИ: систематический обзор и метаанализ. Hum Reprod (2008) 23 (12): 2663–8. doi: 10.1093 / humrep / den321
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Рей Э., Кан С.Р., Дэвид М., Шрайер И.Тромбофилические расстройства и потеря плода: метаанализ. Ланцет (2003) 15361 (9361): 901–8. doi: 10.1016 / S0140-6736 (03) 12771-7
CrossRef Полный текст | Google Scholar
10. Grimbizis GF, Di Spiezio Sardo A, Saravelos SH, Gordts S, Exacoustos C, Van Schoubroeck D, et al. Консенсус ESHRE / ESGE в Салониках по диагностике аномалий женских половых органов. Hum Reprod (2016) 31 (1): 2–7. doi: 10.1093 / humrep / dev264
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Venetis CA, Papadopoulos SP, Campo R, Gordts S, Tarlatzis BC, Grimbizis GF. Клинические последствия врожденных аномалий матки: метаанализ сравнительных исследований. Репродукция BioMed Online (2014) 29 (6): 665–83. doi: 10.1016 / j.rbmo.2014.09.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Чан Й.Й., Джаяпракасан К., Замора Дж., Торнтон Дж. Г., Рейн-Феннинг Н., Кумарасами А. Распространенность врожденных аномалий матки в неизбираемых популяциях и группах высокого риска: систематический обзор. Обновление Hum Reprod (2011) 17 (6): 761–71. doi: 10.1093 / humupd / dmr028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Саравелос С.Х., Кокседж К.А., Ли Т.К. Распространенность и диагностика врожденных аномалий матки у женщин с репродуктивной недостаточностью: критическая оценка. Обновление Hum Reprod (2008) 14 (5): 415–29. doi: 10.1093 / humupd / dmn018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Элькархат З., Киндил З., Заруф Л., Разоки Л., Абулфарадж Дж., Эльбакай С. и др.Хромосомные аномалии в парах с повторным самопроизвольным выкидышем: 21-летнее ретроспективное исследование, отчет о новой вставке и обзор литературы. J Assist Reprod Genet (2019) 36 (3): 499–507. doi: 10.1007 / s10815-018-1373-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Тунч Э., Танрыверди Н., Демирхан О., Сулейманова Д., Четинель Н. Хромосомный анализ 1510 пар, перенесших повторные самопроизвольные аборты. Репродукция BioMed Online (2016) 32 (4): 414–9.doi: 10.1016 / j.rbmo.2016.01.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Сайто С., Накашима А., Шима Т. Будущие направления исследований повторяющихся выкидышей, связанных с иммунной этиологией. J Reprod Immunol (2011) 90 (1): 91–5. doi: 10.1016 / j.jri.2011.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Ван Н.Ф., Кольте А.М., Ларсен Э.С., Нильсен Х.С., Кристиансен О.Б. Иммунологические нарушения, лечение и рецидивирующая потеря беременности: что реально, а что нет? Clin Obstet Gynecol (2016) 59 (3): 509–23.doi: 10.1097 / GRF.0000000000000215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Ticconi C, Pietropolli A, Di Simone N, Piccione E, Fazleabas A. Иммунная дисфункция эндометрия при повторной потере беременности. Int J Mol Sci (2019) 20 (21): 5332. doi: 10.3390 / ijms20215332
CrossRef Полный текст | Google Scholar
21. Куон Р.-Дж., Вебер М., Хегер Дж., Сантильян И., Фомштейн К., Бэр С. и др. Естественные клетки-киллеры матки у пациенток с идиопатическим повторным выкидышем. Am J Reprod Immunol (2017) 78 (4). doi: 10.1111 / aji.12721
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Куэнби С., Бейтс М., Дойг Т., Брюстер Дж., Льюис-Джонс Д.И., Джонсон П.М. и др. Лейкоциты эндометрия до имплантации у женщин с повторным невынашиванием беременности. Hum Reprod (1999) 14 (9): 2386–91. doi: 10.1093 / humrep / 14.9.2386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Клиффорд К., Фланаган А.М., Риган Л.CD56 + естественные киллерные клетки эндометрия у женщин с повторным невынашиванием: гистоморфометрическое исследование. Hum Reprod (1999) 14 (11): 2727–30. doi: 10.1093 / humrep / 14.11.2727
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Рассел П., Сакс Дж., Тремеллен К., Джи А. Распределение иммунных клеток и макрофагов в эндометрии у женщин с повторяющейся репродуктивной недостаточностью. III: Дальнейшие наблюдения и контрольные диапазоны. Патология (2013) 45 (4): 393–401.doi: 10.1097 / PAT.0b013e328361429b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Леде Н., Петитбарат М., Шеврие Л., Виту Д., Везмар К., Рахмати М. и др. Иммунный профиль матки может помочь женщинам с неоднократными необъяснимыми неудачами при имплантации эмбрионов после экстракорпорального оплодотворения. Am J Reprod Immunol (2016) 75 (3): 388–401. doi: 10.1111 / aji.12483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Леде Н., Прат-Элленберг Л., Шеврие Л., Балет Р., Саймон С., Ленобль С. и др.Иммунное профилирование матки для увеличения рождаемости: индивидуальное когортное исследование. J Reprod Immunol (2017) 119: 23–30. DOI: 10.1016 / j.jri.2016.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Lédée N, Petitbarat M, Prat-Ellenberg L, Dray G, Cassuto GN, Chevrier L, et al. Иммунное профилирование эндометрия: метод разработки индивидуального ухода в вспомогательной репродуктивной медицине. Фронт Иммунол (2020) 11: 1032. DOI: 10.3389 / fimmu.2020.01032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Gellersen B, Brosens IA, Brosens JJ. Децидуализация эндометрия человека: механизмы, функции и клинические перспективы. Semin Reprod Med (2007) 25 (6): 445–53. doi: 10.1055 / s-2007-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Шауа Г., Петитбарат М., Дубанше С., Рахмати М., Леде Н. Толерантность к фетальному аллотрансплантату?: ТЕРПИМОСТЬ К ФЕТАЛЬНОМУ АЛЛОГРАФТУ? Am J Reprod Immunol (2010) 63 (6): 624–36.doi: 10.1111 / j.1600-0897.2010.00832.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Моффетт А., Лок С. Имплантация, взаимодействие эмбриона и матери, иммунология и модуляция среды матки — отчет семинара. Плацента. avr (2006) 27 Приложение A: S54–55. doi: 10.1016 / j.placenta.2006.01.021
CrossRef Полный текст | Google Scholar
32. Verma S, Hiby SE, Loke YW, King A. Децидуальные естественные клетки-киллеры человека экспрессируют рецептор цитокина интерлейкина 15 и отвечают на него. Biol Reprod (2000) 62 (4): 959–68. doi: 10.1095 / biolreprod62.4.959
PubMed Реферат | CrossRef Полный текст | Google Scholar
33. Гнаински Ю., Гранот И., Альдо ПБ, Бараш А., Ор Y, Шехтман Э. и др. Местное повреждение эндометрия вызывает воспалительную реакцию, которая способствует успешной имплантации. Fertil Steril (2010) 94 (6): 2030–206. doi: 10.1016 / j.fertnstert.2010.02.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34.Lédée N, Prat-Ellenberg L, Petitbarat M, Chevrier L, Simon C, Irani EE и др. Влияние преднизона на пациентов с повторными неудачными имплантациями эмбрионов: полезно или пагубно? J Reprod Immunol (2018) 127: 11–5. DOI: 10.1016 / j.jri.2018.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Kalampokas T, Pandian Z, Keay SD, Bhattacharya S. Добавление глюкокортикоидов во время стимуляции яичников для ЭКО или ИКСИ. Кокрановская группа гинекологии и репродуктивной медицины, éditeur. Кокрановская база данных Sys Rev (2017) 3 (3): CD004752. doi: 10.1002 / 14651858.CD004752.pub2
CrossRef Полный текст | Google Scholar
37. Boomsma CM, Keay SD, Macklon NS. Периимплантационное введение глюкокортикоидов для циклов вспомогательных репродуктивных технологий. Кокрановская база данных Syst Rev (2012) 13 (6): CD005996. doi: 10.1002 / 14651858.CD005996.pub3
CrossRef Полный текст | Google Scholar
38. Эдди Дж. Л., Круковски К., Янусек Л., Мэтьюз Х. Л.Глюкокортикоиды эпигенетически регулируют функцию естественных клеток-киллеров. Cell Immunol. (2014) 290 (1): 120–30. doi: 10.1016 / j.cellimm.2014.05.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Moustaki A, Argyropoulos KV, Baxevanis CN, Papamichail M, Perez SA. Влияние одновременного введения глюкокортикоидов и ИЛ-15 на фенотип, пролиферацию и функцию человеческих NK-клеток. Cancer Immunol Immunother (2011) 60 (12): 1683–95. DOI: 10.1007 / s00262-011-1067-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Lédée N, Vasseur C, Petitbarat M, Chevrier L, Vezmar K, Dray G, et al. Интралипид® может дать новую надежду пациентам с репродуктивными нарушениями и одновременной сверхиммунной активацией эндометрия. J Reprod Immunol (2018) 130: 18–22. doi: 10.1016 / j.jri.2018.09.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Girardi G, Yarilin D, Thurman JM, Holers VM, Salmon JE.Активация комплемента вызывает нарушение регуляции ангиогенных факторов и вызывает отторжение плода и ограничение роста. J Exp Med (2006) 203 (9): 2165–75. doi: 10.1084 / jem.20061022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Roussev RG, Acacio B, Ng SC, Coulam CB. Продолжительность подавляющего действия интралипида на функциональную активность NK-клеток. Am J Reprod Immunol (2008) 60 (3): 258–63. doi: 10.1111 / j.1600-0897.2008.00621.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Coulam CB, Acacio B. Способствует ли иммунотерапия для лечения репродуктивной недостаточности живорождению? Am J Reprod Immunol (2012) 67 (4): 296–304. doi: 10.1111 / j.1600-0897.2012.01111.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Szekeres-Bartho J, Par G, Dombay GY, Smart YC, Volgyi Z. Антиабортативный эффект индуцированного прогестероном блокирующего фактора у мышей проявляется путем модуляции активности NK. Cell Immunol. (1997) 177 (2): 194–9. DOI: 10.1006 / cimm.1997.1090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Секерес-Барто Дж. Прогестерон-опосредованная иммуномодуляция во время беременности: ее значение для лейкоцитарной иммунотерапии повторного выкидыша. Иммунотерапия (2009) 1 (5): 873–82. doi: 10.2217 / imt.09.54
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Блуа С.М., Каммерер У., Альба Сото С., Тометтен М.К., Шайкли В., Барриентос Г. и др. Дендритные клетки: ключ к толерантности плода? Biol Reprod (2007) 77 (4): 590–8.doi: 10.1095 / biolreprod.107.060632
PubMed Реферат | CrossRef Полный текст | Google Scholar
49. Lédée N, Dubanchet S, Lombroso R, Ville Y, Chaouat G. Подавление человеческого эндометриального IL-18 экзогенными стероидами яичников. Am J Reprod Immunol (2006) 56 (2): 119–23. doi: 10.1111 / j.1600-0897.2006.00401.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Кейн Н., Келли Р., Сондерс ПТК, Кричли ХОД. Пролиферация естественных клеток-киллеров матки индуцируется хорионическим гонадотропином человека и опосредуется рецептором маннозы. Эндокринология (2009) 150 (6): 2882–8. DOI: 10.1210 / en.2008-1309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Берндт С., Блахер С., Перье д’Отерив С., Тири М., Цампалас М., Круз А. и др. Стимуляция хорионическими гонадотропинами ангиогенеза и рекрутирования перицитов. J Clin Endocrinol Metab (2009) 94 (11): 4567–74. DOI: 10.1210 / jc.2009-0443
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Цампалас М., Гриделет В., Берндт С., Фойдарт Дж.М., Гинен В., Перье д’Отерив С.Хорионический гонадотропин человека: гормон с иммунологическими и ангиогенными свойствами. J Reprod Immunol (2010) 85 (1): 93–8. DOI: 10.1016 / j.jri.2009.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Perrier d’Hauterive S, Berndt S, Tsampalas M, Charlet-Renard C, Dubois M, Bourgain C, et al. Диалог между ХГЧ бластоцисты и рецептором ЛГ / ХГЧ эндометрия: какая роль в имплантации? Gynecol Obstet Invest (2007) 64 (3): 156–60. DOI: 10.1159/000101740
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Bansal AS, Bora SA, Saso S, Smith JR, Johnson MR, Thum M-Y. Механизм иммуномодуляции, опосредованной хорионическим гонадотропином человека, при беременности. Expert Rev Clin Immunol (2012) 8 (8): 747–53. doi: 10.1586 / eci.12.77
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Робертсон С.А., Ингман В.В., О’Лири С., Шарки Д.Д., Тремеллен К.П. Трансформирующий фактор роста бета — медиатор иммунных отклонений в семенной плазме. J Reprod Immunol (2002) 57 (1-2): 109-28. DOI: 10.1016 / S0165-0378 (02) 00015-3
PubMed Реферат | CrossRef Полный текст | Google Scholar
57. Шарки Д.Д., Тремеллен К.П., Джаспер М.Дж., Гемзелл-Даниэльссон К., Робертсон С.А. Семенная жидкость индуцирует набор лейкоцитов и экспрессию мРНК цитокинов и хемокинов в шейке матки человека после коитуса. J Immunol (2012) 188 (5): 2445–54. doi: 10.4049 / jimmunol.1102736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Группа рекомендаций ESHRE по RPL, Bender Atik R, Christiansen OB, Elson E management, Kolte AM, Lewis S, et al. Рекомендации ESHRE: повторяющееся невынашивание беременности. Hum Reprod Open (2018) 2018 (2): hoy004. doi: 10.1093 / hropen / hoy004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Аплин Дж.Д., Эй Н.А., Ли ТК. MUC1 как клеточная поверхность и секреторный компонент эпителия эндометрия: снижение уровня при повторном невынашивании беременности. Am J Reprod Immunol (1996) 35 (3): 261–6.doi: 10.1111 / j.1600-0897.1996.tb00042.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Яман К., Зоммергрубер М., Эбнер Т., Пёльц В., Мозер М., Тьюс Г. Воспроизводимость трансвагинальных трехмерных измерений объема эндометрия во время стимуляции яичников. Hum Reprod (1999) 14 (10): 2604–8. doi: 10.1093 / humrep / 14.10.2604
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Kasius A, Smit JG, Torrance HL, Eijkemans MJC, Mol BW, Opmeer BC, et al.Толщина эндометрия и частота наступления беременности после ЭКО: систематический обзор и метаанализ. Обновление Hum Reprod (2014) 20 (4): 530–41. doi: 10.1093 / humupd / dmu011
CrossRef Полный текст | Google Scholar
63. Ма Н-З, Чен Л., Дай В., Бу З-К, Ху Л-Л, Сун Й-П. Влияние толщины эндометрия на результаты лечения после экстракорпорального оплодотворения / интрацитоплазматической инъекции сперматозоидов. Reprod Biol Endocrinol (2017) 15 (1): 5. doi: 10.1186 / s12958-016-0222-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Юань X, Саравелос С.Х., Ван Ц., Сюй И, Ли Т-С, Чжоу С. Толщина эндометрия как предиктор исходов беременности в 10787 свежих циклах ЭКО-ИКСИ. Репродукция BioMed Online (2016) 33 (2): 197–205. doi: 10.1016 / j.rbmo.2016.05.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Raga F, Bonilla-Musoles F, Casañ EM, Klein O, Bonilla F. Оценка объема эндометрия с помощью трехмерного ультразвука до переноса эмбриона: ключи к восприимчивости эндометрия. Hum Reprod (1999) 14 (11): 2851–4.doi: 10.1093 / humrep / 14.11.2851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Зохав Э., Орвието Р., Антеби Э.Й., Сегал О., Мельцер С., Тур-Каспа И. Низкий объем эндометрия может предсказать раннюю потерю беременности у женщин, подвергшихся экстракорпоральному оплодотворению. J Assist Reprod Genet (2007) 24 (6): 259–61. doi: 10.1007 / s10815-007-9121-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Zollner U, Zollner K-P, Specketer M-T, Blissing S, Müller T, Steck T, et al.Объем эндометрия, оцениваемый с помощью трехмерного ультразвука, является предиктором исхода беременности после экстракорпорального оплодотворения и переноса эмбриона. Fertil Steril (2003) 80 (6): 1515–7. doi: 10.1016 / j.fertnstert.2003.08.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Ла Рокка С., Карбон Ф., Лонгобарди С., Матарезе Г. Иммунология беременности: регуляторные Т-клетки контролируют иммунную толерантность матери по отношению к плоду. Immunol Lett (2014) 162 (1 Pt A): 41–8.doi: 10.1016 / j.imlet.2014.06.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Текленбург Г., Салкер М., Молохия М., Лавери С., Трю Дж., Аоджанепонг Т. и др. Естественный отбор человеческих эмбрионов: децидуализованные стромальные клетки эндометрия служат датчиками качества эмбриона при имплантации. PloS One (2010) 5 (4): e10258. doi: 10.1371 / journal.pone.0010258
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Салкер М., Текленбург Г., Молохия М., Лавери С., Трю Дж., Аоджанепонг Т. и др.Естественный отбор человеческих эмбрионов: нарушение децидуализации эндометрия приводит к нарушению взаимодействия эмбриона с матерью и вызывает повторную потерю беременности. PloS One (2010) 5 (4): e10287. doi: 10.1371 / journal.pone.0010287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Тиккони С., Пьетрополли А., Д’Ипполито С., Кьярамонте С., Пиччоне Е., Скамбия Дж. И др. Время до беременности у женщин с необъяснимой рецидивирующей потерей беременности: контролируемое исследование. Reprod Sci (2020) 27 (5): 1121–8.doi: 10.1007 / s43032-019-00122-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Teklenburg G, Salker M, Heijnen C, Macklon NS, Brosens JJ. Молекулярная основа повторного невынашивания беременности: нарушение естественного отбора эмбрионов. Mol Hum Reprod (2010) 16 (12): 886–95. DOI: 10.1093 / мольхр / gaq079
PubMed Реферат | CrossRef Полный текст | Google Scholar
75. Киршенбаум М., Орвието Р. Следует ли предлагать экстракорпоральное оплодотворение парам с необъяснимой повторяющейся потерей беременности? J Clin Med (2019) 8 (11): 2001.doi: 10.3390 / jcm8112001
CrossRef Полный текст | Google Scholar
76. Perfetto CO, Murugappan G, Lathi RB. Время до следующей беременности при спонтанной беременности по сравнению с циклами лечения у фертильных пациенток с повторным невынашиванием беременности. Fertil Res Pract (2015) 1: 5. doi: 10.1186 / 2054-7099-1-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Franasiak JM. Природа анеуплоидии с увеличением возраста партнерши: обзор 15 169 последовательных биопсий трофэктодермы, оцененных с помощью комплексного хромосомного скрининга. Fertil Steril (2014) 101 (3): 656–63.e1. doi: 10.1016 / j.fertnstert.2013.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Сато Т. Преимплантационное генетическое тестирование на анеуплоидию: сравнение показателей живорождений у пациенток с повторной потерей беременности из-за эмбриональной анеуплоидии или повторной неудачной имплантации. Репродукция человека (2020).
Google Scholar
Frontiers | Иммунное профилирование эндометрия: метод разработки персонализированного ухода в вспомогательной репродуктивной медицине
Введение
Три демографических исследования, опубликованных в новом тысячелетии, оценивают показатели бесплодия в несколько миллионов (от 48 до 48%).От 5 до 186 M) (1–3). По оценкам, от бесплодия страдают от 8 до 12% пар репродуктивного возраста во всем мире (4), при этом 9% в настоящее время считаются вероятным средним глобальным показателем (1). В 2010 году из примерно 11 миллионов бесплодных европейцев (распространенность: 9%) половина обращалась за медицинской помощью, а 22% получали лечение от бесплодия. Ежегодно в Европе проводится полмиллиона циклов вспомогательной репродуктивной терапии (ВРТ) (5), и ожидается, что в течение следующего десятилетия они будут расти по мере роста распространенности бесплодия (из-за возраста матери и мужского бесплодия.Математические модели предполагают, что 15% пациенток, включенных в циклы ЭКО, будут иметь в анамнезе повторные неудачные имплантации, а 1% инициированных беременностей заканчиваются повторными выкидышами (6). Основным тормозом успеха вспомогательных репродуктивных методов лечения остается все еще низкая частота имплантации перенесенных эмбрионов, которую Р. Г. Эдвардс назвал «последним барьером» в репродуктивной медицине (7). Только от 15 до 20% эмбрионов третьего дня и 30% эмбрионов пятого дня эффективно приведут к рождению. Действительно, у людей большинство случаев невынашивания беременности происходит до или во время имплантации эмбриона (8).
Иммунное профилирование эндометрия — это новая концепция, основанная на анализе местной иммунной реакции, возникающей в эндометрии во время окна имплантации. Основная гипотеза состоит в том, что некоторые неудачи (несмотря на получение эмбрионов хорошего качества) могут быть следствием дисрегуляции иммунной системы матки, которую можно предвидеть и исправить с помощью индивидуализированной терапии. Иммунное профилирование матки направлено на противодействие такому высокому уровню неудач при имплантации эмбрионов за счет лучшего понимания иммунной среды матки.Наша конечная цель — продвигать на местном уровне механизмы, ведущие к адекватной иммунологической толерантности, которая, как было показано, имеет важное значение для эффективной плацентации.
У человека критическая иммунная реакция матки возникает в каждом цикле в середине лютеиновой фазы независимо от одновременного присутствия или отсутствия эмбриона (9). Эндометрий человека готовится принять эмбрион, но только в течение нескольких дней в каждом цикле. Этот период, называемый окном имплантации, является периодом восприимчивости матки и наступает через 5–9 дней после овуляции.
В этот конкретный период должен происходить фундаментальный иммунный переключатель не только для предотвращения отторжения полуаллогенного эмбриона, но и для стимулирования его роста и питания (10). В это время важные иммунные клетки, принадлежащие нашему адаптивному иммунитету, ускользают из эндометрия (как лимфоциты B, некоторые лимфоциты CD8). В то же время иммунные клетки, принадлежащие к врожденному иммунитету (макрофаги, клетки-естественные киллеры матки (uNK), врожденные лимфоидные клетки-1 и -3 и дендритные клетки), проникают в эндометрий (11–13).Вновь созданная иммунная среда играет решающую роль при имплантации эмбриона (11). uNK-клетки отличаются от циркулирующих NK-клеток продуцируемыми ими цитокинами и низким цитотоксическим потенциалом, а также своим фенотипом и набором активирующих и ингибирующих рецепторов (14). Чтобы контролировать адаптивную систему, регуляторные Т-клетки, подмножество супрессорных CD4 (+) Т-клеток, играют доминирующую роль в поддержании иммунологической самотолерантности, предотвращая иммунные и аутоиммунные ответы против аутоантигенов (15).
Предыдущие авторы задокументировали с помощью проточной цитометрии или иммуногистохимии аномальную мобилизацию или экспрессию иммунных клеток у пациентов с RIF или RM в анамнезе (13, 16–18), предполагая, что местный иммунный дисбаланс эндометрия может способствовать неудачам имплантации.
Иммунное профилирование основано на анализе RT-qPCR уровней CD56 uNK, соотношении IL-15 / Fn-14 (молекула, индуцируемая интерлейкином-15 / фактором роста фибробластов) и соотношениях IL-18 / TWEAK (интерлейкин-18 / некроз опухоли). фактор-подобный слабый индуктор апоптоза), все факторы, которые, как известно, непосредственно участвуют в дифференцировке секреторного эндометрия в сторону рецептивного состояния.
Чтобы задокументировать локальный баланс Th-1 / Th-2, мы решили количественно определить локальную экспрессию интерлейкина-18 из-за его двухвалентности. IL-18 представляет собой Th-2-ангиогенный цитокин с важной продемонстрированной ролью в дестабилизации пространственных артерий (19, 20), что является решающим шагом для подготовки к будущей инвазии спиральных артерий цитотрофобластом. Однако локальная сверхэкспрессия IL-18 переключает его полезную роль на вредную, поскольку IL-18 становится Th-1 и промотором локальной цитотоксичности (21).Уровень местной иммунной регуляции, который характерен для каждого человека, также будет иметь важное значение для стимулирования отклонения Th-1 или нет. Подобный фактору некроза опухоли слабый индуктор апоптоза (TWEAK) и его рецептор, молекула, индуцируемая фактором роста фибробластов (Fn14), участвуют в предотвращении локальной цитотоксичности и уравновешивают цитотоксическую функцию клеток uNK (18, 21, 22). Зрелость маточных NK-клеток, а также их состояние активации также кажутся важными (23). Естественные клетки-киллеры матки еще не полностью созрели и должны завершить процесс созревания, чтобы получить эффективные функции (23).Интерлейкин-15 является центральным цитокином для их набора и созревания в эндометрии (24). Однако сверхэкспрессия IL-15 способна активировать все местные иммунные клетки по отрицательному пути. Отношение IL-15 / Fn-14 используется при иммунном профилировании как биомаркер регулируемого состояния созревания и активации uNK-клеток. Кроме того, мы количественно оцениваем набор CD56-положительных клеток (маркер uNK) сначала с помощью иммунохимии, а в настоящее время с помощью ПЦР в реальном времени.
Документируя местный иммунный ответ, ожидаемый в период восприимчивости матки, мы стремимся обнаружить дисбаланс, который можно исправить, чтобы способствовать дальнейшей имплантации эмбриона.
Понимание местной иммунной среды матки может быть важным для прогнозирования будущего взаимодействия между эндометрием и эмбрионом. Снижающие активность иммунные клетки могут не вызвать необходимую реакцию имплантации. И наоборот, сверхактивные иммунные клетки могут привести к преждевременному разрушению эндометрия и, в конечном итоге, к отторжению эмбриона. Эта уникальная иммунная реакция необходима для стимулирования адгезии эмбрионов, и ее нарушение может препятствовать имплантации.
Первоначально разработанный во Франции для пациентов с историей повторных неудачных имплантаций (RIF) (25, 26), мы описываем здесь клинические результаты, наблюдаемые у 1738 бесплодных пациентов, и документируем его эффективность в клинических условиях, отличных от тех, которые ранее были изучены как благоприятный прогноз для бесплодия. пациенты, пациенты с повторными выкидышами или реципиенты ооцитов.В период с 2012 по 2018 год на основе 1738 задокументированных иммунных профилей клиницисту были предложены предложения по индивидуальному уходу, которые будут применяться в течение следующих 6 месяцев или при последующем переносе эмбрионов. Целью индивидуального ухода является восстановление баланса иммунной среды эндометрия. Чтобы оценить эффективность персонализированного ухода на основе иммунного профилирования, через 1 год после анализа пробы с клиницистами связались, чтобы задокументировать результат первого последующего переноса эмбрионов после анализа, или в течение следующих 6 месяцев, если не было лечения ЭКО или переноса эмбрионов. было запланировано (при повторных выкидышах при самопроизвольной беременности).
Материалы и методы
Утверждение протокола и согласие пациента
В 2011 году Наблюдательный совет и Комитет по этике больницы Сент-Луиса одобрили перспективное наблюдение когорты после иммунного профилирования, чтобы задокументировать их результат и потенциальную пользу (исх. 2011-A00994-37). Все женщины предоставили письменное информированное согласие во время сбора эндометрия, что позволяет связаться напрямую или через их врачей для сбора результатов при первом последующем переводе после иммунного профилирования матки.В 2014 году мы начали рандомизированное контрольное исследование PRECONCEPTIO (NCT02262117). В исследовании PRECONCEPTIO оценивается интерес до зачатия иммунного профилирования эндометрия для увеличения рождаемости (NCT02262117) у пациентов с ЭКО с хорошим прогнозом. Это рандомизированное контрольное исследование (РКИ) начало включать пациентов в августе 2016 года, и в нем планируется рандомизировать 400 пациентов с нарушенной регуляцией. Пациенты с бесплодием с хорошим прогнозом, начинающие лечение ЭКО, включены в исследование и имеют иммунный профиль эндометрия перед ЭКО.Если диагностировано нарушение регуляции, рандомизация распределяет выбор между обычным и персонализированным циклом ЭКО. Результатом является рождаемость при первом последующем переносе эмбрионов. На данный момент рандомизировано 270 пациентов. С октября 2014 г. по август 2016 г. мы начали это РКИ с теми же критериями включения, но при рандомизации был сделан выбор между анализом эндометрия и отсутствием анализа эндометрия с тем же результатом. Мы решили отказаться от этой схемы исследования, потому что в случае отсутствия анализа мы упускаем важную информацию, такую как наличие или отсутствие нарушения регуляции и его тип, которая будет важна для дальнейшего анализа.В настоящем исследовании пациенты с ЭКО с хорошим прогнозом были либо рандомизированы для анализа эндометрия до августа 2016 г., либо индивидуализированное лечение после августа 2016 г. Окончательные результаты исследования PRECONCEPTIO ожидаются в сентябре 2022 г.
Пациенты
Для пациентов, перенесших биопсию эндометрия, была представлена следующая информация: возраст, этиология бесплодия, количество предыдущих сборов ооцитов, общее кумулятивное количество замененных эмбрионов и следующий план лечения (свежее ЭКО с собственными яйцеклетками, замороженный эмбрион перенос FET, ЭКО с донорскими яйцеклетками IVF-OD, контролируемые естественные циклы).
Одна тысяча семьсот тридцать восемь пациентов были включены в это проспективное когортное исследование. Согласно собранным данным, пациенты были разделены на разные категории в зависимости от клинического контекста (ЭКО / ИКСИ; донорство ооцитов, повторные выкидыши), а также от количества попыток и количества ранее замененных эмбрионов (начало их курса в ЭКО или ЭКО- OD против истории RIF с собственными ооцитами или с OD) (Таблица 1):
— 1145 пациенток в анамнезе имели РИФ, определяемый как неспособность забеременеть, несмотря на кумулятивные переносы по крайней мере 6 эмбрионов на по крайней мере две коллекции ооцитов для пациентов моложе 43 лет.
— 210 пациенток были бесплодными молодыми пациентами (до 38 лет) с нормальным овариальным резервом (АМГ> 1,5 нг / мл), оцененным до их первого цикла ЭКО или после 1 неудачи ЭКО (хороший прогноз). Эти бесплодные пациенты с хорошим прогнозом выиграли от иммунного профилирования либо потому, что они были направлены на исследование их клиницистами из-за необъяснимого бесплодия, либо потому, что они участвовали в текущем рандомизированном контрольном исследовании и были рандомизированы для персонализации, если было диагностировано нарушение регуляции (Preconception Пробный).
— 91 пациентка начинала свое лечение с помощью донорства ооцитов (за границей) и была обследована либо до своего первого переноса эмбриона, либо из-за того, что им не удалось забеременеть только после одного переноса эмбриона (OD).
— 128 пациенток имели в анамнезе RIF при донорстве ооцитов (более 4 эмбрионов, перенесенных в течение двух ET) без беременности (RIF-OD).
— у 164 пациенток было не менее трех последовательных повторных выкидышей (РМ).
Таблица 1 . Обобщите клинические данные пациентов, включенных в это исследование.
Биопсия эндометрия: сбор и анализ
Из биопсии эндометрия, полученной путем аспирации в середине лютеиновой фазы за несколько месяцев до вспомогательного репродуктивного лечения, мы количественно оценили с помощью количественной ПЦР в реальном времени пять целевых биомаркеров (IL-18, IL-15, TWEAK, Fn-14 и CD56). документировать иммунную среду эндометрия, в которую будет перенесен эмбрион. В патенте без названия «СПОСОБ ПОВЫШЕНИЯ УСПЕХА ИМПЛАНТАЦИИ ПРИ ПОДДЕРЖКЕ оплодотворения» настоящее изобретение описывается как способ определения профиля восприимчивости матки для повышения успешности имплантации при вспомогательном оплодотворении (PCT / EP2013 / 065355).В патенте мы определили нормы экспрессии наших биомаркеров в фертильной когорте и задокументировали, что иммунный профиль воспроизводится от одного цикла к другому в течение 6 месяцев, если за это время не произошло хирургического вмешательства или беременности.
Биопсии были собраны лечащими врачами в середине лютеиновой фазы, в имитирующем замещенном цикле после 5–9 дней приема прогестерона или в контролируемом естественном цикле. Фрагмент эндометрия осторожно аспирировали путем вращения трубки Pipelle de Cornier в полости эндометрия.Pipelle — это наиболее изученное устройство для биопсии в литературе, это одноразовое медицинское устройство без латекса для аспирации эндометрия (27). Содержимое пипеля было разделено на две части: первая часть была помещена в 4% формальдегид (QPath Formol 4% buffered, VWR Chemicals, Fontenay-sous-Bois, France) для датирования эндометрия (гистологический тест для определения фазы цикла). и иммуно-мечение CD56, а вторую часть помещали в стабилизирующий раствор RNAlater для иммунологического анализа (MatriceLab Innove, Франция).Образцы были отправлены почтовыми службами при комнатной температуре.
После подтверждения средней лютеиновой фазы гистологическим анализом, РНК экстрагировали и подвергали обратной транскрипции с помощью ОТ-ПЦР. Отношения мРНК IL-15 / Fn-14 и IL-18 / TWEAK определяли с помощью количественной ОТ-ПЦР с использованием смеси Light Cycler 480 SYBR Green I Master Mix (Roche Diagnostic). Рекрутирование uNK-клеток первоначально оценивалось с использованием иммунохимической маркировки положительных клеток CD56 и в настоящее время оценивается с помощью ПЦР в реальном времени (25, 26).
Диагностика иммунного профиля эндометрия
Локальный иммунный профиль определяли в соответствии с локальным балансом экспрессии мРНК двух соотношений IL-18 / TWEAK, IL-15 / Fn-14 и иммуноокрашивания CD56 или экспрессии мРНК (25, 26).
Было диагностировано четыре типа иммунного профиля эндометрия:
• СБАЛАНСИРОВАННАЯ активация иммунной системы эндометрия, характеризующаяся соотношением мРНК IL-18 / TWEAK и IL-15 / Fn-14 и количеством клеток CD56 + в том же диапазоне, что и ранее определенная в фертильной когорте.
• НИЗКИЙ профиль иммунной активации эндометрия характеризуется низким соотношением мРНК для IL-15 / Fn-14 (отражающим незрелые клетки uNK) и / или IL-18 / TWEAK или отсутствием рекрутирования uNK.
• ПРЕВЫШЕННАЯ иммунная активация эндометрия характеризуется высоким соотношением мРНК IL-18 / TWEAK и / или IL-15 / Fn-14 и / или высоким количеством клеток CD56 +.
• СМЕШАННЫЙ иммунный профиль эндометрия характеризуется высоким соотношением мРНК IL-18 / TWEAK (избыток цитокинов Th-1) одновременно с низким соотношением IL-15 / Fn-14 (отражающим незрелые NK).
Предложение индивидуального плана лечения
На основании иммунного профиля матки врач получил через 3 недели после сбора эндометрия тип местного иммунного профиля (отсутствие дисрегуляции, низкая иммунная активация, чрезмерная активация иммунной системы, смешанный профиль) и предлагаемый индивидуальный план для устранения местного дисбаланса, если диагностирован (таблица 2).
Таблица 2 . Краткое изложение предлагаемых протоколов в соответствии с задокументированным иммунным профилем.
Предложения были разделены на шесть следующих ниже разделов.
Расчесывание эндометрия в середине лютеиновой фазы цикла, предшествующего переносу
Расчесывание эндометрия рекомендовалось в случае низкого соотношения мРНК IL-15 / Fn-14, которое мы интерпретируем как незрелость uNK-клеток. Расчесывание эндометрия может ускорить созревание uNK-клеток, что сильно зависит от адекватной экспрессии IL-15 (28).Любой тип локальных повреждений (например, биопсия эндометрия), выполняемый в середине лютеиновой фазы цикла, активирует и стимулирует на следующей лютеиновой фазе последующую экспрессию молекул адгезии и, что интересно, IL-15 через пути толл-подобных рецепторов. (29). Механизм действия царапания эндометрия, который мы хотим запустить, зависит от наличия врожденных иммунных клеток. Таким образом, положительный эффект расчесывания эндометрия наблюдается только при выполнении в середине лютеиновой фазы и не наблюдается при выполнении во время пролиферативной фазы.IL-15 активирует созревание uNK-клеток у женщин с низким соотношением мРНК IL-15 / Fn-14.
Использование высокого уровня эстрогенов
Было описано, что высокие концентрации эстрогенов (вызванные гиперстимуляцией яичников во время цикла ЭКО) подавляют ангиогенную экспрессию эндометриального IL-18 (30–32). Поэтому мы предложили избегать такого воздействия, если локальная экспрессия IL-18 была зарегистрирована как низкая.
Иммунотерапия
Было предложено сочетание иммунотерапии в сверхактивированном и смешанном профилях либо для снижения цитокинов Th-1, либо для контроля набора и / или активации uNK-клеток.В качестве терапии первой линии рекомендовалось дополнительное лечение кортикостероидами (33). В повседневной практике у нас до сих пор нет точных показаний к его применению, основанных на объективном тестировании (34–37).
Обоснование назначения кортикостероидов в таких иммунных профилях основано на предыдущих отчетах, описывающих их:
— снижение уровня цитокинов Th-1, цитотоксичности NK и гиперактивации в лимфокин-активированных клетках-киллерах (38).
— ограничивает последствия сверхэкспрессии мРНК IL-15 (39).
— модулировать баланс Th2 / Th3, когда в нем преобладают цитокины Th2 (40).
В случае устойчивости к кортикостероидам, низкомолекулярный гепарин был вариантом из-за их хорошо документированного антикомплементного эффекта (41, 42).
В качестве второго направления лечения мы также оценили эффективность медленной внутривенной перфузии интралипидов ® . Предыдущие авторы сообщали, что внутривенная медленная перфузия разбавленного Intralipid ® может быть полезна для контроля гиперактивации циркулирующих NK-клеток и для регулирования преобладающего баланса цитокинов Th-1 (43, 44).Мы лично наблюдали и сообщали о местном снижении цитокинов Th-1, а также о лучшем контроле рекрутирования uNK-клеток после внутривенной перфузии интралипидов (45).
Внутривенная перфузия интралипидов систематически проводилась под наблюдением врача в больнице.
На данном этапе, что касается выбора иммунотерапии, только нормализация иммунного профиля матки при терапии может указывать на эффективность любого препарата, поскольку мы не можем предсказать ответ на каждый вид терапии.
Гормональная адаптация лютеиновой фазы
Адаптация лютеиновой опоры была рекомендована для сверхактивированных профилей и смешанных профилей.
Прогестерон, помимо своей эндокринной роли, является важным медиатором местной иммунной толерантности, необходимой для успешной беременности.
Прогестерон влияет на иммунную систему матери различными путями:
— Через производство прогестерон-индуцированного блокирующего фактора (PIBF), который ингибирует активность NK-клеток (46) и приводит к выработке Th-2-доминантных цитокинов материнскими лимфоцитами (47).
— Посредством индукции галектина-1, молекулы, индуцированной прогестероном, необходимой для индукции толерогенных дендритных клеток, которая, в свою очередь, способствует экспансии in vivo IL-10 секретирующих Treg-клеток (48).
Следовательно, когда была диагностирована локальная сверхактивация иммунитета, мы рекомендовали высокие суточные вагинальные дозы прогестерона (1200 мг) из-за его иммуносупрессивных свойств. Когда экспрессия IL-18 была повышена, мы также рекомендовали пероральный прием эстрадиола (4 мг) для подавления локальной экспрессии IL-18, как описано ранее (30).Лечение должно начинаться в день забора ооцитов и продолжаться до 8 недель после ЭТ для беременных женщин.
Дополнение лютеиновой фазы хорионическим гонадотропином человека (ХГЧ)
Предыдущие авторы продемонстрировали, что ХГЧ запускает как пролиферацию, так и созревание клеток uNK (49) и способствует локальному ангиогенезу (50, 51). Физиологически продуцируемый эмбрионом ХГЧ принимает непосредственное участие в местной реакции посредством индукции адекватного ангиогенеза, контролируя активацию клеток uNK на границе раздела матери и плода (52, 53).Мы рекомендовали добавление ХГЧ в середине лютеиновой фазы в случае низкого набора CD56 или незрелости клеток uNK.
Половой акт после инопланетян
Вызывая экспрессию провоспалительных цитокинов и хемокинов и надежное привлечение иммунных клеток, семенная плазма может играть положительную роль в подготовке эндометрия к принятию имплантации (54–56). Поэтому мы рекомендовали половой акт в случае низкой иммунной активации, но не рекомендовали воздействие семенной плазмы в случае чрезмерно активированного и смешанного профиля.
Перспективное получение результата
Мы собрали данные за 5 различных периодов времени: 2014 для биопсий, проанализированных в 2012–2013 гг., 2015 г. для биопсий, собранных в 2014 г., 2016 для биопсий, собранных в 2015 г. 2017 для биопсий, собранных в 2016 году, и 2018 для биопсий, проанализированных в 2017 году до июля 2018 года.
Направляющий клиницист подтвердил, применялась ли предложенная персонализация, тип используемой АРТ (ЭКО, FET, контролируемый естественный цикл или ВМИ для пациентов с РМ) и результат.
Исход был классифицирован по трем категориям: продолжающаяся беременность (более 3 месяцев беременности), выкидыш и отсутствие беременности.
Статистический анализ
Мы считали результат надежным при следующих условиях:
— Если был выполнен перенос эмбриона (RIF, ЭКО с хорошим прогнозом, OD, RIF-OD, некоторые RM): беременность наступила после первого переноса эмбриона (свежего или замороженного), выполненного в течение 9 месяцев после иммунного профилирования эндометрия.
— Если перенос эмбрионов не проводился (RM со спонтанной беременностью): беременность наступила в течение следующих 6 месяцев после иммунного профилирования эндометрия с персонализацией, применяемой посредством контролируемых естественных циклов.
Беременность определялась наличием по крайней мере одного эмбриона с сердечной активностью в течение 12 недель аменореи.
Результат был проанализирован в соответствии с клиническим контекстом (хороший прогноз ЭКО, RIF, RM, OD, RIF-OD), с учетом иммунного профиля, дисрегулируемый или сбалансированный, а также с учетом различных типов дисрегуляции эндометрия (сверхактивация иммунитета, иммунная недостаточная активация, смешанный профиль).
Использовался тестANOVA с одним или двумя уровнями дисперсии.Значение p ниже 0,05 считалось значимым.
Результаты
Сравнение перераспределения различных иммунных профилей для каждого клинического контекста
Что касается всей когорты, у 17% бесплодных пациентов была диагностирована отсутствие иммунной дисрегуляции, у 28% — недостаточная активация иммунной системы, у 45% — избыточная активация иммунной системы, у 10% — смешанный профиль.
Как показано в таблице 3, при рассмотрении клинического контекста не наблюдалось никаких значительных различий ( p = 0,20) в отношении перераспределения между различными типами иммунных профилей.
Таблица 3 . Сравнение распределения различных иммунных профилей для каждого клинического контекста.
Более того, мы не наблюдали различий в отношении распределения между профилями дисрегуляции и баланса при рассмотрении клинического контекста ( p = 0,09).
Исходы при наличии или отсутствии иммунной дисрегуляции эндометрия в различных клинических условиях (таблица 4)
На частоту наступления беременности (PR) влияли клинический контекст и наличие местной иммунной дисрегуляции.Что касается клинического контекста, PR, наблюдаемый в группах с хорошим прогнозом IVF и RM был значительно выше, чем в группе RIF (56 и 50% соответственно против 36%, p <0,001) и не был значительно выше. чем наблюдаемый для OD (45% для OD и 42% для RIF-OD). Выкидыши были значительно выше у пациентов, участвовавших в донорстве ооцитов (OD и RIF-OD), по сравнению с пациентами, участвовавшими в ЭКО (хороший прогноз и RIF) с использованием своих собственных ооцитов ( p = 0.02).
Таблица 4 . Результат с учетом наличия или отсутствия нарушения регуляции и клинического контекста.
Что касается местной иммунной дисрегуляции, частота наступления беременности была значительно выше у пациентов с RIF и RM, если была выявлена дисрегуляция и применена предлагаемая персонализация, по сравнению с пациентами без дисрегуляции (соответственно 38,4 и 57,6% против 26,9 и 25%, p < 0,002).
Напротив, в подгруппах ЭКО и OD с хорошим прогнозом не наблюдалось никакой разницы между дисрегуляцией и подгруппой.пациенты без нарушения регуляции, но самые высокие показатели наступления беременности наблюдались при отсутствии нарушения регуляции.
Возникновение нового выкидыша было выше и на грани значимости (24% против 12%, p = 0,057) для пациентов с RM без диагностированной дисрегуляции.
Исход у пациентов с нарушенным иммунным профилем (таблица 5)
При рассмотрении типа диагностированного нарушения регуляции (избыточная активация иммунной системы, недостаточная активация иммунной системы, смешанный профиль) и, следовательно, типа применяемого персонализированного ухода, не наблюдалось значительных различий в показателях беременности или выкидышей.
Таблица 5 . Результат в дерегулированных иммунных профилях.
Сверхиммунная активация и тест на чувствительность к иммунотерапии
Для пациентов с нарушенной регуляцией эндометрия с избыточной активацией или смешанным профилем мы рекомендовали тестовый цикл под терапевтическим лечением, чтобы подтвердить эффективность выбранной иммунотерапии.
Чтобы проверить чувствительность к иммунотерапии, лечение было введено в соответствии с рекомендациями в новом замещенном цикле: введение на 3-й день цикла кортикостероидов, на 8-й день для внутривенной перфузии интралипидов одновременно с лютеиновой поддержкой для НМГ. ).Иммунное профилирование эндометрия выполняли как обычно в средней лютеиновой фазе, как описано ранее.
После терапевтического теста иммунотерапия была классифицирована как эффективная в случае нормализации профиля, резистентная, если иммунный дисбаланс все еще присутствовал или ухудшался, частично реагирующая, если коррекция была неполной. В случае частичного ответа рекомендовалось связать использованную терапию с другой. В случае сопротивления клиницисту посоветовали сменить применяемое лекарство.
99 пациентов получали кортикостероиды. Это было эффективным у 47% (47/99), устойчивым — у 45% (45/99) и частично — у 8% (8/99).
46 пациентов были обследованы после внутривенной медленной перфузии интралипидов. Это было эффективным у 65% (30/46), устойчивым — у 20% (9/46) и частично — у 20% (7/46).
5 пациентов были обследованы на НМГ и кортикостероиды, и все они были классифицированы как реагирующие.
Из 964 пациентов с избыточной активацией или смешанным профилем 150 пациентов прошли терапевтический тест, а 814 пациентов — нет.
Частота продолжающейся беременности была значительно выше у пациенток с терапевтическим тестом по сравнению с пациентами без терапевтического теста (51 против 39,9%. p = 0,012). Частота выкидышей была одинаковой в обеих группах (9%).
Нарушение регуляции иммунитета эндометрия и возраст матери
Все пациенты, использующие собственные ооциты или участвовавшие в OD, были разделены на три категории в зависимости от их возраста: до 35 лет, от 36 до 40 и старше 40 лет. Распределение различных иммунных профилей было одинаковым в трех категориях ( p = 0.9), что позволяет предположить, что иммунный профиль эндометрия не зависит от возраста матери или качества ооцитов.
Поскольку качество ооцитов зависит от возраста матери и сильно влияет на результат, мы проанализировали влияние возраста матери и наличия дисрегуляции эндометрия на результат у пациентов, которым проводилось ЭКО с их собственными ооцитами, по сравнению с пациентами, получавшими лечение с донорскими ооцитами. Для пациенток, использующих собственные ооциты, на исход беременности значительно повлиял возраст матери ( p <0.0001) и наличие дисрегуляции эндометрия ( p = 0,001) в каждой возрастной категории. Такой эффект не наблюдался у пациентов, использовавших донорские ооциты ( p = 0,49) (таблица 6).
Таблица 6 . Нарушение регуляции эндометрия и возраст матери.
Обсуждение
Иммунное профилирование в репродуктивной медицине — это новая концепция, предполагающая, что местный иммунитет эндометрия во время имплантации может быть перебалансирован, чтобы положительно повлиять на исход беременности.Одна тысяча семьсот тридцать восемь бесплодных пациенток проспективно наблюдались в течение 5 лет, чтобы оценить эффективность этого нового диагноза с точки зрения их шансов забеременеть.
Это обширное исследование дало нам новое понимание отсутствия вариаций в распределении иммунных профилей с учетом клинического контекста или возраста матери.
Отсутствие вариаций косвенно свидетельствует о том, что иммунная регуляция эндометрия не является необходимым условием имплантации.Сам эмбрион способен стимулировать адгезию или контролировать локальную активацию иммунных клеток, если это необходимо. Однако, если эмбрион не способен контролировать местные иммунные нарушения, индивидуальное лечение может быть важным для содействия эффективному начальному диалогу.
Отсутствие различий при рассмотрении возраста матери также предполагает, что качество ооцита и локальный иммунный баланс эндометрия независимы.
В подгруппах, где контролировалось качество ооцитов (хороший прогноз, ЭКО или OD), самые высокие показатели беременности наблюдались у пациенток без нарушения регуляции.Для пациентов с нарушенной регуляцией ключевые отсутствующие данные — это уровень их беременности, если бы не применялась персонализация. В 2016 году мы запустили рандомизированное контрольное исследование пациентов с ЭКО с хорошим прогнозом, чтобы ответить на этот вопрос. Планируется принять 500 пациентов. Если диагностировано нарушение регуляции, пациентов рандомизируют либо для обычного цикла ЭКО, либо для персонализированного цикла ЭКО. Результаты ожидаются к концу 2021 года. Такое исследование трудно реализовать в популяции RIF, поскольку пациенты редко соглашаются быть рандомизированными для стандартного цикла, если диагностируется нарушение регуляции.Это рандомизированное контрольное исследование должно определить, когда иммунное тестирование эндометрия может быть полезным для увеличения вероятности беременности в нормальном ходе лечения бесплодия.
В представленном большом проспективном исследовании пациенты с RIF и RM извлекли пользу из иммунного профилирования, независимо от их возраста, в случае диагностированной дисрегуляции эндометрия. Индивидуальный подход к уходу в соответствии с их иммунным профилем значительно повысил их шансы на беременность. Напротив, если в контексте RIF не наблюдалось нарушения регуляции, прогноз сильно зависел от возраста матери, поскольку в отношении эндометрия нельзя было предложить никаких предположений.
У пациентов с РМ отсутствие нарушения регуляции было связано с самым низким PR и высоким риском выкидыша. В этой подгруппе без нарушений регуляции мы можем постулировать, что мы упустили идентификацию механизма, вызывающего выкидыш, и что наших биомаркеров недостаточно для выявления основной проблемы. Интересно, что недавние исследования секвенирования отдельных клеток выявили различные популяции dNK1, dNK2 и dNK3, которые могут отличаться по RIF и RM и для выявления потенциальных изменений требуются маркеры, отличные от маркера pan dNK CD56 (57, 58).Напротив, если было выявлено нарушение регуляции, прогноз забеременеть, по-видимому, значительно улучшился благодаря персонализации ухода на основе иммунитета. Нарушение регуляции эндометрия наблюдалось у 80% из 164 включенных пациентов с РМ и может представлять собой новый вариант для их индивидуального ухода, независимо от вспомогательного репродуктивного лечения в виде ЭКО. Этот подход необходимо оценить с помощью рандомизированного контрольного исследования на пациентах с РМ.
Ранее никогда не сообщалось о результатах иммунного профилирования эндометрия при донорстве ооцитов.Перераспределение нарушений регуляции эндометрия у пациентов, использующих донорские ооциты, было таким же, как и у пациентов с ЭКО и РМ. Однако результат оказался ниже ожидаемого, поскольку качество ооцитов контролировалось per se при донорстве ооцитов. Независимо от наличия или отсутствия дисрегуляции эндометрия, процент выкидышей, наблюдаемых у пациентов, использующих донорские ооциты, был значительно выше, чем у пациентов, вовлеченных в ЭКО с использованием собственных ооцитов (12 vs.8%, р = 0,02). Более того, персонализация не привела к снижению наблюдаемого высокого уровня выкидышей. Это говорит о том, что на имплантацию при OD влияют другие факторы. Точный мониторинг лютеиновой фазы у этих пациенток с отсутствием активности яичников может иметь важное значение и должен оцениваться проспективно. Отсутствие менструального цикла также может повлиять на персонализацию иммунитета. Например, когда было рекомендовано расчесывание эндометрия, некоторые клиницисты выполняли процедуру с использованием монофазных таблеток, которые классически назначают при планировании передозировки.Поскольку принцип требует, чтобы действительная лютеиновая фаза была эффективной, расчесывание эндометрия в этих условиях не будет эффективным. Мы также не исследовали, была ли добавка лютеинового ХГЧ так же эффективна при OD, как это наблюдается у овуляторных женщин. Поэтому возможно, что для повышения эффективности персонализации у пациентов с отсутствием активности яичников и яичниковых циклов необходимы некоторые адаптации.
Главное нововведение говорит о том, что одно решение не подходит для всех.Со временем все метаанализы, оценивающие эффективность царапания эндометрия, назначения кортикостероидов или любого типа иммунотерапии при ЭКО, неоднократно давали отрицательные результаты (59–61). Это полностью соответствует нашим данным. Только 30% любой популяции извлекут выгоду из принципа, независимо от принципа, протестированного в соответствии с наблюдаемыми иммунными профилями.
Что касается типа иммунотерапии, применяемой для контроля сверхактивации иммунной системы эндометрия, у нас все еще нет данных, чтобы определить, какой препарат будет оптимальным.Многие различные иммунные механизмы могут вызывать сверхактивацию иммунной системы (дисбаланс Th-1 / Th-2, гиперактивация uNK в клетках-киллерах, активируемых лимфокинами, неконтролируемая активация комплемента, активация Treg-клеток в Th- 17 ячеек и др.). Поэтому понятно, что в каждом случае может потребоваться отдельный принцип для управления средой эндометрия. Однако, насколько нам известно, только повторный тест с использованием препарата может подтвердить его эффективность. Частота наступления беременности была значительно выше у пациенток, получавших терапевтическое средство, по сравнению с теми, у кого его не было.
В заключение следует отметить, что местный иммунитет эндометрия является новым и важным параметром, способным повлиять на прогноз беременности. У пациентов с RIF и RM диагноз иммунной дисрегуляции эндометрия в сочетании с индивидуальным уходом привел к значительно более высоким показателям беременности, чем наблюдаемые у пациентов без дисрегуляции. Количественная оценка точной пользы при диагностировании нарушения регуляции и применении целевой индивидуальной терапии (по сравнению с традиционным лечением) в настоящее время оценивается в рандомизированном контрольном исследовании среди пациентов с ЭКО с хорошим прогнозом.Местный иммунитет эндометрия не зависит от возраста матери и клинического контекста.
Заявление о доступности данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены институциональным наблюдательным советом больницы Сент-Луиса (2011-A00994-37), одобрившим проспективное наблюдение. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
NL задумал исследование, интерпретировал иммунные профили матки для персонализации последующих рекомендаций и написал рукопись. LC, AK и KV провели молекулярный анализ. LP-E, GD, GNC, GC и MP исправили рукопись и участвовали с самого начала до создания инновационной процедуры.
Финансирование
Это исследование было поддержано MatriceLab Innove для диагностических тестов и проспективного сбора данных для последующего наблюдения.
Конфликт интересов
NL и MP инициировали создание новой компании MatriceLAB Innove. Они работают в компании, которая также финансировала исследование. У них также есть патент на тест иммунной оценки эндометрия и прилагаемые рекомендации (PCT / EP2013 / 065355).
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Прежде всего мы благодарим пациенток, которые согласились на ретроспективный сбор результатов их беременности.Мы также хотим поблагодарить врачей, которые согласились принять участие в инновационной процедуре: Ф. Александра, Ф. К. Обрио, Дж. П. Айель, Г. Барош, Б. Бстандига, И. Седрина, К. Корнели, Д. Корне, А. Дельвинь, С. Демеленн, Э. Дескат, К. Денуаль-Зиад, В. Диври, С. Дуар, Р. Эльбазе, Ф. Фарж, А. Годфруа, Дж. Грейндл, Ф. Эрве, Л. Лару, X. Леха, О. Миалон, К. Натан, П. Огер, М. Паскье, А. Шумакер, А. К. Рубах, Г. Реге, К. Вассер и С. Вердж. Мы особенно благодарим врачей репродуктивного отделения больницы Les Bluets (Париж) за их энтузиазм и поддержку.Наконец, мы также хотим поблагодарить Джоэла и Джонатана Хамонов, которые адаптировали защищенный онлайн-медицинский файл, посвященный бесплодию (Medifirst SAS), к нашему нововведению, внедрив новые данные и информационную поддержку для извлечения соответствующих данных и создания отчетов. Мы благодарим доктора Мону Рахмати за отражение рукописи.
Сокращения
OD, донорство ооцитов; РИФ, Повторные неудачи имплантации; RM, Рецидивирующие выкидыши; ЭКО, in vitro, оплодотворение; АРТ, вспомогательная репродуктивная терапия; PR, Показатель беременности.
Список литературы
1. Бойвин Дж., Бантинг Л., Коллинз Дж. А., Нигрен К. Г.. Международные оценки распространенности бесплодия и обращения за лечением: потенциальная потребность и спрос на медицинскую помощь при бесплодии. Hum Reprod. (2007) 22: 1506–12. DOI: 10.1093 / humrep / dem046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Рутштейн С.О., Шах И.Х. Бесплодие, бесплодие, бездетность в развивающихся странах . Сравнительные отчеты DHS No.9. Женева: Всемирная организация здравоохранения (2004 г.).
3. Mascarenhas MN, Cheung H, Mathers CD, Stevens GA. Измерение бесплодия среди населения: построение стандартного определения для использования с обследованиями демографических и репродуктивных здоровья. Popul Health Metr. (2012) 10:17. DOI: 10.1186 / 1478-7954-10-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Омбелет В., Кук И., Дайер С., Сероур Дж., Деврой П. Бесплодие и предоставление медицинских услуг по лечению бесплодия в развивающихся странах. Обновление Hum Reprod . (2008) 14: 605–21. DOI: 10.1093 / humupd / dmn042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. де Музон Дж., Гуссенс В., Бхаттачарья С., Кастилья Дж. А., Ферраретти А. П., Корсак В. и др. Вспомогательные репродуктивные технологии в Европе, 2006: результаты, полученные из европейских регистров ESHRE. Hum Reprod. (2010) 25: 1851–62. DOI: 10.1093 / humrep / deu175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Busnelli A, Reschini M, Cardellicchio L, Vegetti W, Somigliana E, Vercellini P. Насколько часто встречается реальная повторная неудача имплантации? Косвенная оценка распространенности. Репродукция Биомед Интернет . (2020) 40: 91–7. DOI: 10.1016 / j.rbmo.2019.10.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Текленбург Г., Салкер М., Хейнен С., Маклон Н.С., Бросенс Дж. Дж. Молекулярная основа повторного невынашивания беременности: нарушение естественного отбора эмбрионов. Mol Hum Reprod. (2010) 16: 886–95. DOI: 10,1093 / мольчр / gaq079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Геллерсен Б., Бросенс И.А., Бросенс Дж. Дж. Децидуализация эндометрия человека: механизмы, функции и клинические перспективы. Semin Reprod Med. (2007) 25: 445–53. DOI: 10,1055 / с-2007-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Vacca P, Chiossone L, Mingari MC, Moretta L. Гетерогенность NK-клеток и других врожденных лимфоидных клеток в децидуальной оболочке человека и мыши. Front Immunol. (2019) 10: 170. DOI: 10.3389 / fimmu.2019.00170
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Рассел П., Сакс Г., Тремеллен К., Джи А. Распределение иммунных клеток и макрофагов в эндометрии у женщин с повторяющейся репродуктивной недостаточностью. III: дальнейшие наблюдения и контрольные диапазоны. Патология . (2013) 45: 393–401. DOI: 10.1097 / PAT.0b013e328361429b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15.La Rocca C, Carbone F, Longobardi S, Matarese G. Иммунология беременности: регуляторные Т-клетки контролируют материнскую иммунную толерантность к плоду. Иммунол Письмо . (2014) 162 (1 Pt A): 41–8. DOI: 10.1016 / j.imlet.2014.06.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Маррон К., Уолш Д., Харрити С. Подробная оценка иммунного статуса эндометрия в популяциях с нормальным и неблагоприятным репродуктивным исходом. J Assist Reprod Genet . (2019) 36: 199–210.DOI: 10.1007 / s10815-018-1300-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Лэш Г.Е., Балмер Дж. Н., Ли Т. К., Иннес Б. А., Мари Н., Патель Г. и др. Стандартизация измерений клеток естественных киллеров матки (uNK) в эндометрии у женщин с повторяющейся репродуктивной недостаточностью. J Reprod Immunol. (2016) 116: 50–9. DOI: 10.1016 / j.jri.2016.04.290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ци X, Лэй М., Цинь Л., Се М., Чжао Д., Ван Дж.Эндогенный TWEAK имеет решающее значение для регулирования функции естественных клеток-киллеров матки мышей в иммунологической модели невынашивания беременности. Иммунология . (2016) 148: 70–82. DOI: 10.1111 / imm.12588
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Чжан Дж., Чен З., Смит Г. Н., Крой Б. А.. Трансформация сосудов, вызванная естественными клетками-киллерами: забота матери до рождения? Cell Mol Immunol. (2010) 8: 1–11. DOI: 10,1038 / cmi.2010.38
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20.Goldman-Wohl DS, Ariel I, Greenfield C, Lavy Y, Yagel S. Экспрессия Tie-2 и ангиопоэтина-2 на границе плод-мать: модель рецепторного лиганда для ремоделирования сосудов. Мол Хум Репрод . (2000) 6: 81–7. DOI: 10,1093 / моль · ч / 6,1,81
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Петитбарат М., Рахмати М., Серазин В., Дубанчет С., Морван С., Вайнер Р. и др. TWEAK является модулятором цитотоксической активности естественных киллеров матки, связанной с ИЛ-18 эндометрия. PLOS ONE . (2011) 6: e14497. DOI: 10.1371 / journal.pone.0014497
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Петитбарат М., Серазин В., Дубанше С., Уэйнер Р., де Мазанкур П., Шауа Г. и др. Фактор некроза опухоли, подобный слабому индуктору апоптоза (TWEAK) / индуцибельный фактор роста фибробластов-14, может регулировать эффекты интерлейкина 18 и 15 в эндометрии человека. Fertil Steril . (2009) 94: 1141–3. DOI: 10.1016 / j.fertnstert.2009.10.049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Манастер И., Мизрахи С., Гольдман-Воль Д., Села Х.Й., Стерн-Гиноссар Н., Ланкри Д. и др. NK-клетки эндометрия — это особые незрелые клетки, ожидающие беременности. Дж. Иммунол . (2008) 181: 1869–76. DOI: 10.4049 / jimmunol.181.3.1869
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Блуа С.М., Барриентос Г., Гарсия М.Г., Орсал А.С., Тометтен М., Кордо-Руссо Р.И. и др. Взаимодействие между дендритными клетками и естественными клетками-киллерами во время беременности у мышей. J Mol Med. (2008) 86: 837–52. DOI: 10.1007 / s00109-008-0342-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Лиди Н., Петитбарат М., Шеврие Л., Виту Д., Везмар К., Рахмати М. и др. Иммунный профиль матки может помочь женщинам с повторной необъяснимой неудачей имплантации эмбриона после оплодотворения in vitro . Ам Дж Репрод Иммунол . (2016) 75: 388–401. DOI: 10.1111 / aji.12483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Лиди Н., Прат-Элленберг Л., Шеврие Л., Балет Р., Саймон С., Ленобл С. и др. Иммунное профилирование матки для увеличения рождаемости: индивидуальное когортное исследование. Дж Репрод Иммунол . (2017) 119: 23–30. DOI: 10.1016 / j.jri.2016.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Леклер К.М., Зия Дж. К., Дум К. М., Морган Т. К., Эдельман А. Б.. Боль испытала при использовании двух разных методов биопсии эндометрия: рандомизированного контролируемого исследования. Obstet Gynecol. (2011) 117: 636–41. DOI: 10.1097 / AOG.0b013e31820ad45b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Verma S, Hiby SE, Loke YW, King A. Децидуальные естественные клетки-киллеры человека экспрессируют рецептор цитокинового интерлейкина 15 и отвечают на него. Biol Reprod. (2000) 62: 959–68. DOI: 10.1095 / biolreprod62.4.959
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Гнаински Ю., Гранот И., Альдо П.Б., Бараш А., Ор Y, Шехтман Е. и др.Местное повреждение эндометрия вызывает воспалительную реакцию, которая способствует успешной имплантации. Fertil Steril . (2010) 94: 2030–6. DOI: 10.1016 / j.fertnstert.2010.02.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Ledee N, Dubanchet S, Lombroso R, Ville Y, Chaouat G. Подавление человеческого эндометриального IL-18 экзогенными стероидами яичников. Ам Дж Репрод Иммунол . (2006) 56: 119–23. DOI: 10.1111 / j.1600-0897.2006.00401.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Мураками Ю., Оцуки М., Кусумото К., Такеучи С., Такахаши С. Эстроген подавляет экспрессию мРНК интерлейкина-18 в матке мыши. Дж Репрод Дев . (2005) 51: 639–47. DOI: 10.1262 / jrd.17029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Ван Ф., Чжу Х., Ли Б., Лю М., Лю Д., Дэн М. и др. Влияние хорионического гонадотропина, эстрадиола и прогестерона человека на экспрессию интерлейкина-18 в децидуальных тканях человека. Гинекол Эндокринол . (2017) 33: 265–9.DOI: 10.1080 / 09513590.2016.1212829
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Леде Н., Прат-Элленберг Л., Петитбарат М., Шеврие Л., Саймон С., Ирани Е.Е. и др. Влияние преднизона на пациента с повторными неудачными имплантациями эмбриона: полезно или пагубно? J Reprod Immunol. (2018) 127: 11–5. DOI: 10.1016 / j.jri.2018.03.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Boomsma CM, Keay SD, Macklon NS.Периимплантационное введение глюкокортикоидов для циклов вспомогательных репродуктивных технологий. Кокрановская база данных Syst Rev. (2012) 6: CD005996. DOI: 10.1002 / 14651858.CD005996.pub3
CrossRef Полный текст | Google Scholar
36. Boomsma CM, Keay SD, Macklon NS. Периимплантационное введение глюкокортикоидов для циклов вспомогательных репродуктивных технологий. Кокрановская база данных Syst Rev . (2012) CD005996. DOI: 10.1002 / 14651858.CD005996.pub2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37.Kalampokas T, Pandian Z, Keay SD, Bhattacharya S. Добавление глюкокортикоидов во время стимуляции яичников для ЭКО или ИКСИ. Кокрановская база данных Syst Rev. (2017) 3: CD004752. DOI: 10.1002 / 14651858.CD004752.pub2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Эдди Дж.Л., Круковски К., Янусек Л., Мэтьюз Х.Л. Глюкокортикоиды эпигенетически регулируют функцию естественных клеток-киллеров. Cell Immunol. (2014) 290: 120–30. DOI: 10.1016 / j.cellimm.2014.05.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Мустаки А., Аргиропулос К.В., Баксеванис К.Н., Папамихаил М., Перес С.А. Влияние одновременного введения глюкокортикоидов и ИЛ-15 на фенотип, пролиферацию и функцию человеческих NK-клеток. Cancer Immunol Immunother. (2011) 60: 1683–95. DOI: 10.1007 / s00262-011-1067-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Оберкерш Р., Атторрези А.И., Калабрезе ГК.Ингибирование низкомолекулярного гепарина в классическом пути активации комплемента во время беременности. Thromb Res. (2010) 125: e240–5. DOI: 10.1016 / j.thromres.2009.11.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Руссев Р.Г., Акацио Б, Нг СК, Кулам CB. Продолжительность супрессивного действия интралипида на функциональную активность NK-клеток. Am J Reprod Immunol. (2008) 60: 258–63. DOI: 10.1111 / j.1600-0897.2008.00621.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Coulam CB, Acacio B. Способствует ли иммунотерапия для лечения репродуктивной недостаточности живорождению? Ам Дж Репрод Иммунол . (2012) 67: 296–304. DOI: 10.1111 / j.1600-0897.2012.01111.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Лиди Н., Вассер С., Петитбарат М., Шеврие Л., Везмар К., Дрей Г. и др. Интралипид (R) может дать новую надежду пациентам с репродуктивными нарушениями и одновременной сверхиммунной активацией эндометрия. Дж Репрод Иммунол .(2018) 130: 18–22. DOI: 10.1016 / j.jri.2018.09.050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Szekeres-Bartho J, Par G, Dombay G, Smart YC, Volgyi Z. Антиабортативный эффект индуцированного прогестероном блокирующего фактора у мышей проявляется путем модуляции активности NK. Cell Immunol. (1997) 177: 194–9. DOI: 10.1006 / cimm.1997.1090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Секерес-Барто Дж, Халаш М., Палкович Т.Прогестерон при беременности; рецептор-лигандное взаимодействие и сигнальные пути. Дж Репрод Иммунол . (2009) 83: 60–4. DOI: 10.1016 / j.jri.2009.06.262
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Блуа С.М., Иларреги Дж. М., Тометтен М., Гарсия М., Орсал А. С., Кордо-Руссо Р. и др. Ключевая роль галектина-1 в толерантности плода и матери. Nat Med. (2007) 13: 1450–7. DOI: 10,1038 / нм1680
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Кейн Н., Келли Р., Сондерс П. Т., Кричли Х.О. Пролиферация естественных клеток-киллеров матки индуцируется хорионическим гонадотропином человека и опосредуется рецептором маннозы. Эндокринология. (2009) 150: 2882–8. DOI: 10.1210 / en.2008-1309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Берндт С., Блахер С., Перье д’Отерив С., Тири М., Цампалас М., Круз А. и др. Стимуляция хорионическими гонадотропинами ангиогенеза и рекрутирования перицитов. Дж. Клин Эндокринол Метаб .(2009) 94: 4567–74. DOI: 10.1210 / jc.2009-0443
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Цампалас М., Гриделет В., Берндт С., Фойдарт Дж. М., Джинен В., Перье д’Отерив С. Хорионический гонадотропин человека: гормон с иммунологическими и ангиогенными свойствами. J Reprod Immunol. (2010) 85: 93–8. DOI: 10.1016 / j.jri.2009.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Перье д’Отерив С., Берндт С., Цампалас М., Шарле-Ренар С., Дюбуа М., Бургейн С. и др.Диалог между ХГЧ бластоцисты и рецептором ЛГ / ХГЧ эндометрия: какая роль в имплантации? Гинекол Обстет Инвест . (2007) 64: 156–60. DOI: 10.1159 / 000101740
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Bansal AS, Bora SA, Saso S, Smith JR, Johnson MR, Thum MY. Механизм иммуномодуляции, опосредованной хорионическим гонадотропином человека, при беременности. Эксперт Рев Клин Иммунол. (2012) 8: 747–53. DOI: 10.1586 / eci.12.77
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.Робертсон С.А., Ингман В.В., О’Лири С., Шарки Диджей, Тремеллен К.П. Трансформирующий фактор роста бета — медиатор иммунных отклонений в семенной плазме. J Reprod Immunol. (2002) 57: 109–28. DOI: 10.1016 / S0165-0378 (02) 00015-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Шарки Д.Д., Тремеллен К.П., Джаспер М.Дж., Гемцелль-Даниэльссон К., Робертсон С.А. Семенная жидкость индуцирует набор лейкоцитов и экспрессию мРНК цитокинов и хемокинов в шейке матки человека после коитуса. J Immunol. (2012) 188: 2445–54. DOI: 10.4049 / jimmunol.1102736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Венто-Тормо Р., Ефремова М., Боттинг Р.А., Турко М.Ю., Венто-Тормо М., Мейер К.Б. и др. Одноклеточная реконструкция раннего взаимодействия матери и плода у людей. Природа. (2018) 563: 347–53. DOI: 10.1038 / s41586-018-0698-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Сурьяванши Х., Морозов П., Страус А., Сахасрабудхе Н., Макс КЕА, Гарзия А. и др.Одноклеточное исследование плаценты и децидуальной оболочки человека в первом триместре. Научный руководитель . (2018) 4: eaau4788. DOI: 10.1126 / sciadv.aau4788
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Ахилли С., Дюран-Ретамал М., Сааб В., Серхал П., Сешадри С. Роль иммунотерапии в оплодотворении in vitro и повторном невынашивании беременности : систематический обзор и метаанализ. Fertil Steril . (2018) 110: 1089–100. DOI: 10.1016 / j.fertnstert.2018.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. van Hoogenhuijze NE, Kasius JC, Broekmans FJM, Bosteels J, Torrance HL. Расчесывание эндометрия перед ЭКО; это помогает и кому? Систематический обзор и метаанализ. Hum Reprod Open. (2019) 2019: hoy025. DOI: 10.1093 / hropen / hoy025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиперплазия эндометрия | ACOG
Ячейки : Наименьшие элементы конструкции в теле.Клетки — это строительные блоки для всех частей тела.
Сахарный диабет : Состояние, при котором уровень сахара в крови слишком высок.
Расширение и кюретаж (D&C) : процедура, при которой открывается шейка матки, чтобы можно было удалить ткань матки с помощью инструмента, называемого кюреткой.
Яйцо : женская репродуктивная клетка, вырабатываемая яичниками и высвобождающаяся из них. Также называется яйцеклеткой.
Биопсия эндометрия : процедура, при которой небольшое количество ткани, выстилающей матку, удаляется и исследуется под микроскопом.
Гиперплазия эндометрия : Состояние, при котором слизистая оболочка матки становится слишком толстой.
Внутриэпителиальная неоплазия эндометрия (EIN) : предраковое состояние, при котором участки слизистой оболочки матки становятся слишком толстыми.
Эндометрий : слизистая оболочка матки.
Эстроген : женский гормон, вырабатываемый яичниками.
Гормональная терапия : Лечение, при котором эстроген и часто прогестин используются для облегчения симптомов, которые могут возникнуть во время менопаузы.
Гормоны : Вещества, вырабатываемые в организме для контроля функций клеток или органов.
Гистерэктомия : Операция по удалению матки.
Гистероскопия : процедура, при которой телескоп с подсветкой вводится в матку через шейку матки для осмотра внутренней части матки или выполнения операции.
Внутриматочная спираль (ВМС) : Небольшое устройство, которое вставляется и оставляется внутри матки для предотвращения беременности.
Менопауза : время, когда менструальный цикл женщины прекращается навсегда. Менопауза подтверждается после 1 года отсутствия менструации.
Менструальный цикл : ежемесячный процесс изменений, которые происходят, чтобы подготовить организм женщины к возможной беременности. Менструальный цикл определяется как первый день менструального кровотечения одного цикла до первого дня менструального кровотечения следующего цикла.
Менструальный цикл : ежемесячное выделение крови и тканей из матки.
Менструация : ежемесячное выделение крови и тканей из матки, которое происходит, когда женщина не беременна.
Ожирение : Состояние, характеризующееся чрезмерным содержанием жира в организме.
Врач акушер-гинеколог (акушер-гинеколог) : Врач со специальной подготовкой и образованием в области женского здоровья.
Яичники : Органы женщин, которые содержат яйцеклетки, необходимые для беременности, и вырабатывают важные гормоны, такие как эстроген, прогестерон и тестостерон.
Овуляция : время, когда яичник выпускает яйцеклетку.
Перименопауза : Период времени, предшествующий менопаузе.
Синдром поликистозных яичников (СПКЯ) : заболевание, которое приводит к гормональному дисбалансу, влияющему на месячные менструальные циклы женщины, овуляцию, способность забеременеть и обмен веществ.
Прогестерон : женский гормон, который вырабатывается в яичниках и подготавливает слизистую оболочку матки к беременности.
Прогестин : синтетическая форма прогестерона, аналогичная гормону, вырабатываемому организмом естественным путем.
Тамоксифен : препарат, блокирующий эстроген, иногда используемый для лечения рака груди.
Трансвагинальное ультразвуковое исследование : Тип ультразвукового исследования, при котором устройство вводится во влагалище.
Матка : мышечный орган женского таза. Во время беременности этот орган удерживает и питает плод.Также называется маткой.
Влагалище : трубчатая структура, окруженная мускулами. Влагалище выходит из матки наружу тела.
Неудача физиологической трансформации и атероз спиральной артерии: их роль в преэклампсии
Физиологическая трансформация с ремоделированием маточно-плацентарных спиральных артерий является ключом к успешной плацентации и нормальной функции плаценты. Это сложный процесс, который включает, но не ограничивается сложными взаимодействиями между материнскими децидуальными иммунными клетками и инвазивными трофобластами в стенке матки.При нормальной беременности гладкомышечные клетки средней артериальной оболочки маточно-плацентарных спиральных артерий замещаются вторгающимися трофобластами и фибриноидами, а диаметр артерии увеличивается в 5-10 раз. Плохое ремоделирование маточно-плацентарных спиральных артерий связано с преэклампсией с ранним началом и рядом других основных акушерских синдромов, включая задержку роста плода, отслойку плаценты и спонтанный преждевременный разрыв плодных оболочек. Внезапные эндогландулярные и эндовенозные инвазии трофобластов были недавно предложены как потенциальные факторы, способствующие возникновению этих синдромов.Обобщены общепризнанные нарушенные вневорсинчатые инвазии спиральных артерий матери при преэклампсии, а также кратко представлены новые концепции нарушенных вневорсинчатых эндогландулярных и эндовенозных инвазий трофобластов.
Острый атероз — это пенистое клеточное поражение маточно-плацентарных спиральных артерий, связанное с плохим ремоделированием. Он имеет некоторые морфологические особенности с ранними стадиями атеросклероза, но недавно было обнаружено несколько молекулярных различий между этими поражениями.Острый атероз наиболее распространен на границе раздела матери и плода, на концах спиральных артерий. Локализация острого атероза ниже плохо ремоделированных артерий предполагает, что изменения кровотока могут вызвать воспаление и развитие пенистых клеток. Острый атероз в пределах decidua basalis, однако, не ограничивается неотремонтированными участками спиральных артерий или гипертоническими расстройствами во время беременности и может даже присутствовать при некоторых клинически протекающих беременностях. Учитывая, что пенистые клетки атеросклеротических поражений, как известно, возникают из гладкомышечных клеток или макрофагов, активируемых несколькими типами воспалительной стимуляции, мы предположили, что множественные формы воспаления децидуальных сосудов могут вызывать острый атероз с плохим ремоделированием и / или преэклампсией или без него.Кроме того, мы предполагаем, что острый атероз может развиваться на разных сроках беременности, в зависимости от типа и степени воспалительного инсульта.
В этом обзоре обобщены современные знания о дефектах ремоделирования спиральных артерий и остром атерозе при преэклампсии. Будут представлены некоторые противоречия, включая глубину инвазии эндоваскулярных и интерстициальных трофобластов, концепцию двухэтапной инвазии трофобластов и вопрос о том, является ли замена эндотелия материнской спиральной артерии эндоваскулярными трофобластами плода постоянной.Мы обсудим роль острого атероза в патофизиологии преэклампсии и корреляты краткосрочного и долгосрочного здоровья. Наконец, мы предлагаем будущие возможности для исследования этого интригующего маточно-плацентарного взаимодействия между матерью и плодом.
Судьба оплодотворенного яйца: почему некоторые эмбрионы не приживаются
Некоторые эмбрионы не могут имплантироваться в матку, в то время как другие успешно имплантируются, что приводит к беременности, и новое исследование проливает свет на то, почему это так.
В ходе исследования исследователи обнаружили, что человеческие эмбрионы обычно вырабатывают химическое вещество, называемое трипсином, которое сигнализирует матке о необходимости подготовить внутреннюю оболочку к имплантации.
Но у эмбрионов со значительными генетическими аномалиями этот химический сигнал был изменен, и он вызвал стрессовую реакцию в матке, которая могла сделать имплантацию маловероятной, говорят исследователи. [9 условий, которые может вызвать беременность]
Исследователи сравнили этот процесс с «вступительным экзаменом», который задает матка — эмбрион должен пройти этот тест для имплантации.
Но иногда матка может сделать этот экзамен слишком трудным или слишком легким, что может привести к отторжению здоровых эмбрионов или имплантации эмбрионов с проблемами развития, говорят исследователи.
Новые результаты могут иметь значение для лечения бесплодия, поскольку одна из основных причин неудач таких методов лечения бесплодия, как экстракорпоральное оплодотворение (ЭКО), заключается в том, что эмбрионы не приживаются.
Благодаря будущим исследованиям факторов, влияющих на имплантацию, возможно, удастся выявить женщин с риском выкидыша или других осложнений беременности, взяв образец слизистой оболочки матки, сказал Ян Бросенс, профессор Университета Уорвика в США. Королевство.
Некоторые лекарства могут также помочь матке подготовить почву для имплантации, сказал Бросенс.
«Сейчас мы смотрим на то, как изменить слизистую оболочку матки, чтобы можно было настроить этот« вступительный экзамен »на нужном уровне и предотвратить неудачи имплантации и выкидыши», — сказал Бросенс.
Человеческие эмбрионы генетически разнообразны, и некоторые из них имеют мутации, нарушающие нормальное развитие. В некоторых случаях эти поврежденные эмбрионы не имплантируются в матку, но часто они имплантируются только для последующего выкидыша.
В исследовании использовались человеческие эмбрионы четырехдневного возраста, созданные с помощью ЭКО.Некоторые из эмбрионов позже были имплантированы женщинам и привели к успешной беременности, в то время как другие не подходили для имплантации из-за нарушений развития. В обоих случаях исследователи взяли часть жидкости, в которой росли эмбрионы, и перенесли ее в лабораторные чашки, содержащие клетки слизистой оболочки матки, для проведения своих экспериментов.


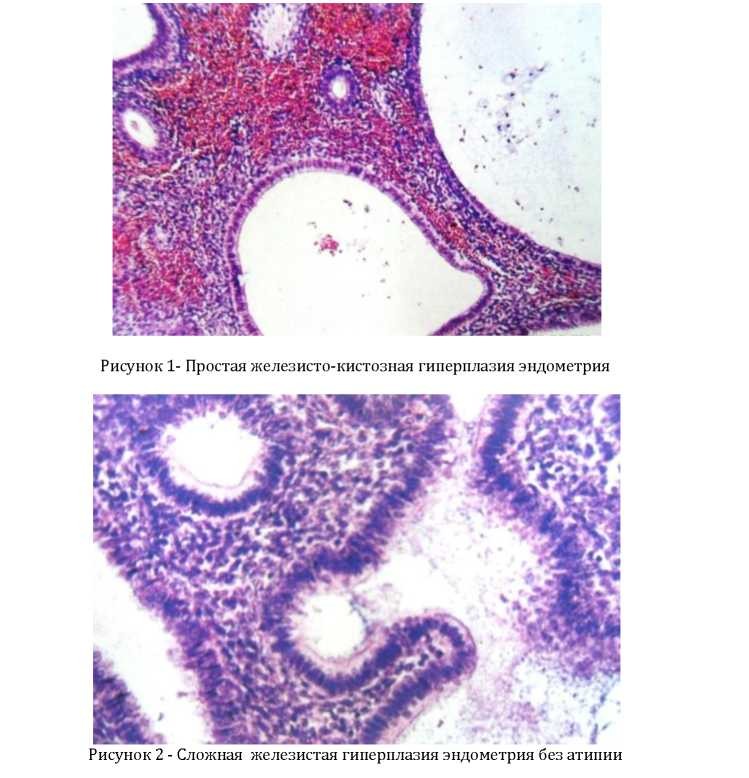 Полип эндометрия является патологической структурой в полости матки, препятствующий имплантации эмбриона. Иногда образование полипа эндометрия происходит без на то явных причин. В этом случае образование полипа эндометрия обусловлено наличием патологического рецепторного аппарата, извращенно воспринимающего нормальный уровень женских половых гормонов. При выявленном полипе эндометрия у женщин, планирующих беременность, оперативное лечение должно выполняться строго с помощью гистерорезектоскопии. Гистерорезектоскопия – метод оперативного лечения внутриматочной патологии с использованием электрической петли. Только выполнение гистерезектоскопии у пациенток репродуктивного возраста позволяет избежать рецидива полипа эндометрия и вернуться к вопросам планирования беременности через 2 месяца. При гистерорезектоскопии выполняется обработка ножки полипа высокочастотной энергией, что позволяет предотвратить рецидив полипа эндометрия ввиду выполнения под визуальным контролем с большим увеличением.
Полип эндометрия является патологической структурой в полости матки, препятствующий имплантации эмбриона. Иногда образование полипа эндометрия происходит без на то явных причин. В этом случае образование полипа эндометрия обусловлено наличием патологического рецепторного аппарата, извращенно воспринимающего нормальный уровень женских половых гормонов. При выявленном полипе эндометрия у женщин, планирующих беременность, оперативное лечение должно выполняться строго с помощью гистерорезектоскопии. Гистерорезектоскопия – метод оперативного лечения внутриматочной патологии с использованием электрической петли. Только выполнение гистерезектоскопии у пациенток репродуктивного возраста позволяет избежать рецидива полипа эндометрия и вернуться к вопросам планирования беременности через 2 месяца. При гистерорезектоскопии выполняется обработка ножки полипа высокочастотной энергией, что позволяет предотвратить рецидив полипа эндометрия ввиду выполнения под визуальным контролем с большим увеличением. Выполнение удаления полипа путем выскабливания полости матки у женщин, планирующих беременность, недопустимо, так как это приводит к лишней травматизации здорового эндометрия вокруг полипа с развитием бесплодия и невынашивания беременности.
Выполнение удаления полипа путем выскабливания полости матки у женщин, планирующих беременность, недопустимо, так как это приводит к лишней травматизации здорового эндометрия вокруг полипа с развитием бесплодия и невынашивания беременности.

 С целью коррекции эндометрита до зачатия рекомендуется наряду с антибактериальной и противовоспалительной терапией провести гормональное и физиотерапевтическое лечение.
С целью коррекции эндометрита до зачатия рекомендуется наряду с антибактериальной и противовоспалительной терапией провести гормональное и физиотерапевтическое лечение.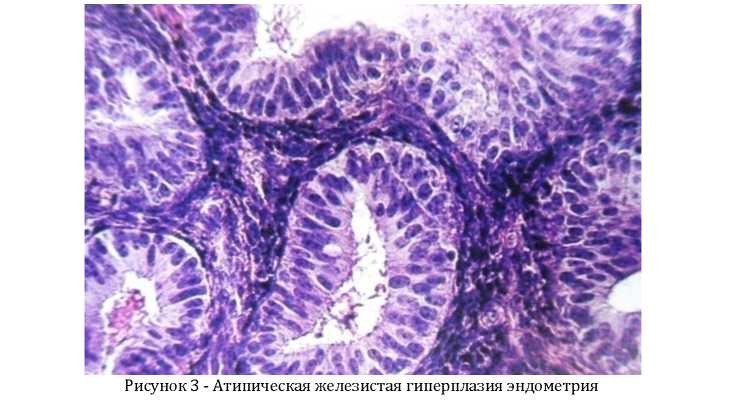
 Планирование беременности после рассечения полной или неполной внутриматочной перегородки должно осуществляться строго через 6 месяцев.
Планирование беременности после рассечения полной или неполной внутриматочной перегородки должно осуществляться строго через 6 месяцев.

