Сдать посев мокроты и трахеобронхиальных смывов на микрофлору с чуствительностью к антибиотикам
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: КОЕ/тампон.
Трактовка результатов исследования «Посев мокроты и трахеобронхиальных смывов на микрофлору с определением чувствительности к антимикробным препаратам и микроскопией мазка»
Форма выдачи результатов
Результат содержит информацию о наличии или отсутствии роста этиологически значимых микроорганизмов, в т. ч. дрожжевых грибов, их количестве, родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий и условно-патогенных микроорганизмов в диагностическом титре проводят определение чувствительности к обычному спектру антимикробных препаратов.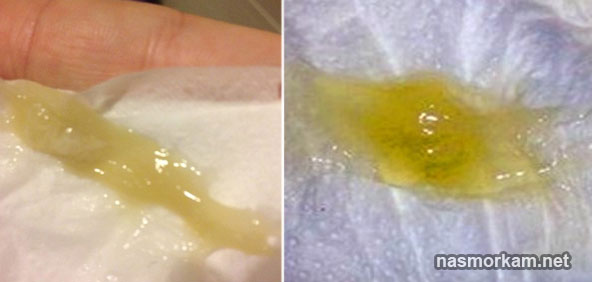
Мокрота, проходя через верхние дыхательные пути и полость рта, может контаминироваться вегетирующей в них микрофлорой. Это могут быть зеленящие стрептококки (Streptococcus viridans group), стафилококки (Staphylococcus еpidermidis), непатогенные нейссерии (Neisseria spр.), непатогенные дифтероиды (Corynebacterium sрp.), Lactobacillus spр., Candida spр. и некоторые другие. В это случае на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к сопутствующей флоре; определение чувствительности к антимикробным препаратам не проводится. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено».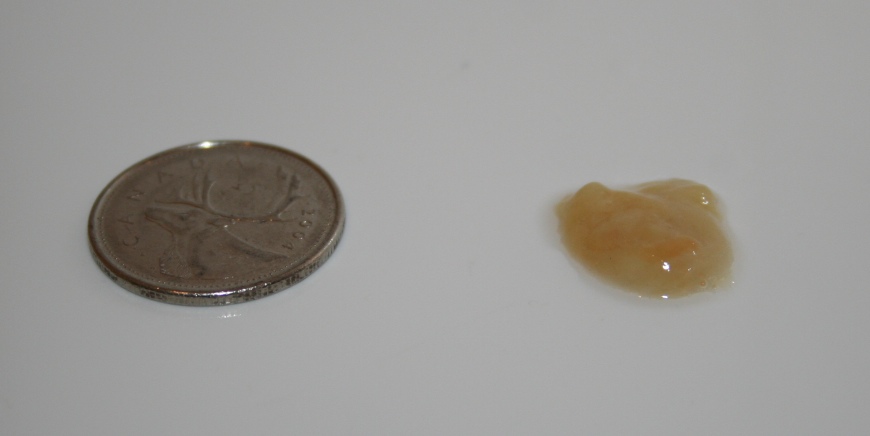
Интерпретация
Ключевыми возбудителями внебольничной пневмонии (ВП) остаются Streptococcus pneumoniae и Haemophilus influenzae.
У пациентов, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ), возрастает этиологическая роль Staphylococcus aureus, энтеробактерий, неферментирующих грамотрицатльных бактерий.
Говоря об этиологии обострения хронических обструктивных болезней легких (хронический бронхит, бронхоэктатическая болезнь), эксперты обращают внимание на тот факт, что в данной клинической ситуации структура возбудителей в значительной степени коррелирует с имеющимися у пациента нарушениями вентиляционной функции легких.
Наличие бронхоэктазов, особенно в сочетании с нарушением вентиляционной функции легких, предшествующий прием антимикробных препаратов ассоциируются с колонизацией бронхиального дерева Pseudomonas aeruginosa.
В неадекватно взятом материале, в основном представленном слюной, при посеве вырастают сапрофитные или условно-патогенные бактерии в низком титре, при микроскопическом исследовании – эпителиальные клетки в умеренном количестве (более 25 в поле зрения), лейкоциты менее 10 в поле зрения (при увеличении х 100). Выделение зеленящих стрептококков, энтерококков или грибов Candida из мокроты позволяет однозначно исключить их этиологическую значимость в развитии инфекции.
Отсутствие роста этиологически значимых бактерий при наличии клинических проявлений инфекции может служить показанием для проведения дополнительных исследований, направленных на обнаружение респираторных вирусов, легионеллы, микоплазмы, хламидий. Часто даже при тщательно выполненных исследованиях этиологию большого числа ИНДП установить не удается.
Часто даже при тщательно выполненных исследованиях этиологию большого числа ИНДП установить не удается.
При полном отсутствии роста исследование рекомендуется повторить, т. к. материал, возможно, был неадекватно собран или собран на фоне приема антибиотиков.
Methodology for Sputum Induction and Laboratory Processing
Горяева
Типичное изображение будет показано в Рисунок 1
Рисунок 1 : Горяева рисунок (A) жизнь не-плоскоклеточный, (B) мертвый плоскоклеточный клеток и (C) плоскоклеточный клеток.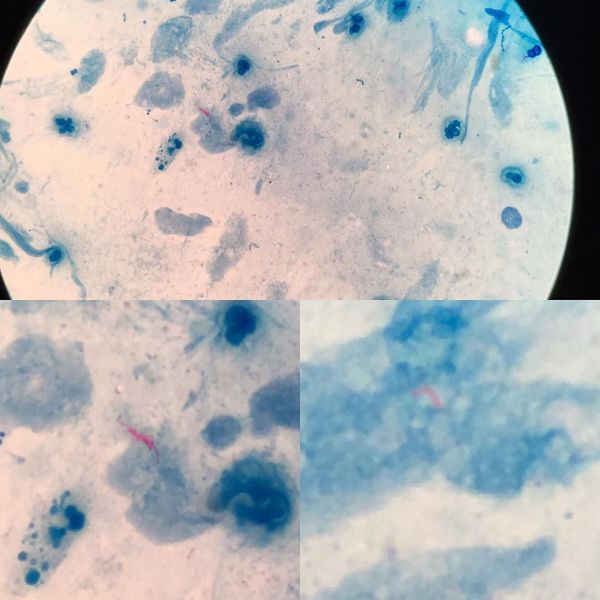 Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Cytospin слайд: на рисунке 2 показан образ представителя cytospin слайд, полученных после обработки мокроты. Различных типов клеток (нейтрофилов, эозинофилов, макрофагов, лимфоцитов и клеток эпителия) могут быть продифференцированы посредством их морфологии и окраской. В некоторых случаях загрязнение плоскоклеточный клетки могут быть важными и, если процент плоскоклеточный клеток больше, чем 80%, образец считается неудачным ( рис. 3).
Рисунок 2 : Cytospin слайд рисунок (A) нейтрофилов, (B) макрофагов, (C) eosinophil, (D) лимфоцитов и (E) эпителиальных клеток. Шкалы бар = 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 : Пример cytospin слайд низкого качества с > 80% плоскоклеточный клеток. Шкалы бар = 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Показатель успеха
В нашем отделе успешность процедуры (сочетания успешных индукции и читается cytospin), основанные на выборке из 1129 больных (здоровых испытуемых, астматики или ХОБЛ), 82% (924/1129). В суб-анализ в зависимости от типа пациентов успех ставка составляет 75% (57/76) в здоровых испытуемых, 82% (827/1004) астматиков и 82% (40/49) у больных ХОБЛ.
Результаты в здоровых испытуемых
Ретроспективный анализ ряда 289 здоровых испытуемых из нашего отдела, медиана (межквартильный диапазон) мокроты вес был 3.72 g (межквартильный диапазон 2.46 g — 5.54 g) и средний всего не-плоскоклеточный фото/g мокроты был 0.59 x6 (10) межквартильный диапазон 0,37 x 106 — 1,29 х 106).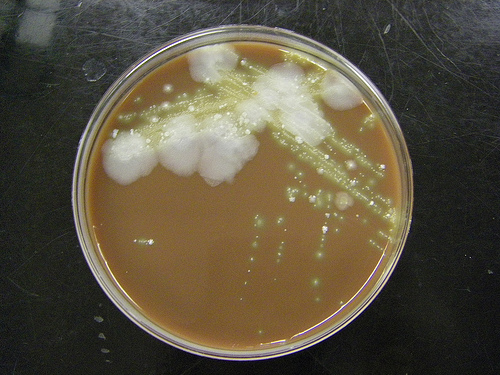
В этих здоровых испытуемых низка доля плоскоклеточный клеток на 19% (10% — 34) и жизнеспособность на 66% (54-78%). Что касается доли различных типов клеток результаты резюмируются в рисунке 4A. Мы можем наблюдать, что процент макрофагов (49% [31-68%]) является выше, чем процент нейтрофилов (34% [14% — 60%]), а процент лимфоцитов (2% [1-3]), эозинофилов (0% [0% — 0%]) и эпителиальных клеток (4% [2-11%]) является низким. Эти результаты схожи, когда данные выражены в абсолютных величинах (рис. 4В).
Рисунок 4 : Представитель результаты подсчета дифференциальной клеток наблюдается в здоровых испытуемых выражены в процентах (A) или (B) абсолютные значения. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 5: Корреляция между возрастом и мокроты нейтрофилов процент. Была рассчитана корреляции Спирмена тест. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 6: Эволюция нейтрофилов процент согласно возрастная категория.
 Множественные сравнения были сделаны с Данн множественные сравнения теста. P значения представлены следующим образом: * p < 0,05, ** p < 0.01, и *** p < 0,001. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Множественные сравнения были сделаны с Данн множественные сравнения теста. P значения представлены следующим образом: * p < 0,05, ** p < 0.01, и *** p < 0,001. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.Результаты у пациентов, страдающих от заболеваний органов дыхания
Метод индуцированной мокроты обычно используется для оценки профиля воспалительных клеток у больных астмой.Этот метод может применяться также для пациентов, страдающих от ХОБЛ, другой воспалительных заболеваний дыхательных путей. При сравнении здоровых испытуемых, астматиков и больных ХОБЛ (3 группы, сопоставляемой по возрасту, полу и табака привычки), мы наблюдали, что профиль воспалительных клеток отличается между этими когорты (
Рисунок 7 : Мокроты воспалительных клеток профиль здоровых испытуемых (n = 45), астматическим пациентов (n = 108) и больных ХОБЛ (n = 54). Три группы были сопоставимы по полу, возрасту и табака привычки. P значения ANOVA были < 0,05, < 0,0001, и < 0.0001 для сравнения нейтрофилов, эозинофилов и макрофагов между группами, соответственно. Множественные сравнения были сделаны с Данн множественные сравнения теста. P значения представлены следующим образом: * p < 0,05 и *** p < 0,001. Результаты представлены как медиана (межквартильный диапазон). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Устройство для удаления мокроты из легких CoughAssist E70
Откашливатель Philips CoughAssistE70 – это инновационный аппарат для очищения дыхательных путей и легких у пациентов, которые не могут откашливаться самостоятельно.
Особенности- Устройство для удаления мокроты из легких CoughAssist E70 имитирует естественный кашель.
 Сначала аппарат вдувает большой объем воздуха в легкие, как при обычном вдохе (с положительным давлением), а затем быстро меняет поток воздуха на обратный (отрицательное давление) для удаления мокроты из бронхов. Чередование давления в дыхательных путях позволяет эффективно выводить мокроту из верхних и нижних отделов дыхательных путей.
Сначала аппарат вдувает большой объем воздуха в легкие, как при обычном вдохе (с положительным давлением), а затем быстро меняет поток воздуха на обратный (отрицательное давление) для удаления мокроты из бронхов. Чередование давления в дыхательных путях позволяет эффективно выводить мокроту из верхних и нижних отделов дыхательных путей. - Аппарат CoughAssist E70 очищает дыхательные пути щадящим неинвазивным способом с использованием лицевой маски, мундштука или адаптера, соединяющего устройство с эндотрахиальной или трахеотомической трубкой. Неинвазивный способ очищения уменьшает дискомфорт и риск развития инфекционных осложнений по сравнению с инвазивной трахеальной аспирацией, использующей аспирационный катетер.
- Согласно клиническим данным, использование устройства CoughAssist Е70 повышает пиковую скорость кашля и снижает частоту рецидивирующих респираторных инфекций у пациентов.
- Лечение можно проводить в ручном и в автоматическом режимах. В ручном режиме кашлевый цикл запускается ручным переключателем вдоха-выдоха или педалью, в автоматическом – на основе усилия вдоха или заданного времени.
 В автоматическом режиме доступна функция Cough-Trak, позволяющая контролировать начало фазы вдоха. Функция Cough-Trak в аппарате CoughAssist E70 определяет готовность к вдоху у пациента и создает в этот момент заданное давление. Кроме того, для повышения эффективности удаления секрета аппарат CoughAssist E70 оснащен функцией осцилляции воздушного потока.
В автоматическом режиме доступна функция Cough-Trak, позволяющая контролировать начало фазы вдоха. Функция Cough-Trak в аппарате CoughAssist E70 определяет готовность к вдоху у пациента и создает в этот момент заданное давление. Кроме того, для повышения эффективности удаления секрета аппарат CoughAssist E70 оснащен функцией осцилляции воздушного потока. - Откашливатель CoughAssist E70 можно использовать в медицинских учреждениях и дома. Перед использованием в домашних условиях необходимо настроить нужный режим терапии в условиях медицинской организации. Аппарат позволяет заранее задать до трех шаблонов лечения.
- Устройство CoughAssist E70 может применяться либо с лицевой маской, либо с загубником, а также с адаптером для эндотрахеальной или трахеостомической трубки пациента.
- Интуитивно понятный пользовательский интерфейс обеспечивает простоту использования устройства. Цифровой дисплей и кнопочное управление легко позволяют устанавливать настройки, что повышает эффективность лечения и создает комфортные условия для пациента.
 Чтобы избежать случайной замены параметров во время проведения терапии, можно включить блокировку настроек.
Чтобы избежать случайной замены параметров во время проведения терапии, можно включить блокировку настроек. - Питание аппарата CoughAssist E70 может осуществляться от сети и аккумулятора, что обеспечивает дополнительную мобильность пациентам и возможность использования откашливателя в различных условиях. Заряда аккумуляторной батареи хватает на проведение четырех сеансов лечения без подзарядки.
- Для проведения терапии в ручном режиме можно использовать ножную педаль управления (опция). Это создает дополнительные удобства для проведения процедур, т.к. ножная педаль позволяет работать с устройством без участия рук.
- Откашливатель CoughAssist E70 может быть установлен на специальную передвижную стойку, которая позволяет легко перемещать устройство. На стойке можно установить устройство CoughAssist в комбинации с аппаратами НИВЛ. Компактные размеры и небольшой вес позволяют легко переносить устройство.
- Аппарат имеет возможность регистрации данных проводимой терапии для последующего анализа и коррекции.
 Средства управления данными помогают регулировать параметры лечения в зависимости от развития заболевания, тем самым повышая эффективность лечения.
Средства управления данными помогают регулировать параметры лечения в зависимости от развития заболевания, тем самым повышая эффективность лечения. - Для повышения эффективности лечения пациенты и врачи могут просматривать такие данные, как дыхательный объем, максимальная скорость выдоха при кашле и др. Программное обеспечение позволяет усовершенствовать систему клинической отчетности и повысить эффективность анализа, отображая и систематизируя клинические данные и параметры терапии.
- Длительное наблюдение обеспечивается благодаря записи данных терапии на SD-карту. Для полного анализа результатов лечения поддерживается совместимость с программами EncorePro 2 и DirectView.
- Сумка обеспечивает удобство при транспортировке. Сумку для CoughAssist E70 можно носить на плече или закрепить на кресле-каталке. Также в нее можно положить дополнительную батарею, контур и иные принадлежности.
- Аппарат без аккумулятора
- SD-карта
- Контур пациента 1,8 м большого размера
- Сумка для переноски
- Шнур питания
- Воздушный фильтр
- Держатель контура
Дополнительные опции:
- Кабель для подключения пульсоксиметра
- Ножная педаль управления
- Передвижная стойка
- Сумка для переноски
- Улавливатель жидкости
- Съемный аккумулятор
- Держатель контура
- Контур пациента (грудные дети)
- Контур пациента (дети младшего возраста)
- Контур пациента (малый размер)
- Контур пациента (средний размер)
- Контур пациента (большой размер)
- Контур пациента (трахеотомический
- Контур пациента (мундштук)
| Автоматический режим | Ручной режим |
Шаблон настройки |
| 1, 2, 3 |
Cough-Trak | ВКЛ/ОТКЛ |
|
Давление при вдохе | от 0 до 70 см h3O, с шагом 1 см h3O | |
Скорость вдоха | низкая/средняя/высокая | |
Длительность вдоха | от 0 до 5 секунд, с шагом 0,1 с | — |
Давление при выдохе | от 0 до —70 см h3O, с шагом 1 см h3O | |
Длительность выдоха | от 0 до 5 секунд, с шагом 0,1 с | — |
Длительность паузы | от 0 до 5 секунд, с шагом 0,1 с (только при отключенной функции Cough-Trak) | — |
Осцилляция | ОТКЛ/Вдох/Выдох/Обе фазы | |
Частота | от 1 до 20 Гц, с шагом 1 Гц только при включенной функции осцилляции | |
Амплитуда | от 1 до 10 см h3O, с шагом 1 см h3O только при включенной функции осцилляции | |
Источник питания переменного тока | 100—240 В, 50/60 Гц | |
Источник питания постоянного тока | 12 В | |
Размеры, см | 23,1 (В) x 29,2 (Ш) x 19 (Г) | |
Масса | 3,8 кг (4,3 кг с аккумулятором) | |
Простая гимнастика поможет восстановить легкие — Российская газета
Даже те, кто болел коронавирусом легко, говорят, что заболевание не из тех, что «как рукой снимает»: даже после выздоровления долго держатся слабость, одышка, остаточный кашель. В минздраве только что выпустили рекомендации по реабилитации больных COVID-19.
В минздраве только что выпустили рекомендации по реабилитации больных COVID-19.
Без дыхательной гимнастики тут не обойтись. Авторы документа говорят: заниматься нужно не менее 3-4 раз в неделю (а лучше, конечно, каждый день), начать с 10-15 минут, постепенно увеличивая нагрузку.
Даже при плохом самочувствии дыхательные и простые физические упражнения можно выполнять прямо в постели, лежа. Кстати, в документе написано, что после окончания лечения нужно соблюдать изоляцию еще 14 дней — самое время заняться собой. Минздрав рекомендует поликлиникам проводить занятия дистанционно — с помощью телемедицины. Но если ваша не настолько продвинута, в интернете можно найти записи дыхательных практик. А некоторые ресурсы по подписке проводят онлайн-занятия.
Согласно документу для окончательного выздоровления пациенты могут быть отправлены в санаторий, если это предусмотрено в региональных дорожных картах по лечению COVID-инфекции. Но и тут можно действовать самим: свежий воздух, прогулки где-нибудь в сосновом лесу или, если удастся, поездка к морю всегда на пользу.
В рекомендациях минздрава есть комплексы лечебной гимнастики для пациентов с разным уровнем состояния. Упражнений несколько десятков. Мы выбрали для примера несколько простых и универсальных.
Как заниматься дома
На что обратить внимание, восстанавливаясь после COVID-19, «РГ — Неделе» рассказала наш постоянный эксперт, врач-пульмонолог Пироговского центра (КДЦ Арбатский) Ольга Богуш.
— Сейчас уже ясно, что даже при легком течении заболевания многим не удается избежать осложнений. У некоторых наблюдается фиброз — поражение легких, когда нормальная ткань замещается соединительной. В легком, по сути, возникают рубцы. В результате уменьшается дыхательная поверхность легких. Если поражены небольшие участки, человек этого не замечает. Но если фиброз более выражен, возникает одышка.
Заниматься физическим восстановлением нужно обязательно. Прежде всего это дыхательная гимнастика — упражнения, направленные на восстановление дыхательной мускулатуры, укрепление мышц, которые отвечают за вдох и выдох.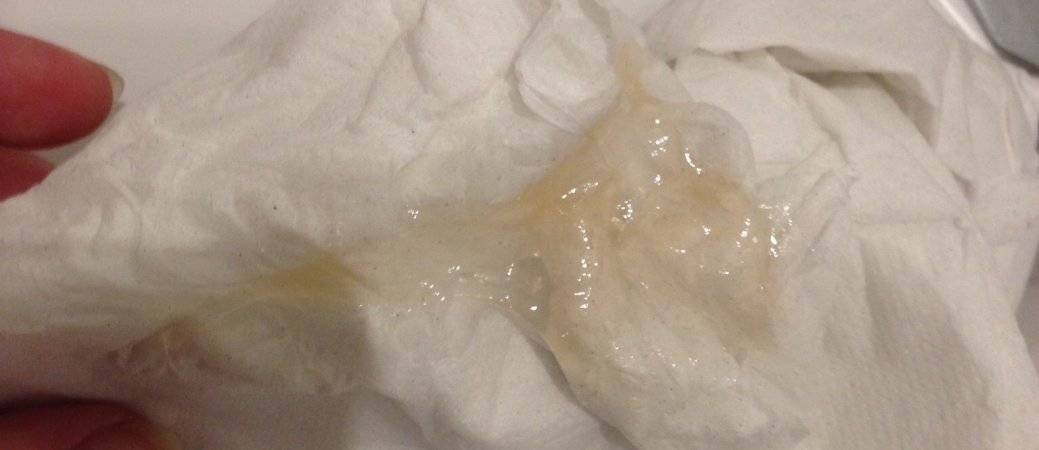 Важно задействовать нижние отделы легких, которые в обычной жизни для дыхания почти не используются. На это, например, направлены йоговские практики.
Важно задействовать нижние отделы легких, которые в обычной жизни для дыхания почти не используются. На это, например, направлены йоговские практики.
Пока сохраняется слабость, заниматься можно лежа в постели
Многие мои пациенты, которые сейчас приходят ко мне на консультацию, занимаются по методике Бутейко — это особое «поверхностное» дыхание, при котором идет накопление углекислого газе в организме. Говорят, что им помогает. Но все же постковидным пациентам я прежде всего рекомендую «парадоксальную» гимнастику, которую много лет назад разработала Александра Стрельникова.
Эти упражнения хорошо работают при астме, других хронических заболеваниях легких. В рекомендациях минздрава, кстати, указано, что можно практиковать йоговское дыхание — и диафрагмальное, и так называемое полное. По способу выполнения эти дыхательные практики отличаются, но на состоянии легких хорошо сказываются и та и другая.
Важный момент: ограничиваться только дыхательными упражнениями не стоит, надо обязательно добавлять физическую нагрузку. Пока сохраняется сильная слабость, можно, лежа в постели, делать совсем простые вещи: надувать шарики, медленно выдыхать через тонкую трубочку в воду. Есть специальные дыхательные тренажеры — они полезные, хотя и довольно дорогие. Думаю, вполне можно обойтись и подручными средствами.
Пока сохраняется сильная слабость, можно, лежа в постели, делать совсем простые вещи: надувать шарики, медленно выдыхать через тонкую трубочку в воду. Есть специальные дыхательные тренажеры — они полезные, хотя и довольно дорогие. Думаю, вполне можно обойтись и подручными средствами.
Когда физическое состояние позволит вставать, добавляем гимнастику. Если дома есть тренажер — шаговая дорожка или велосипед, используем их для увеличения аэробной нагрузки. Если нет, не страшно. Обычная энергичная ходьба, махи руками, наклоны туловища и другие элементарные упражнения помогут восстановиться быстрее.
Если есть возможность, занимайтесь на свежем воздухе. Самое простое и безопасное — ходьба в бодром темпе, можно подключить палки (скандинавская ходьба), использовать велосипед.
Иногда пациенты сами затягивают процесс восстановления. Например, у них сохраняется остаточный кашель, и они делают ингаляции с муколитиками — лазолваном или каким-то другим аналогичным препаратом. Этого без назначения врача делать не надо. Ингаляции для увлажнения дыхательных путей полезны — с минеральной водой, физраствором. Но если добавлять муколитики, это будет провоцировать кашель.
Ингаляции для увлажнения дыхательных путей полезны — с минеральной водой, физраствором. Но если добавлять муколитики, это будет провоцировать кашель.
Хочу предупредить: если неприятные симптомы со временем не проходят — усиливается одышка, ухудшается самочувствие, кашель приобретает другой характер, к нему присоединяются хрипы, например, не надо лечиться самостоятельно, нужно обратиться к врачу и обследоваться.
Кроме гимнастики также хорошо выполнять вибрационный массаж. Это несложно: легко постучите себя ладонями по груди, животу и попросите кого-нибудь также прохлопать несколько минут по спине. Это помогает очистить дыхательные пути от слизи, работает как профилактика застойных явлений в легких.
Наконец, важный совет: я всем своим пациентам, в том числе и старшего возраста, рекомендую обязательно привиться не только от гриппа, но и против пневмококка. Такая прививка защитит от вторичной бактериальной пневмонии. Кстати, из примерно 40 моих пациентов с хроническими заболеваниями легких, которые были в этом сезоне привиты от пневмококка, коронавирусом заразился только один и переболел довольно легко.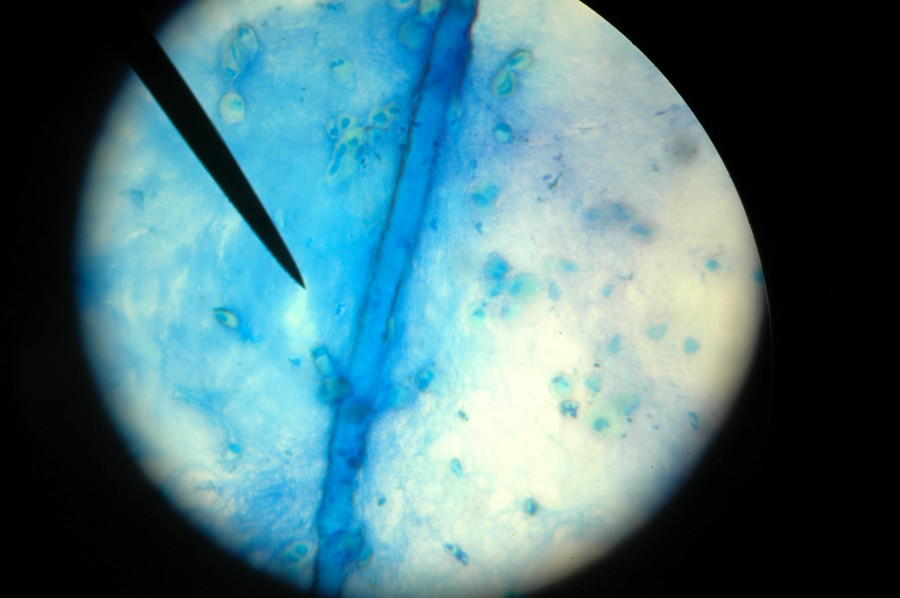 Так что, возможно, эта прививка, стимулируя иммунитет, помогает защититься и от коронавируса.
Так что, возможно, эта прививка, стимулируя иммунитет, помогает защититься и от коронавируса.
Подробности
Методические рекомендации по реабилитации для больных COVID на сайте Минздрава предназначены прежде всего для врачей, но в конце документа приведено несколько полных комплексов лечебной и дыхательной гимнастики — взять их на вооружение может любой человек.
Инфографика «РГ» / Антон Переплетчиков / Ирина Невинная
какие анализы сдавать. Цена в CMD
Пневмоцистоз – широко распространенная оппортунистическая инфекция, вызываемая внеклеточным паразитическим дрожжеподобным грибом Pneumocystis jirovecii (старое название – Pneumocystis carinii, Pneumocystis carinii forma especialis Spanish hominis). P.jirovecii (carinii), обладает выраженным тропизмом к легочной ткани, поражая при этом пневмоциты первого и второго порядков. Цикл развития представлен двумя фазами: половой и бесполой. Различают три основные морфологические формы P. jirovecii (carinii): трофозоит, циста, спорозоит.
jirovecii (carinii): трофозоит, циста, спорозоит.
Основной путь передачи P.jirovecii воздушно-капельный. Описаны единичные случаи трансплацентарной передачи пневмоцист. Факторы передачи: мокрота, слизь верхних дыхательных путей. Входными воротами инфекции являются дыхательные пути. P.jirovecii (carinii) может неопределенное время находиться на эпителии зева, дыхательных путей больных и здоровых носителей. Более 10% здорового населения являются носителями пневмоцист.
Инкубационный период заболевания составляет от 8–10 дней до 2–5 недель, в ряде случаев определить его невозможно, т.к. при иммунодефицитных состояниях оно развивается при реактивации латентной инфекции (человек может быть заражен еще в раннем детстве). Инфекция, вызванная Р.jirovecii, при дефиците гуморального и клеточного иммунитета характеризуется манифестным течением. Рецидивы пневмоцистной пневмонии отмечаются у 10% детей и взрослых с иммунодефицитами, при СПИДе – у 25–30% при отсутствии вторичной профилактики.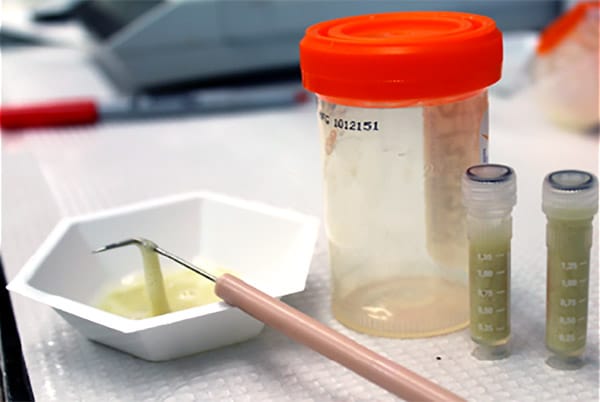 Пневмоцистоз – ведущая опппортунистическая инфекция. Пневмоцистная пневмония является частым осложнением у больных гемобластозами (49,0%), реже у больных солидными опухолями (4,0%). Применение иммуносупрессивной терапии у реципиентов при трансплантации органов также может привести к развитию пневмоцитоза.
Пневмоцистоз – ведущая опппортунистическая инфекция. Пневмоцистная пневмония является частым осложнением у больных гемобластозами (49,0%), реже у больных солидными опухолями (4,0%). Применение иммуносупрессивной терапии у реципиентов при трансплантации органов также может привести к развитию пневмоцитоза.
У здоровых людей пневмоцистоз – достаточно редкое заболевание. У детей раннего возраста болезнь протекает как классическая интерстициальная пневмония с четким соответствием стадиям патологического процесса. Пневмоцистоз у детей может протекать также под маской острого ларингита, обструктивного бронхита или бронхиолита. На фоне грубого нарушения клеточного иммунитета пневмоцистоз может проявляться не только поражением легких, но и надпочечников, щитовидной железы, печени, селезенки, ЖКТ, сердца, кожи, а также могут развиться отиты, мастоидиты и гаймориты пневмоцистной этиологии.
Патогномоничных симптомов при пневмоцистной пневмонии нет, но триада клинических симптомов – сухой кашель, субфебрильная температура и постепенно нарастающая одышка при физической нагрузке – характерна особенно при развитии болезни у ослабленных детей.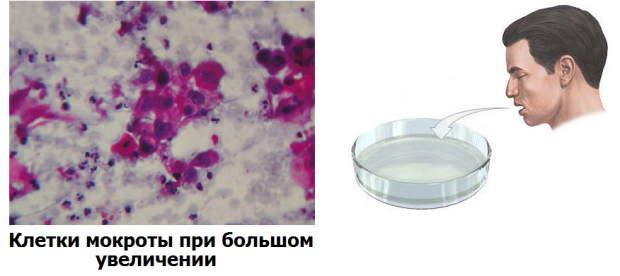 У детей до года заболевание может протекать не только как интерстициальная пневмония, но и в виде ларингита, обструктивного бронхита или бронхиолита, у детей старше года – как астматический бронхит. При развитии отека легких возможен летальный исход заболевания в результате острой дыхательной недостаточности, связанной с резким нарушением вентиляции легких и газообмена. При длительном рецидивирующем течении (при неадекватной терапии) у больных с выраженным иммунодефицитным состоянием возможно развитие полостей в легких. Любые диагностические и лечебные манипуляции в разгар болезни (получение индуцированной мокроты, бронхоскопия, установка подключичного катетера и пр.) и даже изменение положения тела больного могут привести к спонтанному пневмотораксу. Никогда не бывает плеврита (за исключением сочетания пневмоцистоза с туберкулезным процессом). В большинстве случаев при пневмоцистозе рентгенологическая картина не имеет характерных особенностей и характеризуется как двустороннее симметричное поражение интерстиция легких (описана как «завуалированные», «ватные» легкие»).
У детей до года заболевание может протекать не только как интерстициальная пневмония, но и в виде ларингита, обструктивного бронхита или бронхиолита, у детей старше года – как астматический бронхит. При развитии отека легких возможен летальный исход заболевания в результате острой дыхательной недостаточности, связанной с резким нарушением вентиляции легких и газообмена. При длительном рецидивирующем течении (при неадекватной терапии) у больных с выраженным иммунодефицитным состоянием возможно развитие полостей в легких. Любые диагностические и лечебные манипуляции в разгар болезни (получение индуцированной мокроты, бронхоскопия, установка подключичного катетера и пр.) и даже изменение положения тела больного могут привести к спонтанному пневмотораксу. Никогда не бывает плеврита (за исключением сочетания пневмоцистоза с туберкулезным процессом). В большинстве случаев при пневмоцистозе рентгенологическая картина не имеет характерных особенностей и характеризуется как двустороннее симметричное поражение интерстиция легких (описана как «завуалированные», «ватные» легкие»). Достаточно часто у больных ВИЧ-инфекцией при физикальном и рентгенологическом обследовании не выявляют никаких изменений, несмотря на прогрессирующую легочную недостаточность.
Достаточно часто у больных ВИЧ-инфекцией при физикальном и рентгенологическом обследовании не выявляют никаких изменений, несмотря на прогрессирующую легочную недостаточность.
Показания к обследованию. Наличие выраженной легочной патологии у лиц следующих категорий:
- пациенты с иммунодефицитом различной природы;
- дети: недоношенные, ослабленные новорожденные, раннего возраста с гипогаммаглобулинемией, гипотрофией и рахитом;
- дети из домов ребенка;
- пожилые люди из домов престарелых;
- больные лейкозом, онкологические больные, реципиенты органов, получающие иммунодепрессанты;
- больные туберкулезом;
- больные ЦМВИ;
- больные ВИЧ-инфекцией на поздних стадиях болезни, имеющие признаки дыхательной недостаточности;
- больные, длительно получающие стероидную терапию;
- пациенты с лучевой болезнью.
Дифференциальная диагностика. В случае интерстециальных изменений в легких: туберкулез, микоплазменная инфекция, ЦМВИ, токсоплазмоз, гистоплазмоз, криптоспоридиоз (с поражением легких), фиброзирующий альвеолит.
В случае интерстециальных изменений в легких: туберкулез, микоплазменная инфекция, ЦМВИ, токсоплазмоз, гистоплазмоз, криптоспоридиоз (с поражением легких), фиброзирующий альвеолит.
Материал для исследования
- Мокрота, индуцированная мокрота, БАЛ, биоптаты легочной ткани, аспираты из трахеи, смывы и мазки из ротоглотки – микроскопические исследования, выявление ДНК, выявление АГ;
- сыворотка крови – определение АТ.
Этиологическая лабораторная диагностика включает визуальное выявление возбудителя при использовании микроскопии, обнаружение его АГ или ДНК, определение специфических АТ к P.jirovecii (carinii).
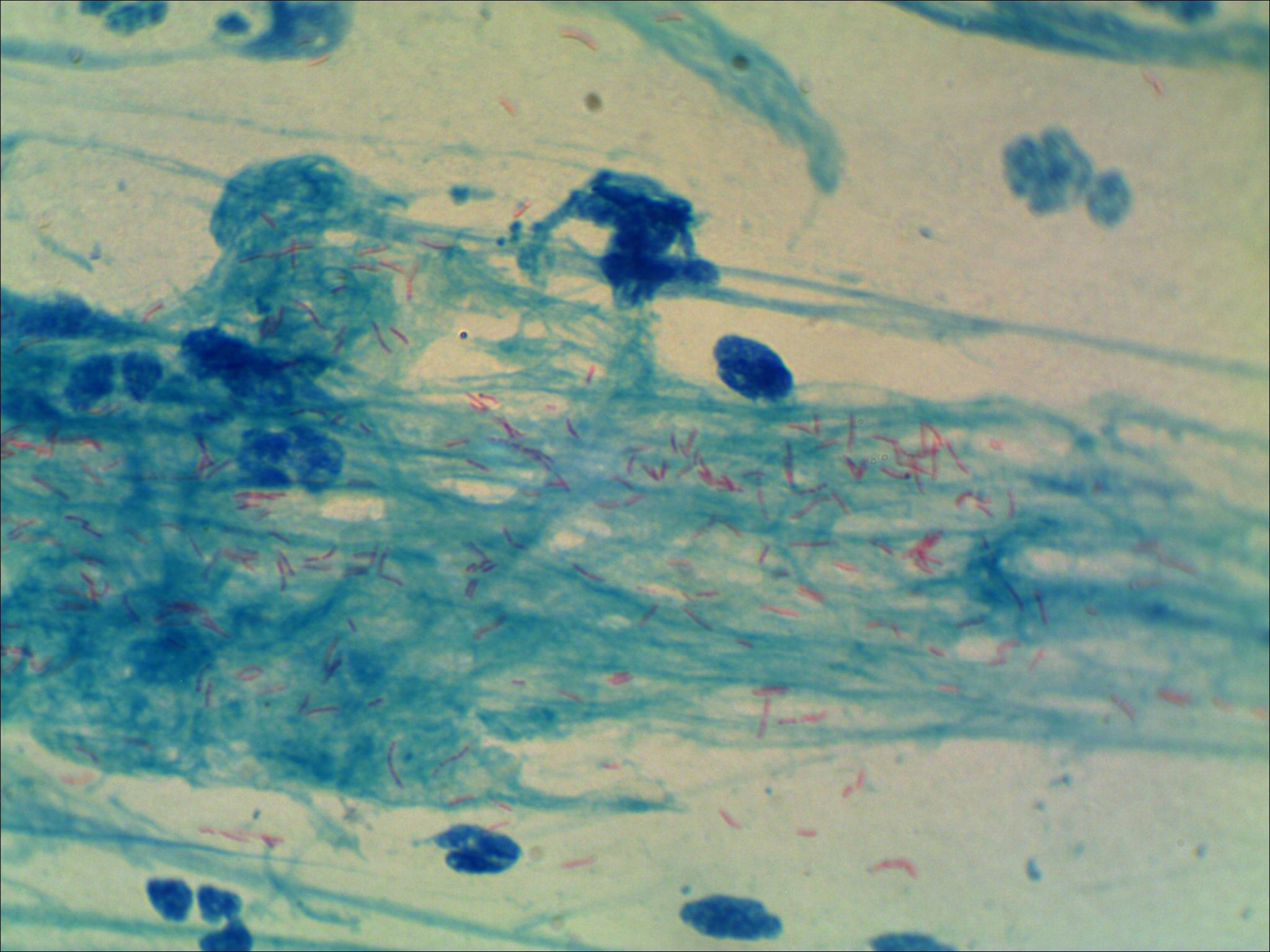
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований и интерпретация их результатов. Наиболее часто используемым в рутинной лабораторной диагностике пневмоцистной пневмонии является микроскопическое исследование окрашенных мазков, мазков-отпечатков препаратов различного биологического материала: мокрота, индуцированная мокрота, БАЛ, биоптаты, у детей раннего возраста – аспираты из трахеи, смывы и мазки из ротоглотки. Выбор метода окрашивания и типа исследуемого биологического материала во многом влияет на достоверность результатов анализа.
Выбор метода окрашивания и типа исследуемого биологического материала во многом влияет на достоверность результатов анализа.
При окрашивании соответствующих препаратов с целью выявления P.jirovecii (carinii) используют классические методы, подразделяемые на две группы. Первая группа методов позволяет дифференцировать внутреннюю структуру клетки без окрашивания оболочки (окраска по Романовскому, по Граму и др.). Такое окрашивание предназначено для проведения скринингового исследования, требующего дополнительной верификации. При использовании второй группы методов (импрегнация метенамин-серебряным нитратом по Гомори, окраска толуидиновым синим и др.) визуализируется клеточная стенка возбудителя без определения внутренней структуры. Наиболее универсальным способом окрашивания препаратов биологического материала, позволяющим выявлять все морфологические формы пневмоцист, является окраска по Романовскому–Гимзе.
Диагностическая чувствительность микроскопического исследования индуцированной мокроты составляет (в зависимости от способа окрашивания) 80–90%. К несомненным достоинствам процедуры получения образца относятся: отсутствие необходимости проведения инвазивных медицинских манипуляций, легкость выполнения и низкая себестоимость. Однако при выборе данного вида биологического материала следует учитывать, что эффективность выявления P.jirovecii (carinii) в индуцированной мокроте у больных, неинфицированных ВИЧ, значительнее ниже, чем у пациентов с ВИЧ–инфекцией. При отрицательном результате тестирования препаратов индуцированной мокроты рекомендуют исследование БАЛ, диагностическая чувствительность возрастает при исследовании двустороннего БАЛ по сравнению с односторонним. Комплексное исследование трансбронхиального биоптата и БАЛ позволяет обнаружить пневмоцисты практически в 100% случаев. При исследовании трансбронхиального биоптата (содержащего не менее 25 неповрежденных альвеол), полученного при проведении фибробронхоскопии, диагностическая чувствительность составляет 66–98%. У пациентов, которым противопоказано проведение трансбронхиальной биопсии при прогрессирующем течении заболевания, возможно получение исследуемого материала с помощью чрезкожной интраторакальной аспирации.
К несомненным достоинствам процедуры получения образца относятся: отсутствие необходимости проведения инвазивных медицинских манипуляций, легкость выполнения и низкая себестоимость. Однако при выборе данного вида биологического материала следует учитывать, что эффективность выявления P.jirovecii (carinii) в индуцированной мокроте у больных, неинфицированных ВИЧ, значительнее ниже, чем у пациентов с ВИЧ–инфекцией. При отрицательном результате тестирования препаратов индуцированной мокроты рекомендуют исследование БАЛ, диагностическая чувствительность возрастает при исследовании двустороннего БАЛ по сравнению с односторонним. Комплексное исследование трансбронхиального биоптата и БАЛ позволяет обнаружить пневмоцисты практически в 100% случаев. При исследовании трансбронхиального биоптата (содержащего не менее 25 неповрежденных альвеол), полученного при проведении фибробронхоскопии, диагностическая чувствительность составляет 66–98%. У пациентов, которым противопоказано проведение трансбронхиальной биопсии при прогрессирующем течении заболевания, возможно получение исследуемого материала с помощью чрезкожной интраторакальной аспирации. Метод открытой биопсии легкого дает наилучшие (100%) результаты, но применяется в крайне редких случаях, когда невозможно установить диагноз другим способом.
Метод открытой биопсии легкого дает наилучшие (100%) результаты, но применяется в крайне редких случаях, когда невозможно установить диагноз другим способом.
Выявление АГ P.jirovecii (carinii) с использованием метода РИФ (РНИФ) проводят в мазках различного биологического материала: мокрота, индуцированная мокрота, БАЛ, биоптаты; у детей раннего возраста – аспираты из ротоглотки и трахеи, смывы и мазки из ротоглотки.
Диагностическая чувствительность выявления ДНК P.jirovecii (carinii) методом ПЦР при исследовании образцов индуцированной мокроты у пациентов с лабораторно подтвержденной пневмоцистной пневмонией составляет 100%. Однако обнаружение ДНК возбудителя в мокроте и даже в БАЛ не является однозначным доказательством болезни, а может свидетельствовать о носительстве. Наиболее перспективным при диагностике пневмоцистоза представляется определение концентрации ДНК P.jirovecii (carinii) в образцах мокроты, индуцированной мокроты, БАЛ, биоптатах, аспиратах из трахеи, смывах и мазках из ротоглотки.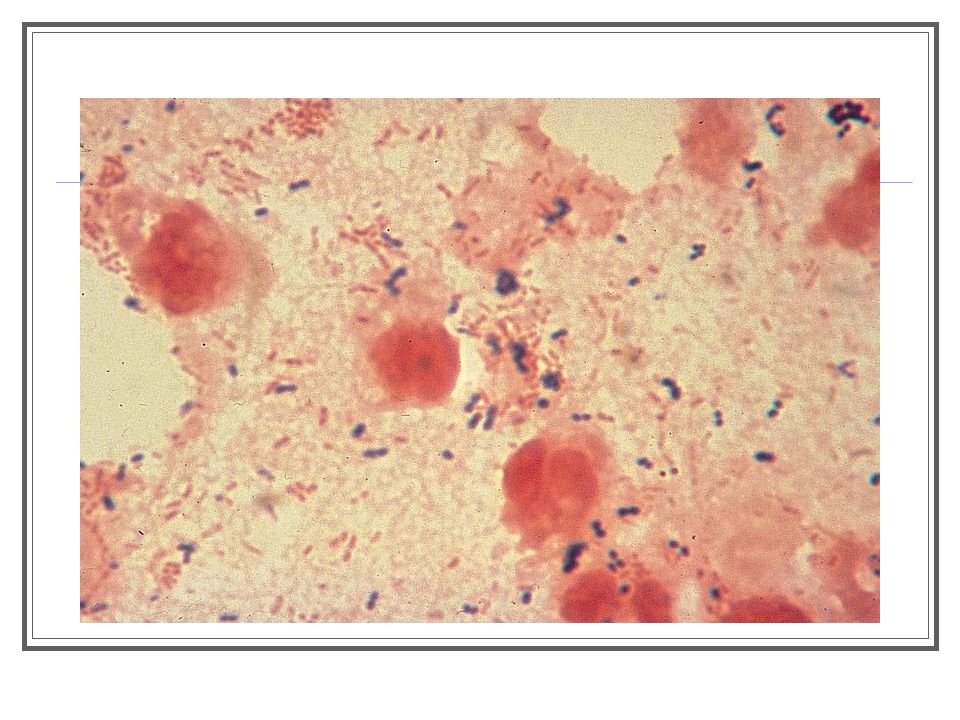
Выявление специфических АТ IgG и IgM к P.jirovecii (carinii) в крови играет значительную роль в диагностике пневмоцистоза, особенно при эпидемиологических исследованиях, оценке течения латентной инфекции или невозможности проведения лабораторных исследований других видов биологического материала. Для определения АТ IgG и IgM к P.jirovecii (carinii) используют методы РНИФ и ИФА. Определение АТ необходимо проводить в динамике, для исследования отбирают образцы крови, взятые с интервалом 14 дней. У больных с иммунодефицитами определение АТ не информативно.
Особенности интерпретации результатов лабораторных исследований. Результаты лабораторных исследований должны быть сопоставлены с клиническими данными. При выраженных клинических проявлениях легочной патологии обнаружение P.jirovecii (carinii) ее АГ или ДНК в биологическом материале из респираторного тракта (БАЛ, мокрота, индуцированная мокрота, аспират трахеи, биоптаты легочной ткани) является лабораторным подтверждением диагноза “пневмоцистоз”.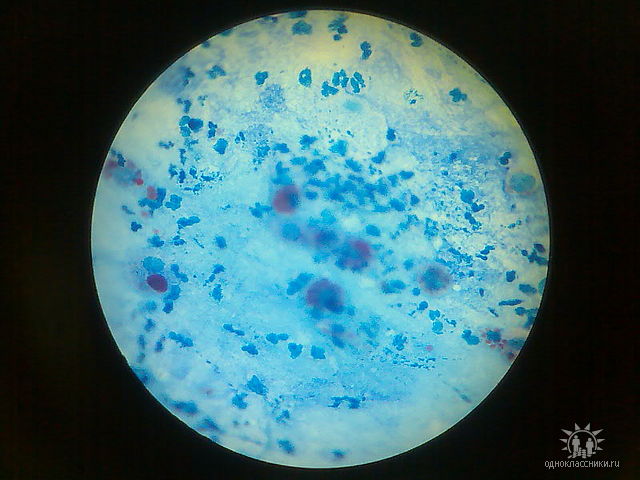
Выявление 4-х кратного нарастания титра/уровня АТ IgG и/или выявление АТ IgM к Pneumocysti sjiroveci говорит об остром инфекционном процессе, вызванном этим возбудителем. Обнаружение только АТ IgG без увеличения уровня во втором образце указывает на наличие анамнестических АТ. Следует учитывать, что АТ IgG к АГ пневмоцисты среди здорового населения выявляют в 60–80%.
Проведение физиотерапии грудной клетки в сравнении с ее отсутствием при кистозном фиброзе (муковисцидозе)
Вопрос обзора
Мы проанализировали доказательства относительно эффекта применения физиотерапии грудной клетки в сравнении с ее (физиотерапии) отсутствием для удаления избыточной слизи из легких у людей с кистозным фиброзом (муковисцидозом).
Актуальность
Легкие у людей с кистозным фиброзом (муковисцидозом) секретируют избыточную слизь. Это приводит к повторным инфекциям и повреждению ткани легких. Важном является очистить легкие от слизи с помощью лекарств и физиотерапии грудной клетки. Физиотерапия очищает слизь различными методами или с помощью механических устройств, или с помощью совместного их использования. Ежедневная физиотерапия занимает много времени и (вызывает много) проблем, поэтому важно знать, эффективна ли она. Мы провели поиск исследований, в которых участники имели равные шансы попасть в группу с применением физиотерапии грудной клетки или в группу без (применения) физиотерапии грудной клетки. Это обновление ранее опубликованного обзора.
Физиотерапия очищает слизь различными методами или с помощью механических устройств, или с помощью совместного их использования. Ежедневная физиотерапия занимает много времени и (вызывает много) проблем, поэтому важно знать, эффективна ли она. Мы провели поиск исследований, в которых участники имели равные шансы попасть в группу с применением физиотерапии грудной клетки или в группу без (применения) физиотерапии грудной клетки. Это обновление ранее опубликованного обзора.
Дата поиска
Доказательства актуальны на 2 июня 2015.
Характеристика исследований
Мы включили восемь исследований в обзор, в котором представлены результаты в общей сложности 96 лиц с кистозным фиброзом (муковисцидозом). Все исследования были очень разными и некоторые из них рассматривали множественные методы лечения в сравнении с отсутствием лечения. Одно исследование изучало аутогенный дренаж, шесть (исследований) рассматривали обычную физиотерапию грудной клетки, три оценивали переменное положительное экспираторное давление (ПЭД), семь рассматривали ПЭД и одно рассматривало высокое ПЭД. Мы не смогли объединить результаты для их статистического анализа.
Мы не смогли объединить результаты для их статистического анализа.
Основные результаты
Обобщая результаты этих восьми исследований, мы обнаружили, что методы очистки дыхательных путей оказывают (лишь) краткосрочную пользу в вопросе удаления слизи. В трех исследованиях измеряли мокроту, выведенную при кашле и обнаружили, что люди, применявшие физиотерапию грудной клетки, вывели больше мокроты; в четырех исследованиях измеряли радиоактивный трассирующий клиренс и обнаружили увеличение клиренса при использовании физиотерапии грудной клетки. Только в одном исследовании сообщалось об улучшении функции легких в некоторых группах лечения; но остальные три исследования, которые сообщили об этом результате, не нашли какого-либо значительного эффекта от применения физиотерапии грудной клетки. В настоящее время нет четких доказательств долгосрочных эффектов очистки грудной клетки, качества жизни или выживаемости при использовании физиотерапии грудной клетки.
Качество доказательств
Большинство включенных исследований имели некоторые проблемы с построением эксперимента, которые могли повлиять на достоверность результатов.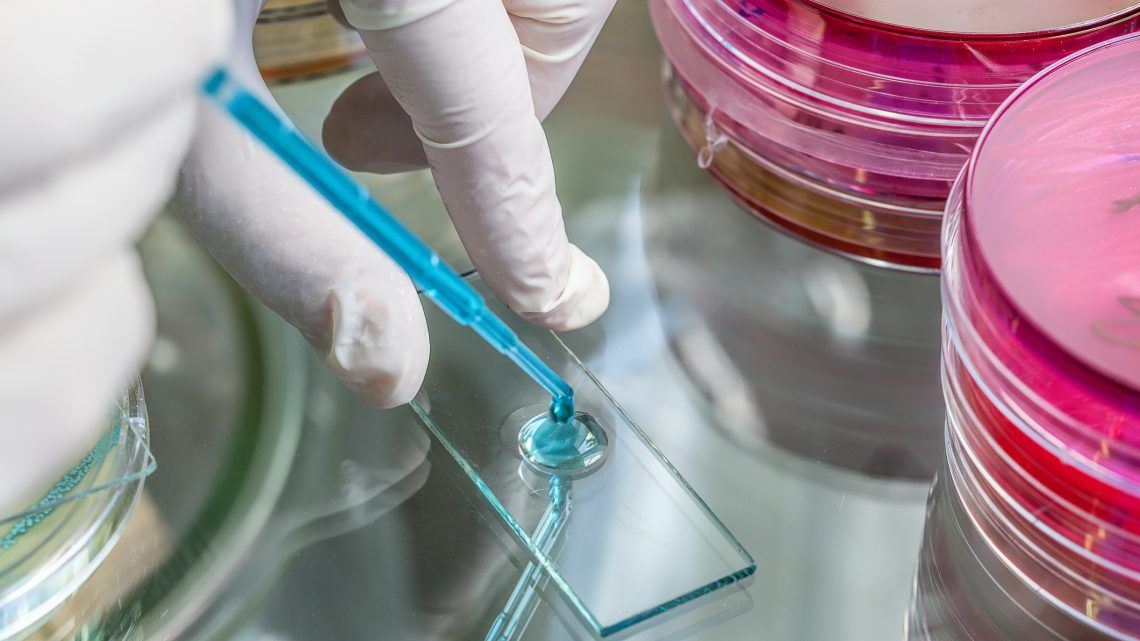 Почти в половине исследований осталось неясным, все ли результаты были опубликованы или нет.
Почти в половине исследований осталось неясным, все ли результаты были опубликованы или нет.
В физиотерапевтических исследованиях пациент и его физиотерапевт будут знать, какое лечение они получают, и это может повлиять на некоторые результаты. Половина исследований оценивали объем выведенной мокроты и (показатели) тестирования функции легких, а также спрашивали мнение человека относительно лечения, и эти результаты возможно подверглись влиянию из-за того, что пациенты были в курсе лечения. Во всех исследованиях было неясно, насколько опытным был человек в проведении лечения. Этот (аспект) может влиять на качество проводимого лечения, что (в свою очередь) могло повлиять на достоверность результатов.
Бронхоскопия
Бронхоскопия – это современное диагностическое исследование слизистых оболочек трахеи и бронхов с помощью специального оптического прибора – бронхоскопа. Это единственный метод, позволяющий непосредственно оценить внутреннюю поверхность бронхов, изучить их конфигурацию, рельеф слизистой оболочки и её сосудистый рисунок, а при обнаружении патологически измененного участка слизистой — произвести биопсию для последующего морфологического анализа. Бронхоскопия является также важнейшим и эффективным способом лечения больных с хроническими воспалительными и гнойными заболеваниями легких.
Бронхоскопия является также важнейшим и эффективным способом лечения больных с хроническими воспалительными и гнойными заболеваниями легких.
Ларингоскопия – это метод визуального исследования гортани. Специалистом осматриваются передняя и задняя части гортани, складки преддверия и истинные голосовые складки. Исследование чаще всего выполняется ЛОР-врачом при помощи гортанного зеркала (непрямая ларингоскопия) либо ригидного ларингоскопа (прямая ларингоскопия). Однако при опухолевых поражениях гортани осмотр с помощью ригидных инструментов бывает затруднён из-за ограниченных условий обзора, угрозы повреждения опухоли и кровотечения, а также из-за болевых ощущений пациента, которыми неминуемо сопровождается это исследование. В отделении эндоскопии НМИЦ онкологии им. Н.Н.Петрова для выполнения ларингоскопии и бронхоскопии применяется цифровая видеосистема Olympus EVIS Exera III с гибким видеоэндоскопом, диаметр которого составляет не более 5 мм. Это позволяет безопасно выполнить полноценный осмотр даже наиболее труднодоступных участков гортани при минимальных негативных ощущениях у пациента, а также произвести прицельную биопсию опухоли, необходимую для постановки диагноза.
Показания для проведения плановой бронхоскопии:
- Подозрение на опухоль трахеи и бронхов
- Кровохарканье
- Подозрение на наличие инородного тела в просвете дыхательных путей
- Ожоги нижних дыхательных путей
- Пневмония с затяжным течением, рецидивирующие пневмонии
- Деструктивная/аспирационная пневмония, абсцесс легкого
- Хронические заболевания бронхов и легких невыясненной причины
- Признаки диссеминированных патологических процессов на рентгене (мелких очагов, кист, полостей)
- Длительная одышка (при исключении бронхиальной астмы и сердечной недостаточности)
- Немотивированный кашель, продолжающийся свыше 1 месяца
Противопоказания к проведению исследования:
В настоящее время врачи снижают количество противопоказаний к бронхоскопии. Но при некоторых патологиях обследование может принести больше вреда, чем пользы.
- Обострение хронической обструктивной болезни легких (ХОБЛ) и бронхиальной астмы (проведение процедуры в этот момент может усилить спазм бронхов и усугубить состояние больного).

- Инфаркт миокарда и инсульт, перенесенные менее 4 недель назад (стресс и спазм сосудов и некоторая нехватка кислорода во время процедуры могут вызвать повторный случай нарушения кровообращения).
- Неконтролируемая аритмия
- Выраженные нарушения свертываемости крови (тромбоцитопения менее 20000)
- Аневризма аорты
- Психические заболевания, такие как шизофрения и эпилепсия (стресс и снижение концентрации кислорода в крови могут спровоцировать приступ судорог)
Подготовка к исследованию
- Исследование проводят строго натощак, полностью исключается прием пищи за 8-10 часов и жидкости за 4–6 часов до начала процедуры. Вечером накануне исследования (до 18:00) — лёгкий ужин. В день исследования от курения следует воздержаться.
- Отменить пероральные антикоагулянты (препараты для разжижения крови) накануне исследования, пауза п/к введения гепарина за 4-6 часов до процедуры.
- На обследование при себе необходимо иметь амбулаторную карту, результаты КТ грудной клетки или описание рентгенограммы легких, полотенце (так как после процедуры возможно непродолжительное кровохарканье).
 Если Вы страдаете бронхиальной астмой, то не забудьте ингалятор.
Если Вы страдаете бронхиальной астмой, то не забудьте ингалятор. - Во время предварительной беседы сообщите врачу об аллергии на медикаменты (особенно если есть аллергия на обезболивающие препараты) и имеющихся у Вас хронических заболеваниях (бронхиальная астма, сердечная недостаточность).
Как осуществляется исследование:
Исследование проводят в положении сидя. При этом нельзя вытягивать вперед голову и выгибать грудную клетку, чтобы аппарат не травмировал слизистую дыхательных путей. С целью местной анестезии непосредственно перед исследованием проводится обработка носовой и ротовой полости 10% Лидокаин-спреем. Он вызывает онемение неба, чувство комка в горле, легкую заложенность носа. Анестезия помогает подавить кашлевой и рвотный рефлекс. В процессе исследования анестетиком поэтапно орошается слизистая гортани, голосовых связок, трахеи и бронхов. Вопреки тревожным ожиданиям большинства пациентов, во время бронхоскопии они совершенно не чувствуют боли.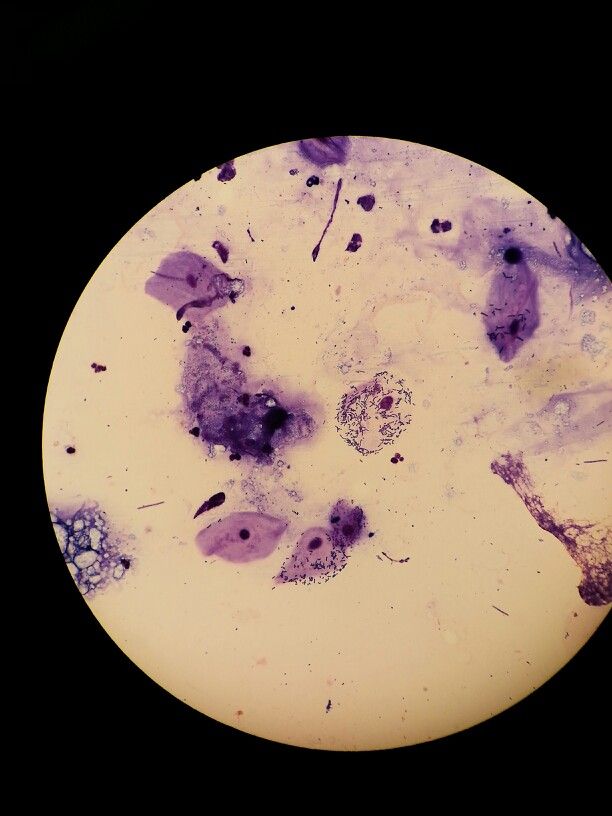
Трубка бронхоскопа имеет очень маленький диаметр, поэтому дыханию обследуемого она не мешает. Во время продвижения трубки по дыхательным путям в них может ощущаться легкое давление, но выраженного дискомфорта Вы при этом не испытываете. Чтобы снизить рвотный рефлекс в момент введения бронхоскопа, рекомендуем Вам дышать поверхностно и как можно чаще.
После процедуры чувство онемения остается на протяжении получаса. Не рекомендуется курить и принимать пищу на протяжении 2-х часов после завершения процедуры.
Процедура бронхоскопии, выполненная на современном цифровом оборудовании, сопровождается фиксацией полученного материала в виде фото– или видеозаписи, что позволяет проследить изменения состояния слизистой органов в динамике.
О результатах исследования Вам сообщит врач–эндоскопист сразу же после обследования, результаты цитологического исследования будут готовы через 3-4 дня, морфологическое заключение будет готово через 8–12 дней
Дополнительные диагностические и лечебные манипуляции во время бронхоскопии:
- Биопсия слизистой оболочки/новообразования
Важной составной частью диагностической бронхоскопии и ларингоскопии является биопсия. Она выполняется для морфологической верификации процесса и определения его распространенности по бронхиальному дереву. Взятие материала для цитологического и гистологического исследований выполняется несколькими способами, каждый из которых имеет свои показания. Наиболее часто биопсию производят с помошью биопсийных щипцов либо щетки-скарификатора (браш-биопсия). Материал помещают в одноразовый маркированный контейнер, а в случае браш-биопсии – на предметное стекло. Процедура безболезненна для пациента.
Она выполняется для морфологической верификации процесса и определения его распространенности по бронхиальному дереву. Взятие материала для цитологического и гистологического исследований выполняется несколькими способами, каждый из которых имеет свои показания. Наиболее часто биопсию производят с помошью биопсийных щипцов либо щетки-скарификатора (браш-биопсия). Материал помещают в одноразовый маркированный контейнер, а в случае браш-биопсии – на предметное стекло. Процедура безболезненна для пациента.
- Смыв со стенок бронхов
Материал для бактериологического и цитологического исследований (с целью обнаружения атипичных клеток при периферическом раке легкого, патогенной флоры при пневмониях и бронхитах, а также выявления микобактерии туберкулеза) получают со стенок и просвета бронхов. Если содержимое бронхов скудное, то в начале через канал эндоскопа в просвет бронхов вводят небольшой объем (20-40 мл) изотонического раствора натрия хлорида, а затем аспирируют раствор, смешанный с бронхиальным содержимым, в одноразовый стерильный контейнер.
- Бронхоальвеолярный лаваж
Бронхоальвеолярный лаваж представляет собой дополнительное исследование для установления характера легочного заболевания, при котором в просвет бронхов мелкого калибра вводится значительный объем изотонического раствора хлорида натрия (порядка 120-240 мл). При этом в получаемой при аспирации лаважной жидкости присутствуют клетки не только из просвета самых мелких бронхов, но и альвеол. Диагностический бронхоальвеолярный лаваж показан пациентам, у которых при рентгенографии органов грудной полости обнаружены неясные изменения в легких, а также диффузные изменения. Диффузные интерстициальные заболевания легких (саркоидоз, аллергический альвеолит, идиопатический фиброз, гистиоцитоз X, пневмокониозы, коллагенозы, облитерирующий бронхиолит) представляют наибольшую трудность для клиницистов, так как их этиология часто неизвестна.
Неясные изменения могут быть инфекционной, неинфекционной, злокачественной этиологии. Даже в тех случаях, когда лаваж не является диагностическим, по результатам его можно предположить диагноз, и тогда внимание врача будет сфокусировано на нужных дальнейших исследованиях. Например, даже в нормальной лаважной жидкости высока вероятность обнаружения различных нарушений. В дальнейшем бронхоальвеолярный лаваж потенциально используется в установлении степени активности заболевания, для определения прогноза и необходимой терапии.
Например, даже в нормальной лаважной жидкости высока вероятность обнаружения различных нарушений. В дальнейшем бронхоальвеолярный лаваж потенциально используется в установлении степени активности заболевания, для определения прогноза и необходимой терапии.
- Санация трахеобронхиального дерева
Санация трахеобронхиального дерева — это лечебная мера, позволяющая устранить скопление слизи на пораженных бронхах. Основными задачами санационной бронхоскопии являются воздействие на характер секрета слизистых желез, улучшение дренажной функции бронхов за счет удаления секрета, проведение противовоспалительной терапии. Однократные курсы лечебной санационной бронхоскопии эффективны при пневмонии, нагноившейся кисте легкого, абсцессе легкого, а при хронической обструктивной болезни легких, хроническом обструктивном бронхите, бронхоэктазах, муковисцидозе необходимо многократное курсовое лечение.
Какие могут быть осложнения?
Как правило, данное исследование хорошо переносится пациентами, но иногда возникают потеря или охриплость голоса, боль в горле, а в случае биопсии может наблюдаться кровохарканье. Эти явления носят временный характер. Вас должны насторожить длительное кровохарканье, интенсивная неослабевающая боль в груди, появление отёка на лице и вокруг шеи, тошнота и рвота, а также повышение температуры тела и озноб. При появлении указанных симптомов немедленно обратитесь к врачу.
Эти явления носят временный характер. Вас должны насторожить длительное кровохарканье, интенсивная неослабевающая боль в груди, появление отёка на лице и вокруг шеи, тошнота и рвота, а также повышение температуры тела и озноб. При появлении указанных симптомов немедленно обратитесь к врачу.
Прохождение процедур бронхоскопии и ларингоскопии в нашем центре возможно только после предварительной записи в регистрационном журнале (см. раздел Контакты), при наличии на руках результатов КТ грудной клетки или описания рентгенограммы легких.
Бронхоскопия и ларингоскопия выполняются ИСКЛЮЧИТЕЛЬНО под местной анестезией.
На амбулаторном этапе процедура выполняется на платной основе. Оплатить исследование можно в регистратуре поликлиники центра на 1-м этаже.
Направление от других специалистов для прохождения исследования не требуется.
Муковисцидоз (CF) Респираторный анализ: мокрота (для родителей)
Что это такое
Дети с муковисцидозом (МВ) часто болеют респираторными инфекциями, иногда вызванными бактериями или грибками. Скрининг или посев мокроты (слизи) из дыхательных путей при МВ помогает врачам обнаруживать и идентифицировать эти бактерии или грибки, чтобы они могли назначить наиболее эффективные антибиотики для борьбы с конкретной инфекцией.
Скрининг или посев мокроты (слизи) из дыхательных путей при МВ помогает врачам обнаруживать и идентифицировать эти бактерии или грибки, чтобы они могли назначить наиболее эффективные антибиотики для борьбы с конкретной инфекцией.
Почему это сделано
Посев мокроты может помочь выявить конкретные причины инфекций легких и дыхательных путей.Такие инфекции могут привести к кашлю с выделением желтой, зеленоватой или кровянистой мокроты, а также к лихорадке и затрудненному дыханию.
Препарат
Перед обследованием обязательно сообщите врачу, принимал ли ваш ребенок в последнее время антибиотики. Лучшее время для тестирования обычно утром, прежде чем ваш ребенок что-нибудь поел или выпил. Кроме того, убедитесь, что ваш ребенок не использует жидкость для полоскания рта перед тестом, поскольку она может содержать антибактериальные ингредиенты, которые могут повлиять на результаты.
п.
Процедура
Вашему ребенку будет предложено прополоскать рот водой, затем глубоко вдохнуть и глубоко кашлять для выделения мокроты из дыхательных путей.
Вам или медицинскому работнику, помогающему вашему ребенку, возможно, потребуется осторожно постучать по груди ребенка, чтобы разжижить мокроту в легких. Если ваш ребенок не может произвести образец, лаборанту может потребоваться использовать депрессор для языка, чтобы стимулировать кашель, или вашему ребенку может потребоваться вдохнуть раствор тумана, чтобы вызвать кашель.
Если вашему ребенку назначена бронхоскопия (тест, проводимый с помощью небольшого телескопа для оценки верхних дыхательных путей и бронхов), скорее всего, в это время будет проведен анализ мокроты.
стр. 2
Чего ожидать
Ваш ребенок может чувствовать легкий дискомфорт при глубоком вдохе или кашле. Если ваш ребенок вдохнет раствор тумана, позыв к кашлю может быть сильным. Для выделения количества мокроты, необходимого для анализа, может потребоваться несколько попыток кашля.
Получение результатов
Образец мокроты собирается в стерильный контейнер и отправляется в лабораторию. Затем образец помещается на специальную пластину, которая способствует росту определенных бактерий и грибков при наличии инфекции.
Затем образец помещается на специальную пластину, которая способствует росту определенных бактерий и грибков при наличии инфекции.
Если у вашего ребенка бактериальная инфекция, организмам может потребоваться 48 часов, чтобы вырасти. Грибкам нужна неделя или дольше. Эти организмы можно будет увидеть под микроскопом или с помощью химических тестов. Если анализы выявляют инфекцию, может потребоваться еще 1-2 дня, чтобы выбрать лучший антибиотик для ее лечения.
Риски
Кашель для получения образца мокроты может вызывать легкий дискомфорт, но эта процедура не связана с риском.
Помощь вашему ребенку
Объяснение теста языком, понятным вашему ребенку, может помочь развеять любой страх. Также убедите ребенка, что процедура не повредит.
Если у вас есть вопросы
Если у вас есть вопросы по поводу респираторного анализа мокроты, поговорите со своим врачом.
Посев мокроты — лабораторные тесты онлайн AU
Кратко
Также известен как
респираторная культура; MC&S
мокротыЗачем сдавать анализы?
Для обнаружения и определения причины бактериальных инфекций нижних дыхательных путей и пневмонии или для мониторинга эффективности лечения антибиотиками
Когда проходить тестирование?
Если у вас есть симптомы, связанные с инфекцией нижних дыхательных путей; когда вы лечились от бактериальной пневмонии
Требуется образец?
Свежий образец (выделения из глубоких дыхательных путей, а не слюна изо рта), обычно собираемый утром в стерильный контейнер.
Требуется подготовка к экзамену?
Прополоскать рот водой перед взятием крови
Что тестируется?
Посев мокроты выявляет наличие у больных бактериальной пневмонией или инфекциями нижних дыхательных путей. Выявляются патогенетические бактерии в образце мокроты и проводится тестирование на чувствительность, чтобы помочь в выборе подходящего противомикробного лечения.
Мокрота — это густая слизь или мокрота, которая выделяется из нижних дыхательных путей (бронхов и легких) при кашле; это не слюна или слюна изо рта.В процессе сбора пробы необходимо следить за тем, чтобы она поступала из нижних дыхательных путей, а не изо рта. Если образец представляет собой в основном слюну, она не будет репрезентативной для тех, кто вызывает инфекцию. Кроме того, наличие слюны и бактерий изо рта в образце мокроты затрудняет выявление потенциальных патогенных бактерий, заражающих легкие.
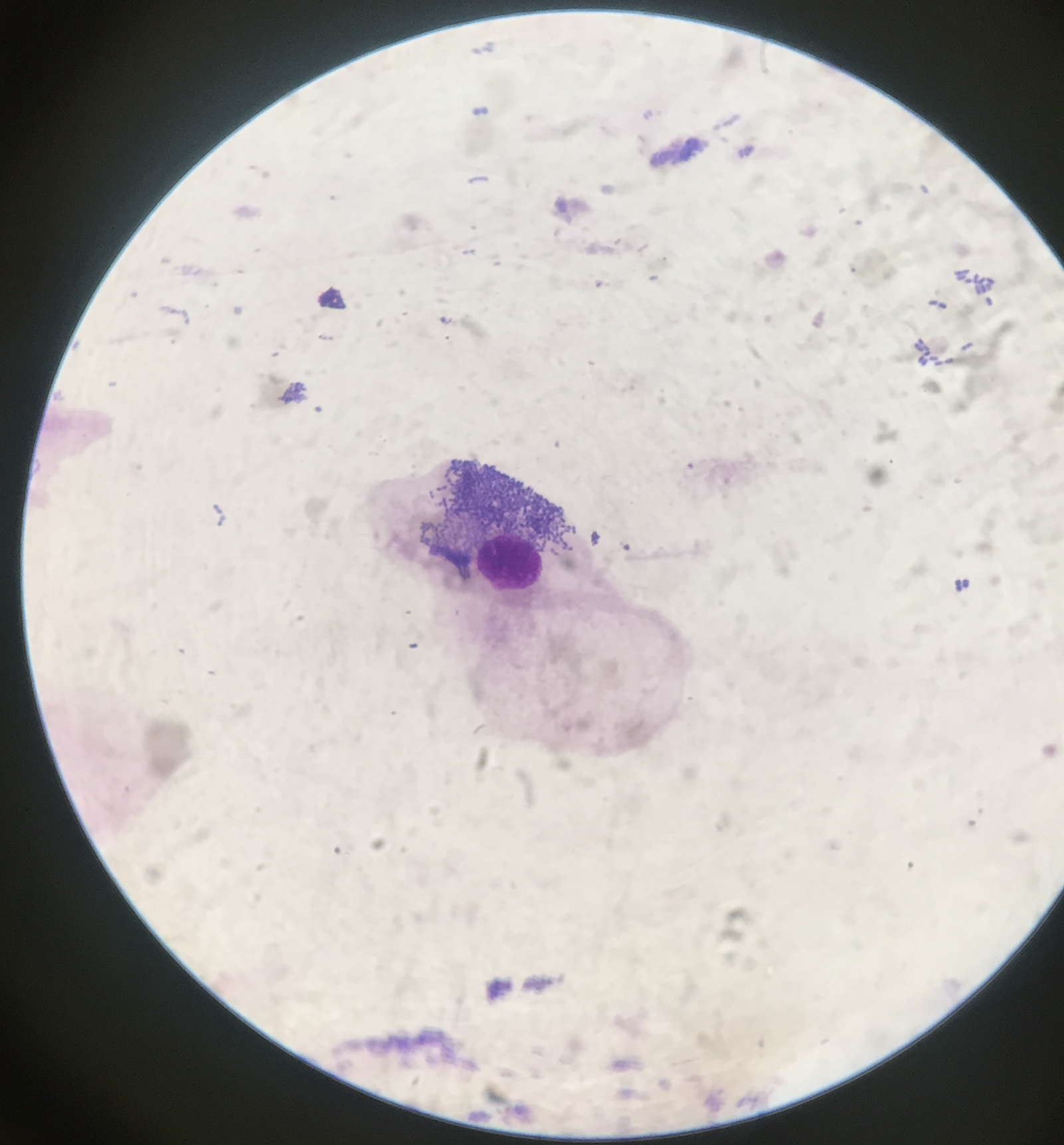
Первым шагом в анализе свежего образца мокроты является окрашивание по Граму для определения типа присутствующих бактерий и определения адекватности образца. Если образец содержит значительное количество эпителиальных (кожных) клеток, выстилающих ротовую полость, много нормальных бактерий полости рта и никаких лейкоцитов, то образец обычно не считается подходящим для культивирования, и может потребоваться повторный сбор образца. если клинически значимо. Если образец содержит большое количество лейкоцитов, указывающих на инфекцию, он считается подходящим образцом для культивирования. Окраска мокроты по Граму также может помочь в выявлении аспирационной пневмонии наряду с клиническими данными.
Если образец содержит значительное количество эпителиальных (кожных) клеток, выстилающих ротовую полость, много нормальных бактерий полости рта и никаких лейкоцитов, то образец обычно не считается подходящим для культивирования, и может потребоваться повторный сбор образца. если клинически значимо. Если образец содержит большое количество лейкоцитов, указывающих на инфекцию, он считается подходящим образцом для культивирования. Окраска мокроты по Граму также может помочь в выявлении аспирационной пневмонии наряду с клиническими данными.
После того, как образец мокроты принят, его помещают в соответствующий контейнер и инкубируют. Среда и условия окружающей среды способствуют росту бактерий, что позволяет проводить дальнейшие исследования и вдавливание. Поскольку мокрота не стерильна, культуры будут расти так же хорошо, как и любые присутствующие бактериальные патогены.
Идентификация — это пошаговый процесс, который может включать несколько биохимических тестов и наблюдение за характеристиками роста организма. Результаты посева представлены в корреляции с окраской по Граму, что помогает лаборатории определить наличие инфекции.
Результаты посева представлены в корреляции с окраской по Граму, что помогает лаборатории определить наличие инфекции.
Тесты на чувствительность к противомикробным препаратам часто выполняются для руководства лечением любых выявленных патогенов и для проверки того, будет ли патоген реагировать на определенные антибиотики. Посев мокроты, окрашивание по Граму и тестирование на чувствительность — все это вносит свой вклад в отчет, который информирует врача, какие патогены присутствуют и какая антибактериальная терапия может устранить инфекцию.
Инфекция может быть вызвана патогеном, который невозможно вырастить и идентифицировать с помощью обычного посева бактериальной мокроты, поэтому другие тесты, такие как культура кислотоустойчивых бацилл (КУБ), культура легионеллы, культура грибов или ПЦР, могут быть заказаны в дополнение к рутинной культуре или вместо нее.Если есть подозрение на необычный патоген, следует проинформировать лабораторию, чтобы обеспечить правильные посевы и / или дополнительные тесты.
Как отбирается образец для тестирования?
Образцы мокроты могут откашливаться или индуцироваться. Отхаркивающиеся образцы откашливаются и выгружаются в стерильный контейнер. Перед взятием пробы необходимо прополоскать рот человека водой или физиологическим раствором. Обычно требуется глубокий кашель, и пациента следует проинформировать о том, что необходима мокрота / слизь из легких, а не слюна.Если кто-то не может получить образец мокроты, то это часто можно вызвать путем вдыхания стерильного физиологического раствора или аэрозоля глицерина в течение нескольких минут для разжижения мокроты в легких.
Все собранные образцы должны быть незамедлительно доставлены в лабораторию для обработки, пока они еще свежие. В зависимости от лаборатории, образцы мокроты могут быть оценены и приняты лабораторией до того, как они будут обработаны для культивирования. Полезные результаты посева мокроты во многом зависят от хорошего сбора образцов. Образец, который не считается «адекватным», может быть отклонен и запрошен повторный анализ. Достаточный образец мокроты означает, что он считается репрезентативным для условий нижних дыхательных путей, то есть не сильно загрязнен слюной.
Достаточный образец мокроты означает, что он считается репрезентативным для условий нижних дыхательных путей, то есть не сильно загрязнен слюной.
Требуется ли подготовка к анализу для проверки качества образца?
Прополощите рот водой перед забором, чтобы удалить свободные клетки во рту.
: инновационный подход к усилению диагностики туберкулеза в Зимбабве
Сеть мотоциклов используется для быстрой доставки образцов мокроты из клиник для тестирования в лабораториях.
Фотография предоставлена: TB Care
«В 2003 году у меня был туберкулез с положительной мокротой, и я успешно вылечился. В начале этого года у меня был хронический кашель в течение 3 недель, и я подумал, что снова болею туберкулезом. Я отправил образец мокроты и в течение 24 часов получил результаты. К счастью, это было отрицательно. Благодаря этой системе многие пациенты с туберкулезом будут своевременно диагностированы и вылечены, прежде чем они слишком сильно заболеют ». Пациент с подозрением на туберкулез, клиника Кувадзана, г. Хараре
Пациент с подозрением на туберкулез, клиника Кувадзана, г. Хараре
Надежная и эффективная система для транспортировки образцов туберкулеза (e.g., образцы мокроты) имеет важное значение для эффективного ухода за больными туберкулезом, обеспечивая более быструю диагностику, начало лечения и последующее наблюдение за пациентом.
Несмотря на недавние улучшения в инфраструктуре туберкулезных лабораторий Зимбабве, значительная часть сельского населения живет далеко от мест, где проводится микроскопия туберкулеза. Чтобы устранить это узкое место в диагностике и лечении туберкулеза, USAID в партнерстве с существующей транспортной системой Зимбабве (Riders for Health) запустил специализированную систему транспортировки образцов туберкулеза в трех крупных городах Зимбабве, включая столицу Хараре.
В рамках этой системы водители мотоциклов ежедневно или еженедельно доставляют образцы туберкулеза из медицинских учреждений в диагностические центры и доставляют результаты лабораторных исследований в соответствующие медицинские учреждения. Благодаря этому вмешательству время, необходимое для постановки точного диагноза ТБ, сократилось с двух-трех недель до одного-двух дней в городских условиях и семи дней в отдаленных сельских районах.
Благодаря этому вмешательству время, необходимое для постановки точного диагноза ТБ, сократилось с двух-трех недель до одного-двух дней в городских условиях и семи дней в отдаленных сельских районах.
Транспортная система также вызвала новое доверие к национальной системе здравоохранения среди обслуживаемых сообществ, что необходимо для того, чтобы пациенты обращались за лечением в случае болезни.После успешного завершения этого пилотного проекта в трех городах USAID расширил услугу до 24 районов. В настоящее время система состоит из 42 мотоциклов, которые обслуживают более 40 процентов медицинских учреждений Зимбабве.
Смежные отрасли работы
Последнее обновление: 12 июля 2021 г.
Гнойная мокрота
Изображения: Ссылки по теме на внешние сайты (из Bing)
Онтология: Гнойная мокрота (C0241235)
| Концепции | Признак или симптом ( T184 ) |
| SnomedCT | 42192008 |
| Итальянский | Эспетторато гнойный |
| Английский | Мокрота гнойная, Мокрота гнойная, Мокрота гнойная, Гнойная мокрота, Гнойная мокрота (находка) |
| Японский | 膿性 痰, ノ ウ セ イ タ ン |
| Чешский | Мокрота Хнисаве |
| Венгерский | Purulens Köpet |
| Испанский | esputo purulento (hallazgo), esputo purulento, esputo purulento, excoración de esputo purulento (hallazgo), excoración de esputo purulento, esputo purulento |
| Португальский | Гнойная Expectoração |
| Голландский | мокрота гнойная |
| Французский | Ссадина гнойная |
| Немецкий | Эитриг мокроты |
Автоматическое микроскопическое обнаружение микобактерий в мокроте: доказательство концепции

ВОЗ. Глобальный доклад о туберкулезе, 2017 г. 262 (Всемирная организация здравоохранения, Женева, 2017 г.).
Forero, M. G., Cristóbal, G. & Desco, M. Автоматическая идентификация Mycobacterium tuberculosis с помощью моделей смеси Гаусса. J Microsc 223 , 120–132 (2006).
MathSciNet Статья PubMed CAS Google ученый
Zingue, D. et al. . Преимущества и недостатки методов обеззараживания мокроты для диагностики туберкулеза и противотуберкулезной лекарственной устойчивости. Ann Biol Clin 71 , 283–291 (2013).
Google ученый
Осибо, О. А., Дендере, Р., Кришнан, С. и Дуглас, Т. С. Автоматическая фокусировка в светлопольной микроскопии для обнаружения туберкулеза. J Microsc 240 , 155–163 (2010).
MathSciNet Статья PubMed PubMed Central CAS Google ученый

Абдельазиз, М. М., Бакр, В. М., Хуссиен, С. М. и Амин, А. Е. Диагностика туберкулеза легких с помощью окрашивания по Цилю-Нильсену или методов холодного окрашивания? J Ассоциация общественного здравоохранения Египта 91 , 39–43 (2016).
Артикул PubMed Google ученый
Ben-Selma, W. et al. . Быстрое обнаружение Mycobacterium tuberculosis в мокроте с помощью набора Patho-TB по сравнению с прямой микроскопией и посевом. Diagn Microbiol Infect Dis 65 , 232–235 (2009).
Артикул PubMed CAS Google ученый
Gordon, C., Van Deun, A. & Lumb, R. Оценка эффективности основного фуксина для окрашивания по Цилю-Нильсену. Int J Tuberc Lung Dis 13 , 130–135 (2009).
PubMed CAS Google ученый
Гупта, С., Прасад, В. , Бейри, И. и Муралидхаран, С. Сравнительная оценка двух методов холодного окрашивания с методом Циля-Нильсена для диагностики туберкулеза. Юго-Восточная Азия J Trop Med Public Health 40 , 765–769 (2009).
, Бейри, И. и Муралидхаран, С. Сравнительная оценка двух методов холодного окрашивания с методом Циля-Нильсена для диагностики туберкулеза. Юго-Восточная Азия J Trop Med Public Health 40 , 765–769 (2009).
PubMed Google ученый
IUATLD. Техническое руководство. Исследование мокроты на туберкулез с помощью прямой микроскопии в странах с низким уровнем доходов. Издание пятое, 32 (2000).
Садафал, П., Рао, Дж., Комсток, Г. В. и Бег, М. Ф. Методы обработки изображений для идентификации Mycobacterium tuberculosis в красителях Циля-Нильсена. Int J Tuberc Lung Dis 12 , 579–582 (2008).
PubMed PubMed Central CAS Google ученый
Марэ, Б. Дж. и др. . Использование светодиодной флуоресцентной микроскопии для обнаружения кислотоустойчивых бацилл в мокроте. Clin Infect Dis 47 , 203–207 (2008).
Артикул PubMed Google ученый
Ким, Т. К., Блэкман, Р. С., Хитвол, К. М., Ким, Т. и Рочестер, Д. Ф. Кислотостойкие бациллы в мазках мокроты пациентов с туберкулезом легких. Распространенность и значимость отрицательных мазков до лечения и положительных мазков после лечения. Am Rev Respir Dis 129 , 264–268 (1984).
PubMed CAS Google ученый
Леви, Х. и др. . Переоценка микроскопии и посева мокроты в диагностике туберкулеза легких. Сундук 95 , 1193–1197 (1989).
Артикул PubMed CAS Google ученый
Ридер, Х. Л. и др. . Национальная справочная лаборатория по туберкулезу службы общественного здравоохранения и национальная лабораторная сеть.Минимальные требования, роль и работа в стране с низким уровнем дохода. Париж, Франция.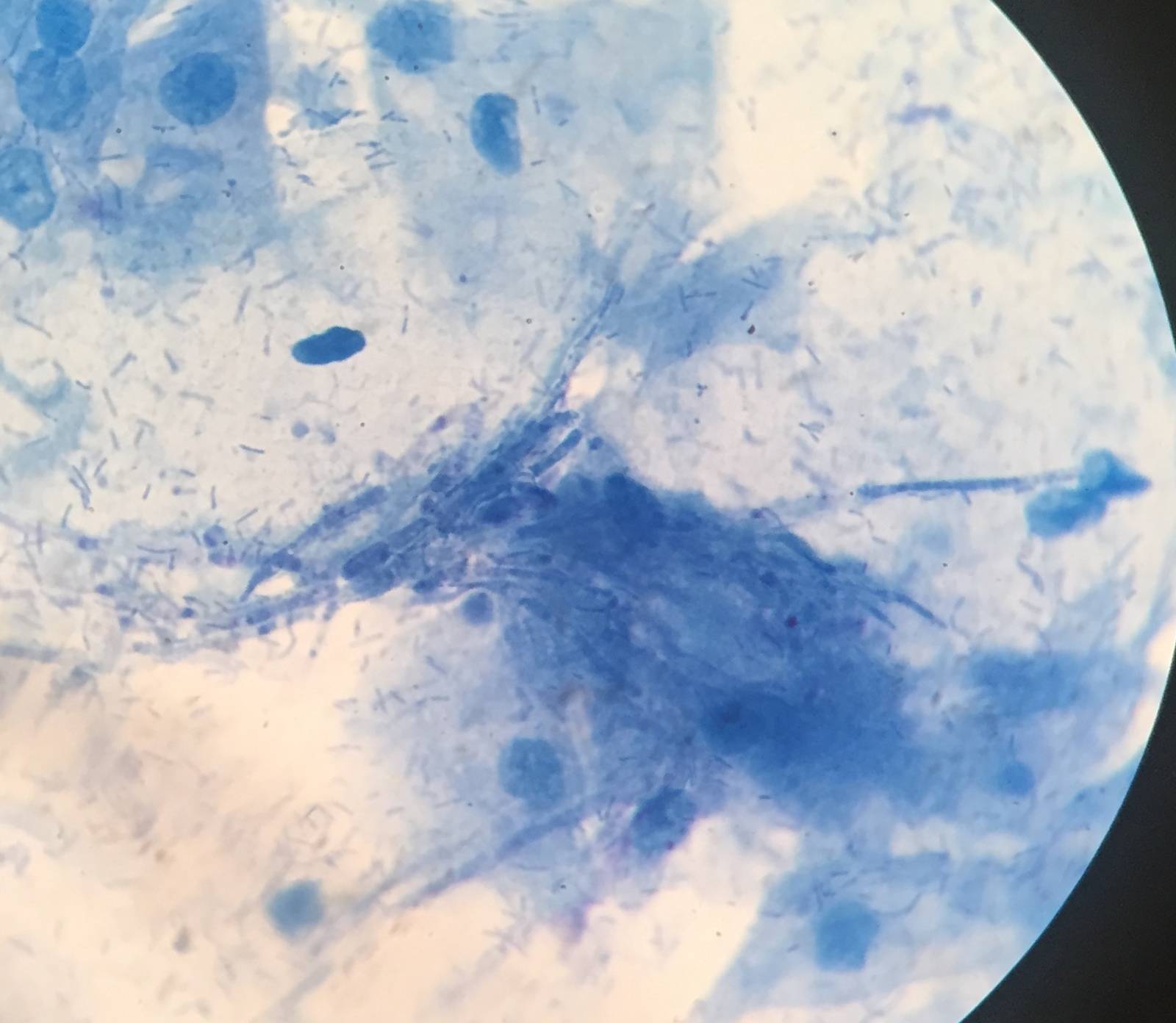 Международный союз борьбы с туберкулезом и болезнями легких (1998).
Международный союз борьбы с туберкулезом и болезнями легких (1998).
Ван Деун, А. и др. . Оптимальное выявление случаев туберкулеза с помощью прямой микроскопии мазка мокроты: насколько лучше — больше? Int J Tuberc Lung Dis 6 , 222–230 (2002).
PubMed Google ученый
ВОЗ. Флуоресцентная светодиодная (LED) микроскопия для диагностики туберкулеза: Заявление о политике WHO / HTM / TB / 2011.8 , 16 , http://apps.who.int/iris/bitstream/handle/10665/44602/9789241501613_eng.pdf?sequence=1 (2011).
Куэвас, Л. Э. и др. . Светодиодная флуоресцентная микроскопия для диагностики туберкулеза легких: кросс-секционная оценка в нескольких странах. PLoS Medicine 8 , e1001057 (2011).
Артикул PubMed PubMed Central Google ученый
Чанг, Э. У., Пейдж, А. Л. и Боннет, М. Светодиодная флуоресцентная микроскопия для диагностики туберкулеза: метаанализ. Eur Respir J 47 , 929–937 (2016).
Л. и Боннет, М. Светодиодная флуоресцентная микроскопия для диагностики туберкулеза: метаанализ. Eur Respir J 47 , 929–937 (2016).
Артикул PubMed Google ученый
Нур-Неаматоллахи, А. и др. . Новый диагностический инструмент для быстрого и точного выявления микобактерий туберкулеза. Саудовская биология, наука 25 , 418–425 (2018).
Артикул PubMed CAS Google ученый
Веропулос К., Лермонт Г., Кэмпбелл К., Найт Б. и Симпсон Дж. Автоматическая идентификация туберкулезных микобактерий в мокроте. Предварительное расследование. Anal Quant Cytol Histol 21 , 277–282 (1999).
PubMed CAS Google ученый
Хутланг, Р. и др. .Классификация Mycobacterium tuberculosis в изображениях мазков мокроты, окрашенных ZN.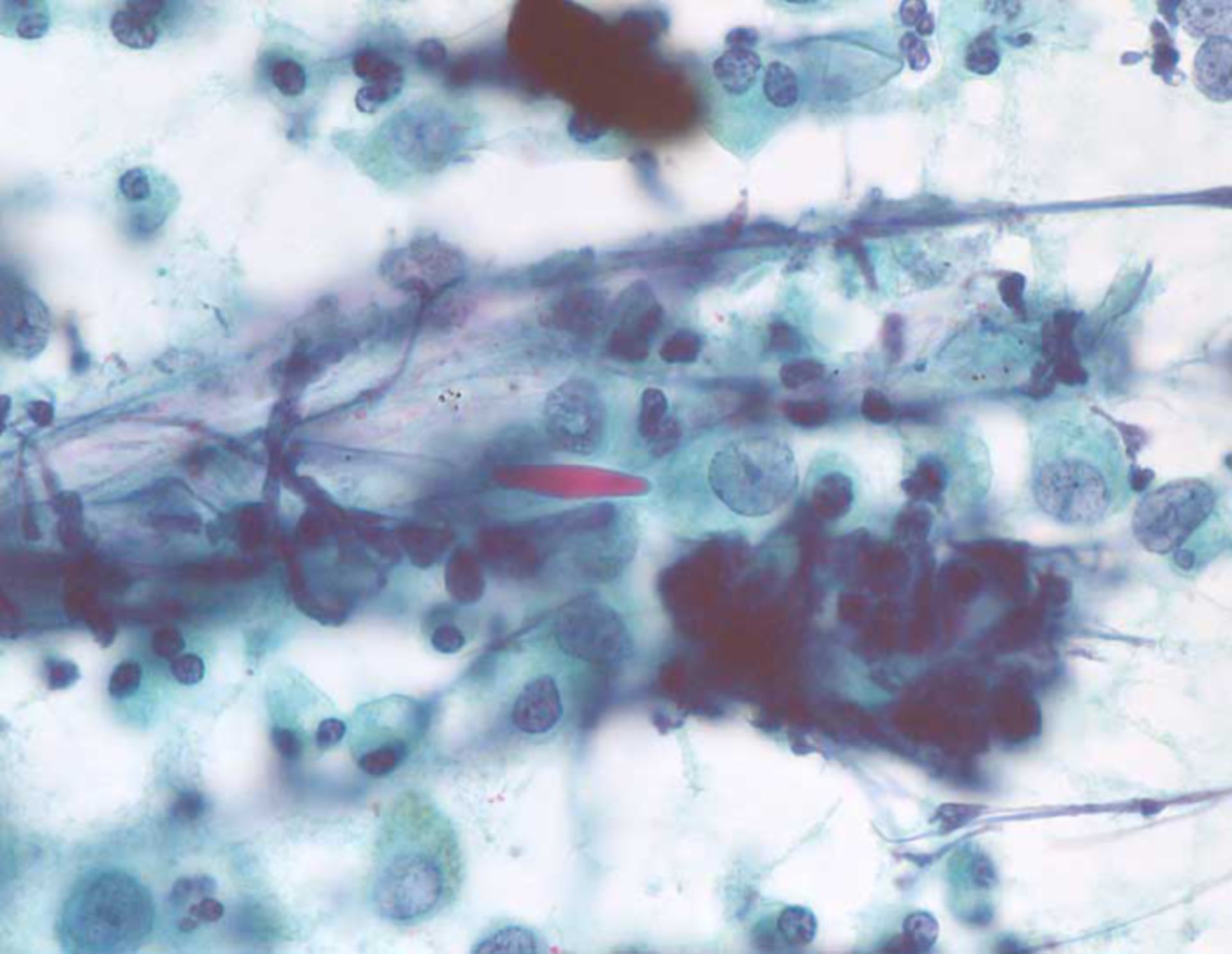 IEEE Trans Inf Technol Biomed 14 , 949–957 (2010).
IEEE Trans Inf Technol Biomed 14 , 949–957 (2010).
Артикул PubMed Google ученый
Khutlang, R., Krishnan, S., Whitelaw, A. & Douglas, T. S. Автоматическое обнаружение туберкулеза в мазках мокроты, окрашенных по Цилю-Нильсену, с использованием двух классификаторов одного класса. J Microsc 237 , 96–102 (2010).
MathSciNet Статья PubMed PubMed Central CAS Google ученый
Льюис, Дж. Дж. и др. . «Доказательная» оценка автоматизированной системы микроскопии мазка мокроты для диагностики туберкулеза. PLoS One 7 , 29 (2012).
Google ученый
Коста М. Г. и др. . База данных изображений микроскопии мазка мокроты для автоматического обнаружения бацилл с помощью традиционной микроскопии. Conf Proc IEEE Eng Med Biol Soc 4 , 6944215 (2014).
Google ученый
Исмаил Н. А. и др. . Выполнение нового алгоритма с использованием автоматизированной цифровой микроскопии для диагностики туберкулеза. Am J Respir Crit Care Med 191 , 1443–1449 (2015).
Артикул PubMed Google ученый
Асмар, С. и Дранкур, М. Быстрая диагностика туберкулеза легких на основе посева в развитых и развивающихся странах. Frontiers Microbiol 6 , 1184 (2015).
Артикул Google ученый
Pichat, C. et al . Комбинированный генотипический, филогенетический и эпидемиологический анализ генетического разнообразия Mycobacterium tuberculosis в регионе Рона-Альпы, Франция. PLoS One 11 , e0153580 (2016).
Артикул PubMed PubMed Central CAS Google ученый
Guthmann, J., Aït Belghiti, F. & Lévy-Bruhl, D. Epidémiologie de la tuberculose en France в 2015 году. Влияние суспензии вакцинации BCG на туберкулезу детей, 2007–2015 гг. Bull Epidémiol Hebd 7 , 116–126 (2017).
Google ученый
Арья, М. и др. . Мишени транскрипции Wnt / ß-катенина при карциноме полового члена. PloS One 10 , e0124395 (2015).
Артикул PubMed PubMed Central CAS Google ученый
Тиан Л. и др. . Взаимная регуляция нормализации сосудов опухоли и иммуностимулирующего репрограммирования. Природа 544 , 250 (2017).
Артикул PubMed PubMed Central ОБЪЯВЛЕНИЯ CAS Google ученый
Саул Л. и др. . Переключение подкласса IgG и клональная экспансия при меланоме кожи и нормальной коже.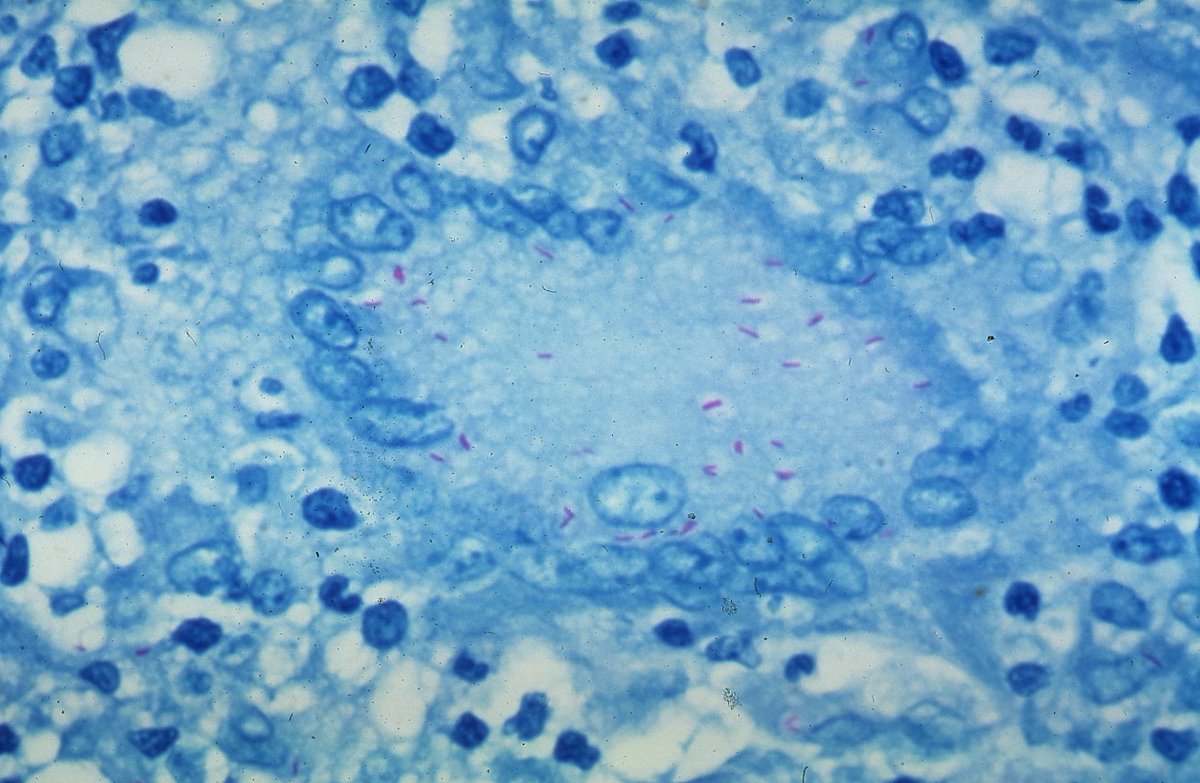 Научный представитель 6 , 29736 (2016).
Научный представитель 6 , 29736 (2016).
Артикул PubMed PubMed Central ОБЪЯВЛЕНИЯ CAS Google ученый
Дойл У. И. и др. . Фекальные желчные кислоты являются естественными лигандами дополнительной обонятельной системы мышей. Nature Commun 7 , 11936 (2016).
Артикул ОБЪЯВЛЕНИЯ CAS Google ученый
Адиль М. М. и др. . Эффективная генерация допаминергических нейронов среднего мозга на основе hPSC на полностью определенной масштабируемой трехмерной платформе биоматериалов. Научный представитель 7 , 40573 (2017).
Артикул PubMed PubMed Central ОБЪЯВЛЕНИЯ CAS Google ученый
Ча, м., Ум, С. В., Квон, М., Нам, Т. С. и Ли, Б. Х. Повторяющаяся стимуляция моторной коры усиливает схемы модуляции боли периферической нейропатической боли.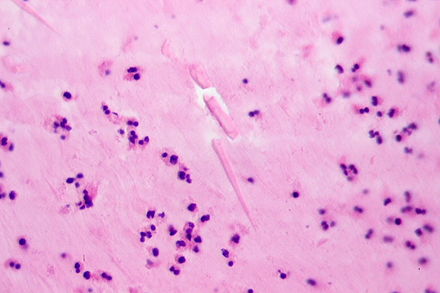 Научный представитель 7 , 7986 (2017).
Научный представитель 7 , 7986 (2017).
Артикул PubMed PubMed Central ОБЪЯВЛЕНИЯ CAS Google ученый
Rousseau, D. et al . Быстрая виртуальная гистология с использованием линейной фазовой рентгеновской томографии: приложение к трехмерной анатомии развивающихся семян кукурузы. Заводские методы 11 , 55 (2015).
Артикул PubMed PubMed Central Google ученый
Бин Б. Х. и др. . Потребность в транспортере цинка ZIP10 для развития эпидермиса: участие оси ZIP10 – p63 в эпителиальном гомеостазе. Proc Natl Acad Sci USA 114 , 12243–12248 (2017).
Артикул PubMed CAS Google ученый
Bjarnadóttir, K. et al . Экспрессия трансформирующего фактора роста β1, производимого В-клетками, ограничивает фазу индукции аутоиммунного нейровоспаления.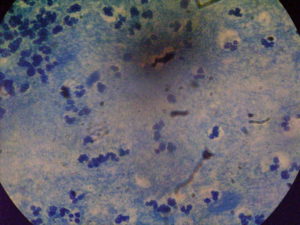 Научный представитель 6 , 34594 (2016).
Научный представитель 6 , 34594 (2016).
Артикул PubMed PubMed Central ОБЪЯВЛЕНИЯ CAS Google ученый
Sacchetti, C. et al . PTP4A1 способствует передаче сигналов TGFβ и фиброзу при системном склерозе. Nature Commun 8 , 1060 (2017).
Артикул ОБЪЯВЛЕНИЯ CAS Google ученый
Белл, Л. К. К. и др. . In vivo Молекулярный анализ эффектов ВИЧ-1 при активном туберкулезе. Патогены PLOS 12 , e1005469 (2016).
Артикул PubMed PubMed Central CAS Google ученый
Ван Деун, А., Хоссейн, М.А., Гумусбога, М.& Ридер, Х. Л. Окрашивание Циля-Нильсена: теория и практика. Int J Tuberc Lung Dis 12 , 108–110 (2008).
PubMed Google ученый
Asmar, S. et al. . Новая твердая среда для культивирования изолятов Mycobacterium tuberculosis из клинических образцов. J Clin Microbiol 53 , 2566–2569 (2015).
Артикул PubMed PubMed Central CAS Google ученый
Асмар, С. и др. . Обеззараживание мокроты хлоргексидином для посева Mycobacterium tuberculosis . BMC Microbiol 15 , 155 (2015).
Артикул PubMed PubMed Central CAS Google ученый
Ghodbane, R. et al . Быстрая диагностика туберкулеза с помощью визуализации с высоким разрешением в реальном времени колоний Mycobacterium tuberculosis . J Clin Microbiol 53 , 2693–2696 (2015).
Артикул PubMed PubMed Central CAS Google ученый
Zingue, D., Flaudrops, C. & Drancourt, M. Прямая матричная лазерная десорбционная ионизация, времяпролетная масс-спектрометрическая идентификация микобактерий из колоний. Eur J Clin Microbiol Infect Dis 35 , 1983–1987 (2016).
& Drancourt, M. Прямая матричная лазерная десорбционная ионизация, времяпролетная масс-спектрометрическая идентификация микобактерий из колоний. Eur J Clin Microbiol Infect Dis 35 , 1983–1987 (2016).
Артикул PubMed CAS PubMed Central Google ученый
Что такое бронхоэктазы | Британский фонд легких
Бронхоэктазия — это хроническое заболевание, поражающее дыхательные пути в легких.
На этой странице:
Что такое бронхоэктазия?
Когда вы дышите, воздух попадает в легкие через дыхательные пути, также называемые бронхами. Бронхи снова и снова делятся на тысячи более мелких дыхательных путей, называемых бронхиолами. Ваши дыхательные пути содержат крошечные железы, которые производят небольшое количество слизи. Слизь помогает поддерживать влажность дыхательных путей и улавливает пыль и микробы, которыми вы дышите. Слизь удаляется крошечными волосками, называемыми ресничками, которые выстилают дыхательные пути.
Если у вас бронхоэктазия, дыхательные пути расширяются и воспаляются густой слизью, также называемой мокротой или мокротой. Ваши дыхательные пути могут не очищаться должным образом. Это означает, что слизь накапливается, и ваши дыхательные пути могут инфицироваться бактериями. Карманы в дыхательных путях означают, что слизь попадает в ловушку и может заразиться.
Иногда, если количество бактерий увеличивается, вы получаете инфекцию грудной клетки или обострение симптомов. Важно распознать и лечить инфекции грудной клетки.Если вы не пройдете лечение, ваши дыхательные пути могут быть повреждены еще больше. Изменения в дыхательных путях нельзя отменить, но есть способы, которыми вы и ваша медицинская бригада можете лечить и управлять бронхоэктазами.
Бронхоэктатическая болезнь, иногда называемая , бронхоэктазия без кистозного фиброза . Это потому, что существует другое состояние , называемое муковисцидозом. У людей с муковисцидозом симптомы в легких могут быть схожи с симптомами бронхоэктаза, но методы лечения и перспективы отличаются.
Каковы симптомы бронхоэктазии?
Симптомы бронхоэктазов у разных людей различаются. У вас может быть 1 или 2 в списке ниже, а может быть и большинство из них.
Наиболее частым симптомом является длительный кашель, обычно кашель с мокротой, иногда называют мокротой. Сумма варьируется. Для людей с более тяжелыми бронхоэктазами это может быть довольно большое количество, например полная чашка для яиц или больше каждый день. У некоторых людей может быть сухой кашель без мокроты или с очень небольшим количеством мокроты.
Частые инфекции грудной клетки также являются частым признаком бронхоэктазов.
Другие симптомы бронхоэктаза , которые могут быть у вас:
- чувство сильной усталости или трудности с концентрацией внимания
- одышка: затрудненное дыхание или ощущение одышки
- Проблемы с носовыми пазухами
- недержание мочи при кашле, также называемое истечением мочевого пузыря
- тревога или депрессия
Менее распространенные симптомы бронхоэктазов включают:
- кашель с кровью
- боль в груди
Что вызывает бронхоэктазы?
Почти у половины людей с диагнозом «бронхоэктазия» нет явной первопричины. Это называется идиопатическим бронхоэктазом.
Это называется идиопатическим бронхоэктазом.
Некоторые болезни, связанные с бронхоэктазами, включают:
- имели в прошлом тяжелые инфекции легких, такие как пневмония, коклюш или туберкулез (ТБ), например, когда вы были ребенком
- воспалительное заболевание кишечника, также называемое язвенным колитом и болезнью Крона
- Недостатки иммунной системы
- Некоторые виды артритов, например ревматоидный артрит
- проблема с нормальной структурой или функцией легких, например первичная цилиарная дискинезия
- астма, ХОБЛ или саркоидоз
Другие причины включают:
- тяжелая аллергическая реакция на грибок или плесень, например, Aspergillus
- рефлюкс желудочный
- закупорка дыхательных путей, вызванная вдыханием небольшого предмета, например гайки
Далее: диагностика бронхоэктазов>
Загрузите наш PDF-файл о бронхоэктазах (108 КБ)(PDF) Автоматическое определение туберкулезных бацилл по микроскопическим изображениям мазка мокроты с использованием более быстрой R-CNN, передачи обучения и увеличения
11.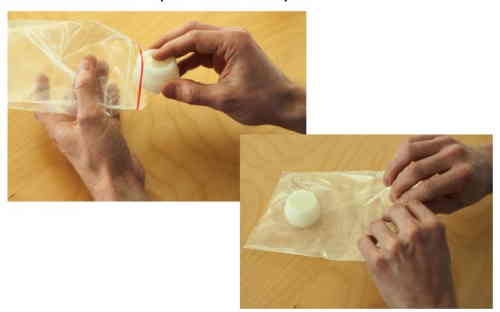 Дивекар, А., Пангилинан, К., Кутзи, Г., Сонд, Т., Лур, Ф.Й.М., Кеннеди, С.: Автоматическое обнаружение туберкулеза
Дивекар, А., Пангилинан, К., Кутзи, Г., Сонд, Т., Лур, Ф.Й.М., Кеннеди, С.: Автоматическое обнаружение туберкулеза
на предметных стеклах с мазком мокроты с использованием пошаговой классификации. In:
International Society for Optical Engineering, February 2012
12. Adi, K., Gernowo, R., Sugiharto, A., Firdausi, KS, Adi, P., Adi, B .: Tuberculosis
(TB ) идентификация в образце мокроты Циля-Нильсена в канале NTSC и поддержка векторной классификации
машины (SVM).Int. J. Innov. Res. Sci. Англ. Technol. 2, 5030–5035 (2013)
13. Quinn, JA, Nakasi, R., Mugagga, PKB, Byanyima, P., Lubega, W., Andama, A .: Deep
сверточные нейронные сети для микроскопии. диагностика пункта оказания медицинской помощи. В:
Международная конференция по машинному обучению для здравоохранения, август 2016 г.
14. Лопес, Ю.П., Коста, CFF, Агилера, LMR, Коста, MGF: Автоматическая классификация
пластырей для светового микроскопа мазков с использованием сверточных нейронных сетей для идентификация
Mycobacterium Tuberculosis. В: CHILEAN Conference on Electrical, Electronics Engineering,
В: CHILEAN Conference on Electrical, Electronics Engineering,
neering, Information and Communication Technologies, October 2017
15. Panicker, RO, Kalmady, KS, Rajan, J., Sabu, MK: Автоматическое обнаружение туберкулеза
бацилл из микроскопические изображения мазка мокроты с использованием методов глубокого обучения. Биокиберн.
Биомед. Англ. 38, 691–699 (2018)
16. Кант, С., Сривастава, М.М .: К автоматизированному обнаружению туберкулеза с использованием глубокого обучения.
препринт arXiv, arXiv: 1801.07080 (2018)
17. Рен, С., Хе, К., Гиршик, Р., Сан, Дж .: Более быстрый R-CNN: к обнаружению объектов в реальном времени с
сетями предложений регионов. В: Proceedings of the Advances in Neural Information Processing
Systems, pp. 91–99, декабрь 2015
18. Khutlang, R., et al .: Классификация Mycobacterium tuberculosis по изображениям мазков мокроты
, окрашенных ZN. Пер. Информация. Tech. Биомед. 14 (4), 949–957 (2010)
19. Лин Т.-Й. и др .: Microsoft COCO: общие объекты в контексте.В: Fleet, D., Pajdla, T.,
Лин Т.-Й. и др .: Microsoft COCO: общие объекты в контексте.В: Fleet, D., Pajdla, T.,
Schiele, B., Tuytelaars, T. (eds.) ECCV 2014. LNCS, vol. 8693, стр. 740–755. Springer,
Cham (2014). https://doi.org/10.1007/978-3-319-10602-1_48
20. Уиджлингс, Дж.Р.Р., ван де Санде, К.Е.А., Геверс, Т., Смелдерс, A.W.M .: Выборочный поиск для распознавания
объектов. Int. J. Comput. Vis. 104 (2), 154–171 (2013)
21. Зитник, К.Л., Доллар, П .: Боковые блоки: обнаружение предложений объектов по краям. В: Fleet, D.,
Pajdla, T., Schiele, B., Tuytelaars, T. (ред.) ECCV 2014. LNCS, vol. 8693, стр. 391–405.
Спрингер, Чам (2014). https://doi.org/10.1007/978-3-319-10602-1_26
22. Гиршик, Р .: Fast R-CNN. В: Proceedings of the International Conference on Computer
Vision, Santiago, Chile, pp. 1440–1448, декабрь 2015 г.
23. Шах, MI, и др .: База данных микроскопии мазка мокроты Ziehl-Neelsen: ресурс для
облегчает автоматическое обнаружение бацилл для диагностики туберкулеза.


 Сначала аппарат вдувает большой объем воздуха в легкие, как при обычном вдохе (с положительным давлением), а затем быстро меняет поток воздуха на обратный (отрицательное давление) для удаления мокроты из бронхов. Чередование давления в дыхательных путях позволяет эффективно выводить мокроту из верхних и нижних отделов дыхательных путей.
Сначала аппарат вдувает большой объем воздуха в легкие, как при обычном вдохе (с положительным давлением), а затем быстро меняет поток воздуха на обратный (отрицательное давление) для удаления мокроты из бронхов. Чередование давления в дыхательных путях позволяет эффективно выводить мокроту из верхних и нижних отделов дыхательных путей.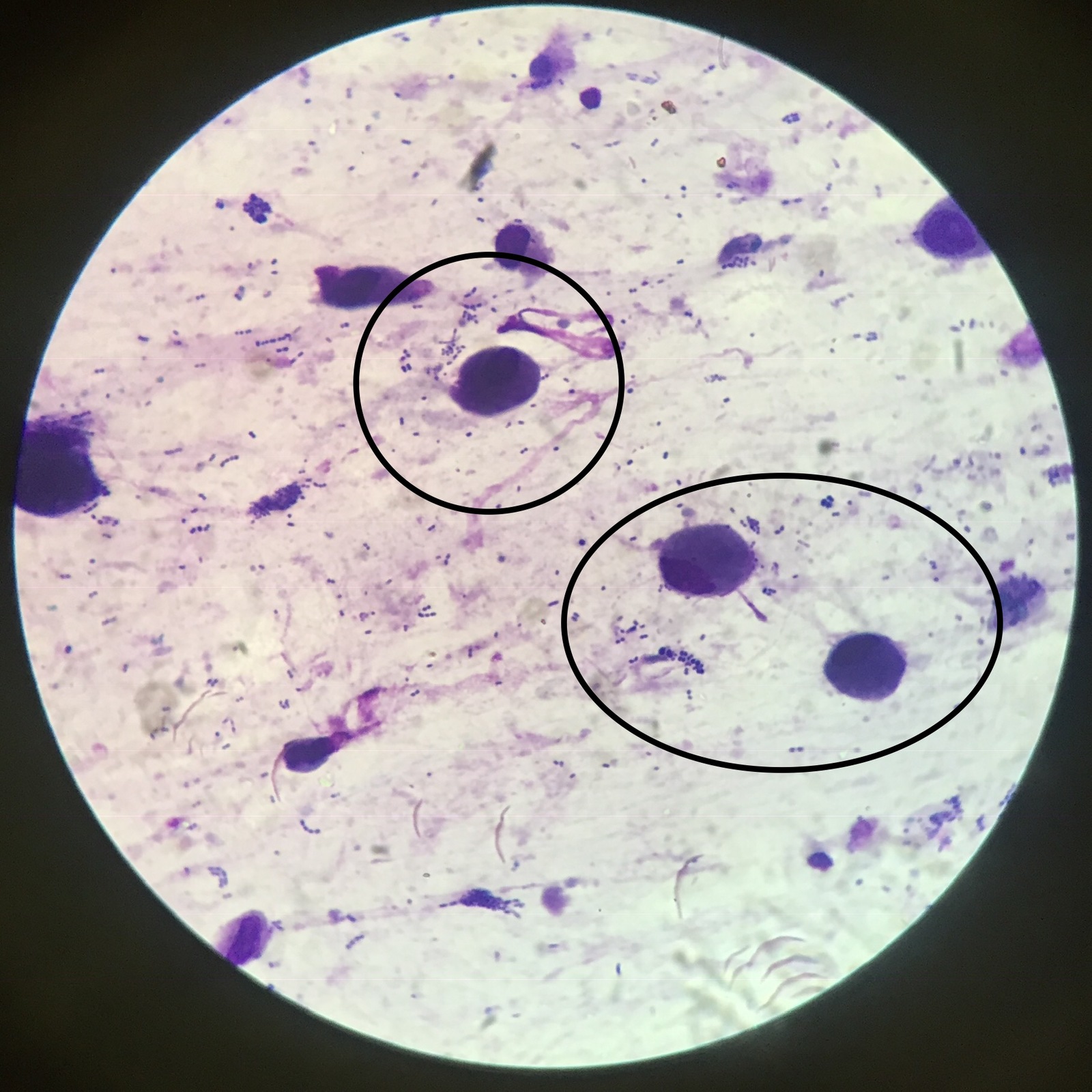 В автоматическом режиме доступна функция Cough-Trak, позволяющая контролировать начало фазы вдоха. Функция Cough-Trak в аппарате CoughAssist E70 определяет готовность к вдоху у пациента и создает в этот момент заданное давление. Кроме того, для повышения эффективности удаления секрета аппарат CoughAssist E70 оснащен функцией осцилляции воздушного потока.
В автоматическом режиме доступна функция Cough-Trak, позволяющая контролировать начало фазы вдоха. Функция Cough-Trak в аппарате CoughAssist E70 определяет готовность к вдоху у пациента и создает в этот момент заданное давление. Кроме того, для повышения эффективности удаления секрета аппарат CoughAssist E70 оснащен функцией осцилляции воздушного потока.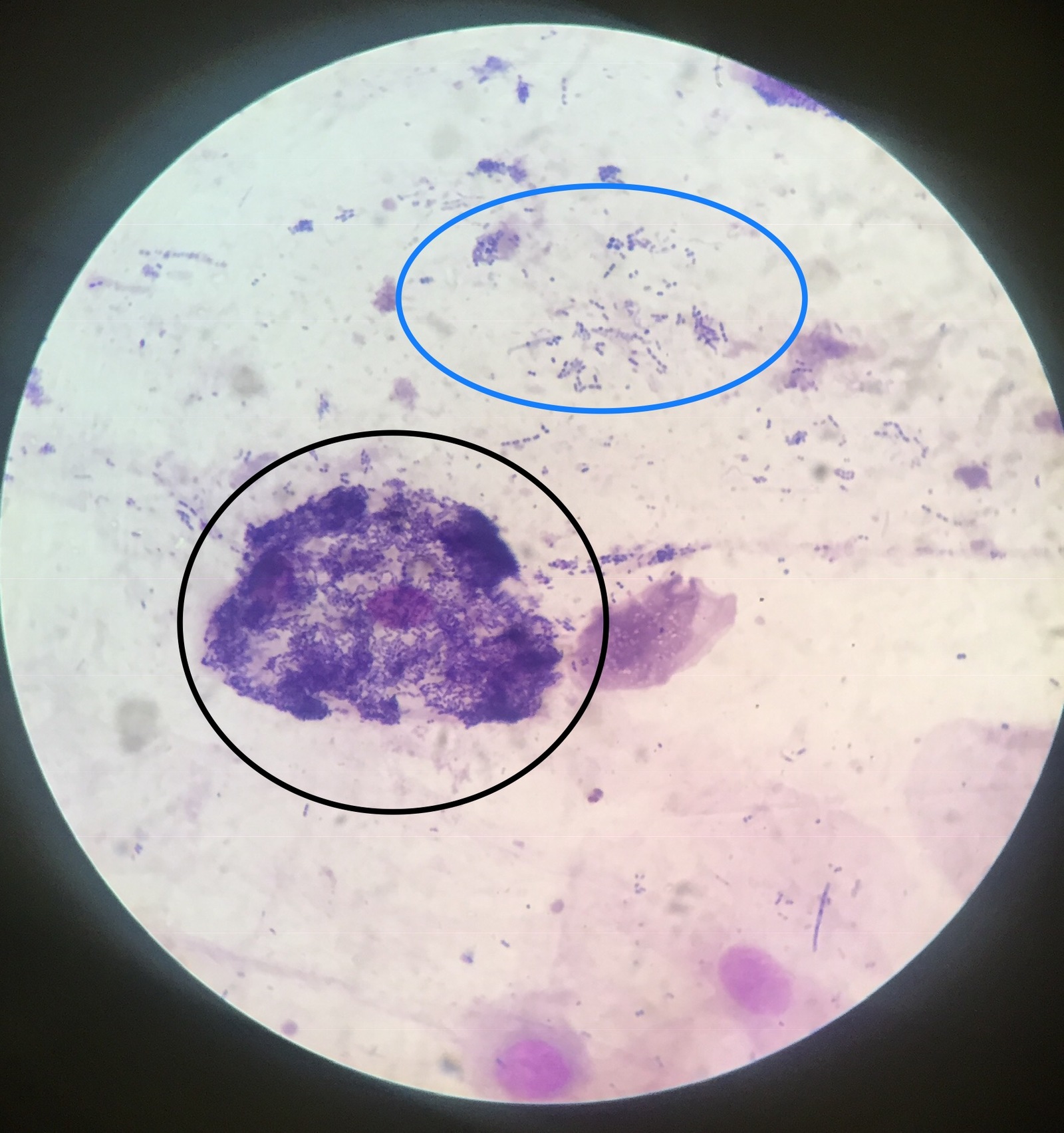 Чтобы избежать случайной замены параметров во время проведения терапии, можно включить блокировку настроек.
Чтобы избежать случайной замены параметров во время проведения терапии, можно включить блокировку настроек.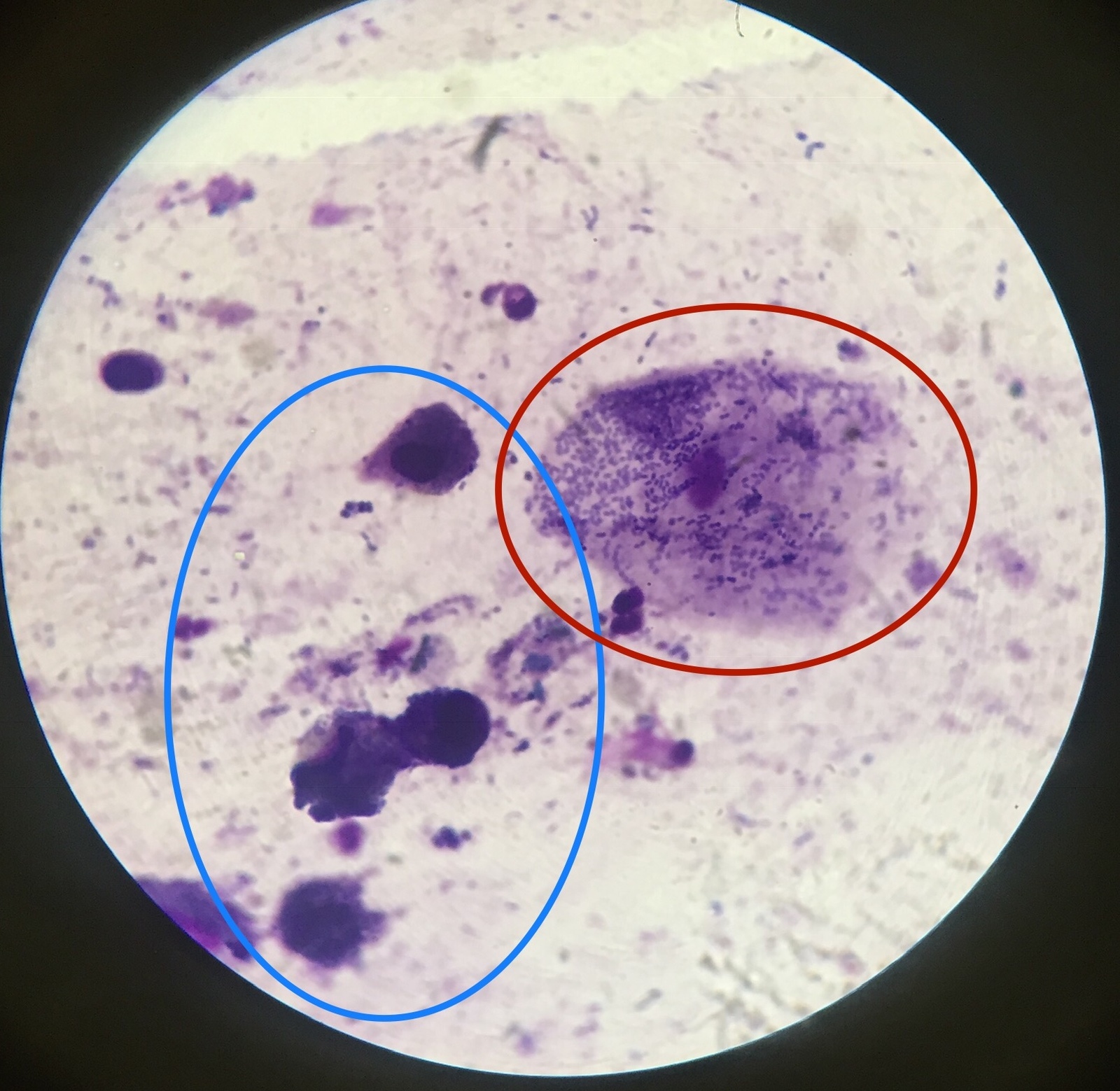 Средства управления данными помогают регулировать параметры лечения в зависимости от развития заболевания, тем самым повышая эффективность лечения.
Средства управления данными помогают регулировать параметры лечения в зависимости от развития заболевания, тем самым повышая эффективность лечения.
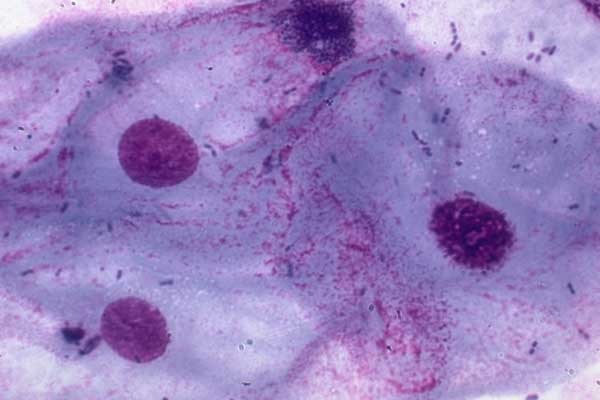 Если Вы страдаете бронхиальной астмой, то не забудьте ингалятор.
Если Вы страдаете бронхиальной астмой, то не забудьте ингалятор.