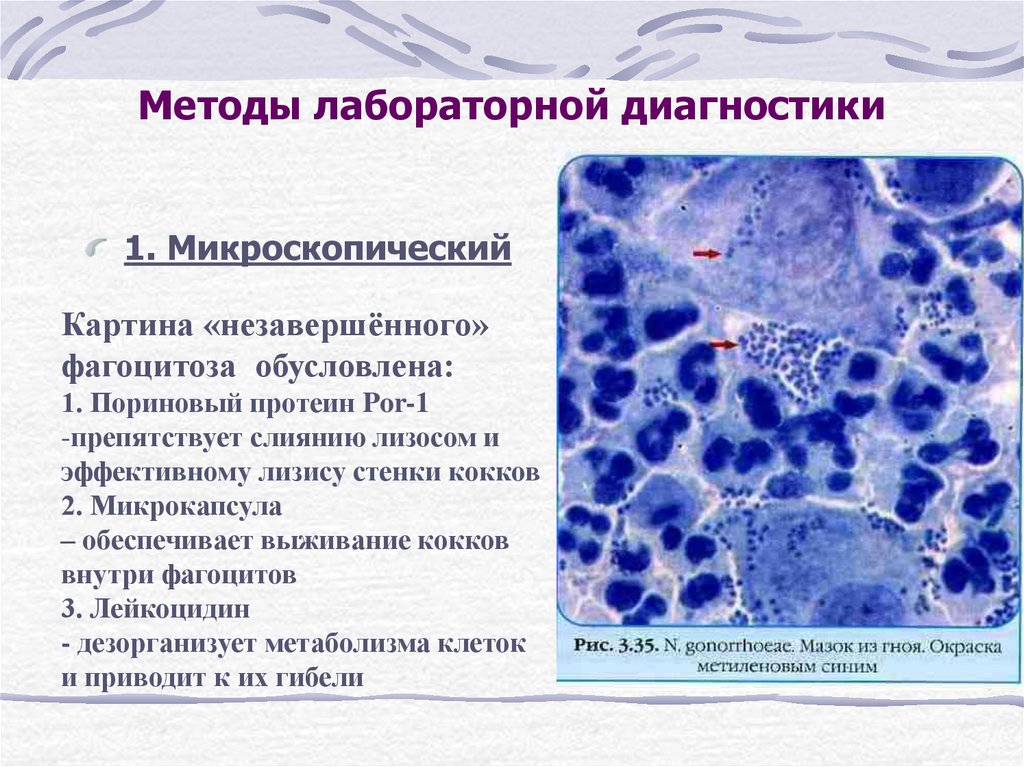
Бактериологические исследования в Медицинском Комплексе
Бактериологическое исследование являет собой комплекс специально разработанных методов для выявления у пациентов патогенных микроорганизмов, возбудителей инфекционного заболевания, для изучения микробного пейзажа объектов или сред, идентификация видов и типов бактерий. Бактериологические исследования используются при диагностике, для профилактики инфекционных заболеваний. Они направлены на выявление бактерий и постановки правильного микробиологического диагноза. Методика отбора проб для анализа зависит от характера патологии и свойств микроорганизмов.
Способы диагностики
Основные методы исследования:
- Прямой метод — бактериоскопическое/бактериологическое исследование для поиска возбудителя.
- Косвенный — серологические исследования позволяют выявить антигены в инфицированных материалах или найти антитела в секретах и кровяной сыворотке, взятых из организма пациента.

- Комплекс микробиологических исследований необходим для конкретизации синдромологического клинического диагноза, точнее поможет установить причину заболеваний полиэтиологической природы. Играют важную роль в диагностировании инфекционных болезней, при целенаправленном выборе терапевтических средств.
Бактериоскопическое исследование основано на микроскопическом изучении материала, производится при разнообразных инфекционных болезнях для выявления в крови возбудителей. На присутствие бактерий проверяются различные материалы. Спинномозговую жидкость берут при туберкулёзном менингите; при дифтерии, ангине используют слизь из носоглотки; при амебиазе, лямблиозе, дисбактериозе кишечника проводится анализ кала; при лептоспирозе — анализ мочи.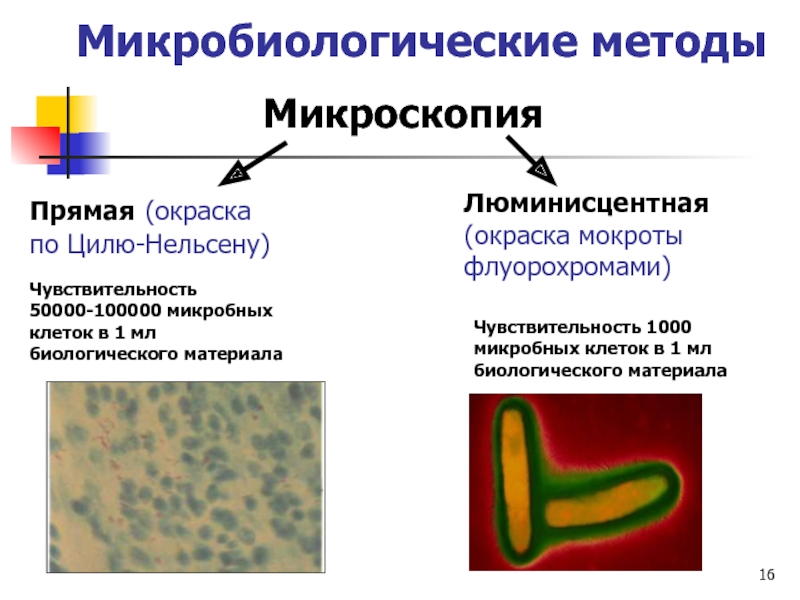
Бактериологическая диагностика позволяет в короткие сроки обнаружить микробы и выяснить, какое количество бактерий есть во взятом для анализа материале. Материал, требуемый для анализа, собирают и упаковывают в стерильную посуду с соблюдением всех правил асептики, доставляют в лабораторию в самые кратчайшие сроки. Пробы недолго можно хранить на холоде.
Вовремя проведённое бактериологическое исследование (в самом начале болезни) даёт высокий положительный результат. Данные анализов лаборатория выдаёт через два-четыре дня, при таких заболеваниях как туберкулёз, бруцеллёз — спустя три-четыре недели, в зависимости от сроков роста анализируемых микроорганизмов для их последующей идентификации. Верная оценка результатов зависит от многих факторов: как правильно взяты биологические материалы, вовремя ли они предоставлены для анализа и т.п.
Сейчас существуют более ускоренные методы для выявления бактерий. Индикаторы СИБ (индикаторные бумажки) позволяют через 6-10 часов выделить чистейшую бактериальную культуру, которая не требует каких-то особых питательных сред.
Индикаторы СИБ (индикаторные бумажки) позволяют через 6-10 часов выделить чистейшую бактериальную культуру, которая не требует каких-то особых питательных сред.
Выбор методов бактериологического исследования и материалов для проведения анализов напрямую зависят от цели проводимого анализа, патогенеза, протекания болезни.
Вы всегда можете воспользоваться услугами нашей поликлиники: мы проведём бактериологическое исследование и предоставим достоверные результаты!
Микроскопическое исследование на микобактерию туберкулеза окрашенного мазка
Методы лабораторной диагностики туберкулеза весьма разнообразны как по характеру производимых исследований, так и по тому патологическому материалу, который подвергается исследованию. Кроме общепринятых исследований, используемых в практике при различных заболеваниях, в клинике туберкулеза применяются специальные лабораторные методы, связанные со спецификой этого заболевания.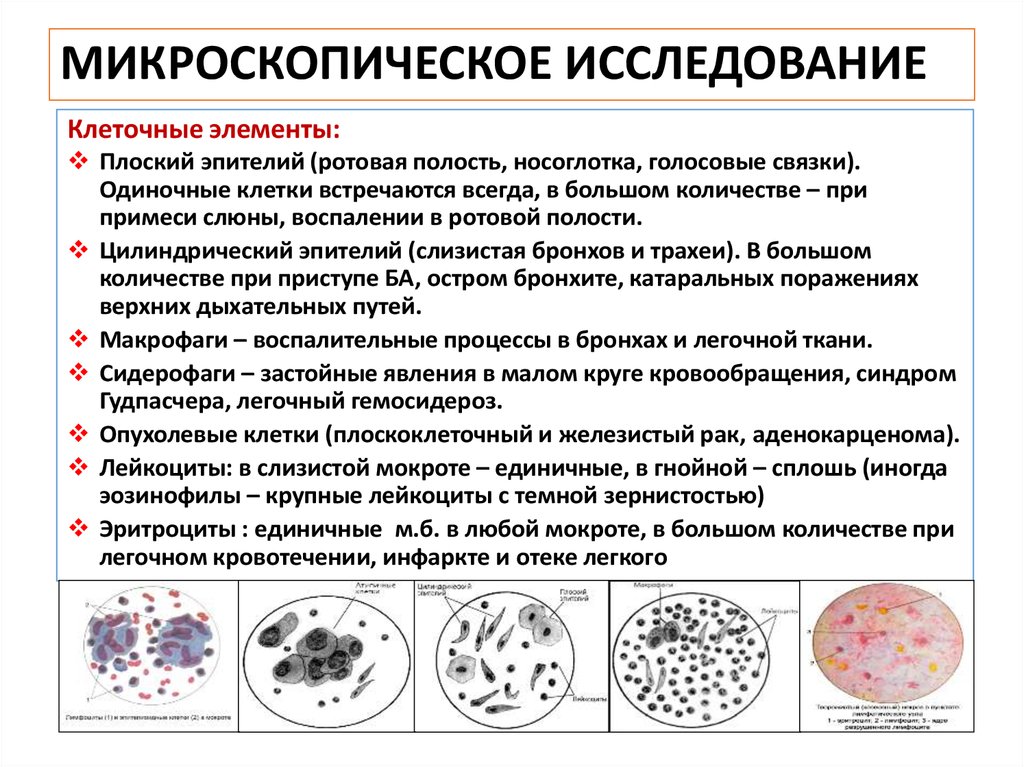
Скрининговым методом диагностики туберкулеза является микроскопический (бактериоскопический) метод. Материалом для исследования могут быть мокрота, моча (при необходимости другие жидкости организма). Они исследуются путем приготовления мазков (нанесение тонкого слоя материала на стекло), с последующим окрашиванием специальными красителями, позволяющими сделать бактерии видимыми при помощи микроскопа. Результат микроскопического исследования носит предварительный характер, так как метод не позволяет определить вид микобактерии, а выявляет лишь ее наличие. Присутствие кислотоустойчивых микобактерий в клиническом материале может быть установлено при микроскопическом и/или культуральном исследовании. Однако необходимо иметь в виду, что микроскопическое исследование не позволяет дифференцировать микобактерии комплекса Mycobacterium tuberculosis (возбудителей туберкулеза) от нетуберкулезных («атипичных») микобактерий — возбудителей микобактериозов.
Несмотря на указанные недостатки, микроскопия остается одним из основных методов микробиологических исследований. Ее преимущество заключается в быстроте получения результата и относительной простоте исследования. Метод позволяет в короткие сроки обнаружить наиболее эпидемически опасных больных туберкулезом и микобактериозами, выделяющих большие количества микобактерий, и остается актуальным методом при выявлении больных туберкулезом и микобактериозами на первичных этапах обследования больных, а также при динамическом наблюдении за состоянием микобактериальной популяции в процессе лечения. Кроме того, микроскопическое подтверждение тинкториальных свойств культуры остается обязательным исследованием при ее диагностике. Человеческий туберкулез вызывают определенные бактерии, относящиеся к микобактериям. Но очень редко заболевание, схожее с туберкулезом, могут вызвать другие виды микобактерий, а также в мазке могут присутствовать неопасные микобактерии. Для более точного исследования используется бактериологический метод посева.
Кроме того, микроскопическое подтверждение тинкториальных свойств культуры остается обязательным исследованием при ее диагностике. Человеческий туберкулез вызывают определенные бактерии, относящиеся к микобактериям. Но очень редко заболевание, схожее с туберкулезом, могут вызвать другие виды микобактерий, а также в мазке могут присутствовать неопасные микобактерии. Для более точного исследования используется бактериологический метод посева.
При подозрении на туберкулез всегда исследуется мокрота, так как легкие поражаются этим заболеванием наиболее часто. При ее отсутствии на исследование направляют промывные воды бронхов. Иногда для уточнения поражения туберкулезом других органов на исследование направляется моча, кал, отделяемое из ран и гнойников.
Микроскопия является предварительным методом исследования с целью выявления наиболее опасных форм туберкулеза («открытых»), при которых больной человек выделяет возбудителя заболевания в окружающую среду. При подозрении на туберкулез органов дыхания необходимо исследовать не менее трёх проб мокроты – это связано с особенностями выделения микобактерий из легких, а также чувствительностью методов исследования.
Метод окраски по Ziehl-Neelsen (Цилю-Нильсену) является наиболее распространенным методом для выявления кислотоустойчивых микобактерий. Он основан на использовании нескольких специальных методических приемов:
- окраска фуксином (с подогреванием) — при одновременном воздействии нагревания и сильного протравливающего действия карболовой кислоты повышается способность красителя проникать в микробную клетку и особенно в структуры ее клеточной стенки, состоящей из липидов, миколовых кислот и восков. Обычные анилиновые красители не проникают в клеточную стенку микобактерий, и последние не окрашиваются;
-
обесцвечивание (3 мин.) — приводит к обесцвечиванию красителя, проникшего в структуры, не обладающие достаточной гидрофобностью и стойкостью к разрушению в кислоте (кислотоустойчивостью).

- контрастирующая окраска (1 мин.) — обесцвеченные элементы мазка докрашивают метиленовым синим для придания контрастности препарату.
Показания к назначению:
- наличие явных симптомов туберкулеза органов дыхания
- наличие продолжительного (более 3 недель) кашля, сопровождающегося выделением мокроты, особенно с кровью, и жалобами на боли в груди
- контактные с больными, имеющими положительный результат бактериоскопического исследования и соответствующие симптомы заболевания
- пациентам, имеющим рентгенологические изменения в легких, подозрительные в отношении туберкулеза
Метод исследования: микроскопия
Мокроту для исследования лучше брать утреннюю, свежую, до еды и после туалета полости рта (чистка зубов и полоскание кипяченой водой). Собирают в чистый сухой контейнер, герметично закрытый, доставляют в лабораторию и исследуют в тот же день.
Собирают в чистый сухой контейнер, герметично закрытый, доставляют в лабораторию и исследуют в тот же день.
Референсные значения: не обнаружено (отрицательный результат) Интерпретация результатов: Отрицательный результат микроскопического исследования не исключает того, что пациент выделяет микобактерии туберкулеза в окружающую среду. Если количество микобактерий очень низкое, то их можно не увидеть в микроскоп. Метод посева намного чувствительнее, так как для того чтобы выросли микобактерии на питательной среде, достаточно одной живой «палочки». В настояще время актуальным является определение специфической ДНК методом ПЦР.
Диагностика инфекционных, паразитарных и грибковых заболеваний
Современная диагностика инфекционных заболеваний помогает раскрыть их механизм, спрогнозировать развитие и, самое главное, помочь назначить эффективное лечение. Высокоточные анализы в наших клинических лабораториях способствуют назначению своевременных профилактических мероприятий и проведению противоэпидемологических мер.
Высокоточные анализы в наших клинических лабораториях способствуют назначению своевременных профилактических мероприятий и проведению противоэпидемологических мер.
Анализы на инфекционные заболевания
Сегодня мы можем предложить нашим пациентам экспресс—диагностику инфекционных заболеваний, а также иммунологические исследования, позволяющие выявить в крови антитела к паразитам, антигены разного рода. Достоверность анализов максимальна. Выявление возбудителя грибков и паразитов проводится по современным технологиям, помогает выявить природу заболевания, его инфекционную или неинфекционную форму.
Поскольку, согласно статистике, каждое третье заболевание кожи имеет грибковую природу, то лабораторные исследования на наличие грибка является одним из самых востребованных.
Паразиты, например, привычные для нас вирусы герпеса или хламидии, могут присутствовать в организме годами и не быть обнаруженными. Между тем, они нарушают работу большинства систем и органов, наносят вред здоровью, даже маленьких детей. Приходя на прием к врачу, пациент жалуется на симптомы, которые можно причислить к тому или иному заболеванию. Без точной диагностики инфекционных заболеваний причину установить очень сложно, а уж тем более назначить профессиональное лечение.
Между тем, они нарушают работу большинства систем и органов, наносят вред здоровью, даже маленьких детей. Приходя на прием к врачу, пациент жалуется на симптомы, которые можно причислить к тому или иному заболеванию. Без точной диагностики инфекционных заболеваний причину установить очень сложно, а уж тем более назначить профессиональное лечение.
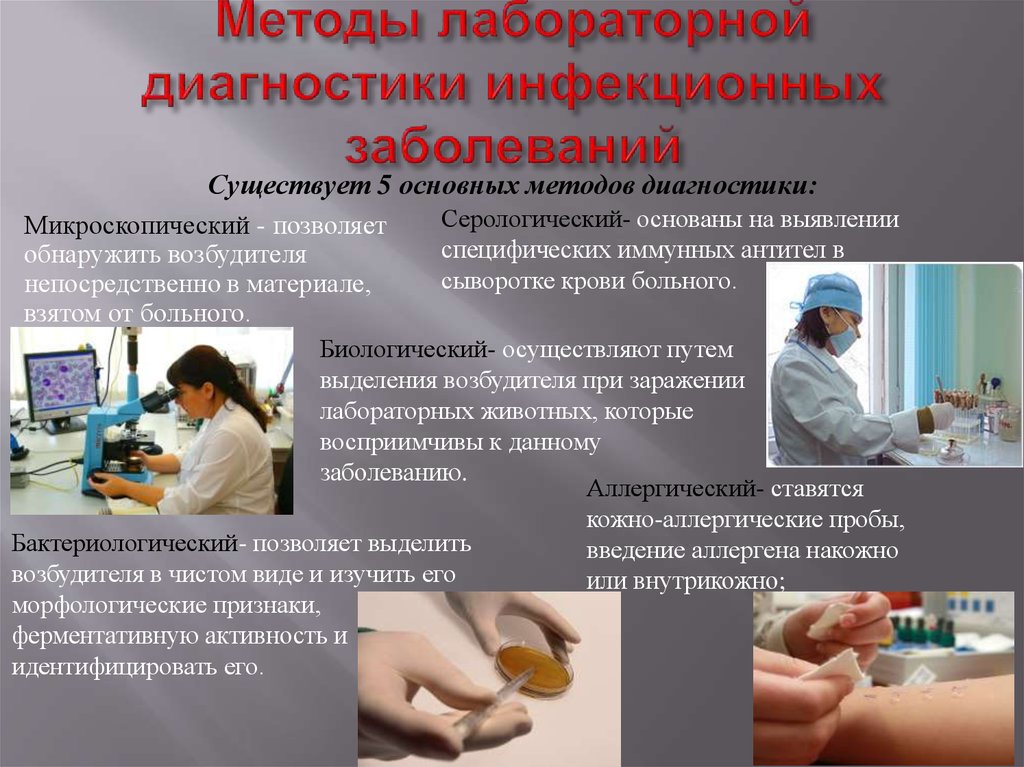
Методы лабораторной диагностики
Методы проведения современной диагностики широко представлены в наших лабораториях.
Микроскопический метод — способствует обнаружению возбудителя в пробах материалов, взятых у пациента. Метод помогает диагностировать такие сложные заболевания, как туберкулез, гонорея, малярия и так далее.
Бактериологический — берется посев на питательные среды (определяются морфологические признаки возбудителя, его ферментативная активность на разных стадиях и так далее).
Серологический — базируется на определении специфических иммунных антител, находящихся в сыворотке крови пациента.
Аллергический — делают кожно-аллергические пробы, при этом аллерген вводится под кожу или на кожный покров. Эффективен при диагностике туляремии, туберкулеза и других опасных заболеваний.
Анализы на инфекционные заболевания в нашей клинике проводятся от 1 суток до 5 дней, в зависимости от сложности. Чтобы провести исследования, звоните, мы обязательно поможем вам консультацией. Вовремя распознать болезнь намного проще, чем лечить ее, поэтому своевременная диагностика необходима.
Бактериологический анализ, физический способ культивирования анаэробов, бактериологический метод диагностики
Бактериологический метод (бактериологический анализ)
Классический бактериологический анализ отделяемого из влагалища позволяет оценить как качественный, так и количественный состав бактериальной микрофлоры. Дифференциация и идентификация микроорганизмов – определение родовой, видовой и типовой принадлежности микроорганизмов является наиболее трудоемким и ответственным этапом бактериологического исследования. Он осуществляется на основании изучения целого комплекса свойств: морфологических, тинкториальных, культуральных, ферментативных и антигенных.
Он осуществляется на основании изучения целого комплекса свойств: морфологических, тинкториальных, культуральных, ферментативных и антигенных.
При идентификации микроорганизмов необходимо работать только с чистой культурой, поскольку присутствие посторонних микроорганизмов может исказить результаты исследования и послужить поводом для ошибочного заключения.
Широкий спектр микрорганизмов, играющих роль в формировании микробиоценоза влагалища, а также в возникновении инфекционного процесса, требует изучения их ферментативной активности путем постановки большого количества различных биохимических реакций, позволяющих по сочетанию полученных результатов в комплексе с другими данными определить вид микроорганизма. Этот раздел работы наиболее трудоемкий, проводится в несколько этапов, требует приготовления большого количества питательных сред, дефицитных реактивов, посуды и т.д., что делает этот метод исследования достаточно дорогостоящим. В связи с этим, в настоящее время для идентификации микроорганизмов используются микрометоды – коммерческие микротест-системы или слайды для биохимической идентификации микроорганизмов различных групп.
Важным фактором, значительно влияющим на успех бактериологической диагностики БВ, является корректный способ взятия и транспортировки исследуемого материала. Так, взятие материала должно всегда осуществляться до начала лечения биотерапевтическими или антибактериальными препаратами или не ранее чем через 10 дней после окончания их приема, а также до начала проведения других местных терапевтических вмешательств. Накануне взятия материала пациентка не должна иметь половую связь. Для предотвращения гибели бактерий, чувствительных к различным факторам окружающей среды, и во избежании размножения в исследуемом материале бактерий-комменсалов транспротировка взятого материала в лабораторию должна осуществляться в максимально короткие сроки и в специальных транспортных средах. В настоящее время бактериологи располагают большим арсеналом коммерческих универсальных транспортных сред, которые способны сохранять в жизнеспособном состоянии весь спектр культивируемых микроорганизмов.
В зависимости от цели исследования, которая определяется в необходимости проведения точной количественной оценки микрофлоры или возможностью ограничиться ориентировочным (полуколичественным) методом, вагинальное отделяемое высевается на питательные среды двумя методами:
1. взятие вагинального отделяемого производится с помощью калиброванной петли (диаметр 3 мм) или ложечки Фолькмана, затем материал погружается в 1 мл жидкой транспортной среды, далее из материала готовят серийные разведения из расчета 10:1(объем/вес) и затем по 0,1 мл высевают на различные селективные питательные среды;
взятие вагинального отделяемого производится с помощью калиброванной петли (диаметр 3 мм) или ложечки Фолькмана, затем материал погружается в 1 мл жидкой транспортной среды, далее из материала готовят серийные разведения из расчета 10:1(объем/вес) и затем по 0,1 мл высевают на различные селективные питательные среды;
2. взятие вагинального отделяемого производится микробиологическим тампоном и засевается на среду обогощения (тиогликолевая среда) и на половину чашки Петри с селективной питательной средой с последующим рассевом (метод истощения).
Степень роста в первом случае определяется в пересчете на 1 мл вагинального отделяемого (КОЕ/мл). При полуколичественной оценке используется четыре уровня (градации) микробного обсеменения:
со среды обогащения – рост только на жидкой среде, на плотной питательной среде рост отсутствует;
скудный рост – на плотной питательной среде рост до 10 колоний микроорганизмов определенного вида;
умеренный рост – на плотной питательной среде рост от 10 до 100 колоний микроорганизмов одного вида;
умеренный рост – на плотной питательной среде рост от 10 до 100 колоний микроорганизмов одного вида;
Посев проводится на набор стандартных питательных сред, позволяющих выявить максимально возможный спектр микроорганизмов. Питательные среды должны:
Питательные среды должны:
• содержать необходимые для питания микроорганизма питательные вещества;
• Иметь реакцию рН, оптимальную для выращиваемого вида микроорганизма;
• иметь достаточную влажность, так как микроорганизмы питаются по законам диффузии и осмоса;
• обладать изотоничностью;
• быть стерильными, обеспечивая тем самым возможность выращивания чистых культур микроорганизмов.
Для выделения всего спектра факультативно-анаэробных микроорганизмов и определения их количественных характеристик обычно используется агар с добавлением 5% донорской крови.
Стафилококки представляют собой широко распространенную в природе группу микроорганизмов, объединяющую в себе наряду с сапрофитическими и болезнетворные формы с различно выраженной степенью их патогенности и вирулентности. В связи с этим, выделение стафилококков из вагинального содержимого, содержащего смешанную флору, не может являться доказательством их этиологического значения.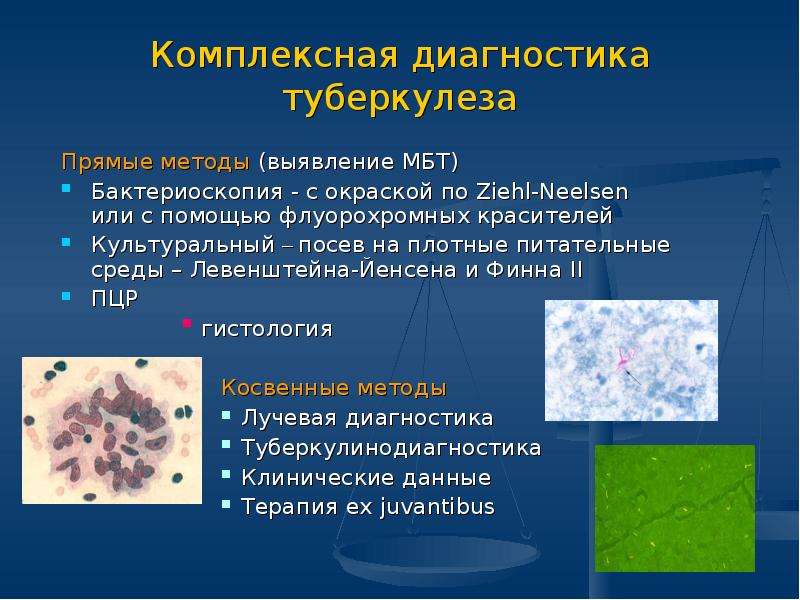 Только выделение монокультуры стафилококка из закрытых гнойных очагов, независимо от свойств штамма является бесспорным доказательством его патогенности. Для выделения стафилококков используют отечественные питательные среды – желточно-солевой агар Чистовича, молочно-солевой агар или коммерческую среду Staphylococcus agar (Becton Dickinson). Эти среды обладают элективными свойствами, обусловленными высоким содержанием хлорида натрия, а желточно-солевой агар, кроме того, позволяет более четко, чем кровяной агар, дифференцировать патогенные и непатогенные штаммы стафилококка.
Только выделение монокультуры стафилококка из закрытых гнойных очагов, независимо от свойств штамма является бесспорным доказательством его патогенности. Для выделения стафилококков используют отечественные питательные среды – желточно-солевой агар Чистовича, молочно-солевой агар или коммерческую среду Staphylococcus agar (Becton Dickinson). Эти среды обладают элективными свойствами, обусловленными высоким содержанием хлорида натрия, а желточно-солевой агар, кроме того, позволяет более четко, чем кровяной агар, дифференцировать патогенные и непатогенные штаммы стафилококка.
Стрептококки выделяют на среде Columbia agar (BioMerioux, Becton Dickinson, Oxoid) с добавлением лошадиной или бараньей дефибринированной крови (5%), налидиксовой кислоты (15 мг/л) и колистина (10 мг/л). Кроме стрептококков на этой среде растут коагулазопозитивные стафилококки. В связи с этим, перед идентификацией бактерии необходимо исследовать на наличие каталазы.
Для выделения энтерококков (стрептококки группы D) используют Enterococcus agar (Serva), Enterococcus agar (Difco), Slanes and Bartley agar или Bile Esculine agar (Oxoid). При проведении количественного исследования посев производится из исходного материала в разведениях 10-3 и 10-5. Во все среды, кроме Bile Esculine agar входит трифенилтетразолий хлорид (ТТХ), который, расщепляясь энтерококками, придает их колониям характерную розовую или малиновую окраску. В состав среды Bile Esculine agar входят соли желчи, к которым устойчивы энтерококки. Кроме того, в среду входят эскулин и цитрат железа. Энтерококки (энтерококк фекалис) способны гидролизовать эскулин с образованием эскулетина и глюкозы. Эскулетин, связываясь с цитратом железа, образует комплекс черного цвета, который придает характерную черную окраску колониям энтерококков и среде вокруг них.
При проведении количественного исследования посев производится из исходного материала в разведениях 10-3 и 10-5. Во все среды, кроме Bile Esculine agar входит трифенилтетразолий хлорид (ТТХ), который, расщепляясь энтерококками, придает их колониям характерную розовую или малиновую окраску. В состав среды Bile Esculine agar входят соли желчи, к которым устойчивы энтерококки. Кроме того, в среду входят эскулин и цитрат железа. Энтерококки (энтерококк фекалис) способны гидролизовать эскулин с образованием эскулетина и глюкозы. Эскулетин, связываясь с цитратом железа, образует комплекс черного цвета, который придает характерную черную окраску колониям энтерококков и среде вокруг них.
Для выделения грамотрицательных неспорообразующих факультативно-анаэробных бактерий обычно используют среды MACCONKEY agar или Эндо (Oxoid, BioMerioux, Becton Dickinson). При количественном методе исследования посевы на эти среды осуществляют из разведений 10-5 и 10-7. При учете колоний отмечают отдельно лактозонегативные и лактозопозитивные колонии.
Для выделения дрожжеподобных грибов используется среда Сабуро с добавлением хлорамфеникола (400 мг/л). При проведении количественного исследования посев производят из разведения 10-3. Инкубация посевов проводится в течении 24-48 часов при температуре +370С.
Для выделения G.vaginalis используют коммерческие селективные питательные среды Columbia CNA agar (Becton Dickinson), Gardneralla vaginalis agar (Oxoid) или HBT Bilayer medium (BBL) в которые добавляется 10% бараньей или донорской крови. Инкубация посевов проводится при 370С в атмосфере с 5% СО2 в течение 48 часов.
Для транспортировки биологического материала при бактериологическом исследовании на микоплазмы используют только специальные транспортные среды, содержащие лошадиную сыворотку и дрожжевой экстракт производства BioMerioux или Becton Dickinson. Посев материала производится на плотную питательную среду A7 (BioMerioux, Becton Dickinson). Для культивирования, идентификации, количественного определения и определения чувствительности к антибиотикам микоплазм могут быть использованы тест-системы — Mycoplasma DOU (Sanofi Diagnostics Pasteur) или Mycoplasma IST (BioMerioux).
Для выделения лактобактерий чаще всего используют агаризованные среды MRS (Difco, Oxoid). При количественном методе исследования посев проводят из разведений 10-3 и 10-5. Для того чтобы избежать роста дрожжеподобных грибов рода Candida в среду добавляют раствор сорбиновой кислоты в 1 М NaOH из расчета 14 г/л, простерилизованную фильтрованием. Инкубацию проводят в анаэростате с газовой смесью без палладиевого катализатора при +370С в течении 48 часов.
Изоляция анаэробных бактерий остается самой деликатной процедурой. Для выращивания анаэробов необходимо создать определенные условия, сущность которых заключается в удалении молекулярного кислорода из питательной среды и пространства, окружающего эти культуры. Среды должны быть приготовлены ex tempore или, в том случае, если они приготовлены заранее, должны храниться в условиях анаэробиоза. Другим обязательным условием, обеспечивающим выделение анаэробов из исследуемого материала, является внесение большого количества посевного материала в питательную среду.
Самым простым способом удаления растворенного кислорода из питательной среды является кипячение. Непосредственно перед посевом материала пробирки с питательными средами кипятят в водяной бане в течение 10-20 минут. При кипячении из среды вытесняется воздух и, следовательно, удаляется кислород. Свежеприготовленную питательную среду быстро охлаждают, погружая в лед или подставляя под струю холодной воды, чтобы не дать ей насытиться кислородом воздуха, и используют для посева. Для уменьшения диффузии кислорода из воздуха питательные среды заливают сверху стерильным вазелиновым или парафиновым маслом (толщина слоя 1-1,5 см). Посев биологического материала производят пипеткой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу, аскорбиновую кислоту, цистеин, гликокол, глютатион. Активно связываются с кислородом животные ткани паренхиматозных органов. На этом свойстве животных клеток основано приготовление питательной среды Китта-Тароцци, широко применяемой для выращивания анаэробов. В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
В жидкие питательные среды помещают иногда пористые вещества: вату, пемзу, которые адсорбируют на своей поверхности пузырьки воздуха.
Для создания бескислородных условий используют физические, химические и биологические факторы.
Физический способ культивирования анаэробов
Способ Виньяля-вейона. Берут 4-5 пробирок с 0,5% расплавленным и охлажденным до температуры 40-450С сахарным агаром. В содержимое одной из них вносят пипеткой небольшое количество исследуемого материала и тщательно размешивают. Для уменьшения концентрации материала с целью получения изолированных колоний засеянную среду в количестве, соответствующем объему внесенного материала, переносят из 1-й пробирки во 2-ю, из 2-й в 3-ю. Затем содержимым каждой пробирки заполняют капилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в момент насасывания ее в пипетки, кончик их, пока он не обломан, погружают на 3-5 минут в стерильную воду при температуре 45-500С. После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2-3 суток в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микрорганизма, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду.
После заполнения вытянутый конец трубки запаивают и помещают в стеклянный цилиндр с ватой на дне. Через 2-3 суток в столбике агара вырастают ясно видимые колонии микробов-анаэробов. Выросшие колонии легко изолировать. Для этого капилляр надрезают напильником выше уровня намеченной колонии, надламывают, а колонию микрорганизма, находящуюся в агаре, извлекают петлей и пересевают в свежую питательную среду.
Выращивание анаэробов в условиях вакуума. Вакуумные условия для выращивания анаэробов создают в анаэростате или эксикаторе. Исследуемый материал или культуру микроорганизмов засевают в пробирки с жидкой средой или на чашки Петри с плотной питательной средой. Сразу после посева чашки со средами помещаются в микроанаэростат с палладиевым катализатором (Oxoid) для поглощения кислорода и индикатором для выявления свободного кислорода (Disposable anaerobic indicator BBL, Becton Dickinson). Катализатор перед употреблением регенерируют в сухожаровом шкафу при температуре +175-1800С в течение часа. Затем микроанаэростат закрывают, удаляют из него воздух при помощи вакуумного насоса, после чего микроанаэростат заполняют нулевым поверочным азотом. Вновь удаляют газ из микроанаэростата, заполняют его газовой смесью (10% СО2, 10% Н2, 80% N2) и помещают в термостат. Анаэробные условия в микроанаэростате могут быть созданы и при использовании коммерческих газогенерирующих пакетов для анаэробов (BioMerioux; Becton Dickinson). После 48 часов инкубации проводят первый учет чашек с отсевом типичных колоний на жидкие питательные среды для анаэробов (Rosenow cysteine, Diagnostics Pasteur; Schadler with Vitamin K1, BBL, Becton Dickinson; Thioglycolate, Serva) для изучения культуральных свойств микроорганизмов и последующей идентификации, а также отсевов на плотные питательные среды, которые затем культивируют в аэробных условиях, чтобы убедиться, что выросшие микроорганизмы не являются факультативно-анаэробными. После первого учета чашки возвращают в микроанаэростат и инкубируют еще в течение 72 часов.
Затем микроанаэростат закрывают, удаляют из него воздух при помощи вакуумного насоса, после чего микроанаэростат заполняют нулевым поверочным азотом. Вновь удаляют газ из микроанаэростата, заполняют его газовой смесью (10% СО2, 10% Н2, 80% N2) и помещают в термостат. Анаэробные условия в микроанаэростате могут быть созданы и при использовании коммерческих газогенерирующих пакетов для анаэробов (BioMerioux; Becton Dickinson). После 48 часов инкубации проводят первый учет чашек с отсевом типичных колоний на жидкие питательные среды для анаэробов (Rosenow cysteine, Diagnostics Pasteur; Schadler with Vitamin K1, BBL, Becton Dickinson; Thioglycolate, Serva) для изучения культуральных свойств микроорганизмов и последующей идентификации, а также отсевов на плотные питательные среды, которые затем культивируют в аэробных условиях, чтобы убедиться, что выросшие микроорганизмы не являются факультативно-анаэробными. После первого учета чашки возвращают в микроанаэростат и инкубируют еще в течение 72 часов. Затем повторно изучают морфологию колоний, обращая особое внимание на появление черного пигмента, и производят отсев в жидкие питательные среды материал из тех колоний, которые отсутствовали при первом учете чашек, т. е. через 48 часов инкубации.
Затем повторно изучают морфологию колоний, обращая особое внимание на появление черного пигмента, и производят отсев в жидкие питательные среды материал из тех колоний, которые отсутствовали при первом учете чашек, т. е. через 48 часов инкубации.
Микроаэрофилы (G.vaginaluis и Lactobacillus sp.) выращиваются в условиях пониженного содержания О2 в атмосфере СО2 в эксикаторе.
Анаэростат – прибор для выращивания микроорганизмов в анаэробных условиях – представляет собой толстостенный металлический цилиндр с герметически привинчивающейся крышкой, на которой имеются вакууметр и два крана для присоединения к вакуум-насосу.
Коммерческие микроанаэростаты (BbioMerioux, Becton Dickinson, Oxoid) представляют собой пластиковые цилиндры различного объема с металлическими плотно закрывающимися крышками, на которых также имеются вакууметр и два крана.
Химические методы выращивания анаэробов
(Метод Аристовского)
Материал, исследуемый на наличие анаэробов, засевают на среду в чашки Петри и помещают их в эксикатор, на дно которого кладут химический поглотитель кислорода: гидросульфат натрия или пирогаллол. В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор помещают в термостат при температуре 370С на 24-48 часов.
В расширенную часть сосуда устанавливают на подставке чашки с посевами. Прибор помещают в термостат при температуре 370С на 24-48 часов.
Биологический метод выращивания анаэробов
(по Фортнеру)
В чашку Петри наливают толстым слоем 5% кровяной агар с 1-2% глюкозы. Посередине чашки в питательной среде вырезают стерильным скальпелем канавку шириной 1-1,5 см, которая делит питательную среду на две половины. Одну из них засевают культурой анаэробов или исследуемым на их наличие биологическим материалом, другую половину – культурой аэробов: Serratia marcescens или E.coli. Перед посевом чашки подсушивают в термостате, чтобы анаэробы вместе с капельками влаги не могли попасть на другую сторону чашки. Засеянные чашки закрывают, а свободное пространство между дном и крышкой заклеивают лейкопластырем, чтобы предупредить поступление в чашку кислорода извне. В термостате чашки устанавливают вверх дном. Быстрорастущие аэробы, поглощая находящийся в чашке кислород, создают тем самым благоприятные условия для роста анаэробов.
Большинство грамотрицательных анаэробных бактерий могут быть изолированы на средах с добавлением канамицина (100 мг/л), ванкомицина (7,5 мг/л), гемина (10 мг/л), витамина К3 (менадион, 1,5 мг/л) или К1(фитоменадион, 1,5 мг/л), а также бараньих эритроцитов (5%). К базовым относятся среды Columbia agar Base (BBL, Becton Dickinson; BioMerioux), Schaedler agar или Wilkins Chalgren agar (Oxoid). При количественном методе исследования материал засевают из 10-6, 10-7 и 10-8 разведений. Срок инкубирования составляет 48 часов при температуре 350С.
Для выделения бифидобактерий используют среду Блаурокка. Для предотвращения роста аэробных бактерий в среду добавляют азид натрия в концентрации 100 мг/л. При количественном методе исследования посев производят из 10-5, 10-7 и 10-9 разведений. При полуколичественном методе исследования посев проводят методом агаровых столбиков в полужидкой питательной среде, либо на плотной питательной среде на чашке Петри. Инкубацию проводят в микроанаэростате при +370С в течении 48 часов. В том случае, если посев производился в толщу среды, после инкубации отмечают образование зоны задержки роста и газообразование. В агаре бифидобактерии образуют характерные колонии, напоминающие гречишные зерна, но могут также образовывать колонии в форме дисков.
В том случае, если посев производился в толщу среды, после инкубации отмечают образование зоны задержки роста и газообразование. В агаре бифидобактерии образуют характерные колонии, напоминающие гречишные зерна, но могут также образовывать колонии в форме дисков.
Грамположительные анаэробные кокки выделяют на базовых средах (Columbia agar Base и др. см. выше), с добавлением бараньей крови (5%), налидиксовой кислоты (10 мг/л) и колистина (10 мг/л) или фенилэтилалкола (2,5 г/л).
Выделение бактерий рода Mobiluncus проводят с использованием Columbia agar Base с добавлением 2,5% лошадиной сыворотки, 15 мкг/мл налидиксовой кислоты и 1,0 мкг/мл тинидазола. Возможно использование и другой селективной среды – Columbia agar Base с добавлением 5% бараньей крови, 10 мкг/мл колистина и 15 мкг/мл налидиксовой кислоты. Инкубация посевов производится в анаэробных условиях 4-5 дней при температуре +370С.
Для выделения клостридий используют плотную среду RCM (Oxoid). В прбирки с расплавленной средой, разлитой по 9 мл и охлажденной до +480С, засевают взятый материал (при количественном методе исследования посев производят из 10-3, 10-5 и 10-7 разведений). Быстро ресуспендируют, затем в каждую пробирку добавляют небольшое количество (1,5 см) расплавленной среды RCM, содержащей метиленовую синьку в концентрации 1:20000 для того, чтобы предохранить среду от диффузии кислорода. Учет результатов производится через 16-18 часов инкубации. Для выделения C.perfringens используют селективную питательную среду TSC (Oxoid). В среду добавляют Д-циклодекстрин (400 мг/л) и эмульсию яичного желтка (50 мг/л) (Oxoid). С.perfringens на этой среде приобретают черный цвет, из за содержания в ней метабисульфита натрия и цитрата железа. Наличие эмульсии яичного желтка позволяет различить лецитиназопозитивные клостридии.
Быстро ресуспендируют, затем в каждую пробирку добавляют небольшое количество (1,5 см) расплавленной среды RCM, содержащей метиленовую синьку в концентрации 1:20000 для того, чтобы предохранить среду от диффузии кислорода. Учет результатов производится через 16-18 часов инкубации. Для выделения C.perfringens используют селективную питательную среду TSC (Oxoid). В среду добавляют Д-циклодекстрин (400 мг/л) и эмульсию яичного желтка (50 мг/л) (Oxoid). С.perfringens на этой среде приобретают черный цвет, из за содержания в ней метабисульфита натрия и цитрата железа. Наличие эмульсии яичного желтка позволяет различить лецитиназопозитивные клостридии.
Культуральные признаки микрооганизмов определяются характером их роста на питательных средах. Будучи постоянными для каждого вида микроорганизма, они являются важным диагностическим признаком.
Идентификация выделенных чистых культур бактерий в зависимости от целей может быть ориентировочной (определение рода) или финальной (определение вида).
Видовая идентификация выделенных чистых культур бактерий проводится общепринятыми методами с использованием номенклатуры Берджи и сведений, обобщенных в руководствах по клинической микробиологии.
При видовой идентификации стафилококков учитываются пигмент, способность гемолизировать эритроциты, продуцировать лецитиназу, коагулировать плазму. Характерная пигментация колоний патогенных стафилококков, относящиеся к виду S. aureus, определяется при их росте на селективной питательной среде, содержащей высокую концентрацию NaCl (7,5%), маннит в качестве источника углеводов и желатин. Патогенные стафилококки, дают на этой среде колонии с желтой пигментацией. Ферментацию маннита определяют путем нанесения на изолированную колонию капли раствора бромтимолового синего (0,04%). В случае смены цвета красителя на желтый реакция считается положительной. На этой же среде возможно определение способности стафилококков сбраживать желатину. Для этого на изолированную колонию наносят каплю 20% водного раствора сульфосалициловой кислоты (реакция Stone). В случае положительной реакции через 10 минут вокруг колонии появляется прозрачная зона. Для подтверждения принадлежности бактерий к виду S.aureus проводятся тесты на выявление плазмокоагулазы и ДНК-азы. ДНК-азная активность выявляется на среде DNA agar (Oxoid) путем пересева материала из подозрительных колоний штрихами от центра к краю чашки. После инкубирования нуклеазная активность стафилококков выявляется при нанесении на среду красителя толуидинового синего (0,1%), при этом вокруг колоний, образованных S. aureus, появляется зона порозовения среды. Для подтверждения принадлежности стафилококков к виду S.aureus можно также воспользоваться идентификационными системами Staphyslide – Test (BioMerioux), принцип работы которых основан на агглюцинации эритроцитов, сенсибилизированных человеческим фибриногеном. Биохимическая идентификация стафилококков проводится при помощи тест-систем API 20 Staph и RAPIDEC staph (BioMerioux).
В случае положительной реакции через 10 минут вокруг колонии появляется прозрачная зона. Для подтверждения принадлежности бактерий к виду S.aureus проводятся тесты на выявление плазмокоагулазы и ДНК-азы. ДНК-азная активность выявляется на среде DNA agar (Oxoid) путем пересева материала из подозрительных колоний штрихами от центра к краю чашки. После инкубирования нуклеазная активность стафилококков выявляется при нанесении на среду красителя толуидинового синего (0,1%), при этом вокруг колоний, образованных S. aureus, появляется зона порозовения среды. Для подтверждения принадлежности стафилококков к виду S.aureus можно также воспользоваться идентификационными системами Staphyslide – Test (BioMerioux), принцип работы которых основан на агглюцинации эритроцитов, сенсибилизированных человеческим фибриногеном. Биохимическая идентификация стафилококков проводится при помощи тест-систем API 20 Staph и RAPIDEC staph (BioMerioux).
Видовая идентификация стрептококков основана на их биохимической активности и может быть проведена при использовании тест-системы API 20 Strept (BioMerioux).
Видовая идентификация грамотрицательных неспорообразующих факультативно-анаэробных бактерий производится при помощи тест систем API 20E (BioMerioux). Оксидазопозитивные бактерии (Pseudomonas spp., Aeromonas spp. и др.) идентифицируются с помощью тест системы API 20NE (BioMerioux). Для идентификации лактозопозитивных бактерий могут быть использованы тест-системы Enterofermtub, а лактозонегативных Oxifermtub (BioMerioux, Becton Dickinson). Кроме того, для идентификации всех грамотрицательных бактерий может быть использована тест-система BBL CRYSTAL (Becton Dickinson) или полуавтоматическая система «Sceptor» (Becton Dickinson) с использованием полистироловых планшетов для видовой идентификации грамотрицательных факультативно-анаэробных бактерий.
При отсутствии вышеперечисленных тест-систем энтеробактерии могут быть идентифицированы с помощю 12 биохимических тестов, которые выявляют:
• способность энтеробактерий ферментировать глюкозу, лактозу, мальтозу,
• маннит, сахарозу;
• способность расти на цитратном агаре Симмонса;
• отношение к мочевине и молонату натрия;
• подвижность и способность продуцировать сероводород и индол.
Для видовой идентификации C.albicans, обладающей способностью продуцировать характерные для них хламидоспоры, подозрительные колонии (белые или розовые) пересевают со среды Сабуро на среду PCB (Diagnostics Pasteur) методом укола в толщу среды. Пробирки с пересевами инкубируют при комнатной температуре 24-48 часов. После инкубации определяют небольшой участок в зоне роста микроорганизмов и делают разветвленный мазок между двумя стеклами. Мазки изучают с помощью темнопольной микроскопии, при этом хламидоспоры ищут в зонах образования филаментов с находящимися на них бластоспорами. В случае отсутствия хламидоспор проводят повторный пересев. Если при этом вновь получают отрицательный результат, проводят биохимическую идентификацию дрожжеподобных грибов при помощи системы API 20C Aux (BioMerioux) или Micotube (BioMerioux, Becton Dickinson). Также видовая идентификация грибов рода Candida может быть проведена с помощью микробиологической системы Quantum (Abbot).
При идентификации гарднереллы учитывается морфология колоний на селективной питательной среде через 2-4 дня инкубации.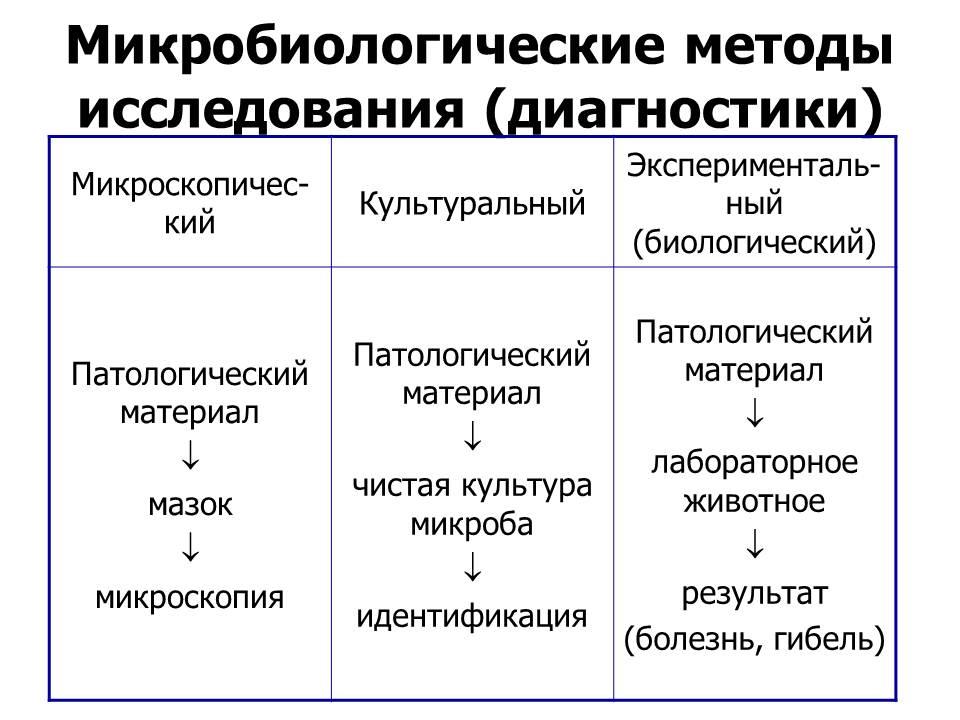 Обычно колонии бывают выпуклыми, шарообразными с гемолизом. При микроскопии – мелкие палочки или коккобациллы, по отношению к окраске по Граму – грамвариабильные. Каталазо- и оксидазоотрицательные, продуцируют кислоту при гидролизе крахмала и мальтозы, чувствительны к метронидазолу и триметоприму.
Обычно колонии бывают выпуклыми, шарообразными с гемолизом. При микроскопии – мелкие палочки или коккобациллы, по отношению к окраске по Граму – грамвариабильные. Каталазо- и оксидазоотрицательные, продуцируют кислоту при гидролизе крахмала и мальтозы, чувствительны к метронидазолу и триметоприму.
Ориентировочная идентификация лактобактерий проводится микроскопическим методом (окраска мазка по Граму), которая позволяет оценить морфологию клеток. В мазках лактобактерии имеют вид прямых палочек, расположенных в виде блоков, не имеют спор. Бактерии рода Lactobacillus не образуют каталазы и оксидазы.
Идентификация факультативно-анаэробных лактобактерий проводится с помощью систем индикаторных бумажных для идентификации лактобактерий (СИБ-Л) и планшета биохимического, дифференцирующего лактобактерии (ПБДЛ) (НИИЭМ, г. Нижний Новгород). Идентификации подвергаются грамположительные каталазоотрицательные палочки, выросшие через 48 часов на среде MRS. Для выделения чистой культуры проводится двукратное пассирование отдельных колоний. Дифференциация основана на выявлении ферментативных свойств штаммов по их действию на углеводы и многоатомные спирты (глюкоза, меллибоза, манноза, мелецитоза, рамноза, салицин). Учет результатов проводится через 72 часа инкубации при температуре +370С. Интерпритация результатов биохимического тестирования производится при помощи таблиц биохимических свойств лактобактерий.
Дифференциация основана на выявлении ферментативных свойств штаммов по их действию на углеводы и многоатомные спирты (глюкоза, меллибоза, манноза, мелецитоза, рамноза, салицин). Учет результатов проводится через 72 часа инкубации при температуре +370С. Интерпритация результатов биохимического тестирования производится при помощи таблиц биохимических свойств лактобактерий.
Анаэробные штаммы лактобактерий идентифицируются с помощью полуавтоматической системы «Sceptor» (Becton Dickinson), после предварительного исключения способности тестируемых бактерий к спорообразованию.
Ориентировочная идентификация облигатно-анаэробных грамотрицательных бактерий проводится по следующим критериям: рост в присутствии желчи (диски 5 мг, BioMerioux), бриллиантового зеленого (диски 100 мкг, BioMerioux) и канамицина (диски 1000 мкг, BBL, Becton Dickinson), ферментация глюкозы, наличие черного пигмента. Используя эти тесты, бактерии делят на 4 группы:
1 группа — Bacteroides fragilis. Все бактерии этой группы сбраживают глюкозу и способны расти в присутствии желчи и канамицина, бриллилантовый зеленый подавляет их рост;
Все бактерии этой группы сбраживают глюкозу и способны расти в присутствии желчи и канамицина, бриллилантовый зеленый подавляет их рост;
2 группа – бактерии рода Prevotella. Бактерии этой группы растут в присутствии канамицина, но не растут в присутствии желчи и бриллиантового зеленого, обладают сахаролитической активностью – сбраживают глюкозу. Некоторые виды могут образовывать черный пигмент на кровяных средах после 5-7 дней инкубации;
3 группа – род Porphyromonas. Асахоролитические бактерии, не растущие в присутствии желчи и бриллиантового зеленого, но растущие в присутствии канамицина, образуют черный пигмент. Бактерии этой группы чувствительны еще и к ванкомицину (диски 5 мкг, BBL, Becton Dickinson).
4 группа – бактерии рода Fusobacterium. Эти бактерии не растут в присутствии желчи и канамицина, но растут в присутствии бриллиантового зеленого.
Для выявления группы Prevotella melaninogenica/ Porphyromonas asacharolytica и некоторых других строгих анаэробов (Fusobacterium spp.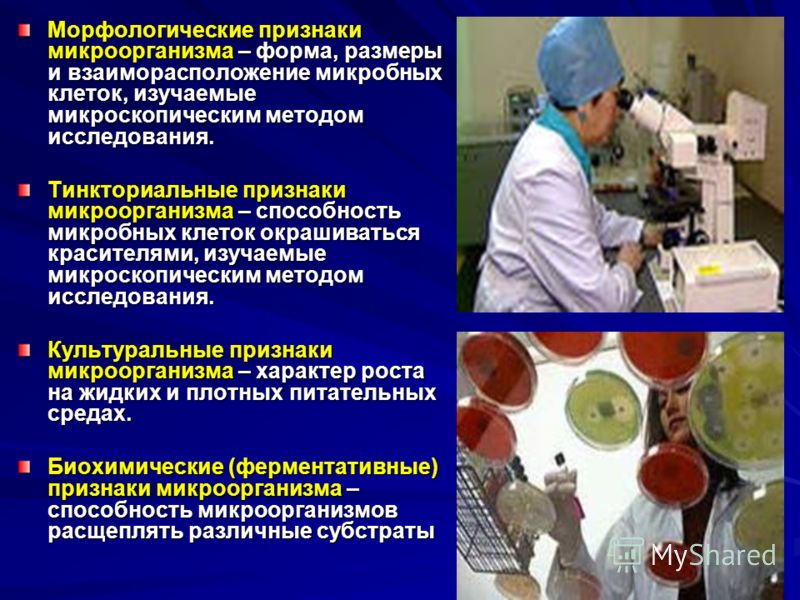 , Clostridium dificile) первичные посевы возможно исследовать в лучах длинноволнового ультрафиолетового излучения, при использовании люминисцентного микроскопа с фильтрами ФС 1-2 и СЗС 24-4. При наличии микроорганизмов группы Pr.melaninogenica / P.asacharoliticus колонии светятся малиновым цветом. Зеленое свечение характерно для Fusobacterium spp. или Clоstridium dificile.
, Clostridium dificile) первичные посевы возможно исследовать в лучах длинноволнового ультрафиолетового излучения, при использовании люминисцентного микроскопа с фильтрами ФС 1-2 и СЗС 24-4. При наличии микроорганизмов группы Pr.melaninogenica / P.asacharoliticus колонии светятся малиновым цветом. Зеленое свечение характерно для Fusobacterium spp. или Clоstridium dificile.
Финальная идентификация облигатно-анаэробных грамотрицательных бактерий проводится с применением биохимической идентификационной системы для этих бактерий API (BioMerioux), а также на полуавтоматической системе «Sceptor» (Becton Dickinson) c использованием полистироловых планшетов для грамотрицательных облигатно-анаэробных бактерий.
Грамположительные анаэробные кокки могут быть идентифицированы на основании их чувствительности к новобиоцину (диски 25 мкг) и по их биохимическому профилю с применением биохимической идентификационной системы rapid ID32 A (API – BioMerioux) или полуавтоматической системы «Sceptor» (Becton Dickinson) с использованием полистироловых планшетов для видовой идентификации грамположительных анаэробных кокков.
Ориентировочная идентификация бифидобактерий проводится микроскопическим методом (окраска мазка по Граму), который позволяет оценить морфологию клеток. В мазках бифидобактерии обычно имеют вид прямых или разветвленных палочек X,Y и V-образной формы с утолщениями на концах. Бактерии рода Bifidobacterium синтезируют фермент фруктозо-6-фосфатфосфокетолазу (Ф6-ФФК), не образуют индол и каталазу, не восстанавливают нитраты, не сбраживают адонит (рубит), дульцит, эритрит, глицерин, рамнозу и альфа-метил-D-маннозид.
Биохимическая идентификация клостридий может быть осуществлена при помощи идентификационных систем API 20A или RapID Ana II (BioMerioux).
Видовая идентификация гарднерелл проводится по морфологическим критериям (окраска по Граму – грамвариабельные коккобациллы) и на основании биохимической идентификации при помощи идентификационных систем API 20 Strep или API Zym (BioMerioux).
Ввиду отсутствия единых представлений о показателях нормы из-за, прежде всего, технической сложности культивирования облигатно-анаэробных и микроаэрофильных микроорганизмов в настоящее время не определены четкие критерии нормоценоза вагинальной микрофлоры, пограничных состояний и БВ. Чаще всего при бактериологической диагностике вагинального отделяемого используются следующие критерии:
Чаще всего при бактериологической диагностике вагинального отделяемого используются следующие критерии:
Нормоценоз
• общее количество микроорганизмов в вагинальном отделяемом составляет 106-108 КОЕ/мл;
• абсолютное преобладание лактобактерий;
• условно-патогенные микроорганизмы в низком титре — <104 КОЕ/мл;
Бактериальный вагиноз
• массивное микробное обсеменение вагинального отделяемого с общим количеством микроорганизмов, превышающим 109 КОЕ/мл;
• отсутствие лактобактерий или резкое снижение их титра до 104 КОЕ/мл и менее;
• полимикробный характер микрофлоры с абсолютным преобладанием облигатно-анаэробных микроорганизмов и G.vaginalis [17].
При проведении классического бактериологического исследования необходимо учитывать тот факт, что само по себе обнаружение отдельных видов облигатных анаэробов и G.vaginalis не всегда равнозначно микробиологическому диагнозу БВ, т. к. G.vaginalis и облигатно-анаэробные микроорганизмы могут быть частью индигенной микрофлоры. Поэтому, бактериологический анализ должен, в первую очередь, основываться на интегральной оценке микрофлоры с учетом не только ее видового и количественного состава, но и количественного соотношения отдельных ее компонентов.
к. G.vaginalis и облигатно-анаэробные микроорганизмы могут быть частью индигенной микрофлоры. Поэтому, бактериологический анализ должен, в первую очередь, основываться на интегральной оценке микрофлоры с учетом не только ее видового и количественного состава, но и количественного соотношения отдельных ее компонентов.
Микробиологические методы лабораторной диагностики инфекционных заболеваний
1. микробиологические методы лабораторной диагностики инфекционных заболеваний
Микроскопическийметод
Микробиологи
ческий метод
Иммунологический
(серологический и
аллергологический)
Молекулярногенетический
Биологический
метод
3. диагностику инфекционных заболеваний
микробиологическиеметоды исследования
направлены на
диагностику
инфекционных
заболеваний
цель
микробиологических
исследований:
установить факт
наличия или отсутствия
возбудителя
инфекционных заболеваний
в организме больного
или на объектах
внешней среды
задачи микробиологических
исследований:
• обнаружить инфекционного
агента в исследуемом
материале
• идентифицировать микробного
агента
• интерпретировать результаты
исследования
6.
 основу микробиологической диагностики составляет правильный отбор биологического материала для исследования выбор материала для исследования
основу микробиологической диагностики составляет правильный отбор биологического материала для исследования выбор материала для исследованиядолжен соответствовать:
►патогенезу заболевания
выбор материала для исследования
должен соответствовать:
►биологическим свойствам
возбудителя
выбор материала для исследования
должен соответствовать:
►эпидемиологии возбудителя
• клинический материал
отбирают в соответствие
с локализацией инфекции
в организме больного
(при поражениях отдельных
органов и систем)
• при отсутствии клинически
выраженного инфекционного
поражения исследуют кровь,
а затем отбирают образцы
биологического материала с учётом
клинической картины заболевания
и доступности взятия материала для
исследования
• образцы клинического
материала забирают до
начала антимикробной
терапии с соблюдением
правил асептики
общие требования к процедуре
отбора и транспортировки:
• каждый клинический материал
следует рассматривать как
потенциально опасный,
вследствие этого при заборе,
транспортировке, хранении и
работе с ним необходимо
соблюдать правила
биологической безопасности
общие требования к процедуре
отбора и транспортировки:
• клинический материал
следует забирать в объёме,
достаточном для всего
комплекса
микробиологических
исследований
общие требования к процедуре
отбора и транспортировки:
• микробиологические
исследования следует
начинать немедленно после
поступления образца в
микробиологическую
лабораторию
исследуемого материала
в лабораторию
►своевременность
доставки
► неизменность образца
термоконтейнер:
лед
ледяная вода
сухой лед
или
+ 37°C
17. направление
Министерство здравоохраненияНаименование учреждения:
Областная клиническая больница
г. Иркутск, ул. Юбилейный 100.
Код формы по ОКУД
Код учреждения по ОКПО
Медицинская документация
Форма N 204/У
Утверждена Минздравом СССР
04.10.80 N 1030
Направление
на микробиологическое исследование
«____»_________________20___г.___________час____мин___________
в_______________________________
лабораторию
Ф.И.О. ____________________________ возраст ____________________
Медицинская карта N _________________________________________
Отделение _______________ палата _____________________________
Диагноз, дата заболевания: _____________________________________
Показания к обследованию: больной, переболевший, реконвалесцент,
контактный, профилактическое обследование (подчеркнуть, вписать)
______________________________________________________________
Материал: кровь, моча, мокрота, кал, дуоденальное содержимое,
пунктат, мазок, соскоб, раневое содержимое, гной, секционный материал,
______________________________________________________________
Цель и наименование исследования:_____________________________
(на какие инфекции исследовать)
Должность и фамилия лица, направляющего материал: __________
—————————————————-Результат исследования №_____
При исследовании______________________________________________
(наименование материала)
______________________________________________________________
Дата выдачи:”_____”_________20_____г. Подпись_________________
18. микробиологические методы исследования:
19. микробиологические методы исследования
направлены на:прямое обнаружение
возбудителя
инфекционного заболевания
в клиническом материале
обследуемого
косвенное определение
возбудителя
инфекционного заболевания
в клиническом материале
обследуемого
адекватный
метод
исследования
клинический материал
20. прямое обнаружение возбудителя инфекционного заболевания в клиническом материале обследуемого:
микроскопический методкультуральный метод
экспресс методы
21. микроскопический метод это самостоятельный метод исследования, позволяющий определить в клиническом материале обследуемого
возбудителя инфекционногозаболевания на основе
морфологических особенностей
микробной клетки
22. Задачи микроскопии:
• выявление возбудителя в клиническомматериале
• идентификация на основе определения
характерных морфологических и
тинкториальных признаков
микроорганизмов
• изучение окрашенных мазков из
колоний чистых культур.
Специальное
расположение
клетки в мазке
Морфология
Микроорганизмы
Тинкториальны
е свойства
Наличие
специфических
органоидов
ь
24. Простые методы окраски микроорганизмов
Особенностьметода
Окраска одним
красителем
Одноэтапность
Назначение
метода
Изучение
величины
микроорганизмов
Изучение формы
микроорганизмов
Изучения
взаимного
расположения
25. Сложные методы окраски микроорганизмов
Особенностьметода
Многоэтапность
Использование
протравы и
дифференцирующие
вещества
Окраски двумя
красителями
Назначение
метода
Дифференцирование
одних видов
микроорганизмов
другими
Изучение
структуры
микроорганизмов
Дифференцирование
одних видов от
других
Метод ЦильНильсона
Метод Грама
Метод Романовского-Гимзы
Отличие Г+ от Гбактерий
Дифференцирование
микроорганизмов
(спирохет)
Выявление нуклеотида
Отличие
кислотоустойчивых от
кислотонеустойчивых
Обнаружение
простейших
Изучение
структуры
микроорганизмов
Метод Ожешко
Метод Леффлера
Метод Нейссера
Метод Гинса
Выявление
жгутиков
Выявление зерен
Выявление
спор
Выявление капсул
28. микроскопический метод включает:
I ЭТАПисследуемый
материал
(вид мазка зависит от
клинического
материала)
ПРИГОТОВЛЕНИЕ МАЗКА-ПРЕПАРАТА
для определения в нем
инфекционного агента
виды мазков:
►нативный
мазок
исследуемый
материал
(вид мазка зависит от
цели исследования)
►фиксированный
мазок
«раздавленная»
капля
мазок-отпечаток
«висячая капля»
фиксированный
мазок
нативные препараты
готовят для исследования
живых неокрашенных бактерий
прижизненное определение
микробов проводят
при микроспопии
в темном поле или фазовоконтрастным методом
31. для приготовления фиксированных препаратов в зависимости от клинического материала используют разные методы фиксации мазка
фиксацияхимическая
мазки погружают на 5-20 мин.
►в метиловый
► этиловый спирт
► смесь Никифорова
► сулемовый спирт
► другие фиксирующие
жидкости
Физическая
мазки фламбируют через
пламя спиртовки 3 раза
II ЭТАП
ОКРАШИВАНИЕ ПРЕПАРАТА
простой
метод
сложный
метод
(в зависимости от
цели исследования)
33. — метод Грама — метод Циля – Нильсена — метод Романовского-Гимзе
дифференцирующие методы:(позволяют выявить тинкториальные свойства микробов)
— метод Грама
— метод Циля – Нильсена
— метод Романовского-Гимзе
специальные методы окраски применяют
для окрашивания различных
морфологических структур:
окраска по Бурри-Гинсу для
обнаружения капсул
на темном фоне препарата контрастно
выделяются неокрашенные капсулы,
внутри которых находятся бактерии
ярко-малинового цвета
мазок из чистой
культуры
Klebsiella
pneumoniae
для обнаружения
жгутиков
используют
прямой метод
Леффлера
или темнопольную
и фазовоконтрастную
микроскопию
37. метод Ожешко позволяет обнаружить споры
споры B. anthracis, окрашеныв рубиново-красный цвет,
палочки – в фиолетовый
III ЭТАП
МИКРОСКОПИЯ ПРЕПАРАТА
МИКРОСКОПИЯ в
микробиологии
световая
электронная
сканирующая
зондовая
IY ЭТАП
ЗАКЛЮЧЕНИЕ ПО РЕЗУЛЬТАТАМ
ИССЛЕДОВАНИЯ
эффективность обнаружения
микроорганизмов в мазке-препарате
определяется степенью обсемененности
им исследуемого материала: если при
обсемененности:
> 106 кл/мл –
обнаружение микроорганизмов не
встречает затруднений
104 кл/мл
обнаружение становится трудно
разрешимой задачей
обнаружение фактически неразрешимо
идентификационные
критерии
микроскопического
метода :
42. морфологические особенности микробной клетки возбудителя к числу которых относятся
►специфическая формамикробной клетки
►наличие необязательных
органоидов в структуре
микробной клетки
►специфическое
расположение
микробных клеток
в мазке
► тинкториальные
свойства
Пример:
возбудитель сифилиса
(серонегативный период)
фиксированный мазок
окраска по Романовскому-Гимзе
— тинкториальные свойства
фиксированный мазок
серебрение по Морозову
— количество завитков
мазок висячая или
раздавленная капля
микроскопия в темном поле
– специфическое движение
культуральный метод
исследования – метод выделения
чистой культуры возбудителя и
ее идентификация на основе
комплекса
его биологических свойств
культуральньй метод является
«золотым стандартом» и составляет
один из основных видов работы
микробиологической лаборатории
Задачи культурального метода исследований
1.Идентифицировать
микроорганизмы в
исследуемом
материале
2. Определить их
видовую
принадлежность
3. Установить
чувствительность к
антимикробным
препаратам (АМП)
по морфологическим,
тинкториальным, биохимическим,
токсигенным, антигенным и
культуральным свойствам
При микробиологической диагностике заболеваний, вызванных условно-патогенными
микробами, представителями нормальной микрофлоры, обязательным является
определение количества возбудителей в исследуемом материале.
Применение культурального метода
клиническая
медицина
Диагностика
инфекционных
заболеваний
эпидемиология
определение
микробоносительства и
выявление источника
инфекции
санитарная
микробиология
определение патогенных
микроорганизмов во
внешней среде и
определение санитарного
состояния объектов внешней
среды
алгоритм
культурального
метода
исследования:
I ЭТАП
посев исследуемого материала
для выделения чистой культуры
II ЭТАП
накопление и выделение
чистой культур
III ЭТАП
постановка идентификационных
тестов с целью
дифференцирования
инфекционного агента
IY ЭТАП определение комплекса
морфология
микробной клетки
биологических свойств
выделенной культуры
с целью ее
идентификации
культуральные
свойства
тинкториальные
свойства
микробной клетки
биохимические
свойства
IY ЭТАП
определение комплекса
биологических свойств
выделенной культуры
с целью ее
идентификации
разрешающая
способность метода
► повышенные требования
к транспортировке и
хранению клинического
материала
►длительные сроки
культивирования
микроорганизмов
► не все виды
микроорганизмов
можно культивировать
in vitro
59. непрямое обнаружение возбудителя инфекционного заболевания в клиническом материале обследуемого:
иммунологическийметод
60. иммунологический метод — это метод косвенного определения инфекционного агента на основе ответной реакции организма на его
иммунологический метод это метод косвенногоопределения
инфекционного агента на
основе ответной реакции
организма
на его присутствие
иммунологический
метод включает:
метод серодиагностики
(in vitro и in vivo)
аллергический метод
(in vivo)
МЕТОД СЕРОДИАГНОСТИКИ заключается в определении титра специфических
антител в сыворотке больного. Для его
реализации используют различные реакции
иммунитета, как простые (агглютинация и ее
разновидности), так и сложные (РСК, ИФА и др.).
МЕТОД СЕРОДИАГНОСТИКИ
in vitro
in vivo
МЕТОД СЕРОДИАГНОСТИКИ
in vitro
АГ
исследуемый материал
— сыворотка крови
АТ
ИК
титр АТ
Сыворотка наливается в ряд пробирок и разводится
физиологическим раствором в разных разведениях.
Затем в каждую пробирку добавляется стандартный,
известный антиген, микроб или вирус
(диагностикум). Смотрят, в каком из наибольших
разведений мутнеет сыворотка – это и будет титр
реакции для данного больного.
Чем титр больше, тем больше вероятность заболевания.
Поэтому говорят о диагностически значимых титрах
для болезни, потому что более низкие титры могут
просто говорить о случайной встрече человека с
данным микробом, но без болезни.
Для обнаружения антитела к исследуемой сыворотке
прибавляют известный антиген. Эти препараты,
называемые диагностикумами, представлят собой
взвесь убитых микроорганизмов (их отдельных
антигенов) или эритроцитов (частиц латекса), на
которых адсорбированы микроорганизмы или их
антигены.
Классическая серодиагностика основана на:
1). Определении антител к возбудителю в диагностическом
титре;
2).Обнаружение в исследуемой сыворотке крови антител к
возбудителю ряда инфекционных болезней недостаточно для
постановки диагноза, поскольку оно может отражать наличие
постинфекционного или поствакцинального иммунитета.
Именно поэтому исследуют парные сыворотки больного, взятые
в первые дни болезни и через 7-10 дней (иногда этот интервал
может быть более длительным). В этом случае оценивают
нарастание титра антител. Нарастание титра антител в 4 раза и
более свидетельствует об инфекционной природе антител.
3)При экзотических инфекционных болезнях, а
также при гепатитах, ВИЧ- инфекции и при
некоторых других заболеваниях сам факт
определения антител свидетельствует об
инфицированности пациента и имеет
диагностическое значение.
Серологический метод диагностики применяют
с конца первой-начала второй недели
заболевания.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА)
основана на использовании эритроцитов с адсорбированными
на их поверхности антигенами, взаимодействие которых с
соответствующими антителами сыворотки крови больных
вызывает склеивание и выпадение эритроцитов на дно
пробирки в виде фестончатого осадка.
При отрицательной реакции эритроциты оседают в виде
«пуговки».
критерии этиологической
значимости
инфекционного агента
в методе серодиагностике
►диагностический титр
► динамика
антителообразования
в парных сыворотках
► циркуляция в крови
иммуноглобулинов
разных классов
Ig G 1:400
Ig M Ig G 1:200
Ig M 1:400
МЕТОД СЕРОДИАГНОСТИКИ/
Аллергометод
in vivo
наличие АТ в сыворотки крови
обследуемого
проба Шика
проба Дика
наличие t-сенсибилизированных
лимфоцитов к АГ в сыворотки крови
обследуемого
проба Манту
Собственно-иммунный метод
Цель: поиск антигенов микробов в патологическом
материале с помощью серологических иммунных
реакций
Реакция агглютинации
В реакции агглютинации (РА) антиген участвует в виде
корпускулярной частицы. Это могут быть суспензии
микроорганизмов, клеток организма, например эритроцитов.
При смешивании со специфической сывороткой происходит
склеивание и оседание визуально различимых хлопьев —
иммунных комплексов.
Реакция преципитации
В реакции преципитации (РП) участвует мелкодисперсный
(растворимый антиген). При контакте с антителами —
преципитинами образуется осадок.
Реакцию преципитации можно проводить в жидкой среде (в
узких пробирках) и в геле (в чашках Петри). При постановке РП в
узких пробирках жидкость, содержащую один из реагентов,
например, прозрачный экстракт из микробных клеток (0,2 мл),
наслаивают на прозрачную преципитирующую сыворотку (0,2
мл). В положительных случаях на границе соприкосновения
жидкостей через 1—5 минут образуется серо-белое кольцо.
75. экспресс методы исследования
76. направлено на выявление возбудителя инфекционного заболевания в исследуемом материале на основе:
77. антигенных свойств
78. сероидентификация
РИФ79. МЕТОД ИММОБИЛИЗАЦИИ
мазок висячая каплядвижение
+
диагностическая
сыворотка мазок висячая капля
иммобилизация
движения
80. молекулярно-генетический метод позволяющий дифференцировать инфекционного агента в клиническом материале на основе стабильного
участка нуклеиновойкислоты
Молекулярно-генетические
методы
• Полимеразная цепная реакция (PCR)
• Методика разветвленных зондов (branched DNA)
• Транскрипционно-опосредованная амплификация
• Nucleic Acid Sequence Based Amplification (NASBA)
• Амплификация с вытеснением цепи (SDA)
• Гибридный захват (HC)
• Лигазная цепная реакция (LCR)
Другие…
QB репликаза, Биочипы
в основе
молекулярно-генетических
методов исследования
лежит уникальное
свойство НК способность
к саморепродукции,
комплементарному
достраиванию
матрицы
ДНК – универсальный носитель генетической
информации и наследственных признаков у всех
существующих на Земле организмов.
95% генетической информации
содержится в ядре клетки, в виде
хромосом (комплекса ДНК и
белков)
У человека ядерная ДНК
находится в виде 46 хромосом (23
пары), из которых 22
соматические и две половые X и Y.
5% генетической информации
содержится в органеллах
цитоплазмы – митохондриях.
Исключение — вирусы, которые
могут нести как РНК, так и ДНК
в начале 1970-х годов
норвежский учёный
Хьелль Клеппе
из лаборатории нобелевского
лауреата
Хара Гобинды Хораны
предложил
способ амплификации ДНК
с помощью пары коротких
одноцепочечных молекул ДНК —
синтетических праймеров
Хара Гобинды Хораны
практического применения
в то время эта идея не нашла
полимеразная
цепная реакция
(ПЦР) была
изобретена
в 1983 году
американским
биохимиком
Кэри Муллисом
его целью было создание метода, который бы
позволил амплифицировать ДНК в ходе многократных
последовательных удвоений исходной молекулы ДНК с
помощью фермента ДНК-полимеразы
первая публикация
по методу ПЦР
появилась в ноябре 1985
года в журнале Science
спустя 8 лет после этого
за изобретение метода ПЦР
К. Муллис получил Нобелевскую премию
87. ПЦР-диагностика включает:
I. пробоподготовкузабор исследуемого материала и
его транспортировку в лабораторию
I. пробоподготовку
экстракция ДНК (РНК) из
исследуемого образца
экстракция
(извлечении) ДНК
из биопрепаратов
и удаление или
нейтрализация
посторонних примесей
для получения ДНК с
чистотой, пригодной для
постановки реакции
амплификации
II. АМПЛИФИКАЦИЮ
специфических фрагментов ДНК
амплификация — лат. amplificatio
— увеличение, распространение
амплификатор Corbett
АМПЛИФИКАЦИЯ ДНКэто процесс,
увеличивающий число
копий какого-либо гена
или
последовательности
ДНК
в исследуемом
материале
(выше обычного уровня)
in vitro
II. АМПЛИФИКАЦИЮ
специфических фрагментов ДНК
ПРОЦЕСС АМПЛИФИКАЦИИ
включает:
а) денатурацию — исходная смесь
нагревается до 94°С,
что обеспечивает расхождение нити ДНК
в) отжиг – этап при котором температура
исходной реакционной смеси снижается до 52 – 60°С и
происходит комплементарное связывание праймеров
с нитями матричной ДНК
праймеры – это искусственно
синтезированные короткие однонитевые
ДНК (20 – 30 нуклеотидов), выполняющие
функцию «затравок» при
ферментативном синтезе ДНК
расстояние между праймерами определяет длину
синтезируемых фрагментов ДНК
при ПЦР используют 2 праймера, которые комплементарны
3′-концевым последовательностям амплифицируемого участка
на обеих нитях ДНК-матицы соответственно
с) синтез новой цепи ДНК — полимеризация
это процесс в ходе которой
Taq-полимераза катализирует
удлинение праймеров (с 3′-конца), что
обеспечивает синтез новых цепей ДНК
Taq-полимераза должна сохранять
активность при высокой температуре
длительное время, поэтому используют
ферменты, выделенные из термофилов
Taq-полимераза — термостабильная ДНКполимераза, катализирующая реакцию
полимеризации ДНК
температура реакционной смеси для проявления
оптимальной активности Taq-полимеразы соответствует 72°С
процесс амплификации многократно
повторяется в приборе – амплификаторе
(термоциклере), что позволяет получить
огромное количество копий нужного
фрагмента ДНК
анализируемый участок ДНК
амплифицируется более чем в
миллион раз в результате проведения
20 циклов ПЦР
III. детекция продуктов
амплификации
амплифицированный фрагмент
выявляют в процессе электрофореза в
1,6 % агарозном геле
22.12.12
достоинства метода ПЦР:
среди методов диагностики инфекционных
возбудителей ПЦР обладает наиболее высокими
показателями чувствительности и специфичности
(для Ампли-Сенс ПЦР-систем – 1000 микроор-мов/1 мл)
возможность использования разнообразного
клинического материала
возможность одновременного выявления
нескольких микроорганизмов в одной
биологической пробе, в отличие от
бактериологических методов, где для разных
возбудителей используются разные способы
культивирования;
повышенная стабильность при транспортировке,
т.к. нет необходимости сохранять возбудителя в
живом виде
скорость проведения анализа (иногда
точное определение этиологии инфекции
определение количества возбудителя, это
особенно актуально для факультативных
патогенов, которые вызывают патологию только
при определенных условиях
22.12.12
проведение контроля за течением
инфекционного процесса
• метод ПЦР, как и любой
другой тест молекулярной
диагностики, во многом
зависит от правильности
забора и транспортировки
исследуемого материала
99. Сфера применения ПЦР
Диагностика большого спектра частной патологии. Наиболее частоиспользуется в практике для диагностики вирусного гепатита, герпетической,
хламидиозной и микоплазменной инфекции, туберкулеза, сальмонеллеза,
сифилиса, цитомегаловируса, ВИЧ.
Метод широко применяется в диагностике онкологических заболеваний:
высокая чувствительность метода позволяет определять аномальную ДНК в
ничтожно малых количествах (10-15-10-18 степени), что означает выявление
неопластических клеток на доклинической стадии опухолевого процесса.
ПЦР применяется для пренатальной диагностики многих моногенных
наследственных заболеваний
В судебно-медицинской практике метод ПЦР используется для определения
отцовства, идентификации личности неопознанных трупов, доказательства
причастности какого либо лица к совершению преступления
Очень перспективным направлением является использование ПЦР для
определения патогенов в пищевых продуктах и абиотических средах
(предметы обихода, жилище, одежда и т.п.). Метод используется в
биотехнологии для определения трансгенных организмов.
Современная трансплантационная хирургия невозможна без использования
метода ПЦР, который гарантированно показывает степень тождественности
гомотрансплантатов.
• Биологический метод (экспериментальный или
биопроба) — заражение исследуемым материалом
чувствительных лабораторных животных или других
биологических объектов (куриные эмбрионы, культуры
клеток). Его используют для выделения чистой культуры
возбудителя, определения типа токсина, активности
антимикробных химиотерапевтических препаратов и
т.д.
• Ограничение — к большинству возбудителей
антропонозных инфекций человека лабораторные
животные невосприимчивы
• Биологический метод неэкономичен, негуманен
Ни один из современных методов не обеспечивает 100 % выявления
возбудителя инфекции
Целесообразным является :
использование не менее 2-х методов диагностики;
нередко требуется проведение повторных исследований
Задача врача заключается в
правильном
выборе метода исследования и
грамотной оценке его результатов !!!!
CDC — Малярия — Диагностические инструменты
Тест непрямых флуоресцентных антител
Обнаружение антител к малярии выполняется с помощью теста непрямых флуоресцентных антител (IFA). Процедуру IFA можно использовать, чтобы определить, был ли пациент инфицирован Plasmodium . Из-за времени, необходимого для выработки антител, а также из-за устойчивости антител серологическое тестирование нецелесообразно для рутинной диагностики острой малярии. Однако обнаружение антител может быть полезно для:
- Скрининг доноров крови, вовлеченных в случаи малярии, вызванной переливанием крови, когда паразитемия донора может быть ниже обнаруживаемого уровня исследования мазка крови
- Тестирование пациента, обычно из эндемичного района, у которого были повторные или хронические инфекции малярии, на состояние, известное как синдром тропической спленомегалии
- Тестирование пациента, который недавно лечился от малярии, но диагноз ставится под сомнение.
Видоспецифическое тестирование доступно для трех из четырех видов человека: P. falciparum , P. vivax и P. malariae. Антигены P. ovale не всегда легко доступны, поэтому тесты на антитела не проводятся рутинно. Перекрестные реакции часто происходят между видами Plasmodium и видами Babesia . Стадия крови Plasmodium видов шизонтов (меронтов) используются в качестве антигена. Сыворотка пациента подвергается воздействию организмов; гомологичное антитело, если оно присутствует, присоединяется к антигену, образуя комплекс антиген-антитело (Ag-Ab).Затем добавляется меченное флуоресцеином антитело против человека, которое присоединяется к специфическим антителам пациента к малярии. Когда предметное стекло исследуют с помощью флуоресцентного микроскопа, если паразиты флуоресцируют яблочно-зеленым цветом, это означает, что реакция положительная.
Иммуноферментный анализтакже использовался в качестве инструмента для скрининга доноров крови, но имеет ограниченную чувствительность из-за использования только антигена Plasmodium falciparum вместо антигенов всех четырех видов человека.
Тест непрямых флуоресцентных антител (IFA).Флуоресценция указывает на то, что исследуемая сыворотка пациента содержит антитела, которые реагируют с препаратом антигена (здесь паразитов Plasmodium falciparum ).
Сравнение трех диагностических методов (микроскопия, БДТ и ПЦР) для обнаружения малярийных паразитов в репрезентативных образцах из Экваториальной Гвинеи | Malaria Journal
Бенито А., Рош Дж., Молина Р., Амела С., Альвар Дж. Применение и оценка диагностики малярии QBC в голоэндемичной зоне.Appl Parasitol. 1994; 35: 266–72.
CAS PubMed Google ученый
ВОЗ. Всемирный доклад о малярии, 2017 г. Женева: Всемирная организация здравоохранения; 2017.
Google ученый
Mendes C, Dias F, Figueiredo J, Mora VG, Cano J, de Sousa B, et al. Отрицательный антиген Даффи больше не является препятствием для молекулярных свидетельств Plasmodium vivax с западного побережья Африки (Ангола и Экваториальная Гвинея).PLoS Negl Trop Dis. 2011; 5: e1192.
CAS Статья Google ученый
Герстл С., Данкли С., Мухтар А., Де Смет М., Бейкер С., Майкер Дж. Оценка двух экспресс-тестов на малярию у детей в возрасте до пяти лет с последующим проведением ложноположительного теста на pLDH приводит к появлению гиперэндемичной зоны малярии falciparum в Сьерра-Леоне. Малар Дж. 2010; 9:28.
Артикул Google ученый
ВОЗ. Рекомендации по лечению малярии. Женева: Всемирная организация здравоохранения; 2010.
Google ученый
Муди А. Экспресс-тест для выявления малярийных паразитов. Clin Microbiol. 2002; 15: 66–78.
CAS Статья Google ученый
Фелеке Д.Г., Тарко С., Хадуш Х. Сравнение эффективности экспресс-теста на малярию CareStartTM HRP ”/ pLDH combo со световой микроскопией в северо-западном Тиграе, Эфиопия: кросс-секционное исследование.BMC Infect Dis. 2017; 17: 399.
Артикул Google ученый
ВОЗ. Паразитологическое подтверждение диагноза малярии. Женева: Всемирная организация здравоохранения; 2009.
Google ученый
ВОЗ. Всемирный доклад о малярии, 2016 г. Женева: Всемирная организация здравоохранения; 2016.
Google ученый
Орт С, Пурномо М., Сутамихарджа М.А., Тан Д., Каин К.С..Влияние ошибки микроскопии на оценку защитной эффективности в испытаниях по профилактике малярии. J Infect Dis. 2002; 186: 540–6.
Артикул Google ученый
Ханшайд Т. Текущие стратегии предотвращения неправильной диагностики малярии. Clin Microbiol Infect. 2003; 9: 497–504.
CAS Статья Google ученый
Пейн Д. Использование и ограничения световой микроскопии для диагностики малярии на уровне первичной медико-санитарной помощи.Bull World Health Organ. 1988; 66: 621–6.
CAS PubMed PubMed Central Google ученый
Федеральное министерство здравоохранения. Малярия: рекомендации по диагностике и лечению для медицинских работников Эфиопии. 3-е изд. Эфиопия: Аддис-Абеба; 2011.
Google ученый
ВОЗ. Новые перспективы: диагностика малярии. Женева: Всемирная организация здравоохранения; 2000.
Google ученый
Обзор диагностического тестирования. http://www.who.int/malaria/areas/diagnosis/overview/en/. Обновление от 14 марта 2016 г.
Угах UI, Alo MN, Owolabi JO, Okata-Nwali OD, Ekejindu IM, et al. Оценка полезности трех диагностических методов при обнаружении малярийных паразитов в эндемичных районах. Малар Дж. 2017; 16: 189.
Артикул Google ученый
Kim SH, Nam MH, Roh KH, Park HC, Nam DH. Оценка экспресс-теста, специфичного для Plasmodium vivax .Trop Med Int Health. 2008; 13: 1495–500.
CAS Статья Google ученый
Kozycki CT, Umulisa N, Rulisa S, Mwikarago I., Musabyimana JP, et al. Ложноотрицательные экспресс-тесты на малярию в Руанде: влияние изолятов Plasmodium falciparum , у которых отсутствует hrp2 , и снижение передачи малярии. Малар Дж. 2017; 16: 123.
Артикул Google ученый
Хумар А, Орт С, Харрингтон Массачусетс, Пиллай Д., Каин К.С.. Парасайт-тест в сравнении с полимеразной цепной реакцией и микроскопией для диагностики малярии Plasmodium falciparum у путешественников. Am J Trop Med Hyg. 1997; 56: 44–8.
CAS Статья Google ученый
Berhane A, Russom M, Bahta I, Hagos F, Ghirmai M., Uqubay S. Экспресс-диагностические тесты для обнаружения Plasmodium falciparum инфекций в Эритрее: расследование ложноотрицательных результатов RDT.Малар Дж. 2017; 16: 105.
Артикул Google ученый
Матисон Б.А., Притт Б.С. Обновленная информация об использовании диагностических тестов на малярию. J Clin Microbiol. 2017; 55: 2009–17.
Артикул Google ученый
Romay-Barja M, Jarrin I., Ncogo P, Nseng G, Sagrado MJ, Santana-Morales MA, et al. Поправка: различия между городом и деревней в поведении детей при обращении за медицинской помощью в связи с подозрением на малярию в районе Бата, Экваториальная Гвинея.PLoS ONE. 2015; 10: e0138518.
Артикул Google ученый
Ncogo P, Herrador Z, Romay-Barja M, García-Carrasco E, Nseng G, Berzosa P, et al. Распространенность малярии в районе Бата, Экваториальная Гвинея: кросс-секционное исследование. Малар Дж. 2015; 14:45.
Артикул Google ученый
Рубио Дж. М., Бенито А., Рош Дж., Берзоса П. Дж., Гарсия М. Л., Мико М. и др. Полувложенная мультиплексная полимеразная цепная реакция для обнаружения малярийных паразитов человека и свидетельство инфекции Plasmodium vivax в Экваториальной Гвинее.Am J Trop Med Hyg. 1999; 60: 183–7.
CAS Статья Google ученый
Та TH, Хисам С., Ланза М., Джирам А.И., Исмаил Н., Рубио Дж. М.. Первый случай естественного заражения человека вирусом Plasmodium cynomolgi . Малар Дж. 2014; 24 (13): 68.
Артикул Google ученый
Rubio JM, Post RJ, van Leeuwen WM, Henry MC, Lindergard G, Hommel M.Альтернативный метод полимеразной цепной реакции для идентификации видов Plasmodium в образцах крови человека: полувложенная мультиплексная ПЦР против малярии (SnM-PCR). Trans R Soc Trop Med Hyg. 2002; 96: S199–204.
Артикул Google ученый
Ta TH, Ali-Tammam M, Lanza M, Rubio JM. Обнаружение и идентификация видов Plasmodium с помощью вложенной мультиплексной ПЦР. В: Merino L, Giusiano G, редакторы. Руководство по молекулярным методам микробиологических исследований.1-е изд. Буэнос-Айрес: Asoc Argentina de Microbiologia; 2011. с. 109–10.
Google ученый
Кан Дж. М., Чо ПЙ, Мо М, Ли Дж., Джун Х., Ли Х. В. и др. Сравнение диагностической эффективности микроскопического исследования с вложенной полимеразной цепной реакцией для оптимальной диагностики малярии в Верхней Мьянме. Малар Дж. 2017; 16: 119.
Артикул Google ученый
Falade CO, Ajayi IO, Nsungwa-Sabiiti J, Siribié M, Diarra A, Sermé L. и др. Экспресс-тесты для диагностики малярии и микроскопия для лечения малярии при неосложненной лихорадке в Нигерии и в случаях до направления в 3 африканских странах. Clin Infect Dis. 2016; 63 (приложение 5): S290–7.
Артикул Google ученый
Алему А., Фюрер Х.П., Гетнет Г, Кассу А., Гети С., Ноэдл Х. Сравнение. микроскопии Гимзы с вложенной ПЦР для диагностики малярии в Северном Гондаре, северо-запад Эфиопии.Малар Дж. 2014; 13: 174.
Артикул Google ученый
Буржуа Н., Буте А, Буске П.Ж., Бассе Д., Дуар-Эно С., Шарашон С. и др. Сравнение трех методов ПЦР в реальном времени с мазками крови и экспресс-диагностическим тестом на Plasmodium sp. инфекционное заболевание. Clin Microbiol Infect. 2010; 16: 1305–11.
CAS Статья Google ученый
ВОЗ.Руководство по обеспечению качества при микроскопии малярии — версия 2. Женева: Всемирная организация здравоохранения; 2016.
Google ученый
Окелл Л.С., Гани А.С., Лайонс Э., Дракли С. Субмикроскопическая инфекция в эндемичных популяциях Plasmodium falciparum : систематический обзор и метаанализ. J Infect Dis. 2009; 200: 1509–17.
Артикул Google ученый
Fançony C, Sebastião YV, Pires JE, Gamboa D, Nery SV.Эффективность микроскопии и БДТ в контексте обследования распространенности малярии в Анголе: сравнение с использованием ПЦР в качестве золотого стандарта. Малар Дж. 2013; 12: 284.
Артикул Google ученый
Маккензи Ф. Э., Сиричайзинтоп Дж., Миллер Р. С., Гассер Р. А. Младший, Вонгсриханалай С. Зависимость обнаружения малярии и диагностики видов с помощью микроскопии от плотности паразитов. Am J Trop Med Hyg. 2003. 69: 372–6.
Артикул Google ученый
Лоран А., Шелленберг Дж., Ширима К., Кетенде С.К., Алонсо П.Л., Мшинда Х. и др. Проведение экспресс-теста на малярию на основе HRP-2 и его изменение с возрастом в районе интенсивной передачи малярии на юге Танзании. Малар Дж. 2010; 9: 294.
Артикул Google ученый
Абеку Т.А., Кристан М., Джонс С., Борода Дж., Мюллер Д.Х., Окия М. и др. Детерминанты точности экспресс-тестов при ведении больных малярией: данные, полученные в условиях низкой и умеренной передачи в высокогорных районах Восточной Африки.Малар Дж. 2008; 7: 202.
Артикул Google ученый
Swarthout TD, Counihan H, Senga RK, Broek I. Paracheck-Pf ® точность и недавно пролеченные Plasmodium falciparum инфекции : существует ли риск гипердиагностики? Малар Дж. 2007; 6:58.
Артикул Google ученый
Siahaan L, Panggabean M, Panggabean YC. Точность RDT в зависимости от возрастной группы при гиперэндемической малярии.В: Серия конференций IOP: наука о Земле и окружающей среде. т. 125. 2018. с. 012018.
Статья Google ученый
Odhiambo F, Buff AM, Moranga C, Moseti CM, Wesongah JO, Lowther SA и др. Факторы, связанные с диагностической эффективностью микроскопии малярии после пилотной программы обеспечения качества в медицинских учреждениях в районах Кении с низким уровнем передачи малярии, 2014 г. Malar J. 2017; 16: 371.
Артикул Google ученый
Crookston BT, Alder SC, Boakye SC, Merill RM, Amuasi JH, Porucznik CA и др. Изучение взаимосвязи между хроническим недоеданием и бессимптомной малярией у детей Ганы. Малар Дж. 2010; 9:39.
Артикул Google ученый
Roh ME, Oyet C, Orikiriza P, Wade M, Kiwanuka GN, Mwanga-Amumpaire J, et al. Бессимптомные Инфекции Plasmodium у детей в условиях низкой передачи малярии, Юго-Западная Уганда.Emerg Infect Dis. 2016; 22: 1494–8.
Артикул Google ученый
Арвати Х., Йотопраното С., Айнум Рохма Э., Сьяфруддин Д. Субмикроскопические случаи малярии играют определенную роль в местной передаче в районе Тренггалек, провинция Восточная Ява, Индонезия. Малар Дж. 2018; 17: 2.
Артикул Google ученый
Katrak S, Nayebare P, Rek J, Ariaitwe E, Nankabirwa J, Kamya M, et al.Клинические последствия субмикроскопической паразитемии малярии в Уганде. Малар Дж. 2018; 17:67.
Артикул Google ученый
Kozycki CT, Umulisa N, Rulisa S, Mwikarago EI, Musabyimana JP, Habimana JP, et al. Ложноотрицательные экспресс-тесты на малярию в Руанде: влияние изолятов Plasmodium falciparum , не содержащих hrp2, и снижение передачи малярии. Малар Дж. 2017; 16 (1): 123.
Артикул Google ученый
ВОЗ. Универсальный доступ к диагностическому тестированию на малярию — оперативное руководство. Женева: Всемирная организация здравоохранения; 2013. http://www.who.int/malaria/publications/atoz/9789241502092/en/. По состоянию на 21 февраля 2017 г.
Abba K, Deeks JJ, Olliaro P, Naing CM, Jackson SM, Takwoingi Y, et al. Экспресс-тесты для диагностики неосложненной малярии P. falciparum в эндемичных странах. Кокрановская база данных Syst Rev.2011; 7: CD008122.
Google ученый
Шакели Д., Эльфвинг К., Айдин-Шмидт Б., Мселлем М.И., Моррис Ю., Омар Р. и др. Полезность экспресс-диагностических тестов в новом контексте низкого уровня передачи малярии на Занзибаре. PLoS ONE. 2013; 8: e72912.
CAS Статья Google ученый
Сравнение микроскопии с наборами для экспресс-диагностики
Asian Pac J Trop Biomed. 2012 Apr; 2 (4): 307–310.
CCA Azikiwe
1 Кафедра фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия
CC Ifezulike
1 Кафедра фармакологии, Государственный университет Анамбры, Симиниал, Ули, штат Анамбра, Нигерия 9
2 Кафедра фармакологии, Университет Порт-Харкорта, Порт-Харкорт, Нигерия
LU Amazu
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
3000 JC Enye
JC Enye
JC Enye
иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, НигерияOE Нваквуните
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
1 Кафедра фармакологии, Государственный университет Анамбра, Анамбра Государство, Нигерия
2 Кафедра фармакологии, Университет Порт-Харкорта, P Орт Харкорт, Нигерия
3 Кафедра иммунологии / паразитологии, Университет Мадонны, кампус Элеле, Нигерия
* Автор для переписки: Dr.Азикиве CCA, Департамент фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия. Тел .: 2348037203029, электронная почта: moc.oohay@ewikizaccПоступила в редакцию 15 октября 2011 г .; Пересмотрено 3 ноября 2011 г .; Принято 27 ноября 2011 г.
© Азиатско-Тихоокеанский журнал тропической биомедицины, 2012 г. Все права защищены.Эта статья цитировалась в других статьях PMC.Реферат
Цель
Сравнить два метода экспресс-диагностики (ДЭТ) и микроскопии в диагностике малярии.
Методы
ДЭТ и микроскопия были выполнены для диагностики малярии. Процент малярийной паразитемии был рассчитан на тонких пленках, и все неострые случаи плазмодоза с менее чем 0,001% малярийной паразитемии были расценены как отрицательные. Результаты были просто представлены как процент положительных результатов от общего числа исследуемых пациентов. Результаты RDT сравнивались с результатами микроскопии, а результаты RDT на основе антигена сравнивались с результатами RDT на основе антител.Наблюдение за пациентами велось во всех случаях.
Результаты
Все 200 пациентов, участвовавших в данном исследовании, дали положительный результат на ДЭТ на основе метода антител к малярии (сыворотка) (100%). 128 из 200 дали положительный результат на ДЭТ на основе метода малярийного антигена (цельная кровь) (64%), в то время как у 118 из 200 пациентов, участвовавших в настоящем исследовании, были получены положительные результаты при визуальной микроскопии Лишмана и разбавленного раствора Гимзы (59%). Все пациенты, у которых были получены положительные результаты при микроскопии, также дали положительные результаты на ДЭТ на основе антигена.Все пациенты на второй день наблюдения не имели лихорадки и получали противомалярийные препараты.
Выводы
На основании настоящего исследования мы пришли к выводу, что ДЭТ, основанные на методе малярийного антигена (цельная кровь), столь же специфичны, как и традиционная микроскопия, и даже кажутся более чувствительными, чем микроскопия. ДЭТ, основанный на методе антител (сыворотки), неспецифичен, поэтому его не следует поощрять. Скорее всего, Африка является эндемичным регионом, поэтому образование определенных уровней антител к малярии может быть не редкостью.Настоящее исследование также подтверждает мнение о том, что большое количество случаев лихорадки не связано с малярией. Мы поддерживаем отчет ВОЗ о рентабельности БДТ, но рекомендуем, чтобы в Африке и других эндемичных по малярии регионах мира, возможно, был принят только метод на основе антигена.
Ключевые слова: Экспресс-диагностические тесты, Микроскопия, Диагностика малярии, Малярия, Паразитемия, Плазмодиаз, Антиген, Антитело, Антималярия, Сыворотка, Цельная кровь
1. Введение
Малярия — одна из самых смертоносных болезней, поражающих большинство тропических стран особенно Африка.Этим заболеванием страдают более 500 миллионов человек во всем мире, и более миллиона детей ежегодно умирают от малярии [1]. Из всех паразитов малярии человека Plasmodium falciparum ( P. falciparum ) является наиболее патогенным и часто приводит к летальному исходу, если вовремя не лечить [2]. В Индии, по данным Нандвани [2], в 2002 году было зарегистрировано 1,82 миллиона случаев малярии и 0,89 миллиона случаев P. falciparum, случаев и 902 смерти. малярия, основанная на лихорадке в анамнезе, но значительная часть пролеченных может не иметь паразитов (более 50% во многих местах) и, следовательно, расходовать значительное количество лекарств [3].Эта старая клиническая практика по-прежнему актуальна сегодня, особенно для младенцев, у которых время, потраченное на получение подтверждающего лабораторного диагноза, может привести к увеличению летальности.
Распространенное назначение хлорохина пациентам, не болеющим малярией, терпимо, отчасти потому, что хлорохин настолько дешев. Однако комбинированная терапия на основе артемизинина (АКТ) стоит как минимум в 10 раз больше за курс лечения. Более того, гипердиагностика малярии подразумевает недостаточный диагноз и ненадлежащее лечение немалярийного фебрильного заболевания, в то время как большая часть таких заболеваний представляет собой самоограничивающиеся вирусные заболевания, а значительное меньшинство, такие как острые респираторные инфекции или бактериальный менингит, являются бактериальными заболеваниями и потенциально смертельными. [3].
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.
Однако традиционный метод микроскопической идентификации паразита не только пугает при плохой настройке мощности, но также требует много времени и опыта.Таким образом, микроскопия в Африке обычно ограничивается более крупными клиниками / центрами высшего образования. Однако это традиционное окрашивание мазков периферической крови / микроскопия все еще остается золотым стандартом в лабораторной диагностике малярии [2].
Быстрые диагностические тесты (БДТ) на малярию могут быть рассмотрены для большинства пациентов в эндемичных регионах, особенно в условиях плохого энергоснабжения, где в Африке не хватает квалифицированной рабочей силы. Однако существует очень мало данных, особенно из эндемичных по малярии районов, которые могли бы помочь лицам, принимающим решения, узнать о чувствительности и специфичности этих БДТ.
RDT коммерчески доступны в виде наборов со всеми необходимыми реагентами и простотой выполнения процедур, не требуют обширного обучения или оборудования для выполнения или интерпретации результатов. Результаты считываются через 12–15 мин [6].
RDT в основном бывают двух видов. Один основан на антигене и обычно требует использования гемолизированных эритроцитов, а другой основан на антителах и обычно требует использования экстрагированной сыворотки. Вообще говоря, антитела лучше экспрессируются в сыворотке, в противном случае плазма также может заменять сыворотку для метода, основанного на антителах.
Принципы испытаний основаны на обнаружении белка малярийных паразитов, то есть гистидина. При использовании метода антител это означает обнаружение наличия антител против гистидина в сыворотке крови человека, а при использовании цельной крови — обнаружение гистидина малярийных паразитов в красных кровяных тельцах [6].
Таким образом, исследование было направлено на сравнение двух методов микроскопии и ДЭТ в диагностике малярии.
2. Материалы и методы
Материалы включали флаконы с кровью этилендиаминтетрауксусной кислоты (ЭДТА), простые пробирки Хана, шприцы 5 мл, красители Лишмана и Гимзы, предметные стекла для микроскопии, световой микроскоп с хорошими объективами 40 и 100, RDT наборы от SD-Diagnostics USA и KS LAB-China.
Образцы крови были собраны в пробирки с ЭДТА и простые пробирки Хана у 200 пациентов, у которых в течение 1-3 дней была лихорадка и у которых был клинически диагностирована малярийная лихорадка.
Толстые и тонкие пленки получали в трех экземплярах из образцов EDTA в течение 10 минут после сбора, в то время как сыворотки собирали из простых пробирок, как только сгустки полностью образовывались.
Толстые пленки окрашивали методами Гимзы и Филда, а тонкие пленки окрашивали методами Лишмана и разбавленными методами Гимзы.
БДТ на основе антигенов проводили на аликвотах гемолизированной цельной крови в дубликатах. Сыворотки тестировали в двух экземплярах для выявления антител к малярийным паразитам на основе метода обнаружения антител к RDT.
Процент малярийной паразитемии был рассчитан на основе тонких пленок, и все неострые случаи плазмодоза с менее чем 10% малярийной паразитемией были расценены как отрицательные.
Был рассчитан процент малярийной паразитемии, а также средний процент подавления малярийной паразитемии.Эти расчеты были выполнены с использованием приведенной ниже формулы.
Где, WBC = лейкоциты, No = количество и MP = паразиты малярии (WBC в случае толстой пленки или RBC в случае тонкой пленки).
Двадцать микроскопических полей со средним значением 50 лейкоцитов на поле были подсчитаны, чтобы получить в общей сложности 1 000 лейкоцитов, как подсчитано количество лейкоцитов. При исследовании тонких пленок эритроциты заменяли лейкоциты в приведенной выше формуле для расчета процента паразитемии [1].
Через день наблюдение было проведено за всеми пациентами со 2 по 4 день.Все пациенты получали противомалярийные препараты вместе с антибиотиками / антибактериальными препаратами.
Все мазки крови с более чем 0,001% (≤50 / мкл) положительными мазками малярийной паразитемии и визуальными малярийными паразитами были просто представлены как положительные, в то время как мазки менее 0,001% и без визуальных малярийных паразитов просто считались отрицательными. RDT на основе как антигена, так и антител также просто сообщались как положительные или отрицательные. Процентная доля от общего числа пациентов (200) была указана для всех методов.
3. Результаты
Результаты показали, что можно понять, что сывороточный метод оказался ненадежным как специфический метод диагностики малярии. Поскольку микроскопия была принята в качестве золотого стандарта, все 72, которые оказались отрицательными с помощью метода антигена, по-прежнему имели отрицательные результаты при микроскопии. В то время как 10 дополнительных отрицательных случаев при микроскопии были положительными при использовании метода антигена (). Таким образом, можно сказать, что метод антигена более надежен, чем метод антитела, и столь же специфичен, как золотой стандарт i.е. микроскопия.
Таблица 1
Сводка положительных / отрицательных значений.
| Предметы | Цельная кровь (антигены) | Сыворотка (антитела) | Мазки цельной крови | |||
| Отрицательный | 72 | NIL | 200 | 118 | ||
| Всего | 200 | 200 | 200 | |||
| Положительный процент | 64% | 100% | 59% |
| Элементы | Время окрашивания (мин) | Время выдержки (мин) | Виды | |||
| Цельная кровь (антигены) | NIL | 90f 13 ± 4 9050P-P-P-P-90 | ||||
| Сыворотка (антитела) | NIL | 5 ± 2 | HRP-Pf | |||
| Толстые пленки цельной крови | 3 ± 1 | 40 ± 10 | Tropho4 903 9050 Whoto Pf тонкие пленки крови | 12 ± 4 | 40 ± 10 | Tropho & Gameto Pf |
4.Обсуждение
Существует четыре основных метода диагностики малярии. Это симптоматические, микроскопические, антигенные и молекулярные методы. Симптоматическая диагностика является наиболее распространенной, и люди в более бедных странах часто используют только симптомы для диагностики малярии. В других областях симптоматическая диагностика также часто является первичной, а затем следует один из других методов. Однако следует отметить, что многие другие заболевания имеют симптомы, очень похожие на малярию, и диагностика только по симптомам может вводить в заблуждение и даже пагубно.Лечение малярии там, где требуется другое лечение, оставляет болезнь неизлечимой, а пациента в критическом состоянии. Поэтому обязательно проводить симптоматическую диагностику одним из других более точных методов.
Длительные периодические лихорадки, озноб и телесные боли часто рассматриваются как симптомы малярии. Однако этот диагноз часто ошибочен; так иногда бывает паразитемия, что означает концентрацию паразитов в крови; оба могут быть вызваны другими видами инфекций.Было показано, что ретинопатия, изучение изменений, происходящих в сетчатке глаза, может служить хорошим признаком малярии, поскольку цвет и другие аспекты сетчатки изменились в результате определенных заболеваний. Следовательно, необходимо принять процентное соотношение паразитемии, чтобы оно коррелировало с клинической картиной.
Исследование крови под микроскопом с момента открытия Лавераном, французским ученым, первым идентифицировавшим паразита плазмодия, является наиболее надежным методом диагностики малярии.Поэтому образец крови исследуется под микроскопом на предмет наличия малярийного паразита. Хотя другие жидкости организма, такие как слюна или моча, также могут использоваться в качестве менее инвазивных методов, кровь предпочтительнее для более высокой концентрации паразита.
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.Внедрение дорогостоящих противомалярийных препаратов, таких как АКТ, побуждает эндемичных по малярии стран Африки к югу от Сахары пересмотреть методы диагностики [3]. Стремление разработать быстрый и точный метод диагностики малярии привело к тому, что Нандвани и др. [2] провели сравнительное обнаружение малярии с помощью полимеразной цепной реакции (ПЦР) и микроскопии у 100 индийских пациентов. Они обнаружили, что метод ПЦР имеет чувствительность 96,8%, но его выполнение занимает около 10–11 часов, тогда как микроскопия занимает в среднем 40–45 минут.ПЦР определяет присутствие малярийных паразитов в красных кровяных тельцах или в них. PCR требует электроэнергии, которая стоит целое состояние и не может быть легко рассмотрена для использования в Африке. Кроме того, это занимает очень много времени и не соответствует нашему желанию по скорости.
Иммунохроматографический метод обнаружения малярийных паразитов оказался наиболее быстрым и требует минимального обучения или вообще не требует его. Иммунохроматографический метод основан на миграции жидкости по поверхности нитроцеллюлозной мембраны [6].Тест основан на захвате антигена паразита из периферической крови с использованием моноклональных антител, полученных против антигена-мишени малярии и конъюгированных либо с липосомой, содержащей селеновый краситель, либо с частицами золота в подвижной фазе. Или наоборот, когда вместо моноклонального антитела для захвата антигена в целлюлозу включается антиген для захвата антитела в сыворотке или плазме. Наше настоящее исследование подтверждает, что иммунохроматографический метод, представленный в виде ДЭТ, является наиболее быстрым, а метод антител — наиболее быстрым.
Микроскопия — наиболее широко используемый инструмент для диагностики малярии на периферических уровнях. В умелых руках он очень чувствителен к паразитемии ≤50 / мкл (0,001%) [2] и может дать важную информацию для клинициста, такую как виды, стадии паразитов и плотность паразитов. Однако хорошее качество микроскопии трудно реализовать и поддерживать. Это трудоемкий процесс, требующий высококвалифицированного персонала и регулярного контроля качества. ВОЗ рекомендует использование ДЭТ против малярии, когда надежная микроскопия недоступна.В неэндемичных условиях, где не хватает опыта в микроскопии из-за низкой заболеваемости, ДЭТ по малярии имеют ценность для диагностики малярии и предоставляют информацию об участии P. falciparum . В ходе недавнего сеанса внешнего контроля качества 72,7% из 183 бельгийских лабораторий, предлагающих диагностику малярии, заявили, что используют ДЭТ в качестве инструмента для диагностики, и их использование рекомендуется в сочетании с микроскопией [7]. Maltha и др. [7] также показали, что P.falciparum , Plasmodium vivax и Plasmodium malariae показал 94,6%, 92,9% и 94,7% степень чувствительности при использовании ДЭТ при концентрации малярийных паразитов ≥1 000 / мкл, соответственно, но они показали проценты ниже, чем в среднем 58 % чувствительности при концентрации малярии ≤100 / мкл. Естественно, следует ожидать, что их чувствительность упадет почти до нуля при концентрации 0,001% (≤50 / мкл), где микроскопия также должна быть отрицательной.
Малярийные антигены, на которые в настоящее время нацелены RDT, — это HRP-2, лактатдегидрогеназа паразита (pLDH) и альдолаза плазмодия (PL-aldo).Moody [6] продемонстрировал, что видов Plasmodium секретируют эти белки, поэтому чувствительность и специфичность RDT измеряются на их основе. P. falciparum , как было показано, секретирует партии HRP-2 больше, чем HRP-1 и HRP-3, тогда как pLDH и PL-aldo обнаружены у других видов Plasmodium .
Мембраны эритроцитов, инфицированных малярийным паразитом человека P. falciparum , образуют выступы, называемые выступами. Эти структуры необходимы для выживания паразита в хозяине, и для их индукции требуется синтез белка-выступа паразитом [8] — [14].Эти шишки богаты гистидином. Гистидин, существующий в организме человека как незаменимая аминокислота, имеет положительно заряженную имидазольную функциональную группу. Имидазол делает его частым участником реакций, катализируемых ферментами. Непротонированный имидазол является нуклеофильным и может служить общим основанием, тогда как протонированная форма может служить общей кислотой. Остаток также может играть роль в стабилизации свернутых структур белков. Гистидин, обнаруженный у малярийных паразитов, является изомером, а ДЭТ чувствительны только к таковым малярии (HRP-2).Однако этот тип встречается только у P. falciparum , в то время как pLDH встречается у других видов. Но большинство RDT не обнаруживают присутствия малярийных паразитов при смешанной инфекции [15]. Наш метод RDT был более чувствителен к HRP-2, поскольку P. falciparum является не только самым смертоносным, но и наиболее часто встречающимся в этой части мира, то есть оправданным. Микроскопия, золотой стандарт, также соответствует этой точке зрения. Однако следует отметить, что, поскольку все пациенты, участвующие в текущем исследовании, имели противомалярийные препараты и все были избавлены от плохого состояния здоровья, существует вероятность появления других видов Plasmodium .
Наша работа также ясно показывает, что метод на основе антигена лучше коррелирует как с золотым стандартом , то есть с микроскопией , так и с клиническими условиями. Метод на основе антител, как и ожидалось, показал хороший уровень чувствительности, но очень неспецифический. Нигерия является эндемичным по малярии районом, поэтому антитела против HRP-2 могут быть обычным явлением. В нашей настоящей работе это было 100%, и если это экстраполировать на наше общество в целом, это означает, что практически каждый человек с лихорадкой будет иметь положительный результат теста на антитела.
Мы пришли к выводу, что ДЭТ для диагностики малярии так же надежен, как и микроскопия, но только метод на основе антигена подходит для Нигерии и, возможно, других частей тропиков, где малярия является эндемической. Мы рекомендуем импортировать только наборы методов на основе антигенов и / или использовать их в Нигерии и, возможно, в других частях тропиков, эндемичных по малярии.
Сноски
Заявление о конфликте интересов: Мы заявляем, что у нас нет конфликта интересов.
Список литературы
1.Amazu LU, Ebong OO, Azikiwe CCA, Unekwe PC, Simialayi MI, Nwosu PJC и др. Эффекты экстракта семян Carica papaya в метаноле на инфицированных мышах Plasmodium berghei . Азиатский Pac J Trop Med. 2009. 2 (3): 1–6. [Google Scholar] 2. Нандвани С., Матур М., Рават С. Оценка анализа полимеразной цепной реакции для диагностики малярии falciparum в Дели, Индия. Индийский J Med Microbiol. 2005. 23 (3): 176–178. [PubMed] [Google Scholar] 3. Шиллкатт С., Морел С., Гудман С., Колман П., Белл Д., Уитти С.Дж. и др.Экономическая эффективность методов диагностики малярии в странах Африки к югу от Сахары в эпоху комбинированной терапии. Bull World Health Organ. 2008. 86: 101–110. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Белл Д., Го Р., Мигель С., Уокер Дж., Какал Л., Саул А. Диагностика малярии в отдаленном районе Филиппин: сравнение методов и их признание медицинскими работниками и обществом. Bull World Health Organ. 2001; 79: 933–941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. КТО . Роль лабораторной диагностики в поддержке борьбы с малярией: сосредоточить внимание на использовании быстрых диагностических тестов в областях с высокой степенью передачи.Женева: ВОЗ; 2006. [Google Scholar] 7. Джессика М., Жилле П., Кнопс Л., Боттио Э., Эсбрук М.В., Брюггеман С. и др. Оценка диагностического экспресс-теста SDFK40 (Pf-pLDH / pan-pLDH) для диагностики малярии в неэндемичных условиях. Малар Дж. 2001; 10 (1): 7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Kilejian A, Sharma YD, Karoui H, Naslund L. Богатый гистидином домен белка выступа малярийного паразита человека Plasmodium falciparum . Proc Natl Acad Sci USA. 1986; 83: 7938–7941.[Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Jombo GTA, Araoye MA, Damen JG. Самолечение малярии и выбор лекарств для ее лечения среди жителей эндемичного по малярии сообщества в Западной Африке. Азиатский Pac J Trop Dis. 2011; 1 (1): 10–16. [Google Scholar] 10. Питер Г., Мануэль А.Л., Шетти А. Исследование, сравнивающее клинический профиль сложных случаев малярии Plasmodium falciparum среди взрослых и детей. Азиатский Pac J Trop Dis. 2011; 1 (1): 35–37. [Google Scholar] 11. Jombo GTA, Alao OO, Araoye MO, Damen JG.Влияние десятилетнего крестового похода против малярии на западноафриканское сообщество. Азиатский Pac J Trop Dis. 2011; 1 (2): 100–105. [Google Scholar] 12. Алайя-Буафиф Н.Б., Чахед М.К., Без Х.Э., Беллали Х., Аяри Л., Ачур Н. Полнота уведомления о малярии в Тунисе, оцененная методом повторной поимки. Азиатский Pac J Trop Dis. 2011; 1 (2): 187–191. [Google Scholar] 13. Осонуга О.А., Осонуга А.А., Осонуга И.О., Осонуга А, Деркий К.Л. Распространенность гипогликемии среди детей с тяжелой малярией среди сельского населения Африки. Азиатский Pac J Trop Dis.2011; 1 (2): 192–194. [Google Scholar] 14. Ахмад М., Хасан В., Али О.М., Реза А.М. Комары Anopheline и их роль в передаче малярии в эндемичной зоне на юге Ирана. Азиатский Pac J Trop Dis. 2011; 1 (2): 209–211. [Google Scholar] 15. Форни JR, Wongsrichanalai C, Magill AJ, Craig LG, Sirichaisinthop J, Bautista CT и др. Устройства для быстрой диагностики малярии: оценка прототипов тестов, которые обнаруживают Plasmodium falciparum гистидин-богатый белок 2 и Plasmodium vivax -специфический антиген.J Clin Microbiol. 2003. 41: 2358–2366. [Бесплатная статья PMC] [PubMed] [Google Scholar]микроскопов и наборы для экспресс-диагностики
Asian Pac J Trop Biomed. 2012 Apr; 2 (4): 307–310.
CCA Azikiwe
1 Кафедра фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия
CC Ifezulike
1 Кафедра фармакологии, Государственный университет Анамбры, Симиниал, Ули, штат Анамбра, Нигерия 9
2 Кафедра фармакологии, Университет Порт-Харкорта, Порт-Харкорт, Нигерия
LU Amazu
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
3000 JC Enye
JC Enye
JC Enye
иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, НигерияOE Нваквуните
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
1 Кафедра фармакологии, Государственный университет Анамбра, Анамбра Государство, Нигерия
2 Кафедра фармакологии, Университет Порт-Харкорта, P Орт Харкорт, Нигерия
3 Кафедра иммунологии / паразитологии, Университет Мадонны, кампус Элеле, Нигерия
* Автор для переписки: Dr.Азикиве CCA, Департамент фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия. Тел .: 2348037203029, электронная почта: moc.oohay@ewikizaccПоступила в редакцию 15 октября 2011 г .; Пересмотрено 3 ноября 2011 г .; Принято 27 ноября 2011 г.
© Азиатско-Тихоокеанский журнал тропической биомедицины, 2012 г. Все права защищены.Эта статья цитировалась в других статьях PMC.Реферат
Цель
Сравнить два метода экспресс-диагностики (ДЭТ) и микроскопии в диагностике малярии.
Методы
ДЭТ и микроскопия были выполнены для диагностики малярии. Процент малярийной паразитемии был рассчитан на тонких пленках, и все неострые случаи плазмодоза с менее чем 0,001% малярийной паразитемии были расценены как отрицательные. Результаты были просто представлены как процент положительных результатов от общего числа исследуемых пациентов. Результаты RDT сравнивались с результатами микроскопии, а результаты RDT на основе антигена сравнивались с результатами RDT на основе антител.Наблюдение за пациентами велось во всех случаях.
Результаты
Все 200 пациентов, участвовавших в данном исследовании, дали положительный результат на ДЭТ на основе метода антител к малярии (сыворотка) (100%). 128 из 200 дали положительный результат на ДЭТ на основе метода малярийного антигена (цельная кровь) (64%), в то время как у 118 из 200 пациентов, участвовавших в настоящем исследовании, были получены положительные результаты при визуальной микроскопии Лишмана и разбавленного раствора Гимзы (59%). Все пациенты, у которых были получены положительные результаты при микроскопии, также дали положительные результаты на ДЭТ на основе антигена.Все пациенты на второй день наблюдения не имели лихорадки и получали противомалярийные препараты.
Выводы
На основании настоящего исследования мы пришли к выводу, что ДЭТ, основанные на методе малярийного антигена (цельная кровь), столь же специфичны, как и традиционная микроскопия, и даже кажутся более чувствительными, чем микроскопия. ДЭТ, основанный на методе антител (сыворотки), неспецифичен, поэтому его не следует поощрять. Скорее всего, Африка является эндемичным регионом, поэтому образование определенных уровней антител к малярии может быть не редкостью.Настоящее исследование также подтверждает мнение о том, что большое количество случаев лихорадки не связано с малярией. Мы поддерживаем отчет ВОЗ о рентабельности БДТ, но рекомендуем, чтобы в Африке и других эндемичных по малярии регионах мира, возможно, был принят только метод на основе антигена.
Ключевые слова: Экспресс-диагностические тесты, Микроскопия, Диагностика малярии, Малярия, Паразитемия, Плазмодиаз, Антиген, Антитело, Антималярия, Сыворотка, Цельная кровь
1. Введение
Малярия — одна из самых смертоносных болезней, поражающих большинство тропических стран особенно Африка.Этим заболеванием страдают более 500 миллионов человек во всем мире, и более миллиона детей ежегодно умирают от малярии [1]. Из всех паразитов малярии человека Plasmodium falciparum ( P. falciparum ) является наиболее патогенным и часто приводит к летальному исходу, если вовремя не лечить [2]. В Индии, по данным Нандвани [2], в 2002 году было зарегистрировано 1,82 миллиона случаев малярии и 0,89 миллиона случаев P. falciparum, случаев и 902 смерти. малярия, основанная на лихорадке в анамнезе, но значительная часть пролеченных может не иметь паразитов (более 50% во многих местах) и, следовательно, расходовать значительное количество лекарств [3].Эта старая клиническая практика по-прежнему актуальна сегодня, особенно для младенцев, у которых время, потраченное на получение подтверждающего лабораторного диагноза, может привести к увеличению летальности.
Распространенное назначение хлорохина пациентам, не болеющим малярией, терпимо, отчасти потому, что хлорохин настолько дешев. Однако комбинированная терапия на основе артемизинина (АКТ) стоит как минимум в 10 раз больше за курс лечения. Более того, гипердиагностика малярии подразумевает недостаточный диагноз и ненадлежащее лечение немалярийного фебрильного заболевания, в то время как большая часть таких заболеваний представляет собой самоограничивающиеся вирусные заболевания, а значительное меньшинство, такие как острые респираторные инфекции или бактериальный менингит, являются бактериальными заболеваниями и потенциально смертельными. [3].
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.
Однако традиционный метод микроскопической идентификации паразита не только пугает при плохой настройке мощности, но также требует много времени и опыта.Таким образом, микроскопия в Африке обычно ограничивается более крупными клиниками / центрами высшего образования. Однако это традиционное окрашивание мазков периферической крови / микроскопия все еще остается золотым стандартом в лабораторной диагностике малярии [2].
Быстрые диагностические тесты (БДТ) на малярию могут быть рассмотрены для большинства пациентов в эндемичных регионах, особенно в условиях плохого энергоснабжения, где в Африке не хватает квалифицированной рабочей силы. Однако существует очень мало данных, особенно из эндемичных по малярии районов, которые могли бы помочь лицам, принимающим решения, узнать о чувствительности и специфичности этих БДТ.
RDT коммерчески доступны в виде наборов со всеми необходимыми реагентами и простотой выполнения процедур, не требуют обширного обучения или оборудования для выполнения или интерпретации результатов. Результаты считываются через 12–15 мин [6].
RDT в основном бывают двух видов. Один основан на антигене и обычно требует использования гемолизированных эритроцитов, а другой основан на антителах и обычно требует использования экстрагированной сыворотки. Вообще говоря, антитела лучше экспрессируются в сыворотке, в противном случае плазма также может заменять сыворотку для метода, основанного на антителах.
Принципы испытаний основаны на обнаружении белка малярийных паразитов, то есть гистидина. При использовании метода антител это означает обнаружение наличия антител против гистидина в сыворотке крови человека, а при использовании цельной крови — обнаружение гистидина малярийных паразитов в красных кровяных тельцах [6].
Таким образом, исследование было направлено на сравнение двух методов микроскопии и ДЭТ в диагностике малярии.
2. Материалы и методы
Материалы включали флаконы с кровью этилендиаминтетрауксусной кислоты (ЭДТА), простые пробирки Хана, шприцы 5 мл, красители Лишмана и Гимзы, предметные стекла для микроскопии, световой микроскоп с хорошими объективами 40 и 100, RDT наборы от SD-Diagnostics USA и KS LAB-China.
Образцы крови были собраны в пробирки с ЭДТА и простые пробирки Хана у 200 пациентов, у которых в течение 1-3 дней была лихорадка и у которых был клинически диагностирована малярийная лихорадка.
Толстые и тонкие пленки получали в трех экземплярах из образцов EDTA в течение 10 минут после сбора, в то время как сыворотки собирали из простых пробирок, как только сгустки полностью образовывались.
Толстые пленки окрашивали методами Гимзы и Филда, а тонкие пленки окрашивали методами Лишмана и разбавленными методами Гимзы.
БДТ на основе антигенов проводили на аликвотах гемолизированной цельной крови в дубликатах. Сыворотки тестировали в двух экземплярах для выявления антител к малярийным паразитам на основе метода обнаружения антител к RDT.
Процент малярийной паразитемии был рассчитан на основе тонких пленок, и все неострые случаи плазмодоза с менее чем 10% малярийной паразитемией были расценены как отрицательные.
Был рассчитан процент малярийной паразитемии, а также средний процент подавления малярийной паразитемии.Эти расчеты были выполнены с использованием приведенной ниже формулы.
Где, WBC = лейкоциты, No = количество и MP = паразиты малярии (WBC в случае толстой пленки или RBC в случае тонкой пленки).
Двадцать микроскопических полей со средним значением 50 лейкоцитов на поле были подсчитаны, чтобы получить в общей сложности 1 000 лейкоцитов, как подсчитано количество лейкоцитов. При исследовании тонких пленок эритроциты заменяли лейкоциты в приведенной выше формуле для расчета процента паразитемии [1].
Через день наблюдение было проведено за всеми пациентами со 2 по 4 день.Все пациенты получали противомалярийные препараты вместе с антибиотиками / антибактериальными препаратами.
Все мазки крови с более чем 0,001% (≤50 / мкл) положительными мазками малярийной паразитемии и визуальными малярийными паразитами были просто представлены как положительные, в то время как мазки менее 0,001% и без визуальных малярийных паразитов просто считались отрицательными. RDT на основе как антигена, так и антител также просто сообщались как положительные или отрицательные. Процентная доля от общего числа пациентов (200) была указана для всех методов.
3. Результаты
Результаты показали, что можно понять, что сывороточный метод оказался ненадежным как специфический метод диагностики малярии. Поскольку микроскопия была принята в качестве золотого стандарта, все 72, которые оказались отрицательными с помощью метода антигена, по-прежнему имели отрицательные результаты при микроскопии. В то время как 10 дополнительных отрицательных случаев при микроскопии были положительными при использовании метода антигена (). Таким образом, можно сказать, что метод антигена более надежен, чем метод антитела, и столь же специфичен, как золотой стандарт i.е. микроскопия.
Таблица 1
Сводка положительных / отрицательных значений.
| Предметы | Цельная кровь (антигены) | Сыворотка (антитела) | Мазки цельной крови | |||
| Отрицательный | 72 | NIL | 200 | 118 | ||
| Всего | 200 | 200 | 200 | |||
| Положительный процент | 64% | 100% | 59% |
| Элементы | Время окрашивания (мин) | Время выдержки (мин) | Виды | |||
| Цельная кровь (антигены) | NIL | 90f 13 ± 4 9050P-P-P-P-90 | ||||
| Сыворотка (антитела) | NIL | 5 ± 2 | HRP-Pf | |||
| Толстые пленки цельной крови | 3 ± 1 | 40 ± 10 | Tropho4 903 9050 Whoto Pf тонкие пленки крови | 12 ± 4 | 40 ± 10 | Tropho & Gameto Pf |
4.Обсуждение
Существует четыре основных метода диагностики малярии. Это симптоматические, микроскопические, антигенные и молекулярные методы. Симптоматическая диагностика является наиболее распространенной, и люди в более бедных странах часто используют только симптомы для диагностики малярии. В других областях симптоматическая диагностика также часто является первичной, а затем следует один из других методов. Однако следует отметить, что многие другие заболевания имеют симптомы, очень похожие на малярию, и диагностика только по симптомам может вводить в заблуждение и даже пагубно.Лечение малярии там, где требуется другое лечение, оставляет болезнь неизлечимой, а пациента в критическом состоянии. Поэтому обязательно проводить симптоматическую диагностику одним из других более точных методов.
Длительные периодические лихорадки, озноб и телесные боли часто рассматриваются как симптомы малярии. Однако этот диагноз часто ошибочен; так иногда бывает паразитемия, что означает концентрацию паразитов в крови; оба могут быть вызваны другими видами инфекций.Было показано, что ретинопатия, изучение изменений, происходящих в сетчатке глаза, может служить хорошим признаком малярии, поскольку цвет и другие аспекты сетчатки изменились в результате определенных заболеваний. Следовательно, необходимо принять процентное соотношение паразитемии, чтобы оно коррелировало с клинической картиной.
Исследование крови под микроскопом с момента открытия Лавераном, французским ученым, первым идентифицировавшим паразита плазмодия, является наиболее надежным методом диагностики малярии.Поэтому образец крови исследуется под микроскопом на предмет наличия малярийного паразита. Хотя другие жидкости организма, такие как слюна или моча, также могут использоваться в качестве менее инвазивных методов, кровь предпочтительнее для более высокой концентрации паразита.
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.Внедрение дорогостоящих противомалярийных препаратов, таких как АКТ, побуждает эндемичных по малярии стран Африки к югу от Сахары пересмотреть методы диагностики [3]. Стремление разработать быстрый и точный метод диагностики малярии привело к тому, что Нандвани и др. [2] провели сравнительное обнаружение малярии с помощью полимеразной цепной реакции (ПЦР) и микроскопии у 100 индийских пациентов. Они обнаружили, что метод ПЦР имеет чувствительность 96,8%, но его выполнение занимает около 10–11 часов, тогда как микроскопия занимает в среднем 40–45 минут.ПЦР определяет присутствие малярийных паразитов в красных кровяных тельцах или в них. PCR требует электроэнергии, которая стоит целое состояние и не может быть легко рассмотрена для использования в Африке. Кроме того, это занимает очень много времени и не соответствует нашему желанию по скорости.
Иммунохроматографический метод обнаружения малярийных паразитов оказался наиболее быстрым и требует минимального обучения или вообще не требует его. Иммунохроматографический метод основан на миграции жидкости по поверхности нитроцеллюлозной мембраны [6].Тест основан на захвате антигена паразита из периферической крови с использованием моноклональных антител, полученных против антигена-мишени малярии и конъюгированных либо с липосомой, содержащей селеновый краситель, либо с частицами золота в подвижной фазе. Или наоборот, когда вместо моноклонального антитела для захвата антигена в целлюлозу включается антиген для захвата антитела в сыворотке или плазме. Наше настоящее исследование подтверждает, что иммунохроматографический метод, представленный в виде ДЭТ, является наиболее быстрым, а метод антител — наиболее быстрым.
Микроскопия — наиболее широко используемый инструмент для диагностики малярии на периферических уровнях. В умелых руках он очень чувствителен к паразитемии ≤50 / мкл (0,001%) [2] и может дать важную информацию для клинициста, такую как виды, стадии паразитов и плотность паразитов. Однако хорошее качество микроскопии трудно реализовать и поддерживать. Это трудоемкий процесс, требующий высококвалифицированного персонала и регулярного контроля качества. ВОЗ рекомендует использование ДЭТ против малярии, когда надежная микроскопия недоступна.В неэндемичных условиях, где не хватает опыта в микроскопии из-за низкой заболеваемости, ДЭТ по малярии имеют ценность для диагностики малярии и предоставляют информацию об участии P. falciparum . В ходе недавнего сеанса внешнего контроля качества 72,7% из 183 бельгийских лабораторий, предлагающих диагностику малярии, заявили, что используют ДЭТ в качестве инструмента для диагностики, и их использование рекомендуется в сочетании с микроскопией [7]. Maltha и др. [7] также показали, что P.falciparum , Plasmodium vivax и Plasmodium malariae показал 94,6%, 92,9% и 94,7% степень чувствительности при использовании ДЭТ при концентрации малярийных паразитов ≥1 000 / мкл, соответственно, но они показали проценты ниже, чем в среднем 58 % чувствительности при концентрации малярии ≤100 / мкл. Естественно, следует ожидать, что их чувствительность упадет почти до нуля при концентрации 0,001% (≤50 / мкл), где микроскопия также должна быть отрицательной.
Малярийные антигены, на которые в настоящее время нацелены RDT, — это HRP-2, лактатдегидрогеназа паразита (pLDH) и альдолаза плазмодия (PL-aldo).Moody [6] продемонстрировал, что видов Plasmodium секретируют эти белки, поэтому чувствительность и специфичность RDT измеряются на их основе. P. falciparum , как было показано, секретирует партии HRP-2 больше, чем HRP-1 и HRP-3, тогда как pLDH и PL-aldo обнаружены у других видов Plasmodium .
Мембраны эритроцитов, инфицированных малярийным паразитом человека P. falciparum , образуют выступы, называемые выступами. Эти структуры необходимы для выживания паразита в хозяине, и для их индукции требуется синтез белка-выступа паразитом [8] — [14].Эти шишки богаты гистидином. Гистидин, существующий в организме человека как незаменимая аминокислота, имеет положительно заряженную имидазольную функциональную группу. Имидазол делает его частым участником реакций, катализируемых ферментами. Непротонированный имидазол является нуклеофильным и может служить общим основанием, тогда как протонированная форма может служить общей кислотой. Остаток также может играть роль в стабилизации свернутых структур белков. Гистидин, обнаруженный у малярийных паразитов, является изомером, а ДЭТ чувствительны только к таковым малярии (HRP-2).Однако этот тип встречается только у P. falciparum , в то время как pLDH встречается у других видов. Но большинство RDT не обнаруживают присутствия малярийных паразитов при смешанной инфекции [15]. Наш метод RDT был более чувствителен к HRP-2, поскольку P. falciparum является не только самым смертоносным, но и наиболее часто встречающимся в этой части мира, то есть оправданным. Микроскопия, золотой стандарт, также соответствует этой точке зрения. Однако следует отметить, что, поскольку все пациенты, участвующие в текущем исследовании, имели противомалярийные препараты и все были избавлены от плохого состояния здоровья, существует вероятность появления других видов Plasmodium .
Наша работа также ясно показывает, что метод на основе антигена лучше коррелирует как с золотым стандартом , то есть с микроскопией , так и с клиническими условиями. Метод на основе антител, как и ожидалось, показал хороший уровень чувствительности, но очень неспецифический. Нигерия является эндемичным по малярии районом, поэтому антитела против HRP-2 могут быть обычным явлением. В нашей настоящей работе это было 100%, и если это экстраполировать на наше общество в целом, это означает, что практически каждый человек с лихорадкой будет иметь положительный результат теста на антитела.
Мы пришли к выводу, что ДЭТ для диагностики малярии так же надежен, как и микроскопия, но только метод на основе антигена подходит для Нигерии и, возможно, других частей тропиков, где малярия является эндемической. Мы рекомендуем импортировать только наборы методов на основе антигенов и / или использовать их в Нигерии и, возможно, в других частях тропиков, эндемичных по малярии.
Сноски
Заявление о конфликте интересов: Мы заявляем, что у нас нет конфликта интересов.
Список литературы
1.Amazu LU, Ebong OO, Azikiwe CCA, Unekwe PC, Simialayi MI, Nwosu PJC и др. Эффекты экстракта семян Carica papaya в метаноле на инфицированных мышах Plasmodium berghei . Азиатский Pac J Trop Med. 2009. 2 (3): 1–6. [Google Scholar] 2. Нандвани С., Матур М., Рават С. Оценка анализа полимеразной цепной реакции для диагностики малярии falciparum в Дели, Индия. Индийский J Med Microbiol. 2005. 23 (3): 176–178. [PubMed] [Google Scholar] 3. Шиллкатт С., Морел С., Гудман С., Колман П., Белл Д., Уитти С.Дж. и др.Экономическая эффективность методов диагностики малярии в странах Африки к югу от Сахары в эпоху комбинированной терапии. Bull World Health Organ. 2008. 86: 101–110. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Белл Д., Го Р., Мигель С., Уокер Дж., Какал Л., Саул А. Диагностика малярии в отдаленном районе Филиппин: сравнение методов и их признание медицинскими работниками и обществом. Bull World Health Organ. 2001; 79: 933–941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. КТО . Роль лабораторной диагностики в поддержке борьбы с малярией: сосредоточить внимание на использовании быстрых диагностических тестов в областях с высокой степенью передачи.Женева: ВОЗ; 2006. [Google Scholar] 7. Джессика М., Жилле П., Кнопс Л., Боттио Э., Эсбрук М.В., Брюггеман С. и др. Оценка диагностического экспресс-теста SDFK40 (Pf-pLDH / pan-pLDH) для диагностики малярии в неэндемичных условиях. Малар Дж. 2001; 10 (1): 7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Kilejian A, Sharma YD, Karoui H, Naslund L. Богатый гистидином домен белка выступа малярийного паразита человека Plasmodium falciparum . Proc Natl Acad Sci USA. 1986; 83: 7938–7941.[Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Jombo GTA, Araoye MA, Damen JG. Самолечение малярии и выбор лекарств для ее лечения среди жителей эндемичного по малярии сообщества в Западной Африке. Азиатский Pac J Trop Dis. 2011; 1 (1): 10–16. [Google Scholar] 10. Питер Г., Мануэль А.Л., Шетти А. Исследование, сравнивающее клинический профиль сложных случаев малярии Plasmodium falciparum среди взрослых и детей. Азиатский Pac J Trop Dis. 2011; 1 (1): 35–37. [Google Scholar] 11. Jombo GTA, Alao OO, Araoye MO, Damen JG.Влияние десятилетнего крестового похода против малярии на западноафриканское сообщество. Азиатский Pac J Trop Dis. 2011; 1 (2): 100–105. [Google Scholar] 12. Алайя-Буафиф Н.Б., Чахед М.К., Без Х.Э., Беллали Х., Аяри Л., Ачур Н. Полнота уведомления о малярии в Тунисе, оцененная методом повторной поимки. Азиатский Pac J Trop Dis. 2011; 1 (2): 187–191. [Google Scholar] 13. Осонуга О.А., Осонуга А.А., Осонуга И.О., Осонуга А, Деркий К.Л. Распространенность гипогликемии среди детей с тяжелой малярией среди сельского населения Африки. Азиатский Pac J Trop Dis.2011; 1 (2): 192–194. [Google Scholar] 14. Ахмад М., Хасан В., Али О.М., Реза А.М. Комары Anopheline и их роль в передаче малярии в эндемичной зоне на юге Ирана. Азиатский Pac J Trop Dis. 2011; 1 (2): 209–211. [Google Scholar] 15. Форни JR, Wongsrichanalai C, Magill AJ, Craig LG, Sirichaisinthop J, Bautista CT и др. Устройства для быстрой диагностики малярии: оценка прототипов тестов, которые обнаруживают Plasmodium falciparum гистидин-богатый белок 2 и Plasmodium vivax -специфический антиген.J Clin Microbiol. 2003. 41: 2358–2366. [Бесплатная статья PMC] [PubMed] [Google Scholar]микроскопов и наборы для экспресс-диагностики
Asian Pac J Trop Biomed. 2012 Apr; 2 (4): 307–310.
CCA Azikiwe
1 Кафедра фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия
CC Ifezulike
1 Кафедра фармакологии, Государственный университет Анамбры, Симиниал, Ули, штат Анамбра, Нигерия 9
2 Кафедра фармакологии, Университет Порт-Харкорта, Порт-Харкорт, Нигерия
LU Amazu
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
3000 JC Enye
JC Enye
JC Enye
иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, НигерияOE Нваквуните
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
1 Кафедра фармакологии, Государственный университет Анамбра, Анамбра Государство, Нигерия
2 Кафедра фармакологии, Университет Порт-Харкорта, P Орт Харкорт, Нигерия
3 Кафедра иммунологии / паразитологии, Университет Мадонны, кампус Элеле, Нигерия
* Автор для переписки: Dr.Азикиве CCA, Департамент фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия. Тел .: 2348037203029, электронная почта: moc.oohay@ewikizaccПоступила в редакцию 15 октября 2011 г .; Пересмотрено 3 ноября 2011 г .; Принято 27 ноября 2011 г.
© Азиатско-Тихоокеанский журнал тропической биомедицины, 2012 г. Все права защищены.Эта статья цитировалась в других статьях PMC.Реферат
Цель
Сравнить два метода экспресс-диагностики (ДЭТ) и микроскопии в диагностике малярии.
Методы
ДЭТ и микроскопия были выполнены для диагностики малярии. Процент малярийной паразитемии был рассчитан на тонких пленках, и все неострые случаи плазмодоза с менее чем 0,001% малярийной паразитемии были расценены как отрицательные. Результаты были просто представлены как процент положительных результатов от общего числа исследуемых пациентов. Результаты RDT сравнивались с результатами микроскопии, а результаты RDT на основе антигена сравнивались с результатами RDT на основе антител.Наблюдение за пациентами велось во всех случаях.
Результаты
Все 200 пациентов, участвовавших в данном исследовании, дали положительный результат на ДЭТ на основе метода антител к малярии (сыворотка) (100%). 128 из 200 дали положительный результат на ДЭТ на основе метода малярийного антигена (цельная кровь) (64%), в то время как у 118 из 200 пациентов, участвовавших в настоящем исследовании, были получены положительные результаты при визуальной микроскопии Лишмана и разбавленного раствора Гимзы (59%). Все пациенты, у которых были получены положительные результаты при микроскопии, также дали положительные результаты на ДЭТ на основе антигена.Все пациенты на второй день наблюдения не имели лихорадки и получали противомалярийные препараты.
Выводы
На основании настоящего исследования мы пришли к выводу, что ДЭТ, основанные на методе малярийного антигена (цельная кровь), столь же специфичны, как и традиционная микроскопия, и даже кажутся более чувствительными, чем микроскопия. ДЭТ, основанный на методе антител (сыворотки), неспецифичен, поэтому его не следует поощрять. Скорее всего, Африка является эндемичным регионом, поэтому образование определенных уровней антител к малярии может быть не редкостью.Настоящее исследование также подтверждает мнение о том, что большое количество случаев лихорадки не связано с малярией. Мы поддерживаем отчет ВОЗ о рентабельности БДТ, но рекомендуем, чтобы в Африке и других эндемичных по малярии регионах мира, возможно, был принят только метод на основе антигена.
Ключевые слова: Экспресс-диагностические тесты, Микроскопия, Диагностика малярии, Малярия, Паразитемия, Плазмодиаз, Антиген, Антитело, Антималярия, Сыворотка, Цельная кровь
1. Введение
Малярия — одна из самых смертоносных болезней, поражающих большинство тропических стран особенно Африка.Этим заболеванием страдают более 500 миллионов человек во всем мире, и более миллиона детей ежегодно умирают от малярии [1]. Из всех паразитов малярии человека Plasmodium falciparum ( P. falciparum ) является наиболее патогенным и часто приводит к летальному исходу, если вовремя не лечить [2]. В Индии, по данным Нандвани [2], в 2002 году было зарегистрировано 1,82 миллиона случаев малярии и 0,89 миллиона случаев P. falciparum, случаев и 902 смерти. малярия, основанная на лихорадке в анамнезе, но значительная часть пролеченных может не иметь паразитов (более 50% во многих местах) и, следовательно, расходовать значительное количество лекарств [3].Эта старая клиническая практика по-прежнему актуальна сегодня, особенно для младенцев, у которых время, потраченное на получение подтверждающего лабораторного диагноза, может привести к увеличению летальности.
Распространенное назначение хлорохина пациентам, не болеющим малярией, терпимо, отчасти потому, что хлорохин настолько дешев. Однако комбинированная терапия на основе артемизинина (АКТ) стоит как минимум в 10 раз больше за курс лечения. Более того, гипердиагностика малярии подразумевает недостаточный диагноз и ненадлежащее лечение немалярийного фебрильного заболевания, в то время как большая часть таких заболеваний представляет собой самоограничивающиеся вирусные заболевания, а значительное меньшинство, такие как острые респираторные инфекции или бактериальный менингит, являются бактериальными заболеваниями и потенциально смертельными. [3].
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.
Однако традиционный метод микроскопической идентификации паразита не только пугает при плохой настройке мощности, но также требует много времени и опыта.Таким образом, микроскопия в Африке обычно ограничивается более крупными клиниками / центрами высшего образования. Однако это традиционное окрашивание мазков периферической крови / микроскопия все еще остается золотым стандартом в лабораторной диагностике малярии [2].
Быстрые диагностические тесты (БДТ) на малярию могут быть рассмотрены для большинства пациентов в эндемичных регионах, особенно в условиях плохого энергоснабжения, где в Африке не хватает квалифицированной рабочей силы. Однако существует очень мало данных, особенно из эндемичных по малярии районов, которые могли бы помочь лицам, принимающим решения, узнать о чувствительности и специфичности этих БДТ.
RDT коммерчески доступны в виде наборов со всеми необходимыми реагентами и простотой выполнения процедур, не требуют обширного обучения или оборудования для выполнения или интерпретации результатов. Результаты считываются через 12–15 мин [6].
RDT в основном бывают двух видов. Один основан на антигене и обычно требует использования гемолизированных эритроцитов, а другой основан на антителах и обычно требует использования экстрагированной сыворотки. Вообще говоря, антитела лучше экспрессируются в сыворотке, в противном случае плазма также может заменять сыворотку для метода, основанного на антителах.
Принципы испытаний основаны на обнаружении белка малярийных паразитов, то есть гистидина. При использовании метода антител это означает обнаружение наличия антител против гистидина в сыворотке крови человека, а при использовании цельной крови — обнаружение гистидина малярийных паразитов в красных кровяных тельцах [6].
Таким образом, исследование было направлено на сравнение двух методов микроскопии и ДЭТ в диагностике малярии.
2. Материалы и методы
Материалы включали флаконы с кровью этилендиаминтетрауксусной кислоты (ЭДТА), простые пробирки Хана, шприцы 5 мл, красители Лишмана и Гимзы, предметные стекла для микроскопии, световой микроскоп с хорошими объективами 40 и 100, RDT наборы от SD-Diagnostics USA и KS LAB-China.
Образцы крови были собраны в пробирки с ЭДТА и простые пробирки Хана у 200 пациентов, у которых в течение 1-3 дней была лихорадка и у которых был клинически диагностирована малярийная лихорадка.
Толстые и тонкие пленки получали в трех экземплярах из образцов EDTA в течение 10 минут после сбора, в то время как сыворотки собирали из простых пробирок, как только сгустки полностью образовывались.
Толстые пленки окрашивали методами Гимзы и Филда, а тонкие пленки окрашивали методами Лишмана и разбавленными методами Гимзы.
БДТ на основе антигенов проводили на аликвотах гемолизированной цельной крови в дубликатах. Сыворотки тестировали в двух экземплярах для выявления антител к малярийным паразитам на основе метода обнаружения антител к RDT.
Процент малярийной паразитемии был рассчитан на основе тонких пленок, и все неострые случаи плазмодоза с менее чем 10% малярийной паразитемией были расценены как отрицательные.
Был рассчитан процент малярийной паразитемии, а также средний процент подавления малярийной паразитемии.Эти расчеты были выполнены с использованием приведенной ниже формулы.
Где, WBC = лейкоциты, No = количество и MP = паразиты малярии (WBC в случае толстой пленки или RBC в случае тонкой пленки).
Двадцать микроскопических полей со средним значением 50 лейкоцитов на поле были подсчитаны, чтобы получить в общей сложности 1 000 лейкоцитов, как подсчитано количество лейкоцитов. При исследовании тонких пленок эритроциты заменяли лейкоциты в приведенной выше формуле для расчета процента паразитемии [1].
Через день наблюдение было проведено за всеми пациентами со 2 по 4 день.Все пациенты получали противомалярийные препараты вместе с антибиотиками / антибактериальными препаратами.
Все мазки крови с более чем 0,001% (≤50 / мкл) положительными мазками малярийной паразитемии и визуальными малярийными паразитами были просто представлены как положительные, в то время как мазки менее 0,001% и без визуальных малярийных паразитов просто считались отрицательными. RDT на основе как антигена, так и антител также просто сообщались как положительные или отрицательные. Процентная доля от общего числа пациентов (200) была указана для всех методов.
3. Результаты
Результаты показали, что можно понять, что сывороточный метод оказался ненадежным как специфический метод диагностики малярии. Поскольку микроскопия была принята в качестве золотого стандарта, все 72, которые оказались отрицательными с помощью метода антигена, по-прежнему имели отрицательные результаты при микроскопии. В то время как 10 дополнительных отрицательных случаев при микроскопии были положительными при использовании метода антигена (). Таким образом, можно сказать, что метод антигена более надежен, чем метод антитела, и столь же специфичен, как золотой стандарт i.е. микроскопия.
Таблица 1
Сводка положительных / отрицательных значений.
| Предметы | Цельная кровь (антигены) | Сыворотка (антитела) | Мазки цельной крови | |||
| Отрицательный | 72 | NIL | 200 | 118 | ||
| Всего | 200 | 200 | 200 | |||
| Положительный процент | 64% | 100% | 59% |
| Элементы | Время окрашивания (мин) | Время выдержки (мин) | Виды | |||
| Цельная кровь (антигены) | NIL | 90f 13 ± 4 9050P-P-P-P-90 | ||||
| Сыворотка (антитела) | NIL | 5 ± 2 | HRP-Pf | |||
| Толстые пленки цельной крови | 3 ± 1 | 40 ± 10 | Tropho4 903 9050 Whoto Pf тонкие пленки крови | 12 ± 4 | 40 ± 10 | Tropho & Gameto Pf |
4.Обсуждение
Существует четыре основных метода диагностики малярии. Это симптоматические, микроскопические, антигенные и молекулярные методы. Симптоматическая диагностика является наиболее распространенной, и люди в более бедных странах часто используют только симптомы для диагностики малярии. В других областях симптоматическая диагностика также часто является первичной, а затем следует один из других методов. Однако следует отметить, что многие другие заболевания имеют симптомы, очень похожие на малярию, и диагностика только по симптомам может вводить в заблуждение и даже пагубно.Лечение малярии там, где требуется другое лечение, оставляет болезнь неизлечимой, а пациента в критическом состоянии. Поэтому обязательно проводить симптоматическую диагностику одним из других более точных методов.
Длительные периодические лихорадки, озноб и телесные боли часто рассматриваются как симптомы малярии. Однако этот диагноз часто ошибочен; так иногда бывает паразитемия, что означает концентрацию паразитов в крови; оба могут быть вызваны другими видами инфекций.Было показано, что ретинопатия, изучение изменений, происходящих в сетчатке глаза, может служить хорошим признаком малярии, поскольку цвет и другие аспекты сетчатки изменились в результате определенных заболеваний. Следовательно, необходимо принять процентное соотношение паразитемии, чтобы оно коррелировало с клинической картиной.
Исследование крови под микроскопом с момента открытия Лавераном, французским ученым, первым идентифицировавшим паразита плазмодия, является наиболее надежным методом диагностики малярии.Поэтому образец крови исследуется под микроскопом на предмет наличия малярийного паразита. Хотя другие жидкости организма, такие как слюна или моча, также могут использоваться в качестве менее инвазивных методов, кровь предпочтительнее для более высокой концентрации паразита.
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.Внедрение дорогостоящих противомалярийных препаратов, таких как АКТ, побуждает эндемичных по малярии стран Африки к югу от Сахары пересмотреть методы диагностики [3]. Стремление разработать быстрый и точный метод диагностики малярии привело к тому, что Нандвани и др. [2] провели сравнительное обнаружение малярии с помощью полимеразной цепной реакции (ПЦР) и микроскопии у 100 индийских пациентов. Они обнаружили, что метод ПЦР имеет чувствительность 96,8%, но его выполнение занимает около 10–11 часов, тогда как микроскопия занимает в среднем 40–45 минут.ПЦР определяет присутствие малярийных паразитов в красных кровяных тельцах или в них. PCR требует электроэнергии, которая стоит целое состояние и не может быть легко рассмотрена для использования в Африке. Кроме того, это занимает очень много времени и не соответствует нашему желанию по скорости.
Иммунохроматографический метод обнаружения малярийных паразитов оказался наиболее быстрым и требует минимального обучения или вообще не требует его. Иммунохроматографический метод основан на миграции жидкости по поверхности нитроцеллюлозной мембраны [6].Тест основан на захвате антигена паразита из периферической крови с использованием моноклональных антител, полученных против антигена-мишени малярии и конъюгированных либо с липосомой, содержащей селеновый краситель, либо с частицами золота в подвижной фазе. Или наоборот, когда вместо моноклонального антитела для захвата антигена в целлюлозу включается антиген для захвата антитела в сыворотке или плазме. Наше настоящее исследование подтверждает, что иммунохроматографический метод, представленный в виде ДЭТ, является наиболее быстрым, а метод антител — наиболее быстрым.
Микроскопия — наиболее широко используемый инструмент для диагностики малярии на периферических уровнях. В умелых руках он очень чувствителен к паразитемии ≤50 / мкл (0,001%) [2] и может дать важную информацию для клинициста, такую как виды, стадии паразитов и плотность паразитов. Однако хорошее качество микроскопии трудно реализовать и поддерживать. Это трудоемкий процесс, требующий высококвалифицированного персонала и регулярного контроля качества. ВОЗ рекомендует использование ДЭТ против малярии, когда надежная микроскопия недоступна.В неэндемичных условиях, где не хватает опыта в микроскопии из-за низкой заболеваемости, ДЭТ по малярии имеют ценность для диагностики малярии и предоставляют информацию об участии P. falciparum . В ходе недавнего сеанса внешнего контроля качества 72,7% из 183 бельгийских лабораторий, предлагающих диагностику малярии, заявили, что используют ДЭТ в качестве инструмента для диагностики, и их использование рекомендуется в сочетании с микроскопией [7]. Maltha и др. [7] также показали, что P.falciparum , Plasmodium vivax и Plasmodium malariae показал 94,6%, 92,9% и 94,7% степень чувствительности при использовании ДЭТ при концентрации малярийных паразитов ≥1 000 / мкл, соответственно, но они показали проценты ниже, чем в среднем 58 % чувствительности при концентрации малярии ≤100 / мкл. Естественно, следует ожидать, что их чувствительность упадет почти до нуля при концентрации 0,001% (≤50 / мкл), где микроскопия также должна быть отрицательной.
Малярийные антигены, на которые в настоящее время нацелены RDT, — это HRP-2, лактатдегидрогеназа паразита (pLDH) и альдолаза плазмодия (PL-aldo).Moody [6] продемонстрировал, что видов Plasmodium секретируют эти белки, поэтому чувствительность и специфичность RDT измеряются на их основе. P. falciparum , как было показано, секретирует партии HRP-2 больше, чем HRP-1 и HRP-3, тогда как pLDH и PL-aldo обнаружены у других видов Plasmodium .
Мембраны эритроцитов, инфицированных малярийным паразитом человека P. falciparum , образуют выступы, называемые выступами. Эти структуры необходимы для выживания паразита в хозяине, и для их индукции требуется синтез белка-выступа паразитом [8] — [14].Эти шишки богаты гистидином. Гистидин, существующий в организме человека как незаменимая аминокислота, имеет положительно заряженную имидазольную функциональную группу. Имидазол делает его частым участником реакций, катализируемых ферментами. Непротонированный имидазол является нуклеофильным и может служить общим основанием, тогда как протонированная форма может служить общей кислотой. Остаток также может играть роль в стабилизации свернутых структур белков. Гистидин, обнаруженный у малярийных паразитов, является изомером, а ДЭТ чувствительны только к таковым малярии (HRP-2).Однако этот тип встречается только у P. falciparum , в то время как pLDH встречается у других видов. Но большинство RDT не обнаруживают присутствия малярийных паразитов при смешанной инфекции [15]. Наш метод RDT был более чувствителен к HRP-2, поскольку P. falciparum является не только самым смертоносным, но и наиболее часто встречающимся в этой части мира, то есть оправданным. Микроскопия, золотой стандарт, также соответствует этой точке зрения. Однако следует отметить, что, поскольку все пациенты, участвующие в текущем исследовании, имели противомалярийные препараты и все были избавлены от плохого состояния здоровья, существует вероятность появления других видов Plasmodium .
Наша работа также ясно показывает, что метод на основе антигена лучше коррелирует как с золотым стандартом , то есть с микроскопией , так и с клиническими условиями. Метод на основе антител, как и ожидалось, показал хороший уровень чувствительности, но очень неспецифический. Нигерия является эндемичным по малярии районом, поэтому антитела против HRP-2 могут быть обычным явлением. В нашей настоящей работе это было 100%, и если это экстраполировать на наше общество в целом, это означает, что практически каждый человек с лихорадкой будет иметь положительный результат теста на антитела.
Мы пришли к выводу, что ДЭТ для диагностики малярии так же надежен, как и микроскопия, но только метод на основе антигена подходит для Нигерии и, возможно, других частей тропиков, где малярия является эндемической. Мы рекомендуем импортировать только наборы методов на основе антигенов и / или использовать их в Нигерии и, возможно, в других частях тропиков, эндемичных по малярии.
Сноски
Заявление о конфликте интересов: Мы заявляем, что у нас нет конфликта интересов.
Список литературы
1.Amazu LU, Ebong OO, Azikiwe CCA, Unekwe PC, Simialayi MI, Nwosu PJC и др. Эффекты экстракта семян Carica papaya в метаноле на инфицированных мышах Plasmodium berghei . Азиатский Pac J Trop Med. 2009. 2 (3): 1–6. [Google Scholar] 2. Нандвани С., Матур М., Рават С. Оценка анализа полимеразной цепной реакции для диагностики малярии falciparum в Дели, Индия. Индийский J Med Microbiol. 2005. 23 (3): 176–178. [PubMed] [Google Scholar] 3. Шиллкатт С., Морел С., Гудман С., Колман П., Белл Д., Уитти С.Дж. и др.Экономическая эффективность методов диагностики малярии в странах Африки к югу от Сахары в эпоху комбинированной терапии. Bull World Health Organ. 2008. 86: 101–110. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Белл Д., Го Р., Мигель С., Уокер Дж., Какал Л., Саул А. Диагностика малярии в отдаленном районе Филиппин: сравнение методов и их признание медицинскими работниками и обществом. Bull World Health Organ. 2001; 79: 933–941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. КТО . Роль лабораторной диагностики в поддержке борьбы с малярией: сосредоточить внимание на использовании быстрых диагностических тестов в областях с высокой степенью передачи.Женева: ВОЗ; 2006. [Google Scholar] 7. Джессика М., Жилле П., Кнопс Л., Боттио Э., Эсбрук М.В., Брюггеман С. и др. Оценка диагностического экспресс-теста SDFK40 (Pf-pLDH / pan-pLDH) для диагностики малярии в неэндемичных условиях. Малар Дж. 2001; 10 (1): 7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Kilejian A, Sharma YD, Karoui H, Naslund L. Богатый гистидином домен белка выступа малярийного паразита человека Plasmodium falciparum . Proc Natl Acad Sci USA. 1986; 83: 7938–7941.[Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Jombo GTA, Araoye MA, Damen JG. Самолечение малярии и выбор лекарств для ее лечения среди жителей эндемичного по малярии сообщества в Западной Африке. Азиатский Pac J Trop Dis. 2011; 1 (1): 10–16. [Google Scholar] 10. Питер Г., Мануэль А.Л., Шетти А. Исследование, сравнивающее клинический профиль сложных случаев малярии Plasmodium falciparum среди взрослых и детей. Азиатский Pac J Trop Dis. 2011; 1 (1): 35–37. [Google Scholar] 11. Jombo GTA, Alao OO, Araoye MO, Damen JG.Влияние десятилетнего крестового похода против малярии на западноафриканское сообщество. Азиатский Pac J Trop Dis. 2011; 1 (2): 100–105. [Google Scholar] 12. Алайя-Буафиф Н.Б., Чахед М.К., Без Х.Э., Беллали Х., Аяри Л., Ачур Н. Полнота уведомления о малярии в Тунисе, оцененная методом повторной поимки. Азиатский Pac J Trop Dis. 2011; 1 (2): 187–191. [Google Scholar] 13. Осонуга О.А., Осонуга А.А., Осонуга И.О., Осонуга А, Деркий К.Л. Распространенность гипогликемии среди детей с тяжелой малярией среди сельского населения Африки. Азиатский Pac J Trop Dis.2011; 1 (2): 192–194. [Google Scholar] 14. Ахмад М., Хасан В., Али О.М., Реза А.М. Комары Anopheline и их роль в передаче малярии в эндемичной зоне на юге Ирана. Азиатский Pac J Trop Dis. 2011; 1 (2): 209–211. [Google Scholar] 15. Форни JR, Wongsrichanalai C, Magill AJ, Craig LG, Sirichaisinthop J, Bautista CT и др. Устройства для быстрой диагностики малярии: оценка прототипов тестов, которые обнаруживают Plasmodium falciparum гистидин-богатый белок 2 и Plasmodium vivax -специфический антиген.J Clin Microbiol. 2003. 41: 2358–2366. [Бесплатная статья PMC] [PubMed] [Google Scholar]микроскопов и наборы для экспресс-диагностики
Asian Pac J Trop Biomed. 2012 Apr; 2 (4): 307–310.
CCA Azikiwe
1 Кафедра фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия
CC Ifezulike
1 Кафедра фармакологии, Государственный университет Анамбры, Симиниал, Ули, штат Анамбра, Нигерия 9
2 Кафедра фармакологии, Университет Порт-Харкорта, Порт-Харкорт, Нигерия
LU Amazu
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
3000 JC Enye
JC Enye
JC Enye
иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, НигерияOE Нваквуните
3 Кафедра иммунологии / паразитологии, Университет Мадонны, Кампус Элеле, Нигерия
1 Кафедра фармакологии, Государственный университет Анамбра, Анамбра Государство, Нигерия
2 Кафедра фармакологии, Университет Порт-Харкорта, P Орт Харкорт, Нигерия
3 Кафедра иммунологии / паразитологии, Университет Мадонны, кампус Элеле, Нигерия
* Автор для переписки: Dr.Азикиве CCA, Департамент фармакологии, Государственный университет Анамбра, Ули, штат Анамбра, Нигерия. Тел .: 2348037203029, электронная почта: moc.oohay@ewikizaccПоступила в редакцию 15 октября 2011 г .; Пересмотрено 3 ноября 2011 г .; Принято 27 ноября 2011 г.
© Азиатско-Тихоокеанский журнал тропической биомедицины, 2012 г. Все права защищены.Эта статья цитировалась в других статьях PMC.Реферат
Цель
Сравнить два метода экспресс-диагностики (ДЭТ) и микроскопии в диагностике малярии.
Методы
ДЭТ и микроскопия были выполнены для диагностики малярии. Процент малярийной паразитемии был рассчитан на тонких пленках, и все неострые случаи плазмодоза с менее чем 0,001% малярийной паразитемии были расценены как отрицательные. Результаты были просто представлены как процент положительных результатов от общего числа исследуемых пациентов. Результаты RDT сравнивались с результатами микроскопии, а результаты RDT на основе антигена сравнивались с результатами RDT на основе антител.Наблюдение за пациентами велось во всех случаях.
Результаты
Все 200 пациентов, участвовавших в данном исследовании, дали положительный результат на ДЭТ на основе метода антител к малярии (сыворотка) (100%). 128 из 200 дали положительный результат на ДЭТ на основе метода малярийного антигена (цельная кровь) (64%), в то время как у 118 из 200 пациентов, участвовавших в настоящем исследовании, были получены положительные результаты при визуальной микроскопии Лишмана и разбавленного раствора Гимзы (59%). Все пациенты, у которых были получены положительные результаты при микроскопии, также дали положительные результаты на ДЭТ на основе антигена.Все пациенты на второй день наблюдения не имели лихорадки и получали противомалярийные препараты.
Выводы
На основании настоящего исследования мы пришли к выводу, что ДЭТ, основанные на методе малярийного антигена (цельная кровь), столь же специфичны, как и традиционная микроскопия, и даже кажутся более чувствительными, чем микроскопия. ДЭТ, основанный на методе антител (сыворотки), неспецифичен, поэтому его не следует поощрять. Скорее всего, Африка является эндемичным регионом, поэтому образование определенных уровней антител к малярии может быть не редкостью.Настоящее исследование также подтверждает мнение о том, что большое количество случаев лихорадки не связано с малярией. Мы поддерживаем отчет ВОЗ о рентабельности БДТ, но рекомендуем, чтобы в Африке и других эндемичных по малярии регионах мира, возможно, был принят только метод на основе антигена.
Ключевые слова: Экспресс-диагностические тесты, Микроскопия, Диагностика малярии, Малярия, Паразитемия, Плазмодиаз, Антиген, Антитело, Антималярия, Сыворотка, Цельная кровь
1. Введение
Малярия — одна из самых смертоносных болезней, поражающих большинство тропических стран особенно Африка.Этим заболеванием страдают более 500 миллионов человек во всем мире, и более миллиона детей ежегодно умирают от малярии [1]. Из всех паразитов малярии человека Plasmodium falciparum ( P. falciparum ) является наиболее патогенным и часто приводит к летальному исходу, если вовремя не лечить [2]. В Индии, по данным Нандвани [2], в 2002 году было зарегистрировано 1,82 миллиона случаев малярии и 0,89 миллиона случаев P. falciparum, случаев и 902 смерти. малярия, основанная на лихорадке в анамнезе, но значительная часть пролеченных может не иметь паразитов (более 50% во многих местах) и, следовательно, расходовать значительное количество лекарств [3].Эта старая клиническая практика по-прежнему актуальна сегодня, особенно для младенцев, у которых время, потраченное на получение подтверждающего лабораторного диагноза, может привести к увеличению летальности.
Распространенное назначение хлорохина пациентам, не болеющим малярией, терпимо, отчасти потому, что хлорохин настолько дешев. Однако комбинированная терапия на основе артемизинина (АКТ) стоит как минимум в 10 раз больше за курс лечения. Более того, гипердиагностика малярии подразумевает недостаточный диагноз и ненадлежащее лечение немалярийного фебрильного заболевания, в то время как большая часть таких заболеваний представляет собой самоограничивающиеся вирусные заболевания, а значительное меньшинство, такие как острые респираторные инфекции или бактериальный менингит, являются бактериальными заболеваниями и потенциально смертельными. [3].
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.
Однако традиционный метод микроскопической идентификации паразита не только пугает при плохой настройке мощности, но также требует много времени и опыта.Таким образом, микроскопия в Африке обычно ограничивается более крупными клиниками / центрами высшего образования. Однако это традиционное окрашивание мазков периферической крови / микроскопия все еще остается золотым стандартом в лабораторной диагностике малярии [2].
Быстрые диагностические тесты (БДТ) на малярию могут быть рассмотрены для большинства пациентов в эндемичных регионах, особенно в условиях плохого энергоснабжения, где в Африке не хватает квалифицированной рабочей силы. Однако существует очень мало данных, особенно из эндемичных по малярии районов, которые могли бы помочь лицам, принимающим решения, узнать о чувствительности и специфичности этих БДТ.
RDT коммерчески доступны в виде наборов со всеми необходимыми реагентами и простотой выполнения процедур, не требуют обширного обучения или оборудования для выполнения или интерпретации результатов. Результаты считываются через 12–15 мин [6].
RDT в основном бывают двух видов. Один основан на антигене и обычно требует использования гемолизированных эритроцитов, а другой основан на антителах и обычно требует использования экстрагированной сыворотки. Вообще говоря, антитела лучше экспрессируются в сыворотке, в противном случае плазма также может заменять сыворотку для метода, основанного на антителах.
Принципы испытаний основаны на обнаружении белка малярийных паразитов, то есть гистидина. При использовании метода антител это означает обнаружение наличия антител против гистидина в сыворотке крови человека, а при использовании цельной крови — обнаружение гистидина малярийных паразитов в красных кровяных тельцах [6].
Таким образом, исследование было направлено на сравнение двух методов микроскопии и ДЭТ в диагностике малярии.
2. Материалы и методы
Материалы включали флаконы с кровью этилендиаминтетрауксусной кислоты (ЭДТА), простые пробирки Хана, шприцы 5 мл, красители Лишмана и Гимзы, предметные стекла для микроскопии, световой микроскоп с хорошими объективами 40 и 100, RDT наборы от SD-Diagnostics USA и KS LAB-China.
Образцы крови были собраны в пробирки с ЭДТА и простые пробирки Хана у 200 пациентов, у которых в течение 1-3 дней была лихорадка и у которых был клинически диагностирована малярийная лихорадка.
Толстые и тонкие пленки получали в трех экземплярах из образцов EDTA в течение 10 минут после сбора, в то время как сыворотки собирали из простых пробирок, как только сгустки полностью образовывались.
Толстые пленки окрашивали методами Гимзы и Филда, а тонкие пленки окрашивали методами Лишмана и разбавленными методами Гимзы.
БДТ на основе антигенов проводили на аликвотах гемолизированной цельной крови в дубликатах. Сыворотки тестировали в двух экземплярах для выявления антител к малярийным паразитам на основе метода обнаружения антител к RDT.
Процент малярийной паразитемии был рассчитан на основе тонких пленок, и все неострые случаи плазмодоза с менее чем 10% малярийной паразитемией были расценены как отрицательные.
Был рассчитан процент малярийной паразитемии, а также средний процент подавления малярийной паразитемии.Эти расчеты были выполнены с использованием приведенной ниже формулы.
Где, WBC = лейкоциты, No = количество и MP = паразиты малярии (WBC в случае толстой пленки или RBC в случае тонкой пленки).
Двадцать микроскопических полей со средним значением 50 лейкоцитов на поле были подсчитаны, чтобы получить в общей сложности 1 000 лейкоцитов, как подсчитано количество лейкоцитов. При исследовании тонких пленок эритроциты заменяли лейкоциты в приведенной выше формуле для расчета процента паразитемии [1].
Через день наблюдение было проведено за всеми пациентами со 2 по 4 день.Все пациенты получали противомалярийные препараты вместе с антибиотиками / антибактериальными препаратами.
Все мазки крови с более чем 0,001% (≤50 / мкл) положительными мазками малярийной паразитемии и визуальными малярийными паразитами были просто представлены как положительные, в то время как мазки менее 0,001% и без визуальных малярийных паразитов просто считались отрицательными. RDT на основе как антигена, так и антител также просто сообщались как положительные или отрицательные. Процентная доля от общего числа пациентов (200) была указана для всех методов.
3. Результаты
Результаты показали, что можно понять, что сывороточный метод оказался ненадежным как специфический метод диагностики малярии. Поскольку микроскопия была принята в качестве золотого стандарта, все 72, которые оказались отрицательными с помощью метода антигена, по-прежнему имели отрицательные результаты при микроскопии. В то время как 10 дополнительных отрицательных случаев при микроскопии были положительными при использовании метода антигена (). Таким образом, можно сказать, что метод антигена более надежен, чем метод антитела, и столь же специфичен, как золотой стандарт i.е. микроскопия.
Таблица 1
Сводка положительных / отрицательных значений.
| Предметы | Цельная кровь (антигены) | Сыворотка (антитела) | Мазки цельной крови | |||
| Отрицательный | 72 | NIL | 200 | 118 | ||
| Всего | 200 | 200 | 200 | |||
| Положительный процент | 64% | 100% | 59% |
| Элементы | Время окрашивания (мин) | Время выдержки (мин) | Виды | |||
| Цельная кровь (антигены) | NIL | 90f 13 ± 4 9050P-P-P-P-90 | ||||
| Сыворотка (антитела) | NIL | 5 ± 2 | HRP-Pf | |||
| Толстые пленки цельной крови | 3 ± 1 | 40 ± 10 | Tropho4 903 9050 Whoto Pf тонкие пленки крови | 12 ± 4 | 40 ± 10 | Tropho & Gameto Pf |
4.Обсуждение
Существует четыре основных метода диагностики малярии. Это симптоматические, микроскопические, антигенные и молекулярные методы. Симптоматическая диагностика является наиболее распространенной, и люди в более бедных странах часто используют только симптомы для диагностики малярии. В других областях симптоматическая диагностика также часто является первичной, а затем следует один из других методов. Однако следует отметить, что многие другие заболевания имеют симптомы, очень похожие на малярию, и диагностика только по симптомам может вводить в заблуждение и даже пагубно.Лечение малярии там, где требуется другое лечение, оставляет болезнь неизлечимой, а пациента в критическом состоянии. Поэтому обязательно проводить симптоматическую диагностику одним из других более точных методов.
Длительные периодические лихорадки, озноб и телесные боли часто рассматриваются как симптомы малярии. Однако этот диагноз часто ошибочен; так иногда бывает паразитемия, что означает концентрацию паразитов в крови; оба могут быть вызваны другими видами инфекций.Было показано, что ретинопатия, изучение изменений, происходящих в сетчатке глаза, может служить хорошим признаком малярии, поскольку цвет и другие аспекты сетчатки изменились в результате определенных заболеваний. Следовательно, необходимо принять процентное соотношение паразитемии, чтобы оно коррелировало с клинической картиной.
Исследование крови под микроскопом с момента открытия Лавераном, французским ученым, первым идентифицировавшим паразита плазмодия, является наиболее надежным методом диагностики малярии.Поэтому образец крови исследуется под микроскопом на предмет наличия малярийного паразита. Хотя другие жидкости организма, такие как слюна или моча, также могут использоваться в качестве менее инвазивных методов, кровь предпочтительнее для более высокой концентрации паразита.
В настоящее время ВОЗ дает предварительную рекомендацию о том, что паразитарная диагностика должна использоваться во всех случаях подозрения на малярию, за возможным исключением детей в районах с высокой распространенностью и некоторых других ситуациях [4], [5]. Для очевидного соблюдения этой рекомендации необходимо быстрое и точное лабораторное обнаружение или демонстрация малярийного паразита.Внедрение дорогостоящих противомалярийных препаратов, таких как АКТ, побуждает эндемичных по малярии стран Африки к югу от Сахары пересмотреть методы диагностики [3]. Стремление разработать быстрый и точный метод диагностики малярии привело к тому, что Нандвани и др. [2] провели сравнительное обнаружение малярии с помощью полимеразной цепной реакции (ПЦР) и микроскопии у 100 индийских пациентов. Они обнаружили, что метод ПЦР имеет чувствительность 96,8%, но его выполнение занимает около 10–11 часов, тогда как микроскопия занимает в среднем 40–45 минут.ПЦР определяет присутствие малярийных паразитов в красных кровяных тельцах или в них. PCR требует электроэнергии, которая стоит целое состояние и не может быть легко рассмотрена для использования в Африке. Кроме того, это занимает очень много времени и не соответствует нашему желанию по скорости.
Иммунохроматографический метод обнаружения малярийных паразитов оказался наиболее быстрым и требует минимального обучения или вообще не требует его. Иммунохроматографический метод основан на миграции жидкости по поверхности нитроцеллюлозной мембраны [6].Тест основан на захвате антигена паразита из периферической крови с использованием моноклональных антител, полученных против антигена-мишени малярии и конъюгированных либо с липосомой, содержащей селеновый краситель, либо с частицами золота в подвижной фазе. Или наоборот, когда вместо моноклонального антитела для захвата антигена в целлюлозу включается антиген для захвата антитела в сыворотке или плазме. Наше настоящее исследование подтверждает, что иммунохроматографический метод, представленный в виде ДЭТ, является наиболее быстрым, а метод антител — наиболее быстрым.
Микроскопия — наиболее широко используемый инструмент для диагностики малярии на периферических уровнях. В умелых руках он очень чувствителен к паразитемии ≤50 / мкл (0,001%) [2] и может дать важную информацию для клинициста, такую как виды, стадии паразитов и плотность паразитов. Однако хорошее качество микроскопии трудно реализовать и поддерживать. Это трудоемкий процесс, требующий высококвалифицированного персонала и регулярного контроля качества. ВОЗ рекомендует использование ДЭТ против малярии, когда надежная микроскопия недоступна.В неэндемичных условиях, где не хватает опыта в микроскопии из-за низкой заболеваемости, ДЭТ по малярии имеют ценность для диагностики малярии и предоставляют информацию об участии P. falciparum . В ходе недавнего сеанса внешнего контроля качества 72,7% из 183 бельгийских лабораторий, предлагающих диагностику малярии, заявили, что используют ДЭТ в качестве инструмента для диагностики, и их использование рекомендуется в сочетании с микроскопией [7]. Maltha и др. [7] также показали, что P.falciparum , Plasmodium vivax и Plasmodium malariae показал 94,6%, 92,9% и 94,7% степень чувствительности при использовании ДЭТ при концентрации малярийных паразитов ≥1 000 / мкл, соответственно, но они показали проценты ниже, чем в среднем 58 % чувствительности при концентрации малярии ≤100 / мкл. Естественно, следует ожидать, что их чувствительность упадет почти до нуля при концентрации 0,001% (≤50 / мкл), где микроскопия также должна быть отрицательной.
Малярийные антигены, на которые в настоящее время нацелены RDT, — это HRP-2, лактатдегидрогеназа паразита (pLDH) и альдолаза плазмодия (PL-aldo).Moody [6] продемонстрировал, что видов Plasmodium секретируют эти белки, поэтому чувствительность и специфичность RDT измеряются на их основе. P. falciparum , как было показано, секретирует партии HRP-2 больше, чем HRP-1 и HRP-3, тогда как pLDH и PL-aldo обнаружены у других видов Plasmodium .
Мембраны эритроцитов, инфицированных малярийным паразитом человека P. falciparum , образуют выступы, называемые выступами. Эти структуры необходимы для выживания паразита в хозяине, и для их индукции требуется синтез белка-выступа паразитом [8] — [14].Эти шишки богаты гистидином. Гистидин, существующий в организме человека как незаменимая аминокислота, имеет положительно заряженную имидазольную функциональную группу. Имидазол делает его частым участником реакций, катализируемых ферментами. Непротонированный имидазол является нуклеофильным и может служить общим основанием, тогда как протонированная форма может служить общей кислотой. Остаток также может играть роль в стабилизации свернутых структур белков. Гистидин, обнаруженный у малярийных паразитов, является изомером, а ДЭТ чувствительны только к таковым малярии (HRP-2).Однако этот тип встречается только у P. falciparum , в то время как pLDH встречается у других видов. Но большинство RDT не обнаруживают присутствия малярийных паразитов при смешанной инфекции [15]. Наш метод RDT был более чувствителен к HRP-2, поскольку P. falciparum является не только самым смертоносным, но и наиболее часто встречающимся в этой части мира, то есть оправданным. Микроскопия, золотой стандарт, также соответствует этой точке зрения. Однако следует отметить, что, поскольку все пациенты, участвующие в текущем исследовании, имели противомалярийные препараты и все были избавлены от плохого состояния здоровья, существует вероятность появления других видов Plasmodium .
Наша работа также ясно показывает, что метод на основе антигена лучше коррелирует как с золотым стандартом , то есть с микроскопией , так и с клиническими условиями. Метод на основе антител, как и ожидалось, показал хороший уровень чувствительности, но очень неспецифический. Нигерия является эндемичным по малярии районом, поэтому антитела против HRP-2 могут быть обычным явлением. В нашей настоящей работе это было 100%, и если это экстраполировать на наше общество в целом, это означает, что практически каждый человек с лихорадкой будет иметь положительный результат теста на антитела.
Мы пришли к выводу, что ДЭТ для диагностики малярии так же надежен, как и микроскопия, но только метод на основе антигена подходит для Нигерии и, возможно, других частей тропиков, где малярия является эндемической. Мы рекомендуем импортировать только наборы методов на основе антигенов и / или использовать их в Нигерии и, возможно, в других частях тропиков, эндемичных по малярии.
Сноски
Заявление о конфликте интересов: Мы заявляем, что у нас нет конфликта интересов.
Список литературы
1.Amazu LU, Ebong OO, Azikiwe CCA, Unekwe PC, Simialayi MI, Nwosu PJC и др. Эффекты экстракта семян Carica papaya в метаноле на инфицированных мышах Plasmodium berghei . Азиатский Pac J Trop Med. 2009. 2 (3): 1–6. [Google Scholar] 2. Нандвани С., Матур М., Рават С. Оценка анализа полимеразной цепной реакции для диагностики малярии falciparum в Дели, Индия. Индийский J Med Microbiol. 2005. 23 (3): 176–178. [PubMed] [Google Scholar] 3. Шиллкатт С., Морел С., Гудман С., Колман П., Белл Д., Уитти С.Дж. и др.Экономическая эффективность методов диагностики малярии в странах Африки к югу от Сахары в эпоху комбинированной терапии. Bull World Health Organ. 2008. 86: 101–110. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Белл Д., Го Р., Мигель С., Уокер Дж., Какал Л., Саул А. Диагностика малярии в отдаленном районе Филиппин: сравнение методов и их признание медицинскими работниками и обществом. Bull World Health Organ. 2001; 79: 933–941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. КТО . Роль лабораторной диагностики в поддержке борьбы с малярией: сосредоточить внимание на использовании быстрых диагностических тестов в областях с высокой степенью передачи.Женева: ВОЗ; 2006. [Google Scholar] 7. Джессика М., Жилле П., Кнопс Л., Боттио Э., Эсбрук М.В., Брюггеман С. и др. Оценка диагностического экспресс-теста SDFK40 (Pf-pLDH / pan-pLDH) для диагностики малярии в неэндемичных условиях. Малар Дж. 2001; 10 (1): 7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Kilejian A, Sharma YD, Karoui H, Naslund L. Богатый гистидином домен белка выступа малярийного паразита человека Plasmodium falciparum . Proc Natl Acad Sci USA. 1986; 83: 7938–7941.[Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Jombo GTA, Araoye MA, Damen JG. Самолечение малярии и выбор лекарств для ее лечения среди жителей эндемичного по малярии сообщества в Западной Африке. Азиатский Pac J Trop Dis. 2011; 1 (1): 10–16. [Google Scholar] 10. Питер Г., Мануэль А.Л., Шетти А. Исследование, сравнивающее клинический профиль сложных случаев малярии Plasmodium falciparum среди взрослых и детей. Азиатский Pac J Trop Dis. 2011; 1 (1): 35–37. [Google Scholar] 11. Jombo GTA, Alao OO, Araoye MO, Damen JG.Влияние десятилетнего крестового похода против малярии на западноафриканское сообщество. Азиатский Pac J Trop Dis. 2011; 1 (2): 100–105. [Google Scholar] 12. Алайя-Буафиф Н.Б., Чахед М.К., Без Х.Э., Беллали Х., Аяри Л., Ачур Н. Полнота уведомления о малярии в Тунисе, оцененная методом повторной поимки. Азиатский Pac J Trop Dis. 2011; 1 (2): 187–191. [Google Scholar] 13. Осонуга О.А., Осонуга А.А., Осонуга И.О., Осонуга А, Деркий К.Л. Распространенность гипогликемии среди детей с тяжелой малярией среди сельского населения Африки. Азиатский Pac J Trop Dis.2011; 1 (2): 192–194. [Google Scholar] 14. Ахмад М., Хасан В., Али О.М., Реза А.М. Комары Anopheline и их роль в передаче малярии в эндемичной зоне на юге Ирана. Азиатский Pac J Trop Dis. 2011; 1 (2): 209–211. [Google Scholar] 15. Форни JR, Wongsrichanalai C, Magill AJ, Craig LG, Sirichaisinthop J, Bautista CT и др. Устройства для быстрой диагностики малярии: оценка прототипов тестов, которые обнаруживают Plasmodium falciparum гистидин-богатый белок 2 и Plasmodium vivax -специфический антиген.J Clin Microbiol. 2003. 41: 2358–2366. [Бесплатная статья PMC] [PubMed] [Google Scholar]Сравнение клинических, микроскопических и быстрых диагностических методов диагностики малярии Plasmodium falciparum в Энугу, Нигерия
Задача: Сравнить использование клинических, микроскопических и иммунохроматографических методов в диагностике малярии, вызванной Plasmodium falciparum.
Методы: Последовательно набирали детей с лихорадкой в анамнезе.Информация о личностных характеристиках и клинических характеристиках была получена с согласия родителей до включения в исследование. Плотность малярийных паразитов определялась с помощью количественной микроскопии, а также идентификации видов как в местных, так и в справочных лабораториях. Наборы для экспресс-диагностики (RDT) также использовались для обнаружения паразитов.
Полученные результаты: У восьмидесяти трех детей был клинический диагноз малярии, а у остальных 6 были другие диагнозы.Под микроскопом у 89 и 26 пациентов была паразитемия, выявленная в местной и справочной лабораториях соответственно. С помощью RDT у 15 пациентов была паразитемия с соответствующей минимальной плотностью паразитов 1200 и 716 паразитов на 1 мкл по данным местной и справочной лабораторий. Чувствительность и специфичность ДЭТ по отношению к справочной лаборатории составляли 42,31% и 93,65% соответственно, в то время как соответствие составляло 57,69% для ДЭТ, 30,49% для клинического диагноза (все симптомы), 43,75% для клинического диагноза (только лихорадка) и 29.21% для местной лаборатории.
Заключение: Существовал значительный недостаток диагностики малярии с использованием одного из этих методов. Для надежной диагностики малярии рекомендуется сочетание методов диагностики. Деградация RDT могла способствовать его низкой чувствительности. Для улучшения диагностики малярии необходимо обеспечить обучение и более качественные гарантии для медицинских и лабораторных работников.
.