ИНФОРМАЦИОННОЕ ПИСЬМО КЛИНИКО-ДИАГНОСТИЧЕСКИЕ АСПЕКТЫ МИКОПЛАЗМЕННОЙ ИНФЕКЦИИ В ОЧАГАХ. ЛЕЧЕНИЕ, ПРОФИЛАКТИКА
Этиология. Микоплазмы — бактерии, относящиеся к семейству Mycoplasmataceae, роду Mycoplasma. Описано более 70 видов микоплазм, как сапрофитных, обитающих в окружающей среде (почве, сточных водах), так и патогенных для человека и животных. Человек является хозяином нескольких видов микоплазм: M.pneumoniae, M.fermentans, M.hominis, M.genitalium, M.lipophilum, M.faucium, M.primatum, M.salivarium, M.buccale, M.orale, M.incognitus, Ureaplasma urealyticum. Микопламы — плеоморфные подвижные факультативные анаэробы, лишенные клеточной стенки. Микроорганизм состоит из нуклеотида, представленного ДНК и РНК, рибосомы и трехслойной мембраны. Микоплазмы лишены компонентов клеточной стенки: кислоты и мукопептидного комплекса, что обусловливает их полиморфизм (форма кольца, гранулы, сферического тела). Микоплазмы могут существовать не только вне, но и внутри клеток, что позволяет им ускользать от механизмов иммунной защиты организма.
Микоплазмы неустойчивы во внешней среде, разрушаются под действием температуры, замораживания, ультрафиолета, ультразвука, а также современных моющих и дезинфицирующих средств.
Эпидемиология. Источником инфекции являются больные острыми и хроническими формами микоплазмоза, а также носители микоплазм. Механизм передачи: капельный, контактный. Пути передачи — воздушно-капельный, половой, вертикальный (трансплацентарный или интранатальный).
Респираторный микоплазмоз, вызываемый M. pneumoniae и передающийся воздушно-капельным путем, составляет от 7% до 21% в структуре острых респираторных заболеваний, занимая 5 место среди болезней органов дыхания. В структуре пневмоний микоплазменная инфекция составляет до 48%, особенно в период сезонного подъема заболеваемости острыми респираторными инфекциями, когда число заболевших респираторным микоплазмозом также увеличивается.
Для микоплазменной инфекции характерно периодическое повышение заболеваемости с интервалом 3 — 5 лет.
Для передачи возбудителя требуется довольно тесный и длительный контакт, поэтому респираторный микоплазмоз особенно распространен в закрытых коллективах.
Микоплазма обнаруживается в носоглоточной слизи в течение 8 недель и более от начала заболевания даже при наличии специфических антител в сыворотке крови и клинически эффективной антибиотикотерапии.
В закрытых учреждениях эпидемический процесс может затягиваться от 8 — 9 недель до 5 — 6 месяцев и более.
Клиническая картина приобретенной микоплазменной инфекции с поражением респираторного тракта.
По Международной классификации болезней 10-го пересмотра заболевания, этиологическим фактором которых выступает M. pneumoniae, шифруются под следующими кодами:
J15.7 Пневмония, вызванная Mycoplasma pneumoniae;
J20. 0 Острый бронхит, вызванный Mycoplasma pneumoniae;
0 Острый бронхит, вызванный Mycoplasma pneumoniae;
B96.0 Mycoplasma pneumoniae как причина болезней, классифицированных в других рубриках.
Инкубационный период при микоплазменной инфекции у детей составляет от 3 дней до 4 недель, средняя продолжительность 7 — 14 дней.
Микоплазмоз верхних дыхательных путей. Начало заболевания чаще постепенное, реже — острое. Синдром интоксикации выражен слабо, лихорадка субфебрильная в течение 7 — 10 дней. При остром начале возможна кратковременная фебрильная лихорадка с длительным субфебрилитетом до 10 — 12 дней. Катаральный синдром в виде острого назофарингита, конъюнктивита. Характерны легкая гиперемия лица, инъекция сосудов склер. У детей раннего возраста нередко отмечают коклюшеподобный кашель, периодически заканчивающийся рвотой. У больных также выявляют кратковременные и умеренно выраженные синдромы: лимфаденопатия (преимущественно шейной и подмышечной группы), умеренная гепатомегалия, возможен диспептический синдром: тошнота, рвота, боли в животе, диарея.
Микоплазменная пневмония. Начало чаще острое, но бывает и постепенное. Характерна фебрильная лихорадка в течение 3 — 10 дней, после чего может отмечаться длительный (до 1 мес) субфебрилитет. Характерно несоответствие высокой лихорадки умеренно выраженному синдрому интоксикации. Для катарального синдрома типичны проявления фарингита, конъюнктивита, ринита. Кашель в начале заболевания сухой, затем становится влажным, с отхождением небольшого количества вязкой мокроты (коклюшеподобный), сохраняется длительно (до 1 месяца). С 5 — 7 суток больные могут жаловаться на боли в грудной клетке. Данные физикального исследования часто скудные: аускультативно выслушиваются непостоянные разнокалиберные влажные хрипы. В ряде случаев возможно развитие бронхообструктивного синдрома. Для моноинфекции не характерны симптомы дыхательной недостаточности. В каждом пятом — седьмом случае пневмония диагностируется только рентгенологически. На рентгенограмме органов грудной клетки характерны интерстициальные изменения с усилением сосудистого и бронхолегочного рисунка и развитием интерстициального отека.
Выделяют легкую, среднетяжелую и тяжелую степени тяжести микоплазменной инфекции.
К легкой степени тяжести, как правило, относится микоплазмоз верхних дыхательных путей (назофарингит).
Среднетяжелая степень тяжести часто проявляется бронхообструктивным синдромом или неосложненной формой пневмонии (интерстициальной, очаговой).
Тяжелая степень тяжести характеризуется выраженной и длительной лихорадкой, очагово-сливным или полисегментарным характером поражения легких. Течение микоплазменной инфекции часто затяжное, выздоровление наступает к 22 — 30 суткам заболевания при остром развитии пневмонии и к 40 — 45 суткам при позднем развитии пневмонии (с 7 — 10 дня заболевания). Рентгенологическое разрешение пневмонии, как правило, наступает через 3 — 4 недели. Негладкое течение заболевания может приводить к развитию пневмосклероза, бронхоэктатической болезни.
Течение микоплазменной инфекции часто затяжное, выздоровление наступает к 22 — 30 суткам заболевания при остром развитии пневмонии и к 40 — 45 суткам при позднем развитии пневмонии (с 7 — 10 дня заболевания). Рентгенологическое разрешение пневмонии, как правило, наступает через 3 — 4 недели. Негладкое течение заболевания может приводить к развитию пневмосклероза, бронхоэктатической болезни.
По течению выделяют гладкое и негладкое, обусловленное развитием осложнений, наслоением сопутствующих заболеваний и обострением хронических инфекций.
Осложнения: пневмосклероз, бронхоэктатическая болезнь, плеврит, пневмоторакс, острый респираторный дистресс-синдром взрослого типа (ОРДСв), серозный менингит, менингоэнцефалит, полирадикулоневрит (синдром Гийена-Барре), моноартрит (преимущественно крупных суставов), синдром Стивена-Джонсона, синдром Рейтера (поражение сосудистой оболочки глаз, суставов и мочеполовой системы), гемолитическая анемия, тромбоцитопения, миокардит.
Диагностика и дифференциальная диагностика.
Лабораторная диагностика респираторного микоплазмоза основана на прямых методах выявления микоплазм и серологических реакциях определения специфических антител. Бактериологическая диагностика микоплазм в практическом здравоохранении используется редко, так как микоплазмы плохо растут на питательных средах. При поражениях респираторного тракта возбудителя можно выделить из носоглоточной слизи, с задней стенки глотки, из мокроты. Забор клинического материала от больного осуществляется в день обращения и до начала этиотропной терапии.
В клиническом анализе крови выявляют незначительно или умеренно выраженный лейкоцитоз, нейтрофилез со сдвигом лейкоцитарной формулы влево, повышение СОЭ. Нередко регистрируют повышение содержания C-реактивного белка и сиаловых кислот, диспротеинемию (повышение уровня альбуминов и снижение фракции) на фоне снижения общего белка.
В случае поступления больного из эпидемического очага внебольничных пневмоний с доказанной этиологией диагноз может быть установлен на основании клинико-эпидемиологического анамнеза без лабораторного подтверждения.
Лечение. В амбулаторных условиях проводят лечение больных с легкими формами респираторного микоплазмоза. Режим может быть полупостельным. Специальной диеты не требуется. Применяются неинвазивные методы введения препаратов.
В стационар направляются, как правило, больные пневмонией, бронхитом, ларинготрахеитом, пациенты с отягощенным преморбидным состоянием и осложненным течением заболевания, а также в случае отсутствия терапевтического эффекта от лечения на дому или по эпидемическим показаниям (при наличии очага заболевания в семье или вспышки в коллективе).
Лечение состоит из специфической (антибактериальные средства), патогенетической и симптоматической терапии (обильное питье, бронхолитические, иммунобиологические, отхаркивающие препараты, комплекс витаминов, жаропонижающие)
Этиотропная терапия включает применение антибактериальных препаратов, проникающих внутриклеточно, т. к. микоплазмы лишены клеточной стенки и являются резистентными к пенициллинам и цефалоспоринам.
к. микоплазмы лишены клеточной стенки и являются резистентными к пенициллинам и цефалоспоринам.
В стандартную антибактериальную терапию включают макролиды. Активны в отношении M. pneumoniae «респираторные» фторхинолоны и тетрациклины, но в связи с возрастными ограничениями эти средства в педиатрической практике не используют.
При выборе антибиотика группы макролидов надо учитывать его лекарственную форму (часто определяется возрастом ребенка) и взаимодействие с другими препаратами. Предпочтение следует отдавать детским лекарственным формам (суспензия) антибиотиков группы азалидов (азитромицин) или джозамицину, рокситромицину, кларитромицину (таблица).
Длительность лечения зависит от тяжести и клинического варианта заболевания: при назофарингите, обструктивном бронхите — 5 — 7 дней, при пневмонии — 10 — 14 дней.
Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера
9 декабря 2021 г. в Президентской библиотеке им. Б.Н. Ельцина в Санкт-Петербурге открыла свою работу II Международная научно-практическая конференция по вопросам противодействия новой коронавирусной инфекции и другим инфекционным заболеваниям.
Организаторы конференции: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; ФБУН Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера Роспотребнадзора; ФКУЗ Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора.
Работу конференции открыла Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека – Главный государственный санитарный врач Российской Федерации Попова Анна Юрьевна. В своём выступлении она поблагодарила органы государственной власти Санкт-Петербурга, которые второй раз оказывают содействие в организации и проведении конференции по вопросам противодействия новой коронавирусной инфекции и другим инфекционным заболеваниям. В работе конференции в очном формате принимают участие 132 ведущих российских и зарубежных учёных, представители стран СНГ, ШОС, Европейского союза, международных организаций из 11-ти стран мира (Социалистическая Республика Вьетнам, Республика Гвинея, Республика Сенегал, Федеративная Республика Германия, Республика Армения, Республика Беларусь, Киргизская Республика, Республика Казахстан, Монголия), в том числе представитель Европейского бюро ВОЗ. В заочном формате запланировано участие 179-ти учёных.
В заочном формате запланировано участие 179-ти учёных.
По словам А.Ю. Поповой, за время начала пандемии удалось значительно расширить понимание этой инфекции и борьбы с заболеванием. На сегодняшний день в мире зарегистрировано 267,5 млн. случаев заражения ковид, вирус мутирует. Россия находится в первой десятке по тестированию на коронавирус, а по уровню заболеваемости на 94-м месте в мире. Российская Федерация достойно справляется с вызовом, применяя опережающую (проективную) стратегию в борьбе COVID-19. В стране второй год проводится масштабная работа по исследованию популяционного иммунитета населения к новой коронавирусной инфекции. Охвачено 26 регионов РФ, проведено 5 этапов, обследовано 74 тыс. человек. Этот опыт также распространён и исследования проводятся в Республике Беларусь, Киргизской Республике, Республике Казахстан; запланировано проведение исследований в Республике Армения, Республике Узбекистан, Республике Сербия. Российская Федерация активно участвует в международных проектах, оказывая большую помощь странам-партнёрам. Так за время пандемии РФ поставила в эти страны 31 мобильную лабораторию. Только Роспотребнадзор осуществляет 10 совместных проектов с 16 странами-партнёрами. На сегодняшний день в мире разработано 28 вакцин против COVID-19, 61 вакцина находится на завершающей стадии клинических исследований. По данным Всемирной организации здравоохранения в мире выпущено более 8 млрд. доз вакцин. Анна Попова подчеркнула координирующую роль ВОЗ в реализации международных усилий по защите здоровья населения от угроз эпидемий инфекционных болезней, особенно если речь идет о чрезвычайной ситуации санитарно-эпидемиологического характера. Она выразила особую благодарность Европейскому бюро ВОЗ за внимание к проблемам стран Восточной Европы и Центральной Азии. Концентрация полученных знаний и опыта чрезвычайно велика. Многие вызовы, связанные с пандемией, заставляют мировое сообщество действовать сообща. Сегодняшняя конференция призвана обобщить накопленный опыт учёных о новой коронавирусной инфекции и познакомить с новыми методами лечения этой опасной инфекции.
Так за время пандемии РФ поставила в эти страны 31 мобильную лабораторию. Только Роспотребнадзор осуществляет 10 совместных проектов с 16 странами-партнёрами. На сегодняшний день в мире разработано 28 вакцин против COVID-19, 61 вакцина находится на завершающей стадии клинических исследований. По данным Всемирной организации здравоохранения в мире выпущено более 8 млрд. доз вакцин. Анна Попова подчеркнула координирующую роль ВОЗ в реализации международных усилий по защите здоровья населения от угроз эпидемий инфекционных болезней, особенно если речь идет о чрезвычайной ситуации санитарно-эпидемиологического характера. Она выразила особую благодарность Европейскому бюро ВОЗ за внимание к проблемам стран Восточной Европы и Центральной Азии. Концентрация полученных знаний и опыта чрезвычайно велика. Многие вызовы, связанные с пандемией, заставляют мировое сообщество действовать сообща. Сегодняшняя конференция призвана обобщить накопленный опыт учёных о новой коронавирусной инфекции и познакомить с новыми методами лечения этой опасной инфекции. Мероприятие – уникально как по составу, так и по спектру докладов. В рамках конференции запланировано проведение двух пленарных, семи секционных заседаний и двух круглых столов. Темы, которые будут обсуждены на конференции затрагивают важнейшие направления исследований, включая молекулярную эпидемиологию нового коронавируса, перспективы появления препаратов для этиотропной терапии COVID-19 и клинические особенности течения болезни, лабораторную диагностику, иммунологию коронавирусной инфекции, эффективность вакцин в контексте эволюции вируса, антибиотикорезистентность в период пандемии и многое другое.
Мероприятие – уникально как по составу, так и по спектру докладов. В рамках конференции запланировано проведение двух пленарных, семи секционных заседаний и двух круглых столов. Темы, которые будут обсуждены на конференции затрагивают важнейшие направления исследований, включая молекулярную эпидемиологию нового коронавируса, перспективы появления препаратов для этиотропной терапии COVID-19 и клинические особенности течения болезни, лабораторную диагностику, иммунологию коронавирусной инфекции, эффективность вакцин в контексте эволюции вируса, антибиотикорезистентность в период пандемии и многое другое.
Анна Попова также зачитала приветственное обращение Председателя Правительства РФ Михаила Мишустина к участникам конференции и предоставила слово для приветствия почётным членам мероприятия – Губернатору Санкт-Петербурга Александру Беглову и директору Европейского регионального бюро ВОЗ д-ру Хансу Клюге. Высокие гости отметили чрезвычайную важность совместных усилий всего мирового сообщества в борьбе с новой коронавирусной инфекцией и другими инфекционными заболеваниями. Они пожелали участникам конференции успешной и плодотворной работы. В послании Михаила Мишустина, в частности, говорится, что «сегодня всех нас объединяет одно – искреннее стремление сделать так, чтобы человечеству не угрожали вспышки и распространение опасных инфекционных заболеваний». Ханс Клюге подчеркнул, что «успех в борьбе с коронавирусом держится на двух столпах – науке и солидарности». Он выразил надежду на то, что сотрудничество ВОЗ и Российской Федерации продолжит развиваться. Как отметил Александр Беглов, «мы научились жить в новой реальности и проводить как международные, так и российские и региональные мероприятия на самом высоком уровне безопасности». По словам губернатора, в Санкт-Петербурге налажен выпуск систем ПЦР-тестирования и лекарственных препаратов от коронавируса. Работает 61 ПЦР-лаборатория; большую организационно-методическую помощь в организации их работы оказал и оказывает Роспотребнадзор. С начала пандемии в Санкт-Петербурге проведено более 14-ти миллионов ПЦР-исследований.
Они пожелали участникам конференции успешной и плодотворной работы. В послании Михаила Мишустина, в частности, говорится, что «сегодня всех нас объединяет одно – искреннее стремление сделать так, чтобы человечеству не угрожали вспышки и распространение опасных инфекционных заболеваний». Ханс Клюге подчеркнул, что «успех в борьбе с коронавирусом держится на двух столпах – науке и солидарности». Он выразил надежду на то, что сотрудничество ВОЗ и Российской Федерации продолжит развиваться. Как отметил Александр Беглов, «мы научились жить в новой реальности и проводить как международные, так и российские и региональные мероприятия на самом высоком уровне безопасности». По словам губернатора, в Санкт-Петербурге налажен выпуск систем ПЦР-тестирования и лекарственных препаратов от коронавируса. Работает 61 ПЦР-лаборатория; большую организационно-методическую помощь в организации их работы оказал и оказывает Роспотребнадзор. С начала пандемии в Санкт-Петербурге проведено более 14-ти миллионов ПЦР-исследований. Активно проводится вакцинация населения: действуют 187 прививочных пунктов, первично привиты более двух миллионов семисот тысяч горожан, полностью закончили цикл вакцинации более двух миллионов трёхсот сорока девяти тысяч жителей Санкт-Петербурга.
Активно проводится вакцинация населения: действуют 187 прививочных пунктов, первично привиты более двух миллионов семисот тысяч горожан, полностью закончили цикл вакцинации более двух миллионов трёхсот сорока девяти тысяч жителей Санкт-Петербурга.
В рамках первого планарного заседания под председательством А.Ю. Поповой и директора РосНИПЧИ «Микроб» Кутырева Владимира Викторовича «COVID-19: эпидемиология, вирусология и иммунология» прозвучали следующие доклады: «Эпидемиологические аспекты пандемии COVID-19» (Кутырев В.В.), «Иммунология COVID-19» (Тотолян А.А., директор Санкт-Петербургского НИИ эпидемиологии и микробиологии имени Пастера), «Вакцины против COVID-19. Достоинства, недостатки, перспективы совершенствования» (Зверев В.В., научный руководитель НИИ вакцин и сывороток им. И.И. Мечникова), «Структура и функции вируса SARS-CoV-2» (Борисевич С.А., начальник ФГБУ «48 ЦНИИ МО РФ»), «Молекулярная эпидемиология COVID-19» (Акимкин В. Г., директор ЦНИИ эпидемиологии Роспотребнадзора).
Г., директор ЦНИИ эпидемиологии Роспотребнадзора).
На первом секционном заседании «Молекулярная эпидемиология SARS-CoV-2. Изучение микробных и вирусных ассоциатов» прозвучали следующие доклады: «Геномная эпидемиология варианта «дельта» в России» (Базыкин Г.А., Сколковский институт науки и технологий), «Эволюция SARS-CoV-2 у больных с длительным течением COVID19» (А.Б. Комиссаров, Д.А. Лиознов, НИИ гриппа им. А.А. Смородинцева), «Вариабельность микробиоты верхних дыхательных путей у пациентов с легкой и тяжелой формой COVID-19» (Е.Н. Ильина, ФНКЦ физико-химической медицины), «Антибиотикорезистентность в период пандемии COVID-19» (Р.С. Козлов, Смоленский государственный медицинский университет), «Генетическая характеристика коронавируса SARS-CoV-2, циркулирующего на территории Российской Федерации и Киргизской Республики» (С.А. Боднев, ГНЦ вирусологии и биотехнологии «Вектор»), «Коронавирус SARS-CoV-2: генетическое разнообразие и особенности распространения» (Е. Л. Гасич, Республиканский научно-практический центр эпидемиологии и микробиологии, Беларусь), «Генетико-эпидемиологический мониторинг COVID-19 в Северо-Западном федеральном округе в 2021 г.» (В.Г. Дедков, ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера»), «Динамика генетической структурированности и филогенетическая реконструкция штаммов SARS-CoV-2, циркулирующих в субъектах Сибирского и Дальневосточного федеральных округов» (Л.В. Миронова, С.В. Балахонов, ФКУЗ «Иркутский научно-исследовательский противочумный институт»).
Л. Гасич, Республиканский научно-практический центр эпидемиологии и микробиологии, Беларусь), «Генетико-эпидемиологический мониторинг COVID-19 в Северо-Западном федеральном округе в 2021 г.» (В.Г. Дедков, ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера»), «Динамика генетической структурированности и филогенетическая реконструкция штаммов SARS-CoV-2, циркулирующих в субъектах Сибирского и Дальневосточного федеральных округов» (Л.В. Миронова, С.В. Балахонов, ФКУЗ «Иркутский научно-исследовательский противочумный институт»).
На втором секционном заседании «Перспективы появления и развития препаратов для этиотропной терапии и клинические особенности COVID-19» презентованы доклады: «Лечение новой коронавирусной инфекции: успехи и ошибки» (С.В. Царенко, МГУ им. М.В. Ломоносова), «Перспективы этиотропного лечения COVID-19. Российские данные» (Д.Ю. Пушкарь, Московский государственный медико-стоматологический университет им. А.И. Евдокимова), «Вариант Дельта: как должны меняться терапевтические подходы с изменением вируса?» (А.В. Аверьянов, ФГБУ НИИ пульмонологии ФМБА России), «Кандидат в лекарственное средство PDSTPи его применение для профилактики и лечения инфекций, вызванных вирусом SARS-CoV-2» (В.А. Макаров, ФИЦ «Фундаментальные основы биотехнологии»), «Специфические противомикробные препараты для лечения COVID-19» (В.В. Зарубаев, НИИ эпидемиологии и микробиологии им. Пастера), «Российские стандарты использования прямой противовирусной терапии на основе таких препаратов, как Авифавир, принятые для борьбы с новой коронавирусной инфекцией еще в 2020 году берутся на вооружение и международной Биг-фармой», (К.В. Балакин, ХимРар), «Препарат природного полифенола для превентивной терапии COVID-19» (Т.С. Ведехина, ФНКЦ физико-химической медицины ФМБА России), «Платформа для быстрого реагирования на новые вызовы биобезопасности: нейтрализующие SARS-CoV-2 антитела» (С.
А.И. Евдокимова), «Вариант Дельта: как должны меняться терапевтические подходы с изменением вируса?» (А.В. Аверьянов, ФГБУ НИИ пульмонологии ФМБА России), «Кандидат в лекарственное средство PDSTPи его применение для профилактики и лечения инфекций, вызванных вирусом SARS-CoV-2» (В.А. Макаров, ФИЦ «Фундаментальные основы биотехнологии»), «Специфические противомикробные препараты для лечения COVID-19» (В.В. Зарубаев, НИИ эпидемиологии и микробиологии им. Пастера), «Российские стандарты использования прямой противовирусной терапии на основе таких препаратов, как Авифавир, принятые для борьбы с новой коронавирусной инфекцией еще в 2020 году берутся на вооружение и международной Биг-фармой», (К.В. Балакин, ХимРар), «Препарат природного полифенола для превентивной терапии COVID-19» (Т.С. Ведехина, ФНКЦ физико-химической медицины ФМБА России), «Платформа для быстрого реагирования на новые вызовы биобезопасности: нейтрализующие SARS-CoV-2 антитела» (С. В. Кулемзин, Институт молекулярной и клеточной биологии СО РАН).
В. Кулемзин, Институт молекулярной и клеточной биологии СО РАН).
На третьем секционном заседании «Лабораторная диагностика COVID19» прозвучали доклады: «Диагностика COVID-19: проблемы и решения» (Кристина Дешермайер, Институт тропической медицины имени Бернхарда Нохта в Гамбурге, Германия (ВКС), «Лабораторная диагностика COVID-19 в Российской Федерации» (А.Н. Летюшев, В.Ю. Ананьев, Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека), «Особенности диагностики COVID-19 методами амплификации нуклеиновых кислот» (С.Б. Яцышина, ЦНИИЭ Роспотребнадзора (ВКС), «Разработка набора реагентов для выявления SARS-CoV-2 методом LAM» (В.В. Петров, ЦНИИЭ Роспотребнадзора), «Опыт разработки и внедрения портативных диагностических систем для выявления возбудителей инфекционных заболеваний методом изотермической амплификации на примере анализатора «Изаскрин-8» (К.А. Прусаков, ФНКЦ физико-химической медицины ФМБА России), «Организация массового ПЦР тестирования в крупной централизованной лаборатории» (А. Г. Комаров, ГБУЗ «Диагностический центр Департамента здравоохранения Москвы»), «Научно-практические аспекты лабораторной диагностики новой коронавирусной инфекции. Опыт работы лаборатории «Клиники АрхиМед» (В.М. Безруков, В.А. Потапов, OOO «Клиника Архимед»), «Гибкие, производительные системы для диагностики и эпидемиологи» (О.Б. Володин, ООО «Лаборатория Литех»), «Роль серологических тестов в определении статуса новой коронавирусной инфекции среди населения» (Л.У. Анварова, Управление по научным исследованиям, инновациям и подготовке научных и педагогических кадров Санэпидслужбы, Ташкент, Узбекистан), «Контроль качества ПЦР-наборов для диагностики SARS-CoV-2 в период пандемии коронавирусной инфекции на территории Узбекистана (Н.Г. Кан, Научно-исследовательский институт вирусологии, Ташкент, Узбекистан).
Г. Комаров, ГБУЗ «Диагностический центр Департамента здравоохранения Москвы»), «Научно-практические аспекты лабораторной диагностики новой коронавирусной инфекции. Опыт работы лаборатории «Клиники АрхиМед» (В.М. Безруков, В.А. Потапов, OOO «Клиника Архимед»), «Гибкие, производительные системы для диагностики и эпидемиологи» (О.Б. Володин, ООО «Лаборатория Литех»), «Роль серологических тестов в определении статуса новой коронавирусной инфекции среди населения» (Л.У. Анварова, Управление по научным исследованиям, инновациям и подготовке научных и педагогических кадров Санэпидслужбы, Ташкент, Узбекистан), «Контроль качества ПЦР-наборов для диагностики SARS-CoV-2 в период пандемии коронавирусной инфекции на территории Узбекистана (Н.Г. Кан, Научно-исследовательский институт вирусологии, Ташкент, Узбекистан).
В рамках четвёртого секционного заседания «Коронавирусы: что нам ждать от них?» прозвучали доклады: «Роль рекомбинации в эволюции родов коронавирусов» (А. Н. Лукашев, Первый Московский государственный медицинский университет им. И.М. Сеченова), «Инфодемия и пандемия COVID-19» (К.А. Зыков, НИИ пульмонологии ФМБА России), «Эпидемиологическая роль домашних животных в передаче вируса SARS-CoV2» (А.В. Луницин, ФГБНУ Федеральный исследовательский центр вирусологии и микробиологии, Покров, Владимирская область), «Распространение COVID-19 в популяции животных и перспективы вакцинопрофилактики» (Т.С. Галкина, ВНИИ защиты животных Россельхознадзора, Владимир), «Моделирование процесса преодоления межвидового барьера коронавирусами на клеточном уровне in vitro» (С.Г. Юрков, ФИЦ вирусологии и микробиологии Минобрнауки РФ), «Альфа и бета-коронавирусы из летучих мышей, обитающих на территории европейской части России» (А.С. Сперанская, А.Е. Самойлов, ЦНИИ эпидемиологии Роспотребнадзора).
Н. Лукашев, Первый Московский государственный медицинский университет им. И.М. Сеченова), «Инфодемия и пандемия COVID-19» (К.А. Зыков, НИИ пульмонологии ФМБА России), «Эпидемиологическая роль домашних животных в передаче вируса SARS-CoV2» (А.В. Луницин, ФГБНУ Федеральный исследовательский центр вирусологии и микробиологии, Покров, Владимирская область), «Распространение COVID-19 в популяции животных и перспективы вакцинопрофилактики» (Т.С. Галкина, ВНИИ защиты животных Россельхознадзора, Владимир), «Моделирование процесса преодоления межвидового барьера коронавирусами на клеточном уровне in vitro» (С.Г. Юрков, ФИЦ вирусологии и микробиологии Минобрнауки РФ), «Альфа и бета-коронавирусы из летучих мышей, обитающих на территории европейской части России» (А.С. Сперанская, А.Е. Самойлов, ЦНИИ эпидемиологии Роспотребнадзора).
Конференция продолжит свою работу 10 декабря 2021 г.
Программа конференции
БД РД НО
Уреаплазмы: лечить или нет? | Passion.
 ru
ruОтсутствуют явные клинические и лабораторные проявления воспаления, а U.urealyticum и/или M.hominis обнаруживаются в низких диагностических титрах
В таком случае часто назначаются препараты, стимулирующие иммунную систему (для местного и/или системного применения), и обследование повторяется через 2 месяца.
Подобные назначения помогают избежать ненужного применения антибиотиков и помогают организму самому «выгнать» генитальные микоплазмы.
Здесь стоит остановиться на очень щепетильном моменте: если обследоваться приходит пациент, у которого есть постоянный половой партнер, то назначение лечения должно основываться на результатах обследования обоих.
Так, например, нередко встречается ситуация, когда у одного из партнеров присутствуют клинические проявления воспаления (выделения из половых путей, зуд, жжение при мочеиспускании и т. п), по результатам обследования уровень генитальных микоплазм может быть как > 10 4 КОЕ/мл, так и
В этом случае необходимо лечить обоих. Так как у одного из половых партнеров организм не справляется с присутствием генитальных микоплазм и отвечает на их внедрение воспалением, поэтому любой незащищенный половой контакт будет вызывать описанные неприятности.
Так как у одного из половых партнеров организм не справляется с присутствием генитальных микоплазм и отвечает на их внедрение воспалением, поэтому любой незащищенный половой контакт будет вызывать описанные неприятности.
Другой вариант: у обоих половых партнеров выявлены генитальные микоплазмы в низких диагностических титрах и отсутствуют клинические и лабораторные признаки воспалительного процесса.
В этом случае необходимо наблюдение с назначением иммунотропных препаратов и повторное обследование через 2-3 месяца.
Случаются также случаи, когда у одного из партнеров генитальные микоплазмы обнаружены, а у другого нет. В этом случае не стоит сразу кидаться обвинениями в адрес друг друга.
Вполне вероятно, что организм партнера, у которого по результатам обследования не обнаружены генитальные микоплазмы, оказался достаточно «сильным» и справился с возбудителем самостоятельно.
Mycoplasma — обзор | ScienceDirect Topics
Этиология и эпидемиология
Гемотропные микоплазмы (гемоплазмы) — это небольшие (0,3–0,8 мкм) некультивируемые микоплазмы, которые располагаются на поверхности эритроцитов и могут вызывать гемолитическую анемию различной степени у инфицированных хозяев. Гемоплазмы инфицируют множество видов млекопитающих, включая человека, и имеют мировое распространение. Хотя ранее они классифицировались как Haemobartonella и Eperythrozoon spp.Анализ последовательности генов 16S рРНК этих организмов показал, что они тесно связаны с группой микоплазм pneumoniae, которая включает в себя патогены микоплазмы человека Mycoplasma pneumoniae и Mycoplasma genitalium .
Гемоплазмы инфицируют множество видов млекопитающих, включая человека, и имеют мировое распространение. Хотя ранее они классифицировались как Haemobartonella и Eperythrozoon spp.Анализ последовательности генов 16S рРНК этих организмов показал, что они тесно связаны с группой микоплазм pneumoniae, которая включает в себя патогены микоплазмы человека Mycoplasma pneumoniae и Mycoplasma genitalium .
Как минимум три вида гемоплазм заражают домашних и диких кошек: Mycoplasma haemofelis , « Candidatus, Mycoplasma haemominutum» и « Candidatus Mycoplasma turicensis». Префикс « Candidatus » применяется к вновь обнаруженным гемоплазмам до тех пор, пока не будет доступна дополнительная информация, подтверждающая их классификацию.Это связано с тем, что гемоплазмы нельзя культивировать в лаборатории, что ограничивает полную характеристику этих организмов. M. haemofelis (ранее штамм Огайо, или большая форма Haemobartonella felis ) является наиболее патогенным организмом и может вызывать гемолитическую анемию от умеренной до тяжелой у иммунокомпетентных кошек. Возникшее в результате заболевание было названо инфекционной анемией кошек. При цитологической оценке мазков крови микроорганизмов M. haemofelis представляют собой кокки, которые иногда образуют короткие цепочки из трех-шести организмов (рис. 41-1). M. haemofelis — наименее распространенная из трех гемоплазм кошек. Он был обнаружен с помощью ПЦР у 0,5–5% больных кошек в ветеринарных больницах. Были определены полные геномные последовательности M. haemofelis и M. haemominutum . 3-5
Возникшее в результате заболевание было названо инфекционной анемией кошек. При цитологической оценке мазков крови микроорганизмов M. haemofelis представляют собой кокки, которые иногда образуют короткие цепочки из трех-шести организмов (рис. 41-1). M. haemofelis — наименее распространенная из трех гемоплазм кошек. Он был обнаружен с помощью ПЦР у 0,5–5% больных кошек в ветеринарных больницах. Были определены полные геномные последовательности M. haemofelis и M. haemominutum . 3-5
‘ Прибл. M. haemominutum ‘(ранее калифорнийский штамм или небольшая форма H. felis ) обычно меньше, чем M. haemofelis , и явно не был связан с заболеванием у иммунокомпетентных кошек.Используя цитологическую оценку мазков крови, « Ca. M. haemominutum ‘- небольшие кокки диаметром от 0,3 до 0,6 мкм, хотя M. haemofelis и Ca . M. haemominutum ‘не всегда можно достоверно отличить этим методом. ‘ Ca . M. haemominutum ‘распространен среди кошачьих популяций во всем мире, заражая до 20% кошек, посещающих ветеринарные больницы. 6-8 Заражение кошек ‘ Ca . M. haemominutum вызывает легкое снижение гематокрита.Есть некоторые свидетельства того, что « Ca . M. haemominutum может играть роль в заболевании. Например, кошки, коинфицированные FeLV и Ca . M. haemominutum развивает более выраженную анемию, чем кошки, инфицированные Ca . Только M. haemominutum ‘, и прогрессирование до FeLV-индуцированного миелопролиферативного заболевания происходило быстрее. 9 Есть также описания кошек с гемолитической анемией, у которых единственной признанной причиной анемии была ‘ Ca .M. haemominutum. ‘ 10 ‘ Ca . M. haemominutum обычно встречается при сочетанных инфекциях с Ca. M. turicensis ‘или M. haemofelis . Также описаны смешанные инфекции, вызванные всеми тремя видами гемоплазмы кошек.
‘ Ca . M. haemominutum ‘распространен среди кошачьих популяций во всем мире, заражая до 20% кошек, посещающих ветеринарные больницы. 6-8 Заражение кошек ‘ Ca . M. haemominutum вызывает легкое снижение гематокрита.Есть некоторые свидетельства того, что « Ca . M. haemominutum может играть роль в заболевании. Например, кошки, коинфицированные FeLV и Ca . M. haemominutum развивает более выраженную анемию, чем кошки, инфицированные Ca . Только M. haemominutum ‘, и прогрессирование до FeLV-индуцированного миелопролиферативного заболевания происходило быстрее. 9 Есть также описания кошек с гемолитической анемией, у которых единственной признанной причиной анемии была ‘ Ca .M. haemominutum. ‘ 10 ‘ Ca . M. haemominutum обычно встречается при сочетанных инфекциях с Ca. M. turicensis ‘или M. haemofelis . Также описаны смешанные инфекции, вызванные всеми тремя видами гемоплазмы кошек.
‘ Прибл. M. turicensis ‘был впервые описан у кошки из Швейцарии, у которой был сильный внутрисосудистый гемолиз ( turicensis относится к Turicum, латинскому названию Цюриха). 11 Инфекции с ‘ Ca.С тех пор во всем мире было обнаружено M. turicensis. 8,12-14 ‘ Прибл. M. turicensis никогда не был обнаружен при исследовании мазков крови под световым микроскопом, а количество организмов у инфицированных кошек, как правило, невелико. Заражение ‘ Ca. M. turicensis немного более распространен в популяции кошек, чем заражение M. haemofelis . Большинство исследований показывают распространенность от 0,5% до 10% у больных кошек, посещающих ветеринарные больницы. Патогенный потенциал этого организма до конца не изучен.Инокуляция кошки с подавленным иммунитетом ‘ Ca. M. turicensis ‘привела к тяжелой анемии, 11 , но у иммунокомпетентных кошек анемия после прививки’ Ca. M. turicensis. ‘ Кофакторы, такие как коинфекция с другими гемоплазмами или одновременная иммуносупрессия, могут влиять на развитие анемии у кошек, инфицированных ‘ Ca. M. turicensis. ‘
‘ Кофакторы, такие как коинфекция с другими гемоплазмами или одновременная иммуносупрессия, могут влиять на развитие анемии у кошек, инфицированных ‘ Ca. M. turicensis. ‘
Заражение кошек гемоплазмами тесно связано с мужским полом, внепородным статусом и доступом на улицу (вставка 41-1). 8,12,15,16 Заражение ‘ Ca . M. haemominutum ‘чаще встречается у пожилых кошек, по-видимому, потому, что вероятность заражения стойкой субклинической инфекцией со временем увеличивается. Напротив, у молодых кошек может быть больше шансов заболеть после заражения M. haemofelis . Некоторые исследования, но не другие, показали связь между ретровирусными инфекциями и инфекциями гемоплазмы. Кошки, инфицированные M. haemofelis в Соединенных Штатах, имели в 6 раз больше шансов быть инфицированными FIV, чем кошки с отрицательными гемоплазмами. 15
Несколько видов гемоплазмы также заражают собак. Заражение Mycoplasma haemocanis (ранее Haemobartonella canis ) было связано с гемолитической анемией у собак после спленэктомии и редко у собак с другими иммуносупрессивными заболеваниями или сопутствующими инфекциями. Ген 16S рРНК M. haemocanis имеет ту же последовательность, что и M. haemofelis , но полная последовательность генома M. haemocanis отличает его от другого вида. 17 M. haemocanis — это кокковидный организм, который часто образует длинные цепочки организмов (рис. 41-2). Распространенность этой инфекции особенно высока у собак, выращиваемых в питомниках, которые часто заражаются субклинически. 18 На юго-западе США инфекция также была распространена среди койотов. 19
Ген 16S рРНК M. haemocanis имеет ту же последовательность, что и M. haemofelis , но полная последовательность генома M. haemocanis отличает его от другого вида. 17 M. haemocanis — это кокковидный организм, который часто образует длинные цепочки организмов (рис. 41-2). Распространенность этой инфекции особенно высока у собак, выращиваемых в питомниках, которые часто заражаются субклинически. 18 На юго-западе США инфекция также была распространена среди койотов. 19
У собак были обнаружены еще три вида гемоплазмы. « Candidatus Mycoplasma haematoparvum» — это небольшой (0,3 мкм) кокковидный организм, напоминающий « Ca. Mycoplasma haemominutum ‘как морфологически, так и генетически (рис. 41-3). ‘ Ca . M. haemominutum ‘также был обнаружен у нескольких собак с помощью ПЦР-тестов и организмов, которые напоминают’ Ca. M. haematoparvum и Ca. M. haemominutum ‘были обнаружены у европейских волков и кустарниковых собак из Бразилии. 20 Гемоплазма овцы Mycoplasma ovis была обнаружена в селезенках небольшого числа собак из юго-востока США, а гемоплазма крупного рогатого скота Ca. Mycoplasma haemobos ‘был обнаружен у собаки из северной Австралии. 21,22 Клиническое значение этих видов гемоплазмы у собак остается неясным.
20 Гемоплазма овцы Mycoplasma ovis была обнаружена в селезенках небольшого числа собак из юго-востока США, а гемоплазма крупного рогатого скота Ca. Mycoplasma haemobos ‘был обнаружен у собаки из северной Австралии. 21,22 Клиническое значение этих видов гемоплазмы у собак остается неясным.
Способ передачи гемоплазм остается неясным. В некоторой степени блохи и другие членистоногие-переносчики могут быть способны переносить кошачьи гемоплазмы, 23 , но экспериментальные доказательства трансмиссивной передачи кошачьих гемоплазм слабые. Передача M. haemocanis коричневым собачьим клещом Rhipicephalus sanguineus была продемонстрирована экспериментально, хотя это было до того, как стали доступны ПЦР-тесты для подтверждения инфекции. 24 Географические различия в распространенности инфекции гемоплазмы у собак и кошек подтверждают роль переносчиков членистоногих в передаче. Например, в Европе инфекция M. haemocanis более распространена в странах Средиземноморья, что соответствует распределению Rh. sanguineus . Вертикальное (например, трансплацентарное) распространение также предполагалось и было документально подтверждено для гемоплазм крупного рогатого скота. Укус был предложен как средство передачи кошачьей гемоплазмы, и сильная склонность к мужскому полу, недавняя история абсцессов от укусов кошек у некоторых кошек и связь с инфекцией FIV в некоторых исследованиях подтверждают этот способ.Кроме того, исследования, проведенные в Швейцарии, показали, что подкожный прививок крови, содержащей Ca. M. turicensis ‘привел к передаче, тогда как инокуляция слюны, которая содержала’ Ca. M. turicensis — нет. 25 Это говорит о том, что передача гемоплазмы при социальном контакте (слюна при взаимном уходе и т. Д.) Менее вероятна, чем передача при агрессивном взаимодействии (передача крови во время укуса кошки). Поскольку инфекция также может передаваться через кровь, может оказаться, что кусающая кошка (а не укушенная кошка) подвергается наибольшему риску заражения.
haemocanis более распространена в странах Средиземноморья, что соответствует распределению Rh. sanguineus . Вертикальное (например, трансплацентарное) распространение также предполагалось и было документально подтверждено для гемоплазм крупного рогатого скота. Укус был предложен как средство передачи кошачьей гемоплазмы, и сильная склонность к мужскому полу, недавняя история абсцессов от укусов кошек у некоторых кошек и связь с инфекцией FIV в некоторых исследованиях подтверждают этот способ.Кроме того, исследования, проведенные в Швейцарии, показали, что подкожный прививок крови, содержащей Ca. M. turicensis ‘привел к передаче, тогда как инокуляция слюны, которая содержала’ Ca. M. turicensis — нет. 25 Это говорит о том, что передача гемоплазмы при социальном контакте (слюна при взаимном уходе и т. Д.) Менее вероятна, чем передача при агрессивном взаимодействии (передача крови во время укуса кошки). Поскольку инфекция также может передаваться через кровь, может оказаться, что кусающая кошка (а не укушенная кошка) подвергается наибольшему риску заражения. Также описана передача M. haemocanis через проглатывание инфицированной крови, 26 , поэтому агрессивные взаимодействия между собаками также могут иметь потенциал передачи гемоплазмы; однако этот способ передачи еще предстоит проверить в полевых условиях. Передача также может произойти после переливания крови.
Также описана передача M. haemocanis через проглатывание инфицированной крови, 26 , поэтому агрессивные взаимодействия между собаками также могут иметь потенциал передачи гемоплазмы; однако этот способ передачи еще предстоит проверить в полевых условиях. Передача также может произойти после переливания крови.
Mycoplasma — обзор | ScienceDirect Topics
Этиология и эпидемиология
Гемотропные микоплазмы (гемоплазмы) имеют небольшие размеры (0.3-0,8 мкм), некультивируемые микоплазмы, которые располагаются на поверхности эритроцитов и могут вызывать гемолитическую анемию различной степени у инфицированных хозяев. Гемоплазмы инфицируют множество видов млекопитающих, включая человека, и имеют мировое распространение. Хотя ранее они были классифицированы как Haemobartonella и Eperythrozoon spp., Анализ последовательности генов 16S рРНК этих организмов показал, что они тесно связаны с группой микоплазм pneumoniae, которая включает микоплазменные патогены человека Mycoplasma и . Mycoplasma genitalium .
Mycoplasma genitalium .
Как минимум три вида гемоплазм заражают домашних и диких кошек: Mycoplasma haemofelis , « Candidatus, Mycoplasma haemominutum» и « Candidatus Mycoplasma turicensis». Префикс « Candidatus » применяется к вновь обнаруженным гемоплазмам до тех пор, пока не будет доступна дополнительная информация, подтверждающая их классификацию. Это связано с тем, что гемоплазмы нельзя культивировать в лаборатории, что ограничивает полную характеристику этих организмов. М.haemofelis (ранее штамм Огайо или большая форма Haemobartonella felis ) является наиболее патогенным организмом и может вызывать умеренную или тяжелую гемолитическую анемию у иммунокомпетентных кошек. Возникшее в результате заболевание было названо инфекционной анемией кошек. При цитологической оценке мазков крови микроорганизмов M. haemofelis представляют собой кокки, которые иногда образуют короткие цепочки из трех-шести организмов (рис. 41-1). M. haemofelis — наименее распространенная из трех гемоплазм кошек.Он был обнаружен с помощью ПЦР у 0,5–5% больных кошек в ветеринарных больницах. Были определены полные геномные последовательности M. haemofelis и M. haemominutum . 3-5
41-1). M. haemofelis — наименее распространенная из трех гемоплазм кошек.Он был обнаружен с помощью ПЦР у 0,5–5% больных кошек в ветеринарных больницах. Были определены полные геномные последовательности M. haemofelis и M. haemominutum . 3-5
‘ Прибл. M. haemominutum ‘(ранее калифорнийский штамм или небольшая форма H. felis ) обычно меньше, чем M. haemofelis , и явно не был связан с заболеванием у иммунокомпетентных кошек. Используя цитологическую оценку мазков крови, « Ca. M. haemominutum ‘- небольшие кокки диаметром от 0,3 до 0,6 мкм, хотя M. haemofelis и Ca . M. haemominutum ‘не всегда можно достоверно отличить этим методом. ‘ Ca . M. haemominutum ‘распространен среди кошачьих популяций во всем мире, заражая до 20% кошек, посещающих ветеринарные больницы. 6-8 Заражение кошек ‘ Ca . M. haemominutum вызывает легкое снижение гематокрита. Есть некоторые свидетельства того, что « Ca . M. haemominutum может играть роль в заболевании. Например, кошки, коинфицированные FeLV и Ca . M. haemominutum развивает более выраженную анемию, чем кошки, инфицированные Ca . Только M. haemominutum ‘, и прогрессирование до FeLV-индуцированного миелопролиферативного заболевания происходило быстрее. 9 Есть также описания кошек с гемолитической анемией, у которых единственной признанной причиной анемии была ‘ Ca . M. haemominutum. ‘ 10 ‘ Ca .M. haemominutum обычно встречается при сочетанных инфекциях с Ca. M. turicensis ‘или M. haemofelis . Также описаны смешанные инфекции, вызванные всеми тремя видами гемоплазмы кошек.
M. haemominutum может играть роль в заболевании. Например, кошки, коинфицированные FeLV и Ca . M. haemominutum развивает более выраженную анемию, чем кошки, инфицированные Ca . Только M. haemominutum ‘, и прогрессирование до FeLV-индуцированного миелопролиферативного заболевания происходило быстрее. 9 Есть также описания кошек с гемолитической анемией, у которых единственной признанной причиной анемии была ‘ Ca . M. haemominutum. ‘ 10 ‘ Ca .M. haemominutum обычно встречается при сочетанных инфекциях с Ca. M. turicensis ‘или M. haemofelis . Также описаны смешанные инфекции, вызванные всеми тремя видами гемоплазмы кошек.
‘ Прибл. M. turicensis ‘был впервые описан у кошки из Швейцарии, у которой был сильный внутрисосудистый гемолиз ( turicensis относится к Turicum, латинскому названию Цюриха). 11 Инфекции с ‘ Ca. С тех пор во всем мире было обнаружено M. turicensis. 8,12-14 ‘ Прибл. M. turicensis никогда не был обнаружен при исследовании мазков крови под световым микроскопом, а количество организмов у инфицированных кошек, как правило, невелико. Заражение ‘ Ca. M. turicensis немного более распространен в популяции кошек, чем заражение M. haemofelis . Большинство исследований показывают распространенность от 0,5% до 10% у больных кошек, посещающих ветеринарные больницы. Патогенный потенциал этого организма до конца не изучен. Инокуляция кошки с подавленным иммунитетом ‘ Ca. M. turicensis ‘привела к тяжелой анемии, 11 , но у иммунокомпетентных кошек анемия после прививки’ Ca. M. turicensis. ‘ Кофакторы, такие как коинфекция с другими гемоплазмами или одновременная иммуносупрессия, могут влиять на развитие анемии у кошек, инфицированных ‘ Ca. M. turicensis. ‘
8,12-14 ‘ Прибл. M. turicensis никогда не был обнаружен при исследовании мазков крови под световым микроскопом, а количество организмов у инфицированных кошек, как правило, невелико. Заражение ‘ Ca. M. turicensis немного более распространен в популяции кошек, чем заражение M. haemofelis . Большинство исследований показывают распространенность от 0,5% до 10% у больных кошек, посещающих ветеринарные больницы. Патогенный потенциал этого организма до конца не изучен. Инокуляция кошки с подавленным иммунитетом ‘ Ca. M. turicensis ‘привела к тяжелой анемии, 11 , но у иммунокомпетентных кошек анемия после прививки’ Ca. M. turicensis. ‘ Кофакторы, такие как коинфекция с другими гемоплазмами или одновременная иммуносупрессия, могут влиять на развитие анемии у кошек, инфицированных ‘ Ca. M. turicensis. ‘
Заражение кошек гемоплазмами тесно связано с мужским полом, внепородным статусом и доступом на улицу (вставка 41-1). 8,12,15,16 Заражение ‘ Ca .M. haemominutum ‘чаще встречается у пожилых кошек, по-видимому, потому, что вероятность заражения стойкой субклинической инфекцией со временем увеличивается. Напротив, у молодых кошек может быть больше шансов заболеть после заражения M. haemofelis . Некоторые исследования, но не другие, показали связь между ретровирусными инфекциями и инфекциями гемоплазмы. Кошки, инфицированные M. haemofelis в Соединенных Штатах, имели в 6 раз больше шансов быть инфицированными FIV, чем кошки с отрицательными гемоплазмами. 15
8,12,15,16 Заражение ‘ Ca .M. haemominutum ‘чаще встречается у пожилых кошек, по-видимому, потому, что вероятность заражения стойкой субклинической инфекцией со временем увеличивается. Напротив, у молодых кошек может быть больше шансов заболеть после заражения M. haemofelis . Некоторые исследования, но не другие, показали связь между ретровирусными инфекциями и инфекциями гемоплазмы. Кошки, инфицированные M. haemofelis в Соединенных Штатах, имели в 6 раз больше шансов быть инфицированными FIV, чем кошки с отрицательными гемоплазмами. 15
Несколько видов гемоплазмы также заражают собак. Заражение Mycoplasma haemocanis (ранее Haemobartonella canis ) было связано с гемолитической анемией у собак после спленэктомии и редко у собак с другими иммуносупрессивными заболеваниями или сопутствующими инфекциями. Ген 16S рРНК M. haemocanis имеет ту же последовательность, что и M. haemofelis , но полная последовательность генома M. haemocanis отличает его от другого вида. 17 M. haemocanis — это кокковидный организм, который часто образует длинные цепочки организмов (рис. 41-2). Распространенность этой инфекции особенно высока у собак, выращиваемых в питомниках, которые часто заражаются субклинически. 18 На юго-западе США инфекция также была распространена среди койотов. 19
haemocanis отличает его от другого вида. 17 M. haemocanis — это кокковидный организм, который часто образует длинные цепочки организмов (рис. 41-2). Распространенность этой инфекции особенно высока у собак, выращиваемых в питомниках, которые часто заражаются субклинически. 18 На юго-западе США инфекция также была распространена среди койотов. 19
У собак были обнаружены еще три вида гемоплазмы. « Candidatus Mycoplasma haematoparvum» — это небольшой (0,3 мкм) кокковидный организм, напоминающий « Ca. Mycoplasma haemominutum ‘как морфологически, так и генетически (рис. 41-3). ‘ Ca . M. haemominutum ‘также был обнаружен у нескольких собак с помощью ПЦР-тестов и организмов, которые напоминают’ Ca. M. haematoparvum и Ca. M. haemominutum ‘были обнаружены у европейских волков и кустарниковых собак из Бразилии. 20 Гемоплазма овцы Mycoplasma ovis была обнаружена в селезенках небольшого числа собак из юго-востока США, а гемоплазма крупного рогатого скота Ca. Mycoplasma haemobos ‘был обнаружен у собаки из северной Австралии. 21,22 Клиническое значение этих видов гемоплазмы у собак остается неясным.
Mycoplasma haemobos ‘был обнаружен у собаки из северной Австралии. 21,22 Клиническое значение этих видов гемоплазмы у собак остается неясным.
Способ передачи гемоплазм остается неясным. В некоторой степени блохи и другие членистоногие-переносчики могут быть способны переносить кошачьи гемоплазмы, 23 , но экспериментальные доказательства трансмиссивной передачи кошачьих гемоплазм слабые. Передача M. haemocanis коричневым собачьим клещом Rhipicephalus sanguineus была продемонстрирована экспериментально, хотя это было до того, как стали доступны ПЦР-тесты для подтверждения инфекции. 24 Географические различия в распространенности инфекции гемоплазмы у собак и кошек подтверждают роль переносчиков членистоногих в передаче. Например, в Европе инфекция M. haemocanis более распространена в странах Средиземноморья, что соответствует распределению Rh. sanguineus . Вертикальное (например, трансплацентарное) распространение также предполагалось и было документально подтверждено для гемоплазм крупного рогатого скота. Укус был предложен как средство передачи кошачьей гемоплазмы, и сильная склонность к мужскому полу, недавняя история абсцессов от укусов кошек у некоторых кошек и связь с инфекцией FIV в некоторых исследованиях подтверждают этот способ.Кроме того, исследования, проведенные в Швейцарии, показали, что подкожный прививок крови, содержащей Ca. M. turicensis ‘привел к передаче, тогда как инокуляция слюны, которая содержала’ Ca. M. turicensis — нет. 25 Это говорит о том, что передача гемоплазмы при социальном контакте (слюна при взаимном уходе и т. Д.) Менее вероятна, чем передача при агрессивном взаимодействии (передача крови во время укуса кошки). Поскольку инфекция также может передаваться через кровь, может оказаться, что кусающая кошка (а не укушенная кошка) подвергается наибольшему риску заражения.Также описана передача M. haemocanis через проглатывание инфицированной крови, 26 , поэтому агрессивные взаимодействия между собаками также могут иметь потенциал передачи гемоплазмы; однако этот способ передачи еще предстоит проверить в полевых условиях.
Укус был предложен как средство передачи кошачьей гемоплазмы, и сильная склонность к мужскому полу, недавняя история абсцессов от укусов кошек у некоторых кошек и связь с инфекцией FIV в некоторых исследованиях подтверждают этот способ.Кроме того, исследования, проведенные в Швейцарии, показали, что подкожный прививок крови, содержащей Ca. M. turicensis ‘привел к передаче, тогда как инокуляция слюны, которая содержала’ Ca. M. turicensis — нет. 25 Это говорит о том, что передача гемоплазмы при социальном контакте (слюна при взаимном уходе и т. Д.) Менее вероятна, чем передача при агрессивном взаимодействии (передача крови во время укуса кошки). Поскольку инфекция также может передаваться через кровь, может оказаться, что кусающая кошка (а не укушенная кошка) подвергается наибольшему риску заражения.Также описана передача M. haemocanis через проглатывание инфицированной крови, 26 , поэтому агрессивные взаимодействия между собаками также могут иметь потенциал передачи гемоплазмы; однако этот способ передачи еще предстоит проверить в полевых условиях. Передача также может произойти после переливания крови.
Передача также может произойти после переливания крови.
Mycoplasma pneumonia: Клинические особенности и лечение
Lung India. Апрель-июнь 2010 г .; 27 (2): 75–85.
Surender Kashyap
Отделение легких, Медицинский колледж Индиры Ганди, Шимла, Индия
Малай Саркар
Отделение легких, Медицинский колледж Индиры Ганди, Шимла, Индия
Медицинское отделение Гандиры Гандира, Пулмонхи Колледж, Шимла, Индия
Адрес для корреспонденции: Dr.Сурендер Кашьяп, Отделение легких, Медицинский колледж Индиры Ганди, Шимла, Химачал-Прадеш, Индия. распространение и воспроизведение на любом носителе при условии правильного цитирования оригинала. Эта статья цитируется в других статьях в PMC.Abstract
Mycoplasma pneumonia — распространенный респираторный патоген, вызывающий заболевания различной степени тяжести, от легкой инфекции верхних дыхательных путей до тяжелой атипичной пневмонии. Помимо инфекций дыхательных путей, этот организм также ответственен за широкий спектр нелегочных проявлений, включая неврологические, печеночные, сердечные заболевания, гемолитическую анемию, полиартрит и многоформную эритему. Этот обзор посвящен молекулярной таксономии, биологическим характеристикам, эпидемиологии, клиническим проявлениям, радиологии и различным лабораторным инструментам в диагностике, дифференциальной диагностике, лечении и профилактике микоплазменной пневмонии.
Помимо инфекций дыхательных путей, этот организм также ответственен за широкий спектр нелегочных проявлений, включая неврологические, печеночные, сердечные заболевания, гемолитическую анемию, полиартрит и многоформную эритему. Этот обзор посвящен молекулярной таксономии, биологическим характеристикам, эпидемиологии, клиническим проявлениям, радиологии и различным лабораторным инструментам в диагностике, дифференциальной диагностике, лечении и профилактике микоплазменной пневмонии.
Ключевые слова: Астма, макролиды, mollicuites mycoplasma, серология
ВВЕДЕНИЕ
Mycoplasma pneumonia — распространенный респираторный патоген, вызывающий заболевания различной степени тяжести, от легкой инфекции верхних дыхательных путей до тяжелой атипической пневмонии.Хотя M. pneumoniae редко приводит к летальному исходу, он является важной причиной острой респираторной инфекции, особенно в качестве потенциальной этиологии клинической формы, называемой «атипичная пневмония». Первоначально он был известен как агент Eaton после того, как Eaton и др. идентифицировали эти плеро-легочные подобные организмы в мокроте пациентов с первичной атипичной пневмонией в 1944 году. Впоследствии он был переименован в Mycoplasma. Из многих известных видов Mycoplasma, инфицирующих человека, M. pneumoniae является важной причиной инфекций дыхательных путей.Помимо инфекций дыхательных путей, этот организм также ответственен за широкий спектр нелегочных проявлений, включая неврологические, печеночные, сердечные заболевания, гемолитическую анемию, полиартрит и многоформную эритему. Из нелегочных проявлений наиболее частыми считаются неврологические проявления [1].
Первоначально он был известен как агент Eaton после того, как Eaton и др. идентифицировали эти плеро-легочные подобные организмы в мокроте пациентов с первичной атипичной пневмонией в 1944 году. Впоследствии он был переименован в Mycoplasma. Из многих известных видов Mycoplasma, инфицирующих человека, M. pneumoniae является важной причиной инфекций дыхательных путей.Помимо инфекций дыхательных путей, этот организм также ответственен за широкий спектр нелегочных проявлений, включая неврологические, печеночные, сердечные заболевания, гемолитическую анемию, полиартрит и многоформную эритему. Из нелегочных проявлений наиболее частыми считаются неврологические проявления [1].
МОЛЕКУЛЯРНАЯ ТАКСОНОМИЯ И БИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Микоплазма — это самые маленькие и самые простые самоограничивающиеся бактерии. [1] Он принадлежит к классу Mollicutes и семейству Mycoplasmataceae.Микоплазмы отличаются от бактерий отсутствием структуры клеточной стенки. Отсутствие структуры клеточной стенки делает эти организмы нечувствительными к бета-лактамным антимикробным агентам, предотвращает их окрашивание красителем по Граму и в значительной степени отвечает за их полиморфизм. Микоплазмы имеют чрезвычайно маленький [2] геном (от 0,58 до 2,20 МБ) по сравнению с 4,64 МБ у E. coli . Манилофф [3] предположил, что небольшой размер генома является следствием постепенного уменьшения размера генома от общего грамположительного предка в процессе дегенеративной эволюции.Филогенетически микоплазмы более близки к грамположительным бактериям. Чрезвычайно малый размер (150-200 нм) и его ограниченные метаболические и биосинтетические возможности определяют многие биологические характеристики организмов. Это объясняет паразитическое и сапрофитное существование организмов и его требовательные требования к росту, которые могут затруднить его обнаружение с помощью культуры. Микоплазма размножается двойным делением.
Микоплазмы имеют чрезвычайно маленький [2] геном (от 0,58 до 2,20 МБ) по сравнению с 4,64 МБ у E. coli . Манилофф [3] предположил, что небольшой размер генома является следствием постепенного уменьшения размера генома от общего грамположительного предка в процессе дегенеративной эволюции.Филогенетически микоплазмы более близки к грамположительным бактериям. Чрезвычайно малый размер (150-200 нм) и его ограниченные метаболические и биосинтетические возможности определяют многие биологические характеристики организмов. Это объясняет паразитическое и сапрофитное существование организмов и его требовательные требования к росту, которые могут затруднить его обнаружение с помощью культуры. Микоплазма размножается двойным делением.
Это внеклеточный патоген, его выживание зависит от адгезии к респираторному эпителию, и эта фиксация к мембранам ресничек происходит в основном за счет интерактивной адгезии и дополнительных белков.Основная адгезия — адгезин P1. Цитоадгезия защищает микоплазмы от мукоцилиарного клиренса. Локально вырабатывается перекись водорода, которая оказывает цитопатическое действие на эпителий дыхательных путей и реснички, а также вызывает стойкий кашель. Микоплазма также инкриминируется развитием аутоиммунитета, который может объяснить внелегочное поражение. Продукция множественных наборов цитокинов и других реактивных веществ в патогенезе [4] M. pneumoniae болезни легких является предметом значительного интереса в течение последних нескольких лет.
Локально вырабатывается перекись водорода, которая оказывает цитопатическое действие на эпителий дыхательных путей и реснички, а также вызывает стойкий кашель. Микоплазма также инкриминируется развитием аутоиммунитета, который может объяснить внелегочное поражение. Продукция множественных наборов цитокинов и других реактивных веществ в патогенезе [4] M. pneumoniae болезни легких является предметом значительного интереса в течение последних нескольких лет.
Текущие данные исследований на людях и животных показывают, что продукция цитокинов и активация лимфоцитов могут либо минимизировать заболевание за счет усиления защитных механизмов хозяина, либо усугубить заболевание за счет развития иммунологических поражений. Чем сильнее клеточно-опосредованный иммунный ответ и стимуляция цитокинов, тем тяжелее клиническое заболевание и повреждение легких. Эта концепция иммуноопосредованного заболевания легких обеспечивает основу для рассмотрения иммуномодулирующих терапевтических средств в дополнение к общепринятым антимикробным препаратам. Иммунитет к микоплазме временный, и рецидивы часты. Климат, сезонность и география не имеют большого значения, хотя большинство вспышек в США [6], как правило, случаются в конце лета и в начале осени. На основе серологических исследований Линд и др. [7] продемонстрировали картину передачи эндемических заболеваний в течение 50 лет, перемежающуюся циклическими эпидемиями каждые три-пять лет.Длительный инкубационный период, относительно низкая скорость передачи и сохранение организмов в дыхательных путях в течение различных периодов после инфекций могут объяснить длительную продолжительность эпидемий. Дориго-Зетсма [8] и др. генотипировали клинических изолятов M. pneumoniae и сгруппировали их в восемь подтипов в двух геномных группах на основе подтипов адгезина P1. Различные подтипы адгезина P1 могут действовать во время развития и цикла эпидемиологии M. pneumoniae .Такое расхождение генов в адгезине P1 и развитие антител, специфичных к подтипу, после первоначального заражения может объяснить частоту повторного инфицирования, которое может быть связано с другим подтипом.
Иммунитет к микоплазме временный, и рецидивы часты. Климат, сезонность и география не имеют большого значения, хотя большинство вспышек в США [6], как правило, случаются в конце лета и в начале осени. На основе серологических исследований Линд и др. [7] продемонстрировали картину передачи эндемических заболеваний в течение 50 лет, перемежающуюся циклическими эпидемиями каждые три-пять лет.Длительный инкубационный период, относительно низкая скорость передачи и сохранение организмов в дыхательных путях в течение различных периодов после инфекций могут объяснить длительную продолжительность эпидемий. Дориго-Зетсма [8] и др. генотипировали клинических изолятов M. pneumoniae и сгруппировали их в восемь подтипов в двух геномных группах на основе подтипов адгезина P1. Различные подтипы адгезина P1 могут действовать во время развития и цикла эпидемиологии M. pneumoniae .Такое расхождение генов в адгезине P1 и развитие антител, специфичных к подтипу, после первоначального заражения может объяснить частоту повторного инфицирования, которое может быть связано с другим подтипом. [9] Инфекция передается от человека к человеку через аэрозоли. Поскольку организмы, как правило, связаны с слущенными клетками, для передачи могут потребоваться относительно крупные капли, о чем свидетельствует тесный личный контакт, типичный для условий вспышки — школ, военных казарм и учреждений.Ввиду тесного контакта, необходимого для передачи капель, и медленного (шестичасового) времени образования M. pneumoniae , для каждого случая типичен период инкубации от одной до трех недель.
[9] Инфекция передается от человека к человеку через аэрозоли. Поскольку организмы, как правило, связаны с слущенными клетками, для передачи могут потребоваться относительно крупные капли, о чем свидетельствует тесный личный контакт, типичный для условий вспышки — школ, военных казарм и учреждений.Ввиду тесного контакта, необходимого для передачи капель, и медленного (шестичасового) времени образования M. pneumoniae , для каждого случая типичен период инкубации от одной до трех недель.
Хотя M. pneumoniae является общепризнанным легочным патогеном на Западе, информация о распространенности заболевания в нашей стране скудна из-за отсутствия надежных и быстрых диагностических методов, а также отсутствия клинической осведомленности. В исследовании [10], проведенном в центре третичной медицинской помощи в Дели, сообщается о M.pneumoniae у 18 (24%) из 75 детей с ВП с использованием критериев посева и / или серологии и / или положительного анализа ПЦР на носоглоточном аспирате.
Мы сообщили [11] о инфекциях M. pneumoniae на основании серологического исследования в 15% случаев ВП у взрослых. Аналогичным образом, Шеной и др. [12] сообщают, что M. pneumoniae были ответственны за 24% случаев пневмонии у госпитализированных детей. Чаудри и др. [13] сообщили о высокой распространенности инфекции Mycoplasma pneumoniae среди детей с внебольничной пневмонией с положительной серологической реакцией 27.4%.
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
M. pneumoniae вызывает до 40% и более случаев внебольничной пневмонии (ВП) и до 18% случаев, когда у детей требуется госпитализация. [14] В более старых исследованиях сообщалось, что пневмония M. pneumoniae несколько редко встречается у детей в возрасте до пяти лет и наиболее часто встречается у детей школьного возраста 5-15 лет, с уменьшением числа случаев после подросткового возраста и во взрослом возрасте [15]. Однако последние исследования документально подтвердили, что M. pneumoniae может возникать эндемически, а иногда и эпидемически у пожилых людей, а также у детей в возрасте до пяти лет. Эти результаты могут отражать улучшенные возможности обнаружения, которые были недоступны в 1960-х и 1970-х годах, когда были опубликованы первые эпидемиологические описания M. pneumoniae .
pneumoniae может возникать эндемически, а иногда и эпидемически у пожилых людей, а также у детей в возрасте до пяти лет. Эти результаты могут отражать улучшенные возможности обнаружения, которые были недоступны в 1960-х и 1970-х годах, когда были опубликованы первые эпидемиологические описания M. pneumoniae .
Клинические проявления респираторного заболевания M. pneumoniae часто сходны с клиническими проявлениями других атипичных патогенов, особенно Chlamydia pneumoniae , различных респираторных вирусов и бактерий. M. pneumoniae может [14] также присутствовать в дыхательных путях одновременно с другими патогенами, и есть некоторые данные на моделях людей и животных, указывающие на то, что инфицирование M. pneumoniae может предшествовать и каким-то образом усиливать последующие инфекции различными респираторными вирусами. [16] и бактерии, включая S. pyogenes и Neisseria meningitides . Возможное объяснение такого синергетического эффекта включает иммуносупрессию или изменение флоры дыхательных путей из-за присутствия M. пневмония . Аналогичным образом, в проспективном поперечном исследовании Dey и др. [17] сообщают о 35% распространенности инфекции Mycoplasma среди пациентов с диагнозом внебольничная пневмония. Они также обнаружили вторичную бактериальную инфекцию у большого количества пациентов. У пациентов с инфекцией Mycoplasma pneumoniae они изолировали другие бактерии из крови в 50% случаев и из секрета дыхательных путей в 68% случаев. Следовательно, начальная эмпирическая антибактериальная терапия внебольничной пневмонии в Индии должна включать антибиотики с активностью против M.пневмония . Staugas и др. [18] также сообщили о высокой распространенности вторичной бактериальной инфекции. Они предположили, что M. pneumoniae , проникая в мукоцилиарное одеяло, вызывает повреждение эпителиальных клеток, а также снижает мукоцилиарный клиренс. Если это не было обнаружено на ранней стадии, это может привести к развитию легочных осложнений.
пневмония . Аналогичным образом, в проспективном поперечном исследовании Dey и др. [17] сообщают о 35% распространенности инфекции Mycoplasma среди пациентов с диагнозом внебольничная пневмония. Они также обнаружили вторичную бактериальную инфекцию у большого количества пациентов. У пациентов с инфекцией Mycoplasma pneumoniae они изолировали другие бактерии из крови в 50% случаев и из секрета дыхательных путей в 68% случаев. Следовательно, начальная эмпирическая антибактериальная терапия внебольничной пневмонии в Индии должна включать антибиотики с активностью против M.пневмония . Staugas и др. [18] также сообщили о высокой распространенности вторичной бактериальной инфекции. Они предположили, что M. pneumoniae , проникая в мукоцилиарное одеяло, вызывает повреждение эпителиальных клеток, а также снижает мукоцилиарный клиренс. Если это не было обнаружено на ранней стадии, это может привести к развитию легочных осложнений.
M. pneumoniae обычно протекает в легкой форме, и многие случаи у взрослых могут протекать бессимптомно, тогда как у детей это встречается гораздо реже, что, возможно, отражает некоторую степень защитного иммунитета при повторных инфекциях.Хотя большинство инфекций происходит среди амбулаторных пациентов (отсюда и термин «ходячая пневмония»), M. pneumonia является важной причиной бактериальной пневмонии у взрослых, нуждающихся в госпитализации в США. Марстон и др. [19] сообщают, что M. pneumoniae окончательно ответственны за 5,4% и, возможно, ответственны за 32,5% из 2776 случаев ВП у госпитализированных взрослых на основании теста фиксации комплемента (CF) для выявления инфекций. Дополнительным поразительным открытием этого исследования стало их наблюдение, что заболеваемость пневмонией, вызванной M.pneumoniae у госпитализированных взрослых увеличивалась с возрастом и уступала только S. pneumoniae у пожилых людей.
pneumoniae обычно протекает в легкой форме, и многие случаи у взрослых могут протекать бессимптомно, тогда как у детей это встречается гораздо реже, что, возможно, отражает некоторую степень защитного иммунитета при повторных инфекциях.Хотя большинство инфекций происходит среди амбулаторных пациентов (отсюда и термин «ходячая пневмония»), M. pneumonia является важной причиной бактериальной пневмонии у взрослых, нуждающихся в госпитализации в США. Марстон и др. [19] сообщают, что M. pneumoniae окончательно ответственны за 5,4% и, возможно, ответственны за 32,5% из 2776 случаев ВП у госпитализированных взрослых на основании теста фиксации комплемента (CF) для выявления инфекций. Дополнительным поразительным открытием этого исследования стало их наблюдение, что заболеваемость пневмонией, вызванной M.pneumoniae у госпитализированных взрослых увеличивалась с возрастом и уступала только S. pneumoniae у пожилых людей.
M. pneumoniae может поражать верхние или нижние дыхательные пути или и то, и другое. Симптомы обычно появляются постепенно, в течение нескольких дней и могут сохраняться в течение недель или месяцев. Типичные клинические признаки [20] включают начальный фарингит, боль в горле и охриплость голоса, лихорадку. Сложный дневной и ночной кашель характеризует распространение инфекции на нижние дыхательные пути.Первоначально кашель непродуктивный, но позже может выделяться небольшое или умеренное количество некровавой мокроты. В более тяжелых случаях может проявляться одышка.
pneumoniae может поражать верхние или нижние дыхательные пути или и то, и другое. Симптомы обычно появляются постепенно, в течение нескольких дней и могут сохраняться в течение недель или месяцев. Типичные клинические признаки [20] включают начальный фарингит, боль в горле и охриплость голоса, лихорадку. Сложный дневной и ночной кашель характеризует распространение инфекции на нижние дыхательные пути.Первоначально кашель непродуктивный, но позже может выделяться небольшое или умеренное количество некровавой мокроты. В более тяжелых случаях может проявляться одышка.
Дети [21] в возрасте до пяти лет чаще всего проявляют насморк и хрипы, и прогрессирование до пневмонии встречается относительно редко, тогда как у детей старшего возраста в возрасте 5-15 лет более вероятно развитие бронхопневмонии в одной или нескольких долях, даже иногда. требующие госпитализации. Легкие инфекции и бессимптомные состояния особенно часто встречаются у взрослых, а бронхопневмония развивается у 3-10% инфицированных.
При аускультации грудной клетки могут быть обнаружены рассеянные или локализованные хрипы и хрипы на выдохе. Поскольку альвеолы обычно сохраняются, хрипы и явное уплотнение встречаются довольно редко, если только ателектаз не является широко распространенным. В неосложненных случаях острый лихорадочный период длится около недели, в то время как кашель и усталость могут длиться две недели или даже дольше. Продолжительность симптомов и признаков обычно будет короче, если антибиотики начать на ранней стадии заболевания. Хотя имеется несколько сообщений об инфекциях Mycoplasma у ВИЧ-инфицированных пациентов, неизвестно, влияет ли иммуносупрессия на частоту, тяжесть инфекций Mycoplasma или ответ хозяина на инфекцию Mycoplasma.Есть несколько сообщений о случаях молниеносной [22,23] инфекции плазмы с поражением нескольких органов, но в остальном это нечасто. Предрасполагающие факторы включают серповидно-клеточную гемоглобинопатию и гипогаммаглобулинемию, синдром Дауна и различные иммуносупрессивные состояния, но молниеносное течение может также возникать у ранее здоровых людей, особенно у молодых мужчин и курильщиков.
Внелегочные проявления при инфекциях M. pneumoniae иногда могут затмевать респираторную картину.Наличие множественных внелегочных проявлений является зловещим [24] прогностическим фактором. До 25% людей, инфицированных M. pneumoniae , могут испытывать внелегочные осложнения в различные периоды времени после начала респираторного заболевания или даже при его отсутствии. Иммунопатогенетические факторы, вероятно, вовлечены во многие внелегочные осложнения, учитывая перекрестную реактивность между человеческим антигеном и M. pneumoniae . Прямое вторжение также следует рассматривать как M.pneumoniae была обнаружена во внелегочных участках путем посева и ПЦР-тестирования. Также важно понимать, что внелегочные осложнения могут наблюдаться до, во время или после легочных проявлений или даже могут возникать при полном отсутствии каких-либо респираторных симптомов. Внелегочные [4] проявления могут возникать не менее чем через три дня после начала респираторного заболевания; и в течение двух-трех недель после исчезновения респираторного заболевания.
Проявления центральной нервной системы (ЦНС) являются наиболее частыми внелегочными осложнениями M.pneumoniae и иногда может представлять опасность для жизни [25].
Энцефалит и менингоэнцефалит [26] чаще всего сменяются полирадикулитом и асептическим менингитом. Часто манифестная респираторная инфекция предшествует симптомам со стороны ЦНС. Средний интервал между появлением респираторных симптомов и проявлениями со стороны ЦНС составлял 9,6 дня (диапазон 2-14 дней) в исследовании, проведенном Циодрасом и др. . [27] Инфекция M. pneumoniae должна регулярно учитываться при дифференциальной диагностике Пациентам с проявлениями ЦНС, особенно если они связаны с пневмонией.Среди серологически подтвержденных инфекций M. pneumoniae , требующих госпитализации, 1–10% [28] связаны с неврологическими проявлениями. Общая частота составляет <0,1%, хотя точная частота осложнений со стороны ЦНС, связанных с M. pneumoniae , остается неизвестной из-за отсутствия соответствующего диагностического теста. Предполагается, что осложнения могут быть результатом прямого вторжения M. pneumoniae в мозг, нейротоксина, продуцируемого организмом, или иммуноопосредованного повреждения.Иммуноопосредованное повреждение может быть вызвано перекрестной реакцией антител на антиген (ы), разделяемым микоплазмой и мозгом, иммуносупрессия, вызванная организмом, васкулопатия иммунного комплекса или сосудистые микротромбы. [26,29]
Предполагается, что осложнения могут быть результатом прямого вторжения M. pneumoniae в мозг, нейротоксина, продуцируемого организмом, или иммуноопосредованного повреждения.Иммуноопосредованное повреждение может быть вызвано перекрестной реакцией антител на антиген (ы), разделяемым микоплазмой и мозгом, иммуносупрессия, вызванная организмом, васкулопатия иммунного комплекса или сосудистые микротромбы. [26,29]
Проявления на коже и слизистых оболочках
Среди пациентов с инфекцией M. pneumoniae 25% могут иметь дерматологические проявления, что делает их одним из наиболее распространенных [28] осложнений этой инфекции. Существует хорошо известная связь между микоплазмой и синдромом Стивенса-Джонсона, мультиформной эритемой и токсическим эпидермальным некролизом. M. pneumoniae — наиболее распространенный инфекционный [30] агент, связанный с синдромом Стивенса-Джонсона. Синдром Стивенса-Джонсона [31] (ССД) — это острое, самоограничивающееся заболевание, характеризующееся тяжелым воспалением и некрозом двух или более слизистых оболочек с такими системными симптомами, как лихорадка и недомогание. Это контрастирует с мультиформной эритемой (EM), которая представляет собой легкое кожное заболевание, характеризующееся симметрично распределенными фиксированными, дискретными, круглыми красными папулами, некоторые из которых развиваются в целевые поражения, но без вовлечения слизистых оболочек и системной токсичности.
Это контрастирует с мультиформной эритемой (EM), которая представляет собой легкое кожное заболевание, характеризующееся симметрично распределенными фиксированными, дискретными, круглыми красными папулами, некоторые из которых развиваются в целевые поражения, но без вовлечения слизистых оболочек и системной токсичности.
Сообщалось о некоторых случаях синдрома Стивенса-Джонсона, поражающего исключительно слизистые оболочки, оставляя кожу нетронутой. В настоящее время неясно, является ли эта сущность вариантом синдрома Стивенса-Джонсона или новой сущностью. Латч и др. [32] описали это как атипичный синдром Стивенса-Джонсона. Пациенты с поражением слизистой оболочки полости рта, а также мочеполовой системы обычно проявляются лихорадкой и общей утомляемостью. Антимикробная терапия быстро разрешает клиническое состояние.Он также может вызывать крапивницу, токсический эпидермальный некролиз и розовый отрубевидный лишай. Точный механизм заболевания кожи и слизистых оболочек неизвестен, но были предложены опосредованные иммунным комплексом повреждение сосудов, клеточный иммунный ответ и цитотоксическое повреждение эпителиальных клеток, а также аутоиммунные механизмы.
Гематологические проявления
Гематологические проявления инфекции M. pneumoniae включают аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению и диссеминированное внутрисосудистое свертывание крови.Механизм может включать перекрестную реакцию с холодными агглютининами. [20] Образование холодовых антител — хорошо известная особенность после инфицирования M. pneumoniae . Преобладающий тип холодовых антител, наблюдаемых после этой инфекции, — это анти-I. Кортикостероиды используются для лечения тяжелой гемолитической анемии, вызванной M. pneumoniae . Переливание крови тоже потребуется редко. M. pneumoniae может иногда вызывать необычные и серьезные осложнения, такие как гемофагоцитарный синдром.[33] Этот синдром характеризуется системной активацией макрофагов / гистиоцитов, которые вызывают фагоцитоз кроветворных элементов.
Желудочно-кишечные проявления
Желудочно-кишечные проявления являются частыми [20,34] и были описаны примерно в 25% случаев, проявляясь тошнотой, рвотой, болями в животе, диареей и потерей аппетита.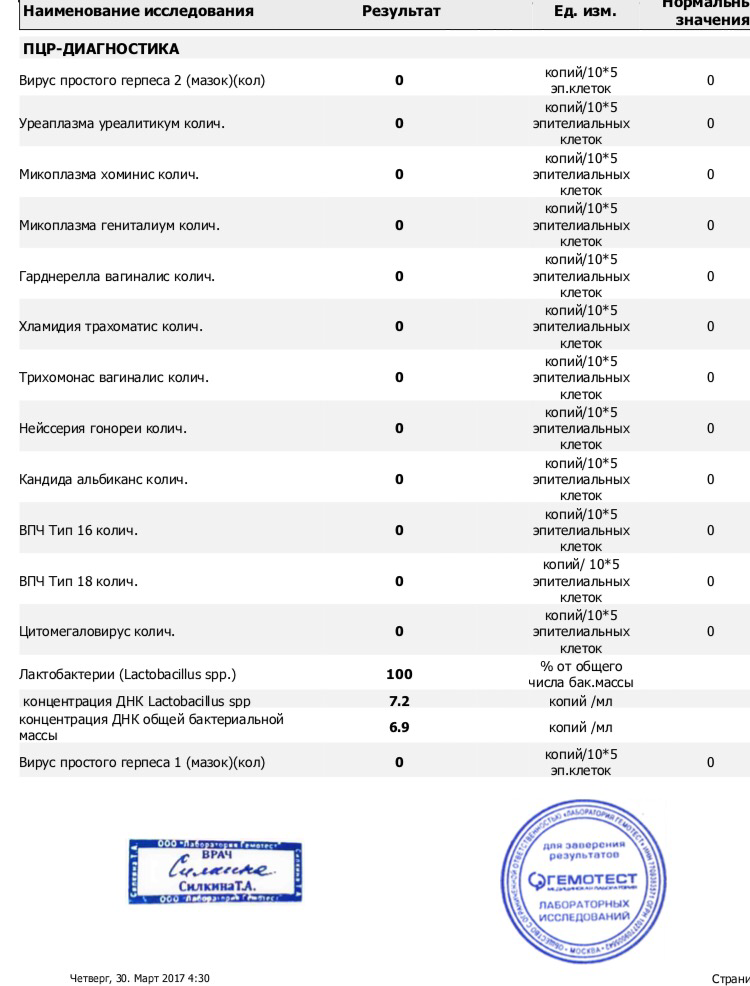 Хотя холестатический гепатит и панкреатит случаются редко. В большинстве клинических случаев показано, что поражение печени M.pneumoniae — это скорее холестаз, чем некроз печени. Острая молниеносная печеночная недостаточность из-за микоплазмы — редкое проявление. Сообщается об одном случае [35] множественного гипоэхогенного поражения селезенки, связанного с инфекцией микоплазмы.
Хотя холестатический гепатит и панкреатит случаются редко. В большинстве клинических случаев показано, что поражение печени M.pneumoniae — это скорее холестаз, чем некроз печени. Острая молниеносная печеночная недостаточность из-за микоплазмы — редкое проявление. Сообщается об одном случае [35] множественного гипоэхогенного поражения селезенки, связанного с инфекцией микоплазмы.
Скелетно-мышечные проявления
Инфекция M. pneumoniae связана с неспецифическими миалгиями, артралгиями и полиартропатиями примерно в 14% случаев [20] с полным выздоровлением в ходе развития болезни; но они могут сохраняться в течение длительного времени.
Полиартрит микоплазменного происхождения может имитировать острую ревматическую лихорадку. В отличие от ревматической лихорадки [34] полиартрит микоплазменного происхождения обычно ассоциируется с умеренно высоким СОЭ и нейтрофильным лейкоцитозом нет.
Почечные проявления
Гломерулонефрит, связанный с M. pneumoniae , встречается редко, и несколько случаев были описаны у детей. Клинические проявления могут быть связаны с острой инфекцией почек и связанных структур или с иммунологическим процессом.Почечные проявления включают прогрессирующий гломерулонефрит, нефротический синдром, преходящую массивную протеинурию, хроническую почечную недостаточность из-за холодового агглютинина, острый интерстициальный нефрит, острую почечную недостаточность из-за острого нефрита, гемоглобинурию или гемолитико-уремический синдром, изолированную гематурию, цистит или уретрит. Наиболее частым поражением является мембранопрофилятивный гломерулонефрит. [20,34] Другие внелегочные проявления представлены в.
pneumoniae , встречается редко, и несколько случаев были описаны у детей. Клинические проявления могут быть связаны с острой инфекцией почек и связанных структур или с иммунологическим процессом.Почечные проявления включают прогрессирующий гломерулонефрит, нефротический синдром, преходящую массивную протеинурию, хроническую почечную недостаточность из-за холодового агглютинина, острый интерстициальный нефрит, острую почечную недостаточность из-за острого нефрита, гемоглобинурию или гемолитико-уремический синдром, изолированную гематурию, цистит или уретрит. Наиболее частым поражением является мембранопрофилятивный гломерулонефрит. [20,34] Другие внелегочные проявления представлены в.
Таблица 1
Внелегочные проявления M.pneumoniae инфекция [4,26-29,36-39]
| Неврологические проявления | Асептический менингит | |
| Менингоэнцефалит | ||
| сосудистая болезнь сердца | ||
| Трансверсивный миелит, восходящий паралич | ||
| Паралич черепных нервов, атксия мозжечка | ||
| Неврит зрительного нерва1, полирадикулопатия | ||
| Скелетно-мышечный | Артралгии миалгии | |
| Септический артрит, | ||
| Полиартрит | Полиартрит | с анемией|
| Тромбические тромбоцитопении пурпура | ||
| внутрисосудистое свертывание | ||
| гемофагоцитарный синдром | ||
| Сердечно-сосудистые | перикардит, миокардит | |
| эндокардит, ККС | ||
| Выпот в перикарде | ||
| Феномен Рейно | ||
| Дерматологический | Сыпь на коже | |
| Синдром Стивенса-Джонсона | синдром Стивенса-Джонсона | |
| Желудочно-кишечный тракт | Диарея, панкреатит | |
| Холестатический гепатит | ||
| Гипоэхогенное поражение селезенки | ||
| Почечный Острый гломерулонефрит, нефропатия IgA | ||
| Тубулоинтерстициальный нефрит, почечная недостаточность |
M.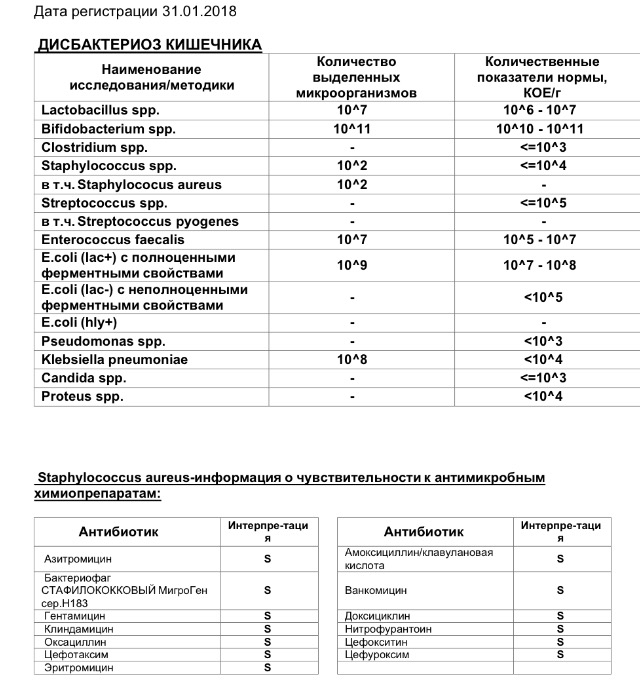 pneumoniae и C. pneumoniae очень похожи друг на друга. Однако есть определенные отличительные [39] особенности, которые могут помочь в прогнозировании этиологического агента.
pneumoniae и C. pneumoniae очень похожи друг на друга. Однако есть определенные отличительные [39] особенности, которые могут помочь в прогнозировании этиологического агента.
M. pneumoniae является острым инфекционным заболеванием, тогда как C. pneumoniae , в отличие от этого, может быть острым, но обычно является хроническим заболеванием.
M. pneumoniae имеет пристрастие как к верхним, так и к нижним дыхательным путям.Таким образом, пациенты с ВП с поражением верхних дыхательных путей с наибольшей вероятностью имеют M. pneumoniae . Общие проявления со стороны верхних дыхательных путей у пациента с ВП включают отит, буллезный мирингит и легкий неэкссудативный фарингит. Эти находки реже встречаются у C. pneumoniae CAP.
Ларингит — наиболее важный клинический признак, позволяющий отличить микоплазму от C. pneumoniae . Хотя все пациенты с C.pneumoniae CAP не болеют ларингитом, в отличие от большинства из них.
 Пациенты с микоплазмоподобным заболеванием с охриплостью, связанной с пневмонией, должны считаться больными C. pneumoniae , пока не будет доказано обратное.
Пациенты с микоплазмоподобным заболеванием с охриплостью, связанной с пневмонией, должны считаться больными C. pneumoniae , пока не будет доказано обратное.Поражение желудочно-кишечного тракта типично для микоплазмы и гораздо реже встречается при пневмонии C. pneumoniae .
Puljiz [40] et al . сообщили, что частота кашля была выше в группе Mycoplasma.Они также сообщили о значительном повышении уровня С-реактивного белка (CRP) и аспартатаминотрансферазы (AST) в группе C.pneumoniae , чем в группе M. pneumoniae . Причина в том, что C. pneumoniae проникает в кровь и распространяется в разные органы, а M. pneumoniae остается в эпителии дыхательных путей, вызывая более слабую воспалительную реакцию с более низкими значениями CRP и AST.
Следующие клинические признаки могут быть полезны для дифференциации [39] Legionella и Mycoplasma pneumoniae пневмонии.Относительная брадикардия — постоянный клинический признак Legionella pneumonia, но не в случае пневмонии M. pneumoniae . Если у пациента с ВП [39] возникает боль в животе с жидким стулом или диареей или без него, то высока вероятность появления легионеллы, поскольку никакая другая причина ВП не связана с острой болью в животе. Поражение верхних дыхательных путей [39], мультиформная эритема способствуют инфицированию M. pneumoniae , в то время как поражение печени и электролитные нарушения (гипонатриемия и гипофосфатемия) являются характерными признаками Legionella pneumonia.
pneumoniae . Если у пациента с ВП [39] возникает боль в животе с жидким стулом или диареей или без него, то высока вероятность появления легионеллы, поскольку никакая другая причина ВП не связана с острой болью в животе. Поражение верхних дыхательных путей [39], мультиформная эритема способствуют инфицированию M. pneumoniae , в то время как поражение печени и электролитные нарушения (гипонатриемия и гипофосфатемия) являются характерными признаками Legionella pneumonia.
Дифференциальная диагностика
M. pneumoniae пневмонии и других бактериальных пневмоний Японское респираторное общество (JRS) предложило систему баллов для различения атипичной и бактериальной пневмонии. [41] В руководстве установлено шесть параметров, основанных на клинических симптомах, физических признаках и лабораторных данных. Эти параметры: 1) моложе 60 лет 2) отсутствие сопутствующего заболевания или незначительное сопутствующее заболевание 3) у пациента упорный кашель 4) Плохие результаты аускультации в грудной клетке 5) отсутствие мокроты или этиологического агента, выявленного с помощью экспресс-тестов, и 6) количество лейкоцитов в периферической крови ниже 10,000 / см. Если среди всех шести параметров имеется корреляция более четырех параметров, то в руководстве рекомендуется использовать макролиды или тетрациклины при подозрении на атипичную пневмонию. Если эти критерии не соблюдены, в руководстве рекомендуется использовать бета-лактамы при подозрении на бактериальную пневмонию. Эта дифференциация приобретает значение в областях, где высока заболеваемость устойчивостью к макролидам, например в Японии.
Если среди всех шести параметров имеется корреляция более четырех параметров, то в руководстве рекомендуется использовать макролиды или тетрациклины при подозрении на атипичную пневмонию. Если эти критерии не соблюдены, в руководстве рекомендуется использовать бета-лактамы при подозрении на бактериальную пневмонию. Эта дифференциация приобретает значение в областях, где высока заболеваемость устойчивостью к макролидам, например в Японии.
ВЛИЯНИЕ НА АСТМУ
Роль атипичных патогенов — C. pneumoniae и M. pneumoniae при астме стали активной областью исследований в последние годы. [42] M. pneumoniae , которая в первую очередь считается возбудителем ВП, недавно была по-разному связана с астмой. Заражение этим организмом может предшествовать развитию астмы. Во-вторых, это может обострить астму и затруднить ее контроль. В серологическом исследовании с участием четырех атипичных патогенов — C. pneumoniae, M. pneumoniae , Legionella и C.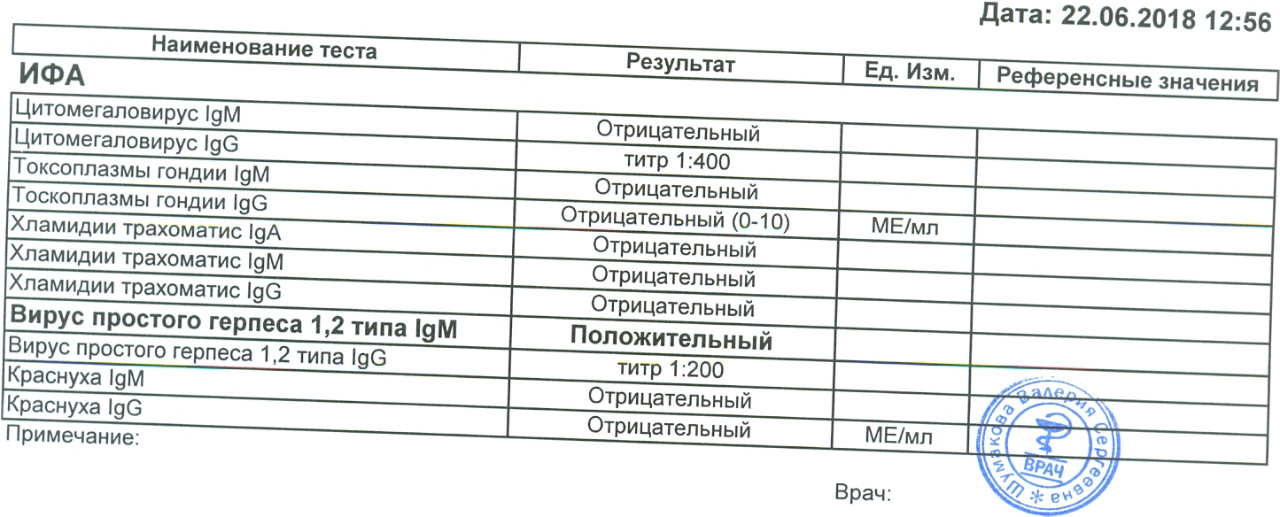 burnettii , Lieberman и др. , [43] обнаружили, что только инфекция M. pneumoniae связана с госпитализацией по поводу обострения бронхиальной астмы. У большинства из этих инфицированных M. pneumoniae пациентов также есть свидетельства инфицирования респираторным вирусом. Однако патофизиологическое и терапевтическое значение этих результатов необходимо подтвердить в надлежащих исследованиях. Бискарди [44] и др. . сообщают, что M. pneumoniae было микробом, вызывающим заболевание, в 20% случаев обострений у детей с астмой, нуждающихся в госпитализации по поводу обострений астмы.Этот высокий уровень не ограничивался ранее диагностированной астмой. Пятьдесят процентов детей, перенесших первый приступ астмы, также имели положительный результат на M. pneumoniae . Эти цифры были значительно больше, чем для других бактерий или вирусов, которые оценивались в этом исследовании. Шестьдесят два процента пациентов с астмой впервые, которые были положительными на M.
burnettii , Lieberman и др. , [43] обнаружили, что только инфекция M. pneumoniae связана с госпитализацией по поводу обострения бронхиальной астмы. У большинства из этих инфицированных M. pneumoniae пациентов также есть свидетельства инфицирования респираторным вирусом. Однако патофизиологическое и терапевтическое значение этих результатов необходимо подтвердить в надлежащих исследованиях. Бискарди [44] и др. . сообщают, что M. pneumoniae было микробом, вызывающим заболевание, в 20% случаев обострений у детей с астмой, нуждающихся в госпитализации по поводу обострений астмы.Этот высокий уровень не ограничивался ранее диагностированной астмой. Пятьдесят процентов детей, перенесших первый приступ астмы, также имели положительный результат на M. pneumoniae . Эти цифры были значительно больше, чем для других бактерий или вирусов, которые оценивались в этом исследовании. Шестьдесят два процента пациентов с астмой впервые, которые были положительными на M. pneumoniae или C. pneumoniae , имели рецидивирующие эпизоды астмы, тогда как только у 27% пациентов, не содержащих патогенов, был последующий приступ ( P -значение <0.05). Таким образом, M. pneumoniae , по-видимому, играет важную роль как в индексном, так и в последующих обострениях астмы.
pneumoniae или C. pneumoniae , имели рецидивирующие эпизоды астмы, тогда как только у 27% пациентов, не содержащих патогенов, был последующий приступ ( P -значение <0.05). Таким образом, M. pneumoniae , по-видимому, играет важную роль как в индексном, так и в последующих обострениях астмы.
Мартин [45] и др. . провели исследование на основе бронхоскопии, чтобы определить распространенность M. pneumoniae или C. pneumoniae в дыхательных путях хронических стабильных астматиков. Они обнаружили атипичные бактерии у 56% хронических стабильных астматиков, у которых не было обострений в течение 3 месяцев после включения в исследование. Двадцать три имели M. pneumoniae , у двух пациентов была другая патогенная микоплазма, но только у одного контроля была микоплазма в дыхательных путях.Таким образом, была очень значимая разница между астматиками и контрольной группой ( P = 0,007). В двойном слепом исследовании лечения Крафт [46] и др. продемонстрировали, что прием кларитромицина улучшал ОФВ1 только у астматиков, которые были положительны на M. pneumoniae или C. pneumoniae в дыхательных путях. ОФВ1 не улучшился у астматиков, у которых не было этих бактерий в дыхательных путях и которые получали кларитромицин. Однако точный механизм действия макролидов в уменьшении симптомов астмы у М.pneumoniae , необходимо выяснить, прежде чем делать какое-либо твердое заключение, поскольку макролиды могут улучшать функцию легких как за счет антимикробного, так и за счет иммуномодулирующего действия. У нас есть ограниченные данные о распространенности и ассоциации респираторной инфекции Mycoplasma pneumoniae с астмой в нашей стране. Недавно Чаудри [47] и др. . обнаружили статистически значимую связь между инфекцией Mycoplasma pneumoniae и детьми с персистирующей астмой средней и тяжелой степени.Они также показали значительную связь инфекции Mycoplasma pneumoniae с острым обострением астмы у детей с ранее диагностированной астмой.
продемонстрировали, что прием кларитромицина улучшал ОФВ1 только у астматиков, которые были положительны на M. pneumoniae или C. pneumoniae в дыхательных путях. ОФВ1 не улучшился у астматиков, у которых не было этих бактерий в дыхательных путях и которые получали кларитромицин. Однако точный механизм действия макролидов в уменьшении симптомов астмы у М.pneumoniae , необходимо выяснить, прежде чем делать какое-либо твердое заключение, поскольку макролиды могут улучшать функцию легких как за счет антимикробного, так и за счет иммуномодулирующего действия. У нас есть ограниченные данные о распространенности и ассоциации респираторной инфекции Mycoplasma pneumoniae с астмой в нашей стране. Недавно Чаудри [47] и др. . обнаружили статистически значимую связь между инфекцией Mycoplasma pneumoniae и детьми с персистирующей астмой средней и тяжелой степени.Они также показали значительную связь инфекции Mycoplasma pneumoniae с острым обострением астмы у детей с ранее диагностированной астмой.
Патофизиологические механизмы
Воздействие микоплазменных инфекций на дыхательные пути кажется многофакторным и включает сложное взаимодействие воспаления дыхательных путей и гиперчувствительности, опосредованной IgE, в дополнение к особенностям отдельных пациентов, таким как атопическая предрасположенность [42].
Инфекции, вызванные микоплазмами, могут привести к преобладанию Т-хелперов 2-го типа заболевания дыхательных путей и развитию воспаления дыхательных путей, которое может вызвать или обострить астму.
Гиперчувствительность, связанная с IgE
РАДИОЛОГИЯ
Рентгенологические проявления M. pneumoniae пневмонии могут быть чрезвычайно разнообразными и могут имитировать широкий спектр заболеваний легких. Воспалительная реакция вызывает воспаление интерстициальных мононуклеарных клеток, которое рентгенологически может проявляться в виде диффузных ретикулярных инфильтратов бронхопневмонии в перихилярных областях или нижних долях, обычно с односторонним распространением, и внутригрудной лимфаденопатии. Двустороннее поражение может произойти примерно в 20% случаев. Другое исследование Puljiz и др. [40] показало, что наиболее частой рентгенологической аномалией грудной клетки был интерстициальный инфильтрат в 90,48% случаев, за которым следовали альвеолярные инфильтраты в 8,84% случаев. Плевральный выпот выявлен у 13 пациентов (8,84%).
Двустороннее поражение может произойти примерно в 20% случаев. Другое исследование Puljiz и др. [40] показало, что наиболее частой рентгенологической аномалией грудной клетки был интерстициальный инфильтрат в 90,48% случаев, за которым следовали альвеолярные инфильтраты в 8,84% случаев. Плевральный выпот выявлен у 13 пациентов (8,84%).
В ретроспективном обзоре КТ грудной клетки между микоплазмой и другими пациентами с ВП, Takahito [48] et al . обнаружили, что утолщение бронхиальной стенки (значение P <0,0001) было наиболее частой аномалией в M.pneumoniae группы. M. pneumoniae прикрепляется к ресничкам через белок P1 и размножается в слое респираторного эпителия. Присоединение к эпителиальным ресничкам отвечает за утолщение стенок бронхов.
ЛАБОРАТОРНЫЙ ДИАГНОЗ
Диагностика инфекции M. pneumoniae является сложной задачей из-за привередливой природы возбудителя, значительной серологической распространенности и возможности преходящего бессимптомного носительства. Лабораторная диагностика сильно затруднена из-за отсутствия стандартизированных, чувствительных и специфических методов [49] для обнаружения этого атипичного респираторного патогена.Вторым серьезным препятствием является сложность отбора проб инфекции нижних дыхательных путей в репрезентативных популяциях пациентов. Однако конкретный диагноз важен, потому что бета-лактамные антибиотики, используемые эмпирически для лечения внебольничной пневмонии, неэффективны против M. pneumoniae .
Лабораторная диагностика сильно затруднена из-за отсутствия стандартизированных, чувствительных и специфических методов [49] для обнаружения этого атипичного респираторного патогена.Вторым серьезным препятствием является сложность отбора проб инфекции нижних дыхательных путей в репрезентативных популяциях пациентов. Однако конкретный диагноз важен, потому что бета-лактамные антибиотики, используемые эмпирически для лечения внебольничной пневмонии, неэффективны против M. pneumoniae .
Культуры могут предоставить информацию о жизнеспособности и биологических характеристиках микоплазм, тестировании на антимикробную чувствительность, а также оценку микробиологической эффективности при испытаниях лечения.Но главными препятствиями для успешных культур являются необходимость использования специальных методов из-за требовательности к выращиванию, правильной обработки образцов и многих дней для обнаружения роста. Более того, посев успешен только в 30-60% серологически диагностированных [50] случаев. Таким образом, серологическое тестирование является наиболее распространенным средством диагностики инфекции M. pneumoniae . Серологические тесты легко проводить, но они не лишены недостатков. Как правило, они носят неспецифический и ретроспективный характер.Требуются образцы сыворотки выздоравливающих, чтобы показать сероконверсию или четырехкратное увеличение титра. Тем не менее, это наиболее полезный способ определения причины вспышки или распространенности инфекций в эпидемиологических исследованиях, и четырехкратное повышение титра между сывороткой острой и выздоравливающей сыворотки по-прежнему считается «золотым стандартом» для диагностики острой инфекции M. pneumoniae респираторные [51] инфекции
Таким образом, серологическое тестирование является наиболее распространенным средством диагностики инфекции M. pneumoniae . Серологические тесты легко проводить, но они не лишены недостатков. Как правило, они носят неспецифический и ретроспективный характер.Требуются образцы сыворотки выздоравливающих, чтобы показать сероконверсию или четырехкратное увеличение титра. Тем не менее, это наиболее полезный способ определения причины вспышки или распространенности инфекций в эпидемиологических исследованиях, и четырехкратное повышение титра между сывороткой острой и выздоравливающей сыворотки по-прежнему считается «золотым стандартом» для диагностики острой инфекции M. pneumoniae респираторные [51] инфекции
СЕРОЛОГИЯ
До появления более совершенных серологических методов обнаружение холодовых агглютининов считалось ценным инструментом для диагностики M.pneumoniae инфекция. Образование холодовых агглютининов является первым гуморальным иммунным ответом на инфекцию M. pneumoniae . Холодовые агглютинины обычно появляются в конце первой или в начале второй недели болезни и исчезают к 2-3 месяцам [52]. Определение этих аутоантител является первым и простым в выполнении, но они не очень надежные индикаторы инфекции M. pneumoniae , поскольку они повышены у 50-60% пациентов. Кроме того, они также повышены у различных других инфекционных агентов, например вируса Эпштейна-Барра, цитомегаловируса, Klebsiella pneumoniae , а также при злокачественных новообразованиях лимфоидных клеток и аутоиммунных заболеваниях.[49]
pneumoniae . Холодовые агглютинины обычно появляются в конце первой или в начале второй недели болезни и исчезают к 2-3 месяцам [52]. Определение этих аутоантител является первым и простым в выполнении, но они не очень надежные индикаторы инфекции M. pneumoniae , поскольку они повышены у 50-60% пациентов. Кроме того, они также повышены у различных других инфекционных агентов, например вируса Эпштейна-Барра, цитомегаловируса, Klebsiella pneumoniae , а также при злокачественных новообразованиях лимфоидных клеток и аутоиммунных заболеваниях.[49]
Существует ряд специфических серологических тестов для M. pneumoniae , в которых используются различные методы и антигены. Два наиболее часто используемых и широко доступных метода — это фиксация комплемента (CF) и иммуноферментный анализ (EIA).
МЕТОД ФИКСАЦИИ КОМПЛЕКТОВ
Этот метод в основном измеряет ранний ответ IgM и не делает различий между классами антител; это желательно, чтобы отличить острую инфекцию от отдаленной. Фиксация комплемента (CF) страдает низкой чувствительностью и специфичностью, поскольку используемая смесь гликолипидных антигенов может быть обнаружена в других микроорганизмах, а также в тканях человека и даже в растениях.Хорошо известны перекрестные реакции [53] с M. genitalium . Несмотря на эти ограничения, некоторые микробиологи по-прежнему считают один титр CF 1:64 признаком недавней инфекции M. pneumoniae .
Фиксация комплемента (CF) страдает низкой чувствительностью и специфичностью, поскольку используемая смесь гликолипидных антигенов может быть обнаружена в других микроорганизмах, а также в тканях человека и даже в растениях.Хорошо известны перекрестные реакции [53] с M. genitalium . Несмотря на эти ограничения, некоторые микробиологи по-прежнему считают один титр CF 1:64 признаком недавней инфекции M. pneumoniae .
ИММУНО-АНАЛИЗЫ ФЕРМЕНТОВ
Иммуноферментный анализ (ИФА) является наиболее широко используемым и надежным коммерческим серологическим тестом на микоплазмы. Он позволяет титровать IgG и IgM и обеспечивает чувствительность 92% и специфичность 95% на парных образцах. Срок сероконверсии составляет от трех до восьми недель.Они более чувствительны, чем культура, для выявления острой инфекции и могут быть сопоставимы по чувствительности к полимеразной цепной реакции (ПЦР) при условии, что с момента инфекции прошло достаточно времени для развития антител и у пациента имеется функциональная иммунная система. Большинство ИФА продаются в формате 96-луночных микротитровальных планшетов. Тем не менее, два EIA упакованы как качественные мембранные процедуры для обнаружения одного тестируемого образца. Они быстрые (10 мин или меньше) и просты в исполнении.
Большинство ИФА продаются в формате 96-луночных микротитровальных планшетов. Тем не менее, два EIA упакованы как качественные мембранные процедуры для обнаружения одного тестируемого образца. Они быстрые (10 мин или меньше) и просты в исполнении.
Immunocard: он измеряет только IgM
Ramel EIA: он обнаруживает IgM и IgG одновременно.Производители одобрили использование единого теста для диагностики острой инфекции у молодых людей.
Хотя одноточечный анализ кажется привлекательным, обычные ИФА типа планшетов могут быть более эффективными и рентабельными в лаборатории, где необходимо одновременно измерять большее количество образцов. Согласно Talkington [4], для максимальной точности необходимы сыворотки в остром периоде и в период выздоровления.
КУЛЬТУРА
Культура трудоемка, дорога и требует много времени.По сравнению с ПЦР его чувствительность может быть не более 60% даже в опытных ЛАБ при строгом соблюдении процедур. [4] Но в случае положительного результата его специфичность составляет 100% при условии, что будут приняты соответствующие меры для определения вида. Сохранение Mycoplasma в течение различных периодов после острой инфекции также затрудняет в некоторых случаях оценку значимости положительного посева без дополнительных подтверждающих тестов, таких как серологическое исследование. Поэтому посев редко используется для рутинной диагностики и / или лечения M.pneumoniae инфекций. Из-за вышеупомянутых ограничений, если она будет предпринята, ее следует дополнить дополнительными диагностическими методами, такими как ПЦР и / или серология. [49] Из-за чувствительности организма к неблагоприятным условиям окружающей среды надлежащий сбор, хранение и транспортировка образцов имеют решающее значение для поддержания жизнеспособности при обработке культур и экстракции ДНК. Из-за его ограниченной метаболической и биосинтетической способности он нуждается в большом количестве питательных веществ во время культивирования.
[4] Но в случае положительного результата его специфичность составляет 100% при условии, что будут приняты соответствующие меры для определения вида. Сохранение Mycoplasma в течение различных периодов после острой инфекции также затрудняет в некоторых случаях оценку значимости положительного посева без дополнительных подтверждающих тестов, таких как серологическое исследование. Поэтому посев редко используется для рутинной диагностики и / или лечения M.pneumoniae инфекций. Из-за вышеупомянутых ограничений, если она будет предпринята, ее следует дополнить дополнительными диагностическими методами, такими как ПЦР и / или серология. [49] Из-за чувствительности организма к неблагоприятным условиям окружающей среды надлежащий сбор, хранение и транспортировка образцов имеют решающее значение для поддержания жизнеспособности при обработке культур и экстракции ДНК. Из-за его ограниченной метаболической и биосинтетической способности он нуждается в большом количестве питательных веществ во время культивирования. Среда SP4 стала наиболее успешной и широко используемой бульонной и агаризованной средой для культивирования M. pneumoniae в клинических целях. Несмотря на низкую чувствительность культуры, изоляция организмов позволила получить некоторое представление о патогенезе внелегочных проявлений, поскольку успешная изоляция свидетельствует о прямой инвазии жизнеспособной микоплазмы.
Среда SP4 стала наиболее успешной и широко используемой бульонной и агаризованной средой для культивирования M. pneumoniae в клинических целях. Несмотря на низкую чувствительность культуры, изоляция организмов позволила получить некоторое представление о патогенезе внелегочных проявлений, поскольку успешная изоляция свидетельствует о прямой инвазии жизнеспособной микоплазмы.
Иногда необходимо провести дополнительные тесты [19], чтобы окончательно доказать, что выделенная микоплазма действительно представляет собой M.пневмония . M. pneumoniae отличается от других микоплазм, особенно от комменсальных ротоглоточных микоплазм, поскольку имеет более медленный рост, ферментирует глюкозу, абсорбирует эритроциты в растущих колониях и снижает содержание тетразолия при аэробном или анаэробном выращивании.
МЕТОДИКА ОБНАРУЖЕНИЯ АНТИГЕНОВ
Экспресс-тесты для прямого антигенного обнаружения M. pneumoniae в образцах дыхательных путей:
Прямая иммунофлуоресценция
Иммуноэлектрофорез
Противодействующий иммуноэлектрофорез
Иммуноэлектрофорез
Все эти тесты отличаются низкой чувствительностью и перекрестной реактивностью с другими микоплазмами, обнаруженными в дыхательных путях.
МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
ДНК-зонды
ДНК-зонды можно использовать для обнаружения M. pneumoniae , мишенью которых являются гены 16S рРНК. К недостаткам можно отнести относительно короткий срок службы, составляющий шесть недель, необходимость в специальном оборудовании, высокую стоимость, а также необходимость закупки и ликвидации радиоизотопов. Они обладают низкой чувствительностью и специфичностью [54] и были заменены другими методами.
Полимеразная цепная реакция
Из-за нечувствительности и длительного времени, необходимого для культивирования, а также необходимости сбора острой и выздоравливающей сыворотки с интервалом в две-три недели для оптимальной серологической диагностики, полимеразная цепная реакция (ПЦР) с самого начала вызвала значительный интерес. его возникновения.Есть несколько преимуществ анализа на основе ПЦР. Во-первых, чувствительность ПЦР очень высока. У него есть потенциальная возможность пройти процедуру тестирования за день, поэтому возможность получения положительного результата раньше после начала болезни, чем серология.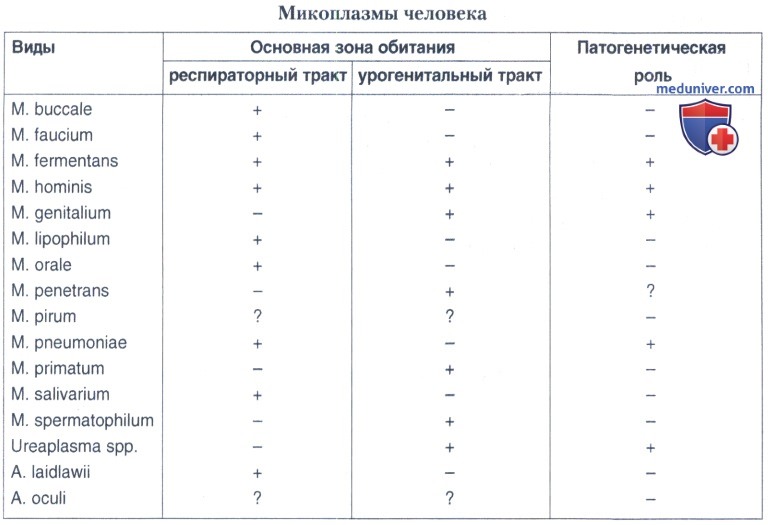 В отличие от серологии, для этого требуется только один образец. Он может предоставить информацию о возможной этиологии микоплазмы при внелегочном поражении, при котором очевидный вклад респираторных инфекций не всегда очевиден. Наконец, для этого нужны не только жизнеспособные организмы.Он также может усиливать мертвые бациллы. ПЦР может также обнаружить микоплазму в ткани, обработанной для гистологического исследования. Поскольку методы амплификации нуклеиновых кислот (NAAT), нацеленные на ДНК, могут обнаруживать как жизнеспособные, так и нежизнеспособные организмы, обнаружение РНК с помощью ПЦР с обратной транскриптазой или амплификации на основе последовательности нуклеиновых кислот может быть полезным методом для выявления продуктивных инфекций M. pneumoniae [55].
В отличие от серологии, для этого требуется только один образец. Он может предоставить информацию о возможной этиологии микоплазмы при внелегочном поражении, при котором очевидный вклад респираторных инфекций не всегда очевиден. Наконец, для этого нужны не только жизнеспособные организмы.Он также может усиливать мертвые бациллы. ПЦР может также обнаружить микоплазму в ткани, обработанной для гистологического исследования. Поскольку методы амплификации нуклеиновых кислот (NAAT), нацеленные на ДНК, могут обнаруживать как жизнеспособные, так и нежизнеспособные организмы, обнаружение РНК с помощью ПЦР с обратной транскриптазой или амплификации на основе последовательности нуклеиновых кислот может быть полезным методом для выявления продуктивных инфекций M. pneumoniae [55].
Различные использованные мишени включают, в первую очередь, ген АТФазы, адгезин P1, ген 16 S рРНК, ген tuf и т. Д.
Молекулярные анализы часто демонстрируют эквивалентную или более высокую чувствительность для обнаружения острой инфекции по сравнению с серологией или посевом, но это не всегда так. [56] Хотя ПЦР имеет высокую чувствительность для обнаружения M. pneumoniae , всегда следует проводить серологические тесты, чтобы различать острые и стойкие инфекции. [34]
[56] Хотя ПЦР имеет высокую чувствительность для обнаружения M. pneumoniae , всегда следует проводить серологические тесты, чтобы различать острые и стойкие инфекции. [34]
Положительная ПЦР, но отрицательные серологические тесты
Наличие патогена в дыхательных путях не обязательно связано с клиническими симптомами.Gnarpe [57] и др. . обнаружили, что 5,1–13,5% здоровых взрослых содержат микроорганизмы в горле. Преходящее бессимптомное носительство M. pneumoniae является результатом персистенции возбудителя после болезни и инфекций во время инкубационного периода. В настоящее время неизвестно, происходит ли регулярное диагностическое повышение титра антител при бессимптомных инфекциях.
У пациентов с ослабленным иммунитетом не может наблюдаться никакого диагностического ответа антител.
Ранняя успешная антибиотикотерапия.
Положительный результат ПЦР у человека с отрицательным посевом без признаков респираторного заболевания
Сохранение микроорганизмов после заражения.

Бессимптомное носительство, возможно, во внутриклеточном компартменте, который не дает культивируемых организмов.
Отрицательные результаты ПЦР в культуре или серологически подтвержденные инфекции увеличивают вероятность ингибиторов или других технических проблем с анализом и его генной мишенью.[4] Резников [58] и др. . показали, что ингибирование ПЦР более вероятно при использовании аспиратов из носоглотки, чем при использовании мазков из зева, и рекомендовали последний образец для диагностических целей. С другой стороны, Дориго-Зецма [59] и др. . провели комплексное обследование 18 пациентов с инфекцией дыхательных путей M. pneumopniae и обнаружили, что образец мокроты с наибольшей вероятностью дает положительный результат ПЦР (62,5% против 41% для носоглотки, 28% для мазков из горла).Существуют коммерческие реагенты для очистки нуклеиновых кислот, которые эффективны для удаления большинства ингибиторов амплификации в анализах ПЦР.
Комбинированное использование ПЦР с серологией IgM [6] может быть полезным подходом для диагностики респираторной инфекции M. pneumoniae у детей, но потенциально менее полезно для взрослых, у которых может не быть ответа IgM. Возможной альтернативой, особенно у пожилых людей, может быть комбинация ПЦР с серологией на IgA. Сочетание этих двух диагностических методов может помочь отличить колонизацию от активного заболевания.
В последнее время в технике ПЦР произошло несколько улучшений. Hardegger [60] и др. . обнаружили, что анализ ПЦР в реальном времени эквивалентен стандартной вложенной ПЦР в отношении чувствительности при обнаружении M. pneumoniae в клинических образцах, что позволяет проводить количественное определение амплифицированного продукта во время ПЦР в сочетании с сокращением времени работы. Разработка количественной ПЦР будет способствовать лучшему пониманию состояния носителя, связанного с M.пневмония . Лоенс [61] и др.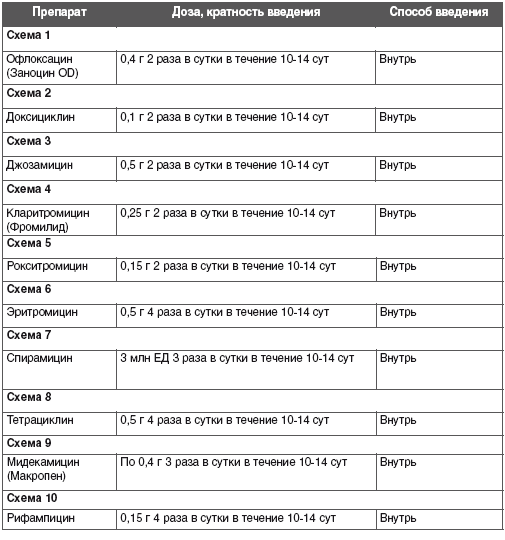 . разработал метод амплификации на основе мультиплексных последовательностей нуклеиновых кислот в реальном времени (анализ NASBA) для обнаружения видов M. pneumoniae , C. pneumoniae и Legionella в респираторных образцах. Это многообещающий инструмент для обнаружения видов M. pneumoniae , C. pneumoniae и Legionella в респираторных образцах с точки зрения обработки, скорости и количества образцов, которые можно проанализировать за один прогон, хотя он немного меньше. чувствительны, чем моно-анализ NASBA в реальном времени.Это определенно требует дальнейшей оценки большого количества клинических образцов от пациентов с ВП. Широкое распространение в нашей стране методов диагностики микоплазм, безусловно, является большим препятствием для установления истинной распространенности инфекции и своевременной диагностики. Хотя ПЦР предлагает улучшения в чувствительности, специфичности и скорости по сравнению с посевом и серологией, сохраняется потребность в разработке дешевых, широко доступных и воспроизводимых диагностических методов, подходящих для нашей страны.
. разработал метод амплификации на основе мультиплексных последовательностей нуклеиновых кислот в реальном времени (анализ NASBA) для обнаружения видов M. pneumoniae , C. pneumoniae и Legionella в респираторных образцах. Это многообещающий инструмент для обнаружения видов M. pneumoniae , C. pneumoniae и Legionella в респираторных образцах с точки зрения обработки, скорости и количества образцов, которые можно проанализировать за один прогон, хотя он немного меньше. чувствительны, чем моно-анализ NASBA в реальном времени.Это определенно требует дальнейшей оценки большого количества клинических образцов от пациентов с ВП. Широкое распространение в нашей стране методов диагностики микоплазм, безусловно, является большим препятствием для установления истинной распространенности инфекции и своевременной диагностики. Хотя ПЦР предлагает улучшения в чувствительности, специфичности и скорости по сравнению с посевом и серологией, сохраняется потребность в разработке дешевых, широко доступных и воспроизводимых диагностических методов, подходящих для нашей страны.
ЛЕЧЕНИЕ
M. PNEUMONIAE ИНФЕКЦИЯРаспространенная точка зрения на лечение M. pneumoniae , особенно при легких инфекциях, заключается в том, что действительно не имеет значения, назначаются ли антибактериальные препараты для большинства этих инфекций из-за смертности частота этих инфекций низкая, и эти инфекции часто являются самоограничивающимися, и смешанные инфекции имеют смешанные эффекты. Тем не менее, исследования [62] 1960-х годов показывают, что лечение легких инфекций M. pneumoniae снижает заболеваемость пневмонией и сокращает продолжительность симптомов.В таких исследованиях терапия макролидами или тетрациклином была лучше, чем пенициллин.
Из-за отсутствия клеточной стенки все микоплазмы изначально устойчивы ко всем бета-лактамам и гликопептидам. Сульфаниламиды, триметоприм, полимиксины, налидиксовая кислота и рифампицин также неактивны. M. pneumoniae чувствительна к антибиотикам, которые мешают синтезу белка или ДНК, таким как тетрациклины, макролиды и хинолоны. Макролиды являются наиболее активными агентами in vitro, а азитромицин — наиболее активным макролидом с минимальными ингибирующими концентрациями в диапазоне от 0.0003 до 0,031 мг / мл. [63] Азитромицин предпочтительнее эритромицина из-за лучшего профиля побочных эффектов и приема дозы один раз в день. Терапия макролидными антибиотиками также может снизить частоту рецидивов хрипов и нарушений функции легких, которые возникают в результате острой инфекции M. pneumoniae . Азитромицин также может быть эффективным для предотвращения заражения M. pneumoniae во время вспышки.
Макролиды являются наиболее активными агентами in vitro, а азитромицин — наиболее активным макролидом с минимальными ингибирующими концентрациями в диапазоне от 0.0003 до 0,031 мг / мл. [63] Азитромицин предпочтительнее эритромицина из-за лучшего профиля побочных эффектов и приема дозы один раз в день. Терапия макролидными антибиотиками также может снизить частоту рецидивов хрипов и нарушений функции легких, которые возникают в результате острой инфекции M. pneumoniae . Азитромицин также может быть эффективным для предотвращения заражения M. pneumoniae во время вспышки.
В японском исследовании [64] Телитромицин был обнаружен кетолидный антибиотик, обладающий хорошей активностью против 41 клинического изолята M.пневмония . Авторы определили активность телитромицина in vitro и обнаружили, что он менее эффективен, чем азитромицин, но более активен, чем четыре других макролида (эритромицин, кларитромицин, рокситромицин, джозамицин), левофлоксацин и миноциклин. Его МПК, при которых подавлялись 50% и 90% изолятов, составляли 0,00097 мг / мл, что оправдывает дальнейшие клинические исследования для определения его эффективности для лечения M. pneumoniae . Хинолоны [65] представляют собой cidal in vitro , а некоторые хинолоны, включая левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин, обладают высокой активностью против M.pneumoniae in vitro . В целом хинолоны оказываются немного менее активными, чем макролиды in vitro . Однако активность in vitro не всегда предсказывает микробиологическую активность in vivo . Было показано, что флурохинолоны обладают бактерицидным действием в отношении M. pneumoniae , тогда как макролиды и тетрациклины обладают прежде всего бактериостатическим действием.
Его МПК, при которых подавлялись 50% и 90% изолятов, составляли 0,00097 мг / мл, что оправдывает дальнейшие клинические исследования для определения его эффективности для лечения M. pneumoniae . Хинолоны [65] представляют собой cidal in vitro , а некоторые хинолоны, включая левофлоксацин, гатифлоксацин, моксифлоксацин, гемифлоксацин, обладают высокой активностью против M.pneumoniae in vitro . В целом хинолоны оказываются немного менее активными, чем макролиды in vitro . Однако активность in vitro не всегда предсказывает микробиологическую активность in vivo . Было показано, что флурохинолоны обладают бактерицидным действием в отношении M. pneumoniae , тогда как макролиды и тетрациклины обладают прежде всего бактериостатическим действием.
Исследование, основанное на методе микротитровального тестирования чувствительности Даффи [65] и др. .демонстрирует превосходную эффективность гемифлоксацина in vitro с диапазоном МИК для микоплазмы от ≤ 0,008 до 0,125 мг / л. Гемифлоксацин оказался таким же или более сильным, чем тетрациклин, клиндамицин и другие исследованные хинолоны.
Гемифлоксацин оказался таким же или более сильным, чем тетрациклин, клиндамицин и другие исследованные хинолоны.
У детей [66] можно безопасно применять только макролиды независимо от возраста из-за потенциальных побочных эффектов тетрациклинов и хинолонов у более молодых пациентов. Principi [67] и др. . в исследовании, в котором участвовал 191 ребенок, госпитализированный по поводу ВП с признаками острой болезни M.pneumonmiae или C. pneumoniae обнаружили, что 106 (97,2%) из 109 детей, получавших макролиды, и только 67 (81,7%) из 82 детей, получавших другие антибиотики, считались вылеченными или улучшившимися через четыре-шесть недель ( P значение <0,05).
В последнее время интерес вызывает устойчивость к противомикробным препаратам у M. pneumoniae . Сообщалось, что в Японии появилась устойчивость к макролидам [68,69]. Его можно легко выделить in vitro . Такие мутанты обычно [4] проявляют устойчивость типа макролид-линкозамиды-стрептограмин B, что делает линкозамиды и стрептограмин B неактивными в дополнение к макролидам.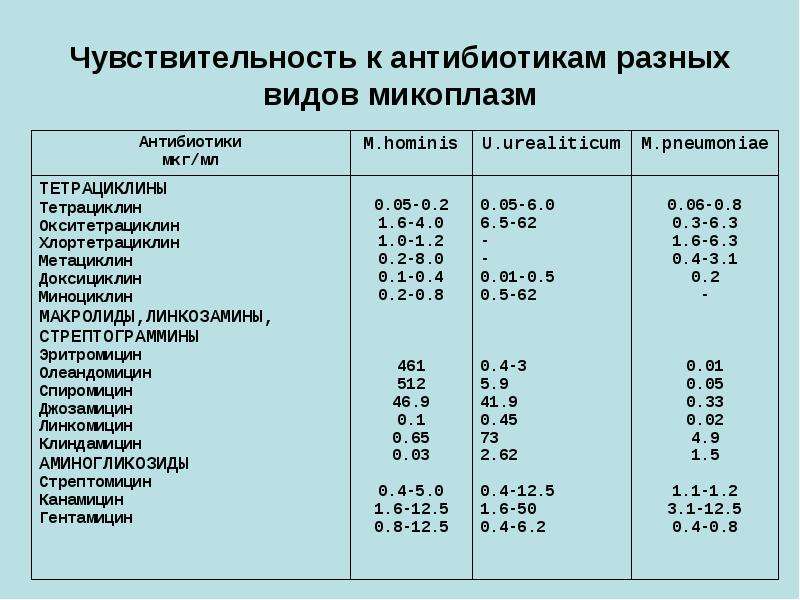 Хорошо известно, что у M. pneumoniae развилась устойчивость к макролидам посредством точечных мутаций, приводящих к переходам от A к G в петле пептидилтрансферазы домена V гена 23S рРНК в положениях 2063 и 2064, что снижает сродство макролида к рибосома. Вероятность того, что M. pneumoniae разовьет устойчивость к макролидам по этому механизму в естественных условиях, может быть увеличена, поскольку в геноме M. pneumoniae имеется только один оперон рРНК [70].В настоящее время идентификация этих устойчивых штаммов зависит от длительных и трудоемких процедур, таких как полиморфизм длины рестрикционных фрагментов, исследования MIC и анализ последовательности.
Хорошо известно, что у M. pneumoniae развилась устойчивость к макролидам посредством точечных мутаций, приводящих к переходам от A к G в петле пептидилтрансферазы домена V гена 23S рРНК в положениях 2063 и 2064, что снижает сродство макролида к рибосома. Вероятность того, что M. pneumoniae разовьет устойчивость к макролидам по этому механизму в естественных условиях, может быть увеличена, поскольку в геноме M. pneumoniae имеется только один оперон рРНК [70].В настоящее время идентификация этих устойчивых штаммов зависит от длительных и трудоемких процедур, таких как полиморфизм длины рестрикционных фрагментов, исследования MIC и анализ последовательности.
Вольф [71] и др. . описывают ПЦР в реальном времени и анализ расплава с высоким разрешением для быстрого обнаружения штаммов, устойчивых к макролидам, в M. pneumoniae . Фторхинолоны [72] могут проявлять антимикоплазменную активность против макролидных и тетрациклинорезистентных штаммов M. pneumoniae из-за их механизма действия и отличного проникновения в ткань легких, особенно в бронхиальный секрет.
pneumoniae из-за их механизма действия и отличного проникновения в ткань легких, особенно в бронхиальный секрет.
Однако, несмотря на резистентность к макролидам, клиническая неудача маловероятна. Судзуки [73] и др. . сравнили клинические исходы у 11 пациентов, устойчивых к макролидам, и 26 пациентов, чувствительных к макролидам, которые получали терапию макролидами. У устойчивой группы было больше лихорадочных дней во время начальной терапии макролидами, чем у восприимчивых пациентов. Но у пациентов, резистентных к макролидам, не было сообщений о явной неудаче лечения или серьезных заболеваниях.Это можно объяснить иммуномодулирующим действием макролидов.
Исследуемый агент цетромицин также показал отличную активность против M. pneumoniae in vitro с МИК ниже [74], чем у макролидов. Он принадлежит к семейству кетолидов, новому классу антибиотиков, производных от макролидов. Однако исследований in vivo с участием этого агента против M. pneumoniae не проводились. Пока не удалось достичь консенсуса относительно продолжительности терапии макролидами, и описаны схемы лечения, охватывающие от одной до трех недель.Наиболее широко используются азитромицин 10 мг / кг / день, суточная доза не превышает 500 мг / доза в течение пяти дней, и кларитромицин 15 мг / кг / день, разделенные на две дозы, не превышающие 500 мг / доза в течение 10-15 дней 4 .
pneumoniae не проводились. Пока не удалось достичь консенсуса относительно продолжительности терапии макролидами, и описаны схемы лечения, охватывающие от одной до трех недель.Наиболее широко используются азитромицин 10 мг / кг / день, суточная доза не превышает 500 мг / доза в течение пяти дней, и кларитромицин 15 мг / кг / день, разделенные на две дозы, не превышающие 500 мг / доза в течение 10-15 дней 4 .
В некоторых недавних исследованиях [75,76] было высказано предположение, что добавление антибиотикопрофилактики к стандартным мерам контроля эпидемии при контактах может быть полезным во время вспышек M. pneumoniae в медицинских учреждениях. Однако при принятии решения об использовании массовой профилактики в закрытых учреждениях необходимо учитывать множество факторов, включая индукцию устойчивости к антибиотикам, стоимость, аллергические реакции и т. Д.
Кортикостероиды могут быть полезны при M. pneumoniae заболевании ЦНС [77], но опыт применения этой терапии ограничен описаниями случаев и небольшими сериями. Сообщается, что плазмаферез эффективен при поперечном миелите и полирадикулите. Также можно рассмотреть возможность введения внутривенных иммунных глобулинов.
Сообщается, что плазмаферез эффективен при поперечном миелите и полирадикулите. Также можно рассмотреть возможность введения внутривенных иммунных глобулинов.
Вакцинация
M. pneumoniae является основной причиной инфекций верхних и нижних дыхательных путей, которые могут привести к тяжелым последствиям, таким как неврологические осложнения.Кроме того, отсутствует естественный защитный иммунитет после первичной инфекции, а также инфицирование M. pneumoniae связано с длительным ношением и склонностью к вспышкам в военных лагерях, школах и больницах. [4] Разработка вакцины также казалась многообещающей с учетом того факта, что этот организм довольно гомогенен в антигенном отношении и, по-видимому, существует некоторая защита от повторного заражения. Таким образом, эффективная вакцина против M. pneumoniae желательна, потому что она не только предотвратила бы тяжелые катастрофические последствия инфекции, такие как энцефалит, но также уменьшила бы более легкие заболевания, вызывающие стресс и потерю рабочего дня, особенно среди солдат, школьников и медицинских работников.В недавнем метаанализе [78] шести клинических испытаний с участием в общей сложности 67 268 субъектов эффективность вакцин против M. pneumoniae специфической пневмонии колебалась между 42% и 54%, когда диагноз был поставлен посевом и серологическим исследованием соответственно. Суммарная эффективность вакцины M. pneumoniae против пневмонии, независимо от этиологии, составила 36%. В этом метаанализе не наблюдалось никаких значительных побочных реакций (включая аутоиммунные эффекты). Инактивированный M.Вакцины pneumoniae могут снизить общую заболеваемость пневмонией и респираторными инфекциями примерно на 40%. Следовательно, определенно существует необходимость в переработке вакцины M. pneumoniae как для условий высокого риска, так и для населения в целом.
ЗАКЛЮЧЕНИЕ
Успехи в обнаружении и характеристике M. pneumoniae с использованием ПЦР, серологии и культуры, дополненные знаниями, полученными из полной последовательности генома этого организма, привели к признанию его роли как патогена человека.Несмотря на эти многочисленные достижения, об этой крошечной бактерии, которая является одной из самых маленьких из всех свободно живущих форм, еще многое неизвестно. Большинство микоплазменных инфекций в клинических условиях никогда не имеют микробиологического диагноза, поскольку быстрые, чувствительные, специфические и недорогие методы недоступны во многих клинических условиях.
На практике серологические тесты — единственный способ широко диагностировать инфекций M. pneumoniae , и этот метод имеет ряд ограничений.Надежный и удобный для пользователя амплифицированный или неамплифицированный метод обнаружения микоплазмы или ее нуклеиновой кислоты в клинических образцах имел бы огромное значение для диагностики и лечения пациентов, для углубления знаний о потенциальной роли в хронических заболеваниях легких.
Сноски
Источник поддержки: Нет
Конфликт интересов: Не объявлен.
СПИСОК ЛИТЕРАТУРЫ
2. Rottem S. Взаимодействие микоплазм с клетками-хозяевами физиологическое.Обзор. 2003; 83: 417–32. [PubMed] [Google Scholar] 3. Манилов Дж. Филогения микоплазм. В: Maniloff J, McElhaney RN, Finch LR, редакторы. Молекулярная биология и патогенез микоплазм. Вашингтон, округ Колумбия: Американское общество микробиологии; 1992. С. 549–59. [Google Scholar] 5. Фой Х.М., Куни М.К., МакМахан Р., Грейстон Дж. Т.. Вирусная и микоплазменная пневмония в группе предоплаченных врачей в течение восьми лет. Am J Epidemiol. 1973; 97: 93–102. [PubMed] [Google Scholar] 6. Аткинсон Т.П., Балиш М.Ф., Уэйтс КБ.Эпидемиология, клинические проявления, патогенез и лабораторное выявление Mycoplasma pneumoniae инфекций. FEMS Microbiol Rev.2008; 32: 956–73. [PubMed] [Google Scholar] 7. Линд К., Бензон М.В., Дженсен Дж. С., Клайд В.А., мл. Сероэпидемиологическое исследование инфекций Mycoplasma pneumoniae в Дании за 50-летний период 1946–1995. Eur J Epidemiol. 1997; 13: 581–6. [PubMed] [Google Scholar] 8. Дориго-Зецма Дж. В., Данкерт Дж., Заат С. А.. Генотипирование клинических изолятов Mycoplasma pneumoniae выявило восемь подтипов P1 в двух геномных группах.J Clin Microbiol. 2000; 38: 965–70. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Якобс Э. Mycoplasma pneumoniae проявления болезни и эпидемиология. В: Разин С., Херрман Р., ред. Молекулярная биология и патогенез микоплазм. Нью-Йорк: Kluwer Academic / Plenum Publishers; 2002. С. 519–30. [Google Scholar] 10. Кашьяп Б., Кумар С., Сетхи Г.Р., Дас BC, Сайгал С.Р. Сравнение ПЦР, посевов и серологических тестов для диагностики Mycoplasma pneumoniae при внебольничных инфекциях нижних дыхательных путей у детей.Индийский J Med Res. 2008; 128: 134–9. [PubMed] [Google Scholar] 11. Bansal S, Kashyap S, Pal LS, Goel A. Клинический и бактериологический профиль внебольничной пневмонии в Шимле, Химачал-Прадеш. Индийский J Chest Dis Allied Sci. 2004; 46: 17–22. [PubMed] [Google Scholar] 12. Шеной В.Д., Упадхьяя С.А., Рао С.П., Шобха К.Л. Mycoplasma pneumoniae Инфекция у детей с острой респираторной инфекцией. J Trop Pediatr. 2005; 51: 232–5. [PubMed] [Google Scholar] 13. Чаудри Р., Назима Н., Дхаван Б., Кабра С.К.Распространенность Mycoplasma pneumoniae и chlamydia pneumoniae у детей с внебольничной пневмонией. Индийский J Pediatr. 1998. 65: 717–21. [PubMed] [Google Scholar] 14. Ферверда А., Молл Х.А., де Гроот Р. Инфекции дыхательных путей от Mycoplasma pneumoniae у детей: обзор диагностических и терапевтических мер. Eur J Pediatr. 2001; 160: 483–91. [PubMed] [Google Scholar] 15. Фой HM, Grayston JT, Kenny GE. Эпидемиология инфекции Mycoplasma pneumoniae в семьях.ДЖАМА. 1966; 197: 859–66. [PubMed] [Google Scholar] 16. Чимолаи Н., Венсли Д., Томас Э. Mycoplasma pneumoniae как кофактор тяжелых респираторных инфекций. Clin Infect Dis. 1995; 21: 1182–5. [PubMed] [Google Scholar] 17. Дей А.Б., Чаудри Р., Кумар П., Нисар Н., Нагаркар К.М. Mycoplasma pneumoniae и внебольничная пневмония. Nat Med J Индия. 2000; 13: 66–70. [PubMed] [Google Scholar] 19. Марстон Б.Дж., Плафф Дж.Ф., File TM, мл., Hackman BA, Salstrom SJ, Lipman HB, et al. Заболеваемость внебольничной пневмонией, требующей госпитализации: результаты активного эпиднадзора среди населения в Огайо: группа изучения заболеваемости пневмонией на уровне общины.Arch Intern Med. 1997; 157: 1709–18. [PubMed] [Google Scholar] 20. Vervloet LA, Marguet C, Camargos PA. Заражение Mycoplasma pneumoniae и его значение в качестве этиологического агента в детских сообществах, приобретенных пневмониями. Braz J Infect Dis. 2007; 11: 507–14. [PubMed] [Google Scholar] 21. Касселл Г. Х., Клайд В. А., младший, Дэвис Дж. Микоплазменные респираторные инфекции. В кн .: Разин С, Бариле М.Ф., ред. Микоплазма. Vol. 4. Нью-Йорк: Academic Press; 1985. С. 65–106. [Google Scholar] 22. Кунтурас Д., Дойч М., Эммануэль Т., Георгиадис Г., Коскинас Дж.Фульминантная инфекция Mycoplasma pneumoniae с поражением нескольких органов: отчет о клиническом случае. Eur J Intern Med. 2003. 14: 329–31. [PubMed] [Google Scholar] 24. Колецкий RJ, Вайнштейн AJ. Фульминантная инфекция Mycoplasma pneumoniae : отчет о летальном случае и обзор литературы. Am Rev Respir Dis. 1980; 122: 491–6. [PubMed] [Google Scholar] 25. Леонарди С., Павоне П., Ротоло Н., Ла Роса М. Инсульт у двух детей с инфекцией Mycoplasma pneumoniae : случайная или причинная связь? Педиатр Infect Dis J.2005; 24: 843–5. [PubMed] [Google Scholar] 26. Guleria R, Nisar N, Chawla TC, Biswas NR. Mycoplasma pneumoniae и осложнения со стороны центральной нервной системы: обзор. J Lab Clin Med. 2005. 146: 55–63. [PubMed] [Google Scholar] 27. Циодрас С., Келесидис I, Келесидис Т., Стамбулис Э., Джамареллоу Х. Проявления Mycoplasma pneumoniae инфекций в центральной нервной системе. J Infect. 2005; 51: 343–54. [PubMed] [Google Scholar] 28. Санчес-Варгас FM, Гомес-Дуарте О.Г. Обзор Mycoplasma pneumoniae : возникающий внелегочный патоген.Clin Microbiol Infect. 2008; 14: 105–15. [PubMed] [Google Scholar] 29. Левин Д.П., Лемер А.М. Клинический спектр инфекций Mycoplasma pneumoniae . Med Clin North Am. 1978; 62: 961–78. [PubMed] [Google Scholar] 30. Ванфлетерен И., Ван Гизель Д., Де Брандт С. Синдром Стивенса-Джонсона: диагностическая проблема при отсутствии повреждений кожи. Педиатр Дерматол. 2003. 20: 52–6. [PubMed] [Google Scholar] 31. Yong-Kwang T, Clark Huff J, Wilfiam L. Weston Инфекция Mycoplasma pneumoniae связана с синдромом Стивенса-Джонсона, а не с мультиформной эритемой.J Am Acad Dermatol. 1996. 35: 757–60. [PubMed] [Google Scholar] 32. Латч К., Гиршик Х. Дж., Абеле-Хорн М. Синдром Стивенса-Джонсона без поражения кожи. J Medical Microbiol. 2007; 56: 1696–9. [PubMed] [Google Scholar] 33. Йозеф Д. Шварцмайер: потенциально смертельное осложнение инфекции Mycoplasma pneumoniae : гемофагоцитарный синдром. Дыхание. 2002; 69: 14–5. [PubMed] [Google Scholar] 34. Джаянта Великобритания. Mycoplasma pneumoniae инфекция в Шри-Ланке. Шри-Ланка J Здоровье детей.2007; 36: 43–7. [Google Scholar] 35. Zou CC. Множественные гипоэхогенные поражения селезенки и Mycoplasma pneumoniae инфекция. Indian Paediatr. 2005; 42: 379–82. [PubMed] [Google Scholar] 36. Blasi F, Tarsia P, Aliberti S, Cosentini R, Allegra L. Chlamydia pneumoniae и Mycoplasma pneumoniae . Semin Respir Critical Care Med. 2005; 26: 617–24. [PubMed] [Google Scholar] 37. Смит Р., Эвиатар Л. Неврологические проявления Mycoplasma pneumoniae инфекций: разнообразный спектр заболеваний: отчет о шести случаях и обзор литературы.Clin Pediatr. 2000; 39: 195–201. [PubMed] [Google Scholar] 38. Вен У. С., Пэн С. С., Ван С. Б., Чжоу Ю. Т., Ли В. Т.. Mycoplasma pneumoniae — поперечный миелит и рабдомиолиз, ассоциированные с заболеванием. Pediatr Neurol. 2009; 40: 128–30. [PubMed] [Google Scholar] 40. Puljiz I, Kuzman I., Dakovic-Rode O, Schönwald N, Mise B. Chlamydia pneumonia и Mycoplasma pneumoniae pneumonia: Сравнение клинических, эпидемиологических характеристик и лабораторных профилей. Эпидемиол Инфекция. 2006. 134: 548–55. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41.Исида Т., Мияшита Н., Накахама С. Клиническая дифференциация атипичной пневмонии с использованием японских руководств. Респирология. 2007; 12: 104–10. [PubMed] [Google Scholar] 42. Нисар Н., Гулерия Р., Кумар С., Чанд Чавла Т., Ранджан Бисвас Н. Mycoplasma pneumoniae и ее роль при астме. Postgrad Med J. 2007; 83: 100–4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Либерман Д., Либерман Д., Принц С., Бен-Яаков М., Лазарович З., Охана Б. и др. Атипичный возбудитель инфекции у взрослых при обострении бронхиальной астмы.Am J Respir Crit Care Med. 2003. 167: 406–10. [PubMed] [Google Scholar] 44. Biscardi S, Lorrot M, Marc E, Moulin F, Boutonnat-Faucher B, Heilbronner C и др. Mycoplasma pneumoniae и астма у детей. Clin Infect Dis. 2004; 38: 1341–6. [PubMed] [Google Scholar] 45. Мартин Р.Дж., Крафт М., Чу Х.В., Бернс Э.А., Касселл Г.Х. Связь между хронической астмой и хронической инфекцией. J Allergy Clin Immunol. 2001; 107: 595–601. [PubMed] [Google Scholar] 46. Крафт М., Касселл Г.Х., Пак Дж., Мартин Р.Дж. Mycoplasma pneumoniae и C.pneumoniae при астме: эффект кларитромицина. Грудь. 2002; 121: 1782–8. [PubMed] [Google Scholar] 47. Варшней А.К., Чаудри Р., Сахаран С., Кабра С.К., Дхаван Б., Дар Л. и др. Ассоциация Mycoplasma pneumoniae и астмы среди индийских детей. FEMS Immunol Med Microbiol. 2009. 56: 25–31. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Nei T, Yamano Y, Sakai F, Kudoh S. Mycoplasma pneumoniae пневмония: Дифференциальный диагноз с помощью компьютерной томографии. Intern Med. 2007; 46: 1083–7.[PubMed] [Google Scholar] 49. Daxboeck F, Krause R, Wenisch C. Лабораторная диагностика инфекции Mycoplasma pneumoniae . Clin Microbial Infect. 2003; 9: 263–73. [PubMed] [Google Scholar] 50. Талли Дж. Г., Роуз Д. Л., Уиткомб Р. Ф., Венцель Р. П.. Усиленная изоляция Mycoplasma pneumoniae из смывов горла с использованием недавно модифицированной культуральной среды. J Infect Dis. 1979; 139: 478–82. [PubMed] [Google Scholar] 51. Гавранич Дж.Б., Чанг А.Б. Антитела к внебольничным инфекциям нижних дыхательных путей, вторичным по отношению к M.pneumoniae у детей. Кокрановская база данных Syst Rev.2005; 3: CD004875. [PubMed] [Google Scholar] 52. Маргарет Р. Хаммершлаг Mycoplasma pneumoniae инфекций. Curr Opin Infect Dis. 2001; 14: 181–6. [PubMed] [Google Scholar] 53. Линд К., Линдхардт Б.О., Шуттен Х.Д., Блом Дж., Кристиансен С. Серологические перекрестные реакции между M. genitalium и M. pneumoniae . J Clin Microbiol. 1984; 20: 1036–43. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Андреу Л.М., Молинос А.С., Фернандес Р.Г., Гонсалес С.В., Аусина Р.В.Серологический диагноз Mycoplasma pneumoniae инфекций. Enferm Infect Microbiol Clin. 2006; 24: 19–23. [PubMed] [Google Scholar] 55. Лоенс К., Урси Д., Гуссенс Х., Ивен М. Молекулярная диагностика Mycoplasma pneumoniae инфекций дыхательных путей. J Clin Microbiol. 2003; 41: 4915–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Микелоу И.К., Олсен К., Лозано Дж., Даффи Л. Б., Маккракен Г. Х., Харди Р. Д.. Диагностическая ценность и клиническое значение образцов из носа и ротоглотки, использованных в ПЦР-анализе для диагностики Mycoplasma pneumoniae инфекции у детей с внебольничной пневмонией.J Clin Microbiol. 2004. 42: 3339–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Гнарпе Дж, Лундбак А, Сунделоф Б, Гнарпе Х. Распространенность Mycoplasma pneumoniae у субъективно здоровых людей. Scand J Infect Dis. 1992; 24: 161–4. [PubMed] [Google Scholar] 58. Резников М, Блэкмор Т.К., Финлей-Джонс Дж.Дж., Гордон Д.Л. Сравнение аспиратов из носоглотки и мазков из зева в тесте на основе полимеразной цепной реакции для Mycoplasma pneumonia . Eur J Clin Microbiol Infect Dis.1995; 14: 58–61. [PubMed] [Google Scholar] 59. Дориго-Зетсма Дж. В., Веркоойен Р. П., Ван Хелден Х. П., ван дер Нат Х., ван ден Бош Дж. М.. Молекулярное обнаружение Mycoplasma pneumoniae у взрослых с ВП, требующих госпитализации. J Clin Microbiol. 2001; 39: 1184–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хардеггер Д., Надаль Д., Боссарт В., Альтвегг М., Датли Ф. Быстрое обнаружение Mycoplasma pneumoniae в клинических образцах с помощью ПЦР в реальном времени. J Microbiol Methods. 2000; 41: 45–51. [PubMed] [Google Scholar] 61.Лоенс К., Бек Т., Урси Д., Овердейк М., Силлекенс П., Гуссенс Х. и др. Разработка мультиплексной амплификации на основе последовательностей нуклеиновых кислот в реальном времени для обнаружения M. pneumoniae, C. pneumoniae и видов Legionella в респираторных образцах. J Clin Microbiol. 2008. 46: 185–91. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Файл TM, Jr, Tan JS, Plouffe JF. Роль атипичных возбудителей: Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella pneumophilia в респираторной инфекции.Заражение Dis Clin North Am. 1998; 12: 569–92. [PubMed] [Google Scholar] 63. Тейлор-Робинсон Д., Бебир С. Чувствительность микоплазм к антибиотикам и лечение микоплазменных инфекций. J Antimicrob Chemother. 1997; 40: 622–30. [PubMed] [Google Scholar] 64. Ямагути Т., Хираката Ю., Изумикава К., Миядзаки Ю., Маэсаки С., Томоно К. и др. Активность телитромицина (HMR3647) in vitro: новый кетолид против клинических изолятов Mycoplasma pneumoniae в Японии. Антимикробные агенты Chemother. 2000; 44: 1381–2.[Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Даффи Л.Б., Крабб Д., Сирси К., Кемпф М.С. Сравнительная эффективность гемифлоксацина, новых хинолонов, макролидов, тетрациклина и клиндамицина против видов Mycoplasma. J Antimicrob Chemother. 2000; 45: с29–33. [PubMed] [Google Scholar] 66. Принципи Н., Эспозито С. Возникающая роль Mycoplasma pneumoniae и Chlamydia pneumoniae в инфекциях дыхательных путей у детей. Lancet Infect Dis. 2001; 1: 334–44. [PubMed] [Google Scholar] 67.Принципи Н., Эспозито С., Блази Ф., Аллегра Л. Группа изучения Маугли. Роль Mycoplasma pneumoniae и Chlamydia pneumoniae у детей с внебольничными инфекциями LRT. Clin Infect Dis. 2001; 32: 1281–9. [PubMed] [Google Scholar] 68. Морозуми М., Хасэгава К., Кобаяси Р., Иноуэ Н., Ивата С., Куроки Х. и др. Появление устойчивой к вмакролиду Mycoplasma pneumoniae с мутацией гена 23S рРНК. Антимикробные агенты Chemother. 2005; 49: 2302–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69.Мацуока М., Нарита М., Окадзаки Н., Ойя Х., Ямадзаки Т., Оучи К. и др. Характеристика и молекулярный анализ клинических изолятов Mycoplasma pneumoniae , устойчивых к макролидам, полученных в Японии. Противомикробные агенты Chemother. 2004; 48: 4624–30. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Гобель Ю., Батлер Г. Х., Стэнбридж Э. Дж. Сравнительный анализ оперонов микоплазменных рибосомных РНК. Isr J Med Sci. 1984; 20: 762–4. [PubMed] [Google Scholar] 71. Вольф Б.Дж., Такер В.Л., Шварц С.Б., Винчелл Дж. М..Определение устойчивости к макролидам у M. pneumoniae с помощью ПЦР в реальном времени и анализа расплава с высоким разрешением. Антимикробные агенты Chemother. 2008; 52: 3542–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Hamamoto K, Shimizu T., Fujimoto N, Zhang Y, Arai S. In vitro активности моксифлоксацина и других фторхинолонов против M. pneumoniae . Антимикробные агенты Chemother. 2001; 45: 1908–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Сузуки С., Ямакази Т., Нарита М., Окадзаки Н., Сузуки И., Андох Т. и др.Клиническая оценка устойчивости к макролидам M. pneumoniae . Антимикробные агенты Chemother. 2006; 50: 709–12. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Уэйтс КБ, Крабб Д.М., Даффи Л.Б. In vitro активности ABT-773 и других противомикробных препаратов против микоплазм человека. Антимикробные агенты Chemother. 2003; 47: 39–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Центры по контролю и профилактике заболеваний. Вспышка ВП, вызванная M. pneumoniae: Колорадо. ДЖАМА. 2000; 285: 2073–4.[PubMed] [Google Scholar] 76. Hyde TB, Gilbert M, Schwartz SB, Zell ER, Watt JP, Thacker WL, et al. Профилактика азитромицином во время госпитальной вспышки M. pneumoniae пневмонии. J Infect Dis. 2001; 183: 907–12. [PubMed] [Google Scholar] 77. Даксбок Ф. Mycoplasma pneumoniae Инфекции ЦНС. Curr Opin Neurol. 2006; 19: 374–8. [PubMed] [Google Scholar] 78. Линчевски И., Клменет Э., Нир-Паз Р. Mycoplasma pneumoniae , защитная эффективность вакцины и побочные реакции: системный обзор и метаанализ.Vaccine. 2009;27:2437–46. [PubMed] [Google Scholar]Gene and cytokine profile analysis of macrolide-resistant Mycoplasma pneumoniaeinfection in Fukuoka, Japan | BMC Infectious Diseases
Ishida K, Kaku M, Irifune K, Mizukane R, Takemura H, Yoshida R, Tanaka H, Usui T, Suyama N, Tomono K, Ishida K, Kaku M, Irifune K, Mizukane R, Takemura H, Yoshida R, Tanaka H, Usui T, Suyama N, Tomono K: In vitro and in vivo activities of macrolides against Mycoplasma pneumoniae. Anti Agents Chem.1994, 38: 790-798. 10.1128 / AAC.38.4.790.
CAS Статья Google Scholar
Окадзаки Н., Нарита М., Ямада С., Изумикава К., Умецу М., Кенри Т., Сасаки Ю., Аракава Ю., Сасаки Т.: Характеристики устойчивых к макролидам штаммов Mycoplasma pneumoniae, выделенных от пациентов и индуцированных эритромицином in vitro. . Micro Im. 2001, 45: 617-620. 10.1111 / j.1348-0421.2001.tb01293.x.
CAS Статья Google Scholar
Cao B, Zhao CJ, Yin YD, Zhao F, Song SF, Bai L, Zhang JZ, Liu YM, Zhang YY, Wang H, Wang C: высокая распространенность устойчивости к макролидам у изолятов Mycoplasma pneumoniae от взрослых и подростков. с инфекцией дыхательных путей в Китае. Clin Infect Dis. 2010, 51: 189-194. 10.1086 / 653535.
CAS Статья PubMed Google Scholar
Кавай Й, Мияшита Н., Кубо М, Акаике Х, Като А, Нишизава Й, Сайто А, Кондо Е., Тераниши Х, Вакабаяси Т, Огита С., Танака Т, Кавасаки К., Накано Т, Терада К. , Ouchi K: Общенациональное наблюдение за устойчивой к макролидам инфекцией Mycoplasma pneumoniae у педиатрических пациентов.Anti Agents Chem. 2013, 57: 4046-4069. 10.1128 / AAC.00663-13.
CAS Статья Google Scholar
Hong KB, Choi EH, Lee HJ, Lee SY, Cho EY, Choi JH, Kang HM, Lee J, Ahn YM, Kang YH, Lee JH: Устойчивость Mycoplasma pneumoniae к макролидам, Южная Корея, 2000– 2011 г. Emerg Infect Dis. 2013, 19: 1281-1284. 10.3201 / eid1908.121455.
Артикул PubMed PubMed Central Google Scholar
Pereyre S, Charron A, Renaudin H, Bébéar C, Bébéar CM: первый отчет о штаммах, устойчивых к макролидам, и описание новой вариации нуклеотидной последовательности в гене адгезина P1 в клинических штаммах Mycoplasma pneumoniae, выделенных во Франции в течение 12 лет. J Clin Microbiol. 2007, 45: 3534-3549. 10.1128 / JCM.01345-07.
CAS Статья PubMed PubMed Central Google Scholar
Вольф Б.Дж., Такер В.Л., Шварц С.Б., Винчелл Дж.М.: Определение устойчивости к макролидам у Mycoplasma pneumoniae с помощью ПЦР в реальном времени и анализа расплава с высоким разрешением.Anti Agents Chem. 2008, 52: 3542-3549. 10.1128 / AAC.00582-08.
CAS Статья Google Scholar
Думке Р., фон Баум Х., Лак П.С., Якобс Э.: Появление макролид-устойчивого штамма Mycoplasma pneumoniae в Германии. Clin Microbiol Infect. 2010, 16: 613-616. 10.1111 / j.1469-0691.2009.02968.x.
CAS Статья PubMed Google Scholar
Ямада М., Буллер Р., Бледоз С., Сторч Г.А.: Рост показателей устойчивости к макролидам Mycoplasma pneumoniae в центральной части США. Pediatr Infect Dis J. 2012, 31: 409-411. 10.1097 / INF.0b013e318247f3e0.
Артикул PubMed Google Scholar
Эшаги А., Мемари Н., Тан П., Ольша Р., Фаррелл Д. Д., Лоу DE, Губбай Дж. Б., Патель С. Н.: Макролид-резистентная Mycoplasma pneumoniae у людей, Онтарио, Канада, 2010–2011 гг.Emerg Infect Dis. 2013, 19: 1525-1527.
Артикул PubMed Central Google Scholar
Мацуока М., Нарита М., Окадзаки Н., Охя Х, Ямадзаки Т., Оучи К., Сузуки И., Андох Т., Кенри Т., Сасаки И., Хорино А., Синтани М., Аракава Ю., Сасаки Т.: характеристика и молекулярный анализ устойчивых к макролидам клинических изолятов Mycoplasma pneumoniae , полученных в Японии. Anti Agents Chem. 2004, 48: 4624-4630. 10.1128 / AAC.48.12.4624-4630.2004.
CAS Article Google Scholar
Morozumi M, Hasegawa K, Kobayashi R, Inoue N, Iwata S, Kuroki H, Kawamura N, Nakayama E, Tajima T, Shimizu K, Ubukata K: Emergence of macrolide-resistant Mycoplasma pneumoniae with a 23S rRNA gene mutation. Anti Agents Chem. 2005, 49: 2302-2306. 10.1128/AAC.49.6.2302-2306.2005.
CAS Article Google Scholar
Suzuki Y, Itagaki T, Seto J, Kaneko A, Abiko C, Mizuta K, Matsuzaki Y: Вспышка устойчивой к макролидам микоплазмы Mycoplasma pneumoniae в общинах в Ямагате, Япония, в 2009 году. Pediatr Infect Dis J. 2012, 32: 237-240.
Google Scholar
Bellau-Pujol S, Vabret A, Legrand L, et al: Разработка трех множественных анализов RT-PCR для обнаружения 12 респираторных РНК-вирусов. J Virol Methods. 2005, 126: 53-63. 10.1016 / j.jviromet.2005.01.020.
CAS Статья PubMed Google Scholar
Gröndahl B, Puppe W, Hoppe A, Kühne I., Weigl JA, Schmitt HJ: Быстрая идентификация девяти микроорганизмов, вызывающих острые инфекции дыхательных путей, с помощью однотрубной мультиплексной ПЦР с обратной транскрипцией: технико-экономическое обоснование. J Clin Microbiol. 1999, 37: 1-7.
PubMed PubMed Central Google Scholar
Люсьер Т.С., Хейтцман К., Лю С.К., Ху П.С.: Переходные мутации в 23S рРНК эритромицин-резистентных изолятов Mycoplasma pneumoniae . Anti Agents Chem. 1995, 39: 2770-2773. 10.1128 / AAC.39.12.2770.
CAS Статья Google Scholar
Нарита М., Окадзаки Н., Охия Х., Исида Т., Мияшита Н., Ямадзаки Т., Ивата С., Каку М., Сасаки Т.: Предлагаемая контрольная точка антибиотика для клинических изолятов микоплазмы пневмонии в отношении макролидных и линкозамидных антибиотиков.Jpn J Mycoplasmol. 2008, 35: 59-60. На японском языке
CAS Google Scholar
Морозуми М., Ивата С., Хасегава К., Чиба Н., Такаянаги Р., Мацубара К., Накаяма Е., Сунакава К., Убуката К.: Группа исследования острых респираторных заболеваний Повышенная устойчивость к макролидам у пациентов с микоплазмой пневмонии у детей внебольничная пневмония. Anti Agents Chem. 2008, 52: 348-350. 10.1128 / AAC.00779-07.
CAS Статья Google Scholar
Lin C, Li S, Sun H, Zhao H, Feng Y, Cao L, Yuan Y, Zhang T: вложенный ПЦР-связанный капиллярный электрофорез и однонитевые конформационные полиморфизмы для выявления макролид-устойчивых Mycoplasma pneumoniae в Пекине, Китай. J Clin Microbiol. 2010, 48: 4567-4572. 10.1128 / JCM.00400-10.
CAS Статья PubMed PubMed Central Google Scholar
Dégrange S, Cazanave C, Charron A, Renaudin H, Bébéar C, Bébéar CM: Разработка анализа тандемных повторов с переменным числом множественных локусов для молекулярного типирования Mycoplasma pneumoniae.J Clin Microbiol. 2009, 47: 914-923. 10.1128 / JCM.01935-08.
Артикул PubMed PubMed Central Google Scholar
Fujii S, Akiyama M, Aoki K, Sugaya Y, Higuchi K, Hiraoka M, Miki Y, Saitoh N, Yoshiyama K, Ihara K, Seki M, Ohtsubo E, Maki H: ошибки репликации ДНК, вызванные репликативный аппарат Escherichia coli. J Mol Biol. 1999, 289: 835-850. 10.1006 / jmbi.1999.2802.
CAS Статья PubMed Google Scholar
Spaucens EB, Hoogenboezem T, Sluijter M, Hartwig NG, van Rossum AM, Vink C: Определение устойчивости к макролидам и молекулярное типирование Mycoplasma pneumoniae с помощью пиросеквенирования. J Microbiol Methods. 2010, 82: 214-222. 10.1016 / j.mimet.2010.06.004.
CAS Статья PubMed Google Scholar
Нарита М., Танака Х., Ямада С., Абэ С., Арига Т., Сакияма Ю.: Значительная роль интерлейкина-8 в патогенезе легочного заболевания, вызванного инфекцией Mycoplasma pneumoniae.Clin Diagn Lab Immunol. 2001, 8: 1028-1030.
CAS PubMed PubMed Central Google Scholar
Танака Х, Нарита М., Терамото С., Сайкай Т., Оаши К., Игараши Т., Эйб С. Роль интерлейкина-18 и цитокинов Т-хелперов 1 типа в развитии пневмонии Mycoplasma pneumoniae у взрослых. Грудь. 2002, 121: 1493-1497. 10.1378 / сундук.121.5.1493.
CAS Статья PubMed Google Scholar
Морозуми М., Такахаши Т., Убуката К.: Устойчивые к макролидам Mycoplasma pneumoniae: характеристики изолятов и клинические аспекты внебольничной пневмонии. J Infect Chemother. 2010, 16: 78-86. 10.1007 / s10156-009-0021-4.
Артикул PubMed Google Scholar
Сузуки С., Ямадзаки Т., Нарита М., Окадзаки Н., Сузуки И., Андох Т., Мацуока М., Кенри Т., Аракава Ю., Сасаки Т.: Клиническая оценка макролидорезистентного Mycoplasma pneumoniae .Anti Agents Chem. 2006, 50: 709-712. 10.1128 / AAC.50.2.709-712.2006.
CAS Статья Google Scholar
Нарита М., Танака Х: Позднее повышение уровня интерлейкина-18 в крови во время пневмонии Mycoplasma pneumoniae. Цитокин. 2012, 59: 18-19. 10.1016 / j.cyto.2012.04.007.
CAS Статья PubMed Google Scholar
Matsubara K, Morozumi M, Okada T., Matsushima T., Komiyama O, Shoji M, Ebihara T., Ubukata K, Sato Y, Akita H, Sunakawa K, Iwata S: сравнительное клиническое исследование чувствительных к макролидам и устойчивые к макролидам инфекции Mycoplasma pneumoniae у педиатрических пациентов.J Infect Chemother. 2009, 15: 380-383. 10.1007 / s10156-009-0715-7.
Артикул PubMed Google Scholar
Положительно взаимодействующие штаммы, которые совместно циркулируют в популяции с сетевой структурой, вызывают циклические эпидемии Mycoplasma pneumoniae
Foy, H.M. Инфекции, вызываемые Mycoplasma pneumoniae , и возможное состояние носительства в различных популяциях пациентов. Clin. Заразить. Дис. 17 , S37 – S46 (1993).
Артикул Google Scholar
Korppi, M., Heiskanen-Kosma., T. & Kleemola, M. Заболеваемость внебольничной пневмонией у детей, вызванной Mycoplasma pneumoniae : серологические результаты проспективного популяционного исследования в первичной медико-санитарной помощи . Respirology 9 , 109–114 (2004).
Артикул Google Scholar
Думке Р. и др. . Оптимизированная серодиагностика Mycoplasma pneumoniae инфекций. Диагн. Microbiol. Заразить. Дис. 73 , 200–203 (2012).
Артикул Google Scholar
Уэйтс, К. Б. и Токингтон, Д. Ф. Mycoplasma pneumoniae и ее роль в качестве патогена для человека. Clin. Microbiol. Ред. 17 , 672–728 (2004).
Артикул Google Scholar
Winchell, J. M. Mycoplasma pneumoniae — Национальная перспектива общественного здравоохранения. Curr. Педиатр. Ред. . 9 (4), https://doi.org/10.2174/157339631130999 (2013).
Chalker, V.J. et al. . Повышенная заболеваемость Mycoplasma pneumoniae инфекцией в Англии и Уэльсе в 2010 г .: многофокусное типирование с тандемным повторением переменных чисел и чувствительность к макролидам. EuroSurveill. 16 (19), 19865 (2011).
Google Scholar
Браун Р. Дж. и др. . Mycoplasma pneumoniae Эпидемиология в Англии и Уэльсе: национальная перспектива. Фронт. Microbiol. 7 , 157, https://doi.org/10.3389/fmicb.2016.00157 (2016).
Артикул PubMed PubMed Central Google Scholar
Jacobs, E. Mycoplasma pneumoniae : теперь в центре внимания клиницистов и эпидемиологов. EuroSurveill 17 , 20084 (2012).
Google Scholar
Nguipdop-Djomo, P. et al . Циклические эпидемии инфекций Mycoplasma pneumoniae в Англии и Уэльсе с 1975 по 2009 год: анализ временных рядов и математическое моделирование. Ланцет 382 , S78, https://doi.org/10.1016/S0140-6736(13)62503-9 (2013).
Артикул Google Scholar
Dorigo-Zetsma, J. W., Dankert, J. & Zaat, S. A. Генотипирование клинических изолятов Mycoplasma pneumoniae выявило восемь подтипов P1 в двух геномных группах. J. Clin. Microbiol. 38 , 965–970 (2000).
CAS PubMed PubMed Central Google Scholar
Pereyre, S. et al. . Распространение Mycoplasma pneumoniae является поликлональным как в эндемичных условиях во Франции, так и в условиях эпидемии в Израиле. PLoS ONE 7 , e38585, https://doi.org/10.1371/journal.pone.0038585 (2012).
ADS CAS Статья PubMed PubMed Central Google Scholar
Dumke, R. & Jacobs, E. Независимый от культуры анализ тандемных повторов с переменным числом и множеством локусов (MLVA) Mycoplasma pneumoniae . J. Microbiol. Методы 86 , 393–396 (2011).
CAS Статья Google Scholar
Симмонс, В. Л. и др. . Штаммы 1 и 2 типа Mycoplasma pneumoniae образуют разные биопленки. Микробиология 159 , 737–747 (2013).
CAS Статья Google Scholar
Kenri, T. et al. . Анализ генотипа клинических штаммов Mycoplasma pneumoniae в Японии в период с 1995 по 2005 гг .: феномен смены типа клинических штаммов M. pneumoniae . J. Med. Microbiol. 57 , 469–475 (2008).
CAS Статья Google Scholar
Kogoj, R. et al. . Генетическое разнообразие и устойчивость к макролидам изолятов Mycoplasma pneumoniae из двух последовательных эпидемий в Словении. евро. J. Clin. Microbiol. Заразить. Дис. 37 , 99–107 (2017).
Артикул Google Scholar
испанцев, Э. Б. и др. . Вариации последовательностей в элементах RepMP2 / 3 и RepMP4 выявляют события внутригеномной гомологичной рекомбинации ДНК в Mycoplasma pneumoniae . Микробиология 155 , 2182–2196 (2009).
CAS Статья Google Scholar
Dumke, R., von Baum, H., Lück, PC & Jacobs, E. Подтипы и варианты Mycoplasma pneumoniae: локальные и временные изменения в Германии 2003–2006 гг. И отсутствие корреляции между генотипом в дыхательные пути и наличие генотип-специфических антител в сыворотках инфицированных пациентов. Epidemiol. Заражение 138 , 1829–1837 (2010).
CAS Статья Google Scholar
Мартинес, М. А. и др. . Идентификация типов и вариантов P1 Mycoplasma pneumoniae во время эпидемии в Чили. J. Med. Microbiol. 59 , 925–929 (2010).
CAS Статья Google Scholar
Чжао, Ф. и др. . Независимое от культуры обнаружение и генотипирование Mycoplasma pneumoniae в клинических образцах из Пекина, Китай. PLoS ONE 10 , e0141702, https://doi.org/10.1371/journal.pone.0141702 (2015).
CAS Статья PubMed PubMed Central Google Scholar
Браун Р. Дж., Холден М. Т., Спиллер О. Б. и Чалкер В. Дж. Разработка схемы мультилокусного типирования последовательностей для молекулярного типирования Mycoplasma pneumoniae . J. Clin. Microbiol. 53 , 3195–3203 (2015).
CAS Статья Google Scholar
Dumke, R. & Jacobs, E. Ответ антител на Mycoplasma pneumoniae : Защита хозяина и влияние на вспышки? Фронт. Microbiol. 7 , 39 (2016).
Артикул Google Scholar
Андерсон Р.М. и Мэй Р. М. Инфекционные болезни человека: динамика и контроль . (Издательство Оксфордского университета, Оксфорд, 1991).
Google Scholar
Клайд, В. А. Клинический обзор типичных инфекций Mycoplasma-Pneumoniae. Clin. Заразить. Дис. 17 , S32 – S36 (1993).
ADS Статья Google Scholar
Фой, Х. М. и др. .Вторые приступы пневмонии, вызванной Mycoplasma pneumoniae . J. Infect. Дис. 135 , 673–677 (1977).
CAS Статья Google Scholar
Ито, И. и др. . Культурно подтверждено Mycoplasma pneumoniae пневмония в Японии: долгосрочное наблюдение в 1979–1999 гг. Epidemiol. Заражение 127 , 365–367 (2001).
CAS Статья Google Scholar
Lind, K. et al. . Сероэпидемиологическое исследование случаев инфицирования Mycoplasma pneumoniae в Демарке за 50-летний период 1946–1995 гг. евро. J. Epidemiol. 13 , 581–586 (1997).
CAS Статья Google Scholar
Килинг, М. Дж. И Рохани, П. Моделирование инфекционных заболеваний у людей и животных . Принстон. Нью-Джерси (Издательство Принстонского университета, США, 2008 г.).
Google Scholar
Омори, Р. и др. . Определитель периодичности в Mycoplasma pneumoniae заболеваемости: выводы из математического моделирования. Sci. Отчет 5 , 14473, https://doi.org/10.1038/SREP14473 (2015).
ADS CAS Статья PubMed PubMed Central Google Scholar
Наката Ю. и Омори Р. Формулировка уравнения задержки для модели эпидемии с ослаблением иммунитета: приложение к Mycoplasma pneumoniae . IFAC-PapersOnLine 48 , 132–135 (2015).
Артикул Google Scholar
Woodhead, M. & Macfarlane, J. Местные руководства по антибиотикам для лечения внебольничной пневмонии у взрослых (ВП): обзор больничной практики Великобритании в 1999 г. J. Antimicrob. Chemother. 46 , 141–143 (2000).
CAS Статья Google Scholar
Морозуми, М. и др. . Повышенная устойчивость к макролидам Mycoplasma pneumoniae у педиатрических пациентов с внебольничной пневмонией. Антимикробные агенты Chemother 52 , 348–350 (2008).
CAS Статья Google Scholar
Чжао, Ф. и др. . Эпиднадзор за устойчивой к макролидам Mycoplasma pneumoniae в Пекине, Китай, с 2008 по 2012 год. Antimicrob.Агенты Chemother. 57 , 1521–1523 (2013).
CAS Статья Google Scholar
Suzuki, Y. et al. . Мутации генов, связанные с устойчивостью к макролидам и генотипированием p1 Mycoplasma pneumoniae , изолированной в Ямагате, Япония, в период с 2004 по 2013 год. Kansenshogaku Zasshi 89 , 16–22 (2015).
Артикул Google Scholar
Моссонг, Дж. и др. . Социальные контакты и модели смешения, имеющие отношение к распространению инфекционных заболеваний. PLoS Med. 5 , e74, https://doi.org/10.1371/journal.pmed.0050074 (2008).
Артикул PubMed PubMed Central Google Scholar
Пастор-Саторрас, Р. и Веспиньяни, А. Распространение эпидемии в безмасштабных сетях. Phys Rev Lett 86 , 3200–3, https: // doi.org / 10.1103 / PhysRevLett.86.3200 (2001).
ADS CAS Статья PubMed Google Scholar
Ватт, Д. Дж. И Строгац, С. Х. Коллективная динамика сетей малого мира. Природа 393 , 440–442 (1998).
ADS CAS Статья Google Scholar
Левенталь, Г. Э., Хилл, А. Л., Новак, М. А., Бонхёффер, С.Эволюция и появление инфекционных заболеваний в теоретической и реальной сети. Нат. Commun. 6 , 6101, https://doi.org/10.1038/ncomms7101 (2015).
ADS CAS Статья PubMed PubMed Central Google Scholar
Дикманн, О., Хестербик, Х. и Бриттон, Т. Математические инструменты для понимания динамики инфекционных заболеваний . (Издательство Принстонского университета, Принстон и Оксфорд, 2013 г.).
MATH Google Scholar
Рожнова, Г. и Нунес, А. Колебания и колебания в простой модели эпидемии. Phys Rev E 79 , 041922 (2009).
ADS MathSciNet CAS Статья Google Scholar
Zhang, X.-S. Цикличность эпидемий в модели эпидемической сети с множеством штаммов SIRS. Теор. Биол. Med. Модель. 13 , 14 (2016).
CAS Статья Google Scholar
Zhang, X.-S. И Цао, К.-Ф. Влияние коинфекций и их одновременная передача на антигенное разнообразие и эпидемический цикл инфекционных заболеваний. BioMed Res. Инт . 375862 , https://doi.org/10.1155/2014/375862 (2014).
Brockmann, D. & Helbing, D. Скрытая геометрия сложных сетевых явлений заражения. Наука 342 , 1337–1342 (2013).
ADS CAS Статья Google Scholar
Данон, Л., Рид, Дж. М., Хаус, Т. А., Вернон, М. К. и Килинг, М. Дж. Социальные сети встреч: характеристика Великобритании. Proc R Soc B 280 , 20131037, https://doi.org/10.1098/rspb.2013.1037 (2013).
Артикул PubMed Google Scholar
Квок, К. О., Коулинг, Б., Вей, В., Райли, С. и Рид, Дж. М. Временные изменения человеческих контактов и количество мест, в которых они происходят: продольное исследование жителей Гонконга. J. R. Soc. Интерфейс 15 , 20170838, https://doi.org/10.1098/rsif.2017.0838 (2018).
Артикул PubMed PubMed Central Google Scholar
Фергюсон, Н., Андерсон, Р. и Гупта, С. Влияние антителозависимого усиления на динамику передачи и устойчивость множественных штаммов патогенов. Proc Natl Acad Sci USA 96 , 790–794 (1999).
ADS CAS Статья Google Scholar
Холстед, С. Б., Махалингам, С., Марович, М. А., Убол, С. и Моссер, Д. М. Внутреннее антитело-зависимое усиление микробной инфекции в макрофагах: регуляция болезни иммунными комплексами. Lancet Infect Dis. 10 , 712–722, https://doi.org/10.1016/S1473-3099(10)70166-3 (2010).
CAS Статья PubMed PubMed Central Google Scholar
Сун, К., Сюй, Б.-П. И Шен, К.-Л. Эффекты бактериальных и вирусных сочетанных инфекций Mycoplasma pneumonia e у детей: аналитический отчет детской больницы Пекина с 2010 по 2014 год. Int. J. Clin. Exp. Med. 8 , 15666–15674 (2015).
PubMed PubMed Central Google Scholar
Циодрас, С. и др. . Проявления Mycoplasma pneumoniae для центральной нервной системы. J. Infect. 51 , 343–354 (2005).
CAS Статья Google Scholar
Goncalves, S., Abramson, G. & Gomes, M. F. C. Колебания в модели SIRS с распределенными задержками. евро. Phys. J. B 81 , 363–371 (2011).
ADS CAS Статья Google Scholar
Бансал, С., Гренфелл, Б. и Мейерс, Л. А. Когда индивидуальное поведение имеет значение: гомогенные и сетевые модели в эпидемиологии. J.R. Soc. Интерфейс 4 , 879–891 (2007).
Артикул Google Scholar
Guclu, H. et al. . Сети социальных контактов и смешивание среди учащихся школ K-12 в Питтсбурге, штат Пенсильвания. PLOS One 11 (3), e0151139, https://doi.org/10.1371 / journal.pone.0151139 (2016).
Иман, Р. Л., Хелтон, Дж. К. и Кэмпбелл, Дж. Э. Подход к анализу чувствительности компьютерных моделей, Часть 1. Введение, выбор входных переменных и предварительная оценка переменных. J. Qual. Technol. 13 , 174–183 (1981).
Артикул Google Scholar
Saltelli, A. et al. . Анализ чувствительности выходных данных модели на основе дисперсии. Расчет и оценка общего индекса чувствительности. Comput Phys Commun. 181 , 259–270 (2010).
MathSciNet CAS МАТЕМАТИКА Google Scholar
Hughes, J. et al. . Преимущества и непредвиденные последствия деэскалации противомикробных препаратов: последствия для программ управления. PLOS ONE 12 , e0171218 (2017).
Артикул Google Scholar
Имс, К. Т. и Килинг, М. Дж. Моделирование динамических и сетевых неоднородностей при распространении болезней, передаваемых половым путем. Proc Natl Acad Sci USA 99 , 13330–13335 (2002).
ADS CAS Статья Google Scholar
Fan, L. et al. . Педиатрические клинические признаки инфекции Mycoplasma pneumoniae связаны с бактериальным генотипом P1. Exp Ther Med 14 , 1892–1898 (2017).
CAS Статья Google Scholar
Всемирный информационный бюллетень «Ожидаемая продолжительность жизни». Cia.gov. https://www.cia.gov/library/publications/the-world-factbook/fields/2102.html, (2012).
R Основная группа R: язык и среда для статистических вычислений. R Фонд статистических вычислений, Вена, Австрия. https://www.r-project.org/ (2016).
Бронхиолит, связанный с Mycoplasma Pneumoniae у младенцев в Сучжоу, Китай, с 2010 по 2012 год
Утверждения
Все эксперименты проводились в соответствии с соответствующими руководящими принципами и правилами Университета Сучжоу.Методы выполнялись в соответствии с утвержденными методическими рекомендациями. Исследование было одобрено Комитетом по медицинской этике Университета Сучжоу (№ Sdfey201005). Перед включением в исследование родители всех участников исследования дали как устное, так и письменное информированное согласие.
Пациенты
Это ретроспективное исследование проводилось с января 2010 года по декабрь 2012 года на педиатрических пациентах в отделении респираторных заболеваний дочерней детской больницы Университета Сучжоу.Диагноз бронхиолита основывался на следующих критериях: 29 . (1) Заболевание возникло в течение двух лет после рождения. (2) Начало было острым, сопровождалось хрипом и одышкой, а также инфекцией верхних дыхательных путей в анамнезе. (3) Пациент пожаловался на беспокойство, учащенное дыхание и частоту сердечных сокращений, симптомы со стороны носа и цианоз. (4) Физикальное обследование выявило распространенное двойное хрип в легких в начале хрипа, сопровождающееся тонкими хрипами или крепитацией.В это исследование были исключены пациенты с врожденным пороком сердца, иммунодефицитом, бронхами или легочной дисплазией.
Сбор образцов мокроты
Носоглоточные выделения были собраны у каждого участника исследования в течение 24 часов после приема лаборантом, как описано ранее. Вкратце, асептический пластиковый катетер для сбора мокроты вводили в ноздрю на глубину примерно 7-8 см до глотки. Примерно 2 мл назофарингеального секрета было собрано путем приложения отрицательного давления.Образец смешивали с 4–8 мл PBS и центрифугировали 10 минут при 300–500 об / мин. Супернатант сливали, осадок смешивали с 4-8 мл PBS и центрифугировали еще 10 минут. Гранулы хранили при -80 ° C до начала испытаний.
Обнаружение и оценка MP-ДНК мокроты
ДНК-лизат (Shanghai Shenyou biotechnology company, Шанхай, Китай) добавляли к осадку мокроты после промывания PBS. Образец нагревали до 95 ° C в течение 10 минут, центрифугировали в течение 5 минут при 12 000 об / мин, а затем собирали супернатант.После извлечения ДНК из образца мокроты ДНК МП детектировали с помощью флуоресцентной ПЦР в реальном времени (BIO-RAD iCycler, США). Установки циклической температуры составляли 93 ° C, 2 мин; 93 ° C, 45 с; 55 ° С, 60 с → 10 циклов; 93 ° C 30 с → 55 ° C, 45 с → 30 циклов. Точка сбора флуоресценции была установлена на 55 ° C, 45 с. Значение C t использовали для количественной оценки результатов количественной ПЦР флуоресценции. Последовательности праймеров и зонда MP показаны в таблице 3. Последовательность связывания зонда располагалась между праймером выше и ниже по течению.Флуоресцентный репортерный краситель на 5′-конце зонда представлял собой 6-карбоксифлуоресцеин (FAM), а гасителем на 3′-конце зонда был 6-карбокситетраметилродамин (TAMRA). Праймеры и зонд были приобретены у Guangzhou Daan Gene Ltd. (Гуанчжоу, Китай). MP-отрицательный образец был определен как имеющий кривую амплификации, которая не была S-образной или значение C t = 30. Оба результата показали, что содержание ДНК MP было ниже предела обнаружения. Положительный образец MP был определен как имеющий S-образную кривую амплификации и значение C t <30.Содержание ДНК в мокроте определяли по следующим критериям. Если образец C <5,00 × 10 2 , содержание ДНК было <2,5 × 10 3 копий гена / мл; если 5,00 × 10 2 ≤ C ≤ 5,00 × 10 8 , содержание ДНК = 5 × 10 3 копий гена / мл; и если C> 5,00 × 10 8 , содержание ДНК было> 5 × 10 3 копий гена / мл.
Таблица 3 Амплификация генов MP , hMPV и hBoVОбнаружение респираторного вируса мокроты
Прямая иммунофлуоресценция использовалась для обнаружения синцитиальной вирусной инфекции (RSV), вируса гриппа A (IVA), вируса гриппа B ( IVB), вирус парагриппа (PIV) I, PIV II, PIV III и аденовирус (ADV).Все наборы для анализа были приобретены в Chemicon (США), и все процедуры окрашивания выполнялись в соответствии с инструкциями производителя. Иммуноокрашенные препараты просматривали с помощью флуоресцентного микроскопа (Leica 020-518.500, Германия).
ЭкстракцияРНК и ПЦР в реальном времени для обнаружения гена метапневмовируса человека (hMPV).
РНКэкстрагировали из образцов мокроты с помощью Trizol (Invitrogen, США). кДНК синтезировали методом обратной транскрипции. Циклические настройки температуры: 94 ° C, 30 с; 55 ° C, 30 с; 68 ° C, 30 с; усиливается на 45 циклов, последний при 68 ° C в течение 7 мин.hMPV анализировали с помощью флуоресцентной ПЦР в реальном времени (BIO-RAD iCycler). Циклические настройки температуры: 94 ° C, 30 с; 56 ° C, 30 с; 72 ° C, 30 с; усиленный, 40 циклов. Последовательности праймеров для hMPV показаны в таблице 3. Экстракция ДНК
и ПЦР в реальном времени для обнаружения гена бокавируса человека (hBoV)
ДНК мокроты экстрагировали, как описано выше, и ДНК hBoV детектировали с помощью флуоресцентной ПЦР в реальном времени. . Циклические настройки температуры: 94 ° C, 30 с; 56 ° C, 30 с; 72 ° C, 30 с; усиливается на 40 циклов.Последовательности праймеров и зонд hBoV показаны в таблице 3.
Статистический анализ
Все данные анализировали с использованием статистического программного обеспечения PASW 20.0 (IBM, США). Сравнение между группами проводилось с использованием критерия хи-квадрат. Для данных, которые не соответствовали условиям критерия хи-квадрат, использовался точный вероятностный критерий Фишера. Данные с ненормальным распределением были выражены как медианы и квартильные диапазоны (M; P25 P75), а различия оценивались с помощью U-критерия Манна-Уитни. P <0,05 считалось значимым.
Лабораторная диагностика инфекции Mycoplasma pneumoniae — Daxboeck — 2003 — Клиническая микробиология и инфекция
Введение
В большинстве исследований 10–30% случаев внебольничной пневмонии вызываются Mycoplasma pneumoniae [1, 2]. Эти случаи составляют менее 10% от случаев инфицирования M. pneumoniae . У большинства пациентов развивается трахеобронхит или заболевание верхних дыхательных путей, и около 15% инфекций остаются бессимптомными [3].
M. pneumoniae пневмония классически называется атипичной пневмонией, проявляющейся как заболевание с постепенным началом, сопровождающееся головной болью, миалгиями, болью в горле и, первоначально, сухим кашлем [4, 5]. Количество лейкоцитов часто нормальное или умеренно повышенное [5, 6]. Однако, хотя эти признаки и симптомы часто связаны с микоплазменной пневмонией, они не обязательно имеют диагностическое значение в данном случае [5]. Недавние исследования подтвердили, что клинических и лабораторных данных недостаточно, чтобы отличить микоплазменную пневмонию от пневмонии, вызванной другими патогенами [1, 7, 8].Следовательно, правильный этиологический диагноз во многом зависит от лабораторного диагноза.
M. pneumoniae пневмония наиболее распространена у детей и молодых людей [3, 9], а у детей младшего возраста наблюдается самая высокая частота приступов [10]. Напротив, возбудитель редко наблюдается у пожилых людей [11]. Эпидемии инфекции M. pneumoniae происходят каждые 3–7 лет [3]. Примечательно, что в нескольких исследованиях была обнаружена низкая частота микоплазменной пневмонии у пациентов с ослабленным иммунитетом [12, 13].Однако опубликованы сообщения о случаях тяжелой микоплазменной пневмонии у пациентов с нарушением иммунной функции [14–16]. На сегодняшний день не обнаружено индивидуальных факторов риска пневмонии M. pneumoniae . Таким образом, полезность диагностики микоплазм не ограничивается определенными группами пациентов. Однако пациенты с клинически тяжелой пневмонией, особенно после неэффективного лечения β -лактамными антибиотиками, с наибольшей вероятностью получат пользу от комплексной диагностики микоплазм и последующей адекватной антимикробной терапии.
M. pneumoniae пневмония обычно характеризуется доброкачественным исходом даже в случаях отсутствия адекватной противомикробной терапии. Был продемонстрирован положительный эффект адекватного лечения с точки зрения сокращения течения болезни [7, 17], но были опубликованы и противоречивые данные [18]. В настоящее время принято считать, что адекватное лечение показано в микробиологически подтвержденных случаях M. pneumoniae пневмонии [19].Текущие терапевтические варианты, в частности, включают макролиды, доксициклин и новые хинолоны, например левофлоксацин и моксифлоксацин, тогда как возбудитель проявляет первичную устойчивость к антимикробным агентам, действующим на клеточную стенку, например β -лактамные антибиотики.
Внелегочные проявления инфекции, вызванной M. pneumoniae , встречаются реже, чем заболевание дыхательных путей, но часто опасны для жизни. Неврологические и сердечные поражения наблюдаются у 6–7% и до 5% госпитализированных пациентов соответственно [20].Кроме того, могут быть поражены суставы и эритроциты [21, 22]. Этот обзор суммирует текущее состояние диагностики M. pneumoniae с акцентом на молекулярные подходы. Обсуждается значение различных методов для рутинной диагностики и исследовательских целей.
Серология
Серология — важный инструмент для диагностики инфекции M. pneumoniae . Преобладающая роль серологии в рутинной диагностике частично объясняется простотой сбора образцов и широкой доступностью серологических тестов.Однако, что касается окончательного доказательства причинной роли M. pneumoniae в данном эпизоде пневмонии, серология далеко не заменяется прямым обнаружением патогенов.
До появления более совершенных серологических методов обнаружение холодовых агглютининов считалось ценным инструментом для диагностики M. pneumoniae . Образование холодовых агглютининов является первым гуморальным ответом на M. pneumoniae [23]. В течение 6 недель после заражения титр холодовых агглютининов снижается до ранее существовавшего уровня.Определение этих аутоантител выполняется быстро и просто. Однако холодовые агглютинины не являются очень надежным индикатором инфекции M. pneumoniae , так как они повышены только у 50–60% пациентов [24, 25]. Кроме того, они также вызываются различными другими инфекционными агентами, например Вируса Эпштейна – Барра, цитомегаловируса и Klebsiella pneumoniae , а также при злокачественных новообразованиях лимфоидных клеток и аутоиммунных заболеваниях [26].
Еще десять лет назад тест фиксации комплемента (CF) считался стандартом для M.pneumoniae серология. Однако отсутствие чувствительности и специфичности теста CF подробно описано [27, 28]. Антиген, используемый в этом тесте, представляет собой экстракт хлороформ-метанолгликолипид M. pneumoniae , который может подвергаться перекрестным реакциям с человеческими, бактериальными и растительными эпитопами. Например, значительное повышение титра антител наблюдалось у пациентов с бактериальным менингитом, тогда как при иммуноблоттинге не было обнаружено увеличения количества специфических антител [29].Для тестов метаболического ингибирования, которые также были заменены более новыми методами, использовался тот же гликолипидный антиген. Более продвинутой альтернативой CF-тесту является анализ агглютинации микрочастиц (MAG) Serodia Myco II (Fujirebio, Tokyo, Japan) [30]. Принцип этого теста — гемагглютинация специфическими антителами к M. pneumoniae . Эритроциты заменяются частицами латекса, чтобы избежать неспецифических реакций.
Однако ни тест CF, ни MAG не позволяют дифференцировать классы антител, что может привести к задержке постановки диагноза.Уровень специфических антител IgG медленно увеличивается в ходе болезни, достигая пика через 5 недель после появления клинических симптомов. Обычно в течение первой недели болезни не наблюдается измеримого ответа IgG [31]. После инфицирования эти антитела остаются повышенными до 4 лет [3]. Таким образом, низкие, но определяемые уровни антител IgG могут указывать либо на раннюю стадию острой инфекции, либо на перенесенное заболевание. В случае низкого уровня специфического IgG необходимо исследовать второй образец через 2–3 недели, чтобы продемонстрировать значительное повышение титра антител.Поскольку CF-тест и MAG являются субъективными анализами, для постановки диагноза требуется как минимум четырехкратное увеличение титра. Когда имеется сильно повышенный титр, измеренный с помощью теста CF (> 1: 80) или MAG (> 1: 160), диагноз может быть поставлен на основании одного определения антител.
Для быстрой диагностики полезно отдельное определение антител IgM или IgA. Антитела IgM появляются в течение первой недели болезни и достигают пика титров на третьей неделе [31].Они снижаются до низких уровней (ниже порогового значения коммерческих анализов) в течение нескольких месяцев. Основным недостатком диагностики на основе IgM является то, что эти антитела не вырабатываются постоянно у взрослых, скорее всего, в результате нескольких предыдущих инфекций [32]. Следовательно, отрицательный результат на IgM не исключает острую инфекцию M. pneumoniae у пожилых людей. Напротив, было показано, что измерение IgM полезно у педиатрических пациентов [33]. Недавние исследования показали, что определение специфического IgA обеспечивает превосходную диагностическую точность [34].Эти антитела также вырабатываются на ранней стадии заболевания, но их образование происходит более надежно. Анализы для определения IgA и IgM в основном основаны на принципе ELISA. Разные компании предлагают различные наборы для тестирования. Для определения IgM также был разработан быстрый анализ на основе карт (ImmunoCard Mycoplasma , Meridian, Cincinatti, OH, USA) [35].
Основным требованием в отношении специфичности этих тестов ELISA является избежание возможных перекрестных реакций с антителами к Mycoplasma genitalium , виду, наиболее близкому к M.пневмония . Белок MgPa M. genitalium (140 кДа) демонстрирует высокую степень сходства с белком P1 M. pneumoniae (169 кДа) [36]. Оба белка важны для цитоадгезии, а белок P1 также является наиболее мощной иммуногенной детерминантой M. pneumoniae [37]. Повышенные уровни антител к M. genitalium в основном являются результатом урогенитальной инфекции, тогда как роль этого патогена в заболеваниях дыхательных путей полностью не выяснена [38].Для преодоления неспецифических реакций вместо цельнобелковых препаратов можно использовать короткие синтетические пептиды [23]. Изменение антигенного паттерна, например антигенная изменчивость (последовательная экспрессия различных эпитопов во время одного и того же инфекционного эпизода для избежания иммунного ответа хозяина), которая была показана для нескольких видов Mycoplasma , не препятствует серологической диагностике инфекции M. pneumoniae [37].
Метод вестерн-иммуноблоттинга для M.pneumoniae была недавно разработана и коммерчески доступна (Virotech, Rüsselsheim, Германия). Этот метод в настоящее время является наиболее специфичным для обнаружения антител против M. pneumoniae . Более того, он позволяет обнаруживать более низкие уровни антител, чем другие анализы.
Обнаружение специфических антител в спинномозговой жидкости (CSF) дает дополнительную информацию в случаях подозрения на микоплазменное заболевание центральной нервной системы. Недавняя работа показала, что может иметь место интратекальный синтез как минимум антител IgG и IgM к M.pneumoniae [39]. Однако описаны даже случаи, когда в спинномозговой жидкости не обнаруживаются специфические антитела с помощью ПЦР и культивирования [40, 41]. Эти данные подтверждают гипотезу о том, что высокие уровни антител эффективно препятствуют росту организма.
Техника культивирования
Для научных целей культивирование M. pneumoniae в основном проводится с бесклеточными препаратами, такими как Hayflick’s, New York City, Soy Peptone или среда SP-4 [42, 43].Последний препарат, который изначально был разработан для выделения Spiroplasma spp., Является наиболее эффективным. Чтобы избежать чрезмерного роста других патогенов, следует добавить антибиотик широкого спектра действия β -лактам и противогрибковый агент, например пенициллин G (100 000 Ед / мл) и амфотерицин B (0,5 мг / мл). Существует также коммерчески доступная система для культивирования M. pneumoniae (Pneumofast, International Microbic Signes, Франция). Когда необходимо провести изоляцию, решающее значение имеет надлежащая транспортировка клинических образцов в лабораторию.Что наиболее важно, микоплазмы уязвимы для высыхания. В частности, тампоны должны храниться в подходящей транспортной среде, например. триптиказо-соевый бульон с 0,5% бычьим сывороточным альбумином. Время транспортировки должно быть менее 4 часов. Однако, если для транспортировки требуется больше времени, жизнеспособность микоплазм можно поддерживать, выдерживая образцы при температуре около 4 ° C. Когда образцы, содержащие сопутствующую физиологическую флору, отправляются на посев на микоплазмы (например, респираторные образцы), в транспортную среду следует добавить антибиотик широкого спектра действия.
Изоляция M. pneumoniae медленная и нечувствительная, поэтому не рекомендуется для рутинной диагностики. Сложность культивирования Mycoplasma связана с высокими потребностями возбудителя в питательных веществах. Как и все микоплазмы, M. pneumoniae содержит лишь небольшой набор ферментов. Полное секвенирование генома M. pneumoniae показало, что этот патоген обладает 677 предсказанными последовательностями, кодирующими белок, по сравнению с примерно 4000 в Escherichia coli [44]. M. pneumoniae не способна к биосинтезу аминокислот. Кроме того, большинство кофакторов и жирных кислот, а также предшественников нуклеиновых кислот необходимо получать из окружающей среды.
Требуемая продолжительность инкубации сильно зависит от исходного посевного материала и может составлять от 4 дней до нескольких недель. В бульонных культурах рост M. pneumoniae обозначен феноловым красным. Производство кислоты в результате использования бактериями глюкозы приводит к пожелтению бульона.На чашках с агаром небольшие колонии M. pneumoniae имеют типичный гранулированный вид. Однако дифференциация M. pneumoniae от других микоплазм только на основании морфологии колонии невозможна. Присутствие M. genitalium , имеющего сходную морфологию колонии, может привести к ошибочным интерпретациям [45]. Поэтому ранее рекомендовалось использование ацетата таллия, который избирательно препятствует росту M. genitalium , но этого вещества следует избегать из-за его токсичности.С другой стороны, M. genitalium и M. pneumoniae демонстрируют одинаковую чувствительность к антимикробным препаратам [46]. Смеси этих двух видов можно наблюдать в образцах урогенитальной, респираторной и синовиальной жидкости.
Для оценки чувствительности выделения или прямого обнаружения патогенов количество микоплазм выражается в единицах образования колоний (КОЕ), единицах изменения цвета (CCU) или количестве копий. Согласно Harris et al., Одна КОЕ содержит 160 бактериальных клеток., и 10–1000 клеток по Разину [47, 48]. По оценкам, в одной CCU содержится 10–100 организмов. В респираторном секрете во время острой инфекции присутствует от 10 2 до 10 4 CCU / мл [49].
Приблизительно 10 5 КОЕ / мл можно определить методами культивирования. Это примерно на три логарифмических разведения менее чувствительно, чем ПЦР. При разрешении с помощью ПЦР чувствительность выделения M. pneumoniae из респираторных образцов оказалась всего 61% [50].Чувствительность, а также скорость роста микоплазм повышаются с помощью систем культивирования клеточных слоев, например с использованием клеток HeLa 229 [51]. Если применяется этот метод, рост M. pneumoniae можно определить через 5 дней инкубации с помощью иммунофлуоресценции (клетки), ПЦР или обнаружения антигена (жидкая фаза) [52]. Чувствительность выделения на чашках с агаром можно повысить, используя двухфазные среды. ПЦР с усилением культуры полезна для удаления ингибиторов ДНК-полимеразы, что позволяет избежать значительной потери чувствительности [52].Для этого используются клинические образцы, например мазки из зева инкубируют в бульонной культуральной среде в течение ночи перед экстракцией ДНК.
Несмотря на низкую чувствительность культуры M. pneumoniae , изоляция патогена позволила получить некоторое представление о патогенезе внелегочных проявлений, поскольку успешная изоляция свидетельствует о прямой инвазии жизнеспособных микоплазм. Подобный вывод не обязательно может быть сделан на основании положительных результатов ПЦР, поскольку целевая ДНК может сохраняться в течение некоторого времени после гибели бактерий.Более того, предполагалось, что ДНК Mycoplasma может переноситься во внелегочные участки антигенпредставляющими клетками [53]. Значительный интерес был сосредоточен на возможной инвазии M. pneumoniae в центральную нервную систему, которая первоначально была продемонстрирована методами культивирования [41, 54]. Другие не респираторные участки, где было обнаружено M. pneumoniae , сведены в Таблицу 1.
Таблица 1. Обнаружение M.pneumoniae в клинических образцах за пределами дыхательных путей| Тип образца | Изоляция | ПЦР | Другой метод | Номер ссылки |
|---|---|---|---|---|
| Спинномозговая жидкость | Есть | Есть | – | [52, 54] |
| Паренхима головного мозга | № | Не выполнено | ДНК / РНК гибридизация | [58] |
| Перикардиальная жидкость | Есть | Не выполнено | – | [76] |
| Цельная кровь | Есть | Есть | – | [81, 82] |
| Мононуклеарные клетки периферической крови | Не выполнено | № | – | [83] |
| Коронарная атерэктомия образцы | Не выполнено | Есть | – | [84] |
| Почечная ткань | Не выполнено | Не выполнено | Окрашивание иммунопероксидазой | [56] |
| Урогенитальные образцы | Есть | Есть | – | [85, 86] |
| Синовиальная жидкость | Есть | № | – | [21] |
| Кость (остеомиелит) | Не выполнено | Не выполнено | ПЦР (эубактериальная 16S рДНК) + секвенирование | [73] |
| Кожа (Стивенса – Джонсона синдром) | Есть | Не выполнено | – | [87] |
Прямое обнаружение антигена и гибридизация нуклеиновых кислот
Анализы для прямого обнаружения антигенов в значительной степени заменены методами, основанными на амплификации.Эти анализы обеспечивают чувствительность приблизительно 10 4 КОЕ / мл [51]. Наборы ELISA для прямого обнаружения антигена коммерчески доступны (Virion, Rüschlikon, Швейцария). Этот диагностический подход, хотя и не рекомендуется для диагностики внелегочных проявлений, является удобной альтернативой для обнаружения M. pneumoniae в респираторном секрете при отсутствии оборудования для ПЦР. Разработаны моноклональные антитела для прямого окрашивания возбудителя, но этот метод имеет низкую чувствительность [55].Однако с помощью окрашивания иммунной пероксидазой присутствие антигена микоплазмы в почечной ткани было продемонстрировано в единичном случае [56].
Гибридизация со специфическими зондами была первым молекулярным применением в диагностике M. pneumoniae . Анализы гибридизации обеспечивают аналогичную чувствительность к тестам ELISA для обнаружения антигена. Система GenProbe Rapid (GenProbe, Сан-Диего, Калифорния, США), которая включает ДНК-зонд, меченный 125 I, для последовательности рРНК, специфичной для M.pneumoniae широко использовалась до того, как ПЦР стала широко доступной. Оценка этого анализа показала высокую степень чувствительности (0,95) и специфичности (0,85) для обнаружения микоплазм в образцах мокроты при анализе посева и серологии. Однако этот анализ имеет ограниченную ценность для обнаружения микоплазмы в мазках из зева [57]. С помощью системы General-Probe Rapid System M. pneumoniae было впервые обнаружено в паренхиме головного мозга, а именно у ребенка с летальным микоплазменным энцефалитом [58].Анализы гибридизации также в значительной степени были заменены ПЦР и родственными методами. Это связано с более высокой чувствительностью анализов на основе амплификации, а также с неудобными процедурами обращения с радиоактивно меченными зондами.
Амплификация нуклеиновой кислоты
ПЦРбыла впервые применена для диагностики M. pneumoniae в 1989 г. Bernet et al. [59]. Первый набор праймеров был выбран из гена оперона АТФазы и позволил амплифицировать фрагмент длиной 144 п.н.В настоящее время сконструированы несколько дополнительных последовательностей праймеров, нацеленных на гены, кодирующие белок P1 [52, 60, 61] и 16S рРНК [62] (таблица 2). Хотя последний ген является высококонсервативным, области V2 и V3 рДНК 16S обнаруживают достаточные межвидовые различия для специфического обнаружения M. pneumoniae [63]. Перекрестные реакции наиболее вероятны с геномом M. genitalium . 16S рДНК также позволяет проводить ПЦР на уровне рода, например обнаружение большинства видов Mycoplasma , Ureaplasma , Spiroplasma и Acholeplasma с помощью одного анализа [63].Это приложение полезно для скрининга клеточных культур на предмет заражения микоплазмами. Однако M. pneumoniae редко встречается как контаминант клеточной культуры.
Таблица 2. Обнаружение M. pneumoniae в респираторных образцах с помощью установки ПЦР| Тип образца | Джин | Ампликон | Номер ссылки |
|---|---|---|---|
| Мокрота | 16S рДНК | 277 п.н. | [62] |
| Тампоны из горла | Ген оперона АТФазы | 144 п.н. (104 п.н.) a | [52] |
| 16S рДНК | 76 п.н. b | [72] | |
| Ген адгезина P1 | 375 п.н. | [88] | |
| Носоглотка | Ген оперона АТФазы | 144 п.н. | [33] |
| аспираты | Ген оперона АТФазы | 144 п.н. (104 п.н.) a | [52] |
| 16S рДНК | 277 п.н. | [50] | |
| 16S рДНК | 76 п.н. b | [72] | |
| Ген адгезина P1 | 209 п.н. | [50] | |
| Трахеальный аспират | Ген оперона АТФазы | 144 п.н. (104 п.н.) a | [52] |
| Бронхоальвеолярный | Ген оперона АТФазы | 144 п.н. | [49] |
| промывание (БАЛ) | 16S рДНК | 427 п.н. | [61] |
| Трансторакальный | Ген оперона АТФазы | 144 п.н. | [89] |
| игла аспирационная | |||
| Фиксированная легочная ткань c | Ген адгезина P1 | 102 п.н. | [90] |
| Открытая биопсия легкого | Ген адгезина P1 | 285 п.н. (170 п.н.) a | [91] |
| экз. в | |||
- а Вложенная ПЦР.
- б ПЦР в реальном времени.
- с Данные доступны только по единичным случаям.
Основным преимуществом ПЦР по сравнению с методами, не основанными на амплификации, является превосходная чувствительность.Одноэтапные ПЦР-анализы обычно имеют уровень обнаружения 10 2 −10 3 копий генома на миллилитр образца [49, 64]. Чувствительность можно повысить с помощью вложенной ПЦР, которая включает повторную амплификацию продукта ПЦР с помощью второго набора праймеров. Эксперименты по разведению ДНК показали, что этот метод позволяет обнаруживать 30–100 фг ДНК, что примерно соответствует 10–100 организмам [52]. Следовательно, применение вложенной ПЦР может привести к увеличению чувствительности в 10 2 раз.Однако при исследовании клинических образцов тенденция клеток M. pneumoniae образовывать конгломераты является ограничением для сверхчувствительного обнаружения. По этой причине предполагалось, что уровень обнаружения ниже 250 копий генома / мл не может быть достигнут [65]. Переносящее загрязнение является серьезной проблемой при ПЦР-диагностике. Это особенно верно для вложенной ПЦР, потому что с продуктами ПЦР, образующими аэрозоль, нужно обращаться при подготовке второго цикла. Вскоре после разработки ПЦР были разработаны рекомендации по предотвращению ложноположительных результатов [66].Применяя такие рекомендации, контаминация может быть снижена до менее 0,5% даже для вложенной ПЦР [52]. Наборы для ПЦР-диагностики M. pneumoniae имеются в продаже (Roche, Базель, Швейцария; Minerva Biolabs, Берлин, Германия).
Считается, что гибридизация продуктов ПЦР увеличивает чувствительность ПЦР по сравнению с анализом с помощью гель-электрофореза и окрашивания бромистым этидием, но были опубликованы и противоречивые результаты [65].Если уровень обнаружения применяемой ПЦР был определен, полуколичественная оценка нагрузки микоплазмы в образце может быть достигнута путем тестирования разведений экстрагированных нуклеиновых кислот [67]. Такая приблизительная количественная оценка может быть полезной, поскольку недавняя работа показала, что пациенты с острой инфекцией M. pneumoniae содержат большее количество патогена в респираторных секретах, чем выздоравливающие пациенты [67]. В таблице 2 приведены различные типы респираторных образцов, в которых M.pneumoniae была обнаружена с помощью ПЦР. Специфичность ПЦР зависит от выбора праймеров и жесткости реакции. Было показано, что в оптимизированных условиях обнаружение M. pneumoniae с помощью ПЦР обеспечивает 100% специфичность [50].
Несмотря на передовые технологии in vitro, одной ПЦР не всегда достаточно для диагностики респираторных инфекций, вызываемых M. pneumoniae . Несколько исследований выявили слабую корреляцию между ответом антител и положительными результатами ПЦР у пациентов с микоплазменной пневмонией.Tjhie et al. сообщили о согласованных результатах ПЦР и МАГ у 88,1% пациентов [65]. Корреляция 72,4% сообщается Skakni et al. [49]. Waris et al., Которые определили как IgM-, так и IgG-ответы на M. pneumoniae с помощью ELISA, достигли положительного результата ПЦР только в 50% педиатрических случаев микоплазменной пневмонии [33]. Сопоставимые наблюдения были сделаны при применении методов культивирования. Kenny et al. обнаружили чувствительность 53% и 64% серологии и культуры, соответственно, когда другой подход рассматривался как эталон [42].Аналогичным образом было продемонстрировано, что только у 58% пациентов с положительной культурой микоплазм наблюдается четырехкратное или большее увеличение титра антител против CF [68].
Существует несколько объяснений обнаружения M. pneumoniae в респираторных секретах пациентов без ответа антител. Что наиболее важно, присутствие возбудителя в дыхательных путях не обязательно связано с клиническими симптомами. Gnarpe et al. установили, что в зависимости от текущей эпидемиологической ситуации 5.У 1–13,5% здоровых взрослых организм находится в горле [69]. Эти данные были получены путем выделения возбудителя из мазков из зева. Преходящее бессимптомное носительство M. pneumoniae является результатом сохранения патогена после болезни и инфекций в течение инкубационного периода. В этом контексте важно отметить, что время инкубации составляет примерно 3 недели для M. pneumoniae заболеваний дыхательных путей [20]. Однако нет никаких доказательств того, что появление симптомов причинно связано с появлением диагностических уровней антител.Кроме того, на ранних стадиях заболевания нет диагностического ответа антител, тогда как M. pneumoniae обнаруживается в респираторных секретах. У пациентов с ослабленным иммунитетом не может наблюдаться диагностического ответа антител. В настоящее время неизвестно, происходит ли регулярное диагностическое повышение титра антител при бессимптомных инфекциях. Как следствие этих соображений, обнаружение M. pneumoniae в респираторных образцах не обязательно указывает на причинную роль патогена в данном эпизоде пневмонии.Однако совокупность клинических свидетельств пневмонии и положительного результата ПЦР указывает на микоплазменную этиологию заболевания и является показанием для терапии антимикоплазмой.
Хотя у некоторых пациентов M. pneumoniae имеет тенденцию сохраняться в дыхательных путях в течение нескольких месяцев после заражения, патоген выявляется реже на более поздних стадиях заболевания [33, 42]. Раннее исчезновение M. pneumoniae могло быть связано с противомикробной терапией или иммунным ответом хозяина.Этим можно объяснить отрицательные результаты ПЦР у пациентов с другими серологически подтвержденными микоплазменными заболеваниями дыхательных путей. В отличие от положительного результата ПЦР, значительный рост специфических антител всегда свидетельствует о текущей инфекции M. pneumoniae .
В дополнение к ПЦР и вложенной ПЦР для диагностики M. pneumoniae было адаптировано несколько новых методов, основанных на амплификации. Одновременное обнаружение M. pneumoniae и других респираторных патогенов может быть выполнено с помощью мультиплексной ПЦР.В настоящее время разработаны мультиплексные ПЦР-анализы для обнаружения M. pneumoniae и Chlamydia pneumoniae и M. pneumoniae , C. pneumoniae и Chlamydia psittaci [70, 71]. Был проведен анализ ПЦР в реальном времени для обнаружения M. pneumoniae в клинических образцах, который оказался равным традиционной вложенной ПЦР в отношении чувствительности [72]. Этот метод позволяет количественно оценить амплифицированный продукт во время ПЦР в сочетании со значительным сокращением рабочего времени.Амплификация эубактериальной ДНК с помощью праймеров, нацеленных на высококонсервативный участок генома (16S рДНК), и последующее секвенирование ампликона позволили диагностировать M. pneumoniae в случае остеомиелита, при котором культуры гноя были неоднократно отрицательными [73, 74 ].
Подозреваемые внелегочные проявления инфекции M. pneumoniae представляют собой важное применение молекулярных методов. В случаях редко встречающихся проявлений прямое обнаружение возбудителя на пораженном участке обеспечивает наибольшую диагностическую точность.В противном случае остается неясным, связаны ли положительные серологические результаты с исследуемым заболеванием. С другой стороны, отрицательная прогностическая ценность обнаружения молекулярных патогенов, очевидно, мала при некоторых внелегочных проявлениях, которые потенциально являются иммунологически опосредованными и, следовательно, не связаны с прямой инвазией патогена. Самое главное, патогенез неврологических проявлений в настоящее время неизвестен. Предполагается, что существуют разные патогенетические механизмы поражения центральной нервной системы у M.pneumoniae , каждая из которых связана либо с прямой инвазией патогенов, либо с аберрантным иммунным ответом [75]. Инвазия сердечных структур M. pneumoniae в случаях перикардита или перимиокардита представляется более постоянным явлением [76]. Однако следует отметить, что большие выпоты в перикард, которые требовали пункции или даже перикардиэктомии, в основном исследовались, в то время как перикардит, вызванный микоплазмой, в основном возникает при небольших выпотах в перикард [77].
Большинство внелегочных участков не обеспечивают благоприятной среды для роста микоплазм.Поскольку возбудитель, вероятно, присутствует в небольших количествах, применение молекулярных методов повышенной чувствительности, например может потребоваться вложенная ПЦР [40]. Однако, если тщательно исключить другую потенциальную этиологию, в большинстве случаев диагноз может быть установлен путем комплексного серологического обследования. Существует только одно сообщение о тяжелом внелегочном проявлении (энцефалит) с обнаружением патогена из пораженного участка (CSF) при отсутствии генерализованного серологического ответа [40].
Методы амплификацииРНК также перспективны в отношении диагностики M. pneumoniae . Преимуществом обнаружения РНК является высокая чувствительность, которая обусловлена большим количеством копий рРНК (> 10 3 ) на бактериальную клетку. Поскольку РНК быстро разлагается in vivo под действием РНКаз, обнаружение этой нуклеиновой кислоты в большей степени указывает на наличие жизнеспособных микоплазм в клиническом образце, чем обнаружение ДНК. Анализы RT-PCR, нацеленные на последовательности 16S рРНК, были разработаны как для родового, так и для видового уровней [63].Недавно была разработана однотрубная множественная ОТ-ПЦР для обнаружения M. pneumoniae и восьми дополнительных респираторных патогенов [78]. Существуют также методы амплификации РНК, которые еще не применялись в диагностике микоплазм, хотя было показано, что они полезны для обнаружения других инфекционных агентов. Анализы опосредованной транскрипцией амплификации (ТМА), которые коммерчески доступны для обнаружения Chlamydia trachomatis [79] и Mycobacterium tuberculosis [80] (GenProbe), могут улучшить диагностику микоплазм.
Заключение
Для серологической диагностики пневмонии M. pneumoniae следует использовать анализ для отдельного обнаружения специфических антител IgM или IgA. Повышенные антитела IgM представляют собой надежный индикатор микоплазменной инфекции у детей, но диагностика на основе IgA обеспечивает более высокую чувствительность у пожилых пациентов. Чтобы исключить возможность того, что повышенный уровень антител вызван прошлой инфекцией, серологические исследования необходимо сочетать с прямым обнаружением патогенов.Однако следует отметить, что M. pneumoniae может быть обнаружено в дыхательных путях бессимптомных людей. При подозрении на внелегочные проявления диагностическим является обнаружение M. pneumoniae из пораженного первичного стерильного участка. Предполагается, что некоторые проявления, особенно с участием центральной нервной системы, имеют иммунологически опосредованный патогенез, не связанный с прямой инвазией патогенов. Эти заболевания необходимо диагностировать при серологическом исследовании.
Стандартная ПЦР в настоящее время является методом выбора для прямого обнаружения M. pneumoniae . ПЦР заменила гибридизацию и прямое определение антигена из-за своей более высокой чувствительности. В последние годы в исследовательских целях было применено несколько методов, связанных с ПЦР. Вложенная ПЦР имеет высокую чувствительность, которая может потребоваться для обнаружения M. pneumoniae из внелегочных участков, где патоген обычно присутствует в небольшом количестве копий.Мультиплексные ПЦР-анализы были разработаны для одновременного обнаружения M. pneumoniae и других респираторных патогенов. ПЦР в реальном времени позволяет контролировать амплификацию во время ПЦР и обеспечивает удобные процедуры обработки. Среди новых методов в области молекулярной диагностики микоплазм последний, скорее всего, получит широкое распространение для рутинной диагностики.
Методы, включающие амплификацию конкретных последовательностей РНК, применялись исключительно в исследовательских целях.Диагностика на основе РНК имеет высокую чувствительность из-за наличия примерно 10 3 копий 16S рРНК на клетку микоплазмы. Обнаружение РНК является дополнительным доказательством жизнеспособности микоплазм в образце, поскольку после гибели клетки микоплазмы РНК разрушается быстрее, чем ДНК. Несмотря на то, что были разработаны анализы ОТ-ПЦР для обнаружения M. pneumoniae , технология ТМА еще не внедрена в диагностику микоплазм. Было показано, что анализы ТМА полезны для рутинной диагностики других инфекций, а также могут облегчить диагностику M.pneumoniae инфекция.
Список литературы
- 1 Либерман Д, Schlaeffer F, Либерман Д, Горовиц С, Порат А. Mycoplasma pneumoniae внебольничная пневмония: обзор 101 госпитализированного взрослого пациента. Дыхание 1996; 63: 261–6.
- 2 Гомес Дж., Банос V, Ruiz-Gomez J et al. Проспективное изучение эпидемиологии и прогностических факторов внебольничной пневмонии. Eur J Clin Microbiol Infect Dis 1996; 15: 556–60.
- 3 Foy HM. Инфекции, вызванные Mycoplasma pneumoniae , и возможное носительство в различных популяциях пациентов. Clin Infect Dis 1993; 17 (приложение 1): S37–46.
- 4 Клайд WA младший Клинический обзор типичных Mycoplasma pneumoniae инфекций. Clin Infect Dis 1993; 17 (добавление 1): S32–6.
- 5 Денни Ф.В., Клайд WA младший, Glezen WP. Mycoplasma pneumoniae болезнь: клинический спектр, патофизиология, эпидемиология и меры борьбы. J Инфекция Dis 1971; 123: 74–92.
- 6 Бохуд П-И, Мозер Ф, Erard P et al. Внебольничная пневмония. Проспективное амбулаторное исследование. Медицина 2001; 80: 75–87.
- 7 Принципи N, Эспозито С, Блази Ф, Аллегра Л., Группа изучения Маугли.Роль Mycoplasma pneumoniae и Chlamydia pneumoniae у детей с внебольничными инфекциями нижних дыхательных путей. Clin Infect Dis 2001; 32: 1281–9.
- 8 Марри TJ, Пилинг RW, Отлично MJ, Певица Д.Е., Коли СМ, Капур WN. Амбулаторные пациенты с внебольничной пневмонией: частота атипичных агентов и клиническое течение. Am J Med 1996; 101: 508–15.
- 9 Ной Н.Д. Mycoplasma pneumoniae инфекция в Соединенном Королевстве, 1967–73. BM J 1974; 2: 544–6.
- 10 Фой HM, Кенни Г.Е., МакМахан Р., Манси А.М., Grayston JT. Mycoplasma pneumoniae пневмония в городской местности. JAMA 1970; 214: 1666–72.
- 11 Marrie TJ. Mycoplasma pneumoniae пневмония, требующая госпитализации, с упором на инфекции у пожилых людей. Arch Intern Med 1993; 153: 488–94.
- 12 Мансель Дж. К., Розенов EC, Смит Т.Ф., Мартин JW.Mycoplasma pneumoniae pneumonia. Сундук 1989; 95: 639–46.
- 13 Брезент B, Дженсен Дж. С., Østergaard L, Андерсен PL. Поиск агентов, вызывающих атипичную пневмонию у ВИЧ-положительных пациентов, с помощью ПЦР-тестов с ингибитором. Eur Respir J 1999; 13: 175–9.
- 14 Перес ЧР, Ли М.В. Mycoplasma pneumoniae как возбудитель пневмонии у хозяина с ослабленным иммунитетом. Сундук 1991; 100: 860–1.
- 15 Фой HM, Ochs H, Дэвис С.Д., Кенни Г.Е., Люс РР. Mycoplasma pneumoniae инфекция у пациентов с синдромами иммунодефицита: отчет о четырех случаях. J Инфекция Dis 1973; 127: 388–93.
- 16 Дженсен Дж. С., Heilmann C, Валериус NH. Mycoplasma pneumoniae Инфекция ребенка, больного СПИДом. Clin Infect Dis 1994; 19: 207.
- 17 Кингстон-младший, Чанок Р.М., Mufson MA et al. Возбудитель пневмонии Eaton. JAMA 1961; 176: 118–23.
- 18 Макфарлейн Дж, Холмс В, Gard P et al. Проспективное исследование заболеваемости, этиологии и исходов заболеваний нижних дыхательных путей у взрослых в сообществе. Грудь 2001; 56: 109–14.
- 19 Тейлор-Робинсон Д, Бебеар К. Чувствительность микоплазм к антибиотикам и лечение микоплазменных инфекций. J Антимикробный препарат Chemother 1997; 40: 622–30.
- 20 Тейлор-Робинсон Д. Инфекции, вызываемые видами Mycoplasma и Ureaplasma: обновленная информация. Clin Infect Dis 1996; 23: 671–84.
- 21 Дэвис С.П., Кокран С, Lisse J et al. Выделение Mycoplasma pneumoniae из образцов синовиальной жидкости у пациента с пневмонией и полиартритом. Arch Intern Med 1988; 148: 969–70.
- 22 Даксбок Ф, Zedtwitz-Liebenstein K, Бургманн H, Граннингер В. Тяжелая гемолитическая анемия и чрезмерный лейкоцитоз, маскирующий микоплазменную пневмонию. Анн Гематол 2001; 80: 180–2.
- 23 Джейкобс Э. Серологический диагноз Mycoplasma pneumoniae инфекций: критический обзор текущих процедур. Clin Infect Dis 1993; 17 (добавление 1): S79–82.
- 24 Али, штат Нью-Джерси, Силлис М, Эндрюс BE, Дженкинс П.Ф., Харрисон BDW. Клинический спектр и диагностика инфекции Mycoplasma pneumoniae . Q J Med 1986; 58: 241–51.
- 25 Хоскер HSR, Там JS, Чан ЧС, Lai CKW. Mycoplasma pneumoniae Инфекция в Гонконге — клинические особенности во время эпидемии. Дыхание 1993; 60: 237–40.
- 26 Гейсслер Р.Г., Кебберлинг Дж. Kälteagglutininkrankheit. Klin Wochenschr 1988; 66: 277–83.
- 27 Руусканен О, Нохинек Х, Ziegler T et al. Пневмония в детском возрасте: этиология и ответ на антимикробную терапию. Eur J Clin Microbiol Infect Dis 1992; 11: 217–23.
- 28 Пёнка А, Пёнка Т, Сарна С, Пенттинен К. Сомнительная специфичность липидного антигена в тесте связывания комплемента Mycoplasma pneumoniae . J Заражение 1981; 3: 332–8.
- 29 Клеемола М, Кайхты Х. Повышение титров антител у больных гнойным менингитом. J Инфекция Dis 1983; 146: 284–8.
- 30 Баркер CE, Силлис Ф, Wreghitt TG. Оценка теста агглютинации частиц Serodia Myco II для обнаружения антитела Mycoplasma pneumoniae : сравнение с мкФ-захватом ELISA и непрямой иммунофлуоресценцией. J Clin Pathol 1991; 43: 163–5.
- 31 Джейкобс Э, Бенневиц А, Бредт В. Характер реакции человеческих антител против Mycoplasma pneumoniae в иммуноферментных анализах и иммуноблоттинге. J Clin Microbiol 1986; 23: 517–22.
- 32 Силлис М.Ограничения анализа IgM в серологической диагностике Mycoplasma pneumoniae инфекций. J Med Microbiol 1990; 33: 253–8.
- 33 Варис МЭ, Тойкка П., Сааринен Т и др. Диагноз Mycoplasma pneumoniae пневмония у детей. J Clin Microbiol 1998; 36: 3155–9.
- 34 Уоткинс-Ридель Т, Станек Г, Даксбок Ф. Сравнение SeroMP IgA с четырьмя другими коммерческими тестами для серодиагностики Mycoplasma pneumoniae пневмонии. Диагностика Microbiol Infect Dis 2001; 40: 21–5.
- 35 Матас Л, Домингес Дж., De Ory F et al. Оценка теста Meridian ImmunoCard Mycoplasma для обнаружения Mycoplasma pneumoniae -специфических IgM у педиатрических пациентов. Scand J Infect Dis 1998; 30: 289–93.
- 36 Моррисон-Пламмер Дж., Лазелл Дж.А., Человек с низов JB. Общие эпитопы между Mycoplasma pneumoniae основного белка адгезина P1 и 140-килодальтонным белком Mycoplasma genitalium . Заражение иммунной 1987; 55: 49–56.
- 37 Ву АС, Фой HM, Картрайт Ф.Д., Kenny GE.Основные антигены изолятов Mycoplasma pneumoniae , измеренные по уровням иммуноглобулина G в сыворотке крови человека, стабильны в штаммах, собранных в течение 10-летнего периода. Заражение иммунной 1987; 55: 1830–6.
- 38 Тейлор-Робинсон Д, Гилрой CB, Сено ЧП. Встречаемость Mycoplasma genitalium в разных популяциях и ее клиническое значение. Clin Infect Dis 1993; 17 (добавление 1): S66–8.
- 39 Benèina D, Дове П, Mueller-Premru M et al. Интратекальный синтез специфических антител у пациентов с инвазией в центральную нервную систему Mycoplasma pneumoniae . Eur J Clin Microbiol Infect Dis 2000; 19: 521–30.
- 40 Нарита М, Мацудзоно Й, Тогаши Т, Каджи Н.ДНК-диагностика инфекции центральной нервной системы, вызываемой Mycoplasma pneumoniae . Педиатрия 1992; 90: 250–3.
- 41 Абрамовиц П., Шварцман П., Харел Д, Лис I, Наот Ю. Прямое вторжение в центральную нервную систему Mycoplasma pneumoniae : сообщение о двух случаях. J Инфекция Dis 1987; 155: 482–7.
- 42 Кенни Г.Е., Кайзер Г.Г., Куни МК, Foy HM.Диагностика Mycoplasma pneumoniae пневмония: чувствительность и особенности серологии с липидным антигеном и выделение организма на соевой пептонной среде для выявления инфекций. J Clin Microbiol 1990; 28: 2087–93.
- 43 Гранато П.А., По L, Вайнер Л.Б. Использование модифицированной среды New York City для роста Mycoplasma pneumoniae . Am J Clin Pathol 1980; 73: 702–5.
- 44 Разин С. Сравнительная геномика микоплазм. Wien Klin Wochenschr 1997; 109: 551–6.
- 45 Талли Дж. Г., Роза DL, Бейсмен JB, Далло СФ, Лаззель А.Л., Дэвис CP. Mycoplasma pneumoniae и Mycoplasma genitalium смесь в изоляте синовиальной жидкости. J Clin Microbiol 1995; 33: 1851–5.
- 46 Маккормак GE. Восприимчивость микоплазм к антимикробным препаратам: клинические последствия. Clin Infect Dis 1993; 17 (приложение 1): 200–1.
- 47 Харрис Р, Мармион БП, Варкансис Г, Кок П.В., Лунн Б, Мартин.Дж. Лабораторная диагностика инфекции Mycoplasma pneumoniae . 2. Сравнение методов прямого обнаружения специфических последовательностей антигена или нуклеиновой кислоты в респираторном экссудате. Эпидемиол. Инфекция 1988; 101: 685–94.
- 48 Разин С. ДНК-зонды и ПЦР в диагностике микоплазменных инфекций. Зонды Mol Cell 1994; 8: 497–511.
- 49 Скакни Л, Сардет А, Just J et al. Обнаружение Mycoplasma pneumoniae в клинических образцах от педиатрических пациентов с помощью полимеразной цепной реакции. J Clin Microbiol 1992; 30: 2638–43.
- 50 Даже M, Гуссенс Х. Актуальность методов амплификации нуклеиновых кислот для диагностики инфекций дыхательных путей в клинической лаборатории. Clin Microbiol Rev 1997; 10: 242–56.
- 51 Мармион БП, Уильямсон Дж. Уорсвик DA, Kok T-W, Харрис Р.Дж. Опыт использования новых методов лабораторного обнаружения инфекции Mycoplasma pneumoniae : Аделаида, 1978–1992. Clin Infect Dis 1993; 17 (добавление 1): S90–9.
- 52 Абеле-Хорн М, Буш У, Nitschko H et al. Молекулярные подходы к диагностике заболеваний легких, вызванных Mycoplasma pneumoniae . J Clin Microbiol 1998; 36: 548–51.
- 53 Абеле-Хорн М, Франк В, Буш У, Ничко Х., Роос Р, Heesemann. Дж. Поперечный миелит, связанный с инфекцией Mycoplasma pneumoniae . Clin Infect Dis 1998; 26: 909–12.
- 54 Флейшхауэр П., Хюбен У, Мертенс Х, Сетхи К.К., Турманн Д. Nachweis von Mycoplasma pneumoniae im Liquor bei akuter Polyneuritis. Dtsch Med Wschr 1972; 97: 678–82.
- 55 Чимолаи Н, Шрайверс А, Брайан Л.Е., Woods DE. Иммунологическое определение Mycoplasma pneumoniae с амплификацией культур в клинических образцах. Диагностика Microbiol Infect Dis 1988; 9: 207–12.
- 56 Эндрюс PA, Ллойд СМ, Уэбб MC, Мешки SH. Острый интерстициальный нефрит, связанный с инфекцией Mycoplasma pneumoniae . Дифференциальный трансплантат нефрола 1994; 9: 564–6.
- 57 Клеемола СРМ, Карьялайнен Й.Е., Räty RKH.Быстрая диагностика инфекции Mycoplasma pneumoniae : клиническая оценка коммерческого зондового теста. J Инфекция Dis 1990; 162: 70–5.
- 58 Launes J, Паэтау А, Линнавури К., Иванаинеу М. Прямая инвазия Mycoplasma pneumoniae в паренхиму головного мозга . Acta Neurol Scand 1997; 95: 374.
- 59 Бернет С, Гаррет М, Де Барбейрак Б, Bebear C, Бонне Дж.Обнаружение Mycoplasma pneumoniae с помощью полимеразной цепной реакции. J Clin Microbiol 1989; 27: 2492–6.
- 60 Даже M, Урси Д, Ван Бевер Х, Квинт W, Нистерс HGM, Гуссенс Х. Обнаружение Mycoplasma pneumoniae с помощью двух полимеразных цепных реакций и роль M. pneumoniae в острых респираторных инфекциях у педиатрических пациентов. J Инфекция Dis 1996; 173: 1445–52.
- 61 Бак Г.Е., О’Хара LC, Summersgill JT. Быстрое и чувствительное обнаружение Mycoplasma pneumoniae в смоделированных клинических образцах путем амплификации ДНК. J Clin Microbiol 1992; 30: 3280–3.
- 62 Ван Куппевельд Ф.Дж., Йоханссон К-Э, Galama JM et al. Полимеразная цепная реакция на основе 16S рРНК в сравнении с культуральными и серологическими методами диагностики инфекции Mycoplasma pneumoniae . Eur J Clin Microbiol Infect Dis 1994; 13: 401–5.
- 63 Ван Куппефельд FJM, Ван дер Логт JTM, Angulo AF et al. Родовая и видоспецифическая идентификация микоплазм с помощью амплификации 16S рРНК. Appl Environ Microbiol 1992; 58: 2606–15.
- 64 Кесслер HH, Dodge DE, Pierer K и др. Быстрое обнаружение Mycoplasma pneumoniae с помощью анализа, основанного на ПЦР и гибридизации зонда в формате нерадиоактивных микропланшетов. J Clin Microbiol 1997; 35: 1592–4.
- 65 Tjhie JHT, Ван Куппефельд FJM, Roosendaal R et al. Прямая ПЦР позволяет обнаруживать Mycoplasma pneumoniae у пациентов с инфекциями дыхательных путей. J Clin Microbiol 1994; 32: 11–16.
- 66 Квок С, Хигучи Р. Избегайте ложных срабатываний с помощью ПЦР. Природа 1989; 339: 237–8.
- 67 Дориго-Зецма JW, Заат САДЖ, Вриесема Дж. М., Данкерт Дж.С помощью вложенной ПЦР для Mycoplasma pneumoniae продемонстрировано, что нагрузка M. pneumoniae в горле выше у пациентов, госпитализированных с инфекцией M. pneumoniae , чем у не госпитализированных субъектов. J Med Microbiol 1999; 48: 1115–22.
- 68 Грейстон JT, Фой HM, Кенни С. Эпидемиология микоплазменных инфекций дыхательных путей.В: Hayflick L, ed. Mycoplasmatales и L-фаза бактерий. Амстердам: Северная Голландия, 1969 год: 651– 82.
- 69 Gnarpe J, Lundbäck A, Sundelöf B, Гнарпе Х. Распространенность Mycoplasma pneumoniae у субъективно здоровых лиц. Scand J Infect Dis 1992; 24: 161–4.
- 70 Корсаро D, Валасина М, Вендитти Д, Венард V, Ле Фау А, Валенсин П.Е.Мультиплексная ПЦР для быстрой и дифференциальной диагностики Mycoplasma pneumoniae и Chlamydia pneumoniae при респираторных инфекциях. Диагностика Microbiol Infect Dis 1999; 35: 105–8.
- 71 Тонна CYW, Доннелли С, Харви Джи, Силлис М. Мультиплексная полимеразная цепная реакция для одновременного обнаружения Mycoplasma pneumoniae , Chlamydia pneumoniae и Chlamydia psittaci в респираторных образцах. J Clin Pathol 1999; 52: 257–63.
- 72 Хардеггер Д, Надаль Д, Боссарт В, Альтвегг М, Датли Ф. Быстрое обнаружение Mycoplasma pneumoniae в клинических образцах с помощью ПЦР в реальном времени. Дж. Методы микробиологии 2000; 41: 45–51.
- 73 Ла Скола B, Мишель Г, Рауль Д.Использование амплификации и секвенирования гена 16S рРНК для диагностики остеомиелита Mycoplasma pneumoniae у пациента с гипогаммаглобулинемией. Clin Infect Dis 1997; 24: 1161–3.
- 74 Weisburg WG, Сарай СМ, Пеллетье Д.А., Lane DJ. Амплификация рибосомальной ДНК 16S для филогенетического исследования. Дж Бактериол 1991; 173: 697–703.
- 75 Пеллегрини М, О’Брайен Т.Дж., Хой Дж, Седаль Л. Mycoplasma pneumoniae Инфекция, связанная с острым синдромом ствола мозга. Acte Neurol Scand 1996; 93: 203–6.
- 76 Кенни RT, Ли Дж.С., Clyde WA Jr et al. Микоплазменный перикардит: свидетельство инвазивного заболевания. Clin Infect Dis 1993; 17 (добавление 1): S58–62.
- 77 Песков MJ, Satz JE, Тернер МЫ, Солофф Л.А. Перикардит и перимиокардит, связанные с активной инфекцией Mycoplasma pneumoniae . Ann Intern Med 1977; 86: 544–8.
- 78 Грёндаль Б, Puppe W, Хоппе А, Кюне I, Weigl JAI, Шмитт Х. Дж.Быстрая идентификация девяти микроорганизмов, вызывающих острые респираторные инфекции, с помощью однотрубной мультиплексной ПЦР с обратной транскрипцией: технико-экономическое обоснование. J Clin Microbiol 1999; 37: 1–7.
- 79 Пастернак Р, Вуоринен П., Миеттинен А. Оценка транскрипционно-опосредованного анализа амплификации General-Probe Chlamydia trachomatis с образцами мочи женщин. J Clin Microbiol 1997; 35: 676–8.
- 80 Миллер Н, Эрнандес С.Г., Клири Т.Дж. Оценка амплифицированного General-Probe Mycobacterium tuberculosis , прямого теста и ПЦР для прямого обнаружения Mycobacterium tuberculosis в клинических образцах. J Clin Microbiol 1994; 32: 393–7.
- 81 Нафталин Ю.М., Веллиш G, Кахана З, Динготт Д. Mycoplasma pneumoniae сепсис. JAMA 1974; 228: 565.
- 82 Нарита М, Мацудзоно Й, Итакура О, Тогаши Т, Кикута Х. Обследование микоплазменной бактериемии у детей методом полимеразной цепной реакции. Clin Infect Dis 1996; 23: 522–5.
- 83 Ковачич Р, Лауна В, Tuppin P et al. Поиск шести видов микоплазм в мононуклеарных клетках периферической крови субъектов, серопозитивных и серонегативных по вирусу иммунодефицита человека. J Clin Microbiol 1996; 34: 1808–10.
- 84 Мараха Б, Ван Дер Зи А, Bergmans AMC et al. Связано ли Mycoplasma pneumoniae с сосудистыми заболеваниями? J Clin Microbiol 2000; 38: 935–6.
- 85 Гуле М, Dular R, Талли Дж. Г., Биллоуз Г, Касатия С. Выделение Mycoplasma pneumoniae из урогенитального тракта человека. J Clin Microbiol 1995; 33: 2823–5.
- 86 Шарма С, Брюссо Р, Касатия С. Обнаружение и подтверждение Mycoplasma pneumoniae в образцах урогенитального тракта с помощью ПЦР. J Clin Microbiol 1998; 36: 277–80.
- 87 Штутман HR. Синдром Стивенса – Джонсона и Mycoplasma pneumoniae : доказательства кожной инфекции. J Педиатр 1987; 111: 845–7.
- 88 Рамирес Дж. А., Аки С, Толентино А, Миллер Р.Д., Summersgill JT.Диагностика инфекции нижних дыхательных путей Legionella pneumophila , Mycoplasma pneumoniae или Chlamydia pneumoniae с использованием полимеразной цепной реакции на одном образце мазка из горла. Диагностика Microbiol Infect Dis 1996; 24: 7–14.
- 89 Фальгера М, Nogues A, Руис-Гонсалес А, Гарсия М, Пуиг Т. Обнаружение Mycoplasma pneumoniae с помощью полимеразной цепной реакции в легочных аспиратах от пациентов с внебольничной пневмонией. Сундук 1996; 110: 972–6.
- 90 Уильямсон Дж. Мармион БП, Кок Т, Antic R, Харрис Р.Дж. Подтверждение смертельной инфекции Mycoplasma pneumoniae с помощью полимеразной цепной реакции. J Инфекция Dis 1994; 170: 1052–3.


 Пациенты с микоплазмоподобным заболеванием с охриплостью, связанной с пневмонией, должны считаться больными C. pneumoniae , пока не будет доказано обратное.
Пациенты с микоплазмоподобным заболеванием с охриплостью, связанной с пневмонией, должны считаться больными C. pneumoniae , пока не будет доказано обратное.