Лейшмании — это… Что такое Лейшмании?
| Лейшмании | |||||
Промастиготы Leishmania major | |||||
| Научная классификация | |||||
|---|---|---|---|---|---|
промежуточные ранги
| |||||
| Международное научное название | |||||
Leishmania Ross, 1903 | |||||
| Виды | |||||
Лейшма́нии[4] (от имени У. Лейшмана) — род паразитических простейших, вызывающих лейшманиозы[5]. Переносчиками лейшманий являются москиты из рода Phlebotomus
 Естественным резервуаром разных видов служат позвоночные животные, относящиеся к шести отрядам млекопитающих и ящерицам[6]; впрочем, на основании изоферментного анализа паразитов ящериц было предложено выделить в отдельный род отряда трипаносоматид — Sauroleishmania[7]. Лейшмании в основном поражают грызунов, собак и людей, но также отмечены случаи поражения у даманов, кошек и лошадей. В Новом Свете инфекция встречается у опоссумов, ленивцев и броненосцев[8]; зарегистрированы случаи лейшманиоза у кенгуру в Австралии[9]. По оценкам ВОЗ от начала 1990-х, лейшманиозами больны около 12 миллионов человек в 88 странах.
Естественным резервуаром разных видов служат позвоночные животные, относящиеся к шести отрядам млекопитающих и ящерицам[6]; впрочем, на основании изоферментного анализа паразитов ящериц было предложено выделить в отдельный род отряда трипаносоматид — Sauroleishmania[7]. Лейшмании в основном поражают грызунов, собак и людей, но также отмечены случаи поражения у даманов, кошек и лошадей. В Новом Свете инфекция встречается у опоссумов, ленивцев и броненосцев[8]; зарегистрированы случаи лейшманиоза у кенгуру в Австралии[9]. По оценкам ВОЗ от начала 1990-х, лейшманиозами больны около 12 миллионов человек в 88 странах.Происхождение
Происхождение лейшманий неясно[10][11]. Одна из теорий предполагает африканское происхождение, с последующей миграцией в Северную и Южную Америку. Другая — миграцию из Северной и Южной Америки через Берингов перешеек, около 15 миллионов лет назад. Третья предлагает палеарктическое происхождение [12].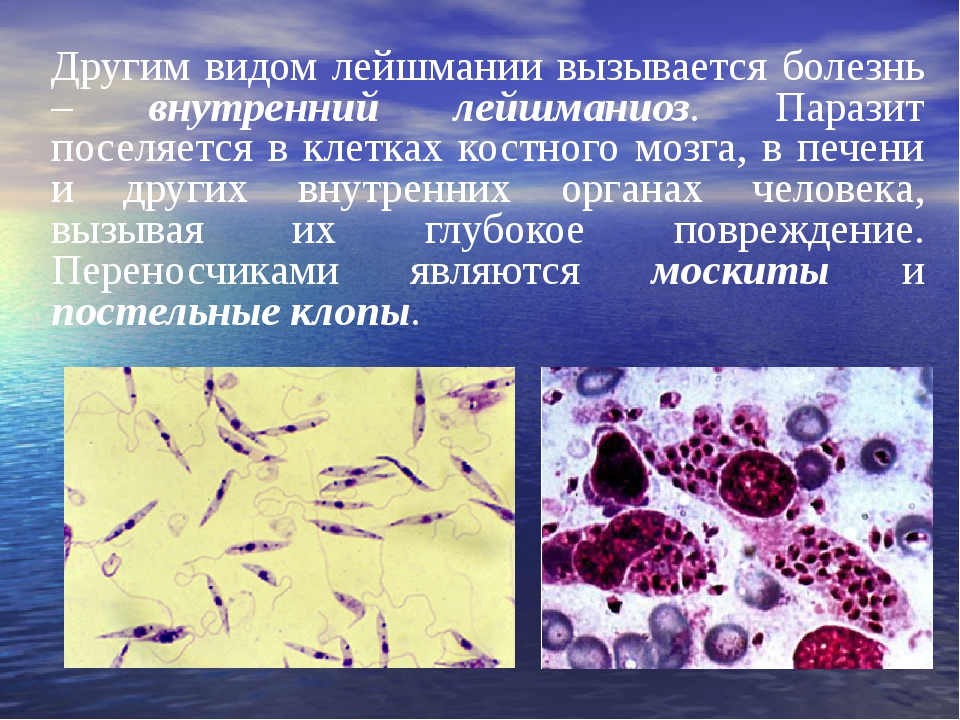
Морфология
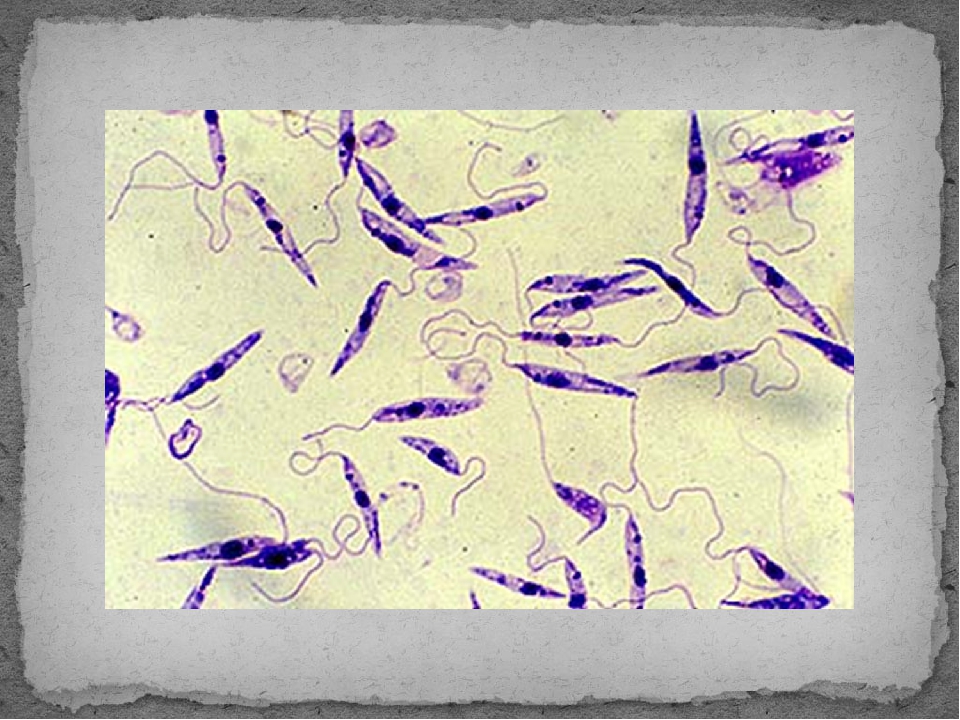
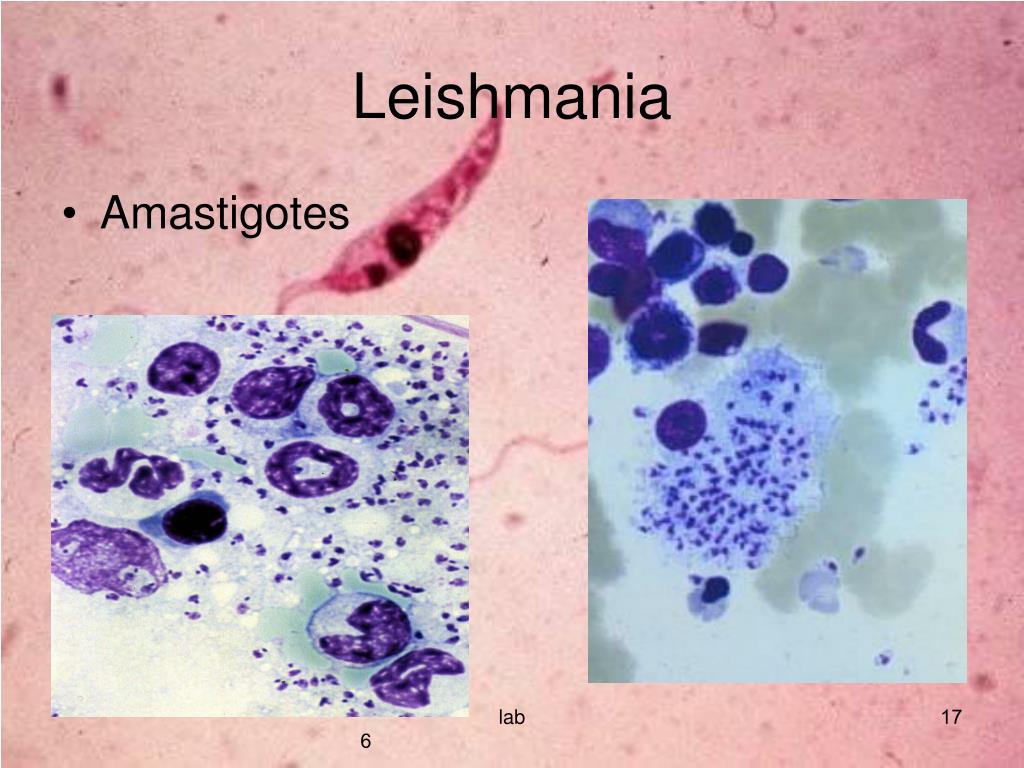
Амастиготы Leishmania mexicana.Лейшмании существуют в двух морфологических формах — промастиготы (с длинным передним жгутиком, веретенообразные, удлинённые, подвижные)[13] в насекомом-хозяине и на искусственных питательных средах, и амастиготы (с коротким жгутиком, круглые или овальные, неподвижные, расположенные внутриклеточно) в организме позвоночных.
Промастиготы разных видов практически неразличимы, но амастиготы некоторых видов возможно предположительно опознать по некоторым внешним признакам либо по характерному распределению внутри макрофагов. Так, амастиготы L. major обычно крупнее (4—5 микрон), чем L. tropica (1,5—2,5 микрон; оба эти вида сосуществуют в некоторых очагах), а число их внутри каждой клетки меньше: L. major, как правило, не больше десяти промастигот на макрофаг (обычно 2—4 амастиготы), в то время как L. tropica — до ста паразитов на клетку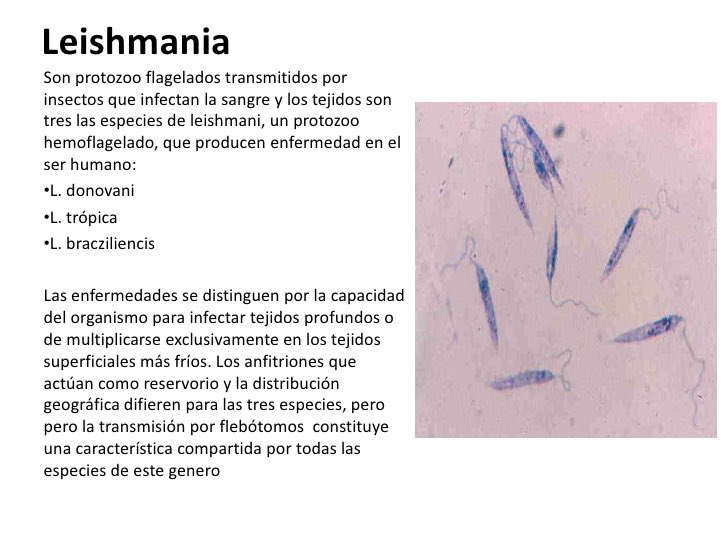
Жизненный цикл
Лейшмании, как и все трипаносоматиды, являются облигатными паразитами. Жизненный цикл лейшманий включает двух хозяев: млекопитающее и насекомое (москит).
Москиты заражаются лейшманиями, когда пьют кровь заражённого млекопитающего. Кровью питаются только самки москитов. Лейшмании вместе с проглатываемой кровью проникают в пищеварительный канал москита. В задней части средней кишки вокруг проглоченной крови у москита (как и у некоторых других кровососущих насекомых, например, комаров) образуется так называемая перитрофическая матрица
.Промастиготы лейшманий размножаются в пищеварительном канале самок москитов. Приблизительно через неделю инфекция распространяется до верхних отделов пищеварительного канала и паразиты блокируют просвет канала своими телами и секретируемым им гелем. Когда самка кусает потенциального хозяина, она выделяет в кожу свою слюну. Самка с блокированным пищеварительным каналом не может глотать, и у неё возникают спастические движения, в результате которых она отрыгивает промастиготы в ранку на коже хозяина.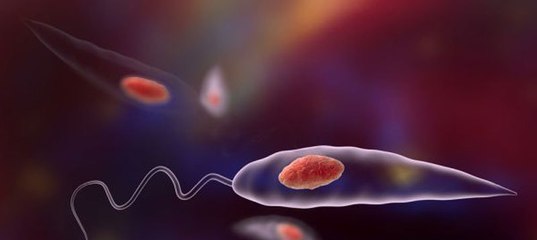
В среднем во время укуса инфицированным москитом в кожу попадает 102 — 103 промастигот.
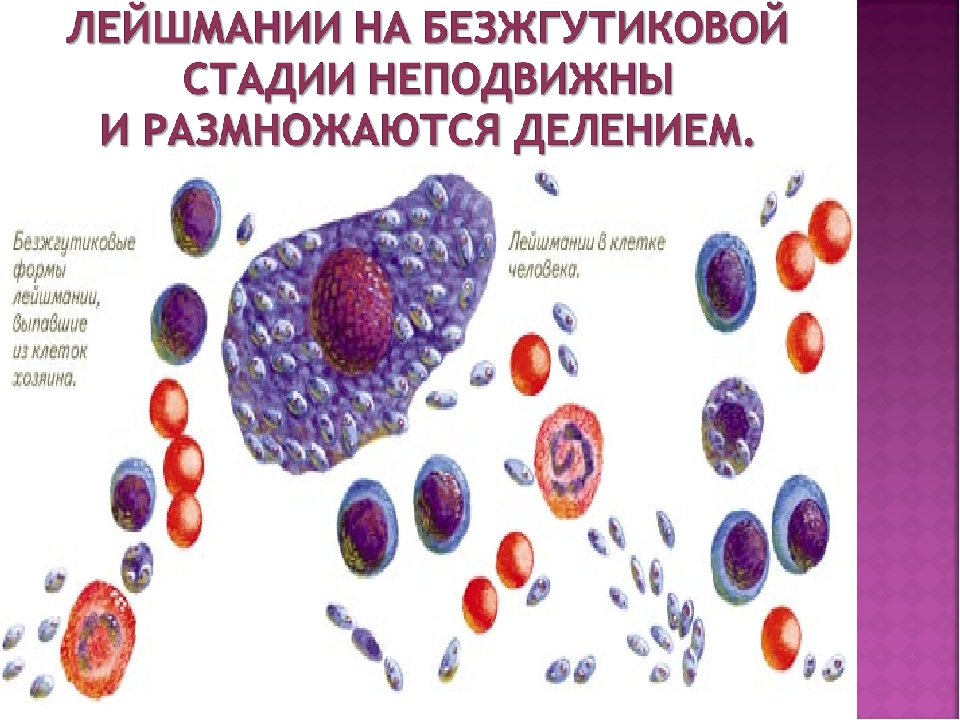
Первыми на место повреждения прибывают полиморфоядерные нейтрофилы, которые фагоциритуют паразитов. Внутри нейтрофилов лейшмании не размножаются и не превращаются в амастиготы. Затем, когда нейтрофилы переходят в фазу апоптоза, они уничтожаются макрофагами, и лейшмании проникают в макрофаги, не вызывая иммунного ответа.
Внутри макрофага лейшмании заключены в так называемые «паразитифорные вакуоли», которые образуются от слияния первичной фагосомы c лизосомами и эндосомами. В них промастиготы транформируются в амастиготы. При этом происходят изменения в морфологии — продолговатые промастиготы с длинным жгутиком превращаются в овальные амастиготы с коротким жгутиком, в метаболизме, чтобы приспособиться к кислой среде, и в биохимическом составе мембраны. Трансформация занимает от двух до пяти дней. Амастиготы способны выживать в кислой среде этих вакуолей и питаться их содержимым. Внутри вакуоли амастиготы медленно размножаются, и каждый цикл размножения занимает около 24 часов.
Трансформация занимает от двух до пяти дней. Амастиготы способны выживать в кислой среде этих вакуолей и питаться их содержимым. Внутри вакуоли амастиготы медленно размножаются, и каждый цикл размножения занимает около 24 часов.
При кожном лейшманиозе инфильтрат образуется в коже и содержит преимущественно макрофаги, а также лимфоидные клетки и немного плазматических клеток. При висцеральном лейшманиозе очаги инфекции образуются в органах ретикуло-эндотелиальной системы.[17]
История открытия
Факсимиле иллюстрации со страницы 935 из статьи Боровского «О сартовской язве». Рисунки поменяны местами: первый на месте второго, и наоборот.Первое точное описание лейшмании в срезах кожных язв было опубликовано российским хирургом П. Ф. Боровским в «Военно-медицинском журнале» в 1898 году в статье «О сартовской язве». Боровский верно описал структуру паразитов и их отношение к тканям хозяина. Наблюдения Боровского подтвердил его коллега по Ташкентскому военному госпиталю К.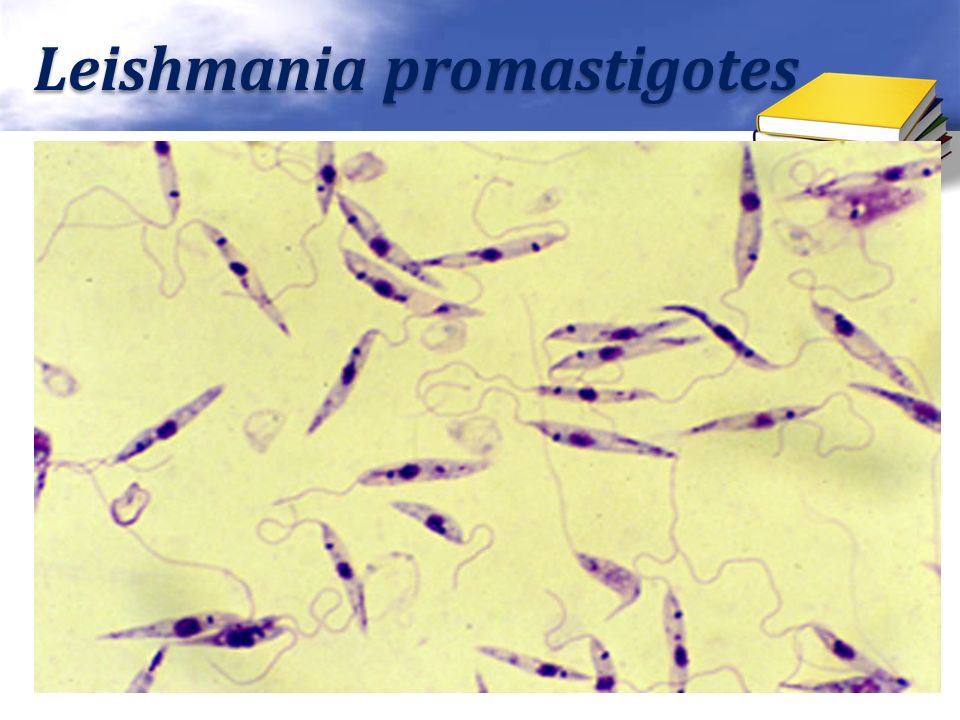 Шульгин в журнале «Русский врач» в 1902 г. В 1903 г. американский врач Райт опубликовал независимое описание паразитов в кожной язве у девочки из Армении, которое принципиально не отличалось от описания Боровского, но содержало качественные иллюстрации. Райт предложил для открытого организма название
Шульгин в журнале «Русский врач» в 1902 г. В 1903 г. американский врач Райт опубликовал независимое описание паразитов в кожной язве у девочки из Армении, которое принципиально не отличалось от описания Боровского, но содержало качественные иллюстрации. Райт предложил для открытого организма название
В 1904 г. Марциновский и Богров опубликовали на русском и немецком описание возбудителя восточной язвы, снабжённое микрофотографиями, для которого они предложили название Ovoplasma orientale, причём, по всей видимости, работали они, не зная о работах Райта, хотя были знакомы с публикацией Боровского. В упомянутой статье они преуменьшают заслуги Боровского и неверно приводят его наблюдения. Хотя наблюдения Марциноского и Богрова опубликованы через несколько месяцев после Райта, их исследование было проведено на несколько месяцев раньше [18].
Классификация
В классификации лейшманий можно выделить четыре перекрывающихся периода. В начале XX в. основой классификации служили клинико-эпидемиологические и морфологические признаки, и лейшмании подразделялись на возбудителей висцерального лейшманиоза — L. donovani и возбудителей кожного лейшманиоза — L. tropica.
В 1913—1915 году В. Л. Якимов выделил два морфологических варианта возбудителя кожного лейшманиоза в Туркестане — с крупными или мелкими амастиготами — Leishmania tropica var. major и L. tropica var. minor[19], впоследствии они чаще обозначались как подвиды, без обозначения «var.». В 1940-х годах Кожевников и Латышев связали эти морфологические разновидности с двумя разными формами кожного лейшманиоза — антропонозным (L. tropica) и зоонозным (L. major)[20]
 Морфологическая классификация применяется на практике и в начале XXI века; так, в провинции Балх на севере Афганистана, где встречается инфекция обоими этими видами, вид лейшманий определяют микроскопически на основании размера и количества амастигот в мазках из язв[14].
Морфологическая классификация применяется на практике и в начале XXI века; так, в провинции Балх на севере Афганистана, где встречается инфекция обоими этими видами, вид лейшманий определяют микроскопически на основании размера и количества амастигот в мазках из язв[14].Тенденция считать возбудителей кожного лейшманиоза подвидами L. tropica просуществовала довольно долго. Так, в 1953 году Biagi предложил назвать описанного им возбудителя кожного лейшманиоза в Центральной Америке L. tropica var. mexicana[15].
Серологические методы классификации лейшманий начали применяться с середины 1910-х годов. Они позволяли отличать виды или комплексы видов. Реакция агглютинации и реакция связывания комплемента показали, что L. donovani и L. infantum серологически неразличимы. В 1930-х годах использование антисыворток позволило различить эти два вида [23]. В дальнейшем, с применением моноклональных антител, стало возможно различать отдельные серотипы внутри видов[24].
Характеризация лейшманий методом электрофореза изоферментов разрабатывалась с 1970-х годов начиная с отдельных ферментов[25], затем комбинаций ферментов[26][27]. Для обеспечения достаточной разрешающей способности требуется применять системы из многих ферментов — десяти до пятнадцати[28]. Штаммы организмов с одинаковыми электрофоретическими профилями называеются «зимодем».
Наиболее полный банк лейшманий, охарактеризованных изоферментным анализом, хранится в университете Монпелье 1 (фр.). Харктеризация проводится на основании электрофореза 15 изоферментов с 1981 года. Начиная с 1989 года применяется метод изоэлектрического фокусирования
Изоферментный анализ в последние четверть века является стандартным методом типирования лейшманий на видовом и подвидовом уровнях, потому что он был применён к наибольшему количеству самых разнообразных штаммов по сравнению с другими методами[31].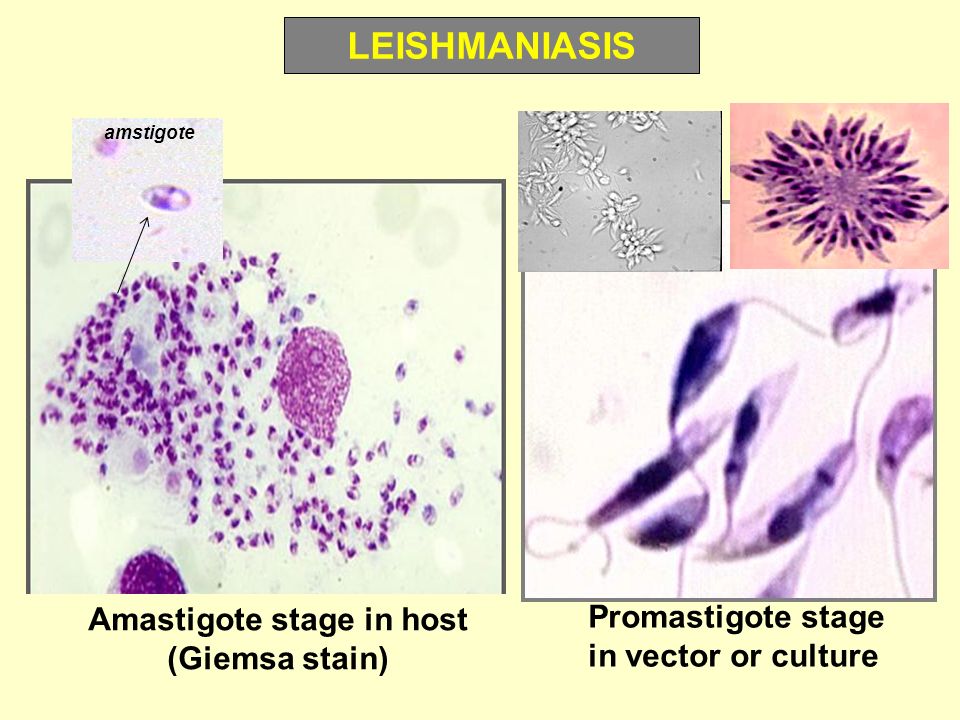
Зимодемы в лаборатории Монпелье получают обозначение, состоящее из сокращения MON (Монпелье), за которым следует порядковый номер зимодема. По состоянию на 2008 год, в лаборатории хранится более 3000 образцов лейшманий, разделённых на более чем 260 зимодемов.
Генетические методы, основанные на ПЦР, начали применяться с 1970-х годов. Эти методы имеют некоторые ограничения. В частности, изучение гетерозиготности и рекомбинации недостаточно разработаны для видов, в жизненном цикле которых нет гаплоидной стадии[31].
Разные методы классификации в основном совпадают в определении комплексов видов и генетических связей между ними.
На основании хода инфекции в моските-переносчике, род Leishmania делится на два подрода: Leishmania (Leishmania) и Leishmania (Viannia). Представители подрода Leishmania прикрепляются к эпителию средней кишки москита, а подрода Viannia — также к эпителию задней кишки. Представители подрода Leishmania распространены в Старом и Новом Свете, а подрода Viannia — только в Новом Свете[7].
Паразитов рептилий одни авторы выделяют в третий подрод лейшманий — Leishmania (Sauroleishmania), другие рассматривают его как отдельный род трипаносоматид — Sauroleishmania[7].
Геномика
Геномы трёх видов (L. major, L. infantum и L. braziliensis) были отсеквенированы, при этом было выявлено более 8300 генов белков и 900 генов РНК. Почти 40% белок-кодирующих генов были распределены по 662 семействам, содержащим от 2 до 500 генов. Небольшие семейства в основном представлены генами, образующими тандемные повторы в различных локусах по всему геному. Каждая из 35 или 36 хромосом организована в небольшое число кластеров из 10-100 генов, расположенных на одной цепи ДНК. Эти кластеры могут быть расположены «голова к голове» (расходящиеся) или хвост к хвосту (сходящиеся). В последнем случае они могут быть разделены генами рРНК, тРНК или мяРНК. Транскрипция белок-кодирущих генов начинается в области расхождения кластеров и продолжается полицистронно до области переключения цепей между сходящимися кластерами.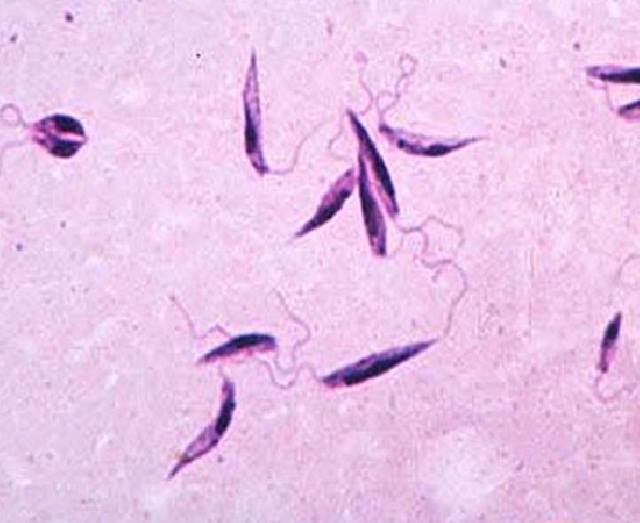 Теломеры лейшманий обычно относительно короткие и состоят из нескольких типов повторяющихся последовательностей[32].
Теломеры лейшманий обычно относительно короткие и состоят из нескольких типов повторяющихся последовательностей[32].
В 2009 году было показано, что в организме насекомого у лейшманий происходит процесс обмена генетической информацией, предполагающий мейоз[33].
Литература
|
По данным ВОЗ висцеральный и кожный лейшманиозы отнесены к «забытым тропическим болезням». Однако на территории Российской Федерации ежегодно регистрируются завозные случаи. Лейшманиозы вызываются простейшими (род Leishmania) внутриклеточными паразитами – это природно-очаговое, зоонозное, трансмиссивное заболевание человека, то есть для их возникновения нужен переносчик – москит. Различают две группы лейшманиозов человека: висцеральный, или кала-азар (поражение органов ретикуло-эндотелиальной системы: печени, селезенки, костного мозга, лимфатических узлов) и кожный, или болезнь Боровского (локальные патологические изменения кожи, иногда слизистых). Инкубационный период при кожном зоонозном 10-20 дней, может сокращаться до недели и удлиняться до полутора месяцев. При висцеральном лейшманиозе составляет от 20 дней до нескольких (3-5) месяцев. Иногда (довольно редко) затягивается до года Ежегодно в мире (в тропиках и субтропиках): По данным ВОЗ регистрируется около 90% случаев в странах мира: Завозные случаи лейшманиоза регистрируются и в Российской Федерации. |
Ученые установили, почему болезнь лейшманиоз приобретает тяжелые формы
Самые тяжелые формы болезни лейшманиоз, вызывающей страшные язвы на теле человека, являются результатом того, что переносящие эту болезнь паразиты содержат в себе еще и вирус.
Вместе с какао, табаком и прочими дарами из Нового Света охотники за приключениями открыли и несколько редких болезней, среди которых кожно-слизистый лейшманиоз (лейшманиоз Нового Света или эспундия).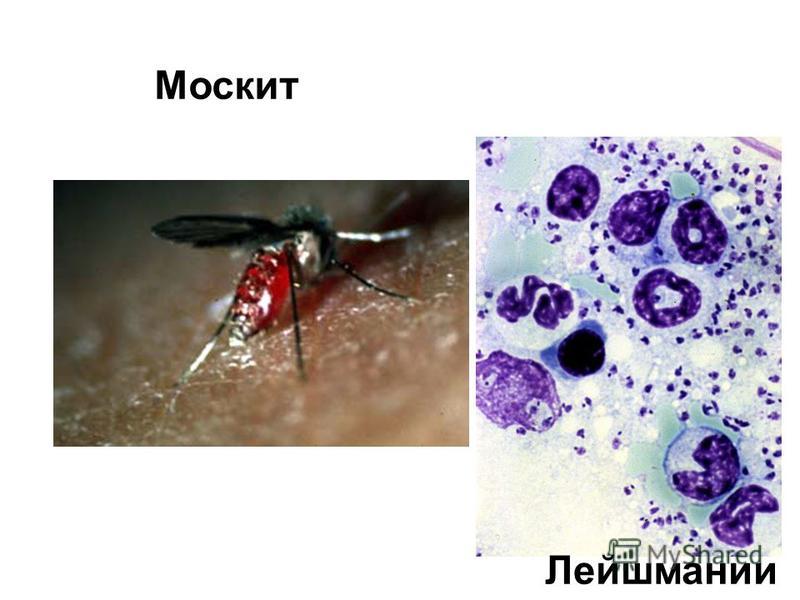 К счастью, в Европе, вовремя научившейся (а нынче уже разучившейся) прижигать язвы сульфидом сурьмы, сия паразитарная зараза не прижилась. А вот в тропической и субтропической Америке простейшие паразиты-лейшмании, поражающие слизистые дыхательных путей, могут стать причиной смерти.
К счастью, в Европе, вовремя научившейся (а нынче уже разучившейся) прижигать язвы сульфидом сурьмы, сия паразитарная зараза не прижилась. А вот в тропической и субтропической Америке простейшие паразиты-лейшмании, поражающие слизистые дыхательных путей, могут стать причиной смерти.
К счастью, в погоне за лекарством от ВИЧ, малярии и туберкулеза научная общественность не забывает и о других болезнях. Аннета Ивес из Университета Лозанны и её коллеги объяснили, почему последствия заражения одним и тем же паразитом (Leishmania Viannia) варьируют от простых язв на коже до тяжелейшего воспаления слизистых.
Оказалось, что наиболее тяжелые формы заболевания возникают при наличии в цитоплазме паразита вирусной РНК, дезориентирующей нашу иммунную систему.
Лейшманиозы
группа паразитарных природно-очаговых, в основном зоонозных, трансмиссивных заболеваний, распространенных в тропических и субтропических странах; вызывается паразитирующими простейшими рода Leishmania, которые передаются человеку через.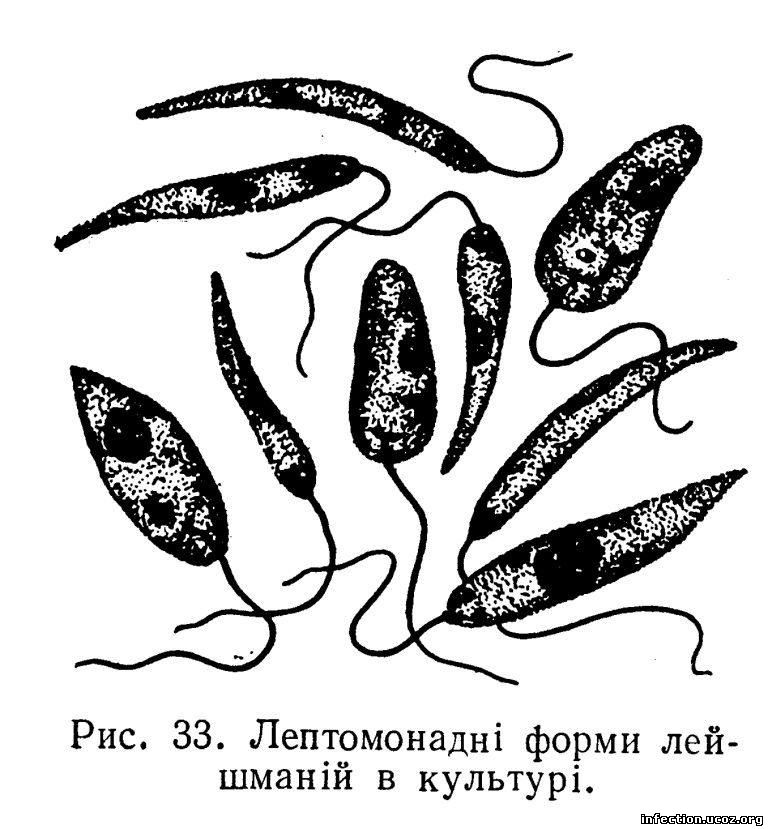 ..
..
Несмотря на то что организм лейшманий устроен намного сложнее, чем у бактерий и вирусов, размножаться эти паразиты предпочитают внутри клеток, причем именно иммунной системы. Распространяясь с укусом москитов, которых они тоже неплохо «приручили», лейшмании попадают вглубь кожи, где им навстречу устремляются наши нейтрофилы и макрофаги.
Последние и становятся жертвой паразитов: проникая внутрь клетки, лейшмании начинают размножаться, в большинстве случаев ограничиваясь, впрочем, кожей и лишь изредка, в 5–10% случаев, переходя на слизистые.
Раньше ученые связывали это с индивидуальностью защитных реакций и ослабленным звеном антипаразитарного ответа у подверженных кожно-слизистому лейшманиозу.
Позже из язв слизистых были выделены агрессивные формы L. Viannia, всегда вызывающие тяжелое поражение при заражении хомячков, но причина их патогенности все равно оставалась необъяснимой. Предпринявшие очередной штурм в борьбе с этой «забытой болезнью» Ивес и коллеги сначала пошли по традиционному пути — детально проанализировали иммунный ответ на агрессивные и умеренные формы лейшманиоза.
Viannia, всегда вызывающие тяжелое поражение при заражении хомячков, но причина их патогенности все равно оставалась необъяснимой. Предпринявшие очередной штурм в борьбе с этой «забытой болезнью» Ивес и коллеги сначала пошли по традиционному пути — детально проанализировали иммунный ответ на агрессивные и умеренные формы лейшманиоза.
«Коктейль» цитокинов (сигнальных молекул нашей иммунной системы, образующихся при заражении агрессивными L. Viannia) больше напоминал реакцию на вирусную инфекцию, нежели на паразитарную инвазию.
Справка
Толл-подобные рецепторы (Toll-like receptor) — класс клеточных рецепторов, которые распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Играют ключевую роль во врождённом иммунитете. Например…
Подобная неспособность правильно определить врага часто объясняет индивидуальную предрасположенность к вирусным или бактериальным заболеваниям. Казалось бы, это и должно было склонить ученых в пользу старой «индивидуальной» теории и объяснению всего особенностями конкретного организма, а не возбудителя.
Казалось бы, это и должно было склонить ученых в пользу старой «индивидуальной» теории и объяснению всего особенностями конкретного организма, а не возбудителя.
К счастью, авторы публикации в Science на этом не остановились, решив получше «обыскать» лейшманий на предмет скрытых уловок.
Заблокировав у хомячков работу определенных Toll-like рецепторов (за открытие класса этих структур у млекопитающих до сих пор прочат Нобелевскую премию россиянину Руслану Меджитову, работающему в США), ученые почти полностью защитили животных от агрессивных лейшманий.
Выяснилось, что агрессивные паразиты отличаются от умеренных всего лишь содержанием небольшого количества двуспиральной РНК в цитоплазме.
Определить, что эта РНК принадлежит вирусу, уже не составило никакого труда.
close
100%
08 сентября 17:29
Весьма элегантная головоломка была решена, в очередной раз подтвердив легкость, с которой паразиты учатся «сотрудничать» друг с другом. Если учесть всех известных (можно смело добавить «пока») участников, то картина представляется следующая. Комар, отпивая крови из язвы, подхватывает лейшманий вместе с заключенными в них вирусами. Через неделю паразиты уже блокируют просвет пищеварительного канала комара своими телами и секретируемым ими гелем.
Если учесть всех известных (можно смело добавить «пока») участников, то картина представляется следующая. Комар, отпивая крови из язвы, подхватывает лейшманий вместе с заключенными в них вирусами. Через неделю паразиты уже блокируют просвет пищеварительного канала комара своими телами и секретируемым ими гелем.
Самка с блокированным пищеварительным каналом не может глотать, и при укусе у неё возникают спастические движения, в результате которых она «отрыгивает» лейшманий в ранку на коже хозяина.
Первыми на место ранения приходят специальные лейкоциты нейтрофилы, которые поедают, но не переваривают лейшманий. Через некоторое время появляются макрофаги — клетки иммунной системы, очищающие организм от отживших свой век клеток. Внутри макрофагов лейшмании перерождаются и начинают делиться, разрушая своих хозяев и поражая все новые и новые клетки. Их аппетит сдерживают другие клетки иммунной системы, ограничивая масштабы инвазии.
И здесь на помощь приходят вирусы, обманывающие нашу защитную систему и сигнализирующие о том, что бороться надо вовсе не с паразитами.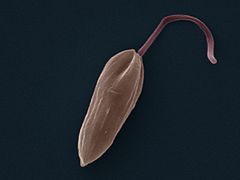
В случае неудачного сценария болезнь распространяется, вовлекает слизистые дыхательных путей и человек погибает. Сделать в этой ситуации можно не так уж много: в отличие от тех же бактерий, обмен веществ лейшманий ближе к нашему, так что выбор препаратов для лечения невелик.
Теперь к соединениям сурьмы достаточно будет добавить ингибитор упомянутых Toll-like рецепторов 3 типа. Который, впрочем, надо ещё поискать.
Определение антител к лейшмании (Leischmania) в крови , цены в Нижнем Новгороде
В данном анализе определяются суммарные антитела классов IgM и IgG к Leishmania infantum.
Определение специфических антител используется в качестве дополнительного метода диагностики висцерального лейшманиоза с методом изучения тканей под микроскопом. Достоверный прирост антител в 4 раза и более при повторном исследовании с интервалом в 10-14 дней подтверждает диагноз заболевания.
Общая информация об исследовании
Лейшманиозы — протозойные, трансмиссивные заболевания, возбудителем которых является лейшмания, относящаяся к семейству Trypanosmatidae. Передается инфекция через укус женской особи песчаной мухи (род Phlebotomus).
Передается инфекция через укус женской особи песчаной мухи (род Phlebotomus).
Существуют три основных типа лейшманиозов:
- кожный — возбудитель L. major;
- кожно-слизистый — возбудитель L. Brasiliensis;
- висцеральный — вызывает L. infantum.
Для висцеральной формы характерно то, что лейшмании диссеминируют и интенсивно размножаются в ретикулоэндотелии паренхиматозных органов (селезенке, печени, костном мозге). Заболевание характеризуется хроническим течением, волнообразной лихорадкой, гепатоспленомегалией, панцитопенией. Географическая локализация Leishmania infantum — бассейн Средиземного моря, Ближний и Средний Восток, Центральная и Южная Америка.
В жизненном цикле лейшманий выделяют позвоночных хозяев — человек, собаки, волки, шакалы и беспозвоночный хозяин и специфический переносчик — москит рода Phlebotomus. Питаясь от больных животных и людей, москиты всасывают паразитов с кровью. В желудке москитов в течение первых суток образуются жгутиковые формы.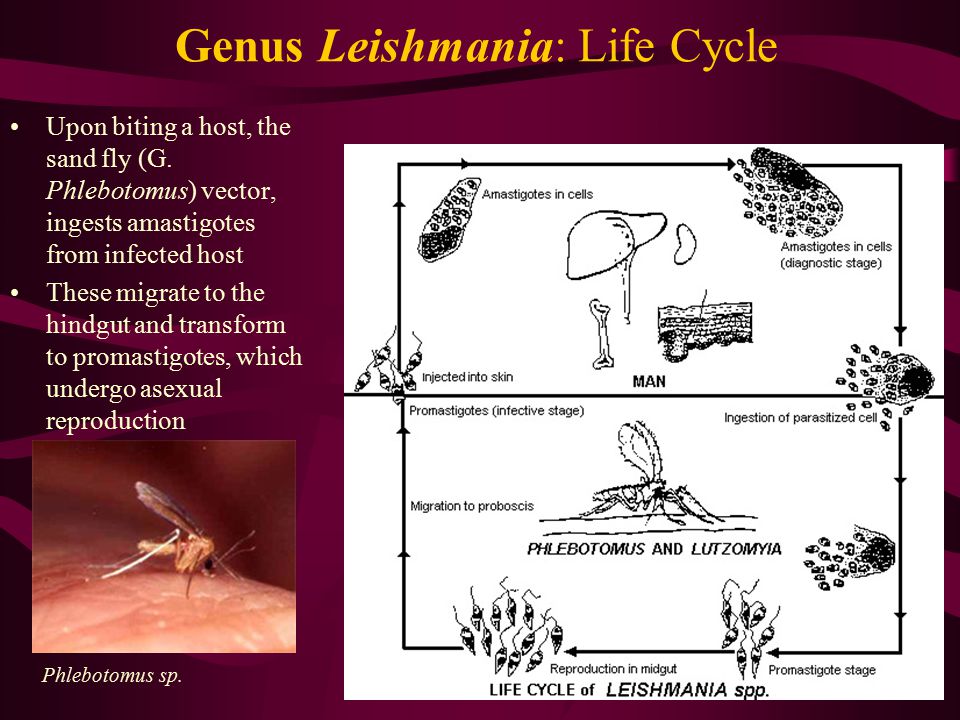 На 6-8-е сутки лейшмании концентрируются в глотке москита, образуя блок, при укусе происходит заражение позвоночного хозяина. Пути заражения: трансплацентарный, гемотрансфузионный и перкутанный.
На 6-8-е сутки лейшмании концентрируются в глотке москита, образуя блок, при укусе происходит заражение позвоночного хозяина. Пути заражения: трансплацентарный, гемотрансфузионный и перкутанный.
При ВИЧ висцеральный лейшманиоз все чаще встречается как оппортунистическая инфекция. Большинство таких случаев зарегистрировано в Южной Европе, висцеральным лейшманиозом там страдают уже не только дети младшего возраста. У ВИЧ-инфицированных даже слабовирулентные штаммы лейшманий могут вызвать поражение внутренних органов.
Микробиологическая диагностика достаточно сложна и основана на исследовании биоптатов костного мозга, печени, селезенки и лимфатических узлов. В связи с этим иммунологические методы занимают лидирующие позиции в диагностике лейшманиоза.
Показания к назначению данного исследования
- Диагностика лейшманиоза.
- Дифференциальная диагностика с другими патологиями: малярией, тифопаратифозными заболеваниями, туберкулезом, сепсисом, абсцессом печени, лимфогранулематозом, гистоплазмозом, бронхопневмонией.

- Лихорадка неясного генеза, особенно у лиц, в анамнезе которых пребывание в эндемичных районах (Южная Европа, Северная Африка, Ближний Восток, Средняя Азия и Северо-Западный Китай).
- ВИЧ-инфицирование.
Литература:
- Бронштейн А.М., Токмалаев А.К. Паразитарные болезни человека. Протозоозы и гельминтозы. — М.: «Российский университет дружбы народов», 2002.
- Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. — М.: ООО «Медицинское информационное агентство», 2009. С. 683-685.
- Методические указания МУК 4.2.3145-13 «Лабораторная диагностика гельминтозов и протозоозов» (утверждены от 26 ноября 2013 года).
Набор Leishmania infantum IgG ELISA
Лейшмании – простейшие, относящиеся к семейству трипаносоматиды. Паразиты существуют в двух формах: промастиготы в средней кишке насекомого-переносчика, и амастиготы в фаголизосомах макрофагов в организме их хозяина-млекопитающего. В макрофагах они живут в форме круглых неподвижных амастигот (3-7 мм в диаметре). Москиты поглощают макрофаги во время высасывания крови и в их желудок высвобождаются амастиготы. Практически сразу же амастиготы превращаются в подвижные, удлиненные (10-20 мкм), жгутиковые промастиготы, которые мигрируют в пищеварительный тракт москита и после размножения продвигаются вперед к слюнным железам насекомого. Лейшманиозы – широко распространенная в мире группа болезней, вызываемых паразитами. «Тип» определяется основной локализацией инфицированных макрофагов. У людей бывают четыре разные формы лейшманиоза с широким диапазоном клинических проявлений, все они могут иметь тяжелые последствия. Лейшманиозом в настоящее время поражено около 12 миллионов человек в 88 странах, все эти страны, кроме 16, являются странами развивающегося мира. По оценкам 350 миллионов человек подвергаются риску инфицирования разными видами паразитов лейшманий, частота новых случаев ежегодно составляет около 2 миллионов (1-1,5 миллиона случаев кожного лейшманиоза, 500000 случаев висцерального лейшманиоза).
В макрофагах они живут в форме круглых неподвижных амастигот (3-7 мм в диаметре). Москиты поглощают макрофаги во время высасывания крови и в их желудок высвобождаются амастиготы. Практически сразу же амастиготы превращаются в подвижные, удлиненные (10-20 мкм), жгутиковые промастиготы, которые мигрируют в пищеварительный тракт москита и после размножения продвигаются вперед к слюнным железам насекомого. Лейшманиозы – широко распространенная в мире группа болезней, вызываемых паразитами. «Тип» определяется основной локализацией инфицированных макрофагов. У людей бывают четыре разные формы лейшманиоза с широким диапазоном клинических проявлений, все они могут иметь тяжелые последствия. Лейшманиозом в настоящее время поражено около 12 миллионов человек в 88 странах, все эти страны, кроме 16, являются странами развивающегося мира. По оценкам 350 миллионов человек подвергаются риску инфицирования разными видами паразитов лейшманий, частота новых случаев ежегодно составляет около 2 миллионов (1-1,5 миллиона случаев кожного лейшманиоза, 500000 случаев висцерального лейшманиоза). Висцеральный лейшманиоз является самой тяжелой формой заболевания, при котором уровень смертности в случае отсутствия лечения составляет практически 100%. Как и многие другие тропические болезни, лейшманиозы связаны с экономическим развитием и антропогенными изменениями окружающей среды, повышающими подверженность воздействию москитов-переносчиков заболевания. Географическая область распространения ограничивается ареалом москитов. СПИД и другие иммунодепрессивные состояния повышают риск развития висцеральной формы лейшманиоза у людей, инфицированных лейшманиями. Одновременное заражение лейшманиями/ВИЧ считается по-настоящему «новой болезнью», особенно в Юго-западной Европе, где 25-70% случаев висцерального лейшманиоза у взрослых связаны с ВИЧ-инфекцией, и 1.5-9.5% людей со СПИДом страдают от впервые приобретенного или реактивированного висцерального лейшманиоза. Установлено, что основную группу риска составляют потребители инъекционных наркотиков.
Висцеральный лейшманиоз является самой тяжелой формой заболевания, при котором уровень смертности в случае отсутствия лечения составляет практически 100%. Как и многие другие тропические болезни, лейшманиозы связаны с экономическим развитием и антропогенными изменениями окружающей среды, повышающими подверженность воздействию москитов-переносчиков заболевания. Географическая область распространения ограничивается ареалом москитов. СПИД и другие иммунодепрессивные состояния повышают риск развития висцеральной формы лейшманиоза у людей, инфицированных лейшманиями. Одновременное заражение лейшманиями/ВИЧ считается по-настоящему «новой болезнью», особенно в Юго-западной Европе, где 25-70% случаев висцерального лейшманиоза у взрослых связаны с ВИЧ-инфекцией, и 1.5-9.5% людей со СПИДом страдают от впервые приобретенного или реактивированного висцерального лейшманиоза. Установлено, что основную группу риска составляют потребители инъекционных наркотиков.
Описание
Набор Leishmania infantum IgG ELISA каталожный номер LEIG0310, предназначены для качественного определения антител класса IgG к лейшманиям (Leishmania infantum) в сыворотке или плазме человека, методом твердофазного иммуноферментного анализа.
Принцип работы набора
Качественное иммуноферментное определение антител к лейшманиям (Leishmania infantum) основано на методе твердофазного иммуноферментного анализа (ELISA). На лунки микротитрационных стрипов уже нанесены антигены Leishmania infantum для связывания соответствующих антител из образца. После промывания лунок для удаления несвязанного материала образца добавляют конъюгат белка A, меченного пероксидазой хрена (HRP). Этот конъюгат связывается с удержанными специфическими антителами к Leishmania infantum. Иммунный комплекс, образованный связанным конъюгатом, визуализируется посредством добавления тетраметилбензидинового субстрата (ТМБ), который в результате реакции дает продукт синего цвета. Интенсивность цвета данного продукта пропорциональна количеству специфических антител класса IgG к Leishmania infantum в образце. Реакцию останавливают добавлением серной кислоты. Это приводит к появлению желтого цвета в конечной точке. С помощью ридера для микролуночных планшетов для ИФА определяют оптическую плотность на длине волны 450 нм.
Состав набора
Набор реагентов Leishmania infantum IgG ELISA на 96 определений. В набор входят стрипы покрытые антигеном Leishmania infantum, конъюгат обработанного пероксидазой белка A, промывочный буфер, ТМБ субстрат, стоп-раствор, буфер для разведения, положительный контроль, пороговый контроль, отрицательный контроль.
Аналитические характеристики набора
Специфичность диагностического метода составляет > 85%. Чувствительность диагностического метода составляет 91%. Продолжительность исследования 1 час 45 минут, небольшой инкубационный период (60 мин/30 мин/15 мин). 10 мкл сыворотки или плазмы на каждый тест. Система обнаружения (OD 450nm/620nm). Готовые к использованию реагенты с цветной кодировкой. Ломкие стрипы для микротитрования. Объём набора 96 определений. Хранение при температуре 2-8°C. Сроки годности до двух лет. Логотип CE.
Клинические значения
Существует две основные формы заболевания: висцеральный лейшманиоз (visceral leishmaniasis), при котором поражаются клетки различных внутренних органов, и кожный лейшманиоз (cutaneous leishmaniasis), при котором поражаются кожа и подкожные ткани. Инкубационный период при висцеральном лейшманиозе продолжается от 3 недель до 3 лет (чаще несколько месяцев). Заболевание начинается постепенно, нарастает общая слабость, появляется лихорадка, которая часто бывает волнообразной. Отмечается бледность кожи вследствие анемии, кожа может быть тёмной за счет поражения надпочечников, иногда наблюдается геморрагическая сыпь. Могут возникнуть язвочки в полости рта. Состояние больных прогрессивно ухудшается, они худеют, нарастают анемия, лейкопения, выявляется значительное увеличение печени (до пупочной линии) и селезёнки (до полости малого таза). Кожный лейшманиоз протекает в виде антропонозного и зоонозного типа. Антропонозный тип (поздно изъязвляющий кожный лейшманиоз городского типа, ашхабадка) характеризуется длительным инкубационным периодом (3-8 месяцев). На месте внедрения возбудителя образуется небольшой бугорок (диаметром 2-3 мм), медленно увеличивающийся и через 3-6 месяцев покрывающийся чешуйчатой корочкой, под которой обнаруживается язва с подрытыми неровными краями.
Инкубационный период при висцеральном лейшманиозе продолжается от 3 недель до 3 лет (чаще несколько месяцев). Заболевание начинается постепенно, нарастает общая слабость, появляется лихорадка, которая часто бывает волнообразной. Отмечается бледность кожи вследствие анемии, кожа может быть тёмной за счет поражения надпочечников, иногда наблюдается геморрагическая сыпь. Могут возникнуть язвочки в полости рта. Состояние больных прогрессивно ухудшается, они худеют, нарастают анемия, лейкопения, выявляется значительное увеличение печени (до пупочной линии) и селезёнки (до полости малого таза). Кожный лейшманиоз протекает в виде антропонозного и зоонозного типа. Антропонозный тип (поздно изъязвляющий кожный лейшманиоз городского типа, ашхабадка) характеризуется длительным инкубационным периодом (3-8 месяцев). На месте внедрения возбудителя образуется небольшой бугорок (диаметром 2-3 мм), медленно увеличивающийся и через 3-6 месяцев покрывающийся чешуйчатой корочкой, под которой обнаруживается язва с подрытыми неровными краями.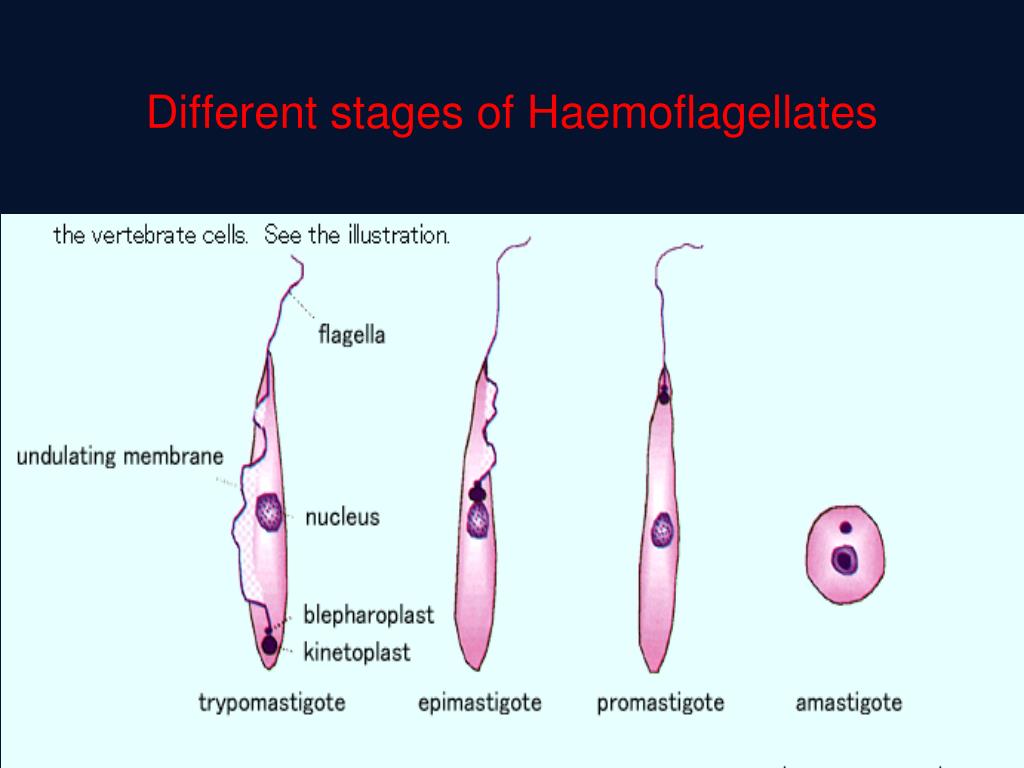 Рубцевание проходит медленно и заканчивается через 1-2 года. Зоонозный тип ложного лейшманиоза (сельский тип) характеризуется более коротким инкубационным периодом (до 3 недель, бугорок на месте укуса быстро увеличивается, через несколько дней его диаметр достигает 10-15 мм. В центре бугорка происходит некроз и открывается язва с широким инфильтратом и отёком вокруг. Диаметр язвы иногда доходит до 5 см. К 3-му месяцу дно язвы очищается, а через 5 месяцев заканчивается рубцевание. Для диагноза имеют значение указание на пребывание в эндемичных по лейшманиозу местностях в последние 1-2 года, характерные клинические симптомы, картина крови. Доказательством болезни служит обнаружение лейшманий.
Рубцевание проходит медленно и заканчивается через 1-2 года. Зоонозный тип ложного лейшманиоза (сельский тип) характеризуется более коротким инкубационным периодом (до 3 недель, бугорок на месте укуса быстро увеличивается, через несколько дней его диаметр достигает 10-15 мм. В центре бугорка происходит некроз и открывается язва с широким инфильтратом и отёком вокруг. Диаметр язвы иногда доходит до 5 см. К 3-му месяцу дно язвы очищается, а через 5 месяцев заканчивается рубцевание. Для диагноза имеют значение указание на пребывание в эндемичных по лейшманиозу местностях в последние 1-2 года, характерные клинические симптомы, картина крови. Доказательством болезни служит обнаружение лейшманий.
Информация для заказа |
|
Лейшмании (Leischmania)
ЛЕЙШМАНИИ
Leischmania donovani – возбудитель общего (висцерального) лейшманиоза, Leischmania tropica – кожного лейшманиоза, а Leischmania brasiliensis – кожно-слизистого лейшманиоза.
Лейшманиозы – трансмиссивные природно-очаговые заболевания. Висцеральный лейшманиоз распространен в странах Средиземноморья, Средней и Южной Азии, Африки и Южной Америки. Кожный лейшманиоз встречается в странах Южной Европы, Северной и Западной Африки, Ближнего Востока, Центральной и Южной Азии. Основной очаг кожнослизистого лейшманиоза находится в Южной и Центральной Америке.
Морфологические особенности (рис. 8): есть 2 формы – промастигота (имеет жгутик, отходящий от кинетопласта и размеры до 10-20 мкм) и амастигота (безжгутиковая округлая или овальная форма, размер – 3-5 мкм). Все возбудители лейшманиоза морфологически сходны, но имеют биохимические и антигенные различия.
Рис. 8. Морфология возбудителей лейшманиозов и их переносчика. А – схема,
Б – жгутиковая форма (7х40), В – безжгутиковая форма внутри макрофага (7х40), Г – москит
Жизненный цикл (рис.9): специфическими переносчиками лейшманий являются москиты р. Phlebotomus, у которых паразиты размножаются в пищеварительном тракте и накапливаются в хоботке. В организме переносчика образуется жгутиковая стадия – промастигота. Заражение человека происходит при укусах москитом (трансмиссивный путь). В организме человека и других позвоночных (рептилии,
В организме переносчика образуется жгутиковая стадия – промастигота. Заражение человека происходит при укусах москитом (трансмиссивный путь). В организме человека и других позвоночных (рептилии,
млекопитающие) лейшмании теряют жгутик, превращаются в амастиготы, переходят к внутриклеточному паразитированию и интенсивно размножаются.
Природными резервуарами L. donovani могут быть шакалы, собаки, грызуны, L. tropica – грызуны, L. braziliensis – грызуны, обезьяны, ленивцы.
Рис. 9. Жизненный цикл возбудителей лейшманиозов
ВИСЦЕРАЛЬНЫЙ ЛЕЙШМАНИОЗ (черная болезнь, лихорадка дум-дум, кала-азар, детский лейшманиоз)
Эти заболевания вызывают L. donovani и L. infantum.
Патогенное действие:
Механическое (разрушение клеток печени, селезенки, лимфатических узлов, красного костного мозга).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Инкубационный период длится от нескольких недель до 6-8 месяцев. Характерные симптомы: лихорадка неправильного типа, слабость, головная боль, интоксикация, истощение, пигментация кожи, сыпь, увеличение печени и селезенки, анемия. Болеют висцеральным лейшманиозом чаще дети. Перенесенные лейшманиозы дают стойкий
Болеют висцеральным лейшманиозом чаще дети. Перенесенные лейшманиозы дают стойкий
иммунитет.
Лабораторная диагностика: обнаружение лейшманий в пунктатах костного мозга (грудина), лимфатических узлов, иногда печени или селезенки.
Применяются иммунологические методы исследований (определение антител в сыворотке крови больных).
КОЖНЫЙ ЛЕЙШМАНИОЗ (пендинка, восточная язва)
Это заболевание вызывают 2 вида лейшманий: L. tropica major и L.tropica minor.
Патогенное действие:
Механическое (разрушение клеток кожи).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Характерные симптомы: небольшие эритематозные бугорки, которые появляются на коже через 2-6 недель после укуса москита. Позже формируется возвышающееся над кожей уплотнение, в центре которого образуется язва с приподнятыми краями (лейшманиома).
Весь процесс от первых проявлений до заживления язвы занимает от 3-4-х месяцев до 2-х лет. После заживления язв остаются обезображивающие рубцы.
Лабораторная диагностика: обнаружение лейшманий в мазках из содержимого язв.
КОЖНО-СЛИЗИСТЫЙ ЛЕЙШМАНИОЗ (эспундия)
Это заболевание вызывают L. brasiliensis, L.mexicana и L.peruviana.
Инкубационный период от 2-3-х недель до 1-3-х месяцев.
Патогенное действие:
Механическое (разрушение клеток кожи и слизистых оболочек и даже хрящей).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Характерные симптомы: язвы, увеличивающиеся в размерах и постепенно разрушающие все мягкие ткани. Разрастание тканей носа, губ,
глотки, гортани.
Болезнь трудно поддается лечению и часто заканчивается смертью в результате осложнений.
Лабораторная диагностика: обнаружение лейшманий в мазках из содержимого язв.
Профилактика лейшманиозов: индивидуальная защита от укусов москитов (реппеленты, противомоскитные сетки) и прививки ослабленными штаммами лейшманий, выявление и лечение больных, уничтожение москитов, уничтожение животных, которые являются резервуарами возбудителей заболеваний, санитарно-просветительная работа.
Тест SNAP Leishmania — IDEXX Russia
You are here
Простое определение результата даже при использовании образцов цельной крови.
- Используйте единственный тест, который позволяет эффективно выявлять лейшманиоз.
- Проводите тестирование ежегодно, чтобы предотвратить новые случаи лейшманиоза, одновременно повышая осведомленность об этих трансмиссивных инфекциях.
- SNAP-тесты обеспечивают высокоточную диагностику рядом с пациентом благодаря технологии, соответствующей качеству референтных лабораторий.
- С целью экономии времени и оптимизации рабочего процесса для автоматической активации тестов SNAP используйте анализатор SNAP Pro.
Свяжитесь с нами
Заболевания
Скрининг на наличие лейшманиоза (паразитарного заболевания).

Лейшманиоз
Лейшманиоз — это паразитарное заболевание, поражающее биологические системы и жизненно важные органы животного. Паразит переносится комарами и может причинить серьезный вред вашему домашнему питомцу. Важную роль играет раннее выявление. Если сразу же не провести диагностику и лечение заболевания, оно может быть опасно для жизни. Ваши клиенты полагаются на вас в вопросе получения самой точной доступной информации. Новый тест SNAP® Leishmania компании IDEXX позволяет получать результаты всего через 6 минут, проведя анализ в клинике. Разработан таким образом, чтобы обеспечивать максимальную точность результата при анализе как положительных, так и отрицательных контрольных образцов.
- Простое определение результата даже при использовании образцов цельной крови.
- В каждом наборе 10 тестов
- Специфичность 99,2%: снижение риска ложноположительных результатов
- Чувствительность 96,3%
youtube.com/embed/xC-ZHKZSoYk» frameborder=»0″ allowfullscreen=»true»/>
Поддержка
Оставить заявку
+7 (499) 951-12-55
Leishmania — обзор | Темы ScienceDirect
Leishmaniasis
Виды Leishmania — жгутиковые кинетопластические простейшие паразиты, передающиеся через укус самки москитов. Существуют кожные (CL), слизисто-кожные (MCL) и висцерализующие (VL) формы лейшманиоза человека. CL и MCL в Западном полушарии (преимущественно в Центральной и Южной Америке) вызываются членами комплекса L. mexicana и L. braziliensis , тогда как CL в Восточном полушарии (преимущественно в Индии, Центральной Азии и некоторых частях Африки). и Ближний Восток) вызывается членами группы L.tropica и L. major complex. VL, также известный как кала-азар, вызывается L. donovani в Индии, Бангладеш, Непале и Китае; L. infantum в Центральной Азии, Северной Африке и Южной Европе; и L. chagasi в Латинской Америке. Члены комплекса L. donovani являются важными появляющимися условно-патогенными микроорганизмами у пациентов с заболеванием приобретенного иммунодефицита. По оценкам, распространенность лейшманиоза во всем мире составляет 12 миллионов случаев, при этом около 350 миллионов человек подвержены риску заражения. 50 Лейшманизация, древняя практика инъекций живых паразитов Leishmania на Ближнем Востоке и в Центральной Азии в качестве средства активной иммунизации против болезней, предшествует вакцинации и может быть такой же старой, как вариоляция. Он основан на заражении человека живыми паразитами с помощью шипа или другого острого инструмента, чтобы искусственно создать кожное поражение. Процедура вызывает легкое заболевание (обычно размером 1-2 см) на необработанном участке, часто на руке или ягодицах, которые заживают в течение 3-4 месяцев.Успешная лейшманизация предотвращает возможность появления на лице косметически обезображивающего поражения («делийский нарыв» или «восточная язва»).
infantum в Центральной Азии, Северной Африке и Южной Европе; и L. chagasi в Латинской Америке. Члены комплекса L. donovani являются важными появляющимися условно-патогенными микроорганизмами у пациентов с заболеванием приобретенного иммунодефицита. По оценкам, распространенность лейшманиоза во всем мире составляет 12 миллионов случаев, при этом около 350 миллионов человек подвержены риску заражения. 50 Лейшманизация, древняя практика инъекций живых паразитов Leishmania на Ближнем Востоке и в Центральной Азии в качестве средства активной иммунизации против болезней, предшествует вакцинации и может быть такой же старой, как вариоляция. Он основан на заражении человека живыми паразитами с помощью шипа или другого острого инструмента, чтобы искусственно создать кожное поражение. Процедура вызывает легкое заболевание (обычно размером 1-2 см) на необработанном участке, часто на руке или ягодицах, которые заживают в течение 3-4 месяцев.Успешная лейшманизация предотвращает возможность появления на лице косметически обезображивающего поражения («делийский нарыв» или «восточная язва»).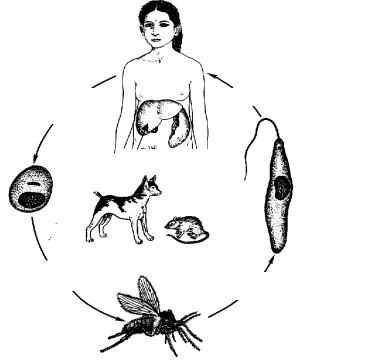 Он по-прежнему широко практикуется в Узбекистане и, возможно, в других местах Центральной Азии. В 1980-х годах лейшманизация была повторно введена в качестве чрезвычайной меры общественного здравоохранения во время ирано-иракской войны, когда было вакцинировано около 2 миллионов человек. 51 Иранская программа лейшманизации была впоследствии остановлена, когда стало известно, что до 3% индуцированных поражений длились более года; в некоторых случаях поражения никогда не заживали даже при последующей антипаразитарной химиотерапии сурьмой. 51 Среди препятствий, которые потенциально могут препятствовать дальнейшему совершенствованию методов лейшманизации, являются трудности со стандартизацией вирулентности вакцины и постоянный риск развития тяжелых и стойких поражений. 50
Он по-прежнему широко практикуется в Узбекистане и, возможно, в других местах Центральной Азии. В 1980-х годах лейшманизация была повторно введена в качестве чрезвычайной меры общественного здравоохранения во время ирано-иракской войны, когда было вакцинировано около 2 миллионов человек. 51 Иранская программа лейшманизации была впоследствии остановлена, когда стало известно, что до 3% индуцированных поражений длились более года; в некоторых случаях поражения никогда не заживали даже при последующей антипаразитарной химиотерапии сурьмой. 51 Среди препятствий, которые потенциально могут препятствовать дальнейшему совершенствованию методов лейшманизации, являются трудности со стандартизацией вирулентности вакцины и постоянный риск развития тяжелых и стойких поражений. 50
Стремясь создать более безопасную процедуру иммунизации против лейшмании, Иран в начале 1990-х годов начал национальную программу разработки вакцины. Вакцина первого поколения, содержащая убитых паразитов Leishmania, была подготовлена в рамках Надлежащей производственной практики Научно-исследовательским институтом вакцин и сывороток Рази (Хессарак, Иран).Банк клеток для вакцины был получен из идентичного штамма L. major , который ранее использовался для программы лейшманизации военного времени. Паразиты L. major были уничтожены автоклавированием, а затем получены рецептуры с БЦЖ. В рандомизированном двойном слепом исследовании безопасность и эффективность однократной инъекции вакцины сравнивали с контролем БЦЖ среди 3637 школьников. 51 Дети с предшествующим анамнезом КЛ или дети с положительной реакцией кожной пробы на лейшманиальный антиген были исключены из исследования.Иранские испытания продемонстрировали безопасность вакцины, хотя ее эффективность не была очевидна до 6 месяцев после инъекции. Было высказано предположение, что БЦЖ оказывала некоторый защитный эффект сразу после вакцинации. Также интересным было наблюдение, что защита была лучше продемонстрирована среди мальчиков, которые из-за иранской одежды и обычаев предположительно подвергаются большему количеству укусов москитов, чем девочки. 51 На основании этих результатов проводятся дополнительные испытания для оценки множественных инъекций убитой вакцины, а также новых составов с квасцами и ИЛ-12.Испытания по оценке убитой вакцины против L. donovani также проводятся в Судане. В Южной Америке вакцины против убитых L. amazonensis и L. mexicana производятся соответственно компаниями BIOBRAS (Бразилия) и Instituto de Biomedicina (Венесуэла). Анализируя данные нескольких клинических испытаний вакцин, состоящих из цельных паразитарных антигенов, Колер и Рид 50 пришли к выводу, что эффективность варьирует от 0 до 75% против CL, но только 6% против VL.Однако исследования подтверждают возможность вакцинации против лейшманиоза.
Частичный успех автоклавно убитых вакцин против Leishmania стимулировал усилия нескольких лабораторий по воспроизведению защиты вакцины с использованием рекомбинантных субъединичных антигенов второго поколения. Некоторые антигены были идентифицированы на основании их поверхностной локализации, распознавания клонами Т-клеток и иммуноскрининга с использованием сывороток пациентов. 50 На сегодняшний день ряд ведущих кандидатов показал себя многообещающим на мышах, особенно в сочетании с IL-12 или другими костимуляторами Th2-иммунитета.В некоторых случаях вакцинация плазмидными ДНК, кодирующими антигены, по отдельности или в комбинации, вызывает более сильный и стойкий иммунитет. Другой многообещающий подход заключался в разработке вакцин, состоящих из белков слюны москитов. 52
Дальше всего группа из IDRI (Исследовательского института инфекционных заболеваний) в Сиэтле, штат Вашингтон, продвинулась в разработке вакцины против лейшманиоза для человека. Группа IDRI разработала полипротеин, состоящий из трех приоритетных антигенов-кандидатов, TSA, LmSTI1 и LeIF, слитых в тандеме. 50 Ранее было показано, что у пациента с рефрактерной ML эти антигены стимулируют иммунный ответ (при введении с GM-CSF), что приводит к разрешению состояния. 53 Полипротеин известен как Leish-111f, и в качестве вакцины он обеспечивает длительную защиту у мышей Balb / c, когда в состав препарата входит запатентованный монофосфориллипид А, известный как MPL®-SE. 50 Доклинические испытания показали, что вакцина Leish-111f-MPL®-SE безопасна для пяти видов животных. 50 План клинических разработок заключается в проведении исследований безопасности и эффективности в терапевтических и профилактических целях с несколькими видами Leishmania в нескольких странах. На сегодняшний день безопасность и иммуногенность были продемонстрированы в Фазе 1 двойного слепого исследования с увеличением дозы при каждой дозе белка (10, 20 и 40 мкг), а терапевтические испытания ML и CL продолжаются в Перу и Бразилии. соответственно, чтобы оценить вакцину в сочетании со стандартной химиотерапией. 50
В регионах, где зоонозная передача лейшманиоза от собак является обычным явлением, возник дополнительный интерес к разработке вакцины, блокирующей передачу от собак. 54 Было показано, что антиген фукозо-маннозного лиганда (FML) L. donovani в сочетании с сапонином (Leishmune) индуцирует до 97% защиты от зоонозного лейшманиоза. 54
от описаний учебников к биологическому пониманию
Open Biol. 2017 сен; 7 (9): 170165.
Джек Сантер
1 Департамент биологических и медицинских наук, Оксфордский университет Брукс, кампус Хедингтон, Оксфорд, OX3 0BP, Великобритания
Кейт Гулл
2 Школа патологии сэра Уильяма Данна, Оксфордский университет, Оксфорд, Оксфорд, Оксфорд, Оксфорд, OX1 3RE, UK
1 Департамент биологических и медицинских наук, Университет Оксфорд Брукс, кампус Хедингтон, Оксфорд, OX3 0BP, Великобритания
2 Школа патологии сэра Уильяма Данна, Оксфордский университет, Оксфорд, OX1 3RE, Великобритания
Поступило 05.07.2017; Принята в печать 4 августа 2017 г.
Опубликовано Королевским обществом в соответствии с условиями лицензии Creative Commons Attribution License http://creativecommons.org/licenses/by/4.0/, которая разрешает неограниченное использование при условии указания автора и источника ссылки на эту статью. другие статьи в PMC.Abstract
Форма и форма простейших паразитов неразрывно связаны с их патогенностью. Эволюционное давление, связанное с установлением и поддержанием инфекции и передачей переносчику или хозяину, сформировало морфологию паразита.Однако не существует «единого для всех» морфологического решения этих различных факторов давления, и паразиты демонстрируют ряд различных морфологий, отражающих разнообразие их сложных жизненных циклов. В этом обзоре мы сосредоточимся на форме и форме Leishmania spp., Группы очень успешных простейших паразитов, вызывающих ряд заболеваний, от самовосстанавливающегося кожного лейшманиоза до висцерального лейшманиоза, который при отсутствии лечения приводит к летальному исходу.
Ключевые слова: морфология , Leishmania , патогенность, паразиты
1.Форма и форма
LeishmaniaКак и многие простейшие паразиты, Leishmania имеют дигенетический жизненный цикл с участием как млекопитающего-хозяина, так и насекомого-переносчика. Паразиты Leishmania демонстрируют множество различных морфологий клеток и ряд типов клеток (форм развития), которые адаптированы либо к хозяину, либо к вектору. Как видно на примере других паразитов, таких как Plasmodium и трипаносомы, некоторые из этих форм развития являются пролиферативными, тогда как другие находятся в состоянии покоя и предварительно адаптированы для передачи следующему хозяину [1–4].Большая часть интерпретации клеточной формы и функции у видов Leishmania происходит из более изученной базовой клеточной биологии трипаносом. Хотя это естественная передача знаний, необходимо сохранять бдительность в отношении того факта, что между двумя системами патогенов могут существовать нераспознанные различия, даже в их базовой биологии.
Leishmania имеет две основные различные морфологии клеток, примером которых является морфология промастигот у песчаных мух и морфология амастигот у млекопитающих-хозяев ( и ).Однако базовая клеточная архитектура сохраняется между двумя клеточными формами Leishmania и определяется поперечносшитыми микротрубочками субпелликулярного корсета. Этот массив сохраняется на протяжении всего клеточного цикла, поэтому деление клеток зависит от вставки и удлинения микротрубочек в существующий массив. Внутри клетки находятся ядро и набор однокопийных органелл, таких как митохондрия и аппарат Гольджи. Перед ядром находится кинетопласт, масса конкатенированной митохондриальной ДНК, которая непосредственно связана с базальным телом, от которого отходит жгутик [5–8].В основании жгутика находится впячивание клеточной мембраны, образующее вазоподобную структуру, называемую жгутиковым карманом, которая важна для этих паразитов, так как это единственное место эндоцитоза и экзоцитоза и, следовательно, является критически важным интерфейсом между паразитом и среда его хозяина [9].
Схема морфологии промастигот и амастигот и жизненный цикл Leishmania с выделенными различными типами клеток. ( a ) Морфология промастигот и амастигот выровнена вдоль задней передней оси с ключевыми структурами в указанных клетках.( b ) Рисунок, демонстрирующий текущее понимание жизненного цикла Leishmania с выделенными критическими событиями и различными типами клеток. Песчаная муха принимает пищу из крови инфицированного млекопитающего-хозяина и проглатывает макрофаг, содержащий амастигот Leishmania . Попав в среднюю кишку песчаной мухи, амастиготы дифференцируются в проциклические промастиготы. Затем проциклические промастиготы становятся промастиготами нектомонад, которые покидают перитрофический матрикс и затем прикрепляются к микроворсинкам в средней кишке, прежде чем перейти в грудную среднюю кишку и стомодальный клапан, где они дифференцируются в промастиготы лептомонад.Здесь промастиготы лептомонад дифференцируются либо на промастиготы гаптомонад, которые прикрепляются к стомодеальному клапану, либо на метациклические промастиготы, которые являются инфекционной формой млекопитающих, которые передаются, когда песчанка в следующий раз принимает пищу с кровью. Стадии пролиферации обозначены круговой стрелкой.
По сути, клетка Leishmania сконструирована из ряда модульных единиц, таких как жгутик, единица базального тела – митохондриального кинетопласта и единица Гольджи – шейка кармана жгутика [8].Эти модульные единицы затем позиционируются относительно друг друга, чтобы вызвать различные наблюдаемые морфологии клеток [10,11]. Ключом к определению динамической формы и формы этого паразита, следовательно, является понимание морфогенеза этих различных индивидуальных модульных единиц и их положения относительно друг друга.
Клеточная морфология паразитов Leishmania очень точно определяется формой клетки, длиной жгутика, положением кинетопласта / ядра и ультраструктурными особенностями, и поэтому традиционно используется для определения наблюдаемых форм клеток.Однако в некоторых случаях эти морфологические описания клеточных форм вошли в литературу как определяющие конкретные типы клеток в жизненном цикле. Однако в настоящее время существует несколько молекулярных маркеров, помогающих более точно определять формы жизненного цикла, и поэтому существует потребность в осторожности и осторожности при определении типов клеток исключительно на основе морфологии клеток.
2. Определение разнообразия: разные виды, разные заболевания, разные клетки в переносчике и хозяине
Различные виды Leishmania паразиты вызывают болезни у людей, при этом разные виды часто группируются вместе в зависимости от того, возникли ли они в старом мире или новый мир () [12] и от характера патологии (кожный, кожно-слизистый или висцеральный лейшманиоз) [12,13].Важно помнить, что это болезнь не только человека, и что Leishmania заразит других млекопитающих, создав зоонозный резервуар, который имеет серьезные последствия для борьбы с болезнями [14]. Переносчик песчаной мухи добавляет еще один уровень сложности: существует множество видов, способных переносить паразит Leishmania ; однако часто существуют особые отношения, при которых некоторые виды песчаных мух способны передавать только один или ограниченное число из видов Leishmania () [15].
Таблица 1.
Переносчик, болезнь и происхождение ряда различных видов Leishmania . По материалам Бейтса [12].
| вид | переносчик песчаной мухи | болезнь | старый или новый мир | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| L. major | Phlebotomus sale duboscqi 9000 phlebotomus sale duboscqi 9000 кожный | старый мир | ||||||||||||||||
| L.mexicana | Lutzomyia olmeca olmeca | кожный | новый мир | |||||||||||||||
| L. braziliensis | Lutzomyia wellcomei Lutzomyia wellcomei 7 | |||||||||||||||||
| L. donovani | Phlebotomus argentipes Phlebotomus orientalis Phlebotomus martini | висцеральный | старый мир | Phlebotomus ariasi Phlebotomus perniciosus Lutzomyia longipalpis | висцеральный | новый и старый мир | разные уровни сложности и морфологии этих видов 9000 9000 9000 9000, все эти различия в морфологии 9000, все эти различия в морфологии 9000 9000, все эти различия в морфологии 9000 9000 9000 9000 сложность и морфология 9000 демонстрирует замечательную сохранность формы в процессе своего жизненного цикла. Клетки с морфологией амастигот или промастигот выглядят кардинально по-разному, но они сохраняют ту же базовую клеточную структуру с кинетопластом впереди ядра и жгутиком, отходящим от базального тела ( a ) [5,6].Морфология амастиготы представлена более мелким и более сферическим телом клетки с коротким неподвижным жгутиком, который едва выходит из жгутикового кармана и потенциально больше ориентирован на сенсорные функции [16,17]. Напротив, морфология промастиготов определяется удлиненным яйцевидным клеточным телом с длинным подвижным жгутиком, выходящим из жгутикового кармана, который обеспечивает движущую силу, вероятно, ответственную за облегчение прохождения через пищеварительный тракт песчаных мух [18].3.Переход от промастиготы к амастиготеКогда песчанка, инфицированная Leishmania , принимает кровяную муку, метациклические промастиготы откладываются в месте укуса ( b ). Повреждение, вызванное песчаной мухой, приводит к рекрутированию макрофагов в место укуса, и это клетки, которые Leishmania инфицирует и находится в них, позволяя им сохраняться в организме хозяина [19–21]; однако существует минимальное количество доказательств, показывающих, где происходит взаимодействие между Leishmania и макрофагами в организме хозяина.Метациклические промастиготы — очень подвижные клетки, и Leishmania способны мигрировать через коллагеновый матрикс [22]. Следовательно, возможно, что фагоцитоз Leishmania может происходить в местах, удаленных от места укуса. Более того, возможно, спектр заболеваний, вызываемых Leishmania , от кожного до висцерального, отражается в способности паразита вторгаться в хозяина за пределами места укуса либо напрямую, либо через движение инфицированных макрофагов. В литературе имеются противоречивые сообщения о полярности взаимодействия и поглощения между Leishmania и макрофагом, причем некоторые предполагают, что это происходит сначала через жгутик, а другие показывают, что это происходит преимущественно через тело клетки или с обоих концов [ 23–25].Учитывая движение жгутика вперед, проявляемое этими метациклическими промастиготами, кончик жгутика, вероятно, будет первой частью клетки, которая взаимодействует с макрофагом. У близкородственного паразита Trypanosoma brucei кончик жгутика имеет ряд белков, включая рецепторы, которые локализуются исключительно в этой области [26,27]. Следовательно, существует вероятность того, что дифференцированный мембранный домен на кончике жгутика будет подготовлен к столкновению с макрофагом, что будет инициировать серию сигнальных событий, ведущих к успешному захвату и дифференцировке паразита.Однако, в какой бы ориентации ни был поглощен Leishmania , паразит заканчивает тем, что его жгутик направлен к периферии макрофага [24,25]. Продолжающееся движение жгутика внутри макрофага приводит к повреждению плазматической мембраны и нарушению целостности, что способствует лизосомному экзоцитозу, потенциально изменяя состав паразитофорной вакуоли, тем самым увеличивая шансы паразита успешно заразить макрофаг [25]. Оказавшись внутри макрофага, промастигот отличается от подвижной формы промастигота, которая имеет длинный жгутик и удлиненную форму клеток, до формы амастиготы, которая имеет короткий жгутик с небольшим выпуклым кончиком, выходящим за пределы теперь более сферического тела клетки. .Это резкое изменение формы клеток и приводит к минимальному соотношению поверхности клетки к объему, следовательно, к уменьшению площади, на которой клетка подвергается воздействию агрессивной среды паразитофорной вакуоли, а также к вероятному изменению формата использования жгутика [28–30]. ]. Наиболее яркое различие между формами амастигот и промастигот — изменение жгутика с длинного подвижного жгутика с аксонемой 9 + 2 на короткий неподвижный жгутик с расположением аксонем 9 + 0 (9v) [17].Wheeler et al. [17] подробно изучили этот специфический аспект процесса дифференцировки и показали, что это изменение в структуре жгутика включает в себя либо (i) разборку существующего длинного жгутика и удаление его центральной пары, а следовательно, его сжатие до короткого 9v аксонема, или (ii) сборка короткого нового жгутика, лишенного центральной пары и демонстрирующего аксонему 9v. Последний механизм интересен тем, что пробазальное тельце, которое собрало аксонему 9v, собрало бы аксонему 9 + 2, если бы эта клетка оставалась в культуре промастигот, показывая способность пробазального тельца переключаться между конструкциями любого типа. аксонема. Учитывая, что есть примеры организмов, которые способны полностью терять и преобразовывать свой жгутик в течение своего жизненного цикла, продолжающееся присутствие жгутика у амастигот предполагает, что он выполняет важную функцию для паразита в макрофаге [30–32] . Наиболее часто постулируемая функция этого жгутика — сенсорная роль, потому что аксонемная архитектура 9v структурно подобна той, которая обнаруживается в первичных ресничках млекопитающих, а кончик жгутика амастиготы Leishmania часто находится в тесном контакте с мембраной паразитофорной вакуоли. [16,33].Паразит Leishmania через свой жгутик потенциально может определять «здоровье» своего макрофага-хозяина, оценивая, например, ключевые метаболиты, такие как аденозиновые нуклеотиды. Если макрофаг «здоров», паразит может делиться, но если макрофаг «нездоров», паразит может решить не делиться, поскольку макрофаг может вот-вот погибнуть и лизироваться, тем самым высвобождая паразита в новую среду. Поэтому, вероятно, существуют определенные контрольные точки, которые будут применяться в клеточном цикле Leishmania на границах от G1 до G0 / S.Более того, высвобождение паразита вряд ли будет «пассивным» процессом, а скорее будет осуществляться самим паразитом. Это область интереса и важности, в которой специфическая клеточная биология возможного высвобождения паразита, связанного с клеточным циклом, не была изучена. Помимо резкого изменения структуры жгутика во время дифференцировки в форму амастиготы, также наблюдается большая реструктуризация кармана жгутика и области шеи, связанная с изменениями локализации белков зоны прикрепления жгутика [7].Неожиданным следствием этой перестройки является закрытие шейки жгутикового кармана так, что нет наблюдаемого промежутка между жгутиком и мембраной шейки жгутикового кармана [7]. Догма в отношении жгутикового кармана у этого и родственных ему паразитов состоит в том, что он является единственным местом экзоцитоза и эндоцитоза в клетке и, следовательно, является основным интерфейсом между паразитом и его хозяевами. Однако, если карман для жгутика закрыт на шее, как это повлияет на этот важный интерфейс? Является ли это закрытие динамичным и больше похоже на операцию клапана? Снижает ли ограниченный доступ к карману жгутика способность паразита поглощать макромолекулы из своего окружения? Скорость роста аксенических амастигот, измеренная с помощью мечения тяжелой водой, была намного медленнее, чем у промастигот [34], и, кроме того, амастиготы имеют гораздо меньший объем клеток, чем промастиготы, что приводит к одновременной меньшей метаболической нагрузке.Взятые вместе, медленная скорость роста и меньшая метаболическая нагрузка могут отражать сниженную скорость поглощения макромолекул клеткой. Однако медленный рост может быть результатом эволюционного давления, направленного на то, чтобы не подавлять иммунную систему хозяина, тем самым позволяя хозяину выжить дольше, а паразиту — дольше размножаться и, таким образом, увеличивая вероятность передачи паразита песчаной мухе. Закрывание шейки жгутикового кармана также вероятно является следствием защиты потенциально уязвимого домена клетки от окружающей среды внутри паразитофорной вакуоли, которая является кислой и полной протеаз [28,29].Уменьшение доступа к карману жгутика из-за уменьшения пространства между шейкой и мембранами жгутика в амастиготах является вероятным объяснением того, что литические липопротеины высокой плотности, содержащие трипанолитический фактор, не могут лизировать амастиготы в кислой паразитофорной вакуоли, но могут чтобы убить метациклические промастиготы, у которых есть более доступный карман жгутика [35]. Будет интересно сравнить морфологию жгутикового кармана амастиготы Leishmania с морфологией внутриклеточной амастиготы близкородственного организма Trypanosoma cruzi , поскольку этот паразит убегает из паразитофорной вакуоли и размножается в совершенно ином окружении — цитоплазме. клетки-хозяина [36]. Существует два различных типа паразитофорных вакуолей, которые развиваются в инфицированных макрофагах, которые коррелируют с видами Leishmania . Заражение некоторыми видами, такими как L. amazonensis , приводит к образованию больших многокомпонентных паразитофорных вакуолей (вакуоли типа II), которые содержат несколько амастигот, тогда как другие виды, такие как Leishmania major , образуют маленькие, плотно прилегающие, одноразовые паразитофорные вакуоли ( вакуоли типа I), которые окружают одиночного паразита амастиготу [37,38].Совместное инфицирование L. amazonensis и L. major в одном макрофаге показало, что слияние двух типов паразитофорных вакуолей, больших, содержащих амастигот L. amazonensis , или малых, содержащих амастиготы L. major , составляет L. не произошло. Это говорит о том, что паразитофорная вакуоль модифицируется в соответствии с конкретными требованиями каждого вида, что препятствует успешному слиянию разных типов паразитофорных вакуолей [37]. Интересно, что несмотря на различия, наблюдаемые в типах паразитофорных вакуолей, клеточная организация и расположение амастигот разных видов хорошо сохраняются [39].Однако есть некоторые наблюдаемые различия между амастиготами разных видов: амастигот L. mexicana примерно на 50% больше по среднему диаметру, чем у L. braziliensis и L. donovani [40]. Эта разница в размерах может иметь последствия для патологии, вызванной различными видами Leishmania , но простой связи между этими или другими признаками и типом патологии нет. Действительно, в качестве другого примера можно привести ультраструктурные исследования амастигот L.tropica и L. donovani выявили отчетливую заднюю инвагинацию, названную «чашечкой» или «задней инвагинацией» [41,42]. Авторы предположили, что это может быть альтернативный сайт экзо / эндоцитоза в этих клетках. Насколько нам известно, эта структура не была обнаружена ни у одного другого вида амастигот Leishmania . Поскольку L. tropica вызывает кожный лейшманиоз, а L. donovani вызывает висцеральный лейшманиоз, эта морфологическая адаптация опять же не связана с патологией заболевания.Таким образом, в целом, хотя различия между промастиготами и амастиготами, вероятно, очень важны для взаимоотношений хозяин / вектор, общее сходство в морфологии амастигот между разными видами предполагает, что не существует простой связи между морфологией и патологией заболевания. Вместо этого либо более тонкие особенности, либо обладание и экспрессия различных потенциальных факторов вирулентности, продуцируемых разными видами, таких как белок A2, могут иметь большее значение для спектра заболевания [43,44]. Распределенная популяция кожи из макрофагов, инфицированных Leishmania , недавно наблюдалась Doehl et al. [45]. Эта распределенная циркулирующая популяция инфицированных макрофагов поможет обеспечить эффективную передачу паразитов Leishmania от хозяина к песчаной мухе, поскольку селезеночная инфекция недоступна для песчаных мух, а москиты вряд ли будут кусать исключительно на месте фактического поражения. локализованная кожная инфекция. Более того, эти инфицированные макрофаги могут содержать потенциально другую форму амастиготы Leishmania , которая предназначена для выживания в средней кишке песчаной мухи при попадании в кровяную муку, что отражает трансмиссивность метациклических клеток промастиготного типа у песчаных мух или коротышек. форма африканских трипаносом [12,30,46]. 4. Переход от амастиготы к промастиготеПосле проглатывания песчаной мухой и высвобождения из макрофага амастигота начинает дифференцироваться в подвижную форму промастиготы. Точные признаки дифференциации еще предстоит установить, но, вероятно, это комбинация изменения температуры и pH, как у других паразитов, и, как видно на примере Leishmania , поскольку он дифференцируется от промастиготы до амастиготы в паразитофорной вакуоли [47]. ]. Однако может также требоваться наличие определенного химического триггера, чтобы гарантировать, что дифференциация происходит только в векторе, а не в хозяине; например, Plasmodium требует для дифференцировки ксантуреновой кислоты, предшественника пигмента москитного глаза [48].Сама по себе температура вряд ли будет единственным триггером для дифференциации, поскольку макрофаг будет испытывать различные температуры при циркуляции по телу, но он может действовать, повышая чувствительность амастиготы к другим сигналам дифференциации, как было обнаружено с T. brucei [ 49]. Дифференциация in vitro амастигот L. amazonensis в промастиготы подробно изучена с помощью микроскопии [50]. Первым видимым шагом в этом процессе является удлинение подвижного жгутика, которое происходит до деления клеток, а после этого первого деления клетки обе дочерние клетки имеют подвижный жгутик [50].Таким образом, при созревании пробазальное тельце в родительской клетке было способно собрать 9 + 2 подвижную аксонему, но, если бы эта же клетка осталась в макрофаге, то же пробазальное тельце собрало бы аксонему 9v, что снова демонстрирует мультипотентность пробазального тела у Leishmania [17]. Эти результаты дополняют результаты Wheeler et al. [17] и показывают, что пробазальные тельца способны собирать аксонему 9 + 2 или 9v независимо от того, какой тип аксонемы продуцировало материнское базальное тельце [17,50]. Во время дифференцировки в форму промастиготы форма клетки также начинает меняться от сферической амастиготы до более вытянутой овоидной формы. Вместе с изменениями, которые происходят с общей формой тела клетки, изменяется организация зоны прикрепления жгутика и жгутикового кармана. В частности, шейная область жгутикового кармана становится более открытой, отражая обращение процесса, происходящего во время дифференцировки в форму амастиготы [7]. Это отверстие на шее может облегчить доступ к карману жгутика, позволяя захватывать большие макромолекулы, а также потенциально влиять на подвижность паразита. 5. Роль жгутикаLeishmania в песчаной мухеЖгутик играет несколько потенциальных ролей, позволяя паразитам Leishmania успешно установить и поддерживать инфекцию у песчаной мухи. У жгутика песчаной мухи есть три потенциальные ключевые функции, которые мы обсудим в следующих разделах:
5.1. ПодвижностьПроглатывание кровяной муки песчаной мухой вызывает в ней многочисленные изменения, включая создание перитрофического матрикса из хитина и гликопротеинов, который покрывает кровяную муку, отделяя ее от эпителия средней кишки. Примерно через 4 дня оставшаяся непереваренная кровяная мука и окружающий перитрофический матрикс испражняются песчаной мухой [51,52]. Следовательно, промастиготы Leishmania должны покинуть перитрофический матрикс до того, как произойдет дефекация.Более того, для успешной передачи млекопитающему-хозяину паразиты Leishmania должны колонизировать область стомодального клапана песчаной мухи и таким образом мигрировать из средней кишки в ротовой аппарат; активная подвижность жгутиков предположительно способствует обоим этим процессам. 5.2. ПриложениеПотеря целостности перитрофического матрикса позволяет паразитам Leishmania покинуть эндотрофическое пространство [53]; Эти клетки затем прикрепляются к эпителию средней кишки, вставляя свои жгутики между микроворсинками, что помогает предотвратить изгнание паразитов из песчаной мухи во время дефекации.Это прикрепление не сопровождается какими-либо наблюдаемыми морфологическими изменениями в клетке Leishmania [54]. Данные свидетельствуют о том, что прикрепление опосредуется посредством специфических взаимодействий гликопротеин-лектин, обеспечивая потенциальный механизм, с помощью которого определяется специфичность вектор-паразит. Компонент поверхностного покрытия липофосфогликан (LPG) считался решающим для этого взаимодействия, поскольку клеток L. major , дефицитных в синтезе LPG, не могли прикрепиться к москитам Phlebotomus papatasi и P.duboscqi [55,56]. Однако недавняя работа показала, что этот мутант L. major способен успешно инфицировать другие виды песчаных мух, такие как P. arabicus , P. argentipes , P. perniciosus и Lutzomyia longipalpis , а также мутант L. mexicana , неспособный синтезировать LPG, также способен полностью развиваться в пределах Lutzomyia longipalpis [56–58]. Очевидно, что LPG важен для взаимодействия между некоторыми видами Leishmania и видами песчаных мух, но он не является универсальным детерминантом этих взаимодействий. Второе место прикрепления Leishmania у песчаной мухи находится на стомодеальном клапане, где наблюдается особый тип клеток, называемый гаптомонадой, прикрепленный к кутикуле клапана гемидесмосомными структурами, которые находятся в увеличенном кончике створки. относительно короткий жгутик [54]. Эти гемидесмосомные структуры напоминают те, которые наблюдаются для прикрепленных эпимастиготных форм трипаносом, и вполне вероятно, что прикрепление к насекомому-переносчику через такие структуры будет универсальной особенностью кинетопластид [59,60].В настоящее время биохимическая идентичность этих структур остается загадочной, но, учитывая их важность для многих видов кинетопластид, открытие молекулярных компонентов будет представлять большой интерес [60]. Сильное прикрепление предположительно останавливает передачу типа клеток Leishmania haptomonad млекопитающему-хозяину, когда песочная муха питается, и, следовательно, может играть роль в поддержании долгосрочной инфекции у песчаных мух и / или в асимметричных делениях [61]. 5.3. СенсорныйПосле выхода из перитрофического матрикса паразиты затем мигрируют вперед через песчаных мух и колонизируют среднюю кишку грудной клетки.Успешная колонизация и передача Leishmania зависят от того, что песчаная муха принимает сахарную муку после еды с кровью, и это заманчивая гипотеза, что Leishmania могут перемещаться по градиенту сахара вдоль кишечника, чтобы обеспечить колонизацию песка. муха передней кишки. Молекулярные компоненты, необходимые для хемотаксиса, присутствуют в Leishmania с углеводными рецепторами, обнаруженными на поверхности клетки, и жгутиком, способным выполнять различные структуры биений, которые позволяют клетке двигаться вперед и переориентировать себя.Более того, экспериментов in vitro показали, что Leishmania способны реагировать на изменение концентрации сахара [62–64]. описывает публикации, в которых морфология и / или подвижность были изменены путем мутационного анализа у видов Leishmania [18,65–78]. Ясно, что некоторые морфологические мутанты будут иметь катастрофические эффекты на деление клеток и как таковые не очень полезны для оценки связи с патогенностью и развитием. Сравнение с работой в т.brucei показывает, что тонкие нокдауны RNAi (доступные сейчас как технология в L. braziliensis ) могут обеспечивать драматические изменения в архитектуре клетки [11,79,80]. Один из уроков из этого состоит в том, что тонкие различия в экспрессии, а не отсутствие или присутствие в геномах могут влиять на вирулентность или патологию. Текущие улучшения как обратной, так и прямой генетики в Leishmania будут очень полезны в этой области [81–84]. Выше мы обрисовали в общих чертах три функции жгутика Leishmania жгутика песчаной мухи, но каковы фактические доказательства того, что жгутик необходим у песчаных мух? Из, мы можем видеть, что существует много мутантов, у которых функция / длина жгутика Leishmania была нарушена, например, из-за сверхэкспрессии KIN13-2 или потери PFR2, но очень мало исследований инфицировали москитов этими насекомыми. мутанты [18,65,72]. Таблица 2.Сводка морфологических и / или подвижных мутантов у Leishmania .
|