Какой врач лечит стафилококковую инфекцию у детей
Инфекционисты Москвы — последние отзывы
Всё прошло нормально. На приёме Светлана Сергеевна меня выслушала, взяла анализы и сказала прийти на повторный приём за их результатами. Она уделила достаточное количество времени для решения моего вопроса. Внимательный, доброжелательный врач.
Валерий, 03 декабря 2021
Была на приеме гастроэнтеролога.
Мадина, 30 ноября 2021
Доктор хороший, опытный. На приеме Ирина Владимировна провела консультацию, все посмотрела, не торопилась, некоторые анализы заново дала. Уделила достаточно времени, ответила на все вопросы. Пойду повторно.
Озода, 24 ноября 2021
Был на приеме у Строилова Ивана Сергеевича. Мне всё понравилось. Врач подробно расспросил, анализы посмотрел, отнесся вдумчиво. То, что я хотел, всю информацию, я изложил. Прием длился минут двадцать. Я бы рекомендовал данного специалиста своим друзьям и знакомым, обратился бы к нему сам на повторный прием.
Мне всё понравилось. Врач подробно расспросил, анализы посмотрел, отнесся вдумчиво. То, что я хотел, всю информацию, я изложил. Прием длился минут двадцать. Я бы рекомендовал данного специалиста своим друзьям и знакомым, обратился бы к нему сам на повторный прием.
Анонимно, 07 декабря 2021
Хорошо спасибо
На модерации, 07 декабря 2021
Обратилась с ребенком к врачу.
Аида, 06 декабря 2021
Приветливый доктор, разъяснил проблему, предложил как её решить. Приняли вовремя, без опозданий, качественно, с добротой. Данного специалиста нашла в интернете. Любовь Анатольевну я бы порекомендовала.
Прием прошел очень хорошо, быстро. Доктор очень вежливая. По итогу приема я получила необходимые для себя рекомендации и назначения. Если понадобится обращусь повторно к данному специалисту.
Доктор очень вежливая. По итогу приема я получила необходимые для себя рекомендации и назначения. Если понадобится обращусь повторно к данному специалисту.
Александра, 06 декабря 2021
Доктора вызывали на дом. Приехала раньше назначенного времени. Марина Витальевна общалась вежливо, опытный специалист. Я задавала ей интересующие меня вопросы и получала развернутые ответы. По итогу приема врач дал рекомендации, направил на сдачу анализов и назначил лечение.
Нина, 06 декабря 2021
 Располагает к себе человек. Отнеслась Анна Леонидовна по-человечески, с пониманием и вошла в моё положение. Доктор дала много рекомендации по дальнейшим действиям по моей болезни. Примерно приём длился полчаса. Буду обращаться повторно к данному специалисту если понадобится.
Располагает к себе человек. Отнеслась Анна Леонидовна по-человечески, с пониманием и вошла в моё положение. Доктор дала много рекомендации по дальнейшим действиям по моей болезни. Примерно приём длился полчаса. Буду обращаться повторно к данному специалисту если понадобится.Екатерина, 05 декабря 2021
Показать 10 отзывов из 2859НЕО, многопрофильный медицинский центр в Новосибирске — отзыв и оценка — Яна
Добрый день! Сразу скажу, что не ставлю ниже оценку только из-за вежливого, добродушного отношения.
Даже не знаю, с чего начать.. В общем, знакома я с этим центром с 2017 года, и всё это время мне никак не могут подобрать оптимальное лечение. То наступает улучшение, то опять всю обсыпает прыщами: гнойничковые высыпания.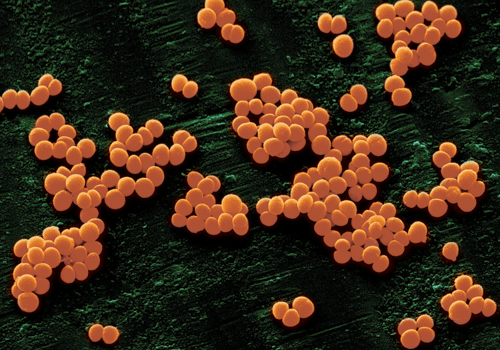
Показать целиком
Добрый день! Сразу скажу, что не ставлю ниже оценку только из-за вежливого, добродушного отношения.
Даже не знаю, с чего начать.. В общем, знакома я с этим центром с 2017 года, и всё это время мне никак не могут подобрать оптимальное лечение. То наступает улучшение, то опять всю обсыпает прыщами: гнойничковые высыпания. К слову, мучаюсь я этой проблемой уже МНОГО ЛЕТ (больше 10!), и НИКТО ИЗ ВРАЧЕЙ НЕ МОЖЕТ (НЕ МОГ!) понять, что это и как это вылечить!!! Столько денег «выкачали». Если посчитать, можно новый Land Cruiser 200 купить))) Моя мечта! Но нет!!! Эти деньги я трачу на врачей, которые выписывают непонятные лекарства, чтобы я, наверное, СНОВА И СНОВА К НИМ ПРИХОДИЛА!
И вот в 2017 году я познакомилась с центром «Нео», врач мой лечащий — Мельниченко Наталья Викторовна.
Первый раз у меня взяли бак.посев с высыпаний на груди и шее — обнаружили эпидермальный стафилококк!
Качество моей жизни очень страдает от того, что у меня постоянно высыпает на шее и груди! ((
Наталья Викторовна прописала лечение, наступило улучшение, а потом через время снова стало «сыпать». И так каждый раз! Но!
И так каждый раз! Но!
За то, что они обнаружили хотя бы причину того, что вызывает у меня фолликулит — 1Я ЗВЕЗДА!
Но, бывало, Наталья Викторовна прописывала и лекарства, которые мне не подходили вовсе, я их покупала, применяла, видела, что всё усугубляется только, прекращала пить! И снова круги ада!
И вот 2020 год, я, как с голодного мыса, только по воде, покупалась в Оби, в этой грязной, ужасной воде! И поймала заразу: ЗОЛОТИСТЫЙ СТАФИЛОКОКК (((
И СНОВА! я обратилась в «Нео». Глупость моя, да. Взяли бак.посев для определения возбудителя. Определили. И что дальше??
Есть антибиотикограмма, есть в том списке вещества, к которым проявил чувствительность ЗОЛОТИСТЫЙ СТАФИЛОКОКК, НО! Наталья Викторовна выписает мне СУПРАКС с действующим веществом ЦЕФИКСИМ, КОТОРОГО НЕТ В СПИСКЕ, СПОСОБНЫХ УНИЧТОЖИТЬ СТАФИЛОКОКК. НАОБОРОТ!!! СТАФИЛОКОКК УСТОЙЧИВ К ЦЕФИКСИМУ!!! К СУПРАКСУ!!!
А это антибиотик, между прочим! Подскажите, зачем вы выписываете то, что не уничтожает бактерию!!???
Я очень разочарована!((
Я прекратила приём всех лекарств (я пропила 5 таблеток Супракса), которые прописала Мельниченко НВ.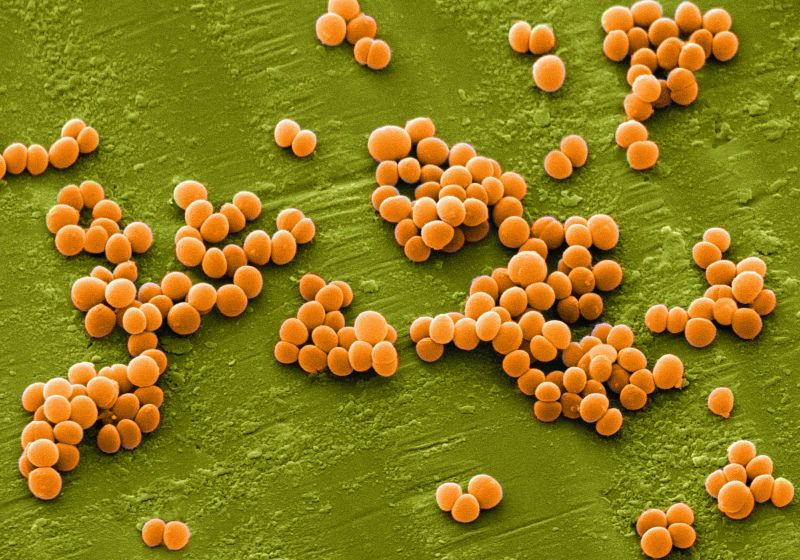 Так как высыпания стали появляться, наоборот. А до этого я пропивала схему гастроэнтеролога, и она помогла! Так как одним из лекарств был КЛАЦИД, к которому исходя из антибиотикограммы у СТАФИЛОКОККА чувствительность! Вот он и помог! Кларитромицин! Но не до конца! Так как мы не лечили с гастроэнтерологом СТАФИЛОКОКК.
Так как высыпания стали появляться, наоборот. А до этого я пропивала схему гастроэнтеролога, и она помогла! Так как одним из лекарств был КЛАЦИД, к которому исходя из антибиотикограммы у СТАФИЛОКОККА чувствительность! Вот он и помог! Кларитромицин! Но не до конца! Так как мы не лечили с гастроэнтерологом СТАФИЛОКОКК.
БУДУ ИСКАТЬ ДРУГОГО ДОКТОРА! Или пойду к гастроэнтерологу!!! ))) Смешно!
P.s Мне помогает сейчас схема лечения гастроэнтеролога!!! Слышите, гастроэнтеролог помогает!! Решить проблему, в которой компетентнее должны быть всё-таки дерматологи!!!
По звёздам:
+ 1 звезда — красивый интерьер
+ 2 звезда — вежливый персонал
+ 3 звезда — выявили причину высыпаний
— 2 ЖИРНЫХ ЗВЕЗДЫ — НЕПРАВИЛЬНО ПОДОБРАННЫЙ АНТИБИОТИК ДЛЯ ЛЕЧЕНИЯ ЗОЛОТИСТОГО СТАФИЛОКОККА!!!
КСТАТИ, Супракс, в основном, действует на ЛОР — органы, но не на кожные высыпания!
Уже скоро больше врачей буду знать! Может, дополнительное Высшее образование получить по Дерматологии?? :))
Буду лечить по совести!
P. s фото обязательно прекреплю.
s фото обязательно прекреплю.
К Вам, Нео, больше не приду! 3 звезды — нормальная оценка, но я буду искать другого врача!
Спасибо!
Pps: я готова заплатить деньги, только вылечите!!! Но нет!!! 10 лет мытарства, а толку нет!!! Одно разочарование!
Ppps: предвкушая вопросы про анализы на гормоны и тд. — не в этом дело! Высыпания, фолликулит можно вылечить! Главное, знания! И грамотная схема лечения!
Теперь я всё сказала!
Всем спасибо за внимание!
Всем мира! Добра! И, самое главное, ЗДОРОВЬЯ ФИЗИЧЕСКОГО И ДУХОВНОГО!
золотистый, в носу, в горле, на коже, у детей,
Что такое стафилококк
Стафилококк — самая распространенная бактерия, вызывающие гнойное воспаление во всех органах и системах человека. Под микроскопом скопления стафилококка похожи на виноградные гроздья. Отсюда название: греческие слова “виноград” + “зерно”.
Выявлено 27 разновидностей стафилококка; из них 14 видов обитает на коже человека.
Следует различать понятия “стафилококк” и “стафилококковая инфекция”. Стафилококк- не болезнь. Большинство видов стафилококка относят к условно-патогенной флоре — живут в носу, глотке, на коже человека не причиняя вреда. Но при наличии патологических факторов условно патогенные стафилококки становятся патогенными — провоцируют стафилококковую инфекцию — воспаление и нагноение.
Приводим эти патологические факторы:
- иммунодефицит, в т.ч. ВИЧ-инфекция; ослабленный организм;
- ОРВИ, грипп, другие инфекции;
- сахарный диабет, гипотиреоз, прочие эндокринологические расстройства;
- бронхит, бронхиальная астма; почечная недостаточность;
- возраст 0-5 лет; пожилой и старческий возраст;
- пребывание на искусственной вентиляции легких,состояние после хирургического вмешательства — госпитальная стафилококковая инфекция;
- беременность;
- курение, алкоголизм, наркомания;
- неправильное питание, злоупотребление фаст-фудом;
- несоблюдение правил личной гигиены.
К сожалению, имеются изначально патогенные формы стафилококка, которые вызывают болезнь даже у здоровых людей. Самая опасная разновидность патогенного стафилококка — золотистый стафилококк.
Стафилококк очень устойчив к высушиванию, высокой температуре, поэтому сохраняется на поверхностях до 6 месяцев. Стафилококк — самая частая больничная флора; заражение пациентов часто происходит прямо на больничной койке.
Стафилококк передается воздушно-капельным путем (при дыхании, чихании, кашле) в любом месте: дома, на улице, на транспорте. Всегда находясь на коже в составе здоровой микрофлоры, стафилококк попадает в кровь через царапины, раны и другие повреждения. Кроме того, стафилококк передается через грязные руки, немытые овощи и фрукты, грязную посуду.
Еще есть вертикальный способ передачи стафилококка — от матери новорожденному: во время беременности и родов.
Вот далеко не полный перечень болезней, вызываемых стафилококком:
- поражение кожи, фурункул, карбункул, ячмень на глазу, абсцесс, пр.;
- синусит (гайморит, фронтит, пр.), ринит, ангина, фарингит, ларингит;
- трахеит, бронхит, пневмония;
- цистит, пиелонефрит;
- бактериальный эндокардит;
- менингит;
- остеомиелит;
- гнойный мастит;
- расстройства пищеварения, сопровождаемые поносом;
- перитонит;
- сепсис.
Симптомы стафилококковой инфекции зависят от локализации патологического процесса. В то же время, есть общие признаки болезни: местное или общее повышение температуры тела, гнойный процесс и интоксикация организма: слабость, быстрая утомляемость, ухудшение аппетита, суставные, мышечные боли, пр.
В зависимости от локализации патологического процесса стафилококковую инфекцию диагностирует и лечит ЛОР-врач, дерматолог, кардиолог, пульмонолог, инфекционист, пр. Чтобы выявить стафилококк, проводят бактериологическое исследование крови, мочи, кала, мазка из носа и горла, соскоба кожи, пр. Наличие стафилококковой инфекции определяют не только по большому количеству бактерий, но и по увеличению этого количества в динамике. При нормальном иммунитете даже избыточное количество стафилококка не является болезнью — стафилококковой инфекцией.
Стафилококки — бактерии, поэтому их лечат антибиотиками, как правило, пенициллинами и цефалоспоринами. Большое значение имеют средства для местного лечения в зависимости от локализации: заживляющие мази (Винилин, пр.), раствор хлорофиллипта, “зеленка”, пр. Из-за высокой устойчивости большинства штаммов стафилококка к антибиотикам вначале определяют чувствительность обнаруженной разновидности инфекции к антибактериальным препаратам — подбирают наиболее эффективное в каждом конкретном случае средство.
Профилактика стафилококка сводится к соблюдению правил личной гигиены (особенно это касается детей до 5 лет, укреплению иммунитета, здоровому образу жизни, правильному питанию, употреблению только мытых овощей и фруктов, обеззараженной воды, регулярной уборке помещений, пр.
Золотистый стафилококк
Золотистый стафилококк (Staphylococcus aureus)- причина 85% стафилококковых инфекций. Золотистый стафилококк почти всегда вызывает болезнь в отличие от большинства разновидностей стафилококка, относящихся к условно-патогенной флоре.
Золотистый стафилококк — самая частая патогенная флора при легочной форме муковисцидоза.
Золотистый стафилококк наиболее опасен в сравнению с другими видами стафилококка — вызывает гнойную инфекцию в любом органе или ткани (перечень болезней см. выше в разделе “Что такое стафилококк”). Легко проникая через плацентарный барьер, приводит к внутриутробному заражению плода. Преодолевая гематоэнцефалический барьер, золотистый стафилококк вызывает менингит и энцефалит.
Золотистый стафилококк выработал устойчивость к большинству антибиотиков пенициллинового ряда с помощью фермента пенициллиназы. Поэтому после выявления золотистого стафилококка назначают модифицированный пенициллин — метициллин, к которому пока нет выраженной устойчивости.
Эффективным средством лечения золотистого стафилококка считают стафилококковый бактериофаг — вирус, проникающий внутрь бактерии и вызывающий ее растворение.
Стафилококк в носу
Слизистая носа — излюбленное место обитания стафилококка, в первую очередь, золотистого стафилококка. Болезнь возникает при воздействии неблагоприятных факторов: аллергический ринит, сопровождаемый неправильным приемом сосудосуживающих препаратов, искривление носовой перегородки, неправильная бесконтрольная антибактериальная терапия, пр.
Стафилококковый ринит проявляется обильными гнойными (желто-зелеными) выделениями из носа и интоксикацией (слабость, повышение температуры тела до 38 градусов, озноб, головная боль). Кроме ринита стафилококковая инфекция в носу приводит к синуситу: гаймориту и фронтиту.
Лечение стафилококка в носу — см. в статьях о болезнях.
Стафилококк в горле
Обычно стафилококк попадает в горло из носа. Инфекция развивается при действии патологических факторов, прежде всего, при сниженном иммунитете после ОРВИ, гриппа.
Самые частые стафилококковая инфекция горла — ангина, фарингит и ларингит.
При несвоевременном неправильном лечении инфекция опускается ниже, приводя к бронхиту и пневмонии.
При заглатывании слизи с бактериями инфекция распространяется на желудок и кишечник — развиваются признаки пищевого отравления — рвота и понос.
Лечение стафилококка в горле — см. в статьях о болезнях.
Стафилококк на коже
Хотя на коже чаще других бактерий живет эпидермальный стафилококк, последний реже вызывает инфекцию, чем золотистый стафилококк. Эпидермальный стафилококк становится патогенным, попадая в новую среду: в сердце, в суставы, в кровь. Поэтому эпидермальный стафилококк вызывает нагноение в послеоперационном периоде, например, при протезировании сердечных клапанов и суставов. Это становится причиной повторных операций, что, естественно, осложняет течение основного заболевания.
Стафилококковая инфекция кожи проявляется гнойным воспалением: волдырем, прыщом, фурункулом и карбункулом, рожей, панарицием, абсцессом, флегмоной, пр. Для любого из видов поражения кожи характерно нагноение, боль, отек и покраснение, местное повышение температуры, нарушение функции.
Стафилококковую инфекцию на коже чаще всего лечат местными антибактериальными препаратами — мазями и кремами: Бактробан, Бондерм, Супироцин, Фузидин, пр. При попадании бактерий в кровь и появлении признаков генерализованной инфекции назначают антибиотики внутримышечно и внутривенно: Цефазолин, Ванкомицин, Амоксициллин, Цефотаксим, пр.
Сопутствующая терапия: бифидобактерии для профилактики дисбактериоза, противогрибковые средства, противовоспалительные и обезболивающие препараты, поливитамины, пр.
При фурункуле, карбункуле, абсцессе может потребоваться хирургическое вмешательство — вскрытие и дренирование гнойника.
Стафилококк у детей
От стафилококка чаще всего страдают новорожденные и дети до 3-5 лет. Причина — неразвитый, ослабленный иммунитет и сопутствующие болезни: ОРВИ, сальмонеллез, дисбактериоз, пр.
У детей стафилококковую инфекцию в 95% случаев вызывает золотистый стафилококк (самый агрессивный), эпидермальный стафилококк и сапрофитный стафилококк.
Вот самые частые проявления стафилококковой инфекции у детей:
Лечить стафилококк у малышей непросто.
Эффективность лечения стафилококковой инфекции у детей зависит от своевременного выявления патогена. Комплексное лечение включает антибиотики, местную терапию (перекись водорода, 70% раствор спирта, мазь Вишневского, пр.), смазывание и полоскание носа/горла раствором серебра, йодинола, Мирамистина, стимуляцию иммунитета, поливитамины.
К какому врачу обратиться
При первых признаках стафилококковой инфекции обратитесь к семейному врачу, педиатру, терапевту. Обратитесь к врачам сервиса врачебных видеоконсультаций Zdorro.online. Посмотрите, как наши врачи отвечают на вопросы пациентов. Задайте вопрос врачам сервиса бесплатно, не покидая данной страницы, или здесь. Проконсультируйтесь у понравившегося врача.
Опасными видами стафилококков заражаются в больницах и роддомах | ЗДОРОВЬЕ: Медицина | ЗДОРОВЬЕ
Давайте жить дружно
Как ни странно, само по себе наличие у человека стафилококка не означает, что его надо непременно лечить. «В нашем организме их много. Например, на коже среди различных микробов стафилококков насчитывается больше всего, — говорит Сергей ЯКОВЛЕВ, профессор кафедры госпитальной терапии Первого МГМУ им. Сеченова. — Эти микробы считаются условнопатогенными — могут вызывать заболевание только в случае предрасполагающих факторов, к примеру, при нарушениях в работе иммунной системы, повреждениях кожи и т. д. Скажем, если стафилококки попадут в кровь, то могут вызвать генерализованную инфекцию (сепсис). А в обычной ситуации для человека с хорошим иммунитетом стафилококки могут быть даже полезны.
Ведь они защищают от проникновения извне чужих, более опасных микробов. На конкретном участке кожи их определённое количество — столько, сколько есть пищи. И они уже настолько сжились с другими микробами, например стрептококками, что никого другого на свою территорию не пускают». Помимо кожи стафилококк может также мирно обитать во рту, в носу, в кишечнике. Но кроме мирных особей есть и по-настоящему опасные. Более того, устойчивые ко многим известным сегодня антибиотикам. К ним, например, относятся некоторые штаммы всем известного золотистого стафилококка. Причём самые смертельные и непобедимые его виды находятся в больницах и роддомах. Именно стафилококк входит в первую тройку возбудителей госпитальных инфекций, приводящих к смерти. Попасть в организм зловредный микроб может, как и любая другая инфекция: через ранки на коже и слизистых оболочках, в результате хирургических вмешательств, при нанесении татуировок и пирсинге, нарушении обычных правил гигиены (там, где пот и грязь, микробы активно размножаются).
Никуда от них не деться
Золотистый стафилококк может навредить везде. На коже он способен вызывать гнойные прыщи и фурункулы, в дыхательных путях — пневмонию, в глазах — конъюнктивит, в сердце — эндокардит (воспаление), в суставах — инфекционный артрит, у женщин после родов нередко вызывает сепсис. Размножаясь в продуктах (консервах, жирных салатах, тортах и даже в твёрдом сыре, копчёной колбасе, которые мы считаем долго непортящимися), золотистый стафилококк выделяет яды, которые вызывают серьёзные пищевые отравления. При кулинарной обработке сама бактерия гибнет, но её токсины остаются.
Борьба с микробом
«То, что инфекцию вызвал стафилококк, можно только предположить, — объясняет Сергей Яковлев. — А чтобы поставить точный диагноз, нужно взять на анализ кровь, мокроту и т.д., сделать посев на специальную питательную среду и посмотреть, какие микробы вырастут (такой анализ делается в бактериологической лаборатории. — Ред.). Далее определяется чувствительность выявленных микробов к антибактериальным препаратам. Сегодня по отношению к антибиотикам существует две группы стафилококков: одни чувствительны к оксициллину, а значит, и практически ко всем другим антибиотикам, другие устойчивы. Последние называются оксициллинрезистентными или метициллинрезистентными стафилококками. Они очень опасны и распространены в больницах.
Сегодня у врачей есть всего четыре антибиотика (из нескольких десятков), которыми можно вылечить таких больных. В тяжёлых, экстренных случаях антибиотики могут назначаться сразу, а потом уже проводиться необходимые исследования». И учтите, что нужно обязательно пройти весь назначенный врачом курс антибиотикотерапии до конца. Иначе бактерия не погибнет, а только приспособится, станет нечувствительной к лекарству. И в следующий раз вылечить инфекцию будет гораздо сложнее.
Смотрите также:
Микробиологи «раскусили» стафилококк — Наука
Золотистый стафилококк Staphylococcus aureus, по информации Всемирной организации здравоохранения (ВОЗ), представляет собой серьезную угрозу жизни человека. Эта бактерия живет в организме почти у каждого третьего человека, но до поры никак не проявляет себя. Стафилококк вызывает самые разные заболевания, от угрей до пневмонии, и обладает высокой устойчивостью к иммунитету и антибиотикам.
Один из приемов иммунной системы состоит в том, чтобы лишить микробы тех веществ, которые им нужны для развития. Клетки иммунной системы, нейтрофилы, доставляют белок кальпротектин на «место действия» инфекции, и тот связывает весь марганец и цинк, нужные бактериям. Как следствие, в стафилококковом абсцессе, например, не найти этих двух металлов — организм пытается заморить микробов голодом.
Марганец нужен стафилококку для работы фермента супероксиддисмутазы (SOD) — белка-антиоксиданта, который превращает свободные радикалы кислорода в молекулы кислорода и перекиси водорода, защищая бактерию от смертельно опасного окислительного стресса. S. aureus умеет делать две формы SOD — SodA и SodM. Первая «работает на марганце», а вторая может использовать и марганец, и железо. Как говорят ученые, прежде считалось, что такое невозможно, но эксперименты показали, что это не так: при удалении марганца из среды, где жил S. aureus, бактерия переходила на синтез формы SodM и справлялась с окислительным стрессом.
Ученые полагают, что в условиях распространения устойчивых к разным антибиотикам форм стафилококка в качестве мишени для лекарств можно использовать белок SodM, чтобы в будущем бороться с микробом эффективнее.
Исследование описано в журнале PLOS Pathogens.
Всемирная организация здравоохранения сообщает о все возрастающей угрозе от микробов, которые выработали устойчивость к антимикробным препаратам. По данным ВОЗ, тот же метициллин-резистентный золотистый стафилококк приводит к смерти пациентов на 64% чаще, чем обычный S. aureus. Ученые ищут новые средства для борьбы с микробом и не пренебрегают даже средневековыми медицинскими трудами.
ОКАЦИН: чтобы смотреть на мир здоровыми глазами
|
Для лечения пациентов с инфекционными поражениями глаз широко используются противомикробные препараты. При применении этой группы лекарственных средств врачи сталкиваются с рядом проблем, самой острой из которых, пожалуй, является развитие резистентности микроорганизмов к этим препаратам. В последние годы все чаще сообщается о появлении резистентных к различным антибактериальным средствам штаммов микроорганизмов.
Глазные капли ОКАЦИН — препарат, предназначенный для современной фармакотерапии при инфекционных заболеваниях глаз бактериальной и хламидийной этиологии. Это лекарственное средство из группы фторхинолонов. Фторхинолоны — один из немногих классов синтетических антибактериальных средств, не имеющих аналогов в естественной среде, поэтому к ним отмечен один из наиболее низких уровней устойчивости: 97% штаммов возбудителей восприимчивы к ним (Acar J.F., O’Brien T.F. et al, 2003). В настоящее время резистентность к фторхинолонам развивается наиболее редко и не является перекрестной с другими антибиотиками (Чоп’як В.В., Федоров Ю.В., 2005).
ОКАЦИН обладает широким спектром противомикробного действия. Он активен в отношении большинства энтеробактерий, грамотрицательных микроорганизмов (гемофильной палочки, включая b-лактамазoпродуцирующие штаммы, гоннококка, менинигококка, моракселлы, включая b-лактамазопродуцирующие штаммы), а также синегнойной палочки. Препарат высокоактивен в отношении золотистого стафилококка, коагулазонегативных стафилококков, стрептококков, включая пневмококк. Важно также, что к ОКАЦИНУ чувствительны внутриклеточные возбудители (хламидии, микоплазмы, легионеллы). Таким образом, ОКАЦИН эффективен в отношении практически всех возбудителей, вызывающих бактериальные и хламидийные инфекции глаз (Майчук Ю. Ф., 2000).
Наряду с широким спектром действия к преимуществам данного препарата относится бактерицидный эффект. Бактерицидное действие ломефлоксацина обусловлено его действием на ДНК-гиразу, в результате чего нарушается объемная структура ДНК бактерий и блокируется их деление. Такое действие препарата на бактериальную клетку приводит к высвобождению меньшего количества эндотоксинов, чем, например, при воздействии b-лактамных антибиотиков, которые нарушают синтез наружных клеточных мембран бактерий. ОКАЦИН накапливается в высокой концентрации в передней камере глаза и слезной жидкости, а также в макрофагах, чем обусловливает повышение эффективности противомикробного клеточного иммунитета и постантибиотический эффект препарата (Perea E.J., Garcia I., Pascual A., 1992; Canton E., Jimenez T. et al, 1993).
ОКАЦИН хорошо изучен. В качестве примера можно привести данные метаанализа 6 клинических исследований, проведенных в Великобритании, Финляндии, Швейцарии, Италии, Испании, Франции (Jauch A., Fsadni M., Gamba G., 1999). В них приняли участие 582 пациента: 290, применявших ОКАЦИН, и 292 — другие глазные капли (0,5% раствор левомицетина, 1% раствор фузидовой кислоты, 0,3% раствор гентамицина, 0,3% раствор тобрамицина, 0,3% раствор норфлоксацина). Высокая эффективность лечения была достигнута у 94,1% пациентов, принимавших ОКАЦИН, и лишь у 86,3% — другими препаратами. Во всех исследованиях была применена методика «нагрузочных доз»: в первый день препарат применяли по 1 капле каждый час на протяжении 6–10 ч или по 1 капле с интервалом 5 мин в течение 20 мин. В последующем препарат назначали по 1 капле 2 раза в день в нижний конъюнктивальный мешок глаза. Такой режим дозирования наилучшим образом помогал решить проблемы возникновения резистентных штаммов микроорганизмов. Результаты этих исследований показали, что ОКАЦИН хорошо переносится пациентами. При его закапывании чувство жжения в глазах кратковременное или практически не возникает, что выгодно отличает его от ряда других противомикробных глазных капель. Таким образом, ОКАЦИН более эффективен, не вызывает значительного дискомфорта при закапывании и снижает риск развития новых резистентных к препарату штаммов микроорганизмов.
Врачами как в мире, так и в Украине накоплен значительный опыт клинического применения глазных капель ОКАЦИН. Отечественные ученые проводили изучение клинической эффективности и переносимости глазных капель ОКАЦИН у пациентов с бактериальными кератитами (Бездетко П.А., Панченко Н.В. и соавт., 2004). Под наблюдением находились 42 больных. 22 больных основной группы получали препарат ОКАЦИН. Пациенты контрольной группы (20 человек) получали глазные капли 0,3% раствора гентамицина. Результаты проведенного исследования свидетельствуют, что ОКАЦИН более эффективен, чем гентамицин при инфекционных заболеваниях глаз, вызванных бактериальной флорой, в частности при бактериальных кератитах. Использование препарата в комплексном лечении больных с инфекционно-воспалительными заболеваниями роговицы бактериальной природы позволяет ускорить клиническое выздоровление и более чем у 60% пациентов добиться полной эрадикации патогенной бактериальной микрофлоры через 7–10 дней лечения. При объективном обследовании ни в одном случае не отмечено проявления побочных действий ОКАЦИНА.
ОКАЦИН успешно применялся также в комплексе лечебных мероприятий, направленных на предупреждение экссудативной воспалительной реакции (ЭВР) на интраокулярную линзу (ИОЛ) после экстракции катаракты (Сергиенко Н.М., Петруня А.М., Пантелеев Г.В., 2004). Все больные в послеоперационный период получали традиционную терапию, включающую кортикостероиды, НПВП (парентерально и местно), мидриатики. 47 больных (основная группа) дополнительно получали ОКАЦИН в виде инстилляций в пораженный глаз в течение 7–10 дней. 39 пациентов составили группу сравнения. Использование ОКАЦИНА в комплексной терапии больных с ЭВР на ИОЛ из основной группы способствовало существенному улучшению состояния прооперированного глаза. В группе сравнения функциональные и клинические показатели длительно не улучшались и к моменту выписки существенно отличались от нормы. Таким образом, установлена эффективность ОКАЦИНА в комплексном лечении пациентов с ЭВР. Препарат способствует ускорению реконвалесценции, снижению частоты развития осложнений и неблагоприятных исходов, что позволяет его рекомендовать для широкого применения в офтальмологической практике.
Опыт применения ОКАЦИНА убедительно доказывает, что это высокоэффективный препарат. Практически в равной степени он активен в отношении как грамположительной, так и грамотрицательной аэробной флоры, а также обладает высокой активностью в отношении внутриклеточных возбудителей. Высокая бактерицидная активность препарата в сочетании с незначительным распространением резистентности к нему микроорганизмов, хорошим проникновением в ткани обеспечивает максимальный терапевтический эффект. Применение глазных капель ОКАЦИН позволяет смотреть на мир здоровыми глазами! o
Эксклюзивный дистрибьютор
препарата ОКАЦИН в Украине — компания «Брюфармэкспорт»,
тел.: 8 (044) 483-12-03
Олег Мазуренко
Антибиотиков, используемых в настоящее время для лечения инфекций, вызванных Staphylococcus aureus
Стафилококковые инфекции — частая и значимая клиническая проблема в медицинской практике. Большинство штаммов Staphylococcus aureus в настоящее время устойчивы к пенициллину, а устойчивые к метициллину штаммы S. aureus (MRSA) широко распространены в больницах и появляются в обществе. Пенициллины, устойчивые к пенициллиназе (флуклоксациллин, диклоксациллин), остаются антибиотиками выбора для лечения серьезных метициллин-чувствительных S.aureus (MSSA), но цефалоспорины первого поколения (цефазолин, цефалотин и цефалексин), клиндамицин, линкомицин и эритромицин играют важную терапевтическую роль в менее серьезных инфекциях MSSA, таких как инфекции кожи и мягких тканей, или у пациентов с гиперчувствительностью к пенициллину, хотя цефалоспорины -показан пациентам с немедленной гиперчувствительностью к пенициллину (крапивница, ангионевротический отек, бронхоспазм или анафилаксия). Все серьезные инфекции MRSA следует лечить парентерально ванкомицином или, если у пациента аллергия на ванкомицин, тейкопланином.Нозокомиальные штаммы MRSA обычно обладают множественной устойчивостью (mrMRSA), а штаммы mrMRSA всегда необходимо лечить комбинацией двух пероральных противомикробных препаратов, обычно рифампицина и фузидовой кислоты, поскольку устойчивость развивается быстро, если они используются в качестве отдельных агентов. Большинство внебольничных штаммов MRSA в Австралии и Новой Зеландии не обладают множественной резистентностью (nmMRSA), а линкозамиды (клиндамицин, линкомицин) или котримоксазол являются антибиотиками выбора при менее серьезных инфекциях nmMRSA, таких как инфекции кожи и мягких тканей.Новые антибиотики, такие как линезолид и хинупристин / далфопристин, обладают хорошей антистафилококковой активностью, но очень дороги, и их следует применять только пациентам, которые не проходят традиционную терапию или не переносят ее, или имеют высокорезистентные штаммы, такие как hVISA (гетерогенный ванкомицин-промежуточный S aureus).
Использование аутологичной бактериотерапии для лечения золотистого стафилококка у пациентов с атопическим дерматитом: рандомизированное двойное слепое клиническое испытание | Аллергия и клиническая иммунология | JAMA дерматология
Ключевые моментыВопрос Может ли персонализированный крем для местного применения, созданный из коагулазонегативного Staphylococcus с антимикробной активностью против Staphylococcus aureus от каждого конкретного человека с атопическим дерматитом (AD), уменьшить S.aureus колонизация и уменьшение тяжести заболевания?
Выводы В этом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании с участием 11 пациентов с БА колонизация S. aureus была снижена на 99,2% в группе лечения по сравнению с контрольной группой. Клиническое улучшение, оцениваемое по шкале локальной зоны экземы и индекса тяжести после окончания лечения, также значительно улучшилось по сравнению с носителем.
Значение Эти результаты показывают, что бактериотерапия аутологичным штаммом бактерий может безопасно улучшить S.aureus колонизация микробиома пациентов с БА и уменьшение тяжести заболевания.
Важность На атопический дерматит (АД) может отрицательно влиять Staphylococcus aureus . В кожном микробиоме AD отсутствует коагулазонегативный Staphylococcus (CoNS), который может убить S aureus .
Цель Оценить возможность аутологичного повторного введения CoNS (CoNS-AM +) пациента с БА тому же пациенту, чтобы снизить выживаемость S aureus и улучшить клинические исходы.
Дизайн, обстановка и участники Это двойное слепое, контролируемое носителем одноцентровое рандомизированное клиническое исследование с участием 11 взрослых пациентов с умеренной и тяжелой БА, которые были рандомизированы для получения либо аутологичного CoNS-AM + (n = 5), либо носителя (n = 6). с апреля 2016 года по май 2018 года. Данные были проанализированы с мая 2018 года по июль 2019 года.
Вмешательства Аутологичный CoNS-AM + был выделен из мазков, полученных с неповрежденной кожи каждого пациента с БА, размножен культивированием и затем повторно нанесен местно на предплечья в концентрации 10 7 колониеобразующих единиц / г.
Основные результаты и мероприятия Первичной конечной точкой этого исследования была оценка численности S aureus через 1 неделю применения аутологичного CoNS-AM + у пациентов с БА методами культивирования и ДНК. Вторичные конечные точки заключались в оценке безопасности и клинических исходов.
Результаты Одиннадцать пациентов (4 мужчин [36,4%] и 7 женщин [63/6%]) были отобраны на основе критериев включения. В группах, получавших аутологичный CoNS-AM + или носитель, серьезных побочных эффектов не было. Staphylococcus aureus Колонизация пораженной кожи в конце лечения у пациентов, получавших аутологичный CoNS-AM + (среднее отношение log10 к исходному уровню, -1,702; 95% ДИ, от -2,882 до -0,523), уменьшилась на 99,2% по сравнению с с обработкой носителем (среднее отношение log10 к исходному уровню, 0,671; 95% ДИ, от −0,289 до 1,613; P = 0,01) и сохранялось в течение 4 дней после лечения (CoNS-AM +: среднее отношение log10 к исходному уровню, −1,752 ; 95% ДИ, от -3,051 до -0,453; носитель: среднее значение отношения log10 к исходному уровню, -0.003; 95% ДИ, от -1,083 до 1,076; P = 0,03). Важно отметить, что локальные показатели индекса площади и тяжести экземы, которые оценивались на 11-й день у пациентов, получавших CoNS-AM + (среднее процентное изменение, -48,45; 95% ДИ, -84,34 до -12,55), были значительно улучшены по сравнению с лечением носителем (среднее процентного изменения, -4,52; 95% ДИ, от -36,25 до 27,22; P = 0,04).
Выводы и значимость Данные этого рандомизированного клинического исследования предполагают, что бактериотерапия аутологичным штаммом кожных комменсальных бактерий может безопасно уменьшить колонизацию S aureus и улучшить тяжесть заболевания.Хотя потребуются более масштабные исследования, этот индивидуальный подход к снижению S aureus может обеспечить альтернативное лечение пациентов с БА помимо антибиотиков, иммуносупрессии и иммуномодуляции.
Регистрация пробной Идентификатор ClinicalTrials.gov: NCT03158012
Цефтриаксон как средство внутривенного введения при стафилококковых инфекциях — Просмотр полного текста
Использование цефтриаксона при глубоко укоренившихся стафилококковых инфекциях, требующих длительного внутривенного лечения, является практикой, которая уже получила развитие как на местном, так и на глобальном уровне, несмотря на отсутствие качественных клинических данных.Ретроспективные исследования, поддерживающие использование цефтриаксона по этому показанию, в том числе те, которые в настоящее время используются в рекомендациях Американского общества инфекционных болезней (IDSA), единодушно согласны с тем, что срочно необходимы проспективные рандомизированные данные. Наше исследование является следующим естественным шагом в исследовательском процессе и значительно расширит совокупность доказательств, подтверждающих эту практику, за счет устранения текущих пробелов в знаниях. На клиническом уровне демонстрация не меньшей эффективности цефтриаксона позволит использовать его в популяции пациентов, которые в настоящее время не подходят для амбулаторного лечения антибиотиками, или в тех случаях, когда в настоящее время используются более широкие и более дорогие препараты.Это способствовало бы более быстрой выписке из больницы, привело бы к значительной экономии средств и существенно повлияло бы на рациональное использование противомикробных препаратов. Что наиболее важно, это улучшило бы качество жизни пациентов, позволив им лечиться дома в тех случаях, когда многократное домашнее внутривенное введение является препятствием для выписки из больницы. Это исследование будет направлено на необходимость поддержки и гармонизации существующей практики в Island Health, повышения уровня доказательности действующих руководств и улучшения ухода за пациентами как на местном, так и на глобальном уровне.
Это проспективное рандомизированное контролируемое неслепое исследование с прагматическим дизайном. Цель состоит в том, чтобы оценить, не уступает ли вмешательство стандартным методам лечения в достижении основного результата. Пациенты будут набраны из стационарных групп, а пациенты, проходящие лечение в амбулаторной клинике антибактериальной терапии, имеют право на дальнейшее внутривенное лечение в рамках программы домашней внутривенной терапии. Пациентам, отвечающим описанным критериям включения, будет предложено принять участие, и будет получено информированное согласие.После получения информированного согласия пациенты будут рандомизированы для получения цефтриаксона или стандартной терапии (клоксациллин, цефазолин, даптомицин), как определит лечащий врач-инфекционист. У пациентов будут глубокие инфекции, такие как:
- Остеомиелит
- Родной септический артрит суставов
- Протезирование сустава, септический артрит
- Инфекция центральной нервной системы
- Инфекция глубоких тканей
- Инфекция диабетической стопы
При микробиологическом исследовании будет подтверждено, что инфекция была вызвана чувствительным к метициллину Staphylococcus aureus или коагулазонегативным стафилококком.Тест на чувствительность гарантирует, что изолят чувствителен к исследуемому препарату и по крайней мере к одному из стандартных методов лечения.
После того, как пациент будет рандомизирован, все остальные аспекты лечения будут соответствовать обычным правилам и процедурам домашней внутривенной терапии. Ни пациент, ни медицинская бригада не будут ничего знать об исследуемом лекарстве, которое получает пациент. Продолжительность лечения определяется лечащим врачом-инфекционистом в зависимости от места заражения и имеющихся руководств. Исходные данные будут собраны исследовательской группой во время рандомизации.
За пациентом в обычном порядке будет наблюдать врач-инфекционист. Данные будут собираться стандартизированным способом в заранее оговоренное время окончания антибактериальной терапии. Клиническое излечение (первичный результат) будет определено на основе этих данных.
Частота нежелательных явлений будет собираться в течение всего периода исследования. Через шесть месяцев после рандомизации исследовательская группа оценит любые маркеры неэффективности лечения (см. Вторичные результаты).
План статистического анализа предварительно указан в протоколе и будет завершен при содействии биостатистического персонала Университета Виктории.Конкретная информация о защите конфиденциальности пациентов и целостности данных изложена в протоколе исследования. Утверждение этики было получено Советом по этике клинических исследований Управления здравоохранения острова Ванкувер.
Границы | Распространенность и терапия устойчивости к антибиотикам у Staphylococcus aureus
Введение
Staphylococcus Aureus
Золотистый стафилококк (S. aureus) является одним из основных возбудителей инфекций в больницах и населенных пунктах и может вызывать многие инфекционные заболевания, такие как легкие инфекции кожи и мягких тканей, инфекционный эндокардит, остеомиелит, бактериемия и фатальная пневмония (Lowy, 1998; Хамфрис, 2012). Золотистый стафилококк был впервые обнаружен в 1880 году в Абердине, Шотландия, хирургом Александром Огстоном у пациентов с изъязвленными язвами. Staphylococcus aureus принадлежит к роду Staphylococcus, Firmicutes; положительный на окрашивание по Граму, диаметром ~ 0,8 мкм, расположенное в виде «виноградной грозди» под микроскопом, аэробным или анаэробным; и оптимально растет при 37 ° C и pH 7,4 (Edwards, Massey, 2011; Gardete, Tomasz, 2014). Колонии на чашке с кровяным агаром толстые, блестящие и круглые, диаметром 1-2 мм (Gonzalez-Perez et al., 2019; Сато и др., 2019). Большинство из них являются гемолитическими, образуя прозрачное гемолитическое кольцо вокруг колоний на пластинах кровяного агара (Sato et al., 2019). Более того, S. aureus не образует спор или жгутиков, но обладает капсулой, может производить золотисто-желтый пигмент и разлагать маннит (Tayeb-Fligelman et al., 2017). Кроме того, также было обнаружено, что тесты на коагулазу плазмы, ферментацию лактозы и дезоксирибонуклеазу положительны у S. aureus (Chino et al., 2017; Тайеб-Флигельман и др., 2017).
Метициллин-устойчивый золотистый стафилококк (MRSA)
Флеминг открыл пенициллин в 1940-х годах и положил начало эре антибиотиков для лечения инфекций (Klevens et al., 2007; Klein et al., 2017). В то время инфекционные заболевания, вызываемые S. aureus , хорошо контролировались, но с широким использованием пенициллина в 1950-х годах в клинике появился устойчивый к пенициллину S. aureus (Rayner and Munckhof, 2005; Pichereau). и Роза, 2010).Устойчивый к пенициллину S. aureus может продуцировать пенициллиназу, которая может гидролизовать бета-лактамное кольцо пенициллина, что приводит к устойчивости к пенициллину. Позже ученые разработали новый полусинтетический пенициллин, устойчивый к пенициллиназе, названный метициллин, который устойчив к гидролизу β-лактамазы (Rayner, Munckhof, 2005; Khoshnood et al., 2019). После применения в клинике в 1959 году метициллин эффективно контролировал инфекцию устойчивых к пенициллину S. aureus (Chambers and Deleo, 2009; Jokinen et al., 2017). Однако всего через 2 года после применения метициллина в 1961 году британский ученый Джевонс сообщил о выделении штамма MRSA; эта устойчивость была вызвана геном, кодирующим пенициллин-связывающий белок 2a или 2 ‘(PBP2a или PBP2’) (mecA), который был интегрирован в хромосомный элемент (SCCmec) метициллин-чувствительного S. aureus (Schulte and Munson, 2019). Более того, MRSA быстро стал наиболее часто встречающимся резистентным патогеном, выявленным во многих частях мира, включая Европу, США, Северную Африку, Ближний Восток и Восточную Азию (Mediavilla et al., 2012; Лахунди, Чжан, 2018). Согласно первоисточнику, MRSA подразделяется на MRSA, приобретенный в больнице (HA-MRSA), и MRSA, приобретенный в сообществе (CA-MRSA) (Lindsay, 2013; Otto, 2013). В Китае доля MRSA, приобретенных в больницах, достигла 50,4% (Shang et al., 2016). Кроме того, по данным Центров по контролю за заболеваниями (CDC) в США, уровень смертности от инфекции MRSA превысил уровень смертности от синдрома приобретенного иммунодефицита (СПИД), болезни Паркинсона и убийств (Lessa et al., 2012). Таким образом, анализ молекулярных характеристик S. aureus , который стал центром внимания глобального общественного здравоохранения, может помочь нам понять распространенность S. aureus , отслеживать эволюцию S. aureus , обнаружить новые молекулярные особенности S. aureus и предоставляют информацию для разработки новых лекарств против S. aureus (рис. 1A).
Рисунок 1 . Механизм эндогенной резистентности Staphylococcus aureus . (A) Краткое введение в эволюцию лекарственной устойчивости S. aureus . (B) Схема снижения внемембранной проницаемости вызвала лекарственную устойчивость S. aureus . (C) Роль активных систем оттока в устойчивости к MRSA. (D) Роль клеточных ферментов в лекарственной устойчивости S. aureus .
Внутренняя устойчивость к антибиотикам
Уровень устойчивости S. aureus к инфекции и штаммам с множественной лекарственной устойчивостью растет, что затрудняет клиническое противоинфекционное лечение.Механизм эндогенной резистентности в основном включает три аспекта (Рисунок 1).
Проницаемость внешней мембраны
Когда проницаемость клеточной мембраны снижается, нарушается энергетический метаболизм бактерий и, следовательно, снижается абсорбция лекарств, что приводит к лекарственной устойчивости (Li et al., 2013; Anuj et al., 2019). Например, устойчивость S. aureus к аминогликозидам вызвана снижением проницаемости мембран и, в конечном итоге, приводит к снижению потребления лекарств (рис. 1B) (Hori and Hiramatsu, 1994; Andrade et al., 2014).
Отводящие системы
Активная система оттока бактерий была открыта в 1980 году Боллом и Макмерри при изучении устойчивости Escherichia coli к тетрациклину (Seifi and Khoshbakht, 2016). Впоследствии ученые провели множество экспериментов с системой активного оттока, которые подтвердили, что система активного оттока является нормальной физиологической структурой бактерий и существует у чувствительных штаммов (Lekshmi et al., 2018). Когда в течение длительного времени индуцируется субстратами в окружающей среде, гены, кодирующие систему оттока, активируются и экспрессируются, и способность оттока лекарств значительно усиливается, что приводит к устойчивости к лекарствам (Zarate et al., 2019). Системы активного оттока лекарств играют определенную роль в устойчивости ко многим лекарствам (Costa et al., 2018). На клеточной мембране Staphylococcus aureus присутствуют три типа белков, перекачивающих множество лекарственных средств: QacA, NorA и Smr (Foster, 2016; Jang, 2016). Noguchi et al. считают QacA важным фактором MRSA (Noguchi et al., 2005; Nakaminami et al., 2019). Все белки, перекачивающие под действием нескольких лекарственных препаратов, являются протонными кинезинами (Foster, 2016). То есть вместо того, чтобы полагаться на гидролиз АТФ для высвобождения энергии, материальный обмен осуществляется за счет электрохимического градиента, образованного H + с обеих сторон клеточной мембраны (Matano et al., 2017). Обычно это обратимый процесс, то есть H + перемещается из внеклеточного во внутриклеточный, в то время как внутриклеточные вредные вещества, такие как красители и антибактериальные препараты, текут изнутри клетки наружу (Lowy, 1998). Эксперименты Кристиансена и др. также продемонстрировали роль активных систем оттока в устойчивости к MRSA (Mo et al., 2007) (Рисунок 1C).
Чрезмерное производство β-лактамазы
β-лактамаза — это фермент, который катализирует гидролиз различных β-лактамных антибиотиков (включая антибиотики, такие как карбапенемные антибиотики широкого спектра действия), кодируется бактериальными хромосомными генами и может передаваться (Lee and Park, 2016).В настоящее время исследования показывают, что β-лактамные антибиотики оказывают смертельное действие на бактерии в основном за счет двух механизмов: во-первых, путем связывания с пенициллин-связывающим белком (PBP, т.е. муцинсинтаза клеточной стенки), который подавляет синтез муцина клеточной стенки, нарушает клеточная стенка и приводит к размножению и лизису бактерий; во-вторых, за счет запуска автолитической ферментативной активности бактерий, что привело к автолизу и гибели (Matono et al., 2018). Избыточная секреция β-лактамазы MRSA в основном снижает эффект антибиотиков за счет двух механизмов, которые приводят к устойчивости к MRSA (Khan et al., 2014). Первый — это механизм гидролиза, то есть β-лактамаза гидролизует и инактивирует β-лактамные антибиотики; второй — механизм защемления, то есть большое количество β-лактамазы быстро и прочно связывается с внеклеточными антибиотиками, предотвращая попадание антибиотиков во внутриклеточное пространство, и, следовательно, антибиотики не могут достичь целевого участка, что в конечном итоге приводит к Устойчивость MRSA к антибиотикам (рис. 1D) (Harada et al., 2014; Hashizume et al., 2017).
Приобретенная устойчивость к антибиотикам
Устойчивость в результате мутаций
Staphylococcus aureus может стать устойчивым к лекарствам из-за генетических мутаций, которые изменяют целевую ДНК-гиразу или уменьшают белки внешней мембраны, тем самым снижая накопление лекарств (Kime et al., 2019; Ян и др., 2019). Например, принцип устойчивости к клиндамицину и эритромицину обусловлен модификацией рибосомальной РНК-метилазы (Heelan et al., 2004; Martinez et al., 2018).
Приобретение генов устойчивости
Приобретенная устойчивость — это тип плазмид-опосредованной устойчивости (Foster, 2017). Посредством плазмид-опосредованной трансдукции, трансформации и встраивания генов устойчивости к лекарствам может вырабатываться избыточная β-лактамаза, что приводит к устойчивости бактерий (Foster, 2017; Haaber et al., 2017). Механизм устойчивости к MRSA обусловлен главным образом тем, что плазмиды или передача гена лекарственной устойчивости опосредована плазмидами, которые могут расширять геном, и гены устойчивости могут передаваться между S. aureus и другими бактериями (Vestergaard et al., 2019). Например, MRSA может получать лекарственно-устойчивые плазмиды из Enterococcus , дополнительно увеличивая и увеличивая его устойчивость (Lazaris et al., 2017).
Биопленочная устойчивость
Бактериальная биопленка представляет собой внеклеточную сложную структуру, состоящую из микробной популяции, прикрепленной к поверхности субстрата, а ее внутренние микроорганизмы окружены высокогидратированным внеклеточным полимерным матриксом, производимым самой собой, что является защитным способом выживания для бактерий, чтобы адаптироваться к ним. их окружение (Craft et al., 2019; Saxena et al., 2019). Более того, подавляющее большинство бактерий в природе существует в форме биопленок, и наиболее характерной особенностью бактериальных биопленок является их сильная адгезия и устойчивость к лекарствам, что позволяет бактериям сопротивляться иммунным ответам хозяина и избегать уничтожения антибиотиками (Kanwar et al., 2017). Их устойчивость к антибактериальным препаратам может возрасти в 1000 раз по сравнению с планктоном. В настоящее время отечественные и зарубежные препараты для лечения биопленок в основном сосредоточены на постоянной разработке новых антибактериальных препаратов, но антибиотики и химические синтетические препараты, используемые в клинической медицине, обладают определенными токсическими эффектами (Saxena et al., 2019). Биопленочные бактерии склонны к устойчивости к этим обычным лекарствам, а резистентные штаммы имеют тенденцию к росту (Craft et al., 2019). Исследования показали, что комбинированное применение традиционной китайской медицины и антибиотиков имеет преимущество в снижении эффективности (Kanwar et al., 2017).
Клетки-персистеры с устойчивостью к антибиотикам
Клетки-персистеры — это небольшое подмножество клеток, которые генетически гомологичны, но фенотипически гетерогены в микробной популяции, медленно растут или находятся в состоянии покоя и выживают при высоких концентрациях антибиотиков (Fisher et al., 2017). Ранние исследования показывают, что, в отличие от устойчивости к антибиотикам, задержка бактерий — это физиологическое состояние бактерий, которое временно сопротивляется антибиотическому стрессу и не приводит к изменению генотипа (Kester and Fortune, 2014). Однако это утверждение подвергается сомнению из-за быстрого развития технологии высокопроизводительного секвенирования. Когда бактерии сталкиваются с внешними раздражителями, такими как антибиотики, большинство бактерий немедленно погибает, но небольшой процент бактерий сопротивляется этому давлению, останавливая рост и оставаясь неактивными (Michiels et al., 2016). Когда внешнее давление исчезает, это небольшое количество бактерий может вернуться к нормальному росту; мы называем эти бактерии клетками-персистерами (Fisher et al., 2017). Присутствие клеток-персистеров создает множество препятствий для полного устранения бактериальных инфекций и предотвращения повторных инфекций (Fisher et al., 2017; Foster, 2017). Бактериальные клетки-персистеры проявляют толерантность к антибиотикам, медленный рост и способность возобновлять инфекцию после лечения антибиотиками. Антибиотики могут вызывать смертельный ущерб бактериям, но клетки-персистеры могут противостоять этому уничтожению, уменьшая рост и метаболизм клеток и даже становясь бездействующими (Lewis, 2008).Устойчивость бактерий относится к состоянию пониженной метаболической активности, которое наделяет субпопуляцию изогенных бактерий множественной лекарственной толерантностью (Fisher et al., 2017). Персистеры являются фенотипическими вариантами, но не мутантами (Kester and Fortune, 2014). Существующие результаты исследований показали, что механизм персистенции бактерий сложен, и связанные с ним сигнальные пути включают системы токсин-антитоксин, физиологическое снижение энергетического метаболизма клетки и синтез белков и нуклеиновых кислот, системы защиты и восстановления ДНК, системы протеаз, транс-трансляцию, внешние насосная система и т. д. (Michiels et al., 2016; Фишер и др., 2017).
Достижения в области исследований широко используемых антибиотиков
MRSA — это разновидность «супербактерий» с множественной лекарственной устойчивостью, устойчивых к пенициллинам, цефалоспоринам, хлорамфениколу, линкомицину, аминогликозидам, тетрациклинам, макролидам, хинофталонам, сульфаниламидам и рифампицину, что является очень сложной проблемой для клинического лечения (2016). Более того, сообщалось, что инфекция MRSA является одним из основных инфекционных заболеваний в мире из-за высоких показателей заболеваемости и смертности, которые серьезно угрожают здоровью человека и привлекли внимание мирового медицинского сообщества (Hassoun et al., 2017). Поэтому актуален поиск эффективных препаратов для лечения бактериальных инфекций с множественной лекарственной устойчивостью. Мы перечислили некоторые из препаратов, используемых против инфекций против MRSA, которые применялись в клинике, в таблице 1, и три из них (т.е. ванкомицин, даптомицин и линезолид) были выделены.
Таблица 1 . Краткое описание эффектов антибиотиков против MRSA.
Ванкомицин
Ванкомицин долгое время считался лучшим лекарством для лечения тяжелой инфекции MRSA, включая HA-MRSA и CA-MRSA, которые могут вызывать серьезные инвазивные инфекции, такие как пневмония и сепсис (Holmes et al., 2015). Ванкомицин известен как последняя линия защиты от инфекции грамположительных кокков (Micek, 2007). Было обнаружено, что механизм устойчивости ванкомицина заключается в основном в специфическом связывании ванкомицина со стенкой бактериальной клетки через небольшие пептиды-предшественники пептидогликана, которые заканчиваются D-аланил-D-аланином; это связывание ингибирует удлинение и сшивание пептидогликанов клеточной стенки бактерий, тем самым подавляя синтез клеточной стенки и в конечном итоге приводя к гибели бактерий (Micek, 2007; Haseeb et al., 2019). Тем не менее, устойчивость Staphylococcus aureus к ванкомицину растет с каждым днем, что вызывает широкую озабоченность в медицинском сообществе (Haseeb et al., 2019). В настоящее время большое количество исследователей обычно делят устойчивый к ванкомицину Staphylococcus aureus на три типа: устойчивый к ванкомицину Staphylococcus aureus (VRSA), промежуточный ванкомицин Staphylococcus aureus (VISA) и гетерологичный устойчивый к ванкомицину гетеро-VRSA) (Amberpet et al., 2019). VRSA означает минимальную ингибирующую концентрацию (МИК) клинически изолированного Staphylococcus aureus по отношению к ванкомицину <32 мг / л, и впервые было сообщено в США в 2002 году. VISA означает, что МИК Staphylococcus aureus по отношению к ванкомицину составляет 8 –16 мг / л, первый штамм был выделен в 1997 г. в Японии и привлек внимание медицинского сообщества (Baseri et al., 2018). Впоследствии США, Китай и другие страны последовательно открыли несколько VISA (Howden et al., 2010). Гетеро-VRSA относится к первичной культуре Staphylococcus aureus , выделенной из клинических образцов. VRSA можно обнаружить с помощью метода разбавления микробов MH или метода разбавления агара, а МПК ванкомицина составляет ≤4 мг / л (Severin et al., 2004).
Даптомицин
Даптомицин — это циклизованный липопептидный препарат, который экстрагируется из ферментационного бульона Streptomyces roseosporus (Heidary et al., 2018). Его механизм действия заключается в разрушении электрического потенциала плазматических мембран в присутствии ионов кальция, но даптомицин не ингибирует липотейхоевую кислоту (Taylor and Palmer, 2016).Благодаря уникальному механизму действия даптомицин не обладает перекрестной резистентностью с другими антибиотиками и может использоваться для лечения инфекций мягких тканей кожи и инфекций кровотока, вызванных MRSA, но не пневмонии, вызванной MRSA, поскольку его активность может подавляться альвеолярным сурфактантом ( Гомес Казанова и др., 2017). Имеется большое количество доказательств того, что даптомицин обладает более быстрым бактерицидным действием, чем ванкомицин, линезолид или хинупристин / далофопин (Stefani et al., 2015; Gomez Casanova et al., 2017). Кроме того, даптомицин обладает эффектом устойчивости к большинству клинических грамположительных бактерий in vitro; , таким образом, даптомицин в основном применяется для лечения инфекций, вызванных многими лекарственно-устойчивыми бактериями, такими как устойчивые к ванкомицину энтерококки , MRSA, гликопептид-чувствительные Staphylococcus aureus , коагулазонегативные Staphylococcus и устойчивые к пенициллину Streptococonia pneumoniae. (Chuang et al., 2016). В США разрешены внутривенные инъекции даптомицина для лечения сложных инфекций кожи и мягких тканей (Heidary et al., 2018). Что касается лекарственной формы, даптомицин в настоящее время доступен только в форме инъекции, а его пероральная лекарственная форма находится в стадии изучения (Mediavilla et al., 2012).
Линезолид
Линезолид — это синтетический новый класс оксазолидиноновых антибактериальных агентов, который подавляет энтерококцистафилококков и большинство штаммов Streptococcus (Sazdanovic et al., 2016). Он в основном используется для борьбы с системными инфекциями, вызванными устойчивым к ванкомицину Enterobacter faecium , такими как сепсис и пневмония (Krueger and Unertl, 2002).Линезолид может связываться с сайтом 23S рибосомной РНК на субъединице 50S у бактерий, ингибируя 50S и 30S рибосомные субъединицы и предотвращая образование комплекса инициации 70S, тем самым препятствуя синтезу белка (Livermore, 2003). Этот уникальный механизм действия устраняет перекрестную резистентность между линезолидом и другими антибиотиками (Livermore, 2003; Hashemian et al., 2018). Сообщалось, что выживаемость и показатель клинического излечения пациентов с инфекцией MRSA, получавших линезолид, были значительно выше, чем у пациентов, получавших ванкомицин.Основываясь на крупномасштабных клинических исследованиях, пероральные и инъекционные лекарственные формы линезолида одинаково эффективны при лечении MRSA, а также против таких инфекций, как устойчивые к ванкомицину энтерококки , устойчивые к пенициллину пневмококки и макролиды- устойчивые бактериостатические стрептококки (Hashemian et al., 2018). Ввиду хорошего терапевтического эффекта препарата на бактерии с множественной лекарственной устойчивостью, он был использован в клинических условиях после одобрения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2000 г. (Tyson et al., 2018). В 2007 году линезолид также вышел на китайский рынок. Поскольку он оказывает сильное антибактериальное действие на большинство грамположительных бактерий, он считается важным выбором для лечения MRSA (Hashemian et al., 2018).
Новые терапевтические стратегии лечения MRSA
MRSA обладает множественной лекарственной устойчивостью, устойчивостью не только к β-лактамным антибиотикам, но и к противомикробным агентам, таким как аминогликозиды, хинолоны и макролиды (Vestergaard et al., 2019).Смертность от системной инфекции составляет более 50%, что стало всемирной проблемой в клинической и общественной противоинфекционной терапии, и ее трудно лечить (Lindsay, 2013; Vestergaard et al., 2019). В то же время отделение интенсивной терапии больницы является основным местом заражения MRSA, который может вызвать вспышку (Lindsay, 2013). Поэтому срочно необходимы многие новые препараты против MRSA. В таблице 2 перечислены недавно изученные препараты против MRSA.
Таблица 2 .Краткое изложение альтернативных терапевтических стратегий лечения MRSA.
Подавление восприятия кворума
Чувствительность кворума — это явление, при котором бактериальные клетки регулируют поведение бактериальных популяций, воспринимая самоиндукторы. Бактерии выделяют сигнальные молекулы, называемые ауто-индуцирующими веществами (Perez-Perez et al., 2017). Когда внеклеточная концентрация этих веществ увеличивается до определенного порога с увеличением концентрации популяции, бактерии включают экспрессию определенных генов, тем самым регулируя групповое поведение бактерий (Yin et al., 2011). Это эффективное средство обмена информацией между бактериями, включая биолюминесценцию, биопленку и экспрессию токсичных генов, а многие другие виды поведения регулируются системой распознавания кворума (Kalia and Purohit, 2011). Микробно-патогенные свойства S. aureus очень сложны и в основном связаны с факторами вирулентности (Yin et al., 2011). Эти факторы вирулентности представляют собой главным образом экзотоксины, которые разрушают клетки-хозяева, мешают иммунным ответам, а также некоторые белки, участвующие в адгезии и защите от защиты хозяина (Kalia and Purohit, 2011; Yin et al., 2011). Экспрессия факторов вирулентности регулируется сложной сетью, состоящей из множества генов, наиболее важным из которых является глобальный регуляторный фактор h2, который регулируется механизмами распознавания кворума (Haseeb et al., 2019). Однако ингибирование этого механизма восприятия кворума у бактерий может привести к препятствованию формированию биопленок, снижению вирулентности бактерий и снижению устойчивости бактерий (Wang et al., 2017; Haseeb et al., 2019).
Ингибирование лектина
Лектин представляет собой сахар-связывающий белок неиммунного происхождения, который обеспечивает агглютинацию клеток или осаждение гликоконъюгатов (Aretz et al., 2018). Сообщалось, что лектины могут не только агглютинировать эритроциты, но также агглютинировать с различными клетками, такими как патогены, иммунные клетки и половые клетки (Aretz et al., 2018; Alghadban et al., 2019). В настоящее время применение лектина в области медицины заключается в основном в специфическом распознавании и адгезии лектинов, что позволяет различным патогенным микроорганизмам связываться и инфицировать свои клетки-реципиенты (Alghadban et al., 2019). Например, некоторые лектины маннозы могут значительно влиять на токсичность ВИЧ, что позволяет разрабатывать противовирусные препараты (Barre et al., 2019). Таким образом, можно использовать характеристики лектина для конструирования и разработки новых клинических лекарств и принципиально предотвратить связывание патогенных микроорганизмов с реципиентными клетками, тем самым предотвращая большинство инфекционных заболеваний (Aretz et al., 2018).
Хелатирование железа
Ионы железа являются важными питательными веществами для большинства организмов, включая бактерии (Carver, 2018). Исследования показали, что ионы железа составляют каталитический центр важных биологических ферментов, таких как оксидоредуктаза, и участвуют в различных жизненных процессах, таких как перенос электронов, антиоксидантные реакции и синтез нуклеиновых кислот (Nuti et al., 2017). Устойчивость патогенных бактерий к антибиотикам постоянно увеличивается; поэтому срочно необходимы новые антибактериальные препараты (Borgna-Pignatti and Marsella, 2015). Одним из важных механизмов устойчивости бактерий является снижение проницаемости внешней мембраны и, таким образом, препятствование проникновению молекул лекарства в клетки (Carver, 2018). Чтобы обойти лекарственную устойчивость, опосредованную этим механизмом, одним из методов является присоединение молекулы антибиотика к носителю железа с образованием конъюгата носитель железа-антибиотик, и этот конъюгат носитель железа-антибиотик может избирательно взаимодействовать с поверхностью мембраны бактериальной клетки ( Райнер и Мункхоф, 2005).Рецепторы внешней мембраны носителя железа взаимодействуют с этим конъюгатом; затем конъюгат пересекает внешнюю клеточную мембрану за счет активного транспорта через систему транспорта ионов железа (Bogdan et al., 2016). В этом случае связанный с антибиотиком носитель железа может быть связан с Fe 3+ , и полученный комплекс (антибиотик-носитель железа-Fe 3+ ) попадает в клетку. Наконец, лекарство высвобождается внутри клетки, оказывая тем самым антибактериальное действие (Bogdan et al., 2016).
Фаготерапия
В начале своего открытия фаг использовался медицинским сообществом бывшего Советского Союза и Восточной Европы для лечения бактериальных инфекций (Cisek et al., 2017). Однако с наступлением эры антибиотиков люди постепенно перестали уделять внимание глубоким исследованиям фагов. В последние годы из-за роста глобального уровня инфицирования лекарственно-устойчивыми бактериями использование антибиотиков для лечения бактериальных инфекций столкнулось с беспрецедентными проблемами (Lin et al., 2017). Появление ряда устойчивых к лекарствам патогенов, таких как Staphylococcus aureus, Pseudomonas aeruginosa, Acinetobacter baumannii, tuberculosis, Enterococcus faecalis и особенно MRSA, заставило некоторых ученых и клиницистов переориентировать свое внимание на исследования фагов, что привело к большому прогрессу. в этой области (Lin et al., 2017; Шлезингер и др., 2017). Большое количество экспериментов доказало, что фаги могут эффективно повышать выживаемость животных, инфицированных бактериями (Shlezinger et al., 2017). По сравнению с антибиотиками фаговые препараты обладают преимуществами высокой специфичности, быстрого самораспространения и короткого времени развития (Krut and Bekeredjian-Ding, 2018). Фаговая терапия считается одним из наиболее многообещающих методов лечения патогенов человека, включая штаммы, устойчивые к антибиотикам (Shlezinger et al., 2017). Еще в 1921 году фаги использовались для лечения кожных инфекций, вызванных стафилококками (Wang et al., 2017). В 2007 году итальянские исследователи продемонстрировали, что фаг Msa может эффективно контролировать летальные инфекции, вызываемые S. aureus , путем создания модели внутривенной инъекции у мышей (Delgado et al., 2000). С увеличением числа устойчивых к лекарствам бактерий преимущества фагов были признаны многими учеными. Однако биологические характеристики S.aureus и связанные с ними исследования на животных, проведенные на протяжении многих лет, показывают, что существует множество ограничений в приготовлении, хранении и условиях фагов (Lin et al., 2017). Подобно антибиотикам, бактерии также могут быть устойчивы к фагам. Однако разнообразие и изменчивость фагов в природе также обеспечивает неисчерпаемый ресурс для бактерий, контролируемых фагами. Кроме того, ферменты, лизирующие фаги, которые оказывают деструктивное действие на основной каркас бактерий, могут восполнить отсутствие устойчивости к фагам (Shlezinger et al., 2017). Более того, в настоящее время фаговая терапия еще не получила своего клинического применения. Основные проблемы заключаются в следующем (Lin et al., 2017; Shlezinger et al., 2017): (1) большинство фагов высокоспецифичны и могут убивать только одну или несколько подгрупп бактерий; (2) фаговая терапия в специфическом тесте in vitro эффективна, но это не означает, что она одинаково эффективна in vivo ; (3) Фаги начинают размножаться только тогда, когда бактерии достигают определенной плотности. Фаги могут быть инокулированы преждевременно или в несоответствующих дозах и могут быть удалены организмом до того, как они начнут размножаться.Следовательно, определение оптимального времени и дозы инокуляции станет большой трудностью при лечении фагами. Вышеупомянутые проблемы являются общими проблемами фаговой терапии. Следовательно, эти проблемы также существуют в ходе лечения Staphylococcus aureus .
Наночастицы
Под нанотехнологиями понимается подготовка, исследование и индустриализация веществ в наномасштабе, а также комплексные технические системы для перекрестных исследований и индустриализации с использованием материалов наномасштаба (Wu et al., 2020). Исследования показали, что нанотехнологии могут применяться в области медицины, медицины, биологии, химии и информационных технологий; следовательно, он может играть важную роль в неинвазивной малоинвазивной медицине (Barbero et al., 2017). В области медицины наночастицы увеличивают способность доставлять лекарство в организм человека (Li et al., 2010). После того, как несколько слоев инкапсулированных в наночастицы интеллектуальных лекарств попадают в организм человека, они могут активно искать и атаковать раковые клетки или восстанавливать поврежденные ткани (Wang et al., 2020). В Китае успешно разработано новое поколение антибактериальных препаратов наноразмерного действия. Порошковые наночастицы имеют диаметр всего 25 нанометров и обладают сильным ингибирующим и убивающим действием на патогенные микроорганизмы, такие как Escherichia coli и S. aureus (Li M. et al., 2017). Наноразмерные антибактериальные препараты обладают многими свойствами, такими как спектр, гидрофильность и защита окружающей среды, и они не вызывают устойчивости из-за использования природных минералов (Howden et al., 2010).
Заключительное замечание
Staphylococcus aureus — это бактерия, которая повсеместно встречается в окружающей среде и часто встречается в организме человека на поверхности кожи и слизистой оболочке верхних дыхательных путей (Lowy, 1998). Примерно 20% населения являются долгосрочными носителями S. aureus , и у большинства людей клинические симптомы не проявляются; однако S. aureus по-прежнему является важным патогеном человека (Humphreys, 2012). S. aureus может вызывать инфекции в больницах и сообществах и стал ведущим патогеном в больницах по всему миру (Edwards and Massey, 2011).В 1840-х годах пенициллин был открыт британским бактериологом Флемингом и использовался в клинике для борьбы с инфекцией S. aureus (Gardete and Tomasz, 2014). Позже продолжали появляться различные антибактериальные препараты. Однако это крупное исследование также заложило скрытую опасность для человеческого общества. Широкое использование антибиотиков привело к увеличению числа случаев бактериальной резистентности, начиная с появления штаммов с множественной лекарственной устойчивостью, таких как MRSA, который считался клинически важной проблемой и также привлек широкое внимание отечественных и зарубежных экспертов-исследователей (Pichereau and Rose, 2010; Klein et al., 2017). Хотя уровень смертности от инфекции MRSA снизился в некоторых европейских странах в последние годы, MRSA по-прежнему представляет собой серьезную проблему для общественного здравоохранения во всем мире (Rayner and Munckhof, 2005). Благодаря своим характеристикам легкого инфицирования, высокой смертности и множественной лекарственной устойчивости, MRSA стал камнем преткновения в клиническом лечении (Khoshnood et al., 2019). Следовательно, как эффективно предотвратить и контролировать MRSA стало горячей темой в современных исследованиях. С годами наука и техника прогрессировали, а медицина продолжала развиваться.Люди добились выдающихся успехов в исследовании патогенных факторов MRSA. В настоящее время ванкомицин, вероятно, по-прежнему является лучшим лекарством для лечения инфекции MRSA (Micek, 2007). Однако множественная лекарственная устойчивость MRSA значительно усложнила исследования на людях (Vestergaard et al., 2019). Необходимы дальнейшие исследования для постоянного изучения способности MRSA вызывать инфекцию и путей устойчивости MRSA к антибиотикам, а также для содействия разработке новых лекарств против инфекции MRSA.Разработка новых лекарств дала врачам больше возможностей для лечения инфекций MRSA, обеспечивая большую защиту здоровья человека. Однако эффективность и безопасность лекарств требуют дальнейших клинических исследований.
Взносы авторов
YW разработал концепт. YG и GS составили рукопись. MS собрал и проанализировал литературу. JW отредактировал рукопись и исправил язык.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
(2016). 36-й Международный симпозиум по интенсивной терапии и неотложной медицине: Брюссель, Бельгия. Crit Care 20 (Приложение 2): 94. DOI: 10.1186 / s13054-016-1208-6
CrossRef Полный текст | Google Scholar
Альгадбан, С., Кенави, Х. И., Дудлер, Т., Швебл, В. Дж., И Брунскилл, Н. Дж. (2019). Отсутствие пути активации лектина комплемента уменьшает повреждение почек, вызванное протеинурией. Фронт. Иммунол. 10: 2238.DOI: 10.3389 / fimmu.2019.02238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Амберпет, Р., Систла, С., Сугумар, М., Нагасундарам, Н., Манохаран, М., и Париджа, С. К. (2019). Обнаружение гетерогенного промежуточного звена ванкомицина Staphylococcus aureus : предварительный отчет из южной Индии. Indian J. Med. Res. 150, 194–198. DOI: 10.4103 / ijmr.IJMR_1976_17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андраде, Дж.К., Мораиш-Брага, М. Ф., Гедес, Г. М., Тинтино, С. Р., Фрейтас, М. А., Менезеш, И. Р. и др. (2014). Повышение антибиотической активности аминогликозидов за счет альфа-токоферола и других производных холестерина. Биомед. Фармакотер. 68, 1065–1069. DOI: 10.1016 / j.biopha.2014.10.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Анудж, С. А., Гаджера, Х. П., Хирпара, Д. Г., и Голакия, Б. А. (2019). Нарушение проницаемости мембраны лекарственно-устойчивого Staphylococcus aureus с катионными частицами наносеребра. евро. J. Pharm. Sci. 127, 208–216. DOI: 10.1016 / j.ejps.2018.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арец, Дж., Анумала, У. Р., Фуксбергер, Ф. Ф., Молави, Н., Зибарт, Н., Чжан, Х. и др. (2018). Аллостерическое ингибирование лектина млекопитающих. J. Am. Chem. Soc. 140, 14915–14925. DOI: 10.1021 / jacs.8b08644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барберо, Ф., Руссо, Л., Витали, М., Piella, J., Salvo, I., Borrajo, M. L., et al. (2017). Формирование белковой короны: интерфейс между наночастицами и иммунной системой. Semin Immunol. 34, 52–60. DOI: 10.1016 / j.smim.2017.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барре А., Симплисиен М., Бенуа Х., Ван Дамм Э. Дж. М. и Руж П. (2019). Маннозоспецифические лектины морских водорослей: разнообразные структурные основы, связанные с общими вирулицидными и противораковыми свойствами. Мар. Наркотики 17: 440. DOI: 10.3390 / md17080440
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Басери, Н., Наджар-Пирайех, С., и Багери Амири, Ф. (2018). Распространенность промежуточного звена ванкомицина Staphylococcus aureus среди клинических изолятов в Иране: систематический обзор и метаанализ. J. Glob. Противомикробный. Сопротивляться. 15, 178–187. DOI: 10.1016 / j.jgar.2018.06.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Богдан, А.Р., Миядзава, М., Хашимото, К., Цудзи, Ю. (2016). Регуляторы гомеостаза железа: новые игроки в метаболизме, гибели клеток и болезнях. Trends Biochem. Sci. 41, 274–286. DOI: 10.1016 / j.tibs.2015.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чино Т., Нукуи Ю., Моришита Ю. и Мория К. (2017). Морфологические бактерицидные быстродействующие эффекты перуксусной кислоты, дезинфицирующего средства высокого уровня, против биопленок Staphylococcus aureus и Pseudomonas aeruginosa в трубках. Антимикробный. Сопротивляться. Заразить. Контроль 6: 122. DOI: 10.1186 / s13756-017-0281-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чуанг, Ю. К., Лин, Х. Ю., Чен, П. Ю., Лин, К. Ю., Ван, Дж. Т., и Чанг, С. С. (2016). Даптомицин по сравнению с линезолидом для лечения устойчивой к ванкомицину энтерококковой бактериемии: влияние дозы даптомицина. Clin. Microbiol. Заразить. 22, 890.e1–890.e7 doi: 10.1016 / j.cmi.2016.07.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цисек, А.А., Домбровска И., Грегорчик К. П., Выжевски З. (2017). Фаговая терапия в лечении бактериальных инфекций: сто лет после открытия бактериофагов. Curr. Microbiol. 74, 277–283. DOI: 10.1007 / s00284-016-1166-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коста, С. С., Собковяк, Б., Паррейра, Р., Эджворт, Дж. Д., Вивейрос, М., Кларк, Т. Г. и др. (2018). Генетическое разнообразие norA, кодирующее основной насос оттока Staphylococcus aureus . Фронт. Genet. 9: 710. DOI: 10.3389 / fgene.2018.00710
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крафт, К. М., Нгуен, Дж. М., Берг, Л. Дж. И Таунсенд, С. Д. (2019). Метициллин-устойчивый Staphylococcus aureus (MRSA): устойчивость к антибиотикам и фенотип биопленки. Medchemcomm 10, 1231–1241. DOI: 10.1039 / C9MD00044E
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Delgado, G. Jr., Нойхаузер, М. М., Берден, Д. Т., и Данцигер, Л. Х. (2000). Хинупристин-далфопристин: обзор. Фармакотерапия 20, 1469–1485. DOI: 10.1592 / phco.20.19.1469.34858
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фостер, Т. Дж. (2016). Замечательно многофункциональные связывающие фибронектин белки Staphylococcus aureus . евро. J. Clin. Microbiol. Заразить. Дис. 35, 1923–1931. DOI: 10.1007 / s10096-016-2763-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гомес Казанова, Н., Силлер Руис, М., и Муньос Беллидо, Дж. Л. (2017). Механизмы устойчивости к даптомицину у Staphylococcus aureus . Rev. Esp. Quimioter. 30, 391–396.
PubMed Аннотация | Google Scholar
Гонсалес-Перес, К. Дж., Танори-Кордова, Дж., Айспуро-Эрнандес, Э., Варгас-Ариспуро, И., и Мартинес-Теллез, М. А. (2019). Морфометрические параметры патогенов пищевого происхождения, оцененные с помощью просвечивающей электронной микроскопии, и их связь с оптической плотностью и колониеобразующими единицами. J. Microbiol. Методы 165: 105691 doi: 10.1016 / j.mimet.2019.105691
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харада Ю., Чонг Ю., Шимоно Н., Мияке Н., Учида Ю., Кадоваки М. и др. (2014). Нозокомиальное распространение метициллин-резистентного Staphylococcus aureus с бета-лактам-индуцибельной резистентностью к арбекацину. J. Med. Микробиол . 63 (Pt 5): 710–714. DOI: 10.1099 / jmm.0.065276-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хасиб, А., Аджит Сингх, В., Тех, К. С. Дж., И Локи, М. Ф. (2019). Добавление цефтаролина фозамила или ванкомицина к PMMA: in vitro сравнение биомеханических свойств и эффективности против MRSA. J. Orthop. Surg. 27: 23094950324. DOI: 10.1177 / 23094950324
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хашемиан, С. М. Р., Фархади, Т., и Ганджпарвар, М. (2018). Линезолид: обзор его свойств, функций и использования при интенсивной терапии. Drug Des. Devel. Ther. 12, 1759–1767. DOI: 10.2147 / DDDT.S164515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хашизуме, Х., Такахаши, Ю., Масуда, Т., Охба, С. И., Охиси, Т., Кавада, М., и др. (2017). In vivo эффективность бета-лактама / трипропептина C на модели мышиной сепсиса и механизм обратной устойчивости к бета-лактаму у метициллин-резистентных Staphylococcus aureus , опосредованных трипропептином C. J. Antibiot. 71, 79–85. DOI: 10.1038 / ja.2017.88
CrossRef Полный текст | Google Scholar
Хассун, А., Линден, П. К., и Фридман, Б. (2017). Заболеваемость, распространенность и лечение бактериемии MRSA в популяциях пациентов — обзор последних достижений в лечении и лечении MRSA. Crit. Уход 21: 211. DOI: 10.1186 / s13054-017-1801-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Heelan, J. S., Hasenbein, M. E., and McAdam, A.Дж. (2004). Устойчивость стрептококка группы B к избранным антибиотикам, включая эритромицин и клиндамицин. J. Clin. Microbiol. 42, 1263–1264. DOI: 10.1128 / JCM.42.3.1263-1264.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейдари, М., Хосрави, А. Д., Хошнуд, С., Насири, М. Дж., Сулеймани, С., и Гударзи, М. (2018). Даптомицин. J. Antimicrob. Chemother. 73, 1–11. DOI: 10.1093 / jac / dkx349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холмс, Н.Э., Тонг, С. Ю., Дэвис, Дж. С., и ван Хал, С. Дж. (2015). Лечение метициллин-резистентного Staphylococcus aureus : ванкомицин и не только. Семин. Респир. Крит. Care Med. 36, 17–30. DOI: 10.1055 / с-0034-1397040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хорн, К. С., Данцигер, Л. Х., Родволд, К. А., и Гловацки, Р. К. (2017). Фармакокинетическая оценка цефтобипрола для лечения MRSA. Exp. Opin. Препарат, средство, медикамент. Метаб.Toxicol. 13, 463–472. DOI: 10.1080 / 17425255.2017.1303481
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хауден, Б. П., Дэвис, Дж. К., Джонсон, П. Д., Стинир, Т. П., и Грейсон, М. Л. (2010). Пониженная чувствительность к ванкомицину у Staphylococcus aureus , включая промежуточные штаммы ванкомицина и гетерогенные промежуточные штаммы ванкомицина: механизмы устойчивости, лабораторное обнаружение и клинические последствия. Clin. Microbiol. Ред. 23, 99–139.DOI: 10.1128 / CMR.00042-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йокинен, Э., Лайне, Дж., Хуттунен, Р., Рахикка, П., Хухтала, Х., Вуенто, Р. и др. (2017). Сравнение исходов и клинических характеристик бактериемии, вызванной метициллин-резистентными, пенициллин-резистентными и пенициллин-чувствительными штаммами Staphylococcus aureus . Заражение. Дис. 49, 493–500. DOI: 10.1080 / 23744235.2017.1292046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калия, В.К., и Пурохит, Х. Дж. (2011). Подавление системы распознавания кворума: потенциальные мишени для антибактериальных препаратов. Crit. Rev. Microbiol. 37, 121–140. DOI: 10.3109 / 1040841X.2010.532479
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канвар, И., Сах, А. К., и Суреш, П. К. (2017). Биопленочные устойчивые к антибиотикам бактериальные инфекции полости рта: механизм и стратегии борьбы. Curr. Pharm. Des. 23, 2084–2095 DOI: 10.2174 / 1381612822666161124154549
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кестер, Дж.К. и Форчун С. М. (2014). Персистеры и не только: механизмы фенотипической лекарственной устойчивости и лекарственной устойчивости у бактерий. Crit. Rev. Biochem. Мол. Биол. 49, 91–101. DOI: 10.3109 / 10409238.2013.869543
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, С., Саллум, У., Чжэн, X., Нау, Г. Дж., И Хасан, Т. (2014). Быстрое оптическое определение активности бета-лактамаз и антибиотиков. BMC Microbiol. 14:84. DOI: 10.1186 / 1471-2180-14-84
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хошнуд, С., Хейдари, М., Асади, А., Сулеймани, С., Мотахар, М., Савари, М. и др. (2019). Обзор механизма действия, устойчивости, синергизма и клинических последствий мупироцина против Staphylococcus aureus . Биомед. Фармакотер. 109, 1809–1818. DOI: 10.1016 / j.biopha.2018.10.131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кайм, Л., Рэндалл, К. П., Банда, Ф. И., Колл, Ф., Райт, Дж., Ричардсон, Дж. И др. (2019). Временное подавление устойчивости к антибиотикам за счет мутации представляет собой значительный потенциальный источник непредвиденной терапевтической неудачи. МБио 10: e01755-19. DOI: 10.1128 / mBio.01755-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кляйн Э. Ю., Мохика Н., Цзян В., Косгроув С. Э., Септимус Э., Морган Д. Дж. И др. (2017). Тенденции в отношении метициллин-резистентных Staphylococcus aureus госпитализаций в США, 2010–2014 гг. Clin. Заразить. Дис. 65, 1921–1923. DOI: 10.1093 / cid / cix640
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клевенс, Р.М., Моррисон, М. А., Надл, Дж., Пети, С., Гершман, К., Рэй, С. и др. (2007). Инвазивные метициллин-устойчивые инфекции Staphylococcus aureus в США. JAMA 298, 1763–1771. DOI: 10.1001 / jama.298.15.1763
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крюгер, В. А., Унертл, К. Э. (2002). [Новый вариант лечения грамположительных инфекций у тяжелобольных — обзор линезолида]. Anasthesiol Intensivmed Notfallmed Schmerzther 37, 199–204.DOI: 10,1055 / с-2002-25077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лахунди, С., Чжан, К. (2018). Метициллин-устойчивый Staphylococcus aureus : молекулярная характеристика, эволюция и эпидемиология. Clin. Microbiol. Ред. 31: e00020–18. DOI: 10.1128 / CMR.00020-18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лазарис, А., Коулман, Д. К., Кернс, А. М., Пишон, Б., Кинневи, П. М., Эрлз, М.R., et al. (2017). Новые плазмиды cfr с множественной резистентностью в линезолид-устойчивом, метициллин-резистентном Staphylococcus epidermidis и устойчивом к ванкомицину Enterococcus faecium (VRE) из больничной вспышки: совместное расположение cfr и optrA в Vre. J. Antimicrob. Chemother. 72, 3252–3257. DOI: 10.1093 / jac / dkx292
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Ю. Д., и Парк, Дж. Х. (2016). Конверсия фага для устойчивости к бета-лактамным антибиотикам Staphylococcus aureus из пищевых продуктов. J. Microbiol. Biotechnol. 26, 263–269. DOI: 10.4014 / jmb.1508.08042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lekshmi, M., Ammini, P., Adjei, J., Sanford, L.M., Shrestha, U., Kumar, S., et al. (2018). Модуляция антимикробных насосов оттока суперсемейства основных фасилитаторов в Staphylococcus aureus . AIMS Microbiol. 4, 1–18. DOI: 10.3934 / microbiol.2018.1.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лесса, Ф.К., Му, Ю., Рэй, С. М., Думяти, Г., Буленс, С., Горвиц, Р. Дж. И др. (2012). Влияние USA300 метициллин-резистентного Staphylococcus aureus на клинические исходы у пациентов с пневмонией или инфекциями кровотока, ассоциированными с центральной линией. Clin. Заразить. Дис. 55, 232–241. DOI: 10.1093 / cid / cis408
CrossRef Полный текст | Google Scholar
Ли, Дж., Хе, С., Янг, З., и Лу, К. (2017). Фармакокинетика и проникновение норванкомицина в спинномозговую жидкость у взрослых китайских пациентов. Внутр. J. Antimicrob. Агенты 49, 603–608. DOI: 10.1016 / j.ijantimicag.2017.01.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, М., Цзоу, П., Тайнер, К., и Ли, С. (2017). Фармакокинетическое моделирование фармацевтических наночастиц на физиологической основе. AAPS J. 19, 26–42. DOI: 10.1208 / s12248-016-0010-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Н., Луо, М., Фу, Ю. Дж., Цзу, Ю. Г., Wang, W., Zhang, L., et al. (2013). Влияние корилагина на проницаемость мембран Escherichia coli, Staphylococcus aureus и Candida albicans . Phytother. Res. 27, 1517–1523. DOI: 10.1002 / ptr.4891
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лин, Д. М., Коскелла, Б., и Лин, Х. С. (2017). Фаговая терапия: альтернатива антибиотикам в эпоху множественной лекарственной устойчивости. World J. Gastrointest. Pharmacol. Ther. 8, 162–173. DOI: 10.4292 / wjgpt.v8.i3.162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линдси, Дж. А. (2013). Больничный MRSA и устойчивость к антибиотикам — что мы узнали из геномики? Внутр. J. Med. Microbiol. 303, 318–323. DOI: 10.1016 / j.ijmm.2013.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартинес, Н., Луке, Р., Милани, К., Вентура, М., Бануэлос, О., и Марголлес, А. (2018).Ген, гомологичный генам метилазы рРНК, придает устойчивость к эритромицину и клиндамицину у bifidobacterium breve. заявл. Environ. Microbiol. 84, 166–176. DOI: 10.1128 / AEM.02888-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Матано, Л. М., Моррис, Х. Г., Хессер, А. Р., Мартин, С. Е. С., Ли, В., Оуэнс, Т. В. и др. (2017). Антибиотик, который ингибирует АТФазную активность переносчика АТФ-связывающей кассеты путем связывания с удаленным внеклеточным сайтом. J. Am. Chem. Soc. 139, 10597–10600. DOI: 10.1021 / jacs.7b04726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Матоно Т., Нагашима М., Мезаки К., Мотохаши А., Куцуна С., Хаякава К. и др. (2018). Молекулярная эпидемиология продукции бета-лактамаз у чувствительных к пенициллину Staphylococcus aureus в условиях высокой чувствительности. J. Infect. Chemother. 24, 153–155. DOI: 10.1016 / j.jiac.2017.10.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mediavilla, J.Р., Чен, Л., Матема, Б., Крейсвирт, Б. Н. (2012). Глобальная эпидемиология ассоциированного с сообществами метициллин-устойчивого золотистого стафилококка (CA-MRSA). Curr. Opin. Microbiol. 15, 588–595. DOI: 10.1016 / j.mib.2012.08.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мичек, С. Т. (2007). Альтернативы ванкомицину для лечения метициллин-устойчивых инфекций Staphylococcus aureus . Clin. Заразить. Dis . 45 (Дополнение 3): S184–90.DOI: 10.1086 / 519471
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Михилс, Дж. Э., Ван ден Берг, Б., Верстратен, Н., и Михилс, Дж. (2016). Молекулярные механизмы и клинические последствия устойчивости бактерий. Препарат. Сопротивляться. Updat. 29, 76–89. DOI: 10.1016 / j.drup.2016.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мо, Х. Н., Ли, Дж. Г., Тан, Ю. К., Чжан, Ю., Чжу, Дж. Х., Тан, С. К., и др. (2007).[Действие системы активного оттока на множественную лекарственную устойчивость у метициллин-резистентных Staphylococcus aureus ]. Чжунхуа Цзе Хе Хе Ху Си За Чжи 30, 40–43.
PubMed Аннотация | Google Scholar
Накаминами, Х., Такадама, С., Окита, М., Сасаки, М., и Ногучи, Н. (2019). Быстродействующее бактерицидное действие оланексидина глюконата против qacA / B-положительного метициллин-устойчивого Staphylococcus aureus . J. Med. Microbiol. 68, 957–960.DOI: 10.1099 / jmm.0.000979
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ногучи, Н., Сува, Дж., Наруи, К., Сасацу, М., Ито, Т., Хирамацу, К. и др. (2005). Чувствительность к антисептикам и распределение генов устойчивости к антисептикам qacA / B и smr метициллин-устойчивого Staphylococcus aureus , изолированного в Азии в 1998 и 1999 годах. J. Med. Микробиол . 54 (Pt 6): 557–565. DOI: 10.1099 / jmm.0.45902-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нути, Р., Гоуд, Н. С., Сарасвати, А. П., Алвала, Р., и Алвала, М. (2017). Противомикробные пептиды: многообещающая терапевтическая стратегия в борьбе с устойчивостью к противомикробным препаратам. Curr. Med. Chem. 24, 4303–4314. DOI: 10.2174 / 0929867324666170815102441
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перес-Перес, М., Хорхе, П., Перес Родригес, Г., Перейра, М. О., и Лоуренко, А. (2017). Ингибирование кворума в биопленках Pseudomonas aeruginosa : новые идеи с помощью сетевого майнинга. Биообрастание 33, 128–142. DOI: 10.1080 / 08927014.2016.1272104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пичеро, С., Роуз, В. Э. (2010). Инвазивные инфекции MRSA, ассоциированные с населением: эпидемиология и управление антимикробными препаратами. Мнение эксперта. Фармакотер. 11, 3009–3025. DOI: 10.1517 / 14656566.2010.511614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамос-Мартин, В., Джонсон, А., МакЭнти, Л., Фаррингтон, Н., Падмор, К., Кожутти, П. и др. (2017). Фармакодинамика тейкопланина против MRSA. J. Antimicrob. Chemother. 72, 3382–3389. DOI: 10.1093 / jac / dkx289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райнер К. и Мункхоф В. Дж. (2005). Антибиотики, применяемые в настоящее время для лечения инфекций, вызванных Staphylococcus aureus . Междунар. Med. J . 35 (Дополнение 2): S3–16. DOI: 10.1111 / j.1444-0903.2005.00976.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сато, А., Ямагути, Т., Хамада, М., Оно, Д., Сонода, С., Оширо, Т. и др. (2019). Морфологические и биологические характеристики биопленки Staphylococcus aureus , образующейся в присутствии плазмы. Microb. Препарат, средство, медикамент. Сопротивляться. 25, 668–676. DOI: 10.1089 / mdr.2019.0068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саксена П., Джоши Ю., Рават К. и Бишт Р. (2019). Биопленки: архитектура, устойчивость, механизмы контроля и контроля кворума. Индиан Дж.Microbiol. 59, 3–12. DOI: 10.1007 / s12088-018-0757-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сазданович П., Янкович С. М., Костич М., Димитриевич А. и Стефанович С. (2016). Фармакокинетика линезолида у тяжелобольных. Мнение эксперта. Препарат, средство, медикамент. Метаб. Toxicol. 12, 595–600. DOI: 10.1517 / 17425255.2016.1170807
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шульте, Р. Х., Мансон, Э.(2019). Staphylococcus aureus Паттерны устойчивости в Висконсине: эпиднадзор за организмами Висконсина за 2018 г. для выявления тенденций в области устойчивости к противомикробным препаратам и эпидемиологии (SWOTARE) программный отчет. Clin. Med. Res . 17, 72–81. DOI: 10.3121 / cmr.2019.1503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сейфи С., Хошбахт Р. (2016). Распространенность детерминант устойчивости к тетрациклину у бройлеров, выделенных Escherichia coli в Иране. руб. Пульт. Sci. 57, 729–733. DOI: 10.1080 / 00071668.2016.1232478
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Северин А., Табей К., Теновер Ф., Чанг М., Кларк Н. и Томаш А. (2004). Высокий уровень устойчивости к оксациллину и ванкомицину и измененный состав клеточной стенки у Staphylococcus aureus , несущего стафилококковый mecA и комплекс генов энтерококкового vanA. J. Biol. Chem. 279, 3398–3407. DOI: 10.1074 / JBC.M309593200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шан, В., Ху, К., Юань, В., Ченг, Х., Ян, Дж., Ху, З. и др. (2016). Сравнительная пригодность и детерминанты характерной лекарственной устойчивости штаммов ST239-MRSA-III-t030 и ST239-MRSA-III-t037, выделенных в Китае. Microb. Препарат, средство, медикамент. Сопротивляться. 22, 185–192. DOI: 10.1089 / mdr.2015.0226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шлезингер М., Халифа Л., Houri-Haddad, Y., Coppenhagen-Glazer, S., Resch, G., Que, Y.A., et al. (2017). Фаговая терапия: новые горизонты в антибактериальной терапии возбудителей заболеваний ротовой полости. Curr. Вверх. Med. Chem. 17, 1199–1211. DOI: 10.2174/1568026616666160930145649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стефани С., Кампаниле Ф., Сантагати М., Меццатеста М. Л., Кафисо В. и Пачини Г. (2015). Понимание и клинические перспективы устойчивости к даптомицину у Staphylococcus aureus : обзор имеющихся данных. Внутр. J. Antimicrob. Агенты 46, 278–289. DOI: 10.1016 / j.ijantimicag.2015.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тайеб-Флигельман Э., Табачников О., Моше А., Гольдшмидт-Тран О., Савая М. Р., Кокель Н. и др. (2017). Цитотоксический Staphylococcus aureus PSMalpha3 обнаруживает перекрестно-альфа-амилоидоподобные фибриллы. Наука 355, 831–833. DOI: 10.1126 / science.aaf4901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тайсон, Г.Х., Сабо, Дж. Л., Хоффманн, М., Хсу, К. Х., Мукерджи, С., Эрнандес, Дж. И др. (2018). Новые плазмиды устойчивости к линезолиду в Enterococcus от пищевых животных в США. J. Antimicrob. Chemother. 73, 3254–3258. DOI: 10.1093 / jac / dky369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Дж., Пань Ю., Шен Дж. И Сюй Ю. (2017). Эффективность и безопасность тигециклина для лечения инфекций кровотока: систематический обзор и метаанализ. Ann. Clin. Microbiol. Противомикробный. 16:24. DOI: 10.1186 / s12941-017-0199-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, К., Ян, К., Ву, В. (2020). Стеганографический аптасенсор на основе графена для обработки информации и мониторинга токсинов биопленки в продуктах питания. Фронт. Микробиол . 10: 3139. DOI: 10.3389 / fmicb.2019.03139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, W., Yu, C., Chen, J., Yang, Q.(2020). Флуорометрическое обнаружение ионов меди с использованием химии щелчков и индуцированного мишенью соединения расщепленных фрагментов ДНКзима. Внутр. J. Environ. Аналит. Chem. 100, 324–332. DOI: 10.1080 / 03067319.2019.1636977
CrossRef Полный текст | Google Scholar
Ян, Дж. Дж., Ченг, А., Тай, Х. М., Чанг, Л. В., Сюй, М. К., и Шэн, В. Х. (2019). Избранные мутации, вызванные воздействием немоноксацина и фторхинолона среди соответствующих грамположительных штаммов бактерий на Тайване. Microb.Устойчивость к наркотикам. 26, 110–117. DOI: 10.1089 / mdr.2019.0048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инь, С. Л., Чанг, Ю. Дж., Дэн, С. П., Ван, К. К., Ю, В. Г. и Гонг, К. Х. (2011). [Прогресс исследований новых антибактериальных препаратов, нацеленных на системы распознавания кворума бактерий]. Яо Сюэ Сюэ Бао 46, 613–621.
PubMed Аннотация | Google Scholar
Сарате, С. Г., Моралес, П., Свидерек, К., Боланос-Гарсия, В. М., и Бастида, А.(2019). Подход к молекулярному моделированию для идентификации новых ингибиторов суперсемейства основных фасилитаторов — переносчиков эффлюксных насосов. Антибиотики 8:25. DOI: 10.3390 / antibiotics8010025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзэн Д., Дебабов Д., Хартселл Т. Л., Кано Р. Дж., Адамс С., Шайлер Дж. А. и др. (2016). Утвержденные гликопептидные антибактериальные препараты: механизм действия и устойчивость. Колд Спринг Харб. Перспектива. Med. 6: a026989.DOI: 10.1101 / cshperspect.a026989
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Метициллин-устойчивый золотистый стафилококк (MRSA)
Что такое стафилококковая инфекция? Что такое MRSA?
«Стафилококк» или стафилококк — это тип бактерий, которые естественным образом существуют в окружающей среде, в том числе на коже людей. Если бактерии попадают под кожу через порез или царапину, стафилококковые бактерии могут вызвать кожные инфекции, которые выглядят как прыщи или фурункулы.Инфекции, вызванные стафилококком, могут быть красными, опухшими, болезненными, иметь гной или другие выделения. Большинство инфекций стафилококка незначительны, и их можно лечить без антибиотиков. Некоторые стафилококковые инфекции сопротивляются лечению классом антибиотиков и известны как устойчивый к метициллину золотистый стафилококк или MRSA. Это затрудняет лечение этих инфекций, поскольку они устойчивы к наиболее часто используемым антибиотикам. Однако существует пара других антибиотиков, к которым бактерии чувствительны и могут использоваться для лечения инфекции.
Кто подвержен риску заражения MRSA?
Люди, которые в целом здоровы, не подвержены высокому риску заражения MRSA. Если они заразятся стафилококковой инфекцией, они обычно могут с ней бороться. Инфекции стафилококка, включая инфекции MRSA, чаще всего возникают у людей в больницах и медицинских учреждениях с ослабленной иммунной системой. Инфекции MRSA становятся все более распространенными в обществе, но все еще встречаются редко.
Подвержены ли школьники большему риску заражения MRSA?
Средний ребенок не входит в группу повышенного риска.Однако ребенок, который занимается командными и контактными видами спорта, может быть. Staph заражает человека при контакте кожи с кожей; бактерии должны попасть под кожу через такие отверстия, как порезы или ссадины. Риск увеличивается, если дети используют личные вещи, например полотенца или бритвы. Загрязненные стафилококком предметы и поверхности, теснота и плохая личная гигиена повышают риск заражения и могут быть обнаружены в школьных условиях. Однако важно отметить, что инфекции стафилококка можно предотвратить с помощью простых мер, таких как тщательное мытье рук перед приготовлением или едой и после посещения туалета, а также очистка и закрытие всех порезов и царапин до их заживления.
Можно ли вылечить инфекцию MRSA?
ИнфекцииMRSA эффективно лечат с помощью других антибиотиков и дренирования инфицированного участка гноя. Более серьезные инфекции, такие как пневмония, инфекции кровотока или инфекции костей, очень редко встречаются у здоровых людей, инфицированных MRSA.
Как я могу защитить себя от инфекций MRSA и стафилококка?
Важно соблюдать правила гигиены. Защититься от инфекций можно по:
- Поддерживайте чистоту рук, тщательно вымыв их водой с мылом или используя дезинфицирующее средство для рук на спиртовой основе.
- Сохранять чистоту порезов и царапин и наложить повязку до заживления.
- Избегать контакта с чужими ранами или повязками.
- Избегать совместного использования личных вещей, таких как полотенца или бритвы.
Инфекция стафилококка | Первичная помощь
Причины стафилококковой инфекции
Инфекции, вызванные стафилококком, вызываются бактериями Staphylococcus aureus, которые могут жить в вашем организме в течение длительного времени, не причиняя вреда. Иногда эти бактерии могут контактировать с порезом или другой раной, вызывая инфекцию.
Инфекции, вызванные стафилококком, легко передаются другим людям через прямую (кожную) инфекцию или при прикосновении к предметам и материалам, которые вступили в контакт с бактериями.
Инфекции, вызванные стафилококком, ежегодно поражают более 3 миллионов американцев. Фурункулы, пищевые отравления, целлюлит и синдром токсического шока — болезни, вызываемые стафилококком.
MRSA — это штамм стафилококка, который чаще всего встречается в больницах, он устойчив ко многим антибиотикам и легче распространяется в кровоток, суставы и органы, вызывая серьезные проблемы со здоровьем.
Факторы риска стафилококковой инфекции
Заразиться стафилококком может любой человек. К людям с повышенным риском развития стафилококка относятся:
- Дети в детских садах — дети могут передавать инфекции друг другу, дети в детских садах подвергаются большему воздействию микробов и имеют более низкий иммунитет, необходимый для борьбы с инфекциями.
- Люди с пониженной иммунной системой — если у вас рак, диабет или другие хронические состояния, снижающие вашу иммунную систему, вы подвержены более высокому риску развития стафилококковой инфекции.
- Люди, часто посещающие общественные места — раздевалки и общие ванные комнаты, повышают риск контакта с бактериями стафилококка.
- Спортсмены — спортсмены, которые занимаются спортом с контактом кожа к коже (борьба, баскетбол или футбол), более подвержены риску развития стафилококковой инфекции.
- Медицинские работники или пациенты — люди, работающие в сфере здравоохранения, или пациенты, получающие помощь в больнице или другом учреждении, подвергаются большему риску развития стафилококка и осложнений в результате инфекции.
Симптомы стафилококковой инфекции
Симптомы стафилококка варьируются от легкой кожной инфекции до опасного для жизни, если он попадает в кровь и поражает внутреннюю оболочку сердца. Симптомы будут отличаться в зависимости от тяжести инфекции.
кипит
Фурункулы — наиболее распространенный тип стафилококковой инфекции. Симптомы стафилококковой инфекции, вызванной кожными абсцессами или фурункулами, включают:
- Боль и припухлость в области поражения
- Гнойный карман над волосяным фолликулом
- Обычно возникает в паху или под мышками
Импетиго
- Большие пузыри, из которых может сочиться жидкость
- Сыпь болезненная
Целлюлит
Целлюлит — это кожная инфекция в более глубоких слоях кожи, обычно вызываемая стафлиококком.
- Покраснение и припухлость на поверхности кожи
- Язвы, выделяющие выделения (не во всех случаях)
Стафилококковый синдром ошпаренной кожи
Инфекции, вызванные стафилококком, иногда могут вызывать образование токсинов, которые приводят к стафилококковому синдрому ошпаренной кожи. Это состояние встречается у детей и младенцев.
Симптомы включают:
- Лихорадка
- Сыпь
- Волдыри — когда волдыри лопаются, верхний слой кожи может отслаиваться, оставляя поверхность, похожую на ожог.
Пищевое отравление
Пищевое отравление часто вызывается бактериями стафилококка.Симптомы пищевого отравления, вызванного бактериями стафилококка, включают:
- Тошнота
- Рвота
- Диарея
- Низкое артериальное давление
- Обезвоживание
Септицемия (заражение крови)
Попадая в кровоток, стафилококк вызывает сепсис. Симптомы сепсиса включают:
- Лихорадка
- Низкое артериальное давление
- Боли в костях и мышцах
Синдром токсического шока
Бактерии стафилококка связаны с синдромом токсического шока при использовании тампонов.Симптомы синдрома токсического шока включают:
- Высокая температура
- Тошнота и рвота
- Диарея
- Боль в животе
- Мышечные боли
- Сыпь, напоминающая солнечный ожог
Диагностика стафилококковой инфекции
Легкие стафилококковые инфекции могут быть диагностированы и вылечены вашим лечащим врачом, который спросит вас о ваших симптомах и осмотрит любые поражения кожи.
В большинстве случаев врач возьмет образец ткани и отправит его в лабораторию для подтверждения присутствия стафилококковых бактерий.Если есть подозрение на стафилококк, но кожная инфекция отсутствует, для подтверждения диагноза будет проведен анализ крови.
Если инфекция тяжелая, вас могут отправить в отделение неотложной помощи. Если в кровотоке обнаружен стафилококк, вас направят в больницу для лечения.
Средства для лечения стафилококковой инфекции
Staph. Требует лечения антибиотиками, которое зависит от тяжести инфекции. В большинстве случаев стафилококковая инфекция лечится пероральными антибиотиками. Иногда необходимо дренировать инфицированную кожную рану, что можно сделать в офисе вашего основного лечащего врача.
Бактерии стафилококка становятся устойчивыми к антибиотикам. Устойчивые к метициллину штаммы золотистого стафилококка (MRSA) сложно поддаются лечению, могут потребоваться внутривенные антибиотики и госпитализация.
Выздоровление от инфекции стафилококка
Каждый случай инфекции стафилококка индивидуален, но чаще всего стафилококк проходит через 1-3 недели. После завершения курса лечения антибиотиками вы перестанете заразиться, но вы должны держать кожные инфекции в чистоте и прикрывать, пока они полностью не исчезнут.
Лечение устойчивых к оксациллину S. Aureus: комбинированное использование двух …: Oncology Times
ЧИКАГО — сочетание двух антибиотиков в крайнем случае — вместо их последовательного применения, как это принято в стандартной практике, — по-видимому, создает синергию против устойчивости к оксациллину Бактериемия, вызванная Staphylococcus aureus (ORSA), согласно данным, представленным здесь на последней Международной конференции по антимикробным препаратам и химиотерапии (ICAAC), организованной Американским обществом микробиологов.Это, в свою очередь, может позволить ввести бактерицидную дозу, которая дает надежду больным раком с нейтропенией и другим людям, у которых развиваются потенциально смертельные инфекции.
«Двое наших пациентов умирали от бактериемии, связанной с инфекционным эндокардитом и почечной дисфункцией», — отметил специалист по инфекционным заболеваниям Джозеф Л. Гульотта, доктор медицинских наук, Медицинский центр Хантердон во Флемингтоне, штат Нью-Джерси, и доцент кафедры медицины Медицинского университета. и стоматология медицинского факультета Нью-Джерси – Роберта Вуда Джонсона.«После трех недель лечения» мы не смогли контролировать устойчивый к оксациллину Staphylococcus aureus , вызывающий инфекции.
«Мы испробовали все возможные антибиотики, включая так называемые препараты последней инстанции — ванкомицин, затем хинупристин / далфопристин [синерцид] с рифампицином [бустер] и без него. Ничего не получилось ».
Обычно при серьезных инфекциях ванкомицин или хинупристин / далфопристин по отдельности могут очистить кровь от ORSA, метициллин-резистентного S.aureus (MRSA) или других смертоносных штаммов S. aureus за пять-семь дней, отметил он.
Доктор Гуглиотта сказал, что он рассматривает возможность увеличения дозировки каждого лекарства, но считает, что это слишком рискованно для таких больных. Затем он решил объединить агентов, хотя в руководстве это не рекомендуется. Обоснование: поскольку ванкомицин разрушает клеточную стенку организма, а хинупристин / далфопристин разрушает рибосомы, парная токсичность не должна быть выше, чем у каждого препарата последовательно, пояснил он.
Оба пожилых пациента затем получали два препарата в стандартной инъекционной дозе для каждого препарата отдельно. Доктор Гуглиотта сообщил, что инфекция исчезла за 24 часа.
«С ростом устойчивости бактерий к ванкомицину врачи должны продолжать поиск новых методов лечения пациентов с потенциально смертельными инфекциями. Синергизм, которого мы достигли с ванкомицином и синерцидом, должен побуждать других [проявлять изобретательность], когда вариантов мало ».
Опрос, чтобы узнать, сколько людей использовали комбинацию
Доктор.Однако находки Гуглиотты не уникальны. Другие клиницисты пришли к такому же выводу — «они просто никогда не сообщали об этом», — объяснил в интервью Джером Шентаг, профессор фармацевтики и фармации фармацевтической школы Университета Буффало (штат Нью-Йорк).
Д-р Шентаг сказал, что он и его коллеги распространяют общенациональный протокол, чтобы выяснить, сколько еще клиницистов объединили хинупристин / далфопристин и ванкомицин, когда традиционные стратегии лечения не дали результатов, и определить их результаты.
«Мы только начали сбор данных», — сказал он. «Мы ищем от 50 до 100 пациентов, и уже поступило около 20 отчетов, подтверждающих опыт доктора Гуглиотты».
Доктор Шентаг привел пример инфицированного раком легких мужчины в возрасте 70 лет, который прошел три курса ванкомицина в течение 35 дней от инфекции нижних дыхательных путей, вызванной MRSA. Не было улучшения симптомов, включая стойкий инфильтрат на рентгенограмме грудной клетки и MRSA в мокроте.Затем пациент получил 10-дневный курс ванкомицина в сочетании с хинупристином / далфопристином.
«Это соединение уничтожило MRSA за четыре дня», — сказал доктор Шентаг. «Пациент оставался без симптомов и отрицательным посевом во время его последующего визита, и теперь он находится дома, по-видимому, излеченный от инфекции».
Чтобы подтвердить клинические данные доктора Гульотты и его коллег, представленные в виде плаката, исследовательская группа также изучила бактерицидную активность ванкомицина и хинупристина / далфопристина по отдельности и вместе.«Мы обнаружили, что один ванкомицин был наименее активным, синерцид был более активным, чем ванкомицин, а коктейль из двух агентов был наиболее активным», — сообщил д-р Гуглиотта.
Исследование проводилось с изолятом ORSA, взятым у каждого из его пациентов. «Цель заключалась в том, чтобы увидеть, воспроизводится ли увеличенное количество смертей, обеспечиваемое комбинацией двух препаратов in vivo, in vitro», — сказал он. «Это было. Обычно исследователи начинают с синергии in vitro и пытаются доказать, что она коррелирует с эффективностью in vivo.Мы изменили процесс ».
Кент Сепковиц, доктор медицины, руководитель клинического отдела службы инфекционных заболеваний Мемориального онкологического центра Слоуна-Кеттеринга в Нью-Йорке, сказал, что он хочет, чтобы результаты доктора Гуглиотты были воспроизведены во многих других исследованиях.

