Кто открыл пенициллин: антибиотик из обычной плесени
Английский учёный-бактериолог Александр Флеминг в 1928 году занимался исследованиями защиты организма человека от инфекционных заболеваний. И совершенно случайно обнаружил, что обычная плесень синтезирует вещество, уничтожающее возбудителей инфекции.
Флемингу удалось выделить активное вещество, разрушающее бактериальные клетки. Он назвал его пенициллином. Название придумано на основе названия грибов «Penicillium notatum», из штамма которых вывел новое вещество Флеминг.
13 сентября 1929 года на заседании Медицинского исследовательского клуба при Лондонском университете Александр Флеминг рассказал о своем открытии пенициллина. Однако доклад Флеминга «Культура пенициллина» особого интереса не вызвал.
Даже после опубликования статья не вызвала у медиков никакого энтузиазма. Связано это было с тем, что пенициллин оказался очень нестойким веществом, который разрушался уже при кратковременном хранении.
В 1930-х годах учёные пытались улучшить эффективность пенициллина, но только в 1938 году учёные Оксфордского университета Говард Флори и Эрнст Чейн смогли выделить чистую форму пенициллина.
Открытие пенициллина оказалось весьма своевременным. И уже в период Второй мировой войны в 1943 году началось производство этого антибиотика в больших масштабах.
В Советском Союзе выпуск пенициллина был налажен в промышленных масштабах также во время Второй мировой войны. В 1944 году его первые порции поступили в госпитали и на фронт. Пенициллин стал незаменимым лекарством и спас жизни многим людям.
Конечно же пенициллин применяли не только на войне. Этот антибиотик помог справиться со множеством бактериальных инфекций, уносящих тысячи жизней, таких как сифилис, гангрена, туберкулез и другие.
В 1945 году Флеминг, Флори и Чейн получили Нобелевскую премию за своё открытие. А в 1999 году журнал «Тайм» назвал Флеминга одним из 100 самых важных людей за весь ХХ-й век, заявив, что «это открытие изменит ход истории».
Изобретатель антибиотиков | Алтайская краевая универсальная научная библиотека им. В.Я. Шишкова
Сэр Александр Флеминг известен миру тем, что он – изобретатель пенициллина, первого в мире антибиотика. Но знаменитый бактериолог всегда считал, что спасение человеческих жизней не может быть источником обогащения. Поэтому никоим образом не претендовал на авторство в изобретении пенициллина. Сегодня мы привыкли к тому, что в аптеке можно купить самые разные антибиотики. Но было время, когда их не существовало. В начале двадцатого века причиной высокой смертности были не болезни, а послеоперационные осложнения, заражение крови. Без пенициллина врачи не могли помочь безнадежно больным людям. Хотя еще в XIX веке французский микробиолог Луи Пастер высказал предположение о возможности разрушения одного микроорганизма — бактерии другим – грибами.
Пастер заметил, что бактерия сибирской язвы погибает под действием других микробов. В результате этого открытия не появилось готового средства для спасения человечества. Но ученые всего мира, узнав о нем, стали искать ответы на возникшие вопросы: какие микробы разрушают бактерии, как это происходит и т. д. В то время как ответ существовал с момента зарождения жизни на Земле. Это – плесень. Досадная для людей плесень, вечно сопровождающая человечество, стала его целителем. В 1860-х годах грибок плесени, распространяющийся в виде спор, возбудил научную полемику между Алексеем Полотебным и Вячеславом Манассеиным.
В результате этого открытия не появилось готового средства для спасения человечества. Но ученые всего мира, узнав о нем, стали искать ответы на возникшие вопросы: какие микробы разрушают бактерии, как это происходит и т. д. В то время как ответ существовал с момента зарождения жизни на Земле. Это – плесень. Досадная для людей плесень, вечно сопровождающая человечество, стала его целителем. В 1860-х годах грибок плесени, распространяющийся в виде спор, возбудил научную полемику между Алексеем Полотебным и Вячеславом Манассеиным.
Спор, в котором произошло научное открытие
Русские врачи спорили о том, какова на самом деле природа плесени. Полотебнов утверждал, что от плесени пошли все микробы. Манассеин был с ним не согласен. Этот спор послужил величайшему открытию целительных свойств плесени.
Для доказательства своей правоты Манассеин стал исследовать зеленую плесень. И спустя какое-то время заметил интересный факт: в непосредственной близости от плесневого грибка не было никаких бактерий. Отсюда логически проистекал вывод: плесень каким-то образом мешает развитию других микроорганизмов. Полотебнов пришел к тому же выводу, когда увидел, что жидкость рядом с плесенью была чистой. По его мнению, это свидетельствовало о том, что бактерий в ней нет.
Отсюда логически проистекал вывод: плесень каким-то образом мешает развитию других микроорганизмов. Полотебнов пришел к тому же выводу, когда увидел, что жидкость рядом с плесенью была чистой. По его мнению, это свидетельствовало о том, что бактерий в ней нет.
Такой плодотворный проигрыш в научном споре побудил Полотебнова продолжить начатое исследование с новой целью – изучить бактерицидные свойства плесени. Для этого он спрыскивал эмульсию с плесневым грибком на кожу людей, страдающих кожными болезнями. Результат оказался ошеломляющим: язвы, которые подверглись подобной обработке, пропадали значительно раньше, чем те, с которыми ничего не делали. В 1872 году врач опубликовал статью, в которой изложил свое открытие и рекомендовал данный способ лечения.
Но наука всего мира просто не заметила эту публикацию, доктора разных стран продолжали лечить больных допотопными средствами, которые сейчас можно принять за обычный набор медицинского шарлатана: кровопусканием, различными порошками из сушеных останков животных и тому подобным препаратами.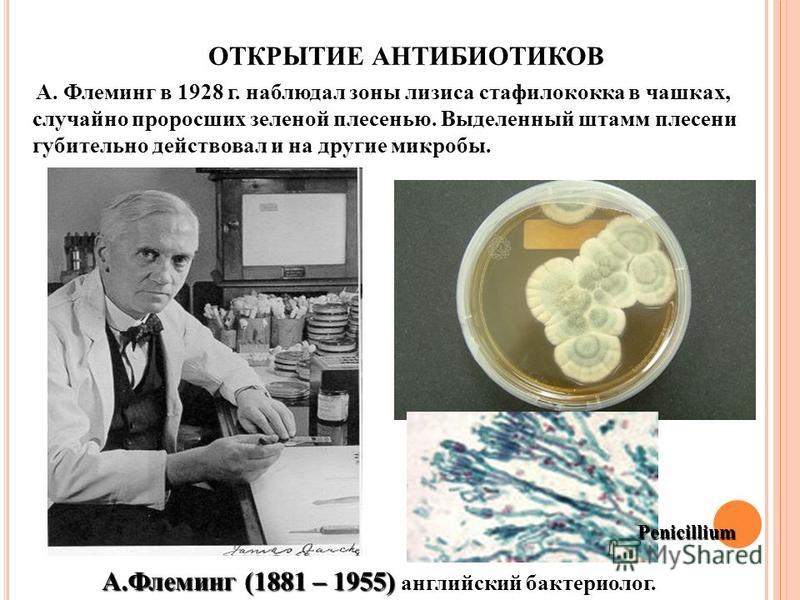 Только подумать, эти «лекарства» использовались в медицине уже во времена, когда братья Райт создавали свои первые летательные аппараты, а Эйнштейн работал над своей теорией относительности. И кто знает, возможно, изобретатель антибиотиков был бы совсем другим человеком, если бы ученые мужи мира обратили внимание на исследования русского врача в свое время.
Только подумать, эти «лекарства» использовались в медицине уже во времена, когда братья Райт создавали свои первые летательные аппараты, а Эйнштейн работал над своей теорией относительности. И кто знает, возможно, изобретатель антибиотиков был бы совсем другим человеком, если бы ученые мужи мира обратили внимание на исследования русского врача в свое время.
Мировое научное сообщество проигнорировало открытие Полотебнова. Полвека ученые оставляли без внимания целительные свойства плесневого грибка. И лишь в самом начале неспокойного ХХ века из-за случайности, которую справедливо можно назвать счастливой, и благодаря одному неряшливому ученому научная идея Полотебнова «воскресла».
Александр Флеминг был шотландцем и изобретателем антибиотиков. Его юношеской мечтой было найти способ уничтожать невидимых врагов человечества — болезнетворные бактерии. В тесной комнатушке в одном из госпиталей Лондона, являвшейся его лабораторией, он ежедневно занимался исследованиями в области микробиологии.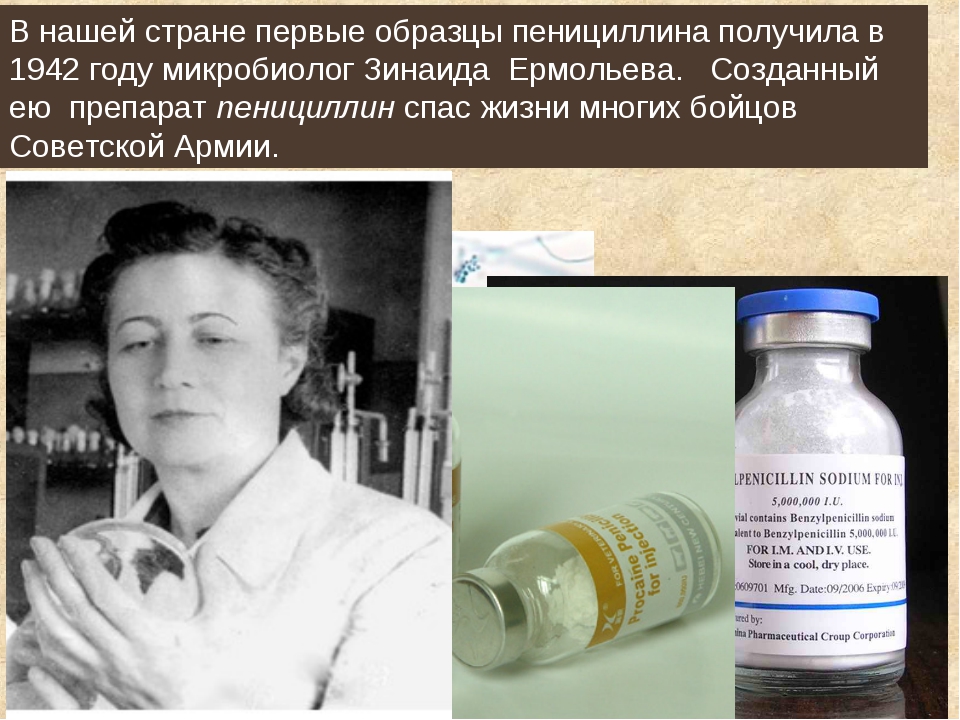 Его коллеги не раз отмечали в нем, помимо таких важных и полезных качеств, как упорство и самоотверженность в работе, его серьезный недостаток — неряшливость. Будущий открыватель пенициллина не мог и не любил содержать в чистоте рабочее место. Емкости с культурами бактерий могли стоять на нем несколько недель. Как ни странно, именно благодаря этому Флеминг буквально наткнулся на великое открытие.
Его коллеги не раз отмечали в нем, помимо таких важных и полезных качеств, как упорство и самоотверженность в работе, его серьезный недостаток — неряшливость. Будущий открыватель пенициллина не мог и не любил содержать в чистоте рабочее место. Емкости с культурами бактерий могли стоять на нем несколько недель. Как ни странно, именно благодаря этому Флеминг буквально наткнулся на великое открытие.
Один раз будущий изобретатель антибиотиков оставил без внимания на своем столе колонию стафилококков. Когда через несколько дней он все-таки решил приступить к уборке, то на поверхности препаратов обнаружил плесень. Флеминг не стал избавляться от, казалось бы, испортившегося материала, но взглянул на него в микроскоп. Каково же было его удивление, когда он увидел, что от бактерий возбудителей болезни не осталось и следа. В склянках не было ничего кроме плесени и капель бесцветной жидкости.
Гипотеза о том, что плесень убивает микроорганизмы – возбудители болезни, требовала немедленного исследования. Ученый взял грибок, выращенный в питательной среде, и поместил его в чашку вместе с другими бактериями. Результат оказался ошеломляющим: плесень и микроорганизмы, светлые и прозрачные пятна. Плесень «огораживала» себя от бактерий и не давала им размножаться.
Ученый взял грибок, выращенный в питательной среде, и поместил его в чашку вместе с другими бактериями. Результат оказался ошеломляющим: плесень и микроорганизмы, светлые и прозрачные пятна. Плесень «огораживала» себя от бактерий и не давала им размножаться.
Это пенициллин!
Жидкая среда, в которой находилась плесень, оказалась еще более губительной для бактерий. Она, даже если ее растворить в воде 1 к 20, полностью уничтожала бактерии. Понимая важность своего открытия, Флеминг оставил свои другие исследования и посвятил себя полностью изучению жидкости, которую он открыл. В ходе своих исследований он изучал проявления противобактериальных свойств грибка.
В 1929 году Флеминг в Лондонском медицинском научно-исследовательском клубе публично рассказал о новом найденном и исследованном препарате. И снова сообщение огромной важности от изобретателя антибиотиков было практически проигнорировано – так же, как в свое время медицинская статья Полотебнова. Однако шотландец, в полном соответствии с темпераментом своего народа, оказался значительно более упрямым, чем русский доктор. На всех конференциях, выступлениях, съездах и собраниях медицинских светил изобретатель антибиотиков Флеминг постоянно рассказывал про открытое им средство для уничтожения болезнетворных бактерий. Но перед ученым стояла еще одна очень важная задача – необходимо было каким-то образом абсорбировать чистый пенициллин из смеси, еще и сохранив при этом его целостность.
На всех конференциях, выступлениях, съездах и собраниях медицинских светил изобретатель антибиотиков Флеминг постоянно рассказывал про открытое им средство для уничтожения болезнетворных бактерий. Но перед ученым стояла еще одна очень важная задача – необходимо было каким-то образом абсорбировать чистый пенициллин из смеси, еще и сохранив при этом его целостность.
Изготовление первого антибиотика
Чтобы выделить пенициллин, потребовался не один год. Флеминг с помощниками предпринял множество экспериментов. Но пенициллин в чужой среде разрушался. В конце концов, стало понятно, что микробиология не может решить эту задачу без помощи химии.
Понадобилось 10 лет на то, чтобы после первого заявления Флеминга о пенициллине информация об удивительном лекарстве достигла американского континента. Открытие шотландского ученого заинтересовало двоих англичан, обосновавшихся в Америке. Это были профессор патологии одного из оксфордских институтов Говард Флери и его коллега, биохимик Эрнст Чейн.
Вторая мировая война стала широким полем апробации полученного антибиотика. В 1942 году пенициллин в первый, но далеко не в последний раз спас жизнь умирающему от менингита человеку. Этот факт, став достоянием широкой общественности, произвел на нее большое впечатление. Под этим же впечатлением оказались и врачи. Но организовать серийное производство пенициллина в Англии так и не удалось, поэтому оно было открыто в Америке в 1943 году. В этом же году поступил заказ от американского правительства на 120 млн единиц лекарственного средства.
Флер, Чейн и Флеминг получили в 1945 году Нобелевскую премию за свое выдающееся открытие. Изобретатель антибиотиов Флеминг десятки раз был отмечен всевозможными научными званиями и наградами. На его счету рыцарское звание, 25 почетных степеней, 26 медалей, 18 премий, 13 наград и почетное членство в 89 академиях наук и научных обществах.
Антибиотики – международное изобретение
Ученые разных стран искали препарат для борьбы с вредоносными бактериями. Этот поиск велся с тех пор, когда люди могли разглядеть их в микроскоп и впервые узнали об их существовании. Особая необходимость в подобном лекарстве назрела в начале Второй мировой войны. Ученые СССР тоже работали над этой проблемой.
В 1942 году профессор Зинаида Ермольева смогла выделить пенициллин из плесени, добытой со стены московского бомбоубежища. В 1944 году, проведя серию из экспериментальных исследований, она испытала полученный препарат на тяжелораненых бойцах Советской армии. Ее пенициллин стал мощным оружием для полевых врачей и целительным средством для многих солдат, получивших ранения в боях Великой Отечественной войны. В том же году, после апробации пенициллина З. Ермольевой, в Советском Союзе было налажено его массовое производство.
Ермольевой, в Советском Союзе было налажено его массовое производство.
Антибиотики – это не только пенициллин, это большой спектр лекарственных средств. Над созданием антибиотика работал Гаузе, который получил грамицидин в 1942 году. А также Ваксман американец украинского происхождения, который в 1944-м выделил стрептомицин.
Все упомянутые в этой статье ученые подарили миру новое, здоровое время, время антибиотиков. Теперь нам не угрожает смерть от многих, ранее не излечимых заболеваний. Средство от них теперь привычно для нас, оно есть в каждой аптеке. Самое интересное в этой истории (кроме грязного стола Флеминга, конечно) – это то, что патент на пенициллин никому выдан не был. Ни один изобретатель антибиотиков не захотел наживаться на спасении человеческих жизней.
75 лет назад медики впервые удачно применили пенициллин для лечения бактериальной инфекции
В эти дни в научном и медицинском сообществе вспоминают открытие, которое обеспечило прорыв в лечении инфекций. 75 лет исполнилось с момента первого удачного клинического применения пенициллина. И хотя с тех пор ученым стал более понятен мир бактерий, сейчас главная проблема — их устойчивость к антибиотикам. Станут ли инфекционные болезни опять неизлечимыми, что ищут на дне океана, и как могут помочь лягушки?
75 лет исполнилось с момента первого удачного клинического применения пенициллина. И хотя с тех пор ученым стал более понятен мир бактерий, сейчас главная проблема — их устойчивость к антибиотикам. Станут ли инфекционные болезни опять неизлечимыми, что ищут на дне океана, и как могут помочь лягушки?
Жидкость в ампуле — антибиотик четвертого поколения, который может действовать сразу против 50 штаммов микроорганизмов. Миллионные поставки суперлекарств — реальность сегодняшнего дня. Но секрет антибиотиков не давался человечеству столетиями. Одно из первых научных описаний подобных веществ сделал итальянец Винченцо Тиберио в XIX веке.
В среде учёных ходит легенда. Якобы Тиберио, когда жил в небольшом городке Арцано, заметил одну странность. Как только местный колодец чистили, в семьях по округе вспыхивала дизентерия. И тогда итальянец подумал, а вдруг в колодце до того, как его почистили, было нечто, что мешало развитию опасных бактерий? К его большому удивлению, это оказалась плесень! Но Тиберио не довёл работу до конца. Успех ждал другого.
Успех ждал другого.
В 1928 году на заплесневелую чашку Петри в своей лаборатории натыкается ученый Александр Флеминг и не верит глазам: плесень остановила размножение бактерий стафилококка, которые там хранились. Бактериолог получает чудо-вещество — естественное оружие плесневого гриба против микробов. К сороковым годам о пенициллине уже говорит весь мир.
«В медицине это было эпохальное, революционное событие, которое абсолютно изменило тактику лечения заболеваний, инфекционных осложнений, различных ранений. Потому что как пытались лечить гнойные раны сулемой — это тяжёлый металл, содержащий ртуть, от него гибнет всё», — поясняет профессор кафедры клинической фармакологии РНИМУ им. Н.И. Пирогова Сергей Зырянов.
В феврале 1941 года пенициллин испытали на первом пациенте. К 1942 году препарат — уже на фронтах Второй Мировой. Ивана Котова, тогда молодого хирурга, направляют на работу в госпиталь. Через его руки прошли сотни раненых. Осложнения — самое страшное. Пневмония, гангрена, заражение крови. Антибиотик впервые в истории позволял спасать таких раненых и избегать ампутаций. Уже в 1945 году Александр Флеминг получает за своё открытие Нобелевскую премию.
Антибиотик впервые в истории позволял спасать таких раненых и избегать ампутаций. Уже в 1945 году Александр Флеминг получает за своё открытие Нобелевскую премию.
И всё же, откуда плесень взялась на рабочем столе у Флеминга? Художница из Москвы Дарья Фёдорова, по сути, раз за разом воспроизводит сценарий того, что случилось в лаборатории бактериолога. В чашках Петри девушка выращивает десятки видов плесени. Красивая и отталкивающая, оказывается, она просто всегда рядом с нами.
«Можно сначала потрогать все дверные ручки, которые есть в доме, потом этой же рукой просто дотронуться до чашки. Можно просто в воздухе движения поделать, и соответственно, засеять то, что находится в воздухе», — объясняет она.
Величайшее открытие в медицине — чистая случайность, Флеминг это признавал. Как выигрыш в лотерею, в чашку со стафилококком попал гриб, который убивал стафилококк. Но в этой истории есть ещё один сюрприз — неприятный. За 75 лет бактерии научились противостоять антибиотикам.
«Не исключена возможность развития ситуации, когда инфекционные болезни опять станут неизлечимыми. Во внутрибольничной среде появились микробы, которые характеризуются сейчас устойчивостью практически ко всем, а иногда даже ко всем антибиотикам», — рассказывает профессор кафедры госпитальной терапии Первого МГМУ имени И.М. Сеченова Сергей Яковлев.
В лабораториях по всему миру ищут способы победить новые супербактерии, устойчивые к лекарствам. А виновных в проблеме уже нашли. Это… мы сами! Антибиотики в домашней аптечке, антибиотики при малейшем чихе… Чем чаще мы принимали эти лекарства, тем лучше бактерии к ним адаптировались. Открывать новые антибиотики всё сложнее, сейчас их ищут на дне океанов, в антарктических грунтах, в растениях и даже на коже лягушек.
Вещества, которые учёные химического факультета МГУ обнаружили в защитной слизи лягушек, могут стать заменой антибиотиков. Принцип действия «антимикробных пептидов» совершенно другой — они не останавливают размножение, а буквально прокалывают мембраны клеток опасных микробов — бьют наповал. К такому нельзя приспособиться.
К такому нельзя приспособиться.
«Поскольку лягушки живут миллионы и миллионы лет, и их ещё не съели, бактерии не могут приноровиться к такому оружию, каким являются пептиды», — объясняет заведующий лабораторией органического анализа, профессор химического факультета МГУ Альберт Лебедев.
Это всего лишь один из вариантов лекарств будущего. Но вполне возможный. Для скептиков у учёных простой ответ — если 75 лет назад миллионы жизней спасла плесень, то чем лягушки хуже?
Ученые создали антибиотик, к которому бактерии не смогут привыкнуть
В каждой бактерии, в том числе в клетках-персисторах, есть протеаза (фермент) ClpP, способная распознавать и расщеплять неправильно свернутые белки. Протеазу активирует вещество ADEP-4 — именно его ученые и применили в качестве действующего вещества. Сначала ADEP4 добавили в колонию золотистых стафилококков, неуязвимых для ряда антибиотиков. Протеаза запустила процесс неконтролируемого расщепления белков, что привело к гибели не только обычных клеток, но и персисторов.
Но ADEP4 не уничтожил колонию полностью. В следующем эксперименте соединение усилили, добавив к нему стандартный антибиотик рифампицин. Полученный препарат ввели мыши с тяжелой формой инфекции (вызванной большой дозой тех же стафилококков). Уже через сутки инфекция была вылечена.
Ученые отмечают, что антибиотик на основе ADEP4 может не постигнуть судьба предшественников: чтобы научиться сопротивляться ему, бактериям придется отказаться от протеазы ClpP, однако нормальная жизнь клетки без нее невозможна.
Сколько труда обычно вкладывается в разработку нового антибиотика
Проблемой устойчивости к антибиотикам во всем мире занимаются действительно передовые научные центры, но дело это непростое. Игра в «салочки» с микробами — ты им новый антибиотик, они тебе через какое-то время устойчивость — обходится недешево: разработка нового антибиотика сегодня стоит от 800 миллионов до 1 миллиарда долларов, и уходит на это обычно 8-10 лет.
При этом, бактерии и грибы мутируют гораздо чаще клеток человека, поэтому они довольно быстро учатся защищаться от опасных препаратов. Кроме того, некоторые виды бактерий умеют «обмениваться опытом» с родственниками, то есть в прямом смысле меняться генетическим материалом и таким образом приобретать полезную с эволюционной точки зрения устойчивость. Читайте подробнее >>
Кроме того, некоторые виды бактерий умеют «обмениваться опытом» с родственниками, то есть в прямом смысле меняться генетическим материалом и таким образом приобретать полезную с эволюционной точки зрения устойчивость. Читайте подробнее >>
«Эпоха антибиотиков уже прошла»
Советник Центра клинической и экспериментальной медицины СО РАМН Влаиль Казначеев: «Пенициллин стал прорывом, сыграл колоссальную историческую роль, но в целом сегодняшняя доступность антибиотиков и их «легкое» назначение даже детям ставит нацию под угрозу вымирания. Эпоха антибиотиков уже прошла, стало ясно, что это тупиковый путь, и сейчас в медицинской биологической науке требуется нечто принципиально новое. Читайте подробнее >>
Когда появились антибиотики
Каким будет мир без антибиотиков — Look At Me
Сегодня устойчивость бактерий к антибиотикам, о которой предупреждал Флеминг, — это одна из главных проблем в медицине и в мире. С изобретением пенициллина человечество вступило в гонку: мы пытаемся обогнать эволюцию, открывая всё новые антибиотики, пока бактерии приспосабливаются к старым. Антибиотик тетрациклин появился в 1950 году, первые бактерии с устойчивостью к нему — в 1959-м. Метициллин в 1960 году, устойчивые к нему бактерии — в 1962-м. Ванкомицин — в 1972 году, а устойчивые бактерии — в 1988-м. Даптомицин появился в 2003-м, первые признаки устойчивости к нему — уже в 2004-м и так далее.
Антибиотик тетрациклин появился в 1950 году, первые бактерии с устойчивостью к нему — в 1959-м. Метициллин в 1960 году, устойчивые к нему бактерии — в 1962-м. Ванкомицин — в 1972 году, а устойчивые бактерии — в 1988-м. Даптомицин появился в 2003-м, первые признаки устойчивости к нему — уже в 2004-м и так далее.
Дело в том, что бактерии размножаются и развиваются очень быстро. Новое поколение бактерий появляется каждые 20 минут. Поэтому микроорганизмы так быстро эволюционируют и адаптируются под внешние угрозы. Более того, чем чаще мы используем тот или иной антибиотик, тем больше шансов мы даём бактериям развить к ним устойчивость.
Об устойчивости к антибиотикам говорят давно. Cерьёзная паника охватила научное сообщество десять лет назад с распространением стафилококка, резистентного к метициллину. Первые такие бактерии появились в 60-е годы, но тогда их была лишь малая доля. Постепенно MRSA (так называют эту бактерию, Methicillin-resistant Staphylococcus aureus) стали распространяться. В 1974 году 2% заражённых стафилококком в США были резистентны к метициллину. В 1995-м — 22%. В 2007-м — уже 63%. Сейчас каждый год в Америке 19 тысяч человек умирают от MRSA.
В 1974 году 2% заражённых стафилококком в США были резистентны к метициллину. В 1995-м — 22%. В 2007-м — уже 63%. Сейчас каждый год в Америке 19 тысяч человек умирают от MRSA.
Теперь устойчивость к антибиотикам начинает принимать поистине апокалиптические масштабы. Мы используем их всё так же много — и почти перестали открывать новые. Разработка нового антибиотика стоит около $1 млн, и фармацевтические компании перестали этим заниматься — невыгодно. Новых типов антибиотиков не появляется, мы используем старые, и устойчивость к ним растёт. Более того, стали появляться так называемые панрезистентные микроорганизмы, устойчивые к нескольким типам антибиотиков, а иногда и ко всем.
В 2009 году один из пациентов в больнице Святого Винсента в Нью-Йорке заразился после операции инфекцией, вызванной бактерией Klebsiella pneumoniae. Бактерия была устойчива ко всем антибиотикам. Он умер через 14 дней после заражения. Британское правительство запустило проект по прогнозированию устойчивости к антибиотикам: учёные считают, что если ситуация будет развиваться так же, как и сегодня, то к 2050 году 10 млн человек в год будут умирать из-за устойчивых бактерий.
Самое печальное, что человечество виновато в этом само. Мы обращались с антибиотиками крайне неаккуратно. Большинство людей не понимают, как работает устойчивость к антибиотикам и как они должны быть использованы. Мы постоянно лечимся ими, когда это совсем не нужно. Немало стран, где антибиотики до сих пор можно купить в аптеке без рецепта. Даже в России, где официально их продают только по рецепту, можно свободно купить многие из 30 видов антибиотиков, доступных на рынке. В США 50% антибиотиков в больницах прописывают без необходимости. 45% врачей в Великобритании прописывают антибиотики, даже когда знают, что те не сработают. И наконец, животные: 80% антибиотиков, продаваемых в США, используют не на людях, а на животных, чтобы ускорить их рост, сделать их толще и защитить от болезней. В итоге бактерии с устойчивостью к этим антибиотикам распространяются на людей через мясо животных.
Одна из последних новостей об устойчивости к антибиотикам как раз связана с препаратами, используемыми на животных и растениях. В Китае обнаружили бактерии с устойчивостью к группе полимиксинов, а конкретно — к антибиотику колистину. В лечении колистин используют как препарат «последнего шанса», то есть им лечат пациента, когда никакие другие препараты уже не действуют. Но устойчивость в Китае была обнаружена при других обстоятельствах: они использовали колистин на свиньях.
В Китае обнаружили бактерии с устойчивостью к группе полимиксинов, а конкретно — к антибиотику колистину. В лечении колистин используют как препарат «последнего шанса», то есть им лечат пациента, когда никакие другие препараты уже не действуют. Но устойчивость в Китае была обнаружена при других обстоятельствах: они использовали колистин на свиньях.
«Мы лечим антибиотиками простуду и насморк! COVID нас расслабил» — Реальное время
К 2050 году человечество может остаться вообще без антимикробных препаратов, потому что бактерии получат резистентность к ним
Фото: Максим ПлатоновАнтибиотики — мощное оружие в борьбе с инфекциями, но при частом и неправильном использовании оно теряет свою эффективность. На пресс-конференции, посвященной Всемирной неделе правильного использования антимикробных препаратов, специалисты рассказали о главных ошибках при лечении антибиотиками и о том, что совсем скоро этот вид препаратов может исчезнуть. Подробности — в материале «Реального времени».
Подробности — в материале «Реального времени».
Что общего между антибиотиками, ядерной энергией и космосом
Доктор медицинских наук, профессор, ректор Смоленского государственного медицинского университета Роман Козлов напомнил о том, что антимикробные препараты открыты сравнительно недавно и их использование позволило существенно сократить смертность:
— Антимикробные препараты — один из самых молодых классов лекарственных средств… Пенициллин с точки зрения клинической фармакологии использовался неправильно, в малых дозах. Но уже он повысил выживаемость пациентов с пневмонией в девять раз. Вдумайтесь, девять из десяти пациентов с воспалением легких умирали! А шанс умереть у роженицы при родах в доантибиотиковую эпоху составлял 20%. Это гениальное открытие человечества.По мнению доктора медицинских наук, профессора, президента «Альянса клинических химиотерапевтов и микробиологов» Сергея Яковлева, открытие антибиотиков — одно из главных достижений в науке XX века:
— Первое применение антибиотиков началось с 40-х годов. Это одно из самых значимых событий в XX веке, и не только в медицине. Я ставлю это на один уровень с расщеплением атомного ядра и полетом в космос. Средняя продолжительность жизни человека на земном шаре увеличилась в среднем на десять лет — это заслуга антибиотиков и вакцин.
Это одно из самых значимых событий в XX веке, и не только в медицине. Я ставлю это на один уровень с расщеплением атомного ядра и полетом в космос. Средняя продолжительность жизни человека на земном шаре увеличилась в среднем на десять лет — это заслуга антибиотиков и вакцин.
Почему антибиотики теряют эффективность?
Однако специалисты отмечают, что микроорганизмы умеют приспосабливаться к средствам борьбы с ними. Со временем антибиотики становятся менее эффективными, ученым приходится совершенствовать их и пытаться создавать новые.
— Эволюционируют бактерии, эволюционирует их устойчивость. От монорезистентности к одному классу препаратов до полирезистентности — устойчивости к трем и более классам антимикробных препаратов. И, наконец, до панрезистентности — устойчивости практически ко всем имеющимся в нашем арсенале препаратам, — констатирует Роман Козлов.
Владимир Кулабухов, ведущий научный сотрудник Института Склифосовского, тоже акцентирует внимание на умение микроорганизмов быстро приспосабливаться. Из-за этого возникают сомнения в том, возможно ли полностью победить инфекции.
Из-за этого возникают сомнения в том, возможно ли полностью победить инфекции.
Ученые обеспокоены, ведь последствия резистентности микроорганизмов ставят под угрозу достижения современной медицины. Если эффективность антибиотиков снизится, любая хирургическая операция может оказаться смертельной.
— Новых препаратов появляется все меньше и меньше, был период, когда новых антибиотиков вообще не было, при этом старые теряли свою эффективность. Скорость появления новых препаратов гораздо ниже скорости того, как мы их теряли в плане клинического применения. Без сомнения, медицина шагнула далеко вперед, появились новые технологии, малоинвазивная хирургия, практически нет противопоказаний к хирургическим операциям. Но устойчивость к антибиотикам — это, пожалуй, самое главное препятствие, которое может затормозить, а то и отбросить назад все эти достижения. К 2050 году, если ничего не делать, резистентность станет основной угрозой, и основная летальность будет обусловлена этой самой резистентностью. Но этот период может наступить гораздо раньше, — говорит Владимир Кулабухов.
Скорость появления новых препаратов гораздо ниже скорости того, как мы их теряли в плане клинического применения. Без сомнения, медицина шагнула далеко вперед, появились новые технологии, малоинвазивная хирургия, практически нет противопоказаний к хирургическим операциям. Но устойчивость к антибиотикам — это, пожалуй, самое главное препятствие, которое может затормозить, а то и отбросить назад все эти достижения. К 2050 году, если ничего не делать, резистентность станет основной угрозой, и основная летальность будет обусловлена этой самой резистентностью. Но этот период может наступить гораздо раньше, — говорит Владимир Кулабухов.
«Нельзя принимать антибиотики как витамины»
Одной из причин снижения эффективности антибиотиков врачи называют неверное их употребление. Специалисты уверяют, что прибегать к лечению этими препаратами нужно только по назначению врача.
— Ковид случился два года назад. И огромное количество антибактериальных препаратов стали применять без показаний. ВОЗ предлагает ряд путей для того, чтобы сдержать резистентность. И прежде всего, это образовательные программы для населения. Люди должны понимать, что нельзя принимать антибиотики как витамины. Не надо «доедать» за кем-то антибиотики, нельзя давать их соседям! Нужно соблюдать гигиену рук, приготовления пищи, безопасность воды и так далее, — говорит Владимир Кулабухов.
ВОЗ предлагает ряд путей для того, чтобы сдержать резистентность. И прежде всего, это образовательные программы для населения. Люди должны понимать, что нельзя принимать антибиотики как витамины. Не надо «доедать» за кем-то антибиотики, нельзя давать их соседям! Нужно соблюдать гигиену рук, приготовления пищи, безопасность воды и так далее, — говорит Владимир Кулабухов.
Использовать антибиотики нужно с большой осторожностью, и делать это только тогда, когда нужно, подчеркивают специалисты. Но население пренебрегает этими простыми правилами. Профессор Сергей Яковлев напоминает, что еще в 2012 году Всемирная организация здравоохранения предрекла возможное наступление «постантибиотической эры», когда бактерии обретут полную устойчивость ко всем препаратам.
— Мы лечим антибиотиками простуду и насморк! Мы до сих пор продаем их в аптеках без рецепта. С 2019 года ужесточили безрецептурный контроль, но COVID-19 опять нас расслабил. Зайдите в любую аптеку, и вы можете купить любой антибиотик. Мы не выполняем назначения врача, забываем вовремя принимать лекарство, иногда пропускаем дозу, сами решаем, когда закончить прием, даем вредные советы нашим родственникам и знакомым. И наконец, мы не любим вакцинироваться, а некоторые и вовсе являются активными противниками прививок. А кто же виноват? Виноваты все мы! — заявил профессор Сергей Яковлев.
Мы не выполняем назначения врача, забываем вовремя принимать лекарство, иногда пропускаем дозу, сами решаем, когда закончить прием, даем вредные советы нашим родственникам и знакомым. И наконец, мы не любим вакцинироваться, а некоторые и вовсе являются активными противниками прививок. А кто же виноват? Виноваты все мы! — заявил профессор Сергей Яковлев.Ученые отмечают, что приобретение резистентности — нормальное биологическое явление, однако неразумное и бесконтрольное использование антибиотиков ускоряет этот процесс так, что производители не успевают создавать новые эффективные препараты. Таким образом, спасение антибактериальной терапии как явления зависит от каждого жителя Земли.
Эмиль Зиянгиров
ОбществоМедицинаКто и как создал первый антибиотик, спасший миллионы жизней
В XX веке было сделано немало важнейших научных открытий, изменивших ход истории. Но одно из них стоит особняком и по степени влияния на медицину вряд ли сопоставимо с чем-либо еще. Речь про разработку первого в мире антибиотика — пенициллина. Причем его открытие произошло едва ли не случайно, но при этом спасло миллионы жизней. Рассказываем в подробностях, как это было.
Но одно из них стоит особняком и по степени влияния на медицину вряд ли сопоставимо с чем-либо еще. Речь про разработку первого в мире антибиотика — пенициллина. Причем его открытие произошло едва ли не случайно, но при этом спасло миллионы жизней. Рассказываем в подробностях, как это было.
Кто и почему считается «отцом» всех антибиотиков
До открытия веществ, подавляющих рост болезнетворных бактерий в организме человека, то есть антибиотиков, жизнь была ощутимо сложнее, чем сегодня. Даже обыкновенная царапина могла привести к смерти, если в кровь попадала инфекция. Шансы на выживание и восстановление тела после хирургического вмешательства если не стремились к нулю, то составляли примерно 50/50. А про туберкулез, воспаление легких, дизентерию и другие подобные заболевания упоминать и вовсе не приходится — в начале прошлого века многие из них считались практически неизлечимыми.
Но все изменилось, когда британец (вернее, шотландец) Александр Флеминг едва ли не случайно (если верить расхожей версии) приблизился к открытию пенициллина. Именно его считают «отцом» всех современных антибиотиков, а журнал Time и вовсе включил Флеминга в список из ста самых важных людей XX века.
Именно его считают «отцом» всех современных антибиотиков, а журнал Time и вовсе включил Флеминга в список из ста самых важных людей XX века.
Но тут важно понимать: Флеминг был первым (или во всяком случае одним из первых), кто сумел облечь свое исследование в научную структурированную форму, при этом сама идея использования плесени в борьбе с рядом заболеваний микробиологу не принадлежит. Если зайти совсем далеко вглубь веков, то еще жители древнего Египта прикладывали размоченный в воде заплесневелый хлеб к ранениям. В конце XIX столетия формулу схожего с пенициллином антибиотика якобы вывел итальянский врач Бартоломео Гозио. Тогда же его французский коллега Эрнест Дюшен представил аналогичное исследование, но научное сообщество его не приняло. Есть еще несколько похожих примеров.
Александр Флеминг родился 6 августа 1881 года в семье простого фермера. По примеру одного из старших братьев молодой человек решился изучать медицину и, будучи еще студентом, попал в прикрепленную к госпиталю Святой Марии в Лондоне исследовательскую лабораторию. Впоследствии микробиолог проработал в ней до самой своей смерти в 1955 году, до этого отслужив капитаном в Королевской медицинской армии Британии во время Первой мировой войны.
Впоследствии микробиолог проработал в ней до самой своей смерти в 1955 году, до этого отслужив капитаном в Королевской медицинской армии Британии во время Первой мировой войны.
Случайное открытие, ставшее возможным благодаря сквозняку и открытому окну
Легенда гласит: открытие произошло едва ли не по случайности. В 1928 году Флеминг занимался изучением стафилококков в лаборатории, когда заметил плесневые грибы Penicillium notatum в чашах для выращивания бактерий — их занесло сквозняком через открытое окно. Ученый занялся более подробным изучением этих объектов и обнаружил, что вокруг каждого из пятен плесени образовалась небольшая область, где бактерии стафилококка полностью уничтожились.
Впрочем, со стопроцентной точностью определить причину подобного эффекта у Флеминга в тот момент не вышло. Как и некоторые его предшественники, ученый сперва предположил: плесень стимулирует иммунную систему организма, а не сам уничтожает бактерии. Затем стало понятно, что на микробы влияет именно плесень. Но с выделением отфильтрованного вещества, впоследствии названного Флемингом пенициллином, были проблемы. Поначалу использовать полученный специалистом образец на людях было слишком рискованно из-за большого количества потенциально опасных примесей.
Но зато, как упоминалось выше, ученый все подробно описал и структурировал, то есть расписал, как фильтрат действует на различные бактерии, занялся сравнением «своей» плесени с другими ее разновидностями и, что важнее, сумел сохранить образцы. В 1929 году Флеминг публично рассказал в Лондонском медицинском научно-исследовательском клубе о разработанном им потенциально перспективном антибактериальном средстве, но экспертное сообщество восприняло новость, мягко говоря, прохладно. На призывы Флеминга заняться его дальнейшей разработкой никто не откликнулся — о пенициллине забыли на 10 лет.
Нобелевская премия, мировое признание и тысячи спасенных жизней
Вновь вспомнили о нем лишь в 1939-м. Немецкий эмигрант Эрнст Чейн спустя бесчисленное множество неудачных попыток все-таки выделил чистое вещество, способное применяться для лечения, из сохраненного в Оксфордском университете образца Флеминга. Его начальник Говард Флори занялся испытанием препарата на животных. В 1942 году, во время Второй мировой войны, «чистый» пенициллин опробовали на умирающем от менингита больном, в 1943-м началось массовое производство — в основном в США. И понятно почему: на территориях, физически не затронутых военными действиями, наладить выпуск было куда проще.
Существует интересная, но неподтвержденная теория. Везти плесень из Великобритании в США в пузырьке было слишком опасно: вещество могли перехватить и передать немецким ученым. Поэтому грибковыми спорами решили пропитать подкладки пальто ученых, которые как раз переправлялись через Атлантический океан.
Так или иначе, но процесс пошел. Терапевтические свойства пенициллина быстро оценили, особенно на фронте. Счет пошел буквально на десятки, если не сотни тысяч спасенных жизней. В 1945-м Флеминг, Флори и Чейн удостоились Нобелевской премии в области физиологии и медицины. Большинство современных антибиотиков были созданы именно после исследования лечебных свойств пенициллина. В сентябре 1945 года, накануне приезда во французскую столицу Александра Флеминга парижские газеты писали: «Для разгрома фашизма и освобождения Франции он сделал больше целых дивизий».
Как появился первый советский антибиотик, или «Мадам пенициллин»
Массовое производство пенициллина в США стартовало в 1943 году, но до СССР доходили лишь единичные дозы препарата. Процесс его получения и вовсе оставался неизвестным. В общем, было необходимо в срочном порядке освоить технологию и наладить выпуск собственного аналога. Этим занималась микробиолог Зинаида Ермольева — позже ее даже стали называть «Мадам пенициллин».
Впрочем, путь Ермольевой к подобному «званию», как и в случае Флеминга, вряд ли можно назвать заурядным. Работа над созданием отечественного пенициллина стартовала в 1942 году, первые образцы были получены в 1943-м. Тогда же запустили производство антибиотика под названием крустозин.
«Известия» пишут, что в 1944 году в СССР прибыл один из создателей оригинального пенициллина Говард Флори — специалист привез с собой штамм их препарата. И советское лекарство, если верить изданию, даже оказалось в 1,4 раза эффективнее. Но в ТАСС при этом добавляют: полученный Ермольевой и ее командой антибиотик терял свойства при хранении и вызывал у пациентов повышение температуры. Ресурс также приводит такие данные: в 1945 году в Советском Союзе начались испытания пенициллина, разработанного по западному образцу. Технология его производства была освоена НИИ эпидемиологии и гигиены Красной армии под руководством Николая Копылова.
Наш канал в Telegram. Присоединяйтесь!
Есть о чем рассказать? Пишите в наш телеграм-бот. Это анонимно и быстро
Перепечатка текста и фотографий Onlíner без разрешения редакции запрещена. [email protected]
антибиотиков: от предыстории до наших дней | Журнал антимикробной химиотерапии
Аннотация
Противомикробные препараты использовались многие тысячи лет в различных форматах. В этой статье я прослежу, как мы перешли от оригинального использования агентов, доступных в окружающей среде, к химически модифицированным агентам.
Введение
В поколении, выросшем в эпоху широко доступных антибиотиков, легко предположить, что до того, как они были введены, любой, у кого была инфекция, в конце концов погиб от ее воздействия.
Это явно не так, поскольку всегда были выжившие даже от самых смертоносных инфекций, таких как бубонная чума, дифтерия и туберкулез, благодаря эффективности врожденного иммунного ответа. Однако справедливо сказать, что когда-то уровень смертности был намного выше, чем сегодня.
Древняя история
Имеются также достоверные исторические свидетельства того, что древние цивилизации использовали множество естественных средств лечения инфекций, например травы, мед и даже фекалии животных. 1 Одним из наиболее успешных методов лечения было местное применение заплесневелого хлеба, многие упоминания о его благотворном действии были получены в Древнем Египте, Китае, Сербии, Греции и Риме. Эта тема пользы плесени продолжалась на протяжении многих лет со ссылками на Джона Паркинсона (1567–1640) (рис. 1) в его книге Theatrum Botanicum , опубликованной в 1640 году.
Рисунок 1.
Джон Паркинсон (1567–1650). Первый человек, задокументировавший использование плесени для лечения инфекций.
Рисунок 1.
Джон Паркинсон (1567–1650). Первый человек, задокументировавший использование плесени для лечения инфекций.
Даже более современные антибиотики могли быть доступны в древние времена. Следы тетрациклинов были обнаружены в человеческих скелетах, раскопанных в Нубии и во время римской оккупации Египта. 2 Происхождение тетрациклина остается загадкой.
Возрождение и Просвещение
Открытие Антони ван Левенгука небольших живых существ или «анималкулов» 3 (1632–1723) в 1676 году — с использованием сконструированного им микроскопа — положило начало изучению бактериологии после того, как он сообщил свои открытия в 1665 году Роберту Гуку (1635). –1703), член-основатель Королевского общества.В конце 1800-х годов Роберт Кох (1843–1910) и Луи Пастер (1822–1895) смогли установить связь между отдельными видами бактерий и болезнями посредством их распространения в искусственных средах и на животных.
Распространение гонореи и сифилиса 4 побудило к дальнейшим экспериментам с возможными методами лечения, особенно среди высших слоев общества. Были испытаны тяжелые металлы, такие как мышьяк, висмут и ртуть; они вводились либо системно, либо местно с помощью специально разработанных шприцев.Хотя симптомы улучшились, введение и побочные эффекты часто оказывались хуже, чем болезнь.
Рассвет современной эпохи
Пиоцианаза, вероятно, была первым антибиотиком, который использовался для лечения человеческих инфекций. Рудольф Эммерих (1856–1914) и Оскар Лёв (1844–1941) обнаружили, что зеленые бактерии, выделенные из повязок раненых пациентов, подавляли рост других микробов. 5 Они выращивали организм ( Pseudomonas aeruginosa, ) партиями и использовали супернатант в качестве лекарства с переменным успехом.
Только после того, как Пол Эрлих (1854–1915) (рис. 2) начал работать над антибактериальным действием красителей, настоящая эра противомикробной химиотерапии началась. Первым интересом Эрлиха была разработка красителей для гистологического исследования тканей, в частности, основы окраски Циля-Нельсона на ТБ и окраски по Граму. Он отметил, что некоторые пятна были токсичными для бактерий, и начал поиски «волшебной пули» немецкого фольклора (изначально предназначенной для уничтожения оборотней). 6 Сальварсан, химическое вещество на основе мышьяка, открытое Эрлихом и его командой в 1909 году, оказалось эффективным средством лечения сифилиса и, вероятно, первым по-настоящему современным противомикробным средством, хотя и не было антибиотиком в строгом смысле этого слова.
Рисунок 2.
Пауль Эрлих (1854–1915). Отец антимикробной химиотерапии.
Рис. 2.
Пауль Эрлих (1854–1915). Отец антимикробной химиотерапии.
Эрлих не ограничивался химическими веществами.Он также очень интересовался иммунологией и работал с Робертом Кохом (1843–1910) и Эмилем фон Берингом (1854–1917) над улучшением антитоксина против дифтерии. Затем антитоксины стали основой антибактериальной терапии. Уильям Ослер (1849–1919) описал использование «антистрептококковой сыворотки» в качестве лечения эндокардита, при котором бактерии, выделенные из культур крови, вводили лошадям, а затем пациентам вводили лошадиную сыворотку. 7
Пенициллин
Всем известна история о том, как Александр Флеминг (1881–1955) открыл пенициллин в 1928 году, 8 , но другие, вероятно, сделали это раньше него.В 1870 году сэр Джон Скотт Бердон-Сандерсон (1828–1905) описал, как культуральная жидкость, покрытая плесенью, подавляет рост бактерий. Год спустя Джозеф Листер (1827–1912) экспериментировал с « Penicillium glaucium » (так в оригинале), продемонстрировав его антибактериальный эффект на ткани человека, а в 1875 году доктор Джон Тиндалл (1820–1893) представил свои эксперименты с Penicillium notatum Королевскому обществу. Наконец, в 1897 году Эрнест Дюшен (1874–1912) наблюдал за арабскими конюхами, лечившими язвы в седлах плесенью, размножающейся на их седлах.Он взял эту плесень, подтвержденную как Penicillium notatum , и использовал ее для успешного лечения индуцированного брюшного тифа у морских свинок. 3
Флеминг понял, что пенициллин обладает огромным потенциалом, но возникли серьезные проблемы с переводом того, что можно было продемонстрировать в лаборатории, в лекарство, которое могло бы стать широко доступным. Он пытался привлечь внимание химиков в течение ряда лет, но, наконец, отказался в 1940 году, чтобы преследовать другие интересы. К счастью, Ховард Флори (1898–1968), фармаколог и патолог, и Эрнст Чейн (1906–1979), биохимик, работающий в Оксфорде, опубликовали в том же году статью, описывающую методику очистки.Этот прорыв в конечном итоге привел к тому, что пенициллин стал доступен для ограниченного использования в 1945 году. 9 Несомненно, пенициллин спасал жизнь, но у него все еще были проблемы. Он имел очень короткую т 1/2 и низкую биодоступность, проблемы, которые сохраняются при его применении сегодня.
Пока Флеминг пытался очистить пенициллин, в Германии ученые компании Bayer следовали примеру Эрлиха и изучали антибактериальные эффекты красителей. Сульфаниламид был синтезирован в 1908 году, а в 1931 году путем его объединения с красителем был получен пронтозил; эта комбинация оказалась эффективной при лечении стрептококковых инфекций у мышей.В 1933 году мальчику, умирающему от стафилококковой сепсиса, препарат с чудодейственным успехом был введен. В 1935 году исследователи поняли, что краситель не нужен, так как пронтозил метаболизировался до сульфаниламида, и началась эра сульфонамидов 10 . Сульфаниламиды якобы спасли жизни Уинстона Черчилля и сына Франклина Д. Рузвельта.
Золотой век
После этого толчка следующие 20 лет стали «золотым веком» открытия антибиотиков.Первоначально лучшим источником новых агентов были другие встречающиеся в природе микроорганизмы, и после того, как в 1944 г. был выделен стрептомицин 11 из Streptomyces griseus (организм, обнаруженный в почве), начался всемирный поиск. Были приложены все усилия, чтобы охватить все уголки земного шара, но ресурсы были ограничены. Эли Лилли пришла в голову блестящая идея попросить христианских миссионеров прислать обратно образцы почвы из каждого экзотического места, которое они посетили. В образце с Борнео, отправленном в 1952 г., выросло Streptomyces orientalis, из которых в конечном итоге был извлечен ванкомицин ; ванкомицин стал доступен для использования пациентами в 1958 году. 12
К этому времени резистентность к антибиотикам стала очевидной, и ученые искали новые способы улучшить существующие агенты для борьбы с этим препятствием. Бичем разработал метициллин в 1959 году как первый устойчивый к пенициллиназе β-лактамный антибиотик, а спектр активности и фармакокинетика пенициллина были улучшены с введением ампициллина в 1961 году.
Цефалоспорины начали появляться в 1960-х годах, и их эволюция разделила их на три поколения в соответствии с их спектром активности, антипсевдомонадный агент третьего поколения цефтазидим, появившийся в конце 1970-х годов.По счастливой случайности, в 1975 году в первое издание этого журнала была включена статья, описывающая антимикробную активность цефамандола. 13
Бактериальные ингибиторы β-лактамаз 14 были впервые идентифицированы как побочный продукт культур Streptomyces clavuligerus в 1976 году. Из них была получена клавулановая кислота, которая была объединена с амоксициллином, чтобы стать ко-амоксиклавом, и тиенамицином. , который стал предшественником карбапенемов.
Тиенамицин превратился в имипенем, который был очень эффективным in vitro, и в моделях на животных, но, к сожалению, имел очень короткий результат t 1/2 в испытаниях на людях.Дальнейшие исследования выявили новый фермент в почках человека, дигидропепидазу I, который быстро метаболизирует имипенем. За счет добавления циластатина к имипенему т 1/2 было увеличено, и эта комбинация стала доступной для использования в Великобритании в конце 1980-х годов. Меропенем был лицензирован в 1995 году и имел аналогичный спектр действия, но был связан с меньшим количеством побочных эффектов. 15
Два ингибитора β-лактамазы, тазобактам и сульбактам, были объединены с другими агентами, чтобы расширить диапазон их действия. 14 Пиперациллин / тазобактам был впервые лицензирован в США в 1993 году и в том же году стал предметом дополнения к этому журналу. Комбинация в настоящее время широко используется в Великобритании в качестве экономичной замены цефалоспоринов Clostridium difficile цефалоспоринам, которые ранее были популярным выбором для эмпирической терапии.
По мере того, как стал доступен ряд доступных антибиотиков широкого спектра действия, частота инфекций, вызванных устойчивыми бактериями, увеличилась из-за давления отбора.До начала 80-х годов прошлого века лечение псевдомонозных инфекций требовало внутривенного введения антибиотиков и госпитализации.
Налидиксовая кислота была доступна для клинического применения в 1967 г., 16 , хотя ее применение ограничивалось лечением неосложненных инфекций мочевыводящих путей. Разработка фторхинолонов вернула эту группу антибиотиков в высшую лигу, особенно потому, что все они были доступны перорально. Ципрофлоксацин был представлен в середине 1980-х годов, когда я был стажером микробиологом, и на протяжении многих лет я отслеживал колебания состояния этого агента.Многие другие новые хинолоны либо не стали клинически доступными, либо были отменены из-за побочных эффектов после их запуска. Интересно поразмышлять над этим: многие из более ранних антибиотиков, такие как макролиды и тетрациклины, вызывают аналогичные (или даже худшие) побочные эффекты, но все еще широко используются.
С течением времени устойчивые грамположительные инфекции, такие как MRSA и энтерококки, становились все более сложными для врачей, поэтому при разработке антибиотиков внимание было сосредоточено на этих бактериях.
Ванкомицин все еще использовался в качестве агента первой линии для этих инфекций, но его было нелегко вводить, он обладал слабым бактерицидным действием и появлялась резистентность к энтерококкам. Тейкопланин, выделенный из Actinoplanes teichomyceticus , был первым из новых гликопептидов, который стал доступен в Европе в 1990-х годах. 17 Хотя его было легче вводить, его активность против стафилококков была разочаровывающей, а его использование для гликопептид-устойчивых энтерококков (GRE) было ограниченным.Тем не менее, он все еще широко используется сегодня.
Использование гликопептидов в амбулаторных условиях привело к поиску препаратов длительного действия. Далбаванцин впервые прошел клинические испытания в 2007 году, но стал доступен только в 2014 году, примерно в то же время, что и оритаванцин, который был лицензирован в США как однократное средство для лечения инфекций кожи и мягких тканей.
Первоначально оксазолидиноны были исследованы для лечения болезней растений. Первым антибиотиком этого класса был циклосерин, который впервые был использован в 1956 году для лечения туберкулеза.Линезолид был одобрен для использования в 2000 году и оказался полезной альтернативой гликопептидам из-за его хорошей пероральной доступности и активности против GRE. Это использование несмотря на то, что оно связано с рядом побочных эффектов и взаимодействием с лекарствами. 18 Линезолид, повторяя свое начало, также оказался полезным средством для лечения устойчивых к лекарствам микобактерий. Недавно стали доступны новые антибиотики того же класса, такие как тедизолид, и пока данные клинических испытаний в отношении побочных эффектов обнадеживают.
Даптомицин, 19 , как и многие другие антибиотики, описанные в этом обзоре, был получен из почвенного организма Streptomyces roseosporus , который был получен с горы Арарат в Турции. Даптомицин впервые был оценен в конце 1980-х годов; однако испытания были остановлены из-за неблагоприятных воздействий на опорно-двигательный аппарат, но агент был реанимирован и запущен в США в 2003 году.
Конец Золотого века
Между тем, после признания того, что введение мер инфекционного контроля может снизить заболеваемость MRSA и GRE, внимание переключилось на проблему устойчивости грамотрицательных бактерий.Лечение инфекций, вызванных панрезистентными Acinetobacter , Enterobacteriaceae и Pseudomonas , оказалось сложной задачей для клиницистов, особенно в условиях интенсивной терапии. Были пересмотрены старые препараты, такие как колистин, хлорамфеникол, миноциклин и фосфомицин, либо по отдельности, либо в комбинации с более новыми препаратами.
Тигециклин, 20 производное тетрациклина, был представлен в 2005 году и был первым агентом широкого спектра действия, получившим лицензию после моксифлоксацина в 2000 году.
Вслед за тигециклином в 2010-х годах появились цефтобипрол и цефтаролин, цефалоспорины, активные против MRSA. Совсем недавно были разработаны комбинации цефалоспорин / β-лактамаз, такие как цефтолозан / тазобактам, цефтазидим / авибактам и цефтазидим / сульбактам 21 , с активностью против устойчивых штаммов Pseudomonas и Enterobacteriaceae, продуцирующих карбапенемазы.
Выводы
The Journal of Antimicrobial Chemotherapy сыграл свою роль в истории антибиотиков, публикации исследований, ведущих статей и дополнений (Таблица 1).
Таблица 1.Примеры приложений к журналу, посвященных отдельным антибактериальным препаратам
| Антибактериальные . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Suppl B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Suppl D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Suppl A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Suppl D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Suppl C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Suppl 1: 1–101 |
| тровафлоксацин | 1997; 39 Suppl 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Suppl 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Suppl 3: 1–37 |
| гемифлоксацин | 2000; 45 Suppl 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Дополнение 2: 1–55 |
| Антибактериальный . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Suppl B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Suppl D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Suppl A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Suppl D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Suppl C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Suppl 1: 1–101 |
| тровафлоксацин | 1997; 39 Suppl 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Suppl 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Suppl 3: 1–37 |
| гемифлоксацин | 2000; 45 Suppl 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Приложение 2: 1–55 |
Примеры приложений к журналу, посвященных отдельным антибактериальным препаратам
| Антибактериальные . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Suppl B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Suppl D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Suppl A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Suppl D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Suppl C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Suppl 1: 1–101 |
| тровафлоксацин | 1997; 39 Suppl 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Suppl 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Suppl 3: 1–37 |
| гемифлоксацин | 2000; 45 Suppl 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Дополнение 2: 1–55 |
| Антибактериальный . | Дополнение . |
|---|---|
| β-лактамы | |
| цефтазидим | 1981; 8 Suppl B: 1–358 |
| цефтазидим | 1983; 12 Suppl A: 1–122 |
| клавуланатные / β-лактамные антибиотики | 1989; 24 Дополнение B: 1–226 |
| имипенем | 1983; 12 Suppl D: 1–153 |
| имипенем | 1986; 18 Дополнение E: 1-232 |
| меропенем | 1989; 24 Suppl A: 1–320 |
| меропенем | 1995; 36 Suppl A: 1–223 |
| пиперациллин / тазобактам | 1993; 31 Suppl A: 1–124 |
| Фторхинолоны | |
| эноксацин | 1984; 14 Дополнение C: 1–344 |
| норфлоксацин | 1984; 13 Дополнение B: 1–142 |
| ципрофлоксацин | 1986; 18 Suppl D: 1-260 |
| пефлоксацин | 1986; 17 Дополнение B: 1–118 |
| эноксацин | 1988; 21 Дополнение B: 1–136 |
| флероксацин | 1988; 22 Дополнение D: 1-234 |
| офлоксацин | 1988; 22 Suppl C: 1-2 |
| ципрофлоксацин | 1990; 26 Дополнение E: 1–142 |
| офлоксацин | 1990; 26 Дополнение D: 1–83 |
| пефлоксацин | 1990; 26 Дополнение B: 1–101 |
| темафлоксацин | 1991; 28 Дополнение C: 1–130 |
| спарфлоксацин | 1996; 37 Suppl A: 1–161 |
| грепафлоксацин | 1997; 40 Suppl 1: 1–101 |
| тровафлоксацин | 1997; 39 Suppl 2: 1–97 |
| ципрофлоксацин | 1999; 43 Suppl 1: 1–41 |
| левофлоксацин | 1999; 43 Suppl 3: 1–90 |
| моксифлоксацин | 1999; 43 Дополнение 2: 1–100 |
| гемифлоксацин | 2000; 46 Suppl 3: 1–37 |
| гемифлоксацин | 2000; 45 Suppl 3: 1–107 |
| Разное | |
| ванкомицин | 1984; 14 : 1–109 |
| teicoplanin | 1988; 21 : 1–172 |
| teicoplanin | 1991; 27 : 1–73 |
| линезолид | 2003; 51 Дополнение 2: 1–53 |
| далбаванцин | 2005; 55 Приложение 2: 1–35 |
| тигециклин | 2013; 68 Suppl 2: 1–55 |
Хотя наука пытается идти в ногу с появлением все более и более устойчивых бактерий, необходимы дополнительные усилия для сохранения существующих антибиотиков и разработки новых.Более широкое использование комбинаций антибиотиков могло бы помочь преодолеть этот пробел, но, хотя данные in vitro и доступны, для валидации необходимо больше результатов клинических исходов.
Одна из повторяющихся тем в этом обзоре заключается в том, что многие из великих достижений в открытии антибиотиков стали результатом выделения новых бактерий из окружающей среды. Эта работа требует много времени. Многие штаммы должны быть проверены на предмет их продуктов, прежде чем даже потенциальный агент может быть идентифицирован.Исследования новых бактериальных мишеней, связанных с WGS, могут в конечном итоге облегчить эту работу, но тем временем естественные среды обитания, где встречаются эти микроорганизмы, подвергаются эрозии из-за вырубки лесов и глобального потепления. Времени может не хватить!
Заявления о прозрачности
Отсутствуют для объявления.
Список литературы
1Keyes
K
,Lee
MD
,Maurer
JJ
.Антибиотики: механизм действия, механизмы резистентности и передачи
. В:Torrance
ME
,Isaacson
RE
, ред.Безопасность микробных пищевых продуктов в животноводстве Текущие темы
.Ames, IA, USA
:Iowa State Press
,2003
:45
—56
,2Basset
EJ
,Keith
MS
, и др. GJ ..Меченная тетрациклином человеческая кость из древней суданской Нубии (350 г. н.э.)
.Наука
1980
;209
:1532
—4
,3Портер
R
.Величайшее благо человечества
.Вокеган, Иллинойс, США
:Fontana Press
,1999
.4Playfair
J
.Жизнь с микробами в состоянии здоровья и болезней
.Оксфорд
:Oxford University Press
,2004
,5Леви
SB
.Парадокс антибиотиков
.Кембридж, Массачусетс, США
:Perseus Publishing
,2002
,6Schwartz
RS
.Волшебные пули Пауля Эрлиха
.NEJM
2004
;350
:1079
—80
,7Pruitt
RD
.Уильям Ослер и его Галстонские лекции по злокачественному эндокардиту
.Mayo Clin Proc
1982
;57
:4
—9
,8Fleming
A
.Об антибактериальном действии культуры Penicillium , с особым упором на их использование в изоляции B
.influenzae. Br J Exp Pathol
1929
;10
:226
—36
.9Аминов
РИ
.Краткая история эпохи антибиотиков: извлеченные уроки и задачи на будущее
.Передний микробиол
2010
;1
:134
—45
.10Шамбо
GE
.История сульфаниламидов
.Арка Отоларингол
1966
;83
:1
—2
.11Saga
T
,Yamaguchi
K
.История противомикробных агентов и резистентных бактерий
.Japan Med Assoc J
2009
;52
:103
—8
.12Левин
DP
.Ванкомицин: история
.Clin Infect Dis
2006
;42
:S5
—12
,13Russell
AD
.Антибактериальная активность нового цефалоспорина, цефамандола
.J Antimicrob Chemother
1975
;1
:97
—101
.14Drawz
SM
,Bonomo
RA
.Три десятилетия ингибиторов β-лактамаз
.Clin Microbiol Rev
2010
;23
:60
—201
.15Papp-Wallace
KM
,Edimiani
A
,Taracila
MA
et al..Карбапенемы: прошлое, настоящее и будущее
.Противомикробные агенты Chemother
2011
;55
:4943
—60
.16Emmerson
AM
,Jones
AM
.Хинолоны: десятилетия разработки и использования
.J Antimicrob Chemother
2003
;51
Доп. S1
:13
—20
,17Гринвуд
D
.Микробиологические свойства тейкопланина
.J Antimicrob Chemother
1988
;21
;Дополнение A
:1
—13
,18Gould
FK
.Линезолид: безопасность и эффективность в особых группах населения
.J Antimicrob Chemother
2011
;66
Suppl 4
:3
—6
,19Eisenstein
BI
,Oleson
FB
,Balz
RH
.Даптомицин: от горы до клиники при существенной помощи Фрэнсиса Талли, MD
.Clin Infect Dis
2010
;50
Suppl 1
:10
—5
.20Greer
ND
.Тигециклин (Tygacil): первый антибиотик из класса глицилциклинов
.Proc Bayl Univ Med Cent
2006
;19
:155
—61
.21Жанель
CG
,Chung
P
,Зеленицкий
S
и др. .Цефтолозан / тазобактам: новая комбинация ингибиторов цефалоспорин / β-лактамаз, обладающая активностью против грамотрицательных бацилл с множественной лекарственной устойчивостью
.Лекарственные препараты
2014
;74
:31
—51
.© Автор, 2016. Опубликовано Oxford University Press от имени Британского общества антимикробной химиотерапии.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Развивающаяся реакция на устойчивость к антибиотикам (1945–2018 гг.)
В том же году, как будто непосредственно обращаясь к таким опасениям относительно необходимости скоординированных политических действий, Дам Салли Дэвис, главный врач Великобритании, опубликовала основной отчет на тему « Инфекции и рост устойчивости к противомикробным препаратам », заявив, что« [t] в Великобритании существует потребность в том, чтобы сделать устойчивость к противомикробным препаратам одной из основных проблемных областей, включая ее включение в национальный реестр рисков … и побуждая к действиям на международном уровне, а также в местных службах здравоохранения »(Дэвис, 2013, стр.16 [в оригинале выделено жирным шрифтом]). Такую просьбу подкрепляло ее более яркое (и часто цитируемое) последующее предупреждение: «Устойчивость к противомикробным препаратам — это бомба замедленного действия не только для Великобритании, но и для всего мира. Нам необходимо работать со всеми, чтобы гарантировать, что апокалиптический сценарий повсеместной устойчивости к противомикробным препаратам не станет реальностью. Это угроза, которая, возможно, не менее важна для мира, чем изменение климата »(там же). Признавая как использование, так и потенциальные недостатки такой апокалиптической риторики, Дэвис и ее коллеги позже предсказали, что, если устойчивость к противомикробным препаратам останется неконтролируемой, «уровень смертности, связанной с инфекциями, может возрасти до уровня, сопоставимого с уровнем викторианской эпохи» (Fowler et al., 2014; Shallcross et al., 2015).
Устойчивость к противомикробным препаратам, таким образом, строилась не столько вокруг нынешнего бремени болезни, сколько в рамках логики предвосхищения грядущей чрезвычайной ситуации, катастрофического будущего, которое мы сами можем создать или уничтожить, в зависимости от нашего нынешнего выбора. Не случайно Дэвис решил сравнить устойчивость противомикробных препаратов к изменению климата, и такие прогнозируемые варианты будущего являются одновременно перформативными и генеративными в их построении и применении (Brown and Michael, 2003; Podolsky and Lie, 2016).В самом деле, усилия Дэвиса ознаменовали еще один поворотный момент в повышении глобальной обеспокоенности по поводу сопротивления (и в ответ на него). В том же году, когда она выпустила свой отчет, Центры по контролю за заболеваниями США выпустили собственный отчет «Угрозы устойчивости к антибиотикам в Соединенных Штатах, 2013 г.», обратив внимание на такие новые приоритетные патогены, как устойчивые к карбапенемам Enterobacteriaceae (CRE) и множественные лекарственные препараты. Устойчивый Acinetobacter, который сопровождает такие известные патогены, как MRSA, гонококки с лекарственной устойчивостью и туберкулез с множественной лекарственной устойчивостью, стал новым лицом устойчивости к противомикробным препаратам в технических и популярных отчетах (Центры по контролю за заболеваниями, 2013).К 2015 году США выпустят свой собственный Национальный план действий по борьбе с устойчивыми к антибиотикам бактериями, сигнализируя о необходимости усиления координации между агентствами США и расширения сотрудничества таких агентств как с промышленными, так и с международными партнерами (2015).
Группы, подобные CDDEP, обращали постоянное внимание на связанную, глобальную экологию потребления антибиотиков и устойчивости, отмечая рост потребления антибиотиков в мире на 35% в период с 2000 по 2010 год, причем 76% этого роста пришлось на Бразилию, Россию, Индия, Китай и Южная Африка (Van Boeckel et al., 2014). В то же время CDDEP и другие участники обратили внимание на необходимость сохранения или улучшения доступа к антибиотикам в развивающихся странах, в то же время, что следует избегать ненадлежащего использования или избытка (Ǻrdal et al., 2016 ). В этом контексте в 2015 году, в том же году, когда Организация Объединенных Наций (ООН) объявила о своих целях в области устойчивого развития (включая искоренение нищеты и голода), которые должны быть достигнуты к 2030 году, ВОЗ выпустила свой собственный «Глобальный план действий по устойчивости к противомикробным препаратам. »Через год после выпуска« Глобального отчета о надзоре за [устойчивостью к противомикробным препаратам] »(ВОЗ, 2014 г .; то же самое, 2015 г.).Как заявила Генеральный директор ВОЗ Маргарет Чан в предисловии к Глобальному плану действий: «Устойчивость к противомикробным препаратам — это кризис, с которым необходимо бороться в срочном порядке. Сейчас, когда мир вступает в новую амбициозную эру устойчивого развития, мы не можем допустить, чтобы с трудом завоеванные достижения в области здравоохранения были сведены на нет из-за неэффективности наших основных лекарственных средств »(ВОЗ, 2015, предисловие). Устойчивость к противомикробным препаратам должна была рассматриваться как общая проблема многих государств-членов ВОЗ, предполагающая как действия отдельных государств, так и более скоординированные усилия в отношении улучшения образования и эпиднадзора, улучшения санитарии и профилактики инфекций, сокращения ненужного использования противомикробных препаратов как в человеческом, так и в сельскохозяйственном секторе. секторов, а также устойчивые инвестиции в новые средства диагностики и лечения.В то же время, признавая необходимость подхода «единого здоровья» к устойчивости к противомикробным препаратам, ВОЗ заявила о своем намерении на постоянной основе сотрудничать как с Продовольственной и сельскохозяйственной организацией (ФАО), так и с Всемирной организацией здравоохранения животных (МЭБ), чтобы достичь таких целей.
Этот акцент на сотрудничестве и совместной ответственности вскоре сопровождался повышенным вниманием к глобальному прогнозированию экономических последствий УПП. Хотя это не совсем новая проблема (как отмечалось выше, она была кратко отмечена в собственном докладе ВОЗ о Глобальной стратегии 2001 г., а до этого — в ее «Рабочем документе» 1994 г., и была подчеркнута в отчете Всемирного экономического форума 2013 г. «Опасности»). высокомерия в отношении здоровья человека »; см. Всемирный экономический форум, 2013 г.), такие последствия приобрели дополнительную значимость, если представить их вместе с U.Цели устойчивого развития Н. Они послужили мощным экономическим обоснованием и обоснованием безопасности для борьбы с устойчивостью к противомикробным препаратам для тех политиков, которые еще не были достаточно обеспокоены возможным возвращением только к медицине викторианской эпохи. И снова Великобритания возглавила свой «Обзор устойчивости к противомикробным препаратам» 2016 года под председательством экономиста Джима О’Нила, в котором прогнозируется, что, если не будут приняты меры для предотвращения траектории устойчивости к противомикробным препаратам, глобальные экономические издержки к 2050 году достигнут 100. триллионов долларов США, что сопровождается потерей 10 миллионов жизней в год (O’Neill et al., 2016). За отчетом О’Нила в начале 2017 г. последует собственный отчет Всемирного банка «Инфекции, устойчивые к лекарственным препаратам: угроза нашему экономическому будущему», который дополняет отчет О’Нила, утверждая, что неконтролируемая устойчивость к противомикробным препаратам может привести к годовому показателю 3,8. % глобальных потерь ВВП к 2050 году, что равняется 3,4 трлн долларов в год к 2030 году, при этом беднейшие страны пострадают больше всего и представляют прямую угрозу для достижения целей глобального развития (Jones et al., 2017). И снова логика предвосхищения глобального экономического спада помогла еще больше усилить опасения по поводу воздействия неконтролируемой устойчивости к противомикробным препаратам.
В этом контексте повышенного внимания к взаимосвязанным последствиям устойчивости к противомикробным препаратам для здоровья и экономики ООН в сентябре 2016 г. созвала заседание Генеральной Ассамблеи высокого уровня, посвященное устойчивости к противомикробным препаратам, и только в четвертый раз такое совещание. был специально сосредоточен на проблеме здоровья. Последующая «Политическая декларация» ООН подтвердила цели глобального плана действий ВОЗ и подтвердила необходимость координации между ВОЗ, ФАО и МБЭ, а также взаимосвязь устойчивости к противомикробным препаратам и ее собственных целей устойчивого развития (Президент Генеральной Ассамблеи, 2016 г.).ООН учредила Специальную межучрежденческую координационную группу (IACG) по устойчивости к противомикробным препаратам с участием представителей высокого уровня; и хотя действия ООН до этого момента не имели никакого отношения к международному договору или даже к прямому координирующему органу (о таких стремлениях см. Ǻrdal et al., 2016), они, похоже, выполнили задачу IACG «отстаивать и выступать за действия против УПП на самом высоком политическом уровне »и привлечь внимание и финансирование к тем, кто поставил перед собой задачу предотвратить наступление постантибиотической эры (Межучрежденческая координационная группа по устойчивости к противомикробным препаратам, 2017).
Такие «действия против УПП» в соответствии с таксономией почти каждого крупного отчета об устойчивости к противомикробным препаратам подразделяются на три широкие категории: усиление эпиднадзора и фактический подсчет использования противомикробных препаратов и устойчивости, сокращение случаев устойчивости к противомикробным препаратам и увеличение числа случаев поставка новых противомикробных препаратов. Что касается надзора, недостаточная финансовая поддержка, стандартизация и координация которого долгое время были недостающими элементами надлежащего глобального надзора, финансирование было увеличено через такие благотворительные группы, как Wellcome Trust и Фонд Билла и Мелинды Гейтс, в то время как усилия по координации под руководством Глобальной системы эпиднадзора за антимикробными препаратами ВОЗ (GLASS), запущенной в 2015 году (Wellcome Trust, 2015; Wellcome Trust, 2017; Всемирная организация здравоохранения, 2017; Mayor, 2018).Хотя на данный момент в программе GLASS участвуют менее трети государств-членов ВОЗ, ВОЗ, похоже, считает, что окно наблюдения наполовину заполнено и находится на «ранней стадии реализации» программы.
Усилия по сокращению спроса на противомикробные препараты основывались на широком спектре усилий, направленных на сокращение использования и чрезмерного использования противомикробных препаратов, начиная от санитарных и вакцинационных мер и заканчивая снижением заболеваемости самой инфекцией, посредством просвещения и регулирования населения, а также медицинских и ветеринарных служб. профессий в отношении назначения противомикробных препаратов (и связанных с этим усилий по разработке улучшенной диагностики для поддержки более рациональной терапии), к дальнейшим попыткам сокращения использования антибиотиков в агробизнесе во всем мире (Laxminarayan et al., 2016; Пульчини и др., 2018; Всемирная организация здравоохранения, 2018 г.). Это остается широкой серией мер, охватывающих разнородный круг глобальных игроков, привлекающих дополнительное внимание к самим структурам повседневной жизни и медицинского обслуживания и их взаимосвязи с устойчивостью к противомикробным препаратам (Laxminarayan and Chaudhury, 2016; Alvarez-Uria et al., 2016 ).
В отличие от мероприятия, посвященного таким разрозненным мерам по сокращению спроса на антибиотики и их использования, возможно, наибольшее внимание — и финансирование — было направлено на увеличение будущих поставок антибиотиков.Меры, пропагандируемые для стимулирования промышленности к возобновлению производства антибиотиков, были описаны как механизмы «выталкивания» или «вытягивания». Механизмы «проталкивания» предполагают государственную или благотворительную поддержку разработки антибиотиков на ранней стадии и простираются от относительно давней поддержки, предоставляемой Управлением передовых биологических исследований и разработок США (BARDA), до таких недавних инициатив, как «Борьба с устойчивыми к антибиотикам бактериями». Pharmaceutical Accelerator (CARB-X, финансируется BARDA и Wellcome Trust) и Глобальным партнерством по исследованиям и разработкам антибиотиков (GARDP, совместная инициатива Инициативы по лекарствам для забытых болезней и ВОЗ).Механизмы «вытягивания» влекут за собой более радикальную переосмысление самой модели возмещения затрат на антибиотики, которые традиционно продаются (действительно, в прибыльные 1950-е годы, закладывая саму основу современного фармацевтического маркетинга) и возмещаются в зависимости от объема продаж. Такие группы, как DRIVE-AB (финансируемые Инициативой инновационных лекарственных средств) и Центр политики здравоохранения Дьюка-Марголиса, с частично совпадающими ключевыми членами, обратили внимание на необходимость новых моделей финансирования, в которых вознаграждение не связано (в различной степени) с объем продаж антибиотиков, а также включение различных элементов начальных наград (в идеале, пропорциональных стоимости препарата) и обязательных усилий по управлению (rdal et al., 2018; Daniels et al., 2017). Такие модели, хотя по-прежнему отражают лежащий в основе оптимизм в отношении способности фармацевтической промышленности не отставать от гонки вооружений с ошибками, которая восходит к 1950-м годам, тем не менее несут в себе ощущение повышенной срочности и отпечаток недавних опасений по поводу управления, которые были вообще отсутствовал шесть десятилетий назад.
Реальная история создания пенициллина
Открытие пенициллина, одного из первых в мире антибиотиков, знаменует собой настоящий поворотный момент в истории человечества — когда у врачей наконец появился инструмент, который мог полностью вылечить своих пациентов от смертельных инфекционных заболеваний.
Многие школьники могут читать основы. Пенициллин был открыт в Лондоне в сентябре 1928 года. Как гласит история, доктор Александр Флеминг, дежурный бактериолог в больнице Святой Марии, вернулся из летних каникул в Шотландии и обнаружил грязный лабораторный стол и многое другое.
При исследовании некоторых колоний золотистого стафилококка доктор Флеминг заметил, что плесень под названием Penicillium notatum заразила его чашки Петри. Аккуратно поместив чашки под микроскоп, он с удивлением обнаружил, что плесень препятствует нормальному росту стафилококков.
Сэр Александр Флеминг (1881-1955) изучает культуру из пробирки с помощью ручной линзы. Фото Криса Уэра / Getty Images.
Флемингу понадобилось еще несколько недель, чтобы вырастить достаточно привередливой плесени, чтобы он смог подтвердить свои выводы. Его выводы оказались феноменальными: в плесени Penicillium был некий фактор, который не только подавлял рост бактерий, но, что более важно, мог использоваться для борьбы с инфекционными заболеваниями.
Как известно д-р Флеминг об этой красной дате: «Когда я проснулся сразу после рассвета 28 сентября 1928 года, я определенно не планировал произвести революцию во всей медицине, открыв первый в мире антибиотик или убийцу бактерий.Но я думаю, что это именно то, что я сделал ».
Четырнадцать лет спустя, в марте 1942 года, Энн Миллер стала первым гражданским пациентом, успешно прошедшим курс лечения пенициллином. Она лежала при смерти в больнице Нью-Хейвен в Коннектикуте после выкидыша и развития инфекции, приведшей к заражению крови.
Но в этой исторической последовательности событий есть еще кое-что.
На самом деле, у Флеминга не было ни лабораторных ресурсов в Сент-Мэри, ни химического образования, чтобы предпринять следующие гигантские шаги по выделению активного ингредиента сока пенициллиевой плесени, его очистке, выяснению, против каких микробов он эффективен и как использовать Это.Эта задача выпала на долю доктора Ховарда Флори, профессора патологии, который был директором Школы патологии сэра Уильяма Данна при Оксфордском университете. Он был мастером в получении исследовательских грантов от скупых бюрократов и абсолютным волшебником в управлении большой лабораторией, заполненной талантливыми, но необычными учеными.
Эта знаменательная работа началась в 1938 году, когда Флори, который давно интересовался тем, как бактерии и плесень естественным образом убивают друг друга, наткнулся на статью Флеминга о плесени пеницилла, листая некоторые старые выпуски Британского журнала экспериментальной патологии.Вскоре после этого Флори и его коллеги собрались в его хорошо укомплектованной лаборатории. Они решили разгадать науку о том, что Флеминг назвал «антибактериальным действием пенициллия».
Чашка Петри с пенициллином, демонстрирующая его ингибирующее действие на одни бактерии, но не на другие. Фото: Keystone Features / Getty Images.
Одним из самых талантливых сотрудников Флори был биохимик доктор Эрнст Чейн, еврейский немецкий эмигрант. Чейн был резким, резким и остро чувствительным человеком, который постоянно боролся с Флори из-за того, кто заслужил признание за разработку пенициллина.Несмотря на свои сражения, они произвели серию неочищенных экстрактов культуральной жидкости из пенициллий-плесени.
Летом 1940 года их эксперименты были сосредоточены на группе из 50 мышей, которых они заразили смертельным стрептококком. Половина мышей умерла ужасной смертью от тяжелого сепсиса. Остальные, которым вводили пенициллин, выжили.
Именно тогда Флори понял, что у него достаточно многообещающей информации, чтобы испытать препарат на людях. Но оставалась проблема: как произвести достаточно чистого пенициллина для лечения людей.Несмотря на усилия по увеличению урожайности культур плесени, потребовалось 2000 литров жидкости для культивирования плесени, чтобы получить достаточно чистого пенициллина для лечения одного случая сепсиса у человека.
В сентябре 1940 года 48-летний констебль оксфордской полиции Альберт Александер представил первый тестовый пример. Александр порезался, работая в розарии. Царапина, зараженная стрептококками и стафилококками, распространилась на его глаза и кожу головы. Хотя Александра поместили в больницу Рэдклиффа и лечили дозами сульфамидных препаратов, инфекция обострилась и привела к тлеющим абсцессам в глазу, легких и плече.Флори и Чейн услышали об ужасном случае за высоким столом однажды вечером и сразу же спросили врачей Рэдклиффа, могут ли они попробовать их «очищенный» пенициллин.
После пяти дней уколов Александр начал поправляться. Но у Чейна и Флори не было достаточно чистого пенициллина, чтобы искоренить инфекцию, и Александр в конце концов умер.
Лаборант исследует флаконы с культурой пенициллина, взятые Джеймсом Ярчем для журнала Illustrated в 1943 году.
Другой важной фигурой в лаборатории был биохимик д-р.Норман Хитли, который использовал все доступные контейнеры, бутылки и поддоны для выращивания чанов с плесенью пенициллина, откачал жидкость и разработал способы очистки антибиотика. Самодельная фабрика по производству пресс-форм, которую он построил, была настолько удалена, насколько это возможно, от огромных резервуаров для брожения и сложной химической технологии, которые характерны для современного производства антибиотиков сегодня.
Летом 1941 года, незадолго до того, как Соединенные Штаты вступили во Вторую мировую войну, Флори и Хитли вылетели в Соединенные Штаты, где они работали с американскими учеными в Пеории, штат Иллинойс., чтобы разработать средство массового производства того, что стало известно как чудо-наркотик.
Зная, что гриб Penicillium notatum никогда не даст достаточно пенициллина для надежного лечения людей, Флори и Хитли искали более продуктивный вид.
В один жаркий летний день приехала лаборант Мэри Хант с дыней, которую она купила на рынке и была покрыта «красивой золотой плесенью». По счастливой случайности плесень оказалась грибком Penicillium chrysogeum, и она давала в 200 раз больше пенициллина, чем виды, описанные Флемингом.Тем не менее, даже этот вид требовал улучшения с помощью вызывающих мутации рентгеновских лучей и фильтрации, что в конечном итоге произвело в 1000 раз больше пенициллина, чем первые партии из Penicillium notatum.
Пенициллин доказал свою стойкость на войне. На протяжении всей истории главным убийцей в войнах была инфекция, а не боевые травмы. Во время Первой мировой войны уровень смертности от бактериальной пневмонии составлял 18 процентов; во время Второй мировой войны он упал до менее 1 процента.
Это таблица пенициллина в U.Эвакуационный госпиталь С. в Люксембурге в 1945 году. Фото Photo12 / UIG.
С января по май 1942 года было произведено 400 миллионов единиц чистого пенициллина. К концу войны американские фармацевтические компании производили 650 миллиардов единиц в месяц.
По иронии судьбы, Флеминг мало работал с пенициллином после своих первых наблюдений в 1928 году. Начиная с 1941 года, после того как репортеры начали освещать первые испытания антибиотика на людях, невзрачный и мягкий Флеминг прославился как первооткрыватель пенициллина.И, к тихому ужасу Флори, вклад оксфордской группы практически не был учтен.
Эта проблема была частично решена в 1945 году, когда Флеминг, Флори и Чейн — но не Хитли — были удостоены Нобелевской премии по физиологии и медицине. В своей приветственной речи Флеминг дальновидно предупредил, что чрезмерное употребление пенициллина может привести к резистентности бактерий.
В 1990 году Оксфорд восполнил оплошность Нобелевского комитета, присвоив Хитли первую за свою 800-летнюю историю степень почетного доктора медицины.
Возможно, 28 сентября, празднуя великое достижение Александра Флеминга, мы вспомним, что пенициллин также требовал акушерства Флори, Чейна и Хитли, а также целой армии лабораторных работников.
У вас есть вопрос к доктору Маркелю о том, как возник конкретный аспект современной медицины? Отправьте их нам по адресу [email protected].
Конец антибиотиков? | Совет по международным отношениям
ВведениеАнтибиотики столкнулись с экзистенциальным кризисом менее чем через столетие после своего появления.Препараты для борьбы с бактериями становятся менее эффективными из-за чрезмерного использования как людьми, так и животными. В то же время исследования и разработки (НИОКР) новых антибиотиков замедлились до минимума, что поставило мир под угрозу вступления в опасную эру, в которой обычные инфекции неизлечимы.
Подробнее от наших экспертов
Визуализация 2021 года: тенденции, за которыми стоит следитьГлобальное число смертей от лекарственно-устойчивых инфекций, которое, по оценкам, составляет не менее семисот тысяч человек ежегодно, к 2050 году может составить миллионы.Некоторые правительства и международные организации вкладывают миллиарды долларов в решение этой проблемы, но многие аналитики говорят, что ее масштабы и оперативность требуют глобально скоординированного ответа.
Что такое антибиотики?Подробнее на:
Угрозы и пандемии общественному здоровью
Политика и инициативы в области здравоохранения
Инфекционные заболевания
Глобальный
Антибиотики, появившиеся в конце 1920-х годов с открытием пенициллина, представляют собой класс лекарств, используемых для лечения бактериальных инфекций.Они попадают в более крупный класс противомикробных препаратов, который включает лекарства для борьбы с такими микроорганизмами, как вирусы, грибки и паразиты. Антибиотики массово производились во время Второй мировой войны, а их использование резко возросло во второй половине двадцатого века. Разработано более ста антибиотиков.
Почему они так важны?Врачи и медицинские работники полагаются на антибиотики в качестве основного средства лечения распространенных бактериальных инфекций, в том числе ангины, туберкулеза, инфекций мочевыводящих путей и некоторых инфекций, передаваемых половым путем.Лекарства также важны для пациентов, чья иммунная система была ослаблена химиотерапией или серьезным хирургическим вмешательством. «Многое из того, что мы делаем каждый день в больнице, зависит от эффективности антибиотиков», — говорит Кэти Токингтон, эксперт по антибиотикам в Pew Charitable Trusts.
Многое из того, что мы делаем каждый день в больнице, зависит от эффективности антибиотиков.Кэти Токингтон, Pew Charitable Trusts
Антибиотики способствовали значительному снижению глобальной смертности от некоторых типов инфекций.Например, уровень смертности от сифилиса, серьезного кризиса общественного здравоохранения в начале двадцатого века, резко упал после введения пенициллина почти до нуля к 1975 году. В последнее время с 2000 года антибиотики предотвратили более пятидесяти восьми миллионов смертей, связанных с туберкулезом. , по данным Всемирной организации здравоохранения (ВОЗ).
Подробнее от наших экспертов
Визуализация 2021 года: тенденции, за которыми стоит следить Как бактерии развивают устойчивость к антибиотикам?Как и все организмы, бактерии приспосабливаются к окружающей среде и развиваются в ней в процессе естественного отбора.Бактерии, у которых развивается защита от антибиотиков, с наибольшей вероятностью выживут, размножаются и распространяются. Следовательно, чем больше используется антибиотиков, тем больше у бактерий возможностей улучшить свою защиту и тем менее эффективными становятся антибиотики.
Злоупотребляют антибиотиками?
Ежегодно во всем мире потребляются десятки миллиардов доз антибиотиков, большая часть которых, по мнению экспертов в области здравоохранения, расходуется на пациентов с вирусами или другими заболеваниями, которые не поддаются лечению антибиотиками.По оценкам Центров по контролю и профилактике заболеваний (CDC) США, не менее одной трети всех рецептов антибиотиков не требуется. Проблема, вероятно, усугубляется в десятках стран, где антибиотики можно купить без рецепта или в Интернете. В 2015 году ВОЗ обнаружила, что противомикробные препараты доступны без рецепта [PDF] более чем в половине из 133 стран, представивших данные.
Подробнее на:
Угрозы и пандемии общественному здоровью
Политика и инициативы в области здравоохранения
Инфекционные заболевания
Глобальный
Между тем, спрос на антибиотики практически не снижается.В период с 2000 по 2015 год мировое потребление подскочило на 65 процентов [PDF], в основном за счет стран с низким и средним уровнем доходов, особенно Бразилии, Китая и Индии. В некоторых странах по-прежнему назначают антибиотики от «всего, от головных болей и усталости до родов и настоящих бактериальных инфекций», — пишет бывший старший научный сотрудник CFR Лори Гарретт.
Как сельское хозяйство способствует решению проблемы?Антибиотики также назначают животным, особенно животным, выращиваемым на убой на промышленных фермах.По оценкам, на фермы приходится примерно 70 процентов от общего объема продаж антибиотиков в Соединенных Штатах; в некоторых других странах эта доля еще выше.
70 %
Американские антибиотики, которые идут на фермы
Эксперты призывают ветеринаров резервировать антибиотики для больных животных, но заводчики обычно используют эти препараты для предотвращения болезней и ускорения роста животных, увеличивая свою прибыль.Такое чрезмерное использование способствует распространению устойчивых бактерий, которые могут передаваться от животных к человеку через пищевую цепочку и более косвенными путями. Сельскохозяйственная промышленность США часто неохотно сотрудничает с учеными, изучающими, как устойчивость к антибиотикам передается между видами. Однако давление со стороны потребителей заставило некоторые крупные компании, такие как Perdue Farms, ограничить использование антибиотиков.
Какие риски?Врачи и медицинские работники в последние годы бьют тревогу по поводу распространения штаммов бактерий, иногда называемых супербактериями, которые устойчивы ко многим лекарствам или даже ко всем лекарствам на рынке.В отчете за 2019 год CDC классифицировал четыре типа бактерий как «неотложные угрозы». В результате такие инфекции, как пневмония, гонорея и инфекции мочевыводящих путей, становится гораздо труднее лечить. Например, по данным ВОЗ, класс антибиотиков, наиболее часто используемых для лечения инфекций мочевыводящих путей, в настоящее время считается неэффективным более чем для половины пациентов во многих частях мира, а число форм туберкулеза, устойчивых к широко используемым антибиотикам, растет. [PDF].
Пациенты с лекарственно-устойчивыми инфекциями остаются госпитализированными на более длительные сроки; они также с большей вероятностью умрут.Считается, что во всем мире ежегодно не менее семисот тысяч человек умирают от лекарственно-устойчивых заболеваний, вызываемых бактериями и другими микроорганизмами. В Соединенных Штатах число смертей от устойчивых к антибиотикам инфекций оценивается более чем в тридцати пяти тысячах в год, что примерно соответствует годовому количеству погибших в автомобилях. Некоторые аналитики в области здравоохранения говорят, что без усилий по сдерживанию распространения антибиотиков мир вступит в эпоху, когда к 2050 году супербактерии могут убивать до десяти миллионов человек в год.
Устойчивость к антибиотикам и другим противомикробным препаратам также может нанести значительный ущерб мировой экономике. По прогнозам Всемирного банка [PDF], устойчивость к противомикробным препаратам может стоить от 1 триллиона до 3 триллионов долларов в виде потерь продукции ежегодно к 2030 году, при этом бедные страны, вероятно, несут основную тяжесть воздействия.
Ежедневная сводка новостей
Сводка мировых новостей с анализом CFR доставляется на ваш почтовый ящик каждое утро.
Большинство рабочих дней. Новые антибиотики на горизонте?Трубопровод для новых лекарств иссякает; с 1987 года не было открыто ни одного нового класса антибиотиков. Ученые разработали вариации существующих лекарств, но многие говорят, что их недостаточно, чтобы опережать эволюционирующие бактерии и другие микроорганизмы.
Частично это связано с тем, что многие фармацевтические компании в последние десятилетия уклонялись от рынка антибиотиков, который не так прибылен, как рынок лекарств для лечения хронических заболеваний, таких как болезни сердца и диабет.Вдобавок к этому создание новых лекарств стало более трудным, что привело к тому, что многие фармацевтические компании отказались от исследований и разработок антибиотиков в 1990-х годах. «Виды устойчивости, которые вы наблюдаете сейчас, похоже, не поддаются еще одной настройке этого конкретного класса молекул», — сказал бывший руководитель фармацевтического отдела Джон Рекс в интервью корреспонденту PBS NewsHour .
Многие эксперты отмечают особую потребность в лекарствах, которые могут остановить так называемые грамотрицательные бактерии, которые трудно вылечить. Из более чем сорока антибиотиков, находящихся в разработке, только около половины нацелены на грамотрицательные бактерии, которые ВОЗ обозначила как критические.«Этого недостаточно, — говорит Talkington Пью. «Ответ должен соответствовать угрозе».
Что делают правительства для борьбы с сопротивлением?Эксперты в области здравоохранения, международные организации и многие правительства призвали к более скоординированным действиям по регулированию использования антибиотиков и увеличению инвестиций в разработку новых лекарств.
В США администрация Барака Обамы запустила план действий в 2015 году, пообещав выделить более 1 миллиарда долларов на разработку новых антибиотиков, сокращение ненадлежащего использования лекарств и усиление надзора за лекарственно-устойчивыми штаммами.Администрация Дональда Дж. Трампа пообещала продолжить реализацию плана, а начатая в 2018 году инициатива, рассчитанная на год, привлекла обязательства более чем тридцати стран принять меры по борьбе с этой проблемой. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов запретило использование некоторых антибиотиков для стимулирования роста домашнего скота, что привело к дальнейшему сокращению использования этих препаратов в сельском хозяйстве, пик которого пришелся на 2015 год.
Соединенные Штаты также установили партнерские отношения с Великобританией для запуска одной из крупнейших государственно-частных инициатив по борьбе с супербактериями.К середине 2019 года в рамках проекта были вложены более 100 миллионов долларов в перспективные препараты, включая восемь новых классов антибиотиков, половина из которых нацелена на грамотрицательные препараты.
успехов также были сделаны на других форумах. Европейская комиссия поддержала инициативу по оптимизации исследований, проводимых на всем континенте, в то время как страны Группы двадцати (G20) открыли свой собственный исследовательский центр в мае 2018 года. Другое государственно-частное партнерство, спонсируемое Европейским союзом, выделило 700 миллионов евро на разработку антибиотиков. .
Устойчивость к антибиотикам представляет собой классический пример «трагедии общества».Эйдан Холлис и Питер Майбардук
Однако некоторые правительства неохотно вводят правила, опасаясь, что это может нанести ущерб продовольственной безопасности и экономическому росту или сделать жизненно важные лекарства недоступными для миллионов граждан. Однако многие эксперты утверждают, что без принятия густонаселенных стран, таких как Индия и Китай, ограничение использования антибиотиков, усилия в других странах будут подорваны.Обе эти страны приступили к осуществлению национальных планов действий по борьбе с устойчивостью к противомикробным препаратам, наряду с более чем семидесяти пятью другими государствами.
Некоторые аналитики говорят, что требуется глобальный ответ. «Устойчивость к антибиотикам представляет собой классический пример« трагедии общества », — пишут экономист Эйдан Холлис и юрист по правам человека Питер Майбардук. Помимо сокращения ненадлежащего использования и увеличения инвестиций в новые антибиотики, они выступают за международное соглашение, которое расширит доступ к антибиотикам для групп населения с низкими доходами.В 2016 году Генеральная Ассамблея ООН созвала саммит по устойчивости к противомикробным препаратам, ознаменовав самое широкое сотрудничество в борьбе с растущей угрозой.
Устойчивость к антибиотикам
Введение
Антибиотики — это лекарства, используемые для профилактики и лечения бактериальных инфекций. Устойчивость к антибиотикам возникает, когда бактерии изменяются в ответ на использование этих лекарств.
Бактерии, а не люди или животные, становятся устойчивыми к антибиотикам. Эти бактерии могут инфицировать людей и животных, и вызываемые ими инфекции труднее лечить, чем инфекции, вызванные неустойчивыми бактериями.
Устойчивость к антибиотикам ведет к более высоким медицинским расходам, длительному пребыванию в больнице и повышению смертности.
Миру срочно необходимо изменить способ прописывания и использования антибиотиков. Даже если будут разработаны новые лекарства, без изменения поведения, устойчивость к антибиотикам останется серьезной угрозой. Изменения в поведении также должны включать действия по сокращению распространения инфекций посредством вакцинации, мытья рук, более безопасного секса и соблюдения правил пищевой гигиены.
Масштаб проблемы
Устойчивость к антибиотикам поднимается до опасно высокого уровня во всех частях мира.Новые механизмы устойчивости появляются и распространяются по всему миру, угрожая нашей способности лечить распространенные инфекционные заболевания. Растущий список инфекций, таких как пневмония, туберкулез, заражение крови, гонорея и болезни пищевого происхождения, становится все труднее, а иногда и невозможно лечить, поскольку антибиотики становятся менее эффективными.
Там, где антибиотики для людей или животных можно купить без рецепта, возникновение и распространение устойчивости усугубляются. Точно так же в странах, где нет стандартных руководств по лечению, медицинские работники и ветеринары часто назначают антибиотики чрезмерно, а население слишком часто их использует.
Если не предпринять срочных мер, мы вступаем в пост-антибиотическую эру, когда обычные инфекции и легкие травмы снова могут убивать.
Профилактика и контроль
Устойчивость к антибиотикам усиливается из-за неправильного и чрезмерного использования антибиотиков, а также плохой профилактики инфекций и борьбы с ними. На всех уровнях общества можно предпринять шаги для уменьшения воздействия и ограничения распространения сопротивления.
Физические лица
Чтобы предотвратить и контролировать распространение устойчивости к антибиотикам, отдельные лица могут:
- Использовать антибиотики только по назначению сертифицированного медицинского работника.
- Никогда не требуйте антибиотики, если ваш медицинский работник говорит, что они вам не нужны.
- Всегда следуйте советам вашего медицинского работника при использовании антибиотиков.
- Никогда не делитесь и не используйте остатки антибиотиков.
- Предотвратите инфекции, регулярно мыть руки, готовя пищу с соблюдением правил гигиены, избегая тесного контакта с больными людьми, практикуя более безопасный секс и своевременно проводя вакцинацию.
- Готовьте пищу гигиенически, следуя пяти принципам безопасности пищевых продуктов ВОЗ (содержать в чистоте, разделять сырое и приготовленное, тщательно готовить, хранить пищу при безопасной температуре, использовать безопасную воду и сырье) и выбирать продукты, которые были произведены без использования антибиотики для стимуляции роста или профилактики заболеваний у здоровых животных.
Политики
Чтобы предотвратить и контролировать распространение устойчивости к антибиотикам, политики могут:
- Обеспечить наличие надежного национального плана действий по борьбе с устойчивостью к антибиотикам.
- Улучшить надзор за устойчивыми к антибиотикам инфекциями.
- Укрепить политику, программы и меры по профилактике инфекций и борьбе с ними.
- Регулировать и поощрять надлежащее использование и утилизацию качественных лекарств.
- Сделайте доступной информацию о влиянии устойчивости к антибиотикам.
Медицинские работники
Чтобы предотвратить и контролировать распространение устойчивости к антибиотикам, медицинские работники могут:
- Предотвратить инфекции, следя за чистотой ваших рук, инструментов и окружающей среды.
- Назначайте и отпускайте антибиотики только тогда, когда они необходимы, в соответствии с действующими рекомендациями.
- Сообщайте бригадам эпиднадзора об инфекциях, устойчивых к антибиотикам.
- Обсудите со своими пациентами, как правильно принимать антибиотики, резистентность к антибиотикам и опасность неправильного использования.
- Поговорите со своими пациентами о профилактике инфекций (например, вакцинации, мытье рук, безопасном сексе и прикрывании носа и рта при чихании).
Отрасль здравоохранения
Для предотвращения и контроля распространения устойчивости к антибиотикам отрасль здравоохранения может:
- Инвестировать в исследования и разработку новых антибиотиков, вакцин, средств диагностики и других средств.
Сельское хозяйство
Чтобы предотвратить и контролировать распространение устойчивости к антибиотикам, сельскохозяйственный сектор может:
- Только давать антибиотики животным, находящимся под ветеринарным надзором.
- Не использовать антибиотики для стимуляции роста или профилактики заболеваний у здоровых животных.
- Вакцинируйте животных, чтобы снизить потребность в антибиотиках, и используйте альтернативы антибиотикам, если таковые имеются.
- Продвигать и применять передовой опыт на всех этапах производства и обработки пищевых продуктов животного и растительного происхождения.
- Повышение биобезопасности на фермах и предотвращение инфекций за счет улучшения гигиены и благополучия животных.
Последние разработки
Несмотря на то, что в разработке находятся некоторые новые антибиотики, ожидается, что ни один из них не будет эффективен против наиболее опасных форм устойчивых к антибиотикам бактерий.
Учитывая легкость и частоту передвижения людей, устойчивость к антибиотикам является глобальной проблемой, требующей усилий со стороны всех стран и многих секторов.
Воздействие
Когда инфекции больше нельзя лечить антибиотиками первой линии, необходимо использовать более дорогие лекарства. Более длительная продолжительность болезни и лечения, часто в больницах, увеличивает расходы на здравоохранение, а также увеличивает экономическое бремя для семей и общества.
Устойчивость к антибиотикам ставит под угрозу достижения современной медицины.Трансплантация органов, химиотерапия и операции, такие как кесарево сечение, становятся намного более опасными без эффективных антибиотиков для профилактики и лечения инфекций.
Ответные меры ВОЗ
Борьба с устойчивостью к антибиотикам является высокоприоритетной задачей ВОЗ. Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам, включая устойчивость к антибиотикам, был одобрен на Всемирной ассамблее здравоохранения в мае 2015 года. Глобальный план действий направлен на обеспечение профилактики и лечения инфекционных заболеваний с помощью безопасных и эффективных лекарств.
«Глобальный план действий по устойчивости к противомикробным препаратам» преследует 5 стратегических целей:
- Повышение осведомленности и понимания устойчивости к противомикробным препаратам.
- Для усиления надзора и исследований.
- Для снижения заболеваемости.
- Для оптимизации использования противомикробных препаратов.
- Для обеспечения устойчивых инвестиций в борьбу с устойчивостью к противомикробным препаратам.
Политическая декларация, одобренная главами государств на Генеральной Ассамблее Организации Объединенных Наций в Нью-Йорке в сентябре 2016 года, свидетельствует о приверженности мира применению широкого скоординированного подхода к устранению коренных причин устойчивости к противомикробным препаратам во многих секторах, особенно в области здравоохранения. здоровье животных и сельское хозяйство.ВОЗ поддерживает государства-члены в разработке национальных планов действий по борьбе с устойчивостью к противомикробным препаратам на основе глобального плана действий.
ВОЗ возглавляет несколько инициатив по борьбе с устойчивостью к противомикробным препаратам:
Всемирная неделя осведомленности об антимикробных препаратах
WAAW, проводимая ежегодно с 2015 года, представляет собой глобальную кампанию, направленную на повышение осведомленности об устойчивости к противомикробным препаратам во всем мире и поощрение передового опыта среди широкой общественности. медицинских работников и лиц, определяющих политику, чтобы избежать дальнейшего появления и распространения лекарственно-устойчивых инфекций.Противомикробные препараты — важнейшие инструменты, помогающие бороться с болезнями людей, животных и растений. В их состав входят антибиотики, противовирусные, противогрибковые и противопротозойные средства. WAAW проходит ежегодно с 18 по 24 ноября. Раньше лозунг назывался «Антибиотики: обращайтесь с осторожностью», но в 2020 году он был изменен на «Противомикробные препараты: обращайтесь с осторожностью», чтобы отразить расширение масштабов лекарственно-устойчивых инфекций.
Глобальная система надзора за устойчивостью к противомикробным препаратам (GLASS)
Поддерживаемая ВОЗ система поддерживает стандартизированный подход к сбору, анализу и обмену данными, касающимися устойчивости к противомикробным препаратам, на глобальном уровне для информирования принятия решений, стимулирования местных, национальных и региональные действия.
Глобальное партнерство по исследованиям и разработкам антибиотиков (GARDP)
Совместная инициатива ВОЗ и инициативы «Лекарства от забытых болезней» (DNDi), GARDP поощряет исследования и разработки через государственно-частные партнерства. К 2023 году партнерство нацелено на разработку и предоставление до четырех новых методов лечения за счет улучшения существующих антибиотиков и ускорения вывода на рынок новых антибиотиков.
Межучрежденческая координационная группа по устойчивости к противомикробным препаратам (IACG)
Генеральный секретарь Организации Объединенных Наций учредил IACG для улучшения координации между международными организациями и обеспечения эффективных глобальных действий против этой угрозы безопасности здоровья.Сопредседателями МУКГ являются заместитель Генерального секретаря ООН и Генеральный директор ВОЗ, и в ее состав входят высокопоставленные представители соответствующих агентств ООН, других международных организаций и отдельные эксперты из различных секторов.
Антибиотики 1928 — 2000
До чуда
Вспомните последний раз вы порезались или задели себя. Вы можете представить, что порез заразится? с бактериями — так серьезно заражены что ты не мог с этим бороться?
До открытия антибиотиков, никто ничего не мог сделать. Streptococcus pyogenes вызвала половину всех послеродовых смертей и была основной причиной смерти от ожогов. Staphylococcus aureus закончился смертельным исходом в 80% случаев инфицированные раны и бактерии туберкулеза и пневмонии были известны убийцы.
Все изменилось с разработка антибиотиков.
Кто бы мог подумать, что к этому приведет заплесневелая тарелка?
В 1928 году Александр Флеминг, бактериолог в Londons St.Госпиталь Марии, обнаружил, что плесень на выброшенной культуральной пластине оказывал антибактериальное действие. Бактерии были стафилококков, , источник серьезных и часто смертельных человеческих инфекция и плесень — пенициллин.
Пенициллин убивает бактерии, препятствуя росту клеточной стенки (изображение
любезно предоставлено Cellsalive).
Но он не понимал, что он обнаружил — он не имел ни малейшего представления.Его выводы, написанные в 1929 году представил пенициллин как возможное антисептическое средство. Осталось для австралийца Говарда Флори и Эрнст Чейн, еврейский беженец из гитлеровского Берлина, чтобы проанализировать биохимии, доказать его эффективность и доставить пенициллин человечеству.
Золотой век антибиотиков
Первые антибиотики были предписано в конце 1930-х годов, начав великую эру открытий, разработок и рецепт.Бактериальная инфекция как причина смерти резко упала. Между 1944 и 1972 годами ожидаемая продолжительность жизни человека подскочила на восемь лет — рост во многом объясняется введением антибиотиков. Многие эксперты были уверены, что в войне против бактериального инфекции. Действительно, в 1969 году тогдашний главный хирург США Уильям Стюарт (William Stewart) смело сказал Конгрессу США, что пора «закрыть книги по инфекционные заболевания.«
Однако некоторые эксперты неудобно с этими прогнозами, включая Александра Флеминга:
«Наибольшая возможность злом в самолечении является употребление слишком малых доз, чтобы вместо того, чтобы избавиться от инфекции, микробы учат сопротивляться пенициллин и множество организмов, устойчивых к пенициллину, которые могут передаваться другим лицам и от них другим до тех пор, пока они достигают кого-то, кто заболевает сепсисом или пневмонией, у которых пенициллин не могу спасти.«
(New York Times, , 26 июня 1945 г.)
появление устойчивых бактерий
К 1950-м годам, когда антибиотики были еще новыми, появилось достаточно свидетельств возникновения сопротивления. Фактически, через четыре года после появления на рынке пенициллина, поступали сообщения об устойчивых инфекциях.Однако в 1950-х гг. 1960-е годы казалось, что резистентные штаммы бактерий не имеют большого значения. Там Для борьбы с ними всегда разрабатывались новые антибиотики.
Но, к концу 1960-х годов новые классы антибиотиков больше не использовались. развитый. Вместо этого большая часть работы заключалась в небольшом изменении существующих антибиотиков. для снижения токсичности и оживления лекарств, ставших неэффективными из-за появления сопротивления.Фармацевтические компании переключили свое внимание на другое, в другие области, такие как вирусные инфекции. К 1970-м годам устойчивость к пенициллину штаммы одного из наиболее распространенных возбудителей пневмонии, Streptococcus pneumoniae , а также многие венерические заболевания, распространившиеся по Мир.
Совершенно новый класс антибиотик не разрабатывался еще 30 лет.
В конце 1999 г. препарата под названием Zyvox было наконец объявлено.Это новый класс антибиотиков под названием Оксазолидиноны. Утверждается, что он эффективен против мультирезистентности. штаммы бактерий.
Сопротивление к антибиотикам к 2000 г.
Во всем мире сопротивление быстро увеличивается до широко используемых антибиотиков.
Оценка 1999 г. из Австралии топ экспертов устрашает:
«Возникло сопротивление. для всех известных используемых антибиотиков.Для большинства антибиотиков и занятий антибиотиков гены устойчивости к антибиотикам также проникли в бактериальную население в областях, где используются антибиотики (например, в больницах, на фермах и в прудах аквакультуры) »
Использование антибиотиков у животных-производителей пищевых продуктов: устойчивость к антибиотикам Бактерии у животных и людей , Joint Экспертный технический консультативный комитет по устойчивости к антибиотикам (JETACAR) Канберра.Октябрь 1999
И, за границей, опыт
похож. «В 90-е годы мы подошли к определенному моменту, когда некоторые инфекции
что у нас нет доступных [антибиотиков] », — говорит Майкл.
Блюм, врач Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США.
разделение противоинфекционных лекарственных средств.
верх
супербактерий
выжившая инфекция
как бактерии становятся устойчивыми к чему
Можем мы сделать?
: часто задаваемые вопросы об использовании антибиотиков в сельском хозяйстве
ссылки
© 1999 Австралийская радиовещательная корпорация
История антибиотиков и устойчивости к бактериям
В лекции, прочитанной доктором Дж.Джеймс Кассат, наш класс узнал об истории открытия антибиотиков. Хронология началась с пенициллина, открытого Александром Флемингом. После отпуска в Шотландии в 1928 году Флеминг вернулся в свою лабораторию и обнаружил пластинку со стафилококком, оставленную на скамейке. Пластина была загрязнена плесенью, которая, как он предположил, выделяла что-то, убивающее стафилококк. Поскольку извлечь секрет из пластины было трудно, профессора Флори, Чейн и Хитли разработали технику и ресурсы, чтобы сделать это успешно.Это привело к широкому использованию пенициллина для лечения инфекций у солдат Второй мировой войны. 1,3 Пенициллин также положил начало золотому веку открытия антибиотиков. Последовавшие за этим открытия включали пронтозил Герхарда Домагка, который успешно вылечил свою дочь от сепсиса. Советы выделили из почвы стрептомицин, который был первым антибиотиком, активным против туберкулеза. Другим антибиотиком, извлеченным из образца почвы, был тетрациклин, который использовался для лечения лихорадки, кожных и респираторных инфекций. 2 Этот взрыв антибиотиков продолжался примерно до 1990-х годов, когда произошло то, что доктор Кассат назвал «открытием, лишенным антибиотиков». Доктор Кассат считает, что мы, возможно, вступаем во второй золотой век антибиотиков, но они не так широко используются и не приносят такой прибыли, как раньше, из-за явления устойчивости к антибиотикам.
Хотя антибиотики — отличный ресурс для лечения различных инфекций, у микроорганизмов быстро развивается защита или устойчивость к этим лекарствам, что делает их менее эффективными.Основная причина устойчивости к антибиотикам — чрезмерное употребление антибиотиков. 3 Это может произойти спонтанно в результате мутаций. 4 Кроме того, гены наследуются или передаются между неродственными бактериями, что называется горизонтальным переносом генов. 4 Поскольку резистентность распространяется так легко, врачи должны прописывать антибиотики только при необходимости. Однако зачастую это не так. В 2010 году многие штаты США прописывали антибиотики в разы больше, чем население штата. 5 Исследования также показывают, что лечение антибиотиками неверно или ненужно в 30-50% случаев. 3 Согласно прогнозам доктора Кассата, устойчивость к антибиотикам приведет к 10 миллионам смертей к 2050 году. 6 Лучший способ снизить резистентность — не лечить бессимптомные инфекции 4 и исчерпать все другие варианты лечения перед применением антибиотиков.
Главное предупреждение врачей, использующих меньше антибиотиков, — это снижение доходов поставщиков.Доктор Кассат заявил, что многие из этих терапевтических средств находятся на полках больниц только в периодических, необходимых случаях, что приводит к небольшому спросу на продукт. Поэтому фармацевтическим компаниям довольно сложно получать прибыль от лечения антибиотиками. 6 Это мешает компаниям использовать возможности для разработки новых антибиотиков, что приводит к отсутствию прогресса в этой области. Доктор Кассат считает, что академические исследования антибиотиков находятся на уровне второго золотого века. Однако довести эти интересные разработки до клиники сложно из-за того, что компании не хотят идти на финансовый риск.Я полностью согласен с мнением доктора Кассата, что федеральное финансирование и финансирование штата следует использовать для поддержки компаний, стремящихся вывести эти лекарства на рынок, чтобы врачи могли продолжать экономно использовать антибиотики. Таким образом, производство новых антибиотиков будет продолжаться, но мы сможем одновременно замедлить будущую смертность, связанную с устойчивостью к антибиотикам.
- Сенгупта, С., Чаттопадхьяй, М. К., и Гроссарт, Х. П. (2013). Многогранность роли антибиотиков и устойчивости к антибиотикам в природе.Границы микробиологии. Фонд исследований границ. https://doi.org/10.3389/fmicb.2013.00047
- Тетрациклин: Информация о лекарствах MedlinePlus. (нет данных). Получено 13 января 2021 г. с сайта https://medlineplus.gov/druginfo/meds/a682098.html .
- Вентола, К. Л. (2015). Кризис устойчивости к антибиотикам: причины и угрозы. P&T Journal, 40 (4), 277–283. https://doi.org/Статья
- Рид, А. Ф., и Вудс, Р. Дж. (2014). Управление устойчивостью к антибиотикам. Эволюция, медицина и общественное здоровье, 2014 (1), 147.https://doi.org/10.1093/emph/eou024
- Гросс, М. (2013). Антибиотики в кризисе. Текущая биология, 23 (24). https://doi.org/10.1016/j.cub.2013.11.057
- Плакетт, Б. (1 октября 2020 г.). Почему крупная фармацевтическая компания отказалась от антибиотиков. Природа . NLM (Medline). https://doi.

