Келоидные рубцы — причины появления, при каких заболеваниях возникает, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу. Келоидный рубец: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.Келоидный рубец – возвышающееся над поверхностью кожи ярко-красное, бордовое или розовое утолщение, в некоторых случаях сопровождающееся болью, жжением и зудом.
Возникает после механического повреждения кожи, а также как следствие ожогов, татуировок, пирсингов, укусов животных. В редких случаях может формироваться без видимой причины.
Чаще всего келоидные рубцы локализуются в области грудной клетки, на верхних и нижних конечностях, на лице, но практически никогда их нет на ладонях, подошвах, коже век и гениталий.
Келоидные рубцы отличаются от других рубцовых образований кожи тенденцией к быстрому росту с захватом здоровой окружающей ткани. Этот процесс может затягиваться на несколько месяцев и даже лет. В результате краевая зона рубца начинает напоминать «клешни рака». Если келоидный рубец располагается на сгибательных и разгибательных поверхностях, он может сковывать движения.
Разновидности келоидных рубцов
- Истинный (спонтанный) келоид. Возникает на визуально измененной коже и представляет собой одиночное образование плотной консистенции, возвышающееся над уровнем кожи, имеет бледно-розовый цвет, шаровидную форму и различные размеры.
- Ложный келоид. Возникает на любом участке кожи, развиваясь после обширных ожогов, травм или на месте послеоперационных шрамов. Выглядит как красноватый рубец, покрытый тонким слоем кожи.
- Акне-келоид (сосочковый дерматит головы, склерозирующий фолликулит затылка) — хроническое воспаление кожи затылка или задней поверхности шеи, проявляющееся множественными рассеянными конусовидными красно-бурыми папулами (плотными, некрупными возвышениями над поверхностью кожи), которые, сливаясь, образуют бляшку.
 Возникает чаще всего у мужчин.
Возникает чаще всего у мужчин.
- молодые – существуют от 4-5 месяцев до 3 лет и характеризуются активным ростом;
- старые (зрелые) – существуют более 3 лет, могут закончить свой рост или медленно увеличиваться.
Выделяют несколько причин, способных привести к формированию келоидных рубцов:
- Спонтанное возникновение, без видимой причины.
- Последствие механического или химического воздействия (бытовые травмы, ожоги, оперативные вмешательства, акне, воспалительные процессы, укусы животных).
- Длительный прием некоторых лекарственных препаратов: гормональных, цитостатиков (препаратов, используемых для лечения ревматологических и онкологических заболеваний), антикоагулянтов (лекарств, разжижающих кровь), противовоспалительных средств.

- Смуглая кожа. Замечено, что у людей со смуглой кожей присутствует бОльшая предрасположенность к возникновению келоидных рубцов, чем в среднем в популяции.
- Генетические заболевания, связанные с нарушением выработки коллагена, проявляющиеся чрезмерной эластичностью кожи, что чревато нарушением процессов ее восстановления в случае даже незначительного повреждения:
- синдром Эллерса–Данлоса – характеризуется гипермобильностью суставов, повышенной растяжимостью кожи;
- синдром Марфана – наследственное заболевание соединительной ткани, которое проявляется патологическими изменениями со стороны сердечно-сосудистой и костно-суставной систем, а также заболеваниями органов зрения;
- склеродермия – аутоиммунное заболевание, относящееся к группе системных заболеваний соединительной ткани. Проявляется уплотнением кожи, поражением внутренних органов, небактериальным воспалением, повышением продукции коллагена и нарушением микроциркуляции;
- синдактилия – генетическое заболевание, характеризующееся сращением пальцев кистей.

- Эндокринные и иммунные заболевания:
а) поражения надпочечников;
б) нарушение работы щитовидной железы;
в) повышенная выработка иммуноглобулина IgE;
д) сахарный диабет. - Заболевания крови (анемии).
Если келоидный рубец появился после травмы или оперативного вмешательства, следует обратиться к хирургу. При спонтанно возникающих рубцах или их появлении на месте измененной кожи (акне, фурункулов и т.д.) можно обратиться к дерматологу. Если келоидные рубцы формируются у людей с заболеваниями эндокринной системы (сахарным диабетом, ожирением), следует обратиться к терапевту, эндокринологу, гинекологу-эндокринологу. При подозрении на системное поражение организма может потребоваться консультация ревматолога или генетика.
Диагностика и обследования при возникновении келоидных рубцов
Во время сбора анамнеза врач обращает внимание на особенности формирования рубцовой ткани.
- начало формирования через несколько недель или месяцев после полного заживления раны;
- достаточно высокая скорость роста;
- отсутствие тенденции к уменьшению;
- распространение за пределы первоначальной раны;
- невозможность сформировать складку кожи на месте рубца;
- присутствие болезненности, зуда, жжения;
- бугристая и плотная консистенция рубца.
- при подозрении на синдром Эллерса–Данлоса;
I. Оценка работы щитовидной железы:
- УЗИ щитовидной железы;
II. Оценка работы надпочечников:
- УЗИ надпочечников;
III. Диагностика сахарного диабета включает биохимический анализ крови с определением уровня глюкозы крови, мочевины, креатинина.
При повышении уровня сахара крови врач может направить на глюкозотолерантный тест, суть которого заключается в измерении сахара крови натощак и затем через 2 часа после принятия воды с 75 г глюкозы, а также посоветовать сдать кровь для определения уровня гликированного гемоглобина (усвоение глюкозы красными клетками крови).
IV. Расчет индекса массы тела (избыточный вес или дефицит массы тела). ИМТ рассчитывается по формуле: ИМТ = вес (кг) / рост (м2).
В некоторых случаях врач может принять решение о проведении исследований на наличии заболеваний крови, сопровождающихся снижением уровня гемоглобина (анемий). Для этого назначают клинический анализ крови с определением гемоглобина, гематокрита, эритроцитов, тромбоцитов MCV (размер эритроцитов). При отклонении этих показателей от референсных значений проводится дополнительная диагностика с целью установления вида анемии (в большинстве случаев анемия может быть связана или с нарушением усвоения железа крови, или с нарушением усвоения витамина В12). Для диагностики железодефицитной анемии используются следующие показатели: ферритин, ОЖСС, трансферрин, железо сыворотки, отвечающие за перенос и усвоение железа. При подозрении на развитие B12-дефицитной анемии выполняют исследование уровня витамина В12 в крови.
Для диагностики железодефицитной анемии используются следующие показатели: ферритин, ОЖСС, трансферрин, железо сыворотки, отвечающие за перенос и усвоение железа. При подозрении на развитие B12-дефицитной анемии выполняют исследование уровня витамина В12 в крови.Что делать при возникновении келоидных рубцов
Самостоятельно ничего делать не нужно, чтобы не усугубить ситуацию (помним – келоидные рубцы имеют тенденцию к росту, и даже их минимальное травмирование может значительно ускорить этот процесс). Кроме того, желательно отказаться от посещения бань, саун, принятия горячих ванн, поскольку термическое воздействие негативно влияет на рубцовые деформации кожи.
Для коррекции келоидных рубцов существует несколько методов, применение которых зависит от стадии формирования рубца.
На стадии молодого рубца, когда он активно растет, задача состоит в том, чтобы остановить его рост и уменьшить болезненность. Для этого непосредственно в рубцовую ткань вводят кортикостероидные препараты.
Для этого непосредственно в рубцовую ткань вводят кортикостероидные препараты.
Неплохие результаты демонстрирует букки-терапия – облучение рубца гамма-лучами, позволяющее снизить болевые ощущения, чувство стянутости кожи, зуда, замедлить или вовсе остановить рост с последующим побледнением рубца Параллельно могут быть назначены наружные препараты, размягчающие рубцовую ткань.
Для молодых рубцов применяют так называемую терапию давлением (силиконовые пластины, эластичные рулонные и трубчатые бинты и т.д.), добиваясь двойного эффекта – смягчения рубца и его уплощения.
Лечение келоидных рубцов – процесс длительный, требующий тщательного соблюдения всех рекомендаций врача.
На стадии зрелого рубца врач в первую очередь должен убедиться, что его рост закончен и рубцовая ткань ведет себя спокойно. Тогда задача состоит в том, чтобы сделать его менее заметным (полностью убрать келоидный рубец невозможно, поскольку коррекция рубцовой деформации ведется строго в границах рубца, а минимальное воздействие на здоровую окружающую ткань может спровоцировать возобновление роста келоида). Для этого используют лазерную шлифовку или иссечение рубца скальпелем.
Для этого используют лазерную шлифовку или иссечение рубца скальпелем.
Источники:
- Федеральные клинические рекомендации по ведению больных c келоидными и гипертрофическими рубцами. Клинические рекомендации РФ (Россия). Российское общество дерматовенерологов и косметологов. Москва, 2015. 16 с.
- Клинический протокол по диагностике и лечению пациентов с рубцовыми поражениями кожи. Секции СтАР «Ассоциация челюстно-лицевых хирургов и хирургов-стоматологов». Москва, 2014. 40 c.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом
Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Келоидный рубец — симптомы и лечение келоидного рубца в клинике
Келоидным рубцом называют доброкачественное избыточное разрастание грубой волокнистой соединительной ткани. По большому счету, это – один из вариантов кожного шрама, выглядящий еще менее эстетично, чем обычный. Келоидный рубец может иметь шаровидную или неправильную форму.
По большому счету, это – один из вариантов кожного шрама, выглядящий еще менее эстетично, чем обычный. Келоидный рубец может иметь шаровидную или неправильную форму.
Келоиды часто встречаются у темнокожих, но вполне могут появиться и у человека со светлой кожей. Этот вид рубцов часто локализуется на мочках ушей, плечах, груди.
Келоидные рубцы могут появляться после заживления ран на травмированной коже или на коже без внешних изменений. Келоидный рубец может появиться и после заживления гнойного воспаления кожи. Например, фурункула.
Келоид выглядит как выпуклое новообразование с гладкой поверхностью и плотной консистенцией. Цвет келоида находится в промежутке от розового и фиолетового до светло-белого.
Есть пациенты, кожа которых предрасположена к образованию келоидных рубцов. Даже при незначительной травме (укол, укус насекомого, ожог) на месте образовавшегося рубца развивается рубец. Келоидный рубец может появиться и у пациента, не склонного к подобным новообразованиям. К примеру, из-за нарушения процесса заживления ткани, иммунного, гормонального баланса.
К примеру, из-за нарушения процесса заживления ткани, иммунного, гормонального баланса.
Рубец может постепенно расти около двух лет, после чего его размер стабилизируется и остается неизменным, но продолжает доставлять болевые ощущения. Но в некоторых случаях рубец может и не приносить никакого дискомфорта.
Келоидные рубцы безвредны, но портят внешний вид человека. Одной и наиболее подходящих методик борьбы с ними является хирургическое удаление. Операция несложная и обычно хорошо переносится пациентами.
Одной из ведущих причин образования рубцов такого вида врачи называют фактор наследственности.
Наши клиники в Санкт-Петербурге
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Келоид
Что такое келоид?
Это рост избыточной рубцовой ткани в том месте, где ранее произошло повреждение кожи. Келоидные рубцы относят к гипертрофическим. Они могут быть размером больше самого шрама, захватывая здоровую кожу. Этот процесс происходит из-за избыточного синтеза коллагена в месте травмы, источником возникновения келоида считают линию разреза или травмы. Предсказать, возникнет келоидный рубец или нет, достаточно сложно, так как заживление у разных пациентов идет по-разному.
Келоидные рубцы относят к гипертрофическим. Они могут быть размером больше самого шрама, захватывая здоровую кожу. Этот процесс происходит из-за избыточного синтеза коллагена в месте травмы, источником возникновения келоида считают линию разреза или травмы. Предсказать, возникнет келоидный рубец или нет, достаточно сложно, так как заживление у разных пациентов идет по-разному.
Код по МКБ
По международной классификации болезней патологию относят к рубрике L91.0 — “Келоидный рубец”.
Причины возникновения келоида
Келоид возникает после повреждения кожи. Причинами могут быть:
- акне (угри)
- ожоги
- ветряная оспа (ветрянка), опоясывающий герпес
- прокалывание ушей. Келоиды на ушах могут возникнуть даже после незначительных травм, например, после попытки пирсинга. Келоид на носу также чаще всего бывает после прокалывания.
- незначительные царапины, в том числе, причиненные животными
- хирургические вмешательства или травмы
- вакцинация
- татуировки.

Иногда человек может и не вспомнить, какая причина привела к образованию гипертрофического рубца.
На каких участках тела келоиды появляются наиболее часто?
- участки кожи на груди вокруг грудины
- верхняя часть руки, плеча (область дельтовидной мышцы)
- верхняя часть спины
- мочки ушей.
Факторы риска келоидных рубцов
Темнокожие люди более склонны к образованию келоида, чем люди со светлой кожей, чаще эта патология поражает африканцев, жителей Латинской Америки и Юго-Восточной Азии. Подвержена заболеванию молодёжь от 10 до 20 лет, часты случаи семейной патологии.
Симптомы
Келоидные рубцы имеют следующие характеристики:
- возвышаются над кожей
- имеют гладкую, блестящую поверхность
- локализованы на месте, где была травма кожи
- кожа над рубцом чувствительная и чешется, может быть болезненность. Часто возникает раздражение от трения, например, одеждой.
- сам рубец больше размером, чем рана, ему предшествовавшая
- могут быть телесного цвета, розоватого или красного.
 Недавно возникшие рубцы имеют фиолетово-красноватый оттенок, который со временем светлеет.
Недавно возникшие рубцы имеют фиолетово-красноватый оттенок, который со временем светлеет. - если в течение первого года после образования рубца на него попадали солнечные лучи, то загар в месте келоида будет темнее, чем на здоровой коже.
- обычно плотные на ощупь, имеют консистенцию резины. Келоид после пирсинга уха может быть в виде мягких комочков.
Обычно келоиды не опасны и не наносят вреда здоровью, однако ухудшают внешний вид кожи. Со временем образования могут стать меньше, тоньше и не такими заметными, как в начале.
Диагностика
Обычно для постановки диагноза достаточно осмотра врачом-дерматологом. Иногда специалист может рекомендовать биопсию (исследование фрагмента кожи под микроскопом) для исключения других типов кожных новообразований. При электронной микроскопии видно, что коллагеновые волокна в рубце расположены случайно в плотном соединительнотканном матриксе. В обычных, не гипертрофированных рубцах они расположены параллельно поверхности кожи.
Лечение
Лечение келоида проводит дерматолог, пластический хирург. Вмешательство нужно, если шрамы
- имеют неприятный вид и пациент хочет их уменьшить
- зудят или болят
- ограничивают движения.
Консервативные методы лечения
Терапевтические методы не могут полностью избавить пациента от рубцов, но могут сделать их менее заметными. Применяют:
- Инъекции кортикостероидов. Для этого рубец обкалывают препаратом для уменьшения объема и сглаживания поверхности. Обычно делают три инъекции с интервалом в 4-6 недель. Если нет улучшения, лечение продолжают до нескольких месяцев.
- Силиконовые гели и накладки. Их продают в аптеках и используют во время заживления (не для открытых ран), чтобы уменьшить красноту и попытаться уменьшить выработку коллагена. Особенно эффективны после ожогов и пересадки кожи. Для получения эффекта гели нужно наносить не менее, чем на 12 часов каждый день в течение минимум 3 месяцев. Накладки давят на шрам, не давая ему разрастаться, их используют 24 часа в сутки в течение 6-12 месяцев.

Удаление келоидов
Хирургическая операция может улучшить внешний вид кожи. С её помощью можно изменить расположение и форму шрама, удалить плотную рубцовую ткань, которая мешает движениям. Но операция, в свою очередь, может оставить шрам, который будет заметен до 2 лет. Кроме того, хирургическое лечение может вызвать еще более интенсивный синтез коллагена и разрастание келоида.
Часто проводят комплексную терапию — удаляют рубец и сразу начинают лечение инъекциями кортикостероидов, чтобы предупредить избыточный рост ткани.
Для хирургического лечения используют:
- криотерапию (замораживание)
- лазерное лечение
- иссечение с помощью скальпеля
- лучевую терапию. Низкие дозы поверхностной радиотерапии назначают только в самых тяжелых случаях, так как возможны серьезные побочные эффекты.
Применение антигистаминных средств, препаратов ретиноевой кислоты, витамина А, витамина Е, цинка, верапамила не показало выраженного эффекта. Возможна терапия интерферонами, так как эти препараты тормозят синтез коллагена фибробластами. В исследованиях выявлено уменьшение высоты рубца на 30% при введении в него интерферона трижды в неделю в течение 3 недель. К сожалению, эта терапия сопряжена с высоким риском побочных явлений: гриппоподобного эффекта, лихорадки, болезненности во время инъекций.
Возможна терапия интерферонами, так как эти препараты тормозят синтез коллагена фибробластами. В исследованиях выявлено уменьшение высоты рубца на 30% при введении в него интерферона трижды в неделю в течение 3 недель. К сожалению, эта терапия сопряжена с высоким риском побочных явлений: гриппоподобного эффекта, лихорадки, болезненности во время инъекций.
Профилактика
Если была травма кожи, то не стоит подвергать это место действию солнечных лучей. Перед выходом на улицу стоит накрыть место повреждения лейкопластырем или использовать солнцезащитные средства c SPF не ниже 15.
Для взрослых защита места травмы должна быть минимум 6 месяцев, а для детей — не менее 18 месяцев.
После оперативных вмешательств для профилактики могут быть использованы мази, например, имиквимод (алдара). Иногда может помочь смазывание свежего рубца увлажняющими кремами.
Наталия ЗакураеваИсточники
- Scheiba N., Hartschuh W. [Atypical keloids with an unusual myofibroblastic differentiation in a patient with acne vulgaris].
 // Hautarzt — 2021 — Vol — NNULL — p.; PMID:33904964
// Hautarzt — 2021 — Vol — NNULL — p.; PMID:33904964 - Asai M., Koike Y., Kuwatsuka Y., Yagi Y., Kashiyama K., Tanaka K., Mishima H., Yoshiura K., Utani A., Murota H. Multifaceted array-based keloidal gene expression profiling reveals specific MDFI upregulation in keloid lesions. // Clin Exp Dermatol — 2021 — Vol — NNULL — p.; PMID:33899950
- Cannistrà C., Al-Shaqsi Y. Peri-areolar double-pedicle technique in the treatment of iatrogenic gynecomastia. // Saudi Med J — 2021 — Vol42 — N5 — p.574-577; PMID:33896789
- Chao K., Elsensohn AN., Singh G., Brian Jiang SI. Suture Materials and Techniques for Optimal Cutaneous Wound Cosmesis: A Systematic Review. // J Am Acad Dermatol — 2021 — Vol — NNULL — p.; PMID:33892012
- Lyu KY., Xia ZF. [Deliberation on the similarities and differences of the diagnosis and treatment of scars and keloids in China and Japan]. // Zhonghua Shao Shang Za Zhi — 2021 — Vol37 — N4 — p.306-311; PMID:33887880
- Coles M., Uy P., Madray V.
 , Yap JE., Sridhar S. The Off-Label Use of a Lumen-Apposing Metal Stent (LAMS) for a Benign Colon Anastomotic Stricture Causing Recurrent Bowel Obstruction in a Patient with Keloids. // Case Rep Gastrointest Med — 2021 — Vol2021 — NNULL — p.5595518; PMID:33884206
, Yap JE., Sridhar S. The Off-Label Use of a Lumen-Apposing Metal Stent (LAMS) for a Benign Colon Anastomotic Stricture Causing Recurrent Bowel Obstruction in a Patient with Keloids. // Case Rep Gastrointest Med — 2021 — Vol2021 — NNULL — p.5595518; PMID:33884206 - Falay Gür T., Savaş Erdoğan S., Kara C., Ertekin SS. Subcutaneous emphysema after intralesional cryotherapy: An unusual complication. // J Cosmet Dermatol — 2021 — Vol — NNULL — p.; PMID:33876565
- Jia CY., Chen LX. [Looking at the essence through the phenomenon: the tumor characteristics of keloid]. // Zhonghua Shao Shang Za Zhi — 2021 — Vol37 — NNULL — p.1-5; PMID:33874707
- Hsieh JC., Maisel-Campbell AL., Joshi CJ., Zielinski E., Galiano RD. Daily Quality-of-life Impact of Scars: An Interview-based Foundational Study of Patient-reported Themes. // Plast Reconstr Surg Glob Open — 2021 — Vol9 — N4 — p.e3522; PMID:33868874
- Bi S., Liu R., Wu B., He L., Gu J. Bioinformatic Analysis of Key Genes and Pathways Related to Keloids.
 // Biomed Res Int — 2021 — Vol2021 — NNULL — p.5897907; PMID:33860039
// Biomed Res Int — 2021 — Vol2021 — NNULL — p.5897907; PMID:33860039
Лечение келоидных рубцов | Государственный научный центр лазерной медицины им. О.К. Скобелкина
Лечение келлоидных рубцов лазером
После механического повреждения кожи зачастую остается рубец. Со временем он белеет и становится менее заметным. Однако бывают случаи, когда соединительная ткань разрастается и образуется келоидный рубец. К сожалению, причины возникновения келоидов до сих пор не изучены и остаются важной проблемой для дерматологов, косметологов и пластических хирургов. Келоидные рубцы развиваются у мужчин и женщин в разном возрасте.
Существуют участки тела, где чаще других формируются келоиды. В 90 % случаев это грудина, верхняя треть плеча и носогубный треугольник. Если возможно удалить рубец хирургически, а пластика келоидных рубцов значительно отличается от стандартной хирургической техники, то вторым этапом проводится курс физиотерапии и мезотерапии. В некоторых случаях комбинируется применение селективных лазеров, буку-терапии или интрарубцовые инъекции глюкокотикоидов. Но все манипуляции проводятся под строгим контролем врача. Если по каким-то причинам пациент прерывает курс лечения, результаты могут оказаться хуже, чем исходная проблема. Поэтому хороших результатов можно добиться только при взаимном сотрудничестве врача и пациента.
Но все манипуляции проводятся под строгим контролем врача. Если по каким-то причинам пациент прерывает курс лечения, результаты могут оказаться хуже, чем исходная проблема. Поэтому хороших результатов можно добиться только при взаимном сотрудничестве врача и пациента.
С келоидными рубцами очень часто путают гипертрофические. Келоид отличается тем, что он имеет тенденцию к постоянному росту соединительной ткани и, как правило, вырастает в размерах больше чем разрез на коже. Гипертрофические рубцы, увеличиваясь до определенных размеров, даже без специального лечения через 6-12 месяцев уплощаются и бледнеют. Поэтому для эффективного лечения большое значение имеет правильная диагностика рубцов.
Для того чтобы назначить правильное лечение келоидных рубцов, необходимо поставить верный диагноз. Основная задача врача-дерматолога – дифференцировать гипертрофический рубец. Внешне разные виды рубцов схожи, однако келоид постоянно растет в отличие от гипертрофического рубца, который увеличивается до определенного размера и со временем бледнеет. Излюбленное место локализации келоидных рубцов – грудная клетка, ушные раковины, шея, плечи, суставы, лицо. По стадии развития келоидные рубцы делятся на молодые (3месяца – 5лет), которые имеют красно-бордовый цвет и гладкую блестящую поверхность, и старые (5–10лет) – более бледные, с неровной поверхностью.
Причины возникновения такой проблемы:
- наследственная предрасположенность;
- нарушения работы нервной, иммунной, эндокринной систем;
- возрастные изменения.
Отличительные признаки:
- повышенная чувствительность и болезненность в месте повреждения;
- гиперемия кожи;
- чёткая граница области повреждения;
- размер рубца больше, чем рана на коже;
- постоянный рост соединительной ткани с наплывом на здоровые области.
Лечение келоидных рубцов в нашем центре
В Государственном научном центре лазерной медицины проводится комплексное лечение келоидных рубцов для достижения максимального терапевтического эффекта. Курс восстановительных процедур назначается после постановки диагноза и изучения истории болезни пациента.
Хирургическое удаление келоида малоэффективно, к тому же механическое повреждение ткани стимулирует рост коллагена и способствует повторному разрастанию рубца.
Сегодня есть возможность избавиться от рубцов с помощью прогрессивных методов. Коллоидный рубец, лечение которого занимает 6–12 месяцев, подвергается воздействию лазера. Приходите в наш центр, и опытные специалисты помогут вам избавиться от рубцов с помощью современной аппаратуры с использованием самых новых технологий и медицинских препаратов без рецидивов. Лечение келлоидных рубцов лазером в комплексе с введением кортикостероидных препаратов дает очень хороший результат.
Келоидный рубец — причины, симптомы, диагностика и лечение
Келоидный рубец – это ограниченное доброкачественное разрастание соединительной ткани, чаще возникающее после травм, термических и химических ожогов кожи, акне. Клиническая картина характеризуется образованием плотного, красного рубцового валика, наличие которого иногда сопровождается зудом, жжением, локальным повышением температуры. Диагностика основывается на клинической картине, анамнезе заболевания и дифференциации с гипертрофическими рубцами. Лечение келоидов включает глюкокортикоиды в различных формах, крио- и лазеротерапию, массаж, компрессионные повязки, интерфероны, хирургическое иссечение.
Общие сведения
Келоидный рубец – одна из разновидностей патологических рубцов, относится к группе псевдоопухолевых фиброматозов. Из всех видов рубцов келоид занимает второе место по распространённости (после гипертрофического рубца) среди европейцев и первое место среди населения южно-африканских стран. Точных статистических данных нет. Это связано с низким количеством обращений пациентов к врачу при отсутствии прогрессивного разрастания и выраженной клинической картины. К образованию келоидных рубцов более склонны мужчины, что связано с повышенной частотой получения травм, а также лица с гормональными нарушениями.
Келоидный рубец
Причины
Этиологические факторы возникновения келоидов разнообразны. Основными причинами являются хирургические вмешательства, ожоги, однако триггером возникновения рубца у предрасположенных лиц может послужить даже микротравма. Развитию келоидов также способствуют некоторые кожные заболевания (прежде всего, акне), протекающие с воспалением глубоких слоев кожи и грубым рубцеванием. Нередко рубцовая ткань формируется в местах инъекций, татуировок, пирсинга, особенно в случае их осложнения нагноительным процессом. Среди предрасполагающих факторов наибольшее значение играют:
- Наследственность. На наличие генетической предрасположенности указывает семейная распространённость (склонность к образованию келоидов передаётся по аутосомно–доминантному типу), большое количество зарегистрированных случаев врождённых келоидов, а также повышенная заболеваемость у лиц африканского и азиатского происхождения.
- Гормональный дисбаланс. У лиц, склонных к келоидному рубцеванию, достоверно чаще выявляется нарушение показателей функционирования желез внутренней секреции (щитовидных, паращитовидных, половых). Наибольшее влияние оказывают кортикостероиды, поэтому патологическое рубцевание часто можно наблюдать у спортсменов, употребляющих анаболические стероиды. Вторым по частоте влияния гормоном является прогестерон – с ним связано увеличение риска образования келоидов при беременности. Келоидные рубцы чаще выявляются у людей со смуглой кожей, что позволяет связать их появление с нарушением синтеза меланина.
Патогенез
Механизм келоидного рубцевания достоверно не установлен, однако известно, что келоид является результатом нарушения процесса нормальной регенерации кожи. Для келоидного рубца характерно разрастание плотной соединительной ткани шире первоначальных границ раны. По всей видимости, это обусловлено избыточной выработкой фибробластами коллагена I типа и его чрезмерным сосредоточением в зоне рубца. При патоморфологическом исследовании в рубцовой ткани обнаруживаются широкие гиалинизированные пучки коллагена тускло-розового цвета. Существует ряд исследований, которые доказывают наличие взаимосвязи нервно–эндокринной нарушений и частоты возникновения келоидных рубцов. В норме по мере созревания рубцовой ткани происходит уменьшение ангиогенеза, но в келоидах идет постоянное образование неососудов, что обусловливает их гиперемию.
Классификация
Все рубцы разделяют на нормотрофические, гипертрофические, атрофические и келоидные. Для первых трёх типов характерно стадийное формирование, светлый цвет при окончательной трансформации (цвет нормальной кожи), положительный и хороший ответ на терапию. Келоидный рубец отличается от остальных патогенезом, быстрым и неконтролируемым ростом, трудностями в лечении. В клинической дерматологии келоиды делятся на:
- Истинные (спонтанные). Образуются без видимых причин, однако, считается, что им может предшествовать микротравма, разрешившиеся гнойничковые высыпания. Излюбленная локализация – лицо и грудь. Истинные келоиды часто имеют причудливую форму с ветвящимися отростками, отходящими от основного рубца.
- Ложные (рубцовые). Возникают на месте поврежденной кожи после операций, порезов, ожогов, фурункулов, акне. Не имеют определенной локализации. Форма ложных рубцов линейная, кожа над ними склонная к изъязвлению.
- Келоидный фолликулит (келоид акне). Встречается у мужчин. Представляет собой фолликулярный дерматит волосистой части головы. Высыпания (папулы и пустулы) обычно располагаются в области затылка.
По стадии развития келоиды подразделяются на активные (растущие) и неактивные. Активный келоид находится в процессе роста и вызывает такие симптомы, как зуд, иногда переходящую в боль, онемение, гиперемию. Неактивный келоид не растёт и не беспокоит. По сроку давности рубцы классифицируют на молодые и старые. Молодым рубцам менее 5 лет, они имеют красный цвет и блестящую поверхность. Старые рубцы старше пяти лет, их окраска приближается к цвету кожи, а поверхность неровная.
Симптомы келоидных рубцов
В области предшествующей травмы или спонтанно возникает чётко ограниченное, плотное, бугристое разрастание келоидной ткани. Рубец синюшно-красного цвета, толстый, зудящий. Покрывающая келоид кожа атрофически истончена, не содержит потовых и сальных желёз, волосяных фолликулов и пигментных клеток, т. е. этот участок кожи никогда не загорает, на нем не растут волосы. Иногда наблюдаются телеангиэктатически расширенные сосуды.
Келоиды отличаются неудержимым ростом и распространением на здоровые участки кожи. Их рост начинается после 10–12 недели заживления, площадь распространения рубцовой ткани намного больше, чем полученная рана. Спонтанные келоиды особенно часто локализуются на лице шее, верхней части туловища, в частности, в области грудины. Наиболее типичные жалобы пациентов с келоидами ‒ неприятные ощущения в области рубца: боль при надавливании, повышенная чувствительность к различным раздражителям, назойливый зуд, иногда переходящий в невропатическую боль.
Осложнения
По мере увеличения глубины и размера рубца возрастает вероятность развития системных нарушений из-за гипертрофии соединительной ткани. На месте некоторых ран впоследствии образуются выраженные контрактуры, имеющие значительные функциональные и эстетические последствия. При наличии предрасположенности к патологическому рубцеванию на месте удаленного келоидного рубца может образовываться новый келоид, который быстро увеличивается в размерах и занимает ещё большую площадь.
Диагностика
Постановка диагноза не представляет особых трудностей и опирается на клинику и анамнез заболевания. Из базовых лабораторных данных исследуют гормональный статус и липидный профиль, которые могут быть изменены. Келоидные рубцы следует отличать от гипертрофических: последние обычно толстые, плотные, белые, с бугристой поверхностью, нередко с поперечными трещинами, возникаю при отсутствии генетической предрасположенности после травм или операций, в отличие от келоидных, не выходят за пределы первичного дефекта. Важным отличием гипертрофических рубцов является их отклик на лечение: хирургическая эксцизия даёт стойкий удовлетворительный косметический результат.
Лечение келоидных рубцов
Келоиды трудно поддаются терапии. Для того чтобы определить глубину, распространённость и способ лечения, необходима консультация хирурга и дерматолога. Грамотный план действий, включающий правильный выбор терапевтической тактики, учет предрасполагающих этиофакторов и эмоциональную поддержку, способствует оптимальным результатам. В отношении келоидов используются следующие виды лечения:
- Местная медикаментозная терапия. До образования корки на рубце можно использовать заживляющие мази и крема на основе пантенола. После формирования келоида в течение нескольких недель или месяцев наносится силиконовый крем или накладывается силиконовый пластырь. Силикон создаёт воздухопроницаемую мембрану, которая благоприятна для регенерации кожи. В случае свежих келоидов достигнуть ремиссии можно, применяя местно глюкокортикоиды либо в форме мазей под окклюзией, либо (что эффективнее) в форме внутриочаговых инъекций кристаллической суспензии.
- Физические методы. Широко используемым безопасным и безболезненным методом является лазерная шлифовка рубца. Лазерная терапия уменьшает размер рубца, снимает красноту и предотвращает повторный рост. При удобном анатомическом расположении келоида можно достичь некоторого регресса с помощью компрессионной повязки. Криотерапия используется только при лечении небольших рубцов на закрытых участках тела, поскольку достаточно болезненна и вызывает депигментацию кожи. Лечение жидким азотом проводится в несколько циклов (до 5 сеансов), чаще применяется в комбинации с другими методами.
- Массаж рубца. Ограниченные плотные келоидные тяжи можно размягчить регулярным массажем. Наиболее актуален данный вид лечения в районе суставов: как только рубец становится стабильным (через 3-4 недели), необходимо противодействовать укорачиванию рубцовой ткани массажем. Не используется в случае инфицирования и при прогрессивном росте рубца (более 1 см в неделю).
- Хирургическое лечение. От хирургических вмешательств рекомендуется воздержаться, после иссечения рубца чаще всего следует образование нового келоида, особенно, если во время операции затрагивают здоровую ткань. Поэтому следует проводить только частичные эксцизии, а затем инъекции глюкокортикоидов или криотерапию, иногда рентгеновское облучение.
- Особые методы лечения. В дерматологии лечение интерферонами и лучевой терапией используют в редких случаях из-за системного воздействия на организм. Несмотря на то, что при применении интерферона келоид уменьшается в размере, нет сведений о продолжительности эффекта. Лучевая терапия используется исключительно при крайней необходимости, т. к. увеличивает риск возникновения злокачественных новообразований.
Прогноз и профилактика
Прогноз зависит от объёма и местоположения рубца, состояния организма (наличия патологий со стороны эндокринной и нервной системы), предрасположенности к распространению, быстрой диагностики и грамотной комбинации различных видов терапии. Профилактика включает в себя предотвращение ожогов, грамотное и раннее лечение угревой болезни, щадящие хирургические разрезы, возможное ограничение инъекций и пирсинга. При наличии данной патологии у родственников стоит исключать вышеперечисленные факторы и защищать себя от всевозможных микротравм, которые могут послужить пусковыми механизмами в развитии рубцов келоидного типа.
Как избавиться от келоидного рубца
Иногда после операции или травмы остается некрасивый рубец, со временем он может увеличиться и доставлять дискомфорт, зуд и боль. Такой рубец называют келоидным. Его можно удалить хирургическим путём. О том, как проходит операция и кому она показана, рассказал врач-хирург, заведующий Центром амбулаторной хирургии и эндоскопии клиники «РИТМ» МункуевЧимитБаторович.
Почему растет рубец
Келоидный рубец возникает из-за неконтролируемого роста дермы на месте повреждения кожи. Такой процесс может случиться у тех людей, у которых в организме повышенное содержание фермента, отвечающего за выработку коллагена. Повлиять на формирование келоида может также избыточное потребление протеина, например, при спортивном питании или чрезмерное употребление мясной пищи.
После травмы, ожога, пирсинга или операциисначала появляется гипертрофический рубец, а затем он может переродиться в келоидный.Рост такого рубца начинается после 10 или 12 недели заживления, при этом площадь распространения рубцовой ткани намного больше, чем полученная рана. Спонтанные келоиды особенно часто находятся на лице, шее, верхней части туловища, в частности, в области грудины.
Как правило, такой рубецдоставляют своему владельцу неприятные ощущения: зудится или болит. Цвет рубца бывает красно-синюшным. Покрывающая келоид кожа может быть атрофически истонченной, не содержит потовых и сальных желез, волосяных фолликулов и пигментных клеток, эта область кожи никогда не загорает, и на ней не растут волосы.
Рубец нужно лечить
В первую очередь рубец нужно лечить, если его просто иссечь, то вероятность рецидива в этом месте очень высока. Вот почему так важно пройти терапевтическое лечение у дерматолога. Оно может включать в себя локальную терапию, когда на место рубца накладываются компрессионные повязки, или медикаментозное лечение. В этом случае врач прописывает мази, гели и лекарственную терапию с введением под кожу в месте образования рубца глюкокортикостероидов. Эти гормоны способствуют обратному развитию келоидной ткани и, соответственно, уменьшению рубца.
Когда келоид нужно удалять
При неэффективности терапевтического лечения, когда сохраняется объем рубца, в дело вступают хирурги. Мы иссякаем эти образования всегда по линии напряжения кожи, а края раны стягиваем тонкими швами. После операции останется едва заметный рубчик.
В послеоперационный период назначается профилактическое лечение. В него входит физиотерапия и введение инъекций. При электрофорезе специальные прокладки пропитывают препаратами, затем в каждой из них фиксируется электрод. Их помещают на проблемную зону на несколько минут. Так как разряды тока малы, человек чувствует лишь легкое покалывание в области рубца.
Физиопроцедуры, как и все лечение, должен назначать врач. В некоторых случаях тот же электрофорез может усилить рост келоидного рубца.
симптомы и отличия от гипертрофических рубцов. Устранение келоидных шрамов
Келоиды — одна из медицинских загадок. Кажется удивительным, но даже сейчас, в 21-м веке, наука не может точно сказать, откуда берется келоидный рубец и из-за чего он может возникнуть. Есть предположения, есть даже способы бороться. Но однозначного понимания, почему возникает келоидная болезнь, нет.
Говоря совсем коротко, келоид – это разрастание соединительной ткани. Соединительная ткань, как правило, разрастается в случае заживления раны – и может делать это тремя способами.
Первый вариант – нормальное рубцевание, при котором образуется плоский рубец. Он не выступает над уровнем кожи, не содержит сосудов, безболезнен и рассасывается сам за 7-10 дней.
Второй вариант – так называемый гипертрофический рубец. Он возвышается над кожей (отсюда и название), но область рубца ограничивается краем раны.
Наконец, третий вариант – келоидный рубец.
Симптомы келоидов
Гипертрофические и келоидные рубцы можно объединить тем, что и те и другие возвышаются над кожей и заметны, но различий между ними больше.
| Гипертрофический рубец | Келоидный рубец | |
|
Ограничивается краем раны, не разрастается, размеры рубца не изменяются или уменьшаются со временем |
Не ограничивается краем раны, разрастается, иногда прорастает в соседние, неповрежденные ткани. Келоидный шрам может в несколько раз превышать размер ранки, на месте которой он образовался | |
|
Нормальный цвет |
Краснота или синюшность | |
|
Безболезненный |
Часто сопровождается болевыми ощущениями, зудом | |
|
Рассасываются сами, хоть и медленнее, чем нормальные рубцы |
Сами не рассасываются, возможно озлокачествление рубца | |
|
Стягивает кожу |
Не стягивает кожу |
Итак:
- если рубец, разрастаясь, захватывает здоровые ткани,
- не рассасывается самостоятельно,
- а при росте рубца вы испытывает зуд или даже боль – все это верные признаки, что перед нами келоидные образования. Стоит помнить также, что келоидные рубцы выделяются на коже контрастным цветом, и могут иметь различную форму.
В медицине келоидные рубцы принято подразделять на два вида: молодые и застарелые. Первые активно растут, имеют яркий цвет, гладкую, блестящую поверхность. Поверхность вторых морщинистая, цвет более бледный, они мягкие и практически не развиваются.
Видео
Как определить келоидный рубец, или нет
Когда появляются келоиды
Как и остальные рубцы, келоиды могут возникнуть на теле или лице после перенесенных хирургических операций, как следствие ожогов, порезов, как «память» о перенесенных заболеваниях, таких как ветрянка. Часто келоидная ткань разрастается на мочках ушей или вокруг губ: причиной становится сделанный пирсинг, татуаж, швы от операций, даже укусы насекомых.
Комментарий эксперта:
Вреден ли келоидный рубец
Принято считать, что сам по себе келоидный рубец не причиняет вреда организму, и достаточно просто скрыть его. Однако мало кто из мучающихся от келоидной болезни с этим согласится: келоид — это болезненное образование.
Лечение келоидов ни в коем случае нельзя начинать самостоятельно. Так называемые «народные методы» являются абсолютным противопоказанием. Любое непрофессиональное вмешательство провоцирует их разрастание.
Впрочем, для тех, кто любит лечиться самостоятельно, у нас есть хорошие новости: келоиды – одно из тех заболеваний, при лечении которых врач бессилен без активного участия пациента.
Если у вас обнаружен и удален келоидный рубец, то профилактика рецидивов зависит почти полностью от ваших усилий: нельзя загорать, посещать сауну, принимать горячие ванны. А вот здоровый образ жизни, то есть правильное питание, спорт, закаливание – очень полезны в том числе и для профилактики келоидов.
Записаться на консультацию пластического хирурга и получить дополнительную информацию вы можете по телефонам:
в Москве +7 495 723-48-38, +7 495 989-21-16
в Казани +7 843 236-66-66.
Запишитесь на прием онлайн, чтобы получить 30% скидку на консультацию. Чтобы сэкономить на процедурах, вы можете купить сертификат клиники и оплачивать любые процедуры со скидкой 10%.
Что такое келоиды? Симптомы, причины, диагностика, лечение и профилактика
Келоиды обычно не нуждаются в лечении. Но лечение может быть полезным, если келоидный рубец вызывает дискомфорт или затрудняет движения (например, если он покрывает сустав или большую площадь). Люди также могут обратиться за лечением келоидного рубца, если шрам влияет на их самооценку и на то, как они относятся к своей внешности. Например, если шрам большой или расположен на очень заметном месте на вашем теле, ваш врач может помочь вам найти способы уменьшить размер и выступить келоидом.
Не существует одного метода лечения, который лучше всего подходит для всех келоидов. Дерматологи обычно подбирают лечение индивидуально, исходя из таких факторов, как возраст и тип келоида. Келоиды трудно полностью удалить, и использование более одного типа лечения часто улучшает результаты. Поэтому дерматологи часто рекомендуют своим пациентам два или более лечения.
Варианты лечения келоидных рубцов включают:
- Криотерапия Это лечение, которое лучше всего работает с небольшими келоидами, включает замораживание келоидов изнутри.Этот метод часто используется до или после инъекций кортикостероидов, чтобы сделать инъекции более эффективными, сообщает AAD.
- Терапия давлением Это включает использование устройства или специальной одежды для оказания давления на область и уменьшения притока крови к участку, чтобы предотвратить повторный рост келоида. Несмотря на то, что это эффективное лечение, которое часто используется после операции, многим людям может быть трудно придерживаться его. Эти устройства могут быть неудобными, и людям необходимо носить их от 6 до 12 месяцев.
- Лучевая терапия Лечение низкими дозами облучения после операции может помочь предотвратить повторное отрастание рубца.
- Лазерная терапия Эта процедура использует высокоэнергетические световые лучи, чтобы уменьшить размер и осветлить цвет келоида. Лазерная терапия обычно сочетается с другими видами лечения, такими как инъекции кортикостероидов или терапия давлением.
- Силиконовые гели и пластыри Эти процедуры на основе силикона помогают сгладить и уменьшить размер и цвет шрамов.
- Лигатура Ваш врач может решить использовать хирургическую нить для обвязки келоида, которая перекрывает кровоснабжение, так что келоид естественным образом отпадет через некоторое время.
- Хирургия Хирургия обычно сочетается с другими видами лечения, такими как инъекции кортикостероидов или лечение силиконом; это потому, что почти в 100% случаев келоиды отрастают после хирургического удаления, согласно данным AAD.
- Инъекции кортикостероидов Эти инъекции вводятся в келоид, чтобы уменьшить воспаление и сузить кровеносные сосуды, что может помочь уменьшить отек, зуд или болезненность.
- Фторурацил Этот химиотерапевтический препарат, который обычно используется для лечения рака, может использоваться вместе с кортикостероидами.
Хотя на рынке есть ряд продуктов, которые заявляют, что они эффективны для профилактики или лечения келоидов, не так много исследований, которые предоставили бы убедительные доказательства в поддержку этих утверждений. Вот два альтернативных и дополнительных метода лечения, за которыми стоит определенная наука.
Центелла азиатская часто рекламируется как средство предотвращения келоидов. В исследовании, опубликованном в апреле 2018 года в журнале Minerva Chirurgica , исследователей проанализировали послеоперационные шрамы 129 пациентов после операции на колене или брюшной полости. У тех, кто получил центеллу азиатскую, было меньше признаков келоидного образования по сравнению с теми, кто ее не получил. Исследователи также отметили, что добавка центеллы азиатской безопасна, не мешает другим методам лечения и хорошо переносится.Связано: Что такое «натуральные» продукты по уходу за кожей и действительно ли они лучше для вас?
Профилактика келоидов
Если вы склонны к развитию келоидов, вам следует проявлять бдительность и принимать меры для предотвращения образования этих рубцов. Несколько советов от AAD, о которых следует помнить:- Старайтесь избегать пирсинга, татуировок или любых плановых операций, так как после этих процедур могут образоваться келоиды.
- Немедленно лечите любую травму, какой бы незначительной она ни была; это может помочь вашей коже быстрее заживать и снизить риск образования рубцов.
- Если вы все-таки обнаружили рану, поговорите со своим дерматологом о том, как лучше ухаживать за ней и как ее перевязать. Это поможет предотвратить образование келоидных рубцов.
Келоидные рубцы — NHS
Когда рана заживает, остается шрам. Келоидный рубец — это рубец, который становится толстым, бугристым, приподнятым и больше, чем исходная рана.
Что такое келоидные рубцы?
Келоидный рубец — это увеличенный приподнятый рубец, который может быть розовым, красным, телесного цвета или темнее окружающей кожи.
Они могут развиться после очень незначительных повреждений кожи, таких как прыщи или пирсинг, и распространяться за пределы первоначальной области повреждения кожи.
Как выглядят келоидные рубцы?
Келоидный шрам может получить любой человек, но чаще он встречается у людей с темной кожей, например, у людей из Африки, афро-карибских и южно-индийских общин.Кредит:
Келоидные рубцы чаще встречаются на верхней части груди, плечах, голове (особенно на мочках ушей после пирсинга) и шее, но они могут появиться где угодно.Кредит:
Келоидные рубцы обычно:
- блестящие
- безволосые
- приподнятые над окружающей кожей
- твердые и эластичные
- сначала красные или фиолетовые, прежде чем стать коричневыми или бледными
Они могут длиться годами, а иногда и нет. формируются через несколько месяцев или лет после первоначальной травмы.
Болят ли келоидные рубцы?
Келоидные рубцы обычно безболезненны, но некоторые из них могут вызывать:
- боль
- болезненность
- зуд
- чувство жжения
- ограничение движений, если они расположены на суставе
Что вызывает келоидные рубцы?
Эксперты не до конца понимают, что вызывает келоидные рубцы, но они возникают при перепроизводстве коллагена (белка кожи).
Они не являются заразными или раковыми.
Если у вас раньше был келоидный шрам, у вас больше шансов получить другой.
У кого появляются келоидные рубцы?
Келоидные шрамы могут повлиять на кого угодно, но они чаще встречаются у людей с темной кожей, и считается, что они могут быть семейными.
Они чаще развиваются у молодых людей в возрасте от 10 до 30 лет.
Можно ли предотвратить келоидные рубцы?
Полностью предотвратить келоидные рубцы невозможно, но можно избежать преднамеренных порезов или разрывов кожи, таких как татуировки или пирсинг, в том числе на мочках ушей.
Лечение прыщей снизит вероятность появления шрамов от прыщей.
По возможности избегайте небольших операций на коже на участках, более склонных к образованию келоидных рубцов (верхняя часть груди, спина и плечи).
Лечение келоидных рубцов
Доступно несколько методов лечения, но ни один из них не оказался более эффективным, чем другие.
Лечение бывает трудным и не всегда бывает успешным.
Лечение, которое может помочь сгладить келоидный рубец, включает:
- инъекции стероидов
- наложение ленты, пропитанной стероидами, на 12 часов в день
- наложение силиконового гелевого покрытия на несколько месяцев
Другие варианты включают:
- раннее замораживание келоидные рубцы с жидким азотом, чтобы предотвратить их рост
- лазерное лечение для уменьшения покраснения (но это не сделает шрам меньше)
- операция, иногда с последующей лучевой терапией для удаления рубца (хотя он может вырасти снова и может быть больше чем раньше)
Если вас беспокоит келоидный шрам и вам нужна помощь, обратитесь к терапевту.
Узнайте больше о лечении шрамов
Видео: шрамы — кожный камуфляж
В этом видео эксперт объясняет, как маскировка кожи используется для маскировки следов и шрамов.
Последний раз просмотр СМИ: 23 июня 2020 г.
Срок сдачи обзора СМИ: 23 июня 2023 г.
Последняя проверка страницы: 5 июня 2019 г.
Срок следующей проверки: 5 июня 2022 г.
Понимание генетической основы, достижений и перспектив
Arch Plast Surg.2012 May; 39 (3): 184–189.
, 1 , 1, 2 , 2 и 2, 3Ахмад Сукари Халим
1 Отдел реконструктивных наук, Школа медицинских наук, Университет Сайнанг, Малайзия Кериан, Келантан, Малайзия.
Азаде Эмами
1 Отдел реконструктивных наук, Школа медицинских наук, Университет святых Малайзии, Кубанг-Кериан, Келантан, Малайзия.
2 Центр генома человека, Школа медицинских наук, Университет святых Малайзии, Кубанг Кериан, Келантан, Малайзия.
Иман Салахшурифар
2 Центр генома человека, Школа медицинских наук, Университет Сайнс Малайзия, Кубанг-Кериан, Келантан, Малайзия.
Thirumulu Ponnuraj Kannan
2 Центр генома человека, Школа медицинских наук, Universiti Sains Malaysia, Кубанг Кериан, Келантан, Малайзия.
3 Школа стоматологических наук, Университет святых Малайзии, Кубанг-Кериан, Келантан, Малайзия.
1 Отдел реконструктивных наук, Школа медицинских наук, Университет святых Малайзии, Кубанг Кериан, Келантан, Малайзия.
2 Центр генома человека, Школа медицинских наук, Университет святых Малайзии, Кубанг Кериан, Келантан, Малайзия.
3 Школа стоматологических наук, Университет святых Малайзии, Кубанг-Кериан, Келантан, Малайзия.
Автор, ответственный за переписку. Для переписки: Ахмад Сукари Халим. Подразделение реконструктивных наук, Школа медицинских наук, Университет святых Малайзии, 16150 Кубанг-Кериан, Келантан, Малайзия. Тел: + 609-7676005, Факс: + 609-7656532, ym.msu.bk@milahsaПоступило 8 февраля 2012 г .; Пересмотрено 14 февраля 2012 г .; Принято 15 февраля 2012 г.
Copyright © 2012 Корейское общество пластических и реконструктивных хирургов Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/) 3.0 /), который разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Келоидная болезнь — это фибропролиферативная кожная опухоль неизвестной этиологии, которая возникает после повреждения кожи у генетически предрасположенных лиц. Повышенная семейная агрегация, более высокая распространенность среди определенных рас, параллелизм у однояйцевых близнецов и изменение экспрессии генов — все это способствует значительному генетическому вкладу в келоидную патологию. Похоже, что окружающая среда вызывает болезнь у генетически предрасположенных людей. Несколько генов вовлечены в этиологию келоидного заболевания, но до сих пор не было обнаружено, что за это отвечает ни одна мутация одного гена.Следовательно, для определения этиологии келоида следует применять комбинацию таких методов, как ассоциация, взаимодействие ген-ген, эпигенетика, сцепление, экспрессия генов и анализ белков.
Ключевые слова: Келоид, кожные заболевания, генетика, воздействие окружающей среды
ВВЕДЕНИЕ
Кожа является самым большим органом и защищает от опасных факторов окружающей среды и потери воды. Кожа состоит из двух основных слоев: дермы и эпидермиса. Дерма содержит различное количество жира, коллагена и эластичных волокон, которые придают коже прочность и гибкость.
Келоиды — это доброкачественные гиперпролиферативные разрастания дермальных фибробластов, характеризующиеся избыточным отложением компонентов внеклеточного матрикса, особенно коллагена, фибронектина, эластина, протеогликанов и факторов роста, таких как трансформирующий фактор роста (TGF) β [1]. Механизмы образования келоидов включают изменения факторов роста, обмена коллагена и выравнивания напряжения, а также генетический и иммунологический вклад. Травмы, реакции на инородное тело, инфекции и эндокринные дисфункции были предложены в качестве факторов риска развития келоидов после операции у генетически предрасположенных людей [1,2].Келоидные заболевания одинаково поражают оба пола [3,4] и могут возникать в любом возрасте, но чаще встречаются в возрасте от 10 до 30 лет [5].
ДОКАЗАТЕЛЬСТВА ГЕНЕТИЧЕСКОЙ ОСНОВЫ КЕЛОИДНОЙ БОЛЕЗНИ
Доказательства, полученные от этнических групп, семей и близнецов
Заболеваемость келоидами различается среди населения, что отражает разные этиологические факторы. Распространенность келоидных заболеваний во всем мире варьируется в зависимости от этнической принадлежности. Однако пациенты с более темной кожей имеют более высокую распространенность, чем пациенты с более светлой пигментацией [6].Это пятое по распространенности кожное заболевание у взрослых чернокожих пациентов в Соединенном Королевстве [3] и самое распространенное кожное заболевание среди пациентов из числа этнических китайцев в Азии [7]. Кроме того, было опубликовано множество отчетов о семейных келоидных случаях [5,8-11], отражающих важность генетических факторов в этих семьях. Наконец, высокая частота однояйцевых близнецов, у которых развиваются келоиды, также решительно подтверждает роль генетики в этиологии келоидов [5,12].
Как аутосомно-доминантные с неполной пенетрантностью и вариабельными режимами экспрессии [5,9,10], так и аутосомно-рецессивные режимы наследования [13] наблюдались среди семей с келоидными заболеваниями.Отмечена клиническая и генетическая гетерогенность с различной клинической выраженностью между семьями и внутри затронутых членов одной семьи [5,8-11]. Хотя аутосомно-доминантный тип наследования с неполной пенетрантностью является наиболее распространенной моделью келоидного заболевания, остается неясным, является ли келоидное заболевание простым менделевским или сложным олигогенным заболеванием. Согласно недавнему обзору, хорошо известно, что факторы окружающей среды могут запускать образование келоидов у генетически предрасположенных лиц [14].Кроме того, исследования людей разных национальностей обнаружили неперекрывающиеся связанные гены и области генома. Взятые вместе, эти исследования показывают, что сложная модель наследования с участием множества генетических факторов наряду с воздействием окружающей среды может быть лучшей моделью для келоидного заболевания. Более конкретно, кажется правдоподобным, что аутосомный ген может играть главную роль в сочетании с более умеренными рецессивными эффектами гена.
Доказательства менделевских расстройств с келоидными симптомами
Некоторые менделевские расстройства проявляют келоиды как часть их клинических проявлений.Например, у людей с заболеванием соединительной ткани могут развиваться келоиды как часть заболевания. Почти все менделевские синдромные формы келоидных заболеваний, такие как латеральный менингоцеле (OMIM # 130720), Рубинштейна-Тайби (OMIM # 180849), некротическая энцефаломиелопатия Ли (OMIM # 161700), врожденная мышечная дистрофия Ульриха (UCMD40-90), OMIM # 25hlers (UCMD40-90) Синдром Данлоса (OMIM # 130050) и синдром Goeminne TKCR (OMIM # 314300) продемонстрировали доминантный тип наследования, который согласуется с типом наследования среди семей с несиндромальной келоидной болезнью [5,9,10].
У пациентов с синдромом Рубинштейна-Тайби 1 (RSTS1) часто возникают келоиды. RSTS1 вызывается делецией смежного гена с участием гена CREBBP , а также других соседних генов на хромосоме 16p13.3 (OMIM # 180849). Анкетное исследование 61 взрослого с RSTS в возрасте от 18 до 67 лет показало, что у 57% пациентов развиваются келоиды [15]. Кроме того, у 28 пациентов были обнаружены келоиды в серии из 574 обследованных лиц с RSTS [16].Высокая частота келоидов как пролиферативного расстройства и новообразований у пациентов с RSTS объясняется функцией CREBBP в иммортализации клеток, регулируемой цАМФ [17].
Надо и др. [18] сообщили об истории болезни 13 пациентов с UCMD, у троих из которых также были келоиды. UCMD — это гетерогенное заболевание, в основном вызванное мутациями в генах коллагена. Точно так же синдром Элерса-Данлоса (СЭД) представляет собой аутосомно-доминантное заболевание соединительной ткани, которое проявляется келоидными рубцами в качестве одного из клинических симптомов.EDS типа IV вызывается гетерозиготной мутацией в гене коллагена типа III ( COL3A1 ; 120180) на хромосоме 2q31, рядом с локусом гена для синдрома UCMD. Кроме того, перекрывающиеся фенотипы наблюдались между EDS и UCMD. Наконец, синдром Goeminne TKCR впервые был зарегистрирован в семье с шестью пострадавшими членами, в которой у двух пациентов также развились множественные келоиды [19].
Таким образом, семейная агрегация, наличие однояйцевых близнецов, менделевские способы наследования, исследования экспрессии и высокая распространенность келоидов среди разных предков — все это убедительно свидетельствует в пользу генетических факторов в формировании келоидов.
ГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ КЕЛОИДНОЙ БОЛЕЗНИ
Данные исследований экспрессии и взаимодействия генов
На PubMed проведено 166 исследований с ключевым словом «экспрессия гена в келоиде». С появлением платформ экспрессии микроматриц было обнаружено, что длинный список генов либо активируется, либо подавляется в образцах келоидов. Келоидная болезнь — это сложное состояние, при котором сообщается о множественных взаимодействиях между чувствительными генами и их продуктами. Келоиды обогащены факторами роста и молекулами внеклеточного матрикса (ЕСМ), а фибробласты составляют большинство клеток дермы, ответственных за производство и ремоделирование внеклеточного матрикса во время заживления ран.Молекулы ВКМ играют важную роль в структуре кожи; следовательно, нарушение ECM может быть ответственным за формирование аномальной рубцовой ткани [20].
Как показано на фиг., Коллагены (тип I и III), микрофибриллярные белки (эластин, фибриллин) и гиалуроновая кислота являются тремя основными структурными элементами ECM [20]. Из них коллагены действуют как сеть по всей дерме для поддержания целостности ткани, а микрофибриллярные белки обеспечивают гибкость в более глубоких слоях дермы [20]. Были проведены обширные исследования экспрессии белков ЕСМ.Большинство исследований экспрессии проводилось на культивируемых клетках фибробластов, полученных из келоидов, по сравнению с нормальной тканью. Влияние компонентов культуры клеток, находящихся в прямом взаимодействии с клетками фибробластов, на экспрессию генов неизбежно. Келоидная ткань характеризуется накоплением внеклеточного матрикса, особенно коллагена (). Кроме того, фибробластные клетки, происходящие из келоидов, демонстрируют высокую экспрессию TGF β1 и TGF β2 [21] и, как следствие, избыточный синтез коллагена [22,23].TGF β стимулирует синтез коллагена и способствует заживлению ран, регулируя рост, дифференцировку и пролиферацию клеток фибробластов [24]. TGF β3 стимулирует синтез коллагена через TGF β1 [22] и TGF β2 [23]. Кроме того, путь TGF β участвует в фиброзе, а также в некоторых других фиброзных нарушениях [14]. Было показано, что на начальных стадиях фиброза в келоидных тканях TGF β1 экспрессируется неоваскулярными эндотелиальными клетками, что, следовательно, стимулирует экспрессию коллагенов I и VI типов на высоком уровне [25].TGF β1 является ключевым фактором развития келоидов и регулирует экспрессию нескольких нижестоящих генов. Экзогенный TGF β1 усиливает экспрессию рецептора фактора роста тромбоцитов (PDGF) α в фибробластных клетках келоидного происхождения, но не в клетках фибробластов некелоидного происхождения [26]. Также было показано, что TGF β стимулирует экспрессию фактора роста эндотелия сосудов (VEGF) в келоидных фибробластах [27].
Внеклеточный матрикс (ЕСМ) в нормальной коже, гипертрофической и келоидной ткани
Компоненты внеклеточного матрикса в нормальной коже по сравнению с гипертрофическими рубцами и келоидной тканью.Цифры указывают относительное выражение. Шесть означает очень высокую экспрессию, а -4 означает очень низкую экспрессию.
SMAD гены действуют ниже TGF β в развитии келоидов. В клетках келоидных фибробластов малые интерферирующие РНК (siRNA) SMAD2 вызывают подавление активности SMAD2 и SMAD3 , что приводит к снижению уровней проколлагена [28,29]. Это указывает на то, что SMAD2 и SMAD3 играют критическую роль в индуцированном TGF β фиброзе в образовании келоидов.
ДОКАЗАТЕЛЬСТВА ИССЛЕДОВАНИЙ ВЗАИМОСВЯЗИ И АССОЦИАЦИИ
Как упоминалось выше, исследования семейной агрегации проливают свет на генетические факторы риска, которые могут быть ответственны за образование келоидов. С тех пор несколько исследователей попытались составить карту восприимчивого локуса (или локусов) келоидного заболевания в этих семьях.
Полногеномные исследования сцепления в японской и афроамериканской семье с келоидным заболеванием привели к обнаружению интервалов сцепления в хромосомных областях 2q23 и 7p11, соответственно [9].Однако связь с 7p11 была исключена из большой китайской семьи с келоидным заболеванием [30], и для этой семьи были обнаружены интервалы сцепления в 15q22.31-q23, 18q21.1 и 10q23.31 [31,32]. Область 18q21.1 несет в себе гены SMAD, 2, 7 и 4, которые участвуют в регуляции сигнального пути TGF β.
Было опубликовано множество исследований по типу случай-контроль связи между келоидными заболеваниями и генами-кандидатами в келоид [33-40]. Несмотря на убедительные доказательства из исследований экспрессии, ни одно исследование еще не обнаружило какой-либо связи между членами семейства TGF β и келоидными заболеваниями в кавказских популяциях [33–36].Однако было обнаружено, что концентрация TGF β1 в плазме связана с -509 T> C вариантом TGF β1 [41], что противоречит результатам, полученным в другом исследовании [34].
Кроме того, нижестоящие гены в сигнальном пути TGF β, а именно SMAD 3, 6 и 7, не достигли статистической значимости в исследовании «случай-контроль», посвященном изучению келоидных заболеваний у афро-карибской этнической группы [42].
В отличие от членов семейства TGF β, гены HLA достигли статистической значимости в нескольких исследованиях [37,39,43].Из них HLA-DRB1 * 15 оказались наиболее устойчивыми с репликацией как в китайских, так и в кавказских этнических группах [37,39], что позволяет предположить, что, по крайней мере, в этих этнических группах, HLA-DRB1 * 15 может быть связано с повышенным риском келоидного заболевания.
ГЕНОМНЫЕ ИССЛЕДОВАНИЯ КЕЛОИДНОЙ БОЛЕЗНИ
С появлением высокопроизводительных технологий генотипирования с помощью микрочипов исследователи использовали эти методы для просмотра всего генома.Однако до сих пор нет исследования сцепления в масштабе всего генома с использованием массивов карт однонуклеотидного полиморфизма (SNP) высокой плотности в семьях с келоидными заболеваниями. Однако недавно в рамках полногеномного исследования ассоциации случай-контроль в популяции Японии было обнаружено четыре локуса восприимчивости к келоидным заболеваниям, включая 1q41, 3q22.3-23 и 15q21.3 [44]. Исследование репликации подтвердило возможную роль гена NEDD4 в хромосомной области 15q21.3. С тех пор было показано, что NEDD4 активирует фибронектин и коллаген 1 типа и, таким образом, играет роль в накоплении внеклеточного матрикса [45].В другом исследовании вариации числа копий в 6p21.32, 11q11, 17q12, 8p23.1, 22q13.1, 19p13.1 и 2q14.3 были обнаружены с помощью сравнительной геномной гибридизации на основе массивов [43]. Область 6p21.32, в которой находится HLA-DRB5 , также показала значительную связь в валидационном исследовании.
РОЛЬ ЭПИГЕНЕТИКИ ПРИ КЕЛОИДНОЙ БОЛЕЗНИ
Роль эпигенетики в образовании злокачественных новообразований хорошо известна. Поскольку келоид является доброкачественной опухолью, существует возможность эпигенетических изменений в келоидной ткани.Действительно, недавно было сообщено, что клетки келоидных фибробластов изменяют паттерны метилирования ДНК и ацетилирования гистонов [46]. Изучение профиля метилирования может дать новое представление о лечении келоидов. Однако необходимы дополнительные исследования, чтобы полностью изучить роль эпигенетики в этиологии келоидных заболеваний.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ И ПЕРСПЕКТИВЫ
Келоидная болезнь — это сложное заболевание, при котором разные этнические группы проявляют разную предрасположенность к развитию болезни.Различия в распространенности между популяциями, вероятно, отражают вклад различных генетических факторов риска. В целом, большинство генов при сложных расстройствах имеют умеренный эффект; поэтому ассоциативные исследования, являющиеся мощными методами обнаружения генов со средним воздействием, отлично подходят для изучения этих типов расстройств. Для поиска генов-кандидатов в этиологии келоидных заболеваний также необходим ряд статистических методов, включая анализ одного маркера, анализ генотипа, анализ гаплотипа, анализ относительного риска и анализ взаимодействия ген-ген и ген-среда.Кроме того, отсутствие воспроизводимости среди некоторых популяций может быть результатом небольшого размера выборки, стратификации населения, несоответствующих методов статистического анализа или реальной неоднородности популяций.
Изменение одной аминокислоты не может быть достаточным критерием для прогнозирования заболевания по сложным признакам, таким как келоид. Варианты также могут оказывать влияние, нарушая или активируя функцию сайтов связывания сплайсинга, или гипоморфные варианты могут проявлять свои эффекты на уровне транскрипции и взаимодействовать с другими факторами риска.Однако, поскольку до сих пор не было обнаружено ни одной мутации внутри гена, лучше всего подходит модель многофакторного наследования. Следовательно, взаимодействие между генами и факторами окружающей среды, а также возможная роль кодирующих и регуляторных вариантов и эпигенетики должны быть учтены в будущих исследованиях.
Footnotes
Это исследование было поддержано краткосрочным грантом Universiti Sains Malaysia (USM) (№ 304 / PPSP / 61310017).
О потенциальном конфликте интересов, относящемся к этой статье, не сообщалось.
Список литературы
1. Келли А.П. Лечебные и хирургические методы лечения келоидов. Dermatol Ther. 2004; 17: 212–218. [PubMed] [Google Scholar] 3. Чайлд Ф.Дж., Фуллер Л.К., Хиггинс Э.М. и др. Исследование спектра кожных заболеваний, встречающихся у чернокожего населения на юго-востоке Лондона. Br J Dermatol. 1999; 141: 512–517. [PubMed] [Google Scholar] 4. Шаффер Дж. Дж., Тейлор С. К., Кук-Болден Ф. Келоидные рубцы: обзор с критическим взглядом на варианты лечения. J Am Acad Dermatol. 2002; 46: S63 – S97. [PubMed] [Google Scholar] 5.Марнерос А.Г., Норрис Дж. Э., Олсен Б. Р. и др. Клиническая генетика семейных келоидов. Arch Dermatol. 2001; 137: 1429–1434. [PubMed] [Google Scholar] 7. Альхади С.М., Шиванантараджах К. Келоиды в различных расах: обзор 175 случаев. Plast Reconstr Surg. 1969; 44: 564–566. [PubMed] [Google Scholar] 8. Баят А., Арскотт Дж., Оллиер В.Е. и др. «Агрессивный келоид»: тяжелый вариант семейного келоидного рубцевания. JR Soc Med. 2003. 96: 554–555. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Марнерос А.Г., Норрис Дж. Э., Ватанабе С. и др.Сканирование генома предоставляет доказательства локусов восприимчивости к келоидам на хромосомах 2q23 и 7p11. J Invest Dermatol. 2004. 122: 1126–1132. [PubMed] [Google Scholar] 10. Чэнь Й., Гао Дж. Х., Лю X Дж. И др. Характеристики возникновения семейных келоидов ханьских китайцев. Бернс. 2006. 32: 1052–1059. [PubMed] [Google Scholar] 11. Белла Х., Хейсе М., Яги К.И. и др. Клиническая характеристика семейного келоидного заболевания у уникальных африканских племен выявляет различные келоидные фенотипы. Plast Reconstr Surg. 2011; 127: 689–702.[PubMed] [Google Scholar] 12. Рамакришнан К.М., Томас К.П., Сундарараджан ЧР. Исследование 1000 пациентов с келоидами в Южной Индии. Plast Reconstr Surg. 1974; 53: 276–280. [PubMed] [Google Scholar] 14. Ших Б., Баят А. Генетика келоидных рубцов. Arch Dermatol Res. 2010. 302: 319–339. [PubMed] [Google Scholar] 15. Стивенс К.А., Паунси Дж., Ноулз Д. Взрослые с синдромом Рубинштейна-Тайби. Am J Med Genet A. 2011; 155A: 1680–1684. [PubMed] [Google Scholar] 16. Сираганян П.А., Рубинштейн Дж. Х., Миллер Р. В.. Келоиды и новообразования при синдроме Рубинштейна-Тайби.Med Pediatr Oncol. 1989; 17: 485–491. [PubMed] [Google Scholar] 17. Петри Ф., Джайлз Р. Х., Дауверзе Х. Г. и др. Синдром Рубинштейна-Тайби, вызванный мутациями в коактиваторе транскрипции CBP. Природа. 1995; 376: 348–351. [PubMed] [Google Scholar] 18. Надо А., Кинали М., Майн М. и др. Естественная история врожденной мышечной дистрофии Ульриха. Неврология. 2009. 73: 25–31. [PubMed] [Google Scholar] 19. Goeminne L. Новый, вероятно, Х-сцепленный наследственный синдром: врожденная мышечная кривошея, множественный келоидный крипторхизм и дисплазия почек.Acta Genet Med Gemellol (Roma) 1968; 17: 439–467. [PubMed] [Google Scholar] 20. Сиджвик Г.П., Баят А. Молекулы внеклеточного матрикса, участвующие в гипертрофических и келоидных рубцах. J Eur Acad Dermatol Venereol. 2012; 26: 141–152. [PubMed] [Google Scholar] 21. Чалмерс Р.Л. Доказательства роли трансформирующего фактора роста бета в формировании аномальных рубцов. Int Wound J. 2011; 8: 218–223. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Мурата Х., Чжоу Л., Очоа С. и др. TGF-бета3 стимулирует и регулирует синтез коллагена посредством TGF-бета1-зависимых и независимых механизмов.J Invest Dermatol. 1997. 108: 258–262. [PubMed] [Google Scholar] 23. Томпсон С.А., Канади Дж.В., Коберли Д.М. и др. Эффекты TGFbeta2 на синтез коллагена в культивируемых нормальных и раненых фетальных мышей. Волчья пасть Craniofac J. 1999; 36: 425–433. [PubMed] [Google Scholar] 24. Беттингер Д.А., Ягер Д.Р., Дигельманн Р.Ф. и др. Влияние TGF-бета на пролиферацию келоидных фибробластов и синтез коллагена. Plast Reconstr Surg. 1996. 98: 827–833. [PubMed] [Google Scholar] 25. Пелтонен Дж., Сяо Л.Л., Яаккола С. и др.Активация экспрессии гена коллагена в келоидах: совместная локализация коллагена типа I и VI и мРНК трансформирующего фактора роста бета-1. J Invest Dermatol. 1991; 97: 240–248. [PubMed] [Google Scholar] 26. Мессади Д.В., Ле А., Берг С. и др. Влияние TGF-бета 1 на экспрессию рецепторов PDGF в фибробластах рубца человека. Передние биоски. 1998; 3: а16 – а22. [PubMed] [Google Scholar] 27. Fujiwara M, Muragaki Y, Ooshima A. Повышение регуляции трансформирующего фактора роста-бета1 и фактора роста эндотелия сосудов в культивируемых келоидных фибробластах: отношение к ангиогенной активности.Arch Dermatol Res. 2005; 297: 161–169. [PubMed] [Google Scholar] 28. Гао З, Ван З, Ши И и др. Модуляция синтеза коллагена в келоидных фибробластах путем подавления Smad2 с помощью siRNA. Plast Reconstr Surg. 2006. 118: 1328–1337. [PubMed] [Google Scholar] 29. Ван З, Гао З, Ши И и др. Подавление экспрессии Smad3 снижает синтез коллагена в фибробластах келоидных заболеваний. J Plast Reconstr Aesthet Surg. 2007; 60: 1193–1199. [PubMed] [Google Scholar] 30. Чэнь Й., Гао Дж. Х., Лю X Дж. И др. Анализ сцепления локусов восприимчивости к келоидам на хромосоме 7p11 в китайской родословной.Нан Фан И Кэ Да Сюэ Сюэ Бао. 2006; 26: 623–625. [PubMed] [Google Scholar] 31. Ян Х, Гао Дж. Х., Чен Й и др. Предварительный анализ сцепления и картирование локуса восприимчивости к келоидам в китайской родословной. Чжунхуа Чжэн Син Вай Кэ За Чжи. 2007; 23: 32–35. [PubMed] [Google Scholar] 32. Чэнь Й., Гао Дж. Х., Янь Х и др. Расположение предрасполагающего гена для одной китайской ханьской келоидной родословной. Чжунхуа Чжэн Син Вай Кэ За Чжи. 2007. 23: 137–140. [PubMed] [Google Scholar] 33. Баят А., Бок О., Мровиц Ю. и др. Генетическая предрасположенность к келоидным заболеваниям и полиморфизм трансформирующего фактора роста бета 2.Br J Plast Surg. 2002; 55: 283–286. [PubMed] [Google Scholar] 34. Баят А., Бок О., Мровиц Ю. и др. Генетическая предрасположенность к келоидным заболеваниям и гипертрофическим рубцам: общие полиморфизмы трансформирующего фактора роста бета1 и уровни в плазме. Plast Reconstr Surg. 2003; 111: 535–543. [PubMed] [Google Scholar] 35. Баят А., Бок О., Мровиц Ю. и др. Генетическая предрасположенность к келоидным заболеваниям: полиморфизм гена бета-рецептора трансформирующего фактора роста не связан с келоидным заболеванием. Exp Dermatol.2004. 13: 120–124. [PubMed] [Google Scholar] 36. Баят А., Вальтер Дж. М., Бок О. и др. Генетическая предрасположенность к келоидным заболеваниям: скрининг мутаций гена TGFbeta3. Br J Plast Surg. 2005; 58: 914–921. [PubMed] [Google Scholar] 37. Лу В.С., Чжан В.Й., Ли И и др. Ассоциация аллелей HLA-DRB1 с келоидами у китайских ханьцев. Тканевые антигены. 2010. 76: 276–281. [PubMed] [Google Scholar] 38. Чжан Дж., Цзян Дж., Ло С. и др. Анализ мутаций гена CDC2L1 в келоидной ткани. Clin Exp Dermatol. 2012; 37: 277–283.[PubMed] [Google Scholar] 39. Браун Дж. Дж., Оллиер В. Е., Томсон В. и др. Положительная связь HLA-DRB1 * 15 с келоидным заболеванием у кавказцев. Int J Immunogenet. 2008. 35: 303–307. [PubMed] [Google Scholar] 40. Ян Л., Лу XY, Ван С.М. и др. Ассоциация между полиморфизмом кодона 72 гена р53 и келоидом в китайской популяции. Чжунхуа Чжэн Син Вай Кэ За Чжи. 2007. 23: 428–430. [PubMed] [Google Scholar] 41. Grainger DJ, Heathcote K, Chiano M и др. Генетический контроль циркулирующей концентрации трансформирующего фактора роста типа бета1.Hum Mol Genet. 1999; 8: 93–97. [PubMed] [Google Scholar] 42. Браун Дж. Дж., Оллиер В., Арскотт Дж. И др. Генетическая предрасположенность к келоидным рубцам: частоты SNP гена SMAD у афро-карибских жителей. Exp Dermatol. 2008. 17: 610–613. [PubMed] [Google Scholar] 43. Shih B, Bayat A. Сравнительный анализ геномной гибридизации келоидной ткани у кавказцев предполагает возможное участие HLA-DRB5 в патогенезе заболевания. Arch Dermatol Res. 2012; 304: 241–249. [PubMed] [Google Scholar] 44. Накашима М., Чунг С., Такахаши А. и др.Полногеномное ассоциативное исследование выявило четыре локуса восприимчивости к келоидам в популяции Японии. Нат Жене. 2010; 42: 768–771. [PubMed] [Google Scholar] 45. Чунг С., Накашима М., Зембутсу Х. и др. Возможное участие NEDD4 в формировании келоидов; его критическая роль в пролиферации фибробластов и производстве коллагена. Proc Jpn Acad Ser B Phys Biol Sci. 2011. 87: 563–573. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Russell SB, Russell JD, Trupin KM, et al. Эпигенетически измененное заживление ран в келоидных фибробластах.J Invest Dermatol. 2010; 130: 2489–2496. [Бесплатная статья PMC] [PubMed] [Google Scholar]Frontiers | Понимание келоидной патобиологии с квази-неопластической точки зрения: меньше шрамов и больше хронических воспалительных заболеваний с раковыми тенденциями
Введение
Келоиды считаются доброкачественными фибропролиферативными кожными опухолями, которые возникают в результате аномальных процессов заживления ран после повреждения кожи. Визуально они характеризуются выпуклыми экзофитными кожными выростами, выходящими за пределы исходной границы раны, и микроскопически утолщенными гиалинизированными коллагеновыми пучками (1, 2).
Возраст большинства людей, страдающих келоидными заболеваниями, составляет от 10 до 30 лет, и у них пигментированная кожа; высокие показатели зарегистрированы у африканцев, афро-карибских, афро-американских, испаноязычных или азиатских предков (3–6). Келоиды могут развиваться через месяцы или годы после первоначальной травмы и могут сопровождаться сильной болью, зудом и другими физическими и психосоциальными симптомами (7). Обычно поражаются передняя часть грудной клетки, плечи, спина и мочка уха, при этом участки на предгрудинной и плечевой областях развиваются при высоком напряжении.Келоиды имеют тенденцию агрессивно вторгаться в соседнюю окружающую здоровую (нормальную) кожу и часто могут повторяться после любого лечения. В частности, монотерапия с одним лишь хирургическим удалением может привести к рецидивам до 100% (8). Фенотипически келоиды соответствуют доброкачественным кожным опухолям, которые возникают из-за чрезмерной выработки коллагена, который никогда не дает метастазов. Однако можно полагать, что морфология и клинически агрессивное поведение келоидов имеют сходство с неопластическими дермальными опухолями.
Существуют различные теории, объясняющие этиологию келоидов, включая повышенное натяжение кожи (9, 10), гипоксию (11), хроническое воспаление (12), аутоиммунные (13-15), генетические (16, 17) и сосудистые факторы ( 18), ни одного из которых, однако, недостаточно для этого. На сегодняшний день варианты лечения келоидов плохо определены, отчасти из-за неудовлетворительных результатов текущих методов лечения и низкого качества доказательств их использования. Исследования келоидов усугубляются отсутствием моделей болезней животных для тестирования.
Этот обзор направлен на изучение явных раковых или квазинопластических атрибутов и особенностей келоидов (рис. 1) и выделяет несколько ключевых областей для будущих исследований.
Рисунок 1 . Ключевые процессы, способствующие квазинопластическому проявлению патобиологии келоидов.
Келоиды: шрамы или раковые опухоли?
Келоиды традиционно рассматриваются как рубцы, относящиеся к спектру фибропролиферативных заболеваний кожи. Однако, чтобы выяснить этиопатогенез келоидов, необходимо различать рубец и заболевание.Рубец является конечной точкой физиологического заживления раны, которому предшествуют воспаление, фиброплазия и грануляция, и проявляется как нефункционирующая фиброзная ткань, которая со временем может регрессировать (19, 20). Кожные рубцы часто меняют такие свойства, как толщина, текстура, цвет и прочность, но остаются в пределах окружающей неповрежденной кожи (19, 21). Напротив, келоиды представляют собой агрессивные экзофитные кожные наросты, непропорционально выросшие за пределы исходной раны из источника, который остается во взвешенном состоянии при «заживлении ран» и созревании рубца.Хотя келоиды обычно не классифицируются как настоящие новообразования из-за отсутствия у них спонтанного возникновения и отсутствия метастазов, они демонстрируют различные раковые характеристики, такие как неконтролируемая пролиферация, инвазивность в окружающие ткани, отсутствие спонтанной регрессии и способность к васкуляризации (22–24). ). Их непропорционально локально агрессивный клинический фенотип предполагает возможные связи с кожными или мезенхимальными опухолями, которые необходимо изучить более подробно.
Из-за сходной клинической картины келоиды ошибочно принимали за другие доброкачественные и злокачественные опухоли кожи и наоборот (25).Из них протуберанская дерматофибросаркома чаще всего связана с келоидами среди других, таких как келоидная дерматофиброма (26), келоидная базально-клеточная карцинома, келоидная атипичная фиброксантома (27), что предполагает возможное совпадение между ними (28). Основываясь на их патобиологии и клиническом фенотипе, келоиды имеют наибольшее сходство между опухолями в отношении фиброза, дермального происхождения и мезенхимального происхождения (29). Сходства между келоидами и мезенхимальными опухолями можно найти по целому ряду характеристик, от экспрессии биомаркеров до клинических проявлений (30).Семенная работа над келоидными мезенхимальными биомаркерами предполагает, что стволовые клетки, идентифицируемые в келоидах, отклоняются от дермальной к хондроцитарной или остеогенной линии (31), однако исследования, подтверждающие такие гипотезы в этом направлении, все еще отсутствуют.
Морфология келоидов: клеточный и матричный состав
При макроскопическом осмотре келоиды представляют собой хорошо разграниченные, приподнятые кожные поражения различной формы, которые могут быть бугорчатыми, узловыми или отвисшими (32). Они могут казаться блестящими с обесцвечиванием — часто эритематозными с телеангиэктазией у людей с более светлой кожей и гиперпигментированными у людей с более темной кожей (32) — и могут достигать размеров от нескольких миллиметров до многих сантиметров в диаметре (33).Келоиды демонстрируют гетерогенный фенотип в отношении жесткости и варьируются от мягких до чрезвычайно твердых с пониженной пластичностью кожи. В центре келоидной ткани часто наблюдается центральная гипоксия из-за закупорки капилляров из-за избытка коллагена и эндотелиальных клеток (34). Келоидные края содержат активные фибробласты, которые проникают в окружающие ткани и хорошо васкуляризируются за счет ангиогенеза, чтобы поддерживать снабжение кислородом и питательными веществами, необходимыми предположительно для подпитки их инвазивности (24, 35).Считается, что это результат миграции эндотелиальных клеток и их выживания в результате активации фактора роста посредством киназных сигнальных путей, таких как PI3K / AKT, ERK1 / 2, FAK и p38 / MAPK (36, 37).
Большая часть расширяющейся келоидной ткани находится в ретикулярном дермальном слое с утолщенным вышележащим эпидермисом. Келоидные ткани не инкапсулированы и имеют периметр, переходящий в окружающую ткань (2). Маргинальные фибробласты более метаболически активны и участвуют в более высокой скорости производства коллагена I и III, что отражается в более эритематозной коже, покрывающей эти края (38).Несколько исследований показали, что внешние края и внутренний комплекс келоидов населены разными типами стволовых клеток. В частности, мезенхимальные стволовые клетки, экспрессирующие негемапоэтические маркеры, составляющие внутренний комплекс, по-видимому, представляют собой нишу, которая жизненно важна для поддержания роста келоидов, окруженная внепочечными гемопоэтическими стволовыми клетками (39, 40). В связи с этим концентрация гомогенного утолщенного гиалинизированного коллагена в центре, окруженного более типично выглядящими коллагеновыми волокнами по краям, уникальна для келоидов (41), но не всегда присутствует (2).
Вкратце, заживление кожных ран включает формирование и ремоделирование коллагенового матрикса с течением времени фибробластами и миофибробластами. Точно так же активированные миофибробласты и келоидные фибробласты представляют собой основные генераторы келоидного матрикса благодаря их синергетическому действию в увеличении жесткости келоидной ткани (42, 43). Фиброциты, которые считаются предшественниками миофибробластов, представляют собой циркулирующие клетки костного мозга, присутствующие в келоидах и тканях, подвергающихся заживлению ран (44–46). Они появляются как нечто среднее между фибробластами, моноцитами и гемопоэтическими стволовыми клетками (HSC) из-за их продуктов фибробластов, маркеров кроветворной поверхности, экспрессии миелоидного антигена и общих морфологических характеристик (47).Их экспрессия CXCR4 является частью оси CXCR4 / SDF-1, которая имеет решающее значение в регуляции кожного заживления кожных ран, системной красной волчанки и ангиогенеза базальноклеточной карциномы (48).
Келоидный матрикс состоит из различных коллагенов, гликопротеинов и гликозаминогликанов (ГАГ) (23, 49, 50). Первоначальное перепроизводство коллагена типа III в келоидном матриксе заменяется коллагеном типа I с чрезвычайно высоким соотношением коллагена типа I к коллагену типа III (17: 1) по сравнению с нормальными рубцами (6: 1) (51).Коллагеновые волокна, составляющие келоиды, больше, чем в нормальных рубцах, и расположены беспорядочно (2) в слабо сшитых (51) мутовках толстых пучков в той же плоскости, что и эпидермис (1). Повышенные уровни MMP-2, TIMP-1 и TIMP-2 наблюдаются в келоидах (52), дисбаланс которых, по-видимому, нарушает регуляцию выработки и накопления коллагена, с усиленной регуляцией MMP-2 и MMP- Экспрессия 9 дополнительно связана с инвазивностью рака (53).Избыточное производство коллагена и матрикса также связано с нарушением регуляции передачи сигналов mTOR (54), которая играет решающую роль в раковых заболеваниях человека (55). Интересно, что отложение эластичных волокон выше в ретикулярной дерме, чем в сосочковой дерме (56, 57), но, как было показано, отсутствует в келоидном внеклеточном матриксе (ЕСМ) наряду с дерегулированной экспрессией белков сборки эластичных волокон, таких как эластин, фибриллин- 1 и фибулин-5 (58). Это связано с избыточным отложением хондроитинсульфата (CS), которое составляет 6.В 9 раз выше, чем у нормальной кожи. Считается, что CS подавляет сборку эластичных волокон за счет нарушения регуляции отложения фибриллина-1 (58), и было обнаружено, что его аберрантная экспрессия способствует метастазированию опухоли при раке молочной железы (59). Функции фибулина-5 и эластина в образовании опухолей являются сложными, включая, среди прочего, регуляцию металлопротеиназ (ММП) (60–62). Взаимодействие между этими ассоциированными с протеогликанами факторами в патогенезе келоидов еще предстоит выяснить.
Sox9 , главный регулятор хондрогенеза (63), активируется в келоидах (31), и его эктопическая экспрессия связана с положительной регуляцией COL2A1 и белка олигомерного матрикса хряща ( COMP ), что приводит к выработке ECM, ориентированной на в сторону хондрогенеза и фиброза (64). COMP стимулирует сборку фибрилл коллагена 1 (65, 66) с уровнем экспрессии, пропорциональным размеру келоида, и экспрессируется при склеродермии и других опухолях (67–69).Келоиды демонстрируют значительно повышенные уровни бигликана в узловатой дерме активных келоидных поражений наряду со сниженной экспрессией декорина (70). Это интересно, поскольку декорин, который, как недавно было обнаружено, подавляет выработку коллагена, повышается при злокачественных новообразованиях (71, 72). Было показано, что все эти протеогликаны по-разному регулируются основным фактором роста фибробластов, который, как считается, участвует в формировании фенотипа опухоли (73, 74).
Келоиды имеют много общего с другими кожными опухолями в силу их общего тканевого происхождения.Это включает интегральную активацию пути β-катенина Wnt в десмоидных опухолях (75) и повышенные уровни TGF-β, коллагена и ГАГ в протуберанской дерматофибросаркоме (76). В обеих этих опухолях травма была названа провоцирующим фактором (75, 77).
Келоиды и признаки рака
Хотя келоиды в значительной степени проявляют признаки рака, эти характеристики еще предстоит полностью изучить в этом контексте (78, 79). Потенциально существует ключевой регулятор или группа обязательных факторов, которые при активации после повреждения кожи запускают каскад событий, кульминацией которых является образование келоидных рубцов.Различные взаимосвязи между факторами, связанными с опухолью, выраженными в келоидах, могут быть сложными, и их роль в поддержании роста келоидов все еще неясна. В таблице 1 выделены ключевые биомаркеры опухолей, обсуждаемые в этом обзоре.
Таблица 1 . Экспрессия опухолевых биомаркеров в келоидах.
Поддержание пролиферативной сигнализации
Келоидные фибробласты экспрессируют более высокие сигналы рецепторной тирозинкиназы по сравнению с фибробластами нормальной кожи (143, 144). Эта повышенная передача сигналов фибробластов, происходящих из келоидов, которая может влиять на рост, дифференцировку и выживаемость клеток, связана с развитием рака при нарушении регуляции (145). Nanog , ген, который наделяет клетки способностью к саморепликации и повышается при различных раковых заболеваниях (111, 146, 147), отсутствует в соматических клетках (148), но недавно было обнаружено, что он активируется в лимфоидной ткани, ассоциированной с келоидом (KALT). ) (112). Zhang et al. (39) описали популяцию клоногенных, самообновляющихся клеток-предшественников келоидного происхождения, экспрессирующих маркеры мезенхимальных и эмбриональных стволовых клеток и управляемых воспалением, опосредованным IL-6 / IL-17. ИЛ-6, наряду с фактором роста гепатоцитов и фактором роста эпидермиса, является канцерогенным (39).Интересно, что IL-6 и его второстепенные мессенджеры JAK / Stat3, оба из которых повышены в келоидных фибробластах, образуют путь IL-6 / JAK / Stat3, который способствует онкогенезу в микросреде опухоли. В частности, Stat3 увеличивает пролиферацию и миграцию клеток внутри келоидных фибробластов (99, 149).
Трансформирующий фактор роста бета (TGF-β) представляет собой хорошо изученный цитокин в патогенезе келоидов из-за его ключевой роли в управлении келоидным фиброзом (150, 151). TGF-β1 влияет на келоидные кератиноциты через Smad-зависимые и Smad-независимые сигнальные пути, такие как ERK1 / 2 и p38, способствуя накоплению коллагена (150, 151).Что касается рака, было показано, что TGF-β1 ингибирует начальное образование опухоли до ускорения ее злокачественности на модели рака кожи трансгенных мышей (152). Келоидные и нормальные фибробласты проявляют дифференциальный ответ на PDGF, EGF, FGF (153) и TGF-β (154), большинство из которых связываются с рецепторами семейства протеинтирозинкиназ (PTK). Рецепторы PTK способствуют пролиферации, дифференцировке (155) и канцерогенезу клеток (156).
Satish et al. (23) обнаружили повышенную регуляцию рибосомных белков в келоидных фибробластах, что также наблюдается при росте рака, что указывает на более жесткую регуляцию в келоидах, которая предотвращает злокачественную трансформацию их клеток-предшественников.Участвующие факторы активации транскрипции включают c-jun и c-fos , которые действуют как протоонкогены. Помимо своей роли в регуляции клеточного цикла фибробластов (84) и активированной Ras эпидермальной неоплазии человека, c-jun также связан с доброкачественными воспалительными состояниями, такими как псориаз и артрит (157).
Уклонение от подавителей роста
Механизмы, лежащие в основе роста келоидов, непросты и включают как повышающую, так и понижающую регуляцию опухолевых супрессоров.Нарушение регуляции p53 является отличительной чертой различных видов рака; совсем недавно механизм, с помощью которого он нарушается в келоидах, был идентифицирован как взаимодействие TRAF4-USP10, которое приводит к пролиферации фибробластов (158). Интересно, что хотя мутация p53 и преобладает в келоидах (159), было обнаружено, что ее экспрессия повышена в центральной области келоидных фибробластов наряду с увеличением p63 , что ингибирует ее трансляцию (101, 160). В свою очередь, это приводит к последующим эффектам, включая повышенный уровень SERPINB5 и маспина , последний из которых также активируется во время старения кератиноцитов (101).Связь полиморфизма кодона 72 TP53 с келоидами остается неясной (124, 161, 162). Другие примеры включают подавленную активность miR-1224-5p, которая обычно функционирует через TGF-β1 / Smad3 и играет роль в развитии рака (163). Точно так же miR-21-5p играет ключевую роль в PTEN-опосредованных механизмах пролиферации и апоптоза в келоидных фибробластах (164), вызывая снижение уровней PTEN , который является супрессором опухоли с широким спектром последующих эффектов на поддержание и морфологию клеток через PI3K / AKT / mTOR (165).Интересно, что повышенные уровни супрессоров опухолей, таких как PML , также наблюдаются в гиперцеллюлярных областях келоидов, что указывает на старение как фактор, придающий келоидам их доброкачественную природу (166). Вполне вероятно, что согласованное взаимодействие между этими факторами приводит к квазинопластическому поведению келоидов.
Индукция ангиогенеза: роль гипоксии в келоидной биоэнергетике
Эффект Варбурга — это явление в раковых клетках, в котором метаболизм благоприятствует, а АТФ производится посредством анаэробного гликолиза в пользу окислительного метаболизма.В раковых клетках скорость поглощения глюкозы резко увеличивается, что приводит к выработке лактата, несмотря на наличие полностью функционирующих митохондрий и доступность кислорода. В частности, это относится к повышенной скорости гликолиза, за которым следует всплеск молочнокислого брожения, даже если нет недостатка в кислороде (167, 168). Точно так же было обнаружено, что келоидные фибробласты предпочтительно используют гликолитический путь вместо окислительного фосфорилирования, последнее из которых используется нормальными фибробластами.Способность келоидных фибробластов подключаться к более широкому источнику энергии может объяснить, почему келоиды процветают в гипоксической микросреде. Действительно, в том же исследовании сообщается, что келоидные фибробласты имеют больше АТФ, в 3,7 раза более активны, чем нормальные фибробласты, и демонстрируют более низкие уровни активных форм кислорода (АФК), которые являются побочным продуктом окислительного фосфорилирования митохондрий (22). Считается, что переход на аэробный гликолиз в опухолях как средство производства АТФ является результатом гликолитических ферментов, активируемых HIF-α (169), который также активируется в келоидах (170, 171).Эти данные подтверждаются более высокими уровнями лактата в келоидах из-за гликолиза и увеличением синтеза келоидного АТФ при воздействии гипоксии (89, 172). Поскольку опухоли становятся все более зависимыми от гликолиза по мере прогрессирования опухоли (173), может быть даже возможно коррелировать рост келоидов с их использованием гликолиза как формы определения стадии келоидного заболевания.
Считается, что гипоксия способствует пролиферации опухолей и инвазивности рака (174). В келоидах локальная гипоксия в зоне повреждения ускоряет заживление ран, стимулируя ангиогенез и стимулируя пролиферацию фибробластов (175), о чем свидетельствует индуцированная гипоксией экспрессия фактора роста эндотелия сосудов (VEGF) (176) в келоидных фибробластах и более высокая плотность кровеносных сосудов. в келоидах, чем в нормальной дерме и рубцах.Помимо ангиогенеза, гипоксия-индуцированная конверсия фибробластов в миофибробластоподобные преобразования также наблюдалась в келоидах и, как предполагается, происходит посредством пути TGF-β1 / Smad3 (177). Ангиогенез жизненно важен для развития многих кожных заболеваний (178). Гипоксия вызывает активацию HIF-α1 как в келоидах, так и при раке (179). Это приводит к активации Twist, который опосредует переключение кадгерина, связанное с EMT, и является главным регулятором морфогенеза и других эмбриональных процессов (180).
Периостин, белок клеточной адгезии ECM (128), увеличивается в физиологических процессах, связанных с восстановлением кожи, фиброзом, пролиферацией клеток и ремоделированием ECM, а также опухолевыми процессами, такими как рост и метастазирование (181).Периостин увеличивает ангиогенез, активируя пути ERK1 / 2 и киназы фокальной адгезии (FAK), увеличивая экспрессию VEGF и ангиопоэтина-1 (Ang-1) (182). Специфический для келоидов периостин связан с повышением способности келоидных фибробластов мигрировать и вторгаться в окружающие ткани при гипоксии (183). Экспрессия периостина активируется гипоксией через HIF-1α-зависимый путь (183). Другой группой вовлеченных белков рецепторов клеточного адгезива являются интегрины, которые, как полагают, взаимодействуют с периостином для облегчения EMT, ангиогенеза и подвижности хондроцитов, фибробластов и раковых клеток (184).Периостин способствует ангиогенезу при раке желудка, груди и яичников (185, 186).
Активация вторжения и метастазирования
Появляется все больше свидетельств того, что ЭМП играет важную роль в патофизиологии келоидов. Хотя известно, что ЭМП способствует миграционному поведению метастатических клеток, доброкачественная природа келоидов не позволяет понять, являются ли они результатом фиброзной ЭМП типа II или приостановленной метастатической ЭМП типа III (187). Нет доказательств значительного разрушения зоны эпидермально-дермальной базальной мембраны (BMZ) или нарушения экспрессии коллагена IV в BMZ келоидов (188), что может объяснить, почему они не метастазируют.Изучение других факторов подвижности клеток в келоидах может выявить уникальные ключевые факторы предотвращения метастазов.
Е-кадгерин, компонент эпителиальных адгезивных соединений, кодируется CDh2 и теряется в раковых клетках, подвергающихся EMT (189). Хотя уровни экспрессии гена CDh2 схожи в нормальных и келоидных кератиноцитах, келоиды экспрессируют пониженные уровни белка E-кадгерина (188, 190), что соответствует переключению кадгерина с E-кадгерина на мезенхимальные маркеры, такие как N-кадгерин (191). , фибронектин-1, виментин и кадгерин-11.Действительно, виментин, фибронектин-1 и кадгерин-11 были идентифицированы в келоидах со сверхэкспрессией фибронектина-1 (23, 49). Виментин, который обычно экспрессируется в опухолях мягких тканей, сильно экспрессируется в келоидных кератиноцитах (190) и связан с изменениями формы, подвижности и адгезионных свойств во время ЭМП (192). N-кадгерин, который связан с повышенной подвижностью опухолевых клеток (193) и прогрессированием (194), еще предстоит изучить в келоидах. Integrin-connected kinase (ILK), которая обычно участвует в регуляции передачи сигналов ECM (195, 196), ведет к супрессии E-cadherin и способствует инвазивности опухоли (197-200) наряду с фибробластным фенотипом при аберрантной активации EMT.При базально-клеточной карциноме экспрессия ILK приводит к повышенной инвазивности опухоли и увеличению маркеров EMT за счет активации Snail , β-катенина и α-SMA (197). β-катенин повышен в ядре и цитоплазме клеток, подвергающихся ЭМП. Точно так же более высокий уровень активности белка β-катенина был обнаружен в келоидных кератиноцитах по сравнению с нормальными кератиноцитами и обратно пропорционален экспрессии E-кадгерина, несмотря на отсутствие значительных различий на уровне транскрипции (140).
При повреждении эпидермальные кератиноциты индуцируют дермальные фибробласты для образования элементов келоидного матрикса путем экспрессии генов, участвующих в эпителиально-мезенхимальном переходе (EMT) (201), и усиления экспрессии медиаторов воспаления, таких как COX1 и COX2, в келоидных фибробластах, эндотелиальных клетках и т.д. и воспалительные клетки (202).Фенотип, подобный фибробластам, в этих келоидных кератиноцитах потенциально поддерживается местной гипоксической средой в келоидах, которая увеличивает инвазивность этих кератиноцитов, тем самым приводя к чрезмерному росту келоидов (202).
Известно, что микроРНКспособствуют онкогенезу и метастазированию, регулируя посттранскрипционную и трансляционную экспрессию генов в клеточной пролиферации, ЕМТ и раковых стволовых клетках (203, 204). Это может объяснить несколько наблюдений в келоидах, например, снижение плотности эластических волокон в келоидах, несмотря на нормальную экспрессию эластина , кодирующую эластичные волокна (205).MiR-21-5p, который опосредует PTEN в келоидах, также способствует EMT в келоидах (188, 206), тем самым предполагая поддержание фенотипа EMT в келоидных кератиноцитах за счет проявления их эффектов, подобных стволовым клеткам (206). Это важно, поскольку утверждается, что MiR-21-5p сверхэкспрессируется при большинстве раковых заболеваний и различных фиброзных расстройствах, таких как поражение кожи, почек и сердечно-легочной системы (206, 207).
Кроме того, рецептор инсулиноподобного фактора роста-I, который способствует инвазивности фибробластов, в келоидных фибробластах сильно регулируется по сравнению с нормальными фибробластами (208).Остеопонтин является основным цитокином, который способствует межклеточному взаимодействию, прогрессированию опухоли, ангиогенезу и устойчивости к апоптозу при злокачественных новообразованиях (120). Он проявляется в келоидах, коже и мезенхимальных опухолях. S100 влияет на хондроидную метаплазию фибробластов в фиброхрящевые клетки (209) и экспрессируется в десмопластической меланоме (160), однако в небольших количествах он обнаруживается только в келоидах (132).
Сопротивление смерти клетки
Считается, что келоидные миофибробласты выдерживают длительное «заживление», избегая апоптоза (210), несмотря на длительную гипоксию.Опухолевые клетки могут избегать апоптоза через активируемый периостином путь Akt / PKB при гипоксии (211). В келоидах активация периостина связана с последующей активацией ERK1 / 2 (182), которая, как известно, регулирует функции Fra-1 и ZEB1 / 2 в онкогенезе (212). Нет единого мнения об уровнях апоптоза в келоидах. Ранее считалось, что келоиды избегают апоптоза, поддерживая более низкий уровень окислительного стресса (213). Более свежие данные противоречат этому; открытие увеличения ROS (125) и подавления Nrf2 (214) согласуется с другими статьями, предполагающими повышенную скорость апоптоза в келоидах (215, 216).Nrf2 защищает от окислительного стресса и различных заболеваний, включая рак (217, 218), тогда как ROS, как полагают, действует как вторичный посредник во внутриклеточной передаче сигналов (130), способствуя прогрессированию рака, так и как апоптотический агент, способствуя старению клеток (219). . Это предполагает возможность дифференциального ответа на АФК разными популяциями клеток.
Было обнаружено, что до восьми генов апоптоза подавлены среди 64 генов, которые были изучены в келоидах, по сравнению с нормальной кожей Sayah et al.(114). Среди них NIP3 известен проапоптозом, индуцируемым в ответ на гипоксию HIF-1α (115). Было нанесено на карту распределение апоптотических клеток, и было обнаружено, что они одинаковы в нормальных тканях, но их меньше и они сконцентрированы на краях келоидных тканей. С региональной точки зрения Luo et al. (220) подробно описали гетерогенную природу микроокружения и субклеточных областей в келоидах в отношении апоптоза. Внутри самой келоидной ткани апоптотические клетки сконцентрированы в гиперклеточных областях по краям и лишены центра, богатого коллагеном (221), что подтверждает предыдущие данные о p53 и Bcl-2 , локализующихся в тех же областях (79). .Согласованная повышающая и понижающая регуляция различных генов, связанных с апоптозом, в келоидных тканях предполагает взаимодействие этих факторов с канцерогенными способностями келоидов.
Келоиды экспрессируют несколько белков теплового шока (HSP), которые отвечают за повышение выживаемости клеток за счет межбелковых взаимодействий в ответ на стрессы (97, 222). HSP47, который жизненно важен для синтеза и созревания коллагена (223), высоко экспрессируется при карциномах головы, шеи (224) и поджелудочной железы (225).HSP90 увеличивается в ответ на клеточные стрессы для увеличения выживаемости клеток (97) и активируется в келоидах (98). Точно так же кластерин увеличивается при клеточном стрессе (226, 227) и инвазивных опухолях (228).
Исследование Yu et al. (140) обнаружили повышенную экспрессию Wnt10A, β-катенина и теломеразы в келоидах. Повышенная передача сигналов Wnt в келоидах способствует росту клеток за счет минимизации апоптоза за счет усиления активности β-катенина и теломеразы (140). В нормальных клетках β-катенин ингибируется Sox9 , что способствует хондрогенезу (229, 230).Неясно, активируются ли эти две молекулы одновременно, и если да, то каковы их эффекты на рост келоидов. Активность теломеразы, связанная с агрессивностью опухолей костей и мягких тканей, обнаруживается в 10% доброкачественных и 44% злокачественных опухолей (231). Было показано, что клетки-предшественники келоидов демонстрируют теломеразную активность, которая может опосредовать удлинение теломер за счет взаимодействия с IL-6 (39). Однако есть сообщения об уменьшении длины теломер (131) и подавлении активности теломеразы в келоидах, поскольку считается, что теломераза перестает функционировать после начальных стадий образования келоидов (232).Неудивительно, что длина теломер отрицательно коррелирует с уровнями АФК (131, 233).
Предполагается, что между опухолевыми клетками и их нишей стволовых клеток существует реципрокная защитная связь, о чем свидетельствует активация различных генов и белков в эндотелиальных клетках для повышения выживаемости в ответ на цитотоксические условия (234, 235). Роль сигналов микросреды (17, 236), которые способствуют связанным с хемокинами изменениям в келоидных фибробластах (237), была недавно исследована после аналогичных исследований эпигенетики в развитии рака (238, 239).Исследования профилей метилирования ДНК келоидной ткани и здоровой кожи предполагают, что метилирование ДНК может быть ключевым фактором патологии келоидов. Сюда входит открытие DNMT1 в келоидных фибробластах (240) и главных регуляторных генов, таких как пироксамид, трибутирин, PRKG2 и PENK в келоидной ткани (241–243). В других исследованиях были обнаружены доказательства модификации гистонов, таких как повышенная регуляция HDAC2 в келоидной ткани (244) и экспрессия некодирующих РНК в келоидах (245). Эти открытия важны, поскольку они представляют собой известные биомаркеры рака.Было обнаружено, что HSP, такие как HSP27, HSP47 и HSP70, сверхэкспрессируются в келоидах (246), при этом HSP27 и HSP70 связаны с раком (247).
Обеспечение репликативного бессмертия: роль ниши келоидных стволовых клеток
Стволовые клетки выполняют различные роли в заживлении кожных ран (248). Определенные популяции нескольких стволовых или стволовых клеток (249) были идентифицированы в келоидных тканях, включая гемопоэтические стволовые клетки, мезенхимальные стволовые клетки и келоидные клетки-предшественники (40).Судьба стволовых клеток, определяемая сигналами из микросреды ниши стволовых клеток (250), представляет собой строго регулируемый процесс в келоидах (251).
Популяция келоидных стволовых клеток-предшественников (KPCs) была описана в дерме, которая обладает способностью к множественной дифференцировке и самообновлению, последнее из которых может объяснять высокую частоту рецидивов в келоидах (39). Их теломеразная активность выше, чем у нормальных клеток-предшественников кожи, но ниже, чем у рака. Значение этого заключается в их корреляции с опухолевыми или раковыми стволовыми клетками (252), которые, как считается, происходят из взрослых стволовых клеток, мутировавших под влиянием нерегулируемой ниши стволовых клеток, после чего они становятся способными к неконтролируемому росту, постоянному самообновлению и множественная дифференцировка, что в конечном итоге приводит к раку.Они также могут играть роль в формировании устойчивости к лечению (253, 254). Роль ниши раковых стволовых клеток более подробно описана Боровски (255).
Как часть процесса заживления ран, организованная активация и взаимодействие между нейтрофилами, эозинофилами, Т-клетками, В-клетками, макрофагами и тучными клетками были продемонстрированы в келоидной ткани, а в последнее время наряду с келоидной лимфоидной тканью (KALT). ) (41, 256). В пределах KALT недавно было обнаружено, что примитивные клетки внутри эндотелия субэпидермальных микрососудов экспрессируют маркеры эмбриональных стволовых клеток (ESC) Oct4, Sox2, pSTAT3 и Nanog (112), что указывает на возможную связь между иммуногенностью и наличием стволовых клеток. клетки в келоидах.
Чувствительность к лечению рака
Доказательства высокого качества по лечению келоидов ограничены (257, 258). Более крупные келоиды часто требуют хирургического иссечения (259), при котором частота рецидивов достигает 100% в качестве монотерапии (8). Облучение, являющееся еще одним давно установившимся методом лечения, в литературе приводило к различным результатам. Первичное облучение образца из 84 неоперабельных келоидов в течение 5 недель привело к значительному регрессу на 97% в течение 18 месяцев (260).Другое исследование показало, что послеоперационная лучевая терапия в виде бета-излучения при 400 сГр два раза в неделю с суммарной дозой до 16 Гр приводила к сглаживанию шрамов у 67% пациентов, но не без побочных эффектов, таких как боль и атрофия, и вызывает частота рецидивов 21,2% (258, 261). Брахитерапия также дала положительные результаты: согласно недавнему исследованию, частота рецидивов составила 3,1% через 33,6 месяца (262). Было продемонстрировано, что в сочетании с хирургическим удалением и применением богатой тромбоцитами плазмы послеоперационная поверхностная лучевая терапия до трех фракций приводит к низкому уровню рецидивов заболевания (263).
Химиотерапия и агенты таргетной терапии также показали многообещающие результаты. Сорафениб, ингибитор тирозинкиназы, оказался эффективным в подавлении келоидной активности путем воздействия на пути TGF-β / Smad и MAPK / ERK, которые участвуют в росте келоидных фибробластов и процессах клеточного цикла (264). Недавний систематический обзор выявил, что 5-фторурацил после удаления в комбинации с триамцинолона ацетонидом является благоприятным лечением с отсутствием рецидивов до 92% (265) в так называемой «комбинированной терапии».Для сравнения, монотерапия с использованием кортикостероидов внутри очага поражения, терапия первой линии для келоидов (8) показала положительные результаты только у 77% пациентов (266). Частота рецидивов при тройной терапии, включающей хирургическое удаление, внутриповрежденные стероиды и силиконовую пластину, составила 4,6% (263), 9,1% (267) и 12,5% (268). Келоиды также чувствительны к опосредованной рекомбинантным аденовирусом генной терапии двойного суицида с использованием CDglyTK, который используется при раке (269).
Использование фотодинамической терапии (ФДТ) при келоидах привело к подавлению кровотока и уровня коллагена наряду с улучшением гибкости тканей (270).Это лечение рака, используемое при базально-клеточной карциноме Боуэна и актиническом кератозе, которое, как считается, подавляет фибропролиферацию через активацию АФК, опосредованную протопорфирином 9 (PpIX), которая, в свою очередь, является цитотоксической (271, 272). Хотя келоиды не являются метастатическими, их чувствительность к мультимодальному лечению рака предполагает аналогичные механизмы основного заболевания с туморогенезом.
Заключение
Идея о том, что келоиды ведут себя как доброкачественные местные агрессивные кожные опухоли, не нова, и это очевидно как по ее фенотипическим, так и по генетическим свойствам.Профиль экспрессии биомаркеров при этих заболеваниях подчеркивает поразительные параллели между келоидами и доброкачественными и злокачественными мезенхимальными опухолями на транскрипционном, трансляционном, клеточном и тканевом уровнях. Келоиды также обладают характеристиками, которые в определенной степени проявляют раковые клетки, в частности эффект Варбурга, который увеличивает выживаемость келоидных клеток при гипоксии. Кроме того, было обнаружено, что сигнальные пути, общие для этих заболеваний, формируют матричный состав келоидов с включением хондрогенных сигнатур.Это, в свою очередь, поддерживается ключевыми клетками, такими как меланоциты, кератиноциты, фибробласты и клетки семейства фиброцитов, которые участвуют в EMT и обладают свойствами, подобными стволовым клеткам. В пользу этого также постулируется ниша келоидных стволовых клеток. Многие важные факторы, связанные с опухолью, которые, как было показано, вносят вклад в общий патогенез, влияя на клеточные процессы, такие как апоптоз. На данный момент лечение рака келоидов показало обнадеживающие результаты, еще больше уменьшив тонкую грань между келоидами и раковыми опухолями.В совокупности это ставит множество вопросов, связанных с патобиологией келоидов, на которые необходимо ответить, чтобы понять, как каскад, охватывающий длительное, нерегулируемое заживление ран, достигает кульминации в раковых или квазинопластических процессах, которые приводят к образованию, прогрессированию келоидов и т.д. настойчивость и повторяемость. Это жизненно важно, поскольку оно может иметь значение для будущей терапии и дальнейших исследовательских исследований этой неуловимой болезни и тех, с которыми она имеет схожие свойства.
Авторские взносы
Обзорная статья была изначально задумана и структурирована AB. СТ провёл литературный поиск и написал статью. Н.К. внесла свой вклад путем чтения и редактирования. AB отредактировал всю статью.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2.Ли Дж.Й., Ян СС, Чао СК, Вонг Т.В. Гистопатологический дифференциальный диагноз келоида и гипертрофического рубца. Ам Дж. Дерматопатол . (2004) 26: 379–84. DOI: 10.1097 / 00000372-200410000-00006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Лу В-с, Чжэн С-д, Яо С-ч, Чжан Л-ф. Клинико-эпидемиологический анализ келоидов у китайских пациентов. Arch Dermatol Res . (2015) 307: 109–14. DOI: 10.1007 / s00403-014-1507-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Рамакришнан К.М., Томас К.П., Сундарараджан ЧР. Исследование 1000 пациентов с келоидами в Южной Индии. Пластиковый Реконстр Сург . (1974) 53: 276–80. DOI: 10.1097 / 00006534-197403000-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Мусто Т.А., Кутер Р.Д., Голд М.Х., Хоббс Ф.Д., Рамелет А.А., Шекспир П.Г. и др. Международные клинические рекомендации по лечению рубцов. Пластиковый Реконстр Сург . (2002) 110: 560–71. DOI: 10.1097 / 00006534-200208000-00031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Чипев С.С., Саймон М. Фенотипические различия между дермальными фибробластами из разных участков тела определяют их реакцию на напряжение и TGFbeta1. BMC Dermatol . (2002) 2:13. DOI: 10.1186 / 1471-5945-2-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Суарес Э., Сайед Ф., Расгадо Т.А., Уолмсли А., Мандал П., Баят А. Эквивалентная сила натяжения кожи изменяет поведение и фенотип келоидных фибробластов. Регенерация для восстановления ран . (2014) 22: 557–68. DOI: 10.1111 / wrr.12215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Кишер К.В., Шетлар М.Р., Чвапил М. Гипертрофические рубцы и келоиды: обзор и новая концепция их происхождения. Сканирующая электронная микросхема . (1982) (Pt 4): 1699–713.
PubMed Аннотация | Google Scholar
15. Маккарти С.М., Сайед Ф., Баят А. Влияние антигенного комплекса лейкоцитов человека на развитие кожного фиброза: иммуногенетическая перспектива. Акта Дерм Венереол . (2010) 90: 563–74. DOI: 10.2340 / 00015555-0975
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Баят А., Арскотт Дж., Оллиер В.Е., Макгрутер Д.А., Фергюсон М.В. Келоидная болезнь: клиническая значимость единичных рубцов в сравнении с множественными. Br J Plastic Surg . (2005) 58: 28–37. DOI: 10.1016 / j.bjps.2004.04.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Огава Р., Акаиси С. Эндотелиальная дисфункция может играть ключевую роль в патогенезе келоидных и гипертрофических рубцов — келоиды и гипертрофические рубцы могут быть сосудистыми нарушениями. Медицинские гипотезы . (2006) 96: 51–60. DOI: 10.1016 / j.mehy.2016.09.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Фергюсон М. В., Уитби Д. Д., Шах М., Армстронг Дж., Зиберт Дж. В., Лонгакер М. Т.. Образование рубцов: спектральная природа заживления ран у плода и взрослого. Пластиковый Реконстр Сург . (1996) 97: 854–60. DOI: 10.1097 / 00006534-199604000-00029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Винсент А.С., Фан Т.Т., Мукхопадхьяй А., Лим Х.Й., Холливелл Б., Вонг К.П.Келоидные фибробласты кожи человека демонстрируют биоэнергетику раковых клеток. Дж Инвест Дерматол . (2008) 128: 702–9. DOI: 10.1038 / sj.jid.5701107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Satish L, Lyons-Weiler J, Hebda PA, Wells A. Паттерны экспрессии генов в изолированных келоидных фибробластах. Регенерация для восстановления ран . (2006) 14: 463–70. DOI: 10.1111 / j.1743-6109.2006.00135.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Niessen FB, Spauwen PH, Schalkwijk J, Kon M. О природе гипертрофических рубцов и келоидов: обзор. Пластиковый Реконстр Сург . (1999) 104: 1435–58. DOI: 10.1097 / 00006534-1990-00031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Кимура К., Инадоми Т., Ямаути В., Йошида Ю., Кашимура Т., Теруи Т. Протуберанская дерматофибросаркома на груди с множеством клинических признаков, маскирующихся под келоид: действительно ли болезнь протекает? Энн Дерматол .(2014) 26: 643–5. DOI: 10.5021 / ad.2014.26.5.643
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Тонгди Э., Тулоэй К., Шитабата П.К., Шариф С., Маранда Э.Л. Келоидная атипичная фиброксантома: случай и обзор литературы. Корпус Rep Dermatol . (2016) 8: 156–63. DOI: 10.1159 / 000446343
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Канади Дж., Каррер С., Флек М., Боссерхофф А.К. Фиброзирующие заболевания соединительной ткани кожи: молекулярные сходства и различия. J Dermatol Sci . (2013) 70: 151–8. DOI: 10.1016 / j.jdermsci.2013.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Bienias W, Miȩkoś-Zydek B, Kaszuba A. Современные взгляды на этиопатогенез келоидов. Постэпы Дерматол Алергол . (2011) 28: 467–75.
Google Scholar
30. Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F. Классификация опухолей ВОЗ . 4-е изд. МАИР (2013).
31.Наито М., Кубота Х., Икеда М., Танака Т., Ширане Х., Сузуки С. и др. Экспрессия генов в келоидах человека изменяется от дермальной к хондроцитарной и остеогенной ветвям. Гены Клеток . (2005) 10: 1081–91. DOI: 10.1111 / j.1365-2443.2005.00902.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Баят А., Арскотт Дж., Оллиер В.Е., Фергюсон М.В., Мак Гроутер Д.А. Описание сайт-специфической морфологии келоидных фенотипов в афрокарибском населении. Br J Plastic Surg .(2004) 57: 122–33. DOI: 10.1016 / j.bjps.2003.11.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Кишер В.В., Тис А.С., Чвапил М. Периваскулярные миофибробласты и окклюзия микрососудов в гипертрофических рубцах и келоидах. Хум Патол . (1982) 13: 819–24. DOI: 10.1016 / S0046-8177 (82) 80078-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Powazniak Y, Kempfer AC, de la Paz Dominguez M, Farias C, Keller L, Calderazzo JC, et al.Влияние эстрадиола, прогестерона и тестостерона на индуцированную апоптозом и пролиферацией передачу сигналов MAPK в эндотелиальных клетках пупочной вены человека. Мол Мед Реп . (2009) 2: 441–7. DOI: 10.3892 / mmr_00000119
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Исфаханян Н., Шакиба Ю., Никбин Б., Сорая Х., Малеки-Дизаджи Н., Гази-Хансари М. и др. Влияние метформина на пролиферацию, миграцию и экспрессию MMP-2 и -9 эндотелиальных клеток пупочной вены человека. Мол Мед Реп . (2012) 5: 1068–74. DOI: 10.3892 / mmr.2012.753
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Syed F, Ahmadi E, Iqbal SA, Singh S, McGrouther DA, Bayat A. Фибробласты на растущей границе келоидных рубцов производят более высокие уровни коллагена I и III по сравнению с участками внутри очага поражения и вне очага поражения: клинические последствия для участка поражения — направленная терапия. Br J Дерматол . (2011) 164: 83–96. DOI: 10.1111 / j.1365-2133.2010.10048.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Чжан К., Ямаза Т., Келли А.П., Ши С., Ван С., Браун Дж. И др. Опухолевые стволовые клетки, полученные из келоидов человека, регулируются воспалительной нишей, управляемой осью IL-17 / IL-6. ПЛОС ОДИН . (2009) 4: e7798. DOI: 10.1371 / journal.pone.0007798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Икбал С.А., Сайед Ф., Макгрутер Д.А., Паус Р., Баят А. Дифференциальное распределение гематопоэтических и негематопоэтических клеток-предшественников в келоиде внутри очага поражения и вне очага поражения: создают ли келоидные рубцы нишу для негематопоэтических мезенхимальных стволовых клеток? Br J Дерматол .(2010) 162: 1377–83. DOI: 10.1111 / j.1365-2133.2010.09738.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Хуанг С., Акаиси С., Хякусоку Х., Огава Р. Келоид и гипертрофический рубец — разные формы одного и того же заболевания? Гипотеза фибропролиферативного кожного заболевания, основанная на келоидных исследованиях. Внутр. Рана J . (2014) 11: 517–22. DOI: 10.1111 / j.1742-481X.2012.01118.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42.Эндрюс Дж. П., Марттала Дж., Макарак Э., Розенблум Дж., Уитто Дж. Келоиды: парадигма фиброза кожи — патомеханизмы и лечение. Матрикс Биол . (2016) 51: 37–46. DOI: 10.1016 / j.matbio.2016.01.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Ashcroft KJ, Syed F, Bayat A. Сайт-специфичные келоидные фибробласты изменяют поведение нормальной кожи и нормальных фибробластов рубца посредством паракринной передачи сигналов. ПЛОС ОДИН . (2013) 8: e75600. DOI: 10.1371 / journal.pone.0075600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Беллини А., Маттоли С. Роль фиброцитов, мезенхимальных предшественников костного мозга, в реактивных и репаративных фиброзах. Лаборатория Инвест . (2007) 87: 858–70. DOI: 10.1038 / labinvest.3700654
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Мори Л., Беллини А., Стейси М.А., Шмидт М., Маттоли С. Фиброциты вносят вклад в популяцию миофибробластов в раненой коже и происходят из костного мозга. Exp Cell Res . (2005) 304: 81–90. DOI: 10.1016 / j.yexcr.2004.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Икбал С.А., Сиджвик Г.П., Баят А. Идентификация фиброцитов из мезенхимальных стволовых клеток в келоидной ткани: потенциальный источник аномальных фибробластов в келоидных рубцах. Arch Dermatol Res . (2012) 304: 665–71. DOI: 10.1007 / s00403-012-1225-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Chen W, Fu X, Sun X, Sun T, Zhao Z, Sheng Z. Анализ дифференциально экспрессируемых генов в келоидах и нормальной коже с помощью микроматрицы кДНК. J Surg Res . (2003) 113: 208–16. DOI: 10.1016 / S0022-4804 (03) 00188-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Bux S, Madaree A. Келоиды показывают региональное распределение пролиферативных и дегенеративных элементов соединительной ткани. Клетки и ткани органов . (2010) 191: 213–34. DOI: 10.1159 / 000231899
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51.Verhaegen PD, van Zuijlen PP, Pennings NM, van Marle J, Niessen FB, van der Horst CM, et al. Различия в архитектуре коллагена между келоидом, гипертрофическим рубцом, нормотрофическим рубцом и нормальной кожей: объективный гистопатологический анализ. Регенерация для восстановления ран . (2009) 17: 649–56. DOI: 10.1111 / j.1524-475X.2009.00533.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Ульрих Д., Ульрих Ф., Унглауб Ф., Пятковски А., Паллуа Н. Матричные металлопротеиназы и тканевые ингибиторы металлопротеиназ у пациентов с различными типами рубцов и келоидов. J Plast Reconstr Aesthet Surg . (2010) 63: 1015–21. DOI: 10.1016 / j.bjps.2009.04.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Roomi MW, Monterrey JC, Kalinovsky T, Rath M, Niedzwiecki A. Паттерны экспрессии MMP-2 и MMP-9 в линиях раковых клеток человека. Онкол Реп . (2009) 21: 1323–33. DOI: 10.3892 / or_00000358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Онг CT, Khoo YT, Mukhopadhyay A, Do DV, Lim IJ, Aalami O, et al.mTOR как потенциальная терапевтическая мишень для лечения келоидов и чрезмерных рубцов. Эксперимент Дерматол . (2007) 16: 394–404. DOI: 10.1111 / j.1600-0625.2007.00550.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Чен Дж., Чжуо С., Цзян Х, Чжу Х, Чжэн Л., Се С. и др. Мультифотонная микроскопия изучает морфологические и количественные изменения компонентов коллагена и эластических волокон при келоидных заболеваниях. Дж. Биомед Опт . (2011) 16: 051305. DOI: 10.1117 / 1,3569617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Amadeu TP, Braune AS, Porto LC, Desmoulière A, Costa AM. Фибриллин-1 и эластин по-разному экспрессируются в гипертрофических рубцах и келоидах. Регенерация для восстановления ран . (2004) 12: 169–74. DOI: 10.1111 / j.1067-1927.2004.012209.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Икеда М., Наито М., Кубота Х., Исико Т., Йошикава К., Ямаваки С. и др. Сборка эластичных волокон нарушается из-за чрезмерного накопления хондроитинсульфата при фиброзном заболевании кожи человека, келоиде. Биохимия Биофиз Рес Коммуна . (2009) 390: 1221–8. DOI: 10.1016 / j.bbrc.2009.10.125
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Куни К.А., Джушегани Ф., Яо-Боренгассер А., Фанаван Б., Гомес Т., Кибер-Эммонс А.М. и др. Хондроитинсульфаты играют важную роль в метастазировании рака молочной железы: роль экспрессии генов CSPG4 и CHST11 в формировании поверхностных лигандов P-селектина в агрессивных клетках рака молочной железы. Резолюция о раке молочной железы . (2011) 13: R58.DOI: 10.1186 / bcr2895
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Янагисава Х., Шлутерман М.К., Бреккен Р.А. Фибулин-5, интегрин-связывающий матрицеклеточный белок: его функция в развитии и заболевании. Сигнал сотовой связи J . (2009) 3: 337–47. DOI: 10.1007 / s12079-009-0065-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Ли Й.Х., Альбиг А.Р., Регнер М., Шиманн Б.Дж., Шиманн В.П. Фибулин-5 инициирует эпителиально-мезенхимальный переход (EMT) и усиливает EMT, индуцированный TGF-бета в эпителиальных клетках молочной железы, посредством MMP-зависимого механизма. Канцерогенез . (2008) 29: 2243–51. DOI: 10,1093 / carcin / bgn199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Donet M, Brassart-Pasco S, Salesse S, Maquart FX, Brassart B. Пептиды эластина регулируют миграцию и инвазию клеток фибросаркомы HT-1080 через Hsp90-зависимый механизм. Брайан Дж. Рак . (2014) 111: 139–48. DOI: 10.1038 / bjc.2014.239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64.Хэнли К.П., Окли Ф., Сагден С., Уилсон Д.И., Манн Д.А., Хэнли Н.А. Эктопический SOX9 опосредует отложение внеклеточного матрикса, характерное для фиброза органов. J Biol Chem. (2008) 283: 14063–71. DOI: 10.1074 / jbc.M7073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Инуи С., Шоно Ф., Накадзима Т., Хосокава К., Итами С. Идентификация и характеристика белка олигомерного матрикса хряща как нового патогенного фактора келоидов. Ам Дж. Патол .(2011) 179: 1951–60. DOI: 10.1016 / j.ajpath.2011.06.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Агарвал П., Шульц Дж. Н., Блумбах К., Андреассон К., Хейнегард Д., Полссон М. и др. Повышенное отложение белка олигомерного матрикса хряща является обычным признаком фиброзных кожных патологий. Матрикс Биол . (2013) 32: 325–31. DOI: 10.1016 / j.matbio.2013.02.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Ямамото М., Такахаши Х., Судзуки С., Наисиро Ю., Ямамото Х., Имаи К. и др.Белок олигомерного матрикса хряща при системном склерозе. Ревматология . (2007) 46: 1858–9. DOI: 10.1093 / ревматология / kem254
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Энглунд Э., Бартошек М., Рейтсма Б., Якобссон Л., Эскудеро-Эспарза А., Оримо А. и др. Белок олигомерного матрикса хряща способствует развитию и метастазированию рака груди. Онкоген . (2016) 35: 5585–96. DOI: 10.1038 / onc.2016.98
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69.Лю Т.Т., Лю XS, Чжан М., Лю XN, Чжу FX, Чжу FM и др. Белок олигомерного матрикса хряща является прогностическим фактором и биомаркером рака толстой кишки и способствует пролиферации клеток за счет активации пути Akt. J Cancer Res Clin Oncol . (2018) 144: 1049–63. DOI: 10.1007 / s00432-018-2626-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Hunzelmann N, Anders S, Sollberg S, Schonherr E, Krieg T. Координировать индукцию экспрессии коллагена I типа и бигликана в келоидах. Br J Дерматол . (1996) 135: 394–9. DOI: 10.1111 / j.1365-2133.1996.tb01502.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Адани Р., Хеймер Р., Катерсон Б., Соррелл Дж. М., Иоццо Р. В.. Измененная экспрессия хондроитинсульфат протеогликана в строме карциномы толстой кишки человека. Гипометилирование гена PG-40 коррелирует с повышенным содержанием PG-40 и уровнями мРНК. Дж. Биол. Хим. . (1990) 265: 11389–96.
PubMed Аннотация | Google Scholar
72.Hunzelmann N, Schonherr E, Bonnekoh B, Hartmann C, Kresse H, Krieg T. Измененная иммуногистохимическая экспрессия малых протеогликанов в опухолевой ткани и строме базальноклеточной карциномы. Дж Инвест Дерматол . (1995) 104: 509–13. DOI: 10.1111 / 1523-1747.ep12605979
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Тан Е.М., Хоффрен Дж., Роуда С., Гринбаум С., Фокс Дж. Уайт, Мур Дж. Х. младший и др. Экспрессия генов декорина, версикана и бигликана келоидными и нормальными дермальными фибробластами: дифференциальная регуляция с помощью основного фактора роста фибробластов. Exp Cell Res . (1993) 209: 200–7. DOI: 10.1006 / excr.1993.1302
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Skubitz KM. Биология и лечение агрессивного фиброматоза или десмоидной опухоли. Mayo Clin Proc . (2017) 92: 947–64. DOI: 10.1016 / j.mayocp.2017.02.012
CrossRef Полный текст | Google Scholar
76. Locci P, Balducci C, Lilli C, Marinucci L, Becchetti E, Dolci C, et al. Десмоидные и фибромные опухоли по-разному реагируют на стимул TGFbeta (1) и накопление макромолекул ECM. Биомед Фармакотер . (2007) 61: 131–6. DOI: 10.1016 / j.biopha.2006.09.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Стивала А, Ломбардо Г.А., Помпили Дж., Тарико М.С., Фраггетта Ф., Перротта РЭ. Протуберанская дерматофибросаркома: наш опыт 59 случаев. Онкол Летт . (2012) 4: 1047–55. DOI: 10.3892 / ol.2012.887
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Ladin DA, Hou Z, Patel D, McPhail M, Olson JC, Saed GM, et al.p53 и изменения апоптоза келоидов и келоидных фибробластов. Регенерация для восстановления ран . (1998) 6: 28–37. DOI: 10.1046 / j.1524-475X.1998.60106.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Bovee JV, van den Broek LJ, Cleton-Jansen AM, Hogendoorn PC. Повышение экспрессии PTHrP и Bcl-2 характеризует прогрессирование остеохондромы в сторону периферической хондросаркомы и является поздним событием при центральной хондросаркоме. Лаборатория Инвест .(2000) 80: 1925–34. DOI: 10.1038 / labinvest.3780202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Теофоли П., Бардуаньи С., Рибуффо М., Кампанелла А., Де Пита О., Пудду П. Экспрессия протоонкогенов Bcl-2, p53, c-jun и c-fos в келоидах и гипертрофических рубцах. J Dermatol Sci. (1999) 22: 31–7. DOI: 10.1016 / S0923-1811 (99) 00040-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Асано Н., Ямакази Т., Сето М., Мацумине А., Йошикава Х., Учида А.Экспрессия и прогностическое значение костного морфогенетического белка-2 у пациентов со злокачественной фиброзной гистиоцитомой. J Bone Joint Surg B . (2004) 86: 607–12. DOI: 10.1302 / 0301-620X.86B4.14484
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Уилкинсон Д.Г., Бхатт С., Райзек Р.П., Браво Р. Тканеспецифическая экспрессия c-jun и junB во время органогенеза у мышей. Развитие . (1989) 106: 465–71.
PubMed Аннотация | Google Scholar
85.Сиолетик С., Чаплински Дж., Ху Л., Флетчер Дж. А., Флетчер С. Д., Вагнер А. Дж. И др. c-Jun способствует миграции клеток и стимулирует экспрессию фактора подвижности ENPP2 в саркомах мягких тканей. Дж. Патол . (2014) 234: 190–202. DOI: 10.1002 / path.4379
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Laner-Plamberger S, Kaser A, Paulischta M, Hauser-Kronberger C, Eichberger T, Frischauf AM. Сотрудничество между GLI и JUN усиливает транскрипцию JUN и выбранных генов-мишеней GLI. Онкоген . (2009) 28: 1639–51. DOI: 10.1038 / onc.2009.10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Shin JU, Kim SH, Kim H, Noh JY, Jin S, Park CO и др. TSLP является потенциальным инициатором синтеза коллагена и активатором оси CXCR4 / SDF-1 в патогенезе келоидов. Дж Инвест Дерматол . (2016) 136: 507–15. DOI: 10.1016 / j.jid.2015.11.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Zhang Q, Oh CK, Messadi DV, Duong HS, Kelly AP, Soo C, et al.Вызванное гипоксией накопление HIF-1 альфа увеличивается в совместной культуре келоидных фибробластов и тучных клеток человека: вовлечение ERK1 / 2 и PI-3K / Akt. Exp Cell Res . (2006) 312: 145–55. DOI: 10.1016 / j.yexcr.2005.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Cohly HHP, Scott H, Ndebele2 K, Jenkins JK, Angel MF. Дифференциальная экспрессия генов фибробластов: келоид по сравнению с нормальным. Int J Mol Sci . (2002) 3: 1162–76. DOI: 10.3390 / i3111162
CrossRef Полный текст | Google Scholar
92.Мелен П., Шульце-Остхофф К., Арриго А.П. Малые стрессовые белки как новые регуляторы апоптоза. Белок теплового шока 27 блокирует гибель клеток, вызванную Fas / APO-1 и стауроспорином. Дж. Биол. Хим. . (1996) 271: 16510–4. DOI: 10.1074 / jbc.271.28.16510
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Гарридо С., Брюнет М., Дидело С., Зермати Ю., Шмитт Е., Кремер Г. Белки теплового шока 27 и 70: антиапоптотические белки с канцерогенными свойствами. Cell Cycle. (2006) 5: 2592–601. DOI: 10.4161 / cc.5.22.3448
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Уозаки Х., Исида Т., Какиучи К., Хориучи Х., Гото Т., Иидзима Т. и др. Экспрессия белков теплового шока при остеосаркоме и ее связь с прогнозом. Патол Рес Прак . (2000) 196: 665–73. DOI: 10.1016 / S0344-0338 (00) 80118-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Наито М., Хосокава Н., Кубота Х., Танака Т., Ширане Х., Савада М. и др.Повышенная регуляция HSP47 и коллагена III типа при фиброзе кожи, келоиде. Биохимия Биофиз Рес Коммуна . (2001) 280: 1316–22. DOI: 10.1006 / bbrc.2001.4257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Ли У. Дж., Ли Дж. Х., Ан Х. М., Сон С. Ю., Ким Й.О., Лью Д.Х. и др. Ингибитор белка теплового шока 90 снижает синтез коллагена в келоидных фибробластах и ослабляет внеклеточный матрикс на модели келоидного сфероида. Пластиковый Реконстр Сург .(2015) 136: 328e − 37e. DOI: 10.1097 / PRS.0000000000001538
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Lim CP, Phan TT, Lim IJ, Cao X. Stat3 вносит вклад в патогенез келоидов, способствуя выработке коллагена, пролиферации и миграции клеток. Онкоген . (2006) 25: 5416–25. DOI: 10.1038 / sj.onc.1209531
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Газизаде М., Тоса М., Симидзу Х., Хьякусоку Х., Каванами О.Функциональное значение сигнального пути IL-6 в патогенезе келоидов. Дж Инвест Дерматол . (2007) 127: 98–105. DOI: 10.1038 / sj.jid.5700564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Онг CT, Khoo YT, Mukhopadhyay A, Masilamani J, Do DV, Lim IJ, et al. Сравнительный протеомный анализ нормальной кожи и келоидного рубца. Br J Дерматол . (2010) 162: 1302–15. DOI: 10.1111 / j.1365-2133.2010.09660.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Николофф Б.Дж., Линген М.В., Чанг Б.Д., Шен М., Свифт М., Карри Дж. И др. Супрессор опухолей маспин активируется во время старения кератиноцитов, проявляя паракринную антиангиогенную активность. Cancer Res . (2004) 64: 2956–61. DOI: 10.1158 / 0008-5472.CAN-03-2388
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Zou Z, Gao C, Nagaich AK, Connell T, Saito S, Moul JW и др. p53 регулирует экспрессию гена-супрессора опухолей маспина. Дж. Биол. Хим. .(2000) 275: 6051–4. DOI: 10.1074 / jbc.275.9.6051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Стетлер-Стивенсон В.Г., Азнавурян С., Лиотта Л.А. Взаимодействие опухолевых клеток с внеклеточным матриксом во время инвазии и метастазирования. Анну Рев Клетка Биол . (1993) 9: 541–73. DOI: 10.1146 / annurev.cb.09.110193.002545
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Curran S, Murray GI. Матричные металлопротеиназы: молекулярные аспекты их роли в инвазии и метастазировании опухолей. Eur J Cancer . (2000) 36: 1621–30. DOI: 10.1016 / S0959-8049 (00) 00156-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Ян Х. К., Чон К. К., Ким Ю. К., Юнг СТ. Роль матриксной металлопротеиназы (MMP) 2 и MMP-9 в саркоме мягких тканей. Clin Orthop Surg . (2014) 6: 443–54. DOI: 10.4055 / cios.2014.6.4.443
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Танриверди-Акхисароглу С., Мендерес А., Октай Г. Активность матричных металлопротеиназ-2 и -9 в келоидах человека, гипертрофических и атрофических рубцах: пилотное исследование. Функция Cell Biochem . (2009) 27: 81–7. DOI: 10.1002 / cbf.1537
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Ли Х, Нахас З., Фенг Ф., Элиссефф Дж. Х., Боахен К. Тканевая инженерия для анализа in vitro матриксных металлопротеиназ в патогенезе келоидных поражений. JAMA Facial Plast Surg . (2013) 15: 448–56. DOI: 10.1001 / jamafacial.2013.1211
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109.Пардо П.С., Люн Дж. К., Луччеси Дж. К., Перейра-Смит О. М.. MRG15, новый хромодоменный белок, присутствует в двух различных мультибелковых комплексах, участвующих в активации транскрипции. Дж. Биол. Хим. . (2002) 277: 50860–6. DOI: 10.1074 / jbc.M203839200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Сайед Ф., Шерис Д., Паус Р., Вармех С., Сингх С., Пандольфи П.П. и др. Келоидное заболевание можно подавить, подавляя избыточную передачу сигналов mTOR с помощью нового двойного ингибитора TORC1 / 2. Ам Дж. Патол . (2012) 181: 1642–58. DOI: 10.1016 / j.ajpath.2012.08.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Джетер С.Р., Ян Т., Ван Дж., Чао Х.П., Тан Д.Г. Краткий обзор: NANOG в раковых стволовых клетках и развитии опухолей: обновленная информация и нерешенные вопросы. Стволовые клетки . (2015) 33: 2381–90. DOI: 10.1002 / стержень.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Грант С., Чудакова Д.А., Итинтеанг Т., Чибналл А.М., Браш HD, Дэвис П.Ф. и др.Экспрессия маркеров эмбриональных стволовых клеток в келоид-ассоциированной лимфоидной ткани. Дж. Клин Патол . (2016) 69: 643–6. DOI: 10.1136 / jclinpath-2015-203483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Wicki A, Lehembre F, Wick N, Hantusch B, Kerjaschki D, Christofori G. Инвазия опухоли при отсутствии эпителиально-мезенхимального перехода: опосредованное подпланином ремоделирование актинового цитоскелета. Cancer Cell. (2006) 9: 261–72. DOI: 10.1016 / j.ccr.2006.03.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Sayah DN, Soo C, Shaw WW, Watson J, Messadi D, Longaker MT и др. Подавление генов, связанных с апоптозом, в келоидных тканях. J Surg Res . (1999) 87: 209–16. DOI: 10.1006 / jsre.1999.5761
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Syed F, Bayat A. Сигнальный путь Notch при келоидном заболевании: усиление активности фибробластов зависимым от пептида Jagged-1 образом в очаге поражения vs.внелезионные фибробласты. Регенерация для восстановления ран . (2012) 20: 688–706. DOI: 10.1111 / j.1524-475X.2012.00823.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Лю Л., Чжан Дж, Фанг Ц., Чжан З., Фенг Y, Си X. OCT4 опосредует ФСГ-индуцированный эпителиально-мезенхимальный переход и инвазию через сигнальный путь ERK1 / 2 при эпителиальном раке яичников. Биохимия Биофиз Рес Коммуна . (2015) 461: 525–32. DOI: 10.1016 / j.bbrc.2015.04.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121.Мираглиотта В., Пироне А., Донадио Е., Абрамо Ф., Риккарди М. П., Теорет CL. Экспрессия остеопонтина в заживлении ран лошадей и келоидов человека. Equine Vet J. (2016) 48: 72–7. DOI: 10.1111 / evj.12372
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122. Лу Ф, Гао Дж, Огава Р., Хякусоку Х., Оу С. Биологические различия между фибробластами, происходящими из периферических и центральных областей келоидных тканей. Пластиковый Реконстр Сург . (2007) 120: 625–30.DOI: 10.1097 / 01.prs.0000270293.93612.7b
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Де Феличе Б., Гарби С., Санториелло М., Сантильо А., Уилсон Р.Р. Дифференциальные маркеры апоптоза келоидов человека и фибробластов гипертрофических рубцов. Мол Клетки Биохим . (2009) 327: 191–201. DOI: 10.1007 / s11010-009-0057-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Мауэс де Паула А., Васильевич А., Джорджи Р., Гомес-Броуше А., Обер С., Лерой X и др.Диагноз гигантской клеточной опухоли кости подтверждается иммуногистохимическим анализом p63, когда окрашивается более 50% клеток. Арка Вирхова . (2014) 465: 487–94. DOI: 10.1007 / s00428-014-1637-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
128. Норрис Р.А., Дэймон Б., Миронов В., Касьянов В., Рамамурти А., Морено-Родригес Р. и др. Периостин регулирует фибриллогенез коллагена и биомеханические свойства соединительных тканей. Дж. Клетка Биохимия .(2007) 101: 695–711. DOI: 10.1002 / jcb.21224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
129. Фукуда К., Сугихара Е., Охта С., Изухара К., Фунакоши Т., Амагай М. и др. Периостин является ключевым нишевым компонентом при раневых метастазах меланомы. ПЛОС ОДИН . (2015) 10: e0129704. DOI: 10.1371 / journal.pone.0129704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Baeuerle PA, Rupec RA, Pahl HL. Реактивный кислород является промежуточным звеном в качестве вторичных посредников общей реакции патогенов. Патол Биол . (1996) 44: 29–35.
PubMed Аннотация | Google Scholar
132. Хунасги С., Конеру А., Ванишри М., Шамала Р. Келоид: отчет о случаях и обзор патофизиологии и различий между келоидными и гипертрофическими рубцами. J Oral Maxillofac Pathol . (2013) 17: 116–20. DOI: 10.4103 / 0973-029X.110701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
133. Гебхардт С., Риль А., Дурчдевальд М., Немет Дж., Фюрстенбергер Г., Мюллер-Декер К. и др.Передача сигналов RAGE поддерживает воспаление и способствует развитию опухоли. J Exp Med . (2008) 205: 275–85. DOI: 10.1084 / jem.20070679
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Basu-Roy U, Seo E, Ramanathapuram L, Rapp TB, Perry JA, Orkin SH, et al. Sox2 поддерживает самообновление опухолевых клеток при остеосаркомах. Онкоген . (2012) 31: 2270–82. DOI: 10.1038 / onc.2011.405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135.Boumahdi S, Driessens G, Lapouge G, Rorive S, Nassar D, Le Mercier M и др. SOX2 контролирует инициирование опухоли и функции раковых стволовых клеток при плоскоклеточной карциноме. Природа . (2014) 511: 246–50. DOI: 10.1038 / природа13305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Wehrli BM, Huang W, De Crombrugghe B, Ayala AG, Czerniak B. Sox9, главный регулятор хондрогенеза, отличает мезенхимальную хондросаркому от других небольших синеклеточных опухолей. Хум Патол . (2003) 34: 263–9. DOI: 10.1053 / hupa.2003.41
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Yu D, Shang Y, Yuan J, Ding S, Luo S, Hao L. Передача сигналов Wnt / β-катенина усугубляет пролиферацию келоидных клеток, регулируя теломеразу. Cell Physiol Biochem . (2016) 39: 2001–13. DOI: 10.1159 / 000447896
PubMed Аннотация | CrossRef Полный текст | Google Scholar
141. Игота С., Тоса М., Мураками М., Эгава С., Симидзу Х., Хякусоку Х. и др.Идентификация и характеристика сигнального пути Wnt в патогенезе келоидов. Int J Med Sci . (2013) 10: 344–54. DOI: 10.7150 / ijms.5349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
143. Чин Г.С., Лю В., Пелед З., Ли Т.Й., Штейнбрех Д.С., Хсу М. Дифференциальная экспрессия рецепторов трансформирующего фактора роста-бета I и II и активация Smad 3 в келоидных фибробластах. Пласт Реконстр Сург . (2001) 108: 423–9. DOI: 10.1097 / 00006534-200108000-00022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144.Чин Г.С., Лю В., Штайнбрех Д., Сюй М., Левинсон Х., Лонгакер М.Т. Передача клеточных сигналов путем фосфорилирования тирозина в келоидных и нормальных фибробластах кожи человека. Пластиковый Реконстр Сург . (2000) 106: 1532–40. DOI: 10.1097 / 00006534-200012000-00014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Лодиш Х., Берк А., Зипурски С.Л., Мацудаира П., Балтимор Д., Дарнелл Дж. Рецепторные тирозинкиназы и рас. Молекулярная клеточная биология . 4-е изд. Нью-Йорк, штат Нью-Йорк: W.Х. Фриман (2000).
146. Камеры I, Колби Д., Робертсон М., Николс Дж., Ли С., Твиди С. и др. Клонирование функциональной экспрессии Nanog, фактора поддержания плюрипотентности в эмбриональных стволовых клетках. Cell. (2003) 113: 643–55. DOI: 10.1016 / S0092-8674 (03) 00392-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
147. Мицуи К., Токудзава Ю., Ито Х., Сегава К., Мураками М., Такахаши К. и др. Гомеопротеин Nanog необходим для поддержания плюрипотентности эпибласта мыши и ES-клеток. Cell. (2003) 113: 631–42. DOI: 10.1016 / S0092-8674 (03) 00393-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Чанг Q, Bournazou E, Sansone P, Berishaj M, Gao SP, Daly L, et al. Петля прямой связи IL-6 / JAK / Stat3 управляет онкогенезом и метастазированием. Неоплазия . (2013) 15: 848–62. DOI: 10.1593 / neo.13706
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150. Беттингер Д.А., Ягер Д.Р., Дигельманн Р.Ф., Коэн И.К.Влияние TGF-бета на пролиферацию келоидных фибробластов и синтез коллагена. Пластиковый Реконстр Сург . (1996) 98: 827–33. DOI: 10.1097 / 00006534-199610000-00012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
152. Cui W, Fowlis DJ, Bryson S, Duffie E, Ireland H, Balmain A, et al. TGFbeta1 ингибирует образование доброкачественных опухолей кожи, но усиливает прогрессирование инвазивной карциномы веретена у трансгенных мышей. Cell. (1996) 86: 531–42.DOI: 10.1016 / S0092-8674 (00) 80127-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
153. Хайса М, Окочи Н, Гротендорст ГР. Повышенные уровни альфа-рецепторов PDGF в келоидных фибробластах способствуют усиленному ответу на PDGF. Дж Инвест Дерматол . (1994) 103: 560–3. DOI: 10.1111 / 1523-1747.ep12396856
PubMed Аннотация | CrossRef Полный текст | Google Scholar
157. Зенц Р., Эфер Р., Кеннер Л., Флорин Л., Хаммерих Л., Мехик Д. и др.Псориазоподобное заболевание кожи и артрит, вызванные индуцибельной эпидермальной делецией белков Jun. Природа . (2005) 437: 369–75. DOI: 10.1038 / nature03963
PubMed Аннотация | CrossRef Полный текст | Google Scholar
158. Дэн С.К., Чжу Д.Х., Чен Ю.Дж., Хуанг Т.Й., Пэн Ю., Лю С.Ю. и др. TRAF4 способствует пролиферации фибробластов в келоидах, дестабилизируя p53 посредством взаимодействия с деубиквитиназой USP10. Дж Инвест Дерматол . (2019). DOI: 10.1016 / j.jid.2019.03.1136
PubMed Аннотация | CrossRef Полный текст | Google Scholar
159. Саед Г.М., Ладин Д., Олсон Дж., Хан Х, Хоу З., Фивенсон Д. Анализ мутаций гена р53 в келоидах с использованием однонитевого конформационного полиморфизма на основе полимеразной цепной реакции и секвенирования ДНК. Арка Дерматол . (1998) 134: 963–7. DOI: 10.1001 / archderm.134.8.963
PubMed Аннотация | CrossRef Полный текст | Google Scholar
161. Ян Л., Лю XY, Ван CM, Цао Р, Инь YH, Цзя С.С. и др.Ассоциация между полиморфизмом кодона 72 гена р53 и келоидом в китайской популяции. Чжунхуа Чжэн Син Вай Кэ За Чжи . (2007) 23: 428-30.
PubMed Аннотация | Google Scholar
162. Zhuo Y, Gao JH, Luo SQ, Zeng WS, Hu ZQ, Lu F и др. Полиморфизм кодона 72 гена р53 и восприимчивость к келоидам в китайской популяции. Чжунхуа Чжэн Син Вай Кэ За Чжи . (2005) 19: 28–30.
PubMed Аннотация | Google Scholar
163. Яо Х, Цуй Х, Ву Х, Сюй П, Чжу В., Чен Х и др.Подавляющая опухоль роль miR-1224-5p в пролиферации, апоптозе и инвазии келоидов через сигнальный путь TGF-β1 / Smad3. Биохимия Биофиз Рес Коммуна . (2018) 495: 713–20. DOI: 10.1016 / j.bbrc.2017.10.070
PubMed Аннотация | CrossRef Полный текст | Google Scholar
164. Лю И, Ван Х, Ян Д., Сяо З, Чен Х. МикроРНК-21 влияет на пролиферацию и апоптоз, регулируя экспрессию PTEN в келоидных фибробластах человека. Пластиковый Реконстр Сург . (2014) 134: 561e − 73e.DOI: 10.1097 / PRS.0000000000000577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
166. Вармех С., Эгиа А., Макгрутер Д., Тахан С.Р., Баят А., Пандольфи П.П. Клеточное старение как возможный механизм остановки прогрессирования келоидных поражений. Гены рака . (2011) 2: 1061–6. DOI: 10.1177 / 1947601
0877
PubMed Аннотация | CrossRef Полный текст | Google Scholar
167. Vander Heiden MG, Cantley LC, Thompson CB. Понимание эффекта Варбурга: метаболические потребности пролиферации клеток. Наука . (2009) 324: 1029–33. DOI: 10.1126 / science.1160809
PubMed Аннотация | CrossRef Полный текст | Google Scholar
170. Чжан Кью, Ву И, Энн Д.К., Мессади Д.В., Туан Т.Л., Келли А.П. и др. Механизмы гипоксической регуляции экспрессии гена ингибитора-1 активатора плазминогена в келоидных фибробластах. Дж Инвест Дерматол . (2003) 121: 1005–12. DOI: 10.1046 / j.1523-1747.2003.12564.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
171.Wu Y, Zhang Q, Ann DK, Akhondzadeh A, Duong HS, Messadi DV, et al. Повышенный фактор роста эндотелия сосудов может объяснять повышенный уровень ингибитора активатора плазминогена-1 посредством активации ERK1 / 2 в келоидных фибробластах. Am J Physiol Cell Physiol . (2004) 286: C905–12. DOI: 10.1152 / ajpcell.00200.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
173. Раманатан А., Ван С., Шрайбер С.Л. Пертурбационное профилирование клеточной модели онкогенеза с использованием метаболических измерений. Proc Natl Acad Sci USA . (2005) 102: 5992–7. DOI: 10.1073 / pnas.0502267102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
175. Локмич З., Мусиока Дж., Хьюитсон Т.Д., Дарби И.А. Передача сигналов гипоксии и гипоксии при восстановлении тканей и фиброзе. Int Rev Cell Mol Biol . (2012) 296: 139–85. DOI: 10.1016 / B978-0-12-394307-1.00003-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
176. Steinbrech DS, Mehrara BJ, Chau D, Rowe NM, Chin G, Lee T. и др.Гипоксия усиливает выработку VEGF в келоидных фибробластах. Энн Пласт Сург . (1999) 42: 514–9. DOI: 10.1097 / 00000637-199
0-00009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
177. Чжао Б., Гуань Х, Лю Дж.К., Чжэн З., Чжоу К., Чжан Дж. И др. Гипоксия приводит к переходу фибробластов кожи человека в миофибробластоподобный фенотип через путь TGF-beta1 / Smad3. Инт Дж Мол Мед . (2017) 39: 153–9. DOI: 10.3892 / ijmm.2016.2816
PubMed Аннотация | CrossRef Полный текст | Google Scholar
181.Чжоу Х.М., Ван Дж., Эллиотт С., Вен В., Гамильтон Д.В., Конвей С.Дж. Пространственно-временная экспрессия периостина во время развития кожи и заживления послеоперационных ран: уроки формирования фиброзных рубцов у человека. Сигнал сотовой связи J . (2010) 4: 99–107. DOI: 10.1007 / s12079-010-0090-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
182. Zhang Z, Nie F, Chen X, Qin Z, Kang C, Chen B, et al. Повышенная регуляция периостина способствует ангиогенезу в келоидах за счет активации ERK 1/2 и путей фокальной киназы адгезии, а также повышенной экспрессии VEGF и ангиопоэтина1. Мол Мед Реп . (2015) 11: 857–64. DOI: 10.3892 / mmr.2014.2827
PubMed Аннотация | CrossRef Полный текст | Google Scholar
183. Zhang Z, Nie F, Kang C, Chen B, Qin Z, Ma J, et al. Повышенная экспрессия периостина влияет на пролиферацию, синтез коллагена, миграцию и инвазию келоидных фибробластов в условиях гипоксии. Инт Дж Мол Мед . (2014) 34: 253–61. DOI: 10.3892 / ijmm.2014.1760
PubMed Аннотация | CrossRef Полный текст | Google Scholar
185.Чжу М., Фейзо М.С., Андерсон Л., Деринг Дж., Гинтер С., Рамос Л. и др. Периостин способствует ангиогенезу и метастазированию рака яичников. Gynecol Oncol. (2010) 119: 337–44. DOI: 10.1016 / j.ygyno.2010.07.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
186. Цю Ф., Ши Ч., Чжэн Дж., Лю Ю.Б. Периостин опосредует повышенную проангиогенную активность клеток рака желудка в условиях гипоксии. Дж. Биохем Мол Токсикол . (2013) 27: 364–9. DOI: 10.1002 / jbt.21498
PubMed Аннотация | CrossRef Полный текст | Google Scholar
188. Hahn JM, McFarland KL, Combs KA, Supp DM. Частичный эпителиально-мезенхимальный переход в келоидных рубцах: регуляция экспрессии гена келоидных кератиноцитов путем трансформации фактора роста-β1. Ожоговая травма . (2016) 4:30. DOI: 10.1186 / s41038-016-0055-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
190. Yan L, Cao R, Wang L, Liu Y, Pan B, Yin Y. Эпителиально-мезенхимальный переход (EMT) в келоидных тканях и кератиноциты внешней корневой оболочки волосяного фолликула, индуцированные TGF-beta1. Регенерация для восстановления ран . (2015) 23: 601–10. DOI: 10.1111 / wrr.12320
CrossRef Полный текст | Google Scholar
192. Мендес М.Г., Кодзима С.И., Гольдман Р.Д. Виментин вызывает изменения формы, подвижности и адгезии клеток во время перехода эпителия в мезенхиму. FASEB J . (2010) 24: 1838–51. DOI: 10.1096 / fj.09-151639
PubMed Аннотация | CrossRef Полный текст | Google Scholar
193. Хулит Дж., Суяма К., Чунг С., Керен Р., Агиостратиду Дж., Шан В. и др.Передача сигналов N-кадгерина усиливает метастазирование опухоли молочной железы за счет усиленной активации киназы, регулируемой внеклеточными сигналами. Cancer Res . (2007) 67: 3106–16. DOI: 10.1158 / 0008-5472.CAN-06-3401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
195. Ханниган Г.Е., Леунг-Хагестейн С., Фитц-Гиббон Л., Копполино М.Г., Радева Г., Фильмус Дж. И др. Регулирование клеточной адгезии и роста, зависящего от закрепления, с помощью новой бета-1-интегрин-связанной протеинкиназы. Природа .(1996) 379: 91–6. DOI: 10.1038 / 379091a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
197. Папаниколау С., Браву В., Гифтопулос К., Накас Д., Репанти М., Пападаки Х. Экспрессия ILK в базально-клеточной карциноме человека коррелирует с маркерами эпителиально-мезенхимального перехода и опухолевой инвазией. Гистопатология . (2010) 56: 799–809. DOI: 10.1111 / j.1365-2559.2010.03556.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
198.Кано А., Перес-Морено М.А., Родриго И., Локашио А., Бланко М.Дж., Дель Баррио М.Г. и др. Фактор транскрипции Snail контролирует эпителиально-мезенхимальные переходы путем репрессии экспрессии E-кадгерина. Нат Клеточная Биол . (2000) 2: 76–83. DOI: 10.1038 / 35000025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
199. Позер I, Домингес Д., де Эррерос А.Г., Варнаи А., Бюттнер Р., Боссерхофф А.К. Потеря экспрессии E-кадгерина в клетках меланомы включает активацию репрессора транскрипции Snail. Дж. Биол. Хим. . (2001) 276: 24661–6. DOI: 10.1074 / jbc.M011224200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
200. Cheng CW, Wu PE, Yu JC, Huang CS, Yue CT, Wu CW, et al. Механизмы инактивации E-кадгерина в карциноме молочной железы: модификация гипотезы двух ударов гена-супрессора опухоли. Онкоген . (2001) 20: 3814–23. DOI: 10.1038 / sj.onc.1204505
PubMed Аннотация | CrossRef Полный текст | Google Scholar
201.Hahn JM, Glaser K, McFarland KL, Aronow BJ, Boyce ST, Supp DM. Кератиноциты, происходящие из келоидов, демонстрируют аномальный профиль экспрессии генов, соответствующий отчетливой причинной роли в келоидной патологии. Регенерация для восстановления ран . (2013) 21: 530–44. DOI: 10.1111 / wrr.12060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
202. Abdou AG, Maraee AH, Abd-Elsattar Saif HF. Иммуногистохимическая оценка экспрессии cox-1 и cox-2 в келоиде и гипертрофическом рубце. Ам Дж. Дерматопатол .(2014) 36: 311–7. DOI: 10.1097 / DAD.0b013e3182a27b83
PubMed Аннотация | CrossRef Полный текст | Google Scholar
203. Санчес-Диас П.К., Сяо Т.Х., Чанг Дж.С., Юэ Д., Тан М.К., Чен Х.И. и др. Дерегулируемые микроРНК в детских раковых стволовых клетках нацелены на пути, участвующие в пролиферации клеток, клеточном цикле и развитии. ПЛОС ОДИН . (2013) 8: e61622. DOI: 10.1371 / journal.pone.0061622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
204.Хао Дж, Чжан И, Дэн М., Е Р, Чжао С., Ван И и др. МикроРНК контроль эпителиально-мезенхимального перехода в раковых стволовых клетках. Инт Дж. Рак . (2014) 135: 1019–27. DOI: 10.1002 / ijc.28761
PubMed Аннотация | CrossRef Полный текст | Google Scholar
205. Лю И, Янг Д., Сяо З., Чжан М. Профили экспрессии MiRNA в келоидной ткани и соответствующей нормальной кожной ткани. Эстетическая пласт хирургия . (2012) 36: 193–201. DOI: 10.1007 / s00266-011-9773-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
206.Ян Л., Цао Р., Лю И, Ван Л., Пан Б., Ур X и др. MiR-21-5p связывает фенотип эпителиально-мезенхимального перехода с сигнатурами стволовых клеток посредством передачи сигналов AKT в келоидных кератиноцитах. Научная репутация . (2016) 6: 28281. DOI: 10.1038 / srep28281
PubMed Аннотация | CrossRef Полный текст | Google Scholar
208. Ёсимото Х., Исихара Х., Охцуру А., Акино К., Мураками Р., Курода Х. и др. Сверхэкспрессия рецептора инсулиноподобного фактора роста-1 (IGF-I) и инвазивность культивированных келоидных фибробластов. Ам Дж. Патол . (1999) 154: 883–9. DOI: 10.1016 / S0002-9440 (10) 65335-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
209. Нарама И., Масуока-Нишияма М., Мацуура Т., Одзаки К., Нагатани М., Моришима Т. Морфогенез дегенеративных изменений, предрасполагающих собак к разрыву черепной крестообразной связки. Журнал ветеринарной медицины . (1996) 58: 1091–7. DOI: 10.1292 / jvms.58.11_1091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
211.Бао С., Оуян Г., Бай Х, Хуанг З., Ма Ц., Лю М. и др. Периостин сильно способствует метастатическому росту рака толстой кишки, увеличивая выживаемость клеток через путь Akt / PKB. Cancer Cell. (2004) 5: 329–39. DOI: 10.1016 / S1535-6108 (04) 00081-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
212. Shin S, Dimitri CA, Yoon SO, Dowdle W., Blenis J. ERK2, но не ERK1, индуцирует трансформацию эпителия в мезенхиму посредством событий передачи сигналов, зависимых от мотива DEF. Mol Cell. (2010) 38: 114–27. DOI: 10.1016 / j.molcel.2010.02.020
CrossRef Полный текст | Google Scholar
214. Ли Й.Дж., Квон С.Б., Ким Ч.Х., Чо Х.Д., Нам Х.С., Ли Ш. и др. Окислительное повреждение и экспрессия белка фактора 2, связанного с ядерным фактором эритроид 2, в нормальной коже и келоидной ткани. Энн Дерматол . (2015) 27: 507–16. DOI: 10.5021 / ad.2015.27.5.507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
215. Акасака Ю., Исикава Ю., Оно И., Фудзита К., Масуда Т., Асува Н. и др.Повышенная экспрессия каспазы-3 в гипертрофических рубцах и келоиде: индукция каспазы-3 и апоптоза в келоидных фибробластах in vitro . Лаборатория Инвест . (2000) 80: 345–57. DOI: 10.1038 / labinvest.3780039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
216. Appleton I, Браун, штат Нью-Джерси, Уиллоуби, округ Колумбия. Апоптоз, некроз и пролиферация: возможные последствия в этиологии келоидов. Ам Дж. Патол . (1996) 149: 1441–7.
PubMed Аннотация | Google Scholar
219.Чен К. М., Бартоломью Дж. К., Кампизи Дж., Акоста М., Рейган Дж. Д., Эймс Б. Н.. Молекулярный анализ H 2 O 2 -индуцированная стареющая остановка роста в нормальных фибробластах человека: p53 и Rb контролируют остановку G1, но не репликацию клеток. Biochem J . (1998) 332 (Pt 1): 43–50. DOI: 10.1042 / bj3320043
CrossRef Полный текст | Google Scholar
220. Луо С., Бенатан М., Раффул В., Паниццон Р.Г., Эглофф Д.В. Нарушение баланса между пролиферацией и апоптотической гибелью клеток в фибробластах, происходящих из келоидных поражений. Пластиковый Реконстр Сург . (2001) 107: 87–96. DOI: 10.1097 / 00006534-200101000-00014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
221. Акасака Ю., Фудзита К., Исикава Ю., Асува Н., Инузука К., Исихара М. и др. Обнаружение апоптоза в келоидах и сравнительное исследование апоптоза между келоидами, гипертрофическими рубцами, нормально зажившими плоскими рубцами и дерматофибромой. Регенерация для восстановления ран . (2001) 9: 501–6. DOI: 10.1046 / j.1524-475x.2001.00501.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
222.Beere HM. «Стресс умирания»: роль белков теплового шока в регуляции апоптоза. J Cell Sci . (2004) 117 (Pt 13): 2641–51. DOI: 10.1242 / jcs.01284
CrossRef Полный текст | Google Scholar
224. Велкоборский Х. Дж., Бернауэр Х. С., Риазиманд Х. С., Джейкоб Р., Манн В. Дж., Хинни М.Л. Особенности хромосомных аберраций при метастазирующих и неметастазирующих плоскоклеточных карциномах ротоглотки и гортани. Анн Отол Ринол Ларингол . (2000) 109: 401–10.DOI: 10.1177 / 0003489400101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
225. Майтра А., Якобуцио-Донахью С., Рахман А., Сон Т.А., Аргани П., Мейер Р. и др. Иммуногистохимическая проверка нового эпителиального и нового стромального маркера аденокарциномы протока поджелудочной железы, идентифицированного с помощью микроматриц глобальной экспрессии: гомолог фасцина морского ежа и белок теплового шока 47. Am J Clin Pathol . (2002) 118: 52–9. DOI: 10.1309 / 3PAM-P5WL-2LV0-R4EG
PubMed Аннотация | CrossRef Полный текст | Google Scholar
227.Шеннан Б., Зайферт М., Лесков К., Уиллис Дж., Бутман Д., Тилген В. и др. Вызов и перспективы: роли кластерина в патогенезе, прогрессировании и терапии рака. Разница в гибели клеток . (2006) 13: 12–9. DOI: 10.1038 / sj.cdd.4401779
PubMed Аннотация | CrossRef Полный текст | Google Scholar
228. Trougakos IP, Djeu JY, Gonos ES, Boothman DA. Достижения и проблемы в фундаментальных и трансляционных исследованиях кластерин. Cancer Res . (2009) 69: 403–6. DOI: 10.1158 / 0008-5472.CAN-08-2912
PubMed Аннотация | CrossRef Полный текст | Google Scholar
229. Akiyama H, Lyons JP, Mori-Akiyama Y, Yang X, Zhang R, Zhang Z, et al. Взаимодействие между Sox9 и бета-катенином контролирует дифференцировку хондроцитов. Гены Дев . (2004) 18: 1072–87. DOI: 10.1101 / gad.1171104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
230. Яно Ф., Кугимия Ф., Охба С., Икеда Т., Чикуда Х., Огасавара Т. и др. Канонический путь передачи сигналов Wnt способствует дифференцировке хондроцитов Sox9-зависимым образом. Биохимия Биофиз Рес Коммуна . (2005) 333: 1300–8. DOI: 10.1016 / j.bbrc.2005.06.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
231. Умехара Н., Одзаки Т., Сугихара С., Кунисада Т., Моримото Ю., Кавай А. и др. Влияние активности теломеразы на опухоли костей и мягких тканей. J Cancer Res Clin Oncol . (2004) 130: 411–6. DOI: 10.1007 / s00432-004-0553-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
232. Граник М., Кимура М., Ким С., Даниали Л., Цао Х, Хербиг Ю. и др.Динамика теломер в келоидах. Эпластика . (2011) 11: e15.
PubMed Аннотация | Google Scholar
233. Колуцци Е., Коламартино М., Коззи Р., Леоне С., Менегини С., О’Каллаган Н. и др. Окислительный стресс вызывает стойкие повреждения теломерной ДНК, ответственные за изменение морфологии ядра в клетках млекопитающих. ПЛОС ОДИН . (2014) 9: e110963. DOI: 10.1371 / journal.pone.0110963
PubMed Аннотация | CrossRef Полный текст | Google Scholar
234.Эжиларасан Р., Моханам И., Говиндараджан К., Моханам С. Клетки глиомы подавляют индуцированный гипоксией апоптоз эндотелиальных клеток и способствуют ангиогенному процессу. Инт Дж. Онкол . (2007) 30: 701–7. DOI: 10.3892 / ijo.30.3.701
PubMed Аннотация | CrossRef Полный текст | Google Scholar
235. Браун С.К., Ходарев Н.Н., Ю.Дж., Му-Янг Т., Лабай Э., Дарга Т.Э. и др. Клетки глиобластомы блокируют радиационно-индуцированную программируемую гибель эндотелиальных клеток. FEBS Lett . (2004) 565: 167–70.DOI: 10.1016 / j.febslet.2004.03.099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
236. Нироди К.С., Девалараджа Р., Нэнни Л. Б., Арринделл С., Рассел С., Трупин Дж. И др. Экспрессия хемокинов и хемокиновых рецепторов в келоидных и нормальных фибробластах. Регенерация для восстановления ран . (2000) 8: 371–82. DOI: 10.1111 / j.1524-475X.2000.00371.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
237. Russell SB, Russell JD, Trupin KM, Gayden AE, Opalenik SR, Nanney LB, et al.Эпигенетически измененное заживление ран в келоидных фибробластах. Дж Инвест Дерматол . (2010) 130: 2489–96. DOI: 10.1038 / jid.2010.162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
239. Файнберг А.П., Колдобский М.А., Гондор А. Эпигенетические модуляторы, модификаторы и медиаторы в этиологии и прогрессии рака. Нат Рев Генет . (2016) 17: 284–99. DOI: 10.1038 / nrg.2016.13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
240.E Y, Qipa Z, Hengshu Z. Экспрессия DNMT1 в патологических фибробластах рубца и влияние 5-аза-2-дезоксицитидина на цитокины патологических фибробластов рубца. Раны . (2014) 26: 139–46.
PubMed Аннотация | Google Scholar
242. Джонс Л. Р., Грин Дж., Чен К. М., Дивайн Дж., Читале Д., Шах В. и др. Биологическое значение полногеномных профилей метилирования ДНК в келоидах. Ларингоскоп . (2017) 127: 70–8. DOI: 10.1002 / lary.26063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
243.Гарсиа-Родригес Л., Джонс Л., Чен К.М., Датта I, Божественный Г., Уоршам М.Дж. Анализ причинно-следственной сети келоидной ткани головы и шеи позволяет выявить потенциальные главные регуляторы. Ларингоскоп . (2016) 126: E319–24. DOI: 10.1002 / lary.25958
PubMed Аннотация | CrossRef Полный текст | Google Scholar
244. Фитцджеральд О’Коннор Э.Дж., Бадшах II, Аддае Л.Й., Кундасами П., Танабаласингам С., Абиойе Д. и др. Гистоновая деацетилаза 2 активируется в нормальных и келоидных рубцах. Дж Инвест Дерматол .(2012) 132: 1293–6. DOI: 10.1038 / jid.2011.432
CrossRef Полный текст | Google Scholar
247. Лианос Г.Д., Алексиу Г.А., Мангано А., Раузей С., Бони Л., Диониджи Г. и др. Роль белков теплового шока при раке. Раковые буквы . (2015) 360: 114–8. DOI: 10.1016 / j.canlet.2015.02.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
249. Ван Д.Л., Чжу Дж.Дж., Дэн К.Л., Ван Б., Ю Л.М. Определение биологических характеристик стволовых клеток, полученных из келоидов человека. Чжунхуа Шао Шан За Чжи . (2011) 27: 210–4. DOI: 10.3760 / cma.j.issn.1009-2587.2011.03.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
251. Moon JH, Kwak SS, Park G, Jung HY, Yoon BS, Park J, et al. Выделение и характеристика мультипотентных мезенхимальных стволовых клеток человека, полученных из келоидов. Разработка стволовых клеток . (2008) 17: 713–24. DOI: 10.1089 / scd.2007.0210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
252.Го В., Ласки Дж. Л. 3-й, Ву Х. Раковые стволовые клетки. Педиатр Рес . (2006) 59 (4 балла 2): 59R − 64R. DOI: 10.1203 / 01.pdr.0000203592.04530.06
CrossRef Полный текст | Google Scholar
253. Тодаро М., Алеа М.П., Ди Стефано А.Б., Каммарери П., Вермёлен Л., Иовино Ф. и др. Стволовые клетки рака толстой кишки диктуют рост опухоли и сопротивляются гибели клеток за счет выработки интерлейкина-4. Cell Stem Cell. (2007) 1: 389–402. DOI: 10.1016 / j.stem.2007.08.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
254.Бао С., Ву Кью, МакЛендон Р.Э., Хао Й., Ши Кью, Хьелмеланд А.Б. и др. Стволовые клетки глиомы способствуют радиорезистентности за счет преимущественной активации ответа на повреждение ДНК. Природа . (2006) 444: 756–60. DOI: 10.1038 / nature05236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
256. Багабир Р., Байерс Р. Дж., Чаудри И. Х., Мюллер В., Паус Р., Баят А. Сайт-специфическое иммунофенотипирование келоидного заболевания демонстрирует иммунную активацию и присутствие лимфоидных агрегатов. Br J Дерматол . (2012) 167: 1053–66. DOI: 10.1111 / j.1365-2133.2012.11190.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
260. Малакер К., Виджайрагаван К., Ходсон И., Яфи Т.А. Ретроспективный анализ лечения неоперабельных келоидов первичным облучением более 25 лет. Клин Онкол . (2004) 16: 290–8. DOI: 10.1016 / j.clon.2004.03.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
261. Дарзи М.А., Чаудри Н.А., Каул С.К., Хан М.Оценка различных методов лечения келоидов и гипертрофических рубцов: последующее 10-летнее исследование. Br J Plastic Surg . (1992) 45: 374–9. DOI: 10.1016 / 0007-1226 (92)
- -L
- Заморозить его.Это называется криотерапией. Лучше всего его использовать при небольших келоидах, например, от прыщей. Криотерапия может осветлить кожу.
- Ввести лекарство.
- Кортикостероид — это наиболее часто используемое лекарство для уменьшения келоидов. Скорее всего, он хорошо подойдет при криотерапии или сразу после операции.
- Другие лекарства могут улучшить состояние келоидов. К ним относятся инъекции верапамила, фторурацила, блеомицина и интерферона альфа-2b. Они не так хорошо изучены, как уколы кортикостероидов, но ваш врач может порекомендовать их.Скорее всего, они подействуют при использовании другого лечения.
- Убери это. Иногда для удаления более крупных келоидов используется хирургическое вмешательство. Но удаление келоидов может привести к их увеличению. Поэтому очень важно обработать область после операции. Лечение может включать лазерные инъекции или инъекции лекарств.
- После операции наложите повязку из силиконового геля. Вы можете купить их в большинстве аптек. Держите силиконовую повязку на коже от 12 до 24 часов в день в течение 2-6 месяцев.Ваш врач скажет вам, когда вы сможете прекратить лечение.
- Давить на него повязкой или бинтом.
- Накройте новую рану тонким слоем вазелина, например вазелина, и антипригарной повязкой. Удерживайте повязку лентой так, чтобы на рану было равномерное давление. Ежедневно мойте пораженный участок водой с мылом.
- После заживления раны более используйте силиконовую гелевую повязку. Поддерживайте равномерное давление на область. Это может предотвратить рост келоидов. Держите повязку на коже от 12 до 24 часов в сутки в течение 2–3 месяцев. (Для роста келоида требуется 3 месяца).
- После пирсинга ушей наденьте нажимные серьги. Их также называют шинами Циммера.
- 1.
Gauglitz GG. Лечение келоидов и гипертрофических рубцов: текущие и новые возможности. Clin Cosmet Investig Dermatol. 2013; 6: 103–14.
PubMed PubMed Central Google ученый
- 2.
Мюррей Дж. К., Поллак С.В., Пиннелл С.Р.Келоиды: обзор. J Am Acad Dermatol. 1981; 4: 461–70.
CAS PubMed Google ученый
- 3.
Вольфрам Д., Цанков А., Пульцл П., Пиза-Кацер Х. Гипертрофические рубцы и келоиды — обзор их патофизиологии, факторов риска и терапевтического лечения. Dermatol Surg. 2009; 35: 171–81.
CAS PubMed Google ученый
- 4.
Halim AS, Emami A, Salahshourifar I, Kannan TP.Келоидные рубцы: понимание генетической основы, достижений и перспектив. Arch Plast Surg. 2012; 39: 184–9.
PubMed PubMed Central Google ученый
- 5.
Гауглиц Г.Г., Кортинг ХК, Павичич Т., Ружичка Т., Йешке М.Г. Гипертрофические рубцы и келоиды: патомеханизмы, текущие и новые стратегии лечения. Mol Med. 2011; 17: 113–25.
CAS PubMed Google ученый
- 6.
Чен Й, Гао Дж. Х., Янь Х, Сун М, Лю XJ. Расположение предрасполагающего гена для одной китайской ханьской келоидной родословной. Чжунхуа Чжэн Син Вай Кэ За Чжи. 2007; 23: 137–40.
CAS PubMed Google ученый
- 7.
Павоне В., Теста Г., Джардина СМЦ, Весио А., Рестиво Д.А. и др. Фармакологическая терапия остеопороза: систематический текущий обзор литературы. Front Pharmacol. 2017; 8: 803.
PubMed PubMed Central Google ученый
- 8.
Чжао В., Шен Г, Рен Х, Лян Д., Ю Икс и др. Терапевтический потенциал микроРНК при остеопорозе функционирует за счет регулирования биологии клеток, связанных с гомеостазом костей. J. Cell Physiol. 2018; 233: 9191–208.
CAS PubMed Google ученый
- 9.
Группа разработки консенсуса NIH по профилактике, диагностике и терапии остеопороза. Профилактика, диагностика и лечение остеопороза. ДЖАМА. 2001; 285: 785-95.
- 10.
Johnell O, Kanis JA. Оценка распространенности и инвалидности остеопоротических переломов во всем мире. Osteoporos Int. 2006; 17: 1726–33.
CAS PubMed Google ученый
- 11.
Рэй Н.Ф., Чан Дж. К., Тамер М., Мелтон Л. Дж. 3-й. Медицинские расходы на лечение остеопоротических переломов в США в 1995 г .: отчет Национального фонда остеопороза. J Bone Miner Res. 1997; 12: 24–35.
CAS PubMed Google ученый
- 12.
Lyles CR, Schafer AL, Seligman HK. Доход, отсутствие продовольственной безопасности и остеопороз среди пожилых людей в Национальном обследовании здоровья и питания (NHANES) за 2007–2008 годы. J Здравоохранение Плохо обслуживается. 2014; 25: 1530–41.
PubMed Google ученый
- 13.
Xie Z, He Y, Sun Y, Lin Z, Yang M и др. Связь между легочным фиброзом и остеопорозом у пожилых людей: исследование случай-контроль. Медицина (Балтимор).2016; 95: e5239.
Google ученый
- 14.
Багабир Р., Байерс Р. Дж., Чаудри И. Х., Мюллер В., Паус Р. и др. Сайт-специфическое иммунофенотипирование келоидного заболевания демонстрирует иммунную активацию и присутствие лимфоидных агрегатов. Br J Dermatol. 2012; 167: 1053–66.
CAS PubMed Google ученый
- 15.
Ла Монтанья Дж., Ватти М., Валентини Дж., Тирри Дж. Остеопения при системном склерозе.Доказательства участвующей роли более ранней менопаузы. Clin Rheumatol. 1991; 10: 18–22.
PubMed Google ученый
- 16.
Ди Манно О., Маззантини М., Массей П., Фердегини М., Питаро Н. и др. Снижение костной массы и нормальный метаболизм кальция при системном склерозе с кальцинозом и без него. Clin Rheumatol. 1995; 14: 407–12.
PubMed Google ученый
- 17.
Wu CY, Lu YY, Lu CC, Su YF, Tsai TH и др.Остеопороз у взрослых пациентов с атопическим дерматитом: общенациональное популяционное исследование. PLoS One. 2017; 12: e0171667.
PubMed PubMed Central Google ученый
- 18.
Лу YY, Лу CC, Yu WW, Zhang L, Wang QR, et al. Келоидный риск у пациентов с атопическим дерматитом: общенациональное ретроспективное когортное исследование на Тайване. BMJ Open. 2018; 8: e022865.
PubMed PubMed Central Google ученый
- 19.
Sun LM, Wang KH, Lee YC. Заболеваемость келоидом у азиатских людей и его коморбидность с другими заболеваниями, связанными с фиброзом: общенациональное популяционное исследование. Arch Dermatol Res. 2014; 306: 803–8.
PubMed Google ученый
- 20.
Умбер П.Г., Дюпон Дж. Л., Рошфор А., Васселет Р., Лукас А. и др. Локализованная склеродермия — ответ на 1,25-дигидроксивитамин D3. Clin Exp Dermatol. 1990; 15: 396–8.
CAS PubMed Google ученый
- 21.
Бикл ДД. Витамин D и кость. Curr Osteoporos Rep. 2012; 10: 151–9.
PubMed PubMed Central Google ученый
- 22.
Lee DE, Trowbridge RM, Ayoub NT, Agrawal DK. Блок группы высокой подвижности Протеин-1, матриксные металлопротеиназы и витамин D в келоидах и гипертрофических рубцах. Plast Reconstr Surg Glob Open. 2015; 3: e425.
PubMed PubMed Central Google ученый
- 23.
Zhang GY, Cheng T, Luan Q, Liao T, Nie CL, et al. Витамин D: новый подход к лечению келоидов, анализ in vitro. Br J Dermatol. 2011; 164: 729–37.
CAS PubMed Google ученый
- 24.
Yu D, Shang Y, Luo S, Hao L. Полиморфизм TaqI гена VDR и уровни циркулирующего 1,25-дигидроксивитамина D создают риск келоидных рубцов в китайских когортах. Cell Physiol Biochem. 2013; 32: 39–45.
PubMed Google ученый
- 25.
Gong ZH, Ji JF, Yang J, Xiang T, Zhou CK, et al. Связь экспрессии ингибитора активатора плазминогена-1 и рецептора витамина D с риском келоидного заболевания в китайской популяции. Kaohsiung J Med Sci. 2017; 33: 24–9.
PubMed Google ученый
- 26.
Seeman E, Delmas PD. Качество костей — материальная и структурная основа прочности и хрупкости костей. N Engl J Med. 2006; 354: 2250–61.
CAS PubMed Google ученый
- 27.
Graat-Verboom L, Smeenk FW, van den Borne BE, Spruit MA, Jansen FH и др. Прогрессирование остеопороза у пациентов с ХОБЛ: трехлетнее наблюдение. Respir Med. 2012; 106: 861–70.
PubMed Google ученый
- 28.
Jilka RL, Hangoc G, Girasole G, Passeri G, Williams DC, et al. Повышенное развитие остеокластов после потери эстрогена: посредничество интерлейкина-6. Наука. 1992; 257: 88–91.
CAS PubMed Google ученый
- 29.
Арима Дж., Хуанг С., Рознер Б., Акаиси С., Огава Р. Гипертония: системный ключ к пониманию степени тяжести местного келоида. Регенерация восстановления ран. 2015; 23: 213–21.
PubMed Google ученый
- 30.
Снайдер А.Л., Змуда Дж. М., Томпсон П.Д. Келоид, связанный с гипертонией. Ланцет. 1996; 347: 465–6.
CAS PubMed Google ученый
- 31.
Огава Р. Келоидные и гипертрофические рубцы являются результатом хронического воспаления ретикулярной дермы.Int J Mol Sci. 2017; 18.
- 32.
Ши К., Чжу Дж., Ян Д. Ключевая роль воспаления в формировании рубцов / келоидов после прыщей. Дерматоэндокринол. 2017; 9: e1448327.
PubMed Google ученый
- 33.
Postlethwaite AE, Smith GN, Mainardi CL, Seyer JM, Kang AH. Модуляция лимфоцитами функции фибробластов in vitro: стимуляция и ингибирование выработки коллагена различными эффекторными молекулами. J Immunol. 1984; 132: 2470–7.
CAS PubMed Google ученый
- 34.
Чен В., Фу Х, Сан Х, Сан Т., Чжао З. и др. Анализ дифференциально экспрессируемых генов в келоидах и нормальной коже с помощью микроматрицы кДНК. J Surg Res. 2003. 113: 208–16.
CAS PubMed Google ученый
- 35.
Dong X, Mao S, Wen H. Повышенная регуляция провоспалительных генов в поражениях кожи может быть причиной образования келоидов (обзор).Биомед Реп. 2013; 1: 833–6.
CAS PubMed PubMed Central Google ученый
- 36.
Редлих К., Смолен Ж.С. Воспалительная потеря костной массы: патогенез и терапевтическое вмешательство. Nat Rev Drug Discov. 2012; 11: 234–50.
CAS PubMed Google ученый
- 37.
Де Бенедетти Ф., Руччи Н., Дель Фатторе А, Перуцци Б., Паро Р. и др. Нарушение развития скелета у трансгенных мышей с интерлейкином-6: модель воздействия хронического воспаления на растущую скелетную систему.Rheum артрита. 2006; 54: 3551–63.
PubMed Google ученый
- 38.
Ambros V. microRNAs: крошечные регуляторы с большим потенциалом. Клетка. 2001; 107: 823–6.
CAS PubMed Google ученый
- 39.
Cheng AM, Byrom MW, Shelton J, Ford LP. Антисмысловое ингибирование человеческих miRNA и показания к участию miRNA в росте клеток и апоптозе. Nucleic Acids Res.2005; 33: 1290–7.
CAS PubMed PubMed Central Google ученый
- 40.
Лю Й., Ян Д., Сяо З., Чжан М. Профили экспрессии миРНК в келоидной ткани и соответствующей нормальной кожной ткани. Aesthet Plast Surg. 2012; 36: 193–201.
Google ученый
- 41.
Кашияма К., Мицутаке Н., Мацусе М., Оги Т., Саенко В.А. и др. Подавление miR-196a увеличивает экспрессию коллагенов типа I и III в келоидных фибробластах.J Invest Dermatol. 2012; 132: 1597–604.
CAS PubMed Google ученый
- 42.
Li C, Bai Y, Liu H, Zuo X, Yao H, et al. Сравнительное исследование профилей микроРНК в келоидных фибробластах и аннотации дифференциально экспрессируемых микроРНК. Acta Biochim Biophys Sin (Шанхай). 2013; 45: 692–9.
CAS Google ученый
- 43.
Yu X, Li Z, Chan MT, Wu WK. Нарушение регуляции микроРНК в келоидах: возможность клинического вмешательства? Cell Prolif.2015; 48: 626–30.
CAS PubMed PubMed Central Google ученый
- 44.
Wu ZY, Lu L, Liang J, Guo XR, Zhang PH и др. Анализ экспрессии келоидных микроРНК и влияние miR-199a-5p на пролиферацию келоидных фибробластов. Genet Mol Res. 2014; 13: 2727–38.
PubMed Google ученый
- 45.
Де-Угарте Л., Йосковиц Г., Балселлс С., Герри-Фернандес Р., Мартинес-Диас С. и др.Профилирование MiRNA всей губчатой кости: идентификация связанных с остеопорозом изменений в MiRNA в тазовых костях человека. BMC Med Genet. 2015; 8: 75.
Google ученый
- 46.
Росси М., Питари М.Р., Амодио Н., Ди Мартино М.Т., Конфорти Ф. и др. miR-29b отрицательно регулирует дифференцировку и функцию остеокластических клеток человека: значение для лечения болезни костей, связанной с множественной миеломой. J. Cell Physiol. 2013; 228: 1506–15.
CAS PubMed Google ученый
- 47.
Ван Т., Фэн Й, Сунь Х, Чжан Л., Хао Л. и др. miR-21 регулирует заживление кожных ран, воздействуя на несколько аспектов процесса заживления. Am J Pathol. 2012; 181: 1911–20.
PubMed Google ученый
- 48.
Cottonham CL, Kaneko S, Xu L. miR-21 и miR-31 сходятся на TIAM1, чтобы регулировать миграцию и инвазию клеток карциномы толстой кишки. J Biol Chem. 2010. 285: 35293–302.
CAS PubMed PubMed Central Google ученый
- 49.
Лю И, Ван Х, Ян Д., Сяо З, Чен Х. МикроРНК-21 влияет на пролиферацию и апоптоз, регулируя экспрессию PTEN в келоидных фибробластах человека. Plast Reconstr Surg. 2014; 134: 561e – 73e.
CAS PubMed Google ученый
- 50.
Zhu HY, Li C, Bai WD, Su LL, Liu JQ и др. MicroRNA-21 регулирует hTERT через PTEN в гипертрофированных фибробластах рубца. PLoS One. 2014; 9: e97114.
PubMed PubMed Central Google ученый
- 51.
Лю И, Ли Й, Ли Н, Тэн В., Ван М. и др. TGF-бета1 способствует пролиферации и трансдифференцировке рубцовых фибробластов посредством повышающей регуляции MicroRNA-21. Научный доклад 2016; 6: 32231.
CAS PubMed PubMed Central Google ученый
- 52.
Sugatani T, Vacher J. Hruska. Сигнатура экспрессии КАА микроРНК остеокластогенеза. Кровь. 2011; 117: 3648–57.
CAS PubMed PubMed Central Google ученый
- 53.
Гарсия Паласиос В., Робинсон Л.Дж., Борисенко К.В., Леманн Т., Калла С.Е. и др. Отрицательная регуляция индуцированной RANKL дифференцировки остеокластов в клетках RAW264.7 эстрогенами и фитоэстрогенами. J Biol Chem. 2005; 280: 13720–7.
CAS PubMed Google ученый
- 54.
Роббинс Дж., Хирш К., Уитмер Р., Каули Дж., Харрис Т. Связь минеральной плотности костной ткани и депрессии у пожилых людей. J Am Geriatr Soc. 2001; 49: 732–6.
CAS PubMed Google ученый
- 55.
Wong SY, Lau EM, Lynn H, Leung PC, Woo J, et al. Депрессия и минеральная плотность костей: есть ли связь у пожилых азиатских мужчин? Результаты от г-на Ос (Гонконг). Osteoporos Int. 2005; 16: 610–5.
PubMed Google ученый
- 56.
Huang WS, Hsu JW, Huang KL, Bai YM, Su TP и др. Посттравматическое стрессовое расстройство и риск остеопороза: общенациональное лонгитюдное исследование.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
262. van Leeuwen MC, Stokmans SC, Bulstra AE, Meijer OW, van Leeuwen PA, Niessen FB. Брахитерапия с высокой мощностью дозы для лечения упорных келоидов: уникальный и эффективный протокол лечения. Пластиковый Реконстр Сург .(2014) 134: 527–34. DOI: 10.1097 / PRS.0000000000000415
PubMed Аннотация | CrossRef Полный текст | Google Scholar
263. Джонс М.Э., Харди С., Риджуэй Дж. Лечение келоидов: ретроспективный обзор нового подхода с использованием хирургического иссечения, обогащенной тромбоцитами плазмы и офтальмологической поверхностной фотонной рентгеновской лучевой терапии. Adv Уход за ранами кожи . (2016) 29: 303–7. DOI: 10.1097 / 01.ASW.0000482993.64811.74
PubMed Аннотация | CrossRef Полный текст | Google Scholar
264.Ван В., Цюй М., Сюй Л., Ву Х, Гао З., Гу Т. и др. Сорафениб проявляет антикелоидную активность, противодействуя сигнальным путям TGF-β / Smad и MAPK / ERK. Дж Мол Мед . (2016) 94: 1181–94. DOI: 10.1007 / s00109-016-1430-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
266. Уд-Дин С., Боуринг А., Дербишир Б., Моррис Дж., Баят А. Идентификация чувствительных к стероидам респондеров по сравнению с не отвечающими на лечение келоидными заболеваниями. Arch Dermatol Res .(2013) 305: 423–32. DOI: 10.1007 / s00403-013-1328-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
267. Де Соуза Р.Ф., Чакраварти Б., Шарма А., Парваз М.А., Малик А. Эффективность тройной терапии келоидов предсердий. Дж. Кутан Эстет Сург . (2014) 7: 98–102. DOI: 10.4103 / 0974-2077.138347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
268. Агбенорку П. Тройная келоидная терапия: комбинация стероидов, хирургического вмешательства и полоски / пластыря силиконового геля для лечения келоидов. Eur J Plast Surg . (2000) 23: 150–1. DOI: 10.1007 / s002380050236
CrossRef Полный текст | Google Scholar
269. Xu B, Liu ZZ, Zhu GY, Yang JF, Zhao JP, Wang JC и др. Эффективность генной терапии двойного суицида, опосредованной рекомбинантным аденовирусом, в келоидных фибробластах человека. Клин Экспер Дерматол . (2008) 33: 322–8. DOI: 10.1111 / j.1365-2230.2007.02615.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
270. Уд-Дин С., Томас Дж., Моррис Дж., Баят А.Фотодинамическая терапия: инновационный подход к лечению келоидных заболеваний, оцениваемый с использованием субъективных и объективных неинвазивных методов. Arch Dermatol Res . (2013) 305: 205–14. DOI: 10.1007 / s00403-012-1295-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
271. Кальцавара-Пинтон П.Г., Вентурини М., Сала Р. Фотодинамическая терапия: обновление 2006 г. — часть 1: фотохимия и фотобиология. J Eur Acad Dermatol . (2007) 21: 293–302. DOI: 10.1111 / j.1468-3083.2006.01902.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
272. Кристенсен Э., Варло Т., Кроон С., Функ Дж., Хелсинг П., Солер А.М. и др. Руководство по практическому применению МАЛ-ФДТ при немеланомном раке кожи. J Eur Acad Dermatol Venereol . (2010) 24: 505–12. DOI: 10.1111 / j.1468-3083.2009.03430.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
келоидных шрамов | Michigan Medicine
Обзор темы
Келоид (скажем, «KEE-loyd») — это шрам, который становится больше и шире, чем исходная травма.Келоиды чаще всего растут на груди, плече, верхней части груди и спине, мочках ушей и лице.
Келоиды не превращаются в рак. Но они могут быть надоедливыми или достаточно болезненными, чтобы вы обратились за помощью. Келоиды часто отрастают после лечения.
Можно предотвратить образование келоида, если принять меры по защите кожи после ее повреждения.
Что вызывает келоид?
Келоиды могут образовываться в местах повреждения кожи, например, в результате хирургического пореза, пирсинга, ожога, ветряной оспы или прыщей.Толстая ткань вырастает вверх и выходит из области заживления, делая шрам больше, чем исходная травма. У некоторых людей даже царапина может привести к образованию келоидов.
Келоиды действительно живут семьями, и они редко вырастают со светлой кожей. Эксперты считают, что келоиды могут быть связаны с геном, связанным с темным пигментом кожи.
Каковы симптомы?
Келоиды выглядят как твердые, выпуклые, твердые шрамы. Со временем они становятся больше. Цвет их варьируется от слегка розового до очень темного.
Келоиды могут натирать одежду и вызывать раздражение, зуд или боль. Под воздействием солнца они могут потемнеть, чем остальная часть вашей кожи. Темный цвет может остаться.
Как лечится?
Нет однозначного лекарства от келоидов, но лечение иногда улучшает их внешний вид и самочувствие. После лечения келоидные рубцы часто отрастают.
При попытке вылечить келоид вашему врачу может потребоваться несколько видов лечения. В зависимости от размера и местоположения келоида, а также в зависимости от того, как скоро он будет обработан, ваш врач может:
Облучение обычно используется в качестве последнего варианта лечения келоидов. Есть шанс, что это может вызвать рак.
Ваша медицинская страховка может покрывать некоторые виды лечения келоидов, но не другие. Ваше лечение также может не покрываться, если страховая компания считает, что оно проводится только для улучшения внешнего вида шрама (по косметическим причинам).
Как предотвратить появление келоидов?
Если у вас есть склонность к келоидам, лучше избегать пирсинга, татуировок или любой операции, в которой вы не нуждаетесь.После этих процедур келоиды могут расти.
Чтобы предотвратить появление келоидных рубцов после незначительного повреждения кожи, сразу начните их лечить. Это может помочь ему быстрее зажить и с меньшим количеством рубцов. Следующие советы помогут предотвратить рост келоидов.
Келоид | дерматология | Британника
Популярные вопросы
Что вызывает келоиды?
Келоиды возникают в результате повреждения кожи, которое может быть вызвано чем угодно — от несчастного случая до операции, прыщей, татуировок или пирсинга.
Что такое келоид?
Келоид — это доброкачественная опухоль и хроническое заболевание кожи, при котором чрезмерная рубцовая ткань образует гладкий резиновый нарост на исходной ране. Часто он больше, чем рана, и в основном состоит из коллагена.
Где чаще всего возникают келоиды?
Келоиды чаще всего возникают на груди, плечах, шее и голове, но они могут возникать в любом месте, где повреждена кожа.
Как образуются келоиды?
Келоидное образование является результатом чрезмерной и продолжительной реакции на рану, при которой процесс образования рубцовой ткани в организме выходит из-под контроля.В результате происходит чрезмерное разрастание фибробластов с отложениями коллагена, которые растут на месте первоначального повреждения кожи.
Как лечат келоиды?
Криотерапия часто используется для лечения больших келоидов. Другие варианты лечения включают хирургическое вмешательство, лазерную терапию, инъекции кортикостероидов и компрессионные повязки. На пораженный участок также можно надевать листы силиконового геля.
Показать ещё
Полная статья
Келоид , доброкачественная опухоль и хроническое заболевание кожи, при котором чрезмерная рубцовая ткань (в основном коллаген) образует гладкий каучуковый нарост на исходной ране и часто больше ее.Келоиды трудно поддаются лечению, и хотя они могут образовываться на любой части тела, чаще всего они встречаются на груди, плечах, шее и голове. В основном они вызваны травмой кожи, например, падением или несчастным случаем, прыщами или пирсингом на теле. Келоиды обычно возникают в возрасте от 5 до 25 лет и являются одним из наиболее распространенных хронических кожных заболеваний у детей. Люди с более темной кожей, как правило, особенно подвержены келоидам.
Характеристики и факторы срабатывания
Обычно заживающая рана оставляет минимальное количество рубцовой ткани.С другой стороны, образование келоидов происходит из-за необузданной, чрезмерной и длительной реакции заживления ран, как если бы тормоза в процессе формирования рубцовой ткани не работали. В результате происходит чрезмерное разрастание фибробластов с отложениями коллагена, которые растут на месте первоначального повреждения кожи.
Келоиды могут проявляться в виде отдельных небольших пятен на коже или поражать несколько участков кожи. Они могут быть круглыми или линейными и могут распространяться на более широкие площади. Широкая изменчивость формы, размера и местоположения, скорее всего, связана с лежащими в основе комплексными генетическими аномалиями.На поздних стадиях келоидные поражения могут проявляться в виде крупных кожных узелков, в виде конгломерата узелков или в виде массивных опухолей кожи и больших келоидных пятен. Помимо часто неприятного внешнего вида, келоидное поражение может вызывать боль, зуд и жжение. Келоиды иногда тоже заражаются.
Тенденция к образованию келоидов имеет сильный генетический компонент, что означает, что люди могут унаследовать предрасположенность к этому состоянию. Главный пусковой фактор — это повреждение кожи, которое может происходить бесчисленными способами.Прокол ушей на сегодняшний день является ведущим фактором, вызывающим келоиды уха и мочки уха. Прыщи, пожалуй, являются наиболее частым провоцирующим фактором келоидов на лице, плечах и груди. Хирургия, простые кожные раны в результате падений или несчастных случаев, пирсинг и татуировка, подтяжка лица и увеличение груди и даже мелкие проколы (например, сделанные иглами во время вакцинации) могут вызвать образование келоидов у генетически предрасположенных людей. У лиц с семейным анамнезом келоидных заболеваний профилактика направлена на максимальную защиту кожи от травм, включая защиту от самоповреждений.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасЛечение келоидов
Келоиды трудно поддаются лечению из-за риска развития нового келоида в обрабатываемой области. Более того, не существует лечебного лечения для людей с генетической предрасположенностью к келоидам. Как правило, тип и успех лечения зависят от расположения, размера и толщины келоида.
плоский келоидПлоский келоид.
Предоставлено Майклом Х.Тирган, доктор медициныИнъекции кортизона (или инъекции стероидов в очаг поражения) — распространенный метод лечения келоидов. У некоторых пациентов инъекция стероида в келоид может быть эффективной, приводя к разрушению коллагеновых отложений и сглаживанию роста. Однако большинство пациентов достигают временного результата, и часто требуется дополнительное лечение для поддержания уменьшенного состояния келоида. У небольшой части пациентов инъекция кортизона действительно ухудшает келоид.
Криотерапия, при которой келоид подвергают замораживанию, является эффективным и относительно безопасным методом лечения больших келоидов. При криотерапии жидкий азот наносится на келоид, вызывая обморожение келоидной ткани; что часто приводит к некрозу и разрушению тканей. Обычно требуется повторное лечение, а обработанный келоид требует постпроцедурного ухода. Кожа, окружающая келоид, также может светлеть или темнеть в результате процедуры.
Хотя операция может быть вариантом, новый и еще более крупный келоид может появиться в месте хирургического иссечения.Хирурги пытаются минимизировать этот риск, вводя стероиды, накладывая давящую повязку на рану после операции или используя послеоперационное облучение. Однако использование радиации может повысить риск образования рака на месте поражения.
Другие методы лечения, которые использовались для лечения келоидов, включают лазерную терапию, силиконовые пластины (в которых пластинка силиконового геля надевается на пораженный участок) и компрессионные повязки. Инъекции фторурацила, соединения, используемого в химиотерапии рака, показали некоторую эффективность в сглаживании небольших келоидов.
Майкл Х. Тирган

 Возникает чаще всего у мужчин.
Возникает чаще всего у мужчин.

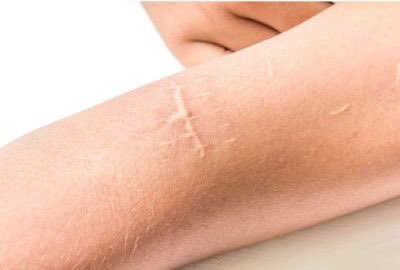
 Недавно возникшие рубцы имеют фиолетово-красноватый оттенок, который со временем светлеет.
Недавно возникшие рубцы имеют фиолетово-красноватый оттенок, который со временем светлеет.
 // Hautarzt — 2021 — Vol — NNULL — p.; PMID:33904964
// Hautarzt — 2021 — Vol — NNULL — p.; PMID:33904964 , Yap JE., Sridhar S. The Off-Label Use of a Lumen-Apposing Metal Stent (LAMS) for a Benign Colon Anastomotic Stricture Causing Recurrent Bowel Obstruction in a Patient with Keloids. // Case Rep Gastrointest Med — 2021 — Vol2021 — NNULL — p.5595518; PMID:33884206
, Yap JE., Sridhar S. The Off-Label Use of a Lumen-Apposing Metal Stent (LAMS) for a Benign Colon Anastomotic Stricture Causing Recurrent Bowel Obstruction in a Patient with Keloids. // Case Rep Gastrointest Med — 2021 — Vol2021 — NNULL — p.5595518; PMID:33884206 // Biomed Res Int — 2021 — Vol2021 — NNULL — p.5897907; PMID:33860039
// Biomed Res Int — 2021 — Vol2021 — NNULL — p.5897907; PMID:33860039