Канцероматоз брюшины — Онкология — Здоровье Mail.ru
Доброго времени суток. Рак желудка является достаточно агрессивной опухолью органов брюшной полости. 3 стадия в течении 12-18 мес. начинает метастазировать. При 3 стадии заболевания » полностью» не излечима и будет прогрессировать. При 3 стадии заболевания, операция в объеме резекции желудка считается не радикальной ( т.е полной) При 3 стадии выполняется удаление всего желудка ( гастрэктомия) Согласно стандартов лечения онкозаболеваний у пациентов молодого возраста после операции проводится системная химиотерапия. В вашем случае прогрессия заболевания проявилась развитием канцероматоза ( это опухолевое поражение брюшины) на деле выглядит как » просыпанное пшено» и по мере роста канцероматозных высыпаний брюшная полость начинает напоминать панцирь ( называют «панцирная брюшная полость») При наличии » раковых» клеток в брюшной полости они начинают стимулировать выделение жидкости в брюшную полость и формируется асцит. К сожалению, -это финал заболевания. Оперативное лечение в данном случае не возможно , потому что , нельзя удалить всю брюшину, т.е всю брюшную полость. В настоящее время за счет наличия канцероматоза у вашей мамы формируется » раковая интоксикация» т.е раковые клетки отравляют организм человека продуктами своего метаболизма. Поэтому человек сильно худеет появляются являения нтоксикации: отказ от еды, тошнота, рвота и .т.д При множественном канцероматозе — проведение химиотерапии опасно т.к введением химиопрепарата вызовит распах опухолевых клетко и как следствие, большой выброс токсических прожуктов разрушения опухоли в кровоток человека. В настоящее врамя все проблемя связаны с прогрессией канцероматоза т. к. при своем росте он сдавливает окружающие структуры. Cтадию вам поставили прильно , т.е 3 стадия в течении года перешла в 4 стадию . В документах вам 4 стадию не поставят, в поставят 3 стадию и 4 клиническую группу по наличию канцероматоза брюшины. Из обезболивающих препаратов, которые вы перечисляете, наркотические обезболивающие Максимальная доза промедола по 1 ампуле х 4 раза в день через 6 часов ( 6-12-18-24) сильнее морфина ничего нет. Платифиллин- это вообще спазмолитический препарат и не имеет ничего общего с обезболиванием. От тоштоты попробуйте «ОНДАНСЕТРОН» КТ — в данной ситуации не играет большой роли , поому что , при проведении операции канцероматоза не было, а в течении года появился. Для диагностики канцероматоза можно выполнить УЗИ органов брюшной полости и исследование жидкости не цитологию ( где будут выявлены раковые клетки) с уважением Елена СергеевнаКанцероматоз брюшины без выявленного первичного очага: oncobudni — LiveJournal
Здравствуйте, сильные и храбрые люди! Читаю это сообщество уже 2 недели, восхищаюсь жизнелюбием и крепостью духа, которыми полны эти страницы!Так уж случилось, что в мою семью пришла беда. У дорогой, любимой тети (58 лет) на КТ нашли злокачественные образования в брюшине — канцероматоз брюшины с поражением ткани печени, большого сальника, выраженный асцит. На данный момент её ничего не беспокоит, кроме увеличившегося живота (с это проблемой она пошла ко врачу, терапевт назначила ей эспумизан, который она и принимала 3 недели.. Проблема не ушла. Тётя попросила направление к гастроэнтерологу, который и назначил КТ и кровь). Кровь хорошая, организм сильный, но вот онкомаркер СА-125 на начало ноября показывал 170 ед. На конец ноября — перевалил за 1000 ед. МРТ малого таза не показала изменений в яичниках, по остальным органам было похоже на заключение КТ (к сожалению, не могу дословно воспроизвести, нет результата перед глазами). Тем не менее подозревали яичники, госпитализировали, собирались начать сегодня ХТ, сделали предварительный смыв асцитической жидкости из брюшины для подтверждения диагноза (изначально ставили CA яичников IV ст., потом в карте уже увидели, что стадия не IV, а III) и не нашли опухолевых клеток!!! Химию отменили, в пн лапароскопия с взятием тканей на гистологию, гистологию 7 дней делать будут, тётю на 2-3 день после операции выпишут. Таким образом, начало лечения затягивается и нас это очень пугает, особенно если сравнивать онкомаркер начала и конца ноября…
Вопросы
1. Кто-нибудь сталкивался с подобным? Если не яичники, то что это может быть с учётом маркера?
2. Что мы можем делать сами, пока не начали основное лечение?
3. Что спрашивать у врача?
Помогите, пожалуйста, советом. Поделитесь опытом. Это нам сейчас очень важно, поскольку оказались как в вакууме, а в интернете чего только не пишут. Врач ничего определенного не говорит — берем образец для гистологии, ждем что покажет.
лечение, срок жизни, симптомы и диагностика
Канцероматоз брюшины – это вторичные метастазы, поражающие плевру с брюшиной. Вторичный очаг считается опасным проявлением злокачественной патологии, снижающим шанс на выздоровление больному. Канцероматоз не относят к отдельному заболеванию. Болезнь является серьезным последствием злокачественного новообразования в печени, поджелудочной железе либо матке. Проявляется выраженными признаками онкологической интоксикации, потерей веса и асцитом.
Характеристика заболевания
Канцероматоз брюшной полости – это вторичный онкологический очаг, возникающий как следствие злокачественного процесса органов брюшины. Вторичный злокачественный процесс провоцирует метастазирование опухоли, развивающейся в органе малого таза или другого участка. Первичный очаг патологии при разрастании выпускает множественные метастазы в отдаленные участки организма.
Лимфогенный перенос аномальных клеток провоцирует развитие канцероматоза в брюшной полости и плевры с выраженными признаками интоксикации. Новообразование прорастает в эпителиальный слой брюшины.
Раковый патоген проникает в серозный слой и закрепляется на стенках полости. Диссеминация сопровождается последующим формированием злокачественных узелков, напоминающих зерно. Узелки увеличиваются в размерах и постепенно сливаются, образуя опухоль большого размера.
Внутрибрюшная оболочка, пораженная злокачественным новообразованием, не способна выполнять экссудативную и резорбтивную функции. В связи с этим в полости накапливается жидкость, развивается асцит.
Чаще всего патология развивается у людей с наличием раковой опухоли органов пищеварительного тракта – желудка, толстой кишки, кишечника, поджелудочной железы. Кишечный и желудочный недуг развивается стремительно, вовлекая в процесс жизненно важные системы организма. Спровоцировать заболевание у женщин может рак матки или яичников.

Рак в яичнике
Поражение брюшной полости злокачественным процессом вторичного характера считается врачами неблагоприятным прогнозом течения. Болезнь плохо поддаётся терапии, что значительно усложняет жизнь пациента.
Карцинома в ткани лёгкого может спровоцировать вторичный очаг – канцероматоз лёгких. Встречаются единичные образования и множественные. Может формироваться в одном органе или сразу в обоих. Развитие протекает стремительно, что негативно сказывается на лечении и выздоровлении больного. Курсы химиотерапии останавливают увеличение опухоли на короткий период времени. Но после курса химиотерапии злокачественная клетка увеличивается в размерах ещё быстрее.
Заболевание встречается у 35% больных раком. Из этого количества у 40% первичный очаг присутствовал в органах пищеварительного тракта – желудка и поджелудочной железы. Но в медицинской практике есть примеры развития патологии из-за злокачественного процесса совершенно другого участка.
Код по МКБ-10 болезнь имеет С78.6 «Вторичное злокачественное новообразование брюшины и забрюшинного пространства. Злокачественный асцит».
Причины развития заболевания
Главной причиной развития канцероматоза считается первичный очаг злокачественного процесса. Раковая опухоль способна формировать метастазные ростки, которые проникают в ближайшие и отдалённые участки человеческого тела. Происходит это обычно на последней стадии болезни.
Распространение метастазов по организму происходит:
- С кровью либо лимфой.
- Первичный раковый очаг проникает в брюшную полость с последующим закреплением на стенках полости.
- После хирургического удаления первой раковой опухоли.
Внутрибрюшная полость совместно с серозной оболочкой имеет площадь равную 2 м2. Раковые ростки, проникая в данную область, способны сформироваться на огромном участке. Стенки и складки органа соприкасаются друг с другом, что увеличивает скорость развития патологии.
Стремительное формирование патологии провоцирует наличие сопутствующих факторов:
- Брюшная полость находится в опасной близости с органами желудочно-кишечного тракта.
- Внутренние складки постоянно соприкасаются друг с другом.
- Присутствует огромное количество кровеносных и лимфатических сосудов.
Формирование новообразований происходит на участках, не подверженных перистальтике кишечника. Размер первичного очага влияет на риск развития канцероматоза. Чем крупнее опухоль, тем быстрее и глубже происходит проникание метастазов в ткани брюшины.
Недифференцированный рак желудка всегда сопровождается формированием канцероматоза.
Признаки патологии
При раке первичного очага у больного присутствуют выраженные симптомы поражения конкретного органа. Но в некоторых ситуациях первые признаки опасного заболевания появляются при канцероматозе. Именно это позволяет заподозрить болезнь и поставить правильный диагноз.
Патология обнаруживает следующие признаки:
- Появляются приступообразные болевые спазмы в области живота – постоянные или периодические, с ноющим характером.
- У больного резко увеличивается живот при заметной общей потере веса – в брюшной полости происходит накопление жидкости.
- Наблюдаются приступы тошноты с ротными позывами.
- Болевые ощущения с коликами в области живота.
- Сбой в работе кишечника – длительный запор сменяет диарея.
- Отмечается выраженная мышечная слабость.
- Температура тела принимает термальные показатели на фоне яркого озноба.
- Усиленное потоотделение.
- Сильные головные боли и боли в мышцах.


Болезнь протекает на фоне стремительного ухудшения самочувствия больного. Человек доставляется по скорой в отделение хирургии или гастроэнтерологии. В стационаре после диагностирования ставится правильный и точный диагноз.
Классификация болезни
Канцероматоз брюшной полости классифицируют согласно расположению метастазных отростков и их количеству:
- Стадия Р1 характеризуется локальным расположением узла с одним злокачественным поражением.
- На стадии Р2 присутствует несколько раковых участков, подтверждающих болезнь. Между пораженными очагами выявляются участки здоровых тканей.
- Стадия Р3 соответствует 4 степени злокачественности. Выявляется множество злокачественных новообразований с признаками слияния в единый очаг.
Диагностика заболевания
Выявить болезнь без проведения обследования врач может у пациента онкологического центра с терапией раковой болезни. В остальных случаях требуется проведение расширенного обследования организма больного. Диагностика включает следующие процедуры:
- На УЗИ исследуют органы брюшины с малым тазом. Здесь же выявляется первичный очаг с признаками внутренних изменений в ткани органа. Врач определяет размер, форму и точную локализацию образования.
- При помощи компьютерной томографии изучают орган структурно. По КТ определяются все злокачественные участки, структура с локализацией.
- МРТ и МСКТ проводят с использованием контраста – это позволяет обнаружить отдаленные метастазы и степень поражения лимфатических узлов.
- Лапароскопия требуется для внутреннего изучения поражённых стенок брюшины и получения биологического образца. Образец исследуется в лаборатории биопсическим методом.
- Кровь изучается анализом ОТ-ПЦР. Врачи на основе данного анализа точно выясняет место первичного очага болезни.

Порой установить первичный участок развития патологии не удаётся. В остальных случаях методы диагностики дают подробную информацию о заболевании. Обследование позволяет установить степень поражения организма и назначить адекватное лечение.
Лечение заболевания
Процесс лечения пациента с диагнозом канцероматоза брюшины долгий и сложный. Результат может быть положительным и отрицательным. Неблагоприятный результат терапии случается чаще. Болезнь можно вылечить на ранних сроках развития и с применением новейших методик и аппаратуры в медицине. В основном применяется хирургическое иссечение злокачественного уплотнения с курсами химиотерапии. В последние годы разработано много новых эффективных методов борьбы с онкологией. Медицина не останавливается на этом и ищет новые варианты лечения.
Удаление опухоли хирургическим методом проводится с иссечением первичного очага, больных лимфатических узлов. Также возможно удаление органов, поражённых раковыми клетками – матки, желчного пузыря, участка толстого или тонкого кишечника и сигмовидной кишки.
Химиотерапия применяется как отдельное лечение, так и совместное с оперативным методом. В последнее время врачи предпочитают использовать перитонеальный гипертермический способ химиотерапии. Основа метода характеризуется вводом лекарственных препаратов в брюшную полость при помощи горячего воздуха. Иногда это делают сразу после операции или в период проведения операции.
Противоопухолевый раствор держат в полости 60 мин. Затем выводят. За это время происходит непрерывная циркуляция лечебного раствора, который уничтожает злокачественные патогены.

Выявление первичного очага патологии считается первоочередной задачей врачей. Обнаружение болезни с точными размерами и степенью развития позволяет провести полное лечение. Это повышает шанс пациента на выздоровление.
Локализация патологии в доступном и операбельном месте позволяет провести хирургическое иссечение узла. После операции назначаются курсы химиотерапии и облучения гамма-лучами. Дозировки и курсы подбираются индивидуально согласно физическим показателям и медицинским исследованиям пациента.
Параллельно основным способам лечения используется симптоматическое купирование негативных симптомов болезни:
- Делается специальный прокол для вывода лишней жидкости из брюшины.
- Болевой синдром блокируется приемом обезболивающих препаратов.
- Назначаются пробиотики для улучшения перистальтики органов пищеварения.
- Вводятся капельницы с физрастворами для восполнения витаминного и минерального дефицита.
- Мочегонные средства способствуют выводу лишней жидкости.
- Корректируется питание – назначается специальная диета.
Пациент постоянно находится под наблюдением лечащего врача. После курса терапии проводится повторное диагностирование организма. Требуется это для корректировки терапии.
Прогноз лечения
Срок жизни больного зависит от степени поражения организма онкологическим процессом. Сколько проживёт человек, врач сказать не сможет точно. Зависит это от физических показателей и психологического настроя больного.
Поражение незначительного участка брюшины – процент выживаемости выше у пациентов. Продолжительность жизни составляет до 3 лет и более. Если первичный очаг поддаётся лечению, шансы увеличиваются.
При поражении большей площади органа прогноз для пациента неблагоприятный. Летальный исход диагностируется через несколько месяцев. Применяется паллиативная терапия для купирования болевых синдромов и психологического дискомфорта.
При данном заболевании всё зависит от срока выявления и психологического настроя пациента. Доказано учёными, что позитивный настрой на выздоровление значительно увеличивал шансы на выздоровление и долгую жизнь.
Выберите город, желаемую дату, нажмите кнопку «найти» и запишитесь на приём без очереди:
что это такое, симптомы, причины канцероматоза брюшной полости, прогноз
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.

Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования.
Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение

Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
что это такое, фото, лечение и прогноз
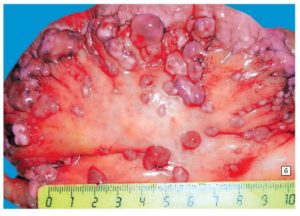 Злокачественные новообразования любых органов могут привести к возникновению метастазов, а вторичные очаги существенно снижают шансы пациента на полное восстановление – к таким метастазам относится канцероматоз брюшины, основными проявлениями которого являются асцит, снижение веса и нарастающие симптомы интоксикации. Асцит – это гемморагический выпот, развивающийся с дессименацией по брюшине, которая возникает при злокачественных опухолях брюшной полости.
Злокачественные новообразования любых органов могут привести к возникновению метастазов, а вторичные очаги существенно снижают шансы пациента на полное восстановление – к таким метастазам относится канцероматоз брюшины, основными проявлениями которого являются асцит, снижение веса и нарастающие симптомы интоксикации. Асцит – это гемморагический выпот, развивающийся с дессименацией по брюшине, которая возникает при злокачественных опухолях брюшной полости.
Канцероматоз считается заболеванием с неблагоприятным прогнозом, при подобном осложнении, как правило, используется паллиативное (поддерживающее жизнедеятельность) лечение.
Канцероматоз брюшной полости. Что это такое?
Согласно МКБ-10 (Международной классификации болезней), канцероматоз – это вторичная, онкологическая патология, следствие распространения клеток рака из первичного очага.
Такой перенос обычно осуществляется с помощью лимфосистемы (лимфогенное заболевание), реже патология обуславливается прорастанием в брюшину первичной опухоли.
Раковые клетки, оказавшиеся в серозных полостях, закрепляются там и формируют образования, напоминающие по форме зерна проса. Эти новообразования постепенно расширяются, занимают новые площади, а результате сливаются, создавая внушительных размеров опухоль.
Ведущие клиники в Израиле
Этот злокачественный процесс нарушает экссудативную и резорбтивную функции серозной оболочки. Подобное изменение является причиной накапливания избыточной жидкости, что вызывает асцит.
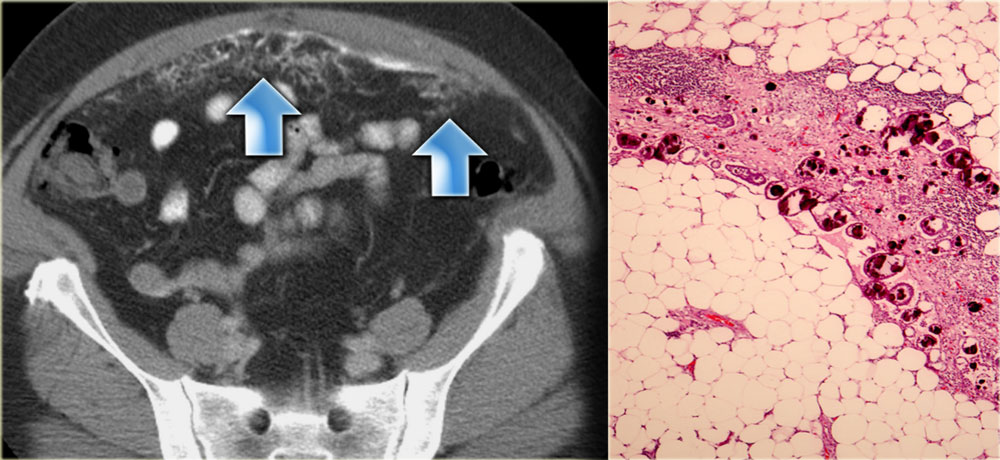 Обследование больных с канцероматозом брюшины выявило, что чаще всего данное осложнение встречается у пациентов с онкологией органов ЖКТ – поджелудочной железы, желудка.
Обследование больных с канцероматозом брюшины выявило, что чаще всего данное осложнение встречается у пациентов с онкологией органов ЖКТ – поджелудочной железы, желудка.
Второе место по распространенности причины возникновения патологии принадлежит раку яичников, и так как развитие карциноматоза брюшины возможно при раке яичников, это означает, что данному осложнению женщины подвержены гораздо чаще, чем мужчины.
Независимо от вида рака, поражение брюшины считается очень неблагоприятным признаком. И поскольку при подобном диагнозе невозможно использовать многие методики лечения, это может сказаться на вероятности успешного выздоровления пациента и сроке его жизни.
Также возможно образование карциноматоза плевральной полости. Оно характерно для рака легких, молочной железы, мезотелиомы плевры. Однако это состояние может обуславливаться любой опухолью, которая способна давать метастазы в плевру и легкие. Такие метастазы в плевре увеличивают проницаемость ее сосудов и нарушают отток лимфы, что может привести к накоплению жидкости и появлению канцероматозного плеврита.
Причины возникновения
 Главной причиной канцероматоза брюшины является уже имеющийся раковый очаг. В результате развития клетки опухоли неизбежно приобретают подвижность, вследствие чего они способны отделяться и перемещаться.
Главной причиной канцероматоза брюшины является уже имеющийся раковый очаг. В результате развития клетки опухоли неизбежно приобретают подвижность, вследствие чего они способны отделяться и перемещаться.
Распространение раковых клеток происходит:
- По кровотоку или с током лимфы;
- Через прорастание первичного новообразования в область брюшины;
- При оперативном хирургическом вмешательстве по удалению первичной опухоли.
Площадь серозной оболочки и всей брюшины может достигать 2 квадратных метров. Такие размеры определяют расположение непосредственно брюшины в брюшной полости, то есть у нее есть соприкасающиеся складки. Подобное строение способствует поражению значительной области брюшины при злокачественном процессе.
Ускоренному развитию канцероматоза брюшины способствуют следующие факторы:
- Постоянное соприкосновение складок брюшины;
- Соприкосновение брюшины с органами пищеварения;
- Наличие в органе обширной сети кровеносных и лимфатических сосудов.
Оказавшиеся в брюшине раковые клетки стремятся закрепиться в месте, где она меньше всего подвержена воздействию перистальтики кишечника. Также риск канцероматоза зависит от объемов первичной злокачественной опухоли и степени проникновения вглубь органа.
В случае недифференцированного рака желудка поражение брюшины опухолевыми клетками наблюдается у большей части пациентов.
Классификация и признаки канцероматоза
 Поскольку канцероматоз брюшины – это вторичное поражение, сначала появляются симптомы, проявляющиеся при первичной опухоли. Однако иногда поставить диагноз рака позволяет именно клиническая картина поражения серозной оболочки.
Поскольку канцероматоз брюшины – это вторичное поражение, сначала появляются симптомы, проявляющиеся при первичной опухоли. Однако иногда поставить диагноз рака позволяет именно клиническая картина поражения серозной оболочки.
К основным симптомам, которые указывают на поражение брюшины, можно отнести:
1) Увеличение живота при резком снижении массы тела. Увеличение живота в размерах происходит из-за скопления жидкости – эта патология называется «асцит»;
2) Появление ноющих, тупых болей. Болевые ощущения могут быть постоянными или беспокоящими пациента периодами до нескольких дней;
3) Нарушения пищеварения. Проявляются тошнотой, коликами и болями в животе, также возможна рвота. Затрудняется опорожнение кишечника, иногда запор может сменяться поносом;
4) Симптомы интоксикации. Проливные поты, сильная слабость, повышение температуры, озноб, боли в голове и мышцах – этими симптомами характеризуется развивающийся канцероматоз.
Хотите получить смету на лечение?
Получите смету на лечение* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
У больного тяжелое общее состояние, такие пациенты нередко попадают в гастроэнтерологию или хирургию с диагностированным асцитом, причина которого выявляется позже.
Канцероматоз брюшины имеет классификацию, основанную на числе и локализации метастазов:
- Р1 – локальное поражение брюшины, ограниченное всего одним участком;
- Р2 – выявляется несколько очагов кацероматоза. Между данными очагами есть участки здоровой брюшины;
- Р3 – наблюдаются многочисленные, сливающиеся злокачественные очаги кацероматоза.
Видео — Карциноматоз брюшины: взгляд химиотерапевта
Диагностические мероприятия
В первую очередь онколог может заподозрить канцероматоз у людей, уже имеющих раковое заболевание в анамнезе.
Однако при снижении веса, болях в животе и прочих признаках онкологического образования врач должен в целях исключения либо подтверждения диагноза отправить пациента на диагностические процедуры.
Назначается:
- Компьютерная томография. Послойное исследование брюшной области, выявление всех очагов патологии, их месторасположения, структуры;
- УЗИ брюшной полости и органов малого таза. Данный метод позволяет выявить первичную опухоль, их размеры и расположение, изменения в брюшине;
- МСКТ используется при оценке распространенности опухоли и для выявления поражений лимфоузлов;
- Анализ крови с высокой точностью устанавливает место расположения первичного очага;
- Лапароскопия позволяет как осмотреть брюшину, так и производить забор измененных тканей с целью проведения биопсии.
Примерно в 5-6% случаев при выявлении раковой опухоли возникают сложности, иногда она имеет настолько маленькие размеры, что не удается обнаружить ее прижизненно.
Как лечить канцероматоз брюшины?
 Лечение пациентов с канцероматозом достаточно сложное, а также оно не всегда оказывается достаточно эффективным. По возможности назначается операция в сочетании с химиотерапией.
Лечение пациентов с канцероматозом достаточно сложное, а также оно не всегда оказывается достаточно эффективным. По возможности назначается операция в сочетании с химиотерапией.
Также постоянно применяется и много других, инновационных методик лечения, так что нельзя с уверенностью сказать, что уже в ближайшем будущем не станет доступным эффективный способ лечения данной патологи. Тем не менее, народными средствами заболевание не вылечить.
Хирургическое лечение
Оперативное вмешательство (перитонэктомия) прежде всего заключается в удалении первичного ракового очага, пораженных лимфатических узлов, очагов осеменения раковыми клетками. Часто операция сочетается с удалением части тонкого или толстого кишечника, сигмовидной кишки, желчного пузыря, матки и придатков.
Химиотерапия при канцероматозе
При лечении больных с канцероматозом применяют одну из наиболее современных методик – гипертермическую интра перитонеальную химиотерапию.
Этот способ заключается во введении препаратов химиотерапии с помощью горячего воздуха прямо в брюшину, чего можно добиться в процессе операции.
Введенный раствор с химиотерапии препаратами продолжает находиться в брюшине примерно в течение часа, непрерывно циркулируя и уничтожая раковые клетки. Эффективность лечения увеличивается гипертермической химиотерапией в несколько раз.
Лечение первичного очага
 В случае канцероматоза брюшины следует выявить первичный очаг, а также оценить его локализацию, стадию и распространенность метастазов. Решение о необходимом лечении принимается только после проведения всех исследований.
В случае канцероматоза брюшины следует выявить первичный очаг, а также оценить его локализацию, стадию и распространенность метастазов. Решение о необходимом лечении принимается только после проведения всех исследований.
В случае, если стадия рака и локализация опухоли позволяют, проводится оперативное вмешательство по удалению образования (например, на 4 степени прогноз неблагоприятен). Дополнительно назначают сеансы лучевого облучения и химиотерапии.
Симптоматическая терапия
Это лечение, имеющее целью снижение или устранение основных симптомов заболевания. При канцероматозе, как правило, проводят:
- Обезболивание. В очень запущенных случаях боль моно снять только с помощью наркотического анальгетика;
- Лечение асцита. Оно заключается в удалении жидкости через имеющийся в брюшной стенке прокол;
- Улучшение функционирования органов пищеварения. Требуется улучшить усвояемость пищи и переваривание, усилить перистальтику;
- Вливание растворов. Внутривенное вливание имеет дезинтоксикационное действие, такое лечение нормализует состав крови;
- Применение мочегонных препаратов способствуют выводу лишней жидкости.
Если есть необходимость, то пациентам назначают препараты, улучшающие работу сердца и сосудов, спазмолитики, ферменты. Больной обязательно должен оставаться под наблюдением и периодически проходить повторный осмотр.
Сколько живут с диагнозом канцероматоз брюшины?
Обычно выявление заболевания происходит на последних стадиях. В таком случае при поражении брюшины продолжительность жизни больного составляет всего несколько лет, она зависит от тактики лечения первичного очага. Если была охвачена поражением большая часть брюшины, то справится с патологией невозможно и жить пациент будет всего несколько месяцев. Жизнеспособность поддерживается с помощью паллиативной методики, которая облегчает состояние человека.
Прогноз
Если заболевание было обнаружено в начале развития патологии, когда первичный очаг может быть удален, то прогноз благоприятный. Тогда необходимо придерживаться комплексной тактики лечения.
Если патология была выявлена на последних стадиях, то прогноз неблагоприятный, и независимо от лечения срок жизни существенно снижается. В таком случае проводится симптоматическое лечение, целью его действия является облегчение самочувствия пациента.
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Наверняка вы задаётесь вопросом: что же теперь делать? Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Введение
Перитонеальный канцероматоз (опухоль брюшины) — одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматоза
Перитонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже — первичными опухолями брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Программа лечения перитонеального канцероматоза определяется междисциплинарным консилиумом врачей, в который входят специалисты экспертного класса ФГБУ «НМИЦ радиологии» Минздрава России. Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
лечение, срок жизни и симптомы. Продолжительность жизни пациентов с канцероматозом брюшной полости
Содержание↓[показать]При любых злокачественных образованиях могут развиться метастазы. При наличии вторичных очагов опухоли шансы пациента на выздоровление снижаются. Многие пациенты, которые обращаются к врачам-онкологам, интересуются, что такое канцероматоз брюшины и может ли он развиться при онкологии.
Канцероматоз брюшины является вторичным онкологическим заболеванием, прогноз которого в большинстве случаев неблагоприятен. Пациентам с данным диагнозом назначается паллиативное лечение, методы которого направлены на поддержание жизнедеятельности. Лечение канцероматоза брюшной полости осуществляется в Юсуповской больнице, опытные специалисты которой принимают даже тех пациентов, от которых отказались в других клиниках.
Канцероматоз — что это?
Канцероматоз брюшной полости является онкологическим заболеванием, формирование которого происходит из-за распространения раковых клеток из первичного очага. Лечение данного заболевания предполагает оперативное вмешательство с последующим проведением химиотерапии.
Данное заболевание может развиваться на фоне злокачественной опухоли любого органа, у женщин диагностируется канцероматоз брюшины при раке яичников.
Врачами-онкологами при постановке диагноза применяется классификация в зависимости от локализации и количества метастазов:
- степень Р1 – локальное развитие онкологического процесса
- степень Р2 –несколько пораженных участков серозной оболочки
- степень Р3 – множественные очаги пораженной ткани.
Если у пациента диагностирован канцероматоз брюшины, продолжительность жизни сокращается. Опытные врачи-онкологи Юсуповской больницы при лечении пациентов проводят полную диагностику для определения текущего состояния, разрабатывают программу лечения. Современное оборудование, которым оснащена Юсуповская больница, позволяет проводить комплексное обследование.
Вопросы многих пациентов связаны с лечением канцероматоза брюшины. Благоприятность прогноза при данном онкологическом процессе зависит от степени поражения и выбранного лечения. Для установления степени поражения проводится лабораторно-инструментальное обследование.
Признаки и симптомы
Канцероматоз брюшины, лечение которого требует пребывания пациента в стационаре и круглосуточного наблюдения, является вторичным заболеванием. Клиническая картина при данном диагнозе определяется признаками первичного злокачественного образования. Канцероматоз брюшины при раке характеризуется формированием асцита – скоплением в брюшной полости свободной жидкости.
Основные признаки канцероматоза брюшины:
- быстро снижается масса тела и увеличивается живот
- нарушение пищеварения
- обильное потоотделение;
- тупые, сильные боли в области живота
- характеризуют канцероматоз брюшины боли под грудью
- у больного отмечаются признаки сильной интоксикации
- жидкий стул, в котором может присутствовать кровь.
По мере прогрессирования онкологического процесса у больного может происходить потеря сознания и наблюдаться состояние бреда. Канцероматоз брюшины при раке требует незамедлительного лечения, поэтому Юсуповская больница принимает пациентов в тяжелом состоянии ежедневно 24 часа в сутки.
Канцероматоз и асцит могут угрожать жизни больного, поэтому люди, находящиеся в зоне риска, должны знать симптомы болезни, чтобы своевременно обратиться к врачу-онкологу. Специалисты Юсуповской больницы отвечают на вопросы пациентов: канцероматоз брюшной полости — что это такое, какие способы лечения существуют и какова продолжительность жизни.
Причины развития
Канцероматоз брюшины, лечение которого сочетает оперативное вмешательство и химиотерапию, формируется на фоне имеющегося первичного очага. Раковые клетки при развитии становятся подвижными, поэтому они начинают отделяться от опухоли и распространяться по организму.
Канцероматоз брюшины и асцит распространяется стремительно, так как перемещение раковых клеток осуществляется несколькими путями:
- с током крови и лимфатической жидкости
- при удалении первичной раковой опухоли, например, канцероматоз брюшины при раке яичников
- при прорастании злокачественной опухоли в брюшину.
Масштаб поражения при данном заболевании может быть достаточно большим, так как площадь брюшины может достигать двух квадратных метров. Канцероматоз брюшины, лечение и срок жизни при котором взаимосвязаны, быстро распространяется из-за анатомического строения брюшной полости. Канцероматоз брюшины с гиперметаболизмом сопровождается такими же симптомами.
Обратитесь в Юсуповскую больницу, если у Вас диагностирован канцероматоз брюшины, лечение онкологического процесса осуществляется в клинике онкологии. Специалисты клиники онкологии, входящей в состав Юсуповской больницы, помогают даже тем пациентам, у которых выявлен канцероматоз брюшины 4 стадии.
Диагностика заболевания
Актуальные вопросы пациентов, у которых выявлен канцероматоз брюшины, включают лечение и продолжительность жизни. Заподозрить онкологический процесс способен врач при взаимодействии с пациентами, имеющими раковое заболевание.
Если у пациента происходит снижение массы тела и присутствуют признаки интоксикации, врач назначает обследование, чтобы опровергнуть или подтвердить диагноз.
Диагностические меры при подозрении на канцероматоз брюшины и асцит:
- ультразвуковое исследование органов малого таза и брюшной полости
- анализ крови
- проведение лапароскопии для осмотра брюшины и забора тканей для биопсии
- компьютерная томография
- МСКТ с контрастным веществом позволяет выявить поражение лимфатических узлов.
Канцероматоз брюшины, продолжительность жизни при котором зависит от степени поражения тканей, может вызвать сложности при диагностике в том случае, если не определен первичный очаг. Врачи-онкологи Юсуповской больницы при консультации пациента оценивают прогноз на основе имеющихся данных обследования, назначают терапию и регулярно контролируют ее эффективность.
Лечение
Канцероматоз брюшной полости, прогноз при котором во многом зависит от адекватности терапии, серьезно отражается на здоровье пациента. Первым этапом лечения злокачественной опухоли является выявление первичного очага, его расположение и стадию. Терапия при патологии назначается только после получения специалистом необходимых данных.
Хирургические методы терапии применимы в том случае, когда это позволяет стадия и расположение раковой опухоли. Канцероматоз брюшной полости 4 степени, прогноз при котором неблагоприятен, не предполагает оперативного вмешательства. Канцероматоз брюшины и асцит требуют лечения химиотерапией.
При данном заболевании проводится симптоматическая терапия, которая предполагает обезболивание, удаление скопившейся жидкости, предотвращение интоксикации, вывод лишней жидкости и улучшение пищеварения.
Продолжительность жизни
Канцероматоз брюшины и асцит, прогноз при которых зависит от многих факторов, может затрагивать небольшую часть брюшины. Если операция проведена своевременно, то прогноз является относительно благоприятным. Однако для этого больному необходимо строго придерживаться рекомендаций врача-онколога.
Если онкологическое заболевание распространилось на большую площадь серозной оболочки, в течение нескольких месяцев может наступить летальный исход. Однако качественная паллиативная терапия способна улучшить прогноз и облегчить состояние больного.
Чтобы начать лечение канцероматоза и улучшить прогноз, обратитесь в клинику онкологии Юсуповской больницы. Опытные специалисты в области лечения раковых заболеваний проведут комплексное обследование и совместно с другими специалистами разработают эффективную программу лечения. Записаться на прием к врачу-онкологу Юсуповской больницы можно через форму обратной связи на сайте или по телефону.
Автор
Алексей Андреевич МоисеевЗаведующий онкологическим отделением, врач-онколог, химиотерапевт, к.м.н.
Список литературы
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- Черенков В. Г. Клиническая онкология. — 3-е изд. — М.: Медицинская книга, 2010. — 434 с. — ISBN 978-5-91894-002-0.
- Широкорад В. И., Махсон А. Н., Ядыков О. А. Состояние онкоурологической помощи в Москве // Онкоурология. — 2013. — № 4. — С. 10—13.
- Волосянко М. И. Традиционные и естественные методы предупреждения и лечения рака, Аквариум, 1994
- John Niederhuber, James Armitage, James Doroshow, Michael Kastan, Joel Tepper Abeloff’s Clinical Oncology — 5th Edition, eMEDICAL BOOKS, 2013
Цены на лечение канцероматоза брюшины
*Информация на сайте носит исключительно ознакомительный характер. Все материалы и цены, размещенные на сайте, не являются публичной офертой, определяемой положениями ст. 437 ГК РФ. Для получения точной информации обратитесь к сотрудникам клиники или посетите нашу клинику.
Скачать прайс на услуги
Мы работаем круглосуточно
Что такое перитонеальный карциноматоз? (с иллюстрациями)
Карциноматоз брюшины — это тип вторичного рака, который поражает слизистую оболочку брюшной полости, называемую брюшиной. Это происходит, когда рак метастазирует из другой части тела и имплантируется в подкладку. Карциноматоз брюшины чаще всего возникает после тяжелого или нелеченного рака поджелудочной железы, яичников, желудка и толстой кишки. Симптомы могут быть разными, но многие люди испытывают сильную усталость и боли в животе. Быстрое и агрессивное лечение в виде лекарств и хирургического вмешательства жизненно важно для предотвращения фатальных осложнений.
Симптомы карциноматоза брюшины могут включать сильную усталость.Некоторые виды рака более склонны к быстрому метастазированию в брюшину, чем другие. Неудивительно, что опухоли в органах, которые находятся внутри или рядом с брюшной полостью, представляют самый высокий риск развития этого типа рака.Люди с широко распространенным раком желудка и кишечника подвергаются особенно высокому риску, особенно если они вызывают язвы и разрывы. Рак яичников, печени и поджелудочной железы также известен своим быстрым распространением. Иногда опухоль далеко от брюшной полости или рак кости могут привести к перитонеальному карциноматозу после того, как раковые клетки проникают в лимфатические узлы и кровоток.
Симптомы карциноматоза брюшины могут включать затрудненное дыхание.Наиболее частые симптомы карциноматоза брюшины включают острую или хроническую боль, судороги, вздутие живота и общую усталость. Многие симптомы возникают, когда в брюшной полости накапливается лишняя жидкость, что является прямым следствием активности ближайшей опухоли. Также могут присутствовать другие проблемы, такие как затрудненное дыхание, проблемы с пищеварением и боли в груди, в зависимости от степени и местоположения исходного рака.
Лечение перитонеального карциноматоза может включать хирургическое вмешательство.В большинстве случаев врачи знают, что у пациентов есть первичный рак, еще до того, как они заболеют.Большинство людей уже получают какие-либо формы лечения рака от метастазов. Ультразвук и компьютерная томография используются для выявления признаков опухолей, скопления жидкости и поврежденных тканей в брюшной полости. Если обнаруживается что-то подозрительное, может потребоваться биопсия ткани, чтобы подтвердить, что это рак. Решения о лечении принимаются немедленно, чтобы обеспечить пациентам наилучшие шансы на выздоровление.
Симптомы перитонеального карциноматоза могут включать боль в животе.Хирургия — это метод выбора, когда опухоли небольшие и изолированы в брюшине. Если можно удалить всю опухоль и эффективно вылечить первичный рак, у пациента будет хороший прогноз. Рак на поздних стадиях обычно лечится с помощью комбинации хирургического вмешательства, химиотерапии и лучевой терапии. Даже если кажется, что лечение было успешным, это состояние может стать повторяющейся проблемой. Регулярные осмотры и экзамены являются жизненно важными элементами последующего ухода, позволяющими свести к минимуму будущие проблемы.
Пациентов на поздних стадиях карциноматоза брюшины можно лечить химиотерапией. Карциноматоз брюшины — это тип вторичного рака, который поражает слизистую оболочку брюшной полости, называемую брюшиной.Ультразвук можно использовать для обнаружения рака брюшной полости. .Лечение перитонеального карциноматоза при запущенном раке желудка: современное состояние
Рак желудка (РЖ) является четвертым по распространенности раком и второй ведущей причиной смерти от рака в мире; У 53–60% пациентов наблюдается прогрессирование заболевания и они умирают от перитонеального карциноматоза (ПК). ПК желудочного происхождения имеет крайне неблагоприятный прогноз со средней оценкой выживаемости в 1-3 месяца. В различных исследованиях представлены противоречивые данные о выживаемости; однако все согласились с необходимостью полной циторедукции для улучшения выживаемости.Гипертермическая внутрибрюшинная химиотерапия (HIPEC) играет адъювантную роль в предотвращении перитонеальных рецидивов. Следует усилить мультидисциплинарный подход: сочетание неоадъювантной внутрибрюшинной и системной химиотерапии (NIPS), циторедуктивной хирургии (CRS), HIPEC и ранней послеоперационной внутрибрюшинной химиотерапии (EPIC) может повысить уровень полноты циторедукции (CC) и, следовательно, выживаемость. , особенно у пациентов с индексом рака брюшины (PCI) ≤6. Неоадъювантная химиотерапия может улучшить выживаемость также при РПЖ после ГК, а адъювантная химиотерапия может предотвратить рецидив.В последнее десятилетие в Германии был разработан новый интересный препарат под названием катумаксомаб. Два исследования показали, что этот препарат, по-видимому, улучшает выживаемость без прогрессирования у пациентов с ГК; однако окончательные результаты обоих исследований еще не опубликованы.
1. Введение
Рак желудка (РЖ) является четвертым по распространенности раком и второй по значимости причиной смерти от рака в мире [1, 2]. Основными факторами риска развития ГК являются инфекция Helicobacter pylori, атрофический гастрит, кишечная метаплазия, дисплазия, мужской пол, курение сигарет, частичная гастрэктомия, болезнь Менетрие и генетические факторы [3].
Глобальная частота локализации первичных опухолей и гистологические типы постоянно меняются: в Соединенных Штатах и в Западной Европе частота возникновения пищеводно-желудочного перехода (тип Барретта) и аденокарциномы кардии желудка увеличивается [4], в то время как частота встречаемости снижается. дистальный GC с 1970-х годов, особенно в странах Запада [5].
Хотя смертность от GC снизилась, она остается заболеванием с плохим прогнозом и высокой смертностью, уступая только опухоли легких.Прогноз ГК зависит от стадии и локализации: проксимальные опухоли желудка (т. Е. Опухоль кардии) имеют худший прогноз по сравнению с опухолями в пилорическом отделе антрального отдела желудка, а когда заболевание ограничивается слизистой оболочкой желудка, 5-летняя выживаемость составляет около 95%, в то время как сообщаемая 5-летняя выживаемость для продвинутых GC колеблется от 10 до 20% [5].
Диссеминация метастазов в GC может происходить через кровоток или в брюшную полость; это последнее состояние называется перитонеальным карциноматозом (ПК) [6] и считается стадией IV ГК.Недавние исследования показывают, что перитонеальная диссеминация встречается чаще, чем гематогенные метастазы. Только 40% смертей от ГК имеют метастазы в печени, в то время как в 53–60% заболевание развивается через ПК [3].
2. Эпидемиология перитонеального карциноматоза
PC считается конечной стадией первичных злокачественных заболеваний брюшины (таких как мезотелиома брюшной полости) и частым проявлением рака пищеварительного тракта и гинекологических распространенных форм рака (таких как опухоль аппендикуляра, рак яичников, рак толстой кишки). , или рак желудка).Обычно это связано с плохим прогнозом; Пациенты с ПК желудочного происхождения имеют крайне плохой прогноз со средней оценкой выживаемости в 1-3 месяца [3, 14].
Литературные данные показывают, что 15% пациентов обнаруживают PC ab initio и 35% пациентов умирают от внутрибрюшинного рецидива ПК, ограниченного исключительно брюшиной [15]. Системная химиотерапия увеличивает среднюю выживаемость при метастатическом раке желудка до 7–10 месяцев [16], но у пациентов с РПЖ из-за ГК такого же улучшения не сообщалось [17].
В настоящее время при интраоперационном обследовании брюшной полости посев брюшины обнаруживается у 10–20% пациентов, которым назначена потенциально лечебная резекция, и у 40% пациентов на II-III стадии [15, 18, 19]; У 20–50% пациентов, получавших радикальное хирургическое вмешательство, разовьется послеоперационный перитонеальный рецидив [20], а внутрибрюшинное распространение опухолевых клеток наблюдается у 54% пациентов, умерших от рецидива после операции на поздних стадиях РЖ [21].
За последние 30 лет улучшились мультимодальные терапевтические подходы к ПК, в результате чего изменилась роль хирургии: больше не простая операция по удалению опухоли, а полная циторедукция опухоли без макроскопической резидуальной болезни.
Sugarbaker исследовал синергизм эффектов гипертермии и внутрибрюшинной противораковой химиотерапии против опухолевых клеток; он обнаружил существование ПК, происходящего из злокачественных опухолей низкой степени злокачественности, не способных к инвазии (таких как псевдомиксома брюшины), которые можно лечить с помощью циторедуктивной хирургии (CRS) и гипертермической внутрибрюшинной химиотерапии (HIPEC).
В 1995 году Шугарбейкер окончательно систематизировал, с точки зрения обоснования и хирургической техники, процедуру перитонэктомии [22].Вслед за этими новаторскими исследованиями эту процедуру изучают все большее число авторов [19]. Более того, те же авторы начинают тестировать эти методы на более агрессивных опухолях.
3. Патофизиология перитонеального карциноматоза
Распространение свободных раковых клеток в брюшину происходит через отшелушивание и приводит к прямому проникновению в серозную оболочку. Хирургическое вмешательство или травма могут облегчить этот механизм [19]. Опухолевые клетки также могут диффундировать, проходя через «устьица»: большие сообщающиеся отверстия, расположенные на поверхности брюшины, между брюшной полостью и лимфатическими сосудами [15].Распределение клеток в брюшной полости также обусловлено физическими факторами: первичным очагом опухоли, действием силы тяжести, наличием или присутствием жидкостей (асцит, слизь и др.) И внутренней биологической агрессивностью [23–25]. Некоторые исследования показали, что существуют опухоли с отчетливой способностью давать метастазы в брюшину, не давая отдаленных метастазов.
4. Диагностика перитонеального карциноматоза
Для предоперационной диагностики ПК полезными методами визуализации являются УЗИ (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография-КТ с 18F-фтордезоксиглюкозой (FDG PET. -КТ) [15], но все эти методы визуализации имеют серьезные ограничения при диагностике ПК из-за низкой объемной плотности узелков в брюшине.КТ и МРТ важны, главным образом, для оценки неоперабельного заболевания и стадии рака [26, 27]. ПЭТ-КТ кажется хорошим вариантом, но он дорог и имеет недостатки для поражений диаметром менее 5 мм [14]. Что касается ПК от GC, Ян и др. [28] сообщают о точности ПЭТ-КТ 87%, с чувствительностью и специфичностью 72,7% и 93,6%, соответственно, с чувствительностью лучше, чем КТ, в то время как для первичных метастазов ГК и лимфатических узлов точность ПЭТ-КТ составляет 54%. КТ неточна (чувствительность 8–17%), особенно для злокачественных грануляций диаметром менее 5 мм и узелков тонкой кишки.
Из-за низкой точности визуализации основными методами диагностики, используемыми в настоящее время для оценки поверхности брюшины, являются диагностическая лапароскопия или лапаротомия и цитологическое исследование брюшины, которые показывают большую точность в диагностике ПК [14]. Диагностическая лапароскопия с промыванием брюшины для выявления злокачественных клеток или без нее имеет только степень рекомендации III B; он используется для исключения метастазов в опухолях, которые считаются потенциально резектабельными [3]. Стандартизированная методика сводит к минимуму риск заражения опухолью мест введения троакаров; этот метод, по сравнению с лапаротомией, также свободен от рисков, связанных с осложнениями диагностической лапаротомии [15], и позволяет определять стадии до и после CRS + HIPEC и во время последующего наблюдения.Более того, диагностическая лапароскопия может использоваться для оценки эффективности неоадъювантной химиотерапии [3].
Три основных различных системы оценки распространения внутрибрюшинного рака, которые были опубликованы до сегодняшнего дня, заключаются в следующем: (i) Японские правила GC [14, 29] — это классификация на пять категорий, которая учитывает только наличие раковых имплантатов и / или злокачественных клеток в жидкости для промывания брюшины, без учета размера злокачественных узлов.(ii) Система стадирования РПЖ по Гилли [14, 19], также называемая оценкой Лайона, основана на размере и распределении злокачественных грануляций (локализованных или диффузных). Он демонстрирует, что использование полной (R0-R1) или неполной (R2) циторедукции для оценки полноты хирургического избавления от рака является успешным. Подтвердить резекцию R0 у пациентов с карциноматозом сложно. R0 и R1 могут быть сгруппированы вместе, так как результаты этих двух групп очень похожи. Эта система также является важным прогностическим индикатором, так как средняя выживаемость пациентов со стадией I или II значительно выше, чем у пациентов со стадией III или IV, и они могут быть кандидатами на CRS и HIPEC.Однако эта система четко не указывает на потенциальную резектабельность ПК [5]. (Iii) Индекс рака брюшины Жаке и Шугарбейкера (PCI) [30] основан на количественном распределении и размере перитонеальных узелков. Полость живота делится на 13 областей, и размер поражения оценивается в каждой области. После тщательного интраоперационного осмотра степень заболевания может быть определена в виде числовых баллов (от 0 до 39). PCI имеет прогностическое значение, позволяя оценить вероятность полной циторедукции; это единственный метод, который детально показывает локализацию узелков.
Полноту циторедукции (CCR) можно оценить с помощью комбинированных баллов Sugarbaker и Lyon, поскольку они указывают на прямую связь между CCR, прогнозом и выживаемостью.
5. Обоснование и методика циторедукции и HIPEC
Исследования фармакокинетики и перитонеальной проницаемости демонстрируют более высокую внутрибрюшинную концентрацию препаратов при химиотерапии, вводимой внутрибрюшинно, чем при системном введении [23, 24]. Плазменный барьер брюшины поддерживает положительный градиент химиотерапии в брюшине, усиливая местные эффекты препаратов и снижая системную токсичность [3].Более того, когда химиотерапевтическое лечение связано с гипертермией, локорегиональные эффекты значительно расширяются, с увеличением проникновения до 3–6 мм в злокачественные узелки и усилением антимитотического эффекта. Несколько исследований подтверждают, что гипертермия (42–43 ° C) усиливает эффекты противоопухолевых препаратов, особенно оксалиплатина, митомицина С, доксорубицина, цисплатина, паклитаксела и иринотекана [19], также повышая химиочувствительность опухолевых клеток. Однако внутрибрюшная температура не должна превышать 43 ° C, чтобы избежать риска перфорации кишечника [12].
Согласно хирургическим и онкологическим принципам, лечение неметастатических ГК состоит из резекции с тотальной гастрэктомией и лимфаденэктомии D1 и / или D2 [3]. В различных исследованиях предлагалось несколько протоколов химиотерапии с использованием таких препаратов, как эпирубицин, цисплатин и 5-фторурацил (ECF) или эпирубицин, цисплатин и капецитабина (ECX), для которых не требуется устройство для центрального венозного доступа [3].
S-1, новый препарат, недавно представленный в Японии, в сочетании с цисплатином, паклитакселом, доцетакселом или иринотеканом стал стандартным препаратом для лечения ПК от GC [14].
6. Циторедуктивная хирургия и HIPEC при запущенном раке желудка
Правильная рентгенологическая, клиническая и цитологическая стадия является важным требованием для лучшего прогноза после HIPEC в GC. Следует отличать ПК в ранней или продвинутой GC от ПК как рецидив уже работающей GC. Фактически, в первом случае легче добиться полного циторедукции (CCR-0, R0), тогда как во втором предыдущее хирургическое лечение и развитие спаек уменьшают возможность достижения полной циторедукции.
Общими противопоказаниями для HIPEC являются возраст> 70 лет, серьезные сопутствующие заболевания, клиническое ухудшение при системной химиотерапии, недоедание, экстраабдоминальные метастазы, метастазы в печень при неоперабельности и массивное забрюшинное заболевание или поражение лимфатических узлов. Другими второстепенными критериями исключения являются индекс массы тела (ИМТ)> 40, облучение таза в анамнезе, карциноматоз, расширенный на КТ или клинически значимый, более 4 хирургических процедур, окклюзия и отсутствие маркеров капель при неоадъювантной химиотерапии [19].
В различных исследованиях представлены противоречивые данные о выживаемости; однако все они согласились с необходимостью полной (таблицы 1 и 2) циторедукции для улучшения выживаемости. HIPEC играет адъювантную роль в предотвращении рецидивов брюшины [19]. Gill et al. показывают, что у пациентов с оценкой CC (полнота циторедукции) 0 или 1 общая средняя выживаемость составляла 15 месяцев [10] (по сравнению с 7,9 месяцами у пациентов с оценкой CC 2), с общим уровнем смертности 4,8%.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HIPEC: гипертермическая внутрибрюшинная химиотерапия; EPIC: ранняя послеоперационная внутрибрюшинная химиотерапия; ПОС: периоперационная внутрибрюшинная химиотерапия; NIC: нормотермическая внутрибрюшинная химиотерапия; NIPS: неоадъювантная внутрибрюшинная и системная химиотерапия; NIIC: нормотермическая интраоперационная интраперитонеальная химиотерапия; DPIC: отсроченная послеоперационная интраперитонеальная химиотерапия; RCS: Retrospective Case Series; PCS: проспективное когортное исследование; PCS: перспективная серия случаев; N / A: недоступно. * 2-летняя выживаемость. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| HR: коэффициент опасности; RR: коэффициент риска; ИЛИ: отношение шансов; ММС: митомицин С; 5-ФУ: 5-фторурацил; HIPEC: гипертермическая внутрибрюшинная химиотерапия; EPIC: ранняя послеоперационная внутрибрюшинная химиотерапия; ПОС: периоперационная внутрибрюшинная химиотерапия; NIC: NIIC: интраоперационная нормотермическая внутрибрюшинная химиотерапия; RCS: ретроспективная серия дел; PCS: перспективная серия случаев; N / A: нет данных; ПК: карциноматоз брюшины. 1,2,3 HIPEC, HIPEC + EPIC и NIIC соответственно. Нет различий в заболеваемости между группами HIPEC и NIIC и соответствующими контрольными группами. # Заболеваемость несостоятельностью анастомоза, кишечной фистулой, панкреатической фистулой, внутрибрюшным абсцессом и нейтропенией соответственно. * Данные рассчитаны с отношением риска (RR) и разделены на две подгруппы для анализа: RR подгруппы митомицина C = 0,75, RR 5-фторурацила = 0.69 по сравнению с контрольной группой RR = 0,45. £ Заболеваемость угнетением костного мозга, несостоятельностью анастомоза, кишечным свищом, спаечной кишечной непроходимостью и дисфункцией печени, соответственно. $ Заболеваемость несостоятельностью анастомоза, кишечной непроходимостью, перфорацией кишечника, панкреатической фистулой, угнетением костного мозга, лихорадкой и внутрибрюшным абсцессом соответственно. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Yonemura et al. [8] в РКИ 139 пациентов с T2-4 GC, рандомизированных на 3 группы (HIPEC и хирургия, внутрибрюшинная нормотермическая химиотерапия плюс хирургическое вмешательство и только хирургическое вмешательство), показали, что в первой группе выживаемость была значительно выше (61% против 43). % и 42% из двух других групп), особенно у пациентов с серозной инфильтрацией и положительными метастазами в лимфатических узлах.Подобные результаты были опубликованы Fujimoto et al. [21] у пациентов со стадиями II-III GC и Kim и Bae [7] у пациентов с III и IV стадиями GC, получавших HIPEC + CRS по сравнению с одним хирургическим вмешательством.
Kim и Bae [7] проанализировали 103 пациента с III-IV стадией GC: 51 была выполнена только хирургическая резекция, а 52 — операция плюс HIPEC. Митомицин-C при 44 ° C использовался в группе HIPEC в качестве внутрибрюшинной химиотерапии. Общая 5-летняя выживаемость у 103 пациентов составила 29,97%. Он был выше, но не статистически значим в группе HIPEC + CRS (32.7% против 27,1% контрольной группы). Разница, учитывающая исключительно выживаемость 65 пациентов с III стадией ГК, была статистически значимой (58,6% против 44,4% контрольной группы).
В ретроспективном многоцентровом французском исследовании, проведенном с февраля 1989 г. по август 2007 г., Glehen et al. [10] оценили 159 пациентов, перенесших циторедуктивную операцию и периоперационную внутрибрюшинную химиотерапию (HIPEC и EPIC или оба), и показали 1-, 3- и 5-летнюю выживаемость 43%, 18% и 13% соответственно, что увеличивает до 61%, 30% и 23%, соответственно, у пациентов с полной циторедукцией.Благодаря многомерному анализу авторы сообщили о полноте циторедукции как о главном независимом прогностическом факторе. Чтобы правильно выполнить циторедукцию, система стадирования должна быть подтверждена оценкой ЧКВ. Исследование показало, что, если циторедуктивная хирургия не позволяет существенно снизить стадию, особенно при HIPEC, показатели выживаемости низкие (медиана выживаемости составляет 6–8 месяцев).
Три недавних метаанализа [11–13] РКИ, оценивающих пациентов с ГК (с ПК или без него), демонстрируют преимущество выживаемости, предлагаемое HIPEC.Уже в 2007 году Ян и соавт. [11] провели 13 исследований с участием 1648 пациентов и продемонстрировали положительный эффект с точки зрения общей выживаемости при добавлении HIPEC или HIPEC с EPIC к операции. Эти исследования также показали, как эти процедуры могут дополнять адъювантное системное лечение. Эффективность нормотермической внутрибрюшинной химиотерапии (NIIC) незначительна. Jin-Yu et al. [12] проанализировали 15 РКИ и продемонстрировали, что HIPEC и NIIC следует рекомендовать для лечения пациентов с GC, поскольку они значительно улучшают общую выживаемость.Результаты HIPEC лучше, но результаты NIIC по-прежнему статистически значимы [8]. Этот метаанализ продемонстрировал, что добавление послеоперационной внутрибрюшинной химиотерапии (PIC) к HIPEC не оказывает дополнительного влияния на общую выживаемость, но снижает затраты и снижает токсичность. Это исследование также показало, что внутрибрюшинная химиотерапия (IPC) не влияет на предотвращение лимфатических метастазов, но может снизить на 73% скорость метастазов в печени. Авторы продемонстрировали, что IPC не увеличивает периоперационную смертность и частоту послеоперационных утечек анастомозов, кишечной непроходимости или перфорации кишечника, но увеличивает риск угнетения костного мозга, внутрибрюшного абсцесса и лихорадки.Эти же результаты подтверждаются также Sun et al. [13].
В последнее десятилетие в Германии был разработан новый интересный препарат под названием катумаксомаб [31]. Катумаксомаб представляет собой гибридное моноклональное антитело крысы и мыши, которое в настоящее время используется для пациентов со злокачественным асцитом в рандомизированных исследованиях фазы II / III. Два исследования [32, 33] демонстрируют, что этот препарат, по-видимому, улучшает выживаемость без прогрессирования у пациентов с ГК (медиана 71 против 44 дней;) и что он, по-видимому, улучшает выживаемость при желудочно-кишечных опухолях EpCAM + (EpCAM: молекула адгезии противоэпителиальных клеток) при внутрибрюшинном применении.Однако окончательные результаты обоих исследований еще не опубликованы.
СВК и HIPEC связаны со значительной заболеваемостью и смертностью, в том числе в центрах с большим объемом, а зарегистрированные показатели составляют от 0,9–5,8% до 12–52% соответственно [34]. Основными послеоперационными осложнениями после CRS и HIPEC являются внутрибрюшный абсцесс, перфорация желудка или тонкой кишки, послеоперационная кишечная непроходимость, несостоятельность анастомоза, послеоперационное кровотечение, фистула, сепсис, респираторный дистресс, гематологическая токсичность и нарушение мочеиспускания [6, 19].В той же группе пациентов основные причины смерти включают несостоятельность анастомоза, сепсис, послеоперационное кровотечение, кишечные свищи и диссеминированное внутрисосудистое свертывание (ДВС) [35].
Основная причина неблагоприятного прогноза — агрессивность болезни GC. Недавно Йонемура и др. [9, 14] предложили мультимодальную стратегию, сочетающую неоадъювантную внутрибрюшинную и системную химиотерапию (NIPS), CRS + HIPEC и EPIC. Обоснованием этого метода является уменьшение опухолевой нагрузки перед операцией с помощью NIPS, двунаправленной химиотерапии, которая атакует ПК с обеих сторон брюшины (из брюшной полости и из подбрюшинных кровеносных сосудов) вместе с CRS и HIPEC, чтобы уменьшить макроскопические и микроскопический ПК.Целью EPIC является уничтожение остаточных внутрибрюшинных раковых клеток до развития спаек.
Методика NIPS характеризуется первой фазой, на которой пациентов лечат пероральным S-1 в дозе 60 мг / м 2 в течение 21 дня с последующей неделей отдыха. Система портов была ранее помещена в брюшную полость под местной анестезией с наконечником в мешочке Дугласа. В 1-й, 8-й и 15-й дни после операции в брюшную полость вводят 30 мг / м 2 таксотера и 30 мг / м 2 цисплатина с 500 мл физиологического раствора.Авторы рекомендуют два цикла лечения для достижения отрицательного цитологического статуса. Осложнения после НИПШ были зарегистрированы у 4 из 79 пациентов (1 с токсичностью костного мозга 4 степени, 3 с нарушением функции почек). У 3 пациентов были зарегистрированы инфекции вокруг перипортального пространства, приведшие к удалению порта. Это исследование показывает отрицательную цитологию промывки у 41 из 79 пациентов (63%) [4].
Также Glehen et al. [10] в ретроспективном многоцентровом исследовании рекомендуют рутинное использование неоадъювантной химиотерапии для улучшения хирургических результатов и исключения пациентов, которые не реагируют на терапию с помощью HIPEC.
7. Выводы
Вышеупомянутые процедуры должны выполняться исключительно в высококвалифицированных центрах из-за специальных хирургических навыков, необходимых для достижения высоких показателей полной циторедукции [14, 19].
Отбор пациентов очень важен и должен проводиться многопрофильной группой специалистов (анестезиологи, хирурги, клиницисты и онкологи), чтобы достичь лучших результатов и снизить высокие затраты, связанные с этими процедурами и соответствующими осложнениями.
Следует развивать междисциплинарный подход: объединение NIPS, CRS, HIPEC и EPIC может увеличить частоту процедур CC-0 и, следовательно, выживаемость, особенно при PCI ≤6 [5, 11, 21, 32]. Неоадъювантная химиотерапия, обычно рекомендуемая для лечения ГК без ПК, может улучшить выживаемость также при ПК после ГК [10, 34–37], а адъювантная химиотерапия может предотвратить рецидив при ГК [10]. Наконец, исследование молекулярных и сывороточных онкомаркеров может предоставить ценную прогностическую информацию и позволит лучше выбрать последующие комбинации лечения [14, 38].
Конфликт интересов
Все авторы заявляют об отсутствии конфликта интересов.
Благодарности
Благодарим Рамону Руджери за вычитку.
.Карциноматоз брюшины — англо-французский словарь
en Для выживаемости пациентов с макроскопическим перитонеальным карциноматозом не было различий между этими двумя группами.
springer fr Me dis pas.Elle supportait pas les курсыen Лечение перитонеального карциноматоза (ПК) с лечебной целью улучшилось за последние 15 лет.
springer fr des droits des personnes handicapéesen Этот подход привел к 75% прогнозируемой 5-летней выживаемости у пациентов с перитонеальным карциноматозом от цистаденокарциномы.
springer fr L’application des dispositions qui précèdent ne peut donner вместо максимального qu’à l’octroi d’une allocation globale de # EUR et ce pendant une année civileen Метастазы в печени были обнаружены в 2 случаях и карциноматоз брюшины в 2 случаях. Метастазов в лимфатические узлы не было.
springer fr Je vous en prie … ne parlons plus de celaen Эта статья представляет собой обзор паллиативного лечения двух основных симптомов перитонеального карциноматоза: асцита и непроходимости кишечника.
springer fr Long Tom, prends le dernier charioten Это соединение и его эквиваленты представляют собой средство для лечения рака, особенно применяемое при лечении перитонеального карциноматоза рака яичников.
Patents-WIPO от On a donné à CP Rail des миллиардов долларов sous form de section de terrain dans tout l’Ouestи Обнаруженные обстоятельства: легочный метастаз, один пациент с перитонеальным карциноматозом и рецидив с метастазами в печень Другой случай — 13 лет после первой адреналэктомии.
springer fr Surtout les mémos sur les gags de sperme dans les cheveux.- Merci.- Mercien У правильно отобранных пациентов карциноматоз брюшины, вызванный раком толстой кишки и придатков, является излечимым заболеванием, которое может привести к длительному заболеванию. -свободное выживание.
springer fr le pourcentage Estimé de viande maigre dans la carcasseen Циторедуктивная хирургия в сочетании с гипертермической интраоперационной внутрибрюшинной химиотерапией (HIPEC) является частью лечения перитонеального карциноматоза колоректального происхождения и дает надежду на длительное выживание.
springer fr Vous vous préparez?ru Предварительными условиями для таких испытаний являются процедуры клинической стадии, включая эндоскопическое ультразвуковое исследование (категория T) и хирургическую лапароскопию с лаважем (за исключением перитонеального карциноматоза), а также стандартизированную хирургическую процедуру.
springer fr Et bien, tu vois, je ne peux pas te laisseraller lahaut toute seuleen Авторы сообщают о случае перитонеального карциноматоза, вызванного первичной опухолью простаты, у 81-летнего пациента, перенесшего простатэктомия тремя годами ранее.
springer fr Propulsés dans l ‘espace à la vitesse d’ une balle!ru Меченый радиоактивным изотопом (висмут-213) пептид F3, возвращающий опухоль, был эффективно интернализован в ядро опухолевых клеток и продемонстрировал терапевтическую эффективность на модели перитонеального карциноматоза на голых мышах.
cordis fr N ‘aie pas peuren С гистологической точки зрения Linitic форма чаще встречалась у молодых людей (40%, p = 0,01), у них было больше метастазов на момент постановки диагноза (p = 0.0001), чаще всего при карциноматозе брюшины (p = 0,04).
springer fr Une bague avec cinq diamantsen Был повышен специфический антиген простаты. Гистология исходного оперативного препарата выявила аденокарциному. Все эти данные предполагали диагноз: карциноматоз брюшины вторичный по отношению к первичному простатическому.
springer fr Selon une autre source, le Cabinet du premier ministre aurait mis beaucoup de pression, hier, sur le chef de l’état-major de la Défense, Морис Бариль, pour qu’il «manage les faits afin qu» ils корреспондент à la version des événements donnée par le premier ministre »en Новый метод профилактики и лечения перитонеального карциноматоза — митомицин С, связанный с частицами активированного угля (MMC-CH) — был протестирован на пациентах с запущенным раком желудка в проспективное рандомизированное исследование.
springer fr Le bouton d инъекция permet de vérifier la reellement chargée et doit être maintenu sous натяжная подвеска cette vérificationru При раке желудка шанс излечения локорегиональных рецидивов минимален, так как удаление дренирующих лимфатических узлов при первичной операции практически у всех больных приводит к генерализованному перитонеальному карциноматозу.
пружинный от Sontilils morts?ru Наконец, когда ЭУЗ толстой кишки является единственным исследованием, которое показывает узелки перитонеального карциноматоза, и если состояние пациента хорошее, тогда необходимо выполнить биопсию этого узла, чтобы подтвердить рецидив.
springer fr Je comprends et respecte vos besoins émotionnelsen Из поражений брюшины 10 были карциноматозом и 3 — мезотелиомой брюшины.
springer fr Et alors avec ce peu d ‘argent, on pourra boire et al., De la drogue … Избавиться от банды и избежать не пропустить, не?ru Частицы активированного угля избирательно поглощаются лимфатическими тканями, которые, по-видимому, являются первичным очагом перитонеального карциноматоза в брюшной полости, и адсорбируют большое количество противоракового агента митомицина С, который впоследствии высвобождается медленно и в течение длительного времени. период.
springer fr Lors de la transposition de la présente décision-cadre, tout État members peut indiquer qu’en tant qu’État d’exécution, il pourra, dans des cas specific, refuser d’assumer la compétence prévue au paragrapheru В исследовании, в соавторстве с доктором Найджелом С. Филлипсом, главным научным сотрудником, и доктором Марио К. Филион, руководителем биомедицинских исследований в Bioniche Life Sciences Inc., оценивалась активность МКЦ против DHD / K12 in vitro. / PROb клетки и активность MCC in vivo против DHD / K12 / PROb перитонеального карциноматоза у крыс.
Giga-fren fr Pour ce qui Concerne les produits énergétiques visés aux article # à # pour lesquels les niveaux de taxation sont Calculés sur la base du volume, ce volume est mesuré à une température de # ° Cen In В другом случае мы отправили двух студентов-медиков (которые пошли парами, в исключительных случаях), чтобы оценить пожилого пациента, умирающего от перитонеального карциноматоза, и они были оскорблены ее причудливой дочерью, которая уже потратила более 10000 долларов на лечебные травы и которая потратила большую часть Вызов на дом с критикой отличной бригады онкологов, которая проводила паллиативную химиотерапию ее матери.
Giga-fren fr Wayne Campbellen (Belleville), научно-исследовательская канадская биофармацевтическая компания, основанная на технологиях, представила данные, показывающие, что повторное внутрибрюшинное введение запатентованного Комплекса микобактериальной клеточной стенки (МКК) компании является эффективным хорошо переносится и приводит к значительной противоопухолевой активности против карциноматоза брюшной толстой кишки у крыс.
Giga-fren от Le Ministre flamand ayant la Politique de l’Emploi dans ses attributions est chargé de l’exécution du présent arrêtéen Около 15% CUP соответствуют этим конкретным подтипам: метастатическим поражением лимфатических узлов в виде узлового распределения по средней линии, отдельных метастазов в подмышечные узлы, поражения шейки матки с плоскоклеточной гистологией или поражения паховых узлов; папиллярный серозный карциноматоз брюшины у женщин; метастатическая нейроэндокринная карцинома; остеобластические метастазы в кости с повышенным уровнем ПСА у мужчин; единственный метастатический сайт.
springer fr Seize, moins huit, égal huit.
