Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний
Канцероматоз – один из самых неблагоприятных вариантов прогрессирования ряда онкологических заболеваний. Он представляет собой тяжёлую стадию онкологии, когда злокачественные клетки с потоком крови или лимфы передвигаются внутри организма, вовлекая в патологический процесс здоровые органы.
Чаще всего канцероматоз развивается на фоне рака желудка, желчевыводящих органов, поджелудочной железы, матки и яичников, толстого и тонкого кишечника. Часто такие пациенты считаются неоперабельными, а лечение – бесперспективным. Тем не менее, метод борьбы с заболеванием существует.
Для лечения канцероматоза в Центре хирургии и трансплантологии ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России используется методика гипертермической интраперитонеальной химиотерапии HIPEC в сочетании с системной химиотерапией: после хирургического вмешательства с максимально возможным удалением всех метастатических очагов пациент подключается к специальному аппарату, и в течение 60-90 минут происходит «промывание» брюшной полости растворами химиопрепаратов при температуре 42-44°C.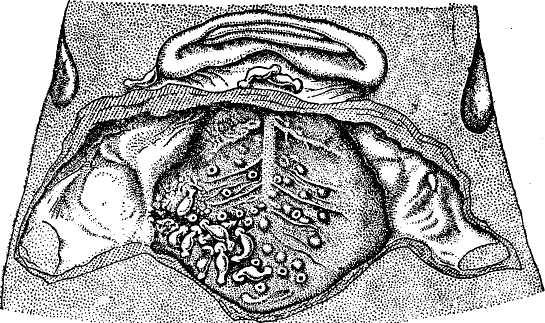
Процедура является завершением обширного хирургического вмешательства, при котором должен быть достигнут уровень полной циторедукции, то есть все видимые глазу опухолевые очаги должны быть удалены. На данной стадии HIPEC часто является единственным эффективным методом лечения.
С 2010 года врачи Центра выполнили свыше 300 процедур HIPEС. Процедура проводится с помощью аппарата Performer HT с использованием одноразовых стерильных наборов RanD Hang&Go HT. Во всех случаях процедура проводилась с использованием методики «Close Abdomen».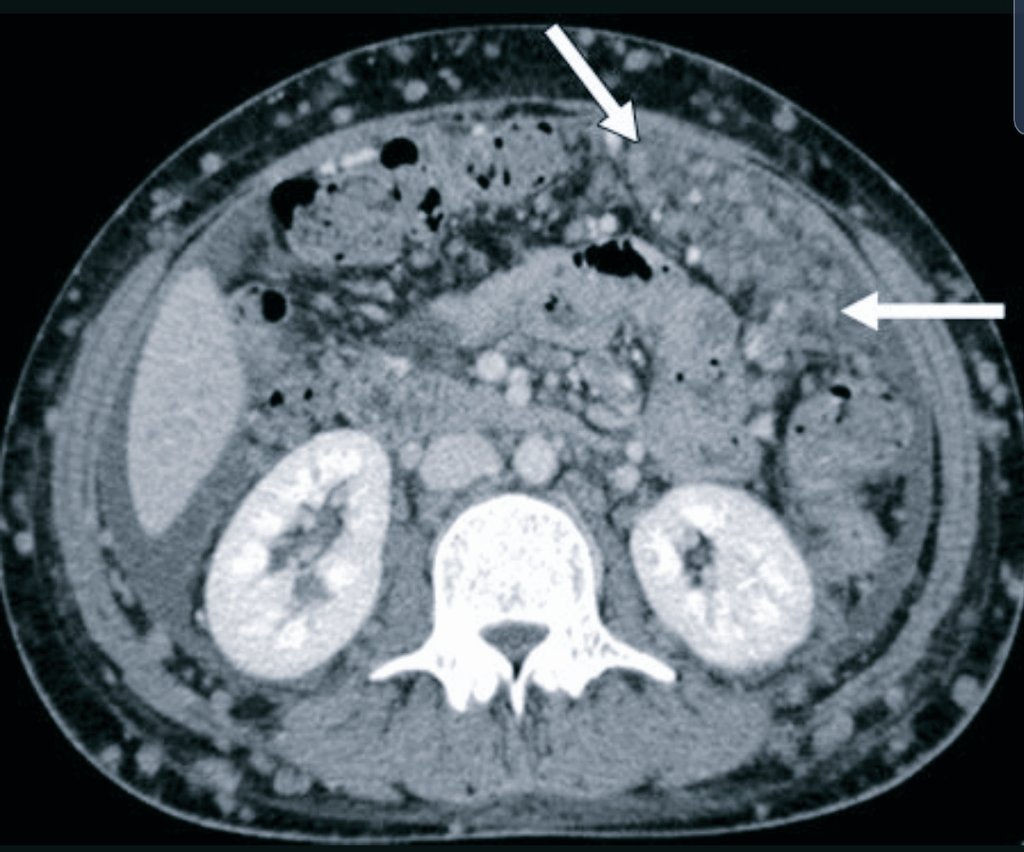
Продолжительность жизни таких пациентов без лечения составляет в среднем 6-12 месяцев. Опыт ФМБЦ им. А.И. Бурназяна ФМБА России показывает, что при использовании методики HIPEC удаётся добиться 2,5-3-летней выживаемости, 5-летняя выживаемость достигает 30%. Были случаи, когда пациенты прожили после операции 7 лет.
Показания к HIPEC:
— Рак яичников – первичная опухоль с признаками канцероматоза либо рецидивные опухоли
— Псевдомиксома брюшины
— Мезотелиома брюшины
— Опухоли аппендикса
— Рак желудка и рак ободочной кишки с канцероматозом брюшины при отсутствии других отдаленных метастазов – имеют ограничения в применении
Новый метод лечения канцероматоза брюшины. | Patient-mt.ru
Продление жизни пациентов на поздних стадиях рака яичников
Ежегодно во всем мире многие пациенты сталкиваются с диагнозом «канцероматоз брюшины». К ним относится целый ряд онкологических заболеваний – в том числе и пациенты с такими относительно редкими заболеваниями как злокачественная мезотелиома и псевдомиксома брюшины (ПМБ). Однако намного чаще канцероматоз брюшины возникает в результате распространения метастазов при первоначальном рака яичников или желудка, например. Еще не так давно канцероматоз брюшины было крайне сложно лечить, так как болезнь развивается агрессивно, у пациентов развивался тяжелый асцит, качество жизни значительно ухудшалось и прогноз у таких пациентов был крайне неблагоприятным.
К ним относится целый ряд онкологических заболеваний – в том числе и пациенты с такими относительно редкими заболеваниями как злокачественная мезотелиома и псевдомиксома брюшины (ПМБ). Однако намного чаще канцероматоз брюшины возникает в результате распространения метастазов при первоначальном рака яичников или желудка, например. Еще не так давно канцероматоз брюшины было крайне сложно лечить, так как болезнь развивается агрессивно, у пациентов развивался тяжелый асцит, качество жизни значительно ухудшалось и прогноз у таких пациентов был крайне неблагоприятным.
К счастью, методы лечения подобных тяжелых диагнозов, таких как эрозивный бульбит, все время развивается и совершенствуется. Один из таких новых методов лечения заключается в хирургическом удалении всей видимой опухоли из брюшной полости с последующим промыванием «горячей химиотерапией». Медицинским языком это называется «циторедуктивная операция» (ЦРО) и «гипертермическая интраперитонеальная химиотерапия» (hyperthermic intra-peritoneal chemotherapy).
Если объяснить все проще, то по сути это хирургическое удаление всех доступных (видимых) участков опухоли, а все остаточные раковые клетки затем уничтожается с помощью высокоактивной химиотерапии, которая заливается в брюшную полость, по сути это применение химиотерапии местно. Что примечательно, химический препарат подогревается до 41 градусов с помощью специального устройства, и таким образом повышается его эффективность и шанс уничтожить все раковые клетки. Благодаря такому комплексному подходу онкологи добиваются значительного увеличения продолжительности жизни и снижают риск рецидива болезни, и в некоторых случаях улучшается качество жизни пациента.
Так как HIPEC весьма агрессивная процедура, существует множество факторов, которые влияют на целесообразность применения этого протокола для каждого отдельного пациента. Именно поэтому проводить лечение должны профессионалы, специализирующие на этой процедуре, а подбирать мультидисциплинарный центр, авторизированный ее проводить, нужно доверить только компетентным медицинским координаторам.
Понятно, что HIPEC — вмешательство достаточно масштабное, длительность операции колоссальна (может занимать до 10 часов под общим наркозом) и даже само описание протокола выглядит пугающе — применяются токсичные препараты, хирургическая часть больше напоминает разбор конструктора, в процессе даже участвует электрический ток. Однако наш опыт показал, что применение HIPEC усложняет процесс восстановления после операции не критично, а долгосрочная польза для пациента очевидна – этот неоднозначный протокол может быть очень эффективным инструментом спасения жизни и здоровья даже в крайне тяжелых случаях. При этом добавление HIPEC к стандартному хирургическому лечению не приводило к росту уровня осложнений или числа смертей, связанных с проводимым лечением.
Для каких пациентов подходит?
HIPEC-лечение в настоящее время считается стандартом медицинской помощи во многих странах для пациентов с мезотелиомой, псевдомиксомой брюшины и пациентами с раком брюшины, первично вызванной колоректальной опухолью. Некоторые клинические центры также применяют HIPEC по другим показаниям, например, при канцероматозе брюшины при первичном раке желудка или яичников.
Некоторые клинические центры также применяют HIPEC по другим показаниям, например, при канцероматозе брюшины при первичном раке желудка или яичников.
Видео, наглядно демонстрирующее применение HIPEC:
Ниже мы подготовили и перевели резюме исследования, которое было опубликовано в январе 2018 года в медицинском журнале The New England Journal of Medicine, результаты которого указывают на существенное повышение выживаемости пациенток с распространенным раком яичников, получавших лечение HIPEC. И по результатам, в среднем пациентки, получавшие лечение в сочетании с HIPEC, жили на 12 месяцев дольше, чем пациенты без проведения HIPEC.
Исследование было проведено в Нидерландах доктором Виллемин ван Дрил и командой ученых, специализирующихся на данной проблеме. По словам онкохирурга доктора Игнаса де Хингх, президента Голландской группы по перитонеальной онкологии, это исследование является крупным шагом вперед в лечении рака яичников. «Это весьма обнадеживающий результат, и в настоящее время мы ищем способы внедрения данного метода лечения в голландскую систему здравоохранения».
По словам онкохирурга доктора Игнаса де Хингх, президента Голландской группы по перитонеальной онкологии, это исследование является крупным шагом вперед в лечении рака яичников. «Это весьма обнадеживающий результат, и в настоящее время мы ищем способы внедрения данного метода лечения в голландскую систему здравоохранения».
Традиционно лечение впервые выявленного рака яичников на поздних стадиях обычно включает проведение циторедуктивной операции и системной химиотерапии. И данное исследование проводилось с целью понять, позволяет ли проведение гипертермической интраперитонеальной химиотерапии (HIPEC) в качестве дополнения к интервальной циторедуктивной операции улучшить прогнозы у пациенток, получающих неоадъювантную химиотерапию по поводу эпителиального рака яичников III стадии.
В рамках многоцентрового открытого исследования III фазы авторы рандомизировано разделили 245 пациенток (с достигнутой стабилизацией заболевания после трех циклов химиотерапии карбоплатином и паклитакселом) на проведение интервальной циторедуктивной операции с или без назначения HIPEC с применением цисплатина.
Результаты
По результатам анализа всех включенных пациенток, рецидив заболевания или смерти были зарегистрированы у 110 из 123 (89%) пациенток с выполненной циторедуктивной операцией без HIPEC (группа хирургического вмешательства) и у 99 из 122 (81%) пациенток с выполненной циторедуктивной операцией в сочетании с HIPEC (группа хирургического вмешательства плюс HIPEC).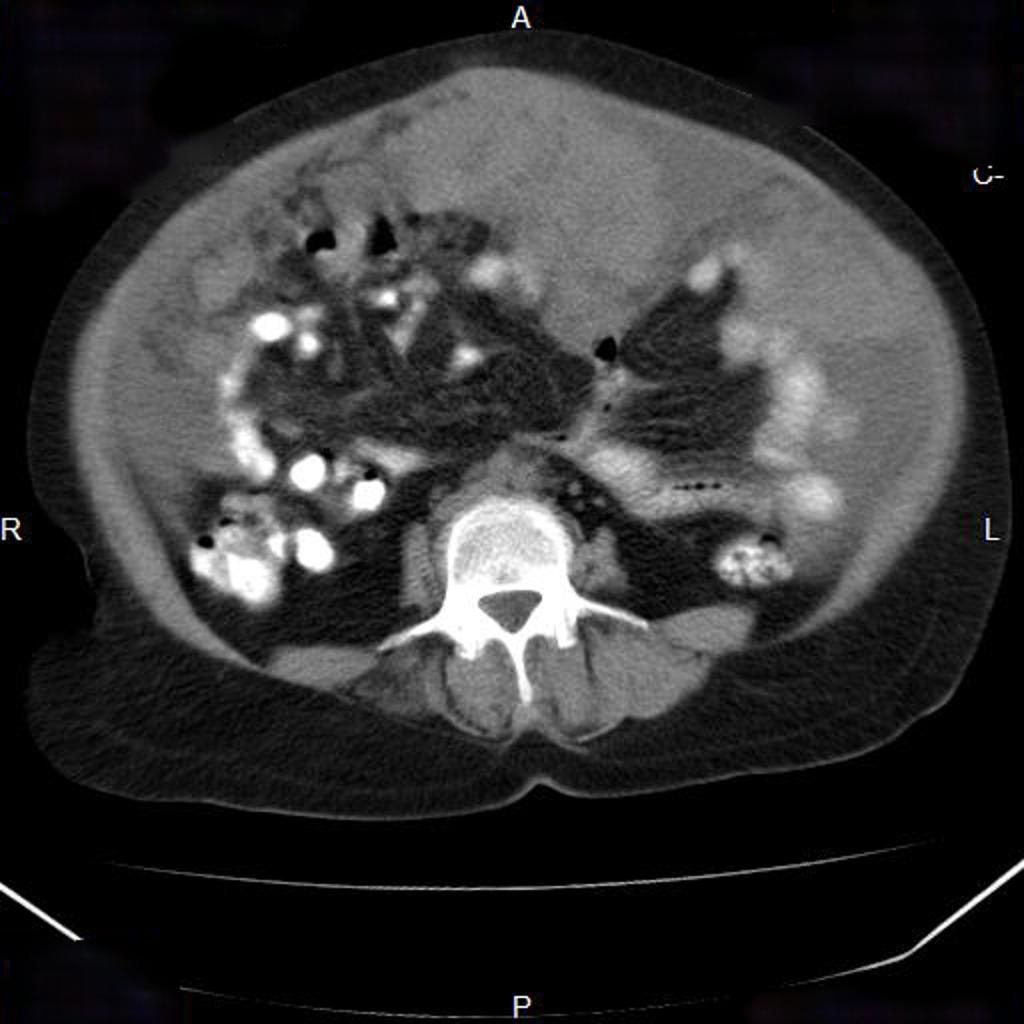
Медиана безрецидивной выживаемости составила 10,7 месяца в группе проведения хирургического вмешательства и 14,2 месяца в группе проведения хирургического вмешательства плюс HIPEC. При медиане последующего наблюдения 4,7 года умерли 76 (62%) пациенток из группы проведения хирургического вмешательства и 61 (50%) пациентка из группы проведения хирургического вмешательства плюс HIPEC. Медиана общей выживаемости составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC. Доли пациенток с нежелательными явлениями 3 или 4 степени тяжести были сходными в двух группах лечения (25% в группе проведения хирургического вмешательства и 27% в группе проведения хирургического вмешательства плюс HIPEC).
Выводы
У пациенток с эпителиальным раком яичников III стадии HIPEC в качестве дополнения к интервальной циторедуктивной операции способствовала достижению более длительной безрецидивной выживаемости и общей выживаемости по сравнению с проведением только лишь хирургического вмешательства и не приводила к повышению частоты развития побочных эффектов.
Эффективность
В процессе последующего наблюдения продолжительностью 4,7 года у 209 из 245 (85%) был зарегистрирован рецидив заболевания или смерть пациента; медиана безрецидивной выживаемости была длительнее на 3,5 месяца в группе проведения циторедуктивной операции в сочетании с HIPEC по сравнению с группой проведения только лишь хирургического вмешательства (14,2 месяца относительно 10,7 месяца).
Вероятность безрецидивной выживаемости спустя 3 года составила 8% в группе проведения хирургического вмешательства и 17% в группе проведения хирургического вмешательства плюс HIPEC.
Общая выживаемость составила 33,9 месяца в группе проведения хирургического вмешательства и 45,7 месяца в группе проведения хирургического вмешательства плюс HIPEC. Вероятность общей выживаемости спустя 3 года составила 48% в группе проведения хирургического и 62% в группе проведения хирургического вмешательства плюс HIPEC.
Безопасность и качество жизни
В целом у более чем у 95% пациенток из обеих групп возникло как минимум одно нежелательное явление вне зависимости от степени тяжести в период от момента рандомизации до 6-й недели после завершения последнего цикла химиотерапии. Но между двумя группами не было зарегистрировано значимых различий в частоте развития нежелательных явлений любой степени тяжести. Нежелательные явления 3 или 4 степени были зарегистрированы у 30 (25%) пациенток из группы проведения хирургического вмешательства и у 32 (27%) пациенток из группы проведения хирургического вмешательства плюс HIPEC. В обеих группах лечения самыми частыми нежелательными явлениями 3 или 4 степени тяжести были боль в животе, инфекция и кишечная непроходимость. В группе хирургического вмешательства был зарегистрирован один случай со смертельным исходом в пределах 30 дней после проведения операции.
Но между двумя группами не было зарегистрировано значимых различий в частоте развития нежелательных явлений любой степени тяжести. Нежелательные явления 3 или 4 степени были зарегистрированы у 30 (25%) пациенток из группы проведения хирургического вмешательства и у 32 (27%) пациенток из группы проведения хирургического вмешательства плюс HIPEC. В обеих группах лечения самыми частыми нежелательными явлениями 3 или 4 степени тяжести были боль в животе, инфекция и кишечная непроходимость. В группе хирургического вмешательства был зарегистрирован один случай со смертельным исходом в пределах 30 дней после проведения операции.
Резекция кишечника была выполнена 59 пациенткам: 30 пациенткам из группы проведения хирургического вмешательства и 29 пациенткам из группы проведения хирургического вмешательства плюс HIPEC. Среди пациенток с выполненной резекцией кишечника колостомию или илеостомию чаще проводили пациенткам из группы проведения хирургического вмешательства плюс HIPEC (21 из 29 [72%] пациенток), чем пациенткам из группы проведения хирургического вмешательства (13 из 30 [43%] пациенток).
Общая длительность госпитализации составила 8 дней в группе проведения хирургического вмешательства и 10 дней в группе проведения хирургического вмешательства плюс HIPEC, включая 1 день пребывания в отделении реанимации и интенсивной терапии в соответствии с требованиями протокола. Период времени между завершением хирургического вмешательства и возобновлением химиотерапии после операции была сходной в двух группах (30 дней в группе проведения хирургического вмешательства и 33 дня в группе проведения хирургического вмешательства плюс HIPEC). Частота завершения всех трех циклов химиотерапии после хирургического вмешательства была также сходной в двух группах (90% в группе проведения хирургического вмешательства и 94% в группе проведения хирургического вмешательства плюс HIPEC соответственно).
Канцероматоз брюшины | CRS и HIPEC- гипертермическая интраперитонеальная химиотерапия. Цены клиник, рейтинг, отзывы
Канцероматозом брюшины называют множественные метастазы рака серозных оболочек брюшной полости. Они поражают брюшину и сальник. Перитонеальный карциноматоз развивается в 40% случаев при раке кишечника, желудка, поджелудочной железы, аппендикса, в 10% случаев при раке прямой кишки. На момент установления диагноза рак яичников карциноматоз брюшины имеется у 65% пациентов. Для лечения этого заболевания используется циторедуктивная хирургия. В Германии непосредственно после операции проводится процедура под названием гипертермическая внутрибрюшинная химиотерапия (HIPEC).
Они поражают брюшину и сальник. Перитонеальный карциноматоз развивается в 40% случаев при раке кишечника, желудка, поджелудочной железы, аппендикса, в 10% случаев при раке прямой кишки. На момент установления диагноза рак яичников карциноматоз брюшины имеется у 65% пациентов. Для лечения этого заболевания используется циторедуктивная хирургия. В Германии непосредственно после операции проводится процедура под названием гипертермическая внутрибрюшинная химиотерапия (HIPEC).
Лечение канцероматоза брюшины
Основным методом лечения остается хирургическая операция. Врач выполняет резекцию брюшины левого и правого квадранта брюшной полости, удаляет большой сальник и селезенку, малый сальник, брюшину сальниковой сумки, желчный пузырь и тазовую брюшину. Иногда также удаляется матка с придатками, сигмовидная кишка, её брыжейка, париетальная брюшина боковых каналов передней брюшной стенки.
По результатам операции оценивается индекс полноты циторедукции:
- СС-0 – очаги опухолевой ткани не определяются визуально;
- СС-1 – остались очаги менее 2,5 мм в диаметре;
- СС-2 – остались очаги от 2,5 мм до 2,5 см;
- СС-3 — остались опухоли более 2,5 см в диаметре.

Даже если все макроскопические опухоли удалены, раковые клетки брюшной полости всё же остаются. Поэтому дополнительно проводится химиотерапия. В большинстве стран используют только системное применение препаратов. В клиниках государств с высоким уровнем медицины всё чаще используют гипертермическую интраперитонеальную химиотерапию. То есть, препараты вводятся непосредственно в брюшную полость.
Преимущества HIPEC:
1. Региональное введение цитостатиков позволяет использовать их в более высоких дозировках. Для системной химиотерапии они недоступны по причине высокой токсичности.
2. Дополнительное нагревание раствора препаратов усиливает цитотоксическое действие за счет лучшего проникновения в раковые клетки. Такой эффект достигается из-за снижения интерстициального давления в опухоли.
3. Используются химиопрепараты с высокой молекулярной массой, которые способны длительное время находиться в полости брюшины.
Гипертермическая внутрибрюшинная химиотерапия выполняется непосредственно после проведения циторедуктивной операции. Используют раствор с температурой от 39 до 43 градусов. В состав чаще всего входят препараты платины. Среднее время выполнения перфузии – 1 час.
Используют раствор с температурой от 39 до 43 градусов. В состав чаще всего входят препараты платины. Среднее время выполнения перфузии – 1 час.
Результаты
Многие квалифицированные врачи, которые работают в специализированных клиниках онкологии, положительно оценивают результаты HIPEC, основываясь на личном опыте использования этой процедуры. Кроме того, субъективное мнение онкологов подтверждается исследованиями.
Так, одно из французских исследований, которое было выполнено ретроспективно (анализ медицинской документации уже пролеченных пациентов), показало, что пятилетняя выживаемость пациентов после проведения процедуры существенно увеличилась при всех видах рака. Она достигла почти 30% при раке ободочной кишки и 38% при раке прямой кишки. Ещё более внушительными были результаты пациентов с перитонеальным карциноматозом, который развился на фоне аденокарциномы аппендикса. Их пятилетняя выживаемость в этом исследовании достигла 63,2%. Эти результаты впечатляют, учитывая, что появление множества метастазов серозных оболочек изначально имеет крайне неблагоприятный прогноз.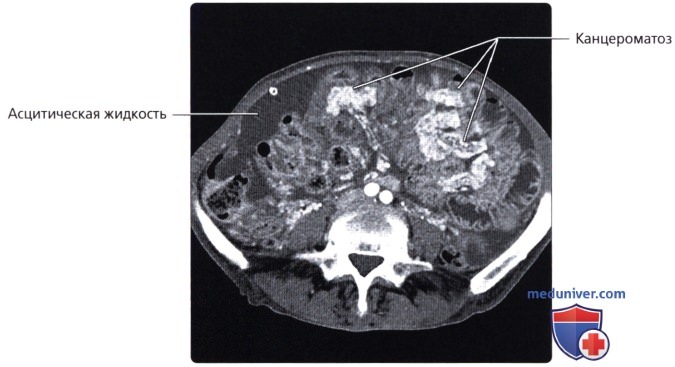
Другое исследование показало, что при перитонеальном карциноматозе, который развился у пациентов с раком желудка, использование HIPEC увеличило медиану продолжительности жизни до 12 месяцев, а пятилетнюю выживаемость пациентов до 20%.
Хотя проблема карциноматоза брюшины далека от разрешения, врачи современных зарубежных клиник уже добиваются впечатляющих результатов в лечении этого осложнения рака. В результате лечения рака яичников, ободочной кишки или других органов брюшной полости при помощи HIPEC достигается значительное увеличение продолжительности жизни пациентов. Хотя все опухолевые очаги врачам не удается уничтожить, полностью излечив рак, применение циторедуктивной операции в сочетании с гипертермической интраперитонеальной химиотерапией дарит человеку ещё несколько лет активной жизни.
Лечение за границей с Booking Health
Чтобы пройти лечение за рубежом в специализированных клиниках, забронируйте программу через Booking Health. Пользуясь нашими услугами, вы получаете множество преимуществ:
- Выбор лучшей клиники для лечения рака яичников, кишечника или другого онкологического заболевания, которое дало метастазы в брюшину.

- Подготовка программы лечения за рубежом с учетом уже выполненных диагностических исследований.
- Запись на удобные для вас даты.
- Снижение стоимости программы лечения карциноматоза брюшины за счет отсутствия надбавок и коэффициентов для иностранных пациентов.
- Установление коммуникации непосредственно с лечащим врачом.
- Контроль всех этапов программы лечения карциноматоза брюшины.
- Контроль счетов и возврат неизрасходованных средств.
- Покупка и пересылка препаратов.
- Организация дополнительной диагностики, лечения или онкологической реабилитации.
- Коммуникация с клиникой после лечения карциноматоза брюшины.
Компания Booking Health гарантирует качественные сервисные услуги: мы забронируем для вас авиабилеты и гостиницу, встретим в аэропорту и доставим в клинику на автомобиле. После завершения программы обеспечим обратный трансфер.
Канцероматоз брюшины — Онкология — 16.08.2014
Доброго времени суток. Рак желудка является достаточно агрессивной опухолью органов брюшной полости. 3 стадия в течении 12-18 мес. начинает метастазировать. При 3 стадии заболевания » полностью» не излечима и будет прогрессировать. При 3 стадии заболевания, операция в объеме резекции желудка считается не радикальной ( т.е полной) При 3 стадии выполняется удаление всего желудка ( гастрэктомия) Согласно стандартов лечения онкозаболеваний у пациентов молодого возраста после операции проводится системная химиотерапия.
В вашем случае прогрессия заболевания проявилась развитием канцероматоза ( это опухолевое поражение брюшины) на деле выглядит как » просыпанное пшено» и по мере роста канцероматозных высыпаний брюшная полость начинает напоминать панцирь ( называют «панцирная брюшная полость») При наличии » раковых» клеток в брюшной полости они начинают стимулировать выделение жидкости в брюшную полость и формируется асцит. К сожалению, -это финал заболевания. Оперативное лечение в данном случае не возможно , потому что , нельзя удалить всю брюшину, т.е всю брюшную полость.
В настоящее время за счет наличия канцероматоза у вашей мамы формируется » раковая интоксикация» т.
3 стадия в течении 12-18 мес. начинает метастазировать. При 3 стадии заболевания » полностью» не излечима и будет прогрессировать. При 3 стадии заболевания, операция в объеме резекции желудка считается не радикальной ( т.е полной) При 3 стадии выполняется удаление всего желудка ( гастрэктомия) Согласно стандартов лечения онкозаболеваний у пациентов молодого возраста после операции проводится системная химиотерапия.
В вашем случае прогрессия заболевания проявилась развитием канцероматоза ( это опухолевое поражение брюшины) на деле выглядит как » просыпанное пшено» и по мере роста канцероматозных высыпаний брюшная полость начинает напоминать панцирь ( называют «панцирная брюшная полость») При наличии » раковых» клеток в брюшной полости они начинают стимулировать выделение жидкости в брюшную полость и формируется асцит. К сожалению, -это финал заболевания. Оперативное лечение в данном случае не возможно , потому что , нельзя удалить всю брюшину, т.е всю брюшную полость.
В настоящее время за счет наличия канцероматоза у вашей мамы формируется » раковая интоксикация» т. е раковые клетки отравляют организм человека продуктами своего метаболизма. Поэтому человек сильно худеет появляются являения нтоксикации: отказ от еды, тошнота, рвота и .т.д При множественном канцероматозе — проведение химиотерапии опасно т.к введением химиопрепарата вызовит распах опухолевых клетко и как следствие, большой выброс токсических прожуктов разрушения опухоли в кровоток человека.
В настоящее врамя все проблемя связаны с прогрессией канцероматоза т. к. при своем росте он сдавливает окружающие структуры.
Cтадию вам поставили прильно , т.е 3 стадия в течении года перешла в 4 стадию . В документах вам 4 стадию не поставят, в поставят 3 стадию и 4 клиническую группу по наличию канцероматоза брюшины.
Из обезболивающих препаратов, которые вы перечисляете, наркотические обезболивающие
Максимальная доза промедола по 1 ампуле х 4 раза в день через 6 часов ( 6-12-18-24) сильнее морфина ничего нет.
Платифиллин- это вообще спазмолитический препарат и не имеет ничего общего с обезболиванием.
е раковые клетки отравляют организм человека продуктами своего метаболизма. Поэтому человек сильно худеет появляются являения нтоксикации: отказ от еды, тошнота, рвота и .т.д При множественном канцероматозе — проведение химиотерапии опасно т.к введением химиопрепарата вызовит распах опухолевых клетко и как следствие, большой выброс токсических прожуктов разрушения опухоли в кровоток человека.
В настоящее врамя все проблемя связаны с прогрессией канцероматоза т. к. при своем росте он сдавливает окружающие структуры.
Cтадию вам поставили прильно , т.е 3 стадия в течении года перешла в 4 стадию . В документах вам 4 стадию не поставят, в поставят 3 стадию и 4 клиническую группу по наличию канцероматоза брюшины.
Из обезболивающих препаратов, которые вы перечисляете, наркотические обезболивающие
Максимальная доза промедола по 1 ампуле х 4 раза в день через 6 часов ( 6-12-18-24) сильнее морфина ничего нет.
Платифиллин- это вообще спазмолитический препарат и не имеет ничего общего с обезболиванием.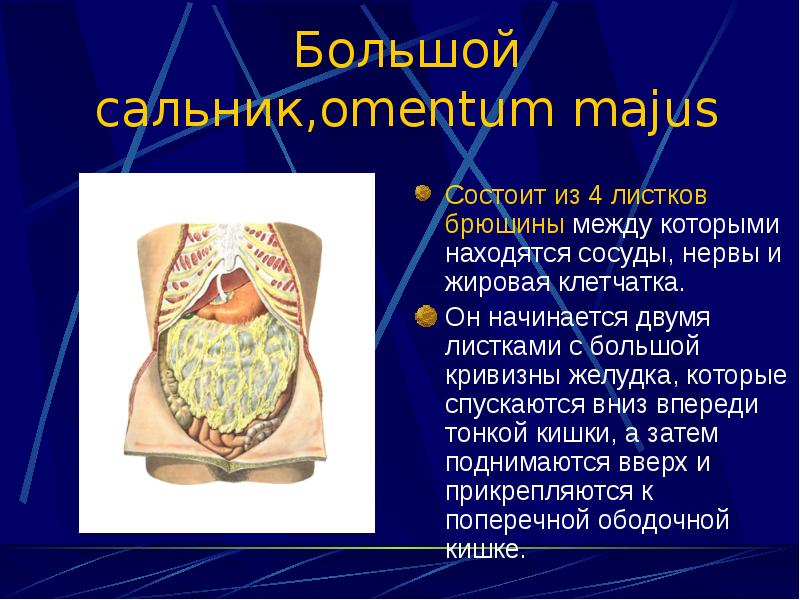 От тоштоты попробуйте «ОНДАНСЕТРОН»
КТ — в данной ситуации не играет большой роли , поому что , при проведении операции канцероматоза не было, а в течении года появился. Для диагностики канцероматоза можно выполнить УЗИ органов брюшной полости и исследование жидкости не цитологию ( где будут выявлены раковые клетки) с уважением Елена Сергеевна
От тоштоты попробуйте «ОНДАНСЕТРОН»
КТ — в данной ситуации не играет большой роли , поому что , при проведении операции канцероматоза не было, а в течении года появился. Для диагностики канцероматоза можно выполнить УЗИ органов брюшной полости и исследование жидкости не цитологию ( где будут выявлены раковые клетки) с уважением Елена СергеевнаМетоды лечения карциноматоза брюшины за рубежом
Доктор Вадим БережнойОснователь платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Время чтения – 16 минут
Карциноматоз – результат метастазирования некоторых злокачественных опухолей в серозную оболочку брюшины и структуры брюшной полости. Также для определения недуга используют термин – канцероматоз.
Появление данной патологии свидетельствует о значительном прогрессировании онкологического процесса. Болезнь развивается у 20% пациентов с гинекологическими опухолями и раком желудочно-кишечного тракта.
До недавнего времени пациенты с карциноматозом имели неблагоприятные прогнозы – выживаемость больных не превышала полгода. Благодаря достижениям современной медицины люди с карциноматозом могут прожить больше 5 лет. Как за рубежом удается добиться таких результатов – узнайте из статьи!
Слушать статью:
Канцероматоз брюшины – что это?
Канцероматоз брюшины – это множественные метастазы рака 4 стадии в брюшной полости. Чаще всего данное состояние вызвано запущенными опухолями толстой кишки, яичников, желудка, прямой кишки или аппендикса.
Около 60% всех случаев карциноматоза брюшины обнаруживают при раке желудка и яичников. Симптомы патологии зависят от того, как проявляется первичная опухоль.
На ранних этапах развития болезни клиническая картина может “маскироваться” под другие заболевания или полностью отсутствовать. На более поздних стадиях канцероматоз имеет следующую симптоматику:
В 30% случаев карциноматоз брюшины осложняется асцитом – скоплением жидкости в брюшной полости.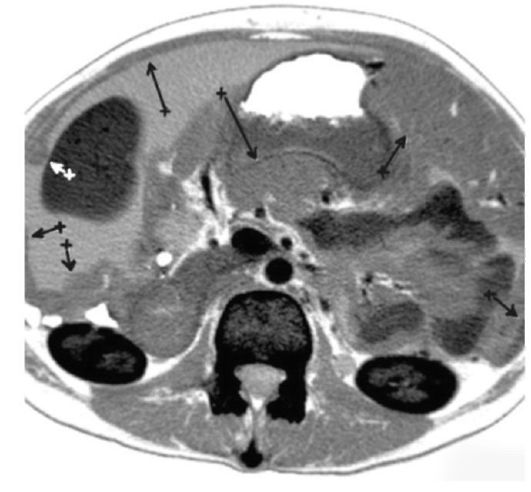 Данное состояние вызывает такие симптомы, как:
Данное состояние вызывает такие симптомы, как:
Если врач подозревает, что у пациента канцероматоз, он назначает комплекс обследований: анализ крови, КТ, МРТ и биопсию. В некоторых случаях болезнь диагностируют во время операции по удалению другого вида рака.
Методы лечения канцероматоза
Долгое время продолжительность жизни пациентов с данной болезнью составляла менее 6 месяцев. С появлением инновационных методов онкотерапии шансы на выживаемость онкобольных увеличились на 50%. Для борьбы с карциноматозом за границей используют:
Циторедуктивная хирургия (CRS)
CRS подразумевает удаление первичной опухоли с регионарными метастазами и злокачественными очагами в брюшине. У 78% пациентов циторедуктивная хирургия проходит без осложнений. Период полного восстановления организма занимает от 2 до 3 месяцев.
Во время вмешательства доктор делает разрез, идущий от нижней части грудины до лобковой кости. С помощью хирургических инструментов он убирает все видимые опухоли в брюшной полости. При этом объем операции определяется размером патологического очага. Длительность хирургии составляет от 2 до 16 часов.
С помощью хирургических инструментов он убирает все видимые опухоли в брюшной полости. При этом объем операции определяется размером патологического очага. Длительность хирургии составляет от 2 до 16 часов.
5-летняя выживаемость пациентов перенесших циторедуктивную операцию без дополнительного лечения составляет около 30%.
Гипертермическая химиотерапия по методу Шурайберейга (HIPEC)
Гипертермическую химиотерапию используют для уничтожения микроскопических раковых клеток, которые остаются после резекции. Процедура проводится сразу с основной операцией по удалению опухоли. Для ее выполнения пациенту в брюшную полость через катетер вводят высокую дозу химического препарата, разогретого до 42-43 градусов Цельсия. Гипертермия увеличивает цитотоксичность хим.вещества и позволяет ему проникнуть глубже в пораженные участки.
Лекарство циркулирует в брюшной полости с помощью специального насоса. Объем, скорость подачи и температуру раствора контролируют компьютерными датчиками. Длительность гипертермической химиотерапии составляет от 40 минут до 1,5 часа.
Длительность гипертермической химиотерапии составляет от 40 минут до 1,5 часа.
Поскольку HIPEC вводится в виде одноразовой дозы непосредственно в брюшную полость, у пациента отсутствуют побочные эффекты, которые возникают после приема химиотерапии в виде таблеток или капельниц.
Однако многим пациентам по-прежнему требуется внутривенная химия до или после операции. HIPEC выполняют только после прекращения действия системной химии.
5-летняя выживаемость пациентов после гипертермической химиотерапии (HIPEC) составляет от 30% до 40%.
Циторедуктивная хирургия CRS и гипертермическая химиотерапия HIPEC
“Золотым стандартом” лечения тотального канцероматоза брюшины является комплексное применение оперативного вмешательства CRS и внутрибрюшной гипертермической химии. Сочетание этих двух методик позволяет уничтожить около 90% всех онкоклеток. Оно дает самые высокие прогнозы эффективности онкотерапии данного заболевания.
В зависимости от локализации метастазов, 5-летняя выживаемость больных составляет от 31% до 50%.
На первом этапе пациенту проводят циторедуктивную хирургию во время которой удаляют большую часть опухоли. Операция необходима, чтобы устранить основной источник болезни.
После удаления злокачественных новообразований, в открытую полость пациента вводят разогретые химические препараты. Они циркулируют в брюшине некоторое время и убивают остаточные онкоклетки. Затем лекарство удаляют и максимально восстанавливают целостность кишечника. На разрез накладывают швы и повязку. Пациент находится в больнице от 7 до 14 дней.
Согласно данным исследования университета Джонса Хопкинса в США, хирургия CRS и HIPEC эффективна при лечении пациентов с поздними стадиями рака желудочно-кишечного тракта и яичников. У каждого второго пациента после онкотерапии улучшается общее состояние и увеличивается продолжительность жизни на 3-5 лет.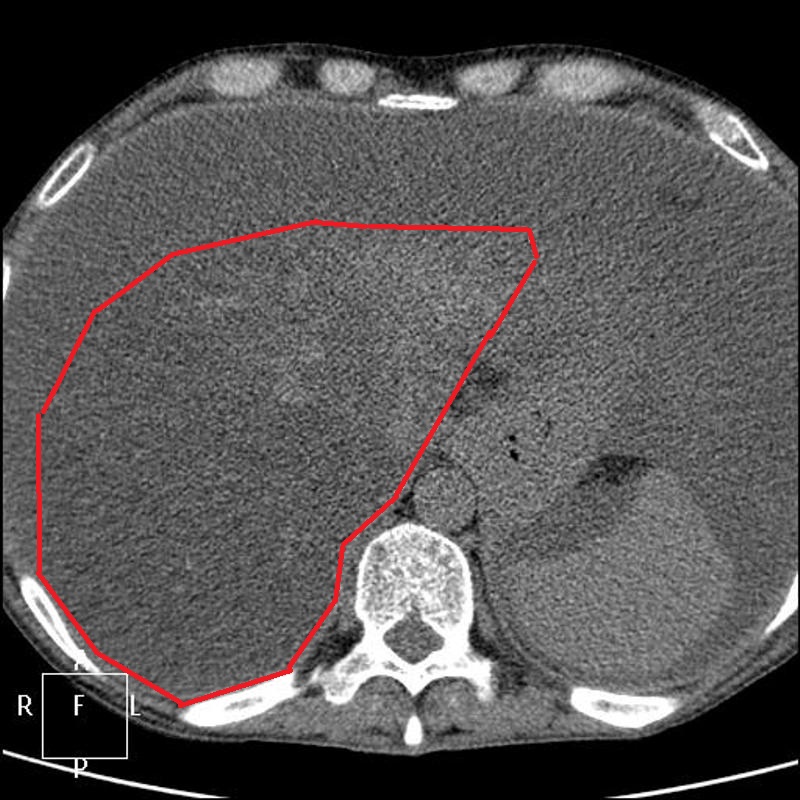
Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPAC)
Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPAC) представляет собой новый подход к лечению карциноматоза. Во время процедуры осуществляется распыление препаратов в высоких дозах непосредственно в брюшную полость. Все манипуляции проводят под общей анестезией.
PIPAC – малоинвазивно лапароскопическое вмешательство, которое подразумевает доставку химических препаратов в аэрозольной форме. Лекарства под высоким давлением распыляются с помощью специализированного устройства CapnoPen. Этот аппарат превращает жидкий химический раствор в спрей. В такой форме лекарство достигает всех уголков брюшной полости и уничтожает онкоклетки даже в труднодоступных местах.
Процедура длится от 60 до 90 минут. После химиотерапии пациенты остаются в больнице на сутки для наблюдения. Обычно данный метод онкотерапии переносится хорошо.
Первые результаты PIPAC заметны через 3 сеанса. Для получения наибольшего эффекта необходимо около 6 повторений. Перерыв между сеансами занимает 5-6 недель. Благодаря PIPEC уничтожают 95% внутрибрюшинных опухолей. В дополнение к прямой доставке химиотерапии в патологический очаг, PIPAC имеет ряд преимуществ:
Для получения наибольшего эффекта необходимо около 6 повторений. Перерыв между сеансами занимает 5-6 недель. Благодаря PIPEC уничтожают 95% внутрибрюшинных опухолей. В дополнение к прямой доставке химиотерапии в патологический очаг, PIPAC имеет ряд преимуществ:
5-летний показатель выживаемости при использовании PIPEC около 50%.
Перитонэктомия
Операция по удалению брюшины называется перитонэктомией. Она является разновидностью циторедуктивной хирургии. В ходе оперативного вмешательства возможно частичное или полное удаление не только брюшины, но и других пораженных органов – тонкого кишечника, желчного пузыря, печени, желудка, поджелудочной железы и селезенки.
Перитонэктомия предназначена для облегчения симптомов – паллиативного лечения. Она может замедлить прогрессирование заболевания. Ремиссия после хирургии достигается у 20% пациентов.
Чтобы улучшить шансы на выживаемость и уменьшить вероятность рецидива, данную операцию сочетают с химиотерапией.
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ КАНЦЕРОМАТОЗА РАЗНЫМИ МЕТОДАМИ
| Метод лечения карциноматоза | Показатель 5-летней выживаемости пациентов |
|---|---|
| Циторедуктивная хирургия | Примерно 30% |
| Гипертермическая химиотерапия (HIPEC) | От 30% до 40% |
| Гипертермическая химиотерапия (HIPEC) и циторедуктивная операция (CRS) | От 31% до 50% |
| Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPEC) | Около 50% |
| Перитонэктомия | Менее 20% |
Где лечат канцероматоз брюшины за границей?
Для борьбы с данной онкопатологией иностранные пациенты обращаются в турецкие, израильские, немецкие, испанские, китайские и корейские медучреждения. За границей эту болезнь успешно лечат в специализированных центрах и широкопрофильных клиниках. Среди них выделяются:
Резюме
Канцероматоз брюшины – состояние при котором в брюшной полости одновременно развивается несколько карцином. Эту патологию провоцирует 4 стадия рака яичников, матки или кишечника. 2 пациента из 10 с гинекологическими опухолями или новообразованиями ЖКТ имеют данное заболевание. Основой борьбы с карциноматозом является оперативное вмешательство и химиотерапия. Выбор методов лечения зависит от индивидуальных потребностей пациента. За границей для каждого больного подбирают персонализированную программу онкотерапии, которая соответствует международным протоколам. Прогноз выживаемости пациентов с канцероматозом брюшины при раке яичников или кишечника зависит от методов, используемых для устранения заболевания и характеристик первичной опухоли. Также на этот показатель влияет уровень медицинского центра и квалификация лечащего доктора. При своевременной онкотерапии около 50% больных преодолевают порог 5-летней выживаемости. Ключевые направления для лечения заболевания – Турция, Испания, Германия, Южная Корея, Израиль, Китай и Австрия. Медицинские туристы часто выбирают такие медицинские центры, как: Мемориал, Наварры, Фуда, Ихилов, СунЧонХян, Рехтс дер Изар.
Эту патологию провоцирует 4 стадия рака яичников, матки или кишечника. 2 пациента из 10 с гинекологическими опухолями или новообразованиями ЖКТ имеют данное заболевание. Основой борьбы с карциноматозом является оперативное вмешательство и химиотерапия. Выбор методов лечения зависит от индивидуальных потребностей пациента. За границей для каждого больного подбирают персонализированную программу онкотерапии, которая соответствует международным протоколам. Прогноз выживаемости пациентов с канцероматозом брюшины при раке яичников или кишечника зависит от методов, используемых для устранения заболевания и характеристик первичной опухоли. Также на этот показатель влияет уровень медицинского центра и квалификация лечащего доктора. При своевременной онкотерапии около 50% больных преодолевают порог 5-летней выживаемости. Ключевые направления для лечения заболевания – Турция, Испания, Германия, Южная Корея, Израиль, Китай и Австрия. Медицинские туристы часто выбирают такие медицинские центры, как: Мемориал, Наварры, Фуда, Ихилов, СунЧонХян, Рехтс дер Изар.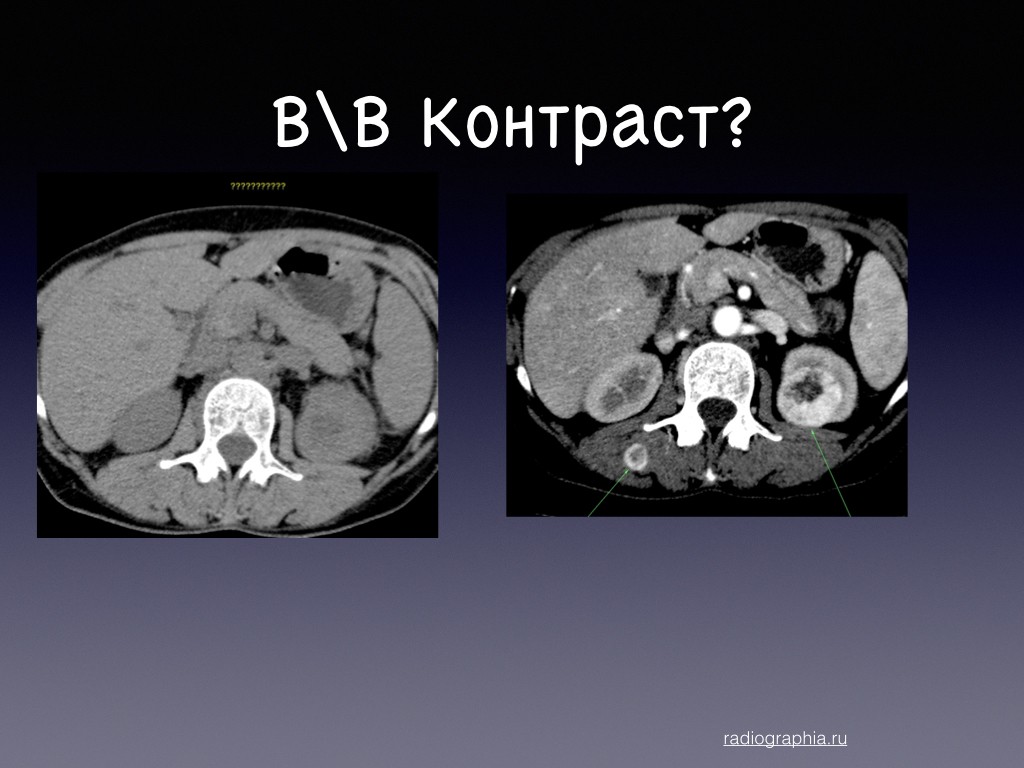
Больше информации о лечении канцероматоза за границей узнайте у специалистов международной медицинской платформы MediGlobus. Наши эксперты ответят на все вопросы и помогут с организацией поездки в зарубежную клинику. Обращайтесь!
Получить бесплатную консультацию
Источники:
- 1. National Center for Biotechnology Information
- 2. Medicina Universitaria
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Editor
Более 2 лет пишет медицинские тексты. Опыт работы в сфере копирайтинга превышает 6 лет. Имеет образование по направлению “Социально-правовая защита”. Освоила программу медицинских курсов. Изучает коммуникативные техники ведения переговоров с пациентами. В свободное время посещает тренинги и семинары по медицинской психологии.
Похожие посты
причины, симптомы, диагностика, лечение, профилактика
Представляет собой вторичное злокачественное поражение брюшины, возникающее в следствие диссеминации эпителиальных опухолей желудочно-кишечного тракта, репродуктивной системы, реже – первичных перитонеальных новообразований.
Канцероматоз брюшины представляет собой вторичное опухолевое поражение, которое возникает на фоне прогрессирования рака различной локализации. Чаще всегопоражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественной опухолью яичников, матки, маточных труб, печеночноклеточного рака, реже – первичной опухоли брюшины. Иногда первичный очаг остается неустановленным.
Развитие канцероматоза брюшины – это поэтапный процесс. Первый этап, характеризуется распространением опухолевых клеток из первичного очага поражения, что связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки изменяют фенотип на мезенхимальный, что сопровождается деградацией межклеточного матрикса. Распространение опухолевых клеток может возникать в процессе хирургического вмешательства. Их механическое отделение может возникать при повреждении лимфатических или кровеносных сосудов. Проникшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов и имплантируются в места повышенной резорбции, например, большом сальнике, в области слепой кишки, дугласовых карманах.
Проникшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов и имплантируются в места повышенной резорбции, например, большом сальнике, в области слепой кишки, дугласовых карманах.
На следующей стадии опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием областей ее повреждения. Затем клетки закрепляются в мезотелии, где происходит их горизонтальное распространение по поверхности перитонеума, позже отмечается их инвазивный рост – прорастание в базальную мембрану и соединительную ткань. Следующим этапом является стимуляция неоангиогенеза, который является обязательным фактором развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины плохо изучены, в связи с чем пока не разработаны радикальные методы его лечения.
СимптомыКанцероматоз брюшины – это вторичное поражение, в связи с этим его клиническая картина во многом определяется проявлениями первичной опухоли. Типичным симптомом данной патологии считается выраженный выпот в брюшную полость, что приводит к развитию асцита. В большинстве случаев асцитический синдром, возникает на фоне обструкции лимфатического дренажа и может являться единственным симптомом заболевания, в связи с этим такие больные поступают в медицинское учреждение для определения причин асцита. У таких больных определяется тяжелое состояние, характерна значительная потеря веса. Неспецифическими признаками патологии являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов их можно прощупать через брюшную стенку.
Типичным симптомом данной патологии считается выраженный выпот в брюшную полость, что приводит к развитию асцита. В большинстве случаев асцитический синдром, возникает на фоне обструкции лимфатического дренажа и может являться единственным симптомом заболевания, в связи с этим такие больные поступают в медицинское учреждение для определения причин асцита. У таких больных определяется тяжелое состояние, характерна значительная потеря веса. Неспецифическими признаками патологии являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов их можно прощупать через брюшную стенку.
Канцероматоз брюшины характеризуется развитием неспецифической клинической картины, однако специалист может предположить наличие патологии на основании симптомов и физикальных данных. Лабораторные анализы малоинформативны. Диагностическая программа включает ультразвуковое обследование органов брюшной полости и малого таза, которые позволяют обнаружить распространенное поражение.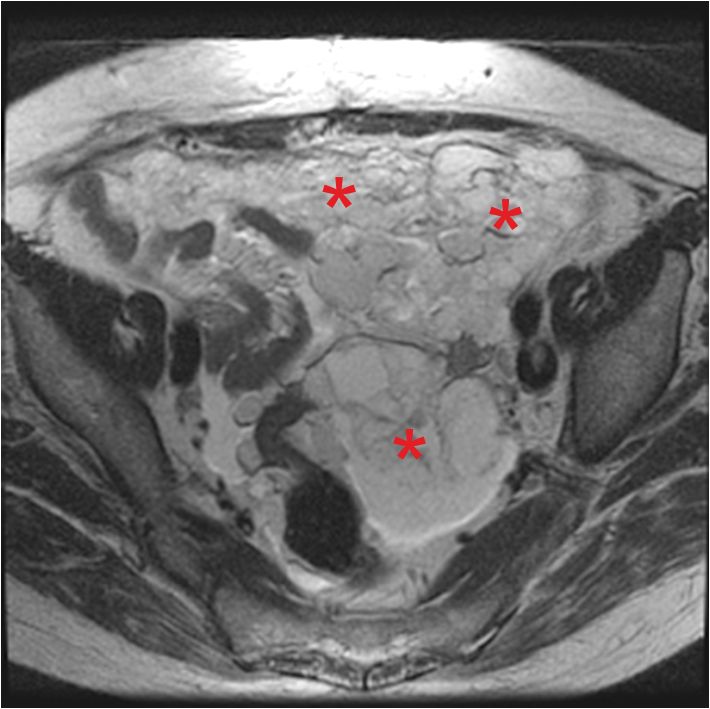 Также больным назначается цитологическое исследование асцитической жидкости. При необходимости больному может быть назначена лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, с обязательным проведение биопсии.
Также больным назначается цитологическое исследование асцитической жидкости. При необходимости больному может быть назначена лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, с обязательным проведение биопсии.
Хирургическое лечение канцероматоза основывается на удалении первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии и может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После хирургического удаления опухоли больному назначается курс химиотерапии.
ПрофилактикаНе разработано профилактики данной формы поражения брюшины, в терапии заболевания важную роль играет своевременность выявления и назначение адекватного лечения первичных опухолей.
Лечение рака в Южной Корее, Внутрибрюшинный Канцероматоз
Что такое перитонеальный рак?
Перитонеальный метастаз понимается как локальный метастаз, а не первичный метастаз. Поэтому требуется более агрессивное лечение этих поражений.
Поэтому требуется более агрессивное лечение этих поражений.
Образования Перитонеального карциноматоза обычно имеет два типичных пути:
1-ый из них является тем, что опухоль происходит через слой серозы другая причина заключается в том, что во время операции лимфатические сосуды, кровеносные сосуды и т. д. Отсекаются или раковые клетки отрываются при прикосновении к раковым тканям вручную.
Раковые клетки попадают в брюшную полость в зависимости от структуры брюшной полости и циркулируют по часовой стрелке. Раковые клетки перемещаются из-за разницы в давлении между верхней и нижней частями брюшной полости. Раковые клетки в основном остаются под правой диафрагмой и в области таза.
Области, в которые часто проникают раковые клетки, — это жировая ткань вокруг желудка, таза, диафрагмы, брыжейки, брюшины серповидной связки и правой верхней части живота. Паренхима печени не имеет лимфатического отверстия и плохо мигрирует.
Механизм перитонеального карциноматоза:
Послеоперационные раны вызывают острое воспаление и заживление, что может привести к послеоперационным спайкам или распространению рака.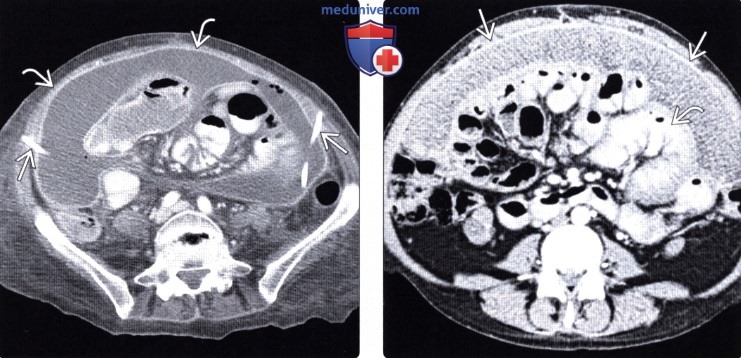
Раковые клетки, которые выпадают из опухоли, метастазируют двумя путями. Первый Клетки выпадают из серозного слоя и прилипают к мезотелиальным клеткам.
Второй Клетки проникает непосредственно в лимфатический тракт и образуют метастазы.
В брюшной полости как правило имеется отверстие лимфатических сосудов и диаметр отверстия составляет 5 ~ 50 мкм (0,005 ~ 0,05 мм), достаточного для проникновения раковых клеток.
Что такое перитонеальный плазменный барьер?
Функция брюшины состоит в том, чтобы смазывать такие вещества, как глюкозаминогликаны и фосфолипиды, распространять лимфатический материал и становиться первой линией защиты от метастазов в брюшной полости. Перитонеально-плазменный барьер представляет собой фармакологическую концепцию, которая очень важна при лечении внутрибрюшинных опухолей, что означает, что лекарства, всасываемые в лимфатическое отверстие трудно распространить в кровеносные сосуды через лимфатические сосуды. Клетки, попадающие в брюшную полость, прикрепляются к брюшине, и вызывают опухоли. Но опухоли, у которых еще нет кровеносных сосудов, (вид примерно можно представить в виде папиллом или бородавок на коже человека) не лечат лекарствами, вводимыми через кровеносные сосуды. Что означает, что они не будут эффективно подвергаться воздействию противораковых препаратов, так как они не имеют кровеносные сосуды.
Но опухоли, у которых еще нет кровеносных сосудов, (вид примерно можно представить в виде папиллом или бородавок на коже человека) не лечат лекарствами, вводимыми через кровеносные сосуды. Что означает, что они не будут эффективно подвергаться воздействию противораковых препаратов, так как они не имеют кровеносные сосуды.
Асцит при перитонеальном канцероматозе:
Раковые клетки, которые были трансплантированы в брюшную полость, находятся в состоянии с низким содержанием ферментов и низким содержанием питательных веществ.
Раковые клетки продуцируют фактор роста эндотелия сосудов (VEGF) для поглощения питательных веществ, стенки кровеносных сосуд ослабевают, онко клетки под воздействием питательных веществ сближают кровеносные сосуды друг с другом. По мере роста раковой ткани впитываемое и образовавшее количество жидкости в брюшной полости приводит к асциту. Блокирование онко клетками лимфатического канала, также может привести к асциту.
Результаты стандартного лечения перитонеального канцероматоза:
Данные получены путем исследования у пациентов с метастатическим раком брюшной полости, метастазы в брюшной полости обнаружены у 212 из 370 пациентов исключая женскую онкологию.
- Выживаемости составила 3,1 месяца для рака желудка, 5,2 месяца для рака прямой кишки и рака прямой кишки применялась только общая химиотерапия.
- Согласно другому исследованию, в котором фактор выживаемости при раке желудка составляла 2,2 месяца, а при колоректальном раке – 8,5 месяцев, наиболее важным прогностическим фактором является наличие асцита.
- Разработка и применение новых противоопухолевых препаратов и таргетной терапии приводит к увеличению продолжительности жизни. При применении данных методов, фактор выживаемости пациентов с метастазами в брюшную полость прямой кишки составила 12,7 месяца.
- В случае метастазов в брюшную полость у пациентов с раком ободочной и прямой кишки выживаемость увеличилась до 32,4 месяца после внутрибрюшинной химиотерапии с максимально возможным удалением раковых тканей путем резекции брюшины.
Это не только химиотерапия, но также возможно активное удаление раковой ткани и лечение с помощью внутрибрюшинной химиотерапии.
- Относительно на ранних стадиях перитонеального карциноматоза показывает лучшие результаты.
Резекция брюшины и внутрибрюшинная химиотерапия при лёгких перитонеальных метастазах увеличили фактор выживаемости до 62,7 месяцев.
Принцип действия гипертермической химиотерапии:
Когда происходит нагрев противоракового коктейля между температурами 40 – 43 градуса тепла происходит воздействие на раковые клетки, структура кровеносных сосудов опухоли усложняется, и состояние с низким содержанием кислорода и кислотности локально изменяется на противоположное. Особенно, верно, для небольших кровеносных сосудов. Когда применяется данный метод, раковые клетки легко меняются из-за местных условий. Когда тепло воздействует на раковые ткани, клетки становятся более уязвимыми. Увеличивая кровоток вокруг него, препараты более эффективно переносится в раковую ткань, поэтому эффект химиотерапии увеличивается, местное насыщение кислородом завышается, а эффект лучевой терапии также увеличивается.
Термоактивный белок, который встречается в это время, обладает механизмом локального повышения иммунитета.
Механизм, с помощью которого гипертермия повышает иммунитет, заключается в следующем. Когда применяется тепло, экспрессия термоактивного белка 70 увеличивается. Этот белок активирует естественные клетки-киллеры.
Кроме того, из-за локального некроза могут выделять гемопоэтические белки 70 и 70-PC.
Гематопоэтический белок 70-PC активирует антиген-переносящие клетки, чтобы повысить иммунитет клеток активации Т-клеток, и эти иммунные клетки атакуют раковые клетки.
Препараты, которые усиливают противораковый эффект, применяя тепло.
Цисплатин, карбоплатин, митомицин, доксорубицин и тому подобное являются типичными лекарственными средствами,
Препараты, такие как обычно используемый 5FU или паклитаксел, не оказывают синергетического эффекта при нагревании.
Что такое внутрибрюшинная перитонеальная гипертермическая терапия HIPEC (ХИПЕК) и LHIPEC (ЛАЙПЕК)?
Терапия HIPEC впервые была применена в 1980г.
Технология HIPEC представляет собой гипертермическую внутрибрюшинную перитонеальную терапию проводимую при полостной операции.
После внедрения метода в лечение перитонеального канцероматоза статистика показывает что 5-летняя выживаемость была в 1,5-2 раза больше, когда рак поражал желудок и его серозу, по сравнению с группой только для хирургического вмешательства и группой послеоперационного Хайпека.
Лечение распространенных метастазов в брюшной полости – системная химиотерапия. Для лечения удаление всех повреждений в брюшной полости, а также первичных органов применяется Лайпек, и данная операция становится стандартным лечением.
Если необходима операции, сочетание системной противоопухолевой химиотерапии может быть хорошей альтернативой.
Технология LHIPEC впервые была представлена в 2001 г.
LHIPEK – это внутрибрюшинная гипертермическая химиотерапия проводимая не полостным а лапароскопическим методом что в данном случае имеет огромное количество плюсов в сравнении с технологией HIPEC.
Назначение LAPEC двоякое: одно – для борьбы со злокачественным асцитом, второе – для лечения метастаз в брюшной полости до и после операции.
Перитонеальный метастаз плохой прогноз и трудно поддается лечению.
Лапароскопическая гипертермия предназначена для анализа клинических результатов внутрибрюшинной химиотерапии.
В целом, Лайпек может использоваться для лечения всех видов метастатического рака брюшины.
Однако, если наблюдается жёсткий живот, либо кишечник растянут, или же общее состояние пациента слабое, данная процедура противопоказана.
пределов диагностики и футляр для жидкостной биопсии
Oncotarget. 2017 июн 27; 8 (26): 43481–43490.
Джеймс Р.В. Макмаллен
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Мэтью Селлек
2 Департамент Хирургия, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Натан Р.
 Wall
Wall1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Махесвари Сентил
2 Отделение хирургии, Отделение Хирургическая онкология, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
2 Отделение хирургии, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Получено 21 января 2017 г .; Принята в печать 15 марта 2017 г.
Эта статья распространяется в соответствии с условиями лицензии Creative Commons Attribution License (CC-BY), которая разрешает неограниченное использование и распространение при условии указания автора и источника.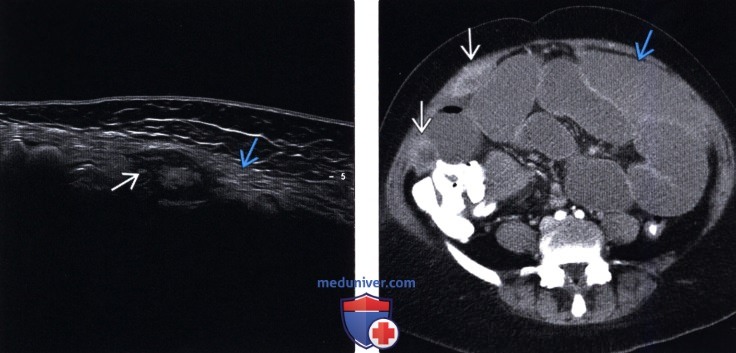 Эта статья цитируется в других статьях PMC.
Эта статья цитируется в других статьях PMC.Abstract
Карциноматоз брюшины (ПК) — это проявление на поздней стадии нескольких злокачественных новообразований желудочно-кишечного тракта, включая рак аппендикса, толстой кишки и желудка. При РПЖ опухоли метастазируют и откладываются на поверхности брюшины и часто оставляют пациентам только варианты паллиативного лечения.При колоректальном РПЖ средняя выживаемость составляет примерно пять месяцев, а паллиативная системная терапия может продлить ее примерно до 12 месяцев. Однако циторедуктивная хирургия с гипертермической внутрибрюшинной химиотерапией (CRS / HIPEC) с лечебной целью возможна у некоторых пациентов с ограниченной опухолевой нагрузкой. Сообщается, что у тщательно отобранных пациентов, перенесших полную циторедукцию, средняя выживаемость составляет 63 месяца. Раннее выявление пациентов, которые либо подвержены риску ПК, либо у которых недавно развился ПК, может предоставить им дополнительные варианты лечения, такие как CRS / HIPEC. ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты у пациентов с ПК, необходимо разработать минимально инвазивный, точный и специфический метод скрининга ПК. Используя циркулирующие биомаркеры ПК в сыворотке крови пациентов, можно создать «жидкую биопсию», которая позволит разработать индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нанопузырьки, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, являются многообещающим инструментом для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы на ПК, проявления этого рака можно будет более эффективно лечить, тем самым повышая выживаемость.
ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты у пациентов с ПК, необходимо разработать минимально инвазивный, точный и специфический метод скрининга ПК. Используя циркулирующие биомаркеры ПК в сыворотке крови пациентов, можно создать «жидкую биопсию», которая позволит разработать индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нанопузырьки, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, являются многообещающим инструментом для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы на ПК, проявления этого рака можно будет более эффективно лечить, тем самым повышая выживаемость.
Ключевые слова: карциноматоз брюшины, жидкостная биопсия, биомаркер, экзосомы
ВВЕДЕНИЕ
Карциноматоз брюшины (ПК) является поздней стадией проявления нескольких злокачественных новообразований желудочно-кишечного тракта, характеризующихся отложением опухоли на поверхности брюшины [1]. Это может протекать бессимптомно на ранних стадиях или по мере прогрессирования заболевания могут развиваться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто обнаруживается при развитии асцита или кишечной непроходимости, обычно возникающих при большей опухолевой нагрузке, которую труднее лечить [2]. Раннее обнаружение ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Это может протекать бессимптомно на ранних стадиях или по мере прогрессирования заболевания могут развиваться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто обнаруживается при развитии асцита или кишечной непроходимости, обычно возникающих при большей опухолевой нагрузке, которую труднее лечить [2]. Раннее обнаружение ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Колоректальный рак (CRC), третий по распространенности вид рака в мире, является хорошим примером ПК. По оценкам, в 2016 году в США будет 95 270 случаев рака прямой кишки и почти 1.4 миллиона случаев во всем мире [4]. Синхронный ПК диагностируется примерно во время постановки диагноза первичной опухоли, в то время как метахронный ПК диагностируется позже, обычно через месяцы или годы после первоначального диагноза [5]. Частота синхронного изолированного перитонеального карциноматоза у пациентов с CRC несколько колеблется в литературе от 4% до 18% [6–9]. Это может быть даже заниженная оценка, учитывая недостаточную чувствительность изображений для ПК и то, что это не может быть обнаружено до хирургического исследования. Между тем, метахронный ПК был зарегистрирован у 5-19% пациентов после окончательного лечения.
Это может быть даже заниженная оценка, учитывая недостаточную чувствительность изображений для ПК и то, что это не может быть обнаружено до хирургического исследования. Между тем, метахронный ПК был зарегистрирован у 5-19% пациентов после окончательного лечения.
ЦИТОРЕДУКТИВНАЯ ХИРУРГИЯ (CRS)
Раньше ПК считался смертельным заболеванием, не имевшим возможности лечения. Однако растущее признание СВК с гипертермической внутрибрюшинной химиотерапией (HIPEC) открыло возможность повышения выживаемости для тщательно отобранных пациентов [3]. В этом методе используется «циторедукция» для хирургического удаления крупных видимых опухолевых отложений с последующим прямым контактом с нагретыми цитотоксическими химиотерапевтическими агентами для воздействия на любую остаточную болезнь.Применяемый во время операции, этот протокол максимизирует потенциальный контакт с поверхностью брюшины при минимизации системной токсичности. В частности, гипертермия между 41 и 43 градусами по Цельсию сочетается с лекарствами с большой молекулярной массой, которые проникают между несколькими клетками на глубину до 3 мм, вызывая цитотоксические эффекты [10]. Доктору Полу Шугарбейкеру приписывают разработку этого варианта лечения путем объединения этих элементов в лечебный подход к перитонеальному распространению злокачественных новообразований желудочно-кишечного тракта [11, 12].Средняя выживаемость CRC PC без какого-либо лечения составляет приблизительно 4-7 месяцев, в то время как паллиативная системная терапия может продлить ее до 12-23 месяцев на основании нескольких серий [13-15]. Сообщается, что медиана общей выживаемости с CRS / HIPEC составляет от 22 до 63 месяцев с 5-летней выживаемостью 40-51% у выбранных пациентов [13, 15, 16]. На исходы CRS / HIPEC сильно влияет тщательный отбор пациентов и полная циторедукция (CC-0) (см. Таблицу) [17]. Выживаемость пациентов с колоректальным раком, получивших менее чем полную циторедукцию (CC-1 или CC-2) или имеющих более высокое бремя заболевания, на что указывает индекс перитонеального карциноматоза (PCI) (см. Рисунок), значительно ниже по сравнению с индексом карциноматоза брюшной полости (PCI) (см. Рисунок). Резекция CC-0 [17–19].Обширное бремя болезни при выявлении часто оставляет пациентам только варианты паллиативного лечения [20]. Несмотря на преимущества CRS / HIPEC, только около 25% пациентов с ПК будут подходить для этого подхода с учетом позднего обращения и бремени болезни. Чтобы расширить возможности пациентов и предложить лечение с лечебной целью, необходимо раннее выявление ПК до того, как разовьется значительная опухолевая нагрузка.
Таблица 1
CC — оценка полноты циторедукции
| Оценка полноты циторедукции | |
|---|---|
| Оценка | Размер самой большой послеоперационной остаточной опухоли |
| CC-0 | Нет видимой опухоли |
| CC-1 | Менее 0.25 см |
| CC-2 | Между 0,25 см и 2,5 см |
| CC-3 | > 2,5 см или сливной |
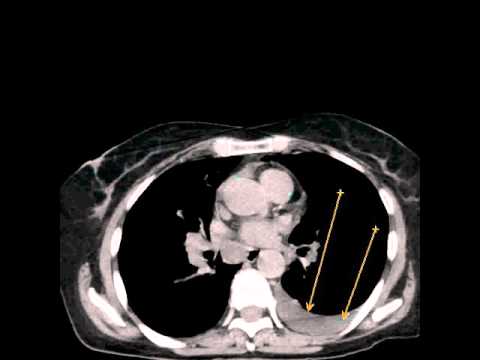
PCI является диагностической и прогностический инструмент, который представляет собой сумму баллов по тринадцати областям брюшной полости. Каждый получает оценку от 0 до 3 на основании самого большого размера опухоли в каждой области. Баллы варьируются от 0 до 39. Более высокие баллы указывают на более распространенные и / или более крупные опухоли в брюшной полости.
ИЗОБРАЖЕНИЕ
Традиционные методы визуализации, такие как КТ и МРТ, не обладают чувствительностью как для обнаружения, так и для оценки бремени болезни на ПК. Признаки классической компьютерной томографии (КТ) ПК, такие как «спекание сальника», утолщение сальника и узелки брюшины, не являются обычными рентгенографическими находками при «ранних» болезненных состояниях. Несколько исследований, разработанных для определения специфичности и точности компьютерной томографии при оценке опухолевой нагрузки на ПК, показали, что КТ значительно занижает количество заболеваний, присутствующих в брюшной полости [21–24].Сообщалось, что чувствительность КТ-обнаружения опухолевых узлов размером менее 0,5 см и 1 см составляет 11% и 25-50% соответственно [23]. Это особенно важно при колоректальном ПК, где ЧКВ является критическим фактором, определяющим полную циторедукцию и долгосрочные результаты [25]. В исследовании, проведенном Кохом и соавторами, изучавшим ПК при КРР, они определили, что КТ значительно недооценивает клиническое ЧКВ [23]. Фактически чувствительность поражения тонкой кишки в каждой области колебалась в пределах 8-17%. Несмотря на это, Пятый международный семинар по злокачественным новообразованиям брюшной полости в Милане определил КТ как основной метод визуализации для оценки пригодности для лечения СВК [26].Ультразвук также имеет очень ограниченную чувствительность для обнаружения узелков ПК [27–29]. В проспективных исследованиях было продемонстрировано, что магнитно-резонансная томография (МРТ) и, в частности, диффузно-взвешенные изображения имеют повышенную точность при обнаружении карциноматоза в определенных областях брюшной полости [30]. Однако это имеет свои ограничения из-за артефактов движения перистальтики, стоимости и необходимости радиологов, обученных их интерпретации и вариациям между наблюдателями. Кроме того, позитронно-эмиссионная технология (ПЭТ) может иметь повышенную чувствительность, но аналогичные ограничения и отсутствие дополнительной клинической ценности часто препятствуют ее использованию для определения резектабельности [24, 31–33].Эти трудности, особенно ограниченная чувствительность, отсутствие значимой клинической корреляции и высокая стоимость, снижают полезность неинвазивной визуализации для раннего обнаружения ПК. При современных технологиях для подтверждения диагноза и степени ПК часто требуется лапароскопия или диагностическая хирургия (см. Таблицу) [34].
Таблица 2
В этой таблице приведены плюсы и минусы каждого метода неинвазивной визуализации при оценке ПК
| Утилита неинвазивной визуализации при обнаружении ПК | ||||
|---|---|---|---|---|
| Модальность изображения | Плюсы | Минусы | Чувствительность / специфичность по сравнению с хирургическим анализом | Ссылки |
| Ультразвук | Недорогой, эффективный для обнаружения асцита | Ограниченная чувствительность узелков ПК, сильно зависит от оператора | Неспецифический [26] | [24] , 25] |
| CT | Стандартное промежуточное обследование | Ограниченная чувствительность узелков малого ПК, вариабельность между наблюдателями | 25–100% / 78–100% с чувствительностью только 11–48% для опухолей менее 5 мм [ 26] | [18–21] |
| МРТ | Высокая чувствительность ПК | Относительно дорого, слабая перистальтика артефакт, вариабельность между наблюдателями | 90% / 95.5% (взвешенный по диффузии) [26] | [28] |
| ПЭТ / ПЭТ-КТ | Высокая чувствительность ПК | Относительно дорого, Артефакт перистальтического движения | 78-97% / 55-90% [26 ] | [27, 28] |
ЖИДКАЯ БИОПСИЯ
Учитывая узкую подгруппу пациентов, которым предлагается CRS / HIPEC, потенциально спасающее жизнь лечение, мы нуждаемся в изменении парадигмы. Пациенты, которые либо подвержены риску развития ПК, либо находятся на самой ранней стадии этого болезненного процесса, могут значительно выиграть от расширенных вариантов лечения.Термин «жидкая биопсия» получил широкое распространение, поскольку крупномасштабные исследования направлены на выявление опухолевых маркеров в сыворотке крови. Обычно это относится к молекулярным диагностическим исследованиям, которые проводятся на крови или биологической жидкости, а не на самой раковой ткани [35]. Множественные сывороточные опухолевые маркеры: карциноэмбриональный антиген (CEA), углеводный антиген CA 19-9 и CA 125 обычно повышены у пациентов с ПК, и степень повышения имеет тенденцию коррелировать с распространением ПК [36]. Однако этих сывороточных онкомаркеров недостаточно для раннего выявления ПК.Более того, им не хватает специфичности для прогнозирования наличия или риска ПК у пациентов с CRC. Существует критическая клиническая потребность в идентификации циркулирующих опухолевых биомаркеров агрессивности, вероятности рецидива, риска метастазов, таких как ПК, или даже наличия злокачественного новообразования, чтобы лучше подбирать терапию для пациентов. Например, если известно, что у пациента с впервые диагностированным колоректальным раком III стадии существует значительный риск рецидива брюшной полости из-за наличия определенного набора биомаркеров в их сыворотке, он может получить пользу от профилактического HIPEC.Это лишь один пример того, как можно применить эту технологию.
Если обнаружены биомаркеры ПК с кровью, обладающие высокой чувствительностью и специфичностью, пациенты, у которых развивается ПК, могут быть быстро идентифицированы с помощью анализа крови, жидкой биопсии. Один такой тип биомаркера, микроРНК (miR), короткие некодирующие РНК, которые регулируют мРНК, продемонстрировал диагностическую полезность, правильно идентифицируя несколько видов рака неизвестной первичной с разумной точностью [37]. Диагностический профиль miR, который использовался в этом исследовании, был получен из анализа miR в хорошо дифференцированных первичных опухолях [37].Некоторые miR, такие как miR-21, были связаны с раком желудочно-кишечного тракта в качестве потенциальных диагностических целей и прогностических индикаторов [38]. Однако эти miRs и другие типы РНК быстро деградируют в плазме [39–41].
ЭКЗОСОМЫ
Экзосомы, везикулы, происходящие из мелких клеток (рисунок), могут защищать РНК и миРНК от деградации [42–46]. Когда исследователи подвергли miRs воздействию РНКазы, miR, находившиеся в экзосомах и клетках, были защищены, в то время как свободные РНК деградировали [42].Когда экзосомы подвергались действию РНКазы, содержащиеся в них РНК были защищены от деградации, в то время как клеточная РНК расщеплялась той же самой РНКазой [45]. Экзосомы обладают большим потенциалом как для диагностики, так и для прогноза заболеваний и исключительно полезны в качестве биомаркеров рака [47]. Когда панель miR, ассоциированных с раком легких, была исследована в солидных опухолях и опухолевых экзосомах из плазмы пациентов, было обнаружено, что большинство miR имеют очень сопоставимые уровни экспрессии (см. Таблицу miR) [48, 49]. Экзосомы (TEX), производные от опухолевой линии клеток рака шейки матки, содержат сурвивин, который способствует агрессивности рака и метастатическому потенциалу [50, 51].В исследовании рака яичников большее количество экзосом рака было обнаружено в сыворотке по мере изучения более поздних стадий рака [52]. Более того, примерно в четыре раза больше экзосом в сыворотке крови было обнаружено у пациентов с раком легкого по сравнению с контрольной группой без рака, и экзосомы содержали более чем в два раза больше miR [48]. В нашем исследовании мы обнаружили повышенные уровни экзосом в сыворотке крови у пациентов с раком простаты и груди по сравнению с контрольной группой, не имеющей заболевания [53–55]. TEX преобладают в сыворотке пациентов от нескольких типов рака и защищают лабильные биомаркеры от деградации [42, 45, 48, 53–55].
Опухолевые клетки высвобождают нанопузырьки, называемые экзосомами, которые несут РНК, включая микроРНК и информационные РНК, и белки
Таблица 3
Эти miR, связанные с раком легких, были обнаружены как в солидной опухоли, так и в экзосомах опухоли
| miR-17-3p | miR-21 | miR-106a | miR-146 | miR-155 | miR-191 |
| miR-192 | miR-203 | miR-205 | miR -210 | miR-212 | miR-214 |
Экзосомы не были широко изучены в диагностике ПК.Андре и его коллеги исследовали экзосомы асцита у пациентов с ПК и обнаружили, что опухолеспецифические маркеры Her2 / Neu, TRP1 и Mart1 присутствуют в экзосомах асцитных опухолей [56]. Tokuhisa с коллегами идентифицировали несколько РНК, присутствующих в экзосомах перитонеального асцита, перитонеального лаважа и метастатических клеточных линий PC [57]. После скрининга miR экзосом 5 miRNA были отобраны в качестве панели значительно дифференцированно регулируемых РНК: miR 1202, 1207-5p, 1225-5p, 320c и 4270 [57]. miR 21 имеет самую сильную интенсивность сигнала при злокачественном асците [57].Экзосомы из перитонеального лаважа исследовали на miR 21, 1225-5p и 320c; Было обнаружено, что miR 21 и 1225-5p активируются на более поздних стадиях рака желудка и коррелируют с серозной инвазией [57]. В исследовании ткани первичного рака желудка активность miR 1255-5p в целом подавлялась, и было обнаружено, что она ингибирует рост раковых клеток, их подвижность, а также инвазию рака [58]. Этот явно противоречивый результат предполагает, что miR 1225-5p в перитонеальном лаваже либо высвобождается незлокачественной тканью в попытке остановить аномальный рост, либо используется раком для облегчения лучшего прикрепления к брюшине.В явно противоречащих результатах вышеуказанному исследованию, в клеточных линиях рака желудка и in vivo , miR 1255-5p, как правило, подавлялась, и было обнаружено, что она ингибирует рост и подвижность клеток, а также инвазию рака [58].
Было обнаружено, что проспективные биомаркеры miR PC желудка, описанные в исследовании Tokuhisa с коллегами [57], также связаны с другими видами рака (см. Таблицу). Примечательно, что miR 1202, 1207-5p, 1225-5p и 4270 были обнаружены в крови больных раком груди [59].В образцах ткани рака мочевого пузыря человека уровень miR 320c был значительно подавлен [60]. В образцах ткани гепатоцеллюлярной карциномы было обнаружено, что miR 1207-5p значительно подавлена [61]. В образцах ткани карциномы надпочечников было обнаружено, что повышенная экспрессия miR 1202 связана со значительным сокращением продолжительности жизни пациентов [62]. Пробелы в наших знаниях о передаче сигналов РНК при раке сразу видны из таблицы. Наблюдение, что эти miRs, индивидуально или в группе, связаны с несколькими типами рака и обнаруживаются в экзосомах из брюшной полости, предполагает потенциал экзосомальной диагностики PC.
Таблица 4
Рак желудка PC-ассоциированные экзосомальные миРи и их распространенность при различных формах рака
| Рак желудка | Рак легких | Рак печени | Рак молочной железы | 3Рак предстательной железы | 3Рак молочной железы | 3Рак надпочечников | ||
|---|---|---|---|---|---|---|---|---|
| miR 1202 | ↔ злокачественный асцит, жидкость перитонеального лаважа, клеточная культура [52] | X | X | ↑ экзосомы сыворотки [54] | X | X | ↑ Ø опухолевая ткань [62] | |
| miR 1207-5p | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52], ↓ tNm опухолевой ткани [63], ↓ опухолевой ткани [64] | X | ↓ солидная опухоль [56] | ↑ экзосомы сыворотки [54] | ↑ сыворотка [65] | ↑ солидная опухоль [66] | X | |
| miR 1225-5p | ↑ tnM p жидкость эритонеального лаважа [52], ↓ раковая ткань [53] | X | ↓ кровь [67] | ↑ экзосомы сыворотки [54] | ↑ кровь [68], ↓ солидная опухоль [69] | ↓ солидная опухоль [70] | ↓ несколько типов солидных опухолей [71] | |
| miR 320c | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | ↓ солидная опухоль [72] | X | X | X | X | X | |
| miR 4270 | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | X | X | ↑ экзосомы сыворотки [54] | X | X | X |
РНК И РАК ЖЕЛУДКА
Было обнаружено, что при раке глобально подавляетсяРНК [37].Повышенная регуляция РНК и miR, вероятно, связана с ростом и функцией рака или реакцией организма на рак. miR 320c ингибирует рост и подвижность клеток при раке мочевого пузыря [60]. miR 1207-5p функционирует, чтобы ингибировать рост клеток и инвазию при раке печени, но функционирует для увеличения стволовости при колоректальном раке [61, 63]. Поскольку эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, появляется возможность индивидуального подхода к лечению ПК на основе того, какие биомаркеры обнаружены в экзосомах пациента.miR 320c ингибирует рост и подвижность клеток, а miR 1207-5p действует, ингибируя рост и инвазию клеток. Наблюдение за тем, что эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, открывает возможность использования этих биомаркеров для адаптации лечения отдельного пациента. [60, 61]
БУДУЩИЕ НАПРАВЛЕНИЯ
Для определения биомаркеров перитонеального карциноматоза необходимы дополнительные исследования. Отличить метастатическое заболевание перитонеального происхождения от метастазов в солидный орган должно быть как биологически возможным, так и клинически полезным.Поскольку мы обращаемся к экзосомам, чтобы получить представление об этой области, необходимо будет решить общие проблемы, связанные с изоляцией и валидацией нанопузырьков. Для клинического использования необходимо разработать надежные и эффективные методы, а также признанные стандарты. Будущая клиническая работа в этой области должна включать проспективный сбор образцов для ретроспективного исследования. Это будет способствовать установлению клинической валидности и полезности. Мы надеемся, что совместная работа многих продолжит приносить успехи в сокращении бремени жизни, потерянного в результате этого агрессивного недуга.
ВЫВОДЫ
Недавно, TEX были вовлечены в облегчение метастазирования. TEX могут поглощаться несколькими типами клеток, включая эндотелиальные клетки, клетки-предшественники костного мозга и другие раковые клетки [64–67]. Эти экзосомы продемонстрировали способность доставлять функциональные РНК и белки к реципиентным клеткам, модифицируя их паттерны роста, делая их проонкогенными [65, 66]. Кроме того, TEX продемонстрировали способность значительно увеличивать количество метастатических опухолей на модели мышей [64].Изучение TEX в контексте метастазирования — многообещающая область. ПК в настоящее время трудно обнаружить в самом начале. Позднее обнаружение ПК обычно оставляет болезнь неизлечимой. ПК должен быть обнаружен раньше для улучшения результатов лечения пациентов. Неинвазивная визуализация нецелесообразна для раннего обнаружения ПК. Обнаружение ПК с помощью маркеров в биожидкостях пациента, таких как «жидкая биопсия» сыворотки, было бы идеальным. И сыворотка, и асцит содержат биомаркеры, выделяемые ПК. Экзосомы попадают в сыворотку при многих типах рака и защищают свое содержимое от разложения в крови.Они предоставляют нам вероятный источник чувствительного и специфического диагностического метода для обнаружения ПК на самой ранней стадии, из которой он поддается лечению.
Благодарности
Авторы выражают благодарность Центру проблем здравоохранения и молекулярной медицины за его поддержку. Они также хотели бы поблагодарить сотрудников Wall Laboratory за внимательное рассмотрение этой рукописи.
Сноски
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ФИНАНСИРОВАНИЕ
Исследование, представленное в этой публикации, было поддержано наградой NIH P20MD006988 (NRW).
ССЫЛКИ
1. Леви А.Д., Шоу Дж. К., Собин Л. Х. Вторичные опухоли и опухолевидные поражения брюшной полости: особенности визуализации с патологической корреляцией. RadioGraphics. 2009; 29: 347–73. DOI: 10.1148 / rg.292085189. [PubMed] [CrossRef] [Google Scholar] 2. Садеги Б., Арвье С., Глеен О., Божар А.С., Ривуар М., Болье Дж., Фонтаумар Э., Браше А, Кайо Дж. Л., Фор Дж. Л., Поршерон Дж., Пейш Дж. Л., Франсуа И. и др.Карциноматоз брюшины от негинекологических злокачественных новообразований. Рак. 2000; 88: 358–63. DOI: 10.1002 / (SICI) 1097-0142 (20000115) 88: 2 <358 :: AID-CNCR16> 3.0.CO; 2-O. [PubMed] [CrossRef] [Google Scholar] 3. Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, Group tBIGR Пациенты с перитонеальным карциноматозом от рака желудка, леченные с помощью циторедуктивной хирургии и гипертермической интраперитонеальной терапии Возможность? Анналы хирургической онкологии.2016: 1–9. DOI: 10.1245 / s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar] 4. Сигел Р.Л., Миллер К.Д., Джемаль А. Статистика рака, 2016. CA Cancer J Clin. 2016; 66: 7–30. DOI: 10.3322 / caac.21332. [PubMed] [CrossRef] [Google Scholar] 5. Mekenkamp LJ, Koopman M, Teerenstra S, van Krieken JH, Mol L, Nagtegaal ID, Punt CJ. Клинико-патологические особенности и исходы у пациентов с запущенным колоректальным раком с синхронными и метахронными метастазами. Br J Рак. 2010 (103): 159–64. DOI: 10.1038 / sj.bjc.6605737.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Клавер Ю.Л., Лемменс В.Е., Ниенхейс С.В., Луйер, доктор медицинских наук, де Хинг IH. Карциноматоз брюшины колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012; 18: 5489–94. DOI: 10.3748 / wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Klaver CE, Musters GD, Bemelman WA, Punt CJ, Verwaal VJ, Dijkgraaf MG, Aalbers AG, van der Bilt JD, Boerma D, Bremers AJ, Burger JW, Buskens CJ, Evers P и др.Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у пациентов с раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. BMC Рак. 2015: 15. DOI: 10.1186 / s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Mitry E, Guiu B, Cosconea S, Jooste V, Faivre J, Bouvier AM. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишечник. 2010; 59: 1383–8. DOI: 10,1136 / гут.2010.211557. [PubMed] [CrossRef] [Google Scholar] 9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживаемость перитонеального карциноматоза от колоректального рака: популяционное исследование. Заболевания толстой и прямой кишки. 2015; 58: 743–52. DOI: 10.1097 / DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar] 10. Ян Т.Д., Цао С.К., Мункхольм-Ларсен С. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. Мир J Gastrointest Oncol.2010; 2: 109–16. DOI: 10.4251 / wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Гудман, доктор медицины, Макпартланд С., Детелич Д., Саиф М.В. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016; 7: 45–57. DOI: 10.3978 / j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстой кишки.Естествознание и презентация лечебного подхода к лечению. Dis Colon Rectum. 1987. 30: 772–9. [PubMed] [Google Scholar] 13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J. Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия с оксалиплатином для перитонеального карциноматоза кишечника. Журнал клинической онкологии. 2009. 27: 681–5. DOI: 10.1200 / JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar] 14.Franko J, Shi Q, Goldman CD, Pockaj BA, Nelson GD, Goldberg RM, Pitot HC, Grothey A, Alberts SR, Sargent DJ. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ исследований N9741 и N9841 группы лечения рака Северной Центральной группы III фазы. Журнал клинической онкологии. 2012; 30: 263–7. DOI: 10.1200 / JCO.2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H, Zoetmulder FA.Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака. Журнал клинической онкологии. 2003; 21: 3737–43. DOI: 10.1200 / JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar] 16. Chua TC. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010; 102: 728–9. DOI: 10.1002 / jso.21748. [PubMed] [CrossRef] [Google Scholar] 17.Sugarbaker PH. Успешное лечение микроскопической резидуальной болезни при раке толстой кишки. Химиотерапия и фармакология рака. 1999; 43: S15 – S25. DOI: 10.1007 / s002800051093. [PubMed] [CrossRef] [Google Scholar] 18. Хармон Р.Л., Шугарбейкер PH. Прогностические показатели при карциноматозе брюшины при раке желудочно-кишечного тракта. Международные семинары по хирургической онкологии. 2005; 2: 3. DOI: 10.1186 / 1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Verwaal VJ, van Ruth S, Witkamp A, Boot H, van Slooten G, Zoetmulder FA.Долгосрочная выживаемость при карциноматозе брюшины колоректального происхождения. Анналы хирургической онкологии. 2004; 12: 65–71. DOI: 10.1007 / s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar] 20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008. 98: 220–3. DOI: 10.1002 / jso.21060. [PubMed] [CrossRef] [Google Scholar] 21. Dromain C, Leboulleux S, Auperin A, Goere D, Malka D, Lumbroso J, Schumberger M, Sigal R, Elias D.Постановка перитонеального карциноматоза: усиленная КТ по сравнению с ПЭТ / КТ. Визуализация брюшной полости. 2007; 33: 87–93. DOI: 10.1007 / s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar] 22. Эскивель Дж., Чуа Т.К., Стоядинович А., Мелеро Дж. Т., Левин Э.А., Гутман М., Ховард Р., Писо П., Ниссан А., Гомес-Портилья А., Гонсалес-Байон Л., Гонсалес-Морено С., Шен П. и др. Точность и клиническая значимость интерпретации компьютерной томографии индекса рака брюшины при колоректальном раке перитонеальный карциноматоз: мультиинституциональное исследование.Журнал хирургической онкологии. 2010; 102: 565–70. DOI: 10.1002 / jso.21601. [PubMed] [CrossRef] [Google Scholar] 23. Ко Дж. Л., Ян Т. Д., Гленн Д., Моррис Д. Л.. Оценка предоперационной компьютерной томографии в оценке индекса рака брюшины при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008. 16: 327–33. DOI: 10.1245 / s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar] 24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса рака брюшины (ЧКВ) до операции у пациентов, рассматриваемых для циторедуктивных хирургических процедур.Анналы хирургической онкологии. 2015; 22: 1708–15. DOI: 10.1245 / s10434-014-4041-7. [PubMed] [CrossRef] [Google Scholar] 25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, получивших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. DOI: 10.1016 / j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar] 26. Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям брюшной полости (Милан, Италия, 4-6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям.Журнал хирургической онкологии. 2008. 98: 258–62. DOI: 10.1002 / jso.21056. [PubMed] [CrossRef] [Google Scholar] 27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М. М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Дж. М.. Полезность эндоскопической ультрасонографии в предоперационной стадии рака желудка: диагностическая ценность и терапевтическое влияние. Revista Española De Enfermedades Digestivas. 2010; 102: 413–20. [PubMed] [Google Scholar] 28. Savelli L, De Iaco P, Ceccaroni M, Ghi T, Ceccarini M, Seracchioli R, Cacciatore B.Трансвагинальные сонографические особенности перитонеального карциноматоза. Ультразвук в акушерстве и гинекологии. 2005; 26: 552–7. DOI: 10.1002 / uog.2587. [PubMed] [CrossRef] [Google Scholar] 30. Фенигер Дж., Томас С., Лендьель Э., Ляо К., Тенни М., Ото А., Ямада С.Д. Проспективное исследование по оценке диффузно-взвешенной магнитно-резонансной томографии (DW-MRI) в выявлении перитонеального карциноматоза при подозрении на гинекологические злокачественные новообразования. Gynecol Oncol. 2016; 142: 169–75. DOI: 10.1016 / j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar] 31.Де Вос Н., Геталс И., Селен В. Клиническая ценность (18) F-FDG-PET-CT в предоперационной стадии перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114: 370–5. [PubMed] [Google Scholar] 32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: внутриличностное сравнение 18F-FDG ПЭТ / КТ и МРТ. Визуализация брюшной полости. 2012; 38: 64–71. DOI: 10.1007 / s00261-012-9881-7.[PubMed] [CrossRef] [Google Scholar] 33. Low RN, Barone RM, Lacey C, Sigeti JS, Alzate GD, Sebrechts CP. Опухоль брюшины: МРТ с разбавленным пероральным барием и внутривенным введением контрастных веществ, содержащих гадолиний, по сравнению с неулучшенной МРТ и КТ. Радиология. 1997; 204: 513–20. DOI: 10.1148 / радиология.204.2.9240546. [PubMed] [CrossRef] [Google Scholar] 34. Йонемура Й, Канбай И, Эндоу И, Ишибаши Х, Мизумото А, Миура М, Ли И, Лю И, Такешита К., Ичиносе М, Такао Н., Хирано М, Сако С. и др. Лечение рака брюшины.Мнение эксперта по фармакотерапии. 2014; 15: 623–36. DOI: 10.1517 / 14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar] 35. Кин С., Кидесс Э., Поултсайдс Г.А., Виссер BC, Джеффри С.С. Диагностика рака прямой кишки: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью одноклеточного анализа. Экспертный обзор молекулярной диагностики. 2013; 13: 581–99. DOI: 10.1586 / 14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar] 36. Wagner PL, Austin F, Sathaiah M, Magge D, Maduekwe U, Ramalingam L, Jones HL, Holtzman MP, Ahrendt SA, Zureikat AH, Pingpank JF, Zeh HJ, Bartlett DL, et al.Значимость уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения. Анналы хирургической онкологии. 2013: 20. DOI: 10.1245 / s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 37. Лу Дж., Гетц Дж., Миска Е. А., Альварес-Сааведра Э., Лэмб Дж., Пек Д., Свит-Кордеро А., Эберт Б. Л., Мак Р. Х., Феррандо А. А., Даунинг Дж. Р., Джекс Т., Хорвиц Х. Р. и др. Профили экспрессии микроРНК позволяют классифицировать рак человека. Природа. 2005; 435: 834–8. DOI: 10,1038 / природа03702. [PubMed] [CrossRef] [Google Scholar] 38.Инь Ц., Чжоу X, Данг И, Ян Дж., Чжан Г. Потенциальная роль циркулирующего MiR-21 в диагностике и прогнозе рака пищеварительной системы: систематический обзор и метаанализ. Медицина (Балтимор) 2015; 94: e2123. DOI: 10.1097 / MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Чен Х, Ба И, Ма Л, Цай Х, Инь И, Ван К., Го Дж, Чжан И, Чен Дж, Го Х, Ли Кью, Ли Х, Ван В. и др. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний.Клеточные исследования. 2008; 18: 997–1006. DOI: 10.1038 / cr.2008.282. [PubMed] [CrossRef] [Google Scholar] 40. Митчелл П.С., Паркин Р.К., Крох Е.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Е.Л., Петерсон А., Нотабум Дж., О’Брайант К.С., Аллен А., Лин Д.В., Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры крови для обнаружения рака. Труды Национальной академии наук. 2008. 105: 10513–8. DOI: 10.1073 / pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Цуй Н.Б., Нг ЭК, Ло Ю.М.Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48: 1647–53. [PubMed] [Google Scholar] 42. Кога А., Аояги К., Имаидзуми Т., Мияги М., Широузу К. Сравнение между клеточной линией рака желудка MKN-45 и линией клеток с высоким потенциалом распространения перитонеального рака желудка MKN-45P. Медицинский журнал Куруме. 2011; 58: 73–9. DOI: 10.2739 / kurumemedj.58.73. [PubMed] [CrossRef] [Google Scholar] 43. Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, van Eijndhoven MA, Hopmans ES, Lindenberg JL, de Gruijl TD, Würdinger T, Middeldorp JM.Функциональная доставка вирусных miRNA через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6328–33. DOI: 10.1073 / pnas.0914843107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Ског Дж., Вурдингер Т., ван Рейн С., Мейер Д., Гайнче Л., Сена-Эстевес М., Карри В. Т., Картер Р. С., Кричевский А. М., Брейкфилд XO. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008; 10: 1470–6.DOI: 10,1038 / NCB1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Валади Х., Экстрём К., Боссиос А., Сьёстранд М., Ли Дж. Дж., Лётвалл Дж. Опосредованный экзосомами перенос мРНК и микроРНК является новым механизмом генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. DOI: 10,1038 / NCB1596. [PubMed] [CrossRef] [Google Scholar] 46. Ченг Л., Шарплз Р.А., Шиклуна Б.Дж., Хилл А.Ф. Экзосомы обеспечивают защитный и обогащенный источник miRNA для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью.J Внеклеточные везикулы. 2014; 3 DOI: 10.3402 / jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Рабиновиц Г., Герчель-Тейлор С., Дэй Дж. М., Тейлор Д. Д., Клоекер Г. Х. Экзосомальная микроРНК: диагностический маркер рака легких. Клинический рак легкого. 2009; 10: 42–6. DOI: 10.3816 / CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar] 49. Янаихара Н., Кэплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче С.М. и др. Уникальные молекулярные профили микроРНК в диагностике и прогнозе рака легких.Раковая клетка. 2006; 9: 189–98. DOI: 10.1016 / j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar] 50. Хан С., Аспе-младший, Асумен М.Г., Альмагуэль Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж WH, Уолл Н.Р. Внеклеточный, проницаемый для клеток сурвивин подавляет апоптоз, способствуя пролиферативному и метастатическому потенциалу. Br J Рак. 2009; 100: 1073–86. DOI: 10.1038 / sj.bjc.6604978. 6604978 [pii] [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Хан С., Джатзи Дж. М., Аспе Дж. Р., МакГрегор Д. В., Нейди Дж. В., Уолл Н. Р..Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16: 1–12. DOI: 10.1007 / s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Тейлор Д.Д., Герсель-Тейлор С. Сигнатуры микроРНК экзосом, полученных из опухоли, как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110: 13–21. DOI: 10.1016 / j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar] 53. Хан С., Беннит Х. Ф., Турай Д., Перес М., Миршахиди С., Юань Ю., Уолл Н. Р.. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке груди.BMC Рак. 2014; 14: 176. DOI: 10.1186 / 1471-2407-14-176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Хан С., Джутзи Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли МБ, Уолл Н. Р.. Экзосомальный сурвивин, полученный из плазмы, вероятный биомаркер для раннего выявления рака простаты. PLoS One. 2012; 7: e46737. DOI: 10.1371 / journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдиг Дж.В., Миршахиди С., Касиано, Калифорния, Уолл Н.Р.Протеомное профилирование экзосом, полученных из сыворотки крови у пациентов с раком простаты, различающихся по этническому признаку. Рак Инвест. 2016; 34: 1–11. DOI: 10.3109 / 07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Андре Ф., Шарц Н. Э., Мовассаг М., Фламент С, Полье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапосо Дж. И др. Злокачественные выпоты и экзосомы, происходящие из иммуногенных опухолей. Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar] 57. Токухиса М., Итикава Й, Косака Н., Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х, Кунисаки С., Эндо И.Экзосомальные миРНК из жидкости промывания брюшины как потенциальные прогностические биомаркеры перитонеальных метастазов при раке желудка. PLoS One. 2015; 10: e0130472. DOI: 10.1371 / journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W., Lin X. MicroRNA-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством репрессии субстрата-1 рецептора инсулина и активации β -катенин сигнализация. Oncotarget. 2015; 7: 4647–63.DOI: 10.18632 / oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Хамам Р., Али А.М., Альсале К.А., Кассем М., Альфаез М., Альдахмаш А., Аладжез Н.М. Профили экспрессии микроРНК у отдельных пациентов с раком груди позволяют идентифицировать новую панель циркулирующих микроРНК для раннего обнаружения. Научные отчеты. 2016; 6: 25997. DOI: 10,1038 / srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. MicroRNA-320c ингибирует опухолевое поведение при раке мочевого пузыря, воздействуя на циклин-зависимую киназу 6.Журнал экспериментальных и клинических исследований рака. 2014; 33: 69. DOI: 10.1186 / s13046-014-0069-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. MicroRNA-1207-5p ингибирует рост и инвазию клеток гепатоцеллюлярной карциномы через путь передачи сигналов Akt / mTOR, опосредованный синтазой жирных кислот. Отчеты онкологии. 2016; 36: 1709–1. DOI: 10.3892 / or.2016.4952. [PubMed] [CrossRef] [Google Scholar] 62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А, Зедениус Дж., Бекдал М., Ларссон С., Луи В.О.Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Эндокринный рак. 2011; 18: 643–55. DOI: 10.1530 / ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Фархана Л., Антаки Ф., Анес М.Р., Нангиа-Маккер П., Джадд С., Хадден Т., Леви Е., Муршед Ф., Ю Й, Ван Бурен Е., Ахмед К., Дайсон Г., Маджумдар А.П. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Онкологическая медицина. 2016; 5: 1268–78. DOI: 10.1002 / cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64.Хосино А., Коста-Силва Б., Шен Т.Л., Родригес Дж., Хашимото А., Тесич Марк М, Молина Х., Косака С., Ди Джаннатале А., Седер С., Сингх С., Уильямс К., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропные метастазы. Природа. 2015; 527: 329–35. DOI: 10,1038 / природа15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W., Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в ассоциированные с раком фибробласты.Кровь. 2015; 126: 1106–17. DOI: 10.1182 / кровь-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 66. Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, Garcia-Santos G, Ghajar C, Nitadori-Hoshino A, Hoffman C, Badal K, et al. Экзосомы меланомы приучают клетки-предшественники костного мозга к прометастатическому фенотипу посредством МЕТ. Nat Med. 2012; 18: 883–91. DOI: 10,1038 / нм 2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Biomed Res Int. 2014; 2014: 619829. DOI: 10.1155 / 2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Хуанг KH, Lan YT, Fang WL, Chen JH, Lo SS, Li AF, Chiou SH, Wu CW, Shyr YM. Корреляция между miRNA и метастазами в лимфатические узлы при раке желудка. BioMed Research International 2015. 2015 DOI: 10.1155 / 2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69.Chen L, Lü MH, Zhang D, Hao NB, Fan YH, Wu YY, Wang SM, Xie R, Fang DC, Zhang H, Hu CJ, Yang SM. miR-1207-5p и miR-1266 подавляют рост и инвазию рака желудка, воздействуя на обратную транскриптазу теломеразы. Смерть и болезнь клеток. 2014; 5: e1034. DOI: 10.1038 / cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрофлюидов определяет диагностические и прогностические сигнатуры микроРНК в сыворотках пациентов с раком простаты.Исследования рака. 2011; 71: 550–60. DOI: 10.1158 / 0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. MiR-20b, -21 и -130b подавляют экспрессию PTEN, что приводит к в сверхэкспрессии B7-h2 при распространенном колоректальном раке. Иммунология человека. 2014; 75: 348–53. DOI: 10.1016 / j.humimm.2014.01.006. [PubMed] [CrossRef] [Google Scholar] 72. Фрике А., Ульрих П.В., Хайнц Дж., Пфайфер Д., Шолбер Дж., Хергет Г.В., Хаушильд О., Бронсерт П., Старк Г.Б., Баннаш Х., Эйзенхардт С.У., Брейг Д.Идентификация передаваемой через кровь сигнатуры miRNA синовиальной саркомы. Молекулярный рак. 2015: 14. DOI: 10.1186 / s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальная диагностика доброкачественной гиперплазии предстательной железы и рака простаты на основе крови: miRNA как источник биомаркеров независимо от уровня PSA, шкалы Глисона, или статус TNM. Биология опухоли. 2016; 37: 10177–85. DOI: 10.1007 / s13277-016-4883-7.[PubMed] [CrossRef] [Google Scholar] 74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых miRNA рака простаты у китайских пациентов. BMC Genomics. 2013; 14: 757. DOI: 10.1186 / 1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Бартли А.Н., Яо Х., Барко Б.А., Иван К., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденома-аденокарцинома для микросателлитно-стабильного колоректального рака.Клинические исследования рака. 2011; 17: 7283–93. DOI: 10.1158 / 1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Веласкес-Фернандес Д., Карамута С., Озата Д.М., Лу М., Хёог А., Бэкдаль М., Ларссон С., Луи В.О., Зедениус Дж. Паттерны экспрессии микроРНК, связанные с гиперфункционирующими и негиперфункциональными фенотипами в адренокортикальных аденомах. Европейский журнал эндокринологии. 2014; 170: 583–91. DOI: 10.1530 / EJE-13-0817. [PubMed] [CrossRef] [Google Scholar] 77. Лэй Т., Чжу Й., Цзян Ц., Ван И, Фу Дж., Фан З, Цинь Х.МикроРНК-320 подавлялась при немелкоклеточном раке легкого и подавляла пролиферацию, миграцию и инвазию клеток, воздействуя на синтазу жирных кислот. Отчеты по молекулярной медицине. 2016; 14: 1255–62. DOI: 10.3892 / mmr.2016.5370. [PubMed] [CrossRef] [Google Scholar]ограничений диагностики и случай для жидкостной биопсии
Oncotarget. 2017 июн 27; 8 (26): 43481–43490.
Джеймс Р.В. Макмаллен
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Мэтью Селлек
2 Департамент Хирургия, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Натан Р.Wall
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Махесвари Сентил
2 Отделение хирургии, Отделение Хирургическая онкология, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
2 Отделение хирургии, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Получено 21 января 2017 г .; Принята в печать 15 марта 2017 г.
Эта статья распространяется в соответствии с условиями лицензии Creative Commons Attribution License (CC-BY), которая разрешает неограниченное использование и распространение при условии указания автора и источника. Эта статья цитируется в других статьях PMC.Abstract
Карциноматоз брюшины (ПК) — это проявление на поздней стадии нескольких злокачественных новообразований желудочно-кишечного тракта, включая рак аппендикса, толстой кишки и желудка. При РПЖ опухоли метастазируют и откладываются на поверхности брюшины и часто оставляют пациентам только варианты паллиативного лечения.При колоректальном РПЖ средняя выживаемость составляет примерно пять месяцев, а паллиативная системная терапия может продлить ее примерно до 12 месяцев. Однако циторедуктивная хирургия с гипертермической внутрибрюшинной химиотерапией (CRS / HIPEC) с лечебной целью возможна у некоторых пациентов с ограниченной опухолевой нагрузкой. Сообщается, что у тщательно отобранных пациентов, перенесших полную циторедукцию, средняя выживаемость составляет 63 месяца. Раннее выявление пациентов, которые либо подвержены риску ПК, либо у которых недавно развился ПК, может предоставить им дополнительные варианты лечения, такие как CRS / HIPEC.ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты у пациентов с ПК, необходимо разработать минимально инвазивный, точный и специфический метод скрининга ПК. Используя циркулирующие биомаркеры ПК в сыворотке крови пациентов, можно создать «жидкую биопсию», которая позволит разработать индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нанопузырьки, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, являются многообещающим инструментом для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы на ПК, проявления этого рака можно будет более эффективно лечить, тем самым повышая выживаемость.
Ключевые слова: карциноматоз брюшины, жидкостная биопсия, биомаркер, экзосомы
ВВЕДЕНИЕ
Карциноматоз брюшины (ПК) является поздней стадией проявления нескольких злокачественных новообразований желудочно-кишечного тракта, характеризующихся отложением опухоли на поверхности брюшины [1]. Это может протекать бессимптомно на ранних стадиях или по мере прогрессирования заболевания могут развиваться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто обнаруживается при развитии асцита или кишечной непроходимости, обычно возникающих при большей опухолевой нагрузке, которую труднее лечить [2]. Раннее обнаружение ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Колоректальный рак (CRC), третий по распространенности вид рака в мире, является хорошим примером ПК. По оценкам, в 2016 году в США будет 95 270 случаев рака прямой кишки и почти 1.4 миллиона случаев во всем мире [4]. Синхронный ПК диагностируется примерно во время постановки диагноза первичной опухоли, в то время как метахронный ПК диагностируется позже, обычно через месяцы или годы после первоначального диагноза [5]. Частота синхронного изолированного перитонеального карциноматоза у пациентов с CRC несколько колеблется в литературе от 4% до 18% [6–9]. Это может быть даже заниженная оценка, учитывая недостаточную чувствительность изображений для ПК и то, что это не может быть обнаружено до хирургического исследования. Между тем, метахронный ПК был зарегистрирован у 5-19% пациентов после окончательного лечения.
ЦИТОРЕДУКТИВНАЯ ХИРУРГИЯ (CRS)
Раньше ПК считался смертельным заболеванием, не имевшим возможности лечения. Однако растущее признание СВК с гипертермической внутрибрюшинной химиотерапией (HIPEC) открыло возможность повышения выживаемости для тщательно отобранных пациентов [3]. В этом методе используется «циторедукция» для хирургического удаления крупных видимых опухолевых отложений с последующим прямым контактом с нагретыми цитотоксическими химиотерапевтическими агентами для воздействия на любую остаточную болезнь.Применяемый во время операции, этот протокол максимизирует потенциальный контакт с поверхностью брюшины при минимизации системной токсичности. В частности, гипертермия между 41 и 43 градусами по Цельсию сочетается с лекарствами с большой молекулярной массой, которые проникают между несколькими клетками на глубину до 3 мм, вызывая цитотоксические эффекты [10]. Доктору Полу Шугарбейкеру приписывают разработку этого варианта лечения путем объединения этих элементов в лечебный подход к перитонеальному распространению злокачественных новообразований желудочно-кишечного тракта [11, 12].Средняя выживаемость CRC PC без какого-либо лечения составляет приблизительно 4-7 месяцев, в то время как паллиативная системная терапия может продлить ее до 12-23 месяцев на основании нескольких серий [13-15]. Сообщается, что медиана общей выживаемости с CRS / HIPEC составляет от 22 до 63 месяцев с 5-летней выживаемостью 40-51% у выбранных пациентов [13, 15, 16]. На исходы CRS / HIPEC сильно влияет тщательный отбор пациентов и полная циторедукция (CC-0) (см. Таблицу) [17]. Выживаемость пациентов с колоректальным раком, получивших менее чем полную циторедукцию (CC-1 или CC-2) или имеющих более высокое бремя заболевания, на что указывает индекс перитонеального карциноматоза (PCI) (см. Рисунок), значительно ниже по сравнению с индексом карциноматоза брюшной полости (PCI) (см. Рисунок). Резекция CC-0 [17–19].Обширное бремя болезни при выявлении часто оставляет пациентам только варианты паллиативного лечения [20]. Несмотря на преимущества CRS / HIPEC, только около 25% пациентов с ПК будут подходить для этого подхода с учетом позднего обращения и бремени болезни. Чтобы расширить возможности пациентов и предложить лечение с лечебной целью, необходимо раннее выявление ПК до того, как разовьется значительная опухолевая нагрузка.
Таблица 1
CC — оценка полноты циторедукции
| Оценка полноты циторедукции | |
|---|---|
| Оценка | Размер самой большой послеоперационной остаточной опухоли |
| CC-0 | Нет видимой опухоли |
| CC-1 | Менее 0.25 см |
| CC-2 | Между 0,25 см и 2,5 см |
| CC-3 | > 2,5 см или сливной |
PCI является диагностической и прогностический инструмент, который представляет собой сумму баллов по тринадцати областям брюшной полости. Каждый получает оценку от 0 до 3 на основании самого большого размера опухоли в каждой области. Баллы варьируются от 0 до 39. Более высокие баллы указывают на более распространенные и / или более крупные опухоли в брюшной полости.
ИЗОБРАЖЕНИЕ
Традиционные методы визуализации, такие как КТ и МРТ, не обладают чувствительностью как для обнаружения, так и для оценки бремени болезни на ПК. Признаки классической компьютерной томографии (КТ) ПК, такие как «спекание сальника», утолщение сальника и узелки брюшины, не являются обычными рентгенографическими находками при «ранних» болезненных состояниях. Несколько исследований, разработанных для определения специфичности и точности компьютерной томографии при оценке опухолевой нагрузки на ПК, показали, что КТ значительно занижает количество заболеваний, присутствующих в брюшной полости [21–24].Сообщалось, что чувствительность КТ-обнаружения опухолевых узлов размером менее 0,5 см и 1 см составляет 11% и 25-50% соответственно [23]. Это особенно важно при колоректальном ПК, где ЧКВ является критическим фактором, определяющим полную циторедукцию и долгосрочные результаты [25]. В исследовании, проведенном Кохом и соавторами, изучавшим ПК при КРР, они определили, что КТ значительно недооценивает клиническое ЧКВ [23]. Фактически чувствительность поражения тонкой кишки в каждой области колебалась в пределах 8-17%. Несмотря на это, Пятый международный семинар по злокачественным новообразованиям брюшной полости в Милане определил КТ как основной метод визуализации для оценки пригодности для лечения СВК [26].Ультразвук также имеет очень ограниченную чувствительность для обнаружения узелков ПК [27–29]. В проспективных исследованиях было продемонстрировано, что магнитно-резонансная томография (МРТ) и, в частности, диффузно-взвешенные изображения имеют повышенную точность при обнаружении карциноматоза в определенных областях брюшной полости [30]. Однако это имеет свои ограничения из-за артефактов движения перистальтики, стоимости и необходимости радиологов, обученных их интерпретации и вариациям между наблюдателями. Кроме того, позитронно-эмиссионная технология (ПЭТ) может иметь повышенную чувствительность, но аналогичные ограничения и отсутствие дополнительной клинической ценности часто препятствуют ее использованию для определения резектабельности [24, 31–33].Эти трудности, особенно ограниченная чувствительность, отсутствие значимой клинической корреляции и высокая стоимость, снижают полезность неинвазивной визуализации для раннего обнаружения ПК. При современных технологиях для подтверждения диагноза и степени ПК часто требуется лапароскопия или диагностическая хирургия (см. Таблицу) [34].
Таблица 2
В этой таблице приведены плюсы и минусы каждого метода неинвазивной визуализации при оценке ПК
| Утилита неинвазивной визуализации при обнаружении ПК | ||||
|---|---|---|---|---|
| Модальность изображения | Плюсы | Минусы | Чувствительность / специфичность по сравнению с хирургическим анализом | Ссылки |
| Ультразвук | Недорогой, эффективный для обнаружения асцита | Ограниченная чувствительность узелков ПК, сильно зависит от оператора | Неспецифический [26] | [24] , 25] |
| CT | Стандартное промежуточное обследование | Ограниченная чувствительность узелков малого ПК, вариабельность между наблюдателями | 25–100% / 78–100% с чувствительностью только 11–48% для опухолей менее 5 мм [ 26] | [18–21] |
| МРТ | Высокая чувствительность ПК | Относительно дорого, слабая перистальтика артефакт, вариабельность между наблюдателями | 90% / 95.5% (взвешенный по диффузии) [26] | [28] |
| ПЭТ / ПЭТ-КТ | Высокая чувствительность ПК | Относительно дорого, Артефакт перистальтического движения | 78-97% / 55-90% [26 ] | [27, 28] |
ЖИДКАЯ БИОПСИЯ
Учитывая узкую подгруппу пациентов, которым предлагается CRS / HIPEC, потенциально спасающее жизнь лечение, мы нуждаемся в изменении парадигмы. Пациенты, которые либо подвержены риску развития ПК, либо находятся на самой ранней стадии этого болезненного процесса, могут значительно выиграть от расширенных вариантов лечения.Термин «жидкая биопсия» получил широкое распространение, поскольку крупномасштабные исследования направлены на выявление опухолевых маркеров в сыворотке крови. Обычно это относится к молекулярным диагностическим исследованиям, которые проводятся на крови или биологической жидкости, а не на самой раковой ткани [35]. Множественные сывороточные опухолевые маркеры: карциноэмбриональный антиген (CEA), углеводный антиген CA 19-9 и CA 125 обычно повышены у пациентов с ПК, и степень повышения имеет тенденцию коррелировать с распространением ПК [36]. Однако этих сывороточных онкомаркеров недостаточно для раннего выявления ПК.Более того, им не хватает специфичности для прогнозирования наличия или риска ПК у пациентов с CRC. Существует критическая клиническая потребность в идентификации циркулирующих опухолевых биомаркеров агрессивности, вероятности рецидива, риска метастазов, таких как ПК, или даже наличия злокачественного новообразования, чтобы лучше подбирать терапию для пациентов. Например, если известно, что у пациента с впервые диагностированным колоректальным раком III стадии существует значительный риск рецидива брюшной полости из-за наличия определенного набора биомаркеров в их сыворотке, он может получить пользу от профилактического HIPEC.Это лишь один пример того, как можно применить эту технологию.
Если обнаружены биомаркеры ПК с кровью, обладающие высокой чувствительностью и специфичностью, пациенты, у которых развивается ПК, могут быть быстро идентифицированы с помощью анализа крови, жидкой биопсии. Один такой тип биомаркера, микроРНК (miR), короткие некодирующие РНК, которые регулируют мРНК, продемонстрировал диагностическую полезность, правильно идентифицируя несколько видов рака неизвестной первичной с разумной точностью [37]. Диагностический профиль miR, который использовался в этом исследовании, был получен из анализа miR в хорошо дифференцированных первичных опухолях [37].Некоторые miR, такие как miR-21, были связаны с раком желудочно-кишечного тракта в качестве потенциальных диагностических целей и прогностических индикаторов [38]. Однако эти miRs и другие типы РНК быстро деградируют в плазме [39–41].
ЭКЗОСОМЫ
Экзосомы, везикулы, происходящие из мелких клеток (рисунок), могут защищать РНК и миРНК от деградации [42–46]. Когда исследователи подвергли miRs воздействию РНКазы, miR, находившиеся в экзосомах и клетках, были защищены, в то время как свободные РНК деградировали [42].Когда экзосомы подвергались действию РНКазы, содержащиеся в них РНК были защищены от деградации, в то время как клеточная РНК расщеплялась той же самой РНКазой [45]. Экзосомы обладают большим потенциалом как для диагностики, так и для прогноза заболеваний и исключительно полезны в качестве биомаркеров рака [47]. Когда панель miR, ассоциированных с раком легких, была исследована в солидных опухолях и опухолевых экзосомах из плазмы пациентов, было обнаружено, что большинство miR имеют очень сопоставимые уровни экспрессии (см. Таблицу miR) [48, 49]. Экзосомы (TEX), производные от опухолевой линии клеток рака шейки матки, содержат сурвивин, который способствует агрессивности рака и метастатическому потенциалу [50, 51].В исследовании рака яичников большее количество экзосом рака было обнаружено в сыворотке по мере изучения более поздних стадий рака [52]. Более того, примерно в четыре раза больше экзосом в сыворотке крови было обнаружено у пациентов с раком легкого по сравнению с контрольной группой без рака, и экзосомы содержали более чем в два раза больше miR [48]. В нашем исследовании мы обнаружили повышенные уровни экзосом в сыворотке крови у пациентов с раком простаты и груди по сравнению с контрольной группой, не имеющей заболевания [53–55]. TEX преобладают в сыворотке пациентов от нескольких типов рака и защищают лабильные биомаркеры от деградации [42, 45, 48, 53–55].
Опухолевые клетки высвобождают нанопузырьки, называемые экзосомами, которые несут РНК, включая микроРНК и информационные РНК, и белки
Таблица 3
Эти miR, связанные с раком легких, были обнаружены как в солидной опухоли, так и в экзосомах опухоли
| miR-17-3p | miR-21 | miR-106a | miR-146 | miR-155 | miR-191 |
| miR-192 | miR-203 | miR-205 | miR -210 | miR-212 | miR-214 |
Экзосомы не были широко изучены в диагностике ПК.Андре и его коллеги исследовали экзосомы асцита у пациентов с ПК и обнаружили, что опухолеспецифические маркеры Her2 / Neu, TRP1 и Mart1 присутствуют в экзосомах асцитных опухолей [56]. Tokuhisa с коллегами идентифицировали несколько РНК, присутствующих в экзосомах перитонеального асцита, перитонеального лаважа и метастатических клеточных линий PC [57]. После скрининга miR экзосом 5 miRNA были отобраны в качестве панели значительно дифференцированно регулируемых РНК: miR 1202, 1207-5p, 1225-5p, 320c и 4270 [57]. miR 21 имеет самую сильную интенсивность сигнала при злокачественном асците [57].Экзосомы из перитонеального лаважа исследовали на miR 21, 1225-5p и 320c; Было обнаружено, что miR 21 и 1225-5p активируются на более поздних стадиях рака желудка и коррелируют с серозной инвазией [57]. В исследовании ткани первичного рака желудка активность miR 1255-5p в целом подавлялась, и было обнаружено, что она ингибирует рост раковых клеток, их подвижность, а также инвазию рака [58]. Этот явно противоречивый результат предполагает, что miR 1225-5p в перитонеальном лаваже либо высвобождается незлокачественной тканью в попытке остановить аномальный рост, либо используется раком для облегчения лучшего прикрепления к брюшине.В явно противоречащих результатах вышеуказанному исследованию, в клеточных линиях рака желудка и in vivo , miR 1255-5p, как правило, подавлялась, и было обнаружено, что она ингибирует рост и подвижность клеток, а также инвазию рака [58].
Было обнаружено, что проспективные биомаркеры miR PC желудка, описанные в исследовании Tokuhisa с коллегами [57], также связаны с другими видами рака (см. Таблицу). Примечательно, что miR 1202, 1207-5p, 1225-5p и 4270 были обнаружены в крови больных раком груди [59].В образцах ткани рака мочевого пузыря человека уровень miR 320c был значительно подавлен [60]. В образцах ткани гепатоцеллюлярной карциномы было обнаружено, что miR 1207-5p значительно подавлена [61]. В образцах ткани карциномы надпочечников было обнаружено, что повышенная экспрессия miR 1202 связана со значительным сокращением продолжительности жизни пациентов [62]. Пробелы в наших знаниях о передаче сигналов РНК при раке сразу видны из таблицы. Наблюдение, что эти miRs, индивидуально или в группе, связаны с несколькими типами рака и обнаруживаются в экзосомах из брюшной полости, предполагает потенциал экзосомальной диагностики PC.
Таблица 4
Рак желудка PC-ассоциированные экзосомальные миРи и их распространенность при различных формах рака
| Рак желудка | Рак легких | Рак печени | Рак молочной железы | 3Рак предстательной железы | 3Рак молочной железы | 3Рак надпочечников | ||
|---|---|---|---|---|---|---|---|---|
| miR 1202 | ↔ злокачественный асцит, жидкость перитонеального лаважа, клеточная культура [52] | X | X | ↑ экзосомы сыворотки [54] | X | X | ↑ Ø опухолевая ткань [62] | |
| miR 1207-5p | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52], ↓ tNm опухолевой ткани [63], ↓ опухолевой ткани [64] | X | ↓ солидная опухоль [56] | ↑ экзосомы сыворотки [54] | ↑ сыворотка [65] | ↑ солидная опухоль [66] | X | |
| miR 1225-5p | ↑ tnM p жидкость эритонеального лаважа [52], ↓ раковая ткань [53] | X | ↓ кровь [67] | ↑ экзосомы сыворотки [54] | ↑ кровь [68], ↓ солидная опухоль [69] | ↓ солидная опухоль [70] | ↓ несколько типов солидных опухолей [71] | |
| miR 320c | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | ↓ солидная опухоль [72] | X | X | X | X | X | |
| miR 4270 | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | X | X | ↑ экзосомы сыворотки [54] | X | X | X |
РНК И РАК ЖЕЛУДКА
Было обнаружено, что при раке глобально подавляетсяРНК [37].Повышенная регуляция РНК и miR, вероятно, связана с ростом и функцией рака или реакцией организма на рак. miR 320c ингибирует рост и подвижность клеток при раке мочевого пузыря [60]. miR 1207-5p функционирует, чтобы ингибировать рост клеток и инвазию при раке печени, но функционирует для увеличения стволовости при колоректальном раке [61, 63]. Поскольку эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, появляется возможность индивидуального подхода к лечению ПК на основе того, какие биомаркеры обнаружены в экзосомах пациента.miR 320c ингибирует рост и подвижность клеток, а miR 1207-5p действует, ингибируя рост и инвазию клеток. Наблюдение за тем, что эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, открывает возможность использования этих биомаркеров для адаптации лечения отдельного пациента. [60, 61]
БУДУЩИЕ НАПРАВЛЕНИЯ
Для определения биомаркеров перитонеального карциноматоза необходимы дополнительные исследования. Отличить метастатическое заболевание перитонеального происхождения от метастазов в солидный орган должно быть как биологически возможным, так и клинически полезным.Поскольку мы обращаемся к экзосомам, чтобы получить представление об этой области, необходимо будет решить общие проблемы, связанные с изоляцией и валидацией нанопузырьков. Для клинического использования необходимо разработать надежные и эффективные методы, а также признанные стандарты. Будущая клиническая работа в этой области должна включать проспективный сбор образцов для ретроспективного исследования. Это будет способствовать установлению клинической валидности и полезности. Мы надеемся, что совместная работа многих продолжит приносить успехи в сокращении бремени жизни, потерянного в результате этого агрессивного недуга.
ВЫВОДЫ
Недавно, TEX были вовлечены в облегчение метастазирования. TEX могут поглощаться несколькими типами клеток, включая эндотелиальные клетки, клетки-предшественники костного мозга и другие раковые клетки [64–67]. Эти экзосомы продемонстрировали способность доставлять функциональные РНК и белки к реципиентным клеткам, модифицируя их паттерны роста, делая их проонкогенными [65, 66]. Кроме того, TEX продемонстрировали способность значительно увеличивать количество метастатических опухолей на модели мышей [64].Изучение TEX в контексте метастазирования — многообещающая область. ПК в настоящее время трудно обнаружить в самом начале. Позднее обнаружение ПК обычно оставляет болезнь неизлечимой. ПК должен быть обнаружен раньше для улучшения результатов лечения пациентов. Неинвазивная визуализация нецелесообразна для раннего обнаружения ПК. Обнаружение ПК с помощью маркеров в биожидкостях пациента, таких как «жидкая биопсия» сыворотки, было бы идеальным. И сыворотка, и асцит содержат биомаркеры, выделяемые ПК. Экзосомы попадают в сыворотку при многих типах рака и защищают свое содержимое от разложения в крови.Они предоставляют нам вероятный источник чувствительного и специфического диагностического метода для обнаружения ПК на самой ранней стадии, из которой он поддается лечению.
Благодарности
Авторы выражают благодарность Центру проблем здравоохранения и молекулярной медицины за его поддержку. Они также хотели бы поблагодарить сотрудников Wall Laboratory за внимательное рассмотрение этой рукописи.
Сноски
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ФИНАНСИРОВАНИЕ
Исследование, представленное в этой публикации, было поддержано наградой NIH P20MD006988 (NRW).
ССЫЛКИ
1. Леви А.Д., Шоу Дж. К., Собин Л. Х. Вторичные опухоли и опухолевидные поражения брюшной полости: особенности визуализации с патологической корреляцией. RadioGraphics. 2009; 29: 347–73. DOI: 10.1148 / rg.292085189. [PubMed] [CrossRef] [Google Scholar] 2. Садеги Б., Арвье С., Глеен О., Божар А.С., Ривуар М., Болье Дж., Фонтаумар Э., Браше А, Кайо Дж. Л., Фор Дж. Л., Поршерон Дж., Пейш Дж. Л., Франсуа И. и др.Карциноматоз брюшины от негинекологических злокачественных новообразований. Рак. 2000; 88: 358–63. DOI: 10.1002 / (SICI) 1097-0142 (20000115) 88: 2 <358 :: AID-CNCR16> 3.0.CO; 2-O. [PubMed] [CrossRef] [Google Scholar] 3. Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, Group tBIGR Пациенты с перитонеальным карциноматозом от рака желудка, леченные с помощью циторедуктивной хирургии и гипертермической интраперитонеальной терапии Возможность? Анналы хирургической онкологии.2016: 1–9. DOI: 10.1245 / s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar] 4. Сигел Р.Л., Миллер К.Д., Джемаль А. Статистика рака, 2016. CA Cancer J Clin. 2016; 66: 7–30. DOI: 10.3322 / caac.21332. [PubMed] [CrossRef] [Google Scholar] 5. Mekenkamp LJ, Koopman M, Teerenstra S, van Krieken JH, Mol L, Nagtegaal ID, Punt CJ. Клинико-патологические особенности и исходы у пациентов с запущенным колоректальным раком с синхронными и метахронными метастазами. Br J Рак. 2010 (103): 159–64. DOI: 10.1038 / sj.bjc.6605737.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Клавер Ю.Л., Лемменс В.Е., Ниенхейс С.В., Луйер, доктор медицинских наук, де Хинг IH. Карциноматоз брюшины колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012; 18: 5489–94. DOI: 10.3748 / wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Klaver CE, Musters GD, Bemelman WA, Punt CJ, Verwaal VJ, Dijkgraaf MG, Aalbers AG, van der Bilt JD, Boerma D, Bremers AJ, Burger JW, Buskens CJ, Evers P и др.Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у пациентов с раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. BMC Рак. 2015: 15. DOI: 10.1186 / s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Mitry E, Guiu B, Cosconea S, Jooste V, Faivre J, Bouvier AM. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишечник. 2010; 59: 1383–8. DOI: 10,1136 / гут.2010.211557. [PubMed] [CrossRef] [Google Scholar] 9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживаемость перитонеального карциноматоза от колоректального рака: популяционное исследование. Заболевания толстой и прямой кишки. 2015; 58: 743–52. DOI: 10.1097 / DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar] 10. Ян Т.Д., Цао С.К., Мункхольм-Ларсен С. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. Мир J Gastrointest Oncol.2010; 2: 109–16. DOI: 10.4251 / wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Гудман, доктор медицины, Макпартланд С., Детелич Д., Саиф М.В. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016; 7: 45–57. DOI: 10.3978 / j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстой кишки.Естествознание и презентация лечебного подхода к лечению. Dis Colon Rectum. 1987. 30: 772–9. [PubMed] [Google Scholar] 13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J. Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия с оксалиплатином для перитонеального карциноматоза кишечника. Журнал клинической онкологии. 2009. 27: 681–5. DOI: 10.1200 / JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar] 14.Franko J, Shi Q, Goldman CD, Pockaj BA, Nelson GD, Goldberg RM, Pitot HC, Grothey A, Alberts SR, Sargent DJ. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ исследований N9741 и N9841 группы лечения рака Северной Центральной группы III фазы. Журнал клинической онкологии. 2012; 30: 263–7. DOI: 10.1200 / JCO.2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H, Zoetmulder FA.Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака. Журнал клинической онкологии. 2003; 21: 3737–43. DOI: 10.1200 / JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar] 16. Chua TC. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010; 102: 728–9. DOI: 10.1002 / jso.21748. [PubMed] [CrossRef] [Google Scholar] 17.Sugarbaker PH. Успешное лечение микроскопической резидуальной болезни при раке толстой кишки. Химиотерапия и фармакология рака. 1999; 43: S15 – S25. DOI: 10.1007 / s002800051093. [PubMed] [CrossRef] [Google Scholar] 18. Хармон Р.Л., Шугарбейкер PH. Прогностические показатели при карциноматозе брюшины при раке желудочно-кишечного тракта. Международные семинары по хирургической онкологии. 2005; 2: 3. DOI: 10.1186 / 1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Verwaal VJ, van Ruth S, Witkamp A, Boot H, van Slooten G, Zoetmulder FA.Долгосрочная выживаемость при карциноматозе брюшины колоректального происхождения. Анналы хирургической онкологии. 2004; 12: 65–71. DOI: 10.1007 / s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar] 20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008. 98: 220–3. DOI: 10.1002 / jso.21060. [PubMed] [CrossRef] [Google Scholar] 21. Dromain C, Leboulleux S, Auperin A, Goere D, Malka D, Lumbroso J, Schumberger M, Sigal R, Elias D.Постановка перитонеального карциноматоза: усиленная КТ по сравнению с ПЭТ / КТ. Визуализация брюшной полости. 2007; 33: 87–93. DOI: 10.1007 / s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar] 22. Эскивель Дж., Чуа Т.К., Стоядинович А., Мелеро Дж. Т., Левин Э.А., Гутман М., Ховард Р., Писо П., Ниссан А., Гомес-Портилья А., Гонсалес-Байон Л., Гонсалес-Морено С., Шен П. и др. Точность и клиническая значимость интерпретации компьютерной томографии индекса рака брюшины при колоректальном раке перитонеальный карциноматоз: мультиинституциональное исследование.Журнал хирургической онкологии. 2010; 102: 565–70. DOI: 10.1002 / jso.21601. [PubMed] [CrossRef] [Google Scholar] 23. Ко Дж. Л., Ян Т. Д., Гленн Д., Моррис Д. Л.. Оценка предоперационной компьютерной томографии в оценке индекса рака брюшины при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008. 16: 327–33. DOI: 10.1245 / s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar] 24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса рака брюшины (ЧКВ) до операции у пациентов, рассматриваемых для циторедуктивных хирургических процедур.Анналы хирургической онкологии. 2015; 22: 1708–15. DOI: 10.1245 / s10434-014-4041-7. [PubMed] [CrossRef] [Google Scholar] 25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, получивших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. DOI: 10.1016 / j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar] 26. Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям брюшной полости (Милан, Италия, 4-6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям.Журнал хирургической онкологии. 2008. 98: 258–62. DOI: 10.1002 / jso.21056. [PubMed] [CrossRef] [Google Scholar] 27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М. М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Дж. М.. Полезность эндоскопической ультрасонографии в предоперационной стадии рака желудка: диагностическая ценность и терапевтическое влияние. Revista Española De Enfermedades Digestivas. 2010; 102: 413–20. [PubMed] [Google Scholar] 28. Savelli L, De Iaco P, Ceccaroni M, Ghi T, Ceccarini M, Seracchioli R, Cacciatore B.Трансвагинальные сонографические особенности перитонеального карциноматоза. Ультразвук в акушерстве и гинекологии. 2005; 26: 552–7. DOI: 10.1002 / uog.2587. [PubMed] [CrossRef] [Google Scholar] 30. Фенигер Дж., Томас С., Лендьель Э., Ляо К., Тенни М., Ото А., Ямада С.Д. Проспективное исследование по оценке диффузно-взвешенной магнитно-резонансной томографии (DW-MRI) в выявлении перитонеального карциноматоза при подозрении на гинекологические злокачественные новообразования. Gynecol Oncol. 2016; 142: 169–75. DOI: 10.1016 / j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar] 31.Де Вос Н., Геталс И., Селен В. Клиническая ценность (18) F-FDG-PET-CT в предоперационной стадии перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114: 370–5. [PubMed] [Google Scholar] 32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: внутриличностное сравнение 18F-FDG ПЭТ / КТ и МРТ. Визуализация брюшной полости. 2012; 38: 64–71. DOI: 10.1007 / s00261-012-9881-7.[PubMed] [CrossRef] [Google Scholar] 33. Low RN, Barone RM, Lacey C, Sigeti JS, Alzate GD, Sebrechts CP. Опухоль брюшины: МРТ с разбавленным пероральным барием и внутривенным введением контрастных веществ, содержащих гадолиний, по сравнению с неулучшенной МРТ и КТ. Радиология. 1997; 204: 513–20. DOI: 10.1148 / радиология.204.2.9240546. [PubMed] [CrossRef] [Google Scholar] 34. Йонемура Й, Канбай И, Эндоу И, Ишибаши Х, Мизумото А, Миура М, Ли И, Лю И, Такешита К., Ичиносе М, Такао Н., Хирано М, Сако С. и др. Лечение рака брюшины.Мнение эксперта по фармакотерапии. 2014; 15: 623–36. DOI: 10.1517 / 14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar] 35. Кин С., Кидесс Э., Поултсайдс Г.А., Виссер BC, Джеффри С.С. Диагностика рака прямой кишки: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью одноклеточного анализа. Экспертный обзор молекулярной диагностики. 2013; 13: 581–99. DOI: 10.1586 / 14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar] 36. Wagner PL, Austin F, Sathaiah M, Magge D, Maduekwe U, Ramalingam L, Jones HL, Holtzman MP, Ahrendt SA, Zureikat AH, Pingpank JF, Zeh HJ, Bartlett DL, et al.Значимость уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения. Анналы хирургической онкологии. 2013: 20. DOI: 10.1245 / s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 37. Лу Дж., Гетц Дж., Миска Е. А., Альварес-Сааведра Э., Лэмб Дж., Пек Д., Свит-Кордеро А., Эберт Б. Л., Мак Р. Х., Феррандо А. А., Даунинг Дж. Р., Джекс Т., Хорвиц Х. Р. и др. Профили экспрессии микроРНК позволяют классифицировать рак человека. Природа. 2005; 435: 834–8. DOI: 10,1038 / природа03702. [PubMed] [CrossRef] [Google Scholar] 38.Инь Ц., Чжоу X, Данг И, Ян Дж., Чжан Г. Потенциальная роль циркулирующего MiR-21 в диагностике и прогнозе рака пищеварительной системы: систематический обзор и метаанализ. Медицина (Балтимор) 2015; 94: e2123. DOI: 10.1097 / MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Чен Х, Ба И, Ма Л, Цай Х, Инь И, Ван К., Го Дж, Чжан И, Чен Дж, Го Х, Ли Кью, Ли Х, Ван В. и др. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний.Клеточные исследования. 2008; 18: 997–1006. DOI: 10.1038 / cr.2008.282. [PubMed] [CrossRef] [Google Scholar] 40. Митчелл П.С., Паркин Р.К., Крох Е.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Е.Л., Петерсон А., Нотабум Дж., О’Брайант К.С., Аллен А., Лин Д.В., Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры крови для обнаружения рака. Труды Национальной академии наук. 2008. 105: 10513–8. DOI: 10.1073 / pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Цуй Н.Б., Нг ЭК, Ло Ю.М.Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48: 1647–53. [PubMed] [Google Scholar] 42. Кога А., Аояги К., Имаидзуми Т., Мияги М., Широузу К. Сравнение между клеточной линией рака желудка MKN-45 и линией клеток с высоким потенциалом распространения перитонеального рака желудка MKN-45P. Медицинский журнал Куруме. 2011; 58: 73–9. DOI: 10.2739 / kurumemedj.58.73. [PubMed] [CrossRef] [Google Scholar] 43. Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, van Eijndhoven MA, Hopmans ES, Lindenberg JL, de Gruijl TD, Würdinger T, Middeldorp JM.Функциональная доставка вирусных miRNA через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6328–33. DOI: 10.1073 / pnas.0914843107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Ског Дж., Вурдингер Т., ван Рейн С., Мейер Д., Гайнче Л., Сена-Эстевес М., Карри В. Т., Картер Р. С., Кричевский А. М., Брейкфилд XO. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008; 10: 1470–6.DOI: 10,1038 / NCB1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Валади Х., Экстрём К., Боссиос А., Сьёстранд М., Ли Дж. Дж., Лётвалл Дж. Опосредованный экзосомами перенос мРНК и микроРНК является новым механизмом генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. DOI: 10,1038 / NCB1596. [PubMed] [CrossRef] [Google Scholar] 46. Ченг Л., Шарплз Р.А., Шиклуна Б.Дж., Хилл А.Ф. Экзосомы обеспечивают защитный и обогащенный источник miRNA для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью.J Внеклеточные везикулы. 2014; 3 DOI: 10.3402 / jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Рабиновиц Г., Герчель-Тейлор С., Дэй Дж. М., Тейлор Д. Д., Клоекер Г. Х. Экзосомальная микроРНК: диагностический маркер рака легких. Клинический рак легкого. 2009; 10: 42–6. DOI: 10.3816 / CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar] 49. Янаихара Н., Кэплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче С.М. и др. Уникальные молекулярные профили микроРНК в диагностике и прогнозе рака легких.Раковая клетка. 2006; 9: 189–98. DOI: 10.1016 / j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar] 50. Хан С., Аспе-младший, Асумен М.Г., Альмагуэль Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж WH, Уолл Н.Р. Внеклеточный, проницаемый для клеток сурвивин подавляет апоптоз, способствуя пролиферативному и метастатическому потенциалу. Br J Рак. 2009; 100: 1073–86. DOI: 10.1038 / sj.bjc.6604978. 6604978 [pii] [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Хан С., Джатзи Дж. М., Аспе Дж. Р., МакГрегор Д. В., Нейди Дж. В., Уолл Н. Р..Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16: 1–12. DOI: 10.1007 / s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Тейлор Д.Д., Герсель-Тейлор С. Сигнатуры микроРНК экзосом, полученных из опухоли, как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110: 13–21. DOI: 10.1016 / j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar] 53. Хан С., Беннит Х. Ф., Турай Д., Перес М., Миршахиди С., Юань Ю., Уолл Н. Р.. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке груди.BMC Рак. 2014; 14: 176. DOI: 10.1186 / 1471-2407-14-176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Хан С., Джутзи Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли МБ, Уолл Н. Р.. Экзосомальный сурвивин, полученный из плазмы, вероятный биомаркер для раннего выявления рака простаты. PLoS One. 2012; 7: e46737. DOI: 10.1371 / journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдиг Дж.В., Миршахиди С., Касиано, Калифорния, Уолл Н.Р.Протеомное профилирование экзосом, полученных из сыворотки крови у пациентов с раком простаты, различающихся по этническому признаку. Рак Инвест. 2016; 34: 1–11. DOI: 10.3109 / 07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Андре Ф., Шарц Н. Э., Мовассаг М., Фламент С, Полье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапосо Дж. И др. Злокачественные выпоты и экзосомы, происходящие из иммуногенных опухолей. Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar] 57. Токухиса М., Итикава Й, Косака Н., Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х, Кунисаки С., Эндо И.Экзосомальные миРНК из жидкости промывания брюшины как потенциальные прогностические биомаркеры перитонеальных метастазов при раке желудка. PLoS One. 2015; 10: e0130472. DOI: 10.1371 / journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W., Lin X. MicroRNA-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством репрессии субстрата-1 рецептора инсулина и активации β -катенин сигнализация. Oncotarget. 2015; 7: 4647–63.DOI: 10.18632 / oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Хамам Р., Али А.М., Альсале К.А., Кассем М., Альфаез М., Альдахмаш А., Аладжез Н.М. Профили экспрессии микроРНК у отдельных пациентов с раком груди позволяют идентифицировать новую панель циркулирующих микроРНК для раннего обнаружения. Научные отчеты. 2016; 6: 25997. DOI: 10,1038 / srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. MicroRNA-320c ингибирует опухолевое поведение при раке мочевого пузыря, воздействуя на циклин-зависимую киназу 6.Журнал экспериментальных и клинических исследований рака. 2014; 33: 69. DOI: 10.1186 / s13046-014-0069-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. MicroRNA-1207-5p ингибирует рост и инвазию клеток гепатоцеллюлярной карциномы через путь передачи сигналов Akt / mTOR, опосредованный синтазой жирных кислот. Отчеты онкологии. 2016; 36: 1709–1. DOI: 10.3892 / or.2016.4952. [PubMed] [CrossRef] [Google Scholar] 62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А, Зедениус Дж., Бекдал М., Ларссон С., Луи В.О.Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Эндокринный рак. 2011; 18: 643–55. DOI: 10.1530 / ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Фархана Л., Антаки Ф., Анес М.Р., Нангиа-Маккер П., Джадд С., Хадден Т., Леви Е., Муршед Ф., Ю Й, Ван Бурен Е., Ахмед К., Дайсон Г., Маджумдар А.П. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Онкологическая медицина. 2016; 5: 1268–78. DOI: 10.1002 / cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64.Хосино А., Коста-Силва Б., Шен Т.Л., Родригес Дж., Хашимото А., Тесич Марк М, Молина Х., Косака С., Ди Джаннатале А., Седер С., Сингх С., Уильямс К., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропные метастазы. Природа. 2015; 527: 329–35. DOI: 10,1038 / природа15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W., Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в ассоциированные с раком фибробласты.Кровь. 2015; 126: 1106–17. DOI: 10.1182 / кровь-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 66. Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, Garcia-Santos G, Ghajar C, Nitadori-Hoshino A, Hoffman C, Badal K, et al. Экзосомы меланомы приучают клетки-предшественники костного мозга к прометастатическому фенотипу посредством МЕТ. Nat Med. 2012; 18: 883–91. DOI: 10,1038 / нм 2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Biomed Res Int. 2014; 2014: 619829. DOI: 10.1155 / 2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Хуанг KH, Lan YT, Fang WL, Chen JH, Lo SS, Li AF, Chiou SH, Wu CW, Shyr YM. Корреляция между miRNA и метастазами в лимфатические узлы при раке желудка. BioMed Research International 2015. 2015 DOI: 10.1155 / 2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69.Chen L, Lü MH, Zhang D, Hao NB, Fan YH, Wu YY, Wang SM, Xie R, Fang DC, Zhang H, Hu CJ, Yang SM. miR-1207-5p и miR-1266 подавляют рост и инвазию рака желудка, воздействуя на обратную транскриптазу теломеразы. Смерть и болезнь клеток. 2014; 5: e1034. DOI: 10.1038 / cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрофлюидов определяет диагностические и прогностические сигнатуры микроРНК в сыворотках пациентов с раком простаты.Исследования рака. 2011; 71: 550–60. DOI: 10.1158 / 0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. MiR-20b, -21 и -130b подавляют экспрессию PTEN, что приводит к в сверхэкспрессии B7-h2 при распространенном колоректальном раке. Иммунология человека. 2014; 75: 348–53. DOI: 10.1016 / j.humimm.2014.01.006. [PubMed] [CrossRef] [Google Scholar] 72. Фрике А., Ульрих П.В., Хайнц Дж., Пфайфер Д., Шолбер Дж., Хергет Г.В., Хаушильд О., Бронсерт П., Старк Г.Б., Баннаш Х., Эйзенхардт С.У., Брейг Д.Идентификация передаваемой через кровь сигнатуры miRNA синовиальной саркомы. Молекулярный рак. 2015: 14. DOI: 10.1186 / s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальная диагностика доброкачественной гиперплазии предстательной железы и рака простаты на основе крови: miRNA как источник биомаркеров независимо от уровня PSA, шкалы Глисона, или статус TNM. Биология опухоли. 2016; 37: 10177–85. DOI: 10.1007 / s13277-016-4883-7.[PubMed] [CrossRef] [Google Scholar] 74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых miRNA рака простаты у китайских пациентов. BMC Genomics. 2013; 14: 757. DOI: 10.1186 / 1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Бартли А.Н., Яо Х., Барко Б.А., Иван К., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденома-аденокарцинома для микросателлитно-стабильного колоректального рака.Клинические исследования рака. 2011; 17: 7283–93. DOI: 10.1158 / 1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Веласкес-Фернандес Д., Карамута С., Озата Д.М., Лу М., Хёог А., Бэкдаль М., Ларссон С., Луи В.О., Зедениус Дж. Паттерны экспрессии микроРНК, связанные с гиперфункционирующими и негиперфункциональными фенотипами в адренокортикальных аденомах. Европейский журнал эндокринологии. 2014; 170: 583–91. DOI: 10.1530 / EJE-13-0817. [PubMed] [CrossRef] [Google Scholar] 77. Лэй Т., Чжу Й., Цзян Ц., Ван И, Фу Дж., Фан З, Цинь Х.МикроРНК-320 подавлялась при немелкоклеточном раке легкого и подавляла пролиферацию, миграцию и инвазию клеток, воздействуя на синтазу жирных кислот. Отчеты по молекулярной медицине. 2016; 14: 1255–62. DOI: 10.3892 / mmr.2016.5370. [PubMed] [CrossRef] [Google Scholar]Карциноматоз брюшной полости у женщин с раком груди в анамнезе
Цели: Цели этого исследования заключались в следующем: (1) охарактеризовать этиологию карциноматоза брюшной полости, (2) определить клинические признаки, позволяющие прогнозировать первичный рак яичников / брюшины, и (3) оценить влияние циторедуктивной хирургии на выживаемость у пациентов с поздними стадиями рака яичников / брюшины. рак и история рака груди.
Методы: Пациенты с анамнезом рака груди, подвергшиеся хирургическому обследованию по поводу карциноматоза брюшной полости в период с 01.01.88 по 31.12.02, были ретроспективно идентифицированы из баз данных регистра опухолей. Логистический регрессионный анализ использовался для изучения клинических характеристик, позволяющих прогнозировать первичный рак яичников / брюшины по сравнению с рецидивирующим раком груди. Анализ и сравнение выживаемости проводились с использованием моделей пропорциональных рисков Каплана-Мейера и Кокса.
Полученные результаты: Семьдесят девять пациентов перенесли операцию по поводу карциноматоза брюшной полости, в среднем через 5,39 года после первоначального диагноза рака груди. Карциноматоз брюшной полости был вызван первичным раком яичников / первичным раком брюшины в 74,7% случаев. История рака груди I стадии [OR = 10,73, 95% CI = 2,6-43,7, P <0,001] и отсутствие предшествующего рецидива рака груди [OR = 10.60, 95% ДИ = 2,5-45,2, P <0,001] независимо предсказывали первичный рак яичников / брюшины. Среди пациентов с первичным раком яичников / брюшины оптимальная (<или = 1 см) циторедуктивная операция была связана со средней выживаемостью 44,0 месяца по сравнению с 18,0 месяцами для пациентов с субоптимальной остаточной болезнью [HR = 6,81, 95% ДИ = 3,37-13,77 , P <0,0001]. Рецидив рака груди был связан со средней продолжительностью жизни 6,4 месяца.
Выводы: Среди пациентов с предшествующим раком молочной железы с карциноматозом брюшной полости ранняя стадия заболевания и отсутствие предшествующего рецидива были прогностическими факторами первичного рака яичников / брюшины.Оптимальная циторедуктивная хирургия была связана со значительным преимуществом выживаемости для пациентов с первичным раком яичников / брюшины.
У мужчины 67 лет развивается карциноматоз брюшины из-за рака желудка
21 августа 2012 г.
Читать 4 мин.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если у вас по-прежнему возникнет эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
67-летний мужчина с относительно хорошим здоровьем обратился в отделение неотложной помощи с болью в животе, тошнотой и рвотой.
В его медицинском анамнезе была значительная гипертензия, и он перенес колостомию с отклоняющейся петлей примерно за 6 месяцев до текущего обращения по поводу перфорированного дивертикулита.Колоноскопия и компьютерная томография брюшной полости, выполненные во время первичной операции, не показали никаких признаков злокачественности.
Он принимал прописанную подготовку кишечника для запланированного реверсирования колостомы, когда у него развились вышеупомянутые симптомы. Он также жаловался на дискомфорт в животе, несварение желудка и общее плохое самочувствие.
Осмотр и анализ крови без особенностей. У него заподозрили непроходимость кишечника, и была сделана компьютерная томография брюшной полости и таза с контрастированием (см. Рисунки).
КТ выявила непроходимость тонкой кишки высокой степени с коллапсом дистального отдела тонкой кишки и толстой кишки. Также было отмечено утолщение желудочно-пищеводного перехода, что указывает на возможность первичного поражения желудочно-пищеводного перехода и сливную лимфаденопатию в надчешневой области и над левым надпочечником.
Рис. 1. Рентгенограмма брюшной полости в вертикальном положении (слева) и снимок КТ (справа) демонстрируют тяжелую непроходимость тонкой кишки.
Источник: Ghesani M
Узелок в переднем сальнике выше справа от пупка, в правой надпузырной ямке и нижнем левом параколическом желобе, поднимает вопрос о метастатических имплантатах.
Рис. 2. Осевое КТ-изображение демонстрирует резкую точку перехода тонкой кишки в таз в области обширных узловых имплантатов мягких тканей (стрелки). В левой нижней части живота отмечается окончательная колостома.
Ему была сделана лапаротомия с лизисом спаек и паллиативная илеоколостомия с анастомозом тонкой кишки в надежде преодолеть тяжелую непроходимость кишечника.Во время операции у него были обнаружены обширные перитонеальные имплантаты с петлями тонкой кишки, спекшимися в тазу с опухолью. Биопсия ткани выявила низкодифференцированную аденокарциному, и дальнейшая операция была прервана, поскольку он не считался подходящим кандидатом для циторедукции из-за обширного перитонеального заболевания.
После операции ему была начата химиотерапия цисплатином и иринотеканом. Он прошел два курса химиотерапии и несколько раз был госпитализирован по разным причинам, включая диарею, инфекции и ухудшение симптомов непроходимости кишечника.Повторная компьютерная томография брюшной полости и таза снова показала признаки обширного прогрессирования заболевания, несмотря на химиотерапию. Он был зачислен в хоспис паллиативной помощи примерно через 2 месяца после постановки диагноза.
Обсуждение
Карциноматоз брюшины — наиболее частая вторичная опухоль, поражающая брюшную полость. Чаще всего встречается при раке желудочно-кишечного тракта и яичников. Распространенные опухоли желудочно-кишечного тракта включают желудок, толстую кишку и аппендикс, хотя также могут иметь место рак других органов желудочно-кишечного тракта, таких как печень, желчный пузырь и поджелудочная железа.
Рис. 3. Аксиальная КТ (слева) и КТ с переформатированием коронки (справа) демонстрируют лимфаденопатию, а также очаговое утолщение в гастроэзофагеальном соединении (стрелки), подозрительное на злокачественное первичное поражение.
К раку экстра-желудочно-кишечного тракта, который обычно метастазирует в брюшину и вызывает карциноматоз брюшины, относятся рак яичников, груди, легких и матки.
Рис. 4. Узелок в переднем сальнике, прилегающий к пупку (стрелка).Хорошо проявляются множественные растянутые петли тонкой кишки.
Поражение брюшины происходит путем внутрибрюшинного посева, прямой инвазии, гематогенного или лимфатического распространения. Общие клинические проявления включают тошноту, рвоту, боль в животе и непроходимость кишечника, и они могут указывать на запущенное заболевание.
Характерные патологические признаки перитонеального карциноматоза включают опухолевые узелки, покрывающие поверхность брюшины. По мере того, как опухоль проникает в ткани брюшины, может возникнуть фиброзный ответ, приводящий к тяжелому фиброзу и образованию классического спекания сальника.Это может привести к закупорке петель кишечника вместе с сальником, что может привести к серьезной непроходимости кишечника. Гистологически эти аденокарциномы обычно характеризуются обильным содержанием муцина или морфологией перстневых клеток.
Режимы визуализации
Наиболее часто используемые методы визуализации для оценки перитонеального карциноматоза — это компьютерная томография, МРТ и ПЭТ / КТ. КТ является обычным методом первичной визуализации, потому что это метод визуализации выбора для оценки пациентов с генерализованными абдоминальными расстройствами, и часто у пациентов с перитонеальным карциноматозом обычно проявляются нечеткие абдоминальные симптомы.
КТ-результаты перитонеального карциноматоза включают дискретные узелки на брюшине, инфильтративные образования и выпрямление сосудистой сети брыжейки, что создает складчатый вид, вторичный по отношению к фиброзу и инфильтрации опухоли. Обструкция тонкой кишки и асцит обычно связаны с карциноматозом брюшины и обычно заметны на КТ.
МРТ обеспечивает превосходный контраст мягких тканей, помогая лучше разграничивать, обнаруживать и прогнозировать опухолевую нагрузку при перитонеальном карциноматозе.ПЭТ / КТ предоставляет метаболическую информацию, которая позволяет идентифицировать злокачественные образования как гиперметаболические узелки / образования, вторичные по отношению к повышенному потреблению глюкозы тканью опухоли. Кроме того, ПЭТ / КТ также помогает определить другие места метастазирования.
Роль HIPEC
Традиционно карциноматоз брюшины считался терминальным заболеванием, и предлагалось паллиативное лечение. Однако с появлением циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии (HIPEC) появилась тенденция к увеличению выживаемости.
Индекс перитонеального карциноматоза Шугарбейкера обычно используется для оценки опухолевой нагрузки. Индекс колеблется от 0 до 39, а баллы ниже 20 связаны с благоприятным прогнозом. Циторедукция состоит из резекции брюшины (париетальной и висцеральной) всех областей, пораженных опухолью, оментэктомии и резекции других вовлеченных органов, в зависимости от ситуации, с целью оставить минимальную остаточную опухоль (обычно менее 1–2 см). ).
HIPEC включает доставку химиотерапии в брюшную полость сразу после операции при высоких температурах (40 ° C-43 ° C).Комбинация гипертермии и химиотерапии считается более эффективной для уменьшения опухолевой нагрузки. Наиболее распространенными агентами, применяемыми для HIPEC, являются цисплатин и митомицин C.
Заболеваемость карциноматозом брюшины при раке желудка составляет от 10% до 50%, особенно при поражении серозной оболочки.
Gill и его коллеги опубликовали обширный обзор литературы о роли HIPEC у пациентов с перитонеальным карциноматозом при раке желудка. Они сообщили, что средняя выживаемость составила 15 месяцев по сравнению с3 месяца среди пациентов, получивших наилучшую поддерживающую терапию. Роль системной химиотерапии у пациентов с перитонеальным карциноматозом при раке желудка четко не определена, но есть некоторые данные, позволяющие предположить улучшение общей выживаемости примерно до 7-10 месяцев.
HIPEC развивается как новый стандарт лечения пациентов с перитонеальным карциноматозом, и он четко продемонстрировал преимущество в выживаемости по сравнению с традиционными подходами.
Ссылки:
- Brücher BL. Рак Инвест . 2012; 30: 209-224.
- Gill RS. J Surg Oncol . 2011; 104: 692-698.
- Klumpp BD. Визуализация брюшной полости . 2012; DOI: 10.1007 / s00261-012-9881-7.
- Леви нашей эры. Рентгенография . 2009; 29: 347-373.
Для доп. Информации:
- Мунир Гесани, доктор медицины, лечащий врач-радиолог в Центре больницы Святого Луки-Рузвельта и Медицинском центре Бет Исраэль, адъюнкт-профессор радиологии Колледжа врачей и хирургов Колумбийского университета и редактор раздела HemOnc Today .Рангасвами Чинтапатла, доктор медицины, является научным сотрудником отделения гематологии и онкологии в больничном центре Святого Луки-Рузвельта. Майкл Томас Старк, доктор медицины, врач-рентгенолог в больничном центре Св. Луки-Рузвельта. Габриэль Сара, доктор медицины, работает в гематологическом / онкологическом центре больничного центра Святого Луки-Рузвельта. Раскрытие информации: Drs. Гесани, Чинтапатла, Старк и Сара не сообщают о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если у вас по-прежнему возникнет эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
ПЕРИТОНЕАЛЬНЫЙ МУЦИНОЗНЫЙ КАРЦИНОМАТОЗ | |||
АЛЬТЕРНАТИВНЫЕ НАИМЕНОВАНИЯ | Первичная злокачественная опухоль поверхности брюшины; Инвазивный муцинозный карциноматоз брюшины | ||
ОПИСАНИЕ | Муцинозный карциноматоз брюшины — редкий тип рака, поражающий слизистую оболочку. брюшной полости называется брюшиной.Это происходит, когда раковые клетки из других части тела, такие как аппендикс, толстая кишка, желчный пузырь, печень, прямая кишка или поджелудочная железа, метастазируют и имплантируют в подкладку брюшины. Это общая черта рака брюшной полости в терминальной стадии. | ||
ДИАГНОСТИЧЕСКИЕ ИСПЫТАНИЯ, ФИЗИЧЕСКИЕ РЕЗУЛЬТАТЫ И МКБ-9-СМ / МКБ-10-СМ КОДИРОВКА | Диагностическое обследование: компьютерная томография, показывающая утолщение брюшины и асцит. Физический Выводы: Клинические признаки этого заболевания включают:
МКБ-9: 197.6 МКБ-10: C48.2 | ||
ПРОГРЕССИЯ | Прогноз для людей с этим заболеванием плохой из-за распространения множественных раковых заболеваний. узелки из других органов в брюшину возникают на поздних стадиях заболевания. | ||
ЛЕЧЕНИЕ | Муцинозный карциноматоз брюшины — это запущенная форма рака, которую лечат агрессивно. чтобы предотвратить дальнейшее распространение рака.Лечение обычно включает хирургическое вмешательство. уменьшение массы тела с последующей химиотерапией. | ||
ПРЕДЛАГАЕМАЯ ПРОГРАММНАЯ ОЦЕНКА * | |||
Предлагаемый MER для оценки:
| |||
| Предлагаемые списки для Оценка: | |||
ОПРЕДЕЛЕНИЕ | ЛИСТИНГ | ЗАМЕЧАНИЯ | |
соответствует | 13.16 Б | Любой пораженный первичный рак брюшной полости, требующий метастазов за пределами региона лимфатические узлы соответствуют критериям, приведенным в листинге 13.16 B. Степень тяжести уровня списка должна быть задокументировано. | |
13,17 | Любой пораженный первичный рак брюшной полости, требующий метастазов за пределами региона лимфатические узлы соответствуют критериям, приведенным в листинге 13.17. Серьезность уровня листинга должна быть задокументирована. | ||
13,18 | Любой пораженный первичный рак брюшной полости, требующий метастазов за пределами региона лимфатические узлы соответствуют критериям листинга 13.18. Уровень серьезности листинга должен быть задокументирован. | ||
13.27 | Любой пораженный первичный рак брюшной полости, требующий метастазов за пределами региона лимфатические узлы соответствуют критериям листинга 13.27. Уровень серьезности листинга должен быть задокументирован. | ||
равно | 13.15 Б | Любые затронутые списки для сайтов, кроме первичного рака брюшной полости, затронутых первичным карцинома брюшины, в том числе 13,15 Б у мужчин. | |
13,23 E 1 | Любые затронутые списки сайтов, кроме первичного рака брюшной полости, затронутых первичным рак брюшины, в том числе 13.23 E 1 для женщин. | ||
* Судьи могут по своему усмотрению использовать медицинские свидетельства записи или листинги предложили оценить претензию. Однако решение разрешить или отрицать иск остается на рассмотрении арбитра. | |||
Метастазы в брюшину (рак брюшины) — NCIS
Брюшина — это мембрана, которая покрывает внутреннюю оболочку брюшной полости и лежащие в ней органы.Он поддерживает эти органы и содержит кровеносные сосуды и нервы, которые питают их. Пространство в брюшной полости, покрытое брюшиной, известно как брюшная полость (рис. 1).
Рис. 1: Брюшная полость
Метастазы возникают, когда рак распространяется с исходного места на другие части тела. Метастазы в брюшину относятся к раку, который распространился на брюшину из других органов. Когда рак распространяется из других органов, он считается запущенным и в большинстве случаев обозначает стадию болезни IV.
Раковые заболевания, которые развиваются из самой брюшины, например первичный рак брюшины или мезотелиома брюшины, очень редки.
Пациенты, страдающие раком преимущественно брюшной полости, таким как рак желудка (желудка), яичников, толстой кишки, аппендикса и поджелудочной железы, подвержены риску развития метастазов в брюшину. Реже другие виды рака также могут распространяться на брюшину.
Осложнения, связанные с метастазами в брюшину:
- Асцит: При метастазах в брюшину в брюшной полости выделяется жидкость, известная как асцит, которая вызывает вздутие живота (рис. 2).
- Кишечная непроходимость: метастазы в брюшину могут вызвать закупорку кишечника.
- Гидронефроз: мочеточники почек могут быть заблокированы перитонеальными метастазами. Это может повлиять на функцию почек.
Некоторые общие симптомы включают:
- Вздутие живота
- Боль в животе
- Тошнота и рвота
- Запор
- Потеря аппетита
- Потеря веса
* При появлении вышеуказанных симптомов следует обратиться к врачу.
Метастазы в брюшину развиваются по мере распространения рака. В настоящее время, помимо борьбы с исходным раком, мало что можно сделать для предотвращения перитонеальных метастазов. Пациентам, у которых наблюдаются указанные выше симптомы, следует обратиться за медицинской помощью для тщательного обследования.
Диагностика рака брюшины может быть сложной задачей. Для подтверждения диагноза метастазов в брюшину может потребоваться визуализация (например, КТ или МРТ), дренирование асцитической жидкости иглой для анализа, хирургия замочной скважины или их комбинация.
Метастазы в брюшину трудно поддаются лечению, и их лучше всего лечит многопрофильная бригада, в которую входят хирурги и медицинские онкологи.
- Системная химиотерапия: Химиотерапевтические препараты, вводимые внутривенно или иногда в комбинации с пероральными таблетками, циркулируют по всему телу. Этот вид лечения подходит для рака, который метастазировал в несколько частей тела.
- Циторедуктивная хирургия (CRS) с гипертермической внутрибрюшинной химиотерапией (HIPEC):
CRS — это обширная операция по удалению всех видимых раковых образований в брюшной полости.В конце CRS нагретый химиотерапевтический раствор наносится в брюшную полость, чтобы разрушить оставшиеся раковые клетки, которые не видны невооруженным глазом.
- Внутрибрюшинная (IP) химиотерапия: IP-химиотерапия (рис. 3) вводится в брюшную полость через внутрибрюшинный порт, который вводится с помощью хирургии замочной скважины. Порт заглублен под кожу и подключен к катетеру, который входит в перитонеальное пространство.
- Узнайте больше о клиническом испытании здесь
страница.
- Читайте о IP-химиотерапии в новостях
здесь.
Рисунок 3: Настройка IP-химиотерапии
Рисунок 4: Схема проведения химиотерапии внутрибрюшинным аэрозолем под давлением (PIPAC)
Видеодемонстрация лечения PIPAC
Видеогид, дающий общее представление о новом методе лечения рака брюшины с помощью химиотерапии с помощью внутрибрюшинной аэрозольной химиотерапии под давлением (PIPAC).
В NCIS пациентов с перитонеальными метастазами (перитонеальный рак) будет лечить многопрофильная команда. В эту команду входят онкологи, хирурги, радиологи, патологи, диетологи и другие медицинские работники. Пациенты обсуждаются на междисциплинарном совещании, чтобы гарантировать, что пациентам будут предложены лучшие варианты лечения. Многочисленные текущие исследовательские инициативы и испытания, проводимые в NCIS, позволяют нашим пациентам получить доступ к передовым методам лечения.
Бригаду по лечению рака брюшины в NCIS возглавляет профессор Джимми Со вместе со своей командой медицинских профессионалов.Команда стремится обеспечить бескомпромиссные и целенаправленные клинические исследования, опыт и помощь в профилактике, лечении и лечении рака брюшины.
Хирургия
Медицинская онкология
Патология
Радиология
Вопросы здоровья — Новый метод доставки лекарств для пациентов с запущенным раком
CNA938 взял интервью у доктора Кима Гуоуи, консультанта по хирургии, Желудочно-кишечная хирургия), который поделился, что процедура химиотерапии с помощью внутрибрюшинного аэрозоля под давлением (PIPAC) — это новый метод доставки противораковых лекарств, который был успешно внедрен в Сингапур в NUH и Национальном университетском институте рака Сингапура (NCIS).Этот новый подход к лечению рака потенциально может дать надежду пациентам с запущенным раком, которые страдают от множества побочных эффектов и по-прежнему плохо переносят обычную химиотерапию. NUH и NCIS проводят это новое лечение рака в Азии с декабря 2016 года.
NUH испытывает новую форму химиотерапии для пациентов на поздних стадиях
Новый метод доставки противораковых лекарств, который обеспечивает целенаправленное, более равномерное и большее проникновение в раковые клетки был успешно введен в Сингапур в NUH и Национальном университетском институте рака Сингапура (NCIS).Этот новый подход к лечению рака потенциально может дать надежду пациентам с запущенным раком, которые страдают от множества побочных эффектов и по-прежнему плохо переносят обычную химиотерапию.
Во главе с профессором Джимми Со, главой и старшим консультантом отделения общей хирургии Национального университета здравоохранения (хирургия верхних отделов желудочно-кишечного тракта), и доктором Йонг Вей Пенгом, старшим консультантом отделения гематологии-онкологии NCIS, NUH и NCIS, исследовали этот новый вид рака. лечение в Азии с декабря 2016 года.На сегодняшний день выполнено 49 процедур PIPAC 31 пациенту.
Пробное лечение рака желудка, продлевающее жизнь
Д-р Йонг Вэй Пэн, старший консультант, отделение гематологии-онкологии, NCIS, и профессор Джимми Со, руководитель отделения общей хирургии (хирургия верхних отделов желудочно-кишечного тракта) NUH были проинтервьюированы в двух исследованиях рака желудка . Первое — это продолжающееся исследование, в ходе которого химиотерапевтический препарат вводился непосредственно в брюшную полость пациентам с определенным типом рака желудка.Второе исследование, посвященное прецизионной медицине, показало, что оксалиплатин лучше действует у пациентов с кишечным подтипом, чем с диффузным подтипом. Участница первого испытания, госпожа Синди Чиа также поделилась своим опытом.
将 化疗 药水 导入 胃部 新 疗法 助 胃癌 延长 寿命
Морская полиция разработала новый метод лечения интраперитонеального Химиотерапия для больных раком желудка на поздней стадии. В рамках этой целевой во время лечения химиотерапия будет введена непосредственно в область желудка.Из 22 пациента, принявших участие в клиническом исследовании, более половины продолжительность жизни пациентов была увеличена более чем на 16 месяцев, что было сравнительно дольше, чем обычно от трех до шести месяцев для таких пациентов, проходящих традиционное лечение. Профессор Джимми Со, руководитель и старший консультант, Отделение хирургической онкологии NCIS дало интервью для этой эксклюзивной статьи.
Карциноматоз брюшины —
Карциноматоз брюшины — это тип рака, который возникает в брюшине.Брюшина представляет собой тонкую оболочку, которая покрывает большинство органов брюшной полости и выстилает брюшную полость. Когда рак распространяется из кишечника или прямой кишки и разрастается в слизистой оболочке брюшной полости, это называется перитонеальным карциноматозом.
Термины, используемые при карциноматозе брюшины
- Метастазы или метастазы: Распространение рака от одного органа или части тела к другому.
- Злокачественные новообразования на поверхности брюшины: Разнообразные виды рака, поражающие брюшину.
- Асцит: Накопление жидкости в брюшной полости.
- Циторедукционная хирургия и гипертермическая внутрибрюшинная химиотерапия (HIPEC): Хирургическая техника, используемая при лечении некоторых случаев перитонеального карциноматоза.
При лечении рака разные врачи часто работают вместе, чтобы составить общий план лечения пациента, который сочетает в себе разные виды лечения.Это называется мультидисциплинарной командой. Бригады по лечению рака включают в себя множество других специалистов в области здравоохранения, таких как фельдшеры, медсестры онкологов, социальные работники, фармацевты, консультанты, диетологи и другие.
Ваша команда будет работать с вами над созданием оптимального индивидуального плана обслуживания в зависимости от вашей ситуации. Это может быть любое из следующего:
- Обновленная визуализация: Сюда могут входить повторные компьютерные томограммы или другие формы визуализации, если текущая визуализация устарела.
- Патологическое обследование: Если у вас ранее была операция или биопсия в другой больнице, мы можем попросить отправить образец этой ткани в больницу Mount Sinai для проверки одним из наших патологов для подтверждения вашего диагноза.
- Наблюдение: Пациенты, у которых полностью или частично удален рак. Компьютерная томография будет выполняться по графику, установленному вашим хирургом для наблюдения.
- Системная химиотерапия: Этот тип химиотерапии попадает в кровоток и достигает раковых клеток по всему телу.Это можно сделать с помощью внутривенной (IV) трубки, которая вводится в вену с помощью иглы или в таблетке, которую нужно проглотить (перорально). Это может быть рекомендовано, если операция невозможна, или в качестве первого шага перед операцией.
- Лапароскопия: Операция, при которой в брюшной полости делают небольшие разрезы и вставляют камеру, чтобы заглянуть внутрь, чтобы оценить степень заболевания.
- Циторедуктивная хирургия с гипертермической внутрибрюшинной химиотерапией (CRS с HIPEC): Это очень специализированный хирургический метод, используемый при лечении некоторых случаев рака.Внутрибрюшинная химиотерапия — это химиотерапия, которая вводится непосредственно в брюшную полость. Обычно хирург пытается удалить как можно большую часть опухоли, а затем вставляет в брюшную полость трубку, через которую после операции можно проводить химиотерапию. Химиотерапию нагревают выше температуры тела, чтобы увеличить ее способность проникать в ткани, которые могут быть выстланы опухолевыми клетками; это называется гипертермической (или горячей) внутрибрюшинной химиотерапией (называемой HIPEC). После завершения химиотерапии трубку удаляют.Госпиталь Mount Sinai — один из немногих центров в Канаде, который предлагает это лечение.



