Хроническая цитомегаловирусная инфекция
Хронический цитомегаловирус — распространенная инфекция, которая характеризируется различными проявлениями. Заболевание может протекать без каких-либо симптомов или же сопровождаться тяжелыми формами поражений ЦНС или внутренних органов. Чтобы патология не обрела хронический характер, необходимо вовремя распознать ее и приступать к терапии. Особую опасность несет вирус для беременных женщин.
Почему обостряется цитомегаловирус?
Хроническая цитомегаловирусная инфекция может обостриться по разным причинам. Но ее симптоматика проявляется не сразу, а по истечении 50–60 суток. Чаще всего вирус начинает активизироваться после тесного общения с зараженным человеком. Такая инфекция выделяется во внешнюю среду с человеческими биологическими жидкостями. Сюда относят мочу, слюну, грудное молоко, кал, сперму и выделения из влагалища. У ребенка вирус проявляется в результате заражения от матери.
Чаще всего обострение заболевания происходит из-за ослабленного иммунитета.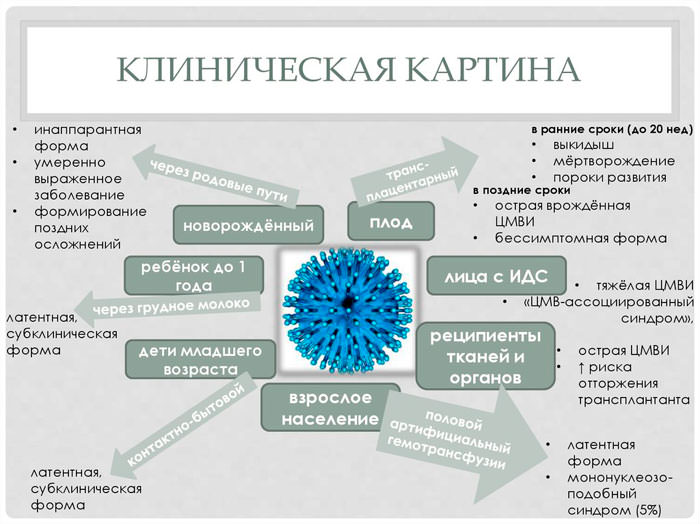
- пережитые заболевания и стрессы;
- продолжительное воздействие солнечных лучей;
- длительное переохлаждение организма;
- ведение беспорядочной половой жизни;
- наличие сомнительных контактов;
- несоблюдение правил питания, употребление продуктов, которые не содержат лизина (вещества, которое способствует борьбе с инфекцией).
Реактивация ЦМВ не произойдет, если постоянно укреплять иммунную систему, соблюдать дневной режим, больше времени проводить на свежем воздухе и полноценно отдыхать.
Как распознать симптоматику заболевания у женщин?
Хроническая форма цитомегаловируса может и не проявляться, если у человека нормальная иммунная система.
- повышенной температурой тела;
- ознобом;
- сильной и быстрой утомляемостью;
- общим недомоганием;
- постоянными головными болями.
Такой синдром наблюдается через 30–60 дней после обострения инфекции. У женщин с ослабленным иммунитетом хронический цитомегаловирус поражает глазные яблоки (снижает зрение), легкие, мозг и пищеварительную систему.
В результате весь этот комплекс недомоганий может привести к летальному исходу. Довольно часто реактивация вируса проявляется в виде лихорадки, мышечной боли и увеличения лимфоузлов. Заболевание исчезает только при наличии антител, которые вырабатывает организм. Иногда обострение вируса проявляется в форме кожной сыпи и воспалительных процессов в суставах.
При сильных нарушениях в работе иммунной системы, у женщин на фоне обострения недуга могут появиться различные осложнения:
- артрит;
- энцефалит;
- миокардит;
- пневмония;
- плеврит;
- вегетативно-сосудистые расстройства.
Довольно часто обострение такого недуга отображается на работе мочеиспускательного канала. Иногда проявляются болезненные ощущения в области влагалища, а также рецидив способен привести к эрозии шейки матки, воспалению яичников и внутреннего слоя матки.
Самым опасным считается обострение заболевания во время беременности. Это может серьезно отобразиться на здоровье будущего ребенка.
Симптоматика обострения заболевания у мужчины
Чаще всего хронический ЦМВ у представителей сильного пола находится в неактивной форме. Обычно он может обостриться по причине снижения работы иммунной системы. Организм сталкивается с этим только в стрессовых ситуациях, при нервных истощениях и простудных болезнях. Симптоматика цитомегаловируса у мужчин проявляется как:
Симптоматика цитомегаловируса у мужчин проявляется как:
- повышение температуры тела;
- озноб;
- боли в области головы;
- отечность слизистой оболочки носа;
- увеличение лимфоузлов;
- сыпь на дерме;
- сильный насморк.
Следует учитывать, что проявления болезни возникают только спустя 1,5 месяца после реактивации недуга и сохраняются на протяжении 4–6 недель. При критическом падении иммунитета симптоматика цитомегаловируса становится ярко выраженной. Она может проявляться как расстройства ЦНС и пневмония. В редких случаях одним из симптомов обострения инфекции может стать паралич, который образуется в тканях головного мозга. Иногда это приводит к летальному исходу.
Как проявляется хронический вирус при беременности и в чем его опасность?
Довольно часто реактивация цитомегаловируса происходит при беременности. Это случается по причине ослабления иммунной системы организма. Это явление считается очень опасным, поскольку отрицательно сказывается на здоровье будущего малыша.
В первую очередь вирус отображается на работе ЦНС ребенка. При беременности симптомы обострения ЦМВ проявляются в течение 2–3 дней после пережитого стресса или в результате простуды. Практически всегда наблюдается лихорадочное состояние, которое сопровождается ринореей и болезненными ощущениями в области мышц.
У представительниц слабого пола хронический цитомегаловирус сопровождается опуханием околоушных желез и наличием сильных выделений из влагалища, имеющих неприятный запах. Очень важно вовремя заметить обострение недуга, чтобы приступить к незамедлительной терапии.
Если цитомегаловирус поражает внутренние половые органы женщины, то это становится серьезной опасностью для нормального протекания беременности. Патология может вызвать преждевременное появление ребенка на свет или же спровоцировать выкидыш. Из-за хронического цитомегаловируса очень низкие шансы родить полноценного малыша. Иногда такие дети рождаются с недостатком в весе и отстают по другим показателям по сравнению со сверстниками.
Признаки поражения хронической инфекцией проявляются у ребенка на 2–4 году жизни. Заболевание будет сопровождаться развитием нарушений в функционировании головного мозга, у малыша могут наблюдаться проблемы с печенью и селезенкой. У инфицированных детей часто встречается глухота, эпилепсия, сильная мышечная боль.
Иногда из-за обострения хронического цитомегаловируса при беременности у ребенка могут появиться проблемы со здоровьем и в старшем возрасте (8–9 лет). К таким патологиям относят слепоту, невозможность нормально говорить, потерю слуха.
Как предупредить обострение ЦМВ?
В первую очередь следует снизить уровень воздействия обостряющихся факторов. Необходимо укреплять свою иммунную систему, ввести в привычный рацион большое количество фруктов, злаковых продуктов и белков. Также следует придерживаться здорового образа жизни и избегать незащищенных половых актов.
Очень важно соблюдать правила личной гигиены: есть только со своей посуды, вытираться собственным полотенцем и т. д. Огромное значение имеет спорт. Нужно стараться делать гимнастику по утрам, проводить больше времени на свежем воздухе. При малейших подозрениях на обострение хронического цитомегаловируса следует сразу же обращаться за помощью к специалисту.
д. Огромное значение имеет спорт. Нужно стараться делать гимнастику по утрам, проводить больше времени на свежем воздухе. При малейших подозрениях на обострение хронического цитомегаловируса следует сразу же обращаться за помощью к специалисту.
Если соблюдать эти простые правила, то можно не только облегчить симптомы ЦМВ, но и предотвратить их реактивацию.
| Постепенное развитие, длительная волнообразная лихорадка неправильного типа свыше 38,5С, слабость, сонливость, утомляемость, снижение аппетита, артралгии, миалгии, частые ОРВИ, бронхиты в том числе и обструктивные, лимфоаденопатии, реже спленомегалия, гепатомегалия, гепатит. Врожденная ЦМВИ, острая форма. Характер поражения зависит от сроков инфицирования. — При инфицировании на ранних сроках (первые 4-6 недель) возможны гибель плода, самопроизвольный выкидыш или формирование системной патологии, сходной с генетическими заболеваниями.  — При инфицировании в первые 3 месяца беременности возможно тератогенное воздействие на плод. — При инфицировании в более поздние сроки может быть врождённая ЦМВ-инфекция, не сопровождающаяся пороками развития. — анамнез матери: а) акушерская патология при предыдущей и настоящей беременности: преждевременные роды, выкидыши, угроза прерывания беременности, многоводие, гестоз, фетоплацентарная недостаточность. б) экстрагенитальная патология: субфебрилитет, лимфоаденопатия, ОРЗ или мононуклеозоподобный синдром, гепатоспленомегалия. | При врожденной ЦМВИ: тромбоцитопеническая пурпура, сенсоневральная тугоухость, желтуха, гепатоспленомегалия, микроцефалия, гипотрофия, недоношенность, гепатит, энцефалит, хориоретинит. У недоношенных, ослабленных детей с отягощенным перинатальным анамнезом клиническая манифестация ЦМВИ возможна уже к 3-5 недели жизни.  Наиболее часто при этом отмечается интерстициальная пневмония, возможно развитие затяжной желтухи, гепатоспленомегалии, анемии и других гематологических расстройств. Наиболее часто при этом отмечается интерстициальная пневмония, возможно развитие затяжной желтухи, гепатоспленомегалии, анемии и других гематологических расстройств.Врождённая ЦМВИ, хроническая форма: волнообразное течение хронической формы внутриутробной ЦМВИ наблюдается у части, перенесших острую форму заболевания. При инфицировании в первые месяцы беременности степень выраженности патологических изменений широко варьирует. Часто при этом формируются врождённые пороки развития — косолапость, глухота, деформация нёба, микроцефалия. Поражение печени может протекать в виде хронического гепатита. Изменения в лёгких характеризуются развитием пневмосклероза и фиброза. Приобретенная форма ЦМВИ: мононуклеоз, «ОРЗ» — подобные заболевания, ЧБД, длительный субфебрилитет, интерстициальная пневмония, плеврит, гепатит, панкреатит, интерстициальный нефрит (микропротеинурия, микрогематурия, абактериальная лейкоцитурия) редко – нефротический синдром, ретинит, иридоциклит, увеит (потеря зрения), энтероколит, васкулит, поражение ЦНС – вентрикулит, миелит, полинейропатии, полирадикулопатии, синдром Гийена-Барре (парезы и параличи демиелинизирующего генеза, миокардиты, кардиты, анемия, лейкопения, нейтропения, тромбоцитопения (панцитопении на фоне поражения костного мозга). |
Цитомегаловирусная инфекция. Цитомегаловирус. Симптомы, диагностика, лечение и профилактика
Цитомегаловирусная инфекция (ЦМВИ, или цитомегалия) — хроническая антропонозная болезнь вирусного происхождения, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания.
Коды по МКБ -10
В25. Цитомегаловирусная болезнь.
В27.1. Цитомегаловирусный мононуклеоз.
Р35.1. Врождённая цитомегаловирусная инфекция.
В20.2. Болезнь, вызванная ВИЧ, с проявлениями цитомегаловирусного заболевания.
Этиология (причины) цитомегаловирусной инфекции
В классификации вирусов возбудитель ЦМВИ под видовым названием Cytomegalovirus hominis отнесён к семейству Herpesviridae, подсемейству Betaherpesviridae, роду Cytomegalovirus.
Особенности ЦМВ:
— крупный ДНК-геном;
— невысокая цитопатогенность в культуре клеток;
— медленная репликация;
— низкая вирулентность.
Вирус инактивируется при температуре 56 °C, длительно сохраняется при комнатной температуре, быстро инактивируется при замораживании до –20 °C. ЦМВ слабо чувствителен к действию интерферона, не восприимчив к антибиотикам. Зарегистрировано 3 штамма вируса: AD 169, Davis и Kerr.
Эпидемиология цитомегаловирусной инфекции
Цитомегалия — широко распространённая инфекция. Доля серопозитивных лиц среди взрослого населения Российской Федерации составляет 73–98%. Показатель заболеваемости ЦМВИ по стране в 2003 г. составил 0,79 на 100 000 населения, причём у детей в возрасте до 1 года — 11,58; 1–2 лет — 1,01; 3–6 лет — 0,44 на 100 000. В Москве в 2006 г. показатель заболеваемости ЦМВИ был равен 0,59 на 100 000 населения, у детей в возрасте до 14 лет 3,24; а среди взрослого населения — 0,24 на 100 000 человек.
Источник возбудителя инфекции — человек. Цитомегаловирусная инфекция характеризуется состоянием длительного латентного носительства вируса с его периодическим выделением в окружающую среду. Вирус может находиться в любой биологической жидкости, а также в органах и тканях, используемых для трансплантации. У 20–30% здоровых беременных женщин цитомегаловирус присутствует в слюне, 3–10% — в моче, 5–20% в цервикальном канале или вагинальном секрете. Вирус обнаруживают в грудном молоке 20–60% серопозитивных матерей. Около 30% мужчин-гомосексуалистов и 15% мужчин, вступающих в брак, имеют вирус в сперме. Кровь около 1% доноров содержит ЦМВ.
Пути заражения. Заражение возможно половым, парентеральным, вертикальным путями, а также контактно-бытовым путём, который обеспечивается аэрозольным механизмом передачи возбудителя через слюну при близких контактах.
Цитомегаловирусная инфекция — классическая врождённая инфекция, частота которой составляет 0,3–3% среди всех родившихся младенцев. Риск антенатального заражения плода при первичной ЦМВИ у беременных составляет 30–40%. При реактивации вируса, возникающей у 2–20% матерей, риск заражения ребёнка значительно ниже (0,2–2% случаев). Интранатальное инфицирование ребёнка при наличии ЦМВ в генитальном тракте у беременных женщин происходит в 50–57% случаев. Основной путь заражения ребёнка в возрасте до года — передача вируса через грудное молоко.
Дети серопозитивных матерей, дети, находящиеся на грудном вскармливании более одного месяца, становятся инфицированными в 40–76% случаев. Следовательно, до 3% среди всех новорождённых заражаются ЦМВ в период внутриутробного развития, 4–5% — интранатально; к первому году жизни количество инфицированных детей составляет 10–60%. Контактно-бытовой путь передачи вируса у детей младшего возраста играет существенную роль. Инфицированность цитомегаловирусной инфекцией детей, посещающих детские дошкольные учреждения, достоверно выше (80% случаев), чем «домашних» воспитанников того же возраста (20%). Количество серо- позитивных лиц увеличивается с возрастом. Около 40–80% подростков и 60–100% взрослого населения имеют антитела класса IgG к ЦМВ. Заражение взрослого человека ЦМВ наиболее вероятно половым путём, также при гемотрансфузиях и парентеральных манипуляциях. Переливание цельной крови и её компонентов, содержащих лейкоциты, ведёт к передаче вируса с частотой 0,14–10 на 100 доз.
Велика опасность развития тяжёлого заболевания при повторных переливаниях крови от серопозитивных доноров новорождённым, особенно недоношенным.
Клинически выраженная ЦМВИ — одно из самых частых и серьёзных инфекционных осложнений при трансплантации органов. Около 75% реципиентов имеют лабораторные признаки активной цитомегаловирусной инфекции в первые 3 мес после трансплантации.
У 5–25% больных, перенёсших пересадку почек или печени, 20–50% больных после аллогенной трансплантации костного мозга, 55–75% реципиентов лёгких и/или сердца развивается заболевание ЦМВ-этиологии, цитомегаловирусная инфекция значительно повышает риск отторжения трансплантата. Манифестная инфекция занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов и наблюдается у 20–40% больных СПИДом, не получающих ВААРТ, и у 3–7% больных ВИЧ-инфекцией при её назначении. Развитие тяжёлой цитомегаловирусной инфекции описано у онкогематологических больных, пациентов, страдавших пневмоцистной пневмонией, туберкулёзом, лучевой болезнью, ожоговой травмой, у лиц, находящихся на длительной кортикостероидной терапии, перенёсших различные стрессовые ситуации. Цитомегаловирус может быть причиной посттрансфузионных и хронических гепатитов, разнообразной гинекологической патологии. Предполагается роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, атеросклероза хронических диссеминированных заболеваний лёгких, криоглобулинемии, опухолевых процессов, атеросклероза, детского церебрального паралича, эпилепсии, синдрома Гийена–Барре, синдрома хронической усталости. Сезонность, вспышки и эпидемии не характерны для заболевания, связанного с цитомегаловирусной инфекцией.
Патогенез цитомегаловирусной инфекции
Решающим условием для развития антенатальной ЦМВИ выступает виремия у матери. Наличие вируса в крови ведёт к инфицированию плаценты, её поражению и заражению плода с возможными последствиями в виде пороков и задержки внутриутробного развития, патологического процесса с поражением внутренних органов, в первую очередь центральной нервной системы. При наличии вируса в канале шейки матки беременной женщины возможен восходящий (трансцервикальный) путь заражения плода без выхода возбудителя в кровь. Реактивация цитомегаловируса в эндометрии — один из факторов ранних абортов. Интранатальное заражение вирусом происходит при прохождении плода через инфицированные родовые пути за счёт аспирации содержащих цитомегаловирус околоплодных вод и/или секретов родовых путей или через повреждённые кожные покровы и также может приводить к развитию клинически выраженного заболевания. При постнатальной цитомегаловирусной инфекции входными воротами для возбудителя служат слизистые оболочки ротоглотки, дыхательной системы, пищеварительного и генитального трактов. После преодоления вирусом входных ворот и его локального размножения наступает кратковременная виремия, моноциты и лимфоциты переносят вирус к различным органам. Несмотря на клеточный и гуморальный ответ, цитомегаловирус индуцирует хроническую латентную инфекцию.
Резервуаром вирусных частиц служат моноциты, лимфоциты, эндотелиальные и эпителиальные клетки. В дальнейшем при незначительной иммуносупрессии возможна «местная» активизация ЦМВИ с выделением вируса из носоглотки или урогенитального тракта. В случае глубоких иммунологических нарушений при наследственной предрасположенности к данной патологии происходят возобновление активной репликации вируса, виремия, диссеминация возбудителя, развитие клинически выраженного заболевания. Активность вирусной репликации, риск манифестации цитомегаловирусной инфекции, тяжесть её течения во многом определяются глубиной иммуносупрессии, прежде всего, уровнем снижения количества СD4-лимфоцитов в крови.
С ЦМВИ связан широкий спектр органных поражений: лёгких, пищеварительного тракта, надпочечников, почек, головного и спинного мозга, сетчатки глаза. У иммуносупрессивных больных ЦМВИ посмертно выявляют фиброателектаз лёгких, иногда с кистами и инкапсулированными абсцессами; эрозивно-язвенное с выраженным фиброзом подслизистого слоя поражение пищевода, толстой кишки, реже желудка и тонкой кишки; массивный, часто двусторонний некроз надпочечников; энцефаловентрикулит, некротическое поражение спинного мозга, сетчатки глаза с развитием некротического ретинита. Специфичность морфологической картины при ЦМВИ определяют крупные цитомегалоклетки, лимфогистиоцитарные инфильтраты, а также продуктивно-инфильтративные панваскулиты с цитомегалическим превращением клеток всех стенок мелких артерий и вен с исходом в склерозирование. Подобное поражение сосудов служит основой для тромбообразования, приводит к хронической ишемии, на фоне которой развиваются деструктивные изменения, сегментарные некрозы и язвы, выраженный фиброз. Распространённый фиброз — характерная особенность ЦМВ-поражения органа. У большинства больных патологический процесс, связанный с ЦМВ, носит генерализованный характер.
Клиническая картина (симптомы) цитомегаловирусной инфекции
Инкубационный период при заражении ЦМВ составляет 2–12 нед.
Классификация
Общепринятой классификации ЦМВИ не существует. Целесообразна следующая классификация заболевания.
• Врождённая ЦМВИ:
— бессимптомная форма;
— манифестная форма (цитомегаловирусная болезнь).
• Приобретённая ЦМВИ.
— Острая ЦМВИ.
– бессимптомная форма;
– цитомегаловирусный мононуклеоз;
– манифестная форма (цитомегаловирусная болезнь).
— Латентная ЦМВИ.
— Активная ЦМВИ (реактивация, реинфекция):
– бессимптомная форма;
– ЦМВ-ассоциированный синдром;
– манифестная форма (цитомегаловирусная болезнь).
Основные симптомы цитомегаловирусной инфекции
При врождённой ЦМВИ характер поражения плода зависит от срока заражения. Острая цитомагалия у матери в первые 20 недель беременности может привести к тяжёлой патологии плода, результатом которой становятся самопроизвольный выкидыш, внутриутробная гибель плода, мёртворождение, пороки, в большинстве случаев несовместимые с жизнью. При заражении цитомегаловирусом в поздние сроки беременности прогноз для жизни и нормального развития ребёнка более благоприятен.
Клинически выраженная патология в первые недели жизни имеет место у 10–15% инфицированных ЦМВ новорождённых. Для манифестной формы врождённой цитомегаловирусной инфекции характерны гепатоспленомегалия, стойкая желтуха, геморрагическая или пятнисто-папулёзная сыпь, выраженная тромбоцитопения, повышение активности АЛТ и уровня прямого билирубина в крови, повышенный гемолиз эритроцитов.
Дети часто рождаются недоношенными, с дефицитом массы тела, признаками внутриутробной гипоксии. Характерна патология ЦНС в виде микроцефалии, реже гидроцефалии, энцефаловентрикулита, судорожного синдрома, снижения слуха. Цитомегаловирусная инфекция — основная причина врождённой глухоты. Возможны энтероколит, фиброз поджелудочной железы, интерстициальный нефрит, хронический сиалоаденит с фиброзом слюнных желёз, интерстициальная пневмония, атрофия зрительного нерва, врождённая катаракта, а также генерализованное поражение органов с развитием шока, ДВС-синдрома и смерти ребёнка. Риск летального исхода в первые 6 нед жизни новорождённых с клинически выраженной ЦМВИ составляет 12%. Около 90% выживших детей, страдавших манифестной ЦМВИ, имеют отдалённые последствия заболевания в виде снижения умственного развития, нейросенсорной глухоты или двустороннего снижения слуха, нарушения восприятия речи при сохранении слуха, судорожного синдрома, парезов, снижения зрения.
При внутриутробном заражении цитомегаловирусом возможна бессимптомная форма инфекции с низкой степенью активности, когда вирус присутствует только в моче или слюне, и высокой степенью активности, если вирус определяют в крови. В 8–15% случаях антенатальная ЦМВИ, не проявляясь яркой клинической симптоматикой, ведёт к формированию поздних осложнений в виде ухудшения слуха, снижения зрения, судорожных расстройств, задержки физического и умственного развития. Фактором риска развития заболевания с поражением ЦНС служит стойкое наличие в цельной крови ДНК ЦМВ в период от момента рождения ребёнка до 3 мес жизни. Дети с врождённой ЦМВИ должны находиться под медицинским наблюдением в течение 3–5 лет, так как нарушение слуха может прогрессировать в первые годы жизни, а клинически значимые осложнения — сохраняться и через 5 лет после рождения.
При отсутствии отягощающих факторов интранатальная или ранняя постнатальная ЦМВИ протекает бессимптомно, проявляется клинически лишь в 2–10% случаях, чаще в виде пневмонии. У недоношенных ослабленных детей с низким весом при рождении, заражённых цитомегаловирусом во время родов или в первые дни жизни путём гемотрансфузий, уже к 3–5-й недели жизни развивается генерализованное заболевание, проявлениями которого служат пневмония, затяжная желтуха, гепатоспленомегалия, нефропатия, поражение кишечника, анемия, тромбоцитопения. Заболевание носит длительный рецидивирующий характер.
Максимальная летальность от ЦМВИ приходится на возраст 2–4 мес.
Клиническая картина приобретённой цитомегаловирусной инфекции у детей старшего возраста и взрослых зависит от формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей заражения, наличия и степени выраженности иммуносупрессии. Первичное инфицирование цитомегаловирусом иммунокомпетентных лиц обычно протекает бессимптомно и лишь в 5% случаев в виде мононуклеозоподобного синдрома, отличительными признаками которого выступают высокая лихорадка, выраженный и длительный астенический синдром, в крови — относительный лимфоцитоз, атипичные лимфоциты. Ангина и увеличение лимфатических узлов не характерны. Заражение вирусом путём гемотрансфузий или при трансплантации инфицированного органа приводит к развитию острой формы заболевания, включающего высокую лихорадку, астению, боли в горле, лимфаденопатию, миалгию, артралгию, нейтропению, тромбоцитопению, интерстициальную пневмонию, гепатит, нефрит и миокардит. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием вируса в организме человека. Развитие иммуносупрессии ведёт к возобновлению репликации ЦМВ, появлению вируса в крови и возможной манифестации заболевания. Повторное попадание вируса в организм человека на фоне иммунодефицитного состояния также может быть причиной виремии и развития клинически выраженной ЦМВИ. При реинфекции манифестация ЦМВИ происходит чаще и протекает более тяжело, чем при реактивации вируса.
Для ЦМВИ у иммуносупрессивных лиц характерно постепенное в течение нескольких недель развитие заболевания, появление симптомов-предвестников в виде быстрой утомляемости, слабости, потери аппетита, значительного снижения веса, длительной волнообразной лихорадки неправильного типа с подъёмами температуры тела выше 38,5 °C, реже — потливости по ночам, артралгии и миалгии.
Данный комплекс симптомов носит название «ЦМВ-ассоциированный синдром».
У детей младшего возраста начало заболевания может протекать без выраженного начального токсикоза при нормальной или субфебрильной температуре.
С ЦМВИ связан широкий спектр органных поражений, одними из первых страдают лёгкие. Появляется постепенно усиливающийся сухой или малопродуктивный кашель, умеренная одышка, нарастают симптомы интоксикации. Рентгенологические признаки лёгочной патологии могут отсутствовать, но в период разгара болезни часто на фоне деформированного усиленного лёгочного рисунка определяют двусторонние мелкоочаговые и инфильтративные тени, расположенные преимущественно в средних и нижних отделах лёгких. При несвоевременной постановке диагноза возможно развитие ДН, РДС и летальный исход. Степень поражения лёгких у больных ЦМВИ варьирует от минимально выраженной интерстициальной пневмонии до распространённого фиброзирующего бронхиолита и альвеолита с формированием двустороннего полисегментарного фиброза лёгких.
Нередко вирус поражает пищеварительный тракт. Цитомегаловирус — основной этиологический фактор язвенных дефектов пищеварительного тракта у больных ВИЧ-инфекцией. Типичными признаками ЦМВ-эзофагита выступают лихорадка, загрудинная боль при прохождении пищевого комка, отсутствие эффекта противогрибковой терапии, наличие неглубоких округлых язв и/или эрозий в дистальном отделе пищевода. Поражение желудка характеризуется наличием острых или подострых язв. Клиническая картина ЦМВ-колита или энтероколита включает диарею, стойкие абдоминальные боли, болезненность толстой кишки при пальпации, значительное снижение массы тела, выраженную слабость, повышение температуры. Колоноскопия выявляет эрозии и изъязвления слизистой оболочки кишки. Гепатит — одна из основных клинических форм ЦМВИ при трансплацентарном заражении ребёнка, у реципиентов после пересадки печени, больных, инфицированных вирусом во время гемотрансфузий. Особенность поражения печени при ЦМВИ — частое вовлечение в патологический процесс желчных путей. ЦМВ-гепатит характеризуется мягким клиническим течением, но при развитии склерозирующего холангита возникают боли в верхней части живота, тошнота, диарея, болезненность печени, повышение активности ЩФ и ГГТТ, возможен холестаз.
Поражение печени носит характер гранулематозного гепатита, в редких случаях наблюдают выраженный фиброз и даже цирроз печени. Патология поджелудочной железы у больных ЦМВИ обычно протекает бессимптомно или со стёртой клинической картиной при повышении концентрации амилазы в крови. Высокой чувствительностью к ЦМВ обладают клетки эпителия мелких протоков слюнных желёз, преимущественно околоушных. Специфические изменения в слюнных железах при ЦМВИ у детей встречаются в подавляющем большинстве случаев. Для взрослых больных ЦМВИ сиалоаденит не характерен.
Цитомегаловирус — одна из причин патологии надпочечников (часто у больных ВИЧ-инфекцией) и развития вторичной надпочечниковой недостаточности, проявляющейся стойкой гипотонией, слабостью, похуданием, анорексией, нарушением работы кишечника, рядом психических отклонений, реже — гиперпигментацией кожи и слизистых. Наличие у больного ДНК ЦМВ в крови, а также стойкой гипотонии, астении, анорексии требует определения уровня калия, натрия и хлоридов в крови, проведения гормональных исследований для анализа функциональной активности надпочечников. ЦМВ-адреналит характеризуется первоначальным поражением мозгового слоя с переходом процесса на глубокие, а в дальнейшем — и на все слои коры.
Манифестная ЦМВИ нередко протекает с поражением нервной системы в виде энцефаловентрикулита, миелита, полирадикулопатии, полинейропатии нижних конечностей. Для ЦМВ-энцефалита у больных ВИЧ-инфекцией характерны скудная неврологическая симптоматика (непостоянные головные боли, головокружение, горизонтальный нистагм, — парез глазодвигательного нерва, невропатии лицевого нерва), но выраженные изменения в психическом статусе (личностные изменения, грубые нарушения памяти, снижение способности к интеллектуальной деятельности, резкое ослабление психической и двигательной активности, нарушение ориентировки в месте и времени, анозогнозии, снижение контроля за функцией тазовых органов). Мнестико-интеллектуальные изменения нередко достигают степени деменции. У детей, перенёсших ЦМВ-энцефалит, также выявляют замедление психического и умственного развития.
Исследования спинно-мозговой жидкости (СМЖ) показывают повышенное количество белка, отсутствие воспалительной реакции или мононуклеарный плеоцитоз, нормальное содержание глюкозы и хлоридов. Клиническая картина полинейропатии и полирадикулопатии характеризуется болевым синдромом в дистальных отделах нижних конечностей, реже в поясничной области в сочетании с чувством онемения, парастезией, гиперестезией, каузалгией, гиперпатией. При полирадикулопатии возможен вялый парез нижних конечностей, сопровождающийся снижением болевой и тактильной чувствительности в дистальных отделах ног. В СМЖ больных полирадикулопатией выявляют повышение содержания белка, лимфоцитарный плеоцитоз.
Цитомегаловирусу принадлежит ведущая роль в развитии миелита у ВИЧ-инфицированных пациентов. Поражение спинного мозга носит диффузный характер и выступает поздним проявлением ЦМВИ. В дебюте заболевание имеет клиническую картину полинейропатии или полирадикулопатии, в дальнейшем, в соответствии с преимущественным уровнем поражения спинного мозга, развиваются спастическая тетраплегия или спастический парез нижних конечностей, появляются пирамидные знаки, значительное снижение всех видов чувствительности, в первую очередь в дистальных отделах ног; трофические нарушения. Все больные страдают грубыми расстройствами функции тазовых органов, в основном, по центральному типу. В СМЖ определяют умеренное повышение содержания белка, лимфоцитарный плеоцитоз.
ЦМВ-ретинит — самая частая причина потери зрения у больных ВИЧ-инфекцией. Данная патология описана также у реципиентов органов, детей с врождённой ЦМВИ, в единичных случаях — у беременных. Больные предъявляют жалобы на плавающие точки, пятна, пелену перед взором, снижение остроты и дефекты полей зрения. При офтальмоскопии на сетчатке по периферии глазного дна выявляют очаги белого цвета с геморрагиями по ходу ретинальных сосудов. Прогрессирование процесса ведёт к формированию диффузного обширного инфильтрата с зонами ретинальной атрофии и очагами кровоизлияний по поверхности поражения. Начальная патология одного глаза через 2–4 мес приобретает двусторонний характер и в отсутствие этиотропной терапии приводит в большинстве случаев к потере зрения. У больных ВИЧ-инфекцией, имеющих в анамнезе ЦМВ-ретинит, на фоне ВААРТ возможно развитие увеита как проявления синдрома восстановления иммунной системы.
Сенсорноневральная глухота имеет место у 60% детей с клинически выраженной врождённой ЦМВИ. Снижение слуха возможно и у взрослых ВИЧ-инфицированных лиц с манифестной ЦМВИ. В основе связанных с ЦМВ дефектов слуха лежит воспалительное и ишемическое повреждение улитки и слухового нерва.
Ряд работ демонстрируют роль ЦМВ как этиологического фактора патологии сердца (миокардит, дилатационная кардипатия), селезёнки, лимфатических узлов, почек, костного мозга с развитием панцитопении. Интерстициальный нефрит, обусловленный ЦМВИ, как правило, протекает без клинических проявлений. Возможны микропротеинурия, микрогематурия, лейкоцитурия, редко вторичный нефротический синдром и почечная недостаточность. У больных ЦМВИ часто регистрируют тромбоцитопению, реже умеренную анемию, лейкопению, лимфопению и моноцитоз.
Диагностика цитомегаловирусной инфекции
Клинический диагноз ЦМВ-заболевания требует обязательного лабораторного подтверждения.
Исследование крови пациента на наличие специфических антител класса IgM и/или антител класса IgG недостаточно ни для установления факта активной репликации ЦМВ, ни для подтверждения манифестной формы заболевания. Наличие анти-ЦМВ IgG в крови означает лишь факт встречи с вирусом.
Антитела IgG новорождённый получает от матери, и они не служат доказательством заражения ЦМВ. Количественное содержание IgG антител в крови не коррелирует ни с наличием заболевания, ни с активной бессимптомной формой инфекции, ни с риском внутриутробного заражения ребёнка. Лишь увеличение в 4 и более раз количества анти-ЦМВ IgG в «парных сыворотках» при обследовании с интервалом в 14–21 сут имеет определённое диагностическое значение.
Отсутствие анти-ЦМВ IgG в сочетании с наличием специфических IgM антител свидетельствует об острой ЦМВИ. Выявление анти-ЦМВ IgM у детей первых недель жизни — важный критерий внутриутробного заражения вирусом, однако серьёзным недостатком определения IgM антител служит их частое отсутствие при наличии активного инфекционного процесса и нередкие ложноположительные результаты. О наличии острой ЦМВИ свидетельствуют нейтрализирующие IgM антитела, присутствующие в крови не более 60 сут от момента заражения вирусом. Определение индекса авидности анти-ЦМВ IgG, характеризующего скорость и прочность связывания антигена с антителом, имеет определённую диагностическую и прогностическую ценность. Выявление низкого индекса авидности антител (менее 0,2 или менее 30%) подтверждает недавнее (в течение 3 мес) первичное заражение вирусом. Наличие низкоавидных антител у беременной служит маркёром высокого риска транспланцентарной передачи возбудителя плоду. В то же время отсутствие низкоавидных антител не исключает полностью недавнюю инфекцию.
Вирусологический метод, основанный на выделении ЦМВ из биологических жидкостей на культуре клеток, является специфическим, но трудоёмким, длительным, дорогим и малочувствительным методом диагностики ЦМВИ.
В практическом здравоохранении используют быстрый культуральный метод обнаружения вирусного антигена в биологических материалах путём анализа инфицированных клеток культуры. Выявление ранних и сверхранних антигенов ЦМВ показывает наличие у больного активного вируса.
Однако методы выявления антигенов уступают по чувствительности молекулярным методам, основанным на ПЦР, дающим возможность прямого качественного и количественного обнаружения ДНК ЦМВ в биологических жидкостях и тканях в кратчайшие сроки. Клиническое значение определения ДНК или антигена ЦМВ в различных биологических жидкостях не одинаково.
Присутствие возбудителя в слюне выступает лишь маркёром инфицированности и не свидетельствует о существенной вирусной активности. Наличие ДНК или антигена ЦМВ в моче доказывает факт заражения и определённую вирусную активность, что имеет значение, в частности, при обследовании ребёнка в первые недели его жизни. Наиболее важное диагностическое значение имеет обнаружение ДНК или антигена вируса в цельной крови, свидетельствующее о высокоактивной репликации вируса и его этиологической роли в имеющейся органной патологии. Выявление ДНК ЦМВ в крови беременной женщины — основной маркёр высокого риска заражения плода и развития врождённой ЦМВИ. Факт заражения плода доказывают наличием ДНК ЦМВ в амниотической жидкости или пуповинной крови, а после рождения ребёнка подтверждают обнаружением ДНК вируса в любой биологической жидкости в первые 2 нед жизни. Манифестную ЦМВИ у детей первых месяцев жизни обосновывают наличием ДНК ЦМВ в крови, у иммуносупрессивных лиц (реципиентов органов, больных ВИЧ-инфекцией) необходимо устанавливать количество ДНК вируса в крови. Достоверно указывает на цитомегаловирусную природу заболевания содержание ДНК ЦМВ в цельной крови, равное 3,0 и более log10 в 105 лейкоцитах. Количественное определение ДНК ЦМВ в крови имеет и большое прогностическое значение. Появление и постепенное повышение содержания ДНК ЦМВ в цельной крови существенно опережает развитие клинической симптоматики. Обнаружение цитомегалоклеток при гистологическом исследовании биопсийных и аутопсийных материалов подтверждает цитомегаловирусную природу органной патологии.
Стандарт диагностики
Обследование беременных женщин для установления наличия активной ЦМВИ и степени риска вертикальной передачи вируса плоду.
• Исследование цельной крови на наличие ДНК ЦМВ или антигена вируса.
• Исследование мочи на наличие ДНК ЦМВ или антигена вируса.
• Исследование крови на наличие антител класса IgМ к ЦМВ методом ИФА.
• Определение индекса авидности антител класса IgG к ЦМВ методом ИФА.
• Определение количества анти-ЦМВ IgG в крови с интервалом в 14–21 сут.
• Исследование амниотической жидкости или пуповинной крови на наличие ДНК ЦМВ (по показаниям).
Исследования крови и мочи на наличие ДНК или интигена вируса проводят планово не менее двух раз за время беременности или по клиническим показаниям.
Обследование новорождённых для подтверждения антенатального инфицирования ЦМВ (врождённой ЦМВИ).
• Исследование мочи или соскоба со слизистой ротовой полости на наличие ДНК ЦМВ или антигена вируса в первые 2 нед жизни ребёнка.
• Исследование цельной крови на наличие ДНК ЦМВ или антигена вируса в первые 2 нед жизни ребёнка, при положительном результате показано количественное определение ДНК ЦМВ в цельной крови.
• Исследование крови на наличие антител класса IgМ к ЦМВ методом ИФА.
• Определение количества IgG-антител в крови с интервалом 14–21 сут.
Возможно проведение исследования крови матери и ребёнка на анти-ЦМВ IgG для сравнения количества IgG антител в «парных сыворотках».
Обследование детей для подтверждения интранатального или раннего постнатального заражения ЦМВ и наличия активной ЦМВИ (при отсутствии вируса в крови, моче или слюне, анти-ЦМВ IgМ в течение первых 2 нед жизни).
• Исследование мочи или слюны на наличие ДНК ЦМВ или антигена вируса в первые 4–6 нед жизни ребёнка.
• Исследование цельной крови на наличие ДНК ЦМВ или антигена вируса в первые 4–6 нед жизни ребёнка, при положительном результате показано количественное определение ДНК ЦМВ в цельной крови.
• Исследование крови на наличие антител класса IgМ к ЦМВ методом ИФА.
Обследование детей раннего возраста, подростков, взрослых лиц при подозрении на острую ЦМВИ.
• Исследование цельной крови на наличие ДНК ЦМВ или антигена вируса.
• Исследование мочи на наличие ДНК ЦМВ или антигена вируса.
• Исследование крови на наличие антител класса IgМ к ЦМВ методом ИФА.
• Определение индекса авидности антител класса IgG к ЦМВ методом ИФА.
• Определение количества IgG антител в крови с интервалом в 14–21 сут.
Обследование больных при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь).
• Исследование цельной крови на наличие ДНК ЦМВ или антигена ЦМВ с обязательным количественным определением содержания ДНК ЦМВ в крови.
• Определение ДНК ЦМВ в СМЖ, плевральной жидкости, жидкости от бронхоальвеолярного лаважа, биоптатах бронхов и органов при наличии соответствующей органной патологии.
• Гистологическое исследование биопсийных и аутопсийных материалов на присутствие цитомегалоклеток (окраска гематоксилином и эозином).
Дифференциальная диагностика цитомегаловирусной инфекции
Дифференциальную диагностику врождённой ЦМВИ проводят с краснухой, токсоплазмозом, неонатальным герпесом, сифилисом, бактериальной инфекцией, гемолитической болезнью новорождённых, родовой травмой и наследственными синдромами. Решающее значение играет специфическая лабораторная диагностика заболевания в первые недели жизни ребёнка, гистологическое исследование плаценты с привлечением молекулярных методов диагностики. При мононуклеозоподобном заболевании исключают инфекции, вызываемые ЭБВ, герпесвирусами 6 и 7 типов, острую ВИЧ-инфекцию, а также стрептококковый тонзиллит и дебют острого лейкоза. В случае развития ЦМВ-заболевания органов дыхания у детей раннего возраста дифференциальную диагностику следует провести с коклюшем, бактериальным трахеитом или трахеобронхитом и герпетическим трахеобронхитом. У больных с иммунодефицитом манифестную ЦМВИ следует дифференцировать с пневмоцистной пневмонией, туберкулёзом, токсоплазмозом, микоплазменной пневмонией, бактериальным сепсисом, нейросифилисом, прогрессирующей многоочаговой лейкоэнцефалопатией, лимфопролиферативными заболеваниями, грибковыми и герпетическими инфекциями, ВИЧ-энцефалитом. Полинейропатия и полирадикулопатия ЦМВ-этиологии требует дифференцировки с полирадикулопатией, вызванной герпесвирусами, синдромом Гийена–Барре, токсической полинейропатией, связанной с приёмом ЛС, алкоголя и наркотических, психотропных веществ. С целью своевременной постановки этиологического диагноза, наряду с оценкой иммунного статуса, стандартными лабораторными анализами, МРТ головного и спинного мозга, проводят исследование крови на наличие ДНК ЦМВ, инструментальные обследования с исследованием СМЖ, лаважной жидкости, плеврального выпота, биопсийных материалов на наличие в них ДНК возбудителей.
Показания к консультации других специалистов
Показаниями к консультации специалистов больных ЦМВИ служат тяжёлое поражение лёгких (пульмонолог и фтизиатр), ЦНС (невролог и психиатр), зрения (офтальмолог), органов слуха (отоларинголог) и костного мозга (онкогематолог).
Пример формулировки диагноза
Диагноз манифестной ЦМВИ формулируют следующим образом:
— острая цитомегаловирусная инфекция, цитомегаловирусный мононуклеоз;
— врождённая цитомегаловирусная инфекция, манифестная форма;
— ВИЧ-инфекция, стадия вторичных заболеваний 4 В (СПИД): манифестная цитомегаловирусная инфекция (пневмония, колит).
Показания к госпитализации
При клинически выраженном ЦМВ-заболевании показана госпитализация.
Лечение цитомегаловирусной инфекции
Режим. Диета
Особого режима и диеты для больных ЦМВИ не требуется, ограничения устанавливают исходя из состояния больного и локализации поражения.
Медикаментозное лечение
Лекарственные средства, эффективность которых доказана контролируемыми исследованиями при лечении и профилактике ЦМВ-заболевания, выступают противовирусные препараты ганцикловир, валганцикловир, фоскарнет натрия, цидофовир. Препараты интерферонового ряда и иммунокорректоры при цитомегаловирусной инфекции не эффективны.
При активной ЦМВИ (наличии ДНК ЦМВ в крови) у беременных препарат выбора — иммуноглобулин человека антицитомегаловирусный (неоцитотект). Для профилактики вертикального заражения вирусом плода препарат назначают по 1 мл/кг в сутки внутривенно капельно 3 введения с интервалом в 1–2 нед.
С целью предупреждения манифестации заболевания у новорождённых с активной ЦМВИ или при манифестной форме заболевания с незначительными клиническими проявлениями показан неоцитотект по 2–4 мл/кг в сутки 6 введений (через 1 или 2 дня). При наличии у детей помимо ЦМВИ других инфекционных осложнений вместо неоцитотекта возможно применение пентаглобина по 5 мл/кг ежедневно 3 дня с повторением при необходимости курса или иных иммуноглобулинов для внутривенного введения.
Применение неоцитотекта в качестве монотерапии у больных, страдающих манифестной, угрожающей жизни или наступлением тяжёлых последствий ЦМВИ, не показано.
Ганцикловир и валганцикловир — препараты выбора для лечения, вторичной профилактики и предупреждения манифестной ЦМВИ. Лечение манифестной ЦМВИ ганцикловиром проводят по схеме: 5 мг/кг внутривенно 2 раза в сутки с интервалом 12 ч на протяжении 14–21 сут у больных ретинитом; 3–4 нед — при поражении лёгких или пищеварительного тракта; 6 нед и более — при патоло- гии ЦНС. Валганцикловир применяют внутрь в терапевтической дозе 900 мг 2 раза в сутки для лечения ретинита, пневмонии, эзофагита, энтероколита ЦМВ-этиологии. Длительность приёма и эффективность валганцикловира идентичны парентеральной терапии ганцикловиром. Критериями эффективности лечения служат нормализация состояния пациента, отчётливая положительная динамика по результатам инструментальных исследований, исчезновение ДНК ЦМВ из крови. Эффективность ганцикловира у больных с ЦМВ-поражением головного и спинного мозга меньшая, прежде всего, из-за поздней постановки этиологического диагноза и несвоевременного начала терапии, когда уже присутствуют необратимые изменения ЦНС. Эффективность ганцикловира, частота и выраженность побочных эффектов при лечении детей, страдающих ЦМВ-заболеванием, сравнимы с показателями для взрослых больных.
При развитии у ребёнка угрожающей жизни манифестной ЦМВИ применение ганцикловира необходимо. Для лечения детей с манифестной неонатальной ЦМВИ ганцикловир назначают в дозе 6 мг/кг внутривенно каждые 12 ч в течение 2 нед, далее при наличии начального эффекта терапии препарат применяют в дозе 10 мг/кг через день в течение 3 мес.
При сохранении состояния иммунодефицита рецидивы ЦМВ-болезни неизбежны. ВИЧ-инфицированным больным, прошедшим лечение манифестной ЦМВИ, для профилактики рецидива заболевания назначают поддерживающую терапию (900 мг/сут) или ганцикловиром (5 мг/кг в сутки). Поддерживающее лечение у больных ВИЧ-инфекцией, перенёсших ЦМВ-ретинит, проводят на фоне ВААРТ до момента повышения количества СD4-лимфоцитов более 100 кл в 1 мкл, сохраняющегося не менее 3 мес. Длительность поддерживающего курса при других клинических формах ЦМВИ должна быть не менее одного месяца. При рецидиве заболевания назначают повторный терапевтический курс. Лечение увеита, развившегося при восстановлении иммунной системы, предусматривает системное или периокулярное введение стероидов.
В настоящее время у больных с активной цитомегаловирусной инфекцией рекомендуют стратегию «упреждающей» этиотропной терапии для предотвращения манифестации заболевания.
Критериями для назначения превентивной терапии служит наличие у больных глубокой иммуносупрессии (при ВИЧ-инфекции — количество CD4-лимфоцитов в крови менее 50 кл в 1 мкл) и определение ДНК ЦМВ в цельной крови в концентрации более 2,0 lg10 ген/мл или выявление ДНК ЦМВ в плазме. Препарат выбора для профилактики манифестной ЦМВИ — валганцикловир, применяемый в дозе 900 мг/сут. Длительность курса составляет не менее месяца. Критерием прекращения терапии служит исчезновение ДНК ЦМВ из крови. У реципиентов органов превентивную терапию проводят в течение нескольких месяцев после трансплантации. Побочные эффекты ганцикловира или валганцикловира: нейтропения, тромбоцитопения, анемия, повышение сывороточного уровня креатинина, кожная сыпь, зуд, диспепсические явления, реактивный панкреатит.
Стандарт лечения
Лечебный курс: ганцикловир 5 мг/кг 2 раза в сутки или валганцикловир 900 мг 2 раза в сутки, длительность терапии составляет 14–21 сут и более до исчезновения симптомов заболевания и ДНК ЦМВ из крови. При рецидиве заболевания проводят повторный лечебный курс.
Поддерживающая терапия: валганцикловир 900 мг/сут не менее месяца.
Превентивная терапия активной ЦМВИ у иммуносупрессивных больных с целью профилактики развития ЦМВ-заболевания: валганцикловир 900 мг/сут в течение не менее месяца до отсутствия ДНК ЦМВ в крови.
Превентивная терапия активной ЦМВИ во время беременности с целью профилактики вертикального заражения плода: неоцитотект 1 мл/кг в сутки внутривенно 3 введения с интервалом в 2–3 нед.
Превентивная терапия активной ЦМВИ у новорождённых, детей младшего возраста для предупреждения развития манифестной формы заболевания: неоцитотект 2–4 мл/кг в сутки внутривенно 6 введений под контролем наличия ДНК ЦМВ в крови.
Прогноз
При ранней поставке диагноза ЦМВ-пневмонии, эзофагита, колита, ретинита, полинейропатии и своевременном начале этиотропной терапии прогноз для жизни и сохранения трудоспособности благоприятен. Позднее выявление цитомегаловирусной патологии сетчатки и развитие её обширного поражения ведёт к стойкому снижению зрения или к его полной потере. ЦМВ-поражение лёгких, кишечника, надпочечников, головного и спинного мозга могут стать причиной инвалидности пациентов или привести к летальному исходу.
Примерные сроки нетрудоспособности
Трудоспособность больных с ЦМВ-заболеванием нарушается не менее чем на 30 сут.
Диспансеризация
Женщины во время беременности проходят лабораторное обследование для исключения активной цитомегаловирусной инфекции. Дети младшего возраста, инфицированные ЦМВИ антенатально, наблюдаются невропатологом, отоларингологом и офтальмологом.
Дети, перенёсшие клинически выраженную врождённую ЦМВИ, находятся на диспансерном учёте у невропатолога. Больные после пересадки костного мозга, других органов в первый год после трансплантации должны не реже 1 раза в месяц проходить обследование на наличие ДНК ЦМВ в цельной крови. Больные ВИЧ-инфекцией, имеющие количество СD4-лимфоцитов менее 100 кл в 1 мкл, должны осматриваться офтальмологом и проходить обследование на количественное содержание ДНК ЦМВ в клетках крови не реже одного раза в 3 мес.
Выполнение рекомендаций, использование современных методов диагностики и применение эффективных терапевтических средств позволяет предотвратить развитие манифестной ЦМВИ или свести к минимуму её последствия.
Профилактика цитомегаловирусной инфекции
Профилактические мероприятия в отношении ЦМВИ должны быть дифференцированы в зависимости от группы риска. Необходимо консультирование беременных женщин (особенно серонегативных) по проблеме цитомегаловирусной инфекции и рекомендации по использованию барьерных контрацептивов при половых контактах, соблюдению правил личной гигиены при уходе за детьми младшего возраста. Желателен временный перевод беременных серонегативных женщин, работающих в домах ребёнка, детских стационарных отделениях и учреждениях ясельного типа, на работу, не связанную с опасностью их заражения ЦМВ. Важной мерой профилактики ЦМВИ в трансплантологии является подбор серонегативного донора, если серонегативен реципиент. Запатентованной антицитомегаловирусной вакцины в настоящее время не существует.
Цитомегаловирусная инфекция | Компетентно о здоровье на iLive
Как лечится цитомегаловирусная инфекция?
У больных СПИДом симптомы ретинита, вызванного цитомегаловирусом, ослабляются антивирусными препаратами. Большинство пациентов получают ганцикловир в дозе 5 мг/кг внутривенно 2 раза в день в течение 2-3 недель или валганцикловир, 900 мг внутрь 2 раза в день в течение 21 дня. Если стартовая лечение цитомегаловирусной инфекции неэффективное хотя бы однажды, должна быть проведена смена препарата. После стартовой дозы пациент должен получать поддерживающую или супрессивную терапию валганцикловиром 900 мг внутрь один раз в день, чтобы остановить прогрессирование болезни. Поддерживающее лечение цитомегаловирусной инфекции валганцикловиром 5 мг/кг внутривенно один раз в день полезна для предотвращения рецидивов. Альтернативно можно применять фоскарнет в сочетании или без ганцикловира, в стартовой дозе 90 мг/кг внутривенно каждые 12 часов в течение 2-3 недель, переходя затем на поддерживающую терапию 90-120 мг/кг внутривенно один раз в день. Побочные эффекты внутривенного введения фоскарнета значительны и включают нефротоксичность, гипокальциемию, гипомагниемию, гипокалиемию, гиперфосфатемию и поражение ЦНС. Комбинированная терапия ганцикловиром и фоскарнетом повышает риск побочных эффектов. Лечение цитомегаловирусной инфекции сидовиром проводится в стартовой дозе 5 мг/ кг внутривенно один раз в неделю в течение 2 недель с последующим введением препарата 1 раз в две недели (поддерживающая доза). Эффективность близка к таковой для ганцикловира или фоскарнета. Применение сидовира ограничивают выраженные побочные эффекты, такие как почечная недостаточность. Для снижения нефротоксичности следует с каждой дозой назначать пробеницид и проводить гидрацию организма. Следует помнить о том, что пробеницид сам может вызвать значительные побочные реакции (сыпь, лихорадка, головная боль).
Для пролонгированного лечения больных можно использовать глазные имплантаты с ганцикловиром. Внутриглазные инъекции в стекловидное тело полезны при неэффективности иных лечебных мероприятий или при противопоказаниях к ним (терапия отчаяния). Такое лечение цитомегаловирусной инфекции включает инъекции ганцикловира или фоскарнета. Потенциально побочные эффекты такого лечения могут включать ретинотоксичность, кровоизлияния в стекловидное тело, эндофтальмиты, отслоение сетчатки, отек сосочка глазного нерва, образование катаракты. Сидовир может привести к развитию ирита или глазной гипотонии. Но даже при проведении такой терапии больные нуждаются в системном применении антивирусных препаратов для предотвращения поражения второго глаза или внеглазных тканей. Кроме того, повышение уровня CD4+ лимфоцитов до уровня более 200 клеток/ мкл в сочетании с системными антиретровирусными препаратами позволяет ограничить применение глазных имплантатов.
Препараты анти-ЦМВ направленности используются для лечения более тяжелых заболеваний, чем ретиниты, но их эффективность гораздо ниже, чем при лечении ретинитов. Ганцикловир в сочетании с иммуноглобулином используется для лечения цитомегаловирусной инфекции пневмонии у пациентов, перенесших операцию по трансплантации костного мозга.
Профилактика цитомегаловирусной инфекции необходима для реципиентов солидных органов и гематопоэтических клеток. Применяют те же ан¬тивирусные препараты.
Цитомегаловирусная инфекция — Симптомы | Компетентно о здоровье на iLive
Основные симптомы цитомегаловирусной инфекции и динамика их развития
При врождённой цитомегаловирусной инфекции характер поражения плода зависит от срока заражения. Острая цитомегаловирусная инфекция у матери в первые 20 недель беременности может привести к тяжёлой патологии плода, результатом которой становятся самопроизвольный выкидыш, внутриутробная гибель плода, мёртворождение, пороки, в большинстве случаев несовместимые с жизнью. При заражении цитомегаловирусом в поздние сроки беременности прогноз для жизни и нормального развития ребёнка более благоприятен. Выраженные симптомы цитомегаловирусной инфекции в первые недели жизни имеют 10-15% инфицированных цитомегаловирусом новорождённых. Для манифестной формы врождённой цитомегаловирусной инфекции характерны гепатоспленомегалия, стойкая желтуха, геморрагическая или пятнисто-папулёзная сыпь, выраженная тромбоцитопения, повышение активности АЛТ и уровня прямого билирубина в крови, повышенный гемолиз эритроцитов. Младенцы часто рождаются недоношенными, с дефицитом массы тела, признаками внутриутробной гипоксии. Характерна патология ЦНС в виде микроцефалии, реже гидроцефалии, энцефаловентрикулита, судорожного синдрома, снижения слуха. Цитомегаловирусная инфекция — основная причина врождённой глухоты. Возможны энтероколит, фиброз поджелудочной железы, интерстициальный нефрит, хронический сиалоаденит с фиброзом слюнных желёз, интерстициальная пневмония, атрофия зрительного нерва, врождённая катаракта, а также генерализованное поражение органов с развитием шока. ДВС-синдрома и смерти ребёнка. Риск летального исхода в первые 6 нед жизни новорождённых с клинически выраженной цитомегаловирусной инфекции составляет 12%. Около 90% выживших детей, страдавших манифестной цитомегаловирусной инфекции, имеют отдалённые последствия заболевания в виде снижения умственного развития, нейросенсорной глухоты или двустороннего снижения слуха, нарушения восприятия речи при сохранении слуха, судорожного синдрома, парезов, снижения зрения. При внутриутробном заражении цитомегаловирусом возможна бессимптомная форма инфекции с низкой степенью активности, когда вирус присутствует только в моче или слюне, и высокой степенью активности, если вирус определяют в крови. В 8-15% случаях антенатальная цитомегаловирусная инфекция, не проявляясь яркой клинической симптоматикой, ведёт к формированию поздних осложнений в виде ухудшения слуха. снижения зрения, судорожных расстройств, задержки физического и умственного развития. Фактором риска развития заболевания с поражением ЦНС служит стойкое наличие в цельной крови ДНК цитомегаловируса в период от момента рождения ребёнка до 3 мес жизни. Дети с врождённой цитомегаловирусной инфекции должны находиться под медицинским наблюдением в течение 3-5 лет, так как нарушение слуха может прогрессировать в первые годы жизни, а клинически значимые осложнения — сохраняться и через 5 лет после рождения.
При отсутствии отягощающих факторов интранатальная или ранняя постнатальная цитомегаловирусная инфекция протекает бессимптомно, проявляется клинически лишь в 2-10% случаях, чаще в виде пневмонии. У недоношенных ослабленных детей с низким весом при рождении, заражённых цитомегаловирусом во время родов или в первые дни жизни путём гемотрансфузий, уже к 3-5-й нед жизни развивается генерализованное заболевание, проявлениями которого служат пневмония, затяжная желтуха. гепатоспленомегалия, нефропатия. поражение кишечника, анемия, тромбоцитопения. Цитомегаловирусная инфекция носит длительный рецидивирующий характер. Максимальная летальность от цитомегаловирусной инфекции приходится на возраст 2-4 мес.
Симптомы цитомегаловирусной инфекции приобретённой у детей старшего возраста и взрослых зависит от формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей заражения, наличия и степени выраженности иммуносупрессии. Первичное инфицирование цитомегаловирусом иммунокомпетентных лиц обычно протекает бессимптомно и лишь в 5% случаев в виде мононуклеозоподобного синдрома, отличительными признаками которого выступают высокая лихорадка, выраженный и длительный астенический синдром, в крови — относительный лимфоцитоз. атипичные лимфоциты. Ангина и увеличение лимфатических узлов не характерны. Заражение вирусом путём гемотрансфузий или при трансплантации инфицированного органа приводит к развитию острой формы заболевания, включающего высокую лихорадку, астению, боли в горле, лимфаденопатию, миалгию. артралгию, нейтропению, тромбоцитопению, интерстициальную пневмонию, гепатит, нефрит и миокардит. При отсутствии выраженных иммунологических нарушений острая цитомегаловирусная инфекция переходит в латентную с пожизненным присутствием вируса в организме человека. Развитие лммуносупрессии ведёт к возобновлению репликации цитомегаловируса. появлению вируса в крови и возможной манифестации заболевания. Повторное попадание вируса в организм человека на фоне иммунодефицитного состояния также может быть причиной виремии и развития клинически выраженной цитомегаловирусной инфекции. При реинфекции манифестация цитомегаловирусной инфекции происходит чаще и протекает более тяжело, чем при реактивации вируса.
Для цитомегаловирусной инфекции у лммуносупрессивных лиц характерно постепенное в течение нескольких недель развитие заболевания, появляются симптомы цитомегаловирусной инфекции в виде быстрой утомляемости, слабости, потери аппетита, значительного снижения веса, длительной волнообразной лихорадки неправильного типа с подъёмами температуры тела выше 38.5 С, реже — потливости по ночам, артралгии и миалгии. Данный комплекс симптомов носит название «ЦМВ-ассоциированный синдром». У детей младшего возраста начало заболевания может протекать без выраженного начального токсикоза при нормальной или субфебрильной температуре. С цитомегаловирусной инфекцией связан широкий спектр органных поражений, одними из первых страдают лёгкие. Появляется постепенно усиливающийся сухой или малопродуктивный кашель, умеренная одышка, нарастают симптомы интоксикации. Рентгенологические признаки лёгочной патологии могут отсутствовать, но в период разгара болезни часто на фоне деформированного усиленного лёгочного рисунка определяют двусторонние мелкоочаговые и инфильтративные тени, расположенные преимущественно в средних и нижних отделах лёгких. При несвоевременной постановке диагноза возможно развитие дыхательной недостаточности, респираторного дистресс-синдромма и летальный исход. Степень поражения лёгких у больных цитомегаловирусной инфекцией варьирует от минимально выраженной интерстициальной пневмонии до распространённого фиброзируюшего бронхиолита и альвеолита с формированием двустороннего полисегментарного фиброза лёгких.
Нередко вирус поражает пищеварительный тракт. Цитомегаловирус — основной этиологический фактор язвенных дефектов пищеварительного тракта у больных ВИЧ-инфекцией. Типичными признаками цитомегаловирусного эзофагита выступают лихорадка. загрудинная боль при прохождении пищевого комка, отсутствие эффекта противогрибковой терапии, наличие неглубоких округлых язв и/или эрозий в дистальном отделе пищевода. Поражение желудка характеризуется наличием острых или подострых язв. Клиническая картина цитомегаловирусного колита или энтероколита включает диарею, стойкие абдоминальные боли, болезненность толстой кишки при пальпации, значительное снижение массы тела, выраженную слабость, повышение температуры. Колоноскопия выявляет эрозии и изъязвления слизистой оболочки кишки.
Гепатит — одна из основных клинических форм цитомегаловирусной инфекции при трансплацентарном заражении ребёнка, у реципиентов после пересадки печени, больных, инфицированных вирусом во время гемотрансфузий. Особенность поражения печени при цитомегаловирусной инфекции — частое вовлечение в патологический процесс желчных путей. Цитомегаловирусный гепатит характеризуется мягким клиническим течением, но при развитии склерозирующего холангита возникают боли в верхней части живота, тошнота, диарея, болезненность печени, повышение активности щелочной фосфатазы и ГГТТ, возможен холестаз. Поражение печени носит характер гранулематозного гепатита, в редких случаях наблюдают выраженный фиброз и даже цирроз печени. Патология поджелудочной железы у больных цитомегаловирусной инфекцией обычно протекает бессимптомно или со стёртой клинической картиной при повышении концентрации амилазы в крови. Высокой чувствительностью к цитомегаловирусу обладают клетки эпителия мелких протоков слюнных желёз, преимущественно околоушных. Специфические изменения в слюнных железах при цитомегаловирусной инфекции у детей встречаются в подавляющем большинстве случаев. Для взрослых больных цитомегаловирусной инфекцией сиалоаденит не характерен.
Цитомегаловирус — одна из причин патологии надпочечников (часто у больных ВИЧ-инфекцией) и развития вторичной надпочечниковой недостаточности, проявляющейся стойкой гипотонией, слабостью, похуданием, анорексией, нарушением работы кишечника, рядом психических отклонений, реже — гиперпигментацией кожи и слизистых. Наличие у больного ДНК цитомегаловируса в крови, а также стойкой гипотонии, астении, анорексии требует определения уровня калия, натрия и хлоридов в крови, проведения гормональных исследований для анализа функциональной активности надпочечников. Цитомегаловирусный адреналит характеризуется первоначальным поражением мозгового слоя с переходом процесса на глубокие, а в дальнейшем — и на все слои коры.
Манифестная цитомегаловирусная инфекция нередко протекает с поражением нервной системы в виде энцефаловентрикулита. миелита, полирадикулопатии, полинеиропатии нижних конечностей. Для цитомегаловмирусного энцефалита у больных ВИЧ-инфекцией характерны скудная неврологическая симптоматика (непостоянные головные боли, головокружение, горизонтальный нистагм, реже парез глазодвигательного нерва, невропатии лицевого нерва), но выраженные изменения в психическом статусе (личностные изменения, грубые нарушения памяти, снижение способности к интеллектуальной деятельности, резкое ослабление психической и двигательной активности, нарушение ориентировки в месте и времени, анозогнозии, снижение контроля за функцией тазовых органов). Мнестико-интеллектуальные изменения нередко достигают степени деменции. У детей, перенёсших цитомегаловирусный энцефалит, также выявляют замедление психического и умственного развития. Исследования спинно-мозговой жидкости показывают повышенное количество белка, отсутствие воспалительной реакции или мононуклеарный плеоцитоз. нормальное содержание глюкозы и хлоридов. Клиническая картина полинеиропатии и полирадикулопатии характеризуется болевым синдромом в дистальных отделах нижних конечностей, реже в поясничной области в сочетании с чувством онемения, парастезиеи, гиперестезией, каузалгией. гиперпатией. При полирадикулопатии возможен вялый парез нижних конечностей, сопровождающийся снижением болевой и тактильной чувствительности в дистальных отделах ног. В спинно-мозговой жидкости больных полирадикулопатией выявляют повышение содержания белка, лимфоцитарный плеоцитоз. Цитомегаловирус принадлежит ведущая роль в развитии миелита у ВИЧ-инфицированных пациентов. Поражение спинного мозга носит диффузный характер и выступает поздним проявлением цитомегаловирусной инфекции. В дебюте заболевание имеет клиническую картину полинеиропатии или полирадикулопатии. в дальнейшем. в соответствии с преимущественным уровнем поражения спинного мозга, развиваются спастическая тетраплегия или спастический парез нижних конечностей, появляются пирамидные знаки, значительное снижение всех видов чувствительности, в первую очередь в дистальных отделах ног; трофические нарушения. Все больные страдают грубыми расстройствами функции тазовых органов, в основном, по центральному типу. В спинно-мозговой жидкости определяют умеренное повышение содержания белка, лимфоцитарный плеоцитоз.
Цитомегаловирусный ретинит — самая частая причина потери зрения у больных ВИЧ-инфекцией. Данная патология описана также у реципиентов органов, детей с врождённой цитомегаловирусной инфекцией, в единичных случаях — у беременных. Больные отмечают следующие симптомы цитомегаловирусной инфекции: на плавающие точки, пятна, пелену перед взором, снижение остроты и дефекты полей зрения. При офтальмоскопии на сетчатке по периферии глазного дна выявляют очаги белого цвета с геморрагиями по ходу ретинальных сосудов. Прогрессирование процесса ведёт к формированию диффузного обширного инфильтрата с зонами ретинальной атрофии и очагами кровоизлияний по поверхности поражения. Начальная патология одного глаза через 2-4 мес приобретает двусторонний характер и в отсутствие этиотропной терапии приводит в большинстве случаев к потере зрения. У больных ВИЧ-инфекцией, имеющих в анамнезе цитомегаловирусный ретинит, на фоне ВААРТ возможно развитие увеита как проявления синдрома восстановления иммунной системы.
Сенсорноневральная глухота имеет место у 60% детей с клинически выраженной врождённой цитомегаловирусной инфекцией. Снижение слуха возможно и у взрослых ВИЧ-инфицированных лиц с манифестной цитомегаловирусной инфекцией. В основе связанных с цитомегаловирусрм дефектов слуха лежит воспалительное и ишемическое повреждение улитки и слухового нерва.
Ряд работ демонстрируют роль цитомегаловируса как этиологического фактора патологии сердца (миокардит, дилатационная кардипатия), селезёнки, лимфатических узлов. почек, костного мозга с развитием панцитопении. Интерстициальный нефрит, обусловленный цитомегаловирусной инфекцией, как правило, протекает без клинических проявлений. Возможны микропротеинурия, микрогематурия, лейкоцитурия, редко вторичный нефротический синдром и почечная недостаточность. У больных цитомегаловирусной инфекцией часто регистрируют тромбоцитопению, реже умеренную анемию, лейкопению, лимфопению и моноцитоз.
Лечение цитомегаловируса (ЦМВ) — методы и препараты
Перед тем как начать лечение цитомегаловируса, необходимо точно диагностировать заболевание и определится нужно ли вообще лечение ЦМВИ в вашем случае. Поскольку оно не всегда требуется, нужно об этом знать. К тому же диагностировать наличие цитомегаловирусной инфекции непросто и ЦМВ легко спутать с другими болезнями. Ниже мы поговорим о том, как вылечить цитомегаловирус и чем он лечится, а также в каких случаях это необходимо.
Особенности лечения цитомегаловируса
Цитомегаловирусную инфекцию необходимо лечить только тогда, когда болезнь представляет собой бесспорную опасность для человеческого организма. Чётко идентифицирует подобные случаи только специалист, после посещения заболевшего клиники для диагностирования заболевания. В случае, если в организме есть симптомы генерализованной инфекции цитомегаловируса, то в клинику обратиться крайне важно. Схема лечения цитомегаловируса может быть составлена только после личного осмотра пациента.
Человек, переболевший цитомегаловирусом и перенёсший инфекционное заболевание без тех или иных тяжёлых последствий, обретает достаточно крепкий иммунитет. В подавляющем большинстве цитомегаловирусная инфекция, поразив человеческий организм, симптомов никаких не вызывает. Сам же вирус в организме принимает спящий режим, оставаясь в человеке вечно. И проявляется, вызывая рецидивы в сопровождении всевозможных осложнений, только при сильном ослаблении иммунной системы.
Во всех случаях лечение цитомегаловирусной инфекции преследует поставленную цель – существенно смягчить негативное воздействие вирусной инфекции на человеческий организм. Чаще всего, после заражения человек, с достаточно сильной иммунной системой, легко выносит первичную вспышку инфекционного заболевания, поэтому нет необходимости заболевшему цитомегаловирусом обращаться в больницу. У таких людей, после краткосрочной манифестации, набор создавшихся симптомов бесследно прекращается. В итоге, заболевание в основном проходит незамеченным.
В каких случаях лечение цитомегаловируса действительно необходимо
К конкретным сложившимся обстоятельствам, согласно которым лечащий врач определяет курс лечения цитомегаловирусной инфекции у взрослых или у детей, имеют отношение такие проявления, как:
- Наличие приобретённого или врождённого иммунодефицита у больного любого возраста.
- Генерализованный этап — обширное распространение вируса сопровождается очень болезненным воспалительным процессом по всему организму или по определённому органу на фоне наличия других инфекций, которые ослабляют основные защитные функции человеческого организма.
- Осложненное или обострённое протекание цитомегаловируса или подготовка к лечению при аллогенной трансплантации органов, пневмонии, энцефалите, онкологических заболеваний – при применении терапии, жёстко подавляющей иммунную систему.
- Во время первого триместра беременности у женщин с ослабленным иммунитетом возможно проявление первичного цитомегаловируса, способного потенциально нанести чрезвычайно тяжёлые повреждения плода, а также может возникнуть провокация выкидыша.
Генерализованная стадия или симптоматическое обострение заболевания цитомегаловирусной инфекцией нередко характеризуется тем, что большинство пациентов и даже порой некоторые врачи, путают эту вирусную болезнь из-за схожести с симптомами заболеваний гриппозной природы или ОРВИ. А также с другими инфекционными заболеваниями. Нередко это приводит к ошибочному лечению и высокому риску формирования развития тяжёлых осложнений.
При абсолютно точной дифференциальной диагностике, лечение от цитомегаловируса пациенту будет назначено максимально адекватное. А лекарства прописаны по верному назначению.
Препараты и витамины для лечения цитомегаловирусной инфекции
Давайте рассмотрим, как лечить цитомегаловирус с помощью лекарственных препаратов. Основные медикаментозные препараты от цитомегаловирусной инфекции и лечение ими, делятся на несколько небольших групп:
- Симптоматические средства – обеспечивают купирование, обезболивают, устраняют воспаления, сужают сосуды (капли в нос, глазные капли, болеутоляющие, противовоспалительные, народные средства).
- Противовирусные медикаментозные препараты — подавляют активность инфекции (Ганцикловир, Панавир, Цидофовир, Фоскарнет).
- Препараты посиндромной терапии — восстанавливают повреждённые органы и ткани при осложнениях (капсулы, свечи, таблетки, инъекции, гели, мази, капли).
- Иммунномодуляторы — укрепляют и стимулируют иммунную систему (Лейкинферон, Роферон A, Неовир, Генферон, Виферон).
- Иммуноглобулины — связывают и уничтожают вирусные частицы (Неоцитотект, Цитотект, Мегалотект).
- Витаминно–минеральный комплекс – для поддержки иммунной системы.
У мужчин цитомегаловирус лечится противовирусными препаратами — Фоскарнет, Ганцикловир, Виферон. И иммуноглобулинами — Цитотект, Мегалотект.
У женщин цитомегаловирус лечится противовирусными препаратами — Ацикловир, Виферон, Генферон, Циклоферон.
Список препаратов
- Фоскарнет – противовирусный препарат. Инфекционный цитомегаловирус довольно успешно лечится Фоскарнетом. Он применяется при тяжёлых случаях заболевания и при сложных формах возможных обострений, которые могут вызываться другими болезнями. Целесообразно применение данного препарата с ослабленным иммунитетом у пациента. При попадании препарата внутрь больной клетки, нарушается элонгация вирусной цепочки, то есть – лекарство замедляет, а вслед за тем полностью стопорит активное размножение вируса.
- Ганцикловир – противовирусный препарат. Препарат является одним из максимально действенных, достаточно сложных в практическом использовании. Средство назначается при протекании болезни – цитомегаловирусной инфекции, осложнённой особо тяжёлыми патологиями органов, довольно обширными воспалениями. Также применяется для профилактики вирусной инфекции, врождённой ЦМВ – инфекции. Форма выпуска – таблетки и кристаллический порошок из группы полярных гидрофильных растворителей. Для глазного геля или инъекции препарат выпускается в виде лиофилизата. Применение Ганцикловира целесообразно при терапии цитомегаловируса – герпетической инфекции.
- Цитотект – иммуноглобулин. Для многих больных Цитотект представляется одним из самых оптимальных средств для лечения цитомегалувируса. Препарат сочетает довольно действенную эффективность и почти что совершенное отсутствие общей токсичности и относительных противопоказаний. Прописывается для профилактики пациентам с подавленной медикаментозными препаратами иммунной системой. Предупреждает массовые манифестации болезни после заражения ЦМВИ. При применении могут создаваться: головные боли; тошнота и рвота; озноб и повышение температуры тела; ломота в суставах и слабая боль в спине; иногда снижение артериального давления.
- Неовир – иммуностимулятор. Раствор для инъекций, применяется в качестве иммуностимулирующего препарата для лечения и профилактики цитомегаловирусной инфекции у людей с иммунодефицитом.
- Виферон – иммуномодулятор. Свечи с противовирусным действием. Применяется при осложнениях инфекционных заболеваний, при первичном воспалении, а также рецидиве цитомегаловирусной инфекции локализованной формы. Препарат применяется ректально. При применении может вызывать аллергию в виде кожного высыпания.
- Бишофит – противовоспалительный препарат. Выпускается в виде бальзама (геля) в тубе или в стеклянной таре в виде рассола. Применяется местно как лечебная грязь или минеральная вода.
Список витаминов
- C – Антиоксидант широкого спектра действий. Стимулирует работу клеток, пожирающих бактерии и вирусы в крови. Повышает сопротивляемость человеческого организма различным инфекциям при помощи устойчивости клеток к проникновению заразных агентов.
- B9 – для мощного поддержания производственной фабрики (костного мозга) иммунной системы организма человека.
К общим правилам лечения цитомегаловируса относится госпитализация больного в тех случаях, когда это крайне необходимо. Так как в период лечения больной представляется весьма активным источником вирусного заражения для окружающих, пациенту необходимо существенно ограничить любые контакты с людьми. Максимально обеспечить абсолютный покой. Обеспечить лучшие необходимые условия микроклимата. Соблюдать жёсткие правила личной гигиены. Пользоваться лечебно-профилактическим рационом питания.
При строгом соблюдении данных правил и всех рекомендаций лечащего врача, можно полагаться на довольно скорое и максимально результативное избавление от инфекции и недопущения осложнений и рецидивов.
Лечение народными средствами
Если человек услышал, что люди лечились от цитомегаловируса домашним врачеванием, то это ошибочное представление о том, что, можно благодаря народной медицине справиться со столь трудной задачей. Лечение подобной инфекции и всевозможных осложнений не должно проистекать само по себе без наблюдения специалиста. Но поддержать иммунную систему народными средствами вполне целесообразно.
Натуральный мёд и все медовые продукты способствуют максимально результативно помочь ослабленной иммунной системе. Отвары из лекарственных трав зарекомендовали себя также эффективно. Тёплые чаи из листьев малины и смородины очень полезны для восстановления организма.
Итак, подводя итоги, стоит заметить, что не всегда цитомегаловирус угрожает организму и требует немедленного лечения. Но не нужно полагать что это закономерность. Лечением цитомегаловируса должен заниматься только врач, несмотря на то, что эта рекомендация очень часто фигурирует в наших статьях, многие ей пренебрегают. Но с подобным заболеванием как цитомегаловирусная инфекция лучше не шутить.
Причины, симптомы и варианты лечения
Проверено с медицинской точки зрения Drugs.com. Последнее обновление: 1 июня 2020 г.
Что такое цитомегаловирус (ЦМВ)?
Цитомегаловирус (CMV) — это вирус, относящийся к вирусу герпеса. Это настолько распространено, что почти все взрослые в развивающихся странах и от 50% до 85% взрослых в Соединенных Штатах инфицированы.
Обычно ЦМВ — легкое заболевание, не вызывающее серьезных проблем у здоровых детей и взрослых.У большинства людей появляются гриппоподобные симптомы или заболевание, похожее на мононуклеоз, если они вообще развиваются.
Однако заражение этим вирусом может быть серьезным и даже смертельным для некоторых людей, в том числе:
- Люди, получающие химиотерапию по поводу рака
- Люди с заболеваниями, подавляющими иммунную систему, такими как СПИД
- Люди, перенесшие трансплантацию органов или костного мозга
- Новорожденные от женщин, инфицированных ЦМВ во время беременности
Женщины, впервые инфицированные ЦМВ во время беременности, могут передать вирус своим будущим детям в утробе матери.Вирус также может передаваться от матери к ребенку с выделениями из влагалища во время родов и с грудным молоком после рождения. Вирус может передаваться от человека к человеку при тесном личном контакте, половом контакте, переливании крови или трансплантации органов.
Симптомы
Существует три класса ЦМВ-инфекции, каждый с разными симптомами:
Врожденный
До 40% младенцев, рожденных от женщин, впервые заразившихся ЦМВ во время беременности, будут инфицированы.Не у всех инфицированных детей симптомы появляются при рождении. Этот тип ЦМВ-инфекции вызывает такую же серьезную инвалидность, как синдром Дауна, алкогольный синдром плода и дефекты нервной трубки.
Новорожденные с ЦМВ, скорее всего, родятся недоношенными и с низкой массой тела при рождении. Другие возможные проблемы включают небольшой мозг (микроцефалия) или другие расстройства нервной системы, которые могут вызывать судороги, глухоту, умственную отсталость или смерть. Эта инфекция может вызвать увеличение размеров печени и селезенки, пожелтение кожи и глаз (из-за болезни печени) и заболевания крови.Новорожденные с ЦМВ могут иметь сыпь, состоящую из небольших синяков, называемых петехиями, и более крупных синяков, известных как пурпура.
Ребенок, родившийся от матери, которая уже была инфицирована ЦМВ до беременности, с меньшей вероятностью родится с ЦМВ. Только от 0,5% до 1,5% таких младенцев инфицированы (по сравнению с 40% младенцев, рожденных от матерей, инфицированных во время беременности), и их проблемы, как правило, менее серьезны.
Здоровые люди
В большинстве случаев у здоровых людей, инфицированных ЦМВ, обычно появляются незначительные симптомы или симптомы отсутствуют совсем.Когда возникают симптомы, они похожи на симптомы мононуклеоза:
- Усталость
- Субфебрильная температура (может длиться дни или недели)
- Озноб и / или пот
- Мышечные боли
- Снижение аппетита
- Увеличенные лимфатические узлы
- Боль в горле
- Головная боль
Вирус обычно становится неактивным (латентным или бездействующим) у здоровых людей без специального лечения.Однако ЦМВ никогда полностью не выводится из организма и может повторно активироваться в таких ситуациях, как подавление иммунитета.
Люди с подавленным иммунитетом
У людей, перенесших трансплантацию органа или костного мозга, а также у больных СПИДом может развиться серьезное заболевание, вызванное ЦМВ. Как правило, скрытый вирус от предыдущей инфекции (исходная инфекция ЦМВ могла произойти много лет назад) снова становится активным, потому что иммунная система человека ослаблена. Люди с ослабленной иммунной системой подвергаются большему риску серьезного заболевания, если у них никогда не было ЦМВ в прошлом, и заражаются новой инфекцией.
Реактивированная инфекция ЦМВ может поражать многие части тела:
- ЦМВ-ретинит поражает глаза и может вызвать слепоту.
- Пневмония, вызванная ЦМВ, может быть опасной для жизни.
- ЦМВ может поражать любую часть желудочно-кишечного тракта, включая пищевод, желудок, печень, желчный пузырь, поджелудочную железу и толстую кишку, вызывая язвы, воспаление печени, кишечную непроходимость и колит. Симптомы могут включать болезненное и затрудненное глотание, тошноту, рвоту, боль в животе, пожелтение кожи и водянистую или кровавую диарею.
- ЦМВ может инфицировать мозг и другие части нервной системы, вызывая такие симптомы, как головная боль, спутанность сознания и слабость в ногах.
Диагностика
Врачи могут назначить анализы крови детям с низкой массой тела при рождении, желтухой, маленьким мозгом или другими проблемами, которые могут быть связаны с врожденным ЦМВ, но могут быть вызваны и другими причинами. Диагноз необходимо подтвердить путем анализа крови или тканей младенца в течение трех недель после рождения.
Молодые здоровые взрослые люди обычно не нуждаются в тестировании, потому что их не нужно лечить специально от ЦМВ. Обычно они выздоравливают в течение нескольких недель. В некоторых случаях могут проводиться анализы крови для подтверждения причины заболевания, поскольку подобные симптомы могут быть вызваны вирусом Эпштейна-Барра (EBV) и даже вирусом иммунодефицита человека (ВИЧ). Также могут потребоваться тесты для контроля уровня в крови и воспаления печени. Иногда требуется ультразвуковое исследование, чтобы контролировать печень или селезенку.
Для людей с ВИЧ / СПИДом с сильно ослабленной иммунной системой или для людей, перенесших трансплантацию органа или костного мозга, диагноз ЦМВ обычно требует подробного медицинского осмотра и анализов крови. В зависимости от симптомов могут быть проанализированы образцы мочи и стула. Иногда для подтверждения диагноза требуется биопсия пораженного органа, такого как легкое или толстая кишка.
Ожидаемая длительность
Прогрессирование заболевания у младенцев, инфицированных в утробе матери, во время родов или при грудном вскармливании, может сильно различаться.Некоторые младенцы могут умереть от инфекции, а некоторые могут вообще не иметь долгосрочных последствий. Прогноз зависит от многих факторов, и таких младенцев должен осматривать специалист.
Взрослые со здоровой иммунной системой, которые уже инфицированы ЦМВ, могут ожидать, что вирус останется неактивным. Дальнейшего развития симптомов, связанных с ЦМВ, не ожидается.
Человеку с ослабленной иммунной системой, у которого развивается заболевание, связанное с ЦМВ (первичная инфекция или реактивация), часто требуется длительное лечение.Улучшение иммунной системы — лучшая надежда на борьбу с любыми вторгающимися вирусами.
Профилактика
Беременным женщинам, ухаживающим за маленькими детьми, следует:
- Часто мойте руки водой с мылом, особенно после смены подгузников. Хорошо промойте 15-20 секунд.
- Не целовать детей младше 5-6 лет в рот или в щеку. Вместо этого поцелуй их в голову или крепко обними.
- Не делиться едой, напитками или посудой (ложками или вилками) с маленькими детьми.
Если вы беременны и работаете в детском саду, уменьшите риск заражения ЦМВ, работая с детьми старше 2 с половиной лет, особенно если вы никогда не были инфицированы ЦМВ или не уверены, были разоблачены.
В некоторых случаях людям, больным СПИДом, или тем, кому была сделана трансплантация органа или костного мозга, может потребоваться прием лекарств для предотвращения реактивации ЦМВ. Если людям с ослабленной иммунной системой потребуется переливание крови, они, вероятно, получат кровь с удаленными лейкоцитами.Это снижает риск заражения.
Кроме того, людям с ВИЧ / СПИДом с чрезвычайно ослабленной иммунной системой необходимо регулярно проверять глаза для раннего выявления ЦМВ, даже до появления симптомов. Это может помочь избежать потери зрения.
Лечение
Лечение младенцев, инфицированных ЦМВ, зависит от типа и тяжести симптомов. Лечение должно проводиться специалистом в индивидуальном порядке.
Здоровым людям обычно не требуется никакого специального лечения ЦМВ.
Хотя ЦМВ неизлечимо, реципиентам трансплантата органов, людям со СПИДом и другим людям с иммунными нарушениями может потребоваться лечение для подавления латентной инфекции. Лечение ЦМВ может включать попытки исправить основное иммунное расстройство. Например, опыт лечения людей со СПИДом показывает, что когда улучшается иммунная система человека, могут улучшаться заболевания, связанные с ЦМВ.
Лекарства, используемые для лечения ЦМВ, включают ганцикловир (Цитовен или Витрасерт), валганцикловир (Вальцит), цидофовир (Вистид) и фоскарнет (Фоскавир).
- Ганцикловир можно вводить внутривенно (в вену), перорально или в виде гранул, имплантированных в глаз для лечения инфекции сетчатки.
- Валганцикловир всасывается лучше, чем ганцикловир, но в остальном эти два препарата очень похожи.
- Цидофовир одобрен для лечения ЦМВ ретинита.
- Фоскарнет следует вводить внутривенно и обычно назначают тем, у кого есть вирус, устойчивый к ганцикловиру, или тем, у кого есть серьезные побочные эффекты от ганцикловира.
Побочные эффекты ганцикловира и валганцикловира включают подавление лейкоцитов (необходимых для борьбы с инфекцией), красных кровяных телец (переносящих кислород) и тромбоцитов (которые способствуют свертыванию крови). Поскольку цидофовир и фоскарнет могут вызывать повреждение почек, необходимо тщательно контролировать функцию почек.
Когда звонить профессионалу
Врач должен осмотреть вашего ребенка, если у него или нее желтая кожа (желтуха), проблемы со слухом, сыпь, жар, судороги или рвота.Если вы здоровый взрослый человек, позвоните своему врачу, если у вас сильная боль в животе, рвота или лихорадка, длящиеся более 48 часов, или если у вас значительная усталость, пот, озноб или вы теряете вес.
Если у вас ослабленная иммунная система, обратитесь к врачу, если у вас есть визуальные изменения, психические изменения, трудности или боль при глотании, боль в животе, рвота или диарея, кашель, лихорадка или затрудненное дыхание.
Прогноз
У младенцев последствия могут длиться всю жизнь или быть фатальными.У здоровых людей ЦМВ почти всегда протекает в легкой форме и проходит сам по себе. Люди с ослабленной иммунной системой могут потерять зрение или иметь опасные для жизни или инвалидизирующие заболевания, которые могут потребовать пожизненной терапии для предотвращения этих осложнений.
Внешние ресурсы
Американская академия семейных врачей (AAFP)
http://www.familydoctor.org/
Национальная сеть профилактической информации CDC (NPIN)
http: // www.cdcnpin.org/
Центры по контролю и профилактике заболеваний (CDC)
http://www.cdc.gov/
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Цитомегаловирусная (ЦМВ) инфекция Справочное руководство по заболеваниям
Проверено с медицинской точки зрения Drugs.com. Последнее обновление: 14 марта 2020 г.
На этой странице
Обзор
Цитомегаловирус (ЦМВ) — распространенный вирус. После заражения ваше тело сохраняет вирус на всю жизнь. Большинство людей не знают, что у них CMV , потому что он редко вызывает проблемы у здоровых людей.
Если вы беременны или ваша иммунная система ослаблена, CMV является поводом для беспокойства. Женщины, у которых во время беременности развивается активная инфекция CMV , могут передать вирус своим младенцам, у которых могут возникнуть симптомы.Для людей с ослабленной иммунной системой, особенно для людей, перенесших трансплантацию органов, стволовых клеток или костного мозга, инфекция CMV может быть фатальной.
CMV передается от человека к человеку через жидкости организма, такие как кровь, слюна, моча, сперма и грудное молоко. Лекарства нет, но есть лекарства, которые помогают избавиться от симптомов.
Симптомы
У большинства здоровых людей, инфицированных CMV , симптомы могут отсутствовать.У некоторых наблюдаются незначительные симптомы. Признаки и симптомы CMV более вероятны:
- Новорожденные, инфицированные CMV до рождения (врожденный CMV ).
- Младенцы, инфицированные во время родов или вскоре после них (перинатальный CMV ). В эту группу входят дети, инфицированные через грудное молоко.
- Люди с ослабленной иммунной системой, например, перенесшие трансплантацию органа, костного мозга или стволовых клеток, или инфицированные ВИЧ.
Младенцы
Большинство детей с врожденной ЦМВ кажутся здоровыми при рождении.
У нескольких младенцев с врожденным CMV , которые кажутся здоровыми при рождении, симптомы появляются со временем — иногда не в течение месяцев или лет после рождения. Наиболее частыми из этих поздних признаков являются потеря слуха и задержка развития. У небольшого числа младенцев также могут развиться проблемы со зрением.
Следующие признаки и симптомы чаще встречаются у детей с врожденным CMV , которые болеют при рождении:
- Преждевременные роды
- Низкая масса тела при рождении
- Желтая кожа и глаза (желтуха)
- Увеличенная и плохо функционирующая печень
- Пурпурные пятна или сыпь на коже или и то, и другое
- Аномально маленькая голова (микроэнцефалия)
- Увеличенная селезенка
- Пневмония
- Изъятия
Люди с ослабленным иммунитетом
Если ваша иммунная система ослаблена, вы можете столкнуться с серьезными проблемами, которые влияют на ваши:
- Глаза
- Легкие
- Печень
- Пищевод
- Желудок
- Кишечник
- Мозг
Здоровые взрослые
Большинство людей, инфицированных CMV , которые в остальном здоровы, не испытывают почти никаких симптомов.При первом заражении некоторые взрослые могут иметь симптомы, похожие на инфекционный мононуклеоз, в том числе:
- Усталость
- Лихорадка
- Боль в горле
- Мышечные боли
Когда обращаться к врачу
Обратитесь к врачу, если:
- У вас ослабленная иммунная система, и вы испытываете симптомы инфекции CMV . Для людей с ослабленной иммунной системой инфекция CMV может быть серьезной или даже смертельной.Люди, перенесшие трансплантацию стволовых клеток или органов, подвергаются наибольшему риску.
- У вас развивается болезнь, похожая на мононуклеоз, во время беременности.
Если у вас CMV , но в остальном вы здоровы, и вы страдаете каким-либо легким генерализованным заболеванием, возможно, у вас период реактивации. Самообслуживания, например, много отдыха, должно быть достаточно, чтобы ваше тело могло контролировать инфекцию.
Когда вашему ребенку следует обратиться к врачу
Если вы знаете, что были инфицированы CMV во время беременности, сообщите об этом врачу вашего ребенка.Врач, скорее всего, осмотрит вашего ребенка на предмет проблем со слухом или зрением.
Причины
CMV относится к вирусам, вызывающим ветряную оспу, простой герпес и мононуклеоз. CMV может циклически проходить периоды, когда он бездействует, а затем снова активируется. Если вы здоровы, CMV в основном остается в спящем состоянии.
Когда вирус активен в вашем теле, вы можете передать вирус другим людям. Вирус распространяется через жидкости организма, включая кровь, мочу, слюну, грудное молоко, слезы, сперму и вагинальные жидкости.Случайный контакт не передает CMV .
Способы передачи вируса включают:
- Прикосновение к глазам, внутренней части носа или рта после контакта с биологическими жидкостями инфицированного человека.
- Сексуальный контакт с инфицированным человеком.
- Грудное молоко инфицированной матери.
- Трансплантация органов, костного мозга или стволовых клеток или переливание крови.
- Рождение. Зараженная мать может передать вирус своему ребенку до или во время родов.Риск передачи вируса вашему ребенку выше, если вы заразитесь впервые во время беременности.
Факторы риска
CMV — широко распространенный и распространенный вирус, который может заразить практически любого.
Осложнения
Осложнения инфекции CMV различаются в зависимости от вашего общего состояния здоровья и того, когда вы были инфицированы.
Здоровые взрослые
Редко CMV вызывает развитие мононуклеоза у здорового взрослого человека.Другие редкие осложнения для здоровых взрослых включают проблемы с пищеварительной системой, печенью, мозгом и нервной системой.
Люди с ослабленным иммунитетом
Осложнения инфекции CMV могут включать:
- Потеря зрения из-за воспаления светочувствительного слоя глаза (ретинит)
- Проблемы с пищеварительной системой, включая воспаление толстой кишки (колит), пищевода (эзофагит) и печени (гепатит)
- Проблемы нервной системы, включая воспаление головного мозга (энцефалит)
- Пневмония
Младенцы с врожденной ЦМВ
Младенец, мать которого впервые заразилась ЦМВ во время беременности, с большей вероятностью испытает осложнения.Осложнения для малыша могут включать:
- Потеря слуха
- Умственная отсталость
- Проблемы со зрением
- Изъятия
- Несогласованность
- Слабость или проблемы с мышцами
Профилактика
Тщательная гигиена — лучшая профилактика против CMV . Вы можете принять следующие меры предосторожности:
- Часто мойте руки. Используйте воду и мыло в течение 15–20 секунд, особенно если вы контактируете с маленькими детьми или их подгузниками, слюной или другими выделениями из ротовой полости.Это особенно важно, если дети посещают детский сад.
- Избегайте контакта со слезами и слюной при поцелуе ребенка. Вместо того, чтобы целовать ребенка, например, в губы, поцелуй в лоб. Это особенно важно, если вы беременны.
- Не делитесь едой или питьем из одного стакана с другими. Совместное использование стаканов и кухонных принадлежностей может распространять CMV .
- Будьте осторожны с одноразовыми предметами. При утилизации подгузников, салфеток и других предметов, загрязненных жидкостями организма, тщательно вымойте руки, прежде чем прикасаться к лицу.
- Чистые игрушки и столешницы. Очистите все поверхности, контактирующие с детской мочой или слюной.
- Практикуйте безопасный секс. Носите презерватив во время полового контакта, чтобы предотвратить распространение CMV через сперму и вагинальные жидкости.
Если у вас ослабленный иммунитет, вам может быть полезно принимать противовирусные препараты для предотвращения болезни CMV .
Опытные вакцины проходят испытания на женщинах детородного возраста. Эти вакцины могут быть полезны для предотвращения инфекции CMV у матерей и младенцев и снижения вероятности того, что у детей, рожденных от женщин, инфицированных во время беременности, разовьется инвалидность.
Диагностика
Лабораторные тесты, в том числе анализы крови и других биологических жидкостей или пробы тканей, могут обнаружить CMV .
Во время беременности и после родов
Если вы беременны, важно пройти тестирование, чтобы определить, были ли вы когда-либо инфицированы CMV .Беременные женщины, у которых уже выработались антитела CMV , имеют очень небольшую вероятность реактивации инфицирования их будущих детей.
Если ваш врач обнаружит новую инфекцию CMV во время беременности, пренатальный тест (амниоцентез) может определить, инфицирован ли плод. В этом тесте ваш врач берет и исследует образец амниотической жидкости. Амниоцентез обычно рекомендуется, когда на УЗИ видны отклонения, которые могут быть вызваны CMV .
Если ваш врач подозревает, что у вашего ребенка врожденный CMV , важно проверить ребенка в течение первых трех недель после рождения. Если у вашего ребенка CMV , ваш врач, вероятно, порекомендует дополнительные тесты для проверки здоровья органов ребенка, таких как печень и почки.
Для людей с ослабленным иммунитетом
Тестирование на CMV также может быть важно, если у вас ослабленная иммунная система. Например, если у вас ВИЧ или СПИД, или если вам сделали трансплантацию, ваш врач может захотеть регулярно наблюдать за вами.
Лечение
Как правило, здоровым детям и взрослым лечение не требуется. Здоровые взрослые, у которых развивается мононуклеоз CMV , обычно выздоравливают без лекарств.
Новорожденные и люди с ослабленным иммунитетом нуждаются в лечении при появлении симптомов инфекции CMV . Тип лечения зависит от признаков и симптомов и их степени тяжести.
Противовирусные препараты — наиболее распространенный вид лечения. Они могут замедлить размножение вируса, но не могут его устранить.Исследователи изучают новые лекарства и вакцины для лечения и профилактики CMV .
Запись на прием
Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
Перед встречей выполните следующие действия:
- Запишите все симптомы, которые испытываете вы или ваш ребенок. Укажите признаки и симптомы, даже если они кажутся незначительными, например субфебрильная температура или слабость.
- Запишите вопросы, которые задайте своему врачу.Ваше время с врачом ограничено, поэтому может быть полезно подготовить список вопросов.
Для CMV вопросы, которые следует задать своему врачу, включают:
- Что, вероятно, вызывает мои симптомы?
- Какие тесты мне нужны?
- Мое состояние вероятно временное или хроническое?
- Как лучше всего действовать?
- Могу ли я заразить других?
- Есть ли какие-то ограничения, которые мне нужно соблюдать?
- У меня другое состояние здоровья.Как мне лучше всего управлять ими вместе?
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов, в том числе:
- Как давно у вас есть симптомы?
- Вы работаете или живете с маленькими детьми?
- Вам недавно делали переливание крови или трансплантацию органов, костного мозга или стволовых клеток?
- Есть ли у вас заболевание, которое может ослабить вашу иммунную систему, например, ВИЧ или СПИД?
- Вы получаете химиотерапию?
- Вы практикуете безопасный секс?
- Вы беременны или кормите грудью?
Кроме того, если вы считаете, что подверглись воздействию во время беременности:
- Как вы думаете, когда вы могли подвергнуться разоблачению?
- Были ли у вас симптомы этого состояния?
- Проверялись ли вы раньше на CMV ?
© 1998-2019 Фонд медицинского образования и исследований Мэйо (MFMER).Все права защищены. Условия эксплуатации.
Как управлять реактивацией вирусов: Эпштейн-Барр, ЦМВ и др.
, доктор Билл Ролз
Опубликовано 25.01.19
Хотя мы склонны думать о вирусах только тогда, когда нас замедляют насморк или кашель, они в гораздо большей степени являются частью повседневной жизни, чем многие могут себе представить. Вирусы распространены по природе и поражают все живые организмы.
Фактически, ваши клетки и все бактериальные клетки вашего тела, составляющие микробиом, являются хозяевами огромного количества различных вирусов.К счастью, подавляющее большинство вирусов, населяющих ваше тело, являются полезной частью вашего микробного состава.
Однако есть исключения. Помимо обычных простуд и гриппа, которые возникают и проходят на протяжении всей вашей жизни, вы — и все остальные на планете — заражаетесь потенциально опасными вирусами, которые постоянно поселяются в вашем теле . И хотя они, как правило, не вызывают серьезных заболеваний или острых инфекций и вместо этого остаются в тканях в спящем состоянии, если функции вашей иммунной системы ухудшаются, эти вирусы могут реактивироваться и вызывать хронические заболевания.
Я называю вирусы и другие микробы с этими уникальными характеристиками скрытия и оживления «микробами-невидимками», и зная, какие вирусы могут реактивироваться, как они влияют на ваше здоровье и способствуют хроническим заболеваниям, и какие факторы ускоряют реактивацию, могут помочь вам остаться на шаг впереди любых симптомов, которые могут появиться. Вот что вам нужно знать о стелс-вирусах.
Основы вирусов
Вирусы — самые простые из всех биологических форм жизни.На самом деле они настолько просты, что остается спорным, живы ли они вообще, и в настоящее время ни у кого нет однозначного ответа на этот спор.
В отличие от бактерий, которые демонстрируют метаболизм, рост и способность к спонтанному воспроизводству, вирусы состоят исключительно из сегмента генетического материала (либо РНК, либо ДНК), заключенного в белковую оболочку. Они плавают в неактивном или спящем состоянии до тех пор, пока не вступят в контакт с совместимой живой клеткой, после чего вирус проникает в клетку и прикрепляет свою белковую оболочку к внешней мембране клетки.Затем он вводит генетический материал, который берет на себя внутренний механизм клетки-хозяина, заставляя его реплицироваться с РНК или ДНК инфильтратора и генерировать новые вирусы.
Совместимость вируса с живой клеткой является ключевой: каждый тип вируса может инфицировать только определенные типы клеток. Но поскольку подавляющее большинство вирусов никогда не достигают своей намеченной цели, они вместо этого накапливаются в окружающей среде. Это означает, что вируса присутствуют в воздухе, которым вы дышите, на каждой поверхности, к которой вы прикасаетесь, и во всем, что вы едите или пьете — их миллиарды .
В течение жизни вы подвергаетесь почти бесконечному количеству вирусов. К счастью, большинство из них совершенно безвредны — они не специфичны для человека и поэтому не могут инфицировать ваши клетки. Однако у вас есть множество вирусов, которые постоянно действуют в вашем теле. Они являются частью вашего микробного зверинца, которое мы называем микробиомом.
Хотя в первую очередь вы слышите о бактериях, связанных с вашим микробиомом, он также наполнен вирусами. На самом деле, имеет больше вирусной активности в вашем теле, чем бактериальной активности .Хотя наука все еще изучает сложности, связанные с вирусами, предполагается, что, учитывая количество вирусной активности, происходящей внутри здорового тела, большая ее часть должна быть полезной.
Возьмем, к примеру, бактериофаг, вирус, поражающий только бактерии. Бактериофаги сильно влияют на баланс бактерий в кишечнике, на коже и во всем теле, атакуя и убивая патогенные бактерии. Согласно обзору, опубликованному в журнале Journal of Infection in Developing Country (JIDC) , ученые учатся использовать эту особенность, разрабатывая штаммы бактериофагов для лечения бактериальных инфекций. Поскольку вирусы очень специфичны по типам бактерий, которые они могут заразить, бактериофаги могут использоваться для борьбы с определенными угрожающими микробами , не нарушая баланса других микробов в организме.
Вирусы как скрытые микробы
Хотя большинство вирусов, населяющих ваш микробиом, не представляют проблемы, всегда есть выбросы — вирусы, которые могут реактивироваться и вызывать хронические заболевания. Но они делают это только в том случае, если иммунная система дает сбой из-за таких факторов, как инфекции, токсины окружающей среды и стресс.
Симптомы реактивации вируса сильно различаются и включают усталость, симптомы гриппа, мозговой туман, мышечные боли, нарушение сна, раздражительность и непереносимость стресса . Другими словами, все те же симптомы характерны для фибромиалгии, синдрома хронической усталости, хронической болезни Лайма и ряда других хронических заболеваний.
Группа микробов-невидимок, которые могут влиять на ваше самочувствие и влиять на ваше здоровье, включает бактерии, вирусы, простейшие и грибы. За прошедшие годы я составил список из более чем сотни известных микробов, которых можно считать незаметными, и, вероятно, еще многие еще предстоит распознать.
К известным стелс-вирусам, обычно связанным с синдромами, напоминающими усталость, относятся:
- Гепатиты B и C
- Вирус Эпштейна-Барра (EBV)
- Цитомегаловирус (CMV)
- Простой герпес 1 и 2 (ВПГ-1 и ВПГ-2)
- Вирус опоясывающего герпеса (HZV)
- Вирус герпеса человека 6 (HHV-6a и HHV-6b)
- Вирус герпеса человека 7 (HHV-7)
- Парвовирус B19
- Аденовирусы, ассоциированные с хроническими респираторными инфекциями
Из этих возможных вирусов наиболее склонными к симптоматической реактивации являются вирусы герпетического типа, которые включают EBV, CMV, HSV-1, HSV-2, HZV и различные формы HHV.
5 лучших стелс-вирусов, за которыми следует опасаться
Когда вы боретесь с такими симптомами, как усталость, плохой сон, туман в мозгу и раздражительность, естественно захотеть точно знать, какой вирус вызывает проблему. В этом и заключается загвоздка: в отличие от первоначального заражения, реактивация стелс-микроба не происходит изолированно — обычно различные микробы появляются повторно одновременно. И , поскольку каждый человек является носителем различного спектра стелс-микробов, синдромы реактивации у каждого человека немного разные .
При этом понимание особенностей некоторых из наиболее распространенных виновников может дать вам ключ к разгадке того, что заставляет вас чувствовать себя плохо, и поможет вам на пути к выздоровлению.
1. Вирус Эпштейна-Барра
EBV, двухцепочечный ДНК-вирус из семейства герпесов, является одним из наиболее распространенных вирусов, вызывающих болезни у людей. Большая часть населения заражается ВЭБ в раннем возрасте. К зрелому возрасту 95% населения подверглось воздействию .Вирус выделяется со слюной, что дало ему прозвище «болезнь поцелуев».
Люди, подвергшиеся воздействию ВЭБ в детстве, обычно испытывают легкие симптомы или совсем не испытывают их. Только у людей, которые впервые подвергаются воздействию ВЭБ во взрослом возрасте, развивается мононуклеоз — более тяжелое заболевание, характерным для которого является сильная усталость, хроническая боль в горле, субфебрильная температура, отек лимфатических узлов, головная боль и увеличение селезенки. Синдром постепенно проходит, но связанная с ним усталость может длиться месяцами или даже годами.
После излечения первичной инфекции EBV — в детстве или во взрослом возрасте — вирус остается в спящем состоянии в слюнных железах и другой лимфоидной ткани . Любой сбой в иммунной функции может привести к реактивации вируса.
Преобладающими симптомами, связанными с рецидивом, являются усталость и ощущение гриппа. Симптомы реактивации могут усиливаться и уменьшаться в течение многих лет. Хотя мононуклеоз, первичная инфекция ВЭБ, поддается лечению различными противовирусными препаратами, хроническая инфекция ВЭБ — нет.
2. Цитомегаловирус
Как и ВЭБ, ЦМВ представляет собой вирус с двухцепочечной ДНК в семействе герпеса, и он очень распространен — 90% населения в целом было инфицировано ЦМВ в какой-то момент . Начальная инфекция может напоминать мононуклеоз и включать жар, ощущение гриппа, увеличение лимфатических узлов, головную боль и увеличение селезенки. Однако большинство людей, возможно, никогда не осознают, что заразились вирусом; у них будет минимальная реакция или она будет отсутствовать вообще.
После первоначального инфицирования ЦМВ остается в спящем состоянии в фибробластах и других иммунных клетках селезенки, печени и других тканей организма, если только иммунная функция не нарушается и не появляется возможность реактивироваться.Симптомы реактивации вируса аналогичны симптомам ВЭБ и в первую очередь включают усталость и ощущение гриппа. Как и ВЭБ, хронический ЦМВ обычно не поддается лечению противовирусными препаратами.
Наибольшую озабоченность ЦМВ вызывает его связь с сердечно-сосудистыми заболеваниями. Хотя это относительно редко, исследование, опубликованное в журнале Американской кардиологической ассоциации , показало, что сердечно-сосудистых заболеваний, связанных с цитомегаловирусом, могут достигать 13,4% . Но важно отметить, что в исследовании был изучен только один микроб — есть вероятность, что в игру были вовлечены и другие скрытые организмы, как и при других хронических заболеваниях.
3. Вирусы герпеса человека (розеоловирус)
Несколько близкородственных вирусов герпетического типа — HHV-6a, HHV-6b и HHV-7 — вызывают легкое преходящее детское заболевание, характеризующееся сыпью, которая обычно возникает на конечностях. К 2 годам большинство детей заражаются через дыхательные пути. После первоначального заражения вирус остается в организме в спящем состоянии. Реактивация может происходить при нарушении иммунной функции. Основным симптомом реактивации является утомляемость, но по сравнению с другими вирусами он часто менее выражен.
4. Вирус простого герпеса (ВПГ-1 и ВПГ-2)
Это классические вирусы, известные большинству людей как герпес. Как правило, ВПГ-1 связан с лихорадочными волдырями (герпесом вокруг губ), а ВПГ-2 связан с генитальным герпесом, но оба вируса могут возникать в любом месте.
Первоначальная инфекция, вызванная ВПГ-1 или ВПГ-2, характеризуется болезненными язвами и гриппоподобным синдромом с увеличением лимфатических узлов, лихорадкой, мышечными болями, головной болью и усталостью.После первоначального заражения вирус поселяется в нервных тканях.
Реактивация связана с болезненной локализованной язвой и иногда с легкой утомляемостью. Как правило, ВПГ не играет важной роли в синдромах, подобных хронической усталости . И острую инфекцию, и реактивацию можно лечить с помощью противовирусных препаратов, таких как ацикловир или валацикловир.
5. Вирус опоясывающего герпеса
Также известный как вирус ветряной оспы, HZV представляет собой еще один двухцепочечный ДНК, вирус герпетического типа, но он является причиной ветряной оспы у детей.Ветряная оспа может быть серьезным заболеванием с тяжелыми язвенными поражениями по всему телу. Как и вирус простого герпеса, HZV остается в нервной ткани в спящем состоянии после первоначальной инфекции.
Когда HZV снова активируется, это называется черепицей . Это происходит вдоль определенного дерматома — участка кожи, который иннервируется одним нервным трактом, исходящим из спинного мозга. Опоясывающий лишай локализован на одной стороне тела, но может возникать в любом дерматоме. Поражения чрезвычайно болезненны и сопровождаются сильной усталостью и ломотой в теле.
Острое заболевание, такое как ветряная оспа, можно лечить с помощью противовирусной лекарственной терапии, включая ацикловир и валацикловир. Кроме того, вакцинация детей против HZV предотвращает как ветряную оспу, так и опоясывающий лишай. У взрослых вакцинация может предотвратить опоясывающий лишай, но иммунная система должна быть здоровой, чтобы вакцина подействовала.
Стоит ли тестировать на скрытые вирусы?
Человеческая природа желает выявить любые проблемные патогены, вызывающие у вас заболевание, чтобы вы могли получить надлежащее лечение.К сожалению, ответ на вопрос, какие микробы вызывают у вас заболевание, не всегда прост.
Хроническая инфекция любого микроба, будь то вирусная, бактериальная, простейшая или грибковая, напрямую связана с тем, насколько хорошо работает ваша иммунная система. Если сеть вашего организма по борьбе с болезнями выходит из строя, у микробов появляется возможность снова активироваться. Любые и все вирусы, описанные выше, наряду с множеством других микробов, могут процветать и вызывать симптомы. Следовательно, маловероятно, что вам удастся определить конкретный микроб, ответственный за ваши хронические симптомы .
При этом, если ваш врач предлагает тестирование на различные возможности микробов, вы можете сделать это. Тестирование может помочь отличить острую вирусную инфекцию от хронической реактивации . Но если вы взрослый человек с хроническими стойкими симптомами, такими как усталость, мышечные боли или общее ощущение гриппа, вы можете рассчитывать на хроническую реактивацию, которая обычно плохо поддается лечению противовирусными препаратами.
Однако, если вы решите не тестировать, вы все равно можете поправиться.Хорошая новость заключается в том, что за все годы моей работы с пациентами отсутствие тестов редко было препятствием для лечения и выздоровления от хронической болезни Лайма или фибромиалгии . Я обнаружил, что начало программы выздоровления, включающей безопасную комплексную травяную терапию, скорее всего, поможет справиться со всем спектром скрытых микробов, которые могут быть задействованы.
В конце концов, если ваше выздоровление прогрессирует (а обычно так и происходит), вам, вероятно, не придется платить за тестирование.В конце концов, тестирование может быть наиболее полезным для людей, у которых есть затяжные, проблемные симптомы, которые не улучшаются с помощью комплексной программы лечения травами.
Растворы для реактивации вирусов
На первый взгляд, линейка стелс-вирусов может показаться огромным списком проблем, которые необходимо решить. Но выздоровление от синдромов вирусной реактивации требует осознания того, что движущая сила проблемы уникальна: хроническая иммунная дисфункция.
Помните, вирусы и другие скрытые микробы становятся активными и вызывают симптоматическое заболевание, только если иммунная система оказывается под угрозой; в противном случае они молчат.И хорошая новость заключается в том, что натуральных лечения и модификации образа жизни могут принести вам пользу независимо от того, какой вирус или комбинация вирусов реактивирует .
Чтобы восстановить хорошее самочувствие, ваша конечная цель — долгосрочное подавление микробов, чтобы ваша иммунная система могла восстановиться и держать эти надоедливые вирусы под контролем. Для подавления микробов и восстановления нормальных функций иммунной системы лечение травами представляет собой многообещающий подход к управлению реактивацией вируса. Я предпочитаю противовирусные травы:
Поскольку в смеси часто бывает много разных видов микробов, которые способствуют развитию болезней, Мне нравится тот факт, что эти травы также обладают широким спектром антимикробных свойств против бактерий, простейших и грибов .Кроме того, они укрепляют вашу иммунную систему, еще один важный компонент восстановления.
Конечно, восстановление иммунной системы также требует устранения основных причин хронической иммунной дисфункции. Всегда есть факторы, способствующие реактивации микробов. Иногда это стрессовое событие, такое как сильная эмоциональная или физическая травма, но часто это хронический стресс, который со временем накапливается.
Факторы, которые могут вызвать реактивацию, можно разделить на пять различных категорий — я называю их системными разрушителями.Сведение к минимуму каждого из этих разрушителей помогает ускорить выздоровление, помимо преимуществ одних трав.
Системный разрушитель №1: Неестественная современная диета
В нашем быстро меняющемся мире быстрого питания легко достать пакет чипсов и газировку, когда мы жаждем перекуса — они вкусные, дешевые и не требуют времени на подготовку, скажем, , измельчить свежие овощи для обмакивания в хумус. Но регулярное употребление продуктов с высокой степенью переработки и упакованных продуктов лишает ваше тело жизненно важных питательных веществ, необходимых для восстановления, и нарушает работу всех систем организма.
Natural Solution: Делайте покупки по периметру продуктового магазина, где выставлены самые свежие и богатые питательными веществами продукты, и избегайте центральных проходов, заполненных упакованными и упакованными вещами. Затем заполните корзину такими продуктами, как органическое мясо, овощи, полезные жиры и фрукты с низким содержанием сахара, чтобы обеспечить наиболее здоровую диету.
Системный разрушитель №2: Токсины в окружающей среде
Скрытые токсины, токсические вещества (побочные продукты производства пластмасс, нефти и угля) и искусственная энергия электронных устройств могут подавлять функции иммунной системы и вызывать системное воспаление.Еще один основной источник
экологических токсинов в современном мире: плесень. Примерно в 50% домов есть проблемы с плесенью в помещении. При вдыхании споры плесени и микотоксины могут атаковать иммунные симптомы, способствовать подавлению иммунитета и прокладывать путь для распространения вирусов и других микробов.
Natural Solution: Максимально сведите к минимуму воздействие токсинов окружающей среды: выбирайте стеклянные банки вместо пластиковых, фильтруйте воду и воздух, не спите с телефоном у кровати и по возможности проводите техническую детоксикацию.Кроме того, будьте бдительны в отношении скрытых источников влаги или плесени в вашем доме и как можно скорее очистите их, чтобы поддерживать чистоту.
Разрушитель системы № 3: Хронический стресс
Постоянный стресс (из-за финансовых трудностей, проблем в отношениях, раздоров на рабочем месте) — частая причина вирусной реактивации. Это свирепствует в нашем обществе и оказывает значительное влияние на способность иммунной системы отражать скрытые микробы.
Natural Solution: Если вы столкнулись с вспышкой вирусов, подумайте, какие меры вы принимаете для здорового управления стрессом.Вы уделяете первостепенное внимание своему сну и придерживаетесь регулярного режима сна? Вы говорите «нет» чрезмерным обязанностям на работе? Вы ограничиваете время, которое проводите с людьми, которые вызывают у вас стресс? Если ответ на эти вопросы отрицательный или они напоминают о других постоянных источниках стресса в вашей жизни, пора принять меры и уменьшить или устранить те вещи в вашей жизни, которые постоянно вызывают у вас беспокойство.
Системный дезинтегратор №4: низкий уровень активности
Со временем малоподвижный образ жизни может привести к ухудшению кровообращения, снижению способности выводить токсины из организма, снижению иммунной функции и ухудшению уровня усталости.
Естественное решение: Изначально, если вы испытываете вирусную реактивацию, вы можете не чувствовать себя в состоянии повысить уровень своей активности; иногда вам может потребоваться отдых, пока вы не начнете выздоравливать. Однако вам не нужно заставлять себя работать на максимум, чтобы ощутить терапевтические преимущества движения. Слабые восстанавливающие упражнения, такие как йога, пилатес, неторопливая прогулка или цигун, могут обеспечить легкий импульс, необходимый для ведения активного образа жизни и преодоления вирусной реактивации, не переусердствуя.
Разрушитель системы № 5: дисбаланс микробиома
Дисбаланс микробиома усугубляет дисфункциональную иммунную систему, давая скрытым патогенам способность увеличиваться, что может вызвать появление новых или ухудшающихся симптомов.
Натуральный раствор: Чтобы смягчить симптомы, связанные с реактивацией вируса, рассмотрите возможность использования травяного подхода для балансировки микробиома. Прием правильных трав позволяет подавить вредные микроорганизмы, не уничтожая полезную флору в кишечнике.В дополнение к рассмотренным выше противовирусным травам, другие травы, которые подходят для этой задачи, включают:
Кроме того, чтобы максимально использовать свой протокол восстановления, не забудьте дать себе время хорошо выспаться. В среднем восемь часов каждую ночь могут уменьшить воспаление, улучшить вашу энергию и поддержать вашу иммунную систему.
К счастью, в большинстве случаев восстановительного подхода к поддержанию работы иммунной системы и управлению вирусной реактивацией будет достаточно для выздоровления, хотя имейте в виду, что это может занять некоторое время.Но с терпением, настойчивостью, ежедневным лечением травами и ведением более здорового образа жизни у вас будут инструменты, необходимые для восстановления вашего здоровья и жизненных сил, и вскоре вы снова почувствуете себя лучше.
Доктор Ролз — врач, победивший болезнь Лайма с помощью натуральных трав. Вы можете узнать больше о болезни Лайма в новом бестселлере доктора Роулза « Unlocking Lyme ».
Вы также можете узнать о личном пути доктора Ролза в преодолении болезни Лайма и фибромиалгии в его популярном сообщении в блоге My Chronic Lyme Journey.
1. Кардинг С.Р., Дэвис Н., Хойлс Л. Обзорная статья: кишечный виром человека в здоровье и болезни. Алимент Фармакология и терапия . 2017 ноя; 46 (9): 800-815. DOI: 10.1111 / apt.14280
2. Коэн Дж. Оптимальное лечение хронической активной болезни, вызванной вирусом Эпштейна-Барра. Детская трансплантация. 2009 июн; 13 (4): 393–396. DOI: 10.1111 / j.1399-3046.2008.01095.x
3. Коллин В., Фламанд Л. Интеграция HHV-6A / B и патогенез, связанный с реактивацией хромосомно интегрированного HHV-6A / B.Вирусы. 2017; 9 (7): 160. DOI: 10.3390 / v
60
4. Драборг А.Х., Дуус К., Хауэн Г. Вирус Эпштейна-Барра в системных аутоиммунных заболеваниях. Клиническая и развивающая иммунология. 2013; 2013: 535738. DOI: 10.1155 / 2013/535738
5. Друлис-Кава З., Майковска-Скробек Г., Мацеевска Б., Делаттре А.С., Лавин Р. Изучение бактериофагов — преимущества и ограничения применения фагов и фаг-кодированных белков. Современная наука о белках и пептидах . 2012 Dec; 13 (8): 699–722. DOI: 10.2174/138920312804871193
6. Данмайр С.К., Хогквист К.А., Бальфур HH. Инфекционный мононуклеоз. Актуальные темы микробиологии и иммунологии . 2015; 390: 211–240. DOI: 10.1007 / 978-3-319-22822-8_9
7. Энквист Л.В., Лейб Д.А. Внутренняя и врожденная защита нейронов: разрядка с герпесвирусами. Журнал вирусологии . 2016 16 декабря; 91 (1). DOI: 10.1128 / JVI.01200-16
8. Ханниган Г.Д., Мейзел Дж. С., Тайлдсли А.С. и др. Виром двухцепочечной ДНК кожи человека: топографическое и временное разнообразие, генетическое обогащение и динамические ассоциации с микробиомом хозяина. мБио . 2015 20 октября; 6 (5): e01578-15. DOI: 10.1128 / mBio.01578-15
9. Голкар З., Багасра О, Пейс Д.Г. Бактериофаговая терапия: потенциальное решение кризиса устойчивости к антибиотикам. Журнал инфекций в развивающихся странах s. 2014 13 февраля; 8 (2): 129-36. DOI: 10.3855 / jidc.3573
10. Хоулдкрофт К., Келлам П. Генетика хозяина инфекции вируса Эпштейна – Барра, латентность и болезнь. Обзоры в медицинской вирусологии. 2015 Март; 25 (2): 71–84. DOI: 10.1002 / RMV.1816
11. Hutt-Fletcher LM.Долгая и сложная связь между вирусом Эпштейна-Барра и эпителиальными клетками. Журнал вирусологии . 2016 16 декабря; 91 (1). DOI: 10.1128 / JVI.01677-16
12. Лопетузо Л.Р., Яниро Дж., Скальдаферри Ф., Каммарота Дж., Гасбаррини А. Виром кишечника и воспалительное заболевание кишечника. 2016 июл; 22 (7): 1708-12. DOI: 10.1097 / MIB.0000000000000807
13. Пашале М., Клеричи П. Серологическая диагностика вирусной инфекции Эпштейна-Барра: проблемы и решения. Всемирный журнал вирусологии. 12 февраля 2012 г .; 1 (1): 31–43.DOI: 10.5501 / wjv.v1.i1.31
14. Раканиелло, В. Вирусология с профессором Винсентом Раканиелло [видео]. YouTube. https://www.youtube.com/watch?reload=9&v=Xp2rjyrQ6Ys&index=12&list=WL&t=0s.Опубликовано 24 января 2016 г.
15. Stanfield BA и Luftig MA. Последние достижения в понимании вируса Эпштейна-Барра [версия 1; судей: 4 одобрены]. F1000Research 2017, 6 (F1000 Faculty Rev): 386 (https://doi.org/10.12688/f1000research.10591.1)
16. Торли-Лоусон, Д.А. Постоянство EBV — введение вируса.Актуальные темы микробиологии и иммунологии. 2015; 390 (часть 1): 151-209. DOI: 10.1007 / 978-3-319-22822-8_8
17. Целлос С. и Фаррелл П. Вариация последовательности вируса Эпштейна-Барра — биология и болезнь. Патогены. 2012 Dec; 1 (2): 156–175. DOI: 10.3390 / pathogens1020156
18. Уоррен-Гэш К., Форбс Х., Брейер Дж. Связь между герпесвирусными инфекциями человека и деменцией или умеренными когнитивными нарушениями: протокол систематического обзора. BMJ Open. 23 июня 2017 г .; 7 (6): e016522. DOI: 10.1136 / bmjopen-2017-016522
19.Вольф Ю.И., Казлаускас Д., Иранзо Дж. И др. Происхождение и эволюция глобального РНК-вирома. 2018 ноябрь-декабрь; 9 (6): e02329-18. DOI: 10.1128 / mBio.02329-18
Скрытая ЦМВ-инфекция вызывает фенотип хронической инфекции при ревматоидном артрите
Результаты недавнего исследования предполагают, что латентная цитомегаловирусная (ЦМВ) инфекция в условиях хронического аутоиммунного реактивного состояния индуцирует «фенотип хронической инфекции» в CD8 + Т-клетках, которые проявляют аутореактивный цитолитический потенциал. Результаты исследования были опубликованы в журнале « Arthritis and Rheumatology».
Наличие латентной ЦМВ-инфекции влияет на клиническое течение ревматоидного артрита (РА), который является аутоиммунным заболеванием, опосредованным Т-клетками. Сообщается, что инфекция ЦМВ вызывает клональные экспансии Т-клеток, создавая популяцию Т-клеток, реагирующих с антигеном ЦМВ.
Латентная ЦМВ-инфекция связана с повышенной экспрессией рецептора естественных клеток-киллеров, лейкоцитов, иммуноглобулин-подобного рецептора 1 (LIR-1) на поверхности CMV-реактивных CD8 + Т-клеток. У здоровых людей экспрессия LIR-1 может ограничивать повреждение, вызванное устойчивым иммунным ответом против ЦМВ, что позволяет предположить, что аномальная экспрессия LIR-1 может быть вовлечена в РА в условиях ЦМВ-инфекции.
Чтобы изучить экспрессию и функцию LIR-1 у CMV-положительных пациентов с РА, исследователи сравнили фенотип, цитолитический потенциал, CMV-специфическую пролиферацию и секрецию интерферона-ƴ Т-лимфоцитами LIR-1 + у пациентов с РА с таковыми у пациентов с РА. здоровая контрольная группа.
Исследователи наблюдали повышенную частоту CD8 + Т-клеток с CMV pp65-специфическими Т-клеточными рецепторами у CMV-положительных пациентов с РА. У этих пациентов CMV-специфические CD8 + Т-клетки обычно были LIR-1 + и демонстрировали терминально дифференцированный полифункциональный фенотип.
Количество LIR-1 + CD8 + Т-клеток увеличивалось с возрастом и активностью заболевания, и эти клетки также показали высокий уровень реактивности к антигенам ЦМВ. Исследователи также провели лигирование LIR-1 с растворимыми молекулами HLA-G in vitro. Они наблюдали, что молекулы играют ингибирующую роль при экспрессии на CD8 + Т-клетках у пациентов с РА.
«Наши данные показывают, что сложная сеть и точно настроенные перекрестные помехи между молекулами UL18, HLA-G и классическим [главный комплекс гистосовместимости] класса I с LIR-1 распространяются во время инфекции ЦМВ при РА», — говорят авторы. написал.«Как следствие, дефицит растворимого HLA-G может снизить ингибирующие эффекты LIR-1 на CD8 + Т-клетки у CMV-положительных пациентов с РА».
Авторы пришли к выводу, что фенотип индуцированной хронической инфекции, вероятно, снижается LIR-1, чтобы избежать подавляющих иммунопатологических изменений в условиях RA. Дефицит HLA-G при РА и ассоциация экспрессии LIR-1 с активностью заболевания позволяют предположить, что Т-клетки LIR-1 + плохо контролируются при РА и могут участвовать в патогенезе заболевания.
Они также отмечают, что LIR-1 + CD8 + Т-клетки «все еще могут участвовать в иммунологическом контроле скрытой ЦМВ-инфекции, что иллюстрирует возможные нежелательные побочные эффекты иммуносупрессии при этом заболевании».
Резюме и клиническая применимость
По сравнению со здоровым контролем, LIR-1 активируется на Т-клетках у пациентов с РА, что приводит к плохому контролю латентной ЦМВ-инфекции. Кроме того, эти LIR-1 + Т-клетки у пациентов с РА полифункциональны и проявляют цитолитический потенциал.
Таким образом, при РА повышенная экспрессия LIR-1 может быть результатом недостаточно контролируемой латентной инфекции CMV, что приводит к увеличению количества Т-клеток, которые сохраняют эффекторные свойства, включая цитолиз. LIR-1 + Т-клетки могут недостаточно контролироваться при РА и, вероятно, вовлечены в патогенез РА.
Это свидетельствует о том, что клетки с аномалиями экспрессии LIR-1 могут играть важную роль в патогенезе RA, а также могут представлять собой будущую фармацевтическую мишень.
Номер ссылки
Роте К., Квандт Д., Шуберт К. и др.Скрытая цитомегаловирусная инфекция при ревматоидном артрите и повышенная частота цитолитических LIR-1 + CD8 + Т-клеток. Arthritis Rheumatol. 2016; 68 (2): 337-346. DOI: 10.1002 / art.39331.
Эта статья изначально была опубликована на сайте Rheumatology Advisor
МРТ головного мозга новорожденного
Часть 4 — Глава 10 — Инфекция головного мозга новорожденных
Сьюзан Блазер, Венита Джей, Лоуренс Э. Беккер и Э. Ли Форд-Джонс
10
Неонатальные инфекции ЦНС, приобретенные в утробе матери (врожденные), во время родов или после родов, остаются важной причиной острых и длительных неврологических заболеваний.Патологические особенности и связанные с ними модели визуализации зависят от стадии развития ЦНС, сродства конкретного инфекционного агента к конкретному типу клеток ЦНС и способности хозяина реагировать на это воздействие. С открытием цитокинов и молекул адгезии и демонстрацией рекрутирования лимфоцитов через гематоэнцефалический барьер (ГЭБ) теперь известно, что ЦНС способна создавать и распространять воспалительный ответ на инфекции. Этот иммунный ответ был вызван при повреждении головного мозга новорожденных, даже когда материнская инфекция, которая, возможно, возникла до беременности, напрямую не затрагивает мозг плода.Воздействие инфекции на быстро развивающийся мозг, подверженность которого постоянно развивается, в сочетании с развивающейся иммунной системой, приводит к сложным паттернам патологии и визуализационным характеристикам, отличным от тех, которые наблюдаются у ребенка старшего возраста, больного аналогичным инфекционным агентом.
Определенные факторы помогают в диагностике и дифференциации врожденных и неонатальных инфекций. Этиологический агент может быть известен, если мать подверглась воздействию инфекционного агента или имела симптоматическую инфекцию.Окончательный диагноз зависит от всестороннего клинического обследования, офтальмологического обследования, микробиологического тестирования младенца и матери и серийных контрольных серологических исследований младенца. Кроме того, фактические клинические проявления инфекции у новорожденного отличаются для вирусов, бактерий и паразитов. Младенцы с бактериальными инфекциями, скорее всего, будут иметь сепсис, тогда как у детей с цитомегаловирусными (ЦМВ) или токсоплазмозными инфекциями могут быть клинически бессимптомные при рождении, несмотря на их очевидное внутричерепное поражение при визуализации или офтальмологическом обследовании.Новорожденные с вирусными инфекциями могут иметь активный гепатит, кожные пузырьки или петехии.
Механизм заражения и повреждения также различается у возбудителей инфекции, что приводит к более точной визуализации и патологическим проявлениям. Например, вирусы имеют тенденцию вызывать селективный некроз определенных типов клеток, тогда как бактерии и грибы менее избирательны. Кроме того, различные модели кальцификации на КТ или патологических образцах типичны для различных инфекций STORCH (сифилис, токсоплазмоз, краснуха, ЦМВ, вирус иммунодефицита человека (ВИЧ) и простой герпес), и время инсульта в течение жизни плода может привести к любому из них. тератогенные или энцефалокластические эффекты.Таким образом, клиническая и визуальная дифференциация этих заболеваний и их соответствующих инфекционных агентов часто возможна 3, 8, 20, 21, 73, 83 .
<предыдущая | наверх | содержание | следующая>
МРТ должна включать стандартные Т1 и Т2 взвешенные изображения как минимум в двух плоскостях у любого младенца с подозрением на инфекцию. Сагиттальная плоскость полезна для обнаружения тромбоза пазух. Осевые изображения всегда должны включать полный вид задней черепной ямки для визуализации поперечных пазух.Использование контраста обязательно для обнаружения ранних изменений в мозговых оболочках или паренхиме и для установления полной степени любых аномалий. В настоящее время признается роль диффузно-взвешенной визуализации у пациентов с инфекцией. Если позволяет время, последовательность восстановления инверсии с ослабленным флюидом (FLAIR) может дать дополнительную постконтрастную информацию.
<предыдущая | наверх | содержание | следующая>
Рис. 10.1 Туберкулезная инфекция с васкулитом. В этом поле показаны несколько сосудов с трансмуральным воспалительным инфильтратом (стрелка).Артериит (наконечник стрелки) — частое осложнение туберкулезного менингита. Васкулит артерий и вен может привести к тромбозу и геморрагическому инфаркту. (Пятно H&E, вид с низким увеличением.)
Факторы, предрасполагающие к бактериальным инфекциям у новорожденных, включают материнский сепсис или хориоамнионит, колонизацию материнского шейки матки возбудителями, такими как стрептококк группы B, длительный разрыв мембран перед родами, осложнения родов и родоразрешения, а также дефицит клеточно-опосредованного или гуморального иммунитета у детей. младенец.Нозокомиальная и ятрогенная этиологии включают воздействие резервуаров патогенов в отделении интенсивной терапии новорожденных и инвазивные процедуры, такие как эндотрахеальная интубация, доступ к центральным сосудам или отведение спинномозговой жидкости. Стрептококк группы B и Escherichia coli ( E. coli ) являются наиболее распространенными бактериями, вызывающими серьезные заболевания у новорожденных. Инфекция от кишечных организмов чаще встречается в течение первых 2 недель жизни, особенно при использовании внутриродовой профилактики стрептококков группы B, тогда как инфекции от стрептококков и стафилококков становятся более распространенными во время вторых 2 недель жизни.E. coli имеет особую склонность инфицировать новорожденных, поскольку фракция макроглобулина 19-S, содержащая материнские антитела к бактериям группы кишечной палочки, не проникает через плаценту, что приводит к отсутствию пассивно приобретенного иммунитета к грамотрицательным организмам. Другими важными агентами в неонатальном периоде являются Listeria monocytogenes и другие представители группы Enterobacteriaceae, Citrobacter sp. и Enterobacter sp. Инфекции Staphylococcus aureus и Epidermidis особенно распространены у новорожденных после хирургических операций, а также у новорожденных с постоянными шунтами или центральными венозными линиями.К 2-месячному возрасту с потерей пассивного иммунитета наблюдается рост инфекций ЦНС с Hemophilus, Pneumococcus и Meningococcus .
Гематогенное распространение бактерий от омфалита, инфекции мочевыводящих путей или пневмонии приводит к сосуществованию перитонита, артрита и в некоторых случаях менингита. Для проникновения в ЦНС бактерии должны пересечь эпителиально-слизистый барьер, такой как верхние дыхательные пути, слизистая оболочка кишечника или культя пуповины, чтобы достичь кровотока.Фактическое место и механизм выхода бактерий из кровотока в спинномозговую жидкость полностью не определены во всех случаях. Пути включают распространение через структуры без интактного ГЭБ, такие как сосудистое сплетение, факторы, выделяемые организмом, которые обеспечивают внутриклеточный транспорт и прямую инвазию стенки сосуда, а также сосудистые нарушения с прямым проникновением в соседнюю некротическую ткань мозга. Негематогенные пути, ведущие к инфекции CSF, включают прямое распространение, например, из вышележащей инфекции кожи головы, или прямую инокуляцию через желудочковый шунт или пункцию.У новорожденных с бактериальными инфекциями ЦНС часто наблюдаются апноэ, летаргия и другие признаки молниеносного системного заболевания или шока, а не признаки раздражения менингеальных сосудов (рис. 10.2). Выпуклый родничок и судороги — это неспецифические признаки, которые наблюдаются в связи с любой причиной повышенного внутричерепного давления в этой возрастной группе, даже если инфекционный агент не вовлечен в интракраниальное вмешательство. Недоношенные младенцы из-за недостаточности неонатальных защитных механизмов хозяина и более высокой проницаемости лептоменингов даже более восприимчивы, чем доношенные новорожденные, к бактериальным инфекциям, включая менингит.У них также намного выше смертность. Показатели смертности младенцев от стрептококков группы B, например, колеблются от 70% для недоношенных с массой тела менее 1 кг до 10% или менее у младенцев с массой тела более 2,5 кг 4, 40, 48, 57, 70, 85 .
Осложнения бактериального менингита чрезвычайно распространены у детей младше 6 месяцев. Поэтому у новорожденных рекомендуется последующая визуализация, чтобы исключить наличие осложнений, требующих хирургического вмешательства или изменения терапии. К таким осложнениям относятся церебрит, инфаркт (рис.10.1), абсцесс головного мозга, субдуральный выпот или эмпиема, тромбоз синуса, вентрикулит и гидроцефалия. При неосложненном бактериальном менингите микроорганизмы и гнойный экссудат воспалительных клеток заполняют борозды над полушариями и распространяются вдоль периваскулярных пространств. Происходит набухание поверхностных сосудов, и неплотный гематоэнцефалический барьер от периваскулярного воспаления приводит к усилению менингеальных и цистернальных сосудов. Присутствие и степень этого усиления более последовательно документируется на МРТ, чем на КТ, но может быть продемонстрировано на обоих методах визуализации (рис.10.2 и рис. 10.3). Первоначально экссудат состоит из гранулоцитов, позже количество моноцитов увеличивается, и происходит прогрессирующая организация экссудата с пролиферацией фибробластов. Субдуральные выпоты, эмпиемы, лептоменингеальные рубцы и фиброз, арахноидит с локализацией спинномозговой жидкости еще больше осложняют неонатальный менингит, хотя, как сообщается, эти скопления реже встречаются у новорожденных, чем у младенцев старше 2 месяцев. Стерильные субдуральные выпоты присутствуют почти у половины детей с менингитом в течение первого года жизни.Очень небольшой процент из них, примерно 2%, разовьется в эмпиемы. Субдуральные выпоты и эмпиемы могут потребовать хирургического отбора образцов для дифференциации, хотя полезные функции визуализации, предполагающие образование эмпиемы, увеличивают корки и интенсивность сигнала, которые не соответствуют CSF. Эмпиемы с большей вероятностью содержат белковую жидкость, при этом интенсивность сигнала на изображениях T2W выше, чем в CSF. Сигнал нижележащего мозга также более вероятно будет аномальным при наличии эмпиемы, чем при наличии выпота.Сигнал в мозге, связанный с эмпиемой или инфицированными скоплениями, изменчив, с повышенным сигналом на изображениях T2W, отражающим отек или ишемию 25, 34, 82, 85 . Снижение интенсивности сигнала при T2W-визуализации соседней коры и подкоркового белого вещества, вероятно, отражает повышенную перфузию сосудов и потерю ауторегуляции сосудов в нижележащем мозге (рис. 10.4).
Рис. 10.2 Стрептококк группы В с водоразделом инфаркта. Неусиленная (а) и усиленная (б) аксиальная КТ выявляют плохую дифференцировку затылочного серо-белого цвета, усиление кортикального слоя и наличие двусторонних эмпием (стрелки) у 7-дневного доношенного ребенка, который поступил в шок с судорогами и фиксировался. ученики.
Рис. 10.3 Менингит, вызванный E. coli, с лентикулостриатным инфарктом. Осевое изображение FLAIR (а) доношенного новорожденного показывает усиление сигнала, заполняющего борозды (стрелка). Этот воспалительный экссудат усиливается (стрелка) на аксиальном изображении T1W (500/20) после введения гадолиния-DTPA (b). Очаговое усиление сигнала инфаркта (стрелка) присутствует в правых базальных ганглиях на изображении T2W (3000/120) (c). Толстый базальный гнойный экссудат (стрелка), закрывающий сосуды, виден на образце вскрытия (d) еще одного младенца, умершего от E.coli менингит.
Рис. 10.4 Эмпиема E. Coli T1 (600/14) (a) и взвешенные по T2 (3000/120) (b) аксиальные изображения у 3-недельного ребенка со сложным врожденным пороком сердца и менингитом, вызванным E. coli очаговый эпидуральный сбор, стирающий правое полушарие мозжечка (стрелка). Обратите внимание на едва уловимый слабый сигнал окружающей ткани мозга на изображении T2W, вероятно, из-за местной закупорки сосудов. Эта коллекция не вызывала подозрений до визуализации, и хирургическим путем было доказано, что это эмпиема.
Увеличение желудочков может быть результатом закупорки отверстий Монро, водопровода Сильвия и выходов 4-го желудочка фибринозным воспалительным экссудатом, который возникает даже при отсутствии вентрикулита. Вентрикулит, однако, является частым и ранним компонентом неонатального менингита, поскольку сосудистое сплетение является частым местом попадания бактерий в ЦНС. Внутрижелудочковый экссудат покрывает сосудистое сплетение, разрушает эпендимальную выстилку и приводит к субэпендимальному венозному тромбозу и, в конечном итоге, субэпендимальному некрозу.Визуализирующие признаки вентрикулита следует искать у всех пациентов с менингитом, но в ранних случаях они могут быть незаметными. Уровни гнойной жидкости и утолщение эпендимы можно увидеть при всех методах визуализации, включая сонографию. Сообщалось, что перивентрикулярная полоса повышенной эхогенности является признаком сонографии головного мозга. Эта полоса также может наблюдаться при химическом вентрикулите после внутрижелудочкового кровотечения, в сочетании с интерстициальным отеком, связанным с обструктивной гидроцефалией, или с перивентрикулярными кальцификациями при инфекциях STORCH.Увеличение и утолщение эпендимы на МРТ и КТ также может наблюдаться после внутрижелудочкового кровоизлияния. Формирование внутрижелудочковой кисты и мостиковые эпендимные тяжи приводят к изоляции желудочков и затрудняют лечение локализаций у выживших на стадии выздоровления и хронической стадии 8, 22, 34, 63, 84 (рис. 10.5).
Рис. 10,5 Pseudomonas с вентрикулитом. Парасагиттальная сонограмма головы (а), выполненная в возрасте 15 дней для оценки системного сепсиса, вызванного Pseudomonas, снижения гемоглобина и низкого количества тромбоцитов у близнецов гестационного возраста 31 неделя, демонстрирует множественные эхогенные очаги в веществе мозга.Осевые изображения T2 (3000/120) (b) и неусиленные и улучшенные T1W (600/22) (c, d, e) с МРТ, выполненного на 30-й день жизни, показывают локализованные изолированные желудочки, мультифокальное кровоизлияние в мозг (стрелка) , и прикрепленное сосудистое сплетение glomus. Также были выявлены эмпиемы позвоночника (f). Последующая МРТ в возрасте 2 лет (не показана) подтвердила обширное разрушение перивентрикулярного вещества головного мозга и кальцификацию у шунтированного и сильно задержанного в развитии ребенка.
Поражение мозговой ткани или церебрит возникает после распространения экссудата по периваскулярным пространствам.Церебрит обычно выявляется при вскрытии менингита; однако особенности изменения и усиления сигнала извилистой формы не всегда присутствуют на ранних стадиях вовлечения мозга. Эти очаги изменения и усиления сигнала могут исчезнуть с терапией или прогрессом. По мере прогрессирования инфекции экссудат, покрывающий поверхностные вены, приводит к тромбофлебиту и окклюзии корковых вен у взрослых. Венозные окклюзии при неонатальном менингите обычно являются вторичными по отношению к фибринозным тромбам внутри венозных скоплений, а не распространяются из основных венозных синусов, и возникают раньше в ходе заболевания у младенцев, чем у взрослых (рис.10.6). Инфаркты, связанные с менингитом, обычно бывают венозными, хотя иногда возникает артериальный инфаркт из-за поражения базальной лептоменингеальной артерии (рис. 10.1 и рис. 10.3). Инфаркт, вызванный обоими путями, встречается примерно у 30% новорожденных с менингитом и часто бывает обширным и геморрагическим. Возникают инфаркты коркового вещества и белого вещества, при этом поражение белого вещества значительно чаще встречается у новорожденных, чем у взрослых. Окклюзия и инфаркт субэпендимальных и перивентрикулярных вен способствуют повреждению.Остаточный глиоз, энцефаломаляция и порэнцефалия присутствуют на контрольных изображениях. 15, 25, 34 .
Рис. 10.6 Синовенозный тромбоз у новорожденного с сепсисом. Неусиленные сагиттальные (а) и аксиальные (b) T1W и T2W (c) и 2D TOF-изображения МР-венографии (d) демонстрируют верхний сагиттальный синус (a) (стрелка), левый внутренний церебральный и медиальный венозный тромбоз предсердий и связанный с ним геморрагический лобное белое вещество и инфаркт базальных ганглиев. Венограмма (d) показывает отсутствие наполнения левой внутренней церебральной вены (верхняя стрелка) и плохое наполнение поперечных пазух (нижние стрелки).Крупным планом — менингеальная поверхность в случае острого бактериального менингита. Обратите внимание на гнойный экссудат, заполняющий борозды и покрывающий поверхностные вены у другого пациента, некоторые из которых кажутся тромбированными (e).
Абсцессы головного мозга могут возникать в результате гематогенного происхождения, прямого заражения или локального распространения, особенно в пораженный мозг. В отличие от взрослых, большинство абсцессов головного мозга у новорожденных является осложнением бактериального менингита. У 5–10% новорожденных с менингитом развиваются абсцессы, за исключением инфицированных Citrobacter sp.у 75% разовьются абсцессы. Когда микроорганизмы обладают низкой вирулентностью, могут наблюдаться ранние и поздние стадии церебрита с минимальным нарушением ГЭБ и усилением контраста. У более старшего возраста происходит быстрое развитие улучшения, связанное с острой воспалительной реакцией. Усиление может быть диффузным до образования коллагеновой капсулы и некротического центра. Особенности визуализации хорошо развитых абсцессов у младенцев старшего возраста включают периферический отек и центральный некроз с гиперинтенсивной жидкостью абсцесса по отношению к спинномозговой жидкости при коротких сканированиях TR (время повторения) и гиперинтенсивностью к серому веществу при длинных сканированиях TR.Обычны концентрические зоны различной интенсивности, как и капсулы абсцесса с гиперинтенсивным сигналом относительно мозга на коротких TR и гипоинтенсивным относительно белого вещества на длинных TR-сканированиях. Интенсивность капсульного сигнала, вероятно, связана с наличием свободных радикалов от макрофагов. Пациенты с ослабленным иммунитетом и новорожденные, чья иммунная система является незрелой, часто не развивают значительную воспалительную реакцию, что приводит к ошибочным или плохо развитым результатам визуализации. Абсцессы новорожденных часто имеют большие размеры и не имеют четко выраженного капсульного образования.Смертность значительно выше у младенцев 29, 45, 85 (рис. 10.7 и рис. 10.8), хотя очаговые лобные церебральные абсцессы могут быть клинически незаметными у недоношенных детей, и отдаленные результаты удивительно хорошие (рис. 10.8) .
Рис. 10.7 Citrobacter — серийная компьютерная томография доношенного ребенка, у которого развивается сепсис на 8-й день Citrobacter Менингит со стерильным «абсцессом», вызванный инфарктом головного мозга. Первоначально церебрит с отеком лобных долей наблюдается на 11-й день (а).Через 19 дней впоследствии наблюдаются обширные участки некроза белого вещества с усилением ободка (b). Доказанный абсцесс (c) в конечном итоге показывает массовый эффект, а «округление» проявляется через 28 дней. Контрольная КТ (d) в возрасте 4 месяцев при эпилептическом статусе демонстрирует атрофию, очаговое рубцевание и слабую кальцификацию.
СПЕЦИАЛЬНЫЕ ОРГАНИЗМЫ
Стрептококк группы B (GBS)
GBS — частично предотвратимый, но, к сожалению, частый этиологический агент неонатального менингита.Системные стрептококковые инфекции группы B встречаются у 10% новорожденных, у которых наблюдается материнская колонизация шейки матки, что составляет 1–5 случаев на 1000 живорождений. Менингит сосуществует примерно у 5–10% из них. Сообщалось о миелите. Известно, что недоношенность, длительный разрыв плодных оболочек и хориоамнионит у матери повышают риск неонатальной инфекции. Инфекции могут появиться в течение первых 24 часов или до 3-месячного возраста. Новорожденные с большей вероятностью, чем дети старшего возраста, будут иметь шоковое состояние и молниеносное течение, а младенцы с очень низкой массой тела при рождении имеют смертность около 70%.У пациентов с более поздним началом болезни более коварная картина — менингит и остеомиелит. Некрологические последствия у выживших после менингита GBS включают гидроцефалию, задержку развития и судороги (рис. 10.2) 4, 32, 69 .
Listeria monocytogenes
Listeria monocytogenes , грамположительная бактерия, имеет тенденцию заражать очень молодых и очень старых. Загрязнение пищевых продуктов, особенно непастеризованным сыром, является причиной многих случаев заражения взрослых. Listeria вызывает гнойный лептоменингит с одним важным фактором, отличающим от других причин неонатального менингита: плод и плацента могут инфицироваться, что приводит к самопроизвольному аборту или преждевременным родам. Хроническое поражение женских половых путей приводит к привычному выкидышу. Типичная клиническая картина у новорожденных с ранним началом инфекций, вызванных Listeria , включает гриппоподобное заболевание матери, преждевременные роды с неповрежденными плодными оболочками, окрашивание мекония, перинатальную асфиксию, неонатальный респираторный дистресс, макулопапуловезикулярную кожную сыпь, преобладание моноцитов в эндоратотрахеальном аспирате. менингит и внутрижелудочковое кровоизлияние.Поражение ЦНС чаще встречается у младенцев с поздним началом инфекции. Поражение мозговых оболочек и головного мозга состоит из милиарных гранулем и микроабсцессов. Склонность к гнойному менингоэнцефалиту или поражению моста и продолговатого мозга у взрослых Инфекция Listeria не наблюдается у плода и новорожденного. Гидроцефалия, кистозная энцефаломаляция, перивентрикулярная кавитация и кальциноз могут присутствовать у выживших 2, 4, 34 (рис. 10.8).
Рис.10.8 (a-d) Citrobacter diversus — MR у 5-недельного ребенка. Осевые МРТ-изображения FLAIR (a), T1W (b) и T2W (3000/120) (c) в отделении интенсивной терапии новорожденных 5-недельного возраста «выпускник» демонстрируют множественные некротические и инфицированные полости с усилением обода, дочерние кисты и жидкость с различной интенсивностью сигнала в соответствии с кровью и гноем. Патологический образец (d) от другого пациента с Citrobacter демонстрирует абсцесс большого белого вещества.
Рис.10.8 (e-f) Enterobacter sakazakki . Последовательность, взвешенная по T1 (860/20), у недоношенного ребенка в возрасте 34 недель в возрасте 4 дней (e) и 6 лет (f). Большой лобный абсцесс клинически отсутствовал. В 6 лет — атрофия и глиоз правой лобной доли. Развитие нормальное, хотя у него недавно начавшиеся очаговые судороги. (С разрешения доктора Мэри Резерфорд.)
Рис. 10,8 (г-ч) Listeria monocytogenes . Осевые изображения T1 (860/20) (g) и T2W fast spin echo (3000/208) (h) у 3-недельного ребенка, родившегося недоношенным на 32-й неделе после симптоматической инфекции Listeria monocytogenes у матери.Имеется обширное внутрижелудочковое кровоизлияние с прилегающим инфарктом справа (стрелка). Слева имеются обширные перивентральные кистозные поражения (стрелка). (С разрешения доктора Мэри Резерфорд.)
Citrobacter diversus
Citrobacter diversus — грамотрицательная кишечная бактерия, которая также имеет пристрастие к пожилым и очень молодым. У ослабленного пожилого пациента он поражает мочевыводящие пути и дыхательную систему. У младенцев он вызывает неонатальный сепсис и менингит. Citrobacter sp. редко заражают ребенка старше 8 недель, в то время как недоношенный ребенок особенно подвержен заражению. Считается, что низкая внутриклеточная выживаемость у хозяина с интактной зрелой иммунной системой является ответственной за низкую вирулентность, связанную с C. diversus за пределами неонатального периода. Приобретенный вертикально или при вспышках в питомниках, он более важен как патоген из-за тяжести последствий, чем его фактическая распространенность. На Citrobacter приходится менее 5% случаев менингита у новорожденных, но он приводит к абсцессам мозга у 75% или более младенцев с менингитом.Неврологические последствия присутствуют у большинства выживших после менингита Citrobacter . Описаны рецидивы и рецидивирующий вентрикулит с длительным сохранением в ЦНС. Сообщалось также о абсцессах спинного мозга. Визуализирующие особенности характерны для множественных крупных очагов, усиливающих кольцо, в виде некроза белого вещества, инфарктов с кавитацией и образования абсцесса. Патологические признаки включают скопление менингеальных сосудов, вентрикулит с очаговым разрушением эпендимы, перивентрикулярный некроз и обширный некроз белого вещества 27, 38, 81, 85 (рис.10.7 и рис. 10.8).
Грибковый менингит
Грибковый менингит может быть приобретен внутриутробно в результате восходящей инфекции хориона, во время родов из инфицированных половых путей матери или постнатально. Candida , сапрофит здоровых людей, является наиболее частым из этих грибковых агентов. К кандидозу предрасполагают ослабление сил, состояние с ослабленным иммунитетом, внутренние очаги и лечение антибиотиками. Особенно восприимчивы недоношенные дети.Сообщается, что системный кандидоз встречается у 3–5% новорожденных с очень низкой массой тела при рождении, при этом поражение ЦНС наблюдается у 64% из них. Поражение ЦНС часто трудно доказать прижизненно, так как концентрация в спинномозговой жидкости может быть низкой, а скорость роста в культуральной среде — медленной. Отличительной чертой патологических изменений являются микроабсцессы. Микроабсцессы могут быть обнаружены при вскрытии у младенцев с явно нормальным МРТ. Маленькие макабсцессы являются наиболее частой находкой при визуализации у новорожденных с очень низкой массой тела при рождении, с небольшими эхогенными микробабсцессами в форме ободка, симметрично разбросанными в подкорковых, перивентрикулярных и базальных областях ганглиев.Дискретные точечные или расширяющиеся по краю диссеминированные мелкие макроабсцессы очень хорошо видны на улучшенных изображениях T1W. Также может быть продемонстрировано слияние макабсцессов, дилатации желудочков и вентрикулита. Дифференциация перивентрикулярной лейкомаляции от поражений основана на характере и времени поражения, при этом кандидозные поражения возникают позже и чаще затрагивают глубокие серые структуры. Поражение паренхимы более типично, но также встречается поражение желудочков.Видны внутрижелудочковые тяжи и обломки, утолщенное неправильное сосудистое сплетение и утолщенные неправильные стенки желудочков. Последующие изображения демонстрируют регресс поражений, хотя встречаются кальцинированные гранулемы. Инвазия головного и спинного мозга приводит к некротическому энцефалиту и энцефаломиелиту. Патологические образцы демонстрируют широко распространенный некротический энцефалит, гранулоцитарные инфильтраты, реактивную пролиферацию глии и большие абсцессы или военные микроабсцессы. Острые очаги Candida с инфильтрирующими нейтрофилами, дрожжевыми грибами и псевдогифами могут быть широко распространенными, включая глубокое белое и серое вещество и субэпендимный зародышевый слой.Особое участие присутствует в зонах водоразделов. Более мелкие хронические очаги обычно локализуются в коре головного мозга, базальных ганглиях, ядрах ствола мозга и лептоменингах. У более старшего ребенка Candida имеет тенденцию вызывать гнойный лептоменингит и вентрикулит, аналогичные бактериальным возбудителям. Гидроцефалия и локализация спинномозговой жидкости — частые осложнения (рис. 10.9). Aspergillus , крайне редко встречается у новорожденных, вызывает аналогичные патологические и, следовательно, визуализирующие признаки. Мукормикоз , также крайне редко, приводит к инфаркту из-за прямой сосудистой инвазии и тромбоза, в дополнение к некрозу от паренхиматозной инвазии, наблюдаемой при других грибковых инфекциях 8, 30, 34, 51, 54, 86 .
Рис. 10.9 Candida абсцессы у недоношенного ребенка 15 дней. Осевые изображения T1 (500/20) (a) и T2W (3000/120) (b) у недоношенного ребенка с системным кандидозом демонстрируют множественные очаги небольших макабсцессов (стрелка).Взвешенные изображения T1 (860/20) (c) и T2 (2700/120) (d) у второго недоношенного ребенка, родившегося на 26 неделе и полученные на 41 неделе, через 12 недель после эпизода кандидозной септицемии. В белом веществе есть множественные поражения, соответствующие кальцификации макабсцессов Candida. Патологические коронарные срезы мозжечка и ствола головного мозга (е) у другого пациента демонстрируют множественные очаги церебрита.
Детский ботулизм
Детский ботулизм — это заболевание младенцев чуть более старшего возраста, хотя были описаны случаи неонатального развития.Младенцы до 1 года подвергаются риску из-за состава кишечной флоры. Clostridium botulinum споры, попавшие в организм с зараженным медом, колонизируют кишечный тракт, связываются с кишечным эпителием, прорастают и производят нейротоксин, который впоследствии абсорбируется. Скелетные мышцы парализованы из-за пресинаптической блокады высвобождения ацетилхолина. У младенцев возникают трудности с приемом пищи, расширение кишечника и желудка, глазной и бульбарный паралич, нисходящий паралич мышц и апноэ.Считается, что внутричерепные проявления связаны с ассоциированной гипоксией. Особенности МРТ не описаны, хотя мы наблюдали демиелинизацию мозолистого тела и усиление нервных корешков конского хвоста у 6-месячного младенца, у которого были проблемы с кормлением, птоз и употребление меда в анамнезе 78 .
Туберкулез
Туберкулез может возникнуть у очень маленьких детей, но крайне редко встречается у новорожденных. Врожденный туберкулез был описан в случае активного туберкулеза у матери, хотя он был более распространен в до-противотуберкулезную химиотерапевтическую эпоху.Заражение происходит через плаценту, аспирацию околоплодных вод во время родов или после послеродового респираторного воздействия. Наблюдается милиарная диссеминация, хотя чаще встречается базальный лептоменингит с инфарктом головного мозга из-за окклюзии базальных перфораторов (рис. 10.1). Гидроцефалия, туберкулез с массивным казеозом и плохой периферической лимфогистиоцитарной реакцией, а также поздняя лептоменингеальная кальцификация — это осложнения 34, 56 .
ВРОЖДЕННЫЕ ИНФЕКЦИИ (ВИЛОМ)
Значительный прогресс был достигнут в профилактике или лечении врожденных инфекций с помощью иммунизации, внутриутробной диагностики и терапии.Однако эти инфекции, обычно включающие сифилис, токсоплазмоз, краснуху, ЦМВ, ВИЧ и вирус простого герпеса (ВПГ), не были ликвидированы. ЦМВ остается наиболее распространенным заболеванием, которым страдает 1 из 100 живорожденных в США. ВИЧ, Treponema pallidum и Toxoplasma gondii следуют за ростом заболеваемости ВИЧ, передаваемым вертикально. Вирус простого герпеса и ветряная оспа поражают 1 из 5 000 и 1 из 10 000, соответственно, а заболеваемость краснухой снизилась до 1 из 100 000.Пути передачи несколько различаются: чаще всего передаются ВИЧ и краснуха внутриутробно , ВПГ передается во время родов, а ЦМВ передается внутриутробно , во время родов и в послеродовом периоде. Дополнительные врожденные инфекции включают ветряную оспу, гепатит, энтеровирус, парвовирус, вирус лимфоцитарного хориоменингита, лихорадку Ку, малярию и туберкулез 31, 43 .
Диагностика врожденных инфекций, независимо от того, достигают ли они плода гематогенным трансплацентарным путем или восходящим путем по родовым путям, остается сложной задачей.Необходимые материнские инфекции обычно протекают бессимптомно, и некоторые младенцы могут быть клинически нормальными при рождении, а позже клинически проявляются лишь оккультными оккультными, аудиологическими осложнениями и осложнениями со стороны ЦНС. Задержка внутриутробного развития, гидроцефалия или микроцефалия, эхогенная кишечная непроходимость, кишечная непроходимость, кальцификации печени или мозга, водянка плода, асцит, плевральный или перикардиальный выпоты должны указывать на внутриутробную инфекцию. Требуется специальное тестирование. Например, тестирование полимеразной цепной реакции (ПЦР) на околоплодных водах доступно при подозрении на инфекцию Toxoplasmosis gondii .Неонатальные особенности могут указывать на наличие врожденной инфекции, хотя многие из них не являются специфическими. Системное поражение включает задержку внутриутробного развития при краснухе, токсоплазмозе и ЦМВ. Гепатоспленомегалия встречается при ЦМВ, краснухе, токсоплазмозе, ВПГ, сифилисе, энтеровирусе и парвовирусе В19. Аналогичным образом прогрессирующая потеря слуха встречается при краснухе, ЦМВ, токсоплазмозе и сифилисе. Анемия может возникать при многих врожденных инфекциях, хотя это особенность парвовируса B19 из-за склонности вируса к эритроцитам плода.Другие клинические признаки могут быть более специфичными, например, врожденный порок сердца при краснухе, паралич конечностей и рубцы при ветряной оспе. Кожные поражения также являются полезными маркерами. Петехии, пурпура, желтуха и кожный эритропоэз наблюдаются при токсоплазмозе, краснухе и ЦМВ, тогда как у младенцев с симптомами вирусной инфекции простого герпеса могут быть единичные или сгруппированные кожные пузырьки, конъюнктивит и язвы во рту 28, 31 .
Патологические и рентгенологические признаки несколько различаются между врожденными инфекциями, хотя кальцификаты и некроз являются отличительными признаками.При сифилисе и краснухе могут иметь место признаки плоских пленок, такие как «стебель сельдерея» длинных костей, а характер кальцификации ЦНС также может дать полезные подсказки. Например, у младенцев с ЦМВ часто возникают перивентрикулярные повреждения с последующим некрозом и кальцификациями. Токсоплазмоз приводит к более диффузным кальцификациям, хотя базальные ганглии и перивентрикулярные кальцификаты встречаются часто. Кальцификации также наблюдаются при парвовирусных инфекциях и вирусных инфекциях лимфоцитарного хориоменингита. Разветвляющиеся эхогенные очаги при сонографии головного мозга возникают при врожденных инфекциях, особенно при ЦМВ, краснухе и ВИЧ, но могут наблюдаться при множестве других заболеваний, таких как асфиксия, хромосомные аномалии, алкогольный синдром плода и неиммунная водянка.Краснуха ассоциируется с поражением сосудов и хроническим менингоэнцефалитом, а ВПГ — с очагами некроза и кровоизлияниями. Краснуха и герпес — инфекции, которые чаще всего вызывают обширные кальцификации коры головного мозга, тогда как краснуха и ЦМВ приводят к микренцефалии. Субэпендимальные кисты встречаются при ЦМВ и краснухе, но также и при синдроме Зеллвегера после кровоизлияния в зародышевый матрикс и D-2-гидроксиглутаровая ацидурия. Гидроцефалия часто встречается при токсоплазмозе, сифилисе и энтеровирусе. Врожденные миксовирусы, включая эпидемический паротит и парагрипп, также имеют предрасположенность к эпендимным клеткам, что приводит к врожденной гидроцефалии 14, 31, 52, 75, 79 .
<предыдущая | наверх | содержание | следующая>
СИФИЛИС
Рис. 10.10 Врожденный сифилис. Коронарная проекция головного мозга взрослого человека, пережившего врожденный сифилис, показывает очаговую атрофию левого мозга с углублением борозд, наложенную на диффузную потерю объема вещества мозга.
Инфекции сифилиса возникают после трансплацентарной передачи трепонемы обычно во время или после 4-го месяца беременности, хотя инфекция может передаваться в любое время во время беременности.Заражение плаценты может привести к мертворождению и преждевременному аборту. Наиболее тяжело инфицированные выжившие плоды инфицируются относительно поздно, после 24 недели беременности, и существует высокая перинатальная смертность. Подавляющее большинство инфицированных младенцев при рождении клинически бессимптомны, что требует тщательного анализа серологических данных матери и последующего наблюдения, чтобы избежать долгосрочных осложнений со стороны ЦНС. Водянка плода и гепатомегалия встречаются часто. У новорожденных могут наблюдаться экзантема, ринит и гепатоспленомегалия.«Псевдопаралич» конечностей в результате остеохондрита — хорошо известная клиническая особенность новорожденных. Кроме того, сообщалось о некротическом энтероколите в результате сосудистого заболевания аорты. Существуют как менинговаскулярные, так и паренхиматозные формы нейросифилиса новорожденных. Паренхиматозное заболевание приводит к диффузной церебральной и мозжечковой дегенерации с пролиферацией микроглии и воспалительными инфильтратами. Менинговаскулярная форма связана с периваскулярным воспалительным экссудатом, пролиферацией интимы и лептоменингеальными спирохетными массами, хотя повреждение паренхимы обычно незначительно.Гидроцефалия может возникнуть в результате сифилитического менингита. Иногда наблюдаются поверхностные корковые инфильтраты и некрозы. Скрытый внутриутробный сифилис (lues tarda) связан с потерей слуха, деформацией резцов, седловидным носом и деформациями большеберцовой кости. Tabes dorsalis встречается редко 1, 34, 64 (рис. 10.10).
ТОКСОПЛАЗМА
Токсоплазма — простейший паразит, вызывающий трансплацентарную инфекцию (токсоплазмоз) человеческого плода в течение или после 3-го месяца плода, и является третьей по распространенности инфекцией головного мозга плода после ЦМВ и ВИЧ.Кошки являются конечным хозяином с ооцистами, выделяемыми с фекалиями кошек. Факторы риска для матери включают воздействие кошачьих экскрементов во время беременности или употребление сырого, ранее размороженного мяса. Загрязненное водоснабжение было связано с одной вспышкой. Инфекция матери обычно протекает бессимптомно, хотя поражение ЦНС встречается примерно у половины инфицированных плодов. Скорость инфицирования увеличивается с каждым триместром, в то время как фактическая тяжесть инфекции уменьшается. Водянка плода, асцит, плевральный и перикардиальный выпот и гидроцефалия могут быть замечены на сонографии плода.Хотя у новорожденных могут быть симптомы при рождении с клиническими признаками, аналогичными врожденному ЦМВ, они обычно протекают бессимптомно. Важным отличительным признаком будет размер головы, поскольку новорожденные с врожденным ЦМВ обычно имеют микроцефалию, тогда как у новорожденных с врожденным токсоплазмозом чаще встречается гидроцефалия. Высвобождение Toxoplasma из кист приводит к интенсивной воспалительной реакции и гранулематозному некрозу. Прогрессирующая гидроцефалия возникает в связи с мутной, белковой спинномозговой жидкости, эпендимитом и последующей обструкцией водопровода.Заметное расширение предсердий боковых желудочков часто встречается у пациентов с гидроцефалией, связанной с Toxoplasma . Аномалии миграции нейронов обычно не наблюдаются, хотя на изображениях видно замедленное созревание миелина. Базальные ганглии и перивентрикулярные кальцификации являются обычным явлением, могут наблюдаться даже у бессимптомных детей и даже могут со временем исчезнуть без лечения. Хориоретинит чрезвычайно распространен и может привести к прогрессирующей потере зрения у бессимптомных детей.Лечение in utero доступно и улучшает исход; лечение в течение первого года жизни также улучшает неврологический исход 8, 13, 33, 34, 36, 67 (рис. 10.11).
Рис. 10.11 Исчезающий кальциноз при врожденном токсоплазмозе. На неулучшенных осевых изображениях головного мозга 12-месячного младенца видно увеличение желудочков (а). КТ в возрасте 4 лет показывает, что кальцификация мозга со временем уменьшается (b). Окрашивание HE, вид с большим увеличением (c) показывает кисту токсоплазмы (стрелка), характерную для установленной инфекции, окруженной воспалительными клетками.Кисты могут обнаруживаться по периферии некротических поражений и могут сохраняться годами. (КТ этого случая используются с разрешения доктора Клинга Чонга из больницы для больных детей на Грейт-Ормонд-стрит.)
РУБЕЛЛА
Краснуха, вирус семейства Togaviridae с одноцепочечной РНК, вызывает немецкую корь, обычно самоизлечимое и доброкачественное заболевание у детей. Однако последствия врожденной краснухи, особенно приобретенные в начале первого триместра, являются серьезными. Фактическая заболеваемость врожденной краснухой после инфицирования матери, как сообщается, является низкой, хотя в критические первые 12 недель беременности частота инфицирования плода может достигать 80%.Врожденные пороки сердца зарегистрированы более чем у половины, глухота из-за повреждения кортиевого органа — примерно у половины, а визуальные изменения, такие как катаракта, — примерно у 40%. Кроме того, у 40% выживших наблюдается задержка в развитии. Неврологические симптомы связаны с вирусной инвазией и репликацией в ткани мозга. Краснуха, по-видимому, оказывает антимитотическое действие на размножение клеток головного мозга, а микрофалия является частым исходом инфекции плода. Основными типами клеток ткани мозга, инфицированных вирусом краснухи in utero , являются астроциты и иногда нейрон.Олигодендроциты относительно устойчивы, что приводит к отсутствию значительной демиелинизации, хотя происходит задержка созревания миелина.
Вирус краснухи имеет особую тенденцию поражать эндотелий сосудов плаценты и плода. Патологические изменения сосудистой системы головного мозга обнаруживаются на патологических образцах более чем в половине случаев. Очаговое разрушение сосудистых стенок с утолщением и разрастанием приводит к сужению просвета. Возникают минерализующие микроангиопатии с артериальной окклюзией и инсультом.Результаты включают гидроэнцефалию, микрофалию, определенную атрофию мозжечка и кальцинированный мозг. Вид сосудов в виде «разветвленных свечей» виден на сонографии головного мозга новорожденных. Концевые сосуды в глубоком белом веществе и базальных ганглиях наиболее часто поражаются в патологических исследованиях младенцев, умерших от синдрома врожденной краснухи. Считается, что этот ишемический паттерн вовлечения отвечает за изменения MR, наблюдаемые у взрослых выживших. Психиатрические нарушения у выживших взрослых наблюдались у 50% выживших после симптоматической врожденной краснухи.Врожденная краснуха также считается важной причиной аутизма. Линейные гиперинтенсивные очаги в глубоком белом веществе лобных и теменных долей являются обычным явлением, наблюдаются более чем у половины выживших взрослых с симптомами шизофрении, а у детей — нормальными, за исключением глухоты. Выжившие дети могут также демонстрировать задержку созревания миелина и подкорковые и перивентрикулярные поражения белого вещества. В другом исследовании взрослых с врожденной краснухой и симптомами, сходными с шизофренией, присутствовали небольшие внутричерепные объемы мозга и увеличение желудочков с сохранением бороздок 4, 8, 16, 34, 35, 37, 46, 53, 60, 61, 74 , 79, 80, 87 (Инжир.10.12).
Прогрессирующее поражение головного мозга с лейкоэнцефалопатией, глиозом и атрофией встречается в подгруппе младенцев, у которых развивается постнатальный прогрессирующий панэнцефалит краснухи. Симптомы, слабоумие, атаксия и судороги при этой медленной вирусной инфекции возникают в возрасте от 8 до 21 года у мужчин с клиническими признаками синдрома врожденной краснухи 59 . Особенности сосудов плаценты и сосудов ЦНС при врожденных инфекциях, вызванных вирусом венесуэльского энцефалита лошадей, аналогичны тем, которые наблюдаются при краснухе.Описан массивный церебральный некроз 39 .
Рис. 10.12 Краснуха. Неулучшенная аксиальная КТ (а) у 3-дневного ребенка с врожденной краснухой демонстрирует точечные кальцификации базальных ганглиев (стрелка) и низкое ослабление белого вещества. Ультразвук (не показан) подтвердил минерализующую васкулопатию. Аксиальная и корональная МРТ (b, c) у глухого, слепого и задержанного в развитии подростка, пережившего краснуху, демонстрирует правый лобный инфаркт белого вещества и мозолистого тела, а также аномалии правого глазного яблока после удаления катаракты.Осевое изображение T1W (860/20) (d) у доношенного ребенка, полученное через 5 дней. У нее была задержка роста, петехиальная сыпь и тромбоцитопения. Врожденная краснуха подтверждена серологическими исследованиями. МРТ показала широко распространенный низкий S1 в WM и крупные очаговые кистозные поражения в височных долях ( стрелка ). (С разрешения доктора Мэри Резерфорд, больница Хаммерсмит.)
ЦИТОМЕГАЛОВИРУС (ЦМВ)
ЦМВ заразит большинство из нас в течение нашей жизни. Осложнения со стороны ЦНС у здоровых детей и взрослых встречаются редко.ЦМВ представляет наибольшую опасность для плода, недоношенного ребенка и ребенка с ослабленным иммунитетом. Обычный путь инфицирования плода — трансплацентарный, при первичном инфицировании матери. От 30 до 40% случаев первичного инфицирования матери приводят к инфицированию плода. Гестационный возраст на момент заражения мало коррелирует со скоростью передачи или тяжестью проявления заболевания. Материнские антитела, которые защищают плод от краснухи и токсоплазмоза, не предотвращают передачу вируса ЦМВ внутри плода, но снижают тяжесть заболевания ЦМВ.Приблизительно 1% новорожденных рождаются инфицированными ЦМВ, но у большинства из них развиваются скрытые инфекции после рецидивной, а не первичной материнской инфекции. Считается, что ЦМВ является ведущей инфекционной причиной нейросенсорной тугоухости в эпоху вакцинации против побеллы, поражая примерно 10% инфицированных новорожденных. Мальформация Мондини с отсутствием межскалярной перегородки, коротким и широким внутренним слуховым проходом и увеличенным вестибулярным водопроводом — особенно частые признаки КТ у выживших с ЦМВ с потерей слуха 7, 35, 50, 77 .
У небольшого процента младенцев, инфицированных внутриутробно , будут проявляться желтуха, гепатоспленомегалия, петехии, микроцефалия или хориоретинит. От половины до трех четвертей этих младенцев будут иметь аномальные нейровизуализации. Сообщалось о пренатальной документации атрофии, увеличения желудочков и выступающих пространств спинномозговой жидкости. Перивентрикулярная кальцификация и субэпендимные кисты были зарегистрированы на in utero и постнатальных изображениях черепа. Было показано, что «кольцеобразные» области перивентрикулярного просвета предшествуют развитию субэпендимальной кальцификации и рассматриваются как очаги субэпендимальной дегенерации и воспаления.Последующие глиальные рубцы и дистрофическая кальцификация происходят. Повышенная эхогенность таламо-полосатых артерий была описана при краниальной сонографии при наличии врожденного ЦМВ, хотя эта особенность не специфична для ЦМВ. Было показано, что наличие аномальной КТ-визуализации в неонатальном периоде, с кальцификацией, как наиболее частым явлением, хорошо коррелирует с неблагоприятным исходом для нервного развития. Кальцификаты перивентрикулярных, реже базальных ганглиев выявляются при КТ в 33–43%.Это число ниже, чем то, о котором сообщалось в эпоху обычной кинопленки, вероятно, из-за того, что все чаще выявляются менее серьезно пострадавшие пациенты. Перивентрикулярные очаги аномалии сигнала часто встречаются на МРТ, хотя трудно отличить кальциноз от точечного кровоизлияния, поскольку кальцификаты менее хорошо оцениваются на МРТ, чем на КТ. (Рис. 10.13–10.15). Такие особенности визуализации, как микроцефалия и диффузные кальцификации головного мозга, характерны для синдрома Айкарди-Гутье, семейного заболевания, сопровождающегося лимфоцитозом спинномозговой жидкости. 4, 12, 24, 76, 79 .
Кроме того, на МРТ было описано несколько различных паттернов повреждений, вызванных врожденной ЦМВ-инфекцией, и они отражают особенности, хорошо описанные на патологических образцах. Лиссэнцефалия с истонченной корой головного мозга, увеличенными боковыми желудочками, уменьшенным объемом белого вещества, задержкой миелинизации и малым мозжечком поддерживает поражение зародышевой зоны и, следовательно, инфекцию до 16–18 недель беременности. Локализованная диспластическая кора головного мозга (полимикрогирия) с утолщенной нерегулярной корой и уменьшенным количеством белого вещества может указывать на инфекцию на поздней стадии миграции или в организационной фазе между 18 и 24 неделями.Очаговая полигирия у пациентов из этой популяции чаще всего выявляется в лобных долях и, в меньшей степени, в височных долях. Нормальный круговой паттерн с аномальным сигналом белого вещества поддерживает инфекцию в третьем триместре, но не всегда возможно предсказать паттерн патологии головного мозга на основании сообщенных сроков материнской инфекции4,6,47 (рис. 10.15).
Рис. 10.13 Минерализующая микроангиопатия и перивентрикулярные кисты при ЦМВ. Сонография (а) новорожденного с документально подтвержденной ЦМВ-инфекцией демонстрирует конфигурацию «канделябра» минерализующей микроангиопатии.Субэпендимальные кисты (стрелка) (b) видны у второго новорожденного. КТ без усиления (c) демонстрирует типичные кальцификаты, а также гипоплазию мозжечка (стрелка), общий признак. Соседний разрез (d) того же пациента показывает дополнительное внутрижелудочковое кровоизлияние (стрелка). Окраска HE, вид с низким увеличением (e) в патологическом образце CMV-инфекции демонстрирует внутрипаренхимальные и периваскулярные (тонкая стрелка) воспалительные инфильтраты, а также несколько цитомегалических клеток (толстая стрелка) с внутриядерными включениями.
Рис. 10.14 Хроническая ЦМВ-инфекция у доношенного новорожденного. Взвешенные изображения T1 (450/12) (a) и T2 (3000/80) (b) показывают задержку развития мозга с примитивными сильвиановыми трещинами и гладкой кортикальной поверхностью у доношенного ребенка с микроцефалией и задокументированной врожденной ЦМВ-инфекцией. Обратите внимание на перивентрикулярные кальцификации (стрелки). На коронарных патологических срезах головного мозга (c) у другого пациента обнаруживаются кальцификаты перивентрикулярного и белого вещества (меловые белые области) в случае врожденной ЦМВ-инфекции и задержки развития мозга.
Рис. 10.15 Недоразвитие мозга у 3-летнего ребенка после врожденного ЦМВ. Осевое изображение T2 (2800/90) (a) показывает небольшое левое полушарие головного мозга, обширную демиелинизацию и деструкцию белого вещества, а также покрытые полигирией лобные доли у 3-летнего ребенка с известной внутриутробной инфекцией, возникшей на 8-м месяце плода. Аномальное белое вещество в ЦМВ. Взвешенные изображения T1 (860/20) (b) и T2 (2700/120) (c) у 2-летнего младенца с врожденным ЦМВ с материнским гриппоподобным заболеванием в первом триместре.В белом веществе широко распространена аномальная интенсивность сигнала, это наиболее заметно на изображении, взвешенном по Т2. Ее развитие в 7 лет в пределах нормы. (С разрешения доктора Мэри Резерфорд, больница Хаммерсмит.)
ВРОЖДЕННЫЙ ВИЧ
Врожденный ВИЧ — вторая по частоте вирусная инфекция новорожденных 43 . Обычно передача составляет в утробе матери , хотя передача от матери ребенку также может происходить в послеродовом периоде через грудное молоко.Поражение ЦНС вирусом ВИЧ происходит во время первоначального инфицирования, до периода симптоматического СПИДа. Первоначально специфические иммунные ответы нейтрализующих антител и цитотоксических Т-лимфоцитов подавляют репликацию вируса. Однако вирус вызывает подострый энцефалит с воспалительной Т-клеточной реакцией с инфильтратами периваскулярных мононуклеарных воспалительных клеток, лептоменингитом и иммунной активацией ткани головного мозга с увеличением производства микроглиальных клеток и цитокинов. Повреждение олигодендроцитов цитокинами и миелиновой бледностью.Происходит поздняя потеря нейронов. Глиоз и атрофия головного мозга являются ранними признаками инфекций у взрослых, в то время как нарушение роста мозга характерно для врожденных инфекций. Многоядерный гигантоклеточный энцефалит и вакуолярная миелопатия при СПИДе у детей встречаются реже, чем у взрослых, хотя дегенерация кортикоспинального тракта действительно имеет место 41, 43 .
Ранние клинические признаки заболевания, связанного с ВИЧ, у самых маленьких детей включают в себя недостаточное развитие, гепатоспленомегалию, гиперплазию легочного лимфоида, хроническую диарею, молочницу и рецидивирующие бактериальные инфекции.Наиболее частым признаком ранней энцефалопатии ЦНС, связанной с ВИЧ, является задержка в достижении психомоторных вех. Позже может произойти потеря вех, приобретенная микроцефалия и двустороннее поражение кортикоспинального тракта. Однако часто симптоматика ЦНС незначительна в течение первого десятилетия, при этом заболевание ЦНС колеблется от 8% у бессимптомных детей до 60% у детей с запущенным заболеванием. Симптомы со стороны ЦНС включают статически-стабильную энцефалопатию или подострое медленно прогрессирующее течение. Прогрессирующая минерализующая васкулопатия базальных ганглиев, часто проявляющаяся при рождении, является наиболее частой аномалией при невропатологии и визуализации (рис.10.16). Эта кальцификация обнаруживается на патологических образцах в областях разрастания интимы. Сосудистые полосы видны на сонографии головного мозга, а диффузная мутная повышенная плотность базальных ганглиев часто видна на КТ. В то время как цереброваскулярное заболевание было зарегистрировано в одном исследовании, которое выявлялось при вскрытии у 24% детей с ВИЧ, инсульт встречается у 1-2%, реже у детей старшего возраста, чем у инфицированных взрослых, и реже у младенцев. Происходит аневризматическая дилатация сосудов Виллизиева круга, о которой сообщалось уже в возрасте 6 месяцев 11, 71 .
Рис. 10.16 Минерализующая микроангиопатия и поражения белого вещества при врожденном ВИЧ. Осевая КТ (а) у 2-месячного младенца с известной вертикальной передачей ВИЧ демонстрирует нечеткую минерализующую микроангиопатию базальных ганглиев и таламуса (стрелка). Аксиальный T2W MR (2800/90) (b) у 6-летнего ребенка с вертикальным заражением ВИЧ и неспособностью к развитию показывает фокально аномальный сигнал в подкорковом белом веществе (стрелка). Этот ребенок впоследствии скончался от последствий массивного аневризматического расширения сосудов Уиллисова круга.
Обычная МРТ при врожденном ВИЧ изначально является нормальным явлением, и, несмотря на идентификацию ВИЧ в тканях мозга плода уже на 15 неделе беременности, связанных с этим пороков развития мозга нет. Задержка созревания миелина часто встречается у инфицированных младенцев. Атрофия, заболевание белого вещества, вызванное ВИЧ, особенно с поражением белого вещества коры головного мозга, и прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) являются поздними проявлениями у ребенка с вертикально приобретенным заболеванием, равно как и симптоматическое поражение мозга оппортунистическими инфекциями, такими как токсоплазмоз и ЦМВ.МР-спектроскопия может быть полезна, даже если обычная МРТ в норме. Протонная МРТ-спектроскопия головного мозга является аномальной у новорожденных, подвергшихся воздействию ВИЧ в утробе матери , хотя это не позволяет отличить инфицированных детей от неинфицированных. Пик неспецифической аминокислоты в области 2,1–2,6 частей на миллион, перекрывающий пик N-ацетиласпарагиновой кислоты, высокое соотношение N-ацетиласпартата (NAA) и креатина и высокое соотношение холина и креатина, возможно, были результатом косвенного воздействия. последствия ВИЧ, такие как задержка внутриутробного развития.Предполагается, что повышенный уровень холина является результатом разрушения миелина или гипертрофии микроглии и астроцитов. Уменьшение отношения NAA к креатину, наблюдаемое у детей старшего возраста и взрослых с симптоматической прогрессирующей энцефалопатией ВИЧ, не наблюдалось у новорожденных, подвергшихся воздействию ВИЧ. Потеря NAA при прогрессирующей энцефалопатии ВИЧ, вероятно, является вторичной по отношению к потере корковых нейронов, а также к потере NAA в аксональных отростках. Также описан лактат, возможно, вторичный по отношению к гликолитическому потоку периваскулярных макрофагов, которые, как известно, присутствуют у пациентов с симптомами.Было показано, что пониженное соотношение NAA / креатин и пик лактата у детей с прогрессирующей ВИЧ-энцефалопатией улучшаются после антиретровирусной терапии 5, 9, 19, 62, 68 .
ВИРУС ГЕРПЕС ПРОСТОЙ (HSV)
HSV, чаще всего передающийся во время родов, может нанести значительный ущерб развивающемуся мозгу, независимо от того, был ли он приобретен внутриутробно или внутриутробно или перинатально. Инфекции HSV-2 составляют 80–90% всех случаев неонатального вируса и почти всех случаев врожденного герпеса.Инфекция эндотелиальных клеток с отеком и некрозом мелких сосудов приводит к раннему разрушению мозга и потере плода. У 20% младенцев с неонатальным ВПГ наблюдается изолированное поражение ЦНС, как правило, в течение второй или третьей недели жизни. У этих младенцев могут быть неспецифические клинические признаки, такие как раздражительность, пронзительный крик, лихорадка или плохое питание. Смертность высока, если ЦНС вовлечена в диссеминированный неонатальный ВПГ. Меньшая группа, инфицированная in utero , будет иметь микроцефалию, катаракту и задержку внутриутробного развития.Герпетические высыпания на коже встречаются не всегда, и о материнской инфекции можно не подозревать, поскольку первичные инфекции, представляющие наибольший риск для плода, обычно протекают бессимптомно.
Поражение головного мозга при неонатальном энцефалите диффузное, двустороннее и обычно не затрагивает белое вещество. Предрасположенности к височным долям не возникает. Последовательная визуализация обычно демонстрирует прогрессирующий отек мозга с последующей энцефаломаляцией и периодическим образованием кист, хотя неулучшенная визуализация на ранней стадии заболевания может быть нормой.Некроз вещества головного мозга может быть тяжелым, и есть склонность к поражению мозжечка, базальных ганглиев и ствола мозга. Повышенное корковое ослабление было описано у новорожденных, возможно, из-за расширения корковых сосудов, а не петехиального кровоизлияния или микрокальцификации. Кровоизлияния или кальцификации присутствуют в таламусе, базальных ганглиях, периинсулярной коре, перивентрикулярном белом веществе и в серо-белом соединении у младенцев. Прогрессирующая диффузная кальцификация головного мозга по степени кальцификации может соперничать с краснухой.Сообщалось о минерализованных отложениях, ограниченных митохондриями, в дезинтегрированных клетках, содержащих вирионы простого герпеса. Известны рецидивы или постоянство инфекции, несмотря на соответствующую противовирусную терапию, особенно в сочетании с частыми кожными рецидивами.
Характер разрушения у младенцев, отличный от такового у детей старшего возраста и взрослых, вероятно, связан не только с реакцией развивающегося мозга на герпетический энцефалит, но и с различием в приобретении инфекционного агента.ВПГ-1, как правило, хотя и не только инфекция у детей старшего возраста и взрослых, обычно проникает во внутричерепное пространство через обонятельный нерв, что приводит к специфическому поражению нижней и средней височных извилин у пожилых пациентов. Внутриутробная инфекция HSV-1 также может быть связана с тяжелой и прогрессирующей атрофией и кальцификацией. Сообщалось о нарушениях миграции нейронов в связи с внутриутробным ВПГ-1 4, 8, 10, 17, 18, 26, 34, 42, 49, 55, 58, 65, 77 (рис.10.17).
Рис. 10.17 (a-i) Простой герпес. Неулучшенная аксиальная КТ у 2-месячного младенца (а) показывает легкий отек мозга у ребенка с лихорадкой, судорогами и энцефалопатией. T2W MR (b) показывает более выраженный отек с высокой интенсивностью сигнала, наиболее заметной во фронтальном белом веществе. Подострая сонограмма демонстрирует мультифокальные кистозные поражения (c), в то время как последующая неулучшенная КТ (d) показывает тяжелую поликистозную энцефаломаляцию с обширными корковыми кальцификациями. Обширный церебральный некроз и энцефаломаляция (e) присутствует в случае энцефалита HSV-2.Вскрытие у младенца с энцефалитом HSV-1 (f) показывает очевидную церебральную атрофию с глубокими бороздами, в то время как на разрезе поверхности мозга (g) наблюдается обширный кальциноз (белый меловой материал) и вентрикуломегалия. Пятно H&E, средняя яркость (h) демонстрирует область некроза, окруженную реактивным глиозом. H&E: увеличенное изображение (i) демонстрирует внутриядерные вирусные включения (стрелки) у другого младенца с энцефалитом HSV-1.
Рис. 10.17 (j-l) Неонатальный энцефалит, вызванный простым герпесом.T1W MR (860/20) через 5 дней (j), 12 дней (k) и 3 месяца (l) у младенца с судорогами на 3 день жизни. Первоначальные изображения показывают минимальную низкую интенсивность сигнала в пределах нормального белого вещества, но через 1 неделю наблюдается обширный геморрагический инфаркт WM и коры (k), приводящий к атрофии (l).
ВРОЖДЕННАЯ ВАРИЦЕЛЛА ZOSTER
Врожденные инфекции, вызванные вирусом ветряной оспы, встречаются реже, чем другие врожденные инфекции. Материнский иммунитет высокий, а инфекционность плода явно низкая.Синдром врожденной ветряной оспы обычно возникает в 2–4% случаев материнской инфекции до 20 недель беременности. Специфическим признаком является рубцевание (поражение кожи, вызванное вспышкой молнии) в дерматомном распределении. Гипоплазия и слабость конечностей являются следствием внутриутробного повреждения шейного или пояснично-крестцового сплетений; Возникают сегментарный некроз спинного мозга, ограничение внутриутробного развития (ЗВУР), катаракта, хориоретинит и микрофтальм. Внутричерепные изменения являются последствиями некротического энцефалита и включают гидроцефалию, порэнцефалию, гидранэнцефалию, кальцификации и пороки развития, связанные с нарушением внутричерепных сосудов, такие как полимикрогирия или фокальная лиссэнцефалия.Тяжелая микроцефалия может быть изолированным признаком, и сообщается о гипоплазии мозжечка. Опоясывающий лишай может быть клиническим проявлением у младенцев, инфицированных после 20 недель беременности. Врожденная ветряная оспа, приобретенная во время послеродовой инфекции матери, приводит к проявлению, которое напоминает ветряную оспу у хозяина с ослабленным иммунитетом с пневмонией, прогрессирующей печеночной недостаточностью с нарушениями свертываемости и кровотечением и высоким уровнем смертности (рис. 10.18). Другие инфекционные причины диссеминированной внутрисосудистой коагулопатии у новорожденных включают семейство энтеровирусов, простой герпес и, иногда, токсоплазмоз 4, 23, 44, 66, 72 .
Рис. 10.18 Ветряная оспа. Фульминантная инфекция ветряной оспы в образце вскрытия 6-месячного младенца с диссеминированным внутрисосудистым свертыванием и обширными петехиями. а) Доношенный ребенок с материнской историей ветряной оспы на сроке 15 недель беременности. У него были сколиоз, крипторхизм, микроптальмия и гипотония. Изображение T1W (860/20) в возрасте 8 дней. (b) Имеется обширный кортикальный и WM-инфаркт ( стрелка ) в достаточно зрелом мозге.Врожденных пороков развития головного мозга не было. (С разрешения доктора Мэри Резерфорд, больница Хаммерсмит.)
<предыдущая | наверх | содержание | следующая>
- Инфекции головного мозга новорожденных могут быть приобретены внутриутробно , во время родов или в послеродовой период.
- Последствия зависят от стадии созревания мозга на момент заражения, состояния развивающейся иммунной системы, а также от инфекционности, дозы и фактической клетки-мишени возбудителя инфекции.
- При подозрении на инфекцию следует использовать стандартные протоколы визуализации с усилением контраста.
- Для подтверждения наличия и степени кальцификации может потребоваться компьютерная томография.
- Различные модели патологических повреждений в развивающемся головном мозге приводят к тому, что визуализация отличается от таковой в полностью сформированном мозге; ранние инфекции влияют на органогенез, а более поздние инфекции часто приводят к разрушению мозга.
- Несмотря на вариабельность паттернов повреждений, визуализирующая дифференциация инфекционных агентов возможна.
<предыдущая | наверх | содержание | следующая>
- Айкарди Дж. (1992) Заболевания нервной системы в детстве . Оксфорд, MacKeith Press.
- Alliet P, Van Lierde S, Bruylants B et al. (1992) [Неонатальный листериоз]. Tijdschr Kindergeneeskd 60 (1) , 18–21.
- Арвин Б., Невилл Л.Ф., Бароне ФК и др. (1996) Роль воспаления и цитокинов в повреждении головного мозга. Neurosci Biobehav Rev 20 (3) , 445–452.
- Bale JF и Murph JR (1997) Инфекции центральной нервной системы у новорожденных. Клиника перинатологии 24 (4) , 787–806.
- Barker PB, Lee RR и McArthur JC (1995) Комплекс деменции СПИДа: оценка с помощью протонной МР-спектроскопии. Радиология 195 , 58–64.
- Баркович А.Дж. и Линдан К.Е. (1994) Врожденная цитомегаловирусная инфекция головного мозга: анализ изображений и эмбриологические аспекты. AJNR 15 (4) , 703–715.
- Бауман Н.М., Кирби-Кейзер Л.Дж., Долан К.Д. и др. (1994) Дисплазия Мондини и врожденная цитомегаловирусная инфекция. J Pediatr 124 (1) , 71–78.
- Becker LE (1992) Инфекции развивающегося мозга. AJNR 13 , 537–549.
- Бельман А.Л. (1990) СПИД и детская неврология. Неврологическая клиника 8 (3) , 571–603.
- Benator RM, Magill HL, Gerald B et al. (1985) Энцефалит, вызванный вирусом простого герпеса: результаты КТ у новорожденных и младенцев. AJNR 6 (4) , 539–543.
- Bode H and Rudin C (1995) Кальцифицирующая артериопатия в базальных ганглиях при инфицировании вирусом иммунодефицита человека. Педиатр Радиол 25 , 72–73.
- Boppana SB, Fowler KB, Vaid Y et al. (1997) Нейрорадиографические данные в период новорожденности и отдаленные результаты у детей с симптоматической врожденной цитомегаловирусной инфекцией. Педиатрия 99 (3) , 409–414.
- Bowie WR, King AS, Werker et al. (1997) Вспышка токсоплазмоза, связанная с питьевой водой из городских районов. Ланцет 350 , 173–177.
- Chang YC, Huang CC и Liu CC (1996) Частота линейной гиперэхогенности базальных ганглиев у детей раннего возраста с синдромом врожденной краснухи. Clin Infect Dis 22 (3) , 569–571.
- Chang YC, Huang CC, Wang ST et al. (1997) Фактор риска осложнений, требующих нейрохирургического вмешательства, у младенцев с бактериальным менингитом. Pediatr Neurol 17 (2) , 144–149.
- Чантлер Дж. К., Смирнис Л. и Тай Г. (1995) Селективное инфицирование астроцитов в культурах глиальных клеток человека вирусом краснухи. Lab Invest 72 (3) , 334–340.
- Cleveland RH, Herman TE, Oot RF et al. (1987) Эволюция неонатального герпетического энцефалита, продемонстрированная краниальным ультразвуком с корреляцией компьютерной томографии. Am J Perinatol 4 (3) , 215–219.
- Кори Л., Уитли Р.Дж., Стоун EF и др. (1988) Разница между неонатальным энцефалитом типа 1 и вирусом простого герпеса 2 типа по неврологическому исходу. Ланцет 1 (8575–6) , 1–4.
- Cortey A, Jarvik JG, Lenkinski RE и др. (1994) Протонная МРТ-спектроскопия аномалий головного мозга у новорожденных, рожденных от ВИЧ-инфицированных матерей. AJNR 15 , 1853–1859.
- Dambska M и Laure-Kamionowska M (1998) Морфологическая картина развития менингоэнцефалита в центральной нервной системе. Folia Neuropathol 36 (4) , 205–210.
- Dammann O и Leviton A (1998) Инфекция, удаленная от мозга, повреждение белого вещества новорожденного и церебральный паралич у недоношенного ребенка. Semin Pediatr Neurol 5 (3) , 190–201.
- Daneman A, Lobo E и Mosskin M (1998) Перивентрикулярная полоса повышенной эхогенности: отек или кальциноз? Педиатр Радиол 28 , 83–85.
- Deasy NP, Jarosz JM, Cox TC et al. (1999) Синдром врожденной ветряной оспы: МРТ черепа у выжившего в течение длительного периода времени. Нейрорадиология 41 , 205–207.
- Dias JMJ, van Rijckevorsel GH, Landriue P et al. (1984) Пренатальная цитоломегаловирусная инфекция и церебральная микрогирия: доказательства недостаточности перфузии, а не нарушения гистогенеза, как основной причины цитомегаловирусной энцефалопатии плода. Нейропедиатрия 15 , 18–24.
- Egelhof JC (1997) Инфекции центральной нервной системы.В: Болл WS (Ред.) Детская нейрорадиология . Филадельфия, Lippincott-Raven, стр. 273–318.
- Enzmann D, Chang Y и Augustyn G (1990) Результаты МРТ при неонатальном энцефалите, вызванном простым герпесом 2 типа. J Comput Assist Tomogr 14 (3) , 453–457.
- Eppes SC, Woods CR, Mayer AS и др. (1993) Рецидивирующий вентрикулит, вызванный Citrobacter diversus : клинический и бактериологический анализ. Clin Infect Dis 17 (3) , 437–440.
- Epps RE, Pittelkow MR and Su WP (1995) TORCH-синдром. Семин дерматол 14 (2) , 179–186.
- Ersahin Y, Mutluer S и Guzelbag E (1994) Абсцесс головного мозга у младенцев и детей. Childs Nerv Syst 10 (3) , 185–189.
- Felderhoff-Mueser U, Rutherford M, Squier W et al. (1999) Связь между магнитно-резонансными изображениями и гистопатологическими данными головного мозга у крайне больных недоношенных детей. Am J Нейрорадиол 20 , 1349–1357.
- Ford-Jones EL (1999) Подход к диагностике врожденных инфекций. Детский педиатр 4 (2) , 109–112.
- Ford-Jones EL и Ryan G (1999) Последствия для плода материнских инфекций во время беременности. В: Armstrong A and Cohen J (Eds) Infectious Diseases . Лондон, Мосби, стр. 55.1–55.14.
- Foulon W, Villena I, Stray-Pedersen B et al. (1999) Лечение токсоплазмоза во время беременности: многоцентровое исследование влияния на передачу инфекции у плода и ее последствия у детей в возрасте 1 года. Am J Obstet Gynecol 180 (2) , 410–415.
- Friede RL (1989) Невропатология развития , 2-е изд. Берлин, Спрингер.
- Friedman S и Ford-Jones EL (1999) Врожденная цитомегаловирусная инфекция — обновленная информация. Детский педиатр 4 (1) , 35–38.
- Friedman S, Ford-Jones LE, Toi A et al. Врожденный токсоплазмоз: пренатальная диагностика, лечение и послеродовой исход. Prenat Diagn 19 , 330–333.
- Frey TK (1997) Неврологические аспекты инфекции вирусом краснухи. Intervirology 40 (2–3) , 167–175.
- Gallagher PG и Ball WS (1991) Инфаркт мозга, вызванный инфекцией ЦНС Enterobacter sakazakii. Педиатр Радиол 21 (2) , 135–136.
- Гарсия-Тамайо Дж. (1992) Тератогенный эффект вируса венесуэльского энцефалита лошадей: обзор проблемы. Invest Clin 33 (2) , 81–86.
- Givner LB и Kaplan SL (1993) Менингит, вызванный Staphylococcus aureus у детей. Clin Infect Dis 16 (6) , 766–771.
- Грей Ф, Скаравилли Ф., Эмбалл I и др. (1996) Невропатология ранней инфекции ВИЧ-1. Brain Pathol 6 (1) , 1–15.
- Gray PH, Tudehope DI and Masel J (1992) Кистозная энцефаломаляция и внутриутробная инфекция вируса простого герпеса. Педиатр Радиол 22 (7) , 529–532.
- Griffith BP и Booss J (1994) Неврологические инфекции плода и новорожденного. Neurol Clin 12 (3) , 541–564.
- Grose C (1994) Врожденные инфекции, вызванные вирусом ветряной оспы и вирусом простого герпеса. Semin Pediatr Neurol 1 (1) , 43–49.
- Haimes AB, Zimmerman RD, Morgello S et al. (1989) МРТ абсцессов головного мозга. AJR 152 , 1073–1085.
- Harwood-Nash DC, Reilly BJ и Turnbull I (1970) Массивная кальцификация мозга у новорожденного. AJR 58 (3) , 528–532.
- Hayward JC, Titelbaum DS, Clancy RR et al. (1991) Лиссэнцефалия – пахигирия, связанная с врожденной цитомегаловирусной инфекцией. J Детский нейрол 6 (2) , 109–114.
- Hazebroek FW, Tibboel D, Leendertse-Verloop K et al. (1991) Оценка смертности новорожденных после хирургических операций за 10-летний период: непредотвратимая, допустимая и предотвратимая смерть. J Pediatr Surg 26 (9) , 1058–1063.
- Herman TE, Cleveland RH, Kushner DC et al. (1985) КТ неонатального герпетического энцефалита. AJNR 6 (5) , 773–775.
- Хикс Т., Фаулер К., Ричардсон М. и др. (1993) Врожденная цитомегаловирусная инфекция и неонатальный слуховой скрининг. J Pediatr 123 (5) , 779–782.
- Huang CC, Chen CY, Yang HB et al. (1998) Кандидоз ЦНС у недоношенных новорожденных и младенцев с очень низкой массой тела при рождении: характеристики УЗИ, гистопатологические и МРТ коррелируют у 5 пациентов. Радиология 209 , 49–56.
- Hughes P, Weinberger E и Shaw DW (1991) Линейные области эхогенности в таламусе и базальных ганглиях новорожденных: расширенная ассоциация. Радиология , 179 (1) , 103–105.
- Hwa HL, Shyu MK, Lee CN и др. (1994) Пренатальная диагностика врожденной краснухи от материнской краснухи на Тайване. Obstet Gynecol 84 (3) , 415–419.
- Incesu L, Akan H и Arslan A (1994) Неонатальный церебральный кандидоз: результаты компьютерной томографии и клиническая корреляция. J Belge Radiol 77 (6) , 278–279.
- Jay V, Becker LE, Blaser S et al. (1995) Патология хронической герпетической инфекции, связанной с эпилепсией: отчет о двух случаях тканевого обнаружения вируса простого герпеса 1 с помощью полимеразной цепной реакции. Pediatr Pathol Lab Med 15 , 131–146.
- Канг Г.Х. и Чи Дж.Х. (1990) Врожденный туберкулез — Отчет о вскрытии. J Korean Med Sci 5 (1) , 59–64.
- Кауфман Д., Килпатрик Л., Хадсон Р.Г. и др. (1999) Снижение продукции супероксида, дегрануляции, фактора некроза опухоли, альфа-секреции и экспрессии рецептора CD11b / CD18 прикрепленными моноцитами недоношенных детей. Clin Diagn Lab Immunol 6 (4) , 525–529.
- Кубота Т., Кусака Х., Хирано А и др. (1985) Ультраструктурное исследование ранней стадии кальцификации при энцефалите простого герпеса. Acta Neuropathol 68 (1) , 77–79.
- Курода Ю. и Мацуи М. (1997) [Прогрессирующий панэнцефалит при краснухе]. Ниппон Риншо 55 (4) , 922–925.
- Lane B, Sullivan EV, Lim KO et al. (1996) МР-гиперинтенсивность белого вещества у взрослых пациентов с врожденной краснухой. AJNR 17 , 99–103.
- Lim KO, Beal DM, Harvey RL et al. (1995) Дисморфология головного мозга у взрослых с врожденной краснухой плюс симптомы шизофрении. Biol Psychiatry 37 (11) , 764–776.
- Лу Д., Павлакис С. Г., Франк Y и др. (1996) Протонная МРТ-спектроскопия базальных ганглиев у здоровых детей и детей, больных СПИДом. Радиология , 199 , 423–428.
- Мэтьюз В.П., Кухарик М.А., Эдвардс МК и др. (1989) МРТ экспериментального бактериального менингита с усилением Gd-DTPA: оценка и сравнение с КТ. AJR 152 , 131–136.
- Натан Л., Твиклер Д.М., Петерс М.Т. и др. (1993) Сифилис плода: корреляция результатов сонографии и исследования инфекционности околоплодных вод на кроликах. J Ultrasound Med 12 (2) , 97–101.
- Noorbehesht B, Enzmann DR, Sullender et al. (1987) Неонатальный энцефалит, вызванный простым герпесом: корреляция клинических данных и результатов компьютерной томографии. Радиология 162 (3) , 813–819.
- Ong CL и Daniel ML (1998) Антенатальная диагностика порэнцефальной кисты при врожденной инфекции вируса ветряной оспы. Педиатр Радиол 28 , 94.
- Патель Д.В., Холфельс Э.М., Фогель Н.П. и др. (1996) Разрешение внутричерепных кальцификатов у младенцев с пролеченным врожденным токсоплазмозом. Радиология , 199 (2) , 433–440.
- Pavlakis SG, Lu D, Frank Y et al. (1998) Лактат и N-ацетиласпартат мозга в детской энцефалопатии СПИДа AJNR 19 , 383–385.
- Puvabanditsin S, Wojdylo E, Garrow E et al. Стрептококковый менингит группы B: случай поперечного миелита с кистами спинного мозга и задней черепной ямки. Педиатр Радиол 27 , 317–318.
- Sage MR и Wilson AJ (1994) Гематоэнцефалический барьер: важное понятие в нейровизуализации. AJNR 15 , 601–622.
- Shah SS, Zimmerman RA, Rorke LB et al. (1996) Цереброваскулярные осложнения ВИЧ у детей. AJNR 17 , 1913–1917.
- Sheffer IE, Baraitser M and Brett EM (1991) Тяжелая микроцефалия, связанная с врожденной инфекцией ветряной оспы. Dev Med Child Neurol 33 (1) , 916–920.
- Стамос Дж. К. и Роули А. Х. (1994) Своевременная диагностика врожденных инфекций. Pediatr Clin North Am 41 (5) , 1017–1033.
- Sugita K, Ando M, Makino M et al. (1991) Магнитно-резонансная томография головного мозга при вирусной врожденной краснухе и цитомегаловирусных инфекциях. Нейрорадиология 33 (3) , 239–242.
- Takano T (1994) [Патогенез врожденной гидроцефалии: роль трансплацентарной миксовирусной инфекции]. Нет в Хаттацу 26 (3) , 206–210.
- Тассин Г.Б., Маклад Н.Ф., Стюарт Р.Р. и др. (1991) Цитомегалическая инклюзионная болезнь: внутриутробная сонографическая диагностика с использованием данных, касающихся головного мозга. AJNR 12 , 117–122.
- Tien RD, Felsberg GJ и Osumi AK (1993) Герпесвирусные инфекции ЦНС: результаты МРТ. AJR 161 , 167–176.
- Tollofsrud PA, Kvittingen EA, Granum PE et al. (1998) [Ботулизм у новорожденных]. Tidsskr Nor Laegeforen 20 , 118 (28), 4355–4356.
- Toma P, Magnano GM, Mezzano P et al. (1989) УЗИ головного мозга при пренатальной цитомегаловирусной инфекции. Нейрорадиология 31 , 278–279.
- Trottier G, Srivastava L и Walker CD (1999) Этиология детского аутизма: обзор последних достижений в генетических и нейробиологических исследованиях. J Psychiatry Neurosci 24 (2) , 103–115.
- Tse G, Silver M, Whyte H и др. (1997) Неонатальный менингит и множественные абсцессы головного мозга, вызванные Citrobacter diversus . Pediatr Pathol Lab Med 17 (6) , 977–982.
- Weingarten K, Zimmerman RD, Becker LE et al. (1989) Субдуральная и эпидуральная эмпиемы: МРТ. AJR 152 , 615–621.
- Веллер Р.О., Энгельхардт Б. и Филлипс М.Дж. (1996) Нацеливание лимфоцитов на центральную нервную систему: обзор афферентных и эфферентных путей ЦНС-иммунитета. Brain Pathol 6 (3) , 275–288.
- Wong TT, Lee LS, Wang HS et al. (1989) Абсцессы головного мозга у детей — совместное исследование 83 случаев. Детская нервная система 5 , 19–24.
- Woods CR, Mason EO и Kaplan SL (1992) Взаимодействие штаммов Citrobacter diversus с эпителиальными клетками HEP-2 и эндотелиальными клетками пупочной вены человека. J Infect Dis 166 , 1035–1044.
- Ямагути К. и Гото Н. (1993) Случай вскрытия кандидоза головного мозга у недоношенных детей: морфология и интрапаренхиматозное распределение очагов Candida . Нет в Хаттацу 25 (4) , 369–373.
- Yoshimura M, Tohyama J, Maegaki Y et al. (1996) [Компьютерная томография и магнитно-резонансная томография головного мозга при синдроме врожденной краснухи]. Нет в Хаттацу 28 (5) , 385–390.
Посетите сайт автора по адресу www.maryrutherfordimaging.co.uk
<предыдущая | наверх | содержание | следующая>
MICI-CMV: Валганцикловир при рецидивирующих приступах криптогенных воспалительных заболеваний кишечника с инфекцией цитомегаловирусом — Просмотр полного текста
Цитомегаловирус (CMV) — это ДНК-вирус из семейства вирусов герпеса.Он передается от человека к человеку, и даже если инфекция широко распространена (от 50 до 80% людей старше 35 являются положительными по ЦМВ-иммуноглобулину G), у иммунокомпетентных людей она часто протекает бессимптомно. Однако для людей с ослабленным иммунитетом такая инфекция приобретает особую частоту, выраженность и серьезность, с высокой частотой атак на пищеварительный тракт (ЦМВ-колит).
У иммунокомпетентных людей колит вызывает лихорадочную кровавую диарею, сопровождающуюся болями в животе. Диагноз колита часто ставится поздно, и сообщалось о случаях с осложнениями (пищеварительное кровотечение, токсический гигантский ободок и перфорация).Эндоскопический аспект колита неспецифичен, и диагноз основывается на серологическом, анатомопатологическом или иммунохимическом исследовании. В последнее время подходы ПЦР позволили поставить более точную диагностику.
УЧАСТИЕ ЦМВ В ФИЗИОПАТОЛОГИИ CIBD:
Несмотря на то, что участие ЦМВ в колитах редко, но очевидно для иммунокомпетентных людей, его участие в запуске и заболеваемости CIBD еще не решено.
Некоторые авторы считают, что инфекция CMV может действовать на CIBD как триггерный фактор; поскольку было зарегистрировано 2 случая ЦМВ колита, совпадающего с началом CIBD.По мнению других авторов, инфицирование ЦМВ является прямым патогенетическим действием, вызывающим язвенные поражения слизистой оболочки толстой кишки, и просто имитирует CIBD, не вызывая его.
Третья гипотеза заключается в том, что инфекция, вызванная ЦМВ, усугубляет воспалительные заболевания кишечника, выступая в качестве обостряющего фактора.
Во всех случаях люди, страдающие CIBD, сильно подвержены инфицированию CMV из-за иммуносупрессивного лечения (кортикоиды, циклоспорин, азатиоприн и метотрексат) и самого воспаления (которое, как предполагается, является фактором проницаемости).
ЦМВ И ПАУХИТ:
Паучит — наиболее частое отдаленное осложнение после тотальной проктоколэктомии. Обычно его можно вылечить с помощью антибактериальной терапии, но в 15% случаев он переходит в хроническую форму и переходит в трудноизлечимый рефрактерный поухит.
Инфекция CMV может имитировать хронический поучит с клинической и эндоскопической точки зрения. В таких случаях было показано, что лечение валганцикловиром (10 мг / кг / день) привело к значительному улучшению в течение 21-дневного периода лечения.
ВЫВОД:
Инфекция CMV, по-видимому, играет важную роль и должна приниматься во внимание в физиопатогенезе CIBD. Вероятно, недооценено, поскольку его не обязательно ищут, это может быть пусковой фактор или фактор устойчивости к лечению. Иммуносупрессивные препараты, применяемые при повторных приступах, особенно циклоспорин, способствуют реактивации вируса. Затем рецидивирующие приступы CIBD могут осложняться ЦМВ-инфекцией. Вот почему было бы интересно установить актуальность противовирусного лечения при повторных приступах CIBD с инфекцией CMV.
Основная цель этого исследования — продемонстрировать актуальность валганцикловира при рецидивирующих приступах криптогенных воспалительных заболеваний кишечника с инфекцией цитомегаловирусом.

