Холера
Холера – это острая диарейная инфекция, вызываемая бактерией Vibrio cholerae при попадании в организм зараженных пищевых продуктов или воды. Холера остается глобальной угрозой для общественного здравоохранения и одним из показателей социального неравенства и отсутствия социального развития. По оценкам исследователей, во всем мире ежегодно происходит от 1,3 до 4,0 миллиона случаев заболевания холерой и 21 000–143 000 случаев смерти от холеры1.
СимптомыХолера – чрезвычайно опасная болезнь, которая может вызывать тяжелую острую водянистую диарею. Между попаданием в организм зараженных пищевых продуктов или воды и появлением симптомов у заболевшего проходит от 12 часов до 5 дней2. Холера поражает как детей, так и взрослых и при отсутствии лечения может за несколько часов приводить к смерти.
У большинства людей, инфицированных бактерией V. cholerae, не развивается никаких симптомов, хотя в течение 1–10 дней после инфицирования в их фекалиях присутствуют бактерии, которые, поступая обратно в окружающую среду, потенциально могут инфицировать других людей.
Если возникают симптомы, то в большинстве случаев они бывают легкими или умеренными, в то время как у меньшинства заболевших развивается острая водянистая диарея с сильным обезвоживанием. При отсутствии лечения это может привести к летальному исходу.
ИсторияВ XIX веке холера распространилась по всему миру из своего первоначального резервуара в дельте реки Ганг в Индии. В дальнейшем произошло шесть пандемий, которые унесли жизни миллионов людей на всех континентах. Текущая (седьмая) пандемия началась в 1961 г. в Южной Азии, в 1971 г. распространилась на Африку, а в 1991 г. – на Америку. В настоящее время холера является эндемической болезнью во многих странах.
Штаммы Vibrio choleraeСуществует много серогрупп V. cholerae, но только две из них – O1 и O139 – вызывают вспышки болезни. Штамм V. cholerae O1 стал причиной всех недавних вспышек. Штамм V. cholerae O139, который был впервые выявлен в Бангладеш в 1992 г., вызывал вспышки в прошлом, но в последнее время выявлялся только в спорадических случаях. Он никогда не выявлялся за пределами Азии. Болезнь, вызванная бактерией любой из двух серогрупп, протекает одинаково.
Штамм V. cholerae O139, который был впервые выявлен в Бангладеш в 1992 г., вызывал вспышки в прошлом, но в последнее время выявлялся только в спорадических случаях. Он никогда не выявлялся за пределами Азии. Болезнь, вызванная бактерией любой из двух серогрупп, протекает одинаково.
Различают эндемическую и эпидемическую холеру. Эндемичный по холере район – это район, в котором подтвержденные случаи холеры выявлялись в течение трех последних лет и имеются фактические данные, подтверждающие местную передачу болезни (то есть, случаи не завезены откуда-либо извне). Вспышка или эпидемия холеры может возникнуть как в эндемичных странах, так и в странах, где холера не возникает регулярно.
В эндемичных по холере странах вспышка может иметь сезонный или спорадический характер и определяется как превышение ожидаемого числа случаев заболевания. В стране, где холера не возникает регулярно, вспышка определяется как появление хотя бы одного подтвержденного случая холеры с фактическими доказательствами местной передачи в районе, где холера обычно отсутствует.
Передача холеры тесно связана с отсутствием надлежащего доступа к чистой воде и средствам санитарии. К типичным районам повышенного риска относятся примыкающие к городским кварталам трущобы, а также лагеря для внутренне перемещенных лиц и беженцев.
Последствия гуманитарного кризиса, такие как разрушение систем водоснабжения и санитарии или перемещение населения в переполненные и ненадлежащим образом оборудованные лагеря, могут повышать риск передачи холеры в случае наличия или завоза бактерий. Трупы людей, не инфицированных холерой, никогда не являлись причиной эпидемий.
Число случаев заболевания холерой, сообщения о которых поступали в ВОЗ, в последние несколько лет по-прежнему остается высоким. В 2019 г. сообщалось о 923 037 случаях в 31 стране, 1911 из которых закончились смертельным исходом3. Расхождение между этими данными и оцениваемым бременем болезни объясняется тем, что многие случаи не регистрируются из-за ограниченных возможностей систем эпиднадзора и опасений, что статистические данные могут негативным образом отразиться на торговле и туризме.
Решающую роль в борьбе с холерой и сокращении смертности из-за этой болезни играет многосторонний подход. Он предусматривает сочетание таких мер, как эпиднадзор, мероприятия по улучшению водоснабжения, санитарии и гигиены, мобилизация общественности, лечение и применение оральных вакцин против холеры.
ЭпиднадзорЭпиднадзор за холерой должен быть частью комплексной системы эпиднадзора за болезнями, которая предусматривает обратную связь на местном уровне и обмен информацией на глобальном уровне.
Случаи холеры выявляются на основании клинических подозрений на это заболевание у пациентов с тяжелой острой водянистой диареей. Далее подозрение подтверждается путем выявления бактерий V. cholerae в образцах кала соответствующих пациентов. Выявление случаев может быть упрощено за счет применения диагностических экспресс-тестов (ДЭТ), когда положительный результат тестирования одного или более образцов служит основанием для оповещения о случаях холеры. Образцы направляются в лабораторию на посев или на ПЦР-тест в целях подтверждения диагноза. Местные возможности для выявления (диагностики) и мониторинга (сбора, компиляции и анализа данных) случаев заболевания играют центральную роль в обеспечении эффективной работы системы эпиднадзора и планировании мер по борьбе с холерой.
Образцы направляются в лабораторию на посев или на ПЦР-тест в целях подтверждения диагноза. Местные возможности для выявления (диагностики) и мониторинга (сбора, компиляции и анализа данных) случаев заболевания играют центральную роль в обеспечении эффективной работы системы эпиднадзора и планировании мер по борьбе с холерой.
Странам, затронутым холерой, настоятельно рекомендуется укреплять эпиднадзор за болезнью и повышать уровень национальной готовности к быстрому выявлению вспышек и реагированию на них. В соответствии с Международными медико-санитарными правилами (ММСП), уведомление обо всех случаях холеры более не является обязательным. Тем не менее, события в области общественного здравоохранения, связанные с холерой, следует всегда оценивать в соответствии с критериями, приведенными в Правилах (ММСП, приложение 2 – «Схема принятия решений»), чтобы определить, существует ли необходимость в официальном уведомлении.
Дополнительную информацию о приложении 2 к ММСП можно получить по ссылке https://www. who.int/ru/publications/i/item/9789241580496
who.int/ru/publications/i/item/9789241580496
В долгосрочной перспективе решение проблемы установления контроля за холерой заключается в экономическом развитии и обеспечении всеобщего доступа к безопасной питьевой воде и надлежащей санитарии. Действия в отношении окружающей среды включают внедрение долгосрочных адаптированных рациональных решений в области водоснабжения, санитарии и гигиены (ВСГ) для обеспечения того, чтобы в высокоэндемичных районах, известных как «горячие точки», население пользовалось безопасными источниками воды, базовыми средствами санитарии и добросовестно соблюдало правила гигиены. Такие мероприятия позволяют предупреждать не только холеру, но и множество других болезней, передающихся через воду, а также способствуют достижению целей, касающихся нищеты, неполноценного питания и просвещения населения. Решения в сфере ВСГ в отношении холеры соответствуют задачам, поставленным в Целях в области устойчивого развития (ЦУР 6).
Холера представляет собой легко излечимую болезнь. Большинство людей можно с успехом лечить, своевременно предоставляя им растворы оральных регидратационных солей (ОРС). Стандартный пакет ОРС ВОЗ/ЮНИСЕФ разводят в 1 литре (л) чистой воды. Взрослым пациентам может потребоваться до 6 л раствора ОРС в первый день лечения умеренного обезвоживания.
Пациентам с сильным обезвоживанием грозит дегидратационный шок, и им требуются срочные внутривенные вливания. Таким пациентам назначают также соответствующие антибиотики для сокращения длительности диареи, уменьшения объема необходимых регидратационных жидкостей и сокращения количества и периода выделения бактерий V. cholerae в фекалиях.
Массовое применение антибиотиков не рекомендуется, так как оно не оказывает подтвержденного воздействия на распространение холеры и может способствовать повышению устойчивости к противомикробным препаратам.
Во время вспышки холеры ключевая роль отводится быстрому доступу к лечению.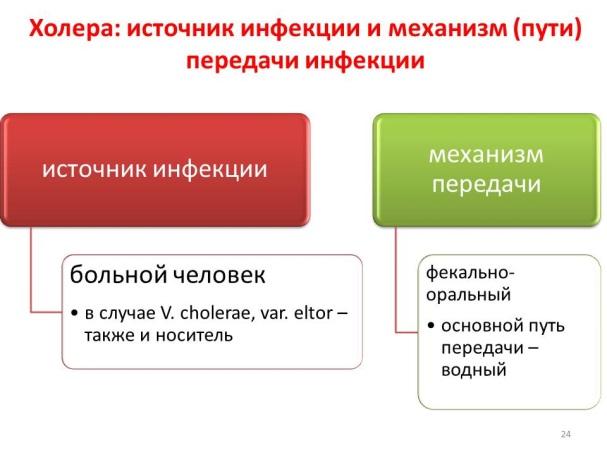 Возможность оральной регидратации должна обеспечиваться в общинах, но в то же время должна существовать возможность обратиться в более крупные лечебные центры, в которых есть все необходимое для проведения внутривенных вливаний и оказания круглосуточной помощи. При своевременном и надлежащем лечении коэффициент летальности не должен превышать 1%.
Возможность оральной регидратации должна обеспечиваться в общинах, но в то же время должна существовать возможность обратиться в более крупные лечебные центры, в которых есть все необходимое для проведения внутривенных вливаний и оказания круглосуточной помощи. При своевременном и надлежащем лечении коэффициент летальности не должен превышать 1%.
Важной дополнительной терапией для детей, больных холерой, в возрасте до пяти лет служит прием препаратов цинка, которые также сокращают длительность диареи и могут в дальнейшем предупреждать эпизоды острой водянистой диареи, вызванной другими причинами.
Следует также поощрять грудное вскармливание.
Укрепление навыков гигиены и мобилизация общественностиКампании санитарного просвещения, адаптированные к местной культуре и верованиям, должны способствовать выполнению надлежащих правил гигиены, таких как мытье рук с мылом, безопасное приготовление и хранение пищевых продуктов и безопасное удаление детских фекалий. Похороны людей, умерших от холеры, должны быть организованы так, чтобы избежать инфицирования присутствующих на церемонии.
Похороны людей, умерших от холеры, должны быть организованы так, чтобы избежать инфицирования присутствующих на церемонии.
Помимо этого, во время вспышек болезни следует организовывать кампании по повышению осведомленности населения и предоставлять общинам информацию о потенциальном риске и симптомах холеры, профилактических мерах во избежание заражения, а также о том, куда и когда следует сообщать о выявленных случаях и о том, что при появлении симптомов нужно без промедления обращаться за медицинской помощью. Необходимо также распространять информацию о местоположении соответствующих пунктов оказания медицинской помощи.
Вовлечение местных сообществ является ключевым условием для долгосрочных изменений в поведении людей и достижения успеха в борьбе с холерой.
Оральные вакцины против холерыВ настоящее время существуют три оральные вакцины против холеры, прошедшие предварительную квалификацию ВОЗ: Dukoral®, Shanchol™ и Euvichol-Plus®5. Для обеспечения полной защиты от болезни все три упомянутые вакцины должны предоставляться в двухдозовом режиме4.
Для обеспечения полной защиты от болезни все три упомянутые вакцины должны предоставляться в двухдозовом режиме4.
Dukoral® применяется в буферном растворе, для приготовления которого требуется 150 мл чистой воды, если речь идет о взрослых пациентах. Dukoral® можно назначать всем лицам старше двух лет. Интервал между приемами каждой дозы должен составлять как минимум семь дней, но не более шести недель. Дети в возрасте от двух до пяти лет должны получать третью дозу. Dukoral® в основном используется людьми, совершающими поездки. Две дозы Dukoral® обеспечивают защиту от холеры в течение двух лет.
Shanchol™ и Euvichol-Plus®, с точки зрения их формулы, представляют собой одну и ту же вакцину, выпускаемую двумя разными производителями. Для их применения не требуется буферного раствора. Они предоставляются всем лицам старше одного года. Интервал между приемами каждой дозы этих двух вакцин должен составлять не менее двух недель. Две дозы Shanchol™ и Euvichol-Plus® обеспечивают защиту от холеры в течение трех лет, между тем как одна доза обеспечивает кратковременную защиту.
Вакцина Shanchol™ прошла процедуру преквалификации для использования ее в рамках системы с регулируемой температурой, которая является инновационным подходом к обращению с вакцинами, позволяющим хранить вакцины при температурах за пределами стандартной холодовой цепи с температурой от +2°C до +8°C в течение ограниченного периода времени при условии мониторинга и контроля.
Дополнительную информацию о системе с регулируемой температурой можно получить по ссылке https://www.who.int/immunization/programmes_systems/
supply_chain/ctc/en/ – на английском языке
Именно вакцины Shanchol™ и Euvichol-Plus® в настоящее время доступны для проведения кампаний массовой вакцинации благодаря формированию глобального запаса оральных вакцин против холеры при поддержке Альянса по вакцинам GAVI.
В документе ВОЗ с изложением позиции в отношении вакцин против холеры, выпущенном в августе 2017 г. и основанном на имеющихся фактических данных, отмечается следующее:
- оральные вакцины против холеры должны использоваться в эндемичных по холере районах, в гуманитарных кризисных ситуациях с высоким риском заболевания холерой и во время вспышек холеры – всегда в сочетании с другими стратегиями по профилактике и борьбе с холерой.

Вакцинация не должна нарушать хода других высокоприоритетных вмешательств в области здравоохранения, направленных на борьбу со вспышками холеры и их предупреждение.
В рамках массовых кампаний вакцинации было использовано более 70 миллионов доз оральных вакцин против холеры. Эти кампании проводились в районах, охваченных вспышкой болезни, в районах с повышенной уязвимостью во время гуманитарных кризисов, а также среди населения, живущего в высокоэндемичных районах, известных как «горячие точки».
Дополнительную информацию о вакцинах против холеры можно получить по ссылке http://www.who.int/cholera/vaccines/en/ – на английском языке
Документ с изложением позиции ВОЗ в отношении оральных вакцин против холеры можно найти по ссылке http://www.who.int/wer/2017/wer9234/en/ – на английском языке
Деятельность ВОЗВ 2014 г. Глобальная целевая группа по борьбе с холерой, Секретариат которой функционирует на базе ВОЗ, получила новый импульс для активизации своей деятельности.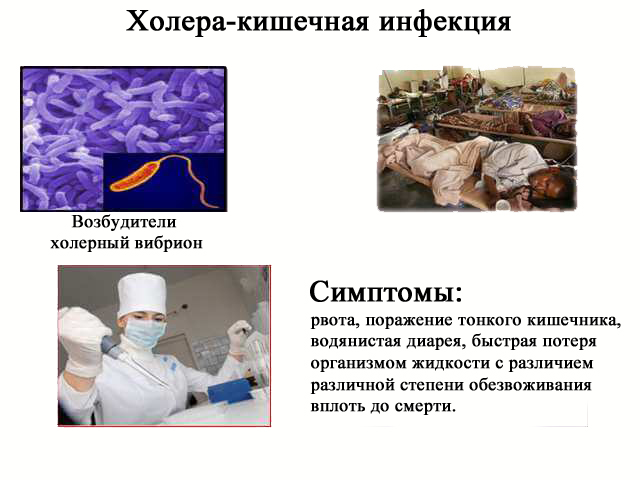 Глобальная целевая группа представляет собой сеть, состоящую из более чем 50 партнеров, в том числе академических учреждений, неправительственных организаций и учреждений системы ООН, активно участвующих в мероприятиях по борьбе с холерой на глобальном уровне.
Глобальная целевая группа представляет собой сеть, состоящую из более чем 50 партнеров, в том числе академических учреждений, неправительственных организаций и учреждений системы ООН, активно участвующих в мероприятиях по борьбе с холерой на глобальном уровне.
Силами Глобальной целевой группы по борьбе с холерой и при поддержке доноров ВОЗ проводит работу по следующим направлениям:
- оказание поддержки разработке и осуществлению глобальных стратегий в целях содействия наращиванию потенциала для профилактики холеры и борьбы с ней в глобальных масштабах;
- предоставление платформы для обмена техническими знаниями, координации деятельности и сотрудничества в области связанных с холерой мероприятий в целях укрепления потенциала стран для профилактики холеры и борьбы с ней;
- оказание поддержки странам в целях внедрения эффективных стратегий по борьбе с холерой и мониторинга прогресса;
- распространение технических руководящих принципов и оперативных руководств;
- содействие разработке программы научных исследований с акцентом на оценку инновационных подходов к профилактике холеры и борьбе с ней в затронутых странах;
- привлечение дополнительного внимания к холере как важной проблеме глобального общественного здравоохранения путем распространения информации о профилактике холеры и борьбе с ней, а также проведение информационно-разъяснительной работы и мероприятий по мобилизации ресурсов в поддержку профилактики холеры и борьбы с ней на национальном, региональном и глобальном уровнях.

Дополнительную информацию о Глобальной целевой группе по борьбе с холерой можно получить по ссылке http://www.gtfcc.org – на английском языке
Ликвидация холеры: дорожная карта до 2030 г.
В октябре 2017 г. партнеры Глобальной целевой группы представили стратегию по борьбе с холерой «Ликвидация холеры: дорожная карта до 2030 г.». Разработанная по инициативе стран стратегия предусматривает сокращение смертности от холеры на 90% и элиминацию холеры не менее чем в 20 странах к 2030 г.
Глобальная дорожная карта акцентирует внимание на трех стратегически важных аспектах:
- Ранее обнаружение вспышек и быстрое принятие ответных мер для их сдерживания. Данная стратегия направлена на сдерживание вспышек, где бы они ни возникали, за счет раннего выявления и быстрого принятия многосекторальных ответных мер, в том числе по вовлечению местных сообществ, укреплению эпиднадзора и потенциала лабораторий, обеспечению готовности систем здравоохранения и поставок, а также оказанию поддержки бригадам быстрого реагирования.

- Адресный многосекторальный подход для предупреждения повторного появления холеры. Глобальная стратегия призывает страны и партнеров обращать особое внимание на холерные «горячие точки» – сравнительно небольшие районы, наиболее серьезно затронутые холерой. Передачу холеры в этих районах можно остановить при помощи ряда мер, в том числе за счет мероприятий по улучшению водоснабжения, санитарии и гигиены, и путем применения оральных вакцин против холеры.
- Эффективный механизм координации технической поддержки, информационно-разъяснительной работы, мобилизации ресурсов и установления партнерских отношений на местном и глобальном уровнях. Глобальная целевая группа служит надежным механизмом содействия странам в активизации усилий по борьбе с холерой, опираясь на разработанные по инициативе стран межсекторальные программы по борьбе с холерой и оказывая им поддержку в виде кадровых, технических и финансовых ресурсов.
В мае 2018 г. на семьдесят первой сессии Всемирной ассамблеи здравоохранения была принята резолюция в поддержку борьбы с холерой, одобряющая стратегию «Ликвидация холеры: дорожная карта до 2030 г.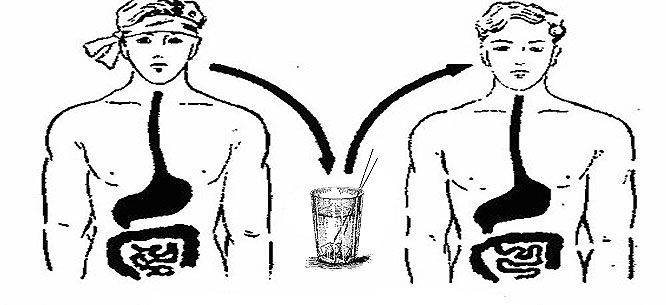 ».
».
Дополнительную информацию о стратегии можно получить по ссылке http://www.who.int/entity/cholera/publications/global-roadmap.pdf?ua=1 – на английском языке
Комплекты для мероприятий по борьбе с холерой
ВОЗ разработала набор комплектов для мероприятий по борьбе с холерой в целях обеспечения действенного и эффективного использования материалов, необходимых для расследования и подтверждения вспышек холеры, а также для лечения пациентов.
После консультации с партнерами, занимающимися осуществлением практических мероприятий, в 2016 г. ВОЗ пересмотрела состав комплектов с тем, чтобы они в большей степени соответствовали потребностям на местах. Речь идет о шести комплектах:
- 1 – для проведения исследований;
- 1 – с материалами для лабораторного подтверждения результатов анализа на посев;
- 3 – для лечения на общинном, периферийном и центральном уровнях;
- 1 комплект со вспомогательными материалами, такими как лампы на солнечных батареях, заграждения, мягкие резервуары и краны для воды.

Каждый комплект для лечения содержит достаточное количество материалов для лечения 100 пациентов. Пересмотренные комплекты для мероприятий по борьбе с холерой предназначены для помощи в подготовке к потенциальной вспышке холеры и оказания поддержки на начальном этапе ответных мер в течение первого месяца их осуществления.
Дополнительную информацию о комплектах для мероприятий по борьбе с холерой можно получить по ссылке http://www.who.int/cholera/kit/en/ – на английском языке
1 Updated global burden of cholera in endemic countries.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4455997/
Ali M, Nelson AR, Lopez AL, Sack D. (2015). PLoS Negl Trop Dis 9(6): e0003832. doi:10.1371/journal.pntd.0003832.
2 The incubation period of cholera: a systematic review.
https://www.ncbi.nlm.nih.gov/pubmed/23201968
Azman AS, Rudolph KE, Cummings DA, Lessler J. J Infect. 2013;66(5):432-8. doi: 10.1016/j.jinf.2012.11.013. PubMed PMID: 23201968; PubMed Central PMCID: PMC3677557.
3 Cholera Annual Report 2019
Weekly Epidemiological Record N° 37, 11 September 2020, Vol. 95 (pp 441-448).
4 Cholera vaccines: WHO position paper – August 2017
http://apps.who.int/iris/bitstream/10665/258764/1/WER9234-477-498.pdf
Weekly Epidemiological Record N° 34, 25 August 2017, Vol. 92 (pp 477–500).
Профилактика холеры
По данным Всемирной организации здравоохранения эпидемическая ситуация в мире по заболеваемости холерой остается напряженной. Ежегодно в мире регистрируется 3-5 миллионов случаев холеры, из которых 100-120 тысяч заканчиваются летальным исходом. Только в текущем году зарегистрировано более 150 тысяч случаев холеры в 32 странах мира, среди них Индия, Гаити, Чешская республика, Южная Корея. Холера – инфекционное заболевание, характеризующееся диареей, рвотой, нарушением водно-солевого обмена. В тяжелых случаях может наступить сильное обезвоживание организма, которое при отсутствии лечения может закончиться смертью больного. Возбудитель инфекции – холерный вибрион, устойчив к низким температурам и не гибнет при замораживании, активно развивается в организме человека (при попадании) и в мелких водоемах в тропических странах. В почве, на загрязненных пищевых продуктах и предметах холерный вибрион может прожить несколько недель. А в воде несколько месяцев. Холерный вибрион погибает при высушивании, воздействии солнечного света, нагревании до 60°C и выше, чувствителен к дезсредствам. Источником инфекции является больной человек или носитель.
Возбудитель инфекции – холерный вибрион, устойчив к низким температурам и не гибнет при замораживании, активно развивается в организме человека (при попадании) и в мелких водоемах в тропических странах. В почве, на загрязненных пищевых продуктах и предметах холерный вибрион может прожить несколько недель. А в воде несколько месяцев. Холерный вибрион погибает при высушивании, воздействии солнечного света, нагревании до 60°C и выше, чувствителен к дезсредствам. Источником инфекции является больной человек или носитель.
Существуют следующие пути передачи холеры:
- Водный — во время купания в открытых заражённых водоёмах, если пить обсеменённую бактериями холеры воду или мыть продукты или посуду в такой воде. Этот путь считается ведущим.
- Контактно-бытовой – через предметы обихода, дверные ручки, посуду, белье, загрязненные рвотными массами или испражнениями больного, при осуществлении ухода за больными холерой.
- Пищевой — при употребляет в пищу заражённых холерным вибрионом продуктов. Наиболее опасны в эпидотношении рыба, а также морепродукты (мидии, креветки), раки, выросшие в зараженной воде.
Заражение может произойти при употреблении фруктов и овоще, вымытых зараженной водой. На продукты бактерии могут также попадать от носителей или посредством мух. Заболевание холерой можно предотвратить! Перед выездом за рубеж узнайте у своего туроператора эпидситуацию по инфекционным заболеваниям в посещаемой стране.
Также помогут простые меры профилактики:
- соблюдайте простое правило: если продукт нельзя вскипятить, сварить, пожарить или очистить (от кожицы, корки и т.п.), то его нельзя употреблять в пищу;
- не употребляйте для питья и бытовых целей воду из случайных источников. Пейте только кипяченую или бутилированную питьевую воду, овощи и фрукты также мойте только водой проверенного качества. Такие напитки, как горячий чай или кофе, вино, пиво, газированная вода или безалкогольные напитки, а также фруктовые соки в бутылках или пакетах, обычно безопасны для питья;
- не употребляйте лед, если вы не уверены, что он сделан из безопасной воды;
- употребляйте в пищу горячие продукты, прошедшие тщательную тепловую обработку. Приготовленные пищевые продукты, оставленные в течение нескольких часов при комнатной температуре, без дополнительного разогревания могут стать источником инфекции.
- не употребляйте в пищу продукты в сыром виде. Исключение составляют фрукты и овощи, которые вы должны собственноручно очистить (от кожицы, корки и т.п.).
- откажитесь от употребления непастеризованного молока, а также других молочных продуктов, если сомневаетесь в их качестве и безопасности;
- убедитесь в том, что пищевые продукты, купленные у уличных торговцев, проходят тщательную тепловую обработку в вашем присутствии;
- купайтесь только в водоемах, разрешенных для организованного отдыха;
- регулярно и тщательно мойте руки.
Холера
ВНИМАНИЕ! ФАКТЫ О ХОЛЕРЕ!
Источник инфекции:
- больной человек;
- бактерионоситель, который выделяет холерный вибрион, но не имеет признаков болезни.
- У больного человека кал и рвотные массы прозрачные и не имеют характерного вида и запаха. Поэтому следы загрязнения остаются незамеченными, что приводит к быстрому распространению инфекции.
Механизм передачи холеры фекально-оральный – больной человек выделяет бактерии при рвоте и поносе. Проникновение в организм здорового человека происходит через рот. Невозможно заразиться холерой воздушно капельным путем.
Пути передачи:
- Водный (основной) – через загрязненную испражнениями воду. В теплых пресных и соленых водоемах, загрязненных сточными водами, концентрация бактерий очень высока. Люди заражаются, употребляя воду и во время купания. Такой водой опасно мыть посуду и продукты.
- Контактно-бытовой – через предметы, дверные ручки, посуду, белье, загрязненные рвотными массами или испражнениями больного.
- Пищевой – через устрицы, мидии, креветки, молочные продукты, фрукты, рыбные и мясные блюда не прошедшие тепловую обработку. На продукты бактерии попадают с грязной водой, от носителей или посредством мух.
Риски развития холеры
Купание в загрязненных водоемах, мытье в них посуды, употребление воды.
Употребление в пищу морепродуктов, особенно сырых моллюсков.
Посещение стран с низким уровнем жизни, где отсутствуют водопровод и канализация, не соблюдаются санитарные нормы.
Большие лагеря беженцев, где не соблюдается санитария, и нет безопасных источников питьевой воды.
Войны, социальные катаклизмы, когда появляется дефицит питьевой воды.
В группе риска люди, страдающие гастритами с пониженной кислотностью и ахилией (состояние при котором желудочном соке отсутствует соляная кислота).
Холера
Что это такое?
Из-за способности в короткое время поражать значительное количество людей (вызывать эпидемии) и 50-процентной смертности при отсутствии лечения может рассматриваться в качестве биологического оружия.
Возбудителем холеры является холерный вибрион (Vibrio cholerae)— слегка изогнутая палочка, отдаленно напоминающая запятую. Вибрионы оснащены жгутиками, что позволяет им очень быстро передвигаться. Микроорганизм был открыт известным немецким ученым Робертом Кохом в 1883 году.
Существует два типа вибрионов — классический и Эль-Тор — и оба они представляют опасность для человека. Они являются частью флоры многих водоемов, обнаруживаются даже в Москве-реке. Определяющий вопрос — количество этих самых вибрионов в единице объема воды. Для того чтобы заболеть холерой, надо проглотить от миллиона до триллиона микроорганизмов.
Такой большой разброс объясняется крайней неустойчивостью возбудителя к соляной кислоте, которая есть в нашем желудке. Если кислотность понижена (например, при атрофическом гастрите) или соляная кислота значительно разведена (при употреблении большого количества жидкости), количество вибрионов, необходимое для инфицирования, снижается в 100 тысяч раз.
Лучше всего вибрион размножается при температуре 30-40°С, поэтому его особенно много в водоемах Индии, Азии и Африки. Возбудитель практически мгновенно погибает при кипячении, при температуре 50 С — в течение 30 минут. Не выносит микроб и высушивание, а прямые солнечные лучи убивают его в течение часа.
На поверхности овощей и фруктов, например, арбузов, вибрион может жить до 5 суток. Единственный источник распространения инфекции — больной человек или вибрионоситель из региона, неблагополучного по холере, выделяющий возбудителя с фекалиями или рвотными массами. Такой способ передачи эпидемиологи называют фекально-оральным.
Что при этом происходит?
Основные события начинают развиваться в организме человека, когда критическая масса вибрионов попадает из желудка в тонкую кишку. Здесь тепло и влажно, среда уже щелочная, что вполне подходит для массового размножения микроорганизмов-вредителей.
Инкубационный период длится от нескольких часов до 2-3 дней.
В ходе своей бурной жизнедеятельности вибрионы вырабатывают токсин — холероген. Этот токсин вызывает интенсивное выделение жидкости из тканей в просвет тонкой кишки. И начинается мощнейший, так называемый профузный понос. А общая интоксикация вызывает неукротимую рвоту. Человек начинает изливать из себя огромное количество жидкости.
Клиническая выраженность зависит от многих факторов — состояния организма, количества попавших внутрь возбудителей и т.п. При стертых формах возможен однократный жидкий стул, а также слабые проявления интоксикации. Существует также бессимптомная форма носительства — когда человек не чувствует себя больным, но выделяет во внешнюю среду огромное количество возбудителей.
Классическая картина холеры — это частый, до 10 и более раз в сутки, понос. Потеря жидкости колоссальна — до 20 литров в сутки, причем в каждом миллилитре содержится до миллиарда вибрионов.
В результате массивной потери жидкости происходит сгущение крови и обезвоживание организма. Состояние больного быстро и резко ухудшается. Из-за потери с жидкостью микроэлементов появляются мышечные судороги, чаще всего — начиная с икроножных мышц.
Черты лица заостряются, глаза западают, синеют губы и ушные раковины. Кожа холодная (холера — одна из немногих инфекций, сопровождающихся нормальной или даже пониженной температурой тела). Кожа теряет упругость, легко собирается в складки и очень долго расправляется обратно, а кожа стоп и рук становится морщинистой — так называемые «руки прачки». Появляется одышка, резкая слабость.
При отсутствии лечения современными средствами половина больных погибает в течение первых суток.
Диагностика
Диагностика холеры во время эпидемической вспышки не представляет трудностей и основана, по большей части, на клинических проявлениях. Диагноз первых случаев требует бактериологического подтверждения — выделением возбудителя в рвотных или каловых массах. Главное в мероприятиях по обузданию вспышки — изоляция заболевших и дезинфекция источников распространения возбудителей.
Лечение
Лечение проводится в инфекционных стационарах, хотя из-за редкости передачи заболевания непосредственно от больного человека к здоровому эксперты ВОЗ считают возможным размещать подобных пациентов в обычных терапевтических палатах. Следует отметить, что в последнее время до 90% холеры протекает в легкой форме.
Основа лечения — восполнение потери жидкости и микроэлеметов, поддержание водно-электролитного и кислотно-щелочного балансов в организме. Антибиотики — лишь дополнительное средство лечения, вибрион до сих пор чувствителен к обычному тетрациклину. Благодаря комплексной терапии смертность от холеры в настоящее время не превышает 1%.
Профилактика
Перенесенная инфекция не оставляет после себя стойкого иммунитета, и повторное заражение холерой возможно в любой период жизни, да и попытки создать эффективную вакцину пока бесплодны. Эффективность вакцинации в настоящее время оценивается в 25-50% при длительности действия 3-6 месяцев, хотя появлялись сообщения и о создании более эффективной вакцины.
Основные меры профилактики при посещении неблагоприятных по холере районов — мыть руки перед едой и приготовлением пищи, а также после посещения туалета. Пить только кипяченую воду, овощи и фрукты после мытья проточной водой обязательно обдавать кипятком; исключить покупку продуктов у случайных лиц; купаться только в разрешенных местах.
Источники
- Reuben RC., Sarkar SL., Ibnat H., Setu MAA., Roy PC., Jahid IK. Novel multi-strain probiotics reduces Pasteurella multocida induced fowl cholera mortality in broilers. // Sci Rep — 2021 — Vol11 — N1 — p.8885; PMID:33903662
- Akter A., Kelly M., Charles RC., Harris JB., Calderwood SB., Bhuiyan TR., Biswas R., Xu P., Kováč P., Qadri F., Ryan ET. Parenteral Vaccination with a Cholera Conjugate Vaccine Boosts Vibriocidal and Anti-OSP Responses in Mice Previously Immunized with an Oral Cholera Vaccine. // Am J Trop Med Hyg — 2021 — Vol — NNULL — p.; PMID:33872211
- Allen LJS., Wang X. Stochastic models of infectious diseases in a periodic environment with application to cholera epidemics. // J Math Biol — 2021 — Vol82 — N6 — p.48; PMID:33830353
- McCarty JM., Cassie D., Bedell L., Lock MD., Bennett S. Long-Term Immunogenicity of Live Oral Cholera Vaccine CVD 103-HgR in Adolescents Aged 12-17 Years in the United States. // Am J Trop Med Hyg — 2021 — Vol — NNULL — p.; PMID:33819178
- Debes AK., Murt KN., Waswa E., Githinji G., Umuro M., Mbogori C., Roskosky M., Ram M., Shaffer A., Sack DA., Boru W. Laboratory and Field Evaluation of the Crystal VC-O1 Cholera Rapid Diagnostic Test. // Am J Trop Med Hyg — 2021 — Vol — NNULL — p.; PMID:33819171
- Pal BB., Mohanty A., Biswal B., Nayak SR., Das BK., Lenka PP. Haitian variant Vibrio cholerae O1 Ogawa caused cholera outbreaks in Odisha. // Indian J Med Microbiol — 2021 — Vol — NNULL — p.; PMID:33812724
- Bencard A. Epidemics before microbiology: Stories from the plague in 1711 and cholera in 1853 in Copenhagen. // APMIS — 2021 — Vol — NNULL — p.; PMID:33797807
- Elimian KO., Musah A., Ochu CL., Onwah SS., Oyebanji O., Yennan S., Fall IS., Yao M., Chukwuji M., Ekeng E., Abok P., Omar LH., Balde T., Kankia A., Williams N., Mutbam K., Dhamari N., Okudo I., Alemu W., Peter C., Ihekweazu C. Identifying and quantifying the factors associated with cholera-related death during the 2018 outbreak in Nigeria. // Pan Afr Med J — 2020 — Vol37 — NNULL — p.368; PMID:33796181
- Dembiński Ł., Stelmaszczyk-Emmel A., Sznurkowska K., Szlagatys-Sidorkiewicz A., Radzikowski A., Banaszkiewicz A. Immunogenicity of cholera vaccination in children with inflammatory bowel disease. // Hum Vaccin Immunother — 2021 — Vol — NNULL — p.1-7; PMID:33794737
- Caniglia EC., Murray EJ. Difference-in-Difference in the Time of Cholera: a Gentle Introduction for Epidemiologists. // Curr Epidemiol Rep — 2020 — Vol7 — N4 — p.203-211; PMID:33791189
ОСТОРОЖНО: ХОЛЕРА! (памятка для населения)
Холера — острая кишечная инфекция, вызываемая при попадании в органы пищеварения бактерии — холерного вибриона.
Источник болезни и механизм передачи. Источником инфекции является человек, больной типичной формой, а также бессимптомной формой, реконвалесцент (выздоравливающий человек) и здоровый носитель.
Заражение происходит главным образом при питье необеззараженной воды, заглатывании воды при купании в загрязненных водоемах, во время умывания. Заражение может происходить при употреблении пищи, инфицированной во время кулинарной обработки, её хранения, мытья или раздачи, особенно продуктами, не подвергающимися термической обработке (моллюски, креветки, вяленая и слабосоленая рыба). Возможен контактно-бытовой (через загрязненные руки) путь передачи. Фекально-оральным путем холерный вибрион попадает в кишечник и вызывает воспаление, что и обуславливает основные клинические симптомы.
Основные симптомы. Инкубационный период длится от нескольких часов до 5 суток, чаще 1-2 дня. Тяжесть заболевания варьирует от бессимптомной формы до тяжёлых состояний с резким обезвоживанием и смертью в течение 1-2 суток. Для типичной клинической картины холеры характерно: острое начало, диарея: обильный стул от 3 до 30 в сутки; характерный стул: кашицеобразные или жидкие каловые массы, сначала бело-серого цвета, затем бесцветные, без запаха и примеси крови, с плавающими хлопьями. Всё это напоминает «рисовый отвар». Боли в животе обычно не бывает. Также характерной является рвота: внезапная, частая, фонтаном, сначала съеденной пищей, затем жидкая типа «рисового отвара». Повышение температуры: обычно отсутствует, в тяжёлых случаях температура она понижена до 35-35,5°С. (особенность — только у детей может быть повышение температуры тела). Далее развивается обезвоживание: жажда, сухость слизистых и кожи, заострившиеся черты лица, западающие глаза, слабость, заторможенность, нарушение сознания, кома. Количество мочи уменьшается, вплоть до ее исчезновения. Появляются судороги жевательных и икроножных мышц, одышка. Наиболее частым осложнением при холере в настоящее время является пневмония.
Лечение. При подозрении на холеру больного обязательно госпитализируют. Назначаются лекарственные препараты, направленные на поддержание водно-солевого баланса организма, антибиотики и др., которые назначаются только врачом.
Если у вас диарея, особенно тяжелая, и вы находитесь в районе, где зарегистрирована холера, немедленно обратитесь за медицинской помощью к врачу или другому медицинскому специалисту. В ожидании медицинской помощи пейте воду и другие несладкие жидкости.
Профилактика. Обязательное соблюдение санитарно-гигиенических мер:
употребляйте гарантированно безопасную воду и напитки (кипяченая вода, дезинфицированная вода, напитки и вода в фабричной упаковке)
тщательно мойте фрукты и овощи безопасной водой
употребляйте в пищу горячие продукты, прошедшие тщательную тепловую обработку. Приготовленные пищевые продукты, оставленные в течение нескольких часов при комнатной температуре, без дополнительного разогревания могут стать источником инфекции.
избегайте питания с лотков, в не сертифицированных государством кафе и ресторанах
при купании в водоемах и бассейнах не допускайте попадания воды в рот не употребляйте в пищу лед, если не уверены в качестве воды, из которой он приготовлен не ешьте мороженое сомнительного происхождения пейте пастеризованное молоко только после кипячения
не употребляйте в пищу сорта экзотических видов рыб и других даров моря, особенно без термической обработки
соблюдайте элементарные правила личной гигиены (мытье руки после посещения туалета, перед едой и курением)
Еще раз напоминаем: при первых признаках заболевания – обращайтесь за медицинской помощью. Берегите свое здоровье!
- Опубликовано: 01 июля 2016
Холера: симптомы и течение болезни
Существует два типа вибрионов — классический и Эль-Тор — и оба они представляют опасность для человека. Они являются частью флоры многих водоемов, обнаруживаются даже в Москве-реке. Определяющий вопрос — количество этих вибрионов в единице объема воды. Чтобы заболеть холерой, надо проглотить от миллиона до триллиона микроорганизмов.
Возбудитель холеры крайне неустойчив к соляной кислоте, которая содержится желудке человека. Однако если кислотность понижена (например, при атрофическом гастрите) или соляная кислота значительно разведена (при употреблении большого количества жидкости), количество вибрионов, необходимое для инфицирования, снижается в 100 тысяч раз.
Холера периодически распространялась на многие страны мира и целые континенты, уносила миллионы человеческих жизней; последняя, седьмая, пандемия болезни началась в 1961 году. Эпидемическая ситуация по холере в мире остается напряженной, ежегодно заболевает до нескольких тысяч человек. В странах Южной и Юго-Восточной Азии и в ряде стран Африки (на африканском континенте регистрируется более половины случаев заболевания) существуют эндемические очаги холеры и периодически возникают эпидемии.
Клиническая выраженность зависит от многих факторов: состояния организма, количества попавших внутрь возбудителей и т.п. При стертых формах возможен однократный жидкий стул, а также слабые проявления интоксикации. Существует и бессимптомная форма носительства — когда человек не чувствует себя больным, но выделяет во внешнюю среду огромное количество возбудителей.
Классическая картина холеры — это частый, до 10 и более раз в сутки, понос. Потеря жидкости колоссальна — до 20 литров в сутки. В результате происходит сгущение крови и обезвоживание организма. Состояние больного быстро и резко ухудшается. Из-за потери с жидкостью микроэлементов появляются мышечные судороги, чаще всего — начиная с икроножных мышц.
Черты лица заостряются, глаза западают, синеют губы и ушные раковины. Кожа холодная (холера — одна из немногих инфекций, сопровождающихся нормальной или даже пониженной температурой тела). Кожа теряет упругость, легко собирается в складки и очень долго расправляется обратно, а кожа стоп и рук становится морщинистой — так называемые «руки прачки». Появляется одышка, резкая слабость.
При отсутствии лечения современными средствами половина больных погибает в течение первых суток.
Лечение проводится в инфекционных стационарах, хотя из-за редкости передачи заболевания непосредственно от больного человека к здоровому эксперты ВОЗ считают возможным размещать подобных пациентов в обычных терапевтических палатах. Следует отметить, что в последнее время до 90% холеры протекает в легкой форме.
Основа лечения — восполнение потери жидкости и микроэлеметов, поддержание водно-электролитного и кислотно-щелочного балансов в организме. Антибиотики — лишь дополнительное средство лечения, вибрион до сих пор чувствителен к обычному тетрациклину. Благодаря комплексной терапии смертность от холеры в настоящее время не превышает 1%.
Материал подготовлен на основе информации открытых источников
Памятка холера
ХОЛЕРА
Холера – острая бактериальная инфекционная болезнь с диарейным синдромом, нарушением водно-солевого обмена, обезвоживанием, токсикозом.
Возбудители: холерный вибрион группы 01 классического или эльтор биовара и холерный вибрион 0139 серогруппы семейства Vibrionaceae рода Vibrio.
Основные эпидемиологические признаки
Инкубационный период: 5 суток (от 10 часов до 5 суток).
Источник инфекции: больной человек, вибрионоситель.
Пути передачи возбудителя инфекции:
- водный;
- пищевой;
- контактно-бытовой.
Условия заражения:
- нахождение в предшествующие заболеванию 5 дней в неблагополучном по холере населенном пункте, районе, иностранном государстве;
- уход за больным диареей;
- использование для питья необеззараженной воды или использование для купания и других нужд воды открытого водоема;
- употребление в пищу слабосоленой рыбы домашнего изготовления, креветок, раков, крабов, морской капусты и других продуктов с недостаточной термической обработкой;
- употребление в пищу овощей и фруктов, привезенных из неблагополучных по холере районов;
- работы, связанные с эксплуатацией открытых водоемов (водолазы, рыбаки), обслуживанием канализационных и водопроводных сооружений.
Основные клинические признаки
Различают: легкое течение холеры, при которой жидкий стул и рвота могут быть однократными. Обезвоживание почти не выражено и не превышает 3% массы тела (дегидратация I степени). Самочувствие удовлетворительное. Жалобы на сухость во рту и повышенную жажду. Больные за медицинской помощью не обращаются, выявление их затруднительно. Без бактериологического исследования зачастую невозможно провести дифференциальный диагноз с желудочно-кишечными заболеваниями другой этиологии. Продолжительность болезни — 1-2 дня.
При среднетяжелом течении холеры начало острое с появления обильного стула (иногда может предшествовать рвота — гастрический вариант). Стул становится все более частым — 15-20 раз в сутки, постепенно теряет каловый характер и приобретает вид рисового отвара (может быть желтоватым, коричневым с красноватым оттенком, вида «мясных помоев»). Понос не сопровождается болями в животе, тенезмами. Иногда могут быть умеренные боли в области пупка, дискомфорт, урчание в животе. Вскоре к поносу присоединяется обильная рвота, без тошноты. Нарастает обезвоживание организма, потеря жидкости составляет 4-6% массы тела (дегидратация II степени). Появляются судороги отдельных групп мышц. Голос сиплый. Жалобы больных на сухость во рту, жажду, недомогание, слабость. Отмечается цианоз губ, иногда акроцианоз. Снижается тургор кожи. Язык сухой.
Тяжелое течение холеры характеризуется выраженной степенью обезвоживания с потерей жидкости 7 — 9% от массы тела и нарушением гемодинамики (дегидратация III степени). У больных частый, обильный водянистый стул, рвота, выраженные судороги мышц. Отмечается падение артериального давления. Пульс слабый, частый. Одышка, цианозы кожных покровов, олигурия или анурия. Черты лица заострившиеся, глаза и щеки впалые, голос сиплый вплоть до афонии. Тургор кожи резко снижен, кожная складка не расправляется. Пальцы рук и ног морщинистые. Язык сухой. Урчание в животе, легкая болезненность в эпигастрии и околопупочной области. Больные жалуются на резчайшую слабость, неутолимую жажду.
Потеря жидкости, достигающая 8-10 % от веса тела больного, а также солевой дефицит приводят к развитию состояния, известного как алгид. При алгиде падает артериальное давление вплоть до его исчезновения. Пульс отсутствует, резкая одышка (до 50-60 в мин). Выраженный общий цианоз кожных покровов, судороги мышц конечностей живота, лица. Олигурия, а затем анурия. Афония. Температура тела до 35,5 0С. Кожа холодная, тургор ее резко снижен, выражен симптомом «рука прачки». Объем стула уменьшается до прекращения. При проведении немедленной регидратации вновь появляется частый стул и может быть рвота. В периферической крови увеличение числа эритроцитов, лейкоцитов, гипокалиемия.
Примечание: Особую диагностическую трудность представляет бессимптомное вибрионосительство. Выявление носителей основывается на положительных результатах бактериологического исследования, причем присутствие вибрионов в испражнениях носителя непостоянно.
Информационный бюллетень по холере
Последняя редакция: август 2017 г.
Что такое холера?
Холера — это бактериальное заболевание, которое вызывает диарею (жидкий стул / фекалии) и вызывается бактериями Vibrio cholerae . Хотя ежегодно в Соединенных Штатах выявляется лишь несколько случаев, многие случаи выявляются каждый год в некоторых частях Африки, Южной и Центральной Америки и Юго-Восточной Азии.
Кто болеет холерой?
Холера — редкое заболевание в США.S., риску могут подвергаться те, кто едет в зарубежные страны, где происходят вспышки, и те, кто потребляет сырые или недоваренные морепродукты из теплых прибрежных вод, которые могут подвергаться загрязнению сточными водами. В обоих случаях риск невелик. Люди, живущие в местах с неадекватной очисткой воды, плохой санитарией и несоответствующей гигиеной (чистотой), подвергаются большему риску заболевания холерой.
Как распространяется холера?
Бактерии холеры передаются с фекалиями.Он распространяется через еду или питье пищи или воды, загрязненной фекалиями (фекалиями) инфицированного человека. Это чаще происходит в слаборазвитых странах, где отсутствует надлежащее водоснабжение и канализация. Маловероятно, что холера передается напрямую от одного человека к другому.
Каковы симптомы холеры и когда они появляются?
Люди, инфицированные холерой, могут испытывать водянистую диарею от легкой до тяжелой степени (жидкий стул / фекалии), рвоту и обезвоживание (потеря воды в организме, вызывающая слабость или головокружение).Симптомы могут появиться через несколько часов до пяти дней после еды или питья зараженной пищи или воды.
Как диагностируется холера?
Холера диагностируется, когда бактерии холеры, Vibrio cholerae , обнаруживаются в образце стула или ректальном мазке.
Как лечить холеру?
Холеру можно легко и успешно вылечить путем немедленного восполнения жидкости и солей, теряемых при диарее (жидкий стул / фекалии). Пациентов можно лечить с помощью раствора для пероральной регидратации, предварительно расфасованной смеси сахара и солей, смешанных с водой в больших количествах.Этот раствор используется во всем мире для лечения диареи. В тяжелых случаях также требуется внутривенное восполнение жидкости. При быстрой регидратации умирает менее 1% больных холерой.
Антибиотики сокращают течение и уменьшают тяжесть заболевания, но они не так важны, как регидратация. Лицам, у которых в странах, где наблюдается холера, развиваются тяжелая диарея и рвота, следует незамедлительно обратиться за медицинской помощью.
Делает ли перенесенное заражение холерой иммунитетом человека?
Люди могут снова заразиться холерой, если снова подвергаются воздействию бактерий.
Есть ли вакцина от холеры?
FDA недавно одобрило однократную дозу живой пероральной вакцины против холеры под названием Vaxchora (лиофилизированный CVD 103-HgR) для взрослых от 18 до 64 лет, которые путешествуют в зону активной передачи холеры с токсигенным холерным вибрионом O1 (штамм бактерий, обычно вызывает холеру). Вакцина обычно не рекомендуется большинству путешественников из Соединенных Штатов, поскольку большинство людей не посещают районы активной передачи холеры. Существуют две другие пероральные инактивированные (или неживые вакцины против холеры), Dukoral® и ShanChol®, но эти вакцины недоступны в США.S. Ни одна вакцина против холеры не обеспечивает 100% защиты, и вакцинация против холеры не заменяет стандартные меры профилактики и контроля.
Как предотвратить распространение холеры?
Самая важная профилактическая мера — избегать употребления сырых продуктов или воды в зарубежных странах, где встречается холера, если только они не считаются безопасными или не подвергались надлежащему лечению (например, запечатанная бутилированная, кипяченая или химически очищенная вода). Кроме того, важно часто мыть руки чистой водой с мылом или очищающим средством для рук на спиртовой основе, особенно перед едой или приготовлением пищи и после посещения туалета.
Общая информация | Холера | CDC
Холера — острое диарейное заболевание, вызванное инфицированием кишечника токсигенной бактерией Vibrio cholerae серогруппы O1 или O139. По оценкам, ежегодно во всем мире происходит 2,9 миллиона случаев заболевания и 95 000 случаев смерти. Инфекция часто протекает в легкой форме или без симптомов, но может быть тяжелой. Примерно у 1 из 10 человек, заболевших холерой, разовьются серьезные симптомы, такие как водянистая диарея, рвота и судороги в ногах.У этих людей быстрая потеря жидкости в организме приводит к обезвоживанию и шоку. Без лечения смерть может наступить в течение нескольких часов.
Бактерия холеры обычно обнаруживается в воде или в пищевых продуктах, зараженных фекалиями (фекалиями) человека, инфицированного холерными бактериями. Холера чаще всего возникает и распространяется в местах с неадекватной очисткой воды, плохой санитарией и несоответствующей гигиеной.
Бактерии холеры также могут жить в окружающей среде в солоноватых реках и прибрежных водах.Источником инфекции были моллюски, употребляемые в пищу в сыром виде. В редких случаях люди в США заразились холерой после употребления в пищу сырых или недоваренных моллюсков из Мексиканского залива.
Человек может заразиться холерой, выпив воду или приняв пищу, зараженную холерными бактериями. Во время эпидемии источником заражения обычно являются фекалии инфицированного человека, загрязняющие воду или пищу. Заболевание может быстро распространяться в районах с неадекватной очисткой сточных вод и питьевой воды. Маловероятно, что инфекция передается напрямую от одного человека к другому; поэтому случайный контакт с инфицированным человеком не является фактором риска заболевания.
Инфекция холеры часто протекает в легкой форме или без симптомов, но может быть тяжелой. Примерно у 1 из 10 человек, заболевших холерой, разовьются серьезные симптомы, такие как водянистая диарея, рвота и судороги в ногах. У этих людей быстрая потеря жидкости в организме приводит к обезвоживанию и шоку. Без лечения смерть может наступить в течение нескольких часов.
Обычно симптомы проявляются через 2-3 дня после того, как человек проглотил бактерии холеры, но это время может варьироваться от нескольких часов до 5 дней.
Лица, живущие в местах с небезопасной питьевой водой, плохой санитарией и несоответствующей гигиеной, подвергаются наибольшему риску заболевания холерой.
Если вы считаете, что вы или член вашей семьи заболели холерой, немедленно обратитесь за медицинской помощью. Обезвоживание может быть быстрым, поэтому восполнение жидкости необходимо. Если у вас есть раствор для пероральной регидратации (ПРС), немедленно начните его принимать; это может спасти жизнь. Продолжайте пить ПРС дома и во время путешествий для лечения. Если у ребенка водянистая диарея, продолжайте кормить грудью.
Для проверки на холеру врачи должны взять образец стула или ректальный мазок и отправить его в лабораторию для поиска бактерий холеры.
Холеру можно просто и успешно вылечить путем немедленного восполнения жидкости и солей, теряемых при диарее. Пациентов можно лечить раствором для пероральной регидратации (ПРС), предварительно расфасованной смесью сахара и солей, которая смешивается с 1 литром воды и выпивается в больших количествах. Этот раствор используется во всем мире для лечения диареи.В тяжелых случаях также требуется внутривенное восполнение жидкости. При своевременной соответствующей регидратации умирает менее 1% больных холерой.
Антибиотики сокращают течение и уменьшают тяжесть заболевания, но они не так важны, как регидратация. Лицам, у которых в странах, где наблюдается холера, развиваются тяжелая диарея и рвота, следует незамедлительно обратиться за медицинской помощью.
Маловероятно, что болезнь передается напрямую от одного человека к другому; поэтому случайный контакт с инфицированным человеком не является фактором риска заболевания.
Будьте в курсе, возникали ли недавно случаи холеры в районе, который вы планируете посетить. Однако риск холеры для людей, посещающих районы с эпидемией холеры, очень низок, если предпринимаются простые меры профилактики.
Все посетители или жители в районах, где наблюдается или возникла холера, должны следовать рекомендациям по предотвращению заболеваний:
- Пейте только бутилированную, кипяченую или химически очищенную воду, а также напитки в бутылках или банках. При использовании напитков в бутылках убедитесь, что пломба не сломана.Газированная вода может быть безопаснее негазированной. Избегайте водопроводной воды, фонтанных напитков и кубиков льда.
- Для дезинфекции собственной воды выберите один из следующих вариантов:
- Варить 1 минуту, или
- Отфильтруйте и добавьте ½ таблетки йода или 2 капли бытового отбеливателя на литр / кварту воды, или
- Используйте имеющиеся в продаже таблетки для хлорирования воды в соответствии с инструкциями производителя.
- Часто мойте руки чистой водой с мылом, особенно перед едой или приготовлением пищи, а также после посещения туалета.
- Если под рукой нет воды и мыла, используйте дезинфицирующее средство для рук на спиртовой основе с содержанием спирта не менее 60%.
- Используйте бутилированную, кипяченую или химически очищенную воду для мытья посуды, чистки зубов, мытья и приготовления пищи, а также для приготовления льда.
- Ешьте упакованные или свежеприготовленные продукты, которые подают горячими.
- Не ешьте сырое или недоваренное мясо и морепродукты, а также сырые или недоваренные фрукты и овощи, если они не очищены от кожуры.
- Утилизируйте фекалии в соответствии с санитарными правилами, чтобы предотвратить загрязнение воды и источников пищи.
- FDA одобрило внешний значок однодозовой живой пероральной вакцины против холеры под названием Vaxchora ® (лиофилизированный CVD 103-HgR) для взрослых от 18 до 64 лет, которые путешествуют в зону активной передачи токсигенных Vibrio cholerae O1 ( штамм, который чаще всего вызывает холеру). Вакцина обычно не рекомендуется большинству путешественников из Соединенных Штатов, потому что очень немногие посещают районы активной передачи холеры.Всемирная организация здравоохранения (ВОЗ) одобрила три других пероральных инактивированных или неживых вакцины против холеры: Дукорал ® , ШанЧол ® и Еввичол-Плюс ® / Еввичол ® для поставок в Организацию Объединенных Наций, но эти вакцины недоступны в США. Ни одна вакцина против холеры не обеспечивает 100% защиты, а вакцинация против холеры не заменяет стандартные меры профилактики и контроля, включая меры предосторожности в отношении продуктов питания и воды.
- Для получения дополнительной информации посетите страницу «Вакцины».
- Холера была распространена в Соединенных Штатах в 1800-х годах, но распространение, связанное с водой, было устранено современными системами очистки воды и сточных вод. Очень редко люди в США заболевают холерой после употребления в пищу сырых или недоваренных моллюсков из Мексиканского залива.
- Однако путешественники из США в районы с эпидемией холеры (например, некоторые части Африки, Азии и Латинской Америки) могут подвергаться воздействию бактерий холеры и могут заболеть после прибытия домой.Некоторые путешественники привозили домой зараженные морепродукты из-за границы, что привело к холере.
- Органы общественного здравоохранения США и других стран работают над усилением эпиднадзора за холерой, расследованием вспышек холеры и реагированием на них, а также разработкой и внедрением профилактических мер по всему миру. Центры по контролю и профилактике заболеваний (CDC) расследуют эпидемию холеры, где бы она ни возникла, по приглашению пораженной страны и обучают лабораторных работников надлежащим методам выявления Vibrio cholerae .Кроме того, CDC предоставляет информацию о диагностике, лечении и профилактике холеры должностным лицам органов здравоохранения и информирует общественность об эффективных профилактических мерах.
- Всемирная организация здравоохранения (ВОЗ) и Глобальная целевая группа по борьбе с холерой (GTFCC) вместе с партнерами и различными заинтересованными сторонами запустили Глобальный план действий по борьбе с холерой до 2030 года, который является беспрецедентной инициативой по борьбе и сокращению передачи холеры во всем мире. В этом всеобъемлющем плане определены приоритеты по сокращению смертности от холеры на 90% и прекращению передачи инфекции в 20 странах к 2030 году.Центры по контролю и профилактике заболеваний (CDC) поддерживают глобальную стратегию, участвуя в рабочих группах целевых групп по водоснабжению, санитарии и гигиене (WASH), ведению больных, эпидемиологии и эпиднадзору, лабораторным и оральным вакцинам против холеры.
- Агентство США по международному развитию спонсирует некоторые международные мероприятия правительства США и предоставляет медицинские принадлежности, а также воду, средства санитарии и гигиены пострадавшим странам.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов тестирует импортных и отечественных моллюсков на В.cholerae и контролирует безопасность грядок моллюсков в США в рамках программы санитарной обработки моллюсков.
Передача холеры | Центр стратегических и международных исследований
7 марта 2012 г.
Написано Алишой Крамер
Vibrio cholerae — возбудитель холеры. Это бобовидная бактерия с длинным хвостом, которую она использует для самодвижения. Бактерии передаются от человека к человеку фекально-оральным путем; укус зараженной пищи или глоток зараженной воды могут вызвать инфекцию.Более конкретно, токсин, выделяемый бактериями, которые нацелены на рецепторы в кишечнике человека, ответственен за патологию, характерную для этого заболевания. Симптомы включают чрезмерную водянистую диарею; рвота; обезвоживание; а без надлежащего лечения быстрое ухудшение состояния и смерть.
Прежде чем заразить человека-хозяина, ключевым компонентом стратегии выживания вибрионов в водной среде является тесное взаимодействие между бактериями и креветкообразным ракообразным, называемым копеподом.Численность бактерий холеры увеличивается за счет образования биопленок на поверхности веслоногих рачков. Эти биопленки действуют как защитные бараки для бактерий — в структуре биопленок бактерии могут выжить в неблагоприятных условиях во время межэпидемических периодов.
Скопление вибрионов на веслоногих рачках также является очень эффективным средством передачи человеческим хозяевам. Исследования показывают, что для развития клинической холеры требуется от 103 до 105 вибрионов.Однако в результате образования биопленок всего 1-10 веслоногих рачков могут содержать достаточно холерных вибрионов, чтобы вызвать заболевание. В районах с плохой санитарией и отсутствием водной инфраструктуры веслоногие рачки обычно встречаются в питьевой воде, что резко увеличивает риск заражения холерой.
Vibrio cholerae — возбудитель холеры. Это бобовидная бактерия с длинным хвостом, которую она использует для самодвижения. Бактерии передаются от человека к человеку фекально-оральным путем; укус зараженной пищи или глоток зараженной воды могут вызвать инфекцию.Более конкретно, токсин, выделяемый бактериями, которые нацелены на рецепторы в кишечнике человека, ответственен за патологию, характерную для этого заболевания. Симптомы включают чрезмерную водянистую диарею; рвота; обезвоживание; а без надлежащего лечения быстрое ухудшение состояния и смерть.
Прежде чем заразить человека-хозяина, ключевым компонентом стратегии выживания вибрионов в водной среде является тесное взаимодействие между бактериями и креветкообразным ракообразным, называемым копеподом.Численность бактерий холеры увеличивается за счет образования биопленок на поверхности веслоногих рачков. Эти биопленки действуют как защитные бараки для бактерий — в структуре биопленок бактерии могут выжить в неблагоприятных условиях во время межэпидемических периодов.
Скопление вибрионов на веслоногих рачках также является очень эффективным средством передачи человеческим хозяевам. Исследования показывают, что для развития клинической холеры требуется от 10 3 до 10 5 вибрионов.Однако в результате образования биопленки всего 1-10 веслоногих рачков могут содержать достаточно V. cholera , чтобы вызвать заболевание. В районах с плохой санитарией и отсутствием водной инфраструктуры веслоногие рачки обычно встречаются в питьевой воде, что резко увеличивает риск заражения холерой.
хозяин, патоген и бактериофаг динамика
Abstract
Зимбабве представляет собой самый последний пример трагедии, которая постигает страну и ее жителей, когда поражает холера.Вспышка 2008–2009 годов быстро распространилась по каждой провинции и привела к уровню смертности, аналогичному тем, которые наблюдались в результате инфекций холеры сто лет назад. В этом обзоре мы выделяем достижения, которые помогут понять, как взаимодействия между хозяином, бактериальным патогеном и литическим бактериофагом могут способствовать возникновению и подавлению вспышек холеры в эндемичных условиях и в развивающихся эпидемических регионах, таких как Зимбабве.
Диарейные болезни, включая холеру, являются ведущей причиной заболеваемости и второй по частоте причиной смерти среди детей в возрасте до 5 лет во всем мире 1,2 .Трудно определить точную заболеваемость и смертность от холеры, поскольку системы эпиднадзора во многих развивающихся странах находятся в зачаточном состоянии, а многие страны не решаются сообщать о случаях холеры в ВОЗ из-за потенциального негативного экономического воздействия этой болезни на торговлю и туризм. Сегодня реальное бремя холеры оценивается в несколько миллионов случаев в год, преимущественно в Азии и Африке 3 . При оптимальной доставке пероральная регидратационная терапия может снизить уровень летальности с> 20%, наблюдавшихся ранее 4–6 до <1% 7 .Еще предстоит проделать большую работу, поскольку 27 стран сообщили о показателях летальности, превышающих пороговое значение в 1% в 2007 году (REF. 8).
Возбудитель холеры, грамотрицательная бактерия Vibrio cholerae, является факультативным патогеном, который имеет этапы жизненного цикла человека и окружающей среды 9,10 . V. cholerae дифференцируется серологически на основе антигена О его липополисахарида (ЛПС) (). Штаммы, продуцирующие токсин холеры ( токсигенный ), серогрупп O1 и O139 вызывают подавляющее большинство заболеваний.Серогруппа O1 подразделяется на два фенотипически различных биотипа , , Эль-Тор и классический, второй из которых связан с более ранними пандемиями. Оба биотипа могут быть далее подразделены на два серотипа, Инаба и Огава 7 . За последние 20 лет Эль Тор заменил классический биотип 11 ; однако наследие классического биотипа сохраняется, поскольку появились штаммы Эль-Тор, содержащие токсин классической холеры 12–14 . Серогруппа O139 впервые появилась в 1992 году в результате замены нескольких генов в O-антиген-кодирующей области штамма-предшественника O1 El Tor 15 .Хотя серогруппа O139 вызвала разрушительные вспышки в 1990-х годах, штамм Эль Тор остается доминирующим штаммом во всем мире 11,16,17 .
Филогенетическое родство штаммов Vibrio choleraeНа основании антигенности компонента O-антигена липополисахарида внешней мембраны в водной среде существует более 200 серогрупп (O1 – O200) Vibrio cholerae . Только подмножество штаммов серогрупп O1 и O139 являются токсигенными (Tox + ) и, следовательно, способны вызывать холеру при приеме внутрь; такие штаммы отбираются у хозяина.Другие штаммы нетоксигены (Tox — ) и отбираются против них. Различные типы О-антигена обозначены цветом внешней мембраны и покрытого оболочкой жгутика (периплазматическое пространство и внутренняя мембрана не показаны). Капсулы присутствуют в подмножестве штаммов. Генотипы разных штаммов обозначены цветом цитоплазмы; обратите внимание, что Tox + O1 и O139 имеют по существу один и тот же генотип, за исключением генов O-антигена.
Патофизиология холеры описана в обширной литературе.Короче говоря, патогенные штаммы несут в себе ключевые факторы вирулентности, которые включают холерный токсин 18 и ко-регулируемые токсином ворсинки (TCP) 19,20 , самосвязывающиеся пилусы, которые связывают бактериальные клетки вместе 21 , возможно, чтобы противостоять силам сдвига. в тонком кишечнике хозяина. Токсин холеры представляет собой секретируемый токсин субъединицы AB 5 . Пентамер субъединицы B связывает моносиалотетрагексозилганглиозиды на абсорбирующих эпителиальных клетках, вызывая эндоцитоз ферментативной субъединицы A, после чего он рибозилирует АДФ субъединицу G-белка, который контролирует активность аденилилциклазы.Хотя вирулентность является многофакторной, холерный токсин является ключевым фактором, ответственным за обильную секреторную диарею, которая возникает у инфицированных людей. Трансмиссивные элементы, такие как лизогенный бактериофаг , несущий гены холерного токсина 22 и элемент SXT, несущий гены устойчивости к антибиотикам 23 , будут продолжать определять эволюцию V. cholerae .
Биологические факторы и факторы окружающей среды, которые способствуют динамике вспышек холеры, продолжают оставаться предметом интенсивных исследований.Было опубликовано несколько обзорных статей, посвященных важности экологических факторов в распространении вспышек холеры. 24–26 . В этом обзоре мы сосредоточимся скорее на трех биологических факторах, которые, как считается, играют важную роль в возникновении и формировании вспышек холеры: восприимчивость хозяина, вирулентность V. cholerae и литические бактериофаги. Ниже мы обсудим эту троицу факторов, связанных с динамическим характером вспышек холеры.
Человек-хозяин
Клинический спектр
В.cholerae инфекцияИнфекция V. cholerae вызывает клинический спектр, который варьируется от бессимптомной колонизации до холеры гравис, наиболее тяжелой формы болезни (). После приема организмом зараженной пищи или воды V. cholerae колонизирует тонкий кишечник в течение 12–72 часов до появления симптомов. Холера часто начинается с желудочных спазмов и рвоты, за которыми следует диарея, которая может прогрессировать до потери жидкости до 1 литра в час 27 .Эти потери приводят к серьезному истощению объема жидкости и метаболическому ацидозу, что может привести к сосудистому коллапсу и смерти 7 . Стул с рисовой водой обычно содержит от 10 10 до 10 12 вибрионов на литр. Пациенты с симптомами могут выделять вибрионы до начала болезни 28,29 и будут продолжать выделять организмы в течение 1-2 недель 30,31 . Бессимптомные пациенты обычно выделяют вибрионы со стулом только в течение 1 дня, примерно 10 3 вибрионов на грамм стула 32 .Следовательно, распределение пациентов с симптомами влияет на количество V. cholerae , которые выделяются для последующей передачи.
Таблица 1
Клинический спектр инфекции Vibrio cholerae
| Бессимптомная инфекция | Легкая инфекция | Тяжелая инфекция | Рвота и обильная диарея |
|---|---|---|---|
| Обезвоживание | Отсутствует | От легкой до легкой | От средней до тяжелой (гиповолемический шок) |
| Характеристики стула | 320Нормальные характеристики стула | 320Нормальный стул | |
| Вибрионов на грамм стула | До 10 5 | До 10 8 | 10 7 до 10 9 в стуле (и рвотных массах) | Нет | Раствор для пероральной регидратации (O RS) | ПРС, внутривенные жидкости и антибиотики ‡ |
| Смертность | Нет | Нет | Без лечения: до 50% Вылечено: менее 1% |
Бессимптомные случаи также могут способствовать распространению микроорганизма, хотя и на гораздо более низком уровне, чем пациенты с симптомами, и могут отражать важный компонент приобретенного иммунитета, который наблюдается в некоторых сообществах. Однако бессимптомные случаи часто трудно задокументировать. Четырехкратное повышение титра вибриоцидного антитела в сыворотке крови является полезной мерой для выявления бессимптомных людей, которые могут быть инфицированы, но от которых невозможно изолировать организм.Используя положительный результат посева из ректального мазка или ответ на вибриоцидные антитела для определения инфекции, недавно было обнаружено, что у бангладешских детей в возрасте до 5 лет вероятность появления симптомов в 2–3 раза выше, чем у детей старше 5 лет 35 . Частота симптомов во всех возрастных группах в этом исследовании составила 57% 35 . Это соответствует показателям симптоматических инфекций, которые были обнаружены в связи с классическими штаммами в более ранней литературе 32,38–40 , но намного выше показателей, сообщенных для инфекций Эль-Тор в 1970-е годы 40 .Таким образом, бессимптомные случаи могут составлять примерно половину всех случаев. Будущие исследования иммунологии бессимптомных пациентов помогут оценить их вклад в защитный иммунитет на популяционном уровне.
Восприимчивость к холере
Генетические факторы хозяина и факторы питания влияют на восприимчивость к холере. Антигены группы гистокрови ABH представляют собой набор клеточных и секретируемых гликолипидов и гликопротеинов, которые являются ключевыми детерминантами восприимчивости хозяина к ряду желудочно-кишечных патогенов; они, по-видимому, влияют на специфичность рецептора клетки-хозяина в отношении связывания патогенов и токсинов.Фенотип O соответствует немодифицированному антигену H и связан со сниженным риском заражения V. cholerae . Однако, как только хозяин инфицирован, фенотип O связан с повышенным риском серьезных симптомов; механизм этого остается неизвестным. Распространенность фенотипа O варьируется среди человеческих популяций; его низкая распространенность в дельте реки Ганг предполагает, что существует отбор против этого фенотипа в эндемичных по холере районах 35,41,42 .В популяциях с высокой распространенностью группы крови O, например в странах Латинской Америки, болезнь протекает тяжелее, и потребности в регидратации и госпитализации инфицированных людей существенно выше 43,44 .
Хотя антиген группы крови H является единственным давно признанным генетическим фактором, связанным с восприимчивостью к холере, другие генетические полиморфизмы, вероятно, были выбраны за или против, учитывая исторически высокие показатели смертности от холеры.Например, недавнее исследование связывало тяжелую холеру с вариантом LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) 45 , консервативного белка врожденного иммунитета. Экспрессия LPLUNC1 активируется в эпителии тонкой кишки во время острой холеры и может влиять на течение инфекции V. cholerae 46 .
Недоедание, измеряемое по задержке линейного роста, не является фактором риска заражения V. cholerae 35 .Однако дефицит ретинола (витамина А), питательного микроэлемента, который способствует иммунитету слизистых оболочек, является фактором риска, связанным как с инфекцией V. cholerae , так и с развитием симптоматического заболевания 35 . Цинк, еще один питательный микроэлемент, который способствует иммунитету слизистых оболочек, может истощаться во время диарейных заболеваний 47 . Оральный цинк устраняет этот дефицит у детей, что приводит к значительному сокращению объема стула и времени до прекращения диареи 44 .
Защитный иммунитет
Несколько исследований демонстрируют, что клинически очевидная инфекция V. cholerae индуцирует защитный иммунитет против последующей инфекции (ВСТАВКА 1). Заражение североамериканских добровольцев классическим биотипом и биотипом Эль-Тор обеспечивало 100% и 90% защиту соответственно от последующего заражения 31,48 . Аналогичным образом, в эндемических условиях было обнаружено, что более 90% пациентов с тяжелым заболеванием, вызванным инфекцией классическим биотипом, были защищены от инфекции в будущем, на основании наблюдаемой и ожидаемой частоты госпитализаций в связи со вторым эпизодом холеры в это население 33 ; аналогичные результаты были получены в отдельном исследовании 49 .Механизм этого защитного иммунитета против инфекции и болезни V. cholerae неизвестен.
Ящик 1 | Иммунный ответ человека на
Vibrio choleraeВрожденный ответ
Считается, что холера является прототипической невоспалительной инфекцией. Часто отсутствуют грубые изменения слизистой оболочки кишечника или архитектурной целостности тонкой кишки. Однако наблюдается повышенная регуляция провоспалительных цитокинов (включая интерлейкин-1β и фактор некроза опухоли), экспрессии различных бактерицидных белков и миграции нейтрофилов в собственную пластинку во время острой холеры.Естественная вариабельность врожденного иммунного ответа может влиять на восприимчивость, что подтверждается открытием, что полиморфизм в промоторной области гена LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) связан с повышенным риском холеры.
Адаптивный ответ
Неизвестно, как адаптивный иммунный ответ на холеру обеспечивает защиту от последующего заболевания. Поскольку Vibrio cholerae неинвазивен, было высказано предположение, что секреторный иммуноглобулин А кишечника (sIgA) защищает от колонизации слизистой оболочки.Примерно через 8 дней после начала холеры наблюдается пик циркуляции антиген-специфических лимфоцитов V. cholerae , которые экспрессируют хемокиновые рецепторы кишечника (см. Рисунок) 112 . Эти лимфоциты вскоре становятся необнаруживаемыми в крови, поскольку они возвращаются на слизистую оболочку кишечника, где они приводят к увеличению секреции sIgA в кишечнике. Реакции сывороточных антител, такие как реакция вибриоцидных антител, также достигают максимума через 1-3 недели после заражения. Хотя высокие сывороточные титры вибриоцидных антител и IgA, специфичного к холерному токсину, коррелируют с защитой от инфекции, эти антитела снижаются до исходного уровня через год после заражения, задолго до того, как защитный иммунитет к холере ослабевает.Точно так же у добровольцев, инфицированных V. cholerae , уровни sIgA слизистой оболочки снижаются до исходного уровня в течение нескольких месяцев. Однако, когда добровольцев, у которых больше нет определяемых антител, повторно провоцируют антигенов V. cholerae , они демонстрируют стойкую способность вызывать анамнестический иммунный ответ, развивая пиковую кишечную секрецию антител так же быстро, как в течение трех дней. Следовательно, возможно, что скорость анамнестического ответа на повторное воздействие, а не заранее сформированные антитела, может опосредовать защиту от холеры.Это подтверждается недавними данными о том, что холера вызывает ответ В-клеток памяти, который выявляется в течение по крайней мере 1 года после заражения холерой 113 .
Выявлено несколько коррелятов иммунитета. Лучше всего охарактеризованным серологическим маркером иммунитета является титр сывороточных вибриоцидных антител. Это антитело является комплемент-зависимым бактерицидным антителом, титр которого заметно увеличивается после болезни, но снижается до исходного уровня через 6–9 месяцев 7 . В Бангладеш вибриоцидные антитела обнаруживаются у большинства людей в возрасте 10–15 лет и связаны со снижением риска инфицирования.Поскольку V. cholerae является неинвазивным патогеном, эти сывороточные антитела могут не вносить непосредственный вклад в защиту на уровне слизистой оболочки кишечника, но они могут быть полезны для оценки степени защитного иммунитета на уровне популяции. Антитела иммуноглобулина A, специфичные к TCP, LPS или субъединице B холерного токсина, коррелируют с защитой от последующей инфекции и заболевания 35 .
Полевые испытания вакциныобеспечивают контролируемую оценку устойчивости адаптивных иммунных ответов к В.холера . В крупнейшем контролируемом исследовании 62 285 участников в Бангладеш были рандомизированы для получения 3 пероральных доз (с интервалом в 6 недель) комбинации убитых целых клеток (Эль Тор и классические) плюс субъединица B холерного токсина (вакцина B – WC), цельноклеточный компонент без B-субъединицы (вакцина WC) или убитый Escherichia coli K12 в качестве контроля. Через 3 года наблюдения две вакцины (B – WC и WC) имели 50% и 52% защитную эффективность, соответственно 50 . Для детей младше 5 лет эффективность составила 23–26%.Через 6 месяцев наблюдения вакцина B – WC дала 85% защиту 51 . Ведутся споры о том, демонстрируют ли эти данные эффективность, достаточную для широкомасштабного распространения. В настоящее время предпринимаются усилия по созданию новых вакцин для обеспечения более высоких и устойчивых ответов у реципиентов, а также для снижения производственных затрат с целью преодоления как иммунологических, так и производственных препятствий, которые ограничивают применимость существующих вакцин против холеры 52–55 .
Роль, которую коллективный иммунитет играет в замедлении передачи холеры, недавно стала оценена.В исследованиях эффективности вакцины отдельные пациенты рандомизируются, чтобы гарантировать, что защитная эффективность отражает только прямой эффект вакцины 56 . Это означает, что лицензирование вакцин не учитывает их преимущества на уровне населения. Обсуждаемое выше испытание вакцины B – WC имело уровень охвата от 4% до 65% в разных регионах 50,57 . Когда уровни заболеваемости холерой сравнивались с показателями охвата вакцинацией в конкретных регионах, было обнаружено, что заболеваемость среди реципиентов плацебо обратно коррелировала с уровнем охвата прививками 57 : там, где охват был высоким, даже среди тех, кто этого не сделал. Получившие вакцину, вероятность заболеть холерой по-прежнему на четверть ниже, чем у невакцинированных лиц в районах с низким охватом.Когда коллективный иммунитет включен в имитационные модели эффективности вакцины, охват вакцинацией B – WC 50% в эндемичных районах приводит к снижению общего числа случаев на 93% 58 . Взятые вместе, эти исследования доказывают, что вакцина B-WC может обеспечить достаточную защиту для широкомасштабной вакцинации в эндемичных регионах и что коллективный иммунитет, вероятно, будет играть важную роль в ограничении передачи холеры.
Передача с точки зрения хозяина
Несколько групп создали математические модели, использующие точки зрения как хозяина, так и патогена, чтобы помочь объяснить и предсказать природу вспышек холеры.Цель большинства этих моделей — точно отразить резкий рост и снижение заболеваемости холерой, которое наблюдается два раза в год в регионах вокруг Бенгальского залива. Модель была построена для включения показателей передачи, фактора сезонных колебаний и расчета количества восприимчивых людей на основе различного защитного иммунитета от прошлой инфекции 59–61 . Эти идеи были основаны на проверке гипотез о том, что высокое соотношение бессимптомных и симптоматических случаев связано с разрешением вспышки и что короткий интервал защитного иммунитета (2–12 недель) после заражения допускает последующие вспышки, которые наблюдаются в Бангладеш 62 .Результаты показывают, что комбинация многих бессимптомных случаев и недолговечного иммунитета, а не молчаливых шеддеров , дает модель, которая лучше всего отражает эпидемиологические данные из Западной Бенгалии. У модели есть ограничения: она предполагает соотношение бессимптомных и симптоматических случаев, которое намного выше, чем наблюдаемое в последние годы, и она была протестирована с использованием показателей смертности, которые связаны с клинически определенной холерой из Западной Бенгалии между 1891 и 1940 годами — эпохой до открытия. ротавируса и энтеротоксигенного E.coli , которые являются смешивающими факторами. Несмотря на свои недостатки, эти модели улучшают наше понимание сложной динамики вспышек и показывают, насколько мощной может быть реакция хозяина в ограничении передачи. Новые модели передачи холеры должны по-прежнему включать факторы сезонных колебаний, соотношение бессимптомных и симптоматических случаев и темпы снижения защитного иммунитета.
Возбудитель
Инфекционные дозы в моделях на животных
Заражение человека-хозяина представляет собой многоступенчатый процесс: V.cholerae необходимо принимать внутрь в дозе, достаточной для преодоления врожденной иммунной защиты, затем экспрессии факторов вирулентности для колонизации тонкой кишки и, наконец, для координации выхода из организма хозяина для облегчения передачи 63 (). Животные модели холеры в значительной степени являются показателями успешности первых двух стадий 64 . Используя модель инфекции у новорожденных мышей, было показано, что V. cholerae , которые выделяются с рисовым водяным стулом человека, находятся в гиперинфекционном состоянии, демонстрируя ID 50 из 10–100 клеток по сравнению с примерно 500 клетками для В.cholerae , выращенный in vitro 65–67 . Гиперинфекция также была задокументирована у Citrobacter rodentium 68 , а гиперинфекционный V. cholerae может быть воспроизведен при прохождении через мышиную модель инфекции 68,69 . Определение и фенотип гиперинфективности противоречивы из-за сложностей при выборе наиболее подходящих условий культивирования для роста контрольного штамма.
Жизненный цикл патогенного Vibrio choleraeТоксигенные штаммы Vibrio cholerae сохраняются в водной среде наряду с нетоксигенными штаммами, чему способствует образование биопленок на биологических поверхностях и использование хитина в качестве источника углерода и азота.При попадании этих адаптированных к водной среде бактерий в загрязненную пищу или воду токсикогенные штаммы колонизируют тонкий кишечник, размножаются, выделяют токсин холеры и возвращаются в окружающую среду хозяином при секреторной диарее. Патогенные микроорганизмы, выделяемые калом, находятся в преходящем гиперинфекционном состоянии, которое способствует усилению вспышки за счет передачи последующим хозяевам.
Молекулярные механизмы, которые способствуют гиперинфективности у V. cholerae , многофакторны.Исследования на микрочипах показали, что глобальный профиль транскрипции гиперинфекционных V. cholerae из рисового водяного стула отличается от такового у V. cholerae , выращенных in vitro или верхних отделов тонкой кишки V. cholerae , выведенных в рвотные массы 65, 70,71 (). Большинство известных генов вирулентности, включая гены холерного токсина и TCP, подавляются в стуле из рисовой воды, но механизм этого подавления остается неизвестным. Еще одна уникальная особенность — подавление генов хемотаксиса, что удивительно, учитывая, что планктонные вибрионы, выделяемые пациентами, являются жгутиками и очень подвижны.Было показано, что это подавление хемотаксиса является одним из компонентов гиперинфективности, потому что подвижные, но нехемотаксирующие мутанты V. cholerae являются гиперинфекционными 66,72,73 .
Паттерны экспрессии гена Vibrio cholerae на разных стадиях жизненного циклаПри проглатывании (нижняя правая панель) Vibrio cholerae использует подвижность и муциназы для проникновения через слизистый гель и N -ацетилглюкозамин-связывающий белок A ( GbpA) и другие факторы колонизации эпителия тонкой кишки.Существенные изменения в экспрессии генов сопровождают этот переход от пруда к острой инфекции, включая, помимо прочего, индукцию vieA, которая кодирует фосфодиэстеразу, гидролизующую вторичный мессенджер циклического ди-GMP, и гены, регулируемые ToxR, включая гены холерного токсина и самоагрегативное пилообразное ядро, регулируемое токсинами (TCP). Кроме того, репрессируются несколько генов, таких как гены хитин-связывающего маннозу-чувствительного гемагглютинина пилуса (MSHA) и стрессового сигма-фактора RpoS.На поздней стадии инфекции (нижняя левая панель) V. cholerae снова изменяет экспрессию своего гена, чтобы отделиться от эпителия — «реакция бегства» — и подготовиться к передаче другому хозяину (например, распространение в домашних условиях). ) или попадание в водную среду. Изменения на поздних стадиях включают индукцию генов синтеза c-di-GMP (дигуанилилциклазы), систем поглощения питательных веществ (таких как регулон регуляции поглощения железа (Fur)) и подвижности (Fla), а также репрессию таких генов, как для хемотаксиса (Che) и регулона ToxR.Возникающее в результате «подвижное, но не хемотаксическое» состояние способствует гиперинфективности. Если бактерии, выделяющиеся со стулом, не попадают в организм другого хозяина в течение короткого периода времени, то их ждет одна из двух судьб (верхняя панель): укоренение в водной среде путем нахождения подходящих источников питательных веществ, таких как хитин, или распад в « активную среду ». но некультивируемое состояние. При воздействии хитина V. cholerae индуцирует несколько генов, участвующих в присоединении и катаболизме хитина (регулон ChiS), а также гены, участвующие в генетической компетентности (регулон TfoX).Образование биопленок на поверхности опосредуется индукцией регулона Vps, который кодирует внеклеточный полисахарид. Во время перехода в активное, но не культивируемое состояние происходят большие изменения в экспрессии генов, поскольку V. cholerae пытается адаптироваться к условиям с низким содержанием питательных веществ. К ним относятся индукция генов фосфатного и азотного голодания (phoB и glnB-1 соответственно) и репрессия генов трансляционного аппарата.
Транскриптом V. cholerae , пассированный от животных, также уникален и был выявлен в двух недавних исследованиях.Во-первых, существует скоординированная «реакция бегства», которая позволяет организму отделяться от ворсинок кишечника, готовясь к выходу из организма хозяина; это регулируется стрессом и стационарной фазой сигма-фактора РНК-полимеразы RpoS 74 . Во-вторых, на более поздних стадиях заражения животных, V. cholerae активирует экспрессию генов, которые не требуются для инфекции, но которые важны для выживания при переходе в водную среду 75 . Эта предварительная индукция генов выживания в окружающей среде на поздних этапах инфекции может подготовить организм к жесткому селективному давлению в воде пруда, тем самым облегчая передачу 24,65 .В большинстве описанных выше исследований бактериальные клетки, составлявшие инфекционную дозу, были планктонными клетками, а не агрегатами. Было проведено одно исследование с участием добровольцев, в котором добровольцам вводили V. cholerae в морщинистой форме (т. Е. Агрегативной и продуцирующей экзополисахариды); Инфекционная доза была аналогична дозе, наблюдаемой для планктонных форм, а морщинистые формы выделялись добровольцами 76 . Кроме того, люди выделяют V. cholerae в виде сложных биопленко-подобных агрегатов 67,77,78 .Идентификатор 50 V. cholerae выделяется в совокупности, и роль, которую эти совокупности играют в передаче, еще предстоит определить.
Инфекционная доза у людей
Инфекционная доза V. cholerae у людей сильно варьируется в зависимости от бактериального штамма и хозяина. Дозы 10 8 –10 11 клеток требовались для обеспечения последовательной колонизации у здоровых добровольцев из Северной Америки 7,29,31 . Инфекционная доза снижается до 10 4 –10 8 при использовании бикарбонатного буфера для нейтрализации желудочного сока незадолго до инокуляции; этот метод дает 90% зараженности 7,29,31 .В домашнем хозяйстве пища может действовать как кислотный буфер; В исследованиях на добровольцах введение бактерии как часть «еды» из риса, рыбы, заварного крема и обезжиренного молока дало результаты, сравнимые с результатами, наблюдаемыми при одновременном введении бактерий и бикарбоната 79 . В эндемичных условиях инфекционная доза неизвестна. Подсчет V. cholerae в образцах домашнего хозяйства и окружающей среды исторически сложен, требует быстрого реагирования и использования флуоресцентной микроскопии для подсчета тех бактерий, культивирование которых, возможно, затруднено. 80 .
Клиническое наблюдение, что буферная кислота желудочного сока снижает инфекционную дозу, предполагает, что бактериальные гены, участвующие в кислотной устойчивости, могут способствовать вирулентности. Сигнатурный мутагенез (STM) был использован для поиска подмножества генов вирулентности, которые вносят вклад в кислотостойкость in vitro 81 . Удаление этих генов ослабило V. cholerae в модели инфекции у новорожденных мышей, что подтверждает их роль в вирулентности. Кроме того, обнажая В. дикого типа.cholerae для подкисления непосредственно перед инокуляцией мышей давало большое конкурентное преимущество перед неадаптированными к кислоте бактериями 82 . Эти данные, наряду с другими, демонстрируют, что бактерии, выращенные in vitro , могут стать более заразными в результате воздействия стресса. Кроме того, эти результаты могут иметь клиническое значение в тех регионах мира, где преобладает пониженная продукция желудочной кислоты (ахлоргидрия), вторичная по отношению к инфекции Helicobacter pylori, например, Бангладеш 7 .
Передача с точки зрения патогена
Роль, которую гиперинфекция играет в быстром распространении холеры среди населения в начале вспышки, остается непроверенной. V. cholerae остается гиперинфекционным в течение как минимум 5 часов после перехода от пациентов в водную среду, что позволяет предположить, что гиперинфекция играет особую роль в передаче инфекции в районах с высокой плотностью населения, где существует вероятность контакта с организмом другого человека. в относительно короткие сроки 65,70 .Одна модель передачи холеры предполагает, что вспышка начинается, когда либо уже инфицированный индексный случай мигрирует и заражает новую территорию, либо потребление V. cholerae из естественного резервуара окружающей среды создает новый индексный случай у постоянного населения. В обоих сценариях возможно ускорение вспышки в результате быстрого распространения гиперинфекционного вируса V. cholerae от человека к человеку при кратковременном нахождении в окружающей среде.Модели передачи, которые допускают только случайное попадание V. cholerae в окружающую среду, не предсказывают резкого роста числа случаев, которые наблюдаются в начале вспышек по всему миру, включая те, которые происходят раз в два года в Бангладеш 11 . Однако модели, учитывающие гиперинфективность 83 , лучше отражают этот резкий подъем.
Поддержание передачи через водоемы
Эндемичная холера встречается в регионах с естественными водными резервуарами токсигенных и нетоксигенных V.cholerae , где бактерии могут сохраняться либо в свободноживущем состоянии, либо в ассоциации с фитопланктоном 84–86 , зоопланткон 85–88 или биотическим и абиотическим детритом 89,90 . Эти взаимодействия могут быть как полезными, так и антагонистическими 91,92 . Ассоциации вообще не случайны. Например, V. cholerae развил механизмы для присоединения, разложения и использования хитина в качестве источника углерода и азота 93–95 ().Для экологических изолятов методы ДНК-типирования, основанные на секвенировании гипервариабельных локусов повторов короткой последовательности, начали лучше определять взаимосвязь между нетоксигенными и токсигенными V. cholerae . Было обнаружено, что два сельских региона, разделенных 80 км в дельте реки Ганг, содержат отдельные, разнообразные штаммы из экологических и клинических условий 96 . Экологические изоляты состояли как из токсигенных, так и из нетоксигенных штаммов O1 El Tor и O139 на фоне нетоксигенных штаммов, представляющих многие серогруппы.Напротив, клинические изоляты были строго токсигенными O1 El Tor и O139, но относились к разным типам штаммов. Эти результаты демонстрируют, что в организме хозяина токсикогенные штаммы обладают селективным преимуществом перед нетоксигенными штаммами из окружающей среды. Взаимосвязь между экологическими и клиническими штаммами может быть разной в других регионах мира и, вероятно, будет варьироваться в зависимости от окружающей среды, санитарии, инфраструктуры и плотности населения.
Селективное давление в водной среде
Некоторые бактериальные патогены, в том числе В.cholerae , теряют способность культивироваться на стандартных средах после переноса от хозяина или лаборатории в водную среду 24,97 . Этот фенотип традиционно известен как «жизнеспособное, но не культивируемое» (VBNC) состояние, поскольку клетки поддерживают способность к основным метаболическим процессам, таким как синтез белка, дыхание и поддержание целостности мембран, несмотря на их неспособность культивироваться 24 . Альтернативный, более консервативный термин, который применяется к этому состоянию, — «активный, но не культивируемый» (ABNC), поскольку остается неясным, живы ли еще бактерии, утратившие культивирование на стандартных средах 98 .
V. cholerae может быстро превратиться в ABNC, когда покидает человека-хозяина и попадает в водную среду. Исследования с участием пациента и in vitro , полученного V. cholerae , которые подвергались диализу в прудовой воде, продемонстрировали снижение культивирования на 60% и 90% через 5 часов и 24 часа соответственно 65 . Анализ микроматрицы продемонстрировал быстрые и заметные изменения транскрипции, когда бактерии входили в состояние ABNC 65 . Эти изменения включали индукцию генов поглощения фосфатов и фиксированного азота и подавление генов синтеза белка и энергетического метаболизма, что согласуется с низкими уровнями источников углерода, фосфатов и фиксированного азота, которые часто встречаются в водной среде.Остается проверить, будет ли включение твердых частиц, которые были отфильтрованы из воды пруда в вышеупомянутом исследовании, продлить культивирование V. cholerae . Учитывая возможность такого быстрого снижения культивируемости, исследователи задали вопрос, является ли большинство клеток V. cholerae , инфицированных людей из окружающей среды, ABNC или культивируемыми клетками. Одна из гипотез гласит, что если культивируемые клетки более заразны, чем клетки ABNC, то ID 50 , рассчитанный по общему количеству клеток, будет увеличиваться по мере уменьшения процента культивируемых клеток в популяции.Это было подтверждено в недавних экспериментах, предполагающих, что основными факторами инфицирования человека, вероятно, являются культивируемые клеток V. cholerae 65 . В будущих математических моделях передачи V. cholerae должна быть учтена возможность уменьшения скорости культивирования.
V. cholerae литический бактериофагБиология вибриофагов
Восемьдесят лет назад было предложено, чтобы бактериофаги могли контролировать естественные популяции патогенов 99,100 .Более поздние исследования в области морской микробиологии выявили элегантный баланс между бактериофагами и их цианобактериальной добычей 101 . С клинической точки зрения бактериофаги, в принципе, можно использовать для профилактики или лечения инфекций. Действительно, документально подтверждена «фаговая терапия» против холеры и других заболеваний (ВСТАВКА 2). Существует не менее 200 видов бактериофагов, которые инфицируют V. cholerae , известных как вибриофаги 102,103 . Нитевидный лизогенный вибриофаг CTXΦ является одним из наиболее охарактеризованных, поскольку он несет гены, кодирующие токсин холеры 22 .Первым секвенированным геномом хвостатого вибриофага был геном κ139; этот вибриофаг может быть как лизогенным, так и литическим. Основным механизмом, с помощью которого V. cholerae O1 становится устойчивым к κ139 и многим другим вибриофагам, является мутация кластера генов rfb , который кодирует ферменты для синтеза ЛПС 104 . В отсутствие рецептора антигена LPS O вибриофаг не может связываться или инфицировать бактериальную клетку. Все мутанты rfb -null V. cholerae O1, которые были протестированы на сегодняшний день, являются аттенуированными 65,67,105 .
Ящик 2 | Исследование бактериофагов
В 1915–1917 годах Twort 114 и d’Hérelle 115 независимо друг от друга открыли бактериофаги. Д’Эрелль определил, что бактериальная инфекция на животных моделях может быть ослаблена бактериофагами, и в 1925 году состояние пациентов с бубонной чумой улучшилось после того, как д’Эрелль ввел бактериофаги непосредственно в их бубоны (увеличенные лимфатические узлы) 116 . Эти открытия привели к исследованию бактериофагов, в задачу которого входило изучение терапии бактериофагом холеры в Индии 116 .Их первое испытание терапии сравнивало 244 нелеченных пациента с холерой с 219 пациентами с холерой, которых лечили вибриофагами; в нелеченой группе смертность составила 20%, тогда как в обработанной группе — 6,8% (χ 2 , p <0,01). Другие исследования показали аналогичные результаты 5,116,117 . Несмотря на некоторые ограничения, характерные для той эпохи, расследование добилось достаточного успеха, чтобы расширить свои усилия 5 .
За 1928, 1929 и 1934 годы сотрудники по расследованию подготовили и распространили 36 000, 130 823 и 871 316 доз вибриофагов в то время, когда начались вспышки в конкретных исследуемых сообществах в Индии. 116 .Вибриофаги также распространялись в общественных источниках питьевой воды для профилактики. Смертность от холеры сравнивалась с контрольными сообществами до и после вмешательств. Трехлетний уровень смертности от холеры снизился с 30 до 2 на 10 000 в регионах, лечившихся вибриофагами 117 . Хотя эти исследования имели несколько ограничений, они предоставляют единственные доступные данные об эффективности терапии вибриофагами. Достижения в области регидратации и антибиотикотерапии в 1930-х и 1940-х годах сделали испытания бактериофагов, основанные на конечных точках смертности, неэтичными и статистически сложными 116,118 .
Вибриофаги в окружающей среде
В 1930-х годах было обнаружено, что случаи холеры положительно коррелировали с изоляцией вибриофагов в водной среде 106 . В наше время была описана отсроченная положительная согласованность между ростом числа случаев холеры и последующим ростом вибриофагов в окружающей среде 107 . Модель, разработанная Jensen et al. предсказывает, что если вспышка будет инициирована увеличением В.cholerae в окружающей среде, плотность вибриофагов впоследствии будет увеличиваться, что в конечном итоге будет способствовать сокращению вспышки 108 . В Международном центре исследований диарейных болезней в Бангладеш (ICDDRB) рост случаев холеры был связан с согласованным, но отсроченным увеличением доли больных холерой с вибриофагами в стуле 109 . Вибриофаги, идентифицированные в этом исследовании, были литическими вибриофагами (JSF4), хотя у пациентов можно выделить несколько типов вибриофагов 107 .Титры вибриофагов в стуле из рисовой воды варьировались от 10 2 до 10 8 бляшкообразующих единиц на миллилитр, что согласуется с другими публикациями 65,67 . Несмотря на присутствие литических вибриофагов, все стула были положительными на V. cholerae и V. cholerae , как правило, по количеству вибриофагов, по крайней мере, на один порядок. Последующие исследования показали, что большинство бактериальных изолятов из стула все еще чувствительны к вибриофагам 65,67 .Пока неясно, почему вибриофаги в кишечнике человека не могут избавиться от инфекции V. cholerae , но эта «неудача» может играть важную роль в распространении клональной экспансии фагов во время вспышек болезни 109 .
Передача с точки зрения вибриофага
Современные эксперименты начали проверять гипотезу о том, что фаги могут ослаблять бактериальную передачу. Например, тесты подвижности с использованием микроскопии в темном поле были использованы для быстрого скрининга стула из рисовой воды на наличие вибриофагов; стул, который был отрицательным в темном поле (не содержал подвижных вибрионов), с большей вероятностью содержал литические вибриофаги и имел низкое количество культивируемых клеток, но схожее общее количество клеток 77 .С помощью этого косвенного измерения для фагов было обнаружено, что по крайней мере половина пациентов с холерой, которые наблюдались в течение 5-летнего периода в ICDDRB, имели вибриофаги, а домашние контакты инфицированного пациента с положительным индексом вибриофага были менее вероятны. с V. cholerae , чем люди, которые контактировали с пациентом, который не был фагоположительным 77 . Эти результаты согласуются с выводом о десятикратном снижении инфекционной дозы В.cholerae , когда в стуле хозяина есть вибриофаги 67 .
V. cholerae обычно превосходит литические бактериофаги сразу после пассажа от хозяина 65 , 67 . В лабораторных экспериментах с использованием стула из рисовой воды, перенесенного человеком, бактериофаги имеют начальный всплеск репликации в течение первых нескольких часов в водной среде и могут достигать отношения бактериофагов к бактериям примерно 1: 1 за 24 часа 65,67 .Хотя гиперинфекция может сохраняться в течение нескольких часов после пассажа от хозяина 65,70 , потеря культивирования (обсуждалось выше) и рост бактериофагов в водной среде, вероятно, объединяются, чтобы блокировать передачу 65 . Контрольные эксперименты с , полученным in vitro , V. cholerae и бактериофагами подтверждают, что бактериофаги могут ограничивать бремя инфекции 65,67 . Однако бактериофаги никогда не могут полностью блокировать инфекцию, потому что мутанты V.cholerae , у которых отсутствует зрелый ЛПС, избегают хищничества и колонизируют мышей, хотя и в меньшем количестве. Как уже упоминалось, мутанты LPS ослаблены и могут быть потеряны в естественном жизненном цикле V. cholerae 65,67,105 .
Таким образом, динамическое взаимодействие между бактериофагом и бактерией в воде пруда предполагает, что модель передачи холеры должна включать в себя меру быстрого снижения способности бактерий к культивированию и уничтожения бактериофагами. В закрытой экспериментальной системе передача В.cholerae можно свести к минимуму, если эти два фактора сочетаются в водной среде. Следовательно, вероятно, будет преимущество пригодности для V. cholerae , которое быстро перейдет к следующему хозяину, когда культивируемость все еще высока, а концентрация бактериофагов все еще низкая. В этом обзоре упоминалось несколько моделей, которые предлагают разные объяснения роста и спада вспышек с точки зрения хозяина (клинический спектр и коллективный иммунитет), бактерии (гиперинфекция) и бактериофага (хищничество).Мы объединили несколько опубликованных моделей в одну рабочую диаграмму, чтобы побудить задуматься о том, как эти факторы могут взаимодействовать в естественной среде (). Лучшее понимание того, как функционирует интегрированная модель, может раскрыть возможности для вмешательств в области общественного здравоохранения.
Комбинированная модель передачи холеры с точки зрения хозяина и микроорганизмовОбщая популяция (H) питает пул восприимчивых хозяев (S), которые становятся инфекционными (I) после употребления Vibrio cholerae из окружающей среды. источник, с литическими бактериофагами или без них (Φ).Инфицированные люди имеют симптомы (I symp ) или бессимптомны (I asymp ) и выздоравливают (R) благодаря действиям своей иммунной системы и, возможно, литических бактериофагов, или погибают от инфекции (m). Выздоровевшие люди будут повторно попадать в пул восприимчивых с разной скоростью (//) в зависимости от степени защитного иммунитета. Литические фаги и гиперинфекционные V. cholerae (VC Hi ) выделяются симптоматическим хозяином в различных концентрациях; бессимптомные хозяева выделяют гораздо меньше бактерий (пунктирная линия).Клетки VC Hi быстро переходят к следующему хозяину, сохраняются в окружающей среде в виде культивируемых клеток с неизвестной инфекционностью (VC C ) или распадаются в «активное, но не культивируемое» состояние (VC ABNC ) с пониженной инфекционностью. Все три типа клеток плюс совокупные бактерии (не показаны), вероятно, играют смешанную роль в качестве резервуаров окружающей среды для будущих вспышек.
Заключительные замечания
Модель передачи, которая точно предсказывает масштабы возникающей вспышки, предоставит органам общественного здравоохранения полезную информацию для надлежащего масштабирования их ответных мер.Вмешательства, направленные на жизненно важные этапы передачи, могут быть эффективными для предотвращения вспышек. Иммунитет хозяина, гиперинфекция патогенов и фаги — все это факторы, которые можно использовать для борьбы со вспышкой. Например, централизованные центры управления отходами часто терпят неудачу в условиях нехватки ресурсов. Поскольку пациенты с симптомами выделяют более V. cholerae , а V. cholerae в стуле из рисовой воды является гиперинфекционным, вспышки холеры лучше всего остановить у источника, уменьшив воздействие на человека свежевыпущенного гиперинфекционного стула.Другими словами, при сохранении централизованного управления следует поощрять и проверять децентрализованные усилия по целевому управлению отходами в единице домашнего хозяйства. Эта концепция подчеркивает решающую важность уже проверенных, но простых мероприятий в домашних условиях, таких как использование кувшинов с узким горлышком, хлорирование хранящейся воды и мытье рук, для профилактики заболеваний 110,111 .
Еще многое предстоит узнать об эффективности вакцины в естественных условиях холеры.Отказ от традиционных мер оценки эффективности вакцин путем включения преимуществ коллективного иммунитета продолжит раскрывать истинное влияние как существующих вакцин, так и вакцин, находящихся в разработке. Кроме того, понимание воздействия хищничества бактериофагов и того, как вакцины снижают пул восприимчивости до такой степени, что передача не может продолжаться, являются важными областями для будущих исследований. Ответы на многие вопросы, поставленные в этом обзоре, имеют решающее значение для стран с ограниченными ресурсами, таких как Зимбабве, для оптимизации использования ограниченных запасов вакцины и борьбы с пагубными последствиями неудовлетворительной санитарии.
динамика хозяина, патогена и бактериофага
Abstract
Зимбабве представляет собой самый последний пример трагедии, которая постигает страну и ее народ, когда поражает холера. Вспышка 2008–2009 годов быстро распространилась по каждой провинции и привела к уровню смертности, аналогичному тем, которые наблюдались в результате инфекций холеры сто лет назад. В этом обзоре мы выделяем достижения, которые помогут понять, как взаимодействия между хозяином, бактериальным патогеном и литическим бактериофагом могут способствовать возникновению и подавлению вспышек холеры в эндемичных условиях и в развивающихся эпидемических регионах, таких как Зимбабве.
Диарейные болезни, включая холеру, являются ведущей причиной заболеваемости и второй по частоте причиной смерти среди детей в возрасте до 5 лет во всем мире 1,2 . Трудно определить точную заболеваемость и смертность от холеры, поскольку системы эпиднадзора во многих развивающихся странах находятся в зачаточном состоянии, а многие страны не решаются сообщать о случаях холеры в ВОЗ из-за потенциального негативного экономического воздействия этой болезни на торговлю и туризм. Сегодня реальное бремя холеры оценивается в несколько миллионов случаев в год, преимущественно в Азии и Африке 3 .При оптимальной доставке пероральная регидратационная терапия может снизить уровень летальности с> 20%, наблюдавшихся ранее 4–6 до <1% 7 . Еще предстоит проделать большую работу, поскольку 27 стран сообщили о показателях летальности, превышающих пороговое значение в 1% в 2007 году (REF. 8).
Возбудитель холеры, грамотрицательная бактерия Vibrio cholerae, является факультативным патогеном, который имеет этапы жизненного цикла человека и окружающей среды 9,10 . V. cholerae дифференцируется серологически на основе антигена О его липополисахарида (ЛПС) (). Штаммы, продуцирующие токсин холеры ( токсигенный ), серогрупп O1 и O139 вызывают подавляющее большинство заболеваний. Серогруппа O1 подразделяется на два фенотипически различных биотипа , , Эль-Тор и классический, второй из которых связан с более ранними пандемиями. Оба биотипа могут быть далее подразделены на два серотипа, Инаба и Огава 7 . За последние 20 лет Эль Тор заменил классический биотип 11 ; однако наследие классического биотипа сохраняется, поскольку появились штаммы Эль-Тор, содержащие токсин классической холеры 12–14 .Серогруппа O139 впервые появилась в 1992 году в результате замены нескольких генов в O-антиген-кодирующей области штамма-предшественника O1 El Tor 15 . Хотя серогруппа O139 вызвала разрушительные вспышки в 1990-х годах, штамм Эль Тор остается доминирующим штаммом во всем мире 11,16,17 .
Филогенетическое родство штаммов Vibrio choleraeНа основании антигенности компонента O-антигена липополисахарида внешней мембраны в водной среде существует более 200 серогрупп (O1 – O200) Vibrio cholerae .Только подмножество штаммов серогрупп O1 и O139 являются токсигенными (Tox + ) и, следовательно, способны вызывать холеру при приеме внутрь; такие штаммы отбираются у хозяина. Другие штаммы нетоксигены (Tox — ) и отбираются против них. Различные типы О-антигена обозначены цветом внешней мембраны и покрытого оболочкой жгутика (периплазматическое пространство и внутренняя мембрана не показаны). Капсулы присутствуют в подмножестве штаммов. Генотипы разных штаммов обозначены цветом цитоплазмы; обратите внимание, что Tox + O1 и O139 имеют по существу один и тот же генотип, за исключением генов O-антигена.
Патофизиология холеры описана в обширной литературе. Короче говоря, патогенные штаммы несут в себе ключевые факторы вирулентности, которые включают холерный токсин 18 и ко-регулируемые токсином ворсинки (TCP) 19,20 , самосвязывающиеся пилусы, которые связывают бактериальные клетки вместе 21 , возможно, чтобы противостоять силам сдвига. в тонком кишечнике хозяина. Токсин холеры представляет собой секретируемый токсин субъединицы AB 5 . Пентамер субъединицы B связывает моносиалотетрагексозилганглиозиды на абсорбирующих эпителиальных клетках, вызывая эндоцитоз ферментативной субъединицы A, после чего он рибозилирует АДФ субъединицу G-белка, который контролирует активность аденилилциклазы.Хотя вирулентность является многофакторной, холерный токсин является ключевым фактором, ответственным за обильную секреторную диарею, которая возникает у инфицированных людей. Трансмиссивные элементы, такие как лизогенный бактериофаг , несущий гены холерного токсина 22 и элемент SXT, несущий гены устойчивости к антибиотикам 23 , будут продолжать определять эволюцию V. cholerae .
Биологические факторы и факторы окружающей среды, которые способствуют динамике вспышек холеры, продолжают оставаться предметом интенсивных исследований.Было опубликовано несколько обзорных статей, посвященных важности экологических факторов в распространении вспышек холеры. 24–26 . В этом обзоре мы сосредоточимся скорее на трех биологических факторах, которые, как считается, играют важную роль в возникновении и формировании вспышек холеры: восприимчивость хозяина, вирулентность V. cholerae и литические бактериофаги. Ниже мы обсудим эту троицу факторов, связанных с динамическим характером вспышек холеры.
Человек-хозяин
Клинический спектр
В.cholerae инфекцияИнфекция V. cholerae вызывает клинический спектр, который варьируется от бессимптомной колонизации до холеры гравис, наиболее тяжелой формы болезни (). После приема организмом зараженной пищи или воды V. cholerae колонизирует тонкий кишечник в течение 12–72 часов до появления симптомов. Холера часто начинается с желудочных спазмов и рвоты, за которыми следует диарея, которая может прогрессировать до потери жидкости до 1 литра в час 27 .Эти потери приводят к серьезному истощению объема жидкости и метаболическому ацидозу, что может привести к сосудистому коллапсу и смерти 7 . Стул с рисовой водой обычно содержит от 10 10 до 10 12 вибрионов на литр. Пациенты с симптомами могут выделять вибрионы до начала болезни 28,29 и будут продолжать выделять организмы в течение 1-2 недель 30,31 . Бессимптомные пациенты обычно выделяют вибрионы со стулом только в течение 1 дня, примерно 10 3 вибрионов на грамм стула 32 .Следовательно, распределение пациентов с симптомами влияет на количество V. cholerae , которые выделяются для последующей передачи.
Таблица 1
Клинический спектр инфекции Vibrio cholerae
| Бессимптомная инфекция | Легкая инфекция | Тяжелая инфекция | Рвота и обильная диарея |
|---|---|---|---|
| Обезвоживание | Отсутствует | От легкой до легкой | От средней до тяжелой (гиповолемический шок) |
| Характеристики стула | 320Нормальные характеристики стула | 320Нормальный стул | |
| Вибрионов на грамм стула | До 10 5 | До 10 8 | 10 7 до 10 9 в стуле (и рвотных массах) | Нет | Раствор для пероральной регидратации (O RS) | ПРС, внутривенные жидкости и антибиотики ‡ |
| Смертность | Нет | Нет | Без лечения: до 50% Вылечено: менее 1% |
Бессимптомные случаи также могут способствовать распространению микроорганизма, хотя и на гораздо более низком уровне, чем пациенты с симптомами, и могут отражать важный компонент приобретенного иммунитета, который наблюдается в некоторых сообществах. Однако бессимптомные случаи часто трудно задокументировать. Четырехкратное повышение титра вибриоцидного антитела в сыворотке крови является полезной мерой для выявления бессимптомных людей, которые могут быть инфицированы, но от которых невозможно изолировать организм.Используя положительный результат посева из ректального мазка или ответ на вибриоцидные антитела для определения инфекции, недавно было обнаружено, что у бангладешских детей в возрасте до 5 лет вероятность появления симптомов в 2–3 раза выше, чем у детей старше 5 лет 35 . Частота симптомов во всех возрастных группах в этом исследовании составила 57% 35 . Это соответствует показателям симптоматических инфекций, которые были обнаружены в связи с классическими штаммами в более ранней литературе 32,38–40 , но намного выше показателей, сообщенных для инфекций Эль-Тор в 1970-е годы 40 .Таким образом, бессимптомные случаи могут составлять примерно половину всех случаев. Будущие исследования иммунологии бессимптомных пациентов помогут оценить их вклад в защитный иммунитет на популяционном уровне.
Восприимчивость к холере
Генетические факторы хозяина и факторы питания влияют на восприимчивость к холере. Антигены группы гистокрови ABH представляют собой набор клеточных и секретируемых гликолипидов и гликопротеинов, которые являются ключевыми детерминантами восприимчивости хозяина к ряду желудочно-кишечных патогенов; они, по-видимому, влияют на специфичность рецептора клетки-хозяина в отношении связывания патогенов и токсинов.Фенотип O соответствует немодифицированному антигену H и связан со сниженным риском заражения V. cholerae . Однако, как только хозяин инфицирован, фенотип O связан с повышенным риском серьезных симптомов; механизм этого остается неизвестным. Распространенность фенотипа O варьируется среди человеческих популяций; его низкая распространенность в дельте реки Ганг предполагает, что существует отбор против этого фенотипа в эндемичных по холере районах 35,41,42 .В популяциях с высокой распространенностью группы крови O, например в странах Латинской Америки, болезнь протекает тяжелее, и потребности в регидратации и госпитализации инфицированных людей существенно выше 43,44 .
Хотя антиген группы крови H является единственным давно признанным генетическим фактором, связанным с восприимчивостью к холере, другие генетические полиморфизмы, вероятно, были выбраны за или против, учитывая исторически высокие показатели смертности от холеры.Например, недавнее исследование связывало тяжелую холеру с вариантом LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) 45 , консервативного белка врожденного иммунитета. Экспрессия LPLUNC1 активируется в эпителии тонкой кишки во время острой холеры и может влиять на течение инфекции V. cholerae 46 .
Недоедание, измеряемое по задержке линейного роста, не является фактором риска заражения V. cholerae 35 .Однако дефицит ретинола (витамина А), питательного микроэлемента, который способствует иммунитету слизистых оболочек, является фактором риска, связанным как с инфекцией V. cholerae , так и с развитием симптоматического заболевания 35 . Цинк, еще один питательный микроэлемент, который способствует иммунитету слизистых оболочек, может истощаться во время диарейных заболеваний 47 . Оральный цинк устраняет этот дефицит у детей, что приводит к значительному сокращению объема стула и времени до прекращения диареи 44 .
Защитный иммунитет
Несколько исследований демонстрируют, что клинически очевидная инфекция V. cholerae индуцирует защитный иммунитет против последующей инфекции (ВСТАВКА 1). Заражение североамериканских добровольцев классическим биотипом и биотипом Эль-Тор обеспечивало 100% и 90% защиту соответственно от последующего заражения 31,48 . Аналогичным образом, в эндемических условиях было обнаружено, что более 90% пациентов с тяжелым заболеванием, вызванным инфекцией классическим биотипом, были защищены от инфекции в будущем, на основании наблюдаемой и ожидаемой частоты госпитализаций в связи со вторым эпизодом холеры в это население 33 ; аналогичные результаты были получены в отдельном исследовании 49 .Механизм этого защитного иммунитета против инфекции и болезни V. cholerae неизвестен.
Ящик 1 | Иммунный ответ человека на
Vibrio choleraeВрожденный ответ
Считается, что холера является прототипической невоспалительной инфекцией. Часто отсутствуют грубые изменения слизистой оболочки кишечника или архитектурной целостности тонкой кишки. Однако наблюдается повышенная регуляция провоспалительных цитокинов (включая интерлейкин-1β и фактор некроза опухоли), экспрессии различных бактерицидных белков и миграции нейтрофилов в собственную пластинку во время острой холеры.Естественная вариабельность врожденного иммунного ответа может влиять на восприимчивость, что подтверждается открытием, что полиморфизм в промоторной области гена LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) связан с повышенным риском холеры.
Адаптивный ответ
Неизвестно, как адаптивный иммунный ответ на холеру обеспечивает защиту от последующего заболевания. Поскольку Vibrio cholerae неинвазивен, было высказано предположение, что секреторный иммуноглобулин А кишечника (sIgA) защищает от колонизации слизистой оболочки.Примерно через 8 дней после начала холеры наблюдается пик циркуляции антиген-специфических лимфоцитов V. cholerae , которые экспрессируют хемокиновые рецепторы кишечника (см. Рисунок) 112 . Эти лимфоциты вскоре становятся необнаруживаемыми в крови, поскольку они возвращаются на слизистую оболочку кишечника, где они приводят к увеличению секреции sIgA в кишечнике. Реакции сывороточных антител, такие как реакция вибриоцидных антител, также достигают максимума через 1-3 недели после заражения. Хотя высокие сывороточные титры вибриоцидных антител и IgA, специфичного к холерному токсину, коррелируют с защитой от инфекции, эти антитела снижаются до исходного уровня через год после заражения, задолго до того, как защитный иммунитет к холере ослабевает.Точно так же у добровольцев, инфицированных V. cholerae , уровни sIgA слизистой оболочки снижаются до исходного уровня в течение нескольких месяцев. Однако, когда добровольцев, у которых больше нет определяемых антител, повторно провоцируют антигенов V. cholerae , они демонстрируют стойкую способность вызывать анамнестический иммунный ответ, развивая пиковую кишечную секрецию антител так же быстро, как в течение трех дней. Следовательно, возможно, что скорость анамнестического ответа на повторное воздействие, а не заранее сформированные антитела, может опосредовать защиту от холеры.Это подтверждается недавними данными о том, что холера вызывает ответ В-клеток памяти, который выявляется в течение по крайней мере 1 года после заражения холерой 113 .
Выявлено несколько коррелятов иммунитета. Лучше всего охарактеризованным серологическим маркером иммунитета является титр сывороточных вибриоцидных антител. Это антитело является комплемент-зависимым бактерицидным антителом, титр которого заметно увеличивается после болезни, но снижается до исходного уровня через 6–9 месяцев 7 . В Бангладеш вибриоцидные антитела обнаруживаются у большинства людей в возрасте 10–15 лет и связаны со снижением риска инфицирования.Поскольку V. cholerae является неинвазивным патогеном, эти сывороточные антитела могут не вносить непосредственный вклад в защиту на уровне слизистой оболочки кишечника, но они могут быть полезны для оценки степени защитного иммунитета на уровне популяции. Антитела иммуноглобулина A, специфичные к TCP, LPS или субъединице B холерного токсина, коррелируют с защитой от последующей инфекции и заболевания 35 .
Полевые испытания вакциныобеспечивают контролируемую оценку устойчивости адаптивных иммунных ответов к В.холера . В крупнейшем контролируемом исследовании 62 285 участников в Бангладеш были рандомизированы для получения 3 пероральных доз (с интервалом в 6 недель) комбинации убитых целых клеток (Эль Тор и классические) плюс субъединица B холерного токсина (вакцина B – WC), цельноклеточный компонент без B-субъединицы (вакцина WC) или убитый Escherichia coli K12 в качестве контроля. Через 3 года наблюдения две вакцины (B – WC и WC) имели 50% и 52% защитную эффективность, соответственно 50 . Для детей младше 5 лет эффективность составила 23–26%.Через 6 месяцев наблюдения вакцина B – WC дала 85% защиту 51 . Ведутся споры о том, демонстрируют ли эти данные эффективность, достаточную для широкомасштабного распространения. В настоящее время предпринимаются усилия по созданию новых вакцин для обеспечения более высоких и устойчивых ответов у реципиентов, а также для снижения производственных затрат с целью преодоления как иммунологических, так и производственных препятствий, которые ограничивают применимость существующих вакцин против холеры 52–55 .
Роль, которую коллективный иммунитет играет в замедлении передачи холеры, недавно стала оценена.В исследованиях эффективности вакцины отдельные пациенты рандомизируются, чтобы гарантировать, что защитная эффективность отражает только прямой эффект вакцины 56 . Это означает, что лицензирование вакцин не учитывает их преимущества на уровне населения. Обсуждаемое выше испытание вакцины B – WC имело уровень охвата от 4% до 65% в разных регионах 50,57 . Когда уровни заболеваемости холерой сравнивались с показателями охвата вакцинацией в конкретных регионах, было обнаружено, что заболеваемость среди реципиентов плацебо обратно коррелировала с уровнем охвата прививками 57 : там, где охват был высоким, даже среди тех, кто этого не сделал. Получившие вакцину, вероятность заболеть холерой по-прежнему на четверть ниже, чем у невакцинированных лиц в районах с низким охватом.Когда коллективный иммунитет включен в имитационные модели эффективности вакцины, охват вакцинацией B – WC 50% в эндемичных районах приводит к снижению общего числа случаев на 93% 58 . Взятые вместе, эти исследования доказывают, что вакцина B-WC может обеспечить достаточную защиту для широкомасштабной вакцинации в эндемичных регионах и что коллективный иммунитет, вероятно, будет играть важную роль в ограничении передачи холеры.
Передача с точки зрения хозяина
Несколько групп создали математические модели, использующие точки зрения как хозяина, так и патогена, чтобы помочь объяснить и предсказать природу вспышек холеры.Цель большинства этих моделей — точно отразить резкий рост и снижение заболеваемости холерой, которое наблюдается два раза в год в регионах вокруг Бенгальского залива. Модель была построена для включения показателей передачи, фактора сезонных колебаний и расчета количества восприимчивых людей на основе различного защитного иммунитета от прошлой инфекции 59–61 . Эти идеи были основаны на проверке гипотез о том, что высокое соотношение бессимптомных и симптоматических случаев связано с разрешением вспышки и что короткий интервал защитного иммунитета (2–12 недель) после заражения допускает последующие вспышки, которые наблюдаются в Бангладеш 62 .Результаты показывают, что комбинация многих бессимптомных случаев и недолговечного иммунитета, а не молчаливых шеддеров , дает модель, которая лучше всего отражает эпидемиологические данные из Западной Бенгалии. У модели есть ограничения: она предполагает соотношение бессимптомных и симптоматических случаев, которое намного выше, чем наблюдаемое в последние годы, и она была протестирована с использованием показателей смертности, которые связаны с клинически определенной холерой из Западной Бенгалии между 1891 и 1940 годами — эпохой до открытия. ротавируса и энтеротоксигенного E.coli , которые являются смешивающими факторами. Несмотря на свои недостатки, эти модели улучшают наше понимание сложной динамики вспышек и показывают, насколько мощной может быть реакция хозяина в ограничении передачи. Новые модели передачи холеры должны по-прежнему включать факторы сезонных колебаний, соотношение бессимптомных и симптоматических случаев и темпы снижения защитного иммунитета.
Возбудитель
Инфекционные дозы в моделях на животных
Заражение человека-хозяина представляет собой многоступенчатый процесс: V.cholerae необходимо принимать внутрь в дозе, достаточной для преодоления врожденной иммунной защиты, затем экспрессии факторов вирулентности для колонизации тонкой кишки и, наконец, для координации выхода из организма хозяина для облегчения передачи 63 (). Животные модели холеры в значительной степени являются показателями успешности первых двух стадий 64 . Используя модель инфекции у новорожденных мышей, было показано, что V. cholerae , которые выделяются с рисовым водяным стулом человека, находятся в гиперинфекционном состоянии, демонстрируя ID 50 из 10–100 клеток по сравнению с примерно 500 клетками для В.cholerae , выращенный in vitro 65–67 . Гиперинфекция также была задокументирована у Citrobacter rodentium 68 , а гиперинфекционный V. cholerae может быть воспроизведен при прохождении через мышиную модель инфекции 68,69 . Определение и фенотип гиперинфективности противоречивы из-за сложностей при выборе наиболее подходящих условий культивирования для роста контрольного штамма.
Жизненный цикл патогенного Vibrio choleraeТоксигенные штаммы Vibrio cholerae сохраняются в водной среде наряду с нетоксигенными штаммами, чему способствует образование биопленок на биологических поверхностях и использование хитина в качестве источника углерода и азота.При попадании этих адаптированных к водной среде бактерий в загрязненную пищу или воду токсикогенные штаммы колонизируют тонкий кишечник, размножаются, выделяют токсин холеры и возвращаются в окружающую среду хозяином при секреторной диарее. Патогенные микроорганизмы, выделяемые калом, находятся в преходящем гиперинфекционном состоянии, которое способствует усилению вспышки за счет передачи последующим хозяевам.
Молекулярные механизмы, которые способствуют гиперинфективности у V. cholerae , многофакторны.Исследования на микрочипах показали, что глобальный профиль транскрипции гиперинфекционных V. cholerae из рисового водяного стула отличается от такового у V. cholerae , выращенных in vitro или верхних отделов тонкой кишки V. cholerae , выведенных в рвотные массы 65, 70,71 (). Большинство известных генов вирулентности, включая гены холерного токсина и TCP, подавляются в стуле из рисовой воды, но механизм этого подавления остается неизвестным. Еще одна уникальная особенность — подавление генов хемотаксиса, что удивительно, учитывая, что планктонные вибрионы, выделяемые пациентами, являются жгутиками и очень подвижны.Было показано, что это подавление хемотаксиса является одним из компонентов гиперинфективности, потому что подвижные, но нехемотаксирующие мутанты V. cholerae являются гиперинфекционными 66,72,73 .
Паттерны экспрессии гена Vibrio cholerae на разных стадиях жизненного циклаПри проглатывании (нижняя правая панель) Vibrio cholerae использует подвижность и муциназы для проникновения через слизистый гель и N -ацетилглюкозамин-связывающий белок A ( GbpA) и другие факторы колонизации эпителия тонкой кишки.Существенные изменения в экспрессии генов сопровождают этот переход от пруда к острой инфекции, включая, помимо прочего, индукцию vieA, которая кодирует фосфодиэстеразу, гидролизующую вторичный мессенджер циклического ди-GMP, и гены, регулируемые ToxR, включая гены холерного токсина и самоагрегативное пилообразное ядро, регулируемое токсинами (TCP). Кроме того, репрессируются несколько генов, таких как гены хитин-связывающего маннозу-чувствительного гемагглютинина пилуса (MSHA) и стрессового сигма-фактора RpoS.На поздней стадии инфекции (нижняя левая панель) V. cholerae снова изменяет экспрессию своего гена, чтобы отделиться от эпителия — «реакция бегства» — и подготовиться к передаче другому хозяину (например, распространение в домашних условиях). ) или попадание в водную среду. Изменения на поздних стадиях включают индукцию генов синтеза c-di-GMP (дигуанилилциклазы), систем поглощения питательных веществ (таких как регулон регуляции поглощения железа (Fur)) и подвижности (Fla), а также репрессию таких генов, как для хемотаксиса (Che) и регулона ToxR.Возникающее в результате «подвижное, но не хемотаксическое» состояние способствует гиперинфективности. Если бактерии, выделяющиеся со стулом, не попадают в организм другого хозяина в течение короткого периода времени, то их ждет одна из двух судьб (верхняя панель): укоренение в водной среде путем нахождения подходящих источников питательных веществ, таких как хитин, или распад в « активную среду ». но некультивируемое состояние. При воздействии хитина V. cholerae индуцирует несколько генов, участвующих в присоединении и катаболизме хитина (регулон ChiS), а также гены, участвующие в генетической компетентности (регулон TfoX).Образование биопленок на поверхности опосредуется индукцией регулона Vps, который кодирует внеклеточный полисахарид. Во время перехода в активное, но не культивируемое состояние происходят большие изменения в экспрессии генов, поскольку V. cholerae пытается адаптироваться к условиям с низким содержанием питательных веществ. К ним относятся индукция генов фосфатного и азотного голодания (phoB и glnB-1 соответственно) и репрессия генов трансляционного аппарата.
Транскриптом V. cholerae , пассированный от животных, также уникален и был выявлен в двух недавних исследованиях.Во-первых, существует скоординированная «реакция бегства», которая позволяет организму отделяться от ворсинок кишечника, готовясь к выходу из организма хозяина; это регулируется стрессом и стационарной фазой сигма-фактора РНК-полимеразы RpoS 74 . Во-вторых, на более поздних стадиях заражения животных, V. cholerae активирует экспрессию генов, которые не требуются для инфекции, но которые важны для выживания при переходе в водную среду 75 . Эта предварительная индукция генов выживания в окружающей среде на поздних этапах инфекции может подготовить организм к жесткому селективному давлению в воде пруда, тем самым облегчая передачу 24,65 .В большинстве описанных выше исследований бактериальные клетки, составлявшие инфекционную дозу, были планктонными клетками, а не агрегатами. Было проведено одно исследование с участием добровольцев, в котором добровольцам вводили V. cholerae в морщинистой форме (т. Е. Агрегативной и продуцирующей экзополисахариды); Инфекционная доза была аналогична дозе, наблюдаемой для планктонных форм, а морщинистые формы выделялись добровольцами 76 . Кроме того, люди выделяют V. cholerae в виде сложных биопленко-подобных агрегатов 67,77,78 .Идентификатор 50 V. cholerae выделяется в совокупности, и роль, которую эти совокупности играют в передаче, еще предстоит определить.
Инфекционная доза у людей
Инфекционная доза V. cholerae у людей сильно варьируется в зависимости от бактериального штамма и хозяина. Дозы 10 8 –10 11 клеток требовались для обеспечения последовательной колонизации у здоровых добровольцев из Северной Америки 7,29,31 . Инфекционная доза снижается до 10 4 –10 8 при использовании бикарбонатного буфера для нейтрализации желудочного сока незадолго до инокуляции; этот метод дает 90% зараженности 7,29,31 .В домашнем хозяйстве пища может действовать как кислотный буфер; В исследованиях на добровольцах введение бактерии как часть «еды» из риса, рыбы, заварного крема и обезжиренного молока дало результаты, сравнимые с результатами, наблюдаемыми при одновременном введении бактерий и бикарбоната 79 . В эндемичных условиях инфекционная доза неизвестна. Подсчет V. cholerae в образцах домашнего хозяйства и окружающей среды исторически сложен, требует быстрого реагирования и использования флуоресцентной микроскопии для подсчета тех бактерий, культивирование которых, возможно, затруднено. 80 .
Клиническое наблюдение, что буферная кислота желудочного сока снижает инфекционную дозу, предполагает, что бактериальные гены, участвующие в кислотной устойчивости, могут способствовать вирулентности. Сигнатурный мутагенез (STM) был использован для поиска подмножества генов вирулентности, которые вносят вклад в кислотостойкость in vitro 81 . Удаление этих генов ослабило V. cholerae в модели инфекции у новорожденных мышей, что подтверждает их роль в вирулентности. Кроме того, обнажая В. дикого типа.cholerae для подкисления непосредственно перед инокуляцией мышей давало большое конкурентное преимущество перед неадаптированными к кислоте бактериями 82 . Эти данные, наряду с другими, демонстрируют, что бактерии, выращенные in vitro , могут стать более заразными в результате воздействия стресса. Кроме того, эти результаты могут иметь клиническое значение в тех регионах мира, где преобладает пониженная продукция желудочной кислоты (ахлоргидрия), вторичная по отношению к инфекции Helicobacter pylori, например, Бангладеш 7 .
Передача с точки зрения патогена
Роль, которую гиперинфекция играет в быстром распространении холеры среди населения в начале вспышки, остается непроверенной. V. cholerae остается гиперинфекционным в течение как минимум 5 часов после перехода от пациентов в водную среду, что позволяет предположить, что гиперинфекция играет особую роль в передаче инфекции в районах с высокой плотностью населения, где существует вероятность контакта с организмом другого человека. в относительно короткие сроки 65,70 .Одна модель передачи холеры предполагает, что вспышка начинается, когда либо уже инфицированный индексный случай мигрирует и заражает новую территорию, либо потребление V. cholerae из естественного резервуара окружающей среды создает новый индексный случай у постоянного населения. В обоих сценариях возможно ускорение вспышки в результате быстрого распространения гиперинфекционного вируса V. cholerae от человека к человеку при кратковременном нахождении в окружающей среде.Модели передачи, которые допускают только случайное попадание V. cholerae в окружающую среду, не предсказывают резкого роста числа случаев, которые наблюдаются в начале вспышек по всему миру, включая те, которые происходят раз в два года в Бангладеш 11 . Однако модели, учитывающие гиперинфективность 83 , лучше отражают этот резкий подъем.
Поддержание передачи через водоемы
Эндемичная холера встречается в регионах с естественными водными резервуарами токсигенных и нетоксигенных V.cholerae , где бактерии могут сохраняться либо в свободноживущем состоянии, либо в ассоциации с фитопланктоном 84–86 , зоопланткон 85–88 или биотическим и абиотическим детритом 89,90 . Эти взаимодействия могут быть как полезными, так и антагонистическими 91,92 . Ассоциации вообще не случайны. Например, V. cholerae развил механизмы для присоединения, разложения и использования хитина в качестве источника углерода и азота 93–95 ().Для экологических изолятов методы ДНК-типирования, основанные на секвенировании гипервариабельных локусов повторов короткой последовательности, начали лучше определять взаимосвязь между нетоксигенными и токсигенными V. cholerae . Было обнаружено, что два сельских региона, разделенных 80 км в дельте реки Ганг, содержат отдельные, разнообразные штаммы из экологических и клинических условий 96 . Экологические изоляты состояли как из токсигенных, так и из нетоксигенных штаммов O1 El Tor и O139 на фоне нетоксигенных штаммов, представляющих многие серогруппы.Напротив, клинические изоляты были строго токсигенными O1 El Tor и O139, но относились к разным типам штаммов. Эти результаты демонстрируют, что в организме хозяина токсикогенные штаммы обладают селективным преимуществом перед нетоксигенными штаммами из окружающей среды. Взаимосвязь между экологическими и клиническими штаммами может быть разной в других регионах мира и, вероятно, будет варьироваться в зависимости от окружающей среды, санитарии, инфраструктуры и плотности населения.
Селективное давление в водной среде
Некоторые бактериальные патогены, в том числе В.cholerae , теряют способность культивироваться на стандартных средах после переноса от хозяина или лаборатории в водную среду 24,97 . Этот фенотип традиционно известен как «жизнеспособное, но не культивируемое» (VBNC) состояние, поскольку клетки поддерживают способность к основным метаболическим процессам, таким как синтез белка, дыхание и поддержание целостности мембран, несмотря на их неспособность культивироваться 24 . Альтернативный, более консервативный термин, который применяется к этому состоянию, — «активный, но не культивируемый» (ABNC), поскольку остается неясным, живы ли еще бактерии, утратившие культивирование на стандартных средах 98 .
V. cholerae может быстро превратиться в ABNC, когда покидает человека-хозяина и попадает в водную среду. Исследования с участием пациента и in vitro , полученного V. cholerae , которые подвергались диализу в прудовой воде, продемонстрировали снижение культивирования на 60% и 90% через 5 часов и 24 часа соответственно 65 . Анализ микроматрицы продемонстрировал быстрые и заметные изменения транскрипции, когда бактерии входили в состояние ABNC 65 . Эти изменения включали индукцию генов поглощения фосфатов и фиксированного азота и подавление генов синтеза белка и энергетического метаболизма, что согласуется с низкими уровнями источников углерода, фосфатов и фиксированного азота, которые часто встречаются в водной среде.Остается проверить, будет ли включение твердых частиц, которые были отфильтрованы из воды пруда в вышеупомянутом исследовании, продлить культивирование V. cholerae . Учитывая возможность такого быстрого снижения культивируемости, исследователи задали вопрос, является ли большинство клеток V. cholerae , инфицированных людей из окружающей среды, ABNC или культивируемыми клетками. Одна из гипотез гласит, что если культивируемые клетки более заразны, чем клетки ABNC, то ID 50 , рассчитанный по общему количеству клеток, будет увеличиваться по мере уменьшения процента культивируемых клеток в популяции.Это было подтверждено в недавних экспериментах, предполагающих, что основными факторами инфицирования человека, вероятно, являются культивируемые клеток V. cholerae 65 . В будущих математических моделях передачи V. cholerae должна быть учтена возможность уменьшения скорости культивирования.
V. cholerae литический бактериофагБиология вибриофагов
Восемьдесят лет назад было предложено, чтобы бактериофаги могли контролировать естественные популяции патогенов 99,100 .Более поздние исследования в области морской микробиологии выявили элегантный баланс между бактериофагами и их цианобактериальной добычей 101 . С клинической точки зрения бактериофаги, в принципе, можно использовать для профилактики или лечения инфекций. Действительно, документально подтверждена «фаговая терапия» против холеры и других заболеваний (ВСТАВКА 2). Существует не менее 200 видов бактериофагов, которые инфицируют V. cholerae , известных как вибриофаги 102,103 . Нитевидный лизогенный вибриофаг CTXΦ является одним из наиболее охарактеризованных, поскольку он несет гены, кодирующие токсин холеры 22 .Первым секвенированным геномом хвостатого вибриофага был геном κ139; этот вибриофаг может быть как лизогенным, так и литическим. Основным механизмом, с помощью которого V. cholerae O1 становится устойчивым к κ139 и многим другим вибриофагам, является мутация кластера генов rfb , который кодирует ферменты для синтеза ЛПС 104 . В отсутствие рецептора антигена LPS O вибриофаг не может связываться или инфицировать бактериальную клетку. Все мутанты rfb -null V. cholerae O1, которые были протестированы на сегодняшний день, являются аттенуированными 65,67,105 .
Ящик 2 | Исследование бактериофагов
В 1915–1917 годах Twort 114 и d’Hérelle 115 независимо друг от друга открыли бактериофаги. Д’Эрелль определил, что бактериальная инфекция на животных моделях может быть ослаблена бактериофагами, и в 1925 году состояние пациентов с бубонной чумой улучшилось после того, как д’Эрелль ввел бактериофаги непосредственно в их бубоны (увеличенные лимфатические узлы) 116 . Эти открытия привели к исследованию бактериофагов, в задачу которого входило изучение терапии бактериофагом холеры в Индии 116 .Их первое испытание терапии сравнивало 244 нелеченных пациента с холерой с 219 пациентами с холерой, которых лечили вибриофагами; в нелеченой группе смертность составила 20%, тогда как в обработанной группе — 6,8% (χ 2 , p <0,01). Другие исследования показали аналогичные результаты 5,116,117 . Несмотря на некоторые ограничения, характерные для той эпохи, расследование добилось достаточного успеха, чтобы расширить свои усилия 5 .
За 1928, 1929 и 1934 годы сотрудники по расследованию подготовили и распространили 36 000, 130 823 и 871 316 доз вибриофагов в то время, когда начались вспышки в конкретных исследуемых сообществах в Индии. 116 .Вибриофаги также распространялись в общественных источниках питьевой воды для профилактики. Смертность от холеры сравнивалась с контрольными сообществами до и после вмешательств. Трехлетний уровень смертности от холеры снизился с 30 до 2 на 10 000 в регионах, лечившихся вибриофагами 117 . Хотя эти исследования имели несколько ограничений, они предоставляют единственные доступные данные об эффективности терапии вибриофагами. Достижения в области регидратации и антибиотикотерапии в 1930-х и 1940-х годах сделали испытания бактериофагов, основанные на конечных точках смертности, неэтичными и статистически сложными 116,118 .
Вибриофаги в окружающей среде
В 1930-х годах было обнаружено, что случаи холеры положительно коррелировали с изоляцией вибриофагов в водной среде 106 . В наше время была описана отсроченная положительная согласованность между ростом числа случаев холеры и последующим ростом вибриофагов в окружающей среде 107 . Модель, разработанная Jensen et al. предсказывает, что если вспышка будет инициирована увеличением В.cholerae в окружающей среде, плотность вибриофагов впоследствии будет увеличиваться, что в конечном итоге будет способствовать сокращению вспышки 108 . В Международном центре исследований диарейных болезней в Бангладеш (ICDDRB) рост случаев холеры был связан с согласованным, но отсроченным увеличением доли больных холерой с вибриофагами в стуле 109 . Вибриофаги, идентифицированные в этом исследовании, были литическими вибриофагами (JSF4), хотя у пациентов можно выделить несколько типов вибриофагов 107 .Титры вибриофагов в стуле из рисовой воды варьировались от 10 2 до 10 8 бляшкообразующих единиц на миллилитр, что согласуется с другими публикациями 65,67 . Несмотря на присутствие литических вибриофагов, все стула были положительными на V. cholerae и V. cholerae , как правило, по количеству вибриофагов, по крайней мере, на один порядок. Последующие исследования показали, что большинство бактериальных изолятов из стула все еще чувствительны к вибриофагам 65,67 .Пока неясно, почему вибриофаги в кишечнике человека не могут избавиться от инфекции V. cholerae , но эта «неудача» может играть важную роль в распространении клональной экспансии фагов во время вспышек болезни 109 .
Передача с точки зрения вибриофага
Современные эксперименты начали проверять гипотезу о том, что фаги могут ослаблять бактериальную передачу. Например, тесты подвижности с использованием микроскопии в темном поле были использованы для быстрого скрининга стула из рисовой воды на наличие вибриофагов; стул, который был отрицательным в темном поле (не содержал подвижных вибрионов), с большей вероятностью содержал литические вибриофаги и имел низкое количество культивируемых клеток, но схожее общее количество клеток 77 .С помощью этого косвенного измерения для фагов было обнаружено, что по крайней мере половина пациентов с холерой, которые наблюдались в течение 5-летнего периода в ICDDRB, имели вибриофаги, а домашние контакты инфицированного пациента с положительным индексом вибриофага были менее вероятны. с V. cholerae , чем люди, которые контактировали с пациентом, который не был фагоположительным 77 . Эти результаты согласуются с выводом о десятикратном снижении инфекционной дозы В.cholerae , когда в стуле хозяина есть вибриофаги 67 .
V. cholerae обычно превосходит литические бактериофаги сразу после пассажа от хозяина 65 , 67 . В лабораторных экспериментах с использованием стула из рисовой воды, перенесенного человеком, бактериофаги имеют начальный всплеск репликации в течение первых нескольких часов в водной среде и могут достигать отношения бактериофагов к бактериям примерно 1: 1 за 24 часа 65,67 .Хотя гиперинфекция может сохраняться в течение нескольких часов после пассажа от хозяина 65,70 , потеря культивирования (обсуждалось выше) и рост бактериофагов в водной среде, вероятно, объединяются, чтобы блокировать передачу 65 . Контрольные эксперименты с , полученным in vitro , V. cholerae и бактериофагами подтверждают, что бактериофаги могут ограничивать бремя инфекции 65,67 . Однако бактериофаги никогда не могут полностью блокировать инфекцию, потому что мутанты V.cholerae , у которых отсутствует зрелый ЛПС, избегают хищничества и колонизируют мышей, хотя и в меньшем количестве. Как уже упоминалось, мутанты LPS ослаблены и могут быть потеряны в естественном жизненном цикле V. cholerae 65,67,105 .
Таким образом, динамическое взаимодействие между бактериофагом и бактерией в воде пруда предполагает, что модель передачи холеры должна включать в себя меру быстрого снижения способности бактерий к культивированию и уничтожения бактериофагами. В закрытой экспериментальной системе передача В.cholerae можно свести к минимуму, если эти два фактора сочетаются в водной среде. Следовательно, вероятно, будет преимущество пригодности для V. cholerae , которое быстро перейдет к следующему хозяину, когда культивируемость все еще высока, а концентрация бактериофагов все еще низкая. В этом обзоре упоминалось несколько моделей, которые предлагают разные объяснения роста и спада вспышек с точки зрения хозяина (клинический спектр и коллективный иммунитет), бактерии (гиперинфекция) и бактериофага (хищничество).Мы объединили несколько опубликованных моделей в одну рабочую диаграмму, чтобы побудить задуматься о том, как эти факторы могут взаимодействовать в естественной среде (). Лучшее понимание того, как функционирует интегрированная модель, может раскрыть возможности для вмешательств в области общественного здравоохранения.
Комбинированная модель передачи холеры с точки зрения хозяина и микроорганизмовОбщая популяция (H) питает пул восприимчивых хозяев (S), которые становятся инфекционными (I) после употребления Vibrio cholerae из окружающей среды. источник, с литическими бактериофагами или без них (Φ).Инфицированные люди имеют симптомы (I symp ) или бессимптомны (I asymp ) и выздоравливают (R) благодаря действиям своей иммунной системы и, возможно, литических бактериофагов, или погибают от инфекции (m). Выздоровевшие люди будут повторно попадать в пул восприимчивых с разной скоростью (//) в зависимости от степени защитного иммунитета. Литические фаги и гиперинфекционные V. cholerae (VC Hi ) выделяются симптоматическим хозяином в различных концентрациях; бессимптомные хозяева выделяют гораздо меньше бактерий (пунктирная линия).Клетки VC Hi быстро переходят к следующему хозяину, сохраняются в окружающей среде в виде культивируемых клеток с неизвестной инфекционностью (VC C ) или распадаются в «активное, но не культивируемое» состояние (VC ABNC ) с пониженной инфекционностью. Все три типа клеток плюс совокупные бактерии (не показаны), вероятно, играют смешанную роль в качестве резервуаров окружающей среды для будущих вспышек.
Заключительные замечания
Модель передачи, которая точно предсказывает масштабы возникающей вспышки, предоставит органам общественного здравоохранения полезную информацию для надлежащего масштабирования их ответных мер.Вмешательства, направленные на жизненно важные этапы передачи, могут быть эффективными для предотвращения вспышек. Иммунитет хозяина, гиперинфекция патогенов и фаги — все это факторы, которые можно использовать для борьбы со вспышкой. Например, централизованные центры управления отходами часто терпят неудачу в условиях нехватки ресурсов. Поскольку пациенты с симптомами выделяют более V. cholerae , а V. cholerae в стуле из рисовой воды является гиперинфекционным, вспышки холеры лучше всего остановить у источника, уменьшив воздействие на человека свежевыпущенного гиперинфекционного стула.Другими словами, при сохранении централизованного управления следует поощрять и проверять децентрализованные усилия по целевому управлению отходами в единице домашнего хозяйства. Эта концепция подчеркивает решающую важность уже проверенных, но простых мероприятий в домашних условиях, таких как использование кувшинов с узким горлышком, хлорирование хранящейся воды и мытье рук, для профилактики заболеваний 110,111 .
Еще многое предстоит узнать об эффективности вакцины в естественных условиях холеры.Отказ от традиционных мер оценки эффективности вакцин путем включения преимуществ коллективного иммунитета продолжит раскрывать истинное влияние как существующих вакцин, так и вакцин, находящихся в разработке. Кроме того, понимание воздействия хищничества бактериофагов и того, как вакцины снижают пул восприимчивости до такой степени, что передача не может продолжаться, являются важными областями для будущих исследований. Ответы на многие вопросы, поставленные в этом обзоре, имеют решающее значение для стран с ограниченными ресурсами, таких как Зимбабве, для оптимизации использования ограниченных запасов вакцины и борьбы с пагубными последствиями неудовлетворительной санитарии.
динамика хозяина, патогена и бактериофага
Abstract
Зимбабве представляет собой самый последний пример трагедии, которая постигает страну и ее народ, когда поражает холера. Вспышка 2008–2009 годов быстро распространилась по каждой провинции и привела к уровню смертности, аналогичному тем, которые наблюдались в результате инфекций холеры сто лет назад. В этом обзоре мы выделяем достижения, которые помогут понять, как взаимодействия между хозяином, бактериальным патогеном и литическим бактериофагом могут способствовать возникновению и подавлению вспышек холеры в эндемичных условиях и в развивающихся эпидемических регионах, таких как Зимбабве.
Диарейные болезни, включая холеру, являются ведущей причиной заболеваемости и второй по частоте причиной смерти среди детей в возрасте до 5 лет во всем мире 1,2 . Трудно определить точную заболеваемость и смертность от холеры, поскольку системы эпиднадзора во многих развивающихся странах находятся в зачаточном состоянии, а многие страны не решаются сообщать о случаях холеры в ВОЗ из-за потенциального негативного экономического воздействия этой болезни на торговлю и туризм. Сегодня реальное бремя холеры оценивается в несколько миллионов случаев в год, преимущественно в Азии и Африке 3 .При оптимальной доставке пероральная регидратационная терапия может снизить уровень летальности с> 20%, наблюдавшихся ранее 4–6 до <1% 7 . Еще предстоит проделать большую работу, поскольку 27 стран сообщили о показателях летальности, превышающих пороговое значение в 1% в 2007 году (REF. 8).
Возбудитель холеры, грамотрицательная бактерия Vibrio cholerae, является факультативным патогеном, который имеет этапы жизненного цикла человека и окружающей среды 9,10 . V. cholerae дифференцируется серологически на основе антигена О его липополисахарида (ЛПС) (). Штаммы, продуцирующие токсин холеры ( токсигенный ), серогрупп O1 и O139 вызывают подавляющее большинство заболеваний. Серогруппа O1 подразделяется на два фенотипически различных биотипа , , Эль-Тор и классический, второй из которых связан с более ранними пандемиями. Оба биотипа могут быть далее подразделены на два серотипа, Инаба и Огава 7 . За последние 20 лет Эль Тор заменил классический биотип 11 ; однако наследие классического биотипа сохраняется, поскольку появились штаммы Эль-Тор, содержащие токсин классической холеры 12–14 .Серогруппа O139 впервые появилась в 1992 году в результате замены нескольких генов в O-антиген-кодирующей области штамма-предшественника O1 El Tor 15 . Хотя серогруппа O139 вызвала разрушительные вспышки в 1990-х годах, штамм Эль Тор остается доминирующим штаммом во всем мире 11,16,17 .
Филогенетическое родство штаммов Vibrio choleraeНа основании антигенности компонента O-антигена липополисахарида внешней мембраны в водной среде существует более 200 серогрупп (O1 – O200) Vibrio cholerae .Только подмножество штаммов серогрупп O1 и O139 являются токсигенными (Tox + ) и, следовательно, способны вызывать холеру при приеме внутрь; такие штаммы отбираются у хозяина. Другие штаммы нетоксигены (Tox — ) и отбираются против них. Различные типы О-антигена обозначены цветом внешней мембраны и покрытого оболочкой жгутика (периплазматическое пространство и внутренняя мембрана не показаны). Капсулы присутствуют в подмножестве штаммов. Генотипы разных штаммов обозначены цветом цитоплазмы; обратите внимание, что Tox + O1 и O139 имеют по существу один и тот же генотип, за исключением генов O-антигена.
Патофизиология холеры описана в обширной литературе. Короче говоря, патогенные штаммы несут в себе ключевые факторы вирулентности, которые включают холерный токсин 18 и ко-регулируемые токсином ворсинки (TCP) 19,20 , самосвязывающиеся пилусы, которые связывают бактериальные клетки вместе 21 , возможно, чтобы противостоять силам сдвига. в тонком кишечнике хозяина. Токсин холеры представляет собой секретируемый токсин субъединицы AB 5 . Пентамер субъединицы B связывает моносиалотетрагексозилганглиозиды на абсорбирующих эпителиальных клетках, вызывая эндоцитоз ферментативной субъединицы A, после чего он рибозилирует АДФ субъединицу G-белка, который контролирует активность аденилилциклазы.Хотя вирулентность является многофакторной, холерный токсин является ключевым фактором, ответственным за обильную секреторную диарею, которая возникает у инфицированных людей. Трансмиссивные элементы, такие как лизогенный бактериофаг , несущий гены холерного токсина 22 и элемент SXT, несущий гены устойчивости к антибиотикам 23 , будут продолжать определять эволюцию V. cholerae .
Биологические факторы и факторы окружающей среды, которые способствуют динамике вспышек холеры, продолжают оставаться предметом интенсивных исследований.Было опубликовано несколько обзорных статей, посвященных важности экологических факторов в распространении вспышек холеры. 24–26 . В этом обзоре мы сосредоточимся скорее на трех биологических факторах, которые, как считается, играют важную роль в возникновении и формировании вспышек холеры: восприимчивость хозяина, вирулентность V. cholerae и литические бактериофаги. Ниже мы обсудим эту троицу факторов, связанных с динамическим характером вспышек холеры.
Человек-хозяин
Клинический спектр
В.cholerae инфекцияИнфекция V. cholerae вызывает клинический спектр, который варьируется от бессимптомной колонизации до холеры гравис, наиболее тяжелой формы болезни (). После приема организмом зараженной пищи или воды V. cholerae колонизирует тонкий кишечник в течение 12–72 часов до появления симптомов. Холера часто начинается с желудочных спазмов и рвоты, за которыми следует диарея, которая может прогрессировать до потери жидкости до 1 литра в час 27 .Эти потери приводят к серьезному истощению объема жидкости и метаболическому ацидозу, что может привести к сосудистому коллапсу и смерти 7 . Стул с рисовой водой обычно содержит от 10 10 до 10 12 вибрионов на литр. Пациенты с симптомами могут выделять вибрионы до начала болезни 28,29 и будут продолжать выделять организмы в течение 1-2 недель 30,31 . Бессимптомные пациенты обычно выделяют вибрионы со стулом только в течение 1 дня, примерно 10 3 вибрионов на грамм стула 32 .Следовательно, распределение пациентов с симптомами влияет на количество V. cholerae , которые выделяются для последующей передачи.
Таблица 1
Клинический спектр инфекции Vibrio cholerae
| Бессимптомная инфекция | Легкая инфекция | Тяжелая инфекция | Рвота и обильная диарея |
|---|---|---|---|
| Обезвоживание | Отсутствует | От легкой до легкой | От средней до тяжелой (гиповолемический шок) |
| Характеристики стула | 320Нормальные характеристики стула | 320Нормальный стул | |
| Вибрионов на грамм стула | До 10 5 | До 10 8 | 10 7 до 10 9 в стуле (и рвотных массах) | Нет | Раствор для пероральной регидратации (O RS) | ПРС, внутривенные жидкости и антибиотики ‡ |
| Смертность | Нет | Нет | Без лечения: до 50% Вылечено: менее 1% |
Бессимптомные случаи также могут способствовать распространению микроорганизма, хотя и на гораздо более низком уровне, чем пациенты с симптомами, и могут отражать важный компонент приобретенного иммунитета, который наблюдается в некоторых сообществах. Однако бессимптомные случаи часто трудно задокументировать. Четырехкратное повышение титра вибриоцидного антитела в сыворотке крови является полезной мерой для выявления бессимптомных людей, которые могут быть инфицированы, но от которых невозможно изолировать организм.Используя положительный результат посева из ректального мазка или ответ на вибриоцидные антитела для определения инфекции, недавно было обнаружено, что у бангладешских детей в возрасте до 5 лет вероятность появления симптомов в 2–3 раза выше, чем у детей старше 5 лет 35 . Частота симптомов во всех возрастных группах в этом исследовании составила 57% 35 . Это соответствует показателям симптоматических инфекций, которые были обнаружены в связи с классическими штаммами в более ранней литературе 32,38–40 , но намного выше показателей, сообщенных для инфекций Эль-Тор в 1970-е годы 40 .Таким образом, бессимптомные случаи могут составлять примерно половину всех случаев. Будущие исследования иммунологии бессимптомных пациентов помогут оценить их вклад в защитный иммунитет на популяционном уровне.
Восприимчивость к холере
Генетические факторы хозяина и факторы питания влияют на восприимчивость к холере. Антигены группы гистокрови ABH представляют собой набор клеточных и секретируемых гликолипидов и гликопротеинов, которые являются ключевыми детерминантами восприимчивости хозяина к ряду желудочно-кишечных патогенов; они, по-видимому, влияют на специфичность рецептора клетки-хозяина в отношении связывания патогенов и токсинов.Фенотип O соответствует немодифицированному антигену H и связан со сниженным риском заражения V. cholerae . Однако, как только хозяин инфицирован, фенотип O связан с повышенным риском серьезных симптомов; механизм этого остается неизвестным. Распространенность фенотипа O варьируется среди человеческих популяций; его низкая распространенность в дельте реки Ганг предполагает, что существует отбор против этого фенотипа в эндемичных по холере районах 35,41,42 .В популяциях с высокой распространенностью группы крови O, например в странах Латинской Америки, болезнь протекает тяжелее, и потребности в регидратации и госпитализации инфицированных людей существенно выше 43,44 .
Хотя антиген группы крови H является единственным давно признанным генетическим фактором, связанным с восприимчивостью к холере, другие генетические полиморфизмы, вероятно, были выбраны за или против, учитывая исторически высокие показатели смертности от холеры.Например, недавнее исследование связывало тяжелую холеру с вариантом LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) 45 , консервативного белка врожденного иммунитета. Экспрессия LPLUNC1 активируется в эпителии тонкой кишки во время острой холеры и может влиять на течение инфекции V. cholerae 46 .
Недоедание, измеряемое по задержке линейного роста, не является фактором риска заражения V. cholerae 35 .Однако дефицит ретинола (витамина А), питательного микроэлемента, который способствует иммунитету слизистых оболочек, является фактором риска, связанным как с инфекцией V. cholerae , так и с развитием симптоматического заболевания 35 . Цинк, еще один питательный микроэлемент, который способствует иммунитету слизистых оболочек, может истощаться во время диарейных заболеваний 47 . Оральный цинк устраняет этот дефицит у детей, что приводит к значительному сокращению объема стула и времени до прекращения диареи 44 .
Защитный иммунитет
Несколько исследований демонстрируют, что клинически очевидная инфекция V. cholerae индуцирует защитный иммунитет против последующей инфекции (ВСТАВКА 1). Заражение североамериканских добровольцев классическим биотипом и биотипом Эль-Тор обеспечивало 100% и 90% защиту соответственно от последующего заражения 31,48 . Аналогичным образом, в эндемических условиях было обнаружено, что более 90% пациентов с тяжелым заболеванием, вызванным инфекцией классическим биотипом, были защищены от инфекции в будущем, на основании наблюдаемой и ожидаемой частоты госпитализаций в связи со вторым эпизодом холеры в это население 33 ; аналогичные результаты были получены в отдельном исследовании 49 .Механизм этого защитного иммунитета против инфекции и болезни V. cholerae неизвестен.
Ящик 1 | Иммунный ответ человека на
Vibrio choleraeВрожденный ответ
Считается, что холера является прототипической невоспалительной инфекцией. Часто отсутствуют грубые изменения слизистой оболочки кишечника или архитектурной целостности тонкой кишки. Однако наблюдается повышенная регуляция провоспалительных цитокинов (включая интерлейкин-1β и фактор некроза опухоли), экспрессии различных бактерицидных белков и миграции нейтрофилов в собственную пластинку во время острой холеры.Естественная вариабельность врожденного иммунного ответа может влиять на восприимчивость, что подтверждается открытием, что полиморфизм в промоторной области гена LPLUNC1 (белок 1, связанный с карциномой длинного неба, легких и носового эпителия) связан с повышенным риском холеры.
Адаптивный ответ
Неизвестно, как адаптивный иммунный ответ на холеру обеспечивает защиту от последующего заболевания. Поскольку Vibrio cholerae неинвазивен, было высказано предположение, что секреторный иммуноглобулин А кишечника (sIgA) защищает от колонизации слизистой оболочки.Примерно через 8 дней после начала холеры наблюдается пик циркуляции антиген-специфических лимфоцитов V. cholerae , которые экспрессируют хемокиновые рецепторы кишечника (см. Рисунок) 112 . Эти лимфоциты вскоре становятся необнаруживаемыми в крови, поскольку они возвращаются на слизистую оболочку кишечника, где они приводят к увеличению секреции sIgA в кишечнике. Реакции сывороточных антител, такие как реакция вибриоцидных антител, также достигают максимума через 1-3 недели после заражения. Хотя высокие сывороточные титры вибриоцидных антител и IgA, специфичного к холерному токсину, коррелируют с защитой от инфекции, эти антитела снижаются до исходного уровня через год после заражения, задолго до того, как защитный иммунитет к холере ослабевает.Точно так же у добровольцев, инфицированных V. cholerae , уровни sIgA слизистой оболочки снижаются до исходного уровня в течение нескольких месяцев. Однако, когда добровольцев, у которых больше нет определяемых антител, повторно провоцируют антигенов V. cholerae , они демонстрируют стойкую способность вызывать анамнестический иммунный ответ, развивая пиковую кишечную секрецию антител так же быстро, как в течение трех дней. Следовательно, возможно, что скорость анамнестического ответа на повторное воздействие, а не заранее сформированные антитела, может опосредовать защиту от холеры.Это подтверждается недавними данными о том, что холера вызывает ответ В-клеток памяти, который выявляется в течение по крайней мере 1 года после заражения холерой 113 .
Выявлено несколько коррелятов иммунитета. Лучше всего охарактеризованным серологическим маркером иммунитета является титр сывороточных вибриоцидных антител. Это антитело является комплемент-зависимым бактерицидным антителом, титр которого заметно увеличивается после болезни, но снижается до исходного уровня через 6–9 месяцев 7 . В Бангладеш вибриоцидные антитела обнаруживаются у большинства людей в возрасте 10–15 лет и связаны со снижением риска инфицирования.Поскольку V. cholerae является неинвазивным патогеном, эти сывороточные антитела могут не вносить непосредственный вклад в защиту на уровне слизистой оболочки кишечника, но они могут быть полезны для оценки степени защитного иммунитета на уровне популяции. Антитела иммуноглобулина A, специфичные к TCP, LPS или субъединице B холерного токсина, коррелируют с защитой от последующей инфекции и заболевания 35 .
Полевые испытания вакциныобеспечивают контролируемую оценку устойчивости адаптивных иммунных ответов к В.холера . В крупнейшем контролируемом исследовании 62 285 участников в Бангладеш были рандомизированы для получения 3 пероральных доз (с интервалом в 6 недель) комбинации убитых целых клеток (Эль Тор и классические) плюс субъединица B холерного токсина (вакцина B – WC), цельноклеточный компонент без B-субъединицы (вакцина WC) или убитый Escherichia coli K12 в качестве контроля. Через 3 года наблюдения две вакцины (B – WC и WC) имели 50% и 52% защитную эффективность, соответственно 50 . Для детей младше 5 лет эффективность составила 23–26%.Через 6 месяцев наблюдения вакцина B – WC дала 85% защиту 51 . Ведутся споры о том, демонстрируют ли эти данные эффективность, достаточную для широкомасштабного распространения. В настоящее время предпринимаются усилия по созданию новых вакцин для обеспечения более высоких и устойчивых ответов у реципиентов, а также для снижения производственных затрат с целью преодоления как иммунологических, так и производственных препятствий, которые ограничивают применимость существующих вакцин против холеры 52–55 .
Роль, которую коллективный иммунитет играет в замедлении передачи холеры, недавно стала оценена.В исследованиях эффективности вакцины отдельные пациенты рандомизируются, чтобы гарантировать, что защитная эффективность отражает только прямой эффект вакцины 56 . Это означает, что лицензирование вакцин не учитывает их преимущества на уровне населения. Обсуждаемое выше испытание вакцины B – WC имело уровень охвата от 4% до 65% в разных регионах 50,57 . Когда уровни заболеваемости холерой сравнивались с показателями охвата вакцинацией в конкретных регионах, было обнаружено, что заболеваемость среди реципиентов плацебо обратно коррелировала с уровнем охвата прививками 57 : там, где охват был высоким, даже среди тех, кто этого не сделал. Получившие вакцину, вероятность заболеть холерой по-прежнему на четверть ниже, чем у невакцинированных лиц в районах с низким охватом.Когда коллективный иммунитет включен в имитационные модели эффективности вакцины, охват вакцинацией B – WC 50% в эндемичных районах приводит к снижению общего числа случаев на 93% 58 . Взятые вместе, эти исследования доказывают, что вакцина B-WC может обеспечить достаточную защиту для широкомасштабной вакцинации в эндемичных регионах и что коллективный иммунитет, вероятно, будет играть важную роль в ограничении передачи холеры.
Передача с точки зрения хозяина
Несколько групп создали математические модели, использующие точки зрения как хозяина, так и патогена, чтобы помочь объяснить и предсказать природу вспышек холеры.Цель большинства этих моделей — точно отразить резкий рост и снижение заболеваемости холерой, которое наблюдается два раза в год в регионах вокруг Бенгальского залива. Модель была построена для включения показателей передачи, фактора сезонных колебаний и расчета количества восприимчивых людей на основе различного защитного иммунитета от прошлой инфекции 59–61 . Эти идеи были основаны на проверке гипотез о том, что высокое соотношение бессимптомных и симптоматических случаев связано с разрешением вспышки и что короткий интервал защитного иммунитета (2–12 недель) после заражения допускает последующие вспышки, которые наблюдаются в Бангладеш 62 .Результаты показывают, что комбинация многих бессимптомных случаев и недолговечного иммунитета, а не молчаливых шеддеров , дает модель, которая лучше всего отражает эпидемиологические данные из Западной Бенгалии. У модели есть ограничения: она предполагает соотношение бессимптомных и симптоматических случаев, которое намного выше, чем наблюдаемое в последние годы, и она была протестирована с использованием показателей смертности, которые связаны с клинически определенной холерой из Западной Бенгалии между 1891 и 1940 годами — эпохой до открытия. ротавируса и энтеротоксигенного E.coli , которые являются смешивающими факторами. Несмотря на свои недостатки, эти модели улучшают наше понимание сложной динамики вспышек и показывают, насколько мощной может быть реакция хозяина в ограничении передачи. Новые модели передачи холеры должны по-прежнему включать факторы сезонных колебаний, соотношение бессимптомных и симптоматических случаев и темпы снижения защитного иммунитета.
Возбудитель
Инфекционные дозы в моделях на животных
Заражение человека-хозяина представляет собой многоступенчатый процесс: V.cholerae необходимо принимать внутрь в дозе, достаточной для преодоления врожденной иммунной защиты, затем экспрессии факторов вирулентности для колонизации тонкой кишки и, наконец, для координации выхода из организма хозяина для облегчения передачи 63 (). Животные модели холеры в значительной степени являются показателями успешности первых двух стадий 64 . Используя модель инфекции у новорожденных мышей, было показано, что V. cholerae , которые выделяются с рисовым водяным стулом человека, находятся в гиперинфекционном состоянии, демонстрируя ID 50 из 10–100 клеток по сравнению с примерно 500 клетками для В.cholerae , выращенный in vitro 65–67 . Гиперинфекция также была задокументирована у Citrobacter rodentium 68 , а гиперинфекционный V. cholerae может быть воспроизведен при прохождении через мышиную модель инфекции 68,69 . Определение и фенотип гиперинфективности противоречивы из-за сложностей при выборе наиболее подходящих условий культивирования для роста контрольного штамма.
Жизненный цикл патогенного Vibrio choleraeТоксигенные штаммы Vibrio cholerae сохраняются в водной среде наряду с нетоксигенными штаммами, чему способствует образование биопленок на биологических поверхностях и использование хитина в качестве источника углерода и азота.При попадании этих адаптированных к водной среде бактерий в загрязненную пищу или воду токсикогенные штаммы колонизируют тонкий кишечник, размножаются, выделяют токсин холеры и возвращаются в окружающую среду хозяином при секреторной диарее. Патогенные микроорганизмы, выделяемые калом, находятся в преходящем гиперинфекционном состоянии, которое способствует усилению вспышки за счет передачи последующим хозяевам.
Молекулярные механизмы, которые способствуют гиперинфективности у V. cholerae , многофакторны.Исследования на микрочипах показали, что глобальный профиль транскрипции гиперинфекционных V. cholerae из рисового водяного стула отличается от такового у V. cholerae , выращенных in vitro или верхних отделов тонкой кишки V. cholerae , выведенных в рвотные массы 65, 70,71 (). Большинство известных генов вирулентности, включая гены холерного токсина и TCP, подавляются в стуле из рисовой воды, но механизм этого подавления остается неизвестным. Еще одна уникальная особенность — подавление генов хемотаксиса, что удивительно, учитывая, что планктонные вибрионы, выделяемые пациентами, являются жгутиками и очень подвижны.Было показано, что это подавление хемотаксиса является одним из компонентов гиперинфективности, потому что подвижные, но нехемотаксирующие мутанты V. cholerae являются гиперинфекционными 66,72,73 .
Паттерны экспрессии гена Vibrio cholerae на разных стадиях жизненного циклаПри проглатывании (нижняя правая панель) Vibrio cholerae использует подвижность и муциназы для проникновения через слизистый гель и N -ацетилглюкозамин-связывающий белок A ( GbpA) и другие факторы колонизации эпителия тонкой кишки.Существенные изменения в экспрессии генов сопровождают этот переход от пруда к острой инфекции, включая, помимо прочего, индукцию vieA, которая кодирует фосфодиэстеразу, гидролизующую вторичный мессенджер циклического ди-GMP, и гены, регулируемые ToxR, включая гены холерного токсина и самоагрегативное пилообразное ядро, регулируемое токсинами (TCP). Кроме того, репрессируются несколько генов, таких как гены хитин-связывающего маннозу-чувствительного гемагглютинина пилуса (MSHA) и стрессового сигма-фактора RpoS.На поздней стадии инфекции (нижняя левая панель) V. cholerae снова изменяет экспрессию своего гена, чтобы отделиться от эпителия — «реакция бегства» — и подготовиться к передаче другому хозяину (например, распространение в домашних условиях). ) или попадание в водную среду. Изменения на поздних стадиях включают индукцию генов синтеза c-di-GMP (дигуанилилциклазы), систем поглощения питательных веществ (таких как регулон регуляции поглощения железа (Fur)) и подвижности (Fla), а также репрессию таких генов, как для хемотаксиса (Che) и регулона ToxR.Возникающее в результате «подвижное, но не хемотаксическое» состояние способствует гиперинфективности. Если бактерии, выделяющиеся со стулом, не попадают в организм другого хозяина в течение короткого периода времени, то их ждет одна из двух судьб (верхняя панель): укоренение в водной среде путем нахождения подходящих источников питательных веществ, таких как хитин, или распад в « активную среду ». но некультивируемое состояние. При воздействии хитина V. cholerae индуцирует несколько генов, участвующих в присоединении и катаболизме хитина (регулон ChiS), а также гены, участвующие в генетической компетентности (регулон TfoX).Образование биопленок на поверхности опосредуется индукцией регулона Vps, который кодирует внеклеточный полисахарид. Во время перехода в активное, но не культивируемое состояние происходят большие изменения в экспрессии генов, поскольку V. cholerae пытается адаптироваться к условиям с низким содержанием питательных веществ. К ним относятся индукция генов фосфатного и азотного голодания (phoB и glnB-1 соответственно) и репрессия генов трансляционного аппарата.
Транскриптом V. cholerae , пассированный от животных, также уникален и был выявлен в двух недавних исследованиях.Во-первых, существует скоординированная «реакция бегства», которая позволяет организму отделяться от ворсинок кишечника, готовясь к выходу из организма хозяина; это регулируется стрессом и стационарной фазой сигма-фактора РНК-полимеразы RpoS 74 . Во-вторых, на более поздних стадиях заражения животных, V. cholerae активирует экспрессию генов, которые не требуются для инфекции, но которые важны для выживания при переходе в водную среду 75 . Эта предварительная индукция генов выживания в окружающей среде на поздних этапах инфекции может подготовить организм к жесткому селективному давлению в воде пруда, тем самым облегчая передачу 24,65 .В большинстве описанных выше исследований бактериальные клетки, составлявшие инфекционную дозу, были планктонными клетками, а не агрегатами. Было проведено одно исследование с участием добровольцев, в котором добровольцам вводили V. cholerae в морщинистой форме (т. Е. Агрегативной и продуцирующей экзополисахариды); Инфекционная доза была аналогична дозе, наблюдаемой для планктонных форм, а морщинистые формы выделялись добровольцами 76 . Кроме того, люди выделяют V. cholerae в виде сложных биопленко-подобных агрегатов 67,77,78 .Идентификатор 50 V. cholerae выделяется в совокупности, и роль, которую эти совокупности играют в передаче, еще предстоит определить.
Инфекционная доза у людей
Инфекционная доза V. cholerae у людей сильно варьируется в зависимости от бактериального штамма и хозяина. Дозы 10 8 –10 11 клеток требовались для обеспечения последовательной колонизации у здоровых добровольцев из Северной Америки 7,29,31 . Инфекционная доза снижается до 10 4 –10 8 при использовании бикарбонатного буфера для нейтрализации желудочного сока незадолго до инокуляции; этот метод дает 90% зараженности 7,29,31 .В домашнем хозяйстве пища может действовать как кислотный буфер; В исследованиях на добровольцах введение бактерии как часть «еды» из риса, рыбы, заварного крема и обезжиренного молока дало результаты, сравнимые с результатами, наблюдаемыми при одновременном введении бактерий и бикарбоната 79 . В эндемичных условиях инфекционная доза неизвестна. Подсчет V. cholerae в образцах домашнего хозяйства и окружающей среды исторически сложен, требует быстрого реагирования и использования флуоресцентной микроскопии для подсчета тех бактерий, культивирование которых, возможно, затруднено. 80 .
Клиническое наблюдение, что буферная кислота желудочного сока снижает инфекционную дозу, предполагает, что бактериальные гены, участвующие в кислотной устойчивости, могут способствовать вирулентности. Сигнатурный мутагенез (STM) был использован для поиска подмножества генов вирулентности, которые вносят вклад в кислотостойкость in vitro 81 . Удаление этих генов ослабило V. cholerae в модели инфекции у новорожденных мышей, что подтверждает их роль в вирулентности. Кроме того, обнажая В. дикого типа.cholerae для подкисления непосредственно перед инокуляцией мышей давало большое конкурентное преимущество перед неадаптированными к кислоте бактериями 82 . Эти данные, наряду с другими, демонстрируют, что бактерии, выращенные in vitro , могут стать более заразными в результате воздействия стресса. Кроме того, эти результаты могут иметь клиническое значение в тех регионах мира, где преобладает пониженная продукция желудочной кислоты (ахлоргидрия), вторичная по отношению к инфекции Helicobacter pylori, например, Бангладеш 7 .
Передача с точки зрения патогена
Роль, которую гиперинфекция играет в быстром распространении холеры среди населения в начале вспышки, остается непроверенной. V. cholerae остается гиперинфекционным в течение как минимум 5 часов после перехода от пациентов в водную среду, что позволяет предположить, что гиперинфекция играет особую роль в передаче инфекции в районах с высокой плотностью населения, где существует вероятность контакта с организмом другого человека. в относительно короткие сроки 65,70 .Одна модель передачи холеры предполагает, что вспышка начинается, когда либо уже инфицированный индексный случай мигрирует и заражает новую территорию, либо потребление V. cholerae из естественного резервуара окружающей среды создает новый индексный случай у постоянного населения. В обоих сценариях возможно ускорение вспышки в результате быстрого распространения гиперинфекционного вируса V. cholerae от человека к человеку при кратковременном нахождении в окружающей среде.Модели передачи, которые допускают только случайное попадание V. cholerae в окружающую среду, не предсказывают резкого роста числа случаев, которые наблюдаются в начале вспышек по всему миру, включая те, которые происходят раз в два года в Бангладеш 11 . Однако модели, учитывающие гиперинфективность 83 , лучше отражают этот резкий подъем.
Поддержание передачи через водоемы
Эндемичная холера встречается в регионах с естественными водными резервуарами токсигенных и нетоксигенных V.cholerae , где бактерии могут сохраняться либо в свободноживущем состоянии, либо в ассоциации с фитопланктоном 84–86 , зоопланткон 85–88 или биотическим и абиотическим детритом 89,90 . Эти взаимодействия могут быть как полезными, так и антагонистическими 91,92 . Ассоциации вообще не случайны. Например, V. cholerae развил механизмы для присоединения, разложения и использования хитина в качестве источника углерода и азота 93–95 ().Для экологических изолятов методы ДНК-типирования, основанные на секвенировании гипервариабельных локусов повторов короткой последовательности, начали лучше определять взаимосвязь между нетоксигенными и токсигенными V. cholerae . Было обнаружено, что два сельских региона, разделенных 80 км в дельте реки Ганг, содержат отдельные, разнообразные штаммы из экологических и клинических условий 96 . Экологические изоляты состояли как из токсигенных, так и из нетоксигенных штаммов O1 El Tor и O139 на фоне нетоксигенных штаммов, представляющих многие серогруппы.Напротив, клинические изоляты были строго токсигенными O1 El Tor и O139, но относились к разным типам штаммов. Эти результаты демонстрируют, что в организме хозяина токсикогенные штаммы обладают селективным преимуществом перед нетоксигенными штаммами из окружающей среды. Взаимосвязь между экологическими и клиническими штаммами может быть разной в других регионах мира и, вероятно, будет варьироваться в зависимости от окружающей среды, санитарии, инфраструктуры и плотности населения.
Селективное давление в водной среде
Некоторые бактериальные патогены, в том числе В.cholerae , теряют способность культивироваться на стандартных средах после переноса от хозяина или лаборатории в водную среду 24,97 . Этот фенотип традиционно известен как «жизнеспособное, но не культивируемое» (VBNC) состояние, поскольку клетки поддерживают способность к основным метаболическим процессам, таким как синтез белка, дыхание и поддержание целостности мембран, несмотря на их неспособность культивироваться 24 . Альтернативный, более консервативный термин, который применяется к этому состоянию, — «активный, но не культивируемый» (ABNC), поскольку остается неясным, живы ли еще бактерии, утратившие культивирование на стандартных средах 98 .
V. cholerae может быстро превратиться в ABNC, когда покидает человека-хозяина и попадает в водную среду. Исследования с участием пациента и in vitro , полученного V. cholerae , которые подвергались диализу в прудовой воде, продемонстрировали снижение культивирования на 60% и 90% через 5 часов и 24 часа соответственно 65 . Анализ микроматрицы продемонстрировал быстрые и заметные изменения транскрипции, когда бактерии входили в состояние ABNC 65 . Эти изменения включали индукцию генов поглощения фосфатов и фиксированного азота и подавление генов синтеза белка и энергетического метаболизма, что согласуется с низкими уровнями источников углерода, фосфатов и фиксированного азота, которые часто встречаются в водной среде.Остается проверить, будет ли включение твердых частиц, которые были отфильтрованы из воды пруда в вышеупомянутом исследовании, продлить культивирование V. cholerae . Учитывая возможность такого быстрого снижения культивируемости, исследователи задали вопрос, является ли большинство клеток V. cholerae , инфицированных людей из окружающей среды, ABNC или культивируемыми клетками. Одна из гипотез гласит, что если культивируемые клетки более заразны, чем клетки ABNC, то ID 50 , рассчитанный по общему количеству клеток, будет увеличиваться по мере уменьшения процента культивируемых клеток в популяции.Это было подтверждено в недавних экспериментах, предполагающих, что основными факторами инфицирования человека, вероятно, являются культивируемые клеток V. cholerae 65 . В будущих математических моделях передачи V. cholerae должна быть учтена возможность уменьшения скорости культивирования.
V. cholerae литический бактериофагБиология вибриофагов
Восемьдесят лет назад было предложено, чтобы бактериофаги могли контролировать естественные популяции патогенов 99,100 .Более поздние исследования в области морской микробиологии выявили элегантный баланс между бактериофагами и их цианобактериальной добычей 101 . С клинической точки зрения бактериофаги, в принципе, можно использовать для профилактики или лечения инфекций. Действительно, документально подтверждена «фаговая терапия» против холеры и других заболеваний (ВСТАВКА 2). Существует не менее 200 видов бактериофагов, которые инфицируют V. cholerae , известных как вибриофаги 102,103 . Нитевидный лизогенный вибриофаг CTXΦ является одним из наиболее охарактеризованных, поскольку он несет гены, кодирующие токсин холеры 22 .Первым секвенированным геномом хвостатого вибриофага был геном κ139; этот вибриофаг может быть как лизогенным, так и литическим. Основным механизмом, с помощью которого V. cholerae O1 становится устойчивым к κ139 и многим другим вибриофагам, является мутация кластера генов rfb , который кодирует ферменты для синтеза ЛПС 104 . В отсутствие рецептора антигена LPS O вибриофаг не может связываться или инфицировать бактериальную клетку. Все мутанты rfb -null V. cholerae O1, которые были протестированы на сегодняшний день, являются аттенуированными 65,67,105 .
Ящик 2 | Исследование бактериофагов
В 1915–1917 годах Twort 114 и d’Hérelle 115 независимо друг от друга открыли бактериофаги. Д’Эрелль определил, что бактериальная инфекция на животных моделях может быть ослаблена бактериофагами, и в 1925 году состояние пациентов с бубонной чумой улучшилось после того, как д’Эрелль ввел бактериофаги непосредственно в их бубоны (увеличенные лимфатические узлы) 116 . Эти открытия привели к исследованию бактериофагов, в задачу которого входило изучение терапии бактериофагом холеры в Индии 116 .Их первое испытание терапии сравнивало 244 нелеченных пациента с холерой с 219 пациентами с холерой, которых лечили вибриофагами; в нелеченой группе смертность составила 20%, тогда как в обработанной группе — 6,8% (χ 2 , p <0,01). Другие исследования показали аналогичные результаты 5,116,117 . Несмотря на некоторые ограничения, характерные для той эпохи, расследование добилось достаточного успеха, чтобы расширить свои усилия 5 .
За 1928, 1929 и 1934 годы сотрудники по расследованию подготовили и распространили 36 000, 130 823 и 871 316 доз вибриофагов в то время, когда начались вспышки в конкретных исследуемых сообществах в Индии. 116 .Вибриофаги также распространялись в общественных источниках питьевой воды для профилактики. Смертность от холеры сравнивалась с контрольными сообществами до и после вмешательств. Трехлетний уровень смертности от холеры снизился с 30 до 2 на 10 000 в регионах, лечившихся вибриофагами 117 . Хотя эти исследования имели несколько ограничений, они предоставляют единственные доступные данные об эффективности терапии вибриофагами. Достижения в области регидратации и антибиотикотерапии в 1930-х и 1940-х годах сделали испытания бактериофагов, основанные на конечных точках смертности, неэтичными и статистически сложными 116,118 .
Вибриофаги в окружающей среде
В 1930-х годах было обнаружено, что случаи холеры положительно коррелировали с изоляцией вибриофагов в водной среде 106 . В наше время была описана отсроченная положительная согласованность между ростом числа случаев холеры и последующим ростом вибриофагов в окружающей среде 107 . Модель, разработанная Jensen et al. предсказывает, что если вспышка будет инициирована увеличением В.cholerae в окружающей среде, плотность вибриофагов впоследствии будет увеличиваться, что в конечном итоге будет способствовать сокращению вспышки 108 . В Международном центре исследований диарейных болезней в Бангладеш (ICDDRB) рост случаев холеры был связан с согласованным, но отсроченным увеличением доли больных холерой с вибриофагами в стуле 109 . Вибриофаги, идентифицированные в этом исследовании, были литическими вибриофагами (JSF4), хотя у пациентов можно выделить несколько типов вибриофагов 107 .Титры вибриофагов в стуле из рисовой воды варьировались от 10 2 до 10 8 бляшкообразующих единиц на миллилитр, что согласуется с другими публикациями 65,67 . Несмотря на присутствие литических вибриофагов, все стула были положительными на V. cholerae и V. cholerae , как правило, по количеству вибриофагов, по крайней мере, на один порядок. Последующие исследования показали, что большинство бактериальных изолятов из стула все еще чувствительны к вибриофагам 65,67 .Пока неясно, почему вибриофаги в кишечнике человека не могут избавиться от инфекции V. cholerae , но эта «неудача» может играть важную роль в распространении клональной экспансии фагов во время вспышек болезни 109 .
Передача с точки зрения вибриофага
Современные эксперименты начали проверять гипотезу о том, что фаги могут ослаблять бактериальную передачу. Например, тесты подвижности с использованием микроскопии в темном поле были использованы для быстрого скрининга стула из рисовой воды на наличие вибриофагов; стул, который был отрицательным в темном поле (не содержал подвижных вибрионов), с большей вероятностью содержал литические вибриофаги и имел низкое количество культивируемых клеток, но схожее общее количество клеток 77 .С помощью этого косвенного измерения для фагов было обнаружено, что по крайней мере половина пациентов с холерой, которые наблюдались в течение 5-летнего периода в ICDDRB, имели вибриофаги, а домашние контакты инфицированного пациента с положительным индексом вибриофага были менее вероятны. с V. cholerae , чем люди, которые контактировали с пациентом, который не был фагоположительным 77 . Эти результаты согласуются с выводом о десятикратном снижении инфекционной дозы В.cholerae , когда в стуле хозяина есть вибриофаги 67 .
V. cholerae обычно превосходит литические бактериофаги сразу после пассажа от хозяина 65 , 67 . В лабораторных экспериментах с использованием стула из рисовой воды, перенесенного человеком, бактериофаги имеют начальный всплеск репликации в течение первых нескольких часов в водной среде и могут достигать отношения бактериофагов к бактериям примерно 1: 1 за 24 часа 65,67 .Хотя гиперинфекция может сохраняться в течение нескольких часов после пассажа от хозяина 65,70 , потеря культивирования (обсуждалось выше) и рост бактериофагов в водной среде, вероятно, объединяются, чтобы блокировать передачу 65 . Контрольные эксперименты с , полученным in vitro , V. cholerae и бактериофагами подтверждают, что бактериофаги могут ограничивать бремя инфекции 65,67 . Однако бактериофаги никогда не могут полностью блокировать инфекцию, потому что мутанты V.cholerae , у которых отсутствует зрелый ЛПС, избегают хищничества и колонизируют мышей, хотя и в меньшем количестве. Как уже упоминалось, мутанты LPS ослаблены и могут быть потеряны в естественном жизненном цикле V. cholerae 65,67,105 .
Таким образом, динамическое взаимодействие между бактериофагом и бактерией в воде пруда предполагает, что модель передачи холеры должна включать в себя меру быстрого снижения способности бактерий к культивированию и уничтожения бактериофагами. В закрытой экспериментальной системе передача В.cholerae можно свести к минимуму, если эти два фактора сочетаются в водной среде. Следовательно, вероятно, будет преимущество пригодности для V. cholerae , которое быстро перейдет к следующему хозяину, когда культивируемость все еще высока, а концентрация бактериофагов все еще низкая. В этом обзоре упоминалось несколько моделей, которые предлагают разные объяснения роста и спада вспышек с точки зрения хозяина (клинический спектр и коллективный иммунитет), бактерии (гиперинфекция) и бактериофага (хищничество).Мы объединили несколько опубликованных моделей в одну рабочую диаграмму, чтобы побудить задуматься о том, как эти факторы могут взаимодействовать в естественной среде (). Лучшее понимание того, как функционирует интегрированная модель, может раскрыть возможности для вмешательств в области общественного здравоохранения.
Комбинированная модель передачи холеры с точки зрения хозяина и микроорганизмовОбщая популяция (H) питает пул восприимчивых хозяев (S), которые становятся инфекционными (I) после употребления Vibrio cholerae из окружающей среды. источник, с литическими бактериофагами или без них (Φ).Инфицированные люди имеют симптомы (I symp ) или бессимптомны (I asymp ) и выздоравливают (R) благодаря действиям своей иммунной системы и, возможно, литических бактериофагов, или погибают от инфекции (m). Выздоровевшие люди будут повторно попадать в пул восприимчивых с разной скоростью (//) в зависимости от степени защитного иммунитета. Литические фаги и гиперинфекционные V. cholerae (VC Hi ) выделяются симптоматическим хозяином в различных концентрациях; бессимптомные хозяева выделяют гораздо меньше бактерий (пунктирная линия).Клетки VC Hi быстро переходят к следующему хозяину, сохраняются в окружающей среде в виде культивируемых клеток с неизвестной инфекционностью (VC C ) или распадаются в «активное, но не культивируемое» состояние (VC ABNC ) с пониженной инфекционностью. Все три типа клеток плюс совокупные бактерии (не показаны), вероятно, играют смешанную роль в качестве резервуаров окружающей среды для будущих вспышек.
Заключительные замечания
Модель передачи, которая точно предсказывает масштабы возникающей вспышки, предоставит органам общественного здравоохранения полезную информацию для надлежащего масштабирования их ответных мер.Вмешательства, направленные на жизненно важные этапы передачи, могут быть эффективными для предотвращения вспышек. Иммунитет хозяина, гиперинфекция патогенов и фаги — все это факторы, которые можно использовать для борьбы со вспышкой. Например, централизованные центры управления отходами часто терпят неудачу в условиях нехватки ресурсов. Поскольку пациенты с симптомами выделяют более V. cholerae , а V. cholerae в стуле из рисовой воды является гиперинфекционным, вспышки холеры лучше всего остановить у источника, уменьшив воздействие на человека свежевыпущенного гиперинфекционного стула.Другими словами, при сохранении централизованного управления следует поощрять и проверять децентрализованные усилия по целевому управлению отходами в единице домашнего хозяйства. Эта концепция подчеркивает решающую важность уже проверенных, но простых мероприятий в домашних условиях, таких как использование кувшинов с узким горлышком, хлорирование хранящейся воды и мытье рук, для профилактики заболеваний 110,111 .
Еще многое предстоит узнать об эффективности вакцины в естественных условиях холеры.Отказ от традиционных мер оценки эффективности вакцин путем включения преимуществ коллективного иммунитета продолжит раскрывать истинное влияние как существующих вакцин, так и вакцин, находящихся в разработке. Кроме того, понимание воздействия хищничества бактериофагов и того, как вакцины снижают пул восприимчивости до такой степени, что передача не может продолжаться, являются важными областями для будущих исследований. Ответы на многие вопросы, поставленные в этом обзоре, имеют решающее значение для стран с ограниченными ресурсами, таких как Зимбабве, для оптимизации использования ограниченных запасов вакцины и борьбы с пагубными последствиями неудовлетворительной санитарии.
Передача холеры
Холера вызывается штаммами бактерий Vibrio cholerae . Существует более 100 видов холерного вибриона, лишь некоторые из которых, как известно, вызывают холеру. Бактерии обычно вызывают тяжелую острую диарею с жидким стулом и многократной рвотой.
Водянистый понос обычно имеет бледный и непрозрачный вид и также известен как «стул из рисовой воды» из-за его сходства с водой, которую использовали для мытья риса.Этот понос изобилует бактериями, которые могут загрязнить питьевую воду в случае плохой санитарии и заразить других людей, пьющих воду.
Передача холеры
Бактерии, вызывающие холеру, присутствуют в стуле или других сточных водах, которые могут проникать в водные пути, почву или источники питьевой воды и загрязнять их. Питье зараженной воды или даже просто мыть ею продукты, кухонные принадлежности или кулинарные изделия может привести к передаче инфекции.
Бактерии также могут прикрепляться к зоопланктону, присутствующему в соленой, солоноватой и даже пресной воде.Бактерии прикрепляются к хитиновому экзоскелету этого планктона.
Проглатывание и выживание человека
Как только бактерия попадает в организм при употреблении в пищу зараженной пищи или воды, она должна выжить, пройдя через пищеварительный тракт. Около двух третей попавших в организм бактерий могут выжить в условиях сильной кислоты, вырабатываемой слизистой оболочкой стенок желудка. Как только эти бактерии попадают в тонкий кишечник, они начинают производить длинные хвостовидные структуры, называемые жгутиками, которые помогают им размножаться и перемещаться через кишечную слизь, пока они не достигнут стенок кишечника.Достигнув стенок кишечника, бактерии образуют на своей поверхности пальцевидные выступы, называемые фримбриями или пили, которые они используют, чтобы держаться за стенки кишечника. Здесь бактерии начинают производить токсичные белки, вызывающие водянистую диарею, и они действуют как сосуд для переноса новых размножающихся бактерий во внешнюю среду, где они могут быть поглощены другим хозяином.





