Пульс-Терапия стероидными гормонами больных с Коронавирусной пневмонией (COVID-19), системным воспалением и риском венозных тромбозов и тромбоэмболий (исследование ПУТНИК) | Мареев
Новая коронавирусная инфекция, вызванная вирусом SARS-CoV-2 и получившая название COVID-19, 11 марта 2020 года была объявлена Всемирной организацией здравоохранения (ВОЗ) пандемией. Тяжелые формы течения этого заболевания сопровождаются развитием вирусной пневмонии с тотальным поражением мелких сосудов легких, бронхиол и альвеол. В патогенезе COVID-19 существенную роль играет прогрессирующее системное воспаление, сопровождающееся лимфопенией и нейтрофилезом. Патологическая гиперреактивность иммунной системы, выражающаяся в неконтролируемой активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов и хемокинов, получила название «цитокиновый шторм». У пациентов с COVID-19 отмечаются высокие уровни интерлейкинов (ИЛ) (ИЛ-1‑β, ИЛ-1RA, ИЛ-6, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-17), макрофагального воспалительного белка, фактора роста эндотелия сосудов, фактора некроза опухоли α (ФНО-α) и других провоспалительных хемокинов, цитокинов и сигнальных белков.
Глюкокортикостероиды (ГКС) являются одними из самых популярных противовоспалительных агентов, с длительной историей использования. В настоящее время ВОЗ не рекомендует рутинное использование кортикостероидов у пациентов для лечения вирусной пневмонии или острого респираторного дистресс-синдрома, если только пациенты не имеют других заболеваний, таких как астма, обострение хронической обструктивной болезни легких или септический шок [2]. Во временных рекомендациях Министерства здравоохранения Российской Федерации (МЗ РФ) есть упоминание о возможности применения ГКС в малых дозах (метилпреднизолон 1 мг / кг / сут., внутривенно) в качестве упреждающей противовоспалительной терапии. При этом пульс-терапия ГКС не входит в список рекомендованных Министерством здравоохранения подходов к лечению COVID-19. (Временные методические рекомендации профилактика, диагностика и лечение новой коронавирусной инфекции (COVID 19) 7 версия) [3].

Тем не менее именно эти лекарства часто применяются при лечении воспаления и «цитокинового шторма», вызванного вирусом SARS-CoV-2, в том числе и по причине наибольшей доступности. В систематическом обзоре 41 исследования по лечению COVID-19 чаще всего (в 25 протоколах) использовалась глюкокортикоидная терапия по разным схемам и в разных дозах [4]. К сожалению, ГКС обладают довольно большим количеством побочных эффектов. Среди основных средне- и долгосрочных нежелательных эффектов этой группы препаратов – увеличение резистентности к инсулину [5–7], увеличение сердечно-сосудистого риска и риска бактериальных инфекций [8]. Нарушения обмена глюкозы и увеличение риска суперинфекций может быть корригировано в условиях стационарного лечения пациентов с коронавирусной пневмонией. Наиболее опасным выглядит повышение риска тромботических и тромбоэмболических осложнений, которые и так характерны для COVID-19 и могут приводить к полиорганным поражениям, и ухудшать прогноз. В целом ряде исследований было показано, что COVID-19 может сопровождаться гиперкоагуляцией, с торможением фибринолиза, что приводит к микротромбозам в сосудах легких, почек, сердца и повышенному риску венозных тромбоэмболий (ВТЭ), включая тромбоэмболию легочной артерии (ТЭЛА) и артериальных, вплоть до развития инсульта [9, 10].

Изучение эффективности (возможное подавление воспаления и «цитокинового шторма») и безопасности (возможное прогрессирование сердечно-сосудистых осложнений и тромбозов) глюкокортикоидной терапии у пациентов с COVID-19 представляет научный интерес и обладает практическим значением.
Мы провели ретроспективное когортное сравнительное исследование 34 пациентов с тяжелым течением коронавирусной пневмонии, требовавших противовоспалительного лечения. Целью работы была оценка клинической эффективности и безопасности пульс-терапии высокими дозами ГКС в течение трехдневного курса с продлением поддерживающими дозами до одной недели больных с COVID-19.

Материалы и методы
В исследование было включено 34 пациента, находящихся на стационарном лечении в Московском Научно-Образовательном центре МГУ имени М. В. Ломоносова (МНОЦ МГУ) с доказанным диагнозом коронавирусной пневмонии. Диагноз во всех случаях был подтвержден определением наличия РНК вируса SARS-CoV-2 по полимеразной цепной реакции и типичными изменениями в легких по данным компьютерной томографии (КТ). Исходно была назначена стандартная терапия гидроксихлорохином с азитромицином, позже с добавлением бромгексина и спиронолактона. Кроме этого, с первого дня госпитализации всем пациентам проводилась антикоагулянтная терапия НМГ (согласно массе тела), причем при повышении величины D-димера ≥5 мкг / мл, пациенты переводились на лечебные дозы НМГ. При необходимости корригировалась антибактериальная терапия, и больные обеих групп принимали в среднем 1,4 антибиотика. Никаких различий во вспомогательной терапии, как и в назначении препаратов для лечения сопутствующей патологии, между группами не было.
У пациентов, которые затем вошли в активную группу, (17 пациентов) течение болезни с высокой лихорадкой, снижением сатурации кислорода в крови, увеличением С-реактивного белка (СРБ) и отсутствием положительной динамики по данным КТ потребовало экстренного проведения противовоспалительной терапии. При отсутствии антиинтерлейкиновых препаратов лечащими врачами было принято решение о проведении пациентам пульс-терапии высокими дозами ГКС: метилпреднизолоном по 1000 мг внутривенно в течение 3 дней с переводом на дексаметазона по 4 мг дважды в день в течение 3–7 дней. Одному пациенту дополнительно вводился тоцилизумаб 400 мг. Пятеро больных после окончания гормонотерапии получали колхицин в дозе 0,5 мг / сут. В качестве контрольной группы были отобраны 17 больных, сходных по основным характеристикам, проходивших в это же время лечение в клинике МНОЦ МГУ, по тем же протоколам, но не получавших пульс-терапии ГКС. Одному пациенту вводился тоцилизумаб 400 мг. Лишь шестеро из них находились на терапии колхицином 1 мг первый день, затем 0,5 мг / сут.

Анализ данных в группах терапии ГКС и контроля проводился с дважды заслепленными конечными точками: на этапе выборки данных и на этапе статистической обработки, что полностью исключает субъективный фактор влияния на результаты.
Исходная характеристика обследованных пациентов представлена в таблице 1.
В группе пульс-терапии ГКС медиана возраста составила 59 лет, 15 из 17 (88,2 %) пациентов были мужчины с медианой индекса массы тела 29,9 кг / м2. В группе контроля медиана возраста была выше – 68 лет, также в большинстве случаев эту группу составили мужчины (58,5 %) с индексом массы тела 27,8 кг / м2, но все эти различия были статистически не значимы. Группы не различались по количеству и частоте сопутствующих заболеваний (сердечно-сосудистых, с преобладанием артериальной гипертонии, сахарного диабета, хронической обструктивной болезни легких и онкологических).
Больные в группе пульс-терапии ГКС по сравнению с группой контроля имели статистически значимо более сильную лихорадку (разница по медиане + 0,9⁰ С), более выраженную, но статистически не значимо, одышку (медиана частоты дыхательных движений (ЧДД) 24 против 19 в минуту), связанную с более низкой сатурацией кислорода (медианы 85 % против 94 % на воздухе и 92 % против 96 % при вентиляции кислородом). В активной группе все пациенты находились на кислородной поддержке против 53 % в группе контроля (р=0,002) и они чаще были в отделении реанимации и интенсивной терапии (ОРИТ) и на искусственной вентиляции легких (ИВЛ), хотя по двум последним показателям значимых различий между группами не было. По исходному уровню систолического артериального давления (САД) группы статистически значимо не различались, а тахикардия имела место в более тяжелой группе пациентов, получивших пульстерапию ГКС.
 Суммарный показатель выраженности воспаления (С-реактивный белок, СРБ) был повышен в 19 раз в группе контроля и в 27 раз в группе активной терапии (р=0,048). Троекратно был повышен уровень D-димера, что, вкупе с увеличением фибриногена, отражало повышенную наклонность к тромбообразованию на фоне воспалительного процесса (р=0,125). В обеих группах отмечались лимфопения и увеличение количества нейтрофилов, выходящее за пределы нормальных значений лишь в активной группе. Соотношение числа нейтрофилов к лимфоцитам (индекс Н / Л) составило 4,06 в контрольной группе и 6,05 в группе активного лечения (р=0,125). Количество тромбоцитов, уровни глюкозы, креатинина и расчетной скорости клубочковой фильтрации (СКФ) были в пределах нормальных величин и не различались по группам.
Суммарный показатель выраженности воспаления (С-реактивный белок, СРБ) был повышен в 19 раз в группе контроля и в 27 раз в группе активной терапии (р=0,048). Троекратно был повышен уровень D-димера, что, вкупе с увеличением фибриногена, отражало повышенную наклонность к тромбообразованию на фоне воспалительного процесса (р=0,125). В обеих группах отмечались лимфопения и увеличение количества нейтрофилов, выходящее за пределы нормальных значений лишь в активной группе. Соотношение числа нейтрофилов к лимфоцитам (индекс Н / Л) составило 4,06 в контрольной группе и 6,05 в группе активного лечения (р=0,125). Количество тромбоцитов, уровни глюкозы, креатинина и расчетной скорости клубочковой фильтрации (СКФ) были в пределах нормальных величин и не различались по группам.По данным КТ все 34 пациента имели признаки двусторонней вирусной пневмонии, характерные для COVID-19. Медиана поражения по стадиям, рекомендованным МЗ РФ и Департаментом здравоохранения Москвы [3], составила 2,0 для группы контроля и 3,0 для группы активной терапии, причем 58,8 % пациентов активной группы имели 3–4 стадии поражения легких, в то время как в группе контроля таких пациентов не было.
 По данным компьютерного анализа (MultiVox, ФФМ МГУ) суммарный объем поражения легких («матовые стекла», «булыжная мостовая» и участки консолидации и фиброза) составил 25,6 % в группе контроля и 53,2 % в активной группе (р<0,001).
По данным компьютерного анализа (MultiVox, ФФМ МГУ) суммарный объем поражения легких («матовые стекла», «булыжная мостовая» и участки консолидации и фиброза) составил 25,6 % в группе контроля и 53,2 % в активной группе (р<0,001).При первом исследовании использовался стандартный протокол КТ с напряжением тока на трубке 120 кВ и автоматическим модулированием силы тока на трубке в диапазоне 200–400 мА, при повторных КТ применяли протокол низкодозной КТ с уменьшенными параметрами напряжения тока на трубке (100 или 110 кВ) и автоматической модуляцией тока на трубке в диапазоне 40–120 мА. При стандартном протоколе средняя лучевая нагрузка составляла 3,9±0,4 мЗв, при низкодозном – 0,9±0,2 мЗв. Исследования КТ выполнялись при поступлении и выписке пациента, в период госпитализации их повторяли по мере клинической необходимости, но не реже, чем один раз в 5 дней.

Все полученные изображения в формате DICOM хранились в радиологической информационной сети (PACS / RIS) МНОЦ МГУ. Для обработки и анализа КТ использовались рабочие станции Syngo.via (Siemens).
При обработке и описании данных КТ использовалась полуколичественная шкала оценки объема зон инфильтрации и консолидации легких, рекомендованная Временными методическими рекомендациями МЗ РФ «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) версий 6 и 7 (КТ – КТ4).
Для точного количественного анализа динамики объема вызванных COVID-19 изменений паренхимы легких во всех случаях использовался отечественный программный комплекс «Гамма Мультивокс» со специальным приложением для анализа поражения легких при COVID-19, созданным лабораторией медицинских компьютерных систем НИИЯФ им. Д. В. Скобельцына МГУ имени М. В. Ломоносова и факультетом фундаментальной медицины (ФФМ) МГУ им. М. В. Ломоносова (https://multivox.ru). С помощью данной программы для всех серий КТ у каждого пациента, включенного в исследование, выполнялись автоматическая цветная кодировка и подсчет объемов зон «матового стекла» и консолидации на КТ изображениях, оценивался их объем в кубических сантиметрах и процент по отношению к объему легкого.
 Учитывалась сумма любых матовых стекол и зон консолидации. Программа генерировала таблицы с измеренными значениями, при выполнении исследований в динамике происходило добавление новых данных в таблицу. Исследование уровня биохимических показателей крови (СРБ, креатинин, мочевина, глюкоза) было выполнено на автоматическом биохимическом анализаторе AU480 Beckman Coulter, Германия; общий анализ крови (5 diff) на гематологическом анализаторе XN 2000 Sysmex Corporation, Япония; исследование уровня показателей гемостаза (фибриноген, D-димер) на автоматическом анализаторе гемостаза STA-Compact Diagnostica Stago SAS, Франция.
Учитывалась сумма любых матовых стекол и зон консолидации. Программа генерировала таблицы с измеренными значениями, при выполнении исследований в динамике происходило добавление новых данных в таблицу. Исследование уровня биохимических показателей крови (СРБ, креатинин, мочевина, глюкоза) было выполнено на автоматическом биохимическом анализаторе AU480 Beckman Coulter, Германия; общий анализ крови (5 diff) на гематологическом анализаторе XN 2000 Sysmex Corporation, Япония; исследование уровня показателей гемостаза (фибриноген, D-димер) на автоматическом анализаторе гемостаза STA-Compact Diagnostica Stago SAS, Франция.Для объективизации тяжести клинического состояния и адекватной оценки эффектов проводимой терапии мы использовали две шкалы. Во-первых, шкалу NEWS-2 (Reproduced from: Royal College of Physicians. National Early Warning Score (NEWS) 2: Standardizing the assessment of cute-illness severity in the NHS. Updated report of a working party. London: RCP, 2017), модернизированную для пациентов с COVID-19 [12].
 Кроме того, нашу оригинальную шкалу оценки клинического состояния больных с коронавирусной инфекцией (ШОКС-COVID).
Кроме того, нашу оригинальную шкалу оценки клинического состояния больных с коронавирусной инфекцией (ШОКС-COVID).Шкала NEWS-2 была создана для оценки тяжести больных с острыми респираторными синдромами, создавалась и много лет широко использовалась для оценки риска клинического ухудшения, своевременного и компетентного принятия решения о месте лечения, необходимости интенсификации лечения. Шкала валидирована на многих популяциях пациентов. И в отношении COVID-19 шкала выполняла задачу быстрой оценки риска клинического ухудшения и сортировки больных. За основу взяты классические клинические проявления – ЧДД, сатурация кислорода, необходимость вентиляции, состояние сознания, температура тела, а также частота сердечных сокращений (ЧСС) и САД. Поэтому она недостаточно учитывает особенности пациентов с COVID-19. Китайские исследовали дополнили эту шкалу параметром возраста, добавив максимальное количество баллов (3) за возраст старше 65 лет [12]. Это отражало ранние представления о течении COVID-19 во время вспышки эпидемии в г.
 Ухань. Сегодня понятно, что далеко не только возраст, а и сопутствующие заболевания утяжеляют прогноз пациентов, и максимальный риск проявляется в подгруппе лиц старше 80 лет, где он в 6 раз выше, чем в 65 лет [13].
Ухань. Сегодня понятно, что далеко не только возраст, а и сопутствующие заболевания утяжеляют прогноз пациентов, и максимальный риск проявляется в подгруппе лиц старше 80 лет, где он в 6 раз выше, чем в 65 лет [13].По модифицированной шкале NEWS-2 низкому риску плохого прогноза соответствует 0 баллов, среднему – 1–4 балла, высокому – 5–6 баллов и очень высокому – 7 баллов и больше. В нашем исследовании пациенты группы контроля имели медиану по шкале NEWS-2 5 баллов, что соответствует высокому риску, а в группе активной терапии 11 баллов, что соответствует очень высокому риску.
Учитывая, что оценка состояния пациентов с COVID-19 зависит от нескольких ключевых показателей и не только степени одышки, сатурации крови кислородом и необходимости вентиляции. Эти показатели в большей степени характеризуют тяжесть поражения легких и дыхательную недостаточность. Состояние сознания напрямую коррелирует с попаданием пациента в ОРИТ и особенно, от нахождения на ИВЛ. Одним из ключевых показателей можно считать степень реального поражения легочной ткани по данным КТ, что далеко не всегда коррелирует с клиническими проявлениями нехватки воздуха, а также степень выраженности воспалительного процесса, главными маркерами которого являются выраженность лихорадки и величина СРБ.
 Кроме того, одним из основных прогностических маркеров неблагоприятного течения болезни может служить риск тромботических и тромбоэмболических осложнений, дополняющих поражение легочной ткани, определяемый величиной D-димера. Исходя из удачного опыта создания подобной интегральной шкалы Шкалы оценки клинического состояния (ШОКС) для пациентов с хронической сердечной недостаточностью (Беленков Ю. Н. и Мареев В. Ю., 2000), мы попытались создать собственную оригинальную шкалу определения клинического состояния пациентов с COVID-19, учитывающую основные маркеры тяжести болезни – ШОКС COVID, представленную в таблице 2.
Кроме того, одним из основных прогностических маркеров неблагоприятного течения болезни может служить риск тромботических и тромбоэмболических осложнений, дополняющих поражение легочной ткани, определяемый величиной D-димера. Исходя из удачного опыта создания подобной интегральной шкалы Шкалы оценки клинического состояния (ШОКС) для пациентов с хронической сердечной недостаточностью (Беленков Ю. Н. и Мареев В. Ю., 2000), мы попытались создать собственную оригинальную шкалу определения клинического состояния пациентов с COVID-19, учитывающую основные маркеры тяжести болезни – ШОКС COVID, представленную в таблице 2.Больные, имеющие от 0 до 3 баллов, относятся к низкому риску, 4–6 – среднему риску, 7–10 – серьезному риску, т. е. выше среднего, 11–14 – баллов к высокому риску и, наконец, пациенты с 15 баллами и выше имеют крайне высокий риск неблагоприятного течения болезни, быстрого прогрессирования поражения легких, полиорганной недостаточности и крайне трудно поддаются терапии. Шкала создавалась на основании теоретических предположений, а не на данных анализа какой‑либо когорты, так же, как и определение категорий риска, и пока не валидирована.

Медиана баллов по шкале ШОКС-COVID составила 7,0 для пациентов контрольной группы, что соответствует риску выше среднего и 12,0 для больных, которым проводилась пульс-терапия ГКС, что определяет высокий риск. Как видно, по шкале NEWS-2 больные обеих групп оцениваются как гораздо более тяжелые, чем по ШОКС-COVID, хотя разделение на высокий и очень высокий риск всегда вопрос во многом философский.
Выявленные различия в клинической тяжести течения болезни в основном и определили решение к проведению более активной противовоспалительной терапии ГКС в активной группе.
В качестве первичной точки исследования использовалось изменение баллов по шкале ШОКС-COVID.
В качестве вторичных конечных точек были использованы: динамика клинического показателя баллов по шкале [NEWS-2 и сатурация крови кислородом (SpO2), изменение уровней СРБ и D-димера в крови, оценка процента поражения легких на КТ по Мультивокс.
Статистическая обработка результатов
Описание количественных данных представлено в виде медианы и интерквантильного размаха (медиана и 25 %;75 %). Качественные данные представлены в виде абсолютных и относительных величин. Значимость различий между группами по качественным признакам оценивалась на основании критерия χ2, а также двустороннего точного теста Фишера. Сравнение количественных признаков между группами было проведено с использованием критерия Манна–Уитни.
Качественные данные представлены в виде абсолютных и относительных величин. Значимость различий между группами по качественным признакам оценивалась на основании критерия χ2, а также двустороннего точного теста Фишера. Сравнение количественных признаков между группами было проведено с использованием критерия Манна–Уитни.
Для сравнения динамики параметров внутри каждой из групп использовался критерий Уилкоксона для связных выборок для количественных признаков и критерий Мак–Немара для качественных данных.
Для оценки корреляции в связи с непараметрическим распределением исследуемых показателей проводилось логарифмическое преобразование данных и последующий расчет коэффициента корреляции Пирсона.
Критический уровень значимости при проверке статистических гипотез принимался ˃0,05.
Статистический анализ проведен в программе R студия с использованием языка программирования R.
Результаты исследования
Динамика баллов по ШОКС-COVID, в качестве первичной точки исследования, представлена на рисунке 1.
В группе контроля медиана баллов по ШОКС-COVID статистически незначимо возросла с 7,00 [6,00; 9,00] до 9,00 [5,50; 10,0] баллов (p=0,148), оставаясь при этом в той же категории риска – выше среднего, в то время как в группе пульс-терапии ГКС снизилась с 13,0 [11,0; 15,0] до 10,0 [7,0; 13,0] баллов (р=0,01). Дельты в процессе лечения также статистически значимо различались + 1,00 [–2,25; 3,00] балл в группе контроля и –4,00 [–5,00; –2,00] балла в группе пульс-терапии ГКС (р=0,011).
На рисунке 2 показана динамика клинического состояния больных в процессе лечения по шкале NEWS-2.
В группе контроля количество баллов незначительно снизилось с 5,00 [4,00; 5,50] до 3,00 [3,00; 6,50] (р=0,97), в то время как в группе активной терапии снижение было статистически значимым с 11,0 [6,00; 12,0] до 6,00 [3,75; 9,25] баллов (р=0,026). Две группы статистически значимо различались и по степени снижения баллов по клинической шкале NEWS-2 от –1,00 [–2,00; 2,50] балла в контрольной группе до –3,50 [–4,50; –0,75] в группе пульс-терапии ГКС (р=0,043).
Максимальная разница в изменении самочувствия пациентов была отмечена за счет изменения сатурации крови кислородом и снижения одышки (рис. 3).
В контрольной группе этот показатель не изменился и составил 94,0 [93,5; 96,0] % исходно, и 94,0 [89,5; 97,0] % после лечения (р=0,51). В группе пульс-терапии сатурация кислорода статистически значимо возрастала с 85,0 [80,0; 89,0] % до 93,0 [91,5; 95,0] % (р=0,025). Динамика этого показателя, естественно, была более значимой при терапии ГКС: +8,00 [2,25; 13,0] % против +1,00 [–6,00; 4,00] % в контрольной группе (р=0,008).
Остальные изменения клинических показателей представлены в таблице 3.
Как видно из таблицы, у больных в группе пульс-терапии ГКС отмечалось статистически значимое снижение температуры тела до нормальных величин, снижение ЧДД на 5 в 1 минуту и ЧСС на 13 уд. / мин. Количество больных в ОРИТ снизилось с 12 до 8, при этом один пациент был переведен с ИВЛ на неинвазивную вентиляцию легких, увеличилось и число пациентов, находящихся в ясном сознании с 8 до 11. В группе контроля никаких существенных изменений не произошло, что лишний раз характеризует коронавирусную пневмонию как очень упорное заболевание, плохо поддающееся лечению на стадии развившегося обширного воспалительного процесса в легких на фоне острого воспаления.
В группе контроля никаких существенных изменений не произошло, что лишний раз характеризует коронавирусную пневмонию как очень упорное заболевание, плохо поддающееся лечению на стадии развившегося обширного воспалительного процесса в легких на фоне острого воспаления.
На рисунке 4 представлены данные компьютерной обработки КТ легких с определением общего процента поражения легких на момент включения и на 10 день наблюдения. Учитывалась сумма любых матовых стекол и зон консолидации.
Как видно, в группе контроля, несмотря на проводимое лечение, общий объем поражения легких не только не уменьшился, но и статистически значимо возрастал с 25,6 [12,6; 34,7] % до 44,9 [23,3; 52,2] % (р=0,0026). Принимая во внимание отсутствие изменений в сатурации кислорода и одышки, не исключено, что при большем проценте поражения не вентилируемые участки легких (зоны консолидации) могли переходить в частично вентилируемые («матовые стекла»). Анализ по стадиям, используемым по рекомендациям МЗ РФ показал отсутствие серьезной динамики в цифрах: медиана 2,00 [1,00; 2,00] исходно и 2,00 [2,00; 3,00] в конце наблюдения, хотя статистически есть разница в пользу увеличения (р=0. 0147).
0147).
В группе терапии ГКС процент поражения легких по данным компьютерного анализа не изменился: исходно – 53,2 [37,3; 65,1] %, после гормонотерапии – 53,9 [41,3; 68,4] % (р=0,67). Не изменилась и стадия поражения легких – медиана 3,00 [2,00; 3,00] до и после пульс-терапии ГКС (р=0,82). Здесь мы тоже можем предположить, что значимое снижение одышки, нарастание сатурации крови кислородом, снижение уровня кислородной поддержки было связано с качественными, а не количественными характеристиками поражения легочной ткани. В любом случае в группе пульс-терапии ГКС медиана изменений процента поражения легких на КТ составила лишь +0,75 [–10,95; 13,9] %, в то время как в контроле +17,6 [0,10; 23,6] % и различия немного не достигали статистической значимости (р=0,062).
В качестве иллюстрации приводим клиническое наблюдение (рис. 5).
На рисунке 5.01 представлены данные больного И., 44 лет, поступившего в МНОЦ МГУ 22.04.2020 (второй день работы клиники c COVID-19), с умеренным поражением легких – 38,4 %, из них минимальная выраженность в виде «матовых стекол» (светло-желтая окраска) – 17,1 %, серьезная – в виде плотных «матовых стекол» (коричневая окраска – 21,3 %) и консолидации (красная окраска – 1,5 %). Субфебрильная лихорадка в течение трех дней 37,6°С, отсутствие выраженной одышки ЧДД 18 в мин, сатурация кислорода при дыхании 94 %, уровень СРБ 38,6 мг / дл и D – димера 0,89 мкг / мл на фоне терапии имидазолилэтанамидом пентандиовой кислоты, гидроксихлорохином и азитромицином, назначенных амбулаторно до поступления больного в стационар. Состояние было расценено как относительно удовлетворительное. Лечение азитромицином было продолжено. Вместо гидроксихлорохина были назначены бромгексин 8 мг х 4 раза в день, спиронолактон 50 мг х 2 раз в день и эноксапарин натрия 40 мг х 2 раза в день. Терапия, подобная той, что проводилась в группе контроля.
Субфебрильная лихорадка в течение трех дней 37,6°С, отсутствие выраженной одышки ЧДД 18 в мин, сатурация кислорода при дыхании 94 %, уровень СРБ 38,6 мг / дл и D – димера 0,89 мкг / мл на фоне терапии имидазолилэтанамидом пентандиовой кислоты, гидроксихлорохином и азитромицином, назначенных амбулаторно до поступления больного в стационар. Состояние было расценено как относительно удовлетворительное. Лечение азитромицином было продолжено. Вместо гидроксихлорохина были назначены бромгексин 8 мг х 4 раза в день, спиронолактон 50 мг х 2 раз в день и эноксапарин натрия 40 мг х 2 раза в день. Терапия, подобная той, что проводилась в группе контроля.
До 28.04.2020 состояние больного постепенно ухудшалось, были сменены антибиотики и увеличена доза эноксапарина натрия до 80 мг х 2 раза. Но 29.04 состояние критически ухудшилось.
На рисунке 5.02 представлены данные КТ от 29.04.20. Как видно, поражение легких увеличилось до 68,6 % из них только 6,6 % – «матовые стекла», 21,1 % – плотные «матовые стекла» и консолидация – 40,9 % (серьезная выраженность поражения – 62 %). У больного лихорадка 38,5ᵒС, ЧДД 26 в 1 мин, ЧСС 120 уд / мин, сатурация кислорода 78 %, СРБ 425 мг / дл, D-димер 1,33 мкг / мл. Уровень нейтрофилов был повышен до 7,55х109 / л, и отмечалась выраженная лимфопения 0,47х109 / л, индекс Н / Л составлял 16,06. Пациент был переведен в ОРИТ и на ИВЛ. Учитывая выраженность процесса, острое воспаление и отсутствие препаратов, влияющих на интерлейкины, было принято решение о проведении пульс-терапии метилпреднизолоном по 1000 мг в течение 3 дней с переводом на дексаметазон по 8 мг дважды в день в течение еще 5 дней. Затем пациент был переведен на колхицин по 1 мг первый день и 0,5 мг последующие дни до выписки.
У больного лихорадка 38,5ᵒС, ЧДД 26 в 1 мин, ЧСС 120 уд / мин, сатурация кислорода 78 %, СРБ 425 мг / дл, D-димер 1,33 мкг / мл. Уровень нейтрофилов был повышен до 7,55х109 / л, и отмечалась выраженная лимфопения 0,47х109 / л, индекс Н / Л составлял 16,06. Пациент был переведен в ОРИТ и на ИВЛ. Учитывая выраженность процесса, острое воспаление и отсутствие препаратов, влияющих на интерлейкины, было принято решение о проведении пульс-терапии метилпреднизолоном по 1000 мг в течение 3 дней с переводом на дексаметазон по 8 мг дважды в день в течение еще 5 дней. Затем пациент был переведен на колхицин по 1 мг первый день и 0,5 мг последующие дни до выписки.
В результате уровень СРБ снизился в 4 раза, фибриноген с 11,07 до 7,2 г / л, насыщение крови кислородом возросло с 78 % до 94 %, ЧДД снизилась до 20, а ЧСС до 92 уд. / мин. D-димер незначительно возрос до 1,63 мг / мл. Увеличился нейтрофилез до 17,2х109 / л, и число лимфоцитов до 1,39х109 / л. Индекс Н / Л уменьшился до 12,4. На фоне отчетливого противовоспалительного действия к 10 дню после начала пульс-терапии ГКС объем поражения легких значительно уменьшился (рисунок 5. 03). Умеренное поражение в виде «матовых стекол» составило лишь 12,3 % и такой же объем составляла зона консолидации. Общий объем непораженной легочной ткани возрос до 75,4 %. Больной был экстубирован на 6 день после пульс-терапии ГКС, переведен из ОРИТ на 10 день и на 14 день был выписан из стационара с рекомендациями приема колхицина 0,5 мг в сутки и ривароксабана 10 мг / сут. Запланирован контроль на 45‑й день.
03). Умеренное поражение в виде «матовых стекол» составило лишь 12,3 % и такой же объем составляла зона консолидации. Общий объем непораженной легочной ткани возрос до 75,4 %. Больной был экстубирован на 6 день после пульс-терапии ГКС, переведен из ОРИТ на 10 день и на 14 день был выписан из стационара с рекомендациями приема колхицина 0,5 мг в сутки и ривароксабана 10 мг / сут. Запланирован контроль на 45‑й день.
В таблице 4 представлены изменения лабораторных показателей в группах гормонотерапии и контроля.
Наибольший интерес представляла динамика динамика СРБ, как наиболее популярного маркера выраженности воспалительного процесса. Он снизился статистически значимо в группе терапии ГКС (р=0,009) и незначимо в группе контроля. Медиана снижения была вдвое больше в активной группе – 85,57 [–155,3; –2,36] мг / дл против 41,03 [–65,0; 24,3] мг / дл в группе контроля, но различия оказались статистически не значимыми (р=0,109). Тем не менее исходно уровень СРБ был на 39 мг / дл выше в группе терапии ГКС, а после лечения, наоборот, на 15 мг / дл выше в группе контроля. СРБ существенно (более чем на 10 %) снизился у 13 (76,5 %) пациентов в группе терапии ГКС и у 6 (35,3 %) в группе контроля.
СРБ существенно (более чем на 10 %) снизился у 13 (76,5 %) пациентов в группе терапии ГКС и у 6 (35,3 %) в группе контроля.
При оценке динамики D-димера отмечено его статистически значимое повышение в группе терапии ГКС (р=0,044) и отсутствие изменений в группе контроля (р=0,31). Медиана повышения в активной группе составила 0,66 [–0,11; 9,16] мкг / мл (на 47 % от исходного), в то время как в группе контроля – 0,01 [–0,64; 0,47] мкг / мл (р=0,040). Увеличение уровня D-димера более чем на 10 % отмечено у 12 (70,6 %) пациентов в группе терапии ГКС. У двух произошла ТЭЛА и еще у двух развился венозный тромбоз конечностей (всего 4 / 17 = 23,5 %). В этих случаях уровень D-димера повышался до 12,8 и 20,0 мкг / мл при ТЭЛА до 13,5 и 12,5 мкг / мл при венозных тромбозах. В группе контроля значимых повышений уровня D-димера и тромботических осложнений выявлено не было.
Изменения фибриногена в обеих группах были минимальными.
Лимфопения имела место исходно в обеих группах, больше среди больных, которым проводилось лечение ГКС, и значимо не изменилась к концу наблюдения ни в одной из групп. Количество нейтрофилов не менялось и даже имело тенденцию к снижению в группе контроля. В активной группе существенно увеличился нейтрофилез на 73 % (р<0,0001), что характерно для лечения ГКС.
Количество нейтрофилов не менялось и даже имело тенденцию к снижению в группе контроля. В активной группе существенно увеличился нейтрофилез на 73 % (р<0,0001), что характерно для лечения ГКС.
Важный показатель индекс Н / Л, отражающий выраженность хронического воспаления, в группе активного лечения увеличился на 153 % (р=0,006) и незначимо снизился в контрольной группе. Медиана изменений в группе терапии ГКС составила +6,12 [0,336; –16,5], против –0,315 [ –1,73; 5,17] в группе контроля (р=0,038).
Из остальных показателей заслуживает внимания значимое увеличение числа тромбоцитов в обеих группах больных, что позитивно на фоне агрессивной терапии антикоагулянтами.
Изменения уровня глюкозы носили разнонаправленный характер – незначимое повышение в группе терапии ГКС (р=0,222) и значимое снижение в группе контроля (р=0,032). Медиана изменений составила –1,02 [–1,63; –0,55] ммоль / л в группе контроля и +0,02 [–1,13; +3,15] ммоль / л в группе лечения ГКС, но различия не достигли статистической значимости (p=0,06). Однако в группе терапии ГКС у 7 / 17 (41,2 %) больных было повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии, при том, что в контрольной группе таких пациентов не было.
Однако в группе терапии ГКС у 7 / 17 (41,2 %) больных было повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии, при том, что в контрольной группе таких пациентов не было.
Статистически значимого изменения функции почек, уровня креатинина и СКФ по медианам не выявлено ни в одной из групп.
Среднее время, проведенное пациентами на лечении в стационаре, составило 18,0 [16,0; 20,5] дней в группе контроля и 26,0 [22,0; 31,5] дней в группе терапии ГКС (р=0,001).
В качестве клинического примера приводим данные больного А., 62 лет. с COVID-19 и 68,2 % поражения легких по данным КТ (рис. 6).
У пациента длительно наблюдалась, уровень СРБ достигал 122 мг / дл, D-димер 1,33 мкг / мл, сатурация кислорода 89 % без кислородной поддержки. Обращала на себя внимание выраженная лимфопения 0,34х109 / л, нейтрофилез 6,26х109 / л и крайне высокий индекс Н / Л – 18,4, как маркер выраженного воспаления и риска ВТЭ. Больной был переведен в ОРИТ на неинвазивную ИВЛ. Было принято решение о проведении пульс-терапии высокими дозами ГКС. Через 5 дней состояние улучшилось, температура тела нормализовалась, СРБ снизился до 46 мг / дл, сатурация кислорода возросла до 95 %, процент поражения легочной ткани уменьшился до 38,2 %, и пациент был переведен в отделение. Хотя оставалась лимфопения 0,37х109 / л, индекс Н / Л увеличился до 20,6 и D-димер возрос до 2,74 мкг / мл. На следующий день состояние резко ухудшилось, крайне усилилась одышка, появились боли в грудной клетке, D-димер увеличился до 13,52 мкг / мл. На КТ-ангиограммах – ТЭЛА, несмотря на постоянную терапию НМГ в лечебной дозе. Доза НМГ была еще увеличена и добавлен дипиридамол. Впоследствии все осложнения удалось купировать, и больной был выписан в удовлетворительном состоянии на 27 день.
Было принято решение о проведении пульс-терапии высокими дозами ГКС. Через 5 дней состояние улучшилось, температура тела нормализовалась, СРБ снизился до 46 мг / дл, сатурация кислорода возросла до 95 %, процент поражения легочной ткани уменьшился до 38,2 %, и пациент был переведен в отделение. Хотя оставалась лимфопения 0,37х109 / л, индекс Н / Л увеличился до 20,6 и D-димер возрос до 2,74 мкг / мл. На следующий день состояние резко ухудшилось, крайне усилилась одышка, появились боли в грудной клетке, D-димер увеличился до 13,52 мкг / мл. На КТ-ангиограммах – ТЭЛА, несмотря на постоянную терапию НМГ в лечебной дозе. Доза НМГ была еще увеличена и добавлен дипиридамол. Впоследствии все осложнения удалось купировать, и больной был выписан в удовлетворительном состоянии на 27 день.
Обсуждение
COVID-19 проходит различные стадии, каждая из которых требует своих лечебных подходов. На стадии развившейся вирусной пневмонии, протекающей с поражением альвеол, проблема усугубляется прогрессированием системного воспаления и вовлечением в процесс не только легочной паренхимы, но и бронхиол, мелких сосудов и повышенным тромбообразованием. В этих случаях гиперреактивность иммунной системы сопровождается чрезмерной активацией цитокинов, дальнейшей активацией макрофагов и эпителиальных клеток и постоянным увеличением выброса цитокинов и хемокинов, что получило название «цитокинового шторма» [14, 15]. Именно лечению такого рода пациентов с COVID-19 посвящено настоящее исследование. Рекомендации ВОЗ и МЗ РФ предполагают использование в таких случаях «упреждающей противовоспалительной терапии» для купирования «цитокинового шторма» и преодоления критического воспаления [2, 3]. Учитывая лидирующую роль провоспалительных ИЛ, в качестве противовоспалительных препаратов рекомендуются ингибитор ИЛ-6 тоцилизумаб [16], ингибитор ИЛ-1β канакинумаб [17] ингибитор ИЛ-17 секукинумаб [18], ингибитор янус киназ JAK-1 и JAK-2 руксолитиниб [19].
В этих случаях гиперреактивность иммунной системы сопровождается чрезмерной активацией цитокинов, дальнейшей активацией макрофагов и эпителиальных клеток и постоянным увеличением выброса цитокинов и хемокинов, что получило название «цитокинового шторма» [14, 15]. Именно лечению такого рода пациентов с COVID-19 посвящено настоящее исследование. Рекомендации ВОЗ и МЗ РФ предполагают использование в таких случаях «упреждающей противовоспалительной терапии» для купирования «цитокинового шторма» и преодоления критического воспаления [2, 3]. Учитывая лидирующую роль провоспалительных ИЛ, в качестве противовоспалительных препаратов рекомендуются ингибитор ИЛ-6 тоцилизумаб [16], ингибитор ИЛ-1β канакинумаб [17] ингибитор ИЛ-17 секукинумаб [18], ингибитор янус киназ JAK-1 и JAK-2 руксолитиниб [19].
Даже при возможной высокой эффективности этих препаратов, кстати, требующих проверки в клинических исследованиях, их доступность и стоимость оставляют желать лучшего.
Применение самых популярных на протяжении последних 50 лет противовоспалительных препаратов – ГКС при COVID-19 не рекомендовано ВОЗ, и лишь в версии 7 рекомендаций МЗ РФ указано возможное использование ГКС в малых дозах до 1 мг / кг / день. Мета – анализ исследований по применению стероидов при коронавирусных пневмониях, включая COVID-19, продемонстрировал отсутствие положительного влияния на прогноз и замедление элиминации вируса [20, 21]. Однако пульс-терапия высокими дозами ГКС при раннем начале терапии атипичной пневмонии показывала замедление прогрессирования болезни, лучшее разрешение изменения в легких при невысоком риске побочных эффектов [22, 23]. Ограничениями к применению ГКС является их способность усиливать протромботическе факторы, особенно при иммунном воспалении, что имеет место при COVID-19 с «цитокиновым штромом» [24]. Существуют исследования, связывающие риск развития ВТЭ при терапии стероидными гормонами с дозами препаратов, причем максимальное повышение риска отмечено при дозах от 1000 до 2000 мг / сут. [25]. И главная опасность в том, что риск тромбозов и тромбоэмболий при терапии ГКС может проявляться непосредственно после начала лечения [26].
Мета – анализ исследований по применению стероидов при коронавирусных пневмониях, включая COVID-19, продемонстрировал отсутствие положительного влияния на прогноз и замедление элиминации вируса [20, 21]. Однако пульс-терапия высокими дозами ГКС при раннем начале терапии атипичной пневмонии показывала замедление прогрессирования болезни, лучшее разрешение изменения в легких при невысоком риске побочных эффектов [22, 23]. Ограничениями к применению ГКС является их способность усиливать протромботическе факторы, особенно при иммунном воспалении, что имеет место при COVID-19 с «цитокиновым штромом» [24]. Существуют исследования, связывающие риск развития ВТЭ при терапии стероидными гормонами с дозами препаратов, причем максимальное повышение риска отмечено при дозах от 1000 до 2000 мг / сут. [25]. И главная опасность в том, что риск тромбозов и тромбоэмболий при терапии ГКС может проявляться непосредственно после начала лечения [26].
Исходя из неясностей и недостаточной изученности этого вопроса, целью нашего исследования стало изучение баланса эффективности и безопасности пульс-терапии ГКС (1000 мг метилпреднизолона в течение 3 дней внутривенно с переводом на дексаметазон мг в течение 3–5 дней) в лечении пациентов с тяжелой коронавирусной пневмонией в сравнении с группой пациентов, не получающих противовоспалительной терапии. Анализ обследованных пациентов продемонстрировал признаки системного воспаления с экстремальным повышением СРБ в 19 раз в контрольной и в 27 раз в группе терапии ГКС (маркер «цитокинового шторма»). Одновременно в активной группе регистрировались лихорадка, лимфопения (0,66х109 / л), нейтрофилез (5,02х109 / л) и повышение индекса Н / Л до 6,05), троекратное повышение D-димера, одышка (ЧДД 26 в 1 мин) при низкой сатурации кислорода (85 %), тахикардия (ЧСС 97 уд. / мин). Суммарный балл клинического состояния NEWS-2, включающий, кроме клинических проявлений болезни, нахождение пациентов в ОРИТ (70,6 %) и на ИВЛ (35,3 %), и спутанность сознания, составил 11, притом, что показатель больше 7 баллов соответствует очень высокому риску. Процент поражения легких был более 50 %, что соответствовало 3 стадии по рекомендациям МЗ РФ. По суммарной шкале ШОКС-COVID, включающей, кроме клинических показателей, уровни СРБ и D-димера и процент поражения легких, то есть анализирующей факторы, определяющие прогноз, пациенты в группе пульс-терапии ГКС набрали 13 баллов, что соответствует высокому риску неблагоприятного прогноза.
Анализ обследованных пациентов продемонстрировал признаки системного воспаления с экстремальным повышением СРБ в 19 раз в контрольной и в 27 раз в группе терапии ГКС (маркер «цитокинового шторма»). Одновременно в активной группе регистрировались лихорадка, лимфопения (0,66х109 / л), нейтрофилез (5,02х109 / л) и повышение индекса Н / Л до 6,05), троекратное повышение D-димера, одышка (ЧДД 26 в 1 мин) при низкой сатурации кислорода (85 %), тахикардия (ЧСС 97 уд. / мин). Суммарный балл клинического состояния NEWS-2, включающий, кроме клинических проявлений болезни, нахождение пациентов в ОРИТ (70,6 %) и на ИВЛ (35,3 %), и спутанность сознания, составил 11, притом, что показатель больше 7 баллов соответствует очень высокому риску. Процент поражения легких был более 50 %, что соответствовало 3 стадии по рекомендациям МЗ РФ. По суммарной шкале ШОКС-COVID, включающей, кроме клинических показателей, уровни СРБ и D-димера и процент поражения легких, то есть анализирующей факторы, определяющие прогноз, пациенты в группе пульс-терапии ГКС набрали 13 баллов, что соответствует высокому риску неблагоприятного прогноза. Пациенты в группе контроля имели менее тяжелое течение болезни по большинству изученных параметров. Это, с одной стороны, затрудняло сравнение результатов в группах, но, с другой, позволяло надеяться на более благоприятное течение болезни.
Пациенты в группе контроля имели менее тяжелое течение болезни по большинству изученных параметров. Это, с одной стороны, затрудняло сравнение результатов в группах, но, с другой, позволяло надеяться на более благоприятное течение болезни.
Проведенное исследование подтвердило возможную эффективность пульс-терапии ГКС в лечении COVID-19 пневмонии с «цитокиновым штормом». Статистически значимо и более существенно, чем в группе контроля, снизился балл ШОКС-COVID (первичная конечная точка исследования). Было достигнуто значительное улучшение клинического состояния ( – 8 баллов по шкале NEWS-2, +9 % сатурации кислорода, нормализация температуры тела, достоверное уменьшение потребности в кислородной поддержке). Подобное улучшение происходило на фоне троекратного снижения уровня СРБ, что характеризовало быстрый противовоспалительный эффект высоких доз ГКС. В итоге процент поражения легких не изменялся в сравнении с группой контроля, где происходило прогрессирование пневмонии и значимое увеличение процента поражения легких. На клиническом примере можно видеть прогрессирование поражения легких при отсутствии противовоспалительной терапии в первом периоде лечения (рис. 5.01, 5.02) и разрешение процесса после пульс-терапии ГКС во втором периоде наблюдения (рис. 5.02, 5.03). В известной степени это яркая иллюстрация сравнительного влияния контроля (без противовоспалительной терапии, первый период) и пульс-терапии ГКС (второй период) на примере одного и того же пациента. Это был один из первых тяжелых больных с COVID-19 в нашей клинике, и этот пример научил нас правилу: течение COVID-19 пневмонии крайне упорное, и при повышении маркеров воспаления пневмония не может быть успешно излечена без противовоспалительных препаратов. Полученные результаты показали, что пульс-терапия ГКС может прерывать «цитокиновый шторм». Однако результаты исследований с COVID-19 не подтвердили улучшения прогноза, скорее наоборот [27, 28]. Это и привело к рекомендациям использования антицитокиновых препаратов, а не ГКС, которые, к тому же могут замедлять элиминацию вируса при лечении COVID-19 [29, 30].
На клиническом примере можно видеть прогрессирование поражения легких при отсутствии противовоспалительной терапии в первом периоде лечения (рис. 5.01, 5.02) и разрешение процесса после пульс-терапии ГКС во втором периоде наблюдения (рис. 5.02, 5.03). В известной степени это яркая иллюстрация сравнительного влияния контроля (без противовоспалительной терапии, первый период) и пульс-терапии ГКС (второй период) на примере одного и того же пациента. Это был один из первых тяжелых больных с COVID-19 в нашей клинике, и этот пример научил нас правилу: течение COVID-19 пневмонии крайне упорное, и при повышении маркеров воспаления пневмония не может быть успешно излечена без противовоспалительных препаратов. Полученные результаты показали, что пульс-терапия ГКС может прерывать «цитокиновый шторм». Однако результаты исследований с COVID-19 не подтвердили улучшения прогноза, скорее наоборот [27, 28]. Это и привело к рекомендациям использования антицитокиновых препаратов, а не ГКС, которые, к тому же могут замедлять элиминацию вируса при лечении COVID-19 [29, 30].
Второй задачей исследования была оценка безопасности пульс-терапии высокими дозами ГКС больных с COVID-19. В целом мы не выявили негативного влияния на кардиологические показатели, включая повышение АД. Повышения уровня глюкозы в среднем по группе терапии ГКС также не зарегистрировано, хотя в группе контроля этот показатель статистически значимо снизился. При индивидуальном анализе у 6 / 17 (35,3 %) больных обнаружено повышение уровня глюкозы больше 9 ммоль / л, что потребовало назначения / усиления сахароснижающей терапии. Наиболее проблемной представлялась динамика D-димера. В группе контроля этот показатель не менялся, а при терапии ГКС статистически значимо увеличивался (медиана до 1,98 мкг / мл). В предыдущих исследованиях было продемонстрировано, что при увеличении D-димера выше 2,0 мкг / мл риск ВТЭ у больных с COVID-19 повышается в 51 раз [31]. Были исследования, где даже повышение D-димера выше 1,0 мкг / мл достоверно в 18 раз увеличивало риск тромбозов [32]. В нашем исследовании у 4 больных были зафиксированы венозные тромбозы (2 ТЭЛА), совпадавшие с повышением D-димера выше 10 мкг / мл. Учитывая, что тромботические осложнения при COVID-19 связывают с аутоиммунным воспалением, мы проанализировали возможные взаимосвязи. Как хорошо известно, ГКС могут вызывать лейкоцитоз и нейтрофилез [33]. В нашем исследовании количество нейтрофилов при лечении ГКС увеличилось на 73 % (р<0,0001), при отсутствии изменений в группе контроля. При сохраняющейся лимфопении индекс Н / Л статистически значимо увеличился в 2,5 раза, при отсутствии изменений в группе контроля. Величина индекса Н / Л отражает активацию хронического воспаления [34, 35], аутоиммунного воспаления эндотелия [36] и характеризует неблагоприятное течение COVID-19 [37, 38]. Поэтому мы провели анализ корреляционной связи между изменениями индекса Н / Л и D-димера в процессе лечения (рис. 7).
Как видно из рисунка 7, была выявлена прямая статистически значимая ассоциация между повышением индекса D-димера и индекса Н / Л по группе в целом (r=0,47, p=0,005) и в группе лечения ГКС (r=0,49, p=0,04), и она отсутствовала в группе контроля. Это особенно важно, так как индекс Н / Л является не только маркером воспаления, но и предиктором ВТЭ и ТЭЛА [39, 40]. Исследование 180 больных с COVID-19 продемонстрировало тесную статистически значимую связь между величиной индекса Н / Л и степенью поражения легких по данным КТ [41]. Таким образом, применение ГКС, несмотря на быстрое снижение СРБ и острого воспаления, и улучшение клинического состояния больных с COVID-19, провоцирует рост нейтрофилеза, индекса Н / Л, что приводит к статистически значимому повышению риска тромбозов и ТЭ, показателем чего является достоверный рост D-димера. Использование индекса Н / Л может предсказывать как тяжесть течения COVID-19 [42], так и неблагоприятный прогноз [43]. При максимальном повышения индекса Н / Л (4,85–88,09) риск смерти больных с коронавирусной пневмонией увеличивается в 15 раз [44], а эффективность ГКС при высоком уровне Н / Л снижается [45]. Поэтому при выборе пульс-терапии высокими дозами ГКС в качестве противовоспалительного ответа на «цитокиновый шторм» у больных с COVID-19 необходимо учитывать уровни индекса Н / Л и D-димера и обязательно рассмотреть усиление антикоагулянтной терапии.
Кроме того, при повышении индекса Н / Л и хронического воспаления, восстановление воздушности легких может затягиваться [41, 46], что может удлинять сроки лечения. Пациенты активной группы провели в стационаре на 8 дней дольше (хотя частично это может объясняться и более тяжелым течением болезни). Для ускорения процесса выздоровления в нашей клинике принята тактика назначения после терапии ГКС курса ингибитора инфламмасом противовоспалительного средства колхицина (что иллюстрируется и нашим клиническим наблюдением), клиническая эффективность которого в настоящее время исследуется (https://clinicaltrials.gov/ct2/show/NCT04403243).
Ограничения исследования
Небольшое количество больных. Отсутствие рандомизации и несбалансированность групп по исходной тяжести, ретроспективный характер исследования.
1. Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H et al. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine & Growth Factor Reviews. 2020;53:38–42. DOI: 10.1016/j.cytogfr.2020.04.002
2. World Health Organization. Clinical management of COVID-19. WHO Reference Number: WHO/2019-nCoV/clinical/2020.5. 2020. [Internet] 2020. Available at: https://www.who.int/publications-detail-redirect/clinical-management-of-covid-19
3. Министерство здравоохранения РФ. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 7 (03.06.2020). Москва. Доступно на: https://static-0.rosminzdrav.ru/system/attachments/attaches/000/050/584/original/03062020_%D0%9CR_COVID-19_v7.pdf
4. Tobaiqy M, Qashqary M, Al-Dahery S, Mujallad A, Hershan AA, Kamal MA et al. Therapeutic management of patients with COVID-19: a systematic review. Infection Prevention in Practice. 2020;100061. [Epub ahead of print]. DOI: 10.1016/j.infpip.2020.100061
5. Darmon P, Dadoun F, Boullu-Ciocca S, Grino M, Alessi M-C, Dutour A. Insulin resistance induced by hydrocortisone is increased in patients with abdominal obesity. American Journal of Physiology-Endocrinology and Metabolism. 2006;291(5):E995–1002. DOI: 10.1152/ajpendo.00654.2005
6. Zarković M, Beleslin B, Ćirić J, Penezić Z, Stojković M, Trbojević B et al. Glucocorticoid effect on insulin sensitivity: A time frame. Journal of Endocrinological Investigation. 2008;31(3):238–42. DOI: 10.1007/BF03345596
7. Clore J, Thurby-Hay L. Glucocorticoid-Induced Hyperglycemia. Endocrine Practice. 2009;15(5):469–74. DOI: 10.4158/EP08331.RAR
8. Shono A, Mori S, Nakamura K, Yatomi A, Takada H, Tanaka H et al. Glucocorticoid-sensitive Paroxysmal Atrial Fibrillation, Sick Sinus Syndrome, and Mitral Regurgitation in a Patient with Malignant Rheumatoid Vasculitis. Internal Medicine (Tokyo, Japan). 2019;58(21):3093–8. DOI: 10.2169/internalmedicine.3090-19
9. Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer MV, Urban S et al. Fibrinolysis Shutdown Correlates to Thromboembolic Events in Severe COVID-19 Infection. Journal of the American College of Surgeons. 2020;S1072-7515(20)30400-2. [Epub ahead of print]. DOI: 10.1016/j.jamcollsurg.2020.05.007
10. Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. Journal of Thrombosis and Haemostasis. 2020;18(4):844–7. DOI: 10.1111/jth.14768
11. Thachil J, Tang N, Gando S, Falanga A, Cattaneo M, Levi M et al. ISTH interim guidance on recognition and management of coagulopathy in COVID‐19. Journal of Thrombosis and Haemostasis. 2020;18(5):1023–6. DOI: 10.1111/jth.14810
12. Liao X, Wang B, Kang Y. Novel coronavirus infection during the 2019–2020 epidemic: preparing intensive care units – the experience in Sichuan Province, China. Intensive Care Medicine. 2020;46(2):357–60. DOI: 10.1007/s00134-020-05954-2
13. The OpenSAFELY Collaborative, Williamson E, Walker AJ, Bhaskaran KJ, Bacon S, Bates C et al. OpenSAFELY: factors associated with COVID-19-related hospital death in the linked electronic health records of 17 million adult NHS patients. Epidemiology. Av. at: http://medrxiv.org/lookup/doi/10.1101/2020.05.06.20092999. DOI: 10.1101/2020.05.06.20092999. 2020.
14. Schett G, Sticherling M, Neurath MF. COVID-19: risk for cytokine targeting in chronic inflammatory diseases? Nature Reviews Immunology. 2020;20(5):271–2. DOI: 10.1038/s41577-020-0312-7
15. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. The Lancet. 2020;395(10229):1033–4. DOI: 10.1016/S0140-6736(20)30628-0
16. Xu X, Han M, Li T, Sun W, Wang D, Fu B et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proceedings of the National Academy of Sciences. 2020;117(20):10970–5. DOI: 10.1073/pnas.2005615117
17. Ucciferri C, Auricchio A, Di Nicola M, Potere N, Abbate A, Cipollone F et al. Canakinumab in a subgroup of patients with COVID-19. The Lancet Rheumatology. 2020; [Av. at: https://www.researchgate.net/publication/341920485_Canakinumab_in_a_subgroup_of_patients_with_COVID-19]. DOI: 10.1016/S2665-9913(20)30167-3
18. Wan MT, Shin DB, Winthrop KL, Gelfand JM. The risk of respiratory tract infections and symptoms in psoriasis patients treated with IL-17-pathway inhibiting biologics: A meta-estimate of pivotal trials relevant to decision-making during the COVID-19 pandemic. Journal of the American Academy of Dermatology. 2020;S0190962220308665. [Epub ahead of print]. DOI: 10.1016/j.jaad.2020.05.035
19. Cao Y, Wei J, Zou L, Jiang T, Wang G, Chen L et al. Ruxolitinib in treatment of severe coronavirus disease 2019 (COVID-19): A multicenter, single-blind, randomized controlled trial. Journal of Allergy and Clinical Immunology. 2020;S0091674920307387. [Epub ahead of print]. DOI: 10.1016/j.jaci.2020.05.019
20. Li H, Chen C, Hu F, Wang J, Zhao Q, Gale RP et al. Impact of corticosteroid therapy on outcomes of persons with SARS-CoV-2, SARSCoV, or MERS-CoV infection: a systematic review and meta-analysis. Leukemia. 2020;34(6):1503– 11. DOI: 10.1038/s41375-020-0848-3
21. Zha L, Li S, Pan L, Tefsen B, Li Y, French N et al. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID‐19). Medical Journal of Australia. 2020;212(9):416–20. DOI: 10.5694/mja2.50577
22. Zhao Z. Description and clinical treatment of an early outbreak of severe acute respiratory syndrome (SARS) in Guangzhou, PR China. Journal of Medical Microbiology. 2003;52(8):715–20. DOI: 10.1099/jmm.0.05320-0
23. Ho JC, Ooi GC, Mok TY, Chan JW, Hung I, Lam B et al. High–Dose Pulse Versus Nonpulse Corticosteroid Regimens in Severe Acute Respiratory Syndrome. American Journal of Respiratory and Critical Care Medicine. 2003;168(12):1449–56. DOI: 10.1164/rccm.200306-766OC
24. Majoor CJ, Sneeboer MMS, de Kievit A, Meijers JCM, van der Poll T, Lutter R et al. The influence of corticosteroids on hemostasis in healthy subjects. Journal of Thrombosis and Haemostasis. 2016;14(4):716–23. DOI: 10.1111/jth.13265
25. Johannesdottir SA, Horváth-Puhó E, Dekkers OM, Cannegieter SC, Jørgensen JOL, Ehrenstein V et al. Use of Glucocorticoids and Risk of Venous Thromboembolism: A Nationwide Population-Based CaseControl Study. JAMA Internal Medicine. 2013;173(9):743. DOI: 10.1001/jamainternmed.2013.122
26. Stuijver DJF, Majoor CJ, van Zaane B, Souverein PC, de Boer A, Dekkers OM et al. Use of Oral Glucocorticoids and the Risk of Pulmonary Embolism. Chest. 2013;143(5):1337–42. DOI: 10.1378/chest.12-1446
27. Ye Z, Wang Y, Colunga-Lozano LE, Prasad M, Tangamornsuksan W, Rochwerg B et al. Efficacy and safety of corticosteroids in COVID-19 based on evidence for COVID-19, other coronavirus infections, influenza, community-acquired pneumonia and acute respiratory distress syndrome: a systematic review and meta-analysis. Canadian Medical Association Journal. 2020;cmaj.200645. [Epub ahead of print]. DOI: 10.1503/cmaj.200645
28. Yang Z, Liu J, Zhou Y, Zhao X, Zhao Q, Liu J. The effect of corticosteroid treatment on patients with coronavirus infection: a systematic review and meta-analysis. Journal of Infection. 2020;81(1):e13–20. DOI: 10.1016/j.jinf.2020.03.062
29. Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical–therapeutic staging proposal. The Journal of Heart and Lung Transplantation. 2020;39(5):405–7. DOI: 10.1016/j.healun.2020.03.012
30. Russell CD, Millar JE, Baillie JK. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. The Lancet. 2020;395(10223):473–5. DOI: 10.1016/S0140-6736(20)30317-2
31. Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z et al. D‐dimer levels on admission to predict in‐hospital mortality in patients with Covid‐19. Journal of Thrombosis and Haemostasis. 2020;18(6):1324–9. DOI: 10.1111/jth.14859
32. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. The Lancet. 2020;395(10229):1054–62. DOI: 10.1016/S0140-6736(20)30566-3
33. Ronchetti S, Ricci E, Migliorati G, Gentili M, Riccardi C. How Glucocorticoids Affect the Neutrophil Life. International Journal of Molecular Sciences. 2018;19(12):4090. DOI: 10.3390/ijms19124090
34. Imtiaz F, Shafique K, Mirza S, Ayoob Z, Vart P, Rao S. Neutrophil lymphocyte ratio as a measure of systemic inflammation in prevalent chronic diseases in Asian population. International Archives of Medicine. 2012;5(1):2. DOI: 10.1186/1755-7682-5-2
35. Lorente D, Mateo J, Templeton AJ, Zafeiriou Z, Bianchini D, Ferraldeschi R et al. Baseline neutrophil–lymphocyte ratio (NLR) is associated with survival and response to treatment with second-line chemotherapy for advanced prostate cancer independent of baseline steroid use. Annals of Oncology. 2015;26(4):750–5. DOI: 10.1093/annonc/mdu587
36. Djaballah-Ider F, Touil-Boukoffa C. Effect of combined colchicinecorticosteroid treatment on neutrophil/lymphocyte ratio: a predictive marker in Behçet disease activity. Inflammopharmacology. 2020; [Epub ahead of print]. DOI: 10.1007/s10787-020-00701-x
37. Liu J, Liu Y, Xiang P, Pu L, Xiong H, Li C et al. Neutrophil-to-lymphocyte ratio predicts critical illness patients with 2019 coronavirus disease in the early stage. Journal of Translational Medicine. 2020;18(1):206. DOI: 10.1186/s12967-020-02374-0
38. Yang A-P, Liu J, Tao W, Li H. The diagnostic and predictive role of NLR, d-NLR and PLR in COVID-19 patients. International Immunopharmacology. 2020;84:106504. DOI: 10.1016/j.intimp.2020.106504
39. Karataş MB, İpek G, Onuk T, Güngör B, Durmuş G, Çanga Y et al. Assessment of Prognostic Value of Neutrophil to Lymphocyte Ratio and Platelet to Lymphocyte Ratio in Patients with Pulmonary Embolism. Acta Cardiologica Sinica. 2016;32(3):313–20. DOI: 10.6515/acs20151013a
40. Kayrak M, Erdoğan Hİ, Solak Y, Akıllı H, Gül EE, Yıldırım O et al. Prognostic Value of Neutrophil to Lymphocyte Ratio in Patients with Acute Pulmonary Embolism: A Restrospective Study. Heart, Lung and Circulation. 2014;23(1):56–62. DOI: 10.1016/j.hlc.2013.06.004
41. Zhang Y, Wu W, Du M, Luo W, Hou W, Shi Y et al. Neutrophil-toLymphocyte Ratio may Replace Chest Computed Tomography to Reflect the Degree of Lung Injury in Patients with Corona Virus Disease 2019 (COVID-19). Av. at: https://www.researchsquare.com/article/rs-23201/v1. DOI: 10.21203/rs.3.rs-23201/v1. 2020.
42. Zhu Z, Cai T, Fan L, Lou K, Hua X, Huang Z et al. Clinical value of immune-inflammatory parameters to assess the severity of coronavirus disease 2019. International Journal of Infectious Diseases. 2020;95:332–9. DOI: 10.1016/j.ijid.2020.04.041
43. Lagunas-Rangel FA. Neutrophil-to-lymphocyte ratio and lymphocyte-to-C- reactive protein ratio in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis. Journal of Medical Virology. 2020; [Epub ahead of print]. DOI: 10.1002/jmv.25819
44. Liu Y, Du X, Chen J, Jin Y, Peng L, Wang HHX et al. Neutrophil- tolymphocyte ratio as an independent risk factor for mortality in hospitalized patients with COVID-19. Journal of Infection. 2020;81(1):e6–12. DOI: 10.1016/j.jinf.2020.04.002
45. Mehra N, Sharp A, Lorente D, Dolling D, Sumanasuriya S, Johnson B et al. Neutrophil to Lymphocyte Ratio in Castration-Resistant Prostate Cancer Patients Treated with Daily Oral Corticosteroids. Clinical Genitourinary Cancer. 2017;15(6):678-684.e1. DOI: 10.1016/j.clgc.2017.05.012
46. Cataudella E, Giraffa CM, Di Marca S, Pulvirenti A, Alaimo S, Pisano M et al. Neutrophil-To-Lymphocyte Ratio: An Emerging Marker Predicting Prognosis in Elderly Adults with Community-Acquired Pneumonia. Journal of the American Geriatrics Society. 2017;65(8):1796–801. DOI: 10.1111/jgs.14894
Глюкокортикостероиды в терапии бронхиальной астмы | Княжеская Н.П.
В последние годы отмечен значительный прогресс в лечении бронхиальной астмы (БА). По–видимому, это связано с определением БА, как хронического воспалительного заболевания дыхательных путей, и вследствие этого – с широким применением ингаляционных глюкокортикостероидов (ГКС) в качестве базисных противовоспалительных препаратов. Однако несмотря на достигнутые успехи, уровень контроля над течением заболевания нельзя считать удовлетворительным. Так, например, почти каждый третий больной БА, как минимум, 1 раз в месяц просыпается ночью в связи с симптомами болезни. Более половины больных имеют ограничения физической активности, более трети вынуждены пропускать занятия в школе или отсутствовать на работе. Более 40% больных вынуждены обращаться за неотложной помощью вследствие обострения заболевания. Причины подобной ситуации многообразны, и не последнюю роль в этом играет недостаточная осведомленность врача в патогенезе БА и, соответственно, выбор неправильной тактики лечения.
Определение и классификация БА
Бронхиальная астма – хроническое заболевание дыхательных путей, в котором принимают участие многие клетки: тучные клетки, эозинофилы и Т–лимфоциты. У предрасположенных лиц это воспаление приводит к повторным эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая, по крайней мере, частично обратима, спонтанно или под влиянием лечения. Воспаление также вызывает увеличение ответа дыхательных путей на различные стимулы (гиперреактивность).
Ключевыми положениями определения следует считать следующие:
1. БА – хроническое персистирующее воспалительное заболевание дыхательных путей вне зависимости от тяжести течения.
2. Воспалительный процесс приводит к гиперреактивности бронхов, обструкции и появлению респираторных симптомов.
3. Обструкция дыхательных путей обратима, по крайней мере, частично.
4. Атопия – генетическая предрасположенность к продукции иммуноглобулинов класса Е (может присутствовать не всегда).
Бронхиальную астму можно классифицировать на основе этиологии, тяжести течения и особенностей проявления бронхиальной обструкции.
Однако в настоящее время бронхиальную астму в первую очередь следует классифицировать по степени тяжести, т. к. именно это отражает степень выраженности воспалительного процесса в дыхательных путях и определяет тактику противовоспалительной терапии.
Степень тяжести определяется по следующим показателям:
- Количество ночных симптомов в неделю.
- Количество дневных симптомов в день и в неделю.
- Кратность применения b2–агонистов короткого действия.
- Выраженность нарушений физической активности и сна.
- Значения пиковой скорости выдоха (ПСВ) и ее процентное соотношение с должным или наилучшим значением.
- Суточные колебания ПСВ.
- Объем проводимой терапии.
Существует 5 степеней тяжести течения БА: легкая интермиттирующая; легкая персистирующая; средней тяжести персистирующая; тяжелая персистирующая; тяжелая персистирующая стероидозависимая (табл. 1).
БА интермиттирующего течения: симптомы астмы реже 1 раза в неделю; короткие обострения (от нескольких часов до нескольких дней). Ночные симптомы 2 раза в месяц или реже; отсутствие симптомов и нормальная функция легких между обострениями: пиковая скорость выдоха (ПСВ) > 80% от должного и колебания ПСВ менее 20%.
БА легкого персистирующего течения. Симптомы 1 раз в неделю или чаще, но реже 1 раза в день. Обострения заболевания могут нарушать активность и сон. Ночные симптомы возникают чаще 2 раз в месяц. ПСВ более 80% от должного; колебания ПСВ 20–30%.
БА средней тяжести. Ежедневные симптомы. Обострения нарушают активность и сон. Ночные симптомы возникают более 1 раза в неделю. Ежедневный прием b2–агонистов короткого действия. ПСВ 60–80% от должного. Колебания ПСВ более 30%.
БА тяжелого течения: постоянные симптомы, частые обострения, частые ночные симптомы, физическая активность ограничена проявлениями астмы. ПСВ менее 60% от должного; колебания более 30%.
Необходимо отметить, что определение степени тяжести астмы по этим показателям возможно только перед началом лечения. Если больной уже получает необходимую терапию, то ее объем также должен учитываться. Таким образом, если у пациента по клинической картине определяется легкая персистирующая астма, но при этом он получает медикаментозное лечение, соответствующее тяжелой персистирующей астме, то у данного пациента диагностируется БА тяжелого течения.
БА тяжелого течения стероидозависимая: независимо от клинической картины пациент, получающий длительное лечение системными кортикостероидами, должен быть расценен, как страдающий БА тяжелого течения.
Ингаляционные ГКС
Рекомендован ступенчатый подход к терапии БА в зависимости от тяжести ее течения (табл. 1). Все препараты для лечения БА разделены на две основные группы: для длительного контроля воспалительного процесса и средства для купирования острых симптомов астмы. Основой терапии для длительного контроля воспалительного процесса являются ингаляционные глюкокортикостероиды (ИГКС), которые следует применять, начиная со второй ступени (легкое персистирующее течение) до пятой (тяжелое стероидозависимое течение). Поэтому в настоящее время ИГКС рассматриваются в качестве средств первой линии для терапии БА. Чем выше степень тяжести течения БА, тем большие дозы ИГКС следует применять. По данным ряда исследований, у пациентов, начавших лечение ИГКС не позже двух лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы по сравнению с группой, начавшей лечение ИГКС по прошествии более чем 5 лет от дебюта заболевания.
Механизмы действия и фармакокинетика
ИГКС способны связываться со специфическими рецепторами в цитоплазме, активируют их и образуют с ними комплекс, который затем димеризуется и перемещается в ядро клетки, где связывается с ДНК и взаимодействует с механизмами транскрипции ключевых ферментов, рецепторов и других сложных белков. Это приводит к проявлению фармакологического и терапевтического действия.
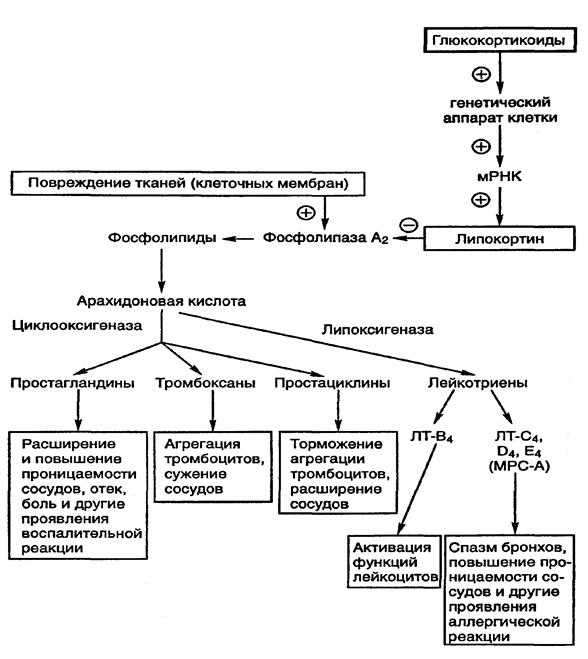
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, предотвращение миграции и активации клеток воспаления. ИГКС увеличивают синтез противовоспалительных белков (липокортина–1), увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина–5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию b–рецепторов как путем синтеза новых, так и повышая их чувствительность, стимулируют эпителиальные клетки.
ИГКС отличаются от системных глюкокортикостероидов своими фармакологическими свойствами: липофильностью, быстротой инактивации, коротким периодом полувыведения из плазмы крови. Важно учитывать, что лечение ИГКС является местным (топическим), что обеспечивает выраженные противовоспалительные эффекты непосредственно в бронхиальном дереве при минимальных системных проявлениях. Количество ИГКС, доставляемое в дыхательные пути, зависит от номинальной дозы препарата, типа ингалятора, наличия или отсутствия пропеллента, а также техники выполнения ингаляции. До 80% пациентов испытывают сложности при использовании дозированных аэрозолей.
Наиболее важной характеристикой для проявления селективности и времени задержки препарата в тканях является липофильность. Благодаря липофильности ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Высоколипофильные ИГКС быстрее и лучше захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. ИГКС отличает от системных препаратов их топическое (местное) действие. Поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона и дексаметазона): эти препараты вне зависимости от способа применения обладают только системным действием.
В многочисленных рандомизированных плацебо-контролируемых исследованиях у больных БА показана эффективность всех доз ИГКС в сравнении с плацебо.
Системная биодоступность складывается из пероральной и ингаляционной. От 20 до 40% от ингалируемой дозы препарата попадает в дыхательные пути (это величина значительно варьирует в зависимости от средства доставки и от ингаляционной техники пациента). Легочная биодоступность зависит от процента попадания препарата в легкие, наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях. 60–80% ингаляционной дозы оседает в ротоглотке и проглатывается, подвергаясь затем полному или частичному метаболизму в желудочно–кишечном тракте и печени. Пероральная доступность зависит от абсорбции в желудочно–кишечном тракте и от выраженности эффекта «первого прохождения» через печень, благодаря чему в системный кровоток поступают уже неактивные метаболиты (за исключением беклометазона 17–монопропионата – активного метаболита беклометазона дипропионата). Дозы ИГКС до 1000 мкг/сутки (для флютиказона до 500 мкг/сут) обладают незначительным системным действием.
Все ИГКС имеют быстрый системный клиренс, сравнимый с величиной печеночного кровотока. Это один из факторов, снижающих системное действие ИГКС.
Характеристика наиболее часто используемых препаратов
К ИГКС относятся беклометазона дипропионат, будесонид, флютиказона пропионат, флунизолид, триамсинолона ацетонид, мометазона фуроат. Они выпускаются в виде дозированных аэрозолей, порошковых ингаляторов, а также в виде растворов для ингаляции через небулайзер (будесонид).
Беклометазона дипропионат. Применяется в клинической практике более 20 лет и остается одним из самых эффективных и часто используемых препаратов. Разрешено применение препарата у беременных. Выпускается в виде дозированного аэрозольного ингалятора (Бекотид 50 мкг, Беклофорте 250 мкг, Альдецин 50 мкг, Беклокорт 50 и 250 мкг, Бекломет 50 и 250 мкг/доза), дозированного ингалятора, активируемого вдохом (Беклазон Легкое Дыхание 100 и 250 мкг/доза), порошкового ингалятора (Бекодиск 100 и 250 мкг/доза ингалятор Дискхалер; мультидозовый ингалятор Изихейлер, Бекломет 200 мкг/доза). Для ингаляторов Бекотид и Беклофорте производятся специальные спейсеры – «Волюматик» (клапанный спейсер большого объема для взрослых) и «Бэбихалер» (2–клапанный спейсер малого объема с силиконовой лицевой маской для детей раннего возраста).
Будесонид. Современный высокоактивный препарат. Используется в виде дозированного аэрозольного ингалятора (Будесонид-мите 50 мкг/доза; Будесонид–форте 200 мкг/доза), порошкового ингалятора (Пульмикорт Турбухалер 200 мкг/доза; Бенакорт Циклохалер 200 мкг/доза) и суспензии для небулайзера (Пульмикорт 0,5 и 0,25 мг/доза). Пульмикорт Турбухалер – единственная лекарственная форма ИГКС, не содержащая носителя. Для дозированных ингаляторов Будесонид мите и Будесонид форте производится спейсер. Будесонид является составной частью комбинированного препарата Симбикорт.
Будесонид имеет наиболее благоприятный терапевтический индекс, что связано с его высоким сродством к глюкокортикоидным рецепторам, и ускоренным метаболизмом после системной абсорбции в легких и кишечнике. Будесонид является единственным ИГКС, для которого доказана возможность однократного применения. Фактор, обеспечивающий эффективность применения будесонида один раз в день, – ретенция будесонида в дыхательных путях в виде внутриклеточного депо благодаря обратимой эстерификации (образованию эфиров жирных кислот). При снижении концентрации свободного будесонида в клетке активируются внутриклеточные липазы, высвобождающийся из эфиров будесонид вновь связывается с рецептором. Подобный механизм не свойственен другим ГКС и позволяет пролонгировать противовоспалительный эффект. В ряде исследований показано, что внутриклеточное депонирование может оказаться более важным в плане активности препарата, чем сродство к рецептору.
Исследования последних лет по препарату Пульмикорт Турбухалер доказали, что он не влияет на конечный рост при длительном применении у детей, на минерализацию кости, не вызывает ангиопатию и катаракту. Пульмикорт также рекомендован к применению у беременных: установлено, что его применение не вызывает увеличения числа аномалий плода. Пульмикорт Турбухалер является первым и единственным ИГКС, которому FDA (организация по контролю за лекарственными средствами в США) присвоила категорию «В» в рейтинге лекарств, назначаемых при беременности. В эту категорию включаются лекарства, прием которых в период беременности является безопасным. Остальные ИГКС относятся к категории «С» (прием их во время беременности не рекомендуется).
Флютиказона пропионат. Самый высокоактивный препарат на сегодняшний день. Обладает минимальной пероральной биодоступностью (<1%). Эквивалентные терапевтические дозы флютиказона почти в два раза меньше, чем у беклометазона и будесонида в аэрозольном ингаляторе и сопоставимы с дозами будесонида в Турбухалере (табл. 2). По данным ряда исследований, флютиказона пропионат больше угнетает надпочечники, но в эквивалентных дозах имеет сходную с другими ИГКС активность в отношении надпочечников.
Представлен в виде дозированного аэрозольного ингалятора (Фликсотид 50, 125 и 250 мкг/доза) и порошкового ингалятора (Фликсотид Дискхалер – ротадиски 50, 100, 250 и 500 мкг/доза; Фликсотид Мультидиск 250 мкг/доза). Для аэрозольных ингаляторов производятся специальные спейсеры – «Волюматик» (клапанный спейсер большого объема для взрослых) и «Бэбихалер» (2–клапанный спейсер малого объема с силиконовой лицевой маской для детей раннего возраста). Флютиказон является составной частью комбинированного препарата Серетид Мультидиск.
Флунизолид. Препарат с низкой глюкокортикоидной активностью. На отечественном рынке представлен торговой маркой Ингакорт (дозированный ингалятор 250 мкг/доза, со спейсером). Несмотря на высокие терапевтические дозы, практически не имеет системных эффектов в связи с тем, что уже при первом прохождении через печень на 95% превращается в неактивное вещество. В настоящее время в клинической практике используется достаточно редко.
Триамсинолона ацетонид. Препарат с низкой гормональной активностью. Дозированный ингалятор 100 мкг/доза. Торговая марка Азмакорт, на российском рынке не представлен.
Мометазона фуроат. Препарат с высокой глюкокортикоидной активностью. На российском рынке представлен только в виде назального спрея Назонекс.
Клинические испытания, сравнивавшие эффективность ИГКС в виде улучшения симптомов и показателей функции внешнего дыхания, показывают, что:
- Будесонид и беклометазона дипропионат в аэрозольных ингаляторах при одинаковых дозах практически не отличаются по эффективности.
- Флютиказона пропионат обеспечивает такое же действие, как удвоенная доза беклометазона или будесонида в дозированном аэрозоле.
- Будесонид, применяемый через Турбухалер, оказывает такое же действие, как удвоенная доза будесонида в дозированном аэрозоле.
Нежелательные эффекты
Современные ИГКС относятся к препаратам с высоким терапевтическим индексом и имеют высокий профиль безопасности даже при длительном применении. Выделяют системные и местные нежелательные эффекты. Системные нежелательные эффекты могут стать клинически значимыми только при использовании высоких доз. Они зависят от сродства препаратов к рецептору, липофильности, объема распределения, периода полувыведения, биодоступности и других факторов. Риск возникновения системных нежелательных для всех имеющихся в настоящее время ИГКС коррелирует с желательными эффектами в дыхательных путях. Применение ИГКС в среднетерапевтических дозах снижает риск возникновения системных эффектов.
В основном побочные эффекты ИГКС связаны с их путем применения и сводятся к кандидозу полости рта, осиплости голоса, раздражению слизистой и кашлю. Чтобы избежать этих явлений, необходима правильная техника ингаляции и индивидуальный подбор ИГКС.
Комбинированные препараты
Несмотря на то, что ИГКС являются основой терапии БА, они не всегда позволяют полностью контролировать воспалительный процесс в бронхиальном дереве и, соответственно, проявления БА. В связи с этим возникала необходимость в назначении b2–агонистов короткого действия по потребности или регулярно. Таким образом появилась острая потребность в новом классе препаратов, свободных от недостатков, которые присущи b2–агонистам короткого действия, и обладающих доказанным длительным протективным и противовоспалительным действием на дыхательные пути.
Были созданы и в настоящее время широко применяются b2–агонисты длительного действия, которые на фармацевтическом рынке представлены двумя препаратами: формотерола фумаратом и сальметерола ксинафоатом. В современных руководствах по терапии астмы рекомендовано добавление b2–агонистов длительного действия при недостаточном контроле БА монотерапией ингаляционными ГКС (начиная со второй ступени). В ряде исследований было показано, что комбинация ингаляционного ГКС с b2–агонистом длительного действия более эффективна, чем удвоение дозы ингаляционных ГКС, и приводит к более значимому улучшению функции легких и лучшему контролю над симптомами астмы. Было показано также снижение количества обострений и значимое улучшение качества жизни у пациентов, получающих комбинированную терапию. Таким образом, появление комбинированных препаратов, содержащих ингаляционный ГКС и b2–агонист длительного действия, – отражение эволюции взглядов на терапию БА.
Главным преимуществом комбинированной терапии является повышение эффективности лечения при использовании более низких доз ИГКС. Кроме того, соединение двух препаратов в одном ингаляторе облегчает пациенту выполнение назначений врача и потенциально улучшает комплайнс.
Серетид Мультидиск. Составными компонентами являются сальметерола ксинафоат и флютиказона пропионат. Обеспечивает высокий уровень контроля над симптомами БА. Используется только в качестве базисной терапии, может назначаться, начиная со второй ступени. Препарат представлен в различных дозировках: 50/100, 50/250, 50/500 мкг сальметерола/флютиказона в 1 дозе. Мультидиск относится к ингаляционным устройствам малого сопротивления, что позволяет использовать его и у пациентов со сниженной скоростью вдоха.
Симбикорт Турбухалер. Составными компонентами являются будесонид и формотерола фумарат. На российском рынке представлен в дозировке 160/4,5 мкг в 1 дозе (дозы препаратов указаны как доза на выходе). Важная особенность Симбикорта – возможность использовать его как для базисной терапии (для контроля воспалительного процесса), так и для немедленного облегчения симптомов астмы. Это обусловлено прежде всего свойствами формотерола (быстрое начало действия) и способностью будесонида активно действовать в течение 24 часов на слизистую бронхиального дерева.
Симбикорт дает возможность индивидуального гибкого дозирования (1–4 ингаляционные дозы в сутки). Симбикорт можно использовать, начиная со 2 ступени, но особенно он показан пациентам с нестабильной астмой, для которой характерны внезапные тяжелые приступы затрудненного дыхания.
Системные ГКС
Системные ГКС применяются в основном для купирования обострения БА. Наиболее эффективны пероральные ГКС. Внутривенно кортикостероиды назначают при обострении БА, если более желателен внутривенный доступ, или при нарушении всасывания из желудочно–кишечного тракта, используя высокие дозы (до 1 г преднизолона, метилпреднизолона и гидрокортизона). Кортикостероиды приводят к клинически значимому улучшению спустя 4 часа после их введения.
При обострении БА показан короткий курс пероральных ГКС (7–14 дней), причем начинают с высоких доз (30–60 мг преднизолона). В последних публикациях рекомендуют следующий короткий курс системных ГКС при не угрожающих жизни обострениях: 6 таблеток преднизолона утром (30 мг) в течение 10 дней с последующим прекращением приема. Хотя схемы лечения системными ГКС могут быть различными, основополагающими принципами являются назначение их в высоких дозах для быстрого достижения эффекта и последующая быстрая отмена. Следует помнить, что как только пациент оказывается готовым к приему ингаляционных ГКС, они должны быть ему назначены с соблюдением ступенчатого подхода.
Системные глюкокортикоиды следует назначить, если:
- Обострение средней тяжести или тяжелое.
- Назначение ингаляционных b2–агонистов короткого действия в начале лечения к улучшению не привело.
- Обострение развилось, несмотря на то, что больной находился на длительном лечении пероральными кортикостероидами.
- Для купирования предыдущих обострений требовались пероральные кортикостероиды.
- 3 и более раз в год проводились курсы глюкокортикоидов.
- Больной находится на ИВЛ.
- Ранее были угрожающие жизни обострения.
Нежелательно использование пролонгированных форм системных стероидов для купирования обострений и проведения поддерживающей терапии БА.
Для длительной терапии при тяжелом течении БА системные ГКС (метилпреднизолон, преднизолон, триамсинолон, бетаметазон) следует назначать в наименьшей эффективной дозе. При длительном лечении альтернирующая схема назначения и прием в первой половине дня (для уменьшения влияния на циркадные ритмы секреции кортизола) вызывают наименьшее количество побочных эффектов. Следует подчеркнуть, что во всех случаях назначения системных стероидов больному должны быть назначены высокие дозы ингаляционных ГКС. Из пероральных ГКС предпочтение отдается тем, у которых отмечается минимальная минералокортикоидная активность, относительно короткий период полураспада и ограниченное действие на поперечно–полосатую мускулатуру (преднизолон, метилпреднизолон).
Стероидозависимость
Пациентам, которые вынуждены постоянно принимать системные ГКС, следует уделять особое внимание. Существует несколько вариантов формирования стероидозависимости у пациентов с БА и другими заболеваниями, сопровождающимися бронхообструкцией:
- Отсутствие комплайенса (взаимодействия) врача и пациента.
- Неназначение ингаляционных ГКС пациентам. Многие врачи считают, что нет необходимости назначать ингаляционные ГКС больным, получающим системные стероиды. Если пациент с БА получает системные стероиды, его следует расценивать, как больного с тяжелой формой БА, имеющего прямые показания к назначению высоких доз ингаляционных ГКС.
- У больных системными заболеваниями (включая легочные васкулиты, например, синдром Чардж–Стросса) бронхиальная обструкция может быть расценена, как БА. Отмена системных стероидов у этих больных может сопровождаться тяжелыми проявлениями системного заболевания.
- В 5% случаев встречается стероидорезистентность, для которой характерна резистентность стероидных рецепторов к стероидным препаратам. В настоящее время различают две подгруппы: больные с истинной стероидной резистентностью (тип II), не имеющие побочных эффектов при длительном приеме высоких доз системных ГКС, и пациенты с приобретенной резистентностью (тип I) – имеющие побочные эффекты системных ГКС. В последней подгруппе резистентность можно преодолеть, скорее всего, повышением дозы ГКС и назначением препаратов, имеющих аддитивный эффект.
Литература:
1. Бронхиальная астма. Глобальная стратегия: совместный доклад Национального института Сердце, Легкие, Кровь и Всемирной организации здравоохранения. Пульмонология, 1996.
2. Бронхиальная астма. Руководство для врачей России (формулярная система). «Пульмонология», приложение–99.
3. Ведущие направления в диагностике и лечении бронхиальной астмы. Основные положения отчета группы экспертов EPR–2. National Institute of Health. National Heart, Lung and Blood Institute. NIH publication–97. Перевод под ред. Проф. Цой А.Н., М, Грантъ,1998.
4. Ильина Н.И. Ингаляционные глюкокортикоиды. Астма.ru. Аллергические и респираторные заболевания. 0*2001 (пилотный выпуск).
5. Огородова Л.М. Системы ингаляционной доставки препаратов в дыхательные пути. Пульмонология, 1999; №1, 84–87
6. Формулярная система: лечение бронхиальной астмы. Астма. ru ,0. 2001, 6–9
7. Чучалин А.Г. Бронхиальная астма. Москва, 1997.
8. Цой А.Н. Ингаляционные глюкокортикоиды: эффективность и безопасность. РМЖ 2001; 9: 182–185
9. Цой А.Н. Сравнительная фармакокинетика ингаляционных глюкокортикоидов. Аллергология 1999; 3: 25–33
10. Agertoft L., Pedersen S. Effect of long–term treatment with inhaled budesonide on adult height in children with asthma. N Engl J Med 2000; 343: 1064–9
11. Ankerst J., Persson G., Weibull E. A high dose of budesonide/formoterol in a single inhaler was well tolerated by asthmatic patients. Eur Respir J 2000; 16 (Suppl 31): 33s+poster
12. Barnes P.J. Inhaled glucocorticoides for asthma. N. Engl. Med. 1995; 332: 868–75
13. Beclomethasone Dipropionate and Budesonide. The clinical evidence Reviewed. Respir Med 1998; 92 (Suppl B)
14. The British Guidelines on Asthma Management. Thorax, 1997; 52 (Suppl. 1) 1–20.
15. Burney PGJ. Current questions in the epidemiology of asthma, in Holgate ST, et al, Asthma: Physiology. Immunology, and Treatment. London, Academic Press, 1993, pp 3–25.
16. Crisholm S et al. Once–daily budesonide in mild asthma. Respir Med 1998; 421–5
17. Kips JC, O/Connor BJ, Inman MD, Svensson K, Pauwels RA, O/Byrne PM. A long–termed study of the antiinflammatory effect of low–dosed budesonide plus formoterol versus high–dosed budesonide in asthma. Am Respir Crit Care Med 2000; 161: 996–1001
18. McFadden ER, Casale TB, Edwards TB et al. Administration of budesonide once daily by means of Turbuhaler to subjects with stable asthma. J Allergy Clin Immunol 1999; 104: 46–52
19. Miller–Larsson A., Mattsson H., Hjertberg E., Dahlback M., Tunek A., Brattsand R. Reversible fatty acid conjugation of budesonide: novel mechanism foe prolonged retention of topically applied steroid in airway tissue. Drug Metab Dispos 1998; 26: 623–30
20. Miller–Larsson A. et al. Prolonged airway activity and improved selectivity of budesonide possibly due to esterification. Am J Respir Crit Care Med 2000;162: 1455–1461
21. Pauwels RA et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. N Engl J Med 1997; 337: 1405–11
22. Pedersen S, O/Byrne P. A comparison of the efficacy and safety of inhaled corticosteroides in asthma. Allergy 1997; 52 (Suppl 39): 1–34.
23. Woolcock A.et al. Comparison of addition of salmeterol to inhaled steroids with doubling of the dose of inhaled steroids. Am J Respir Crit Care Med, 1996, 153, 1481–8.
.
Глюкокортикоиды- Ветеринарная клиника Никавет
Автор: Якименко Анастасия Сергеевна (перевод с английского)
Глюкокортикоиды (ГК) обладают далеко идущими фармакологическими эффектами, которые могут значительно варьироваться в зависимости от дозировки и незначительно в зависимости от типа назначенных ГК (см. Фармакологические эффекты глюкокортикоидов).
Фармакологические эффекты глюкокортикоидов:
• Снижает выработку воспалительных медиаторов
• Ослабление лейкоцитарного фагоцитоза, хемотаксиса и выработки антигенов
• Выраженный катаболический эффект на метаболизм, мышечную массу и костный оборот
• Изменение почечной экскреции калия, кальция и натрия
• Возбуждение стресс-лейкограммы
• Индукция в сыворотку щелочной фосфатазы
Преднизон, Преднизолон и Метилпреднизолон
Преднизон представляет собой пролекарство Преднизолона. У кошек преднизолон, принятый внутрь, приводит к гораздо более высокой его концентрации в плазме крови, чем та же доза перорального преднизола. Это может быть следствие низкой биологической усвояемости преднизона у кошек или его вялотекущего преобразования в преднизолон. По этой причине, преднизолон является наиболее предпочтительным ГК для кошек. В то время как собаки могут одинаково преобразовывать и преднизон, и преднизолон. Метилпреднизолон является более эффективным, чем преднизолон при ингибировании in vitro пролиферации лимфоцитов у человека. Но эти данные не действительны для собак. В учебниках о животных сообщается, что метилпреднизолон, по сравнению с преднизолоном не имеет эффектов минералокортикоидов, но подтверждений этому нет. На самом деле, метилпреднизолон активирует минералкортикоиды, ответственные за почечные пути, по крайней мере, у грызунов.
Дозировка Преднизола, Преднизолона и Метилпреднизолона
Обычно используемые дозы ГК были экстраполированы из предыдущих исследований на людях и при поддержке клинического опыта на собаках и кошках (см. эмпирические рекомендации дозирования глюкокортикоидов). Для физиологической замены, рекомендуемая начальная доза составляет 0,2 мг/кг перорально раз в день. Время проявления не важно, по крайней мере, у кошек.
Дозы, превышающие норму примерно в 3 раза, рекомендованы при стрессе (например, госпитализации или хирургическом вмешательстве) у животных, которые имеют эндогенный дефицит ГК. Это подтверждается исследованиями секреции кортизола у собак при экспериментальных условиях стресса. Для антивоспалительных эффектов рекомендуются пероральные дозы от 0.5 до 1.0 мг/кг в сутки для собак и 1,0-2,0 мг/кг в сутки для кошек; для иммуносупрессии предлагается 2,0 мг/кг в сутки или 50 мг/м2 для собак или до 4,0 мг/кг в сутки для кошек.
Для крупных и гигантских пород собак, использование не более 50 мг/м2 (максимальная доза — 30-40 мг дважды в день) предлагается автором для снижения частоты серьезных побочных эффектов (например, атрофии мышц, вторичных инфекций). У страдающих ожирением кошек, дозу преднизолона следует назначать на основе оценки мышечной массы тела, так как концентрация в плазме преднизолона у тучных кошек повышается в два раза, в сравнении с той же дозировкой на кг у нормальных кошек.
Преднизолон является предпочтительным глюкокортикоидом для кошек.
Положительные и отрицательные эффекты
Глюкокортикоиды обычно вызывают дозозависимую полиурию и полидипсию, мышечную атрофию и алопецию у собак. Кошки более устойчивы ко многим побочным эффектам ГК, возможно из-за меньшего количества и низкого сродства ГК рецепторов в печени и коже. Приобретенный сахарный диабет является основным осложнением хронического лечения с ГК у кошек, и он требует тщательного клинического наблюдения за полидипсией, потерей веса или глюкозурией. Преднизон, преднизолон и метилпреднизолон имеют эффекты минералокортикоидов, и дозы, от умеренных до высоких, следует избегать при гипертензии, сердечной недостаточности, асците, или гипокалиемии у пациентов. Кроме того, ацетат метилпреднизолона может приводить к острому расширению объема плазмы и даже к застойной сердечной недостаточности у кошек, хотя это можно скорее отнести к изменениям межклеточной жидкости, а не общему удержанию воды. ГК, как правило, вызывают в сыворотке крови активность щелочной фосфатазы (ЩФ) у собак, с подавлением аланинаминотрансферазы (АЛТ). Эти изменения не являются клинически действенными, если только не превышена активность АЛТ или ЩФ, или не присутствует гипербилирубинемия, что само по себе предполагает наличие заболевания.
ЩФ не является легко индуцируемой ГК у кошек; небольшое увеличение ЩФ по сравнению с исходными показателями были зарегистрированы при даче кошке ацетата метилпреднизолона, но значения не выходили за пределы диапазона. Любое увеличение в сыворотке крови ЩФ за пределы референсного диапазона клинически значимо у кошек, независимо от того, присутствуют ли в их лечении ГК.
Две недели лечения противовоспалительной дозировкой преднизолона подавляют гипоталамо-гипофизарно-надпочечниковую систему (ГГН система). После одного месяца лечения, может потребоваться 2 недели для восстановления функций надпочечников. Из-за этого, пациент в идеале должен быть изолирован от хронических ГК не менее чем за 2-3 недели до плановой анестезии или хирургического вмешательства, если это возможно; однако, если возможны негативные последствия прекращения лечения, то следует рассматривать отдельно каждого пациента.
Дексаметазон
Дексаметазон примерно от 5 до 10 раз более мощный, чем преднизон, при длительности действия приблизительно от 32 до 48 часов. Дексаметазон не обладает минералкортикоидной активностью из-за замещенного метильного кольца и не содействует задерживанию соли и воды.
Показания и дозирование
Дексаметазон более предпочтительный ГК для пациентов с артериальной гипертензией, сердечной недостаточностью, гипоальбуминемией, отеками или асцитом. На основе повышения потенции дексаметазона, его дозировки могут быть определены эмпирически путем вычисления основных доз преднизона и деления на 7 или 8, для получения эквивалентной дозы дексаметазона.
Дексаметазон также доступен в инъекционной форме, что является полезным для введения ГК в обход тяжелой мальабсорбции при лечении энтеропатии с потерей белка или лимфангиэктазии.
Положительные и отрицательные эффекты
Дексаметазон (0,55 мг/кг перорально в сутки) более диабетогенен для здоровых кошек, чем преднизолон с восьмикратной дозировкой (4,4 мг/кг перорально в день). Это говорит о том, что дексаметазон не менее чем в 8 раз действеннее преднизолона для кошек.
Дексаметазон не подходит для альтернативной одноразовой терапии из-за его длительного срока действия. При хронических сужающихся курсах, дексаметазон может быть заменен на преднизон или преднизолон при достижении более низких доз (например, эквивалентно 0,5 до 1,0 мг/кг перорально преднизолона в день) или на одноразовую альтернативную терапию.
Будесонид
Будесонид является пероральным ГК с высокой начальной дозировкой для людей. У собак, будесонид, с малой вероятностью, приведет к увеличению активности печеночных ферментов или вызовет стресс-лейкограмму.
Показания и Дозирование
Будесонид является альтернативой преднизона или преднизолона для лечения воспалительных заболеваний кишечника и, возможно, воспалительных заболеваний печени. Это доказывает его сконцентрированность на местных эффектах; это делает его привлекательной альтернативой при терапии воспалительных заболеваний кишечника, с эквивалентной эффективностью в сравнении с преднизолоном для собак.
У собак, будесонид с меньшей вероятностью приведет к увеличению активности печеночных ферментов или вызовет стресс -лейкограмму. Хотя опубликованная эмпирическая однократная доза равна 3 мг/м2 в сутки, она может вызвать выраженную полиурию/полидипсию и затрудненность при дыхании у некоторых собак и может полностью подавить ГГН систему. Снижение начальной дозы (например, 1-2 мг/м2 или 1-2 мкг/30 кг [собаки]; 0.5-0.75 мг [кошки]) может лучше перенестись и может достичь клинического эффекта.
Триамцинолон
Эффективность триамцинолона относительно преднизолона имеет широкий разброс, от 10:1 до 1:1; однако, в исследованиях на кошек с зудящими кожными заболеваний, триамцинолон при одной седьмой дозе метилпреднизолона (0,18 мг/кг/сут перорально) показал сопоставимую эффективность (1.41 мг/ кг/сут перорально), это предполагает, что триамцинолон может быть в 7 раз более мощным, чем метилпреднизолон для кошек. Данное исследование также показало меньшую частоту развития полидипсии у кошек, которые лечатся триамцинолоном по сравнению с метилпреднизолоном, хотя количество кошек в исследование было небольшим. Этот вывод согласуется с пониманием того, что триамцинолон, как и дексаметазон, имеет кольцо замещения и убирает минералкортикоидную активность.
Потенцию и эффективность перорального триамцинолона не сравнить с дексаметазоном или преднизолоном у собак. Триамцинолон чаще используется для длительного применения в форме инъекций (препарат «Vetalog», bi-vetmedica.com) у собак.
Инъекции Длительного Действия
Инъекции ГК длительного действия обеспечивают замедленное высвобождение путем медленного растворения ацетонида и ацетата препаратов. Эти ГК удобны для больных, которым трудно давать препараты внутрь, но при длительном использовании они могут привести к подавлению ГГН системы и функциональной недостаточности коры надпочечников при стрессовых ситуациях. Например, действие триамцинолона ацетонида («Vetalog», bi-vetmedica.com) длится недели, и одна инъекция может подавлять функцию надпочечников у собак до 4 недель.
Как пероральные ГК, эти инъекции ГК могут привести к изнурительным побочным эффектам, которые являются более сложными из-за длительной продолжительности действия.
Как триамцинолон ацетонид, так и метилпреднизолона ацетат (Депомедрол, henryschein.com) могут вызвать застойную сердечную недостаточность у чувствительных кошек. Это объясняется увеличением объема плазмы до 40% у кошек в течение первой недели после введения ГК. Это является вторичным по отношению к осмотическим сдвигам между клеточными и плазменными составляющими.
Эти пролонгированные ГК следует избегать в назначении пациентам с сердечной недостаточностью и должны быть использованы только с образованными клиентами и при проведении тщательного клинического мониторинга пациентов с сердечными шумами.
Аналогично, метилпреднизолона ацетат повышает уровень глюкозы в крови у кошек и может вызвать сахарный диабет. У любой кошки при лечении с ГК — особенно с учетом пролонгированного действия препаратов — следует тщательно следить за полидипсией, потерей веса, глюкозурией, или повышением концентрации фруктозамина в сыворотке крови.
Бактериурия без клинических признаков развивается примерно у 20-40% собак при хроническом лечении с ГК; самки более подвержены, чем самцы. Бактериурию видно даже после одноразовой терапии, и мониторинг только осадка мочи является ненадежным, потому что половина положительных культур отсутствует при пиурии у собак, лечившихся с применением ГК. Однако, очевидно, что люди не поддерживают лечение бессимптомной бактериурии, даже у пациентов с иммунодефицитом. Поэтому, периодические посевы мочи, вероятно, не указываются в лечении у собак и кошек с ГК, если не выявлено признаков патологии мочевыводящей системы.
Источник: https://vk.com/doc180197187_438000583?hash=7feb930d4e7f90b5bd&dl=dc9688e907291a753d
Чем нас лечат: Преднизолон. Закупки, которые мы потеряли
Могут назначить Преднизолон и от почечных заболеваний, когда собственные гормоны надпочечников почему-то не выполняют свои функции должным образом. Например, при нефротическом синдроме, когда в мочу попадают белки, которых там быть не должно, люди находятся под угрозой серьезных инфекций, и Преднизолон может снизить этот риск и уменьшить вероятность возвращения заболевания (которое может быть вызвано новой вирусной инфекцией), но более длительные схемы применения, чем два-три месяца, ничем себя не оправдали (и хорошо, тем меньше побочного действия). При воспалении плечевого сустава Преднизолон может спасти от боли, а вот при подагре, у которой совсем другой механизм возникновения, надежда слаба — придется менять образ жизни.
Преднизолон часто используется и при лечении глазных инфекций, а также при хирургии катаракты, помогая защитить глаза от воспаления, однако лучше ли он, чем нестероидные противовоспалительные препараты, неизвестно.
А вот при колитах польза от кортикостероидов не всегда перевешивает их вред, хотя при болезни Крона они помогают запустить ремиссию.
Сила кортикостероидов распространяется и на неврологические воспаления: к примеру, поврежденные проказой нервные окончания успешно лечат, хотя при долгом или слабом нарушении функций польза этих лекарств уже неочевидна. Немного улучшаются мышечные функции и у больных дистрофией Дюшенна (хотя в долгосрочной перспективе соотношение рисков и пользы пока под вопросом), а вот при синдроме Гийена — Барре значительная эффективность препарата не доказана. Та же проблема и с рассеянным склерозом в долгосрочной перспективе: пока исследования не позволяют давать рекомендаций.
Indicator.Ru рекомендует: можно, только осторожно
Несмотря на то, что у препарата очень много исследований на маленьком количестве пациентов (что делает их статистически слабыми), механизм его действия известен — в конце концов, преднизолон относится к глюкокортикоидным гормонам, которые в организме точно работают.
Белгородцы, переболевшие COVID-19, могут резко набрать вес. Белгородские новости
Как сообщили в сетевом издании «ТАСС», перенесённый коронавирус вызывает снижение мышечной массы, что может вызвать быстрый набор веса в период выздоровления.
«Ковид характеризуется тем, что поражает много разных органов и систем, в том числе и мышцы. И есть такое состояние, как „постковидная саркопения“ — из‑за нее после ковида у человека снижается мышечная масса. Поэтому получается так, что человек, используя одни и те же мышцы, раньше тратил больше энергии, а сейчас этих мышц нет — следовательно, и энергии меньше уходит. Параллельно также идёт изменение питания, увеличивается аппетит, и все это выливается в набор веса», — рассказал журналистам «ТАСС» эндокринолог, член Европейского общества эндокринологии и Кокрановского сообщества Юрий Потешкин.
Резкий набор веса также может возникать из‑за глюкокортикостероидов, которые используются для лечения заболевания.
«Для лечения коронавирусной инфекции врачи используют глюкостероиды — гормоны стресса, которые тормозят развитие воспалительных процессов. На их фоне человек непроизвольно начинает хотеть есть чаще, аппетит повышается. К счастью, во время самого заболевания человек ест немного, поэтому глюкостероиды здесь только помогают. Но после того как инфекция, наконец, уходит, их отменяют не сразу, а люди постепенно восстанавливаются и начинают есть. И тут получается, что глюкостероиды „добавляют дров“ в аппетит», — рассказал Юрий Потешкин.
Однако к причинам также относят и депрессию, которая зачастую наблюдается у пациентов.
«На это всё накладывается третий фактор. После ковида люди чувствуют себя плохо довольно длительное время — у них могут возникать и депрессия, и другие проблемы. И к физической активности нет особой склонности. Вот и получается, что человек бездействует, планомерно набирая вес», — заключил врач.
COVID-19 также может спровоцировать воспаление щитовидной железы — характеризуется болью в шее, тремором рук и повышенной потливостью. Врач рассказал, что столкнуться с этим заболеванием может каждый, однако встречается оно крайне редко.
Диетолог Елена Соломатина поделилась советами для восстановления веса с журналистами «ТАСС».
«Организм требует энергии, чтобы восстанавливаться после заболевания. Тут главное — не впадать в крайности, не садиться на какие‑то строгие диеты, но и не есть всё подряд. Стоит есть больше зелени, а также легко усваиваемый белок — это рыба, кролик, индейка, курица, белок яйца. В них же содержится множество витаминов, например, витамины группы В, которые нужны для восстановления нервной системы, цинк, витамин D», — объяснила она.
Хотя некоторым потребуется употреблять и жирные продукты, по типу сала, жирной рыбы и растительных масел.
Врач рассказал о побочных эффектах дексаметазона
У противовоспалительного препарата дексаметазона, который показал свою эффективность при осложнениях COVID-19, есть побочные эффекты, такие как повышение склонности к тромбозам и способность вызывать язву желудка. Поэтому назначать его должны только специалисты. Об этом ТАСС рассказал заслуженный врач России Михаил Каган.
Дексаметазон – это стероидный препарат с противовоспалительным и иммунодепрессивным действием. Его применяют для лечения ревматоидных заболеваний, астмы, аллергий, хронической обструктивной болезни легких и многих других заболеваний. Согласно результатам клинического исследования RECOVERY, в котором участвовало более 6 тыс. пациентов с коронавирусной инфекцией, дексаметазон на треть снизил смертность пациентов с COVID-19, которые были на искусственной вентиляции легких.
После этого глава Всемирной организации здравоохранения (ВОЗ) назвал эти результаты «научным прорывом». Тем не менее, исследование пока не прошло независимую экспертизу и не было опубликовано в каком-либо научном журнале. Авторы обещают сделать это в ближайшее время.
Почему дексаметазон надо принимать осторожно
«[Побочные эффекты] такие же как и у других препаратов этой группы – повышение склонности к тромбозам, повышение артериального давления, повышение уровня глюкозы в крови, способность вызывать язвы желудка и так далее. Это серьезный препарат, для серьезных ситуаций с серьезными побочными действиями. Поэтому только опытный врач поймет, что к чему, – рассказал Каган.
Врач пояснил, что препарат, согласно предварительным результатам исследования, влияет не на сам вирус, он уменьшает лишь чрезмерное воспаление, которое возникает в организме после заражения.
В качестве профилактики и в первую неделю после заражения коронавирусом применять этот препарат Каган не рекомендовал, так как он подавляет иммунную систему. «Это может только помочь вирусу», – пояснил врач.
В целом, как пояснил Каган, дексаметазон известен человечеству с 1960-х годов и давно был зарегистрирован для лечения аутоиммунных болезней во всех странах, включая СССР и Россию. На кортикостероидах основана традиционная терапия многих аутоиммунных болезней, таких как системная красная волчанка, гломерулонефриты, бронхиальная астма, синдром Кавасаки, аутоиммунная тромбоцитопеническая пурпура и других.
Применять кортикостероиды при коронавирусной инфекции логично, отметил врач, но однозначных рекомендаций не было, поскольку раньше не было доказательств эффективности этого препарата против COVID-19. Кроме того, врачи знают о рисках использования таких стероидов. При этом в седьмой версии временных методических рекомендаций Минздрава «Профилактика, диагностика и лечение новой коронавирусной инфекции» от 3 июня была рекомендация о том, что этот препарат можно использовать при тяжелом течении болезни, отметил Каган.
«Надо отметить, что в Великобритании применялась доза дексаметазона существенно более низкая, чем рекомендована нашим Минздравом – 6 мг в день (в отечественных рекомендациях – 20 мг в день. Думаю, что британцам удалось найти оптимальную дозу, уже обеспечивающую положительный эффект и минимизирующую побочные действия», – заключил врач.
Как проходили клинические испытания
В исследовании RECOVERY, которое началось в марте 2020 года, участвовали более 6,4 тыс. пациентов с коронавирусной инфекцией. Из них случайным образом отобрали 2,1 тыс. человек, которым в течение десяти дней давали по 6 мг дексаметазона в день. Остальные участники проходили обычное в таких случаях лечение.
Итоги показали, что этот иммунодепрессант снизил количество смертей среди больных с тяжелыми формами COVID-19: на треть среди пациентов на вентиляции легких и на 20% – среди тех, кому нужен был дополнительный кислород.
совместимость и взаимодействие с организмом
Главная>Статьи>Гормональные препараты и алкоголь: влияние на организм человека
Гормоны – вещества, которые постоянно вырабатываются нашим организмом, они выполняют специфические роли и функции, обеспечивающие нормальное функционирование организма человека. По сути – это органические соединения, цели – координация, регуляция определенных функций внутренних органов и систем человеческого организма. Гормоны – важный фактор жизнедеятельности, без них жизнь и нормальная работа организма невозможны.
Основная задача гормонов – передача информации от органов к внутренним системам нашего организма, другими словами – эти вещества играют роль связистов, устанавливая контакты в организме.
В ряде случаев человеку необходимо восстановление работы выработки гормонов – это происходит путем специального лечения. Различные сбои в функционировании нашего организма бьют по гормональной системе практически в первую очередь. Для восстановления гормонального фона специалисты назначают специальные препараты – применяются методы гормонозаместительной терапии. Лечение протекает не один день – часто качественная терапия занимает продолжительное время, поскольку требуется принимать курс препаратов. Можно ли с гормональными препаратами употреблять алкоголь? Какой и в каких количествах? Стоит ли вообще сочетать препараты и спиртные напитки? Эти вопросы интересуют многих, кто находится на лечении специальными лекарствами.
В каких случаях назначается специфическая терапия?
Гормонозаместительные препараты назначаются только в случае необходимости, принимать их без рекомендации врача не рекомендуется. Причин для назначения таких лекарств немало:
- Сбои в функционировании гипофиза – на фоне проблем может возникнуть нехватка гормона роста;
- Энцефалит;
- Осложнения во время пубертатного периода;
- Опухоли злокачественного характера;
- Проблемы в работе и патологии надпочечников;
- Наследственные проблемы и нарушения;
- Дисфункции щитовидной железы и другие проблемы.
Гормональные препараты прописывают даже в тех случаях, когда сбои в функционировании гормональной системы минимальны – настолько важно действие данных соединений в организме человека. Препараты включают вещества, которые замещают гормоны, или сами чистые гормоны.
Результат приема медикаментов – стабилизация гормональной системы и восстановление нормального функционирования организма.
Совместимы ли гормональные препараты с алкоголем?
Любой алкогольный напиток наносит вред организму человека, уровень вреда зависит от количества и качества потребляемого напитка, комбинации, в которых его употребляют. Обратите внимание: любые препараты со спиртным – опасная для здоровья и жизни смесь.
Гормональные препараты и алкоголь совмещать запрещено, поскольку последствия могут быть крайне опасными. В составе любого спиртного напитка есть этиловый спирт – вещество, которое по своей природе несет опасность и вред. Токсичность этилового спирта усиливается, если комбинировать его с препаратами, особенно – гормональными. Последствия – нарушения в работе внутренних органов, необратимые процессы в организме, фатальный исход, разнообразные побочные эффекты и негативные последствия.
Наиболее худший вариант – одновременное употребление упомянутых веществ.
Почему комбинация опасна?
Алкоголь при приеме гормональных препаратов опасен по причине особенностей и свойств данных веществ. Метаболит этанола или ацетальдегид имеет одну важную функцию – он может стимулировать или чрезмерно угнетать продуцирование различных гормонов. После употребления спиртного и его всасывания в кровь, активно образуется кортизол – гормон стресса. Результаты: наблюдаются признаки депрессии, панические атаки, страх, повышенная тревожность, беспокойство и другие аналогичные проявления.
Особенность данных процессов – высокая скорость проявления, уже через несколько минут после употребления алкоголя наблюдается данный эффект.
Особое внимание на опасность сочетания горячительных напитков и гормональных препаратов стоит обратить женщинам. В результате взаимодействия этанола, который содержится в спиртных напитках, дестабилизируется уровень женских гормонов. Действие опасной комбинации влечет такие последствия:
- Фигура женщины меняется – становится менее женственной, проявляются мужские черты в результате изменения гормонального фона;
- Меняется голос – тембр, звучание более грубое;
- Резко меняется масса тела – женщина начинает стремительно набирать вес;
- Повышается уровень оволосения на теле, лице.
Это наиболее явные нарушения, которые видны визуально. Кроме того, щитовидная железа дает существенные сбои.
С какими проблемами сталкиваются мужчины?
- Понижается уровень либидо;
- Страдает репродуктивная система;
- Отмечается интенсивное накопление жира по женскому сценарию – на животе, бедрах, талии.
На что влияют гормоны человека?
- Половая система;
- Процесс роста;
- Метаболизм;
- Физическое и психическое развитие;
- Интеллектуальные способности.
Другими словами – если алкоголь принимать вместе с препаратами, можно нанести непоправимый урон всем системам, перечисленным выше. Спиртное может ударить во всех направлениях сразу.
Особенности гормональной контрацепции
Опасность создается и во время приема гормональных контрацептивов со спиртным – это также может вести к многочисленным патологиям и сбоям. Причем, часто женщины даже не задумываются о том, что такая комбинация опасна, поскольку многие не воспринимают контрацептив, как препарат, не ассоциируют его с лекарством, которые по определению нельзя пить вместе с алкоголем.
Гормональные противозачаточные средства считаются многими наиболее предпочтительными, поскольку они практически не имеют побочных эффектов, эффективны, существуют в разных формах, доступны.
Этанол абсолютно несовместим с контрацептивами!
Наиболее популярный контрацептив – Клайра. Если принимать его со спиртным, его действие угнетается. Итог – незапланированная беременность.
Стоит учесть, что пить горячительные напитки нельзя не только во время, но и незадолго до приема данного препарата.
Сочетание спиртного и гормональной терапии: последствия
Обратите внимание, что такое сочетание не только нежелательно, но и очень опасно. Чтобы лучше понять и оценить масштаб урона, требуется понять – как функционирует и работает терапия с использованием гормонозаместительных препаратов.
В итоге длительного лечения препараты ускоряют работу надпочечников и других желез, количество и концентрация гормонов повышаются, особенно — адреналина, кортизона, альдостерона. Если в процесс «вмешивается» спиртное, могут сформироваться тяжелые и опасные патологии.
Почему возникают подобные вопросы, относительно возможности сочетания алкоголя и препаратов? Главная причина таких вопросов – то, что горячительные напитки никак не влияют на организм, даже в комбинации с лекарствами. Это зависит от индивидуальных особенностей организма человека, нельзя называть закономерностью, если у кого-то одного не будет проблем. Возможно, у конкретного человека патологии проявятся позже. Согласно исследованиям, подавляющее большинство лиц, которые сочетали терапию препаратами и спиртное, имели серьезные проблемы со здоровьем.
Наиболее распространенные побочные эффекты:
- Судороги и спазмы;
- Головная боль;
- Язвы;
- Тромбофлебит и другие.
Сложность ситуации в том, что, даже медики, не могут точно сказать – какие проблемы будет иметь тот или иной человек, во многом все зависит от персональных особенностей организма.
Совместимость гормональных препаратов и алкоголя опровергается сотнями и тысячами больных, которые вынуждены были бороться с тяжелыми последствиями легкомысленного отношения к собственному здоровью.
Последствия: чего ждать после употребления спиртного в сочетании с гормональными средствами
- Терапия не приносит необходимого эффекта: этанол угнетает действие гормональных препаратов, поэтому лечение не приносит нужного результата. Этот исход наиболее безопасный, но редкий.
- Развитие варикоза и аналогичных результатов – например, тромбофлебита.
- Эндокринная система начинает работать в режиме повышенной интенсивности, особенно – половые железы и надпочечники. Далее наблюдается перенасыщение гормонами, это ведет к передозировке гормонами. Результат – полный дисбаланс всего организма.
- Высокий уровень потребления может привести не только к необратимым патологиям, но и к летальному исходу.
Особенности комбинации некоторых гормонов и спиртного
- Андрогены: повышают уровень эстрогенов, очень быстрое и сильное опьянение, повышенная интоксикация.
- Гормоны гипофиза: вызывают серьезные сбои в работе центральной нервной системы.
- Гормоны щитовидки: спиртное вызывает общее ухудшение состояния, сводит на нет действие лекарств, гормональный уровень резко меняется.
- Инсулин: вызывает широкий спектр последствий – от незначительного ухудшения состояния здоровья до комы.
- Кортикостероиды: язва, нарушения в работе центральной нервной системы.
- Гормональные контрацептивы: повышение уровня эстрогенов, общее нарушение функционирования гормональной системы.
- Окситоцин – «гормон счастья и любви» способствует в нормальном состоянии формировать материнский инстинкт, ощущение радости, любви и гармонии, понижает тревожность и уровень стресса, но повышенное количество приводит к поступкам крайне опасным и рискованным. В сочетании с алкоголем – нарушает работу центральной нервной системы, внутренних органов.
Итоги
Прием гормональных препаратов со спиртными напитками – опасен для здоровья человека, иногда – непоправимо. Последствия: от угнетения действия препарата до комы и летального исхода. Специфика влияния на организм зависят от принимаемого препарата, индивидуальных особенностей организма, количества выпитого спиртного.
Наиболее распространенные последствия: нарушения работы ЦНС, гормональной системы, печени.
Глюкокортикоиды — предупреждения, меры предосторожности, побочные эффекты и взаимодействия
Эти препараты имитируют то, как ваш организм контролирует воспаление.
Глюкокортикоиды — это стероиды, которые либо производятся в организме естественным путем, либо создаются синтетическим путем в виде лекарств.
Как естественные, так и синтетические глюкокортикоиды выполняют две основные функции:
Глюкокортикоиды, отпускаемые по рецепту, используются для лечения воспалений, вызванных широким спектром заболеваний, включая астму, воспалительное заболевание кишечника (ВЗК), ревматоидный артрит, аутоиммунные заболевания, такие как волчанка и т. рак.
Примеры глюкокортикоидных препаратов:
Предупреждения и меры предосторожности
Избегайте приема глюкокортикоидов, если вы:
- У вас аллергия на глюкокортикоиды
- Принимаете лекарства от грибковой инфекции
- У вас есть инфекция малярии в головном мозге
Если вы принимали глюкокортикоиды в течение двух или более недель, не прекращайте прием препарата внезапно, если только ваш врач не скажет вам иное.
Прекращение приема препарата «холодная индейка» может отправить ваш организм в кризисный режим.
Спросите своего врача о глюкокортикоидах, если вы:
- Имеете ослабленную иммунную систему или находитесь в группе повышенного риска инфекции
- У вас активная инфекция, включая корь или ветряную оспу
- У вас высокое кровяное давление, застойная сердечная недостаточность или диабет
- Недавно перенес сердечный приступ
- Есть заболевание, влияющее на ваш пищеварительный тракт, например воспалительное заболевание кишечника, язвенная болезнь или дыры в кишечнике
- Есть судороги
- Есть расстройство настроения
- Есть состояние, связанное с гормональным балансом , например, заболевание щитовидной железы или остеопороз
Общие побочные эффекты
Поскольку глюкокортикоиды так или иначе влияют на многие клетки, ткани и органы, прием этих препаратов может иметь множество побочных эффектов, в том числе:
- Повышение артериального давления , уровень триглицеридов, холестерина или глюкозы
- Задержка воды, включая отек в ногах, лодыжках ноги или руки
- Повышенный аппетит и прибавка в весе
- Нежелательный рост волос
- Головная боль, головокружение и головокружение
- Перепады настроения
- Остеопороз, переломы костей
- Молочница (грибок) во рту
- Тонкая кожа
- Катаракта
- Глаукома
- Угри
- Более легкое заболевание или более медленное заживление ран (при длительном приеме лекарств)
Взаимодействие с другими лекарствами
Не принимайте глюкокортикоиды, если вы:
Также Узнайте у врача о глюкокортикоидах, если вы в настоящее время принимаете какие-либо лекарства от:
- Высокое кровяное давление
- Застойная сердечная недостаточность
- Отек
- Диабет
- Трансплантация органов
- Вирусная инфекция
- Ревматоидный артрит
Глюкокортикоиды
Abstract
Глюкокортикоиды (ГК) широко используются при воспалительных и аутоиммунных заболеваниях. болезни.Их механизм действия чаще всего основан на геномных эффектах, которые имеют как положительные, так и отрицательные последствия. Цель этого обзора — обсудить возможные осложнения и побочные эффекты, которые могут возникнуть при использовании ГХ. Многие из этих осложнений связаны с дозой и продолжительностью применяемой терапии. Обсуждаются научно обоснованные превентивные стратегии. Многие рекомендации основаны на мнении экспертов, а не на убедительных доказательствах. Мужчина 54 лет обратился по поводу слабости проксимальных отделов верхних и нижних конечностей.Сыпей нет. Антинуклеарные антитела отрицательны; скорость оседания эритроцитов и C-реактивный белок составляют 24 мм / ч и 3 мг / дл соответственно. Электромиография показывает потенциалы миопатических двигательных единиц с фибрилляцией, а биопсия мышцы подтверждает полимиозит. Начинается преднизолон в дозе 60 мг / сут. Какие риски связаны с использованием ГХ? Какие еще исследования и вмешательства следует провести у этого пациента, начинающего длительную терапию ГК?
Ключевые слова: аутоиммунные заболевания нервной системы, ревматология, клиническая специализация, васкулит, центральная нервная система, аутоиммунные заболевания нервной системы, миозит, нервно-мышечные заболевания
Введение
Глюкокортикоиды (ГК) часто являются первой линией терапия аутоиммунных заболеваний, включая многие неврологические состояния ().Их использование обычно связано с осложнениями и сопутствующими заболеваниями. К ним относятся как немедленные, так и отдаленные осложнения, которые часто связаны с дозой и кумулятивной дозой ГК. Обычно считается, что низкая доза составляет до 7,5 мг / сут, средняя доза составляет> 7,5 мг и <30 мг / сут, высокая доза составляет> 30 мг, но <100 мг / сут, а очень высокая доза считается более 100 мг / сут. г преднизолона. Считается, что пульс составляет от 250 до 1000 мг / сут в течение от 1 до 3 дней. 1 В следующем обзоре будут обобщены подтвержденные доказательствами эффекты ГК и обсуждены вопросы, которые следует решить, когда пациенту следует начать длительную терапию ГК.
Неврологические заболевания, при которых можно лечить глюкокортикоидами.
Глюкокортикоидная активность и период полураспада
Гидрокортизон и бетаметазон — самые слабые и самые сильные ГК соответственно. Бетаметазон и дексаметазон имеют длительный период полувыведения, и после прекращения приема ГК могут возникнуть побочные эффекты. описывает эффективность различных ГК.
Таблица 1.
Дозирование глюкокортикоидов и эквивалентность.
| Общее название | Фирменное наименование | Эквивалент дозы |
|---|---|---|
| Гидрокортизон | 4 мг | |
| 9014 | ||
| Метилпреднизилон | Солюмедрол | 0.8 мг |
| Дексаметазон | Декадрон | 0,15 мг |
| Бетаметазон | Целестон | 0,12 мг |
Механизм действия на клетки GC
и фагоцитарных клеток GC. , обладающие активностью как для врожденной, так и для приобретенной иммунной системы и, следовательно, обладающие эффективностью при широком диапазоне как аутоиммунных, так и аутовоспалительных заболеваний. Они действуют на клетки как геномными, так и негеномными механизмами.Доза определяет, какие эффекты возникают. Происходит активация цитозольного рецептора GC (cGCR) по классическому геномному механизму. Этот механизм приводит к подавлению провоспалительных молекул, называемых трансрепрессией , и усилению регуляции многих противовоспалительных молекул, называемым трансактивацией . Трансрепрессия является причиной многих желаемых эффектов GC, в то время как трансактивация связана со многими нежелательными побочными эффектами. Геномные эффекты занимают от нескольких часов до нескольких дней по сравнению с негеномными эффектами, которые происходят быстро от секунд до минут.Негеномные эффекты включают передачу сигналов GC через мембранно-ассоциированные рецепторы и вторичные мессенджеры. 2 Негеномные эффекты 3 гораздо более значительны при дозах более 100 мг / сут.Побочные эффекты
Увеличение веса и перераспределение жира
ГК связаны с увеличением веса. Это, вероятно, наиболее частый побочный эффект у пациентов, принимающих хронические ГК. 4 В исследовании ревматоидного артрита у пациентов, принимавших от 5 до 10 мг / сут в течение 2 лет, средняя масса тела увеличилась от 4% до 8%. 5 Считается, что это связано с повышенным аппетитом и диспепсией, которая облегчается во время еды. Перераспределение жира вызывает кушингоидный вид, включая ожирение туловища, буйволиный горб, усиление надключичных жировых подушечек и лунное лицо у пациентов, принимающих умеренные дозы преднизона в течение длительных периодов времени.
Остеопороз и переломы
Наблюдательные исследования показывают, что у 40% пациентов, принимающих ГК, разовьется перелом, связанный с потерей костной массы. Факторы риска, связанные с остеопорозом, вызванным GC, включают пожилой возраст (> 60 лет), низкий индекс массы тела (<24 кг / м 2 ), наличие основного хронического воспалительного заболевания (например, ревматоидного артрита), определенных генотипов рецепторов GC. , повышенная экспрессия 11β-гидроксистероиддегидрогеназы типа 1, более высокая доза GC, более длительная терапия и низкая минеральная плотность костей.Общие факторы риска остеопороза включают в себя как личный, так и семейный анамнез переломов (в частности, перелом бедра), курение, чрезмерное употребление алкоголя и частые падения. 6–8
Механизм GC-индуцированного остеопороза, по-видимому, связан с ингибирующим действием на формирование кости, а не с влиянием на резорбцию кости. В значительной степени это происходит из-за эффектов GC на происхождение остеобластов. 9,10 Это особенно интересно тем, что для лечения этого состояния используются такие агенты, как бисфосфонаты, которые предотвращают резорбцию кости.В исследовании, сравнивающем бисфосфонат, алендронат с терипаратидом (анаболическим агентом) при остеопорозе, вызванном ГК, минеральная плотность костей улучшалась больше у пациентов, получавших терипаратид. 11 Следует отметить, что эти пациенты были в среднем старше 50 лет и имели средний показатель Т для поясничного отдела позвоночника -2,5; следовательно, это следует рассматривать как вторичную профилактику остеопороза. Текущие рекомендации по-прежнему рекомендуют бисфосфонаты в качестве средств первой линии для первичной профилактики остеопороза, вызванного ГК.
Алгоритм предотвращения переломов (FRAX) Всемирной организации здравоохранения недооценивает риск переломов у пациентов, получающих терапию ГК. Поэтому FRAX следует использовать с осторожностью при определении вероятности перелома в этой группе пациентов. Хотя он учитывает использование ГК, он не учитывает дозу или продолжительность терапии. Преобладающие переломы обычно возникают в позвоночнике, но FRAX использует минеральную плотность костной ткани шейки бедренной кости.
В 2010 году Американский колледж ревматологии опубликовал руководство по профилактике и лечению остеопороза, вызванного ГК. 12 На основании этого руководства, если пациент (женщина в постменопаузе или мужчина старше 50 лет) относится к группе низкого риска (вероятность перелома <10%) и принимает дозу ≤7,5 мг / сут, фармакологическое вмешательство не рекомендуется. Если они относятся к среднему или высокому риску (на основе нескольких переменных плюс FRAX и вероятность перелома> 10%), рекомендуется фармакологическое вмешательство. Если пациент находится в пременопаузе или моложе, чем указанная выше мужская группа, то фармакологическое вмешательство рекомендуется, если есть хрупкий перелом у мужчины или женщины (не детородного возраста).Если у женщины в анамнезе есть хрупкие переломы и она находится в детородном возрасте, терапия рекомендуется только в том случае, если ГК назначаются на срок более 3 месяцев.
Профилактика остеопороза, вызванного ГК, должна включать адекватный уровень кальция и витамина D (1500 мг кальция и 800 МЕ витамина D в день, разделенная доза; уровень доказательности A). 12,13 Упражнения с отягощением важны для ремоделирования костей. Были изучены схемы ГК через день, но не было показано, что они вызывают меньшую потерю костной массы, чем ежедневные схемы. 14,15 Другие рекомендации, которые были предложены, но основаны на доказательствах уровня C, включают отказ от курения, употребление менее 2 алкогольных напитков в день, базовый уровень витамина D 25-OH, консультации по питанию по потреблению кальция и витамина D, падение оценка риска, базовая денситометрия костей и оценка хрупких переломов.
Остеонекроз
Остеонекроз встречается у 5–40% пациентов, получавших ГК. Это часто случается при более высоких дозах и более длительной терапии, но может происходить при кратковременном воздействии.Это сильнее связано с пиковой дозой ГК, чем с кумулятивной дозой, но редко встречается при дозах менее 20 мг / сут. Felson et al. Показали, что частота остеонекроза увеличивалась в 4,6 раза на каждые 10 мг / сут увеличения средней суточной дозы преднизона в течение первых 6 месяцев терапии. 16 Следует учитывать диагноз у пациентов с новой болью в суставах (чаще всего поражаются бедро, колено и плечо, но также могут поражать голеностопный сустав и позвоночник) при движении, обычно без отека или тепла.
Осложнения глаз
Катаракта обычно находится в заднем субкапсулярном месте и отличается от старческой катаракты тем, что часто бывает двусторонней и более прогрессирующей. Имеются некоторые данные, позволяющие предположить, что это редко происходит у пациентов, получавших дозу <10 мг / сут, или у тех, кто лечился менее 1 года. 17 Внутриглазное давление также может увеличиваться при применении ГК, но обычно в ответ на глазные капли ГК и редко — при применении системных ГК. Когда это действительно происходит с системными ГК, это обычно происходит у пациентов, уже находящихся в группе риска.Центральная серозная ретинопатия может возникать как при системном, так и при местном применении ГК. Отек может отделять сетчатку от сосудистой оболочки. Лечение заключается в снижении дозы ГК 18
Гипергликемия и диабет
У пациентов с известным диабетом гипергликемия чаще встречается у тех, кто принимает ГК. У пациентов с предиабетом может развиться гипергликемическое состояние при лечении ГК. Откровенный диабет редко возникает вторично по отношению к ГК. Уровень глюкозы натощак следует проверять у пациентов, начинающих терапию ГК, и можно учитывать уровень гемоглобина A1C для оценки преддиабетического состояния, которое может развиться в диабет на ГК. 19,20
Сердечно-сосудистые эффекты
Ишемическая болезнь сердца и сердечная недостаточность могут усиливаться у пациентов, принимающих хронические ГК. В популяционном исследовании соотношение частоты сердечной недостаточности, инфаркта миокарда, инсульта и транзиторных ишемических атак составило 3,7, 3,3, 1,7 и 7,4 соответственно. 21 Другое исследование с участием пациентов, подвергшихся и не подвергавшихся воздействию ГК, не выявило различий в сердечно-сосудистых событиях. 22 Большинство этих исследований проводилось на пациентах с ревматическими заболеваниями.У этих пациентов сложно контролировать активность заболевания, что может повлиять на эти результаты.
Сообщалось также об увеличении фибрилляции и трепетания предсердий у лиц, принимающих высокие дозы ГК, даже при контроле за легочными или сердечно-сосудистыми заболеваниями. 23–25 Однако низкие дозы ГК, по-видимому, снижают риск аритмий, как показано у пациентов, перенесших операцию коронарного шунтирования. 26
Некоторые исследования показывают, что умеренные или более высокие дозы преднизона способствуют задержке жидкости. 27 Другие исследования не подтвердили эту связь. 28,29 Гипертония была описана в связи с использованием ГК; однако эти данные могут быть искажены пациентами с ревматоидным артритом, у которых болезнь более серьезна. 30 Наблюдательные исследования показывают, что на липидный профиль отрицательно влияют дозы преднизона> 10 мг / сут; однако это не было подтверждено национальным образцом в США. Кроме того, другие исследования, в которых изучались умеренные дозы ГК, снижающиеся в течение 3 месяцев, не оказали отрицательного влияния на уровень липопротеинов. 31
Инфекция
Глюкокортикоиды снижают выработку провоспалительных цитокинов и влияют на функцию фагоцитов, тем самым повышая риск инфекции. Признаки заражения могут отсутствовать на фоне ГК. Существует дозозависимый (> 10 мг / сут) и кумулятивный дозозависимый (> 700 мг) риск инфицирования у тех, кто принимает ГК. 32 Другие факторы, такие как основное заболевание, активность заболевания, другие иммунодепрессанты, возраст пациента и функциональный статус, также влияют на этот риск. 33 Распространенные инфекции по-прежнему наиболее часто встречаются в этой группе пациентов. Это включает вирусные инфекции герпеса, бактериальные инфекции стафилококка и грибковые инфекции кандиды. Strongyloides stercoralis может реактивироваться, вызывая тяжелую, а иногда и смертельную гиперинфекцию. Оппортунистические инфекции могут возникать у тех, кто принимает хронические ГК, но обычно в сочетании с другими иммунодепрессантами. Pneumocystis carinii pneumonitis (PCP) может возникать при краткосрочном применении ГК в высоких дозах или хроническом применении в умеренных дозах.Однако это было изучено в форме систематического обзора, за которым последовал Кокрановский обзор. 34,35 Результаты показали, что профилактику PCP следует использовать, когда риск PCP составляет 3,5% или выше. Среди изученных аутоиммунных заболеваний только гранулематоз с полиангитом (ранее называвшийся гранулематозом Вегенера) приближается к этому риску и требует лечения. Единственными неврологическими заболеваниями, включенными в эти мета-анализы, были воспалительные миозиты, при которых риск ППЦ составлял 1,5%, не соответствуя показаниям для профилактики.Многие пульмонологи действительно лечат пациентов с помощью профилактики PCP при интерстициальном заболевании легких. Следует помнить, что, хотя миозит не является достаточно высоким риском для лечения, значительная часть пациентов страдает интерстициальным заболеванием легких.
Вероятность развития туберкулеза (ТБ) в условиях ГК оценивается в 4: 1. Эти данные поступают из британской системы медицинских записей, где случаи заболевания ТБ были подтверждены, а контроли сопоставлялись с несколькими переменными. 36 Этот риск, вероятно, повышен, особенно у пациентов с основным заболеванием легких. В настоящее время Центр по контролю за заболеваниями не рекомендует лечение латентной туберкулезной инфекции у пациентов, получающих хронические ГК, потому что, хотя они признают, что риск выше у этих пациентов, они не могут точно указать пороговую дозу и продолжительность ГК, которые увеличивают риск. 37 Следует также учитывать, что реакция на туберкулиновую кожную пробу будет ослаблена, когда пациент будет принимать ГК в дозе 15 мг или более в день в течение 2–4 недель.
Ответ на вакцинацию обычно сохраняется у тех, кто постоянно принимает низкие или средние дозы ГК, хотя может наблюдаться ослабленный ответ на более высокие дозы. Живые вакцины противопоказаны при дозах более 20 мг преднизона в день. Пациентам, которые принимали ГК в высоких дозах в течение 2 недель или более, рекомендуется сделать трехмесячный период ожидания после прекращения приема ГК перед проведением живой вакцинации. 37
Желудочно-кишечные осложнения
Доказательств того, что использование ГК увеличивает риск язвенной болезни, мало.Однако у пациентов, принимающих нестероидные противовоспалительные препараты (НПВП) с ГК, риск язвенной болезни увеличивается в 4 раза по сравнению с 2-кратным риском развития язвы при приеме только НПВП. Первоначальная ассоциация 38 затем была отброшена метаанализами. 39 Во вложенном исследовании случай – контроль повышенный риск был связан с добавлением НПВП к терапии ГК. 40 Таким образом, противоязвенная терапия не показана пациентам, принимающим ГК, если они также не принимают НПВП.
Миопатия, индуцированная стероидами
Это редкое осложнение, которое еще реже возникает при низких дозах преднизона. Он часто проявляется слабостью проксимальных отделов нижних конечностей и нормальной креатининкиназой. Электромиограмма обычно в норме. Гистопатология показывает потерю волокон типа IIa. Мышечная сила улучшается по мере уменьшения дозы стероидов.
Подавление оси гипоталамус – гипофиз – надпочечники
Это происходит в зависимости от дозы и продолжительности использованных ГК. Большинство пациентов с аутоиммунными заболеваниями, которым требуются ГК, будут подавлены из-за большой продолжительности терапии и относительно более высоких доз, которые требуются изначально.В целом, пациенты, получающие примерно 10 мг / сут преднизона в течение 3 недель или более, должны считаться подавленными, и им следует назначать стрессовые дозы стероидов в соответствующей ситуации. Некоторые утверждают, что эти пациенты должны носить браслет с медицинским предупреждением, и в руководствах рекомендуется, чтобы пациенты, принимающие хронические ГК, имели при себе карточку с информацией о неотложной медицинской помощи, хотя это считается доказательством IV уровня и основывается исключительно на мнении экспертов. 20 Снижение дозы ГК следует проводить медленно, чтобы обеспечить восстановление функции надпочечников.Тем не менее, насколько медленно — это вопрос стиля практики и не основывается на доказательствах. Как правило, от 60 мг до 20 мг пациенты снижают дозу на 10 мг каждые 2 недели. В диапазоне от 20 до 10 мг пациенты уменьшаются на 2,5 мг каждые 2 недели и ниже 10 мг, пациенты снижаются на 1 мг в месяц.
Психиатрические осложнения
Психиатрические проявления, связанные с использованием ГК, относительно распространены и варьируются от легкой тревоги и нарушения сна до тяжелых расстройств настроения, психотической депрессии и делирия. 41 Неудивительно, что проявления обычно возникают при более высоких дозах. Наиболее частыми симптомами являются гипомания и мания. 42–47 Депрессия усиливается с продолжительностью терапии ГК. 48–50 Когнитивная дисфункция, особенно связанная с декларативной или вербальной памятью, хорошо описана 51–57 Хотя эти проявления часто проходят при постепенном снижении дозы стероидов, для контроля симптомов часто необходимо фармакологическое вмешательство. Следует также помнить, что из-за длительного периода полувыведения дексаметазона и бетаметазона появление симптомов может произойти после прекращения приема ГК.
Остеопероз, вызванный глюкокортикоидами
Вы можете узнать, есть ли у вас остеопороз, выполнив простой тест, измеряющий минеральную плотность костной ткани — иногда называемый МПК. BMD — количество костей в определенной области — измеряется в разных частях вашего тела. Часто измерения проводятся на позвоночнике и бедре, включая часть бедра, называемую шейкой бедра, в верхней части бедренной кости (бедренной кости). Двухэнергетическая рентгеновская абсорбциометрия (называемая DXA и произносится как «dex-uh») — лучший современный тест для измерения МПК.
Обследование быстрое и безболезненное. Он похож на рентгеновский, но использует гораздо меньше излучения. Даже в этом случае беременным женщинам не следует проходить этот тест, чтобы избежать риска причинения вреда плоду.
результатов теста DXA сравнивают с МПК молодых здоровых людей. Эта информация приводит к измерению, называемому Т-баллом. Подсчет очков выглядит следующим образом:
| Т-показатель DXA | Минеральная плотность кости (BMD) |
|---|---|
| Не ниже –1.0 | Нормальный |
| Между –1,0 и –2,5 | Остеопения (умеренная потеря МПК) |
| –2,5 или ниже | Остеопороз |
Риск перелома чаще всего ниже у людей с остеопенией, чем у людей с ОП. Но если потеря костной массы продолжается, риск перелома увеличивается. Тем не менее, люди, принимающие глюкокортикоиды, похоже, подвергаются повышенному риску переломов при более высокой плотности костей, чем можно было бы ожидать.
Как лечится остеопороз, вызванный глюкокортикоидами?
Как врачи, являющиеся экспертами в диагностике и лечении заболеваний суставов, мышц и костей, ревматологи могут помочь найти причину остеопороза. Они могут предоставить и проконтролировать лучшие методы лечения этого состояния.
Каждый, кто принимает глюкокортикоиды, должен получать достаточно кальция и витамина D. Американский колледж ревматологии рекомендует ежедневно принимать не менее 1200 мг кальция и от 800 до 1000 международных единиц (называемых МЕ) добавок витамина D.Ваш врач может измерить уровень витамина D в вашей крови, чтобы узнать, нужны ли вам дополнительные добавки витамина D.
Некоторым людям также потребуются лекарства. Решение начать прием лекарств по рецепту будет зависеть от других ваших факторов риска, дозы глюкокортикоидов, которые вы принимаете, и от того, как долго вы можете их принимать, а также от результатов вашей МПК по DXA.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (более известное как FDA) одобрило определенные препараты для профилактики и лечения остеопороза, вызванного глюкокортикоидами.Из класса препаратов, называемых бисфосфонатами, алендронат (Fosamax), ризедронат (Actonel) и золедроновая кислота (Reclast) одобрены FDA как для профилактики, так и для лечения остеопороза, вызванного глюкокортикоидами.
Терипаратид (Фортео), препарат другого типа, также одобрен для лечения остеопороза, вызванного глюкокортикоидами. Эта искусственная форма паратироидного гормона помогает стимулировать образование костей.
Женщины, планирующие беременность, должны поговорить со своим врачом о плюсах и минусах использования бисфосфонатов или терипаратидов.Ни один из отпускаемых по рецепту лекарств для лечения остеопороза не имеет достаточных данных о безопасности, чтобы рекомендовать их использование беременными или кормящими грудью женщинами.
глюкокортикоидов — обзор | Темы ScienceDirect
Роль GC и их рецепторов
GC, которые секретируются в ответ на стресс, существуют в различных формах и могут быть обнаружены в различных циркулирующих концентрациях у разных видов. У людей преобладающим GC является кортизол, в отличие от грызунов, у которых преобладающим GC является кортикостерон.Тем не менее, как люди, так и грызуны синтезируют и свои не преобладающие ГК. 1,2 Интересно, что как у людей, так и у грызунов кортикостерон может относительно легко преодолевать гематоэнцефалический барьер, в то время как кортизол сталкивается с сопротивлением при попадании в мозг с помощью переносчика оттока Р-гликопротеина. Эта эндогенная барьерная система поддерживает более высокое соотношение кортикостерона к кортизолу в головном мозге, чем в плазме крови, что указывает на то, что, хотя кортикостерон не является преобладающим глюкокортикоидом у людей, он может играть важную, еще не полностью решенную роль в функции мозга. 3,4 Однако вопрос о соотношении ГХ в организме является избыточным, без учета их доступности. По большей части эти гормоны связаны с кортикостероидсвязывающим глобулином (CBG), оставляя только относительно небольшую часть (<10%) оставшихся GC в виде свободного гормона. Хотя ГК, связанные с КБГ, биологически неактивны, именно несвязанные гормоны способны оказывать физиологические эффекты. Недавние исследования показали, что секвестрация гормона CBG играет важную регулирующую роль в определении амплитуды ответа GC на стресс.Было обнаружено, что CBG выделялся из печени в кровоток после воздействия умеренных и тяжелых стрессоров, таких как принудительное плавание. Это увеличение концентрации CBG в плазме привело к увеличению связывания GC, тем самым контролируя, сколько свободного гормона было биологически доступно в плазме после стресса. Этот механизм позволяет точно настроить физиологический ответ GC и согласовать его с другими чувствительными к GC ответами на стрессор. 5
Помимо участия в реакции на стресс, GC обладают естественным циркадным ритмом.Под контролем Цайтгебера супрахиазматического ядра ГК секретируются импульсами, и результирующая концентрация гормона колеблется с пиком, наблюдаемым непосредственно перед началом активной фазы организма, и надиром во время фазы покоя / сна. 6 Поддержание этого ритма, по-видимому, жизненно важно для нейроэндокринных реакций, как это наблюдалось в исследованиях на грызунах. Если пульсирующий способ секреции GC переключен на постоянное введение, то организм демонстрирует притупленный ответ на стресс 7 и нарушение долговременной потенциации в гиппокампе. 8 Хотя относительно меньше исследований было проведено по последствиям нарушения циркадных ритмов ГК у людей, изменения в динамике пульса наблюдались как при депрессии 9 , так и при апноэ во сне. 10 Недавнее исследование, посвященное измерениям свободного кортизола у людей за пределами исследовательского центра, показывает замечательную стабильность, сохраняемую в импульсах кортизола в течение 3-дневного периода, что еще раз подчеркивает важность ультрадианного и циркадного ритма GC. 11
Глюкокортикоиды
Глюкокортикоиды
В отличие от потери минералокортикоидов, неспособность производить глюкокортикоиды не представляет серьезной угрозы для жизни. Тем не менее, потеря или значительное уменьшение секреции глюкокортикоидов приводит к состоянию нарушенного метаболизма и неспособности справляться со стрессовыми факторами, которые, если их не лечить, являются фатальными.
Помимо их физиологического значения, глюкокортикоиды также являются одними из наиболее часто используемых лекарств и часто назначаются из-за их противовоспалительных и иммунодепрессивных свойств.
Кортизоловые и глюкокортикоидные рецепторы
Подавляющее большинство глюкокортикоидов у большинства млекопитающих связано с кортизолом , также известным как гидрокортизон. Кортикостерон, основной глюкокортикоид у грызунов, является еще одним глюкокортикоидом.
Кортизол связывается с рецептором глюкокортикоидов в цитоплазме, а комплекс гормон-рецептор затем перемещается в ядро, где он связывается со своим ответным элементом ДНК и модулирует транскрипцию большой батареи генов, что приводит к изменениям фенотипа клетки.Геномический анализ показывает, что 29% генов человека имеют элемент ответа на глюкокортикоиды, что объясняет огромное количество эффектов, которые глюкокортикоиды оказывают на физиологию.
Только около 10% циркулирующего кортизола свободно. Оставшаяся часть циркулирует связанными с белками плазмы, особенно с кортикостероидсвязывающим глобулином (транскортином). Это связывание с белками, вероятно, снижает скорость метаболического клиренса глюкокортикоидов и, поскольку связанный стероид не является биологически активным, имеет тенденцию действовать как буфер и притуплять дикие колебания концентрации кортизола.
Физиологические эффекты глюкокортикоидов
Кажется, не существует клеток, в которых отсутствуют рецепторы глюкокортикоидов, и, как следствие, эти стероидные гормоны оказывают огромное влияние на физиологические системы. При этом можно утверждать, что наиболее известные и изученные эффекты глюкокортикоидов связаны с метаболизмом углеводов и иммунной функцией.
Влияние на метаболизм
Название глюкокортикоид происходит из ранних наблюдений, что эти гормоны участвуют в метаболизме глюкозы.В голодном состоянии кортизол стимулирует несколько процессов, которые в совокупности служат для повышения и поддержания нормальной концентрации глюкозы в крови. Эти эффекты включают:
- Стимуляция глюконеогенеза, особенно в печени: Этот путь приводит к синтезу глюкозы из негексозных субстратов, таких как аминокислоты и липиды, и особенно важен для плотоядных и некоторых травоядных. Повышение экспрессии ферментов, участвующих в глюконеогенезе, вероятно, является наиболее известной метаболической функцией глюкокортикоидов.
- Мобилизация аминокислот из внепеченочных тканей: Они служат субстратами для глюконеогенеза.
- Ингибирование поглощения глюкозы мышечной и жировой тканью: Механизм сохранения глюкозы.
- Стимуляция распада жира в жировой ткани: Жирные кислоты, высвобождаемые при липолизе, используются для производства энергии в таких тканях, как мышцы, а высвобожденный глицерин обеспечивает еще один субстрат для глюконеогенеза.
Влияние на воспаление и иммунную функцию
Глюкокортикоиды обладают сильными противовоспалительными и иммунодепрессивными свойствами.Это особенно очевидно, когда они вводятся в фармакологических дозах, но также важно для нормального иммунного ответа. Как следствие, глюкокортикоиды широко используются в качестве лекарств для лечения воспалительных состояний, таких как артрит или дерматит, и в качестве дополнительной терапии для таких состояний, как аутоиммунные заболевания.
Ранние проявления недостаточности глюкокортикоидов, которые могут быть серьезными, включают чрезмерную секрецию ряда воспалительных цитокинов. Это отражает нормальную роль кортизола в подавлении цитокиновых ответов.
Другие эффекты глюкокортикоидов
Глюкокортикоиды оказывают множественное влияние на развитие плода. Важным примером является их роль в содействии созреванию легких и выработке сурфактанта, необходимого для внематочной функции легких. Мыши с гомозиготными нарушениями в гене рилизинг-гормона кортикотропина (см. Ниже) умирают при рождении из-за незрелости легких.
Известно, что несколько аспектов когнитивной функции стимулируют секрецию глюкокортикоидов и зависят от глюкокортикоидов.Страх является интересным примером этого. Стимулы, вызывающие страх, приводят к секреции глюкокортикоидов из надпочечников, и лечение фобических людей глюкокортикоидами перед стимулом, вызывающим страх, может притупить реакцию страха.
Избыточный уровень глюкокортикоидов в результате применения лекарственного средства или гиперадренокортицизма оказывает влияние на многие системы. Некоторые примеры включают ингибирование образования костей, подавление абсорбции кальция и замедленное заживление ран.Эти наблюдения предполагают множество менее драматических физиологических ролей глюкокортикоидов.
Контроль секреции кортизола
Кортизол и другие глюкокортикоиды секретируются в ответ на единственный стимулятор: адренокортикотропный гормон (АКТГ) из передней доли гипофиза. АКТГ сам секретируется под контролем гипоталамического пептида кортикотропин-рилизинг-гормона (CRH). Таким образом, центральная нервная система является главой и главой глюкокортикоидных реакций, являясь прекрасным примером тесной интеграции между нервной и эндокринной системами.
Практически любой тип физического или психического стресса приводит к повышению концентрации кортизола в крови из-за повышенной секреции CRH в гипоталамусе. Этот факт иногда затрудняет оценку уровня глюкокортикоидов, особенно у животных. Наблюдение за подходом флеботомиста и, особенно, ограничение забора крови — это достаточный стресс, чтобы искусственно поднять уровень кортизола в несколько раз!
Секреция кортизола подавляется классическими петлями отрицательной обратной связи.Когда концентрация в крови превышает определенный порог, кортизол подавляет секрецию CRH гипоталамусом, что отключает секрецию АКТГ, что приводит к отключению секреции кортизола надпочечниками. Комбинация положительного и отрицательного контроля секреции CRH приводит к пульсирующей секреции кортизола. Обычно амплитуда и частота пульса самые высокие утром и самые низкие ночью.
АКТГ связывается с рецепторами плазматической мембраны клеток zona fasiculata и reticularis надпочечников.Взаимодействие гормона с рецептором активирует аденилциклазу, что приводит к повышенным внутриклеточным уровням циклического АМФ, что в конечном итоге приводит к активации ферментных систем, участвующих в биосинтезе кортизола из холестерина.
Болезненные состояния
Наиболее распространенным заболеванием, связанным с глюкокортикоидами, у человека и животных является гиперадренокортицизм или болезнь Кушинга . Избыточный уровень глюкокортикоидов наблюдается в двух ситуациях:
- Чрезмерное эндогенное производство кортизола , которое может быть результатом первичного дефекта надпочечников (АКТГ-независимый) или чрезмерной секреции АКТГ (АКТГ-зависимый).
- Введение глюкокортикоидов в лечебных целях. Это частый побочный эффект этих широко используемых препаратов.
Болезнь Кушинга широко влияет на обмен веществ и функции органов, что неудивительно, учитывая повсеместное распространение рецепторов глюкокортикоидов. Это заболевание сопровождается разнообразным набором клинических проявлений, включая гипертонию, явное ожирение, мышечное истощение, тонкую кожу и метаболические аберрации, такие как диабет.
Недостаточная выработка кортизола, часто сопровождающаяся дефицитом альдостерона, называется гипоадренокортицизмом или болезнью Аддисона . Чаще всего это заболевание возникает в результате инфекционного заболевания (например, туберкулеза у человека) или аутоиммунного разрушения коры надпочечников. Как и болезнь Кушинга, болезнь Аддисона сопровождается многочисленными и разнообразными клиническими признаками, включая сердечно-сосудистые заболевания, летаргию, диарею и слабость. Дефицит альдостерона может представлять серьезную угрозу для жизни из-за нарушений электролитного баланса и сердечной функции.
Обновлено в октябре 2019 г. Отправляйте комментарии по адресу [email protected]
Определение и примеры глюкокортикоидов — Биологический онлайн-словарь
Определение
существительное, множественное число: глюкокортикоиды
Любая группа кортикостероидов, участвующих в метаболизме углеводов (например, глюконеогенез, отложение гликогена в печени, повышение уровня сахара в крови и т. Д.) с противовоспалительными свойствами
Дополнение
Кортикостероиды относятся к группе стероидных гормонов, которые естественным образом вырабатываются в коре надпочечников стероидогенезом в ответ на высвобождение адренокортикотропина или адренокортикотропного гормона из гипофиза.Кортикостероиды можно разделить на две основные группы в зависимости от их преобладающей биологической активности: (1) глюкокортикоиды и (2) минералокортикоиды.
Глюкокортикоид — это вещество (лекарственное средство или гормон), участвующее в углеводном обмене. Например, он способствует глюконеогенезу, то есть метаболическому процессу, в котором глюкоза образуется из неуглеводных предшественников. Он усиливает экспрессию ферментов, необходимых для глюконеогенеза.
Глюкокортикоид также участвует в отложении гликогена в печени и в повышении уровня сахара в крови.Помимо углеводов, он также играет роль в метаболизме жиров и белков. Он также участвует в поддержании артериального давления и изменении реакции соединительной ткани на травму. Он также обладает противовоспалительными и иммунодепрессивными свойствами. Например, он уменьшает количество циркулирующих лимфоцитов.
Глюкокортикоиды продуцируются в основном в пучковой зоне коры надпочечников, особенно в ответ на стресс. Они попадают в кровоток и попадают в клетки-мишени.Они оказывают свое действие на клетку, связываясь с рецептором глюкокортикоидов. Комплекс приводит к усилению экспрессии противовоспалительных белков и снижению экспрессии провоспалительных белков.
Примерами глюкокортикоидов являются преднизолон, метилпреднизолон, гидрокортизон, бетаметазон и дексаметазон.
Синтетические глюкокортикоиды используются в медицине для лечения дефицита глюкокортикоидов и подавления сверхактивной иммунной системы.Возможные побочные эффекты включают замедленное заживление ран, мышечную слабость, повышенный риск инфекции, подавление абсорбции кальция и ингибирование образования костей.
Происхождение слова: портманто из glu (cose), cort (ex) и (ster) oid
Аббревиатура / Акроним:
Синоним (ы):
См. Также:
Связанные термины:
Последнее обновление 1 марта 2021 года
Восстановление баланса глюкокортикоидов при стрессе
Хотя мы часто ассоциируем термин «стресс» с тревогой, на самом деле этот термин охватывает любую проблему, которая может нарушить гомеостаз.Сюда входят факторы физического стресса, такие как инфекция или травма. Все физиологические потребности в ответ на эти разнообразные проблемы опосредуются — по крайней мере частично — глюкокортикоидным кортизолом.
ФИЗИОЛОГИЧЕСКИЕ ДЕЙСТВИЯ
Глюкокортикоиды — это стероидные гормоны холестерина, синтезируемые и секретируемые надпочечниками. Они обладают противовоспалительным действием во всех тканях и контролируют метаболизм в мышцах, жирах, печени и костях.Глюкокортикоиды также влияют на тонус сосудов, а в головном мозге влияют на настроение, поведение и циклы бодрствования и сна.
Избыток глюкокортикоидов (из-за патологии, такой как синдром Кушинга или назначенные синтетические глюкокортикоиды) может вызывать иммуносупрессию, атрофию мышц, центральное ожирение, гепатостеатоз, остеопороз, инсулинорезистентность, гипертензию, депрессию и бессонницу.
Следовательно, повышенный уровень глюкокортикоидов может быть вредным, и поэтому их производство находится под строгим контролем оси гипоталамус-гипофиз-надпочечники (HPA) (рис. 1).Активация гипоталамуса инициирует высвобождение кортикотропин-рилизинг-гормона (CRH), который, в свою очередь, дает сигнал передней доле гипофиза о высвобождении адренокортикотропина (ACTH). Затем это дает сигнал кортикальному слою надпочечников высвобождать глюкокортикоиды, которые могут действовать на периферические ткани.
Со временем повышенное количество циркулирующих глюкокортикоидов возвращается в гипоталамус и гипофиз, блокируя дальнейшее высвобождение CRH и ACTH соответственно, что ингибирует высвобождение глюкокортикоидов.Как следствие, глюкокортикоиды секретируются пульсирующе и демонстрируют суточный ритм, при котором уровень циркулирующих гормонов достигает пика в начале пробуждения.
ПОДДЕРЖАНИЕ БАЛАНСА
В контексте поддержания нормального гомеостаза суточный пик глюкокортикоидов очень важен. Переходный пик повышает сосудистый тонус и бдительность, мобилизует энергию и оказывает стимулирующее действие на иммунную систему. По сути, утренняя доза кортизола подготовит вас к решению потенциальных проблем в течение дня.
Стрессы, возникающие в течение дня, могут вызывать дополнительные импульсы глюкокортикоидов из надпочечников, которые вызывают устойчивый повышенный уровень глюкокортикоидов. Это вызывает тот же физиологический ответ, но с большей силой. Например, в контексте «борьбы или бегства» глюкокортикоиды повышают сосудистый тонус и бдительность, мобилизуют энергию (готовят вас к бегу) и заряжают иммунную систему (готовят вас к травмам). Эти подготовительные эффекты увеличивают вероятность преодоления стрессора и быстрого восстановления нормального гомеостаза.
Кажется парадоксальным, что мощный иммунодепрессивный гормон стимулирует иммунную систему, но облегчение активации иммунных клеток полезно. Это увеличивает способность иммунной системы обнаруживать патогены / травмы и соответствующим образом реагировать, а также способствует разрешению и восстановлению для восстановления баланса. Однако в контексте хронической инфекции или заболевания роль глюкокортикоидов меняется, чтобы предотвратить эскалацию и ограничить ущерб.
Глюкокортикоиды действуют непосредственно на клетки поврежденной ткани, блокируя выработку воспалительных сигналов (цитокинов, хемокинов), которые привлекают иммунные клетки.Они действуют непосредственно на иммунные клетки, подавляя их способность проникать в ткань, а в некоторых типах клеток вызывают их гибель. Глюкокортикоиды также способствуют активации иммунных клеток-скавенджеров, которые помогают удалять клеточный мусор, способствуют восстановлению и предотвращают длительное повреждение (например, фиброз). На клеточном уровне глюкокортикоиды способны контролировать метаболизм, воспаление, адгезию, миграцию и выживание клеточно-специфическим и контекстно-зависимым образом.
МЕХАНИЗМ ДЕЙСТВИЯ
Глюкокортикоиды опосредуют свои клеточные эффекты через связывание и активацию рецептора глюкокортикоидов (GR), который экспрессируется почти в каждой ткани.Глюкокортикоиды проникают в клетку, связывают и активируют GR, который затем перемещается в ядро.
GR может связывать ДНК непосредственно с элементами специфического ответа на глюкокортикоиды (GRE), а затем привлекать коактиватор или корепрессор для увеличения или уменьшения экспрессии генов-мишеней. GR может также связываться или связываться с другими ДНК-связанными факторами транскрипции и модулировать их способность изменять экспрессию генов (рис. 2).
Конкретные гены, которыми GR может управлять, и, следовательно, клеточные процессы, которые могут регулировать глюкокортикоиды, в значительной степени определяются способностью GR связываться.Это добавляет дополнительный уровень контроля, поскольку доступность генов, экспрессия и активность факторов транскрипции зависят от клетки и динамически регулируются.
Например, специфические для печени факторы транскрипции, такие как HNF4 (ядерный фактор гепатоцитов 4), способствуют связыванию GR с (и регуляции) метаболических генов, тогда как специфические для макрофагов факторы транскрипции, такие как PU.1, привлекают GR к генам, важным для иммунитета.
Глюкокортикоидные ответы, таким образом, настраиваются с учетом контекста.Таким образом глюкокортикоиды могут контролировать метаболизм в печени, активацию макрофагов и способствовать гибели Т-клеток.
GR также рекрутируется провоспалительным фактором транскрипции NFκB (ядерный фактор-κB). В отличие от HNF4 и PU.1, NFκB экспрессируется в каждой клетке, но связывает ДНК только при активации в ответ на патоген или повреждение ткани. Следовательно, GR рекрутируется (и ингибирует) провоспалительные гены, только если NFκB активирован. Это объясняет, почему ГР (и глюкокортикоиды) являются мощным ингибитором воспаления только при необходимости: i.е. когда воспаление уже присутствует.
Таким образом, глюкокортикоиды(через GR) идеально адаптированы для интеграции входящих сигналов от других путей, чтобы надлежащим образом реагировать на каждый конкретный вызов. Нам еще предстоит пройти долгий путь, чтобы полностью понять весь спектр действия глюкокортикоидов. Однако теперь у нас есть некоторое представление о том, как, добавив несколько дополнительных точек контроля, глюкокортикоиды могут координировать различные клеточные эффекты для достижения общей цели: восстановления баланса после стресса.

