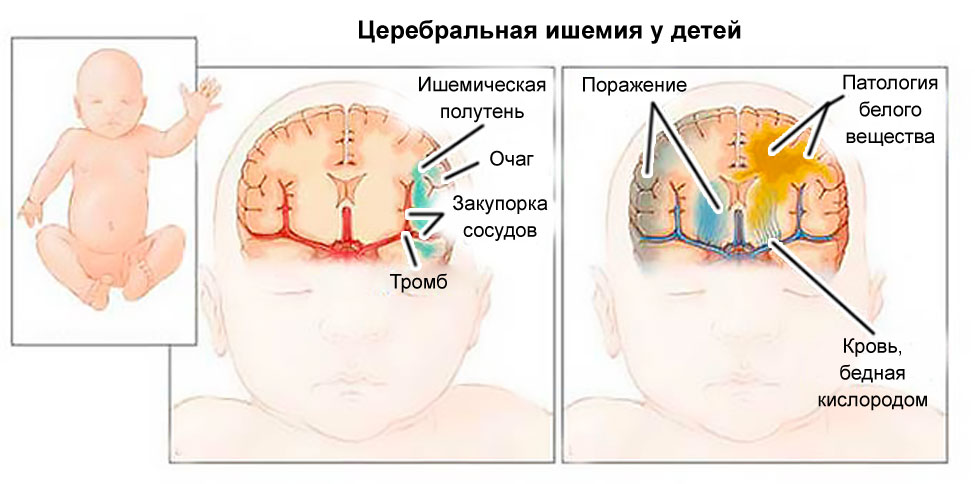
Гипоксически-ишемическое поражение: Причины развития, диагностика
Гипоксически-ишемическое поражение (ГИП) ЦНС – это комплекс изменений в организме ребенка, возникающий вследствие недостаточного снабжения кислородом органов и тканей. Гипоксия на ранних сроках (6-11 недель) может привести к аномалиям развития структур головного мозга плода, а на поздних стадиях – к задержке внутриутробного развития, поражению ЦНС и снижению адаптационных возможностей малыша после рождения.
Основные причины развития ГИП ЦНС:
— анемия у мамы (снижение количества гемоглобина, при котором снижается доставка кислорода и питательных веществ к тканям организма малыша)
— любые хронические заболевания и пороки: врожденные пороки сердца, легких других органов, заболевания почек, наличие сахарного диабета, которые способствуют нарушению кровообращения
— осложнения беременности и родов (гестоз, угроза преждевременных родов, патология плаценты и пуповины, недонашивание и перенашивание беременности, многоплодная беременность, многоводие и маловодие, различные аномалии родовой деятельности)
— заболевания плода (гемолитическая болезнь новорожденных, внутриутробное инфицирование, кровотечения)
Ощутимые признаки гипоксии плода преимущественно выражаются в изменении его двигательной активности (внезапное усиление, учащение сердцебиения и движений (шевеления) плода при острой или урежение и ослабление их же при хронической гипоксии). При выявлении диагноза внутриутробная гипоксия плода, будущей маме необходимо проведение процедур по выявлению причин с последующим комплексным лечением их источника с возможной госпитализацией в стационар, соблюдением постельного или домашнего режима и режима дня.
При выявлении диагноза внутриутробная гипоксия плода, будущей маме необходимо проведение процедур по выявлению причин с последующим комплексным лечением их источника с возможной госпитализацией в стационар, соблюдением постельного или домашнего режима и режима дня.
Диагностика:
Необходимо проведение ультразвукового исследования плода, применение кардиотокографии (запись сердечной деятельности плода) и доплерометрии (исследование кровотока сосудов матки и пуповины плода) с той частотой, которой назначит лечащий врач. Также применяются аускультация (выслушивание) сердцебиения плода стетоскопом.
Следует отметить, что не каждая беременность протекает на фоне вышеперечисленных заболеваний, осложняя внутриутробную гипоксию плода. Чтобы не допустить возможного появления гипоксии, особое внимание уделяется ее профилактике: длительные прогулки на свежем воздухе, обязательные дозированные физические нагрузки (гимнастика, зарядка, упражнения для беременных и дыхательные упражнения, плавание, йога). Возможно применение гипербарической оксигенации (ГБО) по назначению лечащего врача. Необходимо помнить, что лечение должно быть назначено гинекологом, быть комплексным и учитывать индивидуальный подход к каждой будущей маме.
Возможно применение гипербарической оксигенации (ГБО) по назначению лечащего врача. Необходимо помнить, что лечение должно быть назначено гинекологом, быть комплексным и учитывать индивидуальный подход к каждой будущей маме.
— вялое сосание груди, поперхивание при кормлении, вытекание молока через носик малыша
— слабый крик ребенка, гнусавый или осиплый голос
— снижение двигательной активности ребенка, сонливость, вялость или выраженное беспокойство
— дрожание подбородка, верхних и/или нижних конечностей, частые вздрагивания
— трудности при засыпании, частые пробуждения во сне
— запрокидывание головы
— замедление или быстрое увеличение окружности головы
— низкий (дряблые мышцы) или высокий тонус мышц конечностей и туловища
— уменьшение активности движений руки или ноги с какой-либо стороны, ограничение разведения бедер или наличие позы «лягушки» с выраженным разведением бедер, необычная поза ребенка
— косоглазие, кривошея
— рождение ребенка путем кесарева сечения, в тазовом предлежании, с аномалием родовой деятельности или с применением акушерских щипцов, выдавливанием, с обвитием пуповины вокруг шеи
— недоношенность ребенка
— наличие судорог при родах или в послеродовом периодеПоздние симптомы проявления родового травматизма
Бывают случаи, когда при рождении у малыша имеются минимальные нарушения, но спустя годы, под влиянием тех или иных нагрузок – физических, умственных, эмоциональных – неврологические нарушения проявляются с различной степенью выраженности.
— снижение мышечного тонуса (гибкость), которая так часто является дополнительным плюсом при занятиях спортом. Нередко таких детей с радостью принимают в секции спортивной и художественной гимнастики, в хореографические кружки. Но большинство из них не выносят тех физических нагрузок, которые имеют место быть в данных секциях.
— снижение остроты зрения, наличие асимметрии надплечий, углов лопаток, искривления позвоночника, сутулости – признаков возможной родовой травмы шейного отдела позвоночника
-возникновение головных болей, головокружения
Перинатальные поражения ЦНС — ПроМедицина Уфа
Диагноз «перинатальное поражение ЦНС» объединяет большую группу различных по причине и происхождению поражений головного и спинного мозга, возникающих во время беременности, родов и в первые дни жизни малыша.
От 5 до 55% детей первого года жизни получают такой диагноз, поскольку в это число иногда включают детей с лёгкими преходящими нарушениями со стороны нервной системы. Тяжёлые формы перинатальных поражений ЦНС наблюдаются у 1,5–10% доношенных и у 60–70% недоношенных детей.
Тяжёлые перинатальные поражения мозга (в том числе внутричерепные кровоизлияния, тяжёлая ишемия мозга) представляют реальную угрозу для жизни и здоровья ребёнка, даже при своевременно оказанной высококвалифицированной медицинской помощи в условиях перинатального центра. Среднетяжёлые и лёгкие формы поражения мозга непосредственной угрозы для жизни не представляют, но они могут быть причиной нарушений психики и развития двигательной активности у ребёнка.
Причины
Основная причина перинатального поражения ЦНС у плода и новорождённого — гипоксия (кислородная недостаточность), возникающая под влиянием различных факторов. Неблагоприятные условия для развития плода в утробе матери могут быть заложены задолго до наступления беременности вследствие различных заболеваний у девочки-подростка, будущей матери. Инфекционные и неинфекционные заболевания, гормональные нарушения, вредные привычки, производственные вредности во время беременности вызывают усиление гипоксии будущего ребёнка. Предшествующие аборты приводят к нарушению кровотока между матерью и плодом и, следовательно, к внутриутробной гипоксии.
Инфекционные и неинфекционные заболевания, гормональные нарушения, вредные привычки, производственные вредности во время беременности вызывают усиление гипоксии будущего ребёнка. Предшествующие аборты приводят к нарушению кровотока между матерью и плодом и, следовательно, к внутриутробной гипоксии.
Важную роль в развитии перинатальных поражений ЦНС играют инфекции, передающиеся половым путём (хламидиоз, герпес, сифилис).
Причиной острой асфиксии в родах могут быть различные нарушения нормального течения родов, стремительные или затяжные роды, неправильное положение петель пуповины. Механическая травма ребёнка реже приводит к перинатальному повреждению ЦНС (особенно головного мозга).
Симптомы
При легких повреждениях ЦНС у новорожденных наиболее часто отмечается синдром повышенной нервно-рефлекторной возбудимости, который проявляется вздрагиванием, повышением или понижением мышечного тонуса, усилением рефлексов, тремором (дрожанием) подбородка и конечностей, беспокойным поверхностным сном, частым «беспричинным» плачем.
При поражении ЦНС средней степени тяжести в первые дни жизни дети чаще имеют угнетение ЦНС в виде снижения двигательной активности и снижения мышечного тонуса, ослабления рефлексов новорожденных, в том числе рефлексов сосания и глотания. К концу 1-го месяца жизни угнетение ЦНС постепенно исчезает, а у некоторых детей сменяется повышенным возбуждением.
При средней степени поражения ЦНС наблюдаются нарушения в работе внутренних органов и систем в виде неравномерной окраски кожи (мраморность кожи) вследствие несовершенства регуляции тонуса сосудов, нарушений ритма дыхания и сердечных сокращений, дисфункции желудочно-кишечного тракта в виде неустойчивого стула, запоров, частых срыгиваний, метеоризма. Реже может отмечаться судорожный синдром,при котором наблюдаются приступообразные подергивания конечностей и головы, эпизоды вздрагиваний и другие проявления судорог.
Длительно сохраняющиеся нарушения тонуса мышц нередко приводят к появлению у детей задержки психомоторного развития.
К годовалому возрасту у большинства детей проявления перинатальных поражений ЦНС постепенно исчезают либо сохраняются их незначительные проявления. К частым последствиям перинатальных поражений относят:задержку психического, моторного или речевого развития;цереброастенический синдром (он проявляется перепадами настроения, двигательным беспокойством, тревожным беспокойным сном, метеозависимостью), синдром гиперактивности с дефицитом внимания.
Наиболее неблагоприятными исходами являются эпилепсия, гидроцефалия, детский церебральный паралич, свидетельствующие о тяжелых перинатальных повреждениях ЦНС.
Диагностика
Диагноз основывается на данных врачебного осмотра, анамнестических данных и подтверждается инструментальными исследованиями. Большое значение имеет ультразвуковое исследование (УЗИ) мозга с оценкой состояния его сосудов (допплерографией). При необходимости используют рентгенологическое исследование черепа, позвоночника, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ).
Большое значение имеет ультразвуковое исследование (УЗИ) мозга с оценкой состояния его сосудов (допплерографией). При необходимости используют рентгенологическое исследование черепа, позвоночника, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ).Лечение
В остром периоде тяжёлых перинатальных поражений мозга лечение проводят в отделении реанимации и интенсивной терапии новорождённых. В первую очередь устраняют нарушения в работе дыхательной, сердечно-сосудистой системы и нарушения обмена веществ, ликвидируют судороги (при необходимости проводят искусственную вентиляцию лёгких, внутривенные вливания, парентеральное питание). Далее новорождённых переводят в специальное отделение, где продолжают индивидуальное лечение в зависимости от характера и тяжести поражения мозга: применяют противосудорожные препараты, при развивающейся гидроцефалии — дегидратационные, а также средства, стимулирующие рост капилляров и улучшающие питание повреждённых тканей мозга.
При среднетяжёлых и особенно лёгких поражениях ЦНС используют в основном нелекарственную терапию.
В восстановительном периоде (с конца первого года жизни) решающее значение имеют нелекарственные методы реабилитации: лечебный массаж и гимнастика, упражнения в воде, физиотерапия, педагогические методики музыкотерапии (оздоровление и лечение организма с помощью музыки).
Перинатальные поражения центральной нервной системы в ЦКБ РАН
Перинатальные поражения центральной нервной системы (ПП ЦНС) или гипоксически-ишемическая энцефалопатия — это группа патологических состояний, связанная с повреждением головного мозга в перинатальный период.
Основные причины ПП ЦНС:
- Гипоксия плода (хроническая внутриутробная; острая в родах)
- Родовая травма
- Интоксикация (билирубиновая энцефалопатия)
- Гипогликемия
- Инфекционный фактор
Клинические проявления ПП ЦНС
- Синдром возбудимости нервной системы: избыточные и множественные движения, тремор подбородка, языка, конечностей, срыгивания, нарушения сна (избыточное бодрствование), спонтанный рефлекс Моро (раскидывание ручек в положении на спине)
- Синдром угнетения нервной системы: снижение спонтанной двигательной активности, кратковременное бодрствование, избыточный сон, слабость сосательного рефлекса, недостаточная ответная эмоциональная реакция при взаимодействии с ребенком.

- Синдром вегетативно-висцеральных дисфункций: расстройства терморегуляции, преходящий цианоз, нарушение частоты сердечных сокращений и ритма дыхания, мраморность кожи, гипотермия конечностей, вегетативно-сосудистые пятна на коже, срыгивания, рвота, неустойчивый стул.
- Синдром внутричерепной гипертензии, гидроцефальный синдром: избыточный прирост окружности головы, выбухание родничка, запрокидывание головы назад, громкий монотонный плач (мозговой крик), запрокидывание головы назад вплоть до выгибания туловища (опистотонус), упорные рвоты и срыгивания не связанные с приемом пищи, повышенная чувствительность к звуковым раздражителям (гиперестезия), спонтанные выпучивание глаз (синдром Грефе), трудности засыпания (хочет спать, а уснуть не может), кратковременный и поверхностный сон, возбудимость.
- Судорожный синдром: разнообразные внезапные и повторяющиеся сокращения век, мышц лица, отведение глаз, пароксизмально возникающие жевание, глотание, сосание, высовывания языка, плавательные движения рук, педалирование, тоническое напряжение туловища или конечностей, единичные или групповые подергивания мышц конечностей, сопровождающиеся судорожными движениями глаз или «остановкой» взора, апноэ.

- Нарушение регуляции мышечного тонуса (мышечные дистонии) повышенный, пониженный, смешанный тонус мышц в конечностях, объем движений в суставах, спонтанная поза во сне и в бодрствовании, положение кистей и стоп, опора при вертикализации, положение головы при тракции ( подтягивании) за ручки.
Исходы и последствия ПП ЦНС
Последствия ПП ЦНС можно определить к 1 году жизни. Ниже представлены основные их проявления:
- Нарушение моторного развития: задержка приобретения навыков удерживания головы, переворотов, сидения, ползания, вставания, самостоятельной ходьбы относительно физического возраста ребенка.
- Формирование парезов и параличей как одной, так и нескольких конечностей (моноплегия, диплегия, гемипарез, тетрапарез), которые относятся к различным формам детского церебрального паралича.
- Нарушение психо-речевого развития: задержка приобретения навыка гуления, лепета, первых слов и фраз, качество произносимых звуков, сроки формирования пинцетного захвата и указательного жеста, понимание обращенной речи, интерес к окружающим предметам и использование их по назначению, характер игры, запоминание новой информации, концентрация внимания с формированием синдрома дефицита внимания с гиперактивностью.

- Нарушение поведения и эмоций: сроки формирования комплекса оживления, дифференцировка родных и чужих, эмоциональный резонанс, степень выраженности эмоций, общение со сверстниками и взрослыми, возможность совместной игры, формирование навыков опрятности, возможно приводящие к расстройствам аутистического спектра.
- Гидроцефалия: избыточный прирост окружности головы, деформация головы, выраженность подкожных вен в височных областях, признаки гипертензионного и гидроцефального синдромов.
- Пароксизмальные состояния не эпилептического генеза: аффективно-респираторные приступы, доброкачественный миоклонус младенчества ( синдром Фиджермана), доброкачественные неонатальный миоклонус сна, синдром Сандиффера, младенческий тортиколис, беспокойный сон, ночные страхи, ритмичные движения во сне (раскачивания, мотание головой, сосание пальца, скрежет зубов).
- Возрастзависимые эпилептические синдромы: ранняя инфантильная эпилептическая энцефалопатия ( синдром Отахара), ранняя миоклоническая энцефалопатия, синдром Драве, синдром Веста, доброкачественные неонатальные эпилептические синдромы, доброкачественная миоклоническая эпилепсия младенчества, доброкачественная парциальная эпилепсия младенчества.

Инструментальная диагностика
В КДЦ НИИ педиатрии и восстановительного лечения проводят инструментальную диагностику с целью уточнения диагноза:
- УЗИ мозга ( нейросонография)
- ЭЭГ дневного сна и бодрствования
- КТ головного мозга
- МРТ головного мозга и позвоночника
Наша помощь
На базе КДЦ работают специалисты отдела нейробиологии развития НИИ педиатрии и охраны здоровья ЦКБ РАН:
- Диагностику, наблюдение и лечение проводят опытные неврологи, кандидаты медицинских наук с 20 летним стажем работы с этой проблемой. Наши специалисты являются авторами книги «Современные нейробиологические аспекты перинатальных поражений ЦНС», выпущенной издательством российской академии наук.
- К диагностике привлекаются дефектологи и клинические психологи, которые помогают уточнить наличие нарушений в развитии. Оценка развития проводится по унифицированным таблицам развития.

- При необходимости дети могут получить специализированные лечебно-коррекционные, развивающие занятия со специалистами по раннему развитию, направленные на а стимуляцию сенсорных, зрительных, аудиальных, тактильных, координаторных функций.
- Имеется возможность комплексного наблюдения детей с перинатальным поражением ЦНС с привлечение квалифицированных специалистов, кандидатов медицинских наук.
- Сопровождение опытного педиатра, который ответит на все вопросы по уходу, питанию, профилактике рахита и ОРВИ, закаливанию.
- Отделение вакцинопрофилактики: консультация вакцинолога-иммунолога с целью составления индивидуального календаря прививок и непосредственное проведение вакцинации под его контролем.
- Привлечение любых других специалистов педиатрического профиля, включая ортопедов и офтальмологов.
ГИПОКСИЯ — БОМБА ЗАМЕДЛЕННОГО… — Центр Самигуллиных
ГИПОКСИЯ — БОМБА ЗАМЕДЛЕННОГО ДЕЙСТВИЯ!!
Самая частая проблема встречающаяся после родов это ГИПОКСИЯ или Гипоксическое поражение ЦНС у новорожденных — нарушение кровообращения в головном мозге, в результате которого мозг не получает необходимое количество крови, и следовательно, испытывает дефицит кислорода и питательных веществ.
Гипоксия может иметь:
• перинатальное происхождение, связанное с беременностью;
• постнатальную этиологию, возникшую во время рождения ребенка и далее.
Среди причин повреждения ЦНС гипоксия находится на первом месте. В таких случаях специалисты говорят о гипоксически-ишемическом поражении центральной нервной системы у новорожденных.
Перинатальное гипоксически-ишемическое поражение ЦНС
Неблагоприятное воздействие на плод могут оказывать острые, и хронические болезни матери, работа на вредных производствах (химические вещества, различные излучения), вредные привычки родителей (курение, также пассивное курение, алкоголизм, наркомания). Также вредное влияние на развивающегося в утробе матери ребенка оказывают тяжелые токсикозы, частые простудные заболевания, переутомления, стрессы.
Постнатальное гипоксически-ишемическое поражение ЦНС
Во время родов младенец испытывают значительную нагрузку на организм. Особенно серьезные испытания приходится пережить ребенку, если родовой процесс проходит с патологией: преждевременные или стремительные роды, родовая слабость, ранний отход околоплодных вод, крупный плод и т. п.
п.
Степени церебральной ишемии
Различают три степени гипоксического поражения:
1. Гипоксическое поражение ЦНС 1 степени. Это довольно легкая степень характеризуется чрезмерным возбуждением или угнетением в первую неделю жизни малыша.
2. Гипоксическое поражение ЦНС 2 степени. При поражении средней тяжести наблюдается более длительный период нарушения, характерны судороги.
3. Гипоксическое поражение ЦНС 3 степени. При тяжелой степени ребенок пребывает в реанимационном отделении, где проводится интенсивная терапия, так как существует реальная угроза здоровью и жизни малыша.
Последствия гипоксически-ишемического поражения ЦНС
В результате гипоксии могут быть нарушены врожденные рефлексы, возможны функциональные нарушения всех органов и систем. Впоследствии проявляется задержка в физическом и психическом развитии, нарушения сна. Следствием патологии могут быть кривошея, сколиоз, плоскостопие, энурез, эпилепсия. Часто встречающийся в последнее время синдром дефицита внимания с гиперактивностью также является результатом ишемии новорожденного.
Как же максимально избежать последствий?
«В настоящее время ни у кого из ведущих специалистов не остается сомнений в том, что профилактический массаж для новорожденного является необходимым элементом ухода за ребенком, и начинать его нужно как можно раньше — с первых дней жизни ребенка.»
(Комментарий врача-педиатра Смолкина Ю.С., профессора, вице-президента Ассоциации детских аллергологов и иммунологов России.)
Перед новорожденным стоит трудная задача — приспособится к миру, в который он попал. Массаж — главный помощник. И начинать его нужно как можно раньше – с первых дней жизни. Массаж необходим Вашему ребенку для того чтобы он правильно развивался и рос здоровым.
Массаж для новорожденных благоприятно воздействует не только на кожу, подкожно-жировую клетчатку и мышцы, а так же улучшает деятельность всех внутренних органов и систем.
Также массаж является одним из средств укрепления здоровья, хорошего физического и психоэмоционального состояния ребёнка первого года жизни.
Большинство родителей опасаются лишний раз дотронуться до малыша, ведь он кажется таким маленьким и хрупким, и это правильно. Необходимо обратиться к проверенному специалисту с медицинским образованием!
С помощью нашего массажа мы способствуем скорейшему развитию малыша. С нашей помощью младенец постепенно овладеет навыками сидения, ползания, стояния и ходьбы, а также балансу и манипуляциями с предметами. При этом массаж для новорожденных гасит патологические тонические рефлексы, которые в норме, у здоровых детей, должны исчезать к 4-6 месяцам.
Почему массаж так необходим детям первого года жизни?
• Во-первых, под влиянием массажа от кожи по нервным путям к коре головного мозга направляется огромное количество импульсов. Эти импульсы стимулируют центральную нервную систему, которая контролирует работу всех органов и систем.
• Во-вторых, точечный массаж действует непосредственно на те органы и системы, проекция которые расположена на коже. Массаж ускоряет ток лимфы и крови, таким образом, помогая быстрее восстановить ткани после гипоксии (убрать мраморность кожных покровов) и выводить из тканей продукты обмена. Кроме того при правильном проведении массажа кожа розовеет, а это значит, что расширяется периферическая капиллярная сеть. Приток крови к массируемому участку создаёт благоприятные условия для питания и оздоровления кожи: она становится упругой, блестящей и эластичной.
Кроме того при правильном проведении массажа кожа розовеет, а это значит, что расширяется периферическая капиллярная сеть. Приток крови к массируемому участку создаёт благоприятные условия для питания и оздоровления кожи: она становится упругой, блестящей и эластичной.
• И наконец, массаж для новорожденных стимулирует весь организм в целом на скорейший рост и развитие, не говоря уже про работу желудочно-кишечного тракта: улучшает отхождение газов из кишечника.
Мы настоятельно рекомендуем женщинам вставать на врачебный учет на ранних сроках беременности, своевременно проходить скрининговые обследования, вести здоровый образ жизни на стадии подготовки к беременности и в процессе беременности. А после родов массаж необходим не только малышу для эффективного лечения церебральной ишемии, которая должна быть диагностирована в первые месяцы жизни, но и для мамы для быстрейшего восстановления после родов.
Ваш Семейный центр РУСТАМ!
Запишитесь на БЕСПЛАТНУЮ консультацию!!!
Мы поможем Вам быть здоровыми!!
Отзывы:
Когда дочери было чуть больше месяца невролог направил нас на массаж. Мы обратились в семейный центр «РУСТАМ» и сейчас проходим первый курс массажа у Дианы Рашитовны. Результаты уже есть. Лучше спим, животик меньше беспокоит, уверенно держим голову и мышцы спины стали крепче. Ждём новых результатов! Спасибо Диане Рашитовне! Светлана
Мы обратились в семейный центр «РУСТАМ» и сейчас проходим первый курс массажа у Дианы Рашитовны. Результаты уже есть. Лучше спим, животик меньше беспокоит, уверенно держим голову и мышцы спины стали крепче. Ждём новых результатов! Спасибо Диане Рашитовне! Светлана
Большое спасибо Рустаму!! Пришли с одной проблемой — был наклон головы вправо. В итоге после нескольких сеансов ребенка не узнать: спит часами, спокойная, уравновешенная, нежная!! Все удивляются!! Так как все привыкли видеть ее вечно орущей — разница ощутимая: небо и земля. В день консультации Рустам обещал что ребенок будет спать в коляске — все так и произошло!! Выразить словами благодарность невозможно, это надо ощутить на себе. Настоятельно рекомендую!! Лилия Валеева
Мы пришли по рекомендации к Рустаму Рашитовичу. Не пожалели ни на йоту. Делали массаж грудничку с месяца 5 раз. Ребенок начал ползать в 4 мес, сел, встал в конце 5 мес. Сильный, выносливый парень. Рустам от бога массажист, целитель. Душевный человек, который кроме массажа еще и прокачивает родителей в духовном плане. Маме за 5 сеансов поднял органы внутренние на место, убрался животик лишний у нее, шишка на спине солевая сошла — никто не мог ее убрать. Один минус — дороговато, но не жалко, честно, хоть и хочется скидок как корпоративным клиентам) В общем, благодарим вселенную за то, что направила нас к этому доктору! Так держать, Рустам Рашитович, вы один из лучших в своей стезе! Благодарим! Рекомендуем! Ирина Леонович
Маме за 5 сеансов поднял органы внутренние на место, убрался животик лишний у нее, шишка на спине солевая сошла — никто не мог ее убрать. Один минус — дороговато, но не жалко, честно, хоть и хочется скидок как корпоративным клиентам) В общем, благодарим вселенную за то, что направила нас к этому доктору! Так держать, Рустам Рашитович, вы один из лучших в своей стезе! Благодарим! Рекомендуем! Ирина Леонович
Мы прошли 2 курса массажа у Рустама Рашитовича. Ребенок у меня в 5 месяцев не умел переворачиваться. На пятом занятии первого курса он уже самостоятельно начал переворачиваться. Был сильный тонус правой руки. Сейчас он раскрывает руку и начинает держать и тянуться этой рукой. Нормализовался стул. Еще у него глазки косились , сейчас у нас все хорошо. Выражаю огромную благодарность Рустаму Рашитовичу и всему коллективу центра «Рустам». Пусть Ваши руки никогда не устают. У вас золотые руки. Большое Вам спасибо! С нетерпением жду следующего курса. Галямова Гузель
Выражаю огромную благодарность коллективу детского реабилитационного центра «РУСТАМ» за профессионализм и служению людям через полезное дело. Отдельная благодарность врачу педиатру, массажисту, первоисточнику Рустаму Самигуллину. Моей дочери сейчас 2,5 года. Я обратилась за помощью к Рустаму когда дочери было 7 мес. Почему? Мой ребенок стал отставать в физическом развитии, не переворачивалась на бочок, не проявляла желания ползать и присесть. Сама я врач по образованию, приглашала в 6 мес. невролога, сказала, что все хорошо. Но после я сама стала обращать внимание, что то все таки не так, гипотоничная доченька. Обратилась за помощью к Рустаму. Сделали первый курс массажа, результат на лицо, ребенок активно стала переворачиваться на бочок, уверенно держит голову, и проявлять желание сесть. До года мы сделали 5 курсов массажа. Доченька моя догнала всех сверстников. Ходить стали в 1 год 1 месяц. Сама прошла курс массажа неоднократно, после родов ушла в объеме талии на 4см. Затем периодически обращаюсь, когда шею «клинит», волшебные руки Рустама Рашитовича делают свое дело. Здоровья, успехов и процветания Вашему центру! Вы творите благое дело! Сафиуллина Зульфия
Отдельная благодарность врачу педиатру, массажисту, первоисточнику Рустаму Самигуллину. Моей дочери сейчас 2,5 года. Я обратилась за помощью к Рустаму когда дочери было 7 мес. Почему? Мой ребенок стал отставать в физическом развитии, не переворачивалась на бочок, не проявляла желания ползать и присесть. Сама я врач по образованию, приглашала в 6 мес. невролога, сказала, что все хорошо. Но после я сама стала обращать внимание, что то все таки не так, гипотоничная доченька. Обратилась за помощью к Рустаму. Сделали первый курс массажа, результат на лицо, ребенок активно стала переворачиваться на бочок, уверенно держит голову, и проявлять желание сесть. До года мы сделали 5 курсов массажа. Доченька моя догнала всех сверстников. Ходить стали в 1 год 1 месяц. Сама прошла курс массажа неоднократно, после родов ушла в объеме талии на 4см. Затем периодически обращаюсь, когда шею «клинит», волшебные руки Рустама Рашитовича делают свое дело. Здоровья, успехов и процветания Вашему центру! Вы творите благое дело! Сафиуллина Зульфия
Психомоторное, речевое и умственное развитие у детей с детским церебральным параличом | Дочкина
1. Губина-Вакулик Г.И., Омельченко О.А., Кихтенко Е.В. и др. Патоморфология особенностей развития макроглии головного мозга плода и новорожденного при повреждающем воздействии хронической внутриутробной гипоксии в перинатальном периоде (экспериментальное исследование). UNIVERSUM: медицина и фармакология. 2017;4(38):50.
Губина-Вакулик Г.И., Омельченко О.А., Кихтенко Е.В. и др. Патоморфология особенностей развития макроглии головного мозга плода и новорожденного при повреждающем воздействии хронической внутриутробной гипоксии в перинатальном периоде (экспериментальное исследование). UNIVERSUM: медицина и фармакология. 2017;4(38):50.
2. Дочкина Е.С., Устинова А.В., Таранушенко Т.Е. Анализ перинатального периода и поражений ЦНС у детей с ДЦП. Сибирское медицинское обозрение. 2018;(5):41–47. DOI: 10.20333/2500136–2018–5–41–47.
3. Семина В.И., Степанова Ю.А. Перинатальная гипоксия: патогенетические аспекты и подходы к диагностике (обзор литературы). Часть 1. Медицинская визуализация. 2015;2:95–105.
4. Граф А.В., Гончаренко Е.Н., Соколова Н.А. и др. Антенатальная гипоксия: участие в развитии патологий ЦНС в онтогенезе. Нейрохимия. 2008;25(1):11–16.
Нейрохимия. 2008;25(1):11–16.
5. Субботин А.В., Коваленко А.В., Каркашина О.В. Психомоторное развитие детей с гидроцефальным синдромом гипоксически-ишемического генеза на первом году жизни. Мать и дитя в Кузбассе. 2009;1(36):31–35.
6. Жесткова Е.А. Учет психомоторного развития в физическом воспитании детей грудного возраста. Вестник Южно-Уральского государственного университета. Серия: образование. Педагогические науки. 2013;5(1):151–154.
7. Лукашевич И.П., Парцалис Е.М., Шкловский В.М. Перинатальные факторы риска формирования патологии речи у детей. Российский вестник перинатологии и педиатрии. 2008;53(4):19–22.
8. Бобылова М.Ю., Браудо Т.Е., Казакова М.В. и др. Задержка речевого развития у детей: введение в терминологию. Русский журнал детской неврологии. 2017;12(1):56–62.
Русский журнал детской неврологии. 2017;12(1):56–62.
9. Петрухин А.С. Детская неврология. учебник в 2 т.: для студентов образовательных учреждений высшего образования по специальности 060103.65 «Педиатрия» по дисциплине «Нервные болезни». 2012;2:555.
10. Хышиктуева Т.П., Усачева Е.Л., Лебедева Ю.В. и др. Умственная отсталость у детей (обзор литературы). Доктор. ру. 2014;6–2(94):22–26.
11. Немкова С.А., Маслова О.И., Каркашадзе Г.А. и др. Когнитивные нарушения у детей с церебральным параличом (структура, диагностика, лечение). Педиатрическая фармакология. 2012;9(3):77–84.
12. Медведева Е.В. Особенности проявлений и причины возникновения тревожности у детей с церебральным параличом Вестник Адыгейского государственного университета. Серия 3: педагогика и психология. 2009;4:239–243.
Серия 3: педагогика и психология. 2009;4:239–243.
Нейропротекция методом управляемой гипотермии | Медицинская компания ОМБ
Терапевтическая гипотермия
Умеренная терапевтическая гипотермия – контролируемое индуцируемое снижение центральной температуры тела у больного до 32— 34°С, с целью снижению риска ишемического повреждения тканей головного мозга после периода нарушения кровообращения.
Доказано, что гипотермия оказывает выраженный нейропротективный эффект. В настоящий момент терапевтическая гипотермия рассматривается как основной физический метод нейропротекторной защиты головного мозга, поскольку не существует ни одного, с позиций доказательной медицины, метода фармакологической нейропротекции.
Терапевтическая гипотермия входит в стандарты лечения:
- Международного Комитета Взаимодействия по Реанимации (ILCOR)
- Американской Ассоциации Кардиологов (AHA)
А также клинические рекомендательные протоколы:
- Ассоциации Нейрохирургов России
Применение умеренной терапевтическая гипотермии, для снижения рисков возникновения необратимых изменений в мозге, рекомендуется при следующих патологических состояниях:
1. Энцефалопатии новорожденных
Энцефалопатии новорожденных
2. Остановка сердца
3. Инсульты
4. Травматических поражений головного или спинного мозга без лихорадки
5. Травмы головного мозга с нейрогенной лихорадкой
Методология терапевтической гипотермии
Перед началом лечения гипотермией следует ввести фармакологические средства для контроля дрожи.
Температура тела больного снижается до 32— 34°С градусов и поддерживается на таком уровне 24 часа. Врачи должны избегать уменьшения температуры ниже целевого значения. Принятые медицинские стандарты устанавливают, что температура пациента не должна падать ниже порога в 32 °C .
Затем температуру тела постепенно поднимают до нормального уровня в течение 12 часов, под контролем компьютера блока управления системы охлаждения / согревания. Согревание пациента должно происходить со скоростью не менее 0,2-0,3°С в час, чтобы избежать осложнений, а именно: аритмии, снижения порога коагуляции, повышения риска инфекции и увеличения риска нарушения баланса электролитов.
Методы осуществления терапевтической гипотермии:
- Инвазивный метод
Охлаждение осуществляют через катетер введенный в бедренную вену. Жидкость, циркулирующая в катетере, выводит тепло наружу, не попадая в пациента. Метод позволяет контролировать скорость охлаждения, устанавливать температуру тела в пределах 1 °C от целевого значения.
Проводить процедуру должен только хорошо подготовленный и владеющий методикой врач.
Основным недостатком методики являются серьезные осложнения — кровотечения, тромбоз глубоких вен, инфекции, коагулопатии.
- Неинвазивный метод
Для неинвазивного метода терапевтической гипотермии сегодня используются специализированные аппараты, состоящие из блока системы охлаждения / согревания на водной основе и теплообменного одеяла. Вода циркулирует через специальное теплообменное одеяло или облегающий жилет на торсе с аппликаторами на ноги. Для снижения температуры с оптимальной скоростью необходимо покрыть теплообменными одеялами не менее 70 % площади поверхности тела пациента.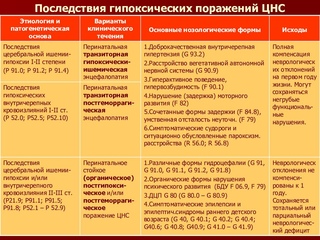 Для локального снижения температуры мозга используют специальный шлем.
Для локального снижения температуры мозга используют специальный шлем.
Современные системы охлаждения / согревания с микропроцессорным контролем и обратной связью с пациентом, обеспечивают создание управляемой терапевтической гипо / гипертермии. Прибор контролирует температуру тела пациента с помощью датчика внутренней температуры и корригирует ее, в зависимости от заданных целевых значений, изменяя температуру воды в системе.
Принцип обратной связи с пациентом обеспечивает высокую точность достижения и контроля температуры в первую очередь тела пациента, как во время охлаждения, так и во время последующего согревания. Это важно для минимизации побочных эффектов связанных с гипотермией.
Система гипо-гипертермии пациента BLANKETROL (CSZ, USA)
Протокол управляемой гипотермии в неонатологии
Практика в США
Практика в Великобритании
youtube.com/embed/x10BRebaEbQ» allowfullscreen=»» frameborder=»0″/>
Протокол терапевтической гипотермии при неонатальной гипоксическишемической энцефалопатии (ГИЭ)
Показатели заболеваемости и смертности новорожденных являются одними из важнейших критериев уровня состояния здравоохранения. В качестве наиболее частого патологического состояния неонатального периода диагностируется гипоксически-ишемическая энцефалопатия (ГИЭ) – 47%, или гипоксическое поражение ЦНС. По данным различных авторов, она может выявляться у 6-8% новорожденных.
Гипоксически-ишемическая энцефалопатия (ГИЭ) у доношенных новорожденных, возникающая вследствие острой перинатальной асфиксии, является важной причиной последующих нарушений их нервно-психического развития. Риск смертельного исхода у младенцев с умеренной ГИЭП составляет 10%, а у выживших детей в 30% случаев выявляются нарушения нервно-психического развития. При тяжелой ГИЭП 60% младенцев умирают и практически все выжившие дети становятся инвалидами.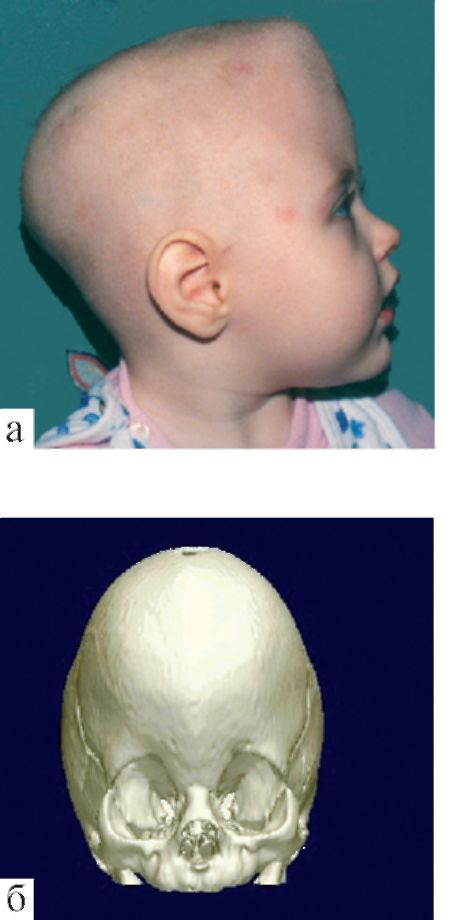
Клинические синдромы, ассоциированные с перинатальной гипоксией, зависят от периода ГИЭ: к синдромам острого периода относятся повышенная нейрорефлекторная возбудимость, синдромы общего угнетения центральной нервной системы, вегетовисцеральных дисфункций, гидроцефально-гипертензионный, судорожный, коматозное состояние; в структуру восстановительного периода ГИЭ входят синдромы задержки речевого, психического, моторного развития, гипертензионно-гидроцефальный, вегетовисцеральной дисфункции, гиперкинетический, эпилептический, церебрастенический . Некоторые авторы в восстановительном периоде выделяют синдромы двигательных нарушений, повышенной нервно-рефлекторной возбудимости .
К. Nelson и соавт. в своих работах отметили, что у детей, имеющих оценку по шкале Апгар менее 3 на 10, 15, 20-й минутах и выживших, чаще, чем у детей с более высокой оценкой, наблюдались детский церебральный паралич, задержка психомоторного развития, судороги. Прогностические признаки зависят от тяжести клинических проявлений. Смертность новорожденных при перинатальном поражении ЦНС гипоксической природы составляет 11,5 % (среди детей с умеренными церебральными нарушениями — 2,5 %, тяжелыми — 50 %). У детей с легким течением гипоксически-ишемической энцефалопатии в неонатальном периоде осложнений не возникает. По данным М.І. Levene , у 80 % доношенных новорожденных тяжелые ГИП ЦНС приводят к смерти или тяжелым неврологическим нарушениям.
Смертность новорожденных при перинатальном поражении ЦНС гипоксической природы составляет 11,5 % (среди детей с умеренными церебральными нарушениями — 2,5 %, тяжелыми — 50 %). У детей с легким течением гипоксически-ишемической энцефалопатии в неонатальном периоде осложнений не возникает. По данным М.І. Levene , у 80 % доношенных новорожденных тяжелые ГИП ЦНС приводят к смерти или тяжелым неврологическим нарушениям.
Воздействия на мозг ребенка повреждающего фактора (травма, кислородное голодание и т. д.) начинается острый период энцефалопатии, который длится 3—4 недели. Именно в остром периоде необходима активная терапия, которая способна серьезным образом повлиять на исход болезни.
Известно, что общая гипотермия (ОГ) в момент реанимационных мероприятий уменьшает частоту летальных исходов, и умеренных и серьёзных нарушений психомоторного развития у новорождённых с гипоксически-ишемической энцефалопатией (ГИЭ) вследствие острой перинатальной асфиксии. Это подтверждено на целом ряде мультицентровых исследований в США и Европе. Более того селективное охлаждение головы вскоре после рождения может применяться для лечения детей с перинатальной энцефалопатией средней и легкой степеней тяжести для предотвращения развития тяжелой неврологической патологии. Селективное охлаждение головы малоэффективно при тяжелой энцефалопатии.
Более того селективное охлаждение головы вскоре после рождения может применяться для лечения детей с перинатальной энцефалопатией средней и легкой степеней тяжести для предотвращения развития тяжелой неврологической патологии. Селективное охлаждение головы малоэффективно при тяжелой энцефалопатии.
Проведение гипотермии при лечении ГИЭ сочетается с меньшим поражением серого и белого вещества головного мозга. У большего числа детей, которым проводится гипотермия, отсутствуют изменения при ЯМР (Rutherford M., et al. Assessment of brain tissue injury after moderate hypothermia in neonates with hypoxic–ischaemic encephalopathy: a nested substudy of a randomised controlled trial. Lancet Neurology, November 6, 2009).
«Накопление доказательств поддерживает преимущества нейропротективной терапевтической гипотермии у доношенных новорожденных с гипоксически-ишемической энцефалопатией» (Сьюзен Е. Джакобс (Susan E. Jacobs) (Neonatal Services, Royal Women’s Hospital, Victoria, Australia).
Гипотермия всего тела состоит из обеспечения новорожденному целевой температуры 33,5°C в течение 72 часов.
Терапевтическая гипотермия, как было обнаружено, уменьшала риск смерти или главной сенсоневральной инвалидности в возрасте 2 года
Отмечаются только минимальные отрицательные воздействия гипотермии. У младенцев с гипотермией был удлинен интервал QT, по сравнению с младенцами контроля, но никакой аритмии, требующей лечения или прекращения гипотермии, не наблюдается.
«Пятнадцатипроцентное сокращение сложного первичного исхода — смерти или главной сенсоневральной инвалидности является и статистически существенным и клинически важным»
Итогом работы специалистов, стало создание ряда клинических протоколов США и Великобритании. В настоящее время этот метод также принят неонатологами Австралии.
В соответствии с национальными мультицентровыми исследованиями в которых участвовали ведущие клиники США (500 новорожденых, система Blanketrol® II, СSZ), Американская Академия Педиатрии (AAP) вынесла резолюцию в 2005 году о необходимости использования гипотермии при ГИЭ в неонатальном периоде для снижения неврологических осложнений в более позднем возрасте.
В 2007 году врачами Детского Госпиталя в Бостоне разработан Национальный протокол с применением одеял устройства Blanketrol® II Hypo‐Hyperthermia System, при котором новорожденный охлаждался до 33.5°C (92.3°F) в течение 72 часов с последующим плавным повышением температуры до нормальной. В разработке Национального протокола США участвовала Медицинский директор и профессор педиатрии Гарвардской медицинской школы Анна Хансен (Anne Hansen, MD, MPH).
Результаты аналогичной работы в клиниках Европы отражены в мультицентровом исследовании TOBY (Национальный Институт Стандартов в здравоохранении Великобритании), которые легли в основу Клинического протокола Великобритании. В исследовании участвовали клиники Великобритании, Швеции, Израиля, Финляндии. Подробнее о данном протоколе вы можете ознакомиться по ссылке http://www.npeu.ox.ac.uk/toby
Терапевтическая гипотермия сегодня – Национальный стандарт лечения для соответствующих групп риска новорожденных и утвержден Британской Ассоциацией Перинатальной медицины.
«Библиотека репродуктивного здоровья ВОЗ» (БРЗ) Департамента репродуктивного здоровья и исследований штаб — квартиры ВОЗ в Женеве (Швейцария) опубликовала следующий обзор: «Охлаждение новорожденных с гипоксической ишемической энцефалопатией», в котором отмечено, что терапевтическая гипотермия у родившихся в срок новорожденных с гипоксической ишемической энцефалопатией оказывается эффективной.
На нашем сайте в разделе информация для специалистов можно скачать клинический протокол ведения новорожденных с ГИЭ (Национальный Институт стандартов Великобритании) и дополнительную информацию по методике и оборудованию.
Экспертное заключение. ДНЕПРОПЕТРОВСКАЯ ГОСУДАРСТВЕННАЯМЕДИЦИНСКАЯ АКАДЕМИЯ. Кафедра анестезиологии и интенсивной терапии. Член-корреспондент НАН и АМН Украины, профессор Л.В. Усенко Член Европейского Совета по реанимации А.  В. Царев В. Царев
| |
Cincinatti Sub-Zero. Blanketrol ®. Обзор. |
Possibilities of osteopathic correction of functional disorders in children | Kuzmina
Остеопатия — область клинической медицины, основанная на холистическом подходе и использующая мануальные методы на этапах профилактики, диагностики, лечения и реабилитации, направленные на восстановление способности организма к самокоррекции. Остеопатия представляет организм человека как единую систему со сложными внутренними и внешними взаимосвязями. Это одно из немногих мануальных медицинских направлений, регламентируемое ВОЗ. Она хорошо зарекомендовала себя во многих развитых странах. Так, в США, где в настоящее время практикуют около 100 тысяч врачей-остеопатов, 28 университетов готовят специалистов по остеопатии.
В России остеопатия начала развиваться с 90-х гг. прошлого века, и за сравнительно небольшой срок это направление медицины получило бурное развитие.
Остеопатия занимается коррекцией соматических дисфункций (СД) (шифр по МКБ М99.0) — обратимых функциональных нарушений. В любом повреждении тканей есть доля как органического поражения, так и функционального, соотношение которых будет обусловливать тяжесть патологического процесса. Не всегда эти функциональные нарушения диагностируются стандартными методами, но тем не менее они являются значимыми в патогенезе заболевания и могут иметь различные клинические проявления. Именно в пределах функциональной части находится основное место приложения остеопатии, где она максимально эффективна.
Клинические исследования эффективности остеопатического лечения затруднены тем, что воздействие мануальное. Двойное слепое плацебо-контролируемое исследование провести невозможно. Но и для других методов лечения (хирургические вмешательства, физиотерапия, методы восстановительной медицины) это также неосуществимо по объективным причинам. Однако можно организовать рандомизированные исследования с достаточным количеством пациентов, набрать сходные по различным критериям основную и контрольную группы (возраст, основное заболевание и т. д.) и применить инструментальные методы исследования для объективизации результатов лечения.
д.) и применить инструментальные методы исследования для объективизации результатов лечения.
Для улучшения качества медицинской помощи детям необходимо эффективное взаимодействие врачей разных специальностей. Цель данной статьи — познакомить педиатров с возможностями остеопатии на основе обзора клинических исследований.
За последние два десятилетия в нашей стране выполнен ряд клинических исследований результатов остеопатического лечения при различных заболеваниях детского возраста, многие из которых являются контролируемыми рандомизированными.
С 1997 г. на базе Владивостокского государственного медицинского университета и Приморского краевого института вертеброневрологии и мануальной медицины проводится большая работа по наблюдению за новорожденными детьми [5]. Под наблюдением в течение 5 лет (до 2002 г.) находилось более 3 тысяч детей в возрасте от 1–5 дней до 1,5 года, у которых при остеопатическом обследовании были выявлены те или иные функциональные блоки костей черепа, шейных двигательных сегментов, крестца, дисфункции тазовых костей. Эти нарушения сопровождались различной неврологической симптоматикой. После остеопатической коррекции у 98 % детей отмечалось существенное улучшение состояния: улучшались эмоциональный фон, сон, снижалось беспокойство, активнее становилось сосание, уменьшались дисфункции черепно-мозговых нервов, вегетативные расстройства, мышечный дисбаланс, увеличивался объем движений, исчезали патологические рефлексы, улучшались и восстанавливались выпрямительные реакции, улучшались хватательные функции кисти. Динамическое наблюдение за детьми выявило стойкий терапевтический эффект. До 30 % детей опережали в двигательном и психоречевом развитии своих сверстников. Дети реже болели, педиатрами и невропатологами все они оценивались как практически здоровые.
Эти нарушения сопровождались различной неврологической симптоматикой. После остеопатической коррекции у 98 % детей отмечалось существенное улучшение состояния: улучшались эмоциональный фон, сон, снижалось беспокойство, активнее становилось сосание, уменьшались дисфункции черепно-мозговых нервов, вегетативные расстройства, мышечный дисбаланс, увеличивался объем движений, исчезали патологические рефлексы, улучшались и восстанавливались выпрямительные реакции, улучшались хватательные функции кисти. Динамическое наблюдение за детьми выявило стойкий терапевтический эффект. До 30 % детей опережали в двигательном и психоречевом развитии своих сверстников. Дети реже болели, педиатрами и невропатологами все они оценивались как практически здоровые.
Данная работа продолжается и в настоящее время. Во Владивостоке 25–30 % новорожденных детей проходят осмотр и лечение у остеопата [2]. В настоящее время число детей, получивших остеопатическую коррекцию в ранние сроки после рождения, уже превышает 20 000. В Приморье ранняя остеопатическая коррекция признана законом Приморского края и внесена в краевую целевую программу «Здоровое поколение Приморского края».
В Приморье ранняя остеопатическая коррекция признана законом Приморского края и внесена в краевую целевую программу «Здоровое поколение Приморского края».
В России в структуре детской инвалидности ведущее место занимают болезни нервной системы и психические расстройства, при этом до 35–40 % приходятся на поражения центральной нервной системы (ЦНС), возникшие в перинатальном периоде. Значительная часть неврологических расстройств у новорожденных связана с гипоксически-ишемическими поражениями ЦНС (ГИП ЦНС), доля которых составляет 60–80 % всех поражений ЦНС, развивающихся в этот период жизни [1]. Одной из составляющих клинической картины ГИП ЦНС перинатального периода являются двигательные нарушения разной степени выраженности. Исходы ГИП ЦНС могут варьировать от минимальных мозговых дисфункций до грубых двигательных расстройств при детском церебральном параличе.
Были обследованы 146 детей в возрасте от 1 до 9 месяцев с диагнозом «последствия церебральной гипоксии-ишемии 1–2-й степени, задержка моторного развития (F82)». К основной группе были отнесены 86 детей, к группе контроля — 60 детей [7, 13]. Дети обеих групп получали стандартный курс лечения неврологических нарушений. Детям основной группы дополнительно проводилась остеопатическая коррекция соматических дисфункций, количество процедур — 3–5 на курс, с частотой 1 раз в 7–10 дней. Наиболее частыми клиническими вариантами двигательных нарушений были мышечная дистония и гемипарез. Повторная оценка неврологического статуса проводилась через два месяца после первичного осмотра. В результате остеопатической коррекции отмечалась существенная положительная динамика в состоянии практически всех детей основной группы в виде уменьшения мышечного дисбаланса, увеличения объема активных и пассивных движений, исчезновения патологических рефлексов и признаков задержки психомоторного развития, восстановления выпрямительных реакций, становления координации движений, улучшения силы и манипулятивных функций кисти. В контрольной группе была также отмечена положительная динамика в состоянии детей, однако менее значимая по сравнению с основной группой.
К основной группе были отнесены 86 детей, к группе контроля — 60 детей [7, 13]. Дети обеих групп получали стандартный курс лечения неврологических нарушений. Детям основной группы дополнительно проводилась остеопатическая коррекция соматических дисфункций, количество процедур — 3–5 на курс, с частотой 1 раз в 7–10 дней. Наиболее частыми клиническими вариантами двигательных нарушений были мышечная дистония и гемипарез. Повторная оценка неврологического статуса проводилась через два месяца после первичного осмотра. В результате остеопатической коррекции отмечалась существенная положительная динамика в состоянии практически всех детей основной группы в виде уменьшения мышечного дисбаланса, увеличения объема активных и пассивных движений, исчезновения патологических рефлексов и признаков задержки психомоторного развития, восстановления выпрямительных реакций, становления координации движений, улучшения силы и манипулятивных функций кисти. В контрольной группе была также отмечена положительная динамика в состоянии детей, однако менее значимая по сравнению с основной группой. У 64 % детей в основной и 28 % детей в контрольной группе двигательные нарушения после лечения исчезли. Таким образом, остеопатическая коррекция у детей с перинатальными поражениями ЦНС гипоксически-ишемического генеза дает лучший результат по сравнению со стандартным лечением, особенно при мышечных дистониях (р < 0,05) (рис. 1).
У 64 % детей в основной и 28 % детей в контрольной группе двигательные нарушения после лечения исчезли. Таким образом, остеопатическая коррекция у детей с перинатальными поражениями ЦНС гипоксически-ишемического генеза дает лучший результат по сравнению со стандартным лечением, особенно при мышечных дистониях (р < 0,05) (рис. 1).
Рис. 1. Динамика двигательных нарушений и дистонии у детей с гипоксически-ишемическими поражениями центральной нервной системы
Одним из наиболее частых синдромов перинатального поражения нервной системы является гипертензионно-гидроцефальный синдром (ГГС). Внутричерепная гипертензия диагностируется у 80 % доношенных и почти у 100 % недоношенных детей с перинатальными поражениями ЦНС. Повышение внутричерепного давления вызывает быстрое нарастание дегенеративных изменений нервных клеток, а длительная интракраниальная гипертензия обусловливает их атрофию и гибель. Поэтому так важна ранняя диагностика и лечение данной патологии у грудных детей. Увеличение частоты аллергических реакций при медикаментозном лечении и недостаточная его эффективность делают необходимым поиск более эффективных методов лечения ГГС у детей первого года жизни.
Увеличение частоты аллергических реакций при медикаментозном лечении и недостаточная его эффективность делают необходимым поиск более эффективных методов лечения ГГС у детей первого года жизни.
Были сформированы две группы детей с ГГС в возрасте от 3 месяцев до 1 года по 30 человек в каждой. Детям основной группы проводилось стандартное лечение в сочетании с остеопатической коррекцией. Курс остеопатической коррекции состоял из 6–7 сеансов с интервалами в 5–6 дней. В контрольной группе дети получали только стандартное лечение [8, 12]. Все пациенты прошли клинико-инструментальное обследование до и после курса лечения: неврологическое, остеопатическое, нейросонографическое (НСГ) исследования, доплерографию сосудов головы и шеи.
Пациентов с полным регрессом неврологической симптоматики не было ни в одной группе. В основной группе наблюдалась более выраженная положительная динамика в ответ на лечение. Наиболее позитивные изменения достигнуты в проявлениях общей мозговой симптоматики, в уменьшении ширины боковых желудочков по данным НСГ (рис. 2), в уменьшении асимметрии линейной скорости кровотока по позвоночным артериям. Установленные различия статистически значимы (р < 0,05). Применение остеопатического лечения ГГС позволяет воздействовать на патогенез данного синдрома, что значительно повышает эффективность комплексного лечения. Результаты исследования показали эффективность остеопатического лечения детей первых месяцев жизни с ГГС. Раннее (до 1 месяца жизни) начало лечения позволяет достигнуть полного выздоровления. Остеопатический метод дает возможность отказаться от медикаментозной терапии при ГГС у доношенных детей без структурных изменений головного мозга.
2), в уменьшении асимметрии линейной скорости кровотока по позвоночным артериям. Установленные различия статистически значимы (р < 0,05). Применение остеопатического лечения ГГС позволяет воздействовать на патогенез данного синдрома, что значительно повышает эффективность комплексного лечения. Результаты исследования показали эффективность остеопатического лечения детей первых месяцев жизни с ГГС. Раннее (до 1 месяца жизни) начало лечения позволяет достигнуть полного выздоровления. Остеопатический метод дает возможность отказаться от медикаментозной терапии при ГГС у доношенных детей без структурных изменений головного мозга.
Рис. 2. Сравнение результатов лечения гипертензионно-гидроцефального синдрома у детей первого года жизни с применением остеопатической коррекции и без нее
Перинатальные нарушения в зоне краниовертебрального перехода являются причиной легкой формы бульбарной дизартрии, что вызывает нарушение тонуса мышц языка и околоротовой мускулатуры и приводит к затруднению артикуляции и задержке предречевого развития. Были обследованы 80 детей первого года жизни с дизартрическими проявлениями при нарушениях в зоне краниовертебрального перехода. Основная группа (44 ребенка) получала остеопатическое лечение, контрольная группа (36 детей) — стандартное медикаментозное лечение. У детей в основной группе в 75 % случаев восстановился тонус языка, в 85 % случаев — нормальная подвижность и тонус круговой мышцы рта, в 80 % случаев исчезала или уменьшалась асимметрия линейной скорости кровотока в вертебробазилярном бассейне. В группе сравнения эти показатели не изменились или ухудшились [6]. Остеопатическая диагностика и лечение позволяют выявить и эффективно устранить причины дизартрических проявлений, что существенно ускоряет процесс восстановления речевых функций, а также предотвращает прогрессирование задержки предречевого развития при нарушениях в зоне краниовертебрального перехода.
Были обследованы 80 детей первого года жизни с дизартрическими проявлениями при нарушениях в зоне краниовертебрального перехода. Основная группа (44 ребенка) получала остеопатическое лечение, контрольная группа (36 детей) — стандартное медикаментозное лечение. У детей в основной группе в 75 % случаев восстановился тонус языка, в 85 % случаев — нормальная подвижность и тонус круговой мышцы рта, в 80 % случаев исчезала или уменьшалась асимметрия линейной скорости кровотока в вертебробазилярном бассейне. В группе сравнения эти показатели не изменились или ухудшились [6]. Остеопатическая диагностика и лечение позволяют выявить и эффективно устранить причины дизартрических проявлений, что существенно ускоряет процесс восстановления речевых функций, а также предотвращает прогрессирование задержки предречевого развития при нарушениях в зоне краниовертебрального перехода.
Две независимые группы исследователей обследовали по сходным протоколам детей первого года жизни с дисплазией и подвывихом тазобедренного сустава, всего 92 ребенка [9, 10]. Основная группа (50 детей) получала остеопатическое лечение на фоне ортопедического лечения. Остеопатическое лечение осуществлялось в промежутках между сменами абдукционных шин-распорок с частотой 2–3 раза в месяц. В контрольной группе (42 ребенка) проводилось только ортопедическое лечение. Остеопатическое лечение улучшало соотношение костных элементов тазобедренного сустава, значительно уменьшало сроки их формирования, давало возможность формировать сустав без назначения лекарственных препаратов, позволяло снизить сроки фиксации ребенка в отводящих шинах в среднем на 1 месяц (рис. 3).
Основная группа (50 детей) получала остеопатическое лечение на фоне ортопедического лечения. Остеопатическое лечение осуществлялось в промежутках между сменами абдукционных шин-распорок с частотой 2–3 раза в месяц. В контрольной группе (42 ребенка) проводилось только ортопедическое лечение. Остеопатическое лечение улучшало соотношение костных элементов тазобедренного сустава, значительно уменьшало сроки их формирования, давало возможность формировать сустав без назначения лекарственных препаратов, позволяло снизить сроки фиксации ребенка в отводящих шинах в среднем на 1 месяц (рис. 3).
Рис. 3. Продолжительность лечения при дисплазии и подвывихе тазобедренного сустава у детей первого года жизни
Двумя группами исследователей показаны хорошие результаты остеопатической коррекции у детей 7–12 лет с миопией легкой степени и спазмом аккомодации. Основная группа (47 человек) получала остеопатическое лечение на фоне стандартного офтальмологического лечения, контрольная группа (47 человек) — только стандартное офтальмологической лечение [4, 11]. В основной группе тяжесть миопии после лечения в среднем уменьшилась на 0,5 D (в 59 % случаев тяжесть миопии уменьшилась, в 18 % случаев произошла стабилизация процесса без изменения данных рефрактометрии, в 23 % случаев состояние ухудшилось), в контрольной группе тяжесть миопии увеличилась на 1,0 D (стабилизация заболевания наступила только в 18 % случаев, ухудшение — в 82 %, а улучшение состояния не произошло вовсе). По данным ультразвуковой доплерографии сосудов головы и шеи исходно у всех детей наблюдалась асимметрия кровотока в позвоночных артериях. После лечения в основной группе симметрия кровотока восстановилась у 83 % пациентов, в контрольной группе изменений не наблюдалось.
Была проведена оценка эффективности остеопатического лечения в комплексной терапии нейрогенных дисфункций мочевого пузыря, осложненных хроническим буллезным циститом и пузырно-мочеточниковым рефлюксом (ПМР) у детей младшего школьного возраста [3]. В исследовании участвовали 33 ребенка, которые были разделены на основную (16 человек) и контрольную (17 человек) группы. Все пациенты прошли инструментальное обследование, включавшее УЗИ мочевого пузыря, цистоскопию, рентгенографию (микционную цистографию). Больные основной группы в составе комплексного лечения получали курс остеопатической терапии — от 5 до 8 сеансов с интервалами от 1 до 4 недель между процедурами; больные контрольной группы — только стандартное медикаментозное лечение. Контроль производился через 3 месяца при повторной плановой госпитализации. В основной группе у 50 % пациентов наблюдался полный регресс дизурической симптоматики, в группе сравнения — только у одного пациента. В основной группе после лечения полностью исчезли симптомы, резко снижающие качество жизни, такие как полное отсутствие позыва к микции (отведение мочи катетером), подтекание мочи и стрессовое недержание. По данным УЗИ в основной группе получено достоверное уменьшение объема мочевого пузыря (p < 0,01), толщины стенки (p < 0,01) и объема остаточной мочи (p < 0,01), в контрольной группе статистически значимыми были лишь изменения остаточного объема мочи (p < 0,05). Полученные результаты показали, что включение остеопатического лечения в программу терапии детей с хроническим буллезным циститом статистически значимо повышает эффективность лечебного воздействия. Комплексный подход (стандартное лечение и остеопатия) в лечении хронического буллезного цистита и ПМР может быть рекомендован также с целью уменьшения фармакологической нагрузки и уменьшения оперативной активности при лечении ПМР.
Все исследователи отмечают отсутствие каких-либо негативных влияний остеопатического лечения на состояние детей.
Заключение
Несмотря на сравнительно короткий период развития остеопатии в России, накоплен достаточно большой объем доказательств эффективности и безопасности ее методов при широком круге заболеваний детского возраста. Чем раньше будет проведена остеопатическая коррекция, тем лучше будет результат. Остеопатическое лечение безопасно, обеспечивает индивидуальный подход к пациенту, позволяет снизить лекарственную нагрузку у детей и риск развития полипрагмазии, хорошо сочетается с другими методами лечения, что особенно важно в педиатрии. Таким образом, остеопатия может дополнить арсенал клинической медицины и занять достойное место в системе оказания медицинской помощи детям.
Синдром врожденной центральной гиповентиляции: MedlinePlus Genetics
Синдром врожденной центральной гиповентиляции (CCHS) — это нарушение, которое влияет на нормальное дыхание. Люди с этим заболеванием делают поверхностный вдох (гиповентиляция), особенно во время сна, что приводит к нехватке кислорода и накоплению углекислого газа в крови. Обычно часть нервной системы, которая контролирует непроизвольные процессы в организме (вегетативная нервная система), реагирует на такой дисбаланс, стимулируя человека дышать глубже или просыпаться.Эта реакция нервной системы нарушена у людей с CCHS. Их необходимо поддерживать с помощью аппарата, который помогает им дышать (механическая вентиляция), или устройства, стимулирующего нормальный ритм дыхания (диафрагмальный кардиостимулятор). Некоторые люди нуждаются в этой поддержке 24 часа в сутки, а другие нуждаются в ней только ночью.
Симптомы CCHS обычно проявляются вскоре после рождения, когда пораженные младенцы гиповентилируют после засыпания. У этих младенцев недостаток кислорода в крови часто вызывает синюшность кожи или губ (цианоз).В некоторых более легких случаях CCHS может проявиться не раньше, чем в более зрелом возрасте.
Помимо проблемы с дыханием, люди с CCHS могут испытывать трудности с регулированием частоты сердечных сокращений и артериального давления, например, в ответ на упражнения или изменения положения тела. У них также уменьшилось восприятие боли, низкая температура тела и эпизодические эпизоды сильного потоотделения.
Люди с CCHS могут иметь дополнительные проблемы, влияющие на нервную систему. Около 20 процентов людей с CCHS имеют аномалии нервов, которые контролируют пищеварительный тракт (болезнь Гиршпрунга), что приводит к тяжелым запорам, кишечной непроходимости и увеличению толстой кишки.(Некоторые исследователи называют комбинацию CCHS и болезни Гиршпрунга синдромом Хаддада.) У некоторых затронутых людей возникают трудности с обучением или другие неврологические проблемы. Люди с CCHS также подвержены повышенному риску развития определенных опухолей нервной системы, называемых нейробластомами, ганглионевромами и ганглионейробластомами.
Кроме того, люди с CCHS обычно имеют аномалии глаз, включая снижение реакции зрачков на свет. Люди с CCHS, особенно дети, могут иметь характерную внешность с коротким, широким, несколько приплюснутым лицом, часто описываемым как «коробчатое».»
В CCHS ожидаемая продолжительность жизни и степень умственной отсталости зависят от тяжести расстройства, времени постановки диагноза и успеха лечения.
О каких неонатальных осложнениях педиатр должен знать в случае гестации матери диабет?
Abstract
В эпидемиологическом контексте материнского ожирения и диабета 2 типа (СД2) за последние десятилетия значительно увеличилась заболеваемость гестационным диабетом. Младенцы от матерей с диабетом склонны к различным неонатальным неблагоприятным исходам, включая метаболические и гематологические расстройства, респираторный дистресс, сердечные расстройства и неврологические нарушения из-за перинатальной асфиксии и родовых травм, среди прочего.Макросомия является наиболее частым последствием диабета, и на ее тяжесть в основном влияет уровень глюкозы в крови матери. Гипогликемия новорожденных — это основное нарушение обмена веществ, которое следует предотвращать как можно скорее после рождения. Тяжесть макросомии и состояние здоровья матери сильно влияют на частоту и тяжесть неблагоприятных исходов у новорожденных. Прегестационный СД2 и материнское ожирение значительно увеличивают риск перинатальной смерти и врожденных дефектов. Высокая частота материнской гипергликемии в развивающихся странах, связанная с нехваткой медицинской помощи матерям и новорожденным, серьезно увеличивает бремя неонатальных осложнений в этих странах.
Ключевые слова: Врожденные пороки, гипогликемия, респираторный дистресс, недоношенность, перинатальная смертность, диабет 2 типа, ожирение
Основной совет: Исторически сложилось так, что новорожденные от матерей с диабетом приписывают повышенную смертность и заболеваемость. Тщательный анализ литературы показывает, что эти неблагоприятные исходы не характерны для младенцев, рожденных от матерей с «чистым» гестационным сахарным диабетом (GDM), которые хорошо контролируются во время беременности. Макросомия является преобладающим неблагоприятным исходом и основным фактором, связанным с неонатальными осложнениями.Плохой материнский гликемический контроль, особенно в контексте материнского диабета 2 типа и ожирения, увеличивает риск всех неблагоприятных неонатальных исходов, особенно риск перинатальной смертности и врожденных дефектов. Следует поощрять разработку стратегий скрининга и ведения женщин с ГСД, особенно в странах со средним и низким уровнем доходов, а также для ограничения неблагоприятных последствий для здоровья населения мира в будущем.
ВВЕДЕНИЕ
Сахарный диабет беременных (ГСД) определяется как непереносимость глюкозы любой степени, возникшая или впервые выявленная во время беременности.В странах с высоким уровнем доходов, а также в странах со средним и низким уровнем доходов из-за распространения индустриального образа жизни резко возросла заболеваемость ожирением и диабетом 2 типа (СД2), а, следовательно, и заболеваемость ГСД [1].
В странах с высоким уровнем ресурсов за последние пятьдесят лет был достигнут прогресс в области до зачатия, скрининга и лечения ГСД. Однако в странах с низким и средним уровнем доходов качество дородовой помощи для выявления и лечения ГСД часто бывает неудовлетворительным.Как следствие, пренатальное и неонатальное бремя ГСД может быть парадоксальным образом выше в этих странах, хотя этот момент недостаточно документирован [2].
Большая часть имеющихся в настоящее время знаний о последствиях материнского диабета для потомства была получена в результате исследований диабета 1 типа (СД1), в то время как риски, связанные с ГСД, который встречается гораздо чаще, необходимо уточнить, чтобы улучшить и адаптировать неонатальное ведение [3]. Более того, обширные данные свидетельствуют о том, что потомки матерей с диабетом подвергаются повышенному риску развития хронических неинфекционных заболеваний во взрослом возрасте [4].
Неонатологи в первую очередь обращаются к этой новой эпидемиологической обстановке. В этом обзоре рассматриваются имеющиеся в настоящее время знания о краткосрочных последствиях ГСД у новорожденных и рассматриваются ситуации с повышенным риском неблагоприятных исходов у новорожденных.
КРАТКОВРЕМЕННЫЕ РЕЗУЛЬТАТЫ
Макросомия
Макросомия — наиболее частое осложнение ГСД. Концепция чрезмерного роста плода выражается либо словом «макросомия», либо выражением «большой для гестационного возраста» (LGA).Макросомия определяется массой тела при рождении 4000 или 4500 г и более, в зависимости от авторов. Однако в этом определении не учитывается гестационный возраст (ГА). Термин LGA соответствует BW ≥ 90 -го процентиля или> + 2SD (> 97 -го процентиля) для GA. Это определение позволяет идентифицировать недоношенных новорожденных с чрезмерным ростом плода. Макросомия у новорожденных от матерей-диабетиков характеризуется избытком жира в организме, увеличением мышечной массы и органегалией без увеличения размера мозга.
Гипотеза Педерсена-Фрейнкеля, высказанная шестьдесят лет назад, предполагала, что избыточный рост плода связан с повышенным трансплацентарным переносом материнской глюкозы, что стимулирует высвобождение инсулина бета-клетками поджелудочной железы плода [5]. Инсулин является основным фактором роста плода и активирует систему инсулиноподобного фактора роста (IGF), что впоследствии приводит к макросомии плода. Согласно этой гипотезе, различные исследования охарактеризовали связь между материнской гликемией и неонатальной макросомией или жировой массой [6,7].
Исследование HAPO показало постоянную положительную связь между материнской гликемией, гиперинсулинизмом плода и массой тела [8]. В этом исследовании была обнаружена линейная и непрерывная зависимость между процентным содержанием жира в организме новорожденных, материнской гликемией и уровнем инсулина плода [9]. Совсем недавно были задействованы другие механизмы, которые также могут способствовать избыточному росту плода, такие как метаболическая среда матери и модификации плаценты [10]. В частности, доступность материнских липидов и их транспортировка к плоду могут быть увеличены в случае материнского диабета [11].
Следовательно, все типы материнского диабета являются факторами риска макросомии. Как обсуждается ниже, макросомия сама по себе является причиной повышенного неонатального неблагоприятного исхода, и этот момент подчеркивает важность распознавания избыточного роста даже у недоношенных детей. Лечение ГСД значительно снижает частоту макросомии [12,13].
Преждевременные роды
В ряде исследований сообщается о повышенном риске преждевременных родов в случае диабета. Однако данные о соотношении индуцированных и самопроизвольных родов не всегда доступны, учитывая повышенную заболеваемость диабетом у матери и плода во время беременности.Преимущества ранних родов во избежание гибели плода или дистоции плеча должны быть сопоставлены с заболеваемостью, связанной с преждевременными родами, особенно с респираторной заболеваемостью.
Связь между GDM и спонтанными преждевременными родами до сих пор остается спорной. Hedderson et al [14] показали в большом когортном исследовании, что ГСД является независимым фактором риска самопроизвольных преждевременных родов (ОР = 1,42, 95% ДИ: 1,15–1,77). С другой стороны, Yogev et al [15] обнаружили, что частота спонтанных преждевременных родов не увеличивалась при GDM по сравнению с пациентами без GDM.Тем не менее, оба исследования обнаружили взаимосвязь между более высокими значениями глюкозы в пероральном тесте на толерантность к глюкозе (OGTT) или более высокими средними уровнями глюкозы в крови и преждевременными родами.
Нарушения обмена веществ
Гипогликемия: Связь между макросомией, повышенным уровнем С-пептида пуповины, который отражает секрецию фетального инсулина, и неонатальной гипогликемией известна давно. Данные, собранные в исследовании HAPO, подтвердили эту взаимосвязь: неонатальная гипогликемия была тесно связана с повышенными уровнями С-пептида в сыворотке пуповины [16].Младенец от матери, страдающей диабетом, подвержен риску преходящего гиперинсулинизма, который предотвращает при рождении нормальную активацию метаболических путей, производящих глюкозу и кетоновые тела, и вызывает повышенное потребление глюкозы тканями [17].
Точную частоту гипогликемии при материнском диабете трудно оценить из-за различных определений, используемых для неонатальной гипогликемии в литературе. В двух крупных исследованиях частота гипогликемии, получавшей внутривенное лечение, составляла от 5% до 7% [18,19].Сравнение с риском, наблюдаемым у здоровых новорожденных, затруднено еще и потому, что в большинстве исследований мониторинг уровня глюкозы крови при рождении отличался в зависимости от того, была ли мать диабетиком или нет. Наконец, во многих исследованиях уровень глюкозы в крови новорожденных проверяется вскоре после рождения, хотя патологическое значение низкого уровня глюкозы в крови сразу после рождения при отсутствии специфических симптомов все еще остается под вопросом. Действительно, после рождения наблюдается немедленное падение концентрации глюкозы в крови из-за прерывания плацентарного питания, достигая надира между 1 и 2 часами у здоровых доношенных детей [20].Нормальные уровни в этот период невозможно отличить от аномальных у бессимптомных младенцев, а частота гипогликемии, вероятно, будет завышена [21]. С 3-х часового возраста уровень глюкозы в крови самопроизвольно повышается, даже при отсутствии каких-либо пищевых добавок, из-за активации метаболических регуляторных путей. Следовательно, при отсутствии патологических клинических признаков первое измерение уровня глюкозы в крови рекомендуется после второго кормления, что обычно позволяет идентифицировать младенцев, которые не могут справиться с адекватным ранним гомеостазом глюкозы [21].
В настоящее время нет единого мнения относительно показаний к систематическому мониторингу уровня глюкозы в крови у бессимптомных младенцев, рожденных от матерей с диабетом. Представляется разумным предположить, что младенцы с LGA или ограниченным ростом (<10 th процентиля), рожденные от диабетической матери, могут получить пользу от проверки концентрации глюкозы в крови с интервалами от 3 до 6 часов в течение первого дня жизни. С другой стороны, нормально выросшие дети от матерей с контролируемым диетой ГСД не подлежат наблюдению [22].
Для новорожденных без клинических признаков терапевтическое вмешательство можно рассматривать, начиная с порогового значения 0.36 г / л (2,0 ммоль / л). Раннее и частое кормление грудью остается ключом к предотвращению гипогликемии, независимо от BW младенца, поскольку он / она может кормить самостоятельно. Таким образом, новорожденных от матерей с диабетом следует держать отдельно от матери при отсутствии серьезных осложнений, требующих перевода в неонатальное отделение особого ухода. Даже у младенцев с легкими или умеренными симптомами с низким уровнем глюкозы в крови, длительным грудным вскармливанием или, в конечном итоге, следует сначала попробовать смеси-добавки при условии получения удовлетворительного клинического ответа [22].В случае, если младенец не может кормиться, следует вводить внутривенное введение глюкозы (3-6 мг / кг в час) с постоянной скоростью инфузии, чтобы избежать повторной гипогликемии.
Гипокальциемия: Гипокальциемию можно определить по концентрации кальция в плазме ниже 2 ммоль / л или концентрации ионизированного кальция ниже 1,1 ммоль / л, независимо от GA или BW. Транзиторная неонатальная гипокальциемия в основном наблюдалась у новорожденных от прегестационных матерей с инсулинозависимым диабетом и может быть частично связана с материнской гипомагниемией и последующей гипомагниемией плода.Тяжесть гипокальциемии также оказалась связанной с тяжестью материнского диабета, поскольку концентрация кальция у новорожденных была отрицательно связана с материнскими уровнями HbA1c [23].
Кажется, что гипокальциемия редко имеет клиническое значение, особенно в случае GDM, если не связаны другие осложнения [24].
Механизм до сих пор неясен, но, по-видимому, связан с аномальным метаболизмом фосфора кальция во время беременности со снижением концентрации кальция и витамина D, особенно в третьем триместре.В некоторых исследованиях сообщается о связи между GDM и низким уровнем витамина D у матери, особенно с плохим контролем уровня глюкозы в крови. И наоборот, появляется все больше свидетельств того, что женщины, у которых развивается ГСД, с большей вероятностью страдают дефицитом витамина D [25]. Другие факторы, такие как недоношенность и перинатальная асфиксия, могут способствовать снижению уровня кальция [26].
Следовательно, нет показаний для обследования здорового ребенка на гипокальциемию и гипомагниемию. Когда показано лечение, оно заключается в приеме пероральных добавок витамина D и глюконата кальция перорально или внутривенно (40-60 мг / кг в день) и лечения магнием в зависимости от уровня в плазме.
Гипербилирубинемия: Гипербилирубинемия чаще наблюдается у младенцев, рожденных от матерей с диабетом. Если диагностировать и лечить нетоксичные уровни, это не является серьезным осложнением, что обычно и имеет место. О риске ядерной желтухи, тяжелой формы гипербилирубинемии, не сообщается в случаях диабета, поскольку он встречается чаще. В исследовании HAPO гипербилирубинемия слабо связана с уровнем глюкозы в крови матери [8]. Полицитемия может быть одной из причин, но могут быть задействованы дополнительные механизмы, такие как преждевременные роды, плохая конъюгация печени.
Гематологические нарушения
Сообщалось, что младенцы от матерей с диабетом могут иметь полицитемию [гематокрит (Ht) выше 65%]. Вызываемые механизмы включают снижение трансплацентарного транспорта кислорода к плоду и увеличение потребления кислорода плодом из-за гиперинсулинизма плода. Это может привести к гипоксии плода и повышению уровня эритропоэтина плода. Однако не было зарегистрировано устойчивой корреляции между уровнем эритропоэтина в плазме и полицитемией у человека. Повышенный уровень инсулина и IGF также может увеличить выработку красных кровяных телец.Сильная положительная корреляция между материнскими уровнями β-гидроксибутирата и полицитемией наблюдалась в небольшом обсервационном исследовании [27].
Нормоволемическая полицитемия, наблюдаемая у младенцев от диабетической матери, может привести к повышенной вязкости. Ранние симптомы неспецифичны, проблемы с кормлением, полнокровие, акроцианоз, летаргия, гипотония, респираторный дистресс, нервозность и раздражительность, судороги (из-за множественных инфарктов головного мозга), некротический энтероколит, гипербилирубинемия и гипогликемия — все они связаны.Полицитемия также может способствовать тромбозу глубоких сосудов. Гипогликемия может усугубляться у младенцев от матерей с диабетом в случае полицитемии из-за повышенного потребления глюкозы за счет увеличения массы эритроцитов. Частичное обменное переливание физиологического раствора должно выполняться младенцам с симптомами в соответствии с формулой (обменный объем в мл): (Ht-55) x вес (кг) x 80 / Ht.
Респираторные расстройства
Частота и риск респираторного дистресс-синдрома (РДС) в случаях ГСД не могут быть точно установлены из-за недостаточности точных данных [28].В недавнем исследовании французской когорты рожденных в 2011 году, включавшей 474 614 родов, риск неонатальных респираторных расстройств был немного, но значительно повышен в случае ГСД [ОШ с поправкой на возраст матери и гестационный возраст 1,2 (1,1–1,3)] ( личные данные еще не опубликованы).
Общепризнано, что, помимо РДС, младенцы, рожденные от матерей с диабетом, подвержены повышенному риску преходящего тахипноэ у новорожденных. Это чаще происходит после кесарева сечения из-за замедленного уменьшения альвеолярной жидкости при рождении и когда у младенцев есть макросомия.Это было четко показано у новорожденных от матерей с СД1 [29].
Диабет, а также индекс массы тела матери (ИМТ) связаны с более высоким риском стойкой легочной гипертензии (ПРК). Однако другие независимые факторы риска, такие как макросомия и кесарево сечение, могут быть причиной между диабетом, избыточной массой тела и ПРК [30].
Сердечные расстройства
Гипертрофическая кардиомиопатия: У плода, подверженного гипергликемии и гиперинсулинизму матери, может развиться гипертрофическая кардиомиопатия.В первую очередь он поражает межжелудочковую перегородку, но в более тяжелых случаях может распространяться на миокард [31].
Сообщалось о гипертрофии миокарда как при прегестационном диабете, так и при ГСД с широким диапазоном частот (от 25% до 75% младенцев, рожденных от матерей с диабетом) [32,33]. Заболеваемость была ниже в случае чистого GDM по сравнению с прегестационным диабетом [34]. Самые последние исследования показали, что хороший контроль гликемии у матери не предотвращает полностью гипертрофию межжелудочковой перегородки и незначительное нарушение сердечной функции плода, независимо от типа диабета [35,36].Хотя гипертрофия миокарда связана с общим снижением податливости желудочков и увеличением сократительной способности левого и правого желудочков, чаще всего она протекает бессимптомно. Иногда это может привести к тяжелой заболеваемости и смертности в зависимости от тяжести и продолжительности сердечной гипертрофии. Большая гипертрофия перегородки может привести к субаортальному стенозу и вторичной митральной недостаточности. Обычно считается, что гипертрофия сердца проходит анатомически в течение нескольких месяцев.Однако долгосрочное влияние диабетической кардиомиопатии на функцию сердца еще предстоит выяснить.
Пороки развития сердца: Некоторые данные подтверждают, что GDM несет небольшое, но значительно увеличенное количество врожденных дефектов (OR между 1,1 и 1,3), но это намного ниже, чем у женщин с прегестационным диабетом [37]. Описанные пороки развития аналогичны таковым при прегестационном диабете, особенно сердечно-сосудистые дефекты и аномалии, затрагивающие скелетно-мышечную и центральную нервную системы [38,39].
Наиболее часто регистрируемые пороки развития сердца включают транспозицию магистральных артерий, двойное выходное отверстие правого желудочка, артериальный ствол, синдром гипоплазии левых отделов сердца и дефекты межжелудочковой перегородки [40].
Антенатальное ультразвуковое исследование играет важную роль в мониторинге анатомии и функции сердца плода. Антенатальная диагностика пороков сердца помогает определить место рождения, когда требуется особая неонатальная кардиологическая помощь. Младенцам женщин с ГСД необходимо пройти эхокардиограмму при наличии при рождении клинических признаков, связанных с врожденными пороками сердца (цианоз, шум) или кардиомиопатией (сердечная недостаточность).
Неврологические нарушения
Младенцы от матерей с диабетом предрасположены к неврологическим нарушениям, в основном из-за перинатальной асфиксии, родовых травм и нарушений обмена веществ.
Перинатальная асфиксия: В ряде исследований сообщалось о повышенном риске перинатальной асфиксии у беременных с диабетом. Риск перинатальной асфиксии увеличивается в случае макросомии, особенно когда имеется дистоция плеча [28,41]. Нарушение среды плода, характеризующееся гипоксией плода, также упоминалось как способствующий фактор.
Однако в случаях ГСД частота перинатальной асфиксии, определяемая 5-минутным баллом по шкале Апгар <7, была очень низкой (1–2%) в исследовании, в котором участвовало более тысячи новорожденных матерей с ГСД [18 ]. В другом исследовании pH пупочной артерии <7,2 составлял около 15% в группе GDM, что сравнимо с группой без диабета [42]. В обоих исследованиях на заболеваемость не влияло лечение материнского диабета.
Нарушения обмена веществ: Глюкоза является основным энергетическим субстратом для мозга.У новорожденных гипогликемия может привести к тому, что энергетический метаболизм мозга не может поддерживаться. Последствия низкого уровня глюкозы в крови зависят от наличия других субстратов, таких как лактат и кетоновые тела, которые также используются мозгом для выработки энергии. Эти альтернативные субстраты обычно не измеряются, и нормальные пороговые значения неизвестны. Их наличие также зависит от клинического состояния и состояния питания младенца.
Для младенцев с клиническими признаками, совместимыми с гипогликемией, такими как апноэ, гипотония, нервозность, апатия, гипотермия, тремор и судороги, лечение должно обеспечивать, чтобы уровень глюкозы в крови оставался выше 0.45 г / л (2,5 ммоль / л). Необходимо срочно ввести болюсную дозу глюкозы (150-200 мг / кг) внутривенно с последующей инфузией с постоянной скоростью. Необходимо убедиться, что в дальнейшем концентрация глюкозы в крови стабилизируется в пределах нормы (20). В случае клинических признаков Cornblath et al [43] предположили, что должна выполняться триада Уиппла: низкая концентрация глюкозы в крови; признаки, соответствующие гипогликемии; и исчезновение признаков и симптомов после восстановления нормальных значений концентрации глюкозы в крови.Следовательно, если симптомы сохраняются, несмотря на адекватное лечение, следует изучить другие причины, поскольку эти симптомы неспецифичны.
Симптомы гипокальциемии аналогичны симптомам, наблюдаемым при гипогликемии, но обычно проявляются позже, между 24–72 часами жизни [31]. Затем следует измерить концентрацию кальция в крови при наличии симптомов, указывающих на гипокальциемию.
Травмы плечевого сплетения: Спинной мозг уязвим для родовой травмы с симптомами, связанными с параличом плечевого сплетения.
Наиболее распространенный тип травмы плечевого сплетения, также называемый параличом Эрба, касается корней шейки матки от C5 до C7. У младенца повёрнутая внутрь рука и согнутое запястье. Второй наиболее распространенный тип, называемый параличом полного сплетения, включает шейные корни C5-C8 и иногда грудной корень T1. Младенец представляет вялую и нечувствительную руку и руку с когтями. Паралич полудиафрагмы также наблюдается при поражении диафрагмального нерва, что приводит к дыхательной недостаточности и необходимости искусственной вентиляции легких [44].
Заболеваемость параличом плечевого сплетения у новорожденных от матерей с диабетом низкая, от 0,2% до 3%. Как следствие, невозможно было точно измерить риск [28].
Плохое кормление грудью: В начале девяностых было показано, что материнский GDM может нарушать неонатальное поведение, приводя к летаргии и гипотонии, связанной с задержкой нервного созревания. Совсем недавно более плохие модели сосания были обнаружены на 3-й день только у младенцев от матерей с ГСД, которым вводили инсулин, но не у матерей, соблюдающих диету [45].Это исследование подтвердило некоторую степень неврологической незрелости в раннем неонатальном периоде.
Нарушение пищеварения
Помимо трудностей с кормлением из-за плохого режима сосания, новорожденные от матерей с диабетом также могут иметь неонатальную тонкую левую кишку, причину функциональной непроходимости нижнего кишечника, которая может имитировать болезнь Гиршпрунга. Патофизиология неизвестна, но в значительной степени связана с материнским диабетом. Лечение всегда консервативное до тех пор, пока не произойдет перфорация кишечника.Контрастная клизма является одновременно диагностической (резкая переходная зона при изгибе селезенки) и лечебной, способствуя эвакуации мекония, снимая кишечную непроходимость [46].
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ТЯЖЕСТЬ НЕОНАТАЛЬНЫХ ПОБОЧНЫХ РЕЗУЛЬТАТОВ ПРИ ГСД
Неблагоприятные исходы для новорожденных, описанные выше, не являются постоянными во всех случаях, но на них существенно влияет качество материнской помощи и здоровье матери. Более того, большая часть этих осложнений чаще возникает у макросомных младенцев.
Состояние матери и исходы новорожденных
Влияние уровня глюкозы в крови матери и прегестационного СД2 на исходы новорожденных: Перинатальная смерть, пороки развития и недоношенность в основном зависят от уровня глюкозы в крови матери. Как обсуждалось выше, существует также линейная зависимость между материнским уровнем глюкозы и частотой макросомии [8]. Кроме того, анализ риска пороков развития плода и перинатальной смерти в случае ГСД показывает, что недиагностированный СД2 до беременности оказывает существенное влияние на эти серьезные перинатальные осложнения.
Существует взаимосвязь между частотой пороков развития и уровнем глюкозы в крови матери натощак [39,47]. Этот риск также увеличивается с увеличением ИМТ матери и при диагностировании ГСД на ранних сроках беременности [48,49]. Большинство серьезных пороков развития возникают на очень ранних сроках беременности, на эмбриональной стадии. При диабетической беременности они связаны с нестабильной периконцепционной гликемией. Гипергликемия у матери приводит к избыточному метаболизму глюкозы в развивающемся эмбрионе, который может изменять различные молекулярные цепные реакции: (1) измененный метаболизм липидов в клетках, в частности, производство простагландина E2, участвующего в проходимости артериального протока в утробе матери [50]; (2) высокие уровни глюкозы вызывают избыточное производство активных форм кислорода, которые, как было показано, вызывают окислительный стресс и, следовательно, увеличивают риск пороков развития плода, особенно дефекта нервной трубки [51]; а также (3) высокие уровни глюкозы вызывают активацию многих белков, участвующих в апоптотической гибели клеток, включая членов семейств каспаз [52].Хотя данные о молекулярной основе диабетической эмбриопатии улучшились за последние годы, механизмы все еще не полностью изучены [53].
Эти клинические и физиопатологические данные предполагают, что повышенный риск врожденных дефектов при ГСД, о котором сообщалось в некоторых исследованиях, вероятно, связан с включением женщин с недиагностированным СД2 в группы ГСД [54].
В отличие от прегестационного диабета, повышенная частота гибели плода в 2 и 3 триместрах беременности является предметом споров в случаях ГСД [55,56].В большом когортном исследовании уровень смертности составил 16,2 / 1000 в группе GDM против 12,5 / 1000 в общей популяции. Через шесть недель после родов женщины с диагнозом GDM были переклассифицированы с помощью послеродового теста на толерантность к глюкозе. Женщины, страдающие диабетом при послеродовом обследовании, рассматривались как «впервые заболевшие СД2». Когда эти женщины были исключены из группы GDM, перинатальная смертность составляла 8,9 / 1000 в «истинной» группе GDM, что было аналогично населению в целом. Смертность была самой высокой в группах с диагнозом СД2 до и после беременности (соответственно 39.1/1000 и 56,2 / 1000) [57]. Эти данные продемонстрировали, что повышенный риск перинатальной смерти, о котором сообщалось в некоторых исследованиях в случае ГСД, по-видимому, может быть связан с недиагностированным СД2.
Недоношенность — одна из основных причин неонатальной смерти. Как обсуждалось выше, более высокие уровни глюкозы у матери наблюдались в случае недоношенности при беременности с GDM. Кроме того, одной из основных причин индуцированных преждевременных родов является преэклампсия у матери, которая чаще всего связана с беременностями СД2 [58].
Влияние материнского ожирения на осложнения GDM: Материнское ожирение связано с худшим перинатальным исходом даже у толерантных к глюкозе женщин. Макросомия является основным осложнением, о котором сообщается у женщин с избыточным весом или ожирением, независимо от диабета [59–62]. Хорошо известно, что новорожденные, рожденные от женщин с ожирением, даже при нормальной толерантности к глюкозе, имеют повышенную жировую массу [63]. Как и при ГСД, повышенное ожирение при рождении связано с избытком глюкозы и липидов у матери и переносом плода через плаценту [11].
Риск гибели плода и младенца в два-три раза выше у женщин с ожирением до зачатия после исключения беременностей, вызванных врожденными аномалиями или прегестационным диабетом [64]. Недавно было показано, что даже небольшое увеличение ИМТ матери было связано с повышенным риском внутриутробной смерти, мертворождения, а также неонатальной, перинатальной и младенческой смерти. Относительный риск на 5-кратное увеличение ИМТ матери варьировал от 1,15 до 1,24 [65]. Материнское ожирение также связано с повышенным риском ряда структурных аномалий, с более высоким риском дефектов нервной трубки [66,67].Интересно отметить, что риск определенных пороков развития, таких как омфалоцеле и диафрагмальная грыжа, увеличивается у беременных с ожирением, но не в случае диабета [68,69].
Существует тесная связь между ожирением у матери и диабетом во время беременности. Действительно, риск ГСД увеличивается с увеличением ИМТ матери [70]. Общая популяционная доля ГСД, связанная с избыточной массой тела, оценивается в 46,2% [71].
Положительный эффект лечения диабета на исходы новорожденных ниже у женщин с ожирением, даже если достигнуты целевые уровни гликемического контроля.Более того, когда ГСД не лечится или плохо контролируется, женщины с избыточным весом и ожирением имеют более высокий риск неблагоприятного неонатального исхода по сравнению с женщинами с ГСД с нормальным весом [42,72].
Комбинация GDM и ожирения оказывает большее влияние на исход беременности, чем только GDM или ожирение. Этот совокупный риск был показан для макросомии, процента жира в организме новорожденного и родовых травм [73]. Сообщалось также о комбинированном неонатальном исходе (МТ> 4000 г, родовая травма, дистоция плеча, гипогликемия или желтуха) [74].
Влияние макросомии на исходы новорожденных
Давно сообщалось, что рождение макросомных младенцев связано с более высоким риском неблагоприятных неонатальных заболеваний, таких как родовая травма, респираторный дистресс и гипогликемия. Макросомия (МТ> 4500 г), независимо от причины, также сама по себе является фактором риска асфиксии и перинатальной смерти [75].
Макросомия увеличивает риск дистоции плеча, независимо от причины. В исследовании Zhang et al [75] риск родовой травмы был самым высоким для младенцев с массой тела при рождении 4500–4999 г и ≥ 5000 г [OR 2.4 (2,2–2,5) и 3,5 (3,0–4,2) соответственно].
В случае ГСД особенно высок риск респираторного дистресса у новорожденных с массой тела ≥ 4000 г по сравнению с новорожденными с массой тела менее 4000 г [OR = 3,1 (1,11-8,65)] [76] . В другом исследовании риск респираторных осложнений возрастал с увеличением BW ≥ 4000 г, независимо от диабетического статуса матери [22]. Более того, кажется, что клинически значимая гипертрофическая кардиомиопатия без сопутствующей макросомии плода наблюдается редко [40].
Анализ данных, собранных в исследовании HAPO, показал, что неонатальная гипогликемия сильно связана с повышенным уровнем С-пептида пуповины. Высокие уровни С-пептида связаны с важностью гиперинсулинемии плода, которая способствует ускоренному росту плода. Следовательно, младенцы с чрезмерным размером при рождении склонны к развитию гипогликемии [16]. Было показано, что при МТ ≥ 4000 г риск гипогликемии повышался, но риск был выше, когда МТ ≥ 4000 г был связан с материнским GDM [76].В другом исследовании риск гипогликемии увеличивался с увеличением BW, независимо от диабетического статуса матери [77].
РАЗМЕР БРЕМЕНИ В СТРАНАХ С НИЗКИМ ДОХОДОМ
Распространенность факторов риска диабета во время беременности увеличивается во всем мире из-за увеличения заболеваемости СД2 и ожирения, а также смещения возраста начала диабета в более молодые возрастные группы. СД2 — это скрытое заболевание, которое может оставаться невыявленным, особенно у молодых женщин репродуктивного возраста.Недавнее исследование показало, что глобальная распространенность гипергликемии у беременных в 2013 году составила 170/1000 живорождений. Большинство случаев произошло в странах с низким и средним уровнем доходов (91,6%). Распространенность широко варьируется во всем мире. В регионе Юго-Восточной Азии была самая высокая распространенность — 23% живорождений, за ним следуют регионы Ближнего Востока и Северной Африки с 22% [78].
Перспективная программа на уровне общины в Индии с универсальным скринингом на GDM показала, что распространенность GDM составила 13 человек.9%. Частота широко варьировалась в городских, полугородских и сельских районах, соответственно 17,8%, 13,8% и 9,9%. Распространенность также варьировалась в зависимости от ИМТ матери. Для ИМТ ≥ 25 мг / м 2 заболеваемость составляла до 28,4%, 23,8% и 16,1% в городских, пригородных и сельских районах соответственно [79].
Недавний анализ данных Глобального исследования Всемирной организации здравоохранения (ВОЗ) по материнским и перинатальным исходам в 23 развивающихся странах описал распространенность макросомии, одного из основных осложнений материнского диабета и ожирения [80].Распространенность младенцев с МТ ≥ 4 кг сильно различалась: от 0,5% в Индии до 15% в Алжире. Материнский диабет и повышенный гестационный ИМТ были значительно связаны с макросомией во всех регионах. Например, в Алжире, где 15% младенцев имели МТ ≥ 4 кг, 25% матерей страдали ожирением (ИМТ ≥ 30 кг / м 2 ). В странах Латинской Америки частота материнского ожирения превышала 30% (Аргентина, Мексика и Парагвай).
Таким образом, можно оценить, что бремя неонатальных осложнений выше в развивающихся странах, чем в странах с высоким уровнем доходов, из-за высокой частоты материнской гипергликемии и отсутствия скрининга и лечения материнского диабета, и, наконец, из-за неонатального неонатального уровня. забота.Это, вероятно, даже хуже всего в сельской местности из-за ограниченных финансовых и человеческих ресурсов.
Травма головного мозга при рождении | Ранние признаки повреждения мозга
Когда у ребенка возникают осложнения во время родов или врачи диагностируют или подозревают врожденный дефект, родители опасаются, что у ребенка повреждение мозга. Если травмы не очевидны, педиатр обычно говорит родителям, что еще слишком рано знать, поврежден ли новорожденный мозг.
Ответ педиатра правильный, но неполный.Что вы действительно хотите знать, так это какова вероятность того, что ваш ребенок получил повреждение мозга? Ваш педиатр предпочел бы отбросить этот вопрос, потому что он не знает или не хочет вам говорить. Вы хотите знать ответ, потому что незнание сводит вас с ума, и, что более важно, раннее вмешательство важно для достижения наилучших результатов для детей с родовой травмой.
Мы не можем сказать вам, какова вероятность того, что ваш ребенок получил повреждение мозга при рождении (или в утробе матери).Но мы можем помочь вам лучше понять ранние признаки повреждения мозга, чтобы вы могли лучше понять, с чем сталкиваетесь вы и ваш ребенок. Скорее всего, с информацией, которую вы получите на этом веб-сайте и в других местах, вы узнаете, есть ли у вашего ребенка травма головного мозга, задолго до того, как врач когда-либо подтвердит вашу гипотезу.
Прежде чем мы начнем, запомните одну вещь: большинство родителей, которые считают, что у их ребенка травма головного мозга при рождении, в конечном итоге оказываются неправы.
Повреждения головного мозга являются наиболее серьезным видом родовых травм.Повреждение головного мозга новорожденного — наиболее частая причина детской смертности и необратимых физических недостатков, таких как церебральный паралич. Повреждения головного мозга у младенцев могут быть вызваны одной из трех причин:
- врожденные дефекты
- внешняя травма головы во время родов или
- кислородное голодание во время родов или беременности.
Повреждения головного мозга у младенцев редко подтверждаются сразу, даже если дети находятся в отделении интенсивной терапии длительное время.Фактически, некоторые черепно-мозговые травмы не диагностируются официально, пока ребенку не исполнится один или два года. Для родителей, которые обеспокоены тем, что их ребенок мог получить черепно-мозговую травму во время родов, очень важно понимать возможные симптомы такой травмы.
Ранние признаки повреждения мозга у новорожденныхНекоторые из самых ранних ранних признаков возможного повреждения мозга у новорожденных — это физические отклонения, которые можно наблюдать, просто глядя на ребенка. Эти ранние физические симптомы присутствуют только при определенных типах травм головного мозга.
- Чрезмерно большой лоб
- Искривленный или деформированный позвоночник
- Черты лица выглядят ненормальными или искаженными
- Голова недостаточного размера
- Спонтанные припадки
- Жесткость в шее
- Глаза не могут двигаться и фокусироваться у новорожденных с ненормальным темпераментом и поведенческими паттернами:
- Неспособность спать лежа
- Интенсивный плач (с изогнутой спиной)
- Проблемы с кормлением
Часто проявляются ранние внешние признаки повреждения мозга младенца или пропустите.У некоторых младенцев с очень серьезными травмами головного мозга могут не проявляться какие-либо из первых физических признаков. Другие будут.
По мере роста младенцы обычно достигают определенных этапов развития в определенном возрасте (например, переворачиваются, садятся, разговаривают, ходят и т. Д.). Эти вехи развития могут быть как когнитивными, так и физическими. Повреждение мозга у младенцев обычно становится очевидным по мере того, как ребенок растет и постоянно не может достичь основных этапов развития.
Симптомы повреждения мозга в возрасте до 6 месяцев:- Слабая шея, и ребенок не может самостоятельно поднимать голову к 6 месяцам
- Ребенок чувствует себя «тряпичной куклой» из-за полного отсутствия мышечного тонуса
- Плач изогнутой спины
- Ребенок не может самостоятельно переворачиваться к 9 месяцам
- Не может самостоятельно сидеть
- Ребенок не может сводить руки вместе
- Проблемы с поднесением рук к лицу
- Непроизвольные движения
- Постоянно не соответствует другим этапам развития
- Аномальная осанка
Стойкая легочная гипертензия у новорожденных (PPHN)
Обзор
На рисунке выше показано нормальное кровообращение в сердце и легких после рождения ребенка.Что такое стойкая легочная гипертензия у новорожденного (PPHN)?
PPHN относится к серьезным проблемам с дыханием у новорожденных. Обычно это случается с доношенными детьми или младенцами, родившимися в возрасте 34 и более недель. У этих младенцев часто бывают другие типы дыхательных состояний.
Это состояние также может быть известно как стойкая легочная гипертензия у новорожденного и / или синдром стойкого кровообращения плода.
Как возникает стойкая легочная гипертензия у новорожденных (PPHN)?
Во время беременности ребенок получает кислород от матери и плаценты.В легкие поступает очень мало крови, потому что кровеносные сосуды в легких ребенка в основном закрыты. Кровеносные сосуды открываются только после рождения, когда ребенок делает первый вдох. Затем сосуды позволяют крови перемещаться в легкие для получения кислорода. PPHN возникает, когда кровеносные сосуды недостаточно открываются, что означает, что существует ограничение на то, сколько кислорода отправляется в мозг и органы. Вот почему PPHN так опасен.
Каковы факторы риска стойкой легочной гипертензии у новорожденных (PPHN)?
Хотя причина неизвестна, некоторые факторы повышают риск развития ПРГН у младенца.Эти факторы включают:
- Аспирация мекония: Это происходит, когда ребенок вдыхает собственные липкие фекалии (меконий).
- Инфекция.
- Респираторный дистресс-синдром (RDS): затруднение дыхания возникает у младенцев, у которых не полностью развиты легкие.
- Недостаток кислорода до или во время родов.
- Диафрагмальная грыжа: Относится к отверстию в диафрагме, которая является мышцей, которая отделяет грудную клетку от брюшной полости. Грыжа — это когда органы с одной стороны проталкиваются через отверстие — в этом случае органы из брюшной полости вторгаются в грудь.
Симптомы и причины
Что вызывает стойкую легочную гипертензию у новорожденных (PPHN)?
Причина PPHN неизвестна.
При PPHN недостаточное открытие сосудов легких может вызвать «противодавление» и заставить сердце продолжать использовать «внутриутробные» (до рождения) пути кровообращения.Эти ярлыки (рисунок выше) — артериальный проток (DA) и овальное отверстие (FO) — позволяют крови с низким содержанием кислорода смешиваться с кровью, перекачиваемой в остальную часть тела ребенка.
Каковы симптомы стойкой легочной гипертензии у новорожденных (PPHN)?
Симптомы PPHN включают:
- Проблемы с дыханием, такие как учащенное или медленное дыхание, кряхтение и втягивание.
- Синий цвет к коже.
- Холодные на ощупь руки и ноги.
- Низкое кровяное давление во всем теле.
- Низкий уровень кислорода в крови.
Диагностика и тесты
Как диагностируется стойкая легочная гипертензия у новорожденных (PPHN)?
Следующие тесты могут использоваться для диагностики PPHN:
- Анализы крови.
- Пульсоксиметрия (неинвазивный способ измерения уровня кислорода в крови).
- Рентген грудной клетки.
- Эхокардиограмма (подробное ультразвуковое исследование сердца ребенка).
Ведение и лечение
Как лечится стойкая легочная гипертензия у новорожденных (PPHN)?
Лечение PPHN может включать:
- Использование кислорода.
- Использование специального аппарата ИВЛ, который очень быстро дышит для ребенка.
- Поддержка артериального давления, например введение лекарств внутривенно (внутривенно или через вену).
- Использование оксида азота, который помогает расширить или открыть легочную сосудистую сеть (кровеносные сосуды в легких).
- Использование временного обходного анастомоза сердце-легкие, называемого экстракорпоральной мембранной оксигенацией (ЭКМО), в качестве экстренной терапии.
Перспективы / Прогноз
Сколько времени потребуется, чтобы вылечиться от стойкой легочной гипертензии у новорожденного (PPHN)?
После лечения легочной гипертензии легким вашего ребенка потребуются недели или даже месяцы, чтобы полностью восстановиться.Важно защитить ребенка от простуды или гриппа. Вы можете помочь в этом, если научитесь мыть руки и держите ребенка подальше от больных и большого скопления людей. Также для вашего ребенка будет особенно важно регулярно посещать своего педиатрического врача и других специалистов для проверки на предмет нормальных этапов развития.
мышечная слабость (гипотония) | Бостонская детская больница
Что такое гипотония?
Гипотония означает снижение мышечного тонуса.Это может быть состояние само по себе, называемое доброкачественной врожденной гипотонией, или оно может указывать на другую проблему, при которой наблюдается прогрессирующая потеря мышечного тонуса, например, мышечная дистрофия или церебральный паралич. Обычно это обнаруживается в младенчестве.
- Младенец с гипотонией проявляет ощущение гибкости или «тряпичной куклы», когда его держат.
- Младенцы могут отставать в достижении определенных этапов развития мелкой и крупной моторики, которые позволяют ребенку держать голову вверх, когда кладут на живот, балансируют или принимают сидячее положение и остаются в сидячем положении, не падая.
- Существует тенденция к вывихам бедра, челюсти и шеи.
- У некоторых детей с гипотонией могут быть проблемы с кормлением, если они не могут сосать или жевать в течение длительного времени.
- У ребенка с гипотонией также могут быть проблемы с речью или поверхностное дыхание.
Что вызывает мышечную слабость?
Гипотония может быть вызвана множеством состояний, в том числе поражающими центральную нервную систему, мышечные и генетические нарушения.Некоторые общие причины могут включать, но не ограничиваются:
Каковы симптомы мышечной слабости?
Ниже перечислены общие симптомы, связанные с гипотонией. Каждый ребенок может испытывать симптомы по-разному. Симптомы различаются в зависимости от основной причины проблемы.
- снижение мышечного тонуса; мышцы кажутся мягкими и рыхлыми
- Способность разгибать конечность сверх нормы
- неспособность достичь связанных с моторикой этапов развития (таких как поднятие головы без поддержки со стороны родителей, переворачивание, сидение без поддержки, ходьба)
- проблемы с кормлением (неспособность сосать или жевать в течение длительного времени)
- поверхностное дыхание
- рот приоткрыт с высунутым языком (недостаточно активный рвотный рефлекс)
Некоторые гипотонии не прогрессируют и имеют неизвестное происхождение. Это состояние известно как доброкачественная врожденная гипотония.
- Функция центральной нервной системы и интеллект у детей в норме.
- Дети с доброкачественной врожденной гипотонией могут не испытывать задержки в развитии.
- Некоторые дети приобретают крупную моторику (сидение, ходьба, бег, прыжки) медленнее, чем большинство.
Признаки и симптомы гипотонии напоминают симптомы других состояний. Всегда консультируйтесь с врачом для постановки диагноза.
Как Бостонская детская больница приближается к мышечной слабости
Слабость мышц вашего ребенка может быть вызвана несколькими различными заболеваниями, и лечение нельзя начинать, не выяснив истинную причину.В Boston Children’s врачи предлагают несколько тестов для диагностики причины слабости вашего ребенка. После того, как диагноз поставлен, под рукой будет несколько программ лечения, включая программы физиотерапии, которые помогут вашему ребенку жить нормальной жизнью.
Врожденные дефекты центральной нервной системы
Врожденные дефекты центральной нервной системы называются дефектами нервной трубки (NTD). ДНТ включают состояния, называемые расщелиной позвоночника, анэнцефалией и энцефалоцеле.Все они присутствуют при рождении и возникают из-за проблемы с развитием головного и / или спинного мозга у развивающегося ребенка (плода).
Головной и спинной мозг растущего плода развивается из простой структуры, называемой нервной трубкой . Нервная трубка «застегивается» по всей длине, закрывая и защищая головной и спинной мозг. Если нервная трубка не закрывается ни на одной части по своей длине, у ребенка будет дефект нервной трубки. Типы дефектов нервной трубки (расщепление позвоночника, анэнцефалия и энцефалоцеле) возникают из-за того, что участок вдоль нервной трубки не закрывается, оставляя обнаженными части головного и / или спинного мозга.
Считается, что за NTD ответственен ряд генетических факторов и факторов окружающей среды, включая недостаточное количество витамина фолиевой кислоты и некоторых лекарств от эпилепсии у матери. Прием фолиевой кислоты (фолиевой кислоты) до и во время беременности может значительно снизить вероятность того, что у матери родится ребенок с таким врожденным дефектом.
Центральная нервная система (ЦНС)
Центральная нервная система состоит из головного и спинного мозга. Оба покрыты тонкой оболочкой, называемой мозговых оболочек , и окружены жидкостью, называемой спинномозговой жидкостью .Головной мозг прикреплен к спинному мозгу стволом головного мозга, расположенным в основании головного мозга. Спинной мозг проходит по всей длине позвоночника и защищен костями (позвонками) позвоночника. Нервы ответвляются от спинного мозга на части тела.
Развитие ЦНС плода
Центральная нервная система растущего плода начинается с простой структуры, называемой «нервная борозда», которая складывается, образуя «нервную трубку». Затем он перерастает в спинной и головной мозг.К 28 дню после зачатия нервная трубка должна быть закрыта и срастается. Если он не закрывается, результатом является дефект нервной трубки.
Во многих случаях эти дефекты можно диагностировать во время беременности с помощью ультразвукового исследования и, в редких случаях, с помощью других тестов, таких как амниоцентез (анализ образца околоплодных вод).
Факторы риска и профилактика врожденных дефектов ЦНС
Считается, что дефекты нервной трубки вызваны сочетанием ряда генетических факторов и факторов окружающей среды.Некоторые из этих факторов включают:
- У матери дефицит фолиевой кислоты — если матери не хватает некоторых питательных веществ, особенно витамина группы B, называемого фолиевой кислотой (фолиевая кислота), вероятность рождения ребенка с NTD увеличивается. . Если принять фолиевую кислоту до зачатия и, по крайней мере, в течение первых четырех недель беременности, можно предотвратить около семи из 10 случаев ДНТ. Вам следует поговорить со своим врачом о том, сколько фолиевой кислоты вам следует принимать, если вы думаете о беременности.
- Генетика — точная генетическая ассоциация неясна, но женщина подвергается повышенному риску рождения ребенка с дефектом нервной трубки, если у нее есть близкий родственник, у которого был ребенок с этим заболеванием (семейный анамнез). Женщина, которая уже родила ребенка с дефектом нервной трубки, также подвержена повышенному риску рождения последующих детей с аналогичным заболеванием.
- Наличие в личном или семейном анамнезе NTD может повлиять на количество фолиевой кислоты, необходимое для снижения вероятности рождения ребенка с дефектом нервной трубки.Вам следует поговорить со своим врачом о том, сколько фолиевой кислоты вам следует принимать, если вы думаете о беременности.
- В некоторых случаях, однако, есть свидетельства того, что некоторые формы дефектов нервной трубки вызываются специфическими генетическими изменениями (мутациями), которые не связаны с фолиевой кислотой. В этих случаях дефект нервной трубки вызван унаследованием ребенком дефектных копий гена от обоих родителей. Эти дефектные гены не позволяют ребенку использовать фолиевую кислоту, необходимую для роста и развития во время беременности (даже если фолиевая кислота присутствует в нужном количестве).В этих случаях прием фолиевой кислоты до и во время беременности не предотвратит заболевание.
- Лекарство — считается, что определенные лекарства, используемые для лечения и контроля эпилепсии, способствуют риску дефекта нервной трубки.
Spina bifida
У ребенка с расщелиной позвоночника кости ( позвонка ) позвоночника не срастаются. Спинной мозг и нервы выступают (или «выскакивают») через щель, образовавшуюся из-за того, что нервная трубка не закрылась.Это может повлиять на нервы, которые распространяются из этой области в брюшную полость и ноги. Расщелина позвоночника может возникать где угодно по длине позвоночника, но чаще возникает в пояснице.
У девяти из 10 пораженных детей также наблюдается скопление спинномозговой жидкости в головном мозге. Это состояние называется гидроцефалией и иногда упоминается как «вода в мозгу». Заболеваемость расщелиной позвоночника в Виктории составляет примерно 1 на каждые 1235 родов.
Spina bifida может быть легкой, средней или тяжелой и классифицируется в зависимости от степени дефекта на:
- Occulta — кости (позвонки) не полностью закрылись, но спинной мозг не поврежден.Характерная мягкая шишка может отсутствовать, поэтому эту форму расщелины позвоночника иногда диагностируют в более позднем возрасте.
- Менингоцеле — оболочка (мозговые оболочки), покрывающая спинной мозг, выступает или выпирает через щель в позвоночнике.
- Myelomeningocele — мозговые оболочки, спинной мозг и кровеносные сосуды выступают через щель.
Расщелина позвоночника неизлечима. Основная форма лечения — операция по устранению разрыва. Если у ребенка гидроцефалия, в мозг вводят шунт для слива излишков спинномозговой жидкости.
Анэнцефалия
Когда нервная трубка не закрывается в области головы, это может привести к частичному или полному отсутствию верхней части мозговой ткани, мозговых оболочек, верхней части черепа (свода черепа) и скальпа. По неизвестным причинам анэнцефалия у женщин встречается в два раза чаще, чем у мужчин. Примерно каждый десятый ребенок с заболеванием — один из пары близнецов. В некоторых случаях у ребенка есть другие проблемы, такие как врожденный порок сердца и волчья пасть. Заболеваемость анэнцефалией в Виктории составляет примерно один на 1370 новорожденных.
Ребенок с анэнцефалией не может жить. Большинство из них рождаются мертвыми или умирают в течение нескольких дней после рождения.
Энцефалоцеле
При этой редкой форме дефекта нервной трубки мозговые оболочки и ткань мозга выпячиваются через щель в черепе. В тяжелых случаях мозг выталкивается настолько, что пучок мозговой ткани, покрытый мозговыми оболочками (мембранами), может быть больше, чем голова ребенка. Заражение может произойти, если мембрана разорвется и обнажит ткань мозга. Другие проблемы, связанные с энцефалоцеле, могут включать расщелину губы или неба, дополнительные пальцы (полидактия) и аномалии половых органов.Заболеваемость энцефалоцеле в Виктории составляет примерно один на каждые 6 667 рождений.
При выталкивании значительного количества мозговой ткани операция может оказаться невозможной. Варианты лечения включают использование шунта для удаления скопления жидкости (лечение гидроцефалии), если это необходимо. Ребенок будет испытывать ряд трудностей, которые могут включать в себя интеллектуальные нарушения, трудности с контролем мышц (спастичность) и припадки (судороги). Могут помочь физиотерапия и противосудорожные препараты.
Куда обратиться за помощью
Тепловая защита новорожденных в условиях ограниченных ресурсов
Lyon AJ. Прикладная физиология: контроль температуры у новорожденного. Curr Pediatr 2004; 14 : 7.
Артикул Google Scholar
Black RE, Cousens S, Johnson HL, Lawn JE, Rudan I, Bassani DG и др. . Глобальные, региональные и национальные причины детской смертности в 2008 году: систематический анализ. Lancet 2010; 375 : 1969–1987.
Артикул Google Scholar
Lawn JE, Cousens S, Zupan J. 4 миллиона неонатальных смертей: когда? где? Зачем? Lancet 2005; 365 : 891–900.
Артикул Google Scholar
Kumar V, Shearer JC, Kumar A, Darmstadt GL. Гипотермия новорожденных в условиях ограниченных ресурсов: обзор. J Perinatol 2009; 29 : 401–412.
CAS Статья Google Scholar
Маллани, LC. Гипотермия новорожденных в условиях ограниченных ресурсов. Семин Перинатол 2010; 34 : 426–433.
Артикул Google Scholar
Такаяма Джи, Тенг В., Уемото Дж., Ньюман ТБ, Пантелл Р.Х. Температура тела новорожденных: какая в норме? Clin Pediatr (Phila) 2000; 39 : 503–510.
CAS Статья Google Scholar
Сильверман В.А., Агат-младший Ф.Дж., Фертиг Дж.В. Последовательное исследование нетеплового влияния влажности воздуха на выживаемость новорожденных с низкой массой тела при рождении. Педиатрия 1963; 31 : 719–724.
CAS PubMed Google Scholar
Сильверман, Вашингтон, Фертиг Дж. В., Бергер А. П.. Влияние тепловой среды на выживаемость новорожденных недоношенных. Педиатрия 1958; 22 : 876–886.
CAS Google Scholar
Привет, Э. Тепловая нейтральность. Br Med Bull 1975; 31 : 69–74.
CAS Статья Google Scholar
Baumgart S. Ятрогенная гипертермия и гипотермия у новорожденного. Clin Perinatol 2008; 35 : 183–197, ix-x.
Артикул Google Scholar
Sherman TI, Greenspan JS, St Clair N, Touch SM, Shaffer TH. Оптимизация термической среды новорожденных. Neonatal Netw 2006; 25 : 251–260.
Артикул Google Scholar
Charpak N, Ruiz-Pelaez JG, Charpak Y. Рей-мартинес Программа для матерей-кенгуру: альтернативный способ ухода за младенцами с низкой массой тела при рождении? однолетняя смертность в двух когортном исследовании. Педиатрия 1994; 94 : 804–810.
CAS Google Scholar
Нобель Р., Холдитч-Дэвис Д. Терморегуляция и предотвращение потери тепла после рождения и стабилизация в отделении интенсивной терапии новорожденных у детей с крайне низкой массой тела при рождении. J Obstet Gynecol Neonatal Nurs 2007; 36 : 280–287.
Артикул Google Scholar
Асакура Х.Терморегуляция плода и новорожденного. J Nippon Med Sch 2004; 71 : 360–370.
CAS Статья Google Scholar
Hackman PS. Распознавание и понимание доношенного ребенка, перенесшего холодовой стресс. Neonatal Netw 2001; 20 : 35–41.
CAS Статья Google Scholar
Tourneux P, Libert JP, Ghyselen L, Leke A, Delanaud S, Degrugilliers L и др. .Echanges thermiques et thermoregulation chez le nouveau-ne [Теплообмен и терморегуляция у новорожденных]. Arch Pediatr 2009; 16 : 1057–1062.
CAS Статья Google Scholar
ВОЗ. Тепловая защита новорожденного: практическое руководство. Отделение охраны здоровья матери и новорожденного / безопасного материнства, Отдел репродуктивного здоровья . Всемирная организация здравоохранения: Женева, 1997 г.
ВОЗ.Решение проблем новорожденных: руководство для врачей, медсестер и акушерок. Комплексное ведение беременности и родов . Всемирная организация здравоохранения: Женева, 2003 г.
Aylott M. Энергетический треугольник новорожденных. Часть 2: Терморегуляторная и респираторная адаптация. Paediatr Nurs 2006; 18 : 38–42.
Google Scholar
Pal DK, Manandhar DS, Rajbhandari S, Land JM, Patel N, de LCAM.Гипогликемия новорожденных в Непале 1. Распространенность и факторы риска. Arch Dis Child Fetal Neonatal Ed 2000; 82 : F46 – F51.
CAS Статья Google Scholar
Даган Р, Городищер Р. Инфекции у детей с гипотермией младше 3 месяцев. Am J Dis Child 1984; 138 : 483–485.
CAS PubMed PubMed Central Google Scholar
Goldsmith JR, Arbeli Y, Stone D.Предотвращение неонатальной холодовой травмы и ее вклад в неонатальную смертность. Environ Health Perspect 1991; 94 : 55–59.
CAS PubMed PubMed Central Google Scholar
Драгович Д., Тамбурлини Г., Алисджахбана А., Камбарами Р., Карагулова Дж., Линчетто О. и др. . Температурный контроль новорожденных: знания и практика медицинских работников семи стран. Acta Paediatr 1997; 86 : 645–650.
CAS Статья Google Scholar
Pfister RH, Soll RF. Гипотермия для лечения детей грудного возраста с гипоксически-ишемической энцефалопатией. J Perinatol 2010; 30 (Дополнение): S82 – S87.
Артикул Google Scholar
Джейкобс С., Хант Р., Тарнов-Морди В., Индер Т., Дэвис П. Охлаждение новорожденных с гипоксической ишемической энцефалопатией. Кокрановская база данных Syst Rev 2007; CD003311.
Домингес Т.Э., Верновски Г., Гейнор Дж.В. Причина и профилактика поражения центральной нервной системы у новорожденных, перенесших операцию на сердце. Semin Thorac Cardiovasc Surg 2007; 19 : 269–277.
Артикул Google Scholar
Лион А. Контроль температуры у новорожденных. Детский педиатр 2008; 18 : 155–160.
Артикул Google Scholar
Laptook AR, Уоткинсон М. Контроль температуры в родильном зале. Semin Fetal Neonatal Med 2008; 13 : 383–391.
Артикул Google Scholar
Maayan-Metzger A, Mazkereth R, Kuint J. Повышение температуры тела у здоровых бессимптомных новорожденных в первые дни жизни. Arch Dis Child Fetal Neonatal Ed 2003; 88 : F312 – F314.
CAS Статья Google Scholar
Херхольц Дж., Криспони Л., Маллик Б. Н., Рутч Ф. Успешное лечение холодовой потливости при синдроме Криспони и его возможный механизм действия. Dev Med Child Neurol 2010; 52 : 494–497.
Артикул Google Scholar
Чоудхари СП, Баджадж РК, Гупта РК. Знания, отношение и практика неонатальной гипотермии среди медицинского и среднего медицинского персонала. Indian J Pediatr 2000; 67 : 491–496.
CAS Статья Google Scholar
Аяз А, Салим С. Неонатальная смертность и распространенность практики ухода за новорожденными в поселении скваттеров Карачи, Пакистан: кросс-секционное исследование. PLoS One 2010; 5 : e13783.
Артикул Google Scholar
Ayaz S, Efe SY.Потенциально вредные традиционные практики во время беременности и в послеродовой период. Eur J Contracept Reprod Health Care 2008; 13 : 282–288.
Артикул Google Scholar
Sreeramareddy CT, Joshi HS, Sreekumaran BV, Giri S, Chuni N. Роды на дому и практика ухода за новорожденными среди городских женщин в западном Непале: анкетный опрос. BMC Беременность и роды 2006; 6 : 27.
Артикул Google Scholar
Осрин Д., Тумбахангпе К.М., Шреста Д., Меско Н., Шреста Б.П., Манандхар М.К. и др. .Поперечное исследование ухода за новорожденными в Непале на уровне сообществ. BMJ 2002; 325 : 1063.
Артикул Google Scholar
Thairu L, Pelto G. Практика ухода за новорожденными на острове Пемба (Танзания) и их значение для здоровья и выживания новорожденных. Matern Child Nutr 2008; 4 : 194–208.
Артикул Google Scholar
Hill Z, Tawiah-Agyemang C, Manu A, Okyere E, Kirkwood BR.Согреть новорожденных: убеждения, практики и потенциал изменения поведения в сельских районах Ганы. Trop Med Int Health 2010; 15 : 1118–1124.
Артикул Google Scholar
Моран А.С., Чоудхури Н., Уз Заман Хан Н., Ахсан Карар З., Вахед Т., Фаиз Рашид С. и др. . Практика ухода за новорожденными среди обитателей трущоб в Дакке, Бангладеш: количественное и качественное исследовательское исследование. BMC Беременность и роды 2009; 9 : 54.
Артикул Google Scholar
Вайсва П., Ньянзи С., Намусоко-Калунги С., Петерсон С., Томсон Г., Париё Г. В.. Я никогда не думала, что этот ребенок выживет; Я думал, что он умрет в любой момент: восприятие недоношенных детей и уход за ними в восточной части Уганды. Trop Med Int Health 2010; 15 : 1140–1147.
Артикул Google Scholar
Дармштадт Г.Л., Кумар В., Ядав Р., Сингх В., Сингх П., Моханти С. и др. .Внедрение ухода за кожей «кожа к коже» на уровне местных сообществ в сельской местности штата Уттар-Прадеш, Индия. J Perinatol 2006; 26 : 597–604.
CAS Статья Google Scholar
Дармштадт, GL, Walker N, Lawn JE, Bhutta ZA, Haws RA, Cousens S. Спасение жизней новорожденных в Азии и Африке: стоимость и влияние поэтапного расширения масштабов вмешательств в рамках континуума помощи. План политики здравоохранения 2008 г .; 23 : 101–117.
Артикул Google Scholar
Эллис Дж. Неонатальная гипотермия. J Neonatal Nurs 2005; 11 : 7.
Артикул Google Scholar
Чинар Н.Д., Филиз ТМ. Неонатальная терморегуляция. J Neonatal Nurs 2006; 12 : 6.
Артикул Google Scholar
Uslu S, Ozdemir H, Bulbul A, Comert S, Bolat F, Can E et al .Сравнение различных методов измерения температуры у больных новорожденных. J Trop Pediatr 2011; 57 : 418–423.
Артикул Google Scholar
Сингх М., Рао Г., Малхотра А.К., Деорари А.К. Оценка температуры новорожденного с помощью прикосновения человека: потенциально полезная стратегия первичной медико-санитарной помощи. Indian Pediatr 1992; 29 : 449–452.
CAS PubMed PubMed Central Google Scholar
Agarwal S, Sethi V, Pandey RM, Kondal D.Человеческое прикосновение против подмышечной цифровой термометрии для обнаружения гипотермии новорожденных на уровне сообщества. J Trop Pediatr 2007; 54 : 200–201.
Артикул Google Scholar
Эллис М., Манандхар Д., Хант Л., Барнетт С., Азад К. Сенсорное обнаружение гипотермии новорожденных в Непале. Arch Dis Child Fetal Neonatal Ed 2006; 91 : F367 – F368.
CAS Статья Google Scholar
Tuitui RL, Suwal SN, Shrestha S.Метод прикосновения руки для обнаружения гипотермии новорожденных в Непале. J Trop Pediatr 2010; 57 : 236–238.
Артикул Google Scholar
Agarwal S, Sethi V, Srivastava K, Jha P, Baqui AH. Человеческое прикосновение для обнаружения гипотермии у новорожденных в индийских трущобах. Indian J Pediatr 2010; 77 : 759–762.
Артикул Google Scholar
Кумар Р., Аггарвал АК.Точность восприятия матерью температуры новорожденного. Indian Pediatr 1996; 33 : 583–585.
CAS PubMed PubMed Central Google Scholar
Морли Д., Блюменталь И. Индикатор неонатальной гипотермии. Lancet 2000; 355 : 659–660.
CAS Статья Google Scholar
Грин Д.А., Кумар А, Ханна Р.Обнаружение неонатальной гипотермии с помощью ThermoSpot в индийских городских трущобах. Arch Dis Child Fetal Neonatal Ed 2006; 91 : F96 – F98.
CAS Статья Google Scholar
Kambarami R, Chidede O, Pereira N. ThermoSpot в обнаружении гипотермии новорожденных. Ann Trop Paediatr 2002; 22 : 219–223.
CAS Статья Google Scholar
Рвение Дж.ThermoSpot в обнаружении гипотермии новорожденных. Ann Trop Paediatr 2003; 23 : 87–88; ответ автора.
Артикул Google Scholar
Обладен М. Neugeborenenintensivpflege. Спрингер . Берлин: Нью-Йорк, 2002, 5-е изд.
Google Scholar
Stothers JK. Изоляция головы и потеря тепла у новорожденного. Arch Dis Child 1981; 56 : 530–534.
CAS Статья Google Scholar
Галлиган М. Предлагаемое руководство по кожному лечению гипотермии новорожденных. MCN Am J Matern Child Nurs 2006; 31 : 298–304; викторина 305–296.
Артикул Google Scholar
Каттанео А., Даванцо Р., Ворку Б., Сурджоно А., Эчеверрия М., Бедри А. и др. . Уход за матерями-кенгуру за младенцами с низкой массой тела при рождении: рандомизированное контролируемое исследование в различных условиях. Acta Paediatr 1998; 87 : 976–985.
CAS Статья Google Scholar
Lawn JE, Mwansa-Kambafwile J, Horta BL, Barros FC, Cousens S. Уход за матерью-кенгуру для предотвращения неонатальной смертности из-за осложнений при преждевременных родах. Int J Epidemiol 2010; 39 (Приложение 1): i144 – i154.
Артикул Google Scholar
Суман Р.П., Удани Р., Нанавати Р.Уход за матерями-кенгуру за младенцами с низкой массой тела при рождении: рандомизированное контролируемое исследование. Indian Pediatr 2008; 45 : 17–23.
PubMed PubMed Central Google Scholar
Charpak N, Ruiz-Pelaez JG. Сопротивление внедрению системы ухода за матерями-кенгуру в развивающихся странах и предлагаемые решения. Acta Paediatr 2006; 95 : 529–534.
Артикул Google Scholar
Слоан Н.Л., Ахмед С., Митра С.Н., Чоудхури Н., Чоудхури М., Роб У и др. .Уход за матерями-кенгуру на уровне сообщества для предотвращения неонатальной и младенческой смертности: рандомизированное контролируемое кластерное исследование Педиатрия 2008; 121 : e1047 – e1059.
Артикул Google Scholar
Acuin CS, Khor GL, Liabsuetrakul T, Achadi EL, Htay TT, Firestone R и др. . Здоровье матери, новорожденного и ребенка в Юго-Восточной Азии: на пути к более тесному региональному сотрудничеству. Ланцет 2011 г .; 377 : 516–525.
Артикул Google Scholar
Bang AT, Bang RA, Baitule SB, Reddy MH, Deshmukh MD. Влияние неонатальной помощи на дому и ведения сепсиса на неонатальную смертность: полевые испытания в сельских районах Индии. Lancet 1999; 354 : 1955–1961.
CAS Статья Google Scholar
Йохансон Р., Маллаб Д., Рольф П., Спенсер А. Влияние послеродового ухода на температуру тела новорожденного. Early Hum Dev 1990; 21 : 132–133.
Артикул Google Scholar
Джилл С.Дж., Фири-Мазала Дж., Герина Н.Г., Касимба Дж., Муленга С., МакЛауд В.Б. и др. . Влияние обучения традиционных повитух на неонатальную смертность (Lufwanyama Neonatal Survival Project): рандомизированное контролируемое исследование. BMJ 2011; 342 : d346.
Артикул Google Scholar
Луский ЖК.Век неонатальной медицины. Minn Med 1999; 82 : 48–54.
CAS PubMed Google Scholar
Lyon AJ, Oxley C. HeatBalance, компьютерная программа для определения оптимальной температуры и влажности воздуха в инкубаторе. Сравнение с настройками медсестры для младенцев менее 29 недель беременности. Early Hum Dev 2001; 62 : 33–41.
CAS Статья Google Scholar
Lyon AJ, Freer Y.Цели и варианты сохранения тепла недоношенных детей. Arch Dis Child Fetal Neonatal Ed 2011; 96 : F71 – F74.
CAS Статья Google Scholar
Солл РФ. Профилактика потери тепла у новорожденных. J Perinatol 2008; 28 (Дополнение 1): S57 – S59.
Артикул Google Scholar
Оценка технологий, направленная на матери и новорожденного.Грелки для младенцев для предотвращения переохлаждения новорожденных. 2011 (по состоянию на 28 сентября 2011 г., http://mnhtech.org/technology/technology-briefs/infant-warmers/).
Кнобель РБ, Виммер-младший Дж. Э., Холберт Д. Профилактика тепловых потерь недоношенных детей в родильном зале. J Perinatol 2005; 25 : 304–308.
Артикул Google Scholar
Дизайн, имеющий значение. Инкубаторы. 2011 (по состоянию на 28 сентября 2011 г., http: // www.designthatmatters.org/news/dtm-blog/project/incubator/).
Объятия.