Микробы, бактерии, и наше здоровье
Этот раздел EDKA.ru — публикация книги Галины Шаталовой — Краткие выдержки. Где купить книгу — написано в первой статье этого раздела.
Враги или друзья?
Прежде чем продолжить разговор на предложенную тему, приведу один малоизвестный читателю факт. Лишь совсем недавно американские ученые установили, что гемолизирующий стрептококк, разрушающий эритроциты крови, одновременно является одним из эффективных средств борьбы с опухолевыми заболеваниями.
Представьте, что по мановению волшебной палочки все микробы и бактерии исчезли с лица земли. Что произойдет? Может быть, наступит рай земной и мы забудем все свои тревоги и заживем здоровой, счастливой жизнью? Да ничего подобного, мы погибнем, как только последний микроб отправится в мир иной. Даже тех ничтожно малых знаний о наших крошечных согражданах по планете Земля, которыми мы на сегодняшний день располагаем, достаточно, чтобы понять это. Начать с того, что мыс вами лишимся тех незаменимых аминокислот и витаминов, которые вырабатываются микрофлорой нашего кишечника.
Мы потеряем и других наших микро помощников — азотфиксирующие бактерии, населяющие наши дыхательные пути и кишечник. Об их существовании не подозревают даже многие специалисты, не говоря уж о подавляющем большинстве людей, далеких от науки. А ведь именно они, эти бактерии, круглосуточно поставляют нам тот самый связанный атмосферный азот, из которого в нашем организме вырабатываются драгоценные белки, что снижает расходы энергии на поглощение, переваривание, всасывание питательных веществ пищи,сокращает наши потребности в ней.
Я умышленно не говорю здесь о других микроорганизмах, используемых при выпечке дрожжевого хлеба, производстве пива и горячительных напитков, кисломолочных продуктов, поскольку все это я отношу к тем «достижениям» человеческого разума, которое не добавляют нам ни разума, ни здоровья.
Зададимся вопросом: полезна ли рыбам и другим обитателям озер и рек, морей и океанов вода? Конечно, скажете вы, это же среда их обитания, без нее они просто не смогли бы существовать.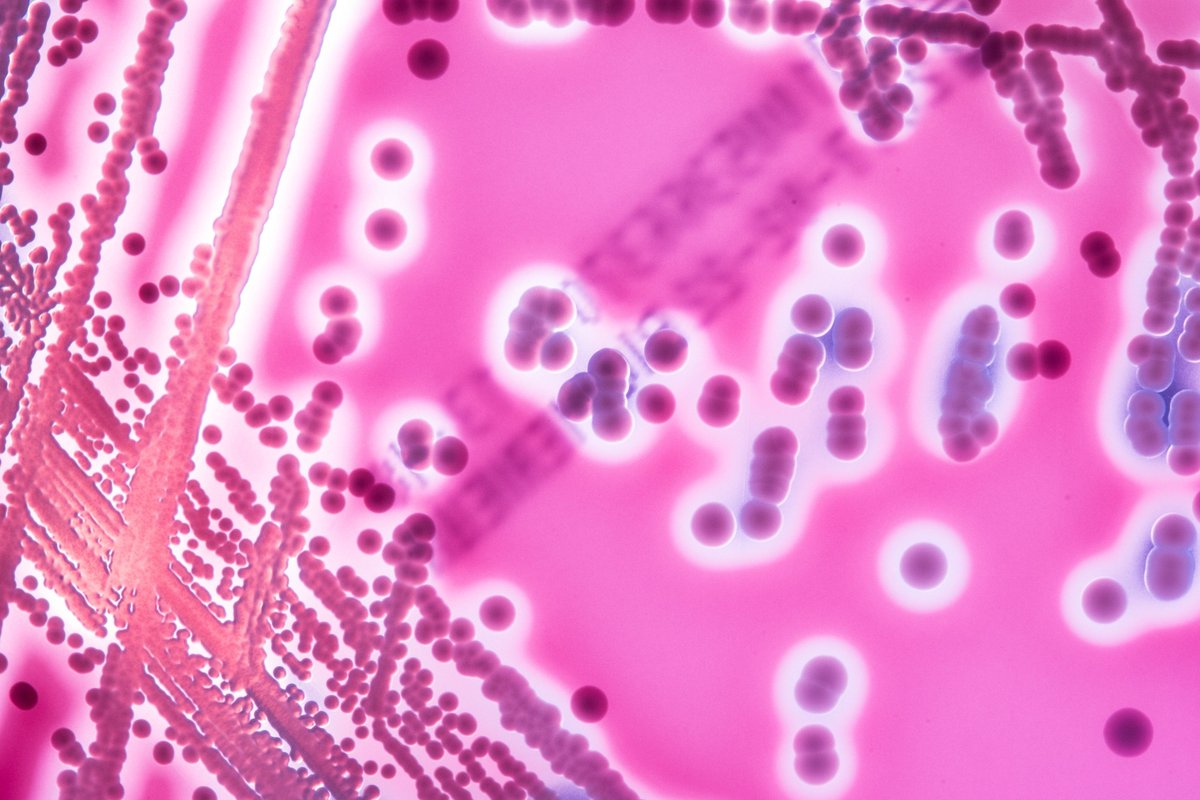 Но ведь и мы с вами не можем существовать без микроорганизмов — этой субстанции живой материи, «затопляющей» всю Землю, составляющей такую же оболочку планеты,как газообразная атмосфера. Мы ее неотъемлемая часть и не можем отгородиться от нее никакими искусственно создаваемыми барьерами. А если и пытаемся, то неизменно терпим поражение, не всегда даже осознавая это. Порой даже считаем, будто одержали победу, хотя впоследствии начинаем понимать, что победа-то была пирровой.
Но ведь и мы с вами не можем существовать без микроорганизмов — этой субстанции живой материи, «затопляющей» всю Землю, составляющей такую же оболочку планеты,как газообразная атмосфера. Мы ее неотъемлемая часть и не можем отгородиться от нее никакими искусственно создаваемыми барьерами. А если и пытаемся, то неизменно терпим поражение, не всегда даже осознавая это. Порой даже считаем, будто одержали победу, хотя впоследствии начинаем понимать, что победа-то была пирровой.
Возьмем тот же пример с гемолизирующим стрептококком. Не обрушивайся мы на него всей мощью фармацевтической промышленности, может статься, что его присутствие в нашем организме обернулось бы не бедой, а благом, и количество онкологических заболеваний заметно поубавилось бы.
Но он же разрушает эритроциты крови, напомните вы. Конечно. Однако в природе нет ничего, что было бы всегда и безоговорочно полезно тому или иному отдельно взятому биологическому объекту. Полезность обязательно соседствует с вредностью, добро всегда противостоит злу, борется с ним.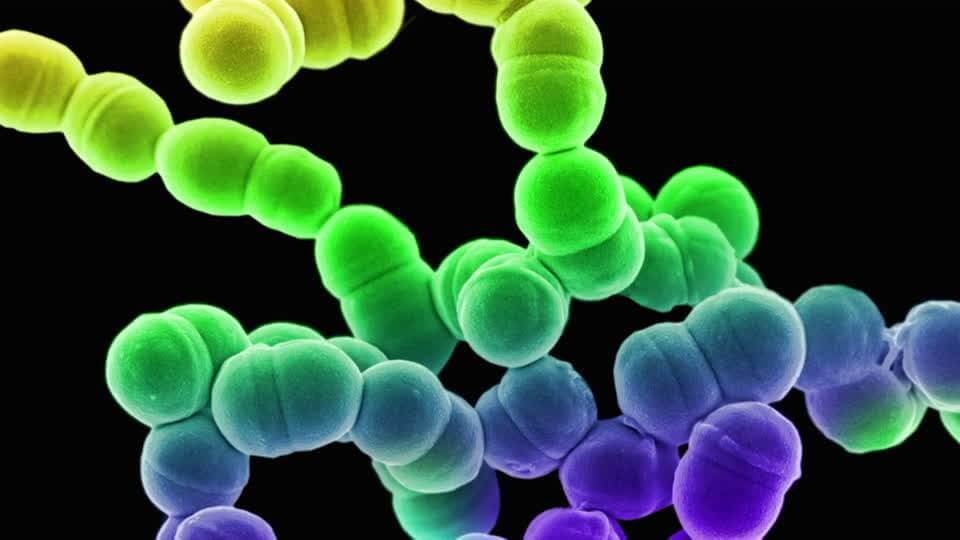 Причем нередко случается, что считавшееся еще вчера злом завтра может обернуться добром, что избыток добра тоже окажется злом. Все должно находиться в естественном равновесии. Но кто же обеспечивает такое равновесие? Сам живой организм. Правда, организм не искусственный, сформировавшийся и развивающийся в отрыве от природы (таких вы там, кстати, и не найдете, если не считать человека и его окружение), а естественный, безоговорочно подчиняющийся ее законам и уложениям. Для этого он располагает весьма действенными средствами, главным из которых является система иммунной защиты.
Причем нередко случается, что считавшееся еще вчера злом завтра может обернуться добром, что избыток добра тоже окажется злом. Все должно находиться в естественном равновесии. Но кто же обеспечивает такое равновесие? Сам живой организм. Правда, организм не искусственный, сформировавшийся и развивающийся в отрыве от природы (таких вы там, кстати, и не найдете, если не считать человека и его окружение), а естественный, безоговорочно подчиняющийся ее законам и уложениям. Для этого он располагает весьма действенными средствами, главным из которых является система иммунной защиты.
Иммунологические барьеры живого организма
Об иммунной защите живых организмов написаны десятки тысяч книг, ее исследованием заняты тысячи институтов и лабораторий, выявлено множество фактов, касающихся отдельных аспектов такой защиты, однако цельной картины мы все еще не имеем. И дело здесь не в недостаточной настойчивости ученых, а в сложности самой проблемы. Только в последнее время получены некоторые данные, дающие надежду, что наши представления об иммунитете обретут достаточно четкие очертания.
Благодаря усилиям селекционеров человеку удало,сь выв,ести такие сорта культурных растений, в которых содержится большое количество питательных веществ, к тому же в легкоусвояемой форме. Одновременно в них снижено содержание веществ, затрудняющих их выращивание. Однако, как оказалось, именно они, эти «вредные» вещества, в избытке содержащиеся в диких сородичах культурных растений, обеспечивают им надежную защиту от вредителей. Из этого факта следует два принципиальной важности вывода, дающих возможность наметить пути выхода современной цивилизации из тупика. Вывод второй. Создавая свой искусственный мир, населяя его искусственными же культурными растениями и не менее искусственными домашними животными, человек все больше отделяется от природы, вступает в противоречие с ее законами. Результатом этого становится, в числе прочих бед, ослабление его иммунной защиты, способности сдерживать наступление болезнетворных микробов и открывающихим дорогу в человеческий организм насекомых, нарушающих целостность нашей естественной «брони» — кожного покрова. Система естественного оздоровления возвращает людей природе, восстанавливает и стабилизирует чистоту внутренней среды их физического тела.
Система естественного оздоровления возвращает людей природе, восстанавливает и стабилизирует чистоту внутренней среды их физического тела.
Вывод первый. Человек, получив «высокопродуктивные» сорта культурных растений, физиологически лишив их активных веществ — природного оружия для борьбы с вредителями, в целом не выиграл, а проиграл. Ему пришлось самому принять на себя заботу об их защите, используя сильнодействующие химические средства — синтетические инсектициды, уничтожающие и вредителей, и полезные организмы. Эти вещества загрязняют окружающую среду,накапливаются в организме человека и отравляют его.
Учитывая склонность живой природы к использованию однотипных функциональных блоков, процессов и механизмов, мы вправе предположить, что с переходом на естественный образ жизни человеческий организм вновь обретает способность выделять физиологически активные вещества, входящие в арсенал защиты живого организма от проникновения врага. Этим, в частности, я объясняю приведенный выше случай излечения тяжелого кожного заболевания.
При переваривании растительных продуктов питания,предписанных ему природой, ферменты, вырабатываемые в его пищеварительном тракте, без труда «входят» в химические структуры пищи и включают ее механизм «само переваривания». Если, конечно, он не разрушен до этого варварской процедурой фабричной или общепринятой ныне кулинарной обработки.
Должна извиниться перед читателем за отклонение от первоначальной темы разговора, начатого в этой главе, о взаимоотношениях человека с миром микроскопических существ, без которых наша с вами жизнь была бы просто-напросто невозможной. Заканчивая разговор о роли иммунного механизма в регулировании микрофлоры, населяющей наш организм, я бы хотела еще раз напомнить о том, что, бесцеремонно вмешиваясь в этот чрезвычайно деликатный процесс с помощью антисептиков,антибиотиков, вакцинации, мы тем самым раскачиваем лодку, в которой и без того едва держимся на плаву. Моя врачебная практика дает тому немало примеров.
Биологическая система «микроб—человек» — эта сложнейшая динамическая система, взаимоотношения в которой складываются по принципу прямых и обратных связей. У человека под воздействием микроорганизмов сформировались черты, обеспечивающие ему защиту от них; эволюция же микробов и бактерий постоянно направлена на формирование способности преодолевать его иммунные барьеры. Но стоит им обрести такую способность, как здоровый человеческий организм тут же реагирует на возникшую опасность и «воздвигает» новые оборонительные укрепления. Подчеркиваю, здоровый, а не «практически здоровый», иммунная защита которого уже от рождения подорвана искусственным образом жизни. Все это я рассказала за тем, чтобы вы еще больше прониклись мыслью, что подлинное здоровье может быть достигнуто лишь в союзе с природой,которая одна только способна восстановить естественную само регуляцию вашего организма.
У человека под воздействием микроорганизмов сформировались черты, обеспечивающие ему защиту от них; эволюция же микробов и бактерий постоянно направлена на формирование способности преодолевать его иммунные барьеры. Но стоит им обрести такую способность, как здоровый человеческий организм тут же реагирует на возникшую опасность и «воздвигает» новые оборонительные укрепления. Подчеркиваю, здоровый, а не «практически здоровый», иммунная защита которого уже от рождения подорвана искусственным образом жизни. Все это я рассказала за тем, чтобы вы еще больше прониклись мыслью, что подлинное здоровье может быть достигнуто лишь в союзе с природой,которая одна только способна восстановить естественную само регуляцию вашего организма.
Роль возбудителей в возникновении хронического простатита
С целью выявления хронического простатита нами было обследовано 45 больных доброкачественной гиперплазией простаты в возрасте от 52 до 83 лет (средний возраст составил 67,5 лет). Острая задержка мочи было у 6, цистостома — у 14 пациентов.
Острая задержка мочи было у 6, цистостома — у 14 пациентов.
Суммарный бал по I-PSS колебался от 14 до 33, составляя в среднем 25,2. Качество жизни оценивали неудовлетворительно (4 балла) 5 пациентов, 5 баллов — 13 и 6 баллов — 7 больных. Средняя скорость мочеиспускания составляла от 4,7 мл в секунду до 20,5 мл в секунду, в среднем — 9,1 мл в секунду. Остаточная моча определялась у 12 больных, среднее ее значение составило 180,0 мл. Объем предстательной железы определялся с помощью ультразвукового сканирования и в среднем составлял 61,0 см куб.
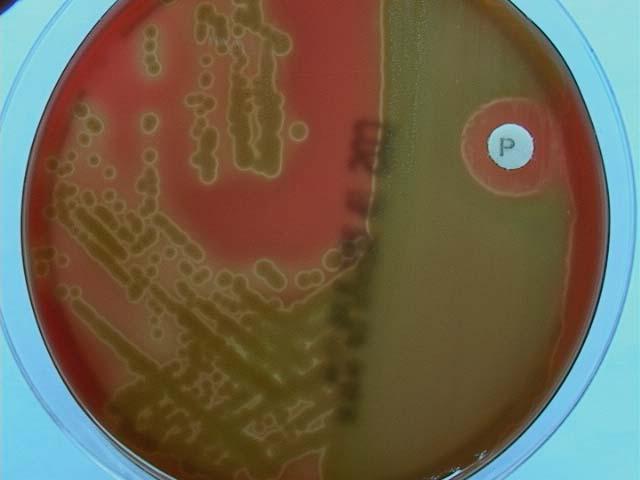
При посеве простатического сока бактериальная инфекция была высеяна у 32 пациентов: гемолизирующий стрептококк — у 7, эпидермальный стафилококк — у 12, гемолизирующий стафилококк — у 3; вульгарный протей, кишечная палочка, пр. Мирабилис — по 2 случая. Сапрофитный стрептококк, синегнойная палочка, зеленящий стрептококк — по 1 случаю и в одном случае определялись два возбудителя — гемолизирующий стафилококк и гемолизирующий стрептококк.
При микроскопии простатического сока повышенное количество лейкоцитов было выявлено у 42 больных. Таким образом, хронический простатит был диагностирован у 42 пациентов, в т. ч. активный процесс — у 21. У последних суммарный бал по I-PSS был в среднем 28, а качество жизни — в среднем составил 5,4, что было выше, чем у пациентов без обострения хронического простатита: I-PSS=23 и L=5 соответственно. Отмечено, что у пациентов с активным воспалительным процессом в предстательной железе ОЗМ встречалась чаще, чем у остальных пациентов.
Проанализировав вышеприведенные данные, можно отметить, что хронический простатит у больных с ДГПЖ диагностируется в 93,3% случаев, в т.ч. в стадии активного воспаления в 46.7%. что проявляется усилением дизурической симптоматики и ухудшением качества жизни, а также способствует возникновению острой задержки мочи. Поскольку у 9,4% пациентов с ДГГГЖ причиной хронического простатита являются уреаплазмы, которые могут способствовать возникновению послеоперационных воспалительных осложнений, возникает необходимость комплексного амбулаторного обследования пациентов с ДГПЖ, включая специальные методы, позволяющие диагностировать инфекции, передающиеся половым путем.
Похожие статьи:
Примите к сведению
Информация на этом сайте представлена в справочных и образовательных целях и не должна быть использована как инструкция по лечению. В любых случаях необходимо консультироваться у врача.
| Позиция | Кол-во | Ед. изм. | Цена | Сумма | Доля |
|---|---|---|---|---|---|
| 1. Альбумин ИВД, набор, спектрофотометрический анализ | 2 | набор | 1 092,30 ₽ | 2 184,60 ₽ | 0,19% |
| 2. Набор реагентов для определения концентрации калия | 1 | шт | 3 186,70 ₽ | 3 186,70 ₽ | 0,27% |
3. Набор реагентов для определения концентрации общего холестерина Набор реагентов для определения концентрации общего холестерина | 1 | шт | 7 465,00 ₽ | 7 465,00 ₽ | 0,64% |
| 4. Множественные аналиты спинномозговой жидкости ИВД, набор | 1 | набор | 2 265,00 ₽ | 2 265,00 ₽ | 0,19% |
| 5. Краситель азур-эозин | 1 | л; дм3 | 557,00 ₽ | 557,00 ₽ | 0,05% |
| 6. Гемоконт | 1 | упак | 2 150,30 ₽ | 0,18% | |
7. Наконечники 0,1-10 мкл Наконечники 0,1-10 мкл | 4 | упак | 4 293,00 ₽ | 17 172,00 ₽ | 1,47% |
| 8. Наконечник 5-200 мкл | 20 | упак | 319,70 ₽ | 6 394,00 ₽ | 0,55% |
| 9. Общий белок ИВД, набор, спектрофотометрический анализ | 1 | набор | 1 557,70 ₽ | 1 557,70 ₽ | 0,13% |
| 10. С-реактивный белок | 2 | набор | 2 217,30 ₽ | 4 434,60 ₽ | 0,38% |
11. Набор реагентов АСАТ Набор реагентов АСАТ | 1 | шт | 909,00 ₽ | 909,00 ₽ | 0,08% |
| 12. D-димер ИВД, набор, реакция агглютинации | 1 | набор | 25 853,70 ₽ | 25 853,70 ₽ | 2,21% |
| 13. Множественные факторы свертывания ИВД, контрольный материал | 1 | упак | 2 584,30 ₽ | 2 584,30 ₽ | 0,22% |
| 14. Экспресс-тест на прокальцитонин | 75 | шт | 725,70 ₽ | 54 427,50 ₽ | 4,66% |
15. Краситель для кислотоустойчивых бактерий ИВД, набор Краситель для кислотоустойчивых бактерий ИВД, набор | 2 | набор | 952,70 ₽ | 1 905,40 ₽ | 0,16% |
| 16. Тропонин T ИВД, набор, иммунохроматографический анализ, экспресс-анализ | 26 | набор | 9 874,70 ₽ | 256 742,20 ₽ | 21,97% |
| 17. Фиксатор-краситель | 3 | л; дм3 | 526,70 ₽ | 1 580,10 ₽ | 0,14% |
| 18. Микроальбуфан | 1 | упак | 1 750,70 ₽ | 1 750,70 ₽ | 0,15% |
19. Планшет с лунками Планшет с лунками | 100 | шт | 96,00 ₽ | 9 600,00 ₽ | 0,82% |
| 20. Бета-гемолитический стрептококк А антитела к стрептолизину O ИВД, набор, реакция агглютинации | 1 | набор | 2 216,70 ₽ | 2 216,70 ₽ | 0,19% |
| 21. Ревматоидный фактор ИВД, набор, реакция агглютинации | 1 | набор | 1 881,00 ₽ | 1 881,00 ₽ | 0,16% |
| 22. Множественные аналиты мочи ИВД, набор, колориметрическая тест-полоска, экспресс-анализ | 100 | набор | 1 505,00 ₽ | 150 500,00 ₽ | 12,88% |
23. Тест-картридж тропонин Тест-картридж тропонин | 20 | шт | 168,00 ₽ | 3 360,00 ₽ | 0,29% |
| 24. Фильтры воздушные сменные | 1 | упак | 557,70 ₽ | 557,70 ₽ | 0,05% |
| 25. Пипетка стеклянная | 200 | шт | 14,70 ₽ | 2 940,00 ₽ | 0,25% |
| 26. Ланцет | 15 | упак | 3 474,70 ₽ | 52 120,50 ₽ | 4,46% |
27. Микропробирка с антикоагулянтом Микропробирка с антикоагулянтом | 100 | шт | 1 074,70 ₽ | 107 470,00 ₽ | 9,20% |
| 28. Маркер перманентный | 20 | шт | 127,30 ₽ | 2 546,00 ₽ | 0,22% |
| 29. Пробирка микроцентрифужная | 2 | упак | 399,00 ₽ | 798,00 ₽ | 0,07% |
| 30. Пробирка лабораторная | 2 000 | шт | 4,80 ₽ | 9 600,00 ₽ | 0,82% |
31. Общий белок ИВД, набор, спектрофотометрический анализ Общий белок ИВД, набор, спектрофотометрический анализ | 1 | набор | 940,70 ₽ | 940,70 ₽ | 0,08% |
| 32. Тест-полоски (микроальбунурии) | 4 | шт | 4 908,00 ₽ | 19 632,00 ₽ | 1,68% |
| 33. Подсчет клеток крови ИВД, набор | 1 | набор | 1 273,30 ₽ | 1 273,30 ₽ | 0,11% |
| 34. Окрашивание по Граму ИВД, набор | 1 | набор | 1 274,00 ₽ | 1 274,00 ₽ | 0,11% |
35. Тест-набор скрытая кровь Тест-набор скрытая кровь | 400 | шт | 115,00 ₽ | 46 000,00 ₽ | 3,94% |
| 36. Сыворотка для диагностики сифилиса положительная | 1 | упак | 2 549,70 ₽ | 2 549,70 ₽ | 0,22% |
| 37. Сыворотка для диагностики сифилиса слабоположительная | 1 | упак | 2 229,70 ₽ | 2 229,70 ₽ | 0,19% |
| 38. Сыворотка для диагностики сифилиса отрицательная | 1 | упак | 2 228,70 ₽ | 2 228,70 ₽ | 0,19% |
39. Антиген кардиолипиновый Антиген кардиолипиновый | 1 | набор | 4 933,70 ₽ | 4 933,70 ₽ | 0,42% |
| 40. Реагенты сложные диагностические или лабораторные прочие, не включенные в другие группировки | 1 | набор | 239,30 ₽ | 239,30 ₽ | 0,02% |
| 41. Аланинаминотрансфераза (АЛТ) ИВД, набор, спектрофотометрический анализ | 1 | набор | 908,70 ₽ | 908,70 ₽ | 0,08% |
| 42. Лента регистрирующая | 20 | шт | 64,00 ₽ | 1 280,00 ₽ | 0,11% |
43. Чип-сенсор лактат Чип-сенсор лактат | 2 | шт | 19 427,00 ₽ | 38 854,00 ₽ | 3,32% |
| 44. Чип-сенсор глюкоза | 1 | шт | 11 275,00 ₽ | 11 275,00 ₽ | 0,96% |
| 45. Дезинфицирующий раствор | 1 | упак | 3 818,70 ₽ | 3 818,70 ₽ | 0,33% |
| 46. Моющий раствор | 1 | упак | 3 340,70 ₽ | 3 340,70 ₽ | 0,29% |
47. Термобумага ТМ-110 Термобумага ТМ-110 | 7 | рул | 159,70 ₽ | 1 117,90 ₽ | 0,10% |
| 48. Раствор РедиКонНорм | 1 | упак | 10 320,00 ₽ | 10 320,00 ₽ | 0,88% |
| 49. Раствор мульти-стандарт | 2 | упак | 7 173,00 ₽ | 14 346,00 ₽ | 1,23% |
| 50. Раствор гемолизирующий | 1 | флак | 24 337,70 ₽ | 24 337,70 ₽ | 2,08% |
51. Реагенты в контейнере Реагенты в контейнере | 6 | шт | 26 050,00 ₽ | 156 300,00 ₽ | 13,37% |
| 52. Капилляры натрий-гепарин | 4 | упак | 6 927,00 ₽ | 27 708,00 ₽ | 2,37% |
| 53. Раствор РедиКонПат | 1 | упак | 10 335,30 ₽ | 10 335,30 ₽ | 0,88% |
| 54. Раствор системный | 1 | флак | 24 429,30 ₽ | 24 429,30 ₽ | 2,09% |
55. Пробирки с замком Пробирки с замком | 4 | упак | 5 573,30 ₽ | 22 293,20 ₽ | 1,91% |
СОСТОЯНИЕ МИКРОБИОТЫ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК У РАБОТНИКОВ КАК КРИТЕРИЙ АДАПТАЦИИ К ФАКТОРАМ ПРОИЗВОДСТВА Текст научной статьи по специальности «Клиническая медицина»
DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020
Original article
Методы исследований
© КОЛЛЕКТИВ АВТОРОВ, 2019
Гимранова Г.Г., Масягутова Л.М., Гизатуллина Л.Г.
СОСТОЯНИЕ МИКРОБИОТЫ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК У РАБОТНИКОВ КАК КРИТЕРИЙ АДАПТАЦИИ К ФАКТОРАМ ПРОИЗВОДСТВА
Федеральное бюджетное учреждение науки «Уфимский научно-исследовательский институт медицины труда и экологии человека», 450106, Уфа
Введение. Условия труда работников нефтедобывающих производств не исключают негативного воздействия вредного биологического фактора рабочей среды. Совместное действие вредных и опасных факторов (шум, вибрация, сложный комплекс химических веществ различной интенсивности), неблагоприятные климатические и географические условия в процессе нефтедобычи приводят к нарушениям структурно-функционального состояния организма и повышению риска формирования заболеваний, вызываемых условно патогенными микроорганизмами.
Условия труда работников нефтедобывающих производств не исключают негативного воздействия вредного биологического фактора рабочей среды. Совместное действие вредных и опасных факторов (шум, вибрация, сложный комплекс химических веществ различной интенсивности), неблагоприятные климатические и географические условия в процессе нефтедобычи приводят к нарушениям структурно-функционального состояния организма и повышению риска формирования заболеваний, вызываемых условно патогенными микроорганизмами.
Материал и методы. Для изучения влияния условий труда рабочих, занятых добычей нефти, на качественный и количественный состав микрофлоры макроорганизма проведено исследование микробиоты кожи, микробиоценоза слизистой верхних дыхательных путей. Использование метода отпечатков кожи с внутренней поверхности предплечья на пластинку с кровяным агаром позволило наряду с общим количеством микроорганизмов определить наличие гемолитических форм на поверхности и в глубинных слоях кожи у рабочих нефтедобычи, оценить влияния условий труда на состояние микробиоценоза верхних дыхательных путей и антиинфекционную резистентность слизистой оболочки. Проанализирован видовой состав микробиоты слизистой носа и зева у рабочих, непосредственно и косвенно занятых добычей нефти.
Проанализирован видовой состав микробиоты слизистой носа и зева у рабочих, непосредственно и косвенно занятых добычей нефти.
Результаты. Проведённые исследования свидетельствуют, что у рабочих, непосредственно занятых добычей нефти, количество микроорганизмов кожных покровов значительно выше, чем у здоровых лиц: в среднем в 2-3,6 раза на поверхности и в 1,7-3,7 раза в глубинных слоях. У машинистов эти различия достигают соответственно 2,5-4 и 1,2-4 раз, а у инженерно-технических работников 1,4-2,3 на поверхности кожи и 1,2-2,5 в глубинных слоях. Для бурильщиков, помощников бурильщиков, операторов характерно наличие на слизистой носа и зева полимикробных ассоциаций условно патогенных микроорганизмов из 3-5 и более компонентов, а для машинистов, ИТР из 2-4, реже 5 компонентов.
Заключение. Воздействие производственных факторов, воздействующих на работников в процессе добычи нефти, способствует формированию нарушений микробиоценоза кожи и слизистых оболочек.
Ключевые слова: микрофлора организма; работники нефтедобывающей отрасли; иммунный статус организма; микрофлора; микробный пейзаж; условия обитания; биологический фактор рабочей среды.
Для цитирования: Гимранова Г.Г., Масягутова Л.М., Гизатуллина Л.Г Состояние микробиоты кожи и слизистых оболочек у работников как критерий адаптации к факторам производства. Гигиена и санитария. 2019; 98(9): 1015-1020. DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020
Для корреспонденции: Масягутова Ляйля Марселевна, доктор мед. наук, зав. отделением лабораторных методов исследований ФБУН «Уфимский НИИ медицины труда и экологии человека», 450106, Уфа. E-mail: [email protected]
Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Участие авторов: концепция, дизайн исследования, редактирование, утверждение окончательного варианта статьи, ответственность за целостность всех частей — Гимранова ГГ.; написание текста, статистическая обработка — Масягутова Л.М.; сбор и обработка материала — Гизатуллина Л.Г Поступила 01.07.2019 Принята к печати 23.07.19 Опубликована: октябрь 2019
Gimranova G.G., Masyagutova L.M., Gizatullina L.G.
THE STATE OF SKIN AND MUCOSAL MICROBIOTES IN WORKERS AS AN ADAPTATION CRITERION TO OCCUPATIONAL FACTORS (BASED ON THE OIL EXTRACTION INDUSTRY)
Ufa Research Institute of Occupational Health and Human Ecology, Ufa, 450106, Russian Federation
Introduction. The working conditions of workers in oil-producing industries do not exclude the negative impact of a harmful biological factor of the working environment.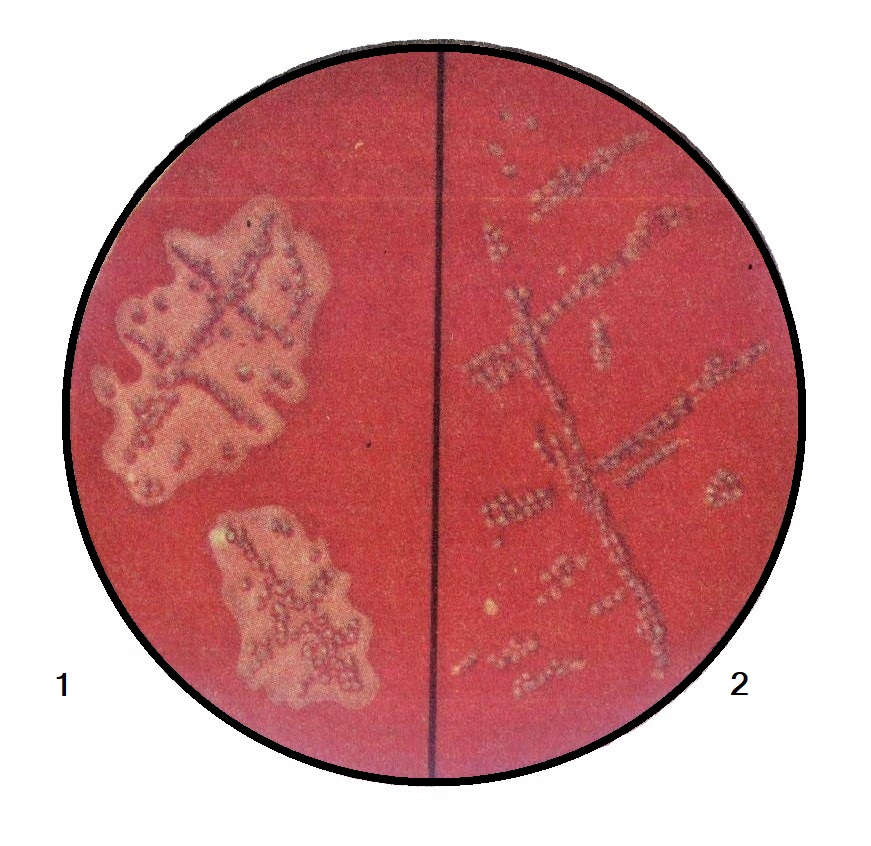 The combined effect of harmful and dangerous factors (noise, vibration, a complex of chemicals of varying intensity), adverse climatic and geographical conditions in the process of oil production lead to violations of the structural and functional state of the body and increase the risk of disease caused by opportunistic microorganisms.
The combined effect of harmful and dangerous factors (noise, vibration, a complex of chemicals of varying intensity), adverse climatic and geographical conditions in the process of oil production lead to violations of the structural and functional state of the body and increase the risk of disease caused by opportunistic microorganisms.
Material and methods. To study the effect of working conditions of workers engaged in oil extraction on the qualitative and quantitative composition of the microorganism, an investigation of skin microbiota and microbiocenosis of the upper respiratory tract mucosa was carried out. Using the method of skin prints from the inner surface of the forearm on a plate with blood agar allowed, along with the total number of microorganisms, to determine the presence of hemolytic forms on the surface and in deep layers of the skin of oil workers. Estimate the influence of working conditions on the microbiocenosis of the upper respiratory tract and mucosal anti-infective resistance of the mucous membrane analyzed the species composition of the microbiota of the nasal mucosa and pharynx in workers, directly and indirectly engaged in oil production.
DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020 Оригинальная статья
Results. Studies show in workers directly involved in oil extraction, the number of microorganisms of the skin is significantly higher than that of healthy people in average by 2.0-3.6 times on the surface and 1.7-3.7 times in the deep layers. For machinists, these differences achieve 2.5-4.0 and 1.2-4.0 times, respectively, and for engineering and technical workers, 1.4-2.3 on the skin surface and 1.2-2.5 in the deep layers. For drillers, drillers ‘ assistants, operators, the presence of conditionally pathogenic microorganisms of 3-5 or more components on the nasal and pharyngeal polymicrobial associations is typical, and for engineers, engineers and technicians from 2-4, less often 5 components.
Conclusion. The impact of occupational factors affecting workers in the process of oil extraction, contributes to the development of microbiocenosis lesions of the skin and mucous membranes. On the surface of the skin and mucous membranes of the upper respiratory tract there are a wide variety and specific structure of the microflora, specific to each of the studied groups in the workers examined.
On the surface of the skin and mucous membranes of the upper respiratory tract there are a wide variety and specific structure of the microflora, specific to each of the studied groups in the workers examined.
Keywords: the body microflora; oil extraction workers; body immune status; microflora; microbial landscape; environmental conditions; biological factor of the work environment.
For citation: Gimranova G.G., L.M. Masyagutova, Gizatullina L.G. The state of microbiotes of the skin and mucous membranes of workers as an adaptation criterion to occupational factors (based on the oil extraction industry. Gigiena i Sanitaria (Hygiene and Sanitation, Russian journal) 2019; 98(9): 1015-1020. (In Russian). DOI: http://dx.doi.org/ 10.18821/0016-9900-2019-98-9-1015-1020
For correspondence: LyaylyaM. Masyagutova, MD, Ph.D., DSci.,Head of the Department of Laboratory Research Methods of the Ufa Institute of Occupational Health and Human Ecology; Ufa, 450106, Russian Federation. E-mail: [email protected]
E-mail: [email protected]
Information about authors: Gimranova G.G. https://orcid.org/0000-0002-8476-1221
Masyagutova L.M. https://orcid.org/0000-0003-0195-8862; Gizatullina L.G. https://orcid.org/0000-0001-6593-2704
Conflict of interest. The authors declare no conflict of interest. Acknowledgment. The study had no sponsorship .
Contribution: Concept, research design, editing, approval of the final version of the article, responsibility for the integrity of all parts — G. Gimranova; Text writing,
statistical processing — Masyagutova L.M.; Collection and processing of material — Gizatullina L.G.
Received: July 01, 2019
Accepted: July 23, 2019
Publilshed: October, 2019
Введение
Условия труда работников нефтедобывающих производств не исключают негативного воздействия вредных факторов рабочей среды [1-6]. При изучении влияния на здоровье работающих неблагоприятных производственных факторов интегральным показателем реактивности организма является количественный и качественный состав нормальной микрофлоры различных биотопов организма человека [7-9]. Видовой спектр популяций микроорганизмов кожи и слизистых оболочек разнообразен и зависит от многих эндогенных и экзогенных факторов. Совместное действие вредных и опасных факторов (шум, вибрация, сложный комплекс химических веществ различной интенсивности), неблагоприятные климатические и географические условия в процессе нефтедобычи приводят к нарушениям структурно-функционального состояния организма и повышению риска формирования заболеваний, вызываемых условно патогенными микроорганизмами [10-15].
При изучении влияния на здоровье работающих неблагоприятных производственных факторов интегральным показателем реактивности организма является количественный и качественный состав нормальной микрофлоры различных биотопов организма человека [7-9]. Видовой спектр популяций микроорганизмов кожи и слизистых оболочек разнообразен и зависит от многих эндогенных и экзогенных факторов. Совместное действие вредных и опасных факторов (шум, вибрация, сложный комплекс химических веществ различной интенсивности), неблагоприятные климатические и географические условия в процессе нефтедобычи приводят к нарушениям структурно-функционального состояния организма и повышению риска формирования заболеваний, вызываемых условно патогенными микроорганизмами [10-15].
Материал и методы
Первичным барьером любого средового воздействия являются кожные покровы и слизистая верхних дыхательных путей, особенно у лиц, работающих в условиях комплексного, комбинированного, сочетанного влияния на организм неблагоприятных производственных факторов. В связи с этим для оценки влияния условий труда рабочих, занятых добычей нефти, на качественный и количественный состав микрофлоры макроорганизма проведено исследование микробиоты кожи, микробиоценоза слизистой верхних дыхательных путей 442 нефтяникам. Профессиональный состав нефтяников представлен следующими специальностями: бурильщики, помощники бурильщика, операторы капитального, подземного ремонта скважин (КРС, ПРС), операторы по добыче нефти и газа, поддержания пластового давления, обезвоживающей и обессоливающей установки (ДНГ, ППД, ООУ), машинисты. В зависимости от длительности воздействия неблагоприятных производственных факторов на организм они были разделены на подгруппы по производственному стажу в отрасли: до 5 лет — 25% нефтяников, до 10 лет -18%, до 15 лет — 29%, до 20 лет — 16% и более 20 лет — 12%.
В связи с этим для оценки влияния условий труда рабочих, занятых добычей нефти, на качественный и количественный состав микрофлоры макроорганизма проведено исследование микробиоты кожи, микробиоценоза слизистой верхних дыхательных путей 442 нефтяникам. Профессиональный состав нефтяников представлен следующими специальностями: бурильщики, помощники бурильщика, операторы капитального, подземного ремонта скважин (КРС, ПРС), операторы по добыче нефти и газа, поддержания пластового давления, обезвоживающей и обессоливающей установки (ДНГ, ППД, ООУ), машинисты. В зависимости от длительности воздействия неблагоприятных производственных факторов на организм они были разделены на подгруппы по производственному стажу в отрасли: до 5 лет — 25% нефтяников, до 10 лет -18%, до 15 лет — 29%, до 20 лет — 16% и более 20 лет — 12%.
Кожа, как известно, повсеместно и довольно обильно заселена различными микроорганизмами. На здоровой коже как постоянные обитатели доминируют стафилококки, коринебактерии, микрококки, редко встречаются стрептококки, дрожжеподобные
грибы, микобактерии, энтеробактерии, ещё реже неферментиру-ющие грамотрицательные бактерии, бациллы и др.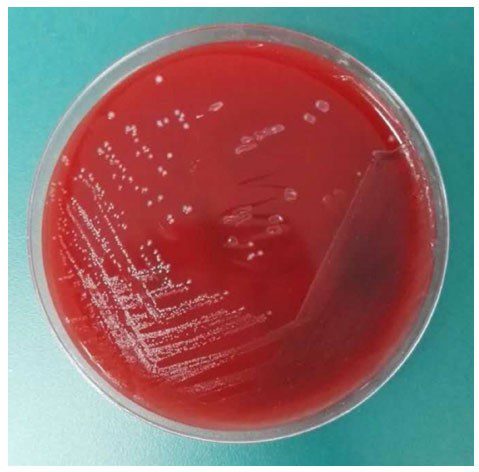
Несмотря на значительное количество и относительное многообразие, состав микрофлоры кожи на поверхности может носить случайный характер, а в глубоких слоях её быть более постоянным. У здоровых людей в норме на поверхности кожи микроорганизмы обнаруживаются в среднем 5-8 КОЕ/см2, в глубинных слоях 8-16 КОЕ/см2, а доля гемолитических форм микробов не превышает соответственно 6-9 и 8-10% от их общего числа.
Использование метода отпечатков кожи с внутренней поверхности предплечья на пластинку с кровяным агаром позволило наряду с общим количеством микроорганизмов определить наличие гемолитических форм на поверхности и в глубинных слоях кожи у 187 рабочих нефтедобычи. Было установлено, что количество поверхностной микрофлоры кожи у нефтяников составило в среднем 16,7 ± 3,6 КОЕ/см2, а в глубинных слоях 27,4 ± 3,4 КОЕ/см2, что соответственно в 2-3 и 1,6-3 раза выше, чем в норме у здоровых людей. Гемолитические формы на поверхности кожи составили 5,2%, в глубинных слоях — 10,1% от общего числа микроорганизмов и были представлены в 9% случаев золотистым стафилококком, в 52% — Р-гемолитическим стрептококком, в 39% — прочими микроорганизмами. Для сравнения количественных показателей микрофлоры кожных покровов нефтяников полученные результаты были сопоставлены с данными о содержании микроорганизмов на поверхности и в глубинных слоях кожи группы рабочих (48 человек) того же возраста (19-50 лет), профессиональная деятельность которых не связана с добычей нефти. Количество микроорганизмов было незначительно ниже, чем у нефтяников, и составляло на поверхности кожи 12,4 ±1,8 КОЕ/см2, в глубинных слоях -19,7 ± 2,4 КОЕ/см2 соответственно, а доля гемолитических форм равнялась соответственно 6,7 и 8,8% от их общего содержания.
Гемолитические формы на поверхности кожи составили 5,2%, в глубинных слоях — 10,1% от общего числа микроорганизмов и были представлены в 9% случаев золотистым стафилококком, в 52% — Р-гемолитическим стрептококком, в 39% — прочими микроорганизмами. Для сравнения количественных показателей микрофлоры кожных покровов нефтяников полученные результаты были сопоставлены с данными о содержании микроорганизмов на поверхности и в глубинных слоях кожи группы рабочих (48 человек) того же возраста (19-50 лет), профессиональная деятельность которых не связана с добычей нефти. Количество микроорганизмов было незначительно ниже, чем у нефтяников, и составляло на поверхности кожи 12,4 ±1,8 КОЕ/см2, в глубинных слоях -19,7 ± 2,4 КОЕ/см2 соответственно, а доля гемолитических форм равнялась соответственно 6,7 и 8,8% от их общего содержания.
Для оценки влияния условий труда на состояние микробиоценоза верхних дыхательных путей и антиинфекционную резистентность слизистой оболочки нами проведён анализ видового состава микробиоты слизистой носа и зева у 302 рабочих, непосредственно и косвенно занятых добычей нефти. Отмечая важную роль нормальной микрофлоры организма человека в поддержании его здоровья, осуществлении многих реакций и функций, следует отметить, что характерной особенностью верхних дыхательных путей является присутствие на слизистой оболочке наряду с собственной нормальной микрофлорой различных патогенных и условно патогенных микроорганизмов.
Отмечая важную роль нормальной микрофлоры организма человека в поддержании его здоровья, осуществлении многих реакций и функций, следует отметить, что характерной особенностью верхних дыхательных путей является присутствие на слизистой оболочке наряду с собственной нормальной микрофлорой различных патогенных и условно патогенных микроорганизмов.
DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020
Original article
Таблица 1
Микрофлора (КОЕ/см2) кожных покровов рабочих, занятых нефтедобычей
Профессиональная группа нефтяников
Микрофлора бурильщики, помощники бурильщиков, n = 87 операторы КРС, ПРС, n = 21 операторы ДНГ, ППД, ООУ, n = 29 машинисты, n = 34 ИТР, n = 16
Поверхностная, в том числе: 16,0 ± 2,1 19,7 ± 1,8 16,1 ± 2,4 20,3 ± 2,7 11,4 ± 0,9
гемолитические формы (стрепто- 1,0 ± 0,2 1,2 ± 0,09* 1,2 ± 0,1* 1,7 ± 0,1* 0,3 ± 0,07
кокки группы А — Р-гемолитические стрептококки), % 6,3 6,1 7,5 8,4 2,6
Глубинная, в том числе: 29,9 ± 3,1 30,7 ± 2,4 23,6 ± 1,3 32,9 ± 2,7 19,7 ± 2,7
гемолитические формы (стрепто- 3,0 ± 0,2* 3,4 ± 0,3* 2,1 ± 0,7 4,2 ± 1,3* 1,5 ± 1,0
кокки группы А — Р-гемолитические стрептококки), % 10,0 11,1 8,9 12,7 7,6
Примечание. Здесь и в табл. 2, 3: * — достоверность различий,р <0,05.
Здесь и в табл. 2, 3: * — достоверность различий,р <0,05.
Результаты
Анализ качественного и количественного состава поверхностной и глубинной микрофлоры кожных покровов в зависимости от стажа работы нефтяников показал более высокую об-семенённость кожных покровов в группах рабочих со стажем до 5 лет и 16-20 лет (р < 0,05). Различий в содержании гемолитических форм на поверхности кожи в зависимости от стажа не выявлено. А в глубинных слоях их количество у рабочих со стажем до 5 лет было в 2 раза выше, чем при большем стаже работы (р < 0,05). Результаты оценки микрофлоры кожных покровов у нефтяников различных профессиональных групп в зависимости от тяжести и интенсивности труда представлены в табл. 1.
У рабочих, непосредственно занятых добычей нефти, количество микроорганизмов кожных покровов значительно выше, чем у здоровых лиц, в среднем в 2-3,6 раза на поверхности и в 1,7-3,7 раза в глубинных слоях. У машинистов эти различия достигают соответственно 2,5-4 и 1,2-4 раз, а у инженерно-технических работников 1,4-2,3 на поверхности кожи и 1,2-2,5 в глубинных слоях. При изучении спектра микроорганизмов, выделенных с кожных покровов нефтяников разных профессий, особых различий в их составе нами не выявлено. Обнаруживались стафилококки, микрококки, стрептококки, коринебактерии, дрожжеподобные грибы, которые выделялись как в виде монокультур, так и в ассоциациях (более 90% случаев) из популяций 2-3, реже 3-4 культур микроорганизмов. Несмотря на то что при
У машинистов эти различия достигают соответственно 2,5-4 и 1,2-4 раз, а у инженерно-технических работников 1,4-2,3 на поверхности кожи и 1,2-2,5 в глубинных слоях. При изучении спектра микроорганизмов, выделенных с кожных покровов нефтяников разных профессий, особых различий в их составе нами не выявлено. Обнаруживались стафилококки, микрококки, стрептококки, коринебактерии, дрожжеподобные грибы, которые выделялись как в виде монокультур, так и в ассоциациях (более 90% случаев) из популяций 2-3, реже 3-4 культур микроорганизмов. Несмотря на то что при
медицинском осмотре патологии кожных покровов у обследованных нефтяников обнаружено не было, выявленные изменения кожной аутофлоры могут служить признаками изменения защитных сил организма под воздействием производственных факторов.
Были выявлены сообщества микроорганизмов, колонизирующие слизистую носа и зева, которые включали популяции более 20 видов, принадлежащих к 16 родам. Так, микрофлора слизистой оболочки носа у нефтяников была представлена в основном бактериями родов Streptococcus, Staphylococcus, Micrococcus, Neisseria, Corynebacterium. Иногда, и в ряде случаев без симптомов заболевания, выявлялись S. aureus, Str. pneumonia, Р-гемолитические стрептококки, бациллы, дрож-жеподобные и плесневые грибы, грамотрицательные бактерии.
Так, микрофлора слизистой оболочки носа у нефтяников была представлена в основном бактериями родов Streptococcus, Staphylococcus, Micrococcus, Neisseria, Corynebacterium. Иногда, и в ряде случаев без симптомов заболевания, выявлялись S. aureus, Str. pneumonia, Р-гемолитические стрептококки, бациллы, дрож-жеподобные и плесневые грибы, грамотрицательные бактерии.
Структура микрофлоры слизистой носа нефтяников в большей степени (71,5% случаев) была представлена грамположи-тельными кокками. Доля грамотрицательных кокков составляла 20,6%, а грамположительных и грамотрицательных палочек соответственно 12,2 и 4,9%, дрожжевых и плесневых грибов -6,3%. В основном в передних отделах носа выявлялись стрептококки (а-, Р-, у-гемолитические) — у 96% нефтяников и стафилококки (золотистый, эпидермальный и др.) — у 74,6%, которые находились в составе 2-4-5-компонентных ассоциаций с тран-зиторной микрофлорой.
Микробный пейзаж глотки был разнообразнее и многочисленнее: среди облигатных представителей выделялись зеленя-
Таблица 2
Частота обнаружения (%) некоторых представителей нормальной микрофлоры слизистой носа у рабочих, занятых нефтедобычей
Профессиональная группа нефтяников
Микрофлора бурильщики, помощники бурильщиков, n = 176 операторы КРС, ПРС, n = 16 операторы ДНГ, ППН, n = 36 машинисты, n = 51 ИТР, n = 23
Грамположительные кокки:
стафилококки 59,1 ± 4,45* 60,0 ± 16,0* 55,5 ± 9,25* 60,8 ± 8,51* 73,9 ± 15,7
стрептококки 85,2 ± 6,40* 86,7 ± 21,6* 83,3 ± 13,88* 100 ± 14,0* 82,6 ± 17,5
Грамотрицательные кокки, в том числе: 13,6 ± 1,02* 33,3 ± 8,30* 25,0 ± 4,16* 39,2 ± 5,49* 56,5 ± 12,0
нейссерии 11,9 ± 0,89* 26,7 ± 6,67* 13,9 ± 2,31* 37,3 ± 6,21* 47,8 ± 10,1
Грамположительные палочки, в том числе: 23,9 ± 1,8* 26,6 ± 6,6* 19,4 ± 3,23* 13,7 ± 1,91* 21,7 ± 4,61
коринебактерии 21,0 ± 1,5* 13,3 ± 3,32* 8,3 ± 1,38* 3,9 ± 0,54 17,4 ± 3,70
Грамотрицательные палочки, в том числе: 10,8 ± 0,81* 20,0 ± 5,0 11,1 ± 1,85 3,9 ± 0,54* —
энтеробактерии 6,8 ± 0,51* 0,6 ± 0,15* 8,3 ± 1,38 — —
неферментирующие грамотрицательные бактерии 2,8 ± 0,21* 0,6 ± 0,15* — 1,9 ± 0,44 —
Грибы, в том числе: 10,2 ± 0,70* 6,7 ± 1,67 11,1 ± 1,85 7,8 ± 1,65 —
дрожжеподобные 6,8 ± 0,52* 6,7 ± 1,67 11,1 ± 1,85 5,9 ± 1,25 —
DOI: http://dx.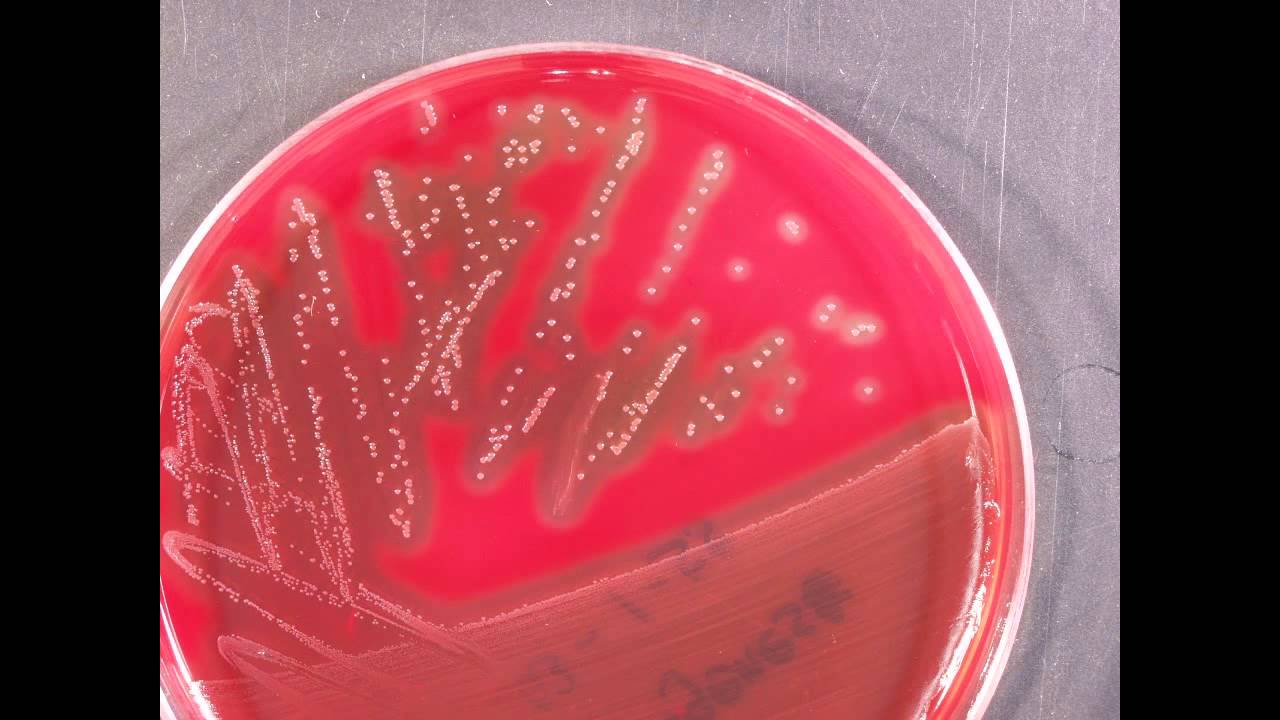 doi.org/10.18821/0016-9900-2019-98-9-1015-1020 Оригинальная статья
doi.org/10.18821/0016-9900-2019-98-9-1015-1020 Оригинальная статья
Таблица 3
Частота обнаружения (%) некоторых представителей нормальной микрофлоры слизистой зева у рабочих, занятых нефтедобычей
Профессиональные группы нефтяников
Микрофлора бурильщики, помощники бурильщиков, п = 176 операторы КРС, ПРС, п = 16 операторы ДНГ, ППН, п = 36 машинисты, п = 51 ИТР, п = 23
Грамположительные кокки:
стафилококки 55,1 ± 4,15* 73,3 ± 18,32* 72,2 ± 12,03* 43,1 ± 6,03* 65,2 ± 13,87
стрептококки 100 ± 7,54* 100 ± 25,0* 100 ± 16,66* 100 ± 14,0* 100 ± 21,27
Грамотрицательные кокки, в том числе: 23,9 ± 1,8* 53,4 ± 13,25* 47,2 ± 7,86* 56,8 ± 7,95* 60,9 ± 12,95
нейссерии 21,0 ± 1,58* 33,3 ± 8,3* 38,8 ± 6,4* 49,0 ± 6,86* 47,8 ± 10,17
Грамположительные палочки, в том числе: 26,7 ± 2,01* 13,4 ± 3,35* 22,2 ± 6,46* 15,7 ± 2,19* 39,1 ± 8,31
коринебактерии 21,0 ± 1,58* 6,7 ± 1,67* 19,4 ± 3,23* 11,8 ± 1,65* 30,4 ± 6,46
Грамотрицательные палочки, в том числе: 18,8 ± 1,41 6,7 ± 1,67 11,1 ± 1,85 9,8 ± 1,37 4,3 ± 0,91
энтеробактерии 12,5 ± 0,94* 6,7 ± 1,67 5,6 ± 0,93 5,9 ± 0,82 4,3 ± 0,91
неферментирующие грамотрицательные бактерии 5,1 ± 0,38* — 2,8 ± 0,46 3,9 ± 0,54 —
Грибы, в том числе: 13,1 ± 0,98 20,0 ± 5,0 22,2 ± 3,7 15,7 ± 2,19 8,7 ± 1,85
дрожжеподобные 13,1 ± 0,98 20,0 ± 5,0 22,2 ± 3,7 15,7 ± 2,19 8,7 ± 1,85
щие и негемолитические стрептококки, нейссерии, стафилококки, коринеформные бактерии. Доля грамположительных и грамотрицательных кокков на слизистой зева составляла соответственно 55,1 и 20,6%. Грамположительные и грамотрица-тельные палочки составляли 2,5 и 14,3% от общего количества выделенных штаммов соответственно. Доля дрожжеподобных и плесневых грибов равнялась 7,5%. У 99% нефтяников были выделены стрептококки, у 60,8% — стафилококки, у 57,5% -нейссерии. Факультативная микрофлора была представлена золотистым стафилококком, пневмококком, гемолитическим стрептококком, аэрококками, энтеробактериями, неферментиру-ющими грамотрицательными бактериями.
Доля грамположительных и грамотрицательных кокков на слизистой зева составляла соответственно 55,1 и 20,6%. Грамположительные и грамотрица-тельные палочки составляли 2,5 и 14,3% от общего количества выделенных штаммов соответственно. Доля дрожжеподобных и плесневых грибов равнялась 7,5%. У 99% нефтяников были выделены стрептококки, у 60,8% — стафилококки, у 57,5% -нейссерии. Факультативная микрофлора была представлена золотистым стафилококком, пневмококком, гемолитическим стрептококком, аэрококками, энтеробактериями, неферментиру-ющими грамотрицательными бактериями.
Изучение микробного пейзажа, частоты встречаемости микроорганизмов, степени обсеменённости слизистой верхних дыхательных путей позволило оценить долю участия различных видов микроорганизмов в структуре биоценоза, выделить представителей основной, дополнительной и случайной микрофлоры респираторного тракта. В табл. 2, 3 представлены данные по частоте обнаружения некоторых условно патогенных представителей нормальной микрофлоры слизистой верхних дыхательных путей нефтяников.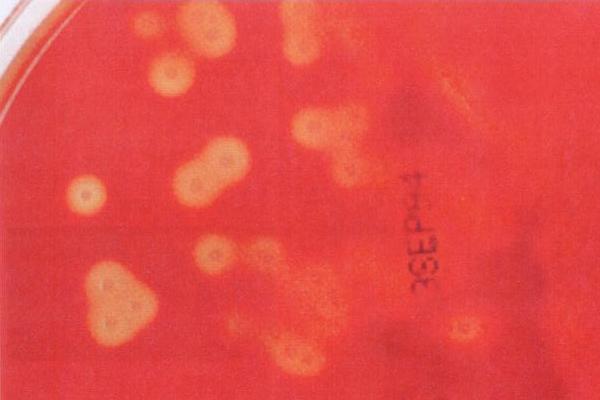
Выявлены некоторые различия, касающиеся частоты обнаружения на слизистой носа ряда представителей нормальной и условно патогенной микрофлоры. У бурильщиков и помощников бурильщиков нейссерии обнаруживаются в 2,8-4 раза реже, коринебактерии — в 1,2-5,4 раза, а энтеробактерии и нефермен-тирующие грамотрицательные бактерии — в 1,5-2,8 раза чаще, чем у работников, непосредственно не занятых добычей нефти. Такая же тенденция в отношении микрофлоры слизистой носа отмечается и у операторов КРС, ПРС, ДНГ, ППД, ООУ.
На слизистой зева, так же как и на слизистой носа, у бурильщиков и их помощников частота обнаружения нейссерий была в 2-2,3 раза ниже, а энтеробактерий в 2,1-2,9 раза выше, чем у машинистов и ИТР, у операторов же эти различия были незначительны. В то же время значительных различий в частоте обнаружения грамположительных кокков и палочек, грибковой микрофлоры не выявлено.
В табл. 4 представлены данные о колонизации слизистой носа и зева у рабочих нефтедобычи некоторыми представителями условно патогенных микроорганизмов в зависимости от выявленной у них патологии верхних дыхательных путей (ВДП).
4 представлены данные о колонизации слизистой носа и зева у рабочих нефтедобычи некоторыми представителями условно патогенных микроорганизмов в зависимости от выявленной у них патологии верхних дыхательных путей (ВДП).
Обсуждение
В неблагоприятных условиях, стрессе, патологических состояниях происходит нарушение баланса взаимоотношений организма и его микрофлоры, дисбиотические сдвиги внутри бактериальных ассоциаций и, как следствие этого, повышение риска формирования заболеваний, вызываемых условно патогенными микроорганизмами.
Динамическое наблюдение за рабочими-нефтяниками показало, что частота воспалительных заболеваний верхних дыхательных путей составляла в среднем 6,1 ± 0,3% случаев без особых различий у рабочих разных профессий. Был отмечен полиморфизм воспалительно-дистрофических изменений слизистой оболочки респираторного тракта, выраженность которых возрастала с увеличением стажа работы. Частота нарушений микроэкологии слизистой верхних дыхательных путей в большей степени проявлялась у лиц со стажем работы 6-10 лет (р < 0,05).
Частота нарушений микроэкологии слизистой верхних дыхательных путей в большей степени проявлялась у лиц со стажем работы 6-10 лет (р < 0,05).
Изучение ассоциаций микроорганизмов, входящих в состав микробиоценозов слизистой верхних дыхательных путей нефтяников, позволило определить причастность отдельных представителей индигенной микрофлоры к развитию патологических процессов. Установлено, что для бурильщиков, помощников бурильщиков, операторов КРС, ПРС, ДНГ, ППД, ООУ характерно наличие на слизистой носа и зева полимикробных ассоциаций условно патогенных микроорганизмов из 3-5 и более компонентов, а для машинистов, ИТР — из 2-4, реже 5 компонентов. Отмечено существенное преобладание золотистого и эпидермального стафилококков, Р-гемолизирующих стрептококков, энтеробакте-рий, дрожжеподобных грибов и их сочетаний без выраженных различий в степени значимости микроорганизмов ассоциантов в развитии патологии ЛОР-органов у всех обследованных групп нефтяников. Тем не менее изучение микробного пейзажа, частоты встречаемости микроорганизмов, являющихся причиной воспалительного процесса верхних дыхательных путей, степень обсеменённости слизистой позволили оценить долю участия различных видов микроорганизмов в структуре биоценоза респираторного тракта.
Тем не менее изучение микробного пейзажа, частоты встречаемости микроорганизмов, являющихся причиной воспалительного процесса верхних дыхательных путей, степень обсеменённости слизистой позволили оценить долю участия различных видов микроорганизмов в структуре биоценоза респираторного тракта.
Среди бурильщиков и их помощников, операторов различных служб число обследованных здоровых лиц было в 4,4 раза выше, чем с заболеваниями органов дыхания, а среди машинистов и ИТР их было в 2,1 раза больше. На слизистой носа
DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020
Original article
Таблица 4
Частота обнаружения (%) некоторых представителей нормальной микрофлоры слизистой верхних дыхательных путей у нефтяников
Группа Микроорганизм Слизистая носа Слизистая зева
рабочих здоровые патология ВДП здоровые патология ВДП
Бурильщики n = 26 n = 94 n = 56 n = 94
Золотистый стафилококк 7,0 ± 1,38 41,2 ± 4,25 14,1 ± 1,88 50,0 ± 5,16
Р-гемолизирующий стрептококк 1,4 ± 0,28 32,4 ± 3,34 9,2 ± 1,23 35,3 ± 3,64
Энтеробактерии 2,8 ± 0,55 11,8 ± 1,22 2,1 ± 0,28 5,9 ± 0,61
НГОБ 0 23,5 ± 2,42 3,5 ± 0,47 5,9 ± 0,61
Дрожжеподобные грибы 3,5 ± 0,69 0 2,8 ± 0,38 11,8 ± 1,22
Операторы КРС, ПРС n = 2 n = 5 n = 4 n = 5
Золотистый стафилококк 8,3 ± 5,88 20,0 ± 8,97 16,7 ± 8,35 33, ± 3
Р-гемолизирующий стрептококк 16,7 ± 11,80 66,7 ± 29,31 16,7 ± 8,35 66,7 ±
Энтеробактерии 80 33,3 ± 14,93 0 0
НГОБ 0 33,3 ± 14,93 0 0
Дрожжеподобные грибы 0 33,3 ± 14,93 8,3 ± 4,15 0
Операторы n = 7 n = 15 n = 14 n = 15
ДНГ, ППН Золотистый стафилококк 9,7 ± 3,67 40 ± 10,33 19,4 ± 5,18 66,7 ± 17,23
Р-гемолизирующий стрептококк 0 60,0 ± 15,5 38,7 ± 10,35 40,0 ± 10,33
Энтеробактерии 3,2 ± 1,21 20,0 ± 5,17 3,2 ± 0,86 0
НГОБ 0 0 3,2 ± 0,86 20,0 ± 5,17
Дрожжеподобные грибы 6,5 ± 2,46 20,0 ± 5,17 3,2 ± 0,86 0
Машинисты n = 8 n = 27 n = 16 n = 27
Золотистый стафилококк 5,9 ± 2,08 23,5 ± 4,51 11,8 ± 2,95 35,3 ± 6,79
Р-гемолизирующий стрептококк 5,9 ± 2,08 41,2 ± 7,92 23,5 ± 5,88 17,6 ± 3,38
Энтеробактерии 0 0 5,9 ± 1,48 5,9 ± 1,13
НГОБ 0 5,9 ± 1,13 5,9 ± 1,48 0
Дрожжеподобные грибы 2,9 ± 1,02 11,8 ± 2,7 5,9 ± 1,48 11,8 ± 2,27
ИТР n = 3 n = 14 n = 6 n = 14
Золотистый стафилококк 13,3 ± 7,82 50,0 ± 13,4 13,3 ± 5,32 37,5 ± 10,02
Р-гемолизирующий стрептококк 2 12,5 ± 3,34 33,3 ± 13,32 25,0 ± 6,68
Энтеробактерии 0 0 0 12,5 ± 3,34
НГОБ 0 0 0 0
Дрожжеподобные грибы 0 0 6,7 ± 25,0 ± 6,68
золотистый стафилококк выделялся у 16,6% обследованных нефтяников, Р-гемолизирующий стрептококк — у 9,9%, энтеро-бактерии — 4,8%, НГОБ — 1,6%, дрожжеподобные грибы рода Candida — 3,8%. На слизистой зева частота их выделения соответственно составляла 46; 20,1; 3,2; 3,5; 5,8%. Как правило, при заболеваниях верхних дыхательных путей частота обнаружения указанных микроорганизмов на слизистой в 3-6 раз выше, чем у здоровых лиц.
На слизистой зева частота их выделения соответственно составляла 46; 20,1; 3,2; 3,5; 5,8%. Как правило, при заболеваниях верхних дыхательных путей частота обнаружения указанных микроорганизмов на слизистой в 3-6 раз выше, чем у здоровых лиц.
Заключение
1. Воздействие на работников производственных факторов в процессе добычи нефти способствует формированию нарушений микробиоценоза кожи и слизистых оболочек.
2. У обследуемых работников на поверхности кожных покровов и слизистых верхних дыхательных путей отмечено широкое разнообразие и видовая структура микрофлоры, специфичные для каждой из изученных групп.
Литер атур а
1. Гимранова Г.Г., Бакиров А.Б., Каримова Л.К. Комплексная оценка условий труда и состояния здоровья нефтяников. Медицина труда и промышленная экология. 2009; 8: 1-5.
Медицина труда и промышленная экология. 2009; 8: 1-5.
2. Голиков Р. А., Суржиков Д.В., Кислицына В.В., Штайгер В.А. Влияние загрязнения окружающей среды на здоровье населения (обзор литературы). Научное обозрение. Медицинские науки. 2017; (5): 20-31.
3. Гимранова Г.Г., Бакиров А.Б., Каримова Л.К. Профессиональная заболеваемость в нефтедобывающей промышленности Республики Башкортостан. Медицина труда и промышленная экология. 2009; 10: 28-31.
4. Каримова Л.К., Гимранова Г.Г., Зотова Т.М., Бакирова А.Э. Профессиональные риски нарушения здоровья работающих при переработке нефти. Медицина труда и промышленная экология. 2009; 11: 9-12
5. Шайхлисламова Э.Р., Каримова Л.К., Гимранова Г.Г., Отарбаева М.Б. Сравнительная оценка условий труда при добыче нефти и рудных полезных ископаемых и связанный с ними риск нарушений здоровья. Гигиена труда и медицинская экология. 2018; 2: 28-36.
Гигиена труда и медицинская экология. 2018; 2: 28-36.
DOI: http://dx.doi.org/10.18821/0016-9900-2019-98-9-1015-1020 Оригинальная статья
6. Бакиров А.Б., Мингазова С.Р., Каримова Л.К., Серебряков П.В., Мухаммадиева Г.Ф. Клинико-гигиенические аспекты риска развития и прогрессирования пылевой бронхолёгочной патологии у работников различных отраслей экономики под воздействием производственных факторов риска. Анализ риска здоровью. 2017; 3: 83-91.
7. Захаренков В.В., Казицкая А.С., Михайлова Н.Н., Романенко Д.В., Жданова Н.Н., Жукова А.Г. Влияние вредных производственных факторов на иммунный статус организма. Медицина труда и промышленная экология. 2017; 12: 19-23.
8. Извин А.И., Катаев Л.В. Микробный пейзаж слизистой оболочки верхних дыхательных путей в норме и патологии. Вестник оториноларингологии. 2009; 2: 64-8.
2009; 2: 64-8.
9. Масягутова Л.М., Бадамшина Г.Г., Бакиров А.Б. Оценка микробиологического риска для работников агропромышленного комплекса. Медицина труда и экология человека. 2015; 1: 34-8 .
10. Панкова В.Б. Современные проблемы диагностики и экспертизы профессиональных заболеваний верхних дыхательных путей. Вестник оториноларингологии. 2015; (5): 14—8.
11. Аравийская Е.Р., Соколовский Е.В. Микробиом: новая эра в изучении здоровой и патологически измененной кожи. Вестник дерматологии и венерологии. 2016; 3: 102-9.
12. Измеров Н.Ф., Симонова Н.И., Низяева И.В. Исследование и анализ профиля профессионального риска. Медицина труда и промышленная экология. 2015; 9: 60-1.
13. Нобл УК. Микробиология кожи человека. Пер. с англ.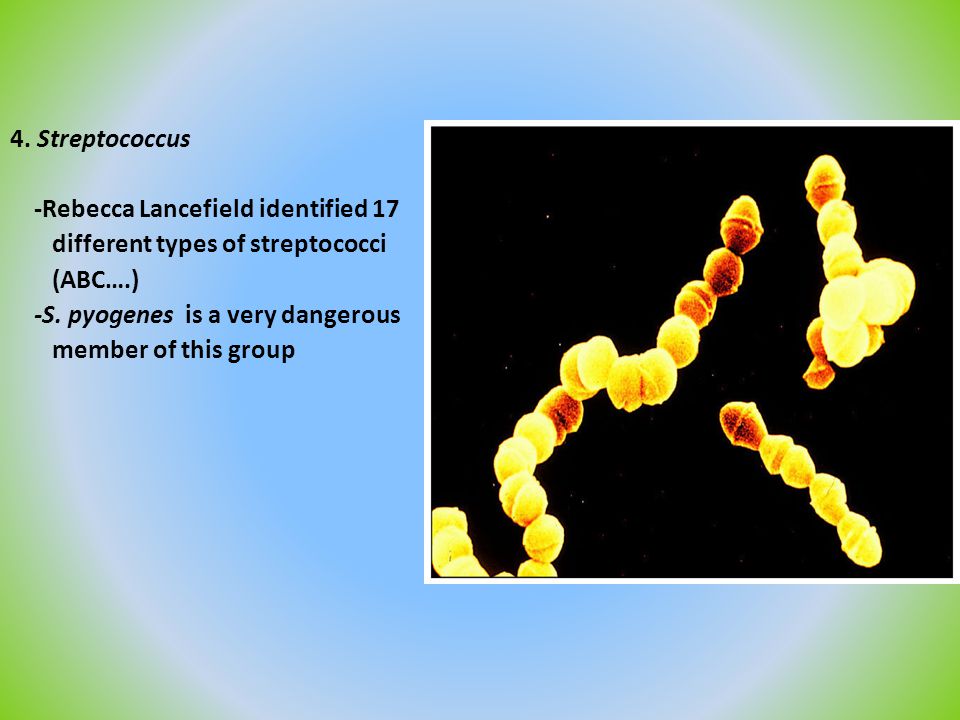 М.: Медици-на;1986. 493 с.
М.: Медици-на;1986. 493 с.
14. Панкова В.Б. Профессиональные заболевания полости носа. Руководство по ринологии. Под ред. Пискунова Г.З., Пискунова С.З. М.: Литтерра; 2011: 704-21.
15. Lederberg J. »Ome Sweet» Omics — A Genealogical Treasury of Words. Scientist. 2001; 15 (7): 8.
References
1. Gimranova G.G., Bakirov A.B., Karimova L. K. Complex assessment of labor conditions and health of oil workers . Meditsina truda i promyshlen-naya ekologiya [Occupational Health and Industrial Ecology]. 2009; 8: 1-5. (in Russian)
2. Golikov R.A., Surzhikov D.V., Kislitsyn V.V., Steiger V.A. The Influence-environmental pollution on public health (literature Review). Nauchnoye obozreniye. Meditsinskiye nauki [Scientific Review. Medical Science].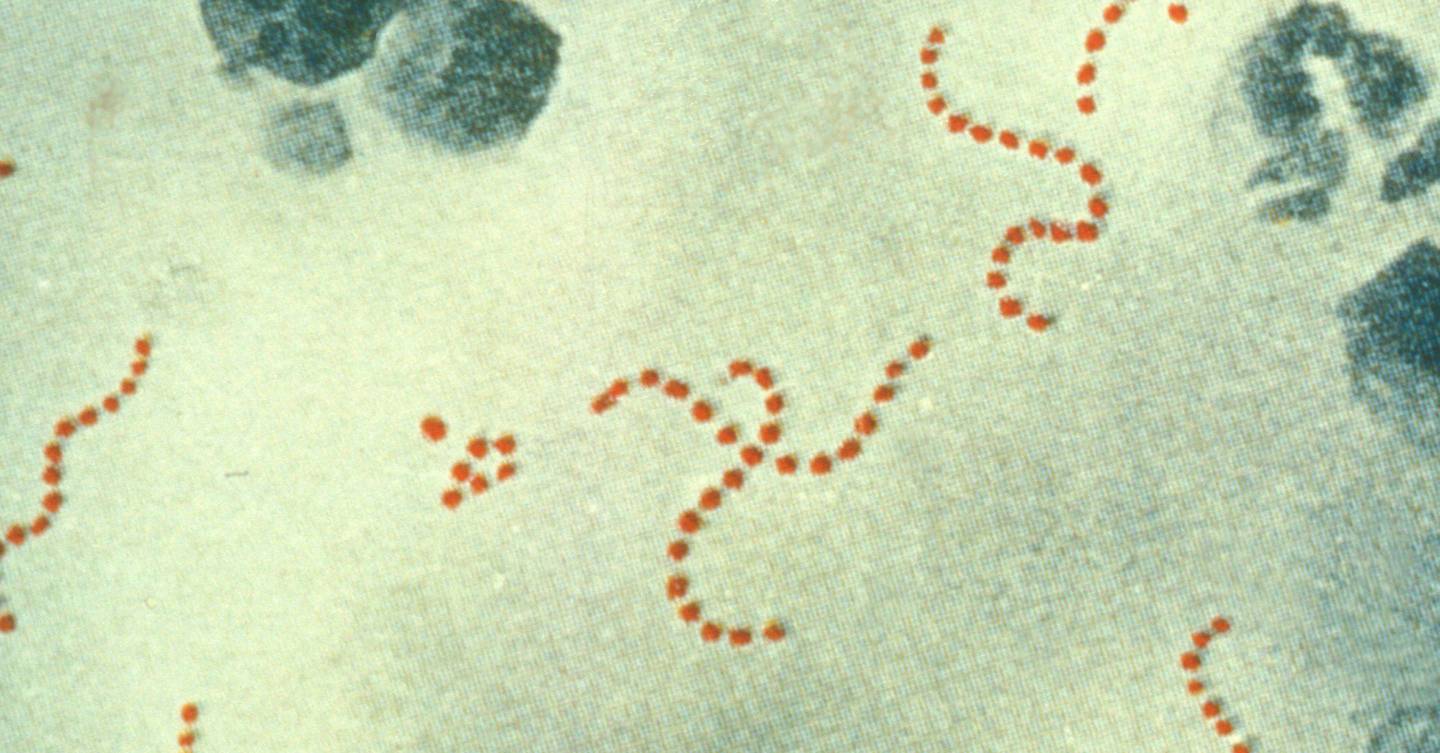 2017; (5): 20-31. (in Russian)
2017; (5): 20-31. (in Russian)
3. Gimranova G.G., Bakirov A.B., Karimova L.K. Professional morbidity in the oil industry of the Republic of Bashkortostan . Meditsina truda i
promyshlennaya ekologiya [Occupational Health and industrial ecology]. 2009; 10: 28-31. (in Russian)
4. Karimova L.K., Gimranova G.G., Zotova T.M., Bakirova A.E. Occupational health risks of workers during oil refining. Meditsina truda i promyshlennaya ekologiya [Occupational Health and Industrial Ecology]. 2009; 11: 9-12. (in Russian)
5. Shaikhlislamova E.R., Karimova L.K., Gimranova G.G., Otarbaeva M . B . Comparative assessment of working conditions in the extraction of oil and ore minerals and the associated risk of health problems . Gigiy-ena truda i meditsinskaya ekologiya [Occupational Health and Medical Ecology]. 2018; 2: 28-36. (in Russian)
6. Bakirov A.B., Mingazova S.R., Karimova L.K., Serebryakov P.V., Mukham-madieva G.F. Clinical and hygienic aspects of the risk of development and progression of PY-left bronchopulmonary pathology in workers of various sectors of the economy under the influence of production risk factors. Analiz riskazdorov’yu [HealthRisk Analysis]. 2017; 3: 83-91. (in Russian)
7. Zakharenkov V.V., Kazitskaya A.S., Mikhailova N.N., Romanenko D.V., Zhda-Nova N.N., Zhukova A.G. Influence of harmful production factors on the immune status of the body. Meditsina truda i promyshlennaya ekologiya Meditsina truda i ekologiya cheloveka [Occupational Health and Human Ecology]. 2017; 12; 19-23. (in Russian).
8. Izvin A.I., Kataev L.V. Microbial landscape of the mucous membrane of the upper respiratory tract in norm and pathology. Vestnik otorinolarin-gologii [Bulletin of Otolaryngology]. 2009; 2: 64-8. (in Russian)
9. Masyagutova L.M., Badamshina G.G., Bakirov A.B. Microbiological risk assessment for agricultural workers Meditsina truda i ekologiya cheloveka [Occupational Health and Human Ecology]. 2015; 1: 34-8. (in Russian)
10. Pankova V.B. Modern problems of diagnosis and examination of occupational diseases of the upper respiratory tract Vestnik otorinolaringologii [Bulletin of Otolaryngology]. 2015; (5): 14-8. (in Russian)
11. Araviyskaya Ye.R., E.R., Sokolovsky E.V. Microbiome: a new era in the study of healthy and pathologically altered skin Vestnik dermatologii i venerologii [Bulletin of Dermatology and Venereology]. 2016; 3: 102-9. (in Russian)
12. Izmerov N.F., Simonova N.I., Nizyaeva I.V. Research and analysis of professional risk profile. Meditsina truda i promyshlennaya ekologiya Meditsina truda i ekologiya cheloveka [Occupational Health and Human Ecology]. 2015; 9: 60-1. (in Russian)
13. Noble U.K. Microbiology of human skin. Transl. from English. Moscow: Meditsina; 1986. 493 p. (in Russian)
14. Pankova V.B. Occupational diseases of the nasal cavity: a Guide to rhi-nology. Under the ed. Piskunov G.Z., Piskunov S.Z. Moscow: publishing House «Liter»; 2011: 704-21. (in Russian)
15. Lederberg J. »Ome Sweet» Omics — A Genealogical Treasury of Words. Scientist. 2001; 15 (7): 8.
вся информация о гломерулонефрите — Docsity
АО «Медицинский университет Астана» Острый гломерулонефрит Термин „Гломерулонефрит“ – не клинический диагноз, а патогистологический термин, описывающий различные гломерулярные повреждения, ассоциированные с различными клиническими симптомами Обязательные симптомы и признаки гломерулонефрита: 1.Гломерулярная протеинурия и/или 2. Гломерулярная эритроцитуруя Синонимы • Острый постинфекционный гломерулонефрит (постстрептококковый, стафилококки, вирусы, бактерии, туберкулез, риккетсии и др.) • Диффузный пролиферативный интра (эндо) капиллярный гломерулонефрит Коды по МКБ -10 • NOO. Острый нефритический синдром • NO1. Быстропрогрессирующий нефритический синдром Острый гломерулонефрит (ОГН) ОГН — острое диффузное преимущественно иммунокомплексное воспаление клубочков почек (гломерулит?!), развивающееся через 1-4 недели после антигенного воздействия, клинически проявляющееся остронефритическим синдромом с характерным циклическим течением и, как правило (в 90-95% случаев) заканчивающее выздоровлением Острый гломерулонефрит (ОГН) Группа морфологически разнородных имму- новоспалительных заболеваний с преимущест- венным поражением клубочков, с вовлечением канальцев и интерстициальной ткани, характери- зующееся впервые возникшим остронефрити- ческим синдромом, часто развивающееся после стрептококковой или другой инфекции. Могут выступать как самостоятельные нозологические формы – первичные; или могут встречаться и при системных заболеваниях (СКВ, геморрагический васкулит, инфекционный эндокардит и др.)-вторичные. Этиология и эпидемиология • Бета- гемолитический стрептококк группы А, нефритогенные серотипы – М-штаммы (типы): 1 – 4, 12, 18), 25, 31, 49, 52, 55-57, 59-6)1 (группы С — Streptococcus zooepidemicus) • Причем 1,4,12 тонзилло-фаренгиальные, а 2, 49, 55, 57, 60 после кожных инфекций • Частота – в мире около 470 тыс. случаев заболеваний, из которых 400 тыс. в детском возрасте (в основном от 5 до 12 лет), при этом 97% в странах с низким уровнем экономического развития (Нефрология, Национальное руководство РФ, 2016 г.) Патогенетические механизмы • Отложения циркулирующих из крови (или образование in situ во время острой фазы стрептококковой инфекции) иммунных комплексов, содержащих антигены стрептококка на гломерулярную базальную мембрану и/или в мезангии • Наиболее значимые антигены: пирогенный экзотоксин В (SpeB) ) и его предшественник – зимоген, эндострептозин (цитоплазматический антиген, обладающий стрептокиназной активностью) и нефритассоциированный рецептор плазминового комплекса (NAP1r)), обладающий высокой связью структурой клубочков почек • При фиксации стрептококкового антигена в почечной ткани вследствие вирулентности стрептококка возможно развитие феномена молекулярной мимикрии (копирование антигенной структуры гломерул почек) и стимуляция иммунного ответа (аутоантитела) на эти органные и тканевые белки (антигены) • Формирование в почечной ткани иммунных депозитов активирует гуморальные системы воспаления (комплемента, свертывающей и антисвертывающей, кинин-каликреиновой), а также гистамина и серотонина • Эта активация обеспечивает хемотаксис (С3а, С5а, С5-С7), прилипание (С3b)) полиморфно-ядерных лейкоцитов и тромбоцитов, дегрануляцию базофилов и тучных клеток (С3а – С5а), приводит к формированию мембраноатакующего комплекса С5 – С9. • Привлеченные в очаг воспаления провоспалительные клетки распознают и представляют антиген, выделяют повреждающие лизосомальные ферменты (протеазы), супероксид-анионы, стимулируют экспрессию адгезивных молекул, синтез активных липидов, цитокинов (ИЛ, ФНО и пр.), провоспалительных простогландинов, вазоактивных субстанций и способствуют стимуляции и пролиферации гломерулярных эндотелиальных, эпителиальных и мезангеальных клеток т р тт Мы з ОЖ ечинЕХ оО 4. ВЧ \ ай что ш- о М: “2 а. ‚м > © м2 на .” и в эй а | и © 5* .й а ь._-®‘ эй |] | о = ты Гы д 2. ‚№ *- «Е у в» А г аб Ус >19 (© о . д в № РУ БЕГ. > ы т 5. т <> К и «%. «р ое» : 7 И ч- 4” = ый вв а % ». ‚ Ай в ы 2 и м Ф э её ` 2% д * » я Е 5 а # — ых в ы ея “д У Е ке г # > «2 За г эк А 8. № 2 ет” ] г р и * < & т в т м т На 9 Острый постстрептококковый гломерулонефрит. Фибриноидный некроз мелкой артерии, гиалиновый цилиндр и гиперцеллюлярный клубочек. ОСТРЫЙ ПОСТСТРЕПТОКОККОВЫЙ ГЛОМЕРУЛОНЕФРИТ: СХЕМА РАЗВИТИЯ Бета-гемолизирующий стрептококк группы А Тип 12 Тип 49 Фарингит Импетиго 6 – 20 дней 14 – 28 дней ОСТРЫЙ ГЛОМЕРУЛОНЕФРИТ Остронефритический синдром (триада симптомов): 1. Отёки на лице, ногах, уменьшение диуреза; 2. Положительный мочевой синдром- гематурия, протеинурия. 3. Повышение АД, жалобы на головную боль; Гематурия при ОГН • Практически обязательный синдром ОГН в виде микрогематурии в 50-70% случаев (м.б. единственным проявлением заболевания и наблюдается длительно после острого периода) или макрогематурии у 30-50% больных • Сопровождается протеинурией, лейкоцитурией (в 50% случаев, чаще лимфоцитурией), повышение СОЭ до 20-30 мм/ч, цилиндрурией (эритроцитарные,, гранулярные, лейкоцитарные, гиалиновые, зернистые и пр.) различной степени выраженности • При макрогематурии моча мутная, обычно темно- коричневого цвета, связанная с окислением гемоглобина, иногда красного цвета «мясных помоев», обычно при щелочной реакции мочи Протеинурия при ОГН • Протеинурия неселективная характеризуется повышением клиренса средне- и высокомолекулярных белков: в составе белков мочи преобладают а2-макроглобулин, бета- липопротеиды, гамма-глобулин. Типична умеренная протеинурия — до 1-3 г/сут • Кроме плазменных белков в моче определяют белки почечного происхождения — уропротеин Тамма- Хорсфолла, секретируемый эпителием извитых канальцев. • К селективной относят протеинурию, представленную белками с низкой молекулярной массой не более 65 000 кДа, главным образом альбумином (церулоплазмин, трансферрин и др.). Канальцевая протеинурия • Канальцевая (тубулярная) протеинурия обусловлена неспособностью проксимальных канальцев реабсорбировать плазменные низкомолекулярные белки, профильтрованные в нормальных клубочках. • Характерный признак канальцевой протеинурии — преобладание бета2-микроглобулина над альбумином, а также отсутствие высокомолекулярных белков. • Канальцевую протеинурию наблюдают при поражении почечных канальцев и интерстиция: при тубулоинтерстициальном нефрите, пиелонефрите, калийпенической почке, остром канальцевом некрозе, хроническом отторжении почечного трансплантата. • Канальцевая протеинурия характерна также для многих врождённых и приобретённых тубулопатий, в частности синдрома Фанконисиндрома Фанкони. Повышение уровня антистрептококковых АТ • Характерна динамика титра этих АТ (АСЛ-О –антистрептолизин- О, антистрептогиалуронидазы, антистрептокиназы, антиникотинамидаденин-динуклеотидазу (анти-НАД) и анти- ДНКазу В (дезоксирибонуклеиновую кислоту В) оказываются положительными более чем в 95% случаев у больных с тонзилло- фарингитом и примерно в 80% при кожной инфекции • После тозилло-фарингита характерно чаще повышение уровня АСЛ-О, анти-ДНКазы В, анти-НАД и антистрепто- гиалуронидазы • После инфекции кожи- только анти-ДНКазы В и антистрепто- гиалуронидазы • Повышение титров указанных АТ наблюдается через 1 неделю после начала инфекции, достигает пика через 1 месяц и постепенно возвращается к исходному уровню в течение нескольких месяцев При трактовке данных исследования уровня АТ следует иметь в виду: * Отрицательные результаты исследования на АТ у пациентов, получавших ранее антибактериальные препараты, не должны исключать перенесенную стрептококковую инфекцию * Информативность и ценность исследования снижается при раннем начале антибактериальной терапии, подавляющей АТ — ответ Уровень АСЛ-О может оказаться заниженным или ложно отрицательным у пациентов с инфекцией кожи, так как для этих инфекции характерно повышение титров анти-ДНКазы В и антиантистрепто- гиалуронидазы Система комплемента С3 и С4 • Система комплемента состоит из 20 белков крови (глобулины), из них 9 основных (С1-С9). Вырабатываются макрофагами и клетками печени, обеспечивают иммунную реакцию в ответ на проникновение в организм антигена (бактерий, вирусов и пр.)- осуществляет фагоцитоз (захват частиц клетками) и их разрушение, участвует в воспалительных реакциях. • Существует два пути активации системы комплемента – классический и альтернативный. Независимо от того, каким образом запускается иммунная реакция, результатом активации становится образование особого белка, способного разрушать мембраны клеток с чужеродными агентами. • Для выявления нарушений в работе системы комплемента достаточно оценить содержание в крови двух её компонентов – С3 и С4. https:// Пункционная биопсия почки • Показана при сомнительном диагнозе ОГН (атипичное течение, неэффективности лечения и длительного отсутствия регресса клинической картины, а также при позднем начале болезни без четкой связи с недавно перенесенной стрептококковой инфекцией • Мочевой синдром при персистирующем более 3-х месяцев низком уровне комплемента С3 • Нефротический синдром • Прогрессирующее снижение функции почек – повышение уровня креатининаи/или снижение СКФ Дифференциальная диагностика • Мембранопролиферативный ГН (МПГН)– клиника подобная. Может после острого респираторного заболевания. Отличие – при МПГН мочевой синдром и гипокомплементемия сохраняется более 4-6 недель, возможно дальнейшее повышение кратинина крови. нет нормализации С3 и СН50, которые при ОСГН номализуются в течение 1-2 недель • IgA – нефропатия для которой характерно более короткий интервал между острым респираторным заболеванием и появлением гематурии (менее 5 дней), наличие эпизодов макрогематурии в анамнезе , а также повышение уровня IgA сыворотки крови • Вторичные ГН при системных заболеваниях- наличие системных проявлений и характерные серологические тесты. Так. при СКВ имеет место снижение С3 иС;, положительные АТ к ДНК, антинуклеарному фактору; для геморрагического васкулита не характерна гипогипокомплементемия Показания к госпитализации (решение индивидуально, вообще!!!???) • Нарушения функции почек, независимо от величины диуреза • Сохраняющая / нарастающая АГ • Сердечная недостаточность • Нефротический синдром • Пожилой возраст • Наличие других сопутствующих заболеваний, отягощающие течение Примеры формулировки диагноза: — Острый гломерулонефрит легкой формы течения, без осложнений с исходом в полное выздоровление. — Острый гломерулонефрит средней тяжести течения, осложнившийся энцефалопатией с кровоизлиянием в сетчатку глаза с исходом в затянувшийся гломерулонефрит. — Острый (постстрептококковый) гломерулонефрит тяжелого течения, осложнившийся острой почечной недостаточностью с исходом в хронический гломерулонефрит. Общие принципы лечения ОСГН • Воздействие на этиологический фактор — стрептококковую инфекцию (больные и их родственники). • Нормализация АД, уменьшение отёков. • Поддержание водно-электролитного баланса. • Лечение осложнений (энцефалопатия, гиперкалиемия, отёк лёгких, ОПН). • Иммунодепрессивная терапия — при НС и затянувшемся течении. Лечение ОСГН • Режим • Диета • Этиотропное • Патогенетическое • Симптоматическое • Лечение осложнений Иммуносупрессивная терапия • При высокоактивном течении ОГН (НС, прогрессирующая протеинурия, наличие более 30% полулуний в биоптате) проводится терапия глюкокортикостероидами (ГКС) • Для достижения эффективных концентраций ГКС в областях иммунного воспаления и отёка в почечной ткани (кровоток снижен), эффективны 2 способа введения : длительное ежедневное введение ГКС внутрь и в/в введение сверх высоких доз ГКС («пульсы»). • В зависимости от тяжести ОГН преднизолон в дозе 1 мг/(кг/сут) в течение 1- 2 мес. можно давать внутрь в 2 -3 приёма (основную часть в утренние часы, достигается лучший контроль почечного воспаления, но чаще развиваются и более выражены побочные эффекты). Поэтому, при первых клинических признаках улучшения, перевод больного с дробного на однократный приём, с последующим снижением до минимально возможной поддерживающей. • При сохраняюшейся более 2 недель НС, стабильно повышенном уровне креатинина без тенденции к дальнейшему нарастанию и нормализации) и при невозможности проведения биопсии почки рекомендуется терапия преднизолоном внутрь в дозе 1мг/кг/сут ( 2/3 дозы утром после еды и 1/3 днем) в течение 1-2 месяцев Симптоматическое лечение • Коррекция нарушений и поддержание нормального водно- электролитного баланса • Лечение отеков — основным условием является ограничение натрия и воды, т.к. развитию отёков способствуют первичная задержка жидкости при ОСГН. • Отёк лёгких, осложняющий течение остронефритического синдрома, также обусловлен задержкой натрия и воды (следствие гиперволемии), а не сердечной недостаточности. • Гипотиазид по 50 -100 мг/сут (неэффективен при значительном снижении СКФ) • Чаще, особенно при сочетании с АГ, назначают петлевые диуретики (фурасемид, торасемид и др.), которые заметно увеличивают натрийурез и фильтрацию, уменьшают задержку жидкости , уменьшают отеки и снижают АГ. • Лечение АГ. Гипотензивная препараты назначают лишь при выраженной и стойкой гипертонии, так как обычно умеренная гипертензия проходит на фоне диеты и назначения мочегонных. • Показаны БКК (как 3, так и 1 – 2 поколения), а ИАПФ и БРА назначают с осторожностью. • Лечение осложнений, например при выраженной гиперкоагуляции и активации внутрисосудистого свертывания, в том числе при НС возможно назначение антикоагулянтов (требует контроля) • С целью улучшения микроциркуляции в почках применяются антиагреганты – дипиридамол таблетки по 25 мг, покрытые пленочной оболочкой, 75 мг/сут; пентоксифиллин 100 мг/сут. Морфологические признаки ГН • Пролиферация клеток клубочков — мезангиальных, эндотелиальных и эпителиальных, • Изменения базальной мембраны капилляров клубочков, • Некроз клеток, • Склероз петель клубочка, • Изменения канальцев почек (дистрофия, атрофия), сосудов и интерстиция (склероз, клеточная инфильтрация). НА КАКИЕ ВОПРОСЫ ОТВЕЧАЕТ НЕФРОБИОПСИЯ? 1) Этиология нефропатии 2) Морфологический и иммунопатогенетический диагноз 3) Тяжесть болезни 4) Обратимость болезни 5) Ожидание эффекта от терапии 6) Активность болезни 7) Исключение других болезней 8) Определение пути к лечению Технические основы патогистологического диагноза Почечный биоптат с минимум >10, в идеале >20 клубочков! Corwin et al., Am J Nephrol 1988 Поражение почек В е р о я тн о с ть Число патологически измененных клубочков в биоптате с 10 клубочками Поражение почек В е р о я тн о с ть Число патологически измененных клубочков в биоптате с 20 клубочками Относительные противопоказания к биопсии почки — Артериальная гипертония с уровнем диастолического АД 110 мм рт. ст. и выше, — Выраженная почечная недостаточность (креатинин крови выше 0,44 ммоль/л, — Распространенный атеросклероз, — Патологическая подвижность почки, — Миеломная болезнь, — Пожилой и старческий возраст, — У женщин биопсию нельзя проводить в дни, предшествующие менструации Клеточная пролиферация Депозиты Внеклеточные структуры КЛЕТОЧНАЯ ПРОЛИФЕРАЦИЯ 1. мезангиальная 2. эндотелиальная 3. экстракапиллярная ДЕПОЗИТЫ 4. субэпителиальные 5. интрамембранозные 6. субэндотелиальные 7. «плотные депозиты» 8. мезангиальные Схематическое изображение различных изменений клубочков при гломерулонефрита Морфология гломерул при световой микроскопии Нормотензивные с гипертензией G. Keller, E. Ritz: The new England Journal of Medicine, Jan.9, 2003, V.348, N2
Микрофлора толстой кишки здорового человека
Пищеварительный тракт представляет собой открытую систему, посредством которой осуществляется контакт макроорганизма с внешней средой, в том числе и с присутствующими в ней микроорганизмами. Макроорганизм и его микрофлора находятся в состоянии динамического равновесия. Взаимодействия между макроорганизмом и заселяющими его микробными ассоциациями носят характер симбиоза, то есть оказываются полезными для обеих сторон.
На жизнедеятельность кишечной микрофлоры расходуется до 10% поступившей энергии и 20% объема принятой человеком пищи.
Биомасса микроорганизмов, заселяющих кишечник взрослого здорового человека, составляет 2,5 – 3 кг (примерно 5% от его общего веса) и включает в себя до 450 – 500 различных видов микроорганизмов.
В толстой кишке содержится около 1,5 кг различных микроорганизмов. В 1 грамме содержимого слепой кишки обнаруживают около 2 миллиардов микробных клеток (представители 17 семейств, 45 родов, 500 видов). Плотность заселения микроорганизмами увеличивается к дистальному отделу тонкой кишки, резко возрастает в толстой кишке, достигая максимальных значений на уровне ободочной кишки. Толстая кишка человека в наибольшей степени колонизирована микроорганизмами. Количество бактерий в фекалиях может достигать 5х10 12 КОЕ/г содержимого (количество образующих колонии микроорганизмов – колониеобразующих единиц — на 1 грамм фекалий). В прямой кишке плотность обсеменения составляет до 400 миллиардов бактерий на 1 грамм содержимого.
§ Состав микрофлоры толстой кишки здорового человека
Доминирующей группой, характерной для эубиоза здоровых взрослых людей, являются анаэробные бактерии, на долю которых приходится до 90-98% от общего количества микроорганизмов кишечника. К анаэробным микроорганизмам относятся микробы, способные существовать без свободного кислорода.
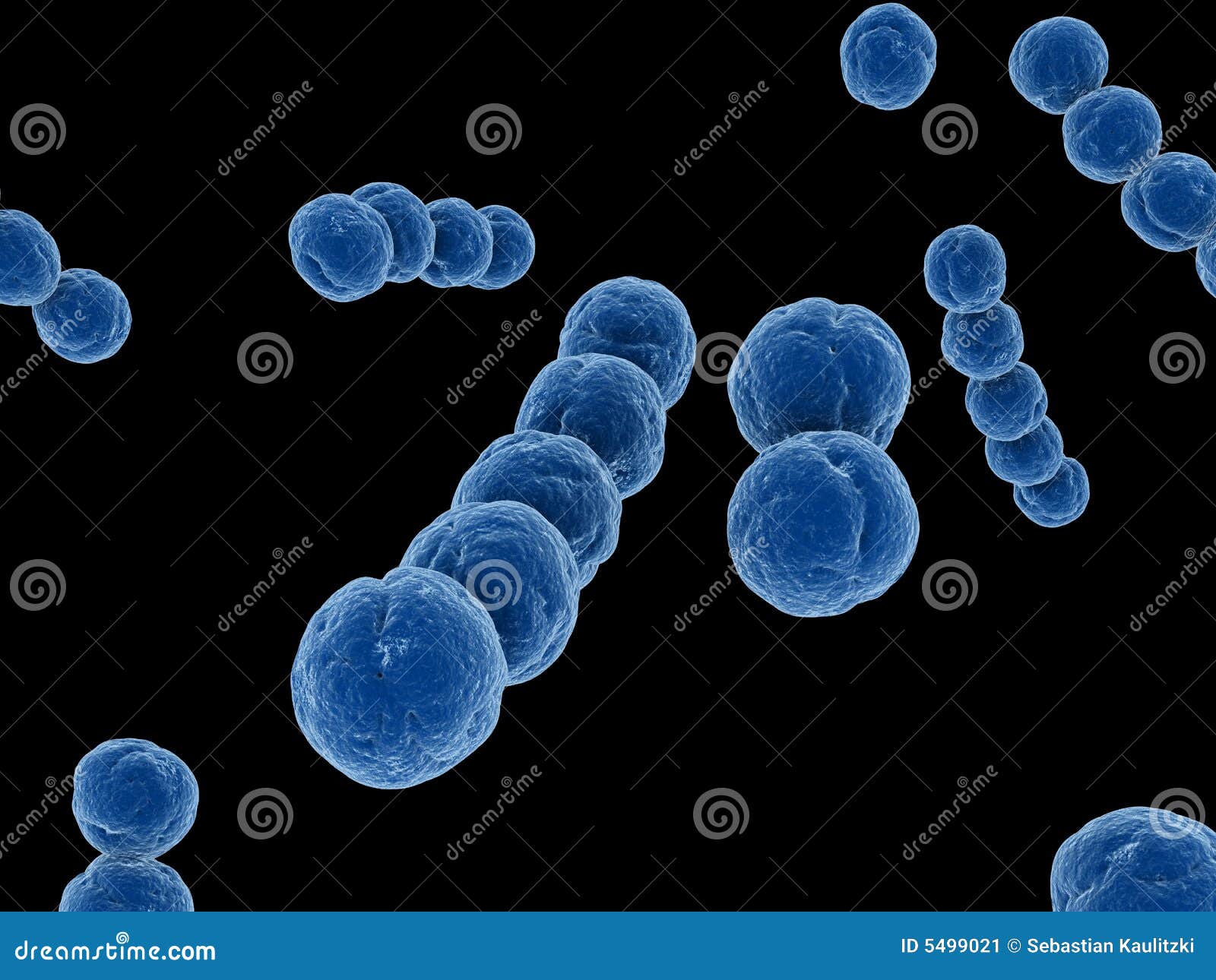
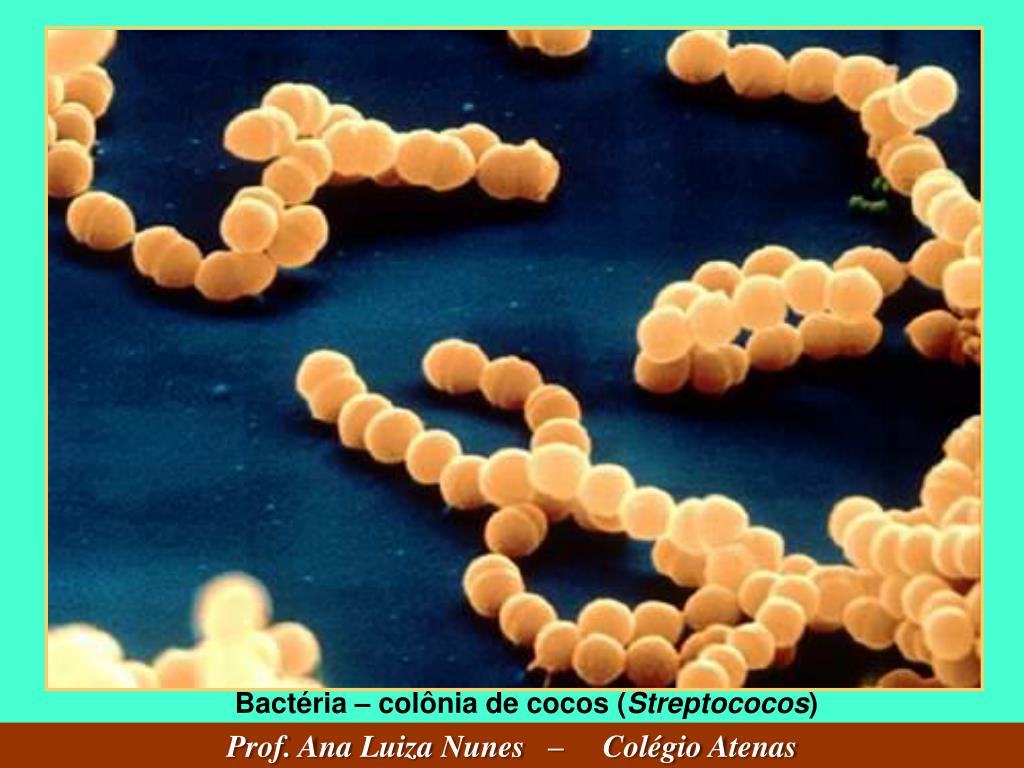
В отличие от них жизнедеятельность аэробной флоры возможна только при наличии свободного кислорода. Аэробные и условно-анаэробные бактерии, представленные кишечными палочками, стрептококками, энтерококками, составляют в сумме не более 5-10% от всей заселяющей кишечника человека аутофлоры.
Соотношение между кишечными анаэробами и аэробами в норме составляет 10:1.
1. Анаэробная микрофлора (90-98%):
a. Бифидобактерии.
b. Бактероиды.
c. Лактобактерии.
d. Фузобактерии.
e. Анаэробные кокки.
f. Вейлонеллы.
g. Клостридии.
2. Аэробная микрофлора (менее 10%):
a. Кишечная палочка.
b. Стрептококки (энтерококк, гемолизирующий стрептококк).
c. Стафилококки.
d. Клебсиеллы.
e. Кампилобактерии.
f. Серацции.
g. Энтеробактер.
h. Цитробактер.
i. Дрожжеподобные грибы.
j. Протей.
Классификация нормальной микрофлоры толстой кишки здорового человека
Нормальная микрофлора кишечника по количественным соотношениям представлена тремя основными группами:
§ Основная или облигатная микрофлора.
Обязательная для толстой кишки. Это в основном грамположительные бесспоровые анаэробы – бифидобактерии и грамотрицательные бактероиды. Составляет 90-95% микробиоценоза человека.
§ Сопутствующая микрофлора.
Представлена, в основном, аэробами – лактобактерии, кокковые формы, кишечная палочка (E.coli). В сумме эти микроорганизмы не превышают 5% микробиоценоза. Лактобактерии и E.coli являются синергистами бифидобактерий.
§ Остаточная микрофлора (условно-патогенная или факультативная микрофлора).
К этой группе относятся стафилококки, кандиды, протей, синегнойная палочка, энтеробактерии, кампилобактерии. Удельный вес этой группы в норме не превышает 1% от общего количества микроорганизмов.
При использовании в качестве критерия фактора постоянного или периодического присутствия бактерий в кишечнике микрофлору здоровых людей подразделяют на несколько видов:
§ Индигенную, или резидентную, или облигатную (бибифидобактерии, лактобактерии, кишечная палочка, бактероиды, энтерококки).
§ Факультативную, или непостоянную (стафилококки, протей, клостридии, кампилобактер, клебсиеллы, микрококки, некоторые эшерихии.).
§ Случайную, или транзиторную (синегнойная палочка, патогенные энтеробактерии).
По локализации в кишечнике микроорганизмы можно также разделить на следующие две группы, отличающиеся друг от друга по количественной и качественной характеристикам:
§ Мукоидная (мукозная) микрофлора (М-микрофлора), к которой относят микроорганизмы (преимущественно бифидобактерии и лактобактерии), тесно ассоциированная с эпителием слизистой оболочки кишечника.
§ Полостная микрофлора (П-микрофлора), представленная микроорганизмами, которые локализуются в просвете кишечника (бактероиды, вейлонеллы, энтеробактерии).
В зависимости от расщепляемых микрофлорой пищевых веществ бактерии разделяют на:
§ Протеолитические бактерии — бактероиды, протей, клостридии, кишечная палочка.
§ Сахаролитические бактерии — бифидо- и лактобактерии, энтерококки.
Множественные абсцессы у новорожденных (abscessus multiplex infantum) или псевдофурункулез Фингера (pseudofurunculosis Finger) | EUROLAB
Множественные абсцессы у новорожденных и в раннем детстве развиваются в результате проникновения инфекции в выводные протоки и клубочки эккринных потовых желез.
Этиология. Возбудителем считают золотистый стафилококк, хотя иногда высевают другие микроорганизмы (гемолизирующий стрептококк, кишечная палочка, палочка обыкновенного протея и др.).
Патогенез. Заболеванию способствуют нечистоплотное содержание детей, перегревание (слишком теплое нательное и постельное белье), редкая смена пеленок, повышенная потливость, что приводит к мацерации кожи, дистрофии, пониженное или неправильное питание, энтериты, общие инфекции. Болезнь чаще встречается у недоношенных детей и у детей с пониженной общей сопротивляемостью организма.
Клиника и течение. Если инфекция захватывает только отверстие выводного протока потовой железы, то образуются небольшие (величиной с просяное зерно) поверхностные пустулы (перипорит), быстро ссыхающиеся в корочки и заживающие без следа. Однако значительно чаще оказываются пораженными весь проток и клубочки потовой железы. В этих случаях образуются многочисленные узлы, плотные, резко отграниченные, красно-синеватого цвета, величиной с горошину, которые вскоре достигают величины лесного ореха. Довольно быстро узлы размягчаются в центре; кожа здесь истончается, пальпируется флюктуация. Узлы вскрываются с выделением полужидкого гнойного содержимого с примесью крови. Процесс заканчивается рубцеванием. Чаще всего множественные абсцессы возникают на местах соприкосновения тела с постелью (область затылка, спины, ягодиц, бедер). При генерализации, когда образуется несколько десятков узлов, процесс может захватывать кожу груди, живота. Обычно общее состояние детей удовлетворительное, температура повышается редко. Однако у истощенных детей могут наступать осложнения: флегмона, воспаление среднего уха, поражение печени и селезенки и даже сепсис с летальным исходом. В этих случаях высыпания появляются приступообразно, сопровождаясь повышением температуры, лейкоцитозом, повышением СОЭ, язвочки долго не рубцуются.
Диагноз. Основывается на обнаружении у грудных детей флюктуирующих узлов без признаков острого воспаления. Фурункулез у детей этого возраста бывает редко, характеризуется небольшим количеством высыпаний, признаками острого воспаления и наличием некротического стержня. Перипорит следует дифференцировать с фолликулитами, при которых всегда имеется связь с волосяным фолликулом и в центре пустулы часто виден волос. Кроме того, фолликулиты, как и фурункулы, образуются у детей более старшего возраста. Начинающиеся множественные абсцессы у детей могут несколько напоминать начальную стадию развития множественного папуленкротического туберкулеза при его локализации на волосистой части головы и коже туловища до образования творожистого некроза. Учитывают наличие проявлений туберкулеза в других органах и динамику реакции Пирке. Реже приходится проводить дифференциацию со скрофулодермой, которая чаще является одиночным поражением, быстро приводящим к расплавлению и вскрытию центрального участка с образованием медленно гранулирующей язвы со скудным серозным отделяемым.
Streptococcus — обзор | Темы ScienceDirect
Стрептококки представляют собой кокковидные бактериальные клетки, микроскопически окрашиваемые в пурпурный (грамположительный) цвет при применении метода окрашивания по Граму. Они неподвижны и не образуют спор. Эти кокки имеют диаметр от 0,5 до 2 мкм. Как клеточное деление Streptococcus spp. происходит вдоль одной оси или плоскости, эти бактерии растут парами или цепочками. После 18–24 ч инкубации при 35–37 ° C на кровяном агаре обычно появляются серовато-белые, гладкие, глянцевые и полупрозрачные колонии с зонами α / β-гемолиза или без гемолиза.α-Гемолиз, продуцируемый многими видами Streptococcus , характеризуется частичным разрушением красных кровяных телец (эритроцитов) в среде и рассматривается как зеленая зона, окружающая колонию, в результате пигментации гемоглобина внутри эритроцитов. Хотя термин α-гемолиз все еще используется для обозначения этого явления, это свойство связано с окислением железа в молекулах гемоглобина (восстановление до метгемоглобина), а не с лизисом эритроцитов. Streptococcus pyogenes или GAS образует обреченные, круглые и целые точечные колонии, которые демонстрируют полный гемолиз, на что указывает прозрачная зона, окружающая колонию, в несколько раз превышающую диаметр самой колонии.Некоторые штаммы могут образовывать слизистые колонии (рис. 1). Streptococcus pyogenes — это микроорганизмы сферической или яйцевидной формы размером до 1 мкм в диаметре. GBS или Колонии S. agalactiae могут быть плоскими, серовато-белыми или оранжевыми, слизистыми и кремовыми. При инкубации в аэробных условиях эта группа стрептококков может вызвать менее очевидный β-гемолиз, также известный как α-первичный гемолиз, который представлен небольшой зоной чистого гемолиза, окруженной областью частичного лизиса на кровяном агаре. Колонии некоторых β-гемолитических ГКС, например S.equi крупнее и более слизистые, чем у большинства классических стрептококков . Кроме того, человеческий вариант S. dysgalactiae subsp. equisimilis известен как тип больших колоний группы C, который разделяет ряд фенотипических характеристик с S . pyogenes , а также S. agalactiae . Однако эти бактерии обычно обнаруживаются как негемолитические in vitro . GDS обычно образуют альфа- или негемолитические колонии диаметром 1-2 мм.Стрептококки группы Viridans (VGS) образуют крошечные α-гемолитические колонии на кровяном агаре. Хотя S. mutans обычно обнаруживается как α- или γ-гемолитический, также были идентифицированы некоторые β-гемолитические штаммы. Колонии Streptococcus pneumoniae (также известные как пневмококки) имеют круглую форму со сплошными краями, часто приподнятые с вдавленными центрами. Эти α-гемолитические колонии обычно являются слизистыми при первичной изоляции. Клетки подвергаются автолизу при длительной инкубации, и центр колонии имеет тенденцию исчезать.Сильно инкапсулированные пневмококки могут иметь более крупные колонии (несколько миллиметров в диаметре), чем менее инкапсулированные штаммы. Поскольку эти бактерии часто рассматриваются как пары кокков, они считаются диплококками. Тем не менее, некоторые штаммы S. pneumoniae также могут наблюдаться как одиночные кокки или короткие цепочки. Большинство стрептококков обычно имеют жесткую клеточную стенку с типичным грамположительным пептидогликановым слоем, внутреннюю плазматическую мембрану с мезосомными везикулами, цитоплазматические рибосомы и нуклеоид.Некоторые штаммы, включая S. pneumoniae и S. pyogenes , содержат полисахаридную капсулу, состоящую из гиалуроновой кислоты (НА). Клеточная стенка S. pyogenes содержит группоспецифичный С-полисахарид и два основных класса типоспецифичных белков, М и Т-антигены. Минорные классы типоспецифичных белков включают F, R и M-подобные или M-ассоциированные белковые антигены. Многие виды стрептококков могут иногда иметь структуры, подобные ворсинкам или фимбриям, выступающие с поверхности бактерий, такие как фимбрии, содержащие белок М размером S.pyogenes (рисунок 2). Эти структуры, как известно, способствуют колонизации эпителия и играют особую роль в вирулентности. Для дальнейшего обсуждения этой темы см. Раздел «Стрептококковые токсины и другие факторы вирулентности в патогенезе».
Рисунок 1. β-Гемолиз, продуцируемый колониями S. pyogenes на кровяном агаре.
Рис. 2. Электронная микрофотография S. pyogenes с фимбриями, окружающими клеточную стенку.
Streptococcus — обзор | Темы ScienceDirect
Стрептококки представляют собой кокковидные бактериальные клетки, микроскопически окрашиваемые в пурпурный (грамположительный) цвет при применении метода окрашивания по Граму.Они неподвижны и не образуют спор. Эти кокки имеют диаметр от 0,5 до 2 мкм. Как клеточное деление Streptococcus spp. происходит вдоль одной оси или плоскости, эти бактерии растут парами или цепочками. После 18–24 ч инкубации при 35–37 ° C на кровяном агаре обычно появляются серовато-белые, гладкие, глянцевые и полупрозрачные колонии с зонами α / β-гемолиза или без гемолиза. α-Гемолиз, продуцируемый многими видами Streptococcus , характеризуется частичным разрушением красных кровяных телец (эритроцитов) в среде и рассматривается как зеленая зона, окружающая колонию, в результате пигментации гемоглобина внутри эритроцитов.Хотя термин α-гемолиз все еще используется для обозначения этого явления, это свойство связано с окислением железа в молекулах гемоглобина (восстановление до метгемоглобина), а не с лизисом эритроцитов. Streptococcus pyogenes или GAS образует обреченные, круглые и целые точечные колонии, которые демонстрируют полный гемолиз, на что указывает прозрачная зона, окружающая колонию, в несколько раз превышающую диаметр самой колонии. Некоторые штаммы могут образовывать слизистые колонии (рис. 1). Streptococcus pyogenes — это микроорганизмы сферической или яйцевидной формы размером до 1 мкм в диаметре.GBS или Колонии S. agalactiae могут быть плоскими, серовато-белыми или оранжевыми, слизистыми и кремовыми. При инкубации в аэробных условиях эта группа стрептококков может вызвать менее очевидный β-гемолиз, также известный как α-первичный гемолиз, который представлен небольшой зоной чистого гемолиза, окруженной областью частичного лизиса на кровяном агаре. Колонии некоторых β-гемолитических ГКС, таких как S. equi , больше и более слизистые, чем колонии большинства классических Streptococcus . Также человеческий вариант S.dysgalactiae subsp. equisimilis известен как тип больших колоний группы C, который разделяет ряд фенотипических характеристик с S . pyogenes , а также S. agalactiae . Однако эти бактерии обычно обнаруживаются как негемолитические in vitro . GDS обычно образуют альфа- или негемолитические колонии диаметром 1-2 мм. Стрептококки группы Viridans (VGS) образуют крошечные α-гемолитические колонии на кровяном агаре. Хотя S. mutans обычно обнаруживается как α- или γ-гемолитический, также были идентифицированы некоторые β-гемолитические штаммы. Колонии Streptococcus pneumoniae (также известные как пневмококки) имеют круглую форму со сплошными краями, часто приподнятые с вдавленными центрами. Эти α-гемолитические колонии обычно являются слизистыми при первичной изоляции. Клетки подвергаются автолизу при длительной инкубации, и центр колонии имеет тенденцию исчезать. Сильно инкапсулированные пневмококки могут иметь более крупные колонии (несколько миллиметров в диаметре), чем менее инкапсулированные штаммы. Поскольку эти бактерии часто рассматриваются как пары кокков, они считаются диплококками.Тем не менее, некоторые штаммы S. pneumoniae также могут наблюдаться как одиночные кокки или короткие цепочки. Большинство стрептококков обычно имеют жесткую клеточную стенку с типичным грамположительным пептидогликановым слоем, внутреннюю плазматическую мембрану с мезосомными везикулами, цитоплазматические рибосомы и нуклеоид. Некоторые штаммы, включая S. pneumoniae и S. pyogenes , содержат полисахаридную капсулу, состоящую из гиалуроновой кислоты (НА). Клеточная стенка S. pyogenes содержит группоспецифичный С-полисахарид и два основных класса типоспецифичных белков, М и Т-антигены.Минорные классы типоспецифичных белков включают F, R и M-подобные или M-ассоциированные белковые антигены. Многие виды стрептококков могут иногда иметь структуры, подобные ворсинкам или фимбриям, выступающие с поверхности бактерий, например, содержащие белок М фимбрии S. pyogenes (рис. 2). Эти структуры, как известно, способствуют колонизации эпителия и играют особую роль в вирулентности. Для дальнейшего обсуждения этой темы см. Раздел «Стрептококковые токсины и другие факторы вирулентности в патогенезе».
Рисунок 1. β-Гемолиз, продуцируемый колониями S. pyogenes на кровяном агаре.
Рис. 2. Электронная микрофотография S. pyogenes с фимбриями, окружающими клеточную стенку.
Гемолиз стрептококков и его типы с примерами
Гемолиз — это разрушение красных кровяных телец (эритроцитов). Вещество, вызывающее гемолиз, — гемолизин. Браун (1919) ввел три термина альфа, бета и гамма для обозначения трех типов стрептококков на основе гемолитических реакций, наблюдаемых на чашках с кровяным агаром .
Бета-гемолитические стрептококки
Бета-гемолиз (β-гемолиз) связан с полным лизисом эритроцитов, окружающих колонию. Бета-гемолиз вызывается двумя гемолизинами O и S; первый неактивен в присутствии кислорода. Таким образом, укол пластины увеличивает интенсивность реакции гемолиза. S — кислород-стабильный цитотоксин.
Имеет широкую зону (2-4 мм шириной). Бета-гемолиз более выражен при анаэробной инкубации планшета.Обычно они являются комменсалами горла и вызывают оппортунистические инфекции.
Примеры: Streptococcus pyogenes , или бета-гемолитический стрептококк группы А.
Слабо-бета-гемолитические виды: Streptococcus agalactiae, Clostridium perfringens, Listeria monocytogenes
Альфа-гемолитические стрептококки
Альфа-гемолиз (α-гемолиз) уменьшение красного цвета является частичным или «зеленым». клеточный гемоглобин.Альфа-гемолиз вызывается перекисью водорода, вырабатываемой бактериями, окисляющей гемоглобин до зеленого метгемоглобина.
Обнаружен неполный гемолиз шириной 1-2 мм. Сохранение некоторых негемолизированных эритроцитов можно увидеть микроскопически.
Примеры: Streptococcus pneumoniae и группа оральных стрептококков ( Streptococcus viridans или viridans streptococci)
Гамма-гемолитические (негемолитические) стрептококки, типичные для стрептококков
, а также типичные для них бета-гемолитические стрептококки
.Однако может наблюдаться небольшое изменение цвета среды. Стрептококки, входящие в эту группу, обычно не являются патогенными.
Примеры: Enterococcus faecalis (ранее называвшаяся «Стрепка группы D»)
Чашки с кровяным агаром | Резюме биохимических тестов | Дополнительная информация | Molb 2021
Шаблоны гемолиза
Это дифференциальная среда. Это богатая и сложная среда, содержащая 5% эритроцитов барана. BAP проверяет способность организма производить гемолизины, ферменты, которые повреждают / лизируют красные кровяные тельца (эритроциты).Степень гемолиза этими гемолизинами помогает дифференцировать представителей родов Staphylococcus , Streptococcus и Enterococcus .
Бета-гемолиз — полный гемолиз. Для него характерна четкая (прозрачная) зона, окружающая колонии. Staphylococcus aureus , Streptococcus pyogenes и Streptococcus agalactiae являются b-гемолитическими (на рисунке справа внизу показан бета-гемолиз пиогенов ).
Частичный гемолиз называется альфа-гемолизом. Колонии обычно окружены зеленой непрозрачной зоной. Streptococcus pneumoniae и Streptococcus mitis являются а-гемолитическими (на рисунке в центре ниже показан а-гемолиз S. mitis ).
Если гемолиза не происходит, это называется гамма-гемолизом. Вокруг колоний нет заметных зон. Staphylococcus epidermidis является гамма-гемолитическим.
| Гамма-гемолиз | Альфа-гемолиз | Бета-гемолиз |
Часто при посеве БАТ для наблюдения за паттернами гемолиза исследователи также несколько раз протыкают агар с помощью посевной петли. Этот укол позволяет обнаруживать стрептолизин О, специфический гемолизин, продуцируемый Streptococcus pyogenes .Этот гемолизин инактивируется O 2 и виден только под поверхностью (в анаэробной среде) вокруг метки укола. Обратите внимание на овальные области просвета вокруг отметин на картинке ниже; они вызваны стрептолизином O.
Производство перекиси водорода Streptococcus pneumoniae приводит к альфа-гемолизу за счет окисления оксигемоглобина до метгемоглобина
Abstract
Streptococcus pneumoniae (Spn) и другие стрептококки образуют зеленоватый ореол на пластинах кровяного агара. α-гемолиз.Этот фенотип используется лабораториями клинической микробиологии для сообщения результатов культивирования α-гемолитических стрептококков, включая Spn, и других бактерий. Ореол α-гемолиза на пластинах с кровяным агаром был связан с гемолитической активностью пневмококкового пневмолизина (Ply) или, в меньшей степени, с лизисом эритроцитов перекисью водорода, продуцируемой Spn. Мы исследовали молекулярную основу гало α-гемолиза, производимого Spn. Штаммы дикого типа TIGR4, D39, R6 и EF3030 и мутанты изогенного производного Δ ply продуцировали аналогичный α-гемолитический ореол на чашках с кровяным агаром, в то время как в культурах с нокаутом перекиси водорода Δ spxB / Δ отсутствовали мутанты lctO . это характерный ореол.Спектроскопические исследования показали, что супернатанты культур TIGR4 высвобождали связанный с гемоглобином гем (гем-гемоглобин) из эритроцитов и окисляли оксигемоглобин до метгемоглобина в течение 30 минут инкубации. Как и ожидалось, учитывая гемолитическую активность Ply и то, что перекись водорода способствует высвобождению Ply, изогенные мутанты TIGR4 Δ ply и Δ spxB / Δ lctO имели значительно сниженное высвобождение гемогемоглобина из эритроцитов. Однако TIGR4Δ ply , который производит перекись водорода, окисляет оксигемоглобин до метгемоглобина, тогда как TIGR4Δ spxB / Δ lctO не вызывает окисления оксигемоглобина.Мы продемонстрировали, что так называемый ореол α-гемолиза вызван окислением оксигемоглобина (Fe +2 ) до не связывающего кислород мет-гемоглобина (Fe +3 ) производимой Spn перекисью водорода. Поскольку Spn колонизирует легкие человека, окисление оксигемоглобина может иметь важные последствия для патогенеза.
Важность Существует заблуждение, что α-гемолиз, наблюдаемый на чашках с кровяным агаром, культурами Streptococcus pneumoniae (Spn) и других α-гемолитических стрептококков продуцируется гемолизином или, альтернативно, лизисом эритроцитов под действием водорода. перекисью.В ходе наших исследований мы заметили, что штаммы Spn дикого типа и нокаут-мутанты гемолизина (например, пневмолизина) продуцируют α-гемолитический ореол на чашках с кровяным агаром. Напротив, дефектные по перекиси водорода мутанты, полученные из четырех различных штаммов, не обладали характерным ореолом α-гемолиза. Мы также продемонстрировали, что штаммы дикого типа и мутанты пневмолизина окисляли оксигемоглобин до метгемоглобина. Мутанты с нокаутом перекиси водорода, однако, не смогли окислить оксигемоглобин. Следовательно, зеленоватый ореол, образующийся на культурах Spn и других так называемых α-гемолитических стрептококков, вызван окислением оксигемоглобина, продуцируемого перекисью водорода.Окисление оксигемоглобина до не связывающей кислородной формы, метгемоглобина, может происходить в легких во время пневмококковой пневмонии.
(PDF) Стрептококковый гемолиз
СПИСОК ЛИТЕРАТУРЫ
1. Баннэтин, Р. М., и А. Робсон. 1974. Бактериемия, вызванная атипичными стрептококками
, принадлежащими к группе А по Лэнсфилду, Сообщение о двух случаях. Являюсь. J. Clin. Дорожка. 61: 358-360.
2. Браун, Дж. Х. 1919. Использование кровяного агара для исследования стрептококков. Нью-Йорк
Rockefeller Inst.Med. Res. Монография № 9
3. Коулбрук, Л., С. Д. Эллиотт, В. Р. Макстед, К. В. Морли и М. Мортелл. 1942.
Заражение негемолитическими стрептококками группы А. Ланцет 1: 30-32.
4. Кук Г. Т. и У. Х. Х. Джебб. 1952. Выделение β-гемолитических стрептококков из
мазков из носа и горла с помощью аэробной и анаэробной инкубации. Bull Ministry Hlth. Паб.
Hlth Lab. Серв. 11: 18-21.
5. Драпкин, М. С., А. В. Карчмер, Р. К. Меллеринг.1976. Бактериемические
инфекции, вызванные устойчивыми к клиндамицину стрептококками. Варенье. Med. Доц. 236: 263-265.
6. Дункан, Дж. Л. 1983. Рост стрептококков и выработка токсинов in vivo. Инфек.
Иммун. 40: 501-505.
7. Факлам Р. Р., Дж. Ф. Падула, Э. К. Уортэм, Р. К. Кукси и Х. А.
Раундтри. 1979. Предположительная идентификация стрептококков групп A, B и D на агаровой среде
. J. Clin. Microbiol. 9: 665-672.
8.Facklam. Р. Р. и Дж. А. Вашингтон. 1991. Стрептококк и родственная каталаза —
отрицательных грамположительных кокков. п. 238-257. В A. Balows, W. J. Hausler, K. L.
Herrmann, H. D. Isenberg и H. J. Shadomy (ed.). Руководство по клинической микробиологии,
5 изд. Американское общество микробиологии, Вашингтон, округ Колумбия
9. Феллер А. Э. и Д. А. Стивенс. 1952. Агар с овечьей кровью для выделения
групп бета-гемолитических стрептококков Лэнсфилда.J. Lab. Clin. Med. 39: 484-491.
10. Фрай Р. М. 1933. Анаэробные методы идентификации гемолических стрептококков
. J. Path. Бакт. 37: 337-440.
350
351
352
353
354
355
356
357
358
359
360
361
362
361
362
361 366
367
368
369
370
371
372
373
374
Обзор методов обнаружения, идентификации, дифференциации и культивирования
Стрептококки, не являющиеся ареалококками сферические бактерии (кокки).Они часто встречаются в виде цепочек или пар и являются факультативными или строгими анаэробами. Стрептококки дают отрицательный тест на каталазу, тогда как стафилококки дают положительный результат на каталазу. Клеточное деление видов Streptococci включает два отдельных биосинтетических процесса: удлинение периферической клеточной стенки и синтез стенки перегородки. 1 Поскольку они не могут синтезировать цитохромы, Streptococci не могут осуществлять окислительное фосфорилирование. Они способны сбраживать сахар, но конечным продуктом всегда является молочная кислота.Таким образом, стрептококки очень кислотоустойчивы и относятся к группе молочнокислых бактерий.
Существует множество природных источников Streptococci , включая людей и различных животных, где они часто колонизируют слизистые оболочки рта, кишечника, носовых ходов и глотки. Присутствие Streptococci в питьевой воде указывает на фекальное загрязнение. Источники пищи с высоким риском заражения стрептококком включают молоко и молочные продукты, яйца, вареный лобстер, фарш, картофельный салат, заварной крем, рисовый пудинг и салат из креветок.В большинстве случаев пищевого отравления, вызванного стрептококковой инфекцией, пищу оставляли стоять при комнатной температуре в течение нескольких часов между приготовлением и употреблением. Загрязнение пищевых продуктов чаще всего является результатом плохой гигиены, обращения с пищевыми продуктами инфицированными людьми или использования сырого (непастеризованного) молока. Хотя они могут быть сильными патогенами, некоторые стрептококки имеют коммерческое значение для производства сыра и йогурта. К ним относятся S. lactis, S. cremoris, S. diacelillactis и S.thermophilus, последний является наиболее известным.
Для обнаружения, идентификации, дифференциации, подсчета и культивирования Streptococci мы предлагаем широкий спектр специфических агаров и бульонов (, таблица 1, ), стрептококков, диагностических тестов, (, таблица 2, ), а также набор для окрашивания по Граму и компонентные растворы ( Таблица 3 ).
.
