✚ Функции нейтрофилов ( по материалам статьи Mayadas T, Cullere X., Lowell C. The Multifaceted Functions of Neutrophils. Annu Rev Pathol. 2014; 9: 181–218). Нейропсихиатрическая клиника профессора Минутко. Статья №8148
Центральное место в функционалшьной активности нейтрофилов играет их способность появляться в очаге инфекции, распознавать и фагоцитировать микробы, а затем уничтожать патогенные микроорганизмы с помощью комбинации цитотоксических механизмов. К ним относятся производство активных форм кислорода, выделение антимикробных пептидов и недавно обнаруженное вытеснение их ядерного содержимого с образованием внеклеточных ловушек нейтрофилов. По — видимому, взаимодействия между нейтрофилами и адаптивными иммунными клетками устанавливают механизм прямой связи, который усиливает патологическое воспаление.
Многоклеточные организмы сталкиваются с постоянной проблемой выживания в среде, содержащей одноклеточные патогены. Фагоциты превратились в специализированные клетки, которые поглощают и убивают вторгающиеся в организм патогены, чтобы защитить хозяина от микроорганизмов. Они являются основным клеточным звеном врожденной иммунной системы, которая является общей для всех видов эволюционного дерева. Действительно, выживание примитивных организмов, например насекомых, у которых отсутствуют адаптивные иммунные клетки, такие как лимфоциты, зависит от функции их врожденных иммунных фагоцитов. У людей нейтрофилы составляют от 50% до 70% всех циркулирующих лейкоцитов, и они являются первой линией защиты организма от широкого спектра инфекционных патогенов, включая бактерии, грибы и простейшие. Нейтрофилы генерируются в количестве 10 11 в день, который может увеличиться до 10 12 в день при бактериальной инфекции. Таким образом, неудивительно, что от 55% до 60% костного мозга направляется на их производство. Нейтрофилы окончательно дифференцированые клетки. Традиционные оценки, основанные на выживании ex vivo в культуре или в периоде полураспада после адаптивного переноса, показали, что эти клетки выживают только в течение 8–12 ч в кровообращении и до 1–2 дней в тканях, причем их оборот замедляется или ускоряется во время воспалительного ответа.
Они являются основным клеточным звеном врожденной иммунной системы, которая является общей для всех видов эволюционного дерева. Действительно, выживание примитивных организмов, например насекомых, у которых отсутствуют адаптивные иммунные клетки, такие как лимфоциты, зависит от функции их врожденных иммунных фагоцитов. У людей нейтрофилы составляют от 50% до 70% всех циркулирующих лейкоцитов, и они являются первой линией защиты организма от широкого спектра инфекционных патогенов, включая бактерии, грибы и простейшие. Нейтрофилы генерируются в количестве 10 11 в день, который может увеличиться до 10 12 в день при бактериальной инфекции. Таким образом, неудивительно, что от 55% до 60% костного мозга направляется на их производство. Нейтрофилы окончательно дифференцированые клетки. Традиционные оценки, основанные на выживании ex vivo в культуре или в периоде полураспада после адаптивного переноса, показали, что эти клетки выживают только в течение 8–12 ч в кровообращении и до 1–2 дней в тканях, причем их оборот замедляется или ускоряется во время воспалительного ответа.
Нейтрофилы образуются в костном мозге во время кроветворения в ответ на несколько цитокинов, главным образом, колониестимулирующего фактора гранулоцитов (G-CSF). Основными детерминантами общего количества нейтрофилов в организме являются скорость их выработки, их накопление и выход из костного мозга, а также их выживание и выведение из крови. Проникновение в ткани во время воспалительных реакций также может влиять на общее количество нейтрофилов.
Одна такая петля обратной связи была обнаружена в исследованиях на мышах с дефицитом адгезии [CD18, E / P / L-селектин или CD11a (LFA-1)]. У этих животных выход нейтрофилов из периферической крови снижен; следовательно, у животных проявляется значительная нейтрофилия. В постоянных условиях стареющие нейтрофилы поглощаются тканевыми макрофагами (главным образом в печени, селезенке и костном мозге ), которые затем инициируют противовоспалительные сигналы посредством экспрессии PPARγ (рецептор γ, активируемый пролифератором пероксисом γ) и LXR (печень X рецептор).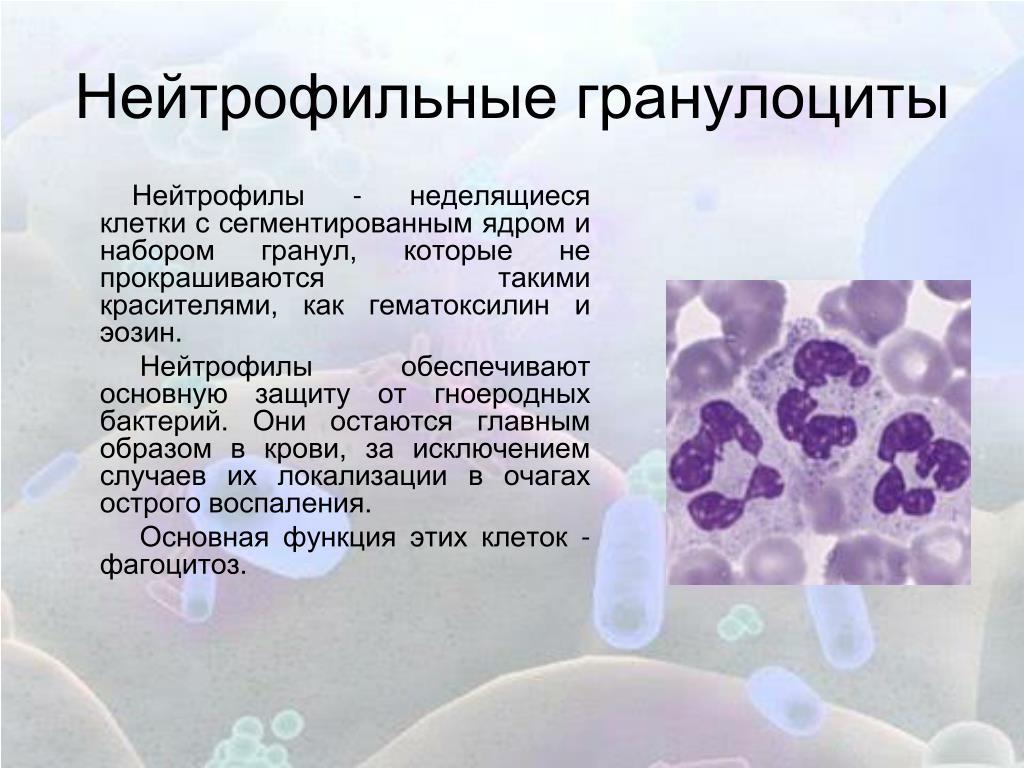

Петля обратной связи IL-23-IL-17-G-CSF, очевидно, не является единственным механизмом, контролирующим выработку нейтрофилов, учитывая, что у мышей, у которых отсутствуют Т-лимфоциты и NK-клетки (т.е. основные источники IL-17), нормальное количество нейтрофилов . Кроме того, опосредуемое антителами истощение нейтрофилов у мышей посредством использования моноклонального антитела Gr-1 приводит к значительному увеличению сывороточных GM-CSF и G-CSF, что в отсутствие других воспалительных цитокинов вызывает пролиферацию нейтрофильных предшественников. Это наблюдение предполагает, что количество нейтрофилов регулируется, по крайней мере частично, просто в соответствии с доступным пространством в костном мозге, способом, называемым зависимым от плотности или измерением нейтрофильной массы. Молекулярное понимание того, как строма костного мозга, которая является основным участком производства G-CSF, может определять низкое количество нейтрофилов, остается неясным. Однако, очень недавние результаты показывают, что этот путь восприятия зависит от врожденного иммунного рецептора Toll-подобного рецептора (TLR) 4 и его сигнального адаптера, содержащего домен Toll / интерлейкина-1 (TIR), содержащий адаптер-индуцирующий интерферон-β (TRIF), поскольку опосредованное антителами истощение нейтрофилов не может вызвать повышение G-CSF или пролиферацию предшественников у мышей, лишенных TLR4 или TRIF.
Большинство исследований было сосредоточено на G-CSF и GM-CSF как на конечных цитокинах, которые регулируют выработку нейтрофилов, но это явно слишком простая точка зрения, учитывая, что мыши, лишенные одного или обоих этих цитокинов, все еще имеют приблизительно 20% от нормального уровня зрелые нейтрофилы в крови . Действительно, эти цитокино-дефицитные животные могут также увеличивать выработку нейтрофилов в ответ на воспалительные раздражители, процесс, называемый экстренным гранулопоэзом. Тот факт, что гематопоэтические предшественники могут увеличивать выработку гранулоцитов в ответ на воспалительные или патогенные заражения, даже в отсутствие канонических гранулопоэз-стимулирующих цитокинов, указывает на то, что для регуляции гранулопоэза должны существовать другие сигнальные пути. Новые исследования ясно демонстрируют, что гематопоэтические клетки-предшественники пролиферируют при восприятии молекул патогенных микроорганизмов через множество врожденных иммунных рецепторов, таких как TLR и Nod-подобные рецепторы.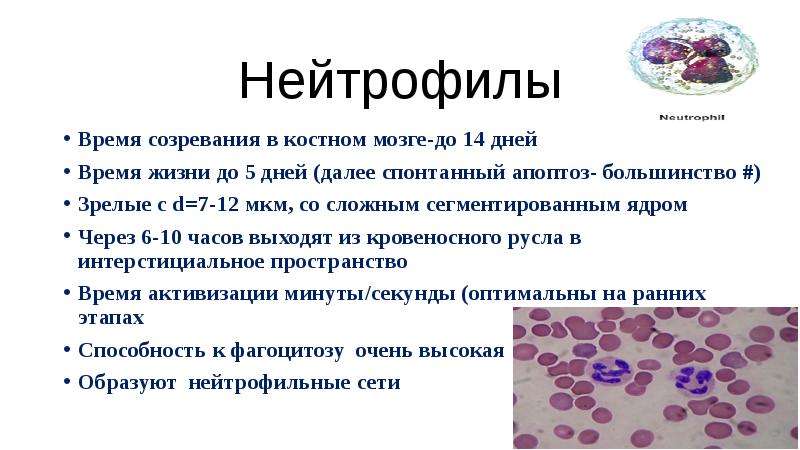
В конце концов, на гомеостаз нейтрофилов, вероятно, влияют все эти процессы — поглощение фагоцитов на периферии, клеточная масса в костном мозге и присутствие патогенных (или комменсальных) стимулов — в комплексе. При любом условии, один путь может доминировать над другими, но четкое понимание регуляции числа нейтрофилов (особенно во время болезненных состояний) потребует дальнейших исследований.
При любом условии, один путь может доминировать над другими, но четкое понимание регуляции числа нейтрофилов (особенно во время болезненных состояний) потребует дальнейших исследований.
После рождения в костном мозге зрелые нейтрофилы попадают в места воспаления или инфекции тканей через сосудистую сеть. Выход нейтрофилов из крови, главным образом через посткапиллярные венулы, следует упорядоченному процессу, называемому рекрутированием нейтрофилов. Каскад рекрутирования нейтрофилов опосредуется последовательным взаимодействием рецепторов, присутствующих на нейтрофилах, с лигандами, индуцированными на поверхности активированного (т.е. воспаленного) эндотелия. Классический многоступенчатый каскад адгезии состоит из следующих этапов: ( а ) первоначальное прикрепление нейтрофилов к эндотелию («захват»), ( б ) прохождение нейтрофилов вдоль эндотелия, ( с) надежный «арест» нейтрофилов с сопутствующим распространением клеток, ( г ) «ползание» нейтрофилов вдоль эндотелия и ( д ) трансмиграция нейтрофилов в ткани , где полная активация нейтрофилов приводит к фагоцитозу и уничтожению патогенов через производство активных форм кислорода (ROS), дегрануляции и генерации внеклеточных ловушек нейтрофилов (NET)..jpg) Однако при аутоиммунных заболеваниях необходимо учитывать вклад компонентов гуморального иммунитета, включая иммунные комплексы и продукты активации комплемента. Рецепторы Fcγ (FcγRs), которые являются рецепторами иммунных комплексов иммуноглобулина (Ig) G, являются тому примером. В моделях антителопосредованного гломерулонефрита и артрита у мышей, у которых отсутствует активирующий FcγR, не наблюдается накопления нейтрофилов. Однако рекрутирование ткани восстанавливается путем селективной экспрессии человеческого FcγRIIA и / или FcγRIIIB на нейтрофилах. Иммунные комплексы IgG также могут запускать активацию комплемента, что приводит к выработке компонента комплемента 5а (С5а), мощного хемоаттрактанта нейтрофилов. C5a снижает порог FcγR-опосредованной активации нейтрофилов и увеличивает активность антигена макрофаг-1 (Mac-1) [рецептор комплемента (CR) 3], который может потенциально влиять на накопление нейтрофилов. Таким образом, в присутствии иммунных комплексов принципы рекрутирования нейтрофилов (т.
Однако при аутоиммунных заболеваниях необходимо учитывать вклад компонентов гуморального иммунитета, включая иммунные комплексы и продукты активации комплемента. Рецепторы Fcγ (FcγRs), которые являются рецепторами иммунных комплексов иммуноглобулина (Ig) G, являются тому примером. В моделях антителопосредованного гломерулонефрита и артрита у мышей, у которых отсутствует активирующий FcγR, не наблюдается накопления нейтрофилов. Однако рекрутирование ткани восстанавливается путем селективной экспрессии человеческого FcγRIIA и / или FcγRIIIB на нейтрофилах. Иммунные комплексы IgG также могут запускать активацию комплемента, что приводит к выработке компонента комплемента 5а (С5а), мощного хемоаттрактанта нейтрофилов. C5a снижает порог FcγR-опосредованной активации нейтрофилов и увеличивает активность антигена макрофаг-1 (Mac-1) [рецептор комплемента (CR) 3], который может потенциально влиять на накопление нейтрофилов. Таким образом, в присутствии иммунных комплексов принципы рекрутирования нейтрофилов (т.
Нейтрофилы уникальны среди лейкоцитов по своей способности катиться по эндотелию сосудов при значительно высоком напряжении сдвига (то есть в более крупных сосудах с более высоким кровяным давлением). Эта способность, вероятно, развивалась, чтобы позволить рекрутирование нейтрофилов происходить в более широком диапазоне областей ткани. Большинство лейкоцитов катятся по посткапиллярным венулам при напряжениях сдвига 0–3 дин / см 2 , тогда как нейтрофилы могут катиться по сосудам при напряжениях сдвига 6–10 дин / см. 2
Нейтрофилы достигают этой устойчивости к сдвиговому усилию жидкости с помощью четырех механизмов: ( a ) выравнивание по эндотелию для вовлечения большего количества адгезивных молекул, ( b) более широкое использование молекул семейства селектинов и их рецепторов для образования улавливающих связей, которые имеют тенденцию усиливаться с увеличением силы, ( в ) образование мембранных нитей, которые могут простираться до нескольких диаметров клеток за вращающимся нейтрофилом, чтобы замедлить его, и ( d ) образование вновь описанных строп мембраны, которые распространяются перед нейтрофилами, катящимися при высоких скоростях сдвига, и помогают противостоять высокому давлению жидкости.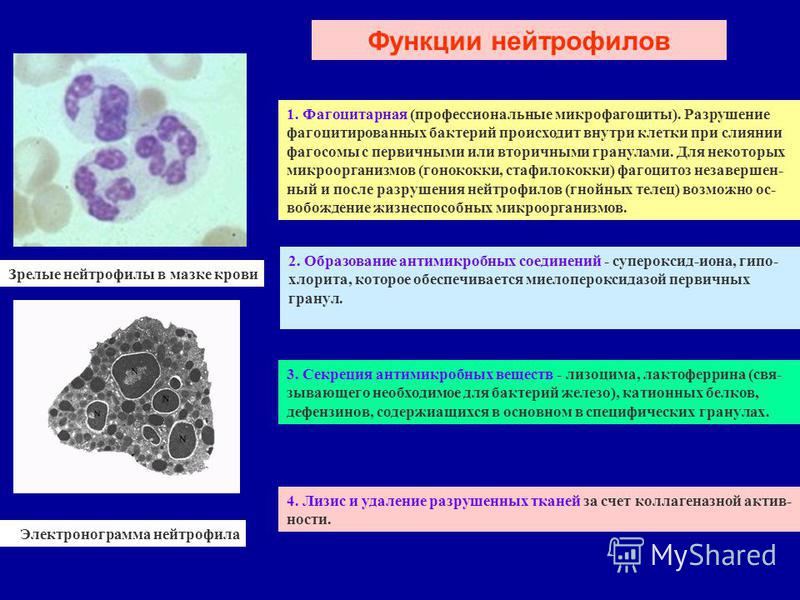 Новые микроскопические методы (количественное динамическое следование с использованием флуоресцентной микроскопии полного внутреннего отражения) позволили визуализировать такие фрагменты мембран, которые образуют «привязи» и «стропы».
Новые микроскопические методы (количественное динамическое следование с использованием флуоресцентной микроскопии полного внутреннего отражения) позволили визуализировать такие фрагменты мембран, которые образуют «привязи» и «стропы».
Нейтрофилы мигрируют через барьер эндотелиальных клеток двумя способами: через парацеллюлярный (между эндотелиальными клетками или трансклеточный (через эндотелиальные клетки) путь. Большая часть трансмиграции происходит через парацеллюлярный путь, хотя трансклеточный путь предпочтителен, когда эндотелиальная экспрессия молекулы внутриклеточной адгезии (ICAM) -1 высока. Параклеточная миграция зависит от образования эндотелиальных куполов (также известных как трансмиграционные чашки), которые представляют собой мембранные выпячивания, богатые молекулами адгезии [ICAM-1 и молекула адгезии сосудистых клеток (VCAM) -1], которые простираются от эндотелиальной клетки, окружая нейтрофил. Молекулы эндотелиальной адгезии взаимодействуют с интегринами нейтрофилов [преимущественно антиген, ассоциированный с функцией лимфоцитов (LFA) -1], образуя плотную печать или кольцо внутри купола.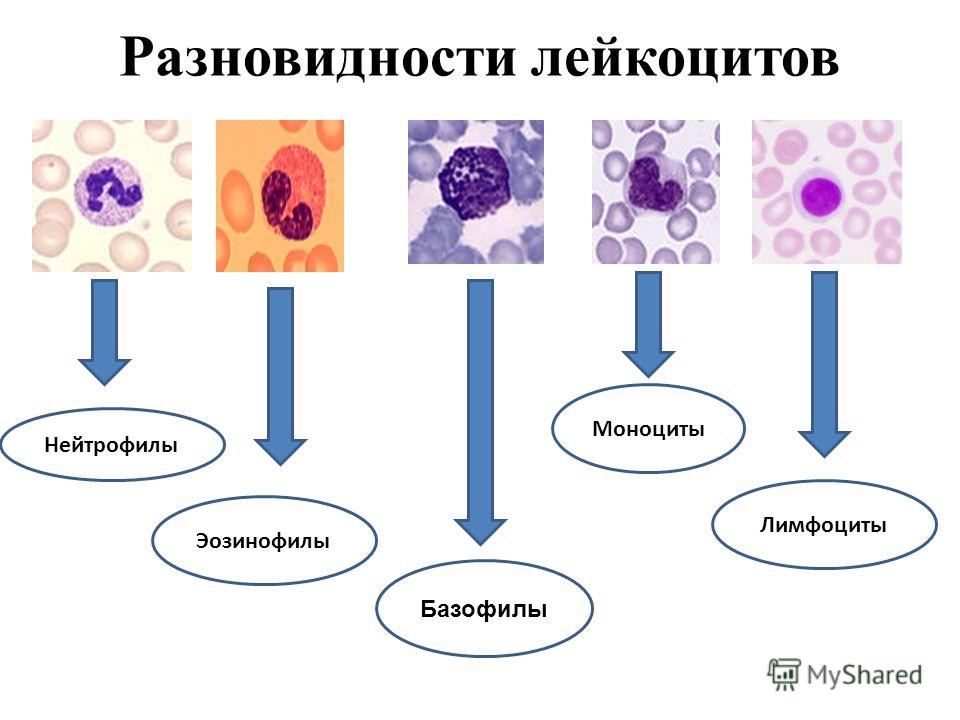 Считается, что формирование этих куполов ограничивает сосудистую проницаемость во время выхода нейтрофилов через эндотелий. Фактические этапы трансмиграции через параклеточные и трансклеточные пути зависят от гомофильных взаимодействий между дополнительными молекулами адгезии, такими как молекула адгезии эндотелиальных клеток тромбоцитов (PECAM) -1 и CD99, которые экспрессируются как на лейкоцитах, так и на эндотелиальных клетках. Взаимодействия между соединительными молекулами адгезии (JAM-A, JAM-B и JAM-C) и интегринами лейкоцитов (Mac-1) также играют важную роль в трансмиграции. Большинство из этих ролей было продемонстрировано на моделях нокаутных мышей, в которых делеция одной или нескольких из этих молекул специфически блокирует трансмиграцию. Многие из молекул адгезии расположены в определенном мембранном отделении на эндотелиальных клетках, называемом отделением рециркуляции на боковой границе. Считается, что эта специфическая субклеточная область на эндотелиальных клетках обеспечивает дополнительные мембранные компоненты, необходимые для формирования больших куполов, которые окружают трансмигрирующий нейтрофил.
Считается, что формирование этих куполов ограничивает сосудистую проницаемость во время выхода нейтрофилов через эндотелий. Фактические этапы трансмиграции через параклеточные и трансклеточные пути зависят от гомофильных взаимодействий между дополнительными молекулами адгезии, такими как молекула адгезии эндотелиальных клеток тромбоцитов (PECAM) -1 и CD99, которые экспрессируются как на лейкоцитах, так и на эндотелиальных клетках. Взаимодействия между соединительными молекулами адгезии (JAM-A, JAM-B и JAM-C) и интегринами лейкоцитов (Mac-1) также играют важную роль в трансмиграции. Большинство из этих ролей было продемонстрировано на моделях нокаутных мышей, в которых делеция одной или нескольких из этих молекул специфически блокирует трансмиграцию. Многие из молекул адгезии расположены в определенном мембранном отделении на эндотелиальных клетках, называемом отделением рециркуляции на боковой границе. Считается, что эта специфическая субклеточная область на эндотелиальных клетках обеспечивает дополнительные мембранные компоненты, необходимые для формирования больших куполов, которые окружают трансмигрирующий нейтрофил. Дополнительные молекулы в отделе рециркуляции на боковой границе, такие как рецептор полиовируса (CD155), активированная молекула адгезии лейкоцитов (ALCAM / CD166) и белок, связанный с интегрином (IAP / CD47), также необходимы для нормальной трансэндотелиальной миграции . Эти белки потенциально влияют на движение мембранных и адгезионных молекул на эндотелиальных клетках или ослабление адгезионных соединений между эндотелиальными клетками, что необходимо для эффективной трансмиграции лейкоцитов. Не удивительно, что большинство этих молекул играют роль как в параклеточной, так и в трансклеточной миграции. Одним из потенциальных различий между этими двумя путями трансмиграции является отсутствие образования трансмиграционной чашки на эндотелиальных клетках во время трансклеточной миграции, которая вместо этого характеризуется образованием инвазивных подосом на лейкоцитах, которые исследуют апикальную (сосудистую) поверхность эндотелиальной клетки. Трансклеточная миграция также может быть предпочтительной, когда эндотелиальные соединения особенно плотные — например, в гематоэнцефалическом барьере или когда высокоактивируются лейкоциты, возможно, путем прямого воздействия воспалительных цитокинов или хемокинов, присутствующих на апикальной стороне эндотелия.
Дополнительные молекулы в отделе рециркуляции на боковой границе, такие как рецептор полиовируса (CD155), активированная молекула адгезии лейкоцитов (ALCAM / CD166) и белок, связанный с интегрином (IAP / CD47), также необходимы для нормальной трансэндотелиальной миграции . Эти белки потенциально влияют на движение мембранных и адгезионных молекул на эндотелиальных клетках или ослабление адгезионных соединений между эндотелиальными клетками, что необходимо для эффективной трансмиграции лейкоцитов. Не удивительно, что большинство этих молекул играют роль как в параклеточной, так и в трансклеточной миграции. Одним из потенциальных различий между этими двумя путями трансмиграции является отсутствие образования трансмиграционной чашки на эндотелиальных клетках во время трансклеточной миграции, которая вместо этого характеризуется образованием инвазивных подосом на лейкоцитах, которые исследуют апикальную (сосудистую) поверхность эндотелиальной клетки. Трансклеточная миграция также может быть предпочтительной, когда эндотелиальные соединения особенно плотные — например, в гематоэнцефалическом барьере или когда высокоактивируются лейкоциты, возможно, путем прямого воздействия воспалительных цитокинов или хемокинов, присутствующих на апикальной стороне эндотелия.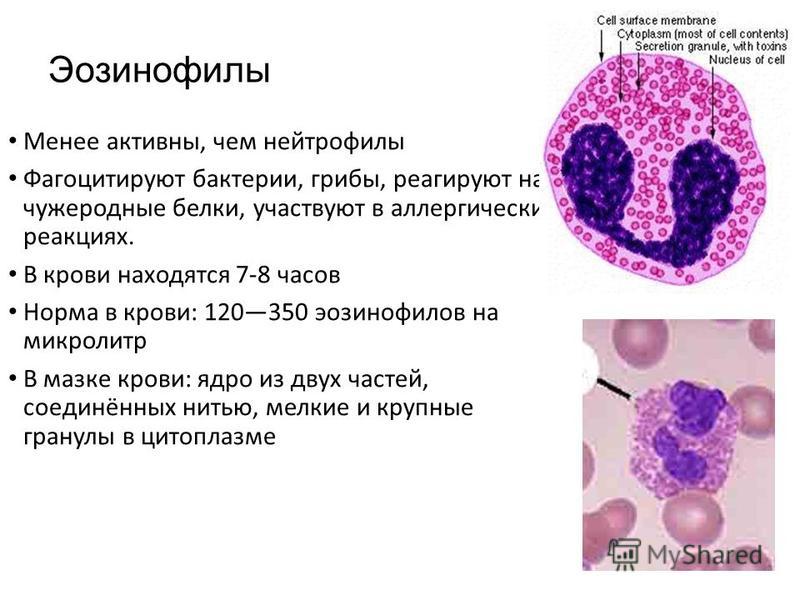 Объединяющие модели параклеточной и трансцеллюлярной трансэндотелиальной миграции были недавно предложены исследователями.
Объединяющие модели параклеточной и трансцеллюлярной трансэндотелиальной миграции были недавно предложены исследователями.
За прошедшие годы улучшения в стратегии маркировки лейкоцитов и появление многофотонной визуализации IVM показали уникальное поведение лейкоцитов в специфических сосудистых ложах ряда органов, таких как легкие, печень и почки. В легких экстравазация нейтрофилов происходит в основном в небольших капиллярах, окружающих альвеолы, а не в посткапиллярных венулах. Легочные капилляры являются особенно узкими, что приводит к низкой скорости кровотока и вынуждает нейтрофилы менять форму, чтобы проходить через них, продлевая время прохождения клеток через сосудистую сеть. Недавняя работа предполагает, что резидентный пул патрулирующих нейтрофилов быстро набирается в легкие после воспалительного инсульта, который зависит от факторов, происходящих из моноцитов. Рекрутирование нейтрофилов через синусоидальный эндотелий печени значительно отличается от такового в других тканях просто из-за пористой природы этой сосудистой сети. Хотя эта пористость позволяет легко обмениваться растворенными веществами между сосудистыми и печеночными клетками, сосуды являются узкими, как в легком, что приводит к большому краевому пулу клеток и относительному отсутствию опосредованного селектином переката при повреждении печени. В печени анатомическое расположение и стимул диктуют молекулярные механизмы, используемые для рекрутирования нейтрофилов. Например, рекрутирование лейкоцитов в портальные и центральные венулы сходно с таковым в брыжейке и кремастере. Однако в синусоидальных капиллярах определенные воспалительные состояния в печени приводят к ползанию нейтрофилов под влиянием иммобилизованного эндотелиальной клеткой хемокина, белка воспаления макрофагов (MIP) -2, который затем замещается градиентом лигандов формилпептидных рецепторов, высвобождаемых некротическими гепатоцитами. Более того, молекулярные механизмы рекрутирования в печени различаются в зависимости от стимула. Секвестрация нейтрофилов в синусоидах в ответ на липополисахарид зависит от связывания нейтрофильного гликопротеина CD44 с синусоидальным эндотелиальным гиалуронаном печени , но в ответ на стерильное повреждение необходимы β 2- интегрин Mac-1 и эндотелиальный ICAM-1.
Хотя эта пористость позволяет легко обмениваться растворенными веществами между сосудистыми и печеночными клетками, сосуды являются узкими, как в легком, что приводит к большому краевому пулу клеток и относительному отсутствию опосредованного селектином переката при повреждении печени. В печени анатомическое расположение и стимул диктуют молекулярные механизмы, используемые для рекрутирования нейтрофилов. Например, рекрутирование лейкоцитов в портальные и центральные венулы сходно с таковым в брыжейке и кремастере. Однако в синусоидальных капиллярах определенные воспалительные состояния в печени приводят к ползанию нейтрофилов под влиянием иммобилизованного эндотелиальной клеткой хемокина, белка воспаления макрофагов (MIP) -2, который затем замещается градиентом лигандов формилпептидных рецепторов, высвобождаемых некротическими гепатоцитами. Более того, молекулярные механизмы рекрутирования в печени различаются в зависимости от стимула. Секвестрация нейтрофилов в синусоидах в ответ на липополисахарид зависит от связывания нейтрофильного гликопротеина CD44 с синусоидальным эндотелиальным гиалуронаном печени , но в ответ на стерильное повреждение необходимы β 2- интегрин Mac-1 и эндотелиальный ICAM-1. Визуализация в реальном времени в почках традиционно не была доступна для IVM из-за сложной структуры органа и оптической недоступности, хотя работа с гидронефротической почкой, при которой атрофия канальцев приводит к образованию тонких тканей, обошла некоторые из этих проблем . Недавняя работа с использованием многофотонной визуализации неповрежденной почки свидетельствует о том, что нейтрофилы и моноциты постоянно патрулируют капилляры клубочков. При воспалении, вызванном антителом к гломерулярным базальным мембранам, эти клетки демонстрируют большее время пребывания и повышенную выработку АФК. Эти процессы зависят от Mac-1, что согласуется с требованием к этому интегрину при откровенном нефрите в этой модели заболевания. Основной характеристикой рекрутирования нейтрофилов в этих органах является увеличенное время прохождения через капилляры малого диаметра, что приводит к увеличению вероятности повреждения сосудов. Арест нейтрофилов в этих небольших сосудах может быть связан с вызванными активацией изменениями в их цитоскелете, которые приводят к снижению деформируемости и последующей секвестрации. Эти исследования иллюстрируют способность современной конфокальной многофотонной флуоресцентной микроскопии предоставлять новое понимание рекрутирования нейтрофилов при различных воспалительных состояниях.
Визуализация в реальном времени в почках традиционно не была доступна для IVM из-за сложной структуры органа и оптической недоступности, хотя работа с гидронефротической почкой, при которой атрофия канальцев приводит к образованию тонких тканей, обошла некоторые из этих проблем . Недавняя работа с использованием многофотонной визуализации неповрежденной почки свидетельствует о том, что нейтрофилы и моноциты постоянно патрулируют капилляры клубочков. При воспалении, вызванном антителом к гломерулярным базальным мембранам, эти клетки демонстрируют большее время пребывания и повышенную выработку АФК. Эти процессы зависят от Mac-1, что согласуется с требованием к этому интегрину при откровенном нефрите в этой модели заболевания. Основной характеристикой рекрутирования нейтрофилов в этих органах является увеличенное время прохождения через капилляры малого диаметра, что приводит к увеличению вероятности повреждения сосудов. Арест нейтрофилов в этих небольших сосудах может быть связан с вызванными активацией изменениями в их цитоскелете, которые приводят к снижению деформируемости и последующей секвестрации. Эти исследования иллюстрируют способность современной конфокальной многофотонной флуоресцентной микроскопии предоставлять новое понимание рекрутирования нейтрофилов при различных воспалительных состояниях.
По сравнению с трансэндотелиальной миграцией трансэпителиальная миграция нейтрофилов изучена хуже. Трансэпителиальная миграция оказывает очевидное влияние на воспалительные заболевания на эпителиальных поверхностях, такие как острое повреждение легких и воспалительные заболевания кишечника. В большинстве исследований, изучающих механизмы трансэпителиальной миграции, использовались модели культивирования клеток in vitro. Трансэпителиальная миграция происходит в направлении, противоположном трансэндотелиальной миграции; то есть нейтрофилы, мигрирующие через интерстициальные ткани, сначала взаимодействуют с молекулами на базальной (то есть, стороне базальной мембраны) эпителия, а затем мигрируют к апикальной стороне эпителия.Эпителиальные клетки имеют тенденцию быть намного больше, чем эндотелиальные клетки, и, следовательно, путь, через который должны проходить нейтрофилы, намного длиннее (20 мкм или более для эпителиальных клеток, по сравнению с 2-4 мкм для эндотелиальных клеток). Трансэпителиальная миграция происходит только через параклеточный путь; нет доказательств трансклеточной трансэпителиальной миграции. Даже в моделях клеточных культур трансэпителиальная миграция часто ассоциируется с более значительной активацией нейтрофилов и повреждением эпителиальных клеток, чем трансэндотелиальная миграция, что приводит к повышенной проницаемости через эпителиальный барьер.Трансмиграция нейтрофилов индуцирует программу восстановления в эпителиальных клетках, опосредованную сигналами β-катенина, которая необходима для восстановления барьера проницаемости ( в результате чего увеличивается проницаемость через эпителиальный барьер.
Нейтрофилы распознают патогены через классы клеточной поверхности и внутриклеточные рецепторы, которые связываются с микроб-специфичными молекулами. Нейтрофилы также используют многочисленные рецепторы, которые распознают белки-хозяева (такие как IgG и комплемент), опсонизирующие микроб. Эти рецепторы вызывают внутриклеточные сигналы, которые приводят к полной способности уничтожать патогенные микроорганизмы. Величина, качество и продолжительность вызванного ответа продиктованы репертуаром рецепторов, задействованных в любой момент времени, что, в свою очередь, определяет статус активации нейтрофилов.
Нейтрофилы хранят протеиназы и антимикробные пептиды в гранулах, которые сливаются с фагосомой во время поглощения патогена. Слияние гранул с плазматической мембраной, вызывающее внеклеточное высвобождение содержимого, также происходит во время активации нейтрофилов. В общем, внеклеточное высвобождение секреторных везикул и третичных везикул происходит при умеренной активации, тогда как высвобождение вторичных и первичных гранул происходит в основном в результате непреднамеренной утечки из фагосомы, чаще всего во время расстроенного фагоцитоза. Слияние секреторных везикул с плазматической мембраной приводит к проявлению адгезии и хемотаксических рецепторов, которые способствуют рекрутированию нейтрофилов. Мобилизация третичных и вторичных гранул во время трансмиграции может способствовать деградации коллагена в базальной мембране и, таким образом, устранению физического барьера для выхода нейтрофилов.
Вклад нейтрофильных антимикробных пептидов в защиту хозяина является особенно богатой областью современных исследований. Нейтрофилы содержат в основном катионные пептиды — α-дефензины и кателицидины. Катионные антимикробные пептиды обеспечивают микробицидную активность благодаря взаимодействию с отрицательно заряженными мембранными компонентами патогенов, что приводит к образованию пор, индукции неспецифической проницаемости мембран, связыванию с внутриклеточными мишенями для ингибирования биосинтеза ДНК и / или РНК и разрушению бактериальных биопленок. Кателицидины, наиболее изученным из которых является LL-37, протеолитически обрабатываются из более крупных белков. Помимо их прямой антимикробной активности, многие антимикробные пептиды (особенно LL-37) также обладают четкими иммуномодулирующими функциями, такими как стимуляция хемотаксиса нейтрофилов, индукция экспрессии хемокиновых рецепторов, индукция продукции цитокинов и подавление апоптоза нейтрофилов.
Атеросклероз
Атеросклероз — это хроническое заболевание, возникающее в результате отложения провоспалительных липидов в сосудистой сети, что приводит к плохо контролируемому воспалению кровеносных сосудов. До недавнего времени потенциальный вклад нейтрофилов в значительной степени игнорировался при этом заболевании, поскольку они не были обнаружены при атеросклеротических поражениях. Однако более чувствительные иммуногистохимические методы с маркерами, ограниченными гранулоцитами, позволили обнаруживать нейтрофилы как на ранних, так и на более развитых атеросклеротических поражениях у людей и на мышиной модели заболевания . Генерируемые MPO активные формы кислорода , которые способствуют апоптозу эндотелиальных клеток, экспрессии тканевого фактора, нитрации липопротеинов низкой плотности и перекисному окислению липидов, могут способствовать развитию поражения. Многие белки нейтрофильных гранул, включая азуроцидин, LL-37 и α-дефензины, также обнаруживаются в атеросклеротических поражениях человека, что позволяет предположить, что активированные нейтрофилы могут непосредственно вносить вклад в развитие поражения . Исследования на мышиной модели атеросклероза и косвенные данные в образцах человека показывают, что многие из этих нейтрофильных факторов привлекают моноциты и влияют на их статус активации. NET, которые содержат кателицидин-хроматиновые комплексы стимулируют воспаление сосудов путем набора моноцитов. Нейтрофилы также могут способствовать деградации матрикса через протеиназу 3 (PR3) и матриксные металлопротеиназы (ММР), что приводит к ослаблению фиброзной крышки на атеросклеротических поражениях сосудов. Манипуляции с количеством циркулирующих нейтрофилов или набор нейтрофилов влияют на развитие поражения на мышиной модели. В частности, нейтропения, вызванная дефицитом CXCR2, приводит к уменьшению размера поражения, тогда как нейтрофилия, вызванная разрушением оси CXCR4-CXCL12, важной для сохранения гранулоцитарных предшественников в костном мозге, приводит к увеличению атеросклеротической нагрузки. Помимо роли нейтрофилов в инициации и прогрессировании атеросклеротических поражений, хроническое присутствие нейтрофилов в этих поражениях может способствовать тромбозу, инфаркту миокарда и инсульту, так как образование NET и высвобождение сериновой протеазы способствуют росту внутрисосудистого тромба. . Осаждение активированных тромбоцитов в стенке сосуда, в свою очередь, привлекает больше нейтрофилов за счет демонстрации молекул адгезии тромбоцитов, таких как P-селектин, или производства хемокинов, полученных из тромбоцитов, таких как CCL5. У мышей, генетически дефицитных в этих молекулах, и у тех, у кого дефицит тромбоцитов, снижается развитие атеросклеротических повреждений. Взятые вместе, гистологические данные подразумевают сложное взаимодействие между нейтрофилами, тромбоцитами и моноцитами, которое вызывает хроническое воспаление в атеросклеротических поражениях.
Аутоиммунные заболевания
Нейтрофилы были вовлечены в патогенез многочисленных аутоиммунных заболеваний, как эффекторных клеток, которые опосредуют повреждение тканей, так и совсем недавно, как иммуномодулирующих клеток, которые влияют на функции других клеток. Гораздо больше известно о том, как нейтрофилы опосредуют повреждение тканей при аутоиммунных заболеваниях, главным образом в результате плохо контролируемой активации нейтрофилов, что приводит к стимуляции эффекторных функций, обычно используемых для контроля патогенной инфекции. Тем не менее, с растущим признанием того, что нейтрофилы могут модулировать функцию других иммунных клеток, посредством продукции цитокинов или прямого взаимодействия, теперь стало понятно, что нейтрофилы могут играть более сложные роли в развитии аутоиммунных заболеваний. При некоторых аутоиммунных заболеваниях нейтрофилы в настоящее время определены как основной источник аутоантигенов, которые управляют патогенезом заболевания.
Многочисленные васкулиты, включая гранулематоз Вегенера, микроскопический полиангиит, синдром Чурга-Штрауса и почечно-ограниченный васкулит, вызваны развитием аутоантител, которые связываются с нейтрофильными антигенами и вызывают клеточную активацию. Эти заболевания характеризуются локализацией нейтрофилов и макрофагов в мелких и средних сосудах без обнаруживаемых иммунных отложений в ткани. Активация нейтрофилов в этих местах связана с серьезным повреждением сосудов в органах, включая легкие и почки. Антинейтрофильные цитоплазматические антитела (ANCAs) направлены против цитоплазматических нейтрофильных продуктов, таких как MPO, PR3 и Lamp-2 (мембранный белок 2, связанный с лизосомами), которые экспонируются на клеточной поверхности примированных / активированных или апоптотических нейтрофилов . Убедительные доказательства патогенного потенциала ANCAs и роли нейтрофилов в патогенезе заболевания были предоставлены на животных моделях, где анти-MPO-антитела в отсутствие функциональных Т-клеток вызывали васкулит и гломерулонефрит, которые были значительно снижены при истощении нейтрофилов , Fab-часть ANCAs может запускать активную активацию нейтрофилов, тогда как Fc-часть вовлекает нейтрофильную FcγRIIA для стимулирования дегрануляции, выделения цитокинов и продукции ROS . Кумулятивная стимуляция нейтрофилов TNF, комплементом (индуцированным TNF и Fc-частью ANCAs), FcγRs и β 2интегрины приводят к повышению уровня активации и последующей секвестрации в сосудах в отсутствие классического селектина, опосредованного селектином. Активированные ANCA нейтрофилы могут приводить в движение каскад прямой передачи увеличения воспаления и выработки аутоантител, вызывая тромбоз (и, следовательно, тромбоцитарную активацию нейтрофилов) или высвобождая BAFF, чтобы стимулировать дифференцировку В-клеток и увеличивать выработку аутоантител . Активированные ANCA нейтрофилы также продуцируют НЭЦ: комплексы хроматин-МПО были обнаружены в клубочках и в интерстиции почечных биопсий у пациентов с васкулитом мелких сосудов . Аутоантиген MPO в тканях, депонированных в тканях, может спровоцировать дальнейшее отложение иммунного комплекса и, таким образом, большую стимуляцию воспалительных клеток.интерстиции почечных биопсий у пациентов с васкулитом мелких сосудов . Аутоантиген MPO в тканях, депонированных в тканях, может спровоцировать дальнейшее отложение иммунного комплекса и, таким образом, большую стимуляцию воспалительных клеток.
Ряд болезненных состояний приводит к выработке аутоантител к антигенам-хозяевам, которые образуют депонированные в ткани иммунные комплексы, которые непосредственно активируют нейтрофилы, что приводит к повреждению тканей, часто через процесс расстроенного фагоцитоза. Многие из этих заболеваний, такие как RA, были смоделированы на мышах и зависят от FcγR- и интегрин-опосредованной активации нейтрофилов. СКВ — еще одно хорошо изученное аутоиммунное заболевание, при котором распознавание нейтрофилов тканевыми иммунными комплексами (главным образом в почках) приводит к рекрутированию нейтрофилов и последующему повреждению тканей. Хотя роль нейтрофилов в эффекторных фазах заболеваний, опосредованных иммунными комплексами, хорошо известна.
В течение десятилетий ревматоидный фактор (IgG, который распознает антитела к собственным IgM) считался основным патогенным аутоантителом при ревматоидном артрите (РА). Совсем недавно исследователи продемонстрировали, что аутоантитела, которые распознают цитруллинированные белки, являются более специфическими показателями РА. Аутоантитела к ослабленному филаггрину, фибрину, виментину и коллагену все определены в RA . Эти же типы антицитруллинированных антител также обнаруживаются у пациентов с синдромом Фелти, тяжелой формой артрита, которая прогрессирует до нейтропении и подверженности повторным инфекциям. Основным источником этих аутоантигенов является сеть. Как обсуждалось выше, NETosis зависит от удаления гистонов (главным образом, превращения остатков аргинина в цитруллины ферментом PAD4), чтобы способствовать разборке хроматина. Многие другие нейтрофильные белки разрушаются во время NETosis и затем захватываются антигенпрезентирующими клетками и представляются самореактивным лимфоцитам, чтобы стимулировать образование аутоантител и иммунных комплексов. Сыворотка от пациентов с РА и синдромом Фелти может напрямую активировать человеческие нейтрофилы in vitro, что приводит к NETosis . Следовательно, нейтрофилы не только реагируют на иммунные комплексы при РА, но и являются основным источником антигенов, которые приводят к заболеванию, снова создавая самоусиливающуюся петлю воспалительной патологии.
Недавние исследования показывают, что нейтрофилы играют важную роль в инициации системных аутоиммунных заболеваний, таких как СКВ. Нейтрофилы уже давно распознаются при поражениях почечной СКВ, и их присутствие связано с повышенной тяжестью заболевания. В настоящее время считается, что стимуляция NETosis тканевыми иммунными комплексами является основным двигателем продукции интерферона I типа (IFN-α и IFN-β) у этих пациентов. Основной особенностью мононуклеарных и тканевых клеток пациентов с СКВ является профиль экспрессии генов, благодаря которому они выглядят так, как если бы они стимулировались интерферонами I типа; этот профиль упоминается как подпись интерферона . Животные модели подтверждают роль интерферонов типа I в качестве основных стимуляторов как антигенпрезентирующих клеток, так и самореактивных лимфоцитов в системном аутоиммунном заболевании. Несколько исследований демонстрируют, что нейтрофилы пациентов с СКВ легко подвергаются НЭТОЗу в ответ на многочисленные раздражители и обладают повышенной способностью сильно активировать выработку интерферона I типа плазмоцитоидными DC. Внутри NET кателицидиновый пептид LL-37 особенно важен для индукции продукции IFN-α. Эти интерфероны могут воздействовать на другие иммунные (и неиммунные) клетки, чтобы стимулировать экспрессию воспалительных цитокинов, активировать молекулы адгезии и продуцировать хемокины, создавая прямую петлю амплификации для патогенеза заболевания. Помимо выработки NET, серьезность SLE у подгрупп пациентов коррелирует со сниженной способностью очищать NET, главным образом из-за аутоантител, которые блокируют опосредованную ДНКазой I распад NET в тканях. Недавно была продемонстрирована прямая корреляция между сниженной способностью разрушать NET и тяжестью заболевания.
Неопровержимые доказательства того, что нейтрофилы непосредственно способствуют повреждению конечных органов при СКВ, получены из исследований общечеловеческих ассоциаций. Эти исследования идентифицировали полиморфизмы в генах, которые высоко экспрессируются в нейтрофилах, в качестве потенциальных локусов чувствительности к СКВ, включая гены, которые кодируют FcγRIIA, FcγRIIIB и Mac-1 (CD11b / CD18) . Недавняя работа предполагает, что несинонимичный однонуклеотидный полиморфизм Mac-1 R77H, один из самых сильных генетических факторов риска при СКВ человека, связан со снижением функции Mac-1 у нейтрофилов. In vivo пассивный перенос иммунной системы, содержащей сывороточную волчанку человека, способствует накоплению в почках нейтрофилов и нефриту у мышей, экспрессирующих человеческую FcγRIIA на нейтрофилах. Интересно, что это происходило только тогда, когда мышам не хватало Mac-1. Были получены доказательства того, что Mac-1 негативно регулирует FcγRIIA-опосредованное накопление нейтрофилов. Приток макрофагов был минимальным, и их истощение не влияло на прогрессирование заболевания в этой модели. Вместе эти исследования демонстрируют важную роль нейтрофилов и их рецепторов в регуляции повреждения конечных органов при СКВ.
Аллергические заболевания
Если в медицине есть область, в которой потенциальный вклад нейтрофилов в патогенез заболевания не оценен, это аллергия и анафилаксия. Тем не менее, недавние исследования подчеркивают роль нейтрофилов и в этих заболеваниях. Хотя обычно считается, что аллергия зависит от IgE и тучных клеток, очевидно, что IgG и другие иммунные клетки играют важную роль в развитии аллергических заболеваний. Эти роли были недавно продемонстрированы на мышиной модели анафилаксии как посредством пассивного введения IgG, так и путем введения антигена сенсибилизированным мышам. В обеих моделях истощение нейтрофилов или нейтрофильных FcγRs защищает мышей от анафилаксии. Удивительно, но адоптивный перенос человеческих нейтрофилов мышам с дефицитом FcγR восстанавливал ответ, предполагая, что клетки человека могут вызывать системные анафилактические реакции в ответ на IgG. В этой модели анафилаксия опосредуется не гистамином, а активирующим тромбоциты фактором, активирующим нейтрофилы, известным вазоактивным липидом. Напротив, гистамин, полученный из нейтрофилов, является основным источником аллергического воспаления легких при хронической микоплазменной инфекции. Нейтрофилы также могут способствовать сенсибилизации аллергических заболеваний кожи. Эта идея подтверждается неожиданным открытием того, что истощение нейтрофилов защищает мышей от развития контактного дерматита, что позволяет предположить, что эти клетки важны для облегчения развития аллерген-специфических Т-клеточных ответов .
Воспалительные заболевания кишечника
Нейтрофилы играют очевидную роль в патофизиологии воспалительных заболеваний кишечника (ВЗК), как болезни Крона, так и язвенного колита. Нейтрофилы составляют значительную долю воспалительного инфильтрата в стенках кишечника пациентов с ВЗК; степень инфильтрации нейтрофилов коррелирует с клинической тяжестью заболевания . В моделях на животных истощение нейтрофилов или блокада их способности реагировать на стимулы хемокинов (т.е. у мышей с дефицитом CXCR2) уменьшает тяжесть заболевания при экспериментальном колите. Как на животных моделях, так и на людях, стимулирование экспансии нейтрофилов через ось IL-23-IL-17-IL-22 играет важную роль в развитии IBD. Большая часть патологии нейтрофилов при ВЗК связана с их влиянием на функцию эпителиального барьера, так как процесс трансэпителиальной миграции связан со значительным нарушением целостности эпителия. В клеточной культуре трансмиграция нейтрофилов через кишечный эпителий приводит к изменениям в эпителиальном актиновом цитоскелете, вызывая ретракцию клеток и потерю барьерной функции. Точно так же высвобождение сериновых протеаз нейтрофилов, таких как эластаза или PR3, может напрямую активировать эпителиальные PAR, что приводит к ретракции клеток и снижению барьерной функции . Повышенные уровни полученных из нейтрофилов MMP8, MMP9 и пролилэндопептидазы были обнаружены в стенках кишечника пациентов с ВЗК. Помимо прямого клеточного повреждения, эти протеазы могут разлагать коллаген с образованием хемотаксических пептидов, которые дополнительно стимулируют рекрутирование нейтрофилов в кишечник. Опосредованная антителами блокада пептидов, полученных из коллагена, снижает заболеваемость при экспериментальном колите. Продукция АФК нейтрофилами также оказывает прямое повреждающее действие на ткани при ВЗК. Мыши , лишенные gp91 phox субъединица NADPH — оксидаза защищены от экспериментального колита (хотя странно, gp47 phox мутантные животные реагируют нормально). Перепроизводство АФК нейтрофилами было связано с воспалительной индукцией рака желудочно-кишечного тракта, которая часто встречается у пациентов с ВЗК, вероятно, в результате прямого мутагенного воздействия на эпителиальные клетки или путем стимуляции дополнительных эпителиальных опосредованных воспалительных реакций. Наконец, развитие ANCA (в частности, анти-PR3-антител), которые могут непосредственно активировать нейтрофилы и, таким образом, усугублять воспаление, также наблюдается у многих пациентов с воспалительные заболевания кишечника . Действительно, эти антитела, наряду с продуктами секреции нейтрофилов (такими как белок липокалин, связанный с нейтрофильной желатиназой), являются полезными сывороточными биомаркерами воспалительной активности у пациентов с воспалительные заболевания кишечника . Следовательно, как и при других воспалительных заболеваниях, таргетная терапия, снижающая активность нейтрофилов, должна оказывать значительное влияние на воспалительные заболевания кишечника.
Рак
Связь между нейтрофилами и патогенезом рака является растущей областью исследований. Это также запутанная область, потому что, по-видимому, нейтрофилы, ассоциированные с опухолью (TAN), могут оказывать протуморигенное или противоопухолевое действие, в зависимости от типа опухоли и / или используемой модельной системы. Большинство клинических наблюдений предполагают, что присутствие обильных нейтрофилов в ложе опухоли связано с повышенным ростом опухоли и, следовательно, плохим прогнозом. Многие опухоли продуцируют хемокины, которые привлекают нейтрофилы к ложу опухоли, включая CXCL6, CXCL8 и CCL3 (а в мышиных системах ортологи GCP-2, KC и MIP-1α). В некоторых модельных системах первоначальный набор нейтрофилов в ложе опухоли приводит к их активации, что приводит к выработке полученных из нейтрофилов хемокинов (таких как CXCL1, CXCL2 и CCL3), которые дополнительно усиливают рекрутирование воспалительных клеток. Профилирование экспрессии TAN в мышиной модели подтверждает, что мРНК для различных хемокинов значительно ( > 75 раз) увеличена. Внутри ложа опухоли нейтрофилы могут продуцировать факторы, способствующие росту опухоли, включая протеиназы, такие как нейтрофильная эластаза, MMP8 и MMP9; проангиогенные факторы, такие как VEGF; и такие агенты, как онкостатин М, которые действуют непосредственно на опухолевые клетки. Большинство данных, подтверждающих эти наблюдения, получены на животных моделях, например, снижение роста опухолей различных типов у мышей, лишенных эластазы или MMP9. Точно так же опосредованное антителами истощение нейтрофилов приводит к потере многих из этих факторов в ложе опухоли, таких как VEGF в трансгенных индуцированных опухолях островков поджелудочной железы. Предполагается, что в модели опухоли меланомы нейтрофилы способствуют метастазированию путем непосредственного связывания с опухолевыми клетками (посредством связывания ICAM-1 опухолевых клеток с нейтрофилом Mac-1) и облегчения их проникновения в сосудистую сеть. Высвобождение эластазы из нейтрофилов также может способствовать метастазированию, разрушая базальные мембраны и позволяя выходить опухолевым клеткам в кровоток. Наконец, TAN оказывают прямое иммуносупрессивное действие на цитолитические CD8 + T-клетки, потенциально через секрецию аргиназы 1, которая расщепляет аргинин и тем самым ограничивает активацию T-клеток . В соответствии с этим эффектом, истощение нейтрофилов у мышей с опухолями может приводить к активации CD8 + эффекторных Т-клеток для стимулирования противоопухолевого иммунитета.
что это такое, нормы у женщин и мужчин по возрастам (таблица)
Белые кровяные тельца или лейкоциты сами по себе неоднородны. Это общее наименование пяти структур. Цель у всех них одна и та же: борьба с инфекционными и прочими аномальными агентами, вторженцами в организм человека. Соответственно, они составляют основу иммунной системы.
Нейтрофилы — это один из подвидов лейкоцитов. Наиболее многочисленны в соотношении с другими подобными же клетками и составляют до 70% общей массы таковых. Выполняют важные функции но разнородные по характеру.
В некотором смысле эти структуры универсальны, способны бороться с большинством видом возбудителей и инородных объектов. Отклонения от нормы всегда говорят о развитии патологических процессов, не считая небольшого ряда субъективных причин, например, приема некоторых препаратов.
Целесообразность лечения определяется конкретной клинической ситуацией. Нейтрофилы в анализе крови отражают иммунную функцию, потому любое отклонение потенциально опасно, из этого врачи исходят при разборе вопроса о необходимости терапии.
Функции нейтрофилов
Названные клетки решают большую группу специфических задач, стоящих перед защитными силами человеческого организма:
Выделение бактерицидных веществ
В структурах цитологических единиц находятся специализированные соединения, обладающие способностью убивать патогенную флору. При обнаружении цели, нейтрофил выделяет вещество, растворяющее клеточные мембраны возбудителя.
Тем самым, генетический материал оказывается не инкапсулированным и бактерия гибнет. Это один из основных механизмов активности нейтрофилов.
Связывание антигенов
Рассматриваемые клетки на мембранах имеют специальные рецепторы к специфическим иммуноглобулинам класса G, они наиболее распространенные в организме и обладают высокой активностью в борьбе с инфекционными агентами всех типов.
Благодаря способности связывать подобные вещества, нейтрофилы могут быстро транспортировать их к месту поражения, чтобы усилить иммунные ответ. Тем самым, уничтожение возбудителей достигается куда быстрее.
Непосредственное поглощение микроорганизмов
Форменные клетки способны к фагоцитозу. Они достаточно крупные и агрессивные чтобы уничтожать бактерии посредством их «поедания». В среднем, разными способами нейтрофил способен устранить до 20-30 инородных структур. Что говорит о высокой его эффективности.
Ингибирование и инактивация вирусных агентов
Белые кровяные тельца обладают возможностью понижать скорость репликации инородных возбудителей и уменьшать продуктивность их существования. В благоприятных случаях достигается полное угнетение структур, благодаря чему воспалительные процессы сходят на нет.
Функции нейтрофилов в конечном итоге сводятся к одному — уничтожению бактерий, вирусов, грибков, прочих объектов различными способами. Потому повышение показателя Neut в анализе крови говорит о иммунном ответе, будь то реакция на инфекционное поражение или аллергические процессы. Далее нужно разбираться уже предметно, по существу.
Виды
Нейтрофилы, несмотря на единое название, также неоднородны. Существует несколько видов таковых. В зависимости от функционального предназначения (узкая специализация) или же степени готовности к работе.
Всего можно определить четыре типа:
- Миелоцит. Условно говоря, его нельзя назвать разновидностью белых кровяных телец. Это предельно незрелая клетка. По своей сути, она еще даже не дифференцировалась. Это грубая «заготовка» организма для будущего превращения в прочие структуры. Не обязательно нейтрофилы.
Возможна трансформация во что угодно: от тромбоцита до эозинофила. В норме таких структур в кровеносном русле быть не должно вообще. Они концентрируются в костном мозге и там же окончательно формируются, только потом выходят в организм и начинют выполнять свою работу.
- Юные или незрелые нейтрофилы. Промежуточная форма. Также сохраняется в месте собственного синтеза, обеспечивает условный резерв. На случай, если потребуется выброс большего количества иммунных клеток. Подобные разновидности тоже отсутствуют в кровеносном русле. Потому как работать они пока еще не способны.
С другой стороны, в результате случайных явлений, возможен выход небольшого их числа. Это не критично, но количество должно быть на уровне погрешности. Около 0.1-1%, с возможным отклонением в меньшую сторону. Все явные изменения говорят о развитии того или иного патологического процесса в организме.
- Палочкоядерные нейтрофилы. Составляют минимум от общей массы. Не свыше 5% количества. Свое название получили за счет особенностей формы, которая хорошо заметна при микроскопическом анализе. Эти клетки обладают примерно теми же функциями, но более узкоспециализированы. Вступают в дело по необходимости, когда основная масса не справляется.
- Нейтрофилы сегментоядерные. Наиболее многочисленный подтип белых кровяных телец. Согласно разным оценкам, составляет до 70% от количества структур. Решает описанные выше задачи постоянно и в полной мере. Особенно хорошо заметна работа нейтрофилов этого типа при развитии инфекционно-воспалительного процесса в организме.
Функционально активных вида, таким образом, всего два. Оба они примерно равноценны по особенностям, роли и потенциалу для борьбы с патогенными агентами, микроорганизмами, вирусами, грибками.
Таблицы норм
Нейтрофилы обозначаются в анализе крови как Neut, а количество клеток считается в процентном отношении. Но в лабораторной, клинической практике также используется абсолютное содержание нейтрофилов, это показатель, который рассчитывается в количестве единиц на литр крови.
Какой способ будет использован, зависит от конкретного учреждения и методик исследования.
У женщин
Показатели варьируются в довольно широких пределах. В среднем, норма нейтрофилов в крови у женщин 50-59%, что несколько выше, чем у мужчин. Это обусловлено особенностями работы иммунитета и прочими факторами.
| Возраст (лет) | Нейтрофилы в процентном отношении (считается по наиболее многочисленной разновидности — сегментоядерной) |
|---|---|
| 16-18 | 51-56% |
| 18-21 | 52-57% |
| 22-35 | 52-59% |
| 35-45 | 51-58% |
| 45-60 | 50-55% |
| После 60 лет | 52-58% |
Данные в таблице приблизительные, возможны незначительные индивидуальные колебания в сторону понижения (но не роста). Также нужно учитывать состояние пациентки в момент исследования.
На концентрации нейтрофилов сказываются пиковые гормональные явления. Будь то активное половое созревание (особенно при запоздалом формировании), менструальный цикл, беременность.
У мужчин
У мужчин нормальные показатели телец не многим меньше (49-57%), в целом, речь идет о расхождении в несколько процентов. В зависимости от случая. Это общее правило.
| Годы жизни | Уровни сегментоядерных нейтрофилов |
|---|---|
| 16-18 | 50-54% |
| 18-21 | 50-55% |
| 22-35 | 51-57% |
| 35-45 | 50-54% |
| 35-45 | 49-53% |
| Старше 60 | 50-56% |
У взрослых людей диапазон нормы нейтрофилов находятся в пределах от 30 до 59% в среднем. Разброс большой. Нижняя граница также возможна и не считается аномалией.
В таблицах представлены усредненные числа, которые не отражают клинические особенности и реальность ситуации в полной мере. Потому расшифровкой, интерпретацией должен заниматься врач.
У детей
В данном случае нужно вести расчет не только по годам, но и по дням, месяцам, в зависимости от возраста ребенка.
| Момент жизни | Нормы нейтрофилов в процентом отношении |
|---|---|
| Момент рождения | 59-60% |
| 12 часов | 65-68% |
| 1-е сутки | 60-61% |
| 7 дней | 40-43% |
| 2 недели | 39-40% |
| 1 месяц | 35-38% |
| 6 месяцев | 30-32% |
| 1 год | 30-31% |
| 2 года | 30-33% |
| 4 года | 40-42% |
| 6 лет | 49-51% |
| 8 лет | 50-53% |
| 10 лет | 50-54% |
| 11-18 лет | 52-55% |
Резкое увеличение в первые дни обусловлено активным формированием иммунитета и появлением в агрессивной внешней среде. Затем наблюдается постепенная адаптация, все приходит в норму после первых нескольких лет жизни.
Абсолютные показатели дают примерно такие же результаты в пропорции.
Естественные причины повышения
Далеко не всегда рост концентрации нейтрофилов (сдвиг лейкоцитарной формулы вправо) имеет аномальное происхождение. Хотя это и справедливо для большинства возможных клинических ситуаций.
Если говорить о естественных факторах, они будут такими:
- Беременность. Гестация создает большую нагрузку на организм матери, усиливаются и все иммунные процессы. Что в конечном итоге и становится провокатором роста уровней в лабораторном исследовании. Это не опасно, потому как ответ ложный. Однако на всякий случай нужно проверить остальные показатели. Возможна вялая манифестация патологии.
- Родоразрешение.
- Менструальный цикл и период прямо до него. Естественные ежемесячные процессы созревания и выхода яйцеклетки организм рассматривает как интенсивный стресс. Итогом становится ложная иммунная реакция. Опасности это так не несет, необходимо дождаться окончания периода и все придет в норму самостоятельно.
- Физическая нагрузка. Чем она более интенсивна, тем существеннее будут отклонения в показателях нейтрофилов. Уровни возвращаются в адекватные рамки без медицинской помощи и вообще внешнего влияния.
- Потребление большого количества пищи. В целом, еда вызывает временное повышение концентрации форменных клеток. Связь прямо пропорциональная. Все приходит в норму спустя несколько часов.
Стрессы сказываются на показателях тем же самым образом. Это касается и любых эмоциональных проявлений.
Патологические факторы роста концентрации нейтрофилов
Норма нейтрофилов в крови изменяется в основном по аномальным причинам. Если говорить о конкретных состояниях:
- Воспалительные процессы. Встречаются двух видов. Инфекционные. Наиболее многочисленная группа. Для них типично попадание в организм инородных структур. В конечном итоге, повышение уровней нейтрофилов и не только — это адекватный и правильный ответ организма на атаку извне.
Несколько сложнее обстоит дело со вторым подвидом патологического процесса. Когда развивается аутоиммунный ответ. Воспалительные явления подобного рода характеризуются отсутствием как такового возбудителя. Тело атакует себя, собственные же клетки.
Это результат сбоя иммунной системы. Нейтрофилы не выполняют полезной функции, однако повышение очевидно.
- Эндокринные расстройства. В основном те, которые провоцируют выраженные нарушения обмена веществ. Лидером этой группы считается сахарный диабет. Сюда же можно включить патологии щитовидной железы, надпочечников. Самых разных типов.
- Злокачественные опухоли. Независимо от локализации и вида. Особенно растут показатели нейтрофилов, если нарушается работе костного мозга. Метастазы или первичные неоплазии, роли это в контексте определения причин уже не играет.
- Кроме собственно заболеваний, называют ятрогенный фактор. То есть всевозможные травматичные хирургические вмешательства. Изменение уровней сохраняется на протяжении всего периода реабилитации. Только затем сходит на нет.
Есть и несколько исключений из правил. Если нейтрофилы при явном патологическом процессе находятся в рамках нормы, это не естественно. Речь идет о слабости работы иммунной системы, необходимо проводить лечение основного заболевания как можно быстрее.
Причины понижения
Факторов сдвига лейкоцитарной формулы влево также немало.
- ВИЧ. Огромная проблема. Патологический процесс провоцирует угнетение всей иммунной системы. В данном случае даже на фоне реальной угрозы, поражения организма роста показателей не будет вообще. Напротив, они окажутся понижены. Необходима поддерживающая терапия.
- Апластическая анемия. Сопровождается нарушением синтеза всех возможных форменных клеток крови. Лейкоциты разных типов здесь не исключение. Без специального лечения вероятны потенциально смертельные осложнения. Необходимо быстрее предпринимать действия.
- Тяжелые инфекционные процессы. В данном случае растет потребность в форменных клетках для активной борьбы. Организм может не успевать продуцировать новые, отсюда временное падение.
- Общая слабость всех систем. Нейтрофилы ниже нормы, если человек в недавнем прошлом перенес тяжелые заболевания или недополучает питательных веществ.
- Алкоголизм в анамнезе. То же самое касается любителей обильно выпить. Концентрация нейтрофилов меньше адекватных значений, поскольку синтез таковых подавляется продуктами распада этанола. Сказывается и общее истощение организма подобных людей.
- Гепатит. Воспалительный процесс со стороны печени. Имеет инфекционное, в частности вирусное происхождение.
- Сепсис. Генерализованное поражение организма.
- Лучевая болезнь.
- Интоксикации. При отравлении некоторыми ядами. Также подобным образом сказывается группа препаратов. Возможность такого побочного явления отражена в аннотациях к конкретным фармацевтическим средствам.
Все причины и механизмы развития нейтропении (малой концентрации нейтрофилов) описаны в этой статье.
Причины повышения одних клеток и снижения других
Нужно учитывать и другие факторы роста или уменьшения показателей. Это касается естественных, закономерных явлений, обусловленных физиологией. Форменных клеток, призванных бороться с атаками извне множество. В данном случае возможно несколько ситуаций.
- Нейтрофилы повышены, а лимфоциты понижены. Идет первая фаза устранения инородных структур. Пока еще центральный иммунитет недостаточно активен, да и потребности в этом нет. При эффективности, изменения в лабораторных показателях далее будут не столь существенными.
- Если нейтрофилы понижены, а лимфоциты завышены — это говорит о второй фазе ответа защитных сил. Когда центральные клетки начинают работать более активно, а структуры местного уровня временно снижают интенсивность деятельности.
Если не вдаваться в сложные биологические механизмы, стоит сказать об общем правиле: при повышении нейтрофилов снижаются лимфоциты и наоборот. Это нормально и закономерно. Одновременного роста или падения не наблюдается.
Какие обследования нужны дополнительно
Обычно для констатации факта повышения уровня нейтрофилов достаточно общего анализа крови. Он показывает довольно развернутую картину по форменным клеткам.
Но этого мало. Чтобы разобраться в ситуации и помощь пациенту основная задача заключается в выявлении первопричины нарушения. Это несколько сложнее и требует вспомогательных исследований.
- Устный опрос. Позволяет оценить жалобы человека на состояние. Симптоматический комплекс дает представление о первичном очаге инфекции или прочих факторах отклонения.
- Сбор анамнеза.
- Рентгенография органов грудной клетки.
- Визуальная оценка состояния ротоглотки и ЛОР-органов вообще.
- Изучение показателей биохимии.
- УЗИ брюшной полости.
По потребности назначаются прочие мероприятия. Все зависит от гипотез, высказанных специалистом. Профильных врачей здесь может быть несколько, потому как речь не о конкретном диагнозе, а о лабораторной находке. В первую очередь имеет смысл обращаться к терапевту (педиатру).
Лечение
Коррекция определяется конкретной причиной патологического процесса. Задача не в том, чтобы искусственными методами поднять нейтрофилы в крови, необходимо устранить источник проблемы. Практикуется медикаментозная терапия.
При инфекционном генезе расстройства применяются следующие средства:
- Антибиотики. Разных типов.
- Стимуляторы синтеза лейкоцитов. Лейкоген и прочие. С осторожностью.
- Местные антисептические препараты.
Если речь об аутоиммунных реакциях:
- Супрессоры. Для угнетения активности защитных сил.
- Глюкокортикоиды. Преднизолон и аналогичные.
- Возможно применение прочих. По потребности и назначению лечащего специалиста.
Количество нейтрофилов в крови показывает, в том числе и эффективность терапии, потому можно исследовать качество проводимой коррекции по этому критерию.
В остальном же методики зависят от клинической ситуации. Сахарный диабет требует контроля глюкозы, злокачественные образования — хирургического лечения и т.д.
Прогноз
В основном — благоприятный. Необходимо бороться с причиной изменений как можно раньше. Это позволит добиться лучших перспектив.
Нейтрофилы — важная часть иммунной системы. Любые отклонения нужно рассматривать как потенциальную угрозу организму. Лечение проводится по потребности. Выбор методики ложится на врачей нескольких смежных специальностей.
Сегментоядерные нейтрофилы повышены у взрослого и ребенка: причины и лечение
Форменные клетки крови, известные как лейкоциты, неоднородны по своему характеру. При этом они составляют огромное число от общей массы подобных структур. Выполняют важную функцию защиты организма от пагубного влияния извне.
Именно они выступают той оборонительной силой, которая не пропускает ни вирусы, ни бактерии, ни грибки. Порой также случаются сбои и иммунные клетки начинают атаковать здоровые ткани. Так, например, развивается аллергия. Но это несколько иная тема.
Что же касается лейкоцитов, их можно разделить на две большие группы:
- Гранулоциты. Имеют четко оформленное ядро. Выполняют задачу первичной иммунной реакции. То есть, как только патогенные структуры проникают в организм, отвечают именно они.
- Агранулоциты. Лимфоциты и некоторые другие. Вступают в «бой» вторыми. Ответственны за формирование стойкого и длительного, пожизненного иммунитета к тому или иному заболеванию.
Сегментоядерные нейтрофилы — это гранулоциты, которых в крови больше всего. Согласно исследованиям, число таких форменных клеток варьируется от 65 до 75% от общей массы лейкоцитов, белых кровяных телец вообще.
Показатели сегментоядерных клеток очень чувствительны к любому отклонению в работе организма. Будь то инфекционное или аутоиммунное воспаление, потому анализ дает информативные сведения, от которых можно оттолкнуться при дальнейшей диагностике.
Как правило, корректировать показатели сегментоядерных нейтрофилов не нужно. Это следствие, а не причина.
Бороться необходимо с первичным фактором-провокатором. Это и будет основа качественной, грамотной терапии.
Нормы нейтрофилов и их функции
Если не конкретизировать отдельные уровни у мужчин и женщин по возрастам (они описаны здесь), средняя цифра форменных клеток составит от 51 до 60% от общей массы белых кровяных телец.
Еще примерно 7-10% приходится на незрелые формы структур. Так называемые палочкоядерные нейтрофилы, которым только предстоит войти во «взрослую», функционально активную жизнь.
Основная задача форменных клеток, белых кровяных телец этого типа, связывать антигены, бороться с патологическими структурами, будь то бактерии или иные нарушители. Большую роль эти тельца играют в устранении глистных инвазий, также в развитии аллергической реакции.
Лабораторная, искусственная функция заключается в маркировании воспалительных процессов, онкологических явлений и прочих патологических состояний, речь о которых пойдет далее.
Причины повышения
Рост количества сегментоядерных нейтрофилов, как правило, наблюдается в следующих случаях:
Инфекционно-воспалительные процессы
Классика жанра. Сюда стоит отнести все возможные расстройства, которые касаются проникновения в организм инородных агентов. Бактерий, вирусов или грибков.
Интенсивность повышения клеточных структур, скорость и конечный объем лейкоцитов зависят от конкретного расстройства. Чем сильнее заболевание, чем больше аномальных агентов и продуктов их жизнедеятельности, тем выше уровень нейтрофилов.
Симптоматика зависит от патологического процесса. В общем случае, всегда присутствуют такие отклонения от нормы:
- Повышение температуры. До каких пределов — нужно смотреть по ситуации.
- Слабость.
- Сонливость.
- Ощущение выраженной усталости.
- Проявления интоксикации организма: тошнота, головная боль.
Плюс-минус. Все определяется диагнозом. - Есть и очаговые признаки патологического процесса. Если это тонзиллит — боли в горле. Пневмонии, бронхиты — одышка, дискомфорт в груди и так далее.
Лечение специфическое, проходит под наблюдением терапевта и профильного специалиста (зависит от болезни).
Назначаются антибиотики, противовирусные, иммуномодуляторы, противовоспалительные средства, жаропонижающие, чтобы сбить температуру.
Далее курс лечения корректируют, исходя из динамики состояния пациента. Это касается и дозировок, и самих наименований препаратов.
Аутоиммунные воспаления
Встречаются не менее часто, но кардинально отличаются от инфекций. В этом случае патогенных структур нет и в помине. Организм начинает реагировать на собственные ткани, клетки неадекватно и атакует их.
В этом процессе участвуют и сегментоядерные нейтрофилы, также базофилы, эозинофилы. Все форменные клетки иммунной системы.
Наиболее часто встречаются такие диагнозы:
- Ревматоидный артрит.
- Поражение миокарда.
- Красная волчанка.
И много чего еще. Сюда же можно отнести и аллергические реакции, о них речь пойдет ниже.
Лечением занимаются ревматологи, иммунологи. Назначают глюкокортикоидные средства. В качестве начальной точки используют Преднизолон.
Далее силу препарата варьируют, исходя из сути патологического процесса, его тяжести.
В самых крайних случаях, если состояние резистентно и не реагирует на терапию, применяют иммуносупрессоры. Они угнетают выработку клеток защитных сил и тем самым устраняют негативное воздействие.
Сепсис
Встречается на фоне длительно текущей инфекции, либо открытой травмы. Второе, не совсем точное название этого патологического состояния — заражение крови.
На самом деле, речь идет о генерализованном воспалительном процессе. Он охватывает все тело целиком, страдают системы, органы. Если ничего не предпринять, велика вероятность быстрого летального исхода.
Сегментоядерные нейтрофилы повышены, чтобы устранить бактерии, вирусы, грибки, продукты их жизнедеятельности, замедлить воспалительный процесс и хоть как-то достичь состояния равновесия. Потому рост существенный, хорошо заметный и стремительный.
Внимание:Сочетание скорости и высоких показателей часто говорит или о сепсисе или о гангрене.
Лечением занимаются инфекционисты. На первое время пациента приходится помещать в реанимацию, чтобы оказать пострадавшему тщательную медицинскую помощь и обеспечить присмотр: состояние может ухудшиться в любую минуту.
Назначают ударные дозы антибиотиков, также препараты группы противовоспалительных, медикаментов от вирусов, грибков.
Даже этих мер порой недостаточно. Прибегают к аппаратному очищению крови методами плазмафереза. Но это скорее вспомогательная мера.
Вводят регидратационные растворы, назначают инфузионную терапию, чтобы быстрее вывести продукты жизнедеятельности аномальных агентов, токсины из структур организма.
Прогнозы туманны даже при качественном лечении. Все зависит от момента начала коррекции.
Злокачественная онкология
Нередко причина повышения сегментоядерных нейтрофилов заключается в отравлении организма продуктами распада опухоли: форменные клетки, лейкоциты выступают своего рода мусорщиками, которые утилизируют отработанные вещества, частицы. К таковым относятся и погибшие злокачественные клетки.
Ожидать разрушения опухоли можно начиная со второй-третьей стадии патологического процесса. Поскольку цитологических структур становится так много, что на всех «еды» уже не хватает. Часть клеток гибнет от «обжорства», другая — от дефицита питания. Суть в одном — распад тканей и отравление всего организма.
Кстати говоря, отсюда регулярное или даже постоянное повышение температуры тела, слабость, сонливость, симптомы общей интоксикации, резкое похудение и прочие «прелести» этого состояния.
Что же касается нейтрофилов, их концентрация растет параллельно увеличению опухоли. Чем дальше он зайдет, тем хуже станет пациенту.
Термические травмы
Повышение сегментоядерных нейтрофилов в крови встречается при массивных ожогах, поскольку в русло выходят продукты разрушения белка, которые располагался в толще дермы. «Мусор» нужно убирать. На эту работу как раз и выходят гранулоциты.
Чем больше площадь поражения, тем хуже обстоит дело в целом. Но проблема не в этом. Если ничего не предпринять, очень вероятны летальные осложнения для пациента.
При ожогах более 20% тела, есть огромная вероятность следующих проблем:
- Почечной недостаточности от обилия белка.
- Остановки сердца из-за перегрузок.
- Инфаркта.
- Комы.
Чтобы этого не произошло, пациента помещают в ожоговое отделение или реанимацию. Зависит от состояния. Но гарантий выживания не дает никто.
Аллергические реакции
Сегментоядерные нейтрофилы повышаются из-за аутоиммунного ответа, ложной атаки собственных защитных клеток на ткани организма. Объективных причин этому нет.
Как правило, аллергия развивается на пищевые красители, естественные пигменты природного происхождения, частички пыли и прочие безобидные вещества.
Обычно подобное — результат гиперсенсибилизации организма. Повышения чувствительности до предела после перенесенной инфекции.
Аллергии могут проявляться по-разному. В одних случаях — это банальная кожная сыпь, крапивница. В других — анафилактиеский шок, отек Квинке. То есть очень опасные, потенциально смертельные нарушения.
Лечением пациентов занимаются врачи-иммунологи. Задача в том, чтобы восстановить нормальную чувствительность организма, снизить степень сенсибилизации.
Назначаются кортикостероиды вроде Приднизолона. Как и в прочих случаях, могут потребоваться иммуносупрессоры. К счастью, это относительно редкий вариант.
Внимание:Полностью вылечить аллергию невозможно. Остается купировать обострения и не допускать рецидивов патологического процесса.
Паразитарные инвазии
Проще говоря, глисты. Не обязательно в классическом понимании. Те, которые располагаются в кишечнике. Есть разные черви.
- Одни предпочитают печеночные протоки (лямблии, сосальщики).
- Другие, вроде эхинококков, и вовсе селятся в легких, головном мозге, также в структурах пищеварительного тракта.
- Описторхисы, водящиеся в речной рыбе, могут потенциально заполонить любой орган, который достаточно снабжается кровью. Даже человеческий глаз. Вариантов много.
Как бы то ни было, паразиты выделяют в кровоток продукты жизнедеятельности. Это своего рода сигнал для организма начинать иммунную реакцию.
Нейтрофилы атакуют незваных гостей и уничтожают их наравне с эозинофилами, которые более приспособлены для целей борьбы с гельминтами.
Чем больше глистов, чем они активнее, тем интенсивнее и сам иммунный ответ. Нужно проверяться по части паразитарной инвазии едва ли не в первую очередь.
Лечением патологического процесса занимаются специалисты по паразитологии. Назначаются специальные препараты. Точное название подберет врач, их много и они, как правило, специфичны. То есть действуют на паразитов определенного типа и происхождения.
Настоятельно рекомендуется проходить лечение в стационаре. Поскольку при распаде глисты отравляют организм и могут спровоцировать осложнения.
Инфаркт миокарда
Как ни странно, и острое нарушение кровообращения в миокарде способно стать виновником роста сегментоядерных нейтрофилов.
Если разобраться подробнее, нет ничего необычного. Дело в том, что при этом неотложном состоянии, клетки миокарда разрушаются. Выходит накопленное вещество, известное как миоглобин. Это белок.
Как и все химические компоненты такого типа, он обладает повышенным аллергенным потенциалом. Тело реагирует на соединение как на потенциально опасное, вырабатывает больше форменных клеток.
К тому же, нужно очистить организм от продуктов распада. Эти две цели и провоцируют завышение содержания сегментоядерных нейтрофилов в крови.
Специально ничего делать не нужно. Высокие показатели форменных элементов, белых кровяных телец сойдут на нет сами, как только острое состояние минует.
Важно сконцентрировать внимание на инфаркте миокарда. Провести курс поддерживающей терапии, назначить реабилитационные мероприятия. С проблемой разбирается врач-кардиолог.
Все симптомы предынфарктного состояния подробно описаны здесь.
Тяжелые формы почечной недостаточности
В норме, именно выделительная система устраняет продукты жизнедеятельности, клеточный мусор, отработанные белки.
Если же фильтрующий парный орган не справляется, эти яды всасываются обратно в кровь и отравляют все системы. Рост концентрации нейтрофилов обусловлен рефлекторной попыткой устранить ядовитые компоненты.
Наиболее частые причины почечной недостаточности, это длительно текущие инфекционно-воспалительные и аутоиммунные процессы. Также можно назвать расстройства паразитарного типа, онкологии, анатомические изменения (опущение почки, сморщивание и прочие).
Лечением занимаются специалисты по нефрологии (не неврологии). Назначаются препараты группы мочегонных, которые стимулируют естественную работу парного органа.
Если состояние запущенное, применять их нельзя. Врачи прибегают к аппаратным методам очистки крови, гемодиализу.
Единственный радикальный и эффективный путь восстановления — это пересадка почки. Найти подходящего донора — вопрос не из легких. Потому пациенты ждут годами.
Многие не успевают с операцией, погибают раньше, чем наступит нужный момент.
Некоторые формы отравлений
Интоксикации тяжелыми металлами. Например, свинцом, ртутью. Сюда же можно отнести патологические процессы, спровоцированные летучими соединениями. Например, сернистыми испарениями или прочими агентами.
Чаще всего с подобными проблемами встречаются работники вредных химических предприятий, лица, проживающие на неблагоприятных с экологической точки зрения территориях.
Лечение специфическое. Им занимаются токсикологи или терапевты, если профильных докторов поблизости нет. Назначается курс детоксикации. Когда это возможно — специфические антидоты.
Коррекция проходит в стенах стационара, чтобы обеспечить пациенту достаточный присмотр.
Кстати говоря, к отравлениям могут привести и некоторые препараты. Например, кортикостероиды. Вероятность нужно оценивать по аннотации. Информации из инструкции по применению.
Перенесенные травмы
После любого повреждения, хоть ушиба, хоть перелома, начинается воспалительный процесс.
Так организм с одной стороны, устраняет возможную инфекцию, вторичное септическое явление. А с другой — повышает местные регенеративные способности тканей, способствует восстановлению анатомической целостности.
В этом процессе участвуют, в том числе, и гранулоциты. В частности — нейтрофилы. Степень роста зависит от сути патологического состояния.
Ушиб практически не спровоцирует изменений. Чего нельзя сказать об открытой ране, обширном повреждении тканей.
Лечение проходит под контролем травматолога, хирурга.
Необходимы специфические меры: оперативные или консервативные. Вопрос остается на усмотрение докторов.
Это основные, но далеко не все возможные провоцирующие факторы.
Причины у детей
У пациентов младшего возраста перечень заболеваний будет примерно таким же. Есть некоторые дополнения. Ряд состояний встречаются только у молодых больных, и проявляется сразу же.
Детские инфекционные болезни
Скарлатина, краснуха, ветряная оспа, коклюш, свинка (паротит) и много чего еще.
Принципиальным образом от инфекционных прочих патологий они не отличаются. На борьбу с инородными агентами спешат все белые кровяные тельца.
Восстановлением занимаются педиатры. Назначаются антибиотики в строго выверенных дозировках. Средства противовоспалительного ряда, также препараты от вирусных поражений, жаропонижающие. Прописывается индивидуальный режим.
Показан регулярный контроль состояния.
Врожденные нарушения работы костного мозга
Сегментоядерные нейтрофилы у ребенка могут быть повышены в результате гиперфункции костного мозга, когда форменных клеток вырабатывается слишком много: в том числе и лейкоцитов в разных вариациях.
Это, как правило, генетически обусловленное расстройство. Оно с трудом поддается коррекции. Остается только бороться с симптоматикой.
Назначаются кортикостероиды и иммуносупрессоры. Часто заболевание протекает периодами. Нарушение сменяется ремиссией и так по кругу. Нужно постоянно наблюдаться у врача-гематолога.
Дополнительные обследования
Показатели нейтрофилов выявляются с помощью общего анализа крови. Но этого недостаточно. Важно установить этиологию болезни.
Тактика включает в себя такие базовые мероприятия:
- Опрос пациента на предмет жалоб, симптомов.
- Сбор анамнеза.
- Биохимия венозной крови.
- Анализ на гормоны.
- ЭКГ, ЭХО.
- УЗИ брюшной полости, в том числе почек.
- Исследование кала на яйца гельминтов.
- Серологические тесты, ИФА, ПЦР, бактериологические посевы. Чтобы выявить инфекции.
- МРТ при подозрениях на рак, онкологию.
- Исследование мочи.
- Сцинтиграфия, радиоизотопное изучение состояния почек.
- Аллергические тесты.
И это далеко не все. Многое зависит от предположений врача.
Повышение сегментоядерных нейтрофилов — неспецифическое лабораторное нарушение, которое встречается и при инфекциях, и при аутоиммунных проблемах, и даже при раке. Перечень состояний широкий.
Нужно выявить виновника и устранить его. Тогда и показатели лейкоцитов придут в норму.
Нейтрофилы — роль клеток, функции, формы, нормы и отклонения
Нейтрофилы (NEUT) являются одним из видов белых кровяных клеток. Им отводится особое место, так как по причине своей многочисленности данные клетки стоят во главе перечня звена лейкоцитов из гранулоцитарного списка.
Что это такое?
Без участия нейтрофилов не проходит ни один воспалительный процесс в человеческом организме. Дело в том, что гранулы этих белых клеток содержат бактерицидные вещества, а их мембраны содержат в себе рецепторы, чувствительные к иммуноглобулинам. Такой состав дает им возможность объединять антитела определенной специфичности.
Главной характеристикой нейтрофильных клеток считается их способность к выполнению фагоцитоза. Эти клетки первыми достигают очага воспаления и сразу же стараются ответить на действия «врага». Только одна нейтрофильная частица способна мгновенно поглотить до тридцати бактерий, опасных для человеческого здоровья.
Функции и задачи
Чтобы доступно разобрать функции данных частиц иммунитета, стоит для начала выделить два значимых аспекта:
- Это клетки, жертвующие собой. Когда на пути попадается вредная бактерия, нейтрофил ее поглощает (процесс фагоцитоза). Затем происходит расщепление чужеродного элемента внутри клетки (лизис), после чего отважный «боец» погибает вместе с вредителем.
- Эти белые клетки характеризуются определенными этапами созревания. Их всего шесть. На первых четырех стадиях они пребывают в костном мозге. На следующих двух этапах выходят в кровяное русло и выполняют свои прямые функции. Появление в крови клеток, находящихся на ранних стадиях созревания становится признаком тяжело протекающего инфекционного заболевания или нарушения функции кроветворения. Анализ крови показывает количество нейтрофилов в крови и появление в ней незрелых форм, что называется сдвигом лейкоцитарной формулы влево является важным диагностическим критерием.
Формы клеток по уровню зрелости
Выделяют такие виды нейтрофильных клеток:
- первичные клетки – миелобласты,
- промиелоциты (в клетках появляются гранулы),
- миелоциты,
- метамиелоциты,
- палочкоядерные гранулоциты,
- сегментоядерные гранулоциты.
Зрелые сегментоядерные первыми начинают нейтрализовать инфекционных агентов. Обычно их действий хватает для полного подавления болезни. Однако при тяжелом течении инфекции кровь берутся защищать палочкоядерные клетки, а затем и незрелые миелоциты и метамиелоциты. Они в нормальном состоянии полностью созревают в костном мозге, поэтому в здоровом организме их вовсе нет в крови.
Внимание! В случае тяжелой болезни сегментоядерные частицы гибнут в первую очередь, а если организму не удается произвести новые клетки, то в крови будет мало зрелых гранулоцитов и много юных клеток. По такому показателю и выявляется сдвиг лейкоцитарного параметра в крови у женщин и мужчин.
Норма нейтрофилов в крови
Абсолютное количество нейтрофилов в норме (абс) у женщин и мужчин условно должно быть равным. А изменения общих показателей в основном определяется по возрасту.
Так как специальной строки для этих клеток в таблице результатов анализа не предусмотрено, то нормальный показатель можно определить по таким строкам: отдельно определяется норма сегментоядерных, и отдельно – палочкоядерных. Для таких видов, как метамиелоциты и миелоциты во время суммирования не определено особой роли, так как в здоровом организме данные частицы в крови не содержатся. Если они все же присутствуют в анализе, это уже говорит об отклонении.
Какие бывают сдвиги?
Для диагностики имеет значение и норма нейтрофилов в крови, и отношение всех клеток этого типа, зрелых и юных, что говорит о той или иной патологии. Разберемся, что могут показать различные отклонения от нормальных показателей, то есть повышение и снижение уровня нейтрофилов у взрослых.
Соотношение с лимфоцитами
Содержание в крови нейтрофилов и лимфоцитов определяется по возрасту. Оба вида клеток постоянно взаимодействуют друг с другом. Нейтрофилы считаются одной из составляющих иммунитета клеток. Они первыми отправляются бороться с бактериями. При этом анализ крови показывает лейкоцитоз, так как повышены нейтрофильные гранулоциты, в то время как абс количество лимфоцитов понижается.
Выполнив свою задачу, нейтрофильные гранулоциты погибают. От них остается только гной. А новые «бойцы», младшие по возрасту, стремятся их заменить. В дальнейшем, вместе с прочими нежелательными веществами (разрушенными клетками) отмершие лейкоциты убираются так называемыми «дворниками», то есть моноцитами.
Это не позволяет судить о том, что защитные клетки перестали принимать участие в борьбе с воспалением, просто их становится меньше. Кроме того, в это время вступают в действие клетки центрального иммунного звена – лимфоциты. Они начинают активно размножаться, растет их общее количество (абс), а общий процент нейтрофилов, соответственно, снижается. Когда заканчиваются процессы борьбы с заболеванием, оба вида клеток снова приходят в норму. Вывод: при остром инфекционном процессе первым повышается уровень нейтрофилов, затем он снижается, и растут лимфоциты, которые продолжают бороться с заболеванием.
Как созревают защитные клетки?
Они начинают формироваться в костном мозге. Самая первая стадия – это миелобласт. Затем гранулоциты проходят этапы созревания до той стадии, когда они способны покинуть свое место рождения. Эти клетки показываются в анализе по возрасту – палочкоядерные и сегментоядерные лейкоциты. Это пятая и шестая стадия развития.
Наименование «сегменты» и «палочки» нейтрофильные лейкоциты получили благодаря структуре и виду ядра. У палочек ядро имеет продолговатую форму, а у сегментов оно делится на доли (3-5 штук). Когда созревшие «защитники» выходят из костного мозга, они делятся на две части: одна группа клеток после сегментации отправляется «на свободу», чтобы всегда быть начеку, а вторая группа остается в резерве, прикрепляясь к эндотелию.
За что отвечают резервные клетки? Свои функции они выполняют за пределами сосудов, а кровяное русло они применяют только в качестве маршрута к очагу воспаления. Однако при необходимости запасные клетки отреагируют стремительно и тут же включаются в защитный процесс.
Самой большой фагоцитарной активностью характеризуются зрелые гранулоциты, но в случае тяжелых инфекций их деятельности недостаточно. Тогда на помощь инфильтрацию нейтрофилами воспаления выполняют их запасные «сородичи», которые долгое время ждали своей участи в костном мозге в юных формах. Так происходит ядерный сдвиг влево.
Нейтрофильные клетки перемещаются, как амебы, за счет этого они, двигаясь по стенкам капилляров, не просто циркулируют непосредственно в крови, но и в случае надобности покидают кровоток, отправляясь к очагам воспаления.
Превышение нормы
Если количество нейтрофилов в крови превышает норму, то это состояние называется нейтрофилезом или нейтрофилией. Данное явление связано с защитой организма от дальнейшего распространения воспаления или очага инфекции. Обычно нейтрофилез возникает на фоне повышения общего количества лейкоцитов (лейкоцитоза).
Причины повышения общего индекса:
- Бактериальные инфекционные поражения с воспалительным и гнойным процессом (ангина, синусит, отит и пр.).
- Прогрессирование процессов отмирания ткани (в случае ожогов, гангрены, инсульта и пр.).
- Наличие злокачественного образования с распадом (опухоли пищеварительной системы).
- Интоксикация организма (при уремии, кетоацидозе).
- Наличие гематологической болезни (миелофиброз, миелолейкоз, эритема).
- Алкогольные отравления.
- Последствия вакцинации.
- Побочные эффекты гистаминных препаратов.
Читайте также: Сегментоядерные нейтрофилы повышены – причины отклонений, методы диагностики и расшифровка результатов
Пониженный уровень
Пониженный процент нейтрофилов – это нейтропения. Данное состояние может быть спровоцировано:
- Тяжелыми и долгими болезнями, во время которых число патогенных бактерий настолько велико, что во время их нейтрализации погибло чрезмерное количество нейтрофильных клеток. При этом организм пациента истощается.
- Сбоями в работе костного мозга, вызванными органическими или функциональными проблемами, отчего ограничивается количество производимых защитных клеток.
- Болезнями крови, разрушающими нейтрофильные клетки.
- Развитием вирусных и инфекционных заболеваний.
- Развитием ВИЛ-инфекций.
- Долговременным приемом некоторых видов лекарств и появлением побочных эффектов. Среди таких медикаментов можно выделить сульфаниламиды, анальгетики, цитостатики.
Нейтропения может иметь три стадии, в зависимости от тяжести заболевания:
- легкую,
- среднюю,
- тяжелую.
С учетом данного показателя косвенно можно определить степень заболевания, протекающего в организме.
Понижение нейтрофилов в крови иногда бывает непродолжительным и временным. Данное явление возможно во время проведения противовирусного лечения (приема иммуноглобулинов). После приема лекарственных средств этот состояние проходит само собой.
Если пониженное количество нейтрофильных клеток не нормализуется в течение трех дней, то увеличивается вероятность инфицирования. Так что нужно обязательно выявить причину изменения числа и начать своевременное лечение, которое поможет восстановить равновесие.
Норма должна быть достигнута в течение недели. Если этого не происходит, при отсутствии других симптомов, это может стать сигналом о развитии заболевания системы кровообразования, полисегментации нейтрофилов и прочих дегенеративных изменениях. Такое состояние может стать угрозой для здоровья и дальнейшей жизни пациента.
Загрузка…что это такое, за что отвечают, норма, как поднять уровень
Нейтрофилы в крови отвечают преимущественно за защиту внутренних органов, мышц, костей и иных структур организма от атаки болезнетворных агентов, в роли которых могут являться как бактерии и вирусные элементы, так и паразитарные одноклеточные формы грибков.
Дать объективную оценку количественного содержания «солдат» иммунной системы может анализ капиллярной крови (берут его из безымянного пальца). Благодаря этому исследованию врачи обрели возможность вовремя выявлять целый спектр заболеваний, способных нанести существенный ущерб человеческому здоровью.
Немного о нейтрофилах
Нейтрофильные элементы делятся на два основных типа – палочкоядерные и сегментоядерные. Первая группа объединяет в себе молодые лейкоцитарные клетки с одиночным ядром, внешне напоминающим немного согнутый прутик, подковку или утолщенный стержень. Подавляющая часть таких компонентов крови (свыше 90%) находится в чертогах костного мозга, в котором и была сформирована.
Там юные нейтрофилы дожидаются периода созревания, затем выходят из «родного дома» с целью патрулирования организма, дожидаясь очередной попытки внедрения патогенов. Сегментоядерные гранулоциты представляют собой взрослые клеточные структуры, снабженные уже фрагментированным ядрышком: оно будто разделено узенькими перешейками на несколько частей.
Данным кровяным тельцам свойственны крайне важные функции:
- Беспрепятственное и быстрое перемещение по организму. Активное движение осуществляется за счет амебовидной формы.
- Хемотаксис. Каждая защитная клетка обеспечена особым сенсором, который указывает точно на место расположения инородных частиц. Речь идет практически о микроскопических навигаторах.
- Захват вредоносных элементов. Без каких-либо осложнений нейтрофилы сцепляются с поверхностью возбудителей заболеваний и «притягивают» к себе.
- Фагоцитоз. Гранулоциты обхватывают крошечных врагов своими ложноножками с дальнейшим поглощением содержимого.
- Ликвидация опасности. За счет активации ферментов нейтрофилы переваривают патогены и подобным образом «разминируют» их.
- Собственная гибель. Как только лейкоцитарная клетка исчерпает свой ресурс, она автоматически прерывает свое существование.
- Постсмертная помощь. После фактической смерти нейтрофилы окончательно выделяют в окружающую среду цитокины, которые оказывают в дальнейшем антибактериальное действие.
Этот идеально продуманный процесс на регулярной основе оберегает человеческий организм от разрушительного воздействия и гибели. Если происходит внедрение через биологические барьеры вредоносных элементов, «в бой» вступают сначала зрелые гранулоциты, а при необходимости содействия из костного мозга «по зову сородичей» прибывают палочкоядерные лейкоциты.
Схематическое строение сегментоядерного нейтрофила
Количество таких телец в крови показывает состояние организма, акцентируя внимание специалистов на воспалениях, некрозах, грибковых инфекциях и т. д. Часто крайне тяжелые процессы деформируют нейтрофилы, например, запущенный лейкоз может приводить к набуханию гранул – такой процесс именуется токсичной зернистостью и хорошо виден в микроскоп.
Когда проводят анализ
Анализ крови на нейтрофилы обычно сдается при выявлении у пациента странных и, на первый взгляд, необъяснимых симптомов. К подобной группе относится довольно много признаков, поэтому будут перечислены только наиболее часто встречающиеся из них:
- Подозрение на отравление ядами или тяжелыми металлами.
- Наличие любой разновидности анемии.
- Ноющие боли, локализующиеся в мышцах, костях и суставах.
- Общая слабость.
- Склонность к обморокам.
- Потеря состояния равновесия.
- Затяжная депрессия в совокупности с необъяснимой агрессивностью.
- Регулярные повышения температуры тела.
- Сыпь на поверхности кожи.
- Появление гематом, не связанных с механическими повреждениями.
- Резкое похудение.
- Опухание лимфатических узлов.
- Учащенное сердцебиение.
- Подозрительный оттенок мочи.
- Сонливость.
- Головокружение.
- Затрудненные глотательные функции.
- Сильная жажда, которую невозможно утолить.
Если лечащий врач подозревает наличие у пациента тканевого некроза или воспалительных заболеваний, он незамедлительно выдает направление на анализ крови, который следует сдать как можно скорее. Длительные заживления царапин и мелких порезов являются серьезным основанием для проведения гематологического исследования на нейтрофилы.
Людям, которым провели операции, анализ крови делают обязательно с целью постоянного мониторинга их состояния.
Что представляют собой нормы нейтрофилов в крови?
Ознакомиться с относительным числом гранулоцитов, указываемым обычно в виде процентной доли каждого из его видов, можно в данной таблице:
| Возраст | Норма содержания нейтрофилов (%) | |
| Палочкоядерные | Сегментоядерные | |
| Первый день | 0,5–17 | 46–80 |
| 2–10 суток | 0,5–7 | 26–56 |
| 11–0 дней | 0,5–4,5 | 15–35 |
| До 1 года | 1–5 | 17–46 |
| 2–6 лет | 1–5 | 30–59 |
| 7–9 лет | 1–5 | 39–60 |
| 10–12 лет | 1–5 | 43–62 |
| 13–15 лет | 1–5 | 45–65 |
| 16+ | 1–6 | 46–72 |
Как у мужчин, так и у женщин наблюдается равное число нейтрофильных клеток, следовательно, оно не имеет зависимости от половой принадлежности человека. Теперь можно изучить цифирные показатели, предполагающие подсчет гранулоцитов в определенном количестве крови. Абсолютные параметры приведены в таблице:
| Возраст | Референтные значения нейтрофилов (×10⁹) |
| До 1 года | 1,5–8,5 |
| 2–6 лет | 1,5–8,6 |
| 7–12 лет | 1,8–8,0 |
| 13–16 лет | 1,8–7,5 |
| 17+ | 1,8–6,5 |
У женщин, ожидающих появление ребенка, показатель может спокойно повыситься до 7–10×10⁹, что является их собственной нормой. В бланке часто встречаются следующие аббревиатуры:
- Относительные гранулоциты – нейтрофилы (отн), NE% и NEUT%.
- Абсолютные гранулоциты – нейтрофилы (отн), NE# и NEUT#.
Нельзя не упомянуть о том, что нейтрофильные лейкоциты иногда указывают в виде 4 разновидностей, среди которых миелоциты, юные, палочки и сегменты. Содержание двух последних типов уже было рассмотрено, поэтому необходимо обратить внимание на первые значения. Эти клеточные элементы являются ранними видами нейтрофилов: находятся таковые исключительно в красном костном мозге до полноценного взросления.
Следовательно, их количество таково: миелоциты – 0%, юные – 0–1% (в индивидуальных случаях небольшое превышение не считается опасным). Качественную расшифровку результатов анализа крови может провести только компетентный врач. Самостоятельная постановка диагноза крайне нежелательна.
Почему гранулоциты повышены?
Увеличение гранулоцитов свойственно немалому числу недугов, среди них:
- Сепсис (заражение крови).
- Ревматоидный артрит.
- Инфаркт и инсульт.
- Клещевой энцефалит.
- Аскаридоз.
- Пищевая аллергия.
- Язва желудка.
- Почечная недостаточность.
- Подагра.
- Пневмония.
- Псориаз.
- Крапивница.
- Анемия.
- Болезнь Вакеза-Ослера (разрастание кровяных телец – эритроцитов).
- Нефропатия (поражение почечных клубочковых аппаратов).
Переедание за несколько часов до исследования также способно поднять количественное содержание гранулоцитов
Повысить нейтрофилы в крови могут и грибковые заболевания, например, рубромикоз, микроспория, а также отрубевидный и стригущий лишай. Опухолевидные образования на последней стадии часто провоцируют нейтрофилию. Повышенные нейтрофилы наблюдаются и при острых воспалениях – панкреатите, аппендиците, тромбофлебите, отите, менингите, холецистите и т. д.
Даже скарлатина и ангина (тонзиллит) не являются исключением. У людей, получивших сильнейшие ожоги, в анализах крови обязательно выявится большое количество гранулоцитов. Детская нейтрофилия иногда связана с полипами, локализующимися в области носа, и с прорезыванием первых зубов.
Нередко такое состояние наблюдается во время месячных, применения лекарств (гистамина, гепарина), депрессии. Работа в условиях тяжелого труда тоже заметно отражается на результатах гематологической диагностики. Причем речь идет и о профессиях, связанных с активной умственной деятельностью и повышенным уровнем стресса.
Что означает уменьшение лейкоцитарных клеток
Недостаток нейтрофилов характерен для таких болезней:
- Брюшной тиф.
- Герпес.
- Корь.
- Гепатит вирусного типа.
- Токсоплазмоз.
- Кахексия (крайняя степень истощения организма).
- Сифилис.
- Сильная алкогольная зависимость.
- Краснуха.
- Паратиф (инфекционное поражение, вызванное сальмонеллами).
- Гемолиз (произвольное патологическое разрушение эритроцитов).
- Лучевая болезнь.
- Паротит (свинка).
- Грипп.
- Гиперспленизм (разрушение форменных элементов крови селезенкой).
К снижению или практически полному отсутствию нейтрофилов приводит значительная часть коллагенозы из группы аутоиммунных заболеваний – красная системная волчанка, дерматомиозит, синдром Когана, неспецифический аортоартериит и им подобные.
Нейтропению вызывает использование лекарств, к которым можно отнести:
- Антидепрессанты.
- Психостимуляторы.
- НПВС (нестероидные противовоспалительные средства).
- Диуретики (мочегонные).
- Анальгетики.
- Антитиреоидные препараты.
У людей с ВИЧ-инфекцией пониженные нейтрофилы встречаются особенно часто
Немалое количество случаев нейтропении можно объяснить несбалансированным питанием, пристрастием к строгим диетам, явным дефицитом витаминов группы B и прохождением лучевой терапии при борьбе с онкологией. Дополнительно о низком содержании гранулоцитов можно почитать в этой статье.
Какие специалисты могут направить на общий анализ крови
Провести анализ на нейтрофилы можно по направлению гематолога, педиатра, терапевта, дерматолога, невролога, офтальмолога, кардиолога, иммунолога, нарколога. К этой же группе врачей относятся онколог, оториноларинголог (ЛОР), эндокринолог, флеболог, специализирующийся по заболеваниям вен, и пульмонолог, в компетенцию которого входят недуги дыхательной системы.
Если тот или иной специалист обнаружит у пациента симптомы, указывающие на болезни, вызванные одноклеточными грибами, вирусами, токсинами, бактериями или паразитными червями, то только тогда он направляет человека на гематологическое исследование. Так, при выявлении соответствующих отклонений в органах мочевыделительной, половой и пищеварительной системы могут рекомендовать сдать общий анализ крови урологи, гинекологи, гастроэнтерологи, урологи, а также проктологи.
Как избежать получения ложного результата?
Избежать ненужных отклонений в содержании нейтрофилов можно, если за 2–3 дня до диагностики:
- Полностью исключить из рациона алкогольные, энергетические и газированные напитки.
- Ограничить доступ к вредной пище: кондитерским изделиям, фастфуду, полуфабрикатам и т. д.
- Избегать переохлаждения.
- Выпивать в сутки минимум 1,5 литра негазированной воды.
- Обеспечить полноценный регулярный сон.
- Свести к минимуму контакт с источниками стресса.
- Прекратить делать упор на танцы, спортивные занятия и силовые нагрузки, отдавая предпочтение размеренному режиму дня.
Дальнейшее употребление лекарств должно заранее обговариваться с лечащим врачом. Если пациенту не удалось пройти консультацию у своего доктора, то после проведения анализа необходимо сообщить специалисту перечень применяемых в момент подготовки препаратов.
За 3–4 часа до процедуры желательно отказаться от курения. Лучше всего прийти в медицинское учреждение заранее, чтобы успеть отдышаться и согреться (при похолодании на улице). В худшем случае даже такие «мелочи» вызовут высокую концентрацию нейтрофилов.
Норма и виды нейтрофилов в анализе крови
Главная функция нейтрофилов — это защита. Нейтрофилы составляют наибольшее количество не только от всех гранулоцитов, но также и от всех лейкоцитов. В каждой 1000 лейкоцитов в норме находится около 600 нейтрофилов.
Нейтрофилы также бывают различными: более молодые, только что вышедшие из костного мозга клетки, вышедшие в периферическую кровь, обладают ядром в форме палочки, а у более зрелых клеток это ядро постепенно разделяется на несколько сегментов. Этот факт имеет важное диагностическое значение.
Норма нейтрофилов в крови
В норме у человека, достигшего 15 — летнего возраста и старше, нормальное значение нейтрофилов в крови составляет от 47 до 72%.
Поэтому в том случае, если врачи говорят, что в крови должно содержаться до 70% нейтрофилов, они правы, но только с той оговоркой, что это число не должно быть меньше 50%.
Для сравнения, количество эозинофилов может составлять 1%, а его значение выше 5% является признаком патологии — чаще всего аллергической реакции или глистной инвазии.
Что касается детского возраста, то у детишек имеется некоторый «провал», и наименьшая концентрация этой разновидности лейкоцитов наблюдается в возрасте от 2 недель до года, когда нормальным является содержание нейтрофилов от 16 до 45%.
Затем этот показатель неуклонно растёт, и концентрация этого пула гранулоцитов постепенно выходят на «плато» к 15 — 16 летнему возрасту.
Причинам повышения и понижения нейтрофилов крови посвящены наши статьи: «Почему повышены нейтрофилы (нейтрофилез)?» и «Нейтропения (уменьшение числа нейтрофилов) в общем анализе крови».
Соотношение сегментоядерных и палочкоядерных нейтрофилов
В норме количество сегментоядерных гранулоцитов, или зрелых клеток, составляет 95%, а количество палочкоядерных, молодых нейтрофилов, не превышает 5%.
Так, появление в периферической крови нейтрофилов с палочковидными ядрами в большем количестве говорит о том, что по какой-то очень важной причине произошла экстренная «мобилизация» молодых клеток.
Также существуют и более молодые классы нейтрофилов, которые в норме вообще в крови обнаружить нельзя. Они находятся в красном костном мозге. Они называются юными нейтрофилами, или метамиелоцитами. Есть и совсем маленькие формы — миелоциты и даже промиелоциты.
В том случае, если они появились в крови, то это является или выраженной реакцией на микробную агрессию – например, на сепсис, либо свидетельствует о патологии красного костного мозга.
Обычно средний зрелый нейтрофил недолго находится в крови, среднее время его жизни составляет около 9 часов. Затем клетка поступает в капиллярный кровоток, а затем в различные ткани. В тканях нейтрофил живёт очень короткий срок, не более 3-4 дней. Поэтому нейтрофилы относятся к короткоживущих клеткам, и красный мозг вырабатывает их в очень большом количестве, особенно с учетом их преобладания.
Так, если сравнивать нейтрофилы с моноцитами, наиболее крупными клетками крови, а тем более с лимфоцитами, которые являются рекордсменами-долгожителями, то выясняется, что последние способны жить несколько лет, поскольку являются носителями иммунологической памяти, и хранят информацию об антигенах, с которыми организм встречался в своей жизни.
При повторной встрече это позволит очень быстро начать выработку специфических антител и побороть инфекцию. У нейтрофилов, скорее всего, никакой иммунологической памяти нет. Они являются «дружинниками», «полицейскими» в наших тканях, внутренними «амебами – хищниками», и способны быстро увеличить свою численность с помощью миграции клеток из сосудов, или из резервных запасов, которые находятся в красном костном мозге.
В том случае, если требуется срочная мобилизация, то может быть усилен гемопоэз, или выработка нейтрофилов силами костного мозга и миграция их в очаг воспаления.
«Пожирание» микроорганизмов и переваривание их — основная функция нейтрофилов. Попавший внутрь нейтрофилы микроорганизм подвергается уничтожению, поскольку нейтрофильные гранулы содержат лизосомы с протеолитическими, разрушающими белок ферментами.
Но так бывает, к сожалению, далеко не всегда. Существуют некоторые «особо изощренные» микроорганизмы, которые маскируются от нейтрофилов, и даже способны проникать внутрь их, и находиться там в безопасности, поскольку сквозь цитоплазму нейтрофилов не проникают антибиотики, которыми могут начать лечить пациента.
Такое внутриклеточное паразитирование характерно для гонококков, для хламидий, для микоплазмы и уреаплазмы. Это приводит к длительному течению инфекции, к носительству и к формированию сниженного клеточного иммунитета.
Загрузка…Роли, механизмы и последствия (Обзор)
- Авторы:
- Сюй Чжан
- Вэнь Чжан
- Сяо Юань
- Мин Фу
- Хуэй Цянь
- Вэньжун Сюй
Просмотр аффилированных лиц
Принадлежности: Ключевая лаборатория медицинской науки и лабораторной медицины Цзянсу, Медицинский факультет, Университет Цзянсу, Чжэньцзян, Цзянсу 212013, П.R. Китай- Опубликовано онлайн: 7 июля 2016 г. https://doi.org/10.3892/ijo.2016.3616
- Страницы: 857-867
Метрики: Всего скачиваний PDF: 0 (Публикации Spandidos: | Статистика PMC:)
Эта статья упоминается в:
Абстрактные
Нейтрофилы — это преобладающие иммунные клетки, защищающие хозяина от микробной инфекции.Роль нейтрофилов в опухоли долгое время игнорировалась из-за их короткой продолжительности жизни и фенотипа терминальной дифференцировки. В последние годы появляются новые данные, указывающие на то, что нейтрофилы обладают фенотипической и функциональной пластичностью. Нейтрофилы уничтожают злокачественные клетки, высвобождая антимикробные и цитотоксические компоненты в их гранулах или секретируя иммунные медиаторы для набора и активации других противоопухолевых эффекторных клеток. Напротив, факторы, происходящие из опухоли, могут преобразовывать нейтрофилы в проопухолевый фенотип.Было показано, что нейтрофилы способствуют онкогенезу, способствуют росту и метастазированию опухоли, стимулируют ангиогенез опухоли и опосредуют иммуносупрессию. Количество нейтрофилов в крови и опухолевых тканях больных раком связано с прогрессированием заболевания и исходом пациента. В этом обзоре мы суммируем недавний прогресс нейтрофилов в патогенезе рака с акцентом на поляризацию нейтрофилов. Лучшее понимание механизмов, регулирующих дихотомию нейтрофилов, не только прольет свет на их роль в развитии рака.
Нормальное и аномальное абсолютное количество нейтрофилов
Абсолютное количество нейтрофилов (АНК) измеряет количество нейтрофильных гранулоцитов в крови человека.Врачи и лаборанты рассчитывают АНК на основе количества белых кровяных телец, часто объединенного на основе процента зрелых и незрелых нейтрофилов. Незрелые нейтрофилы известны как полосы. Количество может быть слишком низким или слишком высоким из-за различных возможных состояний здоровья.
Что такое абсолютное количество нейтрофилов?
Определяется косвенно путем умножения количества лейкоцитов на процент нейтрофилов в разнице количества лейкоцитов. Нормальный диапазон для ANC — 1.От 5 до 8,0, что соответствует от 1500 до 8000 / мм3. Когда уровень пациента безопасен, это означает, что ограничивать деятельность не нужно.
Пример расчета
Количество лейкоцитов: 6000 клеток / мм3 крови
сегментов: 30% лейкоцитов
Диапазоны: 3% от числа лейкоцитов
Нейтрофилы (сегменты + полосы): 33% лейкоцитов
ANC: 33% X 6000 = 2000 / мм3
ANC 2000 / мм3, условно = 2,0
Нормальный диапазон: от 1,5 до 8,0 (от 1500 до 8000 / мм3)
Толкование: Обычный
Функции
Нейтрофилы помогают организму бороться с инфекциями.Когда нейтрофилов низкий, человек становится уязвимым для болезней и инфекций. Иногда это происходит после химиотерапии или лучевой терапии, а также после трансплантации крови или костного мозга. Со временем он должен расти по мере развития и созревания новых клеток крови.
Низкое абсолютное количество нейтрофилов
Считается, что ANC меньше 500 имеет низкий уровень. Многие вещи могут вызвать низкое количество нейтрофилов. Состояние называется нейтропенией.
Причины
- Дефицит B12 или фолиевой кислоты. Слишком мало B12 в системе вызывает истощение нейтрофилов. Когда есть дефицит, организм не может нормально функционировать.
- Тяжелая бактериальная инфекция. Тяжелые инфекции могут разрушить нейтрофилы. Обычно это происходит, когда в крови образуется гной.
- Апластическая анемия. Апластическая анемия возникает, когда наблюдается ненормальное уменьшение количества клеток в крови, обычно из-за нарушения работы костного мозга. Повреждение может быть вызвано лекарствами, радиацией или инфекцией.
- Прелейкемия и лейкемия. Лейкоз — это рак, который возникает в крови, заставляя костный мозг замещаться лейкоцитами. Прелейкемия возникает, когда наблюдается уменьшение нейтрофилов, но полномасштабного рака еще нет.
- Аутоиммунные заболевания. Это происходит, когда организм вырабатывает белки, известные как антинейтрофилы, которые разрушают нейтрофилы. Пример этого происходит у пациентов, страдающих волчанкой.
- Гиперспленизм. Это состояние вызывает аномальное увеличение селезенки и увеличение лейкоцитов. Селезенка помогает предотвратить инфекцию и удаляет старые эритроциты.
- Синдром Фелти. Этот синдром вызывает группу аномальных клеточных изменений и обычно сопровождает ревматоидный артрит. Это еще один тип иммунного расстройства.
- Кардиопульмональное шунтирование. Эта процедура может вызвать снижение количества нейтрофилов. Это операция, которая перемещает кровоток от сердца в легкие к аорте.
- Диализ. Диализ используется для поддержки функции почек. Это может вызвать низкое количество нейтрофилов.
- Действие лекарств. Некоторые лекарства вызывают снижение количества нейтрофилов. Обычно виноваты лекарства, применяемые для лечения аллергии, психоза и рвоты.
Средства правовой защиты
Для лечения нейтропении необходимо найти первопричину проблемы. После того, как выяснится, почему показатель упал, врач предложит соответствующее лечение.Варианты включают:
- Администрация. Отслеживает рост лейкоцитов в организме.
- Антибиотики. Они помогают бороться с инфекциями, вызывающими снижение нейтрофилов.
- Переливания гранулоцитов. Это вид белых кровяных телец, заполненных микроскопическими гранулами. Переливание увеличивает количество в системе.
- Кортикостероидная терапия. Есть два гормона, глюкокортикоиды и минералокортикоиды, вырабатываемые внешней частью надпочечников.Оба поддерживают здоровье нейтрофилов.
- Внутривенный иммунный глобулин. Используется при иммуноопосредованной нейтропении.
Высокое абсолютное количество нейтрофилов
Когда количество нейтрофилов превышает 8000, это считается высоким.
Причины
- Высокий уровень стресса. Количество нейтрофилов возрастает, когда организм подвергается стрессу. Это может быть вызвано физическими упражнениями, нервами или судорогами.
- Внезапная бактериальная инфекция. Начало бактериальной инфекции может вызвать повреждение или воспаление тканей, что может привести к резкому увеличению уровня нейтрофилов.
- Внезапная почечная недостаточность. Почечная недостаточность вызывает всплеск нейтрофилов.
- Кетоацидоз.
Хроническая нейтропения | Центр гемофилии и тромбоза штата Индиана
Когда количество клеток, борющихся с бактериями, хронически низкое
Нейтрофилы — это белые кровяные тельца. Они производятся вместе со всеми другими типами клеток крови в костном мозге.Костный мозг — это красная мягкая губчатая часть внутри костей.
Нейтрофилы выполняют очень специфическую задачу: выявлять и уничтожать микробы бактерий. Нейтрофилы циркулируют по всем тканям организма (ротовая полость, кишечник, кожа, легкие и т. Д.).
Нейтропения (нуклеопени-а) — это низкое количество циркулирующих в крови клеток, борющихся с бактериями. Это может увеличить риск заражения.
Нейтрофилы измеряются с помощью теста CBC (общий анализ крови). Нейтрофилы перечислены в дифференциальной части (называемой «разница») полного анализа крови.Это анализ крови для подсчета количества клеток каждого типа.
Нейтрофилы — убийцы бактерий — существуют разные типы нейтрофилов, все с немного разными функциями:
- гранулоцитов
- полиморфноядерных нейтрофилов
- сегментированных нейтрофилов
- полосчатых нейтрофилов
Нейтрофилы обычно составляют от 1/3 до 2/3 всего семейства белых кровяных телец. Другие клетки семейства белых кровяных телец, такие как лимфоциты, моноциты, эозинофилы и базофилы, не особенно полезны в борьбе с бактериальными инфекциями.
Это общее количество нейтрофилов в организме человека, которое определяет, достаточно ли борцов с бактериями, чтобы справиться с инфекцией. Этот индекс борьбы с инфекцией называется абсолютным числом нейтрофилов (АНК). Поскольку некоторые люди называют нейтрофилы гранулоцитами, вы можете услышать индекс борьбы с инфекцией, называемый абсолютным количеством гранулоцитов (AGC). ANC и AGC говорят об одном и том же: о вашей способности бороться с бактериальными инфекциями.
Нормальный ДРП для кавказцев (взрослых и детей старше двух лет) — что-либо выше 1500.Для афроамериканцев нормальный показатель выше 1000.
ANC рассчитывается путем умножения общего процента нейтрофилов (сложение всех поли / сегментов и полос / уколов) на общее количество лейкоцитов (WBC).
- Легкая нейтропения (АНК между 500 и 1000) обычно не является проблемой.
- Тяжелая нейтропения (АНК ниже 500) всегда вызывает беспокойство из-за повышенного риска бактериальных инфекций.
- Диапазон значений ANC 200-500 может включать: инфекции уха и горла, кожные фурункулы, язвы во рту, воспаленные десны или инфекции мочевыводящих путей
- ANC ниже 200 опасных и опасных для жизни инфекций.Некоторые из них включают: пневмонию, менингит, заражение крови или септический шок.
Причины
Нейтропения может быть вызвана некоторыми вирусными инфекциями или некоторыми лекарствами. В этих случаях нейтропения чаще всего носит временный характер.
Хроническая нейтропения определяется как продолжающаяся более 2 месяцев. Со временем это может исчезнуть или остаться на всю жизнь. Некоторые люди рождаются с ней (врожденная нейтропения), а у других она развивается в раннем детстве.
Циклическая нейтропения — это когда количество нейтрофилов в норме большую часть времени, но предсказуемо падает с регулярными интервалами или циклами примерно каждые три недели.
Доброкачественная нейтропения в детском возрасте чаще всего обнаруживается случайно, так как в целом дети чувствуют себя хорошо. АНК для ребенка с доброкачественной нейтропенией может быть ниже 500, но когда они заражаются, их костный мозг способен выделять достаточное количество нейтрофилов в циркулирующую кровь, чтобы поднять АНК и бороться с инфекцией.
Аутоиммунная нейтропения, вероятно, вызвана выработкой антител, которые прикрепляются к нейтрофилам и вызывают их разрушение в кровотоке. Похоже, что нет проблем со способностью костного мозга вырабатывать нейтрофилы.
Лечение
Есть лекарства, которые стимулируют костный мозг вырабатывать больше нейтрофилов. Чаще всего используется препарат под названием «11 гранулоцитарный колониестимулирующий фактор» (11 GCSFI или просто GCSF). Чаще всего его вводят в виде крошечной инъекции под кожу, подобно тому, как диабетики принимают инсулин.Количество нейтрофилов обычно остается высоким только во время приема лекарства. Некоторым нужно принимать лекарство каждый день, другим можно принимать его несколько раз в неделю. Регулярно принимая GCSF, можно избежать самых тяжелых инфекций.
На что мне смотреть? Признаки инфекции включают:
- Температура> 101 F (38,5 C)
- Боль, покраснение, опухоль суставов или лимфатических узлов
- Покраснение, отек или болезненные язвы или слезы во рту или в области гениталий
Вы должны немедленно сообщить об этих симптомах своему врачу или медсестре (даже если вы заметили их посреди ночи).
Если возникают незначительные инфекции, их можно лечить антибиотиками перорально и / или местными аппликациями на кожу. При более серьезных инфекциях необходимо будет вводить антибиотики внутривенно в больнице.
Что я могу сделать?
Общее здоровье и благополучие
- Незамедлительно сообщайте о симптомах (особенно о лихорадке> 101)
- Будьте в курсе вакцинаций, посещений врача и стоматологической помощи
- Позаботьтесь о своих зубах и деснах
- Принимать все дозы назначенных лекарств
- Если используются прикроватные увлажнители воздуха, очищайте их ежедневно и промывайте разбавленным отбеливателем еженедельно
- Проконсультируйтесь с врачом перед тем, как давать какие-либо травы или добавки
- Очистите царапины и порезы водой с мылом с последующим нанесением бетадина или неоспорина
- Не оставляйте пластыри более чем на 24 часа
- Избегайте применения суппозиториев и измерения ректальной температуры
Гигиена
- Душ ежедневно.Ограничьте время принятия ванн до 10 минут
- Часто мойте руки, особенно перед едой
- Следите за чистотой области детских пеленок. Для девушек, которые принимают ванну с пеной: не более 10 минут (предпочитают душ)
Меры предосторожности при питании
- Тщательно готовьте мясо / рыбу / птицу / яйца
- Избегайте салатных баров в ресторанах
- Тщательно вымыть продукты и фрукты
- Выбирайте фрукты и овощи, которые можно очистить или тщательно промыть
- Избегайте фаст-фуда и ферментированных чаев
Здоровый образ жизни
- Избегайте заплесневелых участков, сена, измельченной мульчи и навоза от любых животных
- Ежемесячная замена воздушных / печных фильтров
- Проверить воду из колодца
- Не чистить аквариумы или клетки / лотки для домашних животных
- Держать песочницы на открытом воздухе закрытыми
- Сделайте прививки домашних животных
- Поговорите со своим врачом или медсестрой о домашних животных, чтобы их избегать
Как IHTC может вам помочь
IHTC стремится предоставлять квалифицированную помощь младенцам, детям, подросткам и взрослым с хронической нейтропенией.Как центр передового опыта в лечении нарушений свертываемости и свертываемости крови, IHTC предлагает высокий уровень скоординированной помощи пациентам с этим заболеванием. Мы также обеспечиваем оперативную связь с вашим местным поставщиком медицинских услуг относительно нашего плана лечения и вашего прогресса. Команда IHTC сотрудничает с национальными экспертами, и пациенты могут участвовать в исследованиях.
В IHTC работают врачи, являющиеся экспертами в лечении хронической нейтропении и оказывающие поддержку пациентам с этим заболеванием.Поскольку у каждого пациента может быть разная скорость прогрессирования заболевания и разные симптомы, очень важно, чтобы вас осмотрел врач, знакомый с признаками и методами лечения хронической нейтропении. Мы можем помочь вам с диагностикой, тестированием и лечением; и может предоставить диетические, генетические и общие консультации в зависимости от ваших конкретных потребностей. Для получения дополнительной информации свяжитесь с нами по телефону 877.CLOTTER (877.256.8837).
Демонстрация и количественная оценка нейтрофилов in vitro…
Абстрактные
В последнее десятилетие внеклеточные ловушки нейтрофилов (NET) были идентифицированы и подтверждены как новое противомикробное оружие нейтрофилов. В этом протоколе мы описываем простые методы для демонстрации образования NET путем иммунофлуоресцентного окрашивания внеклеточного волокна хроматина с антителом против ДНК / гистона h2 и количественного определения NETs с использованием не проницаемого для клеток ДНК специфического красителя Sytox orange.
Ключевые слова: NET (внеклеточные ловушки нейтрофилов), нейтрофилы, Sytox orange, ДНК / гистон h2
Предпосылки
Нейтрофилы составляют самую большую эволюционно консервативную фракцию циркулирующих лейкоцитов. Они создают первую линию защиты от патогенов с помощью различных механизмов, включая образование внеклеточных ловушек нейтрофилов (NET). Во время этого процесса активированные нейтрофилы вытесняют волокна хроматина из ядра.Затем вторгшиеся патогены попадают в сеть хроматина и уничтожаются высококонцентрированными, запутанными NET антимикробными белками, такими как миелопероксидаза (MPO) и эластаза (Brinkmann et al. , 2004). Однако NET — это палка о двух концах; неограниченное образование NET из сверхактивированных нейтрофилов также может вносить вклад в серьезное повреждение тканей, например, за счет цитотоксического действия гистоновых компонентов NETs (Saffarzadeh et al. , 2012). Одним из примеров патологического состояния, при котором нейтрофилы чрезмерно активированы и обладают повышенной способностью образовывать NET, является системная красная волчанка.Уровни антител против двухцепочечной ДНК, а также других компонентов NET повышены в сыворотках пациентов с волчанкой (Knight and Kaplan, 2012; Yu and Su, 2013). Пораженная кожа и почки пациентов с волчанкой инфильтрируются сетчатыми нейтрофилами, которые вызывают повреждение эндотелиальных клеток, что является критическим этапом в патогенезе волчанки и других синдромов сверхактивации нейтрофилов (Villanueva et al. , 2011).
Для обнаружения и количественной оценки NET использовались различные методы, включая иммуноцитохимию (Brinkmann et al., 2010), флуоресцентные красители, проточная цитометрия и ELISA. Иммуноцитохимия с DAPI и ДНК / гистоном была лучшим методом для квалификации и количественной оценки NET, поскольку деконденсация ядра указывает на образование NET. Краситель Picogreen — это чувствительный метод для количественной оценки концентрации NET-ДНК (Саффарзаде и др. , 2012; Танака и др. , 2015), а Sytox Orange — это быстрый и простой метод количественного определения NET. Проточный цитометрический анализ путем измерения сигнала для меченых ДНК / гистоновых антител или ELISA на основе миелопероксидазы ДНК являются полезными методами для обнаружения и количественной оценки NET в патологических образцах, таких как сыворотка или перитонеальная жидкость пациентов (Caudrillier et al., 2012).
В этом протоколе мы предоставляем подробности для демонстрации образования NET с помощью флуоресцентного иммуноокрашивания для волокна хроматина с антителом против ДНК / гистона h2, которое имеет очень высокое сродство к деконденсированному хроматину в NET по сравнению с DAPI или Hoechst (Саффарзаде и др. , 2012). Кроме того, мы описываем быстрый метод количественного определения NET с помощью Sytox orange, не проницаемой для клеток ДНК, специфичной для окрашивания содержания внеклеточной ДНК (Williams et al., 1999; Йост и др. , 2009) по интенсивности флуоресценции, измеренной считывателем микропланшетов. Этот протокол был успешно применен в наших недавних исследованиях, в которых мы показали, что фагоцитоз, индуцированный антителами или комплементом, запускает быстрое образование NET (Saffarzadeh et al. , 2014), и, что более важно, мезенхимальные стволовые клетки подавляют образование NET из-за чрезмерного активированные нейтрофилы (Jiang et al. , 2016).
Материалы и реагенты
- Наконечники для дозаторов (Greiner Bio One International, Ultratip)
- Туба 50 мл (SARSTEDT, номер по каталогу: 62.547.254)
- Шприц 10 мл (B. Braun medical, каталожный номер: 4606108V-02)
- Игла 26 G x ½ ”(B. Braun medical, каталожный номер: 4665457-02)
- Фильтры предварительной сепарации (30 мкм) (Miltenyi Biotec, номер по каталогу: 130-041-407)
- Стекло Millicell EZ Slide на 8 лунок (EMD Millipore, номер по каталогу: PEZGS0816)
- 96-луночный, черный, планшет с плоским дном, стерильный, с крышкой (Corning, номер по каталогу: 3916)
- Мыши C57BL / 6J предпочтительного возраста 8-12 недель, как самцы, так и самки, подходят для этого протокола (ЛАБОРАТОРИЯ ДЖЕКСОНА, номер по каталогу: 000664)
- Солевой раствор с фосфатным буфером (PBS) (Thermo Fisher Scientific, Gibco TM , номер по каталогу: 141 )
- 0.5 M EDTA, стерильный (Thermo Fisher Scientific, Invitrogen TM , номер по каталогу: 15575020)
- Histopaque-1077 (Sigma-Aldrich, каталожный номер: 10771)
- Histopaque-1119 (Sigma-Aldrich, каталожный номер: 11191)
- Необязательно: FITC-конъюгированные мышиные антитела против CD15 человека (клон VIMC6) (Miltenyi Biotec, номер по каталогу: 130-081-101)
- Необязательно: FITC-конъюгированный изотипический контроль мышиного IgM (Miltenyi Biotec, номер по каталогу: 130-093-178)
- Дополнительно: набор для выделения нейтрофилов MACSxpress, человек (Miltenyi Biotec, номер по каталогу: 130-104-434)
- Необязательно: набор для истощения эритроцитов MACSxpress, человек (Miltenyi Biotec, номер по каталогу: 130-098-196)
- Набор для выделения нейтрофилов мыши (Miltenyi Biotec, номер по каталогу: 130-097-658)
- Дополнительно: раствор для окрашивания йодидом пропидия (PI) (BD, BD Biosciences, номер по каталогу: 556463)
- Форбол 12-миристат 13-ацетат (PMA) (Sigma-Aldrich, номер по каталогу: P8139)
Примечание: растворить в ДМСО, чтобы получить исходный раствор 1 мг / мл, и хранить аликвоты при -20 ° C. - Диметилсульфоксид (ДМСО) (Sigma-Aldrich, номер по каталогу: D8418)
- 16% (мас. / Об.) Параформальдегида (PFA), без метанола (Thermo Fisher Scientific, номер по каталогу: 28908)
- Очищенное мышиное антитело против ДНК / гистона h2 (EMD Millipore, номер по каталогу: MAB3864)
Примечание. Сделайте аликвоты и храните при -20 ° C. - 4 ’, 6-диамидино-2-фенилиндол, дигидрохлорид (DAPI) (Thermo Fisher Scientific, Invitrogen TM , номер по каталогу: D1306)
- Вторичное антитело козы против IgG мыши, конъюгированное с Alexa Fluor 555 (Thermo Fisher Scientific, Invitrogen TM , номер по каталогу: A-21422)
- Необязательно: APC-конъюгированные крысиные антитела против Ly6G (Gr-1) (клон RB6-8C5) (Thermo Fisher Scientific, eBioscience TM , номер по каталогу: 17-5931-82)
- Дополнительно: APC-конъюгированный изотипический контроль крысиного IgG2b (клон eB149 / 10H5) (Thermo Fisher Scientific, eBioscience TM , номер по каталогу: 17-4031-82)
- Необязательно: очищенное крысиное антитело против Ly6G мыши (клон RB6-8C5) (Abcam, номер по каталогу: ab25377)
- Необязательно: очищенное кроличье антитело против CD15 человека (клон SP159) (Novus Biologicals, номер по каталогу: NBP2-21754)
- Очищенное козье антитело против миелопероксидазы человека / мыши / МПО (R&D Systems, каталожный номер: AF3667)
- Очищенный контроль изотипа мышиного IgG2a (клон C1.18.4) (BD, BD Biosciences, каталожный номер: 550339)
- Очищенное кроличье антитело против нейтрофильной эластазы человека / мыши (Abcam, номер по каталогу: ab68672)
- Окрашивание нуклеиновой кислоты Sytox оранжевым (Thermo Fisher Scientific, Invitrogen TM , номер по каталогу: S11368)
- Фетальная бычья сыворотка (FBS) (Biochrom, каталожный номер: S 0615)
- Азид натрия (NaN 3 ) (Sigma-Aldrich, номер по каталогу: S2002)
- Среда RPMI 1640 (Thermo Fisher Scientific, Gibco TM , каталожный номер: 21875034)
- GlutaMAX (Thermo Fisher Scientific, каталожный номер: 35050038)
- Незаменимые аминокислоты MEM (NEAA) (Thermo Fisher Scientific, Gibco TM , номер по каталогу: 11140035)
- Пенициллин / стрептомицин (Biochrom, каталожный номер: A 2213)
- Бычий сывороточный альбумин (BSA) (Sigma-Aldrich, номер по каталогу: A2153)
- Козья сыворотка (Sigma-Aldrich, каталожный номер: G9023)
- Среда для фиксации флуоресценции (Agilent Technologies, DAKO, номер по каталогу: S302380-2)
- Буфер FACS (можно хранить при 4 ° C в течение 2 недель) (см. Рецепт 1)
- Среда R1 (подготовленную среду можно хранить при 4 ° C в течение 2 недель) (см. Рецепт 2)
- Блокирующий буфер (приготовить свежий) (см. Рецепт 3)
- Разбавитель антител (приготовить свежий) (см. Рецепт 4)
Оборудование
- Пипетки
- Центрифуга
- Дополнительно: Сепаратор MACSxpress (Miltenyi Biotec, номер по каталогу: 130-098-308)
- Дополнительно: MACSmix TM Tube Rotator (Miltenyi Biotec, каталожный номер: 130-090-753)
- Увлажненный инкубатор для культур клеток установлен на 37 ° C и 5% CO 2
- Орбитальный шейкер, такой как Heidolph Unimax 1010 (Heidolph Instruments, модель: Unimax 1010, номер по каталогу: 543-12310-00)
- Люминесцентный микроскоп, такой как микроскоп Zeiss Axiophot с цифровой цветной камерой AxioCam и программным обеспечением AxioVision v4.7 (Carl Zeiss, модель: Axiophot)
- Цветная цифровая камера AxioCam
- Считывающее устройство для микропланшетов, которое может измерять поглощение и излучение Sytox orange при 547 нм и 570 нм соответственно, например Mithras LB940 (BERTHOLD TECHNOLOGIES, модель: Mithras LB 940)
- Дополнительно: проточный цитометр (для проверки чистоты изолированных нейтрофилов) FACS Canto II (BD, BD Biosciences, модель: BD FACSCANTO II) с программным обеспечением FACSDiva
Программного обеспечения
- Программное обеспечение AxioVision
- Дополнительно: программное обеспечение FACSDiva
Процедура
- Выделение нейтрофилов
- Выделите нейтрофилы человека из свежей периферической крови с помощью градиентного центрифугирования (рисунки 1A и 1B)
- Разбавьте периферическую кровь 1: 2 PBS, содержащим 2 мМ EDTA.
- В каждую пробирку на 50 мл осторожно и последовательно заложите 10 мл Histopaque-1119, 10 мл Histopaque-1077 и 25 мл разбавленной крови.
Примечание. Перед использованием Histopaque необходимо нагреть до комнатной температуры. - Центрифугирование при 700 x g ( Примечание: без перерыва. ) при комнатной температуре в течение 30 мин.
- Перенести слой на границе раздела Histopaque-1077 и Histopaque-1119 в новую пробирку на 50 мл (обычный объем составляет 2-3 мл), долить до 50 мл PBS и центрифугировать при 300 xg при комнатной температуре в течение 10 минут.
- Снова промыть 30 мл PBS.
Примечание: ожидаемый средний выход нейтрофилов на мл периферической крови от здорового донора колеблется в пределах 2-5 миллионов клеток.
Рис. 1. Выделение нейтрофилов. A. Нейтрофилы человека выделяли из свежей периферической крови здоровых доноров градиентным центрифугированием (стадия A1). Слой нейтрофилов на границе раздела h2077 и h2119 был собран. PBMC, мононуклеарные клетки периферической крови; PMN, полиморфноядерные лейкоциты; RBC, красные кровяные тельца.B. Жизнеспособность клеток анализировали с помощью красителя PI, а чистоту жизнеспособных нейтрофилов анализировали с использованием человеческого антитела против CD15 в пределах PI отрицательного гейта. C. Человеческие нейтрофилы выделяли из лейкоцитарной пленки методом MACSxpress (стадия A2). Жизнеспособность клеток анализировали с помощью красителя PI, а чистоту жизнеспособных нейтрофилов анализировали с помощью человеческого антитела к CD15 в пределах PI-отрицательного гейта. D. Нейтрофилы костного мозга мышей выделяли магнитной сортировкой с использованием метода отрицательного истощения (стадия A3).Жизнеспособность клеток анализировали с помощью красителя PI, а чистоту жизнеспособных нейтрофилов анализировали с помощью мышиного антитела Ly6G (Gr-1) в пределах PI-отрицательного гейта. Серые гистограммы: краситель PI, антитело к CD15 или антитело Gr-1; открытая гистограмма: неокрашенный контроль или антитело изотипа.
- Разбавьте периферическую кровь 1: 2 PBS, содержащим 2 мМ EDTA.
- Альтернатива: изолировать нейтрофилы человека с помощью набора для выделения нейтрофилов MACSxpress (рисунок 1C).
- Смешайте 5 мл лейкоцитной пленки ( Примечание: менее 12 ч после сбора.) с 1 мл восстановленного буфера A (компонент набора), 1 мл буфера B и 100 мкл восстановленного реагента MACSxpress для истощения эритроцитов.
- Инкубируйте образец в течение 5 минут при комнатной температуре с помощью вращателя пробирок MACSmix при 12 об / мин.
- Поместите открытую пробирку в магнитное поле сепаратора MACSxpress на 10 мин, затем осторожно соберите супернатант, содержащий нейтрофилы, в новую пробирку.
- Смешайте 5 мл лейкоцитной пленки ( Примечание: менее 12 ч после сбора.) с 1 мл восстановленного буфера A (компонент набора), 1 мл буфера B и 100 мкл восстановленного реагента MACSxpress для истощения эритроцитов.
- Выделение нейтрофилов костного мозга мыши (рис. 1D)
- Рассеките бедренные кости мышей C57BL / 6J и промойте костный мозг 10 мл PBS, содержащего 2 мМ EDTA, с помощью шприца на 10 мл и иглы 26 G в асептических условиях.
- Отфильтруйте суспензию с помощью сетчатого фильтра 30 мкм.
- Изолируйте нейтрофилы с помощью иммуномагнитного разделения (MACS), используя метод отрицательного истощения с помощью набора для выделения нейтрофилов мыши (Miltenyi), следуя инструкциям производителя.
Примечание. Ожидаемый средний выход нейтрофилов из костного мозга двух бедренных костей одной мыши C57BL / 6J в возрасте 8-12 недель колеблется в пределах 10-15 миллионов клеток.
- Рассеките бедренные кости мышей C57BL / 6J и промойте костный мозг 10 мл PBS, содержащего 2 мМ EDTA, с помощью шприца на 10 мл и иглы 26 G в асептических условиях.
- Необязательно: проверьте чистоту и жизнеспособность изолированных нейтрофилов
- Ресуспендируют 2 x 10 5 выделенных нейтрофилов человека в 100 мкл буфера FACS (см. Рецепт 1), содержащего 5 мкл антитела против CD15-FITC человека (или антитела против мышиного Gr1-APC для нейтрофилов мыши).Еще 2 × 10 5 клеток в 100 мкл буфера FACS, содержащего 5 мкл контроля изотипа мышиного IgM-FITC (или контроль изотипа мышиного IgG2b-APC для нейтрофилов мыши). Инкубируйте при комнатной температуре в темноте 30 мин.
- Добавьте 100 мкл буфера FACS, осторожно перемешайте и центрифугируйте для сбора осадка клеток с помощью настольной центрифуги при 3000 об / мин (870 x g с ротором 87 мм) при комнатной температуре, удалите супернатант.
- Ресуспендируйте осадок в 300 мкл буфера для FACS, добавьте 3 мкл окрашивающего раствора иодидом пропидия (PI), быстро перемешайте.
- Приступите к проточному цитометрическому анализу на CD15 + PI — клеток (человек) или Gr-1 hi PI — клеток (мышь).
- Ресуспендируют 2 x 10 5 выделенных нейтрофилов человека в 100 мкл буфера FACS (см. Рецепт 1), содержащего 5 мкл антитела против CD15-FITC человека (или антитела против мышиного Gr1-APC для нейтрофилов мыши).Еще 2 × 10 5 клеток в 100 мкл буфера FACS, содержащего 5 мкл контроля изотипа мышиного IgM-FITC (или контроль изотипа мышиного IgG2b-APC для нейтрофилов мыши). Инкубируйте при комнатной температуре в темноте 30 мин.
- Выделите нейтрофилы человека из свежей периферической крови с помощью градиентного центрифугирования (рисунки 1A и 1B)
- Демонстрация NET путем иммуноокрашивания
Примечание. Если целью является изучение взаимодействия специфических адгезивных клеток с нейтрофилами и образованием NET, засевайте интересующие клетки за день до выделения нейтрофилов на предметное стекло с 8-луночным стеклом (слайд Millicell EZ 8- стекло для лунок) в 300 мкл среды на лунку и культивирование в течение ночи.Количество посевных клеток зависит от соотношения клеток-мишеней и нейтрофилов. Сделайте дубликаты лунок для каждого условия. Перед добавлением нейтрофилов удалите питательную среду.- Индукция образования NET
- Добавьте свежевыделенные нейтрофилы на предметное стекло с 8-луночным стеклом с плотностью 2 x 10 5 нейтрофилов в 300 мкл среды R1 (см. Рецепт 2) на лунку. Сделайте дубликаты лунок для каждого условия.
Примечание: ресуспендировать нейтрофилы в среде R1 при 6.67 x 10 5 клеток / мл, затем добавьте 300 мкл на лунку. - Добавьте интересующее лечение (, например, , потенциальный химический активатор / ингибитор NET, бактерии, взаимодействующие клетки, и т. Д. )
Примечание: время инкубации необходимо оптимизировать индивидуально, подробнее см. Примечание 1. - Растворите ФМА в ДМСО, чтобы получить исходный раствор 1 мг / мл. В лунки с положительным контролем и в условиях, при которых желательно образование NET, добавляют PMA в конечной концентрации 100 нг / мл для активации нейтрофилов ( i.е. , разбавьте исходный PMA 1: 100 в среде R1, затем добавьте 3 мкл разбавленного PMA в каждую лунку). (см. Примечание 2)
- Разбавьте ДМСО 1: 100 в среде R1, добавьте 3 мкл разбавленного ДМСО в каждую лунку лунок отрицательного контроля (покоящиеся нейтрофилы).
- Инкубируйте в течение 3 ч в инкубаторе 37 ° C.
- Добавьте 100 мкл 4% PFA в каждую лунку, не удаляя среду (, т.е. , при конечной концентрации 1%), чтобы зафиксировать клетки при 4 ° C в течение ночи.
- Добавьте свежевыделенные нейтрофилы на предметное стекло с 8-луночным стеклом с плотностью 2 x 10 5 нейтрофилов в 300 мкл среды R1 (см. Рецепт 2) на лунку. Сделайте дубликаты лунок для каждого условия.
- Окрашивание антителом против ДНК / гистона h2 и DAPI на следующий день (рисунки 2A и 2B).
Рисунок 2. Демонстрация NET с помощью иммуноокрашивания. 2 × 10 5 нейтрофилов человека (A) или нейтрофилов мыши (B) активировали 100 нг / мл PMA в течение 3 часов в лунках предметного стекла стеклянной камеры. Отдыхающие нейтрофилы с ДМСО служили отрицательным контролем. Срезы фиксировали и метили антителом против ДНК / гистона h2 с последующим нанесением конъюгированного с AF555 антимышиного IgG (красный), и ядра контрастировали с помощью DAPI (синий) (этапы B1 и B2).C. Иммуноокрашивание человеческого нейтрофильного маркера CD15 (зеленый) и NET-маркера ДНК / гистона h2 (красный) на залитых парафином срезах кожи пациентов с васкулитом человека. D. Иммуноокрашивание мышиного нейтрофильного маркера Ly6G (зеленый) и NET-маркера ДНК / гистона h2 (красный) на залитом парафином срезе кожи мышей с индуцированным иммунным комплексом-опосредованным васкулитом (стадия B3). Масштабные линейки = 100 мкм.- Удалите среду, добавьте 100 мкл PBS в каждую лунку, а затем удалите.
- Добавьте 100 мкл блокирующего буфера (см. Рецепт 3) в каждую лунку.Слайды оставляли на столе при комнатной температуре на 45 мин.
- Разведите антитело ДНК / гистон h2 в разбавителе антител (см. Рецепт 4) до конечной концентрации 4 мкг / мл.
- Добавьте 100 мкл разведенных антител в каждую лунку, инкубируйте на столе при комнатной температуре в течение 1 часа.
- Удалите антитела, промойте предметные стекла дважды по 100 мкл PBS в каждой лунке на орбитальном шейкере при 100 об / мин в течение 5 минут каждый раз.
- Развести вторичный антимышиный AF555 1: 200 в разбавителе антител.
- Добавьте 100 мкл разведенных вторичных антител в каждую лунку, инкубируйте при комнатной температуре в темноте в течение 45 мин.
- Удалите антитела, промойте 2 раза 100 мкл PBS на орбитальном шейкере.
- Развести DAPI 5 мг / мл исходного раствора 1: 5000 в PBS, добавить по 100 мкл в каждую лунку, инкубировать при комнатной температуре в темноте в течение 3 минут.
- Удалите окрашивающий раствор DAPI и снимите рамку слайдов камеры. Вымойте слайды 2 раза, окунув в контейнер с PBS.
- Установите покровные стекла с флуоресцентной монтажной средой.
- Флуоресцентная микроскопия с красным каналом (AF555) и синим каналом (DAPI) (, например, , микроскоп Zeiss Axiophot с цифровой цветной камерой AxioCam и программным обеспечением AxioVision) (см. Примечание 3).
- Удалите среду, добавьте 100 мкл PBS в каждую лунку, а затем удалите.
- Необязательно: окрашивание дополнительным маркером нейтрофилов (рисунки 2C и 2D).
Дополнительные маркеры нейтрофилов могут быть совместно окрашены NET, чтобы обеспечить дополнительное подтверждение.Были протестированы следующие первичные антитела, и можно рассмотреть одну или несколько комбинаций в зависимости от количества цветных фильтров, доступных на флуоресцентном микроскопе: CD15 (человек, Novus, 1:50), Ly6G (мышь, Abcam, 1: 100) , MPO (человек и мышь, R&D Systems, 1:50) или NE (человек и мышь, Abcam, 1: 200). Необходимы правильные вторичные антитела с другими флуорофорами, кроме окрашивания NET. Это окрашивание можно проводить до окрашивания NET. Рекомендуется последовательное окрашивание в зависимости от специфичности и интенсивности окрашивания. - После блокирования (шаг B2b) добавьте 100 мкл разведенного первичного антитела в каждую лунку, инкубируйте при 4 ° C в течение ночи.
- Удалите первичное антитело, промойте 2 раза 100 мкл PBS.
- Добавьте 100 мкл разведенных вторичных антител в каждую лунку, инкубируйте при комнатной температуре в темноте в течение 1 часа.
- Удалите вторичные антитела, промойте 2 раза 100 мкл PBS.
- Продолжайте окрашивание NET (шаг B2c).
- Индукция образования NET
- Количественное определение NET с помощью Sytox Orange (рис. 3)
Примечание: если целью является изучение взаимодействия определенных адгезивных клеток с нейтрофилами и образованием NET, засейте интересующие клетки за день до выделения нейтрофилов в 96-луночный черный планшет с плоским дном в 100 мкл среды на лунку и культивирование в течение ночи. Количество посевных клеток зависит от соотношения клеток-мишеней и нейтрофилов. Сделайте 5 повторных лунок для каждого условия. Перед добавлением нейтрофилов удалите питательную среду.
Фиг. 3. 1 x 10 5 нейтрофилов человека (hNeu) культивировали отдельно или с мезенхимальными стволовыми клетками (MSC) жировой ткани при соотношениях hNeu: MSC 1000: 1, 100: 1 и 10: 1 и затем активировали 100 нг / мл ФМА в течение 3 часов. Сокультуры метили 0,25 мкМ Sytox Orange в течение 5 мин при комнатной температуре и измеряли интенсивности флуоресценции с помощью считывающего устройства для микропланшетов. Питательная среда, содержащая Sytox orange, служила фоновым флуоресцентным контролем.Интенсивности флуоресценции нормализовали по интенсивности неактивированных контролей. Результаты выражены как среднее значение ± стандартная ошибка среднего пяти повторных измерений. Этот эксперимент был независимо повторен трижды с аналогичными результатами. ** P <0,01; *** P <0,001; RFI - относительная интенсивность флуоресценции; AU, условная единица.- Добавьте свежевыделенные нейтрофилы в 96-луночный черный планшет с плоским дном с плотностью 1 x 10 5 нейтрофилов в 100 мкл среды R1 (см. Рецепт 2) на лунку.Необходим контроль фоновой флуоресценции только со средой R1, положительный контроль с активацией PMA и отрицательный контроль покоящихся нейтрофилов только с ДМСО.
Примечание. Сделайте 5 повторных лунок для каждого условия. Избегайте лунок в первом и последнем рядах / столбцах планшета. (У нас был опыт, что периферийные лунки планшета могут давать неточные показания флуоресценции, особенно лунки на четырех углах. Это может быть связано с техническими характеристиками микропланшет-ридера или качеством 96-луночного планшета с черным дном.) - Добавьте интересующую обработку (см. Примечание 1 в разделе «Примечания»).
- В лунки положительного контроля и в условиях, при которых желательно образование NET, добавьте PMA в конечной концентрации 100 нг / мл для активации нейтрофилов. (, то есть , разбавьте 1 мг / мл исходного раствора PMA 1: 100 в среде R1, затем добавьте 1 мкл разбавленного PMA в каждую лунку).
- Разведите ДМСО 1: 100 в среде R1, добавьте 1 мкл разбавленного ДМСО в каждую лунку лунок отрицательного контроля.
- Инкубируйте в течение 3 ч в инкубаторе 37 ° C.
- Разведите 5 мМ исходного раствора Sytox orange 1: 5,000 в среде R1. Затем с помощью многоканальной пипетки добавьте 50 мкл 1 мкМ рабочего раствора в каждую лунку (, т.е. , Sytox orange в конечной концентрации 0,25 мкМ).
- Инкубируйте 5 мин при комнатной температуре в темноте.
- Центрифугируйте планшет при 400 x g в течение 5 минут, осторожно удалите по 100 мкл супернатанта из каждой лунки, чтобы уменьшить фоновую флуоресценцию.
Примечание. Удалите среду медленно и осторожно, не касаясь дна чашки. - Немедленно измерьте интенсивность флуоресценции микропланшетным ридером Mithras LB940 при длинах волн возбуждения и излучения 540 нм и 580 нм соответственно (см. Примечание 4).
- Добавьте свежевыделенные нейтрофилы в 96-луночный черный планшет с плоским дном с плотностью 1 x 10 5 нейтрофилов в 100 мкл среды R1 (см. Рецепт 2) на лунку.Необходим контроль фоновой флуоресценции только со средой R1, положительный контроль с активацией PMA и отрицательный контроль покоящихся нейтрофилов только с ДМСО.
Анализ данных
- Расчет интенсивности флуоресценции Sytox Orange Assay
- Возьмите в среднем 5 повторов условия только среды R1.Это фоновая флуоресценция Sytox orange в среде.
- Вычтите эту фоновую флуоресценцию из показаний интенсивности флуоресценции всех других образцов.
- Возьмите в среднем 5 повторений для каждого условия.
- Нормализовать интенсивность флуоресценции каждого состояния к отрицательному контролю (нейтрофилы в покое), который установлен как 1 условная единица (AU).
- Этот анализ следует выполнить не менее 3 раз с независимыми образцами нейтрофилов.Данные могут быть представлены как среднее значение ± стандартное отклонение (или SEM). Непарный двусторонний критерий Стьюдента t может использоваться для проверки значимости.
Примечания
- Продолжительность лечения необходимо определять для каждого индивидуального условия лечения. Чтобы изучить влияние клеток-мишеней на образование NET, необходимо рассмотреть надлежащее время инкубации, чтобы обеспечить взаимодействие исследуемых клеток с нейтрофилами перед добавлением активатора, такого как PMA. Например, для изучения влияния мезенхимальных стволовых клеток (MSC) или дермальных фибробластов человека (HDF) на образование NET нейтрофилы совместно культивируют с MSC или HDF в течение 2 часов в среде R1 в инкубаторе при 37 ° C (Jiang et al. al., 2016).
- PMA используется для искусственного запуска образования NET, например, в качестве положительного контроля. В условиях, когда изучается подавление образования NET потенциального лечения, нейтрофилы также искусственно активируются с помощью PMA. Однако, если ожидается, что потенциальное лечение вызовет образование NET (, например, , бактериальный), добавление PMA не требуется.
- Картина иммуноокрашивания NET отличается в нейтрофилах человека и мыши.Волокна NET нейтрофилов человека намного длиннее и имеют более заметную сетевую структуру. Нейтрофилы костного мозга мыши менее способны к образованию NET, но их можно увеличить, добавив кальций для активации цитруллинирования гистонов, которые важны для NETosis. Что касается нескольких ядер на рисунке 2B, исходя из нашего опыта, по сравнению с нейтрофилами человека меньшая часть нейтрофилов мыши подвержена НЕТозу. Окислительный взрыв и другие процессы активации приводят к гибели клеток и их не прилипанию к посуде.
- Считыватель микропланшетов CLARIOstar с монохроматором от BMG Labtech (Ортенберг, Германия) был протестирован для анализа Sytox orange, и он хорошо работает при возбуждении при 547 нм и эмиссии при 570 нм.
- Жизнеспособность и чистота нейтрофилов человека, выделенных из лейкоцитарной пленки, зависит от свежести образца. В течение 12 часов после сбора ожидаемая жизнеспособность нейтрофилов превышает 80%. Ожидаемая чистота как при градиентном центрифугировании, так и при использовании методов MACSxpress превышает 80%.Никаких различий в функциональном ответе нейтрофилов, выделенных двумя методами, не наблюдается.
- В общем, рекомендуется использовать разные методы количественной оценки для оценки NET и сочетать ее с иммунофлуоресцентной микроскопией для визуализации NET. Анализ Sytox Orange полезен как простой метод количественного определения NET для экспериментов in vitro . Для условий in vivo рекомендуется демонстрация маркера нейтрофилов вместе с антителами против компонентов NET, которые могут обнаруживать деконденсированный хроматин.
Рецепты
- Буфер для FACS (может храниться при 4 ° C в течение 2 недель)
PBS, содержащий 0,5% FBS, 0,02% NaN 3 , pH 7,4 - Среда R1 (приготовленные среды можно хранить при 4 ° C в течение 2 недель)
Среда RPMI1640
1% FBS
1x GlutaMAX
1x MEM NEAA
1x пенициллин / стрептомицин - Блокирующий буфер (приготовить свежий)
PBS, содержащий 5% BSA вместе с 5% козьей сыворотки - Разбавитель антител (приготовить свежий)
PBS, содержащий 1% BSA
Благодарности
Эта работа частично поддержана исследовательскими грантами Фонда Баден-Вюртемберга (P-BWS-ASII / 15), Европейской комиссии (CASCADE HEALTH-FP7-223236) и Немецкого исследовательского фонда (SFB1149) К.S.-K., Программа Баустейна от медицинского факультета Ульмского университета (LSBN.0100) до Д.Дж., и от Кластерной кардио-легочной системы (ECCPS) до М.С. Часть рисунков адаптирована и модифицирована из недавнего исследования Jiang et al. , 2016.
Ссылки
- Бринкманн В., Лаубе Б., Абу Абед У., Гусманн К. и Зихлински А. (2010). Внеклеточные ловушки нейтрофилов: как их создавать и визуализировать. J Vis Exp (36): 1724.
- Бринкманн В., Райхард У., Гусманн К., Фаулер Б., Улеманн Ю., Вайс Д. С., Вайнраух Ю. и Зихлинский А. (2004). Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 303 (5663): 1532-1535.
- Кодрийе, А., Кессенброк, К., Гиллисс, Б. М., Нгуен, Дж. Х., Маркес, М. Б., Монестиер, М., Той, П., Верб, З. и Луни, М. Р. (2012). Тромбоциты индуцируют внеклеточные ловушки нейтрофилов при остром повреждении легких, связанном с переливанием крови. J Clin Invest 122 (7): 2661-2671.
- Цзян Д., Мушхаммер Дж., Ци Ю., Куглер А., де Фрис, Дж. К., Саффарзаде, М., Синдрилару, А., Бекен, С. В., Влашек, М., Клут, М. А., Ганс, К., Франк, Нью-Йорк, Франк, М. Х., Прейсснер, К. Т. и Шарффеттер-Кочанек, К. (2016). Подавление опосредованного нейтрофилами поражения тканей — новый навык мезенхимальных стволовых клеток. стволовых клеток 34 (9): 2393-2406.
- Найт, Дж. С. и Каплан, М. Дж. (2012). Нейтрофилы волчанки: «NET» для понимания патогенеза волчанки. Curr Opin Rheumatol 24 (5): 441-450.
- Саффарзаде, М., Кабрера-Фуэнтес, Х. А., Вейт, Ф., Цзян, Д., Шарффеттер-Кочанек, К., Гилле, К., Ройаккерс, С. Х. М., Хартл, Д. и Прейсснер, К. Т. (2014). Характеристика быстрого образования внеклеточной ловушки нейтрофилов и его взаимодействия с фагоцитозом нейтрофилов человека. Открытия 2 (2): e19.
- Саффарзаде, М., Юенеманн, К., Кайссер, М.А., Лохнит, Г., Баррето, Г., Галуска, С.П., Ломейер Дж. И Прейсснер К. Т. (2012). Внеклеточные ловушки нейтрофилов напрямую вызывают гибель эпителиальных и эндотелиальных клеток: преобладающую роль играют гистоны. PLoS One 7 (2): e32366.
- Танака, К., Окигами, М., Тояма, Ю., Окугава, Ю., Иноуэ, Ю., Араки, Т., Мохри, Ю., Мидзогути, А. и Кусуноки, М. (2015). Количественная оценка ex vivo внеклеточных ловушек нейтрофилов. Bio Protoc 5 (15): e1549.
- Вильянуэва, Э., Ялаварти, С., Бертье, С.Ч., Ходжин, Дж. Б., Кхандпур, Р., Лин, А. М., Рубин, С. Дж., Чжао, В., Олсен, Ш., Клинкер, М., Шили, Д., Денни, М. Ф., Плумас, Дж., Шаперо, Л., Крецлер, М., Брюс, А.Т. и Каплан, М.Дж. (2011). Сетчатые нейтрофилы вызывают повреждение эндотелия, инфильтрируют ткани и обнажают иммуностимулирующие молекулы при системной красной волчанке. J Immunol 187 (1): 538-552.
- Уильямс, М.А. и Соломкин, Дж. С. (1999). Интегрин-опосредованная передача сигналов в функционировании нейтрофилов человека. J Leukoc Biol 65 (6): 725-736.
- Йост, К.С., Коди, М.Дж., Харрис, Е.С., Торнтон, Н.Л., Макинтурфф, А.М., Мартинес, М.Л., Чендлер, Н.Б., Родеш, С.К., Альбертин, К.Х., Петти, Калифорния, Вейрих, А.С. и Циммерман, Джорджия (2009) . Нарушение образования внеклеточной ловушки нейтрофилов (NET): новый врожденный иммунный дефицит новорожденных человека. Кровь 113 (25): 6419-6427.
- Ю. Ю. и Су К. (2013). Внеклеточные ловушки нейтрофилов и системная красная волчанка. J Clin Cell Immunol 4 (2): 139
Просмотр полного текста
Скачать PDF
Вопросы и ответы
Авторские права: © 2017 Авторы; эксклюзивный лицензиат ООО «Биопротокол».
Как цитировать: Jiang, D., Saffarzadeh, M. и Scharffetter-Kochanek, K. (2017). In vitro Демонстрация и количественная оценка образования внеклеточных ловушек нейтрофилов. Биопротокол 7 (13): e2386. DOI: 10.21769 / BioProtoc.2386.Методы изучения липидных изменений в нейтрофилах и последующего образования внеклеточных ловушек нейтрофилов
Нейтрофилы, полученные из крови человека, выделяли центрифугированием в градиенте плотности (, рисунок 2, ).Чтобы исследовать влияние липидных изменений на нейтрофилы, клетки обрабатывали 10 мМ MβCD, который истощает холестерин из клетки. Впоследствии липиды были выделены из образцов Bligh and Dyer (, рис. 1, , левая панель), как описано Brogden et al. 23 . Подготовленные образцы липидов загружали на планшеты для ВЭТСХ с силикагелем и запускали с использованием протокола с тремя растворами, который был оптимизирован для разделения и визуализации широкого спектра липидов, включая холестерин, сложные эфиры холестерина, сфингомиелин, фосфолипиды и триацилглицериды, свободные жирные кислоты. , моноацилглицерин, фосфатидилэтаноламин, кардиолипин, фосфатидилсерин и фосфатидилхолин (, рис. 3A, ).Кислородные производные холестерина (оксистерины) этим методом не обнаруживаются. Дополнительный количественный анализ холестерина проводили с помощью ВЭЖХ (, фиг. 3B, ). Значение регрессии для холестерина было заметно лучше при использовании ВЭЖХ ( Рисунок 4A, ) по сравнению с ВЭТСХ ( Рисунок 4B ). Чтобы визуализировать NET, клетки стимулировали вышеупомянутыми стимулами, фиксировали и окрашивали на ДНК / гистон 1 (зеленый), MPO (красный) и ДНК (синий) в качестве типичных маркеров NET (, рис. 5A, ).Как показано на фиг. 5A , явное появление MPO, ДНК / гистона 1 и ДНК происходит в NET, когда клетки обрабатывали 10 мМ MβCD в течение 2 часов. Впоследствии эффект снижения холестерина анализировали под микроскопом. Поэтому клетки окрашивали на ДНК (синий) и ДНК / гистон 1 (зеленый), а ядра, высвобождающие NET, подсчитывали с использованием подключаемого модуля счетчика клеток из программного обеспечения для обработки изображений ImageJ (, рис. 5B, ). Необработанные нейтрофилы служили контролем для спонтанного образования NET ( Рисунок 5B-i ).На представленном рисунке высвобождение NET в необработанных нейтрофилах через 2 часа инкубации составило 3,89%, тогда как обработка клеток 10 мМ MβCD привела к образованию 35,17% NET (, фиг. 5B, ).
Рис. 1: Схема, показывающая этапы определения липидного состава и высвобождения внеклеточных ловушек из нейтрофилов крови человека. нейтрофилов выделяют с использованием градиента плотности и обрабатывают метил-β-циклодекстрином (MβCD), чтобы вызвать изменения липидов и образование NET.После этого липиды выделяют и анализируют с помощью HPTLC или HPLC, а NET визуализируют и количественно определяют с помощью иммунофлуоресценции.
Рисунок 2: Изображения, изображающие типичный градиент плотности, используемый для выделения полиморфно-ядерных клеток из свежевыделенной крови. После центрифугирования видны четыре слоя: плазма, мононуклеарные клетки, полиморфноядерные клетки и эритроциты.
Рисунок 3: ВЭТСХ и анализ ВЭЖХ липидов, выделенных из нейтрофилов. ( A ) Стандарт, используемый для идентификации липидов, присутствующих в нейтрофилах, с помощью ВЭТСХ (левая полоса). CE: сложные эфиры холестерина, TG: триацилглицериды, FFA: свободные жирные кислоты, Chol: холестерин, MG: моноацилглицерин, PE: фосфатидилэтаноламин, CL: кардиолипин, PS: фосфатидилсерин, PC: фосфатидилхолин и SM: сфингомиелин. ( B ) Типичный результат, показывающий пик холестерина 2 мг / мл через 4,980 мин с использованием протокола ВЭЖХ, описанного здесь.
Рисунок 4: ВЭЖХ и ВЭТСХ анализы холестерина. Графики, показывающие взаимосвязь между концентрацией холестерина и площадью, измеренной с помощью ВЭЖХ ( A ), и интенсивностью полосы, измеренной с помощью ВЭТСХ ( B ). Минимальный предел обнаружения для ВЭЖХ составил 0,0016 мг / мл со значением регрессии для стандартной кривой 0,998 N = 3, SEM ( A ). Холестерин в диапазоне от 2 мг / мл до 0,05 мг / мл может быть частично определен с помощью ВЭТСХ ( B ) с минимальным пределом обнаружения 0,05 мг / мл N = 3, SEM. Значение регрессии для стандартной кривой ВЭТСХ равно 0.918.
Рисунок 5: Репрезентативные флуоресцентные микрофотографии, показывающие структуры NET и последующее количественное определение NET. ( A ) Нейтрофилы, стимулированные 10 мМ MβCD в течение 2 ч, окрашивали на (ii) MPO (красный), (iii) ДНК / гистон 1 (зеленый) и (iv) ДНК (синий). (i) Наложение пунктов (ii), (iii) и (iv). ( B ) Клетки инкубировали в течение 2 часов с (i) средой HBSS или (ii) 10 мМ MβCD, и высвободившиеся NET окрашивали на ядра (синий) и ДНК / гистон 1 (зеленый).NET-отрицательные ядра были отмечены счетчиком 8 (желтый), а NET-положительные ядра — счетчиком 7 (красный).

