Биохимические исследования глюкозы и метаболитов углеводного обмена (фруктозамина и гликированного гемоглобина)
Сахарный диабет (СД) является важной медико-социальной проблемой и стоит в ряду приоритетов национальных систем здравоохранения всех стран мира. По данным экспертной комиссии ВОЗ, к настоящему времени СД страдают более 60 млн. человек в мире, ежегодно этот показатель увеличивается на 6-10%, его удвоения следует ожидать каждые 10-15 лет. По степени важности это заболевание стоит непосредственно после сердечных и онкологических заболеваний.
Сахарный диабет– это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, развивающейся вследствие абсолютного или относительного дефицита инсулина и проявляющейся также глюкозурией, полиурией, полидипсией, нарушениями липидного (гиперлипидемия, дислипидемия), белкового (диспротеинемия) и минерального (например, гипокалиемия) обменов и развитием осложнений.
Измерение глюкозы крови является одним из основных лабораторных тестов в диагностике сахарного диабета.
Критерии диагностики сахарного диабета при использовании измерения глюкозы крови:
— глюкоза в сыворотке натощак ≥ 7,0 ммоль/л.— предварительный диагноз СД;
— глюкозы в сыворотке через 2 часа при проведении перорального глюкозотолерантного теста ≥ 11,1 ммоль/л. — предварительный диагноз СД;
случайная глюкоза в сыворотке ≥ 11,1 ммоль/л — СД вероятен.
Для клинических целей диагноз СД всегда должен быть подтвержден повторным тестированием в последующие дни, за исключением случаев несомненной гипергликемии с острой метаболической декомпенсацией или очевидными симптомами (полиурия, полидипсия, снижение массы тела, иногда с полифагией, расплывчатость зрения).
В случае необходимости контроля углеводного обмена и подтверждения его компенсации у больных СД в течение длительного времени определяют гликозилированный гемоглобин (HbA1c).
Гликозилированный гемоглобин (HbA1c) HbA1c – это гемоглобин, в котором молекула глюкозы конденсируется с β-концевым валином β-цепи молекулы гемоглобина.
По рекомендации ВОЗ (2002 г.) определение содержания HbA1c в крови больных СД следует проводить 1 раз в квартал. Этот показатель широко используется как для скрининга населения и беременных женщин для выявления нарушения углеводного обмена, так и для контроля лечения больных СД.
Фруктозамин преимущественно представлен гликированным альбумином, образующимся в результате неферментативного присоединения глюкозы к альбумину. Период полувыведения этих сывороточных белков меньше, чем срок жизни эритроцитов. Поэтому, в отличие от гликированного гемоглобина, уровень фруктозамина отражает степень постоянного или транзиторного повышения уровня глюкозы не за 3- 4 месяца, а за 1- 3 недели, предшествующие исследованию.
Все вышеперечисленные исследования выполняются в клинико — диагностической лаборатории Минского клинического консультативно — диагностического центра бесплатно для пациентов, имеющих направление и платно для пациентов без направления врача.
Врач лабораторной диагностики Т.Б. Парицкая
Influence of hyperinsulinemic – hypoglycemic clamp on induced platelet aggregation, activity of physiological anticoagulants and von Willebrand factor in patients with type I diabetes
90 | Сахарный диабет / Diabetes Mellitus ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
1. D’Addio F, Maffi P, Vezzulli P, et al. Islet transplantation stabilizes
hemostatic abnormalities and cerebral metabolism in individ-
uals with type 1 diabetes. Diabetes Care. 2014;37(1):267-276.
doi: 10.2337/dc13-1663
2. Wisinski JA, Kimple ME. Platelet Dysfunction in Type 1 Diabe-
tes: Stressing the Thromboxanes. Diabetes. 2016;65(2):349-351.
doi: 10.2337/dbi15-0032
3. Wieczorek I, Pell ACH, McIver B, et al. Coagulation and fibrino-
Coagulation and fibrino-
lytic systems in type I diabetes: effects of venous occlusion and
insulin-induced hypoglycaemia. Clin Sci (Lond). 1993;84(1):79-86.
doi: 10.1042/cs0840079
4. Hu H, Li N, Yngen M, et al. Enhanced leukocyte-platelet cross-talk in
Type 1 diabetes mellitus: relationship to microangiopathy. J Thromb
Haemost. 2004;2(1):58-64. doi: 10.1111/j.1538-7836.2003.00525.x
5. Кособян Е.П., Ярек-Мартынова И.Р., Мартынов М.Ю., и др.
Роль эндотелиальной дисфункции в развитии цереброва-
скулярного поражения у пациентов с сахарным диабетом //
Сахарный диабет. – 2012. – Т. 15. – №1. – С. 42-48. [Kosobyan EP,
Yarek-Martynova IR, Martynov MY, et al. Endothelial dysfunction
in development of cerebrovascular disorders in patients with
diabetes mellitus. Diabetes mellitus. 2012;15(1):42-48. (In Russ.)]
doi: 10.14341/2072-0351-5978
6. Husted SE, Nielsen HK, Bak JF, Beck-Nielsen H. Antithrombin III
activity, von Willebrand factor antigen and platelet function in
young diabetic patients treated with multiple insulin injections
versus insulin pump treatment. Eur J Clin Invest. 1989;19(s1):90-94.
Eur J Clin Invest. 1989;19(s1):90-94.
doi: 10.1111/j.1365-2362.1989.tb00312.x
7. Benedetti MM, Celleno R, Timi A, et al. Impaired endothelial anti-
thrombotic activity following short-term interruption of continuous
subcutaneous insulin infusion in type1 diabetic patients. Thromb
Haemost. 2017;98(09):635-641. doi: 10.1160/th07-03-0201
8. Hunt KJ, Baker NL, Cleary PA, et al. Longitudinal Association Between
Endothelial Dysfunction, Inflammation, and Clotting Biomarkers
With Subclinical Atherosclerosis in Type 1 Diabetes: An Evaluation
of the DCCT/EDIC Cohort. Diabetes Care. 2015;38(7):1281-1289.
doi: 10.2337/dc14-287777
9. Schwarz HP, Schernthaner G, Griffin JH. Decreased plasma levels of
protein S in well-controlled type I diabetes mellitus. Thromb Haemost.
1987;57(2):240-246.
10. Schernthaner G, Vukovich T, Knöbl P, et al. The effect of near-nor-
moglycaemic control on plasma levels of coagulation factor
VII and the anticoagulant proteins C and S in insulin-depen-
dent diabetic patients. Br J Haematol. 1989;73(3):356-359.
Br J Haematol. 1989;73(3):356-359.
doi: 10.1111/j.1365-2141.1989.tb07752.x
11. Zaccardi F, Rizzi A, Petrucci G, et al. In Vivo Platelet Activation and
Aspirin Responsiveness in Type 1 Diabetes. Diabetes. 2016;65(2):503-
509. doi: 10.2337/db15-0936
12. Sabatier F, Darmon P, Hugel B, et al. Type 1 And Type 2 Diabetic
Patients Display Different Patterns of Cellular Microparticles. Diabetes.
2002;51(9):2840-2845. doi: 10.2337/diabetes.51.9.2840
13. Salem MA, Adly AA, Ismail EA, et al. Platelets microparticles as
a link between micro- and macro-angiopathy in young pa-
tients with type 1 diabetes. Platelets. 2015;26(7):682-688. doi:
10.3109/09537104.2015.1018880
14. Malachowska B, Tomasik B, Szadkowska A, et al. Altered plate-
lets’ morphological parameters in children with type 1 dia-
betes – a case-control study. BMC Endocr Disord. 2015;15:17.
doi: 10.1186/s12902-015-0011-8
15. Gimenez M, Gilabert R, Monteagudo J, et al. Repeated episodes
Repeated episodes
of hypoglycemia as a potential aggravating factor for preclinical
atherosclerosis in subjects with type 1 diabetes. Diabetes Care.
2011;34(1):198-203. doi: 10.2337/dc10-1371
16. Gogitidze Joy N, Hedrington MS, Briscoe VJ, et al. Effects of acute hy-
poglycemia on inflammatory and pro-atherothrombotic biomarkers
in individuals with type 1 diabetes and healthy individuals. Diabetes
Care. 2010;33(7):1529-1535. doi: 10.2337/dc09-0354
17. Joy NG, Tate DB, Younk LM, Davis SN. Effects of Acute and An-
tecedent Hypoglycemia on Endothelial Function and Markers
of Atherothrombotic Balance in Healthy Humans. Diabetes.
2015;64(7):2571-2580. doi: 10.2337/db14-1729
18. Hartley PS, Savill JS, Brown SB. Hypoglycaemia predisposes platelets
to death by affecting calcium homeostasis and mitochondrial integ-
rity. Platelets. 2007;18(2):103-112. doi: 10.1080/09537100600760822
19. Hutton RA, Mikhailidis D, Dormandy KM, Ginsburg J. Platelet aggre-
Platelet aggre-
gation studies during transient hypoglycaemia: a potential method
for evaluating platelet function. J Clin Pathol. 1979;32(5):434-438.
doi: 10.1136/jcp.32.5.434
20. Trovati M, Anfossi G, Cavalot F, et al. Studies on Mechanisms
Involved in Hypoglycemia-Induced Platelet Activation. Diabetes.
1986;35(7):818-825. doi: 10.2337/diab.35.7.818
21. Lingenfelser T, Overkamp D, Renn W, et al. Insulin-associated
modulation of neuroendocrine counterregulation, hypoglycemia
perception, and cerebral function in insulin-dependent diabetes
mellitus: evidence for an intrinsic effect of insulin on the central
nervous system. J Clin Endocrinol Metab. 1996;81(3):1197-1205.
doi: 10.1210/jcem.81.3.8772600
22. Blockmans D, Deckmyn H, Vermylen J. Platelet actuation. Blood Rev.
1995;9(3):143-156. doi: 10.1016/0268-960x(95)90020-9
23. Castoldi E, Hackeng TM. Regulation of coagulation by protein S. Curr Opin
Curr Opin
Hematol. 2008;15(5):529-536. doi: 10.1097/MOH.0b013e328309ec97
24. Kim HK, Kim JE, Park SH, et al. High coagulation factor levels and
low protein C levels contribute to enhanced thrombin genera-
tion in patients with diabetes who do not have macrovascular
complications. J Diabetes Complications. 2014;28(3):365-369.
doi: 10.1016/j.jdiacomp.2014.01.006
25. Olson ST, Björk I. Regulation of thrombin by antithrombin and
heparin cofactor II. In: Berliner LJ, editor. Thrombin: Structure and
Function. New York: Plenum Press; 1992. p. 159-217.
26. Chiu PL, Bou-Assaf GM, Chhabra ES, et al. Mapping the interac-
tion between factor VIII and von Willebrand factor by electron
microscopy and mass spectrometry. Blood. 2015;126(8):935-938.
doi: 10.1182/blood-2015-04-641688
27. Дёмина О.В., Ходонов А.А., Швец В.И., Варфоломеев С.Д. Агрегация
тромбоцитов человека: молекулярно-кинетические механизмы
и пути регуляции // Биологические мембраны: журнал мембран-
ной и клеточной биологии.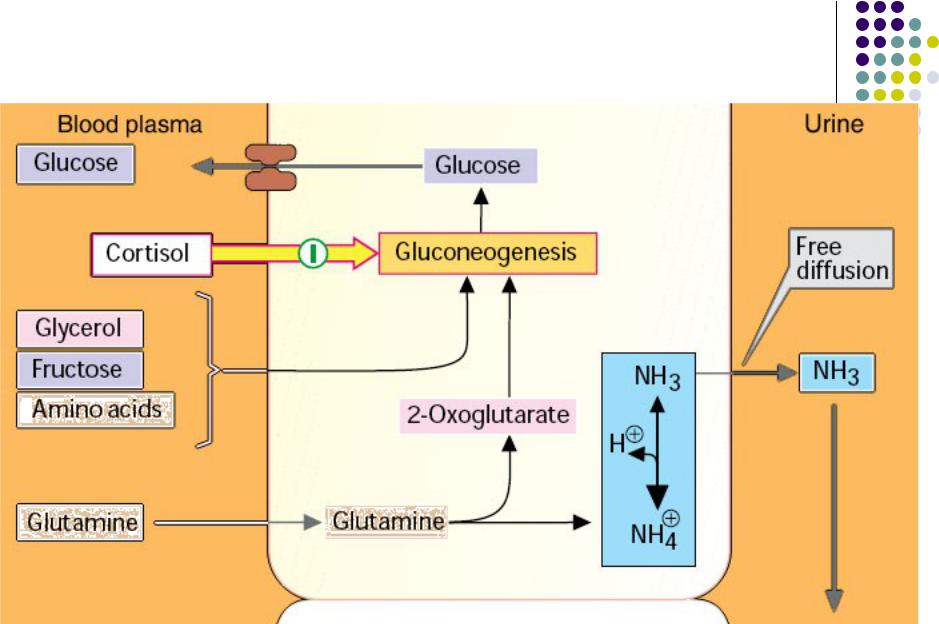 – 2002. – Т. 19. – №2. – С. 115-152.
– 2002. – Т. 19. – №2. – С. 115-152.
[Demina OV, Khodonov AA, Shvets VI, Varfolomeev SD. Human
platelet aggregation process: molecular-kinetic mechanisms and
the regulation ways. Biological membranes. Membrane & cell biology.
2002;19(2):115-152. (In Russ.)]
28. Шатурный В.И., Шахиджанов С.С., Свешникова А.Н., Пантелеев М.А.
Активаторы, рецепторы и пути внутриклеточной сигнализации
в тромбоцитах крови // Биомедицинская химия. – 2014. – Т. 60. –
№2. – С. 182-200. [Shaturny VI, Shakhidzhanov SS, Sveshnikova AN,
Panteleev MA. Activators, receptors and signal transduction path-
ways of blood platelets. Biomed Khim. 2014;60(2):182-200. (In Russ.)]
29. Wallén NH, Goodall AH, Li N, Hjemdahl P. Activation of haemosta-
sis by exercise, mental stress and adrenaline: effects on platelet
sensitivity to thrombin and thrombin generation. Clin Sci (Lond).
1999;97(1):27-35. doi: 10.1042/cs0970027
30. Stel HV, Sakariassen KS, Scholte BJ, et al. Characterization of 25
Stel HV, Sakariassen KS, Scholte BJ, et al. Characterization of 25
monoclonal antibodies to factor VIII-von Willebrand factor: relation-
ship between ristocetin-induced platelet aggregation and platelet
adherence to subendothelium. Blood. 1984;63(6):1408-1415.
31. Воронина Е.Н., Филипенко М.Л., Сергеевичев Д.С., Пикалов И.В.
Мембранные рецепторы тромбоцитов: функции и полиморфизм
// Информационный вестник ВОГиС. – 2006. – Т 10. – №3. –
С. 553-564. [Voronina EN, Filipenko ML, Sergeyevichev DS, Pikalov IV.
Platelet membrane glycoprotein receptors: functions and polymor-
phism. Informatsionnyi vestnik VOGiS. 2006;10(3):553-564. (In Russ.)]
32. Stavenuiter F, Gale AJ, Heeb MJ. Phosphorylation of protein S by
platelet kinases enhances its activated protein C cofactor activity.
FASEB J. 2013;27(7):2918-2925. doi: 10.1096/.12-225961
33. Khan MS, Singh P, Azhar A, et al. Serpin Inhibition Mechanism: A Deli-
cate Balance between Native Metastable State and Polymerization. J
J
Amino Acids. 2011;2011:606797. doi: 10.4061/2011/606797
34. Ceriello A, Esposito K, Ihnat M, et al. Simultaneous control of
hyperglycemia and oxidative stress normalizes enhanced thrombin
generation in type 1 diabetes. J Thromb Haemost. 2009;7(7):1228-
1230. doi: 10.1111/j.1538-7836.2009.03445.x
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
Сахарный диабет. 2018;21(2):84-91 Diabetes Mellitus. 2018;21(2):84-91doi: 10.14341/DM9533
улучшение контроля гликемии, простота и безопасность
Авторы: Заведующая отделением возрастной эндокринологии и клинической фармакологии Института, доктор медицинских наук О.В. Зиныч, старший научный сотрудник научно-консультативного отдела амбулаторно-профилактической помощи больным с эндокринной патологией Института, кандидат медицинских наук С.В. Болгарская
Статья в формате PDF
21-22 февраля в Киеве, под патронатом ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» (г. Киев) (далее – Институт), в рамках ежегодного образовательного проекта «Школа эндокринолога» состоялась научно-практическая конференция. Основная часть прозвучавших здесь докладов была посвящена диагностике и лечению сахарного диабета (СД).
В.П. Комиссаренко НАМН Украины» (г. Киев) (далее – Институт), в рамках ежегодного образовательного проекта «Школа эндокринолога» состоялась научно-практическая конференция. Основная часть прозвучавших здесь докладов была посвящена диагностике и лечению сахарного диабета (СД).
Темой одной из наиболее интересных секций, в которой принимали участие ведущие специалисты Института, стала инъекционная терапия СД 2 типа.
Открыла работу секции заведующая отделением возрастной эндокринологии и клинической фармакологии Института, доктор медицинских наук Олеся Вадимовна Зиныч,
– Выбор идеального препарата для конкретного пациента с СД 2 типа не всегда очевиден, несмотря на наличие шаблонов и пошаговых алгоритмов. Возьмем, например, агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1) и глифлозины, применяемые в лечении пациентов с превалирующими атеросклеротическими изменениями. Обе группы препаратов снижают общую смертность от сердечно-сосудистых заболеваний (ССЗ), причем глифлозины даже в большей степени, чем инкретиномиметики. Но при анализе причин смертности становится понятно, что эти лекарственные средства обладают разным протекторным эффектом. Например, риски смерти от нефатального инфаркта снижаются в равной степени в обеих группах препаратов. Но на риски смерти от нефатального инсульта глифлозины не оказывают существенного влияния. Кроме того, они потенциально повышают риски ампутации конечностей, что уже было доказано в многочисленных исследованиях. Поэтому целесообразность назначения глифлозинов пациентам с атеросклеротическим поражением периферических сосудов сомнительна.
Обе группы препаратов снижают общую смертность от сердечно-сосудистых заболеваний (ССЗ), причем глифлозины даже в большей степени, чем инкретиномиметики. Но при анализе причин смертности становится понятно, что эти лекарственные средства обладают разным протекторным эффектом. Например, риски смерти от нефатального инфаркта снижаются в равной степени в обеих группах препаратов. Но на риски смерти от нефатального инсульта глифлозины не оказывают существенного влияния. Кроме того, они потенциально повышают риски ампутации конечностей, что уже было доказано в многочисленных исследованиях. Поэтому целесообразность назначения глифлозинов пациентам с атеросклеротическим поражением периферических сосудов сомнительна.
В последнее время все чаще поднимается тема мультифокального атеросклероза, когда поражается несколько сосудистых областей. Так, по результатам международного исследования AGATA, у 25% пациентов с ишемической болезнью сердца (ИБС) выявляется атеросклеротическое поражение ≥2 фокусов – у 1/3 это дополнительно цереброваскулярные сосуды, а у 1/5 – периферические. И в этой ситуации возникает вопрос – какие препараты назначить: с изолированным протекторным действием только на коронарные сосуды или те, что защищают несколько локусов? Тем более учитывая тот факт, что пациенты с ИБС крайне редко дополнительно обследуются на предмет выявления атеросклеротического поражения других сосудистых бассейнов.
И в этой ситуации возникает вопрос – какие препараты назначить: с изолированным протекторным действием только на коронарные сосуды или те, что защищают несколько локусов? Тем более учитывая тот факт, что пациенты с ИБС крайне редко дополнительно обследуются на предмет выявления атеросклеротического поражения других сосудистых бассейнов.
У пациентов с СД 2 типа и сердечной недостаточностью (СН) более предпочтительны глифлозины благодаря их кардиопротекторному действию, однако первопричина СН – это ИБС, метаболические нарушения и почечная недостаточность, поэтому, вероятно, более оправданна ее своевременная профилактика. Кроме этого, по данным Европейского общества кардиологов (ESC), частота СН у пациентов с СД 2 типа составляет 12%, из которых старше 70 лет – 16% мужчин и 22% женщин. А у этой категории больных эффективность и безопасность глифлозинов, потенциально ухудшающих клубочковую фильтрацию, которая снижается с возрастом, – весьма спорны. Также возникает вопрос: будут ли одинаково эффективны эти препараты при разной степени выраженности СН, ведь чем выше класс, тем хуже клубочковая фильтрация.
- Лираглутид (Виктоза®) стимулировал секрецию инсулина только тогда, когда уровень глюкозы в крови превышал 4,3 ммоль/л.
- Подавление секреции глюкагона на фоне приема арГПП-1 происходило только в состоянии эугликемии, т.е. >3,7 ммоль/л.
- арГПП-1 не нарушали общую контррегуляцию гипогликемии и не подавляли высвобождение катехоламинов, кортизола и глюкагона.
Другое исследование, которое оценивало секрецию инсулина на фоне введения арГПП-1 в зависимости от глюкозы крови, показало, что при уровне гликемии 2,8 ммоль/л не происходило выработки инсулина, но при 6,6 ммоль/л его секреция повышалась и продолжала нарастать даже при гликемии 16,7 ммоль/л.
Рано или поздно у пациентов с СД 2 типа возникает необходимость перевода их с пероральных сахароснижающих препаратов (ПССП) на инсулинотерапию. Но сегодня, благодаря арГПП-1, есть возможность отсрочить этот момент. Согласно новым клиническим рекомендациям (октябрь, 2018) по интенсификации инсулинотерапии СД, перед переводом на базальный инсулин в случае неэффективности 2-3 ПССП должны быть назначены арГПП-1. На базальный инсулин переводят декомпенсированных пациентов или больных, не ответивших на терапию арГПП-1 (рис. 1).
Косвенным подтверждением перспективности применения арГПП-1 является большое количество исследований по этой группе препаратов. Например, в настоящее время продолжается исследование по применению лираглутида у пациентов с ожирением. В то время как по глифлозинам не отмечается такой тенденции.
Тем не менее, несмотря на все преимущества арГПП-1, они также могут оказаться неэффективными, поэтому перед их назначением имеет смысл оценить сохранность функциональной активности β-клеток поджелудочной железы. Маркерами их активности являются С-пептид и антитела к β-клеткам. Низкий уровень С-пептида и наличие антител – это предикторы недостаточной эффективности арГПП-1.
Маркерами их активности являются С-пептид и антитела к β-клеткам. Низкий уровень С-пептида и наличие антител – это предикторы недостаточной эффективности арГПП-1.
Таким образом, при существующих сегодня возможностях терапии СД выбор должен быть основан на клинических рекомендациях, но с обязательным учетом индивидуальных особенностей пациента и коморбидности.
Тему персонификации лечения СД 2 типа продолжила в своем докладе старший научный сотрудник научно-консультативного отдела амбулаторно-профилактической помощи больным с эндокринной патологией Института, кандидат медицинских наук Светлана Викторовна Болгарская,
– Подход к выбору терапии СД должен быть индивидуальным, с учетом возможных побочных эффектов того или иного препарата у конкретного пациента.
При необходимости перевода больного на базальный инсулин основной фокус выбора должен быть направлен на безопасность – низкий риск гипогликемии. Наиболее предпочтительными с этой точки зрения являются инсулины деглюдек (представлен на отечественном рынке препаратом Тресиба® от компании Novo Nordisk А/S, Дания) и гларгин 300 ЕД. По данным различных исследований, эти инсулины показали наименьший риск гипогликемии в сравнении с аналогами инсулина 1-го поколения – детемир и гларгин 100 ЕД, не говоря уже об инсулине НПХ [нейтральный протамин Хагедорна], который Американская диабетическая ассоциация (ADA) не рекомендует применять у пациентов с СД 2 типа. Чтобы выбрать из наиболее предпочтительных лучший инсулин, необходимо сравнить их фармакокинетику, определить продолжительность действия, эффективность и профиль активности в течение суток по результатам исследований высокого качества.
Наиболее предпочтительными с этой точки зрения являются инсулины деглюдек (представлен на отечественном рынке препаратом Тресиба® от компании Novo Nordisk А/S, Дания) и гларгин 300 ЕД. По данным различных исследований, эти инсулины показали наименьший риск гипогликемии в сравнении с аналогами инсулина 1-го поколения – детемир и гларгин 100 ЕД, не говоря уже об инсулине НПХ [нейтральный протамин Хагедорна], который Американская диабетическая ассоциация (ADA) не рекомендует применять у пациентов с СД 2 типа. Чтобы выбрать из наиболее предпочтительных лучший инсулин, необходимо сравнить их фармакокинетику, определить продолжительность действия, эффективность и профиль активности в течение суток по результатам исследований высокого качества.
Одно из таких исследований (двойное слепое перекрестное) было проведено с участием 60 пациентов с СД 1 типа, рандомизированных на 2 группы. 1-й группе был назначен инсулин Тресиба® в первой части исследования с последующим переводом на инсулин гларгин 300 ЕД, а во 2-й группе, наоборот, пациентам вначале назначали гларгин 300 ЕД с последующим переводом на инсулин Тресиба® (рис. 2).
2).
Целевыми точками исследования были: вариабельность гликемии у одного пациента, вариабельность гликемии в течение суток и общий гипогликемический эффект.
Было подтверждено, что деглюдек имеет более прогнозируемое и стабильное действие по сравнению с инсулином гларгин 300 ЕД, который продемонстрировал значительные колебания гликемии в промежутке 8-18 ч после введения. Вариабельность сахароснижающего эффекта инсулина деглюдек в течение суток оказалась на 40% ниже, чем у гларгина 300 ЕД, а у каждого отдельного пациента это выражается более стабильным уровнем гликемии в течение дня.
Дополнительно было обнаружено, что гипогликемический эффект инсулина Тресиба® на 30% выше, чем у гларгина 300 ЕД.
Важно, что результаты исследования фармакокинетики подтверждаются данными реальной клинической практики. В качестве иллюстрации можно привести пример одного из самых крупных сравнительных исследований CONFIRM, в ходе которого проводился ретроспективный анализ эффективности инсулина деглюдек и гларгина 300 ЕД у 4056 пациентов с СД 2 типа, ранее не получавших инсулин. Участники были отобраны из самой большой базы данных США, охватывающей все уровни медицинской помощи за последние 10 лет и включающей порядка 15% населения страны. Рандомизация была программной и идеальной – пациенты не отличались по возрасту, сопутствующей патологии, индексу массы тела и многим другим параметрам.
Участники были отобраны из самой большой базы данных США, охватывающей все уровни медицинской помощи за последние 10 лет и включающей порядка 15% населения страны. Рандомизация была программной и идеальной – пациенты не отличались по возрасту, сопутствующей патологии, индексу массы тела и многим другим параметрам.
Целевыми точками были: эффективность; частота всех гипогликемий; количество пациентов, перенесших ≥1 эпизод гипогликемии; количество пациентов, отказавшихся от использования инсулина по тем или иным причинам.
Были получены такие результаты:
- Спустя 6 мес применения деглюдек продемонстрировал достоверно большее снижение уровня гликированного гемоглобина (HbA1c) по сравнению с гларгином 300 ЕД.
- Риск развития гипогликемии у пациентов, получавших деглюдек, снизился на 30% в сравнении с таковым у пациентов из группы гларгина 300 ЕД, а риск развития хотя бы одного эпизода гипогликемии – на 25%.
- Приверженность к инсулину деглюдек оказалась значимо выше, отказавшихся от его применения пациентов было на 27% меньше.

- Доза инсулина деглюдек, обеспечивающая лучший контроль гликемии, была на 9,3% ниже, чем у инсулина гларгин 300 ЕД.
Додолнительно безопасность применения инсулина деглюдек была доказана в исследовании DEVOTE с участием 7637 пациентов. В этом исследовании принимали участие пациенты с СД 2 типа, у которых имелись сопутствующие ССЗ. У этой тяжелой группы пациентов, при применении инсулина деглюдек:
- на 53% снизился риск ночной тяжелой гипогликемии;
- на 40% снизился риск тяжелой гликемии;
- на 27% меньше пациентов перенесли тяжелую гипогликемию.
Итак, согласно фармакологическим характеристикам, результатам многочисленных исследований и данным реальной клинической практики, применение инсулина Тресиба® более эффективно и безопасно по сравнению с инсулином гларгин 300 ЕД.
Завершающим в работе секции стало выступление руководителя научно-консультативного отдела амбулаторно-профилактической помощи больным с эндокринной патологией Института, кандидата медицинских наук Валерии Леонидовны Орленко, которая представила инновационный инсулин Райзодег® ФлексТач® (компания Novo Nordisk А/S, Дания), значительно расширяющий возможности врача и пациента.
– Часть больных, нуждающихся в инсулинотерапии, требует одновременной коррекции тощаковой и прандиальной гипергликемии. Но добавление прандиального инсулина к болюсному всегда ухудшает приверженность к терапии и усложняет ее. Многим пациентам и врачам известны «микст-инсулины», позволяющие сократить количество инъекций, однако они требуют четкого расчета пика действия и перекусов, чтобы избежать риска гипогликемии.
Сегодня в нашем распоряжении впервые появился базальный и болюсный инсулин в одной шприц-ручке – Райзодег®. Он сочетает в себе преимущества пролонгированного инсулина деглюдек (70%) и давно известного инсулина аспарт (30%). То есть это наиболее физиологичная комбинация из всех возможных. Этот инсулин объединил преимущество двух инсулинов – базального инсулина деглюдек и прандиального инсулина аспарт.
Деглюдек: действие >42 ч, низкий риск гипогликемии, вводится в удобное для пациента время (с минимальным интервалом в 8 ч и максимальным – 42 ч), разрешен у детей от 1 года, имеет опыт применения во всем мире >6 лет.
Аспарт – продолжительность действия в 2 раза быстрее и короче, чем у человеческого инсулина, меньше риск гипогликемии, введение – до, во время или после приема пищи, международный опыт применения – почти 20 лет.
Необходимость проведения базально-болюсной (Б-Б) терапии у пациентов с СД 2 типа продиктована наличием прандиальной гипергликемии, которая является следствием нарушения 1-й фазы секреции инсулина. А она, в свою очередь, не восстанавливается многими другими препаратами/инсулинами и является независимым фактором риска ССЗ. Кроме этого, отсутствие 1-й фазы секреции инсулина приводит к гиперглюкагонемии, глюконеогенезу, глюкогенолизу.
В отличие от здоровых людей у больных СД 2 типа вдвое увеличиваются глюконеогенез и глюкогенолиз (рис. 3). И именно это обстоятельство в большей степени, чем углеводная нагрузка, служит фактором, влияющим на повышение уровня постпрандиальной гликемии (ППГ). Вследствие потери 1-й фазы постпрандиальной секреции инсулина не подавляется продукция глюкагона. Поэтому независимо от употребления экзогенных углеводов продолжается образование эндогенной глюкозы (глюкогенез, глюконеогенез и гликолиз) с развитием выраженной ППГ, которая влияет на интегральные показатели компенсации.
Поэтому независимо от употребления экзогенных углеводов продолжается образование эндогенной глюкозы (глюкогенез, глюконеогенез и гликолиз) с развитием выраженной ППГ, которая влияет на интегральные показатели компенсации.
В исследовании DECODE, включившем >25 тыс пациентов с СД 2 типа, сравнивалась роль показателей гликемии натощак и 2-часовой ППГ в качестве предикторов смертности. В процессе исследования были получены уникальные данные, показавшие, что отсутствие контроля уровня ППГ (>8 ммоль/л) вдвое повышает риск сердечно-сосудистой смертности.
Доказано, что пациенты, контролирующие прандиальную гликемию с помощью болюсного инсулина, чаще достигают эффективного контроля HbA1c – 94 против 64%. Поэтому при целевых значениях гликемии натощак, но сохранении высоких показателей HbA1c следует оценить ППГ и использовать БАЗАЛ + инсулин перед наибольшим приемом углеводной пищи (рис. 4). Причем подстраивать прием еды под введение инсулина необязательно; напротив, время инъекции может быть изменено в зависимости от времени наибольшего приема пищи. При большей углеводной нагрузке – 2, а не 1 раз в день, суточная доза инсулина Райзодег® может быть разделена на 2 инъекции с интервалом не менее 4 ч (с учетом длительности действия инсулина аспарт).
При большей углеводной нагрузке – 2, а не 1 раз в день, суточная доза инсулина Райзодег® может быть разделена на 2 инъекции с интервалом не менее 4 ч (с учетом длительности действия инсулина аспарт).
Таким образом, выбор инсулина Райзодег® в качестве старта инсулинотерапии обеспечивает целый ряд преимуществ:
- одновременный контроль гликемии натощак и после приема пищи;
- простота применения – введение перед наибольшим приемом пищи;
- безопасность – снижение риска ночных эпизодов гипогликемии;
- более длительный контроль диабета с применением одного препарата.
Недостаточная эффективность базального инсулина требует добавления 1 болюса перед самым большим приемом пищи или перехода на 2 инъекции комбинированного инсулина (рекомендации ADA/EASD). Реализовать этот подход можно просто назначив БАЗАЛ + инсулин Райзодег®.
Важно отметить, что перевод с базального, двухфазного инсулинов или с Б-Б терапии на Райзодег® прост и безопасен – используются те же суточные дозы, даже если до этого не были достигнуты целевые значения гликемии, потому что чувствительность к деглюдеку в составе Райзодег® выше, чем к гларгину 300 ЕД.
Титруется доза инсулина Райзодег® 1 раз в неделю согласно среднему значению трехкратного определения глюкозы натощак. Если целевые значения гликемии не были достигнуты, добавляют 2 ЕД, при показателях ниже целевых доза снижается на 2 ЕД. Хлебные единицы не подсчитывают.
Преимущества перевода на инсулин Райзодег®:
- Улучшение контроля гликемии независимо от предыдущего режима инсулинотерапии.
- Простота применения – меньшее количество инъекций.
- Безопасность:
- снижение риска ночных гипогликемий;
- невозможность перепутать препараты инсулина.
- Достижение рекомендованного контроля диабета с меньшей дозой инсулина.
Инновационный инсулин Райзодег® значительно расширяет возможности старта и интенсификации инсулинотерапии, делает ее более удобной и эффективной.
Таким образом, сегодня есть все основания утверждать, что современная терапия СД позволяет сделать оптимальный выбор для каждого конкретного пациента, повысить его комплаенс к лечению и свести к минимуму риски.
Подготовила Ирина Чумак
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 1 (45) березень 2019 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
15.11.2021 Ендокринологія Нейропротекторні властивості тіоктової кислоти у хворих на діабетДіабет є одним із системних захворювань із великою кількістю ускладнень, які впливають на різні системи організму, в тому числі на серцево-судинну й нервову [1]. Зростання частки в загальній популяції літніх людей призводить до проблем, пов’язаних зі зниженням когнітивних здібностей. Відомо також, що в осіб із діабетом деменція спостерігається у 2-3 рази частіше [2]….
Зростання частки в загальній популяції літніх людей призводить до проблем, пов’язаних зі зниженням когнітивних здібностей. Відомо також, що в осіб із діабетом деменція спостерігається у 2-3 рази частіше [2]….
Науково-освітній проєкт «Школа ендокринолога» передбачає не лише класичні лекції, а й консиліуми, під час яких відбувається обговорення окремих клінічних випадків і ситуацій. Так, консиліум № 6 був присвячений обговоренню кардіометаболічного пацієнта, в якому взяли участь старший науковий співробітник ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска»
НАМН України» (м. Київ), доктор медичних наук Лариса Анатоліївна Міщенко та старший науковий співробітник ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Любов Костянтинівна Соколова….
Так, консиліум № 6 був присвячений обговоренню кардіометаболічного пацієнта, в якому взяли участь старший науковий співробітник ДУ «Національний науковий центр «Інститут кардіології ім. М. Д. Стражеска»
НАМН України» (м. Київ), доктор медичних наук Лариса Анатоліївна Міщенко та старший науковий співробітник ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Любов Костянтинівна Соколова….
Складним завданням для лікаря загальної практики є раннє виявлення гіперфункції паращитоподібних залоз (ПЩЗ), частота якої неухильно зростає [1-3]. Поширеність первинного гіперпаратиреозу (ГПТ) досягає 0,3% у загальній популяції, а серед жінок віком >50 років – 1%, але часто ця патологія залишається недіагностованою [4], що зумовлено значним поліморфізмом клінічних ознак унаслідок різноманіття причин і механізмів патогенезу первинного, вторинного чи третинного ГПТ [3, 5]….
Поширеність первинного гіперпаратиреозу (ГПТ) досягає 0,3% у загальній популяції, а серед жінок віком >50 років – 1%, але часто ця патологія залишається недіагностованою [4], що зумовлено значним поліморфізмом клінічних ознак унаслідок різноманіття причин і механізмів патогенезу первинного, вторинного чи третинного ГПТ [3, 5]….
Незважаючи на вагомий арсенал цукрознижувальних препаратів (ЦЗП), більшість пацієнтів із цукровим діабетом (ЦД) 2 типу не досягають контролю захворювання. Зі збільшенням
тривалості ЦД 2 типу та подальшим його прогресуванням ситуація тільки погіршується,
оскільки ефективність дії пероральних ЦЗП починає знижуватися. Виходом із цієї ситуації є своєчасне призначення інсулінотерапії, але таке лікування асоціюється з підвищеним ризиком гіпоглікемії та збільшенням маси тіла. При цьому контроль захворювання в більшості випадків
так і залишається незадовільним….
Зі збільшенням
тривалості ЦД 2 типу та подальшим його прогресуванням ситуація тільки погіршується,
оскільки ефективність дії пероральних ЦЗП починає знижуватися. Виходом із цієї ситуації є своєчасне призначення інсулінотерапії, але таке лікування асоціюється з підвищеним ризиком гіпоглікемії та збільшенням маси тіла. При цьому контроль захворювання в більшості випадків
так і залишається незадовільним….
Воздействие острой гипогликемии на воспалительные и проатеротропные биомаркеры у лиц с диабетом 1 типа и здоровыми людьми
Effects of Acute Hypoglycemia on Inflammatory and Pro-atherothrombotic Biomarkers in Individuals With Type 1 Diabetes and Healthy IndividualsИсточник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2890354/
Недавние крупные рандомизированные исследования связаны с неблагоприятными сердечно-сосудистыми и цереброваскулярными событиями с гипогликемией. Однако интегрированные физиологические и сосудистые биологические механизмы, возникающие при гипогликемии, не были широко исследованы. Поэтому целью этого исследования было определить, может ли 2 h умеренной зажатой гипогликемии уменьшать фибринолитический баланс и активировать проатеротромботические механизмы у людей с диабетом 1 типа и здоровыми людьми.
Однако интегрированные физиологические и сосудистые биологические механизмы, возникающие при гипогликемии, не были широко исследованы. Поэтому целью этого исследования было определить, может ли 2 h умеренной зажатой гипогликемии уменьшать фибринолитический баланс и активировать проатеротромботические механизмы у людей с диабетом 1 типа и здоровыми людьми.
Тридцать пять здоровых добровольцев (19 мужчин и 16 женщин в возрасте 32 ± 2 года, ИМТ 26 ± 2 кг / м2, А1С 5,1 ± 0,1%) и двадцать четыре с диабетом 1 типа (12 мужчин и 12 женщин в возрасте 33 ± 3 года, ИМТ 24 ± 2 кг / м2, A1C 7,7 ± 0,2%) изучали в течение двухчасового гиперинсулинемического (9 пмоль · кг-1 · мин-1) эугликемического или гипогликемического (2,9 ± 0,1 ммоль / л) зажима или оба протокола. Уровни глюкозы в плазме были нормализованы в течение ночи у пациентов с диабетом 1-го типа до каждого исследования.
Уровни инсулина были одинаковыми (602 ± 44 пмоль / л) во всех четырех протоколах. Гликемия была эквивалентна как в эвгликемических протоколах (5,2 ± 0,1 ммоль / л), так и в уровне гипогликемии была одинаковой как у пациентов с диабетом типа 1, так и у здоровых контрольных субъектов (2,9 ± 0,1 ммоль / л). Используя повторный ANOVA, было установлено, что ингибитор активатора плазминогена (PAI-1), молекула адгезии сосудов (VCAM), молекула межклеточной адгезии (ICAM), E-селектин, P-селектин, интерлейкин-6 (IL-6), сосудистый эндотелиальный фактор роста (VEGF) и ответы адипонектина были значительно увеличены (P
Используя повторный ANOVA, было установлено, что ингибитор активатора плазминогена (PAI-1), молекула адгезии сосудов (VCAM), молекула межклеточной адгезии (ICAM), E-селектин, P-селектин, интерлейкин-6 (IL-6), сосудистый эндотелиальный фактор роста (VEGF) и ответы адипонектина были значительно увеличены (P
Таким образом, умеренная гипогликемия резко увеличивает циркулирующие уровни PAI-1, VEGF, молекул сосудистой адгезии (VCAM, ICAM, E-selectin), IL-6 и маркеров активации тромбоцитов (P-селектин) у лиц с диабетом 1 типа и здоровых людей. Мы пришли к выводу, что острая гипогликемия может привести к комплексным сосудистым эффектам, включая активацию протромботических, провоспалительных и проатерогенных механизмов у лиц с диабетом 1-го типа и здоровыми людьми.
Гипогликемия встречается очень часто у людей с диабетом 1 типа. Несмотря на это, эффекты гипогликемии на сосудистую биологию in vivo при диабете 1-го типа не изучались широко. Сообщения о случаях заболевания и недавнее исследование связаны с гипогликемией со стенокардией, инфарктом миокарда и острыми цереброваскулярными событиями (1,2). В последнее время большое эпидемиологическое исследование показало, что гипогликемия приводит к увеличению риска сердечно-сосудистых заболеваний и смертности от всех причин (3). Кроме того, недавнее крупное рандомизированное клиническое исследование при диабете 2 типа выявило повышенный риск смерти, когда уровни глюкозы интенсивно лечились (4). Принимая во внимание, что роль гипогликемии в непосредственном воздействии на увеличение побочных эффектов в действии для борьбы с сердечно-сосудистым риском при диабете (ACCORD) не установлена, гораздо более сильная связь между тяжелой гипогликемией и сосудистыми неблагоприятными событиями была указана в исследовании диабета по делам ветеранов ( VADT) (также при диабете 2 типа) (5). Поскольку пациенты с диабетом типа 1 переходят в средний возраст, они также, вероятно, станут более восприимчивыми к сосудистым заболеваниям. Гипогликемия была связана с внезапной смертью при диабете 1 типа, хотя механизм остается спекулятивным (6). Смещение этого риска, предшествующий период интенсивного контроля глюкозы в сочетании с продолжающимися умеренными гликемическими уровнями (A1C ~ 8,0%), привел к снижению сердечно-сосудистых заболеваний при диабете 1-го типа (7).
В последнее время большое эпидемиологическое исследование показало, что гипогликемия приводит к увеличению риска сердечно-сосудистых заболеваний и смертности от всех причин (3). Кроме того, недавнее крупное рандомизированное клиническое исследование при диабете 2 типа выявило повышенный риск смерти, когда уровни глюкозы интенсивно лечились (4). Принимая во внимание, что роль гипогликемии в непосредственном воздействии на увеличение побочных эффектов в действии для борьбы с сердечно-сосудистым риском при диабете (ACCORD) не установлена, гораздо более сильная связь между тяжелой гипогликемией и сосудистыми неблагоприятными событиями была указана в исследовании диабета по делам ветеранов ( VADT) (также при диабете 2 типа) (5). Поскольку пациенты с диабетом типа 1 переходят в средний возраст, они также, вероятно, станут более восприимчивыми к сосудистым заболеваниям. Гипогликемия была связана с внезапной смертью при диабете 1 типа, хотя механизм остается спекулятивным (6). Смещение этого риска, предшествующий период интенсивного контроля глюкозы в сочетании с продолжающимися умеренными гликемическими уровнями (A1C ~ 8,0%), привел к снижению сердечно-сосудистых заболеваний при диабете 1-го типа (7). Однако информация, касающаяся любой возможной провоспалительной и результирующей активации проатеротромботических ответов при диабете 1 типа при гипогликемии, недостаточна. На сегодняшний день в очень немногих исследованиях изучено влияние гипогликемии на сосудистую физиологию при диабете 1 типа (8-10). Усложнением интерпретации этих скудных данных является тот факт, что уровни инсулина и глюкозы не контролируются. Таким образом, поскольку теперь признано, что как инсулин, так и гипергликемия могут иметь независимые сосудистые биологические эффекты (11), становится важным строго контролировать эти две важные переменные. Поэтому в настоящем исследовании была проверена гипотеза о том, что острая умеренная гипогликемия может активировать провоспалительные механизмы и уменьшать фибринолитический баланс как у индивидуумов с диабетом 1 типа, так и у людей бездиабетической инфекции. Использовались методы гиперинсулинемического эугликемического и гипогликемического зажима, чтобы уровни инсулина можно было приравнять, а значения глюкозы можно было контролировать независимо в течение каждого исследования.
Однако информация, касающаяся любой возможной провоспалительной и результирующей активации проатеротромботических ответов при диабете 1 типа при гипогликемии, недостаточна. На сегодняшний день в очень немногих исследованиях изучено влияние гипогликемии на сосудистую физиологию при диабете 1 типа (8-10). Усложнением интерпретации этих скудных данных является тот факт, что уровни инсулина и глюкозы не контролируются. Таким образом, поскольку теперь признано, что как инсулин, так и гипергликемия могут иметь независимые сосудистые биологические эффекты (11), становится важным строго контролировать эти две важные переменные. Поэтому в настоящем исследовании была проверена гипотеза о том, что острая умеренная гипогликемия может активировать провоспалительные механизмы и уменьшать фибринолитический баланс как у индивидуумов с диабетом 1 типа, так и у людей бездиабетической инфекции. Использовались методы гиперинсулинемического эугликемического и гипогликемического зажима, чтобы уровни инсулина можно было приравнять, а значения глюкозы можно было контролировать независимо в течение каждого исследования.
Тридцать пять здоровых субъектов (19 мужчин и 16 женщин, возраст 32 лет ± 2, ИМТ 26 ± 2 кг / м2, A1C 5,1 ± 0,1) и двадцать четыре с диабетом 1 типа (12 мужчин и 12 женщин, возраст 33 ± 3 лет, BMI 24 ± 2 кг / м2, A1C 7,7 ± 0,2 [нормальный диапазон 4-6,5%], продолжительность диабета 17 ± 8 лет) (данные можно найти в онлайн-приложении Таблица 1, доступная по адресу http: // care .diabetesjournals.org / CGI / содержание / полный / dc09-0354 / DC1). У индивидов с диабетом 1 типа были нормальные прикроватные тесты автономной функции (12) и не имели неосведомленности гипогликемии на основе методов Gold и др. (13). У пациентов с диабетом 1-го типа не было серьезных макро- или микро-осложнений диабета. Тип 1 диабетических субъектов были исключены из исследования, если у них была история судорог, вызванных гипогликемией, или главный эпизод гипогликемии в предыдущие 2 года. Лица, страдающие сахарным диабетом 1-го типа, лечились несколькими инъекциями инсулина в день или инсулиновой помпой. Все испытуемые были некурящими и имели нормальный уровень крови, липиды плазмы, электролиты плазмы, функции печени и почек и были нормотензивными. Ни один субъект не принимал лекарства, которые, как известно, влияли на нейроэндокринные реакции на гипогликемию (в частности, флуоксетин) или влияли на тромбоциты, свертывание крови или фибринолитический баланс. Некоторые из индивидуумов, включенных в настоящее исследование, служили контрольным субъектом для определения обычных исходных противорегуляторных ответов на гипогликемию в предыдущих исследованиях (14,15). Исследования были одобрены Советом по изучению институциональных исследований Университета Вандербильта, и все участники дали письменное информированное согласие.
Все испытуемые были некурящими и имели нормальный уровень крови, липиды плазмы, электролиты плазмы, функции печени и почек и были нормотензивными. Ни один субъект не принимал лекарства, которые, как известно, влияли на нейроэндокринные реакции на гипогликемию (в частности, флуоксетин) или влияли на тромбоциты, свертывание крови или фибринолитический баланс. Некоторые из индивидуумов, включенных в настоящее исследование, служили контрольным субъектом для определения обычных исходных противорегуляторных ответов на гипогликемию в предыдущих исследованиях (14,15). Исследования были одобрены Советом по изучению институциональных исследований Университета Вандербильта, и все участники дали письменное информированное согласие.
Субъекты участвовали либо в одном гиперинсулинемическом эугликемическом или гипогликемическом зажиме, либо в обоих наборах экспериментов. Число индивидуумов, участвующих в каждой группе исследования, было: эвгликемия диабета 1 типа (n = 14), гипогликемия диабета 1 типа (n = 17), здоровая контрольная эугликемия (n = 22), здоровая контрольная гипогликемия (n = 25) , Десять здоровых контрольных субъектов и семь индивидуумов с диабетом типа 1 участвовали как в эугликемических, так и в гипогликемических протоколах рандомизированным образом. Результаты этой подгруппы концептуально похожи на всю когорту (данные доступны в онлайн-приложении Таблица 3, рис. A1 и A2). Все пациенты-исследователи просили избегать любых упражнений и потреблять их обычную диету для поддержания веса в течение 3 дней перед каждым экспериментом. У всех пациентов с диабетом 1 типа было предложено проводить интенсивный мониторинг уровня глюкозы в домашних условиях (т. Е. По меньшей мере четыре теста на глюкозу в день) и избегать гипогликемии в течение как минимум 5 дней до начала исследования. В день, предшествующий исследованию, инсулин промежуточного или длительного действия был прекращен и заменен инъекциями обычного инсулина перед завтраком и обедом. Каждый испытуемый был принят в Центр клинических исследований Vanderbilt (CRC) в ~ 5:00. вечером перед экспериментом. В это время у индивидуумов с диабетом 1 типа были введены две внутривенные канюли под местной анестезией 1% лидокаина. Одна канюля была помещена ретроградным способом в вену на тыльной стороне кисти.
Результаты этой подгруппы концептуально похожи на всю когорту (данные доступны в онлайн-приложении Таблица 3, рис. A1 и A2). Все пациенты-исследователи просили избегать любых упражнений и потреблять их обычную диету для поддержания веса в течение 3 дней перед каждым экспериментом. У всех пациентов с диабетом 1 типа было предложено проводить интенсивный мониторинг уровня глюкозы в домашних условиях (т. Е. По меньшей мере четыре теста на глюкозу в день) и избегать гипогликемии в течение как минимум 5 дней до начала исследования. В день, предшествующий исследованию, инсулин промежуточного или длительного действия был прекращен и заменен инъекциями обычного инсулина перед завтраком и обедом. Каждый испытуемый был принят в Центр клинических исследований Vanderbilt (CRC) в ~ 5:00. вечером перед экспериментом. В это время у индивидуумов с диабетом 1 типа были введены две внутривенные канюли под местной анестезией 1% лидокаина. Одна канюля была помещена ретроградным способом в вену на тыльной стороне кисти. Эта рука была помещена в нагретую коробку (55-60 ° C) во время исследования, чтобы можно было получить артериализованную кровь. Другая канюля была помещена в контралатеральный рукав для инфузий. Все испытуемые получали ужин, а люди с диабетом 1 типа получали непрерывную инфузию инсулина с низкой дозой для нормализации уровня глюкозы в плазме. Вливание инсулина регулировали в течение ночи для поддержания уровня глюкозы в крови между 4,4 и 7,2 ммоль / л.
Эта рука была помещена в нагретую коробку (55-60 ° C) во время исследования, чтобы можно было получить артериализованную кровь. Другая канюля была помещена в контралатеральный рукав для инфузий. Все испытуемые получали ужин, а люди с диабетом 1 типа получали непрерывную инфузию инсулина с низкой дозой для нормализации уровня глюкозы в плазме. Вливание инсулина регулировали в течение ночи для поддержания уровня глюкозы в крови между 4,4 и 7,2 ммоль / л.
Все испытуемые изучали после ночной, 10-часовой быстрой. Венозные канюли, как описано выше, помещали в здоровые контрольные субъекты. После этого разрешался период в 120 мин, а затем 120-минутный гиперинсулинемический гипогликемический экспериментальный период. В течение 120 мин вводили начальную константу (9,0 пмоль · кг-1 · мин-1) инсулина (Human Regular Insulin, Eli Lilly, Indianapolis, IN) и продолжали до 240 мин. Скорость падения глюкозы контролировалась (~ 0,08 ммоль / мин), а глюдиновая надир (2,9 ммоль / л) была достигнута с использованием модификации метода зажима глюкозы. В течение периода зажима глюкозу в плазме измеряли каждые 5 мин, а инфузию декстрозы 20% регулировали так, чтобы уровни глюкозы в плазме поддерживались на уровне 2,9 ± 0,1 ммоль / л (16). Хлорид калия (20 ммоль / л) вводили во время зажима для снижения индуцированной инсулином гипокалиемии.
В течение периода зажима глюкозу в плазме измеряли каждые 5 мин, а инфузию декстрозы 20% регулировали так, чтобы уровни глюкозы в плазме поддерживались на уровне 2,9 ± 0,1 ммоль / л (16). Хлорид калия (20 ммоль / л) вводили во время зажима для снижения индуцированной инсулином гипокалиемии.
Эти эксперименты проводились в том же формате, что и описанные выше эксперименты по гипогликемии, за исключением того, что во время каждого исследования поддерживалась эвгликемия (5,2 ± 0,1 ммоль / л).
Сбор образцов крови описан в другом месте (14). Концентрации глюкозы в плазме измеряли в трех повторностях с использованием метода глюкозооксидазы с помощью анализатора глюкозы (Beckman, Fullerton, CA). Инсулин измеряли, как описано выше, с коэффициентом вариации (CV), равным 9% (14). Катехоламины определяли с помощью высокоэффективной жидкостной хроматографии с интервазом CV 12% для эпинефрина и 8% для норадреналина (14). Кортизол анализировали с использованием набора для радиоиммуноанализа с гамма-покрытием для клинических исследований с интервазом CV 6% (14).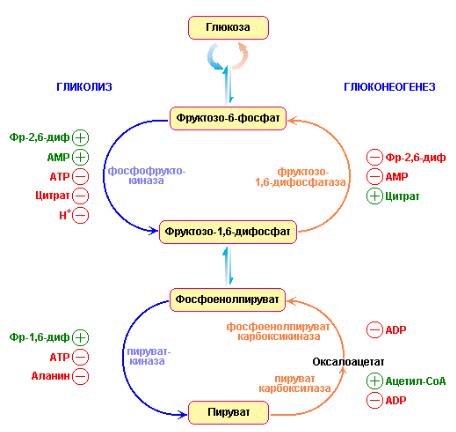 Нестерифицированные жирные кислоты (NEFA) измеряли с использованием набора WAKO с интервазом CV 7%.
Нестерифицированные жирные кислоты (NEFA) измеряли с использованием набора WAKO с интервазом CV 7%.
Кровь брали каждые 60 мин для растворимой молекулы адгезии сосудистых клеток-1 (sVCAM-1), растворимой молекулы межклеточной адгезии-1 (sICAM-1), E-селектина, P-селектина, интерлейкина-6 (IL-6), опухоли фактор некроза-α (TNF-α), фактор роста эндотелия сосудов (VEGF), ингибитор активатора плазминогена 1 (PAI-1), активатор тканевого плазминогена (tPA) и адипонектин проводили каждые 60 минут и каждые 30 минут для катехоламинов, кортизола , и NEFA в течение экспериментального периода. Сосудистые адгезионные молекулы и адипонектин анализировали с использованием исследовательских наборов LINCO (Сент-Чарльз, Миссури) с интервальными CV 8,5% для sVCAM, 9,7% для sICAM, 13,4% для sE-селектина, 15,9% для адипонектина), 9,02% для IL- 6, 9,98% для TNF-α и 8,2% для VEGF. P-селектин (CV 9,9%), обнаружение масштаба Мезо (Gaithersburg, MD), PAI-1 и tPA-антиген определяли с помощью TintElize PAI-1 Kit с интервальным CV 3,3%.
Данные выражаются как средние ± SE и анализируются с использованием стандартного, параметрического, одно- и двухстороннего анализа дисперсии (ANOVA) с повторными мерами (SPSS, Chicago, IL). Данные также анализировались с помощью парного и непарного двухстороннего теста t (Graph Pad Software, Сан-Диего, Калифорния). Во всех случаях значение P
Уровень глюкозы в плазме поддерживался равным образом (5,2 ± 0,1 ммоль / л) во время зажимов эвгликемии. Плазменная глюкоза достигла стационарного состояния на 150 мин, а эквивалентная гипогликемия (2,9 ± 0,1 ммоль / л) поддерживалась во всех процедурах загустения гипогликемии (онлайн-приложение А3). Уровни инсулина (602 ± 24 пмоль / л) как для здоровых, так и для диабетических групп типа 1 были одинаковыми во всех четырех исследованиях зажима в протоколе (онлайн-приложение на рис. A3).
Реакции эпинефрина были значительно выше (Р
Уровни уровня NEFA крови значительно снизились (Р
За исключением VCAM-1 у здоровых субъектов управления и ICAM-1 у пациентов с диабетом 1 типа, исходные значения были одинаковыми в начале зажимов эугликемических и гипогликемических препаратов (онлайн-приложение Таблицы 2 и 3).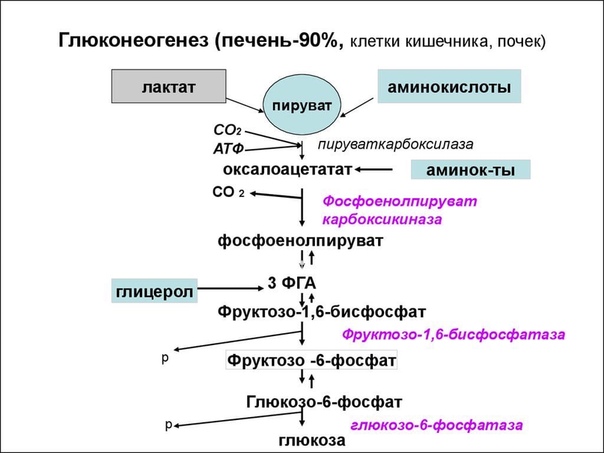 Реакции плазмы VCAM, ICAM и E-селектина во время 120-минутных исследований зажима были существенно различны (P
Реакции плазмы VCAM, ICAM и E-селектина во время 120-минутных исследований зажима были существенно различны (P
Эффекты гиперинсулинемической эугликемии и гипогликемии (2,9 ммоль / л) у здоровых контрольных субъектов с ночным голоданием (n = 35) и лиц с диабетом 1 типа (n = 24), которые участвовали либо в одном, либо в обоих исследованиях по сосудистым биологическим маркерам. Реакция VCAM-1, ICAM-1, E-селектина и VEGF значительно повышается во время гипогликемии по сравнению с эугликемией как у здоровых пациентов, так и у пациентов с диабетом 1-го типа. Статистическая разница с двухсторонним ANOVA во время 120-минутных экспериментов зажима отмечена на каждой панели графа.
Реакция P-селектина плазмы была значительно различной (P
Эффекты гиперинсулинемической эугликемии и гипогликемии (2,9 ± 0,1 ммоль / л) у здоровых контрольных субъектов с ночной голодами (n = 35) и пациентов с диабетом 1 типа (n = 24), которые участвовали либо в одном, либо в обоих исследованиях по сосудистым биологическим маркеры. Ответы PAI-1, P-селектина, IL-6 и адипонектина значительно повышаются во время гипогликемии по сравнению с эугликемией у здоровых субъектов контроля. Реакции P-селектина, IL-6 и адипонектина значительно повышаются при гипогликемии по сравнению с эугликемией при диабете 1-го типа. Статистическая разница с двухсторонним ANOVA во время 120-минутных экспериментов зажима отмечена на каждой панели графа.
Ответы PAI-1, P-селектина, IL-6 и адипонектина значительно повышаются во время гипогликемии по сравнению с эугликемией у здоровых субъектов контроля. Реакции P-селектина, IL-6 и адипонектина значительно повышаются при гипогликемии по сравнению с эугликемией при диабете 1-го типа. Статистическая разница с двухсторонним ANOVA во время 120-минутных экспериментов зажима отмечена на каждой панели графа.
* Средние индивидуальные пиковые ответы VCAM-1, ICAM-1, E-селектина, VEGF, PAI-1, IL-6, P-селектина и адипонектина у здоровых контрольных субъектов (n = 35) и пациентов с диабетом типа 1 (n = 24), которые участвовали в одном или обоих исследованиях, значительно увеличились (P
Исходные значения для адипонектина, VEGF, IL-6 и TNFα были одинаковыми в начале обоих наборов глюкозных зажимов (онлайн-приложения Таблицы 2 и 3). Реакции адипонектина в плазме были значительно различны (P
Это исследование определило влияние 2 ч зажатой гиперинсулинемической эугликемии и умеренной гипогликемии на провоспалительные механизмы и фибринолитический баланс у лиц с диабетом 1 типа и здоровыми людьми.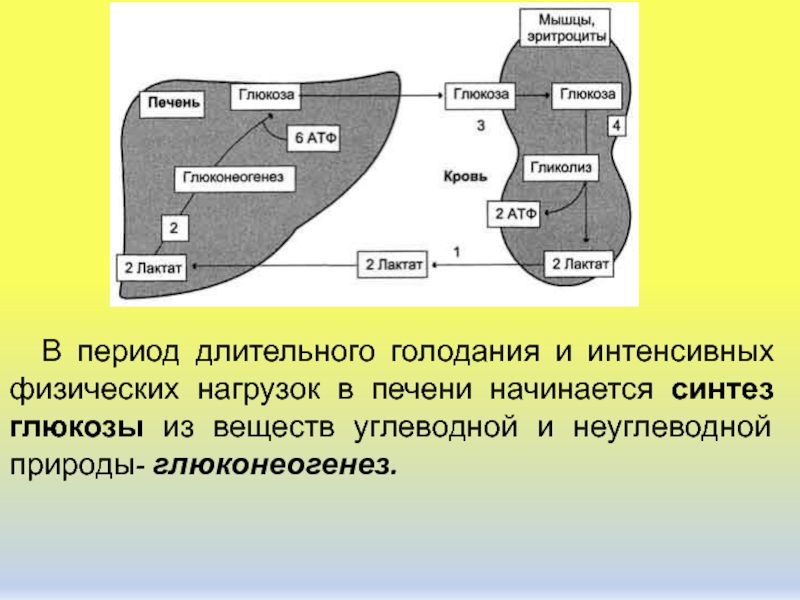 Наши результаты показывают, что гипогликемия может оказывать острое и широко распространенное воздействие на сосудистую биологию. Гипогликемия может 1) активировать провоспалительные механизмы (ICAM, VCAM, E-selectin, VEGF, IL-6), 2) увеличивать активацию тромбоцитов (P-селектин) и 3) одновременно уменьшать системный фибринолитический баланс (увеличение PAI-1, no изменение tPA) у обоих индивидуумов диабет 1 типа и здоровых людей. Эти эффекты были одинаковой величины у здоровых субъектов управления и пациентов с диабетом 1-го типа и были противоположны уменьшенным ответам вышеуказанных сосудистых биологических механизмов, которые возникали во время зажатой эугликемии с эквивалентной гиперинсулинемией.
Наши результаты показывают, что гипогликемия может оказывать острое и широко распространенное воздействие на сосудистую биологию. Гипогликемия может 1) активировать провоспалительные механизмы (ICAM, VCAM, E-selectin, VEGF, IL-6), 2) увеличивать активацию тромбоцитов (P-селектин) и 3) одновременно уменьшать системный фибринолитический баланс (увеличение PAI-1, no изменение tPA) у обоих индивидуумов диабет 1 типа и здоровых людей. Эти эффекты были одинаковой величины у здоровых субъектов управления и пациентов с диабетом 1-го типа и были противоположны уменьшенным ответам вышеуказанных сосудистых биологических механизмов, которые возникали во время зажатой эугликемии с эквивалентной гиперинсулинемией.
В настоящем исследовании были определены эффекты гипогликемии и гиперинсулинемии на различные провоспалительные и потенциально проатеротромботические механизмы. ICAM-1, VCAM-1 и E-селектин являются белками клеточной поверхности, которые активируются во время воспаления и повышают адгезию лейкоцитов к поврежденным артериальным эндотелиальным клеткам, что является основной стадией образования бляшек и последующего атеросклероза. Анализ ответов во время гиперинсулинемических зажимов демонстрирует значительное влияние гипогликемии на увеличение VCAM, ICAM, E-селектина и VEGF по сравнению с эугликемией как у здоровых пациентов, так и у лиц с диабетом типа 1. Сообщается, что VEGF является проатеросклеротическим на животных (17). Кроме того, VEGF может сильно увеличить пролиферацию эндотелия, приводя к появлению новых кровеносных сосудов. Гипогликемия также имела сходные эффекты, увеличивая уровни P-селектина в плазме у людей с диабетом 1 типа и недиабетическими индивидуумами. P-селектин является молекулой адгезии, которая активируется воспалением (18) и выражается как эндотелиальными клетками, так и тромбоцитами. Недавняя работа продемонстрировала, что тромбоциты являются основным источником P-селектина, и, таким образом, эта молекула была признана в качестве значимого маркера активации тромбоцитов и увеличения тромботических механизмов (18). PAI-1 был увеличен при гипогликемии по сравнению с эугликемией у здоровых контрольных субъектов, но не у пациентов с диабетом типа 1.
Анализ ответов во время гиперинсулинемических зажимов демонстрирует значительное влияние гипогликемии на увеличение VCAM, ICAM, E-селектина и VEGF по сравнению с эугликемией как у здоровых пациентов, так и у лиц с диабетом типа 1. Сообщается, что VEGF является проатеросклеротическим на животных (17). Кроме того, VEGF может сильно увеличить пролиферацию эндотелия, приводя к появлению новых кровеносных сосудов. Гипогликемия также имела сходные эффекты, увеличивая уровни P-селектина в плазме у людей с диабетом 1 типа и недиабетическими индивидуумами. P-селектин является молекулой адгезии, которая активируется воспалением (18) и выражается как эндотелиальными клетками, так и тромбоцитами. Недавняя работа продемонстрировала, что тромбоциты являются основным источником P-селектина, и, таким образом, эта молекула была признана в качестве значимого маркера активации тромбоцитов и увеличения тромботических механизмов (18). PAI-1 был увеличен при гипогликемии по сравнению с эугликемией у здоровых контрольных субъектов, но не у пациентов с диабетом типа 1. Однако индивидуальные пиковые значения PAI-1 были увеличены во время гипогликемии как у здоровых людей, так и у пациентов с диабетом 1 типа, что свидетельствует о том, что гипогликемия 2,9 ммоль / л может быть стимулом для увеличения значений PAI-1.
Однако индивидуальные пиковые значения PAI-1 были увеличены во время гипогликемии как у здоровых людей, так и у пациентов с диабетом 1 типа, что свидетельствует о том, что гипогликемия 2,9 ммоль / л может быть стимулом для увеличения значений PAI-1.
Наши результаты показывают, что гипогликемия снижает системный фибринолитический баланс за счет увеличения уровней PAI-1 при сохранении значений tPA. Таким образом, по крайней мере два отдельных механизма для увеличения тромбоза активируются гипогликемией у лиц с диабетом 1 типа и здоровых лиц. Потенциал in vivo вызывает ответственность за сниженный фибринолитический баланс и повышенные провоспалительные механизмы, активируемые гипогликемией, неизвестны. Во время гипогликемии активируется широкий спектр физиологических реакций, которые могут иметь потенциальные сосудистые биологические эффекты. На сегодняшний день не полностью понятна роль катехоламинов, симпатической нервной системы и нейроэндокринных гормонов в активации молекул адгезии и влиянии фибринолитического баланса. Одно исследование с использованием культивируемой жировой ткани человека показало, что уровни PAI-1 могут быть подавлены катехоламинами, но увеличены с помощью высоких доз глюкокортикоидов (19). Другая работа (20) сообщила, что адреналин может играть роль через α-2 адренорецепторные механизмы при увеличении активации тромбоцитов при гипогликемии у лиц с диабетом 2 типа и здоровыми людьми. Поэтому возможно, что и увеличение оси гипоталамо-гипофизарной системы, и симпатическая нервная система могут иметь последствия для активации провоспалительных и протромботических механизмов при гипогликемии.
Одно исследование с использованием культивируемой жировой ткани человека показало, что уровни PAI-1 могут быть подавлены катехоламинами, но увеличены с помощью высоких доз глюкокортикоидов (19). Другая работа (20) сообщила, что адреналин может играть роль через α-2 адренорецепторные механизмы при увеличении активации тромбоцитов при гипогликемии у лиц с диабетом 2 типа и здоровыми людьми. Поэтому возможно, что и увеличение оси гипоталамо-гипофизарной системы, и симпатическая нервная система могут иметь последствия для активации провоспалительных и протромботических механизмов при гипогликемии.
Известно, что циркулирующие триглицериды и NEFA уменьшают эндотелиальную функцию и повышают клеточную резистентность к инсулину через ядерный фактор-κB (21). NEFA были увеличены как у пациентов с диабетом типа 1, так и у здоровых субъектов контроля во время гипогликемии по сравнению с исследованиями эугликемии. Это происходит главным образом из-за повышенного уровня катехоламинов и стимуляции симпатической нервной системы при гипогликемии и невосприимчивых подавляющих эффектов инсулина на липолиз во время экспериментов с эугликемией. Таким образом, повышенные уровни NEFA остаются возможным механизмом для наших результатов. Цитокины, IL-6 и TNF-α, имели дифференциальные ответы при гипогликемии и эугликемии как у пациентов с диабетом 1-го типа, так и у здоровых субъектов контроля. IL-6 был увеличен во время гипогликемии по сравнению с эугликемией в обеих группах, тогда как TNF-α был увеличен при гипогликемии при сахарном диабете 1 типа. Величина увеличения IL-6 во время гипогликемии у здоровых контрольных субъектов была аналогичной величине, описанной в двух недавних исследованиях Dotson et al. (22) и Разави Нематоллахи и др. (23) Таким образом, похоже, что подобная гипергликемия, острая гипогликемия может также опосредовать ее проатеротромботические эффекты через тропы TNF-α или IL-6 (21). Оксид азота (NO) также участвовал в регуляции молекул адгезии как эндотелиальных, так и тромбоцитов (24). Несмотря на то, что в настоящем исследовании специально не рассматривается, у нас есть предварительные данные, свидетельствующие о том, что гипогликемия нарушает функцию эндотелия NO.
Таким образом, повышенные уровни NEFA остаются возможным механизмом для наших результатов. Цитокины, IL-6 и TNF-α, имели дифференциальные ответы при гипогликемии и эугликемии как у пациентов с диабетом 1-го типа, так и у здоровых субъектов контроля. IL-6 был увеличен во время гипогликемии по сравнению с эугликемией в обеих группах, тогда как TNF-α был увеличен при гипогликемии при сахарном диабете 1 типа. Величина увеличения IL-6 во время гипогликемии у здоровых контрольных субъектов была аналогичной величине, описанной в двух недавних исследованиях Dotson et al. (22) и Разави Нематоллахи и др. (23) Таким образом, похоже, что подобная гипергликемия, острая гипогликемия может также опосредовать ее проатеротромботические эффекты через тропы TNF-α или IL-6 (21). Оксид азота (NO) также участвовал в регуляции молекул адгезии как эндотелиальных, так и тромбоцитов (24). Несмотря на то, что в настоящем исследовании специально не рассматривается, у нас есть предварительные данные, свидетельствующие о том, что гипогликемия нарушает функцию эндотелия NO. Поэтому мы бы предположили, что NO также может быть значительным молекулярным механизмом, связанным с сосудистыми эффектами гипогликемии.
Поэтому мы бы предположили, что NO также может быть значительным молекулярным механизмом, связанным с сосудистыми эффектами гипогликемии.
Адипонектин выделяется из жировой ткани и, как известно, обладает мощными сенсибилизирующими и антиатерогенными свойствами инсулина. Насколько нам известно, реакции адипонектина не исследовались при гипогликемии при диабете 1 типа или здоровых добровольцах. Мы были заинтригованы, обнаружив, что гипогликемия также увеличивала уровни адипонектина (по сравнению с эугликемией) у пациентов с диабетом 1-го типа и здоровых субъектов контроля. Значение открытия неясно и требует дальнейшего изучения.
Мы также хотели бы указать, что в настоящем исследовании инсулин, как таковой, оказал значительное положительное влияние на сосудистую физиологию. Примечательно, что в каждом случае, когда гипогликемия приводила к активации патологического процесса, при исследованиях гиперинсулинемического эугликемического контроля как при диабете 1 типа, так и у здоровых людей наблюдался равный и противоположный положительный эффект. Таким образом, наши нынешние результаты подтверждают предыдущую работу, демонстрирующую, что инсулин обладает противовоспалительными и антиатерогенными свойствами (10, 21, 24, 25). Есть некоторые ограничения для этого исследования. Существуют значительные индивидуальные различия в воспалительных и проатерохромных сосудистых биомаркерах. Таким образом, исходные значения для VCAM-1 у здоровых контрольных субъектов и ICAM-1 и PAI-1 у пациентов с диабетом 1-го типа были значительно различны в начале эпигликемических и гипогликемических зажимов. Мы не знаем причины этих базовых различий. Одно из возможных объяснений заключается в том, что не все в исследовании участвовали как в эугликемических, так и в гипогликемических зажимах. Мы полагаем, что это вряд ли будет причиной, так как существует существенная разница в исходных значениях PAI-1 у пациентов с диабетом типа 1, которые участвовали в обеих сериях глюкозных зажимов. Величина изменений сосудистых биомаркеров при гипогликемии (и эвгликемии) относительно скромна.
Таким образом, наши нынешние результаты подтверждают предыдущую работу, демонстрирующую, что инсулин обладает противовоспалительными и антиатерогенными свойствами (10, 21, 24, 25). Есть некоторые ограничения для этого исследования. Существуют значительные индивидуальные различия в воспалительных и проатерохромных сосудистых биомаркерах. Таким образом, исходные значения для VCAM-1 у здоровых контрольных субъектов и ICAM-1 и PAI-1 у пациентов с диабетом 1-го типа были значительно различны в начале эпигликемических и гипогликемических зажимов. Мы не знаем причины этих базовых различий. Одно из возможных объяснений заключается в том, что не все в исследовании участвовали как в эугликемических, так и в гипогликемических зажимах. Мы полагаем, что это вряд ли будет причиной, так как существует существенная разница в исходных значениях PAI-1 у пациентов с диабетом типа 1, которые участвовали в обеих сериях глюкозных зажимов. Величина изменений сосудистых биомаркеров при гипогликемии (и эвгликемии) относительно скромна. Таким образом, максимальные изменения в сосудистых биомаркерах при гипогликемии 50-75% значительно снижаются по сравнению с множественным увеличением нейроэндокринных гормонов, возникающих при идентичной гипогликемии. Однако способность сравнивать увеличение сосудистых биомаркеров во время гиперинсулинемической гипогликемии с аналогичным снижением, возникающим во время гиперинсулинемической эугликемии, демонстрирует независимые эффекты гипогликемии. Клиническая значимость величины изменений в различных провоспалительных и проатерохромных сосудистых биомаркерах еще не установлена. Мы изучали только один уровень гипогликемии. Таким образом, мы не можем комментировать, будет ли более глубокая гипогликемия (т. Е. Менее 2,9 ммоль / л) вызвать большие изменения в сосудистых биологических маркерах. Кроме того, настоящее исследование было разработано для изучения сосудистых физиологических изменений при длительной гипогликемии в течение 2 часов. Поэтому мы не можем определить эффекты более короткой продолжительности гипогликемии (т.
Таким образом, максимальные изменения в сосудистых биомаркерах при гипогликемии 50-75% значительно снижаются по сравнению с множественным увеличением нейроэндокринных гормонов, возникающих при идентичной гипогликемии. Однако способность сравнивать увеличение сосудистых биомаркеров во время гиперинсулинемической гипогликемии с аналогичным снижением, возникающим во время гиперинсулинемической эугликемии, демонстрирует независимые эффекты гипогликемии. Клиническая значимость величины изменений в различных провоспалительных и проатерохромных сосудистых биомаркерах еще не установлена. Мы изучали только один уровень гипогликемии. Таким образом, мы не можем комментировать, будет ли более глубокая гипогликемия (т. Е. Менее 2,9 ммоль / л) вызвать большие изменения в сосудистых биологических маркерах. Кроме того, настоящее исследование было разработано для изучения сосудистых физиологических изменений при длительной гипогликемии в течение 2 часов. Поэтому мы не можем определить эффекты более короткой продолжительности гипогликемии (т. Е. 30-45 мин) на конечных точках исследования.
Е. 30-45 мин) на конечных точках исследования.
Таким образом, данное настоящее исследование продемонстрировало комплексные эффекты острой умеренной гипогликемии на фибринолитический баланс и провоспалительные механизмы у пациентов с диабетом 1-го типа и здоровых субъектов контроля. Используя глюкозные зажимы для приравнивания уровней инсулина, это исследование показало, что гипогликемия приводит к значительному увеличению провоспалительных и потенциально проатерогенных молекул адгезии (ICAM, VCAM, E-selectin, IL-6, VEGF) активации тромбоцитов (P-селектин) и снижение фибринолитического баланса (увеличение PAI-1). Мы пришли к выводу, что 1) гипогликемия может аналогичным образом активировать широкий спектр сосудистых биологических механизмов как у пациентов с диабетом типа 1, так и у пациентов с недиабетическим контролем с возрастом и весом и 2) потенциально вредных долгосрочных эффектов гипогликемии на проатеротромботические механизмы нуждается в дальнейшем изучении.
Клинические испытания reg. нет. NCT00574340, researchtrialss.gov.
нет. NCT00574340, researchtrialss.gov.
Расходы на публикацию этой статьи частично покрывались оплатой сборов за страницу. Поэтому в этой статье должно быть указано «реклама» в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
См. Сопроводительную оригинальную статью, стр. 1591 и редакционной, стр. 1686.
Эта работа была поддержана следующими Национальными институтами здравоохранения: P50-HL-081009, R01-DK-069803, MO1-RR-000095, P01-HL-056693 и P60-DK-020593.
N.G.J. получил стипендию от Takeda Pharmaceuticals. Никаких других потенциальных конфликтов интересов, имеющих отношение к этой статье, не сообщалось.
Авторы благодарят Ванду Снеад, Эрика Аллена и лабораторию Assain Core от Vanderbilt, за их отличную техническую помощь, и медсестер из Центра клинических исследований Vanderbilt за их превосходную заботу. Авторы благодарны Ян Хиксу, Университету Вандербильта, Департаменту медицины за ее превосходную редакционную помощь.
Молочный белок убивает (часть 2)
Существуют две точки зрения, объясняющие способность ВСАА вызывать инсулинорезистентность. Первая заключается в том, что аминокислоты и инсулин аддитивно активируют фермент мTOR (англ. mammalian target of rapamycin) или мишень рапамицина. мTOR относится к группе серин-треониновых киназ, которая стимулирует трансляцию мРНК и синтез белков с помощью фосфорилирования S6 киназы-1(S6K1). Но S6K1 также негативно регулирует ИРС-1, как на уровне транскрипции, так и через прямое фосфорилирование (негативная обратная связь). В ответ на инфузию аминокислот в организме человека или животных, сопровождающуюся хронической активацией сигнального пути мТOR/S6K1 и последующим ингибирующим фосфорилированием серина ИРС‐1, происходит торможение фосфорилирования тирозина ИРС‐1, его деградация, что ведет к резистентности и лежит в основе нарушения действия инсулина.
Первая заключается в том, что аминокислоты и инсулин аддитивно активируют фермент мTOR (англ. mammalian target of rapamycin) или мишень рапамицина. мTOR относится к группе серин-треониновых киназ, которая стимулирует трансляцию мРНК и синтез белков с помощью фосфорилирования S6 киназы-1(S6K1). Но S6K1 также негативно регулирует ИРС-1, как на уровне транскрипции, так и через прямое фосфорилирование (негативная обратная связь). В ответ на инфузию аминокислот в организме человека или животных, сопровождающуюся хронической активацией сигнального пути мТOR/S6K1 и последующим ингибирующим фосфорилированием серина ИРС‐1, происходит торможение фосфорилирования тирозина ИРС‐1, его деградация, что ведет к резистентности и лежит в основе нарушения действия инсулина.
Авторы второй точки зрения указывают на то, что развитие резистентности к инсулину связано не с ВСАА как таковыми, а скорее с побочными продуктами катаболизма аминокислот, такими как С3 и С5 ацилкарнитины. Прямая связь ВСАА и С3, С5 ацилкарнитинов демонстрируется ростом плазменных и тканевых уровней этих метаболитов в ответ на пероральный прием аминокислот ВСАА. Причем важен тот факт, что помимо пищевых источников ВСАА, генетические вариации в экспрессии генов, кодирующих ключевые ферменты катаболизма ВСАА или белков в жировой ткани, могут быть еще одним фактором, влияющим на повышение аминокислот. В итоге, увеличение циркулирующих аминокислот в рационе питания (либо из-за генетических различий в метаболизме BCAA) приводит к увеличению пула BCAA. Этот аминокислотный пул вступает в катаболические пути в скелетных мышцах и печени с последующим увеличением циркулирующих С3 и С5 ацилкарнитинов. Следствием этого является образование промежуточных соединений пропионил-КоА и сукцинил-КоА. Эти субстраты «засоряют» цикл трикарбоновых кислот аналогично влиянию избыточных жиров, приводя к снижению эффективности окисления жирных кислот и глюкозы, накоплению не полностью окисленных субстратов, митохондриальному стрессу, нарушению функции клеток и действия инсулина и, в конечном итоге, нарушению гомеостаза глюкозы, развитию ожирения и диабета.
Причем важен тот факт, что помимо пищевых источников ВСАА, генетические вариации в экспрессии генов, кодирующих ключевые ферменты катаболизма ВСАА или белков в жировой ткани, могут быть еще одним фактором, влияющим на повышение аминокислот. В итоге, увеличение циркулирующих аминокислот в рационе питания (либо из-за генетических различий в метаболизме BCAA) приводит к увеличению пула BCAA. Этот аминокислотный пул вступает в катаболические пути в скелетных мышцах и печени с последующим увеличением циркулирующих С3 и С5 ацилкарнитинов. Следствием этого является образование промежуточных соединений пропионил-КоА и сукцинил-КоА. Эти субстраты «засоряют» цикл трикарбоновых кислот аналогично влиянию избыточных жиров, приводя к снижению эффективности окисления жирных кислот и глюкозы, накоплению не полностью окисленных субстратов, митохондриальному стрессу, нарушению функции клеток и действия инсулина и, в конечном итоге, нарушению гомеостаза глюкозы, развитию ожирения и диабета.
В настоящее время известно, что инсулиновая реакция, вызванная аминокислотами, параллельно запускает секрецию глюкагона для предотвращения возможной гипогликемии, которую может вызвать высокий инсулин, если вместе с белками не поступают углеводы. Именно ГИП ответственен за высвобождение глюкагона в ответ на прием белковой пищи. Он подавляет секрецию глюкагона при гипергликемии, но повышает секрецию глюкагона во время гипогликемии или эугликемии, поэтому важно учитывать концентрацию глюкозы. Было показано, что секреция глюкагона стимулируется ГИП исключительно при концентрации глюкозы ниже 5,5 ммоль/л, а при концентрации глюкозы более 5,5 ммоль/л он стимулирует выплеск инсулина. Из вышесказанного можно логически предположить, что если белковая пища повышает одновременно инсулин и глюкагон, то глюкагон, являясь полным конкурентным антагонистом инсулина, должен нивелировать его эффекты, т.е. гликогенез, липогенез и синтез белка, и, напротив, стимулировать гликогенолиз и липолиз. Идея, что глюкагон способствует липолизу, основана на том, что в жировых клетках есть рецепторы к глюкагону, и в исследованиях «in vitro» было показано, что глюкагон усиливает липолиз в жировых клетках человека. Однако, результаты на людях «in vivo» в естественных условиях показывают противоположный результат.
Именно ГИП ответственен за высвобождение глюкагона в ответ на прием белковой пищи. Он подавляет секрецию глюкагона при гипергликемии, но повышает секрецию глюкагона во время гипогликемии или эугликемии, поэтому важно учитывать концентрацию глюкозы. Было показано, что секреция глюкагона стимулируется ГИП исключительно при концентрации глюкозы ниже 5,5 ммоль/л, а при концентрации глюкозы более 5,5 ммоль/л он стимулирует выплеск инсулина. Из вышесказанного можно логически предположить, что если белковая пища повышает одновременно инсулин и глюкагон, то глюкагон, являясь полным конкурентным антагонистом инсулина, должен нивелировать его эффекты, т.е. гликогенез, липогенез и синтез белка, и, напротив, стимулировать гликогенолиз и липолиз. Идея, что глюкагон способствует липолизу, основана на том, что в жировых клетках есть рецепторы к глюкагону, и в исследованиях «in vitro» было показано, что глюкагон усиливает липолиз в жировых клетках человека. Однако, результаты на людях «in vivo» в естественных условиях показывают противоположный результат. Использование технологии тканевого микродиализа жировой ткани абдоминальной области во время эуглюкагонемии, гиперглюкагонемии и эугликемии с одновременной инфузией глюкозы показало, что внутритканевая концентрация глицерола не меняется во всех трех условиях (р = 0.98). Глицерол и свободные жирные кислоты плазмы крови также не отличались. Был сделан вывод, что гиперглюкагонемия, как таковая, не увеличивает интерстициальный глицерол (и, таким образом, липолиз) в подкожной жировой ткани.
Использование технологии тканевого микродиализа жировой ткани абдоминальной области во время эуглюкагонемии, гиперглюкагонемии и эугликемии с одновременной инфузией глюкозы показало, что внутритканевая концентрация глицерола не меняется во всех трех условиях (р = 0.98). Глицерол и свободные жирные кислоты плазмы крови также не отличались. Был сделан вывод, что гиперглюкагонемия, как таковая, не увеличивает интерстициальный глицерол (и, таким образом, липолиз) в подкожной жировой ткани.
В другом исследовании при интерпретации полученных данных после локальной перфузии глюкагона и ГПП-1 как в ткани скелетных мышц (икроножной мышцы), так и в подкожно-жировую ткань в брюшной области и последующем измерении содержания глицерола в диализате не было обнаружено каких-либо значимых изменений в скорости липолиза в мышечной или жировой ткани. А вот изопропилнорадреналин — химическое вещество, относящееся к группе катехоламинов, — перфузированный после глюкагона и ГПП-1, значительно увеличил скорость липолиза (увеличение глицерола на 249% и 72% в диализате из жировой ткани и скелетных мышцах соответственно). Исследователи заключили, что ни глюкагон, ни ГПП-1 не влияют на скорость липолиза в подкожно-жировой ткани и скелетных мышцах человека. Из этого следует, что в отличие от инсулина — главного липогенного гормона — глюкагон не является основным липолитическим гормоном. Но еще более важен тот факт, что на преобладание липогенеза или липолиза влияет не абсолютная концентрация гормонов, а их соотношение. При постоянном соотношении инсулин/глюкагон не меняется скорость глюконеогенеза, кетогенеза, гликогенолиза, липолиза и продукции лактата. Если это отношение увеличивается, то инсулин блокирует действие глюкагона. Он дозозависимо тормозит глюкагон-индуцированную продукцию вторичного мессенджера цАМФ в гепатоцитах, подавляет выход глюкагона, активируя активность К-каналов α-клеток и вызывая в результате гиперполяризацию мембран с прекращением электрической активности. Эксперименты показали, что из 20 аминокислот 17 глюкогенных сопоставимо стимулируют секрецию обоих гормонов, а аминокислоты с разветвленной цепью — валин, лейцин и изолейцин — повышают инсулин при подавлении секреции глюкагона.
Исследователи заключили, что ни глюкагон, ни ГПП-1 не влияют на скорость липолиза в подкожно-жировой ткани и скелетных мышцах человека. Из этого следует, что в отличие от инсулина — главного липогенного гормона — глюкагон не является основным липолитическим гормоном. Но еще более важен тот факт, что на преобладание липогенеза или липолиза влияет не абсолютная концентрация гормонов, а их соотношение. При постоянном соотношении инсулин/глюкагон не меняется скорость глюконеогенеза, кетогенеза, гликогенолиза, липолиза и продукции лактата. Если это отношение увеличивается, то инсулин блокирует действие глюкагона. Он дозозависимо тормозит глюкагон-индуцированную продукцию вторичного мессенджера цАМФ в гепатоцитах, подавляет выход глюкагона, активируя активность К-каналов α-клеток и вызывая в результате гиперполяризацию мембран с прекращением электрической активности. Эксперименты показали, что из 20 аминокислот 17 глюкогенных сопоставимо стимулируют секрецию обоих гормонов, а аминокислоты с разветвленной цепью — валин, лейцин и изолейцин — повышают инсулин при подавлении секреции глюкагона. Смешанные растворы АК, содержащие примерно равные концентрации заменимых и незаменимых кислот, увеличивают примерно в два раза плазменные концентрации как инсулина, так и глюкагона. А, к примеру, соевый белок и казеин индуцируют различные соотношения инсулин/глюкагон. Соевый белок имеет повышенное содержание заменимых аминокислот, таких как аргинин и глицин, и вызывает низкий постпрандиальный коэффициент инсулин/глюкагон, а казеин – высокий. Аргинин и глицин связаны с уменьшением, а аминокислоты с разветвленной цепью — с повышением уровня холестерина в сыворотке крови. Белки растительного происхождения, обладая преимуществом в пользу продукции глюкагона, характеризуются сниженным уровнем липидов в сыворотке крови, ИФР-1 и способствуют снижению веса. Увеличение же в рационе животных молочных белков, богатых разветвленными аминокислотами, смещает равновесие в сторону инсулина и приводит к увеличению веса.
Смешанные растворы АК, содержащие примерно равные концентрации заменимых и незаменимых кислот, увеличивают примерно в два раза плазменные концентрации как инсулина, так и глюкагона. А, к примеру, соевый белок и казеин индуцируют различные соотношения инсулин/глюкагон. Соевый белок имеет повышенное содержание заменимых аминокислот, таких как аргинин и глицин, и вызывает низкий постпрандиальный коэффициент инсулин/глюкагон, а казеин – высокий. Аргинин и глицин связаны с уменьшением, а аминокислоты с разветвленной цепью — с повышением уровня холестерина в сыворотке крови. Белки растительного происхождения, обладая преимуществом в пользу продукции глюкагона, характеризуются сниженным уровнем липидов в сыворотке крови, ИФР-1 и способствуют снижению веса. Увеличение же в рационе животных молочных белков, богатых разветвленными аминокислотами, смещает равновесие в сторону инсулина и приводит к увеличению веса.
Дополнительным подтверждением преобладающего влияния инсулина является быстрое снижение содержания неэстерифицированных жирных кислот НЭЖК в крови, наступающее после приема сывороточного белка или аминокислот ВСАА и умеренное понижение уровня глюкозы в крови в рандомизированных исследованиях.
Хотя эпидемиологические данные свидетельствуют о том, что люди, имеющие избыточную массу тела и потребляющие большое количество молочных продуктов, имеют сниженный риск развития инсулинорезистентности и что соблюдение рациона с высоким содержанием молочных продуктов приводит к снижению жировой массы тела, интервенционные исследования не находят последовательных результатов. Так, в систематическом обзоре из девяти рандомизированных исследований семь не нашли никаких существенных различий в массе тела между группами с высоким и низким потреблением молочных продуктов, а два исследования наблюдали значительно большее увеличение веса у пожилых людей в группе с высоким потреблением молочной продукции. В проспективном 12-летнем исследовании найдена положительная связь между потреблением молочных продуктов и увеличением веса. Имеются данные, что более высокое потребления молочных продуктов значительно связано с увеличением индекса массы тела (ИМТ), веса, окружности талии и снижением липопротеинов высокой плотности.
Все имеющиеся результаты работ, констатирующих обратную ассоциацию высокого потребления молочного белка со снижением массы тела, показаны только для лиц с избыточным весом, ожирением и метаболическим синдромом, т.е. зависят от исходной массы тела. Причина же снижения веса кроется в том, что молочный белок увеличивает чувство насыщения и уменьшает потребление пищи. По данным экспериментов, увеличение сытости наблюдается после приема пищи с содержанием белка в диапазоне от 10% до 81%, что совпадает с высокими концентрациями лейцина, лизина, триптофана, изолейцина, треонина. Инсулиновая реакция ассоциируется со снижением аппетита и сывороточный протеин, наиболее активно воздействующий на инсулин, вызывает наибольшее снижение аппетита по сравнению с тунцом (р < 0.033), индейкой (р < 0,001) и яичным альбумином (р < 0,001). Сигналы сытости опосредуются также через пептиды кишечника, включающие холецистокинин и ГПП-1, оказывающие широкий спектр метаболических эффектов. Незаменимые аминокислоты, образующиеся в процессе гидролиза белков, максимально эффективно стимулируют высвобождение данных пептидов, которые вызывают насыщение и задерживают опорожнение желудка. Предполагается, что регуляция процесса опорожнения желудка осуществляется путем связывания ГПП-1 с его рецепторами в головном мозге, что ведет к парасимпатической стимуляции ветвями блуждающего нерва и регуляции желудочной моторики. Немаловажно, что с инсулином из панкреатических бета-клеток в общий кровоток в ответ на стимуляцию питательными веществами секретируется гормон амилин, который также замедляет опорожнение желудка и снижает аппетит. Таким образом, снижение ожирения и инсулинорезистентности у людей можно объяснить снижением потребления пищи и скорости ее переваривания.
Незаменимые аминокислоты, образующиеся в процессе гидролиза белков, максимально эффективно стимулируют высвобождение данных пептидов, которые вызывают насыщение и задерживают опорожнение желудка. Предполагается, что регуляция процесса опорожнения желудка осуществляется путем связывания ГПП-1 с его рецепторами в головном мозге, что ведет к парасимпатической стимуляции ветвями блуждающего нерва и регуляции желудочной моторики. Немаловажно, что с инсулином из панкреатических бета-клеток в общий кровоток в ответ на стимуляцию питательными веществами секретируется гормон амилин, который также замедляет опорожнение желудка и снижает аппетит. Таким образом, снижение ожирения и инсулинорезистентности у людей можно объяснить снижением потребления пищи и скорости ее переваривания.
В большинстве случаев, высокие уровни инсулина являются первоочередным фактором и приводят к инсулинорезистентности и ожирению.
Молочный белок, особо богатый аминокислотами ВСАА, может способствовать увеличению массы тела: во первых, за счет стимулирования значительно большей секреции инсулина, чем углеводы в отдельности, если потребляются незадолго до углеводной пищи, проявляя сахароснижающий эффект; во-вторых, BCAA и родственные метаболиты связаны с инсулинорезистентностью, ожирением, диабетом, являются предикторами развития сахарного диабета и однозначно реагируют на терапевтическое вмешательство; в-третьих, соотношение инсулин/глюкагон увеличивается после приема молочных белков, давая возможность инсулину проявить свое антилиполитическое действие.
Определение и значение эугликемии — Merriam-Webster
eu · gly · ce · mia
варианты: или главным образом британская эвгликемия \ ˌYü- ˌglī- ˈsē- mē- ə \: нормальный уровень сахара в крови
Определение инсулинорезистентности с помощью зажимов для гиперинсулинемии-эугликемии
Abstract
ЦЕЛЬ Это исследование было разработано для определения пороговой точки для определения инсулинорезистентности на основе исследований гиперинсулинемических-эугликемических зажимов, выполненных при 120 мЕд / м 2 ⋅ мин в белом популяции и для составления уравнений на основе регулярно измеряемых клинических показателей и переменных крови для прогнозирования скорости утилизации глюкозы (GDR) на основе клэмп-теста, i.е., чувствительность к инсулину.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ Мы собрали данные гиперинсулинемико-эугликемических зажимов (120 мЕд / м 2 мин доза инсулина), выполненных в Центре биомедицинских исследований Пеннингтона в период с 2001 по 2011 годы. Субъекты были разделены на субъектов с диабетом ( n = 51) и субъектов без диабета ( n = 116) по самоотчету и / или уровень глюкозы натощак ≥126 мг / дл.
РЕЗУЛЬТАТЫ Мы обнаружили, что 75% лиц с GDR <5.6 мг / кг обезжиренной массы (FFM) + 17,7 ⋅ мин были действительно инсулинорезистентными. Пороговые значения для GDR, нормализованные по массе тела, площади поверхности тела или FFM, составляли 4,9 мг / кг мин, 212,2 мг / м 2 мин и 7,3 мг / кг FFM мин, соответственно. Затем мы использовали модели классификационного дерева для прогнозирования GDR на основе регулярно измеряемых клинических и биохимических переменных. Мы обнаружили, что индивидуальная инсулинорезистентность может быть оценена с хорошей чувствительностью (89%) и специфичностью (67%) с помощью модели гомеостаза оценки инсулинорезистентности (HOMA-IR)> 5.9 или 2,8 ВЫВОДЫ Мы разработали пороговое значение для определения инсулинорезистентности по гиперинсулинемико-эугликемическим зажимам. Более того, теперь мы предлагаем деревья классификации для прогнозирования инсулинорезистентности на основе рутинно измеряемых клинических и биохимических маркеров. Эти результаты расширяют ограничения от инструмента исследования до предоставления клинически значимого сообщения для участников исследований, потенциально предоставляя больше возможностей для более раннего распознавания инсулинорезистентности. Имеются убедительные доказательства того, что инсулинорезистентность, обычно определяемая как пониженная чувствительность или чувствительность к метаболическим действиям инсулина, является предшественником метаболического синдрома и диабета 2 типа. Золотым стандартом для оценки инсулинорезистентности у людей является гиперинсулинемико-эугликемический зажим. Разработано DeFronzo et al. в 1979 г. (1) эта процедура предполагает, что при инфузии высоких доз инсулина (> 80 мЕд / м 2 мин) гиперинсулинемическое состояние является достаточным для полного подавления продукции глюкозы в печени и что нет чистого изменения уровня глюкозы в крови. концентрации в стационарных условиях.В таких условиях скорость инфузии глюкозы равна скорости утилизации глюкозы во всем организме (GDR) или метаболизируемой глюкозы (M) и отражает количество экзогенной глюкозы, необходимое для полной компенсации гиперинсулинемии. GDR выражается как функция от метаболических размеров тела, таких как масса тела (кг), площадь поверхности тела (m 2 ; BSA), масса без жира (кг; FFM) или метаболический размер (kgFFM + 17,7) ( 2). Гиперинсулинемико-эугликемические зажимы используются в поперечных исследованиях и в проспективных исследованиях, предназначенных для проверки влияния вмешательств (потеря веса, увеличение веса или фармакологическое лечение) на чувствительность к инсулину.Вопрос о том, что такое «нормальное» значение M, в значительной степени неизвестен, но зависит от введенной дозы инсулина. В 1985 году Бергман и др. (3) изучили значения M в 18 независимых клэмп-исследованиях со скоростью инфузии инсулина 40 мЕд / м 2 мин. Для нормальных субъектов с толерантностью к глюкозе, не страдающих ожирением, среднее значение M составляло от 4,7 до 8,7 мг глюкозы на килограмм массы тела в минуту. Исходя из этих данных, Bergman et al. (3) предложили консервативное определение инсулинорезистентности как значение M <4.7 мг / кг ⋅ мин. Насколько нам известно, только в одном исследовании использовался статистический подход для определения порогового значения для определения инсулинорезистентности по зажиму (4). В этом анализе были собраны результаты 2321 (2138 субъектов без диабета) процедуры эугликемического зажима (40 мЕд / м 2 мин) в этнически разнообразной популяции. Было обнаружено, что инсулинорезистентность лучше всего прогнозируется, когда субъекты имеют GDR (значение M) <28 мкмоль / кгFFM мин (4). Вместе эти предыдущие исследования дают разумную оценку распределения GDR для зажимов, выполненных со скоростью инфузии инсулина 40 мЕд / м 2 мин. Вопрос о том, каково нормальное и клинически значимое значение M, полученное для зажимов с использованием других инфузионных доз инсулина, таких как 120 мЕд / м 2 мин (5–7), неизвестен. Таким образом, клиницистам трудно объяснить участникам исследования важность результатов, полученных с помощью этих зажимов. Инсулин 120 мЕд / м 2 мин был выбран для этого анализа по двум основным причинам: 1 ) эндогенное производство глюкозы, вероятно, будет полностью подавлено, и 2 ) требуется более короткое время для достижения устойчивого состояния. условий с более высокой скоростью инфузии, что делает эту дозу инсулина более рентабельной, а также снижает нагрузку на участников.Более того, хотя клэмп-метод является золотым стандартом для прямой оценки инсулинорезистентности у людей, он требует много времени, трудозатрат и в целом дорог. Следовательно, важна возможность прогнозирования результатов зажима на основе других клинических данных, которые проще получить и дешевле измерить. В текущем исследовании мы собрали данные исследований зажимов, проведенных в соответствии со стандартными операционными процедурами в Центре биомедицинских исследований Пеннингтона (PBRC; Батон-Руж, штат Луизиана) в период с 2001 по 2011 год при скорости инфузии инсулина 120 мЕд / м 2 ⋅ мин.Нашей целью было: 1 ) определить пороговую точку для определения инсулинорезистентности для клэмп-исследований гиперинсулинемии-эугликемии, проводимых при 120 мЕд / м 2 ⋅ мин в белом населении и 2 ) составить уравнения из обычно измеряемых клиник и крови переменные для прогнозирования чувствительности к инсулину (значения M, полученные из зажима). Продольное исследование Центра Пеннингтона — это продолжающееся исследование влияния ожирения и факторов образа жизни на развитие хронических заболеваний, таких как диабет 2 типа и сердечно-сосудистые заболевания.Выборка состоит из добровольцев, которые участвовали в исследованиях питания, похудания и других метаболических вмешательствах и наблюдениях в PBRC с 1992 года. Текущий перекрестный анализ ограничен взрослыми участниками, у которых было одношаговое значение 120 мЕд / м 2 ⋅ мин гиперинсулинемико-эугликемический зажим перед любым вмешательством и двухэнергетической рентгеновской абсорбциометрией (DXA) в период с 2001 по 2011 год ( n = 263). Исключались пациенты с уровнем глюкозы в плазме натощак> 180 мг / дл или диагнозом диабет> 5 лет.Наша когорта состояла из 167 белых, 94 афроамериканцев и двух других. Когда одним из авторов (E.R.) в PBRC были впервые проведены клэмп-исследования эугликемии-гиперинсулинемии, возможность измерения изотопных индикаторов и, следовательно, продукции глюкозы в печени была недоступна. Следовательно, зажимы выполнялись при 120 мЕд / м 2 мин, поскольку эта доза инсулина считалась достаточно высокой для полного подавления продукции глюкозы в печени. Статус диабета определялся по самооценке или по концентрации глюкозы в плазме натощак ≥126 мг / дл.Субъекты были классифицированы как страдающие диабетом, если они 1 ) сами ответили «да» на диабет ( n = 62) или 2 ) сами ответили «нет» на диабет, но имели уровень глюкозы натощак ≥126 мг / кг. дл ( n = 4). Субъекты были классифицированы как недиабетические, если они сами ответили «нет» и имели уровень глюкозы натощак <126 мг / дл ( n = 197). Кроме того, чтобы проверить статус диабета, мы также получили данные HbA 1c , которые были доступны у 104 из 263 пациентов.Уровни HbA 1c были выше у субъектов, классифицированных как страдающие диабетом (6,1 ± 0,6%), по сравнению с субъектами, классифицированными как не страдающие диабетом (5,4 ± 0,4%). Все процедуры были одобрены Советом по институциональной проверке PBRC, и все участники предоставили письменное информированное согласие. Рост измеряли с помощью настенного ростометра, а метаболический вес — с помощью цифровых весов. ИМТ рассчитывался как вес в килограммах, разделенный на рост в метрах в квадрате.Процент жира в организме в целом измеряли с помощью DXA (Hologics QDR 4500A; Hologics, Бедфорд, Массачусетс), а массу жира (FM) и FFM рассчитывали из процента жира в организме и веса тела. BSA рассчитывали по уравнению Дюбуа (8). Чувствительность к инсулину in vivo оценивалась с помощью гиперинсулинемико-эугликемического зажима с примированной непрерывной инфузией инсулина при 120 мЕд / м 2 мин для достижения устойчивых эндогенных концентраций инсулина и взятия стабильной крови образцы.Внутривенный катетер был помещен в переднекубитальную вену для инфузии инсулина и глюкозы. Второй катетер был установлен ретроградно в дорсальную вену контралатеральной руки для забора крови. Рука помещалась в нагревательный бокс при 41 ° C для артериализации венозной крови. 20% раствор глюкозы вводили с переменной скоростью, необходимой для поддержания концентрации глюкозы в плазме от 90 до 100 мг / дл. Для зажимов, выполняемых при 120 мЕ / м 2 мин, продолжительность составляла 2 часа, а для зажимов при 80 мЕ / м 2 мин продолжительность зажима составляла не менее 3 часов.Средняя скорость инфузии экзогенной глюкозы в течение последних 30 мин была определена как GDR (1). Во-первых, GDR был скорректирован с учетом концентраций глюкозы в течение этого установившегося интервала (GDR × [средняя групповая стационарная глюкоза / индивидуальная стационарная глюкоза]) (3). Затем, чтобы скорректировать метаболический размер, GDR нормализовали по весу, BSA, FFM или FFM + 17,7 (2). Глюкозу в плазме анализировали с помощью анализатора глюкозы Yellow Springs Instruments 2300 STAT (Yellow Springs Instruments Inc., Йеллоу-Спрингс, Огайо). Плазменный инсулин измеряли хемилюминесцентным иммуноанализом на анализаторе Immulite 2000 (продукты для диагностики), а концентрации липидов (FFA, общий холестерин и HDL) измеряли с помощью Beckman Coulter Synchron DXC 600 Pro. ЛПНП рассчитывали по расчету Фридевальда. Описательные данные представлены как среднее ± стандартное отклонение. Статистический анализ был выполнен с помощью SAS версии 9.2 (Институт SAS, Кэри, Северная Каролина). Тест χ 2 использовался для проверки значимости групповых различий по полу.Для проверки групповых различий для непрерывных переменных использовались тесты независимой выборки t и тесты Манна-Уитни U . GDR, определенная с помощью гиперинсулинемико-эугликемического зажима и скорректированная по весу, BSA, FFM или FFM + 17,7 использовалась в качестве биомаркера для разделения субъектов, которые были резистентны к инсулину (имели сахарный диабет 2 типа), от тех, кто был чувствителен к инсулину (не имел сахарный диабет 2 типа). Мы определили оптимальную точку отсечения для различения инсулинорезистентных субъектов от инсулиночувствительных субъектов как GDR, который обеспечивает как высокую чувствительность (способность обнаруживать инсулинорезистентных субъектов), так и одновременно высокую специфичность (способность обнаруживать чувствительных к инсулину субъектов).Таким образом, чувствительность — это доля истинно положительных результатов (люди с известной инсулинорезистентностью, которые были классифицированы как инсулинорезистентные на основании их GDR), тогда как 1 — специфичность — это доля ложноположительных результатов (люди, известные как инсулинорезистентные, которые были классифицированы как инсулинорезистентные). стойкие на основе их ГДР). Мы использовали кривую рабочей характеристики приемника (ROC), график зависимости чувствительности от специфичности 1, чтобы отобразить компромисс между истинно положительными и ложными срабатываниями при инкрементальном выборе различающих точек отсечки для скорости утилизации глюкозы (9, 10). .Точка отсечения, соответствующая оптимальному балансу истинных и ложноположительных результатов, указывает на лучший порог для различения инсулинорезистентных людей от инсулиночувствительных людей. Деревья классификации использовались для определения определенного набора правил (алгоритмов) классификации субъектов как инсулинорезистентных или инсулинорезистентных из GDR (11). Этот метод не делает никаких предположений о базовом распределении данных и учитывает взаимодействие между ковариатами и конечными переменными.Преимущество метода дерева классификации заключается в том, что он позволяет проводить наблюдения с пропущенными значениями в наборе данных, в отличие от традиционного логистического регрессионного анализа, который удаляет наблюдения с отсутствующими значениями предикторов. Древовидные методы рекурсивно разделяют переменные-предикторы на набор точек принятия решения или «узлов» классификации. Бинарное дерево решений полностью вырастает, когда правила классификации полностью нанесены на схему. Без обрезки можно построить большое и сложное дерево за счет переобучения данных (12).Таким образом, выполняется обрезка дерева, чтобы мы могли выбрать размер дерева, который минимизирует перекрестную проверку ошибки и избегает переобучения. Правила принятия решений для классификации субъектов могут быть получены путем присвоения каждому терминальному узлу метки класса либо «1» (наличие инсулинорезистентности), либо «0» (отсутствие инсулинорезистентности). Выбор метки класса основан на определенной точке отсечения, а также на доле истинных событий в этом конечном узле. Например, если в качестве точки отсечки выбрано «0,25» или выше, то только оконечные узлы с истинной долей возникновения событий, равной или большей, чем «0.25 »классифицируются как« инсулинорезистентные », а остальные классифицируются как« 0 »или чувствительные к инсулину. Пропорцию, отображаемую на каждом терминальном узле, можно рассматривать как «оценку риска» инсулинорезистентности. Чтобы выбрать наиболее эффективные модели для изучения взаимосвязи между чувствительностью к инсулину и клиническими переменными, испытуемые были случайным образом разделены на обучающую подгруппу для построения модели ( n = 125) и тестовую подгруппу для оценки эффективности модель ( n = 42) в соотношении 3: 1. Метод единого дерева классификации был выбран в качестве статистического исследовательского метода, потому что он превзошел другие подходы, такие как логистическая регрессия и усиление деревьев регрессии, с точки зрения чувствительности, специфичности и площади под кривой ROC, обозначенной aROC (10), при тестировании. набор данных. Таким образом, aROC используется в качестве меры средней эффективности прогнозирования различных алгоритмов классификации. Поскольку aROC представляет собой площадь части под единичным квадратом, его значение находится в диапазоне от 0 до 1.Случайное угадывание приводит к aROC, приблизительно равному 0,5. Реалистичный метод классификации должен иметь aROC> 0,5, а правило классификации с aROC> 0,70 обычно считается адекватным; Очень близкое к 1 значение aROC указывает на исключительно хорошую производительность. Наша цель состояла в том, чтобы изучить выбранные деревья решений для прогнозирования инсулинорезистентности, чтобы приспособить их к различным клиническим / исследовательским условиям, в которых значения для всех переменных не обязательно будут доступны. Древовидный анализ был проведен на данных 167 белых.Основной исходной переменной, использованной в этом анализе, была GDR с поправкой на FFM + 17,7 (GDR с поправкой ), потому что мы считаем, что эта поправка является наилучшим доступным методом, учитывающим метаболический размер (2). Коварианты включали пол, возраст, вес, рост, ИМТ, BSA, FFM, семейный анамнез диабета, уровень глюкозы натощак, инсулин натощак, холестерин, ЛПВП, ЛПНП, триглицериды, FFA и оценку инсулинорезистентности на модели гомеостаза (HOMA- IR) [инсулин натощак (мкЕд / мл) × глюкоза натощак (мг / дл) / 405].Для ответа на разные вопросы были разработаны три модели классификационного дерева. Модель 1 была построена со всеми доступными входными переменными, имитируя клиническую ситуацию, когда были включены состав тела и маркеры крови. В модели 2 в качестве входных переменных используются только концентрации глюкозы и инсулина натощак, ИМТ, возраст и пол. Модель 3 — это минималистская модель, построенная с использованием возраста, пола и ИМТ. Наша белая когорта включала 51 пациента с диабетом и 116 пациентов без диабета (Таблица 1).Субъекты с диабетом были значительно старше (возраст 57,2 ± 8,6 против 44,2 ± 13,2 года, P <0,001) и имели более высокие уровни ЛПНП ( P = 0,05) и уровни глюкозы (по дизайну исследования; P <0,001), чем субъекты без диабета. Не было значительных половых различий между пациентами с диабетом и без него ( P = 0,10). Характеристики субъектов для белых, проходящих клэмп-исследования гиперинсулинемии-эугликемии при 120 мЕд / м 2 ⋅ мин Распределение GDR , с поправкой на вес , BSA, FFM или FFM + 17.7 был бимодальным (сведено в Таблицу 2). Как и ожидалось, GDR был ниже у субъектов с диабетом по сравнению с субъектами без диабета, независимо от того, как GDR был скорректирован с учетом метаболического размера. Для GDR adj среднее значение составляло 7,4 ± 2,7 мг / кг FFM + 17,7 мин у субъектов без диабета и 4,6 ± 1,7 мг / кг FFM + 17,7 мин у субъектов с диабетом. Пороговое значение 5,6 мг / кг FFM + 17,7 мин обеспечило максимальную теоретическую чувствительность (75%) и специфичность (71%) с aROC 80% для определения инсулинорезистентности.Другими словами, оптимальная граница для выявления инсулинорезистентных людей из зажима 120 мЕд / м 2 мин составляла 5,6 мг / кг FFM + 17,7 ⋅ мин. Используя этот критерий во всей группе, 44,3% людей упали ниже этой точки отсечения и могли считаться инсулинорезистентными. Такой же порог (5,6 мг / кг FFM + 17,7 мин) наблюдался, когда этот анализ проводился во всей когорте ( n = 267) (данные не показаны). Когда GDR корректировали на массу тела, BSA или FFM, пороговое значение для инсулинорезистентности составляло 4.9 мг / кг веса мин, 212 мг / м 2 мин и 7,3 мг / кг FFM мин, соответственно (таблица 2). GDR при 120 мЕд / м 2 ⋅ мин для субъектов с диабетом и без него с поправкой на метаболический размер, включая массу тела, BSA, FFM и FFM + 17,7 кг В качестве субанализа мы также собрали данные из 86 гиперинсулинемико-эугликемических зажимов, выполненных при 80 мЕд / м 2 ⋅ мин. Подобно дозе инсулина 120 мЕд, распределение GDR было бимодальным с более низким GDR у субъектов с диабетом ( n = 11) по сравнению с субъектами без диабета ( n = 75).Средние данные и пороговые значения для GDR, выраженного по массе, BSA, FFM или FFM + 17,7, а также характеристики субъектов для этой когорты представлены в дополнительных таблицах 1 и 2. У субъектов без диабета среднее значение GDR прил. составило 8,2. ± 3,0 мг / кг FFM + 17,7 мин по сравнению с 3,3 ± 0,7 мг / кг FFM + 17,7 мин у субъектов с диабетом, а пороговое значение для определения инсулинорезистентности составляло 4,1 мг / кг FFM + 17,7 мин с максимальной чувствительностью и специфичностью 83 и 96% соответственно (aROC = 0.98). Когда GDR корректировали на массу тела, BSA или FFM, пороговое значение для инсулинорезистентности составляло 4 мг / кг веса мин, 192 мг / м 2 мин и 5 мг / кг FFM мин, соответственно (дополнительная таблица 2) . Анализ древовидной модели не проводился при дозе инсулина 80 мЕд из-за относительно небольшого размера выборки и несбалансированной доли субъектов с диабетом и без него. Как указано в плане и методах исследования, были разработаны древовидные модели и правила принятия решений для прогнозирования GDR adj на основе случайно выбранной обучающей выборки ( n = 125), за которой следует оценка производительности моделей в оставшейся тестовой выборке ( n = 42). В древовидной модели, основанной на всех предикторах (Модель 1), следующие предикторы были статистически значимыми: HOMA-IR, HDL и глюкоза натощак, что привело к aROC, равному 87%. На рисунке 1 изображена модель дерева классификации с использованием этих предикторов. Количество инсулинорезистентных лиц и количество инсулино-чувствительных людей показано на рис. 1. Используя произвольное пороговое значение 0,25 в качестве «оценки риска» наличия инсулинорезистентности, узлы ≥25% (доля инсулинорезистентных людей ) предсказывают инсулинорезистентность, а узлы <25% предсказывают чувствительность к инсулину.Следовательно, на рис. 1 соответствующие правила принятия решений для прогнозирования инсулинорезистентности человека имеют либо следующее: 1 ) a HOMA-IR> 5,9 или 2 ) HOMA-IR = 2,8–5,9 и HDL < 51 мг / дл. Использование других вариантов для прогнозируемого порогового значения (например, 50%) дало аналогичные результаты по чувствительности (89%) и специфичности (67%) (данные не показаны). Древовидная модель инсулинорезистентности, определяемая с использованием всех доступных показателей состава тела и крови.HOMA-IR и HDL были единственными значимыми детерминантами в этой модели. Модель построена на случайно выбранной обучающей когорте из 125 человек и протестирована на 42 предметах. Рассчитывается произвольная оценка риска 0,25. Следовательно, если доля терминального узла> 25%, эти субъекты с большей вероятностью будут инсулинорезистентными ( пунктирные линии, ). Узлы определения инсулинорезистентности следующие: 1 ) HOMA-IR> 5,9 и 2 ) 2,8 Следующая модель дерева была выполнена с использованием только состава тела, глюкозы натощак, инсулина, возраста и пола в качестве переменных-предикторов. Только инсулин натощак и глюкоза были значимыми предикторами при построении модели дерева с aROC 86% в тестируемой подгруппе (рис. 2). Подобно описанной выше древовидной модели с использованием всех предикторов, мы назначили произвольное пороговое значение 0,25 в качестве «оценки риска» быть классифицированным как инсулинорезистентный.Следовательно, на рис. 2 связанным правилом принятия решения для прогнозирования инсулинорезистентности человека является концентрация инсулина натощак> 10,6 мкЕд / мл. Это правило принятия решения имеет оценочную чувствительность 100% и специфичность 54%. Древовидная модель инсулинорезистентности с использованием только глюкозы натощак, инсулина, возраста, пола и ИМТ. Только инсулин натощак был значимым детерминантом модели. Модель построена на случайно выбранной обучающей группе из 125 человек и протестирована на 42 предметах.Рассчитывается произвольная оценка риска 0,25. Следовательно, если доля терминального узла> 25%, эти субъекты с большей вероятностью будут инсулинорезистентными ( пунктирные линии, ). Узел принятия решения о резистентности к инсулину — уровень инсулина натощак> 10,6 мкЕд / мл. Последняя модель дерева, которую мы протестировали для прогнозирования чувствительности к инсулину на основе зажима, использовала только возраст, пол и ИМТ в качестве переменных-предикторов. Опять же на основе произвольного обрезания 0.25% для выявления инсулинорезистентности, единственной значимой переменной-предиктором был ИМТ с aROC 61% и ИМТ> 24,7 кг / м 2 , предсказывающим инсулинорезистентность. Как и ожидалось, по мере уменьшения числа переменных-предикторов результаты aROC, чувствительности и специфичности ухудшаются. Тот же самый древовидный модельный анализ был также проведен в более крупной, более этнически разнообразной когорте из 263 человек (167 белых, 94 афроамериканца, один латиноамериканец и еще один). Как и ожидалось, при большем количестве субъектов, более высокие значения aROC, а также результаты чувствительности и специфичности были получены в большей когорте (данные не показаны). Клэмп-метод гиперинсулинемического-эугликемического зажима является золотым стандартом для оценки чувствительности к инсулину у людей. Этот метод широко используется в научных исследованиях для изучения эффектов вмешательства, такого как низкокалорийная диета или фармакологическая терапия. К сожалению, существует мало данных о том, что считается «нормальной» скоростью инфузии глюкозы, то есть нормальной чувствительностью к инсулину. Более того, возможность сравнивать результаты клэмп-исследований затрудняется тем фактом, что результаты GDR выражаются как функция массы тела, BSA или FFM.Целью настоящего исследования было предоставить пороговые значения для определения инсулинорезистентности и чувствительности к инсулину в зажимах, выполняемых при дозе инсулина 120 мЕд / м 2 мин, а также предоставить деревья решений для прогнозирования инсулинорезистентности на основе рутинных клинических и биохимических измерений. параметры. Как и в предыдущем исследовании (4), мы обнаружили, что распределение скорости утилизации глюкозы в организме является бимодальным. Эта бимодальность позволила нам использовать статистический подход для определения порогового значения для определения инсулинорезистентности или чувствительности к инсулину.Мы обнаружили, что значение GDR или M 5,6 мг / кг FFM + 17,7 ⋅ мин у белых дает почти 80% вероятность прогнозирования инсулинорезистентности. Другими словами, люди с GDR <5,6 мг / кг FFM + 17,7 ⋅ мин имеют 80% шанс быть инсулинорезистентным. Такой же предел был обнаружен в более крупной, более этнически разнообразной когорте (данные не показаны). В меньшем образце зажимов, выполненных при 80 мЕд / м 2 мин, для определения инсулинорезистентности было определено пороговое значение 5,3 мг / кг FFM + 17,7 мин (98% вероятность прогноза).То есть субъекты с GDR <5,3 мг / кг FFM + 17,7 мин имеют 98% вероятность наличия инсулинорезистентности. Чтобы расширить применимость этих результатов к исследователям, которые не измеряют состав тела, мы определили точки отсечения для инсулинорезистентности для GDR, выраженного по массе, BSA или FFM. Эти данные позволяют исследователям, выполняющим гиперинсулинемико-эугликемические зажимы при скорости инфузии инсулина 80 и 120 мЕд / м 2 ⋅ мин, получить ценную клиническую информацию о чувствительности субъекта к инсулину и перевести результаты, полученные в основном из исследовательских условий, в клинически значимое сообщение.Сводка наших результатов при 80 и 120 мЕд / м 2 мин и результатов других исследований при 40 мЕ / м 2 мин (3,4) представлена в дополнительной таблице 3. С учетом требовательного характера Мы стремились разработать модели для прогнозирования инсулинорезистентности с помощью зажима на основе рутинно измеряемых антропометрических, композиционных и биохимических маркеров. Наша первая классификационная модель (Модель 1) включала все доступные переменные (перечисленные в дизайне и методах исследования) и обнаружила, что у субъектов с 1 ) HOMA-IR> 5.9 или 2 ) HOMA-IR между 2,8 и 5,9 и HDL <51 мг / дл предсказывали инсулинорезистентность с хорошей специфичностью и чувствительностью. Вывод о том, что HOMA-IR был самым сильным предиктором GDR adj , неудивителен, учитывая сильную корреляцию между HOMA-IR и чувствительностью к инсулину, полученной от зажимов, продемонстрированной ранее (13). Кроме того, наши результаты аналогичны результатам исследования Stern et al. (4), в котором они сгенерировали деревья классификации из зажимов, выполненных при 40 мЕ / м 2 ⋅ мин.Stern et al. (4) обнаружили, что HOMA-IR, ИМТ, окружность талии и ЛПНП являются значимыми предикторами инсулинорезистентности с аналогичными результатами по чувствительности и специфичности (наше исследование: aROC = 0,87; Stern et al .: aROC = 0,90). Модель 2 использовала только антропометрию, глюкозу натощак, инсулин, а также возраст и пол. Подобно модели 1, мы обнаружили, что только инсулин натощак был значимым предиктором GDR adj , а инсулин натощак> 10,6 мкЕд / мл определял инсулинорезистентность. Модель 3 использовала только возраст, пол и ИМТ для прогнозирования GDR прил. Эта модель дала плохие результаты по специфичности и чувствительности, которые подчеркнули хорошо известный факт, что инсулинорезистентность является гетерогенным заболеванием, которое зависит не только от веса, пола и возраста (14). В сочетании с предыдущими исследованиями по определению инсулинорезистентности с помощью зажимов, выполненных при 40 мЕд / м 2 мин (3,4), наши результаты при 80 и 120 мЕд / м 2 мин дозы инсулина вносят существенный вклад в литературу, определяющую инсулинорезистентность. от зажимов (дополнительная таблица 3). Чтобы учесть метаболическую массу, которая использует инсулин во время клэмп-процедуры, GDR, полученный на основе клэмпа, должен быть скорректирован с учетом метаболического размера. В большинстве исследований в литературе, как правило, используется общая масса тела или килограммы FFM, в меньшем количестве исследований используется BSA. Однако общая масса тела не является полностью подходящим методом для сравнения индивидуумов, потому что у субъектов с ожирением большая доля массы с низким уровнем метаболизма (жировая ткань), а у женщин процент жира выше, чем у мужчин.BSA также создает проблему различия полов (2). Из исследований скорости метаболизма у индейцев пима, Lillioja и Bogardus (2) показали, что скорость метаболизма прямо пропорциональна FFM + 17,7 кг, предполагая, что эта мера может быть приравнена к метаболическому размеру. На основании этого вывода мы выбрали этот метод нормализации в нашем классификационном анализе. Однако мы также учли, что не все исследователи могут иметь доступ к измерению состава тела (DXA), и также сообщили об этих пороговых значениях инсулинорезистентности, нормализованных по весу и BSA.Наконец, необходимо отметить, что разделение GDR во время зажима на скорость метаболизма в состоянии покоя действительно представляет собой лучший способ сравнить значения людей с разным размером тела. Ограничениями этого исследования может быть небольшой размер выборки клэмп-исследований при 120 мЕ / м 2 мин, и особенно при 80 мЕ / м 2 мин. Однако в этой когорте нам удалось достичь хороших результатов статистической чувствительности и специфичности (вероятность предсказания> 80%). Мы также продемонстрировали те же самые точки отсечения для более многочисленного и более этнически разнообразного населения.Другим потенциальным ограничением может быть то, что мы не использовали радиоактивно меченные индикаторы глюкозы для количественного определения эндогенного производства глюкозы. Однако высокие дозы инфузии инсулина, о которых сообщалось в этом исследовании, обычно подавляют большую часть, если не весь, исходный внутренний выброс глюкозы (15). Мы также признаем, что существует значительное совпадение чувствительности к инсулину (M) между пациентами с диабетом и без него (2). Альтернативный подход заключался бы в разделении нашей когорты на субъектов с нормальной толерантностью к глюкозе, нарушенной толерантностью к глюкозе или диабетом 2 типа; однако это еще больше уменьшило бы размер нашей выборки. В заключение, наше исследование предоставляет новые данные для определения инсулинорезистентности с помощью гиперинсулинемико-эугликемических зажимов, выполненных при дозах инсулина 120 и 80 мЕд / м 2 мин. Кроме того, мы предоставили деревья классификации для прогнозирования инсулинорезистентности по стандартным биохимическим маркерам. В совокупности наши результаты расширяют гиперинсулинемический-эугликемический зажим от того, что в значительной степени считается инструментом исследования, до предоставления клинически значимых сообщений для пациентов, что обеспечивает большую вероятность более раннего выявления инсулинорезистентности. Это исследование было поддержано Национальным институтом здравоохранения (гранты P30DK072476 и R01DK060412, R00HD060762 и U01DK094418) L.M.R. О потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось. C.S.T. написал рукопись, участвовал в обсуждениях результатов, рецензировал и редактировал окончательную рукопись. W.X. выполнил статистический анализ, участвовал в обсуждениях результатов, а также просмотрел и отредактировал окончательную рукопись.W.D.J. выполнил статистический анализ, участвовал в обсуждениях результатов, а также просмотрел и отредактировал окончательную рукопись. W.T.C. участвовал в обсуждениях результатов, рецензировал и редактировал окончательную рукопись. L.M.R. участвовал в обсуждениях результатов, рецензировал и редактировал окончательную рукопись. E.R. участвовал в обсуждениях результатов, а также отредактировал окончательную рукопись. E.R. является гарантом этой работы и, как таковая, имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных. Мы благодарим доктора Фрэнка Гринуэя за то, что он неоднократно спрашивал нас, что такое хорошая (или плохая) чувствительность к инсулину? ДеФронцо Р.А.: Патогенез сахарного диабета 2 типа. Med Clin North Am 88: 787–835, ix, 2004 Предпосылки: Точное знание скорости всасывания глюкозы после кормления пищей требует инвазивных методов у людей. Цель: Это исследование было направлено на валидацию на модели животных метода, сочетающего эугликемический гиперинсулинемический зажим и пероральную углеводную нагрузку (OC-Clamp) в качестве неинвазивной процедуры для количественной оценки постпеченочного появления глюкозы после пероральной углеводной нагрузки. Дизайн: Двадцати одной свинке были установлены артериальный, яремный, портальный и двенадцатиперстный катетеры и датчик портального кровотока. В стабильном состоянии зажима глюкозы вводили глюкозу двенадцатиперстной кишки (0,9 г / кг; DG-Clamp) и пероральный углевод (140 г кукурузного крахмала или крахмала из маша как часть смешанного приема пищи; OC-Clamp), в то время как инфузия глюкозы постепенно снижалась до компенсировать постепенное постпеченочное появление глюкозы.[3- 3 H] глюкозу использовали для оценки скорости оборота глюкозы. Результаты: Производство глюкозы в печени было полностью подавлено инфузией инсулина, и скорость оборота глюкозы во всем организме оставалась стабильной во время абсорбции глюкозы. Постепенное появление глюкозы в воротной вене после нагрузки ДГ не было изменено гиперинсулинемией, а совокупное появление глюкозы в постпеченочном периоде составило 63 ± 3% ( x ± стандартная ошибка среднего) от нагрузки ДГ. Чистый внешний вид глюкозы в портальных воротах печени оставался постоянным во время всасывания (34 ± 3% нагрузки).После нагрузки ОК соответствующие показатели появления глюкозы в воротной вене значительно различались между источниками углеводов; однако частота соответствовала показателям постпеченочного появления глюкозы. Опять же, чистое поглощение глюкозы печенью, выраженное в виде портала, было одинаковым для обоих углеводов. Выводы: Результаты подтверждают правильность метода OC-Clamp для мониторинга постпеченочного появления глюкозы после приема углеводов и для различения различных источников углеводов.Результаты показывают, что этот метод может быть использован на людях. После ночного голодания гомеостаз глюкозы в крови поддерживается за счет точного баланса между скоростью производства глюкозы в печени и почках и количеством глюкозы, поглощаемой периферическими тканями. После приема глюкозы производство глюкозы в печени снижается, а внутреннее и периферическое поглощение глюкозы сильно стимулируется за счет комбинированного действия преходящей гипергликемии и гиперинсулинемии (1–4).Следовательно, экзогенная глюкоза эффективно метаболизируется, накапливается в виде гликогена или того и другого, и концентрация глюкозы в крови быстро возвращается к предрандиальным значениям. Количество глюкозы, доступное для периферической утилизации, представляет собой часть экзогенной глюкозы, не извлеченную внутренним ложе, вместе с остаточным образованием глюкозы. Таким образом, при патологическом изменении контроля гомеостаза глюкозы скорость поступления глюкозы в системный кровоток может быть нарушена (4, 5).Как следствие, в этих обстоятельствах может оказаться полезным управление питанием (6, 7). Такая стратегия питания требует точного знания кинетики абсорбции глюкозы после еды. Поскольку прямое измерение скорости появления глюкозы в портальной циркуляции у людей нецелесообразно с этической точки зрения, было разработано несколько косвенных методов. Однако эти методы обеспечивают только качественное определение скорости всасывания глюкозы в кишечнике после углеводной нагрузки.Действительно, методы интубации и дыхательные водородные тесты показывают количество углеводов, не усваиваемых после еды (8, 9). Точно так же определение гликемического индекса по концентрациям глюкозы в плазме после приема пищи позволяет только качественное сравнение между различными источниками углеводов (10, 11). Наконец, изотопные методы показывают скорость системного появления экзогенной глюкозы, которая может быть не связана с кинетикой абсорбции глюкозы после еды, поскольку производство глюкозы в печени может оставаться активным (2, 3, 12, 13). Целью настоящего исследования было проверить на свиньях методику эугликемического гиперинсулинемического зажима в качестве метода количественной оценки постпеченочного появления глюкозы после нагрузки глюкозой, предполагая, что определенный уровень гиперинсулинемии может полностью подавить выработку глюкозы в печени. Этот метод был недавно применен у людей для количественной оценки поглощения глюкозы внутренними органами после нагрузки глюкозой (14, 15). Более того, предварительные данные указывают на его способность предоставлять информацию о постпеченочном появлении глюкозы, когда кишечное всасывание глюкозы активно (16).Свинья представляет собой хорошую животную модель в физиологии пищеварения для хронической портальной катетеризации и катетеризации печени (17). Таким образом, сопутствующее сравнение между скоростью появления глюкозы в воротной вене и определением скорости постпеченочного появления глюкозы может быть выполнено после дуоденальной глюкозной (DG) или пероральной углеводной (OC) нагрузок. Эксперименты выполнены на 21 свинье-самке (средняя живая масса на момент операции: 58 ± 2 кг) крупной белой породы.За две недели до операции животных содержали в ограничивающих клетках и кормили дважды в день 800 г полусинтетической диеты (казеин, 178 г / кг; очищенный кукурузный крахмал, 516 г / кг; сахароза, 65 г / кг; соевое масло, 150 г / кг). кг; очищенная целлюлоза, 50 г / кг; минеральные и витаминные добавки, 41 г / кг; UFAC, Лимур, Франция), смешанные с 1,6 л воды. В то время как свиньи находились под общей анестезией, индуцированной галотаном (Fluothan; Laboratoires Belamont, Париж), 3 поливинилхлоридных катетера (внутренний диаметр 1,27 мм, внешний диаметр 2,29 мм; Tygon Norton, Кливленд) были имплантированы в их воротную и яремную вены и правую сонную артерию. артерии; Датчики портального кровотока (Transonic зонды; Transonic Systems, Итака, Нью-Йорк) также были размещены в соответствии с процедурами, описанными ранее (18) для непрерывной регистрации портального кровотока.Зонды артериального печеночного кровотока и катетеры для печеночных вен также были имплантированы 5 из 21 животного, как описано ранее (19). Для экспериментов с инфузией ДГ выполняли постоянный свищ двенадцатиперстной кишки. Эксперименты начинали через 8–10 дней после хирургического вмешательства, когда животные возобновляли дооперационный прием корма. Все аспекты протокола соответствовали Международным руководствам по биомедицинским исследованиям с участием животных. Восемь животных случайным образом подвергали 3 протоколам: 1 ) нагрузку DG в сочетании с зажимом для эугликемической гиперинсулинемии (DG-Clamp), 2 ) нагрузку без глюкозы водой в двенадцатиперстную кишку в сочетании с зажимом для эугликемической гиперинсулинемии и 3 ) груз ДГ.Между каждым протоколом эксперимента был период задержки ≥3–4 дня. Пять дополнительных животных были помещены в DG-Clamp в сочетании с прямым измерением чистого баланса глюкозы в печени. . После того, как свиней лишили пищи в течение 24 часов, была проведена примированная (40 мЕд / кг в течение 1 мин), непрерывная (2 мЕд • кг -1 • мин -1 ) 240-минутная инфузия свиного инсулина (Органон, Сен-Дени, Франция) в яремную вену для подавления продукции глюкозы в печени.Концентрация глюкозы в артериальной крови поддерживалась на исходном уровне с помощью компьютерной инфузии 30% раствора глюкозы (BRAUN Medical, Булонь, Франция) в яремную вену. Для контроля за зажимом для глюкозы собирали 20 мкл артериальной крови с интервалами 2–5 мин для определения глюкозы (One-Touch II; Lifescan, Руасси, Франция). Устойчивые концентрации глюкозы в плазме крови и инсулина в артериальной крови были получены через 90 минут после начала зажима глюкозы. После 30-минутного периода плато нагрузка ДГ (0.9 г d-глюкозы / кг в 500 мл воды) вводили в течение 60 минут согласно трехступенчатой линейной скорости дегрессии: 50%, 33% и 17% нагрузки глюкозы в течение 3 последовательных 20-минутных периодов. Концентрация глюкозы в артериальной крови поддерживалась на прежнем уровне в течение 2 часов путем регулирования скорости инфузии глюкозы для компенсации увеличения постпеченочного появления глюкозы. Скорость оборота глюкозы также измеряли с использованием примированной [2220 кБк (60 мкКи) в течение 1 мин], непрерывной инфузии [3- 3 H] глюкозы (Dupont de Nemours, Les Ulis, Франция) в яремную вену для За 1 час до начала инфузии инсулина (скорость базального обмена глюкозы) и во время клэмп-процедуры (скорость обмена эугликемической гиперинсулинемической глюкозы).Удельная активность глюкозы в крови поддерживалась постоянной за счет постепенного увеличения скорости инфузии индикатора с 22,2 кБк / мин (0,6 мкКи / мин) до 62,9 кБк / мин (1,7 мкКи / мин) после начала инфузии инсулина. . В качестве контроля процедуру зажима также выполняли в сочетании с загрузкой безглюкозной воды (500 мл) в двенадцатиперстную кишку в соответствии с протоколом, описанным для DG-Clamp, за исключением того, что инфузия индикатора глюкозы не проводилась. . После того как свиней лишали пищи в течение 24 часов, вводили 60-минутную нагрузку DG (0,9 г d-глюкозы / кг в 500 мл воды) в соответствии с трехступенчатой линейной скоростью дегрессии, описанной выше. . Восемь животных были подвергнуты 2 процедурам зажима глюкозы, как описано выше для зажима DG-Clamp. Нагрузка DG была заменена нагрузкой OC как часть 0.2 кг смешанной еды. Шрот состоял из 700 г кукурузного крахмала или крахмала маша на килограмм, смешанного с другими макроэлементами (казеин, 160 г / кг; соевое масло, 99 г / кг; и минералы и витамины, 41 г / кг). Таким образом, оба тестируемых блюда содержали 140 г крахмала и были съедены в течение 5 минут. Действительно, кукурузный крахмал, как известно, быстро переваривается (20), тогда как крахмал из маша переваривается медленно на основе оценок in vivo и in vitro (21). Вливания трассера не было. Образцы артериальной и воротной крови отбирались с 10-15-минутными интервалами в рамках этих различных протоколов для определения концентрации глюкозы в крови и концентрации инсулина в плазме.Кровь собирали регулярно для определения концентраций лактата, глутамина и аланина во время процедур DG и DG-Clamp, а кровь из печеночной вены собирали во время процедуры DG-Clamp для оценки концентрации глюкозы. Как показывают значения гематокрита крови, кумулятивный удаленный объем крови был <10% от общего объема в конце эксперимента. Для определения удельной активности глюкозы образцы крови объемом 100 мкл депротеинизировали в Ba (OH) 2 ZnSO 4 , как описано ранее (22), и сразу же центрифугировали (16000 × г в течение 5 минут при 4 ° C. ).Для определения глюкозы в крови из супернатанта использовался специфический ферментативный метод (23). Аликвоту (500 мкл) упаривали досуха для удаления меченой тритием воды, а затем определяли содержание [3- 3 H] d-глюкозы с помощью жидкостного сцинтилляционного счетчика (LKB-Pharmacia, Saint-Quentin-en-Yvelines, France ). Для определения концентрации субстрата собирали 1 мл крови и немедленно депротеинизировали в 2 мл ледяной 6% (вес: объем) хлорной кислоты. Концентрации глюкозы, лактата, глутамина и аланина в артериальной и воротной крови определяли в нейтрализованных фильтратах хлорной кислоты стандартными ферментативными методами (23).Образцы крови (1 мл) собирали одновременно в пробирки с гепарином и ЭДТА, а плазму получали после центрифугирования при 16000 × g в течение 5 мин при 4 ° C. Инсулин плазмы определяли радиоиммуноанализом (Kit ERIA Pasteur; Marnes La Coquette, Франция). Все ферменты и коферменты, используемые для ферментативных анализов, были от Boehringer (Meylan, Франция). Скорость чистого появления глюкозы в воротной вене и балансы лактата, глутамина и аланина в кишечнике рассчитывались как разница между концентрациями в воротной вене и артериальной крови, умноженная на скорость потока в воротной вене, как описано ранее (18).Общая скорость появления глюкозы в пуле глюкозы была рассчитана с использованием стандартных уравнений для непрерывной инфузии индикатора во время устойчивого или нестационарного состояния (24). Скорость продукции глюкозы в печени рассчитывалась как разница между скоростью появления глюкозы и скоростью инфузии экзогенной глюкозы. Скорость чистого постпеченочного появления глюкозы рассчитывали путем вычитания скорости инфузии экзогенной глюкозы из средней скорости вливания экзогенной глюкозы в устойчивом состоянии, полученной до введения глюкозы или углеводов.Интегрированный постпеченочный внешний вид глюкозы в течение времени, необходимого для полного всасывания глюкозы, одновременно сравнивали с соответствующим портальным внешним видом глюкозы. Чистый баланс глюкозы в печени рассчитывался как разница между выходом глюкозы в печени (рассчитанным на основе гликемии печеночной вены и общим кровотоком в печени) и входом (сумма потоков глюкозы в артериальной печени и воротной вене, рассчитанная на основе артериальной и портальной гликемии и соответствующего кровотока). . Результаты выражены как средние значения ± SEM.Статистический анализ состоял из дисперсионного анализа с повторными измерениями (с тестом Шеффе для апостериорного анализа), теста Стьюдента t и двухфакторного дисперсионного анализа значений метаболитов в крови (STATVIEW, версия 1.03; Abacus Concepts, Беркли, Калифорния). ). Значение P <0,05 указывает на значительные различия. Во время экспериментов по валидации с DG портальный кровоток оставался постоянным.Базальный портальный кровоток составил 33,0 ± 1,3 мл • кг -1 • мин -1 ( n = 8). Ни инфузия инсулина (33,9 ± 1,4 мл • кг -1 · мин -1 ), ни инфузия DG (нагрузка DG: 34,1 ± 1,4 мл • кг -1 • мин -1 ; DG-Clamp: 35,4 ± 1,2 мл • кг -1 • мин -1 ) значительно изменил портальный кровоток ( n = 8). Артериальный печеночный кровоток во время экспериментов с DG-Clamp составлял 17,2 ± 1,8% от общего печеночного кровотока ( n = 5) в стабильном состоянии зажима глюкозы и во время всасывания глюкозы. До инфузии инсулина концентрация глюкозы в артериальной и воротной крови составляла 3,4 ± 0,1 и 3,3 ± 0,1 ммоль / л соответственно ( n = 13). Во время устойчивого состояния зажима глюкозы концентрация глюкозы в артериальной крови поддерживалась на уровне 3,8 ± 0,1 ммоль / л (рис. 1А), а концентрации глюкозы в воротной ( n = 13) и печеночной ( n = 5) вене составляли 3,4 ± 0,1 и 3,1 ± 0,1 ммоль / л соответственно.Во время поглощения нагрузки DG ( n = 8) концентрация глюкозы в артериальной крови оставалась постоянной (4,0 ± 0,1 ммоль / л), а концентрация глюкозы в воротной вене значительно увеличивалась через 10 мин после инфузии и достигала пиковых значений (7,3 ± 0,4 ммоль). / Л) через 30 мин после начала инфузии ДГ. РИСУНОК 1. Среднее (± SEM) содержание глюкозы в крови в сонной артерии (квадраты) и воротной вены (кружки) и концентрации инсулина в плазме крови во время инфузии дуоденальной глюкозы (DG) свиньям ( n = 8) в условиях эугликемического гиперинсулинемического зажима (DG). -Зажим; открытые символы) и незажимные (нагрузка DG; закрытые символы). РИСУНОК 1. Среднее (± SEM) содержание глюкозы в крови в сонной артерии (квадраты) и воротной вены (кружки) и концентрации инсулина в плазме крови во время инфузии глюкозы двенадцатиперстной кишки (DG) свиньям ( n = 8) при эугликемическом гиперинсулинемическом зажиме ( DG-Clamp; открытые символы) и незажимные (DG нагрузка; закрытые символы) условия. Уровень инсулина в базальной артерии и плазме воротной вены составлял 8 ± 4 мЕд / л и 15 ± 6 мЕд / л ( n = 8), соответственно. Во время процедуры DG-Clamp ( n = 8) инфузия инсулина увеличивала плазменные концентрации инсулина до стационарных артериальных (116 ± 3 мЕд / л) и портальных (101 ± 6 мЕд / л) концентраций (рис. 1А).Концентрация артериального инсулина была стабильной в течение периода абсорбции; однако концентрация портального инсулина значительно увеличилась через 10 минут после начала инфузии DG, но после этого вернулась к стабильному состоянию ( P > 0,05). Динамика концентрации глюкозы в артериальной и воротной крови и плазменного инсулина ( n = 8) после инфузии DG была такой же, как и ожидалось, быстро увеличиваясь сразу после инфузии, достигая пиковых значений через 30 минут и возвращаясь к базовым значениям через 75 минут (Рисунок 1B ). Базальная общая скорость появления глюкозы, определенная по удельной активности [3- 3 H] глюкозы в крови, которая была стабильной, составила 21,7 ± 1,2 мкмоль · кг −1 · мин −1 ( n = 8). Во время инфузии инсулина (DG-Clamp) удельная активность глюкозы в крови оставалась постоянной, даже в течение периода абсорбции глюкозы (данные не показаны). Скорость появления глюкозы заметно увеличивалась во время инфузии инсулина (106.7 ± 2,8 мкмоль • кг -1 • мин -1 ) и оставалась постоянной во время нагрузки ДГ (рис. 2, вставка). РИСУНОК 2. Средние (± SEM) скорости инфузии глюкозы свиньям ( n = 8) в условиях эугликемического гиперинсулинемического зажима плюс вливание глюкозы в двенадцатиперстную кишку (0,9 г / кг; жирная черная линия) или вливание воды ( 500 мл) отдельно (тонкая черная линия). Инфузия глюкозы и воды началась в момент времени 0. Скорость инфузии глюкозы в установившемся состоянии была аналогичной после инфузии глюкозы двенадцатиперстной кишки и воды.Общая скорость появления глюкозы, определенная по удельной активности [3- 3 H] глюкозы, была постоянной во время инфузии глюкозы в двенадцатиперстную кишку в условиях зажима (вставка). РИСУНОК 2. Средние (± SEM) скорости инфузии глюкозы свиньям ( n = 8) в условиях эугликемического гиперинсулинемического зажима плюс вливание глюкозы в двенадцатиперстную кишку (0,9 г / кг; жирная черная линия) или вливание воды (500 мл) отдельно (тонкая черная линия). Вливание глюкозы и воды началось в момент времени 0.Скорость инфузии глюкозы в установившемся режиме была аналогичной после инфузии глюкозы двенадцатиперстной кишки и воды. Общая скорость появления глюкозы, определенная по удельной активности [3- 3 H] глюкозы, была постоянной во время инфузии глюкозы в двенадцатиперстную кишку в условиях зажима (вставка). Во время DG-Clamp скорость инфузии экзогенной глюкозы быстро увеличивалась, достигая стабильного значения (110,0 ± 5,5 мкмоль • кг -1 • мин -1 ; n = 8) в пределах 30-60 мин до инфузии ДГ.Сравнение как общей скорости появления глюкозы, так и скорости инфузии экзогенной глюкозы показало, что остаточная продукция глюкозы была полностью подавлена до начала инфузии DG. Действительно, рассчитанная продукция глюкозы в печени (-3,3 ± 2,6 мкмоль • кг -1 • мин -1 ) существенно не отличалась от нуля ( P > 0,05). После этого скорость инфузии экзогенной глюкозы значительно снизилась, начиная с 10 мин после начала инфузии DG до надира 51.8 ± 11,5 мкмоль • кг -1 • мин -1 , получено через 35 мин. (Фигура 2). Скорость инфузии экзогенной глюкозы вернулась к предыдущему значению устойчивого состояния на ≈72 ± 3 мин ( P > 0,05). Когда вводили воду без глюкозы, скорость инфузии экзогенной глюкозы не отличалась от значения в равновесном состоянии (рис. 2). Как показано на рисунке 3, кинетика глюкозы в воротной вене была сходной в обоих экспериментальных условиях (нагрузка DG и зажим DG-Clamp).Количество абсорбированной глюкозы по отношению к глюкозной нагрузке составляло 93 ± 4% (DG) и 95 ± 7% (DG-Clamp). Чистое постпеченочное появление глюкозы, рассчитанное по снижению скорости инфузии экзогенной глюкозы, составило 63 ± 3% от глюкозной нагрузки. Кроме того, время, в которое было достигнуто всасывание глюкозы, рассчитанное как время, когда концентрация глюкозы в воротной вене не отличалась от концентрации глюкозы в артериальной крови, также было одинаковым: 65 ± 5 мин (DG) и 71 ± 5 мин (DG-Clamp). . РИСУНОК 3. Средняя (± SEM) чистая скорость появления глюкозы в воротной и постпеченочной артериях у свиней ( n = 8) после вливания глюкозы в двенадцатиперстную кишку (0,9 г / кг), определенная на основе артерио-портальной разницы либо при отсутствии зажима (•), либо при эугликемической гиперинсулинемии условия зажима (○). (Поскольку линии перекрываются, белые кружки в некоторых случаях скрыты.) Чистое постпеченочное появление глюкозы () рассчитывалось как уменьшение скорости инфузии глюкозы во время процедуры зажима ( см. Рисунок 2). РИСУНОК 3. Средняя (± SEM) чистая скорость появления глюкозы в воротной вене и постпеченочном отделе у свиней ( n = 8) после инфузии глюкозы в двенадцатиперстную кишку (0,9 г / кг), определенная на основе артерио-портальной разницы либо без зажима ( •) или эугликемический гиперинсулинемический зажим (○). (Поскольку линии перекрываются, белые кружки в некоторых случаях скрыты.) Чистое постпеченочное появление глюкозы () рассчитывалось как уменьшение скорости инфузии глюкозы во время процедуры зажима ( см. Рисунок 2). Когда DG-Clamp был объединен с катетеризацией печеночной вены, скорости поступления и вывода глюкозы из печени, рассчитанные в устойчивом состоянии, составили 122,5 ± 7,7 и 109,0 ± 11,0 мкмоль • кг -1 • мин -1 , соответственно ( n = 5). Чистый баланс глюкозы в печени составлял –13,5 ± 5,2 мкмоль • кг -1 • мин -1 ( n = 5), что свидетельствует о поглощении глюкозы печенью. Во время абсорбции глюкозы скорость ввода и вывода глюкозы в печень значительно увеличивалась через 10 минут после начала инфузии глюкозы, достигая максимума через 30 минут (240.0 ± 18,7 и 182,3 ± 20,8 мкмоль • кг -1 • мин -1 соответственно), а затем вернулись к значениям, незначительно отличающимся от значений в установившемся режиме (117,6 ± 17,8 и 105,1 ± 9,8 мкмоль • кг -1 • мин −1 соответственно) при 75 мин. Кумулятивное поступление и выход глюкозы в печени во время абсорбции глюкозы составили 14,48 ± 0,71 и 11,63 ± 0,70 ммоль / кг соответственно ( n = 5). Таким образом, чистое поглощение глюкозы печенью составило 2,85 ± 0,61 ммоль ( n = 5), или 19,7 ± 3.8% поступающей глюкозы в печень. Для сравнения кинетики постпеченочного появления глюкозы, рассчитанной по снижению скорости инфузии экзогенной глюкозы, вход и выход глюкозы в печени также рассчитывались после вычитания соответствующих скоростей устойчивого состояния. Следовательно, кумулятивное поступление и выход глюкозы в печени после введения DG (то есть интеграция дополнительных значений по сравнению со значениями в равновесном состоянии) составили 5,29 ± 0,63 и 3,46 ± 0,25 ммоль / кг, соответственно ( n = 5), через 75 минут после инфузии (рис. 4), что соответствует чистому поглощению глюкозы печенью 34 ± 3% от поступления глюкозы в печень ( n = 5).Кроме того, чистое поглощение глюкозы печенью было постоянным уже через 20 минут после начала инфузии DG (рис. 4, вставка). При расчете по снижению скорости инфузии экзогенной глюкозы ( см. выше) чистое поглощение глюкозы печенью [то есть (внешний вид воротной вены — постпеченочный вид) / внешний вид воротной вены] было идентичным (34 ± 3%, n = 8 ). РИСУНОК 4. Средняя (± SEM) совокупная скорость поступления и вывода глюкозы из печени свиней ( n = 5) после инфузии глюкозы в двенадцатиперстную кишку (0.9 г / кг). Соответствующие количества глюкозы, соответствующие повышенным значениям по сравнению с устойчивым состоянием, определяли в условиях эугликемического гиперинсулинемического зажима плюс катетеризация печеночной вены и непрерывно оценивали кровоток в печени. Чистое поглощение глюкозы печенью (вход-выход) было постоянным через 20 минут после инфузии (вставка). РИСУНОК 4. Средняя (± SEM) совокупная скорость поступления и вывода глюкозы из печени свиней ( n = 5) после дуоденальной инфузии глюкозы (0.9 г / кг). Соответствующие количества глюкозы, соответствующие повышенным значениям по сравнению с устойчивым состоянием, определяли в условиях эугликемического гиперинсулинемического зажима плюс катетеризация печеночной вены и непрерывно оценивали кровоток в печени. Чистое поглощение глюкозы печенью (вход-выход) было постоянным через 20 минут после инфузии (вставка). OC-Clamp проводились с кукурузным крахмалом и крахмалом из маша в качестве источников углеводов, поскольку крахмал из маша имеет низкий гликемический индекс, а кукурузный крахмал — высокий гликемический индекс (25).Во время OC-Clamp кровоток в воротной вене значительно увеличился через 15 минут после приема пищи. Оно увеличилось с 33,1 ± 1,5 мл • кг -1 • мин -1 перед едой до пика 38,2 ± 1,1 мл • кг -1 • мин -1 через 60 минут после начала приема пищи, независимо от того. типа потребляемых углеводов ( n = 8). Во время экспериментов OC-Clamp с обоими углеводами уровень глюкозы в артериальной крови составлял 3,2 ± 0,1 ммоль / л в стабильном состоянии и оставался постоянным в течение периода всасывания глюкозы (3.3 ± 0,4 ммоль / л, n = 8). Точно так же концентрация инсулина в артериальной плазме была зафиксирована на уровне 86 ± 2 мЕд / л. В стабильном состоянии скорость инфузии экзогенной глюкозы составляла 106 ± 5 мкмоль • кг -1 • мин -1 ( n = 8). Во время всасывания глюкозы скорость введения экзогенной глюкозы снижалась, чтобы компенсировать увеличение постпеченочного появления глюкозы. Скорость инфузии экзогенной глюкозы значительно снижалась через 20 мин после кормления.Затем он выходил на плато через 35-70 минут после кукурузной крахмальной муки (56,7 ± 7,7 мкмоль • кг -1 • мин -1 ) и от 35 до 55 минут после крахмальной муки из маша (77,8 ± 10,5 мкмоль • кг. −1 • мин. −1 ). Как показано на рисунке 5, кинетика постпеченочного появления глюкозы значительно различалась между двумя углеводными приемами пищи. Как и ожидалось, внешний вид глюкозы в воротной вене после 2-х углеводных приемов пищи значительно отличался ( P <0.05), но параллельно с соответствующими временными курсами постпеченочного появления глюкозы (Рисунок 5). Чистый внешний вид глюкозы в воротной вене в течение 2 часов всасывания составлял 257 ± 14 и 90 ± 21 ммоль для крахмала кукурузного и маша, соответственно. Более того, чистое поглощение глюкозы печенью было сходным для обоих углеводов (кукурузный крахмал: 21 ± 3%; крахмал из маша: 20 ± 3%; NS). РИСУНОК 5. Среднее (± SEM) чистое постпеченочное и портальное появление глюкозы у свиней ( n = 8) после 2-часовой процедуры эугликемического гиперинсулинемического зажима в сочетании с пероральной углеводной нагрузкой, состоящей из кукурузного крахмала (•) или крахмал из маша (○) в составе смешанной еды. РИСУНОК 5. Среднее (± SEM) чистое постпеченочное и портальное появление глюкозы у свиней ( n = 8) после 2-часовой эугликемической гиперинсулинемической процедуры зажима в сочетании с пероральной углеводной нагрузкой, состоящей из кукурузного крахмала (•) или крахмал из маша (○) в составе смешанной еды. Инфузия инсулина сильно изменила поглощение глюкозы в кишечнике, определенное до инфузии DG. Действительно, потребление глюкозы в кишечнике значительно увеличилось с 2.От 6 ± 0,4 до 13,9 ± 2,5 мкмоль • кг -1 • мин -1 ( n = 8), тогда как уровень глюкозы в артериальной крови оставался постоянным. Концентрация артериального глутамина значительно снизилась во время гиперинсулинемического зажима, тогда как кишечное поглощение глутамина несколько снизилось (таблица 1). Однако нагрузка DG стимулировала поглощение глутамина в кишечнике как при базальных, так и при гиперинсулинемических состояниях. Концентрация в артериальной крови и баланс глутамина, аланина и лактата в кишечнике после инфузии дуоденальной глюкозы (DG) в базальном состоянии и в условиях эугликемического гиперинсулинемического зажима 1 Концентрация глутамина, лактана в крови и баланс в кишечнике инфузия глюкозы двенадцатиперстной кишки (ДГ) в базальном состоянии и в условиях эугликемического гиперинсулинемического зажима 1 Концентрация артериального аланина значительно снизилась после инфузии инсулина; однако продукция аланина в кишечнике существенно не изменилась после инфузии инсулина или глюкозы (таблица 1).Концентрация лактата в артериальной крови была значительно увеличена либо инфузией инсулина, либо глюкозной нагрузкой, и этот стимулирующий эффект, по-видимому, был аддитивным (таблица 1). Однако введение глюкозы только изменило баланс лактата в кишечнике. Действительно, нагрузка глюкозой значительно изменила баланс лактата в кишечнике от поглощения к высвобождению при всасывании глюкозы (таблица 1). Целью настоящего исследования было проверить технику зажима глюкозы как неинвазивный метод количественной оценки кинетики постпеченочного появления глюкозы после углеводной нагрузки.Поскольку прямое определение внешнего вида глюкозы в воротной вене требовалось параллельно с процедурой зажима для эугликемической гиперинсулинемии, свинья использовалась в качестве модели животного, поскольку ее размер делает ее пригодной для хронической катетеризации. Кроме того, кинетика абсорбции глюкозы после пероральной или DG нагрузки и параметры метаболизма глюкозы в основных или постпрандиальных условиях очень похожи у людей и свиней, как показано в настоящем исследовании и других (2–4, 26–28). . Проверка состояла из 2 этапов: 1 ) хорошо контролируемая глюкоза вводилась непосредственно в двенадцатиперстную кишку свиней, и 2 ) 1 из 2 источников углеводов (кукурузный крахмал или крахмал из маша) с разными гликемическими индексами кормили как часть смешанной еды. После инфузии DG общая скорость появления глюкозы соответствовала как экзогенной абсорбции глюкозы, так и остаточной эндогенной продукции глюкозы. С помощью процедуры зажима глюкозы была установлена легкая гиперинсулинемия, полностью подавляющая эндогенное производство глюкозы. Концентрация инсулина в плазме поддерживалась на физиологическом уровне (≈100 мЕд / л), близком к пиковому значению, полученному во время нагрузки DG в условиях отсутствия зажима. Кроме того, поскольку скорость оборота глюкозы и выработка эндогенной глюкозы часто недооцениваются во время введения инсулина (29, 30), индикаторная глюкоза вводилась со скоростью, обеспечивающей постоянную удельную активность глюкозы в крови (31).Как и ожидалось, гиперинсулинемия полностью подавляла скорость выработки эндогенной глюкозы и заметно увеличивала скорость как инфузии глюкозы, так и оборота глюкозы. Более того, 5-кратное увеличение скорости инфузии глюкозы было достаточно высоким, чтобы позволить ее последующее снижение, чтобы компенсировать абсорбцию глюкозы (14, 15, 32). Поскольку общая скорость оборота глюкозы и гликемия поддерживались постоянными во время всасывания глюкозы, скорость инфузии экзогенной глюкозы, определенная в установившемся состоянии перед нагрузкой DG, может использоваться для оценки скорости постпеченочного появления глюкозы.Более того, настоящее исследование доказало, что скорость появления глюкозы в воротной вене существенно не изменилась при клэмп-процедуре и что она соответствовала постпеченочному появлению глюкозы во время абсорбции глюкозы. В свою очередь, время, когда скорость инфузии экзогенной глюкозы снова достигает устойчивого состояния, можно рассматривать как время полного поглощения глюкозы. Настоящее исследование показало, что поглощение глюкозы печенью во время легкой гиперинсулинемии было ограничено до нагрузки глюкозой (11% поступления глюкозы в печень), но увеличивалось во время всасывания глюкозы.Действительно, чистое поглощение глюкозы печенью, определенное с помощью 2 различных процедур, составило 34% от ввода глюкозы в печень, рассчитанного после вычитания скорости устойчивого состояния (также эквивалентно возрастанию появления глюкозы в воротной вене), или 26 мкмоль • кг -1 • мин −1 , что находится в пределах диапазона, ранее обнаруженного у других видов (33). Предыдущие эксперименты показали, что гиперинсулинемия увеличивает чистое поглощение печенью только при отрицательном градиенте глюкозы в артериально-воротной артерии (33–36).Таким образом, усиленная портальная гликемия или портальный сигнал могут объяснить печеночный ответ. Чистое поглощение глюкозы печенью было подтверждено увеличением содержания гликогена в печени с 0,2 ± 0,1 до 3,2 ± 0,1 ммоль / кг массы тела в течение периода поглощения ( n = 4; F Bernard, P Vaugelade, неопубликованные наблюдения, 1997). . Настоящие данные также показывают, что чистое поглощение глюкозы печенью, выраженное как скорость абсорбции глюкозы, остается постоянным уже через 20 минут после начала абсорбции глюкозы, что позволяет количественно сравнить чистое постпеченочное появление глюкозы из различных источников углеводов.В базальном состоянии, а также при гиперинсулинемии скорость использования глюкозы в кишечнике составляла 12–13% от общего использования глюкозы. Это подтверждает, что у свиней кишечник представляет собой место высокой утилизации глюкозы, как было зарегистрировано ранее (1, 26–28). Во время абсорбции глюкозы было невозможно определить количество утилизации глюкозы тканями кишечника на основе различий между концентрациями в артериальной и воротной артериях. Однако чистая утилизация глюкозы в кишечнике может достигать 5% от нагрузки глюкозы во время абсорбции (≈70 мин после инфузии), если предположить, что экзогенная глюкоза, не обнаруженная в воротной вене, метаболизируется в кишечнике.Таким образом, чистая утилизация глюкозы составила 3,6 мкмоль • -1 кг • мин -1 , что близко к определению по выходу лактата в кишечнике (4,6 мкмоль • кг -1 • мин -1 ). Это говорит о том, что использование глюкозы в кишечнике во время DG-Clamp снижается во время введения DG, как это было ранее обнаружено в изолированных энтероцитах (28). Помимо глюкозы, ткани кишечника используют глутамин и выделяют аланин, как сообщалось ранее (37–39). Более того, поглощение глутамина связано с концентрацией глютамина в артериальной крови и увеличивается во время абсорбции глюкозы, что подтверждает предыдущие наблюдения (40). Для расширения валидации метода были проведены эксперименты с 2 источниками углеводов с разными гликемическими индексами (25) в составе смешанного питания. Результаты настоящего исследования подтверждают использование эугликемической гиперинсулинемической клэмп-процедуры для определения постпеченочного появления глюкозы после кормления пищей. Действительно, отношения между появлением портального портала и постпеченочным появлением глюкозы были сходными после приема быстро перевариваемого кукурузного крахмала и медленно перевариваемого крахмала из маша.Кроме того, чистое поглощение глюкозы печенью, выраженное как чистый внешний вид глюкозы в воротной вене, было сходным для обоих приемов углеводной пищи. Однако чистое поглощение глюкозы печенью после смешанного приема пищи было ниже, чем после нагрузки DG, что можно объяснить изменением соотношения инсулина и глюкагона, которое происходит, когда углеводы употребляются вместе с белком (41). Таким образом, настоящие данные доказывают, что постпеченочный внешний вид глюкозы после углеводной нагрузки может быть оценен с помощью процедуры зажима эугликемической гиперинсулинемии, предполагая, что производство глюкозы в печени полностью подавлено, а общее использование глюкозы остается постоянным.Поскольку чистое поглощение глюкозы печенью остается пропорциональным скорости абсорбции глюкозы (т. Е. Постоянная экстракция) и поскольку использование глюкозы в кишечнике представляет собой лишь небольшую часть внутреннего поглощения глюкозы, результаты настоящего исследования подтверждают расширение этого метода для использования у людей. исследования. Однако настоящее исследование предполагает, что сравнение различных углеводов требует хорошо контролируемых условий питания. Мы благодарим Малкольма Уотфорда за полезное обсуждение. Abumrad NN Cherrington AD Williams PE Lacy WW Rabin D ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ
Антропометрия и состав тела
Чувствительность к инсулину
Анализ крови
Статистические методы
Принципы классификационных деревьев.
Метод единого дерева классификации.
РЕЗУЛЬТАТЫ
Характеристики субъектов
Распределение и оптимальное пороговое значение для определения инсулинорезистентности
Древовидные модели для прогнозирования инсулинорезистентности с использованием всех предикторов
Модель 1: все предикторы.
Модель 2: антропометрия, измерение уровня глюкозы натощак и инсулина.
Модель 3: возраст, пол и ИМТ.
ВЫВОДЫ
Выражение признательности
Список литературы
Эугликемический гиперинсулинемический зажим для оценки постпеченочного уровня глюкозы после углеводной нагрузки. 1. Проверка у свиней | Американский журнал клинического питания
РЕФЕРАТ
ВВЕДЕНИЕ
МАТЕРИАЛЫ И МЕТОДЫ
Животные и хирургические процедуры
Опытный образец
Валидация глюкозы двенадцатиперстной кишки
Зажим DG
Зажим контрольный
Нагрузка ДГ
Валидация с пероральными углеводами
Зажим OC
Аналитические методы
Расчеты и статистический анализ
РЕЗУЛЬТАТЫ
Валидация глюкозы двенадцатиперстной кишки
Измерение кровотока
Концентрация глюкозы в крови и инсулина в плазме
Скорость появления глюкозы
Чистый портал и внешний вид глюкозы в печени
Чистый баланс глюкозы в печени
Валидация с пероральными углеводами
Эксперименты Метаболит артериальной крови и метаболизм кишечника
. Без зажима
. Зажим ( A )
. п. 2 . . Без нагрузки ДГ
. нагрузка ДГ
. Без нагрузки ДГ
. Нагрузка ДГ (В) . А . B . A × B . Глутамин Концентрация в артериальной крови (мкмоль / л) 22722 9055 307 307 307 907 ± 24 0,001 — — Кишечный баланс (мкмоль • кг -1 • мин -1 ) -1.80 ± 0,18 −2,25 ± 0,23 −1,15 ± 0,17 −1,82 ± 0,19 0,01 0,006 — Аланин 9075 9075 9055 9075 Концентрация в артериях (мкмоль / л) 312 ± 7 415 ± 28 280 ± 27 275 ± 30 0,003 — 0,04 кг (Баланс в кишечнике • −1 • min −1 ) 1.26 ± 0,19 1,57 ± 0,22 1,06 ± 0,13 1,54 ± 0,11 — — — Лактат 9075 9075 9055 9075 9055 9075 9055 9075 9055 9075 Концентрация в артериях (мкмоль / л) 1,63 ± 0,14 2,59 ± 0,27 2,67 ± 0,22 3,21 ± 0,36 0,003 0,009 — 900 Кишечный баланс (мкмоль 16 900) • min −1 ) −3.37 ± 0,74 11,86 ± 2,60 -5,01 ± 1,23 9,11 ± 1,77 — 0,001 —
ТАБЛИЦА 1 . Без зажима
. Зажим ( A )
. п. 2 . . Без нагрузки ДГ
. нагрузка ДГ
. Без нагрузки ДГ
. Нагрузка ДГ (В) . А . B . A × B . Глутамин Концентрация в артериальной крови (мкмоль / л) 22722 9055 307 307 307 907 ± 24 0.001 — — Кишечный баланс (мкмоль • кг -1 • мин -1 ) -1,80 ± 0,18 -2,25 ± 0,23 -1,15 ± 0,17 ± 0,19 0,01 0,006 — Аланин 9075 4 Артериальная концентрация 28 280 ± 27 275 ± 30 0.003 — 0,04 Кишечный баланс (мкмоль • кг -1 • мин -1 ) 1,26 ± 0,19 1,57 ± 0,22 1,06 ± 0,13 1,54 ± — — — Лактат Артериальная концентрация (мкмоль / л) 1 907.63 ± 0,14 2,59 ± 0,27 2,67 ± 0,22 3,21 ± 0,36 0,003 0,009 — Кишечный баланс (мкмоль • кг −1 • мин −1 4) -3,37 ± 0,74 11,86 ± 2,60 -5,01 ± 1,23 9,11 ± 1,77 — 0,001 — . Без зажима
. Зажим ( A )
. п. 2 . . Без нагрузки ДГ
. нагрузка ДГ
. Без нагрузки ДГ
. Нагрузка ДГ (В) . А . B . A × B . Глутамин Концентрация в артериальной крови (мкмоль / л) 22722 9055 307 307 307 907 ± 24 0,001 — — Кишечный баланс (мкмоль • кг -1 • мин -1 ) -1.80 ± 0,18 −2,25 ± 0,23 −1,15 ± 0,17 −1,82 ± 0,19 0,01 0,006 — Аланин 9075 9075 9055 9075 Концентрация в артериях (мкмоль / л) 312 ± 7 415 ± 28 280 ± 27 275 ± 30 0,003 — 0,04 кг (Баланс в кишечнике • −1 • min −1 ) 1.26 ± 0,19 1,57 ± 0,22 1,06 ± 0,13 1,54 ± 0,11 — — — Лактат 9075 9075 9055 9075 9055 9075 9055 9075 9055 9075 Концентрация в артериях (мкмоль / л) 1,63 ± 0,14 2,59 ± 0,27 2,67 ± 0,22 3,21 ± 0,36 0,003 0,009 — 900 Кишечный баланс (мкмоль 16 900) • min −1 ) −3.37 ± 0,74 11,86 ± 2,60 -5,01 ± 1,23 9,11 ± 1,77 — 0,001 — . Без зажима
. Зажим ( A )
. п. 2 . . Без нагрузки ДГ
. нагрузка ДГ
. Без нагрузки ДГ
. Нагрузка ДГ (В) . А . B . A × B . Глутамин Концентрация в артериальной крови (мкмоль / л) 22722 9055 307 307 307 907 ± 24 0.001 — — Кишечный баланс (мкмоль • кг -1 • мин -1 ) -1,80 ± 0,18 -2,25 ± 0,23 -1,15 ± 0,17 ± 0,19 0,01 0,006 — Аланин 9075 4 Артериальная концентрация 28 280 ± 27 275 ± 30 0.003 — 0,04 Кишечный баланс (мкмоль • кг -1 • мин -1 ) 1,26 ± 0,19 1,57 ± 0,22 1,06 ± 0,13 1,54 ± — — — Лактат Артериальная концентрация (мкмоль / л) 1 907.63 ± 0,14 2,59 ± 0,27 2,67 ± 0,22 3,21 ± 0,36 0,003 0,009 — Кишечный баланс (мкмоль • кг −1 • мин −1 4) -3,37 ± 0,74 11,86 ± 2,60 -5,01 ± 1,23 9,11 ± 1,77 — 0,001 — ОБСУЖДЕНИЕ
ССЫЛКИ
1
Поглощение и распределение глюкозы в сознании собаки
.Am J Physiol
1982
;242
:E398
—406
,2Ferrannini
E
,Björkman
O
,Reichard
GA
и др.Устранение пероральной глюкозной нагрузки у здоровых людей. Количественное исследование
.Диабет
1985
;34
:580
—8
.3Джексон
RA
,Рошания
RD
,Hawa
MI
,Sim
BM
il.Влияние приема глюкозы на печеночный и периферический метаболизм глюкозы у человека: анализ, основанный на одновременном использовании предплечья и методов двойного изотопа
.J Clin Endocrinol Metab
1986
;63
:541
—9
,4Консоли
A
.Пути метаболизма глюкозы после перорального приема глюкозы
.Diabetes Nutr Metab
1994
;7
:97
—107
,5De Fronzo
RA
.Патогенез сахарного диабета 2 типа (инсулиннезависимый): сбалансированный обзор
.Диабетология
1992
;35
:389
—97
,6Slama
G
,Jean-Joseph
P
,Goicola
I
и др.Сахароза, принятая во время смешанного приема пищи, не оказывает дополнительного гипергликемического действия по сравнению с изокалорийным количеством крахмала у хорошо контролируемых диабетиков
.Ланцет
1984
;2
:122
—6
,7Bornet
F
,Haardt
MJ
,Costagliola
D
,Blayo
A
A
Сахароза или мед за завтраком не оказывают дополнительного острого гипергликемического эффекта по сравнению с изоглюцидным количеством хлеба у пациентов с диабетом 2 типа
.Диабетология
1984
;28
:213
—7
,8Стивен
AM
,Хаддад
AC
,Phillips
SF
.Прохождение углеводов в толстую кишку. Прямые измерения на людях
.Гастроэнтерология
1983
;85
:589
—95
.9Levitt
MD
,Hirsh
P
,Fetzer
CA
,Sheahan
M
,Levine
AS
.H 2 Выведение сложных углеводов после приема внутрь
.Гастроэнтерология
1987
;92
:383
—9
.10Jenkins
DJA
,Wolever
TMS
,Taylor
RH
и др.Гликемический индекс продуктов: физиологическая основа углеводного обмена
.Am J Clin Nutr
1981
;34
:362
—6
.11Bornet
FR
,Costagliola
D
,Rizkalla
SW
и др.Инсулинемические и гликемические индексы шести богатых крахмалом пищевых продуктов, принимаемых отдельно и в составе смешанного питания, для больных сахарным диабетом 2 типа
.Am J Clin Nutr
1987
;45
:588
—95
.12Lacroix
M
,Mosora
F
,Pontus
M
,Lefebvre
P
,Luyckx
A
,Hab
,Lope
,Lope
Глюкоза, естественно меченная 13 C: использование для метаболических исследований на человеке
.Наука
1973
;181
:445
—6
.13Normand
S
,Pachiaudi
C
,Khalfallah
Y
,Guilluy
Riou
JP
.13 Появление C в глюкозе плазмы и в дыхании CO 2 во время кормления естественно обогащенной крахмалистой пищей 13 C-обогащенной крахмалистой пищей у нормальных людей
.Am J Clin Nutr
1992
;55
:430
—5
.14Людвик
B
,Нолан
J
,Робертс
A
и др.Неинвазивный метод измерения внутреннего поглощения глюкозы после перорального введения глюкозы
.Дж. Клин Инвест
1995
;95
:2232
—8
.15Людвик
B
,Нолан
J
,Робертс
A
и др.Доказательства снижения внутреннего поглощения глюкозы после перорального приема глюкозы при инсулиннезависимом сахарном диабете
.J Clin Invest
1997
;100
:2354
—61
.16Lang
V
,Vaugelade
P
,Bernard
F
и др.Экспериментальная проверка неинвазивного метода количественной оценки кинетики абсорбции глюкозы на свиньях
.Диабет
1995
;44
(доп.):93A
.17Moughan
PJ
,Rowan
AM
.Свинья как модельное животное для исследования питания человека
.Proc Nutr Soc N Z
1989
;14
:116
—23
,18Rérat
A
,Chayvialle
JA
,Kandé
J
,Vaissade
000
000 Paugel
Бурье
Т
.Метаболические и гормональные эффекты пробных завтраков с различным содержанием белка у свиней
.Can J Physiol Pharmacol
1985
;63
:1547
–59
,19Simoes Nunes
C
,Rérat
A
,Galibois
I
,Vaugelade
0003Vaugelade
Балансы глюкозы, амино-азота, аммиака и мочевины в печени и кишечнике свиньи после приема казеина или белков рапса
.Nutr Rep Int
1989
;40
:901
—7
,20Rerat
A
,Vaissade
P
,Vaugelade
P
.Кинетика абсорбции некоторых углеводов у находящихся в сознании свиней
.Br J Nutr
1984
;51
:517
—29
,21Кабир
M
,Rizkalla
S
,Champ
M
и др.Содержание крахмала амилоза-амилопектина в рационе влияет на метаболизм глюкозы и липидов в адипоцитах нормальных и диабетических крыс
.J Nutr
1998
;128
:35
—43
.22Somogyi
M
.Определение сахара в крови
.J Biol Chem
1945
;160
:69
—73
.23Bergmeyer
HU
.Методы ферментативного анализа.
Нью-Йорк
:Academic Press
,1974
,24Стил
R
.Влияние нагрузки глюкозой и инсулина на продукцию глюкозы в печени
.Proc N Y Acad Sci
1959
;82
:420
—30
.25Bornet
F
,Fontvieille
A
,Rizkalla
S
и др.Инсулин и гликемические реакции здоровых людей на нативный крахмал обрабатываются разными способами: корреляция с гидролизом α-амилазы in vitro
.Am J Clin Nutr
1989
;50
:315
—23
.26Björkman
O
,Eriksson
LS
,Nyberg
B
,Wahren
J
Кишечный обмен глюкозы и лактата в базальном состоянии и после перорального приема глюкозы у послеоперационных пациентов
.Диабет
1990
;39
:747
—51
.27Müller
MJ
,Paschen
U
,Seitz
HJ
.Производство глюкозы, измеренное с помощью индикатора и данных баланса у миниатюрной свиньи в сознании
.Am J Physiol
1983
;244
:E236
—44
,28Vaugelade
P
,Posho
L
,Darcy-Vrillon
B
,0003
Bernard
MT
8 ,
Duée
PH
.Поглощение кислорода кишечником и метаболизм глюкозы во время поглощения питательных веществ у свиней
.Proc Soc Exp Biol Med
1994
;207
:309
—16
,29Argoud
GM
,Schade
DS
,Eaton
RP
.Недооценка продукции глюкозы в печени с помощью радиоактивных и стабильных индикаторов
.Am J Physiol
1987
;252
:E606
—15
.30Нили
RDG
,Руни
DP
,Аткинсон
AB
и др.Недооценка оборота глюкозы, определенная с использованием индикатора глюкозы [6- 3 H] в нестационарном состоянии
.Диабетология
1990
;33
:681
—7
.31Finegood
DT
,Bergman
RN
,Vranic
M
.Оценка выработки эндогенной глюкозы во время гиперинсулинемико-эугликемических глюкозных зажимов
.Диабет
1987
;36
:914
—24
.32Jacot
E
,De Fronzo
RA
,Jéquier
E
,Maeder
E
,Felber
JP
.Влияние гипергликемии, гиперинсулинемии и пути введения глюкозы на окисление глюкозы и накопление глюкозы
.Метаболизм
1982
;31
:922
—30
.33Pagliassotti
MJ
,Cherrington
AD
.Регулирование чистого поглощения глюкозы печенью in vivo
.Annu Rev Physiol
1992
;54
:847
—60
. 34Шульман
GI
,Россетти
L
.Влияние способа введения глюкозы на восполнение запасов гликогена в печени
.Am J Physiol
1989
;257
:E681
—5
.35Adkins
BA
,Myers
SR
,Hendrick
GK
,Stevenson
000
RW
RW Черрингтон
н.э.
.Важность пути внутривенной доставки глюкозы для баланса глюкозы в печени у собаки в сознании
.J Clin Invest
1987
;79
:557
—65
,36De Fronzo
RA
,Ferrannini
E
,Hendler
R
,Wahren
9000J
Влияние гиперинсулинемии, гипергликемии и способа введения глюкозы на внутренний обмен глюкозы
.Proc Natl Acad Sci U S A
1978
;75
:5173
—7
.37Windmueller
HG
.Энтерогепатические аспекты метаболизма глутамина
. В:Mora
J
,Palacios
R
, ред.Глютамин: метаболизм, энзимология и регуляция.
Нью-Йорк
:Academic Press
,1980
:235
—57
,38Уотфорд
M
.Метаболизм глутамина в тонком кишечнике крысы: синтез трехуглеродных продуктов в изолированных энтероцитах
.Biochim Biophys Acta
1994
;1200
:73
—8
.39Duée
PH
,Darcy-Vrillon
B
,Blachier
F
,Morel
MT
MT
MT
Выбор топлива в клетках кишечника
.Proc Nutr Soc
1995
;54
:83
—94
.40Weber
FL
,Veach
G
,Friedman
DW
.Стимуляция выработки аммиака из глутамина внутрипросветной глюкозой в тонком кишечнике собак
.Am J Physiol
1982
;242
:G552
—7
.41Pagliassotti
MJ
,Horton
,TJ
.Гормональная и нервная регуляция поглощения глюкозы печенью
.В:Pagliassotti
MJ
,Davis
SN
,Cherrington
AD
, ред.Роль печени в поддержании гомеостаза глюкозы.
Остин, Техас
:Landes RG Co
,1994
:45
—70
.© 1999 Американское общество клинического питания
SPECS: Безопасная детская эугликемия в кардиохирургии — Полный текст
Дети, перенесшие операцию на сердце, подвергаются значительному физическому стрессу, который может привести к повышению или понижению уровня глюкозы в крови выше нормы.Синтетическая форма инсулина, естественного гормона в организме, может вводиться людям для нормализации уровня глюкозы в крови. Инсулин чаще всего используется для лечения людей с диабетом, но он также используется в больницах для контроля уровня глюкозы в крови у пациентов. Предыдущие исследования взрослых пациентов отделения интенсивной терапии (ОИТ) показали, что пациенты, у которых уровень сахара в крови поддерживается на нормальном уровне с помощью инсулина, реже заражаются и быстрее выходят из отделения интенсивной терапии, чем пациенты, у которых не поддерживается нормальный уровень глюкозы в крови. .В этом исследовании будет использоваться система непрерывного мониторинга уровня глюкозы в крови для обнаружения изменений уровня глюкозы в крови. Для безопасного поддержания нормального уровня глюкозы в крови будут использоваться внутривенные инфузии инсулина. Цель этого исследования — определить, поможет ли поддержание нормального уровня глюкозы в крови во время пребывания в отделении интенсивной терапии снизить частоту инфекций и улучшить хирургическое выздоровление маленьких детей после операции на сердце.
В это исследование будут включены дети, перенесшие операцию на сердце, требующую искусственного кровообращения.Участники будут случайным образом распределены либо в контрольную группу, либо в группу лечения. Все участники получат обычную помощь в отделении интенсивной терапии и будут проходить постоянный мониторинг уровня глюкозы. Участники группы лечения будут получать внутривенные инфузии инсулина, чтобы поддерживать уровень глюкозы в крови в пределах нормы. Находясь в отделении интенсивной терапии, у всех участников будут собирать кровь один раз в день в течение первых 3 дней, а затем один раз в неделю для контроля уровня глюкозы, гормонов и измерений питания и иммунной функции.На 1-й и 5-й дни после операции участникам, находящимся на аппарате ИВЛ, будут измерять свое дыхание, чтобы контролировать функцию сердца и потребление энергии. Через 30 дней и 1 год после операции исследователи свяжутся с родителями или врачом участника для сбора информации о состоянии здоровья и любых новых инфекциях в месте операции. Детей, участвующих в исследовании, попросят принять участие в последующих оценках нервного развития в возрасте 1 и 3 лет, чтобы оценить долгосрочные когнитивные эффекты жесткого гликемического контроля в отделении интенсивной терапии.
Гиперинсулинемико-эугликемические зажимы у мышей, находящихся в сознании, без ограничений
1. Подготовка катетеров и антенны мыши для доступа к пробам (MASA tm )
- Подготовьте артериальный катетер, вставив кусок полиэтилена 10 длиной 1,3 см (внутренний диаметр 0,011 дюйма) в кусок эластичной трубки длиной 6 см (внутренний диаметр 0,012 дюйма), как показано на , рис. 1А, . Срежьте кончик PE-10 скальпелем так, чтобы длина от конца пластика до кончика скоса была равна 0.9 см.
- Подготовьте венозный катетер, сдвинув 1-миллиметровую пластиковую трубку (внутренний диаметр 0,020 дюйма) на 1,1 см от скошенного конца 6-сантиметрового отрезка пластической трубки (внутренний диаметр 0,012 дюйма), как показано на , рис. 1В, . Кусок силикона толщиной 1 мм используется как ограничивающий бусинку.
- Чтобы подготовить MASA TM , вставьте каждый из двух 1,3-сантиметровых соединителей из нержавеющей стали 25 калибра в каждый из двух 3-сантиметровых кусков полиэтилена PE-20 (внутренний диаметр 0,015 дюйма).
- Прикрепите соединители PE-20 / друг к другу, сдвинув кусок эластичной трубки диаметром 5 мм (0.Внутренний диаметр 040 дюймов) в зоне стыка стальных трубок и полиэтилена PE-20.
- Согните стальные трубы на угол ~ 120 ° и отделите каждую трубку на ~ 45 °.
- Поместите готовую оснастку в ложку медицинского силиконового клея так, чтобы трубка PE-20 была вертикальной, а концы трубок из нержавеющей стали выходили за пределы клея (, рис. 1C, ). Подождите 24 часа.
2. Катетеризация хирургическая
- Перед операцией простерилизуйте катетеры 70% этанолом, заполните их гепаринизированным физиологическим раствором (200 Ед гепарина / мл физиологического раствора) и вставьте пробки из нержавеющей стали.
- Анестезируйте мышь, предпочтительно с использованием метода, который непрерывно доставляет анестетик (например, вдыхаемый изофлуран).
- Используя стерильную технику, удалите волосы в местах разрезов с помощью машинки для стрижки и / или крема для депиляции и продезинфицируйте кожу спиртом, а затем скрабом с бетадином. Для введения катетера удалите волосы в области, простирающейся от нижней челюсти до верхней части грудной клетки и между ключицами. Для экстернализации катетеров за головой удалите волосы в области между основанием черепа и межлопаточной областью и продезинфицируйте кожу спиртом, а затем скрабом с бетадином.
- Положите мышь спиной на нагревающуюся поверхность под зоной обзора хирургического микроскопа. Закрепите хвост и конечности хирургической лентой. Закрепите головку в носовом конусе, проводя анестезию.
- Сделайте небольшой вертикальный разрез по средней линии на 5 мм от головы до грудины. Используя щипцы, тупо рассеките ткань, чтобы обнажить левую грудинно-сосцевидную мышцу. Отразите эту мышцу, чтобы обнажить левую сонную артерию. Осторожно отделите соединительную ткань от артерии. На этом этапе важно изолировать блуждающий нерв от артерии, не повреждая ни артерию, ни нерв.
- Изолируйте артерию и перевяжите головной конец шелковой нитью. Слабо завяжите другой кусок нити на каудальном конце открытого сосуда.
- Зажмите сосуд зажимом из микросерфина на каудальном конце и разрежьте пружинными ножницами чуть ниже лигированного конца. Осторожно введите катетер до зажима. Осторожно ослабьте зажим микросерфина и продвиньте катетер к соединению силиластик-полиэтилен.
- Надежно привяжите обе лигатуры к катетеру и убедитесь, что катетер пробы, подключив свободный конец катетера к шприцу для отбора проб.
- Сделайте еще один разрез на 5 мм справа от средней линии и примерно на 2 мм каудальнее первого разреза. Используя щипцы, рассеките ткань тупым предметом, чтобы обнажить и изолировать правую яремную вену.
- Осторожно перевяжите головной конец шелковой нитью и свободно завяжите другой кусок нити на каудальном конце.
- Разрежьте пружинными ножницами сразу под головной лигатурой и вставьте катетер до ограничивающего валика. Завяжите нить за бусиной и убедитесь, что образец катетера.
- Переверните мышь и сделайте небольшой разрез между лопатками.
- Вставьте иглу 14 калибра под кожу от разреза для артериального катетера на передней части мыши до межлопаточного разреза на спине. Пропустите артериальный катетер через иглу, чтобы вывести его наружу сзади мыши. Повторите это для катетера яремной вены, вставив иглу № 14 под кожу на правой стороне мыши от места разреза спереди до межлопаточного разреза на спине.
- Зажмите артериальный катетер зажимом из микросерфина в месте разреза между лопатками. Обрежьте катетер примерно на 1 см выше этого зажима. Поместите MASA tm так, чтобы разъемы из нержавеющей стали были обращены в сторону головы мыши. Подключите артериальный катетер к разъему из нержавеющей стали, направленному к левой стороне мыши. Следите за тем, чтобы в катетере не было отверстий и перегибов. Повторите то же самое для венозного катетера, подключив его к коннектору из нержавеющей стали, указывающему на правую сторону мыши.
- Вставьте MASA TM в разрез между лопатками. Трубка PE-20, соответствующая катетеру яремной вены, должна быть справа от мыши, а трубка PE-20, соответствующая артериальному катетеру, должна быть слева.
- Закройте вентральные и дорсальные разрезы нейлоновым швом. Для дорсального закрытия нить можно пропустить через затвердевший силикон MASA TM , чтобы закрепить ее на месте. Подтвердите проходимость катетеров с помощью промывочного раствора, содержащего гепаринизированный физиологический раствор и антибиотик, чтобы минимизировать риск инфекции.Поместите мышь в теплую чистую клетку для немедленного выздоровления. На рисунке 2 показан готовый продукт.
- Дайте мыши восстановиться не менее 5 дней. Следите за весом и общим состоянием здоровья. Используйте соответствующий послеоперационный режим обезболивания, одобренный Комитетом по уходу за животными и их использованию.
3. Гиперинсулинемико-эугликемический зажим
- Быстрая мышь в течение 5-6 часов. Для справки, время t = 0 мин относится к концу голодания и началу инфузии инсулина и глюкозы (т.е.е. период зажима).
- Установка и временная шкала для типичного эксперимента показаны на Рис. 3 . Для линий инфузии и отбора проб используйте трубки Micro-Renathane или аналогичные. Подвесьте двухканальный вертлюг над мышью. Он служит центром между мышью и шприцами для инфузии / отбора проб. Во время эксперимента мышь остается в домашней клетке или подобном контейнере и привязана к вертлюгу.
- Перед подключением мыши заполните артериальную линию отбора проб гепаринизированным физиологическим раствором (10 Ед гепарина / мл физиологического раствора) и поместите соединитель из нержавеющей стали в нижний конец линии.Оставьте шприц с гепаринизированным физиологическим раствором (очищающий шприц) подключенным к верхней части линии отбора проб. Это будет использоваться для взятия образцов крови.
- Заполните венозную инфузионную линию негепаринизированным физиологическим раствором, начиная с инфузионного порта вертлюга ( сегмент A на рисунке 3A ) до конца линии. Подключите верхний конец линии и поместите соединитель из нержавеющей стали (или Y-образный соединитель, если необходимо ввести болюс) на нижнем конце линии. Если изотопный индикатор глюкозы (например,грамм. [3- 3 H] глюкоза), прикрепите шприц на 1 мл, содержащий индикатор, к шприцу для инфузии. Заполните венозную инфузионную линию индикатором вместо физиологического раствора ( Рисунок 3B ).
- Через три часа голодания взвесьте мышь и подключите PE-20 для яремной вены и артериальных катетеров к линиям инфузии и забора образцов соответственно.
- При введении индикатора глюкозы [3- 3 H] начните непрерывную инфузию примированного индикатора при t = -90 мин ( Рисунок 3C ).Типичная начальная доза составляет 1 мкКи. Приготовьте раствор глюкозы 0,05 мкКи / мкл [3- 3 H] в негепаринизированном физиологическом растворе. Загрузите раствор в шприц на 1 мл и закрепите шприц в инфузионном насосе. Введите начальную дозу, вводя 20 мкл / мин в течение 1 мин. Затем следует непрерывная инфузия 0,05 мкКи / мин (1 мкл / мин) в течение 90-минутного периода уравновешивания.
- Приготовьте инфузаты инсулина и глюкозы. Инсулин готовят в негепаринизированном физиологическом растворе, содержащем 3% плазмы в качестве носителя (также может использоваться соответствующая концентрация BSA).Инфузаты глюкозы коммерчески доступны в различных концентрациях (5, 20 и 50%).
- Приготовьте инфузат эритороцитов, промытых физиологическим раствором, взяв цельную кровь от мыши-донора, предпочтительно того же штамма, что и экспериментальная мышь. Обычно на каждую исследуемую мышь требуется 1 мл цельной крови. Центрифугируйте кровь для отделения эритроцитов. Промойте эритроциты гепаринизированным физиологическим раствором 10 Ед / мл и центрифугируйте, чтобы удалить физиологический раствор. Определите объем эритроцитов и ресуспендируйте в равном объеме 10 Ед / мл гепаринизированного физиологического раствора.
- Наберите каждую инфузию в шприц на 1 мл и прикрепите каждый шприц к отдельному инфузионному насосу. Подключите каждый шприц к 4-контактному разъему (, рис. 3, ).
- При t = -15 мин возьмите образец крови, медленно набирая 50–100 мкл крови в очищающий шприц. Зажмите артериальную пробоотборную линию и извлеките очищающий шприц. Используя ручной глюкометр, снимите показания уровня глюкозы в крови, сняв зажим на артериальной линии отбора проб и позволив крови течь в полоску глюкометра.
- После измерения уровня глюкозы зажмите артериальную линию взятия пробы и вставьте шприц с тупой иглой (шприц для взятия пробы) в артериальную пробоотборную линию. Снимите зажим и наберите объем крови (см. , примечание ) в шприц для отбора проб. Зажмите артериальную линию отбора проб и извлеките шприц для отбора проб. Вставьте очищающий шприц обратно в артериальную пробоотборную линию. Поднимите поршень, чтобы удалить пузырьки воздуха, и повторно влейте 50–100 мкл крови, которая была взята изначально.
Примечание. Объем взятой крови зависит от выполняемого анализа. Например, для анализа концентрации [3- 3 H] глюкозы требуется 10 мкл плазмы, поэтому берется 50 мкл крови. Это дает 20-30 мкл плазмы, чего достаточно для анализа, плюс дополнительная плазма, если необходимо. Для измерения гормонов и других метаболитов (например, инсулина, свободных жирных кислот) требуется дополнительный забор крови.
- Перелейте кровь из шприца для отбора проб в микропробирку, покрытую ЭДТА.Центрифугируйте и соберите плазму. Держите плазму на льду до конца исследования или сразу же храните при -20 ° C.
- Повторите шаги с 3.10 по 3.12 при t = -5 мин. Получите дополнительную кровь (50 мкл) для измерения исходного уровня инсулина в плазме. Измерьте исходный гематокрит, набрав кровь в капиллярную трубку, обработанную гепарином или ЭДТА. Измерения, полученные для образцов плазмы при t = -15 и -5 мин, представляют собой исходные значения (т. Е. Натощак).
- После взятия пробы при t = -5 мин заполните линии инфузии глюкозой, инсулином и эритроцитами, промытыми физиологическим раствором, до 4-ходового соединителя.Подсоедините 4-сторонний соединитель к трубке, прикрепленной к поворотному инфузионному порту (или трубке, подключенной к Y-образному соединителю, если вводится [3- 3 H] глюкозы), как показано на Рис. 3 .
- Начните вливание эритроцитов, промытых физиологическим раствором. Установите скорость инфузии, чтобы заменить общий объем крови, отбираемой на протяжении всего исследования (например, если в течение 120 минут исследования отбирается всего 500 мкл крови, установите скорость инфузии на 4,2 мкл / мин). В отличие от других инфузатов раствор эритроцитов имеет красный цвет.Вливание этого раствора в первую очередь позволяет выявить и исправить любое потенциальное сопротивление или препятствия в линиях инфузии.
- Как только инфузия эритроцитов достигнет мыши, начните инфузию инсулина и глюкозы. Теперь это t = 0 мин. Инсулин вводится с постоянной заранее определенной скоростью. Скорость инфузии инсулина 4 мЕд • кг -1 • мин -1 обычно подавляет выработку эндогенной глюкозы на 80-100% и стимулирует исчезновение глюкозы в 2-3 раза.Начальная скорость инфузии глюкозы (GIR) оценивается на основе исходных уровней глюкозы в крови и предыдущего опыта.
- При введении [3- 3 H] глюкозы можно выбрать увеличение скорости введения индикатора, чтобы соответствовать предполагаемому увеличению оборота глюкозы (обычно в 2-3 раза).
- Учитывая высокую скорость оборота глюкозы у мышей, образцы крови следует брать из артериальной линии не реже чем каждые 10 минут для измерения концентрации глюкозы в течение всего эксперимента.Отрегулируйте GIR для достижения и поддержания целевой эугликемии (, рис. 3C, ). Эта цель может варьироваться в зависимости от модели или целей исследования. Хорошая целевая концентрация глюкозы составляет 150 мг • дл-1, поскольку это типичный 6-часовой уровень глюкозы натощак для мышей C57Bl / 6J, получавших пищу.
- Цель состоит в том, чтобы достичь эугликемии быстро, в идеале в течение первых 40-50 минут, и чтобы глюкоза и GIR были стабильными к началу периода устойчивого состояния (t = 80 минут).
- При вливании [3- 3 H] глюкозы получите дополнительную кровь при t = 80, 90, 100, 110 и 120 мин для измерения удельной активности [3- 3 H] глюкозы в плазме.
- Соберите дополнительный объем крови при t = 100 и 120 мин для измерения инсулина в плазме и любых других гормонов или метаболитов. При t = 110 мин наберите кровь в капиллярную трубку, обработанную гепарином или ЭДТА, для измерения гематокрита зажима.
- После взятия пробы при t = 120 мин можно ввести 2 [ 14 C] дезоксиглюкозу для измерения тканеспецифического поглощения глюкозы. Введите болюс 12 мкКи в линию болюса, соединенную с линией взятия пробы из яремной впадины (, рис. 3B, ).
- Возьмите образцы крови (50 мкл) из артериальной линии для отбора проб через t = 2, 15, 25 и 35 мин после введения болюса для измерения уровней дезоксиглюкозы в плазме 2 [ 14 C].
- После последнего образца анестезируйте мышь инфузией пентобарбитала, вводимой непосредственно в артериальную линию. Быстро препарируйте любые ткани, необходимые для оценки поглощения глюкозы (например, скелетные мышцы различных типов, жировую ткань, сердце, мозг) и любые другие ткани (например, скелетные мышцы различных типов, жировую ткань, сердце, мозг).грамм. печень, селезенка, почки). Ткани замораживают в жидком азоте и хранят при -80 ° C до анализа. Тканевая глюкоза анализируется путем измерения накопления фосфорилированной 2 [ 14 C] дезоксиглюкозы в замороженных тканях и исчезновения 2 [ 14 C] дезоксиглюкозы из плазмы.
4. Представитель Результаты
Пример результатов, полученных в эксперименте с зажимом для инсулина, показан на Рис. 4 . Этот пример показывает способность диеты с высоким содержанием жиров вызывать инсулинорезистентность у мышей.Все представления результатов инсулиновых зажимов должны включать следующее, чтобы их можно было интерпретировать: динамика уровней глюкозы в крови, динамика GIR и уровней инсулина в плазме (исходный и зажимной). Как показано здесь, уровни глюкозы натощак (, фиг. 4A, ) и инсулина (, фиг. 4C, ) выше у мышей, получавших диету с высоким содержанием жиров, что свидетельствует об инсулинорезистентности. Представление динамики уровней глюкозы на протяжении всего клэмп-исследования (, рис. 4A, ) позволяет читателю оценить, насколько хорошо поддерживалась эугликемия, что свидетельствует о качестве клэмп-теста.Точно так же динамика GIR (, рис. 4B, ) позволяет читателю определить, насколько быстро было достигнуто установившееся состояние. Отображение этих данных в виде временного графика значительно более информативно, чем традиционная практика в литературе по фиксации инсулина на мышах, когда двухчасовой эксперимент представляется в виде единой точки отсчета, представляющей средние значения из неопределенного периода «фиксации» ( 4-13 ). В данном примере уровни глюкозы были равны между контрольной группой и группой с высоким содержанием жира, но GIR был значительно ниже в группе с высоким содержанием жира (, фиг. 4B, ).Это указывает на нарушение действия инсулина на все тело. Уровни клещевого инсулина также были выше в группе с высоким содержанием жира (, рис. 4C ), что еще раз подтверждает наличие инсулинорезистентного фенотипа у этих мышей. Использование инфузий изотопных индикаторов позволяет оценить действие инсулина в конкретных тканях. [3- 3 H] глюкоза используется для оценки скорости появления эндогенной глюкозы (endoRa), которая является индексом продукции глюкозы в печени (HGP) и скоростью исчезновения глюкозы во всем организме (Rd).В то время как инсулин полностью подавляет HGP у контрольных мышей, это нарушается у мышей, получавших диету с высоким содержанием жиров (, фиг. 4D, ). Точно так же способность инсулина стимулировать Rd у контрольных мышей нарушена у мышей, получавших диету с высоким содержанием жиров (, фиг. 4E, ). 2 [ 14 C] дезоксиглюкоза используется для оценки метаболического индекса глюкозы (Rg), показателя тканеспецифического поглощения глюкозы. Как видно из этого примера, стимулированное инсулином поглощение глюкозы скелетными мышцами нарушено у мышей, получавших диету с высоким содержанием жиров (, фиг. 4F, ).
Рисунок 1: Подготовка артериальных (A) и (B) венозных катетеров и (C) MASA TM . Артериальные катетеры получают путем вставки 1,3-сантиметрового кусочка полиэтилена-10 примерно на 3 мм в 6-сантиметровый кусок пластика с внутренним диаметром 0,012 дюйма. Наконечник из полиэтилена-10 скошен таким образом, чтобы длина от скоса до пластика составляла 0,9 см. Венозный катетеры изготавливают путем скольжения небольшого кусочка пластика внутренним диаметром 0,020 дюйма на 1,1 см со скошенного конца 6-сантиметрового фрагмента пластика внутреннего диаметра 0,012 дюйма. Кусок пластика внутреннего диаметра 0,020 дюйма действует как ограничивающий валик, прикрепляющий катетер к яремной вене.Для сборки MASA TM каждый из двух соединителей размером 1,3 см 25 калибра вставляется в каждый из двух 3-сантиметровых кусков полиэтилена PE-20. Они удерживаются вместе небольшим кусочком силикона с внутренним диаметром 0,040 дюйма. Соединители изогнуты под углом 120 ° и разделены под углом 45 °. Вся сборка погружена в медицинский силиконовый клей.
Рисунок 2: Катетеризованная мышь. Катетеры хирургическим путем имплантируются в левую сонную артерию и правую яремную вену. Свободные концы катетеров выводятся за голову и подключаются к MASA TM .MASA TM вводится подкожно между лопатками. Это обеспечивает доступ к сосудам во время экспериментов с зажимом для инсулина без необходимости удерживать, манипулировать или обезболивать мышь.
Рисунок 3: Изображение установки и временной шкалы для эксперимента с зажимом инсулина. Мышь привязана к двухканальному вертлюгу, который действует как концентратор для шприцев для инфузии и взятия проб. Показаны типичные установки для экспериментов, в которых не используются инфузии индикаторов (A) и используются как [3- 3 H] глюкозы, так и 2 [ 14 C] дезоксиглюкозы (B).Также показана временная шкала процедур для настройки и выполнения зажима инсулина (C). Во время зажима каждые 10 минут берут образцы крови () для измерения уровня глюкозы в крови. GIR корректируется соответствующим образом для поддержания эугликемии. Образцы для определения исходного уровня глюкозы в крови, инсулина в плазме и [3- 3 H] глюкозы в плазме берутся при t = -15 и -5 мин. Образцы для глюкозы клэмп-плазмы [3- 3 H] берут при t = 80, 90, 100, 110 и 120, а для клэмп-инсулина — при t = 100 и 120 мин. 2 [ 14 C] дезоксиглюкозу вводят после образца в t = 120 мин, а кровь собирают в t = 2, 15, 25 и 35 мин после.Ткани берут после взятия пробы t = 35 мин.
Рисунок 4: Результаты эксперимента с зажимом инсулина, сравнивающего мышей на контрольной диете (Chow) и мышей на диете с высоким содержанием жиров (HFD). Показаны изменения уровня глюкозы в артериях (A) и GIR (B), исходного уровня и клэмп-инсулина (C), EndoRa (D) и Rd (E), а также Rg (F) скелетных мышц (икроножная и большая мышца бедра). Все результаты указывают на то, что кормление с высоким содержанием жиров вызывает резистентность к инсулину.
Синонимы эугликемии, антонимы эугликемии — FreeThesaurus.com
На следующий день кривая ГК показала, что с ProZinc был достигнут более длительный период эугликемии, чем с комбинированным инсулином (Таблица 1). Окрашивание опухолевых клеток E-кадгерином было сильнее в группе эугликемии, чем в группе гипергликемии, что указывает на эта гипергликемия способна снизить экспрессию E-кадгерина. Уровни вновь синтезированного гликогена, измеренные от 4 до 80 часов, были значительно выше после гипогликемии (2,9 [+ или -] 0,3 ммоль / л), чем после эугликемии (5,1 [+ или — ] 0.1 ммоль / л), что указывает на повышенный синтез гликогена в мозге после умеренной гипогликемии. Управление диабетом во время родов и родоразрешения направлено на поддержание материнской эугликемии во избежание неонатальной гипогликемии. Кроме того, это важно в периоды истощения, когда контролируется секреция инсулина ПБЦ в чтобы поддерживать эугликемию, подавляя аутофагию и избирательно разрушая новые секреторные гранулы через лизосомы, чтобы поддерживать низкую секрецию инсулина во время голодания [135]. Удивительно, но у пациента была эугликемия и высокий рост.PER и PIR нейроны чувствительны к изменениям глюкозы от 2,5 до 5 мМ, что находится в диапазоне, который мозг воспринимает как переход уровня глюкозы в плазме от эугликемии к гипергликемии. После 15-летнего наблюдения потеря веса была на 16 кг больше. в подгруппе диабета на 18 кг больше в подгруппе преддиабета и на 20 кг больше в подгруппе эугликемии, которые перенесли бариатрическую операцию по сравнению с традиционным лечением (P менее 0,0001 для всех). Обоснование состоит в том, что после еды нормальная толерантность к глюкозе женщина сможет поддерживать эугликемию, несмотря на провокацию глюкозы, благодаря быстрому и адекватному инсулиновому ответу.Кроме того, другие индексы сосредоточены на эугликемии (процент от целевого показателя) и, наконец, другие индексы объединяют эти три аспекта гликемического состояния (среднее и медианное значение глюкозы, GRADE, M-VALUE, IGC и ADRR). Park et al., Упражнения поддерживают эугликемию в сочетании со сниженной активацией c-Jun Nh3-концевой киназы и фосфорилированием серина IRS-1 в печени крыс ZDF », — Американский журнал физиологии: эндокринология и метаболизм, том. Отмеченная гипергликемия замедляет опорожнение желудка у здоровых людей. и пациентов с диабетом 1 и 2 типа по сравнению с эугликемией.[1] Механизм (ы), опосредующий эффекты гипергликемии на перистальтику желудка, плохо определены, но, по-видимому, связаны с путями оксида азота. [17] И глюкоза, и фруктоза обладают способностью замедлять опорожнение желудка как в результате их взаимодействия с тонкой кишкой, так и в результате повышения концентрации моносахаридов в плазме крови. [16] Другое исследование с использованием сингенных островков, трансплантированных в костный мозг, вызывало гипергликемию более чем на 1 год. год у диабетических мышей и показал 2,4-кратное увеличение эугликемии по сравнению с трансплантацией через портальный участок [109].Влияние эугликемии на исход беременности у женщин с инсулинозависимым диабетом по сравнению с нормальными контрольными субъектами. Они также получают глибурид или инсулин по мере необходимости для достижения эугликемии.Эугликемический диабетический кетоацидоз с ингибиторами SGLT-2
Авторы и раскрытие информации
Энн Л. Петерс 1 , Элизабет О. Бушур 2 , Джон Б. Буз 3 , Пейман Кохан 4 , Джейми К. Дайнер 3 и Ирл Б. Хирш 5
1 Медицинский факультет Кека Университета Южной Калифорнии, Лос-Анджелес, Калифорния
2 Медицинский колледж Университета штата Огайо, Колумбус, Огайо
3 Медицинский факультет Университета Северной Каролины, Чапел-Хилл, Северная Каролина
4 Специализированный центр эндокринной помощи, Беверли-Хиллз, Калифорния
5 Школа медицины Вашингтонского университета, Сиэтл, Вашингтон
Автор, ответственный за переписку
Энн Л.Питерс, [email protected].
Финансирование
J.B.B. был поддержан Национальным центром развития трансляционных наук (NCATS) и Национальными институтами здравоохранения в рамках гранта № 1UL1-TR-001111. Авторы несут полную ответственность за содержание, которое не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Двойственность интересов
A.L.P. был исследователем, спикером и / или консультантом в Abbott Diabetes Care, Amgen, AstraZeneca, BD, Biodel, BMS, Boehringer Ingelheim, Janssen, Lexicon, Eli Lilly, Medtronic, Merck, Novo Nordisk, OptumRx, Sanofi, Takeda и Термалин.J.B.B. является исследователем и / или консультантом без какой-либо прямой финансовой выгоды по контрактам между его работодателем и следующими компаниями: Andromeda, Astellas, AstraZeneca, Boehringer Ingelheim, Bristol-Myers Squibb, Dance Pharmaceuticals, Elcelyx, Eli Lilly, GI Dynamics, GlaxoSmithKline, Halozyme , Hoffmann-La Roche, Intarcia Therapeutics, Johnson & Johnson, Lexicon, LipoScience, Medtronic, Merck, Metabolic Solutions Development Company, Metabolon, Metavention, Novartis, Novo Nordisk, Orexigen, Osiris, Pfizer, Rhythm, Sanofi, Takeda, Tolerex, Transtech Фарма, Веритас и Верва.J.B.B. является консультантом и получал опционы на акции от PhaseBio. И. Б. Х. получает гранты на исследования от Sanofi, Novo Nordisk и Halozyme и является консультантом Abbott Diabetes Care, Roche и Valeritas.


