если повышен креатинин в крови — 25 рекомендаций на Babyblog.ru
Девочки нашла тут статью, хочу поделиться. Если б в свое время я была бы более внимательной к таким вещами (не говорю о врачах) ЭТОГО можно было бы избежать Тромботические осложнения являются наиболее серьезными, потенциально смертельными осложнениями вспомогательных репродуктивных технологий. Частота использования искусственных репродуктивных технологий продолжает активно увеличивает, так в 2004 году в Европе эти методики были применены более чем у 250 000 женщин [1]. У женщин, включаемых в программы ЭКО, имеет место объективно более высокий риск венозных тромбоэмболических осложнений (ВТЭ). Это связано с их более старшим возрастом, высокой распространенность метаболического синдрома и сопутствующей патологии. Нельзя также не учитывать четкую взаимосвязь между бесплодием и тромбофилическими состояниями, как генетически обусловленными, так и приобретенными, включая антифосфолипидный синдром (АФС). Несмотря на то, что частота ВТЭ у этой группы пациенток согласно мировым данным невысока (0,08-0,11%) [2], учитывая тяжелые осложнения ВТЭ, в том числе и фатальные, а также повышенный риск ВТЭ у пациенток, включаемых в программы ЭКО, этот вопрос требует особого внимания.
Изменения гемостаза, связанные со стимуляцией овуляции
Стимуляция овуляция приводит к возникновению состояния гиперэстрогении. При этом, как и в случае применения оральных контрацептивов и препаратов заместительной гормональной терапии, в результате воздействия экзогенных эстрогенов формируется состояние гиперкоагуляции. Исследования, посвященные изучению влияния сверхфизиологических уровней эстрогенов на систему гемостаза, очень ограничены. Кроме того, интерпретация их результатов осложняется использованием различных протоколов стимуляции овуляции, а также тем, что в эти исследование было включено очень небольшое количество пациенток. В целом результаты этих исследований свидетельствуют о том, что уровни эстрадиола коррелируют с концентрацией фибриногена, уровнями D-димера и резистентностью к АРС [3]. Кроме того, стимуляция овуляции также ассоциируется с увеличением уровней некоторых факторов свертывания крови: фактора V, фибриногена, фактора Фон Виллебранда. Одновременно выявляется повышение маркеров активации система гемостаза - фрагментов протромбина F 1+2 и D-димера и нарушение функций эндогенной антикоагулянтной системы, что проявляется снижением уровней антитромбина и протеина S.Резистентность к АРС увеличивает при стимуляции овуляции и сохраняется на повышенном уровне при проведении поддержки лютеиновой фазы. Важно отметить, что нарушение функции естественных антикоагулянтов и развитие резистентности к АРС представляет особый риск у пациенток с мутацией FV Leiden и антифосфолипидным синдром, когда уже исходно имеющаяся резистентность к АРС определяется фоновое повышение риска тромбоэмболических осложнений.
В еще большей степени эти изменения гемостаза развиваются при синдроме гиперстимуляции яичников (СГЯ). СГЯ сопровождается повышением уровней фибриногена, D-димера, комплексов тромбин-антитромбин и F1+2, снижением уровня прекалликреина и тканевого фактора [4], причем эти изменения сохраняются в течение нескольких недель. Интересно, что повышенные уровни D-димера и комплексов тромбин-антитромбин ассоциируется с неудачами ЭКО [3]. Подобная взаимосвязь между избыточной активацией коагуляции и неудачными результатами ЭКО еще раз подтверждает важность механизмов гемостаза в процессе имплантации. В отличие от нормальных циклов стимуляции овуляции, когда наблюдаются минимальные изменения гематокрита, при СГЯ имеет место выраженная гемоконцентрация, что многократно повышает риск ВТЭ.
Следует обратить внимание на то, что клиническая картина ВТЭ при стимуляции овуляции редко развивается до введения хорионического гонадотропина (ЧХГ). Это наблюдение поставило перед учеными вопрос о роли ЧХГ для активации системы гемостаза. Было показано, что после назначения ЧХГ происходит повышение уровней фибриногена, факторов II, V, VII, VIII и IX. Вслед за такой активацией прокоагулянтных механизмов с задержкой на 2 дня запускаются фибринолитические механизмы, пик активности которых достигает через 8 дней [4]. Кроме того, при использовании очищенного ФСГ мочевого происхождения, которые также содержат ЧХГ, наблюдается снижение уровней протеина С и антитромбина, в то время как для рекомбинантного ФСГ эти изменения не были статистически достоверными по сравнению с женщинами с нормальным менструальным циклом [5].Таким образом, гиперкоагуляция, связанная с гиперэстрогенией, имеющая место во время стимуляции овуляции, может усиливаться под действием ЧХГ, что имеет место и во время физиологической беременности.
В большинстве случаев для развития тромбоза требуется «синнергичный» эффект нескольких факторов риска (табл. 1).
Таблица 1.
Патогенез тромботических осложнений в условиях стимуляции овуляции и СГЯ
| Гемоконцентрация Сдавление тазовых вен Состояние гиперкоагуляции Тромбофилические состояния Личный или семейный анамнез тромботических осложнений Нарушение реактивности сосудов |
Риск тромбоэмболических осложнений при использовании вспомогательных репродуктивных технологий
Несмотря на описанные выше выраженные изменения гемостаза, которые возникают при использовании вспомогательных репродуктивных технологий, общая частота ВТЭ в абсолютных значениях остается не высокой. В целом риск ВТЭ у женщин, включенных в программы ЭКО, в 10 раз превышает риск ВТЭ у женщин репродуктивного возраста, который составляет 2-3 на 10 000 человек в год.

Артериальные тромбозы у пациенток, включенные в программы ЭКО, развиваются реже, чем венозные, и в более короткие сроки: в среднем через 10-14 дней после переноса эмбриона.
Роль тромбофилии в патогенезе тромботических осложнений программ вспомогательных репродуктивных технологий
Важно помнить о том, что тромбоэмболические осложнения могут развиваться и при отсутствии тяжелого СГЯ, сопровождающегося гемоконцентрацией. По данным Delvigne А. и соавт. (2004), у пациенток с тромбозами в 12% имел место СГЯ средней тяжести и примерно у такого же процента пациенток — СГЯ легкой степени [7]. Кроме того, тяжелые формы СГЯ выявляются у 0,56-6,5% женщин с СГЯ, тогда как тромботические осложнения развиваются у 1 из 128 женщин с СГЯ. Таким образом, для развития тромбозов значение могут иметь и другие фоновые факторы риска тромботических осложнений, в частности, наследственная и приобретенная тромбофилия. Наследственная тромбофилия была выявлена у 23% женщин с СГЯ, причем в 18% обнаружена мутация FVLeiden [8]. Dulitzkyи соавт. (2002) провели проспективную оценку маркеров тромбофилии, включая плазменные уровни антитромбина III, протеина S, протеина С, антифосфолипидных антител, мутацию FVLeiden и MTHFRC677T, у пациенток, госпитализированных в связи с тяжелым СГЯ.
Оценка факторов риска тромботических осложнений перед использованием вспомогательных репродуктивных технологий
Перед включением пациенток в программы вспомогательных репродуктивных технологий необходима индивидуальная оценка факторов риска, включая наличие тромбофилических состояний, отягощенного семейного и личного тромботического анамнеза, индекса массы тела, сопутствующих заболеваний, возраста (> 40 лет).
 У таких пациенток повышен риск неудач ЭКО, нарушений имплантации и тромбоэмболических осложнений. Наличие генетических форм тромбофилий, особенно их сочетание с антифосфолипидным синдромом, однонаправленность действия различных форм тромбофилии могут быть причиной клинически не диагностированных ранних преэмбрионических потерь. Антифосфолипидные антитела повышают экспрессию ингибитора активатора плазминогена 1 (PAI-1) и тканевого фактора, что усиливает протромботические механизмы и снижает активность фибринолиза, приводя к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта.
У таких пациенток повышен риск неудач ЭКО, нарушений имплантации и тромбоэмболических осложнений. Наличие генетических форм тромбофилий, особенно их сочетание с антифосфолипидным синдромом, однонаправленность действия различных форм тромбофилии могут быть причиной клинически не диагностированных ранних преэмбрионических потерь. Антифосфолипидные антитела повышают экспрессию ингибитора активатора плазминогена 1 (PAI-1) и тканевого фактора, что усиливает протромботические механизмы и снижает активность фибринолиза, приводя к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта.Если считать тромбофилию постоянно персистирующим фактором у женщин с генетической тромбофилией или АФС, то первые ее эффекты представляются как дефекты имплантации плодного яйца, недостаточная глубина инвазии трофобласта, неполноценная плацентация и, как следствие, эндотелиопатия. Предполагается возможная этиологическая роль АФА в генезе бесплодия и привычного выкидыша, препятствующих развитию цитотрофобласта в синцитиотрофобласт на ранних сроках беременности. С нашей точки зрения, новая эра в понимании этиологии и патогенеза бесплодия и неудач ЭКО (в том числе преэмбрионических потерь беременности — после ЭКО) началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера и АФС, а также с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушениях маточно-плацентарной перфузии. В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, тканевого фактора и снижение уровня активаторов плазминогена тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора — эндотелина 1. Эти физиологические механизмы регуляции гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлены на предотвращение образования геморрагии при дальнейшей инвазии трофобласта. Со своей стороны бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации.
С нашей точки зрения, новая эра в понимании этиологии и патогенеза бесплодия и неудач ЭКО (в том числе преэмбрионических потерь беременности — после ЭКО) началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера и АФС, а также с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушениях маточно-плацентарной перфузии. В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, тканевого фактора и снижение уровня активаторов плазминогена тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора — эндотелина 1. Эти физиологические механизмы регуляции гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлены на предотвращение образования геморрагии при дальнейшей инвазии трофобласта. Со своей стороны бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их излишний синтез в свою очередь регулируется хорионическим гонадотропином. В процессе «дозированного» разрушения матрикса под действием ферментов, выделяемых бластоцистой, клетки эндометрия, которые содержат определенное количество экстраваскулярного фибрина, не фагоцитируются, а как бы «отодвигаются» посредством «контактного ингибирования». Эта фаза процесса имплантации носит название «аваскулярной», или «гистиотрофной». Следует отметить, что это наиболее уязвимая фаза имплантации: часто такие факторы, как вирусы, токсины, антитела и пр., могут непосредственно влиять на полноценность имплантации. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1, гиперфибриногенемией и АФА. Так, согласно нашим данным, тромбофилия как сложный интегральный (с нашей точки зрения, и инициальный) фактор неудачи ЭКО была обнаружена у 90% пациенток с неудачами ЭКО в анамнезе [11]. Таким образом, подготовка к ЭКО женщин с бесплодием и тромбофилией требует особого похода.
Их излишний синтез в свою очередь регулируется хорионическим гонадотропином. В процессе «дозированного» разрушения матрикса под действием ферментов, выделяемых бластоцистой, клетки эндометрия, которые содержат определенное количество экстраваскулярного фибрина, не фагоцитируются, а как бы «отодвигаются» посредством «контактного ингибирования». Эта фаза процесса имплантации носит название «аваскулярной», или «гистиотрофной». Следует отметить, что это наиболее уязвимая фаза имплантации: часто такие факторы, как вирусы, токсины, антитела и пр., могут непосредственно влиять на полноценность имплантации. С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1, гиперфибриногенемией и АФА. Так, согласно нашим данным, тромбофилия как сложный интегральный (с нашей точки зрения, и инициальный) фактор неудачи ЭКО была обнаружена у 90% пациенток с неудачами ЭКО в анамнезе [11]. Таким образом, подготовка к ЭКО женщин с бесплодием и тромбофилией требует особого похода.
В большинстве случаев возникновение тромбозов связано с синдромом гиперстимуляции яичников (СГЯ), поэтому этому серьезному осложнению мы решили посвятить отдельный раздел.
Синдром гиперстимуляции яичников
СГЯ является жизнеугрожающим состоянием, симптомы которого колеблются от легкого недомогания до развития ОРДС, почечной недостаточности и тромбозов. При ЭКО СГЯ развивается у 1-10% женщин. Тромбоэмболические осложнения при СГЯ развивается в 0,04% случаев [12].
Факторами риска развития СГЯ являются молодой возраст пациентки, низкий вес, наличие синдрома поликистозных яичников. Считается, что у женщин молодого возраста плотность рецепторов гонадотропинов больше, следовательно, больше и чувствительность к ним. У пациентов к СГЯ с достоверно большей частотой выявляются атопии по сравнению с контрольной группы [13]. Возможно, нарушение иммунологических механизмов приводит к развитию гиперчувствительности и воспалительного ответа даже в ответ на неспецифические стимуляторы. Риск развития СГЯ во многом определяется видом программы ЭКО. Риск СГЯ больше при применении агонистов гонадолиберин-рилизинг гормона, чем при применении его антагонистов [14]. Еще меньше риск развития СГЯ при применении кломифена цитрата или менопаузального хорионического гонадотропина. Факторами риска СГЯ также является стремительное увеличение уровня эстрадиола в плазме крови (>2500 пг/мл), появление множества фолликулов среднего размера по данным ультразвукового исследования. Кроме того, если в результате ЭКО наступает беременность, начинается дополнительная выработка эндогенного ХГЧ, что увеличивает риск развития СГЯ. Факторы риска развития СГЯ суммированы в табл. 2.
Риск развития СГЯ во многом определяется видом программы ЭКО. Риск СГЯ больше при применении агонистов гонадолиберин-рилизинг гормона, чем при применении его антагонистов [14]. Еще меньше риск развития СГЯ при применении кломифена цитрата или менопаузального хорионического гонадотропина. Факторами риска СГЯ также является стремительное увеличение уровня эстрадиола в плазме крови (>2500 пг/мл), появление множества фолликулов среднего размера по данным ультразвукового исследования. Кроме того, если в результате ЭКО наступает беременность, начинается дополнительная выработка эндогенного ХГЧ, что увеличивает риск развития СГЯ. Факторы риска развития СГЯ суммированы в табл. 2.
Таблица 2.
Факторы риска развития СГЯ
| Характеристика пациентки: Молодой возраст (<30 лет) Низкая масса тела СГЯ в анамнезе Сидром поликистозных яичников Использование высоких доз гонадотропинов для стимуляции овуляции Применение ХГЧ, а не прогестерона для поддержки лютеиновой фазы Большое количество антральных в яичнике, по данным УЗИ, до начала стимуляции овуляции Быстрый рост концентрации эстрадиола (>2500 пг/мл) Большое число полученных ооцитов (>20) Наступление беременности |
Описаны семейные случаи СГЯ, в том числе и рецидивов этого синдрома и его развитие во время беременности у родственников. Это может свидетельствовать о наличии наследственных признаков, определяющих повышенный риск развития этого синдрома. Так, сообщается об обнаружении у пациенток с СГЯ полиморфизма рецепторов ФСГ, которые определяют повышенную чувствительность рецепторов к этому гормону [12].
Это может свидетельствовать о наличии наследственных признаков, определяющих повышенный риск развития этого синдрома. Так, сообщается об обнаружении у пациенток с СГЯ полиморфизма рецепторов ФСГ, которые определяют повышенную чувствительность рецепторов к этому гормону [12].
Патогенез СГЯ
Репродуктивные технологии включают применение антагонистов или агонистов гонадолиберин-рилизинг гормона для стимуляции яичников и человеческого хорионического гонадотропина (ХГЧ) для индукции овуляции. Стимуляция яичников может приводить к их избыточной активации и развитию СГЯ. Развитие этого синдрома связывают с применением экзогенного ХГЧ. Крайне редко СГЯ может возникать при самопроизвольной беременности (чаще в условиях, когда наблюдается повышенная продукция ХГЧ, например, при многоплодной беременности), а также при стимуляции овуляции кломифеном цитратом [8]. Основным характерным признаком, обнаруживающимся при СГЯ, является двустороннее увеличение яичников за счет множественных кист. При морфологическом исследовании в таких яичниках выявляются многочисленные желтые тела, фолликулярные кисты и выраженный отек овариальной стромы. Образование кист в яичниках при СГЯ предположительно связано с непосредственным влиянием стимуляции гонадотропинами, так как сходные изменения в яичниках наблюдаются и при других состояниях, сопровождающихся повышенными уровнями эндогенных гонадотропинов, например, при пузырном заносе, хорионкарциноме и многоплодной беременности.
При морфологическом исследовании в таких яичниках выявляются многочисленные желтые тела, фолликулярные кисты и выраженный отек овариальной стромы. Образование кист в яичниках при СГЯ предположительно связано с непосредственным влиянием стимуляции гонадотропинами, так как сходные изменения в яичниках наблюдаются и при других состояниях, сопровождающихся повышенными уровнями эндогенных гонадотропинов, например, при пузырном заносе, хорионкарциноме и многоплодной беременности.
Патогенез СГЯ пока еще мало изучен. Предполагается, что при СГЯ происходит выброс из яичника вазоактивных субстанций (цитокины, ангиотензин, эндотелиальный сосудистый фактор роста). Это приводит к повышению проницаемости сосудов и выходу белков и жидкости в интерстициальное пространство. В результате развивается асцит, гидроторакс, анасарка, гемоконцентрация и тромбоэмболические осложнения. При СГЯ происходит падение артериального давление, увеличение сердечного выброса, активация ренин-ангиотензин-альдостероновой и симпатоадреналовой системы.
Весьма интересна история развития представлений о патогенезе СГЯ. Впервые подтверждения того, что основным механизмом патогенеза СГЯ является повышение проницаемости капилляров, выло показано в экспериментах на кроликах с использованием внутривенного красителя [15]. При этом основным условием для перехода жидкости из внутрисосудистого пространства в брюшную полость было наличие яичников. СГЯ в экспериментах не удалось индуцировать ни у животных мужского пола, ни у мужчин. Эти эксперименты легли в основу концепции о том, что ключевым фактором для развития СГЯ является наличие яичников, которые секретируют вазоактивный медиатор. Кроме того, позднее при СГЯ был выявлен феномен активации ангиогенеза. В дальнейшем многочисленные эксперименты были направлены на то, чтобы установить этот медиатор, выделяемый яичниками и повышающий проницаемость сосудов. Исходно внимание ученых было обращено к изучению эстрогенов, прогестнинов и пролактина в качестве медиаторов СГЯ, однако прямое патогенетическое значение этих субстанций для развития СГЯ выявить не удалось. Так, развитие асцита у кроликов женского пола не было связано с высокими дозами эстрогенов и прогестерона [7]. Таким образом, повышенный уровень эстрадиола служит маркером ответа яичников на стимуляцию, но не является причиной для возникновения СГЯ.
Так, развитие асцита у кроликов женского пола не было связано с высокими дозами эстрогенов и прогестерона [7]. Таким образом, повышенный уровень эстрадиола служит маркером ответа яичников на стимуляцию, но не является причиной для возникновения СГЯ.
Доказанным фактом является то, что ренин-ангиотензин-альдостероновая система (РААС) принимает активное участие в механизмах развития СГЯ. С одной стороны, яичники секретируют некоторые компоненты РААС, с другой, на функционирование РААС оказывает непосредственное влияние ХГЧ, который напрямую ассоциирован с СГЯ. Также была подтверждена системная активация РААС в условиях гемодинамических сдвигов у пациенток с СГЯ. Однако остается неясным, могут ли компоненты РААС быть основным патогенетическим звеном СГЯ или эта система активируется вторично в качестве ответа организма на гиповолемию в условиях СГЯ,
Патофизиологические изменения, происходящие в условиях СГЯ, напоминают агрессивно развивающийся системный воспалительный ответ. Однако данные о роли цитокинов в патогенезе СГЯ весьма противоречивы. Эти низкомолекулярные протеины проявляют свою активность в крайне низких концентрациях и реализуют свои эффекты при помощи аутокринных, паракринных и эндокринных механизмов. На активность цитокинов оказывает влияние функциональный статус цитокиновых рецепторов, наличие ингибиторов цитокинов, растворимых рецепторов и связывающих белков. Тем не менее большинство исследований в этой области указывает на повышение уровней медиаторов ранней фазы воспаления (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-18, ИЛ-18, TNF-альфа и сосудистого эндотелиального фактора роста) и на одновременное снижение уровней иммуносупрессивных и противовоспалительных цитокинов (ИЛ-10) на ранних стадиях развития СГЯ. Существует гипотеза о врожденных дефектах иммунного ответа, обуславливающих повышенный риск СГЯ. Растворимая молекула адгезии клеток сосудов-1 (sVCAM-1) и растворимая молекула межклеточной адгезии-1 (sICAM-1), которые принадлежат к суперсемейству иммуноглобулинов и являются основными медиаторами адгезии лейкоцитов, их взаимодействий с сосудистой стенкой и экстравазации в процессе иммунных и воспалительных реакций, также могут участвовать в патогенезе СГЯ.
Эти низкомолекулярные протеины проявляют свою активность в крайне низких концентрациях и реализуют свои эффекты при помощи аутокринных, паракринных и эндокринных механизмов. На активность цитокинов оказывает влияние функциональный статус цитокиновых рецепторов, наличие ингибиторов цитокинов, растворимых рецепторов и связывающих белков. Тем не менее большинство исследований в этой области указывает на повышение уровней медиаторов ранней фазы воспаления (ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-18, ИЛ-18, TNF-альфа и сосудистого эндотелиального фактора роста) и на одновременное снижение уровней иммуносупрессивных и противовоспалительных цитокинов (ИЛ-10) на ранних стадиях развития СГЯ. Существует гипотеза о врожденных дефектах иммунного ответа, обуславливающих повышенный риск СГЯ. Растворимая молекула адгезии клеток сосудов-1 (sVCAM-1) и растворимая молекула межклеточной адгезии-1 (sICAM-1), которые принадлежат к суперсемейству иммуноглобулинов и являются основными медиаторами адгезии лейкоцитов, их взаимодействий с сосудистой стенкой и экстравазации в процессе иммунных и воспалительных реакций, также могут участвовать в патогенезе СГЯ.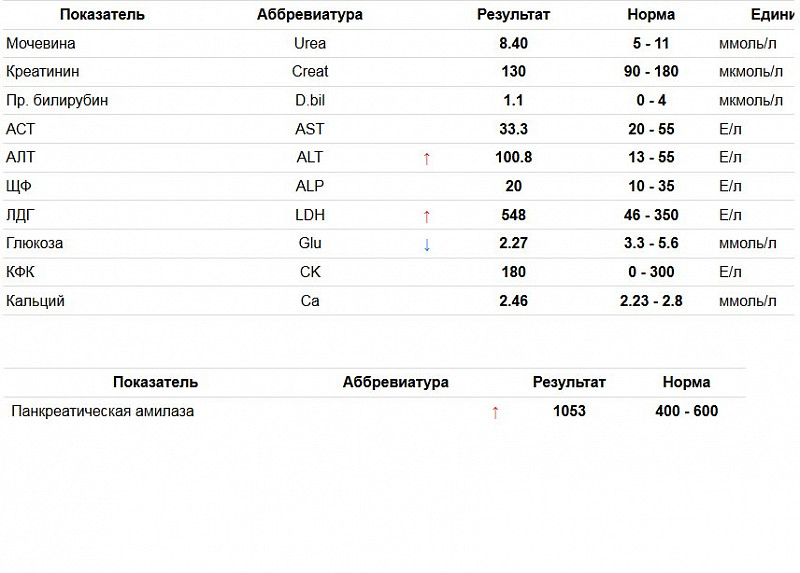 Это предположение было доказано в одном из исследований по типу случай-контроль по оценке уровней sICAM-1 и sVCAM-1 в перитонеальной жидкости и в плазме крови [16]. Еще в одном исследовании в сыворотке крови и в асцитической жидкости у пациенток с СГЯ были выявлены более высокие уровни sICAM-1 и более низкие уровни растворимого Е-селектина — еще одной молекулы, контролирующей эндотелиальную адгезию [16]. Конкретные механизмы участия этих медиаторов в патогенезе СГЯ еще предстоит установить, однако на данном этапе ясно, что они имеют значение для регуляции сосудистой проницаемости.
Это предположение было доказано в одном из исследований по типу случай-контроль по оценке уровней sICAM-1 и sVCAM-1 в перитонеальной жидкости и в плазме крови [16]. Еще в одном исследовании в сыворотке крови и в асцитической жидкости у пациенток с СГЯ были выявлены более высокие уровни sICAM-1 и более низкие уровни растворимого Е-селектина — еще одной молекулы, контролирующей эндотелиальную адгезию [16]. Конкретные механизмы участия этих медиаторов в патогенезе СГЯ еще предстоит установить, однако на данном этапе ясно, что они имеют значение для регуляции сосудистой проницаемости.
Повышение сосудистой проницаемости с последующим развитием асцита при СГЯ связано с субстанциями, накапливающимися в фолликулярной жидкости. Одним из важнейших таких факторов, принимающих участие в патогенезе СГЯ, предположительно является VEGF. Существует несколько доказательств этой гипотезы. Во-первых, уровни VEGF в фолликулярной жидкости превышают таковые в плазме крови. Во-вторых, во время овуляции регистрируется повышение концентрации VEGF в крови. Кроме того, введение ХГЧ стимулирует экспрессию мРНК VEGF лютеинизирующимися клетками гранулезы яичников [17], что объясняет, почему введение ХГЧ часто является критическим фактором для развития СГЯ. Повышенные уровни VEGFв плазме крови и перитонеальной жидкости были выявлены у пациенток с СГЯ по сравнению с контрольной группой [18]. Усиленная экспрессия мРНК VEGF была описана у пациенток с синдромом поликистозных яичников, для которых характерен повышенный риск развития СГЯ. Тем не менее конкретные патогенетические механизмы, посредством которых VEGF обуславливает развитие СГЯ, остаются не до конца известными.
Кроме того, введение ХГЧ стимулирует экспрессию мРНК VEGF лютеинизирующимися клетками гранулезы яичников [17], что объясняет, почему введение ХГЧ часто является критическим фактором для развития СГЯ. Повышенные уровни VEGFв плазме крови и перитонеальной жидкости были выявлены у пациенток с СГЯ по сравнению с контрольной группой [18]. Усиленная экспрессия мРНК VEGF была описана у пациенток с синдромом поликистозных яичников, для которых характерен повышенный риск развития СГЯ. Тем не менее конкретные патогенетические механизмы, посредством которых VEGF обуславливает развитие СГЯ, остаются не до конца известными.
Большой вклад в изучение роли VEGF в патогенезе СГЯ внес Rizk и соавт. (1997) [19]. VEGF представляет собой член семейства гепарин-связывающих протеинов, который непосредственно воздействуют на эндотелиальные клетки и индуцирует процессы пролиферации и ангиогенеза. VEGF кодируется общим геном с фактором сосудистой проницаемости (VPF), которые способствует экстравазации белков в сосудах злокачественных опухолей. В результате транскрипции этого гена при участии альтернативного сплайсинга получаются несколько изоформ VEGF. Семейство VEGF включает четыре разных димерных формы (A-D) и плацентарный фактор роста. Все члены семейства VEGF связываются с тремя рецепторами (VEGF-R 1-3), которые экспрессируются на эндотелиальных клетках. Было идентифицировано и клонировано два рецептора VEGF (VEGFR-1 и VEGFR-2), которые относятся к семейству тирозинкиназных рецепторов. VEGFR-1 экспрессируется на эндотелиальных клетках, клетках трофобласта, моноцитах и мезангиальных клетках в почках. VEGFR-2 также экспрессируется на гемопоэтических стволовых клетках и мегакариоцитах. Экспрессия VEGF стимулируется под действием гипоксии, а также цитокинами и простагландинами. Таким образом, цитокины и факторы роста, непосредственно не стимулирующие ангиогенез, могут модулировать процессы ангиогенеза путем влияния на экспрессию VEGF. Иными словами цитокины могут оказывать непрямой ангиогенный и антиангиогенный эффект. Продукцию VEGF стимулирует трансформирующий фактор роста бета, фактор роста фибробластов-4, фактор роста тромбоцитарного происхождения, инсулиноподобный фактор роста, интерлейкин-1бета и интерлейкин-6, тогда как тромбоспондин и интерлейкин-10 подавляют экспрессию VEGF.
В результате транскрипции этого гена при участии альтернативного сплайсинга получаются несколько изоформ VEGF. Семейство VEGF включает четыре разных димерных формы (A-D) и плацентарный фактор роста. Все члены семейства VEGF связываются с тремя рецепторами (VEGF-R 1-3), которые экспрессируются на эндотелиальных клетках. Было идентифицировано и клонировано два рецептора VEGF (VEGFR-1 и VEGFR-2), которые относятся к семейству тирозинкиназных рецепторов. VEGFR-1 экспрессируется на эндотелиальных клетках, клетках трофобласта, моноцитах и мезангиальных клетках в почках. VEGFR-2 также экспрессируется на гемопоэтических стволовых клетках и мегакариоцитах. Экспрессия VEGF стимулируется под действием гипоксии, а также цитокинами и простагландинами. Таким образом, цитокины и факторы роста, непосредственно не стимулирующие ангиогенез, могут модулировать процессы ангиогенеза путем влияния на экспрессию VEGF. Иными словами цитокины могут оказывать непрямой ангиогенный и антиангиогенный эффект. Продукцию VEGF стимулирует трансформирующий фактор роста бета, фактор роста фибробластов-4, фактор роста тромбоцитарного происхождения, инсулиноподобный фактор роста, интерлейкин-1бета и интерлейкин-6, тогда как тромбоспондин и интерлейкин-10 подавляют экспрессию VEGF. VEGF синтезируется и депонируется в гранулах Т-лимфоцитов, тучных клеток, нейтрофилов и мегакариоцитов. VEGF-А или собственно VEGF существует минимум в 5 изоформах, имеющих разную молекулярную массу. Главное, что отличает эти изоформы друг от друга, это способность к связыванию гепарина и гепарин-сульфата.
VEGF синтезируется и депонируется в гранулах Т-лимфоцитов, тучных клеток, нейтрофилов и мегакариоцитов. VEGF-А или собственно VEGF существует минимум в 5 изоформах, имеющих разную молекулярную массу. Главное, что отличает эти изоформы друг от друга, это способность к связыванию гепарина и гепарин-сульфата.
InvivoVEGF является мощным медиатором сосудистой проницаемости. Он также принимает непосредственное участие в инициации и поддержании ангиогенеза на различных этапах эмбриогенеза, а также в тканях взрослого организма, для которых характерны интенсивные процессы новообразования сосудов, например, в ткани эндометрия и лютеинизирующихся фолликулах. Помимо своей физиологической роли VEGF выполняет свои функции и в условиях патологии, являясь критически важным фактором ангиогенеза при становлении васкуляризации опухолей. Повышенные уровни VEGF также выявляются в перитонеальной жидкости в условиях эндометриоза. VEGF может играть важную роль в регуляции циклических процессов ангиогенеза в яичниках, а его способность повышать сосудистую проницаемость может служить важным фактором для обеспечения продукции секрета маточных труб и появления фолликулярной жидкости, а также жидкости в доброкачественных опухолях яичника, имеющих эпителиальную выстилку, которая содержит VEGF. GordonJD и соавт. (1996) показали, что VEGF в здоровых яичниках локализуется в слое тека-клеток, тогда как содержание этого белка в клетках гранулезы минимальное. VEGF не экспрессируется в атрезирующихся фолликулах и дегенерирующем желтом теле [20]. В то же время высокий уровень VEGF обнаруживается в хорошо васкуляризованном желтом теле. В постменопаузе в яичниках VEGF в норме не выявляется и обнаруживается только в инклюзионных эпителиальных кистах и серозных цистаденомах. На основании этих экспериментальных данных авторы сделали вывод о том, что в течение репродуктивного периода VEGF играет важную роль для процессов роста и поддержания функции фолликулов и желтых тел в яичнике, что осуществляется на уровне модуляции ангиогенеза.
GordonJD и соавт. (1996) показали, что VEGF в здоровых яичниках локализуется в слое тека-клеток, тогда как содержание этого белка в клетках гранулезы минимальное. VEGF не экспрессируется в атрезирующихся фолликулах и дегенерирующем желтом теле [20]. В то же время высокий уровень VEGF обнаруживается в хорошо васкуляризованном желтом теле. В постменопаузе в яичниках VEGF в норме не выявляется и обнаруживается только в инклюзионных эпителиальных кистах и серозных цистаденомах. На основании этих экспериментальных данных авторы сделали вывод о том, что в течение репродуктивного периода VEGF играет важную роль для процессов роста и поддержания функции фолликулов и желтых тел в яичнике, что осуществляется на уровне модуляции ангиогенеза.
Молекулярно-биологические исследования свидетельствуют о четкой взаимосвязи между VEGF и ХГЧ [19]. Было показано, что экспрессия мРНК VEGF у крыс и в яичниках приматов происходит преимущественно после пика ЛГ. Этот пик ЛГ также является ключевым фактором и для развития СГЯ. Кроме того, использование антагониста ГнРГ в лютеиновую фазу с целью подавления выброса ЛГ приводит к торможению экспрессии мРНК VEGF. Отсюда ясно, почему использование прогестерона для поддержки лютеиновой фазы снижает вероятность развития СГЯ по сравнению с ХГЧ. Экспрессия VEGF под влиянием ХГЧ в яичниках осуществляется в клетках гранулезы и зависит от его дозы. Активность VEGF нарастает в процессе роста граафова фолликула и достигает пика при формировании желтого тела [21]. Было показано, что именно повышенная суммарная продукция VEGF на уровне фолликулов обуславливает нарастание уровней VEGF в плазме крови, что ассоциируется с развитием СГЯ [22].
Кроме того, использование антагониста ГнРГ в лютеиновую фазу с целью подавления выброса ЛГ приводит к торможению экспрессии мРНК VEGF. Отсюда ясно, почему использование прогестерона для поддержки лютеиновой фазы снижает вероятность развития СГЯ по сравнению с ХГЧ. Экспрессия VEGF под влиянием ХГЧ в яичниках осуществляется в клетках гранулезы и зависит от его дозы. Активность VEGF нарастает в процессе роста граафова фолликула и достигает пика при формировании желтого тела [21]. Было показано, что именно повышенная суммарная продукция VEGF на уровне фолликулов обуславливает нарастание уровней VEGF в плазме крови, что ассоциируется с развитием СГЯ [22].
Фактор фон Виллебранда (vWF) считается маркером активации эндотелиальных клеток. Его концентрация повышается в условиях избыточной экспрессии VEGF эндотелиальными клетками. Было показано, что повышенные уровни vWF в день переноса эмбрионов коррелируют с тяжестью СГЯ, а повышение уровней vWF предшествует развитию тяжелого СГЯ [23]. Однако такого повышения уровней vWF не было зарегистрировано в фолликулярной жидкости, что указывает на то, что повышенные уровни vWF не могут быть яичникового происхождения. По всей видимости, источником vWF при СГЯ является эндотелий, а на выброс vWF оказывают вазоактивные медиаторы овариального происхождения. У пациенток с СГЯ по сравнению с женщинами с высоким ответом на стимуляцию было выявлено более выраженное повышение уровней vWF за день до забора ооцитов, причем повышенные уровни vWF сохранялись в условиях СГЯ в течение всей лютеиновой фазы, тога как у пациенток без СГЯ уровни vWF прогрессивно снижались после забора ооцитов [24]. Снижение уровней vWF при СГЯ сопровождает клиническое улучшение. Таким образом, в клинической практике повышенные уровни vWF можно рассматривать в качестве прогностических для развития СГЯ и в качестве дискриминаторного параметра. Однако vWF предположительно играет роль в генезе формирования патологического каскада реакций в условиях СГЯ в качестве вторичного медиатора, который выделяется эндотелиальными клетками в ответ на их стимуляцию фактором яичникового происхождения.
По всей видимости, источником vWF при СГЯ является эндотелий, а на выброс vWF оказывают вазоактивные медиаторы овариального происхождения. У пациенток с СГЯ по сравнению с женщинами с высоким ответом на стимуляцию было выявлено более выраженное повышение уровней vWF за день до забора ооцитов, причем повышенные уровни vWF сохранялись в условиях СГЯ в течение всей лютеиновой фазы, тога как у пациенток без СГЯ уровни vWF прогрессивно снижались после забора ооцитов [24]. Снижение уровней vWF при СГЯ сопровождает клиническое улучшение. Таким образом, в клинической практике повышенные уровни vWF можно рассматривать в качестве прогностических для развития СГЯ и в качестве дискриминаторного параметра. Однако vWF предположительно играет роль в генезе формирования патологического каскада реакций в условиях СГЯ в качестве вторичного медиатора, который выделяется эндотелиальными клетками в ответ на их стимуляцию фактором яичникового происхождения.
Вазоконстриктор эндотелин-1 является еще одном фактором, повышающим сосудистую проницаемость. При СГЯ его концентрация в фолликулярной жидкости в 100-300 раз превышает таковую в плазме крови. У пациенток с СГЯ выявляется повышение плазменных уровней эндотелина-1, однако его концентрации нарастают параллельно с содержанием в крови других нейрогуморальных вазоактивных факторов и коррелируют с тяжестью СГЯ [25], что может говорить о том, что повышение уровней эндотелин-1 является частью ответа организма, направленного на сохранение гомеостаза, а не инициирующим фактором в развитии СГЯ.
При СГЯ его концентрация в фолликулярной жидкости в 100-300 раз превышает таковую в плазме крови. У пациенток с СГЯ выявляется повышение плазменных уровней эндотелина-1, однако его концентрации нарастают параллельно с содержанием в крови других нейрогуморальных вазоактивных факторов и коррелируют с тяжестью СГЯ [25], что может говорить о том, что повышение уровней эндотелин-1 является частью ответа организма, направленного на сохранение гомеостаза, а не инициирующим фактором в развитии СГЯ.
Роль эндотелия в патогенезе СГЯ. Впервые роль эндотелия в патогенезе СГЯ была показана в элегантном исследовании Albert С. и соавт. (2002) [18]. В основу этой гипотезы легли более ранние наблюдения о более высоком уровне VEGF в плазме крови по сравнению с фолликулярной жидкостью у женщин из группы риска развития СГЯ [26]. Это свидетельствует о том, что другие клетки помимо фолликулярных могут быть источником и мишенями для VEGF. Для тестирования этой гипотезы Albert С. и соавт. создали invitro модель, в которой проверяли воздействие эстадиола и ХГЧ на человеческий микрососудистый эндотелий с целью оценки способности эндотелиальных клеток к экспрессии и секреции медиаторов, которые могут быть вовлечены в патогенез СГЯ [18]. В результате этих экспериментов было показано, что эндотелий является источником VEGF и ИЛ-6. Эти медиаторы могут реализовывать свое воздействие на паракринном и аутокринном уровне, индуцируя изменения в сосудах, связанные с СГЯ, Рецепторы к VEGF и ИЛ-6 были обнаружены в клетках желтого тела. Кроме того, была установлена роль этих рецепторов для повышения сосудистой проницаемости у человека [27]. Albert С. и соавт. в своем исследовании установили, что ХГЧ индуцирует экспрессию KDR в эндотелиальных клетках человека — наиболее функционального рецептора VEGF, который регулирует митогенез, ангиогенез и процессы перестройки цитоскелета [18]. Эта усиленная экспрессия рецептора KDR, по всей видимости, и является ключевой причиной для резкого увеличения проницаемости сосудов в условиях СГЯ. Схематично патогенетическая роль эндотелия в условиях СГЯ отображена на рис. 1. Непрерывность архитектоники цитоскелета в эндотелиальных клетках является важным фактором сохранения функций эндотелиального барьера.
В результате этих экспериментов было показано, что эндотелий является источником VEGF и ИЛ-6. Эти медиаторы могут реализовывать свое воздействие на паракринном и аутокринном уровне, индуцируя изменения в сосудах, связанные с СГЯ, Рецепторы к VEGF и ИЛ-6 были обнаружены в клетках желтого тела. Кроме того, была установлена роль этих рецепторов для повышения сосудистой проницаемости у человека [27]. Albert С. и соавт. в своем исследовании установили, что ХГЧ индуцирует экспрессию KDR в эндотелиальных клетках человека — наиболее функционального рецептора VEGF, который регулирует митогенез, ангиогенез и процессы перестройки цитоскелета [18]. Эта усиленная экспрессия рецептора KDR, по всей видимости, и является ключевой причиной для резкого увеличения проницаемости сосудов в условиях СГЯ. Схематично патогенетическая роль эндотелия в условиях СГЯ отображена на рис. 1. Непрерывность архитектоники цитоскелета в эндотелиальных клетках является важным фактором сохранения функций эндотелиального барьера. Проницаемость эндотелия для воды и солей зависит от формы и конфигурации эндотелиоцитов. Эта же группа ученых выявила нарушение регулярности эндотелиального слоя, перестройку активных филаментов и морфологические изменения в эндотелиоцитах под действием ХГЧ. В то же время сам по себе эстрадиол не способен индуцировать экспрессию рецепторов VEGF и не повышает сосудистую проницаемость. Таким образом, блокада VEGF или его рецептора с использованием, например, специфических антител, может быть привлекательной мишенью для разработки новых методов для профилактики и лечения СГЯ.
Проницаемость эндотелия для воды и солей зависит от формы и конфигурации эндотелиоцитов. Эта же группа ученых выявила нарушение регулярности эндотелиального слоя, перестройку активных филаментов и морфологические изменения в эндотелиоцитах под действием ХГЧ. В то же время сам по себе эстрадиол не способен индуцировать экспрессию рецепторов VEGF и не повышает сосудистую проницаемость. Таким образом, блокада VEGF или его рецептора с использованием, например, специфических антител, может быть привлекательной мишенью для разработки новых методов для профилактики и лечения СГЯ.
Рисунок 1.
Роль эндотелиальных клеток в патогенезе СГЯ
VEGF- сосудистый эндотелиальный фактор роста, KDR- рецептор VEGF, ИЛ-6 — интерлейкин-6, ХГЧ — хорионический гонадотропин человека
Таким образом, основную гипотезу развития СГЯ в настоящее время можно представить следующим образом (рис. 2). В условиях СГЯ происходит нарушение регуляции процесса овуляции, что сопровождается гиперпродукцией провоспалительных факторов в яичниках. В результате происходит вторичное увеличение проницаемости капилляров и переход воспалительных медиаторов в другие компартменты. При наиболее тяжелых формах СГЯ этот процесс сопровождается системными проявлениями.
В результате происходит вторичное увеличение проницаемости капилляров и переход воспалительных медиаторов в другие компартменты. При наиболее тяжелых формах СГЯ этот процесс сопровождается системными проявлениями.
Рисунок 2.
Патофизиология СГЯ
sVCAM-1 — растворимая молекула сосудистой адгезии-1, TNF- фактор некроза опухолей,VEGF- сосудистый эндотелиальный фактор роста,VEGFR-1 — рецептор сосудистого эндотелиального фактора роста, vWF- фактор фон Виллебранда
Классификация СГЯ была предложена RabauE. в 1967 году. Он выделял три клинических категории СГЯ (легкий, средней тяжести, тяжелый) и шесть степеней тяжести, выделенных на основании клинических и лабораторных признаков. В дальнейшем эта классификация была модифицирована MathurR и соавт. (2007) [28]:
Таблица 3.
Классификация СГЯ
| Легкий СГЯ | вздутие живота слабо выраженная боль в животе увеличение яичников до <8 см |
| СГЯ средней тяжести | умеренно выраженная боль в животе тошнота +/- рвота увеличение яичников до 8-12 см наличие признаков асцита по данным УЗИ |
| СГЯ тяжелой степени | клинически выраженный асцит (в ряде случаев плевральный выпот) олигурия гемоконцентрация (гематокрит >45%) гипопротеинемия увеличение яичников >12 см |
| Критический СГЯ | напряженный асцит или массивный плевральный выпот гемоконцентрация (гематокрит >55%) лейкоцитоз >25000 олигурия/анурия тромбоэмболические осложнения острый респираторный дистресс-синдром |
Критериями тяжести СГЯ является нарушение функции печени, гемоконцентрация, лейкоцитоз, почечная недостаточность, анасарка. Выделяют также жизнеугрожающий или критический СГЯ, который включает в себя увеличение размера яичников, развитие острого респираторного дистресс-синдрома, напряженного асцита, гидроторакса, анасарки, перикардиального выпота, тяжелой почечной недостаточности и тромбоэмболические осложнения. Критерии тяжести СГЯ суммированы в табл. 4.
Выделяют также жизнеугрожающий или критический СГЯ, который включает в себя увеличение размера яичников, развитие острого респираторного дистресс-синдрома, напряженного асцита, гидроторакса, анасарки, перикардиального выпота, тяжелой почечной недостаточности и тромбоэмболические осложнения. Критерии тяжести СГЯ суммированы в табл. 4.
Таблица 4.
Критерии тяжести СГЯ
| Тяжелый СГЯ | Жизнеугрожающий СГЯ |
| Увеличения размера яичников Асцит, гидроторакс, анасарка Гематокрит >45% Лейкоцитоз >15 000 Олигурия Креатинин до 1,6 мг/дл Скорость клубочковой фильтрации >50 мл/мин Дисфункция печени | Увеличения размера яичников Напряженный асцит, гидроторакс, анасарка Гематокрит >55% Лейкоцитоз >25 000 Креатинин >1,6 мг/мл Скорость клубочковой фильтрации <50 мл/мин Тромбоэмболические осложнения Острый респираторный дистресс-синдром |
СГЯ обычно развивается примерно через 20 дней (в период от 5 до 45 дней) после индукции овуляции [19]. Выделяют раннее начало синдрома — через 3-5 дней назначения овуляторных доз ХГЧ, и позднее начало СГЯ. Последнее бывает обусловлено нарастанием ХГЧ в условиях наступившей беременности и клинически является более тяжелой формой.
Выделяют раннее начало синдрома — через 3-5 дней назначения овуляторных доз ХГЧ, и позднее начало СГЯ. Последнее бывает обусловлено нарастанием ХГЧ в условиях наступившей беременности и клинически является более тяжелой формой.
Клинические проявления СГЯ
СГЯ является тяжелым осложнением стимуляции овуляции, которое может привести в том числе и к фатальному исходу. С момента внедрения гонадотропинов в клиническую практику для индукции овуляцию был зарегистрирован целый ряд смертельных случаев, косвенно или напрямую связанных с СГЯ. Впервые летальный случай был описан в 1951 году Gotzsche, который сообщил о фатальном артериальном тромбозе — тотальной окклюзии левой внутренней сонной артерии у 37-летней пациентки с бесплодием, получавшей терапию гонадотропином. В последующем были описаны и другие летальные случаи, связанные с СГЯ, когда причиной смерти была массивная тромбоэмболия и ишемический инсульт (Mozws, 1965, Cluroe 1995). Таким образом, тромбозы и эмболии можно рассматривать как наиболее тяжелые осложнения СГЯ, которые могут привести к летальному исходу, инвалидизации вследствие инсульта и ампутации конечностей.
Массивный переход жидкости в интерстициальное пространство характеризуется развитием асцита, гидроторакса, перикардиального выпота, электролитными нарушениями, олигурией, гемоконцентрацией, гиповолемическим шоком. Первым проявлением СГЯ обычно бывают дискомфорт в животе, тошнота, рвота, диарея. Развитие диареи и рвоты, возникновение одышки, одышки, асцита в течение первых 48 часов после назначения ХГЧ свидетельствуют о тяжелом течении заболевания. При физикальном обследовании обнаруживается прибавка массы тела, увеличение объема живота, симптомы гиповолемии. Через брюшную стенку пальпируются увеличенные яичники. Особое внимание следует уделить осмотру конечностей и шеи, чтобы не пропустить тромбоз.
Данные лабораторных исследований свидетельствуют об электролитных нарушениях (гиперкалиемия и гипонатриемия), гемоконцентрации, гипоальбуминемии, повышении уровня креатинина. Примерно у 30% пациенток выявляются нарушения функции печени (умеренная гиперферментемия). При СГЯ вследствие перехода плазмы крови в экстравазальное пространство происходит значительное снижение уровня IgG и IgA в плазме крови, что делает пациентов с СГЯ чувствительными к развитию инфекционных осложнений. При анализе асцитической жидкости выявляется высокая концентрация белка, низкое содержание лейкоцитов и высокий уровень эритроцитов. При ультразвуковом исследовании выявляются множественные фолликулярные кисты и асцит.
Причиной развития дыхательной недостаточности при СГЯ могут служить компрессия легких вследствие асцита, плеврита, перикардиального выпота, развития ОРДС, тромбоэмболии, отека легких, ателектаза, внутриальвеолярных кровоизлияний. В большинстве случаев плевральный выпот развивается с двух сторон и наблюдается одновременно с асцитом. Однако описаны случаи возникновения одностороннего плеврального выпота в качестве единственного симптома СГЯ. Односторонний выпот чаще развивается с правой стороны.
Интересно, что если при спонтанно наступившей беременности тромбозы затрагивают преимущественно (в 70% случаев) глубокие вены нижних конечной (илиофеморальный сегмент), то тромбозы, возникающие вследствие индукции овуляции, локализуются в основном в венах верхней части тела. Хотя увеличение размеров яичников при СГЯ, казалось бы, способствует стазу крови в тазовых венах и венах нижних конечностей. В большинстве случаев (60%) тромбозы, связанные с ЭКО, развиваются в яремной вене, подключичной, подмышечной венах, а также венах головного мозга. Последнее является наиболее тяжелым осложнением. Летальность при тромбозе церебральных вен достигает 5-30%, при этом более опасны тромбозы синусов головного мозга. Интересно, что исход тромбозов церебральных вен у беременных и в послеродовом периоде более благоприятный, чем при церебральных тромбозах, не связанных с беременностью. Полное выздоровление, по данным анализа OuY. и соавт. (2003), наблюдалось у 49% женщин с церебральными тромбозами и у 79% с тромбозами других локализаций [12]. В большинстве случаев развиваются венозные тромбозы, однако у 25% пациентов могут иметь место и артериальные тромбозы (в основном инсульты). В 75% тромбозы развиваются у пациенток с наступившей беременностью, у 66% выявляется СГЯ [12].
По данным KodamaH. и соавт. (1996), маркеры активации коагуляции и фибринолиза (ТАТ, РАР) остаются повышенными после индукции овуляции на протяжении 3-4 недель у женщин с наступившей беременностью [4]. Поэтому развитие тромбоэмболических осложнений возможно и после купирования симптомов СГЯ. В течение первых двух дней после стимуляции овуляции активируется коагуляционный каскад и лишь потом фибринолитическая система. Ранняя активация коагуляции, возможно, является причиной развития субклинических тромбозов. Вероятно, меньший диаметр церебральных сосудов объясняет более раннее развитие клинических проявлений при тромбозах данной локализации (в среднем через 10 дней после стимуляции овуляции). Множественные тромбозы мелких сосудов мозга могут протекать практически бессимптомно или проявляться в виде стертой неврологической симптоматики [29], кроме того, при аутопсии выявляются множественные тромбозы с вовлечением сосудов мозга различного диаметра [30].
Возникновение тромбозов связывают с повышением уровня эстрадиола в крови, гемоконцентрацией и гиповолемией. При повышении уровня эстрогенов возрастает содержание тромбоцитов, фибриногена, vWF и снижается уровень ATIII. Вследствие гемоконцентрации увеличивается вязкость крови и концентрации факторов коагуляции.
Тромбоэмболические осложнения при СГЯ чаще развиваются у пациенток с генетическими формами тромбофилии (дефицит протеинов С, S, ATIII) [12]. Поэтому расширенное исследование системы гемостаза с определением генетических форм тромбофилии и маркеров АФС у пациенток с СГЯ мы считаем обязательным.
Лечение СГЯ
Специфическое лечение СГЯ отсутствует, и терапия сводится в основном к симптоматической. Симптомы СГЯ обычно проходят самостоятельно с уменьшением уровня ХГЧ (в течение 7 дней у небеременных и в течение 10-20 дней у беременных пациенток). Пациенткам требуется полный покой и строгий постельный режим в течение 2-3 недель.
Ежедневно требуется контроль массы тела, диуреза. Рекомендуется выпивать в день более 1 литра жидкости, содержащей электролиты. При среднетяжелом и тяжелом СГЯ следует избегать проведения влагалищного обследования в связи с риском разрыва киста яичника и развития кровотечения. Требуется ежедневный контроль креатинина, электролитов, гематокрита, гемоглобина, клеточного состава крови, печеночных ферментов, коагулограммы, по возможности — бета-ХГЧ [37]. Желательно установить подключичный катетер, что связано с меньшим риском развития тромботических осложнений, чем наличие периферического катетера. При развитии дыхательной недостаточности при отсутствии плеврального выпота или при сомнительных результатах рентгенографии легких требуется исключение ТЭЛА (КТ, вентиляционно-перфузионная сцинтиграфия). Обязательным компонентом лечения является инфузионная терапия. Ее задачами является восстановление ОЦК, ликвидация гемоконцентрации, борьба с почечной недостаточностью. Предпочтительно вводить физиологический раствор и глюкозу. Восстановление электролитного баланса, повышение осмотического давления крови способствует переходу жидкости из внеклеточных пространств обратно в сосудистое русло. При выраженной гиповолемии, гемоконцентрации (гематокрит >45%), гипоальбуминемии (<3 г/дл) рекомендуется применение альбумина и/или свежезамороженной плазмы, которая позволяет также коррегировать показатели системы гемостаза. Важно отметить, что применение диуретиков в условиях гиповолемии и гемоконцентрации, а также их передозировка увеличивают риск развития тромбоэмболических осложнений.
При плевральном выпоте обычно проводится консервативное лечение. Плевральная функция показана при прогрессировании дыхательной недостаточности. Асцит также рекомендуется вести консервативно. Показаниями к парацентезу является напряженный асцит, почечная недостаточность, резистентная к консервативной терапии. Парацентез проводится трансабдоминально или трансвагинально под контролем УЗИ, что позволяет снизить риск повреждения увеличенных яичников. Восстановление функции почек после парацентеза связывают с восстановлением перфузии почек, венозного оттока, нормализацией сердечного выброса. У пациенток с тяжелым СГЯ нередко приходится выполнять парацентез 2-3 раза в неделю. Abuzeid М. и соавт. (2003) предложили применять у таких пациенток постоянный катетер по типу хвоста свиньи [31]. Также при тяжелом СГЯ было предложено наложение перитонеально-венозных шунтов, что позволяет возвращать перитонеальную жидкость в сосудистое русло. При этом удается восполнить потери иммуноглобулинов [12].
В связи с повышенным риском развития инфекционных осложнений у пациенток c СГЯ целесообразным является профилактическое назначение антибиотиков. Риск инфекционных осложнений можно снизить, применяя инвазивные процедуры (лапарацентез, плевральную пункцию) строго по показаниям. Следует отметить, что в 50% случае AbramovY. и соавт. (1998) не выявили возбудителей у пациенток с признаками развития сепсиса [32]. Это может быть связно с тем, что само течение СГЯ является проявлением синдрома системного воспалительного ответа, связанного с массивным выбросом цитокинов и играющего ведущую роль в развитии состояния гиперкоагуляции.
Обязательным является профилактическое назначение антикоагулянтов под контролем маркеров тромбофилии (D-димер) [38]. Препаратом первого выбора для лечения тромботических осложнений СГЯ является НМГ. НМГ должны назначаться всем пациенткам, находящимся на стационарном лечении по поводу СГЯ. При стойкой тяжелой неврологической симптоматике, тромбозе венозных синусов возможно проведение прицельного тромболизиса и тробэктомии. Целесообразно проводить скрининг на наличие генетических форм тромбофилии и АФС, особенно у женщин с тромботическими осложнениями, а также профилактическое применение НМГ у таких пациенток. Важно обеспечить адекватную инфузионную терапию для снижения гемоконцентрации.
По последним данные, учитывая патогенез СГЯ с развитием гиперкоагуляции, воспаления, ДВС-синдрома, возможным эффективным методом терапии может быть применение рекомбинантного активированного протеина С, который уже доказал свою эффективность при тяжелом сепсисе [33]. Однако эта гипотеза требует дальнейших подтверждений.
Сообщается также о новых подходах к лечению СГЯ, которые основаны пока преимущественно на данных экспериментальных исследований на животных. Для терапии СГЯ, в частности, предается применять индометацин, блокирующий синтез простагландинов, которые могут быть одним из патогенетических факторов развития СГЯ. Однако в ретроспективном исследовании BorensteinR. и соавт. (1989) преимуществ использования индометацина показано не было [34]. Более того, в настоящее время применение нестероидных противовоспалительных препаратов при СГЯ не рекомендуется, так как они могут оказывать неблагоприятное влияние на процессы имплантации и усугубить развивающиеся в условиях тяжелого СГЯ нарушения функции почек [35]. Одной из теорий патогенеза СГЯ является выброс гистамина и гистаминоподобных субстанций из яичника. Отчасти эту теорию подтверждает тот факт, что аллергии являются фактором риска развития СГЯ. В исследованиях на животных антигистаминные препараты были эффективными для предотвращения развития СГЯ [36], однако для подтверждения этих предположений требуются проспективные исследования с участием человека.
Резекция яичников при СГЯ категорически противопоказана. Хирургической вмешательство, предпочтительно лапароскопическое, необходимо только при разрыве кисты яичника, перекруте кисты, кровотечении. Перекрут кисты яичника следует заподозрить при появлении болей в нижнем отделе живота и обнаружении уплотненного болезненного образования при пальпации. Снижение гематокрита может быть связано с восстановлением ОЦК, однако прежде всего при этом следует исключать развитие кровотечения.
Редко при неэффективности консервативного лечения при тяжелом течении СГЯ для снижения уровня ХГЧ требуется прерывание беременности.
Профилактика СГЯ включаетвведение ХГЧ только при приемлемом уровне эстрадиола, применение прогестерона, а не ХГЧ в лютеиновую фазу. Кроме того, нами была разработана схема профилактики тромбоэмболических осложнений при подготовки и проведении программ вспомогательных репродуктивных технологий.
Рекомендации по профилактике тромбозов у пациенток, включенных в программы ЭКО
При планировании ЭКО к выбору профилактики венозных тромбоэмболических осложнений следует подходить индивидуально, взвешивая все факторы риска. Особое внимание необходимо уделить оценке состояния системы гемостаза, включая наследственные и приобретенные формы тромбофилии. Согласно международным рекомендациям (табл. 5) введение НМГ следует начинать с утра в день стимуляции овуляции гонадотропинами. Для сведения к минимуму геморрагических осложнений во время забора яйцеклетки в день процедуры НМГ вводить не следует; инъекции НМГ возобновляют на следующий день. В день переноса эмбриона с утра НМГ не вводится. Затем НМГ применяют в профилактических дозах вплоть до подтверждения беременности. В случае наступления беременности профилактическую антикоагулянтную терапию продолжают.
Таблица 5.
Рекомендации по профилактике тромбоэмболических осложнений у женщин, включенных в программы ЭКО
| Клиническая ситуация | Тактика ведения |
| Один эпизод ВТЭ в анамнезе, не связанный с беременностью или приемом оральных контрацептивов), возникший на фоне транзиторных факторов риска и при отсутствии дополнительных факторов риска, например, ожирения | Динамическое наблюдение или профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, фрагмин 5000 МЕ один раз в день) +/- компрессионное белье |
| Один идиопатический эпизод ВТЭ в анамнезе или один эпизод ВТЭ в анамнезе при наличии тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию, или один случай ВТЭ в анамнезе при наличии дополнительных факторов риска (например, ИМТ >35) | Профилактические дозы НМГ (эноксапарин 40 мг, фраксипарин 0,3 мл, далтепарин 5000 МЕ один раз в день) до стимуляции овуляции и в течение всей беременности +/- компрессионное белье. При дефиците антитромбина необходимо назначение более высоких доз НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) |
| Более одного эпизода ВТЭ в анамнезе при отсутствии данных о тромбофилии у пациенток, не получающих постоянную антикоагулянтную терапию | Профилактические дозы НМГ до стимуляции овуляции и в течение всей беременности + компрессионное белье |
| Один или более эпизодов ВТЭ в анамнезе у пациенток, получающих постоянную антикоагулянтную терапию (например, при наличии тромбофилии) | Переход с пероральных антикоагулянтов на НМГ (эноксапарин 0,5 1 мг/кг, далтепарин 50-100 МЕ/кг каждые 12 часов) до контролируемой стимуляции овуляции, продолжение применения НМГ в течение всей беременности + компрессионное белье |
| Подтвержденная тромбофилия при отсутствии ВТЭ в анамнезе | Динамическое наблюдение или профилактические дозы НМГ +/- компрессионное белье. Профилактику настоятельно рекомендуется проводить при наличии дефицита антитромбина III, кроме того, лечение в пользу активного ведения следует принять при наличии симптомных ВТЭ в семейном анамнезе и дополнительных факторов риска |
| Наличие факторов риска ВТЭ при отсутствии тромбофилии и ВТЭ в анамнезе | Необходимо проведение индивидуальной оценки риска. При наличии нескольких факторов риска, включая высокий ИМТ, гиподинамию, тяжелые формы гестоза в анамнезе решение следует склонить в пользу активной профилактики: профилактические дозы НМГ +/- компрессионное белье. При высоком ИМТ может потребоваться коррекция дозы НМГ |
| Синдром гиперстимуляции яичников | Профилактические дозы НМГ +/- компрессионное белье. При отсутствии наступления беременности антикоагулянтная терапия может быть закончена после разрешения симптомов. В случае наступления беременности применение НМГ следует продолжить минимум до конца первого триместра. А в дальнейшем в зависимости от показателей системы гемостаза и наличия дополнительных факторов риска ВТЭ |
| Развившаяся ВТЭ | Терапевтические дозы НМГ (например, 1 мг/кг эноксапарина или 90 МЕ/кг далтепарина каждые 12 часов). Антикоагулянтная терапия должна быть продолжена в течение не менее 6 недель после родов |
Нами разработана тактика подготовки к ЭКО и ведения беременности у пациенток с бесплодием и тромбофилией. При подготовке пациенток с бесплодием, с повторными неудачами ЭКО и тромбофилиями к программе ЭКО мы проводим дифференцированную противотромботическая профилактику в зависимости от причины тромбофилии и степени ее выраженности, а также гирудотерапию в течение 1,5 месяца до программы ЭКО. В качестве антитромботической терапии мы используем низкомолекулярный гепарин, начиная с фертильного цикла, а именно в процессе стимуляции овуляции. Терапия отменяется за сутки до планируемой пункции и через 12 ч. после подсадки эмбрионов возобновляется. Также параллельно мы назначаем минидозы аспирина 50-75 мг 1 раз в сутки, начиная с фертильного цикла в зависимости от агрегационной активности тромбоцитов. Всем женщинам назначаются витамины, полиненасыщенную жирную кислоту (омега-3) и антиоксиданты. В случае обнаружения MTHFR C667T обязательно дополнительно назначение фолиевой кислоту (4 мг/сут), а также витамины группы В. Низкомолекулярные гепарина мы применяем на протяжении всей беременности, за сутки до родов (кесарево сечение) препарат отменяется, через 8 ч. терапия возобновляется до 10-го дня послеродового/послеоперационного периода. Контролем эффективности противотромботической терапии служат маркеры тромбинемии и фибринообразования (ТАТ, F1+2, D-димер). Начало программы ЭКО у пациенток с тромбофилией, как наследственной, так и приобретенной, в условиях выраженной активации системы гемостаза и/или повышенных уровней антифосфолипидных антител мы считает противопоказанным до проведения адекватной подготовки к беременности с применением антикоагулянтной терапии и нормализации или улучшения показателей системы гемостаза.
Биохимический анализ крови на креатинин
Общая характеристика
Является конечным продуктом распада креатина, который играет важную роль в энергетическом обмене мышечной и других тканей. Концентрация креатинина в крови зависит от его образования и выведения. Его образование непосредственно зависит от состояния мышечной массы. Креатинин удаляется почками посредством клубочковой фильтрации, но, в отличие от мочевины, не реабсорбируется. Так как на уровень креатинина влияют пол, раса, масса тела, характер питания, наличие воспалительных заболеваний и возраст пациента, а также с учетом того, что его уровень в плазме крови может оставаться в пределах нормы даже при снижении скорости клубочковой фильтрации на 50 %, рекомендуется определять скорость клубочковой фильтрации по уровню цистатина С (метод имеет значительно большую чувствительность по сравнению с контролем уровня креатинина).
Показания для назначения
1. Оценка выделительной функции почек.
2. Диагностика заболеваний почек и мышечной системы.
Маркер
Маркер нарушений выделительной функции почек.
Клиническая значимость
1. Диагностика и мониторинг лечения острых и хронических заболеваний почек.
2. Мониторинг реципиентов почечного трансплантата.
Состав показателей:
Креатинин
Метод: КолориметрическийДиапазон измерений: 0-0
Единица измерения: Микромоль на литр
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
сыворотка ВК
Условия доставки:
24 час. при температуре от 2 до 25 градусов Цельсия
Контейнер:
Вакутейнер с разделительным гелем
Объем:
3.5 Миллилитров
капиллярная кровь
Условия доставки:
24 час. при температуре от 2 до 25 градусов Цельсия
Контейнер:
Микровет с активатором свертывания крови
Объем:
0.5 Миллилитров
Правила подготовки пациента
Стандартные условия подготовки (если иное не определено врачом): За 8 часов Выдержать голодание, исключить жирную пищу. Можно пить воду.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Нефротоксические препараты.
- Глюкокортикоиды
Интерпретация:
- Показатель обильной мясной диеты (если повышен в крови и в моче), почечной недостаточности (если повышен только в крови). Обезвоживание организма, поражение мышц, физическая нагрузка.
- Снижение мышечной массы, беременность (І и ІІ триместр), недостаток белка в рационе, тяжелые заболевания печени.
возможные причины. Что делать? Химический анализ крови кота: расшифровка
Креатинином называют конечный продукт креатинин-фосфатной реакции. Образуется это вещество в мышцах, а затем выделяется в кровь. Определив его уровень в крови домашнего питомца, можно продиагностировать несколько его патологических состояний. Повышенный креатинин у кота свидетельствует прежде всего о нарушении работы выделительной системы.
Нормы содержания
Формируется это вещество в организме животного из белка креатина, являющегося источником энергии и питания для скелетных мышц. Нормальный уровень его содержания в крови может колебаться в зависимости от веса кота и скорости обменных процессов, происходящих в его организме. У молодых и подвижных животных этот показатель обычно бывает более высоким, чем и у старых.
Норма креатинина в крови домашних кошек составляет 40-130 мкмоль/литр. Зависеть этот показатель, помимо всего прочего, может от пола животного и развитости его мышечной массы.
В каких случаях повышается уровень
Чаще всего наличие слишком большого количества этот вещества в крови животного свидетельствует о почечной недостаточности или нефропатии. Креатинин-фосфатная реакция возникает при сокращении мышц кота. При этом соединение распадается на три составляющих:
- воду;
- креатинин;
- фосфор.
Все три компонента в последующем выводятся из организма животного с мочой. Если почки работают плохо, креатинин задерживается в организме кошки. Постепенно он начинает накапливаться в крови животного.
Диагностировать почечную недостаточность только по такому признаку, как повышенный креатинин, у кота, однако, нельзя. При подозрении на такую патологию ветеринар проводит дополнительные лабораторные исследования. При этом специалист определяет уровень содержания мочевины и азота мочевины в крови. При наличии почечной недостаточности эти показатели также будут зашкаливать.
Иногда причиной повышенного креатинина в крови у кота являются также и какие-либо проблемы с печенью. Помимо этого такая патология у животного может возникнуть и при обезвоживании организма. В данном случае у кота дополнительно повышается плотность мочи.
Собственно, сам креатинин токсичным веществом не является. Плохо себя животное при его повышенном содержании чувствует именно из-за проблем с внутренними органами.
Диагностика заболеваний: что следует учитывать?
Причины повышенного креатинина в крови у котов могут быть разными. Но на уровень содержания этого вещества в организме у животного могут повлиять в том числе и следующие факторы:
- ожирение;
- сильный дефицит энергетических веществ в организме;
- диета с низким содержанием калорийных продуктов;
- отклонения в массе для данной конкретной породы;
- крайние отметки возраста животного.
Выполняя диагностику состояния здоровья кота и определяя уровень креатинина, все эти факторы обязательно следует учитывать.
Симптоматика
При повышении уровня креатинина в крови до 200 мкмоль/литр поведение животного, скорее всего, никак не изменится. Ухудшаться состояние кота начнет после того, как этот показатель достигнет 300 мкмоль/литр. При повышенном креатинине у кота могут в этом случае наблюдаться следующие симптомы:
- вялость и слабость;
- понос и рвота;
- бледность слизистых;
- прекращение мочеиспусканий или сокращение объема выделяемой мочи;
- снижение аппетита.
Изо рта у кота с повышенным содержанием креатинина обычно неприятно пахнет мочой.
Определяться уровень этого вещества в крови животных может и не только в мкмоль/литр. Иногда случается, к примеру, так, что владельцы интересуются, есть ли шансы у кота при креатинине до 1500 мг/дл. Такой уровень соответствует 250-300 мкмоль/литр. Поскольку креатинин не слишком точный индикатор, говорить о развитии ПН в данном случае еще преждевременно. Кровь кота предварительно стоит проверить на содержание мочевины. Возможно, такой показатель связан с обезвоживанием или же патологией печени.
Прогноз при креатинине у кота в 1200 мг/дл также может быть не слишком уж плохим. Такой уровень свидетельствует об относительно незначительном повышении этого вещества в организме. Но провести диагностику почечной недостаточности обязательно следует и в этом случае.
О чем нужно знать
Иногда уровень креатинина в крови кошки остается в норме. Но такое заболевание, как почечная недостаточность, у животного все же развивается. Случается так обычно тогда, когда кот, к примеру, подобранный на улице, слишком истощен. При недостаточном кормлении у животных может резко снижаться объем мышечной массы. В результате падает и содержание в крови креатинина. При почечной недостаточности у такого животного показатели количества этого вещества будут приближены к нормальным. Но на самом деле содержание креатинина для такого состояния животного может в данном случае считаться повышенным.
Как берут анализы
Определять количество содержания креатинина ветеринары могут путем исследования как цельной крови, так и плазмы либо сыворотки. Выбор способа анализа зависит в первую очередь от того, какое лабораторное оборудование имеется в клинике.
Забор крови для определения уровня содержания креатинина может производиться в любое время суток. Плохое самочувствие кота препятствием к этой процедуре также обычно не является.
Недостатки диагностики
В норме креатинин у кота в крови должен быть равен, таким образом, 40-130 ммоль/литр. Но к сожалению, этот показатель у таких домашних питомцев может колебаться на самом деле в очень больших пределах. Помимо веса и активности питомца на него может влиять характер питания, породные особенности и пр. Кроме того, и собственно сама чувствительность креатинина как индикатора состояния выделительной системы считается не слишком высокой. Даже при снижении фильтрации почек из-за патологии на 50 % уровень этого вещества в крови может оставаться практически нормальным.
Показатели мочевины
Как уже упоминалось, при при повышенном креатинине у кота и подозрении на почечную недостаточность врачи часто проводят дополнительные лабораторные исследования. Уровень мочевины для кошек считается нормальным в 6-12 ммоль/литр. При повышенном ее содержании у животного будут наблюдаться, помимо всего прочего, следующие симптомы:
- вялость и слабость;
- шаткость походки;
- аммиачный запах изо рта;
- язвы во рту;
- потеря веса;
- отказ от корма.
Что делать при повышенном содержании
Определяют уровень креатинина в крови кошек, конечно же, только в условиях ветклиники. В соответствии с полученными результатами врач дает владельцу животного все нужные рекомендации и в случае необходимости назначает дополнительные анализы. Сделать исследования на процент содержания мочевины в крови при высоком креатинине у кота стоит обязательно. Почечная недостаточность — очень серьезная болезнь. И оставлять животное без врачебной помощи при наличии такой патологии, конечно же, не стоит.
Анализ крови кота: расшифровка
На уровень креатинина в крови кошки ветеринары исследования обычно проводят в случае именно подозрения на болезни почек. Если же причина недомогания животного пока неясна, в клинике выполняется комплексный анализ. Расшифровка его обычно выглядит следующим образом:
- НСТ — гематокрит. Переизбыток этого вещества может сигнализировать об обезвоживании организма животного или, к примеру, развитии у него сахарного диабета. Норма этого вещества в крови кошки — 24-26 %;
- HGB — гемоглобин. Повышенный уровень указывает на обезвоживание, пониженный — на анемию, поражение органов кроветворения, голодание. Нормальный уровень гемоглобина в крови кошки — 80-150 %.
- WBC — лейкоциты. Повышение показаний может свидетельствовать о лейкемии, воспалении, онкологии, понижение — о вирусном заболевании, болезни костного мозга, радиоактивном поражении. Нормальный уровень лейкоцитов для кошек — 5,5-18,0×109/л.
- RGB — эритроциты. Повышенный уровень может говорить об обезвоживании, нехватке кислорода и в некоторых случаях заболеваниях почек и печени. Пониженное содержание свидетельствует о кровопотере, анемии, воспалении. Нормальный уровень — 5,3-10×1012/л.
- СОЭ — скорость оседания эритроцитов. Повышение уровня может свидетельствовать о болезни печени и почек, инфаркте, онкологии, отравлении, шоке. Пониженной СОЭ не бывает. В норме этот показатель составляет 0-13 мм/ч.
Также при выполнении лабораторных анализов кровь животного может проверяться, к примеру, на такие показатели, как эозинофилы, нейрофилы, моноциты, тромбоциты, лимфоциты и пр. Плохие анализы крови у кота — это, конечно же, повод провести диагностику заболевания и назначить соответствующее лечение.
Как понизить уровень креатинина в крови
Приводят этот показатель в норму обычно с помощью лекарственных препаратов. К примеру, ветеринар может назначить при высоком креатинине у кота лечение с использованием средства «Хофитол». Препарат это человеческий, и продается он в обычных аптеках. Чаще всего эти таблетки дают животным 2 раза в день по половинке. Но выписывать лекарство и выбирать дозировку должен, конечно же, исключительно ветеринар.
При хронической почечной недостаточности лечение животного может производиться только симптоматическое. Ответом на вопрос о том, как понизить креатинин у кота, служат разного рода лекарственные препараты. Выписываются ветеринаром они обычно в комплексе с другими средствами, позволяющими улучшить состояние домашнего питомца и продлить его жизнь.
Причины почечной недостаточности
Собственно, сама ПН болезнью по сути не является. Почечная недостаточность — это в первую очередь синдром нарушения функциональности выделительной системы. Привести к возникновению такой проблемы могут:
- отравления и интоксикации;
- васкулиты, пиелонефриты в области почек;
- стеноз почечных сосудов;
- сахарный диабет у старых котов.
К почечной недостаточности у животных может быть в том числе и наследственная предрасположенность. При покупке дорогой кошки ее родословной поэтому поинтересоваться стоит обязательно.
Последствия почечной недостаточности
Лечить эту патологию следует обязательно, причем незамедлительно. Почечная недостаточность — болезнь очень коварная. Сам креатинин — вещество безопасное. Но токсичные азотистые основания, содержание которых также повышается при ПН в крови у кошек, разрушают витамины и многие другие полезные вещества. У животного с почечной недостаточностью происходит серьезное нарушение водно-солевого баланса и кислотно-основного состояния.
В случае сильного поражения страдает эндокринная функция надпочечников домашнего питомца. В организме кошки прекращается синтез глюкокортикоидов. Это со временем приводит к гипоклемии и снижению чувствительности к инсулину, что, в свою очередь, может стать причиной развития сахарного диабета.
Симптомы почечной недостаточности
Итак, у кота повышен креатинин. Что это значит, мы выяснили. Конечно же, такие анализы обычно становится причиной беспокойства владельца по поводу состояния почек животного. Диагностировать недостаточность может только ветеринар. Но хозяину животного при повышенных показаниях креатинина, разумеется, нужно и самому понаблюдать за своим питомцем. Симптомами почечной недостаточности в частности являются:
- постоянная неутолимая жажда;
- повышение количества мочеиспусканий;
- осветление мочи;
- периодические отказы от приема пищи.
Иногда у животного с ПН может быть тошнота и рвота. Сам по себе этот признак о каком-либо заболевании не говорит. Кошки специально едят траву и разные несъедобные вещи для очистки желудка. Но в комплексе с другими симптомами этот признак также может свидетельствовать о наличии ПН.
На поздних стадия симптомами недостаточности могут быть:
- неспособность кошки глотать пищу;
- анорексия и дистрофия;
- поражение нервной системы из-за токсинов;
- появление белка и крови в моче животного;
- зуд.
Очень часто у котов с почечной недостаточностью на поздних стадиях сильно повышается давление. А это, в свою очередь, может привести к слепоте из-за разрыва сосудов в глазном яблоке.
Лечение острой недостаточности
В данном случае терапия обычно направлена на коррекцию электролитного баланса и кислотно-щелочных нарушений. Чаще всего причиной ОПН становится отравление животного. Конечно же, в этом случае принимаются меры по выведению токсинов из организма домашнего питомца.
Достаточно часто при ОПН ветеринары проводят котам такую процедуру, как диализ. В этом случае брюшная полость животного разрезается и в нее вставляется трубка с особой жидкостью. За время нахождения в организме кота в этот раствор переходят токсины из его организма. Такая процедура назначается только животным с серьезными нарушениями электролитного баланса в организме.
Как лечить хроническую недостаточность
Острую форму ПН попытаться вылечить еще как-то можно. Но чаще всего у котов встречается все же хроническая почечная недостаточность. К сожалению, болезнь это неизлечимая. Давать животному с такой патологией специальные корма и лекарственные препараты, скорее всего, придется до конца жизни. Определенных схем лечения такого заболевания нет. Подход к каждому животному должен быть в данном случае индивидуальным.
Лечение при наличии ХПН животных проводится симптоматическое. При анемии коту, к примеру, может вводиться «Эритропоэтин», при ацидозе используется гидрокарбонат натрия и т. д. При интоксикациях лекарства домашним питомцам вводятся обычно через капельницу.
Если креатинин в крови у кота повышен и у него диагностирована ПН, владельцу обязательно придется держать питомца на специальной диете, назначенной его любимцу ветеринаром. Обычно при почечной недостаточности врачи рекомендуют хозяину четвероногого питомца покупать для него готовые профессиональные корма, специально предназначенные для животных с таким заболеванием.
Вылечить ХПН практически невозможно. Но хозяину такого кота вполне по силам облегчить его страдания и повысить качество его жизни путем снятия тяжелых симптомов. Отчаиваться и опускать руки при таком диагнозе в любом случае не стоит. Нужно лишь в точности выполнять рекомендации ветеринара, и тогда животное будет радовать владельцев своим присутствием еще долгие годы.
Креатинин крови — описание, показания к анализу, норма
Креатинин (в крови)Креатинин крови – это один из конечных продуктов обмена белка в организме. Его предшественник – креатин – отвечает за обеспечение энергией мышечных клеток.
Образуется креатин в печени, затем током крови переносится к мышцам. В мышечной ткани к нему присоединяется остаток фосфорной кислоты. Полученное соединение — креатининфосфат — переносит энергию в клетках.
При отщеплении фосфатной группы от креатининфосфата в мышечной ткани образуется креатинин. Он выделяется в общий кровоток с определённой постоянной скоростью, поэтому и концентрация его в крови является величиной постоянной.
В почках креатинин свободно фильтруется из крови и выделяется из организма с мочой. Если его содержание в крови повышается, это указывает на нарушение работы почек, которые своевременно не выводят креатинин из организма. На начальных стадиях заболеваний почек уровень креатинина значительно не повышается, поэтому обычно врач назначает одновременно анализ на креатинин и мочевину.
Уровень креатинина в крови отличается у людей разного возраста, пола и веса. Низкий уровень креатинина характерен для людей с малой мышечной массой, для пожилых, для пациентов после ампутации конечностей. Следует помнить, что нормальное значение креатинина в анализе крови не исключает полностью патологию почек.
Кому определяют креатинин в крови
Подозрение на заболевания почек.
Болезни скелетной мускулатуры.
Плановое обследование перед оперативным вмешательством.
Подготовка к исследованию
Кровь на исследование сдают утром натощак, исключается даже чай или кофе. Допустимо пить обычную воду.
Накануне вечером ограничить жирную пищу, не употреблять спиртные напитки, нежелательны физические нагрузки.
Сдавать кровь нужно до приёма утренней дозы лекарственных препаратов.
Материал для исследования
Материал для исследования – сыворотка крови. Лаборант выполняет забор крови из вены, её сдают утором натощак. Если сдать кровь на креатинин во второй половине дня, показатель будет выше утреннего. Причина – физическая активность, сопровождающаяся выделением креатитина из мышц и присутствие белковой пищи в рационе питания.
Интерпретация результатов
Норма: показатель зависит от пола и возраста.
Дети:
- до 1 месяца — 12 – 50 мкмоль/л,
- 2 – 12 месяцев — 20 – 60 мкмоль/л,
- 1 – 14 лет — 27 – 62 мкмоль/л,
Взрослые:
- Женщины — 53 – 96 мкмоль/л,
- Мужчины (до 50 лет)- 62 – 115 мкмоль/л,
- Мужчины (> 50 лет) — 62 – 124 мкмоль/л.
Повышение уровня креатинина в крови:
1. Острая почечная недостаточность: почки внезапно перестают выполнять свои основные функции. В норме креатинин и мочевина, как конечные продукты обмена азота, выделяются с мочой. При ОПН они накапливаются в крови и не выводятся из организма. Одновременно нарушается обмен электролитов (калия, хлора и натрия) и воды. Количество вырабатываемой почками мочи резко снижается. ОПН развивается при острых воспалительных болезнях почек, при отравлении токсическими веществами (мышьяком, ртутью), при нарушении проходимости мочевыводящих путей.
Критерии ОПН по уровню креатинина:
- уровень в крови 200 — 500 мкмоль/л,
- повышение уровня креатинина в 2 раза по сравнению с исходным показателем.
2. Хроническая почечная недостаточность – постепенно развивающееся нарушение работы почек. Носит необратимый характер, обусловлено гибелью нефронов – основных элементов почек. К ХПН приводят амилоидоз, гломерулонефрит, пиелонефрит.
3. Акромегалия – нейроэндокринное заболевание, избыточный рост конечностей у взрослых (утолщение и расширение).
4. Гигантизм – нейроэндокринное заболевание у детей и подростков, для которого характерен чрезмерный пропорциональный рост туловища и конечностей. При этом кости растут не только в толщину, но и в длину.
5. Миозиты, дерматомиозиты.
6. Прием нефротоксических веществ (соединения ртути, барбитураты, циметидин, антибиотики — аминогликозиды, тетрациклины).
7. Обширные оперативные вмешательства.
8. Гипертиреоз.
9. Лучевая болезнь.
10. Чрезмерная физическая нагрузка.
11. Преобладание белковой пищи в рационе питания.
Снижение уровня креатинина в крови:
1. Первый и второй триместр беременности.
2. Голодание.
3. Вегетарианская диета.
4. Приём гормональных препаратов.
Инфекционист объяснил, какие анализы нужно сдать переболевшим COVID-19
Примерно у трети пациентов COVID-19 (а у болевших в тяжелой форме намного чаще) заболевание может иметь долгосрочные последствия. Причем осложнения бывают даже у тех, кто перенес инфекцию легко или в бессимптомной форме. Какие исследования нужно сделать и в какие сроки, рассказал врач-инфекционист, главный врач клинико-диагностической лаборатории «Инвитро-Сибирь» Андрей Поздняков.
«Есть общие рекомендации, которые не привязаны к тяжести состояния. Это связано с тем, что проблемы поражения печени, почек или склонность к тромбозу после COVID-19 могут быть и у тех, кто переболел в легкой форме, — пояснил Поздняков. — После перенесенного заболевания симптоматика может быть самой разнообразной, поскольку одна из главных мишеней вируса — клетки эндотелия (внутренняя выстилка сосудов). Повреждение внутренней сосудистой оболочки ведет к усилению тромбообразования. Поскольку сосуды есть во всех органах, то тромбы могут образоваться где угодно, то есть в любом органе могут возникнуть сосудистые нарушения и появиться симптоматика. У многих пациентов одновременно может встречаться более десяти симптомов поражения».
Когда лучше сдавать анализы?
Обследоваться нужно тогда, когда прошло более четырех-шести недель с момента заболевания (появления симптомов COVID-19), но при этом нет улучшения состояния. Потребуется обследоваться и в том случае, если возник рецидив и состояние ухудшилось, или появились новые симптомы.
Какие анализы нужно сдать?
Главный принцип: все исследования нужно проходить под контролем врача. Базовый набор тестов включает общий анализ крови (ОАК), общий анализ мочи (ОАМ), биохимию крови — С-реактивный белок (СРБ), АлТ, АсТ, ГГТ, мочевину, креатинин, а также тест, по которому судят о риске тромбообразования — Д-димер.
Общий анализ крови (ОАК) помогает оценить наличие воспалительной реакции либо, наоборот, угнетение лейкоцитарного ростка (высокое или низкое значение лейкоцитов, оценка лейкоцитарной формулы), показатели «красной» крови (анемия либо, наоборот, сгущение крови), количество тромбоцитов.
Общий анализ мочи (ОАМ) помогает оценить наличие/отсутствие воспалительных изменений в мочевой системе, показатели фильтрации, маркеры различной почечной и внепочечной патологии.
С-реактивный белок (СРБ) — маркер воспаления. Он часто повышен у пациентов с COVID-19, особенно со среднетяжелыми и тяжелыми формами заболевания. Длительное сохранение повышенного СРБ при подозрении на лонг-ковид чаще всего говорит о наличии воспалительного процесса в организме, вызванного активацией бактериальной флоры, который необходимо обнаружить и назначить адекватную терапию (чаще антимикробную). Возможны и другие причины повышения СРБ после перенесенного COVID-19, например, дебют аутоиммунной патологии.
АлТ, АсТ, ГГТ — биохимические показатели, с помощью которых оценивается наличие или отсутствие патологических процессов в печени (воспаления, застоя желчи — холестаза). Печень — один из наиболее часто поражаемых органов при COVID-19, поэтому мониторинг ее состояния обязателен для всех пациентов с длительно сохраняющимися симптомами и подозрением на лонг-ковид.
Креатинин и мочевина — биохимические маркеры почечной патологии, также необходимы для всех пациентов, поскольку почки — тоже часто страдают при COVID-19.
Д-димер — наиболее чувствительный показатель нарушения в системе гемостаза (системе свертывания крови). Поскольку SARS-CoV-2 — это вирус, поражающий эндотелий, то процесс патологического тромбообразования является одним из самых часто встречающихся при данном заболевании. Важно вовремя оценить наличие склонности организма к патологическому возникновению тромбов и при ее выявлении назначить соответствующую антикоагулянтную (противосвертывающую) терапию.
Может ли вакцинация обезопасить пациента от долгосрочных последствий COVID-19 в случае заболевания? Или привитым тоже стоит проверить эти показатели после заболевания?
Вакцинация помогает обезопасить от долгосрочных последствий COVID-19, если человек заразился после прививки.
Лонг-ковид может быть у всех. Но когда человек вакцинирован, у него есть иммунная защита, и время действия вируса сокращается. Соответственно, вероятность получить длительный COVID-19 намного меньше после вакцинации.
Проверять все показатели нет смысла, если нет клинических проявлений и серьезной фоновой патологии. Пациентам с симптомами и сопутствующими заболеваниями, особенно в сочетании с преклонным возрастом, лучше обследоваться даже после обычного ОРВИ.
Проще всего пройти все нужные обследования, если обратиться в свою поликлинику и провести диспансеризацию. Она в этом году проходит по углубленной программе и включает тесты и анализы именно для проверки состояния после перенесенного COVID-19. Если на первом этапе обследования будут обнаружены отклонения от нормы, доктор направит на более углубленные исследования — КТ легких, эхографию сердца и другие — и при необходимости назначит лечение.
Все обследования во время диспансеризации, включая и дорогостоящие (ту же КТ) бесплатны, поскольку проводятся за счет ОМС.
Хроническая болезнь почек: обнаружение и оценка
1. Министерство здравоохранения и социальных служб США. Годовой отчет направлен на хроническое заболевание почек в Соединенных Штатах [пресс-релиз]. http://www.nih.gov/news/health/oct2008/niddk-08.htm. По состоянию на 21 апреля 2011 г. ….
2. Collins AJ, Ли С, Гилбертсон Д. Т., Лю Дж, Чен СК, Herzog CA. Хроническая болезнь почек и сердечно-сосудистые заболевания у населения Medicare. Почки Int Suppl .2003; (87): S24–31.
3. Кейт Д.С., Николс Г.А., Гуллион СМ, Браун JB, Смит Д.Х. Длительное наблюдение и результаты среди населения с хроническим заболеванием почек в крупной организации управляемой медицинской помощи. Arch Intern Med . 2004. 164 (6): 659–663.
4. Абрамсон Дж. Л., Юрковиц CT, Ваккарино V, Вайнтрауб WS, Макклеллан В. Хроническая болезнь почек, анемия и случайный инсульт у населения среднего возраста, проживающего в общинах: исследование ARIC. Почки Инт . 2003. 64 (2): 610–615.
5. Корэш Дж., Селвин Э, Стивенс Л.А., и другие. Распространенность хронической болезни почек в США. JAMA . 2007. 298 (17): 2038–2047.
6. Система данных США по почкам. Годовой отчет USRDS за 2009 год. Глава 2: заболеваемость и распространенность. http://www.usrds.org/2009/slides/flash/vol2_02_incid_prev_09.swf. По состоянию на 6 октября 2010 г.
7. Plantinga LC, Boulware LE, Coresh J, и другие.Осведомленность пациентов о хронической болезни почек: тенденции и предикторы. Arch Intern Med . 2008. 168 (20): 2268–2275.
8. Макклеллан В.М., Рамирес СП, Юрковиц К. Скрининг хронической болезни почек: нерешенные вопросы. Дж. Ам Соц Нефрол . 2003; 14 (7 доп. 2): S81 – S87.
9. Национальный фонд почек. K / DOQI Руководство по клинической практике хронической болезни почек: оценка, классификация и стратификация. Am J Kidney Dis . 2002; 39 (2 доп. 1): S1 – S266.
10. Американская диабетическая ассоциация. Стандарт медицинской помощи при сахарном диабете — 2011. Уход за диабетом . 2011; 34 (приложение 1): S11 – S61.
11. Руководство KDOQI по клинической практике и рекомендации по клинической практике диабета и хронической болезни почек Am J Kidney Dis . 2007; 49 (2 доп. 2): S12 – S154.
12. Чобанян А.В., Бакрис Г.Л., Черный HR, и другие.; Объединенный национальный комитет Национального института сердца, легких и крови по профилактике, обнаружению, оценке и лечению высокого кровяного давления; Координационный комитет Национальной образовательной программы по высокому кровяному давлению. Седьмой отчет Объединенного национального комитета по профилактике, выявлению, оценке и лечению высокого кровяного давления: отчет JNC 7 [опубликованное исправление появляется в JAMA. 2003; 290 (2): 197]. JAMA . 2003. 289 (19): 2560–2572.
13.Бросиус ФК III, Хостеттер TH, Келепурис Э, и другие.; Американская кардиологическая ассоциация, Совет по заболеваниям почек и сердечно-сосудистых заболеваний. Совет по исследованиям высокого кровяного давления; Совет по сердечно-сосудистым заболеваниям у молодежи; Совет по эпидемиологии и профилактике; Междисциплинарная рабочая группа по исследованию качества медицинской помощи и результатов. Выявление хронического заболевания почек у пациентов с повышенным риском сердечно-сосудистых заболеваний. Тираж .2006. 114 (10): 1083–1087.
14. Vassalotti JA, Фокс СН, Беккер Б.Н. Факторы риска и скрининг хронической болезни почек. Adv Хроническая болезнь почек . 2010. 17 (3): 237–245.
15. Vassalotti JA, Стивенс Л.А., Левей А.С. Тестирование на хроническое заболевание почек: заявление о позиции Национального фонда почек. Am J Kidney Dis . 2007. 50 (2): 169–180.
16. U.S. Renal Data System. Справочные таблицы ESRD.http://www.usrds.org/2010/pdf/v2_aa_ref_tables.pdf. По состоянию на 21 апреля 2011 г.
17. Cockcroft DW, Gault MH. Прогноз клиренса креатинина из сывороточного креатинина. Нефрон . 1976; 16 (1): 31–41.
18. Левей А.С., Bosch JP, Льюис Дж. Б., Грин Т, Роджерс Н, Roth D; Модификация диеты в группе изучения заболеваний почек. Более точный метод оценки скорости клубочковой фильтрации по креатинину сыворотки: новое уравнение прогноза. Энн Интерн Мед. . 1999. 130 (6): 461–470.
19. Левей А.С., Стивенс Л.А., Шмид СН, и другие.; CKD-EPI (Сотрудничество по эпидемиологии хронических заболеваний почек). Новое уравнение для оценки скорости клубочковой фильтрации. Энн Интерн Мед. . 2009. 150 (9): 604–612.
20. Национальный фонд почек. Часто задаваемые вопросы об оценках СКФ. http://www.kidney.org/professionals/kls/pdf/kba_faqs_aboutgfr.pdf. По состоянию на 29 сентября 2010 г.
21. Michels WM, Гроотендорст, округ Колумбия, Verduijn M, Эллиотт Э.Г., Деккер FW, Кредит РТ. Эффективность формул Кокрофта-Голта, MDRD и новых формул CKD-EPI в отношении СКФ, возраста и размера тела. Clin J Am Soc Nephrol . 2010. 5 (6): 1003–1009.
22. Джонс, Калифорния, Фрэнсис МЭ, Эберхардт М.С., и другие. Микроальбуминурия у населения США: третье национальное исследование здоровья и питания. Am J Kidney Dis . 2002. 39 (3): 445–459.
23. Viazzi F, Леончини Г, Ратто Э, и другие. Микроальбуминурия, нагрузка артериальным давлением и системная проницаемость сосудов при первичной гипертензии. Am J Hypertens . 2006. 19 (11): 1183–1189.
24. Молич М.Е., ДеФронцо Р.А., Франц MJ, и другие.; Американская диабетическая ассоциация. Нефропатия при сахарном диабете. Уход за диабетом .2004; 27 (приложение 1): S79 – S83.
25. Нотон, CA. Нефротоксичность, вызванная лекарствами. Ам Фам Врач . 2008. 78 (6): 743–750.
26. Мунар М.Я., Сингх Х. Корректировка дозирования препаратов у пациентов с хронической болезнью почек. Ам Фам Врач . 2007. 75 (10): 1487–1496.
27. Министерство по делам ветеранов США; Министерство обороны США. VA / DoD Руководство по клинической практике ведения хронической болезни почек в первичной медико-санитарной помощи.http://www.healthquality.va.gov/ckd/ckd_v478.pdf. Проверено 2 октября 2010 г.
28. Леви А. Хроническая болезнь почек: прогрессирование. http://ocw.tufts.edu/data/33/497964.pdf. 2 октября 2010 г.
29. Левей А.С., Перроне Р.Д., Мадайо МП. Лабораторная оценка почечной недостаточности: клиренс, анализ мочи и биопсия почек. В: Бреннер Б.М., ректор Фр. Почка. Филадельфия, Пенсильвания: W.B. Сондерс; 1991: 919–968.
30. Руководство KDOQI по клинической практике и рекомендации по клинической практике анемии при хронической болезни почек: обновление целевого показателя гемоглобина 2007 г.. Am J Kidney Dis . 2007. 50 (3): 471–530.
31. Национальный фонд почек. Руководство KDOQI по клинической практике и рекомендации по клинической практике при анемии при хронической болезни почек [опубликованная поправка опубликована в Am J Kidney Dis. 2006; 48 (3): 518]. Am J Kidney Dis . 2006; 47 (5 доп. 3): S11 – S145.
32. Гуч К., Каллтон BF, Маннс Би Джей, и другие. Применение НПВП и прогрессирование хронической болезни почек. Am J Med . 2007; 120 (3): 280.e1–280.e7.
33. De Broe ME, Elseviers MM. Использование безрецептурных анальгетиков. Дж. Ам Соц Нефрол . 2009. 20 (10): 2098–2103.
Повышенный креатинин у пациента с циррозом печени — Клаван — 2016 — Клиническое заболевание печени
Реферат
Посмотреть видео-презентацию этой статьи
Посмотреть интервью с автором
Сокращения
- ADH
- антидиуретический гормон
- Алк фос
- щелочная фосфатаза
- ALT
- аланинаминотрансфераза
- АКИ
- Острая почечная недостаточность
- АКИН
- Сеть острых травм почек
- АСТ
- аспартатаминотрансфераза
- ATN
- Острый тубулярный некроз
- CKD
- Хроническая травма почек
- Cr
- креатинин
- CX
- культура
- CXR
- Рентген грудной клетки
- Дбили
- билирубин прямой
- FENa
- фракционное выведение натрия
- GFR
- Скорость клубочковой фильтрации
- GI
- желудочно-кишечный тракт
- часов
- гепаторенальный синдром
- INR
- международное нормализованное соотношение
- КАРТА
- среднее артериальное давление
- MICU
- отделение интенсивной терапии
- НПВП
- нестероидный противовоспалительный препарат
- PRA
- преренальная азотемия
- РААС
- ренин-ангиотензин-альдостероновая система
- RRT
- почечная заместительная терапия
- SBP
- Спонтанный бактериальный перитонит
- SCr
- креатинин сыворотки
- СНС
- Симпатическая нервная система
- Тбилиси
- билирубин общий
- UNa
- Натрий в моче
- UO
- диурез
- УОсм
- Осмоляльность мочи
Повышение уровня креатинина в сыворотке крови — обычная лабораторная находка у пациентов с циррозом печени и может указывать на наличие острого повреждения почек (ОПП) или хронического заболевания почек (ХБП).Однако креатинин может недооценивать реальную степень почечной недостаточности, и было доказано, что уравнения сывороточного креатинина и креатинина для оценки скорости клубочковой фильтрации неточны для пациентов с циррозом печени.1 Следовательно, клиницисты должны иметь низкий порог для диагностики и лечения Поражение почек у больных циррозом печени. Медицинские работники должны знать, что пациенты с циррозом часто имеют более низкий исходный уровень креатинина из-за наличия белково-калорийной недостаточности, снижения мышечной массы, нарушения выработки креатинина печенью и повышенной экскреции креатинина почечными канальцами.1 Таким образом, клиническая значимость одного значения креатинина требует сравнения с предыдущими лабораторными значениями и интерпретации в клиническом контексте.
Для целей этого целенаправленного обзора мы сосредоточимся на диагностике и лечении ОПН, которая является наиболее частой причиной повышенного креатинина у пациентов с циррозом, встречающейся почти в 20% всех госпитализаций с циррозом.2 Раннее выявление ОПН имеет решающее значение, поскольку он связан с другими осложнениями цирроза, такими как спонтанный бактериальный перитонит (САД) и кровотечение из варикозно расширенных вен, и является независимым предиктором смертности.3 Пациенты, у которых в анамнезе постоянно повышались значения креатинина или оценивалась низкая скорость клубочковой фильтрации, вероятно, страдают ХБП, и они не будут рассмотрены в этом обзоре.
Начальная оценка
Согласно сети Acute Kidney Injury Network (AKIN), ОПН определяется как резкое (в течение 48 часов) снижение функции почек, проявляющееся в повышении уровня креатинина в сыворотке не менее чем на 0,3 мг / дл или повышении не менее чем на 50%. (В 1,5 раза) от исходного уровня или снижение диуреза до менее 0.5 мл / кг / час в течение более 6 часов.4 Существует три стадии тяжести ОПП согласно классификации критериев AKIN (таблица 1). Клиницисты также должны знать, что пациенты с ХБП подвержены острой травме.
Таблица 1. Сетевая классификация острой почечной травмы / Система стадийной классификации острой почечной травмы| AKIN Stage | Критерии креатинина сыворотки | Моча |
|---|---|---|
| 1 этап | Увеличение SCr ≥0.3 мг / дл или увеличение до ≥150% -200% от исходного уровня | UO <0,5 мл / кг / час в течение> 6 часов |
| 2 этап | Увеличение SCr до> 200% -300% от исходного уровня | UO <0,5 мл / кг / час в течение> 12 часов |
| 3 этап | Увеличение SCr до> 300% от исходного уровня или SCr ≥4.0 мг / дл после повышения по крайней мере на 0,5 мг / дл или лечения RRT | UO <0,3 мл / кг / час в течение 24 часов или анурия в течение 12 часов |
- Сокращения: ОПП — острое повреждение почек; ЗПТ — заместительная почечная терапия; SCr, креатинин сыворотки; UO, диурез.
- Преренал:
- Почечная гипоперфузия: вызвана истощением внутрисосудистого объема (например, обезвоживанием из-за гипердиуреза), как это наблюдается при преренальной азотемии (PRA) или кардиоренальном синдроме, вызванном снижением сердечного выброса
- Функциональная вазоконстрикция почек при гепаторенальном синдроме (HRS)
- Внутренние почек: ишемическое или токсическое повреждение, ведущее к острому тубулярному некрозу (ОТН), гломерулонефриту или интерстициальному нефриту
- Постренальный: вызван обструкцией мочевыводящих путей
Первоначальное обследование включает полную оценку функций почек и печени, а также исключение общих клинических факторов, особенно инфекций, таких как САД (таблица 2).
Таблица 2. Первоначальная оценка острой почечной недостаточности при циррозе печени| Обследование | Испытания на заказ |
|---|---|
| Почечная функция | • Общий анализ мочи, включая микроскопию мочи и осадка • Анализы мочи: электролиты, осмоляльность, белок, альбумин • Моча • УЗИ почек • Рассмотрите возможность проведения эхокардиограммы, если вы заинтересованы в кардиоренальном процессе. |
| Функция печени | • Печеночные тесты: AST, ALT, Tbili, Dbili, Alk Phos, INR, альбумин • УЗИ печени с допплером • Диагностический парацентез (включая общий белок, альбумин, количество клеток) |
| Инфекция | • Посев: моча, кровь • Диагностический парацентез (окраска перитонеальной жидкости по Граму и посев) • Рентген грудной клетки |
- Сокращения: Alk phos, щелочная фосфатаза; AST, аспартатаминотрансфераза; АЛТ, аланинаминотрансфераза; Дбили, прямой билирубин; INR, международное нормализованное соотношение; Тбили, билирубин общий.
Диагноз
Чтобы диагностировать тип ОПП, необходимо проанализировать клинический сценарий и результаты первичной оценки. Постпочечная недостаточность быстро определяется по наличию гидронефроза на УЗИ почек или по разрешению непроходимости мочевыводящих путей с установкой мочевого катетера. Однако различить PRA, HRS и ATN сложнее. В таблице 3 представлены основные диагностические данные в качестве общего руководства.В зависимости от клинических условий, использование электролитов в моче, а также мочевого осадка потенциально может прояснить диагноз. PRA обычно реагирует на восполнение объема, тогда как HRS представляет собой функциональный тип преренального повреждения почек из-за почечной вазоконстрикции, которое сохраняется после объемной провокации. оценка с помощью эхокардиограммы для определения наличия сниженной фракции выброса.ATN обычно можно отличить по клиническому сценарию и исследованиям мочи, особенно по зернистым цилиндрам в осадке мочи; однако это открытие может быть неспецифическим при запущенном циррозе печени.
Таблица 3. Ключевые диагностические выводы| PRA | часов | ATN | |
|---|---|---|---|
| Клинические характеристики | Обезвоживание, агрессивный диурез, диарея | Продвинутый цирроз печени, низкое САД, низкое содержание натрия в сыворотке (гиперволемическая гипонатриемия) | Септический шок, инфекция, гипотензия, нефротоксины |
| Состояние объема | Сухой | Перегруженный (рефрактерный асцит) | Либо |
| UNaa | Низкое (<20 мэкв / л) | Низкое (<20 мэкв / л) | высокий (> 40) |
| FENaa | Низкое (<1%) | Низкий (<0.1%) | Высокий (2%) |
| УОсм | Высокая (> 500 мОсм / кг) | Высокая (> 500 мОсм / кг) | Низкое (<350 мОсм / кг) |
| Осадок мочи | Блэнд | Блэнд | Гранулярные цилиндры, b эпителиальные цилиндры |
- Новые биомаркеры в моче могут помочь дифференцировать острое повреждение почек (ОПП) от цирроза.6
- Сокращения: АТН — острый некроз канальцев; FENa, фракционное выведение натрия; HRS, гепаторенальный синдром; САД — среднее артериальное давление; PRA — преренальная азотемия; UNa, натрий мочи; УОсм, осмоляльность мочи.
- а FENa и UNa: не интерпретируются при приеме диуретиков.
- б Зернистые цилиндры могут быть неспецифическими при запущенном циррозе и обнаруживаться как при ATN, так и при HRS.
Важно определить наличие HRS. Существует два типа HRS (типы 1 и 2), которые различаются по времени и характеристикам пациента. HRS-1 — это тип ОПП с внезапным снижением функции почек (в течение 2 недель), часто развивающийся после провоцирующего события, такого как САД, и связан с плохим краткосрочным прогнозом. В то время как HRS-2 протекает медленнее, с течением времени (от недель до месяцев) и обычно проявляется в амбулаторных условиях в виде рефрактерного асцита.2 HRS рассматривается как возможный диагноз только у пациентов с циррозом и асцитом после исключения других причинных факторов, таких как ATN, снижение сердечного оттока, шок, нефротоксины и паренхиматозное заболевание почек. Если не наблюдается улучшения креатинина после как минимум 2 дней увеличения объема (альбумин 1 г / кг массы тела / день), наиболее вероятной причиной является HRS.2, 5 HRS составляют примерно одну шестую (17%) всех Случаи ОПП среди госпитализированных пациентов с циррозом печени и около четверти (25%) случаев, определенных как преренальные ОПП.2 Патофизиология HRS проиллюстрирована на Рисунке 1.2
Патофизиология гепаторенального синдрома (ГРС). HRS является следствием прогрессирующего системного сосудорасширяющего состояния, связанного с портальной гипертензией, что приводит к общему неэффективному объему артериальной крови. Последующий эффект приводит к гипоперфузии почек и развитию почечной недостаточности. Сокращения: АДГ, антидиуретический гормон; РААС, ренин-ангиотензин-альдостероновая система; СНС, симпатическая нервная система.Адаптировано с разрешения Hepatology (рис. 2, стр. 2066) .2 Авторское право 2008 г., Американская ассоциация по изучению заболеваний печени.Лечение
Первым шагом в лечении повышенной концентрации креатинина и опасения по поводу ОПН у любого пациента с циррозом печени является прекращение приема потенциально опасных агентов, таких как диуретики, лактулоза, НПВП, вазодилататоры и другие нефротоксины. Одновременно следует обследовать пациента на предмет наличия основных преципитентов, таких как желудочно-кишечное кровотечение или инфекция (т. Е. САД).Если функция почек не улучшается через 24 часа, пациентам следует назначить восполнение внутрисосудистого объема с использованием альбумина в качестве предпочтительного агента.2, 5 Диагноз, скорее всего, является PRA, если креатинин реагирует на объем. Однако, если пациент не реагирует на лечение по крайней мере после 2 дней отмены диуретиков и увеличения объема за счет альбумина, следует настоятельно рассмотреть вопрос о ГРС. Если есть клиническое подозрение на HRS (т. Е. Асцит, низкое среднее артериальное давление, гипонатриемия), предполагается диагноз HRS и следует немедленно начать комбинацию альбумина и вазоконстрикторов.Согласно практическим рекомендациям AASLD, если пациент находится на медицинском этаже, пероральное сосудосуживающее средство, мидодрин, можно комбинировать с октреотидом, аналогом соматостатина, и альбумином для первоначального лечения HRS6; хотя недавняя литература показала, что этот режим не так эффективен, как более сильнодействующие вазоконстрикторы.7 Однако в отделении интенсивной терапии следует рассмотреть возможность применения альбумина плюс норадреналин (или терлипрессина, если он находится за пределами США). Все пациенты с HRS должны быть немедленно направлены в центр трансплантации печени для оценки трансплантата.6 На Рисунке 2 представлен предлагаемый алгоритм лечения ОПН у госпитализированных пациентов с циррозом печени.
Предлагаемый алгоритм лечения острого повреждения почек (ОПП) при циррозе печени. Этот предложенный алгоритм обеспечивает пошаговый процесс диагностики и лечения распространенных причин ОПП у пациентов с циррозом печени. После первоначального обследования, в том числе поиска возможных преципитентов, пациентам следует задать объем, чтобы определить, улучшается ли функция почек.Однако, если он не реагирует на объем и если клиническое подозрение велико, пациентов следует лечить от HRS с помощью сосудосуживающей терапии, а также направлять для оценки трансплантата печени. Сокращения: АТН — острый некроз канальцев; Cr, креатинин; CX, культура; Рентгенография грудной клетки; ЖКТ, желудочно-кишечный тракт; HRS, гепаторенальный синдром; САД — среднее артериальное давление; МИКУ, отделение интенсивной терапии; НПВП, нестероидные противовоспалительные препараты.
Клинические исходы / прогноз
Пациенты с циррозом печени и почечной недостаточностью имеют плохой прогноз.Для всех причин почечной недостаточности уровень смертности в течение 1 месяца составляет около 50%, в то время как уровень смертности в течение 6 месяцев приближается к 80% .8 Прогноз в значительной степени зависит от причины повреждения почек. По данным большой одноцентровой проспективной когорты, 3-месячная выживаемость колебалась от 73% для паренхиматозного заболевания, 46% для гиповолемии, 31% для инфекционно-ассоциированной почечной недостаточности и только 15% для HRS.9 Кроме того, тип 1 HRS имеет худший прогноз по сравнению с HRS 2 типа со средней выживаемостью только 1.0 месяцев по сравнению с 6,7 месяцами соответственно.10 Учитывая низкую краткосрочную выживаемость при HRS, для этих пациентов крайне важно пройти обследование для трансплантации печени, поскольку это остается единственным вариантом лечения2, 6, 9
Ключевые клинические точки
- ОПП у пациентов с циррозом печени ассоциируется с плохими результатами.
- Абсолютный креатинин мало полезен, и клиницисты должны оценить изменение креатинина по сравнению с исходными значениями, чтобы диагностировать ОПП.
- Пациенты с HRS должны быть обследованы для трансплантации печени.
ССЫЛКИ
- 1 Франко С, Прие Д, Абдельразек В, Моро Р, Мандот А, Belghiti J, et al. Неточности в уравнениях на основе креатинина и креатинина у кандидатов на трансплантацию печени с низким уровнем креатинина: влияние на модель оценки терминальной стадии болезни печени. Liver Transpl 2010; 16: 1169–1177.
- 2 Гарсия-Цао Г, Парих ЧР, Виола А. Острое повреждение почек при циррозе печени. Гепатология 2008; 48: 2064-2077.
- 3 Белчер Дж. М., Гарсия-Цао Г, Саньял А.Дж., Бхогал Х, Лим JK, Ансари Н. и др. Связь ОПП со смертностью и осложнениями у госпитализированных пациентов с циррозом печени. Гепатология 2013; 57: 753-762.
- 4 Мехта Р.Л., Келлум JA, Шах С.В., Молиторис Б.А., Ронко С, Warnock DG, et al. Сеть Acute Kidney Injury Network: отчет об инициативе по улучшению результатов лечения острой почечной недостаточности. Crit Care 2007; 11: R31.
- 5 Салерно F, Гербы А, Гинес П, Вонг Ф, Арройо В.Диагностика, профилактика и лечение гепаторенального синдрома при циррозе печени. Gut 2007; 56: 1310–1318.
- 6 Runyon BA; Комитет по практическим рекомендациям AASLD. Ведение взрослых пациентов с асцитом из-за цирроза: обновленная информация. Гепатология 2009; 49: 2087-2107.
- 7 Каваллин М, Камат П.С., Мерли М, Фасолато S, Тониутто П., Салерно Ф. и др.Терлипрессин плюс альбумин по сравнению с мидодрином и октреотидом плюс альбумином при лечении гепаторенального синдрома: рандомизированное исследование. Гепатология 2015; 62: 567-574.
- 8 Гинес П, Schrier RW. Почечная недостаточность при циррозе печени. N Engl J Med 2009; 361: 1279–1290.
- 9 Мартин-Ллахи М, Гевара М, Торре А, Фагундес C, Restuccia T, Gilabert R, et al.Прогностическое значение причины почечной недостаточности у пациентов с циррозом печени. Гастроэнтерология 2011; 140: 488-496.e484.
- 10 Алессандрия C, Оздоган О, Гевара М, Restuccia T, Хименес В, Арройо V и др. Оценка MELD и клинический тип предсказывают прогноз при гепаторенальном синдроме: актуальность для трансплантации печени. Гепатология 2005; 41: 1282–1289.
Влияние приготовленной мясной еды на креатинин сыворотки и расчетную скорость клубочковой фильтрации при диабете, связанном с заболеванием почек
Резюме
ЦЕЛЬ Голодание обычно не рекомендуется для тестов функции почек, несмотря на известное влияние приготовленного мяса на креатинин.Поэтому мы изучили вариации креатинина и оценочную скорость клубочковой фильтрации (рСКФ) после стандартной приготовленной мясной еды у 80 субъектов: здоровых добровольцев и пациентов с диабетом с хронической болезнью почек (ХБП) 1 и 2 стадии, 3a, 3b и 4 ( n = 16 / группа).
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ Вмешательства включали стандартизированное приготовленное мясо и немясную муку, каждое из которых давало около 54 г белка вместе с 250 мл воды в отдельные дни. Образцы крови натощак и после приема пищи через 1, 2 и 4 часа были взяты для измерения креатинина с использованием кинетического щелочного анализа пикратов на анализаторе Olympus AU640.Для расчета рСКФ использовалось модифицированное уравнение «Модификация диеты при заболевании почек» с четырьмя переменными, прослеживаемое по масс-спектрометрии изотопного разведения креатинина.
РЕЗУЛЬТАТЫ Потребление стандартизированной приготовленной мясной муки значительно повысило уровень креатинина в сыворотке и привело к значительному снижению рСКФ на всех изученных стадиях ХЗП; 6 из 16 пациентов с ХБП 3а были ошибочно классифицированы как ХБП 3b. Этот эффект вареного мяса на креатинин сыворотки исчезает после 12 часов голодания у всех участников исследования.
ВЫВОДЫ Креатин в мясе превращается в креатинин при приготовлении пищи, который всасывается, вызывая значительное повышение креатинина в сыворотке крови. Это может повлиять на лечение, поскольку порог для начала и отмены определенных лекарств и дорогостоящих исследований определяется рСКФ. рСКФ, рассчитанная с использованием креатинина сыворотки натощак, могла бы лучше отражать функцию почек у этих пациентов.
Введение
Диабетическая нефропатия является ведущей причиной терминальной стадии почечной недостаточности (ТПН) в мире.Точный скрининг и определение стадии хронической болезни почек (ХБП) необходимы для своевременного вмешательства в соответствии с рекомендациями национальных и международных руководств (1, 2) и для корректировки дозы других лекарственных средств. Скорость клубочковой фильтрации (СКФ) признана лучшим показателем функции почек при здоровье и болезнях, но измерение ее с помощью золотых стандартных методов, таких как клиренс инулина и радиоизотопные методы, клинически непрактично. Поэтому рекомендуется оценка СКФ с использованием креатинина сыворотки и других переменных, таких как возраст, пол, раса и размер тела (3,4).
Вариации уровня креатинина сыворотки могут привести к неправильной классификации стадии ХБП с клиническими последствиями для пациента и стоимостью услуг. Некоторые из факторов, ответственных за вариабельность креатинина, — это употребление вареного мяса, жидкостный статус, суточные колебания и задержка центрифугирования образцов крови (5). Большинство образцов крови в первоначальном исследовании «Модификация диеты при заболевании почек» (MDRD) было взято после ночного голодания (6). Однако в большинстве клинических ситуаций это не учитывается, и расчетная СКФ (рСКФ) рассчитывается лабораториями на основе всех образцов крови, отправленных на функциональные тесты почек.Внутрииндивидуальные биологические вариации измерения креатинина значительно выше у людей с ХБП (коэффициент вариации 5,3%), чем у здоровых людей (коэффициент вариации 2,7%) (7,8).
Было проведено несколько исследований, посвященных изучению диетического белка и функции почек (9). Было показано, что СКФ, почечный плазменный ток и клиренс креатинина увеличивают потребление белка и инфузию аминокислот, особенно в доклинических исследованиях (8,10). Привычное увеличение потребления белка приводит к увеличению общей мышечной массы и общего запаса креатинина в организме, но острое употребление вареного мяса вызывает временное повышение уровня креатинина в сыворотке и моче.При приготовлении мяса креатин в скелетных мышцах превращается в креатинин. Исследования, посвященные влиянию приготовления пищи на извлекаемые кислотой химические составляющие говядины, показали значительное повышение уровня креатинина (11,12). Прием пищи, содержащей приготовленное мясо, вызывал заметное повышение концентрации креатинина в сыворотке крови после приема пищи, тогда как прием сырого мяса не влиял на креатинин сыворотки у нормальных людей (13). Было показано, что большая приготовленная мясная мука (225 г) вызывает среднее повышение креатинина на 52% по сравнению со средним значением для контрольного приема пищи у шести здоровых людей (14).Максимальная концентрация креатинина сыворотки была достигнута через 2 ч после мясной муки. Исследование, посвященное влиянию белковой нагрузки у пациентов с трансплантацией почки и здоровых контрольных субъектов, показало повышение уровня креатинина в сыворотке на 30%, причем в абсолютном выражении рост был выше в группе с трансплантатом (15). Следовательно, влияние вареного мяса на креатинин сыворотки может быть выше на более поздних стадиях ХБП.
Более недавнее исследование с участием 17 здоровых добровольцев и 15 пациентов дневного отделения по уходу за престарелыми показало значительное повышение медианного креатинина сыворотки с 80.От 5 до 101,0 мкмоль / л (от 0,91 до 1,14 мг / дл), а средняя рСКФ падает с 84 до 59,5 мл / мин / 1,73 м 2 через 1-2 часа после приема нормальной порции приготовленного мяса (6). Исследование также показало, что повышение креатинина, измеренное тремя разными методами, было одинаковым после приготовленной мясной еды. Разница между значениями креатинина через 2 и 4 часа после приема пищи была небольшой, что поднимало вопросы относительно стойкости эффектов приготовленной еды после 4 часов. Это имеет клиническое значение, поскольку пациенты, посещающие утреннюю клинику, вполне могли съесть большую приготовленную мясную еду накануне вечером.
Доказательства влияния вареного мяса на креатинин у четко определенной популяции пациентов с различными стадиями ХБП, связанной с диабетом, в литературе отсутствуют. Влияние приготовленной мясной муки на уровень креатинина> 4 ч после еды также не определено.
Целью настоящего исследования было оценить изменение креатинина, вызванное стандартизированной приготовленной мясной едой у участников с различными стадиями диабетической ХБП. Мы предположили, что стандартизованная приготовленная мясная еда вызовет значительное повышение уровня креатинина в сыворотке и что голодание в течение ночи устранит этот эффект.
Дизайн и методы исследования
Это было проспективное экспериментальное исследование, в котором участвовали участники с разными стадиями диабетической ХБП и здоровые добровольцы. Пациенты с ХБП были разделены на четыре подгруппы: ХБП стадии 1 и 2, 3а, 3b и 4. Мы набрали по 16 участников в каждой из пяти групп (всего n = 80). Исследование было рассмотрено и одобрено Ливерпульским комитетом по этике исследований, и все участники исследования дали письменное информированное согласие.
Объекты исследования и выборка
Участников исследования набирали из диабетических клиник, а здоровых добровольцев набирали из персонала и широкой общественности, набираемых через рекламу. В качестве нашей стратегии выборки мы использовали квотную выборку, выбирая последовательно, чтобы добиться равного числа в исследовательских группах и позволить анализировать прогресс по этапам. Критерии включения: сахарный диабет 1 или 2 типа, ХБП 1–4 стадии и возраст> 18 лет. Пациенты, у которых было выявлено недиабетическое заболевание почек, все, кто не мог есть мясо, и пациенты, получающие заместительную почечную терапию, были исключены из этого исследования.Средний возраст участников составлял 67 лет (межквартильный размах [IQR] 52,5–73), все были европейцами, а 66 — мужчинами. Все пациенты с рСКФ <60 мл / мин / 1,73 м 2 , включенные в исследуемые группы, имели повышенную экскрецию альбумина, о чем свидетельствует отношение альбумина к креатинину в моче> 2,5 у мужчин и> 3,5 у женщин как минимум в двух случаях. 86% участников исследуемой группы страдали диабетом 2 типа.
Вмешательство
Вмешательство состояло из стандартизированной еды, содержащей приготовленное мясо в количестве, которое считается нормальной порцией.Мы обеспечивали пациентов мясными и немясными блюдами, каждая из которых содержала ~ 44 г белка, что составляет не более 65% суточной нормы белка каждого пациента [1,0 г белка / кг идеальной массы тела / день]. Мясное блюдо состояло из двух четвертьфунтовых бургеров из абердин-ангусской говядины, а немясное блюдо — из двух вегетарианских гамбургеров. Бургеры из говядины Абердин-Ангус, содержащие 23 г белка, были приготовлены на гриле из замороженного состояния при умеренном огне в течение 25 минут. Бургеры без мяса, содержащие 22 г белка, жарили на гриле при умеренном огне в течение 15 минут в соответствии с инструкциями по приготовлению.Они подавались вместе с двумя булочками и овощным салатом, за которым следовало 250 мл воды.
Во время первого визита участники посетили после ночного голодания, а также пробы крови перед приемом пищи и три пробы крови после еды через 1, 2 и 4 часа после мясной муки. Вечером перед вторым визитом участники ели стандартную мясную еду с 250 мл воды и принимали участие после ночного (12-часового) голодания. Это было сделано для оценки влияния стандартизированной мясной муки на креатинин сыворотки после ночного голодания.Были получены образцы крови натощак и три образца крови после еды через 1, 2 и 4 часа после стандартной безмясной еды.
Измеряемые переменные
Основной переменной в исследовании был креатинин сыворотки, который измерялся с помощью кинетического щелочного анализа пикратов на анализаторе Olympus AU640. Модифицированное уравнение MDRD, прослеживаемое по масс-спектрометрии изотопного разведения — креатинин и скорректированное с учетом методологии Olympus (мл / мин / 1,73 м 2 ), выглядит следующим образом: рСКФ = 175 × {[(креатинин — точка пересечения) / наклон] × 0.011312} −1,154 × (возраст) — 0,203 × (1,212, если афро-карибская раса) × (0,742, если женщина) (16). Для методологии Olympus точка пересечения равна 16,14, а наклон — 0,955.
Статистические соображения
Для обнаружения среднего сдвига на 10 мкмоль / л (примерно эквивалентно 1 стандартное отклонение) между значениями после приема пищи за вычетом предрандиальных значений с мощностью 90%, P = 0,05 в парном тесте t потребовалось 13 участников в каждой группе. Однако для ненормальных распределений использование знакового рангового критерия Уилкоксона требовало 15 участников для мощности не менее 90%.Статистический анализ проводился с использованием SPSS (версия 17.0 для Windows; SPSS, Чикаго, Иллинойс) и Graphpad Prism 5 для Windows. Сдвиги в значениях креатинина и рСКФ во всех группах сравнивали с использованием знакового рангового критерия Вилкоксона, поскольку большинство данных имели ненормальное распределение. Результаты представлены в виде медианы (IQR), и P <0,05 было принято для обозначения статистической значимости.
Результаты
Мы получили результаты от 80 участников после стандартных приготовленных мясных и немясных блюд.Средний уровень гликированного гемоглобина среди 64 участников с диабетической ХБП составил 62,7 ± 16,1 ммоль / моль (7,9 ± 1,6%).
В таблице 1 приведены значения креатинина натощак и после приема пищи, а также рСКФ у участников всех пяти групп. Постпрандиальные значения составляют 1 час, 2 часа и 4 часа после мясных и немясных блюд.
Таблица 1Медиана (IQR) креатинина и рСКФ до и после стандартизированной мясной муки
Влияние вареной мясной муки на креатинин сыворотки в течение 4 часов
Значительные различия были обнаружены в значениях креатинина сыворотки и рСКФ после стандартной мясной муки в здоровые добровольцы и участники с ХБП, но после приема немясной пищи существенных различий не было.На рисунке 1 показано изменение сывороточного креатинина и рСКФ после мясных и немясных блюд. У здоровых добровольцев и при ХБП 1 и 2 стадии максимальное повышение креатинина было отмечено через 2 часа, в то время как у пациентов с ХБП 3а и 3b максимальное повышение наблюдалось через 4 часа после приема пищи. При ХБП 4 4-часовой креатинин был всего на 0,5 мкмоль / л (0,005 мг / дл) ниже 2-часового значения (таблица 1).
Рисунок 1Медиана и IQR изменения сывороточного креатинина через 2 часа после мясной ( A ) и немясной ( B ) еды. Медиана и IQR изменения рСКФ после мясных ( C ) и немясных ( D ) блюд.** P <0,01 и *** P <0,001 сравнивают исходные и двухчасовые значения.
Влияние приготовленной мясной еды на креатинин сыворотки крови после ночного голодания
Средняя разница между креатинином натощак через 12 часов после мясной и немясной пищи не была статистически значимой ни в одной из пяти исследуемых групп, как показано на рис. 2.
Рисунок 2Медиана и IQR креатинина через 12 часов после мясной (□) и немясной (■) еды у здоровых добровольцев и четырех групп участников с ХБП.Никаких существенных различий не было отмечено ни в одной группе, все значения P > 0,05.
Выводы
Наше исследование демонстрирует значительное повышение уровня креатинина в сыворотке после жареной мясной еды у здоровых добровольцев и участников с диабетической ХБП 1–4 стадии. Вероятно, это связано с эффектом абсорбированного креатинина, присутствующего в приготовленном мясе. Это привело к снижению расчетной СКФ во всех исследованных группах. Относительное падение рСКФ пропорционально меньше у пациентов с более поздними стадиями ХБП, но процентное снижение остается значительным во всех группах.Часть пациентов с ХБП может быть ошибочно отнесена к более тяжелым стадиям в зависимости от их исходной рСКФ. Шесть из 16 пациентов с ХБП 3а были ошибочно классифицированы как ХБП 3b в результате употребления вареного мяса. Это могло оказать существенное влияние на ведение таких пациентов, особенно в связи с тем, что порог для начала и отмены определенных лекарств и необходимость дорогостоящих исследований определяются рСКФ.
В нашем исследовании пик креатинина и надира рСКФ не были одинаковыми через 2 часа после приема пищи, как показано в таблице.Это может быть связано с разной скоростью всасывания в желудочно-кишечном тракте у разных пациентов. Таким образом, исходя из наших данных, мы не можем сделать вывод, когда повышение уровня креатинина в сыворотке крови достигает максимума в разных группах. Мы можем только предположить, что через 12 ч после употребления мясной муки существенной разницы нет.
Было показано, что влияние вареного мяса на креатинин сыворотки остается неизменным независимо от методологии, используемой для измерения креатинина сыворотки в ранее опубликованных исследованиях (6,13–15).
Мы также демонстрируем, что после ночного голодания влияние приготовленного мяса на креатинин сыворотки не остается статистически или клинически значимым. Мы предлагаем оценивать СКФ с использованием натощак, а не случайных образцов сыворотки.
Информация об изделии
Двойственность интересов. О потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Авторские взносы. С.Н. задумал и разработал исследование, исследовал данные и написал рукопись.С.В.О. участвовал в разработке и наборе исследования, а также рецензировал и редактировал рукопись. К.Х. и Б. участвовали в разработке исследования, рецензировали и редактировали рукопись. P.J.G.L. оказал помощь в проведении статистического анализа, рецензировал и редактировал рукопись. К.Дж.Х. и J.P.H.W. задумал и разработал исследование, участвовал в обсуждениях, рецензировал и редактировал рукопись. С.Н. является гарантом этой работы и, как таковой, имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных.
Предварительная презентация. Части этого исследования были представлены в виде тезисов на 73-й научной сессии Американской диабетической ассоциации, Чикаго, штат Иллинойс, 21–25 июня 2013 г.
- Получено 28 июля 2013 г.
- Принято 13 сентября 2013 г.
- © 2014 Американская диабетическая ассоциация.
Ложные оценки повышенного креатинина — Журнал Permanente
Ложные оценки повышенного креатинина
Corridor Consult
Manpreet Samra, MD; Антуан С. Абкар, MD
Весна 2012 — Том 16, номер 2
https: // doi.org / 10.7812 / TPP / 11-121Аннотация
Одна из наиболее частых причин, по которой обращаются за консультацией к нефрологу, — это повышенный уровень креатинина. Повышение концентрации креатинина в сыворотке обычно отражает снижение скорости клубочковой фильтрации (СКФ). Учитывая связь повышенного креатинина и риска сердечно-сосудистой смертности, важно помнить, что иногда повышение креатинина не является показателем истинного снижения СКФ. Есть разные причины искусственного повышения креатинина.Их можно в общих чертах сгруппировать по увеличению выработки креатинина, вмешательству в анализ и снижению канальцевой секреции креатинина.
Введение
Коллега спрашивает о пациенте: женщине в возрасте 48 лет с диагнозом гипертония в течение 2 лет и гиперлипидемией в течение 10 месяцев, у которой уровень креатинина постоянно повышался с 0,7 до 1,8 за последние 8 месяцев. Ее лекарства включают гидрохлоротиазид per os 12,5 мг / день и фенофибрат per os 200 мг / день.
Одной из наиболее частых причин обращения за консультацией к нефрологу является повышенный креатинин, который обычно отражает снижение скорости клубочковой фильтрации (СКФ). Учитывая связь повышенного креатинина со смертностью от сердечно-сосудистых заболеваний, важно помнить, что повышенный креатинин не всегда свидетельствует о снижении СКФ. Здесь мы обсудим различные причины ложных оценок повышенного креатинина.
На ранних стадиях почечной недостаточности у пациентов мало признаков и симптомов.Раннее обнаружение нарушения функции почек важно, потому что раннее лечение обычно замедляет прогрессирование заболевания.
Поскольку невозможно напрямую измерить функцию почек или СКФ, необходим суррогат. Эндогенным маркером, наиболее часто используемым для измерения функции почек, является креатинин. 1 Креатинин вырабатывается в мышцах, пропорционален мышечной массе и остается относительно постоянным. От восьмидесяти пяти до 90% креатинина выводится почками; остальное подвергается канальцевой секреции.Чаще всего его измеряют с помощью колориметрического анализа, называемого реакцией Яффе. В реакции Яффе креатинин соединяется с пикриновой кислотой с образованием окрашенного комплекса, который измеряется для количественного определения креатинина.
Имея это в виду, мы можем выделить несколько факторов, которые могут искусственно повышать расчетный уровень креатинина. Их можно разделить на три категории: повышенное производство креатинина, вмешательство в анализ и снижение канальцевой секреции креатинина.
Увеличение производства креатинина
Креатинин вырабатывается в мышцах путем неферментативного преобразования креатина и фосфокреатинина.Вырабатываемый креатинин пропорционален мышечной массе и относительно постоянен. Печень играет важную роль в образовании креатинина посредством метилирования гуанидин-аминоуксусной кислоты. Креатинин сыворотки может варьироваться от 0,5 до 1,0 мг / дл в зависимости от суточных и менструальных изменений, расы и диеты (и метода приготовления мяса).
Повышение уровня креатинина в сыворотке крови может быть результатом повышенного потребления вареного мяса (которое содержит креатинин, преобразованный из креатина под воздействием тепла при приготовлении) или повышенного потребления белков и добавок креатина сверх рекомендуемой дозировки.Креатин присутствует в органах, мышцах и жидкостях тела животных. Креатиновые добавки способствуют синтезу белка и являются быстро доступным источником энергии для сокращения мышц, поэтому они используются для улучшения спортивных результатов. Кроме того, интенсивные упражнения могут увеличить креатинин за счет разрушения мышц. 2,3
Помехи в анализе
Как указывалось ранее, реакция Яффе представляет собой колориметрический анализ. На него могут влиять другие эндогенные хромогены, такие как ацетон и ацетоацетат (например, при диабетическом кетоацидозе), голодание, липемия и гемолиз, что приводит к завышению креатинина сыворотки.Лекарства, которые могут помешать анализу, включают антибиотики, такие как цефалоспорины, в частности цефокситин и цефазолин; барбитураты; N-ацетилцитеин; и химиотерапевтические агенты, такие как флуцитозин (хотя и другим методом: методом Kodak Ektachem). 4,5 Другим материалом, который, как известно, мешает реакции Яффе, является нитрометан, обычный компонент топлива для радиоуправляемых транспортных средств.
В методе Kodak Ektachem для количественного определения креатинина используется реакция аммиака. Креатинин превращается в N-метилгидантоин и аммиак.Флуцитозин — единственный известный агент, вызывающий ложное повышение креатинина при использовании этого метода. 6 Этот искусственный результат приписывается 4-аминогруппе флуцитозина, которая превращается в свободный аммиак креатиниминогидролазой.
В настоящее время исследуются более конкретные методы анализа креатинина, не подверженные такому влиянию. Один из таких тестов, VITROS CREA, использует реакцию окисления для измерения уровня эндогенного креатинина и скоро будет доступен в лабораториях Kaiser Permanente.Анализ VITROS CREA позволяет более точно определять креатинин.
Пониженная секреция
Примерно 15% креатинина секретируется в канальцах. Он вырабатывается секреторной помпой органических катионов, которая может подавляться другими органическими катионами. Триметоприм, циметидин и другие препараты, блокирующие h3, могут ингибировать этот процесс и вызывать повышение измеренного сывороточного креатинина 7,8 (Таблица 1).
Дело в вопросе
У вышеупомянутой пациентки мы прекратили прием фенофибрата, и через несколько месяцев мы увидели, что у нее нормализовался уровень креатинина.Предполагается, что фибраты (особенно фенофибрат) нарушают выработку сосудорасширяющих простагландинов и могут изменять внутрипочечную гемодинамику, возможно, изменяя СКФ, но окончательный механизм, с помощью которого это происходит, еще предстоит выяснить. 9
Тематические исследования пациентов с трансплантатом почки показали доказательства канальцевой токсичности, вызванной фенофибратами, и повышенного производства креатинина. 10 Величина изменений креатининемии колебалась от 8% до 18% для фенофибрата.Однако было показано, что изменение креатинина обратимо после отмены фибратов.
В заключение, при обнаружении повышенного креатинина сыворотки важно оценить пациента в целом, чтобы исключить возможные причины.
Заявление о раскрытии информацииАвтор (ы) не имеет конфликта интересов, о котором следует сообщать.
Благодарность
Лесли И. Паркер, ELS, оказала помощь в редактировании.
Список литературы
1.Шемеш О., Гольбец Х., Крисс Дж. П., Майерс Б. Д.. Ограничения креатинина как маркера фильтрации у пациентов с гломерулопатией. Kidney Int 1985 ноября; 28 (5): 830-8.
2. Гамильтон Р. В., Гарднер Л. Б., Пенн А. С., Голдберг М. Острый некроз канальцев, вызванный миоглобинурией, вызванной физической нагрузкой. Ann Intern Med 1972 Jul; 77 (1): 77-82.
3. Ой, MS. Повышается ли уровень креатинина в сыворотке быстрее при рабдомиолизе? Нефрон 1993; 63 (3): 255-7.
4. Молич М.Е., Родман Э., Хирш К.А., Дубинский Э. Ложное повышение креатинина сыворотки при кетоацидозе.Ann Intern Med, август 1980; 93 (2): 280-1.
5. Саах А.Дж., Кох Т.Р., Друсано ГЛ. Цефокситин ложно повышает уровень креатинина. JAMA 1982, 8 января; 247 (2): 205-6.
6. Митчелл EK. Флуцитозин и ложное повышение уровня креатинина сыворотки. Ann Intern Med 1984, август; 101 (2): 278.
7. Берг К.Дж., Гьелестад А., Нордби Г. и др. Почечные эффекты триметоприма у пациентов с аллографией почек, получавших циклоспорин и азатиоприн. Нефрон 1989; 53 (3): 218-22.
8. Кемперман Ф.А., Зильбербуш Дж., Слаатс Э.Х., Принс А.М., Krediet RT, Арис Л.Наблюдение за СКФ по креатинину плазмы после введения циметидина у пациентов с сахарным диабетом 2 типа. Clin Nephrol 2000 Oct; 54 (4): 255-60.
9. Broeders N, Knoop C, Antoine M, Tielemans C, Abramowicz D. Повышение уровня мочевины и креатинина в крови, индуцированное фибратами: является ли гемфиброзил единственным безвредным агентом? Пересадка нефрола Dial 2000 Dec; 15 (12): 1993-9.
10. Анхелес С., Лейн Б.П., Миллер Ф., Норд ЕР. Связанная с фенофибратом обратимая острая дисфункция аллотрансплантата у 3 реципиентов почечного трансплантата: биопсия, свидетельствующая о канальцевой токсичности.Am J Kidney Dis 2004 сентябрь; 44 (3): 543-50.
Коронавирус: повреждение почек, вызванное COVID-19
Инфекционные заболеванияРекомендуемые эксперты:
COVID-19 — заболевание, вызванное коронавирусом, которое привело к глобальной пандемии, — как известно, поражает легкие. Но по мере того, как заражается все больше людей, появляется большее понимание болезни.
Врачи и исследователи обнаруживают, что этот коронавирус, официально называемый SARS-CoV-2, также может причинить серьезный и длительный вред другим органам, включая сердце и почки.К. Джон Сперати, доктор медицины, магистр медицины, специалист по здоровью почек, обсуждает, как новый коронавирус может повлиять на функцию почек по мере развития болезни и впоследствии по мере выздоровления человека.
COVID-19 Поражение почек: возможное осложнение
У некоторых людей, страдающих тяжелыми случаями COVID-19, наблюдаются признаки поражения почек, даже у тех, у кого не было основных проблем с почками до заражения коронавирусом. В ранних отчетах говорится, что до 30% пациентов, госпитализированных с COVID-19 в Китае и Нью-Йорке, получили умеренное или тяжелое повреждение почек.В отчетах врачей из Нью-Йорка говорится, что процент может быть выше.
Признаки проблем с почками у пациентов с COVID-19 включают высокий уровень белка в моче и нарушение работы крови.
Поражение почек в некоторых случаях достаточно серьезное, чтобы потребовать диализа. Некоторые больницы, в которых наблюдается резкое увеличение количества пациентов, которые серьезно болеют COVID-19, сообщили, что им не хватает оборудования и стерильных жидкостей, необходимых для выполнения этих процедур почек.
«Многие пациенты с тяжелой формой COVID-19 — это пациенты с сопутствующими хроническими заболеваниями, включая высокое кровяное давление и диабет.Оба эти фактора увеличивают риск заболевания почек », — говорит Сперати.
Но Сперати и другие врачи также наблюдают повреждение почек у людей, у которых не было проблем с почками до того, как они заразились вирусом.
Как COVID-19 повреждает почки?
Воздействие COVID-19 на почки еще не ясно. Вот некоторые возможности, которые изучают врачи и исследователи:
Коронавирус может поражать клетки почек
Сам вирус поражает клетки почек.Клетки почек имеют рецепторы, которые позволяют новому коронавирусу прикрепляться к ним, вторгаться и копировать себя, потенциально повреждая эти ткани. Подобные рецепторы обнаружены в клетках легких и сердца, где, как было показано, новый коронавирус вызывает травмы.
Недостаток кислорода может привести к нарушению работы почек
Другая возможность заключается в том, что проблемы с почками у пациентов с коронавирусом связаны с аномально низким уровнем кислорода в крови, результатом пневмонии, обычно наблюдаемой в тяжелых случаях заболевания.
Цитокиновые бури могут разрушить ткань почек
Также может быть ответственна реакция организма на инфекцию. Иммунный ответ на новый коронавирус у некоторых людей может быть экстремальным, что приводит к так называемому цитокиновому шторму.
Когда это происходит, иммунная система посылает в организм прилив цитокинов. Цитокины — это небольшие белки, которые помогают клеткам общаться, когда иммунная система борется с инфекцией. Но этот внезапный большой приток цитокинов может вызвать сильное воспаление.При попытке убить вторгшийся вирус эта воспалительная реакция может разрушить здоровую ткань, в том числе почек.
COVID-19 вызывает образование тромбов, которые могут закупоривать почки
Почки подобны фильтрам, которые задерживают токсины, лишнюю воду и продукты жизнедеятельности из организма. COVID-19 может вызывать образование крошечных сгустков в кровотоке, которые могут закупоривать мельчайшие кровеносные сосуды в почке и нарушать ее функцию.
Команда Джона Хопкинса разрабатывает метод приготовления диализной жидкости для пациентов с COVID-19
Когда в нью-йоркских больницах начали заканчиваться диализирующая жидкость для того типа диализа, который используется в реанимации, на звонок ответила группа из Джона Хопкинса.
Повреждение почек коронавирусом: серьезный признак
Системы органов, такие как сердце, легкие, печень и почки, зависят и поддерживают функции друг друга, поэтому, когда новый коронавирус наносит ущерб в одной области, другие могут оказаться в опасности. Основные функции почек влияют на сердце, легкие и другие системы. Возможно, поэтому врачи отмечают, что повреждение почек, возникающее у пациентов с COVID-19, является возможным предупреждающим знаком о серьезном, даже фатальном течении болезни.
Могут ли почки восстановиться после COVID-19?
На данный момент, говорит Сперати, неизвестно, у скольких людей с повреждением почек, вызванным COVID-19, функция почек восстанавливается.
Он говорит: «Пациенты с острым повреждением почек из-за COVID-19, которым не требуется диализ, будут иметь лучшие результаты, чем те, кто нуждается в диализе, и мы видели пациентов в Johns Hopkins, у которых восстанавливалась функция почек. У нас даже были пациенты в отделении интенсивной терапии с острым повреждением почек, которым требовался диализ, и впоследствии функция почек восстановилась.Как часто это происходит, до сих пор неизвестно, но, несомненно, необходимость в диализе вызывает беспокойство у пациентов с COVID-19 ».
Следует ли мне продолжать принимать лекарства от высокого кровяного давления?
Гипертония (высокое кровяное давление) — частая причина проблем с почками. Гипертония повреждает кровеносные сосуды почек и влияет на их способность фильтровать кровь. Почки также помогают регулировать кровяное давление, поэтому повреждение почек может усугубить гипертонию. Со временем гипертония может вызвать почечную недостаточность.
Если вы живете с гипертонией, вы можете принимать лекарства от этой проблемы. Возможно, вы читаете новостные статьи, в которых ставится под сомнение безопасность приема определенных лекарств, отпускаемых по рецепту, для лечения их состояния: ингибиторов АПФ и блокаторов рецепторов ангиотензина (БРА).
Сперати говорит, что пациенты должны продолжать принимать лекарства и обсуждать проблемы со своими врачами.
«Сейчас по этому поводу спорят две стороны. Одна сторона утверждает, основываясь на исследованиях на животных, что эти лекарства могут быть вредными, увеличивая риск заражения.Другой говорит, что эти же препараты могут защитить от повреждения легких и других проблем, связанных с COVID-19.
«Но все профессиональные сообщества опубликовали статьи, рекомендующие не менять лекарства», — говорит он. Он добавляет, что соблюдение назначенного курса может снизить риск повреждения сердца и почек из-за неконтролируемого высокого кровяного давления.
Сперати рекомендует пациентам с проблемами почек воздерживаться от нестероидных противовоспалительных препаратов (НПВП), таких как ибупрофен и напроксен.Они могут повышать кровяное давление и увеличивать объем жидкости в организме, что создает нагрузку на почки.
Исследования показывают больше информации о поражении почек SARS-CoV-2
Хотя поражение почек при COVID-19 все еще недостаточно изучено, дополнительные данные покажут, как это происходит. Сперати, который также проводит исследования заболеваний почек, говорит, что отделение нефрологии Джона Хопкинса изучает, как именно SARS-CoV-2 — и реакция организма на него — влияет на здоровье почек.
Он говорит, что пациенты с повреждением почек, связанным с COVID-19, должны проконсультироваться со своими врачами, чтобы убедиться, что функция почек возвращается к норме. Длительное повреждение почек может потребовать диализа или других методов лечения даже после выздоровления от COVID-19.
В основном Сперати подчеркивает важность соблюдения правил физического дистанцирования и мытья рук, основ профилактики. «Для всех, особенно для людей с хроническими заболеваниями, крайне важно избегать заражения COVID-19 как можно дольше», — говорит он.
«Сейчас у нас нет лечения или вакцины от этой болезни. Чем дольше человек может не заразиться, тем больше у него шансов получить пользу от терапии в будущем ».
Коронавирус (COVID-19)
Что вам нужно знать от Johns Hopkins Medicine.
Обновлено: 14 мая 2020 г.
Почечная биопсия Необъяснимое повышение уровня креатинина в сыворотке — Просмотр полного текста
Хроническая болезнь почек (ХБП) может рассматриваться как имеющаяся, если у пациента скорость клубочковой фильтрации (СКФ) <60 мл / мин или имеются маркеры структурного заболевания почек, которые были выявлены. присутствует более 3 месяцев.К ним относятся протеинурия, гематурия и радиологические отклонения.
ХБП — важная проблема для глобального здравоохранения. Он встречается у 10% населения Земли. Стандартизованная по возрасту глобальная распространенность ХБП 1–5 стадий у взрослых в возрасте 20 лет и старше составила 10,4% у мужчин и 11,8% у женщин. Заболеваемость терминальной почечной недостаточностью увеличивается во всем мире с ежегодным приростом на 8%.
В 2010 году общее количество пациентов, получавших заместительную почечную терапию (ЗПТ) во всем мире, составило 2 человека.6 миллионов, в то время как количество пациентов, нуждающихся в этом лечении, оценивается от 4,9 до 9,7 миллиона, с самым большим разрывом между потребностью и предложением ЗПТ в странах с низкими доходами, особенно в Азии и Африке.
В 2013 г. Египет входил в число стран, для которых ХБП входила в топ-10 по потерянным годам жизни (ПЖЖ, рассчитанному путем умножения числа смертей на ожидаемую продолжительность жизни на момент смерти в контрольной группе населения) из-за преждевременной смерти и инвалидности. — Скорректированные годы жизни (DALY), чтобы отразить степень инвалидности, такую как боль или функциональные ограничения, вызванные каждым заболеванием.
Раннее выявление и лечение ХБП могут быть реализованы с минимальными затратами и снизят бремя ТПН, улучшат исходы диабета и сердечно-сосудистых заболеваний (включая гипертонию) и существенно снизят заболеваемость и смертность от неинфекционных заболеваний (НИЗ).
Диабет и гипертония являются преобладающими факторами риска хронической болезни почек (ХБП) во всем мире. Инфекционные заболевания, приводящие к гломерулонефриту, также важны в странах с низким уровнем дохода.Однако за последние два десятилетия у людей без этих факторов риска регистрировалась тяжелая форма ХБП. ХБП неизвестной этиологии (ХБП) поражает взрослых в возрасте от третьего до пятого десятилетия жизни и часто приводит к летальному исходу из-за прогрессирования заболевания и отсутствия вариантов диализа или трансплантации в затронутых географических регионах. CKDu был зарегистрирован в Шри-Ланке, нескольких странах Центральной Америки, штате Андхра-Пракеш в Индии и Египте.
Помимо стандартного обследования случаев ХБП, биопсия почек показана пациентам с ХБП, почки которых нормальные или почти нормальные по размеру, и диагноз не может быть установлен другими способами.
Биопсия почек определенно по-прежнему играет важнейшую и незаменимую роль в исследованиях случаев необъяснимой почечной недостаточности. Несмотря на то, что результаты биопсии у разных пациентов сильно различаются, биопсия почек помогла определить наилучшее лечение и прогноз для пациентов.
Хроническая болезнь почек — Диагноз
Хроническая болезнь почек (ХБП) может быть диагностирована с помощью анализов крови и мочи.
Во многих случаях ХБП обнаруживается только тогда, когда обычный анализ крови или мочи, который у вас есть для другой проблемы, показывает, что ваши почки могут не работать нормально.
Кому следует пройти обследование на ХБП?
Обратитесь к своему терапевту, если у вас стойкие симптомы ХБП, например:
Ваш терапевт может найти другие возможные причины и при необходимости назначить анализы.
Поскольку на ранних стадиях ХБП часто протекает бессимптомно, некоторые люди с повышенным риском должны проходить регулярное обследование.
Регулярное обследование рекомендуется, если у вас:
У вас также больше шансов заболеть почечной недостаточностью, если вы темнокожий или человек южноазиатского происхождения.
Люди, длительно принимающие лекарства, которые могут повлиять на почки, такие как литий, омепразол или нестероидные противовоспалительные препараты (НПВП), также должны регулярно проходить тестирование.
Поговорите со своим терапевтом, если вы считаете, что вам могут потребоваться регулярные анализы на заболевание почек.
Тесты на ХБП
Анализ крови
Основным тестом на заболевание почек является анализ крови. Тест измеряет уровень креатинина в крови.
Ваш врач использует результаты вашего анализа крови, а также данные о вашем возрасте, размере, поле и этнической группе, чтобы вычислить, сколько миллилитров отходов ваши почки могут отфильтровать за минуту.
Этот расчет известен как расчетная скорость клубочковой фильтрации (рСКФ).
Здоровые почки должны фильтровать более 90 мл / мин. У вас может быть CKD, если ваш показатель ниже этого.
Анализ мочи
Анализ мочи также проводится, чтобы:
- проверить уровни веществ, называемых альбумином и креатинином, в вашей моче, известных как соотношение альбумин: креатинин, или ACR
- для проверки крови или белка в моче
Наряду с рСКФ анализы мочи могут помочь дать более точное представление о том, насколько хорошо работают ваши почки.
Другие тесты
Иногда для оценки степени повреждения почек также используются другие тесты.
Сюда могут входить:
- УЗИ, МРТ или КТ — чтобы увидеть, как выглядят почки, и проверить, есть ли какие-либо закупорки.
- Биопсия почки — небольшой образец ткани почек удаляется с помощью иглы. и клетки исследуются под микроскопом на наличие признаков повреждения
Результаты тестов и стадии ХБП
Результаты вашего теста могут быть использованы для определения степени повреждения почек, известной как стадия ХБП.
Это может помочь вашему врачу выбрать лучшее лечение для вас и как часто вам следует сдавать анализы для наблюдения за вашим состоянием.
Ваши результаты рСКФ представлены в виде стадии от 1 из 5:
- стадия 1 (G1) — нормальная рСКФ выше 90 мл / мин, но другие тесты выявили признаки повреждения почек
- стадия 2 (G2) — a немного сниженная рСКФ от 60 до 89 мл / мин, с другими признаками поражения почек
- стадия 3a (G3a) — рСКФ от 45 до 59 мл / мин
- стадия 3b (G3b) — рСКФ от 30 до 44 мл / мин
- стадия 4 (G4) — рСКФ от 15 до 29 мл / мин
- стадия 5 (G5) — рСКФ ниже 15 мл / мин, что означает, что почки утратили почти всю свою функцию
Ваш результат ACR представлен как стадия от 1 до 3:
- A1 — ACR менее 3 мг / ммоль
- A2 — ACR от 3 до 30 мг / ммоль
- A3 — ACR более 30 мг / ммоль
Как для рСКФ, так и для ACR , Более высокая стадия указывает на более тяжелое заболевание почек.


 Резистентность к АРС увеличивает при стимуляции овуляции и сохраняется на повышенном уровне при проведении поддержки лютеиновой фазы. Важно отметить, что нарушение функции естественных антикоагулянтов и развитие резистентности к АРС представляет особый риск у пациенток с мутацией FV Leiden и антифосфолипидным синдром, когда уже исходно имеющаяся резистентность к АРС определяется фоновое повышение риска тромбоэмболических осложнений.
Резистентность к АРС увеличивает при стимуляции овуляции и сохраняется на повышенном уровне при проведении поддержки лютеиновой фазы. Важно отметить, что нарушение функции естественных антикоагулянтов и развитие резистентности к АРС представляет особый риск у пациенток с мутацией FV Leiden и антифосфолипидным синдром, когда уже исходно имеющаяся резистентность к АРС определяется фоновое повышение риска тромбоэмболических осложнений. В отличие от нормальных циклов стимуляции овуляции, когда наблюдаются минимальные изменения гематокрита, при СГЯ имеет место выраженная гемоконцентрация, что многократно повышает риск ВТЭ.
В отличие от нормальных циклов стимуляции овуляции, когда наблюдаются минимальные изменения гематокрита, при СГЯ имеет место выраженная гемоконцентрация, что многократно повышает риск ВТЭ. Таким образом, гиперкоагуляция, связанная с гиперэстрогенией, имеющая место во время стимуляции овуляции, может усиливаться под действием ЧХГ, что имеет место и во время физиологической беременности.
Таким образом, гиперкоагуляция, связанная с гиперэстрогенией, имеющая место во время стимуляции овуляции, может усиливаться под действием ЧХГ, что имеет место и во время физиологической беременности.