3. Жизненный цикл малярийных плазмодиев. Пути и источники заражения.
При малярии возможны различные механизмы передачи инфекции.
♦ Трансмиссивный механизм (при укусе комара). Этот механизм является основным, обеспечивающим существование плазмодиев как биологического вида. Источник инфекции – человек, в крови которого имеются зрелые гаметоциты. Переносчики малярии — только женские особи комаров рода Anopheles.
♦ Трансплацентарный механизм передачи (от матери плоду). Чаще заражение происходит во время родов при попадании в кровоток новорожденного некоторого количества материнской крови, в эритроцитах которой находятся бесполые формы паразита.
♦ При гемотрансфузиях и реже при нарушениях асептики при инъекциях. В случае заражения при переливании крови источником инфекции является донор-паразитоноситель.
Стадии
развития малярийных паразитов.
В ходе шизогонии у всех видов малярийных паразитов традиционно выделяют 3 стадии: экзо-эритроцитарную шизогонию (ЭЭШ), эритроцитарную шизогонию (ЭШ) и гаметогонию. Кроме того, в жизненных циклах P. vivax иP. ovale выделяют отдельную стадию («спячку») вследствие возможного внедрения в организм человека при укусе комара спорозоитов морфологически неоднородной группы — тахиспорозоитов и брадиспорозоитов или только брадиспорозоитов. В этих случаях брадиспорозоиты (гипнозоиты) длительно сохраняются в гепатоцитах в неактивном состоянии до начала ЭЭШ.
Экзоэритроцитарная шизогония. Внедренные со слюной комара в организм
человека спорозоиты очень быстро (в
течение 15-30 мин) попадают с кровотоком
в печень, где активно проникают в
гепатоциты, не повреждая их. Спорозоиты P. falciparum, P.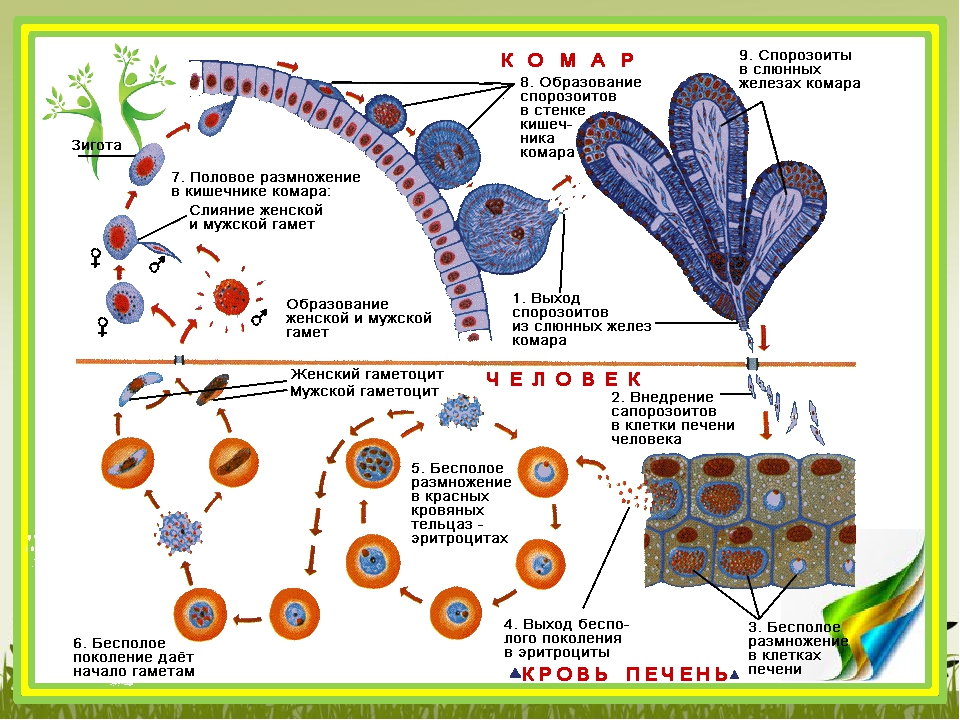 malariae и тахиспорозоитыP.
vivax иP. ovale немедленно начинают
ЭЭШ с образованием большого количества
экзоэритроцитарных мерозоитов. Гепатоциты
разрушаются, и мерозоиты снова попадают
в кровоток с последующим быстрым (в
течение 15-30 мин) внедрением в эритроциты.
Длительность ЭЭШ при малярии falciparum
обычно составляет 6 дней, при малярии
vivax — 8, при малярии ovale — 9, при малярии
malariae — 15 дней.
malariae и тахиспорозоитыP.
vivax иP. ovale немедленно начинают
ЭЭШ с образованием большого количества
экзоэритроцитарных мерозоитов. Гепатоциты
разрушаются, и мерозоиты снова попадают
в кровоток с последующим быстрым (в
течение 15-30 мин) внедрением в эритроциты.
Длительность ЭЭШ при малярии falciparum
обычно составляет 6 дней, при малярии
vivax — 8, при малярии ovale — 9, при малярии
malariae — 15 дней.
Стадия «спячки». При малярии vivax и малярии ovale брадиспорозоиты, внедрившиеся в гепатоциты, превращаются в неактивные формы — гипнозоиты, которые могут оставаться без деления несколько месяцев или даже лет до последующей реактивации.
Эритроцитарная
шизогония. После внедрения мерозоитов
в эритроциты малярийные паразиты
многократно (циклически) последовательно
проходят стадии трофозоита (питающаяся
одноядерная клетка), шизонта (делящаяся
многоядерная клетка) и морулы
(сформировавшиеся паразиты, находящиеся
внутри эритроцита). В последующем после
разрушения эритроцитов в плазму крови
попадают мерозоиты.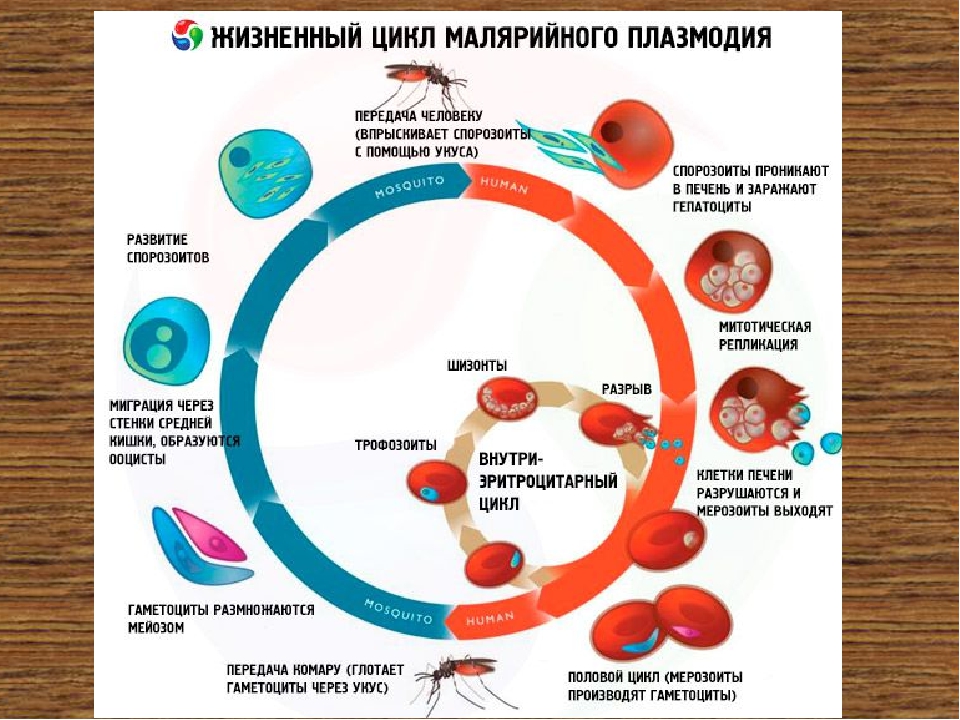
Стадия ЭШ имеет строго определенную длительность: 48 ч при малярии falciparum, малярии vivax и малярии ovale и 72 ч при малярии malariae.
4. Патогенное действие, лабораторная диагностика малярии и профилактика.
Малярийные плазмодии вызывают малярию — острое протозойное заболевание человека с трансмиссивным механизмом заражения, характеризующееся выраженными симптомами интоксикации, циклическим течением с чередованием приступов лихорадки и периодов апирексии, увеличением селезенки и печени, развитием гемолитической анемии, рецидивами.
Клинические проявления. Клиническое течение малярии зависит от состояния иммунитета больного и вида возбудителя. Необходимо отметить, что малярия vivax, малярия ovale и малярия malariae протекают доброкачественно и почти никогда не заканчиваются летально, в то время как тропическая малярия при позднем или неадекватном лечении часто приводит к смерти.
Основу
клинической картины любой формы малярии
составляет малярийный пароксизм
(при-ступ), включающий последовательные
фазы разной длительности: озноб (1-3 ч и
более), жар (5-8 ч и более) и потоотделение.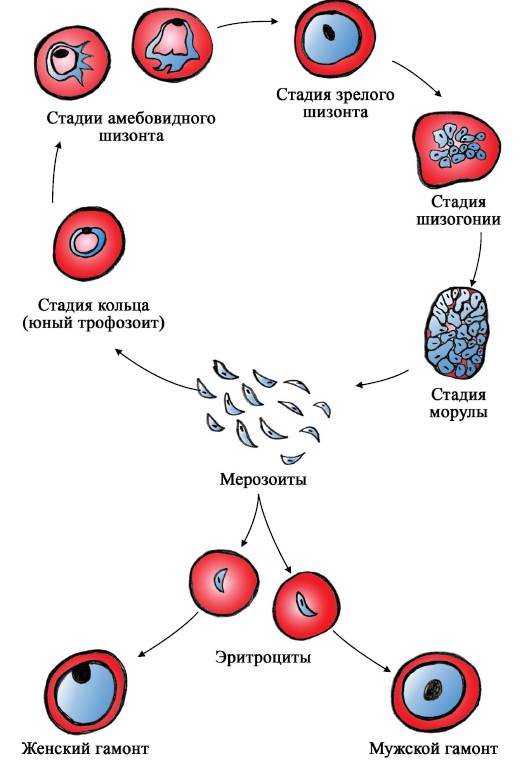
Малярия vivax ималярия ovale. Существенных различий в клинических проявлениях этих форм малярии не отмечается. Заболевание развивается после короткой или (реже) длительной инкубации. За 1-2 сут или за несколько часов до появления лихорадки может отмечаться продромальный период (недомогание, познабливание, головная боль).
Типичные
малярийные пароксизмы обычно начинаются
в первой половине дня с озноба и быстрого
повышения температуры тела до 39-40 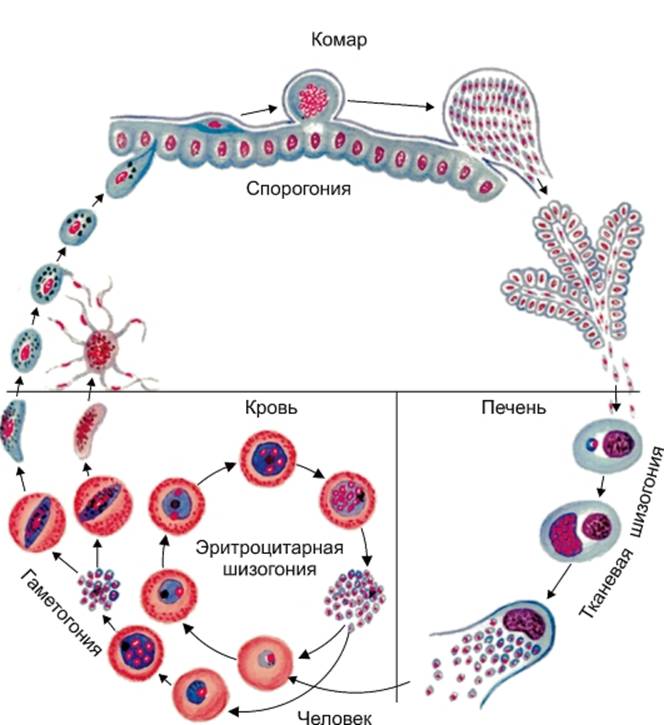 Следующий
пароксизм развивается через день. Через
3-5 дней после начала заболевания
отмечаются гепато- и спленомегалия
(увеличение печени и селезенки), через
10-14 дней — анемия, которые, как правило,
выражены умеренно. Если больному не
проводят специфическую терапию, приступы
повторяются в течение 2-4 нед и более,
постепенно становясь более легкими, и
затем самопроизвольно прекращаются.
Следующий
пароксизм развивается через день. Через
3-5 дней после начала заболевания
отмечаются гепато- и спленомегалия
(увеличение печени и селезенки), через
10-14 дней — анемия, которые, как правило,
выражены умеренно. Если больному не
проводят специфическую терапию, приступы
повторяются в течение 2-4 нед и более,
постепенно становясь более легкими, и
затем самопроизвольно прекращаются.
В отсутствие специфической терапии (или при неадекватной терапии) через 1-2 мес после се-рии малярийных пароксизмов могут развиться ранние рецидивы, обусловленные активизацией эритроцитарной шизогонии, а через 6-8 мес и более — поздние рецидивы (экзоэритроцитарные).
Малярия malariae. Инкубационный период обычно
составляет от 3 до 6 нед. Пароксизмы при
малярии malariae отличаются наиболее
длительным ознобом по сравнению с
другими формами малярии. Длительность
пароксизма — до 13 ч и более. Анемия,
сплено- и гепатомегалия развиваются
более медленно. При отсутствии лечения
клинические проявления малярии malariae
купируются самостоятельно после 8-14
приступов.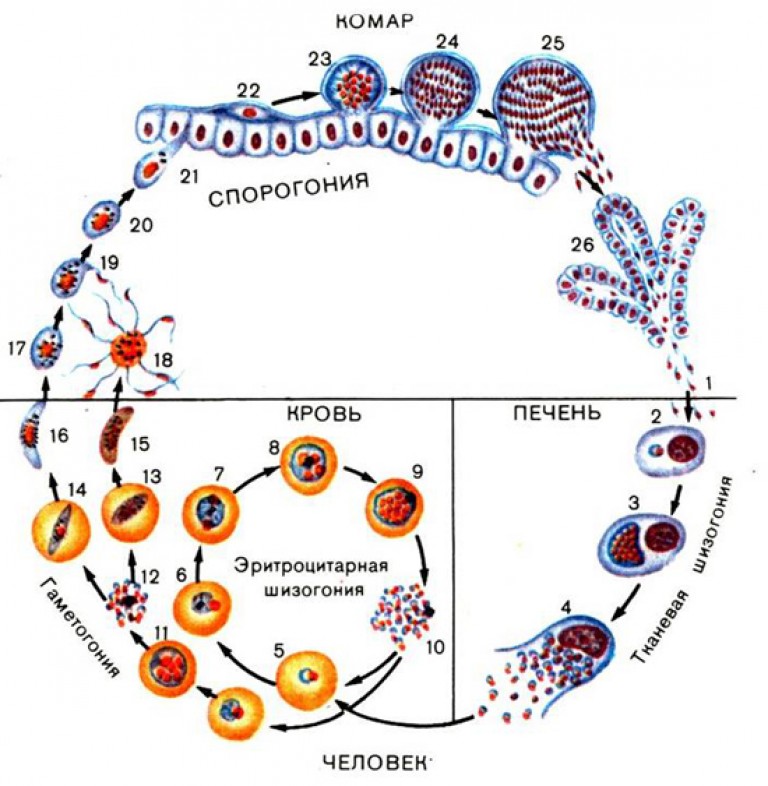 Через 2- 6 нед возможно развитие
рецидивов.
Через 2- 6 нед возможно развитие
рецидивов.
Малярия
 Развитие
сплено- и гепатомегалии наблюдается
через 3-4 дня.
Развитие
сплено- и гепатомегалии наблюдается
через 3-4 дня.Профилактика. Профилактические мероприятия в очаге предусматривают своевременное выявление и лечение больных и паразитоносителей (источники инфекции), а также борьбу с переносчиками малярии. Эффективных вакцин для активной иммунизации против малярии пока нет.
Профилактика заражения заключается в принятии мер защиты от укусов комаров (использование репеллентов, сеток на окнах и дверях, надкроватных пологов, одежды, закрывающей руки и ноги лиц, находящихся на открытом воздухе в вечернее и ночное время.
Генетические варианты, связанные с изменением свойств эритроцитов и обеспечивающие устойчивость к возбудителям малярии.
Серповидно-клеточные
анемии. Эта мутация приводит к
пониженной растворимости гемоглобина
и повышению его полимеризации, что в
свою очередь обусловливает изменение
формы эритроцитов, которые становятся
серповидными. Такие эритроциты теряют
эластичность, закупоривают мелкие
сосуды и гемолизируются.
Отсутствие антигенов Даффи в эритроцитах. Единственной аномалией, защищающей от малярии и не вызывающей патологию, является отсутствие антигенов Даффи в эритроцитах жителей Западной и Центральной Африки. Эта мутация делает ее носителей невосприимчивыми к трехдневной малярии, так какP. vivax не могут проникать в эритроциты, не имеющие антигенов Даффи, выполняющих роль рецепторов для плазмодия данного вида. В Западной и Центральной Африке частота такой аномалии составляет 97 %. Только в этих регионах земного шара встречаются гомозиготы по данной мутации.
Генетически обусловленная недостаточность мембранных эритроцитарных белков — глико-форинов А, В, С. Эти белки выполняют роль рецепторов для связывания с паразитом. Их генетическая недостаточность делает эритроциты относительно устойчивыми к инвазии P. falciparum.
Определенной
устойчивостью к заражению всеми формами
малярии обладают также новорожденные.
Это объясняется наличием пассивного
иммунитета за счет антител класса G,
получаемых от гипериммунной матери;
поддержанием специфического иммунитета
после рождения за счет антител класса
А, получаемых с грудным молоком; наличием
у новорожденного фетального гемоглобина.
Иммунитет при малярии нестойкий и непродолжительный. Для поддержания защитного уровня антител необходима постоянная антигенная стимуляция в виде повторных заражений малярией. Иммунитет к P. malariae иP. vivax формируется раньше и сохраняется дольше, чем кP. falciparum.
Малярия
Инфекционная болезнь, вызываемая малярийными плазмодиями; характеризуется периодическими приступами лихорадки, увеличением печени и селезенки, анемией, рецидивирующим течением. Распространение малярии ограничено ареалом переносчиков – комаров рода Anopheles и температурой окружающей среды, обеспечивающей завершение развития возбудителя в организме комара, т. е. 64° северной и 33° южной широты; заболевание распространено в странах Африки, Юго-Восточной Азии и Южной Америки. В России регистрируются главным образом завозные случаи.
Возбудители малярии – простейшие рода плазмодиев. У человека паразитируют плазмодии 4 видов: Plasmodium vivax, P. ovale, P. malariae, P. falciparum. Наиболее широко распространен P. vivax, так как он способен развиваться в переносчике при более низкой температуре, чем плазмодии других видов. Жизненный цикл возбудителей малярии включает двух хозяев: человека и комара. В организме комара-переносчика плазмодии проходят половое развитие (половой процесс и спорогонию), в организме человека – бесполое развитие (шизогонию). Комар, питаясь кровью больного малярией (или паразитоноснтеля), заглатывает плазмодии. В желудке насекомого бесполые стадии паразитов перевариваются, а половые гаметоциты оплодотворяются и претерпевают ряд превращений, в результате чего появляются спорозоиты, скапливающиеся в слюнных железах комара-переносчика. При последующем питании на человеке комар со слюной вводит спорозоитов в его организм, где происходит процесс шизогонии. Кровью и лимфой спорозоиты заносятся в печень человека, и в ее клетках – гепатоцитах осуществляется тканевая (экзоэритроцитарная) шизогония, вследствие чего развиваются экзоэритроцитарные трофозоиты, а затем шизонты.
ovale, P. malariae, P. falciparum. Наиболее широко распространен P. vivax, так как он способен развиваться в переносчике при более низкой температуре, чем плазмодии других видов. Жизненный цикл возбудителей малярии включает двух хозяев: человека и комара. В организме комара-переносчика плазмодии проходят половое развитие (половой процесс и спорогонию), в организме человека – бесполое развитие (шизогонию). Комар, питаясь кровью больного малярией (или паразитоноснтеля), заглатывает плазмодии. В желудке насекомого бесполые стадии паразитов перевариваются, а половые гаметоциты оплодотворяются и претерпевают ряд превращений, в результате чего появляются спорозоиты, скапливающиеся в слюнных железах комара-переносчика. При последующем питании на человеке комар со слюной вводит спорозоитов в его организм, где происходит процесс шизогонии. Кровью и лимфой спорозоиты заносятся в печень человека, и в ее клетках – гепатоцитах осуществляется тканевая (экзоэритроцитарная) шизогония, вследствие чего развиваются экзоэритроцитарные трофозоиты, а затем шизонты. Шизонты быстро растут, ядра их многократно делятся и в результате образуется от 10 000 до 40 000 мерозоитов, которые выходят из гепатоцитов, прикрепляются к эритроциту и внедряются в него. Продолжительность тканевой шизогонии у P. falciparum – 6 – 8 суток, у P. Vivax – 8 – 10 суток, у P. ovale – 9 – 10 суток и у P. malariae – 15 – 20 суток.
Шизонты быстро растут, ядра их многократно делятся и в результате образуется от 10 000 до 40 000 мерозоитов, которые выходят из гепатоцитов, прикрепляются к эритроциту и внедряются в него. Продолжительность тканевой шизогонии у P. falciparum – 6 – 8 суток, у P. Vivax – 8 – 10 суток, у P. ovale – 9 – 10 суток и у P. malariae – 15 – 20 суток.
Источником возбудителей является больной человек или паразитоноснтель, в крови которого имеются гаметоциты. Переносчики возбудителя – самки комара рода Anopheles. Возможно внутриутробное заражение плода через плаценту или в процессе родов, а также заражение при переливании крови, полученной от паразитоносителей.
Клиническая картина болезни в значительной степени обусловлена видом возбудителя, поэтому разлгмают четыре формы малярии: трехдневную, вызываемую P. vivax; овале-малярию, возбудителем которой является P. ovale; четырехдневную, обусловленную P. malariae; тропическую, возбудитель – P. falciparum.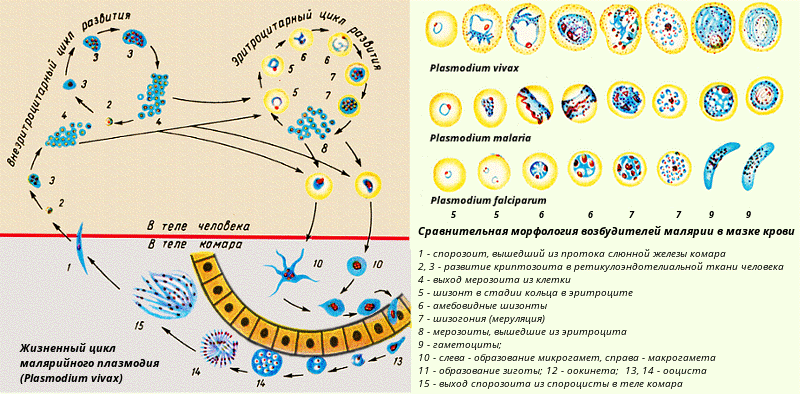 Однако ряд клишмеских проявлений болезни свойствен всем формам. Длительность инкубационного периода зависит от вида возбудителя. При тропической малярии он составляет 6 – 16 дней, при трехдневной с коротким инкубационным периодом – 7 – 21 день (при длинной инкубации – 8 – 14 мес), при овале-малярии – 7 – 20 дней (в ряде случаев 8 – 14 мес), четырехдневной – 14 – 42 дня. В начале болезни может быть период продромы, проявляющийся недомоганием, сонливостью, головной болью, ломотой в теле, ремиттирующей лихорадкой. Через 3 – 4 дня возникает приступ малярии, в течение которого выделяют три периода – озноб, жар, обильное потоотделение.
Однако ряд клишмеских проявлений болезни свойствен всем формам. Длительность инкубационного периода зависит от вида возбудителя. При тропической малярии он составляет 6 – 16 дней, при трехдневной с коротким инкубационным периодом – 7 – 21 день (при длинной инкубации – 8 – 14 мес), при овале-малярии – 7 – 20 дней (в ряде случаев 8 – 14 мес), четырехдневной – 14 – 42 дня. В начале болезни может быть период продромы, проявляющийся недомоганием, сонливостью, головной болью, ломотой в теле, ремиттирующей лихорадкой. Через 3 – 4 дня возникает приступ малярии, в течение которого выделяют три периода – озноб, жар, обильное потоотделение.
Первый период может быть выражен в различной степени: от легкого познабливания до потрясающего озноба. Лицо и конечности становятся холодными, синюшными. Пульс учащен, дыхание поверхностное. Продолжительность озноба от 30 – 60 мин до 2 – 3 ч. В период жара, продолжающегося от нескольких часов до 1 сут и больше в зависимости от вида возбудителя, общее состояние больных ухудшается.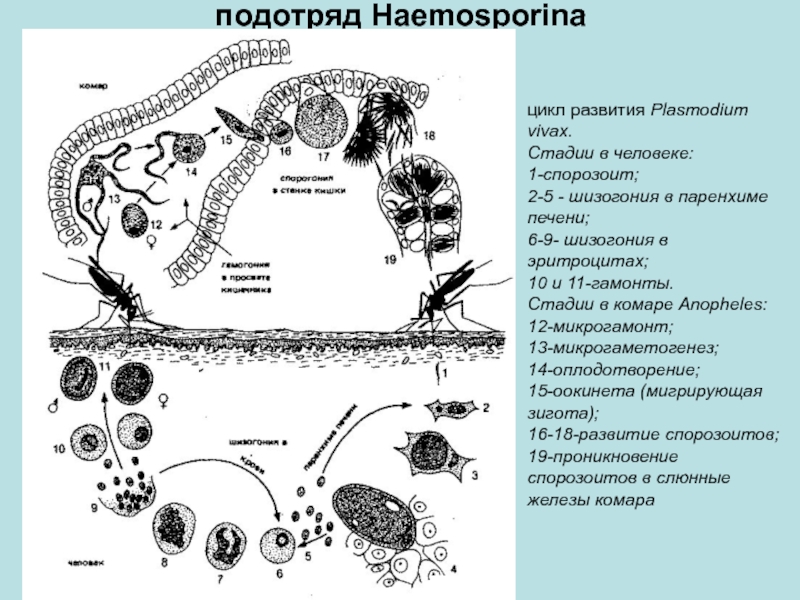 Температура достигает высоких цифр (40 – 41 °C), лицо краснеет, появляются одышка, возбуждение, нередко рвота. Головная боль усиливается. Иногда возникает бред, спутанность сознания, коллапс. Возможны поносы. Окончание приступа характеризуется снижением температуры до нормальных или субнормальных цифр и усиленным потоотделением (третий период), продолжающимся 2 – 5 ч. Затем наступает глубокий сон. В целом приступ обычно длится 6 -10 ч. В последующем в течение различного времени, в зависимости от вида возбудителя (например, один день, два дня), сохраняется нормальная температура, но больной испытывает слабость, усугубляющуюся после каждого очередного приступа. Через 3 – 4 приступа увеличиваются печень и селезенка. Одновременно развивается анемия, кожа больного приобретает бледно-желтоватый или землистый оттенок. Без лечения число приступов может доходить до 10 – 12 и более, затем они спонтанно прекращаются. Однако полного выздоровления не наступает. По прошествии нескольких недель наступает период ранних рецидивов, которые по клиническим признакам мало отличаются от первичных острых проявлений малярии.
Температура достигает высоких цифр (40 – 41 °C), лицо краснеет, появляются одышка, возбуждение, нередко рвота. Головная боль усиливается. Иногда возникает бред, спутанность сознания, коллапс. Возможны поносы. Окончание приступа характеризуется снижением температуры до нормальных или субнормальных цифр и усиленным потоотделением (третий период), продолжающимся 2 – 5 ч. Затем наступает глубокий сон. В целом приступ обычно длится 6 -10 ч. В последующем в течение различного времени, в зависимости от вида возбудителя (например, один день, два дня), сохраняется нормальная температура, но больной испытывает слабость, усугубляющуюся после каждого очередного приступа. Через 3 – 4 приступа увеличиваются печень и селезенка. Одновременно развивается анемия, кожа больного приобретает бледно-желтоватый или землистый оттенок. Без лечения число приступов может доходить до 10 – 12 и более, затем они спонтанно прекращаются. Однако полного выздоровления не наступает. По прошествии нескольких недель наступает период ранних рецидивов, которые по клиническим признакам мало отличаются от первичных острых проявлений малярии. По прекращении ранних рецидивов при трехдневной малярии и овале-малярии через 8 – 10 мес (и позже), обычно весной следующего за заражением года, могут развиться поздние рецидивы. Они протекают легче первичной болезни. У лиц, принимавших в недостаточном количестве противомалярийные средства с профилактической целью, клиническая картина болезни может быть атипичной, инкубационный период может продолжаться несколько месяцев или даже лет.
По прекращении ранних рецидивов при трехдневной малярии и овале-малярии через 8 – 10 мес (и позже), обычно весной следующего за заражением года, могут развиться поздние рецидивы. Они протекают легче первичной болезни. У лиц, принимавших в недостаточном количестве противомалярийные средства с профилактической целью, клиническая картина болезни может быть атипичной, инкубационный период может продолжаться несколько месяцев или даже лет.
Трехдневная малярия обычно протекает доброкачественно. Приступ начинается днем с внезапного подъема температуры и озноба. Приступы возникают через один день. Возможны и ежедневные приступы.
Овале-малярия сходна с трехдневной, вызванной P. vivax, но протекает легче. Приступы возникают чаще в вечерние часы.
Четырехдневная малярия, как правило, не имеет продромального периода. Болезнь начинается сразу с приступов, возникающих через 2 дня на третий или продолжается два дня подряд с одним безлихорадочным днем. Ознобы выраженыслабо.
Тропическая малярия характеризуется наиболее тяжелым течением, чаще начинается с продромальных явлений: за 2–3 дня до приступа могут появиться головная боль, артралгии, миалгии, боль в пояснице, тошнота, рвота, понос.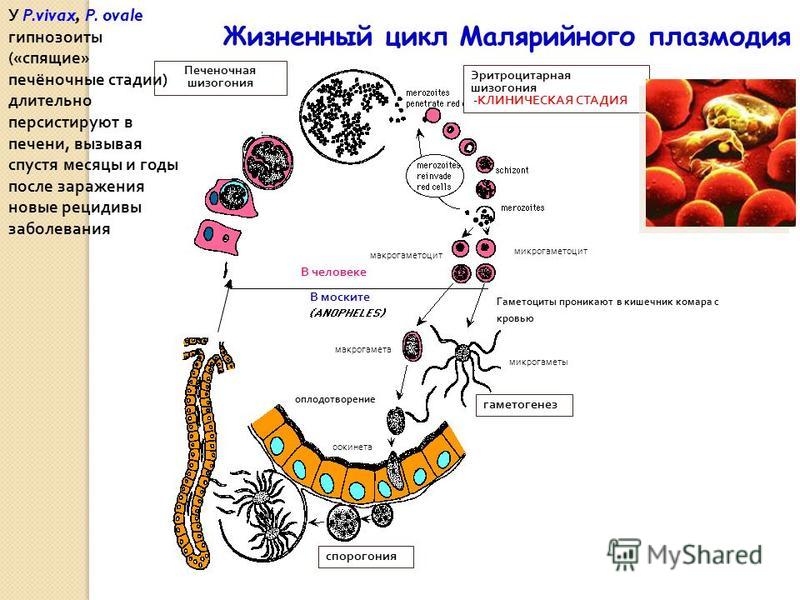 В течение нескольких дней лихорадка может иметь постоянный или неправильный характер. У жителей эндемичных районов при тропической малярии температура чаще носит перемежающийся характер. В отличие от других форм малярии при этой форме озноб менее выражен, а лихорадочный период более продолжительный – 12 – 24 и даже 36 ч. Периоды нормальной температуры короткие, потоотделение нерезкое. Уже в первые дни болезни при пальпации определяется болезненность в левом подреберье, селезенка становится доступной для пальпации через 4 – 6 дней болезни. Печень увеличивается с первых дней болезни. Нередко развивается желтуха, появляются тошнота, рвота, боль в животе, понос.
В течение нескольких дней лихорадка может иметь постоянный или неправильный характер. У жителей эндемичных районов при тропической малярии температура чаще носит перемежающийся характер. В отличие от других форм малярии при этой форме озноб менее выражен, а лихорадочный период более продолжительный – 12 – 24 и даже 36 ч. Периоды нормальной температуры короткие, потоотделение нерезкое. Уже в первые дни болезни при пальпации определяется болезненность в левом подреберье, селезенка становится доступной для пальпации через 4 – 6 дней болезни. Печень увеличивается с первых дней болезни. Нередко развивается желтуха, появляются тошнота, рвота, боль в животе, понос.
Осложнения наиболее часто наблюдаются при тропической малярии; они развиваются у неиммунных лиц и в большинстве случаев связаны с высокой паразитемией (более 100 тыс в 1 мкл крови). К ним относятся церебральная форма болезни (малярийная кома), инфекционно-токсический шок, острая почечная недостаточность, отек легких, гемоглобинурийная лихорадка.
Диагноз устанавливают на основании клинической картины (появление характерных малярийных приступов) и данных эпидемиологического анамнеза (например, пребывание в местности, неблагополучной по малярии в последние 2 года). При тропической малярии нередко трудно выявить цикличность течения, поэтому заподозрить ее следует во всех случаях заболеваний, сопровождающихся лихорадкой, при наличии соответствующего эпидемиологического анамнеза. Решающую роль в диагностике в этом случае играет обнаружение возбудителя. Исследованию подлежат мазок и толстая капля крови. В последней паразитов обнаружить легче вследствие более высокой их концентрации; в мазке определяется вид возбудителя. Забор крови производится как во время приступа, так и в межприступный период. Однократный отрицательный результат исследования не исключает малярии, необходимы повторные исследования. Подспорьем в диагностике может служить обнаружение анемии, являющейся одним из характерных признаков малярии.
Лечение проводится в стационаре. Больных госпитализируют в палаты, защищенные от комаров. Для ликвидации приступов малярии назначают гематошизотропные препараты, которые губительно действуют на бесполые эритроцитарные стадии плазмодия. К ним относятся хлорохин дифосфат и его аналоги из группы 4-аминохинолинов (хингамин, делагил, резохин и др.), а также плаквенил, хинин, бигумаль, хлоридин, мефлохин. Чаще применяют хлорохин (делагил). Указанные средства обеспечивают радикальное излечение только тропической и четырехдневной малярии. После ликвидации приступов трехдневной и овале-малярии необходимо провести противорецидивное лечение примахином и хиноцидом.
Больных госпитализируют в палаты, защищенные от комаров. Для ликвидации приступов малярии назначают гематошизотропные препараты, которые губительно действуют на бесполые эритроцитарные стадии плазмодия. К ним относятся хлорохин дифосфат и его аналоги из группы 4-аминохинолинов (хингамин, делагил, резохин и др.), а также плаквенил, хинин, бигумаль, хлоридин, мефлохин. Чаще применяют хлорохин (делагил). Указанные средства обеспечивают радикальное излечение только тропической и четырехдневной малярии. После ликвидации приступов трехдневной и овале-малярии необходимо провести противорецидивное лечение примахином и хиноцидом.
Прогноз при своевременном лечении благоприятный. При осложненных формах тропической малярии наблюдаются летальные исходы, особенно часто у детей и беременных.
Профилактика направлена на раннее выявление и радикальное лечение больных и паразитоносителей, а также на борьбу с комарами – переносчиками возбудителя малярии. Для раннего выявления больных и паразитоносителей обязательно исследование крови у всех лихорадящих больных, прибывших из неблагоприятных по малярии местностей. В этих местностях необходимо пользоваться репеллентами, которые наносят на открытые части тела, предохранять жилища от комаров с помощью защитных сеток на окнах и дверях, применять защитные пологи над постелями. Большое значение в борьбе с комарами имеет ликвидация мест их выплода, благоустройство хозяйственно-полезных водоемов.
В этих местностях необходимо пользоваться репеллентами, которые наносят на открытые части тела, предохранять жилища от комаров с помощью защитных сеток на окнах и дверях, применять защитные пологи над постелями. Большое значение в борьбе с комарами имеет ликвидация мест их выплода, благоустройство хозяйственно-полезных водоемов.
Лицам, выезжающим в эндемичные по малярии районы, проводят личную химиопрофилактику. За неделю до выезда в очаг малярии дают делагил (или хингамин) по 0,25 г 2 раза. Затем препарат принимают в той же дозе в течение всего времени пребывания в очаге и 4–6 нед после возвращения 1 раз в неделю.
Переболевшие малярией в течение 2 лет находятся под диспансерным наблюдением, которое включает клиническое наблюдение и обследование на носительство плазмодиев.
Апикомплексы (споровики), подготовка к ЕГЭ по биологии
Споровики (апикомлексы) — тип паразитических простейших, произошедших, вероятно, от жгутиконосцев. Наиболее известные представители: малярийный плазмодий,
токсоплазма, криптоспоридии.
Малярийный плазмодий
Малярийный плазмодий вызывает тяжелое заболевание — малярию. Призываю вас строго разграничить два понятия. Есть «возбудитель» заболевания — малярийный плазмодий, а есть «переносчик» — малярийный комар.
Существует еще два важных понятия: промежуточной и основной хозяин. Промежуточный хозяин, в организме которого происходит бесполое размножение, для малярийного плазмодия — человек, млекопитающие. Основной хозяин, в организме которого осуществляется половое размножение — комар рода Anopheles.
Только малярийный комар (комар рода Anopheles) может переносить малярийного плазмодия, но имейте в виду, что не все комары рода Anopheles инфицированы малярийным плазмодием — есть и здоровые особи, поэтому укус комара рода Anopheles не всегда приводит к заболеванию малярией.
Жизненный цикл малярийного плазмодия довольно сложный, есть несколько новых понятий, с которыми вам предстоит познакомиться.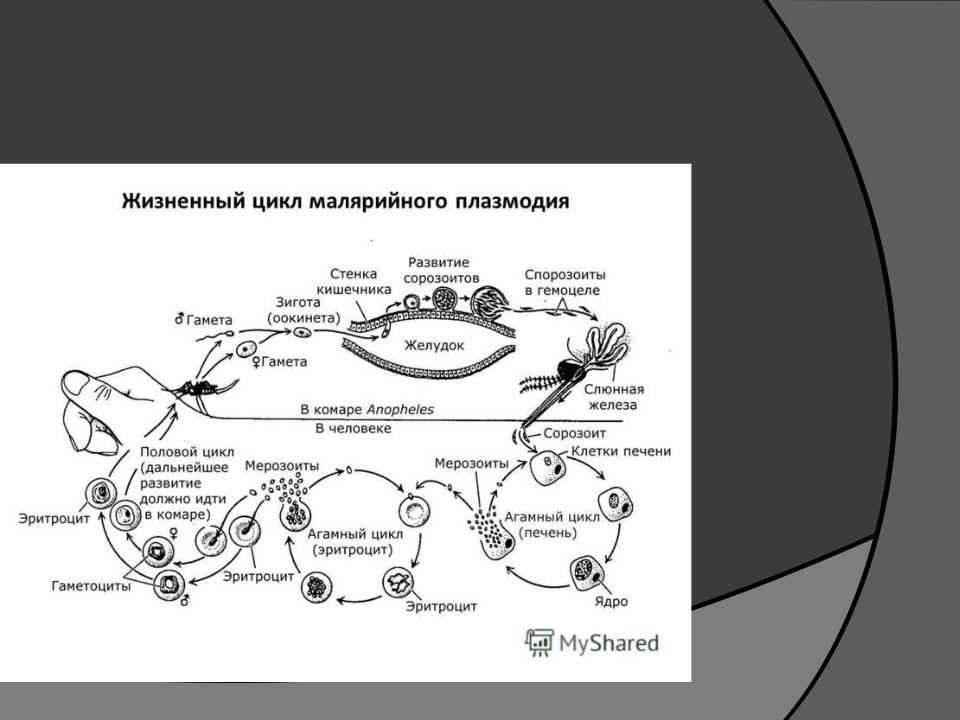 Я же постараюсь сделать
материал интересным, а от вас потребуется то, что важнее знаний — воображение.
Я же постараюсь сделать
материал интересным, а от вас потребуется то, что важнее знаний — воображение.
Жизненный цикл малярийного плазмодия
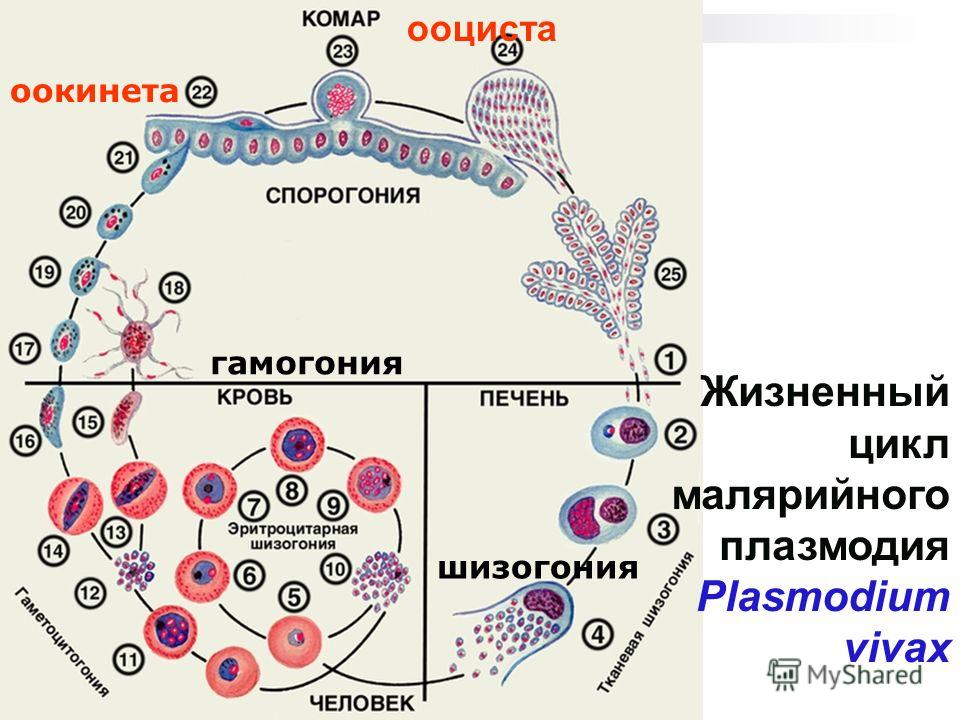
Цикл состоит из 3 стадий: шизогония, гаметогония, спорогония. Начнем со спорогонии, стадии, которая протекает в организме комара перед тем, как он укусит человека.
- Спорогония — половой цикл
- Шизогония — множественное деление
- Гаметогония — образование гамет
Спорогония малярийного плазмодия происходит в самке малярийного комара. Мерозоиты (в дальнейшем будет понятно, откуда взялась эта жизненная форма), попав в желудок комара, перевариваются, а гаметоциты трансформируются в гаметы. Гаметы сливаются друг с другом, образуется зигота, из которой через несколько часов появляется клетка веретеновидной формы — оокинента.
Оокинета внедряется в толщу кишечной стенки комара, делится мейозом на четыре споры. Каждая спора покрываются капсулой, образуется ооциста.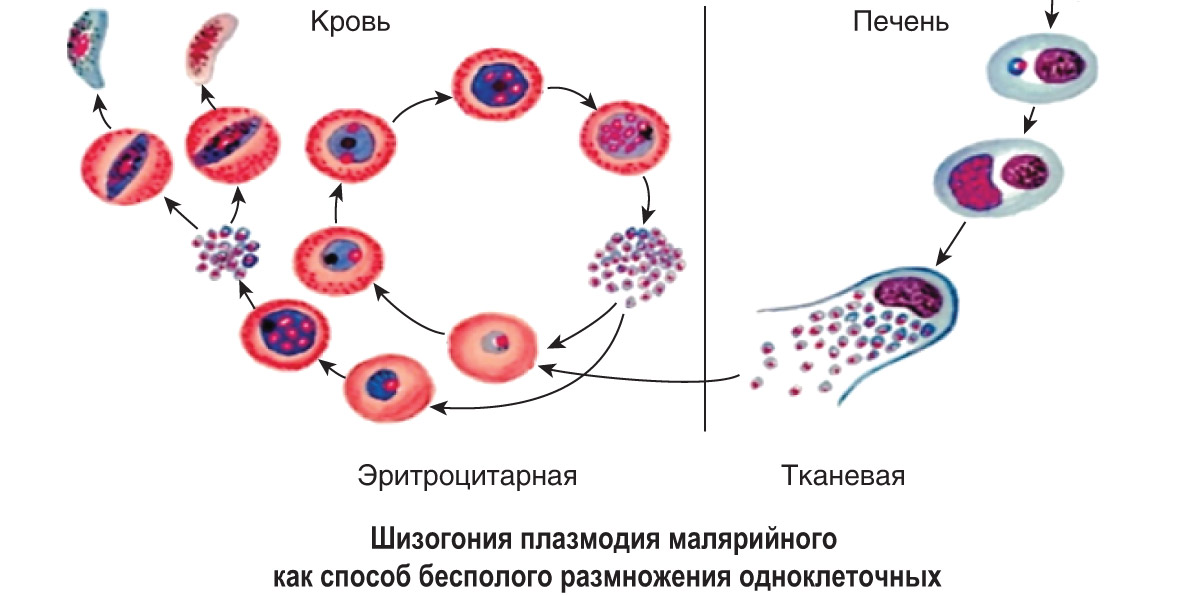 Ооциста растет и делится
митозом на несколько тысяч
спорозоитов. Такое активное деление разрывает ооцисту (на этом этапе ее называют — спороциста), после чего спорозоиты выходят в полость тела и собираются в
слюнных железах комара.
Ооциста растет и делится
митозом на несколько тысяч
спорозоитов. Такое активное деление разрывает ооцисту (на этом этапе ее называют — спороциста), после чего спорозоиты выходят в полость тела и собираются в
слюнных железах комара.
Теперь совершенно очевидно, что с укусом комара в кровь человека, млекопитающего попадает именно спорозоит. Перемещаясь по кровяному руслу, спорозоиты достигают печени и проникают в ее клетки где начинается следующая стадия — множественного деления (шизогония). Митоз происходит без деления цитоплазмы, поэтому количество ядер в шизонте растет — созревают молодые шизонты.
Когда число ядер достигает передела, происходит деление цитоплазмы вокруг ядер и обособление клеток (соответственно числу ядер). В результате в клетках печени
происходит катастрофа: сами клетки разрушаются, а из них выходят тысячи новых подвижных форм — мерозоитов. Мерозоиты внедряются в эритроциты (красные клетки крови),
где вновь начинается шизогония — образуются тысячи шизонтов, которые в итоге разрывают эритроциты (красные клетки крови).
Мерозоиты внедряются в эритроциты (красные клетки крови),
где вновь начинается шизогония — образуются тысячи шизонтов, которые в итоге разрывают эритроциты (красные клетки крови).
Мы с вами только что обсудили две шизогонии: тканевую — в клетках печени, и эритроцитарную — в эритроцитах (красных кровяных клетках). Замечу, что эритроцитарная шизогония может протекать несколько раз, причем происходит это одномоментно: раз в 48 часов, 72 часа (в зависимости от вида малярийного плазмодия). У человека такой одномоментный выход мерозоитов в кровеносное русло и гема — остатка от разрушенных эритроцитов, сопровождается подъемом температуры до 40°C-41°C.
Затем происходит резкий спад температуры — такая лихорадка носит название истощающая, и нередко заканчивается летальным исходом. Примечательно, что в Средние века,
когда не знали, как лечить сифилис, было замечено излечение от сифилиса после перенесенной малярии. Теперь известно, что это действительно связано именно
с высокими цифрами температуры, которые
губительны для бледной трепонемы (возбудителя сифилиса).
Теперь известно, что это действительно связано именно
с высокими цифрами температуры, которые
губительны для бледной трепонемы (возбудителя сифилиса).
Задача любого живого организма — размножаться. Без размножения никогда бы не фиксировались новые случаи заболевания малярией, давайте разберемся, как оно происходит.
После множества повторяющихся эритроцитарных шизогоний часть мерозоитов приобретает способность переходить в новую форму — гаметоциты. Во время укуса комара из кровеносного русла им засасывается кровь с гаметоцитами, которые попадают в желудок вместе с мерозоитами. Цикл замыкается.
Попробуйте самостоятельно рассказать о жизненном цикле малярийного плазмодия, ориентируясь на схему ниже 😉
Токсоплазма
Токсоплазма — простейшее класса споровиков, внутриклеточный паразит.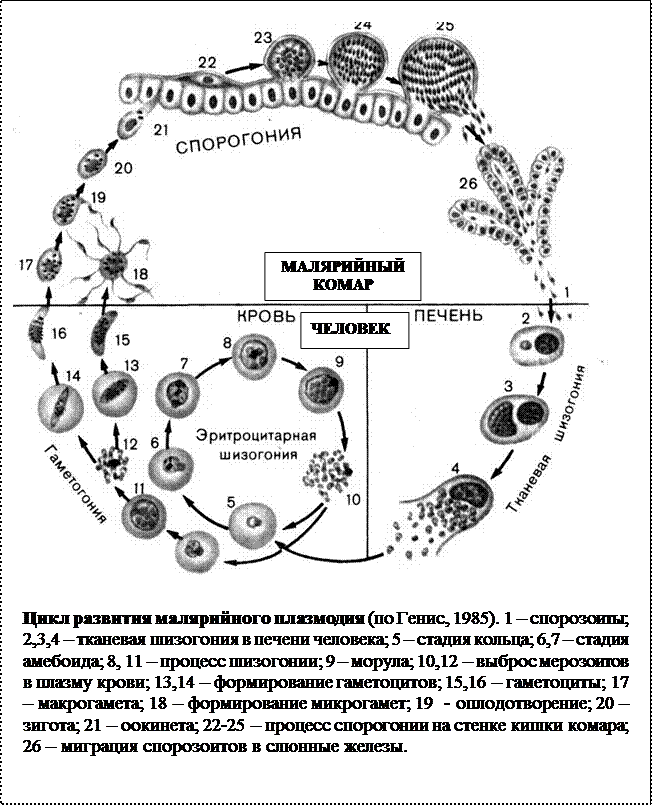 Основные хозяева токсоплазм — семейство кошачьих (в их организме у токсоплазмы идет
половое размножение). Промежуточным хозяином (организм, в котором происходит бесполое размножение) являются человек и другие теплокровные.
Основные хозяева токсоплазм — семейство кошачьих (в их организме у токсоплазмы идет
половое размножение). Промежуточным хозяином (организм, в котором происходит бесполое размножение) являются человек и другие теплокровные.
Заражение токсоплазмой происходит множеством путей — через немытые овощи, непрожаренное мясо, от матери к плоду во время беременности. В кишечнике паразиты попадают в макрофаги, после чего через кровь распространяются по всему телу.
Токсоплазмоз протекает достаточно легко, однако у лиц с иммунодефицитом и беременных женщин последствия могут быть фатальными (у беременных плод может погибнуть).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Частное учреждение здравоохранения «Больница «РЖД-Медицина» города Рузаевка»
Малярия (синонимы болезни: лихорадка, болотная лихорадка) — острая инфекционная протозойная болезнь, которая вызывается несколькими видами плазмодиев, передается комарами рода Anopheles и характеризуется первичным поражением системы мононуклеарных фагоцитов и эритроцитов, проявляется приступами лихорадки, гепатолиенальным синдромом, гемолитической анемией, склонностью к рецидивам.
Исторические данные малярии
Как самостоятельная болезнь малярия выделенная из массы лихорадочных болезней Гиппократом в V в. до н. е., однако систематическое изучение малярии начато лишь с XVII в. Так, в 1640 г. врач Хуан дель Вего предложил для лечения малярии настой коры хинного дерева.
Впервые подробное описание клинической картины малярии сделал в 1696 г.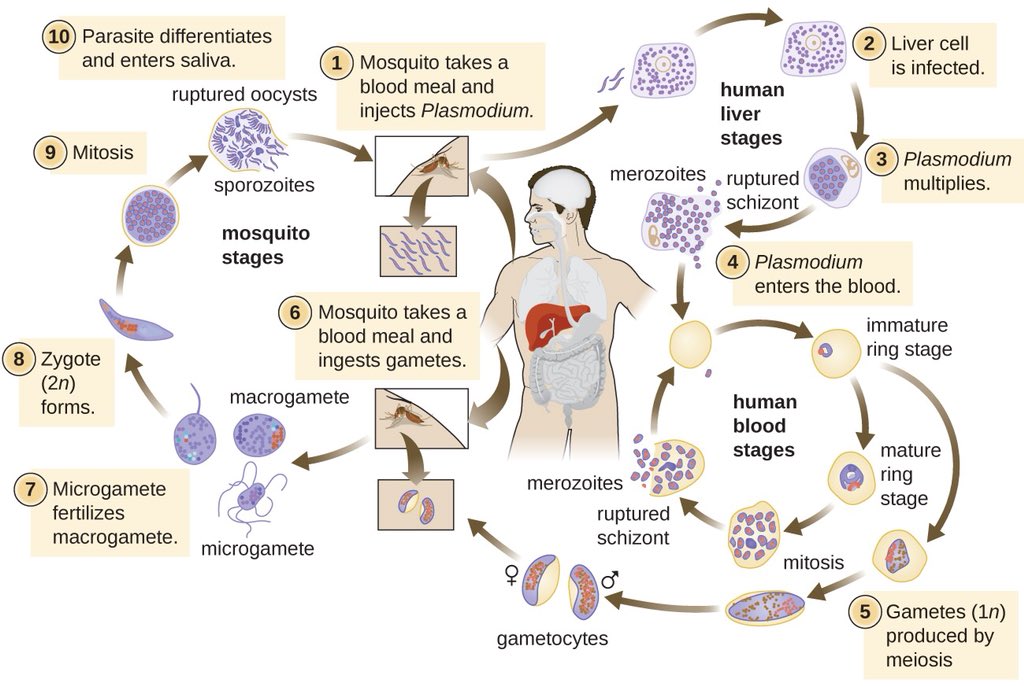 женевский врач Morton. Итальянский исследователь G. Lancisi в 1717 г. связал случаи малярии с негативным воздействием испарений болотистой местности (в переводе с итал. Mala aria — испорченный воздух).
женевский врач Morton. Итальянский исследователь G. Lancisi в 1717 г. связал случаи малярии с негативным воздействием испарений болотистой местности (в переводе с итал. Mala aria — испорченный воздух).
Возбудителя малярии открыл и описал в 1880 p. A. Laveran. Роль комаров из рода Anopheles как переносчиков малярии установил в 1887 p. R. Ross. Открытие в маляриологии, которые были сделаны в XX в. (Синтез эффективных противомалярийных препаратов, инсектицидов и др.), исследования эпидемиологических особенностей болезни позволили разработать глобальную программу ликвидации малярии, принятой на VIII сессии ВОЗ в 1955 г. Проведенная работа позволила резко снизить заболеваемость в мире, однако в результате возникновения резистентности отдельных штаммов плазмодиев к специфическому лечение и переносчиков к инсектицидам активность основных очагов инвазии сохранилась, о чем свидетельствует увеличение заболеваемостью малярией в последние годы, а также рост завоза малярии в неэндемичных регионы.
Этиология малярии
Возбудители малярии относятся к типу Protozoa, классу Sporosoa, семьи Plasmodiidae, рода Plasmodium. Известно четыре вида малярийного плазмодия, которые способны вызывать малярию у людей:
- P. vivax — трехдневную малярию,
- P. ovale — трехдневную овалемалярию,
- P. malariae — четырехдневную малярию,
- P. falciparum — тропической малярией.
Заражение человека зоонозными видами плазмодия (около 70 видов) наблюдается редко. В процессе жизнедеятельности плазмодии проходят цикл развития, который состоит из двух фаз: спорогонии — половой фазы в организме самки комара Anopheles и шизогонии — бесполой фазы в организме человека.
Спорогония
Комары из рода Anopheles заражаются при сосании крови больного малярией или носителя плазмодиев. При этом в желудок комара попадают мужские и женские половые формы плазмодиев (микро-и макрогаметоциты), которые превращаются в зрелые микро-и макрогаметы. После слияния зрелых гамет (оплодотворение) образуется зигота, которая позже превращается в оокинет.
После слияния зрелых гамет (оплодотворение) образуется зигота, которая позже превращается в оокинет.
Последняя проникает во внешнюю оболочку желудка комара и превращается в ооцист. В дальнейшем ооцисты растет, содержание ее многократно делится, в результате чего образуется большое количество инвазионных форм — спорозоитов. Спорозоиты концентрируются в слюнных железах комара, где могут храниться в течение 2 месяцев. Скорость спорогония зависит от вида плазмодиев и температуры окружающей среды. Так, в P. vivax при оптимальной температуре (25 ° С) спорогония длится 10 дней. Если температура окружающей среды не превышает 15 ° С, спорогония прекращается.
Шизогония
Шизогония происходит в организме человека и имеет две фазы: тканевую (пре-, или внеэритроцитарную) и эритроцитарную.
Тканевая шизогония происходит в гепатоцитах, где из спорозоитов последовательно образуются тканевые трофозоиты, шизонты и обилие тканевых мерозоитов (в P. vivax — до 10 тыс. с одного спорозоита, в P. falciparum — до 50 тыс.). Наименьшая продолжительность тканевой шизогонии составляет 6 суток — в P. falciparum, 8 — в P. vivax, 9 — в P. ovale и 15 суток — в P. malariae.
с одного спорозоита, в P. falciparum — до 50 тыс.). Наименьшая продолжительность тканевой шизогонии составляет 6 суток — в P. falciparum, 8 — в P. vivax, 9 — в P. ovale и 15 суток — в P. malariae.
Доказано, что при четырехдневной и тропической малярии после окончания тканевой шизогонии мерозоиты полностью выходят из печени в кровь, а при трехдневной и овале-малярии вследствие гетерогенности спорозоитов в генетическом отношении тканевая шизогония может происходить как непосредственно после инокуляции (тахиспорозоиты), так и через 1 ,5-2 года после нее (бради-или гипнозоиты), что является причиной длительной инкубации и отдаленных (настоящих) рецидивов болезни.
Эритроцитарная шизогония. После окончания тканевой шизогонии мерозоиты поступают в кровь, проникают в эритроциты. При исследовании пораженных эритроцитов под микроскопом обнаруживают три стадии трансформации паразита:
- кольца-мерозоиты увеличивается, у его ядра образуется вакуоль, которая выжимает ядро на периферию, и паразит по форме напоминает перстень,
- амебовидного шизонты (взрослая форма),
- морулы — при достижении больших размеров шизонт принимает овальную форму, ядро и цитоплазма его начинают делиться, в результате чего образуется от 6 до 24 эритроцитарных мерозоитов.

Эритроциты разрушаются и мерозоиты попадают в плазму крови, где одна часть из них погибает, а вторая проникает в другие эритроциты, и цикл эритроцитарной шизогонии повторяется. Длительность одного цикла эритроцитарной шизогонии составляет 48 часов в P. vivax, P. ovale и P. falciparum и 72 ч — в P. malariae. Уже с первых дней, а при тропической малярии с 8-10-го дня болезни часть мерозоитов в эритроцитах превращается в незрелые мужские и женские половые клетки (микро-и макрогаметоциты).
В P. vivax, P. ovale и P. malariae эритроцитарная шизогония происходит в эритроцитах циркулирующей крови, поэтому в ее в мазках можно обнаружить все стадии развития паразита, в то время как P. falciparum — в капиллярах внутренних органов, поэтому в периферической крови можно обнаружить только начальные и конечные стадии плазмодиев (кольцевые трофозоиты и гаметоциты), а промежуточные формы — только в случаях злокачественного течения болезни.
Эпидемиология малярии
Источником инфекции при малярии являются больные или паразитоносители, в крови которых имеются половые формы малярийных плазмодиев (гамонты). Количество гамонты в крови резко возрастает во время рецидивов болезни, поэтому такие больные составляют большую эпидемиологическую опасность, чем больные с первичной малярией. Паразитоносительство, которое является основным источником болезни в межэпидемическом периоде, может провоцироваться неадекватным лечением или устойчивостью паразитов к этиотропным препаратам
Количество гамонты в крови резко возрастает во время рецидивов болезни, поэтому такие больные составляют большую эпидемиологическую опасность, чем больные с первичной малярией. Паразитоносительство, которое является основным источником болезни в межэпидемическом периоде, может провоцироваться неадекватным лечением или устойчивостью паразитов к этиотропным препаратам
Механизм передачи малярии – трансмиссивный. Переносчиком являются самки комара Anopheles (около 80 видов). В эндемичных регионах нередко имеет место также трансплацентарный путь передачи или от матери к ребенку во время родов. Описаны случаи передачи инвазии при гемотрансфузий, особенно при четырехдневной малярии вследствие частого длительного (десятки лет) паразитоносительства. В случае нарушения правил асептики плазмодии могут передаваться и через медицинский инструментарий (шприцы, иглы и т.п.). Комары размножаются в малопроточних водоемах, которые хорошо прогреваются. В них происходит развитие комаров из яиц через фазы личинки, куколки в имаго (окрыленная форма) за 2-4 недели. При температуре воздуха ниже 10 °С развитие личинок прекращается. Период передачи плазмодиев комарами (в зависимости от температуры внешней среды) в зонах умеренного климата длится до 2 месяцев, субтропического — до 6 месяцев, тропического — круглогодично.
При температуре воздуха ниже 10 °С развитие личинок прекращается. Период передачи плазмодиев комарами (в зависимости от температуры внешней среды) в зонах умеренного климата длится до 2 месяцев, субтропического — до 6 месяцев, тропического — круглогодично.
Восприимчивость к инфекции высокая, особенно у детей раннего возраста. К малярии относительно резистентны носители аномального гемоглобина-S (HbS). Сезонность в регионах умеренного и субтропического климата летне-осенняя, в странах с тропическим климатом случаи малярии регистрируются в течение года.
Сегодня малярия редко наблюдается в зонах с умеренным климатом, но широко распространена в странах Африки, Южной Америки, Юго-Восточной Азии, где сформировались устойчивые очаги болезни. В эндемичных регионах ежегодно около 1 млн детей погибают от малярии, которая является основной причиной их смертности, особенно в раннем возрасте. Степень распространения малярии в отдельных эндемичных регионах характеризуется селезеночный индекс (СИ) — соотношением количества лиц с увеличенной селезенкой к общему числу обследованных (%)
Согласно рекомендациям ВОЗ, по этому индексу различают четыре типа ячеек малярии:
- гипоендемични — СИ у детей от 2 до 9 лет достигает 10%,
- мезоендемични — СИ у детей того же возраста-11-50%,
- гиперэндемичных — СИ у детей того же возраста выше 50%, у взрослых также высокий,
- голоендемични — СИ в детей указанного возраста выше 75%, у взрослых низкий (африканский тип) или высокий (новогвинейских тип), а у грудных детей — постоянно выше 75%.
 Риск заражения в гипер-и голоендемичних очагах очень высок, особенно среди некоренного неиммунного населения.
Риск заражения в гипер-и голоендемичних очагах очень высок, особенно среди некоренного неиммунного населения.
После перенесенной малярии остается типоспецифический и нестойкий иммунитет. В эндемичных регионах вследствие частого повторного
Инфицирование уровень коллективного иммунитета среди взрослого населения может быть высоким.
Патогенез и патоморфология малярии
В зависимости от способа заражения малярия протекает в виде спорозоитной или шизонтной инвазии. При укусе инфицированным комаром спорозоиты со слюной попадают в кровь, развивается спорозоитна инвазия. Она начинается с фазы тканевой шизогонии, соответствующей инкубационном периода болезни без заметных клинических проявлений. В отдельных случаях шизонтной инвазии (например, при гемотрансфузии, родов) в кровь попадают эритроцитарные формы плазмодия. Шизонтная малярия характеризуется сокращенным инкубационным периодом вследствие отсутствия преэритроцитарной стадии развития паразита.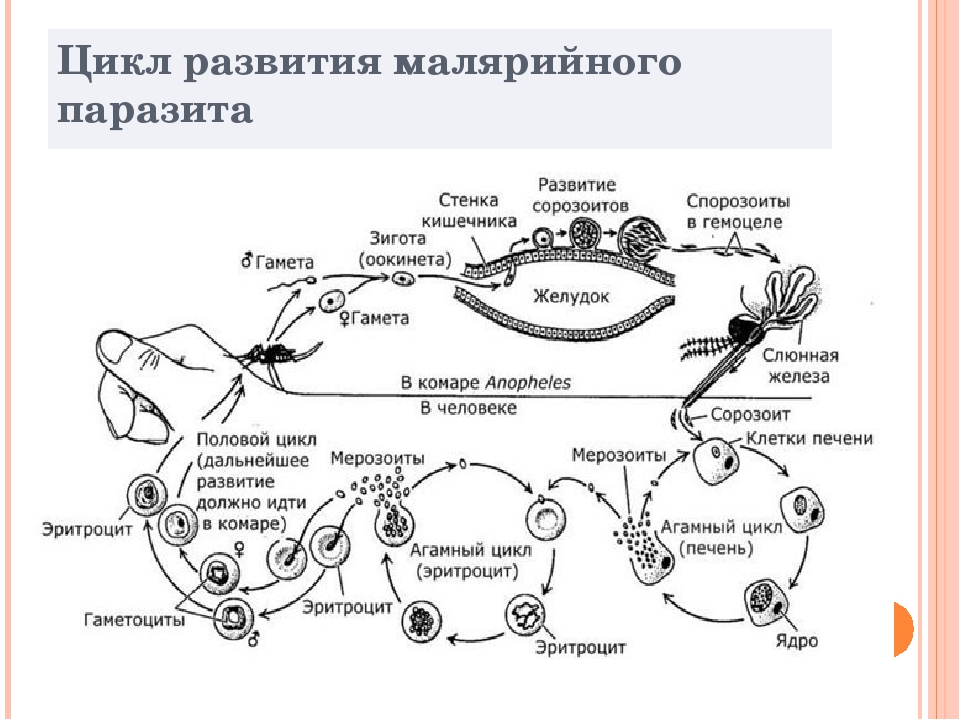
Клинические проявления малярии связаны с фазой эритроцитной шизогонии и является следствием выхода в плазму крови как продуктов разрушения эритроцитов, так и белковых продуктов жизнедеятельности паразита. Пароксизмы лихорадки развиваются только тогда, когда паразитемия достигает пирогенного уровня, в зависимости от вида возбудителя составляет несколько десятков или сотен паразитов в 1 мкл крови. В начальном периоде эритроцитарной шизогонии в крови является шизонты нескольких поколений на разных стадиях развития, что приводит горячку неправильного типа, но через 2-3 дня наступает синхронизация стадий развития паразита с периодическими приступами лихорадки зависимости от продолжительности эритроцитарной шизогонии: при трехдневной и овале-малярии — через 48 ч, при четырехдневной — через 72 час. Несмотря на то что при тропической малярии цикл шизогонии длится 48 час, приступы лихорадки могут повторяться ежедневно или несколько раз в день вследствие поступления из печени в кровь нового поколения тканевых мерозоитов и начала новой фазы эритроцитарной шизогонии. Повторный распад пораженных эритроцитов приводит к прогрессирующей гемолитической анемии и развитию аутоиммунных процессов, что является причиной агглютинации и гемолиза части пораженных плазмодиями эритроцитов, рост количества биогенных аминов (в том числе гистамина и серотонина), активизации каликреинкининовои системы, расстройств микроциркуляции, а в тяжелых случаях тропической малярии — инфекционно-токсического шока.
Повторный распад пораженных эритроцитов приводит к прогрессирующей гемолитической анемии и развитию аутоиммунных процессов, что является причиной агглютинации и гемолиза части пораженных плазмодиями эритроцитов, рост количества биогенных аминов (в том числе гистамина и серотонина), активизации каликреинкининовои системы, расстройств микроциркуляции, а в тяжелых случаях тропической малярии — инфекционно-токсического шока.
Наличие в крови продуктов распада эритроцитов приводит к активизации и гиперплазии ретикулоэндотелия селезенки, печени и костного мозга на фоне угнетения лейкопоэза и тромбоцитопоеза. В тяжелых случаях (при тропической малярии) нарушается микроциркуляция в головном мозге, образуются паразитарные тромбы, что приводит к малярийной коме, а массивный гемолиз эритроцитов — к гемоглобинурийной горячке.
Вследствие неполноценности начального иммунитета в отдельных случаях в течение двух месяцев возможны ранние рецидивы болезни. При четырехдневной малярии часто развивается многолетнее паразитоносительство, которое на фоне ослабления иммунитета может вызывать отдаленные рецидивы болезни даже через десятки лет.![]() Поздние рецидивы (через 1-2 года) при трехдневной и овале-малярии связаны с активацией «гипнозоиты» тканевой фазы шизогонии. При тропической малярии после окончания периода ранних рецидивов происходит радикальное освобождение организма от возбудител
Поздние рецидивы (через 1-2 года) при трехдневной и овале-малярии связаны с активацией «гипнозоиты» тканевой фазы шизогонии. При тропической малярии после окончания периода ранних рецидивов происходит радикальное освобождение организма от возбудител
Патоморфологически обнаруживают значительные дистрофические изменения во внутренних органах. Печень и, особенно селезенка значительно увеличены, аспидно-серого цвета вследствие отложения пигмента, обнаруживаются очаги некроза. В почках, миокарде, надпочечниках и других органах обнаруживаются некробиотические изменения и кровоизлияния.
При малярийной коме в головном мозге образуются гранулемы Дирк — вокруг капилляров, заполненных множеством инвазированных эритроцитов (паразитарные тромбы), с очагами отека, некроза и кровоизлияний в вещество мозга и его оболочки происходит пролиферация олигодендроглицитив и глиальных макрофагов, т.е. развивается специфический менингоэнцефалит.
Клиника малярии
Инкубационный период при трехдневной малярии составляет 10-14 дней, при овале-малярии — 7-21 день, при тропической — 8-16 дней, при четырехдневной — 25-40 дней.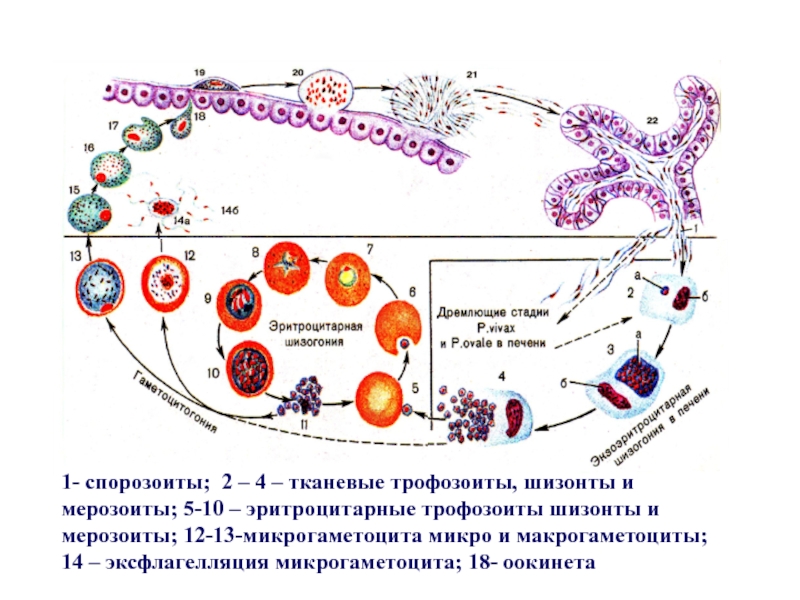
Трехдневная малярия
Чаще встречается трехдневная малярия. Болезнь начинается остро с озноба и повышения температуры тела, лишь в отдельных случаях наблюдаются непродолжительное недомогание, слабость, головная боль. Характерна триада симптомов: лихорадка, анемия, спленомегалия. В первые 2-3 дня болезни лихорадка ремиттирующего или неправильного типа (инициальная лихорадка). Типичный приступ малярии в большинстве случаев начинается внезапно на 3-5-й день болезни и имеет три последовательные фазы: озноб, жар, пот. Чаще в первой половине дня появляется резкая (тряся) озноб, температура тела повышается, больной вынужден лечь в постель, не может согреться под одеялом. Наблюдается боль в голове и пояснице, тошнота, иногда рвота. Кожа бледная, «гусиная», конечности холодные, акроцианоз. Фаза озноба длится 1-2 часа, по окончании ее температура тела достигает 40-41 °С и удерживается на высоком уровне в течение 5-8 час. В настоящее время выявляется гиперемия лица, инъекция склер, сухость слизистых оболочек, язык обложен белым налетом. Тоны сердца приглушены, тахикардия. Через 6-8 ч от начала приступа температура тела резко снижается до нормального или субнормального уровня, наблюдается профузное потоотделение, состояние больного постепенно улучшается. Длительность приступа-от 2 до 14 час. В период апирексии самочувствие больных может быть удовлетворительным, они сохраняют работоспособность. Повторные приступы при трехдневной малярии возникают через день (на 3-й день).
Тоны сердца приглушены, тахикардия. Через 6-8 ч от начала приступа температура тела резко снижается до нормального или субнормального уровня, наблюдается профузное потоотделение, состояние больного постепенно улучшается. Длительность приступа-от 2 до 14 час. В период апирексии самочувствие больных может быть удовлетворительным, они сохраняют работоспособность. Повторные приступы при трехдневной малярии возникают через день (на 3-й день).
После первых приступов у больных появляется субиктеричнисть склер и кожи, увеличиваются селезенка и печень (спленогепатомегалия), которые приобретают плотную консистенцию. При исследовании крови обнаруживают уменьшение количества эритроцитов, гемоглобина, лейкопению с относительным лимфоцитозом, тромбоцитопения, увеличение СОЭ.
При первичной малярии количество пароксизмов может достигать 10-14. Если течение благоприятное, с 6-8-го приступа температура тела при пароксизмах постепенно снижается, печень и селезенка сокращаются, картина крови нормализуется и больной постепенно выздоравливает.
Ранние рецидивы (1-2 месяца после выздоровления) изначально характеризуются периодичностью приступов, отсутствием, как правило, инициальной лихорадки. Признаки интоксикации слабе, чем в начале болезни, продолжительность пароксизмов короче. Характерным признаком рецидивов малярии является быстрое увеличение печени и особенно селезенки, даже бо́льших размеров, чем при первичной малярии. Поздние рецидивы (6-14 месяцев от начала болезни), которые иногда развиваются при трехдневной малярии, характеризуются доброкачественным течением, но возможны и тяжелые случаи. Продолжительность трехдневной малярии — 2-3 года
Тропическая малярия
Озноб и потливость менее выражены, чем при других формах болезни, однако лихорадка является длительной (до 24 ч) и имеет неправильный характер. Состояние больных часто тяжелое, сознание омрачено, наблюдается интенсивная головная боль, рвота. Часто появляется боль в подложечной области, иногда понос (кал без патологических примесей). Периодичности приступов нет. Периоды апирексии выражены нечетко. Быстро увеличиваются селезенка и печень. Алгидная форма тропической малярии, которая встречается очень редко, с первых дней имеет течение с признаками инфекционно-токсического шока, тромбо-геморрагического синдрома на фоне нормальной или пониженной температуры тела. В неиммунных лиц, особенно на фоне иммунодефицита, тропическая малярия имеет злокачественное течение, являются причиной смерти у 96-98% всех летальных случаев от малярии. В случае доброкачественного течения болезнь длится около года.
Периодичности приступов нет. Периоды апирексии выражены нечетко. Быстро увеличиваются селезенка и печень. Алгидная форма тропической малярии, которая встречается очень редко, с первых дней имеет течение с признаками инфекционно-токсического шока, тромбо-геморрагического синдрома на фоне нормальной или пониженной температуры тела. В неиммунных лиц, особенно на фоне иммунодефицита, тропическая малярия имеет злокачественное течение, являются причиной смерти у 96-98% всех летальных случаев от малярии. В случае доброкачественного течения болезнь длится около года.
Четырехдневная малярия
Инициальная лихорадка наблюдается реже, чем при трехдневной малярии. Приступы повторяются через 2 дня (на 4-й день). Возможны сдвоенные приступы (два дня подряд с последующей апирексии течение одного дня). Характерна длительная клиническая активность болезни, паразитемия не достигает высокого уровня, гепатоспленомегалия развивается медленнее. Лечение эффективно, однако без назначения адекватных этиотропных средств часто наблюдается субмикроскопическая паразитемия с возможностью отдаленных рецидивов. Описаны рецидивы четырехдневной малярии через 3О-40 лет после инфицирования.
Описаны рецидивы четырехдневной малярии через 3О-40 лет после инфицирования.
Овале-малярия
Чаще, чем при других формах, приступы начинаются в вечернее и ночное время, инициальной лихорадки в большинстве случаев нет. Приступы повторяются через день (на 3-й день). Уровень паразитемии невысок. Течение легче, чем при других формах малярии, возможно спонтанное выздоровление после 3-5-го приступа лихорадки. Ранние и поздние рецидивы имеют доброкачественное течение, летальные исходы наблюдаются редко. Продолжительность болезни 1-2 года.
Малярия у детей
У детей раннего возраста течение болезни тяжелое, типичные приступы наблюдаются редко, озноба нет. Чаще они начинаются со побледнение, общего цианоза, похолодание конечностей, при высокой температуре тела возможны судороги, рвота. Температура тела чаще держится на высоких цифрах только в начале болезни, а потом — становится субфебрильной. Потливость нехарактерна, при снижении температуры тела умеренно потеют голова и шея.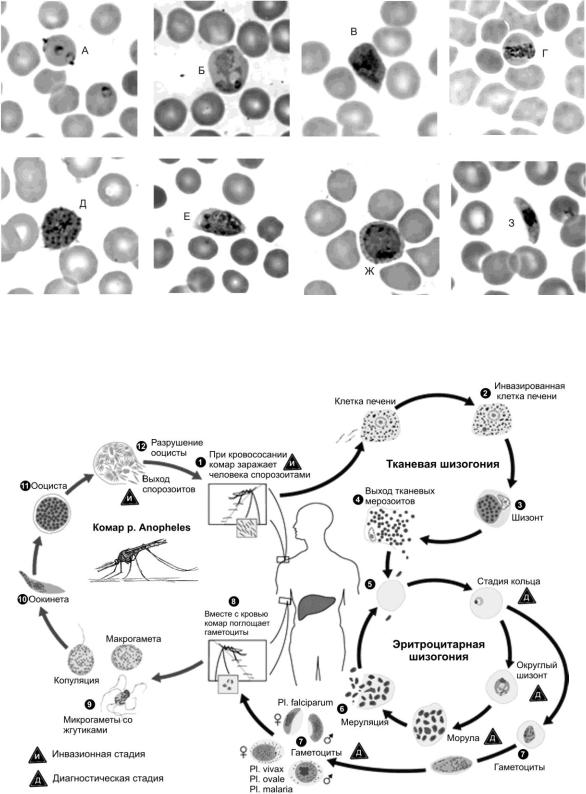 Часто наблюдаются понос, боль в животе, быстро развивается анемия, увеличиваются, становятся болезненными печень и особенно селезенка.
Часто наблюдаются понос, боль в животе, быстро развивается анемия, увеличиваются, становятся болезненными печень и особенно селезенка.
Малярия у беременных
У беременных течение малярии тяжелое, с частым развитием анемии, желтухи, отеков, различных осложнений. Малярия отягощает течение беременности, при тропической форме способствует развитию эклампсии, гибели плода, росту летальности в 2 раза.
Врожденная малярия
Внутриутробное (через поврежденную плаценту) заражении плода в первой половине беременности может привести к выкидышу. В других случаях и при внутриутробном заражении во второй половине беременности дети часто рождаются недоношенными, с выраженными гипотрофией, анемией, гепатолиенальным синдромом, иногда желтухой. Приступы болезни часто протекают без лихорадки, характеризуются цианозом, судорогами, беспокойством, поносом, икотой. Если заражение происходит во время родов, болезнь начинается после инкубационного периода, течение ее такой, как и у детей до года.
Осложнения малярии
В тяжелых случаях возможно развитие малярийной комы, гемоглобинурийный лихорадки, разрыва селезенки.
Малярийная кома развивается при злокачественных формах болезни, чаще при первичной тропической малярии. Сначала на фоне высокой температуры тела появляются невыносимая головная боль, многократная рвота.
Быстро развивается нарушение сознания, которое проходит три последовательные фазы:
- сомноленция — адинамия, сонливость, инверсия сна, больной неохотно вступает в контакт,
- сопора — сознание резко заторможена, больной реагирует только на сильные раздражители, рефлексы снижены, возможны судороги, менингеальные симптомы,
- комы — обморок, рефлексы резко снижены или не вызываются.
Гемоглобинурийная лихорадка развивается вследствие внутрисосудистого гемолиза, чаще на фоне лечения больных тропической малярией хинином. Это осложнение начинается внезапно: резкий озноб, быстрое повышение температуры тела до 40-41 ° С.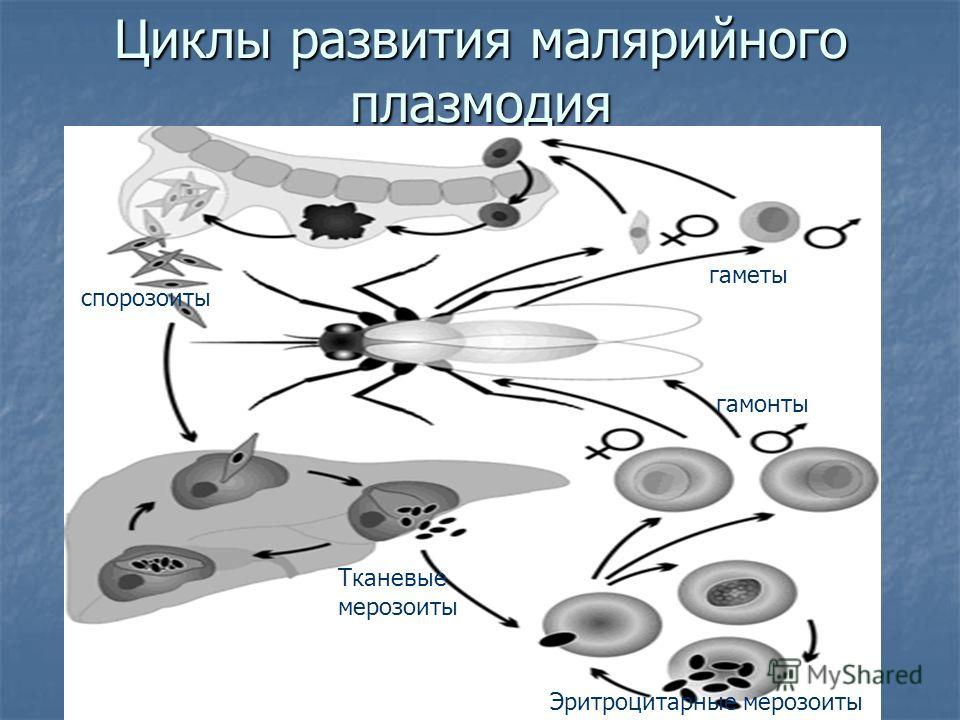 Вскоре моча приобретает темно-коричневый цвета, нарастает желтуха, появляются признаки острой недостаточности почек, гиперазотемия.
Вскоре моча приобретает темно-коричневый цвета, нарастает желтуха, появляются признаки острой недостаточности почек, гиперазотемия.
Летальность высока. Больной погибает при проявлениях азотемической комы. Чаще гемоглобинурийная лихорадка развивается у лиц с генетически обусловленным дефицитом глюкозо-6-фосфатдегидрогеназы, что приводит к снижению резистентности эритроцитов.
Разрыв селезенки происходит внезапно и характеризуется кинжальной болью в верхних отделах живота с распространением в левое плечо и лопатку. Наблюдается резкая бледность, холодный пот, тахикардия, нитевидный пульс, артериальное давление снижается. В брюшной полости появляется свободная жидкость. Если экстренное оперативное вмешательство не проводится, больные погибают от острой кровопотери на фоне гиповолемического шока.
К другим возможным осложнениям относятся малярийный алгид, отек легких, ДВС-синдром, геморрагический синдром, острая почечная недостаточность и т.д.
Прогноз при своевременном адекватном лечении благоприятный. Общая летальность составляет около 1% за счет тяжелых осложненных форм тропической малярии.
Общая летальность составляет около 1% за счет тяжелых осложненных форм тропической малярии.
Диагноз малярия
Опорными симптомами клинической диагностики малярии является острое начало, приступообразная интермиттирующая лихорадка (с сильным ознобом, жаром, потливостью), которая повторяется через 48 или 72 ч, спленогепатомегалия, гемолитическая анемия. Важное значение имеет факт пребывания больного в эндемичных регионах в течение двух лет до начала болезни, учитываются данные по гемотрансфузии или парентерального вмешательства в течение последних 2-3 месяцев.
Специфическая диагностика малярии
Из лабораторных методов широкого применения приобрела микроскопия толстой капли и мазка крови.
Кровь от больных надо брать до начала специфического лечения и повторять исследования при лечении. При микроскопии оценивают как массивность инвазии (количество паразитов в 1 мл крови), что легче обнаружить в толстой капле, так и качественную характеристику (установка вида плазмодия и стадий шизогонии) при исследовании мазка. Паразитов больше в крови на высоте лихорадки, после 2-3-го приступа, хотя результаты исследования часто являются позитивными и в период апирексии. В случае отрицательного результата микроскопического исследования нельзя отбросить диагноза малярии. Исследования следует повторять многократно.
Паразитов больше в крови на высоте лихорадки, после 2-3-го приступа, хотя результаты исследования часто являются позитивными и в период апирексии. В случае отрицательного результата микроскопического исследования нельзя отбросить диагноза малярии. Исследования следует повторять многократно.
Микроскопическое исследование крови на малярию необходимо проводить не только у больных с подозрением на малярию, но и во всех с лихорадкой неясного генеза.
Вспомогательное значение имеют серологические методы: РИГА, реакция флуоресцирующих антител (РФА), которые чаще применяются в ретроспективной диагностике малярии, а также с целью выявления паразитоносительства у доноров.
Дифференциальная диагностика малярии
Клиническое течение малярии часто может напоминать другие инфекционные и неинфекционные болезни (вследствие этого малярию называли «большой симулянткой»), поэтому дифференцировать ее следует с сепсисом, гриппом, лептоспирозом, висцеральным лейшманиозом, брюшным тифом, бруцеллезом, менингитом, болезнями крови, острым пиелонефритом, крупозной пневмонией.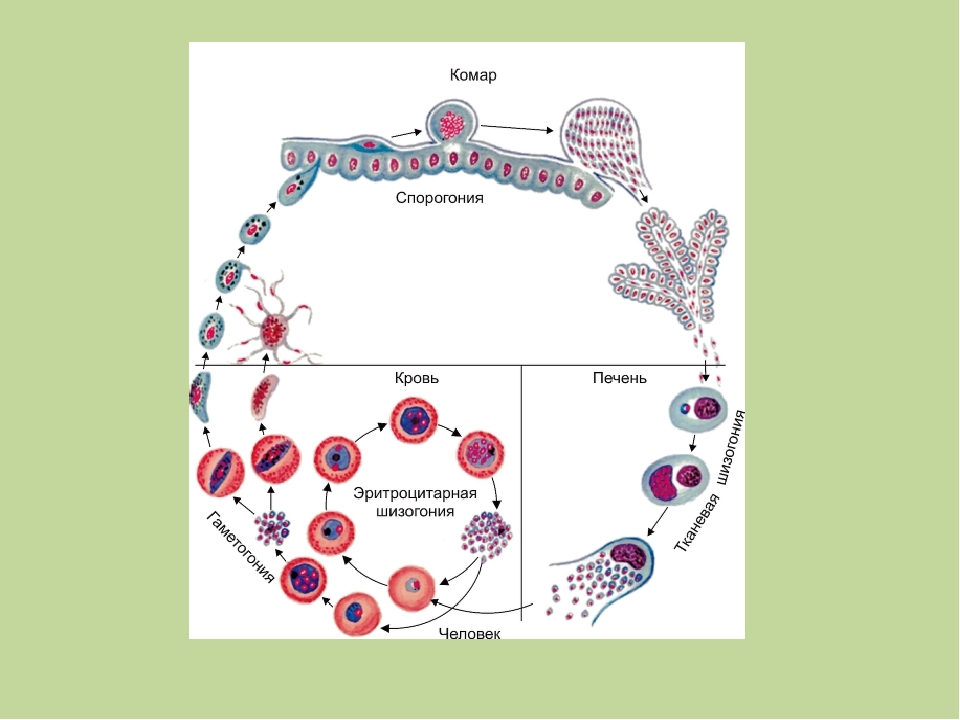 ..
..
- Во время сепсиса часто наблюдается острое повышение температуры тела с ознобом, потливостью, миалгии, болью в пояснице, но, в отличие от малярии, нет длительных периодов апирексии, значительный геморрагический синдром, увеличена печень мягкой консистенции, часто оказываются септические очаги, нейтрофильный лейкоцитоз.
- Значительная лихорадка с ознобом, признаками интоксикации, ломота в суставах имеют место и при гриппе, но оказываются катаральные изменения верхних дыхательных путей, сухой кашель, не наблюдается спленогепатомегалия, анемия.
- Лептоспироз начинается остро с озноба, повышения температуры тела до 39-40 ° С, сопровождается болью в мышцах, гиперемией лица, инъекцией сосудов склер, но, в отличие от малярии, есть типичная миалгия в икроножных мышцах, чаще наблюдается поражение почек с их недостаточностью, выраженная желтуха вследствие повышения уровня прямого (при малярии — непрямого) билирубина, значительный геморрагический синдром, оказывается нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево.

- Клиника висцерального лейшманиоза во многом напоминает малярию (лихорадка, заметное увеличение печени и селезенки, значительная анемия, лимфоцитопения), но начало болезни постепенное, лихорадка продолжительная, неправильного волнообразного типа, оказывается лимфаденопатия, кахексия, часто на месте укуса москита является первичный аффект.
- У больных брюшным тифом возможные высокая температура тела, увеличение печени и селезенки, лимфоиения, но, в отличие от малярии, начало болезни постепенное, лихорадка чаще постоянного характера, наблюдаются относительная брадикардия, брюшнотифозных язык, на коже розеолезная сыпь, феномен пальпаторно крепитации, метеоризм .
- В ряде случаев трудно дифференцировать мальярию с бруцеллезом, при котором часто наблюдается ремитирующая и интермиттирующая лихорадка с профузным потом, увеличение печени и селезенки, лейкопения, но для бруцеллеза характерно отсутствие значительной интоксикации на высоте температуры, постоянная потливость, болевой синдром, относительно частое поражение органов движения и опоры с образованием фиброзит, половой системы.
 Решающее значение имеют эпидемиологический анамнез и лабораторные исследования.
Решающее значение имеют эпидемиологический анамнез и лабораторные исследования. - Для острого менингита характерны внезапное начало, озноб, резкое повышение температуры тела, но, в отличие от малярии, типичными является многократная рвота, положительные менингеальные симптомы, соответствующие изменения цереброспинальной жидкости.
Лечение малярии
Все больные малярией подлежат обязательной госпитализации в инфекционное отделение.
Применяют этиотропное лечение с целью:
- прекращение острых приступов болезни,
- обезвреживание тканевых шизонтов при трехдневной и овале-малярии (радикальное лечение),
- обезвреживание гаметоцитов (при тропической малярии).
Во время острых приступов назначают препараты гемошизотропного действия (против эритроцитарных шизонтов). Наиболее широко применяется хингамин (делагил, хлорохин, резохин), который назначают как можно раньше в разовой дозе 1 г (4 таблетки по 0,25 г), через 6-8 ч — повторно 0,5 г.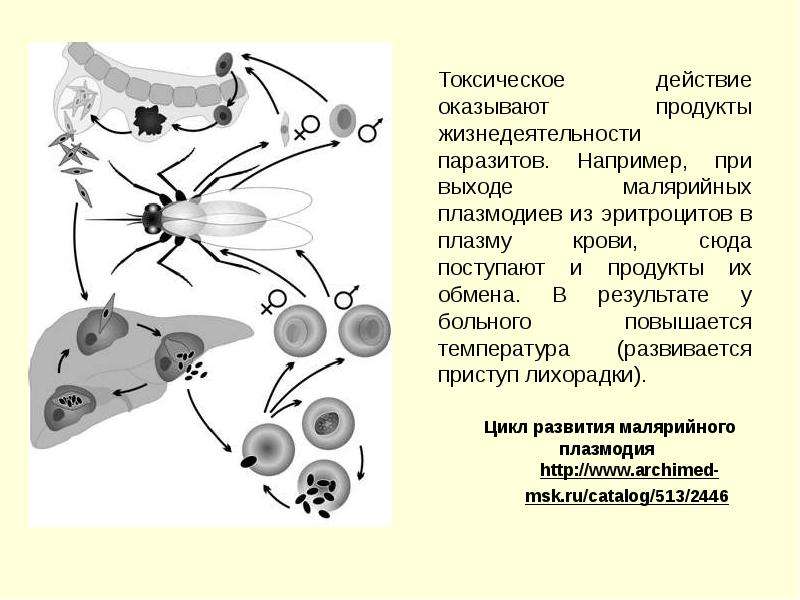 В последующие дни — по 0,5 г в день однократно. При трехдневной и овале-малярии курс лечения длится 3 дня, при тропической и четырехдневной — 5 дней. Детям в первый день хингамин назначают в сутки: до 1 года — 0,05 г, 1-6 лет-0, 125, 6-10 лет — 0,25, 10-15 лет — 0,5 г. В дальнейшем суточную дозу уменьшают вдвое. Гемошизотропным действием обладают также хинин, хлоридин (пириметамин), мефлохин, бигумаль (прогуанил), акрихин, сульфаниламидные препараты, тетрациклины. Если P. falciparum устойчив к хингамину, назначают хинина гидрохлорид по 0,65 г 3 раза в сутки в течение 7 дней, фанзидар (хлоридин + сульфадоксин) по 3 таблетки в сутки на протяжении 3 дней, малоприм (хлоридин + диафенилсульфон) по 1 таблетке 1 раз в неделю . Больным злокачественными формы тропической малярии хинина гидрохлорид вводят внутривенно капельно (20 мг / кг в сутки в три приема), а при улучшении состояния переходят к переральному введения препарата.
В последующие дни — по 0,5 г в день однократно. При трехдневной и овале-малярии курс лечения длится 3 дня, при тропической и четырехдневной — 5 дней. Детям в первый день хингамин назначают в сутки: до 1 года — 0,05 г, 1-6 лет-0, 125, 6-10 лет — 0,25, 10-15 лет — 0,5 г. В дальнейшем суточную дозу уменьшают вдвое. Гемошизотропным действием обладают также хинин, хлоридин (пириметамин), мефлохин, бигумаль (прогуанил), акрихин, сульфаниламидные препараты, тетрациклины. Если P. falciparum устойчив к хингамину, назначают хинина гидрохлорид по 0,65 г 3 раза в сутки в течение 7 дней, фанзидар (хлоридин + сульфадоксин) по 3 таблетки в сутки на протяжении 3 дней, малоприм (хлоридин + диафенилсульфон) по 1 таблетке 1 раз в неделю . Больным злокачественными формы тропической малярии хинина гидрохлорид вводят внутривенно капельно (20 мг / кг в сутки в три приема), а при улучшении состояния переходят к переральному введения препарата.
Если при тропической и четырехдневной малярии с помощью гемошизотропных препаратов удается полностью освободить организм от шизонтов, то для радикального лечения трехдневной и овалемалярии требуется назначение единовременно препаратов с гистошизотропным действием (против внеэритроцитарных шизонтов). Применяют примахин по 0,027 г в сутки (15 мг основания) в 1 — С приема в течение 14 дней или хиноцид по 30 мг в сутки в течение 10 дней. Такое лечение является эффективным в 97-99% случаев.
Применяют примахин по 0,027 г в сутки (15 мг основания) в 1 — С приема в течение 14 дней или хиноцид по 30 мг в сутки в течение 10 дней. Такое лечение является эффективным в 97-99% случаев.
Гамонтотропным действием обладают хлоридин, примахин. При трехдневной, овале-и четырехдневной малярии гамонтотропное лечения не проводят, поскольку при этих формах малярии гамонты быстро исчезают из крови после прекращения эритроцитарной шизогонии.
Кроме этиотропного широко применяется патогенетическое лечение, особенно в случае тропической малярии. Проводят внутривенные инфузии коллоидных и кристаллоидных растворов. Назначают гликокортикоиды, антигистаминные препараты, диуретические препараты, если нужно, — средства кардиотонического действия. В случае острой недостаточности почек применяют гемосорбцию, гемодиализ.
Профилактика малярии
Профилактика предусматривает своевременное выявление и лечение больных малярией и паразитоносиив, эпидемиологический надзор за эндемическими регионами, проведение химиопрофилактики, широкий комплекс мер по уничтожению комаров (использование лярвицидных средств в местах выплода комаров, имагоцидных — в жилых и хозяйственных помещениях, биологических методов борьбы с личинками комаров — разведение личинкоидних рыбок и др.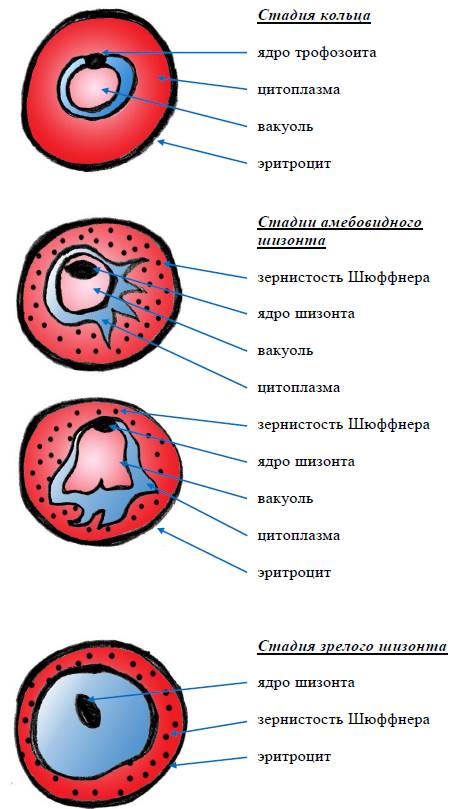 ).
).
Больных выписывают из стационара после окончания курса этиотропного лечения при условии трехкратного отрицательного результата паразитоскопического исследование толстой капли и мазка крови.
Лицам, выезжающим в эндемичные зоны, проводится индивидуальная химиопрофилактика. С этой целью используют гемошизотропные препараты, чаще хингамин по 0,5 г и раз в неделю, а в гиперэндемичных районах — 2 раза в неделю. Препарат назначают за 5 дней до въезда в эндемическую зону, во время пребывания в зоне и в течение 8 недель после отбытия. Среди населения эндемичных районов химиопрофилактику начинают за 1-2 недели до появления комаров. Химиопрофилактику малярии можно проводить также бигумаль (0,1 г в сутки), амодиахин (0,3 г 1 раз в неделю), хлоридина (0,025-0,05 г 1 раз в неделю) и т.д.. Эффективность химиопрофилактики повышается в случае чередования двух-трех препаратов через каждые один-два месяца. В эндемичных очагах, вызванных хингаминостойкими штаммами малярийных плазмодиев, с целью индивидуальной профилактики используют фанзидар, метакельфин (хлоридин-Ьсульфален).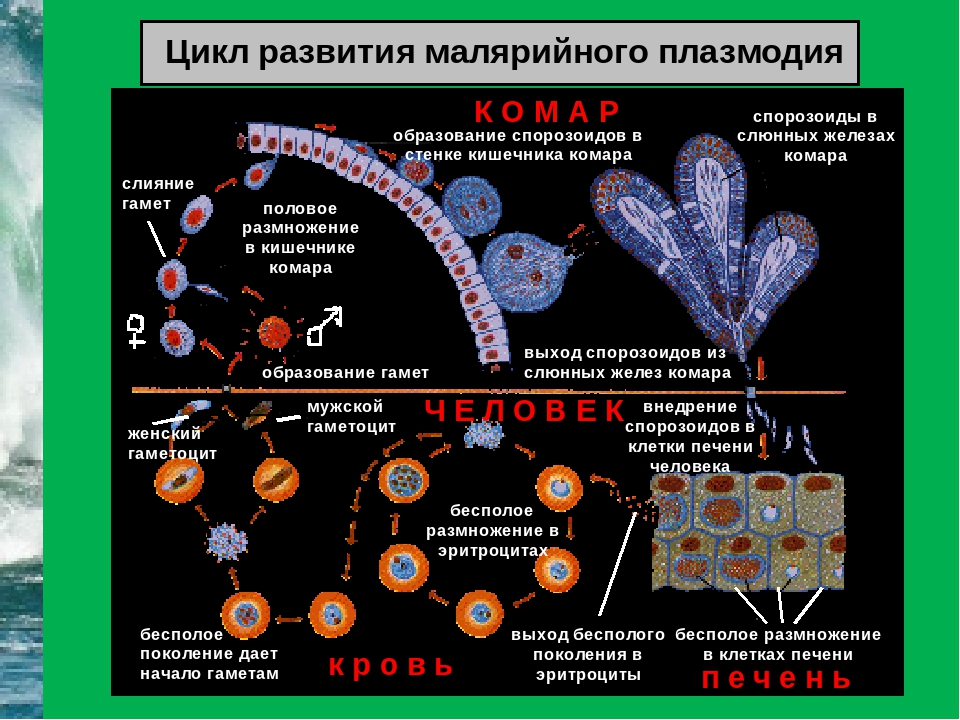 Лицам, прибывшим из ячеек трехдневной малярии, проводится сезонная профилактика рецидивов примахином (по 0,027 г в сутки 14 дней) в течение двух лет. Для защиты от укусов комаров, применяют репелленты, завесы и тому подобное.
Лицам, прибывшим из ячеек трехдневной малярии, проводится сезонная профилактика рецидивов примахином (по 0,027 г в сутки 14 дней) в течение двух лет. Для защиты от укусов комаров, применяют репелленты, завесы и тому подобное.
ПЛАЗМОДИИ • Большая российская энциклопедия
В книжной версии
Том 26. Москва, 2014, стр. 334
Скопировать библиографическую ссылку:
Авторы: С. А. Карпов
Жизненный цикл малярийного паразита (выше черты – в комаре, ниже – в позвоночном животном):1, 2 – спорозоиты, проникающие в клетки печени человека; 3, 4 – шизогония (образовани. ..
..
ПЛАЗМО́ДИИ (Plasmodium), род внутриклеточных паразитических простейших отр. гемоспоридии. Известно ок. 160 видов, 11 из которых патогенны для животных и человека. Окончательными хозяевами П. являются насекомые, гл. обр. комары родов Anopheles, Aedes и Culex; промежуточными – пресмыкающиеся, птицы и млекопитающие (в осн. грызуны и приматы). В организм позвоночного П. попадают во время укуса со слюной комара. Их клетки, называемые спорозоитами (расселительная гаплоидная стадия), внедряются в гепатоциты (клетки паренхимы печени), где развиваются в крупных (до 1 мм) шизонтов. Последние размножаются путём многократного деления – шизогонии, образуя до нескольких тысяч подвижных клеток (мерозоитов). Вышедшие из печени мерозоиты внедряются в эритроциты, в которых также размножаются путём шизогонии, но дают уже меньшее количество мерозоитов.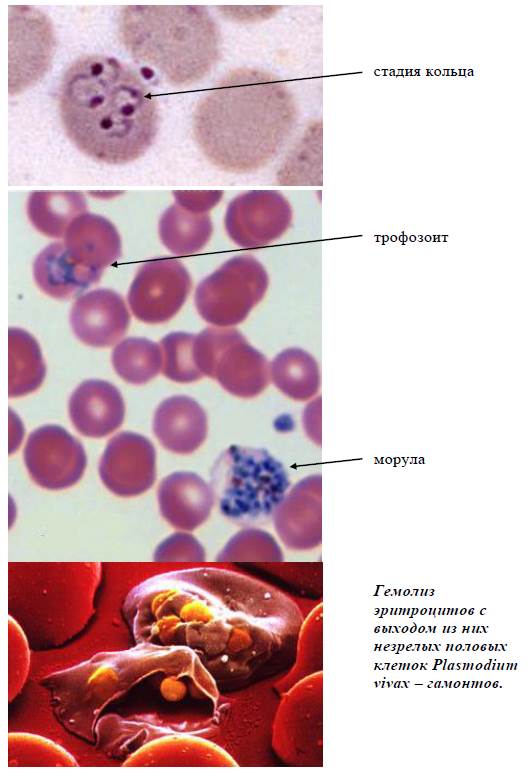 Вторичная, или эритроцитарная, шизогония повторяется многократно. Через неск. дней деления внутри эритроцитов становятся синхронными. При выходе каждого поколения мерозоитов эритроциты разрушаются; в кровь попадают фрагменты клеток и непереваренные продукты деградации гемоглобина (пигмент гемозоин), вызывая характерное лихорадочное состояние, периодически возникающее у больного (см. Малярия). Некоторые мерозоиты не растут и остаются в печени в латентной форме (гипнозоиты) и могут активизироваться лишь спустя годы, вызывая рецидив заболевания. Примерно через 10 дней в промежуточном хозяине из мерозоитов начинают развиваться первые мужские и женские гаплоидные формы (гамонты). При кровососании они попадают в кишечник комара, где и формируются макро- и микрогаметы. При копуляции гамет образуется подвижная зигота (оокинета).
Вторичная, или эритроцитарная, шизогония повторяется многократно. Через неск. дней деления внутри эритроцитов становятся синхронными. При выходе каждого поколения мерозоитов эритроциты разрушаются; в кровь попадают фрагменты клеток и непереваренные продукты деградации гемоглобина (пигмент гемозоин), вызывая характерное лихорадочное состояние, периодически возникающее у больного (см. Малярия). Некоторые мерозоиты не растут и остаются в печени в латентной форме (гипнозоиты) и могут активизироваться лишь спустя годы, вызывая рецидив заболевания. Примерно через 10 дней в промежуточном хозяине из мерозоитов начинают развиваться первые мужские и женские гаплоидные формы (гамонты). При кровососании они попадают в кишечник комара, где и формируются макро- и микрогаметы. При копуляции гамет образуется подвижная зигота (оокинета).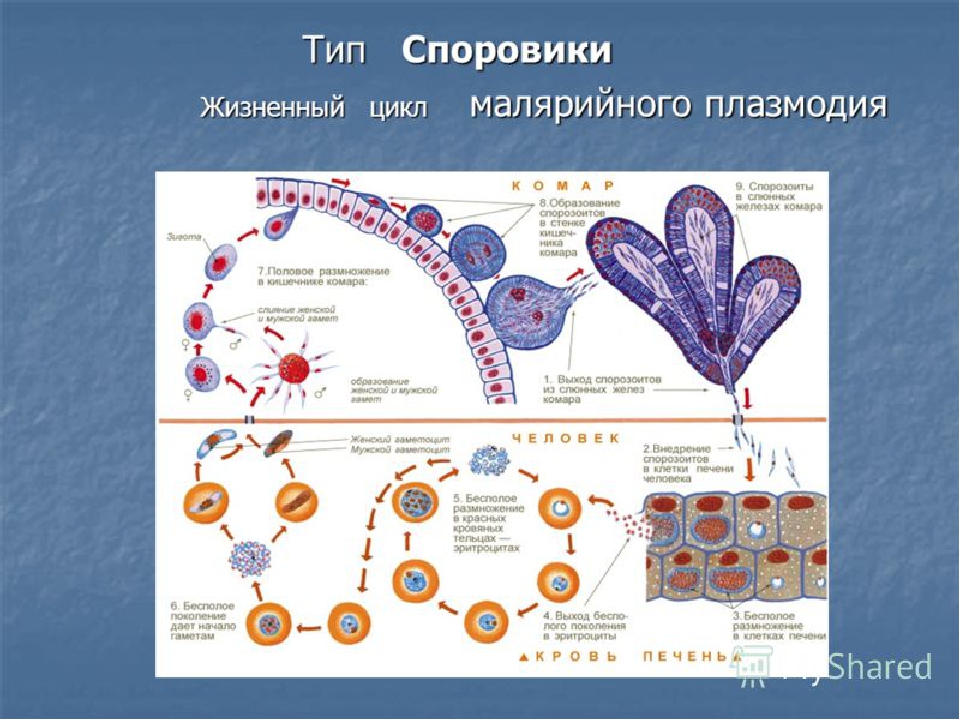 Внедряясь в ткани кишечника, она одевается тонкой оболочкой и превращается в ооцисту, в которой развиваются спорозоиты. Зрелые спорозоиты разрывают оболочку ооцисты, мигрируют с током гемолимфы и накапливаются в слюнных железах хозяина, где приобретают инвазионность. Для созревания гамет нужна темп-ра выше 16 °C, поэтому малярия встречается преим. в тёплых странах.
Внедряясь в ткани кишечника, она одевается тонкой оболочкой и превращается в ооцисту, в которой развиваются спорозоиты. Зрелые спорозоиты разрывают оболочку ооцисты, мигрируют с током гемолимфы и накапливаются в слюнных железах хозяина, где приобретают инвазионность. Для созревания гамет нужна темп-ра выше 16 °C, поэтому малярия встречается преим. в тёплых странах.
Микроскопическое исследование «толстой капли» мазка крови на малярийные плазмодии (Plasmodium)
Малярия (лихорадка, болотная лихорадка) — острая или хроническая эндемическая трансмиссивная болезнь, характеризующаяся приступами лихорадки, увеличением печени и селезенки, гемолитической анемией, рецидивирующим течением. Заболевание у людей вызывают 4 вида малярийных плазмодиев: 1. Plasmodium vivax — возбудитель трехдневной формы малярии; 2. Plasmodium ovale — вызывает трехдневный овале-малярии; 3. Plasmodium malariae — возбудитель четырехдневной формы малярии; 4. Plasmodium falciparum — вызывает тропическую малярию. Заболевание через укусы передают самки комаров рода Anopheles. Кроме того, определенное эпидемиологическое значение имеет трансфузионная малярия, которая возникает после переливания крови от донора паразитоносителей или при манипуляции инструментами, загрязненными зараженной кровью. В процессе своей жизнедеятельности плазмодии проходят сложный цикл развития со сменой хозяина. Он состоит из двух фаз: половой (спорогонии), которая проходит в теле самки комара, и бесполой (шизогонии), что происходит в организме человека. Сначала плазмодии проникают в клетки печени (тканевая шизогония), позже — в эритроциты (эритроцитарная шизогония). Успешная лабораторная диагностика малярии возможна именно в период эритроцитарной шизогонии.
Plasmodium falciparum — вызывает тропическую малярию. Заболевание через укусы передают самки комаров рода Anopheles. Кроме того, определенное эпидемиологическое значение имеет трансфузионная малярия, которая возникает после переливания крови от донора паразитоносителей или при манипуляции инструментами, загрязненными зараженной кровью. В процессе своей жизнедеятельности плазмодии проходят сложный цикл развития со сменой хозяина. Он состоит из двух фаз: половой (спорогонии), которая проходит в теле самки комара, и бесполой (шизогонии), что происходит в организме человека. Сначала плазмодии проникают в клетки печени (тканевая шизогония), позже — в эритроциты (эритроцитарная шизогония). Успешная лабораторная диагностика малярии возможна именно в период эритроцитарной шизогонии.
Микроскопическое исследование толстой капли и мазков крови
Микроскопическое исследование толстой капли и мазков крови является наиболее распространенным и важным методом диагностики заболевания. Кровь от больных надо брать до начала лечения и несколько раз повторять во время лечения.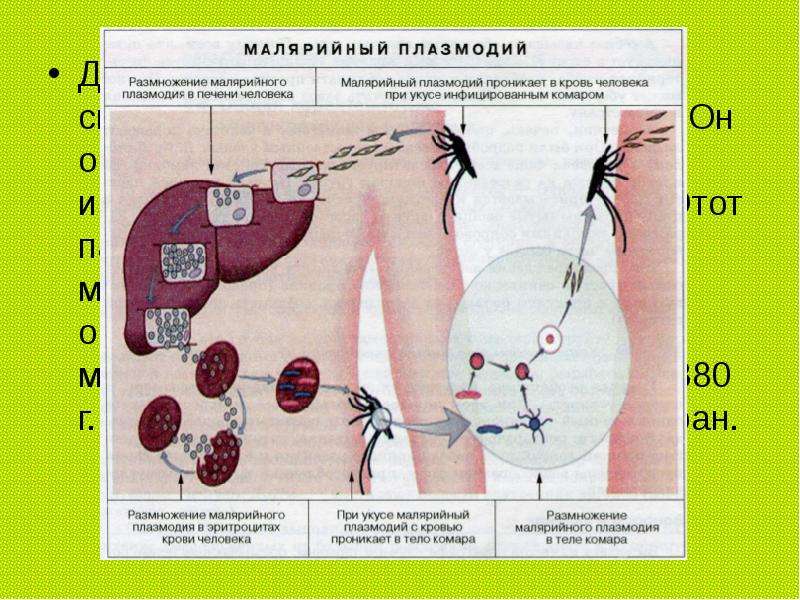 Плазмодиев в крови больше на высоте лихорадки, особенно после 2-3-го приступа, хотя их можно обнаружить и в период апирексии. Для исследования крови от каждого больного после прокола мякоти пальца готовят 4-8 препаратов (мазки и толстые капли), которые окрашивают по методу Романовского-Гимза. Ядра паразитов окрашиваются в красный, а цитоплазма — в сине-голубой цвет. При наличии возбудителей в эритроцитах обнаруживают различные стадии их развития: 1) кольцевидные трофозоиты возникают после их проникновения в эритроциты; узкий ободок цитоплазмы окружает вакуоль, которая выжимает ядро к периферии и паразит по форме напоминает кольцо (кольцо) 2) амебовидную трофозоиты (взрослые формы) 3) зрелые трофозоиты (шизонты), которые делятся на 6-24 еротроцитарних мерозоитов. При разрушении эритроцитов они попадают в плазму крови. Часть мерозоитов в эритроцитах превращается в незрелые мужские и женские половые клетки — микро-и макрогаметоциты. Для определения вида малярийных плазмодиев необходимо уметь дифференцировать их морфологические особенности.
Плазмодиев в крови больше на высоте лихорадки, особенно после 2-3-го приступа, хотя их можно обнаружить и в период апирексии. Для исследования крови от каждого больного после прокола мякоти пальца готовят 4-8 препаратов (мазки и толстые капли), которые окрашивают по методу Романовского-Гимза. Ядра паразитов окрашиваются в красный, а цитоплазма — в сине-голубой цвет. При наличии возбудителей в эритроцитах обнаруживают различные стадии их развития: 1) кольцевидные трофозоиты возникают после их проникновения в эритроциты; узкий ободок цитоплазмы окружает вакуоль, которая выжимает ядро к периферии и паразит по форме напоминает кольцо (кольцо) 2) амебовидную трофозоиты (взрослые формы) 3) зрелые трофозоиты (шизонты), которые делятся на 6-24 еротроцитарних мерозоитов. При разрушении эритроцитов они попадают в плазму крови. Часть мерозоитов в эритроцитах превращается в незрелые мужские и женские половые клетки — микро-и макрогаметоциты. Для определения вида малярийных плазмодиев необходимо уметь дифференцировать их морфологические особенности. Сначала просматривают толстые капли. Если у них плазмодиев не проявляют, тонкие мазки крови вообще не исследуют. И только при наличии паразитов в толстой капле, особенности их строения изучают в мазках.
Сначала просматривают толстые капли. Если у них плазмодиев не проявляют, тонкие мазки крови вообще не исследуют. И только при наличии паразитов в толстой капле, особенности их строения изучают в мазках.
Плазмодии
3. Жизненный цикл
Окончательным хозяином и переносчиком малярийного плазмодия является самка малярийного комара, здесь плазмодий проходит половой цикл спорогонию. Попав в желудок комара шизонты и мерозоиты перевариваются, а гаметоциты преобразуются в гаметы. Из одного макрогаметоцита формируется одна макрогамета, из одного микрогаметоцита формируется 4-8 мужских микрогамет со жгутиками. В дальнейшем гаметы сливаются, происходит оплодотворение и из диплоидной зиготы впоследствии образуется червеобразная подвижная оокинета. Через стенку желудка оокинета проникает под его наружную оболочку, а там инкапсулируется, превращается в ооцисту, содержимое которой делится с образованием спорозоитов.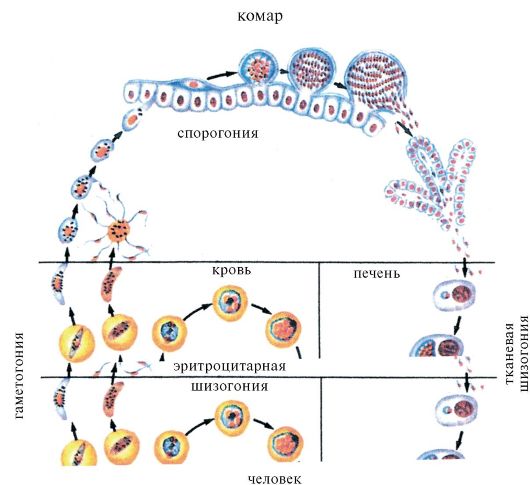 Спорозоиты покидают ооцисту, проникают в гемолимфу комара и разносятся по всем тканям, достигают слюнных желез, с этого момента самка комара становится инвазионной. В организм человека спорозоиты из слюнных желез насекомого попадают при кровососании, далее спорозоиты проникают в клетки печени, где происходит бесполое размножение экзоэритроцитарная шизогония — молодые шизонты созревают и когда число ядер в них достигает определенного в зависимости от вида числа от 8 до 32 в одном шизонте происходит обособление и разделение цитоплазмы вокруг каждого ядра, т. е. клетка печени разрушается и в результате образуются тканевые мерозоиты, такая шизогония не повторяется. Мерозоиты — это подвижные стадии паразита удлиненной формы, которые попадают в общий кровоток и проникают в непораженные эритроциты, где они преобразуются в трофозоиты, те, в свою очередь, опять превращаются в шизонты. Впоследствии происходит уже вторая шизогония, но теперь эритроцитарная с образованием эритроциртарных мерозоитов, при этом эритроцит разрывается и такие мерозоиты попадают в кровяное русло, где проникают в непораженные эритроциты и цикл эритроцитарной шизогонии повторяется многократно, причем продолжительность цикла у P.
Спорозоиты покидают ооцисту, проникают в гемолимфу комара и разносятся по всем тканям, достигают слюнных желез, с этого момента самка комара становится инвазионной. В организм человека спорозоиты из слюнных желез насекомого попадают при кровососании, далее спорозоиты проникают в клетки печени, где происходит бесполое размножение экзоэритроцитарная шизогония — молодые шизонты созревают и когда число ядер в них достигает определенного в зависимости от вида числа от 8 до 32 в одном шизонте происходит обособление и разделение цитоплазмы вокруг каждого ядра, т. е. клетка печени разрушается и в результате образуются тканевые мерозоиты, такая шизогония не повторяется. Мерозоиты — это подвижные стадии паразита удлиненной формы, которые попадают в общий кровоток и проникают в непораженные эритроциты, где они преобразуются в трофозоиты, те, в свою очередь, опять превращаются в шизонты. Впоследствии происходит уже вторая шизогония, но теперь эритроцитарная с образованием эритроциртарных мерозоитов, при этом эритроцит разрывается и такие мерозоиты попадают в кровяное русло, где проникают в непораженные эритроциты и цикл эритроцитарной шизогонии повторяется многократно, причем продолжительность цикла у P. Malarie — 72 ч, а у остальных видов — 48 ч. Часть мерозоитов после каждого из циклов могут развиваться в микро и макрогаметоциты. При укусе комара кровь зараженного попадает в желудок насекомого и цикл повторяется.
Malarie — 72 ч, а у остальных видов — 48 ч. Часть мерозоитов после каждого из циклов могут развиваться в микро и макрогаметоциты. При укусе комара кровь зараженного попадает в желудок насекомого и цикл повторяется.
Жизненный цикл малярийного паразита
Малярийный паразит развивается как у человека, так и у самок Anopheles комаров. Размер и генетическая сложность паразита означают, что каждая инфекция представляет тысячи антигенов (белков) для иммунной системы человека.
Паразит также проходит несколько этапов жизни, даже находясь в организме человека-хозяина, представляя разные антигены на разных этапах своего жизненного цикла. Было сложно понять, какие из них могут быть полезными мишенями для разработки вакцины.Кроме того, паразит разработал ряд стратегий, которые позволяют ему сбивать с толку, скрывать и дезориентировать иммунную систему человека.
- Заражение малярией начинается, когда инфицированная самка комара Anopheles кусает человека, вводя в кровоток паразитов Plasmodium в виде спорозоитов.

- Спорозоиты быстро проникают в печень человека.
- Спорозоиты размножаются в клетках печени бесполым путем в течение следующих 7-10 дней, не вызывая никаких симптомов.
- В модели на животных паразиты в форме мерозоитов высвобождаются из клеток печени в пузырьках, проходят через сердце и попадают в легкие, где оседают в капиллярах легких. Везикулы в конечном итоге распадаются, освобождая мерозоиты для перехода в фазу своего развития в крови. *
- Мерозоиты проникают в эритроциты (эритроциты) в кровотоке и снова размножаются, пока клетки не лопнут. Затем они вторгаются в другие эритроциты.Этот цикл повторяется, вызывая лихорадку каждый раз, когда паразиты высвобождаются и вторгаются в клетки крови.
- Некоторые инфицированные клетки крови выходят из цикла бесполого размножения. Вместо того, чтобы размножаться, мерозоиты в этих клетках развиваются в половые формы паразита, называемые гаметоцитами, которые циркулируют в кровотоке.

- Когда комар кусает инфицированного человека, он поглощает гаметоциты, которые в дальнейшем развиваются в зрелые половые клетки, называемые гаметами.
- Оплодотворенные женские гаметы развиваются в активно движущиеся оокинеты, которые проникают сквозь стенку средней кишки комара и образуют ооцисты на внешней поверхности.
- Внутри ооцисты развиваются тысячи активных спорозоитов. В конечном итоге ооциста лопается, выделяя в полость тела спорозоиты, которые попадают в слюнные железы комара.
- Цикл заражения человека начинается снова, когда комар кусает другого человека.
* Baer K, Klotz C, Kappe SH, et al. Высвобождение мерозоитов Plasmodium yoelii из печени в микрососуды легких. Патогены PLoS . 2007; (11): e171.
Жизненный цикл плазмодия
Plasmodium видов, инфицирующих людей До недавнего времени было четыре вида Plasmodium , которые считались ответственными за малярию у людей: P. vivax , P. falciparum , P. ovale и P. malariae . В 2008 году P. knowlesi , вид, который раньше инфицировал исключительно человекообразных обезьян из рода Macaque , был признан ВОЗ пятым видом плазмодиев , заражающим людей.
vivax , P. falciparum , P. ovale и P. malariae . В 2008 году P. knowlesi , вид, который раньше инфицировал исключительно человекообразных обезьян из рода Macaque , был признан ВОЗ пятым видом плазмодиев , заражающим людей.
Пути передачи
Основной путь передачи болезни — укусы инфицированных комаров Anopheles, которые ранее питались кровью от человека с паразитемией. Менее распространенные пути передачи — переливание инфицированной крови, трансплантация, инфицированные иглы и от матери к ее плоду во время беременности.
Плазмодий жизненный цикл
Жизненный цикл (рис. 1) почти одинаков для всех пяти видов, заражающих людей, и состоит из трех стадий:
(I) заражение человека спорозоитами
(II) бесполое размножение
(III) половое размножение
Две первые стадии проходят исключительно в человеческом теле, а третья начинается в человеческом теле и завершается в организме комара.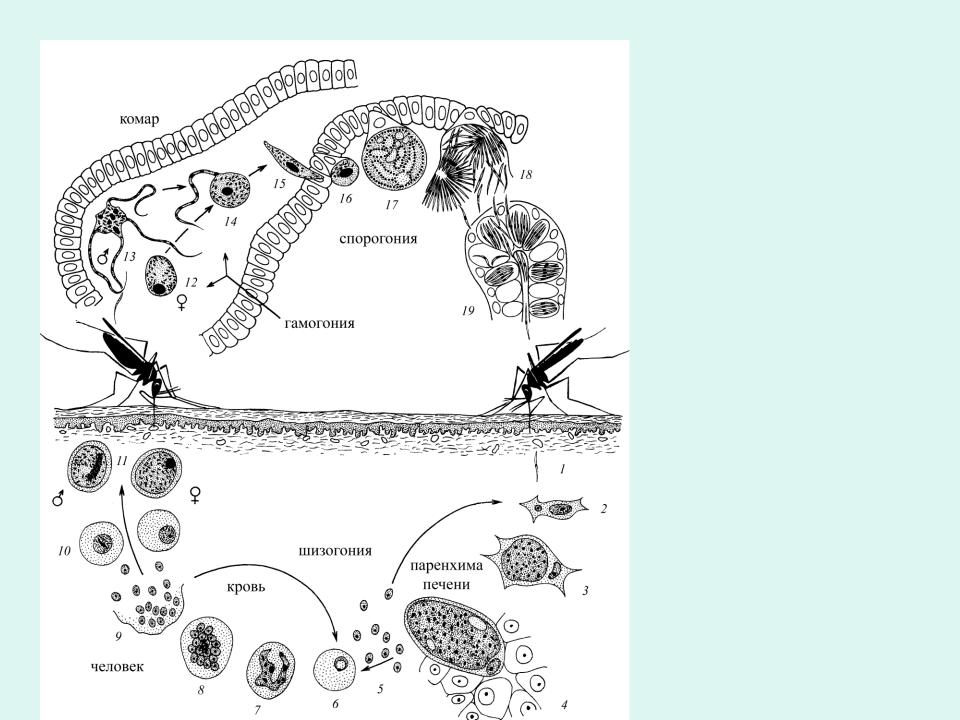
Рисунок 1. Жизненный цикл Plasmodium
(Источник: Open Course Ware)
Следующей стадией жизненного цикла малярии является стадия бесполого размножения, которая делится на различные фазы: преэритроцитарную (или, лучше сказать, экзоэритроцитарную ) и эритроцитарную фазу .Спустя всего 30-60 минут после заражения паразитами спорозоиты попадают через кровообращение к своей первой цели — печени . Спорозоиты попадают в клетки печени и начинают делиться, что приводит к созданию шизонтов через 6-7 дней. Каждый шизонт рождает тысячи мерозоитов, ( экзоэритроцитов, , , шизогония, ), которые затем выделяются в кровоток, отмечая конец экзоэритроцитарной фазы бесполой репродуктивной стадии.

Следует отметить, что в отношении P. vivax и P. ovale спорозоитов могут не следовать стадии воспроизводства и оставаться в состоянии покоя ( гипнозоитов ) в печени; они могут активироваться через долгое время, что приведет к рецидивам, попадающим в кровоток (в виде мерозоитов) через недели, месяцы или даже годы. Экзоэритроцитарная фаза не является патогенной и не вызывает симптомов или признаков заболевания. Его продолжительность не одинакова для всех видов паразитов.
Мерозоиты , выпущенные в кровоток, направляются к своей второй цели, эритроцитам (эритроцитам). Проникая в клетки, они отмечают начало эритроцитарной фазы. Первая стадия после вторжения — это кольцевая стадия, которая превращается в трофозоит . Трофозоиты не могут переваривать гем, поэтому они превращают его в гемозоин и переваривают глобин, который используется в качестве источника аминокислот для их воспроизводства.
 Следующая клеточная стадия — это эритроцитарный шизонт (сначала незрелый, а затем зрелый шизонт).Каждый зрелый шизонт рождает мерозоитов нового поколения ( эритроцитарная шизогония ), которые после разрыва эритроцитов выделяются в кровоток для вторжения в другие эритроциты. Именно тогда возникает паразитемия и появляются циничные проявления. Фаза печени возникает только один раз, а фаза эритроцитов проходит несколько циклов; высвобождение мерозоитов после каждого цикла создает фебрильные волны.
Следующая клеточная стадия — это эритроцитарный шизонт (сначала незрелый, а затем зрелый шизонт).Каждый зрелый шизонт рождает мерозоитов нового поколения ( эритроцитарная шизогония ), которые после разрыва эритроцитов выделяются в кровоток для вторжения в другие эритроциты. Именно тогда возникает паразитемия и появляются циничные проявления. Фаза печени возникает только один раз, а фаза эритроцитов проходит несколько циклов; высвобождение мерозоитов после каждого цикла создает фебрильные волны. Второй сценарий в эритроцитах — это дифференциация паразита на мужские и женские гаметоциты , которые являются непатогенной формой паразита.Когда самка комара Anopheles кусает инфицированного человека, она поглощает эти гаметоциты вместе с кровяной мукой (комары могут заразиться, только если они едят в период, когда гаметоциты циркулируют в крови человека). Затем гаметоциты созревают и превращаются в микрогамет, (мужские) и макрогамет, (женские) в процессе, известном как гаметогенез. Время, необходимое для созревания гаметоцитов, различается для каждого вида плазмодия: 3-4 дня для P. vivax и P.ovale , 6-8 дней для P. malariae и 8-10 дней для P. falciparum .
Время, необходимое для созревания гаметоцитов, различается для каждого вида плазмодия: 3-4 дня для P. vivax и P.ovale , 6-8 дней для P. malariae и 8-10 дней для P. falciparum .
В кишечнике комара ядро микрогаметы делится три раза, образуя восемь ядер; каждое ядро оплодотворяет макрогамету, образуя зиготу . Зигота после слияния ядер и оплодотворения становится так называемой оокинетой . Таким образом, оокинета проникает через стенку средней кишки комара, где проникает в образование, называемое ооцистой. Внутри ооцисты ядро оокинеты делится с образованием спорозоитов ( спорогоний ).Это конец третьей стадии (стадии полового размножения / спорогонии). Спорогония длится 8-15 дней .
Разрывы ооцист и спорозоиты попадают в полость комара и попадают в его слюнные железы, но только нескольким сотням спорозоитов удается проникнуть внутрь.
 Таким образом, когда вышеупомянутый инфицированный комар принимает пищу с кровью, он вводит свою инфицированную слюну следующей жертве, отмечая начало нового цикла.
Таким образом, когда вышеупомянутый инфицированный комар принимает пищу с кровью, он вводит свою инфицированную слюну следующей жертве, отмечая начало нового цикла. Продолжительность каждой описанной выше фазы различна для каждого из плазмодиев, как показано в Таблице 1 ниже.
Виды Plasmodium | ||||
| П. vivax | P. ovale | P. malariae | P. falciparum | |
| Проэритроцитарная фаза (дни) | 6-8 | 9 | 14-16 | 5-7 |
| Эритроцитарный цикл (часы) | 48 | 50 | 72 | 48 |
| Инкубационный период (дни) | 12-17 месяцев или даже 6-12 месяцев | 16-18 и более | 18-40 и более | 9-14 |
| Спорогоны (сут) | 8-10 | 12-14 | 14–16 | 9-10 |
Жизненный цикл
— Зона малярии
Малярийный паразит имеет сложный, многоступенчатый жизненный цикл, протекающий внутри двух живых существ, комаров-переносчиков и позвоночных-хозяев. Выживание и развитие паразита внутри беспозвоночных и позвоночных-хозяев, во внутриклеточной и внеклеточной среде, стало возможным благодаря набору инструментов из более чем 5000 генов и их специализированных белков, которые помогают паразиту вторгаться и расти внутри нескольких типов клеток и уклоняться от иммунные ответы хозяина. [1,2] Паразит проходит несколько стадий развития, таких как спорозоиты (Gr. Sporos = семена; инфекционная форма, вводимая комарами), мерозоиты (Gr. Meros = шт .; стадия вторжения в эритроциты), трофозоиты (гр. Trophes = питание; форма, размножающаяся в эритроцитах) и гаметоциты (половые стадии), и все эти стадии имеют свои собственные уникальные формы и структуры и белковые комплексы. Поверхностные белки и метаболические пути продолжают меняться на этих различных стадиях, что помогает паразиту избежать иммунного очищения, а также создает проблемы для разработки лекарств и вакцин. [2]
Выживание и развитие паразита внутри беспозвоночных и позвоночных-хозяев, во внутриклеточной и внеклеточной среде, стало возможным благодаря набору инструментов из более чем 5000 генов и их специализированных белков, которые помогают паразиту вторгаться и расти внутри нескольких типов клеток и уклоняться от иммунные ответы хозяина. [1,2] Паразит проходит несколько стадий развития, таких как спорозоиты (Gr. Sporos = семена; инфекционная форма, вводимая комарами), мерозоиты (Gr. Meros = шт .; стадия вторжения в эритроциты), трофозоиты (гр. Trophes = питание; форма, размножающаяся в эритроцитах) и гаметоциты (половые стадии), и все эти стадии имеют свои собственные уникальные формы и структуры и белковые комплексы. Поверхностные белки и метаболические пути продолжают меняться на этих различных стадиях, что помогает паразиту избежать иммунного очищения, а также создает проблемы для разработки лекарств и вакцин. [2]
Жизненный цикл малярийных паразитов [Источник]
Больше изображений: 1,2,3
youtube.com/embed/A2-XTlHBf_4?version=3&rel=1&showsearch=0&showinfo=1&iv_load_policy=1&fs=1&hl=en-US&autohide=2&wmode=transparent» allowfullscreen=»true» sandbox=»allow-scripts allow-same-origin allow-popups allow-presentation»/>
Видео с изображением жизненного цикла малярийного паразита
См. Также: Анимация из HHMI, Анимация из McGraw Hill
Спорогония в комарах:
Комары являются окончательными хозяевами малярийных паразитов, в которых происходит половая фаза жизненного цикла паразита.Половая фаза называется спорогония и приводит к развитию бесчисленных инфекционных форм паразита внутри комара, которые вызывают заболевание у человека-хозяина после его инъекции при укусе комара.
Когда самка Anopheles получает кровь от человека, инфицированного малярией, мужские и женские гаметоциты паразита попадают в кишечник комара. Молекулярные и клеточные изменения в гаметоцитах помогают паразиту быстро приспособиться к насекомому-хозяину из теплокровного человека-хозяина, а затем запустить спорогонический цикл.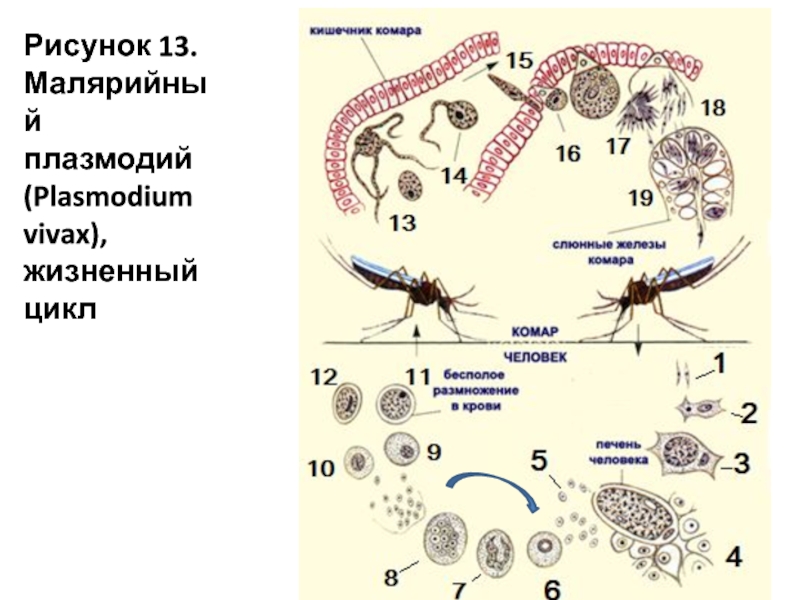 Мужские и женские гаметы сливаются в кишечнике комара, образуя зиготы, которые впоследствии развиваются в активно движущиеся оокинеты, которые зарываются в стенку средней кишки комара и превращаются в ооцисты. В результате роста и деления каждой ооцисты образуются тысячи активных гаплоидных форм, называемых спорозоитами. После фазы спорогонии, продолжающейся 8–15 дней, ооциста разрывается и высвобождает спорозоиты в полость тела комара, откуда они проникают в слюнные железы комара и проникают в них. Когда комар, нагруженный спорозоитами, принимает еще одну пищу с кровью, спорозоиты попадают из его слюнных желез в кровоток человека, вызывая заражение малярией у человека-хозяина.Было обнаружено, что инфицированный комар и паразит взаимно полезны друг другу и тем самым способствуют передаче инфекции. Комары, инфицированные Plasmodium , имеют лучшую выживаемость и повышенную скорость кормления кровью, особенно от инфицированного хозяина. [3-5]
Мужские и женские гаметы сливаются в кишечнике комара, образуя зиготы, которые впоследствии развиваются в активно движущиеся оокинеты, которые зарываются в стенку средней кишки комара и превращаются в ооцисты. В результате роста и деления каждой ооцисты образуются тысячи активных гаплоидных форм, называемых спорозоитами. После фазы спорогонии, продолжающейся 8–15 дней, ооциста разрывается и высвобождает спорозоиты в полость тела комара, откуда они проникают в слюнные железы комара и проникают в них. Когда комар, нагруженный спорозоитами, принимает еще одну пищу с кровью, спорозоиты попадают из его слюнных желез в кровоток человека, вызывая заражение малярией у человека-хозяина.Было обнаружено, что инфицированный комар и паразит взаимно полезны друг другу и тем самым способствуют передаче инфекции. Комары, инфицированные Plasmodium , имеют лучшую выживаемость и повышенную скорость кормления кровью, особенно от инфицированного хозяина. [3-5]
Цветной ПЭМ спорозоитов малярии в кишечнике комара Anopheles
Шизогония в человеческом хозяине:
Человек является промежуточным хозяином малярии, в которой происходит бесполая фаза жизненного цикла. Спорозоиты, привитые зараженным комаром, инициируют эту фазу цикла из печени, а последняя часть продолжается в красных кровяных тельцах, что приводит к различным клиническим проявлениям заболевания.
Спорозоиты, привитые зараженным комаром, инициируют эту фазу цикла из печени, а последняя часть продолжается в красных кровяных тельцах, что приводит к различным клиническим проявлениям заболевания.
Преэритроцитарная фаза — шизогония в печени:
При укусе комара в кожу проникают от десятков до нескольких сотен инвазивных спорозоитов. После внутрикожного отложения некоторые спорозоиты разрушаются местными макрофагами, некоторые попадают в лимфатические сосуды, а некоторые другие находят кровеносный сосуд.[6–8] Спорозоиты, попадающие в лимфатический сосуд, достигают дренирующего лимфатического узла, где некоторые из спорозоитов частично развиваются до экзоэритроцитарной стадии [6], а также могут стимулировать Т-клетки для создания защитного иммунного ответа.
Спорозоиты, обнаружившие кровеносный сосуд, достигают печени в течение нескольких часов. Недавно было показано, что спорозоиты перемещаются по непрерывной последовательности подвижных движений типа «липко-скользко», используя семейство связанных с тромбоспондином анонимных белков (TRAP) и актин-миозиновый мотор. [7,10,11] [См. Видео из ссылки 10] Затем спорозоиты проходят через синусоиды печени и мигрируют в несколько гепатоцитов, а затем размножаются и растут в паразитофорных вакуолях. Каждый спорозоит превращается в шизонта, содержащего 10 000–30 000 мерозоитов (или более в случае P. falciparum ). [12–14] Росту и развитию паразита в клетках печени способствует благоприятная среда, создаваемая циркумспорозоитный белок паразита. [15,16] Вся преэрироцитарная фаза длится около 5–16 дней в зависимости от вида паразита: [17] в среднем 5-6 дней для P.falciparum , 8 дней для P. vivax, 9 дней для P. ovale, 13 дней для P. malariae и 8-9 дней для P. knowlesi. [См. Также] Преэритроцитарная фаза остается «тихой» фазой с небольшой патологией и отсутствием симптомов, так как поражены только несколько гепатоцитов. [6] Эта фаза также представляет собой единый цикл, в отличие от следующей, эритроцитарной стадии, которая повторяется повторно.
[7,10,11] [См. Видео из ссылки 10] Затем спорозоиты проходят через синусоиды печени и мигрируют в несколько гепатоцитов, а затем размножаются и растут в паразитофорных вакуолях. Каждый спорозоит превращается в шизонта, содержащего 10 000–30 000 мерозоитов (или более в случае P. falciparum ). [12–14] Росту и развитию паразита в клетках печени способствует благоприятная среда, создаваемая циркумспорозоитный белок паразита. [15,16] Вся преэрироцитарная фаза длится около 5–16 дней в зависимости от вида паразита: [17] в среднем 5-6 дней для P.falciparum , 8 дней для P. vivax, 9 дней для P. ovale, 13 дней для P. malariae и 8-9 дней для P. knowlesi. [См. Также] Преэритроцитарная фаза остается «тихой» фазой с небольшой патологией и отсутствием симптомов, так как поражены только несколько гепатоцитов. [6] Эта фаза также представляет собой единый цикл, в отличие от следующей, эритроцитарной стадии, которая повторяется повторно.
Спорозоит плазмодия попадает в клетку печени [Источник]
Мерозоиты, которые развиваются в гепатоцитах, содержатся внутри везикул, происходящих из клеток-хозяев, называемых мерозомами, которые выходят из печени неповрежденными, тем самым защищая мерозоиты от фагоцитоза клетками Купфера. Эти мерозоиты в конечном итоге попадают в кровоток в капиллярах легких и инициируют стадию инфицирования крови на них [8].
Эти мерозоиты в конечном итоге попадают в кровоток в капиллярах легких и инициируют стадию инфицирования крови на них [8].
При малярии P. vivax и P. ovale некоторые спорозоиты могут оставаться в состоянии покоя в течение нескольких месяцев в печени. Называемые гипнозоитами, эти формы развиваются в шизонтов после некоторого латентного периода, обычно от нескольких недель до месяцев. Было высказано предположение, что эти поздно развивающиеся гипнозоиты генотипически отличаются от спорозоитов, которые вызывают острую инфекцию вскоре после заражения от укуса комара [18,19], и у многих пациентов вызывают рецидивы клинической инфекции через несколько недель или месяцев.
Эритроцитарная шизогония — центральная стадия красных клеток
Красные кровяные тельца являются «центральной площадкой» для бесполого развития малярийного паразита. В эритроцитах повторяющиеся циклы паразитарного развития происходят с определенной периодичностью, и в конце каждого цикла высвобождаются сотни свежих дочерних паразитов, которые вторгаются в большее количество эритроцитов.
Мерозоиты, высвобождаемые из печени, распознают, прикрепляются и проникают в красные кровяные тельца (эритроциты) посредством множественных взаимодействий рецептор-лиганд всего за 60 секунд.Это быстрое исчезновение из кровообращения в эритроциты сводит к минимуму воздействие антигенов на поверхности паразита, тем самым защищая эти формы паразита от иммунного ответа хозяина. [1,8,20] Инвазия мерозоитов в эритроциты. этому способствуют молекулярные взаимодействия между отдельными лигандами на мерозоитах и рецепторами хозяина на мембране эритроцитов. P. vivax проникает только в эритроциты с положительной группой крови Даффи, используя связывающий Даффи белок и белок гомологии ретикулоцитов, обнаруживаемый в основном на ретикулоцитах.более вирулентный P. falciparum использует несколько различных семейств рецепторов и альтернативные пути инвазии, которые очень избыточны. Разновидности гомологичных белков, подобных связыванию Даффи (DBL), и гомологичных белков, подобных связыванию ретикулоцитов, P. falciparum распознают различные рецепторы эритроцитов, отличные от группы крови Даффи или рецепторов ретикулоцитов. Такой избыточности способствует тот факт, что P. falciparum имеет четыре гена связывающих эритроциты белков, подобных связыванию Даффи, по сравнению только с одним геном в семействе DBL-EBP, как в случае P.vivax , позволяя P. falciparum проникать в любые эритроциты. [21,22]
falciparum распознают различные рецепторы эритроцитов, отличные от группы крови Даффи или рецепторов ретикулоцитов. Такой избыточности способствует тот факт, что P. falciparum имеет четыре гена связывающих эритроциты белков, подобных связыванию Даффи, по сравнению только с одним геном в семействе DBL-EBP, как в случае P.vivax , позволяя P. falciparum проникать в любые эритроциты. [21,22]
Процесс вторжения мерозоитов в красные клетки [© 2009 QIAGEN, все права защищены]
Процесс прикрепления, инвазии и закрепления мерозоитов в эритроцитах становится возможным благодаря специализированным апикальным секреторным органеллам мерозоитов, называемым микронемами, рооптриями и плотными гранулами. Первоначальное взаимодействие между паразитом и эритроцитами стимулирует быструю «волну» деформации через мембрану эритроцитов, приводящую к образованию стабильного соединения паразит-клетка-хозяин.После этого паразит проталкивается через бислой эритроцитов с помощью актин-миозинового двигателя, белков семейства анонимных белков, связанных с тромбоспондином (TRAP) и альдолазы, и создает паразитофорную вакуоль, изолирующую себя от клетки-хозяина. цитоплазма, тем самым создавая благоприятную среду для ее развития в эритроцитах. На этом этапе паразит проявляется как внутриклеточное «кольцо». [20,23,24]
цитоплазма, тем самым создавая благоприятную среду для ее развития в эритроцитах. На этом этапе паразит проявляется как внутриклеточное «кольцо». [20,23,24]
В эритроцитах количество паразитов быстро увеличивается с устойчивым циклом популяции паразитов.Несмотря на то, что эритроциты обеспечивают некоторое иммунологическое преимущество для растущего паразита, отсутствие стандартных путей биосинтеза и внутриклеточных органелл в эритроцитах, как правило, создает препятствия для быстрорастущих внутриклеточных паразитов. Эти препятствия преодолеваются стадиями роста кольца с помощью нескольких механизмов: путем ограничения питательного вещества до обильного гемоглобина, резкого увеличения площади поверхности за счет образования тубовезикулярной сети, а также путем экспорта ряда факторов ремоделирования и вирулентности в красная клетка.[8] Гемоглобин эритроцитов, основное питательное вещество для растущего паразита, попадает в пищевую вакуоль и разрушается. Доступные таким образом аминокислоты используются для биосинтеза белка, а оставшийся токсичный гем детоксифицируется гем-полимеразой и секвестрируется в виде гемозоина (малярийного пигмента). Паразит зависит от анаэробного гликолиза для получения энергии, используя ферменты, такие как pLDH, альдолаза плазмодия и т. Д. По мере роста и размножения паразита в эритроцитах проницаемость мембраны и цитозольный состав клетки-хозяина изменяются.[25,26] Эти новые пути проникновения, индуцированные паразитом в мембране клетки-хозяина, помогают не только в поглощении растворенных веществ из внеклеточной среды, но и в удалении метаболических отходов, а также в возникновении и поддержании электрохимических ионных градиентов. В то же время преждевременный гемолиз инфицированных эритроцитов с высокой проницаемостью предотвращается за счет чрезмерного проглатывания, переваривания и детоксикации гемоглобина клетки-хозяина и его выхода из инфицированных эритроцитов через новые пути проникновения, тем самым сохраняя осмотическую стабильность. инфицированных эритроцитов.[25,26]
Паразит зависит от анаэробного гликолиза для получения энергии, используя ферменты, такие как pLDH, альдолаза плазмодия и т. Д. По мере роста и размножения паразита в эритроцитах проницаемость мембраны и цитозольный состав клетки-хозяина изменяются.[25,26] Эти новые пути проникновения, индуцированные паразитом в мембране клетки-хозяина, помогают не только в поглощении растворенных веществ из внеклеточной среды, но и в удалении метаболических отходов, а также в возникновении и поддержании электрохимических ионных градиентов. В то же время преждевременный гемолиз инфицированных эритроцитов с высокой проницаемостью предотвращается за счет чрезмерного проглатывания, переваривания и детоксикации гемоглобина клетки-хозяина и его выхода из инфицированных эритроцитов через новые пути проникновения, тем самым сохраняя осмотическую стабильность. инфицированных эритроцитов.[25,26]
TEM шизонта P. falciparum (X2810) [Источник: Dennis Kunkel Microscopy, Inc./Visuals Unlimited, Inc.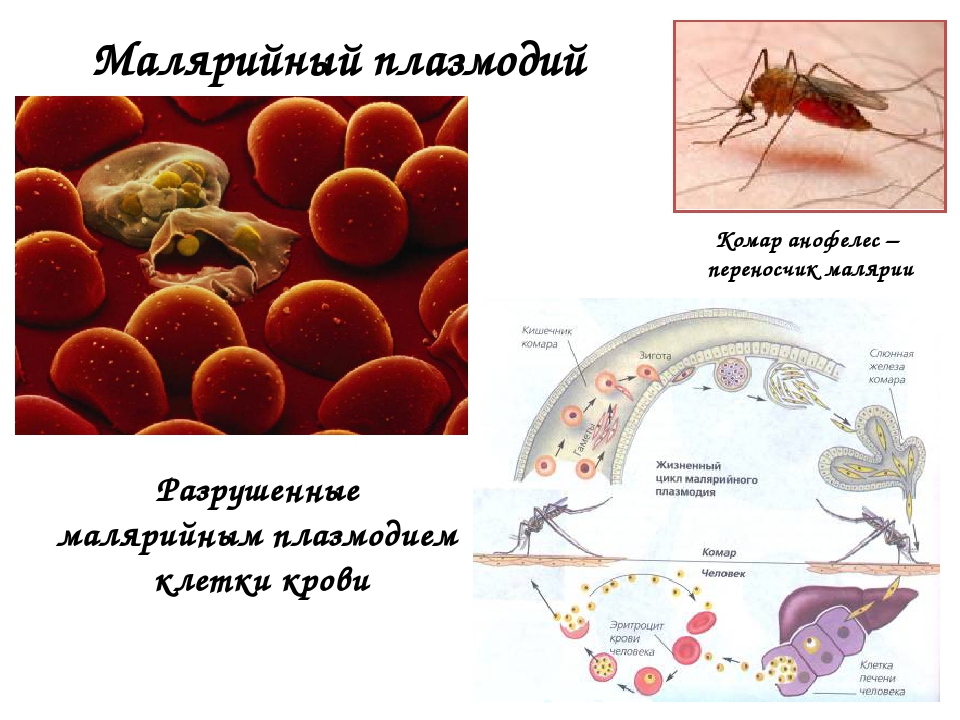 ]
]
SEM красных клеток, инфицированных P. falciparum (X4000) Kunkel Microscopy, Inc./Visuals Unlimited, Inc.]
Эритроцитарный цикл происходит каждые 24 часа в случае P. knowlesi, 48 часов в случае P. falciparum, P. vivax и P. ovale и 72 часа в случае P. malariae. В течение каждого цикла каждый мерозоит растет и делится внутри вакуоли на 8–32 (в среднем 10) свежих мерозоитов, проходя стадии цикла, трофозоита и шизонта. В конце цикла инфицированные эритроциты разрываются, высвобождая новые мерозоиты, которые, в свою очередь, инфицируют больше эритроцитов. При солнечном росте количество паразитов может быстро возрасти до уровня 10 13 на хозяина. [1]
Небольшая часть бесполых паразитов не подвергается шизогонии, а дифференцируется в гаметоциты половой стадии.Эти мужские или женские гаметоциты являются внеклеточными и непатогенными и помогают передавать инфекцию другим через самок анофелиновых комаров, в которых они продолжают половую фазу жизненного цикла паразита. Гаметоциты P. vivax развиваются вскоре после высвобождения мерозоитов из печени, тогда как в случае P. falciparum гаметоциты развиваются намного позже, причем пиковые плотности половых стадий обычно происходят через 1 неделю после пиковых значений плотности бесполых стадий.[27,28]
Гаметоциты P. vivax развиваются вскоре после высвобождения мерозоитов из печени, тогда как в случае P. falciparum гаметоциты развиваются намного позже, причем пиковые плотности половых стадий обычно происходят через 1 неделю после пиковых значений плотности бесполых стадий.[27,28]
Дополнительная литература:
- Брайан М. Гринвуд, Дэвид А. Фидок, Деннис Э. Кайл, Стефан Х.И. Каппе, Педро Л. Алонсо, Фрэнк Х. Коллинз, Патрик Э. Даффи. Малярия: прогресс, опасности и перспективы искоренения. J. Clin. Вкладывать деньги. 2008; 118: 1266–1276. doi: 10.1172 / JCI33996 Полный текст на http://www.jci.org/articles/view/33996/files/pdf
- Лоуренс Флорен, Майкл П. Уошберн, Дж. Дейл Рейн и др. Протеомный вид жизненного цикла Plasmodium falciparum Nature October 2002; 419: 520-526.Полный текст на http://www.nature.com/nature/journal/v419/n6906/pdf/nature01107.pdf
- Каролина Барильяс-Мюри, Санджив Кумар. Взаимодействие плазмодий и комаров: рассказ об опасных связях.
 Клеточная микробиология 2005; 7 (11): 1539–1545 DOI: 10.1111 / j.1462-5822.2005.00615.x. Полный текст на http://www3.interscience.wiley.com/cgi-bin/fulltext/118714410/PDFSTART
Клеточная микробиология 2005; 7 (11): 1539–1545 DOI: 10.1111 / j.1462-5822.2005.00615.x. Полный текст на http://www3.interscience.wiley.com/cgi-bin/fulltext/118714410/PDFSTART - Hill AVS. Преэритроцитарные вакцины против малярии: в сторону большей эффективности. Nature Reviews Immunology Январь 2006 г .; 6: 21-32
- Хизер М. Фергюсон, Эндрю Ф. Рид.Аппетит комаров к крови стимулируется инфекциями Plasmodium chabaudi как самих комаров, так и их позвоночных-хозяев. Malaria Journal 2004; 3: 12 doi: 10.1186 / 1475-2875-3-12 Полный текст на http://www.malariajournal.com/content/pdf/1475-2875-3-12.pdf
- Эшли М. Воан, Ахмед С. И. Али, Стефан Х. И. Каппе. Малярийная паразитарная инфекция на преэритроцитарной стадии: скольжение и прячется. Клеточный микроб-хозяин. 11 сентября 2008 г .; 4 (3): 209–218. Полный текст на http: // www.ncbi.nlm.nih.gov/pmc/articles/PMC2610487/pdf/nihms69860.pdf
- Люси Мегуми Ямаути, Алида Коппи, Жорж Сноуну, Фотини Синнис.
 Спорозоиты плазмодия вытекают из места инъекции. Cell Microbiol. , 1 мая 2007 г .; 9 (5): 1215–1222. Полный текст на http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1865575/pdf/cmi0009-1215.pdf
Спорозоиты плазмодия вытекают из места инъекции. Cell Microbiol. , 1 мая 2007 г .; 9 (5): 1215–1222. Полный текст на http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1865575/pdf/cmi0009-1215.pdf - Оливье Сильви, Мария М Мота, Кай Матущевски, Мигель Пруденсио. Взаимодействие малярийного паразита и его млекопитающего-хозяина. Текущее мнение в микробиологии 2008; 11: 352–359.Полный текст на http://www.mpiib-berlin.mpg.de/research/Mat_2008_Silvie_etal_COM.pdf
- Майкл Ф. Гуд, Дениз Л. Дулан. Путь малярии через лимфатический узел. Nature Medicine 2007; 13: 1023-1024.
- Сильвия Мюнтер, Бенедикт Сабасс, Кристин Селхубер-Унке и др. Подвижность спорозоитов плазмодия модулируется оборотом отдельных участков адгезии Клетка-хозяин и микроб. , декабрь 2009 г .; 6 (17): 551-562. Полный текст на http://download.cell.com/cell-host-microbe/pdf/PIIS193131280 49.pdf? intermediate = true
- Джейк Баум, Дэйв Ричард, Джули Хил и др. Консервативный молекулярный мотор управляет инвазией клеток и скользящей подвижностью на стадиях жизненного цикла малярии и других апикомлексных паразитов.
 Журнал биологической химии . Февраль 2006 г .; 281: 5197-5208. Полный текст на http://www.jbc.org/content/281/8/5197.full.pdf+html
Журнал биологической химии . Февраль 2006 г .; 281: 5197-5208. Полный текст на http://www.jbc.org/content/281/8/5197.full.pdf+html - Кебайер С., Воза Т., Вандерберг Дж. Кинетика спорозоитов плазмодия, инъецированных комарами, у мышей: меньшее количество спорозоитов вводится иммунизированным спорозоитом мышам. PLoS Pathog 2009; 5 (4): e1000399. Полный текст на http://www.plospathogens.org/article/info:doi%2F10.1371%2Fjournal.ppat.1000399
- Amino R, Thiberge S, Martin B et al. Количественная визуализация передачи плазмодия от комара к млекопитающему. Нат Мед . Февраль 2006; 12 (2): 220-224.
- Малькольм К. Джонс, Майкл Ф. Гуд. Малярийные паразиты вблизи. Nature Medicine 2006; 12: 170-171 Полный текст на http://ecofog.cirad.fr/actualites/documents/JCP20060224.pdf
- Мигель Пруденсио, Ана Родригес, Мария М.Мота. Тихий путь к тысячам мерозоитов: стадия печени плазмодия. Nature Reviews Microbiology 2006; 4: 849–856
- Агам Прасад Сингх, Карлос А.
 Бускалья, Цянь Ван и др. Циркумспорозоитный белок плазмодия способствует развитию печеночных стадий паразита. Cell 2007; 131: 492–504.
Бускалья, Цянь Ван и др. Циркумспорозоитный белок плазмодия способствует развитию печеночных стадий паразита. Cell 2007; 131: 492–504. - Малярия: жизненный цикл малярийного паразита. На http://www3.niaid.nih.gov/topics/Malaria/lifecycle.htm
- Уильям Э. Коллинз. Дальнейшее понимание природы рецидива инфекции Plasmodium vivax . Журнал инфекционных болезней 2007; 195: 919–920. Полный текст на http://www.journals.uchicago.edu/doi/pdf/10.1086/512246
- Фрэнк Б. Когсуэлл. Гипнозоит и рецидив малярии приматов. Обзоры клинической микробиологии . Январь 1992; 5 (1): 26-35. Полный текст на http://cmr.asm.org/cgi/reprint/5/1/26.pdf
- Алан Ф. Кауман, Брендан С. Крабб. Вторжение малярийных паразитов в эритроциты. Ячейка . 24 февраля 2006 г., 124: 755–766. Полный текст на http: // download.cell.com/pdf/PIIS0092867406001814.pdf
- Гислен Майера, округ Колумбия, Джоанн Кофия, Любин Цзянб, Дэниел Л. Хартлк, Эрин Трейси, Джурадж Кабатд, Лоуренс Х.
 Мендоза, Луи Х. Миллера. Гликофорин B является рецептором эритроцитов Plasmodium falciparum эритроцит-связывающего лиганда, EBL-1. PNAS 31 марта 2009 г .; 106 (13): 5348–5352 Полный текст на http://www.pnas.org/content/106/13/5348.full.pdf+html
Мендоза, Луи Х. Миллера. Гликофорин B является рецептором эритроцитов Plasmodium falciparum эритроцит-связывающего лиганда, EBL-1. PNAS 31 марта 2009 г .; 106 (13): 5348–5352 Полный текст на http://www.pnas.org/content/106/13/5348.full.pdf+html - Дэвид Дж. Уизерал, Луи Х. Миллер, Дрор И. Барух, Кевин Марш, Огобара К.Думбо, Климент Казальс-Паскуаль, Дэвид Дж. Робертс. Малярия и красная клетка. Гематология 2002; 1: 35-57. Полный текст на http://asheducationbook.hemologylibrary.org/cgi/reprint/2002/1/35
- Кастури Халдар, Нарла Мохандас. Ремоделирование эритроцитов малярийными паразитами. Curr Opin Hematol 2007; 14: 203–209. Полный текст на http://www.nd.edu/~haldarlb/pubs/article007.pdf
- Юрген Бош, Карлос А. Бускалья, Брайан Крумм, Бьярни П. Ингасон, Роберт Лукас, Клаудиа Роуч, Тимоти Кардозо, Виктор Нуссенцвейг, Вим Г.J. Hol. Альдолаза обеспечивает необычный сайт связывания анонимного белка, связанного с тромбоспондином, в механизме инвазии малярийного паразита.
 PNAS 24 апреля 2007 г .; 104 (17): 7015–7020. Полный текст на http://www.pnas.org/content/104/17/7015.full.pdf
PNAS 24 апреля 2007 г .; 104 (17): 7015–7020. Полный текст на http://www.pnas.org/content/104/17/7015.full.pdf - Вирджилио Л. Лью, Тереза Тифферт, Хагай Гинзбург. Избыточное переваривание гемоглобина и осмотическая стабильность эритроцитов, инфицированных Plasmodium falciparum, . Кровь. 15 мая 2003 г .; 101 (10): 4189-4194. Полный текст на http: // bloodjournal.hematologylibrary.org/cgi/reprint/101/10/4189
- Киаран Кирк. Мембранный транспорт в эритроцитах, инфицированных малярией. Physiological Reviews April 2001; 81 (2): 495-537. Полный текст на http://physrev.physiology.org/cgi/reprint/81/2/495
- Саситон Пукриттаяками, Маллика Имвонг, Пратап Сингхасиванон, Касия Степневска, Николас Дж. Дэй, Николас Дж. Уайт. Влияние различных противомалярийных препаратов на перенос гаметоцитов при малярии P. vivax. Am. J. Trop. Med. Hyg., 2008; 79 (3): 378-384. Полный текст на http://www.ajtmh.org/cgi/reprint/79/3/378
- Луи Х. Миллер, Дрор И. Барух, Кевин Марш, Огобара К. Думбо. Патогенная основа малярии. Nature Февраль 2002 г .; 415 (7): 673-679. Полный текст на http://www.doh.gov.za/issues/malaria/red_reference/cross_cutting/cross20.pdf
© malariasite.com © BS Kakkilaya | Последнее обновление: 2 янв.2018 г.
СвязанныеСтадия эритроцитов — обзор
Иммунный ответ хозяина
Иммунный ответ человека-хозяина несколько различается для каждой из двух стадий малярийного жизненного цикла (т.е.е., преэритроцитарная стадия и эритроцитарная стадия). Считается, что Т-клетки, особенно Т-клетки CD8 + , играют важную роль в преэритроцитарном иммунитете. Мишенью для врожденной иммунной активности на этой стадии, по-видимому, являются молекулы, связанные с паразитом и антигеном, экспрессирующиеся на поверхности инфицированных гепатоцитов. С другой стороны, регуляция Т-лимфоцитов CD4 + , по-видимому, играет решающую роль в приобретении иммунитета к эритроцитарной стадии малярийной инфекции. Тяжесть инфекции серьезно влияет на баланс между иммунными функциями, опосредованными Th2 (IFN-γ) и Th3 (IL-4), причем последнее значительно усиливается по мере увеличения тяжести инфекции.Малярийная лихорадка (лихорадка) часто связана с высоким уровнем TNF-α, в то время как бессимптомные интервалы между рецидивами могут быть вызваны потерей реактивности к TNF-α.
Врожденная иммунная система играет важную роль в защите от многочисленных патогенов, включая Plasmodium . TLR активируются путем распознавания PAMPs Plasmodium гликозилфосфатидилинозитолов (TLR-2, TLR-4) и гемозоина (TLR-9). Последующее связывание этих лигандов с соответствующими TLR ускоряет высвобождение провоспалительных цитокинов, что приводит к лихорадке, болям и болям.
Помимо исследований в области химиотерапии, активно ведется разработка защитной вакцины против малярии. Действительно, разработка вакцин и иммунодиагностических тестов — два основных приоритета ВОЗ. В основе разработки успешной вакцины лежит определение тех стадий, которые стимулируют защитные иммунные ответы у позвоночных-хозяев. Поскольку многие стадии развития малярийных паразитов у позвоночного-хозяина являются внутриклеточными и, следовательно, защищены от иммунного механизма хозяина, внеклеточные формы (т.е., спорозоиты и мерозоиты) становятся мишенями для вакцины. В настоящее время изучаются основные типы вакцин: антиспорозоитных вакцин, , направленных против спорозоитов при введении комаров позвоночным животным-хозяевам, , вакцины против бесполой стадии крови , направленные против различных антигенов стадии крови, таких как те, которые приписываются мерозоитам а также введенные на поверхность инфицированных эритроцитов; и вакцины , блокирующие передачу, , нацеленные на остановку развития паразита в комаре.Ряд подходов, таких как клонирование генов и генная инженерия, вселяют в эти поиски некоторую степень осторожного оптимизма. Определенные особенности поверхностного покрытия спорозоитов уже определены. Шерсть действует как возобновляемая «приманка» для иммунной системы позвоночного хозяина, стимулируя выработку антител. Когда спорозоит атакован и его «приманка» осыпается, синтезируется замещающая оболочка, и эффект «приманки» продолжается. Эта система обеспечивает идеальную защиту спорозоитов, которые ненадолго пребывают в крови, прежде чем попадут в клетку печени, где он защищен от циркулирующих антител.Также предлагается краткое «окно возможностей» для выявления потенциально уязвимой стадии развития. Защита, обеспечиваемая спорозоитом с помощью его поверхностной оболочки при его кратковременном прохождении через кровеносную систему хозяина, контрастирует с защитой африканских трипаносом (стр. 104), которые подвергаются воздействию иммунной системы в течение длительного времени на протяжении длительного пребывания в крови. Следует напомнить, что поверхностные антигены африканских трипаносом постоянно меняются, и каждая доминирующая популяция на шаг опережает иммунную систему позвоночного хозяина.
В эндемичных районах предварительное ранение (стр. 34) является основой защитного иммунитета до тех пор, пока сохраняется низкий уровень инфекции. Однако после полного излечения жертва восстанавливает восприимчивость. Кроме того, в то время как грудные младенцы в эндемичных районах защищены антителами в материнском молоке, во время отлучения от груди дети подвергаются наибольшему риску, и самый высокий уровень смертности в таких регионах наблюдается среди детей. Также сообщалось, что P. falciparum проникает через плаценту и вызывает инфекцию плода.
Другие факторы, помимо иммунологических, также могут влиять на восприимчивость людей. Несколько генетических состояний влияют на малярийный организм. Чувствительность, обусловленная присутствием антигенов Даффи, уже обсуждалась. Генетический дефицит глюкозо-6-фосфатдегидрогеназы в эритроцитах (, favism ) создает неблагоприятную среду для паразитов. Этот фермент ограничивает скорость пентозного пути, который, помимо других функций, обеспечивает снижающий потенциал для защиты плазматической мембраны эритроцита от токсичных побочных продуктов, таких как продуцируемые паразитом.Отсутствие защиты приводит к чрезмерной утечке калия из инфицированной клетки, а также к проникновению избытка натрия. Поскольку малярийному паразиту может потребоваться более высокий уровень калия, чем доступно, он умирает. Люди, гетерозиготные по серповидноклеточной анемии , обладают избирательным преимуществом перед людьми с нормальным гемоглобином в регионах, где P. falciparum является эндемичным. Склонность к «серповидности» усиливается, когда пораженные эритроциты подвергаются воздействию низкого давления кислорода.Одним из объяснений такого селективного преимущества является то, что эритроцитов, инфицированных P. falciparum , попадая в ловушку висцеральных капилляров, вызывают серповидное движение, повреждая мембрану эритроцитов, вызывая чрезмерную утечку калия из инфицированной клетки. В гетерозиготном хозяине до 40% клеток относятся к этому типу и поэтому непригодны для развития паразита, что объясняет устойчивость к заболеванию среди таких людей. По иронии судьбы, тяжелые патологические эффекты малярии falciparum привели к сохранению этой крайне опасной мутации в человеческой популяции.Потребность малярийных организмов во внутриклеточном калии подвергается сомнению. Эксперименты in vitro показали, что паразит может нормально расти в эритроцитах с высоким содержанием натрия и низким содержанием калия. Альтернативное объяснение состоит в том, что такие генетические условия в сочетании с присутствием паразита увеличивают возможность обнаружения и удаления фагоцитарными клетками хозяина.
Бесполый рост и половое развитие плазмодиев в гематопоэтической нише хозяина
ВОЗ. Всемирный доклад о малярии, 2018 г. . https://www.who.int/malaria/publications/world-malaria-report-2018/report/en/ (2018).
Tavares, J. et al. Роль пересечения клетки-хозяина спорозоитом малярии во время инфекции печени. J. Exp. Med. 210 , 905–915 (2013).
CAS PubMed PubMed Central Google ученый
Amino, R. et al. Количественная визуализация передачи Plasmodium от комара к млекопитающему. Nat. Med. 12 , 220–224 (2006).
CAS PubMed Google ученый
Mota, M. M. et al. Миграция спорозоитов Plasmodium через клетки до заражения. Science 291 , 141–144 (2001).
CAS PubMed Google ученый
Sturm, A. et al. Манипулирование гепатоцитами хозяина малярийным паразитом для доставки в синусоиды печени. Наука 313 , 1287–1290 (2006).
CAS PubMed Google ученый
Сологуб Л. и др. Протеазы малярии опосредуют выход гаметоцитов из эритроцитов наизнанку после передачи паразита комару. Cell Microbiol. 13 , 897–912 (2011).
CAS PubMed Google ученый
Janse, C.J., Ramesar, J., van den Berg, F. M. & Mons, B. Plasmodium berghei : создание и отбор in vivo мутантов кариотипа и мутантов-продуцентов, не являющихся гаметоцитами. Exp. Паразитол. 74 , 1–10 (1992).
CAS PubMed Google ученый
Alano, P. et al. Plasmodium falciparum : паразиты, дефектные на ранних стадиях гаметоцитогенеза. Exp. Паразитол. 81 , 227–235 (1995).
CAS PubMed Google ученый
Kafsack, B.F. et al. Переключение транскрипции лежит в основе приверженности половому развитию малярийных паразитов. Природа 507 , 248–252 (2014).
CAS PubMed PubMed Central Google ученый
Sinha, A. et al. Каскад ДНК-связывающих белков для полового акта и развития у Plasmodium . Nature 507 , 253–257 (2014).
CAS PubMed PubMed Central Google ученый
Brancucci, N.M.B. et al. Гетерохроматиновый белок 1 обеспечивает выживание и передачу малярийных паразитов. Клеточный микроб-хозяин 16 , 165–176 (2014).
CAS PubMed Google ученый
Коулман, Б. И.и другие. Гистондеацетилаза Plasmodium falciparum регулирует антигенную изменчивость и конверсию гаметоцитов. Клеточный микроб-хозяин 16 , 177–186 (2014).
CAS PubMed PubMed Central Google ученый
Eksi, S. et al. Plasmodium falciparum Развитие гаметоцитов 1 (Pfgdv1) и идентификация ранних генов гаметоцитогенеза и приверженность половому развитию. PLOS Pathog. 8 , e1002964 (2012).
CAS PubMed PubMed Central Google ученый
Филарский М. и др. GDV1 вызывает сексуальную активность малярийных паразитов, противодействуя HP1-зависимому подавлению генов. Наука 359 , 1259–1263 (2018).
CAS PubMed PubMed Central Google ученый
Выпучивание, А., Ranford-Cartwright, L.C., Miles, A. & Read, A. F. Хлорохин усиливает гаметоцитогенез Plasmodium falciparum in vitro. Паразитология 118 (Pt 4), 339–346 (1999).
CAS PubMed Google ученый
Buchholz, K. et al. Высокопроизводительный скрининг, нацеленный на стадии передачи малярии, открывает новые возможности для разработки лекарств. J. Infect. Dis. 203 , 1445–1453 (2011).
PubMed PubMed Central Google ученый
Бранкучи, Н. М. Б. и др. Лизофосфатидилхолин регулирует дифференцировку половой стадии у малярийного паразита человека Plasmodium falciparum . Ячейка 171 , 1532–1544.e15 (2017).
CAS PubMed PubMed Central Google ученый
Бранкучи, Н. М.B. et al. Зондирование Plasmodium falciparum сексуальной активности на одноклеточном уровне. Wellcome Open Res. 3 , 70 (2018).
PubMed PubMed Central Google ученый
Poran, A. et al. Секвенирование одноклеточной РНК показывает признак сексуальной приверженности малярийных паразитов. Nature 551 , 95–99 (2017).
PubMed PubMed Central Google ученый
Brancucci, N.M., Witmer, K., Schmid, C. & Voss, T. S. Верхний элемент гена var контролирует синтез белка на уровне инициации трансляции в Plasmodium falciparum . PLOS ONE 9 , e100183 (2014).
PubMed PubMed Central Google ученый
Джослинг, Г. А. и Ллинас, М. Половое развитие у паразитов Plasmodium : знание, когда пора совершать коммит. Nat. Rev. Microbiol. 13 , 573–587 (2015).
CAS PubMed Google ученый
Джослинг, Г. А., Уильямсон, К. К. и Ллинас, М. Регулирование половой активности и гаметоцитогенеза у малярийных паразитов. Annu. Rev. Microbiol. 72 , 501–519 (2018).
CAS PubMed Google ученый
Хокинг, Ф., Wilson, M. E. & Gammage, K. Доказательства циклического развития и недолгой зрелости гаметоцитов Plasmodium falciparum . Пер. R. Soc. Троп. Med. Hyg. 65 , 549–559 (1971).
CAS PubMed Google ученый
Gautret, P. & Motard, A. Периодическая инфекционность гаметоцитов Plasmodium для вектора. Обзор. Паразит 6 , 103–111 (1999).
CAS PubMed Google ученый
Dearnley, M. et al. Обратимое ремоделирование клеток-хозяев лежит в основе изменений деформируемости на стадиях половой крови малярийных паразитов. Proc. Natl Acad. Sci. США 113 , 4800–4805 (2016).
CAS PubMed Google ученый
Hliscs, M. et al. Организация и функция актинового цитоскелета в гаметоцитах Plasmodium falciparum . Cell. Microbiol. 17 , 207–225 (2015).
CAS PubMed Google ученый
Dearnley, M. K. et al. Происхождение, состав, организация и функция комплекса внутренней мембраны гаметоцитов Plasmodium falciparum . J. Cell Sci. 125 , 2053–2063 (2012).
CAS PubMed Google ученый
Turner, L. et al. Тяжелая форма малярии связана со связыванием паразитов с рецептором эндотелиального протеина С. Природа 498 , 502–505 (2013).
CAS PubMed PubMed Central Google ученый
Seydel, K. B. et al. Набухание мозга и смерть у детей от церебральной малярии. N. Engl. J. Med. 372 , 1126–1137 (2015).
CAS PubMed PubMed Central Google ученый
Фрид М. и Даффи П. Э. Привязка Plasmodium falciparum к хондроитинсульфату а в плаценте человека. Science 272 , 1502–1504 (1996).
CAS PubMed Google ученый
Cranston, H.A. et al. Созревание Plasmodium falciparum устраняет физиологическую деформируемость эритроцитов. Science 223 , 400–403 (1984).
CAS PubMed Google ученый
Гинзбург, Х. и Кругляк, М. Поглощение L-триптофана эритроцитами, инфицированными малярийными паразитами ( Plasmodium falciparum, ). Biochim. Биофиз. Acta 729 , 97–103 (1983).
CAS PubMed Google ученый
Вествебер Д. Как лейкоциты проникают через эндотелий сосудов. Nat. Rev. Immunol. 15 , 692–704 (2015).
CAS PubMed Google ученый
Пиявка, Дж. Х., Барнуэлл, Дж. У., Миллер, Л. Х. и Ховард, Р. Дж. Идентификация штамм-специфического малярийного антигена, экспонированного на поверхности эритроцитов, инфицированных Plasmodium falciparum . J. Exp. Med. 159 , 1567–1575 (1984).
CAS PubMed Google ученый
Su, X. Z. et al. Большое разнообразие генов семейства var кодирует белки, участвующие в цитоадгезии и антигенной изменчивости эритроцитов, инфицированных Plasmodium falciparum . Cell 82 , 89–100 (1995).
CAS PubMed Google ученый
Smith, J. D. et al. Идентификация связывающего домена молекулы-1 межклеточной адгезии Plasmodium falciparum : признак адгезии паразитов, связанный с церебральной малярией. Proc. Natl Acad. Sci. USA 97 , 1766–1771 (2000).
CAS PubMed Google ученый
Salanti, A. et al. Доказательства участия VAR2CSA в связанной с беременностью малярии. J. Exp. Med. 200 , 1197–1203 (2004).
CAS PubMed PubMed Central Google ученый
Flick, K. et al. Роль неиммунного IgG, связанного с PfEMP1, при плацентарной малярии. Наука 293 , 2098–2100 (2001).
CAS PubMed Google ученый
Chan, J. A. et al. Мишени антител против Plasmodium falciparum -инфицированных эритроцитов при иммунитете к малярии. J. Clin. Вкладывать деньги. 122 , 3227–3238 (2012).
CAS PubMed PubMed Central Google ученый
Kyes, S. A., Rowe, J. A., Kriek, N. & Newbold, C. I. Rifins: второе семейство клонально вариантных белков, экспрессируемых на поверхности эритроцитов, инфицированных Plasmodium falciparum . Proc. Natl Acad. Sci. США 96 , 9333–9338 (1999).
CAS PubMed Google ученый
Cheng, Q. et al. Стевор и риф представляют собой мультикопийные семейства генов Plasmodium falciparum , которые потенциально кодируют вариантные антигены. Mol. Biochem. Паразитол. 97 , 161–176 (1998).
CAS PubMed Google ученый
Niang, M. et al. STEVOR — это связывающий эритроциты белок Plasmodium falciparum , который опосредует инвазию и розетку мерозоитов. Клеточный микроб-хозяин 16 , 81–93 (2014).
CAS PubMed PubMed Central Google ученый
Goel, S. et al. RIFIN — это адгезины, вызывающие тяжелую малярию Plasmodium falciparum . Nat. Med. 21 , 314–317 (2015).
CAS PubMed Google ученый
Смит, К. Д., Браун, А. Е., Накадзава, С., Фудзиока, Х. и Айкава, М. Секвестрация мультиорганных эритроцитов и экспрессия лиганда у макак-резусов, инфицированных малярией Plasmodiumcoatneyi . Am. J. Trop. Med. Hyg. 55 , 379–383 (1996).
CAS PubMed Google ученый
Handayani, S. et al. Высокая деформируемость эритроцитов, инфицированных Plasmodium vivax , в микрофлюидных условиях. J. Infect. Dis. 199 , 445–450 (2009).
PubMed PubMed Central Google ученый
Marchiafava, E. & Bignami, A. Sulle febbri estivo aumnali ( E. Loescher , 1894).
Baro, B. et al. Plasmodium vivax гаметоцитов в костном мозге пациента с острой малярией и изменения в профиле миРНК эритроидных клеток. PLOS Negl. Троп. Dis. 11 , e0005365 (2017).
PubMed PubMed Central Google ученый
Фарфур, Э., Шарлотта, Ф., Сеттеграна, К., Мияра, М. и Баффет, П. Внесосудистый отсек костного мозга: ниша для созревания гаметоцитов Plasmodium falciparum ? Малар. J. 11 , 285 (2012).
PubMed PubMed Central Google ученый
Смолли М. Э., Абдалла С. и Браун Дж. Распределение Plasmodium falciparum в периферической крови и костном мозге детей Гамбии. Пер. R. Soc. Троп. Med. Hyg. 75 , 103–105 (1981).
CAS PubMed Google ученый
Томсон, Дж. Г. и Робертсон, А. Структура и развитие гаметоцитов Plasmodium falciparum во внутренних органах и периферическом кровообращении. Пер. R. Soc. Троп. Med. Hyg. 14 , 31–40 (1935).
Google ученый
Joice, R. et al. Plasmodium falcipa Этапы передачи рома накапливаются в костном мозге человека. Sci. Пер. Med. 6 , 244re245 (2014). Это исследование предоставляет количественные доказательства P. falciparum обогащения гаметоцитов в костном мозге человека .
Google ученый
Aguilar, R. et al. Молекулярные доказательства локализации незрелых гаметоцитов Plasmodium falciparum в костном мозге. Кровь 123 , 959–966 (2014).
CAS PubMed PubMed Central Google ученый
Эллис, Р. Э. Распределение активного костного мозга у взрослых. Phys.Med. Биол. 5 , 255–258 (1961).
CAS PubMed Google ученый
Woodard, H. Q. & Holodny, E. Обобщение данных Mechanik о распределении костного мозга человека. Phys. Med. Биол. 5 , 57–59 (1960).
CAS PubMed Google ученый
Номбела-Арриета, К. и Манц, М. Г. Количественная оценка и трехмерная микроанатомическая организация костного мозга. Blood Adv. 1 , 407–416 (2017).
CAS PubMed PubMed Central Google ученый
Часис, Дж. А. и Мохандас, Н. Эритробластические острова: ниши для эритропоэза. Кровь 112 , 470–478 (2008).
CAS PubMed PubMed Central Google ученый
Obaldia, N., 3rd et al. Костный мозг является основным резервуаром паразитов для инфекции Plasmodium vivax . MBio 8 , 1–16 (2018). Это исследование предоставляет количественные доказательства для P. vivax обогащения гаметоцитами и бесполого резервуара в костном мозге нечеловеческих приматов .
Google ученый
De Niz, M. et al. Plasmodium гаметоцитов обнаруживают самонаведение и трансмиграцию сосудов в костный мозг хозяина. Sci. Adv. 4 , eaat3775 (2018). Это исследование показывает P. berghei резервуар бесполых и гаметоцитов в костном мозге и селезенке инфицированных мышей и дает первое описание событий трансмиграции паразитов через эндотелиальный барьер .
PubMed PubMed Central Google ученый
Duffier, Y. et al. Гуманизированная модель мыши для секвестрации Plasmodium falciparum половых стадий и оценки гаметоцитидных препаратов in vivo. Sci. Отчет 6 , 35025 (2016). Это исследование демонстрирует P. faciparum обогащение гаметоцитов в костном мозге и селезенке гуманизированных мышей .
CAS PubMed PubMed Central Google ученый
Ли Р. С., Уотерс А. П. и Брюэр Дж. М. Скрытый цикл в гематопоэтических нишах способствует инициации передачи малярии и уклонению от химиотерапии. Nat. Commun. 9 , 1689 (2018). Это исследование предоставляет доказательства того, что у бесполого паразита P. berghei резервуар паразита в селезенке инфицированных мышей может приводить к рецидиву .
PubMed PubMed Central Google ученый
Lopes, S.C. et al. Малочисленность зрелых шизонтов Plasmodium vivax в периферической крови связана с их повышенным цитоадгезивным потенциалом. J. Infect. Dis. 209 , 1403–1407 (2014).
PubMed Google ученый
Lim, C. et al. Предпочтение ретикулоцитов и стадия развития изолятов Plasmodium vivax . J. Infect. Dis. 214 , 1081–1084 (2016).
PubMed PubMed Central Google ученый
Fonseca, L. L., Joyner, C.Дж., Ма, Х. С., Галински, М. Р. и Войт, Е. О. Модель маскировки Plasmodium vivax , основанная на инфекциях Plasmodium cynomolgi в Macaca mulatta . Малар. Дж. 16 , 375 (2017).
PubMed PubMed Central Google ученый
Usui, M. et al. Plasmodium falciparum Половая дифференциация у больных малярией связана с факторами хозяина и GDV1-зависимыми генами. Nat. Commun. 10 , 2140 (2019).
PubMed PubMed Central Google ученый
Фарид Р., Диксон М. В., Тилли Л. и Маккарти Дж. С. Инициирование гаметоцитогенеза при очень низкой плотности паразитов при инфекции Plasmodium falciparum . J. Infect. Dis. 215 , 1167–1174 (2017).
CAS PubMed PubMed Central Google ученый
Rono, M. K. et al. Адаптация Plasmodium falciparum к среде его передачи. Nat. Ecol. Evol. 2 , 377–387 (2018).
PubMed Google ученый
Pelle, K. G. et al. Транскрипционное профилирование определяет динамику секвестрации тканей паразита при заражении малярией. Genome Med. 7 , 19 (2015).
PubMed PubMed Central Google ученый
Perrin, A.J., Bartholdson, S.J. & Wright, G.J. P-селектин является рецептором хозяина для лигандов Plasmodium MSP7. Малар. J. 14 , 238 (2015).
PubMed PubMed Central Google ученый
Avril, M., Brazier, A.J., Melcher, M., Sampath, S. & Smith, J. D. Гены DC8 и DC13 var, ассоциированные с тяжелой формой малярии, активно связываются с различными эндотелиальными клетками. PLOS Pathog. 9 , e1003430 (2013).
CAS PubMed PubMed Central Google ученый
Rogers, NJ, Hall, BS, Obiero, J., Targett, GA & Sutherland, CJ Модель секвестрации стадий передачи Plasmodium falciparum : адгезия эритроцитов, инфицированных гаметоцитами, к костному мозгу человека клетки. Заражение. Иммун. 68 , 3455–3462 (2000).
CAS PubMed PubMed Central Google ученый
Tiburcio, M. et al. Ранние гаметоциты малярийного паразита Plasmodium falciparum специфически изменяют адгезивные свойства инфицированной поверхности эритроцитов. Cell. Microb. 15 , 647–659 (2012).
Google ученый
Silvestrini, F., Tiburcio, M., Bertuccini, L. & Alano, P. Дифференциальные адгезивные свойства изолированной бесполой и половой стадий рома Plasmodium falcipa на эндотелиальных клетках человека не зависят от ткани. PLOS ONE 7 , e31567 (2012).
CAS PubMed PubMed Central Google ученый
Fraschka, S.A. et al. Сравнительное профилирование гетерохроматина выявляет консервативные и уникальные сигнатуры эпигенома, связанные с адаптацией и развитием малярийных паразитов. Клеточный микроб-хозяин 23 , 407–420.e8 (2018).
CAS PubMed PubMed Central Google ученый
Messina, V. et al. Гаметоциты малярийного паразита Plasmodium falciparum взаимодействуют с мезенхимальными клетками костного мозга и стимулируют их секретирование ангиогенетических факторов. Фронт. Клетка. Заразить. Microbiol. 8 , 50 (2018). Это исследование предоставляет доказательства связывания бесполых iRBC и гаметоцитов с МСК костного мозга .
PubMed PubMed Central Google ученый
Neveu, G.и другие. Plasmodium falciparum Эритроциты, инфицированные гаметоцитами, не прикрепляются к первичным эритробластам человека. Sci. Отчетность 8 , 17886 (2018).
CAS PubMed PubMed Central Google ученый
Silvestrini, F. et al. Экспорт белка знаменует собой раннюю фазу гаметоцитогенеза малярийного паразита человека Plasmodium falciparum . Mol. Клетка. Протеомика 9 , 1437–1448 (2010).
CAS PubMed PubMed Central Google ученый
Dantzler, K. W. et al. Естественно приобретенный иммунитет против незрелых гаметоцитов Plasmodium falciparum . Sci. Пер. Med. 11 , 1–14 (2019). Это исследование идентифицирует общие антигены на асексуальной и гаметоцитарной поверхности iRBC .
Google ученый
Hermand, P. et al. Plasmodium falciparum белков, участвующих в цитоадгезии инфицированных эритроцитов к хемокину CX3CL1. Sci. Отчет 6 , 33786 (2016).
CAS PubMed PubMed Central Google ученый
Гончаренко М. и др. Стромальные клетки костного мозга человека экспрессируют особый набор биологически функциональных рецепторов хемокинов. Стволовая клетка 24 , 1030–1041 (2006).
CAS Google ученый
Тамез, П. А., Лю, Х., Фернандес-Поль, С., Халдар, К. и Викрема, А. Стадия-специфическая чувствительность эритробластов человека к Plasmodium falciparum малярийной инфекции. Кровь 114 , 3652–3655 (2009).
CAS PubMed PubMed Central Google ученый
Tiburcio, M. et al.Переключение деформируемости инфицированных эритроцитов на этапах созревания и кровообращения Plasmodium falciparum . Кровь 119 , e172 – e180 (2012).
CAS PubMed PubMed Central Google ученый
Aingaran, M. et al. Деформируемость клетки-хозяина связана с передачей малярии у человека паразитом Plasmodium falciparum . Cell. Microbiol. 14 , 983–993 (2012).
CAS PubMed PubMed Central Google ученый
Во, Р. Э. Жесткость ретикулоцитов и прохождение через поры, подобные эндотелию. Кровь 78 , 3037–3042 (1991).
CAS PubMed Google ученый
Ramdani, G. et al. Передача сигналов цАМФ регулирует деформируемость инфицированных гаметоцитами эритроцитов, необходимую для передачи паразитов малярии. PLOS Pathog. 11 , e1004815 (2015). Это исследование демонстрирует, что на деформируемость гаметоцитов можно воздействовать лекарствами .
PubMed PubMed Central Google ученый
Naissant, B. et al. Plasmodium falciparum Фосфорилирование STEVOR регулирует деформируемость эритроцитов хозяина, обеспечивая передачу паразитов малярии. Кровь 127 , e42 – e53 (2016).
CAS PubMed Google ученый
Nixon, C. P. Plasmodium falciparum Транзит гаметоцитов через кожный микрососуд: новая цель для вакцин, блокирующих передачу малярии? Hum. Вакцин. Immunother 12 , 3189–3195 (2016).
PubMed PubMed Central Google ученый
Lawniczak, M. K.И Экхофф П.А. Вычислительная линза для передачи, воспроизводства, приспособленности и кинетики на сексуальной стадии у Plasmodium falciparum . Малар. Дж. 15 , 487 (2016).
PubMed PubMed Central Google ученый
Srivastava, A. et al. Ретикулоциты хозяина являются резервуарами обмена веществ, которые могут использоваться малярийными паразитами. PLOS Pathog. 11 , e1004882 (2015).
PubMed PubMed Central Google ученый
Mu, C. F. et al. Адресная доставка лекарств для лечения опухолей внутри костного мозга. Биоматериалы 155 , 191–202 (2018).
CAS PubMed Google ученый
Ng, C. L. & Fidock, D. A. Plasmodium falciparum Выбор устойчивости к лекарствам in vitro и редактирование генов. Methods Mol. Биол. 2013 , 123–140 (2019).
PubMed PubMed Central Google ученый
Camarda, G. et al. Антималярийная активность примахина действует через двухступенчатую биохимическую реле. Nat. Commun. 10 , 3226 (2019).
PubMed PubMed Central Google ученый
Duez, J. et al. Высокопроизводительная микрофильтрация для оценки деформируемости эритроцитов и выявления препаратов, блокирующих передачу малярии. Nat. Protoc. 13 , 1362–1376 (2018).
CAS PubMed Google ученый
Lavazec, C. & Naissant, B. Виагра делает Plasmodium жестким: новый способ блокировать передачу малярии? [Французский]. Med. Sci. 31 , 826–828 (2015).
Google ученый
Немази, Д. Механизмы центральной толерантности для В-клеток. Nat. Rev. Immunol. 17 , 281–294 (2017).
CAS PubMed PubMed Central Google ученый
Vainieri, M. L. et al. Систематическое отслеживание измененного гематопоэза во время развития малярии, опосредованной спорозоитом, выявляет множество точек ответа. Открыть Биол . 6 , 1–13 (2016).
Google ученый
Бокстал В., Геуртс Н. и Магез С. Острое нарушение В-лимфопоэза костного мозга и апоптоз В-клеток переходной и маргинальной зоны в селезенке после инфицирования мышей на стадии крови Plasmodium chabaudi . J. Parasitol. Res. 2011 , 534697 (2011).
PubMed PubMed Central Google ученый
Nduati, E. W. et al. Четкая кинетика ответов В-клеток памяти и плазматических клеток в периферической крови после инфицирования мышей на стадии Plasmodium chabaudi на стадии крови. PLOS ONE 5 , e15007 (2010).
PubMed PubMed Central Google ученый
Маркус, М. Б. Новые свидетельства гипнозоит-независимых Plasmodium vivax рецидивов малярии. Trends Parasitol. 34 , 1015–1016 (2018).
PubMed Google ученый
Nothelfer, K., Sansonetti, P.J.& Фалипон, А. Манипуляции с В-клетками патогенами: лучшая защита — хорошее нападение. Nat. Rev. Microbiol. 13 , 173–184 (2015).
CAS PubMed Google ученый
Das, B. et al. CD271 + мезенхимальные стволовые клетки костного мозга могут обеспечивать нишу для покоящихся Mycobacterium tuberculosis . Sci. Пер. Med. 5 , 170ра113 (2013).
Google ученый
Варма, Н. и Насим, С. Гематологические изменения при висцеральном лейшманиозе / кала азар. Indian J. Hematol. Переливание крови. 26 , 78–82 (2010).
PubMed PubMed Central Google ученый
Pinho, S. & Frenette, P. S. Активность гемопоэтических стволовых клеток и взаимодействия с нишей. Nat. Преподобный Мол. Cell Biol. 20 , 303–320 (2019).
CAS PubMed PubMed Central Google ученый
Torisawa, Y. S. et al. Костный мозг-на-чипе воспроизводит физиологию гематопоэтической ниши in vitro. Nat. Meth. 11 , 663–669 (2014).
CAS Google ученый
Sieber, S. et al. Костный мозг-на-чипе: долговременная культура гемопоэтических стволовых клеток человека в трехмерной микрофлюидной среде. J. Tissue Eng. Regen. Med. 12 , 479–489 (2018). Это исследование описывает первую платформу человеческого костного мозга на чипе.
CAS PubMed PubMed Central Google ученый
Rahmig, S. et al. Улучшенный эритропоэз человека и образование тромбоцитов у гуманизированных мышей NSGW41. Stem Cell Rep. 7 , 591–601 (2016).
CAS Google ученый
Baryawno, N. et al. Клеточная таксономия стромы костного мозга при гомеостазе и лейкемии. Cell 177 , 1915–1932.e16 (2019). Это исследование представляет собой одноклеточный атлас ниши костного мозга человека .
CAS PubMed Google ученый
Howick, V. M. et al. Атлас клеток малярии: отдельные транскриптомы паразитов на протяжении полного жизненного цикла Plasmodium . Наука 365 , 1–11 (2019). Это исследование представляет собой атлас одноклеточных клеток жизненного цикла P. falciparum .
Google ученый
Телфорд, С. Р. in Гемопаразиты рептилий: Атлас цветов и текст 376 стр. (CRC, 2009).
Garnham, P. C. C. в Малярийные паразиты и другие гемоспоридии 1132 стр. (Blackwell, 1966).
Валкюнас Г. в Птичьи малярийные паразиты и другие гемоспоридии 946 стр. (CRC Press, 2005).
Палинаускас В. и др. Описание, молекулярная характеристика, диагностика и жизненный цикл Plasmodium elongatum (линия pERIRUB01), вирулентного птичьего малярийного паразита. Внутр. J. Parasitol. 46 , 697–707 (2016). Эта работа является одним из нескольких исследований птичьей малярии, в которых описываются эритроцитарные шизонты в костном мозге инфицированных птиц .
CAS PubMed Google ученый
Перкинс, С. Л. Множество друзей Малярии: прошлое, настоящее и будущее систематиков отряда Haemosporida. J. Parasitol. 100 , 11–25 (2014).
PubMed Google ученый
MacCallum, W. G. О жгутиковых формах малярийного паразита. Ланцет 11 , 1240–1241 (1897).
Google ученый
Aragão, H. B. Über den Entwicklungsgang и die Übertragung von Haemoproteus columbae. Arch. Protistenkunde 12 , 154–167 (1908).
Google ученый
Джеймс, С. П. и Тейт, П. Новые знания о жизненном цикле малярийных паразитов. Nature 139 , 545 (1937).
Google ученый
Росс Р.Отчет о культивировании Proteosoma, Labbé у серых комаров. Indian Med. Газ. 33 , 401–408 (1898).
Google ученый
Коатни, Г. Р., Купер, В. К., Эдди, Н. Б. и Гринберг, Дж. Обзор противомалярийных средств: химиотерапия инфекций, вызванных Plasmodium gallinaceum, ; токсичность; соотношение структуры и действия. Моногр. Общественного здравоохранения. 9 , 1–322 (1953).
CAS PubMed Google ученый
Хокинг Ф. Тканевая культура малярийных паразитов ( Plasmodium gallinaceum ). Ланцет 246 , 693–694 (1944).
Google ученый
Ilgunas, M. et al. Паттерны вирулентности Plasmodium homocircumflexum у экспериментально зараженных воробьиных птиц. Малар.Дж. 18 , 174 (2019).
PubMed PubMed Central Google ученый
Валкюнас, Г. и Иежова, Т. А. Экзоэритроцитарное развитие малярии птиц и родственных гемоспоридических паразитов. Малар. Дж. 16 , 101 (2017). Настоящий обзор является первым, посвященным экзоэритроцитарному развитию малярийных паразитов птиц, включая клетки гематопоэтической ниши .
PubMed PubMed Central Google ученый
Бен-Харел С. Исследования птичьей малярии в связи с механизмом рецидива. Am. J. Hyg. 3 , 652 (1923).
Google ученый
Ilgunas, M., Palinauskas, V., Platonova, E., Iezhova, T. & Valkiunas, G. Экспериментальное исследование восприимчивости обычных европейских певчих птиц к Plasmodium elongatum (линия pGRW6), a широко распространенный птичий малярийный паразит. Малар. Дж. 18 , 290 (2019). Это исследование предоставляет доказательства того, что вирулентность связана с повреждением клеток костного мозга во время птичьей малярии .
PubMed PubMed Central Google ученый
Лейнсон Р. в Атлас простейших паразитов амазонской фауны Бразилии . Том 1: Гемоспоридии рептилий 81 стр. (Instituto Evandro Chagas, 2012).
Schaer, J. et al. Никтерии-паразиты афротропических насекомоядных летучих мышей. Внутр. J. Parasitol. 45 , 375–384 (2015).
CAS PubMed Google ученый
Schaer, J. et al. Летучие мыши с эполетами демонстрируют исключительно высокий уровень инфицирования комплексом видов Hepatocystis в Южном Судане. Sci. Отчет 7 , 6928 (2017).
PubMed PubMed Central Google ученый
Гален, С.C. et al. Полифилия Plasmodium : всесторонний филогенетический анализ паразитов малярии (отряд Haemosporida) выявил широко распространенный таксономический конфликт. R. Soc. Открыть. Sci. 5 , 171780 (2018). Это исследование представляет собой всесторонний филогенетический анализ гемоспоридий, предлагающий полифилетический статус рода Plasmodium .
PubMed PubMed Central Google ученый
Borner, J. et al. Филогения гемоспоридий паразитов крови, выявленная с помощью мультигенного подхода. Mol. Филогенет. Evol. 94 , 221–231 (2016).
CAS PubMed Google ученый
Гален, С. К., Нунес, Р., Свит, П. Р. и Перкинс, С. Л. Объединение разграничения сливающихся видов с анализом специфичности хозяина позволяет выявить обширное скрытое разнообразие, несмотря на минимальное расхождение митохондрий у малярийных паразитов рода Leucocytozoon. BMC Evol. Биол. 18 , 128 (2018).
PubMed PubMed Central Google ученый
Малярийный паразит проявляет сложный жизненный цикл с участием насекомого-переносчика (комара) и позвоночного хозяина (человека). (См. Также файл в формате pdf для печати.) Основными фазами жизненного цикла являются: стадия печени, стадия крови, половая стадия и спорогония.
(Вернуться к разделу жизненного цикла в основном документе.)
Легенда
Инфекция инициируется при введении спорозоитов со слюной кормящегося комара. Спорозоиты переносятся кровеносной системой в печень и проникают в гепатоциты (1). Внутриклеточный паразит подвергается бесполой репликации, известной как экзоэритроцитарная шизогония внутри гепатоцита (2-4). Экзоэритроцитарная шизогония достигает высшей точки в производстве мерозоитов, которые попадают в кровоток (5).Часть паразитов на стадии печени из P. vivax и P. ovale проходит через период покоя (не показан) вместо того, чтобы немедленно проходить через бесполое размножение (т.е. временно оставаться на стадии 2). Эти гипнозоиты реактивируются через несколько недель или месяцев (или лет) после первичной инфекции и являются причиной рецидивов. (Вернуться к рецидивам в основном документе.)
Мерозоиты проникают в эритроциты (6) и проходят трофический период, в течение которого паразит увеличивается (7-8).Ранний трофозоит часто называют «кольцевой формой » из-за его морфологии. Увеличение трофозоитов сопровождается активным метаболизмом, включая поглощение цитоплазмы хозяина и протеолиз гемоглобина до аминокислот. Конец трофического периода проявляется в нескольких раундах деления ядра без цитокинеза, в результате чего получается шизонт (9). Мерозоиты отпочковываются от зрелого шизонта, также называемого сегментером (10), и мерозоиты высвобождаются после разрыва инфицированного эритроцита (11).Инвазия эритроцитов повторно инициирует еще один виток репликативного цикла стадии крови (6-11). (Возвращение к кровной шизогонии в основном документе.)
Периодическая лихорадка, часто связанная с малярией, возникает из-за синхронного разрыва инфицированных эритроцитов и высвобождения мерозоитов (см. Малярийный пароксизм). Эритроциты, инфицированные трофозоитом и шизонтом, редко обнаруживаются в периферическом кровообращении во время инфицирования P. falciparum . Эритроциты, инфицированные на этих стадиях, прикрепляются к эндотелиальным клеткам и изолируются в микрососудистом русле жизненно важных органов, особенно мозга, сердца и легких.Секвестрация в головном мозге является фактором, способствующим церебральной малярии.
В качестве альтернативы бесполому репликативному циклу паразит может дифференцироваться в половые формы, известные как макро- или микрогаметоциты (12). Гаметоциты — большие паразиты, которые заполняют эритроциты, но содержат только одно ядро. Поглощение гаметоцитов москитным вектором вызывает гаметогенез (т. Е. Производство гамет) и выход из эритроцитов хозяина. Факторы, которые участвуют в индукции гаметогенеза, включают: падение температуры, увеличение углекислого газа и метаболитов комаров. Microgametes , образованные в процессе, известном как эксфлагелляция (13), представляют собой жгутиковые формы, которые оплодотворяют макрогамету (14), что приводит к зиготе (15). (Вернитесь к сексуальному воспроизведению в основном документе.)
Зигота развивается в подвижную оокинету (16), которая проникает в эпителиальные клетки кишечника и развивается в ооцисту (17). Ооциста проходит несколько раундов бесполой репликации (18), в результате чего образуются спорозоиты (19).При разрыве зрелой ооцисты спорозоиты попадают в гемоцель (полость тела) комара (20). Спорозоиты мигрируют и проникают в слюнные железы (не показаны), завершая, таким образом, жизненный цикл. (Вернуться к спорогонам в основном документе.)
Таким образом, малярийные паразиты подвержены трем различным бесполые репликативные стадии (экзоэритроцитарная шизогония, кровяная шизогония, и спорогония), в результате чего образуются инвазивные формы (мерозоиты и спорозоиты).Половое размножение происходит с переключением с позвоночных на беспозвоночный хозяин и приводит к инвазивному оокинету. Все инвазивные стадии характеризуется апикальными органеллами, типичными для апикомплексных видов. В инвазивные стадии различаются в зависимости от типов клеток или тканей, в которые они проникают и их подвижность. После успешного вторжения некоторые из этих агрессивных формы будут подвергаться высокому уровню распространения, чтобы установить инфекцию в новом хосте. (См. Розенберг, 2008 для обсуждения чисел.)
| |
|
Перейти к:
Эти страницы разработаны и поддерживаются Марком Ф.Wiser, Университет Тулейна (© 2000). Последнее обновление 28 апреля 2020 г.
Каков жизненный цикл плазмодии?
Piola P, Nabasumba C, Turyakira E, et al. Эффективность и безопасность артеметер-люмефантрина по сравнению с хинином у беременных с неосложненной малярией, вызванной Plasmodium falciparum: открытое рандомизированное исследование не меньшей эффективности. Ланцет Infect Dis . 2010 ноябрь 10 (11): 762-9. [Медлайн].
McGready R, Lee SJ, Wiladphaingern J, et al.Побочные эффекты малярии falciparum и vivax и безопасность противомалярийного лечения на ранних сроках беременности: популяционное исследование. Ланцет Infect Dis . 2012 май. 12 (5): 388-96. [Медлайн].
Cox-Singh J, Davis TM, Lee KS, et al. Малярия Plasmodium knowlesi у людей широко распространена и потенциально опасна для жизни. Clin Infect Dis . 2008 15 января. 46 (2): 165-71. [Медлайн]. [Полный текст].
Marchand RP, Culleton R, Maeno Y, Quang NT, Nakazawa S.Сопутствующие инфекции Plasmodium knowlesi, P. falciparum и P. vivax среди людей и комаров Anopheles dirus, Южный Вьетнам. Emerg Infect Dis . 2011 июл.17 (7): 1232-9. [Медлайн].
Уильям Т., Менон Дж., Раджахрам Г. и др. Тяжелая форма малярии, вызванной Plasmodium knowlesi, в больнице третичного уровня, Сабах, Малайзия. Emerg Infect Dis . 2011 июл.17 (7): 1248-55. [Медлайн].
Эпиднадзор за малярией — США, 2010 г. Центры по контролю и профилактике заболеваний.Доступно по адресу http://www.cdc.gov/mmwr/preview/mmwrhtml/ss6102a1.htm?s_cid=ss6102a1_e. Доступ: 1 марта 2012 г.
Центры по контролю и профилактике заболеваний. Малярия. Доступно по адресу http://www.cdc.gov/malaria. Доступ: 15 сентября 2011 г.
Тейлор С.М., Паробек С.М., Фэрхерст, РМ. Гемоглобинопатии и клиническая эпидемиология малярии: систематический обзор и метаанализ. Ланцет Infect Dis . 2012 Июнь 12 (6): 457-68. [Медлайн].
Trape JF, Tall A, Diagne N и др. Заболеваемость малярией и устойчивость к пиретроидам после введения обработанных инсектицидами надкроватных сеток и комбинированной терапии на основе артемизинина: продольное исследование. Ланцет Infect Dis . 2011 Декабрь 11 (12): 925-32. [Медлайн].
[Рекомендации] Бейли Дж. У., Уильямс Дж., Бэйн Б. Дж., Паркер-Уильямс Дж., Чиодини П. Целевая группа по общей гематологии. Руководство по лабораторной диагностике малярии. Лондон (Великобритания): Британский комитет стандартов в гематологии.2007; 19. [Полный текст].
Бейли Дж. У., Уильямс Дж., Бэйн Б. Дж. И др. Руководство: лабораторная диагностика малярии. Целевая группа по общей гематологии Британского комитета стандартов в гематологии. Br J Haematol . 2013 декабрь 163 (5): 573-80. [Медлайн].
Экспресс-тесты для диагностики малярии — Гаити, 2010. MMWR Morb Mortal Wkly Rep . 29 октября 2010 г. 59 (42): 1372-3. [Медлайн].
Wongsrichanalai C, Barcus MJ, Muth S, Sutamihardja A, Wernsdorfer WH.Обзор средств диагностики малярии: микроскопия и экспресс-диагностический тест (RDT). Ам Дж. Троп Мед Хиг . 2007 декабрь 77 (6 приложение): 119-27. [Медлайн].
Центры по контролю и профилактике заболеваний. Примечание для читателей: экспресс-тест на малярию. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5627a4.htm. Доступ: 30 сентября 2011 г.
de Oliveira AM, Skarbinski J, Ouma PO и др.Проведение экспресс-тестов на малярию в рамках рутинного ведения больных малярией в Кении. Ам Дж. Троп Мед Хиг . 2009 Март 80 (3): 470-4. [Медлайн].
Polley SD, Gonzalez IJ, Mohamed D, et al. Клиническая оценка набора для петлевой амплификации для диагностики завозной малярии. J Заразить Dis . 2013 Август 208 (4): 637-44. [Медлайн]. [Полный текст].
d’Acremont V, Malila A, Swai N, et al. Отказ от приема противомалярийных препаратов у детей с лихорадкой, у которых отрицательный результат экспресс-диагностики. Clin Infect Dis . 2010 сен 1. 51 (5): 506-11. [Медлайн].
Mens P, Spieker N, Omar S, Heijnen M, Schallig H, Kager PA. Является ли молекулярная биология лучшей альтернативой микроскопии для диагностики малярии? Сравнение микроскопии, обнаружения антигенов и молекулярных тестов в сельской Кении и городской Танзании. Троп Мед Инт Здоровье . 2007 12 февраля (2): 238-44. [Медлайн].
[Рекомендации] Центры по контролю и профилактике заболеваний.Обновленные рекомендации CDC по использованию артеметера-люмефантрина для лечения неосложненной малярии у беременных женщин в США. Доступно по адресу https://www.cdc.gov/mmwr/volumes/67/wr/mm6714a4.htm?s_cid=mm6714a4_e#contribAff. Апрель 2018 г .; Доступ: 13 апреля 2018 г.
Dondorp AM, Fanello CI, Hendriksen IC, et al. Сравнение артесуната и хинина в лечении тяжелой формы малярии, вызванной falciparum, у африканских детей (AQUAMAT): открытое рандомизированное исследование. Ланцет .2010 13 ноября. 376 (9753): 1647-57. [Медлайн]. [Полный текст].
Sinclair D, Donegan S, Isba R, Lalloo DG. Артесунат в сравнении с хинином для лечения тяжелой формы малярии. Кокрановская база данных Syst Rev . 2012, 13 июня: CD005967. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило таблетки Коартема для лечения малярии. FDA. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm149559.htm. Доступ: 8 апреля 2009 г.
Teuscher F, Gatton ML, Chen N, Peters J, Kyle DE, Cheng Q.Артемизинин-индуцированный покой у Plasmodium falciparum: продолжительность, скорость восстановления и последствия неэффективности лечения. J Заразить Dis . 2010, 1. 202 (9): 1362-8. [Медлайн]. [Полный текст].
Tozan Y, Klein EY, Darley S, Panicker R, Laxminarayan R, Breman JG. Предпочтительный ректальный артесунат для лечения тяжелой детской малярии: анализ экономической эффективности. Ланцет . 4 декабря 2010 г. 376 (9756): 1910-5. [Медлайн].
Amaratunga C, Sreng S, Suon S и др.Устойчивый к артемизинину Plasmodium falciparum в провинции Пурсат, западная Камбоджа: исследование скорости выведения паразитов. Ланцет Infect Dis . 2012 12 ноября (11): 851-8. [Медлайн].
Dondorp A, Nosten F, Stepniewska K, Day N, White N, Группа испытаний хинина артесуната в Юго-Восточной Азии (SEAQUAMAT). Сравнение артесуната и хинина для лечения тяжелой формы малярии, вызванной falciparum: рандомизированное исследование. Ланцет . 2005, 27 августа — 2 сентября. 366 (9487): 717-25. [Медлайн].[Полный текст].
Othoro C, Johnston D, Lee R, Soverow J, Bystryn JC, Nardin E. Повышенная иммуногенность пептидных вакцин Plasmodium falciparum с использованием местного адъюванта, содержащего мощный синтетический агонист Toll-подобного рецептора 7, имиквимод. Заражение иммунной . 2009 Февраль 77 (2): 739-48. [Медлайн]. [Полный текст].
Ричардс Дж. С., Станисич Д. И., Фаукс Ф. Дж. И др. Связь между естественно приобретенными антителами к эритроцит-связывающим антигенам Plasmodium falciparum и защитой от малярии и паразитемии высокой плотности. Clin Infect Dis . 2010 15 октября. 51 (8): e50-60. [Медлайн].
Olotu A, Lusingu J, Leach A, et al. Эффективность вакцины против малярии RTS, S / AS01E и исследовательский анализ титров антител против циркумспорозоитов и защиты у детей в возрасте 5-17 месяцев в Кении и Танзании: рандомизированное контролируемое исследование. Ланцет Infect Dis . 2011 Февраль 11 (2): 102-9. [Медлайн].
Хант К. Первая в мире вакцина против малярии, предназначенная для 360 000 африканских детей.CNN. Доступно по адресу https://www.cnn.com/2019/04/23/health/malaria-africa-worlds-first-vaccine-intl/index.html?fbclid=IwAR38y1BxCtPED9-zd0h6HeFun1VQXFd1_Mrxx478aHTmBRD3_Mrxx478aHTmBRD3 25 апреля 2019 г .; Дата обращения: 26 апреля 2019 г.
Первая вакцина против малярии, одобренная регулирующими органами ЕС. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/848608. 24 июля 2015 г .;
Janeczko LL. Примахин защищает от рецидива малярии, вызванной P. vivax.Медицинские новости Medscape. 3 января 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/777109. Доступ: 16 января 2013 г.
Sutanto I, Tjahjono B, Basri H, et al. Рандомизированное открытое испытание примахина против рецидива малярии vivax в Индонезии. Противомикробные агенты Chemother . 2013 Март 57 (3): 1128-35. [Медлайн].
Llanos-Cuentas A, Lacerda MV, Rueangweerayut R, Krudsood S, Gupta SK, Kochar SK, et al. Тафенохин плюс хлорохин для лечения и профилактики рецидивов малярии Plasmodium vivax (ДЕТЕКТИВ): многоцентровое, двойное слепое, рандомизированное исследование по подбору дозы фазы 2b. Ланцет . 2014 22 марта. 383 (9922): 1049-58. [Медлайн].
Кринтафель (тафенохин) [вкладыш в упаковке]. Парк Исследовательского Треугольника, Северная Каролина: GlaxoSmithKline. Июль 2018 г. Доступно в [Полный текст].
Аракода (тафенохин) [вставка в упаковку]. Вашингтон, округ Колумбия: 60 Degrees Pharms, LLC. Август 2018 г. Доступно по ссылке [Полный текст].
Lowes R. FDA усиливает предупреждение о рисках, связанных с мефлохином. Medscape Medical News .29 июля 2013 г. [Полный текст].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Сообщение FDA по безопасности лекарств: FDA одобряет изменения на этикетке противомалярийного препарата мефлохина гидрохлорида из-за риска серьезных психических и нервных побочных эффектов. FDA. Доступно по адресу http://www.fda.gov/downloads/Drugs/DrugSafety/UCM362232.pdf. Доступ: 6 августа 2013 г.
Briand V, Bottero J, Noel H, et al. Прерывистое лечение для профилактики малярии во время беременности в Бенине: рандомизированное открытое исследование эквивалентности, сравнивающее сульфадоксин-пириметамин с мефлохином. J Заразить Dis . 2009 15 сентября. 200 (6): 991-1001. [Медлайн].
Briand V, Cottrell G, Massougbodji A, Cot M. Периодическое профилактическое лечение для предотвращения малярии во время беременности в районах с высокой степенью передачи. Малар J . 4 декабря 2007 г. 6: 160. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний. Атланта, Джорджия: DHHS; 2009. Малярия и путешественники. Доступно по адресу http://www.cdc.gov/malaria/travelers/index.html. Доступ: 15 сентября 2011 г.
Партнерство по клиническим исследованиям RTS, S. Первые результаты фазы 3 испытания вакцины против малярии RTS, S / AS01 у африканских детей. N Engl J Med . 2011 / Октябрь. 365: [Полный текст].
Белый NJ. Вакцина от малярии (передовая). N Engl J Med . 2011 / Октябрь. 365: [Полный текст].
[Рекомендации] Центры по контролю и профилактике заболеваний. Диагностика и лечение малярии в США.Доступно по адресу http://www.cdc.gov/malaria/diagnosis_treatment/index.html. Доступ: 15 сентября 2011 г.



 Риск заражения в гипер-и голоендемичних очагах очень высок, особенно среди некоренного неиммунного населения.
Риск заражения в гипер-и голоендемичних очагах очень высок, особенно среди некоренного неиммунного населения.
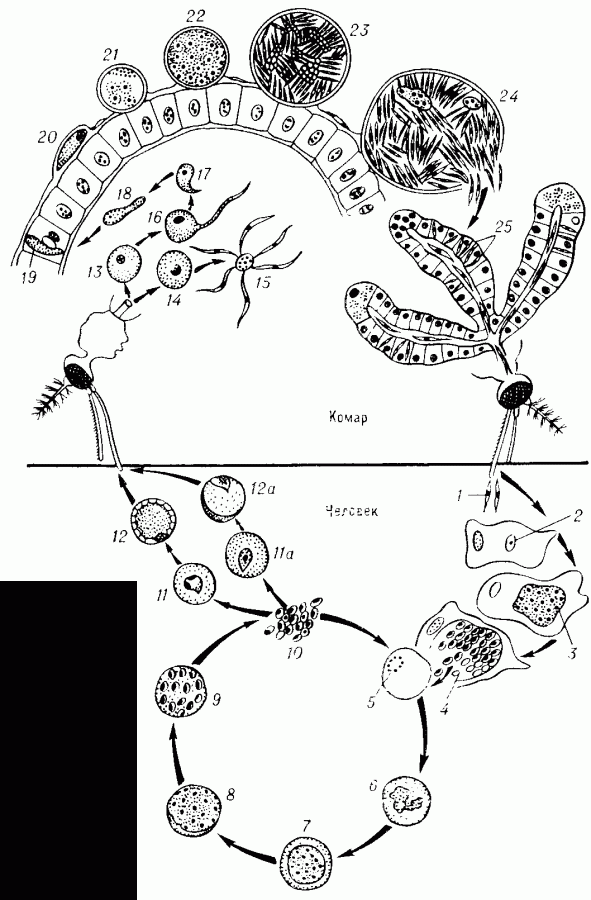 Решающее значение имеют эпидемиологический анамнез и лабораторные исследования.
Решающее значение имеют эпидемиологический анамнез и лабораторные исследования.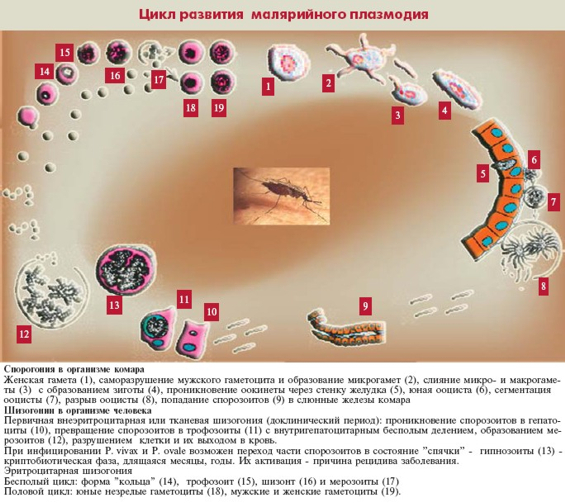

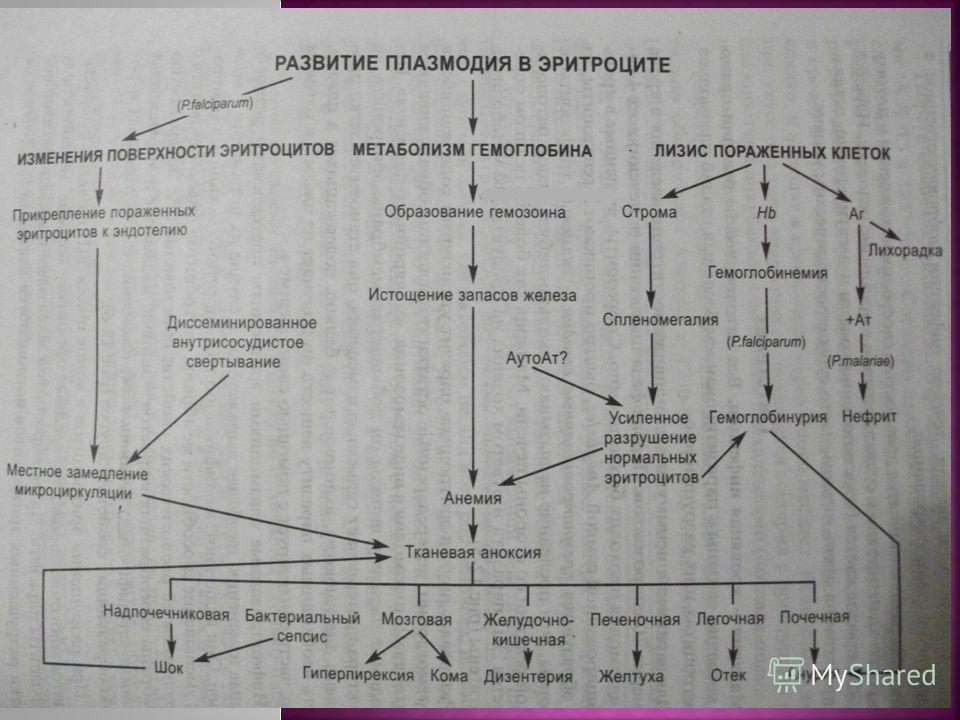 Клеточная микробиология 2005; 7 (11): 1539–1545 DOI: 10.1111 / j.1462-5822.2005.00615.x. Полный текст на http://www3.interscience.wiley.com/cgi-bin/fulltext/118714410/PDFSTART
Клеточная микробиология 2005; 7 (11): 1539–1545 DOI: 10.1111 / j.1462-5822.2005.00615.x. Полный текст на http://www3.interscience.wiley.com/cgi-bin/fulltext/118714410/PDFSTART Спорозоиты плазмодия вытекают из места инъекции. Cell Microbiol. , 1 мая 2007 г .; 9 (5): 1215–1222. Полный текст на http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1865575/pdf/cmi0009-1215.pdf
Спорозоиты плазмодия вытекают из места инъекции. Cell Microbiol. , 1 мая 2007 г .; 9 (5): 1215–1222. Полный текст на http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1865575/pdf/cmi0009-1215.pdf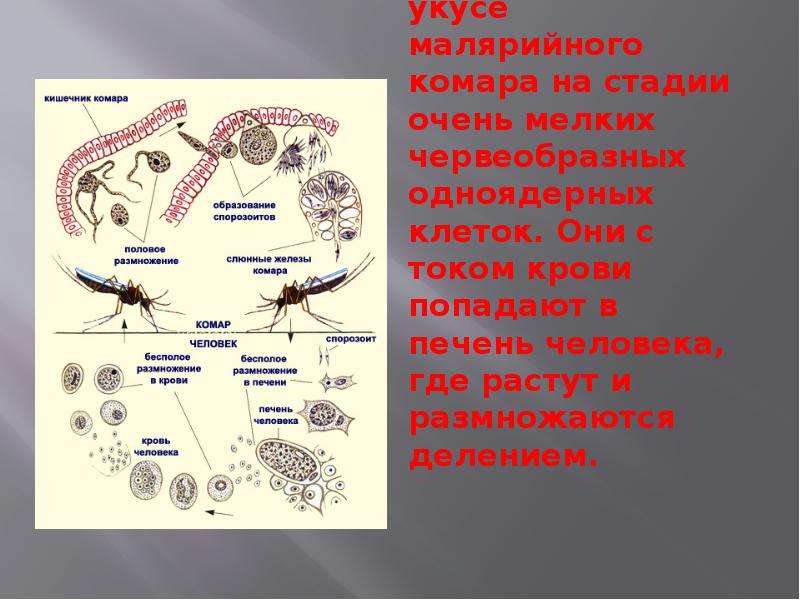 Журнал биологической химии . Февраль 2006 г .; 281: 5197-5208. Полный текст на http://www.jbc.org/content/281/8/5197.full.pdf+html
Журнал биологической химии . Февраль 2006 г .; 281: 5197-5208. Полный текст на http://www.jbc.org/content/281/8/5197.full.pdf+html Бускалья, Цянь Ван и др. Циркумспорозоитный белок плазмодия способствует развитию печеночных стадий паразита. Cell 2007; 131: 492–504.
Бускалья, Цянь Ван и др. Циркумспорозоитный белок плазмодия способствует развитию печеночных стадий паразита. Cell 2007; 131: 492–504. Мендоза, Луи Х. Миллера. Гликофорин B является рецептором эритроцитов Plasmodium falciparum эритроцит-связывающего лиганда, EBL-1. PNAS 31 марта 2009 г .; 106 (13): 5348–5352 Полный текст на http://www.pnas.org/content/106/13/5348.full.pdf+html
Мендоза, Луи Х. Миллера. Гликофорин B является рецептором эритроцитов Plasmodium falciparum эритроцит-связывающего лиганда, EBL-1. PNAS 31 марта 2009 г .; 106 (13): 5348–5352 Полный текст на http://www.pnas.org/content/106/13/5348.full.pdf+html PNAS 24 апреля 2007 г .; 104 (17): 7015–7020. Полный текст на http://www.pnas.org/content/104/17/7015.full.pdf
PNAS 24 апреля 2007 г .; 104 (17): 7015–7020. Полный текст на http://www.pnas.org/content/104/17/7015.full.pdf