Анализы на ДНК хламидии (Chlamydia trachomatis), цены в лаборатории KDL
Выберите требуемый вид биоматериала
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если необходимо получить соскоб из уретры, то перед взятием материала нужно не мочиться 1,5 — 2 часа. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Мокроту можно собрать только при наличии кашля! Перед сбором мокроты рекомендуется почистить зубы и прополоскать рот кипяченой водой.
Первая порция утренней мочи собирается после тщательного туалета наружных половых органов. Перед исследованием не применять местно антибактериальное мыло и антисептические средства.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Накануне исследования не применять местные лекарственные препараты и процедуры, исключить половой акт. При взятии соскоба из уретры не мочиться в течение 1,5-2 часов до процедуры. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Материал рекомендуется собирать до местного применения антибиотиков или антисептиков, до еды, (или не менее чем через 2 часа после еды), можно утром натощак (воду пить и чистить зубы можно).
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Пациент собирает материал самостоятельно путем мастурбации в стерильный контейнер.
Смешанный соскоб урогенитального тракта не берется на фоне местной терапии (свечи, мази, спринцевания) и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ или полового контакта должно пройти 48 часов. Если есть необходимость взятия материала из уретры, то перед взятием материала нужно не мочиться 1,5 — 2 часа. Если исследование назначается для контроля излеченности, то взятие материала на исследование возможно через 14-21 день после окончания приема антибиотиков.
Соскобы из урогенитального тракта не берутся в течение суток после местной терапии (свечи, мази, спринцевания), после полового контакта и во время менструации у женщин. После кольпоскопии, интравагинального УЗИ должно пройти 48 часов. В случае наличия признаков острого воспаления необходимость взятия мазка определяется лечащим врачом. Если необходимо получить соскоб из уретры, то перед взятием материала нужно не мочиться 1,5 — 2 часа. Если исследование назначается для контроля излеченности, то взятие материала на исследование методом ПЦР возможно не ранее, чем через 28 дней после окончания приема антибиотиков, на микробиологические исследования не ранее,чем через 14 дней.
Взятие материала на исследование возможно только врачом соответствующей квалификации.
Накануне взятия материала не применять местные антибиотики и антисептики в виде спреев, полоскания, капель, мазей. Материал берется натощак или не ранее, чем через 2 часа после еды. Чистить зубы (пастой без антибактериальных компонентов) можно.
Чистить зубы (пастой без антибактериальных компонентов) можно.
Материал для исследования можно взять утром натощак или в течение дня, не ранее чем через 2 часа после еды. Чистить зубы и пить воду можно. Накануне взятия материала не применять местно антибиотики или антисептики в виде полосканий, капель или спреев. Повторное исследование для контроля излеченности целесообразно не ранее, чем через 4 недели.
Материал для исследования можно взять утром натощак или в течение дня, не ранее чем через 2 часа после еды. Чистить зубы и пить воду можно. Накануне взятия материала не применять местно антибиотики или антисептики в виде полосканий, капель или спреев. Повторное исследование для контроля излеченности целесообразно не ранее, чем через 4 недели.
Повторное исследование для контроля излеченности целесообразно не ранее, чем через 4 недели.
Материал берется до начала терапии. Накануне не использовать антисептики, в течение двух часов исключить любые местные процедуры (промывания, капли). В случае невозможности взятия материала в медицинском офисе, Вы можете получить бесплатно расходный материал и обратиться к Вашему врачу- офтальмологу.
цены на лечение, причины и диагностика хламидиоза в «СМ-Клиника»
Специалисты «СМ-Киника» знают об особенностях течения хламидиоза. Диагноз в нашем центре устанавливается оперативно и корректно. Наши специалисты используют только проверенные и современные методики, позволяющие безошибочно определить наличие возбудителя в организме. Стоит отметить, что качественная диагностика хламидиоза стала доступной только в конце XX века с изобретением и широким распространением полимеразной цепной реакции (ПЦР).
ПЦР в «СМ-Клиника» гарантирует практически 100%-ную точность исследования. Методика может показать ложноположительный результат только в случае неправильной подготовки перед забором биологического материала для теста. У мужчин берется мазок из мочеиспускательного канала, а у женщин – из уретры, влагалища и цервикального канала. Забор материала в нашей клинике осуществляется одноразовыми инструментами, что исключает риск дополнительного инфицирования. Результаты ПЦР доступны пациенту уже через 1-2 дня. На сегодняшний день данная методика является «золотым стандартом» в выявлении хламидиоза.
Методика может показать ложноположительный результат только в случае неправильной подготовки перед забором биологического материала для теста. У мужчин берется мазок из мочеиспускательного канала, а у женщин – из уретры, влагалища и цервикального канала. Забор материала в нашей клинике осуществляется одноразовыми инструментами, что исключает риск дополнительного инфицирования. Результаты ПЦР доступны пациенту уже через 1-2 дня. На сегодняшний день данная методика является «золотым стандартом» в выявлении хламидиоза.
Однако, кроме ПЦР, в арсенале специалистов «СМ-Клиника» имеются и другие информативные методы диагностики описываемого заболевания, которые при необходимости дополняют ПЦР-исследование:
- иммуноферментный анализ (ИФА) – серологический метод, основанный на выявлении в крови пациента специфических антител к возбудителю. Точность теста составляет 60-65%;
- посев хламидий на специальную питательную среду. Методика требует больше времени на выполнение, но позволяет дополнительно установить чувствительность к антибиотикам и выбрать оптимальное средство для лечения;
- реакция иммунофлюоресценции (РИФ).
 Методика заключается в окрашивании мазка особыми красителями. При наличии хламидий они святятся в поле зрения микроскопа. Точность теста – около 50%.
Методика заключается в окрашивании мазка особыми красителями. При наличии хламидий они святятся в поле зрения микроскопа. Точность теста – около 50%.
Специалисты «СМ-Клиника» пользуются современным и высокотехнологичным диагностическим оборудованием, которое гарантирует высокую точность конечного результата. При необходимости пациента направляют к смежным специалистам (кардиолог, уролог, терапевт и другие) для выявления сопутствующей патологии.
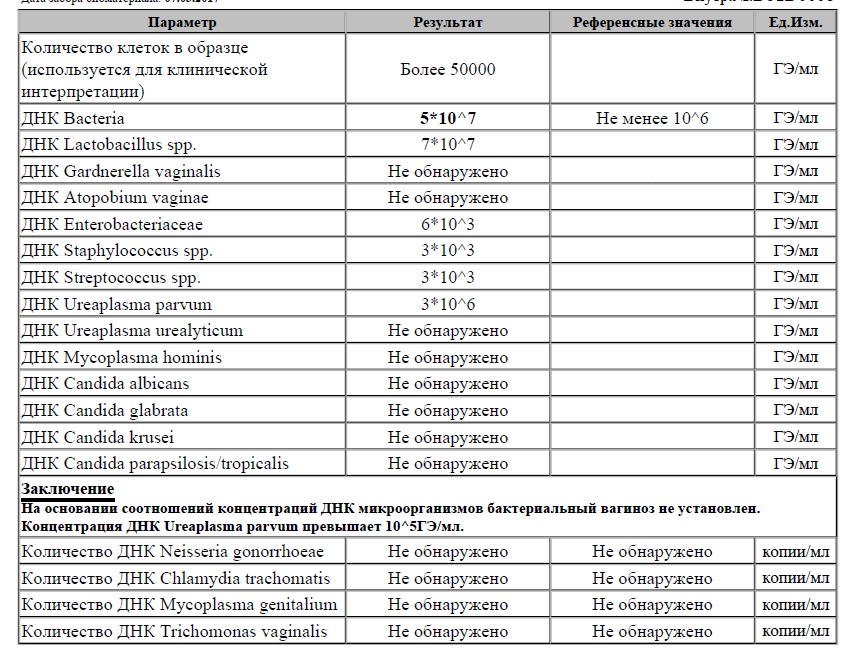
Обнаружение Chlamydia trachomatis методом ПЦР в режиме реального времени
Хламидиоз – это заболевание, которое передается половым путем при незащищенном половом контакте. Помимо этого, новорожденные дети подвергаются риску заражения хламидиозом во время продвижения по родовым путям. Возбудителем хламидиоза является хламидия (Chlamydia trachomatis).
Симптоматика хламидиоза скудная, довольно часто протекает бессимптомно, что связано с бесконтрольным применением антибиотиков. Тем не менее, клиническая картина позволяет заподозрить наличие половой инфекции.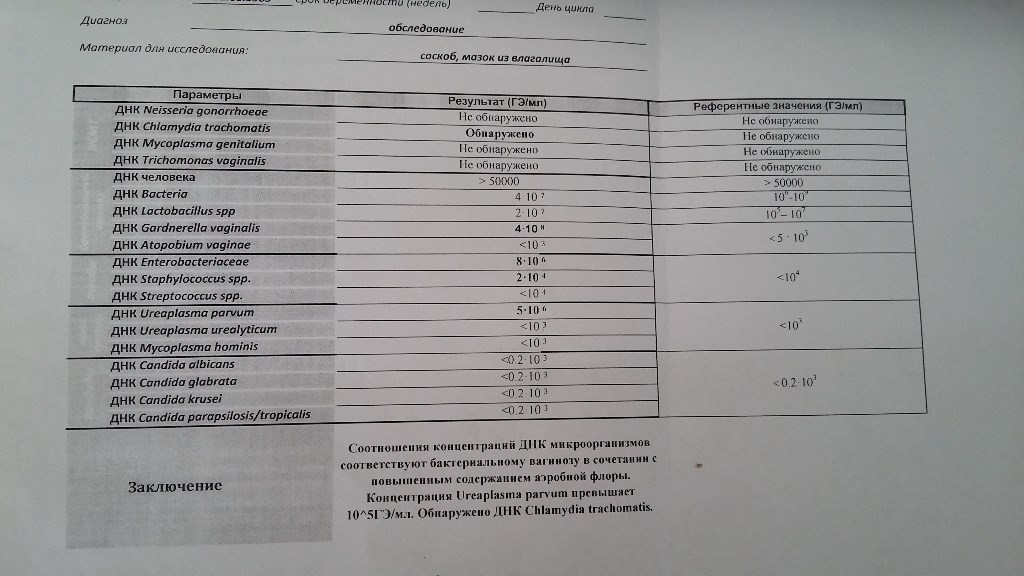
У мужчин:
Прозрачные выделения из наружного отверстия мочеиспускательного канала чаще всего по утрам;
Болезненность при мочеиспускании.
У женщин:
Прозрачные выделения из половых путей;
Межменструальные кровотечения из половых путей мажущего характера;
Тянущие боли внизу живота;
Болезненность при мочеиспускании.
Вышеупомянутая симптоматика проявляется не ранее одной-двух недель от момента инфицирования.
Самое грозное осложнение хламидиоза для мужчин и женщин – развитие бесплодия. У женщин это обусловлено образованием спаек в репродуктивных органах. У мужчин бесплодия развивается по причине перехода хламидиоза из внеклеточной формы во внутриклеточную: микробы проникают в сперматозоиды, делая их неспособными к оплодотворению. Данный факт свидетельствует о необходимости своевременной диагностики и лечения хламидиоза!
Определение Сhlamydia trachomatis методом полимеразной цепной реакцией (ПЦР) отличается высокой чувствительностью и специфичностью (98%). Принцип ПЦР заключается в идентификации уникального фрагмента ДНК, принадлежащего данному микроорганизму, после многократного удвоения исследуемого генетического материала в пробирке.
Принцип ПЦР заключается в идентификации уникального фрагмента ДНК, принадлежащего данному микроорганизму, после многократного удвоения исследуемого генетического материала в пробирке.
В сети КДЛ «ОЛИМП» ПЦР-исследования выполняются в режиме REAL-TIME – это означает, что после каждого аппаратного цикла (амлификации) происходит измерение количества ДНК в биоматериале. Данная процедура сводит вероятность ложноположительного результата практически к нулю!
Исследуемым материалом является мазок с мочеиспускательного канала или влагалища. Следовательно, результат анализа свидетельствуют о наличии или отсутствии возбудителя непосредственно в месте взятия биоматериала.
Подробнее о хламидиозе читайте статью: «8 ПРИЧИН ПРОЙТИ ОБСЛЕДОВАНИЕ НА ХЛАМИДИОЗ»
Лечение хламидиоза у женщин и мужчин
Хламидиоз – это болезнь, которую вызывают хламидии, микроорганизмы – паразиты, живущие внутри клеток хозяина. Эти организмы – нечто среднее между вирусами и бактериями.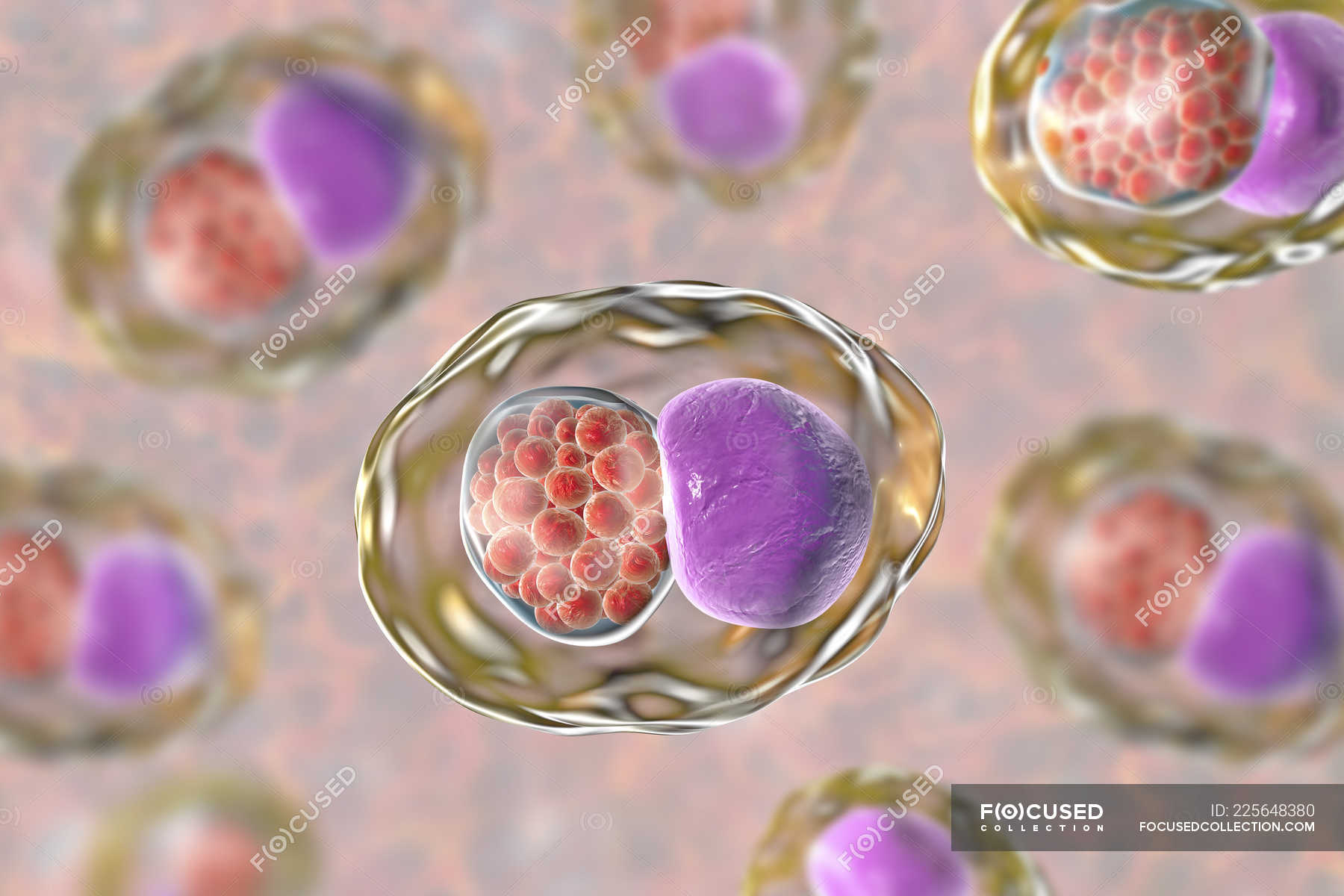 В отличие от вирусов, у них есть собственная ДНК, РНК и рибосомальный центр, необходимый для синтеза белковых молекул. По строению клеточной стенки они схожи с грамотрицательными бактериями.
В отличие от вирусов, у них есть собственная ДНК, РНК и рибосомальный центр, необходимый для синтеза белковых молекул. По строению клеточной стенки они схожи с грамотрицательными бактериями.
ЛЕЧЕНИЕ ХЛАМИДИОЗА ДОСТУПНО В ФИЛИАЛАХ:
Лечение хламидиоза в Приморском районе
Адрес: г. Санкт-Петербург, Приморский район, ул. Репищева, 13
Лечение хламидиоза в Петроградском районе
Адрес: г. Санкт-Петербург, Петроградский район, ул. Ленина, 5
Лечение хламидиоза во Всеволожске
Адрес: г. Всеволожск, Октябрьский пр-т, 96 А
Есть разные типы хламидий: некоторые их них заражают в основном птиц и млекопитающих (Chlamydia pecorum), но у человека пока не были обнаружены, виды, паразитирующие как на человеке, так и на животных (Chlamydophila felis), а есть виды, встречающиеся только у человека (Chlamydia trachomatis, Chlamydia pneumoniae).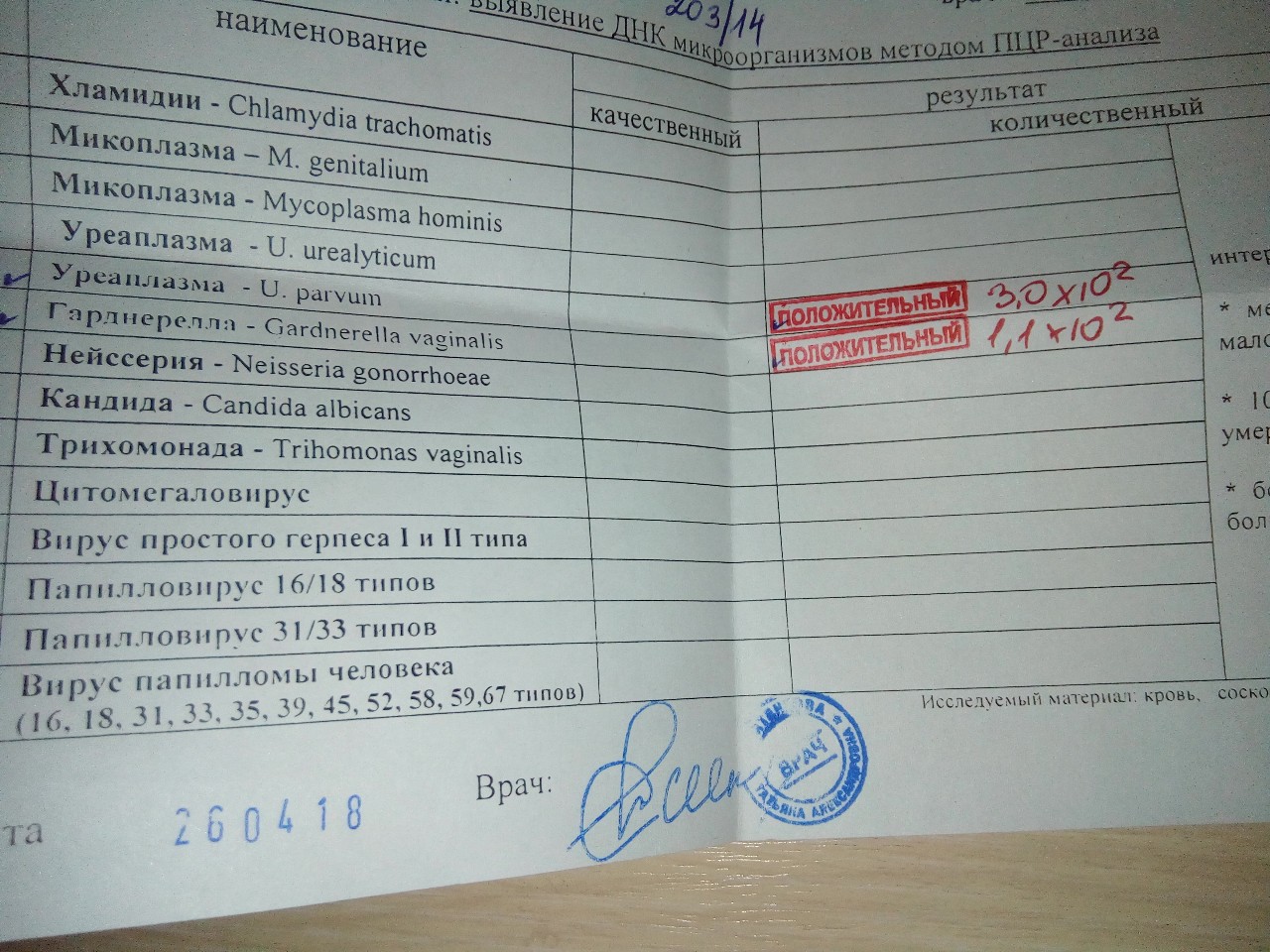 Проникают хламидии в основном через эпителиальные клетки.
Проникают хламидии в основном через эпителиальные клетки.
Чаще всего хламидиоз передается половым путем. Наиболее подвержены заболеванию молодые люди, до 30 лет. Частая смена половых партнеров и неиспользование средств механической контрацепции (презервативы) увеличивают риск заражения хламидиями до 80-90% уже после первого полового контакта. Зарегистрированы так же случаи заражения через воду в бассейне.
Клиническое течение инфекции хламидиоза зависит от вида бактерий, заразивших человека. Заражение серотипами L1, L2, L3, приводит к тропической венерической болезни — лимфогранулёма венерическая (паховый лимфогранулематоз). В нашей стране встречается редко и является завозным заболеванием.
Серотипы D, E, F, G, H, I, Y, K являются причиной урогенитальных хламидиозов. Чаще передаются половым путём, реже – через контакт грязным руками со слизистыми глаз.
У новорождённых детей, при инфицировании Chlamydia trachomatis от матери во время родов, на фоне заражения может развиться пневмония.
Симптомы и проявления хламидиоза
Большинство половых инфекции легко обнаружить и диагностировать. Но в случае с хламидиями это не так. Весьма важной проблемой является бессимптомное течение инфекции (в большинстве случаев при нормальной иммунной системе организма). Это является причиной отсутствия своевременного лечения, возможности появления осложнений при ослабевании иммунитета, а кроме того бессознательного дальнейшего заражения половых партнеров.
Симптомы хламидиоза проявляются в основном при ослабленном иммунитете в 25% — 50% случаев заболевания.
1. Венерические гранулемы
Начинается заболевание с возникновения небольших пузырьков в месте проникновения инфекции (на половых органах). После 2 — 6 недель увеличиваются паховые лимфатические узлы, которые могут уплотняться и спаиваться между собой. При осложнениях возможно образование свища (патологического канала) мошонки (у мужчин), мочеиспускательного канала, прямокишечно-влагалищного свища (у женщин), слоновость половых органов, сужение прямой кишки.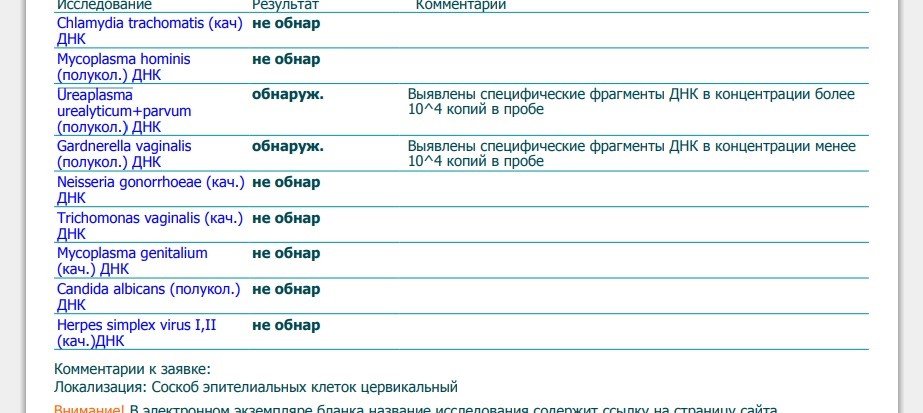
2. Хламидиоз у женщин
Хламидиоз у женщин может быть причиной воспаления мочеиспускательного канала, шейки матки и слизисто-гнойного проктита (воспаление прямой кишки). Симптомы хламидиоза у женщин включают:
- покраснение и отек влагалища, сопровождающиеся болью, жжением во время мочеиспускания, ощущением не полностью опорожнённого мочевого пузыря;
- при воспалении шейки матки: слизисто-гнойные выделения, покраснение и отек влагалищной части шейки матки, задержка и увеличение продолжительности месячных, кровотечения между ними;
- боль во время полового акта;
- повышенная температура;
- тошнота.
Хламидиоз у женщин может вызвать много осложнений. При восходящей инфекции хламидии могут распространиться на верхние отделы репродуктивной системы, вызывая воспаление слизистой оболочки матки, маточных труб, яичников, эрозию шейки матки, воспаление бартолиновой железы.
Воспалительные процессы малого таза могут приводить к сложностям при зачатии.
Заражение хламидиозом также может негативно сказаться на течении беременности.
В этих случаях наблюдается более высокий уровень внематочной беременности, самопроизвольные аборты, преждевременный разрыв околоплодного пузыря, преждевременные роды и увеличение перинатальной смертности новорожденных.
3. Хламидиоз у мужчин
Инфекция у мужчин наиболее часто проявляется, как воспаление мочеиспускательного канала, проктит (в основном у гомосексуальных мужчин) и фарингит (воспаление горла) в случае орогенитальных контактов.
Симптомы хламидиоза у мужчин появляются через 7-21 дней после заражения. Наиболее частые симптомы:
- прозрачные или молочно-белые, серозные или слизеподобные выделения из мочеиспускательного канала;
- повышение температуры;
- покраснение и чрезмерный нагрев кожи промежности;
- жгучая боль при мочеиспускании;
- острый эпидидимит (воспаление придатка семенника).

Когда воспалительный процесс затрагивает паховые железы, появляется тупая боль в паху, отдающаяся в область паха, яичек и спины.
Распространение инфекции может привести к воспалению яичка (орхит), что может стать причиной бесплодия. Кроме того, не лечёный хламидиоз может вызвать хронический простатит и сужение уретры.
Все эти симптомы не обязательно могут проявляться вместе. Некоторые из них схожи с симптомами других заболеваний и не всегда ассоциируются с половой инфекцией. В результате чего, человек узнаёт о том, что он является носителем хламидий, уже спустя много лет, например, при безуспешных попытках завести ребёнка.
Среди общих осложнений хламидиозной инфекции для мужчин и женщин стоит упомянуть:
- воспаление слизистой оболочки прямой кишки;
- конъюнктивит;
- воспаление горла;
- воспаление легких;
- воспаление головного мозга;
- воспаление мозговых оболочек (менингит).

Диагностика хламидиоза
Как в случае со многими другими заболеваниями, особенно гинекологическими, регулярное посещение врача и своевременная диагностика хламидиоза поможет избежать многих негативных побочных эффектов. При наличии активной половой жизни рекомендуется хотя бы раз в год проводить анализы на хламидиоз.
Диагностика хламидиоза связана, прежде всего:
- с цитологическими анализами мазков с инфицированной области.
- с бактериальным посевом клеток с соскоба (даёт возможность выполнить антибиотикограмму – чувствительность инфекционных клеток к определённым препаратам).
- с ПЦР-анализом клеток с поражённых участков (полимеразная цепная реакция) — позволяет выделить фрагменты ДНК хламидий и определить тип микроорганизмов.
- с анализом крови — анализ на хламидиоз, оценка уровня иммуноглобулинов IgM и IgG (антитела) – образуются в крови человека при заражении под действием чужеродных белков (антигенов).

Лечение хламидиоза
Важно заметить, что любое венерическое заболевание, в том числе хламидиоз, запрещено лечить самостоятельно! Схему лечения хламидиоза составляет врач, опираясь на симптоматику и результаты исследований.
Это заболевание не требует госпитализации, при условии, что инфекция не у беременной женщины и нет угрозы беременности.
Необходимо помнить, что для эффективности лечения хламидиоза и предотвращения повторного заражения, необходим курс терапии для обоих партнеров. После прохождения лечения рекомендуются повторные анализы для оценки его результативности.
При лечении хламидиоза как у мужчин, так и у женщин, используют комплексную терапию, направленную на борьбу с хламидиями и поддержку организма в целом:
- антибиотики — наиболее часто используются препараты группы эритромицина и азитромицина, применяются антибиотики широкого действия, так как часто возникают трудности с постановкой точного диагноза
- иммуномодуляторы (повышение собственного иммунитета человека)
- энзимотерапия (ферментативная терапия, стимулирует работу печени и почек для уменьшения интоксикации организма антибиотиками)
- гепатопротекторы (защита печени и повышение устойчивости к действию антибиотиков)
- витаминотерапия (повышение иммунного ответа) – витамин Е, аскорбиновая, глютаминовая кислоты
- пробиотики (профилактика дисбактериоза)
Выбор препарата, его дозировка и длительность лечения определяется врачом в зависимости от возраста, пола и типа хламидий.
При отсутствии адекватного лечения, хламидиоз может спровоцировать опасные осложнения: артрит, изменения в нервной системе, снижение иммунитета, различные виды сосудистых заболеваний, а также астму и аллергические реакции. Распространение инфекции по кровотоку может вызвать воспаление печени, проявляющееся болями в животе, которые часто принимают за воспаление желчного пузыря или поджелудочной железы.
Получить квалифицированную консультацию гинеколога в нашей клинике «Династия» Вы можете, записавшись по телефону или форму обратной связи внизу страницы.
Прием ведут врачи:
Выберите филиал“Династия” на Новочеркасском пр-те, Красногвардейский район“Династия” на Ленина, Петроградский район“Династия” на Репищева, Приморский район“Династия” во ВсеволожскеВыездная служба
Стоимость лечения хламидиоза:
| Наименование услуг | Цена в рублях | |
| Санкт-Петербург | Всеволожск | |
| Первичный прием акушера-гинеколога 1 ступени | 1850 | 1500 |
| Повторный прием акушера-гинеколога 1 ступени | 1650 | 1300 |
| Первичный прием акушера-гинеколога 2 ступени | 2100 | — |
| Повторный прием акушера-гинеколога 2 ступени | 1900 | — |
| МАНИПУЛЯЦИИ | ||
| Забор мазков (гинекологический) | 300 | 250 |
| УЗИ органов малого таза (одним датчиком) | 1600 | 1300 |
| УЗИ органов малого таза (двумя датчиками) | 1900 | 1500 |
| КТГ (кардиотокография плода) | 1800 | — |
| КТГ (многоплодная беременность) | 2300 | — |
| Видеокольпоскопия | 1700 | 1700 |
| Местная обработка наружных половых органов | 700 | 700 |
| Лечебная обработка влагалища | 700 | 700 |
| Интравагинальное введение свечей (без стоимости медикаментов), 1 процедура | 500 | 500 |
| Штрих-биопсия эндометрия (пайпель-диагностика) | 1500 | 1200 |
| Введение акушерского пессария | 1500 | 1500 |
| Удаление акушерского пессария | 1000 | 1000 |
| Медикаментозное прерывание беременности | 8000 | — |
| PRP-терапия | — | 3500 |
| Интимная контурная пластика | — | 26000 |
| Введение имплантируемого контрацепива «ИМПЛАНОН» (без стоимости контрацептива) | 2500 | 2100 |
| Удаление имплантируемого контрацепива «ИМПЛАНОН» | 2500 | 2300 |
| Введение внутриматочной спирали (ВМС) | 2500 | 2500 |
| Удаление внутриматочной спирали (ВМС) | 1500 | 1500 |
| Инструментальное удаление внутриматочной спирали (ВМС) | 2500 | 2100 |
| Установка внутриматочной спирали «Мирена» | 4000 | 4000 |
| Снятие внутриматочной спирали «Мирена» | 3000 | 3000 |
| Удаление инородного тела из влагалища | 1800 | 1800 |
| Хирургическая дефлорация | 8000 | 8000 |
| ЛАЗЕРНАЯ ХИРУРГИЯ | ||
| Биопсия шейки матки + гистология | 5000 | 4000 |
| Единичная киста шейки матки | 1500 | 1500 |
| Единичные папилломы и кондиломы стенок влагалища | 3000 | 3000 |
Удаление единичных кондилом, папиллом вульвы, шейки матки (за 1 ед.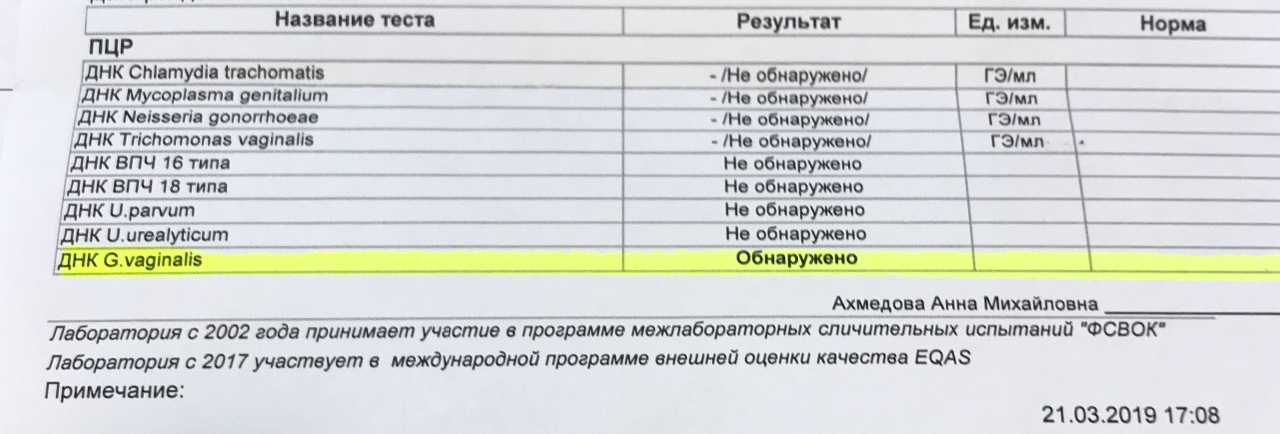 ) ) | 600 | 600 |
| Распространенный кондиломатоз, папилломатоз | от 6000 | от 6000 |
| Эктопия (эрозия) шейки матки (менее 2 см) | 6000 | 4000 |
| Эктопия (эрозия) шейки матки (более 2 см) | 9000 | 9000 |
| Эндометриоз шейки матки (единичный очаг) | 1000 | 1000 |
| РАДИОХИРУРГИЯ | ||
| Биопсия шейки матки радионожом | 2500 | 2000 |
| Фульгурация кист, эндометриоидных очагов с помощью радиохирургического ножа | 3500 | 2200 |
| Лечение лейкоплакии и крауроза вульвы с помощью радиохирургического ножа | 5300 | 5100 |
| Лечение патологии шейки матки с помощью радиохирургического ножа до 1 см | 5000 | 3700 |
| Лечение патологии шейки матки с помощью радиохирургического ножа до 2 см | 6500 | 6000 |
| Удаление полипов шейки матки с помощью радиохирургического ножа | 4000 | 2250 |
Электрокоагуляция кондилом на коже в области промежности радионожом (за 1 ед.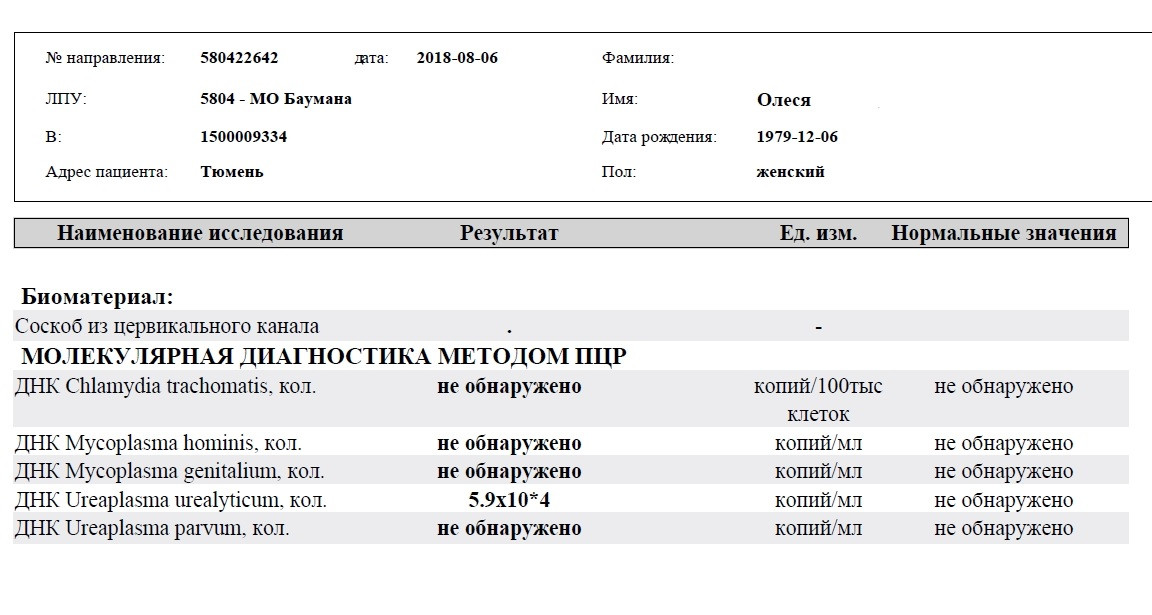 ) ) | 800 | 800 |
| Электрокоагуляция кондилом, папиллом вульвы радионожом | 1400 | 1400 |
| Электрокоагуляция кондилом, папиллом влагалища радионожом | от 3200 | от 3200 |
Указанные на сайте цены не являются публичной офертой. Уточняйте стоимость у администраторов.
ЗАПИСЬ НА ЛЕЧЕНИЕ ХЛАМИДИОЗА
Ваша заявка отправлена
Менеджер свяжется с вами для уточнения деталей
Мы ценим ваше обращение в наш медицинский центр «Династия»
Лечение хламидиоза у женщин, симптомы, лечение заболевания хламидиоз ◈ Медицинский центр Елены Малышевой Ижевск
Хламидиоз – инфекционное заболевание, передающееся половым путем. В результате проникновения бактерий происходит поражение органов мочеполовой системы. Клиническая картина довольно разнообразна, и в женском организме она может быть представлена симптомами уретрита, цистита, вульвовагинита, цервицита, эндометрита.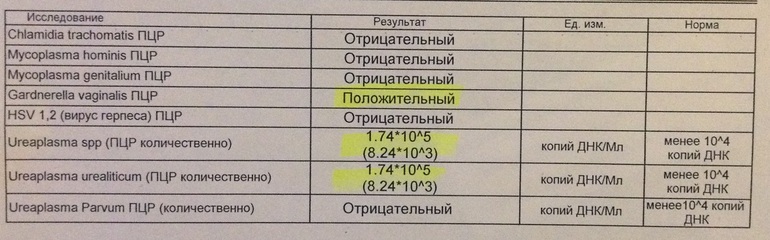
Лечение хламидиоза заключается в приеме ряда лекарственных препаратов, которые подбирает врач, исходя из чувствительности патогенного микроорганизма и общего состояния пациентки.
Выявить хламидии в организме можно только с помощью специфических методов лабораторной диагностики. Эта инфекция опасна своими осложнениями. В запущенных случаях она может не только поражать суставы и нервную систему (нейрохламидиоз), но и провоцировать патологии сердца и сосудов, а также стать причиной бесплодия.
Причины возникновения
Возбудитель заболевания – Chlamydia trachomatis. Это бактерия, являющаяся внутриклеточным паразитом. Она поражает преимущественно мочеполовую систему, проникая в клетки слизистой оболочки, где начинает активно размножаться.
Заболевание чаще всего передается половым путем при вагинальном или анальном контакте. Иногда заразиться можно контактно-бытовым путем, например, при посещении бани или сауны. В таких случаях бактерия попадает на половые органы с загрязненных рук. Установлено, что свою вирулентность вне организма во влажных условиях при температуре 18-200 С хламидия может сохранять до 2-х суток.
Установлено, что свою вирулентность вне организма во влажных условиях при температуре 18-200 С хламидия может сохранять до 2-х суток.
Симптомы хламидиоза у женщин
Инкубационный период длится от 2 недель до месяца. Нередко заболевание протекает бессимптомно или в субклинической форме – с минимальными признаками, на которые пациентка не обращает внимания. Основной симптом патологии – слизистые или слизисто-гнойные выделения из влагалища. От физиологического секрета они отличаются неприятным запахом и желтоватым оттенком. По мере прогрессирования заболевания появляются:
- зуд и чувство жжения в половых органах;
- рези при мочеиспускании;
- боль внизу живота;
- межменструальные кровотечения.
При ослабленном иммунитете возможно появление симптомов общей интоксикации – слабости и повышения температуры до субфебрильных цифр.
Диагностика и лечение заболевания хламидиоз
Опрос и осмотр женщины гинекологом позволяют лишь заподозрить инфекцию.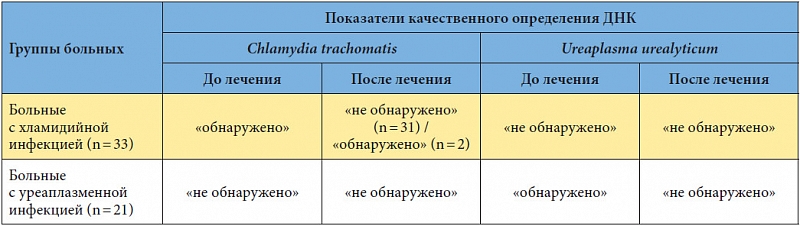 Окончательный диагноз ставится только после проведения специфических лабораторных тестов. Пациентке могут быть назначены следующие анализы:
Окончательный диагноз ставится только после проведения специфических лабораторных тестов. Пациентке могут быть назначены следующие анализы:
- ПЦР. Ведущий метод диагностики, позволяющий обнаружить ДНК хламидии даже в незначительном количестве.
- ИФА. Выявляет антитела к бактерии и определяет их титр. Помогает уточнить, на какой стадии находится заболевание – острой или хронической.
- Бактериологический посев. Длительный, но высокоинформативный метод диагностики, позволяющий уточнить тип возбудителя и его чувствительность к антибиотикам.
Лечение заболевания хламидиоз проводит гинеколог. По результатам диагностики он назначает ряд лекарственных препаратов. Их действие направлено на уничтожение возбудителя, укрепление иммунитета и восстановление нормальной микрофлоры влагалища. Кроме медикаментозной терапии пациентке могут быть рекомендованы физиопроцедуры.
Лечение в медицинском центре Елены Малышевой
Опрос с уточнением симптомов и лечение хламидиоза у женщин требуют внимательного и мягкого подхода. Эту деликатную проблему помогут решить гинекологи медицинского центра Елены Малышевой.
При появлении первых неприятных симптомов не нужно раздумывать и выжидать, что все пройдет само собой. И уже тем более пытаться лечить болезнь самостоятельно. Позвоните и запишитесь на прием к гинекологу. Своевременно начатое лечение и индивидуальный подбор препаратов помогут избавиться от инфекции и избежать серьезных осложнений.
Эту деликатную проблему помогут решить гинекологи медицинского центра Елены Малышевой.
При появлении первых неприятных симптомов не нужно раздумывать и выжидать, что все пройдет само собой. И уже тем более пытаться лечить болезнь самостоятельно. Позвоните и запишитесь на прием к гинекологу. Своевременно начатое лечение и индивидуальный подбор препаратов помогут избавиться от инфекции и избежать серьезных осложнений.
Chlamydia trachomatis (п/кол.) — Клиника 1
Chlamydia trachomatis является наиболее распространенным в мире бактериальным возбудителем ИППП, особенно среди людей молодого возраста. Известны три серовара и 15 биоваров Chl. trachomatis, в частности трахомальный биовар, урогенитальный биовар и биовар, вызывающий венерическую лимфогранулему. Чаще всего хламидиоз передается при прямом половом контакте, дети могут инфицироваться при прохождении по родовым путям. Уровень заражения при прямом сексуальном контакте превышает 75%, таким образом, уведомление партнера и своевременное лечение крайне важны.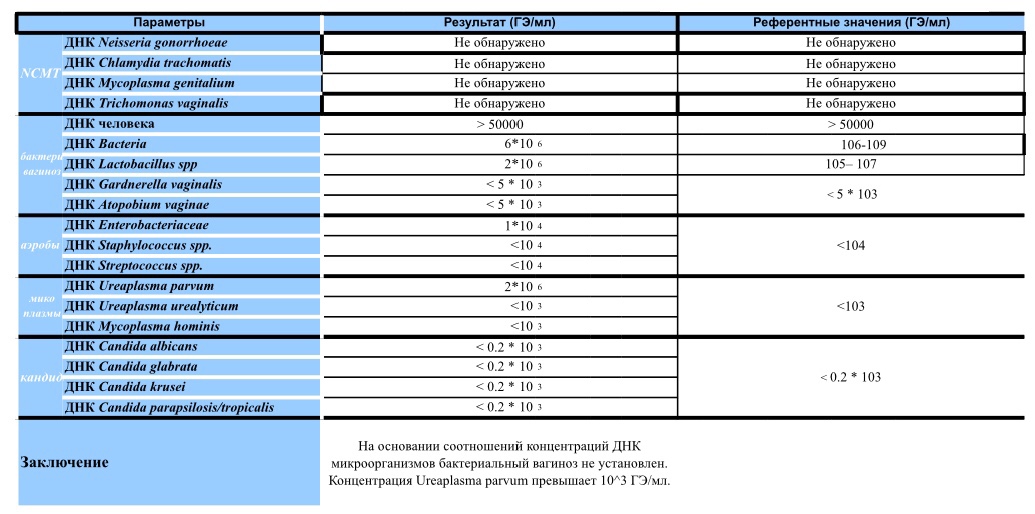 У женщин Chl. trachomatis вызывает цервициты, уретриты, посткоитальные кровотечения, воспалительные заболевания органов малого таза (ВЗОМТ), проктиты. Учитывая высокий процент бессимптомных форм (до 90%), зачастую не происходит своевременная диагностика и лечение, процесс приобретает хроническое течение и развиваются осложнения (сальпингиты, эндометриты, спаечный процесс в трубах, внематочная беременность), которые приводят к бесплодию (установлено, что при трубном бесплодии в 80% случаев причиной является Chl. trachomatis). Это определяет необходимость исключения инфицирования не только в случаях ярких клинических проявлений, но и во всех случаях бесплодия. У мужчин Chl. trachomatis вызывает негонококковые уретриты, эпидидимиты, проктиты. Может привести к развитию синдрома Рейтера.
У женщин Chl. trachomatis вызывает цервициты, уретриты, посткоитальные кровотечения, воспалительные заболевания органов малого таза (ВЗОМТ), проктиты. Учитывая высокий процент бессимптомных форм (до 90%), зачастую не происходит своевременная диагностика и лечение, процесс приобретает хроническое течение и развиваются осложнения (сальпингиты, эндометриты, спаечный процесс в трубах, внематочная беременность), которые приводят к бесплодию (установлено, что при трубном бесплодии в 80% случаев причиной является Chl. trachomatis). Это определяет необходимость исключения инфицирования не только в случаях ярких клинических проявлений, но и во всех случаях бесплодия. У мужчин Chl. trachomatis вызывает негонококковые уретриты, эпидидимиты, проктиты. Может привести к развитию синдрома Рейтера.
Бессомптомные формы встречаются реже, чем у женщин, но все-таки составляют приблизительно 50% всех случаев, что определяет необходимость исключения данной инфекции не только при выраженной клинике поражения, но и во всех случаях бесплодия.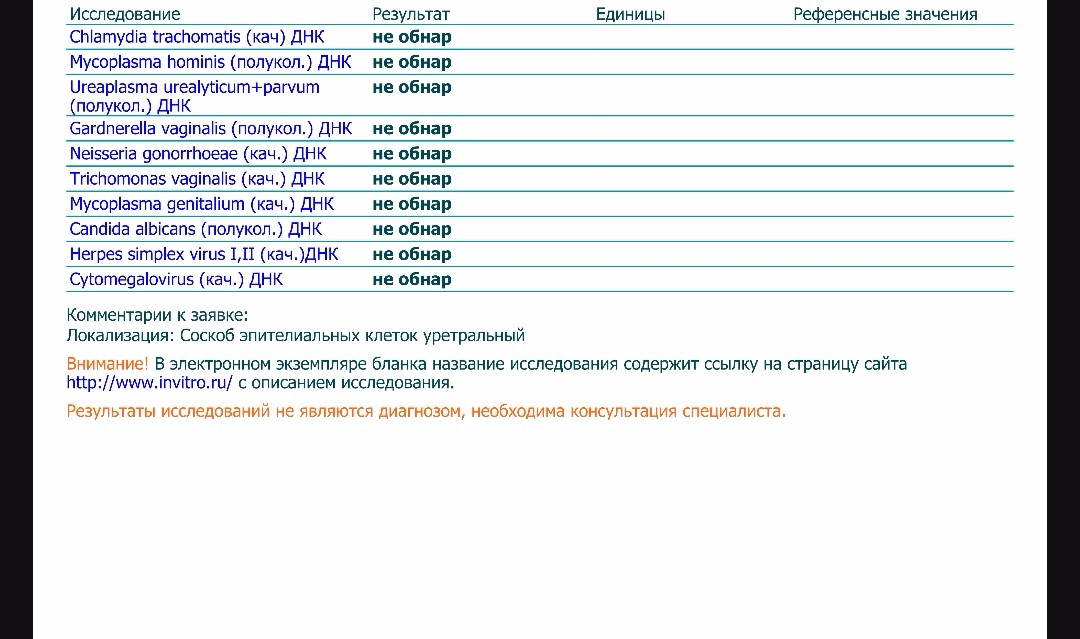 У новорожденных детей инфицирование при прохождении по родовым путям может привести к развитию клиники конъюнктивита или пневмонии в первые недели жизни. Кроме того,к клиническим проявлениям хламидийной инфекции, вызванной Chl. trachomatis, относятся офтальмологические заболевания (трахома, конъюктивиты), венерическая лимфогранулема (клиника уретрита с гнойным паховым лимфаденитом), синдром Рейтера (триада: уретрит, конъюнктивит, артрит), проктиты, проктоколиты, более редко встречаются поражения конъюнктивы, верхних дыхательных путей, эндокардиты, перигепатит.
У новорожденных детей инфицирование при прохождении по родовым путям может привести к развитию клиники конъюнктивита или пневмонии в первые недели жизни. Кроме того,к клиническим проявлениям хламидийной инфекции, вызванной Chl. trachomatis, относятся офтальмологические заболевания (трахома, конъюктивиты), венерическая лимфогранулема (клиника уретрита с гнойным паховым лимфаденитом), синдром Рейтера (триада: уретрит, конъюнктивит, артрит), проктиты, проктоколиты, более редко встречаются поражения конъюнктивы, верхних дыхательных путей, эндокардиты, перигепатит.
Показания к назначению исследования
- В комплексе с другими маркерами выявление острой стадии инфекции, вызваннойChl. trachomatis при клинике цервицита, сальпингита, эндометрита (женщины), эпидидимита (мужчины), уретрита, проктита, синдрома Рейтера, артрита, конъюнктивита, трахомы.
- У новорожденных детей и детей первого месяца жизни-при конъюнктивите, пневмонии
Стоимость исследования
Сдать ДНК Chl.
 trach./N.gonorr./M.genit./Tr.vag. анализ во Владимире
trach./N.gonorr./M.genit./Tr.vag. анализ во ВладимиреОписание
Диагностика инфекционных заболеваний (ПЦР) — ДНК Chl.trach./N.gonorr./M.genit./Tr.vag. Сроки исполнения:3-5 рабочих дней*. Биоматериал: соскоб. Описание: Подготовка к исследованию: Перед взятием соскоба пациенту рекомендуют не мочиться в течение 1,5-2 часов. Перед взятием материала из цервикального канала необходимо удалить слизь ватным тампоном. Справка: данный тест предназначен для количественного определения четырех наиболее часто встречающихся возбудителей инфекционной патологии урогенитального тракта (Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium и Trichomonas vaginalis) в соскобе с помощью полимеразной цепной реакции (ПЦР). Хламидии (Chlamydia trachomatis) — облигатные внутриклеточные паразиты, передающиеся преимущественно половым путем, и вызывающие хламидиоз (в первую очередь, поражения слизистых оболочек половых путей, конъюнктивиты). Хламидии обитают там, где есть цилиндрический эпителий: шейка матки, уретра и прямая кишка.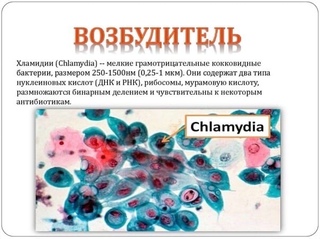 В настоящее время насчитывается более 20 нозологических форм, ассоциированных с хламидийной инфекцией. Особенностью урогенитального хламидиоза является как разнообразие клинических проявлений, так и отсутствие выраженной симптоматики. Хламидиоз может протекать бессимптомно, часто хронизируется, сопровождается различными осложнениями, которые иногда у женщин является причиной бесплодия и невынашивания беременности.
Особенности жизненного цикла Chlamydia trachomatis приводят к частому возникновению персистирующей формы инфекции, резистентности к терапии. Реактивация инфекции может произойти под действием изменения иммунного или гормонального статуса, травмы, операции, стресса. Для диагностики и контроля терапии хламидиоза используются серологические методы (определение антител к антигенам Chlamydia trachomatis) и выявление ДНК возбудителя методом ПЦР.
Гонорея — венерическое заболевание вызывается грамотрицательным диплококком — Neisseria gonorrhoeae. Источник инфекции – больной человек, особенно хронической бессимптомно протекающей формой гонореи.
В настоящее время насчитывается более 20 нозологических форм, ассоциированных с хламидийной инфекцией. Особенностью урогенитального хламидиоза является как разнообразие клинических проявлений, так и отсутствие выраженной симптоматики. Хламидиоз может протекать бессимптомно, часто хронизируется, сопровождается различными осложнениями, которые иногда у женщин является причиной бесплодия и невынашивания беременности.
Особенности жизненного цикла Chlamydia trachomatis приводят к частому возникновению персистирующей формы инфекции, резистентности к терапии. Реактивация инфекции может произойти под действием изменения иммунного или гормонального статуса, травмы, операции, стресса. Для диагностики и контроля терапии хламидиоза используются серологические методы (определение антител к антигенам Chlamydia trachomatis) и выявление ДНК возбудителя методом ПЦР.
Гонорея — венерическое заболевание вызывается грамотрицательным диплококком — Neisseria gonorrhoeae. Источник инфекции – больной человек, особенно хронической бессимптомно протекающей формой гонореи. Экологической нишей являются слизистые оболочки мочеполовых путей человека. Механизм передачи – контактный, путь – половой, крайне редко бытовой (например, больная гонореей мать может заразить ребенка при пользовании общей мочалкой, сиденьем унитаза и т. п.), возможно инфицирование плода при прохождении через родовые пути матери. Восприимчивость к гонококкам очень высокая. После перенесенного заболевания иммунитет к вторичным заражениям не вырабатывается; возможны супер и реинфекции. У мужчин возбудитель гонореи является причиной уретритов, стриктуры уретры, эпидидимита, простатита, орхита и других заболеваний яичек и его придатков. У женщин инфекция проявляется как уретрит, бартолинит, эндоцервицит, эндометрит, сальпингит и пельвиоперитонит. Симптомы хронической гонореи у женщин могут быть минимальными, заболевание трудно диагностируется, поэтому женщины представляют основной резервуар инфекции. Новорожденные могут заразиться гонореей при прохождении ребёнка через родовые пути (бленнорея новорожденных).
Экологической нишей являются слизистые оболочки мочеполовых путей человека. Механизм передачи – контактный, путь – половой, крайне редко бытовой (например, больная гонореей мать может заразить ребенка при пользовании общей мочалкой, сиденьем унитаза и т. п.), возможно инфицирование плода при прохождении через родовые пути матери. Восприимчивость к гонококкам очень высокая. После перенесенного заболевания иммунитет к вторичным заражениям не вырабатывается; возможны супер и реинфекции. У мужчин возбудитель гонореи является причиной уретритов, стриктуры уретры, эпидидимита, простатита, орхита и других заболеваний яичек и его придатков. У женщин инфекция проявляется как уретрит, бартолинит, эндоцервицит, эндометрит, сальпингит и пельвиоперитонит. Симптомы хронической гонореи у женщин могут быть минимальными, заболевание трудно диагностируется, поэтому женщины представляют основной резервуар инфекции. Новорожденные могут заразиться гонореей при прохождении ребёнка через родовые пути (бленнорея новорожденных). Микоплазмы – группа внутриклеточных микроорганизмов — грамотрицательных бактерий размером, не имеющих плотной клеточной стенки, покрытых трехслойной цитоплазматической мембраной. Описано несколько штаммов микоплазм. Условно микоплазмы разделяют на 6 групп, в зависимости от вызываемых ими заболеваний у человека. К группе микоплазм, вызывающих поражения урогенитального тракта у мужчин и женщин, относят Mycoplasma hominis, Mycoplasma genitalium и Ureaplasma urealyticum. Микоплазмы характеризуются полиморфизмом и своеобразным жизненным циклом. Источником инфекции является человек, больной микоплазмозом, или здоровый носитель микоплазм. Микоплазменные инфекции урогенитального тракта занимают одно из ведущих мест среди инфекций, передающихся половым путем (ИППП). Mycoplasma hominis способны заселять слизистые оболочки и вызывать инфекции мочевых путей и половых органов. Эти микроорганизмы можно обнаружить, по разным данным, у 10-50% здоровых женщин (частота случаев выявления увеличивается во время беременности) и у 8-9% здоровых мужчин.
Микоплазмы – группа внутриклеточных микроорганизмов — грамотрицательных бактерий размером, не имеющих плотной клеточной стенки, покрытых трехслойной цитоплазматической мембраной. Описано несколько штаммов микоплазм. Условно микоплазмы разделяют на 6 групп, в зависимости от вызываемых ими заболеваний у человека. К группе микоплазм, вызывающих поражения урогенитального тракта у мужчин и женщин, относят Mycoplasma hominis, Mycoplasma genitalium и Ureaplasma urealyticum. Микоплазмы характеризуются полиморфизмом и своеобразным жизненным циклом. Источником инфекции является человек, больной микоплазмозом, или здоровый носитель микоплазм. Микоплазменные инфекции урогенитального тракта занимают одно из ведущих мест среди инфекций, передающихся половым путем (ИППП). Mycoplasma hominis способны заселять слизистые оболочки и вызывать инфекции мочевых путей и половых органов. Эти микроорганизмы можно обнаружить, по разным данным, у 10-50% здоровых женщин (частота случаев выявления увеличивается во время беременности) и у 8-9% здоровых мужчин. Являясь условно патогенными и активизируясь при действии провоцирующих факторов (изменение гормонального и иммунного фона, одновременное инфицирование возбудителями инфекций, передающихся половым путем), могут вызывать возникновение урогенитальных воспалительных заболеваний у мужчин и женщин. Наличие микоплазменной инфекции также связывают с возможностью развития патологии новорожденных вследствие восходящей инфекции или инфицирования во время родов.
Трихомониаз — заболевание мочеполового тракта, вызванное инфицированием Trichomonas vaginalis – жгутиковым простейшим из рода трихомонад. Заболевание широко распространено у женщин 20-40 лет, реже бывает у мужчин и исключительно редко — у детей. У женщин поражаются уретра, вульва, влагалище и шейка матки. У мужчин — уретра, предстательная железа и семенные пузырьки, но обычно заболевание протекает малосимптомно. Обычно инфекция передается половым путем, реже – контактно-бытовым. Прикрепляясь к клеткам плоского эпителия мочеполового тракта, трихомонады взаимодействуют с окружающей микробной флорой и нарушают нормальный биоценоз влагалища, тем самым и вызывая клинические проявления заболевания.
Являясь условно патогенными и активизируясь при действии провоцирующих факторов (изменение гормонального и иммунного фона, одновременное инфицирование возбудителями инфекций, передающихся половым путем), могут вызывать возникновение урогенитальных воспалительных заболеваний у мужчин и женщин. Наличие микоплазменной инфекции также связывают с возможностью развития патологии новорожденных вследствие восходящей инфекции или инфицирования во время родов.
Трихомониаз — заболевание мочеполового тракта, вызванное инфицированием Trichomonas vaginalis – жгутиковым простейшим из рода трихомонад. Заболевание широко распространено у женщин 20-40 лет, реже бывает у мужчин и исключительно редко — у детей. У женщин поражаются уретра, вульва, влагалище и шейка матки. У мужчин — уретра, предстательная железа и семенные пузырьки, но обычно заболевание протекает малосимптомно. Обычно инфекция передается половым путем, реже – контактно-бытовым. Прикрепляясь к клеткам плоского эпителия мочеполового тракта, трихомонады взаимодействуют с окружающей микробной флорой и нарушают нормальный биоценоз влагалища, тем самым и вызывая клинические проявления заболевания. Трихомониаз может быть причиной бесплодия и осложнений беременности.
Основными методами лабораторного подтверждения трихомониаза являются микроскопическое исследование мазка, микробиологический посев и ПЦР-тестирование. В последнее время в диагностике трихомониаза преобладает метод ПЦР, дополненный исследованием специфических антител.
Показания к назначению: Диагностика этиологии хронического инфекционного процесса урогенитального тракта. Беременность с отягощенным акушерским анамнезом, бесплодие. Профилактические скрининговые исследования (для исключения вероятности бессимптомного течения инфекции).
Единицы измерения: копий/мл для каждого из возбудителей
Нормальные показатели: в норме ДНК данных возбудителей в соскобе не определяется.
Интерпретация результатов:
Определение ДНК Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium и Trichomonas vaginalis с помощью ПЦР зачастую играет решающую роль в диагностике этиологии заболеваний мочеполовой системы , поскольку дает возможность обнаружить единичные молекулы ДНК возбудителя, не выявляемые другими методами (ИФА, микроскопия и т.
Трихомониаз может быть причиной бесплодия и осложнений беременности.
Основными методами лабораторного подтверждения трихомониаза являются микроскопическое исследование мазка, микробиологический посев и ПЦР-тестирование. В последнее время в диагностике трихомониаза преобладает метод ПЦР, дополненный исследованием специфических антител.
Показания к назначению: Диагностика этиологии хронического инфекционного процесса урогенитального тракта. Беременность с отягощенным акушерским анамнезом, бесплодие. Профилактические скрининговые исследования (для исключения вероятности бессимптомного течения инфекции).
Единицы измерения: копий/мл для каждого из возбудителей
Нормальные показатели: в норме ДНК данных возбудителей в соскобе не определяется.
Интерпретация результатов:
Определение ДНК Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium и Trichomonas vaginalis с помощью ПЦР зачастую играет решающую роль в диагностике этиологии заболеваний мочеполовой системы , поскольку дает возможность обнаружить единичные молекулы ДНК возбудителя, не выявляемые другими методами (ИФА, микроскопия и т. д.). Выявление в соскобе специфического фрагмента геномной последовательности, характерной только для конкретного возбудителя или возбудителей, позволяет диагностировать этиологию воспалительного процесса мочеполовой системы, выявить носителей данной инфекции и назначить соответствующее лечение.
Однако следует помнить, что для диагностики методом ПЦР необходимо наличие генома микроорганизма во взятом материале. При локализации процесса в глубоких отделах половой системы (яичники, маточные трубы, придатки яичек, предстательная железа) возможны ложноотрицательные результаты. Иногда ПЦР может давать ложноположительные результаты, если во взятом материале находится генетический материал близких видов непатогенных возбудителей. Кроме того зачастую для более точной диагностики этиологии заболевания урогенитального тракта необходимо одновременно с ПЦР определить наличие антител в крови к определенному возбудителю (если это возможно).
Внимание! Интерпретировать результаты теста и назначать соответствующее лечение должен только квалифицированный специалист совместно с данными клинических и других лабораторных исследований.
д.). Выявление в соскобе специфического фрагмента геномной последовательности, характерной только для конкретного возбудителя или возбудителей, позволяет диагностировать этиологию воспалительного процесса мочеполовой системы, выявить носителей данной инфекции и назначить соответствующее лечение.
Однако следует помнить, что для диагностики методом ПЦР необходимо наличие генома микроорганизма во взятом материале. При локализации процесса в глубоких отделах половой системы (яичники, маточные трубы, придатки яичек, предстательная железа) возможны ложноотрицательные результаты. Иногда ПЦР может давать ложноположительные результаты, если во взятом материале находится генетический материал близких видов непатогенных возбудителей. Кроме того зачастую для более точной диагностики этиологии заболевания урогенитального тракта необходимо одновременно с ПЦР определить наличие антител в крови к определенному возбудителю (если это возможно).
Внимание! Интерпретировать результаты теста и назначать соответствующее лечение должен только квалифицированный специалист совместно с данными клинических и других лабораторных исследований.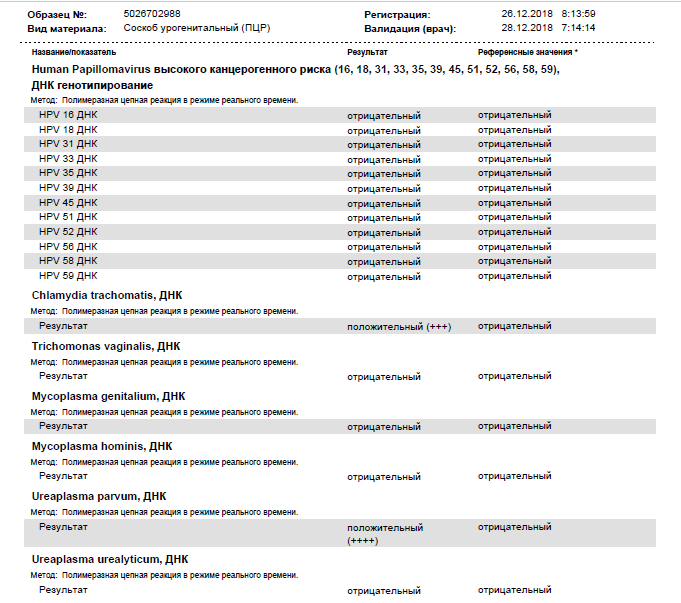
Chlamydia Trachomatis — обзор
Введение
Chlamydia trachomatis была первой и окончательно изолирована от пациентов с трахомой с использованием куриных эмбрионов Tang et al., Как сообщалось в ряде статей, опубликованных в 1956 и 1957 годах [1-3]. В то время как окулярные штаммы C. trachomatis по-прежнему являются причиной большинства предотвратимых случаев слепоты в слаборазвитых странах с неадекватной гигиеной [4], генитальные штаммы C. trachomatis , как известно, являются основными возбудителями инфекций, передаваемых половым путем (ИППП) во всем мире [5–9] .В США зарегистрированный уровень заболеваемости хламидийными ИППП в 4–5 раз выше, чем частота гонореи, и в 100 раз выше, чем частота сифилиса [9].
C. trachomatis изначально считался вирусом, потому что он настолько мал, что его инфекционность сохраняется после фильтрации через фильтры, используемые в то время для отделения вируса от бактерий [3]. Однако это бактерия, потому что она синтезирует собственные макромолекулы. Он принадлежит к относительно небольшой группе облигатных внутриклеточных прокариот. C. trachomatis реплицируется только внутри вакуоли, называемой включением, в цитоплазме клетки-хозяина (рис. 81.1). Эпителиальные клетки слизистой оболочки являются первичным типом клеток-мишеней in vivo. Для большинства штаммов C. trachomatis инфекция ограничивается слизистой оболочкой, хотя штаммы венерической лимфогранулемы (LGV) поражают глубокие лимфатические ткани.
Он принадлежит к относительно небольшой группе облигатных внутриклеточных прокариот. C. trachomatis реплицируется только внутри вакуоли, называемой включением, в цитоплазме клетки-хозяина (рис. 81.1). Эпителиальные клетки слизистой оболочки являются первичным типом клеток-мишеней in vivo. Для большинства штаммов C. trachomatis инфекция ограничивается слизистой оболочкой, хотя штаммы венерической лимфогранулемы (LGV) поражают глубокие лимфатические ткани.
Рисунок 81.1. C. trachomatis в клетках-хозяевах . Слева: иммуноокрашенное изображение C. trachomatis. клеток HeLa, инфицированных сероваром L2, были получены с 100-кратным увеличением.Хламидии, F-актин и ДНК окрашивались в зеленый, красный и цианидный синий соответственно. Справа: электронно-микроскопическое изображение клетки, инфицированной сероваром F. C. trachomatis . Масштабная полоса составляет 2 мкм.
(любезно предоставлено Wandy Beatty, PhD.) В целом, различные негематопоэтические клетки могут относительно эффективно поддерживать рост C. trachomatis in vitro. Конъюнктивальные клетки предпочитают глазные штаммы [10]. Клеточная линия карциномы шейки матки человека HeLa229 была наиболее распространенной клеточной моделью для изучения C.trachomatis . Клетки McCoy фибробластов мышей часто используются для диагностических целей и для увеличения запасов, поскольку они очень чувствительны к большинству генитальных штаммов, а суспензионные культуры L-клеток мышей могут быть удобно использованы для приготовления больших количеств организмов LGV [11–14]. Были постоянные попытки разработать физиологически более подходящие клеточные системы. Три линии эпителиальных клеток, выделенные из влагалищной, эктоцервикальной и эндоцервикальной областей женщин репродуктивного возраста [15], могут быть полезны для сравнительного анализа взаимодействия хозяин-хламидий в различных анатомических областях нижних половых путей [16].Линии эпителиальных клеток яйцевода мышей, созданные лабораторией Джонсона, были использованы для выявления ответов верхних отделов половых путей на хламидийную инфекцию [17].
trachomatis in vitro. Конъюнктивальные клетки предпочитают глазные штаммы [10]. Клеточная линия карциномы шейки матки человека HeLa229 была наиболее распространенной клеточной моделью для изучения C.trachomatis . Клетки McCoy фибробластов мышей часто используются для диагностических целей и для увеличения запасов, поскольку они очень чувствительны к большинству генитальных штаммов, а суспензионные культуры L-клеток мышей могут быть удобно использованы для приготовления больших количеств организмов LGV [11–14]. Были постоянные попытки разработать физиологически более подходящие клеточные системы. Три линии эпителиальных клеток, выделенные из влагалищной, эктоцервикальной и эндоцервикальной областей женщин репродуктивного возраста [15], могут быть полезны для сравнительного анализа взаимодействия хозяин-хламидий в различных анатомических областях нижних половых путей [16].Линии эпителиальных клеток яйцевода мышей, созданные лабораторией Джонсона, были использованы для выявления ответов верхних отделов половых путей на хламидийную инфекцию [17]. Исследовательская группа под руководством Вайрика создала различные клеточные модели, включая поляризованные и неполяризованные эпителиальные клетки влагалища, эндоцервикса и эндометрия, которые особенно полезны для изучения воздействия половых гормонов на C. trachomatis [18–22]. .
Исследовательская группа под руководством Вайрика создала различные клеточные модели, включая поляризованные и неполяризованные эпителиальные клетки влагалища, эндоцервикса и эндометрия, которые особенно полезны для изучения воздействия половых гормонов на C. trachomatis [18–22]. .
C. trachomatis существует в виде 15 сероваров (серотипов): A, B, Ba, C, D, E, F, G, H, I, J, K, L1, L2 и L3 (Таблица 81.1). Серотипирование хорошо коррелирует с четырьмя вариабельными доменами главного белка внешней мембраны (MOMP) [23–26]. 15 сероваров можно разделить на два патотипа. Глазной патотип, который включает серовары A – C, ответственен за трахому. Глазные штаммы редко выделяются из половых путей. При генитальном патотипе, вызывающем инфекции, передающиеся половым путем, серовары D – K поражают в основном слизистую оболочку; для сравнения, более инвазивные серовары L1 – L3 могут атаковать местные лимфатические узлы, приводя к LGV (Таблица 81.1). Инфекции, передаваемые половым путем C. trachomatis , также повышают риск заражения вирусом иммунодефицита человека [27,28]. Следует отметить, что в литературе серовары D – K вместе с сероварами A – C были сгруппированы в так называемый биовар трахомы. Однако эти две группы сероваров по-разному влияют на глаз. В то время как глазные серовары (A – C) вызывают хроническую глазную инфекцию, которая может привести к слепоте, генитальные серовары (D – K) вызывают только временную, самоограничивающуюся инфекцию слизистой оболочки конъюнктивы без серьезных осложнений.
trachomatis , также повышают риск заражения вирусом иммунодефицита человека [27,28]. Следует отметить, что в литературе серовары D – K вместе с сероварами A – C были сгруппированы в так называемый биовар трахомы. Однако эти две группы сероваров по-разному влияют на глаз. В то время как глазные серовары (A – C) вызывают хроническую глазную инфекцию, которая может привести к слепоте, генитальные серовары (D – K) вызывают только временную, самоограничивающуюся инфекцию слизистой оболочки конъюнктивы без серьезных осложнений.
Таблица 81.1. C. trachomatis Патотипы и серотипы
| Патотип | Серовары | Передача | Острое заболевание | Осложнения | |
|---|---|---|---|---|---|
| Глазной | A – C | Контакт, конъюнктивит | Контакт, конъюнктивит | Трахоматозный трихиаз, слепота | |
| Генитальный | D – K (без LGV) | Половой | Мужчина: уретрит, эпидидимит, проктит Женщина: уретрит, вагинит, цервицит, эндометрит, сальпингит | 66, | роды, выкидыш, воспалительные заболевания органов малого таза, бесплодие, внематочная беременность, реактивный артрит, приобретенный половым путем, рак (?) |
| Перинатальный | Детский конъюнктивит, пневмония | ? | |||
| L1, L2, L3 (LGV) | Половой | Генитальная язва, проктит, лимфоаденопатия | Венерическая лимфогранулема |
Хотя эта глава находится на C. trachomatis , необходимо упомянуть C. muridarum. Впервые выделенный от нормальной мыши, C. muridarum вызывает пневмонию у мышей, которым интраназально привиты [29], и был классифицирован как отдельный биовар C. trachomatis до конца прошлого тысячелетия [30] и продолжал оставаться часто упоминается в литературе как возбудитель пневмонита мышей C. trachomatis еще несколько лет в новом тысячелетии. C. muridarum имеет геном, который очень похож на геном C.trachomatis [31,32] и служил чрезвычайно полезным организмом для моделирования урогенитальной инфекции C. trachomatis у мышей [33–35].
trachomatis , необходимо упомянуть C. muridarum. Впервые выделенный от нормальной мыши, C. muridarum вызывает пневмонию у мышей, которым интраназально привиты [29], и был классифицирован как отдельный биовар C. trachomatis до конца прошлого тысячелетия [30] и продолжал оставаться часто упоминается в литературе как возбудитель пневмонита мышей C. trachomatis еще несколько лет в новом тысячелетии. C. muridarum имеет геном, который очень похож на геном C.trachomatis [31,32] и служил чрезвычайно полезным организмом для моделирования урогенитальной инфекции C. trachomatis у мышей [33–35].
Как и все хламидии, C. trachomatis имеет уникальный двухфазный цикл развития, который состоит из двух чередующихся клеточных форм: инфекционного неделящегося элементарного тельца (EB) и пролиферативного неинфекционного сетчатого тела (RB). В то время как EB имеет диаметр около 300 нм, но при электронной микроскопии показывает высокую электронную плотность (рис. 81.1) и имеет низкую плавучесть в градиенте диатризоат меглумин / диатризоат натрия, RB больше по размеру (300–400 нм в диаметре), имеет более низкую электронную плотность (рис. 81.1) и более высокую плавучесть [36]. Цикл развития инициируется прикреплением EB, который способен выживать во внеклеточной среде, к плазматической мембране клетки-хозяина (рис. 81.2). EB переносится клеткой-хозяином в вакуоль. Внутри вакуоли, которая обозначена как включение, EB дифференцируется в более крупную RB, которая размножается за счет бинарного деления и дифференцируется обратно в EB асинхронным образом.Цикл завершается после высвобождения внутриклеточных хламидий [37,38]. В то время как типичный цикл развития занимает около 2–3 дней, он может изменяться в ответ на иммунные реакции хозяина, лечение антибиотиками или другие неблагоприятные факторы, что приводит к стойкой инфекции. Устойчивое состояние характеризуется образованием аберрантных РБ, которое характеризуется расширением клеточного содержимого без деления.
81.1) и имеет низкую плавучесть в градиенте диатризоат меглумин / диатризоат натрия, RB больше по размеру (300–400 нм в диаметре), имеет более низкую электронную плотность (рис. 81.1) и более высокую плавучесть [36]. Цикл развития инициируется прикреплением EB, который способен выживать во внеклеточной среде, к плазматической мембране клетки-хозяина (рис. 81.2). EB переносится клеткой-хозяином в вакуоль. Внутри вакуоли, которая обозначена как включение, EB дифференцируется в более крупную RB, которая размножается за счет бинарного деления и дифференцируется обратно в EB асинхронным образом.Цикл завершается после высвобождения внутриклеточных хламидий [37,38]. В то время как типичный цикл развития занимает около 2–3 дней, он может изменяться в ответ на иммунные реакции хозяина, лечение антибиотиками или другие неблагоприятные факторы, что приводит к стойкой инфекции. Устойчивое состояние характеризуется образованием аберрантных РБ, которое характеризуется расширением клеточного содержимого без деления.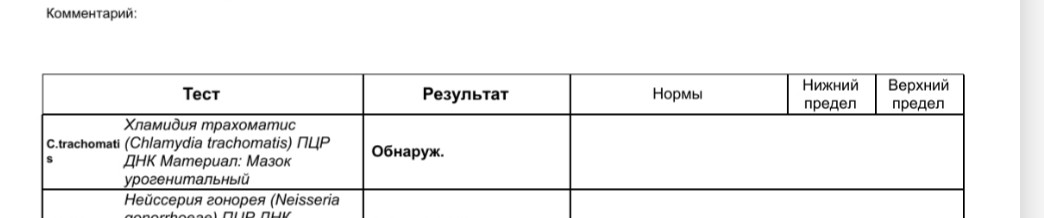 Аберрантные RBs могут превращаться обратно в нормальные RBs и повторно входить в регулярный цикл развития, чтобы продуцировать инфекционные EB после восстановления условий, благоприятствующих делению клеток [39–41].
Аберрантные RBs могут превращаться обратно в нормальные RBs и повторно входить в регулярный цикл развития, чтобы продуцировать инфекционные EB после восстановления условий, благоприятствующих делению клеток [39–41].
Рисунок 81.2. Схематическое изображение цикла развития C. trachomatis . Красные и зеленые кружки обозначают EB и RB соответственно.
Влияние на параметры спермы и маркеры апоптоза сперматозоидов
Abstract
Это исследование было предпринято для определения распространенности Chlamydia trachomatis , Mycoplasmas и Ureaplasmas в образцах спермы партнеров мужского пола бесплодных пар, а также для изучения того, может ли Chlamydiapermatozois Chlamydia trachomatis инициироваться апоптозом человека . .В исследование были включены в общей сложности 85 мужчин-партнеров бесплодных пар, прошедших рутинный анализ спермы в соответствии с рекомендациями Всемирной организации здравоохранения.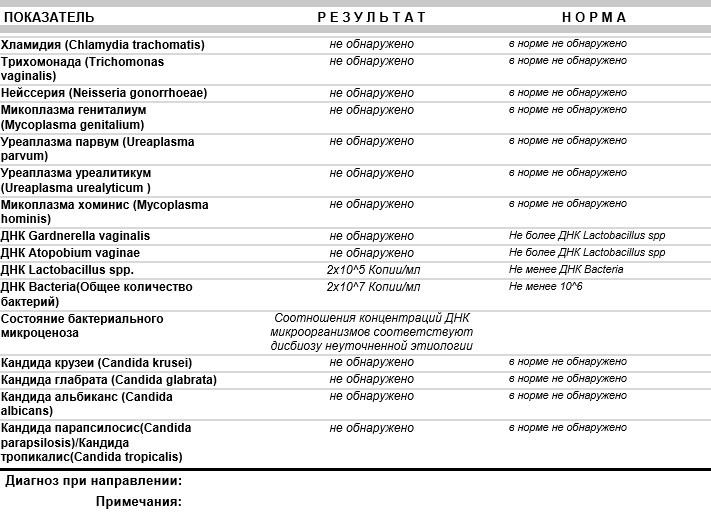 Образцы были исследованы на наличие Chlamydia trachomatis , Neisseria gonorrhoeae , Mycoplasma hominis , Mycoplasma genitalium , Ureaplasma urealyticum Ras и ma по методу Real-PClasma. Образцы спермы анализировали на наличие апоптотических маркеров (фрагментация ДНК сперматозоидов, уровни активированной каспазы 3, потенциал митохондриальной мембраны (ΔΨm)) с помощью проточной цитометрии. C. trachomatis , N. gonorrhoeae , U. urealyticum , M genitalium были обнаружены в образцах спермы 13 (15,2%), 5 (5,8%), 5 (5,8%) и 3 (3,5%) ) партнеры-мужчины бесплодных пар соответственно. M. hominis и U. parvum были обнаружены в семенной пробе только у одного пациента (1,1%). Сперма бесплодных мужчин с положительным результатом на C. trachomatis показала более низкое среднее количество сперматозоидов и более низкую быстро прогрессирующую подвижность (категория [a]) сперматозоидов по сравнению с неинфицированными мужчинами со статистической значимостью ( p = 0.
Образцы были исследованы на наличие Chlamydia trachomatis , Neisseria gonorrhoeae , Mycoplasma hominis , Mycoplasma genitalium , Ureaplasma urealyticum Ras и ma по методу Real-PClasma. Образцы спермы анализировали на наличие апоптотических маркеров (фрагментация ДНК сперматозоидов, уровни активированной каспазы 3, потенциал митохондриальной мембраны (ΔΨm)) с помощью проточной цитометрии. C. trachomatis , N. gonorrhoeae , U. urealyticum , M genitalium были обнаружены в образцах спермы 13 (15,2%), 5 (5,8%), 5 (5,8%) и 3 (3,5%) ) партнеры-мужчины бесплодных пар соответственно. M. hominis и U. parvum были обнаружены в семенной пробе только у одного пациента (1,1%). Сперма бесплодных мужчин с положительным результатом на C. trachomatis показала более низкое среднее количество сперматозоидов и более низкую быстро прогрессирующую подвижность (категория [a]) сперматозоидов по сравнению с неинфицированными мужчинами со статистической значимостью ( p = 0. 02 и p = 0,04 соответственно). Анализ проточной цитометрии продемонстрировал значительное увеличение средней скорости семени с низким ΔΨm и активацией каспазы 3 у бесплодных мужчин, положительных на C. trachomatis , по сравнению с неинфицированными мужчинами ( p = 0,006 и p = 0,001, соответственно). Фрагментация ДНК также была увеличена в сперме бесплодных мужчин, положительных на C. trachomatis , по сравнению с неинфицированными мужчинами, но без статистической значимости ( p = 0.62). Инфекция хламидий была связана с потерей ΔΨm и активацией каспазы 3. Таким образом, C . trachomatis Инфекция может быть инкриминирована индукцией апоптоза сперматозоидов. Эти эффекты могут объяснить негативное прямое влияние инфекции C. trachomatis на способность к оплодотворению сперматозоидов.
02 и p = 0,04 соответственно). Анализ проточной цитометрии продемонстрировал значительное увеличение средней скорости семени с низким ΔΨm и активацией каспазы 3 у бесплодных мужчин, положительных на C. trachomatis , по сравнению с неинфицированными мужчинами ( p = 0,006 и p = 0,001, соответственно). Фрагментация ДНК также была увеличена в сперме бесплодных мужчин, положительных на C. trachomatis , по сравнению с неинфицированными мужчинами, но без статистической значимости ( p = 0.62). Инфекция хламидий была связана с потерей ΔΨm и активацией каспазы 3. Таким образом, C . trachomatis Инфекция может быть инкриминирована индукцией апоптоза сперматозоидов. Эти эффекты могут объяснить негативное прямое влияние инфекции C. trachomatis на способность к оплодотворению сперматозоидов.
Образец цитирования: Sellami H, Znazen A, Sellami A, Mnif H, Louati N, Zarrouk SB, et al. (2014) Молекулярное обнаружение Chlamydia trachomatis и других бактерий, передающихся половым путем, в сперме мужчин-партнеров бесплодных пар в Тунисе: влияние на параметры спермы и маркеры апоптоза сперматозоидов.PLoS ONE 9 (7):
e98903.
https://doi.org/10.1371/journal.pone.0098903
(2014) Молекулярное обнаружение Chlamydia trachomatis и других бактерий, передающихся половым путем, в сперме мужчин-партнеров бесплодных пар в Тунисе: влияние на параметры спермы и маркеры апоптоза сперматозоидов.PLoS ONE 9 (7):
e98903.
https://doi.org/10.1371/journal.pone.0098903
Редактор: Анил Кумар, Университет Миссури, Канзас-Сити, Соединенные Штаты Америки
Поступило: 7 марта 2014 г .; Одобрена: 8 мая 2014 г .; Опубликовано: 14 июля 2014 г.
Авторские права: © 2014 Sellami et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Работа финансировалась исследовательской лабораторией «MPH» Университетской больницы им.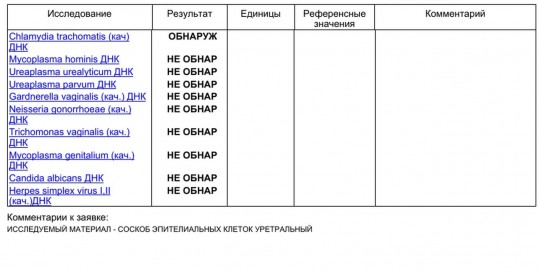 Хабиба Бургибы в Сфаксе, Тунис. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Хабиба Бургибы в Сфаксе, Тунис. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Конкурирующие интересы отсутствуют.
Введение
Инфекции, передаваемые половым путем, вызывают серьезную озабоченность исследователей и врачей в области репродуктивной медицины.По оценкам, 15% мужского бесплодия связано с инфекциями половых путей [1]. У мужчин могут быть субклинические инфекции половых путей в течение продолжительных периодов времени, и несколько возбудителей инфекций, передаваемых половым путем, например, C. trachomatis , были обнаружены в семенной жидкости бессимптомных мужчин [2]. Согласно отчету Всемирной организации здравоохранения (ВОЗ) [3], C. trachomatis вызывает наиболее распространенную во всем мире бактериальную инфекцию, передаваемую половым путем, от которой страдают более 90 миллионов человек, и в течение некоторого времени было известно, что она оказывает значительное влияние на репродукция человека [4]. Роль инфекции C. trachomatis в мужском бесплодии противоречива [5] — [6]. В ряде исследований специально изучалась взаимосвязь между инфекцией Chlamydial и качеством спермы. В то время как некоторые авторы показали, что инфекция C. trachomatis связана с плохим качеством спермы [7] — [8], другие утверждали, что это не так [9] — [10]. В некоторых сообщениях указано, что инфекция C. trachomatis связана с уменьшением концентрации и подвижности сперматозоидов, а также с изменением pH спермы и уменьшением объема эякулята [11], [12], [13] — [14].Напротив, другие исследования не выявили связи между инфекцией C. trachomatis мужских половых путей и изменением качества спермы [9], [15], [16], [17], [18], [19], [20]. ] — [21]. Таким образом, имеющиеся данные противоречивы и по-прежнему не позволяют установить четкую взаимосвязь между инфекцией C. trachomatis и качеством спермы.
Роль инфекции C. trachomatis в мужском бесплодии противоречива [5] — [6]. В ряде исследований специально изучалась взаимосвязь между инфекцией Chlamydial и качеством спермы. В то время как некоторые авторы показали, что инфекция C. trachomatis связана с плохим качеством спермы [7] — [8], другие утверждали, что это не так [9] — [10]. В некоторых сообщениях указано, что инфекция C. trachomatis связана с уменьшением концентрации и подвижности сперматозоидов, а также с изменением pH спермы и уменьшением объема эякулята [11], [12], [13] — [14].Напротив, другие исследования не выявили связи между инфекцией C. trachomatis мужских половых путей и изменением качества спермы [9], [15], [16], [17], [18], [19], [20]. ] — [21]. Таким образом, имеющиеся данные противоречивы и по-прежнему не позволяют установить четкую взаимосвязь между инфекцией C. trachomatis и качеством спермы.
Апоптотический способ гибели клеток — это активный и определенный процесс, который играет важную роль в развитии многоклеточных организмов, а также в регуляции и поддержании клеточных популяций в тканях при физиологических и патологических состояниях [22]. Маркеры апоптоза, характерные для соматических клеток, были отмечены в сперматозоидах человека в нескольких исследованиях. Они включают, в основном, экстернализацию фосфатидилсерина (PS) через плазматическую мембрану и фрагментацию ДНК. Такие маркеры чаще наблюдаются в эякулятах бесплодных мужчин по сравнению с фертильными контрольными [23] — [24]. Кроме того, ключевые компоненты путей апоптоза соматических клеток, такие как присутствие и активация каспаз, были описаны в очищенных популяциях эякулированных сперматозоидов из фракций с высокой и низкой подвижностью [24] — [25].Более того, митохондрии играют важную роль в контроле апоптоза [26]. Marchetti и др. (2002) продемонстрировали, что анализ ΔΨm является чувствительным тестом для определения качества сперматозоидов по сравнению с анализом основных параметров сперматозоидов, образования активных форм кислорода и наличия фрагментации ДНК [27]. Несколько исследований in vitro и in vivo пытались установить взаимосвязь между маркерами апоптоза в сперматозоидах и хламидийной инфекцией .
Маркеры апоптоза, характерные для соматических клеток, были отмечены в сперматозоидах человека в нескольких исследованиях. Они включают, в основном, экстернализацию фосфатидилсерина (PS) через плазматическую мембрану и фрагментацию ДНК. Такие маркеры чаще наблюдаются в эякулятах бесплодных мужчин по сравнению с фертильными контрольными [23] — [24]. Кроме того, ключевые компоненты путей апоптоза соматических клеток, такие как присутствие и активация каспаз, были описаны в очищенных популяциях эякулированных сперматозоидов из фракций с высокой и низкой подвижностью [24] — [25].Более того, митохондрии играют важную роль в контроле апоптоза [26]. Marchetti и др. (2002) продемонстрировали, что анализ ΔΨm является чувствительным тестом для определения качества сперматозоидов по сравнению с анализом основных параметров сперматозоидов, образования активных форм кислорода и наличия фрагментации ДНК [27]. Несколько исследований in vitro и in vivo пытались установить взаимосвязь между маркерами апоптоза в сперматозоидах и хламидийной инфекцией . In vitro, некоторые авторы продемонстрировали, что C. trachomatis может взаимодействовать со сперматозоидами, влияя на их функцию и вызывая апоптоз [28], [29] — [30]. Апоптоз человеческого сперматозоида может быть вызван инкубацией in vitro человеческих сперматозоидов с Chlamydial LPS, который обладает спермицидной активностью в 550 раз выше, чем Escherichia coli LPS [31] — [32]. Кроме того, серовар E C. trachomatis может прикрепляться к человеческим сперматозоидам и влиять на их функцию, что приводит к преждевременной емкостности [33].Было показано, что Chlamydial LPS взаимодействуют с CD14 на поверхности сперматозоидов, что приводит к увеличению продукции активных форм кислорода и приводит к каспазо-опосредованному апоптозу [29]. Несмотря на все эти исследований in vitro , четкая связь между C. trachomatis и повреждением сперматозоидов еще не подтверждена исследованиями in vivo . Gallegos и др. (2008) сообщили, что пациенты с инфекциями мочеполовых органов, вызванными C. trachomatis и Mycoplasmas , имеют повышенную фрагментацию ДНК сперматозоидов по сравнению с контрольной фертильной группой [34].Наконец, мы показали, что инокуляция фертильных самцов мышей Swiss в проходной канал уретры с C. trachomatis может привести к изменению параметров спермы, индукции апоптоза в сперматозоидах и снижению репродуктивной способности самцов мышей [35]. Взятые вместе, эти данные подтверждают роль C. trachomatis в индукции апоптоза сперматозоидов. Однако большинство исследований показывают, что механизм индукции апоптоза неизвестен.
In vitro, некоторые авторы продемонстрировали, что C. trachomatis может взаимодействовать со сперматозоидами, влияя на их функцию и вызывая апоптоз [28], [29] — [30]. Апоптоз человеческого сперматозоида может быть вызван инкубацией in vitro человеческих сперматозоидов с Chlamydial LPS, который обладает спермицидной активностью в 550 раз выше, чем Escherichia coli LPS [31] — [32]. Кроме того, серовар E C. trachomatis может прикрепляться к человеческим сперматозоидам и влиять на их функцию, что приводит к преждевременной емкостности [33].Было показано, что Chlamydial LPS взаимодействуют с CD14 на поверхности сперматозоидов, что приводит к увеличению продукции активных форм кислорода и приводит к каспазо-опосредованному апоптозу [29]. Несмотря на все эти исследований in vitro , четкая связь между C. trachomatis и повреждением сперматозоидов еще не подтверждена исследованиями in vivo . Gallegos и др. (2008) сообщили, что пациенты с инфекциями мочеполовых органов, вызванными C. trachomatis и Mycoplasmas , имеют повышенную фрагментацию ДНК сперматозоидов по сравнению с контрольной фертильной группой [34].Наконец, мы показали, что инокуляция фертильных самцов мышей Swiss в проходной канал уретры с C. trachomatis может привести к изменению параметров спермы, индукции апоптоза в сперматозоидах и снижению репродуктивной способности самцов мышей [35]. Взятые вместе, эти данные подтверждают роль C. trachomatis в индукции апоптоза сперматозоидов. Однако большинство исследований показывают, что механизм индукции апоптоза неизвестен.
В настоящем исследовании мы стремились определить распространенность C.trachomatis , Mycoplasmas и Ureaplasmas в образцах спермы мужчин-партнеров бесплодных пар и в основном для исследования того, может ли C. trachomatis инициировать апоптоз в сперматозоидах человека.
Материалы и методы
Субъекты
Всего для исследования было отобрано 85 бесплодных мужчин, посещающих клиники акушерства и гинекологии в Сфаксе (юг Туниса) для диагностического анализа спермы. Все мужчины проходили анализ спермы в рамках обследования на бесплодие после того, как не смогли забеременеть со своим партнером после одного года незащищенного полового акта.Средняя продолжительность бесплодия составляла 4 года (диапазон 1–15). Средний возраст пациентов составил 36,7 года (от 23 до 57 лет). Это исследование было одобрено нашим институциональным наблюдательным советом «Комитетом по этике больниц Университета Хабиба Бургибы» под номером 8–12. Все субъекты подписали письменное информированное согласие. Форма согласия также была одобрена нашим этическим комитетом
Семинологические переменные спермы
Перед анализом спермы мужчин просили воздерживаться от половых сношений или мастурбации в течение 3-5 дней перед посещением клиники.Все образцы для анализа были собраны на месте и собраны в стандартные контейнеры, которые, как ранее было доказано, не обладают цитотоксическим действием на сперматозоиды человека в соответствии с методами, описанными ВОЗ. Сразу после получения спермы образцы помещали в инкубатор и разжижали при 37 ° C в течение 30 минут перед анализом. Анализ спермы проводился в соответствии с критериями ВОЗ [36] для определения следующих переменных: концентрация сперматозоидов, жизнеспособность, общая прогрессивная подвижность (категория [a + b]), быстрая прогрессивная подвижность (категория [a]), окрашивание пероксидазой, практическое и надежный метод, рекомендованный ВОЗ [36] для определения лейкоцитов в сперме, был использован для подсчета и дифференциации лейкоцитов (лейкоцитов) от незрелых половых клеток.На лейкоцитоспермию указывает концентрация лейкоцитов ≥10 6 / мл.
Анализ спермиокультуры
Образцыколичественно высевали с помощью калиброванной петли на чашки с агаром: кровяной агар, шоколадный агар с изовиталексом (1%), инкубировали в 5% CO2 при 37 ° C в течение 48 часов. Микроорганизмы идентифицировали с помощью систем окрашивания по Граму и Bio-Mérieux Api (Bio-Mérieux, Marcy l’Etoile, Франция).
Спермиокультуры считались положительными, когда количество колоний составляло ≥10 4 КОЕ мл -1 в случае грамположительных кокков и ≥10 5 КОЕ мл -1 в случае грамотрицательных палочек.
Количественное определение бактерий в образцах спермы методом КПЦР
Для каждого пациента мужского пола использовали 200 мкл образцов спермы для количественного определения бактерий с помощью ПЦР в реальном времени.
Экстракция ДНК методом бромида цетилтриметиламмония (CTAB) -фенол-хлороформ / изоамиловый спирт.
Осадки из каждых 200 мкл образцов спермы собирали центрифугированием при 14000 g в течение 20 минут. Осадки обрабатывали 5 мкл протеиназы K (20 мг / мл) при 55 ° C в течение 2 ч в 600 мкл буфера для разложения (30 мкл 10% додецилсульфата натрия и 570 мкл буфера TE [10 мМ Tris-HC1 (pH: 8), 1 мМ EDTA]).
После гомогенизации образцы инкубировали в растворе CTAB-NaCl (100 мкл 5 M NaCl и 80 мкл 10% CTAB) в течение 10 минут при 65 ° C, а затем смешивали с 750 мкл хлороформ-изоамилового спирта ( 24∶1 [об. / Об.]) И центрифугировали в течение 15 минут при 14000 g на центрифуге Eppendorf. Водную фазу отделяли, смешивали с 750 мкл смеси фенол хлороформ / изоамиловый спирт (25 ± 24 ± 1 [об. / Об. / Об.]) И центрифугировали в течение 15 минут при 14000 g на центрифуге Eppendorf. Полученную водную фазу смешивали с равным объемом изопропанола.
Образцы оставляли при -80 ° C на 1 час, а затем центрифугировали в течение 15 минут при 14000 g. Осадок ДНК один раз промывали 70% этанолом, сушили на воздухе и растворяли в конечном объеме 100 мкл буфера ТЕ.
Праймеры и зонды для Qpcr.
Первоначально экстрагированная ДНК была протестирована на ген β-глобина человека, чтобы убедиться, что в образцах нет ингибиторов ПЦР. Праймеры β-GPCO (5′-ACACAACTGTGTTCACTAGC-3 ‘) и β-GPCPO (5′-GAAACCCAAGAGTCTTCTCT-3’) использовали для амплификации фрагмента гена β-глобина человека длиной 209 п.н. [37].Образцы, которые оказались отрицательными с помощью ПЦР на β-глобин, были повторно протестированы после 10-кратного разведения в дистиллированной воде. Затем образцы, показавшие положительный результат по β-глобину, исследовали для количественного определения бактерий с помощью ПЦР в реальном времени.
Анализ ПЦР в реальном времени выполняли на циклере для ПЦР в реальном времени CFX96 ™ (Biorad, США) в конечном объеме 20 мкл с Ex Taq Premix Tli RNaseH Plus (Takara, Япония). Пару праймеров и меченый зонд в формате TaqMan использовали для амплификации: 149 п.н. области Cryptic плазмиды для C.trachomatis, 80 п.н. области MgPa гена адгезина для M. genitalium, область 101 п.н. гена, кодирующего 16 S рРНК для M. hominis, область 101 п.н. псевдогена Por A для N. gonorrhoeae и 146 п.н. гена уреазы U. parvum и U. urealyticum.
ПЦР в реальном времени включала начальную денатурацию при 95 ° C в течение 2 минут, затем 40 циклов при 95 ° C в течение 30 секунд и температуру отжига в соответствии с микроорганизмами в течение 30 секунд ( C. trachomatis 60 ° C, M. genitalium , M. hominis и N.gonorrhoeae 55 ° C, U. parvum и U. urealyticum 50 ° C).
Во всех экспериментах каждый запуск ПЦР включал отрицательный контроль экстракции (стерильная вода) и отрицательный контроль ПЦР, содержащий 5 мкл обработанного диэтилпирокарбонатом (DEPC) h3O вместо экстракта ДНК, для обнаружения любых возможных загрязняющих ДНК. Образцы и контроли были проанализированы в двух экземплярах.
Положительный контроль рекомбинантной плазмиды.
Для облегчения количественного определения бактерий была сконструирована плазмида, содержащая целевой ген для всех бактерий.
ДНК было выделено из C. trachomatis , N. gonorrhoeae , M. genitalium , M. hominis , U. parvum и U. urealyticum эталонных штаммов и целевой последовательности для всех выбранных генов. для ПЦР в реальном времени амплифицировали с теми же праймерами, что и в (Таблица 1).
Последние 25 мкл реакционной смеси содержали 1X буфер для ПЦР (Promega, Лион, Франция), 0,2 мМ каждый праймер, 0,2 мМ каждый dNTP, 2,5 мМ MgCl 2 , 1.ДНК-полимераза 25 U Go Taq (Promega) и 5 мкл экстракта ДНК. ПЦР выполняли в системе Gene-Amp PCR System 9700 (Applied Biosystems, Фостер-Сити, Калифорния) в соответствии со следующей процедурой: 4 мин при 95 ° C, 35 циклов при 95 ° C в течение 30 с, 55 ° C в течение 1 мин, 72 ° C в течение 20 мин. Затем продукты ПЦР очищали с помощью набора для экстракции гелей QIAquick (Qiagen) и клонировали в вектор с использованием набора для клонирования (вектор pGEM-T; Promega, Мэдисон, Висконсин, США) в соответствии с инструкциями производителя. Выделение рекомбинантной плазмидной ДНК выполняли с использованием набора QIAprepSpin Miniprep (Qiagen), и наличие правильной вставки подтверждали секвенированием с использованием коммерческого BigDye Terminator v3.1 комплект (Applied Biosystems) на секвенсоре 3730XL (Applied Biosystems). Полученные последовательности обрабатывали генетическим анализатором ABI 3100 и сравнивали с последовательностями, доступными в GenBank, с помощью сервера BLAST с веб-сайта NCBI (http://www.ncbi.nlm.nih.gov/BLAST). Затем плазмиды линеаризовали и количественно определяли с помощью спектрофотометра NanoDrop ND-1000. Число копий клонированного гена рассчитывали с использованием следующего уравнения, описанного в [38], для получения стандартов в диапазоне от 1 до 10 6 молекул и хранили при -20 ° C.
Оценка жизнеспособности сперматозоидов с использованием красителя 7-аминоактиномицин-D
Процент мертвых клеток сперматозоидов (клеток с положительным 7-AAD) и жизнеспособных клеток сперматозоидов (клеток с отрицательным 7-AAD) оценивали с использованием красителя 7-AAD. 7-AAD проникает только в мертвые клетки. Из каждого образца спермы 1 мл раствора спермы в PBS, содержащего 2 × 10 6 клеток / мл, окрашивали 10 мкл 7-аминоактиномицина-D (7-AAD) (Immunotech, Beckman Coulter Company, Марсель. -Франция). Образцы инкубировали в темноте при комнатной температуре в течение 20 минут перед анализом проточной цитометрии.После периода инкубации добавляли 1 мл PBS и образец анализировали с помощью проточной цитометрии.
Оценка потенциала митохондриальной мембраны (ΔΨm)
JC-1 обладает уникальной способностью по-разному маркировать митохондрии с низким и высоким ΔΨm. В митохондриях с высоким ΔΨm JC-1 образует мультимерные агрегаты, которые излучают оранжевую длину волны 590 нм при возбуждении на 488 нм. В митохондриях с низким ΔΨm JC-1 образует мономеры; эти мономеры излучают в зеленой длине волны (525–530 нм) при возбуждении на 488 нм.
ΔΨm анализировали с использованием набора MitoProbe JC-1 Assay kit (Molecular Probes, Юджин, Орегон). Для окрашивания готовили 2 мкМ маточный раствор JC-1 в диметилсульфоксиде (ДМСО). Из каждого образца спермы 1 мл раствора спермы в PBS, содержащего 2 × 10 6 клеток / мл, окрашивали 10 мкл исходного раствора JC-1. Образцы инкубировали при 37 ° C в темноте в течение 20 минут перед анализом проточной цитометрии. Таким образом было идентифицировано 2 субпопуляции сперматозоидов:
- Представлены сперматозоиды с высоким ΔΨm (оранжевая флуоресценция).
- Представлены сперматозоиды с низкой ΔΨm (зеленая флуоресценция).
Согласно протоколу, чтобы подтвердить чувствительность JC-1 к изменениям мембранного потенциала, карбонилцианид-3-хлорфенилгидразон (CCCP = конечная концентрация 50 мкМ) был использован в качестве разрушителя мембранного потенциала (отрицательный контроль).
Проточно-цитометрическое определение активированной каспазы 3
Уровни активированной каспазы 3 были обнаружены в сперматозоидах с использованием флуоресцеин-меченного ингибитора каспаз (FLICA), который проницаем для клеток, не цитотоксичен и ковалентно связывается с активной каспазой 3.Ингибитор использовали с соответствующими контролями в соответствии с инструкциями к набору, предоставленными производителем (набор для обнаружения апоптоза Carboxyfluorescein FLICA, AbCys, Франция). Вкратце, 3,10 6 сперматозоидов ресуспендировали в 300 мкл PBS. 150-кратный исходный раствор ингибитора готовили растворением лиофилизированного ингибитора каспазы в 50 мкл диметилсульфоксида (ДМСО) и дополнительно разбавляли 1-5 в PBS с получением 30-кратного рабочего раствора (на аликвоту: 2 мкл основной раствор плюс 8 мкл PBS).Все тестовые аликвоты и контроли (с 300 мкл PBS) инкубировали при 37 ° C в темноте в течение 1 ч с 10 мкл рабочего раствора. Затем образцы спермы промывали, ресуспендировали в 400 мкл промывочного буфера и хранили во льду до анализа проточной цитометрии.
Отрицательный контроль (образец с 300 мкл PBS) и положительный контроль (образец, обработанный 10 мкМ H 2 O 2 в течение 1 часа при 37 ° C) использовали во всех экспериментах.
TUNEL анализ
Для оценки фрагментации ДНК использовали коммерческий набор (In situ Cell Death Detection Kit, Fluorescein, Takara, Japan), основанный на ферментативной реакции мечения свободных 3′-ОН-концов.Вкратце, 3,10 6 клеток промывали фосфатно-солевым буфером (1xPBS, pH 7,4), затем фиксировали 200 мкл 4% параформальдегида в течение 1 ч при комнатной температуре в темноте. После отделения сперматозоиды промывали 1xPBS и повышали проницаемость с использованием 0,1% Triton X-100 в 0,1% цитрате натрия в течение 15 минут на льду. После промывания PBS ДНК сперматозоидов метили путем инкубации сперматозоидов с 50 мкл реакционной смеси TUNEL (фермент Tdt и нуклеотиды, меченные FITC) во влажной атмосфере в течение 60 минут при 37 ° C в темноте, при перемешивании каждые 15 минут.Затем промытые и меченые сперматозоиды ресуспендировали в 1xPBS для анализа проточной цитометрии. Отрицательный контроль (образец без добавления фермента Tdt) и положительный контроль (образец, обработанный ДНКазой I (3 Ед / мл, Invitrogen) в течение 10 минут при комнатной температуре для образования разрывов цепи ДНК) также оценивали с помощью анализа TUNEL.
Проточная цитометрия и анализ данных
Проточный цитометрический анализ выполняли с использованием проточного цитометра EPICS XL (Beckman Coulter), оснащенного аргон-ионным лазером мощностью 15 мВт для возбуждения при 488 нм.Было проанализировано не менее 10 000 событий на выборку. Данные по светорассеянию и флуоресценции были получены при гибкой настройке коэффициента усиления в логарифмическом режиме. Обломки были исключены путем создания области вокруг интересующей популяции на основе характеристик светорассеяния (прямое угловое рассеяние света (FSC) по сравнению с боковым угловым рассеянием света (SSC). Процент меченых сперматозоидов охарактеризовали путем идентификации области которые включали> 90% событий в частотной гистограмме положительных контролей как при оценке жизнеспособности, ΔΨm, активации каспазы 3, так и фрагментации ДНК.Данные были выражены как процент окрашенных клеток по гистограммам с использованием программного обеспечения System II. Типичные примеры гистограмм, полученных с помощью проточной цитометрии для обнаружения флуоресценции, показаны на рисунке 1 (жизнеспособность сперматозоидов), рисунке 2 (ΔΨm), рисунке 3 (активация каспазы 3) и рисунке 4 (анализ TUNEL).
Рисунок 1. Проточная цитометрия жизнеспособности сперматозоидов с использованием красителя 7-аминоактиномицин-D.
Гистограммы показывают: ( A ) Отрицательный контроль с 10% положительных по 7-AAD клеток. ( B ) Положительный контроль с 98.5% 7-AAD положительных клеток. ( C ) Образец спермы одного мужчины-партнера бесплодных пар, положительный по кПЦР C. trachomatis с 56,5% 7-AAD-отрицательных клеток и 43,5% 7-AAD-положительных клеток. B: окно настроено для определения процента клеток с положительным 7-AAD.
https://doi.org/10.1371/journal.pone.0098903.g001
Рисунок 2. Проточная цитометрия изменений потенциала митохондриальной мембраны (ΔΨm).
Гистограммы показывают: ( A ) Отрицательный контроль с 95.8% ячеек с низким ΔΨm. ( B ) Положительный контроль с 9,6% клеток с низким ΔΨm. ( C ) Образец спермы одного мужчины-партнера бесплодных пар, положительный по кПЦР C. trachomatis с 32,5% клеток с низким ΔΨm и 67,5% с клетками с высоким ΔΨm. C: окно настроено для определения процента ячеек с низким ΔΨm.
https://doi.org/10.1371/journal.pone.0098903.g002
Рис. 3. Гистограммы обнаружения каспазы 3 проточной цитометрией.
( A ) Отрицательный контроль с 0.85% клеток, меченных FITC. ( B ) Положительный контроль с 95,8% клеток, меченных FITC. ( C ) Образец спермы одного мужчины-партнера бесплодных пар, положительный по кПЦР C. trachomatis с 32,5% клеток, меченных FITC. D: окно настроено для определения процента клеток, демонстрирующих активацию каспазы 3.
https://doi.org/10.1371/journal.pone.0098903.g003
Рис. 4. Анализ сперматозоидов, опосредованный TdT (терминальная дезоксинуклеотидилтрансфераза) dUTP, мечение по нику (TUNEL).
Гистограммы показывают: ( A ) отрицательный контроль с 2,35% TUNEL-положительных клеток. ( B ) Положительный контроль (сперматозоиды, обработанные ДНКазой) с 90,5% TUNEL-положительных клеток. ( C ) Образец спермы одного мужчины-партнера бесплодных пар, положительный на C. trachomatis КПЦР с 20,5% TUNEL-положительных клеток. B: окно настроено для определения процента TUNEL-положительных клеток.
https://doi.org/10.1371/journal.pone.0098903.g004
Статистический анализ
SPSS 18.0 (SPSS Inc, Чикаго, Иллинойс) использовали для статистического анализа. Для сравнения частот использовался тест χ 2 . Непараметрический тест (Mann-Whitney) из программного обеспечения SPSS использовался для сравнения параметров распределения сперматозоидов и данных проточной цитометрии инфицированных и неинфицированных мужчин. Корреляцию между средними значениями параметров спермы, ΔΨm, фрагментацией ДНК и активацией каспазы 3 и инфекцией C. trachomatis оценивали с помощью Т-теста. Все тесты считались статистически значимыми при p <0.05.
Результаты
Анализ спермиокультуры
Анализ спермиокультуры был положительным в 6 случаях (7%). Группа B Streptococcus (GBS) был обнаружен в 3 образцах (3,5%), Enterococcus spp в 1 образце (1,1%), Staphylococcus aureus в 1 образце (1,1%) и Corynebacterium spp в 1 образце ( 1,1%).
Частота урогенитальных бактерий в образцах спермы с использованием количественной ПЦР
Среди 85 образцов спермы 13 (15,2%) были положительными на C.trachomatis и 5 (5,8%) для N. gonorrhoeae . U. urealyticum, M. genitalium, U. parvum и M. hominis были обнаружены у 5 пациентов (5,8%), 3 пациентов (3,5%), 1 пациента (1,1%) и 1 пациента (1,1%) соответственно. Распределение обнаруженных видов среди пациентов показано в таблице 2.
C. trachomatis Инфекция и качество спермыСредние значения (± SD) параметров спермы 85 включенных пациентов показаны в таблице 3. Жизнеспособность сперматозоидов и общая подвижность сперматозоидов у мужчин-партнеров бесплодных пар с C.trachomatis в образцах спермы были ниже, но незначительно, чем у неинфицированных партнеров-мужчин (71,3% против 73,3%, p = 0,65 и 41,1% против 43,9%, p = 0,39, соответственно) (Таблица 3). Концентрация сперматозоидов и быстро прогрессирующая подвижность (категория a) сперматозоидов в ДНК-положительной сперме C. trachomatis были значительно ниже, чем у неинфицированной спермы (41,4 × 10 6 / мл против 84,4 × 10 6 / мл, p = 0,02 и 8.8% против 12,6%, p = 0,04 соответственно) (Таблица 3). Количество лейкоцитов у мужчин-партнеров бесплодных пар с ДНК C. trachomatis в образцах спермы было выше, но незначительно, чем в неинфицированной сперме (0,8 × 10 6 / мл против 0,4 × 10 6 / мл, p = 0,36) (таблица 3).
Жизнеспособность сперматозоидов с использованием красителя 7-аминоактиномицин-D
На рис.1 представлены гистограммы частотного распределения отрицательного контроля (рис. 1А), положительного контроля (рис.1B), и одна сперма партнеров-мужчин бесплодных пар положительна на C. trachomatis qPCR (рис. 1C). Процент жизнеспособных сперматозоидов (клеток с 7-AAD-отрицательными) оценивали в образцах спермы мужчин-партнеров бесплодных пар, положительных на C. trachomatis qPCR, и неинфицированных мужчин. Средняя доля жизнеспособных сперматозоидов (± стандартное отклонение) у неинфицированных пациентов составила 63,2 ± 13,9%, в то время как она снизилась до 51,3 ± 21,13% у пациентов, положительных по C . trachomatis КПЦР со статистически значимой разницей ( p = 0.014) (таблица 4).
Потенциал митохондриальной мембраны (ΔΨm)
Анализ состояния митохондриального дыхания в сперматозоидах человека оценивали с помощью JC-1 для определения ΔΨm, как показано на рисунке 2. Результаты проточной цитометрии выражены как процент сперматозоидов с низким ΔΨm (зеленая флуоресценция). На рис. 2 представлены гистограммы частотного распределения отрицательного контроля (рис. 2А), положительного контроля (рис. 2Б) и одной спермы партнеров-мужчин бесплодных пар, положительных на C.trachomatis КПЦР (рис. 2С). Средний процент сперматозоидов с низким ΔΨm (± SD) был выше у партнеров-мужчин из бесплодных пар, положительных на C. trachomatis кПЦР, чем у неинфицированных пациентов (33,7 ± 13,3% против 24,5 ± 9,7%), и разница была статистической. значительный ( p = 0,006) (таблица 4).
Активация каспазы 3
Результаты проточной цитометрии выражены в процентах активированных клеток спермы каспазы 3. На рис.3 представлены гистограммы частотного распределения отрицательного контроля (рис.3A), положительный контроль (фиг. 3B) и одна сперма партнеров-мужчин бесплодных пар, положительных по C. trachomatis qPCR (фиг. 3C). Средний процент сперматозоидов с активированной каспазой 3 (± SD) был выше у партнеров-мужчин из бесплодных пар, положительных на C. trachomatis кПЦР, чем у неинфицированных пациентов (54,5 ± 18,1% против 20,8 ± 14%), и разница была статистической. значительный ( p = <0,001) (таблица 4).
Фрагментация ДНК
РезультатыTUNEL-сопряженной проточной цитометрии выражены в процентах ДНК-фрагментированных сперматозоидов.На фиг.4 представлены гистограммы частотного распределения отрицательного контроля (фиг. 4A), положительного контроля (фиг. 4B) и одной спермы партнеров-мужчин бесплодных пар, положительных на C. trachomatis qPCR (фиг. 4C). Средний процент сперматозоидов с фрагментацией ДНК (± стандартное отклонение) был выше у партнеров-мужчин из бесплодных пар, положительных на C. trachomatis кПЦР, чем у неинфицированных пациентов (29,2 ± 17,2% против 25,1 ± 14,3%). Но увеличение фрагментации ДНК сперматозоидов остается статистически незначимым ( p = 0.62) (таблица 4).
Распределение процентного содержания различных маркеров апоптоза среди пациентов, положительных на C. trachomatis кПЦР, по сравнению с неинфицированными пациентами показано на рисунке 5.
Рисунок 5. Распределение процентного содержания различных маркеров апоптоза среди пациентов, положительных на C. trachomatis КПЦР, по сравнению с неинфицированными пациентами.
( A ) Средний процент жизнеспособности сперматозоидов, оцененный с помощью красителя 7-аминоактиномицин-D (7-AAD).( B ) Средний процент митохондриального мембранного потенциала сперматозоидов (ΔΨm), оцененный с помощью JC-1. ( C ) Средний процент активации каспазы 3, оцененный с помощью меченного флуоресцеином ингибитора каспаз (FLICA). ( D ) Средний процент фрагментации ДНК сперматозоидов, оцененный с помощью (TUNEL). Неинфицированные : Сперма неинфицированных пациентов (отрицательная для всех проведенных ПЦР и анализа спермиокультуры). CT + : сперма пациентов с положительным результатом на C.trachomatis КПЦР. * Обозначает значительные различия по сравнению с незараженной спермой ( P <0,05). ** Обозначает значительные различия по сравнению с незараженной спермой ( P <0,001).
https://doi.org/10.1371/journal.pone.0098903.g005
Обсуждение
Значение микроорганизмов половых путей как этиологического фактора мужского бесплодия остается спорной темой [39]. Целью этого исследования было определение распространенности нескольких распространенных возбудителей заболеваний, передающихся половым путем, среди мужчин, являющихся членами бесплодных пар.Бессимптомно инфицированные люди могут быть носителями меньшего количества организмов [40]. Кроме того, ПЦР в реальном времени проще и имеет более высокую чувствительность и специфичность. Таким образом, ПЦР в реальном времени может быть методом выбора для выявления и количественного определения бактерий в образцах спермы бессимптомных партнеров-мужчин. Наше исследование показало, что C. trachomatis , по-видимому, является наиболее распространенным возбудителем, передающимся половым путем среди мужчин-партнеров бесплодных пар в Сфаксе (юг Туниса), о чем свидетельствует его высокая распространенность.Наши результаты подтверждают предыдущие сообщения о мужчинах-партнерах бесплодных пар в Тунисе [41], с меньшей частотой (15,2% против 43,3%). Это различие можно объяснить использованием разных методов обнаружения этой бактерии. Мы использовали количественную ПЦР в реальном времени, которая более специфична, чем собственный метод гибридизации ПЦР-микротитровального планшета. Распространенность N. gonorrhoeae в нашем исследовании была (5,8%) среди мужчин-партнеров бесплодных пар. Эта распространенность была выше, чем ранее сообщалось в недавних исследованиях, проведенных в других странах, например, в Канаде [42] и в нашей стране [41].Распространенность N. gonorrhoeae (5,8%) была почти такой же, как и в других недавних исследованиях [43] в Иордании (6,5%). Кроме того, два автора сообщали о высокой чувствительности и специфичности КПЦР, использованного в нашем исследовании [44] — [45]. Результаты этого исследования также показали, что распространенность M. genitalium (3,5%) у бесплодных мужчин почти аналогична той, о которой сообщают Gdoura et al. (2008) (4,8%) в нашей стране и Аль-Свейх. и др. (2012) в Иордании (3.2%) [41] — [46]. Удивительно, но распространенность U. urealyticum (5,8%), обнаруженная в нашем исследовании, была значительно ниже, чем ранее сообщалось в нашей стране Gdoura et al (2008) [41]. В литературе распространенность U. urealyticum в образцах спермы мужчин с бесплодием колеблется от 5% до 42% [47], [48] — [49]. Такой широкий разброс можно объяснить разнообразием методов обнаружения, используемых для характеристики исследуемых популяций. В большинстве ранее опубликованных исследований обсуждалась роль Ureaplasma в мужском бесплодии без различия между U.urealyticum и U. parvum [47] — [50]. В нашем исследовании мы использовали количественную ПЦР в реальном времени для облегчения обнаружения и количественного определения U. urealyticum , U. parvum , M. hominis и M. genitalium в образцах спермы. Таким методом U. parvum было обнаружено только у одного пациента (1,1%). Распространенность этого вида в нашем исследовании была ниже, чем сообщенная Knox et al (2003) (19,2%), и была почти такой же, как у Gdoura et al (2008) в нашей стране (2.9%) [41] — [48]. В литературе M. hominis связывают с бактериальным вагинозом, воспалительными заболеваниями органов малого таза у женщин [51]. Однако его роль при негоноккокальном уретрите и бесплодии исследовалась редко [52]. Распространенность M. hominis в нашем исследовании была (1,1%) сопоставима с данными Rosemond et al. (2006) (0%), но меньше, чем обнаруженная Gdoura et al (2008) (9,6%). ) [41–53]. Роль инфекции C. trachomatis на параметры спермы при мужском бесплодии является спорной.Фактически, большое количество исследований показало, что положительные маркеры инфекции Chlamydia не связаны с измененными параметрами сперматозоидов [18], [19], [46], [54] — [55]. Другие, однако, обнаружили, что инфекция Chlamydia коррелирует со снижением подвижности сперматозоидов [34] — [56], увеличением доли аномалий сперматозоидов [57], значительным снижением плотности спермы, морфологии и жизнеспособности сперматозоидов [58] и повышенной вероятностью лейкоцитоспермии [34]. Кроме того, Veznik и др. (2004) сообщили об уменьшении семенной плазмы, подвижности, скорости и нормальной морфологии сперматозоидов у C.trachomatis — инфицированные пациенты с бесплодием по сравнению с пациентами без инфекции [59]. Маццоли и др. (2010) обнаружили, что C. trachomatis влияет на концентрацию сперматозоидов, процент подвижных сперматозоидов и нормальные морфологические формы у пациентов с простатитом [12]. Окончательный вывод из всех исследований сделать трудно из-за разнообразия населения, с одной стороны, и вариабельности чувствительности и специфичности используемых методов, с другой. Более того, во время оценки бесплодия бесплодные пары не подвергаются систематическому скринингу на эту инфекцию, следовательно, C.trachomatis может выявляться по осложнениям. Фактически, средняя продолжительность бесплодия в нашем исследовании составляла 4 года, и пациенты консультировались на разных стадиях инфекции. Наконец, мы показали, что инокуляция фертильных самцов мышей Swiss в проходной канал уретры с C. trachomatis может привести к изменению параметров спермы (подвижности, жизнеспособности, морфологии и концентрации сперматозоидов) [35]. Наше исследование соответствует нашему последнему экспериментальному исследованию, концентрации сперматозоидов и быстро прогрессирующей подвижности (категория а) сперматозоидов у мужчин-партнеров бесплодных пар с C.trachomatis в образцах спермы показало значительное снижение по сравнению с образцами без инфекции. Более того, жизнеспособность и общая подвижность сперматозоидов у мужчин-партнеров бесплодных пар с ДНК C. trachomatis в образцах спермы были ниже, но не значимы по сравнению с пациентами без инфекции. Количество лейкоцитов у мужчин-партнеров бесплодных пар с ДНК C. trachomatis в образцах спермы было выше, но несущественно по сравнению с таковыми без инфекции.Таким образом, заражение C. trachomatis могло привести к снижению качества спермы.
Апоптоз — это способ запрограммированной гибели клеток, основанный на генетическом механизме, который вызывает серию клеточных, морфологических и биохимических изменений, ведущих к самоубийству клетки, не вызывая воспалительной реакции. Сообщалось, что зрелые сперматозоиды экспрессируют различные маркеры клеточного повреждения, связанного с апоптозом [60] — [61]. Брошюра об экстернализации PS на внешней мембране сперматозоидов считается признаком терминального апоптоза.Активированная каспаза-3, потеря целостности ΔΨm и фрагментация ДНК являются другими маркерами терминального апоптоза, экспрессируемого различной долей эякулированных сперматозоидов [25] — [62]. Было высказано предположение, что гибель сперматозоидов связана с мужским бесплодием [63] — [64]; однако точные механизмы его участия еще предстоит выяснить [65]. Сообщалось также об апоптозе и дисфункции сперматозоидов после воздействия на сперматозоиды C. trachomatis , in vivo и in vitro . Исследования in vitro показали, что совпадение сперматозоидов человека с сероваром E C. trachomatis вызывает значительное снижение процента подвижных сперматозоидов и приводит к преждевременной гибели сперматозоидов [33]. Было показано, что эта гибель сперматозоидов в первую очередь вызывается LPS [32]. Более того, было показано, что Chlamydial LPS взаимодействуют с CD14 на поверхности сперматозоидов, приводя к увеличению продукции активных форм кислорода и вызывая каспазо-опосредованный апоптоз при использовании флуорогенного субстрата [29].Наконец, Satta и др. (2006) наблюдали, что экспериментальная инфекция C. trachomatis вызывает экстернализацию PS сперматозоидов и фрагментацию ДНК [30]. Исследования in vivo показали более высокую частоту появления сперматозоидов с фрагментированной ДНК у бесплодных субъектов с инфекцией мочеполовой системы C. trachomatis , чем у контрольных фертильных субъектов, с использованием теста дисперсии хроматина сперматозоидов [34]. Более того, наша экспериментальная модель на мышах также показала значительное увеличение процентного содержания апоптозных и некротических сперматозоидов у инфицированных мышей по сравнению с контрольной группой [35].В соответствии с этими результатами наши данные продемонстрировали прямую роль C. trachomatis в апоптозе. Чтобы выяснить значение апоптоза в сперме, инфицированной ДНК C. trachomatis , в первой части нашего исследования мы изучали жизнеспособность сперматозоидов с использованием красителя 7-AAD vital краситель. Мы обнаружили значительное снижение среднего процента жизнеспособных сперматозоидов (7-AAD-отрицательных) у партнеров-мужчин бесплодных пар с ДНК C. trachomatis по сравнению с неинфицированными партнерами-мужчинами в бесплодных парах. Инфекция C. trachomatis больше отрицательно коррелировала с жизнеспособностью, измеренной с использованием красителя 7-AAD, чем с жизнеспособностью, измеренной с помощью окрашивания эозином. Краситель 7-AAD более объективен, чем окрашивание эозином. Во второй части нашего исследования мы изучали состояние митохондриального мембранного потенциала в сперме с помощью липофильного флуоресцентного зонда JC-1. Зонд JC-1 был проверен при оценке сперматозоидов жеребцов и быков с помощью проточной цитометрии [66] — [67] и обеспечивает более точную оценку метаболической функции, чем Mito Tracker или Rhodamine 123 [67].В нашем исследовании мы обнаружили значительное увеличение среднего процента сперматозоидов с низким ΔΨm у мужчин-партнеров бесплодных пар с ДНК C. trachomatis в образцах спермы по сравнению с мужчинами-партнерами бесплодных пар без ДНК C. trachomatis в образцах спермы. образцы спермы. Насколько нам известно, наше исследование представляет собой первое исследование, характеризующее состояние ΔΨm в сперматозоидах бесплодных пар с ДНК C. trachomatis . В соответствии с нашими выводами, Mabel и др. (2010) сообщили о значительном снижении процента сперматозоидов с интактной ΔΨm на инкубации in vitro человеческих сперматозоидов с E.coli и супернатант, полученный от этих бактерий [68]. Кроме того, это исследование демонстрирует, что контакт с бактериями E. coli влияет на функцию митохондрий сперматозоидов, а также подтверждает первое исследование in vitro , опубликованное Виллегасом и др. (2005), демонстрирующее, что растворимые факторы, выделяемые E. coli способствуют увеличению маркеров апоптоза в сперматозоидах человека [69]. Наше исследование in vivo подтверждает эти результаты in vitro и позволяет предположить, что C.trachomatis может повлиять на функцию митохондрий сперматозоидов. Было показано, что активность каспазы присутствует в сперматозоидах человека [25] — [70]. Более того, у бесплодных мужчин был обнаружен более высокий процент сперматозоидов с активированными каспазами, что подтверждает существование каспазозависимого апоптотического пути в эякулированной человеческой сперме [71]. В третьей части нашего исследования мы изучали активацию каспазы 3 в сперматозоидах бесплодных мужчин. Мы заметили также значительное увеличение активации каспазы 3 у мужчин-партнеров бесплодных пар с C.trachomatis ДНК в образцах спермы по сравнению с мужчинами-партнерами бесплодных пар без ДНК C. trachomatis в образцах спермы. Наш результат in vivo подтверждается результатами Eley и др. (2005), которые продемонстрировали, что совместная инкубация сперматозоидов in vitro с ЛПС C. trachomatis приводит к гибели клеток, частично вызванной апоптозом. и опосредуется каспазой 3 [29]. В последней части нашего исследования мы изучали фрагментацию ДНК сперматозоидов с помощью анализа (TUNEL).Индукция фрагментации ДНК ядер сперматозоидов была широко предложена несколькими авторами, поскольку их возможное влияние на фертильность выходит за рамки оплодотворения и исхода беременности [34] — [72]. Фактически, Gallegos и др. (2008) оценили целостность ДНК сперматозоидов с помощью теста на дисперсию сперматозоидов и обнаружили, что мужчины с инфекциями C. trachomatis и Mycoplasma имели значительно большую фрагментацию ДНК сперматозоидов, чем фертильные контрольные субъекты [34]. Эти результаты показывают, что C.trachomatis и Mycoplasma может влиять на ДНК сперматозоидов. В соответствии с этим исследованием, мы заметили небольшое увеличение повреждений ДНК сперматозоидов у партнеров-мужчин бесплодных пар с ДНК C. trachomatis в образцах спермы по сравнению с партнерами-мужчинами бесплодных пар без ДНК C. trachomatis в образцах спермы. Ограничениями нашего исследования были, во-первых, низкая численность нашей популяции (всего 85 бесплодных мужчин) и, во-вторых, отсутствие контрольных групп, состоящих из фертильных мужчин.Таким образом, мы ограничили наше сравнение между спермой инфицированных и неинфицированных бесплодных мужчин с C. trachomatis .
В заключение, используя количественную ПЦР в реальном времени, наше исследование показало, что эта ПЦР обеспечивает чувствительную меру для обнаружения ДНК человека C. trachomatis , генитальных микоплазм и генитальных уреаплазм , что полезно для эпидемиологических исследований этих патогенов. . Наши результаты также показали, что C. trachomatis , по-видимому, широко распространена среди мужчин-партнеров бесплодных пар в Сфаксе (юг Туниса).Это исследование подтверждает, что инфекция C. trachomatis может привести к снижению качества спермы и индукции апоптоза. Фактически было обнаружено, что инфекция C. trachomatis увеличивает дисфункцию ΔΨm в сперматозоидах и активацию каспазы 3. Однако повреждение ДНК сперматозоидов не было существенно связано с инфекцией C. trachomatis . Это заставляет нас предположить, что каспаза 3 может быть вовлечена в инфекцию C. trachomatis , но не вызывает прямого повреждения ДНК.
Вклад авторов
Эксперимент задумал и спроектировал: HS AZ RG AS. Проведены эксперименты: HS SB AZ HM NL. Проанализированы данные: HS AZ RG AS HM. Предоставленные реагенты / материалы / инструменты для анализа: HM TR AH LK. Написал документ: HS AZ RG AS. Внесены в коллекцию экз .: ЛК.
Список литературы
- 1. Кек С., Гербер-Шефер С., Клад А., Вильгельм С., Брекволдт М. (1998) Инфекции семенного тракта: влияние на мужскую фертильность и варианты лечения.Обновление Hum Reprod 4: 891–903.
- 2. Hamdad-Daoudi F, Petit J, Eb F (2004) Оценка инфекции Chlamydia trachomatis у бессимптомных мужчин-партнеров бесплодных пар. J Med Microbiol 53: 985–990.
- 3. Rowe PJ, Comhaire FH, Hargreave TB, Mahmoud AMA (2000) Руководство ВОЗ по стандартизированному исследованию, диагностике и лечению бесплодия у мужчин, Издательство Кембриджского университета, Кембридж.
- 4. Паавонен Дж, Эггерт-Крузе В. (1999) Chlamydia trachomatis : влияние на репродуктивную функцию человека.Обновление Hum Reprod 5: 433–447.
- 5. Гдура Р., Кескес-Аммар Л., Бузид Ф., Эб Ф., Хаммами А. и др. (2001) Chlamydia trachomatis и мужское бесплодие в Тунисе. Eur J Contracept Reprod Health Care 6: 102–107.
- 6. Ochsendorf FR (2008) Инфекции, передаваемые половым путем: влияние на мужскую фертильность. Андрология 40: 72–75.
- 7. Дженгиз Т., Айдоганлы Л., Байкам М., Мунган Н.А., Тунчбилек Э. и др. (1997) Хламидийные инфекции и мужское бесплодие.Int Urol Nephrol 29: 687–693.
- 8. Аль-Мусли Н., Кросс Н.А., Элей А., Пейси А.А. (2009) Полимеразная цепная реакция в реальном времени показывает, что центрифугирование плотности не всегда удаляет Chlamydia trachomatis из спермы человека. Fertil Steril 92: 1606–1615.
- 9. Habermann B, Krause W (1999) Измененная функция сперматозоидов или антитела к сперматозоидам не связаны с антителами Chlamydial у бесплодных мужчин с лейкоцитоспермией. J Eur Acad Dermatol Venereol 12: 25–9.
- 10. Хоссейнзаде С., Элей А., Пейси А.А. (2004) Качество спермы мужчин с бессимптомной хламидийной инфекцией . Дж. Андрол 25: 104–109.
- 11. Idahl A, Boman J, Kumlin U, Olofsson JI (2004) Демонстрация антител IgG Chlamydia trachomatis у мужчины-партнера бесплодной пары коррелирует с пониженной вероятностью достижения беременности. Hum Reprod 19: 1121–1126.
- 12. Маццоли С., Цай Т., Аддонизио П., Бечи А., Мондаини Н. и др.(2010) Инфекция Chlamydia trachomatis связана с плохим качеством спермы у молодых пациентов с простатитом. Eur Urol 57: 708–714.
- 13. La Vignera S, Vicari E, Condorelli RA, D’Agata R, Calogero AE (2011) Инфекция мужской добавочной железы и параметры спермы (обзор). Инт Дж. Андрол 34: e330 – e347.
- 14. Pajovic B, Radojevic N, Vukovic M, Stjepcevic A (2013) Анализ спермы до и после лечения антибиотиками бессимптомной пиоспермии, связанной с Chlamydia и Ureaplasma .Андрология 45: 266–271.
- 15. Weidner W, Floren E, Zimmermann O, Thiele D, Ludwig M (1996) Хламидийные антитела в сперме: поиск «тихих» Хламидийных инфекций у бессимптомных андрологических пациентов. Инфекция 24: 309–313.
- 16. Охсендорф Ф. Р., Оздемир К., Рабенау Х., Феннер Т., Оремек Р. и др. (1999) Chlamydia trachomatis и мужское бесплодие: Chlamydia -IgA-антитела в семенной плазме составляют C.trachomatis специфичен и связан с воспалительной реакцией. J Eur Acad Dermatol Venereol 12: 143–152.
- 17. Vigil P, Morales P, Tapia A, Riquelme R, Salgado AM (2002) Инфекция Chlamydia trachomatis у мужчин-партнеров бесплодных пар: частота и функция сперматозоидов. Андрология 34: 155–161.
- 18. Эггерт-Круз В., Рор Дж., Кунт Б., Мейер А., Вондра Дж. И др. (2003) Распространенность Chlamydia trachomatis в субфертильных парах.Fertil Steril 80: 660–663.
- 19. Motrich RD, Cuffini C, Oberti JP, Maccioni M, Rivero VE (2006) Возникновение Chlamydia trachomatis и его влияние на качество спермы у пациентов с хроническим простатитом. J Infect 53: 175–183.
- 20. Де Барбейрак Б., Папаксантос-Рош А., Матье С., Жермен С., Брун Дж. Л. и др. (2006) Chlamydia trachomatis в субфертильных парах, проходящих программу оплодотворения in vitro : проспективное исследование.Eur J Obstet Gynecol Reprod Biol 129: 46–53.
- 21. Gdoura R, Kchaou W., Chaari C., Znazen A, Keskes L, et al. (2007) Ureaplasma urealyticum , Ureaplasma parvum , Mycoplasma hominis и Mycoplasma genitalium Инфекции и качество спермы бесплодных мужчин. BMC Infect Dis 7: 129
- 22. Gewies A, Grimm S (2003) Уровни экспрессии катепсина-B и катепсина-L не коррелируют с чувствительностью опухолевых клеток к апоптозу, опосредованному TNF-альфа.Br J Cancer 89: 1574–1580.
- 23. Gorczyca W, Traganos F, Jesionowska H, Darzynkiewicz Z (1993) Наличие разрывов цепей ДНК и повышенная чувствительность ДНК in situ к денатурации в аномальных человеческих сперматозоидах: аналогия с апоптозом соматических клеток. Exp Cell Res 207: 202–205.
- 24. Schuffner A, Morshedi M, Vaamonde D, Duran EH, Oehninger S (2002) Влияние различных условий инкубации на экстернализацию фосфатидилсерина и параметры движения очищенных фракций высокоподвижных сперматозоидов человека.Дж. Андрол 23:: 194–201.
- 25. Пааш У., Грюневальд С., Агарвал А., Гландера Х. Дж. (2004) Паттерн активации каспаз в сперматозоидах человека. Fertil Steril 81: 802–809.
- 26. Расола А., Бернарди П. (2007) Пора перехода митохондриальной мембраны и ее участие в патогенезе гибели клеток и болезней. Апоптоз 12: 815–833.
- 27. Marchetti C, Obert G, Deffosez A, Formstecher P, Marchetti P (2002) Исследование потенциала митохондриальной мембраны, активных форм кислорода, фрагментации ДНК и жизнеспособности клеток с помощью проточной цитометрии в сперме человека.Hum Reprod 17: 1257–1265.
- 28. Hosseinzadeh S, Brewis IA, Eley A, Pacey AA (2001) Совместная инкубация сперматозоидов человека с Chlamydia trachomatis сероваром E вызывает преждевременную гибель сперматозоидов. Hum Reprod 16: 293–299.
- 29. Eley A, Hosseinzadeh S, Hakimi H, Geary I, Pacey AA (2005) Апоптоз эякулированных человеческих сперматозоидов индуцируется совпадением с липополисахаридом Chlamydia trachomatis . Hum Reprod 20: 2601–2607.
- 30.Сатта А., Стивала А., Гароццо А., Морелло А., Пердичицци А. и др. (2006) Экспериментальная инфекция Chlamydia trachomatis вызывает апоптоз сперматозоидов человека. Hum Reprod 21: 134–137.
- 31. Galdiero F, Sommese L, Gorga F, Galdiero E, Rizzo A и др. (1994) Токсическое действие очищенного липополисахарида Chlamydia trachomatis на сперматозоиды человека. FEMS Microbiol Lett 115: 197–200.
- 32. Hosseinzadeh S, Pacey AA, Eley A (2003) Chlamydia trachomatis -индуцированная смерть сперматозоидов человека вызвана в первую очередь липополисахаридом.J Med Microbiol 52: 193–200.
- 33. Hosseinzadeh S, Brewis IA, Pacey AA, Moore HDM, Eley A (2000) Совместная инкубация сперматозоидов человека с Chlamydia trachomatis in vitro вызывает повышенное фосфорилирование тирозина белков спермы. Infect Immun 68: 4872–4876.
- 34. Гальегос Дж., Рамос Б., Сантисо Р., Гоянес В., Госальвез Дж. И др. (2008) Фрагментация ДНК сперматозоидов у бесплодных мужчин с инфекцией мочеполовой системы Chlamydia trachomatis и микоплазмой.Fertil Steril 90: 328–334.
- 35. Селлами Х., Гдура Р., Мабрук И., Фриха-Гаргури О., Кескес Л. и др. (2011) Предложенная модель мыши для изучения мужского бесплодия, вызванного генитальным сероваром E, Chlamydia trachomatis . Журнал андрологии 32: 86–94.
- 36. Всемирная организация здравоохранения (1999) Лабораторное руководство ВОЗ по исследованию взаимодействия человеческой спермы и цервикальной слизи. 4-е издание. Кембридж, Соединенное Королевство: University Press.
- 37.Vogels WHM, Van Voost Vader PC, Schrorder FP (1993) Инфекция Chlamydia trachomatis в популяции высокого риска: сравнение полимеразной цепной реакции и культуры клеток для диагностики и последующего наблюдения. J Clin Microbiol 31: 1103–1107.
- 38. Уилан Дж. А., Рассел Н. Б., Уилан М. А. (2003) Метод абсолютного количественного определения кДНК с использованием ПЦР в реальном времени. J Immunol Methods 278: 261–269.
- 39. Dejucq N, Jegou B (2001) Вирусы в мужских половых путях млекопитающих и их влияние на репродуктивную систему.Microbiol Mol Biol Rev 65: 208–231.
- 40. Виткин С.С. (2002) Иммунологические аспекты генитальных Chlamydia инфекций. Лучшая практика Res Clin Obstet Gynaecol.16: 865–874.
- 41. Gdoura R, Kchaou W., Ammar-Keskes L, Chakroun N, Znazen A, et al. (2008) Оценка Chlamydia trachomatis , Ureaplasma urealyticum , Ureaplasma parvum , Mycoplasma hominis и Mycoplasma genitalium в образцах спермы партнеров мужского пола с инфарктом мочеиспускания.Дж. Андрол 29: 198–206.
- 42. Купола Т., Ло К.С., Гробер Э.Д., Маллен Дж. Б., Мацзулли Т. и др. (2011) Полезность и стоимость скрининга Chlamydia trachomatis и Neisseria gonorrhoeae среди мужчин, страдающих бесплодием. Fertil Steril 97: 299–305.
- 43. Абусара Е.А., Аввад З.М., Чарвалос Э., Шехаби А.А. (2013) Молекулярное обнаружение потенциальных патогенов, передающихся половым путем, в образцах спермы и мочи бесплодных и фертильных мужчин. Диагностика Microbiol Infect Dis 77: 283–286.
- 44. Jalal H, Delaney A, Bentley N, Sonnex C, Carne CA (2013) Молекулярная эпидемиология отдельных инфекций, передаваемых половым путем. Int J Mol Epidemiol Genet 4: 167–174.
- 45. Датку Р., Гесинк Д., Малвад Дж., Монтгомери-Андерсен Р., Ринк Е. и др. (2013) Микробиом влагалища у женщин из Гренландии, оцененный с помощью микроскопии и количественной ПЦР. BMC Infect Dis 13: 480.
- 46. Аль-Свейх Н.А., Аль-Фадли А.Х., Ому А.Э., Ротими В.О. (2012) Распространенность Chlamydia trachomatis , Mycoplasma hominis , Mycoplasma genitalium и Ureaplasma genitalium при инфекциях, вызванных инфузией и зачатием менструального цикла .Дж. Андрол 33: 1323–1329.
- 47. Де Йонг З., Понтонье Ф., Планте П., Пери Н., Талазак Н. и др. (1990) Сравнение заболеваемости Ureaplasma urealyticum у бесплодных мужчин и у доноров спермы. Eur Urol 18: 127–131.
- 48. Knox CL, Allan JA, Allan JM, Edirisinghe WR, Stenze DL, et al. (2003) Ureaplasma parvum и Ureaplasma urealyticum обнаруживаются в сперме после промывания перед процедурами вспомогательных репродуктивных технологий.Fertil Steril 80: 921–929.
- 49. Ван И, Лян С.Л., Ву Дж.К., Сюй Ц., Цинь С.Х. и др. (2006) Ureaplasma urealyticum Инфекции половых путей влияют на качество спермы? Азиатский Дж. Андрол 8: 562–568.
- 50. Борнман М.С., Магомед М.Ф., Бумкер Д., Шуленбург Г.В., Рейф С. и др. (1990) Микробная флора в сперме бесплодных африканских мужчин в больнице Гаранкува. Андрология 22: 118–121.
- 51. Yoshida T, Maeda S, Deguchi T, Ishiko H (2002) Быстрая идентификация на основе филогении микоплазм и уреаплазм от пациентов с уретритом.J Clin Microbiol 40: 105–110.
- 52. Паннекук Ю., Трум Дж. В., Блекер О. П., Вин ФВД, Спанджаард Л. и др. (2000) Концентрации цитокинов в семенной плазме субфертильных мужчин не указывают на присутствие Ureaplasma urealyticum или Mycoplasma hominis в нижних отделах половых путей. J Med Microbiol 49: 697–700.
- 53. Rosemond A, Lanotte P, Watt S, Sauget AS, Guerif F и др. (2006) Existe-t-il un benéfice au dépistage systematique de Chlamydia trachomatis , Mycoplasma hominis et Ureaplasma urealyticum dans les prelèvements genito-urinaires réalisuntilis. Патол Биол 54: 125–129.
- 54. Рыбарь Р., Приносилова П., Копецка В., Главикова Ю., Везник З. и др. (2012) Влияние бактериального загрязнения спермы на целостность хроматина спермы и стандартные параметры спермы у мужчин от бесплодных пар. Андрология 44: 410–418.
- 55. Лю Дж, Ван Кью, Джи Х, Го С., Дай И и др. (2014) Распространенность инфекций Ureaplasma Urealyticum , Mycoplasma Hominis, Chlamydia Trachomatis и качество спермы у бесплодных и фертильных мужчин в Китае.Урология 83: 795–799.
- 56. Jakiel G, Robak-Chołubek D, Wieczorek P, Bokiniec M (2004) Оценка некоторых параметров человеческой спермы с положительной реакцией на хламидий . Ann Univ Mariae Curie Sklodowska Med 59: 61–4.
- 57. Custo GM, Saitto LV, Frongillo RF (1989) Хламидийная инфекция и мужская фертильность: эпидемиологическое исследование. Арка Андрол 23: 243–248.
- 58. Land JA, Van Bergen JE, Morré SA, Postma MJ (2010) Эпидемиология инфекции Chlamydia trachomatis у женщин и экономическая эффективность скрининга.Обновление Hum Reprod 16: 189–204.
- 59. Везник З., Поспишил Л., Свецова Д., Зайцова А., Унцайтиг В. (2004) Хламидии в эякуляте: их влияние на качество и морфологию сперматозоидов. Acta Obstet Gynecol Scand 83: 656–660.
- 60. Sakkas D, Mariethoz E, St John JC (1999) Аномальные параметры сперматозоидов у людей свидетельствуют об абортивном апоптотическом механизме, связанном с Fas-опосредованным путем. Экспериментальные исследования клеток 251: 350–355.
- 61.Shen HM, Dai J, Chia SE, Lim A, Ong CN (2002) Обнаружение апоптотических изменений в сперме у субфертильных пациентов и их корреляция с качеством спермы. Репродукция человека 17: 1266–1273.
- 62. Evenson DP, Larson KL, Jost LK (2002) Анализ структуры хроматина сперматозоидов: его клиническое использование для обнаружения фрагментации ДНК сперматозоидов при мужском бесплодии и сравнения с другими методами. Дж. Андрол 23: 25–43.
- 63. Sakkas D, Seli E, Bizzaro D, Tarozzi N, Manicardi GC (2003) Аномальные сперматозоиды в эякуляте: абортивный апоптоз и неправильное ядерное ремоделирование во время сперматогенеза.Reprod Biomed Online 7: 428–432.
- 64. Тейлор С.Л., Вен С.Л., Фокс П., Дюран Э.Х., Моршеди М.С. и др. (2004) Маркеры и пути апоптоза соматических клеток в эякулированной сперме человека: потенциальная полезность в качестве индикаторов качества спермы. Мол Хум Репрод 10: 825–834.
- 65. Agarwal A, Said TM (2005) Окислительный стресс, повреждение ДНК и апоптоз при мужском бесплодии: клинический подход. BJU Int 95: 503–507.
- 66. Гарнер Д.Л., Томас К.А. (1999). Специфический для органелл зонд JC-1 определяет различия мембранного потенциала в митохондриальной функции бычьей спермы.Мол Репрод Дев 53: 222–229.
- 67. Gravance CG, Garner DL, Baumber J, Ball BA (2000) Оценка митохондриальной функции сперматозоидов лошади с использованием JC-1. Theriogenoyly 53: 1691–1703.
- 68. Schulz M, Sanchez R, Soto L, Risopatron J, Villegas J (2010) Влияние Escherichia coli и его растворимых факторов на потенциал митохондриальной мембраны, транслокацию фосфатидилсерина, жизнеспособность и подвижность сперматозоидов человека. Fertil Steril 94: 619–623.
- 69.Виллегас Дж., Шульц М., Сото Л., Санчес Р. (2005) Бактерии вызывают экспрессию апоптоза в сперматозоидах человека. Апоптоз 10: 105–110.
- 70. Weng SL, Taylor SL, Morshedi M, Schuffner A, Duran EH и др. (2002) Активность каспазы и маркеры апоптоза в эякулированной сперме человека. Мол Хум Репрод 8: 984–991.
- 71. Paasch U, Grunewald S, Fitzl G, Glander HJ (2003) Ухудшение плазматической мембраны связано с активированными каспазами в сперматозоидах человека.Дж. Андрол 24: 246–252.
- 72. Reichart M, Kahane I, Bartoov B (2000) In vivo и in vitro нарушение целостности ядерного хроматина сперматозоидов человека и барана инфекцией, передаваемой половым путем Ureaplasma urealyticum . Биол Репрод 63: 1041–1048.
- 73. Джалал Х., Стивен Х., Карран М.Д., Бертон Дж., Брэдли М. и др. (2006) Разработка и валидация анализа ПЦР в реальном времени с роторным геном для обнаружения, идентификации и количественного определения Chlamydia trachomatis в одной реакции.J Clin Microbiol 44: 206–213.
- 74. Hjelmevoll SO, Olsen ME, Sollid JU, Haaheim H, Unemo M и др. (2006) Быстрый метод полимеразной цепной реакции в реальном времени для чувствительного и специфического обнаружения псевдогена Neisseria gonorrhaeae por A. J Mol Diagn 8: 574–581.
- 75. Jensen JS, Björnelius E, Dohn B, Lidbrink P (2004) Использование 5′-нуклеазы TaqMan 5′-ПЦР в реальном времени для количественного определения ДНК Mycoplasma genitalium у мужчин с уретритом и без него, которые были посетителями клиники по лечению заболеваний, передающихся половым путем.J Clin Microbiol 42: 683–692.
- 76. Pascual A, Jaton K, Ninet B, Bille J, Greub G (2010) Новая диагностическая ПЦР в реальном времени для специфического обнаружения ДНК Mycoplasma hominis . Int J Microbiol 2010: 317512.
- 77. Vancutsem E, Soetens O, Breugelmans M, Foulon W, Naessens A (2011) Модифицированная ПЦР в реальном времени для обнаружения, дифференциации и количественного определения Ureaplasma urealyticum и Ureaplasma parvum . J Mol Diagn 13: 206–212.
Хламидиоз (хламидийные мочеполовые инфекции): предпосылки, патофизиология, этиология
Автор
Шахаб Куреши, доктор медицинских наук, FACP Лечащий врач общей внутренней медицины, Общая больница Святой Катарины; Адъюнкт-клинический профессор, Медицинский факультет Университета Макмастера, Канада
Шахаб Куреши, доктор медицины, FACP является членом следующих медицинских обществ: Американский колледж врачей, Колледж врачей и хирургов Онтарио, Медицинская ассоциация Онтарио
Раскрытие информации : Нечего раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Главный редактор
Майкл Стюарт Бронз, доктор медицины Дэвид Росс Бойд Профессор и председатель медицинского факультета, кафедра внутренней медицины, кафедра медицины, Научный центр здравоохранения Университета Оклахомы; Магистр Американского колледжа врачей; Научный сотрудник Американского общества инфекционных болезней; Член Королевского колледжа врачей, Лондон
Майкл Стюарт Бронз, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американская медицинская ассоциация, Ассоциация профессоров медицины, Общество инфекционных болезней Америки, Медицинская ассоциация штата Оклахома, Южное общество клинических исследований
Раскрытие информации: раскрывать нечего.
Благодарности
Джеффри Блитштейн, MD Штатный врач, Отделение внутренней медицины, Отделение инфекционных заболеваний, Вирджиния, Нью-Йоркская система здравоохранения гавани в Бруклине,
Раскрытие информации: нечего раскрывать.
Марк Джеймс Грелла, MD Клинический инструктор, Отделение педиатрии, Массачусетская больница общего профиля
Марк Джеймс Грелла, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии педиатрии, Американской медицинской ассоциации и Массачусетского медицинского общества
Раскрытие информации: нечего раскрывать.
Джонатан А. Хендлер, MD Главный архитектор развертывания HSG, Microsoft Corporation, адъюнкт-профессор, факультет неотложной медицины, Северо-Западный университет, Школа Медина им. Файнберга
Джонатан Хэндлер, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американского колледжа врачей скорой помощи, Американской ассоциации медицинской информатики, Phi Beta Kappa и Общества академической неотложной медицины
Раскрытие информации: нечего раскрывать.
Ренука Хеддуршетти, доктор медицины Научный сотрудник по инфекционным болезням, факультет внутренней медицины, Государственный университет Нью-Йорка в Бруклине
Ренука Хеддуршетти, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционистов Америки
Раскрытие информации: нечего раскрывать.
Дебра Э. Хоури, доктор медицины, магистр здравоохранения Директор Центра по контролю за травмами, доцент кафедры неотложной медицины, факультет неотложной медицины, Университет Эмори
Debra E Houry, MD, MPH является членом следующих медицинских обществ: Американского колледжа врачей скорой помощи, Американской медицинской ассоциации, Американской ассоциации общественного здравоохранения и Общества академической неотложной медицины
Раскрытие информации: нечего раскрывать.
Ретт Л. Джексон, доктор медицины Адъюнкт-профессор и заместитель председателя по образованию медицинского факультета, директор резидентуры по внутренним болезням Медицинского колледжа Университета Оклахомы; Помощник начальника медицинской службы больницы по делам ветеранов Оклахома-Сити
Ретт Л. Джексон, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей-Американского общества внутренней медицины и Американской медицинской ассоциации
Раскрытие информации: нечего раскрывать.
Ашир Кумар, MD, MBBS, FAAP Почетный профессор кафедры педиатрии и человеческого развития, Колледж медицины человека Мичиганского государственного университета
Ашир Кумар, MD, MBBS, FAAP является членом следующих медицинских обществ: Американской ассоциации врачей индийского происхождения и Общества инфекционных болезней Америки
Раскрытие информации: нечего раскрывать.
Ричард Лавели, доктор медицинских наук, магистр медицины, магистр здравоохранения Преподаватель политики и управления в области здравоохранения, Департамент общественного здравоохранения, Медицинская школа Йельского университета
Ричард Лавели, доктор медицинских наук, магистр медицины, магистр здравоохранения, является членом следующих медицинских обществ: Американского колледжа врачей скорой помощи, Американского колледжа судебной медицины и Американской медицинской ассоциации
Раскрытие информации: нечего раскрывать.
John M. Leedom, MD Заслуженный профессор медицины Медицинской школы Кека Университета Южной Калифорнии
Джон М. Лидом, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей — Американское общество внутренней медицины, Американское общество микробиологии, Американское общество инфекционных болезней, Международное общество по СПИДу и Phi Beta Kappa
Раскрытие информации: нечего раскрывать.
Ларри Лютвик, доктор медицины Профессор медицины, Медицинская школа Нижнего штата Нью-Йоркского университета; Директор по инфекционным заболеваниям, Служба по делам ветеранов, система здравоохранения Нью-Йоркской гавани, Бруклинский кампус
Ларри I Латвик, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционных болезней Америки
Раскрытие информации: нечего раскрывать.
Марк Р. Шлейсс, доктор медицины Председатель педиатрии Американского легиона, профессор педиатрии, директор отдела инфекционных заболеваний и иммунологии, кафедра педиатрии, Медицинская школа Университета Миннесоты
Марк Р. Шлейс, доктор медицины, является членом следующих медицинских обществ: Американского педиатрического общества, Американского общества инфекционных болезней, Общества педиатрических инфекционных болезней и Общества педиатрических исследований
Раскрытие информации: нечего раскрывать.
Russell W. Steele, MD Руководитель отделения детских инфекционных болезней Детского оздоровительного центра Ochsner; Клинический профессор кафедры педиатрии медицинского факультета Тулейнского университета
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологов, Американского общества инфекционных заболеваний, Медицинского общества штата Луизиана, Общества педиатрических инфекционных болезней, Общество педиатрических исследований и Южная медицинская ассоциация
Раскрытие информации: нечего раскрывать.
Келли Страбл, научный сотрудник DO , кафедра инфекционных болезней, Медицинский колледж Университета Оклахомы
Kelley Struble, DO является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционистов Америки
Раскрытие информации: нечего раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Лабораторные исследования для скрининга мужского хламидиоза —
Мужчины являются резервуаром для непрерывной передачи C. trachomatis женщинам, таким образом представляя популяцию для потенциального целевого скрининга. Официальных рекомендаций профессиональных организаций по скринингу мужчин на хламидиоз не существует, однако Центры по контролю и профилактике заболеваний (CDC) предоставили руководство для клинических центров, желающих проводить скрининг мужчин, у которых в основном отсутствуют симптомы.В статье описаны и рассмотрены методы лабораторной диагностики Chlamydia trachomatis у мужчин. Текущие рекомендации по скринингу гетеросексуальных мужчин на хламидиоз включают использование мочи и тестирование с помощью тестов амплификации нуклеиновых кислот (NAAT).
Chlamydia trachomatis — это наиболее часто регистрируемое бактериальное заболевание, передаваемое половым путем, в Соединенных Штатах; по оценкам, 3-4 миллиона новых случаев в год 1 . В то время как большинство заболеваний, связанных с хламидиозом, приходится на женщин, мужчины являются резервуаром для продолжения передачи новых и рецидивирующих инфекций среди женщин и, таким образом, представляют собой популяцию для целевого скрининга, особенно если они протекают бессимптомно 2 .CDC не давал никаких официальных рекомендаций по скринингу мужчин на хламидиоз, но недавно предложил руководство для сайтов, которые в настоящее время проводят скрининг или планируют ввести скрининг мужчин 3 . Руководящие принципы включают в себя заключенных в тюрьму мужчин старше 30 лет, мужчин, посещающих клиники по лечению заболеваний, передаваемых половым путем, мужчин, проходящих обучение в корпусе вакансий, мужчин в армии и мужчин в клиниках по борьбе с ВИЧ, а также мужчин, поступающих в учреждения для несовершеннолетних с распространенностью> 2%, и мужчин в отделениях неотложной помощи. , средние школы и подростковые клиники с высокой распространенностью хламидиоза в общине 3 .
Клиницисты традиционно собирали мазки из уретры в качестве диагностических образцов для выявления хламидиоза, что могло стать препятствием для скрининга мужчин. Теперь, когда доступны тесты амплификации нуклеиновых кислот на основе мочи (NAAT), было показано, что они работают лучше, чем уретральная культура, иммуноферментный анализ (EIA), прямой флуоресцентный анализ (DFA) или зонд нуклеиновой кислоты для обнаружения хламидий 4-10 . Доступность неинвазивных тестов на хламидиоз потенциально должна привести к более широкому скринингу бессимптомных мужчин в сообществе 2,11 .
Для мужчин, практикующих секс с мужчинами (МСМ), ректальные образцы (и / или образцы из глотки на гонорею) могут быть образцом выбора, поскольку мазки из уретры или мочи могут пропустить многие инфекции; однако эти образцы еще не одобрены FDA для анализов NAAT, хотя некоторые лаборатории уже провели проверочные исследования и используют их. Мазки из глотки не рекомендуются для скрининга на хламидиоз у мужчин (или МСМ) из-за очень низкой распространенности, но поскольку многие образцы из глотки проверяются на гонорею, положительные результаты на хламидиоз из глотки могут быть возвращены врачу.От таких инфекций следует назначать лечение до тех пор, пока мы не получим дальнейшие исследования, чтобы порекомендовать иное.
Тестирование амплификации нуклеиновых кислот (NAAT)
Хотя старые тесты для выявления хламидиоза у мужчин включают культивирование в клетках тканевых культур, тесты с прямым флуоресцентным антителом (DFA), иммуноферментный анализ (EIA), гибридизацию зонда нуклеиновой кислоты, в настоящее время для обнаружения хламидиоза у мужчин рекомендуются только тесты NAAT. Анализы NAAT включают несколько доступных коммерческих тестов; полимеразная цепная реакция (ПЦР), ПЦР в реальном времени, гибридизация замещения цепи (SDA) и гибридизация, опосредованная транскрипцией (TMA).Хотя все эти тесты можно проводить с мазками из уретры, они также одобрены FDA для использования с образцами первой уловленной мочи (FCU). NAAT считаются наиболее чувствительными из доступных тестов. Моча является образцом выбора при использовании анализов NAAT, поскольку чувствительность и специфичность обычно незначительно различаются между мазками из мочи и уретры; моча может быть даже более чувствительной. Дополнительно рекомендуются образцы мочи, поскольку они неинвазивны и могут привести к тому, что больше мужчин будут обследованы 10 .
Экспресс-тесты на антигены в месте оказания помощи (POC) еще не обладают достаточной чувствительностью для использования с образцами мочи. Таким образом, рекомендация для скрининга симптоматических и особенно бессимптомных мужчин состоит в том, чтобы использовать анализ NAAT на «первой мочеиспускательной» части (15-20 мл) образца мочи (FVU) 3 .
Медико-правовые вопросы
Чувствительность культуры C. trachomatis от умеренной до низкой ограничивает ее диагностическую ценность, а необходимость получения мазка из уретры с последующей обширной лабораторной обработкой не позволяет использовать ее в скрининге.В отличие от этого, культура C. trachomatis рекомендуется для судебно-медицинских расследований для выявления хламидиоза в случаях расследования сексуального насилия из-за ее почти идеальной специфичности 12 . Использование NAAT для судебно-медицинских расследований привлекло некоторое внимание 13,14 , и продемонстрированная точность может позволить принять эти тесты в будущем правовой системой.
Состояние симптомов пациента
Когда у мужчин наблюдаются симптомы заболевания и они обращаются в клинику, они должны пройти полное урогенитальное обследование с получением образцов уретры или мочи для диагностических тестов с использованием наиболее чувствительных и специфических доступных тестов, i.е. тест NAAT, рекомендованный CDC в качестве теста выбора 15 . Когда обследуются группы бессимптомных мужчин, которые не обращаются за медицинской помощью, рекомендуется использовать неинвазивные образцы, такие как моча. 3. Такие образцы устраняют необходимость в клиницистах для сбора образцов и их использования. может быть рентабельным, особенно при обследовании большого числа людей 16-24 . Когда эти неинвазивные образцы используются для скрининга бессимптомных людей на хламидиоз, можно использовать только тест NAAT, поскольку ни один из других старых тестов не имеет достаточно высокой чувствительности.
Использование анализов NAAT может влиять на эпидемиологию хламидиоза в группах мужского населения
Число заражений, обнаруженных с помощью NAAT, может быть на 80% выше, чем при использовании более старых тестов 25,26 . NAAT довольно точны при скрининге бессимптомных мужчин, даже несмотря на то, что бремя бактериальной нагрузки может быть низким 16,17 . Выборка национального обследования домохозяйств продемонстрировала распространенность хламидиозной инфекции 2,8% 23 . Большая программа показа фильмов в четырех городах США.S. продемонстрировал распространенность хламидиоза на уровне 7% у большинства бессимптомных мужчин 2 . Продемонстрирована высокая распространенность (4-5%) инфекций хламидиоза у мужчин-призывников 17,24 . Недавние опросы молодых людей и подростков в рамках исследования «Здоровье подростков», первоначально зачисленных в школы с использованием технологии NAAT, также показали значительную распространенность хламидиоза у мужчин в возрасте 18–26 лет (в целом, 3,67%; белых мужчин, 1,38%; чернокожих мужчин, 11,12%). 16 . Крупное городское школьное обследование показало распространенность среди мальчиков 2 лет.5% 26. Скрининг в нетрадиционных условиях, таких как Национальная программа профессионального обучения мужчин, показал, что общая распространенность хламидиоза составила 8,2% 27 . Центры содержания под стражей, тюрьмы, городские приюты, группы потребителей инъекционных наркотиков и отделения неотложной помощи также были проверены на хламидиоз у мужчин с распространенностью до 14,3–15% и обнадеживающими результатами для высокой доли инфицированных мужчин, получающих лечение 28 -32 .
Скрининг мочи на хламидиоз также приемлем для мужчин в условиях скрининга 17,33-34 .Без анализа мочи мужчин NAAT эти исследования не были бы проведены. Повышение интереса общественного здравоохранения к скринингу мужчин является важным предупреждением, направленным на сокращение резервуаров инфекции, доступных для передачи женщинам.
Другие лабораторные аспекты
NAATS измеряет ДНК или РНК, а не живые организмы; поэтому следует с осторожностью использовать тесты амплификации для тестов на излечение. Остаточная нуклеиновая кислота из клеток, ставших неинфекционными в результате лечения антибиотиками, может давать «положительный» усиленный тест в течение до 3 недель после терапии, когда пациент фактически излечен от жизнеспособных организмов 35-36 .Обычно CDC не рекомендует проводить тесты на излечение ни мужчинам, ни женщинам37. Кроме того, нет необходимости подтверждать положительные результаты NAAT в скрининговых популяциях с низкой распространенностью 38 .
Вопросы стоимости
АнализыNAAT дороже, чем более старые, не культуральные, неамплифицированные тесты, и часто слишком дороги для многих программ общественного здравоохранения. Исследования на мужчинах показали, что они экономически эффективны для предотвращения осложнений у женщин 39-40 . Высокая стоимость NAATS по сравнению с другими технологиями, одобренными FDA, и конкурирующие обязанности создали трудности для сектора общественного здравоохранения при проведении скрининга NAAT.
Сводка
АнализыNAAT — это предпочтительный тест для тестирования мужчин на хламидиоз, а моча — образец выбора. Для программ, заинтересованных в тестировании мужчин в различных местах с высокой распространенностью, можно получить руководство по CDC 3 . Необходимы дальнейшие исследования, чтобы дать окончательные официальные рекомендации по скринингу самцов.
Выражаем особую благодарность Шарлотте Гайдос, доктору медицинских наук, Международному союзу по борьбе с инфекциями, передаваемыми половым путем (IUSTI), и Университету Джонса Хопкинса за написание этого краткого обзора.Представленная информация адаптирована из статьи Gaydos CA, Ferrero DV, Papp J. «Лабораторные аспекты скрининга мужчин на Chlamydia trachomatis в новом тысячелетии», опубликованной в Sex Transm Dis 35 (11 Suppl): S44-50, 2008.
Список литературы
- Центры по контролю и профилактике заболеваний. Эпиднадзор за заболеваниями, передаваемыми половым путем, 2005 г. Атланта, Джорджия: Министерство здравоохранения и социальных служб США, 2006 г. CDC. 2006.
- Schillinger JA, Chapman JB, Rietmeijer CA et al.Распространенность инфекции Chlamydia trachomatis среди мужчин, обследованных в четырех городах США. Sex Transm Dis. 2005; 32: 74-77.
- Центры по контролю и профилактике заболеваний. Консультация по скринингу на хламидиоз у мужчин, 28-29 марта 2006 г., отчет о встрече. http: // www cdc gov / std / chlamydia / ChlamydiaScreening-males pdf. 2007; по состоянию на 6 июля 2007 г.: 1-11.
- Jaschek G, Gaydos C, Welsh L, Quinn TC. Прямое обнаружение Chlamydia trachomatis в образцах мочи мужчин с симптомами и бессимптомными симптомами с помощью быстрого анализа полимеразной цепной реакции.J Clin Microbiol. 1993; 31: 1209-1212.
- Shafer M, Schachter J, Moncada J et al. Оценка стратегий скрининга на основе мочи для выявления Chlamydia trachomatis среди сексуально активных бессимптомных молодых мужчин. ДЖАМА. 1993; 270: 2065-20795.
- Chernesky MA, Chong S, Jang D, Luinstra K, Sellors J, Mahony JB. Возможность коммерческих лигазных цепных реакций и анализов ПЦР для диагностики инфекций Chlamydia trachomatis у мужчин путем тестирования мочи при первом мочеиспускании. J Clin Microbiol. 1997; 35: 982-984.
- Ван Дер Поль Б., Куинн Т.C., Gaydos CA et al. Оценка AMPLICOR и автоматизированных тестов COBAS AMPLICOR CT / NG для обнаружения Chlamydia trachomatis. J Clin Microbiol. 2000; 38: 1105-1112.
- Ван дер Пол Б., Ферреро Д., Бак-Баррингтон Л. и др. Многоцентровая оценка системы BDProbeTec ET для обнаружения Chalmydia trachomatis и Neisseria gonorrhoeae в образцах мочи, женских эндоцервикальных мазках и мужских мазках из уретры. J Clin Microbiol. 2001; 39: 1008-1016.
- Marrazzo JM, Whittington WH, Celum CL et al.Скрининг мочи на Chlamydia trachomatis у мужчин, посещающих клиники по лечению заболеваний, передающихся половым путем. Sex Transm Dis. 2001; 28: 219-225.
- Чернеский М.А., Мартин Д.Х., Хук Э.В. 3-й и др. Возможность новых анализов APTIMA CT и APTIMA GC для обнаружения Chlamydia trachomatis и Neisseria gonorrhoeae в мужской моче и мазках из уретры. J Clijn Microbiol. 2005; 43: 127-131.
- Marrazzo JM, White CL, Krekeler B et al. Скрининг мочи на Chlamydia trachomatis на базе сообщества с использованием лигазной цепной реакции.Ann Intern Med. 1997; 127: 796-803.
- Hammerschlag MR. Использование тестов амплификации нуклеиновых кислот при расследовании сексуального насилия над детьми. Sex Transm Inf. 2001; 77: 153-154.
- Джесперсен DJ, Flatten M, Jones MF, Smith TF. Проспективное сравнение клеточных культур и тестов амплификации нуклеиновых кислот для лабораторной диагностики инфекций Chlamydia trachomatis. J Clin Microbiol. 2005; 43: 5324-5326.
- Black CM, Driebe EM, Beck-Sague CM et al. Многоцентровое исследование урогенитальных хламидийных инфекций у детей, оцениваемых на предмет сексуального насилия.Материалы 11-го Международного симпозиума по хламидийным инфекциям человека. 2006; Онтарио, Канада: 89-92.
- Центры по контролю и профилактике заболеваний. Скрининговые тесты для выявления инфекций Chlamydia trachomatis и Neisseria gonorrhoeae – 2002. MMWR. 2002; 51 (№ РР-15): 1-38.
- Miller WC, Ford CA, Morris M et al. Распространенность хламидийных и гонококковых инфекций среди молодых людей в США. ДЖАМА. 2004; 291: 2229-2236.
- Arcari CM, Gaydos JC, Howell MR, McKee JKT, Gaydos CA.Осуществимость и краткосрочные последствия связанного обучения и вмешательств по скринингу мочи на хламидиоз и гонорею у мужчин-новобранцев. Sex Transm Dis. 2004; 31: 443-447.
- Blake DR, Gaydos CA, Quinn TC. Анализ экономической эффективности скрининга подростков мужского пола на Chlamydia trachomatis при поступлении в тюрьму. Sex Transm Dis. 2004; 31: 85-95.
- Блейк Д.Р., Куинн Т.С., Гайдос К.А. Следует ли включать в программы скрининга на хламидиоз мужчин без симптомов заболевания? Экономическая эффективность скрининга на хламидиоз среди мужчин и женщин, поступающих в национальную программу профессионального обучения.Sex Tansmit Dis. 2008; 35: 91-101.
- Ван Л.Ю., Бурштейн Г.Р., Коэн Д.А. Экономическая оценка школьной программы скрининга на заболевания, передаваемые половым путем. Sex Tansmit Dis. 2002; 29: 737-745.
- Gift TL, Lincoln T, Tuthill R et al. Оценка экономической эффективности программы скрининга мужчин на хламидиоз в тюрьмах и ее влияние на их партнеров в сообществе. Sex Tansmit Dis. 2006; 33 доп: S103-S110.
- Chen H, Macaluso M, Vermund SH, Hook IEW. Относительная точность тестов амплификации нуклеиновых кислот и посева при обнаружении хламидиоза у бессимптомных мужчин.J Clin Micro. 2001; 39: 3927-3937.
- Mertz KJ, McQuillin GM, Levine WC et al. Пилотное исследование распространенности хламидийной инфекции в рамках национального обследования домашних хозяйств. Секс Транс Дис. 1998; 25: 225-228.
- Cecil JA, Howell MR, Tawes JJ et al. Особенности заражения Chlamydia trachomatis и Neisseria gonorrhoeae у мужчин-новобранцев. J Infect Dis. 2001; 184: 1216-1219.
- Schachter J. Chlamydia trachomatis: чем больше смотришь, тем больше находишь — сколько там? Sex Transmit Dis.1998; 25: 229-231.
- Black CM, Marrazzo JM, Johnson RE et al. Прямое многоцентровое сравнение тестов ДНК-зонда и амплификации нуклеиновых кислот на Chlamydia trachomatis у женщин, выполненных с использованием улучшенного эталонного стандарта. J Clin Microbiol. 2002; 40: 3757-3763.
- Asbel LE, Newbern AC, Salmon M, Испания CV, Goldberg M. Школьный скрининг на Chlamydia trachomatis и Neisseria gonorrhoeae среди учащихся государственных средних школ Филадельфии. Sex Tansmit Dis. 2006; 33: 614-620.
- Joesoef MR, Mosure DJ. Распространенность хламидиоза среди молодых мужчин в США. По результатам недавно введенного всеобщего скрининга в рамках Национальной программы профессионального обучения. Sex Tansmit Dis. 2006; 33: 636-639.
- Mehta SD, Rothman RE, Kelen GD, Quinn T.C., Zenilman J.M.Клинические аспекты диагностики гонореи и хламидиозной инфекции в условиях неотложной помощи. Clin Infect Dis. 2001; 32: 655-659.
- Gaydos CA, Hardick J, Willard N. et al. Скрининг бессимптомных мужчин на Chlamydia trachomais и Neisseria gonorrhoeae в условиях центра заключения.Internat J ЗППП и СПИД. 2001; 12 (приложение 2): 83-85.
- Mertz KJ, Schwebke JR, Gaydos CA, Beidinger HA, Tulloch SD, Levine WC. Скрининг женщин в тюрьмах на хламидийную и гонококковую инфекцию с использованием анализов мочи: осуществимость, приемлемость, распространенность и показатели лечения. Секс Транс Дис. 2002; 29: 271-276.
- Plitt SS, Garfein RS, Gaydos CA, Strathdee SA, Sherman SG, Taha TE. Распространенность и корреляты инфекций Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis и бактериального вагиноза среди группы молодых потребителей инъекционных наркотиков в Балтиморе, штат Мэриленд.Секс Транс Дис. 2005; 32: 446-453.
- Гримли Д.М., Аннанг Л., Льюис И. и др. Инфекции, передающиеся половым путем, среди клиентов городских приютов. Sex Tansmit Dis. 2006; 33: 666-669.
- Marrazzo JM, Ellen JM, Kent C.K. и другие. Приемлемость скрининга мочи на Chlamydia trachomatis для бессимптомных молодых мужчин и их поставщиков. Sex Tansmit Dis. 2006; 34: 147-153.
- Monroe KW, Weiss HL, Jones M, Hook III EW. Приемлемость скрининга мочи на Neisseria gonorrhoeae и Chlamydia trachomatis у подростков в городском отделении неотложной помощи.Sex Transmit Dis. 2003; 33: 850-853.
- Gaydos CA, Crotchfelt KA, Howell MR, Kralian S, Hauptman P, Quinn TC. Анализы молекулярной амплификации для выявления хламидийных инфекций в образцах мочи учениц старших классов и для мониторинга устойчивости хламидийной ДНК после терапии. J Infect Dis. 1998; 177: 417-424.
- Workowski KA, Lampe MF, Wong KG, Watts MB, Stamm WE. Долгосрочное искоренение генитальной инфекции Chlamydia trachomatis после антимикробной терапии. ДЖАМА. 1993; 270: 2071-2075.
- 38. Центры по контролю и профилактике заболеваний. Руководство по лечению заболеваний, передающихся половым путем, 2006 г. MMWR 4 августа 2006 г .; 55 (№ RR-11): 1-100. доступно по адресу www.cdc.gov/std/treatment/2006/rr5511.pdf. (ошибка опубликована в еженедельном выпуске MMWR от 15 сентября 2006 г., том 55, № 36 (дата обращения 28.02.07). CDC. 2007.
- Schachter J, Chow JM, Howard H, Bolan G., Moncada J. Обнаружение Chlamydia trachomatis с помощью тестирования на амплификацию нуклеиновых кислот: наша оценка показывает, что подходы, рекомендованные CDC для подтверждающего тестирования, нецелесообразны.J Clin Microbiol. 2006; 44: 2512-2517.
- Blake DR, Gaydos CA, Quinn TC. Анализ экономической эффективности скрининга подростков мужского пола на Chlamydia trachomatis при поступлении в тюрьму. Sex Transm Dis. 2004; 31: 85-95.
- Блейк Д.Р., Куинн Т.С., Гайдос К.А. Следует ли включать в программы скрининга на хламидиоз мужчин без симптомов заболевания? Экономическая эффективность скрининга на хламидиоз среди мужчин и женщин, поступающих в национальную программу профессионального обучения. Sex Transmit Dis. 2008; 35: 91-101.
183194: Хламидиоз / гонококк, NAA | Labcorp
Вариант 1: Gen-Probe® Aptima® Эндоцервикальный, мужской уретральный или вагинальный тампон
Эндоцервикальный тампон: Удалите лишнюю слизь из зева шейки матки и окружающей слизистой оболочки с помощью чистящего тампона (тампона с белым стержнем в пакет с красной печатью). Выбросьте этот тампон. Вставьте тампон для забора образцов (тампон с синим стержнем в упаковке с зеленой печатью) в эндоцервикальный канал. Осторожно поверните тампон по часовой стрелке в течение 10–30 секунд в эндоцервикальном канале, чтобы обеспечить надлежащий отбор пробы. Осторожно извлеките тампон; избегать попадания на слизистую влагалища. Снимите колпачок с пробирки для транспортировки образцов и немедленно поместите тампон для сбора образцов в транспортировочную трубку. Осторожно сломайте стержень тампона по линии разреза; будьте осторожны, чтобы избежать разбрызгивания содержимого.Плотно закройте трубку для транспортировки образцов тампона.
Мазок из уретры у мужчин: Пациент не должен был мочиться в течение как минимум одного часа до сбора образца. Вставьте тампон для сбора образцов (тампон с синим стержнем в упаковке с зеленой печатью) на 2–4 см в уретру. Осторожно поверните тампон по часовой стрелке в течение двух-трех секунд в уретре, чтобы обеспечить надлежащий отбор пробы. Осторожно извлеките тампон. Снимите колпачок с пробирки для транспортировки образцов и немедленно поместите тампон для сбора образцов в трубку для транспортировки образцов.Осторожно сломайте стержень тампона по линии разреза; будьте осторожны, чтобы избежать разбрызгивания содержимого. Плотно закройте трубку для транспортировки образцов тампона.
Вагинальный тампон: Образец врача: Соберите образец вагинальной жидкости с помощью набора для вагинального тампона Gen-Probe® Aptima®, приложив тампон к нижней трети стенки влагалища и вращая тампон в течение 10-30 секунд, чтобы впитывать жидкость. Немедленно поместите тампон в транспортировочную трубку и осторожно сломайте стержень тампона о стенку трубки.Плотно закрутите колпачок. Самовывоз пациентом: Частично откройте упаковку набора для тампона из влагалища Gen-Probe® Aptima®. Не касайтесь мягким наконечником и не кладите тампон. Если прикоснулись к мягкому наконечнику, тампон положили или уронили, используйте новый набор для сбора образцов тампона Aptima®. Удалите тампон. Осторожно введите тампон во влагалище на расстоянии около двух дюймов от входа и осторожно вращайте тампон в течение 10–30 секунд, убедившись, что тампон касается стенок влагалища, чтобы тампоном впиталась влага.Извлеките тампон, не касаясь кожи. Немедленно поместите тампон в транспортировочную трубку и осторожно сломайте стержень тампона о стенку трубки. Плотно закрутите колпачок.
Вариант 2: Образец мочи: Пациент не должен мочиться в течение как минимум одного часа до сбора образца. Посоветуйте пациенту внести мочу первого сбора (примерно 20–30 мл исходной струи мочи) в емкость для сбора мочи без каких-либо консервантов.Сбор больших объемов мочи может привести к разбавлению образца, что может снизить чувствительность теста; меньшие объемы могут не привести к адекватному вымыванию организмов в образце. Пациентам женского пола следует , а не очистить губную область перед сдачей образца. Добавьте мочу в устройство для сбора мочи Aptima® Combo 2. Окончательный объем должен находиться между двумя черными линиями на устройстве (около 2 мл).
Вариант 3: Образец для цитологии на жидкой основе
ThinPrep® Vial — Веник или щетка / шпатель
Методика взятия метлы: Взять образец из шейки матки с помощью устройства, похожего на метлу. вставив часть щетки в зев шейки матки, а затем поверните щетку пять раз.Промойте устройство для сбора в растворе PreservCyt®, нажав щеткой на дно флакона 10 раз, заставляя щетинки сгибаться в стороны, чтобы высвободить цервикальный материал. В качестве последнего шага энергично вращайте щетку между большим и указательным пальцами, чтобы высвободить клеточный материал. Выбросьте устройство для сбора. Затяните крышку на флаконе ThinPrep® так, чтобы линия крутящего момента на крышке проходила через линию крутящего момента на флаконе.
Кисть / шпатель: Вставьте щетку в эндоцервикальный канал так, чтобы обнажились только самые нижние волокна.Медленно поверните щетку на ¼ до ½ оборота в одном направлении. Не переверните щетку , а не . Затем поверните кисть в растворе PreservCyt® 10 раз, прижимая ее к стенке флакона ThinPrep®. Сильно покрутите щетку, чтобы высвободить дополнительный материал. Выбросьте кисть. Возьмите адекватный образец эктоцервикса с помощью пластикового шпателя. Энергично перемешайте флакон ThinPrep® 10 раз и выбросьте шпатель. Затяните крышку на контейнере ThinPrep® так, чтобы линия крутящего момента на крышке проходила линии крутящего момента на флаконе.
LOINC 23838-6 — рРНК Chlamydia trachomatis [наличие] в генитальной жидкости с помощью зонда
Описание деталей
LP14298-1 Chlamydia trachomatis
Chlamydia trachomatis — один из трех видов бактерий рода Chlamydia, семейства Chlamydiaceae, класса Chlamydiae. C. trachomatis была обнаружена только в клетках человека. Он вызывает уретрит, эпидидимит и проктит у мужчин и цервицит, сальпингит, уретрит и проктит у женщин.C. trachomatis также был обнаружен у некоторых пациентов с заболеванием височно-нижнечелюстного сустава (ВНЧС). Его можно лечить любым из нескольких антибиотиков, таких как азитромицин, эритромицин или доксициклинтетрациклин. C. trachomatis был первым хламидийным агентом, обнаруженным у человека. Он состоит из двух биоваров человека: трахомы и венерической лимфогранулемы (LGV). Многие, но не все штаммы C. trachomatis имеют внехромосомную плазмиду. Текст об авторских правах доступен по лицензии Creative Commons Attribution / Share-Alike.Подробнее см. Http://creativecommons.org/licenses/by-sa/3.0/. Источник: Википедия, Chlamydia trachomatis (Википедия)
LP14298-1 Chlamydia trachomatis
Виды хламидий, вызывающие различные заболевания глаз и мочеполовой системы. Источник: Национальная медицинская библиотека, MeSH 2006
LP37619-1 рРНК Chlamydia trachomatis
Зонд нуклеиновой кислоты для амплификации мишени, который использует захват мишени для качественного обнаружения и дифференциации рибосомной РНК (рРНК) из Chlamydia trachomatis in vitro.Образцы включают мазки из влагалища и мужского уретры, а также образцы женской и мужской мочи. Chlamydia trachomatis — причина номер один заболеваний, передающихся половым путем в Соединенных Штатах. Младенцы, рожденные женщинами с хламидийной инфекцией шейки матки, подвержены риску заражения инфекцией во время родов через естественные родовые пути. Источник: Институт Регенстриф
Хламидийные инфекции — Knowledge @ AMBOSS
Последнее обновление: 9 февраля 2021 г.
Резюме
Chlamydiaceae — это семейство грамотрицательных облигатных внутриклеточных бактерий, которое включает 3 патогенных для человека организма: Chlamydia trachomatis, Chlamydophila pneumydophila и Chlamydophila pneumydophila. .C. trachomatis можно разделить на серотипы A – C, D – K и L1 – L3. Серотипы A – C в основном поражают глаза и вызывают трахому. Инфекция серотипов D – K может привести к инфекциям мочеполовой системы (например, вагиниту, ВЗОМТ, уретриту), конъюнктивиту и детской пневмонии. Серотипы L1 – L3, в свою очередь, приводят к венерической лимфогранулеме, передаваемой половым путем. В то время как C. pneumoniae и C. psittaci в первую очередь влияют на дыхательную систему, C. psittaci также вызывает орнитоз. Хламидийные инфекции чаще всего диагностируются на основании клинических проявлений и лечатся доксициклином или макролидами.Во всех случаях хламидийной инфекции, передающейся половым путем, следует как можно скорее начать ускоренную партнерскую терапию. Подробнее обо всех глазных проявлениях читайте в статье «Конъюнктивит».
Общие
Общие характеристики
Жизненный цикл
- Первая фаза: элементарные тельца (маленькие и плотные тельца, характеризующие инфекционную стадию Chlamydiaceae; стабильные во внеклеточной среде и почти неактивные метаболически) [1]
- Присоединение внеклеточных элементарных тел к клеткам-мишеням (в основном на респираторном или урогенитальном эпителии)
- Эндоцитоз
- Превращение в сетчатые тела в эндосоме
- Вторая фаза: сетчатые тельца (представляют собой облигатную внутриклеточную, репликативную и метаболически активную форму Chlamydiaceae)
- Репликация путем деления и агрегации различных сетчатых тел в эндосоме (в этот момент они называются телами включения)
- Превращение сетчатых тел в элементарные тела
- Лизис эндосом
- Освобождение новообразованных элементарных тел и выход из ячейки
- Новое начало цикла
Элементарные тела выживают в окружающей среде, проникают в клетку посредством эндоцитоза и эволюционируют в сетчатые тела.
Сетчатые тела Реплицируются в клетке и реорганизуются в элементарные тела.
Характеристики
Хламидийная пневмония
Детская пневмония, вызванная Chlamydia trachomatis (серотипы D – K)
Chlamydophila pneumoniae
- Передача: передача выделений из дыхательных путей от человека к человеку в виде аэрозолей [8]
- Инкубационный период: 3-4 недели.
- Клинические особенности
- Диагностика [6] [10]
- Лечение
- Осложнения [8]
Chlamydophila psittaci (пситтакоз, «попугайная лихорадка» или орнитоз)
[11]- Трансмиссия
- В воздухе; (возбудители из фекалий и / или перхоти инфицированных птиц)
- В основном поражает людей, контактирующих с птицами или домашними животными, находящимися на свободном выгуле, или возникает как профессиональное заболевание.
- Инкубационный период: 5–14 дней [11]
- Клинические особенности: Симптомы могут сильно различаться.
- Диагностика [12]
- Лечение
- Осложнения [11] [13]
Chlamydophila psittaci накапливается у попугаев и других птиц и вызывает атипичную пневмонию.
Пситтакоз является заболеванием, о котором необходимо уведомлять, и о нем следует сообщать в большинстве штатов.
Инфекции, передаваемые половым путем
Хламидийные мочеполовые инфекции
Венерическая лимфогранулема
[22]C.trachomatis серотипов L1-L3 вызывают венерную лимфогранулему.
Венерическая лимфогранулема (возбудитель: Chlamydia trachomatis серотипов L1 – L3) не следует путать с паховой гранулемой или донованозом (возбудитель: Klebsiella granulomatis).
Список литературы
- Эпиднадзор за заболеваниями, передаваемыми половым путем, 2014 г .: хламидиоз. https://www.cdc.gov/std/stats14/chlamydia.htm . Обновлено: 17 ноября 2015 г. Доступ: 25 сентября 2016 г.
- Марраццо Дж. Клинические проявления и диагностика инфекций, вызванных Chlamydia trachomatis. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-chlamydia-trachomatis-infections?source=machineLearning&search=chlamydia&selectedTitle=2%7E150&anchor=h326885=63§ion ноября 5, 2015. Дата обращения: 5 сентября 2016 г..
- Мейер Т.Диагностические процедуры для выявления инфекций Chlamydia trachomatis. Микроорганизмы . 2016; 4 (3): стр.25. DOI: 10.3390 / microorganisms4030025. | Открыть в режиме чтения QxMD
- Руководство по лечению заболеваний, передающихся половым путем, 2015 г. http://www.cdc.gov/std/tg2015/chlamydia.htm . Обновлено: 4 июня 2015 г. Доступ: 25 сентября 2016 г.
- Марраццо Дж. Лечение инфекции Chlamydia trachomatis.В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/treatment-of-chlamydia-trachomatis-infection?source=machineLearning&search=chlamydia&selectedTitle=1~150§ionRank=1&anchor=H5622559#H5622559, последнее обновление: января 2016 г., последнее обновление: января 2016 г. 25 сентября 2016 г.
- Swygard H, Seña AC, Cohen MS. Лечение неосложненных гонококковых инфекций. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. http: // www.uptodate.com/contents/treatment-of-uncomplicated-gonococcal-infections?source=see_link#H7889919 . Последнее обновление: 21 июля 2016 г. Дата обращения: 25 сентября 2016 г.
- Marrazzo J. Клинические проявления и диагностика Chlamydia trachomatis инфекции. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-chlamydia-trachomatis-infections?source=machineLearning&search=chlamydia&selectedTitle=2~150§ionRank=3&anchor=h32688563#Последнее обновление: 5 ноября 2015 г. Дата обращения: 25 сентября 2016 г.
- Рекомендации по лабораторному выявлению Chlamydia trachomatis и Neisseria gonorrhoeae — 2014. http://www.cdc.gov/mmwr/preview/mmwrhtml/rr6302a1.htm . Обновлено: 14 марта 2014 г. Доступ: 19 марта 2019 г.
- Зенилман Дж. Венерическая лимфогранулема. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/lymphogranuloma-venereum?source=search_result&search=lymphogranuloma+inguinale&selectedTitle=1%7E43 .Последнее обновление: 23 декабря 2015 г. Дата обращения: 25 сентября 2016 г.
- Венерическая лимфогранулема (LGV). https://www.cdc.gov/std/tg2015/lgv.htm . Обновлено: 4 июня 2015 г. Доступ: 1 октября 2020 г.
- Pammi M, Hammerschlag MR. Инфекции Chlamydia trachomatis у новорожденных. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/chlamydia-trachomatis-infections-in-the-newborn?source=machineLearning&search=chlamydia+trachomatis+pneumonia&selectedTitle=1%7E150&anchor=h141§ion279.Последнее обновление: 21 сентября 2016 г. Дата обращения: 25 сентября 2016 г.
- Фалькоу С., Розенберг Э., Шлейфер К. Х., Стакебрандт Э. Прокариоты: Vol. 7. Протеобактерии: подклассы Delta и Epsilon. Глубоко укоренившиеся бактерии . Springer Science & Business Media ; 2006 г. : п. 749
- Хламидийные инфекции — Руководство по лечению заболеваний, передающихся половым путем, 2015 г. https://www.cdc.gov/std/tg2015/chlamydia.htm . . Доступ: 19 июня 2020 г.
- Мишра К., Бхардвадж П., Мишра А., Кошик А. Острая респираторная инфекция Chlamydia trachomatis у младенцев. Журнал мировых инфекционных болезней . 2011; 3 (3): с.216. DOI: 10.4103 / 0974-777x.83525. | Открыть в режиме чтения QxMD
- Chlamydia pneumoniae Инфекция. http://www.cdc.gov/pneumonia/atypical/c-pneumoniae.html . Обновлено: 7 февраля 2014 г.Доступ: 25 сентября 2016 г.
- Залезник Д.Ф. Пневмония, вызванная Chlamydia pneumoniae, у взрослых. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/pneumonia-caused-by-chlamydia-pneumoniae-in-adults?source=machineLearning&search=chlamydia+pneumonia&selectedTitle=1~47§ionRank=3&anchor updated=H5#Last5 . 3, 2016. Дата обращения: 25 сентября 2016 г..
- Барон Э. Дж., Миллер Дж. М., Вайнштейн М. П. и др.Руководство по использованию микробиологической лаборатории для диагностики инфекционных заболеваний: Рекомендации Американского общества инфекционистов (IDSA) и Американского общества микробиологов (ASM) 2013 г. a. Клинические инфекционные болезни . 2013; 57 год (4): p.e22-e121. DOI: 10,1093 / cid / cit278. | Открыть в режиме чтения QxMD
- Пситтакоз. http://www.cdc.gov/pneumonia/atypical/psittacosis.html . Обновлено: 7 июля 2016 г.Доступ: 25 сентября 2016 г.
- Balsamo G, Maxted AM, Midla JW и др. Сборник мер по борьбе с инфекцией Chlamydia psittaci среди людей (Psittacosis) и домашних птиц (птичий хламидиоз), 2017. J Avian Med Surg . 2017; 31 год (3): с.262-282. DOI: 10.1647 / 217-265. | Открыть в режиме чтения QxMD
- Стюардсон AJ, Грейсон ML. Пситтакоз. Инфекция Dis Clin North Am . 2010; 24 (1): стр.7-25. DOI: 10.1016 / j.idc.2009.10.003. | Открыть в режиме чтения QxMD
- Stanberry LR, Bernstein DI. Заболевания, передающиеся половым путем . Академическая пресса ; 2000 г.
- Люгер А. [Эпидемиология, клинические аспекты и терапия инфекций, вызываемых Chlamydia trachomatis серотипа D-K] .. Wien Klin Wochenschr . 1989; 99 : с.1-14.
- Залезник Д.Ф. Пневмония, вызванная Chlamydia pneumoniae, у взрослых.В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. http://www.uptodate.com/contents/pneumonia-caused-by-chlamydia-pneumoniae-in-adults?source=search_result&search=chlamydia+pneumonia&selectedTitle=1~19 .


 Методика заключается в окрашивании мазка особыми красителями. При наличии хламидий они святятся в поле зрения микроскопа. Точность теста – около 50%.
Методика заключается в окрашивании мазка особыми красителями. При наличии хламидий они святятся в поле зрения микроскопа. Точность теста – около 50%.