Клиническая анатомия протоков поджелудочной железы
1. Агафонов А. А. Новые данные о хирургической анатомии желчных и панкреатических протоков / А. А. Агафонов, Р. 3. Нариманов // Казан, мед. журнал. 1981. — № 4. — С. 35-38.
2. Акжигитов Г. Н. Острый панкреатит / Г. Н. Акжигитов. М.: Медицина, 1974. — 167 с.
3. Алексе Р. О. Сонографическое изучение панкреатического протока до и после стимуляции секретином / Р. О. Алексе, А. Я. Анцанс // Восьмой республиканский съезд терапевтов Белорусской ССР: Тез. докл., дек. 1990 г. Минск, 1990. — С. 58-59.
4. Алиджанов Ф. Б. Трансдуоденальная папиллосфинктеропластика в неотложной хирургии билиарной системы / Ф. Б. Алиджанов: Автореф. дис. канд. мед. наук: 14.00.27 / Ташк. гос. мед. ин-т. Ташкент, 1988. — 16 с.
5. Аляви Р. А. Отношение поджелудочной железы к общему желчному протоку / Р. А. Аляви // Вопросы морфологии: Сб. трудов / Самаркандский мед. ин-т им. акад. И. П. Павлова. Ташкент: Медицина, 1965. — Т. 35. — С. 147-149.
6. Аминов Г. А. Индивидуальная изменчивость взаимоотношения поджелудочной железы с чревным стволом и верхней брыжеечной артерией / Г. А. Аминов // Здравоохранение Туркменистана. 1980. -№ 10.- С. 10-12.
7. Анатомия кролика /В. Н. Жеденов, С. С. Бигдан, В. П. Лукьянова, Е. П. Самборская, Г. М. Удовин, К. И. Яншин. М.: Советская наука, 1957. -310 с.
8. Андрейцева О. И. Диагностика и лечение околососочковых дивертикулов двенадцатиперстной кишки / О. И. Андрейцева: Автореф. дис. . канд. мед. наук: 14.00.27 / Рос. гос. мед. ун-т. М., 1993.-23 с.
9. Андрющенко В. П. Новые подходы к решению проблемы холангита в хирургии билиарного тракта / В. П. Андрющенко // Материалы I Всесоюзной конференции по хирургии печени и желчных путей, 14-15 ноября 1991 г.-Ташкент, 1991С. 10-12.
10. Аниханова М. Д. Детали топографии интрадуоденального и панкреатического отделов общего желчного протока / М. Д. Аниханова // Вестн. хирургии им. И. И. Грекова. 1960. — Т. 85. — № 10. — С. 30-35.
11. Арендт Р. Эндоскопическая сфинктеротомия при билиарном панкреатите / Р. Арендт, С. Либе, К. Эрдман // Современные аспекты теоретической и практической гастроэнтерологии: Сб. науч. трудов / Риж. мед. ин-т/ Отв. ред. Н. А. Скуя. 1988. — С. 214—216.
12. Артемьева Н. Н. Значение эндоскопической папиллосфинктеротомии в хирургии желчных путей / Н. Н. Артемьева, И. П. Савинов, М. В. Пузань // Вестн. хирургии им. И. И. Грекова. 1989. — № 10. — С. 29-33.
13. Аруин Л. И. Морфологическое изучение фатерова соска по материалам прицельных биопсий / Л. И. Аруин, Ю. В. Васильев, В. С. Городинская // Актуальные вопросы гастроэнтерологии. М., 1979. — С. 298-305.
14. Атанов Ю. П. Панкреонекроз (Клиника, диагностика, лечение) / Ю. П. Атанов: Автореф. дис. . д-ра мед. наук. М., 1986. -40 с.
15. Атанов Ю. П. Клинико-морфологические признаки различных форм деструктивного панкреатита / Ю. П. Атанов // Хирургия. 1991. — № 11.-С. 62-69.
16. Багдасаров В. В. Тактика лечения билиарного панкреатита (патогенетическое обосновагие) / В. В. Багдасаров: Автореф. дис. . д-ра мед. наук. М., 1995. — 40 с.
В. Багдасаров: Автореф. дис. . д-ра мед. наук. М., 1995. — 40 с.
17. Балалыкин В. Д. Нетипичные способы операции эндоскопической папиллосфинктеротомии / В. Д. Балалыкин: Автореф. дис. . канд. мед. наук: 14.00.27 / Моск. обл. научно-иссл. клинич. ин-т им. М. Ф. Владимирского. М., 1988. — 22 с.
18. Балалыкин В. Д. Нетипичные способы эндоскопической папиллотомии / В. Д. Балалыкин // Эндоскопическая хирургия: Материалы 1 междунар. регион, науч.-практ. конф. врачей Дал. Востока и Сибири. Южно-Сахалинск, 23-25 августа 1993 г. М., 1993. — С. 32-34.
19. Барденикова С. И. Сфинктер Одди и холестаз / С И. Барденикова, С. А. Годулян, В. И. Пугачева, Л. Я. Бульба // Патология желчевыводящих путей: Сб. науч. тр. / Моск. мед. стоматол. ин-т им. Н. А. Семашко / Под ред. Л. П.Воробьева. 1987.-С. 17-19.
20. Башкин А. Д. Структурные преобразования поджелудочной железы человека в пренатальном и раннем постнатальном онтогенезе / А. Д. Башкин: Автореф. дис. . канд. мед. наук: 14.00.02 / Яросл.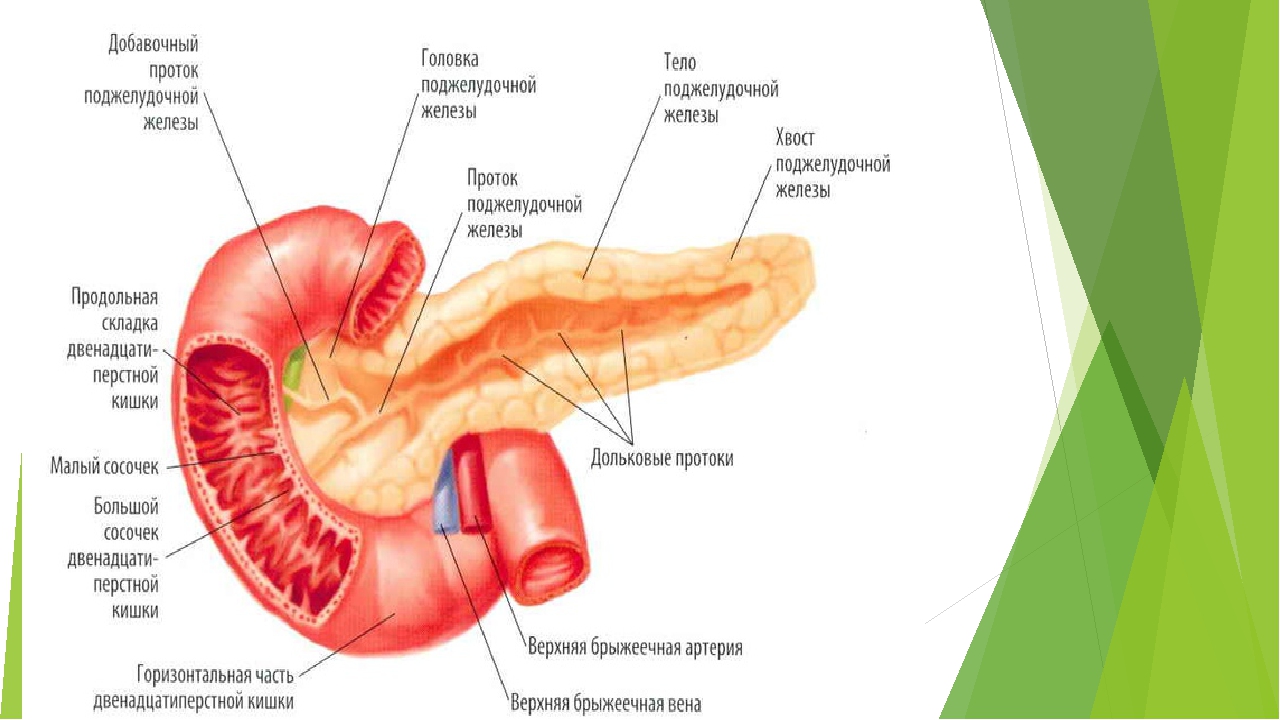 д. ин-т. Ярославль, 1988. — 20 с.
д. ин-т. Ярославль, 1988. — 20 с.
21. Башняк В. В. Сиктопия поджелудочной железы / В. В. Башняк // Клиническая хирургия. 1950. — № 11. — С. 19-30.
22. Белозор И. С. Архитектура выводных протоков поджелудочной железы и её значение в хирургии / И. С. Белозор /У Вестник хирургии. 1934. -№ 12.-С. 97-99.
23. Белый И. С. Деструктивный панкреатит / И. С. Белый, В. И. Десятерик, Р. Ш. Вахтангишвили. Киев: Здоров’я, 1986. — 128 с.ie ‘ • t ■ „ r j» >,щ »■*»162
24. Березов В. Д. Внутренний рельеф большого дуоденального соска при холециститах и панкреатитах / В. Д. Березов, Л. JI. Шимкевич // Архив патологии. 1983.-Т. 45.-№ 10.-С. 52-55.
25. Богер М. М. Панкреатиты: физиологические и патофизиологические аспекты / М. М. Богер. Новосибирск: Наука, 1984. — 218 с.
26. Богомолова А. П. Артериальные дуги в области головки поджелудочной железы человека / А. П. Богомолова // Архив анатомии, гистологии и эмбриологии. 1957. — Т. 35. — № 5. — С. 60-63.
27. Богомолова А. П. К топографии протоков поджелудочной железы человека и взаимоотношения главного протока железы с желчным протоком / А. П. Богомолова // Труды 6-го Всесоюн. съезда анатомов, гис гологов, эмбриологов. 1961. — Т. 2. — С. 406-408.
П. К топографии протоков поджелудочной железы человека и взаимоотношения главного протока железы с желчным протоком / А. П. Богомолова // Труды 6-го Всесоюн. съезда анатомов, гис гологов, эмбриологов. 1961. — Т. 2. — С. 406-408.
28. Божко Г. Г. Диагностика и лечение стеноза большого дуоденального сосочка / Г. Г. Божко: Автореф. дис. . канд. мед. наук: 14.00.27 / Белорус, гос. ин-т усоверш. врачей. Минск, 1994. — 25 с.
29. Бойко Ю. Г. Актуальные аспекты острого деструктивного панкреатита /Ю. Г. Бойко // Архив патологии, 1998.-№ 1.-С. 64-67.
30. Болдак И. И. Анатомо-экспериментальное обоснование резекций поджелудочной железы / И. И. Болдак: Автореф. дис. . канд. мед. наук. М., 1969.- 18 с.
31. Ботезату Г. А. Кровоизлияния в поджелудочную железу при острой смерти в судебно-медицинской практике / Г. А. Ботезату, Г. X. Когеля, Г. П. Блувштейн // Судебно-медицинские записки. Кишинёв, 1971. -Вып. 5.-С. 91-94.
32. Брискин Б. С. Хирургическое лечение панкреатита / Б. С. Брискин // Российский журнал гастроэнтерологии, гепатологии, колопрологии. -2000. № 2. — С. 67-74.
С. Брискин // Российский журнал гастроэнтерологии, гепатологии, колопрологии. -2000. № 2. — С. 67-74.
33. Вайль С. С. Об изменениях печени и поджелудочной железы при поражениях фатерова сосочка / С. С. Вайль // Архив пат. анатомии и пат. физиол. 1940. -№ 1-2. — С. 57-66.
34. Васильев Ю. В. Диагностика поражений большого дуоденального соска и эндоскопическая сфинктеротомия / Ю. В. Васильев, С. А. Зеленикин // Болезни гепатобилиарной системы и поджелудочной железы. М.: ЦНИИ гастроэнтерологии, 1984. — С. 105-113.
35. Вересова А. А. Сочетание заболевания желчекаменной болезни с язвой двенадцатиперстной кишки / А. А. Вересова // Клин. Медицина. 1972. -Т. 50.-№ 11.-С. 39-42.
36. Веронский Г. И. Острый послеоперационный панкреатит при папиллосфинктеротомии / Г. И. Веронский, В. Г. Вискунов // Вестн. хирургии им. И. И. Грекова. 1988.-№ 11.-С. 118-120.
37. Веронский Г. И. Окклюзия протоков поджелудочной железы при панкреонекрозе / Г. И. Веронский, С. Г. Штофин, Ю. А. Мартынов, В. Н. Григорьев // Хирургия. 1993. — № 9. — С. 54-58.
Мартынов, В. Н. Григорьев // Хирургия. 1993. — № 9. — С. 54-58.
38. Виноградов В. В. Заболевания фатерова соска / В. В. Виноградов. М.: Медгиз, 1962.- 124 с.
39. Виноградов В. В. Патогенез некоторых форм панкреатита / В. В. Виноградов, Ф. В. Базилевич, М. С. Медведева // Клинич. хирургия. -1978.-№ 11.-С. 1-5.
40. Виноградов В. С Папиллосфинктеротомия / В. В. Виноградов, П. И. Зима, Ф. А. Брагин, Т. А. Любфалиев // Хирургия. 1981. — № 10. — С. 6.
41. Виноградов В. В. Обтурационный панкреатит / В. В. Виноградов, Ф. В. Базилевич, П. И. Зима, В. И. Денисенк // Панкреонекроз: диагностика и лечение. М„ 1987. — С. 19-24.
42. Вискунов В. Г. Панкреонекрозы / В. Г. Вискунов. Новосибирск: ВО «Наука», 1995.-257 с.
43. Владимиров В. Г. Острый панкреатит (экспериментально-клинические исследования) / В. Г. Владимиров, В. И. Сергиенко. М.: Медицина, 1986.-240 с.
44. Гвоздухин А. П. Раннее развитие протоков поджелудочной железы человека / А. П. Гвоздухин // Гистогенез и патоморфология тканевых структур: Сб. трудов / Крымский мед. ин-т. Симферополь, 1973. — Т. 52.-С. 85-87.
трудов / Крымский мед. ин-т. Симферополь, 1973. — Т. 52.-С. 85-87.
45. Гидинов А. А. Теоретические основы электромиографии / А. А. Гидинов. Л.: Наука, 1975. — 181 с.
46. Гладенин В. Ф. Материалы к хирургической анатомии поджелудочной железы и ее выводных протоков / В. Ф. Гладенин: Автореф. дис. . канд. мед. наук. Саратов, 1965. — 12 с.
47. Гладкий Е. Ю. Клинико-экспериментальные аспекты функциональной топографии панкреатодуоденального комплекса / Е. Ю. Гладкий: Автореф. дис. . канд. мед. наук. Краснодар, 2000. — 19 с.
48. Голубев А. С. Эндоскопическая папиллосфинктеротомия в комплексе интенсивной терапии острого панкреатита / А. С. Голубев // Реанимация и интенсивная терапия в неотложной хирургии: Респ. сб. науч. тр. / Отв. ред. А. П. Кузьмичев. М., 1987. — С. 80-84.
49. Голубев А. С. Эндоскопическая папиллосфинктеротомия в комплексном лечении острого панкреатита / А. С. Голубев: Автореф. дис. . канд. мед. наук: 14.00.27 / Моск. НИИ скорой помощи им. Н. В.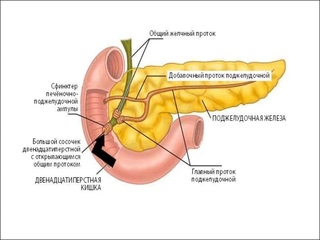 Склифосовского. М., 1989. — 15 с.
Склифосовского. М., 1989. — 15 с.
50. Горшкова С. М. О функциональных взаимоотношениях сфинктера Одди и желчного пузыря в процессе желчевыделения при рефлекторных воздействиях с кишечника / С. М. Горшкова // Мед. журнал. Казань, 1960. — № 4. — С. 45.
51. Гостищев В. К. Заболевания большого дуоденального сосочка как причина постхолецистэктомического синдрома / В. К. Гостищев, В. И. Мисник, И. Д. Канарский, Р. А. Меграбян, А. Д. Гурьев, Ю. С. Комелев //Хирургия. 1991.-№ 2.-С. 3-6.
52. Гришин И. Н. Хирургия поджелудочной железы: Справ. Пособие / И. Н. Гришин, Г. И. Аскальдович, И. Л. Мадорский. Мн.: Выш. шк., 1993.-231 С.
53. Губергриц А. Я. Хронические болезни поджелудочной железы / А. Я. Губергриц. Киев: Здоров’я, 1984. — 128 с.
54. Гугушвили Л. Л. Хирургическая анатомия и артериальное кровоснабжение внепеченочных желчных протоков / Л. Л. Гугушвили //
55. Труды института им. Н. В. Склифосовского. М., 1958. — Т. 4. — № 2. -С.180-198.
56. Гудимов Б. С. Особенности топографии протоков поджелудочной железы и корней воротной вены / Б. С. Гудимов, К. Н. Тарун // Здравоохранение Белоруссии. 1982. — № 4. — С. 32-34.
С. Особенности топографии протоков поджелудочной железы и корней воротной вены / Б. С. Гудимов, К. Н. Тарун // Здравоохранение Белоруссии. 1982. — № 4. — С. 32-34.
57. Данилов М. В. Хирургия поджелудочной железы: Руководство для врачей / М. В. Данилов, В. Д. Федоров. М.: Медицина, 1995. — 510 с.
58. Должиков А. А. Структура большого сосочка двенадцатиперстной кишки (сравнительно-морфологическое и экспериментальное исследование) / А. А. Должиков. М., 1997. — 41 с.
59. Едемский А. И. Морфологические особенности строения большого дуоденального сосочка в норме и при патологии билиопанкреатической области / А. И. Едемский // Архив патологии. -1983. Т. 45. — Вып. 9. — С. 42-48.
60. Едемский А. И. Анатомо-стереологическая характеристика слизистой оболочки большого сосочка двенадцатиперстной кишки / А. И. Едемский, А. В. Свищев // Архив анатомии, гистологии и эмбриологии. 1986. — Т. 90. — № 3. — С. 61-66.
61. Едемский А. И. Патологическая анатомия заболеваний большого сосочка двенадцатиперстной кишки (вопросы этиологии, морфо- и патогенеза, классификации) / А.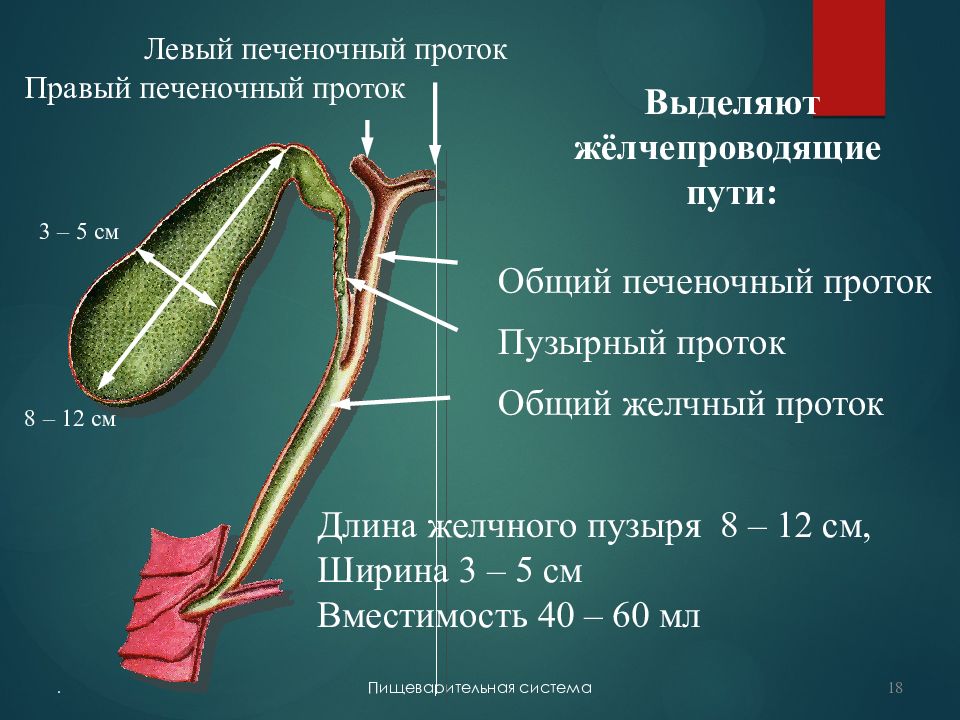 И. Едемский: Автореф. дис. . докт. мед. наук. М., 1987. — 39 с.
И. Едемский: Автореф. дис. . докт. мед. наук. М., 1987. — 39 с.
62. Елецкая О. И. Особенности строения протоков поджелудочной железы и их значение в хирургии / О. И. Елецкая // Вестн. хирургии им. И. И. Грекова. 1960. — Т. 84. — № 2. — С. 15-20.
63. Елецкая О. И. Артерии и протоки поджелудочной железы / О. И. Елецкая // Труды VII Всесоюзного съезда анатомов, гистологов и эмбриологов. Тбилиси, 6-12 июня 1966 г. Тбилиси, 1969. — С. 502503.
64. Ермолов А. С. Эндоскопическая папиллотомия: Обзор / А. С. Ермолов, И. А. Жарахович, А. А. Гукасян // Хирургия. 1991. — № 3. — С. 129134 с.
65. Жарков В. П. Структурные основы барьерных свойств эпителия главного протока поджелудочной железы некоторых млекопитающих / В. П. Жарков, В. Н. Ярыгин, А. А. Должиков // Бюл. эксперим. биологии и медицины. 1994. — № 11. — С. 514-516.
66. Железное Л. М. Использование магнитно-резонансной и компьютерной томографии в изучении прижизненной анатомии и топографии поджелудочной железы человека / Л. М. Железное // Магнитный резонанс в медицине. 1997. — С. 92.
М. Железное // Магнитный резонанс в медицине. 1997. — С. 92.
67. Жуков Н. А. Возрастные функциональные и морфологические особенности поджелудочной железы и их клини ¡еское значение / Н. А. Жуков: Автореф. дис. . д-ра мед. наук. Томск, 1965. -41 с.
68. Жуков Н. А. Сфинктер Одди, причины и механизмы нарушения его функции / Н. А. Жуков // Российский гастроэнтерологический журнал. -2000. №2.-С. 55-61.
69. Заблоцкий Ю. В. Операции, дренирующие протоковую систему поджелудочной железы, в лечении острого панкреатита / Ю. В. Заблоцкий: Автореф. дис. . канд. мед. наук: 14.00.27 / Киев. мед. ин-т им. А. А. Богомольца. Киев, 1990. — 20 с.
70. Заводнов В. Я. Эндоскопическое изучение слизистой оболочки большого дуоденального соска / В. Я. Заводнов, В. С. Городинская //
71. Актуальные вопросы гастроэнтерологии: Сб. трудов / ЦНИИ гастроэнтерологии. М., 1976. — Т. 2. — С. 128-132.
72. Захаров Н. А. Диагностика и лечение спазма и стеноза сфинктера Одди / Н. А. Захаров // Вопросы клинической хирургии. Барнаул, 1963. — С. 230-237.
Барнаул, 1963. — С. 230-237.
73. Зеленикин С. А. Эндоскопическая панкреатохолангиография и сфинктеротомия в диагностике поражений фатерова соска / С. А. Зеленикин // Российский гастроэнтерологический журнал. 1998. — № 2.-С. 60-61.
74. Иванов В. И. Методические аспекты рентгеноэндоскопического исследования панкреатобилиарной системы / В. И. Иванов // Весты, рентгенологии и радиологии. 1991. — № 4. — С. 26-31.
75. Киселёв И. И. Протоки поджелудочной железы и взаимоотношение их с желчными протоками / И. И. Киселёв: Автореф. дис. .канд. мед. наук. 1939,- 16 с.
76. Клименко Г. А. Кинохолангиография и некоторые функции фатерова сосочкА / Г. А. Клименко, А. М. Левендюк, Ф. Т. Воробьев, Ю. Л. Шальков // Вестн. хирургии им. И. И. Грекова. 1972. — Т. 108. — № 4. -С. 35-39.
77. Климов П. К. Биоэлектрическая активность желчного пузыря, сфинктера Одди, сфинктера Люткенса и антрального отдела желудка /
78. П. К. Климов, В. И. Котельникова // Физиол. журн. СССР им.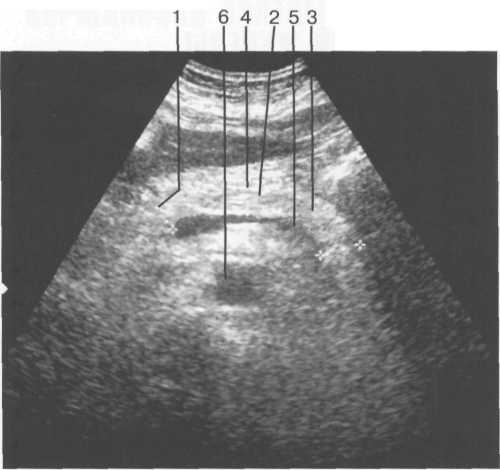 И. М. Сеченова.- 1973.-Т. 59.-№ 1.-С. 140-155.
И. М. Сеченова.- 1973.-Т. 59.-№ 1.-С. 140-155.
79. Климов П. К. Выход желчи и биоэлектрическая активность органов пищеварительного тракта / П. К. Климов, В. И. Котельникова, В. Н. Устинов // Физиол. журн. СССР им. И. М. Сеченова. 1974. — № 3. — С. 1249-1260.
80. Климов П. К. Функциональные взаимосвязи в пищеварительной системе / П. К. Климов. Л.: Наука, 1979. — 270 с.
81. Ковалев А. И. Причины развития острого панкреатита после ЭРПХГ и вмешательств на БДС / А. И. Ковалев, А. А. Соколов, А. Кашек // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 69-70.
82. Козырев М. А. Способ профилактики холангита при папиллосфинктеротомии / М. А. Козырев // Материалы I Всесоюзной конференции по хирургии печени и желчных путей. Ташкент, 14-15 ноября 1991 г.-Ташкент, 1991.-С. 102-103.
83. Колесников Л. Л. Сфинктерный аппарат человека / Л. Л. Колесников. -С.-Пб.: Спецлит, 2000. -183 с.
84. Комкова Т. Б. Новые методы хирургического лечения заболеваний поджелудочной железы / Т.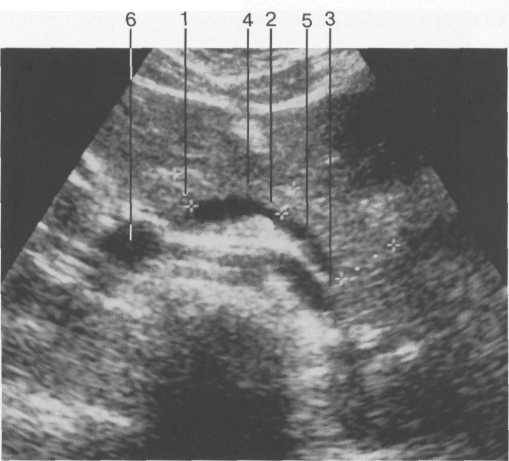 Б. Комкова: Дис. . д-ра мед. наук. -Томск, 1995.-235 с.
Б. Комкова: Дис. . д-ра мед. наук. -Томск, 1995.-235 с.
85. Королева Т. С. К анатомии сфинктера общего желчного протока (сфинктера Одди) / Т. С. Королева: Автореф. дис. . канд. мед. наук. -Л., 1948,- 18 с.
86. Коротько Г. Ф. Секреция поджелудочной железы / Г. Ф. Коротько. -М.: «Триада-Х», 2002. 224 с.
87. Костюк Г. Я. Последствия повышения давления в протоках поджелудочной железы / Г. Я. Костюк, С. П. Жученко, Л. И. Ланский, П. Л. Потолочный, Ю. В. Заблоцкий // Клин, хирургия. 1991. — № 11. -С. 21-22.
88. Коченков Д. П. Некоторые вопросы хирургической тактики при панкреонекрозе / Д. П. Коченков, Ю. В. Иванов, В. Ю. Дубинин // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 54.
89. Кочнев О. С. Интраоперационная перфузионная холангиоманометрия в оценке функционального состояния сфинктера Одди / О. С. Кочнев, В. 3. Ситдиков // Казанский мед. журнал. 1991. — № 2. — С. 96-100.
90. Крендаль А. П. Рентгеноэндоскопическое исследование желчных путей после эндоскопической папиллосфинктеротомии / А. П. Крендаль, В. Ф. Аныкин, Н. В. Сударикова, Н. М. Тильман // Вестн. рентгенологии и радиологии. 1989. — № 1. — С. 89.
Рентгеноэндоскопическое исследование желчных путей после эндоскопической папиллосфинктеротомии / А. П. Крендаль, В. Ф. Аныкин, Н. В. Сударикова, Н. М. Тильман // Вестн. рентгенологии и радиологии. 1989. — № 1. — С. 89.
91. Крутикова И. Ф. Кровеносные сосуды и протоки поджелудочной железы человека / И. Ф. Крутикова //Архив анатомии, гистологии и эмбриологии. -1958. Т. 35. — № 5. — С. 27-32.
92. Крутикова И. Ф. Морфогенез секреторного дерева, стромы поджелудочной железы и ее кровеносного русла / И. Ф. Крутикова // Материалы IX научной конференции по возрастной морфологии, физиологии и биохимии. М., 1969. — Т. 1. — С. 235-236.
93. Крутикова И. Ф. О сегментарном строении поджелудочной железы в применении к технике ее резекции / И. Ф. Крутикова // Труды Ленинград, общ-ва анатомов, гистологов и эмбриологов. 1969. — № 1. -С. 100-103.
94. Кузин М. И. Хронический панкреатит / М. И. Кузин, М. В. Данилов, Д. Ф. Благовидов. М.: Медицина, 1985. — 368 с.
95. Лепорский Н.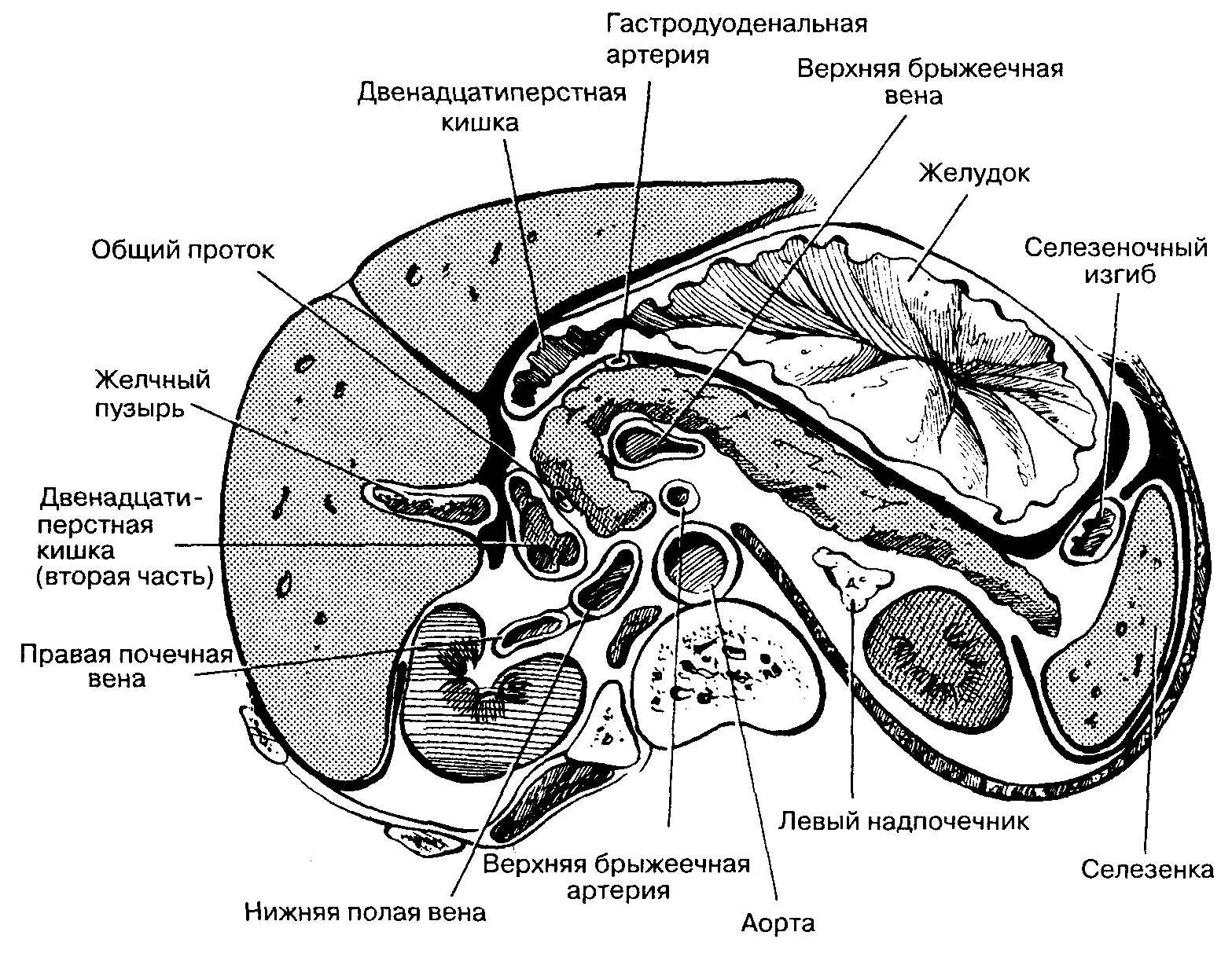 И. Болезни поджелудочной железы / Н. И. Лепорский. -М., 1951.-С. 24-25.
И. Болезни поджелудочной железы / Н. И. Лепорский. -М., 1951.-С. 24-25.
96. Лопухин Ю. М. Экспериментальная хирургия / Ю. М. Лопухин. М.: Медицина, 1971.-С. 286.
97. Лукоянова Г. М. Хирургическое лечение хронического панкреатита, обусловленного врожденным стенозом вирсунгова протока у ребенка 8 лет / Г. М. Лукоянова, В. П. Обрядов, А. Н. Дикушин, Э. И. Еголина // Нижегород. мед. журн. 1991. -№ 1. — С. 70-71.
98. Лященко С. Н. Микрохирургическая анатомия большого дуоденального сосочка и сфинктера печеночно-поджелудочной ампулы /С. Н. Лященко//Морфология, 1999.-Т. 116. — № 5. — С. 50-53.
99. Майборода Ю. Н. Развитие выводных протоков печени, поджелудочной железы и их нервного аппарата / Ю. Н. Майборода //
100. Регуляция морфогенеза и регенерации пищеварительных желез. Л., 1974.-С. 92-93.
101. Майборода Ю. Н. Развитие нервных и тканевых компонентов выводных протоков печени, поджелудочной железы и сфинктера Одди в эмбриогенезе человека / Ю. Н. Майборода // Архив анатомии, гистологии и эмбриологии. 1976. — Т. 70. — № 2. — С. 47-50.
1976. — Т. 70. — № 2. — С. 47-50.
102. Майборода Ю. Н. Развитие дуоденального сосочка и его нервного аппарата у человека / Ю. Н. Майборода // Вопросы иннервации внутренних органов: Сб. трудов / Ставропольский мед. ин-т. -Ставрополь, 1978. С. 79-87.
103. Майборода Ю. Н. Развитие желчных и панкреатических протоков и их нервного аппарата в эмбриогенезе человека / Ю. Н. Майборода: Автореф. дис. . канд. мед. наук. Ярославль, 1979. -23 с.
104. Малкерова H. Н. Возможности дуоденоскопии и эндоскопической панкреато- и холангиографии в выявлении заболеваний большого дуоденального соска, желчных и панкреатических протоков / H. Н. Малкерова: Автореф. дис. . канд. мед. наук.-М., 1977.-21 с.
105. Малле-Ги П. Синдром после холецистэктомии / П. Малле-Ги, П. Ж. Кестенс. М.: Медицина, 1973. — 138 с.
106. Мартынов Ю. А. Лечение деструктивных форм острого панкреатита окклюзией протоковой системы поджелудочной железы / Ю. А. Мартынов: Автореф. дис. . канд. мед. наук: 14.00.27 / Новосиб.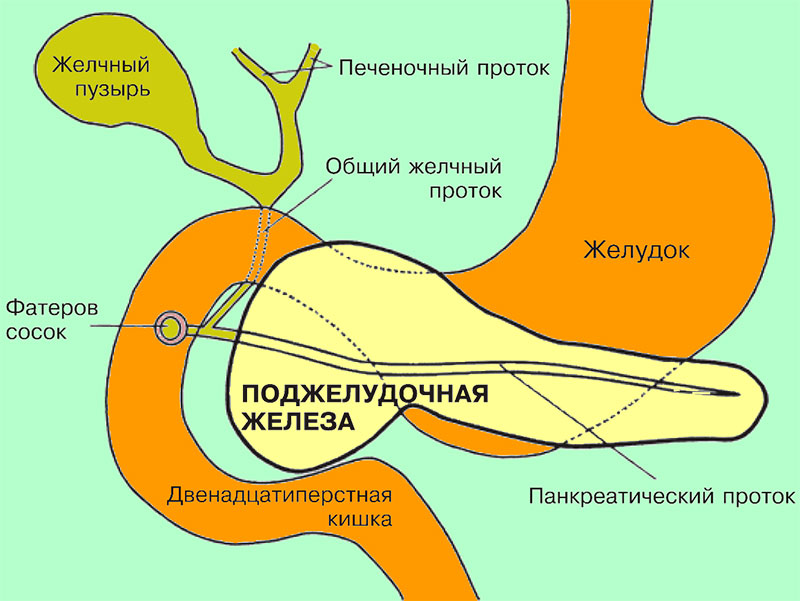 мед. ин-т. Новосибирск, 1991. — 17 с.
мед. ин-т. Новосибирск, 1991. — 17 с.
107. Мартынов Ю. А. Лечение деструктивного панкреатита окклюзией панкреатических протоков / Ю. А. Мартынов, С. Г. Штофин // Заболевания поджелудочной железы. Новосибирск, 1992. — С. 11-12.
108. Маслов С. Н. Анатомическое строение протоков поджелудочной железы с учётом их внутриутробного развития / С. Н. Маслов, А. П. Гвоздухин // Труды Крым. мед. ин-та. 1973. — Т. 49. — С. 56-59.
109. Медведева М. С. Папилломатоз устья большого дуоденального сосочка у больных хроническим рецидивирующгч панкреатитом (по данным операционных биопсий) / М. С. Медведева // Архив патологии. 1979.- Т. 41.-№4.-С. 56-59.
110. Медведева М. С. Опухоли и опухолеподобные процессы большого сосочка двенадцатиперстной кишки / М. С. Медведева, Т. В. Саввина // Патологоанатомическая диагностика опухолей человека: Руководство.- М.: Медицина, 1993. С. 105-113.
111. Миланов О. Б. О так называемых дуоденобилиарных связях в патологии желчных протоков и поджелудочной железы / О. Б. Миланов // Хирургия. 1969. — № 11. — С. 56-63.
Б. Миланов // Хирургия. 1969. — № 11. — С. 56-63.
112. Михайличенко В. А. Строение протоков поджелудочной железы / В. А. Михайличенко // Клиническая хирургия. 1962. — № 8. — С. 52-55.
113. Мишин В. Ю. Результаты оперативного лечения деструктивного панкреатита / В. Ю. Мишин, А. П. Квезерова, А. А. Билокур // IX
114. Мясников А. Д. К методике изготовления коррозионных препаратов поджелудочной железы /А. Д. Мясников // Архив анатомии, гистологии и эмбриологии. 1960.-Т. 39.-№ 12.-С. 106-107.
115. Мясников А. Д. К вопросу о взаимоотношениях общего желчного протока и внутриорганных сосудов поджелудочной железы /А. Д. Мясников // Сб. трудов Курского мед. ин-та. Курск, 1961. — Вып. 15. -С.221-226.
116. Мясников А. Д. К патогенезу панкреатитов (анатомо-топографическое и экспериментальное исследование) /А. Д. Мясников: Автореф. дис. . д-ра мед. наук. М., 1972. — 30 с.
117. Мясников А. Д. Субмукозная папиллосфинктеротомия / А. Д. Мясников, А. Ф. Жмакин, А. И. Едемский // Актуальные вопросы хирургической гастроэнтерологии: Тез. докл. к науч. конф. / Отв. ред. А. В. Завьялов. Курск, 1987. — С. 40-41.
докл. к науч. конф. / Отв. ред. А. В. Завьялов. Курск, 1987. — С. 40-41.
118. Назаренко П. M. Хирургическая анатомия большого дуоденального соска / П. Н. Назаренко: Автореф. дис. . канд. мед. наук. Харьков, 1969.- 18 с.
119. Нестеренко Ю. А. Морфофункциональные аспекты в хирургии хронического панкреатита / Ю. А. Нестеренко, С. Г. Шаповальянц, О. Б. Зубков // Хирургия. 1993. — № 10. — С. 19-24.
120. Нестеренко Ю. А. Основные принципы лечения больных острым панкреатитом / Ю. А. Нестеренко, С. Г. Шаповальянц, В. В. Лаптев, С. В. Михайлусов // Хирургия. 1994. — № 1. — С. 3-6.
121. Нестеров С. С. Некоторые особенности строения выводной системы поджелудочной железы (рентгено-анатомическое исследование) / С. С. Нестеров // Хирургия. 1962. — № 11. — С. 67-73.
122. Новаковский А. Р. Лучевая диагностика спазма сфинктера Одди / А. Р. Новаковский: Автореф. дис. . канд. мед. наук: 14.00.19 / Казан, гос. ин-т усоверш. врачей им В. И. Ленина. Казань, 1988. — 23 с.
123. Образов И. М. Пломбировка протоков поджелудочной железы при хроническом панкреатите (Экспериментально-клиническое исследование) / И. М. Образов: Автореф. дис. . канд. мед. наук: 14.00.27 / 1 Ленингр. мед. ин-т им. И. П. Павлова. Л., 1990. -17 с.
Образов И. М. Пломбировка протоков поджелудочной железы при хроническом панкреатите (Экспериментально-клиническое исследование) / И. М. Образов: Автореф. дис. . канд. мед. наук: 14.00.27 / 1 Ленингр. мед. ин-т им. И. П. Павлова. Л., 1990. -17 с.
124. Оноприев В. И. Перспективы в изучении патогенеза деструктивного панкреатита / В. И. Оноприев, Г. Ф. Коротько, С. Я. Восканян // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 90-91.
125. Орлов С. Ю. Функциональное состояние сфинктера Одди по данным эндоскопической манометрии / С. Ю. Орлов // Российский журналгастроэнтерологии, тепатологии, колопроктологии. 1994. — Т. 4. — № 4. — С. 28-34.
126. Орлов С. Ю. Изменение функционального состояния сфинктера Одди после эндоскопической папиллосфинктеротомии / С. Ю. Орлов, С. А. Чернякевич, Е. Д. Федоров // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 1997. — № 5. — С. 179.
127. Осипов А. И. Судебно-медицинские аспекты кровоизлияний и некрозов поджелудочной железы / А. И. Осипов, Ю. Н. Бунин, А. А. Сотников, Ю. А. Шамарин // Актуальные вопросы судебной медицины и экспертной практики. Новосибирск, 1999. — № 4. — С. 69-70.
И. Осипов, Ю. Н. Бунин, А. А. Сотников, Ю. А. Шамарин // Актуальные вопросы судебной медицины и экспертной практики. Новосибирск, 1999. — № 4. — С. 69-70.
128. Папазова М. Гастроинтестинальни сфинктери / М. Папазова, И. Лолова. -София: Изд. Болг. АН, 1981.-271 с.
129. Пермяков Н. К. О патогенезе панкреатита / Н. К. Пермяков, А. Е. Подольский // Хирургия. -1973. -№ 9. С. 51-58.
130. Полосатое М. В. Анализ изменений давления в протоках поджелудочной железы / М. В. Полосатое // Бюл. эксперим. биологии и медицины. 1967. — Т. 64. — № 7. — С. 20-23.
131. Пономаренко А. А. Коррекция нарушений проходимости большого сосочка двенадцатиперстной кишки у больных острым билиарнымпанкреатитом / А. А. Пономаренко: Автореф. дис. . канд. мед. наук. -Воронеж, 1992.- 17 с.
132. Пронин О. В. Хирургическая анатомия протоков поджелудочной железы / О. В. Пронин // Вестн. хирургии им. И. И. Грекова. 1957. -Т. 78. — № 6. — С. 37-46.
133. Пронин О. В. Топографо-анатомические взаимоотношения поджелудочной железы и крупных сосудов / О. В. Пронин // Вестн. хирургии им. И. И. Грекова. 1959. — Т. 89. — № 8. — С. 64-69.
В. Пронин // Вестн. хирургии им. И. И. Грекова. 1959. — Т. 89. — № 8. — С. 64-69.
134. Протасевич И. П. Интраорганная архитектоника сосудов и протоков поджелудочной железы / И. П. Протасевич, И. Г. Жук // Хирургия. -1989.-№7.-С. 72-75.
135. Пэттен Б. М. Эмбриология человека / Б. М. Пэттен. М.: Медгиз, 1962. -467 с.
136. Розенман С. 3. Анатомия выводной и кровеносной систем поджелудочной железы человека / С. 3. Розенман: Автореф. дис. . д-ра мед. наук. Волгоград, 1965. — 35 с.
137. Розенман С. 3. Протоки головки поджелудочной железы человека / С. 3. Розенман // Труды Туркменского мед. ин-та. 1971. — Т. 15. — С. 167— 170.
138. Роль изменений большого дуоденального сосочка при заболеваниях органов панкреатобилиарной области // Хирургия. 1993. — № 3. — С. 49-55.
139. Роль изменений большого дуоденального сосочка при заболеваниях органов панкреатобилиарной области / Ю. А. Нестеренко, С. Г. Шаповальянц, О. И. Андрейцева, М. А. Хоконов // Хирургия. 1993. -№ 3.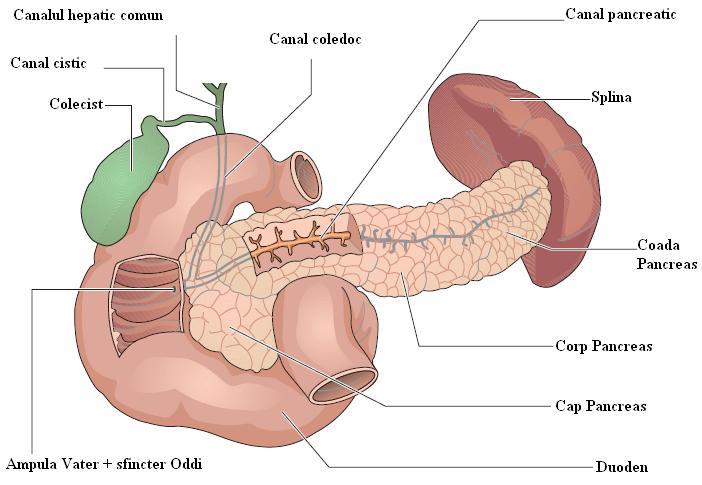 — С. 49-55.
— С. 49-55.
140. Рыбус М. Я. Морфологическая диагностика доброкачественных стенозов фатерова сосочка в клинике / М. Я. Рыбус, Ф. П. Воробьев // 4-й Всерос. съезд патологоанатомов. М., 1977. — С. 52-53.
141. Рылюк А. Ф. Топографическая анатомия и хирургия органов брюшной полости: Практич. Пособие / А. Ф. Рылюк. Минск: Выш. шк., 1997. -319с.
142. Савельев В. С. Острый панкреатит / В. С. Савельев, В. М. Буянов, Ю. В. Огнев. М.: Медицина, 1983. — 238 с.
143. Сажин В. П. Особенности патоморфологии острого алкогольного панкреатита / В. П. Сажин, Ю. А. Ерохин, А. Л. Авдовенко // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 110.
144. Серапинас И. Л. Анатомические взаимоотношения внепеченочных желчных протоков с протоками поджелудочной железы / И. Л. Серапинас // Хирургия. 1981. -№ 1. — С. 52-54.
145. Сидоров А. И. Диагностика и хирургическое лечение ишемических повреждений поджелудочной железы, обусловленных компрессионным стенозом чревного ствола (Клинико-морфологическое исследование) / А.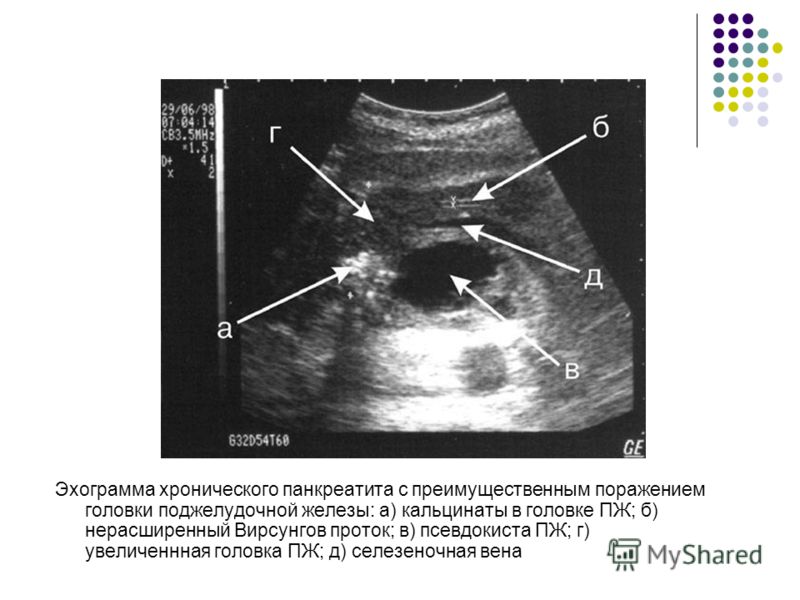 И. Сидоров: Дис. канд. мед. наук. Л., 1989. — 177 с.
И. Сидоров: Дис. канд. мед. наук. Л., 1989. — 177 с.
146. Сильченко В. Н. Морфология стенозирующего папиллита / В. Н. Сильченко, А. С. Костромин // 4-й Всеросс. съезд патологоанатомов. -М., 1977.-С. 55-56.
147. Синев Ю. В. Эндоскопическая папиллосфинктеротомия при остром панкреатите / Ю. В. Синев, А. С. Голубев, С. В. Волков // Хирургия. -1988.-№9.-С. 87-89.
148. Скуя Н. А. Заболевания поджелудочной железы / Н. А. Скуя. М.: Медицина, 1986.-240 с.
149. Соколов В. И. О недостаточности сфинктера Одди при хроническом панкреатите / В. И. Соколов, С. А. Тужилин, А. А. Мовчун // Хирургия. 1972.-№ 1.-С. 92-96.
150. Соколов В. И. Холепанкреатит / В. И. Соколов, К. А. Цыбырнэ. -Кишинев: Штиинца, 1978. 233 с.
151. Соколов J1. К. О клинике и диагностике папиллита \ Л. К. Соколов, Н. Н. Малкерова // Клин, медицина. 1981. -№ 1. — С. 52-55.
152. Сотников А. А. Кровоснабжение жома общего желчного протока / А. А. Сотников // Морфология нервной системы в норме и патологии: Часть II.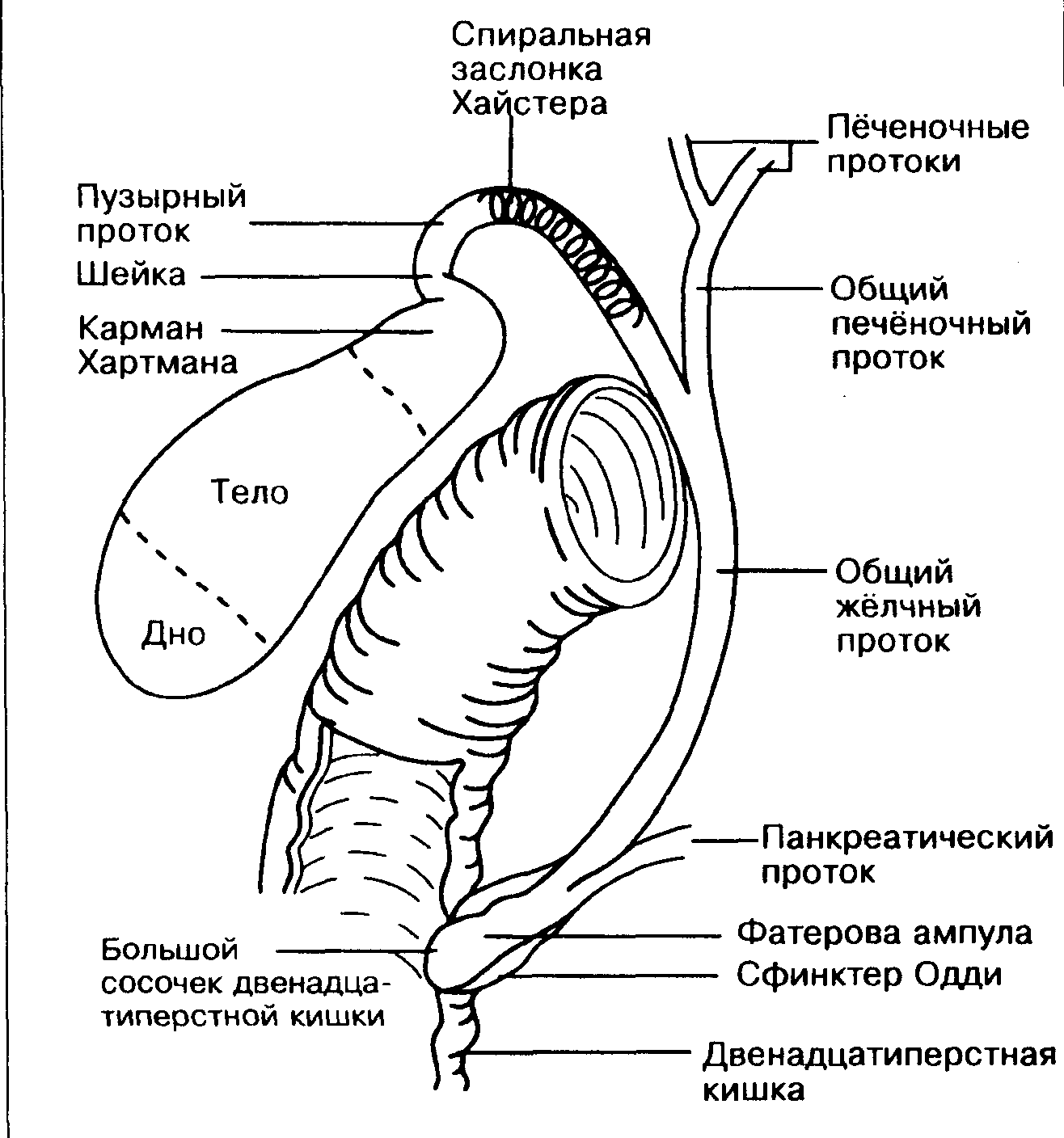 Сосудистая система. Томск, 1980. — С. 35-37.
Сосудистая система. Томск, 1980. — С. 35-37.
153. Сотников А. А. О функциональной взаимосвязи жома Одди и прилежащего отдела двенадцатиперстной кишки / А. А. Сотников // Вопросы теоретической и клинической медицины. Томск, 1980. — С. 29-30.
154. Сотников А. А. Строение сфинктера Одди при различных вариантах впадения общего желчного и панкреатических протоков в двенадцатиперстную кишку / А. А. Сотников, А. И. Осипов //
155. Материалы симпозиума «Сфинктеры пищеварительной системы». -Томск, 1984.-С. 41-43.
156. Сотников А. А. Морфологические предпосылки функциональной автономности сфинктера общего желчного протока / А. А. Сотников // Тез. X Всесоюзного съезда анатомов, гистологов и эмбриологов. -Полтава, 198*.-С. 322.
157. Сотников А. А. Функциональная морфология сфинктера Одди / А. А. Сотников, Ф. Ф. Сакс // Сфинктеры пищеварительной системы в норме и патологии: Материалы Всесоюзного симпозиума. Томск, 1988. — С. 43-44.
158. Сотников А. А. Электрофизиологические основы перистальтического сокращения сфинктера общего желчного протока / А. А. Сотников // Сфинктеры пищеварительной системы в норме и патологии: Материалы Всесоюзного симпозиума. Томск, 1988. — С. 53-54.
А. Сотников // Сфинктеры пищеварительной системы в норме и патологии: Материалы Всесоюзного симпозиума. Томск, 1988. — С. 53-54.
159. Сотников А. А. Функциональная морфология сфинктеров пищеварительного тракта / А. А. Сотников // Бюл. СО АМН СССР. -Новосибирск, 1988. С. 34-35.
160. Сотников А. А. Особенность строения сфинктера Одди при различных вариантах впадения общего желчного и панкреатических протоков вдвенадцатиперстную кишку / А. А. Сотников/ А. А. Сотников // Труды XI съезда АГЭ. Полтава, 1992. — С. 46-47.
161. Сотников А. А. К вопросу о строении сфинктера Одди у новорожденных / А. А. Сотников // Физиология и патология моторной деятельности органов пищеварительного тракта. Томск, 1992. — С. 82-84.
162. Сотников А. А. Механизмы эвакуаторной и антирефлюксной функции сфинктера Одди / А. А. Сотников, В. Ф. Байтингер // Биоритмы пищеварительной системы и гомеостаз: Материалы конференции России и стран СНГ. Томск, 1994. — С. 93-96.
163. Сотников А. А. Морфология сфинктера Одди / А. А. Сотников // Сфинктеры пищеварительного тракта / Под ред. В. Ф. Байтингера. Томск, 1994. — С. 132-151.
А. Сотников // Сфинктеры пищеварительного тракта / Под ред. В. Ф. Байтингера. Томск, 1994. — С. 132-151.
164. Сотников А. А. Клиническая анатомия дуоденальных сосочков / А. А. Сотников // Вопросы реконструктивной и пластической хирургии. -Томск, 2002. № 1. — С. 54-57.
165. Сотников А. А. Локализация очагов геморрагического панкреонекроза при различных вариантах протоковой системы поджелудочной железы / А. А. Сотников // Вопросы реконструктивной и пластической хирургии. Томск, 2002. — № 2. — С. 45-49.
166. Тимошин А. Д. Эхинококкоз поджелудочной железы с обтурацией панкреатического протока / А. Д. Тимошин, Л. А. Помелова // Хирургия. 1992. — № 1. с. 95-97.
167. Толстой А. Д. Острый панкреатит: трудности, возможности, перспективы / А. Д. Толстой. СПб.: Гиппократ, 1997. — 136 с.
168. Толстой А. Д. Деструктивный панкреатит и парапанкреатит / А. Д. Толстой, В. Б. Краснорогов, Р. А. Сотия. СПб.: Гиппократ, 1999. — 126 с.
169. Толстой А. Д. Концепция «обрыва» панкреонекроза / А.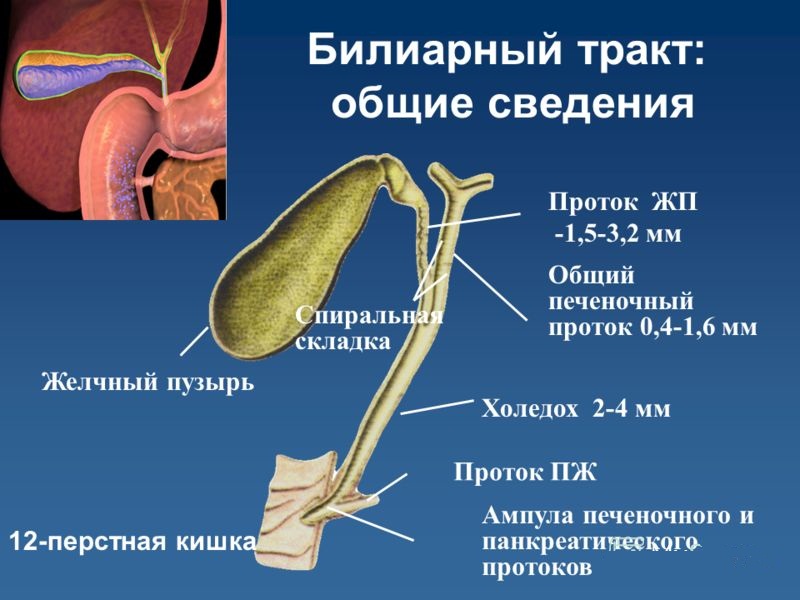 Д. Толстой // Вестн. хирургии им. И. И. Грекова. 2001. — Т. 160. — № 6. — С. 26-30.
Д. Толстой // Вестн. хирургии им. И. И. Грекова. 2001. — Т. 160. — № 6. — С. 26-30.
170. Трунин М. А. Клиническое значение дуоденобилиарного и дуоденопанкреатического рефлюкса / М. А. Трунин, Н. А. Пострелов, Е. Л. Корчемник // Вестн. хирургии им. И. И. Грекова. 1981. — Т. 126. — № 5. — С. 17-21.
171. Устинов В. Н. Биопотенциалы гладких мышц и сократительная деятельность двенадцатиперстной кишки / В. Н. Устинов // Физиол. журнал СССР им. И. М. Сеченова. 1975. -№ 7. — С. 1060-1068.
172. Федоров В. Э. Диагностика и лечение панкреонекроза билиарного происхождения / В. Э. Федоров // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000.-С. 134.
173. Филимонов М. И. Патоморфология стенозирующего папиллооддита / М. И. Филимонов, Е. А. Мугинштейн, И. М. Чудаков // Актуальные вопросы хирургической гастроэнтерологии. Курск, 1979. — С. 158— 160.
174. Филин В. К. Неотложная панкреатология / В. И. Филин, А. Л. Костюченко. СПб/. Питер, 1994. — 416 с.
СПб/. Питер, 1994. — 416 с.
175. Функциональная морфология сфинктеров пищеварительного тракта / Ф. Ф. Сакс, В. Ф. Байтингер, Н. П. Ефимов, А. А. Сотников, О. Б. Чупрова // Бюл. СО АМН СССР. Новосибирск, 1987. — № 2. — С. 4349.
176. Халов Ю. Н. Наш опыт лечения панкреонекроза / Ю. Н. Халов, В. Л. Слувко, Р. Ф. Силищев, П. С. Кирносов, А. Т. Шамгунов // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 121-122.
177. Хальзов В. Л. Окклюзия вирсунгова протока при полном поперечном разрыве поджелудочной железы / В. Л. Хальзов, д. В. Хальзов // IX Всероссийский съезд хирургов: Тез. докл. и сообщ. Волгоград, 20-22 сентября 2000 г. Волгоград, 2000. — С. 121.
178. Хирургическая анатомия живота / Под ред. чл.-кор. АМН СССР профессора А. Н. Максименкова. Л.: Медицина, 1972. — 743 с.
179. Хирургия желчных путей / Под ред. Б. И. Альперовича. Томск, 1997. -605 с.
180. Хромов Б. М. Сфинктеры и клапаны пищеварительной системы и их клиническое значение / Б. М. Хромов. Л., 1976. — 19 с.
М. Хромов. Л., 1976. — 19 с.
181. Худоярова А. Г. Секреция поджелудочной железы в условиях различного гидрстатического давления в ее протоках / А. Г. Худоярова: Автореф. дис. канд. мед. наук: 14.00.17 / Том. гос. мед. ин-т. Томск, 1989.-20 с.
182. Чебыкина Н. В. О функции сфинктера Одди при панкреатобилиарной патологии Н. В. Чебыкина // Гастроэнтерология. Киев, 1975. — Вып. 7. -С. 110-114.
183. Чесноков А. А. Топографо-анатомические обоснования мобилизации и смешения двенадцатиперстной кишки при резекции желудка / А. А. Чесноков: Дис. канд. мед. наук. Томск, 1974. — 211 с.
184. Чесноков А. А. Топография и вариации поджелудочно-двенадцатиперстных артерий / А. А. Чесноков // Морфология нервной системы в норме и патологии: Часть II. Сосудистая система. Томск, 1980.-С. 32-35.
185. Чудаков И. М. Рентгеноанатомия большого дуоденального соска / И. М. Чудаков // Актуальные вопросы хирургической гастроэнтерологии. -Курск, 1981.-С. 134-136.
186. Шадрина Н. С. Внеорганные и внутриорганные связи артерий поджелудочной железы / Н. анального соска / С. А. Шалимов. Киев: Здоровья, 1985. — 147 с.
анального соска / С. А. Шалимов. Киев: Здоровья, 1985. — 147 с.
191. Шалимов С. А. Руководство по экспериментальной хирургии / С. А. Шалимов, А. П. Радзиховский, Л. В. Кейсевич. М.: Медицина, 1989. -272 с.
192. Школьник Е. Б. Некоторые особенности хирургической анатомии общего желчного протока / Е. Б. Школьник // Вестн. хирургии им. И. И. Грекова. 1959. — Т. 82. — № 2. — С. 46-50.
193. Штофин С. Г. Окклюзия протоковой системы поджелудочной железы в лечении ее заболеваний и повреждений / С. Г. Штофин: Автореф. дис. . канд. мед. ьаук. Томск, 1987. — 20 с.
194. Юпатов С. И. О взаимоотношениях общего желчного и вирсунгова протоков / С. И. Юпатов // Труды научной конференции, посвященной 100-летию со дня рождения Н. И. Напалкова. Ростов-на-Дону, 1969. -С. 201-203.
195. Юрченко В. П. Вариантная анатомия поджелудочной железы / В. П. Юрченко // Тез. докл. 5 конгресса Междунар. ассоц. морфологов. Москва, 3 февраля 2000 г. / Морфология. Москва, 2000. — Вып. 3. — С. 142.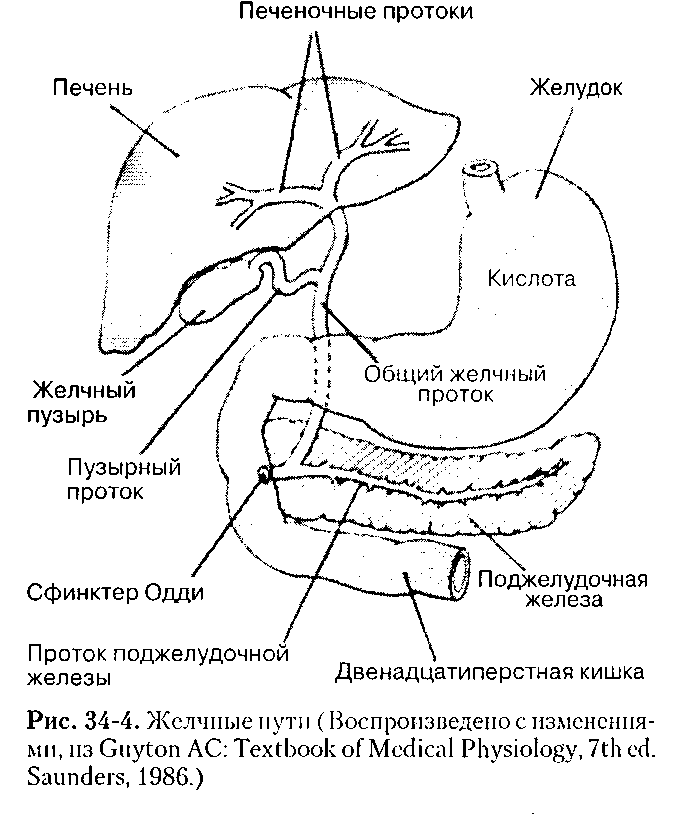
196. Янгибаев 3. Р. Новые способы папиллосфинктеротомии и пагшллосфинктеропластики / 3. Р. Янгибаев // V Съезд хирургов республик Средней Азии и Казахстана: Тез. докл. и сообщ. Ташкент, 20-22 мая 1991 г. Ташкент, 1991. — Часть 2. — С. 325-326.
197. Action of cholecystokinin and caerulein on the rabbit sphincter of Oddi / J. C. Sarles, J. M. Bidart, M. A. Devaux, L. Echinard, A. Castagnini // Digestion. 1976. — Vol. 14. — P. 415-423.
198. Adrenergic innervation and receptors in the sphincter of Oddi /1. Mori, H. Azuma, M. Fujiwara, Y. Chin // Eur. J. Immunol. 1971. — Vol. 17. — P. 365-373.
199. A functional description of the canine choledochoduodene valve / M. F. Tansy, D. L. Innés, J. S. Martin, F. M. Kendall // Am. J. Dig. Dis. 1976. -Vol. 21, №3.-P. 233-241.
200. Akasaka Y. Electromyographic study of the postoperative function of duodenal papilla / Y. Akasaka, M. Nakajima, K. Kawai // Am. J. Gastroenterol. 1976. — Vol. 66, № 4. — P. 337-342.
201. Akute und chronische Pancreatitis im Tierexperiment / J. O. Jost, M. Clemens, K. D. Richter, K. D. Badura //Anat. Anz. 1980. — Bd. 148. — S. 611-613.
O. Jost, M. Clemens, K. D. Richter, K. D. Badura //Anat. Anz. 1980. — Bd. 148. — S. 611-613.
202. Alnor P. C. Die Papillitis stenosans Vateri / P. C. Alnor // Bruns Beitr. Klin. Chir. 1972. -Vol. 219, № 3. — S. 229-240.
203. Altered sphincter of Oddi phasic activity following truncal vagotomy / H. A. Pitt, J. E. Doty, L. Denbesten, S. B. Kuckenbecker // J. Surg. Res. 1982. -Vol. 32, № 6. — P. 598-607.
204. Anuras S. Recurrent or chronic intestinal pseudoobstruction / S. Anuras, J. Christensen // Clin. Gastroenterol. 1981. — Vol. 10. — P. 17-190.
205. Archibald E. The expwrimental production of pancreatitis in animals as the result of the resistance of the common duct sphincter / E. Archibald // Studies Surg. Gynec. Obstet. 1919. — Vol. 28. — P. 529.
206. Baggenstoss G. H. Major duodenal papilla variations of pathology interest and lesions of the mucosae / G. H. Baggenstoss // Arch. path. 1938. — Vol. 26, № 4. — P. 859-868.
207. Baldwin W. M. The pancreatic ducts in Man, together with a study of the microscopical structure of the minor duodenal papilla / W. M. Baldwin // Anat. Rec.- 191 1,-Vol. 5.-P. 197-228.
M. Baldwin // Anat. Rec.- 191 1,-Vol. 5.-P. 197-228.
208. Barraya L. La region oddiene. Anatomic millimétrique / L. Barraya, K. Soler, J. Yvergneaux // Press, med. 1971. — Vol. 79, № 55. — P. 25272534.
209. Becker J. M. Myoelectric control of gastrointestinal and biliary motility / J. M. Becker, M. W. Duff, F. G. Moody // Surgery. 1981. — Vol. 89, № 4. -P. 446-411.
210. Bergh G. S. A demonstration of the independent contraction of the sphincter of the common bile duct in human subjects / G. S. Bergh, J. A. Layne // Am. J. Physiol. 1940. — Vol. 128, № 6. — P. 690-694.
211. Bernard C. Memoire sur le pancreas / C. Bernard. Paris, 1856. — 134 p.
212. Biazotto W. The fine venous architecture of the major duodenal papilla in human beings / W. Biazotto // Anat. Anz. 1990. — Vol. 171, № 2. — P. 105— 108.
213. Bile flow mechanism in man / K. Ono, N. Watanabe, K. Suzuki, H. Tsuchida // Arch. Surg. 1968. — Vol. 96. — P. 868-874.
214. Biliary and gastrointestinal biopotentials following various form of vagotomy / A. Nana, C. Mircioli, E. Neumann, M. Nana // Europ. Surg. Res.- 1969.-Vol. 1.-P. 230-231.
Nana, C. Mircioli, E. Neumann, M. Nana // Europ. Surg. Res.- 1969.-Vol. 1.-P. 230-231.
215. Bock P. Pancreatic duct glands. III. Morphology of secretory epithelium and endoepithclial glands / P. Bock, S. Geleff // Z. microsk. anat. Forsch. 1984.- Vol. 98, № 6. P. 857-872.
216. Bourke J. B. Pressure studies of the choledochoduodenal junction in man and pig / J. B. Bourke, H. G. Ritchie // J. Surg. Res. 1970. — Vol. 57, № 8.- P. 848.
217. Boyden E. A. The sphincter of Oddi in the dog / E. A. Boyden, R. A. Schwegler//Am. J. Physiol. 1936. — Vol. 116,№ l.-P. 14.
218. Boyden E. A. The anatomy of the choledochoduodenal junction in man / E. A. Boyden // Surg., Gynec., Obstetr. 1957. — Vol. 104. — P. 641-652.
219. Boyden E. A. The choledochoduodenal junction in man. A restudy of Oddi’s sphincter / E. A. Boyden // Anat. Rec. 1957. — Vol. 127 № 4. — P. 399.
220. Boyden E. A. The development and structure of the choledochoduodenal junction in whales / E. A. Boyden // Anat. Rec. 1966. — Vol. 154. — № 4. -P. 320.
Rec. 1966. — Vol. 154. — № 4. -P. 320.
221. Brujnes E. Choledochol pressure profilometry followig dilatation, sphincterotomy, sphincteroplasty or diathermic sphincterotomy / E. Brujnes, P. I. Klopper // Hepato-gastroenterology. 1981. — Vol. 28, № 4. — P. 327332.
222. Burlui D. Papillosphincterotomia oddiana / D. Burlui, C. Constantinescu, E. Bratucu // Chirurgie. 1979. — Vol. 27, № 1. — P. 25-36.
223. Burlui D. Sfmcterotomia oddiana in tratamentul colangitei scleroase primitive / D. Burlui, T. Bratucu, E. Bobocescu, C. Dragoucea // Chirurgia. 1981. — Vol. 30, № 3. — P. 191-198.
224. Cai W. Innervation of the gallbladder and biliary pathways in the guinea-pig / W. Cai, G. Gabella // J. Anat. 1983. — Vol. 136, № 2. — P. 97-109.
225. Cai W. The musculature of the gall bladder and biliary pathways in the guinea-pig / W. Cai, G. Gabella // J. Anat. 1983. — Vol. 136, № 2. — P. 237-250.
226. Carlson H. E. Motor action of the canine gastroduodenal junction. A cineradiographic, pressure and elektric study / H.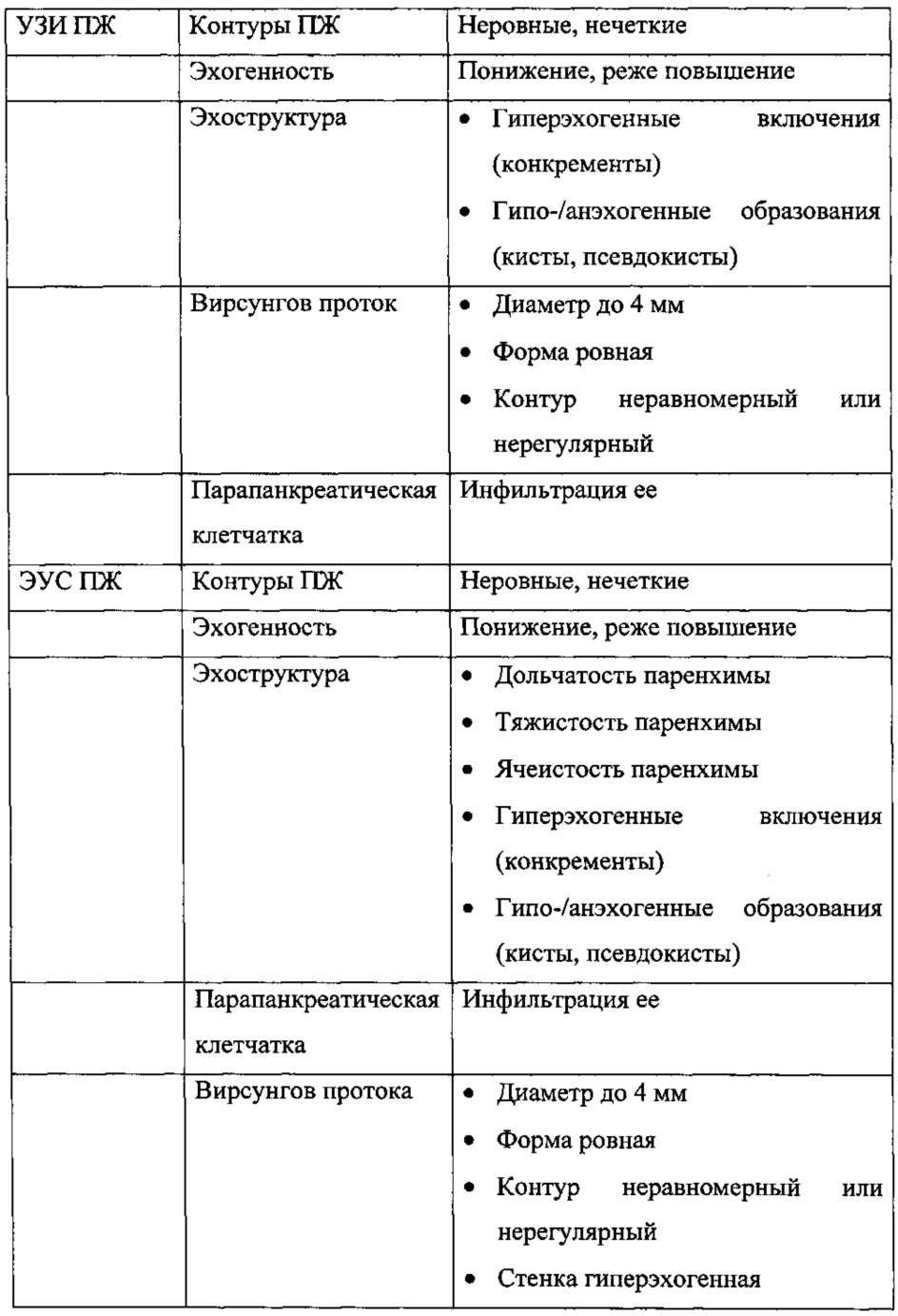 E. Carlson, C. F. Code, R. A. Nelson // Am. J. Dig. Dis. 1966. — Vol. 11. — P. 155.
E. Carlson, C. F. Code, R. A. Nelson // Am. J. Dig. Dis. 1966. — Vol. 11. — P. 155.
227. Carr-Locke D. L. Effect of gut peptides on human sphincter of Oddi function / D. L. Carr-Locke // Ital. J. Gastroenterol. 1986. — Vol. 18. — P. 43-45.
228. Choi T. K. Late result et sphincteroplasty in the treament of primary cholangitis / T. K. Choi, J. M. Wong, K. H. Lam, T. K. Lim, G. B. Ong // Arch. Surg. 1982. — Vol. 116, № 9. — P. 1173-1 175.
229. Common bile duct complications of pancreatitis evaluation and treatment / Ih. R. Gadacz, K. Lilliemoe, M. Zinner, W. Merrill // Surgery. 1983. -Vol. 93, № 2. — P. 235-242.
230. Common-Channel und massive Oberbauchbeschwerden bei Choledocholithiasis / J. Riethmuller, H. P. Haber, M. R. Lobler, M. Stern // Monatsschr Kinderheilkd. 1999. — Vol. 147. — P. 32-34.
231. Contribution of cineradiography of study of the human biliary tract / J. Caroli, P. Porcher, G. Peuchot, M. Delattre // Am. J. Dig. Dis. 1960. — Vol. 5,№7.-P. 677.
232. Cosco-Montaldo M. H. Nuevos conceptos en la fisiopatologia del confluente choledoco-pancreatico-duodenal. El electromanometria y radiocinematografia en operados biliares / M. H. Cosco-Montaldo // Prens. Med. Arg. 1967. — Vol. 54, № 11. — P. 1517-1524.
233. Dalton S. J. Routine magnetic resonance cholangiopancreatography and intraoperatuve cholangiogram in the evaluation of common bile duct stones / S. J. Dalton, S. Balupuri, J. Guest // Br. J. Surg. 2002. — Vol. 89, № 6. — P. 62-63.
234. Daniel E. E. Electrical activity of the small intestine / E. E. Daniel, D. R. Carlow, B. T. Wächter // Gastroenterology. 1959. — Vol. 37, № 2. — P. 268.
235. Dardinski V. J. The anatomy of the major duodenal papilla of man, with special reference ist musculature / V. J. Dardinski // J. Anat. 1935. — Vol. 69, № 4. — P. 469-478.
236. Delmont 1. Le sphincter d’Oddi. Anatomie tradionnelle et anatomie functionnelle /1. Delmont // Gastroent. Clin. Biol. 1979, № 3. — P. 157165.
237. Didio L. J. A. The sphincters of the digestive system / L. J. A. Didio. -Baltimore, 1969.-P. 119-151.
238. Dimagno E. P. Pancreaticobiliary ductal anatomy and pancreatic cancer / E. P. Dimagno, R. G. Shorter, W. F. Taylor // Gastroenterology. 1982. — Vol. 83, №2.-P. 152.
239. Duthie H. L. Electrical activity of gastrointestinal smoot muscle / H. L.
240. Duthie//Gut. 1974.-Vol. 15.-P. 669-681.
241. Eichhorn E. P. The choledochoduodenal junction in the dog a restudy of Oddi’s sphincter / E. P. Eichhorn, E. A. Boyden // Am. J. Anat. — 1955. -Vol. 97.-P. 431-459.
242. Embryogenesis of pancreaticobiliary maljunction inferred from development of duodenal atresia / H. Ando, K. Kaneko, F. Ito, T. Seo, T. Harada, Y. Watanabe // J. Hepatobiliary Pancreat. Surg. 1999. — Vol. 1. — P. 50-54.
243. Endoscopic manometry of the sphincter of Oddi and pancreatic duct in patients with papillary stenosis / T. Ochi, S. Nakazawa, Y. Naito, Y. Tsukamoto // Endoscopy. 1991. — Vol. 23, № 5. — p. 255-258.
244. Endoscopic sphincterotomy for stenosis of sphincter of Oddi / C. Sugawa, D. H. Park, C. E. Lucas, D. Higuchi, K. Ukawa // Surg. Endosc. 2001. -Vol. 15.-P. 1004-1007.
245. Evaluation and treatment of dominant dorsal duct syndrome (pancreas divisum redefined) / A. L. Warshaw, J. F. Simeone, R. H. Schapiro et all. // Am. J. Surg. 1990. — Vol. 159. — P. 59-64.
246. Fernandes-Crus L. Dynamic morphology of the distal end of the common bile duct / L. Fernandes-Crus, R. Pujol-Soler, C. Pera // Chir. Gastroent. -1975. Vol. 9, № 3. — P. 374-384.
247. Fernandes-Crus L. A histological study of the sphincter of Oddi / L. Fernandes-Crus, C. Pera // In: The sphincter Oddi. Basel, 1977. — P. 1320.
248. Fernandes-Crus L. Etude comparative de la cholangiographic selective et de l’examen anatomopathologique du sphincter d’Oddi / L. Fernandes-Crus, R. Pujol-Soler // Rev. Med. Suisse Romande. 1978. — Vol. 98, № 10. — P. 545-552.
249. Floquet I. Is the sphincter of Oddi a really in man? /1. Floquet, J. Laurent, F. Plenat, B. Wartin // The sphincter of Oddi. Basel, 1977. — P. 21-24.
250. Fodisch H. Feingeweblich Studien zur Orthologie und Pathologic der Papilla Vateri / H. Fodisch. Stuttgart, 1972. — 276 s.
251. Franco S. De. Pancreatite acuta sperimentale da lesione papilläre nel ratto / S. De. Franco, R. Lampugnani // Ateneo parm. Acta biomed. 1979. — Vol. 50, № l.-P. 107-112.
252. Giermann H. Stereoskopische und microskopische Untersuchungen zur Pathologic der Schleimhautereliefe und Klappenapparat der Papilla Vateri / H. Giermann, G. Holle // Acta Hepatosplen. (Stattg.). 1961. — Bd. 8, № 4. -S. 189-205.
253. Guindani M. Une technique de sphincterotomie oddienne / M. Guindani, E. Pelizzari, D. Fisogni // J. Chir. (Paris). 1979. — Vol. 116, № 3. — P. 207208.
254. Hadidi A. Pancreatic duct diameter: sonographic measurement in normal subjects / A. Hadidi // J. Clin. Ultrasound. 1983. — Vol. 11, № 1. — P. 1722.
255. Haley-Russel D. Anatomy of the bilioduodenal junction of the opossum / D. Haley-Russel, R. Calabuig, F. G. Moody // Anat. Ree. 1992. — Vol. 232, № 4. — P. 579-586.
256. Hand B. H. An anatomical study of the choledochoduodenal area / B. H. Hand // Brit. J. Surg. 1963. — Vol. 50, № 5. — P. 486-494.
257. Hauge C. W. Common bile duct motility and sphincteric mechanism. Pressure measurements with multiple lumen catheters in dogs / C. W. Hauge, J. B. D. Mark // Ann. Surg. 1967. — Vol. 162. — P. 1028-1038.
258. Hayaski A. Bioelectrographic study on the mechanism of bile discharge in to the duodenum / A. Hayaski // Fukuoka Acta. Med. 1963. — Vol. 54. — P. 307-329.
259. Hein D. Systematische morphologische Untersuchungen über die Papillitis stenosans / D. Hein // Francfurt Z. Pathol. 1964. — Bd. 73. — S. 427-451.
260. Helly K. K. Zur Entwicklungsgeschichte der Pancreasanlagen und der Duodenalpapillen des Menschen / K. K. Helly // Arch. Mikrosk. Anat. -1900.-Vol. 56.-P. 291-307.
261. Hendrickson W. F. On the musculature of the duodenal portion of the common bile-duct and of the sphincter / W. F. Hendrickson // Anat. Anz. -1898.-Vol. 17.-P. 197-216.
262. Hess W. Die Erkrankungen der Gallenwege und des Pancreas / W. Hess. -Stuttgart, 1961.-273 s.
263. Hicken N. F. Anatomy Variations of the Extrahepatic Biliary Systems as Cholangiographie / N. F. Hicken, Q. B. Coray // Studies Surg. Gynecol. Obstet. 1949. — Vol. 88. — P. 323-339.
264. Hirano T. Role of the biliary tract in the pathogenesis of gallstone pancreatitis: an experimental model in rats / T. Hirano, T. Manabe // Med. Seien. Res. 1992. — Vol. 20, № 24. — P. 931-932.
265. Hirose T. Excitatory and inhibitory responses of Oddi’s sphincter in guinea-pigs / T. Hirose, Y. I to // Am. J. Physiol. 1991. — Vol. 260. — P. 615-624.
266. Holle G. Structure and function of the papilla of Vater / G. Holle // German. Med. Monthly. Stuttgart, I960. — Bd. 10, № 5. — S. 328-332.
267. Holle G. Die Vaterische Papille bei chronischer Cholezystitis und Cholelithiasis / G. Holle // Deutsch. Z. Verdau Stoffwechselkr. 1965. — Bd. 25, № 4. — S. 148-150.
268. Immunoelectron cytochemical localization of motilin and substance P in rabbit bile enterochromaffin (EC) cells / Ph. Heitz, J. M. Polak, M. Kasper, C. M. Timson, A. G. Pearse // Histochemistry. 1977. — Vol. 50, № 4. — P. 319-325.
269. Interdiges tive canine pancreatic juice composition and pancreatic reflux and pancreatic sphincter anatomy / F. B. Keane, R. R. Dozois, V. L. W. Go, T. P. Dimagno // Dig. Dis. Seien. -1981.- Vol. 26, № 7. P. 577-584.
270. Ishioka T. Electromyographic study of the choledochoduodenal junction and duodenal wall muscle / T. Ishioka // Tohoku J. exp. Med. 1959. — Vol. 70. — P. 73-84.
271. Ishioka T. Electromyographic studies of the duodenum and the choledochoduodenal junction / T. Ishioka // Jap. J. Smoth. Muscle Res. 1965, № 1. -P. 50-71.
272. Kantor E. Zur Pathogenese der Papillenstenose / E. Kantor // Zbl. Chir. -1974. Bd. 99, № 25. — S. 769-773.
273. Kirk J. Observations on the histology of the choledochoduodenal junction and papilla duodeni, with particular reference to the ampulla of Vater and sphincter of Oddi / J. Kirk // J. Anat. 1944. — Vol. 78. — P. 118-120.
274. Klar E. Neue pathophysiologische Kenntnisse der akuten Pankreatitis / E. Klar, J. Werner // Chirurg. 2000. — Bd. 771. — S. 253-264.
275. Kreilkamp B. L. Variability in the composition of the sphincter of Oddi. A possible factor in the pathologic physiology of the biliary tract / B. L. Kreilkamp, E. A. Boyden // Anat. Ree. 1940. — Vol. 76. — P. 485-497.
276. Kricke E. Das Konstructionsprinzip der Papilla duodeni / E. Kricke // Brus. Beitr. Klin. Chir. 1971. — Bd. 219, № 1. — S. 217-228.
277. Kunath U. 1st die Papilla duodeni ein autonomer Sphincter Ein Beitrag zur funktionellen Morphologie / U. Kunath, H. Hommerding // Res. Exp. Med. -1981.-Vol. 178, № 2. P. 103-116.
278. Kyösola K. Neurohistochemical observations of the nervous control of the sphincteric mechanisms regulating the flow of bile / K. Kyösola // Scand. J. Clin. Lab. Invest. 1973.-Vol. 31.-P. 26.
279. Kyösola K. Cholinesterase histochemistry of the innervation of the smooth muscle sphincters around the terminal intramural part of the ductuscholedochus of the cat and dog / K. Kyosola // Acta. Physiol. Scand. 1974. — Vol. 90. — P. 273-280.
280. Kyosola K. The anatomy and innervation of the sphincter of Oddi in the dog and cat / K. Kyosola, L. Reckardt // Amer. J. Anat. 1974. — Vol. 140. — P. 497-521.
281. Kyosola K. Electron microscopic observations on the innervation of the sphincter of Oddi in the dog / K. Kyosola, L. Reckardt // Cell, and Tissue Res. 1975. — Vol. 161. — P. 167-176.
282. Kyosola K. Structure and innervation of the choledocho-duodenal junction / K. Kyosola // Ann. Chir. et Gynaec. Helsinki, 1976. — Vol. 65, № 192. — P. 135-139.
283. Kyosola K. Sympatho-adrenergic neural control of the sphincter of Oddi of the cat and the dog / K. Kyosola // Tohoku J. Exp. Med. 1979. — Vol. 127, №2.-P. 113-117.
284. Labeyrie E. Evaluation de l’aiverture du sphincter d’Oddi / E. Labeyrie // J. Chir. (Paris). 1976. — Vol. 112. — P. 281-287.
285. Langman I. Medical embryology /1. Langman. 1972. — 262 p.
286. Lempke R. E. The sphincter Oddi and gallbladder function. Preservation of function after section and resection of the sphincter / R. E. Lempke // Ann. Surg. 1960. — Vol. 152. — P. 815-826.
287. Linder H. H. A clinical and anatomical study of anomalous terminations of the common bile duct into duodenum / H. H. Linder, V. A. Pena, R. A. Ruggeri // Ann. Surg. 1976. — Vol. 184, № 5. — P. 626-632.
288. Ludwick J. R. Observation on the smooth muscle and contractile activity of the common bile duct / J. R. Ludwick // Ann. Surg. Vol. 164, № 6. — P. 1041-1050.
289. Ludwick J. R. Contractile and electric activity of the extrahepatic biliary tract and duodenum / J. R. Ludwick, P. Bass // Surg. Gynecol., Obstet. -1967.-Vol. 124.-P. 536-546.
290. Luoma P. Studies on drugs affecting the choledochoduodenal junction in rabbits, with special reference to the action of spasmolytic and analgetic drugs / P. Luoma // Acta Pharmacol, et Toxicil. 1971. — Vol. 29, № 1. — P. 1-55.
291. Lurje A. The Topography of the Extrahepatic Biliar Sages / A. Lurje // Ann. Surg. 1937.-Vol. 105.-P. 161.
292. Lütkens U. Aufbau und Function der extrahepatis en Gallenwege / U. Lütkens. Leipzig: F. C. W. Vogel, 1926. — 258 s.
293. Macellari G. Considerazioni attuali sulla papillosphincterotomia / G. Macellari, U. Baraldi, A. Antamati // Minerva Ckir. 1981. — Vol. 36. — № 3.-P. 131-134.
294. MacPherson B. R. Morphology of canine gallbladder. Scanning electronmicroscope observations onthe epithelium / B. R. MacPherson, G. W. Scott, F. Lennon // Cell and Tissue Res. 1983. — Vol. 233, № 1. — P. 161.
295. Mallet-Guy P. Bilan de 215 operations nerveuses, spldnchnicectomies on gangliectomios coeliagues gauches, pour pancreatite chronigue et recidivante / P. Mallet-Guy // Lion. Chir. 1980. — Vol. 76. — P. 351-373.
296. Margo E. P. Pancreaticobiliary ductal anatomy and pancreatic cancer / E. P. Margo, R. G. Shorter, W. F. Taylor // Gastroenterology. 1982. — Vol. 83, № l.-P. 152.
297. Mattig H. Papilla Vateri. Nórmale und pathologische Function / H. Mattig. -Leipzig, 1977. -216 s.
298. Mawe G. M. Structure, afferent innervation and transmitter content of the gallbladder ganglia: relationship to the enteric nervous system / G. M. Mawe, M. D. Gershon // J. Comp. Neurol. 1989. — Vol. 238. — P. 374-390.
299. Mester Z. The motor function of the sphincter of Oddi and its role in pancreatic reflux / Z. Mester, G. Csanaky, L. Mocsay // J. Intern. Coll. Surg.- 1964.-Vol. 41.-P. 111-126.
300. Mirizzi P. L. Fisiologia del gepatocoledoco EI vaciamiento y replecion de la vesicular. Aporte documental de la colangiografia operatoria / P. L. Mirizzi // La Prensa Medica. Argentina, 1945. — Vol. 11. — P. 445-451.
301. Moody F. G. Surgical applications of sphincteroplasty and choledocho-duodenostomy / F. G. Moody // Surg. Clin. N. Am. 1981. — Vol. 61, № 4.- P. 909-922.
302. Morphological Aspects of Necrosis as a Guideline for Treatment of Necrotizing Pancreatitis / J. L. Mee, S. Janny, A. Sauvanet, P. Werner, J. Belghiti // DigestiveDiseases and Sciences. 1997. — Vol 42, № 8. — P. 1792-1795.
303. Naatanen E. Uber die Pankreasgange mit besondererBerucksichtigung des Vorkommens einesn D. Santorinii / E. Naatanen // Z. Anat. U. Entwickl.-Gesch.- 1941.-Bd. XXX. S. 355.
304. Nahofdil V. Petilete zkusenosti s transduodenali papillosfincterotomii / V. Nahofdil, J. Havlik, J. Vesely // Rozhl. Chir. 1981. — Vol. 60, № 7. — P. 461-466.
305. Nakayama S. Relationship between activities of the sphincter of Oddi and the duodenal muscle / S. Nakayama, K. Tsuchiya, T. Yaamasato // Jap. J. Smooth. Res. 1973. — Vol. 9. — P. 87-97.
306. Nakayama S. Conduction of activity between muscles in the terminal region of the common b’le duct and in the neighboring duodenum / S. Nakayama, H. Fucuda // Acta Med. Okayama, 1976. — Vol. 30. — P. 21-35.
307. Nebel O. Manometric evaluation of the papilla of Vateri / 0. Nebel // Gastrointestinal Endosc. 1975. — Vol. 21. — P. 126-128.
308. Negri A. Patologia del choledocho terminal / A. Negri // Prensa med. Argent. 1947. — Vol. 34. — P. 36.
309. New insight into bile flow dynamics in anomalous arrangement of the pancreaticobiliary duct / S. Fumino, K. Tokiwa, T. Katoh, S. Ono, N. Iwai // British Journal of Surgery. 2002. — Vol. 89. — P. 865-869.
310. Nicolet Th. Gallenblasendyskinesie und Manometrie des Sphinkter Oddi / Th. Nicolet, R. de Peyer, B. Miazza // Schweiz. med. Wochenschr. 1993. -Bd. 123, № 54. — S. 50-70.
311. Northover J. M. A. A new look at the arterial supply of the bile duct in man and its surgical implication / J. M. A. Northover, J. Terblanche // Brit. J. Surg. 1979. — Vol. 66, № 2. — P. 379-384.
312. Nuboer J. F. La funzione del muscolo d’Oddi / J. F. Nuboer // Policlin. Sez. Prat. 1929. — Vol. 49, № 6. — P. 1810.
313. Oddi R. D’une disposition a sphincter speciale de l’ouvertura de canal choledoque/ R. Oddi // Arch. ital. de Biol. 1887. — T. 8. — P. 317-322.
314. Ono K. The discharge of bile into the duodenum and electrical activities of the muscle of Oddi and duodenum / K. Ono // Jap. J. Smooth Muse. Res. -1970,- Vol. 6.-P. 123-128.
315. Opie E. H. The etiology of acute haemorrhagic pancreatitis / E. H. Opie // Bull. Johns Hopkins Hosp. 1901. — Vol. 12.-P. 182-188.
316. Opie E. H. The anatomy of the pancreas / E. H. Opie // Bull. Johns Hopkins Hosp. 1903. — Vol. 14. — P. 229-232.
317. Pancreatico-biliary reflux and cystic duct morphology: relation to common bile duct stones and endoscopic sphincterotomy / S. Tranter, M. Thompson, M. Gillett, L. Biddlestone // Br. J. Surg. 2002. — Vol. 89, № 6. — P. 63.
318. Papamiltiades M. Architecture musculaire de la jonction choledoco-pancreatico-duodenale / M. Papamiltiades, R. Rettori // Acta. Anat. 1957. -Vol. 30.-P. 575-600.
319. Park I. S. Characterization of the endocrine cells in the pancreatic-bile duct system of the rat /1. S. Park, M. Bendayan // Anat. Rec. 1992. — Vol. 233, № 2. — P. 247-256.
320. Peptide immunoreactive nerves and cells of the guinea-pig gallbladder and biliary pathways / W. Cai, J. Gu, W. Huang, G. P. McGregor, M. A. Chatei, S. R. Bloom, J. M. Polak // Gut. 1983. — Vol. 24. — P. 1186-1193.
321. Pereira-Lima J. Anomalaous location of the papilla of Vater / J. Pereira-Lima, L. M. Pereira-Lima // Am. J. Surg. 1974. — Vol. 128. — P. 71-74.
322. Persson C. G. A. Effect of morphine, CCK and sympathomimetics on the sphincter of Oddi and intramural pressure in cat duodenum / C. G. A. Person, M. Ekman // Scand. J. Gastroent. 1972. — Vol. 7. — P. 345-351.
323. Peterson M. S. Santorinicele in pancreas divisum: diagnosis with secretin-stimulated magnetic resonance pancreatography / M. S. Peterson, A. Slivka // Abdom. Imaging. New York, 2001. — Vol. 26. — P. 260-263.
324. Phillip J. Variations and anomalies of the papilla of Vater, the pancreas and the biliary duct system / J. Phillip, H. Koch, M. Classen // Endoscopy. -1974,-Vol. 6, №2.-P. 70-71.
325. Pirola R. C. Effects of ethyl alcohol on sphincteric resistance at the choledochol-duodenal junction in man / R. C. Pirola, A. E. Davis // Gut. -1968.-Vol. 9.-P. 557.
326. Reich H. Relation of the duct of santorini to the pathogenesis of duodenal ulcer / H. Reich // New England J. Med. 1963. — Vol. 269. — P. 1119.
327. Rosato E. F. Papillary Integrity as a Factor in Pancreatic Reflux / E. F. Rosato, J. C. Oran-Smith, H. A. Rober // Am. J. Surg. 1971. — Vol. 121, № l.-P. 13-15.
328. Sadler T. W. Langman’s Medical Embryology / T. W. Sadler. Baltimore, 1990.-41 p.
329. Safrang L. Apreliminary report: Urgent duodenoscopic Sphincterotomy for acute gallstone pancreatitis / L. Safrang, P. B. Cotton // Surg. J. 1981. -Vol. 89, № 4. — P. 424-428.
330. Sankarau H. Sphincteric mechanism of the main pancreatic duct in the dog an experimental model of the isolated sphincteric preparation / H. Sankarau, T. 0. Gerald, K. F. Meguney // Digestion. 1978. — Vol. 17. — P. 221-228.
331. Santorini G. D. Observationes anatomicae Venetiis / G. D. Santorini. 1724. -237 p.
332. Sappey M. P. C. Traite danatomie descriptive / M. P. C. Sappey. Rapis: Delahaye, 1889. — Vol. 4. — P. 272.
333. Sarles J. C. Electromyography of the sphincter of Oddi / J. C. Sarles, A. N. Midejean, M. A. Devaux // Am. J. Gastroent. 1975. — Vol. 63. — P. 221231.
334. Sarles J. C. Neurotransmitters and motility of the circular smooth muscle in the rabbit sphincter of Oddi / J. C. Sarles, R. Awad // Gastroenterology. -1981,-Vol. 80, №5.-P. 1270.
335. Schirmer F. M. Inaugural Dissertation / F. M. Schirmer. Basle University, 1893.-180 p.
336. Schreiber H. Der Muskelapparat des duodenal Choledochusende (Papilla Vateri) beim Menschen / H. Schreiber // Arch. Klin. Chir. Berlin, 1944. -Vol. 206.-P. 194.
337. Schweizer P. Semicircular papillotomy: a new surgical technique for removal of bile stones lodged in ampulla of Vater / P. Schweizer, K. Schellinger, M. Schweizer // Pediatr. Surg. Int. 2001. — Vol. 17. — P. 406409.
338. Siegel J. H. Endoscopic management of choledocholithiasis and papillary stenosis / J. H. Siegel // Surg. Gynecol. Obstet. 1979. — Vol. 148, № 5. — P. 747-752.
339. Singh M. Ethanol and the pancreas / M. Singh, H. Simsek // Gastroenterology. 1990. — Vol. 98. — P. 1051.
340. Speranza V. Papillary stenosis: fact or fiction? / V. Speranza // Ital. J. Surg. Scien. 1988. — Vol.8, № 4. — P. 401-406.
341. Sphincter of Oddi manometry: usefullness for diagnosis and therapeutic approach / R. Cestari, G. Missale, M. Braga, P. Ravelli // 26-th World Congress of the International Colledge of Surgens. 1988. — P. 234-241.
342. Sphincter of Oddi motor activity. Demonstration of unique high-pressure phasic contractions / R. D. Shaffer, W. J. Hogan, J. E. Geenen, W. J. Dodds, E. T. Stewart, R. C. Arndorfer // Gastroenterology. 1977. — Vol. 72, № 5. -P. 1107-1130.
343. Sphincter of Oddi motor activity. Differences between patients with common bile duct stones and controls / J. Toouli, J. E. Geenen, W. J. Hogan, W. J. Dodds, R. C. Arndorfer // Gastroenterology. 1981. — Vol. 80, № 5. -P. 1304.
344. Spikeburst frequency of the opossum sphincter of Oddi in fasted and fed amimals / J. Toouli, R. Honda, W. J. Dodds, W. J. Hogan, S. Sarna // Gastroenterology. 1981.-Vol. 80, №5. — P. 1305.
345. Stenosi, insufficienza e stenoinsufflcienza deilo sfintere di Oddi / E. B. Riboli, G. P. Mortola, G. A. Reboa, N. S. Pandolfo // Minerva Gastroent. -1977.-Vol. 23, № l.-P. 31-34.
346. Structure of the common bile duct in man. Presence or absence of smooth muscle / G. H. Mahour, K. G. Wakim, E. H. Soule, D. O. Ferris // Ann. Surg. 1967. — Vol. 166. — P. 91-93.
347. Suarez C. V. Structure of the piajor duodenal papilla / C. V. Suarez // Mount. Sinai J. Med. 1982. — Vol. 49, № 1. — P. 31-37.
348. Tanaka I. Electromyographic studies of the duodenum and the choledochoduodenal junction / I. Tanaka // Jap. J. Smooth Muscle Res. -1965.-Vol. l.-P. 50-71.
349. Testut L. Tratie d’anatomie humaine, ect / Testut L. Paris, 1889-1891 -468 p.
350. The dynamics of the main biliary duct and the mechanism of the biliopancreatic reflux / H. W. Pinotti, O. M. Desousa, J. B. Penolari, V. P. Conte, A. M. Raia, A. C. Netto // Am. J. Dig. Dis. 1967. — Vol. 12. — P.878.890.
351. The electric biopotentials of the sphincter territories within the biliary pathways / A. Nana, C. Toader, V. Soltuz, E. Neumann, M. Nana // Gastroenterology. 1963. — Vol. 100. — P. 182-198.
352. The role of adrenergic receptors in the mobility of duodenum and choledochoduodenal junction in the pig / A. Blichowski, W. Andrzejewski, N. Gaszynski, W. Kozulski // Acta physiol. Pol. 1977. — Vol. 28, № 6. — P. 521-528.
353. The T. L. Relationship between the structural arrangement of the sphincter of Oddi and the patency/non-patency of the pancreatic duct of Santorini at the papilla minor / T. L. The // Anat. Rec. 1979. — Vol. 193, № 3. — P. 702-703.
354. Transduodenal sphincteroplasty (not sphincterotomy) for biliary and pancreatic disease / S. A. Jones, R. A. Steedman, T. B. Keller, L. L. Smith // Am. J. Surg. 1969. — Vol. 118. — P. 292-304.
355. Ultrasonographic study of the Wirsung duct caliber after meal / A. Brogna, A. M. Bucceri, F. Catalano, R. Ferrara, A. Mangiameli, S. Monello, A. Blasi // Ital. J. Gastroenterolog. -1991.- Vol. 23, № 4. P. 8-10.
356. Under H. H. A clinical and anatomical study of anomalous terminations of the common bile duct into duodenum / H. H. Under, V. A. Pena, R. A. Ruggeri // Ann. Surg. 1976. — Vol. 184, № 5. — P. 626-632.
357. Valle D. Choledocho-Odditis retractil chronica, concepto clinico y quirurgico / D. Valle, R. Donovan // Arch, agent, enterm. apar. digest. -1926. Vol. 1, № 4. — P. 605-620.
358. Volgalis F. Nerve-mediated contractile and electrical activity of the guinea-pig choledocho-duodenal junction / F. Volgalis, R. A. R. Bywater, G. S. Taylor // J. Auton. Nerv. Syst. 1989. — Vol. 29. — P. 19-28.
359. Weaver F. C. Ductal vasculature in the atrophic pancreas: evidence for autonomous ductal angioarchitecture / F. C. Weaver // Pancreas. 1988. -Vol. 3, № 6. — P. 88-99.
360. Wells D. G. Physiological and morphological properties of neurons in sphincter of Oddi region of the guinea-pig / D. G. Wells, G. M. Mawe // Am. J. Physiol. 1993. — Vol. 265, № 2. — P.528-533.
361. Wood M. Anomalous location of the papilla of Vater / M. Wood // Am. J. Surg. 1966. — Vol. 111. — P. 265-268.
362. Worthly C. S. Human fasting postprandial sphincter of Oddi motility / C. S. Worthly, R. A. Baker, J. Ianos // Brit. J. Surg. 1989. — Vol. 76, № 7. — P. 709-714.
363. Wyatt A. P. The relationship of the sphincter of Oddi to the stomach duodenum and gallbladder / A. P. Wyatt // J. Physiol. London, 1967. -Vol. 193, №2.-P. 225-253.
MEDISON.RU — Ультрасонография органов брюшной полости
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Методика исследования
Эхография органов брюшной полости проводится утром натощак после ночного голодания, однако в экстренных ситуациях исследование может быть выполнено в любое время. В большинстве случаев особой подготовки не требуется, хотя у тучных пациентов, больных с выраженным метеоризмом качественный осмотр может быть затруднен. Для уменьшения помех, обусловленных наличием газа в кишечнике, рекомендуется в течение 2-3 дней соблюдение диеты, бедной клетчаткой, исключение из пищи продуктов, усиливающих газообразование в кишечнике. Помимо этого показан прием карболена, ферментных препаратов (фестал, дигестал). Очистительную клизму ставить нет необходимости. При обследовании в экстренном порядке, а также после еды, необходимо помнить о возможности выявления в желудке или в кишечнике дополнительных включений, обусловленных наличием содержимого в их просвете.
Эхография проводится в положении больного лежа на спине, левом и правом боку, сидя или стоя, при этом желательно придерживаться следующей последовательности: обследование начинают с верхней части живота продольными срезами. Транcдьюсер располагают в эпигастрии по срединной линии. В этой позиции визуализируются левая доля печени и за ней брюшная аорта. Затем транедьюсер смещают влево, осматривая оставшуюся часть левой доли. После этого датчик последовательно перемещают в обратную сторону, вдоль правого подреберья до передней аксилярной линии. При этом визуализируются переход левой доли в правую, область круглой связки печени, хвостатая и квадратная доли, нижняя полая вена, правая доля печени, вены печени, портальная вена, желчный пузырь, правая почка. Затем продольные срезы повторяют, перемещая датчик вновь влево до срединной линии. После этого проводят сканирование в поперечной плоскости: транcдьюсер устанавливают на уровне мечевидного отростка и производят последовательные срезы, перемещая его до пупка и обратно. В этом случае визуализируются левая доля печени, желудок, поджелудочная железа, аорта, нижняя полая вена, чревный ствол, верхняя брыжеечная артерия, селезеночная вена.
Схема 1. Алгоритм проведения ультразвукового исследования органов брюшной полости (продольное сканирование):
а) — сканирование от средней линии живота влево;
б) — сканирование от левой передней аксилярной линии к правой передней аксилярной линии;
Исследование осуществляют без задержки дыхания. В результате проведенного сканирования в 2-х плоскостях получают общее представление о топографии органов верхнего этажа брюшной полости и выявляют грубые отклонения от нормы (схемы 1, 2).
Схема 2. Алгоритм проведения ультразвукового исследования органов брюшной полости (поперечное сканирование):
а) — сканирование от мечевидного отростка до пупка;
б) — сканирование от пупка в краниальном направлении.
Затем приступают к детальному изучению органов при задержке дыхания на высоте глубокого вдоха. Обследуя печень и желчный пузырь, трансдьюсер устанавливают параллельно правой реберной дуге и небольшими его наклонами, просматривают всю печень и желчный пузырь. При выраженном метеоризме возможно проведение исследования через межреберные промежутки справа в положениии больного на левом боку, что позволит избежать помех, обусловленных раздутыми петлями кишок. Эхографию поджелудочной железы начинают с поперечных срезов, переходя в последующем к сканированию в продольной плоскости. Селезенку осматривают в положении больного на правом боку, располагая трансдьюсер перпендикулярно реберной дуге.
Для обследования желудочно-кишечного тракта проводят вначале продольные срезы по всему животу слева направо и обратно, затем поперечные сверху вниз и обратно. И желудок, и кишечник должны быть осмотрены в поперечной и продольной плоскостях.
Ультразвуковое исследование почек осуществляют как со стороны спины (поперечные и продольные сечения), так и с передней (лежа на спине) и боковых (лежа на правом и левом боку) поверхностей живота, лучше при задержке дыхания в фазе глубокого вдоха. Для выявления подвижности или опущения почек эхографию производят в положении пациента сидя или стоя.
Предложенного алгоритма проведения ультразвукового исследования органов брюшной полости и почек необходимо придерживаться во всех случаях, поскольку лишь системный анализ получаемых эхограмм позволяет провести полноценное исследование, избежать возможных ошибок, получить необходимую информацию. Следует помнить, что качество обследования, в первую очередь, зависит от внимания врача, а поспешный осмотр недопустим.
Печень
Ультразвуковое исследование печени можно проводить в любое время без предварительной подготовки. Обследование проводится, как правило, в трех плоскостях (продольной, поперечной и косой) со стороны правого подреберья и эпигастрия. При этом необходимо оценить расположение, форму, контуры, размеры, структуру и эхогенность паренхимы, сосудистый рисунок в целом и конкретные сосуды, протоковую систему, влияние окружающих органов на состояние изображения печени. Точность диагностики выявляемых изменений возрастает при динамическом наблюдении (схема 3).
Схема 3. Положения датчика при сканировании печени:
1-3 — субкостальное сканирование
4 — продольное сканирование
5 — поперечное сканирование
6-7 — интеркостальное.
В норме большая часть печени располагается справа от позвоночника, а меньшая — слева от него и доходит до левой парастернальной линии. Контуры печени ровные, она имеет четкое очертание, капсула хорошо просматривается в виде гиперэхогенной структуры, окружающей ее паренхиму (за исключением участков, прилежащих к диафрагме, где капсула не дифференцируется от последней). В норме нижний край печени не выступает из-под реберной дуги. Общепринятыми являются измерение косого вертикального размера правой доли (не превышает 13-15 см) и толщины левой доли (до 5 см). Структура неизмененной печени представлена мелкозернистым изображением, состоящим из множества мелких точечных и линейных структур, равномерно расположенных по всей площади полученного среза. По эхогенности паренхима нормальной печени сопоставима или несколько выше эхогенности коркового вещества почки (при отсутствии ее патологии). Эхография позволяет дифференцировать различные трубчатые структуры, находящиеся в печени.
Отличительным признаком печеночных вен является их радиальное расположение (от периферии к центру), «отсутствие» стенок, возможность проследить ход мелких ветвей (до 1 мм в диаметре) до периферии органа. Портальная вена образуется в результате слияния верхнебрыжеечной и селезеночной вен. Лучше всего она видна при косом сканировании через правое подреберье и визуализи-руется в виде трубчатой структуры, имеющей четкие стенки. Ее можно проследить от места образования до впадения в ворота печени, где она разделяется на левую и правую ветви. В норме диаметр воротной вены не превышает 13-15 мм. Печеночная артерия визуализируется в области ворот печени как трубчатая структура небольшого диаметра (до 4-6 мм) с высокоэхогенными стенками. Внутрипеченочные желчные протоки в норме могут быть визуализированы только начиная с долевых. Они также имеют высокоэхогенные стенки и малый диаметр (не более 1 мм).
Результаты исследований
Рис. 1. Эхографическая картина нормальных левой и правой долей печени.
Рис. 2. Один из вариантов эхограммы нормальной паренхимы печени.
Рис. 3. Эхографическая картина изображения долевого печеночного протока.
Рис. 4. Эхограмма правой доли печени при ее увеличении: Liver — печень, Kidney — почка.Рис. 5. Эхографическая картина жировой инфильтрации печени — повышение эхогенности паренхимы с эффектом ослабления в глубоких отделах печени.
Рис. 6. Эхографическая картина очаговой формы жировой инфильтрации (отмечена стрелками).
Рис. 8. Эхографическая картина порто-кавальных анастомозов в воротах печени: 1 — печень, 2 — желчный пузырь, 3 — порто-кавальные анастомозы, 4 — киста печени.
Рис. 9. Эхографическая картина одного из вариантов изображения капиллярной гемангиомы левой доли печени.
Рис. 10. Эхографическая картина простой салитарной кисты правой доли печени (отмечена маркерами).
Рис. 11. Эхографическая картина поликистоза печени.
Рис. 12. Эхографическая картина мелког кальцината печени (отмечен стрелкой).
Рис. 13. Эхографическая картина множественного метастатического поражения печени: M — метастазы.
Желчный пузырь и желчевыводящие протоки
Эхографию желчного пузыря и желчевыводящих протоков проводят обязательно натощак, не ранее чем через 8-12 часов после приема пищи. Это необходимо для достаточного заполнения пузыря желчью. Больного обследуют в трех позициях — в положении на спине, на левом боку, стоя, на высоте глубокого вдоха. В норме желчный пузырь расположен на дорсальной поверхности печени, в нем различают дно, тело и шейку, которая переходит в пузырный проток. При продольном сканировании желчный пузырь лоцируется как эхонегативное овальное, удлиненное или грушевидное образование, длиной от 4 до 9,5 см, шириной до 3-3,5 см, с тонкими (до 1,5-2 мм) стенками. В норме содержимое пузыря однородное, гомогенное (схема 4).
Схема 4. Положение датчика при сканировании желчного пузыря.
1,3 — в положении на спине;
2,4 — в положении на левом боку.
Внутрипеченочные желчные протоки идут параллельно ветвям воротной вены, располагаясь вентрально от них. Мелкие желчные протоки (в норме практически не видны) соединяются в более крупные по направлению ворот печени, образуя правый и левый печеночные протоки, сливающиеся в воротах печени в общий печеночный проток (в норме диаметр его не превышает 4-5 мм).
Схема 5. Анатомия желчного пузыря и желчевывадящих протоков.
Последний, соединяясь с пузырным протоком, образует общий желчный проток (в норме его диаметр не превышает 7 мм), который открывается в 12-перстную кишку. Протоки имеют ровные, четкие стенки, просвет свободен от эхосигналов (схема 5).
Результаты исследований
Рис. 14. Эхографическая картина нормального желчного пузыря.
Рис. 15. Эхографическая картина деформированного желчного пузыря.
Рис. 16. Эхографическая картина холестероза желчного пузыря (холестериновые полипы отмечены стрелками).
Рис. 17. Эхографическая картина замазкообразной желчи в полости желчного пузыря, напоминающая солидное образование (отмечено стрелкой).
Рис. 18. Эхографическая картина одного из вариантов желчно-каменной болезни — множественные мелкие (1-2 мм) плавающие конкременты в полости желчного пузыря.
Рис. 19. Эхографическая картина одного из вариантов желчно-каменной болезни (два «мягких» холестериновых конкремента отмечены стрелками).
Рис. 20. Эхографическая картина одного из вариантов желчно-каменной болезни — конкремент размером 1,9 см, дающий за собой акустическую тень.
Рис. 21. Эхографическая картина одного из вариантов желчно-каменной болезни — отключенный желчный пузырь. В области проекции желчного пузыря визуализируется конгломерат плотных эхо-структур (отмечен стрелкой), дающий за собой акустическую тень.
Рис. 22. Эхографическая картина одного из вариантов изображения желчного пузыря при обострении хронического холецистита (утолщение и слоистость стенки).
Рис. 23. Один из вариантов осложненного течения послеоперационного периода — инфильтрат (обведен курсором) в области ложа желчного пузыря после его удаления.
Рис. 24. Один из вариантов осложнения операции холецистэктомии — в культе желчного пузыря (отмечена стрелками) визуализируется мелкий конкремент, дающий акустическую тень.
Рис. 25. Эхографическая картина холедохолитиаза (конкремент, дающий акустическую тень, отмечен стрелкой).
Рис. 26. Эхографическая картина расширенного холедоха (диаметр 21 мм) после операции холецистэкомии: 1 — холедох, 2 — желудок, 3 — расширенный вирсунгов проток, 4 — портальная вена, 5 — верхняя брыжеечная артерия, 6 — аорта.
Поджелудочная железа
Эхографию поджелудочной железы проводят на высоте форсированного вдоха или при надутом животе, когда левая доля печени значительно опускается в брюшную полость, являясь хорошей средой для проведения ультразвука. В некоторых случаях для лучшей визуализации железы можно рекомендовать больному выпить маленькими глотками 300-500 мл теплой дегазированной воды, создавая тем самым акустическое окно.
Исследуя поджелудочную железу, сначала проводят поперечное, а затем продольное сканирование. Поперечное сканирование осуществляют приблизительно под углом 10-20° вдоль условной линии, проведенной от ворот правой почки до ворот селезенки или верхнего полюса левой почки, путем последовательного смещения трансдьюсера от мечевидного отростка по направлению к пупку. Продольное сканирование производят, последовательно перемещая датчик от правой срединноключичной линии до левой передней аксилярной. Основные анатомические ориентиры для выявления поджелудочной железы: селезеночная вена, расположенная под нижним краем железы, верхняя брыжеечная артерия — округлое анэхогенное образование ниже вены, а еще ниже и левее — округлое анэхогенное образование — аорта, а правее и ниже — анэхогенное овальное образование — нижняя полая вена (схема 6).
Схема 6. Положения датчика при сканировании поджелудочной железы:
а) — поперечное сканирование;
б) — продольное сканирование.
По своей эхогенности поджелудочная железа либо приближается к внутренней структуре печени, либо слегка превосходит ее. Паренхима железы в большинстве случаев является гомогенной, однако в некоторых случаях может быть мелкозернистой. С возрастом и у тучных людей эхогенность железы постепенно повышается. Определение размеров железы имеет первостепенное значение для диагностики ее различных заболеваний. Толщина, т.е. передне-задний размер головки составляет 2,5-3,0 см, тела -1.5-1,7 см и хвоста до 2,0 см. В норме может быть визуализирован и вирсунгов проток, его диаметр в теле железы у здоровых лиц не превышает 1 мм, а в головке — 2 мм.
Результаты исследований
Рис. 27. Один из вариантов эхографического изображения анатомии и топографии нормальной поджелудочной железы: 1 — печень, 2 — головка, 3 — тело, 4 — хвост железы, 5 — портальная вена, 6 — селезеночная вена, 7 — верхняя брыжеечная артерия, 8 — нижняя полая вена, 9 — аорта.
Рис. 28. Эхографическая картина псевдокисты поджелудочной железы: 1 — печень, 2 — желудок, 3 — киста.
Рис. 29. Эхографическая картина опухоли поджелудочной железы: Hepar — печень, Pancreas — поджелудочная железа, Tumor — опухоль, V.p. — портальная вена, AMS — верхняя брыжеечная артерия, Aorta — аорта.
Селезенка
Эхографию селезенки лучше проводить на глубине высокого вдоха в положении больного на правом боку. Наружная ее поверхность слегка выпуклая, внутренняя — слегка вогнута, при этом она имеет вид полумесяца, длинная ось которого направлена сверху вниз и вперед. Иногда селезенка прикрыта легкими и не визуализируется. В этом случае предлагается исследование через межреберные промежутки слева, при котором полученное УЗ-изображение сходно с изображением органа по длинной оси. На внутренней поверхности селезенки визуализируются ее ворота — место вхождения в паренхиму артерии и вены. Паренхима селезенки имеет вид однородного образования, имеющего мелкозернистое внутреннее строение, эхогенность ее существенно ниже эхогенности печени и несколько выше паренхимы почки. В норме длина селезенки не превышает 11-12 см, толщина — 4-5 см, площадь — 50 кв.см. Диаметр селезеночной вены в области ворот составляет 5-7 мм (схема 7).
Схема 7. Положение датчика при сканировании селезенки:
1-2 — поперечное сканирование;
3 — продольное сканирование.
Результаты исследований
Рис. 30. Эхографическая картина нормальной селезенки.
Рис. 31. Эхографическая картина добавочной селезенки.
Рис. 32. Эхографическая картина увеличенной при циррозе печени селезенки (1), расширенных селезеночной (2) и желудочной (3) вен.
Рис. 33. Эхографическая картина кисты селезенки: С — селезенка, К — киста, С.В. — селезеночная вена.
Рис. 34. Эхографическая картина инфаркта селезенки (отмечен стрелкой).
Пищевод, желудок, кишечник
Эхографию пищевода и желудка проводят натощак, а кишечника лучше после дефекации. Положение больного может быть различным и выбирается с учетом возможной локализации патологического процесса и лучшей его визуализации. На сагиттальном сечении, проходящем через пищеводное отверстие диафрагмы (транедьюсер устанавливается в эпигастрии под мечевидным отростком) нормальный пищевод лоцируется как трубчатая структура, образованная двумя анэхогенными полосками, соответствующими передней и задней стенкам пищевода, и заключенной между ними гиперэхогенной центральной зоной, соответствующей его слизистой оболочке. Диаметр пищевода измеряется от его передней до задней стенки (наружно-наружный размер) по плоскости, перпендикулярной оси пищевода, и не превышает в норме 10,5 мм. Длина брюшного отдела пищевода составляет у здоровых лиц 15-20 мм.
Ультразвуковое исследование желудка проводят в эпигастрии в продольном и поперечном сечениях. Толщина стенки желудка в норме составляет 3-7 мм, в ряде случаев удается визуализировать 5 слоев его стенки (первый — эхогенный, соответствует слизистой; второй — анэхогенный — мышечной пластине слизистой; третий — эхогенный — подслизистой; четвертый — анэхогенный — мышечной и пятый — эхогенный — серозной оболочкам) и проследить перистальтические сокращения.
Эхографическая картина тонкого и толстого кишечника во многом схожа, толщина стенок и того и другого в норме составляет 2- 5 мм, зависит от перистальтики и степени растяжения. Основным ультразвуковым признаком поражения желудка или кишечника является утолщение их стенок, появление так называемого симптома псевдопочки (поражения полого органа).
Результаты исследований
Рис. 35. Эхографическая картина неизмененного брюшного отдела пищевода: 1 — печень, 2 — брюшной отдел пищевода, 3 — сердце, 4 — диафрагма.
Рис. 36. Эхографическая картина гиперсекции желудка, видны 5 слоев стенки: St. — желудок, G.B. — желчный пузырь.
Рис. 37. Эхографическая картина одного из вариантов тела желудка и метастатического поражения печени: 1 — утолщенная до 17 мм стенка желудка, 2 — печень, 3 — метастаз.
Рис. 38. Эхографическая картина рака толстой кишки и метастатического поражения печени: М — метастазы, ТК — утолщенная стенка кишки.
Почки и мочевой пузырь
Поскольку верхний сегмент почек закрыт ребрами, для уменьшения обусловленных ими помех эхографию осуществляют со стороны спины (передней и боковых поверхностей живота) при задержке дыхания в фазе глубокого вдоха. При высоком расположе-нии почек, а также для определения их подвижности сканирование проводят в вертикальном положении больного. Для определения положения почек первоначально производят серию поперечных сканирований (со стороны спины в положении лежа на животе), последовательно перемещая трансдьюсер от нижнего полюса к верхнему. Продольное сканирование осуществляют, смещая датчик от наружной поверхности почек к внутренней. Чтобы получить более точное представление о состоянии паренхимы, размерах лоханок и определить сосуды, исследование проводят также со стороны передней поверхности живота. На продольных сечениях почка визуализируется в виде удлиненно-овальной, а на поперечных — овоидной формы образования, четко дифференцируемого от окружающих тканей. В норме длина почки составляет 7,5-12,0 см, ширина — 4,5-6,5 см, а различие в длине обеих почек не превышает 1,5- 2,0 см (схема 8).
Схема 8. Положение датчика при сканировании почек:
1 — продольное сканирование;
2 — поперечное сканирование.
Паренхима почки имеет очень нежную, почти анэхогенную внутреннюю структуру. Между капсулой почки и чашечно-лоханочной системой, особенно у лиц молодого и среднего возраста, можно видеть множественные почти округлой формы эхонегативные образования, представляющие собой пирамиды. Диаметр пирамид колеблется от 0,5 до 0,9 см. Чашечный комплекс выявляется как образование повышенной эхогенности, расположенное в центре почки. В норме отношение паренхимы почки к чашечному комплексу составляет приблизительно 2:1.
Исследование мочевого пузыря выполняют со стороны передней брюшной стенки. Необходимым условием является хорошее его наполнение, так как пустой мочевой пузырь эхографически не определяется. При этом чем больше жидкости в пузыре, тем более надежными будут результаты. В норме неизмененный мочевой пузырь на поперечных срезах визуализируется как эхонегативное бочковидное образование, а на продольных — как эхо-негативное образование овоидной формы, четко очерченное, с ровной и гладкой поверхностью, свободное от внутренних структур.
Результаты исследований
Рис. 39. Эхографическая картина нормальных правой (R.K.) и левой (L.K.) почек.
Рис. 40. Эхографическая картина простой неосложненной кисты (K) левой почки.
Рис. 41. Эхографическая картина поликистоза почек (левая почка обведена курсором).
Рис. 42. Эхографическая картина левой и правой почек с мелкими ангиомиолипомами в паренхиме.
Рис. 43. Эхографическая картина почки с конкрементом в шейке чашечки с явлениями ее обструкции и гидрокаликозом (стрелка).
Рис. 44. Эхографическая картина почки с конкрементом в лоханке: 1 — почка, 2 — конкремент, 3 — акустическая тень.
Рис. 45. Эхографическая картина почки с дилатированной лоханкой (указана стрелками).
Рис. 46. Эхографическая картина почки с дилатацией лоханки и проксимального отдела мочеточника: 1 — мочевой пузырь, 2 — мочеточник, 3 — почка, 4 — лоханка.
Рис. 47. Эхографическая картина нормального мочевого пузыря (выброс струи мочи из устья левого мочеточника обозначен стрелкой).
Рис. 48. Эхографическая картина дивертикула мочевого пузыря: 1 — мочевой пузырь, 2 — дивертикул.
Сосуды брюшной полости
Эхографию сосудов брюшной полости проводят через переднюю брюшную стенку на высоте глубокого вдоха и при свободном дыхании. Ультразвуковое исследование позволяет легко лоцировать большинство магистральных сосудов: аорту, чревный ствол, верхнюю брыжеечную, печеночную и селезеночную артерии, нижнюю полую, воротную, селезеночную, верхнюю брыжеечную и правую почечную вены. Их визуализация имеет важное значение, поскольку магистральные сосуды — это своеобразная «дорожная карта», использование которой позволяет определить местоположение органов и других анатомических образований брюшной полости, в некоторых случаях правильно оценить выраженность патологического процесса в органе, а также диагностировать различные повреждения и заболевания сосудов.
На продольных сканограммах брюшной отдел аорты имеет вид пульсирующей трубчатой структуры, расположенной чуть левее или над позвоночником, несколько сужающейся в каудальном направлении, образованной двумя эхопозитивными линейными структурами с эхонегативной центральной зоной. Диаметр аорты в норме составляет 2,0-2,5 см. Нижняя полая вена имеет вид аналогичной трубчатой структуры с четко очерченными стенками, лоцируемой несколько правее позвоночника, наибольший диаметр, изменяющийся при натуживании (!), не превышает в норме 2,5 см.
Результаты исследований
Рис. 49. Эхографическая картина продольного сечения аорты (1), верхней брыжеечной (2) и чревной (3) артерий.
Рис. 50. Эхографическая картина поперечного сечения аорты, чревной артерии и ее ветвей: 1 — аорта, 2 — чревная артерия, 3 — печеночная артерия, 4 — селезеночная артерия, 5 — портальная вена, 6 — нижняя полая вена, 7 — позвоночник.
Рис. 51. Эхографическая картина брюшной аорты в области бифуркации (отмечена стрелкой).
Рис. 52. Эхографическая картина аневризмы брюшной аорты: 1 — просвет аорты, 2 — тромботические массы заполняющие аневризму, 3 — участок реканализации.
Рис. 53. Эхографическая картина нижней полой вены (слева — при свободном дыхании, справа при натуживании).
Все исследования проводились с использованием УЗ-сканера SonoAce-5000 (Medison, Ю. Корея), оснащенного конвексным датчиком 3,5 МГц.
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Панкреатический проток — это… Что такое Панкреатический проток?
Гла́вный прото́к поджелу́дочной железы́ (синонимы: проток поджелудочной железы, панкреатический проток, вирсунгов проток, вирзунгиев проток; лат. ductus pancreaticus) — проток, по которому сок поджелудочной железы попадает в двенадцатиперстную кишку.
У большинства индивидуумов начинается у хвоста поджелудочной железы, проходит вдоль всей её длины и заканчивается после слияния с общим желчным протоком в большом сосочке двенадцатиперстной кишки (фатеровом сосочке).
Форма главного протока
Форма протока может быть дугообразной, колено-образной и S-образной и, в основном, повторяет форму поджелудочной железы. В большинстве случаев основной изгиб главного протока располагается в области головки поджелудочной железы, а расположенная в теле железы часть протока, более или менее прямолинейна.
При прохождении вдоль железы проток принимает более мелкие протоки, постепенно увеличиваясь в диаметре. Все элементы протоковой системы отличаются большой вариабельностью. Можно выделить два типа её строения: магистральный и рассыпной. При магистральном типе число более мелких протоков, впадающих в главный проток, от 18 до 34, а расстояние между ними колеблется от 0,5 до 1,5 см. При рассыпном типе количество впадающих мелких протоков достигает 60, а промежутки между ними уменьшаются до 0,8—2 мм.[1]
Диаметр протока: в области хвоста поджелудочной железы — 1,0—1,7 мм, в области тела — 2,4—2,6 мм, в области головки — 2,6—3,3 мм.[2]
Сфинктеры
Регулирование поступления панкреатического сока в двенадцатиперстную кишку происходит с помощью сфинктера панкреатического протока (в месте слияния главного протока поджелудочной железы с общим желчным протоком) и, далее, сфинктером Одди (при впадении в двенадцатиперстную кишку).
Анатомическая вариабельность
В 60 % случаев с главным протоком в области головки поджелудочной железы сливается дополнительный проток поджелудочной железы. В 20-25 % случаев протоки поджелудочной железы впадают в двенадцатиперстную кишку раздельно. В 10 % случаев происходит атрофия терминального отдела главного протока и весь сок поджелудочной железы поступает в двенадцатиперстную кишку через дополнительный проток (такой вариант относят к аномалиям развития).[3]
Примерно в 20 % случаев главный проток поджелудочной железы не соединяется с общим желчным протоком и открывается в двенадцатиперстную кишку на 2-4 см выше большого дуоденального сосочка.[4]
Этимология
Назван в честь открывшего его немецкого анатома Иоганна Георга Вирсунга (нем. Johann Georg Wirsung, 1589—1643).[5]
Источники
Wikimedia Foundation. 2010.
Холедохолитиаз: камни в желчных протоках операция
Холедохолитиаз — одна из форм проявления желчнокаменной болезни, при которой конкременты обнаруживаются не в желчном пузыре, а в желчных протоках. Чаще всего — в холедохе, общем желчном протоке.
Причём они либо попадают туда из желчного пузыря, либо образуются непосредственно в холедохе. Как правило, лечение такого заболевания оперативное. Отметим, что заболевание является достаточно серьёзным особенно в тех случаях,когда развиваются тяжёлые осложнения в виде перекрытия протока, тогда возникает угроза жизни пациенту.
Как камни появляются в желчном протоке?
Обычно они формируются в желчном пузыре и перемещаются с током желчи через пузырный проток. При этом общий вид камней, находящихся в пузыре и в протоках, их микроструктура и химический состав идентичны. Доказательством пузырного происхождения конкрементов считается наличие на их поверхности граней, которые формируются вследствие соприкасания нескольких камней в желчном пузыре. Вероятность перемещения камней в холедох тем больше, чем шире диаметр пузырного протока. В некоторых случаях камнеобразование может происходить непосредственно в просвете самого холедоха. Это возникает при условии затруднения оттока желчи по протокам.
Причинами образования камней в желчевыводящих путях могут быть:
- Стеноз терминального (конечного) отдела холедоха.
- Проникновение из двенадцатиперстной кишки некоторых гельминтов (аскариды, кошачья двуустка).
- Выработка желчи с особо высокими литогенными свойствами в некоторых географических регионах (т.н. дальневосточный холедохолитиаз). Механизм образования такой желчи пока неизвестен. В этих случаях холедохолитиаз считается первичным.
- Иногда камни в желчных протоках выявляют спустя некоторое время (несколько месяцев, иногда несколько лет) после холецистэктомии,проведенной ранее. Это могут быть как не обнаруженные до операции и при ее выполнении камни («резидуальные» или «забытые»), так и вновь образованные («рецидивирующий» холедохолитиаз), которые сформировались в желчных протоках уже после хирургического вмешательства из-за нарушений обмена веществ, застоя желчи или наличия инфекции.
Диагностика холедохолитиаза не может основываться только на клинике. Пузырные камни в общем желчном протоке клинически выявляются не всегда, и могут существовать бессимптомно длительное время. Только появление приступа печеночной колики с последующей желтухой наводит на мысль о возможной проблеме в желчевыводящих путях. Характер печеночной колики при холедохолитиазе ничем не отличается от таковой, исходящей из желчного пузыря. Хотя иногда боль может локализоваться несколько выше и медиальнее, чем при холецистолитиазе, в надчревной области. Еще реже наблюдается непереносимая боль при внезапной закупорке камнем области дуоденального сосочка (так называемый “сосочковый илеус”).
При наличии мелких (менее 5-7 мм) конкрементов в желчном пузыре у любого больного с желчнокаменной болезнью следует подозревать присутствие камней в холедохе, так как такие размеры позволяют им беспрепятственно мигрировать через пузырный проток. Особенно следует насторожиться при билирубинемии (даже небольшом повышении билирубина в сыворотке крови). Обычно одновременно повышается уровень щелочной фосфатазы, вероятно повышение уровня аминотрансфераз. Однако, после устранения обструкции (закупорки), уровень аминотрансфераз, как правило быстро нормализуется. Тогда как уровень билирубина нередко остается повышенным в течение 2 недель, еще дольше сохраняется повышенный уровень щелочной фосфатазы.
Лабораторная диагностика.
Бессимптомный холедохолитиаз может не сопровождаться изменениями в лабораторных анализах. При развитии воспаления в крови повышается уровень лейкоцитов, СОЭ. При нарушении оттока желчи наблюдают повышение концентрации билирубина (за счёт прямой фракции), повышение уровня аминотрансфераз (трансаминаз) и щелочной фосфатазы в биохимическом анализе крови, увеличивается содержание жёлчных пигментов в моче. Может отсутствовать стеркобилин в кале. Очень грозным лабораторным симптомом является повышение амилазы крови, так как это говорит о поражении поджелудочной железы.
Инструментальная диагностика.
Ультразвуковое исследование органов брюшной полости (УЗИ) — наиболее доступный метод обследования желчных путей, по сути скриннинг-метод. Чувствительность его на предмет выявления расширения общего желчного протока составляет до 90%. Однако, не всегда специалисту ультразвуковой диагностики удается осмотреть терминальный отдел холедоха (зону слияния общего желчного и панкреатического протоков, и их впадения в двенадцатиперстную кишку), т. е. очень важный для постановки правильного диагноза отдел. Осмотру может мешать газ или жидкость (даже в небольшом количестве), находящиеся в кишке.
Поэтому во многих случаях приходится прибегать к дополнительным методам:
- Эндоскопическое УЗИ (эндосонография). Осмотр проводится специальным эндосонографическим датчиком через просвет желудка и двенадцатиперстной кишки. При таком осмотре эффективность правильной диагностики повышается до 85-100%.
- MPT-холангиография. Точность данного метода исследования составляет до 97%. При выполнении МРТ- холангиографии получают изображение желчного пузыря и пузырного протока, сегментарных, долевых желчных протоков, общего печеночного протока, холедоха и панкреатического протока. Появляется возможность точной визуализации камней в просвете протоков, их сужения или расширения. К большим преимуществам МРТ-холангиографии относится ее неинвазивность и отсутствие необходимости в использовании контрастных веществ.
Следующие два метода диагностики являются инвазивными, поэтому могут применяться только при нахождении пациента в стационаре. Речь идет об эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) и чрескожной чреспеченочной холангиографии (ЧЧХГ).
- ЭРХПГ — стандартный способ диагностики холедохолитиаза, в руках опытного врача-эндоскописта эффективен в 90 — 95% случаев. Однако этот метод сопряжён с возможным развитием серьезных осложнений: гиперамилаземии, холангита, панкреатита, забрюшинной перфорации двенадцатиперстной кишки, кровотечения. Поэтому его использование должно быть обоснованным.
- Чрескожную чреспеченочную холангиографию применяют у больных с обтурационной желтухой при невозможности выполнения ретроградной панкреатохолангиографии. При этом под контролем УЗИ или рентгеновской установки через кожу пунктируют расширенный проток правой или левой доли печени. После эвакуации желчи в просвет желчного хода вводят контрастное вещество и выполняют серию снимков. Это позволяет получить четкое изображение желчных путей, определить причину механической желтухи и уровень препятствия.
К дополнительным методам обследования можно отнести компьютерную томографию и видеодуоденоскопию.
- Компьютерная томография (КТ) брюшной полости используется при подозрении на сдавление желчных протоков извне, или наличия новообразования в их просвете.
- Видеодуоденоскопия — эндоскопическое исследование, при котором используется специальный эндоскоп с боковой оптикой, позволяющий хорошо осмотреть область большого дуоденального сосочка или «фатерова сосочка» (место впадения желчных протоков в двенадцатиперстную кишку). Это очень важное исследование, поскольку иногда причиной холедохолитиаза является патология именно фатерова сосочка (воспаление, рубцовая стриктура, опухоль, или вклиненный конкремент).
Основные проявления холедохолитиаза
-
Приступ желчной колики.
Конкременты в гепатикохоледохе травмируют его стенку. Повреждение слизистой происходит особенно легко в наиболее узкой части — в области большого дуоденального сосочка. Поэтому главный и самый яркий симптом печеночной колики — это боль. Ощущение боли при холедохолитиазе практически не отличается от колики при холецистолитиазе. Характерна иррадиация её в спину или поясницу. Боль может приобретать опоясывающий характер в том случае, если перекрытие конкрементом произошло в области фатерова сосочка, расположенного в 12-перстой кишке. В таком случае происходит нарушение оттока и желчи, и панкреатического сока, в результате страдает поджелудочная железа. -
Механическая (подпеченочная) желтуха.
Когда камни обтурируют проток, то в желчевыводящих путях повышается давление, последние расширяются, но закупорка камнем мешает поступлению желчи в кишечную трубку, появляется так называемый ахоличный стул (осветление кала) и темная моча (цвета пива).
Таким образом, развивается механическая желтуха. Затруднение оттока желчи по желчевыводящим путям приводит к тому, что в крови появляется билирубин — желчный пигмент, которым насыщаются ткани больного человека. Кожа человека, его склеры, слизистые оболочки приобретают желтую окраску. -
Однако полная закупорка и постоянная желтуха при холедохолитиазе бывают не так часто. В то же время любое препятствие оттоку желчи создает благоприятные условия для развития инфекции и воспалительного процесса в протоках. Возникает холангит, который легко развивается на фоне повреждений слизистой оболочки. Вследствие многократной травмы и воспаления могут сформироваться сужения просвета протока на его протяжении и в области большого дуоденального сосочка — стенозирующие холангит и папиллит. Распространение воспалительного процесса вверх, в сторону печени, может привести к тяжелому осложнению: холангиогенному абсцессу печени. Следует также отметить, что диаметр общего желчного протока, конечно, отражает состояние гипертензии в нем, но так бывает далеко не всегда — при нешироких протоках также может образоваться холедохолитиаз. Воспалительный процесс проявляется повышением температуры тела, ознобами, кожным зудом. В типичных случаях холангит сопровождается септической лихорадкой. Менее типичны для холедохолитиаза малые температурные пики, сопровождающие приступы болей.
-
При латентном холедохолитиазе характерны жалоба на тупую боль под правой реберной дугой.
-
При диспептической форме холедохолитиаза больной жалуется на нехарактерную давящую боль под правой реберной дугой или в надчревной области, на диспепсию, тошноту, отрыжку, газы и непереносимость жирной пищи.
-
1. Холангит. Как говорилось ранее, при наличии камней в желчных протоках инфекция имеет условия для своего развития, это приводит к воспалению — холангиту. При возникновении этого осложнения появляется высокая температура с ознобами и проливными потами, сильные боли в правом подреберье, тошнота, рвота. выраженная общая слабость. Опасность данного осложнения связана с тем, что на фоне развивающейся инфекции нарушается функция печени. Кроме того, если лечение не проводить своевременно, существует опасность формирования абсцесса печени, как говорилось выше, а в дальнейшем — развития общего сепсиса и печеночной недостаточности.
-
2. Желтуха. Всегда имеет застойный характер. Закупорка, как правило, бывает неполной и интенсивность повышения билирубина колеблется. Подозрительной в отношении холедохолитиаза должна быть не только любая желтуха на фоне печеночной колики, но и мимолетная субиктеричность, особенно, если она часто повторяется. Однако, даже тяжелый холедохолитиаз далеко не всегда проявляется желтухой. Еще Kehr отмечал, что иногда при нагромождении камней желчь, «словно горный ручей, свободно переливается через камни». Более чем у 1/3больных холедохолитиазом желтухи не бывает. Значительно реже случается проявление желтухи без сопутствующей ей желчной колики.
-
3. Острый панкреатит. Общий желчный проток и проток поджелудочной железы у людей в 70% случаев сливаются в одно русло и вместе впадают в 12-перстную кишку. Когда этот общий канал перекрывается камнем (обычно это случается в месте выхода в 12-перстную кишку), то и желчь, и ферменты поджелудочной железы теряют возможность выделяться в кишечник. Происходит повышение давления в желчных и поджелудочных протоках, что приводит к тяжелому осложнению — острому панкреатиту. Острое воспаление поджелудочной железы — очень тяжелое заболевание, часто смертельное. Требуется немедленное хирургическое лечение для того, чтобы устранить это препятствие, а также проведение других лечебных мероприятий.
Камни в желчных протоках — операция
Лечение холедохолитиаза может быть только хирургическим. Однако, это не означает обязательного выполнения большой операции с большим разрезом на животе.
Наиболее часто при холедохолитиазе проводится удаление конкрементов желчных протоков эндоскопическим способом.
В стационаре пациенту проводят ЭРХПГ для уточнения наличия камня, его локализации и других параметров. Если диагноз холедохолитиаза подтвержден, это исследование превращается из диагностического в лечебное. Выполняется рассечение суженной зоны Фатерова сосочка (папиллосфинктеротомия), дробление камней (литотрипсия) или их удаление (экстракция). Тактика хирурга зависит от размеров камня. Камни более 2 см обычно дробят, менее 1 см чаще отходят самостоятельно в течение 2 суток. Но как показывает практика, в большинстве случаев, чтобы удалить или обеспечить самостоятельное отхождение камней, приходится прибегать к эндоскопической папиллосфинктеротомии. Редко удается этого избежать.
Когда невозможно удалить камень эндоскопическим методом, прибегают к хирургической операции. Операцию выполняют классическим методом или путем лапароскопии. Во время операции проводят рассечение холедоха (холедохотомию) специальным инструментом и удаление камней. Во всех случаях лечения холедохолитаза одномоментно проводят удаление желчного пузыря (если он не был удален ранее). В дальнейшем после хирургического лечения необходимо проходить послеоперационное обследование, соблюдать рекомендации по режиму, питанию и приему медикаментов, которые будут назначены лечащим врачом в стационаре.В любом случает тактика обследования и лечения должна определяться специалистом и направляться от простых методов диагностики и лечения к более сложным.
В нашей Клинике выполняется полный спектр диагностики, хирургического и эндоскопического лечения желчнокаменной болезни и ее осложнений. Оперативное лечение в большинстве случаев проводится малоинвазивно с применением лапароскопических и эндоскопических технологий.
Вопросы для экзамена в формате до по дисциплине факультетская хирургия, урология
Подборка по базе: Новые вопросы.docx, (ОТВЕТЫ) вопросы из уч-ка.pdf, Каверзные вопросы HR.docx, Ответы на вопросы к аттестации 4-х механиков.pdf, ДФП Вопросы к экзамену (мфюа — фин мен).docx, Ответы на контрольные вопросы к лекции 1 правоведение.docx, Билет государственного экзамена Геодезия каз.doc, Контрольные вопросы к экзамену.docx, ВОПРОСЫ ДЛЯ ЭКЗАМЕНА.docx, Новый документ в формате RTF (2).rtf
ВОПРОСЫ ДЛЯ ЭКЗАМЕНА В ФОРМАТЕ ДО
ПО ДИСЦИПЛИНЕ: «ФАКУЛЬТЕТСКАЯ ХИРУРГИЯ, УРОЛОГИЯ»
1. Что не является характерным для стеноза выходного отдела желудка в стадии компенсации?
2. Какая операция считается операцией выбора при двусторонней паховой грыже?
3. Что не является характерным осложнением острого холецистита?
4. Какие исследования наиболее информативны во время приступа острого холецистита?
5. Болезненность в левом реберно-позвоночном углу при остром панкреатите – это симптом?
6. После операции — холецистэктомии, дренирования холедоха, выполнено рентгенконтрастное исследование. Как называется исследование и по какому способу дренирован холедох?
7. На снимке представлена R-картина через 12 часов после приема бария per os. Ваш диагноз?
8. Укажите абсолютные показания к хирургическому лечению геморроя?
9. Что не является характерным для абсцесса Дугласова пространства, возникшего после аппендэктомии?
10. Какому классу С по классификации СЕАР соответствует активная трофическая язва при
ХВН?
11. Чем должен заканчиваться алгоритм обследования при неясном диагнозе острого аппендицита?
12. Откуда отходит аппендикулярная артерия?
13. Ветвью какой вены является аппендикулярная вена?
14. В результате чего чаще всего образуется артерио-венозный свищ?
15. Где чаще всего располагаются атеросклеротические аневризмы?
16. У кого чаще всего бывают бедренные грыжи?
17. Болезненность при перкуссии в правой подвздошной области — это симптом?
18. Болезненность при надавливании между ножками правой грудино-ключично-сосцевидной мышцы – это симптом?
19. Болезненность при поколачивании по правой реберной дуге – это симптом:
20. При осмотре пациентки: молочная железа инфильтрирована, отечна, резко уплотнена и увеличена в объеме, кожа железы покрыта красными пятнами с неровными «языкообразными краями», сосок втянут и деформирован. Ваш диагноз?
21. Пациентка жалуется на тремор рук, тахикардию, приливы жара. Ваш предварительный диагноз?
22. Куда чаще всего открывается большой дуоденальный сосок?
23. Какое лечение показано 1-й стадии облитерирующего тромбангиита?
24. Что не применяется в диагностике ЖКБ?
25. Что не используют в диагностике инородных тел пищевода?
26. Что не информативно в диагностике острого панкреатита?
27. Что не учитывается в дифференциальном диагнозе между острым венозным и артериальном тромбозе?
28. Какое сплетение не участвует в иннервации поджелудочной железы?
29. Какая артерия не участвует в кровоснабжении поджелудочной железы?
30. Что необходимо использовать для лечения разлитого перитонита аппендикулярного происхождения?
31. Что не применяется для лечения острого панкреатита в фазе токсемии?
32. Какие препараты в настоящее время не применяются для профилактики и лечения геморроя?
33. Сколько в норме составляет диаметр холедоха?
34. Чему равен в норме шоковый индекс?
35. Какая теория получила наибольшее признание в обосновании патогенеза варикозной болезни?
36. Какие клетки не имеются в островках поджелудочной железы?
37. Исчезновение опухоли молочной железы в положении лежа – это симптом:
38. Сколько % составляет геморрагический гастрит в структуре причин гастродуоденальных кровотечений?
39. Сколько % составляет синдром Меллори-Вейса в структуре причин гастродуоденальных кровотечений?
40. Сколько % составляет язвенная болезнь в структуре причин гастродуоденальных кровотечений?
41. Что является основным в диагностике абсцесса Дугласова пространства?
42. Ваш предположительный диагноз по данным рентгенографии?
43. Какой ведущий симптом при трещинах заднего прохода?
44. Изображение слизистой толстой кишки во время колоноскопии. Ваш предварительный диагноз?
45. Изображение слизистой толстой кишки во время колоноскопии. Ваш предварительный диагноз?
46. Что необходимо выполнить, если время ректороманоскопии перфорирован ампулярный отдел прямой кишки?
47. Что всегда характерно для врожденной паховой грыжи?
48. Изображение диагностической лапароскопии через 4 часа после начала заболевания. Ваш предварительный диагноз?
49. Какой основной признак скользящей грыжи?
50. Для какого заболевания характерно выделение крови из соска?
51. Какие клетки вырабатывают гастрин?
52. В какие органы опухоли поджелудочной железы не метастазируют гематогенным путем?
53. При каких значениях «красной крови» гемотрансфузия должна выполняться по абсолютным показаниям?
54. Что не является характерным проявлением гнойного холангита?
55. Какому классу С по классификации СЕАР соответствует данная картина ХВН?
56. Изображение диагностической видеолапароскопии. Ваш предварительный диагноз?
57. Изображение, полученное при ректоскопии. Ваш предварительный диагноз?
58. Какой признак характерен для двусторонних паховых грыж?
59. При каком виде острой кишечной непроходимости наиболее быстро развивается дегидратация организма?
60. Сколько в норме составляет диаметр Вирсунгова протока в области устья?
61. Сколько в норме составляет диаметр Вирсунгова протока в области хвоста поджелудочной железы?
62. Где располагается дивертикул Меккеля?
63. Что вызывает дисфункцию нервно-регуляторного аппарата червеобразного отростка?
64. С какими заболеваниями следует дифференцировать острый панкреатит?
65. Какова длина Вирсунгова протока в норме?
66. Какова длина поджелудочной железы в норме?
67. Что не характерно для острой тонкокишечной непроходимости?
68. Что не характерно для 2 степени тяжести гастродуоденального кровотечения?
69. Что не характерно для 3 степени тяжести гастродуоденального кровотечения?
70. Что не характерно для 4 степени тяжести гастродуоденального кровотечения?
71. Что не характерно для высокой тонкокишечной непроходимости?
72. Какая проба используется для выявления несостоятельности клапанов поверхностных вен?
73. Что не характерно для гангренозной формы аппендицита?
74. Что не характерно для гастродуоденального кровотечения?
75. Что не характерно для деструктивного панкреатита?
76. Что характерно для деструктивного панкреатита: 1) Гипотензия, 2) Гиперволемия, 3)
77. Какой метод может быть использован для диагностики новообразований средостения?
78. Какие методы используются для диагностики острого аппендицита?
79. Что не применяют для диагностики острого аппендицита?
80. Что не применяется для диагностики острой кишечной непроходимости?
81. Что не применяется для диагностики рака поджелудочной железы, осложненного желтухой?
82. Что не применяется для диагностики язвенной болезни?
83. Что является малоинформативным при дифференциальной диагностике между нижнедолевой правосторонней пневмонией и острым аппендицитом?
84. Что не характерно для инсулиномы?
85. Что не характерно для карциноида червеобразного отростка?
86. Что не применяется для лечения паралитического илеуса?
87. Какие лимфоузлы не являются регионарными для молочной железы?
88. Что не характерно для низкой толстокишечной непроходимости?
89. Какой симптом не характерен для острого аппендицита?
90. Что является характерным для острого аппендицита при тазовой локализации червеобразного отростка?
91. Что не характерно для острой артериальной недостаточности?
92. Что не характерно для острой ишемии конечности 1Б степени?
93. Что не характерно для острой ишемии конечности 2Б степени:
94. Что не характерно для паралитической кишечной непроходимости?
95. Что не характерно для первой степени тяжести гастродуоденального кровотечения?
96. Что не характерно для периода мнимого благополучия при перфорации язвы?
97. Что не характерно для периода первичного шока при перфорации язвы?
98. Что характерно для перфоративного аппендицита?
99. Что не характерно для подключично-подмышечного венозного тромбоза?
100. Что не характерно для периода позднего перитонита при перфорации язвы?
101. Что не характерно для поздней стадии перитонита?
102. Что не характерно для полной эмболии бедренной артерии?
103. Что не характерно для посттромбофлебетического синдрома?
104. Как выполняется профилактика цитратного шока при гемотрансфузии?
105. Какие симптомы не характерны для рака головки поджелудочной железы?
106. Что не является характерным для рака молочной железы?
107. Что не характерно для синдрома Золлингера – Элиссона?
108. Что не характерно для стадии декомпенсации стеноза выходного отдела желудка?
109. Что характерно для стадии рака 2 Б молочной железы?
110. Что не характерно для стадии субкомпенсации стеноза выходного отдела желудка?
111. Что не характерно для тонко-толстокишечной инвагинации?
112. Что является характерным проявлением ульцерогенной аденомы?
113. Что не характерно для флеботромбоза подвздошно-бедренного сегмента?
114. Укажите достоверный лапароскопический признак деструктивного панкреатита?
115. Сколько панкреатичекого сока за сутки выделяет поджелудочная железа?
116. К какому виду кишечной непроходимости относится заворот тонкой кишки?
117. При какой форме острого панкреатита наиболее эффективны ингибиторы протеаз?
118. Откуда осуществляется иннервация червеобразного отростка?
119. Что не относится к признакам нежизнеспособности кишки при ущемлении?
120. Что не относят к рентгенологическим признакам рака тела поджелудочной железы?
121. Что не относится к вариантам расположения червеобразного отростка?
122. Какая форма не относится к диффузным формам рака молочной железы?
123. К какому виду кишечной непроходимости относится инвагинация?
124. Какие лекарственные препараты не используются для консервативного лечения острого холецистита?
125. Что не относится к методам эндоскопического гемостаза?
126. Что не относится к клинико-морфологическим формам острого аппендицита?
127. Какой симптом не встречается в начальной фазе перитонита?
128. Какой способ оперативного лечения не направлен на удаление подкожных вен?
129. Что не относится к осложнениям ущемленных грыж?
130. Что не относится к осложнениям варикозной болезни?
131. Что не относится к осложнениям острого аппендицита?
132. Что не относится к осложнениям язвенной болезни?
133. Что не является особенностью течения острого аппендицита у детей?
134. Какая операция не относится к паллиативным хирургическим вмешательствам при раке поджелудочной железы?
135. Какие симптомы при остром аппендиците относят к перитонеальным?
136. Что не относится к прямым рентгенологическим признакам язвы желудка?
137. Что не относится к ранним осложнениям острого панкреатита?
138. Что не относится к факторам агрессии?
139. Что не относится к факторам защиты?
140. Как называется данное исследование?
141. Какое исследование представлено на снимке? Ваш диагноз?
142. Какие изменения в крови отмечаются при гнойном халангите?
143. Какие изменения в поджелудочной железе происходят при отечном панкреатите?
144. Какие симптомы не характерны для водянки желчного пузыря?
145. Какое из анатомических образований не входит в состав гепатодуоденальной связки.?
146. Какое из анатомических образований не является границей foramen epiplocum (vinslowi)?
147. Какое из этих исследований относится к группе инвазивных?
148. Какое осложнение острого холецистита не относится экстравезикальным?
149. Какой вид паховой герниопластики подразумевает использование аллотрансплантата?
150. Какой вид пластики пахового канала представлен на рисунке?
151. Какой из видов ваготомии не нарушает функцию привратника?
152. Какой из факторов является абсолютным показанием к операции при самопроизвольно вправившейся ущемленной грыже?
153. Какой основной интраоперационный признак врожденной паховой грыжи?
154. Какой симптом острого аппендицита встречается наиболее часто?
155. Какой уровень диастазурии свидетельствует о наличии острого панкреатита?
156. Какую операцию применяют при подкожно-подслизистых свищах?
157. Какую стенку пахового канала предпочтительно укреплять у взрослых мужчин при наличии паховой грыжи?
158. Для какого заболевания характерен в виде «малинового желе»?
159. На данных какого исследования основана классификация стенозов выходного отдела желудка?
160. Что не является характерным признаком ущемленной грыжи живота?
161. Какое заболевание клинически может симулировать приступ острого аппендицита?
162. Что не является клиническим симптомом тромбоэмболии легочной артерии?
163. Что определяет клиническую картину ВИПомы?
164. Изображение, полученное во время колоноскопии. Ваши дальнейшие действия?
165. Что не включает в себя консервативное лечение анальной трещины?
166. В каком случае проводится консервативное лечение кишечной непроходимости?
167. При каком виде кишечной непроходимости консервативное лечение неэффективно?
168. У кого чаще встречаются косые паховые грыжи?
169. Какие критерий не является определяющим при решении вопроса о выполнении резекции желудка, при перфорации?
170. В каком случае кишечной непроходимости не нарушается кровообращение в брыжейке кишки?
171. Какова летальность при остром аппендиците?
172. Какая будет лечебная тактика при самопроизвольном вправлении ущемленной грыжи в лечебном учреждении?
173. Какое лечебное действие оказывает локальная внутрижелудочная гипотермия при панкреатите?
174. Какой способ лечения инсулиномы?
175. Что является лучшим методом лечения аневризмы аорты?
176. Сколько в среднем составляет масса поджелудочной железы?
177. Какой метод не относится к способам наружного дренирования холедоха?
178. Что не влияет на выбор лечебной тактики при кишечной непроходимости?
179. Что может навести на мысль о мезентериальном тромбозе?
180. Назовите радикальный метод лечения геморроя?
181. Укажите немедикаментозные средства консервативного лечения острого холецистита?
182. Укажите факторы, способствующие образованию послеоперационных грыж:1) нагноение раны 2) парез кишечника в послеоперационном периоде; 3) подкожная эвентрация;
4) нарушение иннервации брюшных мышц; 5) раннее вставание с постели после операции.
Выберите правильную комбинацию ответов?
183. После какого способа герниопластики наблюдается наиболее выраженный болевой синдром?
184. С какими заболеваниями наиболее затруднительна дифференциальная диагностика острого аппендицита?
185. Какой наиболее информативный рентгенологический признак перфорации язвы?
186. Какой метод наиболее информативный для диагностики острого панкреатита и его форм?
187. Какой метод наиболее информативный для диагностики гастродуоденального кровотечения?
188. Какой метод наиболее информативный для диагностики инсулиномы?
189. Какой метод наиболее информативный для диагностики холедохолитиаза?
190. Какое осложнение грыжи пищеводного отверстия диафрагмы является наиболее опасным?
191. Какое осложнение тромбоза глубоких вен является наиболее опасным?
192. Какой наиболее радикальный способ лечения интрасфинктерных параректальных свищей?
193. Какой симптом является наиболее ранним проявлениям рака пищевода?
194. Какой метод является наиболее рациональным при обработке культи аппендикса у взрослых?
195. Какой метод наиболее информативный для диагностики тромбоэмболии легочной артерии?
196. Какая форма острого парапроктита является наиболее тяжелой?
197. Что не относится к характерным поздним осложнениям острого панкреатита?
198. Какой наиболее частый признак острого панкреатита при гастродуоденоскопии?
199. Какая наиболее часто встречающаяся форма острого парапроктика?
200. Какая операция наиболее часто применяется при некротизирующем панкреатите?
201. В каком отделе кишечника наиболее часто происходит инвагинация?
202. Что является наиболее частой причиной острого артериального тромбоза?
203. Что является наиболее частой причиной тонкокишечной механической непроходимости?
204. Какой метод подготовки кишечника является наиболее эффективным у больных с заболеванием прямой кишки?
205. Какой наиболее эффективный способ лечения анаэробного парапроктита?
206. Что является наиболее эффективным средством профилактики прогрессирования варикозной болезни?
207. Какой метод исследования является наиболее эффективным при опухоли молочной железы менее 0,5 см?
208. Какой степени острой артериальной недостаточности нижних конечностей соответствует наличие у больного онемения, парестезии, боли в конечности в покое или при нагрузке?
209. Какой признак не является характерным для синдрома Педжетта, болезни Педжета-
Шретера?
210. Какое утверждение будет неверным для острого аппендицита?
A case of successful radical surgical treatment of chronic pancreatitis complicated by a giant pseudoaneurysm of the common hepatic artery
Введение
Сосудистые нарушения являются достаточно частым и наиболее грозным осложнением острого некротического панкреатита (ОНП) и обострения хронического панкреатита (ХП). Они включают венозные тромбозы портальных, селезеночных и брыжеечных сосудов, диффузные кровотечения из варикозно расширенных вен, ишемические некрозы с образованием инфаркта селезенки и некроза желудка, тонкой и толстой кишки, аррозии артериальных сосудов с образованием ложных аневризм (ЛА). Аррозия сосудов с образованием ЛА висцеральных сосудов, вовлеченных в некротический процесс, является наиболее опасным осложнением. Данная категория осложнений ОНП и ХП нечастая, однако наиболее грозная и тяжелая.
Впервые описал аневризму селезеночной артерии в 1770 году M. Beaussier при аутопсии больного, умершего от внутреннего кровотечения, которая стала случайной находкой. Образование ЛА наблюдается как в острый период, так и в последующее время после перенесенного ОНП на этапе развития у пациента ХП. Предрасполагающими факторами в генезе ЛА являются дисплазия сосудов, портальная гипертензия, спленомегалия и локальные воспалительные процессы. Частота возникновения ЛА при ОНП составляет 1,2–14 % [1–7]. Зарегистрированная заболеваемость ХП, осложненного кровотечением из псевдоаневризм, колеблется от 4 до 10 % [8, 9]. Наиболее часто развиваются псевдоаневризмы селезеночной артерии, реже — гастродуоденальной, панкреатодуоденальной и печеночных артерий [10].
Формирование ЛА имеет два варианта. В случае аррозии артерии в ткани поджелудочной железы размеры ЛА бывают небольшими. Этот вариант ЛА протекает, как правило, бессимптомно и диагностируется случайно на этапах динамического обследования.
Второму варианту формирования ЛА предшествует образование псевдокисты. Развитие постнекротических псевдокист осложняет течение острого панкреатита у 5–15 % больных [3]. Самой частой причиной возникновения аневризм является аррозия сосудов псевдокист (жидкостных скоплений) поджелудочной железы. Псевдокисты содержат панкреатические энзимы, которые вызывают периартериальное воспаление, некроз стенки сосуда, расположенного рядом со стенкой кисты, и разрушают ее. Когда артерия «прорывается» в кисту, она формирует ложную аневризму или кровотечение в псевдокисту [2, 11, 12]. Таким образом, псевдокиста трансформируется в ложную аневризму. В таких вариантах размеры ЛА соответствуют размерам псевдокист и бывают достаточно большими. Чаще большая часть объема ЛА тромбируется, а полость с сохраненным кровотоком составляет 20–70 % от объема ЛА [1]. Развитие кровотечения в постнекротическую кисту является грозным осложнением и сопровождается летальностью до 80 % [13].
Еще одной особенностью ЛА второго типа является связь полости с панкреатическими протоками. Длительный контакт сосудов с агрессивными ферментами поджелудочной железы (ПЖ) ведет к повреждению стенки и аррозивному кровотечению с клиникой вирсунгоррагии и кишечного кровотечения. Эти кровотечения бывают различной интенсивности и часто рецидивируют [14, 15]. Дальнейшая патологическая картина связана с развитием тромбоза одноименных висцеральных вен на фоне продолжающегося некроза окружающих поджелудочную железу тканей. Повышение давления в питающей ложную аневризму артерии при сохраняющемся венозном блоке приводит к ее разрыву и массивному кровотечению. Кровоизлияние может распространяться в брюшную полость, забрюшинное пространство, в просвет кишки, чаще двенадцатиперстной, или в панкреатический проток.
В большинстве случаев клиническая картина ОНП и обострения ХП, осложненного ЛА непарных висцеральных артерий, является неспецифичной и вызывает трудности в дифференциальной диагностике. ЛА больших размеров клинически проявляются выраженным болевым синдромом. Часто отмечаются анемии неясного генеза и сдавления рядом расположенных органов брюшной полости. Заподозрить ЛА можно при возникновении осложнений, основное из которых — разрыв аневризмы и кровотечение в забрюшинную клетчатку, свободную брюшную полость, панкреатический проток или кисту поджелудочной железы. Часто единственным клиническим симптомом ЛА является рецидивирующее желудочно-кишечное кровотечение без выявленного источника. ЛА, как правило, не вызывают появления симптомов, пока не происходит их разрыв, что проявляется симптомами острой кровопотери.
Диагностический комплекс обследования включает рентгенографию брюшной полости и желудка, гастродуоденоскопию (ГДС), ультразвуковое исследование (УЗИ) с дуплексным сканированием сосудов, компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), ангиографию. Рентгенографию брюшной полости выполняют всем пациентам с выраженным болевым синдромом для дифференциальной диагностики с другими острыми хирургическими заболеваниями. По данным рентгенографии выявляется наличие полостных образований в проекции ПЖ. Контрастная гастродуоденография показывает картину внешнего сдавления желудка и двенадцатиперстной кишки (ДПК) с явлениями частичной или полной гастродуоденальной непроходимости в зависимости от топографического расположения псевдокисты или ЛА. Данные ГДС (сдавление задней стенки желудка и медиально-верхней стенки двенадцатиперстной кишки, явления гастродуоденостаза, воспалительно-некротическое изменение слизистой) дополняют информацию о наличии объемного образования. Наблюдение о выделении свежей крови из дуоденального соска подтверждает аррозию сосуда с прорывом в главный панкреатический проток. Однако вышеперечисленные методы лишь косвенно указывают на наличие ложной аневризмы.
Эффективным методом инструментальной диагностики ЛА является УЗИ органов брюшной полости с дуплексным сканированием сосудов (УЗДГ) [16], а также КТ и МРТ органов брюшной полости с внутривенным контрастированием. Однако золотым стандартом в настоящее время является ангиография, позволяющая получить исчерпывающую информацию о наличии ЛА и ее локализации, топографические особенности зоны исследования и информацию об анатомии сосудов, питающих аневризму. Полученные при ангиографии данные помогают определить тактику лечения и выбор метода выключения ЛА из кровотока [17, 18].
Применяются два метода лечения ложных аневризм непарных висцеральных артерий — открытые операции или рентгенэндоваскулярные вмешательства.
Рентгенэндоваскулярные методы лечения ЛА включают в себя использование различных эмболизирующих спиралей, губок, гелей и стент-графтов. Ангиография широко используется для выявления источника висцерального артериального кровотечения с последующей артериальной эмболизацией для остановки кровотечения. Радиологический сосудистый подход показал свою эффективность для пациентов с псевдоаневризмами, осложненными кровотечениями [17, 19, 25]. На сегодняшний день сохраняется высокий риск рецидива кровотечения из псевдоаневризмы у больных после ангиоэмболизации. Тем не менее применение ангиографии и ангиоэмболизации в качестве первой линии терапии, для диагностики и остановки кровотечения и стабилизации жизненных показателей является рациональной стратегией лечения и широко используется в современной клинической практике [17, 18].
Открытые операции включают в себя различные варианты резекции ЛА, лигирования устья ЛА и резекции поджелудочной железы с ЛА. Хирургические вмешательства, в том числе прямая артериальная перевязка с опорожнением псевдокисты или резекция поджелудочной железы, используются для лечения ЛА, осложненных кровотечением. Для пациентов с ЛА, расположенными в головке и теле поджелудочной железы, используется цистотомическая артериальная перевязка и наружное дренирование кисты ПЖ. Дистальная панкреатэктомия рекомендуется для пациентов с ЛА, расположенными в хвосте поджелудочной железы. После безуспешной артериальной эмболизации рекомендуют выполнять экстренную открытую перевязку артерии, питающей ЛА. Однако лигирование или ушивание сосуда связано с более высокими показателями рецидива кровотечения и повторных вмешательств, и резекция ПЖ является предпочтительным выбором лечения. Таким образом, роль открытых хирургических вмешательств при кровотечениях из ЛА у больных с ХП остается спорной. Большинство специалистов считают, что хирургическое вмешательство следует проводить у пациентов, у которых эмболизация артерии, питающей ЛА, невозможна по техническим причинам или ее результат неэффективен [20, 21].
Клинический случай
Пациент Н., 37 лет, поступил в отделение хирургии Минской областной клинической больницы для планового оперативного лечения с диагнозом «хронический панкреатит, обострение, киста головки и тела поджелудочной железы больших размеров, сахарный диабет». На момент поступления рост — 169 см, масса тела — 50 кг, индекс массы тела — 17,5. Выраженный болевой синдром. Из анамнеза: страдает хроническим панкреатитом около 5 лет; за последний год состояние ухудшилось: усилился болевой синдром, неоднократно лечился стационарно без положительного эффекта, отмечает потерю массы тела на 10 кг.
По данным УЗИ: поджелудочная железа — 60 × 54 × × 5 мм, контур неровный, нечеткий, структура диффузно неоднородная, эхогенность смешанная. В головке-теле киста 63 × 35 мм с эхопозитивными включениями, вирсунгов проток 4–6 мм, расширен.
Гастроскопия: просвет желудка деформирован в пилородуоденальной зоне, перистальтика не изменена, слизистая оболочка умеренно гиперемирована в антральном отделе, складки нормальные, привратник асимметричный. Просвет двенадцатиперстной кишки деформирован и сужен из-за отека.
КТ: поджелудочная железа 75 × 16 × 16 мм, структура паренхимы неоднородная, множественные кальцинаты, вирсунгов проток расширен в области тела и хвоста до 8 мм с конкрементами до 7 мм. В области головки визуализируются два дополнительных объемных образования однородной жидкостной плотности (+8 едН) размерами 78 × 55 × 32 мм и 40 × 29 × 47 мм, имеющие стенку 3–10 мм, компримирующие ДПК. Заключение: хронический кальцифицирующий панкреатит, псевдокисты поджелудочной железы, панкреатолитиаз, вирсунгоэктазия (рис. 1).
Учитывая данные обследований, диагноз псевдо–аневризмы установлен не был. Планировалось выполнить реконструктивную операцию на поджелудочной железе, включающую резекцию головки поджелудочной железы со вскрытием кисты. На операции была выявлена выраженная сеть варикозно расширенных вен в области большого и малого сальника, желудочно-ободочной связки. Выполнена холецистэктомия. После панкреатовирсунготомии над перешейком под давлением выделялся секрет поджелудочной железы, вирсунгов проток расширен до 6–7 мм. Выполнена локальная передняя резекция головки поджелудочной железы в объеме операции Фрея со вскрытием кисты, располагавшейся по задней стенке головки поджелудочной железы. При ревизии полости кисты установлено, что киста больших размеров, до 10 см в диаметре, многокамерная. Из полости кисты удалены сгустки крови и элементы аневризматической чашки, после чего открылось активное артериальное кровотечение из полости кисты. При попытке расширить цисто-панкреатическое отверстие по задней стенке головки поджелудочной железы произошло повреждение воротной вены, с последующим ушиванием дефекта последней. Достичь временного частичного гемостаза удавалось пальцевым прижатием и тампонированием полости псевдоаневризмы. Для установки источника произведена дополнительная мобилизация двенадцатиперстной кишки с головкой поджелудочной железы с последующим широким рассечением задней стенки псевдоаневризмы, где в глубине был выявлен крупный артериальный ствол, предположительно селезеночная или печеночная артерия, с большим дефектом в стенке, ушить последний не удалось из-за хрупкости сосуда, в связи с чем он был прошит и перевязан. Учитывая большой объем кровопотери (за время операции перелито 2500 мл свежезамороженной плазмы и 2000 мл эритроцитарной массы), длительность операции более 7 часов, а также неясный прогноз в отношении жизнеспособности печени и других органов брюшной полости, реконструктивный этап операции на поджелудочной железе решено отсрочить. При дополнительной ревизии патологии мезентериальных сосудов не выявлено, воротная вена после ушивания проходима. Зона операции тампонирована и дренирована, швы на рану через все слои на протекторах.
Биопсия: ткань ПЖ с выраженным интра- и перилобарным склерозом, эктазия протоков с застоем секрета и формированием конкрементов; очаговая пролиферация сосудов.
В послеоперационном периоде лечение проводилось в реанимационном отделении: инфузионная терапия, антибиотикотерпия, гепатопротекторы, низкомолекулярные гепарины, октреотид, раннее энтеральное питание и др. В 1-е сутки выявлены признаки ишемического повреждения печени: УЗИ — артериальный кровоток в паренхиме печени не определяется, воротная вена — до 13 мм, скорость кровотока — 0,47 м/с, перистальтика кишечника определяется. Лабораторные признаки цитолиза (общий билирубин — 30 мкмоль/л, аланинаминотрансфераза (АЛТ) — 1440 ед/л, аспартата–минотрансфераза (АСТ) — 1800 ед/л), с постепенной нормализацией показателей в течение 3 дней до АЛТ — 462 ед/л, АСТ — 244 ед/л. На контрольном УЗИ участки некроза паренхимы печени не определяются.
В связи с компенсацией состояния пациента и лабораторных показателей на 3-и сутки после операции было решено выполнить реконструктивный этап операции. На операции: после извлечения тампонов печень бледно-розового цвета, с очагами уплотнения. Зона резекции головки поджелудочной железы и вирсунгов проток несколько отечны, крови и сгустков в полости псевдокисты нет. Тонкая и толстая кишка розового цвета, с активной перистальтикой. Выполнена панкреатоеюностомия на петле по Ру. На 5-е сутки переведен из реанимации в хирургическое отделение. Послеоперационное течение без осложнений, однако на 8-е сутки по дренажу из брюшной полости начало ежедневно выделятся до 150–200 мл желчного отделяемого, в последующем сформировался неполный наружный желчный свищ. При выписке на 17-е сутки после операции: гемоглобин — 138/л, гематокрит — 40 %, общий белок — 71 г/л, мочевина — 2,5 ммоль/л, общий билирубин — 7,0 мкмоль/л, АЛТ — 108 ед/л, АСТ — 107 ед/л.
Через 4 месяца пациент повторно госпитализирован с наружным желчным свищом и полным сбросом желчи, кал ахоличен. При выполнении МРТ с холангио–панкреатографией и ангиографией выявлено: дренаж под печенью в области общего печеночного протока, желчный пузырь и холедох не дифференцируются, расширены внутрипеченочные протоки. Головка и частично тело поджелудочной железы четко не дифференцируются, в S7 печени визуализируются два кольцевидных очага, окруженных перифокальным отеком 34 × 30 мм. Состояние после реконструктивной операции на поджелудочной железе, панкреатоеюноанастомоз (ПЕА) на петле по Ру, абсцесс правой доли печени? На КТ-ангиографии: холедох не дифференцируется, внутрипеченочные желчные протоки расширены, в них воздух, портальная вена проходима (рис. 2), выявлено отсутствие контрастирования общей печеночной артерии, собственная печеночная артерия контрастируется через коллатерали (рис. 3). На фистулографии через наружный дренаж контрастируются внутрипеченочные протоки, холедох не контрастируется.
Для ликвидации полного наружного желчного свища пациенту выполнено 3-е оперативное вмешательство. На операции: выраженный спаечный процесс, из рубцовых сращений и спаек выделены печень, желудок, ДПК, ПЕА и печеночно-двенадцатиперстная связка, при детальной ревизии которой установлено отсутствие гепатикохоледоха в печеночно-двенадцатиперстной связке. В воротах печени определяются правый и левый долевые печеночные протоки. С учетом отсутствия данных об интраоперационном повреждении холедоха можно предположить его ишемический некроз после первичного вмешательства с перевязкой общей печеночной артерии. Петля тонкой кишки по Ру, участвующая в ПЕА, недостаточно подвижна из-за рубцовых сращений и непригодна для формирования дополнительного желчеотводящего анастомоза. Учитывая интраоперационные находки, выполнена резекция участка печени в области ворот с мобилизацией долевых печеночных протоков с последующей бигепатикоеюностомией на сформированной второй петле по Ру. В раннем послеоперационном периоде развилась частичная несостоятельность бигепатикоеюноанастомоза с желчным затеком в подпеченочное пространство. На 3-и сутки после первичной операции выполнена релапаратомия с дополнительным дренированием, после чего состояние пациента стабилизировалось. На 10-е сутки после операции желчеистечение прекратилось. На 30-е сутки после операции пациент в удовлетворительном состоянии выписан из стационара.
Пациент через 4 месяца прошел плановое обследование. Жалоб не предъявляет, прибавил в массе 10 кг. Клинические и биохимические показатели в пределах нормы, по данным УЗИ, МРТ — диффузные изменения печени, незначительные признаки внутрипеченочного холестаза.
Заключение
Результаты приведенного клинического случая свидетельствуют о возможности успешного хирургического лечения хронического панкреатита с редким осложнением — гигантской псевдоаневризмой общей печеночной артерии. Развившееся массивное кровотечение потребовало интенсивной интраоперационной терапии кровопотери с массивной гемотрансфузией препаратов крови (4,5 л). С целью спасения жизни пациента применена технология damage control (контроля повреждений) [22, 23] с выполнением реконструктивного этапа операции через 3 суток после стабилизации его состояния. В послеоперационном периоде развилось ишемическое повреждение печени, которое купировалось восстановлением кровотока в собственной печеночной артерии по коллатералям из левой желудочной артерии и верхнебрыжеечной артерии через артериальную дугу в головке ПЖ на фоне интенсивной комплексной терапии с применением гепатопротекторов. Развившийся ишемический некроз холедоха привел к формированию полного желчного свища. Это ослож–нение потребовало выполнения дополнительной реконструктивной операции: бигепатикоеюностомии на второй петле по Ру.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Bibliography1. Кригер А.Г. Ложные аневризмы артерий бассейна чревного ствола у больных хроническим панкреатитом / А.Г. Кригер, Л.С. Коков, Г.Г. Кармазановский, Г.И. Кунцевич, В.Д. Федоров, П.Б. Барбин, Н.В. Тарбаева // Хирургия. — 2008. — Т. 12. — С. 17-23.
2. Воробей А.В. Неязвенные гастроинтестинальные кровотечения / А.В. Воробей, В.В. Климович. — Минск: Полипринт, 2008. — C. 228.
3. Покровский А.В. Клиническая ангиология. Руководство в 2 томах. — М.: Медицина, 2004. — Т. 2. — С. 127-128.
4. Bergert H. Prevalence and treatment of bleeding complications in chronic pancreatitis / H. Bergert, F. Dobrowolski, S. Caffier et al. // Langenbecks. Arch. Surg. — 2004. — № 389. — P. 504-510.
5. Sparrow P. Ultrasonic-Guided Percutaneous Injection of Pancreatic Pseudoaneurysm with Thrombin / P. Sparrow, J. Asquith, N. Chalmers // Cardiovasc. Int Radiol. — 2003. — № 26. — P. 312-315.
6. Sharma P. Hemorrhage in acute pancreatitis: should gastrointestinal bleeding be considered an organ failure? / P. Sharma, K. Madan, P. Garg // Pancreas. — 2008. — № 36. — P. 141-145.
7. Kiviluoto T. Pseudocysts in chronic pancreatitis. Surgical results in 102 consecutive patients / T. Kiviluoto, L. Kivisaari, E. Kivilaakso, M. Lempinen // Arch. Surg. — 1989. — № 124. — P. 240-243.
8. Udd M. Treatment of bleeding pseudoaneurysms in patients with chronic pancreatitis / M. Udd, A.K. Leppäniemi, S. Bidel, P. Keto et al. // World J. Surg. — 2007. — № 31. — P. 504-510.
9. Balachandra S. Systematic appraisal of the management of the major vascular complications of pancreatitis / S. Balachandra, A.K. Siriwardena // Am. J. Surg. — 2005. — № 190. — P. 489-495.
10. Moringhini A. Pseudocysts in acute non-alcoholic pancreatitis: incidence and natural history / A. Moringhini, G. Uomo, R. Patti // Dg. Dis. Sci. — 1999. — № 44. — P. 1669-1673.
11. Ido К. Case of hemorrhagic pancreatic pseudocyst in which ultrasound imaging was useful / К. Ido, К. Isobe, К. Kimura et al. // Med. Ultrasonics. — 2004. — № 31. — P. 41-45.
12. Kane M.G. Pancreatic pseudocyst / M.G. Kane, G.J. Krejs // Adv. Intern. Med. — 1984. — № 29. — P. 271-300.
13. Chen H.L. Ruptured Pancreaticoduodenal Artery Pseudoaneurysm with Chronic Pancreatitis Presenting as Recurrent Upper Gastrointestinal Bleeding / H.L. Chen, W.H. Chang, S.C. Shih et al. // Dig. Dis. Sci. — 2006.
14. Ikeda О. Hemorrhage into pancreatic pseudocyst / О. Ikeda, S. Кirе, Y. Torigoe et al. // Abdom. Imaging. — 2006. — № 20. — P. 1-4.
15. Fukatsu K. A case of chronic pancreatitis in which endoscopic ultrasonography was effective in the diagnosis of a pseudoaneurysm / K. Fukatsu, K. Ueda, H. Maeda et al. // World J. Gastrointest. Endosc. — 2012. — № 4. — P. 335-338.
16. Balthazar E.J. Hemorrhagic complications of pancreatitis: radiologic evaluation with emphasis on CT imaging / E.J. Balthazar, L.A. Fisher // Pancreatology. — 2001. — № 1. — P. 306-313.
17. Bergert H. Management and outcome of hemorrhage due to arterial pseudoaneurysms in pancreatitis / H. Bergert, I. Hinterseher, S. Kersting et al. // Surgery. — 2005. — № 137. — P. 323-328.
18. De Perrot M. Management of bleeding pseudoaneurysms in patients with pancreatitis / M. De Perrot, T. Berney, L. Bühler et al. // Br. J. Surg. — 1999. — № 86. — P. 29-32.
19. Bhasin D.K. Non-surgical management of pancreatic pseudocysts associated with arterial pseudoaneurysm / D.K. Bhasin, S.S. Rana, V. Sharma et al. // Pancreato–logy. — 2013. — № 13. — P. 250-253.
20. Chong C.N. Ruptured gastroduodenal artery pseudo–aneurysm as the initial presentation of chronic pancreatitis / C.N. Chong, K.F. Lee, K.T. Wong et al. // Am. J. Surg. — 2009. — № 197. — P. 38-40.
21. Rotondo M.F. Damage Control — an approach for improved survival in exsanguinating penetrating abdominal injury / M.F. Rotondo, C.W. Schwab, M.D. McGonigal et al. // J. Trauma. — 1993. — № 35. — P. 375-382.
22. Germanos S. Damage control surgery in the abdomen: an approach for the management of severe injured patients / S. Gourgiotis, C. Villias, M. Bertucci et al. // Int. J. Surg. — 2008 Jun. — № 6(3). — P. 246-52.
Резекционно-дренирующий способ хирургического лечения хронического кальцифицирующего панкреатита при нерасширенном главном панкреатическом протоке
Изобретение относится к медицине, в частности к хирургии, и может быть использовано для хирургического лечения хронического кальцифицирующего панкреатита при нерасширенном главном панкреатическом протоке.
Хронический панкреатит в последние годы стал наиболее частой патологией поджелудочной железы, доля которого в структуре заболеваемости органов желудочно-кишечного тракта составляет от 8 до 9% (Маев И.В., 2005; Buchler M.W., 2002). Несмотря на успехи в консервативной терапии и внедрении новых методов хирургического лечения, количество осложненных форм хронического панкреатита растет и наблюдается у 2/3 больных, а летальность достигает 50% (Кузин М.И., 1985; Ачкасов Е.Е., 2003; Mayerle J., 2013). Хирургическое лечение хронического панкреатита остается одной из сложных задач современной панкреатологии. Выбор метода хирургического вмешательства основывается на клинических проявлениях, локализации процесса, состоянии протоковой системы и осложнениях хронического панкреатита (Егоров В.И., 2009; Andersen D.K., 2010).
Дренирующие операции, направленные на декомпрессию протоковой системы поджелудочной железы, не всегда позволяют устранить такие осложнения хронического панкреатита, как абдоминальный болевой синдром, обусловленный дегенеративными изменениями в головке поджелудочной железы, что приводит к неудовлетворительным результатам и рецидиву заболевания (Кубышкин В.А., 2004; Но H.S., 2001). Основываясь на том, что головка поджелудочной железы является «триггером» хронического панкреатита, стали активно применяться резекционные методы лечения, направленные на удаление головки поджелудочной железы. В настоящее время предложен целый ряд способов локальной резекций головки поджелудочной железы, основным преимуществом которых является сохранение двенадцатиперстной кишки (Frey C.F., 1987; Beger H.G., 1989; Izbicki J.R., 1998; Gloor В., 2001).
Однако болевой синдром при хроническом панкреатите редко бывает обусловлен одной патогенетической причиной, чаще он бывает следствием нескольких факторов, потенцирующих друг друга. Современная теория болевого синдрома объясняет его возникновение нейроиммунным воспалением в ткани поджелудочной железы, протоковой и паренхиматозной гипертензией (Паклина О.В., 2009; Щастный А.Т., 2011; Olesen S.S., 2013; Bouwense S.A., 2015). Основываясь на этом, наиболее патогенетически обоснованным хирургическим методом лечения хронического панкреатита являются резекционно-дренирующие операции, направленные на удаление фиброзно-измененной ткани поджелудочной железы и декомпрессии протоковой системы. Это в большинстве случаев позволяет купировать болевой синдром и стабилизировать дальнейшее развитие панкреатита, что является профилактикой его осложнений (Гальперин Э.И., 2006; Воробей А.В., 2012).
Известен способ резекции поджелудочной железы при хроническом панкреатите (патент РФ №2465842, 10.11.2012), заключающийся в резекции центральной части головки поджелудочной железы и иссечении Вирсунгова протока с формированием продольного панкреатоеюноанастомоза. После наложения по внутреннему контуру двенадцатиперстной кишки 5-7 швов для перевязки ветвей поджелудочно-двенадцатиперстной артерии производят иссечение центральной части головки поджелудочной железы с Санториневым и Вирсунговым протоком. При помощи зонда, введенного в просвет Вирсунгова протока и используемого как ориентир, производится иссечение Вирсунгова протока с окружающими измененными тканями в виде клина до уровня перехода тела поджелудочной железы в хвост с формированием в ткани поджелудочной железы открытой кпереди желобовидной полости, которая анастомозируется с просветом продольно вскрытой отключенной по Ру петлей тонкой кишки однорядным непрерывным швом. Вышеописанная методика не позволяет в полной мере устранить такие осложнения хронического панкреатита, как механическая желтуха, вызванная компрессией интрапанкреатической части общего желчного протока фиброзно-измененной тканью головки поджелудочной железы, сдавления двенадцатиперстной кишки, мезентериальных сосудов. При нерасширенном Вирсунговом протоке не всегда удается его идентифицировать, зондировать и осуществить резекцию.
Известен способ резекции головки поджелудочной железы (патент РФ №2276583, 20.05.2006), заключающийся в резекции ткани головки поджелудочной железы, выделении интрапанкреатической части холедоха (из патологический измененной паренхимы) и селективной перевязки проксимального отдела главного панкреатического протока с формированием панкреатоэнтероанастомоза. В способе после мобилизации двенадцатиперстной кишки и рассечения ткани поджелудочной железы, начиная с медиального края двенадцатиперстной кишки, выделяют интрапанкреатическую часть общего желчного протока из фиброзно-измененную ткань головки поджелудочной железы. Главный панкреатический проток в месте его впадения в общий желчный проток пересекают и селективно перевязывают. Затем приступают к иссечению воспаленно-измененной ткани головки поджелудочной железы по направлению к хвосту, до перешейка железы, где начинается здоровая ткань. Формируют панкреатоеюноанастомоз на наружной временной стоме панкреатического протока, которую выводят на переднюю брюшную стенку через подвесную энтеростому.
Данная методика не позволяет в полной мере устранить такие осложнения хронического панкреатита, как болевой синдром, отсутствие адекватного дренирования долевых протоков головки поджелудочной железы (Санторинева и протока крючковидного отростка), и дистальных ее отделов, приводит к неудовлетворительным результатам и рецидиву заболевания.
Известен способ хирургического лечения хронического панкреатита (патент РФ №2421158, 20.06.2011), включающий изолированную субтотальную резекцию головки поджелудочной железы с формированием концепетлевого панкреатоэнтероанастомоза, в котором вокруг резецированной головки поджелудочной железы формируют «сальниковую сумку» из пряди правой половины большого сальника. После мобилизации поджелудочной железы и пересечения ее на уровне перешейка в главный панкреатический проток культи железы вводят силиконовый дренаж соответствующего диаметра и фиксируют к стенками протока кисетным швом с целью предотвращения попадания панкреатического сока в зону панкренатоэнтероанастомза. Однако известно, что использование техники прецизионного шва, современных шовных материалов, препаратов, угнетающих секрецию поджелудочной железы, а также фиброзно-измененная паренхима поджелудочной железы позволяет выполнить надежный анастомоз без использования временных наружных дренажей панкреатического протока. Рассекают паренхиму головки поджелудочной железы на введенном в главный панкреатический проток зонде, тем самым вскрывая просвет протока. Максимально удаляют измененную ткань головки с сохранением интрапанкреатической части общего желчного протока и участок железы, где располагаются ветви панкреатодуоденальных сосудов. Формируют концепетлевой панкреатоэнтероанастомоз, при этом силиконовый дренаж выводят через подвесную энтеростому. Следующим этапом вокруг резецированной головки поджелудочной железы формируют «сальниковую сумку» из свободной пряди правой половины большого сальника, в нее вводят силиконовый дренаж, выводимый на кожу.
Недостатком метода является необходимость формирования «сальниковой сумки» вокруг резецированной головки поджелудочной железы с наружным дренажом этой полости, что в ряде случаев может привести к формированию абсцессов, наружных панкреатических свищей. Известны способы субтотальной резекции головки поджелудочной железы, при которых не формируется проксимальный панкреатоэнтероанастозом в связи с малым объемом оставшейся паренхимы головки поджелудочной железы. При этом сохраняется задняя ветвь поджелудочно-двенадцатиперстной артерии для кровоснабжения двенадцатиперстной кишки и терминального отдела общего желчного протока.
Известен способ хирургического лечения хронического калькулезного панкреатита (патент РФ №2480197, 10.11.2011), заключающийся во вскрытии главного панкреатического протока, удалении и дроблении ультразвуковым диссектором конкрементов с формированием панкреатоеюноанастомоза, причем после доступа в малый сальник, мобилизации двенадцатиперстной кишки по Кохеру и мобилизации нижнего края поджелудочной железы, под ультразвуковым контролем производят пункцию и вскрытие главного панкреатического протока длиной до 8-10 см. Ультразвуковым диссектором дробят и удаляют конкременты в протоке и его стенки, после удаляют часть верхней и нижней стенки Вирсунгова протока с раскрытием протоков I-II порядка. Далее ультразвуковым диссектором дробят и удаляют конкременты в дистальной части поджелудочной железы далее линии рассечения протока, в просвете проксимальной части Вирсунгова протока до прохождения инструмента в устье главного панкреатического протока. На границе головки и тела железы расширяют вскрытый Вирсунгов проток до 1,5-1,8 см по типу операции Фрея. Операцию завершают формированием продольного панкреатоеюноанастомоза бок в бок.
Недостатком вышеописанной методики является то, что данный способ направлен только на дренирование главного панкреатического протока, а не на устранение патологического очага в головке поджелудочной железы (фиброзно-измененной паренхимы — «триггера» хронического панкреартита) и купирования болевого синдрома. Также данная методика не позволяет адекватно предупредить такие осложнения хронического панкреатита, как механическая желтуха (билиарная гипертензия), компрессия двенадцатиперстной кишки и мезентериальных сосудов.
Наиболее близким к предлагаемому способу, выбранным в качестве прототипа является способ хирургического лечения хронического головчатого панкреатита (патент РФ №2228720, 20.05.2004), заключающийся в интрапаренхиматозной резекции головки поджелудочной железы с формированием продольного панкреатоэнтероанастомоза.
Сущность метода заключается в продольном рассечении капсулы и поверхностного слоя паренхимы поджелудочной железы по передней поверхности головки, интрапаренхиматозном удалении тканевых масс из головки поджелудочной железы с оставлением паренхиматозно-капсулярного каркаса толщиной 0,5-0,7 см, рассечении передней стенки панкреатического протока, открывающегося в образовавшуюся полость, выделении отрезка тонкой кишки и анастомозирования его с паренхиматозно-капсулярным каркасом, ограничивающим полость головки поджелудочной железы.
Недостатком способа является необходимость формирования панкреатоэнтероанастомоза с воспалительно-измененными тканями головки поджелудочной железы, что может привести к развитию гнойно-воспалительных осложнений из-за несостоятельности швов соустья. Кроме того, не устраняется компрессия интрапанкреатической части общего желчного протока и мезентериальных сосудов, а также отсутствует адекватное дренирование панкреатических протоков 2-, 3-го порядка (долевых панкреатических протоков) дистальной части поджелудочной железы, что может привести к рецидиву болевого синдрома и необходимости повторных хирургических вмешательств.
Новый технический результат предлагаемого изобретения заключается в повышении надежности панкреатоеюноанастомоза, предупреждении развития послеоперационных стриктур общего желчного и панкреатического протоков, возникновения панкреатических свищей, гнойно-септических осложнений, болевого синдрома и повышении качества жизни пациентов.
Для достижения нового технического результата в резекционно-дренирующем способе хирургического лечения хронического кальцифицирующего панкреатита, включающем субтотальную резекцию ткани головки поджелудочной железы, путем иссечения паренхимы вдоль внутреннего края подковы двенадцатиперстной кишки и перидуктальную резекцию рубцово-измененной ткани вдоль интрапанкреатической части общего желчного протока, выполняют предварительную сосудистую изоляцию ткани головки поджелудочной железы путем лигирования переде-верхней и передне-нижней ветвей панкреатодуоденальной артерии под контролем интраоперационного ультразвукового исследования (ИОУЗИ), проводят маркировку терминального отдела общего желчного протока билиарным стентом, после чего осуществляют резекцию передней поверхности дистальной части поджелудочной железы с продольным параллельным рассечением паренхимы, выполняют вентральную тракцию тела поджелудочной железы за швы-держалки, вскрывают панкреатический проток в дистальном направлении на протяжении 8 см, резецируют переднюю часть тела и хвоста с продольным параллельным рассечением паренхимы, далее накладывают позади ободочный продольный панкреатикоеюноанастомоз на отключенной по Ру петле тонкой кишки, непрерывным однорядным швом, в проекции головки поджелудочной железы шов с медиальной стенкой подковы двенадцатиперстной кишки, на расстоянии 8 см ниже панкреатикоеюноанастомоза накладывают межкишечный анастомоз «конец в бок».
Заявляемое изобретение иллюстрируется фигурами 1-3.
Обозначения, принятые на фигурах: 1 — поджелудочная железа, 2 — общий желчный проток, 3 — билианый стент, 4 — главный панкреатический проток, 5 — двенадцатиперстная кишка, 6 — зонд, 7 — швы-держалки, 8 — верхняя брыжеечная вена, 9 — панкреатодуоденальная артерия, 10 — верхняя брыжеечная артерия, 11 — гемостатические швы, 12 — полость резекции головки поджелудочной железы, 13 — иссеченная паренхима тела-хвоста поджелудочной железы, 14 — продольное параллельное рассечение ткани поджелудочной железы, 15 – панкреатоеюноанастомоз.
Способ осуществляют следующим образом. Доступ срединный от мечевидного отростка до пупка или двусторонний подреберный разрез, экспозицию достигают использованием ретракторов Сигала. Выполняют доступ к поджелудочной железе путем мобилизации и низведения печеночного изгиба ободочной кишки, широкого маневра Кохера, рассечения желудочно-ободочной связки, с мобилизацией селезеночного угла ободочной кишки. После пересечения желудочно-сальниковых сосудов полностью высвобождают вентральную часть поджелудочной железы, выполняют мобилизацию левых ее отделов по нижнему и верхнему краю. Производят интраоперационное ультразвуковое исследование (ИОУЗИ) поджелудочной железы. Левее мезентериальных сосудов накладывают швы-держалки на верхний и нижний край тела поджелудочной железы (в количестве 4). Идентифицируют (тонкоигольная пункция, ИОУЗИ) и вскрывают на максимальном протяжении главный панкреатический проток (ГПП), выполняют ревизию, удаляются конкременты, проверяют проходимость в проксимальном направлении. Под контролем ИОУЗИ идентифицируют передне-верхнюю поджелудочно-двенадцатиперстную и передне-нижнюю поджелудочно-двенадцатиперстную артерии (из бассейна ВБА), накладывают гемостатические швы. Далее выполняют субтотальную резекцию ткани головки ПЖ с практически полным иссечением паренхимы вдоль внутреннего края двенадцатиперстной кишки, крючковидного отростка, перидуктальной резекцией рубцово-измененной ткани вдоль интрапанкреатической части ОЖП. Для идентификации терминального отдела общего желчного протока его маркируют билиарным стентом. Кровоснабжение двенадцатиперстной кишки и терминального отдела ОЖП осуществляют за счет задне-верхней поджелудочно-двенадцатиперстной артерии, что подтверждается ИОУЗИ. Далее осуществляют контроль за мезентериальными сосудами и выполняют вентральную тракцию за швы-держалки, выполняют резекцию передней части тела и хвоста ПЖ (с иссечением ГПП) с продольным параллельным рассечением паренхимы с целью дренажа долевых протоков. Гемостаз выполняют с использованием препарата «ТахоКомб». Операцию завершают формированием позади ободочного продольного панкреатоеюноанастомоза путем наложения непрерывного однорядного шва. В проекции головки поджелудочной железы шов накладывают с медиальной стенкой подковы двенадцатиперстной кишки (ПЖ с медиальной стенкой двенадцатиперстной кишки). Брюшную полость дренируют, ушивают послойно.
Клинический пример
Больной М., 72 года. В 2015 поступил в отделение абдоминальной хирургии КГБУЗ «КМКБ №20 им. И.С. Берзона» г. Красноярска 09.09.15 года в плановом порядке.
Больной в течение 5 лет страдает хроническим калькулезным панкреатитом. В течение этого времени неоднократно находился на амбулаторном и стационарном лечении по поводу приступов хронического кальцифицирующего панкреатита. За последний год трижды проходил курсы стационарного лечения в хирургических отделениях города. Последние 8 месяцев беспокоит периодический болевой синдром, по поводу чего принимает нестероидные анальгетики, похудел на 12 кг. Больного периодический беспокоят вздутие живота, диспепсия.
При осмотре больной с дефицитом массы тела, кожа обычной окраски, живот не вздут, участвует в акте дыхания, при пальпации мягкий, незначительно болезненный в правом подреберье и эпигастрии. Перистальтика активная. Пульс ритмичный, удовлетворительного наполнения, ЧСС — 88 в мин, АД 110/60 мм рт. ст.
Диагноз подтвержден данными УЗИ, МСКТ, МРТ. Головка поджелудочной железы увеличена до 40 мм, тело 22 мм, хвост 28 мм, Вирсунгов проток извитой, неравномерно расширен до 7 мм, в ткани поджелудочной железы и просвете Вирсунгова протока, на всем протяжении, определяются конкременты максимальным размером до 7 мм. Общий желчный проток не расширен, до 5,4 мм.
Осмотрен терапевтом, выставлен диагноз гипертонической болезни I-II, риск 3, СН о, хронический бронхит курильщика, ДН 0 — I. По данным лабораторных исследований в анализах крови отклонений от нормы нет.
В предоперационном периоде, за 5 дней до планируемого оперативного вмешательства, больному с диагностической целью выполнено ЭРХПГ. Вирсунгов проток извитой, неравномерно расширен до 7-8 мм, симптом «цепи озер», определяются тени конкрементов. Желчный проток проходим на всем протяжении, гипертензии нет, в просвет по проводнику установлен билиарный пластиковый стент диаметром 8,5 Fr, длиной 15 см.
Оперирован в плановом порядке 16.09.15. Под общей эндотрахеальной анестезией выполнена верхнесрединная лапаротомия. Доступ к поджелудочной железе путем низведения печеночного изгиба поперечно-ободочной кишки, мобилизации двенадцатиперстной кишки по Кохеру, широкого рассечения желудочно-ободочной связки, мобилизации селезеночного угла ободочной кишки. Отмечается выраженный спаечный процесс в полости малого сальника, поджелудочная железа увеличена в размере, макроскопическая паренхима ее фиброзно изменена, плотная на ощупь. После пересечения желудочно-сальниковых сосудов и рассечения спаек высвобождена вентральная часть поджелудочной железы, выполнена мобилизация левых ее отделов по нижнему и верхнему краю. Идентифицирована портальная и верхняя брыжеечная вены. Выполнено ИОУЗИ поджелудочной железы, идентифицирован главный панкреатический проток, который определяется пальпаторно в виде «желобка», произведена тонкоигольная пункция, получен прозрачный панкреатический секрет. Левее мезентериальных сосудов наложены 4 шва на верхний и нижний край тела поджелудочной железы, взяты на держалки. Вскрыт главный панкреатический проток, последний диаметром до 7-8 мм, выполнена ревизия, удалены конкременты размером от 3 до 6 мм. В дистальном направлении зонд проходит до хвоста поджелудочной железы, в проксимальном направлении зонд через папиллу провести не удалось из-за препятствия в проекции головки ПЖ.
Под контролем ИОУЗИ идентифицированы передне-верхняя и передне-нижняя поджелудочно-двенадцатиперстная артерии, наложены гемостатические швы. Выполнена резекция ткани головки поджелудочной железы, включающая иссечение паренхимы вдоль внутреннего края двенадцатиперстной кишки, крючковидного отростка, перидуктальную резекцию вдоль интрапанкреатической части общего желчного протока. При этом желчный проток определялся в такни поджелудочной железы за счет введенного стента. Иссечен главный панкреатический проток в головке поджелудочной железы, в удаленной ткани определяется множество конкрементов. Срочное гистологическое исследование — фиброз поджелудочной железы, хронический панкреатит. Выполнен ультразвуковой контроль кровоснабжения оставшейся ткани головки поджелудочной железы.
Выполняют вентральную тракцию тела поджелудочной железы за швы-держалки, вскрывают панкреатический проток в дистальном направлении на протяжении 8 см, резецируют переднюю часть тела и хвоста с продольным параллельным рассечением паренхимы, с целью дренажа долевых протоков 2-3-го порядка.
Далее накладывают позадиободочный продольный панкреатикоеюноанастомоз на отключенной по Ру петле тонкой кишки, непрерывным однорядным швом, в проекции головки поджелудочной железы шов с медиальной стенкой подковы двенадцатиперстной кишки. На расстоянии 8 см ниже панкреатикоеюноанастомоза наложен межкишечный анастомоз «конец в бок».
Выполнен тщательный гемостаз, при дальнейшей ревизии брюшной полости патологии не найдено. Брюшная полость дренирована двумя трубчатыми дренажами, расположенными продольно поджелудочной железе, выведенными через контропретуру в правом подреберье. Контроль на гемостаз и инородные тела. Брюшная полость ушита послойно. Ас. повязка. Резецированная ткань головки поджелудочной железы отправлены на плановое гистологическое исследование.
Послеоперационный период на фоне интенсивной инфузионной терапии протекал без осложнений. Перистальтическая активность ЖКТ восстановилась к третьим суткам, самостоятельный стул на 5 сутки, дренажи удалены на 6 сутки после операции. На гистологии препарата: в ткани поджелудочной железы выраженный фиброз, опухолевых клеток не выявлено. Длительность пребывания в стационаре 21 койко-день. Выписан на амбулаторное лечение под наблюдение хирурга в удовлетворительном состоянии.
Преимущества заявленного способа хирургического лечения хронического панкреатита:
1. Оптимальное сочетание резекционного и дренирующего компонента предлагаемого способа позволяет эффективно бороться с такими осложнениями хронического панкреатита, как болевой синдром, стеноз желчного и панкреатического протоков, компрессией двенадцатиперстной кишки, ретропанкреатических и мезентериальных сосудов, стабилизировать заболевание и предотвратить дальнейшее его прогрессирование.
2. Сосудистая изоляция ткани головки поджелудочной железы под ИОУЗИ контролем позволяет более полно и безопасно удалять дегенеративно-измененную ткань.
3. Маркировка интрапанкреатической части общего желчного протока стентом дает возможность безопасно выполнять перидуктальное иссечение фиброзно-измененной паренхимы головки поджелудочной железы.
4. Передняя клиновидная резекция паренхимы дистальных отделов поджелудочной железы позволяет добиться наилучшего дренирующего эффекта, а вентральная тракция за швы-держалки делает этот этап операции более простым и безопасным.
5. Наложение панкреатоэнтероанастомоза в проекции головки поджелудочной железы с медиальной стенкой подковы двенадцатиперстной кишки придает большую надежность соустью и является профилактикой гнойно-воспалительных осложнений.
Источники информации
1. Ачкасов Е.Е., Калачев С.В., Каннер Д.Ю. и др. Тактика лечения больных хроническим панкреатитом с преимущественным поражением головки поджелудочной железы / Анналы хирургической гепатологии. — 2003. — Т. 8, №2. — С. 182-183.
2. Воробей А.В., Шилейко А.В., Гришин И.Н., Лурье В.Н., Орловский Ю.Н., Вижинис Ю.И., Бутра Ю.В., Ладогич Н.А. Патогенетическое обоснование первичных и повторных операций на поджелудочной железе при хроническом панкреатите // Анналы хирургической гепатологии. — 2012. — Т. 17, №3. — С. 80-88.
3. Гальперин Э.И., Дюжева Т.Г., Ахаладзе Г.Г., Нурутдинов P.M. Хронический панкреатит, резецирующие и дренирующие вмешательства // Хирургия. — 2006. — №8. — С. 4-9.
4. Егоров В.И., Вишневский В.А., Щастный А.Т., Шевченко Т.В., Жаворонкова О.И., Петров Р.В., Полторацкий М.В., Мелехина О.В. Резекция головки поджелудочной железы при хроническом панкреатите. Как делать и как называть? (аналитический обзор) // Хирургия им. Н.И. Пирогова. 2009. №8. — С. 57-66.
5. Кубышкин В.А., Козлов И.А. Анатомические условия выполнения изолированной проксимальной резекции поджелудочной железы // Хирургия. — 2004. — №5. — С. 10-15.
6. Кузин М.И., Данилов М.В., Благовидов Д.Ф. Хронический панкреатит.- М.: Медицина. — 1985.- С. 368.
7. Маев И.В., Казюлин А.Н., Кучерявый Ю.А. / Хронический панкреатит. — М.: Медицина, 2005. — 504 с.
8. Паклина, О.В. Морфогенез хронического панкреатита и протоковой аденокарциномы поджелудочной железы: автореф. Дис. … докт. Мед. наук. — М., 2009. — 26 с.
9. Щастный А.Т. Зависимость болевого синдрома и качества жизни больных хроническим панкреатитом от патоморфологических изменений поджелудочной железы // Анналы хирургической гепатологии. — 2011. — Т. 16, №4. — С. 83-90.
10. Andersen D.K., Frey C.F. The Evolution of the Surgical Treatment of Chronic Pancreatitis // Annals of Surgery. — 2010. — Vol. 251, N 1. — P. 18-32
11. Beger H.G., Buchler M., Bittner R.R., Oettinger W., Roscher R. Duodenum-preserving resection of the head of the pancreas in severe chronic pancreatitis. Early and late results // Ann Surg. — 1989. — Vol. 209, N 3. — P. 273-278.
12. Bouwense S.A, de Vries M, Schreuder L.T., Olesen S.S., Frokjaer J.B., Drewes A.M, van Goor H., Wilder-Smith O.H. Systematic mechanism-orientated approach to chronic pancreatitis pain // World J Gastroenterol. — 2015. — Vol. 21, N 1. — P. 47-59.
13. Buchler M.W., Fries H., Uhl W., Malfertheiner P. Chronic Pancreatitis. Novel Concepts in Biology and Therapy. Blackwell Science, Berlin 2002; 614.
14. Frey C.F., Smith G.J. Description and rationale of a new operation for chronic pancreatitis // Pancreas. — 1987. — Vol. 2, N 6. — P. 701-707.
15. Gloor В., Friess H., Uhl W., Buchler M.W. A modified technique of the Beger and Frey procedure in patients with chronic pancreatitis // Dig Surg. — 2001. Vol. 18, N 1. — P. 21-25.
16. Ho H.S., Frey C.F. The Frey Procedure: Local Resection of Pancreatic Head Combined With Lateral Pancreaticojejunostomy // Arch. Surg. — 2001. — Vol.136. — P. 1353-1358.
17. Izbicki J.R., Bloechle C, Broering D.C., Kuechler Т., Broelsch C.E. Longitudinal V-shaped excision of the ventral pancreas for small duct disease in severe chronic pancreatitis: prospective evaluation of a new surgical procedure // Ann Surg. — 1998. — Vol. 227, N 2. — P. 213-219.
18. Mayerle J., Hoffmeister A., Werner J., Witt H., Lerch M.M., Mosser J. Chronic pancreatitis — definition, etiology, investigation and treatment // Dtsch Arztebl. Int. — 2013. — Vol. 110, N. 22. — P. 387-393.
19. Olesen S.S., Juel J., Graversen C., Kolesnikov Y., Wilder-Smith O.H., Drewes A.M. Pharmacological pain management in chronic pancreatitis // World J Gastroenterol. — 2013. — Vol.19, N 42. — P. 7292-7301.
Резекционно-дренирующий способ хирургического лечения хронического кальцифицирующего панкреатита, включающий субтотальную резекцию ткани головки поджелудочной железы, путем иссечения паренхимы вдоль внутреннего края подковы двенадцатиперстной кишки и перидуктальную резекцию рубцово-измененной ткани вдоль интрапанкреатической части общего желчного протока, отличающийся тем, что выполняют предварительную сосудистую изоляцию ткани головки поджелудочной железы путем лигирования передне-верхней и передне-нижней панкреатодуоденальных артерий под контролем интраоперационного ультразвукового исследования, проводят маркировку терминального отдела общего желчного протока билиарным стентом, после чего осуществляют резекцию передней поверхности дистальной части поджелудочной железы, для чего выполняют вентральную тракцию тела поджелудочной железы за швы-держалки, вскрывают панкреатический проток в дистальном направлении на протяжении 8 см, резецируют переднюю часть тела и хвоста с продольным параллельным рессечением паренхимы, далее накладывают позадиободочный продольный панкреатикоеюноанастомоз на отключенной по Ру петле тонкой кишке, непрерывным однорядным швом, в проекции головки поджелудочной железы накладывают панкреатикоеюноанастомоз с медиальной стенкой подковы двенадцатиперстной кишки, на расстоянии 8 см ниже панкреатикоеюноанастомоза накладывают межкишечный анастомоз «конец в бок».Расширение одинарных и двойных протоков
World J Gastroenterol. 2007 21 марта; 13 (11): 1701–1705.
Марк Д. Эдж, Мааруф Хотейт, Амил Патель, Сяопин Ван, Цян Цай, Отделение болезней органов пищеварения, Медицинский факультет Университета Эмори, Атланта, Джорджия 30322, США
Дебора А Баумгартен, Отделение радиологии, Школа Университета Эмори of Medicine, Атланта, Джорджия 30322, США
Вклад авторов: Все авторы внесли равный вклад в работу.Для корреспонденции: Qiang Cai, MD, PhD, Отделение болезней органов пищеварения, 1365 Clifton Road, NE, Suite B1262, Медицинский факультет Университета Эмори, Атланта, GA 30322, США.ude.vrome@iacq
Телефон: + 1-404-7275638 Факс: + 1-404-7275767
Получено 6 ноября 2006 г .; Пересмотрено 12 декабря 2006 г .; Принято 3 февраля 2007 г.
Copyright © 2007 Baishideng Publishing Group Co., Limited. Все права защищены.Эта статья цитировалась в других статьях в PMC.Abstract
ЦЕЛЬ: изучить пациентов с расширением главного протока поджелудочной железы с помощью компьютерной томографии (КТ) и, таким образом, предоставить прогностические критерии для выявления пациентов с высоким риском серьезных заболеваний, таких как рак поджелудочной железы, и избежать ненужной работы пациенты с низким риском таких заболеваний.
МЕТОДЫ: Пациенты с расширением главного протока поджелудочной железы на компьютерной томографии в больнице Университета Эмори в 2002 году были идентифицированы с помощью компьютерного поиска. Клинический курс и окончательный диагноз были получены у всех идентифицированных пациентов путем извлечения данных из их компьютерных баз данных.
РЕЗУЛЬТАТЫ: Семьдесят семь пациентов были идентифицированы в этом исследовании. Хронический панкреатит и рак поджелудочной железы были наиболее частыми причинами расширения главного протока поджелудочной железы на КТ. Хотя у большинства пациентов с изолированной дилатацией главного протока поджелудочной железы (однопротоковая дилатация) был хронический панкреатит, у одной трети пациентов с расширением единственного протока, но без хронического панкреатита были злокачественные новообразования поджелудочной железы, тогда как у большинства пациентов с сопутствующим расширением желчных протоков (двойное расширение протока) расширение протока) имел рак поджелудочной железы.
ЗАКЛЮЧЕНИЕ: Пациенты с расширением двойного протока поджелудочной железы нуждаются в обширном обследовании и тщательном наблюдении, поскольку у большинства этих пациентов в конечном итоге диагностируется рак поджелудочной железы. Пациенты с расширением одного протока, особенно пациенты без каких-либо признаков хронического панкреатита, также нуждаются в тщательном наблюдении, поскольку вероятность злокачественных новообразований поджелудочной железы, включая аденокарциному и внутрипротоковые папиллярные муцинозные опухоли, все еще высока.
Ключевые слова: Проток поджелудочной железы, Общий желчный проток, Внутрипеченочный проток, Хронический панкреатит, Рак поджелудочной железы
ВВЕДЕНИЕ
Заболевания поджелудочной железы, такие как панкреатит и рак поджелудочной железы, являются обычными, но, к сожалению, часто более тяжелыми. диагностировать, чем другие органы брюшной полости [1,2].
Методы диагностики заболеваний поджелудочной железы включают химические анализы крови, такие как липаза, амилаза и т. Д., И визуализационные тесты, такие как УЗИ брюшной полости, эндоскопическая ретроградная холангиопанкреатография (ERCP), магнитно-резонансная холангиопанкреатография (MRCP), компьютерная томография (CT), и т. д. [1-4]. Среди всех диагностических методов КТ все чаще используется в клинической практике для диагностики заболеваний поджелудочной железы [5,6].
В отличие от просветных органов желудочно-кишечного тракта, таких как пищевод или желудок, поджелудочная железа представляет собой орган, состоящий из двух основных частей: паренхимы поджелудочной железы и системы протоков поджелудочной железы.Заболевания поджелудочной железы могут вызывать изменения паренхимы поджелудочной железы, такие как острый панкреатит, или изменения в системе протоков поджелудочной железы, такие как рак поджелудочной железы, или изменения как паренхимы поджелудочной железы, так и протоков поджелудочной железы, такие как хронический панкреатит [1-6].
Система протоков поджелудочной железы состоит из главного протока и боковых ответвлений [1,2]. В клинической практике нередко можно встретить отчеты КТ расширенного главного панкреатического протока. Однако клиническое значение расширенного главного протока поджелудочной железы на КТ не очень ясно.В нашем обзоре литературы не было обнаружено ни одного предыдущего исследования, которое бы конкретно связывало клинический исход с расширением протока поджелудочной железы, отмеченным на КТ. Мы провели ретроспективное исследование значимости расширенного главного протока поджелудочной железы на КТ, чтобы предоставить прогностические критерии для выявления пациентов с высоким риском серьезных заболеваний.
МАТЕРИАЛЫ И МЕТОДЫ
Это ретроспективное исследование, проведенное в больнице Университета Эмори, учреждении третичного уровня в Атланте, штат Джорджия. Была использована радиологическая информационная система IDXRAD (система IDX, Берлингтон, Вермонт) и произведен поиск в строке символов «расширенный проток поджелудочной железы».В поиск были включены пациенты из больницы Университета Эмори, которым в 2002 году была сделана КТ брюшной полости. Клинический курс каждого пациента и окончательный диагноз были проанализированы путем извлечения записей из компьютерной базы данных с помощью Powerchart (Cerner Corp, Северный Канзас-Сити, Миссури). Все КТ выполнялись с пероральным и внутривенным контрастом. Для внутривенного контраста вводили 150 мл Omnipaque (Amersham Health, Princeton, NJ). Подробная информация о пероральном введении контрастного вещества не была задокументирована в отчетах КТ.Всем пациентам была сделана спиральная компьютерная томография, изображения были получены с шагом 2,5-5 мм.
Все пациенты прошли более одной КТ брюшной полости во время исследования. Для этого исследования использовалась первая компьютерная томография, показывающая расширение протока поджелудочной железы. Наличие или отсутствие новообразования поджелудочной железы на компьютерной томографии было проверено для каждого пациента. Также были рассмотрены функциональные тесты печени в течение 30 дней после компьютерной томографии.
Хотя не существует строгих критериев для диагностики дилатации главного протока поджелудочной железы, как правило, если размер главного протока поджелудочной железы превышает 3 мм в головке и 2 мм в теле или хвосте поджелудочной железы, в больнице Университета Эмори он считается увеличенным. .Для диагностики расширения желчных протоков общий желчный проток размером более 6 мм считается увеличенным у пациента с желчным пузырем. Когда желчный пузырь отсутствует или пациент пожилого возраста, считается, что несколько миллиметров больше в пределах нормы (до 10 мм в отдельных случаях). Диагноз рака поджелудочной железы был поставлен на основании патологии, цитологии или вскрытия. Диагноз хронического панкреатита был поставлен на основании данных КТ при клинических проявлениях, включая атрофию поджелудочной железы, кальцификаты паренхимы и расширение протоков.Если пациенты не имели каких-либо идентифицируемых заболеваний поджелудочной железы, печени или желчевыводящих путей, дилатация считалась идиопатической, даже если у этих пациентов могли быть другие серьезные заболевания, такие как рак желудка или почечная недостаточность.
Точный тест Фишера использовался для оценки различий в процентной доле злокачественных новообразований между пациентами с расширением одного протока и пациентами с расширением двойного протока (определение одинарного и двойного расширения протока было описано в разделе «Результаты»).Для получения этих значений использовалась статистическая компьютерная программа ELTS (ELTS, Чикаго, Иллинойс). T-критерий Стьюдента (Microsoft Excel, Microsoft Widows, 1997) использовался для проверки разницы в среднем возрасте между пациентами с расширением одинарного и двойного протока. Значение P менее 0,05 считалось статистически значимым.
РЕЗУЛЬТАТЫ
Семьдесят семь пациентов, в том числе 47 мужчин и 30 женщин, были идентифицированы с отчетом о расширенном главном протоке поджелудочной железы на КТ во время этого исследования.Средний возраст пациентов составил 58 лет. Большинство составили пациенты с хроническим панкреатитом и / или раком поджелудочной железы (таблица). На основании тщательного анализа отчетов КТ пациенты были разделены на две группы: (1) пациенты с расширением только основного протока поджелудочной железы (однопроходное расширение) и (2) пациенты с сопутствующим расширением желчных протоков (двойное расширение протока).
Таблица 1
Диагностика у 77 пациентов с расширением протока поджелудочной железы на КТ
| Заболевания | n | % |
| Хронический панкреатит | 40 | 52 |
| Карцинома поджелудочной железы | 17 | 22 |
| Идиопатическая дилатация | 10 | 13 |
| IPMT | 2 | 3 |
| Холангиокарцинома | 2 | |
| Холангиокарцинома | 2 | |
| 2 | 3 | |
| Камень CBD + PD | 1 | 1 |
| Камень CBD | 1 | 1 |
| Саркома поджелудочной железы | 1 | 1 |
| Цирроз | 1 | 1 |
| Итого | 77 | 100 |
Изолированная дилатация главного протока поджелудочной железы (однопроходная дилатация, SDD)
Среди 77 пациентов 51 имел SDD.У этих пациентов общий желчный проток (CBD) и внутрипеченочные желчные протоки (IHBD) не были расширены. Большинство пациентов этой группы страдали хроническим панкреатитом. Вторым наиболее частым диагнозом в этой группе была идиопатическая дилатация (таблица). Около одной трети пациентов с SDD и без хронического панкреатита имели злокачественные новообразования поджелудочной железы.
Таблица 2
Диагностика у 51 пациента с расширением единственного протока поджелудочной железы
| Заболевания | n | % |
| Хронический панкреатит | 37 | |
| Идиопатическая дилатация | 8 | 15 |
| Карцинома поджелудочной железы | 2 | 4 |
| IPMT | 2 | 4 |
| Саркома поджелудочной железы | 1 | 75|
| Острый холецистит | 1 | 2 |
| Всего | 51 | 100 |
Расширение главного протока поджелудочной железы и сопутствующее расширение желчных протоков (двойное расширение протока, DDD)
Остальные 26 пациентов имели DDD.У этих пациентов была сопутствующая дилатация CBD и / или IHBD. У большинства пациентов этой группы был рак поджелудочной железы, за которым последовал хронический панкреатит (таблица). Ни у одного пациента с диагнозом рак поджелудочной железы не было хронического панкреатита.
Таблица 3
Диагностика у 26 пациентов с расширением двойного протока поджелудочной железы
| Заболевания | n | % |
| Карцинома поджелудочной железы | 5815 | |
| Хронический панкреатит | 3 | 12 |
| Холангиокарцинома | 2 | 8 |
| Идиопатическое расширение | 2 | 8 |
| CBD + PD камень | 1 | 4 |
| Камень CBD | 1 | 4 |
| Цирроз | 1 | 4 |
| Острый холецистит | 1 | 4 |
| Всего | 26 | 100 |
Поджелудочная железа масса
У семнадцати пациентов обнаружено новообразование поджелудочной железы. идентифицировано КТ, включая 12 пациентов в группе DDD и пять в группе SDD.Среди пятнадцати пациентов в группе DDD, у которых был рак поджелудочной железы, у четырех не было дискретного новообразования поджелудочной железы, идентифицированного на КТ, но имелась выступающая головка поджелудочной железы.
Печеночные пробы
Всем пациентам были сделаны функциональные пробы печени в течение 30 дней после компьютерной томографии, которая выявила аномалии печени у 22 пациентов. Из 22 пациентов у 15 был DDD, а у остальных 7 — SDD. Среди 7 пациентов с SDD у 5 был только повышенный уровень щелочной фосфатазы.
Последующее наблюдение
Как упоминалось в разделе «Методы», в этом исследовании у всех пациентов было более одной КТ брюшной полости.Повторные КТ обычно выполнялись через 3-6 мес. После первоначального КТ. Хотя были изменения по сравнению с исходной рентгенологией, такие как массовое увеличение (рак) или массовое уменьшение (воспаление), основной диагноз хронического панкреатита или рака поджелудочной железы остался прежним на контрольной компьютерной томографии. У пяти пациентов с SDD и опухолью головки поджелудочной железы при последующем наблюдении были выявлены воспалительные образования. У двух пациентов с SDD были обнаружены внутрипротоковые папиллярные муцинозные опухоли (IPMT).
Статистический анализ
Было проведено сравнение пациентов с SDD и пациентов с DDD.Пациенты с DDD имели значительно более высокую заболеваемость раком поджелудочной железы, чем пациенты с SDD (17/26, 65%, против , 5/51, 10%) (таблица). Пациенты с DDD также имели гораздо более высокую частоту аномальных тестов печени, чем пациенты с SDD (15/26, 58%, против , 7/51, 14%). IPMT был представлен только у 2 пациентов с SDD, но ни у одного пациента с DDD.
Таблица 4
Сравнение расширения одинарного и двойного протоков
| SDD | DDD | P | |
| Номер | 51 | 26 | |
| Возраст (средний год) | 55 | 65 | > 0.05 |
| Диагноз: n (%) | |||
| Доброкачественный | 46 (90) | 9 (35) | <0,05 |
| Злокачественный | 5 (10) | 17 (65) ) | <0,05 |
ОБСУЖДЕНИЕ
Наиболее интересным результатом этого исследования является то, что большинство пациентов с СДР имели доброкачественные заболевания поджелудочной железы. Напротив, более половины пациентов с DDD имели злокачественные заболевания.Среди пациентов с DDD, у которых был рак поджелудочной железы, около четверти (4/15) не имели дискретного новообразования поджелудочной железы, идентифицированного на КТ. Еще одним интересным открытием является то, что пациенты с SDD имели высокую вероятность злокачественного новообразования поджелудочной железы, если не было доказательств хронического панкреатита.
КТ используется в клинической практике более двух десятилетий [5,6]. Он стал общепризнанной диагностической процедурой при различных распространенных желудочно-кишечных расстройствах и важным инструментом в клинической практике.КТ является основным методом диагностики заболеваний поджелудочной железы, включая панкреатит и рак поджелудочной железы [5,6]. Измерение ширины протока поджелудочной железы в настоящее время используется как один из основных критериев диагностики некоторых заболеваний поджелудочной железы [5-7]. Хотя официальных рекомендаций по диагностике расширения протока поджелудочной железы не существует, распознать расширение протока поджелудочной железы на КТ несложно. Опубликованные исследования показали, что нормальная ширина протока поджелудочной железы у здорового взрослого человека немного отличается в головке, теле и хвосте поджелудочной железы [5-7].Хотя ширина может зависеть от возраста, вариация не должна превышать 1 мм в каждой части поджелудочной железы [7,8]. Ширина главного панкреатического протока одинакова в изученных группах населения, например, в Европе, Азии и Америке [9–12]. Кроме того, считается, что после холецистэктомии может произойти расширение желчных протоков, однако данных, подтверждающих это, недостаточно. Хотя семь пациентов в этом исследовании, четыре в группе SDD и три в группе DDD, имели задокументированные истории холецистэктомии, мы не увидели никакого эффекта холецистэктомии в этом исследовании.
Хотя расширение протока поджелудочной железы само по себе не всегда дает точную информацию, позволяющую отличить нормальную поджелудочную железу от пораженной, хронический панкреатит и рак поджелудочной железы являются двумя наиболее распространенными заболеваниями, вызывающими расширение основного протока поджелудочной железы [5-7].
В этом исследовании мы ретроспективно рассмотрели всех пациентов с дилатацией главного панкреатического протока, о которых сообщалось в ходе исследования. В целом хронический панкреатит был наиболее частым заболеванием в этой группе. Пятьдесят два процента (40/77) пациентов страдали хроническим панкреатитом, а 22 процента пациентов (17/77) имели карциному поджелудочной железы.Расширение главного протока поджелудочной железы у пациентов с раком поджелудочной железы может быть несколько более выраженным, чем у пациентов с хроническим панкреатитом. Но дифференцировать эти два заболевания только по степени расширения основного протока поджелудочной железы невозможно.
Однако пациенты с сопутствующей дилатацией желчных протоков, включая общий желчный проток (CBD) или внутрипеченочные протоки, имели более чем 60% шанс заболеть раком поджелудочной железы. Пациенты с SDD также имели 35% шанс заболеть злокачественной опухолью поджелудочной железы, если не было хронического панкреатита.
В литературе мало информации о значении расширенного главного панкреатического протока на КТ. Напротив, интраоперационное ультразвуковое исследование показало, что расширение протока поджелудочной железы, стриктура или инвазия верхней брыжеечной вены и расширение общего желчного протока могут помочь установить диагноз злокачественного новообразования [13]. Одно исследование из Японии показало, что наличие расширенного протока поджелудочной железы является признаком высокого риска рака поджелудочной железы при трансабдоминальном УЗИ, но не оценивало никакой корреляции с расширением желчных протоков, как в этом исследовании [14].
MRCP быстро получает признание как полезный неинвазивный инструмент для оценки протока поджелудочной железы. Было опубликовано несколько исследований, в которых сравнивали его диагностическую ценность с ЭРХПГ [15-19]. Ни одно из этих исследований не подтвердило убедительно прогностическую силу MRCP при оценке расширенного протока поджелудочной железы.
Расширение главного протока поджелудочной железы и желчных протоков во многих, если не во всех случаях, могло быть вызвано стриктурой просвета дистального желчного протока. Если это предположение верно, наши результаты можно сравнить с исследованиями так называемого «двухканального знака» [20-22].Признак двойного протока определяется как сосуществующий и соседний стеноз основной поджелудочной железы и CBD, как видно на ERCP. Первоначально считалось, что признак двойного протока предсказывает наличие карциномы поджелудочной железы со специфичностью, приближающейся к 100%. Недавнее исследование показало, что специфичность двойного протока при прогнозировании рака поджелудочной железы ниже, чем сообщалось ранее [22]. В этом исследовании специфичность двойного протока при раке поджелудочной железы составила 85%.В нашем исследовании специфичность DDD для рака поджелудочной железы составляет 82%, что приближается к таковой в исследовании ERCP и отражает сходство результатов визуализации.
Как и во всех ретроспективных исследованиях, есть ограничения. Возможно, что не все пациенты с расширением главного протока поджелудочной железы могут быть охвачены компьютерным поиском либо потому, что строка символов не появилась в отчете, как искали, либо потому, что не было сообщено о расширении. Неясно, были ли пропущены только случаи изолированного расширения главного протока поджелудочной железы или случаи двойного расширения протока также были пропущены.Как это повлияет на результаты исследования, неизвестно. Все пациенты в этом исследовании находились под наблюдением, и большинству пациентов были выполнены повторные компьютерные томографии. Шанс пропустить рак поджелудочной железы у этих пациентов очень низок. Кроме того, степень расширения главного протока поджелудочной железы редко объективно указывается в миллиметрах, случаи завышения или занижения могут возникать как вариабельность между наблюдателями.
Две трети пациентов с SDD страдали хроническим панкреатитом; следующий по частоте диагноз — идиопатическая дилатация в 15% случаев.В этом исследовании для диагностики хронического панкреатита использовались КТ и ЭРХПГ, а также клинические данные. У 10 пациентов с идиопатической дилатацией химические тесты для исключения тонкого хронического панкреатита не проводились. Мы не знаем этиологии расширения протока поджелудочной железы у этих пациентов. Средний возраст этих пациентов составлял 63 года, пожилой возраст не мог быть фактором. Расширение главного протока поджелудочной железы у этих пациентов было стабильным при контрольной компьютерной томографии. Пациенты с IPMT поджелудочной железы могут иметь SDD [23], у нас было 2 таких пациента в группе SDD.
В заключение мы подчеркиваем, что, хотя КТ-изображения с высоким разрешением дают нам очень важную информацию о поджелудочной железе, до сих пор не существует комбинации критериев, включая клиническую и мультимодальную визуализацию, которая могла бы надежно отличить рак поджелудочной железы от хронического панкреатита. Необходимо тщательное наблюдение за пациентами с расширением главного протока поджелудочной железы при КТ. Есть две группы пациентов с высоким риском злокачественного новообразования поджелудочной железы: пациенты с DDD и пациенты с SDD, но без хронического панкреатита.Следовательно, этим пациентам необходимы повторные компьютерные томографии или другие визуализационные тесты, такие как ERCP, если первоначальная компьютерная томография не выявляет новообразование поджелудочной железы.
Сноски
S- редактор Лю Й. L- редактор Ma JY E- Editor Chin GJ
Ссылки
1. Малхолланд М.В., Мусса А.Р., Лиддл Р.А. Поджелудочная железа: анатомия и структурные аномалии. В: Тадатака Ямада, редактор. Гастроэнтерология, 2-е изд. Филадельфия: компания «Липпинкотт»; 1995. С. 2051–2063. [Google Scholar] 2. Маги DJ, Бурдик Дж. С.. Анатомия, гистология, эмбриология и аномалии развития поджелудочной железы.В: Feldman M, Friedman LS, Sleisenger MH, редакторы. Заболевания желудочно-кишечного тракта и печени: патофизиология, диагностика и лечение. 7-е изд. Филадельфия: W.B. Saunders Co; 2002. С. 859–870. [Google Scholar] 3. Dandol SJ. Физиология поджелудочной железы и секреторные тесты. В: Feldamn M, Scharschmidt BF, Sleisenger MH, редакторы. Заболевания желудочно-кишечного тракта и печени: патофизиология, диагностика и лечение. 7-е изд. Филадельфия: Сондерс; 2002. С. 871–880. [Google Scholar] 4. DiMagno EP, Малагелада JR, Тейлор WF, Go VL.Проспективное сравнение текущих диагностических тестов для рака поджелудочной железы. N Engl J Med. 1977; 297: 737–742. [PubMed] [Google Scholar] 5. Салливан Л.М. В печени, желчевыводящей системе и поджелудочной железе. В: Juhl JH, Crummy AB, Kuhlman JE, редакторы. Основы радиологических изображений. 7-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 1998. С. 511–544. [Google Scholar] 6. Haaga JR. Поджелудочная железа. В: Haana JR, редактор. Компьютерная томография и магнитно-резонансное изображение всего тела. 3-е изд. Сент-Луис: Мосби; 1994 г.С. 1035–1130. [Google Scholar] 7. Ladas SD, Tassios PS, Giorgiotis K, Rokkas T., Theodosiou P, Raptis SA. Ширина протока поджелудочной железы: его значение как диагностический критерий заболевания поджелудочной железы. Гепатогастроэнтерология. 1993; 40: 52–55. [PubMed] [Google Scholar] 8. Anand BS, Vij JC, Mac HS, Chowdhury V, Kumar A. Влияние старения на протоки поджелудочной железы: исследование, основанное на эндоскопической ретроградной панкреатографии. Gastrointest Endosc. 1989. 35: 210–213. [PubMed] [Google Scholar] 9. Хлопок ПБ. Канюляция сосочка Фатера с помощью эндоскопии и ретроградной холангиопанкреатографии (ERCP) Кишечник.1972; 13: 1014–1025. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Касугай Т., Куно Н., Кобаяши С., Хаттори К. Эндоскопическая панкреатохолангиография. I. Нормальная эндоскопическая панкреатохолангиограмма. Гастроэнтерология. 1972; 63: 217–226. [PubMed] [Google Scholar] 11. Classen M, Hellwig H, Rosch W. Анатомия протока поджелудочной железы, дуоденоскопическое радиологическое исследование. Эндоскопия. 1973: 5: 14–17. [Google Scholar] 12. Варлей П.Ф., Рорманн CA, Silvis SE, Vennes JA. Нормальная эндоскопическая панкреатограмма. Радиология. 1976; (2): 118: 295–300.[PubMed] [Google Scholar] 13. Сигель Б., Коэльо Дж. К., Найхус Л. М., Веласко Дж. М., Донахью ЧП, Вуд Д. К., Спигос Д. Г.. Обнаружение опухолей поджелудочной железы ультразвуком во время операции. Arch Surg. 1982; 117: 1058–1061. [PubMed] [Google Scholar] 14. Танака С., Накаидзуми А., Иока Т., Осикава О., Уэхара Х., Накао М., Ямамото К., Исикава О., Охигаши Н., Китамра Т. Расширение главного протока поджелудочной железы: признак высокого риска рака поджелудочной железы. Jpn J Clin Oncol. 2002. 32: 407–411. [PubMed] [Google Scholar] 15. Георгопулос СК, Шварц Л.Х., Ярнагин В.Р., Гердес Х., Брейте I, Фонг Y, Блюмгарт Л.Х., Курц Р.К.Сравнение магнитно-резонансной и эндоскопической ретроградной холангиопанкреатографии при злокачественной панкреатобилиарной обструкции. Arch Surg. 1999; 134: 1002–1007. [PubMed] [Google Scholar] 16. Митаке М., Окамура С., Охаши С., Урано Ф., Симодаира М., Канамори С., Охьяма И., Окада Н., Сегава К. Значение МР-холангиографии в диагностике заболеваний поджелудочной железы по сравнению с эндоскопической ретроградной холангиопанкреатографией. Нихон Риншо. 1998. 56: 2885–2889. [PubMed] [Google Scholar] 17. Ямагути К., Чидзива К., Симидзу С., Йокохата К., Морисаки Т., Танака М.Сравнение эндоскопической ретроградной и магнитно-резонансной холангиопанкреатографии в хирургической диагностике заболеваний поджелудочной железы. Am J Surg. 1998; 175: 203–208. [PubMed] [Google Scholar] 18. Павоне П., Лаги А., Каталано С., Броглия Л., Фиокка Ф, Пассариелло Р. Неинвазивная оценка желчного дерева с помощью магнитно-резонансной холангиопанкреатографии: начальный клинический опыт. Итал Дж. Гастроэнтерол. 1996. 28: 63–69. [PubMed] [Google Scholar] 19. Хатано С., Кондо С., Акияма Т., Окита К. Оценка MRCP по сравнению с ERCP при диагностике желчных и панкреатических протоков.Нихон Риншо. 1998. 56: 2874–2879. [PubMed] [Google Scholar] 20. Freeny PC, Бильбао МК, Катон РМ. «Слепая» оценка эндоскопической ретроградной холангиопанкреатографии (ERCP) в диагностике карциномы поджелудочной железы: «двойной проток» и другие признаки. Радиология. 1976; 119: 271–274. [PubMed] [Google Scholar] 21. Schlauch D, Kohler B, Riemann JF. Двустворчатый знак — всегда ли это рак? Эндоскопия. 1993; 25: 489–490. [PubMed] [Google Scholar] 22. Менгес М., Лерх М.М., Цейтц М. Знак двойного протока у пациентов со злокачественными и доброкачественными поражениями поджелудочной железы.Gastrointest Endosc. 2000; 52: 74–77. [PubMed] [Google Scholar] 23. Прасад С.Р., Сахани Д., Нассер С., Фаррелл Дж., Фернандес-Дель Кастильо С., Хан П.Ф., Мюллер П.Р., Саини С. Внутрипротоковые папиллярные муцинозные опухоли поджелудочной железы. Визуализация брюшной полости. 2003. 28: 357–365. [PubMed] [Google Scholar]поджелудочной железы | MUSC Health | Чарльстон SC
Эти клетки печени производят желчь и направляют ее в крошечные каналы (cannaliculi). Маленькие протоки соединяются вместе как ветви, образуя главное желчное дерево, один ствол которого образуется сразу за поверхностью печени.Это называется общим печеночным протоком.
Желчный пузырь — это мешочек для сбора желчи, которая входит и выходит через узкую трубку, называемую пузырным протоком. Желчный пузырь размером с яйцо в полном объеме. Желчный проток ниже пузырного протока обычно называют общим желчным протоком. Общий желчный проток и общий печеночный проток вместе составляют главный желчный проток. Нижний конец желчного протока проходит за двенадцатиперстной кишкой и через головку поджелудочной железы, прежде чем присоединиться к протоку поджелудочной железы у главного сосочка (Фатера).
Система протоков поджелудочной железы
Есть главный проток поджелудочной железы, который собирает соки из всех ветвей панкреатического русла и выходит из главного сосочка Фатера. Рисунок этих ветвей значительно различается, но это не имеет значения. Однако часто существует другой важный проток (названный в честь Санторини), который соединяет главный проток поджелудочной железы с другим маленьким сосочком (второстепенным или дополнительным сосочком), который находится примерно на 2 см (3/4 дюйма) выше главного сосочка Фатера в двенадцатиперстная кишка.Это (нормальное) устройство возникает в результате сложной перестройки во время внутриутробного развития. В начале развития эмбриона поджелудочная железа состоит из двух частей (дорсальной и вентральной частей). Эти части обычно соединяются вместе, образуя одну поджелудочную железу на сроке от шести до восьми недель беременности. Даже после присоединения santorini остается открытым или «проходимым» и стекает в малый сосочек более чем у половины пациентов. Таким образом, у пациента, у которого развивается проблема на главном сосочке (например, камень или опухоль), могут не развиться какие-либо симптомы обструкции поджелудочной железы, если проток Санторини и малый сосочек открыты, и он может взять на себя дренажную функцию.
Рентгеновское изображение желчного дерева во время процедуры ERCP.Однако это слияние (присоединение) не происходит примерно у каждого двенадцатого человека (по крайней мере, в западных популяциях). Тогда поджелудочная железа остается разделенной (так называемая «поджелудочная железа»). У пациентов с divisum самая большая (дорсальная) часть поджелудочной железы отводится через проток Санторини и малый сосочек, в то время как только небольшая часть (вентральная поджелудочная железа) оттекает через обычный (большой) сосочек. Важность этого состоит в том, что малый сосочек может быть слишком маленьким, чтобы позволить беспрепятственный отток панкреатического сока; и у некоторых пациентов с делением поджелудочной железы в результате этого относительного сужения могут развиться приступы боли и панкреатит.
Существуют и другие, более редкие варианты анатомии поджелудочной железы. Кольцо поджелудочной железы описывает врожденное состояние, при котором одна из ветвей поджелудочной железы вращается вокруг двенадцатиперстной кишки; это может сузить двенадцатиперстную кишку настолько, чтобы вызвать обструкцию и потребовать операции. Это состояние обычно проявляется в младенчестве (по очевидным причинам), но может быть обнаружено только в более позднем возрасте, если сужение не такое сильное, а иногда и когда с ним связаны приступы панкреатита. Другие аномалии развития поджелудочной железы дают интересные картины, но не имеют клинического значения.
Функционирование и управление
Ткани поджелудочной железы (ацинарные клетки) производят прозрачную пищеварительную жидкость, состоящую из бикарбоната и ферментов. Бикарбонат является щелочным веществом и помогает пищеварению, нейтрализуя желудочную кислоту, содержащую пищу, когда она попадает в двенадцатиперстную кишку. Ферменты более важны. Они предназначены для помощи в расщеплении (переваривании) сложных углеводов (сахаров), белков и жиров, содержащихся в пище. Основные ферменты — амилаза, протеазы (трипсин, химотрипсин) и липаза.Секреция фермента и бикарбоната вместе называется «экзокринной» функцией поджелудочной железы.
Желчные протоки функционируют как дренажная система для печени. Желчь — горькая темная жидкость, состоящая из желчных кислот, желчных пигментов, билирубина, холестерина и других жиров, воды и электролитов. Некоторые из этих компонентов полезны для пищеварения, другие — просто продукты жизнедеятельности (например, холестерин).
Желчный пузырь хранит желчь и делает ее более концентрированной за счет удаления воды.Несмотря на свою тонкость, стенка желчного пузыря имеет мышечную ткань, поэтому при необходимости она может сокращаться и опорожняться.
Производство сока желчи и поджелудочной железы и их выброс в двенадцатиперстную кишку через сосочек Фатера контролируется брюшными нервами, а также специфическими мессенджерами (гормонами), которые передаются к своим целям через кровоток. Эти системы также контролируют сокращение желчного пузыря и расслабление сфинктера Одди (мышечный клапан внутри сосочка Фатера).Вместе они гарантируют, что соки производятся и попадают в двенадцатиперстную кишку только тогда, когда они необходимы, то есть когда пища поступает из желудка, готовая к окончательному перевариванию и последующему всасыванию.
Поджелудочная железа также выполняет «эндокринную» функцию — вырабатывает инсулин и другие важные гормоны. Они вырабатываются в отдельных тканях поджелудочной железы (островки Лангерганса) и попадают непосредственно в кровоток (а не в проток поджелудочной железы). Инсулин очень важен для контроля уровня сахара в крови; недостаток инсулина приводит к диабету.Поджелудочная железа вырабатывает многие другие ферменты (например, соматостатин, полипептид поджелудочной железы, глюкагон и т. Д.), Функции которых имеют менее важное значение. Глюкагон помогает противодействовать инсулину и помогает предотвратить гипогликемию, частую проблему после обширных / тотальных операций на поджелудочной железе.
Дисфункции и симптомы
Сок поджелудочной железы может не достигнуть двенадцатиперстной кишки, если проток или сосочек заблокирован, или если поджелудочная железа настолько повреждена болезнью, что не может производить достаточное количество бикарбоната и ферментов.Недостаток сока поджелудочной железы приводит к нарушению пищеварения. Клинически это заметно по прохождению большого испражнения, который имеет сильный запах и который трудно смыть в унитаз из-за высокого содержания жира. Действительно, иногда пациенты с недостаточностью поджелудочной железы могут заметить «масляное пятно» на туалетной воде. Избыточный жир в стуле называется стеатореей. Поскольку пища не усваивается должным образом, пациенты обычно теряют вес.
Эти ферменты поджелудочной железы можно заменить, по крайней мере, до определенной степени, давая их в виде лекарств через рот — так называемых добавок ферментов поджелудочной железы.Обычно нет необходимости заменять отсутствующий выход бикарбоната.
Недостаток желчи также нарушает пищеварение (особенно жиров) и может привести к стеатореи. Недостаток желчи в двенадцатиперстной кишке обычно происходит из-за закупорки главного желчного протока или сосочка. Печень продолжает вырабатывать желчь, которая затем попадает обратно в кровоток. В конечном итоге это вызывает пожелтение тела (желтуху), которое сначала проявляется в белках глаз. Если желчь не попадает в двенадцатиперстную кишку, испражнения теряют свой обычный цвет и выглядят как бледная замазка.Когда желчные протоки заблокированы, задержка солей желчных кислот в крови может также привести к значительному зуду (зуду). Закупорка желчных протоков или протоков поджелудочной железы может вызвать боль из-за чрезмерного растяжения.
Недостаток секреции инсулина поджелудочной железой приводит к диабету. Также возможно получить слишком много инсулина, когда островки Лангерганса чрезмерно израстают или становятся опухолевыми. Это приводит к падению сахара в крови ниже нормального уровня, что приводит к обмороку и, в конечном итоге, к коме. Недостаток или избыток других гормонов поджелудочной железы (таких как соматостатин, вазоингибиторный пептид, глюкагон и т. Д.)) очень редко может вызывать необычные симптомы.
Инфекция | ||
Абсцесс поджелудочной железы Рис. 22.6 | Четко выраженное кистозное поражение поджелудочной железы. Рекомендация сканирования: Двухфазная КТ (КТ без усиления, паренхиматозная фаза [PP]). КТ без усиления: сбор жидкости, находящейся рядом с водой.Внутрикистозный газ присутствует в 30-50% случаев. PP: Незначительное улучшение обода. Диагностические жемчужины: Четко выраженная кистозная масса с внутрикистозным газом у пациента с панкреатитом в анамнезе. | Редкое, но тяжелое осложнение острого панкреатита. В 30% случаев возникают множественные абсцессы. Свищи часто ответственны за сбор газа внутри очага поражения. Без наличия газа абсцессы часто неотличимы от неинфицированных (псевдо) кист.Лечение: ЗПА, хирургическое вмешательство (без высокой летальности). |
Врожденный | ||
Pancreas divisum Рис. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: большая головка поджелудочной железы. Разделение вентрального и дорсального сегментов поджелудочной железы иногда с видимой жировой щелью между ними.Несращение протоков видно на проекции минимальной интенсивности тонких срезов (MinIP). PP: Гипоаттенуация некротических участков (при наличии). Диагностическая жемчужина: Большая головка поджелудочной железы с раздельным дуоденальным дренажом неслитого длинного (дорсального) и короткого (вентрального) протока поджелудочной железы у пациента с рецидивирующим панкреатитом. | Нарушение вращения вентральной части поджелудочной железы во время эмбриогенеза кзади от двенадцатиперстной кишки, чтобы войти (физиологически) в контакт с дорсальной частью поджелудочной железы. Типичными клиническими симптомами являются боль в эпигастрии с рвотой или без нее у молодых пациентов из-за повторяющихся эпизодов идиопатического панкреатита. Лечение (только у пациентов с симптомами): сфинктеропластика или хирургическое вмешательство. Обычно не диагностируется при компьютерной томографии. Выбор метода магнитно-резонансной холангиопанкреатографии (MRCP). | |
Кольцевидная поджелудочная железа Рис. 22.8a, b | Покрытие нисходящей двенадцатиперстной кишки через кольцевидную ткань поджелудочной железы. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). NECT: Обструктивная полоса ткани поджелудочной железы вокруг нисходящей двенадцатиперстной кишки с расширением желудка и проксимального отдела двенадцатиперстной кишки. PP: Лучшее разграничение ткани поджелудочной железы. Гипоаттенуация некротических участков (если есть). | Либо из-за гипертрофии дорсального и вентрального протоков поджелудочной железы, либо из-за аномальной миграции левого вентрального зачатка поджелудочной железы вправо от двенадцатиперстной кишки, а не влево. Обычно диагностируется в детстве. Клинические симптомы — боль в эпигастрии с рвотой или без нее из-за повторяющихся эпизодов идиопатического панкреатита, но панкреатит наблюдается только в 20-30% случаев. Дифференциальный диагноз: карцинома поджелудочной железы или двенадцатиперстной кишки. |
Агенезия дорсальной части поджелудочной железы | Врожденное отсутствие хвоста, тела и шейки поджелудочной железы. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: нормальная головка поджелудочной железы, отсутствие хвоста и частичное или полное отсутствие тела. PP: Дополнительной информации нет. Жемчужина диагностики: При частичном отсутствии тела следует учитывать атрофию поджелудочной железы. | Редко. Семейное происхождение указывает на потенциальный наследственный механизм. Агенезия — это, скорее всего, дефект дорсальной зачатка поджелудочной железы. Обычно бессимптомное, случайное обнаружение.У пациентов с симптомами заболевания могут возникать периодические боли в животе и сахарный диабет. |
Травма | ||
Разрыв поджелудочной железы Рис. 22.9a, b | Травматический разрыв либо шеи, либо тела. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: гиподенсная щель на стороне разрыва.Кровь может казаться гиперплотной. PP: Дополнительной информации нет. Диагностическая жемчужина: (Гиперплотная) перипанкреатическая жидкость у пациента с травмой ремня безопасности. | Типичное осложнение автомобильной аварии из-за травм ремнем безопасности. Кратковременное, но сильное перекрытие между позвоночником дорсально и сжатой брюшной полостью вентрально (через ремень безопасности) в сочетании с резким антефлексированием тела (из-за резкого торможения) обычно приводит к разрыву внутри тела поджелудочной железы. Разрыв — тяжелая посттравматическая травма, которую легко пропустить или неверно истолковать при первоначальном сканировании. |
Воспаление | ||
Острый панкреатит Рис. 22.10a – c | Острое воспаление поджелудочной железы различной этиологии. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: очаговое диффузное набухание (отек) поджелудочной железы. Гиподенсная перипанкреатическая жидкость / гиперплотное скручивание перипанкреатического жира. PP: Ткань поджелудочной железы обычно улучшается однородно. Гиподенситные области указывают на некроз. Ослабление обода характерно для абсцесса / флегмоны. Диагностические жемчужины: Диффузный отек поджелудочной железы, некротические (некротические) интрапанкреатические области и скопление перипанкреатической жидкости. Может сопровождаться плевральными выпотами и жидкостью вдоль фасции Герота / в тазу (пространство Дугласа). Признак почечного ореола означает воспалительную инфильтрацию околопочечного пространства с сохранением околопочечного пространства. Панкреатическое кровоизлияние можно рассматривать как скопление гиперплотной перипанкреатической жидкости (> 60 HU). | Этиология включает злоупотребление алкоголем, травмы, холелитиаз, проникающую язвенную болезнь, гиперлипопротеинемию, гиперкальциемию и инфекцию. Клиническая тяжесть и изменения КТ могут не коррелировать. На компьютерной томографии возможна дифференциация между отечным (набухание поджелудочной железы и скопление перипанкреатического жира), экссудативным (скопление перипанкреатической жидкости) и некротическим (гиподенсные интрапанкреатические области в пределах нормальной ослабляющейся ткани поджелудочной железы) панкреатитом. Флегмонозное расширение наблюдается примерно в 20% случаев (в основном поражая пациентов с тяжелыми симптомами с самого начала). Любая флегмона может развиться в псевдокисту в результате прогрессирующего разжижения содержимого и образования фиброзной капсулы. Кровоизлияние / некроз возникает примерно в 5% случаев, связано с высокой летальностью и обычно возникает в результате эрозии или окклюзии сосудов. Флегмона поджелудочной железы обычно распространяется в малый мешок или в левое переднее околопочечное пространство, реже в поперечную мезоколону и брыжейку тонкой кишки. |
Хронический панкреатит Рис. 22.7 , p. 723 | Необратимая атрофия и дисфункция желез из-за повторяющихся эпизодов воспаления. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: кальцификации атрофической поджелудочной железы (т. Е. Жировая дегенерация). PP: Нерегулярное расширение главного желчного протока поджелудочной железы (лучше всего видно на КТ с тонкими срезами).Может проявляться тромбоз гиподензии внутри селезеночной вены с повышенной плотностью или четко выраженными псевдокистами поджелудочной железы. Диагностические жемчужины: Неравномерно расширенный главный проток поджелудочной железы, атрофия желез, псевдокисты и кальцификации тканей. | Обычно ассоциируется со злоупотреблением алкоголем, но также наблюдается у пациентов с рецидивирующим холелитиазом, поджелудочной железой divisum или кольцевидной поджелудочной железой. Кальцификации тканей возникают в результате реакции и осаждения ферментов поджелудочной железы с Са ++ (из ткани поджелудочной железы). Часто приводит к дисфункции желез при сахарном диабете II типа и жирном стуле. Расширение протока поджелудочной железы из-за карциномы поджелудочной железы происходит в 80% случаев и ограничивается головкой или телом поджелудочной железы и выглядит менее неравномерным. Внутрипротоковое папиллярное муцинозное новообразование (IPMN) в качестве другого дифференциального диагноза может имитировать хронический панкреатит клинически и радиологически. |
Псевдокиста поджелудочной железы Рис.22.11 | Фиброзное инкапсулированное жидкое скопление воспалительного экссудата поджелудочной железы. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: четко выраженное гиподенсное сальниковое или кистозное поражение забрюшинного пространства. Пузырьки внутрикистозного газа низкой плотности наблюдаются при вторичной инфекции. Стенки кисты могут кальцифицироваться. PP: Затухание края псевдокисты. Диагностическая жемчужина: Усиливающий ободок, сбор жидкости с низким ослаблением жидкости у пациента с признаками хронического панкреатита или после операции / вмешательств на поджелудочной железе. | Гистологически скопление некротической ткани, крови и ферментативной жидкости поджелудочной железы, инкапсулированных грануляционной тканью, а затем фиброзной стенкой. Во время созревания плотность содержимого может уменьшаться по мере разжижения крови и мусора. Может оставаться в капсуле поджелудочной железы, но чаще встречается в экстрапанкреатических зонах, таких как брюшная полость, забрюшинное пространство или даже средостение. Наблюдается примерно у 10% больных панкреатитом. Почти 50% разрешаются спонтанно в течение 6 недель; остальные требуют дренажа. Может имитировать некротическую или кистозную опухоль, псевдоаневризму или абсцесс. |
Муковисцидоз (КФ) | Нарушение функции желез с липоматозной гипертрофией поджелудочной железы. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: гиподенсный аспект всей поджелудочной железы с несколькими узловыми кистами и кальцификациями или без них. PP: Неоднородное затухание (жировая инфильтрация) поджелудочной железы с преимущественно низкой плотностью. Жемчужины диагностики: Жировая дегенерация поджелудочной железы с множественными узловыми кистами и рассеянными кальцификациями. | CF — это рецессивно наследуемое полиорганное заболевание, поражающее, в частности, легкие, экзокринные железы и кишечник. Заболевания поджелудочной железы наблюдаются более чем у 80% пациентов. МВ является основной причиной недостаточной внешнесекреторной функции поджелудочной железы в детстве. Лечение пероральным замещением ферментов поджелудочной железы. |
Доброкачественные новообразования | ||
Серозная цистаденома (или микрокистозная) опухоль Рис. 5 см) или микрокистоз (кисты <5 мм). Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: гиподензивные кисты. В центральном рубце могут образоваться кальцификации. PP: Ячеистая структура микрокистозной аденомы с усилением контраста между перегородками и капсулами. Макрокистозная аденома остается гиподенсированной без усиления. Диагностический жемчуг: Четко выраженная губчатая кистозная масса в головке поджелудочной железы с отчетливым увеличением капсулы / перегородки и нормальной шириной главного протока поджелудочной железы (MPD). | Редко (~ 1% новообразований поджелудочной железы). Гистологически богатая гликогеном муцинозная опухоль, возникающая из центроацинарных клеток. Предпочтительным местом является головка поджелудочной железы, но это может произойти в любой части поджелудочной железы. Простые кисты поджелудочной железы могут быть множественными (например, болезнь фон Гиппеля – Линдау, поликистоз), но обычно не имеют внутренней структуры. Дифференциальный диагноз: IPMN, кистозно-островковая опухоль и цистаденокарцинома. Серозная цистаденома не имеет злокачественного потенциала, но дифференцировать от этих других кистозных новообразований только визуализацию часто невозможно. | |
Киста поджелудочной железы | Обычно врожденные истинные кисты, которые не вызваны ни новообразованиями, ни воспалительными заболеваниями. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: четко очерченные, от округлой до овальной формы, гипоаттенуирующие кисты. PP: Поражения остаются гиподенсированными без улучшения. | Гистологические истинные кисты с эпителиальной выстилкой. Обычно ассоциируется с кистозным заболеванием печени и других органов, таким как аутосомно-доминантная поликистозная болезнь почек (ADPKD) или болезнь фон Хиппеля – Линдау. Внутри поджелудочной железы видны одиночные или множественные скопления околоводной плотности. |
Злокачественные новообразования | ||
Цистаденокарцинома, муцинозно-кистозная опухоль поджелудочной железы Рис.22.13 | Кистозное новообразование различного размера (3–10 см) в теле или хвосте поджелудочной железы. Рекомендация сканирования: Многофазная КТ (КТ без усиления, фаза воротной вены [PVP], PP). КТ без усиления: Гиподензивное однокамерное кистозное образование с кальцификациями или без них. PVP: Небольшие опухоли могут быть лучше очерчены на ранней стадии контрастирования. PP: Отчетливое усиление контраста между перегородкой и капсулой. Макрокистозная аденома остается гиподенсированной без усиления. Диагностическая жемчужина: Однокулярная кистозная масса в теле или хвосте поджелудочной железы с гиператенизацией толстой неровной стенки на постконтрастном сканировании. | Кистозные злокачественные новообразования составляют <10% всех злокачественных новообразований. Кисты обычно располагаются дистальнее опухоли и представляют собой псевдо- или ретенционные кисты. По сравнению с простыми кистами или псевдокистами злокачественные новообразования обычно имеют более высокие значения аттенюации в центре и имеют неровные толстые стенки.Карциномы могут быть замаскированы при наличии хронического воспаления. Расширение протока часто является единственной аномалией на компьютерной томографии. У> 50% пациентов наблюдается расширение протока поджелудочной железы (5–10 мм) и желчевыводящих путей. Скручивание перипанкреатического жира указывает на лимфангиоз и, таким образом, вызывает подозрение на рост внелезистых опухолей. Брыжеечные лимфатические узлы могут быть <10 мм, но инфильтрированы. |
Протоковая карцинома поджелудочной железы Рис.22.14a, b | Карцинома поджелудочной железы, возникающая из протокового эпителия экзокринной части поджелудочной железы. Рекомендация сканирования: Двухфазный КТ (КТ без усиления, PP). КТ без усиления: гипо- / изоденсия к нормальной ткани поджелудочной железы. PP: Неоднородный, часто с плохим усилением. Диагностическая жемчужина: Гетерогенная, плохо увеличивающая неравномерная масса в головке поджелудочной железы с расширенным общим желчным протоком (CBD) и MPD (признак двойного протока). | Протоковая карцинома поджелудочной железы составляет 95% всех новообразований поджелудочной железы. Гистологически представляет собой в основном муцинозные аденокарциномы. Шестьдесят процентов в голове, 20% в теле, 5% в хвосте и 15% диффузно. Разделение на три стадии: I: ограничено поджелудочной железой II: стадия I и метастазы регионарных лимфатических узлов III: стадия II и отдаленные метастазы |
| Островоклеточная опухоль Рис.22.15a, b | Нейроэндокринные опухоли, возникающие из эндокринных клеток поджелудочной железы (островковые клетки Лангерганса). Рекомендация сканирования: Многофазная КТ (КТ без усиления, артериальная фаза [AP], PVP). КТ без усиления: небольшое или большое поражение, изоденсное нормальной ткани поджелудочной железы. Могут присутствовать кальцификации. AP: Опухоли из небольших островковых клеток обычно усиливаются сильно и однородно. В больших опухолях может наблюдаться усиление кольца с центральной некротической областью с низкой плотностью. PVP: Опухоли быстро изоденсируются (маскируются) нормальной поджелудочной железе. Диагностические жемчужины: Небольшое гиперваскулярное образование поджелудочной железы с несколькими поражениями печени, демонстрирующее аналогичную картину усиления. | Опухоли островковых клеток являются секреторными (функционирующими) или нефункционирующими. Секреторные опухоли выявляются раньше из-за клинических симптомов. На момент обнаружения нефункционирующие опухоли обычно имеют большие размеры. От 60 до 75% опухолей секреторных островковых клеток секретируют инсулин (инсулиномы), а 20% представляют собой опухоли из островковых клеток, секретирующих альфа-1 (гастриномы), вызывающие синдром Золлингера – Эллисона. Редкие островковые опухоли включают опухоли, продуцирующие глюкагон (альфа-2 клетки), вазоактивный кишечный пептид (VIPoma, не-бета-клетки) и соматостатин (соматостатинома [дельта-клетки]). Опухоли клеток-предшественников амина и декарбоксилирования (APUDomas) иногда встречаются в поджелудочной железе. Они производят адренокортикотропный гормон (АКТГ), антидиуретический гормон (АДГ) и вазоактивный кишечный полипептид (VIP). Метастазы в печени часто обнаруживаются до постановки диагноза первичной опухоли островковых клеток. |
Папиллярно-кистозная карцинома, солидная и папиллярная опухоль поджелудочной железы Рис. 22.16 | Хорошо выраженная большая (> 2 см) неоднородная масса в хвосте или теле поджелудочной железы. Рекомендация сканирования: Двухфазная КТ (КТ без усиления, PVP). КТ без усиления: Четко выраженное центрально-гиподенсное образование, в зависимости от соотношения кровоизлияние / некроз. Могут присутствовать кальцификации. PVP: Поражение остается в центре с пониженной аттенюацией с толстой и сильно усиливающейся стенкой. Жемчужины диагностики: Хорошо выраженная большая (> 2–20 см) опухоль в теле или хвосте поджелудочной железы с сосуществованием солидных и кистозных компонентов. | Редко. Гистологические твердые и псевдопапиллярные структуры, окруженные участками некроза и кровоизлияния. Обычно возникает у молодых (<40 лет) пациентов. Хирургия — лечение выбора. Редко рецидивирует после иссечения; Таким образом, общий прогноз благоприятный. |
Внутрипротоковое папиллярное муцинозное новообразование (IPMN) Рис. 22.17a, b | Муцин-продуцирующее новообразование, возникающее из эпителиальной оболочки протоков или ветвей поджелудочной железы или протоков ДПЖ тип). Рекомендация сканирования: Двухфазная КТ (КТ без усиления, PVP). КТ без усиления: расширенный и извилистый главный канал типа MPD.Редко кальцификаты. КТ без усиления: расширенный и извилистый главный канал типа MPD. Редко кальцификаты. Гроздеподобное скопление множественных небольших гиподенсных кист при БЛД. PVP: Тонкое неравномерное усиление слизистой оболочки кисты. Диагностические жемчужины: Грозоподобный, гипоаттенуирующий кластер микронодулярных кист в крючковидном отростке, переходящий в расширенный MPD. | MPD IPMN обычно располагается в теле или хвосте, тип BPD обычно в головке поджелудочной железы и крючковидном отростке.Тридцать процентов опухолей переходят в злокачественный вариант. Обычно диагностируется у пациентов старше 60 лет. Симптоматическая IPMN может вызвать боль, рецидивирующий панкреатит, сахарный диабет, диарею и потерю веса. Лечение выбора — постоянное наблюдение за пожилыми и бессимптомными пациентами и хирургическая резекция у молодых и симптоматических пациентов. |
Метастазы поджелудочной железы | Поражения поджелудочной железы без обструкции MPD. Рекомендация сканирования: Двухфазная КТ (КТ без усиления, PVP). КТ без усиления: Обычно изоденсен нормальной поджелудочной железе (меланома: гиперплотная). PVP: переменная; может напоминать первичную опухоль поджелудочной железы. Жемчужины диагностики: Внутрипанкреатические поражения с сопутствующими внутрибрюшными метастазами (лимфатические узлы, надпочечники, почки, печень). | Чаще всего метастазы возникают при меланоме, раке легких, раке груди и раке яичников.Карцинома желудка, желчного пузыря и печени может напрямую поражать ткань поджелудочной железы. Поражения левого надпочечника и почки первоначально смещают хвостовую часть поджелудочной железы, затем поражают перипанкреатический жир и, наконец, могут закупорить селезеночную вену. |
Лимфома Рис. 22.18a, b | Либо большие, однородные, твердые интрапаренхиматозные образования, либо увеличенные перипанкреатические лимфатические узлы. Рекомендация сканирования: Двухфазная КТ (КТ без усиления, PVP). КТ без усиления: диффузное увеличение поджелудочной железы с образованием околопеченочного жира, увеличенные перипанкреатические лимфатические узлы. PVP: Обычно изоаттенуирует поджелудочную железу; иногда незначительное увеличение опухоли. Жемчужина диагностики: Увеличенные перипанкреатические лимфатические узлы или диффузно увеличенная поджелудочная железа у пациента с известной лимфомой. | Первичная лимфома составляет <1% всех новообразований поджелудочной железы.Чаще встречаются вторичные лимфомы. Наиболее распространенный подтип - неходжкинская лимфома. Лечение выбора обычно - химиотерапия. |
Атравматический разрыв Вирсунга у пациента с псевдокистами поджелудочной железы: клинический случай | BMC Gastroenterology
Разрыв протока поджелудочной железы сопровождается утечкой панкреатического сока и, как следствие, определяет скопление поджелудочной жидкости (PFC).
Клинические проявления утечки из главного протока поджелудочной железы включают псевдокисты, некроз стенок (WON), свищи поджелудочной железы, асцит, плевральные и перикардиальные выпоты [5].Согласно пересмотренной классификации Атланты, псевдокисты и WON являются поздними результатами (> 4 недель после начала боли) скоплений после панкреатита [5, 6]. Псевдокиста — наиболее частый результат утечки протока поджелудочной железы. WON является вторичным по отношению к очаговому некрозу поджелудочной железы и характеризуется наличием некротических осколков в скоплении, в то время как содержимое псевдокист является серозным [6].
Синдром отсоединенного протока (DDS) — это редкое заболевание, характеризующееся утечкой поджелудочной железы с полным пересечением главного протока поджелудочной железы в дистальной части железы.Обычно это происходит в результате тяжелого острого панкреатита с некрозом поджелудочной железы и наблюдается у 16% этих пациентов [7].
КТ и MRCP сканирование — основные методы визуализации у пациентов с a PFC [5]. КТ часто переоценивает жидкий компонент коллекции и может ошибочно диагностировать WON как псевдокисту [8]. MRCP можно использовать вместо эндоскопической ретроградной холангиопанкреатографии (ERCP), поскольку он может идентифицировать активную утечку из протока поджелудочной железы [9].EUS может быть особенно полезным при выявлении некротических остатков в коллекциях жидкости [5]. EUS-FNA может быть полезен при дифференциальной диагностике кистозных поражений путем сбора жидкости для цитологического исследования, амилазы и CEA [10,11,12]. Содержание псевдоцисты обычно характеризуется высокой концентрацией амилазы и низким уровнем СЕА. У этих пациентов жидкость кисты обычно содержит воспалительные клетки при цитологической оценке [5]. Тем не менее цитология и анализ жидкости имеют некоторые ограничения.В большой серии исследований FNAC показал высокую специфичность (83%), но низкую чувствительность (34%) в отношении муцинозно-кистозных поражений [10]. Только концентрация CEA в кистозной жидкости (пороговое значение = 192 нг / мл) была связана с замечательной специфичностью и чувствительностью (83% и 75% соответственно) для муцинозных поражений [10]. Действительно, концентрация амилазы в жидкости кисты может быть повышена не только в псевдокистах, но и в новообразованиях с протоками поджелудочной железы [13].
У нашего пациента не было факторов риска, анамнеза или признаков острого панкреатита.Сообщений о предыдущих травмах живота не поступало. Симптомами обращения были появление желтухи и значительная потеря веса. Боль в животе — наиболее частый симптом псевдокисты [3]. Желтуха и похудание чаще возникают при новообразованиях поджелудочной железы. Согласно большому ретроспективному анализу, желтуха и потеря веса составляют соответственно 3,9 и 18,6% симптомов псевдокисты [14]. Действительно, пациенты, у которых развиваются псевдокисты, редко протекают бессимптомно по поводу панкреатита, что делает наш диагноз более сложным.Муцинозное кистозное новообразование (MCN) и внутрипротоковое папиллярное муцинозное новообразование (IPMN) считались альтернативным диагнозом [15].
MCN — это толстостенные макрокистозные опухоли без связи с системой протоков [16,17,18]. Крупные кистозные образования, обнаруженные при КТ, соответствовали MCN, но результаты MRCP исключили этот диагноз. IPMN был рассмотрен из-за наличия связи между кистами и протоками поджелудочной железы; однако расширение вирсунговского протока, характерное для главного протока типа IPMN, отсутствовало.
Тем не менее, отсутствие опухолевых клеток на FNAC под контролем EUS и высокая концентрация амилаз сделали диагноз доброкачественной кисты более вероятным, чем злокачественное поражение [16].
Лечение ПФУ консервативно в случае небольших скоплений, небольших дефектов протока и при отсутствии обструкции протока ниже по потоку вследствие разрыва протока [6]. Большие разрывы протока с обструкцией ниже по потоку требуют оперативного лечения. В настоящее время для дренирования рекомендуются только симптоматические ПФУ [6].В нашем случае наличие желтухи, сдавления верхних отделов желудочно-кишечного тракта и больших размеров псевдокист требовало дренирования. В настоящее время дренирование псевдокисты может выполняться хирургическим или эндоскопическим методом: в последние десятилетия эндоскопическое лечение стало методом выбора [19].
Хирургическая цистогастростомия обычно выполняется через анастомоз между просветом полости кисты и желудком [20]. Хирургический дренаж — эффективное лечение. После дренирования частота рецидивов псевдокист — 2.5–5%, но частота осложнений может достигать 30% [21].
Эндоскопические методы лечения включают трансмуральный дренаж, транспапиллярный дренаж и панкреатодуоденостомию или гастростомию.
Первоначальные исследования, сравнивающие хирургическую и эндоскопическую цистогастростомию, показали эквивалентное разрешение псевдокист и сопоставимую частоту осложнений [22, 23]. Однако улучшение навыков минимально инвазивной хирургии сделало эндоскопическую технику предпочтительным начальным подходом. Более поздние исследования пришли к выводу, что два метода дали одинаковый технический успех и частоту осложнений, но эндоскопическое лечение имело более короткую продолжительность пребывания в больнице и меньшую стоимость больницы [24,25,26].Более того, в Кокрановском обзоре, сравнивающем хирургические и эндоскопические методы лечения, сделан вывод о том, что необходимы дальнейшие исследования по этой теме [27]. Недавний анализ пришел к выводу, что оптимальное лечение псевдокисты поджелудочной железы все еще остается спорным в отсутствие метаанализа, сравнивающего два подхода [25].
Мы провели хирургическое обследование по трем причинам. Во-первых, исследование брюшины и замороженный участок могут окончательно исключить опухолевую природу кистозного поражения.Кроме того, хирургический дренаж позволил ускорить декомпрессию желчевыводящих путей и желудка. Наконец, ограниченный опыт эндоскопического дренирования псевдокист под руководством EUS в нашем учреждении сделал хирургическое лечение более надежным.
Ретроспективно, в нашем случае, более надежным объяснением происхождения множественных псевдокист был разрыв главного панкреатического протока, вторичный по отношению к бессимптомному фокально-некротическому панкреатиту хвоста железы. Позднее сложная кистозная масса была выявлена в результате сдавления желудка и желчевыводящих путей.
Псевдокисты поджелудочной железы обычно осложняют острые и симптоматические эпизоды панкреатита. В нашем случае наличие сложного кистозного поражения поджелудочной железы и разрыва вирсунгова протока при отсутствии предыдущего эпизода острого панкреатита или травмы живота затрудняло диагностику. В таких случаях КТ, РМ и ЭУЗИ необходимы для подозрения на злокачественные новообразования и для определения наличия связи с протоками поджелудочной железы.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Осевой срез, 5 мм. Виден проток поджелудочной железы в норме.
Контекст 1
… резонансная холангиопанкреатография (MRCP) — это неинвазивный метод визуализации, который точно отображает морфологические особенности желчных и поджелудочных протоков и является многообещающей альтернативой диагностической эндоскопической ретроградной холангиопанкреатографии (ERCP). Принцип MRCP основан на сборе последовательностей, взвешенных по T, в которых 2 неподвижных флюида имеют результирующую высокую интенсивность сигнала.Появление быстрых последовательностей, особенно RARE [1] и их вариантов, резко сократило время визуализации и сделало жизнеспособными методы задержки дыхания. Первоначально MRCP выполнялся с использованием эхо-последовательности градиентного отзыва (GRE) с параметрами, которые привели к созданию устойчивого состояния свободной обработки (SSFP). При использовании этой техники ни нерасширение желчных протоков, ни желчный проток дистальнее места обструкции не визуализировались. В настоящее время используются два разных метода: (1) 2D или 3D сильно T-взвешенный FSE, обычно 2 с тихим дыханием или дыхательной синхронизацией, но могут использоваться с техникой задержки дыхания.(2) HASTE 2D с техникой задержки дыхания. Визуализация протока поджелудочной железы чувствительна к дыхательным движениям, требующим задержки дыхания или других методов компенсации дыхания. Методы подавления жира, массивы тела и методы постобработки (MIP и MPR) улучшают визуализацию протока поджелудочной железы. Мы используем систему 1 Тл (Siemens Magneton Impact Expert, Эрланген, Германия) с катушками с фазовой решеткой. Мы выполняем две разные последовательности: во-первых, косую корональную задержку дыхания с тяжелым Т-взвешенным 2 FSE (TR: 2800; TE: 1100; толщина: 80–40 мм; TA: 7 сегментов).) как локализатор. После этого мы выполняем задержку дыхания HASTE 2D с подавлением жира (TR: 10.92; TE: 87; TD: 100; a: 150; TA: 15 сегментов) в аксиальной, сагиттальной и корональной плоскостях с мультипланарной реформацией (MPR) и реконструкцией проекции. (MIP). Можно использовать другие плоскости, чтобы избежать перекрытия петель кишечника. Использование отрицательного перорального контрастного вещества является спорным. Хотя он может устранить перекрывающиеся органы, содержащие жидкость, он затемняет двенадцатиперстную кишку и может маскировать папиллярную патологию, вызывающую расширение протока поджелудочной железы.Визуализация после инъекции секретина может добавить функциональную информацию к МРТ панкреатографии, которая может отражать один аспект физиологии экзокрины поджелудочной железы [2]. Главный панкреатический проток в большинстве случаев визуализируется. Он идет в головном направлении, поворачивается на 45–90 ° в шее и продолжается горизонтально в теле и в хвосте железы (рис. 1). Его нормальный диаметр составляет от 2 до 3 мм. В нормальных условиях ни добавочный проток Санторини, ни боковые ответвления не визуализируются. Деление поджелудочной железы — наиболее распространенный анатомический вариант поджелудочной железы.Это происходит из-за неспособности слиться вентрального и дорсального зачатков поджелудочной железы в течение 6-8 недель. В большинстве случаев отсутствие сращения полное и отсутствует сообщение между дорсальным и вентральным протоком поджелудочной железы. Его распространенность составляет около 10%. До сих пор диагноз деления поджелудочной железы ставился с помощью ERCP. Однако из-за его небольшого размера частота неудач при кануляции малого сосочка высока (30–60%). Это относительное преимущество MRCP в диагностике деления поджелудочной железы.С другой стороны, из-за ограниченного пространственного разрешения различие между полным и неполным делением поджелудочной железы может быть затруднительным. MRCP учитывает два разных и независимых канала [3]. Доминантный проток поджелудочной железы можно непрерывно отслеживать от хвоста к голове, пересекая кпереди к общему желчному протоку и дренируя его в двенадцатиперстную кишку (рис. 2). Проток Вирсунга может быть нормальным, атрофическим или отсутствовать. Поперечные срезы могут быть более предпочтительными, чем корональные плоскости (рис. 3), а MPR более полезен, чем MIP для выявления этой аномалии.Недавние сообщения показывают, что МРТ — очень чувствительный метод демонстрации воспаления. Однако проток поджелудочной железы может быть нормальным в легких случаях панкреатита (рис. 4). Иногда увеличенная и отечная поджелудочная железа может вызвать сдавление протока поджелудочной железы. В этих случаях проток поджелудочной железы либо не визуализируется, либо имеет плавное и симметричное сужение. В более тяжелых случаях панкреатита MRCP может предоставить информацию о состоянии протока поджелудочной железы: наличие растяжения, разрыва или утечки протока или наличие внутрипротокового поражения, которое может предрасполагать к формированию псевдокист (рис. 5).Однако в этих случаях экстрапанкреатическая жидкость может ограничивать визуализацию протока поджелудочной железы. MRCP может легко обнаружить псевдокисты поджелудочной железы, их форму, количество и размер, что дает хирургу ценную информацию. В легкой форме диагноз хронического панкреатита на основании критериев визуализации часто является относительно субъективным. MRCP имеет ограниченное применение в диагностике ранних стадий хронического панкреатита из-за его неспособности отобразить недилатационные боковые ветви и кальцинозы, а также из-за ограниченного пространственного разрешения.По мере прогрессирования заболевания главный проток поджелудочной железы вовлекается в появление на MRCP расширения протока, неровностей фрески, потери нормального сужения и стенозов. Стенозы обычно короче, ровнее и симметричнее, чем стенозы, связанные с новообразованием (рис. 6). При запущенном хроническом панкреатите дилатация более выражена и могут быть видны внутрипротоковые камни. Эти камни видны как дефекты наполнения с низким уровнем сигнала, окруженные панкреатической жидкостью с высокой интенсивностью сигнала (признак мениска) (Рисунок 7).При тяжелом панкреатите боковые ветви имеют вид «цепочки озер» [4]. (Рисунок 8). Десмоплазический рак протока и хронический фиброзирующий очаговый панкреатит часто трудно дифференцировать. MRCP может отображать как суженный главный проток поджелудочной железы, так и изолированные расширенные боковые ответвления внутри опухоли, что может указывать на доброкачественную природу образования [5]. Хотя это открытие характерно для хронического панкреатита, оно не является специфическим. Обструкция главного протока поджелудочной железы является наиболее частой панкреатографической находкой при карциноме.Протоки, проксимальные к обструкции, могут демонстрировать некоторую престенотическую дилатацию, но в остальном они нормальны, тогда как изменения, соответствующие панкреатиту, обычно наблюдаются при обструкции из-за панкреатита (рис. 9). Сама обструкция обычно бывает неправильной, узловатой, крысино-хвостовой или эксцентричной при карциноме и гладкой или тупой при панкреатите. MRCP четко показывает уровень, длину и степень обструкции с адекватной визуализацией дистального тракта. Следующее наиболее частое появление — это локализованная оболочка главного протока поджелудочной железы.Оболочка обычно имеет длину 1-2 см и имеет неправильную форму. Смежная непроходимость или закрытие общего желчного протока, «признак двойного протока», с высокой степенью вероятности указывает на злокачественное новообразование (рис. 10). Внутрипротоковые опухоли, продуцирующие муцин, проявляются в виде кистозных расширений боковых ветвей или виноградных поражений с сообщающимся каналом с основным протоком поджелудочной железы. MRCP может превосходить ERCP, поскольку муцин часто препятствует контрастному наполнению протоков. В случаях ампулярной карциномы, помимо обструкции общего желчного протока, обычно присутствует обструкция высокой степени с резким прекращением и умеренным расширением протока поджелудочной железы [6] (Рисунок 11).MRCP может быть полезен для локализации скоплений жидкости, а также для определения состояния главного протока поджелудочной железы при тупой травме поджелудочной железы. Однако в нашем опыте точка утечки не была обозначена. Явным преимуществом этой методики является отсутствие инвазивности. Кроме того, MRCP не ограничивается пациентами с измененной анатомией (пилорический или дуоденальный стеноз, гепатоеюностомия) и не зависит от оператора. Текущий недостаток MRCP — его относительно низкое пространственное разрешение, которое ограничивает визуализацию недилатированных боковых ветвей протока поджелудочной железы и характеристику стриктур.MRCP — многообещающая альтернатива ERCP при оценке протока поджелудочной железы; особенно у больных, пациентов с предшествующей гастродуоденальной операцией, пациентов с полной окклюзией протока поджелудочной железы с подозрением на новообразование или без него и с избыточным весом, ослабленным или отказавшимся от сотрудничества …
невероятно расширенный Вирсунг, имитирующий серокистозное новообразование головки поджелудочной железы | Журнал хирургических историй болезни
Абстрактные
Пациент с диабетом, у которого при обычном УЗИ брюшной полости был обнаружен очень расширенный проток поджелудочной железы.Компьютерная томография (КТ) диагностировала серокистозное поражение головки поджелудочной железы. Гастродуоденоскопия обнаружила гиперемированную область двенадцатиперстной кишки, из которой был взят образец. Биопсия показала, что внутрислизистые сосудистые эмболы нейроэндокринной карциномы положительны по хромогранину А и соматостатину и отрицательны по гастрину. Холангиомагнитно-резонансная томография показала, что серокистозное поражение, обнаруженное на КТ, имитировалось чрезвычайно расширенным протоком поджелудочной железы, но предполагало возможность внутрипротокового или ампулярного новообразования.Анализы крови и мочи не помогли, октреоскан дал отрицательный результат. Пациент перенес операцию. Прямое обследование подтвердило серьезное расширение протока поджелудочной железы и поражение головы, требующее панкреатодуоденэктомии. Гистология подтвердила нейроэндокринную опухоль, инфильтрирующую двенадцатиперстную кишку. Мы пришли к выводу, что, несмотря на современные сложные методы визуализации и эндоскопии, оценка билиопанкреатической области может быть сложной задачей и может вызвать хирургические сюрпризы.
ВВЕДЕНИЕ
Современные методы визуализации значительно облегчают оценку билиопанкреатических структур, однако точное определение поражений поджелудочной железы иногда может быть проблематичным, несмотря на обширную предоперационную оценку.Мы описываем случай вводящих в заблуждение особенностей изображения, за которым последовал хирургический «сюрприз», который побудил к другой хирургической стратегии.
ДЕЛО
Бессимптомный 55-летний мужчина с сахарным диабетом 2 типа, контролируемым пероральным приемом метформина, прошел ультразвуковое исследование брюшной полости, которое случайно обнаружило заметное расширение протока поджелудочной железы. Головка поджелудочной железы плохо визуализировалась.
Таким образом, пациенту была проведена компьютерная томография (КТ) (рис. 1 и 2), которая выявила «утолщенную стенку двенадцатиперстной кишки и серокистозное поражение головки поджелудочной железы без контрастного усиления, которое сдавило просвет двенадцатиперстной кишки и вызвало расширение. Вирсунгова протока ».Печень, желчный пузырь и внепеченочные желчные пути были в норме. Лимфаденопатии не обнаружено.
Рисунок 1:
КТ-сканирование, показывающее серокистозное поражение головки поджелудочной железы без контрастного усиления, сжимающее просвет двенадцатиперстной кишки и вызывающее расширение вирсунговского протока.
Рисунок 1:
КТ-сканирование, показывающее серокистозное поражение головки поджелудочной железы без контрастного усиления, сжимающее просвет двенадцатиперстной кишки и вызывающее расширение вирсунговского протока.
Рисунок 2:
Еще одно изображение компьютерной томографии, показывающее серокистозное поражение головки поджелудочной железы.
Рисунок 2:
Еще одно изображение компьютерной томографии, показывающее серокистозное поражение головки поджелудочной железы.
Эзофагогастродуоденоскопия показала нормальную луковицу двенадцатиперстной кишки и нисходящую часть двенадцатиперстной кишки, но на верхнем колене двенадцатиперстной кишки была обнаружена и взята пробы гиперемированной области 13 мм. В то время эндоскопист решил не проводить ЭРХПГ, оценив как релевантный риск кровотечения.Гистология выявила сосудистые эмболы нейроэндокринной карциномы в слизистой оболочке двенадцатиперстной кишки. Иммуноцитохимические тесты были положительными на хромогранин А и соматостатин; и отрицательный для Гастрина.
Сывороточные уровни CEA, CA 19-9, AFP и уровни VIP, соматостатина, гастрина и хромогранина A в плазме были нормальными, как и уровни 5HIAA в моче.
Холангиомагнитно-резонансная томография (МРТ) (рис. 3) показала, что серокистозное поражение, обнаруженное на КТ, имитировалось чрезвычайно расширенным протоком поджелудочной железы, который достиг в диаметре 2 см на уровне поджелудочной железы. тело.Расширение хвоста поджелудочной железы уменьшилось до 1 см, а просвет вирсунговского протока имел неправильный профиль. Напротив, калибр Wirsung внезапно уменьшился в непосредственной близости от дуоденального конца. Это открытие не было однозначным и могло указывать на внутрипротоковую опухоль, секретирующую слизистую, хронический панкреатит или ампулярное изменение. Паренхима поджелудочной железы тела и хвоста была в высшей степени гипотрофной, и на крючковидном отростке наблюдалась лишь небольшая часть остаточной ткани поджелудочной железы.Холедох сохранил нормальный размер почти до конца двенадцатиперстной кишки, но в непосредственной близости от ампулы Фатера он исчез примерно на один см, что свидетельствует о функциональном спазме или, что более вероятно, патологическом процессе ампулы. Октреоскан не обнаружил рецепторов соматостатина.
Рисунок 3:
Холангио-МРТ, показывающая чрезвычайно расширенный проток поджелудочной железы диаметром 2 см на уровне тела поджелудочной железы, имитирующий серокистозное поражение, обнаруженное на КТ.
Рисунок 3:
Холангио-МРТ, показывающая чрезвычайно расширенный проток поджелудочной железы диаметром 2 см на уровне тела поджелудочной железы, имитирующий серокистозное поражение, обнаруженное при КТ.
Предоперационное обследование подтвердило наличие нейроэндокринной опухоли поджелудочной железы, вероятно, соматостатиномы [1, 2].
Учитывая клиническую картину, предполагающую ампульное новообразование размером около 1 см, хирургическое лечение было запланировано для предполагаемой энуклеации предполагаемого ампульного новообразования [3, 4], даже если пациент был проинформирован о возможности серьезной резекции поджелудочной железы. быть необходимым, и был достигнут соответствующий консенсус.
При дуоденотомии мы фактически обнаружили поражение головки поджелудочной железы размером 2 × 3 см, инфильтрирующее медиальную стенку двенадцатиперстной кишки, расположенное кверху от сосочка Фатера, которое не подлежало ограниченной резекции. Поэтому мы перешли на дуоденоцефалопанкреазэктомию с сохранением привратника в соответствии с Traverso – Longmire.
Оперативный препарат показал нормальный тонкий холедок (инканнлированный зондом) в цефале от хрупкой неоднородной области, соответствующей опухоли (рис.4), и сильно расширенный проток поджелудочной железы (удерживаемый щипцами) (рис.5).
Рисунок 4:
Оперативный образец показывает нормальный тонкий холедок (инканнулированный зондом) в цефале от опухоли.
Рис. 4:
Операционный образец показывает нормальный тонкий холедок (инкрустированный зондом) цефалальнее опухоли.
Рисунок 5:
Чрезвычайно расширенный проток поджелудочной железы (удерживается щипцами).
Рисунок 5:
Чрезвычайно расширенный проток поджелудочной железы (удерживается щипцами).
Послеоперационная гистология подтвердила нейроэндокринное новообразование ампуллярной области, инфильтрирующее стенку двенадцатиперстной кишки, а также перидуоденальные и перипанкреатические мягкие ткани. Проток поджелудочной железы расширен до диаметра 2,5 см. Ткань поджелудочной железы атрофирована, имеется диффузный склероз главного протока поджелудочной железы. В шести из 17 перипанкреатических и перидуоденальных лимфатических узлов обнаружены нейроэндокринные метастазы. Пролиферирующая активность (MIB-1) составляла <2% с числом митозов / 10HPF ниже 2.Иммуногистохимическое окрашивание было положительным для синаптофизина и соматостатина и было отрицательным для инсулина, глюкагона и полипептида поджелудочной железы.
Послеоперационное течение прошло без осложнений, пациентка выписана на 11-е сутки после операции.
ОБСУЖДЕНИЕ И ВЫВОДЫ
Даже при использовании более продвинутых и сложных диагностических методов визуализации, эндоскопических, иммунологических и ядерных методов оценка ампулярной области поджелудочной железы может быть трудной, а строгие отношения между заметно измененными соседними анатомическими структурами могут вводить в заблуждение [5, 6].В этом случае поражение было интерпретировано КТ как серокистозное новообразование, затем распознано МРТ как большое расширение Вирсунга, и, наконец, только при дуоденотомии причина расширения Вирсунга могла быть определена. План лечения был изменен на дуоденопанкреазэктомию.
ЗАЯВЛЕНИЕ О КОНФЛИКТЕ ИНТЕРЕСОВ
Не объявлено.
ССЫЛКИ
1Оберг
К
.Нейроэндокринные опухоли желудочно-кишечного тракта: последние достижения молекулярной генетики, диагностики и лечения
.Curr Opin Oncol
2005
;17
:386
—91
,2Kaltsas
GA
,Besser
GM
,Grossman
AB
.Диагностика и лечение запущенных нейроэндокринных опухолей
.Endocr Ред.
2004
;25
:458
—511
.3Viola
KV
,Sosa
JA
.Современные достижения в диагностике и лечении эндокринных опухолей поджелудочной железы
.Curr Opin Oncol
2004
;17
:24
—7
.4Wiedenmann
B
,Jensen
RT
,Mignon
M
,Modlin
000 BI000,000,000,000 ДоэртиG
и др. .Предоперационная диагностика и хирургическое лечение нейроэндокринных гастроэнтеропанкреатических опухолей: общие рекомендации консенсусного семинара
.World J Surg
1998
;22
:309
—18
,5Перейра
PL
,Вискирхен
J
.Морфофункциональные исследования нейроэндокринных опухолей поджелудочной железы
.евро Радиол
2003
;13
:2133
—46
,6Ким
TU
,Kim
S
,Lee
JW
,Woo
000 SK
SK
Lee Choo
KS
и др..Ампулла Фатера: комплексная анатомия, МРТ патологических состояний и корреляция с эндоскопией
.евро J Radiol
2008
;66
:48
—64
.Опубликовано Oxford University Press и JSCR Publishing Ltd. Все права защищены. © Автор (ы) 2018.
.
