Врожденная цитомегаловирусная инфекция: диагностика, лечение и профилактика | Карпова
1. Swanson E.C., Schleiss M.R. Congenital Cytomegalovirus Infection: New Prospects for Prevention and Therapy. Pediatr Clin North Am 2013; 60: (2): 335–349.
2. Halwachs-Baumann G. (Ed.). Congenital Cytomegalovirus Infection. Epidemiology, Diagnosis, Therapy. SpringerWien-NewYork, 2011; 149.
3. Никонов А.П., Асцатурова О.Р. Цитомегаловирусная инфекция. Педиатрия. Приложение к журналу Consilium Medicum 2009; (1): 7–10. [Nikonov A.P., Ascaturova O.R. Cytomegalovirus Infection. Pediatriya. Supplement to the journal Consilium Medicum 2009; (1): 7–10. (in Russ)]
4. Volpe J.J. Neurology of the newborn.
5. Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. McGraw-Hill, 2013; 698.
6. Reddehase M. J. (Ed.). Cytomegaloviruses From Molecular Pathogenesis to Intervention. Norfolk, UK: Caister Academic Press, 2013; 539.
7. Cannon M.J., Griffiths P.D., Aston V., Rawlinson W.D. Universal newborn screening for congenital CMV infection: what is the evidence of potential benefit? Rev Med Virol 2014; (24): 291–307.
8. Williams E.J., Kadambari S., Berrington J.E. et al. Feasibility and acceptability of targeted screening for congenital CMVrelated hearing loss. Arch Dis Child Fetal Neonatal Ed 2014; 99: F230–F236.
9. Lanzieri T.M., Dollard S.C., Bialek S.R., Grosse S.D. Systematic review of the birth prevalence of congenital cytomegalovirus infection in developing countries. Int J Infect Dis 2014; (22): 44–48.
10. Mussi-Pinhata M.M., Yamamoto A.Y., Britt R.M. et al. Birth prevalence and natural history of congenital cytomegalovirus infection in a highly seroimmune population. Clin Infect Dis 2009; (15): 522–528.
11. Townsend C.L., Forsgren M., Ahlfors K., Ivarsson S.A., Tookey P.A., Peckham C.S. Long- term Outcomes of Congenital Cytomegalovirus Infection in Sweden and the United Kingdom. Clinical Infectious Diseases 2013; 56: (9): 1232–1239. DOI: 10.1093/cid/cit018.
12. Manicklal S. , Emery V.C., Lazzarotto T., Boppana S.B., Gupta R.K. The «Silent» Global Burden of Congenital Cytomegalovirus. Clin Microbiol Rev 2013; 26: (1): 86–102. DOI: 10.1128/CMR.00062–12.
, Emery V.C., Lazzarotto T., Boppana S.B., Gupta R.K. The «Silent» Global Burden of Congenital Cytomegalovirus. Clin Microbiol Rev 2013; 26: (1): 86–102. DOI: 10.1128/CMR.00062–12.
13. Yamamoto A.Y., Mussi-Pinhata M.M., Boppana S.B., Novak Z., Wagatsuma V.M., Oliveira P.F. et al. Human cytomegalovirus reinfection is associated with intrauterine transmission in a highly cytomegalovirus-immune maternal population. Am J Obstet Gynecol 2010; 202: (3): 297.e1-8. DOI: 10.1016/j.ajog.2009.11.018.
14. Boppana S.B., Ross S.A., Fowler K.B. Congenital Cytomegalovirus Infection: Clinical Outcome. Clin Infect Dis 2013; 57: S4: S178–181. DOI: 10.1093/cid/cit629.
15. Buonsenso D., Serranti D., Gargiullo L., Ceccarelli M., Ranno O., Valentini P. Congenital cytomegalovirus infection: current strategies and future perspectives. Eur Rev Med Pharmacol Sci 2012; (16): 919–935.
Eur Rev Med Pharmacol Sci 2012; (16): 919–935.
16. Fox G., Hoque N., Watts T. (Ed.) Oxford handbook of neonatology. New York: Oxford university press, 2010; 523.
17. Ghekiere S., Allegaert K., Cossey V., Van Ranst M., Cassiman C., Casteels I. Ophthalmological Findings in Congenital Cytomegalovirus Infection: When to Screen, When to Treat? J Pediatr Ophthalmol Strabismus 2012; (49): 274–282. DOI: 10.3928/01913913-20120710-03.
18. Hayakawa J., Kawakami Y., Takeda S., Ozawa H, Fukazawa R., Takase M., Fukunaga Yu. A neonate with reduced cytomegalovirus DNA copy number and marked improvement of hearing in the treatment of congenital cytomegalovirus infection. J Nippon Med Sch 2012; (79): 471–477.
19. Nigro G., Adler S.P. Hyperimmunoglobulin for Prevention of Congenital Cytomegalovirus Disease. Clin Infect Dis 2013; 57: S4: 193–195.
Nigro G., Adler S.P. Hyperimmunoglobulin for Prevention of Congenital Cytomegalovirus Disease. Clin Infect Dis 2013; 57: S4: 193–195.
20. Nigro G. Maternal–fetal cytomegalovirus infection: From diagnosis to therapy. J Matern Fetal Neonatal Med 2009; 22: (2): 169–174. DOI: 10.1080/14767050802609767.
21. Picone O., Teissier N., Cordier A.G. Vauloup-Fellous C., Adle-Biassette H., Martinovic J. et al. Detailed in utero ultrasound description of 30 cases of congenital cytomegalovirus infection. Prenat Diagn 2014; (34): 1–7. DOI: 10.1002/pd.4340.22. Irizarry K., Honigbaum S., Demmler-Harrison G., Rippel S., Wilsey M.Jr. Successful Treatment with Oral Valganciclovir of Primary CMV Enterocolitis in a Congenitally Infected Infant. Fetal Pediatr Pathol 2011; (30): 437–441. DOI: 10.3109/15513815.2011.587501.
DOI: 10.3109/15513815.2011.587501.
23. Bar-Meir M., Farrow K.N., Melin-Aldana H., Chadwick E.G. Cytomegalovirus Enterocolitis Mimicking Necrotizing Enterocolitis: Case Report and Review of the Literature. J Ped Infect Dis 2013; 2: (1): 71–75.
24. Khan R., Ranganathan M., Mondal T. Congenital Cytomegalovirus ( Cmv) Infection and Ascending Aorta Dilation. J Cardiol Curr Res 2015; 4: (1): 00130. DOI: 10.15406/jccr.2015.04.00130.
25. Alarcon A., Martinez-Biarge M., Cabanas F., Hernanz A., Quero J., Garcia-Alix A. Clinical, Biochemical, and Neuroimaging Findings Predict Long-Term Neurodevelopmental Outcome in Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2013; 163: 828-834. DOI: 10.1016/j.jpeds.2013.03.014.
26.
27. Capretti M.G., Lanari M., Tani G., Ancora G., Sciutti R., Marsico C. et al. Role of cerebral ultrasound and magnetic resonance imaging in newborns with congenital cytomegalovirus infection. Brain Dev 2014; (36): 203–211. DOI: 10.1016/j.braindev.2013.04.001.
28. Полин Р.А., Спитцер А.Р. Секреты неонатологии и перинатологии. Пер.с англ. Москва: БИНОМ, 2011; 622.
29. [Polin R.A., Spitcer A.R. Secrets of Neonatology and Perinatology. Translation from English.
30. Adler S.P., Nigro G. Fetal infections: Cytomegalovirus, Herpes simplex, and Varicella. In: Neonatology. A practical approach to neonatal diseases. G. Buonocore, R. Bracci, M. Weindling (Eds). Springer-Verlag, Italia, 2012; 869–879.
31. Bernard S., Wiener-Vacher S., Abbeele T.V.D., Teissier N. Disorders in Children With Congenital Cytomegalovirus Infection. Pediatrics 2015; 136: (4): e887–895.
32. Turner K.M., Lee H.C., Boppana S.B., Carlo W.A., Randolph D.A. Incidence and Impact of CMV Infection in Very Low Birth Weight Infants. Pediatrics 2014; 133: e609–e615. DOI: 10.1542/peds.2013–2217.
33. Duval M., Park A.H. Congenital cytomegalovirus: what the otolaryngologist should know. Curr Opin Otolaryngol Head Neck Surg 2014; (22): 495–500.
Curr Opin Otolaryngol Head Neck Surg 2014; (22): 495–500.
34. Павлова М.В., Федорова Н.Е., Гаджиева З.С., Адиева А.А., Евстигнеева Ж.В., Щербо С.Н. и др. Алгоритм лабораторной диагностики врожденной цитомегаловирусной инфекции у недоношенных детей и влияние терапии вифероном на течение внутриутробных инфекций. Педиатрия 2009; 87: (2): 55 – 62. [Pavlova M.V., Fedorova N.E., Gadzhieva Z.S., Adieva A.A., Evstigneeva Zh.V., Shherbo S.N. et al. Algorithm of laboratory diagnosis of congenital cytomegalovirus infection in preterm infants and the effect of therapy with viferon intrauterine infections. Pediatrija 2009; 87: (2): 55–62. (in Russ)]
35. Ross S.A., Ahmed A., Palmer A.L., Michaels M.G., Sánchez P.J., Bernstein D.I. et al. Detection of Congenital Cytomegalovirus Infection by Real-Time Polymerase Chain Reaction Analysis of Saliva or Urine Specimens. The Journal of Infectious Diseases 2014; (210): 1415–1418. DOI: 10.1093/infdis/jiu263.
The Journal of Infectious Diseases 2014; (210): 1415–1418. DOI: 10.1093/infdis/jiu263.
36. Boppana S.B., Ross S.A., Shimamura M., Palmer A.L., Ahmed A., Michaels M.G. et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. N Engl J Med 2011; (364): 2111–2118. DOI: 10.1056/NEJMoa1006561.
37. Lanary M., Lazzarotto T., Venturi V., Papa I., Gabrielli L., Guerra B. et al. Neonatal cytomegalovirus blood load and risk of sequelae in symptomatic and symptomatic congenitally infected newborns. Pediatrics 2006; 117: e76–83.
38. Boppana S.B., Fowler K.B., Pass R.F., Rivera L.B., Bradford R.D., Lakeman F.D., Britt W.J. Congenital cytomegalovirus infection: The association between virus burden in infancy and hearing loss. J Pediatr 2005; (146): 817–823.
39. Walter S., Atkinson C., Sharland M., Rice P., Raglan E., Emery V.C., Griffiths P.D. Congenital cytomegalovirus: association between dried blood spot viral load and hearing loss. Arch Dis Child Fetal Neonatal Ed 2008; 93: F280–F285.
40. Запорожан В.Н., Старец Е.А., Дубковская М.В. Особенности нервно-психического развития и слуха у детей с внутриутробной трансмиссией цитомегаловируса. Перинатология и педиатрия 2013; (2): (54): 44–46. [Zaporozhan V.N., Starec E.A., Dubkovskaya M.V. Features of mental development, and hearing in children with intrauterine transmission of cytomegalovirus. Perinatologija i pediatrija 2013; (2): (54): 44–46. (in Russ)]
41. Forner G., Abate D., Mengoli C., Palù G., Gussetti N. High Cytomegalovirus (CMV) DNAemia Predicts CMV Sequelae in Asymptomatic Congenitally Infected Newborns Born to Women With Primary Infection During Pregnancy. J Infect Dis 2015; (212): 67–71. DOI: 10.1093/infdis/jiu627.
J Infect Dis 2015; (212): 67–71. DOI: 10.1093/infdis/jiu627.
42. Ross S.A., Novak Z., Fowler K.B., Arora N., Britt W.J., Boppana S.B. Cytomegalovirus blood viral load and hearing loss in young children with congenital infection. Pediatr Infect Dis J2009; (28): 588–592. DOI: 10.1097/INF.0b013e3181979a27.
43. Park A.H., Mann D., Error M., Miller M., Firpo M.A., Wang Y. et al. Comparative analysis of detection methods for congenital cytomegalovirus infection in a guinea pig model. JAMA Otolaryngol Head Neck Surg 2013; (139): 82–86. DOI: 10.1001/jamaoto.2013.1090.
44. Hashaw J.B., Dudgeon J.A., Marshall W.C. Viral diseases of the fetus and newborn. Philadelphia: Saunders, 1985; 335.
45. Dreher A.M., Arora N., Fowler K.B., Novak Z., Britt W.J., Boppana S.B., Ross S.A. Spectrum of Disease and Outcome in Children with Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2014; 164: (4): 855-859. DOI: 10.1016/j.jpeds.2013.12.007.
Dreher A.M., Arora N., Fowler K.B., Novak Z., Britt W.J., Boppana S.B., Ross S.A. Spectrum of Disease and Outcome in Children with Symptomatic Congenital Cytomegalovirus Infection. J Pediatr 2014; 164: (4): 855-859. DOI: 10.1016/j.jpeds.2013.12.007.
46. Goderis J., De Leenheer E., Smets K., Van Hoecke H., Keymeulen A., Dhooge I. Hearing loss and congenital CMV infection: a systematic review. Pediatrics 2014; 134: (5): 972-982. DOI: 10.1542/peds.2014–1173.
47. Kimberlin D.W., Jester P.M., Sanchez P.J., Ahmed A., Arav-Boger R., Michaels M.G. et al. Valganciclovir for Symptomatic Congenital Cytomegalovirus Disease. N Engl J Med 2015; (372): 933–943. DOI: 10.1056/NEJMoa1404599.
48. Kimberlin D.W., Lin C.Y., Sanchez P.J., Demmler G.J., Dankner W., Shelton M. et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial. J Pediatr 2003; (143): 16–25.
et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system: A randomized, controlled trial. J Pediatr 2003; (143): 16–25.
49. Oschman A., Murthy V., Kollipara R., Kenneth Lord R., Oluola O. Intravitreal Ganciclovir for Neonatal Cytomegalovirus-Associated Retinitis: A Case Report. J Perinatol 2013; (33): 329–331. DOI: 10.1038/jp.2012.139.
50. Tawse K.L., Baumal C.R. Intravitreal foscarnet for recurring CMV retinitis in a congenitally infected premature infant. J AAPOS 2014; 18: (1): 78–80.
51. Lacker A., Acham A., Alborno T., Moser M., Engele H., Raggam R.B. et al. Effect on hearing of ganciclovir therapy for asymptomatic congenital cytomegalovirus infection: four to 10 year follow up. J Laryngol Otol 2008; (30): 1–6. DOI: 10.1017/S0022215108003162.
J Laryngol Otol 2008; (30): 1–6. DOI: 10.1017/S0022215108003162.
52. Nassetta L, Kimberlin D, Whitley R. Treatment of congenital cytomegalovirus infection: implications for future therapeutic strategies. J Antimicrob Chemother 2009; 63: (5): 862–867.
53. Luck S.E., Emery V.C., Atkinson C., Sharland M., Griffiths P.D. Compartmentalized dynamics of cytomegalovirus replication in treated congenital infection. J Clin Virol 2016; (82): 152– 158. DOI: 10.1016/j.jcv.2016.07.018. Epub 2016 Jul 27.
54. Erice A. Resistance of Human Cytomegalovirus to Antiviral Drugs Clin Microbiol Rev 1999; 12: (2): 286–297.
55. Choi K.Y., Sharon B., Balfour Jr., Belani K., Pozos T.C., Schleiss M.R. Emergence of antiviral resistance during oral valganciclovir treatment of an infant with congenital cytomegalovirus (CMV) infection. J Clin Virol 2013; 57: (4): 356–360. DOI: 10.1016/j.jcv.2013.04.004.
Emergence of antiviral resistance during oral valganciclovir treatment of an infant with congenital cytomegalovirus (CMV) infection. J Clin Virol 2013; 57: (4): 356–360. DOI: 10.1016/j.jcv.2013.04.004.
56. Hughes B.L., Gyamfi-Bannerman C. Society for Maternal-Fetal Medicine (SMFM). Diagnosis and antenatal management of congenital cytomegalovirus infection. Am J Obstet Gynecol 2016; 214: (6): B5–B11.
57. Weng Y.H., Chu S.M., Lien R.I., Chou Y.H., Lin T.Y. Clinical experience with ganciclovir and anti-cytomegalovirus immunoglobulin treatment for a severe case of congenital cytomegalovirus infection. Chang Gung Med J 2003; 26: (2): 128–132.
58. Aslam M., Anderson J.L., Guglietti D., Cardwell D. CMV-induced neonatal thrombocytopenia: a case report and review of the literature. Am J Perinatol 2007; 24: (7): 429–434.
Am J Perinatol 2007; 24: (7): 429–434.
59. Cekinović D., Golemac M., Pugel E.P., Tomac J., Cicin-Sain L., Slavuljica I. et al. Passive immunization reduces murine cytomegalovirus-induced brain pathology in newborn mice. J Virol 2008; 82: (24): 12172–12180. DOI: 10.1128/JVI.01214–08.
60. Дубковская М.В. Анализ факторов, связанных с тяжестью течения врожденной цитомегаловирусной инфекции. Перинатология и педиатрия 2011; (1): (45): 116–120. [Dubkovskaya M.V. Analysis of factors associated with the severity of congenital cytomegalovirus infection. Perinatologija i pediatrija 2011; (1): (45): 116–120. (in Russ)]
61. Cannon M.J., Stowell J.D., Clark R., Dollard P.R., Johnson D., Mask K. et al. Repeated measures study of weekly and daily cytomegalovirus shedding patterns in saliva and urine of healthy cytomegalovirus-seropositive children. BMC Infect Dis. 2014; 14: 569. DOI: 10.1186/s12879-014-0569-1.
BMC Infect Dis. 2014; 14: 569. DOI: 10.1186/s12879-014-0569-1.
62. Ross E.S., Dollard S.C., Victor M., Sumartojo E., Cannon M.J. The epidemiology and prevention of congenital cytomegalovirus infection and disease: Activities of the Centers For Disease Control and Prevention Workgroup. J Women’s Health 2006; 15: (3): 224–229.
63. Van Zuylen W.J., Hamilton S.T., Naing Z., Hall B., Shand A., Rawlinson W.D. Congenital cytomegalovirus infection: Clinical presentation, epidemiology, diagnosis and prevention. Obstet Med 2014; (7): (4): 140–146. DOI: 10.1177/1753495X14552719.
64. http://www.cdc.gov/cmv/clinical/features.html. Page last updated: June 17, 2016.
65. Cannon M.J., Westbrook K. , Levis D., Schleiss M.R., Thackeray R., Pass R.F. Awareness of and behaviors related to childto- mother transmission of cytomegalovirus. Prev Med 2012; 54: (5): 351–357. DOI: 10.1016/j.ypmed.2012.03.009.
, Levis D., Schleiss M.R., Thackeray R., Pass R.F. Awareness of and behaviors related to childto- mother transmission of cytomegalovirus. Prev Med 2012; 54: (5): 351–357. DOI: 10.1016/j.ypmed.2012.03.009.
66. Jeon J., Victor M., Adler S., Arwady A., Demmler G., Fowler K. et al. Knowledge and awareness of congenital cytomegalovirus among women. Infect Dis Obstet Gynecol 2006; (2006): 1–7.
Сдать анализ на антитела IgM к цитомегаловирусу, ЦМВ
Метод определения Иммуноферментный анализ (ИФА).
Исследуемый материал Сыворотка крови
Антитела класса IgM к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет определение IgM, как показателя активности процесса, что может свидетельствовать об остро текущем заболевании, реинфекции, суперинфекции или реактивации.
Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет определение IgM, как показателя активности процесса, что может свидетельствовать об остро текущем заболевании, реинфекции, суперинфекции или реактивации. Появление анти-CMV IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции. При эндогенной реактивации инфекции IgM-антитела образуются нерегулярно (обычно в довольно низких концентрациях) или могут вообще отсутствовать. Выявление иммуноглобулинов класса G также позволяет определить первичную цитомегаловирусную инфекцию (ЦМВИ), проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и помогать при ретроспективной диагностике. При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция — это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т.
Появление анти-CMV IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции. При эндогенной реактивации инфекции IgM-антитела образуются нерегулярно (обычно в довольно низких концентрациях) или могут вообще отсутствовать. Выявление иммуноглобулинов класса G также позволяет определить первичную цитомегаловирусную инфекцию (ЦМВИ), проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и помогать при ретроспективной диагностике. При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция — это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т. п.).
Цитомегаловирус — вирус семейства герпес-вирусов. Так же как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5 — 6 лет, взрослые 16 — 30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путем от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов.
ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра.
п.).
Цитомегаловирус — вирус семейства герпес-вирусов. Так же как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5 — 6 лет, взрослые 16 — 30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путем от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов.
ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
 Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определенный орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т. д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определенный орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т. д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.На сегодняшний момент вакцина против цитомегаловируса не разработана. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма. Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Но если своевременно, при малейшем подозрении на инфицирование этим вирусом, обратиться к врачу, произвести необходимые анализы, то можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребенка. Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет у следующих категорий обследуемых:
| Категория | Причины |
| Женщины, при подготовке к беременности | 1. Латентное течение заболевания
2. Сложность дифференциальной
диагностики первичного инфицирования
и рецидива инфекции при обследовании
во время беременности
3. Тяжёлые последствия внутриутробной
инфекции у новорожденных. Латентное течение заболевания
2. Сложность дифференциальной
диагностики первичного инфицирования
и рецидива инфекции при обследовании
во время беременности
3. Тяжёлые последствия внутриутробной
инфекции у новорожденных. |
| Беременные женщины | Тяжёлые последствия внутриутробной инфекции у новорожденных |
| Иммунодефицитные состояния | Генерализованные формы |
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врожденное заражение (постоянный уровень) от неонатального (нарастание титров). Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растет, следует рассмотреть вопрос об аборте. ВАЖНО! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребенка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
ВАЖНО! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребенка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Медицинский центр «Консультант» — Серологические исследования
Данные инфекции считаются потенциально опасными для развития ребенка. Проконсультироваться с врачом и пройти лабораторное обследование на TORCH –инфекции женщине необходимо за 2-3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Герпетическая инфекция
Инфекцию, вызываемую ВПГ 1 и 2 типа, называют герпесом. ВПГ-1 обычно поражает верхнюю половину туловища (слизистые оболочки рта, слизисто-кожные соединения лица, глаза), ВПГ- 2 большей частью поражает нижнюю половину туловища — половые органы, анальную область, ягодицы, бедра. Заражение ВПГ-1 типа обычно происходит при контакте со слюной больного, а ВПГ – 2 типа – обычно половым путем. Но каждый вирус потенциально может поражать как один, так и оба указанных участка тела.
Герпес – одна из наиболее распространенных инфекций человека(65-90% населения), из двух типов ВПГ — чаще встречается ВПГ 1 типа. После выздоровления больного от первичной инфекции вирус не удаляется полностью из организма, а остается в латентном (дремлющем) состоянии в нейронах тройничного или крестцовых ганглиев. Время от времени вирус реактивируется и вызывает рецидивы инфекции. Клинические проявления более выражены при первичной инфекции, чем при рецидивах. Активность клинических проявлений напрямую связана с состоянием иммунной системы.
Активность клинических проявлений напрямую связана с состоянием иммунной системы.
В лаборатории ООО «Консультант Фарм» проводятся исследования на определение следующих маркеров герпетической инфекции:
- anti HSV-1,2 IgM – антитела класса М к вирусу простого герпеса 1 и 2 типа. Маркер первичного инфицирования вирусом простого герпеса. Тест качественный.
- anti HSV-1 IgG – антитела класса G к вирусу герпеса 1 типа – типоспецифический серологический маркер контакта с вирусом герпеса 1 типа. Тест качественный.
- anti HSV-2 IgG – антитела класса G к вирусу герпеса 2 типа – типоспецифический серологический маркер контакта с вирусом герпеса 2 типа. Тест качественный.
Цитомегаловирусная инфекция
Это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний, а также у лиц с врождёнными или приобретёнными иммунодефицитами. Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. ЦМВ – инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно.
Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. ЦМВ – инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно.
В ответ на внедрение в организм цитомегаловируса образуются специфические антитела классов IgM, IgG к ЦМВ, которые отвечают за лизис внутриклеточного вируса, блокируют его внутриклеточное размножение и распространение от клетки к клетке.
В лаборатории ООО «Консультант Фарм» проводятся исследования на определение
- anti ЦМВ — IgM – антитела класса М к ЦМВ. Маркер первичного инфицирования. Тест качественный.
- anti ЦМВ — IgG – антитела класса G к ЦМВ –серологический маркер контакта с ЦМВ.
 Тест качественный.
Тест качественный.
Краснуха
Краснуха — острое вирусное инфекционное заболевание, которое может протекать в типичной, стёртой и асимптомной формах. Передача инфекции происходит воздушно-капельным путём и трансплацентарно (от матери к плоду). Болеют в основном дети 1 — 7 лет. При инфицировании беременной женщины возникают тяжёлые пороки развития или самопроизвольное прерывание беременности. В ответ на внедрение вируса краснухи образуются специфические антитела классов IgM, IgG.
В лаборатории ООО «Консультант Фарм» проводятся исследование на:
- антитела класса M к вирусу краснухи. Определение IgM антител к вирусу краснухи используют в целях диагностики первичной инфекции вирусом краснухи (Rubella). Они могут быть обнаружены уже через 1-3 дня после появления клинических симптомов, и в большинстве случаев их концентрация быстро снижается за 6-8 недель от начала заболевания. Присутствие IgM антител к вирусу краснухи указывает на недавнюю инфекцию.
 Лабораторная диагностика этой инфекции у беременных женщин предпринимается для оценки риска инфицирования плода. Определение IgM важно также для диагностики врожденной краснухи у новорожденных детей. Тест на определение IgM к краснухе – качественный.
Лабораторная диагностика этой инфекции у беременных женщин предпринимается для оценки риска инфицирования плода. Определение IgM важно также для диагностики врожденной краснухи у новорожденных детей. Тест на определение IgM к краснухе – качественный. - антитела класса G к вирусу краснухи — индикатор наличия иммунитета к вирусу краснухи. Антитела класса G к вирусу краснухи начинают вырабатываться через 3-4 недели с момента инфицирования и выявляются после окончания острого заболевания пожизненно, обеспечивая защиту от повторной инфекции. Выявление anti – Rubella- Ig G в концентрации менее 10 Ед/мл говорит об их недостаточном уровне для предохранения от клинических проявлений заболевания. Уровень anti – Rubella- Ig G более 10 Ед/мл рекомендован как показатель наличия иммунитета к данному вирусу. Тест на определение Ig G к краснухе – количественный. Результаты выдаются в виде концентрации Ig G в МЕ в интервале от 0 до 200 МЕ.
Токсоплазмоз
Возбудитель токсоплазмоза токсоплазма ( Toxoplasma gondii) — относится к простейшим. Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Жизненный цикл возбудителя проходит внутри клеток организма-хозяина. Окончательный хозяин паразита — заражённые кошки и прочие представители семейства кошачьих выделяют с испражнениями особую форму токсоплазм — ооцисты. Ооцисты устойчивы во внешней среде. Попавшие в организм промежуточного хозяина (грызуны, птицы, скот, человек) ооцисты продолжают жизненный цикл, в мышечной и других тканях организма, где образуются псевдо- и истинные цисты.
Инфицирование возможно:
- при употреблении в пищу не обработанных термически мясопродуктов, дегустации сырого фарша;
- при употреблении плохо промытых овощей и несоблюдении санитарно-гигиенических норм при контактах с домашними животными;
- от матери к плоду, в случае инфицирования женщины во время данной беременности.
Передача возбудителя от человека к человеку исключена!
При инфицировании беременной в первом триместре, возможно самопроизвольное прерывание беременности; вероятность инфицирования плода составляет не более 15%. В случае заражения в третьем триместре беременности, вероятность инфицирования плода повышается до 65%.
В случае заражения в третьем триместре беременности, вероятность инфицирования плода повышается до 65%.
У лиц с нормальным иммунитетом токсоплазмоз обычно протекает без клинических проявлений. При подавлении иммунитета заболевание может проявиться в острой, подострой или хронической формах.
В лаборатории ООО «Консультант Фарм» определяются:
- антитела класса М к токсоплазме (Анти-Toxo-IgM) — появляются в течение 2 недель после инфицирования и могут сохраняться до года и более. Их присутствие не является, строгим показателем острой инфекции. Но обнаружение у ранее серонегативных (то есть не имевших антител к Toxoplasma gondii) женщин при беременности анти-Toxo-IgM антител указывает на свежую инфекцию, которая может приводить к врождённому токсоплазмозу. Тест на антитела класса М к токсоплазме качественный.
- антитела класса G к токсоплазме (Анти-Toxo-IgG)- вырабатываются на антиген токсоплазмы при острой, подострой, хронической и латентной формах токсоплазмоза по истечении 3 — 4 недель с момента инфицирования.
 Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование. Тест на антитела класса G к токсоплазме – количественный. Результат выдается в виде концентрации Ig G в МЕ в интервале от 0 до 200 МЕ.
Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование. Тест на антитела класса G к токсоплазме – количественный. Результат выдается в виде концентрации Ig G в МЕ в интервале от 0 до 200 МЕ.
Врожденная цитомегаловирусная инфекция: подходы к терапии uMEDp
В настоящее время проблема диагностики и лечения цитомегаловирусной инфекции (ЦМВИ) крайне актуальна в силу широкого спектра клинических проявлений и осложнений, многообразия способов передачи, роста частоты перинатальной инфекции. В рамках IX ежегодного Всероссийского конгресса по инфекционным болезням с международным участием (Москва, 27 марта 2017 г.) состоялся симпозиум «Актуальные вирусные инфекции различных возрастных периодов». На симпозиуме выступила д.м.н., профессор кафедры факультетской педиатрии с пропедевтикой детских болезней Ярославской государственной медицинской академии Елена Павловна СИТНИКОВА с докладом об особенностях течения, методах диагностики и лечения ЦMВИ. Она отметила необходимость комплексного подхода к лечению ЦМВИ с применением препаратов интерферона альфа-2b, обладающих прежде всего антивирусной и иммуномодулирующей активностью и отвечающих современному пониманию проблемы в возрастном аспекте.
Она отметила необходимость комплексного подхода к лечению ЦМВИ с применением препаратов интерферона альфа-2b, обладающих прежде всего антивирусной и иммуномодулирующей активностью и отвечающих современному пониманию проблемы в возрастном аспекте.
Е.П. Ситникова
Клетки, пораженные цитомегаловирусом (ЦМВ) и впервые описанные в 1882 г. немецким патологоанатомом Н. Ribbert, были выявлены в эпителии околоушных слюнных желез и мочевых канальцев, имели гигантские размеры и своеобразные внутриядерные включения. Впоследствии такие клетки были обнаружены в легких, печени, почках и других органах мертворожденных детей с цитомегаловирусной инфекцией (ЦМВИ).
В 1921 г. E. Goodpasture и F. Talbot предложили назвать болезнь детской цитомегалией, подчеркнув специфичность гигантоклеточного метаморфоза пораженных клеток. Вирус был выделен в 1956 г. М. Smith.
Цитомегаловирусная инфекция – общее инфекционное заболевание, вызываемое герпесвирусом человека 5-го типа (семейство Herpesviridae, подсемейство Beta—herpesviridae) и характеризующееся многообразием форм – от бессимптомных до генерализованных. Морфологически проявляется образованием в слюнных железах, висцеральных органах и центральной нервной системе цитомегалов – гигантских клеток с типичными внутриядерными и цитоплазматическими включениями. Возбудитель (Cytomegalovirus hominis) относится к медленно размножающимся цитолитическим вирусам, вызывающим цитомегалию клеток и латентную инфекцию в слюнных железах и почках. Вирион содержит дезоксирибонуклеиновую кислоту (ДНК), имеет размер 150–300 нм. Вирус состоит из капсида, вирусной оболочки и слабо характеризованной области под названием tegument.
Морфологически проявляется образованием в слюнных железах, висцеральных органах и центральной нервной системе цитомегалов – гигантских клеток с типичными внутриядерными и цитоплазматическими включениями. Возбудитель (Cytomegalovirus hominis) относится к медленно размножающимся цитолитическим вирусам, вызывающим цитомегалию клеток и латентную инфекцию в слюнных железах и почках. Вирион содержит дезоксирибонуклеиновую кислоту (ДНК), имеет размер 150–300 нм. Вирус состоит из капсида, вирусной оболочки и слабо характеризованной области под названием tegument.
Вирусный геном представлен двойной молекулой ДНК и несет генетическую информацию о синтезе 100 вирусных протеинов. Капсид, окружающий вирусный геном, состоит из 162 капсомеров – нефосфорилированных протеинов. Область между вирусным геномом и оболочкой (tegument) представлена 20 белками, многие из которых фосфорилированы. Главный фосфорилированный белок pp UL83 (pp65) составляет 95% tegument и вместе с главным структурным белком pp UL32 (pp150) имеет значение в диагностике ЦМВИ.
Вирус цитомегалии обладает строгой видовой специфичностью, термолабилен, инактивируется при температуре 56 °С, но сохраняется при комнатной температуре, быстро теряет инфекционность при замораживании. Оптимальные условия его жизнедеятельности в биологических объектах – рН 7,2–8,0, температура 4 °С. Вирус характеризуется слабым интерфероногенным действием, нечувствителен к антибиотикам.
На сегодняшний день известно шесть штаммов ЦМВИ (Davis, AD 169, Kerr, C-87, Esp, Towne). Не исключена возможность возникновения суперинфекции. Как и все остальные герпесвирусы, ЦМВ после внедрения в организм способен переходить в латентное состояние, которое периодически сменяется реактивацией с возможностью выделения вируса из организма с любыми биологическими жидкостями. Пребывание в детских учреждениях, школах способствует распространению ЦМВИ среди детей разного возраста. При этом инкубационный период при заражении ЦМВ составляет от 15 дней до трех месяцев.
По эпидемиологическим данным, ЦМВИ заболевают на всех континентах, во всех социально-экономических группах. В США процент инфицированных варьируется в пределах 50–80% взрослого населения. Доля сероположительных лиц зависит от возраста: в возрасте от шести лет инфицировано 58,9% индивидов, старше 80 лет – 90,8%1.
Основными группами риска по ЦМВИ являются беременные, новорожденные, особенно недоношенные, дети с иммунодефицитными состояниями, ВИЧ-инфицированные, внутривенные наркопотребители, реципиенты гемотрансфузий и трансплантатов, лица пожилого возраста, пациенты, принимающие лекарственные препараты (антибиотики, химиопрепараты, гормоны, рентгенотерапию и др.). Кроме того, к группе риска относится медицинский персонал родильных домов, отделений интенсивной терапии, перинатальных центров.
ЦМВ обнаруживается в различных биологических жидкостях инфицированного человека: грудном молоке, слезной жидкости, носоглоточной слизи, крови, слюне, моче, ликворе, сперме, цервикальном и вагинальном секрете, фекалиях.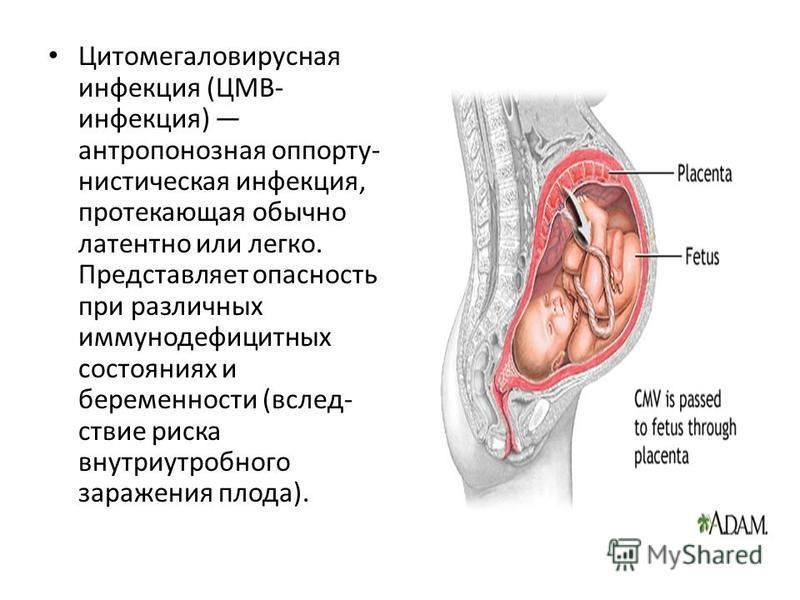
Известно несколько путей заражения ЦМВИ: трансплацентарный, интранатальный, контактный, воздушно-капельный, фекально-оральный, контаминационный и половой.
Цитомегалия относится к персистирующим инфекциям, что дает основание рассматривать ее как одну из форм взаимодействия микро- и макроорганизма на клеточном уровне, позволяющих вирусу длительное время находиться в организме человека. Персистенцию рассматривают как разновидность облигатного внутриклеточного паразитизма вирусов в лейкоцитах, системе мононуклеарных фагоцитов, эндотелии сосудов, лимфоидных и других органах.
Основными путями внутриутробного инфицирования ЦМВИ являются гематогенный (трансплацентарный), восходящий и нисходящий. При внутриутробном инфицировании плода, как правило, имеет место трансплацентарный путь передачи ЦМВИ. Находящийся в материнской крови вирус проникает через плаценту к плоду по пупочной вене. Инфицирование возможно и при повреждении плаценты. Плод может инфицироваться от матери с латентной или острой формой ЦМВИ. Для трансплацентарной передачи ЦМВИ решающую роль играют длительная и выраженная вирусемия и синдром плацентарной недостаточности. Вероятность инфицирования плода при латентном течении процесса практически отсутствует, при реактивации и хроническом персистирующем течении она составляет 0,5–0,7%, при первичном инфицировании – 40–50%.
Плод может инфицироваться от матери с латентной или острой формой ЦМВИ. Для трансплацентарной передачи ЦМВИ решающую роль играют длительная и выраженная вирусемия и синдром плацентарной недостаточности. Вероятность инфицирования плода при латентном течении процесса практически отсутствует, при реактивации и хроническом персистирующем течении она составляет 0,5–0,7%, при первичном инфицировании – 40–50%.
При восходящем (трансцервикальном) пути заражение происходит при наличии вируса в цервикальном и вагинальном секретах, а также через инфицированные околоплодные воды, которые заглатывает плод. Нисходящий (трансовариальный) путь внутриутробного заражения ЦМВИ характеризуется проникновением вируса из брюшной полости по маточным трубам. Нисходящий путь развития внутриутробной инфекции возможен только у женщин с очагами хронического воспаления в яичниках и маточных трубах.
ЦМВИ отличается от большинства внутриутробных инфекций тем, что плод чувствителен к ней на всех этапах развития. В зависимости от срока гестации, на котором произошло инфицирование ЦМВ, различают инфекционные бластопатии, эмбрио- и фетопатии.
В зависимости от срока гестации, на котором произошло инфицирование ЦМВ, различают инфекционные бластопатии, эмбрио- и фетопатии.
Интранатально заражается до 5–7% новорожденных как путем непосредственного контакта с инфицированными тканями родового канала, так и при аспирации околоплодных вод, содержащих ЦМВ.
В постнатальном периоде новорожденный заражается в 30% случаев от выделений матери, содержащих вирус: слюны, мочи, выделений из гениталий, грудного молока, крови. Риск инфицирования новорожденного возникает во время родов или сразу после рождения от медицинского персонала в случае вирусоносительства, а также при переливании компонентов крови2.
Характер поражения плода и новорожденного зависит от сроков инфицирования и отличается многообразием проявлений – от серьезных дефектов развития, генерализованных форм до бессимптомного течения.
Врожденная ЦМВИ манифестирует в течение первых двух-трех недель жизни ребенка. При появлении симптомов болезни после третьей недели жизни можно говорить о постнатальном инфицировании.
При появлении симптомов болезни после третьей недели жизни можно говорить о постнатальном инфицировании.
ЦМВИ относится к группе TORCH-инфекций и чревата серьезными последствиями у новорожденных. Клиническая картина острой формы врожденной ЦМВИ характеризуется наиболее тяжелым течением с признаками гипотрофии второй-третьей степени, длительной желтухой, пневмонией, сиалоаденитом, панкреатитом, поражением почек, микроцефалией, хориоретинитом, петехиями. Нередко наблюдаются тромбоцитопения, прогрессирующая анемия.
У детей, перенесших острую форму заболевания, отмечается волнообразное течение хронической формы ЦМВИ. Часто формируются кальцификаты в головном мозге, имеют место микро- или гидроцефалия, нейросенсорная глухота, церебральный паралич, задержка психомоторного и речевого развития, поражение глаз (атрофия зрительного нерва, катаракта), хронический гепатит, панкреатит, пневмофиброз.
Лабораторная диагностика ЦМВИ основана на выявлении в исследуемых пробах клеток, пораженных цитомегаловирусом, самого вируса и его ДНК, антигенов, а также специфических антител к вирусу.
В настоящее время основными методами лабораторной диагностики ЦМВИ являются цитологический, вирусологический, молекулярно-генетический (полимеразная цепная реакция – ПЦР), иммуноферментный анализ, реакция иммунофлуоресценции.
Характерный патоморфологический признак ЦМВИ – цитомегалические клетки, выявляемые в тканях, слюне, мокроте, осадке мочи и цереброспинальной жидкости. При исследовании в световом микроскопе клетки в слюнных железах имеют вид совиного глаза. В ядре цитомегалических клеток формируется плотное внутриядерное включение, отделенное от оболочки ядра светлой оптически пустой зоной. Эти клетки настолько специфичны, что при их обнаружении не требуется вирусологического подтверждения диагноза ЦМВИ.
Диагностическими критериями острой врожденной ЦМВИ служат клинические проявления, развившиеся в первые три месяца жизни ребенка, обнаружение антигена вируса в моче, крови, наличие иммуноглобулинов М и G в крови, низкоавидных антител (индекс авидности до 30%) и определение ДНК или антигена вируса в лейкоцитах крови.
Цели лечения при ЦМВИ – устранение симптомов острой формы заболевания и удержание вируса в пассивном, неактивном состоянии. В остром периоде ЦМВИ применяют этиотропную и посиндромную терапию. Этиотропная терапия предполагает применение противовирусных препаратов (виростатиков), специфического гипериммунного антицитомегаловирусного иммуноглобулина (Цитотект/Неоцитотект) и интерферонов.
К этиотропной терапии прибегают только в фазе репликации вируса, при наличии клинических симптомов и выявлении специфических низкоавидных иммуноглобулинов G и/или иммуноглобулинов М.
При тяжелой генерализованной форме ЦМВИ используют виростатические препараты – ганцикловир, фоскарнет. Применение ганцикловира имеет возрастные ограничения: детям препарат назначают, если польза от лечения превышает существенный риск.
Особое место в лечении детей с ЦМВИ занимают интерфероны. Противовирусный эффект – одно из основных свойств интерферонов.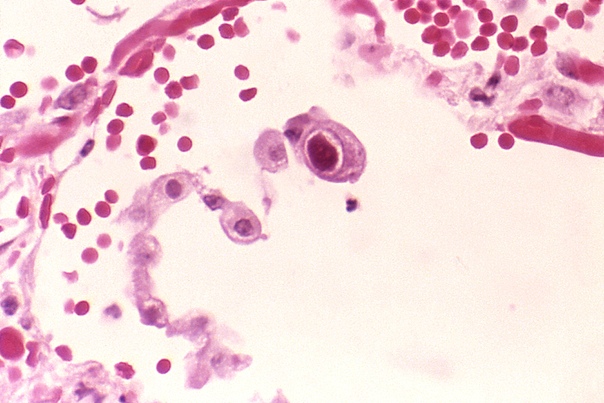 В невысоких терапевтических дозах они являются модуляторами иммунитета, что позволяет отнести их к семейству регуляторных цитокинов.
В невысоких терапевтических дозах они являются модуляторами иммунитета, что позволяет отнести их к семейству регуляторных цитокинов.
Введение экзогенного интерферона обеспечивает элиминацию инфекционного агента задолго до того, как собственные клетки начинают синтезировать интерферон в необходимом количестве. Поступление интерферона помогает разгрузить пораженные клетки и компенсировать недостаток в продукции собственного интерферона в достаточном количестве. При лечении внутриутробной ЦМВИ экзогенный интерферон жизненно необходим в связи с возрастными различиями свойств интерферона у новорожденных, который не обладает противовирусным эффектом и направлен в первую очередь на пролиферацию, а не на борьбу с вирусами. Это показано в фундаментальных работах по изучению системы интерферона в России и за рубежом3. Ускоренная элиминация инфекционного агента при введении экзогенного интерферона сокращает сроки инфекционного процесса.
У детей с рождения можно использовать интерферон альфа-2b Виферон® (ООО «Ферон»), полученный методом генной инженерии. Препарат обладает противовирусным, антипролиферативным и иммуномодулирующим эффектами.
Препарат обладает противовирусным, антипролиферативным и иммуномодулирующим эффектами.
Научными сотрудниками Ярославской государственной медицинской академии в 2016 г. был запатентован способ лечения генерализованной ЦМВИ у детей раннего возраста. Предложена комбинированная схема противовирусного лечения. При вирусной нагрузке 105 коп/мл и более применяется ганцикловир (Цимевен) в дозе 5–7,5 мл/кг в течение 14–21 дня. Препарат отменяют при достижении положительной динамики и снижении вирусной нагрузки в крови до 104–103 коп/мл. Далее лечение продолжают препаратом ВИФЕРОН® (150 000 МЕ) по схеме: один суппозиторий два раза в сутки в течение десяти дней, затем – по одному суппозиторию три раза в неделю (понедельник, среда, пятница).
Данную схему применяли в клиническом исследовании: 48 детей с ЦМВИ получали ганцикловир (Цимевен) под контролем количества вируса в сыворотке крови на 14-й и 21-й дни от начала лечения. Далее в течение 3–6 месяцев ежемесячно контролировали вирусную нагрузку методом ПЦР. Группа из 22 детей перешла на Виферон®. При достижении полной элиминации вируса из крови (отрицательной ПЦР) лечение препаратом Виферон® завершали. Результаты наблюдения показали, что рецидив ЦМВИ не зафиксирован ни у одного ребенка, получавшего комбинированную терапию. В группе из 26 детей, не принимавших Виферон®, вирусная нагрузка оставалась на прежнем уровне (11 пациентов) или увеличивалась на 101–2 коп/мл (15 пациентов), что свидетельствовало о репликации вируса и продолжении инфекционного процесса. Исследователи сделали вывод, что внедрение новой схемы терапии ЦМВИ у детей может приводить к успешной эрадикации инфекции.
Далее в течение 3–6 месяцев ежемесячно контролировали вирусную нагрузку методом ПЦР. Группа из 22 детей перешла на Виферон®. При достижении полной элиминации вируса из крови (отрицательной ПЦР) лечение препаратом Виферон® завершали. Результаты наблюдения показали, что рецидив ЦМВИ не зафиксирован ни у одного ребенка, получавшего комбинированную терапию. В группе из 26 детей, не принимавших Виферон®, вирусная нагрузка оставалась на прежнем уровне (11 пациентов) или увеличивалась на 101–2 коп/мл (15 пациентов), что свидетельствовало о репликации вируса и продолжении инфекционного процесса. Исследователи сделали вывод, что внедрение новой схемы терапии ЦМВИ у детей может приводить к успешной эрадикации инфекции.
Таким образом, ЦМВИ остается актуальной проблемой в педиатрической практике. Эффективный подход к противовирусной терапии ЦМВИ должен включать комбинацию препаратов различных групп разнонаправленного действия.
Anti-CMV-IgM (Антитела класса IgM к цитомегаловирусу, ЦМВ, CMV)
Исследуемый материал Сыворотка крови
Метод определения
Иммуноферментный анализ (ИФА).
Антитела класса IgM к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. Сыворотки пациентов после первичной инфекции содержат антитела, реагирующие с внутренними протеинами ЦМВ (р28, р65, р150). В сыворотке выздоровевших людей содержатся в основном антитела, реагирующие с гликопротеинами оболочки.
Наибольшее диагностическое значение имеет определение IgM, как показателя активности процесса, что может свидетельствовать об остро текущем заболевании, реинфекции, суперинфекции или реактивации. Появление анти-CMV IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции. При эндогенной реактивации инфекции IgM-антитела образуются нерегулярно (обычно в довольно низких концентрациях) или могут вообще отсутствовать. Выявление иммуноглобулинов класса G также позволяет определить первичную цитомегаловирусную инфекцию (ЦМВИ), проводить наблюдение в динамике за лицами с клиническими проявлениями инфекции и помогать при ретроспективной диагностике. При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
При тяжелой ЦМВИ, а также у беременных и детей раннего возраста выработка антител к ЦМВ замедлена. Это проявляется обнаружением специфических антител в низкой концентрации или отсутствием положительной динамики антител.
Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция — это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т. п.).
Цитомегаловирус — вирус семейства герпес-вирусов. Так же как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5 — 6 лет, взрослые 16 — 30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путем от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов.
Дети восприимчивы к передаче инфекции воздушно-капельным путем от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов.
ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.

На сегодняшний момент вакцина против цитомегаловируса не разработана. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма.
Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Но если своевременно, при малейшем подозрении на инфицирование этим вирусом, обратиться к врачу, произвести необходимые анализы, то можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребенка.
Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет у следующих категорий обследуемых:
| Категория | Причины |
|
Женщины,
| 1. Латентное течение заболевания Латентное течение заболевания
2. Сложность дифференциальной диагностики первичного инфицирования и рецидива инфекции при обследовании во время беременности 3. Тяжёлые последствия внутриутробной инфекции у новорожденных. |
| Беременные женщины | Тяжёлые последствия внутриутробной
инфекции у новорожденных |
| Иммунодефицитные состояния | Генерализованные формы |
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врожденное заражение (постоянный уровень) от неонатального (нарастание титров). Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растет, следует рассмотреть вопрос об аборте.
ВАЖНО! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребенка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Anti-CMV-IgG (Антитела класса IgG к цитомегаловирусу, ЦМВ, CMV)
Исследуемый материал Сыворотка крови
Метод определения
Иммуноферментный анализ (ИФА).
Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ).
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию.
Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция — это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т.п.).
Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т.п.).
Цитомегаловирус — вирус семейства герпес-вирусов. Так же как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5 — 6 лет, взрослые 16 — 30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов.
ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
При первичном инфицировании беременной цитомегаловирусом (в 35 — 50% случаев) или реактивации инфекции в период беременности (в 8 — 10% случаев) развивается внутриутробная инфекция. При развитии внутриутробной инфекции на сроке до 10 недель есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11 — 28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определённый орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т. д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
При инфицировании на 11 — 28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определённый орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т. д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
На сегодняшний момент вакцина против цитомегаловируса не разработана. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма.
Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Но если своевременно, при малейшем подозрении на инфицирование этим вирусом, обратиться к врачу, произвести необходимые анализы, то можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребёнка.
Это обеспечит нормальное вынашивание беременности и роды здорового ребёнка.
Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет у следующих категорий обследуемых:
| Категория | Причины |
Женщины, при подготовке к беременности | 1. Латентное течение заболевания
2. Сложность дифференциальной диагностики первичного инфицирования и рецидива инфекции при обследовании во время беременности 3. Тяжёлые последствия внутриутробной инфекции у новорожденных |
| Беременные женщины | Тяжёлые последствия внутриутробной
инфекции у новорожденных |
| Иммунодефицитные состояния | Генерализованные формы |
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врождённое заражение (постоянный уровень) от неонатального (нарастание титров).
 Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растёт, следует рассмотреть вопрос об аборте.
Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растёт, следует рассмотреть вопрос об аборте.Важно! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Anti-CMV Ig M кач.
Антитела класса IgM к цитомегаловирусу (ЦМВ, CMV).
Цитомегаловирусная инфекция (ЦМВИ) – повсеместно распространенное вирусное заболевание с преимущественно латентным течением у взрослых и широким спектром клинико-патогенетических проявлений, характеризуется тансплацентарной передачей и внутриутробным поражением плода. ЦМВИ относится к оппортунистическим инфекциям, клинические проявления которых становятся возможными только в условиях первичного или вторичного иммунодефицитного состояния (ВИЧ инфекция, трансплантация, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет), а также при физиологическом иммунодефиците (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре).
ЦМВИ относится к оппортунистическим инфекциям, клинические проявления которых становятся возможными только в условиях первичного или вторичного иммунодефицитного состояния (ВИЧ инфекция, трансплантация, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет), а также при физиологическом иммунодефиците (дети первых 3 — 5 лет жизни, беременные — чаще во 2 и 3 триместре).
Возбудитель инфекции – цитомегаловирус (ЦМВ), относится к семейству герпесвирусов наряду с вирусом простого герпеса Iи IIтипов, вирусом опоясывающего лишая и вирусом Эпштейна-Барр. Общей их чертой является прежде всего способность персистировать в организме человека неопределенно долго с нерегулярной продукцией вирусных частиц и обострением хронической инфекции. Группу риска составляют дети 5 — 6 лет, взрослые 16 — 30 лет. Дети восприимчивы к передаче инфекции воздушно-капельным путем от родителей и других детей с латентными формами инфекции. У взрослых возможен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. Цитомегаловирусом можно заразиться через различные биологические жидкости: слюну, мочу, сперму, кровь.
Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. Цитомегаловирусом можно заразиться через различные биологические жидкости: слюну, мочу, сперму, кровь.
Инкубационный период колеблется от 15 дней до 3 месяцев. ЦМВИ характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра. Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта. При снижении иммунитета ЦМВИ представляет серьезную угрозу, так как заболевание может затрагивать любой орган, возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
Заболевание может заканчиваться летально.
При первичной инфекции у беременной женщины вирус может проникнуть и в организм ребенка. Примерно в 10 % случаев развивается внутриутробная инфекция. При развитии внутриутробной инфекции на сроке до 10 недель беременности есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11 — 28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определенный орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса.
ЦМВ-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях — Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребенка. В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры.
В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2 — 3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры.
В ответ на внедрение в организм ЦМВ развивается иммунная перестройка организма. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Специфические антитела отвечают за лизис внутриклеточного вируса, а также ингибируют его внутриклеточную репликацию или распространение от клетки к клетке. При первичном инфицировании сначала повышается уровень иммуноглобулинов M, а затем IgG. Активация синтеза ЦМВ Ig M наблюдается обычно с 1 по 6 неделю после инфицирования. Через 3-4 месяца IgM исчезают, но период циркуляции IgM антител может значительно варьировать в зависимости от инфекционного возбудителя и индивидуальных особенностей иммунного ответа организма. Следовые количества IgM-антител к ЦМВ в некоторых случаях выявляют в течение 1-2 и более лет. При обострении ЦМВИ возможно незначительное и кратковременное увеличение уровня IgM (в 30 % случаев), в то время как уровень IgGво время реактивации инфекции более значительный.
Активация синтеза ЦМВ Ig M наблюдается обычно с 1 по 6 неделю после инфицирования. Через 3-4 месяца IgM исчезают, но период циркуляции IgM антител может значительно варьировать в зависимости от инфекционного возбудителя и индивидуальных особенностей иммунного ответа организма. Следовые количества IgM-антител к ЦМВ в некоторых случаях выявляют в течение 1-2 и более лет. При обострении ЦМВИ возможно незначительное и кратковременное увеличение уровня IgM (в 30 % случаев), в то время как уровень IgGво время реактивации инфекции более значительный.
Таким образом, IgM выявляются: при первичной инфекции (в этом случае уровень IgM наиболее высокий), при обострении болезни (а также при реинфекции, т. е. заражении новой формой вируса). Появление анти-ЦМВ IgM антител у ранее серонегативного пациента свидетельствует о первичной инфекции.
Кровь рекомендуется сдавать не ранее чем через 4 часа после последнего приема пищи (воду пить можно).
Материал для исследования: сыворотка крови.
Интерпретация результатов содержит аналитическую информацию для лечащего врача. Лабораторные данные входят в комплекс всестороннего обследования пациента, проводимого врачом и не могут быть использованы для самодиагностики и самолечения.
Тест Anti-CMVIgMявляется качественным. При отсутствии IgMвыдается ответ — «отрицательно». В случае обнаружения Anti-CMVIgM выдается ответ «положительно». При очень низких значениях («серая зона») выдается ответ «сомнительно» и рекомендация повторить исследование через 10 — 14 дней. Следует учитывать, что такой результат возможен при очень низком уровне антител, который может иметь место в начальный период заболевания. В зависимости от клинической ситуации может быть полезным повторное исследование уровня антител через 10-14 дней для оценки динамики.
Ревматоидный фактор в крови способствует ложноположительному результату.
Отрицательный результат:
§ в данный момент нет текущей ЦМВ-инфекции. Если заражение произошло недавно (несколько дней назад), то антитела IgM еще не успели появиться в крови;
Если заражение произошло недавно (несколько дней назад), то антитела IgM еще не успели появиться в крови;
§ инфицирование ЦМВ произошло более 3 — 4 месяцев назад;
§ внутриутробная инфекция маловероятна.
Положительный результат:
§ первичная ЦМВ — инфекция;
§ реактивация инфекции;
§ внутриутробная инфекция возможна.
Внутриутробная цитомегаловирусная инфекция: возможный риск церебрального паралича и связанные с его клиническими особенностями, результаты нейровизуализации: ретроспективное исследование | BMC Pediatrics
Айсен М.Л., Керкович Д., Маст Дж., Малрой С., Рен Т.А., Кей Р.М., Ретлефсен С.А. Детский церебральный паралич: клиническая помощь и неврологическая реабилитация [J]. Lancet Neurol. 2011; 10 (9): 844–52.
PubMed Статья PubMed Central Google ученый
Морено-Де-Лука А, Ледбеттер DH, Мартин CL. Генетическое понимание причин и классификации церебрального паралича [J]. Ланцетная неврология. 2012; 11 (3): 283–92.
CAS PubMed PubMed Central Статья Google ученый
Холмстрём Л., Фоллмер Б., Тедрофф К., Ислам М., Перссон Дж. К., Наборы А, Форссберг Х., Элиассон А.С. Функция руки в отношении поражений головного мозга и кортикомоторно-проекционного характера у детей с односторонним церебральным параличом [J].Медицина развития Детская неврология. 2010. 52 (2): 145–52.
PubMed Статья PubMed Central Google ученый
Рид С.М., Дагия С.Д., Дичфилд М.Р., Карлин Дж.Б., Реддихау Д.С. Популяционные исследования паттернов изображений мозга при церебральном параличе [J]. Медицина развития Детская неврология. 2014. 56 (3): 222–32.
Медицина развития Детская неврология. 2014. 56 (3): 222–32.
PubMed Статья PubMed Central Google ученый
Ким J-S, Хан Z-A, Сон DH, Oh H-M, Chung ME. Характеристики дисфагии у детей с церебральным параличом, связанные с крупной двигательной функцией [J]. Американский журнал реабилитации по физической медицине. 2013. 92 (10): 912–9.
PubMed Статья PubMed Central Google ученый
Park ES, Sim EG, Rha D-W. Влияние деформаций верхних конечностей на основные двигательные функции и функции верхних конечностей у детей со спастическим церебральным параличом [J].Res Dev Disabil. 2011. 32 (6): 2389–97.
PubMed Статья PubMed Central Google ученый
Ко Дж, Ким М. Надежность и отзывчивость измерения общей двигательной функции-88 у детей с церебральным параличом [J]. Физиотерапия. 2013; 93 (3): 393–400.
PubMed Статья PubMed Central Google ученый
Ботчер Л. Дети со спастическим церебральным параличом, их когнитивные функции и социальное участие: обзор [J].Child Neuropsychol. 2010. 16 (3): 209–28.
PubMed Статья PubMed Central Google ученый
Christensen D, Van Naarden Braun K, Doernberg NS, Maenner MJ, Arneson CL, Durkin MS, Benedict RE, Kirby RS, Wingate MS, Fitzgerald R. Распространенность церебрального паралича, сопутствующие расстройства аутистического спектра, и двигательное функционирование — Аутизм и возможности развития Мониторинг сети, США, 2008 [J]. Медицина развития Детская неврология.2014; 56 (1): 59–65.
Медицина развития Детская неврология.2014; 56 (1): 59–65.
PubMed Статья PubMed Central Google ученый
Miller JE, Pedersen LH, Streja E, Bech BH, Yeargin-Allsopp M, Van Naarden Braun K, Schendel DE, Christensen D, Uldall P, Olsen J. Материнские инфекции во время беременности и церебральный паралич: популяция Когортное исследование [J]. Педиатр Перинат Эпидемиол. 2013. 27 (6): 542–52.
PubMed PubMed Central Статья Google ученый
Streja E, Miller JE, Bech BH, Greene N, Pedersen LH, Yeargin-Allsopp M, Braun KVN, Schendel DE, Christensen D, Uldall P. Врожденный церебральный паралич и дородовой контакт с материнскими инфекциями, лихорадкой или курением, о которых сообщают сами. [J]. Американский журнал акушерства и гинекологии. 2013; 209 (4): 332. е331-332. e310.
[J]. Американский журнал акушерства и гинекологии. 2013; 209 (4): 332. е331-332. e310.
PubMed Статья PubMed Central Google ученый
Bear JJ, Wu YW. Инфекции матери во время беременности и церебральный паралич у ребенка [J].Pediatr Neurol. 2016; 57: 74–9.
PubMed PubMed Central Статья Google ученый
Смитерс-Шиди Х, Рейнс-Гриноу С., Бадави Н., Фернандес М.А., Кессон А., Макинтайр С., Люнг К.-С., Джонс, Калифорния. Врожденный цитомегаловирус у детей с церебральным параличом [J]. J Pediatr, 2017, 181 (267–71. E261.
Dakovic I, Da Graça Andrada M, Folha T. , Neubauer D, Hollody K, Honold M, Horber V, Duranovic V, Bosnjak VM.Клинические особенности церебрального паралича у детей с симптоматической врожденной цитомегаловирусной инфекцией [J]. европейский журнал детской неврологии. 2014; 18 (5): 618–23.
, Neubauer D, Hollody K, Honold M, Horber V, Duranovic V, Bosnjak VM.Клинические особенности церебрального паралича у детей с симптоматической врожденной цитомегаловирусной инфекцией [J]. европейский журнал детской неврологии. 2014; 18 (5): 618–23.
PubMed Статья PubMed Central Google ученый
Смитерс-Шиди Х., Рейнес-Гриноу С., Бадави Н., Макинтайр С., Джонс, Калифорния, Группа ACPR. В ретроспективном популяционном исследовании [J] врожденный цитомегаловирус ассоциирован с тяжелыми формами церебрального паралича и женским полом.Медицина развития Детская неврология. 2014; 56 (9): 846–52.
PubMed Статья PubMed Central Google ученый
Ахлин К., Химмельманн К., Хагберг Г. , Касеровски М., Кобо Т., Веннерхольм У.Б., Якобссон Б. Неинфекционные факторы риска различных типов церебрального паралича у доношенных детей: популяционный случай –Контрольное исследование [J]. BJOG: Международный журнал акушерской гинекологии. 2013; 120 (6): 724–31.
, Касеровски М., Кобо Т., Веннерхольм У.Б., Якобссон Б. Неинфекционные факторы риска различных типов церебрального паралича у доношенных детей: популяционный случай –Контрольное исследование [J]. BJOG: Международный журнал акушерской гинекологии. 2013; 120 (6): 724–31.
CAS Статья Google ученый
Ахлин К., Химмельманн К., Хагберг Г., Касеровски М., Кобо Т., Веннергольм У. Б., Якобссон Б. Церебральный паралич и перинатальная инфекция у доношенных детей [J]. Акушерство и гинекология. 2013; 122 (1): 41–9.
Артикул Google ученый
Готч Ф., Ромеро Р., Кусанович Дж. П., Мазаки-Тови С., Пинелес Б. Л., Эрез О., Эспиноза Дж., Хассан С.С. Синдром воспалительной реакции плода [J]. Clin Obstet Gynecol. 2007. 50 (3): 652–83.
Clin Obstet Gynecol. 2007. 50 (3): 652–83.
PubMed Статья PubMed Central Google ученый
Гуо Р., Хоу В., Донг И, Ю З., Стайтес Дж., Вайнер С.П. Повреждение мозга, вызванное хронической гипоксемией плода, опосредуется активацией воспалительного каскада [J]. Репродуктивные науки. 2010. 17 (6): 540–8.
CAS PubMed Статья PubMed Central Google ученый
Mallard C, Wang X. Уязвимость перинатального повреждения головного мозга, вызванная инфекцией [J]. Международное неврологическое исследование, 2012, 2012 (.
Zhao J, Chen Y, Xu Y, Pi G.Влияние внутриутробной инфекции на развитие мозга и травмы [J]. Int J Dev Neurosci. 2013. 31 (7): 543–9.
Int J Dev Neurosci. 2013. 31 (7): 543–9.
PubMed Статья PubMed Central Google ученый
Малаеб С., Дамманн О. Воспалительная реакция плода и повреждение головного мозга у недоношенных новорожденных [J]. J Child Neurol. 2009. 24 (9): 1119–26.
PubMed PubMed Central Статья Google ученый
Dammann O, Kuban KC, Leviton A. Перинатальная инфекция, воспалительная реакция плода, повреждение белого вещества и когнитивные ограничения у недоношенных детей [J]. Ment Retard Dev Disabil Res Rev. 2002; 8 (1): 46–50.
PubMed Статья PubMed Central Google ученый
Силберейс Дж. К., Хуанг Э. Дж., Бэк С.А., Рович Д.Х. На пути к улучшенным моделям на животных повреждений белого вещества новорожденных, связанных с церебральным параличом [J]. Модели и механизмы заболеваний.2010. 3 (11–12): 678–88.
Артикул Google ученый
Паннек К., Бойд Р.Н., Фиори С., Гузцетта А., Роуз С.Е. Оценка структурной сети мозга выявляет изменение связности у детей с односторонним церебральным параличом из-за перивентрикулярных поражений белого вещества [J]. 5. Нейроизображение: клиническое; 2014. С. 84–92.
Google ученый
Fleiss B, Gressens P.Третичные механизмы повреждения мозга: новая надежда на лечение церебрального паралича? [J]. Lancet Neurol. 2012. 11 (6): 556–66.
2012. 11 (6): 556–66.
PubMed Статья PubMed Central Google ученый
Штаудт М. Пластичность мозга после травмы головного мозга в раннем возрасте: выводы из нейровизуализации . в Семинары по перинатологии . 2010. Elsevier.
Girard S, Kadhim H, Roy M, Lavoie K, Brochu M-E, Larouche A, Sébire G.Роль перинатального воспаления при церебральном параличе [J]. Pediatr Neurol. 2009. 40 (3): 168–74.
PubMed Статья PubMed Central Google ученый
Юн Б.Х., Пак К.В., Чайворапонгса Т. Внутриутробная инфекция и развитие церебрального паралича [J]. BJOG: Международный журнал акушерской гинекологии. 2003; 110: 124–7.
2003; 110: 124–7.
Артикул Google ученый
Странк Т., Индер Т., Ван X, Бургнер Д., Маллард С., Леви О. Инфекционное воспаление и церебральное повреждение у недоношенных детей [J]. Ланцет инфекционных болезней. 2014. 14 (8): 751–62.
PubMed PubMed Central Статья Google ученый
Видак Х.К., Ивкович Т.С., Йокич М., Спавенти Р., Капитанович С. Связь между провоспалительным полиморфизмом цитокинов и церебральным параличом у очень недоношенных детей [J]. Цитокин.2012. 58 (1): 57–64.
CAS Статья Google ученый
Leviton A, Allred EN, Kuban KC, Hecht JL, Onderdonk AB, O’shea TM, Paneth N. Микробиологические и гистологические характеристики плаценты чрезвычайно недоношенного ребенка позволяют прогнозировать повреждение белого вещества и последующий церебральный паралич. исследование ELGAN [J]. Pediatr Res. 2010; 67 (1): 95.
Микробиологические и гистологические характеристики плаценты чрезвычайно недоношенного ребенка позволяют прогнозировать повреждение белого вещества и последующий церебральный паралич. исследование ELGAN [J]. Pediatr Res. 2010; 67 (1): 95.
PubMed PubMed Central Статья Google ученый
Terlizzi V, Improta F, Di Fraia T, Sanguigno E, D’amico A, Buono S, Raia V, Boccia G. Первичная вирусная инфекция герпеса и ишемический инсульт в детстве: новая ассоциация? [J]. Журнал клинической неврологии. 2014. 21 (9): 1656–8.
PubMed Статья PubMed Central Google ученый
Benoist G, Salomon L, Mohlo M, Suarez B, Jacquemard F, Ville Y. Поражения мозга плода, связанные с цитомегаловирусом: сравнение прицельного ультразвукового исследования и магнитно-резонансной томографии [J]. Ультразвук в акушерской гинекологии: Официальный журнал Международного общества ультразвука в акушерской гинекологии. 2008. 32 (7): 900–5.
Ультразвук в акушерской гинекологии: Официальный журнал Международного общества ультразвука в акушерской гинекологии. 2008. 32 (7): 900–5.
CAS Статья Google ученый
Санкар С., Мундкур Н. Определение, классификация, этиология и ранняя диагностика церебрального паралича [J]. Индийский журнал педиатрии. 2005. 72 (10): 865–8.
PubMed Статья PubMed Central Google ученый
Рассел Диджей, Эйвери Л.М., Розенбаум П.Л., Райна П.С., Уолтер С.Д., Палисано Р.Дж. Улучшенная шкала измерения общей моторной функции у детей с церебральным параличом: доказательства надежности и достоверности [J]. Физиотерапия. 2000. 80 (9): 873–85.
CAS PubMed Статья PubMed Central Google ученый
Bagnato SJ, Neisworth JT. Отслеживание восстановления после ранней черепно-мозговой травмы [J]. Лечебное специальное образование.1986. 7 (5): 31–6.
Артикул Google ученый
Mcintyre S, Taitz D, Keogh J, Goldsmith S, Badawi N, Blair E. Систематический обзор факторов риска церебрального паралича у доношенных детей в развитых странах [J]. Медицина развития Детская неврология. 2013. 55 (6): 499–508.
PubMed Статья PubMed Central Google ученый
Lanzieri TM, Dollard SC, Bialek SR, Grosse SD.Систематический обзор распространенности врожденной цитомегаловирусной инфекции при рождении в развивающихся странах [J]. Международный журнал инфекционных болезней. 2014; 22: 44–8.
2014; 22: 44–8.
PubMed PubMed Central Статья Google ученый
Манара Р., Балао Л., Бараккини С., Дриго П., Д’Элия Р., Руга Е.М. Результаты магнитного резонанса головного мозга при симптоматической врожденной цитомегаловирусной инфекции [J]. Детская радиология. 2011; 41 (8): 962–70.
PubMed Статья PubMed Central Google ученый
Noyola DE, Demmler GJ, Nelson CT, Griesser C, Williamson WD, Atkins JT, Rozelle J, Turcich M, Llorente AM, Sellers-Vinson S. Ранние предикторы исхода нервного развития при симптоматической врожденной цитомегаловирусной инфекции [J ]. J Pediatr. 2001. 138 (3): 325–31.
CAS PubMed Статья PubMed Central Google ученый
Giannattasio A, Bruzzese D, Di Costanzo P, Capone E, Romano A, D’amico A, Bravaccio C, Grande C, Capasso L, Raimondi F. Профили нейровизуализации и исходы нервного развития у младенцев с врожденной цитомегаловирусной инфекцией [J]. Pediatr Infect Dis J. 2018; 37 (10): 1028–33.
PubMed Статья PubMed Central Google ученый
Смилга А.С., Гарфинкль Дж., Нг П, Андерсен Дж., Бакли Д., Фелингс Д., Киртон А., Вуд Е, Ван Ренсбург Е., Шевелл М.Неонатальная инфекция у детей с церебральным параличом: когортное исследование на основе регистра [J]. Pediatr Neurol. 2018; 80: 77–83.
PubMed Статья PubMed Central Google ученый
Рид С.М., Ланиган А, Реддихау Д. С. Постнеонатальный церебральный паралич, Виктория, Австралия, 1970–1999 [J]. J Paediatr Child Health. 2006. 42 (10): 606–11.
С. Постнеонатальный церебральный паралич, Виктория, Австралия, 1970–1999 [J]. J Paediatr Child Health. 2006. 42 (10): 606–11.
PubMed Статья PubMed Central Google ученый
Гретер Дж. К., Нельсон КБ, Уолш Э., Уиллоуби Р. Э., Редлайн Р. Внутриутробное инфицирование и риск церебрального паралича у очень недоношенных детей. Архивы педиатрии и подростковой медицины. 2003. 157 (1): 26–32.
Артикул Google ученый
Becher H, Grau A, Steindorf K, Buggle F, Hacke W. Предыдущая инфекция и другие факторы риска острой цереброваскулярной ишемии: относимые риски и характеристика групп высокого риска [J].J Epidemiol Biostat. 2000. 5 (5): 277–83.
CAS PubMed PubMed Central Google ученый
Макколл Б., Аллан С., Ротвелл Н. Системная инфекция, воспаление и острый ишемический инсульт [J]. Неврология. 2009. 158 (3): 1049–61.
CAS PubMed Статья PubMed Central Google ученый
Ромеро Р., Чайворапонгса Т., Эспиноза Дж. Микронутриенты и внутриутробная инфекция, преждевременные роды и синдром воспалительной реакции плода [J].J Nutr. 2003; 133 (5): 1668S – 1673S.
CAS PubMed Статья PubMed Central Google ученый
Бартлетт Д.Д., Ханна С.Е., Эйвери Л., Стивенсон Р.Д., Галуппи Б. Корреляты снижения общей двигательной способности у подростков с церебральным параличом на уровнях III – V системы классификации общей двигательной функции: предварительное исследование [J] . Медицина развития Детская неврология. 2010; 52 (7): e155–60.
Медицина развития Детская неврология. 2010; 52 (7): e155–60.
PubMed Статья PubMed Central Google ученый
Ханна С.Е., Розенбаум П.Л., Бартлетт Д.Дж., Палисано Р.Дж., Уолтер С.Д., Эйвери Л., Рассел Д. Стабильность и снижение общей двигательной функции у детей и подростков с церебральным параличом в возрасте от 2 до 21 года [J]. Медицина развития Детская неврология. 2009. 51 (4): 295–302.
PubMed Статья PubMed Central Google ученый
Новак И. Доказательная диагностика, медицинское обслуживание и реабилитация детей с церебральным параличом [J].J Child Neurol. 2014. 29 (8): 1141–56.
PubMed Статья PubMed Central Google ученый
Мораис Б.А., Солла DJF, Ямаки В.Н., Феррачолли С.Ф., Алвес КАПФ, Кардал Д.Д., Матушита Х., Тейшейра М.Дж. Аномалии мозга у пациентов с миеломенингоцеле [J]. Childs Nerv Syst. 2020; 36 (7): 1507–13.
PubMed Статья PubMed Central Google ученый
Uematsu M, Haginoya K, Kikuchi A, Hino-Fukuyo N, Ishii K, Shiihara T., Kato M, Kamei A, Kure S. Бессимптомная врожденная цитомегаловирусная инфекция с неврологическими последствиями: ретроспективное исследование с использованием пуповины [J]. Brain Dev. 2016; 38 (9): 819–26.
PubMed Статья PubMed Central Google ученый
Rawlinson WD, Boppana SB, Fowler KB, Kimberlin DW, Lazzarotto T, Alain S, Daly K, Doutré S, Gibson L, Giles ML, Greenlee J, Hamilton ST, Harrison GJ, Hui L, Jones CA , Palasanthiran P, Schleiss MR, Shand AW, van Zuylen WJ. Врожденная цитомегаловирусная инфекция у беременных и новорожденных: согласованные рекомендации по профилактике, диагностике и терапии [J]. Lancet Infect Dis. 2017; 17 (6): 177–88.
Врожденная цитомегаловирусная инфекция у беременных и новорожденных: согласованные рекомендации по профилактике, диагностике и терапии [J]. Lancet Infect Dis. 2017; 17 (6): 177–88.
Артикул Google ученый
Мусси-Пинхата М.М., Ямамото А.Ю., Моура Брито Р.М., де Лима Исаак М., де Карвалью и Оливейра П.Ф., Боппана С., Бритт В.Дж. Распространенность рождения и естественное течение врожденной цитомегаловирусной инфекции в популяции с высоким уровнем сероиммунитета [J].Clin Infect Dis. 2009. 49 (4): 522–8.
PubMed PubMed Central Статья Google ученый
МакМайкл Дж., МакЛеннан А., Гибсон С., Альвино Е., Голдуотер П., Хаан Е., Деккер Дж., Австралийская совместная исследовательская группа по церебральному параличу.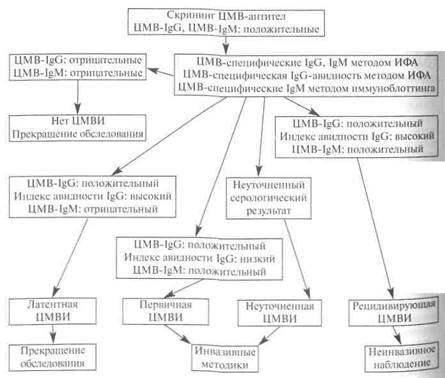 Цитомегаловирус и вирус Эпштейна-Барра могут быть связаны с некоторыми случаями церебрального паралича [J]. J Matern Fetal Neonatal Med. 2012. 25 (10): 2078–81.
Цитомегаловирус и вирус Эпштейна-Барра могут быть связаны с некоторыми случаями церебрального паралича [J]. J Matern Fetal Neonatal Med. 2012. 25 (10): 2078–81.
PubMed Статья PubMed Central Google ученый
Гибсон С.С., МакЛеннан А.Х., Голдуотер П.Н., Хаан Е.А., Прист К., Деккер Г.А., Южно-Австралийская исследовательская группа по церебральному параличу. Нейротропные вирусы и церебральный паралич: популяционное исследование случай-контроль. BMJ. 2006; 332: 76–80.
PubMed PubMed Central Статья Google ученый
Исхак М., Мэннинг Дж. Х., Вулси М. Д., Франклин К. Г., Салинас Ф. С., Фокс П. Т.. Патология тракта белого вещества при аноксической травме головного мозга в результате утопления у детей [J]. Американский журнал нейрорадиологии. 2017; 38 (4): 814–9.
Американский журнал нейрорадиологии. 2017; 38 (4): 814–9.
CAS PubMed Статья PubMed Central Google ученый
ЗВРП и врожденная цитомегаловирусная инфекция | Журнал инфекционных болезней
(См. Основную статью Перейры и др. На страницах 1573–84.)
Ограничение внутриутробного развития (ЗВУР), состояние, при котором плод патологически ограничен в росте внутриутробно, остается серьезной проблемой.Хотя этот термин часто используется взаимозаменяемо с small для гестационного возраста ( SGA ), для исследований важно дифференцировать эти состояния. Последний термин относится ко всем младенцам, у которых масса тела при рождении ниже 10-го процентиля гестационного возраста, что для доношенного ребенка соответствует весу <2500 г. Младенцы могут быть конституционально SGA просто из-за своей наследственности. Патологический ЗВУР также не является единым целым и имеет несколько причин, включая плохое питание матери, хроническую гипертензию, диабет, генетические аномалии, курение, злоупотребление психоактивными веществами, преэклампсию и внутриутробные инфекции, такие как цитомегаловирус, краснуха, сифилис или токсоплазмоз. Этиология ЗВУР может быть внешней для плода, например, когда маточно-плацентарная недостаточность вызывает снижение транспорта питательных веществ и кислорода, или присуща плоду, когда ограничение роста является результатом хромосомных аномалий или инфекции плода. Происхождение ЗВУР также может быть как внутренним, так и внешним для плода, например, когда материнская инфекция приводит как к плацентарной недостаточности, так и к инфицированию плода. Однако примерно в половине случаев ЗВУР может не быть выявленной причины, и такие случаи классифицируются как идиопатические .
Этиология ЗВУР может быть внешней для плода, например, когда маточно-плацентарная недостаточность вызывает снижение транспорта питательных веществ и кислорода, или присуща плоду, когда ограничение роста является результатом хромосомных аномалий или инфекции плода. Происхождение ЗВУР также может быть как внутренним, так и внешним для плода, например, когда материнская инфекция приводит как к плацентарной недостаточности, так и к инфицированию плода. Однако примерно в половине случаев ЗВУР может не быть выявленной причины, и такие случаи классифицируются как идиопатические .
Уже более 50 лет известно, что внутриутробное инфицирование цитомегаловирусом человека (ЦМВ), членом группы герпесвирусов, может поражать центральную нервную систему плода [1, 2]. Фактически, ЦМВ является основной вирусной причиной врожденных дефектов. От 0,5% до 2,5% всех новорожденных инфицированы ЦМВ, а из 5–10%, у которых имеются симптомы при рождении, у большинства развиваются осложнения; к ним относятся микроцефалия, нейросенсорная тугоухость, атрофия зрительного нерва и хориоретинит, а также двигательные нарушения. Даже в бессимптомной группе примерно у 15% позже обнаружится прогрессирующая потеря слуха, нарушение зрения или когнитивные нарушения. Заражение плода может произойти у CMV-серонегативных женщин из-за первичной инфекции или у женщин с ранее существовавшим иммунитетом из-за реактивации эндогенного вируса от предыдущей инфекции или повторного заражения новым вирусом. Однако риск передачи плоду выше при первичной инфекции (примерно 40%), чем у женщин с положительной реакцией на ЦМВ (1%).Хотя ранее считалось, что только врожденно инфицированные дети, рожденные от женщин, у которых была первичная инфекция, имели последствия, приводящие к стойкой инвалидности, теперь признано, что потеря слуха и другие неврологические нарушения встречаются у 10–20% врожденно инфицированных детей, рожденных женщинами. с уже существующим иммунитетом [3–6]. В обеих ситуациях наиболее частым исходом является нейросенсорная тугоухость.
Даже в бессимптомной группе примерно у 15% позже обнаружится прогрессирующая потеря слуха, нарушение зрения или когнитивные нарушения. Заражение плода может произойти у CMV-серонегативных женщин из-за первичной инфекции или у женщин с ранее существовавшим иммунитетом из-за реактивации эндогенного вируса от предыдущей инфекции или повторного заражения новым вирусом. Однако риск передачи плоду выше при первичной инфекции (примерно 40%), чем у женщин с положительной реакцией на ЦМВ (1%).Хотя ранее считалось, что только врожденно инфицированные дети, рожденные от женщин, у которых была первичная инфекция, имели последствия, приводящие к стойкой инвалидности, теперь признано, что потеря слуха и другие неврологические нарушения встречаются у 10–20% врожденно инфицированных детей, рожденных женщинами. с уже существующим иммунитетом [3–6]. В обеих ситуациях наиболее частым исходом является нейросенсорная тугоухость.
В прошлом, когда не было доступных более чувствительных тестов, ЗВУР была одним из индикаторов врожденного ЦМВ-заболевания. Хотя было установлено, что врожденная ЦМВ-инфекция, возникшая в результате первичной инфекции матери, имеет тяжелые исходы, включая повреждение плаценты и ЗВУР, было трудно показать окончательную связь ЗВУР с врожденной ЦМВ-инфекцией у младенцев, у которых не было других клинических проявлений. Одно из первых исследований, предполагающих наличие связи, было проведено Старром и Голдом [7], которые в 1969 году сообщили, что 93% из> 1000 младенцев, рожденных в Кливлендской столичной больнице общего профиля, были проверены на наличие ЦМВ-инфекции.Это было до проведения полимеразной цепной реакции и диагностических анализов на основе ДНК, и для выявления врожденной ЦМВ-инфекции потребовалось посев образцов мочи от 1-2-дневных младенцев в культуру ткани и наблюдение для доказательства цитопатического эффекта ЦМВ. ЦМВ-инфекция была подтверждена у 1,5% младенцев, и ни у одного из них не было клинических проявлений цитомегалической болезни включения. Единственное отклонение от нормы заключалось в том, что вес при рождении инфицированных младенцев был значительно ниже, чем у неинфицированных младенцев, и эта разница не была связана с преждевременными родами.
Хотя было установлено, что врожденная ЦМВ-инфекция, возникшая в результате первичной инфекции матери, имеет тяжелые исходы, включая повреждение плаценты и ЗВУР, было трудно показать окончательную связь ЗВУР с врожденной ЦМВ-инфекцией у младенцев, у которых не было других клинических проявлений. Одно из первых исследований, предполагающих наличие связи, было проведено Старром и Голдом [7], которые в 1969 году сообщили, что 93% из> 1000 младенцев, рожденных в Кливлендской столичной больнице общего профиля, были проверены на наличие ЦМВ-инфекции.Это было до проведения полимеразной цепной реакции и диагностических анализов на основе ДНК, и для выявления врожденной ЦМВ-инфекции потребовалось посев образцов мочи от 1-2-дневных младенцев в культуру ткани и наблюдение для доказательства цитопатического эффекта ЦМВ. ЦМВ-инфекция была подтверждена у 1,5% младенцев, и ни у одного из них не было клинических проявлений цитомегалической болезни включения. Единственное отклонение от нормы заключалось в том, что вес при рождении инфицированных младенцев был значительно ниже, чем у неинфицированных младенцев, и эта разница не была связана с преждевременными родами. Последующие исследования подтвердили эти наблюдения, но различия невелики, и обратный результат не наблюдался; то есть исследования младенцев с SGA показали, что инфицирование ЦМВ встречается редко (2%), и большинство инфицированных ЦМВ младенцев не относятся к группе SGA [8–10].
Последующие исследования подтвердили эти наблюдения, но различия невелики, и обратный результат не наблюдался; то есть исследования младенцев с SGA показали, что инфицирование ЦМВ встречается редко (2%), и большинство инфицированных ЦМВ младенцев не относятся к группе SGA [8–10].
Имеется мало информации о патологическом механизме ЦМВ-инфекции плаценты у серопозитивных женщин, у которых был реактивирован вирус от предшествующей инфекции, и о том, как это влияет на инфицирование плода и ЗВУР.В статье Перейры и др. [11] в этом выпуске рассматриваются заболевания плаценты, антитела против ЦМВ, факторы, связанные с гипоксией, и инфекция ЦМВ в случаях идиопатической ЗВУР. Выборка была небольшой и включала плаценты от 7 пациентов, родивших детей с ЗВУР, но без других клинических проявлений врожденной инфекции. Согласно серологическому тестированию на ЦМВ, 1 женщина была серонегативной, у 2 была первичная инфекция, которая не была диагностирована во время беременности, у 3 была рецидивная инфекция и у 1 были признаки давно перенесенной инфекции (> 6 месяцев назад). Для сравнения исследовали плаценты от 9 нормальных родов. В этой группе было 2 серонегативных женщины, 5 женщин с рецидивирующей инфекцией и 2 женщины с давно перенесенной инфекцией. Для сравнения были включены 3 женщины с преэклампсией; 2 были серонегативными, и у 1 была давно перенесенная инфекция. Хотя серологические результаты для материнской крови и пуповинной крови представлены для всех пациентов, результаты углубленного анализа плаценты представлены только для 4 из 9 контрольных пациентов (1 серонегативный и 3 с рецидивирующей инфекцией) и 5 из них. 7 пациентов в группе ЗВУР (3 с рецидивирующей инфекцией и 2 с первичной инфекцией).Тем не менее, для 9 проанализированных плацент не только были описаны патологические находки, но они также были количественно оценены, обеспечивая уровень информации, который выходит за рамки большинства исследований патологии плаценты.
Для сравнения исследовали плаценты от 9 нормальных родов. В этой группе было 2 серонегативных женщины, 5 женщин с рецидивирующей инфекцией и 2 женщины с давно перенесенной инфекцией. Для сравнения были включены 3 женщины с преэклампсией; 2 были серонегативными, и у 1 была давно перенесенная инфекция. Хотя серологические результаты для материнской крови и пуповинной крови представлены для всех пациентов, результаты углубленного анализа плаценты представлены только для 4 из 9 контрольных пациентов (1 серонегативный и 3 с рецидивирующей инфекцией) и 5 из них. 7 пациентов в группе ЗВУР (3 с рецидивирующей инфекцией и 2 с первичной инфекцией).Тем не менее, для 9 проанализированных плацент не только были описаны патологические находки, но они также были количественно оценены, обеспечивая уровень информации, который выходит за рамки большинства исследований патологии плаценты.
Как и ожидалось, плаценты пациенток из группы IUGR, у которых была первичная инфекция во время беременности, показали наиболее тяжелое заболевание с большими фибриноидами, некротическими бессосудистыми ворсинками, инфильтрацией лейкоцитов в базальной пластинке и расширенными кровеносными сосудами. Две плаценты от пациентов из группы IUGR с рецидивирующей инфекцией также имели значительное, хотя и менее тяжелое, заболевание с фибриноидами, некротическими ворсинками и повышенным количеством отечных ворсинок.Неожиданно третья плацента от пациента с рецидивирующей инфекцией в группе ЗВУР не показала значительного заболевания и была сопоставима с плацентой от серонегативного контрольного пациента. Также неожиданным было обнаружение низкого уровня фибриноидов, некротических аваскулярных ворсинок и отечных ворсинок в 3 плаценте у пациентов из бессимптомной контрольной группы с рецидивирующей инфекцией. Две из этих контрольных плаценты также показали признаки воспаления, о чем свидетельствует различная инфильтрация лейкоцитов.
Две плаценты от пациентов из группы IUGR с рецидивирующей инфекцией также имели значительное, хотя и менее тяжелое, заболевание с фибриноидами, некротическими ворсинками и повышенным количеством отечных ворсинок.Неожиданно третья плацента от пациента с рецидивирующей инфекцией в группе ЗВУР не показала значительного заболевания и была сопоставима с плацентой от серонегативного контрольного пациента. Также неожиданным было обнаружение низкого уровня фибриноидов, некротических аваскулярных ворсинок и отечных ворсинок в 3 плаценте у пациентов из бессимптомной контрольной группы с рецидивирующей инфекцией. Две из этих контрольных плаценты также показали признаки воспаления, о чем свидетельствует различная инфильтрация лейкоцитов.
Плаценты также анализировали на предмет наличия ЦМВ-инфекции с помощью полимеразной цепной реакции на вирусную ДНК и иммуногистохимии на вирусные белки. Вирусная ДНК была обнаружена только в 3 плацентах в группе ЗВУР; 1 от пациента с первичной инфекцией и 2 от пациентов с рецидивирующей инфекцией и значительным поражением плаценты. Однако вирусные белки можно было обнаружить во всех 5 плацентах из группы IUGR. Однако наиболее удивительными оказались результаты иммуногистохимического анализа поляризованных эпителиальных клеток амниотической мембраны, обращенных к компартменту плода.Как и ожидалось, вирусные белки были обнаружены в образцах от пациентов с первичной инфекцией. Однако они также были обнаружены в образцах от 3 бессимптомных контрольных пациентов с рецидивирующей инфекцией, что указывает на инфекцию плода. Напротив, независимо от того, было ли заболевание плаценты, вирусные белки не были обнаружены в эпителиальных клетках амниотической мембраны группы ЗВУР с рецидивирующей инфекцией. К сожалению, не удалось проверить мочу новорожденных на наличие вирусной ДНК, и поэтому мы не знаем, были ли инфицированы эти 3 новорожденных с нормальным весом из контрольной группы.Если бы это было так, это означало бы необычно высокий уровень передачи (> 40%) от CMV-серопозитивных женщин с бессимптомными младенцами.
Однако вирусные белки можно было обнаружить во всех 5 плацентах из группы IUGR. Однако наиболее удивительными оказались результаты иммуногистохимического анализа поляризованных эпителиальных клеток амниотической мембраны, обращенных к компартменту плода.Как и ожидалось, вирусные белки были обнаружены в образцах от пациентов с первичной инфекцией. Однако они также были обнаружены в образцах от 3 бессимптомных контрольных пациентов с рецидивирующей инфекцией, что указывает на инфекцию плода. Напротив, независимо от того, было ли заболевание плаценты, вирусные белки не были обнаружены в эпителиальных клетках амниотической мембраны группы ЗВУР с рецидивирующей инфекцией. К сожалению, не удалось проверить мочу новорожденных на наличие вирусной ДНК, и поэтому мы не знаем, были ли инфицированы эти 3 новорожденных с нормальным весом из контрольной группы.Если бы это было так, это означало бы необычно высокий уровень передачи (> 40%) от CMV-серопозитивных женщин с бессимптомными младенцами.
В течение последних 15 лет Перейра и ее коллеги внесли значительный вклад в наше понимание молекулярной и клеточной биологии плацентарной инфекции ЦМВ и механистической основы патогенеза путем изучения характера инфекции, типов клеток, инфицированных как in vivo и in vitro, а также влияние инфекции на созревание и функцию клеток.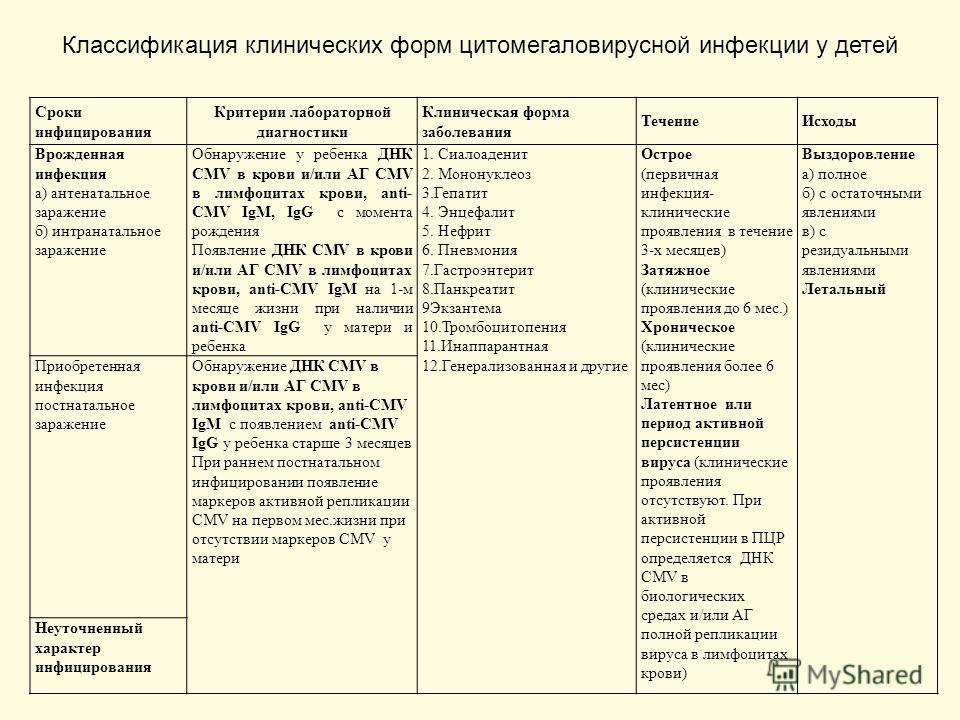 Одним из наиболее неожиданных результатов ее группы была высокая частота ДНК ЦМВ (63%) на границе раздела матка-плацента в плаценте первого триместра, которая увеличилась до 74% в плаценте во втором триместре и составила 62% в срок [ 12–14]. Плацента по-прежнему представляет собой значительный барьер для инфицирования плода, но передача у женщин с первичной инфекцией значительно выше, чем у женщин, у которых был реактивирован вирус от предшествующей инфекции. Работа той же лаборатории показала, что это отчасти связано с алчностью к CMV-специфическим антителам [15].После первичной инфекции ЦМВ иммуноглобулин G (IgG) имеет низкую авидность, и авидность увеличивается по мере созревания иммунного ответа. Неонатальные Fc-рецепторы синцитиотрофобластов плаценты важны для трансцитоза IgG из материнской крови к плоду, тем самым защищая плод пассивной иммунизацией. Однако этот же процесс может облегчить трансцитоз CMV-специфических IgG, связанных с вирионами CMV. Таким образом, у беременных женщин с первичной инфекцией и низкой авидностью антител вирионы, присоединенные к IgG, могут трансцитироваться без нейтрализации, что приводит к распространению инфекции в компартмент плода.
Одним из наиболее неожиданных результатов ее группы была высокая частота ДНК ЦМВ (63%) на границе раздела матка-плацента в плаценте первого триместра, которая увеличилась до 74% в плаценте во втором триместре и составила 62% в срок [ 12–14]. Плацента по-прежнему представляет собой значительный барьер для инфицирования плода, но передача у женщин с первичной инфекцией значительно выше, чем у женщин, у которых был реактивирован вирус от предшествующей инфекции. Работа той же лаборатории показала, что это отчасти связано с алчностью к CMV-специфическим антителам [15].После первичной инфекции ЦМВ иммуноглобулин G (IgG) имеет низкую авидность, и авидность увеличивается по мере созревания иммунного ответа. Неонатальные Fc-рецепторы синцитиотрофобластов плаценты важны для трансцитоза IgG из материнской крови к плоду, тем самым защищая плод пассивной иммунизацией. Однако этот же процесс может облегчить трансцитоз CMV-специфических IgG, связанных с вирионами CMV. Таким образом, у беременных женщин с первичной инфекцией и низкой авидностью антител вирионы, присоединенные к IgG, могут трансцитироваться без нейтрализации, что приводит к распространению инфекции в компартмент плода.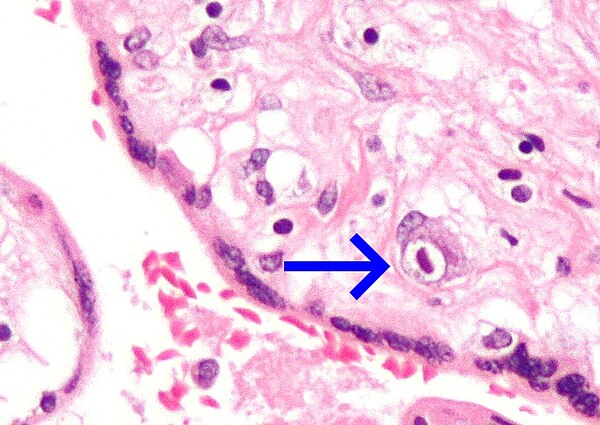 Напротив, вирионы, связанные с IgG с высокой авидностью, все еще могут подвергаться трансцитозу, но инфекция не распространяется. Эти данные послужили основанием для лечения беременных женщин с первичной инфекцией ЦМВ-специфическим гипериммунным глобулином для предотвращения или уменьшения инфицирования плода. Хотя ранние исследования были очень многообещающими, для определения эффективности этой терапии все еще необходимы хорошо контролируемые клинические испытания [16, 17].
Напротив, вирионы, связанные с IgG с высокой авидностью, все еще могут подвергаться трансцитозу, но инфекция не распространяется. Эти данные послужили основанием для лечения беременных женщин с первичной инфекцией ЦМВ-специфическим гипериммунным глобулином для предотвращения или уменьшения инфицирования плода. Хотя ранние исследования были очень многообещающими, для определения эффективности этой терапии все еще необходимы хорошо контролируемые клинические испытания [16, 17].
Из статьи Перейры и др. [11] можно сделать вывод, что первичная ЦМВ-инфекция во время беременности или рецидивирующая инфекция с плацентарным заболеванием связаны с ЗВУР и передачей вируса плоду.Однако менее ясно, влияет ли плацентарная инфекция с низким уровнем плацентарного заболевания или без значительного заболевания плацентой на вероятность ЗВУР. Более того, когда присутствует и плацентарная инфекция, и ЗВУР, выше ли вероятность того, что младенец инфицирован? Мы до сих пор не знаем иммунных корреляторов в случае рецидива инфекции или каких-либо других биомаркеров, которые коррелируют с защитой от плацентарного заболевания или передачи вируса плоду. Возможно, самый важный урок заключается в том, что никакой суррогатный маркер не может заменить прямое исследование мочи или слюны новорожденного на врожденную ЦМВ-инфекцию.Тот факт, что примерно 20% инфицированных младенцев будут иметь постоянную инвалидность, с наиболее распространенной прогрессирующей потерей слуха, подчеркивает важность введения всеобщего скрининга новорожденных для выявления тех, кто подвержен риску осложнений. Затем за этими детьми можно наблюдать, чтобы меры вмешательства были приняты как можно скорее. Этот мониторинг необходимо сочетать с обнаружением материнской первичной инфекции путем регулярного получения исходного образца сыворотки при самом раннем дородовом посещении и мониторинга серонегативных женщин на протяжении всей беременности на предмет сероконверсии ЦМВ.
Возможно, самый важный урок заключается в том, что никакой суррогатный маркер не может заменить прямое исследование мочи или слюны новорожденного на врожденную ЦМВ-инфекцию.Тот факт, что примерно 20% инфицированных младенцев будут иметь постоянную инвалидность, с наиболее распространенной прогрессирующей потерей слуха, подчеркивает важность введения всеобщего скрининга новорожденных для выявления тех, кто подвержен риску осложнений. Затем за этими детьми можно наблюдать, чтобы меры вмешательства были приняты как можно скорее. Этот мониторинг необходимо сочетать с обнаружением материнской первичной инфекции путем регулярного получения исходного образца сыворотки при самом раннем дородовом посещении и мониторинга серонегативных женщин на протяжении всей беременности на предмет сероконверсии ЦМВ.
Примечание
Возможный конфликт интересов. Автор удостоверяет отсутствие потенциального конфликта интересов.
Автор отправил ICMJE форму для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1Craig
JM
,Macauley
JC
,Weller
TH
,Wirth
P
.Выделение агентов, продуцирующих внутриядерные включения, от младенцев с заболеваниями, напоминающими цитомегалическую болезнь включения
,Proc Soc Exp Biol Med
,1957
, vol.94
(стр.4
–12
) 2Weller
TH
,Hanshaw
JB
.Вирусологические и клинические наблюдения цитомегалической инклюзионной болезни
,N Engl J Med
,1962
, vol.266
(стр.1233
—44
) 3Boppana
SB
,Fowler
KB
,Britt
WJ
,Stagno
0003 S0003 SСимптоматическая врожденная цитомегаловирусная инфекция у младенцев, рожденных от матерей с ранее существовавшим иммунитетом к цитомегаловирусу
,Педиатрия
,1999
, vol.
104
(стр.55
—60
) 4Boppana
SB
,Rivera
LB
,Fowler
KB
,Mach
M 9000tJ,
Mach
M 9000tJ
Внутриутробная передача цитомегаловируса младенцам от женщин с преконцептивным иммунитетом
,N Engl J Med
,2001
, vol.344
(стр.1366
—71
) 5Fowler
KB
,Stagno
S
,Pass
RF
.Материнский иммунитет и профилактика врожденной цитомегаловирусной инфекции
,JAMA
,2003
, т.289
(стр.1008
—11
) 6Ross
SA
,Fowler
KB
,Ashrith
G
и др.Потеря слуха у детей с врожденной цитомегаловирусной инфекцией, рожденных от матерей с ранее существовавшим иммунитетом
,J.Педиатр
,2006
, т.148
(стр.332
—6
) 7Старр
J
,Золото
E
.Врожденная цитомегаловирусная инфекция, связанная с низкой массой тела при рождении
,J Pediatr
,1969
, vol.74
(стр.815
—6
) 8Berge
P
,Stagno
S
,Federer
W
и др.Влияние бессимптомной врожденной цитомегаловирусной инфекции на размер при рождении и срок беременности
,Pediatr Infect Dis J
,1990
, vol.9
(стр.170
—5
) 9Мусси-Пинхата
MM
,Ямамото
AY
,Моура Брито
RM
и др.Распространенность при рождении и естественное течение врожденной цитомегаловирусной инфекции в популяции с высоким уровнем сероиммунитета
,Clin Infect Dis
,2009
, vol.49
(стр.522
—8
) 10van der Weiden
S
,de Jong
EP
,Te Pas
AB
и др.Оправдан ли плановый TORCH-скрининг и посев мочи на ЦМВ у новорожденных с гестационным возрастом?
,Early Hum Dev
,2011
, т.87
(стр.103
—7
) 11Перейра
L
,Петит
M
,Фонг
A
и др.Ограничение внутриутробного развития, вызванное основной врожденной цитомегаловирусной инфекцией
,J Infect Dis
,2014
, vol.209
(стр.1573
—84
) 12McDonagh
S
,Maidji
E
,Chang
HT
,Pereira
L
L
Паттерны цитомегаловирусной инфекции человека в доношенной плаценте: предварительный анализ
,J Clin Virol
,2006
, vol.35
(стр.210
—5
) 13McDonagh
S
,Maidji
E
,Ma
W
,Chang
HT
,,0003 HT,Перейра
L
.Вирусные и бактериальные патогены на границе раздела матери и плода
,J Infect Dis
,2004
, vol.190
(стр.826
—34
) 14Перейра
L
,Maidji
E
,McDonagh
S
,Genbacev
0003 O0003Передача цитомегаловируса человека из матки в плаценту коррелирует с наличием патогенных бактерий и материнским иммунитетом
,J Virol
,2003
, vol.77
(стр.13301
—14
) 15Maidji
E
,McDonagh
S
,Genbacev
O
,Песка
TABata
TABata
Материнские антитела усиливают или предотвращают цитомегаловирусную инфекцию в плаценте за счет трансцитоза, опосредованного неонатальным рецептором Fc
,Am J Pathol
,2006
, vol.168
(стр.1210
—26
) 16Nigro
G
,Adler
SP
,La Torre
R
,Best
AM
.Пассивная иммунизация во время беременности от врожденной цитомегаловирусной инфекции
,N Engl J Med
,2005
, vol.353
(стр.1350
—62
) 17Нигро
G
,Адлер
SP
,Parruti
G
и др.Иммуноглобулиновая терапия фетальной цитомегаловирусной инфекции в первой половине беременности — исследование исходов у детей методом случай-контроль
,J Infect Dis
,2012
, vol.205
(стр.215
—27
) © Автор, 2014 г. Опубликовано издательством Oxford University Press от имени Общества инфекционистов Америки. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected].Цитомегаловирус и беременность
Цитомегаловирус (также называемый ЦМВ) — это разновидность вируса герпеса. Есть много видов герпесвирусов. Некоторые из них являются заболеваниями, передающимися половым путем, некоторые могут вызывать такие проблемы, как герпес, а некоторые могут вызывать инфекции, такие как ЦМВ.Многие люди заражаются ЦМВ в какой-то момент своей жизни, чаще всего в детстве.
Если у вас есть цитомегаловирус во время беременности, у вас есть шанс 1 из 3 (33 процента) передать его вашему ребенку. ЦМВ — наиболее распространенный вирус, передающийся от матери младенцу во время беременности. Примерно от 1 до 4 из 100 женщин (от 1 до 4 процентов) имеют ЦМВ во время беременности. Большинство детей, рожденных с ЦМВ, не имеют проблем со здоровьем, вызванных вирусом. Но ЦМВ может вызвать проблемы у некоторых детей, включая микроцефалию. Это врожденный дефект, при котором голова ребенка меньше, чем ожидалось, по сравнению с детьми того же пола и возраста.
Вы можете передать ЦМВ своему ребенку на любом сроке беременности. Более вероятно, что это вызовет проблемы у вашего ребенка, если это произойдет на ранних сроках беременности. Вы также можете передать ЦМВ своему ребенку во время схваток и родов, а также во время кормления грудью. Если ваш ребенок заразится вирусом в это время, у него меньше шансов иметь проблемы со здоровьем, чем если он заразится вирусом во время беременности.
Около половины всех беременных женщин в прошлом болели цитомегаловирусом. Если он у вас уже был, вам не нужно беспокоиться о его получении снова.После заражения ЦМВ остается в вашем организме на всю жизнь. Вы все еще можете передать инфекцию своему ребенку, но это редко и обычно не причиняет никакого вреда вашему ребенку.
Как узнать, есть ли у вас ЦМВ?
У большинства людей с ЦМВ нет никаких признаков или симптомов. Но у некоторых может быть:
- Ангина
- Повышенная температура в течение нескольких дней
- Увеличение лимфоузлов
- Усталость (постоянное чувство усталости)
Сообщите своему врачу, если вы думаете, что у вас может быть ЦМВ.Ваш поставщик медицинских услуг может сдать вам анализ крови, чтобы узнать, есть ли он у вас.
Если у вас слабая иммунная система, ЦМВ может вызвать серьезные проблемы со здоровьем, включая пневмонию или глазные инфекции. Например, ЦМВ может вызывать такие проблемы у людей с ВИЧ.
Как лечат ЦМВ во время беременности?
Если ваш анализ крови положительный на ЦМВ, ваш врач может проверить вашего ребенка на вирус с помощью амниоцентеза (также называемого амнио). Во время этого теста ваш врач вводит тонкую иглу в живот, чтобы удалить небольшое количество околоплодных вод.Амниотическая жидкость — это жидкость, которая окружает вашего ребенка в утробе матери. Лаборатория проверяет жидкость на ЦМВ. Ваш врач также может использовать ультразвук для проверки физических признаков того, что ваш ребенок инфицирован. Ультразвук использует звуковые волны и экран компьютера, чтобы показать изображение вашего ребенка в утробе матери.
Ученые работают над созданием вакцины от ЦМВ. Они также ищут другие способы предотвратить рождение детей с ЦМВ.
Как можно заразиться ЦМВ?
Вы можете заразиться цитомегаловирусом при контакте с биологической жидкостью человека, который вызывает кариес.Жидкости организма включают слюну, грудное молоко, сперму, слизь, мочу и кровь.
Женщины обычно заражаются половым путем с кем-то, кто инфицирован ЦМВ, или контактируя с маленькими детьми с ЦМВ. Целых 7 из 10 детей (70 процентов) в возрасте от 1 до 3 лет, посещающих детский сад, могут иметь ЦМВ. Они могут передать его своим семьям, опекунам и другим детям.
У вас может быть больше шансов заразиться ЦМВ, если вы:
- Иметь детей младшего возраста дома
- Работа с маленькими детьми, например, воспитатель или учитель
- Работа в сфере здравоохранения.Если вы медицинский работник, контактирующий с людьми, инфицированными ЦМВ, включая новорожденных, примите стандартные меры предосторожности, чтобы не заразиться самостоятельно. Вы можете пройти тестирование до беременности, чтобы узнать, есть ли у вас ЦМВ.
Как защитить себя от ЦМВ?
Вот что вы можете сделать:
- Если вы находитесь рядом с детьми, хорошо мойте руки после контакта с жидкостями их тела. Например, мойте руки после смены подгузников, вытирания носов и сбора игрушек.
- Осторожно выбросьте использованные подгузники и салфетки.
- Не целуйте маленьких детей в губы или в щеку.
- Не делитесь едой, стаканами, чашками, вилками или другой посудой с маленькими детьми или с кем-либо, кто может заразиться цитомегаловирусом.
- Если у вашего партнера ЦМВ, используйте латексный презерватив во время секса.
Дополнительная информация
nationalcmv.org
Последнее рассмотрение: ноябрь 2013 г. у младенцев.На сегодняшний день не существует лечения для предотвращения передачи вируса, и самый высокий риск повреждения плода возникает в результате первичной инфекции у матери на ранних сроках беременности.
В последней презентации на IDWeek 2019 исследователи из Израиля попытались оценить влияние противовирусного препарата валацикловира на скорость вертикальной передачи ЦМВ. Беременные женщины с серологическим подтверждением первичной ЦМВ-инфекции в периконцепционный период и в первом триместре были включены в рандомизированное двойное слепое плацебо-контролируемое исследование.
Участников случайным образом распределили в группу лечения валацикловиром в дозе 8 г / день, начатую во время серологического обнаружения и продолжавшуюся до амниоцентеза или плацебо. Первичная конечная точка — частота вертикальной передачи ЦМВ — определялась с помощью полимеразной цепной реакции ЦМВ в амниотической жидкости, а вторичные конечные точки свидетельствовали о симптоматической врожденной ЦМВ-инфекции внутриутробно или постнатально.
Из 90 женщин, включенных в анализ данных, 45 получали валацикловир, а 45 составили контрольную группу.При 2 беременностях двойней в группе было доступно 92 результата амниоцентеза. Пять (11,1%) амниоцентез были положительными по ЦМВ в группе валацикловира по сравнению с 14 (29,8%) в контрольной группе, что соответствует отношению шансов 0,29 (95% доверительный интервал [ДИ]: 0,09–0,90) для вертикальной передачи ЦМВ. .
«Среди пациентов, инфицированных в течение первого триместра, положительный результат амниоцентеза на ЦМВ был значительно (p = 0,02) менее вероятным в группе валацикловира (2/19) по сравнению с [с] плацебо (11/23)», — сообщили исследователи.«Никаких значительных различий (p = 0,91) в CMV-положительном амниоцентезе не наблюдалось между группами исследования среди пациентов, инфицированных периконцептивно».
В целом валацикловир снижает частоту инфицирования плода на 71%.
Керен Шахар-Ниссан, доктор медицины, специалист по педиатрической неотложной медицинской помощи в Детском медицинском центре Шнайдер в Израиле и автор исследования, подробно остановился на импульсе исследования, резюмировал основные результаты и объяснил следующие шаги в интервью Contagion® на IDWeek (см. Видео).
«Валацикловир в дозе 8 г / день эффективен в снижении частоты инфицирования ЦМВ плода после раннего первичного инфицирования матери во время беременности», — заключила исследовательская группа.
Исследование «Валацикловир для предотвращения вертикальной передачи цитомегаловируса после первичной материнской инфекции во время беременности» было представлено в виде запоздалой устной аннотации в субботу, 5 октября 2019 г., на выставке IDWeek в Вашингтоне, округ Колумбия.
Внутриутробная терапия цитомегаловирусной инфекции валганцикловиром: обзор литературы
Барри П.А. (2015) Использование естественной истории вирусов для разработки вакцины. Med Microbiol Immunol 204: 255–262
CAS Статья PubMed PubMed Central Google ученый
Бергин С., Фергюсон В., Коркоран С., Варугезе А., Бирн Д., Лоулесс М., Эоган М., Ламберт Дж. С. (2014) Симптоматическая первичная инфекция Cytomegalovirus у ВИЧ-инфицированной беременной женщины. Int J STD AIDS 25: 1041–1043
Статья PubMed Google ученый
Brandy RC, Schleiss MR, Witte DP, Siddiqi TA, Fame PT (2002) Перенос ганцикловира через плаценту у женщины с синдромом приобретенного иммунодефицита и заболеванием Cytomegalovirus . Pediatr Infect Dis J 21: 796–797
Статья PubMed Google ученый
Braun T, Sloboda DM, Tutschek B, Harder T., Challis JR, Dudenhausen JW, Plagemann A, Henrich W. (2015) Исходы плода и новорожденного после доношенных и преждевременных родов после введения бетаметазона.Int J Gynaecol Obstet 130: 64–69
Статья PubMed Google ученый
Бритт В. (2015) Противоречия в естественной истории врожденной цитомегаловирусной инфекции человека: парадокс инфекции и болезни у потомков женщин с иммунитетом до беременности. Med Microbiol Immunol 204: 263–271
CAS Статья PubMed Google ученый
Buxmann H, Hamprecht K, Meyer-Wittkopf M, Friese K (2017) Первичная инфекция цитомегаловируса человека (HCMV) во время беременности. Deutsches Arzteblatt Int 114: 45–52
Google ученый
Cannon MJ, Stowell JD, Clark R, Dollard PR, Johnson D, Mask K, Stover C, Wu K, Amin M, Hendley W, Guo J, Schmid DS, Dollard SC (2014) Исследование повторных измерений еженедельных и ежедневных паттернов выделения Cytomegalovirus в слюне и моче здоровых детей с серопозитивным цитомегаловирусом.BMC Infect Dis 14: 569
Статья PubMed PubMed Central Google ученый
Czock D, Scholle C, Rasche FM, Schaarschmidt D, Keller F (2002) Фармакокинетика валганцикловира и ганцикловира при почечной недостаточности. Clin Pharmacol Ther 72: 142–150
CAS Статья PubMed Google ученый
Enders G, Daiminger A, Lindemann L, Knotek F, Bader U, Exler S, Enders M (2012) Распространенность цитомегаловируса (ЦМВ) среди беременных женщин, доноров костного мозга и подростков в Германии, 1996–2010 годы.Med Microbiol Immunol 201: 303–309
Статья PubMed Google ученый
Filler G, Lampe D, von Bredow MA, Lappenberg-Pelzer M, Rocher S, Strehlau J, Ehrich JH (1998) Профилактический пероральный ганцикловир после трансплантации почки — дозирование и фармакокинетика. Педиатр Нефрол 12: 6–9
CAS Статья PubMed Google ученый
Френзель К., Леманн Дж., Крюгер Д.Х., Мартин-Паррас Л., Ухарек Л., Хофманн Дж. (2014) Комбинация иммуноглобулинов и естественных клеток-киллеров в контексте инфекции ЦМВ и ВЭБ.Med Microbiol Immunol 203: 115–123
CAS Статья PubMed Google ученый
Gilstrap LC, Bawdon RE, Roberts SW, Sobhi S (1994) Перенос нуклеозидного аналога ганцикловира через перфузируемую плаценту человека. Am J Obstet Gynecol 170: 967–972 (обсуждение 972–973)
CAS Статья PubMed Google ученый
Goegebuer T, van Meensel B, Beuselinck K, Cossey V, van Ranst M, Hanssens M, Lagrou K (2009) Клиническая прогностическая ценность количественной оценки ДНК человеческого цитомегаловируса в образцах околоплодных вод с помощью ПЦР в реальном времени. J Clin Microbiol 47: 660–665
CAS Статья PubMed Google ученый
Guerra B, Simonazzi G, Puccetti C, Lanari M, Farina A, Lazzarotto T, Rizzo N (2008) Ультразвуковое прогнозирование симптоматической врожденной цитомегаловирусной инфекции.Am J Obstet Gynecol 198: 380-e1–380-e7
Статья Google ученый
Henderson GI, Hu ZQ, Yang Y, Perez TB, Devi BG, Frosto TA, Schenker S (1993) Перенос ганцикловира через плаценту человека и его влияние на эмбриональные клетки крысы. Am J Med Sci 306: 151–156
CAS Статья PubMed Google ученый
Юнг Д., Гриффи К., Вонг Р., Колберн В., Халс Дж. (1998) Стабильная относительная биодоступность трех схем перорального приема ганцикловира, доставляющих 6000 мг / день, у пациентов с вирусом иммунодефицита человека.J Clin Pharmacol 38: 1021–1024
CAS Статья PubMed Google ученый
Kampmann SE, Schindele B, Apelt L, Buhrer C, Garten L, Weizsaecker K, Kruger DH, Ehlers B, Hofmann J (2011) Пиросеквенирование позволяет обнаруживать возникающие мутации устойчивости к ганцикловиру после инфицирования HCMV. Med Microbiol Immunol 200: 109–113
CAS Статья PubMed Google ученый
Kimberlin DW, Acosta EP, Sanchez PJ, Sood S, Agrawal V, Homans J, Jacobs RF, Lang D, Romero JR, Griffin J, Cloud GA, Lakeman FD, Whitley RJ (2008) Фармакокинетическая и фармакодинамическая оценка перорального валганцикловира в лечение симптоматической врожденной цитомегаловирусной болезни. J Infect Dis 197: 836–845
CAS Статья PubMed Google ученый
Kimberlin DW, Jester PM, Sanchez PJ, Ahmed A, Arav-Boger R, Michaels MG, Ashouri N, Englund JA, Estrada B, Jacobs RF, Romero JR, Sood SK, Whitworth MS, Abzug MJ, Казерта М.Т., Фаулер С., Лухан-Зильберманн Дж., Сторч Г.А., Дебиаси Р.Л., Хан Дж.Й., Палмер А., Вайнер Л. Б., Боккини Дж. А., Деннехи П. Х., Финн А., Гриффитс П. Д., Лак С., Гутьеррес К., Халаса Н., Хоманс Дж. Shane AL, Sharland M, Simonsen K, Vanchiere JA, Woods CR, Sabo DL, Aban I, Kuo H, James SH, Prichard MN, Griffin J, Giles D, Acosta EP, Whitley RJ (2015) Валганцикловир для симптоматической врожденной цитомегаловирусной болезни .N Engl J Med 372: 933–943
CAS Статья PubMed PubMed Central Google ученый
Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W., Shelton M, Jacobs RF, Vaudry W., Pass RF, Kiell JM, Soong SJ, Whitley RJ (2003) Эффект терапии ганцикловиром на слух при симптоматическом врожденном цитомегаловирусном заболевании с поражением центральной нервной системы: рандомизированное контролируемое исследование. J Pediatr 143: 16–25
CAS Статья PubMed Google ученый
Klug S, Lewandowski C, Merker HJ, Stahlmann R, Wildi L, Neubert D (1991) Исследования in vitro и in vivo пренатальной токсичности пяти вирустатических аналогов нуклеозидов по сравнению с ацикловиром. Arch Toxicol 65: 283–291
CAS Статья PubMed Google ученый
Lazzarotto T, Guerra B, Lanari M, Gabrielli L, Landini MP (2008) Новые достижения в диагностике врожденной цитомегаловирусной инфекции. J Clin Virol 41: 192–197
CAS Статья PubMed Google ученый
Lemmermann NA, Reddehase MJ (2016) Усовершенствование человеческой Т-клеточной иммунотерапии заболевания, вызванного цитомегаловирусом , : модель на мышах с «гуманизированным» представлением антигена в качестве нового инструмента доклинических исследований. Med Microbiol Immunol 205: 549–561
CAS Статья PubMed Google ученый
Leruez-Ville M, Ghout I, Bussieres L, Stirnemann J, Magny JF, Couderc S, Salomon LJ, Guilleminot T, Aegerter P, Benoist G, Winer N, Picone O, Jacquemard F, Ville Y ( 2016) Внутриутробное лечение врожденной цитомегаловирусной инфекции валацикловиром в многоцентровом открытом исследовании II фазы.Am J Obstet Gynecol 215: 462 e1–462 e10
Статья Google ученый
Людвиг А., Хенгель Х (2009) Эпидемиологическое воздействие и бремя болезней врожденной цитомегаловирусной инфекции в Европе. Европейский надзор: бюллетень Europeen sur les consistents = Eur Commun Dis Bull 14: 26–32
CAS Google ученый
Маруяма Ю., Самешима Х., Камитомо М., Ибара С., Канеко М., Икеноуэ Т., Минемацу Т., Эйзуру Ю. (2007) Плодовые проявления и неблагоприятные исходы врожденных цитомегаловирусных инфекций: возможные кандидаты для внутриматочного противовирусного лечения.J Obstet Gynaecol Res 33: 619–623
Статья PubMed Google ученый
Miller BW, Howard TK, Goss JA, Mostello DJ, Holcomb WL Jr, Brennan DC (1995) Трансплантация почки через неделю после зачатия. Трансплантация 60: 1353–1354
CAS PubMed Google ученый
Natale F, Bizzarri B, Cardi V, Gaeta A, Villani P, Liuzzi G, de Curtis M (2015) Ганцикловир проникает в спинномозговую жидкость младенца с врожденной цитомегаловирусной инфекцией.Ital J Pediatr 41:26
Статья PubMed PubMed Central Google ученый
NIAID 2004. Таблица для оценки степени тяжести нежелательных явлений у взрослых и детей. Версия 1.0, декабрь 2004 г .; разъяснение, август 2009 г., Национальный институт аллергии и инфекционных заболеваний http://rsc.tech-res.com/document/safetyandpharmacovigilance/table_for_grading_severity_of_adult_pediatric_adverse_events.pdf. По состоянию на 22 сентября 2016 г.
Nigro G, Adler SP, la Torre R, Best AM (2005) Пассивная иммунизация во время беременности от врожденной цитомегаловирусной инфекции. N Engl J Med 353: 1350–1362
CAS Статья PubMed Google ученый
Nihi F, Moreira D, Santos Lourenco AC, Gomes C, Araujo SL, Zaia RM, Trevisani NB, de Athayde Pinto L, Moura-Costa DD, de Morais RN, Roma Paumgartten FJ, Martino-Andrade AJ (2014) Эффекты на яичек после внутриутробного воздействия антивирусных препаратов ацикловира и ганцикловира у крыс.Toxicol Sci 139: 220–233
CAS Статья PubMed Google ученый
Pacifici GM (2005) Перенос противовирусных препаратов через плаценту человека. Early Hum Dev 81: 647–654
CAS Статья PubMed Google ученый
Pescovitz MD (1999) Отсутствие тератогенности перорального ганцикловира, применяемого на ранних сроках беременности у реципиента трансплантата печени.Трансплантация 67: 758–759
CAS Статья PubMed Google ученый
Пиконе О., Коста Дж. М., Леруес-Вилле М., Эрно П., Оливи М., Вилле И. (2004) Генотип гликопротеина В цитомегаловируса (ЦМВ) и нагрузка ДНК ЦМВ в амниотической жидкости инфицированных плодов. Prenat Diagn 24: 1001–1006
CAS Статья PubMed Google ученый
Plachter B (2016) Перспективы вакцины для профилактики врожденной цитомегаловирусной болезни.Med Microbiol Immunol 205: 537–547
CAS Статья PubMed Google ученый
Плоткин С. (2015) История вакцинации против цитомегаловируса. Med Microbiol Immunol 204: 247–254
CAS Статья PubMed Google ученый
Пулианда Д.П., Сильверман Н.С., Леман Д., Во А., Буннапрадист С., Радха Р.К., Тойода М., Иордания С.К. (2005) Успешное использование перорального ганцикловира для лечения внутриутробной цитомегаловирусной инфекции у реципиента почечного аллотрансплантата.Transplant Infect Dis 7: 71–74
CAS Статья Google ученый
Rawlinson WD, Boppana SB, Fowler KB, Kimberlin DW, Lazzarotto T, Alain S, Daly K, Doutre S, Gibson L, Giles ML, Greenlee J, Hamilton ST, Harrison GJ, Hui L, Jones CA , Palasanthiran P, Schleiss MR, Shand AW, van Zuylen WJ (2017) Врожденная цитомегаловирусная инфекция у беременных и новорожденных: согласованные рекомендации по профилактике, диагностике и терапии.Lancet Infect Dis 17: e177 – e188
Артикул PubMed Google ученый
Rawlinson WD, Hamilton ST, van Zuylen WJ (2016) Обновленная информация о лечении инфекции Cytomegalovirus у беременных и новорожденных с врожденным цитомегаловирусом. Curr Opin Infect Dis 29: 615–624
Статья PubMed Google ученый
Revello GM, Percivalle E, Baldanti F, Gerna G, Kustermann A, Nava S, Nicolini U (1993) Пренатальное лечение врожденной цитомегаловирусной инфекции человека путем внутрисосудистого введения ганцикловира плоду.Clin Diagn Virol 1: 61–67
Статья Google ученый
Revello MG, Lazzarotto T, Guerra B, Spinillo A, Ferrazzi E, Kustermann A, Guaschino S, Vergani P, Todros T, Frusca T, Arossa A, Furione M, Rognoni V, Rizzo N, Gabrielli L , Klersy C, Gerna G (2014) Рандомизированное испытание гипериммунного глобулина для предотвращения врожденного цитомегаловируса. N Engl J Med 370: 1316–1326
CAS Статья PubMed Google ученый
Ревелло М.Г., Заваттони М., Фурионе М., Балданти Ф, Герна Г. (1999) Количественная оценка ДНК цитомегаловируса человека в околоплодных водах матерей с врожденно инфицированными плодами. J Clin Microbiol 37: 3350–3352
CAS PubMed PubMed Central Google ученый
Шульц М., Иверсен-Бергманн С., Андресен Х., Шмольдт А. (2012) Терапевтические и токсические концентрации в крови почти 1000 лекарств и других ксенобиотиков. Crit Care 16: R136
Статья PubMed PubMed Central Google ученый
Simonazzi G, Curti A, Murano P, Cervi F, Contoli M, Lazzarotto T, Capretti MG, Rizzo N, Guerra B (2014) Врожденная цитомегаловирусная инфекция и малая для младенцев гестационного возраста. Prenat Diagn 34: 765–769
Артикул PubMed Google ученый
Сон Ю.М., О М.К., Балкарек КБ, Клауд Г.А., Пасс РФ (1991) Цитомегаловирусная инфекция у сексуально активных подростков. J Infect Dis 163: 460–463
CAS Статья PubMed Google ученый
Stowell JD, Mask K, Amin M, Clark R, Levis D, Hendley W, Lanzieri TM, Dollard SC, Cannon MJ (2014) Поперечное исследование выделения цитомегаловируса и иммунологических маркеров среди серопозитивных детей и их матерей. BMC Infect Dis 14: 568
Статья PubMed PubMed Central Google ученый
Sugawara M, Huang W., Fei YJ, Leibach FH, Ganapathy V, Ganapathy ME (2000) Транспорт валганцикловира, пролекарства ганцикловира, через пептидные транспортеры PEPT1 и PEPT2.J Pharm Sci 89: 781–789
CAS Статья PubMed Google ученый
Teissier N, Fallet-Bianco C, Delezoide AL, Laquerriere A, Marcorelles P, Khung-Savatovsky S, Nardelli J, Cipriani S, Csaba Z, Picone O, Golden JA, van den Abbeele T, Gressens P , Adle-Biassette H (2014) Цитомегаловирусные пороки развития мозга у плода. J Neuropathol Exp Neurol 73: 143–158
Статья PubMed Google ученый
Ville Y (1998) Мегаловирус. Ультразвуковой акушерский гинекол 12: 151–153
CAS Статья PubMed Google ученый
Вайсблюм Y, Панет А, Закай-Ронес З., Хаймов-Кохман Р., Гольдман-Воль Д., Ариэль I, Фальк Х., Натансон-Ярон С., Голдберг М.Д., Гилад Р., Лурайн Н.С., Гринфилд С. Ягель С., Вольф Д. Г. (2011) Моделирование передачи цитомегаловируса человека от матери к плоду в новой культуре децидуальных органов. J Virol 85: 13204–13213
CAS Статья PubMed PubMed Central Google ученый
Welz J, Müller A, Gembruch U, Geipel A (2016) Внутриматочная терапия феталеном CMV Infektion mit Valganciclovir, eine Falldarstellung. Geburtshilfe und Frauenheilkunde 76: P40
Артикул Google ученый
Вутцлер П., Туст Р. (2001) Генетические риски противовирусных аналогов нуклеозидов — обзор. Antivir Res 49: 55–74
CAS. Статья PubMed Google ученый
ЦМВ-инфекция и беременность | SpringerLink
Скрининг беременных
Обнаружение сывороточных антител IgG указывает на то, что инфекция ЦМВ произошла в недавнем или далеком прошлом.Ценность тестирования на антитела IgG заключается в том, чтобы определить, был ли пациент когда-либо инфицирован ЦМВ. Для выявления сероконверсии необходимо провести повторные тесты через 2–4 недели у пациента, у которого изначально были отрицательные антитела к CMV IgG.
Диагностика материнской инфекции
Большинство ЦМВ-инфекций у беременных женщин протекают бессимптомно даже в острой стадии. Приблизительно у 25% беременных женщин первичная инфекция протекает с симптомами. Даже в случаях с симптомами проявления неспецифические и легкие, такие как стойкая низкая температура, утомляемость и головная боль.Лабораторные тесты иногда могут выявить атипичный лимфоцитоз и незначительное повышение уровня трансаминаз [12]. Клинический диагноз ЦМВ-инфекции недостоверен.
Беременные женщины, у которых изначально были отрицательные антитела к CMV IgG, могут быть диагностированы как первичная инфекция, когда произошла сероконверсия (от отрицательных антител к CMV IgG к положительным). Однако количество антител IgG к ЦМВ не может быть использовано для точного прогнозирования недавнего инфицирования ЦМВ. «Золотым стандартом» первичной ЦМВ-инфекции является материнская сероконверсия или наличие сывороточных антител IgM к ЦМВ в сочетании с антителами IgG к ЦМВ с низкой авидностью.Фактически, если доступны последовательные образцы крови, наличие антител IgM и IgG к ЦМВ у беременной женщины, ранее имевшей отрицательный результат по IgG, позволяет определить сероконверсию и первичную инфекцию ЦМВ.
Тестирование на антитела IgM к ЦМВ является наиболее широко используемой и подходящей процедурой скрининга беременных. Хотя антитела IgM к CMV встречаются почти при всех первичных инфекциях, они также могут возникать после реактивации или повторного инфицирования [13]. Замечено, что пик IgM к ЦМВ обычно достигает 3–6 месяцев после первичной инфекции, но может оставаться в сыворотке крови более 12 месяцев [12].Однако важно отметить, что ложноположительные результаты являются обычным явлением и могут возникать у пациентов с другими вирусными инфекциями (например, парвовирусом B19, вирусом Эпштейна-Барра) или аутоиммунным заболеванием, или в результате вмешательства ревматоидного фактора класса IgM. [14]. Следовательно, обнаружение IgM к ЦМВ в одной сыворотке беременной женщины не само по себе указывает на недавнюю первичную инфекцию ЦМВ во время беременности [15].
Из-за этих трудностей с интерпретацией серологии анализ авидности IgG может быть полезным инструментом, помогающим отличить первичную инфекцию от прошлой или рецидивирующей инфекции, и может помочь определить время заражения [12 •].Авидность антител отражает силу связывания поливалентного антигена с антителом. В течение первой недели после первичной инфекции антитела IgG к ЦМВ демонстрируют низкую авидность к антигену, но они постепенно и медленно созревают, сначала приобретая умеренную, а затем высокую авидность. Антитела с высокой авидностью ЦМВ могут сохраняться в течение многих лет, но антитела IgG к ЦМВ с низкой авидностью обнаруживаются только после первичной антигенной стимуляции и обычно сохраняются в течение примерно 16-18 недель после начала инфекции ЦМВ.Высокая авидность обнаруживается только при отдаленной или рецидивирующей ЦМВ-инфекции [12 •]. Индекс авидности <30% убедительно указывает на первичную инфекцию менее 3 месяцев. Таким образом, определение авидности антител к ЦМВ, выполняемое до 12–16 недель беременности, является полезным инструментом для выявления всех беременных женщин, которые могут родить инфицированных новорожденных (100% чувствительность). Если индекс авидности IgG определяется позже во время беременности (после 18-20 недель гестации), чувствительность резко снижается (62.5%) [12 •].
В настоящее время для диагностики первичной материнской инфекции используется сочетание наличия антител IgM к ЦМВ и низкой авидности IgG к ЦМВ, а также симптомов у матери или плода. У женщин, серологический статус которых до беременности неизвестен, наличие высоких титров сывороточных специфических IgG с / без CMV IgM в сочетании с высокой авидностью IgG в течение первых 12-16 недель беременности может указывать на непервичную инфекцию CMV (рецидивирующую). инфицирование или повторное заражение другим штаммом ЦМВ).На сегодняшний день серологическая диагностика не первичной ЦМВ-инфекции затруднена и часто ненадежна, поскольку не существует оптимальных диагностических методов.
Доступно множество коммерческих анализов, но между этими анализами существуют значительные различия в чувствительности и специфичности для обнаружения антител IgM или IgG к CMV и авидности IgG к CMV. Обычно между этими коммерческими тестами для обнаружения антител IgM к ЦМВ нет хорошего согласия. Это несоответствие было приписано другому принципу анализа (захват IgM vs.непрямой анализ), использованию вирусных лизатов по сравнению с рекомбинантными антигенами и используемому порогу анализа. Gentile et al. сообщили, что уровень положительности для CMV IgM с помощью AxSYM был значительно выше, чем у других коммерческих тестов [16]. Карлье и др. сообщили, что Access имеет лучшую чувствительность и специфичность, чем VIDAS, в обнаружении антител IgG и IgM к CMV, и пришли к выводу, что тесты Access CMV IgG и IgM подходят для скрининга пренатальных инфекций CMV [17]. Revello et al. сообщили о результатах сравнительной оценки восьми анализов авидности IgG к CMV и обнаружили, что характеристики этих коммерческих наборов для определения авидности IgG изменчивы [18].
Диагностика инфекции плода
После того, как материнская инфекция была задокументирована, важно определить, имела ли место инфицирование плода, поскольку это поможет определить необходимость дальнейшей оценки и наблюдения во время беременности. Поэтому за инфекцией ЦМВ плода следует внимательно следить с помощью ультразвукового исследования.
Ультразвуковые аномалии у плода, включая увеличение максимальной толщины плаценты, являются независимыми предикторами неблагоприятного исхода новорожденного [19].Отклонения от нормы при ультразвуковом исследовании включают задержку внутриутробного развития, водянку или асцит, гиперэхогенный кишечник, плевральный или перикардиальный выпот, гепатоспленомегалию, внутрипеченочные кальцинации, псевдонекониевую кишечную непроходимость и аномалии центральной нервной системы [12 •]. Кроме того, эти данные наблюдаются только у менее чем 25% инфицированных плодов [2]. Поскольку отсутствие результатов ультразвукового исследования не исключает врожденную инфекцию, ультразвуковое исследование является относительно плохим предиктором симптоматической врожденной инфекции.
По сравнению с результатами ультразвукового исследования выделение ЦМВ из околоплодных вод имеет гораздо более высокую чувствительность и специфичность и считается «золотым стандартом» пренатальной диагностики ЦМВ-инфекции плода [12 •]. Плод выделяет ЦМВ с мочой, поэтому мы можем обнаружить вирус в околоплодных водах, когда почечная система плода функционирует.
Кроме того, передача вируса от матери к плоду может не произойти вскоре после заражения матери. Было показано, что гестационный возраст на момент амниоцентеза является дополнительной переменной, влияющей на чувствительность.Yinon et al. продемонстрировала чувствительность 30%, если первый образец околоплодных вод был взят до 21 недели гестации, после чего повысилась до 71%. По этим причинам амниоцентез следует отложить примерно до 20–21 недели беременности и 6–8 недель после заражения матери, чтобы избежать ложноотрицательных результатов [2].
Вирусный посев околоплодных вод имеет 100% специфичность, но может давать ложноотрицательные результаты из-за низкой чувствительности. Для получения результата с помощью традиционной системы культивирования вирусов может потребоваться 2 недели или больше.Методики культивирования из флаконов с оболочкой имеют аналогичную чувствительность по сравнению с обычными культурами ЦМВ и позволяют обнаруживать вирус через 24–48 часов после сбора околоплодных вод [2]. Некоторые исследования показали, что ПЦР имеет почти 100% чувствительность и специфичность для обнаружения даже небольшого количества вирусной ДНК в околоплодных водах, что коррелирует с врожденной инфекцией при рождении [2, 12, 20]. Для максимальной точности должны быть получены как вирусный посев, так и ПЦР. Одного только диагноза ЦМВ плода недостаточно для прогнозирования заболевания новорожденного.
Большое количество вируса, измеренное с помощью ПЦР в амниотической жидкости, скорее всего, связано с гестационным возрастом и не должно использоваться в качестве независимого предиктора неблагоприятного исхода для плода [20]. Если и посев ЦМВ, и ПЦР отрицательны, инфицирование плода можно исключить с высокой степенью уверенности. Положительные результаты в околоплодных водах позволяют идентифицировать инфицированные ЦМВ плоды, но не позволяют различить тех младенцев, у которых симптомы будут проявляться при рождении [21].
Кроме того, низкая вирусная нагрузка в околоплодных водах, отобранных на 20-21 неделе беременности и когда временной интервал между началом материнской инфекции составляет ≥6-8 недель, неизменно ассоциируется с бессимптомной врожденной инфекцией и может исключить внутриутробное развитие плода. повреждение при рождении.Хотя самые высокие медианные значения ДНК ЦМВ в околоплодных водах, как правило, указывают на повышенный риск тяжелой инфекции, корреляция между высокой нагрузкой ЦМВ в околоплодных водах и исходом для плода / новорожденного не была продемонстрирована [21]. Амниоцентез можно использовать в случаях первичной или вторичной инфекции ЦМВ у матери. Риск инфицирования плода низкий при вторичной материнской инфекции; однако иногда возникали серьезные последствия. Таким образом, соотношение риска и пользы от выполнения этого инвазивного диагностического теста необходимо тщательно оценивать в случае вторичной инфекции.
Кордоцентез может быть полезным дополнением к амниоцентезу, поскольку кровь плода может быть проверена на определение вирусного генома, IgM и культуры. ПЦР крови плода, взятой на 20-21 неделе беременности, имеет более низкую чувствительность к врожденным инфекциям, чем полученная с околоплодными водами [12 •]. Чувствительность ПЦР к крови плода достигает 100%, когда кровь плода берется после 30 недель беременности [22]. Чувствительность определения IgM к ЦМВ в крови плода, полученной после 20 недель беременности, колеблется от 55.От 5% до 80%. Кроме того, наличие IgM к ЦМВ является прогностическим маркером врожденного ЦМВ-заболевания. Yinon et al. изучили 63 беременных с первичной ЦМВ-инфекцией и не обнаружили ни одного случая положительного IgM в сыворотке плода с отрицательным посевом амниотической жидкости или ПЦР. Эти результаты показали, что кордоцентез не увеличивал возможности точной диагностики внутриутробной инфекции [2]. Однако взятие образцов из пуповины увеличивает осложнения во время процедуры, тогда как амниоцентез более безопасен.
Диагностика инфекции новорожденных
При рождении новорожденного, рожденного от матери с первичной ЦМВ-инфекцией во время беременности, следует проверить на врожденную инфекцию.Обнаружение ЦМВ в моче или слюне в течение первых 2 недель жизни с помощью вирусного посева или ПЦР полезно для диагностики врожденной ЦМВ-инфекции. Кроме того, новорожденные антитела IgM к ЦМВ присутствуют только от 20% до 70% [12 •]. Все младенцы с врожденной ЦМВ-инфекцией должны быть тщательно обследованы на предмет потери слуха, ретинита и неврологической функции и проходить последующее наблюдение через 1, 3, 6 и 12 месяцев жизни, а затем ежегодно до школьного возраста.
Цитомегаловирус (ЦМВ) и информация о беременности
Что такое ЦМВ?
Цитомегаловирус (ЦМВ) — распространенный вирус в семействе вирусов герпеса.Пятьдесят процентов людей были инфицированы в молодом возрасте и до 85 процентов — к 40 годам.
Пики инфицирования наблюдаются у детей младше 2 лет и в подростковом возрасте. Когда человек заражается, вирус остается живым, но обычно неактивным (бездействующим) в организме этого человека на всю жизнь.
У человека редко появляются симптомы после первоначальной инфекции, если его иммунная система не ослаблена тяжелым заболеванием и лечением (например, при раке).
Реактивация может происходить во время беременности у женщин, которые ранее были инфицированы, с очень небольшим риском передачи ЦМВ нерожденному ребенку.
Каковы симптомы?
У детей и взрослых со здоровой иммунной системой симптомы обычно не развиваются при инфицировании, но может развиться заболевание, подобное железистой лихорадке, с усталостью, болью в горле, опухшими железами и лихорадкой. Симптомы чаще развиваются у людей с ослабленной иммунной системой.
Как распространяется ЦМВ?
Люди — единственный источник ЦМВ. Вирус обнаружен в моче, слюне, слизистой носа, грудном молоке, вагинальных выделениях и сперме инфицированных людей.
Риск передачи от детей, рожденных с инвалидностью вследствие ЦМВ-инфекции, не выше, чем от детей, у которых ЦМВ-инфекция протекает бессимптомно.
ЦМВ распространяется через:
- тесный контакт с человеком, выделяющим вирус со слюной, слизистой носа, мочой или другими биологическими жидкостями
- обращение с детскими игрушками, на которых есть слюна или слизь, или обращение с загрязненными предметами, такими как грязные салфетки или грязные подгузники, затем прикосновение к глазам, носу или рту без предварительного мытья рук
- от матери ее будущему ребенку в результате материнской инфекции во время беременности
- от матери ее будущему ребенку в результате реактивации вируса во время беременности
- грудное молоко инфицированной женщины, кормящей грудью
- половой контакт.
Кто подвергается риску?
Если женщина заразилась ЦМВ во время беременности, существует риск инфицирования ее будущего ребенка (врожденный ЦМВ). Инфицированные дети могут, но не всегда, родиться с инвалидностью.
Наибольший риск для будущего ребенка возникает, когда женщина, никогда ранее не болевшая ЦМВ, впервые заражается этим вирусом во время беременности (первичная инфекция ЦМВ) и когда инфекция происходит в течение первой половины беременности.Заражение во время одной беременности не увеличивает риск последующих беременностей. Однако в случае первичной инфекции следует подождать не менее 12 месяцев, прежде чем снова забеременеть.
Исследования, проведенные в Австралии, показали, что из 1000 живорождений около 6 младенцев будут иметь врожденную ЦМВ-инфекцию, а 1-2 из этих 6 младенцев (в целом примерно 1 из 1000 младенцев) будут иметь постоянную инвалидность различной степени. Это может быть потеря слуха, потеря зрения, маленький размер головы, церебральный паралич, задержка в развитии или умственная отсталость, а в редких случаях — смерть.
Иногда вирус может реактивироваться во время беременности женщины, но реактивация обычно не вызывает проблем у женщины или ее будущего ребенка.
Можно ли предотвратить врожденный ЦМВ?
В настоящее время лицензированной вакцины против ЦМВ нет.
Беременным женщинам рекомендуется принимать меры для снижения риска заражения ЦМВ и, таким образом, снижения риска заражения их развивающегося ребенка. Профилактические меры включают:
- часто мойте руки проточной водой с мылом в течение не менее 15 секунд и тщательно вытирайте их.Это следует делать особенно после тесного контакта с маленькими детьми, смены подгузников, сморкания, кормления маленького ребенка и обращения с детскими игрушками, пустышками / пустышками.
- не делится едой, напитками, столовыми приборами или зубными щетками с маленькими детьми.
- избегать контакта со слюной при поцелуях ребенка.
- используйте простое моющее средство и воду для очистки игрушек, столешниц и других поверхностей, которые контактируют с детской мочой, слизистыми оболочками или слюной.
Беременные или планирующие беременность работники по уходу за детьми должны уделять особое внимание хорошей гигиене рук, особенно после смены подгузников, помощи в высморкавании носа или использования туалета.
Как диагностируется врожденный ЦМВ?
У человека, инфицированного ЦМВ, в крови вырабатываются антитела, указывающие на то, что инфекция произошла недавно или в прошлом. Эти антитела остаются в организме на всю оставшуюся жизнь. Другие тесты, которые обнаруживают вирус, используются, чтобы определить, есть ли у человека активная инфекция ЦМВ.
Тестирование на ЦМВ обычно не рекомендуется всем женщинам во время беременности или новорожденным. Тестирование на ЦМВ следует предлагать беременным женщинам, только если они часто контактируют с большим количеством очень маленьких детей (например, работники детских садов).
Младенцы, рожденные от матерей, у которых во время беременности диагностирована первичная ЦМВ-инфекция, должны быть проверены на врожденную ЦМВ-инфекцию. Младенцы, не прошедшие нормальный скрининговый тест на слух при рождении (SWISH), также могут быть проверены на врожденный ЦМВ, поскольку потеря слуха является наиболее частым признаком врожденного ЦМВ.Однако у некоторых младенцев с врожденной ЦМВ-инфекцией, которые кажутся здоровыми при рождении, со временем развивается потеря слуха или зрения. По этой причине у инфицированных младенцев следует регулярно проверять слух и зрение.
Можно ли лечить врожденный ЦМВ?
Беременных женщин, у которых диагностирована первичная (первая) ЦМВ-инфекция, следует направлять для последующего наблюдения и консультации к специалисту, чтобы получить актуальную информацию о рисках и преимуществах доступных методов лечения, которые в настоящее время являются экспериментальными.
Младенцам, рожденным с неврологическими нарушениями из-за ЦМВ, может быть полезно раннее противовирусное лечение; это следует обсудить со специалистом-педиатром.
Большинство детей, рожденных с ЦМВ-инфекцией, вырастают с нормальным здоровьем. Обеспокоенность по поводу ЦМВ-инфекции можно обсудить с терапевтом или с бесплатной телефонной службой MotherSafe, которая предоставляет комплексные консультационные услуги женщинам и их медицинским работникам, обеспокоенным контактами во время беременности и кормления грудью.
Каковы ответные меры общественного здравоохранения?
ЦМВ-инфекция в Новом Южном Уэльсе не подлежит регистрации.


 Тест качественный.
Тест качественный. Лабораторная диагностика этой инфекции у беременных женщин предпринимается для оценки риска инфицирования плода. Определение IgM важно также для диагностики врожденной краснухи у новорожденных детей. Тест на определение IgM к краснухе – качественный.
Лабораторная диагностика этой инфекции у беременных женщин предпринимается для оценки риска инфицирования плода. Определение IgM важно также для диагностики врожденной краснухи у новорожденных детей. Тест на определение IgM к краснухе – качественный.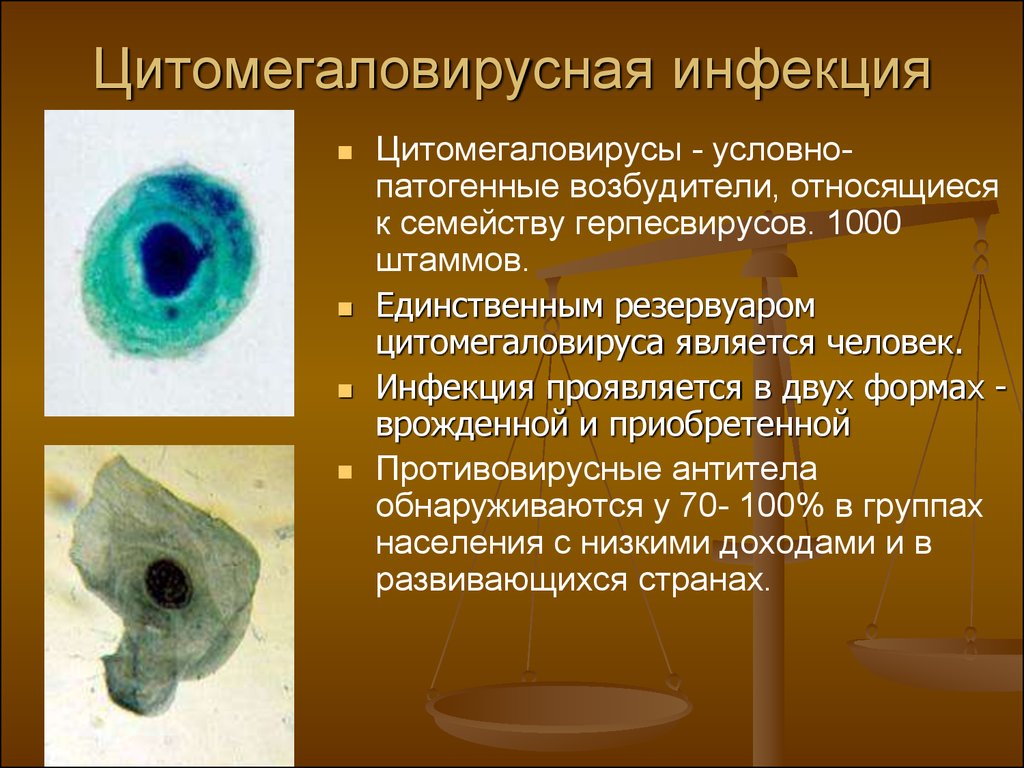 Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование. Тест на антитела класса G к токсоплазме – количественный. Результат выдается в виде концентрации Ig G в МЕ в интервале от 0 до 200 МЕ.
Антитела класса G обычно сохраняются пожизненно. Они выполняют защитную функцию и предотвращают в подавляющем большинстве случаев повторное инфицирование. Тест на антитела класса G к токсоплазме – количественный. Результат выдается в виде концентрации Ig G в МЕ в интервале от 0 до 200 МЕ.