Микролиты почек / Почки / Здоровье / 36on.ru Воронежский городской портал
Микролиты почек – это небольшие камни, способствующие развитию мочекаменной болезни. Образуются при нарушении обменных процессов в организме, а именно при выпадении солей в осадок. Выводятся из организма вместе с мочой.
Состоят из фосфатов, уратов, оксолатов. Виновниками уратных камней являются соли мочевой кислоты, фосфатных – соли фосфорных кислот, оксолатных – соли щавелевой кислоты.
Микролиты почек образуются вне зависимости от возраста и пола. Однако, по статистике, их чаще всего находят у людей, длительно проживающих в жарком и засушливом климате.
Причины
Факторами риска образования микролитов в почках являются заболевания почек и мочевыделительного аппарата, неправильное питание, употребление спиртных напитков и жесткой воды с большим количеством солей (либо наоборот – длительное обезвоживание организма), наследственная предрасположенность, врожденные аномалии строения почек, опухоли, авитаминоз и гиповитаминоз, нарушения работы эндокринной системы и т.

Симптомы
Микролиты долгое время могут не проявлять себя. Однако быстрый рост камней сопровождается выраженным болевым синдромом. Пациент ощущает тупую ноющую боль в поясничной области, в паху и внизу живота, которая усиливается при смене положения тела и физических нагрузках. Моча мутная, в ней может быть небольшое количество крови и песка. В особо тяжелых случаях (когда микролиты «вырастают» в большие, полноценные камни) возможны приступы почечной колики.
Диагностика
Как правило, микролиты в почках (на ранней стадии) обнаруживаются случайно, во время ультразвукового исследования. При обнаружении таковых, назначают дополнительные обследования: рентген, анализы мочи и крови (общий и биохимический). Возможно направление на цистоскопию (исследование мочевого пузыря, в частности, его слизистой оболочки).
Окончательный диагноз ставится только по результатам всего комплекса обследований.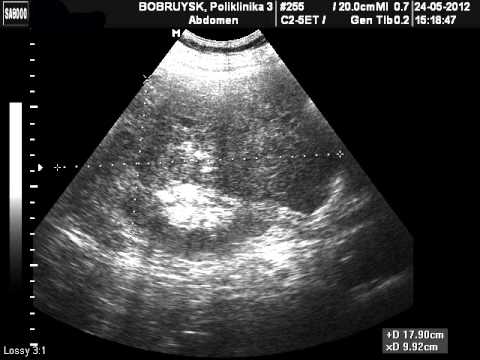
Лечение
Лечение микролитов в почках назначается индивидуально, в зависимости от их размеров, и характера и химического состава. В большинстве случаев (на ранних стадиях) показано регулярное наблюдение у уролога и УЗИ почек и мочевыводящих путей.
При наличии хронических заболеваний почек – прежде всего, излечивают их, а также устраняют их причину. Болевой синдром купируют спазмолитическими препаратами.
Полное избавление от микролитов в почках невозможно при коррекции рациона питания. Больному назначается специальная диета, в зависимости от состава солей (преимущественно – молочно-растительная), рекомендуется увеличить объем потребляемой жидкости, обратить внимание на химический состав воды.
Также при наличии микролитов в почках будут полезны траволечение (урологические травяные сборы можно приобрести в любой аптеке) и водные процедуры – регулярные горячие ванны ускоряют процесс вывод мелких камней из организма.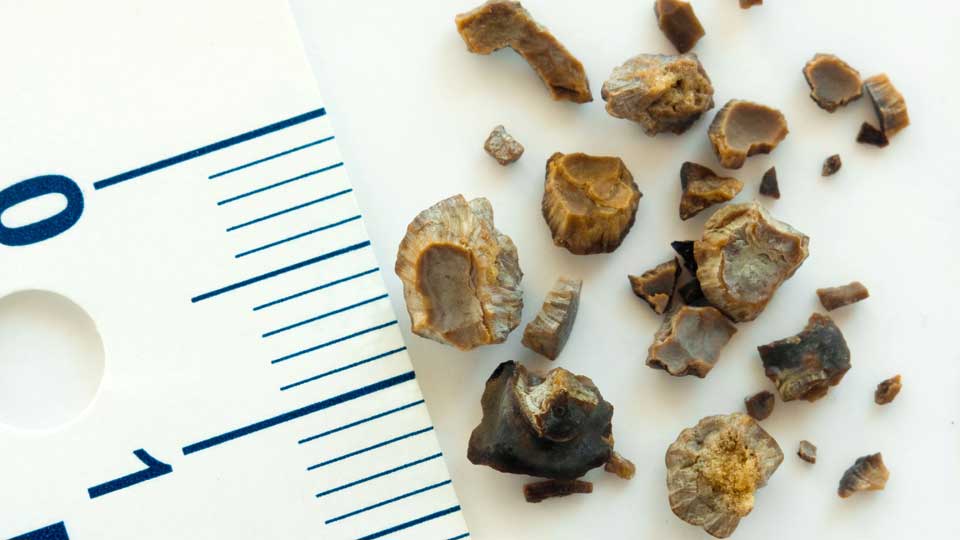
кто это и что лечит
Хирург уролог – это специалист узкого профиля, который занимается диагностикой и лечением болезней мочеполовой системы у мужчин и мочевой системы у женщин. Уролог-онколог Пшихачев Ахмед Мухамедович обладает колоссальным опытом хирургического лечения онкологических болезней органов урогенитального тракта, операции проводит качественно и недорого. Так как урология является довольно узкой медицинской специальностью и относится по большей части к хирургии, Пшихачев Ахмед Мухамедович посвятил себя исключительно оперативной урологии и на данный момент его хирургический стаж составляет более 13-ти лет. Получить бесплатную онлайн консультацию врача Вы можете, задав вопрос доктору лично по телефону или записавшись к нему на приём в клинику «К+31» или в Городской Клинической больнице №31, которые находятся недалеко от станции метро Проспект Вернадского. Также, для Вашего удобства Вы можете воспользоваться специальной формой обратной связи, расположенной на сайте.
Консультация с опытным специалистом
На самом деле ответ кроется уже в самом вопросе. Каждый пациент хочет найти врача с большим опытом практической работы и это вполне оправданно, ведь опытный специалист потому так и называется, что за свою карьеру он видел огромное количество клинических случаев и разобраться с Вашей проблемой ему не составит труда.
Как проходит консультация
Консультация врача уролога проходит в несколько этапов:
1. Сначала доктор внимательно выслушает жалобы пациента и, при необходимости, задаст уточняющие вопросы. В ходе беседы врач соберет информацию о жалобах, симптомах, сроках их появления, проведенных ранее лечениях и т.п.
Сначала доктор внимательно выслушает жалобы пациента и, при необходимости, задаст уточняющие вопросы. В ходе беседы врач соберет информацию о жалобах, симптомах, сроках их появления, проведенных ранее лечениях и т.п.
2. Вторым этапом после беседы будет осмотр пациента, который сопровождается пальпацией живота, при необходимости, наружных половых органов и простаты.
3. После сбора анамнеза и осмотра врач сможет поставить предварительный диагноз, назначит необходимые анализы и подберет план лечения.
Как попасть на консультацию
В настоящее время Пшихачев Ахмед Мухамедович ведет приём пациентов и проводит хирургические вмешательства в двух клиниках, которые расположены на одной территории рядом со станцией метро Проспект Вернадского:
1 – в платной многопрофильной медицинской клинике «К+31», расположенной по адресу ул. Лобачевского д. 42 стр. 4,
2 – в Городской Клинической больнице №31, расположенной по адресу ул. Лобачевского д. 42 стр. 1.
Свяжитесь с врачом на прямую – позвоните доктору по указанному на сайте номеру, задайте все интересующие вопросы и при необходимости запишитесь на очный прием.
Мы рекомендуем почитать отзывы наших пациентов и Вы сможете оценить качество работы уже перед приходом к нашему специалисту.
Мочекаменная болезнь — симптомы, причины, лечение в СПБ
Виды почечных камней
Почечные камни делятся на три категории:
- Уратные — гладкие, твердые и желтые из-за мочевой кислоты.
- Кальциево-фосфатные — светло-серые, мягкие, с шероховатостями.
- Кальциево-оксалатные — черно-серые, плотные, с наростами в форме шипов.
Они способны появляться не только в почках, но также в мочеточниках или мочевом пузыре. В 83% случаев камни образуются только в одной почке, и лишь в 17% случаев в обеих. У женщин чаще, чем у мужчин, формируются коралловидные шипованные камни, вызывающие наиболее интенсивную боль.
Факторы влияющие на формирование камней в почках
К мочекаменной болезни существует наследственная предрасположенность. Из-за нарушенного обмена вещества меняется водно-солевая структура и химический состав мочи.
Формированию камней способствуют в равной степени и чрезмерные физические нагрузки, и полное отсутствие движения. Риск развития заболевания ощутимо выше у тех, кто неправильно питается, страдает от болезней пищеварительной системы и/или дефицита витамина D, а также подвергается регулярному обезвоживанию.
Обезвоживание характерно в первую очередь для жителей регионов с засушливым климатом. В то же время, слишком холодные погодные условия и нехватка естественного солнечного освещения тоже не идут на пользу почкам. Кроме того, МКБ часто диагностируется в тех районах, жители которых не имеют стабильного доступа к чистой питьевой воде.
Симптомы заболевания
У пациентов обоих полов МКБ симптомы таковы:
- В районе пояса ощущается сильная боль. Она может быть как тупой, так и острой, как периодической, так и непрекращающейся.
- Стихийно возникают почечные колики — исключительно острые боли, которые сообщают о закупорке мочеточника.

- Мочеиспускание становится учащенным и болезненным.
- Цвет мочи меняется, в ней появляется гной, кровь.
- Температура тела и артериальное давление повышаются.
- Пациента тошнит и рвет.
У женщин боли отдаются в половые губы, а у мужчин — в половой член.
Диагностические методики
Диагностируют МКБ с помощью нижеследующих методик:
- Анализ мочи. Выявляет наличие примесей.
- Общий анализ крови и биохимия. Помогает установить наличие воспалительных процессов в организме и патологических изменений в структуре органов.
- УЗИ почек. Обнаруживает даже самые мелкие образования, не подвергая организм негативному воздействию.
- Рентген, он же экскреторная урография. Во время процедуры организм подвергается вредному облучению. Рентген позволяет рассмотреть не все типы камней.
- Компьютерная томография. Недешевый, зато наиболее информативный метод.
Если пациент постоянно откладывает визит к врачу и болезнь не диагностируют своевременно, она может перерасти в хронический либо гнойный пиелонефрит. Если дело дойдет до гнойного расплавления почки, проблемный орган придется удалять — чтобы этого избежать, достаточно своевременно сходить в клинику.
Если дело дойдет до гнойного расплавления почки, проблемный орган придется удалять — чтобы этого избежать, достаточно своевременно сходить в клинику.
Виды лечения
Лечение МКБ проводится с помощью следующих методик:
- Уретроскопия. Камни дробятся тонким инструментом, вводимым в мочеточник.
- Ударно-волновая литотрипсия. Малоприятных ощущений при этом нет — но нет и гарантии успешного результата. Камень дробится быстрыми импульсами ударной волны.
- Медикаментозное лечение. У этого метода самая низкая эффективность. Врач назначает пациенту препараты, которые при благополучном исходе растворят камни и выведут за пределы организма.
Эти методы можно использовать как по отдельности, так и в совокупности. Если же они не возымеют результата и воспаление достигнет жизнеугрожающего уровня, человека придется отправлять на операционный стол.
Консервативное лечение в клинике “На Сенной”
В клинике “На Сенной”вы сможете пройти полную диагностику и своевременно выявить мочекаменную болезнь.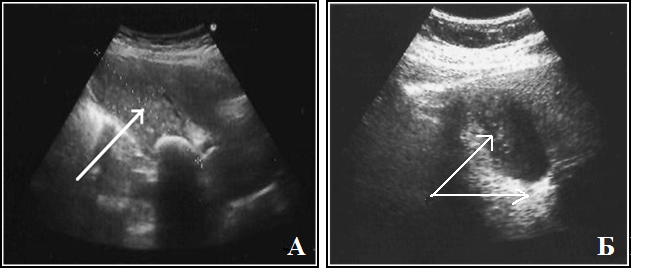 Наши врачи разработают для вас план консервативного лечения, которое поможет за кратчайшее время и с минимальными затратами избавиться от проблемы, не прибегая к операции.
Наши врачи разработают для вас план консервативного лечения, которое поможет за кратчайшее время и с минимальными затратами избавиться от проблемы, не прибегая к операции.
Все наши специалисты обладают высокой квалификацией и обширным опытом работы. Они умеют найти подход к любому пациенту и обеспечить максимальный психологический комфорт на всем протяжении лечения. Доктор назначит вам эффективные и безопасные препараты последнего поколения, порекомендует оптимальную диету и комплекс профилактических мер.
Наша клиника оснащена современным оборудованием и работает в полном соответствии с новейшими отраслевыми стандартами. Наши расценки неизменно держатся на доступном уровне и соответствуют качеству предоставляемых услуг.
Рекомендации по профилактике
Чтобы избежать МКБ, необходимо придерживаться следующих мер:
– расстаться с вредными привычками;
– избегать стрессов;
– приучить себя к регулярным фитнес-тренировкам со сбалансированной нагрузкой;
– ограничить употребление соли;
– проконсультироваться с врачом насчет оптимального питания и подходящего питьевого режима;
– не допускать переохлаждений, прежде всего в районе поясницы;
– ездить в специализированные санатории.
Мочекаменная болезнь имеет свойство возвращаться. Профилактические меры актуальны как для тех, кто уже ее перенес, так и для тех, кто находится в зоне риска по наследственным либо иным факторам.
Камни в почках: описание болезни, причины, симптомы, диагностика и лечение
Основное проявление мочекаменной болезни – формирование камней в почках (они называются солевыми конкрементами). Появляются ноющие боли в нижней части спины, почечные колики, гематурия, пиурия. Диагностические мероприятия заключаются в проведении компьютерной томографии, ультразвукового исследования. Пациенту могут назначить экскреторную урографию, радиоизотопную нефросцинтиграфию. Также исследуются биохимические параметры мочи, крови. Чтобы устранить почечнокаменную болезнь, назначается консервативная терапия, целью которой является растворить образовавшиеся конкременты. Иногда проводится хирургическое лечение, когда камни удаляются (нефролитотрипсия, пиелолитотомия, нефролитотомия).
Общая информация
Образование камней в почках – довольно распространенная патология. Заболевание ещё называют нефролитиазом. Практическая урология свидетельствует о том, что конкременты могут обнаружить как у взрослого, так и у ребёнка. В большинстве случаев заболевание диагностируют у мужчин. Согласно статистическим данным, заболевание поражает правую почку, и лишь в 17-20 процентах диагностируют двухстороннюю локализацию камней.
Если человек страдает мочекаменной болезнью, обнаружить конкременты у него могут не только в почке, но и в мочевом пузыре, мочеточнике, мочеиспускательном канале. В основном, первоначальное образование конкрементов происходит в почке, после чего камни спустятся в нижний отдел мочевого тракта. Камни бывают одиночными и множественными, мелкими и крупными. Мелкие камни не превышают три миллиметра, а крупные могут достигать десяти-пятнадцати сантиметров.
Почему возникают камни
Основной причиной возникновения конкремента в почке является сбой обмена веществ. Особую опасность несет водно-солевой дисбаланс, Нарушенный химический состав крови. Из-за сбоя обмена веществ происходит увеличение соли в моче, в результате чего формируются кристаллы.
Особую опасность несет водно-солевой дисбаланс, Нарушенный химический состав крови. Из-за сбоя обмена веществ происходит увеличение соли в моче, в результате чего формируются кристаллы.
Существует ряд различных факторов, которые способствуют нарушению обмена веществ, что ведет к образованию конкрементов. К таким факторам относят:
-
Человек регулярно употребляет воду, которая содержит много соли. Жесткая вода провоцирует быстрое формирование камня в почке. Люди, которые проживают в регионе с жесткой водопроводной водой, должны пользоваться различными методами, с помощью которых вода смягчается. Это может быть фильтр или народный метод по смягчению воды. Благодаря этому, происходит значительное снижение риска образования конкрементов в почке.
-
Неправильное питание. Если человек регулярно и в большом количестве употребляют кислые, соленые, острые, жареные блюда, повышается кислотность мочи, в результате чего, формируются камни в почке.
 Кроме этого, необходимо максимально исключить соль из рациона, употреблять достаточное количество жидкости в течении суток. Необходимо запомнить, что исключение из повседневного рациона вредных продуктов способствует минимизации риска возникновения как мочекаменного заболевания, так и любого другого.
Кроме этого, необходимо максимально исключить соль из рациона, употреблять достаточное количество жидкости в течении суток. Необходимо запомнить, что исключение из повседневного рациона вредных продуктов способствует минимизации риска возникновения как мочекаменного заболевания, так и любого другого.
-
Организм не получает достаточное количество жидкости. Человек употребляет мало воды, урина становится более концентрированной. Она разжижается благодаря достаточному объему жидкости в организме. Также уменьшается вязкость крови. В этой ситуации организм не только интенсивнее избавляется от вредных веществ, но и снижается вероятность формирования камней. Общепринятая норма ежедневного употребления жидкости – от двух до трех литров. Этот объём может варьироваться в зависимости от наличия других патологий мочевыделительной и сердечно-сосудистой системы. Определить объём воды, которую необходимо употреблять каждый день, способен только квалифицированный специалист.

-
Несоблюдение активного образа жизни. Современное общество страдает от гиподинамии. Физическая активность способствует нормальному циркулированию крови в организме. При малоподвижном образе жизни циркулирование нарушается, поэтому жизненно важные органы и системы получают недостаточное количество кислорода и других питательных веществ. Мочекаменная болезнь часто встречается у лежачих пациентов. Отсутствие достаточной двигательной активности является причиной нарушений в костно-мышечной системе. Происходит быстрое вымывание из костных тканей кальция, Как результат – повышение в крови кальция, который выводится организмом с мочой. Это значит, что начинается формирование камней.
-
Климат. Жаркий климат способствует обезвоживанию организма. Тем более, если употреблять недостаточное количество жидкости. Происходит возрастание концентрации соли в моче, вследствие чего формируются конкременты в почках.

-
Неправильно работают почки и мочевыводящие пути. Любое травмирование этого органа приводит к тому, что застаивается моча. Это также служит причиной сужения мочеточника и верхних мочевыводящих путей. Также может присоединиться инфекция. Такое нарушение следует своевременно выявить и вылечить.
-
Хроническое заболевание пищеварительной и мочеполовой системы. Это бывает при пиелонефрите, цистите, язве желудка. В основном, наличие любой инфекции может стать причиной нарушения обменных процессов. Это значит, что любое воспаление следует своевременно лечить.
-
Костная болезнь, перенесенная травма. Стать причиной конкрементов в почках может наличие остеомиелита, остеопороза и других заболеваний костной системы. Необходимо следить, чтобы костно-мышечный аппарат нормально функционировал.
-
Наследственные факторы.
 Если у близкого родственника диагностировали почечнокаменную болезнь, повышается вероятность её возникновения. Наличие наследственной предрасположенности не является гарантией того, что заболевание появится в любом случае. Если человек будет придерживаться правильного питания и вести активный образ жизни, вероятность формирования камней в почках значительно понизится.
Если у близкого родственника диагностировали почечнокаменную болезнь, повышается вероятность её возникновения. Наличие наследственной предрасположенности не является гарантией того, что заболевание появится в любом случае. Если человек будет придерживаться правильного питания и вести активный образ жизни, вероятность формирования камней в почках значительно понизится.
-
Авитаминоз и гиповитаминоз. Формирование конкрементов в почках может происходить, если в организме витамин C присутствует в большом количестве. Также заболевание может развиться, если не хватает витамина А и Д.
-
Если человек страдает алкоголизмом или употребляет в чрезмерном количестве диуретики. Мочегонные препараты провоцируют быструю потерю жидкости организмом. В результате этого увеличивается концентрация мочи, формируются конкременты в почках. Необходимо запомнить, что дозировка и длительность применения мочегонного препарата определяется исключительно лечащим и квалифицированным врачом.
 Строго запрещено заниматься самолечением.
Строго запрещено заниматься самолечением.
-
Лекарственные препараты. Спровоцировать камни в почках может аскорбиновая кислота, сульфаниламиды и другие препараты, из-за которых нарушаются метаболические процессы.
Описание патогенеза
Нарушенный коллоидный баланс и изменённая почечная паренхима способствует возникновению физико-химических сложных процессов, вследствие чего, начинают образовываться камни в почках. Имеются в виду неблагоприятные местные условия в мочевыводящих путях, то есть инфекции. Такое бывает при пиелонефрите, нефротуберкулезе, цистите, уретрите, простатите, гидронефрозе, дивертикулите.
Отток мочи замедляется, она перенасыщается солями, затем соли выпадают в осадок. Песок и микролиты не отходят с уриной. Развитие инфекционного процесса приведет к тому, что в мочу попадают воспалительные субстраты. Сюда относят слизь, бактерии, гной, белок. Из-за таких веществ образовывается первичное ядро будущего камня. Около этого ядра происходит кристаллизация соли, которая в чрезмерном количестве содержится в моче.
Около этого ядра происходит кристаллизация соли, которая в чрезмерном количестве содержится в моче.
Как классифицируют конкременты
Камни в почках отличаются между собой, учитывая их химический состав.
-
Оксалаты. В состав такого камня входят соли кальция щавелевой кислоты. Они отличаются плотной структурой, темным цветом, шиповатой неровной поверхностью.
-
Фосфаты. Такие камни состоят из солей кальция фосфорной кислоты. Имеют мягкую и крошащуюся консистенцию. Поверхность у них гладкая и немного шероховатая, цвет бело-серый. Отличаются интенсивным ростом, особенно, если в организме присутствует инфекция.
-
Ураты. Это кристаллы соли мочевой кислоты. Отличаются плотной структурой, светло желтым или кирпичным цветом, гладкой или мелко точечной поверхностью.
-
Карбонаты. Формирование таких конкрементов происходит, когда оседают кальциевые соли угольной кислоты.
 У них мягкая структура, светлый оттенок, гладкая поверхность. Могут быть различной формы.
У них мягкая структура, светлый оттенок, гладкая поверхность. Могут быть различной формы.
-
Цистиновые. Состоят из сернистого соединения аминокислоты цистеина. Отличаются такие камни мягкой консистенцией, гладкой поверхностью, округлой формой, бело желтым цветом.
-
Холестериновые. Их можно встретить довольно в редких случаях. В состав таких камней входит холестерин. Они отличаются мягкой крошащейся консистенцией, чёрным цветом.
В некоторых случаях в почке может присутствовать неоднородный, а смешанный камень.
Как проявляется болезнь
Существует ряд основных симптомов камня в почке. А именно:
Болят почки. Локализацией болезненных ощущений является поясничная область. Этот признак может свидетельствовать не только о наличии мочекаменной болезни, но и о другом заболевании. Когда начинается почечная колика, у человека болит левая или правая сторона живота. Такая боль может ощущаться в лобке или в бедре. В такой ситуации человеку требуется незамедлительная квалифицированная помощь.
Такая боль может ощущаться в лобке или в бедре. В такой ситуации человеку требуется незамедлительная квалифицированная помощь.
В моче появляется кровь. Гематурию относят к весьма опасному симптому. Это может свидетельствовать о том, что в почке присутствует камень или опухоль, произошло развитие пиелонефрита или другого воспалительного заболевания.
Больной может сам заметить, что в моче появилась кровь. Урина, которая выводится из организма, приобретает цвет мясных помоев. Кроме этого, развитие гематурии является следствием травмирования мочевого пузыря, почки, чрезмерной физической нагрузки.
Необходимо запомнить, что окрашивание мочи в такой цвет происходит, если употребить некоторые продукты с содержанием соответствующего пигмента. К таким продуктам относятся свеклу, гранат.
Повышается температура тела. Наличие такого признака не говорит о том, что в почке содержится камень. Но увеличение температуры тела в комплексе с другими симптомами почечнокаменной болезни свидетельствует о том, что необходимо в срочном порядке обратиться в клинику.
Появляются отёки. Наличие почечной болезни всегда сопровождается отеками. Происходит отёк рук, ног, лица. В течение дня такая отёчность уменьшается, но утром наблюдается её увеличение. К сожалению, многие оставляют такой симптом без внимания.
Повышается артериальное давление. Развитие артериальной гипертензии является поводом для прохождения обследования. Необходимо обследовать всю мочевыделительную систему.
Мочеиспускание становится болезненным. Если появились болезненные ощущения при мочеиспускании, можно заподозрить камни в почках, развитие цистита, уретрита. В такой ситуации оценивается, какого цвета моча. Она должна быть прозрачной и желтоватого оттенка. При малейшем изменении этих показателей необходимо обратиться к врачу.
Изменился объем выделяемой урины. Происходит сокращение суточного объёма выделяемой мочи.
Как диагностируют заболевания
Чтобы распознать камни в почках, врач собирает анамнез, назначает лабораторные и инструментальные исследования. При пальпаторном осмотре почки у пациента присутствуют болезненные ощущения. Чтобы подтвердить нефролитиаз выполняют:
При пальпаторном осмотре почки у пациента присутствуют болезненные ощущения. Чтобы подтвердить нефролитиаз выполняют:
-
Лабораторную диагностику. Исследуя мочу, можно выявить эритроциты, лейкоциты, белок, соли, бактерии. По биохимическому исследованию мочи и крови можно определить состав и причину формирования камня.
-
Ультразвуковое исследование. Благодаря такому диагностическому методу оценивается, как анатомически изменён орган, где расположен камень, подвижен он или нет. Кроме этого, исключаются такие заболевания, как аппендицит, острый холецистит, так как правосторонняя колика может свидетельствовать об их наличии. Для этого ультразвуковым датчиком исследуется брюшная полость.
-
Рентгеновскую диагностику. Большую часть камней можно определить, проводя обзорную урографию. Белковый и уратный камень не отобразится на рентгеновском снимке, также он не дает тень на обзорной урограмме.
 Для их выявления используется экскреторная урография или пиелография. Благодаря такому методу можно определить, где локализованы конкременты (они могут находиться в лоханке, чашечке, мочеточнике), какой они формы и размера.
Для их выявления используется экскреторная урография или пиелография. Благодаря такому методу можно определить, где локализованы конкременты (они могут находиться в лоханке, чашечке, мочеточнике), какой они формы и размера.
Компьютерную томографию. Такой метод относят к стандарту во время диагностических мероприятий. Объясняется это тем, что на снимке видны камни любого размера и любой плотности. Если необходимо, пациенту назначают радиоизотопную нефросцинтиграфию.
Ответы
ангиомиолипомаАрхивная запись
Очень прошу ответить специалиста: моему отцу (67 лет) поставлен диагноз ангиомиолипома, но вдруг Вы еще что-нибудь увидите в результатах исследований, ведь лучше раньше определить рак, чем когда уже поздно. Буду очень благодарна за ответ.
Направлен в больницу с данными:
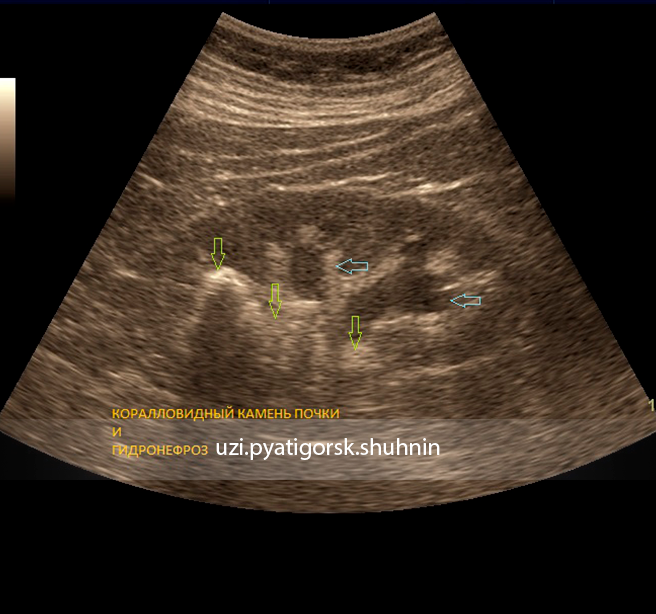
1. УЗИ (15.10.07г): почки в положении лежа расположены обычно, контуры волнистые, размеры: правая 9,5х5,4см, толщина паренхимы-1,4см; левая 9,2х5см, толщина паренхимы-1,4см, эхогенность паренхимы обычная, в паренхиме среднего сегмента правой почки выявляется округлое гипоэхогенное образование-0,8см; ЧЛК умеренно деформирован с обеих сторон, инвагинация паренхимы в почечные синус обеих почек, микролиты и единичные конкременты 0,5см в обеих почках
Заключение: очаговое образование в паренхиме правой почки (киста?-эхо-контроль, связь с клин. -лаб.данными для исключения абсцесса.
-лаб.данными для исключения абсцесса.
2. Анализ крови (25.10.07г.): СОЭ-60, гемоглобин-72,2.
В больнице (гематологическое отделение) проведены следующие исследования:
1. Компьютерная томография (31.10.07г.): на серии поперечных срезов КТ почек с шириной шага 5мм и толщиной среза 5мм – форма, размеры почек обычные, контуры ровные, четкие, полостная система умеренно расширена с обеих сторон, в полостной системе песок. Соотношение полостной системы и паренхимы сохранено. В паренхиме левой почки, по передней поверхности, определяется киста до 11,5мм в диаметре. По задней поверхности левой почки определяется образование неоднородной структуры и плотности размером 13,5х11,5мм. Образование деформирует контур почки. При контрастном усилении (омнипак 350 мк-50мл) образование неравномерно копит контраст. Функции почек сохранена с обеих сторон. Надпочечники не изменены. Забрюшинные л/узлы не увеличены. Свободной жидкости в брюшной полости не определяется.
2. Урография (12.11.07г): почки обычной формы, размеров, расположения. Ренгенконтрастных теней конкрементов не определяется. Функции обеих почек сохранена, полостная система обеих почек (чашечки) деформированные, своды их нечеткие. Признаков сдавления, оттеснения полостной системы отмечается. Цистоидная функция обеих мочеточников сохранена. Мочевой пузырь обычной формы, размеров, расположения с ровными контурами, средней интенсивности, однородной структуры.
Урография (12.11.07г): почки обычной формы, размеров, расположения. Ренгенконтрастных теней конкрементов не определяется. Функции обеих почек сохранена, полостная система обеих почек (чашечки) деформированные, своды их нечеткие. Признаков сдавления, оттеснения полостной системы отмечается. Цистоидная функция обеих мочеточников сохранена. Мочевой пузырь обычной формы, размеров, расположения с ровными контурами, средней интенсивности, однородной структуры.
3. УЗИ (13.11.07г): почки расположены обычно, контуры ровные, размеры: правая-9,8х5,4см, толщины паренхимы-2см; левая-10х5,4см, толщина паренхимы-1,8см, по наружному контуру округлое анэхогенное образование 1,2х1,1см; эхогенность паренхимы почек обычная, ЧЛК умеренно деформирован с обеих сторон, микролиты до 0,3см. Мочеточники, надпочечники не визуализируются. Мочевой пузырь с ровными контурами, стенки не утолщены. Свободной жидкости в брюшной полости и плевральных полостях не выявлено. Увеличенные лимфоузлы брюшной полости и забрюшинного пространства.
4. УЗИ сосудов – атеросклероз брюшного отдела аорты и подвздошных артерий без признаков стеноза.
5. Рентген легких – норма; рентген кишечника – норма; ЭФГДС – норма
Диагноз при выписке: ангиомиолипома. Анализ крови при выписке: СОЭ-40, гемоглобин-104.
Жалобы на данный момент
— не указано —
Прошедшие обследования
— не указано —
Данные биопсии и гистологии
— не указано —
Предшествующее лечение
— не указано —
Наблюдения уролога: лечение камни в почках
Мини-перкутанная нефролитотрипсия справа
Пациентка МО.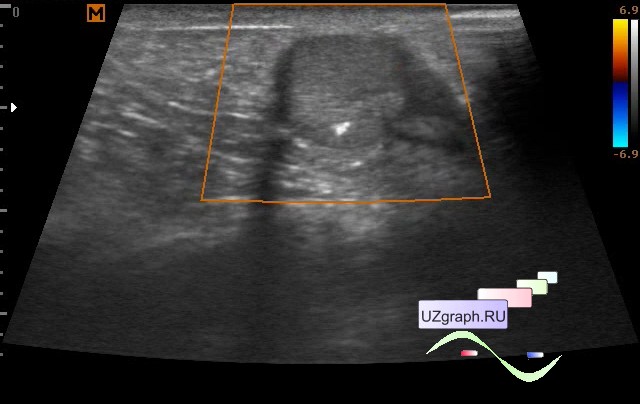 , 48 лет.
, 48 лет.
Диагноз: мочекаменная болезнь, камни почек. Стеноз лоханочно-мочеточникового сегмента слева. Хронический пиелонефрит. Киста правой почки.
Клиническая картина: тупая боль в пояснице у женщины.
Данные анамнеза: считает себя больной с 2007 года, когда впервые на фоне почечной колики слева самостоятельно отошел конкремент коричневого цвета максимальным размером 8 мм. В последующем урологом не наблюдалась. С 22.11.14. отмечает тупую боль в пояснице области слева. При обследовании выявлен камень левой почки, дилатация ЧЛС слева. Консультирована в клинике урологии, госпитализирована для оперативного лечения.
Данные УЗИ: в проекции лоханки и нижней чашечки визуализируются гиперэхогенные включения размерами 16 мм и 11 мм с четкой акустической тенью. Проекции нижней групп чашечек также визуализируются гиперэхогенные включения размером до 3 мм без четкой акустической тени.
Данные МСКТ: с контрастированием в средне сегменте правой почки определяется киста размером 13 мм. В лоханке левой почки визуализируется конкремент треугольной формы размерами 16х13 мм плотностью 1998 ед.Н. В средней чашечке левой почки конкременты размерами 11 мм плотностью 1161 ед.Н. В нижней и средней группах чашечек левой почки, а также в нижней чашечке правой почки визуализируются конкременты размерами от 1 до 4 мм. ЧЛС слева расширена: чашечки до 19 мм, лоханка до 19 мм. Отмечается утолщение стенки лоханки левой почки до 9 мм, лоханочно-мочеточниковый сегмент сужен до нитевидного на протяжении 11 мм. Левый мочеточник заполняется контрастным препаратом в позднюю отсроченную фазу, стенка его утолщена в верхней трети до 5 мм, контур его неровный, тяжистый за счет воспалительного перипроцесса. Матка увеличена в размере, отклонена кзади.
В лоханке левой почки визуализируется конкремент треугольной формы размерами 16х13 мм плотностью 1998 ед.Н. В средней чашечке левой почки конкременты размерами 11 мм плотностью 1161 ед.Н. В нижней и средней группах чашечек левой почки, а также в нижней чашечке правой почки визуализируются конкременты размерами от 1 до 4 мм. ЧЛС слева расширена: чашечки до 19 мм, лоханка до 19 мм. Отмечается утолщение стенки лоханки левой почки до 9 мм, лоханочно-мочеточниковый сегмент сужен до нитевидного на протяжении 11 мм. Левый мочеточник заполняется контрастным препаратом в позднюю отсроченную фазу, стенка его утолщена в верхней трети до 5 мм, контур его неровный, тяжистый за счет воспалительного перипроцесса. Матка увеличена в размере, отклонена кзади.
С целью восстановления оттока мочи из левой почки, предотвращения развития острого обструктивного пиелонефрита показано оперативное лечение, направленное на избавление больной от камней левой почки. Учитывая размеры, количество и плотность конкрементов, а также подозрение на стеноз ЛМС слева, показана перкутанная нефролитотрипсия слева. В ходе операции осмотрена зона ЛМС, необходимости в выполнение эндопиелотомия не было.
Учитывая размеры, количество и плотность конкрементов, а также подозрение на стеноз ЛМС слева, показана перкутанная нефролитотрипсия слева. В ходе операции осмотрена зона ЛМС, необходимости в выполнение эндопиелотомия не было.
Камни полностью удалены. Время оперативного пособия составила – 65 минут. Осложнений ни во время операции, ни после не отмечалось. После операции нефростомический дренаж удален на вторые сутки, после выполненного антеградного контрастного рентгенологического исследования. На третьи сутки пациент была выписана домой.
Задать вопрос
Песок в почках — причины, симптомы, диагностика и лечение
Песок в почках — это образование и накопление в чашечках и почечных лоханках белково-кристаллической взвеси, содержащей микроконкременты диаметром до 1 мм. При отсутствии другой урологической патологии протекает бессимптомно. У некоторых пациентов наблюдается дизурия, учащение позывов к мочеиспусканию, болезненность в поясничной области, субфебрилитет. Диагностируется с помощью общего и биохимического анализа мочи, УЗИ почек. Терапевтическая программа включает коррекцию образа жизни, рациона, питьевого режима, лечение урологической, эндокринной и другой основной патологии, назначение почечных фитопрепаратов, спазмолитиков, НПВС, диуретиков.
Диагностируется с помощью общего и биохимического анализа мочи, УЗИ почек. Терапевтическая программа включает коррекцию образа жизни, рациона, питьевого режима, лечение урологической, эндокринной и другой основной патологии, назначение почечных фитопрепаратов, спазмолитиков, НПВС, диуретиков.
Общие сведения
В последней редакции МКБ-10 песок, выявляемый в почках, не рассматривается в качестве отдельной нозологической единицы. Фактически микролитиаз является преморбидным состоянием или начальной обратимой стадией почечнокаменной болезни. По результатам наблюдений, при тщательном исследовании микроконкременты в почках и моче определяются у 70% обследуемых, что связано с нарастающей гиподинамией населения, нерациональным питанием, недостаточным употреблением воды. Образование песка чаще наблюдается у мужчин в возрасте 20-55 лет. Из-за небольшого размера частиц выявление почечного микролитиаза с помощью традиционных скрининговых методов диагностики представляет определенные сложности.
Песок в почках
Причины
Поскольку появление микролитов обычно является одним из начальных признаков почечнокаменной болезни, их образование вызвано теми же экзогенными и эндогенными этиологическими факторами, что и более крупных конкрементов. В большинстве случаев микролитиаз становится следствием обменных нарушений, в то время как заболевания почек и других органов мочевыделительной системы создают предпосылки для камнеобразования. Специалисты в сфере урологии и нефрологии выделяют следующие причины формирования песка:
- Неблагоприятная наследственность. Риск почечного микролитиаза возрастает у пациентов, в роду у которых была диагностирована мочекаменная болезнь или предрасполагающие к ней метаболические расстройства. Генетические предпосылки к образованию песка существуют у больных, страдающих идиопатической семейной гиперурикемией, мочесолевым диатезом, оксалозом, наследственной цистинурией и др.
- Алиментарные факторы.
 Уратный почечный песок чаще выявляется при несбалансированном рационе с избытком белков животного происхождения. При употреблении в пищу больших количеств бобов, свеклы, щавеля, шпината, лиственных овощей возрастает риск осаждения оксалатов. Микролиты быстрее образуются при дисбалансе витаминов D, A, C, питье жёсткой воды с ионами кальция, магния, фосфора.
Уратный почечный песок чаще выявляется при несбалансированном рационе с избытком белков животного происхождения. При употреблении в пищу больших количеств бобов, свеклы, щавеля, шпината, лиственных овощей возрастает риск осаждения оксалатов. Микролиты быстрее образуются при дисбалансе витаминов D, A, C, питье жёсткой воды с ионами кальция, магния, фосфора. - Гиперфункция паращитовидных желёз. Причиной формирования микрокальцинатного песка является высокая концентрация паратгормона, который усиливает канальцевую реабсорбцию ионов кальция в почках. Повышение уровня паратиреоидного гормона отмечается при гиперплазии, опухолях паращитовидных желез, наследственной остеодистрофии, синдромах Золлингера-Эллисона, Олбрайта.
- Урологические заболевания. Провоцирующими факторами микролитообразования при болезнях мочевыводящих органов являются застой, способствующий повышению концентрации мочи, и изменение ее pH. Риск формирования конкрементов увеличивается при хроническом пиелонефрите, гломерулонефрите, лекарственных нефропатиях, сморщенной почке, мочеполовых свищах, аномалиях строения почек.

Вероятность обнаружения песка при скрининговом исследовании почек повышена у жителей стран с влажным и жарким климатом, лежачих больных, людей, ведущих малоподвижный образ жизни, страдающих генитальными инфекциями, заболеваниями органов ЖКТ, печени, желчных путей, кариесом, хроническим тонзиллитом, саркоидозом, лейкемией, болезнью Крона. В группу риска также входят пациенты, длительно употребляющие сульфаниламиды, диуретики, кортикостероиды.
Патогенез
Основой для образования песка в почках является ускорение преципитации литообразующих компонентов мочи (кальция, магния, оксалатов, уратов, фосфатов, аминокислот и пр.) в условиях повышения их концентрации и нестабильности pH. В формировании органической матрицы, на которой осаждаются солевые кристаллы, могут участвовать белковые молекулы, эритроциты, лейкоциты, микроорганизмы, почечный эпителий.
При возникновении дисбаланса между количественно-качественным соотношением солей и защитными коллоидами, удерживающими минеральные составляющие мочи в растворенном состоянии, соединения с повышенной концентрацией кристаллизуются на органическом матриксе. В результате в почках образуется белково-солевая взвесь, содержащая микролиты диаметром до 0,8-0,9 мм и не оформленная в более крупные конкременты. Как и камни при почечнокаменной болезни, песок по составу может быть карбонатным, уратным, оксалатным, фосфатным, цистиновым, белковым, смешанным.
В результате в почках образуется белково-солевая взвесь, содержащая микролиты диаметром до 0,8-0,9 мм и не оформленная в более крупные конкременты. Как и камни при почечнокаменной болезни, песок по составу может быть карбонатным, уратным, оксалатным, фосфатным, цистиновым, белковым, смешанным.
Симптомы песка в почках
У большинства пациентов симптоматика отсутствует. Возможен клинический дебют при травмировании слизистой оболочки вследствие движения песка по мочевым путям. В таких случаях наблюдается дизурия, частые позывы к мочеиспусканию, чувство неполноты опорожнения пузыря, режущие боли в области поясницы с иррадиацией в пах или в верхние отделы живота (иногда болевой синдром напоминает почечную колику). При сильном повреждении эпителия почек и мочеточников появляется кровь в моче. В крайне редких случаях нарушается общее состояние больного: отмечается подъем температуры тела до субфебрильных цифр, ознобы, повышенная потливость, бледность кожи и слизистых, тошнота и рвота.
Осложнения
Длительное течение микролитиаза усиливает застой мочи, что является основным предрасполагающим фактором для размножения патогенных микроорганизмов. Развиваются инфекции почек и мочевыводящих путей – пиелонефриты, уретериты, циститы. При отсутствии лечения бактериальных процессов возможно возникновение пионефроза.
Основная опасность песка, присутствующего в почках, — прогрессирование нефролитиаза с формированием крупных конкрементов, обструкцией мочевыводящего тракта, нарушением функции почек вплоть до хронической почечной недостаточности, которая возникает спустя несколько лет от начала заболевания и характеризуется прогрессирующим снижением фильтрационной способности нефронов. У части пациентов ситуация усугубляется стойкой артериальной гипертензией на фоне нарушения ренин-ангиотензин-альдостероновой регуляции.
Диагностика
Постановка диагноза зачастую затруднена, поскольку клинические симптомы отсутствуют или являются неспецифичными, характерными для другой почечной патологии.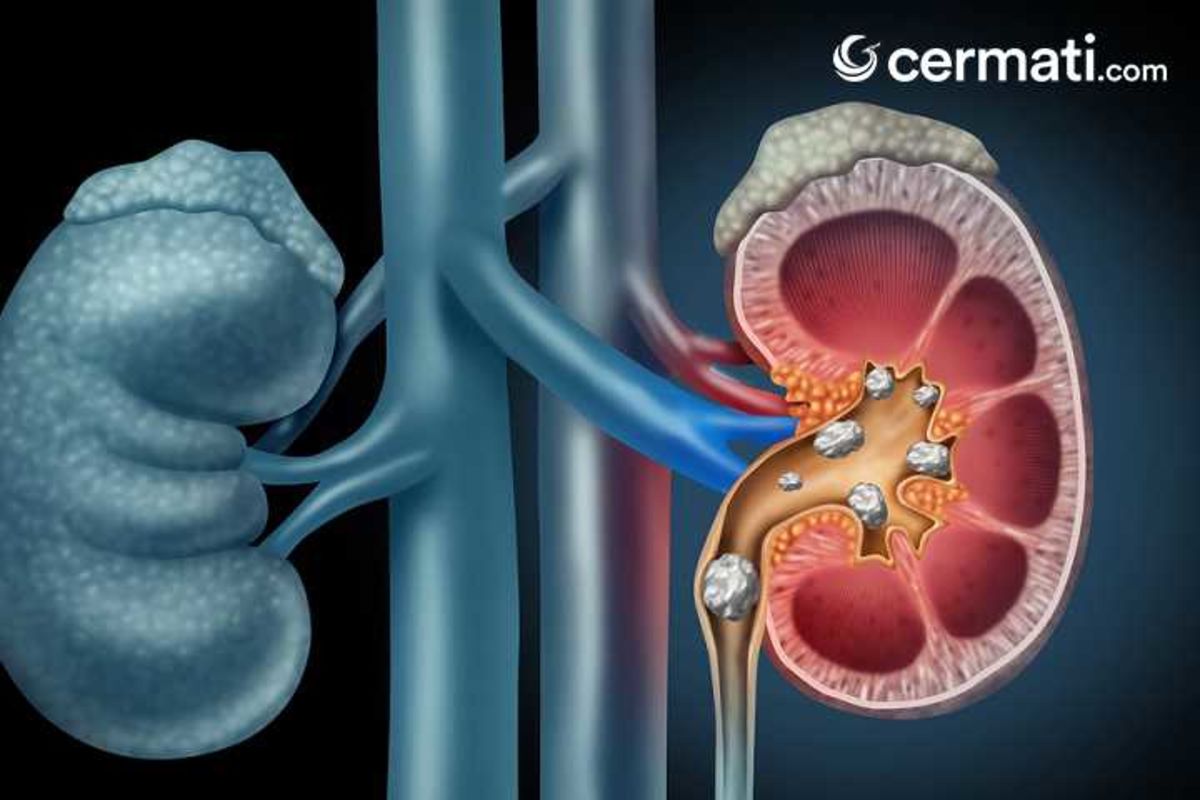 Подтвердить наличие песка в почках можно только после проведения комплексного лабораторного и инструментального обследования. План диагностики для пациента с подозрением на микролитиаз включает следующие методы:
Подтвердить наличие песка в почках можно только после проведения комплексного лабораторного и инструментального обследования. План диагностики для пациента с подозрением на микролитиаз включает следующие методы:
- Сонография почек. Чаще всего о возможном присутствии микроконкрементов в мочевыводящих путях больной узнает при плановом УЗИ почек по поводу другого заболевания. Поскольку размеры частиц песка не позволяют их достоверно визуализировать, обычно микролитиаз описывается как повышение эхогенности и может быть гипердиагностирован.
- Общий анализ мочи. В осадке мочи определяется песок в виде кристаллов солей. Важный признак — изменение рН среды в кислую или щелочную сторону в зависимости от типа камнеобразования. Исследование дополняют биохимическим анализом мочи, позволяющим выявить повышение концентраций кальция, оксалатов, мочевой кислоты, магния, неорганического фосфора.
Крупные микролиты могут быть обнаружены при проведении экскреторной урографии, радиоизотопной нефросцинтиграфии, однако эти методы более информативны на следующих стадиях почечнокаменной болезни.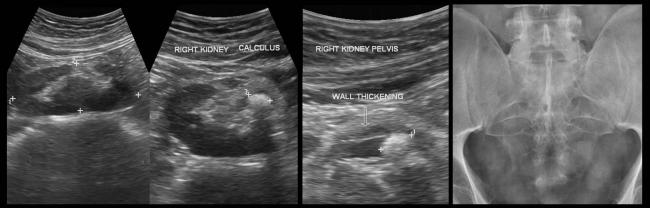 Для комплексной оценки состояния мочевыделительной системы назначают обзорную урографию, КТ, МРТ почек, мочеточников, мочевого пузыря, уретры. При наличии показаний исследуют кровь для обнаружения повышенных уровней мочевой кислоты, кальция, магния, паратгормона.
Для комплексной оценки состояния мочевыделительной системы назначают обзорную урографию, КТ, МРТ почек, мочеточников, мочевого пузыря, уретры. При наличии показаний исследуют кровь для обнаружения повышенных уровней мочевой кислоты, кальция, магния, паратгормона.
Дифференциальная диагностика почечного микролитиаза проводится с хроническим интерстициальным нефритом, злокачественными новообразованиями, туберкулезным поражением почек, острым и хроническим пиелонефритом, нефропатией при отравлении свинцом. Помимо посещения врача-нефролога и уролога пациентам рекомендованы консультации онколога, фтизиатра, инфекциониста, терапевта, эндокринолога.
Лечение песка в почках
Терапевтическими задачами при наличии ренального микролитиаза являются выведение из мочевыделительных органов белково-кристаллических образований, купирование патологических симптомов (при их наличии), предупреждение повторного литообразования. Ведущими считаются немедикаментозные методы, которые при необходимости дополняются препаратами для улучшения уродинамики, растворения микролитов, повышения стабильности мочи. При наличии в почках песка показаны:
При наличии в почках песка показаны:
- Коррекция образа жизни и привычек. Пациенту рекомендуется увеличение физической активности: занятия плаванием, йогой, ЛФК, продолжительные пешие прогулки, отказ от пользования лифтом. Микролитообразование замедляется при отказе от курения и злоупотребления спиртными напитками.
- Высокожидкостный питьевой режим. Объём потребляемой жидкости должен составлять 1,7-3,0 л чистой негазированной воды в день. Это позволяет увеличить диурез и снизить концентрацию мочи, что обеспечивает ускорение выведения существующего песка и предотвращение образования новых микролитов.
- Контроль опорожнения мочевого пузыря. При регулярном отхождении мочи уменьшается её застой, снижается избыточная реабсорбция, улучшается фильтрация. Особенно важно своевременное опорожнение мочевого пузыря у больных с другой диагностированной уропатологией.
- Изменение питания. Рекомендовано исключить из рациона кофе, крепкий чай, кофеин-содержащие напитки, ограничить употребление специй, копчёностей, маринадов, соли, жирных блюд.
 При наличии микроуратов эффективно ограничение мяса и рыбопродуктов, при оксалатном микролитиазе — щавеля, ревеня, листовых овощей, при фосфатном — молочная диета.
При наличии микроуратов эффективно ограничение мяса и рыбопродуктов, при оксалатном микролитиазе — щавеля, ревеня, листовых овощей, при фосфатном — молочная диета.
Медикаментозная терапия направлена на этиопатогенетическое лечение заболеваний, осложняющихся нефролитиазом. Для растворения песка, нормализации уровня pH, предупреждения дальнейшего камнеобразования применяют растительные сборы и фитопрепараты, обладающие литолитическим, противовоспалительным, уросептическим, диуретическим, спазмолитическим эффектом.
Подбор конкретного лекарственного средства выполняется с учётом состава песка, выявленного в почках. При наличии выраженных клинических симптомов назначают спазмолитики, нестероидные противовоспалительные средства, тиазидные диуретики. Хирургическое лечение не проводится, поскольку размер микроконкрементов позволяет им самостоятельно выделяться без риска обструкции мочевыводящих путей.
Прогноз и профилактика
При своевременной диагностике и правильной врачебной тактике обычно удается достичь стойкой ремиссии. Прогноз благоприятный. Методы профилактики включают терапию патологических состояний, которые могут осложниться образованием песка, достаточную двигательную активность, сбалансированную диету с достаточным количеством витаминов, микроэлементов, фитонутриентов.
Прогноз благоприятный. Методы профилактики включают терапию патологических состояний, которые могут осложниться образованием песка, достаточную двигательную активность, сбалансированную диету с достаточным количеством витаминов, микроэлементов, фитонутриентов.
Особую роль в предупреждении почечного микролитиаза у предрасположенных пациентов играет соблюдение высокожидкостного питьевого режима, коррекция рациона при наличии наследственной отягощённости с ограничением употребления некоторых продуктов питания в соответствии с данными о метаболических нарушениях и составе камней у больных родственников, регулярное скрининговое исследование мочи.
Какой период человеческого общества называют каменным веком? — Mvorganizing.org
Какой период человеческого общества называется каменным веком?
Каменный век был широким доисторическим периодом, в течение которого камень широко использовался для изготовления инструментов с острием, острием или ударной поверхностью. Этот период длился примерно 3,4 миллиона лет и закончился между 8700 и 2000 гг. До н.э. с появлением металлообработки.
Этот период длился примерно 3,4 миллиона лет и закончился между 8700 и 2000 гг. До н.э. с появлением металлообработки.
Что вы знаете о микролитах?
Микролит — это небольшой каменный инструмент, обычно сделанный из кремня или сланца, обычно около сантиметра в длину и полсантиметра в ширину.Они были созданы людьми примерно 35 000–3 000 лет назад в Европе, Африке, Азии и Австралии. Микролиты использовались в наконечниках копий и стрел.
Какой возраст микролитический возраст?
Эпоха мезолита
В каких микролитах каменного века обычно находили?
В каком из следующих эпох чаще всего находили микролиты в каменном веке? Примечания: Микролиты чаще всего находили в эпоху мезолита.
Какие микролиты приводят примеры?
треугольной, квадратной или трапециевидной формы, называемых микролитами.Эти маленькие кусочки острого кремня были зацементированы (с использованием смолы) в канавке в куске дерева, чтобы сформировать инструмент с режущей кромкой, более длинной, чем это было возможно из цельного куска хрупкого кремня; примеры — копье.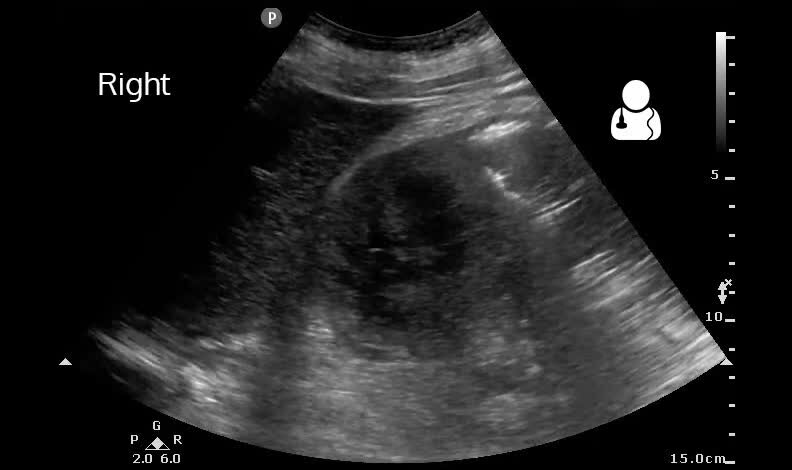 / span>
/ span>
Что такое Microliths History 6?
Эпоха мезолита: Каменные орудия этого периода, также известные как микролиты, были меньше, острее и эффективнее, чем орудия более раннего периода. В это время использовались камень, кости животных и рога.
В чем разница между монолитом и микролитом?
Как существительные, разница между монолитом и микролитом состоит в том, что монолит — это большой цельный каменный блок, используемый в архитектуре и скульптуре, а микролит — это (археология) небольшой каменный инструмент.
Что такое микролит с медицинской точки зрения?
Медицинское определение микролита: микроскопический камень или конкреционный разрыв микролитов в кровеносных сосудах — Современная медицина — сравните гравийное ощущение 1.
Что такое микролит в почках?
Почечный микролитиаз или микрокалькулы (РМ) определяется как ультразвуковое обнаружение гиперэхогенных отложений диаметром менее 3 мм в чашечках почек, лоханке или мочеточнике. Если микрокалькулы располагаются только в чашечках, их называют микролитиазом чашечек почек (5-8).
Кто известен как отец индейцев в истории, в которой обычно находили микролиты каменного века?
Роберт Брюс Фут
Как мезолит человек использовал микролиты?
Каменные орудия, найденные в период мезолита, называются микролитами. Обычно они были крошечными по размеру. Человек мезолита, вероятно, прикрепил эти камни к рукояткам из костей или дерева, чтобы сделать такие инструменты, как пилы и серпы. Эти инструменты использовались для рытья земли и сшивания одежды./ промежуток>
Какие новые инструменты использовал человек мезолита?
Скребки использовались для очистки шкур животных в процессе изготовления кожи. Резцы использовались для резьбы или гравировки дерева и кости, как долото. Лезвия использовались как ножи, а микролиты представляли собой крошечные кремни, которые приклеивались / прикреплялись к деревянным древкам для изготовления стрел или копий для охоты.
Что означает период мезолита?
Средний каменный век
Как эпоха мезолита знаменует собой переход от эпохи палеолита?
Этот период имел самую длинную историю человечества i.е. 99% поколения человечества было охвачено в этот период. В этот период использовались небольшие каменные орудия, известные как микролиты. В эту эпоху произошли изменения окружающей среды. Например. Исследования показали, что на этом периоде закончился ледниковый период. / период>
Что было изобретено в эпоху мезолита?
Другие изобретения эпохи мезолита Горшки из обожженной на солнце глины использовались для хранения еды и воды. Лук и стрела, изобретенные либо в конце периода палеолита, либо в период мезолита, служили охотникам и воинам, пока огнестрельное оружие не заняло свое место в 14 веке нашей эры./ промежуток>
Какое значение имеет эпоха мезолита?
Эпоха мезолита была переходной фазой между эпохой палеолита и эпохой неолита. Он имеет характеристики как эпохи палеолита, так и эпохи неолита. Люди этого возраста жили охотой, рыбной ловлей и собиранием пищи, а на более позднем этапе они также приручили животных. / Span>
Какое влияние оказало земледелие на каменный век?
Влияние земледелия на людей в каменном веке: оно позволяло им строить постоянные поселения.Это позволяло им путешествовать. Это позволило им нарисовать пещеры. Это позволяло им охотиться на животных. / Продолжительность>
Каковы основные черты индийского мезолитического искусства?
Некоторые из характерных черт мезолитических росписей:
- На них изображены сцены повседневной жизни, такие как охота, танцы, домашние животные и т. Д. Нарисованные
- фигур имеют меньший размер. Было использовано
- белого, зеленого, желтого и красного цветов.
- картины описывают период, когда охотничьи сообщества начали оседать.
Почечные канальцы — обзор
Enzymuria
Почечные канальцы метаболически активны и отвечают за абсорбцию или выведение широкого спектра веществ. Транспорту этих соединений способствуют несколько ферментов, которые в больших количествах обнаруживаются в лизосомах внутри или в щеточных краях эпителиальных клеток канальцев. Регулярный оборот этих клеток и высвобождение эндоцитотических пузырьков и лизосом в просвет канальцев приводит к активности ферментов в моче (энземурия). 291 Ряд веществ, которые фильтруются в клубочках (включая желчные кислоты, аминогликозидные и цефалоспориновые антибиотики, маннит, декстраны, рентгенографические контрастные вещества и тяжелые металлы), попадают через эндоцитоз в эпителиальные клетки проксимальных канальцев. Эндоцитозные везикулы соединяются с лизосомами, и вещества, которые не расщепляются лизосомальными ферментами, впоследствии вытесняются в просвет канальцев за счет эвакуации остаточных тел.
Воспаление или некроз эпителиальных клеток канальцев приводит к повышению активности лизосомальных ферментов и ферментов щеточной каймы в моче.Поскольку эпителиальные клетки проксимальных канальцев являются наиболее метаболически активными из всех клеток почек, они особенно подвержены ишемическому повреждению. Более того, они могут быть повреждены аналогичным образом при воздействии большого количества нефротоксинов в клубочковом фильтрате. В результате определение активности определенных мочевых ферментов может предоставить доказательства повреждения канальцев за несколько дней до развития азотемии. 292-295 Дополнительные факторы, способствующие увеличению активности ферментов в моче, включают (1) ферменты с низкой молекулярной массой, такие как амилаза, которые обычно фильтруются клубочками и реабсорбируются в проксимальных канальцах, (2) постренальный эпителий мочеполовых путей, который обычно вносит незначительный вклад. составляют общую активность ферментов мочи (если они не становятся неопластическими) и (3) секреции дополнительных половых желез.Вклад последних объясняет, почему интактные мужчины, как правило, имеют более высокую мочевую активность лактатдегидрогеназы (ЛДГ) и N -ацетил-β-d-глюкозаминидазы (NAG).
Хотя в моче разных видов было обнаружено более 40 ферментов, лишь немногие из них имеют диагностическое значение. Для клинического применения мочевой фермент должен обладать измеримой активностью в почках; его активность должна находиться в узком диапазоне в моче здоровых животных; он должен быть достаточно большим (молекулярная масса более 60 000), чтобы не фильтроваться свободно через клубочки; и его активность должна возрасти достаточно рано во время повреждения почек, чтобы можно было назначить корректирующее лечение.Наконец, активность мочевого фермента должна оставаться довольно стабильной в моче в течение нескольких дней без необходимости специальной обработки. Было продемонстрировано, что у людей и собак ряд ферментов, включая NAG, LDH, β-глюкуронидазу, аланин-аминопептидазу, щелочную фосфатазу (ALP), лейцинаминопептидазу, γ-глутамилтрансферазу (GGT) и калликреин, являются чувствительными индикаторами почечной недостаточности. повреждать. 292-294 296 297 Что касается лошадей, были установлены нормальные значения активности GGT, ALP, NAG, LDH и калликреина. 298-302 Попытки определить активность аспартатаминотрансферазы и аланинаминотрансферазы в нормальной лошадиной моче не увенчались успехом. 299
ALP и GGT представляют собой ассоциированные с мембраной ферменты, обнаруженные в основном в щеточной кайме проксимального эпителия канальцев. 293-297,303 Их активность в эпителии дистальных канальцев незначительна. 257 Эти ферменты обладают активностью в других тканях, но поскольку они не фильтруются клубочками, предполагается, что повышенная активность в моче при отсутствии значительной протеинурии происходит из почек.Измеряемая активность в нормальной моче объясняется обменом клеток. 293 ЛДГ является более распространенным энзимом эпителия канальцев, проявляющим такую же активность в дистальных канальцах и мозговых сосочках, как и в эпителии проксимальных канальцев. 296-303 NAG — лизосомальный фермент проксимальных канальцев. 293-303 Только GGT, ALP, LDH и NAG были проанализированы в моче лошадей, о которых известно или предположительно имеется какая-либо форма почечной дисфункции. Определение активности NAG в нормальной лошадиной моче может быть затруднено из-за ее щелочности, а нормальные значения могут быть меньше определяемых пределов анализа, когда используется спектрофотометрический, а не флуорометрический метод. 304-307 Опубликованные нормальные активности (выраженные на грамм Cr) для этих ферментов в моче лошади: GGT: от 0 до 25 МЕ / г Cr; ЩФ: от 0 до 28 МЕ / г Cr; LDH: от 0 до 12 МЕ / г Cr; и НАГ: менее 1 МЕ / г Cr (менее 2 МЕ / л мочи). Сравнение с концентрацией Cr, которая является относительно постоянной, приводит к меньшим вариациям, связанным с объемом, и позволяет интерпретировать случайно собранный образец (по сравнению с образцом мочи, полученным в течение определенного периода сбора). 298,308,309
Факторы, которые необходимо учитывать при измерении активности ферментов в моче, включают условия, при которых хранился образец мочи, pH мочи, суточные вариации, половые и возрастные вариации, а также другие встречающиеся в природе ингибиторы или промоторы ферментативной активности моча (альбумин, мукопротеины, протеолитические агенты, аминокислоты и аммиак).Хотя эти факторы получили ограниченное количество исследований в отношении мочи лошадей, было документально подтверждено, что замораживание может снизить активность всех ферментов, особенно GGT. Кроме того, чем ниже температура, тем быстрее теряется активность ферментов. 298 Для получения наиболее точных результатов следует охладить образцы (4 ° C) и проанализировать их в течение 72 часов после сбора. У видов, у которых pH мочи слабокислый или нейтральный, анализ NAG считается одним из наиболее ценных доступных диагностических тестов.Однако его активность, по-видимому, чувствительна к изменениям pH. У людей, получающих нефротоксические препараты, активность NAG в моче становилась неопределяемой при значениях pH выше 8. 310 Аналогичным образом, активность NAG не определялась (менее 2 МЕ / л) в моче здоровых лошадей. 311 В исследовании токсикоза монензина у лошадей активность NAG увеличивалась по мере снижения pH мочи. 300 Определенные аминокислоты и аммиак, кроме того, действуют как ингибиторы лизосомальных ферментов, таких как ALP и NAG, в моче людей, собак и крыс, 312 313 , и были разработаны методы удаления этих агентов из мочи с помощью гель-фильтрации. проба их активности. 314
Теоретически оценка изменений мочевой активности выбранных ферментов может помочь клиницисту определить сегмент нефрона, страдающий наибольшей дисфункцией или повреждением. Хотя NAG, GGT и ALP связаны в первую очередь с эпителием проксимальных канальцев, ЛДГ обычно связана с эпителиальными клетками дистальных канальцев. Увеличение активности GGT и ALP в моче было экспериментально индуцировано у лошадей, получавших гентамицин и неомицин в течение 5-10 дней. 315 316 Повышение также было измерено у лошадей с диареей, острым абдоминальным кризом и эндотоксическим шоком. В последних случаях предполагалось, что энземурия указывает на повреждение канальцев после ишемии. Пять последовательных дней введения фуросемида также приводили к умеренному увеличению активности GGT и ALP, причем активность ALP увеличивалась быстрее. 311 Однако 48 часов водного голодания не вызвали никаких изменений в активности GGT, ALP или LDH. 302 Аналогичным образом не наблюдалось изменений активности ЛДГ в моче у лошадей, которым вводили фенилбутазон (8.8 мг / кг перорально) ежедневно в течение 6 дней. 302
Хотя увеличение активности ферментов в моче обычно указывает на острое повреждение канальцев, необходимо тщательно интерпретировать соотношение ферментов к Cr в моче. Пороговые значения, выше которых повышение является значительным, не были хорошо задокументированы, хотя в одном исследовании сообщалось, что значение GGT / Cr более 25 МЕ / г указывает на повреждение трубок. 298 Напротив, в исследовании нефротоксичности, вызванной гентамицином, у пони-кобыл, Хинчклифф и его коллеги 315 измерили значения GGT / Cr, превышающие 100 МЕ / г, за несколько дней до измерения увеличения концентрации Cr.Кроме того, часто можно измерять значения GGT / Cr от 25 до 100 МЕ / г у лошадей, получающих гентамицин в рекомендуемых дозах. Подобно фармакокинетике гентамицина, энземурия у этих лошадей сильно варьирует; у этих лошадей не обнаружено риска развития острой почечной недостаточности. Хотя энзимурия, вероятно, отражает степень повреждения канальцев у этих пациентов, следует с осторожностью интерпретировать увеличение значений GGT / Cr между 25 и 100 МЕ / г, тогда как повышение более 100 МЕ / г с большей вероятностью будет клинически значимым.
Лошади с хроническим заболеванием почек могут иметь нормальную или пониженную активность ферментов, что отражает клеточные изменения, происходящие в нефроне в ответ на хроническое воспаление. Так же, как концентрации азота мочевины и хрома могут быть нормальными на ранних стадиях почечной недостаточности; активность ферментов в моче может неточно отражать почечную дисфункцию на более позднем этапе развития болезни, когда результаты анализов крови и мочи с большей вероятностью будут отклоняться от нормы. Возможная причина этого явления заключается в том, что существенное разрушение эпителия канальцев, происходящее на ранней стадии заболевания, оставляет меньшее количество эпителиальных клеток, которые являются постоянным источником повышенной активности ферментов.С другой стороны, регенерирующие эпителиальные клетки канальцев могут быть более невосприимчивыми к воздействию токсина.
В целом, определение активности ферментов в моче не получило признания в качестве рутинного метода измерения повреждения почечных канальцев в большинстве клиник для лошадей. Такое неприятие можно объяснить высокой чувствительностью к выявлению субклинических повреждений почечных канальцев. Например, хотя отношение GGT / Cr в моче, повышенное до значения 75, свидетельствует о повреждении канальцев, оно не дает клиницисту поддающегося количественной оценке риска развития острой почечной недостаточности.Таким образом, как единичное измерение, соотношение имеет ограниченное применение при принятии решения о прекращении приема нефротоксических препаратов (например, гентамицина). Напротив, более резкое повышение соотношения GGT / Cr может предшествовать развитию азотемии и может быть полезным предупреждением о том, что может потребоваться прекратить прием лекарства или, как минимум, продлить интервал между приемами. До тех пор, пока значения активности ферментов в моче не будут сообщены для большего числа пациентов-лошадей с различными заболеваниями, истинная ценность оценки активности ферментов в моче останется неясной.
Легочно-альвеолярный микролитиаз | Европейское респираторное общество
Реферат
Легочный альвеолярный микролитиаз (ПАМ) — удивительное редкое заболевание легких, которое связано с накоплением микролитов гидроксиапатита в просвете альвеолярных пространств. У большинства пациентов ПАМ обнаруживается случайно на рентгенограммах, сделанных для других целей, и типичное течение болезни характеризуется медленно прогрессирующей дыхательной недостаточностью на протяжении десятилетий.Недавние генетические анализы, которые показали, что дефицит натрий-фосфатного котранспортера NPT2B является причиной PAM, позволили разработать мощные модели на животных, которые используются в нашем подходе к ведению и лечению заболеваний. Здесь мы рассматриваем эпидемиологию и молекулярную патофизиологию PAM, а также диагностический подход, клинические проявления, рентгенологические и патологические особенности и клиническое ведение болезни. Несмотря на то, что не существует проверенных методов лечения ПАМ, прогресс в нашем понимании патогенеза заболевания дает представление, которое предлагает стратегии для испытаний.
Реферат
Обзор эпидемиологии и молекулярной патофизиологии легочного альвеолярного микролитиаза https://bit.ly/3lBgM7p
Введение
Легочный альвеолярный микролитиаз (ПАМат) является редкой наследственной патологией фосфорной болезни. накопление кристаллов фосфата кальция в альвеолярных воздушных пространствах легких. ПАМ был впервые описан Мальпиги [1] в 1686 году и назван Пуром [2] в 1933 году. Во всем мире зарегистрировано более 1000 случаев [3].Заболевание часто обнаруживается случайно у бессимптомных субъектов и имеет тенденцию к медленному прогрессированию, часто приводя к дыхательной недостаточности в среднем возрасте. Попытки лечить ПАМ эмпирически всегда были безуспешными, и трансплантация легких остается единственным лекарством от терминальной стадии болезни. Открытие того, что мутации в гене-переносчике фосфата натрия SLC34A2 вызывают PAM, пролило новый свет на патогенез заболевания и предложило новые подходы к испытаниям.
Эпидемиология
PAM зарегистрирован почти на всех континентах.Большинство случаев в литературе было из Азии (56,3%) и Европы (27,8%) [3]. Заболеваемость на миллион человек составляет примерно 1,85 для Турции, 1,08 для Италии, 0,92 для Японии, 0,15 для США, 0,10 для Китая и 0,06 для Индии. В литературе примерно 50% пациентов составляют мужчины и 41% — женщины, при этом пол не указан в 9% случаев. Диагноз чаще всего ставится во втором-четвертом десятилетии и регистрируется у людей всех возрастов, от младенцев до восьмидесятилетних [4–7].
Спорадические мутации встречаются примерно в двух третях случаев. В отчете Castellana [3] выявлено 163 семьи с PAM, что составляет 381 (37%) из 1022 пациентов. Почти во всех семейных случаях передача была горизонтальной, что подтверждает аутосомно-рецессивный тип наследования. Интересно, что когда поражались трое или более братьев и сестер, обычно это были женщины. В тех немногих случаях, когда имела место вертикальная передача, присутствовало кровное родство. Родители были троюродными братьями в 36 (22% от общего семейного наследства) из 163 семей, и в шести (17%) из этих 36 семей наблюдалась вертикальная передача.
Патогенез
Ген SLC34A2 был идентифицирован в сегменте ДНК на хромосоме 4p15, содержащем ко-транспортер фосфата натрия, японской группой, выполнявшей полногеномное картирование гомозиготности на основе однонуклеотидного полиморфизма высокой плотности у шести пациентов из пяти. семьи [8]. Было обнаружено, что пять неродственных людей с PAM имеют гомозиготные мутации потери функции в этом гене. Другая независимая группа также вовлекла хромосому 4p15 посредством анализа сцепления большой кровной семьи с тремя затронутыми членами [9].Ген SLC34A2 включает 13 экзонов, 12 из которых кодируют натрийзависимый ко-переносчик типа II, называемый NPT2b (также известный как NPTIIb или NaPi-IIb).
NPT2b наиболее широко экспрессируется в легких и тонком кишечнике, с самыми высокими уровнями экспрессии в альвеолярном эпителии и эпителии подвздошной кишки, соответственно, но этот ген также экспрессируется в щитовидной железе, слюнной железе, молочной железе, матке и семенниках. Важно отметить, что экспрессия NPT2b в почках низкая.В легких экспрессия наиболее высока в клетках альвеолярного типа II, где, как полагают, она необходима для экспорта фосфата, образующегося в результате опосредованного альвеолярными макрофагами катаболизма поверхностно-активных фосфолипидов. В кишечнике NPT2b поглощает пищевой фосфат [10]. Отсутствие экспрессии NPT2b в кишечнике не приводит к гипофосфатемии, поскольку компенсаторные почечные механизмы способны поддерживать гомеостаз фосфата в условиях обычного потребления фосфата с пищей. Однако мышиные модели предполагают, что при ограничении количества фосфатов в пище NPT2b защищает хозяина от гипофосфатемии [11].Другие гены, кодирующие котранспортеры фосфата натрия, включают SLC34A1 , SLC34A3 , SLC20A1 и SLC20A2 , которые также известны как NPT2a, NPT2c, PIT1 и PIT2 соответственно [12–14].
На сегодняшний день идентифицировано 27 мутаций, которые связаны с фенотипическим развитием PAM, как указано в таблице 1 [8, 9, 15–26]. У большинства пациентов с PAM, подвергшихся генотипированию, были выявлены гомозиготные мутации в SLC34A2 .Сложные гетерозиготные мутации описаны у нескольких пациентов, не имеющих родственных родителей [19, 23]. Семейные родословные продемонстрировали, что субъекты с пораженными генами SLC34A2 и почти всегда будут проявлять заболевание, что соответствует полной пенетрантности [17, 18, 21].
ТАБЛИЦА 1Патогенетические мутации
Saito et al. [11] разработал мышиную модель PAM путем делеции NPT2b в эпителии легких и кишечника. У этих мышей развиваются зависимые от возраста рентгенологические проявления диффузного, гиперплотного помутнения с инфильтратами матового стекла, ретикулярные и микронодулярные кальцифицированные помутнения и уплотнение высокой плотности с воздушными бронхограммами.Уровни поверхностно-активного белка (SP) -D и моноцитарного хемоаттрактантного белка (MCP) -1 повышены в сыворотке мышей Npt2b — / — по сравнению с мышами Npt2b + / + и увеличиваются по мере роста микролита. бремя прогрессирует. Когда микролиты от мышей Npt2b, — / — были введены в легкие мышей Npt2b + / + , гистологический анализ показал, что они распределялись по легкому в день 1, собираясь в скопления, богатые макрофагами, в течение дня. 7 и полностью исчезла без остаточного воспаления или фиброза через 1 месяц.Уровень MCP-1 в сыворотке после заражения микролитами у мышей Npt2b + / + следовал той же временной динамике, достигая пика на 7 день и возвращаясь к исходному уровню на 28 день, что указывает на потенциальную полезность в качестве биомаркера отложения камней и их выведения. В совокупности эти данные предполагают, что генетическая коррекция экспрессии NPT2b в эпителиальных клетках дыхательных путей может быть многообещающим будущим подходом к снижению нагрузки микролитами при PAM. Другие стратегии лечения, которые были исследованы на этой доклинической платформе, включали лечение низкофосфатной диетой в течение 8 недель, которое эффективно предотвращало и обращало вспять накопление микролитов, и терапевтический альвеолярный лаваж с хелаторами кальция этилендиаминтетрауксусной кислотой или эгтазиновой кислотой, что уменьшало количество камней у человека. Эксплантат легкого PAM и мыши NPT2b — / — .
Признаки и симптомы
У пациентов с ПАМ наблюдается значительная неоднородность начала заболевания, симптомов и естественного течения болезни. Это заболевание поражает людей любого возраста, и у большинства людей на ранних стадиях симптомы отсутствуют. Случайное обнаружение гиперплотных инфильтратов на рентгенограммах грудной клетки, полученных при несвязанных жалобах, является основным способом проявления PAM. Часто бывает трудно определить время начала заболевания с точностью, поскольку у большинства пациентов нет предшествующей рентгенограммы грудной клетки для сравнения, а естественная история болезни неясна из-за нехватки доступных продольных исследований.В общемировом обзоре литературы, посвященном 1022 пациентам, предыдущая нормальная рентгенограмма грудной клетки была доступна только в шести (0,5%) случаях, и только 52 (5%) пациента наблюдались в течение 10 лет и более [3]. Даже в семьях пострадавших людей течение болезни широко варьируется. Например, в семье из двух больных детей младшему брату или сестре потребовалась трансплантация легких, а у его сестры болезнь протекала в легкой форме [27].
Редко PAM выявляется у новорожденных и младенцев, но чаще обнаруживается в молодом возрасте.У пациентов появляется одышка при физической нагрузке и сухой кашель по мере прогрессирования заболевания, но эти симптомы часто менее выражены, чем можно было бы предположить на рентгенограммах грудной клетки. Это явление получило название клинико-радиологической диссоциации. Дополнительные менее распространенные симптомы могут включать боль в груди, цианоз и кровохарканье. У детей младше 5 лет чаще наблюдаются сухой кашель и острая дыхательная недостаточность, при этом рентгенологические данные отличаются от болезни взрослых тем, что матовое стекло более выражено, а кальцификаты более мягкие [28].Нет никаких клинических признаков, которые, как известно, связаны с будущим прогрессированием заболевания, или полезных прогностических биомаркеров. Хотя ПАМ, как правило, прогрессирует, есть много исключений, включая зарегистрированные случаи, когда пациент с диагнозом до 10 лет прожил> 45 лет [29], а мужчина, который выжил в течение 58 лет без клинических, функциональных или рентгенологических данных. прогрессия [30].
Пневмоторакс при ПАМ встречается редко; в одном большом обзоре сообщалось о происшествии в 1.6% пациентов [3]. Имеются некоторые свидетельства того, что пациенты с PAM, у которых развивается пневмоторакс, могут не реагировать на обычное лечение плевральной трубки и могут потребовать более агрессивных плевральных вмешательств, таких как тальковый плевродез или плеврэктомия для разрешения [31, 32]. У одного пациента с 17-летним стажем курения было три рецидива, потребовавших плеврэктомии и сшивания апикальных пузырьков [33]. Другой пациент с ПАМ перенес трансплантацию одного легкого гемиторакса, пораженного рецидивирующим пневмотораксом, и имел остаточный пневмоторакс на момент трансплантации [34].
Легочная гипертензия и фиброз легких могут развиваться со временем [32]. Многие пациенты, которые проходят обследование для трансплантации легких, имеют клинические и эхокардиографические доказательства легочной гипертензии, вероятно, вторичной по отношению к прогрессирующему паренхиматозному заболеванию легких с гипоксией и деструкцией легочного капиллярного русла [33, 35, 36].
Легочные функциональные пробы
Хотя легочные функциональные пробы (PFT) часто являются нормальными на ранних стадиях заболевания, рестриктивный дефект со снижением диффузионной способности для монооксида углерода является наиболее типичным [37].Имеются сообщения о бессимптомных детях с рентгенологическими данными, указывающими на PAM и нормальные начальные PFT, у которых в подростковом возрасте развивается рестриктивный дефект при спирометрии, который прогрессирует с возрастом [32]. Тест с 6-минутной ходьбой может продемонстрировать снижение способности к физической нагрузке и вызванную физической нагрузкой десатурацию до того, как станет очевидной гипоксия в покое.
Диагностика
Серологическое тестирование
Обычные анализы крови у пациентов с ПАМ обычно нормальны.К ним относятся сывороточные концентрации кальция и фосфора, почечные и печеночные панели, а также уровни паратироидного гормона [7]. Уровни холекальциферола (витамина D3) также в норме. Сурфактантный белок (SP) -D, продуцируемый исключительно в легких клубами и альвеолярными клетками II типа [38], повышен в сыворотке пациентов с PAM по сравнению со здоровыми добровольцами и далее увеличивается по мере прогрессирования заболевания [7, 11] . SP-D может быть повышен в сыворотке крови пациентов с идиопатическим фиброзом легких (IPF) и легочным альвеолярным протеинозом (PAP), при этом повышенные значения указывают на прогрессирующее заболевание [39].Считается, что механизмы повышения уровня белка сурфактанта в сыворотке пациентов, страдающих этими двумя заболеваниями, различны; потеря целостности барьера воздух-жидкость, приводящая к «утечке» белка в кровоток в IPF по сравнению с гиперпродукцией белков сурфактанта в PAP . Уровни SP-A и SP-D были снижены в образцах бронхоальвеолярного лаважа (БАЛ) от одного случая PAM по сравнению со здоровыми добровольцами [7]. Сайто и др. [11] недавно сообщил, что MCP-1 — еще один потенциальный биомаркер, основанный на моделях мышей.Хотя MCP-1 и SP-D могут в конечном итоге оказаться полезными для оценки тяжести заболевания у пациентов с PAM, они вряд ли будут иметь диагностическую ценность, поскольку они могут быть повышены при других легочных заболеваниях.
Генетическое тестирование
Генетическое тестирование ДНК из миелоидных клеток периферической крови, которое демонстрирует повреждающие мутации в SLC34A2 является высокоспецифичным для PAM, на сегодняшний день сообщается как минимум о 27 известных мутациях. Он может точно определять диагноз для пациентов без необходимости проведения более инвазивных исследований, таких как биопсия легкого.Ограниченное количество коммерческих организаций предлагают секвенирование всего экзома для диагностики PAM.
Радиология
Рентгенография грудной клетки
Патологические рентгенограммы грудной клетки часто являются первым исследованием, предполагающим ПАМ. Описаны случаи, когда первоначальная рентгенограмма грудной клетки была нормальной, а у пациента развивались аномальные изображения [40]. Степень отложения микролитов может в конечном итоге стать достаточно плотной, чтобы на рентгенограмме грудной клетки образовался мелкопесочный микронодульный узор, который часто более заметен в основании, чем в вершинах, как показано на рисунке 1a.По мере прогрессирования заболевания плотность паренхимы легких может скрывать границы сердца, диафрагмы, реберно-диафрагмальные синусы и сердечно-диафрагмальные борозды, что приводит к рентгенологическим проявлениям, описываемым как «феномен исчезающего сердца».
РИСУНОК 1Рентгенологические данные при микролитиазе легких. а) Рентгенограмма грудной клетки, показывающая мелкий песочный микронодульный узор с преобладанием базиляров. б, в) Компьютерная томография высокого разрешения с микронодулями задней нижней и передней верхней доли, утолщением межлобулярной перегородки, субплевральной эмфиземой с преобладанием мелких кист.г) Окна средостения выявляют кальцифицирующую нагрузку в паренхиме и наиболее сконцентрированы в периферической септоплевральной области.
Компьютерная томография грудной клетки с высоким разрешением
Компьютерная томография грудной клетки является наиболее полезным рентгенологическим методом диагностики PAM. Изображения обычно выявляют диффузные сверхплотные микронодулярные непрозрачности воздушного пространства, которые наиболее обширны в задних сегментах нижних долей и передних сегментах верхних долей [41]. Агрегаты микролитов могут проявляться в виде известковых отложений диаметром более 3 мм.Также может присутствовать помутнение в виде матового стекла, вероятно, из-за активной воспалительной реакции на внутриальвеолярные микролиты. Поражение паренхимы может включать особенности, связанные с интерстициальным заболеванием легких, такие как субплевральное интерстициальное утолщение, утолщение межлобулярной перегородки и другие проявления легочного фиброза, включая субплевральные ретикулярные изменения и тракционные бронхоэктазы периферических дыхательных путей [7, 41, 42]. Многие из этих функций показаны на рисунках 1b и c. Рентгенологическая картина утолщения межлобулярной перегородки, известная как «сумасшедшая мостовая», может быть видна при PAM, хотя на окнах средостения кальцификаты видны, отслеживая линии перегородки, которые могут помочь отличить этот процесс от PAP [43].Это можно увидеть на рисунке 1d. Прогрессирующее утолщение субплеврального интерстициального канала может привести к кальцификации плевры, хотя это редко выявляется при первичной диагностической визуализации [41]. Парасептальная и субплевральная эмфизема может проявляться в виде участков слабого ослабления, прилегающих к плевральной поверхности, проявляющихся в виде небольших кист.
Предложено четыре этапа рентгенографического развития [44]. Первая (предкальцифицированная) фаза включает небольшое количество плохо кальцинированных микролитов и диффузную непрозрачность матового стекла.Это проявление было описано у бессимптомных детей, и неясно, возникает ли оно у взрослых. На втором этапе рентгенограмма имеет «песчаный» вид с разбросанными кальцинированными микронузлами диаметром от 2 до 4 мм и сохраненными границами сердца и диафрагмы. В третьей фазе происходит прогрессирующее помутнение с утолщением интерстиция и затемнение сердца и диафрагмы. Четвертая и последняя фаза характеризуется интенсивным обызвествлением промежутков с различным вовлечением серозной оболочки плевры, что приводит к появлению «белого цвета» легкого, иногда с сохранением апикальной зоны.Это может прогрессировать до участков плотного кальцификации / помутнения [45]. Прогрессия этих результатов на компьютерной томографии высокого разрешения (HRCT) хорошо коррелирует со снижением легочной функции, включая спирометрические показатели (объем форсированного выдоха в соотношении 1 с / форсированная жизненная емкость легких) и диффузионной способности [41].
Черная плевральная линия между грудной клеткой и кальцинированным легочным инфильтратом на рентгенограмме грудной клетки была впервые описана Felson [46]. На КТВР это можно увидеть как слой тонких кистозных изменений в субплевральной вентральной области или как слой с плотностью жира ∼1–2 мм шириной между ребрами и кальцинированной паренхимой в нижнем и среднем полях легких [47, 48 ].Использование количественной компьютерной томографии для оценки изменения средней плотности легких на основе единиц Хаунсфилда может быть полезным для определения прогрессирования заболевания [49].
Позитронно-эмиссионная томография.
Позитронно-эмиссионная томография с фтордезоксиглюкозой была проведена у взрослого пациента, показав максимальное стандартизованное значение поглощения 7,3 в областях без кальцификации и более низкое стандартизованное значение поглощения 2,6 в областях с плотной кальцификацией [50]. Этот паттерн предполагает наличие воспаления, особенно в тех областях легкого, которые еще не полностью кальцинированы.
Сканирование костей
В ранних исследованиях часто использовалась сцинтиграфия костей (сканирование костей с технецием 99m-метилендифосфонатом) в качестве диагностического теста, чтобы продемонстрировать, что помутнения в легких при рентгенографии грудной клетки требовали индикатора и соответствовали костям [51–54]. В большинстве случаев HRCT устраняет необходимость в сцинтиграфии костей в качестве метода диагностики PAM.
УЗИ
Ультразвуковое исследование грудной клетки может выявить утолщение и неровности плевры, а также эхогенные очаги порядка миллиметров без акустической тени в субплевральной области [47, 55].Отсутствие ожидаемого артефакта акустической тени (также описываемого как феномен «хвоста кометы») объясняется сложной плевральной границей с утолщенной плеврой, субплевральными микрокистами и утолщенным интерстицием, которые могут уменьшить глубокое проникновение ультразвуковых волн.
Патология
Ткани легких можно получить с помощью трансбронхиальной биопсии с помощью щипцов, трансбронхиальной криобиопсии, хирургической биопсии легких, в виде эксплантатов легких от трансплантированных пациентов или при вскрытии. Общий анатомический анализ эксплантированной легочной ткани показывает гранулярную и узловатую плевральную поверхность с фиброзными и кальцифицированными участками [56].Срезы легкого имеют зернистую консистенцию из-за обширных круглых или яйцевидных микрокальцификаций, которые могут быть усилены вдоль междольковых перегородок (рис. 2a – c) [37]. Конкременты различного размера с концентрическими слоями присутствуют как в альвеолярных пространствах, так и в интерстиции диаметром от 0,01 до 2,8 мм (рис. 2d и e) [37]. Микролиты содержат кальций, который можно выделить на гистологических срезах красителем по фон Коссу (рисунок 2f). Прогрессирование паренхиматозного заболевания может привести к рубцовому фиброзу с очагами метастатической оссификации [57].
РИСУНОК 2Патологические находки при легочном альвеолярном микролитиазе (ПАМ). a) Эксплантат легкого от 2-летнего мальчика, пересаженного для PAM, демонстрирующий области легких с усилением межлобулярных перегородок скоплением микролитов (стрелка) и другие области с более диффузными скоплениями зернистых, песчанистых микролитов (*). б, в) Гистологические срезы, показывающие микролиты вдоль междольковых перегородок (б, стрелка) и области с более диффузными скоплениями микролитов (в). г) Микролиты разного размера присутствуют как в альвеолярном пространстве, так и в интерстиции.д) Микролиты представляют собой характерные концентрически слоистые кальцифицированные сферулы. е) Кальций может быть обнаружен в микролитах окрашиванием по Фон Коссе. б – д) окраска гематоксилином и эозином; оригинальные увеличения × 20 (b, c), × 200 (d), × 1000 (e, f).
Цитологические исследования и исследования мокроты
Микролиты могут быть обнаружены в отхаркиваемой мокроте или образцах БАЛ, и их можно использовать для установления окончательного диагноза на фоне типичного анамнеза и КТВР. Микролиты в отхаркиваемой мокроте не совсем специфичны для ПАМ и иногда могут наблюдаться у пациентов с ХОБЛ и раком легких [58, 59].Гистология, демонстрирующая типичную пластинчатую структуру микролитов, может помочь отличить их от других конкрементов дыхательных путей в дифференциале. Хотя спирали Куршмана, связанные с астмой и хроническим бронхитом, состоят из гликопротеинов и обычно не кальцинированы, у пациентов с ПАМ может развиться бронхиальная плесень с кальцификациями, которые имеют похожий внешний вид, который отличается от классических пластинчатых кальцинированных тел, типичных для микролитов. [58, 60–62]. Тельца псаммомы представляют собой концентрические кальцифицированные слоистые структуры, которые образуются внутри агрегатов эпителиальных клеток или небольших фрагментов ткани и часто связаны с аденокарциномой [45, 59, 63–65].
Сканирующая электронная микроскопия
Сканирующая электронная микроскопия (СЭМ) может продемонстрировать сферическую структуру микролитов с типичной пористой поверхностью, напоминающей кортикальный слой кости. Элементная структура была определена с помощью энергодисперсионного рентгеноструктурного анализа, который обычно выявляет соли кальция и фосфора со следами металлов, таких как железо, медь и магний [66]. Отношение кальция к фосфату составляет примерно от 2: 1 до 3: 1, что соответствует составу гидроксиапатита [67].СЭМ использовался для характеристики твердых частиц в образцах БАЛ из популяций пневмокониоза, включая силикоз и асбестоз [68–70]. Изображения SEM и энергодисперсионная спектроскопия (EDAX), полученные у пациентов с PAM, показаны на рисунке 3. Демонстрация характерной структуры и элементного состава микролитов BAL с помощью SEM и EDAX имеет потенциал в качестве неинвазивного диагностического подхода к PAM.
РИСУНОК 3Сканирующая электронная микроскопия (SEM) и энергодисперсионная спектроскопия (EDAX) легочного альвеолярного микролитиаза (PAM).а, б) Микролиты, выделенные из эксплантированных легких, демонстрирующие а) характерную сферическую структуру и б) сигнатуру неорганических элементов. Микролит (белая стрелка) в жидкости бронхоальвеолярного лаважа (БАЛ) с характеристиками SEM (c) и EDAX, аналогичными контрольным эксплантам, демонстрируя возможность использования SEM и EDAX в качестве диагностического теста BAL для PAM. Обратите внимание на выброс углерода, связанный с мусором из лаважа. Kα, Kβ и Lα представляют собой рентгеновские лучи, испускаемые, когда электроны возвращаются на K- и / или L-электронную оболочку.г) Неорганический элементный анализ микролитов БАЛ.
Внелегочные проявления
В нескольких отчетах о случаях описана потенциальная ассоциация кальцификатов в гениталиях мужчин с ПАМ, включая микролиты в яичках, семенных пузырьках, придатках яичка и симпатических ганглиях, состояние, называемое микролитиазом яичек. Микролитиаз яичек имеет распространенность 0,6–0,9% среди мужского населения в целом, может быть связан с 1% всех случаев идиопатического бесплодия и связан со злокачественными новообразованиями яичек [9].Микролитиаз яичек может привести к двусторонней атрофии яичек и обструктивной азооспермии [71–76]. Симптомы включают повторяющиеся боли в животе, повторяющуюся гематурию и бесплодие. Пациенты с поражением обычно появляются в третьем и четвертом десятилетиях. Corut et al. [9] обследовал 15 пациентов с диффузным двусторонним микролитиазом яичек и идентифицировал двух пациентов с гетерозиготными мутациями в SLC34A2 , хотя было неясно, являются ли эти редкие мутации повреждающими.Они также не обнаружили доказательств микролитиаза яичек у семи субъектов мужского пола с известным PAM из этой группы. Остается неясным, были ли это случайными ассоциациями или микролитиаз яичек является проявлением PAM.
Удар пальцами (также известный как вторичная гипертрофическая легочная остеоартропатия) обычно присутствует на поздних стадиях ПАМ и наблюдается в 7% из 1022 рассмотренных случаев во всем мире [3]. Это также можно увидеть при легких проявлениях симптоматического заболевания [77].Сообщалось о повышенном поглощении радиоизотопов при сканировании костей в диафизе и метафизе пястных костей и запястий [42].
Сопутствующие заболевания
В большом обзоре заболевания, которые, как сообщалось, были связаны с ПАМ, включали ревматоидный артрит, синдром Шегрена, лимфоцитарный интерстициальный пневмонит, псориаз, антифосфолипидный синдром и дискоидную волчанку после ветряной оспы, рецидивирующую инфекцию, вызванную ветряной оспой и опоясывающим молоком, диафизарно-вафизарный актомальбург. щелочной синдром, киста перикарда, остеопетроз, экскаваторная грудная клетка и неходжкинская лимфома [3].Распространенность каждого из этих сопутствующих заболеваний при ПАМ очень низка, и прямая связь с заболеванием в лучшем случае является предположением.
Диагноз
Хотя клинически достоверный диагноз PAM часто можно поставить на основании рентгенографических исследований, для окончательного диагноза требуется по крайней мере одна дополнительная клиническая характеристика, включая анализ микролитов (обнаруженный в мокроте или ЖБАЛ), гистопатологию, положительный семейный анамнез или генетический тестирование, демонстрирующее мутацию в SLC34A2 .Был предложен алгоритм диагностики, который предусматривает поэтапный переход от наименее инвазивного к наиболее инвазивному анализу (рис. 4). Первоначальное подозрение на ПАМ часто возникает при получении совместимой рентгенограммы у пациента, который поступает на обследование при приеме на работу, с несвязанными жалобами или респираторными симптомами в виде одышки или кашля [44]. Если есть семейный анамнез больного брата, сестры или родителя с положительным генетическим тестом, а рентгенограмма грудной клетки или КТВ показывают типичные гиперплотные микронодулярные помутнения воздушной оболочки, диагноз является точным.В отсутствие генетического подтверждения у членов семьи наиболее подходящим следующим шагом, если таковой имеется, является генотипирование индексируемого пациента. Спорадические мутации, которые происходят при отсутствии известного семейного анамнеза, составляют большинство новых случаев [3].
РИСУНОК 4Алгоритм диагностики пациентов с подозрением на альвеолярный микролитиаз легких (ПАМ). Ключевым моментом является получение семейного и генетического анамнеза. После этого методы диагностики переходят от наименее инвазивных к наиболее инвазивным. HRCT: компьютерная томография высокого разрешения; БАЛ: бронхоальвеолярный лаваж; НДС: видеоассистированная торакоскопическая биопсия.
Если генетическое тестирование недоступно, недоступно или непрактично и определено, что диагностическая достоверность требуется на основе предпочтений пациента, необходимо исключить излечимые заболевания при дифференциальной диагностике или при появлении терапии ПАМ, исследование мокроты на микролиты с последующим Следующими разумными шагами являются БАЛ с трансбронхиальной биопсией или без нее. Идентификация пластинчатых микролитов в мокроте или в клеточном блоке, состоящем из клеток ЖБАЛ, в условиях характерной КТВР считается диагностической, хотя чувствительность и специфичность этих подходов неизвестны.Трансбронхиальная биопсия, показывающая микролиты в просвете альвеол, более убедительна, но результат зависит от ошибки выборки и зависит от степени отложения микролитов и связан с риском кровотечения и пневмоторакса. Трансбронхиальная криобиопсия — это новый диагностический метод, позволяющий получить в три-четыре раза больше ткани, чем биопсия с помощью трансбронхиального зажима, но также связана с повышенным риском кровотечения и пневмоторакса [78, 79]. Насколько нам известно, криобиопсия еще не применялась для диагностики ПАМ.Видеоассистированная торакоскопическая биопсия является золотым стандартом диагностики, но из-за рисков, связанных с общей анестезией и хронической болью, которая может возникнуть после торакостомии, ее следует зарезервировать для случаев, когда менее инвазивные подходы были недоступны или безуспешны.
Дифференциальный диагноз
Диффузные кальцификации легких также могут наблюдаться при милиарном туберкулезе, силикозе, амилоидозе, бериллиозе, саркоидозе, липоидных эмболах, гемосидерозе, излеченной ветряной оспе или пневмонии натуральной оспы, грибковых инфекциях, включая гистоплазмоз и кокцинозную метастазовую метастазирование. гиперпаратиреоз, терминальная стадия почечной недостаточности или злокачественное новообразование [80–83].Паттерны кальцификации различаются при этих заболеваниях и редко прогрессируют до затемнения границы сердца, как это может происходить при ПАМ. Метастатические и дистрофические кальцификации, которые встречаются у других имитаторов PAM, локализуются в интерстициальных или сосудистых компартментах, в отличие от почти исключительных внутриальвеолярных кальцификаций в PAM [84]. Несколько рентгенографических примеров этих процессов, которые могут быть ошибочно приняты за PAM, представлены на рисунке 5.
РИСУНОК 5Другие примеры диффузной кальцификации легких.Компьютерная томография, показывающая примеры а, г) амилоидоза с кальцинированными массами, лимфаденопатии и редких кист, б, д) силикоза с перилимфатическими кальцифицированными узелками, кальцификациями лимфатических узлов яичной скорлупы и конгломератным фиброзом, в) метастатическим кальцинозом в легкие при хронической почечной недостаточности, характеризующейся дольчатая матовая непрозрачность с сохранением междольковой перегородки и f) зажившие гранулемы из-за гистоплазмоза с переформатированием проекции максимальной интенсивности.
Туберкулез упоминался во многих отчетах о случаях ранее леченного у лиц с ПАМ [7, 57, 85].Методы, с помощью которых был поставлен диагноз во время лечения, неясны, но вполне вероятно, что раннее рентгенологическое проявление PAM могло побудить к диагностике туберкулеза без микробиологического подтверждения в распространенных группах населения, где эти два заболевания частично совпадают. Из 13 пациентов, которым первоначально был поставлен диагноз милиарный туберкулез в турецкой серии случаев, у двух (15%) пациентов был обнаружен положительный мазок на кислотоустойчивые бациллы [86], но неясно, сколько в этой когорте получали эмпирическое лечение от туберкулеза.Еще один пациент, перенесший трансплантацию легких, ранее получал противотуберкулезную терапию в течение 18 месяцев, несмотря на отрицательные результаты мазков, культур и нереактивного очищенного производного белка [87].
Варианты фармакологического лечения
Учитывая отсутствие каких-либо организованных испытаний для оценки безопасности и эффективности фармакологической терапии ПАМ, все доступные данные получены из отчетов о случаях эмпирической терапии у небольшого числа пациентов.
Бисфосфонаты
Бисфосфонаты адсорбируются на костях, делая их устойчивыми к опосредованной остеокластами резорбции, подавляя развитие, функцию и жизнеспособность остеокластов.По сравнению с более часто используемыми бисфосфонатами, такими как алендронат и ризедронат, этидронат динатрия менее эффективен в качестве антиостеокластного агента, но имеет уникальное теоретическое преимущество при ПАМ, заключающееся в том, что он ингибирует образование кристаллов гидроксиапатита [88].
Сообщалось, что лечение этидронатом приносит пользу детям с ПАМ. В одном случае у 3,5-летней девочки с ПАМ, задержкой развития и непродуктивным кашлем были рентгенологические и симптоматические улучшения после 36 месяцев ежедневного перорального приема динатрия этидроната [89].Она продолжала прием этидроната динатрия в течение 9 лет, а затем консервативно лечилась без вмешательства в течение 11 лет [90]. В конце периода наблюдения PFT выявили незначительное снижение спирометрических показателей и минимальное прогрессирование утолщения и кальцификации перегородки на HRCT по сравнению с исходным уровнем. Аналогичным образом, 9-летняя девочка с нарушением нормального развития, у которой было обнаружено, что рентгенограммы совместимы с PAM, показала рентгенологическое улучшение на КТВР после 12 месяцев лечения пероральным динатрий этидронатом [91].Ее график приема динатрия этидроната был изменен после того, как у нее развился рахит как осложнение терапии. Она продолжила 15-дневный цикл лечения этидронатом динатрия каждые 4 месяца в течение 11 лет общей терапии с документально подтвержденным улучшением спирометрии [90]. Наконец, 11-летнего мальчика и его 4-летних сестер-близнецов с одинаковой гомозиготной мутацией гена SLC34A2 лечили этидронатом динатрия. Мальчик и одна из его братьев и сестер улучшили результаты рентгенографии грудной клетки и результаты КТВР после 12 месяцев лечения этидронатом динатрия [92], но другой близнец не показал никаких улучшений.Эти данные указывают на то, что даже у пациентов с одним и тем же генетическим дефектом реакция на лечение может значительно варьироваться.
Побочные эффекты терапии бисфосфонатами включают преходящую гипокальциемию, остеомаляцию, преходящую лихорадку, глазные осложнения, преходящую миалгию, лейкопению, лимфопению и расширение пластинки роста у детей, что приводит к рахиту [93].
В литературе также описаны случаи, когда лечение бисфосфонатами было безуспешным.Девочка 8,5 лет с подтвержденной биопсией легочной PAM и нормальным PFT прошла 18 месяцев лечения ежедневным динатрий этидронатом без рентгенологического улучшения рентгенографии грудной клетки, хотя повторные PFT или HRCT не выполнялись [94]. Не было опубликованных примеров пользы терапии бисфосфонатами у взрослых, хотя неясно, была ли продолжительность терапии адекватной в этих случаях. 46-летний мужчина с подтвержденной биопсией ПАМ и фиброзным поражением получал пероральную терапию этидронатом натрия в течение 6 месяцев без улучшения рентгенографии грудной клетки, хотя симптомы оставались стабильными [95].В небольшой серии случаев два пациента лечились в течение 6 месяцев и 1,5 года соответственно с продолжающимся прогрессированием заболевания легких [19]. Лечение этидронатом динатрия было предпринято у 18-летнего и 51-летнего мужчины, у которых не было симптоматического улучшения после 2 лет и 6 месяцев терапии, соответственно, и которые самостоятельно прекратили терапию [25]. Еженедельно алендронат вводили в течение 6 и 12 месяцев двум взрослым мужчинам пятого десятилетия жизни с улучшением симптомов, хотя рентгенограммы не изменились [96].
Ингаляционные кортикостероиды
Ингаляционные кортикостероиды, по-видимому, не улучшают рентгенографические проявления ПАМ. Он эффективно использовался для лечения симптомов и нарушения функции легких у пациентов с ПАМ с сопутствующими заболеваниями, такими как спирометрически подтвержденное обструктивное заболевание легких, указывающее на астму, лимфоцитарный интерстициальный пневмонит и дискоидную красную волчанку среди других [97–99], но мало доказательства в пользу рутинного использования ингаляционных кортикостероидов у пациентов с ПАМ.
Системные кортикостероиды
Несколько клиницистов испытали системные кортикостероиды в качестве варианта лечения ПАМ. Badger et al. [100] обеспечил лечение стероидами в течение 48 дней пациенту с ПАМ без улучшения. В одном обзоре двух пациентов лечили преднизоном; Первому было 66 лет, и он был потерян для последующего наблюдения, а вторым был взрослый человек, который лечился в течение 2 месяцев безрезультатно [19]. Сообщалось, что до трансплантации у 47-летнего мужчины, который проходил лечение преднизоном, наблюдалось частичное улучшение, хотя неясно, как это измерялось [57].
Тиосульфат натрия
Тиосульфат натрия (STS) представляет собой хелатирующий кальций и солюбилизирующий агент, который использовался для лечения заболеваний, связанных с гетеротопической оссификацией, таких как кальцифилаксия, при терминальной стадии почечной недостаточности [101]. Сообщается, что как системная терапия, так и прямая инъекция в очаг поражения эффективны, и, поскольку испытания отсутствуют, лечение в настоящее время остается эмпирическим [102]. Taille et al. [49] предпринял попытку менее интенсивного ежемесячного внутривенного вливания в течение 9 месяцев без улучшения симптомов, PFT или микролитовой нагрузки согласно оценке HRCT.Вместо этого они наблюдали заметное увеличение плотности легких, а также снижение диффузии и предположили, что использованная доза или интервал STS могли быть недостаточными для подавления прогрессирования заболевания. Также возможно, что лечение STS ускорило прогрессирование заболевания.
Низкофосфатная диета
Лечение мышей Npt2b — / — с выраженным ограничением фосфатов в рационе приводит к предотвращению накопления микролитов и снижению нагрузки микролитов, возможно, за счет усиления альтернативных альвеолярных транспортеров фосфата и / или активности легочных остеокластов [11].У взрослого пациента, который в течение 2 лет лечился на диете с низким содержанием фосфатов и снижением уровня фосфата в сыворотке, наблюдалось продолжающееся прогрессирование заболевания легких [19]. Одним из возможных объяснений того, что диета не влияет на микролитную нагрузку у пораженных людей, является практический уровень ограничения фосфатов с пищей для людей (от среднего суточного потребления примерно 1,8 г в день -1 до примерно 1 г в день. -1 ) меньше, чем в два раза по сравнению с 5-7-кратным снижением, которое, как было показано, оказывает положительное влияние на микролиты у мышей.Прежде чем давать рекомендации по ограничению потребления фосфатов с пищей, необходимы испытания, но до тех пор, пока они не будут выполнены, пациентам с ПАМ может быть благоразумно избегать продуктов с очень высоким содержанием фосфатов, таких как газированные напитки, плавленые сыры и мясо.
Поддерживающее ведение
Несмотря на то, что нет никаких исследований PAM, предполагающих улучшение смертности, переносимости физической нагрузки или качества жизни с помощью кислородной терапии, были сделаны рекомендации для обеспечения целевого уровня кислорода в состоянии покоя и нагрузки ≥88% у пациентов без легочного сердца и > 90% у пациентов с легочным сердцем [103].В одном случае у пациента с легким сердцем, не страдающим ожирением, была снижена фракция шунта и улучшилась дневная оксигенация после использования ночного постоянного положительного давления в дыхательных путях с устойчивым улучшением переносимости физической нагрузки через 3 месяца после начала [104]. Точно так же пациенты с ПАМ должны пройти плановую вакцинацию против гриппа и Pneumococcus , а также должны быть поощрены к отказу от курения сигарет, что подходит всем людям с хроническим заболеванием легких.
Варианты процедурного / хирургического лечения
Промывание всего легкого
Несколько исследователей попытались промыть все легкое, чтобы определить, можно ли удалить микролиты вручную.Хотя обильные сферулы размером ≤1 мм были обнаружены в серийных лавадах у одного пациента, не было значительных изменений в рентгенологических аномалиях [105]. В другом случае промывание 22 л забуференного физиологического раствора позволило удалить 14,5 г твердого материала, но без улучшения рентгенологических данных или клинических симптомов [32]. Исследователи предположили, что микролиты, превышающие диаметр альвеолярного отверстия или респираторных бронхиол, не могут быть легко удалены с помощью полного лаважа легких.
Трансплантация легких
Единственным проверенным методом лечения поздних стадий PAM является трансплантация легких. Несмотря на многочисленные процедурные проблемы, включая кальцинированную паренхиму легкого, ограничивающую интраоперационную дефляцию и доступ к воротам, более плотные плевральные спайки и более высокий риск интраоперационного и послеоперационного кровотечения, трансплантация как одиночного, так и двойного легкого была успешной при ПАМ. (таблица 2) [27, 33–36, 57, 87, 106–113]. Первоначально высказывались опасения, что шунтирование легкого может повлиять на результаты трансплантации одного легкого, но это оказалось необоснованным.На сегодняшний день не зарегистрировано каких-либо задокументированных рецидивов внутриальвеолярных микролитов у пациентов с трансплантацией легких.
ТАБЛИЦА 2Трансплантация легкого при легочном альвеолярном микролитиазе
В небольшой серии пациентов с ПАМ из Венского медицинского университета (Вена, Австрия) всем пяти пациентам была проведена двусторонняя трансплантация легкого, средний возраст составил 46,3 года [35 ]. Средний интервал от появления симптомов до трансплантации составил 8,6 года, и у большинства пациентов на момент обращения была обнаружена вторичная легочная гипертензия.В послеоперационном периоде у одного пациента была первичная дисфункция трансплантата с повторной трансплантацией на второй день после операции, а затем он умер от сепсиса на 11 день после операции. до 74 месяцев с момента трансплантации. Выживаемость пациентов в этой когорте PAM была сопоставима с выживанием пациентов, перенесших трансплантацию легких по другим показаниям.
Прогноз
Существует несколько продольных исследований, которые можно использовать для определения прогноза у пациентов с ПА.В долгосрочном исследовании с участием 53 японских пациентов респираторная недостаточность была причиной смерти у 34,1% пациентов в течение 10–20 лет после постановки диагноза, а из выживших — еще у 42,9% в течение 20–49 лет после постановки диагноза. [114]. Средняя общая выживаемость составила 46,2 года.
Перспективы развития
ПАМ — удивительное заболевание, при котором легкие наполняются костными альвеолярными камнями и приводят к медленно прогрессирующей дыхательной недостаточности. Эффективных методов лечения не существует, и лечение в основном поддерживает трансплантацию легких, предназначенную только для пациентов с прогрессирующим заболеванием.Открытие генетической основы PAM является крупным достижением, проливающим свет на патогенез заболевания и предлагающим стратегии для разработки будущих биомаркеров и методов лечения. Из-за редкости заболевания, чтобы испытания были успешными, пациенты с ПАМ должны организовываться таким образом, чтобы облегчить исследования.
Сноски
Номер 3 в серии «Ультраредкое заболевание легких» Под редакцией Серджио Харари и Марка Умберта
Предыдущие статьи серии: No.1: Weatherald J, Dorfmüller P, Perros F, и др. . Легочный капиллярный гемангиоматоз: отдельная сущность? Eur Respir Rev 2020; 29: 1
.
№ 2: Элиа Д., Торре О., Кассандро Р., и др. . Крайне редкое кистозное заболевание. Eur Respir Rev 2020; 29: 1.
Происхождение: заказная статья, рецензирование.
Конфликт интересов: П. Кошюку нечего раскрывать.
Конфликт интересов: C.Мейеру нечего раскрывать.
Конфликт интересов: К. Викенхайзер-Брокамп нечего раскрывать.
Конфликт интересов: F.X. Маккормаку нечего раскрывать.
Заявление о поддержке: Эта работа была частично поддержана HL127455 и Национальным центром развития трансляционных наук (NCATS).
- Поступила 25 февраля 2020 г.
- Принята 7 июля 2020 г.
Цветное мерцание допплеровских камней в почках: артефакт или знак? | Клинический журнал почек
Аннотация
Мерцающие цветные доплеровские изображения создаются быстро меняющейся серией цветных горизонтальных полос, которые появляются за пределами отражающих поверхностей.Спектральный анализ показывает типичную прямоугольную волновую диаграмму время / скорость, а звуковой сигнал с неудобной высокой частотой насыщает эхо-систему. Мерцание можно обнаружить на кальцинированных участках различных тканей и обычно интерпретируется как артефакт; тем не менее, в этом отчете описаны два случая, предполагающие, что он может быть полезен для ранней диагностики и последующего наблюдения почечнокаменной болезни. Это наблюдение может иметь важные диагностические, эпидемиологические и клинические последствия.
Введение
Мерцающие цветные доплеровские изображения создаются быстро меняющейся серией цветных горизонтальных полос, которые появляются за пределами отражающих поверхностей [1], принимая треугольную форму, когда они очень заметны.Спектральный анализ показывает типичную прямоугольную волновую диаграмму время / скорость, а звуковой сигнал с неудобной высокой частотой насыщает эхо-систему. Мерцание можно обнаружить на кальцинированных участках различных тканей и обычно интерпретируется как артефакт. Рахмуни и др. [1] и Kamaya et al. [2] относят его происхождение к аномалиям в обработке эхо-сигналов, исходящих от нерегулярных и гиперэхогенных поверхностей. Хотя сложность явления выходит за рамки цели данной статьи, его внешний вид сильно зависит от типа машины и ее предварительных настроек [3,4].Фактически, на интенсивность знака сильно влияет механический индекс, связанный с выходной акустической мощностью, тогда как он не зависит от изменения цветового фильтра движения стены или частоты повторения импульсов. Однако более высокое значение частоты повторения импульсов улучшает видимость артефакта за счет уменьшения шума, происходящего от сигналов кровотока. Более того, мерцание четко отличается от сигнала кровотока из-за его специфического аспекта смешанных цветных полос, параллельных ультразвуковому лучу, независимо от артериальных импульсов.
Хотя мерцание было впервые описано несколько лет назад [1–3], диагностическая ценность мерцания при почечном литиазе обычно не признается [1]. Возможно, это связано с отсутствием подходящих сравнительных исследований с использованием стандартной эталонной методики, такой как спиральная компьютерная томография [5,6], которая, однако, является дорогостоящей и не всегда доступной, подвергает пациентов значительному воздействию рентгеновского излучения и является считается неоправданным или даже неэтичным при отсутствии сопутствующего нарушения функции почек.Более того, эффект мерцания можно увидеть у большого процента людей, у которых клинически бессимптомно [4].
В этом отчете описаны два случая, которые предполагают, что мерцание может иметь диагностическую ценность в случаях почечного литиаза [7] и не должно рассматриваться как простой артефакт [4,7,8].
История болезни
Мужчина 83 лет (Пациент 1) с артериальной гипертензией, сахарным диабетом 2 типа и гипертрофией простаты в анамнезе прошел УЗИ брюшной полости после самопроизвольного удаления мочевых камней.Обследование показало наличие мерцания на изображениях обеих почек (Рисунок 1) и мочевого пузыря (Рисунок 2, панели B и C). Ультрасонография мочевого пузыря в B-режиме показала множественные гиперэхогенные области с акустическим затемнением (рис. 2, панель A), где цветные допплеровские изображения показали серию мерцающих эффектов (рис. 2, панели B и C). В связи с наличием гипертрофии простаты, большой поллакиурии и дизурии пациенту была проведена аденомэктомия простаты и литотомия мочевого пузыря, на дне мочевого пузыря за предстательной железой были обнаружены восемь сферических камней диаметром 5-10 мм с ровной и белесой поверхностью ( Рисунок 2, панель D).Подобное мерцание на уровне обеих почек, а также мочевого пузыря предполагает, что допплеровский признак также может быть диагностическим для камней в почках.
Рис. 1
Цветные допплеровские изображения обеих почек пациента 1, показывающие мерцание вместо небольших гиперэхогенных участков, выявленных при УЗИ в B-режиме (см. Стрелки).
Рис. 1
Цветные допплеровские изображения обеих почек Пациента 1, показывающие мерцание вместо небольших гиперэхогенных участков, выявленных при УЗИ в B-режиме (см. Стрелки).
Рис. 2
Изображение мочевого пузыря Пациента 1 в B-режиме, показывающее несколько гиперэхогенных областей с акустическим затемнением (панель A), где на цветных доплеровских изображениях наблюдается мерцание (панели B и C). На дне мочевого пузыря обнаружено восемь камней диаметром 5–10 мм (панель D).
Рис. 2
Изображение мочевого пузыря пациента 1 в B-режиме, показывающее несколько гиперэхогенных областей с акустическим затенением (панель A), где на цветных доплеровских изображениях наблюдается мерцание (панели B и C).На дне мочевого пузыря обнаружено восемь камней диаметром 5–10 мм (панель D).
На Рисунке 3 показаны изображения другого взрослого пациента (Пациент 2), поступившие в наше отделение из-за острой левой почечной колики, в B-режиме и в цветном доплеровском режиме. Ультрасонография в B-режиме показала две небольшие гиперэхогенные области без акустической тени только в правой почке (Рисунок 3, панель A), тогда как мерцание наблюдалось в обеих почках (Рисунок 3, панели B и C), а также в дистальной части левый мочеточник (рис. 3, панель D).Струя мочеточника-мочевого пузыря, видимая красным цветом над феноменом мерцания, указывает на то, что камень мочеточника не является обструктивным, и стоит отметить, что мерцание исчезло после самопроизвольного удаления камня.
Рис. 3
B-режим (панель A) и цветные допплеровские изображения (панели B – D) Пациента 2, направленного в наше отделение из-за левой почечной колики. Ультрасонография в B-режиме показала две небольшие гиперэхогенные области без акустической тени только в правой почке (панель A), тогда как мерцание наблюдалось не только в обеих почках (панели B и C), но и в дистальной части левого мочеточника. (панель D) (см. стрелки).Струя мочеточника-мочевого пузыря (отображается красным цветом над мерцанием) указывает на то, что конкремент мочеточника не был обструктивным. Это мерцание исчезло после того, как камень был устранен.
Рис. 3
B-режим (панель A) и цветные доплеровские изображения (панели B – D) Пациента 2, направленного в наше отделение из-за левой почечной колики. Ультрасонография в B-режиме показала две небольшие гиперэхогенные области без акустической тени только в правой почке (панель A), тогда как мерцание наблюдалось не только в обеих почках (панели B и C), но и в дистальной части левого мочеточника. (панель D) (см. стрелки).Струя мочеточника-мочевого пузыря (отображается красным цветом над мерцанием) указывает на то, что конкремент мочеточника не был обструктивным. Это мерцание исчезло после того, как камень был устранен.
Обсуждение
Наши наблюдения показывают, что пришло время пересмотреть значение мерцания на цветных доплеровских изображениях почек, и что было бы более уместно рассматривать его как знак, а не «артефакт». Фактически, он, по-видимому, имеет четкую диагностическую роль не только при литиазе нижних мочевыводящих путей (мочевой пузырь и дистальный отдел мочеточника), но и при почечном литиазе.Обратите внимание, что у Пациента 1 (Рисунок 1) почечное мерцание расположено в области почечной паренхимы, тогда как у Пациента 2 (Рисунок 3) оно расположено в классической чашеобразной области почечных камней, на границе между паренхимой и лоханкой. область. Интересно отметить, что в экспериментальной модели нефролитиаза у крыс с резекцией тонкой кишки и высоким литогенным риском [9] местом кристаллов, состоящих из оксалата кальция, апатита и карбоната кальция, чаще была паренхиматозная кора головного мозга (83 % почек), чем мозговое вещество (73%) и верхушка сосочка (47%).
Мерцание может иметь важные диагностические, эпидемиологические и клинические последствия.
С диагностической точки зрения мерцание может использоваться для повышения диагностической эффективности УЗИ в В-режиме для более мелких почечных камней за счет повышения специфичности в положительных случаях В-режима (Пациент 1, рис. 1), повышения чувствительности в отрицательных В- случаев (Пациент 2, рис. 3, панели C и D) и позволяющий отличать очень маленькие камни от других небольших эхогенных структур в мочевыводящих путях [6].
С эпидемиологической точки зрения мерцание может увеличить распространенность нефролитиаза среди населения в целом, что позволяет раньше и с небольшими затратами выявлять субъектов с риском осложнений, вызванных почечным литиазом. Turrin et al. [4] в серии из 67 контрольных субъектов систематически обследовали брюшную полость с помощью цветного допплера и обнаружили 6 субъектов (9%) с бессимптомным микронефролитиазом с помощью мерцающего знака. Следует отметить, что ни у одного из них не было признаков почечных камней при УЗИ в B-режиме.
С клинической точки зрения диагноз микролитиаза может помочь при диагностическом обследовании и последующем наблюдении пациентов с почечными камнями. Кроме того, присутствие микролитов отдельно или связанных с крупными почечными камнями после спонтанного отхождения камня может указывать на стойкую литогенную активность. Фактически, сохранение небольших остаточных фрагментов в почечных полостях после литотрипсии связано с высокой частотой рецидивов почечных камней [10,11]. Ранняя диагностика их наличия может выявить подгруппу пациентов из группы риска.С другой стороны, наличие микролитов, связанных с наличием крупных почечных камней, может указывать на устойчивую и сильную литогенную активность. В таких случаях феномен мерцания может помочь в клиническом ведении, указывая на необходимость более интенсивных стратегий профилактики или лечения.
Выводы
Стандартный рентгеновский снимок брюшной полости эффективен при диагностике камней, но его эффективность сильно ограничена размером тела и наличием кишечного метеоризма.Спиральная компьютерная томография продемонстрировала высокую точность диагностики как рентгеноконтрастных, так и рентгенопрозрачных камней, но ее использование по-прежнему ограничено стоимостью и повышенной рентгеновской экспозицией. Почечная Сонография в B-режиме является предпочтительным воспроизводимым и дешевым подходом к исследованию камней, поскольку она способна показать как наличие дилатации собирающей системы, так и наличие больших рецидивирующих камней. К сожалению, диагностика камней с помощью сонографии в B-режиме ограничена их размером. В сочетании с сонографией в B-режиме цветной допплер, благодаря феномену «мерцания», может эффективно преодолеть эту трудность, открывая новый захватывающий сценарий в клинических исследованиях почечных камней.
Заявление о конфликте интересов . Ничего не объявлено.
Список литературы
1« и др.Артефакт мерцания цветного допплера в гиперэхогенных областях
,Радиология
,1996
, т.199
(стр.269
—271
) 2,,.Мерцающий артефакт на цветной допплеровской сонографии: зависимость от параметров аппарата и первопричины
,AJR Am J Roentgenol
,2003
, vol.180
(стр.215
—222
) 3,.Влияние цветовой допплеровской системы на мерцающий знак, связанный с камнями мочевыводящих путей
,J Clin Ultrasound
,1999
, vol.27
(стр.433
—439
) 4« и др.Диагностическая ценность артефакта мерцания цветного допплера в участках, отрицательных для камней при УЗИ почек в режиме B
,Urol Res
,2007
, vol.35
(стр.313
—317
) 5« и др.Спиральная компьютерная томография в оценке острой боли в боку: замена экскреторной урографии
,J Urol
,1997
, vol.15
(стр.2071
—2073
) 6« и др.Заметность почечных камней при КТ без усиления: влияние состава и размера камня и техники КТ
,Радиология
,2002
, vol.225
(стр.91
—96
) 7« и др.Мерцающий артефакт при мочекаменной болезни
,G Итал Нефрол
,2005
, т.22
(стр.503
—507
) 8,,, et al.Артефакт мерцания цветного и энергетического допплера из мочевых камней
,AJR Am J Roentgenol
,2001
, vol.176
(стр.1441
—1445
) 9« и др.Нефролитиаз и нефрокальциноз у крыс с резекцией тонкой кишки
,Urol Res
,2005
, vol.33
(стр.105
—115
) 10,,.Клинические последствия клинически незначимых фрагментов после экстракорпоральной ударно-волновой литотрипсии
,Дж Урол
,1996
, т.155
(стр.1186
—1190
) 11« и др.Фрагменты почечных камней после ударно-волновой литотрипсии
,Дж Урол
,1997
, т.158
(стр.352
—355
)© Автор 2009. Опубликовано Oxford University Press [от имени ERA-EDTA]. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Oxford University Press
Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http: // creativecommons.org / licenses / by-nc / 4.0 /), который разрешает некоммерческое повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. По вопросам коммерческого повторного использования обращайтесь по адресу [email protected]
.Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Уникальный случай семейной PAM, осложненной отторжением трансплантата
Предпосылки . Легочный альвеолярный микролитиаз (ПАМ) — редкое заболевание легких, характеризующееся отложением микролитов или кальцосферитов фосфата кальция в альвеолярном воздушном пространстве. Типичные результаты визуализации демонстрируют появление «песчаной бури» из-за двусторонних интерстициальных песчаных микронодульностей с преобладанием базального слоя. Методы и результаты . Мы описываем необычный случай 48-летнего мужчины с тяжелой семейной ПАМ, которому в конечном итоге была проведена двусторонняя трансплантация легкого. Выводы . ПАМ — редкое заболевание легких, вызванное мутацией гена SLC34A2 , который кодирует натрий-фосфатный котранспортер в альвеолярных клетках II типа, что приводит к накоплению внутриальвеолярного фосфата, вызывающему образование микролитов. ПАМ протекает медленно, но может прогрессировать до хронической гипоксической дыхательной недостаточности, что в конечном итоге требует трансплантации легких, единственного известного эффективного лечения.
1. Введение
Легочно-альвеолярный микролитиаз (ПАМ) — редкое заболевание легких, характеризующееся отложением микролитов или кальцосферитов фосфата кальция в альвеолярном воздушном пространстве [1].Впервые он был описан примерно 150 лет назад как многочисленные слоистые тела в альвеолярных пространствах и интерстиции [2]. PAM является вторичным по отношению к мутациям гена «34 члена 2 семейства растворенных носителей» ( SLC34A2 ), который кодирует натрий-фосфатный котранспортер NPT2b, обнаруживаемый на альвеолярных клетках типа II [2–4]. В PAM происходит блокада реабсорбции фосфата, что приводит к избытку альвеолярного фосфата, который связывается с кальцием с образованием кристаллов фосфата кальция [5]. Из более чем 1000 случаев, зарегистрированных во всем мире [6], многие обнаруживаются случайно при визуализации грудной клетки, а при симптоматике клиническое течение обычно медленно прогрессирует [1, 7, 8].Типичные результаты визуализации демонстрируют появление «песчаной бури» из-за двусторонних интерстициальных песчаных микронодульностей с преобладанием базального уровня [7, 9]. Здесь мы сообщаем о случае 48-летнего мужчины с тяжелой семейной PAM, в конечном итоге пролеченного с помощью двусторонней трансплантации легкого.
2. История болезни
48-летний мужчина латиноамериканского происхождения поступил в наше учреждение после того, как шесть лет назад ему был поставлен диагноз ПАМ в ходе хирургической биопсии легкого во время процедуры торакоскопической хирургии с использованием видео (VATS).Через год он стал зависимым от кислорода. Через три года пациент прошел обследование по пересадке легкого, но не получило его из-за злоупотребления алкоголем, отсутствия социальной поддержки и плохой моторики пищевода. Совсем недавно пациент несколько раз был госпитализирован из-за дыхательной недостаточности, требующей большого количества кислорода и стероидов. На момент обращения пациент получал 10 л кислорода и все еще испытывал одышку в покое. Он также одобрил периодическую резкую боль в груди при физической нагрузке, периферические отеки и усталость.В анамнезе отмечалась гипертензия легочной артерии, лечившаяся силденафилом, амбрисентаном и лазиксом. У него также был инсулинозависимый диабет, хронический панкреатит, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), гипертония и злоупотребление алкоголем. Семейный анамнез был известен у двух сестер из восьми братьев и сестер, которым также был поставлен диагноз ПАМ предполагаемого генетического происхождения, хотя до сих пор пациентка отказывается проходить тестирование, и дополнительная информация недоступна. Эти братья и сестры прошли курс лечения и не перенесли трансплантации легких.
После презентации в нашем учреждении пациент прошел обследование и был направлен в программу трансплантации легких. Тестирование функции легких продемонстрировало нормальное соотношение ОФВ1 / ФЖЕЛ со снижением ОФВ1, ФЖЕЛ и ТСХ. Пациенту не удавалось прекратить подачу кислорода на достаточно долгое время, чтобы выполнить DLCO. Рентгенограмма грудной клетки продемонстрировала классический вид «песчаной бури» тяжелых двусторонних интерстициальных гиперплотностей с преобладанием базилярной части (рис. 1 (а)). Компьютерная томография грудной клетки показала хроническое интерстициальное заболевание легких с диффузными помутнениями матового стекла, периферическими кистозными изменениями и многочисленными участками кальцификации (рис. 1 (b)).
Пациенту выполнена двусторонняя трансплантация легкого. Успешно вылеченная пневмония осложнила его непосредственное послеоперационное течение, и он вернулся домой через три недели после операции. При макроскопическом исследовании эксплантированных легких выявлены антракозные плевральные поверхности с диффузными фиброзными спайками. При разрезании паренхима показала диффузный фиброз и двусторонние диффузные кальцификации. Гистологический анализ выявил многочисленные двусторонние внутриальвеолярные слоистые эозинофильные тельца в сочетании с выраженным интерстициальным фиброзом.Выявлены множественные очаги костной метаплазии и хронического воспаления с образованием зародышевого центра (рисунки 2 (а) и 2 (б)). Эти изменения были более заметными в основании, хотя вовлечение было диффузным и двусторонним.
Многократные повторные госпитализации осложнили постбольничный курс больного. Через девять дней после первой выписки у него появился жар и кашель. Обследование показало плевральный выпот и признаки расхождения грудины. Бронхоскопия показала некроз анастомоза, а биопсия показала минимальное острое отторжение (степень 1А).Пациенту произведена аппаратная замена грудины. Через неделю после выписки у него возникла гипоксемия во время легочной реабилитационной терапии, и он был повторно госпитализирован. КТ грудной клетки подозрительно на пневмонию. Повторная биопсия показала очаговое периваскулярное хроническое воспаление без острого отторжения (степень 0). Однако иммуноокрашивание C4d показало сильное линейное окрашивание нескольких небольших интерстициальных сосудов, и пациент дал положительный результат на донор-специфические антитела с увеличением средней интенсивности флуоресценции (MFI) для HLA-DQ7.Пациенту был введен ВВИГ и проведено пять циклов плазмафереза. Повторные биопсии после плазмафереза дали отрицательные доказательства отторжения. ОФВ1 и ФЖЕЛ улучшились по сравнению с уровнями до трансплантации. DQ7 MFI значительно снизился, но пациент продолжает поддерживать внутривенный иммуноглобулин (ВВИГ).
Из-за семейного анамнеза PAM и известной семейной природы этого заболевания было рекомендовано генетическое тестирование, но на момент публикации этой публикации оно еще не было завершено.
3.Обсуждение
PAM — редкое аутосомно-рецессивное интерстициальное заболевание легких, характеризующееся широко распространенным отложением кристаллов фосфата кальция (микролитов гидроксиапатита) в альвеолярных воздушных пространствах, также известных как микролиты, кальцифериты или кальцосфериты [7]. У этих пациентов нет известной кальциевой метаболической дисфункции, а скорее мутация гена «член 2 семейства 34 растворенных носителей» (SLC34A2), который кодирует натрий-фосфатный котранспортер, NPT2b, обнаруженный на альвеолярных клетках типа II [1–4].Дисфункция транспортера приводит к чрезмерному накоплению фосфата в воздушном пространстве и последующему образованию микролитов [1]. Эта мутация является семейной примерно в одной трети случаев аутосомно-рецессивного наследования [7]. В семейных случаях наследование горизонтальное, характерное для аутосомно-рецессивных заболеваний. Castellana et al. сообщают, что, когда в семейных случаях затрагиваются три или более братьев и сестер, это обычно женщины, и вертикальный образец наследования связан с признаками кровного родства [1, 6].В настоящее время идентифицировано 27 различных мутаций гена SLC34A2 , кодирующего транспортер [1]. PAM распространен во всем мире, но более распространен в Азии и Европе, причем большинство случаев приходится на Турцию, за которой следуют Китай, Япония, Индия, Италия и США [6]. Большинство пораженных пациентов диагностируются в период от второго до четвертого десятилетия без явной гендерной предрасположенности [1, 10]. Клинические проявления ПАМ сильно различаются: у большинства пациентов на ранних стадиях заболевания не наблюдается симптомов с незаметным началом и медленным прогрессированием на протяжении десятилетий [1, 10].По мере накопления микролитов развивается фиброз легких, приводящий к нарушению газообмена и гипоксии, легочной гипертензии [1, 11]. Симптомы могут прогрессировать, включая одышку при физической нагрузке и, в конечном итоге, в покое, сухой кашель, боль в груди и цианоз при тяжелом заболевании, что в конечном итоге приводит к дыхательной недостаточности [12, 13]. Внелегочное заболевание недостаточно охарактеризовано, но поражает яички, почки, желчный пузырь, симпатическую нервную цепь и сердце [6, 11, 14, 15]. Диагноз обычно ставится на основании рентгенологического исследования грудной клетки, включая рентгенологическое исследование и компьютерную томографию.Визуализирующие исследования часто выявляют мелкие, похожие на песок микронодулярные интерстициальные гиперплотности с преобладанием базиляров [1]. Недавно была предложена четырехуровневая система оценки радиологической степени тяжести [16]. Степень клинико-патологической диссоциации часто бывает значительной при ПАМ с обширным радиологическим прогрессированием и минимальными сопутствующими клиническими симптомами [16]. Важно дифференцировать ПАМ от других заболеваний со схожими рентгенологическими проявлениями, включая милиарный туберкулез, грибковую инфекцию, пневмонию, саркоидоз, амилоидоз, альвеолярный протеиноз легких, легочный гемосидероз, метастатический кальциноз и пневмокониоз [7, 16].Тестирование функции легких может помочь в диагностике, хотя на ранних стадиях заболевания часто наблюдаются нормальные результаты. При запущенном заболевании тестирование обычно показывает ограничительный паттерн с пониженным DLCO [16]. Обычные анализы крови не имеют значения для диагностики ПАМ и в целом нормальны [1, 16]. Окончательный диагноз PAM основывается на типичных рентгенологических данных плюс генетическое тестирование или, в отсутствие тестирования, рентгенография с диагнозом ткани [16]. Бронхоальвеолярный лаваж может помочь восстановить микролиты, но в остальном он ничем не примечателен и не используется для диагностики [12].Ткань легкого доступна либо через трансбронхиальный доступ с помощью щипцов, либо через криобиопсию, либо через хирургическую биопсию, открытую или видео-ассистированную [1, 12]. Гистологические признаки, типичные для PAM, представляют собой внутриальвеолярные, сферические, пластинчатые кристаллы фосфата кальция, обычно <1,0 мм, но могут достигать 5,0 мм, как в нашем случае [16]. Кроме того, эти микролиты могут подвергаться костной метаплазии [17]. В интерстиции могут наблюдаться фиброз, воспаление и кальцификация [17]. Эти характерные находки обычно поражают H&E, но окрашивание трихромом выделяет микролиты [16].
Эмпирическое лечение ПАМ безуспешно [1]. Стероиды неэффективны, и использование этидроната динатрия бисфосфоната дало смешанные результаты [10, 18, 19]. Единственным эффективным лечением в настоящее время является трансплантация легкого, хотя четкие рекомендации относительно сроков трансплантации не ясны из-за редкости заболевания [1, 20]. Как одинарная, так и двойная трансплантация легкого оказались эффективными, при этом не было зарегистрировано случаев рецидива в пересаженных легких [1, 21].
4. Заключение
Здесь мы представляем интересный случай тяжелой конечной стадии семейной PAM, в конечном итоге вылеченной с помощью двойной трансплантации легкого.ПАМ — редкое заболевание легких, вызванное мутацией гена SLC34A2 , который кодирует натрий-фосфатный котранспортер в альвеолярных клетках II типа. Мутировавший переносчик приводит к накоплению внутриальвеолярного фосфата, вызывая образование кальций-фосфатных микролитов. Микролиты нарушают газообмен и вызывают дальнейшие патологические изменения, включая интерстициальный фиброз и легочную гипертензию. ПАМ протекает медленно, но может прогрессировать до хронической гипоксической дыхательной недостаточности, что в конечном итоге требует трансплантации легких, единственного эффективного лечения.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Микролит почек — что это?
Иногда после УЗИ врач ставит диагноз — «микролиты почек». Что это такое и стоит ли паниковать? Микролитами в медицине называют песок и мелкие камни, которые почему-то выпали в осадок в почках. Эти образования обычно не вызывают опасений, но к такому диагнозу не стоит относиться легкомысленно.Ведь со временем эти маленькие камни могут сильно увеличиться в размерах и превратиться в большие камни, с которыми гораздо труднее бороться. Последний этап перед развитием мочекаменной болезни — микролиты почек. Что это такое, как лечить, причины и симптомы заболевания вы узнаете из этой статьи.
Причины
При любом заболевании до начала лечения необходимо выяснить причину патологии. Только в этом случае терапия будет максимально эффективной.Это касается и диагностики «микролиты почек». Что это за патология, почему она появляется? Основные причины микролитов следующие:
- Наследственность — нарушения водно-солевого обмена из-за генетического изменения состава белков.
- Врожденные патологии развития органов мочевыделительной системы, приводящие к застою мочи в почках и отложению кристаллов соли.
- Воспалительные заболевания мочевыводящих путей.
- Эндокринные расстройства. При этом происходит сбой в обменных процессах, что вызывает повышенный выброс кальция из организма.
- Недостаточное потребление жидкости. Моча становится очень концентрированной, и количество солей в ней значительно увеличивается. В некоторых регионах, где вода очень жесткая, микролиты в почках не редкость.
- Неправильное питание. Избыток острой и соленой пищи, мяса в рационе увеличивает риск этого заболевания.
- Гиповитаминоз.
- Различные новообразования, препятствующие нормальному оттоку мочи.
Симптомы
Заболевание не имеет особых проявлений. Во время планового осмотра или посещения врача по другой причине неожиданно назвали диагноз «микролиты почек». Что это такое и откуда взялось, человек даже не догадывается. При дальнейшем обследовании можно обнаружить другие признаки микролитов почек.
Например, при сборе мочи на анализ легко увидеть ее мутность.Иногда появляется розоватый оттенок, что вызвано повреждением слизистой оболочки мочевыводящих путей острыми краями микролитов. Это может привести к возникновению воспалительных заболеваний, таких как цистит и пиелонефрит, с симптомами, характерными для этих патологий.
Наиболее частым симптомом является боль, которая может быть колющей, режущей, тупой или острой. Болезненные ощущения возникают в основном из-за задержки мочи, по пути которой поднялись мелкие камешки. Накапливаясь в любом отделе мочеточника, микролиты могут спровоцировать развитие почечной колики, которая проявляется резкой острой болью.Неприятные ощущения начинаются в пояснице и переходят в половые органы и внутреннюю поверхность бедра.
Локализация
Важно не путать микролиты правой почки с заболеваниями желчного пузыря или печени. Иногда даже пациент находился на операционном столе, чтобы удалить аппендикс. Боль в этом случае отдает внизу живота.
Микролиты левой почки можно обнаружить только тогда, когда размер кристаллов достигает нескольких миллиметров.Для диагностики необходимо исключить заболевания кишечника и миозит поясничных мышц. У человека возникают боли в пояснице, усиливающиеся при нагрузке и попытках изменить положение тела.
Диагностика
Для определения наличия данного заболевания проводят следующие исследования:
- Общий анализ мочи. Позволяет определить микрогематурию, количество и химический состав солей, наличие бактерий.
- Общий анализ крови на воспалительные процессы.Позволяет узнать, произошло ли заражение.
- Анализ крови на биохимию — определяет характер нарушения обмена веществ.
- Ультразвуковая диагностика — основной метод исследования этого заболевания.
- Экстренная урография помогает определить расположение, количество и размер микролитов. Во время этого исследования в вену вводят контрастный агент и делают серию рентгеновских снимков.
Иногда приходится прибегать к такому методу исследования, как радиоизотопная сцинтиграфия.
Как лечить
Диагноз «микролиты обеих почек» в оперативном вмешательстве не нуждается. Лечение такого заболевания консервативное и зависит от результатов обследования. В основном врач назначает препараты, способствующие растворению микролитов. Иногда необходимо использовать спазмолитические и мочегонные средства, чтобы облегчить процесс выхода мелких камней. Если образования видны только в одной из почек, то, возможно, причиной заболевания стало воспаление в ней.В этом случае назначают противовоспалительные и антибактериальные препараты, которые также необходимы при инфекции мочевыводящих путей. Хороший результат наблюдается при лечении отварами и настоями растений, обладающих мочегонными и противовоспалительными свойствами.
Очень важно правильно питаться, ведь микролиты обеих почек являются признаком того, что у пациента нарушен обмен веществ.
Диета
Если вы обнаружили микролиты, вы должны отказаться от мяса, рыбного бульона, шпината, щавеля, бобовых, субпродуктов, колбас, копченостей, соленой, острой пищи, шоколада, крепкого чая и кофе, алкогольных напитков.В целом рацион зависит от того, какие микролиты обнаруживаются. Фосфаты делают мочу щелочной, а значит, необходимо ограничить потребление овощей и фруктов, молочных продуктов. Полезны будут мясо, рыба, мучные изделия и растительные масла, так как они подкисляют мочу. При обнаружении карбонатных микролитов следует отказаться от молочных продуктов и употреблять больше мяса и рыбы, круп, мучных изделий, яиц. Своевременное обращение к врачу, правильный диагноз и выполнение всех рекомендаций позволят избавиться от болезни без операции.
.

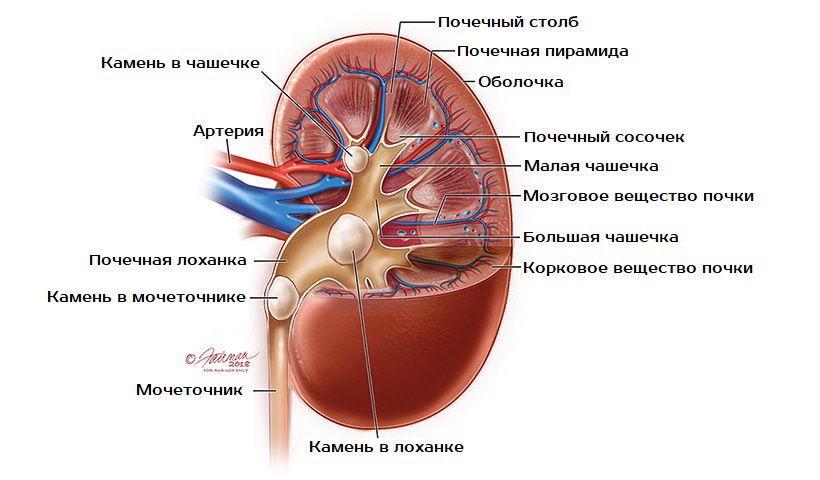
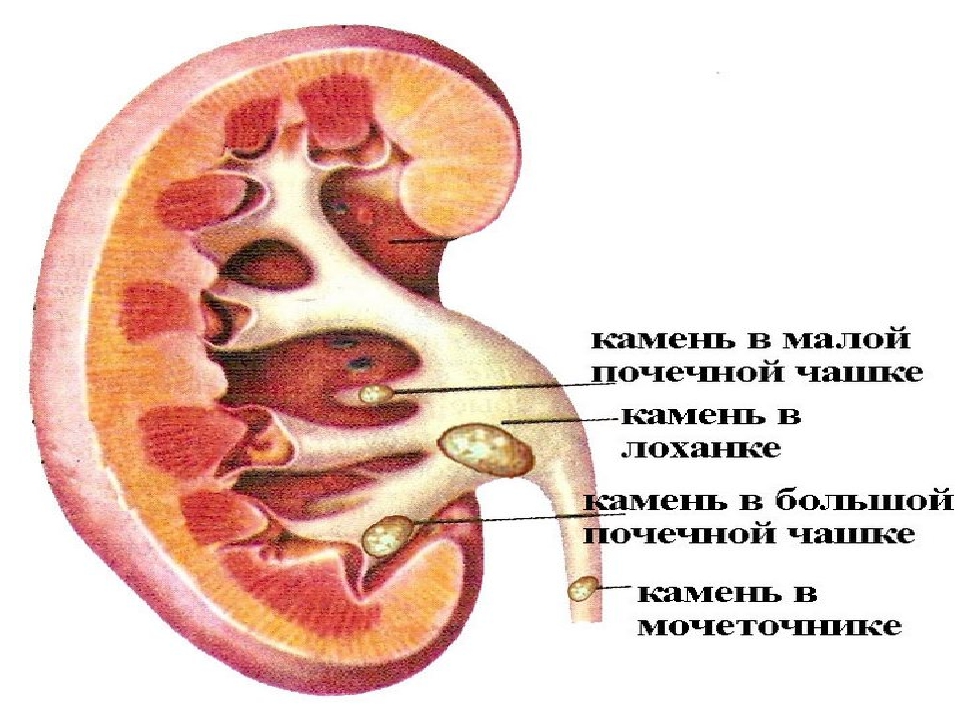 Кроме этого, необходимо максимально исключить соль из рациона, употреблять достаточное количество жидкости в течении суток. Необходимо запомнить, что исключение из повседневного рациона вредных продуктов способствует минимизации риска возникновения как мочекаменного заболевания, так и любого другого.
Кроме этого, необходимо максимально исключить соль из рациона, употреблять достаточное количество жидкости в течении суток. Необходимо запомнить, что исключение из повседневного рациона вредных продуктов способствует минимизации риска возникновения как мочекаменного заболевания, так и любого другого.
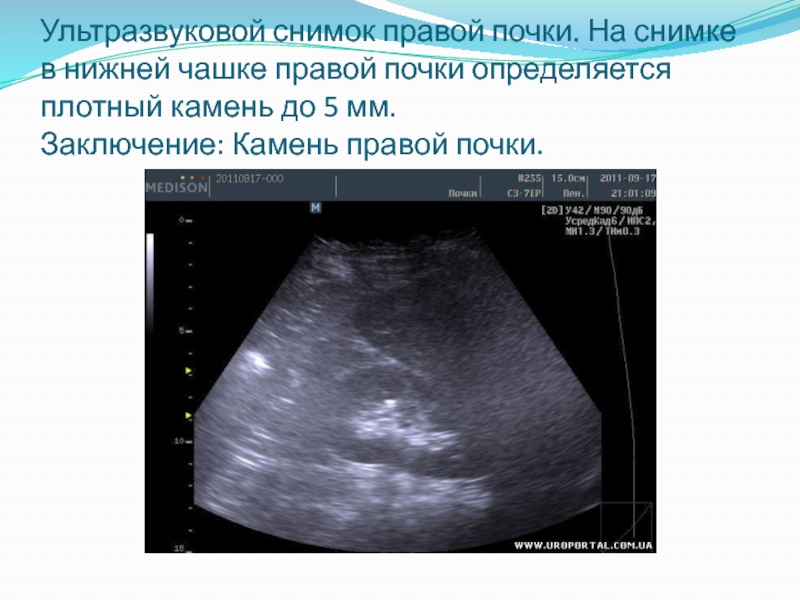
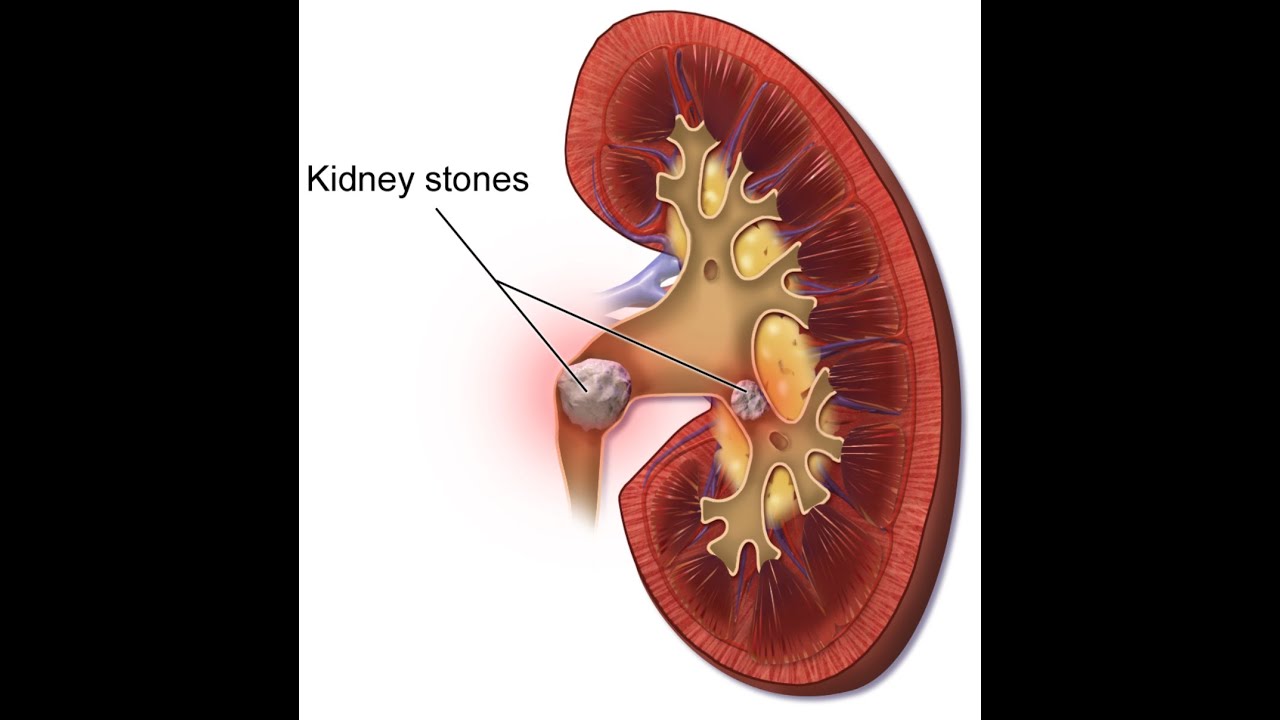 Если у близкого родственника диагностировали почечнокаменную болезнь, повышается вероятность её возникновения. Наличие наследственной предрасположенности не является гарантией того, что заболевание появится в любом случае. Если человек будет придерживаться правильного питания и вести активный образ жизни, вероятность формирования камней в почках значительно понизится.
Если у близкого родственника диагностировали почечнокаменную болезнь, повышается вероятность её возникновения. Наличие наследственной предрасположенности не является гарантией того, что заболевание появится в любом случае. Если человек будет придерживаться правильного питания и вести активный образ жизни, вероятность формирования камней в почках значительно понизится.
 Строго запрещено заниматься самолечением.
Строго запрещено заниматься самолечением.
 У них мягкая структура, светлый оттенок, гладкая поверхность. Могут быть различной формы.
У них мягкая структура, светлый оттенок, гладкая поверхность. Могут быть различной формы.
 Для их выявления используется экскреторная урография или пиелография. Благодаря такому методу можно определить, где локализованы конкременты (они могут находиться в лоханке, чашечке, мочеточнике), какой они формы и размера.
Для их выявления используется экскреторная урография или пиелография. Благодаря такому методу можно определить, где локализованы конкременты (они могут находиться в лоханке, чашечке, мочеточнике), какой они формы и размера.
 Уратный почечный песок чаще выявляется при несбалансированном рационе с избытком белков животного происхождения. При употреблении в пищу больших количеств бобов, свеклы, щавеля, шпината, лиственных овощей возрастает риск осаждения оксалатов. Микролиты быстрее образуются при дисбалансе витаминов D, A, C, питье жёсткой воды с ионами кальция, магния, фосфора.
Уратный почечный песок чаще выявляется при несбалансированном рационе с избытком белков животного происхождения. При употреблении в пищу больших количеств бобов, свеклы, щавеля, шпината, лиственных овощей возрастает риск осаждения оксалатов. Микролиты быстрее образуются при дисбалансе витаминов D, A, C, питье жёсткой воды с ионами кальция, магния, фосфора.
 При наличии микроуратов эффективно ограничение мяса и рыбопродуктов, при оксалатном микролитиазе — щавеля, ревеня, листовых овощей, при фосфатном — молочная диета.
При наличии микроуратов эффективно ограничение мяса и рыбопродуктов, при оксалатном микролитиазе — щавеля, ревеня, листовых овощей, при фосфатном — молочная диета.