«Почему в крови базофилы повышены, о чем это говорит?» – Яндекс.Кью
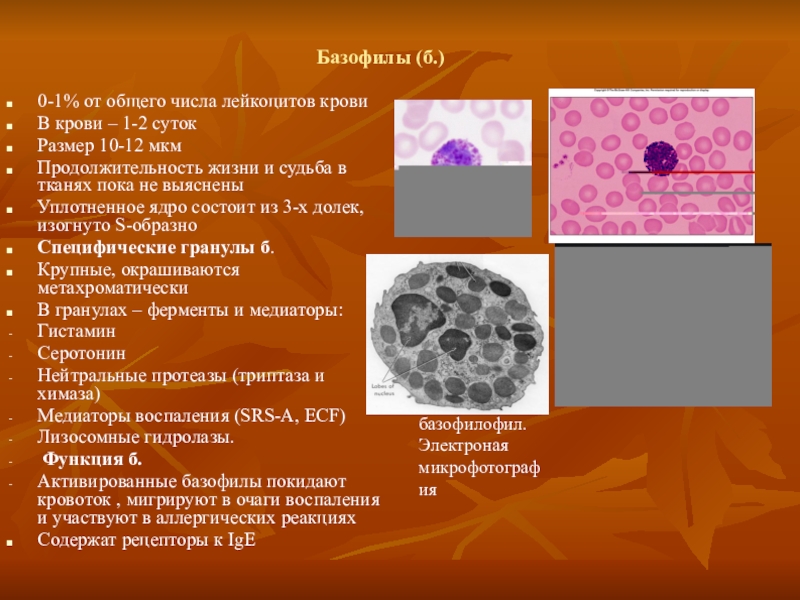
Наиболее малочисленной группой лейкоцитов являются базофилы, выполняющие множество функций в человеческом организме.
В частности, они не только поддерживают кровоток в небольших сосудах и обеспечивают миграционный путь прочим лейкоцитам в ткани, но и эффективно влияют на рост новых капилляров.
Если у взрослого в крови базофилы повышены, то это говорит о развитии заболевания — базофилия. Причины этого состояния различны, ниже мы рассмотрим основные недуги, из-за которых базофилы в крови повышаются выше нормы.
Функции базофилов
Основной функцией данного вида гранулоцитов есть участие в воспалительном процессе и развитии аллергических реакций, а именно анафилактического шока. Кроме того базофилы блокируют попавшие в организм через кожу токсины (яды насекомых и животных) и снижают свёртываемость крови за счёт наличия в них гепарина. В месте разрушения базофилов возникает отёк тканей, зуд, покраснение.
Можно обобщить основные функции базофилов в человеческом организме:
- подавление и «блокировка» аллергенов;
- препятствие распространению чужеродных частиц по организму;
- сохранение защитных сил организма;
- регуляция проницаемости и тонуса микрососудов;
- поддержание водного и коллоидного состояния, а также метаболизма кожи;
- нейтрализация токсинов и ядов, в том числе и насекомых;
- участие в процессах свертываемости и фагоцитоза.
Если базофилы повышены у взрослого, это значит, что проблему необходимо искать в анамнезе, проанализировать перенесенные ранее болезни, и условия жизни пациента. Далее рассмотрим более подробно, почему бывают повышены базофилы в крови у взрослого, и какие заболевания приводят к таким показателям.
Норма базофилов
Нормальное количество базофилов варьируется в зависимости от возраста и высчитывается в процентах по отношению к общему числу лейкоцитов в крови:
- для взрослого: 0,5-1%;
- новорожденный: 0,75%;
- 1 месяц: 0,5%;
- 1 год: 0,6%;
- 2 года: 0,7%
Как видно, норма базофилов в крови составляет от 0,5% до 1% от общего числа лейкоцитов. По абсолютной величине это выходит примерно 0,3 нанолитра на литр крови.
По абсолютной величине это выходит примерно 0,3 нанолитра на литр крови.
Причины повышенных базофилов
Почему в крови базофилы повышены у взрослого, о чем это говорит? Различные состояния могут провоцировать увеличение значений базофилов выше нормы, начиная от немедленной реакции на введение лекарственного препарата и заканчивая длительно протекающим воспалительным процессом.
Рассмотрим основные причины повышенных базофилов у взрослого:
- Аллергические реакции. При контакте с аллергеном высвобождаются содержащиеся в клетках специальные гранулы. Из-за этого наступают типичные симптомы аллергии: зуд, сыпь, отеки и т. д.
- При острых инфекционных заболеваниях печени также базофилы повышены.
- Воспаления (в том числе и хронические), расположенные в ЖКТ. Особенно отчётливо эффект наблюдается при острых воспалениях кишечника.
- Часто базофилы в крови повышены в период, предшествующий менструации.
- Постоянное облучение небольшими дозами радиации (к примеру, это касается тех, кто работает с рентген аппаратами).

- Заболевания кровеносной системы.
Таким образом, общий анализ крови с повышенным количеством базофильных гранулоцитов в первую очередь говорит о проникновении чужого антигена, который по своим характеристикам абсолютно не вписывается в антигенный состав данного организма, поэтому последний и пытается как можно быстрее отторгнуть врага.
Порой, ответ бывает весьма бурным и стремительным (анафилактический шок), тогда пациенту требуется такая же стремительная медицинская помощь (введение адреналина, гормонов), иначе быстро наступит печальный итог.Физиологические причины
Физиологические процессы, вызывающие повышение базофилов:
- При менструации, в начале овуляции, когда повышается уровень эстрогена в крови.
- Во время восстановления организма после перенесенной инфекции.
- Повышаются базофилы в результате небольшого воздействия доз облучения, часто от него страдают рентгенологи, лаборанты.

- После приема контрацептивных медикаментозных средств, в составе которых содержится большое количество эстрогенов.
Таким образом, причин базофилии множество, поэтому следует пройти тщательное обследование, для выявления причины каждого конкретного случая. Самолечение категорически неприемлемо.
Повышенные базофилы у ребенка
Что это значит? Состояние, когда базофилы у ребенка повышены, называется базофилией и причины его возникновения бывают различными:
- Отравление.
- Укусы насекомых.
- Заражение гельминтами..
- Гемолитическая анемия.
- Дефицит в крови железа
- Синуситы хронические.
- Нефротический синдром.
- Инфекционные заболевания
- Прием некоторых лекарственных препаратов.
- Генерализованная аллергия, лекарственная или пищевая.
- Микседема, или недостаточное снабжение тканей и органов гормонами щитовидной железы.
- Болезни крови: миелолейкоз хронический, лейкоз острый, истинная полицитемия, болезнь Ходжкина.

- Желудочно-кишечные патологии хронического протекания, например, язвенный колит. Базофилы могут повышаться при переходе острого заболевания в острую форму.
Снижение уровня базофилов возможно, только при своевременном лечении основного заболевания, которое стало их причиной повышения, при этом необходимо ввести в рацион ребенка продукты, содержащих витамин В12 (молочные, яйца, почки).
Что делать, если базофилы в крови повышены
В большинстве случаев базофилия излечивается, если устранить непосредственную причину ее возникновения, в частности, вылечить основное заболевание. Но в некоторых случаях высокий уровень базофилов может наблюдаться у относительно здоровых людей., тогда необходимо воспользоваться данными рекомендациями:
- Повысить насыщение организма витамином В12, ведь он активно участвует в процессе образования кровяных клеток и работе головного мозга. Это можно сделать, принимая специальные препараты или добавив в свой рацион блюда из мяса, почек, яиц и молока.

- Включить в рацион железосодержащие витамины и продукты: печень (особенно куриную), гречку, рыбу и другие морепродукты.
Если базофилы в крови повышены, в некоторых случаях, достаточно отменить прием лекарственных препаратов: антитиреоидных, эстрогенсодержащих и им подобных. У женщин базофилия может наблюдаться во время овуляции, в первые дни менструального цикла, а также при наступлении беременности. Это обусловлено прямой связью между уровнем эстрогенов и прогестерона в крови и количеством базофилов.
Материал предоставлен simptomy-lechenie.netПочему базофилы повышены в общем анализе крови
Базофилы представляют собой самую малочисленную группу из лейкоцитов гранулоцитов. Количество базофилов не превышает и одного процента от всех лейкоцитов в общем анализе крови: моноцитов, лимфоцитов, эозинофилы. Рождаются они в костном мозге, где затем попадают в кровяное русло и там циркулируют. Живут около 7 – 12 дней.
Рождаются они в костном мозге, где затем попадают в кровяное русло и там циркулируют. Живут около 7 – 12 дней.
Называют базофилы потому что они отлично окрашиваются щелочными красками при выделении их под электронным микроскопом. Латинское название щелочи – базис, от этого и произошло название этих клеток крови.
В клетках имеется такие вещества как серотонин, гистамин, простагландин и лейкотриен. Вступая в взаимодействие с пораженным участком тела базофил выделяет гистамин, гепарин, серотонин, что приводит к расширению кровеносных сосудов и покраснению и ряду других реакций на действие этих клеток, при воспалительном процессе. Например, при аллергической реакции количество их в ткани увеличивается и понижается в крови. Все это приводит, что у больного развивается зуд, покраснение и оттек ткани, повышение температуры пораженного участка.
Основное назначение базофилов – это иммунный ответ на внедрившийся чужеродный агент. Эти лейкоциты так же предотвращают быстрое распространение ядовитых веществ при укусах змей и ядовитых пауков. Норма для базофилов: 0-0,065 тыс./мл (0-1%).
Норма для базофилов: 0-0,065 тыс./мл (0-1%).
Базофилы в крови так же участвуют в защите нашего организма при травмах с кровотечениями как внутренними, так и наружными. Выделяя вещество, такое как гепарин, они регулируют свертываемость крови.
При попадании инфекции в организм они увеличивает кровоснабжение в воспаленом участке и в разы увеличивает активность других лейкоцитов, которые устремляются в пораженный орган или участок. Так срабатывает система иммунологической защиты организма человека.
Когда повышены базофилы
Основные причины повышения базофилов (базофилия) можно назвать заболевания крови: острый лейкоз, полицитемия, лимфогранулематоз. Повышены базофилы и при других болезнях, среди них болезни желудка, кишечника, при ветрянке, микседеме. Порой повышаются при недостатке железа в организме. Чтобы нормализовать их уровень, полезен прием витаминов, в особенности витамина В12. Повышают уровень их и некоторые лекарственные препараты на основе антитиреоидных, эстрогенсодержащих вешеств.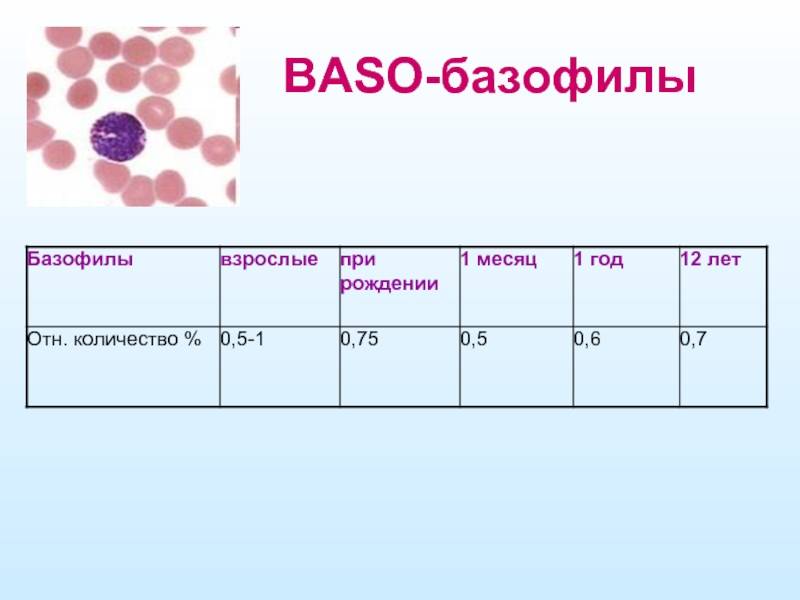
Ситуация когда базофилы наоборот понижены говорит о развитии базопении. Базопения развивается при таких болезнях: инфекционные заболевания в острой фазе, гипертиреоз нарушение выработки гормонов щитовидной железы, при беременности, болезнь Иценко-Кушинга, при овуляции.
Причины отклонения от нормы определить может только врач, порой требуется пройти через ряд уточняющих анализов, чтобы точно установить диагноз.
причины и что это значит
Если базофилы повышены, то это может говорить о наличии различных заболеваний. Что такое базофилы? Это кровяные клетки, способные показать при анализе присутствие воспалительного процесса. Данные клетки циркулируют в кровотоке в течение нескольких часов, попадая после этого в ткани. На протяжении 1-2 недель они находятся в данной структуре, позволяя предотвращать патологические процессы.
Функции и норма базофилов
Базофилы принимают участие в немедленных реакциях аллергий, что понижает их уровень концентрации в кровотоке. Данные клетки крови могут влиять на реакции гиперчувствительности косвенно – через лимфоциты. При прогрессировании воспаления гранулы, содержащиеся в базофилах, освобождаются. При этом происходит выделение биоактивных веществ, что провоцирует некоторые неприятные симптомы: зуд, жжение, красноту и отечность кожных покровов. Если воспаление длится на протяжении 3 дней и более, то это говорит о том, что костный мозг усиленно образовывает новые клетки.
Также у гранулоцитов есть еще одна функция: обеспечение адекватного развития капилляров и активизации кровообращения в мелких сосудах. Данные клетки крови позволяют регулировать коагулирующие процессы за счет содержания в них вещества под названием «гепарин».
Кроме того, данные гранулоциты обеспечивают следующие функции:- перемещают другие лейкоциты через стенку мелких кровеносных сосудов к отрицательно влияющим на организм веществам;
- активизируются при борьбе с паразитарными формами организмов;
- обеспечивают защитную функцию покровов кожи, а также слизистых и кишечника при источниках заражения заболеваниями, передавшимися от клещей и гельминтов;
- останавливают распространение ядов различных насекомых в тканях;
- позволяют очищать ткани от различных негативно влияющих веществ, накапливая их в гранулах, с последующим выведением из организма.

Уровень содержания данных гранулоцитов в крови определяется отношением их количества к общему числу лейкоцитов.
Содержание базофилов в крови у взрослого человека должно составлять от 0,5 до 1 %.
У детей в крови базофилы могут содержаться в пределах от 0,4 до 0,9 %.
Анализ крови на количественный состав гранулоцитов поможет определить наличие или отсутствие процессов воспаления или аллергических реакций в организме. Этот метод исследования не является диагностическим, но иногда требуется знание об общей лейкоцитарной активности.
Как снизить уровень базофилов?
Если базофилы в крови повышены, то, прежде всего, больному требуется комплексная диагностика и последующее компетентное лечение. Это необходимо из-за большой вероятности проявления какого-либо заболевания. Если базофилы повышены у взрослого или ребенка, то лучше всего уравновесить концентрацию гранулоцитов в нормальные пределы еще на ранних стадиях заболевания.
Это необходимо из-за большой вероятности проявления какого-либо заболевания. Если базофилы повышены у взрослого или ребенка, то лучше всего уравновесить концентрацию гранулоцитов в нормальные пределы еще на ранних стадиях заболевания.
Чтобы постепенно увеличивать содержание железа и витамина B12, можно употреблять определенные продукты для снижения уровня нужных клеток крови.
Чаще всего это продукты животного происхождения, в пищу принимают наиболее насыщенные данными компонентами:- Печень: говяжью или телячью.

- Рыбу.
- Устриц.
- Красное мясо.
Для восполнения недостатка витамина B12 необходимо кушать мясо, яйца и кисломолочные продукты. Однако один полноценный рацион не уберет повышение базофилов. Чтобы получить максимальный эффект от всасывания необходимых веществ и микроэлементов, необходимо пить белое сухое вино и сок апельсина.
Если базофилы повышены у взрослого, нужно найти причины этого и устранить их, путем вылечивания основного заболевания. Но базофильные повышения в клетках крови могут не обозначать ничего: человек может быть абсолютно здоров, просто уровень данных клеток превышен.
Если базофилы в крови повышены у взрослого, то причина может крыться в приеме препаратов, в основном антитиреоидного и эстрогенсодержащего классов. У женщины уровень может повышаться при состоянии беременности, при овуляции, а также в первые несколько дней с начала менструального цикла. Повышение базофилов в крови здесь обусловлено непосредственным действием эстрогена с прогестероном.
Причины изменения уровня базофилов, в том числе у детей
Если уровень базофилов выше нормы, можно подозревать наличие следующих патологических состояний организма:- нарушений работы эндокринной железы;
- всевозможных аллергий;
- миелолейкоза;
- болезней, затрагивающих лимфоциты;
- вирусных инфекций;
- микседемы;
- колитов;
- дерматитов;
- анемий;
- воспалений околоносовых пазух;
- послеоперационного периода после удаления селезенки;
- радиоактивного излучения;
- повышенного уровня эстрогенов;
- употребления лекарственных препаратов, нормализующих деятельность эндокринной системы.
- Высокие показатели эстрогена у женщин во время беременности, овуляции или менструального цикла.
- Период реабилитации после перенесения инфекций.
- При воздействии радиационным облучением в рентген-кабинете.

У детей данные клетки крови выступают в качестве защитников работоспособности иммунной системы. Чтобы выявить уровень этих клеток, проводится специальный клинический анализ ΒASO, который определяется при помощи лейкоцитарной формулы. Новорожденные дети обычно дают показатели 0,75 %, а по достижении года он уменьшается до 0,5 %.
Высокий уровень данных клеток крови резко возрастает при всевозможных заболеваниях хронического или острого характера, а также при аллергиях и болезнях, поражающих кровь.
У детей может развиться базопения – снижение уровня базофилов. Это чаще всего говорит о том, что костный мозг не полностью выполняет свои функции или есть отклонения в работе эндокринной системы.
Пониженный уровень базофилов
Понижение уровня гранулоцитов в крови выявляется показателем менее 0,01 %. Повысить их концентрацию можно только способами, которые разрешены врачом.
youtube.com/embed/Y8fSCDx9kuw?ecver=1″ src=»data:image/gif;base64,R0lGODlhAQABAAAAACH5BAEKAAEALAAAAAABAAEAAAICTAEAOw==»/>
Пониженный уровень часто наблюдается в следующих случаях:- острые инфекционные процессы;
- гипертиреоз;
- пневмония;
- прием некоторых лекарственных средств;
- овуляция и беременность;
- проведение химиотерапевтических процедур;
- кортикостероиды;
- стрессы.
При беременности низкий уровень гранулоцитов характеризуется быстрым увеличением объема крови, хотя состав ее при этом остается таким же, как и раньше. Именно поэтому в первом триместре такая ситуация не должна вызывать тревогу.
Небольшие колебания показателей не следует оставлять без внимания, так как это может привести к довольно серьезным осложнениям и различным заболеваниям. Причины колебания может определить только квалифицированный специалист. Чтобы правильно поставить диагноз, недостаточно знать только формулу лейкоцитов.
Часто врачи назначают специальные диеты в комплексе с традиционным лечением, чтобы восполнить недостаток витаминов и микроэлементов в организме. При подозрении на повышение или понижение гранулоцитов, следует немедленно обратиться к врачу и пройти полное обследование для последующей диагностики и лечения.
ребенка, взрослого, причины выше нормы
Базофильные лейкоциты относятся к клеткам крови, которые выполняют защитные функции в организме. Принцип действия этих клеток заключается в выделении специфичных веществ в кровь, при воспалительных заболеваниях. Также они отвечают за аллергическую реакцию. Если базофилы повышены это говорит об имеющейся в организме развивающейся патологии. Нормы этих клеток различаются в зависимости от возраста, а на их отклонение могут влиять сторонние факторы.
Зачем нам нужны эти клетки
Базофилы — это вид гранулоцитов, которые охраняют наш организм от всевозможных инфекций. Несмотря на то, что базофильные лейкоциты содержатся в нашем организме в малых количествах, их роль для человека нельзя переоценить. Почему нужно контролировать этот показатель? Эти клетки не борются с угрозой, они оповещают об атаке вирусов и аллергенов, выбрасывая в кровь активные вещества. Повышенное содержание базофилов в крови — это всегда повод для проведения дополнительной диагностики.
Почему нужно контролировать этот показатель? Эти клетки не борются с угрозой, они оповещают об атаке вирусов и аллергенов, выбрасывая в кровь активные вещества. Повышенное содержание базофилов в крови — это всегда повод для проведения дополнительной диагностики.
Нормы
Базофилы в анализе крови вычисляются по лейкоцетарной формуле. В норме их содержание не должно превышать одного процента от общего числа лейкоцитов. Показатели могут немного отличаться в зависимости от возраста пациента, так у взрослого нормой принято считать нормой от 0,5 до 1%, у ребенка эта норма зависит от возрастной категории и составляет от 0,75 при рождении до 0,7 в тринадцать лет. Абсолютное количество базофилов у здорового взрослого человека составляет 0,01-0,065х10⁹/л.
Отклонения в сторону повышения
Отклонение, когда базофилы повышены, называется базофилия. Базофилы уже повышены у взрослого причины:
- Рак крови.
- Эндокринные заболевания.
- Онкология легких.

- Развитие сахарного диабета.
- Гепатит.
- Вирусные болезни.
- Аллергия.
- Заболевания ЖКТ в хронической форме.
- Анемия.
- Заболевание Ходжкина.
От чего еще могут быть базофилы в крови чуть повышены у взрослого? Повышенные базофилы в крови также могут наблюдаться при приеме некоторых лекарственных препаратов. Врачи советуют пройти дополнительные обследования даже в том случае, когда базофилы повышены незначительно.
Небольшое отклонение от норм может свидетельствовать о наличии хронического скрытого воспалительного процесса.
У женщин небольшое повышение базофилов может наблюдаться в первые дни менструации и в день овуляции. При выявлении отклонения в анализе исследование нужно повторить через определенное время. Определение базофилов в периферической крови входит в общий анализ, который проводится в любой поликлинике в профилактических и диагностических целях. Стоит отметить, что у взрослых пациентов понижение baso в крови не оценивается.
Отклонения у детей
Если повышены базофилы у ребенка, это должно насторожить как врачей, так и родителей. Увеличение количества любого из видов лейкоцитов у ребенка свидетельствует о развитии болезни. У здоровых детей базофилии не наблюдается. Любое острое или хроническое заболевание отражается изменениями показателей в крови у ребенка.
Причин тому, что базофильный анализ показал увеличение, может быть масса. Уровень количества базофилов у детей колеблется до года. После этого возраста уровень относительно стабилен и не должен превышать показателей 0,7х10⁹/л. Стоит отметить, что при развитии инфекционного или опухолевого заболевания в крови будут также повышены моноциты.
Высокий уровень базофилов у детей чаще всего наблюдается по причине:
- Вирусных инфекций.
- Скрытых воспалительных процессов.
- Аллергических реакций.
- Заболеваний крови.
- Наличия паразитов.
Если у взрослых врачи оценивают только когда базофилы выше норм, то детские анализы оценивают и на понижение этих клеток в крови.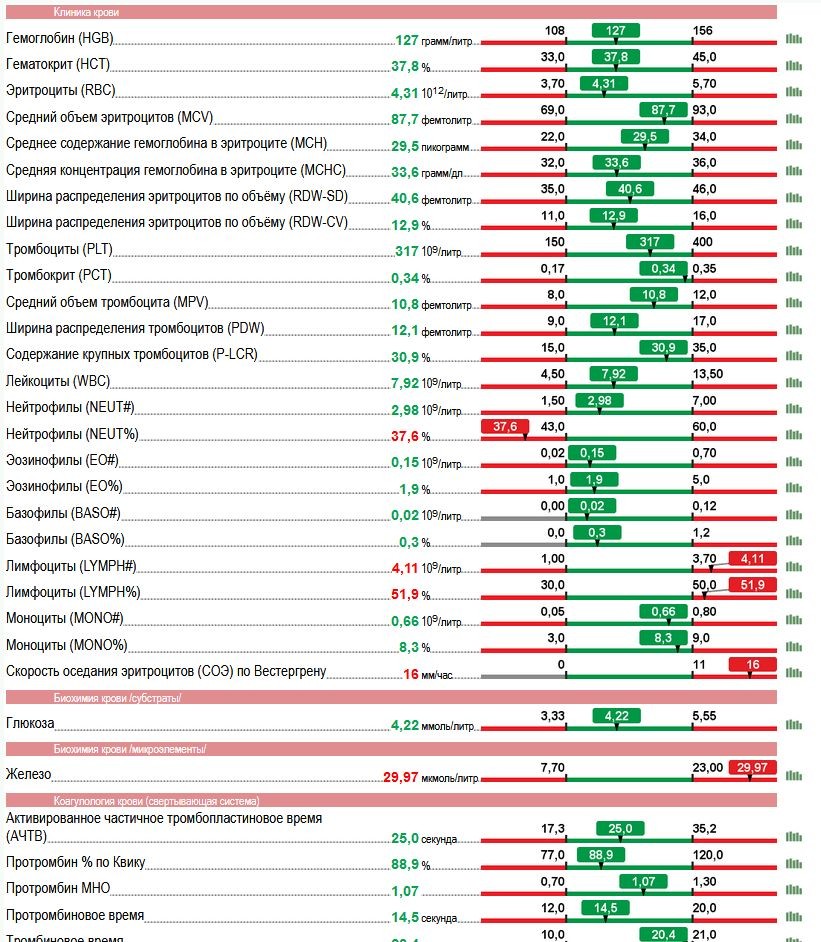 Диагноз базопения, что это значит?
Диагноз базопения, что это значит?
Понижение базофилов у ребенка может означать серьезные нарушения работы костного мозга или наличие эндокринных заболеваний.
По этой причине проведение анализа крови у детей крайне важно, особенно в первые годы жизни, когда малыши наиболее подвержены различным заболеваниям.
Критическая опасность
В некоторых ситуациях организм реагирует на проникновение опасных микробов слишком стремительно. В этом случае базофилы могут повышаться до критических отметок, что вызывает анафилактический шок у пациента. Что такое анафилактический шок? Это стремительная аллергическая реакция организма на попадание аллергена в кровь. Это очень опасное состояние. Дети и взрослые при данной патологии должны немедленно получить первую помощь и быть госпитализированы. При несвоевременном оказании медицинской помощи последствия могут быть плачевны.
Лечение
Увеличиться в крови базофилы не могут самостоятельно. Увеличивать этот компонент крови может только наличие какого-либо заболевания. Лечение в этом случае зависит от формы и характера основной болезни. После того как врачи выявят истинную причину при помощи дополнительного обследования, пациенту будет назначено лечение. По прошествии некоторого времени анализ нужно будет повторить, если уровень снизился, это будет обозначать, что лечение выбрано правильно и является эффективным.
Лечение в этом случае зависит от формы и характера основной болезни. После того как врачи выявят истинную причину при помощи дополнительного обследования, пациенту будет назначено лечение. По прошествии некоторого времени анализ нужно будет повторить, если уровень снизился, это будет обозначать, что лечение выбрано правильно и является эффективным.
В некоторых случаях повысить базофилы в крови может нехватка витамина В12 или железа, в этом случае пациенту назначаются витаминные инъекции.
В качестве профилактики повышения базофилов врачи рекомендуют кушать больше продуктов с содержанием витамина В12. К такой еде относятся мясо, яйца и молочные продукты. При правильном питании в организм будут поступать все необходимые витамины, и ваша иммунная система будет в порядке, а анализы в норме.
Определение базофилов в крови помогает специалистам сузить круг поиска многих заболеваний. Конечно, этот анализ нельзя причислить к средствам точной диагностики, но он позволяет понять врачам, где кроится болезнь.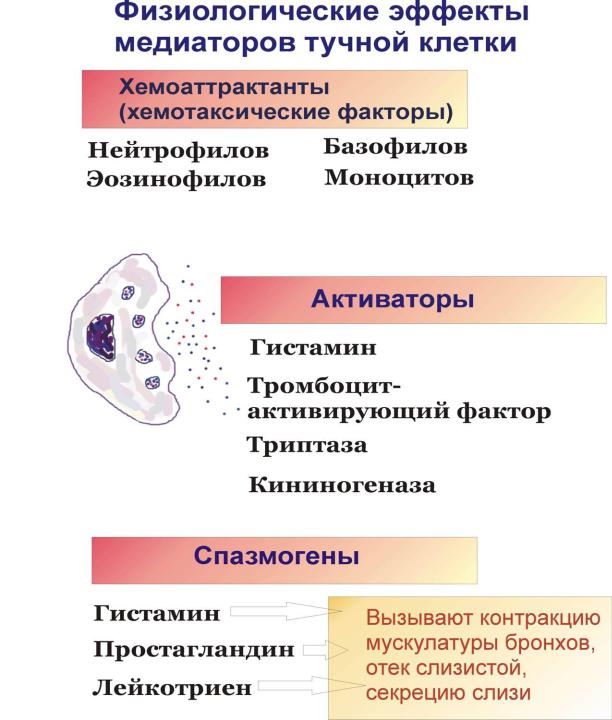 Общий анализ крови должен сдавать каждый человек, который хочет прожить здоровую жизнь. Ведь определение болезни на ранней стадии является гарантией здорового будущего без опасных осложнений и тяжелых заболеваний.
Общий анализ крови должен сдавать каждый человек, который хочет прожить здоровую жизнь. Ведь определение болезни на ранней стадии является гарантией здорового будущего без опасных осложнений и тяжелых заболеваний.
Вконтакте
Google+
Одноклассники
их роль, норма и факторы
Базофилами принято называть клетки крови, которые происходят из так называемого гранулоцитарного ростка кроветворения, точно так же как и нейтрофилы и эозинофилы. Так, как и все имеющиеся гранулоциты в периферической крови, клетки базофилы, выходя из костного мозга, способны циркулировать несколько часов, затем они просто мигрируют в ткани, и там эти клетки функционируют на протяжении восьми — двенадцати дней.
Вместе с остальными лейкоцитами базофилы принимают участие в воспалительном процессе.
Так, непосредственно в воспалительном участке клетки базофилы выделяют:
- серотонин;
- гепарин;
- гистамин.

Этими веществами и обусловлены функции клеток базофилов в любом воспалительном процессе. При этом следует отметить, что базофилы чаще всего принимают участие в реакции гиперчувствительности мгновенного типа, и одновременно с лимфоцитами принимают участие в реакциях замедленного типа.
При заборе крови для общего анализа крови определение базофилов, как известно, входит в подсчет определенной лейкоцитарной формулы.
Таким образом, норма базофилов обозначена в следующих показателях:
- взрослые — 0,5−1
- при рождении — 0,75
- один месяц — 0,5
- один год — 0,6
- двенадцть лет — 0,7
Основные причины базофилии
Специалисты увеличение количества клеток базофилов (когда базофилы повышены в крови — более чем 0,2*109/л) называют базофилией. Вообще, в клинической практике состояние базофилия встречается не очень часто, но ее причины врачам известны.
Как правило, базофилы повышены у взрослого могут быть при таких патологических состояниях и недугах:
- При различных болезнях крови, например:
- хронический миелолейкоз;
- запущенный, острый лейкоз;
- лимфогранулематоз;
- истинная полицитемия.

- Хронических воспалительных заболеваниях желудочного, а так же кишечного тракта и при развитии язвенного колита.
- Микседеме.
- Хроническом синусите.
- Аллергических реакциях.
- Гемолитической анемии.
- При приеме антитиреоидных препаратов или эстрогенов.
- Болезни Ходжкина.
Многочисленные наблюдения специалистов показывают, что у человека умеренная базофилия выступать может и в качестве симптома какого-либо воспалительного скрытого очага (хронического энтероколита в том числе), аллергической реакции, гипотиреоза. Поэтому, в случае, если было выявлено, что в вашем анализе крови несколько повышены базофилы, вам в любом случае следует пройти комплексное обследование. Ни в коем случае не пренебрегайте направлением врача на исследования.
Базофилы понижены: основные причины базопении
Врачи называют уменьшение в периферической крови количества клеток базофилов (когда она понижены и анализ показывает менее чем 0,01*109/л) — называют базопенией.
Базопения, как известно, может наблюдаться при таких патологических состояниях и болезнях:
- При острых инфекциях.
- Гипертиреозе.
- При овуляции и во время беременности.
- Во время стрессовых ситуациях.
- При приеме каких-либо кортикостероидов.
- Болезни Кушинга.
Какие функции базофилы выполняют в организме?
Главной функцией клеток базофилов считается их участие в различных аллергических реакциях. Базофилы также отвечают кровоток, который проходит в тонких капиллярах. Данные клетки обладают важной способностью к так называемому фагоцитозу, но при этом в поддержании иммунитета и защите организма какой-то существенной функции они не играют. Зато в процессе свёртываемости крови этот тип белых клеточек крови играет довольно важную роль. Клетки базофилов способны провоцировать сокращение мускулатуры (гладкой), увеличивать проницаемость сосудов.
Как и остальные лейкоциты, клетки базофилы принимают участие в воспалительном процессе (об этом мы упоминали чуть выше), и в первую очередь в аллергических реакциях, во время развития которых проявляются такие клинические признаки как: жжение, зуд, покраснение и даже отеки тканей. В случае длительной воспалительной реакции (больше 72-х часов) непосредственно в костном мозге начинает происходить быстрое образование новых клеточек и наблюдается состояние, которое специалисты именуют как базофилоцитоз.
В случае длительной воспалительной реакции (больше 72-х часов) непосредственно в костном мозге начинает происходить быстрое образование новых клеточек и наблюдается состояние, которое специалисты именуют как базофилоцитоз.
Так же важной функцией базофилов считается обеспечение в небольших сосудах кровотока и эффективного роста в организме новых капилляров. Клеточки этого типа активно принимают участие и в процессе регулирования свертываемости крови за счет наличия в гранулах гепарина. При этом напомним, что базофилы не играют вообще никакой роли в поддержании каких-либо защитных сил человеческого организма, хоть они и обладают явной способностью к фагоцитозу.
Базофилы повышены: что делать?
Когда базофилы в крови повышены, их нужно понижать. Чтобы снизить их содержание в крови, следует повысить в организме количество всем известного витамина B12. Он действительно играет важную роль в образовании новых клеточек крови и нормальной работе головного мозга. Вообще, существует довольно таки много продуктов, которые выступает в качестве натуральных источников данного природного компонента. Таким источником является пища животного происхождения. Самыми надёжными из них по праву считаются мясо, молоко, и, конечно же, яйца. Незначительно содержание B12 обнаружено недавно было в и таких продуктах как дрожжи и соевое молоко.
Таким источником является пища животного происхождения. Самыми надёжными из них по праву считаются мясо, молоко, и, конечно же, яйца. Незначительно содержание B12 обнаружено недавно было в и таких продуктах как дрожжи и соевое молоко.
Иногда базофилы в крови у взрослого повышаются по причине недостатка железа в его организме. Восполнить помогут его ливер, телячья печень, устрицы, рыба и красное мясо. Врачи нередко назначают специальные железосодержащие средства в капсулах. И отметим, что активному всасыванию такого элемента как железо способствуют обычный апельсиновый сок и сухое белое вино.
Это важно! На понижение базофилов, как известно, также влияет и гормон прогестерон. В крови их соотношение как бы обратно пропорционально. У представительниц женского пола считается вполне нормальным незначительное повышение в крови базофилов во время беременности, в период овуляции, а так же в начале каждого цикла, потому что уровень эстрогенов всегда влияет на количество в крови базофилов.
Как правило, базофилия успешно излечивается, если устраняется непосредственная причина ее возникновения, то есть, важно произвести лечение основного заболевания. Но порой патологически завышенный уровень базофилов наблюдаться может даже у вполне здоровых людей. Когда у взрослого базофилы повышены и при этом он ни чем не болен, врач может просто прописать пациенту особый рацион питания: есть больше фруктов и овощей, рыбы, молочных продуктов.
Когда базофилы в крови сильно повышены, в некоторых индивидуальных случаях, достаточно просто отменить употребление лекарственных препаратов. Например, эстрогенсодержащих, антитиреоидных средств и им подобных.
Оцените статью: Loading …
Записи по теме:
Базофилы и лимфоциты повышены, нейтрофилы понижены — Вопрос гематологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.
Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 72 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.44% вопросов.
Оставайтесь с нами и будьте здоровы!
Повышенное количество и активация периферических базофилов при болезни минимальных изменений у взрослых
Abstract
В настоящее время патогенез болезни минимальных изменений (MCD) все еще недостаточно известен, и текущее понимание MCD в основном основано на полученных данных от детей и очень мало взрослых. Здесь мы всесторонне проанализировали корреляцию между изменениями периферических базофилов и частотой возникновения и рецидивами БКД у взрослых. Результаты показали, что у пациентов в начале MCD соотношение и активация базофилов были выше, чем у здоровых контролей (все P <.05). Результаты испытаний in vitro показали, что базофилы здоровых людей могут быть активированы сывороткой, взятой у пациентов с MCD. Среди 62 пациентов с дебютом MCD, с полной ремиссией после лечения и через 1 год наблюдения, относительное и абсолютное количество базофилов до лечения было выше в группе длительной ремиссии (n = 33), чем в группе рецидива. (n = 29). Количество базофилов было значительно выше в группе с редкими рецидивами (n = 13), чем в группе с частыми рецидивами (n = 16; P <.05). Эти данные свидетельствуют о том, что базофилы могут играть патогенную роль в MCD, начинающемся у взрослых, а повышенное количество и активация периферических базофилов может предсказать рецидив у взрослых MCD.
(n = 29). Количество базофилов было значительно выше в группе с редкими рецидивами (n = 13), чем в группе с частыми рецидивами (n = 16; P <.05). Эти данные свидетельствуют о том, что базофилы могут играть патогенную роль в MCD, начинающемся у взрослых, а повышенное количество и активация периферических базофилов может предсказать рецидив у взрослых MCD.
Ключевые слова: активация , взрослый, базофил, болезнь минимальных изменений, рецидив
1. ВВЕДЕНИЕ
Болезнь минимальных изменений (MCD) представляет собой комбинацию заболеваний клубочков, которые проявляются нефротическим синдромом. Клетки не обнаруживают явных патологических изменений под световым микроскопом, но обширное устранение подоцитарных процессов можно наблюдать с помощью электронного микроскопа.МКД — это патологический диагноз, на который приходится 70–90% первичного нефротического синдрома у детей и 10–15% нефротического синдрома у взрослых. 1
Текущее понимание MCD в основном основано на данных, полученных от детей и очень небольшого числа взрослых. У большинства пациентов MCD поддается терапии глюкокортикоидами и легко поддается лечению; однако частота рецидивов чрезвычайно высока.
2
Более того, MCD может трансформироваться даже в очаговый сегментарный гломерулонефрит и терминальную стадию почечной недостаточности.3
,
4
Патогенетические механизмы MCD в настоящее время неясны. Некоторые исследования показали, что Т-лимфоциты, особенно Т-хелперные (Th) клетки, влияют на начало MCD.
5
,
6
После того, как Th-клетки дифференцируются в Th3-клетки, те, которые экспрессируют высокие уровни IL-4 и IL-13, могут участвовать в возникновении MCD.
7
,
8
,
9
,
10
,
11
,
12
Важно отметить, что у пациентов с MCD низкий уровень IgG в сыворотке крови.
13
и повышенный уровень IgE,
14
,
15
предполагая, что гуморальный иммунитет участвует в возникновении MCD.Начало MCD связано с циркулирующими иммунными факторами.
16
и протеинурия, вызванная дисфункцией подоцитов и повреждением подоцитов
17
; однако другие механизмы также могут быть вовлечены в патогенез MCD, и патогенные факторы, участвующие в этих механизмах, еще не идентифицированы.
У большинства пациентов MCD поддается терапии глюкокортикоидами и легко поддается лечению; однако частота рецидивов чрезвычайно высока.
2
Более того, MCD может трансформироваться даже в очаговый сегментарный гломерулонефрит и терминальную стадию почечной недостаточности.3
,
4
Патогенетические механизмы MCD в настоящее время неясны. Некоторые исследования показали, что Т-лимфоциты, особенно Т-хелперные (Th) клетки, влияют на начало MCD.
5
,
6
После того, как Th-клетки дифференцируются в Th3-клетки, те, которые экспрессируют высокие уровни IL-4 и IL-13, могут участвовать в возникновении MCD.
7
,
8
,
9
,
10
,
11
,
12
Важно отметить, что у пациентов с MCD низкий уровень IgG в сыворотке крови.
13
и повышенный уровень IgE,
14
,
15
предполагая, что гуморальный иммунитет участвует в возникновении MCD.Начало MCD связано с циркулирующими иммунными факторами.
16
и протеинурия, вызванная дисфункцией подоцитов и повреждением подоцитов
17
; однако другие механизмы также могут быть вовлечены в патогенез MCD, и патогенные факторы, участвующие в этих механизмах, еще не идентифицированы. Единая теория не может полностью объяснить патофизиологическое течение MCD, и необходимы более подробные сведения о механизмах, участвующих в этом процессе.
Единая теория не может полностью объяснить патофизиологическое течение MCD, и необходимы более подробные сведения о механизмах, участвующих в этом процессе.
Pirotzky et al. 18 обнаружили, что пациенты с MCD проявляют сенсибилизацию и базофилы могут участвовать в патологических событиях при MCD.Кроме того, Mack et al. 19 предположил, что базофилы «следует анализировать при болезни минимальных изменений и очаговом сегментарном гломерулонефрите». Однако влияние базофилов на MCD в дальнейшем не исследовалось. В последние годы, когда методы обнаружения базофилов стали более продвинутыми, исследователи продемонстрировали, что базофилы выполняют более важные функции при аллергических реакциях и иммунной регуляции. 20
В этом исследовании, определяя количество и активацию периферических базофилов у взрослых пациентов с MCD, мы впервые всесторонне проанализировали взаимосвязь между базофилами, началом MCD и рецидивом MCD.Мы также исследовали влияние сыворотки взрослых пациентов с MCD на активацию базофилов здоровых людей in vitro.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Пациенты и контрольная группа
В это исследование были включены пациенты с начальной стадией MCD, которые были госпитализированы в дочернюю больницу Гуандунского медицинского университета с января 2015 года по февраль 2018 года. Все пациенты были взрослыми, у них был диагностирован идиопатический MCD, и они соответствовали диагностическим критериям. критерии нефротического синдрома.21 год Контрольными группами были здоровые испытуемые, чей пол и возраст совпадали с экспериментальными группами.
2.2. Схема лечения
Пероральный преднизон 1 мг / кг / сут или равная доза метилпреднизолона использовалась в качестве исходной дозы. Затем каждые 2 недели ее снижали примерно на 10% от первоначальной дозы. До тех пор, пока доза преднизона не достигла 10 мг / сут, ее поддерживали в течение примерно 6 месяцев, а затем препарат медленно отменяли. Общий терапевтический курс составил 9-12 месяцев. У пациентов с резистентностью к стероидам или частыми рецидивами его можно комбинировать с иммунодепрессантами, такими как циклофосфамид.
2.3. Определения
Рецидивы были определены следующим образом: (а) рецидив, рецидив после того, как белок в моче был отрицательным с белком мочи ≥1 +; (б) частые рецидивы, более двух эпизодов рецидива за 6 месяцев или более трех эпизодов рецидива за 1 год; (c) длительная ремиссия, отсутствие рецидивов после того, как белок мочи был отрицательным в течение более 1 года. 22 , 23
2.4. Процедура наблюдения за пациентами с MCD
Случаи с 2015 по 2016 год были ретроспективно проанализированы на предмет различных исходов рецидивов после лечения и различий в количестве и пропорциях базофилов до лечения (как определено стандартными анализами крови).В начальной стадии MCD было 85 пациентов, которые наблюдались до декабря 2017 года; 62 пациента, которые наблюдались в течение 1 года после того, как у них был отрицательный белок в моче после первоначального лечения; 33 пациента с длительной ремиссией; и 29 пациентов с рецидивом (в том числе 16 случаев частых рецидивов и 13 случаев нечастых рецидивов).
2,5. Экспериментальный метод и анализ проточной цитометрии
Образцы периферической венозной крови были взяты у пациентов с начальным началом MCD, начиная с 2017 года, которые не получали глюкокортикоиды или иммунодепрессанты.Образцы обрабатывали в течение 2 часов и использовали проточную цитометрию для определения соотношений базофилов (CD123 + CD203c + ), индексов активации (средней интенсивности флуоресценции [MFI] CD203c и CD62L) и внутриклеточных факторов, выражаемых базофилами ( ИЛ-4, ИЛ-6 и ИЛ-13). Всего было включено 17 пациентов, средний возраст 27,7 ± 13,3 года. В тот же период здоровые добровольцы были включены в нормальную контрольную группу, в том числе 22 человека со средним возрастом 26 лет.1 ± 2,0 года.
Образцы периферической крови были разделены на внеклеточные и внутриклеточные пробирки. Во внеклеточной пробирке базофилы человека были заблокированы на CD203c-PE и CD123-Alexa Fluor 647 (BioLegend) двойные положительные клетки после внеклеточного окрашивания. MFI экспрессии CD203c-PE и CD62L-PE-Cy7 (BioLegend) количественно определяли как индексы активации базофилов. Во внутриклеточной пробирке базофилы человека были заблокированы на CD203c-PE-Cy7 (eBioscience) и CD123-Alexa Fluor 647 (BD Biosciences) после внеклеточного окрашивания.После этого уровни экспрессии IL-4-PerCP / Cy5.5, IL-6-FITC и IL-13-PE (BD Biosciences) в базофилах были количественно определены и выражены как положительный процент от общего количества базофилов. На каждом этапе использовались изотипические контроли (мышиный IgG1-PE, мышиный IgG1-Alexa Fluor 647, мышиный IgG1-PE-Cy7, мышиный IgG1-PerCP / Cy5.5, крысиный IgG2a-FITC и крысиный IgG1-PE).
Проточный цитометр FACScanto ™ II (Becton Dickinson) и программное обеспечение FlowJo 7.6 использовали для сбора и анализа данных соответственно. Кроме того, количество базофилов в периферической крови некоторых пациентов с MCD также определялось с помощью обычных анализов крови с помощью автоматизированной системы счисления (система Beckman coulter COULTER ® LH 750) для анализа линейной корреляции между тестами FCM и стандартными анализами крови.
2.6. Влияние сыворотки пациентов с MCD на активацию базофилов
Кровь была собрана у здоровых добровольцев (n = 9) для отрицательного отбора базофилов и отделения сыворотки. Затем была взята сыворотка у девяти пациентов с MCD. Набор для обогащения базофилов человека EasySep ™ (Stemcell Technologies) использовали для отрицательной очистки базофилов человека до получения чистоты более 90% с использованием проточной цитометрии.
Девять порций базофилов здоровых людей помещали в среду RPMI 1640 (Gibco Laboratories) с сывороткой пациентов с MCD (20%) и IL-3 (20 нг / мл; PeproTech), затем культивировали в течение 24 часов.Затем использовали проточную цитометрию для обнаружения изменений MFI CD203c и CD62L на базофилах. Используя тот же метод, девять порций базофилов нормальных людей были помещены в культуральную среду с аллогенной сывороткой здоровых добровольцев (20%) и IL-3 (20 нг / мл). Перед тестом FCM жизнеспособность клеток проверяли 0,2% раствором трипанового синего (Sigma).
2.7. Этическое одобрение
Исследование было одобрено этическим комитетом больницы-филиала Гуандунского медицинского университета (разрешение №PJ2017054). Исследование соответствовало принципам Хельсинкской декларации. Все пациенты дали информированное согласие перед участием в исследовании.
2,8. Статистический анализ
Весь статистический анализ был выполнен с использованием SPSS 23.0 (SPSS, Inc). Нормально распределенные данные были выражены как среднее значение ± стандартное отклонение, и двухгрупповые сравнения были выполнены с использованием парного или непарного двустороннего теста t . Данные с ненормальным распределением были выражены как медиана ( P 25 , п. 75 ), а двухгрупповые сравнения были выполнены с использованием критерия Манна-Уитни U .Линейный регрессионный анализ использовался для определения корреляции между стандартными анализами крови и тестами проточной цитометрии для определения количества периферических базофилов. P <0,05 считалось показателем статистической значимости.
3. РЕЗУЛЬТАТЫ
3.1. У пациентов в начальной стадии MCD было повышенное количество и повышенная активность периферических базофилов
С марта 2017 г. по февраль 2018 г. в нашей больнице были взяты образцы периферической крови у 17 пациентов в начальной стадии MCD (еще не пролеченных).Не было обнаружено статистической значимости возрастных различий между пациентами и нормальными контрольными группами ( P > 0,05). Анализ проточной цитометрии показал, что среднее соотношение периферических базофилов в лейкоцитах (0,48% ± 0,29%) в группе MCD было значительно выше, чем в группе нормальной контрольной группы (0,31% ± 0,17%) ( P <0,05). ; Фигура ).
Соотношение периферических базофилов в лейкоцитах, определяемое методом проточной цитометрии. A, типичный график разброса проточной цитометрии.Группа белых кровяных телец была использована для установки ворот для маркировки белых кровяных телец. B, C, типичные диаграммы соотношений базофилов в нормальной контрольной группе и группе MCD; базофилы были определены как CD123 + CD203c + . D, сравнительная диаграмма соотношений периферических базофилов между нормальной контрольной группой (n = 22) и группой MCD (n = 17). * P <.05, было проведено непарное испытание t . Ba, базофилы
В течение того же периода при тех же условиях значения MFI CD203c и CD62L на базофилах пациентов с MCD были выше, чем в нормальной контрольной группе ( P <.05; Фигура ; Стол ).
Типичная диаграмма статуса активации периферических базофилов у пациентов с MCD, определенная с помощью проточной цитометрии. Типичная диаграмма значений MFI индекса активации CD203c (A) и CD62L (B) базофилов у пациентов с MCD и нормальной контрольной группы. Ba, базофилы; MFI, средняя интенсивность флуоресценции
ТАБЛИЦА 1
Значения MFI активации базофилов в MCD и нормальной контрольной группах за тот же период
| Индекс активации | MCD (n = 10) | Нормальный (n = 8) | П |
|---|---|---|---|
| CD203c MFI (среднее ± стандартное отклонение) | 14.8 ± 8,8 | 5,4 ± 2,2 | .008 |
| CD62L MFI (среднее ± стандартное отклонение) | 100,3 ± 61,6 | 35,8 ± 31,5 | .016 |
Проточная цитометрия обнаружила дальнейшую внутриклеточную экспрессию факторы базофилов до лечения у пациентов с МКД. Процентное соотношение базофилов IL-4 + и базофилов IL-6 + к общему количеству базофилов в группе MCD (n = 15) было выше, чем у нормальной контрольной группы (n = 16; P <.05). Процент базофилов IL-13 + был чрезвычайно низким в группе MCD, и не было существенной разницы по сравнению с таковой в нормальной контрольной группе ( P > 0,05; рисунок; таблица).
Типичная диаграмма процентного соотношения базофилов с положительными IL-4, IL-6 и IL-13 к общему количеству базофилов у пациентов с MCD и нормальным контролем. A, B и C, репрезентативная диаграмма процентного содержания базофилов IL-4 + , базофилов IL-6 + и базофилов IL-13 + к общему количеству базофилов, соответственно, в нормальном контроле.D, E, F, репрезентативная диаграмма процентного соотношения базофилов IL-4 + , базофилов IL-6 + и базофилов IL-13 + к общему количеству базофилов, соответственно, у пациентов с начальным началом MCD. Ba, базофилы
ТАБЛИЦА 2
Сравнение процентного содержания внутриклеточных факторов-положительных базофилов к общему количеству базофилов в группах MCD и нормальном контроле
| Внутриклеточные факторы | MCD (n = 15) | Нормальный (n = 16) | П |
|---|---|---|---|
| IL ‐ 4 + Ba M (-пол. 25 , п. 75 )% | 1.98 (0,97, 4,67) | 0,54 (0,38, 1,22) | 0,021 |
| IL ‐ 6 + Ba M ( P 25 , п. 75 )% | 3,5 (1,94, 6,03) | 0,67 (0,32, 1,15) | .000 |
| IL-13 + Ba M ( P 25 , п. 75 )% | 0,20 (0,13, 2,09) | 0,27 (0,08, 0,57) | ,545 |
3.2. Сыворотка пациентов с активированными MCD базофилами здорового контроля
После того, как базофилы здорового контроля были культивированы и стимулировались в культуральной среде аллогенной сывороткой нормальных людей в течение 24 часов, жизнеспособность клеток была выше 95%, а Значения MFI активированных и меченых CD203c и CD62L не показали значительных различий ( P > 0,05). После культивирования и стимуляции в культуральной среде с сывороткой от пациентов с MCD все значения MFI для CD203c и CD62L были значительно увеличены ( P <.05; Стол ).
ТАБЛИЦА 3
Изменения активированных параметров после стимуляции базофилов нормальных индивидуумов и культивирования их сывороткой от пациентов с MCD в течение 24 часов
| Индекс активации | До стимуляции (Нормальный, n = 9) | После стимулированный (Нормальный, n = 9) | П | После стимуляции (MCD, n = 9) | П |
|---|---|---|---|---|---|
| CD203c MFI | 2930.3 ± 1247,5 | 2871,0 ± 1244,8 | ,439 а | 4182,6 ± 2401,5 | 0,048 б |
| CD62L MFI | 5290,7 ± 2871,6 | 5720,0 ± 3242,5 | 0,095 а | 9052,9 ± 3639,2 | 0,038 б |
3.3. Подсчет периферических базофилов позволяет оценить активность MCD
На основании вышеупомянутых экспериментальных данных, периферические базофилы пациентов с MCD показали значительно увеличенное количество и усиленную активацию.Однако рутинные анализы крови используются в клинической практике для получения количественных результатов; поэтому затем мы использовали стандартные анализы крови для оценки периферической крови у вышеупомянутых 16 пациентов с MCD. Не было значительных различий в соотношениях базофилов, как было определено парными тестами t ( P = 0,731). Анализ линейной корреляции показал, что два метода (FCM и рутинные анализы крови) значительно коррелировали ( r = 0,915, P <.001; Фигура ). Вышеупомянутые результаты показали, что эти два метода были совместимы в отношении обнаружения изменений в количестве базофилов.
Линейный корреляционный анализ двух методов идентификации базофилов. Результаты тестов между рутинными анализами крови и тестами проточной цитометрии изменений в количестве периферических базофилов у здоровых добровольцев (n = 16)
Затем мы использовали ретроспективный анализ, чтобы выяснить, можно ли использовать только количество базофилов для оценки активности MCD. Во-первых, были исследованы различия в количестве периферических базофилов между активной фазой и фазой ремиссии у пациентов с MCD.В период с 2015 по 2016 год в нашу больницу поступило 25 пациентов с начальной стадией MCD, у которых была полная ремиссия после полного курса лечения (> 9 месяцев). Эти пациенты прекратили лечение глюкокортикоидами более чем на 1 месяц (что позволяет исключить влияние глюкокортикоидов на количество лейкоцитов и количество базофилов), а затем снова были выполнены стандартные анализы крови для определения соотношения и количества базофилов. Соотношение базофилов во время активной стадии (начальное начало, до лечения) (0.61% ± 0,34%) была заметно выше стадии ремиссии (0,36% ± 0,17%) ( P <0,001; рисунок). Количество базофилов в активной стадии (51,9 ± 31,3 / мкл) было значительно выше, чем в стадии ремиссии (31,0 ± 12,7 / мкл) ( P <0,01; рисунок). Следовательно, соотношение и количество базофилов во время активной стадии были выше, чем во время стадии ремиссии у пациентов с MCD. Эти результаты позволяют предположить, что количество периферических базофилов оценивает активность MCD.
Изменения соотношения и количества базофилов во время активной стадии и стадии ремиссии у пациентов с MCD.A: Соотношение базофилов в активной стадии и стадии ремиссии у пациентов с MCD (n = 25). B, количество базофилов в активной стадии и стадии ремиссии у пациентов с MCD. *** P <0,001; ** P <0,01, было выполнено парное испытание т
3.4. Подсчет периферических базофилов может предсказать ремиссию и рецидив у пациентов с MCD
Другой важный клинический вопрос — это количество периферических базофилов во время ремиссии и рецидива у пациентов с MCD.В период с 2015 по 2016 год с начальной стадией MCD поступили 62 пациента, у которых был отрицательный белок в моче после начального лечения и которые наблюдались в течение 1 года, в том числе 33 случая длительной ремиссии и 29 случаев рецидива (16 случаев частых рецидивов и 13 случаев нечастых рецидивов). Результаты показали, что соотношение базофилов до лечения в группе длительной ремиссии (0,61% ± 0,32%, n = 33) было выше, чем в группе рецидива (0,42% ± 0,24%, n = 29) ( P <.05; Фигура ). Количество базофилов до лечения в группе длительной ремиссии (52,5 ± 33,0 / мкл, n = 33) также было выше, чем в группе рецидива (34,7 ± 17,0 / мкл, n = 29; P <0,01; рисунок ). Соотношение базофилов до лечения в группе с нечастыми рецидивами (0,53% ± 0,25%, n = 13) было выше, чем в группе с частыми рецидивами (0,33% ± 0,20%, n = 16) ( P <0,05; рисунок) . Примечательно, что количество базофилов до лечения в группе с редкими рецидивами (38,6 ± 14,1 / мкл) существенно не отличалось по сравнению с группой с частыми рецидивами (31.5 ± 18,8 / мкл) ( P = 0,276). Соотношение базофилов в группе длительной ремиссии, группе нечастых рецидивов и группе частых рецидивов демонстрировало постепенную тенденцию к снижению (рисунок). Эти результаты свидетельствуют о том, что пациенты с начальным дебютом MCD с относительно высоким соотношением и количеством базофилов с большей вероятностью будут иметь долгосрочную ремиссию после лечения.
Сравнение соотношения и количества базофилов у пациентов с начальным началом MCD с различными клиническими исходами. A, Сравнение соотношений базофилов во время начального развития БКД в группе длительной ремиссии (n = 33) и группе рецидива (n = 29).B. Сравнение количества базофилов во время начального развития БМК в группе длительной ремиссии (n = 33) и группе рецидива (n = 29). C. Сравнение соотношений базофилов во время начального начала MCD в группе с нечастыми рецидивами (n = 13) и в группе с частыми рецидивами (n = 16). D, Тенденции соотношения базофилов в группе длительной ремиссии (n = 33), группе нечастых рецидивов (n = 13) и группе частых рецидивов (n = 16). * P <.05; ** P <0,01, непарный т испытание было выполнено
4.ОБСУЖДЕНИЕ
IgE и базофилы могут участвовать в патогенезе MCD, 14 , 18 и Th-клетки могут приводить к возникновению MCD за счет активации Th3-клеток, которые экспрессируют высокие уровни цитокинов Th3, включая IL-4 и IL-13. 7 , 8 , 9 , 10 , 11 , 12 , 24 Кроме того, базофилы являются доминирующим типом клеток, продуцирующих цитокины Th3 на ранней стадии ответа Th3. Кроме того, ИЛ-4, происходящий из клеток Th3, может воздействовать на В-клетки, вырабатывая антитела IgE, которые активируют базофилы, способствуя патогенному циклу.25 , 26 Базофилы в лейкоцитах периферической крови можно точно определить с помощью антител, нацеленных на CD123 и CD203c, два индикатора активации, чувствительных к базофилам. 27 , 28 год , 29 Таким образом, активированные базофилы могут напрямую влиять на функции Т- и В-лимфоцитов или косвенно влиять на Т- и В-лимфоциты через образование специфических метаболитов.
В нашем текущем исследовании мы обнаружили, что периферические базофилы у взрослых пациентов в начальной стадии MCD показали повышенное количество и повышенную активность по сравнению с пациентами со стабильным MCD.Эти результаты согласуются с результатами, описанными Pirotzky et al, 18 это также указывает на то, что периферические базофилы у пациентов в начальной стадии MCD были активированы, а изменения количества и активации базофилов у пациентов с MCD были тесно связаны с активностью заболевания.
Хотя патогенные факторы, связанные с протеинурией у пациентов с MCD, не определены, такие патогенные факторы могут происходить из кровообращения, а не из почек.16 , 30 Когда сыворотка пациентов с MCD использовалась для лечения базофилов от здоровых добровольцев, базофилы были активированы, что позволяет предположить, что вещество, активирующее базофилы, могло происходить из сыворотки, например, IgE.
Биологические функции базофилов зависят от активации клеток, которая может опосредоваться множественными стимуляторами, включая IgE. 31 год , 32 Уровни IgE в сыворотке повышаются у пациентов с MCD, а затем восстанавливаются до нормального уровня после ремиссии. 14 , 15 , 33 Напротив, патологическое исследование почек у пациентов с MCD не показало отложения IgE или IgE-циркулирующих иммунных комплексов (CIC), что указывает на то, что IgE был промежуточным фактором в начале MCD.Следовательно, активация базофилов может быть опосредована IgE-CIC или другими IgE-релевантными соединениями, сшитыми с высокоаффинным рецептором FcεR1 базофильного IgE. 32 Активированные базофилы демонстрируют повышенную регуляцию поверхностных молекул, включая CD203c и CD62L, и быстро продуцируют цитокины, включая IL-4. 34
Соотношение базофилов, позитивно экспрессирующих цитокины, включая IL-4, IL-6 и IL-13, является еще одним параметром активации периферических базофилов у пациентов с MCD. По сравнению с CD203c и CD62L это соотношение делает больший акцент на функциональной экспрессии активированных базофилов, то есть на том, могут ли активированные базофилы секретировать активные медиаторы.Исследователи пришли к выводу, что базофилы продуцируют важный цитокин IL-4, который необходим для дифференцировки Th3-клеток, тогда как IgE участвует в основном пути, опосредующем активацию Th3-клеток. 35 год В нашем текущем исследовании мы подтвердили, что повышенный процент IL-4-положительных базофилов от общего количества базофилов в периферической крови у пациентов с MCD был связан с активацией базофилов и секреции цитокинов у пациентов с MCD, тем самым подчеркивая участие этих клеток в патогенез MCD.IL-6-положительные базофилы у пациентов с MCD также были увеличены; однако никакие исследования не продемонстрировали роли IL-6 в патогенезе MCD. Повышенная экспрессия IL-6 может быть только сопутствующим феноменом повышенной активации базофилов и не обязательно может напрямую участвовать в патогенезе MCD.
Несколько исследований показали, что уровень IL-13 в сыворотке повышен у пациентов с MCD во время активной фазы. 8 , 36 Однако в этом исследовании базофилы экспрессировали чрезвычайно низкие уровни IL-13 у пациентов с MCD и здоровых людей в контрольной группе, что позволяет предположить, что базофилы могут не действовать на подоциты, напрямую экспрессируя IL-13, но могут высвобождать цитокины, включая IL-4, для опосредования. другие клетки (например, опосредуют клетки Th0 для дифференцировки в клетки Th3) и продуцируют IL-13.Необходимы дальнейшие исследования, чтобы определить, опосредуются ли более высокие концентрации IL-13 в сыворотке крови пациентов с MCD непосредственно базофилами.
Частые рецидивы MCD — проблема, которую трудно лечить в клинической практике. Ритуксимаб, моноклональное антитело к CD20, может успешно лечить часто рецидивирующие и рефрактерные MCD путем целевого клиренса CD20-положительных В-лимфоцитов. 37 это указывает на то, что частые рецидивы MCD тесно связаны с появлением B-лимфоцитов. IgE, продуцируемый B-лимфоцитами, может опосредовать активацию базофилов.Соответственно, необходимы дальнейшие исследования для оценки механизмов, посредством которых базофилы участвуют в рецидиве и ремиссии MCD.
Использование FCM для обнаружения активации базофилов связано со сложными методами, которые трудно применять в клинической практике. Напротив, количественная оценка может быть достигнута с использованием обычных анализаторов клеток крови; поэтому мы исследовали взаимосвязь между количеством базофилов, активностью MCD и клиническими исходами. Результаты показали, что изменения в количестве базофилов, определяемые обычными анализами крови, можно использовать для оценки активности MCD в клинической практике; однако для подтверждения этих результатов необходимы дальнейшие исследования.Другим важным фактором является то, что количество периферических базофилов, рассчитываемое обычными тестами, которые, как известно, не являются точными, 38 которые во многом зависят от модели машины, есть ли у нее независимый канал обнаружения базофилов.
В нашем анализе взаимосвязи между базофилами и рецидивом MCD мы случайно обнаружили, что после лечения глюкокортикоидами более низкое количество и соотношение базофилов у пациентов с начальным началом MCD до лечения были связаны с более высокой вероятностью рецидива в будущем.Это явление было трудно согласовать с нашим пониманием базофилов. В частности, было неясно, почему большее количество базофилов и более серьезная сенсибилизация не привели к более легкому рецидиву. Согласно текущим исследованиям MCD, 39 есть два возможных объяснения. Одна из возможностей заключается в том, что базофилы могут быть вредными во время патогенеза MCD. У пациентов с бронхиальной астмой 40 , 41 год с той же аллергической реакцией и частыми рецидивами, что и БКД, и у пациентов с аутоиммунными заболеваниями, такими как системная красная волчанка, 42 , 43 год базофилы мигрируют из кровотока во вторичные лимфоидные органы 44 год или место воспаления в начале заболевания, что приводит к уменьшению количества базофилов в кровообращении и повреждению перемещенных тканей.В отличие от СКВ, в патогенезе БКД отсутствуют иммунные комплексы или отложения лейкоцитов в клубочках. Возможно, что в процессе патогенеза лейкоциты не мигрируют к органу-мишени. Это может объяснить, почему MCD поддерживает высокий уровень базофилов с самого начала, хотя это только предположение. Другая возможность заключается в том, что базофилы могут быть полезны во время начала MCD. Высокие уровни IL-4 и IL-13 в сыворотке крови пациентов с MCD во время активной фазы прямо или косвенно не производятся базофилами, а повышенный уровень базофилов у пациентов с MCD может подавлять экспрессию патогенных факторов, что приводит к длительному срок ремиссии у пациентов с более высоким числом периферических базофилов.В любом случае необходимы дальнейшие исследования с более крупными выборками, чтобы предоставить справочную информацию для выбора подходящего терапевтического режима в клинической практике. Основываясь на наших выводах, взрослым пациентам с более низким соотношением базофилов до лечения может быть полезно сочетание иммунодепрессантов для уменьшения рецидива.
В рамках текущего исследования были отмечены определенные ограничения. Одним из ограничений нашего исследования является то, что пациенты с нефротическим синдромом без МЦД не были включены в контрольную группу, поэтому изменения и активация базофилов не обязательно могут быть уникальными у пациентов с нефротическим синдромом.Другой заключается в том, что пДК CD123 + может присутствовать в воротах базофилов из-за более низкой экспрессии CD203c базофилами из нормального контроля, что может привести к тому, что реальные данные о частоте базофилов в нормальном контроле могут быть немного ниже. Кроме того, результаты показали, что по сравнению с пациентами MCD частота базофилов была значительно ниже, чем у MCD, даже там, возможно, присутствовали pDC в воротах базофилов нормального контроля. Таким образом, это вмешательство не повлияло на вывод этого исследования.
Эти данные свидетельствуют о том, что базофилы могут играть патогенную роль в MCD, начинающемся у взрослых, а повышенное количество и активация периферических базофилов может предсказать рецидив у взрослых MCD.
Базофильная клетка — обзор
Развитие и распространение базофилов
Базофилы — самые редкие гранулоциты у млекопитающих (<1% лейкоцитов периферической крови) и получили свое название от базофильных гранул в их цитоплазме. Редкость и короткая продолжительность жизни (~ 2.5 дней у мышей) базофилов до недавнего времени препятствовали изучению их функций, но сейчас растет понимание их роли в различных иммунных процессах, отличных от тучных клеток. К ним относятся FcεRI-зависимый захват антигена и мощная и быстрая способность генерировать и секретировать IL-4 и IL-13.
Базофилы — это миелоидные клетки, которые возникают и развиваются в костном мозге. Подобно тучным клеткам, они развиваются из GMP, которые становятся BMCP или BaP, каждый из которых обладает способностью развиваться в зрелый базофил. 2,3 Компетенция к линии базофилов регулируется факторами транскрипции GATA-2 и C / EBPα. В отличие от тучных клеток, базофилы покидают костный мозг только после того, как полностью созреют. Развитию базофилов способствует воспалительная реакция Т-хелперных клеток-2 (Th3). Цитокины, включая IL-3 и цитокин TSLP, происходящий из эпителиальных клеток, также регулируют развитие базофилов. 3
Исследования развития Ex vivo с человеческими клетками-предшественниками предположили общее происхождение базофилов и эозинофилов.Denburg et al. показали, что часть клональных колоний, происходящих из клеток-предшественников периферической крови человека, содержит как эозинофилы, так и базофилы, при этом некоторые клетки демонстрируют промежуточный фенотип с гранулами обеих ветвей. 22 Сайто и др. показали, что рекомбинантный ИЛ-3 стимулировал рост как эозинофилов, так и базофилов из предшественников пуповинной крови. 23 Базофилы человека экспрессируют катионный белок эозинофилов, основной основной белок, кристаллический белок Шарко-Лейдена и пероксидазу эозинофилов, которые являются маркерами гранул эозинофилов, 24 , что соответствует общему происхождению обоих типов клеток.Недавнее исследование транскрипционного профилирования подтвердило, что базофилы крови мышей больше похожи на эозинофилы по паттерну экспрессии генов, чем на любой другой тип клеток. 5 Общий путь происхождения базофилов и эозинофилов объясняет, почему количество базофилов в крови часто повышается в условиях, связанных с повышенным количеством эозинофилов в крови.
Рекрутирование базофилов в ткани, вероятно, регулируется комбинацией хемоаттрактантов белков и липидов. Базофилы человека экспрессируют CCR1, CCR2, CCR3, CCR5, CXCR1 и CXCR2 и отвечают ex vivo на соответствующие лиганды.Базофилы сильно экспрессируют гомолог рецептора хемоаттрактанта, экспрессируемый клетками Th3 (CRTh3), специфическим рецептором простагландина D 2 (PGD 2 ). PGD 2 является обильным продуктом активированных тучных клеток, а лиганды CCR3 (CCL11, CCL24, CCL26) обильно экспрессируются структурными клетками при аллергическом воспалении. 1 Таким образом, все они являются хорошими кандидатами для объяснения накопления базофилов, которое часто наблюдается при рините и астме и является характерным для индуцированных аллергенами реакций поздней фазы.
Количество базофилов: Медсестринское дело 2020 Реанимационное отделение
Отделение: Глядя в лаборатории
DOI: 10.1097 / 01.CCN.0000559778.07144.9d
МетрикиФон
Базофилы, составляющие небольшой процент от общего количества лейкоцитов, считаются фагоцитарными. Базофильные гранулы содержат гепарин, гистамин и серотонин. Базофилы ткани называются тучными клетками и похожи на базофилы крови.Обычно тучные клетки не обнаруживаются в периферической крови и редко встречаются в здоровом костном мозге. Подсчет базофилов используется для оценки хронического воспаления. Существует положительная корреляция между высоким количеством базофилов и высокими концентрациями гистамина в крови, хотя эта корреляция не подразумевает причинно-следственных связей.
Нормальные контрольные значения для взрослых
- Абсолютное количество базофилов: от 15 до 50 / мм 3 или от 0,02 до 0,05 × 10 9 / л
- Дифференциал: от 0% до 1.0% от общего количества лейкоцитов.
Возможные причины базофилии
(увеличенное количество) более 50 / мм 3 или более 0,05 × 10 9 / л
- гранулоцитарный (миелоцитарный) лейкоз
- острый базофильный лейкоз
- миелоидная метаплазия, миелопролиферативные нарушения
- Болезнь Ходжкина
- , реже ассоциируется с:
- воспаление, аллергия или синусит
- истинная полицитемия
- хроническая гемолитическая анемия
- спленэктомия
- ионизирующее излучение
- гипотиреоз
- инфекций, включая туберкулез, оспу, ветряную оспу, грипп
- инъекция чужеродного белка.
Возможные причины базопении
(уменьшенное количество) <15 / мм 3 или <0,02 × 10 9 / л
- острая инфекция
- гипертиреоз
- стрессовые реакции (например, беременность, инфаркт миокарда)
- пролонгированная стероидная терапия, химиотерапия, лучевая терапия
- наследственное отсутствие базофилов.
Мешающие факторы
Ложноположительные значения могут быть вызваны:
- дезипрамин
- пароксетин
- третиноин
- триазолам
- венлафаксин.
Ложноотрицательные значения могут быть вызваны:
Источник: Fischbach FT, Fischbach MA. Руководство по лабораторным и диагностическим исследованиям . 10-е изд. Филадельфия, Пенсильвания: Уолтерс Клувер; 2018.
Wolters Kluwer Health, Inc. Все права защищены. Просмотреть полный текст статьиВозрастное увеличение IgE-связывания и экспрессии FcεRI на циркулирующих базофилах у детей
Aebischer I, Stadler BM 1996 Th2-Th3 клетки при аллергии отзывы: в пределах концепции. Adv Immunol 61 : 341–403
CAS Статья PubMed Central Google ученый
Tsuji T, Nibu R, Iwai K, Kanegane H, Yachie A, Seki H, Miyawaki T, Taniguchi N 1994 Эффективная индукция выработки иммуноглобулина в неонатальных наивных B-клетках с помощью памяти CD4 + T-клеточная субпопуляция, экспрессирующая хоминг рецептор L-селектина. J Immunol 152 : 4417–4424
CAS PubMed PubMed Central Google ученый
Kanegane H, Kasahara Y, Niida Y, Yachie A, Sugii S, Takatsu K, Taniguchi N, Miyawaki T 1996 Экспрессия L-селектина (CD62L) различает Th2- и Th3-подобные цитокины памяти CD4 + Т-клеток. Иммунология 87 : 186–190
CAS Статья PubMed Central Google ученый
Yachie A, Konno A, Ohta K, Wada T, Seki H, Taniguchi N, Miyawaki T. 1995 Определение способности наивных B-клеток продуцировать подклассы IgG и IgA у новорожденных и взрослых людей. Clin Exp Immunol 102 : 204–209
CAS Статья PubMed Central Google ученый
Chalmers IM, Janossy G, Contreras M, Navarrete C 1998 Внутриклеточный цитокиновый профиль пуповинных лимфоцитов и взрослых лимфоцитов крови. Кровь 92 : 11–18
CAS Статья PubMed Central Google ученый
Bradding P, Feather IH, Howarth PH, Mueller R, Roberts JA, Britten K, Bews JP, Hunt TC, Okayama Y, Heusser CH, Bullock GR, Church MK, Holgate ST 1992 Interleukin 4 локализован на высвобождается тучными клетками человека. J Exp Med 176 : 1381–1386
CAS Статья PubMed Central Google ученый
Brunner T, Heusser CH, Dahinden CA 1993 Базофилы периферической крови человека, примированные интерлейкином 3 (IL-3), продуцировали IL-4 в ответ на стимуляцию рецептора иммуноглобулина E. J Exp Med 177 : 605–611
CAS Статья PubMed Central Google ученый
Schroeder JT, MacGlashan DW Jr, Kagey-Sobotka A, White JM, Lichtenstein LM 1994 IgE-зависимая секреция IL-4 базофилами человека. J Immunol 153 : 1808–1817
CAS PubMed PubMed Central Google ученый
Gauchat JF, Henchoz S, Mazzei G, Aubry JP, Brunner T, Blasey H, Life P, Talabot D, Flores-Romo L, Thompson J, Kishi K, Butterfield J, Dahinden C, Bonnefoy JY 1993 Induction синтеза человеческого IgE в В-клетках тучными клетками и базофилами. Nature 365 : 340–343
CAS Статья PubMed Central Google ученый
Мечери С., Дэвид Б. 1997 Разрешение дилеммы тучных клеток: виновник или жертва их щедрости. Immunol Today 18 : 212–215
CAS Статья PubMed Central Google ученый
Schroeder JT, MacGlashan DW Jr 1997 Новые концепции: базофилы. J Allergy Clin Immunol 99 : 429–433
CAS Статья PubMed Central Google ученый
Леонард Э.Дж., Робертс Р.Л., Скил А. 1984 Очистка базофилов крови человека одностадийным изопикническим бэндингом на перколле. J Leukoc Biol 35 : 169–177
CAS Статья PubMed Central Google ученый
Ra C, Kuromitsu S, Hirose T, Yasuda S, Furuichi K, Okumura K 1993 Растворимый высокоаффинный рецептор человека для IgE отменяет опосредованную IgE аллергическую реакцию. Int Immunol 5 : 47–54
CAS Статья PubMed Central Google ученый
Zhang K, Clark EA, Saxon Стимуляция CD40 1991 г. обеспечивает IFN-гамма-независимый и IL-4-зависимый сигнал дифференцировки непосредственно к человеческим В-клеткам для продукции IgE. J Immunol 146 : 1836–1842
CAS PubMed PubMed Central Google ученый
Sigurs N, Hattevig G, Kjellman B, Kjellman NI, Nilsson L, Bjorksten B 1994 Появление атопического заболевания по отношению к сывороточным антителам IgE у детей, наблюдаемых с рождения в течение 4-15 лет. J Allergy Clin Immunol 94 : 757–763
CAS Статья PubMed Central Google ученый
Martin SJ, Reutelingsperger CP, McGahon AJ, Rader JA, van Schie RC, LaFace DM, Green DR 1995 Раннее перераспределение фосфатидилсерина плазматической мембраны является общим признаком апоптоза независимо от инициирующего стимула: ингибирование сверхэкспрессией Bcl -2 и Abl. J Exp Med 182 : 1545–1556
CAS Статья PubMed Central Google ученый
Willheim M, Agis H, Sperr WR, Koller M, Bankl HC, Kiener H, Fritsch G, Fureder W, Spittler A, Graninger W, Scheiner O, Gadner H, Lechner K, Boltz-Nitulescu G, Valent P 1995 Очистка базофилов и тучных клеток человека методом многоступенчатого разделения и mAb к CDw17 и CD117 / c-kit. J Иммунологические методы 182 : 115–129
CAS Статья PubMed Central Google ученый
Malveaux FJ, Conroy MC, Adkinson NF, Lichtenstein LM 1978 рецепторы IgE на базофилах человека. J Clin Invest 61 : 176–181
Артикул Google ученый
Conroy MC, Adkinson NF Jr, Lichtenstein LM 1977 Измерение IgE на базофилах человека: связь с сывороточным IgE и анти-IgE-индуцированным высвобождением гистамина. J Immunol 118 : 1317–1321
CAS PubMed PubMed Central Google ученый
Park CS, Ra DJ, Lee SM, Jeong SW, Uh S, Kim HT, Kim YH 1996 Интерлейкин-4 и низкоаффинный рецептор IgE к B-клеткам в периферической крови пациентов с атопической бронхиальной астмой. J Allergy Clin Immunol 97 : 1121–1128
CAS Статья PubMed Central Google ученый
Sihra BS, Kon OM, Grant JA, Kay AB 1997 Экспрессия высокоаффинных рецепторов (FcεRI) на базофилах, моноцитах и эозинофилах периферической крови у субъектов с атопией и без нее: отношение к общим концентрациям IgE в сыворотке. J Allergy Clin Immunol 99 : 699–706
CAS Статья PubMed Central Google ученый
Yamaguchi M, Lantz CS, Oettgen HC, Katona IM, Fleming T, Miyajima I, Kinet JP, Galli SJ 1997 IgE усиливает экспрессию FcεRI тучных клеток мыши in vitro и in vivo: доказательства нового механизма амплификации в IgE -зависимые реакции. J Exp Med 185 : 663–672
CAS Статья PubMed Central Google ученый
Lantz CS, Yamaguchi M, Oettgen HC, Katona IM, Miyajima I, Kinet J-P, Galli SJ 1997 IgE регулирует экспрессию мышиного базофила FcεRI in vivo. J Immunol 158 : 2517–2521
CAS PubMed PubMed Central Google ученый
MacGlashan DW Jr, Bochner BS, Adelman DC, Jardieu PM, Togias A, McKenzie-White J, Sterbinski SA, Hamilton RG, Lichtenstein LM 1997 Подавление экспрессии FcεRI на базофилах человека во время лечения атопии in vivo. пациенты с антителами против IgE. J Immunol 158 : 1438–1445
CAS PubMed PubMed Central Google ученый
MacGlashan D Jr, McKenzie-White J, Chichester K, Bochner BS, Davis FM, Schroeder JT, Lichtenstein LM 1998 Регулирование in vitro экспрессии FcεRIα на базофилах человека с помощью антибобов IgE. Кровь 91 : 1633–1643
CAS Статья PubMed Central Google ученый
Gounni AS, Lamkhioued B, Ochiai K, Tanaka Y, Delaporte E, Capron A, Kinet JP, Capron M 1994 Высокоаффинный рецептор IgE на эозинофилах участвует в защите от паразитов. Nature 367 : 183–186
CAS Статья PubMed Central Google ученый
Maurer D, Fiebiger E, Reininger B, Wolff-Winiski B, Jouvin MH, Kilgus O, Kinet JP, Stingl G 1994 Экспрессия функциональных высокоаффинных рецепторов иммуноглобулина E (FcεRI) на моноцитах лиц с атопией. J Exp Med 179 : 745–750
CAS Статья PubMed Central Google ученый
Sutton BJ, Gould HJ 1993 Сеть человеческого IgE. Nature 366 : 421–428
CAS Статья PubMed Central Google ученый
Thompson HL, Metcalfe DD, Kinet JP 1990 Ранняя экспрессия высокоаффинного рецептора иммуноглобулина E (FcεRI) во время дифференцировки тучных клеток мыши и базофилов человека. J Clin Invest 85 : 1227–1233
CAS Статья PubMed Central Google ученый
Увеличение базофилов в мокроте является маркером воспаления дыхательных путей с преобладанием эозинофилов при астме у взрослых
Резюме
Предпосылки: Ранее мы сообщали, что количество базофилов в мокроте положительно коррелирует с количеством эозинофилов в мокроте у пациентов с астмой. Однако остается неизвестным, указывает ли увеличение базофилов дыхательных путей на специфический воспалительный фенотип или нет.
Цели: Целью данного исследования является выяснение специфического фенотипа, увеличивающего базофилы мокроты.
Методы: Мы проанализировали образцы индуцированной мокроты от взрослых пациентов с астмой, которые лечились с помощью ICS более 2 месяцев. Базофилы мокроты исследовали методом проточной цитометрии, а эозинофилы и нейтрофилы мокроты исследовали под микроскопом. Воспаление дыхательных путей было разделено на 4 подтипа: малоклеточный тип (нейтрофилы <60%, эозинофилы <2%), нейтрофильный тип (нейтрофилы> 60%, эозинофилы <2%), эозинофильный тип (нейтрофилы <60%, эозинофилы> 2). %) и смешанного клеточного типа (нейтрофилы> 60%, эозинофилы> 2%).Хронический синусит оценивали с помощью компьютерной томографии и оценивали по системе Lund-Mackay.
Результаты: Было исследовано шестьдесят восемь образцов. Базофилы мокроты были увеличены по эозинофильному типу. С другой стороны, количество базофилов мокроты не увеличивалось при смешанном клеточном типе, а также при низкоклеточном и нейтрофильном типах. Компьютерная томография для оценки хронического синусита показала положительную корреляцию между количеством базофилов в мокроте и оценками решетчатой кости.
Заключение: Увеличение количества базофилов мокроты наблюдалось при воспалении с преобладанием эозинофилов, но не при смешанном клеточном воспалении.Базофилы дыхательных путей могут быть полезным биомаркером для выбора подходящей терапии в эпоху биологии.
Сноски
Цитируйте эту статью как: European Respiratory Journal 2018 52: Suppl. 62, PA4425.
Это тезисы Международного конгресса ERS. Полнотекстовая версия недоступна. Дополнительные материалы, сопровождающие этот тезис, могут быть доступны на сайте www.ers-education.org (только для членов ERS).
- Авторские права © авторы 2018
Старые мыши демонстрируют измененное количество и фенотип базофилов, а также активацию базофилов костного мозга с ограниченной ролью связанной со старением микробиоты | Иммунитет и старение
Лаки Т. Введение в микроэкологию кишечника. Am J Clin Nutr. 1972. 25 (12): 1292–4.
CAS Статья Google ученый
Tlaskalová-Hogenová H, Štěpánková R, Kozáková H, Hudcovic T., Vannucci L, Tučková L, et al. Роль кишечной микробиоты (комменсальных бактерий) и слизистого барьера в патогенезе воспалительных и аутоиммунных заболеваний и рака: вклад моделей болезней человека на животных без микробов и гнотобиотов.Cell Mol Immunol. 2011; 8 (2): 110–20.
Артикул Google ученый
Bianconi E, Piovesan A, Facchin F, Beraudi A, Casadei R, Frabetti F, et al. Оценка количества клеток в организме человека. Ann Hum Biol. 2013. 40 (6): 463–71.
Артикул Google ученый
Иванов И.И., Литтман Д.Р. Модуляция иммунного гомеостаза комменсальными бактериями. Curr Opin Microbiol.2011; 14 (1): 106–14.
CAS Статья Google ученый
Чу Х, Мазманян СК. Врожденное иммунное распознавание микробиоты способствует симбиозу между хозяином и микробом. Nat Immunol. 2013. 14 (7): 668–75.
CAS Статья Google ученый
Луо Ю., Чен Г.-Л, Ханнеманн Н., Ипсейс Н., Крёнке Г., Бойерле Т. и др. Микробиота мышей с ожирением регулирует дифференцировку гемопоэтических стволовых клеток, изменяя костную нишу.Cell Metab. 2015; 22 (5): 886–94.
CAS Статья Google ученый
Кларк ТБ, Дэвис К.М., Лысенко Е.С., Чжоу А.Ю., Юй Ю, Вайзер Дж. Распознавание пептидогликана из микробиоты с помощью Nod1 повышает системный врожденный иммунитет. Nat Med. 2010. 16 (2): 228–31.
CAS Статья Google ученый
Hill DA, Siracusa MC, Abt MC, Kim BS, Kobuley D, Kubo M, et al.Сигналы, полученные от комменсальных бактерий, регулируют базофильный гемопоэз и аллергическое воспаление. Nat Med. 2012. 18 (4): 538–46.
CAS Статья Google ученый
Доршкинд К., Монтесино-Родригес Э., подписант RAJ. Старение иммунной системы: неужели когда-нибудь слишком стар, чтобы снова стать молодым? Nat Rev Immunol. 2009. 9 (1): 57–62.
CAS Статья Google ученый
Смит П., Данн Д.В., Фаллон П.Г. Нарушение in vivo индукции функциональных цитокиновых ответов типа 2 у старых мышей. Eur J Immunol. 2001. 31 (5): 1495–502.
CAS Статья Google ученый
Уцеховски П., Ринк Л. Функции базофилов, эозинофилов и нейтрофилов у пожилых людей. В: Massoud A, Rezaei N. (eds) Immunology of Aging. Берлин: Springer; 2014.
Биаги Э., Найлунд Л., Кандела М., Остан Р., Буччи Л., Пини Е. и др.В результате старения и не только: микробиота кишечника и воспалительный статус у пожилых и долгожителей. PLoS One. 2010; 5 (5): e10667.
Артикул Google ученый
Биенеман А.П., Чичестер К.Л., Чен И-Х, Шредер Дж. Т.. Лиганды Toll-подобного рецептора 2 активируют базофилы человека как на IgE-зависимую, так и на IgE-независимую секрецию. J Allergy Clin Immunol. 2005. 115 (2): 295–301.
CAS Статья Google ученый
Kamijo S, Nunomura S, Ra C, Kanaguchi Y, Suzuki Y, Ogawa H и др. Врожденные базофильные ответы IL-4 против аллергенов, эндотоксинов и цитокинов требуют γ-цепи рецептора Fc. J Allergy Clin Immunol. 2016; 137 (5): 1613–5. e2.
CAS Статья Google ученый
Мароне Дж., Пото С., ди Мартино Л., Кондорелли М. Высвобождение базофилов человека: I. Возрастные изменения высвобождаемости базофилов. J Allergy Clin Immunol. 1986. 77 (2): 377–83.
CAS Статья Google ученый
Шварценбах Х., Накагава Т., Конрой М., Век А. Реактивность кожи, дегрануляция базофилов и уровни IgE при старении. Clin Exp Allergy. 1982; 12 (5): 465–73.
CAS Статья Google ученый
Ленг SX, Сюэ Q-L, Хуанг Y, Ферруччи Л., Фрид LP, Уолстон Дж. Д.. Базовый общий и специфический дифференциальный подсчет лейкоцитов и пятилетняя смертность от всех причин среди пожилых женщин, проживающих в общинах.Exp Gerontol. 2005. 40 (12): 982–7.
Артикул Google ученый
Ленг SX, Сюэ Q-L, Тиан Дж, Хуанг Y, Yeh S-H, Fried LP. Связь количества нейтрофилов и моноцитов с хрупкостью у пожилых женщин-инвалидов, проживающих в общинах: результаты исследований здоровья женщин и старения I. Exp Gerontol. 2009. 44 (8): 511–6.
Артикул Google ученый
Шад К.Ф., Агазаде Я., Ахмад С., Кресс Б.Периферические маркеры болезни Альцгеймера: наблюдение за лейкоцитами. Синапс. 2013. 67 (8): 541–3.
CAS Статья Google ученый
Сонг С., Вандевуд М., Стивенс В., Де Клерк Л., Ван дер Планкен М., Уилан А. и др. Изменения иммунных функций при нормальном старении и болезни Альцгеймера. Psychiatry Res. 1999. 85 (1): 71–80.
CAS Статья Google ученый
Ван Бик А.А., Кнол Э.Ф., Де Вос П., Смелт М.Дж., Савелкул Х.Ф.Дж., Ван Нирвен RJJ. Последние достижения в исследованиях базофилов: инициируют и поддерживают ли базофилы ответы Т-хелперных клеток 2 типа? Int Arch Allergy Immunol. 2013; 160 (1): 7–17.
CAS Статья Google ученый
Мур М.Л., Ньюкомб, округ Колумбия, Парех В.В., Ван Каер Л., Коллинз Р.Д., Чжоу В. и др. STAT1 отрицательно регулирует экспрессию базофильного IL-4 в легких, вызванную инфекцией респираторно-синцитиального вируса.J Immunol. 2009; 183 (3): 2016–26.
CAS Статья Google ученый
Chen K, Xu W., Wilson M, He B, Miller NW, Bengtén E, et al. Иммуноглобулин D усиливает иммунный надзор за счет активации противомикробных, провоспалительных и стимулирующих В-клеток программ в базофилах. Nat Immunol. 2009. 10 (8): 889–98.
CAS Статья Google ученый
Denzel A, Maus UA, Gomez MR, Moll C, Niedermeier M, Winter C, et al.Базофилы усиливают иммунологические реакции памяти. Nat Immunol. 2008; 9 (7): 733–42.
CAS Статья Google ученый
Charles N, Hardwick D, Daugas E, Illei GG, Rivera J. Базофилы и среда T-helper 2 могут способствовать развитию волчаночного нефрита. Nat Med. 2010. 16 (6): 701–7.
CAS Статья Google ученый
Пан Q, Gong L, Xiao H, Feng Y, Li L, Deng Z, et al.Зависимые от активации базофилов аутоантитела и выработка интерлейкина-17 усугубляют системную красную волчанку. Фронт Иммунол. 2017; 8: 348.
PubMed PubMed Central Google ученый
Liang P, Tang Y, Fu S, Lv J, Liu B, Feng M, et al. Количество базофилов, маркер активности заболевания при системной красной волчанке. Clin Rheumatol. 2015; 34 (5): 891–6.
Артикул Google ученый
Сектиоглу И.М., Карретеро Р., Бульбук Н., Лысый Т., Тутинг Т., Руденский А.Ю. и др. Базофилы способствуют отторжению опухоли за счет хемотаксиса и инфильтрации CD8 + Т-клеток. Cancer Res. 2017; 77 (2): 291–302.
CAS Статья Google ученый
Siracusa MC, Saenz SA, Hill DA, Kim BS, Headley MB, Doering TA и др. TSLP способствует интерлейкин-3-независимому базофильному гематопоэзу и воспалению 2 типа. Природа. 2011; 477: 229–33.
CAS Статья Google ученый
Schneider E, Thieblemont N, De Moraes ML, Dy M. Базофилы: новые игроки в сети цитокинов. Eur Cytokine Netw. 2010. 21 (3): 142–53.
CAS PubMed Google ученый
Йошимото Т., Наканиши К. Генерация и характеристика базофилов мышей из костного мозга и очистка базофилов из селезенки. Curr Protoc Immunol 2012: 3.24.1–3..16.
Йошимото Т., Ясуда К., Танака Х., Накахира М., Имаи Ю., Фудзимори Ю. и др.Базофилы вносят вклад в Th3-IgE-ответы in vivo через продукцию IL-4 и презентацию комплексов пептид-MHC класса II CD4 + Т-клеткам. Nat Immunol. 2009. 10 (7): 706–12.
CAS Статья Google ученый
Кодзима Т., Обата К., Мукаи К., Сато С., Такай Т., Минегиси Ю. и др. Тучные клетки и базофилы избирательно активируются in vitro и in vivo через CD200R3 IgE-независимым образом. J Immunol. 2007. 179 (10): 7093–100.
CAS Статья Google ученый
Gerdes J, Lemke H, Baisch H, Wacker H-H, Schwab U, Stein H. Анализ клеточного цикла ядерного антигена человека, связанного с пролиферацией клеток, определенного моноклональным антителом Ki-67. J Immunol. 1984. 133 (4): 1710–5.
CAS PubMed Google ученый
Хида С., Ямасаки С., Сакамото Ю., Такамото М., Обата К., Такай Т. и др.G-цепь рецептора Fc, составляющая компонента рецептора IL-3, необходима для индуцированного IL-3 продукции IL-4 в базофилах. Nat Immunol. 2009. 10 (2): 214–22.
CAS Статья Google ученый
Ширатори И., Ямагути М., Судзукава М., Ямамото К., Ланье Л.Л., Сайто Т. и др. Подавление функции базофилов CD200 человека и CD200 вируса герпеса-8 человека. J Immunol. 2005. 175 (7): 4441–9.
CAS Статья Google ученый
van Beek AA, Hugenholtz F, Meijer B, Sovran B, Perdijk O, Vermeij WP и др. Ограничение триптофана останавливает развитие В-клеток и увеличивает микробное разнообразие у мышей дикого типа и у преждевременно стареющих мышей Ercc1- / Δ7. J Leukoc Biol. 2016; 101 (4): 811–21.
Артикул Google ученый
Mahbub S, Deburghgraeve CR, Kovacs EJ. Пожилой возраст нарушает поляризацию макрофагов. J Interf Cytokine Res. 2012; 32 (1): 18–26.
CAS Статья Google ученый
Чжан Б., Бейли В.М., Браун К.Дж., Дженсель Дж.С. Возраст снижает экспрессию макрофагального IL-10: последствия для функционального восстановления и восстановления тканей при повреждении спинного мозга. Exp Neurol. 2015; 273: 83–91.
CAS Статья Google ученый
Fransen F, Van Beek A, Borghuis T., El Aidy S, Hugenholtz F, Van der Gaast-de Jongh C, et al. Престарелая микробиота кишечника способствует системному воспалению после передачи мышам, свободным от микробов.Фронт Иммунол. 2017; 8: 1385.
Артикул Google ученый
Базофилы усиливают иммунные ответы 2-го типа, но не выполняют защитной роли при хроническом заражении мышей филяриальной нематодой Litomosoides sigmodontis
Abstract
Хронические гельминтозы вызывают иммунный ответ 2-го типа, характеризующийся эозинофилией, высоким уровнем IgE и повышенная продукция цитокинов типа 2 Т-клетками. Поскольку было показано, что базофилы вносят существенный вклад в ИЛ-4 при гельминтных инфекциях, и поскольку базофилы способны индуцировать дифференцировку Th3 Т-клеток CD4 + и переключение изотипа IgE в В-клетках, мы предположили, что базофилы выполняют функцию амплификации типа 2. иммунные ответы при хронической гельминтозной инфекции.Чтобы проверить это, мы оценили функцию базофилов с использованием модели Litomosoides sigmodontis filaria хронической гельминтной инфекции у мышей BALB / c. Исследования с течением времени показали, что эозинофилия, паразитарный Ag-специфический CD4 + Т-клеточная продукция IL-4 и IL-5, активация базофилов и продукция IL-4 в ответ на паразитарный Ag достигают пика поздно (6-8 недель) в течение инфекции L. sigmodontis после того, как стали обнаруживаться паразитоспецифические IgE. Эксперименты по имплантации червей смешанного и однополого пола продемонстрировали, что относительно поздний пик этих реакций не зависел от появления циркулирующих микрофилярий, но мог быть связан с исходными низкими уровнями нагрузки паразитами Ag и / или обитанием развивающихся червей в плевральная полость.Истощение базофилов в течение инфекции L. sigmodontis вызвало значительное снижение общего и паразитоспецифического IgE, эозинофилии и паразитарной Ag-управляемой пролиферации CD4 + Т-клеток и продукции IL-4, но не повлияло на общий уровень червя. числа. Эти результаты демонстрируют, что базофилы усиливают иммунные ответы типа 2, но не выполняют защитную роль при хроническом инфицировании мышей филяриальной нематодой L. sigmodontis .
В отличие от большинства других патогенов, гельминты вызывают иммунный ответ 2 типа, характеризующийся эозинофилией, повышенными уровнями Ag-специфических и поликлональных IgE в сыворотке крови и повышением продукции Т-клетками IL-4, IL-5 и IL-13. .Этот ответ типа 2, вероятно, полезен для борьбы с гельминтозными инфекциями, поскольку дефицит IL-4, передачи сигналов IL-4R и IgE связан с увеличением количества паразитов в ряде моделей на животных (1–7).
Базофилы, которые обычно составляют> 0,5% всех циркулирующих лейкоцитов, все чаще признаются как играющие центральную роль в развитии иммунных ответов типа 2 при аллергических и гельминтозных заболеваниях (8–12). Из всех PBMC только базофилы обладают способностью к раннему высвобождению большого количества IL-4 в ответ на соответствующие стимулы, высвобождая предварительно сформированный IL-4 в течение 5-10 минут после активации (13).Исследования, которые мы и другие провели, предполагают, что базофилы продуцируют значительно больше IL-4 на клеточную основу, чем другие типы клеток, в ответ на антигенную нагрузку (14–16). Помимо ИЛ-4, базофилы также синтезируют и высвобождают стромальный лимфопоэтин тимуса, который также может способствовать иммунным ответам 2-го типа (17, 18).
Идея о том, что базофилы могут управлять иммунными ответами типа 2, подтверждается исследованиями in vitro, которые продемонстрировали, что базофилы, которые экспрессируют CD40L, а также высвобождают IL-4, могут побуждать В-клетки к переключению на изотип IgE (19, 20) и может заставить наивные Т-клетки дифференцироваться до фенотипа 2 типа (21).В соответствии с этими результатами, было показано, что истощение базофилов in vivo снижает количество Th3-клеток через 4 дня после заражения Th3-индуцирующим аллергеном (22), экспрессию мРНК IL-4 из ткани толстой кишки через 21 день после инфицирования (pi) мышей с желудочно-кишечный гельминт Trichuris muris (23), тканевая эозинофилия в модели кожной анафилаксии (24), циркулирующая и тканевая эозинофилия, а также экспрессия мРНК IL-4, IL-5 и IL-13 у мышей, сенсибилизированных сывороткой из Nippostrongylus brasiliensis -инфицированных мышей, а затем зараженных этим паразитом (25).
В этом исследовании мы стремились определить физиологическое значение базофилов в развитии ответов типа 2 на модели хронической гельминтной инфекции. Чтобы достичь этого, мы оценили функцию базофилов в течение 10-недельного периода времени у мышей, инфицированных Litomosoides sigmodontis , мышиной моделью филяриатоза. В этой модели личинки L3 на стадии инфицирования, введенные в подкожно-жировой клетчаткой. ткани мигрируют в плевральную полость в течение первой недели после рождения, развиваются во взрослых червей к 4 неделям.i., и начинают выпуск микрофилярий на стадии L1 в кровоток через 7 недель p.i. Как и при филяриозных инфекциях человека, инфицирование мышей L. sigmodontis приводит к преобладающему иммунному ответу 2-го типа с высоким уровнем циркулирующих эозинофилов и IgE-антител, а также продукции цитокинов 2-го типа Т-клетками CD4 + .
Наши результаты показывают, что как иммунные ответы типа 2, так и активация базофилов в ответ на L. sigmodontis становятся максимально поздними (6–8 недель с.i.) в ходе инфицирования L. sigmodontis после того, как стал обнаруживаться специфический IgE. Эксперименты по имплантации червей показали, что относительно поздний пик этих ответов не зависел от появления циркулирующих микрофилярий. Наконец, истощение базофилов ясно показывает, что базофилы играют важную роль в усилении иммунных ответов типа 2 на L. sigmodontis , таких как эозинофилия, уровни Ag-специфических IgE паразитов, пролиферация Т-клеток CD4 + в ответ на Ag паразитов и Ag паразитов. Производство IL-4 из CD4 + Т-клеток было значительно снижено в л.sigmodontis -инфицированные мыши, лишенные базофилов в течение 8-недельного периода времени.
Материалы и методы
Мыши и инфекция
Самок мышей BALB / c (репозиторий мышей Национального института рака, Фредерик, Мэриленд) содержали в животноводческом учреждении Университета военной службы. Эксперименты проводились на мышах в возрасте от 5 до 8 недель в соответствии с протоколом, одобренным Комитетом по уходу и использованию животных Университета униформ (Bethesda, MD).
Личинки L3 на инфекционной стадии из Litomosoides sigmodontis были выделены путем лаважа из плевральной полости 4-х инфицированных грызунов ( Meriones unguiculatus , полученных из лаборатории TRS, Афины, Джорджия), как описано ранее (26).Взрослых червей получали путем физического извлечения из плевральной полости убитых мышей, инфицированных в течение 8 недель. Мыши были заражены подкожно. инъекция 40 личинок L3 или внутрибрюшинно хирургическая имплантация пяти взрослых червей. Для хирургической имплантации взрослых червей мышей анестезировали смесью кетамина, ацетопромазина и ксилазина, как описано ранее (27). В конечные точки исследования мышей умерщвляли диоксидом углерода и цельной кровью, полученной при сердечной пункции и собираемой в гепаринизированные микроцентрифужные пробирки (Sarstedt, Nümbrecht, Германия).
Истощение базофилов
Для истощения базофилов in vivo, Ba103 получали крысиные моноклональные антитела IgG2b, которые распознают CD200R3, как описано ранее (24), и вводили мышам внутрибрюшинно, начиная с 2 дней преинфекции, или вводили однократно через 8 недель p.i. Контрольным мышам в экспериментах по истощению базофилов вводили i.p. инъекции контрольных антител изотипа IgG2b крысы (BD Biosciences, Сан-Хосе, Калифорния).
Проточно-цитометрические анализы активации базофилов
Цельную кровь разбавляли наполовину RPMI 1640 (Cellgro, Mediatech, Herndon, VA) и стимулировали л.sigmodontis Ag (LsAg) при 20 мкг / мл в течение 2 ч при 37 ° C в 5% CO 2 . При измерении внутриклеточного IL-4 вместе с CD200R, монензин (ингибитор транспорта белков BD GolgiStop, BD Biosciences) добавляли через 1 час инкубации при конечной концентрации 2 мМ, и пробирки инкубировали еще 2 часа при 37 ° C в течение 5 часов. % CO 2 . Клетки дважды промывали 2 мл PBS (Mediatech) и центрифугировали при 500 × g в течение 5 мин. Супернатанты аспирировали и лизировали эритроциты с использованием набора реагентов для лизиса цельной крови (Beckman Coulter, Fullerton, CA).Immuno-Lyse разводили 1/25 в PBS, добавляли по 1 мл рабочего раствора в каждую пробирку и инкубировали 1 мин при комнатной температуре. Лейкоциты немедленно фиксировали 250 мкл фиксирующего раствора (9,25% формальдегида и 3,75% метанола), дважды промывали 2 мл PBS и центрифугировали при 500 × g в течение 5 мин. Супернатанты аспирировали, и сайты неспецифического связывания блокировали ресуспендированием клеток в 100 мкл 1% BSA / PBS и инкубировали при 4 ° C в течение 1 часа. Клетки окрашивали анти-IgE FITC, анти-CD4 PerCP, анти-B220 PerCP и анти-CD200R-PE в течение 30 мин при 4 ° C, дважды промывали 2 мл PBS и центрифугировали при 500 × g в течение 5 минут. мин.В исследованиях, в которых также оценивался внутриклеточный IL-4, клетки окрашивали в два этапа. После окрашивания поверхности и двух промывок клетки подвергали проницаемости с помощью буфера BD Perm / Wash (BD Biosciences), ресуспендировали в 1% BSA / PBS, окрашивали аллофикоцианином против IL-4 в течение 30 минут при 4 ° C и дважды промывали. Клетки ресуспендировали в 200 мкл PBS и анализировали с использованием проточного цитометра BD LSR II Optical Bench и программного обеспечения FACSDiVa 6.1 (BD Biosciences).
Для всех экспериментов по проточной цитометрии Abs индивидуально титровали перед использованием, а компенсации оценивали с помощью BD compBeads (BD Biosciences), связанного с Abs, используемыми в этом эксперименте.Для анализов активации базофилов пороговые значения для положительности CD200R-PE и IL-4-аллофикоцианина были установлены с использованием метода флуоресценции минус один (28). Анти-IgE FITC (R35-72), анти-CD4 PerCP (RM4-5), анти-B220 PerCP (RA3-6B2), анти-Siglec-F PE (E50-2440), анти-CD49b аллофикоцианин (HMα2), и анти-IL-4 аллофикоцианин (11B11) был приобретен у BD Pharmingen (Сан-Диего, Калифорния), а анти-CD200R-PE (OX-110) у AbD Serotec (Кидлингтон, Оксфорд, Великобритания).
LsAg
Растворимый LsAg был получен из л взрослого самца и самки.sigmodontis , полученные из плевральной полости инфицированных червей и замороженные при -20 ° C. Черви размораживали, промывали PBS, повторно замораживали при -20 ° C и лиофилизировали в течение ночи. Лиофилизированных червей ресуспендировали в PBS и механически разрушали путем перемешивания с помощью магнитного стержня при 4 ° C в течение ночи. После центрифугирования при 750 × g в течение 10 мин при 4 ° C без тормоза супернатант собирали. Осадок снова перемешивали в течение ночи, центрифугировали при 1200 × g в течение 10 минут при 4 ° C и снова собирали супернатант.Два супернатанта объединяли и центрифугировали в последний раз при 12000 × g в течение 30 минут при 4 ° C. Этот последний супернатант пропускали через фильтр 0,22 мкм (Milex-GV; Millipore, Bedford, MA), и общую концентрацию белка измеряли с использованием набора для анализа белка BCA (Pierce, Rockford, IL). Конечный растворимый продукт Ag, LsAg, содержит Ag от взрослых особей червей мужского и женского пола, а также от микрофилярий, присутствующих в матке взрослых женских особей. Хотя черви L3 не используются для производства LsAg, Ab и клеточные иммунные ответы, индуцированные червями на стадии L3, реагируют на LsAg (29).
Извлечение червей и подсчет клеток
Червей L4 и взрослых были извлечены и подсчитаны путем рассечения плевральной полости. Для подсчета микрофилярий 30 мкл аликвоты цельной крови инкубировали в лизирующем буфере ACK в течение 10 мин, центрифугировали, а затем ресуспендировали в 30 мкл PBS и визуализировали неокрашенными с использованием интегрированного модулирующего контраста.
Для временного исследования количество базофилов и эозинофилов анализировали с использованием дифференциального счетчика лейкоцитов Bayer Advia 120.Для экспериментов по имплантации червей количество базофилов и эозинофилов получали путем ручного дифференциального подсчета мазков крови, окрашенных May Grünwald / Giemsa. Для исследований истощения базофилов количество эозинофилов определяли путем окрашивания образцов крови анти-CD11b FITC (BD Pharmingen) и анти-CCR3-PE (R&D Systems, Миннеаполис, Миннесота) и идентификации эозинофилов с помощью проточного цитометрического анализа как CD11b тусклый CCR3 + . В подгруппе животных эозинофилы также были идентифицированы как анти-Siglec-F PE + и анти-IgE FITC —.
Поликлональный и специфический IgE ELISA
Кровь собирали у инфицированных L. sigmodontis- самок мышей BALB / c в различные моменты времени с помощью ретроорбитального кровотечения или сердечной пункции и анализировали на поликлональные IgE и LsAg-специфические IgE с помощью колориметрического сэндвича. ELISA. Плоскодонные планшеты Immulon 4 (Thomas Scientific, Swedesboro, NJ) покрывали в течение ночи при 4 ° C 10 мкг / мл антимышиного IgE (клон R35-72) для поликлонального IgE или 20 мкг / мл LsAg для паразитоспецифических. IgE. Блокирование осуществляли путем инкубации планшетов с 5% BSA в PBS в течение 1 часа.Перед тестированием IgG адсорбировали из образцов сыворотки путем инкубации сыворотки с GammaBind G-сефарозой (Amersham Biosciences, Упсала, Швеция) в течение ночи при 4 ° C. Затем образцы сыворотки разбавляли 1: 5 и 1:50 для измерения поликлонального IgE. Планшеты промывали и инкубировали с биотинилированным крысиным антимышиным IgE (клон R35-118) в PBS. После промывки добавляли разбавление 1/1000 стрептавидина, конъюгированного с щелочной фосфатазой (BD Pharmingen), и планшеты инкубировали в течение 1 ч при 37 ° C. Нитрофенилфосфат динатрий (Sigma-Aldrich, St.Луи, Миссури) был использован в качестве субстрата. Очищенный мышиный IgE использовали в качестве стандарта для общего IgE (BD Biosciences). Для измерения специфического IgE образцы из контрольной и экспериментальной групп анализировали как дубликаты на одном планшете, чтобы обеспечить точное сравнение между группами по OD. Поглощение определяли при 405 нм с использованием микропланшетного ридера PerkinElmer Victor 3 V (PerkinElmer, Waltham, MA).
Количественный анализ цитокинов и анализы пролиферации
Спленоциты ресуспендировали в буфере для лизирования ACK (Quality Biological, Gaithersburg, MD) для лизиса эритроцитов.Клетки промывали, а затем ресуспендировали в среде Iscove DMEM (Mediatech) с добавлением 10% FCS (Valley Biomedical, Winchester, VA), 1% l-глутамина (Mediatech), 1% среды инсулин-трансферрин-селен (Invitrogen, Карлсбад, Калифорния). и 80 мкг / мл гентамицина (Quality Biological). Клетки CD4 + и CD11c + выделяли из спленоцитов с помощью магнитной сортировки клеток (Miltenyi Biotec, Auburn, CA) в соответствии с инструкциями производителя. Клетки CD4 + высевали из расчета 2 × 10 6 клеток / мл с 10% дендритных клеток, выделенных от неинфицированных мышей.Клетки стимулировали 20 мкг / мл LsAg или 5 мкг / мл анти-CD3 (eBioscience, Сан-Диего, Калифорния) и культивировали при 37 ° C, 5% CO 2 . Супернатанты собирали из культур клеток CD4 + , инкубированных в течение 3 дней, и анализировали на Th2 / Th3 6-Plex мыши (BioSource International, Camarillo, CA), как указано производителем. IL-4 определяли количественно с помощью ELISA (eBioscience) в соответствии с инструкциями производителя. Пролиферацию клеток CD4 + количественно определяли с помощью хемилюминесценции после 3-дневного культивирования с использованием иммуноанализа включения BrdU (Roche Applied Science, Мангейм, Германия) в соответствии с инструкциями производителя.
Статистический анализ
Статистический анализ выполняли с помощью статистического программного обеспечения GraphPad Prism 4 (GraphPad Software, Сан-Диего, Калифорния). Различия между несколькими группами для исследований динамики времени были проверены на значимость с помощью теста Краскела-Уоллиса, за которым следовали апостериорные множественные сравнения Данна. Сравнение между двумя группами проводилось с помощью теста Стьюдента t с последующей поправкой Велча на дисперсию. p Значения <0,05 считались значимыми.Данные выражены как среднее значение ± SEM. Все данные представляют как минимум два независимых эксперимента, за исключением экспериментов по имплантации взрослых червей, которые проводились только один раз.
Результаты
Иммунные ответы типа 2 становятся заметными через 6–8 недель p.i. с
L. sigmodontisВ модели L. sigmodontis личинки L3, введенные в подкожную клетчатку. ткань мигрирует в плевральную полость к 4–6 суткам, когда происходит последующее развитие. Личинки линяют до стадии L4 между 8 и 12 сутками.i., становятся взрослыми к 25–30 дням p.i. и способны производить микрофилярии, которые циркулируют в крови к 50 p.i. Как и при филяриозных инфекциях человека, инфицирование мышей L. sigmodontis приводит к преобладающему иммунному ответу 2-го типа, характеризующемуся высоким уровнем циркулирующих эозинофилов и антител IgE, а также выработкой цитокинов 2-го типа Т-клетками. Чтобы лучше понять развитие иммунных ответов 2-го типа при хроническом филяриатозе, мы провели наблюдательное исследование динамики этих маркеров иммунитета 2-го типа.Мышей умерщвляли в различные моменты времени в течение 10-недельной инфекции, количество червей, проживающих в грудной полости, количество микрофилярий в крови, количество циркулирующих эозинофилов и базофилов, концентрации поликлональных и LsAg-специфических IgE-антител и Измеряли концентрации IL-4, IL-5 и IFN-γ, продуцируемые CD4 + Т-клеток селезенки после стимуляции in vitro LsAg.
Как видно на рис. 1 A , количество паразитов, извлеченных из плевральной полости, оставалось довольно постоянным в течение исследованных периодов времени.После инъекции 40 личинок L3 на стадии инфицирования максимальное среднее значение 23 червя было извлечено через 6 недель в день, а минимальное среднее значение 18 червей было извлечено как через 4, так и 10 недель в день. Как и ожидалось, микрофилярии появлялись в крови позже, чем через 6 недель p.i. (Рис.1 B ). Поликлональные IgE-антитела были обнаружены в плазме уже через 2 недели в день, резко повысились на 6 недель в день и оставались очень высокими до 10 недель в день. (Рис.1 C ). Тестирование на паразитарные Ag-специфические ответы проводили с использованием LsAg.LsAg — это неочищенная гомогенатная растворимая смесь Ag, которая содержит Ag от взрослых самцов червей, взрослых самок червей и микрофилярий и обладает перекрестной реактивностью с иммунными ответами, вызванными заражением червями стадии L3 (29). Концентрации LsAg-специфического IgE не определялись до 4 недель p.i., когда они присутствовали в концентрациях чуть выше чувствительности ELISA, а затем продолжали увеличиваться до 10 недель p.i. (Рис.1 C ).
РИСУНОК 1.Динамика иммунного ответа на L.sigmodontis . Мыши были заражены подкожно. инъекция 40 личинок L. sigmodontis L3 , а затем их умерщвление в разные моменты времени. A , Количество паразитов, извлеченных из грудной полости. В , Число циркулирующих микрофилярий. C , Уровни поликлонального и LsAg-специфического IgE, измеренные в плазме. D , Число циркулирующих базофилов. E , Количество циркулирующих эозинофилов. Концентрации IL-4 ( F ), IL-5 ( G ) и IFN-γ ( H ) в супернатантах LsAg-стимулированных клеток селезенки CD4 + , культивированных в течение 3 дней после субстракции контрольной среды.Показанные данные относятся к одному из двух экспериментов с использованием 5–10 мышей на группу. Планки погрешностей представляют ± SEM. Существенные различия между группами были проанализированы с помощью теста Краскела-Уоллиса с последующим апостериорным множественным сравнением Данна. * p <0,05 по сравнению с незараженной временной точкой. U - неинфицированные мыши.
Число базофилов не увеличивалось заметно на ранних этапах инфицирования, но явно увеличивалось на поздних этапах инфицирования от исходного уровня 119 клеток / мкл у неинфицированных мышей до пика 403 клеток / мкл на 8-й неделе после заражения.я. (Рис.1 D ). Циркулирующие эозинофилы увеличивались рано, от исходного среднего значения 424 клеток / мкл у неинфицированных мышей до среднего значения 613 клеток / мкл на 4 недели p.i., а затем поднялись до пикового среднего значения 1520 клеток / мкл при 8 неделях p.i. (Рис.1 E ). Продукция IL-4, IL-5 и IFN-γ Т-клетками CD4 + , стимулированными LsAg, достигала пика через 6 недель p.i. а впоследствии уменьшилась (рис. 1 F — H ).
В совокупности эти данные демонстрируют, что пик иммунного ответа 2-го типа приходится на поздний период инфицирования.Максимальная продукция цитокинов типа 2 ИЛ-4 и ИЛ-5 происходит через 6 недель в день, а максимальное количество эозинофилов и базофилов — через 8 недель в день. Эти пики возникают после того, как специфический для паразитов IgE впервые попадает в кровоток, и совпадают с развитием циркулирующих микрофилярий. Интересно, что хотя уровни как поликлонального, так и LsAg-специфического IgE прогрессивно увеличивались на протяжении всего периода инфекции, эозинофилия, базофилия и продукция цитокинов, управляемая LsAg, Т-клетками снижалась на поздних этапах развития инфекции, несмотря на продолжающееся присутствие как взрослых червей, так и циркулирующих. микрофилярии.
Существенная активация базофилов в ответ на паразитарный Ag происходит только через несколько недель после начала инфекции. 4 и поверхностный CD200R измеряли с помощью проточной цитометрии после культивирования in vitro цельных клеток крови с паразитическим Ag в течение 3 часов в различные моменты времени инфицирования.
Базофилы были идентифицированы как клетки CD4 — B220 — IgE + с помощью проточной цитометрии (дополнительный рис.1 A , 1 B ), стратегия, которая определяет популяцию высокочистых базофилов в крови (30). Дополнительное окрашивание части образцов крови подтвердило, что клетки CD4 — B220 — IgE + в этом исследовании были почти полностью базофилами, поскольку эти клетки обычно окрашивались> 98% отрицательных для c-Kit (дополнительный рисунок 1 ). C ) и> 96% положительных по CD49b (дополнительная фигура 1 D ).
Процент базофилов, положительно окрашенных на поверхностный CD200R и внутриклеточный IL-4, а также средняя интенсивность окрашивания этих маркеров обычно увеличивались, когда кровь инфицированных мышей инкубировали с LsAg или анти-IgE по сравнению со средой ( репрезентативные графики FACS на дополнительном рис.1 E ). Как видно на рис. 2 A , базофилы от мышей, инфицированных L. sigmodontis , начали продуцировать IL-4 в ответ на LsAg через 4–6 недель p.i. Максимальная частота положительного окрашивания базофилов на IL-4 в ответ на LsAg наблюдалась через 8 недель p.i. (в среднем 25% IL-4 + базофилов) с последующим резким снижением через 10 недель p.i. (в среднем 8% IL-4 + базофилов). Анализ базофильной поверхностной экспрессии CD200R, который, как было показано, функционирует как маркер активации для базофилов мыши в ответ на IgE-опосредованные и IgE-независимые стимулы (30), совпал с результатами экспрессии IL-4.Процент базофилов, экспрессирующих CD200R в ответ на LsAg, немного увеличивался в моменты времени 4–6 недель в день, достигал максимума через 8 недель в день, а затем снижался через 10 недель в день. (Рис.2 B ). Чтобы подтвердить данные проточной цитометрии, свидетельствующие о том, что базофилы от 8-недельных инфицированных мышей активируются при стимуляции LsAg, измеряли IL-4 в супернатантах клеток крови после 2-часовой стимуляции in vitro только средой, LsAg или анти-IgE. Как видно на фиг. 2 C , LsAg, а также стимуляция анти-IgE крови от 8-недельных инфицированных мышей заметно увеличивали концентрации IL-4 в супернатанте.
РИСУНОК 2.Пики активации паразит-специфических базофилов 8 недель p.i. с L. sigmodontis . Процент базофилов, положительных по IL-4 ( A ) или CD200R ( B ) после субстракции контрольных сред из культур in vitro крови, стимулированных LsAg в течение 3 часов. C , IL-4, высвобождаемый из культур крови in vitro, стимулированных только средой, LsAg или анти-IgE в течение 2 ч, измеренный при 8 нед. P.i. с помощью ELISA. D , ИЛ-4, высвобожденный из культур крови in vitro, стимулированных LsAg в течение 2 часов, измеренный через 8 недель после введения.я. с помощью ELISA от неинфицированных контрольных мышей, инфицированных мышей в течение 8 недель, получавших изотип Ab (iso), и мышей, инфицированных в течение 8 недель, лишенных базофилов посредством i.p. инъекция Ba103 Ab за 24 ч до забора крови. Показаны данные одного из двух экспериментов с использованием пяти мышей на группу. Планки погрешностей представляют ± SEM. Значительные различия между группами для A и B были проанализированы с помощью теста Краскела-Уоллиса с последующим апостериорным множественным сравнением Данна. Значимые различия между группами для C и D были проанализированы с помощью теста Стьюдента t с последующей поправкой Велча на дисперсию.* p <0,05. U - неинфицированные мыши.
Чтобы продемонстрировать, что базофилы являются основным источником ИЛ-4 в 2-часовых культурах крови, стимулированных LsAg, высвобождение ИЛ-4 в ответ на LsAg было оценено у неинфицированных мышей и мышей BALB / c, инфицированных L. sigmodontis . в течение 8 недель, а затем обрабатывали истощающими базофилы Ab (Ba103) или изотипом Ab за 24 часа до стимуляции in vitro. Анализ проточной цитометрии показал, что обработка Ba103 приводила к истощению базофилов> 95% через 24 часа после инъекции (данные не показаны).Как видно на фиг.2 D , не наблюдалось существенного высвобождения IL-4 из цельной крови мышей, лишенных базофилов, что демонстрирует, что базофилы действительно являются основным источником IL-4 в ответ на LsAg в 2-часовых культурах крови и подтверждая предыдущее исследование, которое показало, что базофилы являются единственной циркулирующей клеткой, способной к быстрому высвобождению IL-4 (13).
Эти результаты демонстрируют, что базофилы активируются и высвобождают IL-4 в ходе филярийной инфекции. Следует отметить, что существенная активация базофилов наблюдалась только в моменты времени после 4 нед.я. когда LsAg-специфический IgE уже присутствует (рис. 1 C ), это согласуется с представлением о том, что перекрестное связывание специфических антител может быть основным средством активации базофилов при гельминтозной инфекции. Также интересно отметить, что даже несмотря на то, что уровни паразитоспецифического IgE очень высоки при 10 неделях в день, чувствительность базофилов к LsAg в этот поздний момент времени существенно снижается.
Микрофилярии не требуются для индукции поздних иммунных ответов типа 2 у мышей, инфицированных
L.sigmodontisПоскольку ответы типа 2 стали максимальными ближе к тому времени, когда циркулирующие микрофилярии появляются в кровотоке (рис. 1), мы провели эксперименты по имплантации однополых червей, чтобы определить, являются ли микрофилярии основными факторами ответа типа 2 при хроническом филяриатозе. . Имплантация 8-недельных самок червей, продуцирующих микрофилярии, в брюшину мышей BALB / c привела к циркулирующей микрофиляремии на протяжении всего эксперимента у всех протестированных мышей, в то время как микрофиляремия никогда не возникала после имплантации взрослых самцов червей (данные не показаны) .Через восемь недель после имплантации однополые глистные инфекции не показали различий в уровнях паразитарного Ag-специфического IgE (рис. 3 A ), эозинофилии (рис. 3 B ) или базофилии (рис. 3 C ). Точно так же CD4 + Т-клетки от инфицированных самок (микрофиляремных) мышей и инфицированных самцов (амикрофиляремных) мышей не продемонстрировали значительных различий в продукции IL-4 после стимуляции in vitro паразитным Ag (фиг. 3 D ). Уровни ИЛ-5 были выше у мышей-самцов, инфицированных гельминтами (рис.3 E ), а уровни IFN-γ имели тенденцию к более высокому у самок инфицированных гельминтами мышей (рис. 3 F ), хотя ни одно из этих различий не было статистически значимым.
РИСУНОК 3.Иммунные ответы через 8 недель после внутрибрюшинного введения. имплантация пяти самцов или пяти взрослых особей женского пола, продуцирующих микрофилярии, L. sigmodontis . A , Уровни LsAg-специфического IgE, измеренные в плазме. Уровни циркуляции эозинофилов ( B ) и базофилов ( C ). Концентрации IL-4 ( D ), IL-5 ( E ) и IFN-γ ( F ) в супернатантах LsAg-стимулированных T-клеток селезенки CD4 + , культивированных в течение 3 дней после субстракции контрольной среды .Процент базофилов, положительных по внутриклеточному IL-4 ( G ) или поверхностному CD200R ( H ) после субстракции контрольных сред из культур in vitro крови, стимулированных LsAg в течение 3 часов. По пять мышей на группу. Планки погрешностей представляют ± SEM. Существенные различия между группами анализировали с помощью теста Стьюдента t с последующей поправкой Велча на дисперсию. р <0,05.
Наконец, активация базофилов в ответ на паразитарный Ag была эквивалентной в двух группах с аналогичным процентом базофилов, экспрессирующих IL-4 (рис.3 G ) и CD200R (фиг. 3 H ) после инкубации in vitro с LsAg. Эти эксперименты по однополой имплантации демонстрируют, что микрофилярии не требуются для развития иммунных ответов типа 2 на поздних стадиях хронического филяриатоза.
Имплантация взрослых червей в брюшную полость ускоряет начало активации базофилов в ответ на LsAg
Личинки L3 L. sigmodontis намного меньше взрослых червей (850 мкм против 4-8 см в длину) и в пределах 3 к 4 дню инфекции мигрируют в плевральную полость, где в течение нескольких недель развиваются до взрослых глистов.Чтобы определить, связано ли позднее начало активации базофилов в ответ на паразитарный Ag либо с низким исходным содержанием Ag паразитов, либо с обитанием взрослых червей в плевральной полости, три женских и два взрослых особи мужского пола были хирургически имплантированы в брюшину паразита. Мыши BALB / c, уровни IgE и ответы базофилов на LsAg оценивались в различные моменты времени.
Как и при первоначальном заражении с использованием личинок L3, уровни общего и LsAg-специфического IgE достигли пика относительно поздно (6–8 недель) в ходе инфекции (рис.4 A , 4 B ). Интересно, что начало и пик продукции базофильного IL-4 в ответ на LsAg происходили намного раньше после имплантации взрослых червей, чем это наблюдалось после подкожной инъекции. инъекция личинок L3 (день 7 пи для начала и пика у мышей с имплантированными червями, рис. 4 C , против 14–28 дней после начала и 56 дней после пика у мышей, инфицированных L3, рис. 2 A ). Точно так же момент времени, в который активация базофилов в ответ на LsAg снижался, наступал раньше у имплантированных мышей (56d, стр.i., фиг.4 C ), чем у мышей, инфицированных L3 (70d p.i., фиг.2 A , 2 B ). Эти результаты предполагают, что позднее начало активации базофилов, наблюдаемое после инфицирования личинками L3, может быть связано с относительно низкой исходной нагрузкой Ag паразитами, секвестрацией червей и Ags червей в плевральной полости или комбинацией этих факторов. Следует отметить, что, как наблюдалось с инфекциями L3, начало активации базофилов в ответ на LsAg коррелировало с обнаружением паразитоспецифического IgE, поскольку уровни LsAg-специфического IgE увеличивались до уровня чуть выше уровня обнаружения в моменты времени 7 и 14. d p.я. (Рис.4 B ).
РИСУНОК 4.Динамика уровней IgE и активации базофилов в ответ на LsAg после внутрибрюшинного введения. имплантация взрослых особей L. sigmodontis как самцов (три), так и самок (две). Уровни поликлонального ( A ) и LsAg-специфического IgE ( B ) в плазме. C , Процент базофилов, положительных по IL-4 после субстракции контрольных сред из культур in vitro крови, стимулированных LsAg в течение 3 часов. По пять мышей на группу. Планки погрешностей представляют ± SEM.Существенные различия между группами анализировали с помощью теста Краскела-Уоллиса с последующим проведением множественных сравнений Данна. * p <0,05; ** p <0,01. U, незараженный.
Истощение базофилов подавляет иммунные ответы типа 2 во время инфекции
L. sigmodontisДля изучения роли базофилов в иммунном ответе на L. sigmodontis мы еженедельно вводили мышам, инфицированным L. sigmodontis , Ba103, mAb против CD200R3, которое специфически истощает циркулирующие базофилы (24), и оценивает иммунные ответы через 8 недель после этого.i., поскольку это был момент времени, в который было обнаружено, что большинство иммунных ответов типа 2 являются максимальными (рис. 1). 50 мкг Ba103 вводили внутрибрюшинно. каждой недели было достаточно для удаления> 95% циркулирующих базофилов у всех мышей на протяжении всего курса инфекции (дополнительный рис. 2 A ). Важно отметить, что, как сообщалось ранее (24), инъекции Ba103 не влияли на количество тучных клеток брюшины, хотя тучные клетки также могут экспрессировать CD200R3 (дополнительный рисунок 2 B ).
Иммунологические исследования четко демонстрируют, что истощение базофилов приводит к ослаблению иммунных ответов типа 2 8 нед. С.я. с L. sigmodontis . Во-первых, продукция поликлональных и паразитоспецифических IgE Ab была значительно снижена у инфицированных мышей, лишенных базофилов, по сравнению с обработанными изотипом мышами L. sigmodontis , инфицированными изотипом (фиг. 5 A , 5 B ). Как и ожидалось, у неинфицированных мышей не было обнаруживаемого специфического IgE и они имели значительно более низкие уровни поликлонального IgE, чем любая инфицированная группа (фиг. 5 A , 5 B ). Аналогичным образом, в то время как у всех мышей, инфицированных L. sigmodontis , развилась некоторая степень эозинофилии по сравнению с неинфицированными мышами, у L.sigmodontis -инфицированные мыши, лишенные базофилов, демонстрировали значительно меньшую эозинофилию, чем не истощенные инфицированные мыши (фиг. 5 C , 5 D ). Это снижение эозинофилии было подтверждено периферическими мазками и, в подгруппе животных, идентификацией эозинофилов с помощью проточной цитометрии как Siglec-F + и IgE — (данные не показаны).
РИСУНОК 5. УровниIgE и циркулирующих эозинофилов у неинфицированных мышей, мышей, инфицированных L. sigmodontis , получавших контрольный изотип Ab (Iso), и L.sigmodontis -инфицированные мыши, лишенные базофилов с Ba103 (истощенные). Мыши были заражены подкожно. инъекция 40 личинок L. sigmodontis L3, вводимая еженедельно внутрибрюшинно. инъекции изотипического контрольного Ab или Ba103 Ab для истощения базофилов и эвтаназии 8 недель p.i. Измерение уровней поликлонального IgE ( A ) и LsAg-специфического IgE ( B ) в плазме. C , Эозинофилы, идентифицированные методом проточной цитометрии как CD11b тусклый CCR3 +. D , Уровни циркулирующих эозинофилов.Показаны данные одного из двух экспериментов с использованием пяти мышей на группу. Планки погрешностей представляют ± SEM. Существенные различия между группами анализировали с помощью теста Стьюдента t с последующей поправкой Велча на дисперсию. * p <0,05; ** p <0,01. U - неинфицированные мыши.
Что касается клеточного иммунного ответа, измерение цитокинов из LsAg-стимулированных T-клеток CD4 + продемонстрировало значительно меньшую продукцию IL-4 из CD4 + T-клеток мышей с истощенными базофилами по сравнению с мышами, инфицированными контрольной группой (рис. .6 А ). Продукция IL-5 и IFN-γ из LsAg-стимулированных Т-клеток CD4 + также была меньше у мышей с истощением базофилов, чем у контрольных мышей, но эти различия не были статистически значимыми (Рис.6 B , 6 C ) . Кроме того, CD4 + Т-клетки мышей с истощенными базофилами демонстрировали значительно меньшую пролиферацию в ответ на паразитарный Ag, чем контрольные мыши, инфицированные L. sigmodontis (фиг. 6 D ). Это не было связано с внутренней разницей в способности CD4 + T-клеток к пролиферации, потому что CD4 + T-клетки от истощенных базофилами и контрольных мышей вызвали эквивалентные пролиферативные ответы после стимуляции анти-CD3 (рис.6 E ). Неинфицированные мыши не проявляли какого-либо измеримого высвобождения цитокинов (фиг. 6 A — C ) или пролиферации в ответ на LsAg (данные не показаны). Наконец, истощение базофилов Ba103 не повлияло на количество взрослых червей, извлеченных из плевральной полости 8 недель в день. (Рис. 6 F ) или уровни циркулирующей микрофиляремии (данные не показаны).
РИСУНОК 6.CD4 + Т-клеточные ответы и нагрузка взрослых червей у неинфицированных мышей, мышей, инфицированных L. sigmodontis , получавших контрольные антитела изотипа, и L.sigmodontis -инфицированные мыши, лишенные базофилов с Ba103. Мыши были заражены подкожно. инъекция 40 личинок L. sigmodontis L3, вводимая еженедельно внутрибрюшинно. инъекции изотипического контрольного Ab или Ba103 Ab для истощения базофилов и эвтаназии 8 недель p.i. Концентрации IL-4 ( A ), IL-5 ( B ) и IFN-γ ( C ) в супернатантах LsAg-стимулированных T-клеток селезенки CD4 + , культивированных в течение 3 дней после субстракции контрольной среды . Селезеночная пролиферация CD4 + Т-клеток в ответ на LsAg ( D ) и стимуляцию анти-CD3 ( E ). F , Количество взрослых червей, извлеченных из грудной полости в конечной точке исследования. Показанные данные относятся к одному из двух экспериментов с использованием 5–10 мышей на группу. Планки погрешностей представляют ± SEM. Существенные различия между группами анализировали с помощью теста Стьюдента t с последующей поправкой Велча на дисперсию. * p <0,05; ** p <0,01. Истощенные, мышей, инфицированных L. sigmodontis , лишены базофилов с Ba103; ISO, мышей, инфицированных L. sigmodontis , получавших контрольные антитела изотипа; U, неинфицированные мыши
Таким образом, истощение базофилов с помощью Ba103 привело к нарушению иммунного ответа типа 2 во время хронического L.sigmodontis инфекция. Истощение базофилов не отменяет полностью инициирование ответов типа 2, потому что, в отличие от неинфицированных мышей, мышей, инфицированных L. sigmodontis , лишенных базофилов, все еще были способны развивать измеримые уровни паразитоспецифичных IgE и CD4 + Т-клеточная продукция ИЛ-4 и ИЛ-5 в ответ на паразитарный Ag. Истощенные базофилами мыши , инфицированные L. sigmodontis , также развили значительно более выраженную эозинофилию, чем неинфицированные мыши. Однако, если сравнивать с базофил-компетентными л.sigmodontis -инфицированные мыши, у -инфицированных L. sigmodontis обедненных базофилами мышей развились значительно более низкие уровни поликлонального IgE, LsAg-специфического IgE, эозинофилии и продуцирования и пролиферации T-клеточного IL-4 CD4 + .
Обсуждение
Важность базофилов в развитии иммунных ответов типа 2 становится все более очевидной за последние несколько лет (8–12). Посредством высвобождения IL-4 и активации CD40L базофилы способны индуцировать переключение изотипа IgE в В-клетках (19, 20) и дифференцировку Th3 Т-клеток CD4 + (21).Несмотря на то, что они являются наименее распространенными циркулирующими лейкоцитами, в исследованиях гельминтозов как на людях, так и на животных было показано, что базофилы вносят существенный вклад в IL-4, основной цитокин, управляющий иммунитетом 2 типа (14–16, 31–33). У человека количество базофилов, высвобождающих IL-4 в ответ на паразитарный Ag, эквивалентно количеству CD4 + Т-клеток, высвобождающих IL-4 (15). Кроме того, базофилы от пациентов, инфицированных филярией, требуют меньше Ag для активации и высвобождают больше IL-4 на клеточную основу, чем CD4 + Т-клетки (15).Используя модель филяриоза на мышах L. sigmodontis , это исследование демонстрирует, что базофилы играют важную роль в усилении иммунных ответов типа 2 во время хронической гельминтозной инфекции.
Оценка времени и времени показала, что иммунные ответы 2-го типа становятся максимальными довольно поздно в ходе филярийной инфекции мышей. В частности, продукция CD4 + Т-клетками цитокинов типа 2 IL-4 и IL-5 достигла пика через 6 недель p.i., а эозинофилия и базофилия достигла пика через 8 недель.я. Специфический IgE не выявлялся до 4 недель p.i. а затем продолжала увеличиваться на протяжении всего изученного периода времени (10 недель).
Наблюдаемые нами поздние иммунные ответы типа 2 согласуются с другими исследованиями по оценке хронических гельминтозов. При заражении L. sigmodontis максимальная продукция IL-4 и IL-5, вызванная паразитами, спленоцитами ранее обнаруживалась при 10–12 нед. (34). и максимальное количество транскриптов цитокинов IL-4 и IL-5 — через 4–5 недель p.i. (35). Точно так же уровни эозинофилов были выше на 30 дн.я. у мышей, инфицированных L. sigmodontis , чем через 10 или 80 дней p.i. (36), а уровни эозинофилов у свиней, инфицированных Trichuris suis , достигли пика 5 недель в день. (37). Морские свинки, инфицированные Fascioloides magna , демонстрировали максимальные уровни эозинофилов через 7–10 недель в день. и максимальные уровни базофилов при 10 неделях в день. (38). Что касается активации базофилов, то наблюдаемая нами поздняя активация базофилов согласуется с недавним исследованием на людях, в котором базофилы индивидуумов, экспериментально инфицированных анкилостомами, не проявляли активированного фенотипа до 4-6 недель.я. (39)
Важно отметить, что иммунные ответы позднего типа 2, наблюдаемые у инфекции L. sigmodontis и других моделей хронической гельминтной инфекции, отличаются от таковых у грызунов, инфицированных Nippostrongylus brasiliensis, — моделью острой гельминтной инфекции. при котором кишечные паразиты быстро изгоняются в течение ~ 2 недель после заражения. Ежедневное исследование мазков крови крыс, инфицированных N. brasiliensis , показало, что пиковые уровни эозинофилов и базофилов составляют 12–14 сут.я. (40). В этом исследовании мы наблюдали, что хирургическая имплантация взрослых червей L. sigmodontis в брюшину мышей увеличила временную точку, в которой базофилы активируются в ответ на LsAg, что позволяет предположить, что позднее начало активации базофилов наблюдается у L. sigmodontis может быть вызван недостаточной нагрузкой Ag или секвестрированием Ag в плевральной полости. Таким образом, различия во времени активации базофилов и других иммунных ответов типа 2, наблюдаемых при различных гельминтных инфекциях, могут быть частично связаны с проблемами нагрузки Ag и воздействием на иммунную систему.
Обнаружение, что базофилы от неинфицированных мышей и от мышей, инфицированных в течение 2 недель после инъекции L3 и в течение 2 дней после имплантации взрослого червя, не активируются по существу в ответ на паразитарный Ag, что измеряется как экспрессией IL-4, так и активацией CD200R с помощью проточная цитометрия показывает, что филяриатные агенты не активируют базофилы неспецифическим образом. Хотя ряд молекул, полученных из гельминтов, могут напрямую активировать базофилы (41–43), результаты этого исследования согласуются с предыдущими исследованиями, которые мы провели с клетками человека, которые показали, что неочищенные растворимые экстракты целых нитчатых червей не активируют базофилы неинфицированных частные лица (15).Учитывая, что активация базофилов при инфекции L3 и эксперименты по имплантации взрослых червей не происходили до тех пор, пока в сыворотке не стал обнаруживаться паразитоспецифический IgE, вполне вероятно, что активация базофилов в нашей модели в первую очередь зависит от сенсибилизации базофилов специфическими Ab.
Поскольку несколько ответов типа 2 достигают пика в моменты времени, когда микрофилярии циркулируют в крови, мы исследовали иммунные ответы типа 2 в условиях однополых инфекций. Мы обнаружили, что уровни циркулирующего IgE и концентрации IL-4 и IL-5, высвобождаемые CD4 + Т-лимфоцитами в ответ на паразитарный Ag, были эквивалентны 8-недельной постимплантации взрослых самок червей, у которых развилась микрофиляремия, или самцов глистов у глистов. при котором не развилась микрофиляремия.Кроме того, базофилия, эозинофилия и процент активированных базофилов в ответ на паразитарный Ag были одинаковыми независимо от того, были имплантированы взрослые особи женского или мужского пола. Таким образом, поздний пик иммунных ответов типа 2 не был связан с развитием циркулирующих микрофилярий.
Две линии доказательств этого исследования предполагают, что базофилы ответственны за усиление иммунных ответов типа 2 при инфекции L. sigmodontis . Во-первых, мы обнаружили, что поздняя амплификация продукции цитокинов 2 типа и эозинофилия, которая произошла на 6 и 8 неделях p.i., соответственно, произошло после 4-недельной временной точки, в которой базофилы впервые стали существенно активироваться и высвобождать IL-4 в ответ на паразитарный Ag. Насколько нам известно, это первое временное исследование активации базофилов на модели хронической гельминтной инфекции, и наблюдение, что активация базофилов начинается до пиков в других ответах типа 2, согласуется с концепцией, что базофилы усиливают иммунитет 2 типа.
Вторая и более прямая линия доказательств того, что базофилы важны для усиления иммунных ответов типа 2, получена в экспериментах по истощению базофилов.Истощение базофилов во время хронической инфекции L. sigmodontis привело к значительному снижению уровней паразитоспецифического IgE, эозинофилии и паразитарной Ag-управляемой пролиферации CD4 + Т-клеток и продукции IL-4. Хотя эксперименты по истощению базофилов ранее не проводились на модели продолжительной гельминтозной инфекции, наши результаты согласуются с результатами двух других экспериментов, в которых оценивалось влияние истощения базофилов на ответы типа 2 во время заражения гельминтами.Истощение базофилов с Ab до Thy 1.2 у мышей 4get / rag — / — , у которых базофилы были сенсибилизированы сывороткой от мышей дикого типа, инфицированных N. brasiliensis , привело к снижению циркулирующей и тканевой эозинофилии, а также экспрессии мРНК IL-4, IL-5 и IL-13 через 10 дней после контрольного заражения N. brasiliensis (25). Точно так же истощение базофилов с помощью MAR-1 Ab до FcεR1 существенно снижает экспрессию мРНК IL-4 в ткани толстой кишки 21 день p.i.мышей с желудочно-кишечным гельминтом Trichuris muris (23).
Важно отметить, что наше исследование демонстрирует, что базофилы повышают выработку IgE при хронической гельминтной инфекции. Предыдущие исследования in vitro ясно показали, что базофилы, которые экспрессируют CD40L, а также высвобождают IL-4, обладают способностью индуцировать переключение В-клеток на изотип IgE (19, 20). Однако, как подчеркивается в недавнем обзоре, вопрос о том, действительно ли базофилы важны для продукции IgE во время гельминтной инфекции, ранее не оценивался на модели in vivo (12).Поскольку истощение базофилов привело к значительному снижению как общего, так и паразитоспецифического уровня IgE в циркуляции мышей, хронически инфицированных L. sigmodontis , наши результаты позволяют предположить, что базофилы играют физиологически важную роль в стимулировании выработки IgE. Хотя вполне вероятно, что IL-4 является основной молекулой, ответственной за усиливающие эффекты базофила 2-го типа, высвобождение стромального лимфопоэтина тимуса, который также смещает Т-клетки CD4 + в сторону Th3-фенотипа, также может быть важным.Кроме того, хотя мы считаем вероятным, что базофилы непосредственно участвуют в усилении многих аспектов воспаления 2 типа, возможно, что некоторые эффекты базофилов на воспаление 2 типа являются косвенными. Например, базофилы могут главным образом функционировать, увеличивая количество клеток Th3, которые затем вызывают дальнейшее увеличение эозинофилии и продукции IgE.
Что касается защитного иммунитета, мы не обнаружили повышенной восприимчивости к инфекции L. sigmodontis у мышей, лишенных базофилов.Этот результат отличается от результатов других исследований, в которых наличие базофилов коррелирует со снижением восприимчивости к гельминтозной инфекции. Мыши, лишенные базофилов, продемонстрировали повышенное кишечное носительство T. muris (23) и мышей с дефицитом IL-3, которые поддерживают физиологические базовые уровни базофилов, но не увеличивают количество базофилов в ответ на гельминтную инфекцию, демонстрируют снижение выведения Strongyloides. venezuelensis (44) по сравнению с контрольными инфицированными мышами.Возможно, что базофилы являются важными эффекторами иммунитета против некоторых, но не всех гельминтов, поскольку те же авторы, которые отметили корреляцию между базофилией и меньшим количеством гельминтов с S. venezuelensis , не увидели каких-либо заметных различий в количестве паразитов между IL- 3-дефицитные и IL-3-компетентные мыши постинфекция N. brasiliensis (44). Разрозненные результаты, которые мы и другие сообщаем о роли базофилов в защитном иммунитете, демонстрируют, что иммунологические корреляты защиты от одной гельминтной инфекции не могут быть распространены на все гельминты.
Поскольку у мышей RAG, восстановленных с помощью Т-клеток с дефицитом IL-4 / IL-13, наблюдается снижение на N. brasiliensis изгнания после истощения базофилов, возможно, что для некоторых гельминтных инфекций защитные эффекты, обеспечиваемые базофилами, являются избыточными, а возможно, и нет. аддитивный, с интактными CD4 + Т-лимфоцитами (25). Важно отметить, что в нашем исследовании мы наблюдали, что истощение базофилов приводит к уменьшению, но не устранению ответов Th3. Поскольку полный дефицит ИЛ-4 или ИЛ-5 приводит к увеличению, соответственно, л.sigmodontis микрофилярий и нагрузка взрослых червей при 60 дн. (45), и потому что мы не увидели никаких различий в нагрузке червей при 56 сутках в день. Несмотря на снижение иммунных ответов 2-го типа, наше исследование предполагает, что вклад базофилов в иммунитет 2-го типа не усиливает иммунную защиту против первичной филярийной инфекции.
Учитывая, что IgE-опосредованная активация базофилов в ответ на паразитарный Ag сохраняется в течение многих лет после лечения филяриатной инфекции у людей (46), будущие исследования позволят оценить, играют ли базофилы роль в защитном иммунитете против вторичных гельминтозных инфекций после того, как животные были ранее подвергнуты воздействию. или привиты.
Интересно, что наше временное исследование показало существенное снижение активации базофилов в ответ на паразитарный Ag в 10-недельную временную точку по сравнению с 8-недельной временной точкой, несмотря на продолжающееся присутствие взрослых червей, микрофилярий и паразитоспецифических IgE. Известно, что хронические гельминтозы индуцируют иммунорегуляторные сети, которые снижают иммунную реактивность. Механизмы включают активацию регуляторных Т-клеток, индукцию альтернативно активируемых макрофагов, повышенную продукцию супрессорных цитокинов, таких как IL-10 и TGF-β, а также прямые иммуномодулирующие эффекты гельминтных Ag (47–49).Подавление иммунной реактивности CD4 + Т-клеток к паразитарному Ag было хорошо продемонстрировано на поздних этапах заражения L. sigmodontis (50), что согласуется с уменьшением продукции CD4 + Т-клеточных цитокинов, вызванной паразитами Ag. наблюдается через 10 недель и, как было показано, частично связано с активным подавлением регуляторными Т-клетками (50). Снижение реактивности базофилов мы наблюдали в ответ на паразитарный Ag 10 нед. предполагает, что базофилы также могут подвергаться некоторому типу активного подавления при хронической гельминтозной инфекции.Такое явление может быть одной из причин, по которой хронические гельминтозы часто связаны с уменьшением аллергической болезни. Влияние хронической инфекции L. sigmodontis на высвобождение базофилов будет более подробно оценено в будущих исследованиях.
Наконец, важно отметить, что недавно три независимые группы продемонстрировали, что базофилы, которые экспрессируют MHC класса II, способны действовать как APC и, когда они это делают, индуцируют развитие Th3 CD4 + Т-клеток ( 18–20).В то время как эти исследования показывают, что базофилы обладают способностью инициировать иммунные ответы типа 2, степень, в которой базофилы действительно делают это во время гельминтозов, остается неопределенной. Результаты этого исследования показывают, что базофилы не являются необходимыми для индукции иммунных ответов 2-го типа на гельминтозную инфекцию, поскольку эозинофилия, паразитоспецифический IgE и продуцирование паразитарным Ag IL-4 из CD4 + Т-клеток — все это развилось в году. Мыши, инфицированные L. sigmodontis , лишены базофилов, хотя и на более низком уровне, чем у компетентных по отношению к базофилам мышей.Однако мы не можем окончательно заключить, что базофилы незаменимы для инициации иммунных ответов типа 2, потому что истощение Ab базофилов обычно устраняет> 95%, но не все, циркулирующие базофилы. Таким образом, вопрос о том, являются ли базофилы основными клетками, ответственными за инициирование иммунных ответов типа 2 при гельминтных инфекциях, скорее всего, не будет определено с уверенностью до тех пор, пока не разовьются мыши с дефицитом базофилов.
Таким образом, результаты этого исследования демонстрируют, что базофилы усиливают иммунные ответы типа 2 при хронической гельминтозной инфекции.Активация базофилов в ответ на паразитарный Ag не происходила до 2–4 недель развития инфекции, достигала максимума через 8 недель p.i. и совпадала с поздним усилением иммунных ответов 2 типа. Эксперименты по имплантации однополых червей показали, что поздний иммунный ответ 2-го типа не зависел от развития циркулирующих микрофилярий, а имплантация смешанного червя позволила предположить, что отсроченное начало активации базофилов может быть частично связано с исходной низкой нагрузкой паразита Ag или секвестрированием Ag. в плевральной полости.Прямое доказательство функциональной роли базофилов в усилении иммунитета 2 типа было получено в экспериментах по истощению базофилов, которые показали, что истощение базофилов на протяжении хронической инфекции вызывает снижение уровней циркулирующих эозинофилов, снижение выработки специфического IgE к паразитам, снижение пролиферации Т-лимфоцитов CD4 + в ответ на паразитарный Ag, и уменьшало продукцию IL-4, управляемую паразитами Ag, из CD4 + Т-клеток при хронической гельминтной инфекции. Наконец, истощение базофилов не изменило бремени паразитов, что позволяет предположить, что базофилы не играют значительной роли в защитном иммунитете во время первичной филяриальной инфекции.
Благодарности
Мы благодарим Харли Клинтона из Научно-исследовательского института радиобиологии вооруженных сил (Бетесда, Мэриленд) за обработку образцов крови для подсчета клеток. Мы также благодарим Карен Уолкотт и Катерину Лунд из Центра биомедицинских инструментов Университета военной службы за ценную помощь в проточной цитометрии.
Раскрытие информации У авторов нет финансового конфликта интересов.
Сноски
Эта работа была поддержана Национальным институтом аллергии и инфекционных заболеваний / Национальными институтами здравоохранения, грантами K22AI065915 и R01AI076522, а также грантом R073QS Университета военной службы.
Онлайн-версия этой статьи содержит дополнительные материалы.
Сокращения, использованные в этой статье:
- Depleted
- Litomosoides sigmodontis -инфицированные мыши, лишенные базофилов с помощью Ba103
- Iso
- isopedus 988 9178 iso-8 iso-988
- isopedus 988 Litomfected 988 Litomfected 988 Litomphycted 988 Litomosoides sigmodontis Ag
- pi
- постинфекция
- U
- незараженные.
- isopedus 988 9178 iso-8 iso-988
- Получено 2 декабря 2009 г.