CA 15-3
Это измерение в плазме крови уровня специфических антигенов, располагающихся на эпителии секретирующих клеток и протоков молочных желез. Его повышение может свидетельствовать о раке молочной железы.
Синонимы русские
Углеводный антиген 15-3, раковый антиген СА 15-3.
Синонимы английские
Сancer Antigen 15-3, Carbohydrate Antigen 15-3.
Метод исследования
Иммунохемилюминесцентный анализ.
Диапазон определения: 1 — 3000 Ед/мл.
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Раковый антиген СА 15-3 – это высокомолекулярный гликопротеин муцинового типа, который вырабатывается нормальными клетками молочной железы.
Уровень CA 15-3 повышен у 10 % женщин с ранней стадией опухоли молочной железы и примерно у 70 % с метастазами такого рака. Тест на CA 15-3 не обладает достаточной чувствительностью и специфичностью для диагностики ранней стадии рака, однако он позволяет следить за течением заболевания и возникновением рецидивов.
Чрезмерная концентрация СА 15-3 не всегда свидетельствует о раке молочной железы, иногда превышение нормы бывает при опухолях других локализаций (колоректальном раке, раке легких, яичников, шейки матки и эндометрия), доброкачественных образованиях молочных желез, гепатитах и циррозе печени, у здоровых женщин в период беременности.
Для чего используется исследование?
- Для контроля за эффективностью лечения рака молочной железы и выявления рецидивов заболевания.
- Для дифференциальной диагностики доброкачественных и злокачественных новообразований молочных желез.
- Для получения информации об объеме и распространенности опухоли.
 Чем выше уровень СА 15-3 в крови, тем больше масса опухолевых клеток в организме.
Чем выше уровень СА 15-3 в крови, тем больше масса опухолевых клеток в организме.
Когда назначается исследование?
- Для контроля за течением рака молочной железы и для выработки тактики его лечения.
- Периодически для контроля за эффективностью лечения и выявления рецидивов пациентам с изначально повышенным уровнем CA 15-3.
Что означают результаты?
Изолированное использование исследования в целях скрининга и диагностики онкологических заболеваний недопустимо. Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. Диагностика любого заболевания строится на основании разностороннего обследования с использованием различных, не только лабораторных методов и осуществляется исключительно врачом.
Референсные значения: 0 — 25 Ед/мл.
Как правило, чем выше уровень СА 15-3, тем более поздняя стадия рака молочной железы и больше масса опухоли у пациента, так как концентрация этого онкомаркера в крови нарастает совместно с увеличением опухоли.
При распространении опухоли из первичного очага высокий уровень СА 15-3 чаще всего указывает на метастазы в костях и/или печени.
Умеренное повышение уровня СА 15-3 может сопровождать различные заболевания, например колоректальный рак, рак легких, поджелудочной железы, печени, яичников, шейки матки и эндометрия, цирроз печени, доброкачественные образования молочной железы, кроме того, он выявляется у определенного процента здоровых людей.
Стабильно повышенным обычно остается содержание CA 15-3 в течение определенного времени при доброкачественных опухолях.
Нормальная концентрация CA 15-3 не исключает наличия локализованной или метастатической формы рака молочной железы. Уровень CA 15-3 может не быть повышенным на начальной стадии опухолевого процесса и у 25-30 % пациентов с опухолью молочной железы, не продуцирующей онкомаркер.
Нарастание концентрации СА 15-3 может означать, что проводимое лечение неэффективно или что рак рецидивирует.
Отсутствие СА 15-3 или его пониженный уровень:
- норма,
- эффективность проводимого лечения,
- ранняя стадия рака молочной железы, когда уровень онкомаркеров еще не успел повыситься.

Причины повышенного уровня СА 15-3:
- рак молочной железы,
- опухоли других локализаций (колоректальный рак, рак легких, поджелудочной железы, печени, яичников, шейки матки и эндометрия),
- доброкачественные образования молочных желез,
- цирроз печени,
- 3-й триместр беременности.
Что может влиять на результат?
Аутоиммунные заболевания, туберкулез, саркоидоз способствуют ложноположительному результату.
Скачать пример результатаВажные замечания
- Онкомаркер СА 15-3 очень важен в прогнозировании развития рака молочной железы.
- Диагностическая ценность анализа на СА 15-3 возрастает при одновременном определении РЭА (раково-эмбрионального антигена).
- Тест на СА 15-3 наиболее информативен в процессе лечения или через несколько недель после него – по нарастанию или снижению уровня онкомаркера можно судить об эффективности проводимой терапии.

Также рекомендуется
Кто назначает исследование?
Онколог, маммолог, гинеколог.
Раковый антиген CA 15-3
Раковый антиген CA 15-3
Раковый антиген CA 15-3 – опухолевой маркер, использующийся при мониторинге течения и оценке эффективности терапии карциномы молочной железы. Это высокомолекулярный гликопротеин муцинового типа, который вырабатывается нормальными клетками молочной железы. Уровень CA 15-3 повышен у 10 % женщин с ранней стадией опухоли молочной железы и примерно у 70 % с метастазами такого рака. Тест на CA 15-3 не обладает достаточной чувствительностью и специфичностью для диагностики ранней стадии рака, однако он позволяет следить за течением заболевания и возникновением рецидивов. Чрезмерная концентрация СА 15-3 не всегда свидетельствует о раке молочной железы, иногда превышение нормы бывает при опухолях других локализаций (колоректальном раке, раке легких, яичников, шейки матки и эндометрия), доброкачественных образованиях молочных желез, гепатитах и циррозе печени, у здоровых женщин в период беременности.
Подготовка к исследованию
Не принимать пищу в течение 12 часов перед исследованием.
Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
Показания к исследованию
Для контроля за течением рака молочной железы и для выработки тактики его лечения.
Периодически для контроля за эффективностью лечения и выявления рецидивов пациентам с изначально повышенным уровнем CA 15-3.
Интерпретация
Референсные значения: 0:32.4U/mL
Отсутствие СА 15-3 или его пониженный уровень:
норма
эффективность проводимого лечения
ранняя стадия рака молочной железы
когда уровень онкомаркеров еще не успел повыситься.
Причины повышенного уровня СА 15-3:
рак молочной железы,
опухоли других локализаций (колоректальный рак, рак легких, поджелудочной железы, печени, яичников, шейки матки и эндометрия),
доброкачественные образования молочных желез,
цирроз печени,
3-й триместр беременности.
P.S. Изолированное использование данного анализа в целях скрининга и диагностики онкологических заболеваний недопустимо! Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. Диагностика любого заболевания строится на основании разностороннего обследования с использованием различных, не только лабораторных методов и осуществляется исключительно врачом!
На результаты могут влиять
Аутоиммунные заболевания, туберкулез, саркоидоз способствуют ложноположительному результату.
Назначается в комплексе с
РЭА
СА 125
Онкомаркер са 15 3. Онкомаркер молочной железы. Сдать анализ СА-15-3
Референсные значения (вариант нормы):
| Параметр | Референсные значения | Единицы измерения |
|---|---|---|
| CA 15 — 3 (Раковый антиген 15 — 3, Cancer Antigen 15 — 3) |
0 — 31. 3 3
|
Ед/мл |
Дискриминационный уровень*:
* Дискриминационный уровень (ДУ) – верхняя допустимая граница концентраций у здорового человека.
ВНИМАНИЕ! Следует помнить, что незначительное повышение концентрации многих онкомаркёров возможно при различных доброкачественных и воспалительных заболеваниях, физиологических состояниях. Поэтому выявление повышенного содержания того или иного онкомаркёра ещё не является основанием для постановки диагноза злокачественной опухоли, а служит поводом к дальнейшему обследованию.
| Повышение значений |
|---|
|
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Са 15-3 (Углеводный антиген 15-3)
Исследуемый материал Сыворотка крови
Метод определения Иммуноферментный анализ.
Рак молочной железы – один из центральных вопросов современной онкологии, ведь только за последние двадцать лет степень заболеваемости возросла на 25-30%.
В диагностике данного заболевания врачам помогает раковый антиген са 15-3 (углеводный антиген 15-3), который является высокомолекулярным гликопротеином муцинового типа, вырабатываемый обычными клетками молочной железы. На ранней стадии опухоли молочной железы его уровень повышен почти у 10% женщин и около 70% у женщин с метастазами этого рака. Онкомаркер са 15-3 не достаточно чувствителен при диагностике ранней стадии рака, но дает возможность наблюдать за течением заболевания, появлением рецидивов.
Динамика онкомаркеров при раке молочной железы более важна, чем однократное значение уровня. По скорости возрастания опухолевого маркера можно делать заключения о течении болезни, в том числе о метастазировании. Рост концентрации этого антигена может опережать проявления клинических симптомов на шесть – девять месяцев.
Са 15-3 онкомаркер молочной железы имеет довольно высокую специфичность (95%) по отношению к карциноме молочной железы при сопоставлении с доброкачественными заболеваниями.
Повышенный онкомаркер 15-3 может наблюдаться и на фоне иных видов рака, к примеру, рак прямой кишки.
При мастопатии назначение анализов на онкомаркеры не обязательно. В данном случае проводят другие обследования.
Иные причины повышенного онкомаркера груди
Анализ на онкомаркеры груди может показать повышенный уровень СА 15-3 при мастопатии и других неопухолевых болезнях, включая:
- фиброаденому,
- воспаление желчных путей, болезни печени (цирроз, вирусные гепатиты и др.
 ),
), - болезни легких,
- болезни почек,
- ревматические заболевания.
Онкомаркер молочной железы имеет еще особенность, которую необходимо учитывать – при беременности он повышается до 40 МЕ/л.
Влияет ли кормление грудью на онкомаркеры
Женский половой гормон экстроген играет ведущую роль в развитии данного вида рака. Его избыток создает благоприятные условия для развития заболевания. В период беременности, а также после родов при кормлении грудью гормоны экстрогены наименее активны. Роды, длительное кормление грудью уменьшают риски развития болезни молочной железы. Аборты же могут провоцировать развитие опухолей.
Онкомаркер мужских молочных желез
Для мужчин рак молочной железы явление довольно редкое, оно может развиваться у подростков и пожилых мужчин в результате нарушения гормонального баланса.
Лечение заболевания проводится также как и у женщин.
Для чего необходим анализ на опухолевый антиген
Анализ крови на онкомаркеры молочной железы дает возможность:
- отличить злокачественную опухоль от доброкачественной;
- наряду с другими исследованиями опровергнуть или подтвердить опухолевый процесс;
- оценить эффективность лечения;
- контролировать состояние пациента после завершения лечения.

Нормой считаются результаты в пределах 0-51 ЕД/мл. В качестве материала для исследования берется венозная кровь.
Правильная сдача анализа предусматривает:
- сдачу натощак,
- необходимо сдавать утром,
- за три дня не увеличивать физическую нагрузку, не употреблять алкоголь, жирную пищу, лекарства,
- не курить в день анализа.
Свои услуги в проведении данного исследования предлагает современная лаборатория ИНВИТРО, которая выполнит работу быстро и качественно.
Анализ на СА 15-3 антиген со скидкой 50% в Lab4U
Интерпретация результатов исследования «СА 15-3»
Интерпретация результатов анализов носит информационный характер, не является диагнозом и не
заменяет консультации врача. Референсные значения могут отличаться от указанных в
зависимости от используемого оборудования, актуальные значения будут указаны на бланке
результатов.
Онкомаркёр CA 15-3 применяется в основном при мониторинге течения карциномы молочной железы, диагностике ранних рецидивов, метастазов и контроле эффективности лечения. Кроме того, возможно применение данного теста при дифференциальной диагностике рака молочной железы и доброкачественной мастопатии.
Единица измерения: Ед/мл
Референсные значения: < 31,3 Ед/мл
Повышение:
- Онкологические заболевания (карцинома молочной железы, бронхогенная карцинома, рак желудка, рак печени, рак поджелудочной железы, рак яичников, рак эндометрия, рак матки).

- Другие заболевания (доброкачественные заболевания молочных желез, цирроз печени, аутоиммунные заболевания).
- Физиологическое повышение (беременности III триместр).
Снижение:
- Диагностического значения не имеет.
Са 15-3 (Углеводный антиген 15-3, СА 15-3)
Исследуемый материал Сыворотка крови
Метод определения
Иммуноферментный анализ.
- г. Алматы, 5 мкрн д 17 (Абая/Алтынсарина).
- г. Алматы, ул. Мендикулова (мкр. Самал-2), д.3
- г. Алматы, Бостандыкский р-н, мкр. Орбита — 4, д. 11
- г. Алматы, пр-кт Абая, 89
Опухолевый маркёр, использующийся при мониторинге течения и оценке эффективности терапии карциномы молочной железы.
Этот антиген возникает из мембран клеток карциномы молочной железы. Он определяется на эпителии секретирующих клеток и в секретах. Относится к высокомолекулярным гликопротеинам муцинового типа с молекулярной массой 300 000 Да.
Относится к высокомолекулярным гликопротеинам муцинового типа с молекулярной массой 300 000 Да.
Динамика уровня маркёра представляет бóльший интерес, нежели единичное значение уровня, взятое само по себе. Скорость возрастания опухолевого маркера обычно позволяет сделать заключение о природе прогредиентного течения заболевания, в частности, о метастазировании. При рецидивах или метастазах рост концентрации СА 15-3 может опережать появление клинических симптомов на 6 — 9 месяцев. До 80% женщин с метастазами рака молочной железы имеют значительное повышение уровня этого онкомаркера, в то время как всего у 20% женщин с диагнозом рака молочной железы I — II стадии в крови повышается СА 15-3.
CA-15-30 (онкомаркер рака молочной железы) (определение уровня в крови)
Артикул: 00090
Стоимость анализа
в лаборатории:
Обычный
1 000рубстоимость указана без учета стоимости забора биологического материала
Добавить в корзинуГотовность результатов анализа
Обычные*: 1 р. д.
д.
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Подготовка к анализу
Не ранее, чем через 3-4 часа после последнего приема пищи (не употреблять жирное).
Забор биоматериала
Методы выполнения и тесты
Иммуноанализ. Количественный, ед/мл
Файлы
Скачать образец результата анализаЭтот анализ входит в блоки:
Для чего это нужно
Опухолевый антиген СА 15-3 чаще всего назначается до и после лечения рака молочной железы с целью мониторинга лечения и развития рецидива. Тест может быть использован в качестве маркера, если опухоль производит достаточное количество СА 15-3.
CA 15-3 представляет собой белок, который секретируется клетками молочной железы. Раковые клетки производят белок в больших количествах, что приводит к увеличению его уровня в крови.
Тест имеет свои ограничения, поскольку не у всех пациентов с раком молочной железы повышается уровень маркера в крови (повышение выявляется у 20-30% пациентов). Процент относительно выше при метастазах в молочные железы (50-90% пациентов имеют повышенный уровень).
Результаты следует интерпретировать всегда в соответствии с клинической картиной.
Повышенный уровень маркера, не связанный с раком молочной железы, может быть мастите, воспалении яичников, поликистозе, беременности, кормлении грудью, гепатите.
Также спрашивают:
С этим анализом сдают:
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 10% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Тест на раковый антиген 15-3: использование, процедура, результаты
Тест биомаркера ракового антигена 15-3 (CA 15-3) используется для мониторинга рака груди. Антиген CA 15-3 — это белок, попадающий в кровоток при определенных типах рака. Хотя рак груди тесно связан с антигеном CA 15-3, он также связан с другими злокачественными и незлокачественными заболеваниями.
CA 15-3 — одно из нескольких веществ, классифицируемых как онкомаркеры, количество которых может увеличиваться по мере прогрессирования злокачественного новообразования и уменьшаться по мере того, как опухоль реагирует на терапию рака.CA 15-3 — один из нескольких онкомаркеров, используемых для мониторинга людей с раком груди 4 стадии (также известным как метастатический рак груди). Хотя некоторые онкологи будут использовать этот тест для выявления рецидива рака груди, он не одобрен для этого. использовать.
Назначение
CA 15-3 — это антиген, обычно обнаруживаемый в тканях груди. Антигены — это белки Y-образной формы, которые идентифицируют клетку для организма, выступая в качестве ее уникальной «сигнатуры».
Антигены — это белки Y-образной формы, которые идентифицируют клетку для организма, выступая в качестве ее уникальной «сигнатуры».
Хотя антиген CA 15-3 не вызывает рак, его количество может увеличиваться по мере быстрого деления раковых клеток.Поскольку раковые клетки не подвергаются апоптозу (запрограммированной гибели клеток), количество антигенов CA 15-3 будет увеличиваться вместе с ростом опухоли.
С учетом сказанного, не все виды рака груди выделяют антигены CA 15-3. Это особенно верно в отношении рака молочной железы на ранней стадии, при котором менее половины пациентов демонстрируют повышение значений CA 15-3. Напротив, до 80% людей с метастатическим раком груди будут иметь повышенные уровни CA 15-3.
Эта динамика делает CA 15-3 полезным для мониторинга рака груди 4 стадии, при котором первичная опухоль груди распространилась (метастазировала), создавая вторичные опухоли в других частях тела.Если ваш онколог назначает тест CA 15-3, это может быть по одной из двух причин:
- Регулярно отслеживая ваши значения CA 15-3, онколог может оценить, насколько эффективно лечение рака.

- Если уровень антигенов CA 15-3 превышает определенный уровень, это может указывать на обострение болезни и требовать исследования метастазов в других частях тела (чаще всего в кости или печени).
Ограничения
Хотя тест CA 15-3 полезен для мониторинга рака груди, он менее надежен при его использовании.Частично это связано с тем, что CA 15-3 — это , специфичный для рака груди, но не , эксклюзивный для него. Другие доброкачественные и злокачественные заболевания также могут вызывать увеличение, например:
Даже беременность и кормление грудью могут повышать уровень CA 15-3, создавая ложное впечатление о прогрессировании или рецидиве заболевания.
Даже помимо своей неспецифичности, тест CA 15-3 имеет низкую чувствительность (процент случаев, когда он дает правильный диагноз). Фактически, согласно исследованию 2015 года, проведенному в Германии, тест CA 15-3 имеет чувствительность всего 55.6% при использовании для диагностики метастатического рака груди.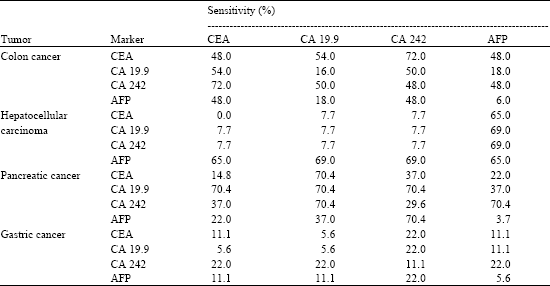
Обычная маммография по-прежнему считается основным инструментом скрининга на рак груди в большинстве стран.
Риски и противопоказания
С тестом CA 15-3 связано несколько рисков. Для анализа требуется забор крови, процедура которого может вызвать легкую боль, покраснение или синяки. Также могут возникать головокружение и обмороки. Инфекция после забора крови возникает редко, если приняты стандартные меры предосторожности.
Реже забор крови может вызвать утечку крови под кожу, что приведет к образованию гематомы. Большинство гематом проходят самостоятельно; более крупные могут затруднить кровоток и потребовать лечения.
Перед испытанием
CA 15-3 — это анализ крови, который обычно проводится вместе с общим анализом крови (CBC), тестами функции печени и тестами функции почек. Подготовка к любому из этих тестов не требуется.
Сроки
Забор крови занимает всего несколько минут.С учетом регистрации и времени ожидания ваша встреча может занять от 30 до 90 минут.
Расположение
Тест CA 15-3 часто можно выполнить в кабинете онколога во время вашего визита. Кроме того, вас могут направить в ближайшую лабораторию.
Что надеть
Выбирайте топ с короткими рукавами или рукава, которые легко закатываются. Если вы планируете вернуться к работе после теста, вы можете надеть длинные рукава, чтобы закрыть повязку или след от прокола на руке.
Еда и напитки
Для теста CA 15-3 нет ограничений в еде или питье.
Если у вас маленькие вены, часто помогает выпить пару стаканов воды перед обследованием. Это не повлияет на результаты, но может привести к расширению вен и облегчению забора крови.
Использование лекарств
Некоторые лекарства и добавки могут помешать тесту CA 15-3. Среди них биотин (также известный как витамин B7, витамин B8, витамин H или кофермент R).Тест CA 15-3 основан на связывании биотина с антигеном CA-153 и может быть нарушен, если потребляется слишком много биотина.
Хотя рекомендованное ежедневное потребление биотина вряд ли нанесет какой-либо вред, добавки с биотином в высоких дозах могут вызвать ложноотрицательные результаты. Прекратите принимать любые добавки, содержащие более 0,03 миллиграмма биотина, за 72 часа до теста.
Кроме того, таргетный противораковый препарат Афинитор (эверолимус) может вызывать парадоксальные эффекты. Поскольку Афинитор может блокировать путь экспрессии CA-153, препарат может вызывать повышение уровня CA 15-3, когда лечение работает (что приводит к ложноположительному результату), или падение, когда лечение не помогает (что приводит к ложноположительному результату). отрицательный результат).Взаимодействие с другими людьми
Если вы принимаете Афинитор, вам также следует сообщить об этом флеботомику, чтобы сделать запись для проверяющего патологоанатома.
Стоимость и медицинское страхование
Стоимость теста CA 15-3 может варьироваться в зависимости от местоположения, но обычно составляет от 50 до 80 долларов, а иногда и больше. Если вам приходится платить из своего кармана или у вас высокие затраты на доплату, это поможет найти лучшую цену. Даже если у вас есть страховка, убедитесь, что лаборатория является поставщиком услуг внутри сети; в противном случае ваша претензия может быть отклонена.
Если вам приходится платить из своего кармана или у вас высокие затраты на доплату, это поможет найти лучшую цену. Даже если у вас есть страховка, убедитесь, что лаборатория является поставщиком услуг внутри сети; в противном случае ваша претензия может быть отклонена.
Тест обычно не требует предварительной авторизации, но вы можете быть ограничены в том, сколько вы можете проходить каждый год. Проверьте свой полис или позвоните в свою медицинскую страховку для получения подробной информации.
Если вы не застрахованы или испытываете трудности с расходами на лечение, спросите своего онколога, есть ли какие-либо программы финансовой помощи, на которые вы имеете право. Вам также следует связаться с Коалицией финансовой помощи при раке (CFAC), группой национальных организаций, которые предоставляют финансовую помощь больным раком.
Что взять с собой
Вам потребуется предъявить удостоверение личности, карту медицинского страхования и кредитную карту или чек для покрытия любых личных расходов. Уточняйте, какую форму оплаты принимает офис, до встречи.
Уточняйте, какую форму оплаты принимает офис, до встречи.
Во время теста
Когда вы приедете в лабораторию, вам будет предложено войти в систему и заполнить регистрационную форму. Многие лаборатории попросят вас оплатить совместное страхование или доплату заранее; другие выставят вам счет позже.Также может быть предоставлена форма согласия, хотя согласие обычно подразумевается, если вы запрашиваете диагностическую процедуру, например анализ крови.
Забор крови, также известный как венепункция, выполняет флеботомист.
На протяжении всего теста
Флеботомист начинает с того, что осторожно прижимает пальцы к вашей коже, чтобы найти лучшую вену.
После выбора вены они надевают одноразовые перчатки, накладывают жгут на ваше плечо и просят сжать кулак.Вас могут попросить несколько раз накачать кулак, если у вас маленькие вены или они «стесняются». Затем место венепункции протирают спиртовой салфеткой.
Когда игла будет введена, вы почувствуете небольшой укол. Для теста CA 15-3 флеботомисту потребуется минимум 0,3 миллилитра крови, хотя потребуется больше, чтобы учесть повторные тесты. Пробирка, запаянная под вакуумом, обычно имеет красный верх или гелевый барьер.
Для теста CA 15-3 флеботомисту потребуется минимум 0,3 миллилитра крови, хотя потребуется больше, чтобы учесть повторные тесты. Пробирка, запаянная под вакуумом, обычно имеет красный верх или гелевый барьер.
После извлечения иглы на руку накладывают ватный диск или марлю, пока кровотечение не прекратится.Затем флеботомист накладывает пластырь на колотую рану.
Пост-тест
Вы должны иметь возможность уйти вскоре после теста, если у вас не будет кровотечения или одурманения. Затем вы можете продолжить свой день как обычно.
После теста
Вы можете почувствовать болезненность, покраснение или синяк в месте прокола. Эти проблемы обычно проходят сами по себе без лечения. При необходимости вы можете принять тайленол (ацетаминофен), чтобы облегчить боль.
Если у вас образовалась небольшая гематома, вы можете прикладывать к руке холодный компресс на 20 минут несколько раз в день, чтобы снять отек. (Не прикладывайте лед непосредственно к коже и не оставляйте его на более длительное время, поскольку это может вызвать обморожение. ) Более крупные или затвердевшие гематомы могут потребовать наложения шин и сдавливания.
) Более крупные или затвердевшие гематомы могут потребовать наложения шин и сдавливания.
Позвоните своему врачу, если у вас появятся какие-либо признаки инфекции после анализа крови, включая высокую температуру и постоянную или усиливающуюся боль, отек или болезненность в месте прокола.
Интерпретация результатов
Результаты вашего теста должны быть отправлены вашему онкологу в течение трех-пяти рабочих дней. Отчет будет включать в себя контрольный диапазон с указанием, когда уровни CA 15-3 являются нормальными или ненормальными. Референсный диапазон основан на ожидаемых значениях в популяции и может незначительно отличаться от лаборатории к лаборатории.
Вообще говоря, значение CA 15-3, равное 30 единиц на миллиметр (Ед / мл) или меньше, считается нормальным. С учетом вышесказанного, одно значение, как правило, имеет меньшее значение, чем серийные значения (в которых ваши результаты обычно измеряется в процессе лечения).Взаимодействие с другими людьми
Чтобы тест CA 15-3 был действительно качественным, его необходимо оценивать в сочетании с физическим осмотром, диагностической визуализацией и другими анализами крови.
Более высокие уровни CA 15-3 обычно соответствуют более поздним стадиям рака груди. Наивысшие уровни обычно наблюдаются при метастатическом раке груди, особенно когда поражены печень или кость. Однако уровни CA 15-3 могут быть низкими или нормальными даже при запущенной стадии заболевания, поскольку не все раковые образования груди производят CA 15-3.
С другой стороны, уровни CA 15-3 могут быть ненормально повышены в течение первых четырех-шести недель новой терапии рака. В конце концов, любое лечение, разрушающее опухоль, может вызвать временное повышение онкомаркеров. Чтобы избежать неправильного толкования, тест CA 15-3 следует проводить не менее чем через два-три месяца после начала нового лечения.
Важно отметить, что уровни CA-153 могут быть повышены у людей с доброкачественными заболеваниями или вообще без них. В отличие от рака, эти уровни обычно остаются стабильными.Дальнейшее расследование может потребоваться только при повышении уровня.
Продолжение
Если ваши результаты CA 15-3 будут выше, ваш онколог, скорее всего, назначит дополнительные тесты. Если подъем минимален, врач может подождать и просто назначить повторный тест через несколько недель. Если повышение сохраняется или увеличивается, врач, скорее всего, проведет дополнительное обследование. Это может включать:
Если подъем минимален, врач может подождать и просто назначить повторный тест через несколько недель. Если повышение сохраняется или увеличивается, врач, скорее всего, проведет дополнительное обследование. Это может включать:
Слово Verywell
Анализы крови, используемые для мониторинга метастатического заболевания груди, могут вызвать стресс и беспокойство, особенно если вы столкнулись с внезапным повышением маркера опухоли.Однако важно помнить, что CA 15-3 дает лишь небольшое представление о том, что на самом деле происходит, и имеет ценность только в контексте вашего здоровья и других диагностических оценок. по своей сути не означает, что рак распространяется или поражает другие органы. Также временное снижение не означает, что рак исчезает, учитывая, что рак 4 стадии неизлечим.
Раковый антиген (CA) 15-3 Анализ крови
Категории
Этот анализ крови на раковый антиген (CA) 15-3 используется для мониторинга реакции на инвазивное лечение рака груди и отслеживания рецидивов заболевания.
Код теста: 143404
Также известен как: CA 15-3, CA-Breast; Раковый антиген груди
Методология: иммуноферментный электрохемилюминесцентный анализ (ECLIA)
Подготовка: Пост не требуется. Прекратите потребление биотина по крайней мере за 72 часа до сбора.
Результаты тестов: 1-2 дня. Может занять больше времени в зависимости от погоды, праздников или задержек в лаборатории.
Код теста: 5819
Также известен как: CA 15-3, CA-Breast; Раковый антиген груди
Методология: иммуноанализ (IA)
Подготовка: Пост не требуется.Прекратите потребление биотина по крайней мере за 72 часа до сбора.
Результаты тестов: 1-2 дня. Может занять больше времени в зависимости от погоды, праздников или задержек в лаборатории.
Описание
CA 15-3 — это антиген или вещество, которое стимулирует защитную систему вашего тела. Некоторые типы раковых клеток выделяют антиген CA 15-3 в кровь. Этот тест используется для отслеживания некоторых видов рака. CA 15-3 не используется в качестве скринингового или диагностического теста для выявления рака груди.
Этот тест используется для отслеживания некоторых видов рака. CA 15-3 не используется в качестве скринингового или диагностического теста для выявления рака груди.
Рак груди — это рак, который, скорее всего, выделяет CA 15-3, особенно после лечения рака груди. Такие антигены, как CA 15-3, которые предоставляют информацию о раке, называются онкомаркерами.
Этот тест может потребоваться, если:
Диагноз «рак груди» установлен, лечение необходимо контролировать.
Лечение рака груди завершено, и необходимо подтверждение, чтобы узнать, вернулся ли рак или распространился.
Важно знать, что положительный результат анализа крови на CA 15-3 не означает, что у вас рак груди или что рак груди вернулся. Дополнительные условия могут привести к CA 15-3 в вашей крови. Незлокачественные заболевания груди, яичников и печени могут привести к повышению CA 15-3.
Как правило, повышенные значения могут указывать на прогрессирование или рецидив заболевания. Уменьшение значений может означать регресс заболевания.
Уменьшение значений может означать регресс заболевания.
CA 15-3 — обзор
Жидкие биопсии
Опухолевые маркеры — это белки, например, полученные из MUC1 (например,g., CA15-3, CA27.29) и карциноэмбриональный антиген, которые выделяются из опухолей и идентифицируются в кровотоке. 125 Однако их полезность ограничена мониторингом ответа на терапию или прогрессирования заболевания. Совсем недавно были достигнуты значительные методологические успехи в оценке циркулирующих биомаркеров рака, включая циркулирующие опухолевые клетки (ЦКО) и циркулирующие нуклеиновые кислоты, которые могут играть роль в диагностике, мониторинге и лечении заболевания.
Можно измерить ЦОК с помощью автоматического обогащения иммунных шариков с последующим окрашиванием панцитокератином. 126,127 При таком подходе наличие пяти или более ЦОК на 7,5 мл крови является прогностическим, со значительно худшей общей выживаемостью (ОС; 8,2 месяца по сравнению с 18 месяцами) по сравнению с пациентами с меньшим количеством ЦКО. 128 Клиническая полезность ЦКО для принятия решения о лечении метастатического рака молочной железы была проспективно проверена в рандомизированном исследовании III фазы; однако не было показано, что использование теста приводит к улучшению исходов заболевания, и поэтому неясно, как лучше всего включить его в повседневную клиническую помощь. 129 Методу иммунных шариков недостает чувствительности из-за использования определения на основе молекулы адгезии эпителиальных клеток (EpCAM), поскольку менее дифференцированные клетки часто не имеют экспрессии EpCAM и избегают обнаружения, поэтому новые методологии, включая выделение ЦОК на основе размера или других свойств разрабатываются. 127,130 Кроме того, способность выделять ЦОК позволяет проводить анализ отдельных клеток, включая оценку молекулярных маркеров, таких как экспрессия ER и амплификация HER2 в режиме реального времени.
128 Клиническая полезность ЦКО для принятия решения о лечении метастатического рака молочной железы была проспективно проверена в рандомизированном исследовании III фазы; однако не было показано, что использование теста приводит к улучшению исходов заболевания, и поэтому неясно, как лучше всего включить его в повседневную клиническую помощь. 129 Методу иммунных шариков недостает чувствительности из-за использования определения на основе молекулы адгезии эпителиальных клеток (EpCAM), поскольку менее дифференцированные клетки часто не имеют экспрессии EpCAM и избегают обнаружения, поэтому новые методологии, включая выделение ЦОК на основе размера или других свойств разрабатываются. 127,130 Кроме того, способность выделять ЦОК позволяет проводить анализ отдельных клеток, включая оценку молекулярных маркеров, таких как экспрессия ER и амплификация HER2 в режиме реального времени.
Технологические достижения также привели к способности обнаруживать нуклеиновые кислоты, включая циркулирующую опухолевую ДНК (цтДНК) и микроРНК (миРНК), которые выделяются из умирающих опухолевых клеток в кровь и могут быть более чувствительными и специфичными, чем стандартные биомаркеры. 130,131 Поскольку анализ циркулирующих нуклеиновых кислот может выявить возникающие мутации, которые могут привести к изменению вариантов лечения, их использование может улучшить исход болезни. ctDNA и могут быть специфически идентифицированы по наличию опухолеспецифических мутаций, в том числе у более чем 90% пациентов с метастатическим раком груди. 132,133 Последовательная оценка ctDNA посредством обнаружения этих мутаций может быть полезна для мониторинга пациентов на предмет рецидива или прогрессирования заболевания 134 ; относительные уровни коррелируют с опухолевой нагрузкой. 133,135,136 Подобные результаты были продемонстрированы с miRNAs. 137
130,131 Поскольку анализ циркулирующих нуклеиновых кислот может выявить возникающие мутации, которые могут привести к изменению вариантов лечения, их использование может улучшить исход болезни. ctDNA и могут быть специфически идентифицированы по наличию опухолеспецифических мутаций, в том числе у более чем 90% пациентов с метастатическим раком груди. 132,133 Последовательная оценка ctDNA посредством обнаружения этих мутаций может быть полезна для мониторинга пациентов на предмет рецидива или прогрессирования заболевания 134 ; относительные уровни коррелируют с опухолевой нагрузкой. 133,135,136 Подобные результаты были продемонстрированы с miRNAs. 137
Совсем недавно стало очевидно, что помимо выявления рака, оценка циркулирующих биомаркеров может быть полезной для мониторинга изменений в опухолях, которые могут повлиять на лечение.Например, несколько групп выявили активирующие мутации в лиганд-связывающем домене ESR1, гена, кодирующего ERα, которые присутствуют у 30% пациентов, устойчивых к эндокринной терапии, но редко выявляются в образцах первичной опухоли. . 138,139 Исследования также продемонстрировали использование массового параллельного секвенирования ктДНК для изучения внутриопухолевой гетерогенности, что также потенциально может быть использовано для идентификации целевых мутаций. 140 Компании в настоящее время извлекают выгоду из новой технологии и предоставляют анализы для наблюдения за пациентами, 141 , хотя клиническая полезность этих коммерческих анализов в настоящее время все еще находится под вопросом.Поскольку чувствительность обнаружения этих циркулирующих биомаркеров улучшается с развитием технологий, вполне вероятно, что жидкие биопсии станут рутинно использоваться для мониторинга пациентов с метастатическим раком груди. Однако использование этой технологии для диагностики или выявления рецидива заболевания остается под вопросом.
. 138,139 Исследования также продемонстрировали использование массового параллельного секвенирования ктДНК для изучения внутриопухолевой гетерогенности, что также потенциально может быть использовано для идентификации целевых мутаций. 140 Компании в настоящее время извлекают выгоду из новой технологии и предоставляют анализы для наблюдения за пациентами, 141 , хотя клиническая полезность этих коммерческих анализов в настоящее время все еще находится под вопросом.Поскольку чувствительность обнаружения этих циркулирующих биомаркеров улучшается с развитием технологий, вполне вероятно, что жидкие биопсии станут рутинно использоваться для мониторинга пациентов с метастатическим раком груди. Однако использование этой технологии для диагностики или выявления рецидива заболевания остается под вопросом.
Список пятерки лучших онкологов
Два списка лучших онкологов были разработаны в рамках участия ASCO в кампании Выбирая разумно , инициативе Американского совета по внутренней медицине, направленной на привлечение врачей, пациентов, и другие заинтересованные стороны здравоохранения, размышляющие и обсуждающие ценность каждого медицинского теста, процедуры и лечения.Первый список был опубликован в апреле 2012 года, а второй — 29 октября 2013 года. Оба содержат пять тестов, процедур и методов лечения, которые обычно используются в онкологической помощи, но не подтверждены доказательствами и должны подвергаться сомнению.
2013 Список
Узнайте больше о втором списке ASCO Top Five в онкологии:
Cancer.Net Краткое описание пациента: Выбор Wisely® 2013: Второй список ASCO из пяти основных тестов, процедур и методов лечения, связанных с раком, в которых многие пациенты не нуждаются
Рак.Net Podcast : Пять лучших онкологических исследований за 2013 год: что это означает для пациентов, с директором по маркетингу ASCO Ричардом Шильски, MD (2013–2021)
2012 Список
Узнайте больше о первом списке ASCO «Пятерка лучших онкологов» :
Cancer.Net Краткое описание пациента : Выбор Wisely® 2012: пять основных тестов, процедур и методов лечения, связанных с раком, в которых многие пациенты не нуждаются
Para leer la lista de los «cinco Principales» en español, haga clic aquí.
Cancer.Net Podcast : «Пятерка лучших онкологических заболеваний за 2012 год — что это означает для пациентов» с Алленом С. Лихтером, доктором медицины, FASCO
Узнайте больше в этих раздаточных материалах Consumer Reports для пациентов о пятерке лучших в онкологии 2012 года. Данное издание является партнером кампании Выбирая мудро .
Consumer Reports : Уход в конце жизни для продвинутых больных раком (Тема 1; PDF)
Consumer Reports : Визуализационные тесты на ранний рак простаты (Тема 2; PDF)
Consumer Reports : Визуализация и тесты на онкомаркеры для рака груди (темы 3 и 4; PDF)
Consumer Reports : Лекарства для увеличения лейкоцитов у онкологических больных, получающих химиотерапию (Тема 5; PDF)
Общие ресурсы
Узнайте больше о двух кампаниях Top Five List in Oncology и выбирая мудро :
ASCO.org: Выбор мудро — Узнайте больше об усилиях ASCO по разработке этих списков для онкологии.
ChoosingWisely.org : Посетите веб-сайт кампании ABIM.
Мета-анализ, включая 12 993 пациента
Цель . Прогностическая роль ракового антигена в сыворотке 15-3 (CA15-3) и ракового антигена (СЕА) при раке молочной железы остается спорным. В этом исследовании мы провели метаанализ, чтобы изучить прогностическую ценность этих двух маркеров у пациентов с раком груди. Методы . После поиска в электронных базах данных было включено 36 исследований (31 с информацией о CA15-3 и 23 с информацией о CEA) с 12 993 участниками. На основании данных, прямо или косвенно полученных из доступных исследований, отношения рисков (HR) и отношения шансов (OR) и их 95% доверительные интервалы (CI) были объединены в соответствии с более высокими или более низкими уровнями маркеров. Результатов . Повышенное значение CA15-3 или CEA было статистически значимым с более низкими показателями DFS и OS при раке груди (многомерный анализ OS: HR = 2.03, 95% ДИ 1,76–2,33 для CA15-3; HR = 1,79, 95% ДИ 1,46–2,20 для CEA; многомерный анализ DFS: HR = 1,56, 95% CI 1,06–1,55 для CA15-3; HR = 1,77, 95% ДИ 1,53–2,04 для CEA). Анализ подгрупп показал, что CA15-3 или CEA имели значительную прогностическую ценность в отношении первичного или метастазирующего типов и различных пороговых значений и включали размеры выборки и даже год публикации исследования. Кроме того, повышенный CA15-3 был связан с более высокой гистологической степенью и более молодым возрастом, тогда как повышенный CEA был связан с нетройным отрицательным типом опухоли и более старшим возрастом.Эти два повышенных маркера были связаны с более высокой опухолевой нагрузкой. Выводы . Этот метаанализ показал, что повышенный уровень CA15-3 или CEA в сыворотке был связан с плохим DFS и OS у пациентов с раком груди, и их следует тестировать в любое время, если это возможно.
1. Введение
Рак груди имеет самый высокий уровень заболеваемости и второй по уровню смертности среди онкологических заболеваний у женщин [1]; таким образом, прогноз его выживания касается врачей и пациентов. Прогностические факторы — это те клинико-патологические параметры, которые связаны с исходами опухоли.При раке молочной железы наиболее часто используемые прогностические факторы включают характеристики пациента (возраст и менструальный статус), особенности опухоли (размер опухоли, статус узла и стадия TNM), маркеры опухолевой ткани (рецептор эстрогена, рецептор прогестерона, статус HER-2 и ki. -67) и генетических маркеров (BRCA1 / 2) [2–8]. Использование только прогностических факторов или их комбинации для прогнозирования худшего исхода у пациентов и раннего начала лечения может улучшить выживаемость пациентов. Очень важно определить более доступные и удобные факторы.
маркеров в сыворотке крови могут быть легко достигнуты, и они играют важную роль во многих злокачественных опухолях [9-11], но их роль при раке молочной железы остается спорной. Существует некоторая корреляция между опухолевыми маркерами и клинико-патологией опухолей [12], и когда получение образцов ткани недоступно, в некоторых случаях эти маркеры могут предложить полезную информацию о фенотипе рака груди на ранней стадии [13]. Онкомаркеры сыворотки при раке груди включают раковый антиген 15-3 (СА15-3), раковый антиген 27.29 (CA27.29), карциноэмбриональный антиген (CEA), тканевый полипептидный антиген (TPA), циркулирующий внеклеточный домен HER-2 и тканевый полипептид-специфический антиген (TPS) [14, 15]. Среди них СА15-3 и СЕА — наиболее используемые и рекомендуемые маркеры. Прогностическая ценность CA15-3 была подтверждена некоторыми исследованиями [16–18], в то время как другие исследования показали отрицательные результаты [19–21]. Эбелинг и др. в исследовании 1046 пациентов сообщили, что CA15-3 в однофакторном, но не многомерном анализе, является предиктором худшего исхода [22].В обзорной статье Даффи собрал по крайней мере 10 исследований и описательно указал, что более высокое значение CA15-3 может быть связано с плохим исходом, но не провел объединенный анализ для подтверждения результатов [14]. CEA менее широко исследуется как прогностический фактор, чем CA15-3, потому что он имеет менее положительную частоту и более противоречивый. В некоторых исследованиях сообщается, что CEA не является предиктором первичного и метастазирующего рака груди [20, 21, 23, 24], но другие сообщают, что высокие концентрации CEA связаны с плохим прогнозом при раке молочной железы [17, 25, 26]. ].Эти вышеупомянутые противоречивые результаты CA15-3 и CEA при раке молочной железы в отношении их прогностической ценности могут быть связаны с небольшими размерами выборки, изменчивым дизайном исследований или другими ошибками в каждом отдельном исследовании. Мы провели поиск и объединили доступные исследования в этом метаанализе, чтобы изучить прогностическую роль CA15-3 и CEA при раке груди, а также их взаимосвязь с клинико-патологическими факторами опухоли, надеясь помочь медицинским работникам подтвердить и правильно использовать эти два сывороточных маркера.
2. Материалы и методы
2.1. Стратегия поиска
Мы провели систематический поиск литературы с помощью PubMed, Embase и Web of Science. Термины стратегии поиска следующие: «CA15-3» (например, «раковый антиген 15-3», «углеводный антиген 15-3» и «антиген, связанный с раком 15-3»), «CEA» (например, « карциноэмбриональный антиген »,« карцино-эмбриональный антиген »и« карцино-эмбриональный антиген »),« прогноз »(например,« исход »,« выживаемость »,« прогноз »,« смертность »и« рецидив ») и« грудь ». рак »(например,« новообразования груди »и« карцинома груди »).Поиск обновлен до 15 июля 2017 года. Соответствующие статьи также проверялись вручную.
2.2. Критерии включения и исключения
Критерии включения в этот метаанализ были следующими: (i) диагноз рака груди был определен на основании патологических результатов, (ii) CEA и CA15-3 были получены на основе анализа сыворотки, (iii ) сообщалось о корреляции сывороточного CEA и / или CA15-3 с общей выживаемостью (OS) и / или безрецидивной выживаемостью (DSS), и / или безрецидивной выживаемостью (DFS) и / или выживаемостью без прогрессирования (PFS). и (iv) коэффициенты риска (HR) и 95% доверительные интервалы (CI) могут быть получены прямо или косвенно.Критерии исключения были следующими: (i) рефераты, письма, обзоры, отчеты о случаях, экспертные заключения; (ii) литература, написанная не на английском языке; (iii) исследования без отношения рисков (HR) и 95% доверительных интервалов; (iv) исследования с повторяющимися данными с небольшим количеством случаев; и (v) нечеловеческие исследования.
2.3. Извлечение данных
Мы извлекли данные двух независимых авторов и путем обсуждения или согласия третьего автора относительно спорных данных. Следующие элементы были записаны для каждого исследования: имя первого автора, год публикации, страна, критерии включения данных для каждого исследования, общий размер выборки, средний возраст и время наблюдения пациентов, данные опухоли на стадии TNM, время сбор образцов сыворотки, пороговые значения CEA и / или CA15-3 и связанных клинико-патологических факторов, а также данные о выживаемости, включая HR с 95% доверительным интервалом.Мы использовали шкалу Ньюкасла – Оттавы (NOS) для оценки качества каждого исследования, проведенного двумя авторами. Баллы включали три части: избирательность пациентов (0–4), сопоставимость групп (0–2) и оценка результата (0–3). Исследования с баллами> 5 считались высококачественными.
2.4. Статистический анализ
Мы напрямую получили все многомерные данные и некоторые одномерные данные HR и 95% доверительных интервалов из литературы. Некоторые одномерные данные были оценены в соответствии с методами, проиллюстрированными Parmar et al.и Tierney et al. используя Engauge 4.0 и электронную таблицу расчета HR [27, 28]. HR> 1 указывает на худший прогноз у пациентов с раком груди. Все исследования с HR и 95% доверительным интервалом были разделены на три группы (исследования с первичными TNM I – III в группу 1; исследования с метастатическим раком груди в группу 2; и исследования с первичными TNM I – IV или неясной стадии в группу 3). , и объединенные результаты включали все три исследовательские группы. Связь между CEA и / или CA15-3 с клинико-патологическими параметрами определялась с использованием OR и 95% доверительных интервалов.
В этом метаанализе для оценки неоднородности был проведен тест Кокрена Q . Во всех исследованиях сначала использовались модели с фиксированным эффектом (метод Мантеля – Хензеля) для расчета объединенных результатов, но если (значение неоднородности) Ph <0,1 или I 2 > 50%, что предполагало значительную неоднородность, мы изменили на более консервативная модель случайных эффектов (метод Дер-Симоняна – Лэрда) для подтверждения результатов. Для изучения и объяснения неоднородности был проведен анализ подгрупп.Предвзятость публикации сначала оценивалась по графику воронки Бегга, а результат pr> | z | > 0,05 расценено как отсутствие предвзятости публикации. Если систематическая ошибка не была достоверной, для подтверждения использовался тест индикатора систематической ошибки Эггера. Результаты считались статистически значимыми, и все результаты были двусторонними.
3. Результаты
3.1. Характеристики исследования
По первоначальной поисковой информации было найдено 751 статья. После тщательного изучения 36 исследований, опубликованных в период с 1986 по 2017 гг., В которых участвовало 12 993 пациента с раком груди, соответствовали нашим критериям включения и были наконец включены в этот метаанализ [3, 13, 16–21, 23–26, 29–52].Конкретные процессы отбора литературы показаны на Рисунке 1. Среди них 18 исследований были из Европы и США, 14 исследований из Азии и 4 исследования из Африки. Двадцать восемь исследований касались начального лечения пациентов с раком груди, а восемь были сосредоточены на пациентах с метастатическим раком груди. В 24 исследованиях собирали образцы сыворотки до лечения, а в 12 исследованиях собирали образцы сыворотки после операции или во время рецидива и метастазов.Тридцать одно исследование предоставило информацию о выживаемости сывороточного CA15-3, а его пороговые значения варьировались от 20,11 до 77 Ед / мл; Между тем, двадцать три исследования предоставляют информацию о выживаемости сывороточного CEA, а его пороговые значения варьируются от 2,5 до 20 нг / мл. Информация о клинико-патологии, коррелированная с сывороткой CA15-3 или CEA, может быть извлечена из шестнадцати исследований. Дополнительная информация о статьях в этом исследовании представлена в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. CA15-3 и DFS при раке молочной железы
Четырнадцать исследований предоставили одномерные HR и 95% CI DFS в соответствии с пороговым значением сывороточного CA15-3 (рис. 2 (а)).Объединенные данные из четырнадцати исследований показали, что более высокий CA15-3 был значительно скорректирован с плохой DFS с объединенным одномерным HR 2,61 (95% ДИ: 2,17–3,13) со значительной гетерогенностью ( I 2 = 50%, Ph = 0,02, модель случайных эффектов). Десять исследований предоставили многомерную информацию о ЧСС и 95% ДИ DFS относительно CA15-3 (HR = 1,56, 95% ДИ: 1,38–1,76, I 2 = 31%, Ph = 0,16, модель с фиксированным эффектом; Рисунок 3 (а)). Только одно исследование было включено в группу 2, и оно показало, что CA15-3 не был независимым фактором прогнозирования DFS при метастатическом раке молочной железы (группа 2: HR = 1.28; 95% ДИ 0,43–3,80; ). Среди четырнадцати исследований два исследования сообщили о результатах ВБП, которые были результатом группы 2, которые показали, что ОР составляло 2,00 (95% ДИ: 1,46–2,74) для ВБП без значительной гетерогенности ( I 2 = 0% , Ph = 0,69). В многомерном анализе подгрупп результаты в европейских странах и США по сравнению с результатами в странах Азии и Африки показали значительную гетерогенность подгрупп, а более низкие пороговые значения у пациентов до лечения имели более высокие прогностические значения (Таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Чем выше уровень СА 15-3 в крови, тем больше масса опухолевых клеток в организме.
Чем выше уровень СА 15-3 в крови, тем больше масса опухолевых клеток в организме.

 ),
),