Диагностика антифосфолипидного синдрома (АФС)
Диагностика антифосфолипидного синдрома включает в себя выявление в крови пациента антинуклеарного фактора и антител к кардиолипину.
Определяемые показатели:
Синонимы русские
Антинуклеарный фактор (АНФ), антиядерные антитела, антинуклеарные антитела (АНА), антитела к кардиолипину, IgG и IgM (АКЛ).
Синонимы английские
Antinuclear Antibodies (ANA), Hep-2 Substrate, ANA-Hep2, Fluorescent AntiNuclear Antibody detection (FANA). Cardiolipin Antibodies, aCL antibody, Antiphospholipid Antibodies, APAs.
Метод исследования
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В медицинской практике определение в крови антинуклеарного фактора и антител к кардиолипину в совокупности с клиническими проявлениями применяется для диагностики антифосфолипидного синдрома.
Антифосфолипидный синдром (синдром Хьюза) – это нарушение иммунной системы, поражающее кровеносную систему. При этом в крови человека повышается склонность к образованию тромбов. Последние могут формироваться в кровеносных сосудах любого органа, в том числе плаценты у беременных. Тромбообразование может стать причиной следующих заболеваний: тромбоз глубоких вен нижних конечностей, тромбоэмболии легочной артерии или инсульта. У беременных это патологическое состояние может привести к задержке внутриутробного развития плода, замершей беременности, преэклампсии, выкидышу или преждевременным родам (акушерский антифосфолипидный синдром). Антифосфолипидный синдром, как правило, развивается у женщин детородного возраста. Своевременная диагностика антифосфолипидного синдрома играет важную роль в предотвращении серьезных осложнений.
Причины антифосфолипидного синдрома до сих пор детально не изучены, но ученые связывают его развитие с наличием в крови антифосфолипидных антител (антинуклеарный фактор, антитела к кардиолипину, IgG и IgM), разрушающих фосфолипиды в организме человека.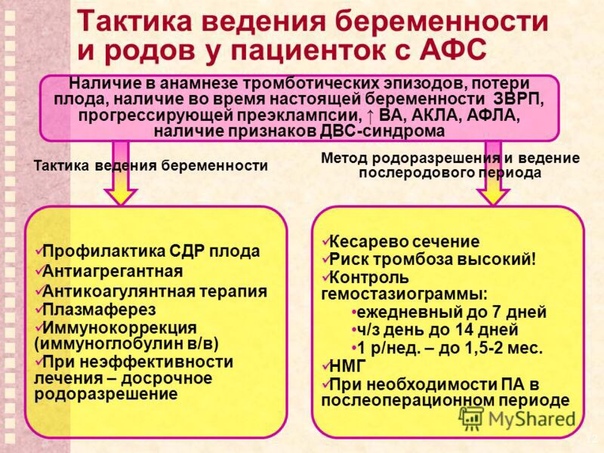
Изучение генов, отвечающих за развитие антифосфолипидного синдрома, находится на ранней стадии. Однако достоверно известно, что наличие у близких родственников этой патологии повышает вероятность ее проявления в следующем поколении.
К факторам внешней среды, влияющим на развитие антифосфолипидного синдрома, относятся вирусные инфекции (цитомегаловирус или парвовирус B19), бактериальные инфекции (колибактериоз, лептоспироз), противоэпилептические препараты, оральные контрацептивы.
К факторам риска развития клинических проявлений антифосфолипидного синдрома относятся беременность, хирургические вмешательства, повышенный уровень артериального давления или холестерина, гиподинамия, прием оральных контрацептивов или заместительная гормонотерапия, курение, ожирение.
Типичными проявлениями заболевания являются тромбозы различной локализации как в артериальном (ишемический инсульт, гангрена нижних конечностей), так и венозном русле (тромбофлебит глубоких и поверхностных вен конечностей).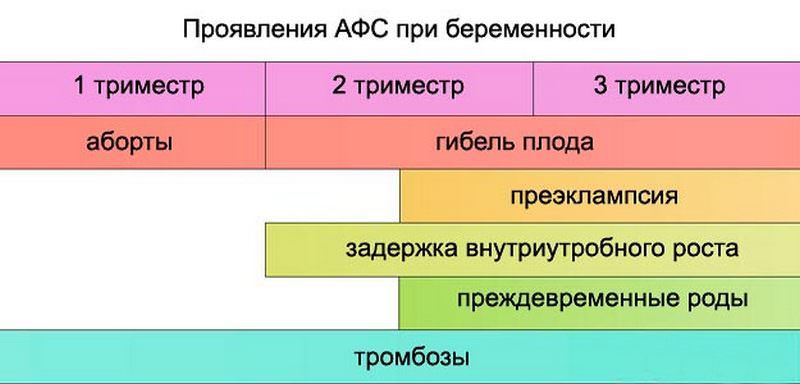
Особое место отводится проявлениям заболевания, связанным с тромбозом сосудов плаценты (акушерский антифосфолипидный синдром). Основным признаком в этом случае являются повторные выкидыши. Акушерский антифосфолипидный синдром характеризуется внутриутробной задержкой развития плода, замершей беременностью, преэклампсией (повышение артериального давления, отеки и белок в моче у беременной), преждевременными родами.
Антифосфолипидный синдром – сложное патологическое состояние, которое диагностируется на основании клинических проявлений (осложнения тромбообразования у молодых людей, отягощенный акушерский анамнез) и выявления в крови пациентки антифосфолипидных антител.
При выявлении в крови пациента одного из антифосфолипидных антител исследование необходимо повторить через 6-8 недель, поскольку результат первого теста может быть ложноположительным. Вероятность ложноположительного результата исследования повышается у пожилых людей, больных злокачественными новообразованиями, хроническими заболеваниями или инфекциями, во время терапии определенными лекарствами (гидралазин, изониазид, прокаинамид, некоторые препараты для лечения эпилепсии).
Лечение антифосфолипидного синдрома должно быть направлено на предотвращение образования тромбов. С этой целью таким пациентам назначаются антикоагулянты и антиагреганты.
Степень тяжести антифосфолипидного синдрома индивидуальна. Длительная антикоагулянтная терапия снижает вероятность образования тромбов и улучшает прогноз течения заболевания (большинство пациентов могут вести нормальный образ жизни).
Для чего используется исследование?
- Для диагностики антифосфолипидного синдрома.
Когда назначается исследование?
- При обследовании больных системной красной волчанкой;
- при планировании беременности;
- при невынашивании беременности, внутриутробной задержке развития плода, замершей беременности, преэклампсии, преждевременных родах и выкидышах;
- при флебитах и тромбофлебитах, хронических заболеваниях почек, кардиологической патологии (в т.ч. острый инфаркт миокарда), инсультах, транзиторных ишемических атаках у молодых людей;
- при пестрой фиолетовой пурпуроподобной сыпи, тромбоцитопении, гемолитической анемии, остеонекрозе, снижении остроты зрения, бесплодии.

Что означают результаты?
Референсные значения
1. Антинуклеарный фактор:
Результат: отрицательный.
Титр: 1:160.
2. Антитела к кардиолипину:
- IgM: 0-10 MPL-U-ml.
- IgG: 0-10 GPL-U-ml.
Если уровень исследуемых антител в крови находится в пределах референсных значений, значит, антифосфолипидный синдром отсутствует.
Для диагностики антифосфолипидного синдрома необходима совокупность клинических проявлений и как минимум двух положительных результатов лабораторных исследований концентрации антител в крови, выполненных с интервалом 1,5-2 месяца.
Что может влиять на результат?
Вероятность ложноположительного результата исследования повышается у пожилых людей, больных злокачественными новообразованиями, хроническими заболеваниями или инфекциями, во время терапии определенными лекарствами (гидралазин, изониазид, прокаинамид, некоторые препараты для лечения эпилепсии).
Важные замечания
Во время терапии определенными лекарствами (гидралазин, изониазид, прокаинамид, некоторые препараты для лечения эпилепсии) у пациента может развиваться лекарственно индуцированная системная красная волчанка. Симптомы последней проходят при отмене препарата.
Также рекомендуется
- [13-045] Антинуклеарный фактор на HEp-2 клетках
- [13-015] Антитела к ядерным антигенам (ANA), скрининг
- [13-063] Антинуклеарные антитела, IgG (анти-Sm, RNP, SS-A, SS-B, Scl-70, PM-Scl, PCNA, CENT-B, Jo-1, гистонов, нуклеосом, Ribo P, AMA-M2), иммуноблот
- [13-046] Антитела к экстрагируемому ядерному антигену (ENA-скрин)
- [06-050] С-реактивный белок, количественно (высокочувствительный метод)
- [13-020] Ревматоидный фактор
Кто назначает исследование?
Врач общей практики, терапевт, ревматолог, акушер-гинеколог.
Литература
- Wilson D. McGraw-Hill Manual of Laboratory and Diagnostic Tests 1st Ed Normal, Illinois, 2007: 55-57 pp.
- Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4:295-306.
- Hoppensteadt DA, Fabbrini N, Bick RL, et al. Laboratory evaluation of the antiphospholipid syndrome. Hematol Oncol Clin N Am. 2008;22:19-32.
- Ruffatti A, Pengo V. Antiphospholipid syndrome classification criteria: comments on the letter of Swadzba and Musial. J Thromb Haemost. 2009;7:503-504.
- Favaloro EJ, Wong RCW. Laboratory testing and identification of antiphospholipid antibodies and the antiphospholipid syndrome: a potpourri of problems, a compilation of possible solutions. Sem Thromb Haemost. 2008;34:389-410.
- Swadzba J, Musial J. More on: the debate on antiphospholipid syndrome classification criteria.
 J Thromb Haemost. 2009;7:501-502.
J Thromb Haemost. 2009;7:501-502.
Опыт применения экстракорпоральной гемокоррекции в комплексной терапии антифосфолипидного синдрома при привычном невынашивании беременности
Г.А.Лотц, В.А.Щанин
Кемеровская областная клиническая больница, отделение гравитационной хирургии крови, г. Кемерово
Трансфузиология № 2, 2010
Проведен анализ лечения 40 пациенток с привычным невынашиванием беременности, у которых был выявлен антифосфолипидный синдром.
Антифосфолипидный синдром (АФС) клинически проявляется тромбозами или повышенным свертыванием крови в сосудах любого калибра — от мелких до крупных. Из-за возможности тромбоза сосуда любого органа клиническая симптоматика очень разнообразна. По правилам диагностики, принятым в международной практике, диагноз АФС устанавливается при развитии двух клинических проявлений. Первый — это тромбоз, артериальный или венозный, который обязательно должен быть подтвержден специальными методами исследования. Вторым кардинальным признаком АФС является повторные случаи потери беременности. На ранних сроках — это выкидыши, в более поздних сроках беременности — внутриутробная гибель плода. Акушерская патология, связанная с АФС, имеет свои особенности. Характерным для АФС является один или более случаев внутриутробной гибели нормального плода после 10 недель беременности, а также три или более последовательных случаев спонтанных абортов до 10 недель беременности (исключение — анатомические дефекты матки, гормональные нарушения, материнские или отцовские хромосомные нарушения). Типичным считается также один (или более) случай преждевременных родов нормального плода до 34 недель беременности из-за выраженной преэклампсии или эклампсии. Однако и при характерных клинических проявлениях для достоверного диагноза АФС необходимо двукратное подтверждение в крови антикоагулянтов волчаночного типа (АВТ) с промежутком времени не менее 6 недель.
Вторым кардинальным признаком АФС является повторные случаи потери беременности. На ранних сроках — это выкидыши, в более поздних сроках беременности — внутриутробная гибель плода. Акушерская патология, связанная с АФС, имеет свои особенности. Характерным для АФС является один или более случаев внутриутробной гибели нормального плода после 10 недель беременности, а также три или более последовательных случаев спонтанных абортов до 10 недель беременности (исключение — анатомические дефекты матки, гормональные нарушения, материнские или отцовские хромосомные нарушения). Типичным считается также один (или более) случай преждевременных родов нормального плода до 34 недель беременности из-за выраженной преэклампсии или эклампсии. Однако и при характерных клинических проявлениях для достоверного диагноза АФС необходимо двукратное подтверждение в крови антикоагулянтов волчаночного типа (АВТ) с промежутком времени не менее 6 недель.
Сочетание тромботических осложнений, повторных случаев потери беременности, низкого количества тромбоцитов в периферической крови с АВТ получило название антифосфолипидный синдром.
Одним из эффективных методов, направленных на патогенетическую терапию данного состояния, является плазмаферез (ПА). Среди специфических эффектов плазмафереза выделяют детоксикацию, коррекцию реологических свойств крови, иммунокоррекцию, повышение чувствительности к эндогенным веществам и медикаментозным препаратам. Детоксикационный эффект достигается не только путем элиминации экзогенных и эндогенных токсичных субстанций, но и посредством антиоксидантного действия вследствие активации процессов биотрансформации промежуточных метаболитов, эндотоксинов бактерий до конечных продуктов. Действие плазмафереза, корригирующее реологические свойства крови, реализуется путем влияния на все звенья системы гемостаза: плазменное, клеточное, сосудистое. Особое значение в терапии больных с АФС приобретает удаление в процессе процедуры антифосфолипидиых аутоантител, иммунных комплексов, иммуногенных плазменных белков, аутоантигенов, что позволяет снизить активность aутоиммунного процесса. Под действием плазмафереза изменяются функциональные свойства мембран клеток, в частности повышается деформируемость и снижаются агрегационные свойства эритроцитов и тромбоцитов, что особенно важно у больных с АФС, ввиду наличия у большинства из них выраженной гиперкоагуляции.
Наш опыт показывает, что у женщин с упорным невынашиванием беременности лучший эффект дают курсы плазмафереза в сочетании с малыми дозами антикоагулянтов и дезагрегантов.
После удаления АВТ методом плазмафереза уровень последних в крови нарастает очень медленно — через несколько месяцев, поэтому во время беременности достаточными являются выполнение 1-2 курсов дискретного плазмафереза. Удаление АВТ из крови во время беременности является необходимой процедурой, т.к. гепарин и фраксипарин могут улучшить микроциркуляцию в области плацентарного ложа, но они не проникают через плацентарный барьер и не улучшают микроциркуляции в плаценте и в органах плода.
За 2006-2008 годы нами пролечено 40 женщин в возрасте от 24 до 37 лет, средний возраст составил 31 год. 27 женщинам с установленным диагнозом АФС плазмаферез проводили во время беременности, из них девятерым потребовался повторный курс, а двоим — курс ПА выполняли троекратно. Частота проведения курсов ПА определялась динамикой лабораторных показателей. 13 женщинам курс плазмафереза проведен по поводу подготовки к планируемой беременности.
13 женщинам курс плазмафереза проведен по поводу подготовки к планируемой беременности.
ПА проводился в дискретном режиме. Курс составлял 8-10 сеансов с интервалом 2 дня. За сеанс удалялось 250-300мл. плазмы. Замещение удаляемой плазмы проводилось только 0,9% раствором NaCI. Лечение проводилось под контролем тех лабораторных тестов, которые у данного пациента наиболее информативно выявили нарушения гемостаза.
У 27 женщин беременность была пролонгирована до доношенного срока и закончилась родами. Данными о наступлении беременности у оставшихся женщин мы не располагаем (лечение проводилось амбулаторно).
Таким образом, комплексное применение этапного плазмафереза, малых доз низкомолекулярных гепаринов и дезагрегантов позволяет успешно пролонгировать беременность до доношенного срока у женщин с подтвержденным диагнозом антифосфолипидного синдрома.
Все статьи в разделе «Клиническая трансфузиология»
Антифосфолипидный синдром
Акушерство и гинекология Антифосфолипидный синдромАнтифосфолипидный синдром это аутоиммунный процесс, который ассоциируется с осложнениями беременности, включающими замершую беременность, задержку развития плода, преэклампсию, тромбозы и аутоиммунную тромбоцитопению. Диагностика антифосфолипидного синдрома основана на данных клинических проявлений ( то есть признаков болезни) и данных лабораторных анализов.
Диагностика антифосфолипидного синдрома основана на данных клинических проявлений ( то есть признаков болезни) и данных лабораторных анализов.
Что лежит в основе антифосфолипидного синдрома
Упрощенно говоря, все аутоиммунные процессы можно представить как реакции собственной иммунной системы, направленные против собственных тканей. В физиологических условиях во время внутриутробного развития плода в его иммунной системе протекают процессы, ответственные за возникновение иммунологической толерантности. Иммунологическая толерантность это отсутствие реакций на определенные виды антигенов. В частности, иммунная система человека находится в состоянии толерантности к собественным тканям. Такой механизм необходим для того, чтобы факторы защиты против воздействия внешних инфекционных агентов и чужеродных тканей не вредили бы своему собственному организму. В нормальной иммунной системе функционирует система распознавания «свой-чужой». Все ткани организма человека несут для своей иммунной системы сигнал «свой».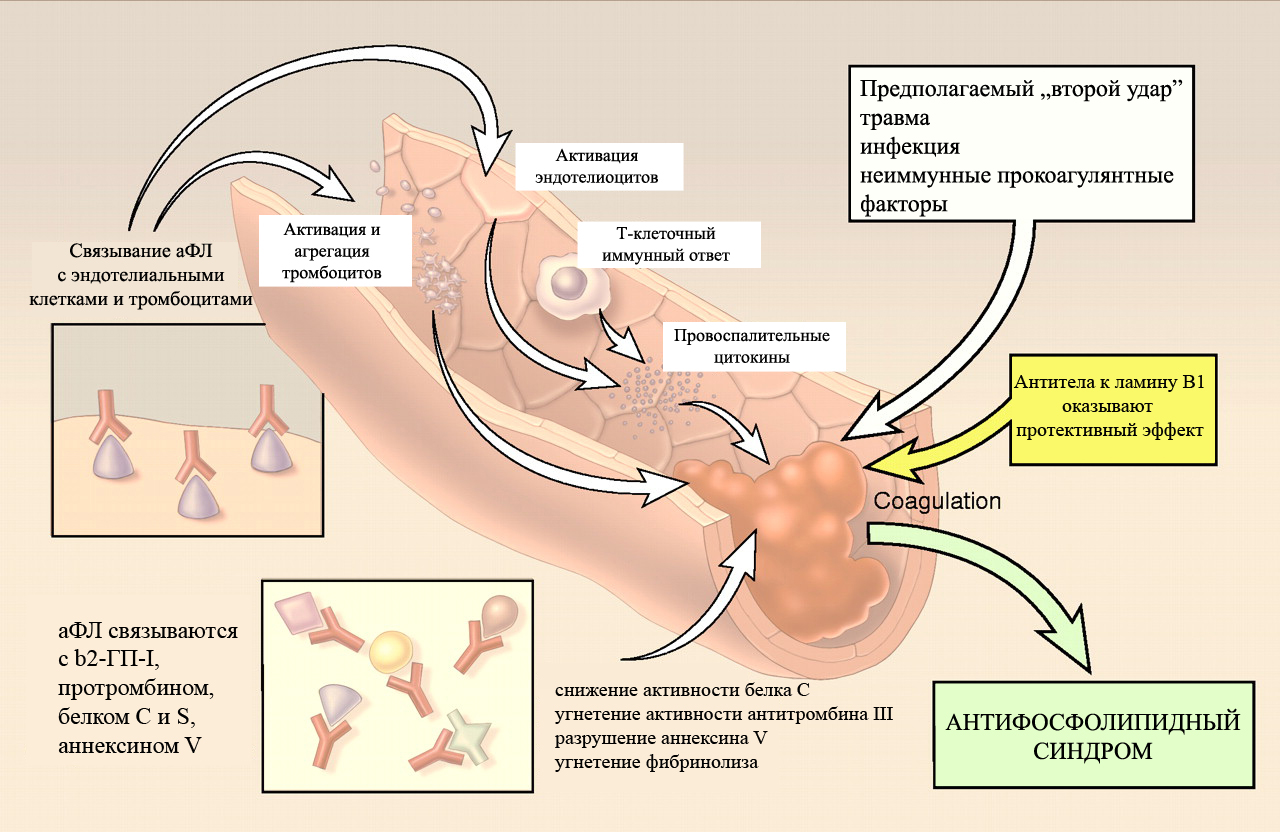 Благодаря ему иммунная система не проявляет агрессии к тканям своего организма, однако моментально реагирует на те факторы, которые не несут сигнала «свой». В процессе формирования аутоиммунных реакций происходит аномальная активация факторов защиты от собственных тканей. При этом становится возможной атака иммунной системой тканей своего организма.В настоящее время существует мнение, что склонность к аутоиммунным процессам заложена в наследственной информации и существуют люди, у которых вероятность развития аутоиммунных заболеваний более высока.
Благодаря ему иммунная система не проявляет агрессии к тканям своего организма, однако моментально реагирует на те факторы, которые не несут сигнала «свой». В процессе формирования аутоиммунных реакций происходит аномальная активация факторов защиты от собственных тканей. При этом становится возможной атака иммунной системой тканей своего организма.В настоящее время существует мнение, что склонность к аутоиммунным процессам заложена в наследственной информации и существуют люди, у которых вероятность развития аутоиммунных заболеваний более высока.
При антифосфолипидном синдроме в организме беременной женщины начинают вырабатываться антитела к фрагментам клеток и некоторым органическим соединениям. Эти антитела называются антифосфолипидными антителами или антителами к фосфолипидам. Фосфолипиды это соединения, которые входят в состав клеточных мембран. Повышение уровня антифосфолипидных антител ведет к повреждению клеток, выстилающих сосуды – эндотелиоцитов. Эндотелиоциты вырабатывают простагландины Е2 и тромбоксан. Повреждение эндотелия ведет к нарушению выработки простагландинов и тромбоксана сосудистой стенкой.
Повреждение эндотелия ведет к нарушению выработки простагландинов и тромбоксана сосудистой стенкой.
Так как фосфолипиды входят в состав стенки тромбоцитов, то появление антител к фосфолипидам ведет к нарушению структуры тромбоцитов и к изменению в их способности к агрегации.
Появление антител к фосфолипидам нарушает регуляцию некоторых иммунных процессов, а также вызывает повреждения структур плаценты.
Различают первичный и вторичный антифосфолипидный синдром. Первичный антифосфолипидный синдром возникает без какой –либо связи с другими заболеваниями. Вторичный антифосфолипидный синдром развивается на фоне уже присутствующих аутоиммунных заболеваний, например при системной красной волчанке.
В чем заключается опасность антифосфолипидного синдрома для беременных
Женщины с антифосфолипидным синдромом имеют более высокую вероятность развития преэклампсии в сроках до 34 недель. У некоторых беременных преэклампсия протекает настолько тяжело, что вызывет необходимость стимулировать преждевременные роды. Антифосфолипидный синдром также может вызывать бесплодие, замершую беременность и преждевременные роды.
Антифосфолипидный синдром также может вызывать бесплодие, замершую беременность и преждевременные роды.
Во время беременности у женщин с антифосфолипидным синдромом может развиться полиорганная недостаточность.
Смерть плода в сроке 20 и более недель гестации может быть связана с этим синдромом. У нелеченных пациенток с антифосфолипидным синдромом смерть плода может наступить приблизительно в 90% случаев. Лечение способно снизить этот процент до 25%.
Диагностика антифосфолипидного синдрома
Диагностика основана на определенных клинических и лабораторных признаках. Для постановки диагноза необходимо наличие не менее 1 клинического и не менее 1 лабораторного признака заболевания.
К клиническим критериям относится наличие одного или более эпизода артериального или венозного тромбоза любой локализации (возникающего в любом органе или ткани). К акушерским признакам относится:
- Наличие одного или более эпизода смерти плода с 10 и более недели беременности.
 При этом у плода отсутстуют признаки анатомических аномалий.
При этом у плода отсутстуют признаки анатомических аномалий. - Наличие одного или более эпизода преждевременных родов с морфологически нормальным плодом на 34 неделе или ранее, вследствие тяжелой преэклампсии, эклампсии или развития плацентарной недостаточности.
- Три или более последовательных самопроизвольных аборта в сроке до 10 недель беременности с отсутствие хромосомных, гормональных и морфологических аномалий у матери и отсутстием хромосомных аномалий у отца.
К лабораторным критериям антифосфолипидного синдрома относятся:
- Выявление антикардиолипиновых антител IgG и /или IgM в средних и высоких концентрациях не менее ,чем в 2 случаях на протяжении 12 недель.
- Выявление антител к волчаночному антикоагулянту IgG и /или IgM не менее ,чем в 2 случаях на протяжении 12 недель.
- Выявление антител к бета 2 гликопротеину I в высоких концентрациях.
Так как диагноз антифосфолипидный синдром у беременных является произоводным от истории болезни и лабораторных данных, выявить клинические признаки у беременной с первичной формой заболевания не всегда удается. В случае с вторичным антифосфолипидным синдромом, котроый возникает на фоне предшествующего основного заболевания, клинические признак более очевидны.
В случае с вторичным антифосфолипидным синдромом, котроый возникает на фоне предшествующего основного заболевания, клинические признак более очевидны.
После тромбозов , вызывающих нарушения мозгового кровообращения могут остаться неврологические изменения.
На коже могут появляться следующие поражения: синюшность кончиков пальцев , носа , ушей и губ, язвы на ногах и гангрена пальцев, фотосенсибилизация, поражения кожи по типу дискоидной волчанки и другие признаки. Причины их появления неясны.
Также возможны поражения суставов, появление выпота в плевральных полостях и перикарде, нарушения функции почек, неврологические нарушения, изменения в составе крови.
Почему при антифосфолипидном синдроме страдает плод
При антифосфолипидном синдроме антитела матери, направленные против собственных тканей организма, проникают через плаценту, вызывая многочисленные повреждения структур плода, что может привести к его гибели. Другим механизмом воздействия на плод является нарушение циркуляции крови в плаценте, в результате чего плод лишается возможности полноценно питаться.
Показания к лабораторному обследованию на выявление антифосфолипидного синдрома:
Акушерские:
- Необъясненная смерть плода или замершая беременность
- Привычное невынашивание беременности ( 3 или более спонтанных аборта)
- Необъясненная смерть плода во 2 или 3 триместре
- Тяжелая преэклампсия на сроке до 34 недель беременности
- Необъясненная тяжелая задержка развития плода
- Хорея беременных
Неакушерские :
- Нетравматические тромбозы или тромбоэмболии (венозные и артериальные)
- Инсульт, особенно у женщин 24-50 лет
- Необъясненные транзиторные нарушения мозгового кровообращения
- Аутоиммунная тромбоцитопения
- Аутоиммунная гемолитическая анемия
- Ложноположительный тест на сифилис
- Проявления системной красной волчанки или других аутоиммунных заболеваний
Лечение проявлений антифосфолипидного синдром у беременных
Все женщины с неблагополучной предшествующей историей беременности или страдающие аутоиммунными заболеваниями нуждаются в тщательном медицинском контроле. Если во время первого месяца беременности при контроле уровня бета ХГЧ зарегистрирована нормальная динамика его нарастания, то прогноз благоприятен в 80-90 % случаев. Если же рост уровня бета ХГЧ ниже, чем в два раза в течение 2 дней, вероятность неблагоприятного исхода достигает 70-80%. Беременные с задержной внутриутробного развития плода нуждаются в узи контроле каждые 3-4 недели после достижения 18-20 недели беременности.
Если во время первого месяца беременности при контроле уровня бета ХГЧ зарегистрирована нормальная динамика его нарастания, то прогноз благоприятен в 80-90 % случаев. Если же рост уровня бета ХГЧ ниже, чем в два раза в течение 2 дней, вероятность неблагоприятного исхода достигает 70-80%. Беременные с задержной внутриутробного развития плода нуждаются в узи контроле каждые 3-4 недели после достижения 18-20 недели беременности.
Лечение антифосфолипидного синдрома направлено на уменьшение тромбообразования. Для этих целей используют препараты, обладающие антикоагулянтными свойствами. Также для лечения используют внутривенное введение специальных антител, которые связывают антитела к фосфолипидам, а также способствуют снижению синтеза аутоантител В-лимфоцитами и выработку лимфокинов Т-лимфоцитами.
Экстрагенитальная патология ( изменения органов, не связанные с половой системой) лечится в зависимости от поражения органа. Например при возникновении гломерулонефрита лечат гломерулонефрит, а при поражении клапанов аорты делают операцию по замене аортального клапана. Если у беременной тяжелая тромбоцитопения и анемия, делают спленэктомию (удаление селезенки).
Если у беременной тяжелая тромбоцитопения и анемия, делают спленэктомию (удаление селезенки).
Анализы на Антифосфолипидный синдром (АФС), цены в лаборатории KDL
Антифосфолипидный синдром – лабораторный комплекс тестов для оценки аутоиммунной патологии, когда в организме вследствие перестройки иммунной системы вырабатываются антитела к фосфолипидам – структурным компонентам клеточных мембран и в результате отмечается повышенная активность свертывающей системы крови. Наиболее частые клинические проявления у женщин детородного возраста — привычное невынашивание беременности, осложненное течение беременности (гестозы, преэклампсия). Также может протекать под маской повышенного давления, ишемической болезни сердца, артериальных и венозных тромбозов, поражений кожи.
Что входит в состав комплекса?
Кардиолипин и бета-2-гликопротеин – структурные компоненты фосфолипидов; выработка антител к ним лежит в основе механизма развития антифосфолипидного синдрома.
В каких случаях можно заподозрить АФС (антифосфолипидный синдром)
- Привычное невынашивание беременности (выкидыш на раннем сроке, преждевременные роды)
- Осложнения беременности (гестозы, преэклампсия)
- Один или более случаев тромбоза артерий или вен и любой локализации в личной истории пациента
- Сердечно-сосудистые заболевания
Что означают результаты теста?
Для того, чтобы установить диагноз антифосфолипидного синдрома, констатируется один клинический признак (тромбоз, потеря плода и т.п.) и один лабораторный критерий (наличие волчаночного антикоагулянта, антител к кардиолипину или к бета 2 –гликопротеину1). Причем, лабораторный маркер должен быть положительным дважды при исследовании с интервалом в 12 недель (положительный результат не менее 2 раз).
Расшифровку результатов исследования осуществляет лечащий врач на основании совокупности данных.
Сроки выполнения теста.
8-9 дней
Как подготовиться к анализу?
Кровь сдаётся утром натощак, можно пить чистую негазированную воду. Специальная подготовка не нужна.
Специальная подготовка не нужна.
(PDF) Антифосфолипидный синдром. Диагностика и лечение: учебное пособие.
10
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ АФС
Весь спектр клинических проявлений АФС обусловлен сосудистым
тромбозом. Антифосфолипидный синдром может проявляться одним или
одновременно несколькими клиническими признаками, или возникнуть на фоне
функциональных расстройств со стороны различных органов и систем.
Клиническая картина АФС: неврологические (мигрень, потеря памяти, слуха),
кардиологические, пульмонологические синдромы, поражения кожи,
акушерская патология, тромбозы, тромбоцитопения, специфическое поражение
почек, печени, глаз и др.
Рецидивирующие тромбозы – одно из основных и наиболее опасных
проявлений антифосфолипидного синдрома. Наиболее часты венозные
тромбозы, как правило, локализующиеся в глубоких венах голеней, что
сопряжено с риском развития тромбоэмболии ветвей легочной артерии. Однако
Однако
нередки случаи тромбозов почечных и печеночных вен, что приводит к
развитию, соответственно, нефротического синдрома и синдрома Бадда-Киари
(тромбоз печеночных вен). Описаны тромботические поражения воротной,
подключичной, нижней полой вен, интракраниальных сосудов, артерий и вен
сетчатки, крупных сосудов нижних конечностей, различных отделов аорты.
При АФС может возникнуть тромбоз сосудов почек любой локализации:
почечной артерии, мелких внутрипочечных артерий, гломерулярных
капилляров и почечных вен. В случае развития стеноза почечной артерии без ее
полной окклюзии формируется стойкая артериальная гипертензия. Длительная
ишемия коркового слоя может привести к возникновению инфаркта почки.
Нарушения функции клубочков, связанные с АФС, проявляются снижением
клиренса креатинина, артериальной гипертензией и протеинурией. Для
дифференциальной диагностики между гломерулонефритом и нефропатией,
связанной с АФА, больным СКВ с АФА проводится биопсия почек. При АФС
При АФС
характерными изменениями при биопсии почек являются микроангиопатия с
наличием тромбов, атрофия коркового вещества и удвоение мембраны
клубочков. Вероятность возникновения сосудистого тромбоза повышена у ВА-
позитивных пациентов, находящихся на гемодиализе.
Клиническими проявлениями артериального тромбоза часто являются
инсульт и транзиторная ишемическая атака (служат дебютом заболевания в
23% случаев), периферическая гангрена, синдром дуги аорты, преходящая
слепота или потеря зрения, нарушения мозгового кровообращения и др.
Рецидивирующие инсульты могут вести к деменции. Несмотря на то, что
ишемический инсульт и/или транзиторная ишемическая атака составляют 50%
неврологических осложнений АФС, имеют место и другие, менее частые
неврологические проявления, которые включают хорею, поперечный миелит и
мигрень. Возникновение хореи у пациентов с АФС может быть связано с
использованием пероральных противозачаточных препаратов и беременностью.
Опасность тромботических осложнений возрастает с течением беременности и
в послеродовом периоде, так как возникает физиологическое повышение
коагуляционного потенциала крови на фоне гиперволемии.
Антифосфолипидный синдром — фактор невынашивания
При изучении причин привычного невынашивания беременности особое значение приобретает исследование влияния аутоиммунных реакций (образование антител к некоторым собственным фосфолипидам) на процессы имплантации, роста, развития эмбриона и плода, течение беременности и исход родов.
В настоящее время антифосфолипидный синдром (АФС) описанный впервые у больных системной красной волчанкой, широко изучается учеными различных медицинских специальностей в связи с многообразием клинической симптоматики, длительным персистирующим течением, необходимостью своевременной диагностики и коррекции возникающих нарушений. В настоящее время различают первичный и вторичный антифосфолипидный синдромы.
В настоящее время различают первичный и вторичный антифосфолипидный синдромы.
Развитие вторичного АФС связано с аутоиммунными, онкологическими, инфекционными заболеваниями, а также с воздействием некоторых лекарственных препаратов и токсичных веществ. О первичном АФС можно говорить в отсутствие перечисленных заболеваний и состояний.
Скорее всего у Вас АФС, если:
- выявлен волчаночный антикоагулянт (ВА) в венозной крови как минимум двукратно с интервалом 6-8 недель;
- наличие в молодом возрасте (до 45 лет) венозных или артериальных тромбозов, в частности инфарктов, инсультов, преходящих нарушений мозгового кровообращения, тромбоэмболии легочной артерии, тромбозов сосудов сетчатки;
- снижено количество тромбоцитов, которое может проявляться клинически или быть бессимптомным;
- наличие в прошлом потерь плода в разные сроки беременности, особенно 10 недель и более, когда маловероятна гибель эмбриона (плода) вследствие генетических причин.

К дополнительным диагностическим критериям АФС можно отнести сетчатое ливедо, неврологические проявления (мигрень, хорея), хронические язвы голеней, эндокардит.
Среди пациенток с привычным невынашиванием беременности АФС встречается в 27-42%, причем без проведения лечения гибель эмбриона (плода) наблюдается у 90-95% женщин, имеющих аутоантитела к фосфолипидам.
Предположить развитие АФС можно при наличии аутоиммунных заболеваний, привычного невынашивания беременности (не связанного с эндокринными, генетическими причинами, аномалиями развития половых органов, органической или функциональной истмико-цервикальной недостаточностью), при раннем развитии гестоза (токсикоза второй половины беременности), особенно тяжелых его форм, плацентарной недостаточности, гипотрофии плода в течение предыдущих беременностей, тромбоцитопении неясной этиологии, ложноположительных реакциях Вассермана. Среди пациенток с привычным невынашиванием беременности АФС встречается в 27-42%, причем без проведения лечения гибель эмбриона (плода) наблюдается у 90-95% женщин, имеющих аутоантитела к фосфолипидам.
Антифосфолипидный синдром наблюдается у женщин в 2-5 раз чаще, чем у мужчин, что, вероятно, объясняется большей предрасположенностью женщин к системным заболеваниям соединительной ткани. Исследования антигенов системы HLA (human leucocites antigen) показало, что у больных с АФС чаще, чем в популяции встречаются HLA: DR4, DR7, DRw53, что свидетельствует о возможной генетической предрасположенности к заболеванию. В литературе описаны семейные случаи АФС, составляющие, по данным некоторых авторов, до 2%.
Опасность тромботических осложнений возрастает с течением беременности и в послеродовом периоде, так как возникает физиологическое повышение свертываемости крови. Доказана роль АФС в возникновении неразвивающейся беременности, задержки внутриутробного развития плода, вплоть до внутриутробной гибели плода во II и III триместрах. У женщин, страдающих АФС, чрезвычайно важной представляется проблема обследования вне беременности, своевременная диагностика и коррекция гемостазиологических, метаболических и иммунных нарушений, динамический контроль на протяжении всей беременности и послеродового периода. Такой подход к проблеме позволяет правильно оценить риск развития осложнений и своевременно назначить необходимую терапию, предотвратить гибель или внутриутробное страдание плода.
Такой подход к проблеме позволяет правильно оценить риск развития осложнений и своевременно назначить необходимую терапию, предотвратить гибель или внутриутробное страдание плода.
При ведении беременных и родильниц, страдающих АФС, невынашиванием беременности, бесплодием, врачи нашей клиники осуществляют необходимый и тщательный контроль за активностью аутоиммунного процесса, состоянием системы свертывания крови, проводят профилактику, своевременную диагностику и грамотное лечение возникающих нарушений на высоком профессиональном уровне.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Читайте также
Антифосфолипидный синдром > Клинические рекомендации РФ 2013-2017 (Россия) > MedElement
Рекомендации по ведению больных АФС с тромбозом1. Ведение пациентов с артериальными и/или венозными тромбозами и аФЛ, не набирающих критерий для достоверного АФС (серологические маркёры в низких уровнях), не отличается от ведения аФЛ негативных больных с подобными тромботическими исходами (уровень доказательства 1С)
Ведение пациентов с артериальными и/или венозными тромбозами и аФЛ, не набирающих критерий для достоверного АФС (серологические маркёры в низких уровнях), не отличается от ведения аФЛ негативных больных с подобными тромботическими исходами (уровень доказательства 1С)
Комментарии. Данные системного обзора свидетельствуют, что пациенты с венозным тромбоэмболизмом и аФЛ, даже если они не набирают лабораторные критерии для диагноза АФС, лечение антикоагулянтами не отличается от ведения больных с тромбозами, не связанными с аФЛ [7,8]. Обычно вначале назначаются гепарины: нефракционированный (обычный), или низко-молекулярные , или пентасахариды, с последующим переводом на приём антагонистов витамина К (АВК) (варфарин).
2. Рекомендовано больным с определённым АФС и первым венозным тромбозом назначение антагонистов витамина К (АВК) с целевым значением международного нормализованного отношения (МНО) в пределах 2,0-3,0 (уровень доказательства 1В)
Комментарии. В двух клинических исследованиях [9,10] было показано, что высоко-интенсивный уровень (МНО>3,0) гипокоагуляции не превосходит стандартный уровень (МНО 2,0-3,0) в профилактике рецидива тромбоза и ассоциировался с более частыми геморрагическими осложнениями. В одной из работ [11] по сравнению двух режимов высоко-интенсивного и стандартного, было показано что высокая интенсивность гипокоагуляции ассоциировалась с высокой частотой кровотечений, но и парадоксально с более частыми тромбоэмболическими осложнениями, что видимо, связано с частой флюктуацией МНО.
В двух клинических исследованиях [9,10] было показано, что высоко-интенсивный уровень (МНО>3,0) гипокоагуляции не превосходит стандартный уровень (МНО 2,0-3,0) в профилактике рецидива тромбоза и ассоциировался с более частыми геморрагическими осложнениями. В одной из работ [11] по сравнению двух режимов высоко-интенсивного и стандартного, было показано что высокая интенсивность гипокоагуляции ассоциировалась с высокой частотой кровотечений, но и парадоксально с более частыми тромбоэмболическими осложнениями, что видимо, связано с частой флюктуацией МНО.
3. Пациенты с определённым АФС и артериальными тромбозами должны получать варфарин с целевым значением МНО > 3,0 или комбинировать с низкими дозами аспирина (МНО 2,0-3,0). (Уровень доказательства не градуирован в связи с отсутствием согласия.) Некоторые члены комиссии полагают, что только антиагреганты (аспирин или клопидогрель) или АВК с целевым МНО 2,0-3,0 будут одинаково обоснованы в этих ситуациях)
Комментарии. В ретроспективном исследовании [12] было отмечено, что ни аспирин в низких дозах, ни антагонисты витамина К с достижением стандартной (средне-интенсивной степени) гипокоагуляции не были эффективны для вторичной тромбопрофилактики у больных с аФЛ и артериальными тромбозами. Другое проспективное двухгодичное исследование [13] не отметило различий в ответе ни на аспирин, ни на антикоагулянты у больных с инсультами аФЛ позитивных и негативных. Однако это исследование не может быть экстраполировано на популяцию больных с инсультами и достоверным АФС, уровни аФЛ были исследованы вначале включения в исследование, что могло привести к включению пациентов с транзиторно позитивными аФЛ. Различия в интенсивности гипокоагуляции обсуждаются последние 10 лет. В системном обзоре [7] было сделано заключение: для достоверного АФС высокий риск рецидива отмечался при стандартной гипокоагуляции, рецидив тромбоза был реже при МНО > 3,0. Сверх того, смерть из-за кровотечений была намного реже, чем смерть из-за тромбоза [7].
В ретроспективном исследовании [12] было отмечено, что ни аспирин в низких дозах, ни антагонисты витамина К с достижением стандартной (средне-интенсивной степени) гипокоагуляции не были эффективны для вторичной тромбопрофилактики у больных с аФЛ и артериальными тромбозами. Другое проспективное двухгодичное исследование [13] не отметило различий в ответе ни на аспирин, ни на антикоагулянты у больных с инсультами аФЛ позитивных и негативных. Однако это исследование не может быть экстраполировано на популяцию больных с инсультами и достоверным АФС, уровни аФЛ были исследованы вначале включения в исследование, что могло привести к включению пациентов с транзиторно позитивными аФЛ. Различия в интенсивности гипокоагуляции обсуждаются последние 10 лет. В системном обзоре [7] было сделано заключение: для достоверного АФС высокий риск рецидива отмечался при стандартной гипокоагуляции, рецидив тромбоза был реже при МНО > 3,0. Сверх того, смерть из-за кровотечений была намного реже, чем смерть из-за тромбоза [7].
4. Оценка риска кровотечения у больного должна быть выполнена до назначения высокой степени гипокоагуляции или комбинирования антикоагулянтов и антиагрегантов (Уровень доказательства не градуирован)
5. Пациенты без СКВ с одним эпизодом инсульта, не связанного с кардиоэмболическим механизмом, с профилем аФЛ низкого риска тромбоза и наличием обратимых провоцирующих факторов могут отдельно считаться кандидатами для назначения антитромбоцитарных препаратов (Уровень доказательства не градуирован)
6. Больные с достоверным АФС и тромбозами должны длительно (пожизненно) получать антитромботическую терапию (уровень доказательства 1С)
7. Больным с одним случаем венозного тромбоза с профилем аФЛ низкого риска и известными преходящими преципитирующими факторами антикоагулянтная терапия может быть лимитирована в пределах 3-6 месяцев (Уровень доказательства не градуирован)
8. Пациентам с аФЛ, но без СКВ и без предшествующих тромбозов при профиле аФЛ высокого риска рекомендована долгосрочный приём низких доз аспирина, особенно при наличии других факторов риска тромбоза (уровень доказательства 2С)
Пациентам с аФЛ, но без СКВ и без предшествующих тромбозов при профиле аФЛ высокого риска рекомендована долгосрочный приём низких доз аспирина, особенно при наличии других факторов риска тромбоза (уровень доказательства 2С)
Комментарии. Первичная профилактика тромбоза должна проводиться у больных СКВ с аФЛ или с классическими кардиоваскулярными факторами риска, хотя эффективность аспирина в этих случаях оспаривается, преимущественно у больных без СКВ [14,15,16,17,18]
9. Больным СКВ с положительным ВА или стойко позитивными аКЛ в средних или высоких уровнях рекомендуется первичная тромбопрофилактика гидроксихлорохином (ГХ) (уровень доказательства 1В, некоторыми членами специальной комиссиb поддержан уровень доказательности 2В для использования ГХ) и низкие дозы аспирина (уровень доказательства 2В)
Комментарии. ГХ кроме противовоспалительного действия , обладает антитромботическим эффектом ингибируя агрегацию тромбоцитов и высвобождение арахидоновой кислоты из активированных тромбоцитов [18].
10. Всем носителям аФЛ рекомендована тромбопрофилактика в ситуациях высокого риска тромбоза, таких как хирургические вмешательства, длительная иммобилизация и послеродовый период (уровень доказательства 1С)
11. У всех больных с профилем аФЛ высокого риска следует контролировать кардиоваскулярные факторы независимо от наличия предшествующих тромбозов, сопутствующей СКВ, или дополнительных АФС проявлений (уровень доказательства не градуирован)
Комментарии. Больные АФС часто имеют другие дополнительные кардиоваскулярные факторы риска такие как: гипертензия, курение, гиперхолестеринемия, приём оральных контрацептивов [19,20,22,23].В исследовании случай-контроль [24] риск инсульта удваивался у курящих женщин с ВА, по сравнению с некурящими; использование контрацептивов увеличивало риск развития инсультов в 7 раз. В этом исследовании все женщины с инфарктом миокарда были курящими во время его развития.
Клинические рекомендации при акушерской патологии АФС
Акушерская патология одна из крупных аспектов АФС и является критериальным признаком диагностических критерий АФС [1,2,3,25]. Акушерская патология АФС включает материнские тромбозы, рецидивирующие спонтанные аборты до 10 недель гестации, поздние нежелательные исходы беременности (например: внутриутробная гибель плода, преэклампсия, плацентарная недостаточность, задеожка внутриутробного развития плода, преждевременные роды). Даже при проведении оптимальной терапии согласно существующим рекомендациям неблагоприятные исходы у женщин с АФС до сих пор варьируют в пределах 20-30% случаев [27,28].
1. Тромбопрофилактика у бессимптомных аФЛ-позитивных женщин при ведении беременности и послеродовом периоде следует проводить согласно риск-стратифицированного подхода. (уровень доказательства не градуирован)
2. Гидроксихлорохин рекомендуется для первичной тромбопрофилактики у беременных бессимптомных аФЛ-позитивных женщин, особенно на фоне заболеваний соединительной ткани (уровень доказательства не градуирован) (уровень доказательства не градуирован) [29].
3. При возникновении ситуаций высокого риска тромбоза (периоперативный период, длительная иммобилизация) рекомендуются профилактические дозы гепарина для бессимптомных аФЛ-позитивных женщин [30]
Комментарии. Необходимость тромбопрофилактики у женщин с аФЛ при отсутствии тромботических осложнений в анамнезе остаётся спорной среди экспертов. Прекращение курения и снижение индекса массы тела при его высоком уровне является одним из важных условий профилактики тромбоза у этих женщин [3]. Мнение экспертов было единогласным о высоком риске тромбоза в этой группе при приёме оральных контрацептивов. Некоторыми экспертами предложено сочетание их приёма с антикоагулянтами, но протромботический риск может перевешивать положительные моменты контрациптивов. Учитывая риск нежелательных явлений антикоагулянтов, большинство экспертов не согласны с продолжением приёма варфарина в послеродовом периоде у аФЛ-позитивных, но без клинических проявлений больных. В отношении приёма низких доз аспирина также мнение экспертов противоречиво. Это основано на заключениях двух рандомизированных исследований, где одно отметило успешное завершение беременности в этой группе женщин на фоне низких доз аспирина [31], второе – отметило неэффективность его в тромбопрофилактике [32]. Однако большинство работ подтверждают при аФЛ профиле высокого риска тромбоза профилактические дозы гепарина показаны.
Это основано на заключениях двух рандомизированных исследований, где одно отметило успешное завершение беременности в этой группе женщин на фоне низких доз аспирина [31], второе – отметило неэффективность его в тромбопрофилактике [32]. Однако большинство работ подтверждают при аФЛ профиле высокого риска тромбоза профилактические дозы гепарина показаны.
4. Гепарины (нефракционированный или низко молекулярные) с или без низких доз аспирина рекомендуется для ведения беременных женщин с АФС (уровень доказательства 1с).
Одобрено рекомендацией EULAR при ведении беременных женщин с СКВ и АФС [33]. Эффективность гепарина у женщин с АФС является доказанной и этому уделено большое внимание в литературе, на самом деле, в настоящее время отмечается его назначение беременным женщинам, у которых причина потери предыдущей неизвестна [34,35] . Кохрановский системный обзор и мета-анализ позволили сделать заключение, что применение нефракционного гепарина и аспирина снижало частоту потерь беременности до 54% у женщин с аФЛ и предыдущей акушерской патологией [36]. Информации о преимуществе низко молекулярных гепаринов над нефракционном гепарином в сочетании с аспирином недостаточно. В двух малых исследованиях была показана схожесть обоих гепаринов у беременных с аФЛ [37,38].
Информации о преимуществе низко молекулярных гепаринов над нефракционном гепарином в сочетании с аспирином недостаточно. В двух малых исследованиях была показана схожесть обоих гепаринов у беременных с аФЛ [37,38].
5. Вторичная профилактика тромбоза у женщин с АФС в послеродовом периоде пожизненная, с назначением антагонистов витамина К и поддержанием уровня гипокоагуляции от 2,0 до 3,0 — при венозных тромбозах и выше 3,0 – при артериальных . (уровень доказательства 1В)
6. Катастрофическая микроангиопатия во время беременности или в послеродовом периоде обычно включает эффективную антикоагулянтную терапию и в/в введение глюкокртикоидов (ГК) ± плазмаферез с последующим введением одногруппной свежезамороженной плазмы и в/в введение человеческого иммуноглобулина в зависимости от клинической ситуации.
В послеродовом периоде при резистентных формах имеются единичные сообщения об эффективности генно-инжинерной терапии (ритуксимаб, ингибиторы комплементаб анти-ФНО ингибиторы) [39,40,41].
Клинические рекомендации при катастрофическом антифосфолипидном синдроме (КАФС).
КАФС характеризуется вовлечением в патологический процесс многих органов за короткий период времени. Гистологическая картина проявляется наличием окклюзии мелких сосудов и лабораторными маркёрами в крови являются антифосфолипидные антитела (аФЛ) [42,43]. С точки зрения патофизиологии, КАФС – тромботическая микроангиопатия, характеризующаяся диффузной тромботической микроваскулопатией [44]. И хотя, частота КАФС составляет 1% из всех случаев АФС, они обычно представляют собой жизненно-угрожающие состояния в 30-50% случаев со смертельным исходом [44].
Предварительные классификационные диагностические критерии КАФС с диагностическим алгоритмом были разработаны в 2003г [43]. Для улучшения алгоритма и более точной диагностики КАФС был разработан пошаговый подход алгоритма КАФС [45]. В этот алгоритм был включен предшествующий анамнез наличия АФС или постоянная позитивность по аФЛ, число вовлечённых органов, время исхода, наличие микротромбозов по данным биопсии и другие данные, позволявшие объяснить причину множественных тромбозов.
Информация, основанная на доказательной базе, приводится в четырёх ретроспективных исследованиях, анализировавших КАФС регистр [46,47,48,49]. Наиболее важные заключения по терапии КАФС сводятся к следующим выводам:
1. Высокий уровень выздоровления достигается при комбинации антикоагулянтов (АК) с ГК плюс плазмаобмен (плазмаферез (ПФ) (77,8% против 55,4% при отсутствии подобной комбинации р=0,083), следующей за антикоагулянтной терапией плюс ГК, плюс ПФ и/или в/в иммуноглобулин (69% против 54,4% при отсутствии подобной комбинации р=0,089).
2. Изолированнное использование ГК было связано с низким уровнем выздоровления (18,2% против 58,1% эпизодов не леченных ГК).
3. Использование циклофосфамида (ЦФ) улучшало выживаемость больных КАФС на фоне СКВ [47].
4. Уровень смертности уменьшился с 53% у больных с КАФС до 2000 года до 33,3% у тех, кто перенёс КАФС с 2001 до февраля 2005г (р=0,005 , отношение шанса (ОШ) 2,25; 95% конфиденциальный интервал (КИ) 1,27-3,99) [46]. Главным объяснением подобного снижения уровня смертности было комбинированное применение АК+ГК+ПФ и/или в/в иммуноглобулин.
Главным объяснением подобного снижения уровня смертности было комбинированное применение АК+ГК+ПФ и/или в/в иммуноглобулин.
Исходя из вышеперечисленных выводов, в терапевтическую стратегию КАФС рекомендуется включение идентификации и лечения любых сопутствующих факторов риска тромбоза (в первую очередь инфекций) и в терапии КАФС рекомендована комбинация АК с ГК плюс ПФ и/или в/в человеческий иммуноглобулин. При развитии КАФС на фоне СКВ в/в введение ЦФ [47] может быть рекомендовано при отсутствии противопоказаний и, особенно, при наличии других клинических проявлений СКВ.
Данные Международного регистра КАФС не дал ответы на спорные и неизвестные стороны этого варианта АФС. Первый и возможно наиболее важным неизвестным моментом является почему незначительное число больных с аФЛ развивают полиорганную недостаточность, называемого КАФС. Кроме того, распределение по возрасту, полу, связи с СКВ, профилю аФЛ у больных классическим АФС и КАФС схож [42]. С патофизиологической точки зрения КАФС является тромботическим микроангиопатическим состоянием, характеризующийся диффузной тромботической микроваскулопатией. Подобные патологические находки могут быть представлены и в других состояниях таких как тромботическая тромбоцитопеническая пурпура (ТТП), гемолитико-уремический синдром (ГУС), злокачественной гипертензии, HELLP –синдроме, послеродовой почечной недостаточности и преэкласмпсии. Тромботическая микроангиопатия, сопровождающаяся наличием аФЛ в крови, описывается во всех выше перечисленных состояниях, приводя к концепции «микроангиопатического антифосфолипид-ассоциированного синдрома» [50] и приводя к диагностическим поискам. Однако источник и патогенетический потенциал аФЛ в этих состояниях остаётся неизвестным; предполагается, что аФЛ могут вызывать пертурбацию и повреждение эндотелиальных клеток, что прводит к катастрофически исходом [51]. Ещё одним важным моментом должно быть идентификация АФС пациентов с высоким риском развития КАФС. Выявление и лечение преципитирующих факторов для предотвращения развития катастрофических эпизодов у больных с аФЛ является существенным [52]. Прекращение приёма антикоагулянтов или низкое медународное нормализованное отношение (МНО) было одним из подобных факторов у 8% больных с катастрофическими эпизодами [53], тем не менее доктора лечащие пациентов с АФС должны быть особенно внимательны в клинических ситуациях, когда приём антикоагулянтов следует прекратить, например при хирургических вмешательствах [54]. Дискуссия по этому вопросу продолжается из-за отсутствия рандомизированных контролируемых исследований. Вопросы касаются наиболее приемлемого гепарина (фракционированного или низкомолекулярного гепарина) оптимальное значение МНО после КАФС, начальные дозы ГК и темп их снижения, эффективный протокол проведения ПФ, типы растворов при плазмаобмене, а также дозы и длительность в/в человеческого иммуноглобулина являются объектами будущих исследований [55].
Экспертной комиссией в рамках Международного Конгресса по аФЛ рекомендовано [3] при КАФС:
· Использование нефракционированного или низкомолекулярного гепарина в лечебных дозах как можно быстрее. После острой фазы больные КАФС должны продолжить антикоагулянтную терапию пожизненно для профилактики рецидива тромбоза. При использовании АВК уровень гипокоагуляции остаётся спорным: средне-интенсивный уровень (МНО от 2,0до 3,0) или высоко-интенсивный (выше 3,0). Большинство экспертов склонны к рекомендации высокой степени гипокоагуляции.
· Раннее подключение к терапии ГК, но начальная доза вариабельна.
Комментарии. По мнению всех экспертов жизненно угрожающие состояния (такие как респираторный дисстресс синдром, ГУС) являются показанием для в/в пульс терапии метилпреднизолоном в течении 3-5 дней до стабилизации состояния с последующим переходом на пероральный приём из расчёта 1мг на кг веса
· При отсутствии ответа на вышеперечисленную терапию подключение ПФ с замещением одногруппной свежезамороженной плазмой или плюс в/в человеческий иммуноглобулин (уровень доказательства 2В)
· При отсутствии ответа подключение экспериментальной терапии , включающая введение генно-инжинерных препаратов (ритуксимаб (В-клеточная терапия), экулизумаб (eculizumab — моноклональные антитела против белка С5 компонента комплемента) (уровень доказательства отсутствует)
Комментарии. Отсутствуют доказательства о подключении антибиотиков для профилактики инфекции при иммуносупрессивной терапии КАФС, при отсутствии явных признаков инфекции (мнение экспертов противоречиво). Классификация больных КАФС по подгруппам по провоцирующим факторам или сопутствующим факторам показана. Для стратификации состояния больного рекомендовано использавание шкалы APACHE II, как наиболее валидированную в реаниматологии.
Клинические рекомендации при не критериальных проявлениях АФС
Некоторые проявления, такие как: тромбоцитопения, сетчатое ливедо, поражение клапанов сердца, почечная нефропатия на фоне серологических маркёров АФС могут быть в дебюте заболевания. В настоящее время наличие какого-то из перечисленных признаков с повышенными уровнями аФЛ при отсутствии другого заболевания верифицируется как «преАФС» или вероятный АФС [56]. Нет доказательной базы по ведению подобных больных, однако экспертами по аФЛ рекомендовано [3,26]:
· Тромбоцитопения (клинически значимая). Глюкокртикоиды, ритуксимаб, в/в человеческий иммуноглобулин при резистентности спленэктомия
· Патология клапанов сердца. Антикоагулянты (при мерцательной аритмии или наличия других факторов риска тромбоза с учётом профиля риска аФЛ)
· Нефропатия. Антикоагулянты и ингибиторы ангиотензин конвертирующего фермента
· Когнитивные нарушения . Нет данных по ведению.
Клинические рекомендации при рефрактерном АФС
Несмотря на проведение антикоагулянтной терапии варфарином с поддержанием средне-интенсивного уровня гипокоагуляции (2,0-3,0) и даже высокого уровня (выше 3,0) у некоторых больных отмечаются рецидивы тромбозов [57]. В рекомендациях сформулированных экспертами 13-го Междунароного Конгресса по аФЛ [8] подобным больным альтернативой длительного приёма варфарина предлагаются низкомолекуляные гепарины. В одном из исследований было показано, что больные получавшие длительно подобную терапию не имели рецидива тромбоза [58]. В тоже время все антикоагулянты, используемые многие годы, имеют ряд побочных действий и далеки от “идеальных” антикоагулянтов. Предполагается, что новые антикоагулянты с селективной точкой приложения на факторы свёртывания будут более эффективными и безопасными по сравнению с гепаринами и варфарином. Эти новые препараты в настоящее время одобренные или, находящиеся в испытании, для лечения и профилактики венозного тромбоэмболизма действуют непосредственно на активный участок тромбина (прямой ингибитор тромбина) – дабигатран этемзилат, и прямые ингибиторы фактора Ха: ривароксабан, апиксабан, эндоксабан и бетриксабан [59]. Проведение рандомизированных контролируемых исследований по лечению АФС этими препаратами экспертами считается целесообразным [57]. Подключение в лечение подобных больных с АФС гидроксихлорохина и статинов считается оправданным [8].
по последнему слову техники
Реферат
Акушерские осложнения — отличительная черта антифосфолипидного синдрома. Рецидивирующий выкидыш, ранние роды, маловодие, недоношенность, ограничение внутриутробного развития, дистресс плода, тромбоз плода или новорожденного, преэклампсия / эклампсия, HELLP-синдром, артериальный или венозный тромбоз и плацентарная недостаточность являются наиболее серьезными осложнениями, связанными с APS, для беременных женщин. Антифосфолипидные антитела способствуют активации эндотелиальных клеток, моноцитов и тромбоцитов, вызывая перепроизводство тканевого фактора и тромбоксана А2.Активация комплемента может иметь центральную патогенетическую роль. Эти факторы, связанные с типичными изменениями в системе гемостаза при нормальной беременности, приводят к состоянию гиперкоагуляции. Это является причиной тромбоза, который, как предполагается, вызывает многие осложнения беременности, связанные с APS. Акушерский уход основан на комбинированном акушерско-медико-акушерском управлении и лечении с применением аспирина и гепарина. Этот обзор направлен на определение современного состояния APS путем изучения достижений знаний последних лет, чтобы обеспечить наиболее подходящее диагностическое и терапевтическое лечение беременных женщин, страдающих этим синдромом.
Ключевые слова: Антифосфолипид, тромбофилия, гиперкоагуляция, тромбопрофилактика
Введение
Антифосфолипидный синдром (АФС) — это аутоиммунное тромбофильное состояние, которое характеризуется наличием в крови фосфолипидных белков, которые скорее распознают и распознают в крови антитела. чем сам фосфолипид (1). Клинические проявления APS включают тромбоз сосудов и осложнения беременности (2), особенно повторяющиеся самопроизвольные выкидыши и, реже, тромбоз матери (3).Возможны многие другие клинические проявления (4, 55).
Наличие одного только антифосфолипидного антитела (aPL) при отсутствии типичных клинических осложнений не указывает на диагноз APS; Существуют длительно бессимптомные пациенты с aPL-положительным статусом. При диагностировании у пациентов с основным аутоиммунным заболеванием (обычно системной красной волчанкой или СКВ) APS называют вторичным APS; у здоровых людей это называется первичным АФС. Катастрофический антифосфолипидный синдром (CAPS) представляет собой тяжелый конец спектра множественных тромбозов органов за короткий период времени.Мультиорганная недостаточность была описана во время беременности Эшерсоном (6) и послеродовым периодом Коченуром (7).
Клинический спектр этого синдрома расширился (8, 9), благодаря значительному прогрессу в изучении его патогенеза и клинического ведения за последние несколько лет.
Материалы и методы
В этой работе мы стремились предложить современный взгляд на основные патофизиологические, клинические, диагностические и терапевтические достижения в области антифосфолипидного синдрома.
Литературный поиск проводился с 2006 по 2011 год, уделяя больше внимания последним исследованиям. База данных PubMed использовалась с терминами медицинских предметных заголовков «антифосфолипидный синдром» ИЛИ «антитела, антифосфолипиды» ИЛИ «волчаночный антикоагулянт». Был проведен поиск в Кокрановской базе данных систематических обзоров по ключевому слову «антифосфолипид». Мы получили дополнительные статьи из справочных разделов выбранных рукописей. Мы уделили особое внимание систематическим обзорам, рандомизированным клиническим испытаниям, согласованным документам и обзорным статьям, посвященным диагностике и терапии антифосфолипидного синдрома.Были также включены более старые статьи, чтобы привлечь внимание к патогенетическим, клиническим и эпидемиологическим вопросам.
Обсуждение
Этиология и патогенез
Как и другие аутоиммунные заболевания, APS не имеет известной этиологии. Существует несколько гипотез, объясняющих возможную причину (10):
Пассивный перенос материнских антител опосредует аутоиммунные нарушения у плода и новорожденного. Механизм избыточной продукции аутоантител и образования иммунных комплексов не совсем понятен, хотя текущие исследования сосредоточены на аномальных функциях регулятора и возможности медленной вирусной инфекции.
Сообщалось о семейном возникновении aPL, и предполагаемые генетические ассоциации включают HLA-DR4, DR7, DRw53 и нулевой аллель C4 (11).
Молекулы PL вездесущи по своей природе и присутствуют на внутренней поверхности клетки и в микроорганизмах. Следовательно, при инфекционных заболеваниях, включая вирусные (например, ВИЧ, вирус Эпштейна-Барра [EBV], цитомегаловирус [CMV], аденовирусы), бактериальные (например, бактериальный эндокардит, туберкулез, микоплазменная пневмония), спирохетальные (например, сифилис, лептоспироз). , Болезнь Лайма) и паразитарные (например, малярийная инфекция), разрушение клеточных мембран может происходить во время повреждения клеток.PL высвобождают и стимулируют антитела к aPL.
Антифосфолипидные антитела можно в целом разделить на те антитела, которые продлевают фосфолипид-зависимые анализы коагуляции, известные как волчаночные антикоагулянты (LA) или антикардиолипиновые антитела (aCL), которые нацелены на молекулярный конгенер кардиолипина (сердечный белок крупного рогатого скота). Волчаночные антикоагулянты (LA) снижают коагулянтный потенциал плазмы и увеличивают время свертывания в тестах на коагуляцию, основанных на активированном частичном тромбопластиновом времени (12).
Консенсусные рекомендации рекомендуют скрининг на LA с помощью 2 или более тестов на фосфолипид-зависимую коагуляцию (13). Антикоагулянтная терапия может помешать выявлению ЛА (14). Антикардиолипиновые антитела (aCL) обладают общей аффинностью связывания in vitro с кардиолипином и могут быть обнаружены с помощью иммуноферментных анализов. Тесты иммуноферментного анализа на aCL плохо стандартизированы, а тестирование aCL показало плохое соответствие между лабораториями (12). И LA, и aCL могут демонстрировать специфичность в отношении 2-гликопротеина I (2GPI) (15, 16).Фактически, даже если описаны многие другие антигенные мишени, включая белки C и S, протромбин (17) и аннексин V (18), основным антигеном, распознаваемым аутоантителами к фосфолипидам (aPL), является 2-гликопротеин I, также известный как аполипопротеин H, член суперсемейства белка контроля комплемента или короткого консенсусного повтора (SCR). Белок имеет форму рыболовного крючка и связывается с анионными фосфолипидными бислоями через катионные и гидрофобные аминокислоты в пятом из его 5 SCR-доменов, около карбоксиконца (19).Недавние данные показали, что субнабор антител против aPL ( Anti-2-гликопротеин I антител ) (20, 21), связанных с повышенным риском тромбоза и эмболии, распознает эпитоп в домене I 2GPI, который состоит из Gly40-Arg43. (22, 23). Было высказано предположение, что опосредованная антителами димеризация и пентамеризация 2GPI увеличивают аффинность / авидитность иммунных комплексов антитело-2GPI к фосфолипиду и что это увеличение может быть ответственно за патогенные эффекты антител против aPL (23).Лабораторный анализ этих антител не стандартизирован, что затрудняет сравнение исследований (16). Есть некоторые свидетельства того, что эти антитела более специфичны для APS (24).
Антифосфолипидные антитела с активностью против 2-гликопротеина-1 действуют по множеству механизмов (25, 26):
—
APL активируют эндотелиальные клетки (27), и они экспрессируют молекулы адгезии (такие как молекула межклеточной адгезии 1, молекула адгезии сосудистых клеток-1, Е-селектин) и (подобно моноцитам) повышают выработку тканевого фактора (28).
—
APL активирует моноциты и индуцирует их повышенную экспрессию тканевого фактора (29).
—
APL активирует тромбоциты, которые увеличивают экспрессию гликопротеина 2b-3a и синтез тромбоксана A2. Активация эндотелиальных клеток, моноцитов и тромбоцитов антифосфолипидными антителами, что ведет к усиленному синтезу тканевого фактора и тромбоксана A2. вызывают прокоагулянтное состояние (30, 31).
—
Активация каскада комплемента может закрыть петлю7 и спровоцировать тромбоз и потерю плода (32-35).Часто это происходит при втором ударе (36). Традиционные факторы риска сердечно-сосудистых заболеваний, такие как табак, воспаление или эстрогены, могут играть важную роль на этом этапе, на самом деле такие факторы риска присутствуют более чем у 50% пациентов с антифосфолипидным синдромом. Чтобы подтвердить роль комплемента, исследования показывают, что фрагменты C4d и C3b откладываются в плаценте пациентов с антифосфолипидным синдромом (37).
—
Кроме того, взаимодействие антифосфолипидных антител с белками, участвующими в регуляции свертывания, такими как протромбин, фактор X, протеины C и S (38) и плазмин (39), ингибитор пути тканевого фактора (40), может препятствуют инактивации прокоагулянтных факторов и препятствуют фибринолизу (28, 36).
Взаимодействие с аннексином А5, природным антикоагулянтом, который связывается с фосфатидилсерином, воздействующим на формирование синцития трофобласта, может способствовать более прямому воздействию на структуры плаценты, способствуя тромбозу плаценты и потере плода (18, 28, 41).
В качестве доказательства того, что тромбоз является причиной многих акушерских осложнений, были описаны нарушения плацентации при невынашивании беременности, связанные с антифосфолипидными антителами (42). 2-гликопротеин 1 напрямую связывается с культивируемыми клетками цитотрофобласта и впоследствии распознается антителами к 2-гликопротеину 1 (43).Более того, антифосфолипидные антитела могут вызывать воспалительный ответ, опосредованный путем TLR4 / MyD88, что приводит к повреждению трофобласта (44).
Эпидемиология aPL
Сообщалось, что распространенность aCL и LAC в нормальных здоровых популяциях колеблется от 1,0% до 5,6% и от 1,0% до 3,6%, соответственно (45–47). Распространенность повышенных антител к aPL также может увеличиваться с возрастом (48). Около одной трети пациентов с СКВ имеют aCL-положительный результат. Распространенность ЛП у пациентов с СКВ составляет около 15%.Положительный LA более специфичен для APS, чем повышенный aCL. Сила связи между aPL и тромбозом варьируется. В первую очередь, aCL не являются таким сильным фактором риска тромбоза, как LA. Волчаночный антикоагулянт неизменно является наиболее сильным предиктором тромбоза (49–51).
Около 40% пациентов с системной красной волчанкой имеют антифосфолипидные антитела (52), но менее 40% из них в конечном итоге будут иметь тромботические события (49, 53). Однако тромботический антифосфолипидный синдром считается основным неблагоприятным прогностическим фактором у пациентов с волчанкой (53).Важны титр и изотип: aCL IgG сильнее связаны с клиническими проявлениями, чем aCL IgM, и риск тромбоза увеличивается с более высокими титрами (> 40 U). Иммуноглобулин A aCL и низкие титры IgG и IgM aCL реже связаны с осложнениями (54).
APL составляют значительную долю тромбозов в общей популяции (55-57).
Наличие дополнительных факторов протромботического риска у aPL-положительных лиц, вероятно, влияет на риск тромбоза.Согласно принятой в настоящее время гипотезе «второго удара», второе триггерное событие — например, курение сигарет, оральные контрацептивы, хирургические процедуры, длительная иммобилизация или генетическое протромботическое состояние — может повысить вероятность того, что у пациента с положительным АФЛ развивается сосудистая патология. мероприятие. Женщины, у которых только наступила беременность, имеют высокую вероятность развития тромбоза в более поздние годы (58).
Диагностика APS
Критерии
В 1998 г. предварительные критерии классификации антифосфолипидного синдрома были предложены в Саппоро, Япония (60).Для классификации этого синдрома необходимо наличие по крайней мере одного клинического проявления вместе с положительными тестами на циркулирующие антифосфолипидные антитела, включая волчаночный антикоагулянт или антикардиолипин, или и то, и другое, при средних или высоких значениях, обнаруживаемых не менее двух раз в течение 6 недель. В 2006 г. критерии классификации были обновлены (61) и перечислены в таблице.
Таблица 1
— Краткое изложение Сиднейского консенсуса по критериям классификации расследований для APS (61).
По существу, клинические критерии остались неизменными; однако были внесены два важных изменения: время, прошедшее между двумя положительными определениями, было увеличено до 12 недель, чтобы гарантировать обнаружение только стойких антител; и анти-2-гликопротеин 1, как IgG, так и IgM, были добавлены к лабораторным критериям.Средние титры антикардиолипина или анти-2-гликопротеина 1 были определены как более 40 GPL или MPL или выше 99-го процентиля. Примечательно, что изотипы IgA, антипротромбиновые антитела и антитела, направленные против фосфатидилсерин-протромбинового комплекса, остались исключенными из критериев. Эти модификации подверглись критике (63), и дискуссия о клинических последствиях различных антифосфолипидных антител все еще остается открытой.
Вы можете распознать различные типы APS. См. Таблицу.
Таблица 2
— Типы пациентов, у которых есть антифосфолипидные (aPL) антитела.
Обзор лабораторных тестов
Лабораторные тесты, которые часто используются для диагностики этого состояния, показаны в таблице.
Таблица 3
— Тесты, используемые для диагностики антифосфолипидного синдрома.
Первым тестом, который идентифицировал это состояние, был тест на биологический ложноположительный (BFP) сифилис, который фактически сообщил о распознавании аутоантителами фосфолипид-связывающих белков, в первую очередь 2GPI (в отличие от истинно-положительных тестов на сифилис, в которых антитела распознают фосфолипид напрямую).Тест на сифилис BFP был сначала доработан до количественного иммуноанализа на антикардиолипин (64), а затем включал иммуноанализы, в которых использовались другие фосфолипиды, такие как фосфатидилсерин, и иммуноанализы, которые выявляли антитела против предполагаемых антигенов, в первую очередь 2GPI. Второй способ диагностического тестирования, проводимого для тестов, которые сообщают о влиянии на фосфолипид-зависимые реакции коагуляции, вызывая увеличенное время свертывания крови с помощью любого из следующих тестов: активированное частичное тромбопластиновое время (АЧТВ), разбавленное время яда гадюки Рассела (dRVVT), каолин время свертывания, время свертывания плазмы.Это продление должно быть подтверждено смешиванием исследований с нормальной плазмой (время свертывания остается увеличенным с LA) или тестом нейтрализации тромбоцитов.
Высокоаффинные (авидные) комплексы фосфолипид-связывающее антитело-кофакторфосфолипид являются вероятной основой феномена LA. Оба подхода — иммуноферментный анализ и исследование LA — можно рассматривать как эмпирически полученные суррогатные тесты для синдрома. Чувствительность и специфичность тестов различны, и один отрицательный тест не может исключить диагноз пациента.Обычно рекомендуется провести ряд тестов, чтобы попытаться исключить диагноз. Специфический ELISA для антител, направленных против домена 1 2-гликопротеина, является одним из новых ожидаемых тестов, которые потребуют оценки (65).
Наличие более одного класса антифосфолипидных антител увеличивает риск тромбоза (20). Пациенты с положительными результатами всех трех основных анализов — положительный LAC, повышенный уровень антикардиолипиновых антител и повышенный уровень антител против 2GPI (так называемый «тройной положительный результат»), имеют значительно повышенный риск тромбоза (66-68) и осложнений беременности. (69).
Эти тесты бесполезны для скрининга бессимптомных общих медицинских или акушерских групп. В настоящее время тестирование на антитела к aPL обычно должно быть ограничено пациентами, у которых был тромбоз, эмболия или осложнения беременности, которые могут быть связаны с APS, и пациентами с SLE, даже если у них не было ни одного из вышеперечисленных проявлений. Всегда необходимо проводить ряд анализов.
Акушерские осложнения
Антифосфолипидный синдром вызывает несколько клинических проявлений.См. Таблицу.
Таблица 4
— Клинические проявления антифосфолипидного синдрома.
Акушерские осложнения — еще одна отличительная черта антифосфолипидного синдрома.
Риск тромбоза у женщин с антифосфолипидными антителами может быть повышен (58). Предполагается, что тромбоз является причиной многих осложнений беременности, связанных с АФС. Наиболее частым акушерским проявлением этого синдрома является повторный выкидыш. Рецидивирующий выкидыш происходит примерно у 1% населения в целом, пытающегося иметь детей (70).Около 10-15% женщин с повторным невынашиванием беременности диагностируют антифосфолипидный синдром (71, 72). Потеря плода (≥10 недель беременности) сильнее связана с АФЛ, чем потеря плода на более ранней стадии (73). Волчаночный антикоагулянт тесно связан с повторным невынашиванием беременности до 24-й недели беременности (74). В целом, примерно половина случаев потери беременности, связанной с aPL, происходит в первом триместре (преэмбриональная и эмбриональная потеря, <10 недель беременности) (75). Диагноз APS следует ставить только при трех или более последовательных потерях при отсутствии другой идентифицируемой этиологии.Двумя наибольшими факторами риска потери плода являются высокий титр aCL IgG и предыдущая потеря плода в анамнезе. У таких пациенток риск невынашивания беременности составляет до 80% (76). Как IgG, так и IgM антикардиолипины связаны с повышенным риском выкидыша, хотя и в меньшей степени, чем волчаночный антикоагулянт (74). Клиническая значимость антител против 2-гликопротеина I также не ясна; в трех систематических обзорах (16, 50, 74). у других эти антитела не были связаны ни с тромбозом, ни с повторным ранним выкидышем (23, 77, 78).они показали повышенный риск акушерских осложнений и тромбозов. Также риск потери плода среди бессимптомных женщин, у которых есть антифосфолипидные антитела, по-видимому, повышен (58, 79-82). Хотя гибель плода связана с антифосфолипидным синдромом (83), общий вклад этого синдрома неясен, отчасти из-за влияния других возможных способствующих факторов, таких как лежащая в основе гипертония или ранее существовавшие сопутствующие заболевания, такие как системная красная волчанка или заболевание почек. .
Акушерские проявления APS не ограничиваются потерей плода (8, 58,75, 84-86). Текущие критерии APS включают ранние роды, маловодие, неонатальные осложнения (такие как недоношенность оценивается в 30-60% и чаще встречается у пациентов с СКВ, задержка внутриутробного развития — IUGR -, дистресс плода (60) и редко тромбоз плода или новорожденного) (87 ), сопутствующие акушерские осложнения у матери (такие как преэклампсия / эклампсия и HELLP-синдром — гемолитическая анемия, повышенные ферменты печени и низкое количество тромбоцитов, артериальный или венозный тромбоз) и другие осложнения, связанные с aPL (плацентарная недостаточность) (75).Связь между антифосфолипидными антителами и риском преждевременных родов из-за эклампсии или преэклампсии и ограничения внутриутробного развития остается спорной; исследования, предоставляющие данные в этой области, как правило, небольшие, ретроспективные и дают противоречивые результаты (88, 89). Кроме того, токсичность методов лечения, оцениваемых в этих исследованиях, может способствовать потере или осложнению беременности и может затруднять связь между антифосфолипидными антителами и неблагоприятными исходами беременности (90).
Скрининг здоровых беременных не показан (91).
Хотя и aCL, и LA предсказывают потерю плода, соответствие неполное, поэтому при подозрении на APS необходимо провести тестирование обоих. Другие APL не так полезны для прогнозирования риска. Фактически, антитела, направленные против других фосфолипидов, таких как антифосфатидилсерин или антифосфатидилэтаноламин, обычно не позволяют идентифицировать дополнительных пациентов (92). Неясно, добавляют ли анти-2GPI антитела значительную прогностическую ценность aCL и LA при выявлении пациентов с риском потери плода (93), хотя иногда пациенты могут иметь только эти антитела.Исключение сопутствующих условий важно у пациенток с АФЛ-положительными заболеваниями во время беременности.
Гинекологические состояния могут включать аномалии матки, гормональный дисбаланс (например, дефект лютеиновой фазы), аномалии материнского и отцовского кариотипа или генетические аномалии плода. Кроме того, наличие наследственного прокоагулянтного состояния, такого как фактор V Лейдена, может имитировать APS (94).
Тяжелым осложнением беременности, которое значительно увеличивает риск АФС, является ВТЭ.
Беременность и послеродовой период фактически несут повышенный риск ВТЭ с частотой от 0,61 до 1,72 на 1000 родов (95, 96). По сравнению с небеременными женщинами вероятность развития ВТЭ у беременных и женщин в послеродовом периоде примерно в 4–5 раз выше (97).
Триада Вирхова описывает 3 элемента, которые способствуют развитию тромбоза: (а) застой, (б) сосудистая травма и (в) гиперкоагуляция. Все эти элементы присутствуют во время беременности и в послеродовой период.Венозный застой нижних конечностей был продемонстрирован во время беременности (98). Скорость венозного кровотока уменьшается по мере продвижения беременности и ниже в левой конечности по сравнению с правой нижней конечностью. Когда ТГВ проявляется во время беременности, он, скорее всего, находится в левой нижней конечности (9, 99). Преобладание образования сгустка левой нижней конечности может быть связано с компрессией левой общей подвздошной вены увеличивающейся беременной маткой (100). Кроме того, было продемонстрировано расширение вен, что может привести к повреждению эндотелия и протромботическим изменениям эндотелия (101).Скорость венозного кровотока в нижних конечностях увеличилась, а диаметр сосудов уменьшился между 4 и 42 днями после родов (102). Скорость и диаметр венозного кровотока вернулись к уровням, наблюдаемым на ранних сроках беременности на 42-дневном измерении (101, 102). Помимо механического сжатия вен таза, повышенный уровень циркулирующего эстрогена и местная выработка простациклина и оксида азота увеличивают емкость глубоких вен во время беременности (103). Более того, нормальная беременность сопровождается изменениями в системе гемостаза, которые могут привести к гиперкоагуляции для предотвращения кровотечения во время родов:
—
Факторы II, VII, VIII, IX, XII, и увеличение фактора фон Виллебранда (104).
—
Уровни фибриногена повышаются до уровней, которые почти в два раза выше, чем в небеременном состоянии (104, 105).
—
Снижение уровней антигена свободного и общего белка S, а также снижение активности происходит на очень ранних сроках беременности.
—
Хотя уровни протеина C остаются неизменными (104, 106), общее повышение устойчивости к активированному протеину C присутствует, причем степень устойчивости зависит от нескольких модификаторов, включая наличие лейденской мутации фактора V ( FVLM), образование тромбина и наличие антифосфолипидных антител (107).Снижается фибринолиз, в основном из-за снижения активности тканевого активатора плазминогена.
—
Другие маркеры состояния гиперкоагуляции включают увеличение комплексов тромбин-антитромбин, фрагменты протромбина 1 и 2, пиковое образование тромбина и повышенные уровни D-димера (104-106).
Во время беременности может также произойти травма сосудов в виде повреждения эндотелия из-за расширения вен (101) или может возникнуть при таких состояниях, как преэклампсия, когда присутствует активация эндотелия сосудов (108).
Во время нормальных родов может возникнуть венозное сжатие.
Считается, что оперативные и вспомогательные роды способствуют травме сосудов, а также, возможно, повышают риск тромбоза в послеродовом периоде; особенно это касается кесарева сечения.
Тестирование на антифосфолипидный синдром (с помощью волчаночного антикоагулянта, антикардиолипина и анти-2-гликопротеина I) является обычной практикой при первом эпизоде ВТЭ, поскольку пациенты с антифосфолипидным синдромом должны рассматриваться для длительной антикоагуляции (109).Важно исключить антифосфолипидный синдром, так как этот диагноз может изменить уход за беременными, а также будет показанием для применения гепарина.
Ведение и антитромботическое лечение APS во время беременности
При правильном ведении более 70% беременных женщин с антифосфолипидным синдромом родят жизнеспособного живого ребенка (110). В идеале предварительное консультирование дает врачу возможность понять конкретный контекст каждой пациентки с синдромом и обозначить риски беременности и лечения.Всем женщинам с тяжелой легочной гипертензией следует препятствовать беременности из-за высокого риска материнской смерти (111), и ее следует отложить на фоне неконтролируемой гипертензии или недавних тромботических событий, особенно инсульта (111). Перед планированием беременности должен быть доступен полный профиль антифосфолипидных антител, включая повторные антикардиолипиновые и волчаночные антикоагулянты. Однако эти тесты не нужно повторять во время беременности, поскольку последующие отрицательные результаты (после диагностических, повторно положительных тестов) не устраняют риск осложнений (111).
Пациентов следует консультировать во всех случаях относительно симптомов тромбоза и тромбоэмболии, а также информировать и часто обследовать на предмет признаков или симптомов тромбоза или тромбоэмболии, тяжелой преэклампсии или снижения подвижности плода. Мы рекомендуем частые дородовые посещения, по крайней мере, каждые 2-4 недели до середины беременности и каждые 1-2 недели после этого.
Значения хорионического гонадотропина человека (ХГЧ) в первом триместре можно отслеживать для оценки жизнеспособности беременности.Если уровень ХГЧ повышается нормально (то есть удваивается каждые 2 дня) в первый месяц беременности, успешный результат прогнозируется в 80-90% случаев. Однако, когда увеличение является ненормальным (т. Е. Более медленным), плохой результат прогнозируется в 70-80% случаев. Пациентам с плохим акушерским анамнезом, признаками преэклампсии или признаками задержки роста плода рекомендуется ультразвуковое исследование каждые 3-4 недели, начиная с 18-20 недель беременности. Целями пренатальной помощи во втором и третьем триместрах являются тщательное наблюдение за материнской гипертензией, протеинурией и другими признаками преэклампсии, частое обследование пациентов, акушерское ультразвуковое исследование для оценки роста плода и объема околоплодных вод, а также соответствующее обследование плода.Надзорное тестирование следует начинать на сроке гестации 32 недели или раньше, если есть подозрение на клиническую ситуацию недостаточности плаценты, и проводить его, по крайней мере, каждую неделю до родов. Рекомендуется регулярная и скоординированная консультация врача каждые 2-4 недели, особенно женщинам с системной красной волчанкой. Пациентам с неосложненным АФС рекомендуется ультразвуковое исследование на сроке беременности 30-32 недели для оценки роста плода. Задержка роста плода может отражать маточно-плацентарную недостаточность у пациентов с АФС (10).Допплерография матки и пупочной артерии широко используется в Европе для оценки риска преэклампсии, плацентарной недостаточности и задержки роста плода после 20-й недели гестации, а обычные обследования имеют высокую отрицательную прогностическую ценность (112).
Целями лечения беременных женщин с антифосфолипидным синдромом являются улучшение исходов у матери и плода-неонат путем сведения к минимуму рисков признанных осложнений заболевания, включая тромбоз у матери, потерю плода, преэклампсию, плацентарную недостаточность и внутриутробное развитие плода. ограничение роста и необходимость ятрогенных преждевременных родов (75).
Оптимальное лечение беременных женщин антифосфолипидными антителами и одной или более гибелью плода после 10 недель беременности без тромбоза является спорным (113).
Самым ранним методом лечения повторяющейся потери беременности, связанной с АФЛ, была комбинация высоких доз преднизона и низких доз аспирина, с успешным исходом в 75% пролеченных беременностей. Однако это привело к высокой заболеваемости матери и плода, включая гестационный диабет, гипертензию и преждевременный разрыв плодных оболочек.Рандомизированное контролируемое исследование преднизона и аспирина по сравнению с гепарином и аспирином показало, что подкожное введение низких доз гепарина с низкими дозами аспирина одинаково эффективно при меньшей заболеваемости (114). Более того, Кокрановский анализ показал, что внутривенные иммуноглобулины были связаны с повышенным риском потери беременности или преждевременных родов по сравнению с гепарином и низкими дозами аспирина (115).
Затем исследования, сфокусированные на эффективности терапии НФГ, НМГ и низкими дозами аспирина и их возможной связи, привели к противоречивым результатам.В двух исследованиях (116, 117) доля успешных беременностей существенно улучшилась при добавлении нефракционированного гепарина к низким дозам аспирина. Два других рандомизированных испытания (118,119), в которых использовался низкомолекулярный гепарин, оказались отрицательными. Кроме того, в двух исследованиях не было зарегистрировано различий в исходах беременности при сравнении нефракционированного гепарина с низкомолекулярным гепарином в сочетании с аспирином (120, 121). Более того, низкие дозы нефракционированного гепарина подкожно (5000 единиц два раза в день) оказываются столь же эффективными, как и высокие дозы гепарина (10000 единиц два раза в день) (117, 122).Наконец, в нескольких обсервационных исследованиях сообщается, что при применении только низких доз аспирина частота успешных беременностей составляет 79–100% (123–129). Другие доступные исследования показали, что аспирин (50–81 мг / сут) по сравнению с плацебо или обычным лечением не снижает частоту выкидышей (130, 131). Несмотря на очевидные противоречия, возникшие в результате этих исследований, в систематическом обзоре Кокрейна 2005 г. сделан вывод о том, что женщинам с повторным невынашиванием беременности и антифосфолипидным синдромом следует вводить комбинацию гепарина 5000 МЕ подкожно два раза в день и аспирина в низких дозах (115).Руководства экспертов рекомендуют комбинацию аспирина с низкими дозами гепарина или низкомолекулярным гепарином (132).
Гепарин — препарат выбора во время беременности (133). Гепарин не проникает через плаценту и считается безопасным для эмбриона. Из 2 клинически доступных форм препараты низкомолекулярного гепарина (НМГ) обладают некоторыми преимуществами перед нефракционированным гепарином (НФГ). И НФГ, и НМГ действуют, прежде всего, путем связывания с антитромбином, катализируя связывание молекулы с прокоагулянтами сериновой протеазы и изменяя их активность.НФГ усиливает активность антитромбина в отношении фактора Ха и тромбина, тогда как преобладающий эффект НМГ проявляется через опосредованную антитромбином активность против фактора Ха. У НФГ сложная фармакокинетика, которая в конечном итоге приводит к несколько непредсказуемому антикоагулянтному ответу. Кроме того, биодоступность НФГ после подкожной (п / к) инъекции снижается по сравнению с внутривенной инфузией.
НМГ, напротив, с меньшей вероятностью неспецифически связывается с различными циркулирующими белками или поверхностями клеток и, таким образом, имеет улучшенную фармакокинетику и биодоступность при подкожном введении.Кроме того, НМГ с меньшей вероятностью, чем НФГ, вызывают гепарин-индуцированную тромбоцитопению (ГИТ) и остеопороз, хотя последний нечасто (1-2% случаев) у женщин, получающих лечение во время беременности (100, 103). Важно проконсультировать пациента относительно возможных побочных эффектов гепарина.
Исследования плотности костной ткани следует рассматривать у пациентов, получающих антикоагулянтную терапию с гепарином, или НМГ могут быть важны для женщин, которые получали лечение во время предыдущей беременности или планируют беременность. По большей части более длительный период полувыведения НМГ рассматривается как преимущество, поскольку он позволяет использовать режимы дозирования один или два раза в день.
Беременных с антифосфолипидным синдромом можно классифицировать по:
• Пациенты с антифосфолипидным синдромом без предшествующего тромботического события (диагностированного из-за акушерского события:
(a) пациенты с рецидивирующим ранним (преэмбриональным) или эмбриональный) выкидыш и отсутствие других признаков антифосфолипидного синдрома, или
(b) с одной или более предшествующей внутриутробной смертью (при сроке беременности более 10 недель) или предшествующими ранними родами (при сроке менее 34 лет). недель беременности) из-за тяжелой преэклампсии или плацентарной недостаточности.
• Пациенты с острой ВТЭ в течение нескольких месяцев после зачатия или во время беременности или рецидивирующей ВТЭ (2 или более предшествующих ВТЭ).
В таблице приведены рекомендуемые методы лечения для этих групп.
Таблица 5
— Предлагаемые схемы лечения антифосфолипидного синдрома при беременности.
Таким образом, в Руководстве по доказательной клинической практике Американского колледжа грудных врачей (132) предполагается, что женщины с антифосфолипидными антителами и в анамнезе 2 или более выкидышей на ранних сроках или 1 или более случаев выкидышей на поздних сроках, не имевшие в анамнезе тромбозов, получают лечение комбинацией аспирина и гепарина (нефракционированного или низкомолекулярного) во время беременности.Аспирин (81 мг / сут) следует начинать с попытки зачатия; Большинство исследователей фактически рекомендуют аспирин до зачатия из-за его возможного положительного воздействия на ранних стадиях имплантации (123). Гепарин (5000-10 000 единиц каждые 12 часов) или низкомолекулярный гепарин в профилактических дозах (эноксапарин 40 мг подкожно каждые 24 часа) следует начинать при подтверждении жизнеспособной внутриутробной беременности и продолжать до конца третьего триместра (134 ). Пациенты с тромбозом в анамнезе должны получать полную антикоагулянтную терапию с использованием схемы НФГ или НМГ с отрегулированными дозами (НФГ подкожно каждые 12 ч или эноксапарин 1 мг / кг подкожно каждые 12 часов) в течение как минимум 6 месяцев с момента первоначального обращения с ВТЭ.Женщинам, принимающим варфарин, следует прекратить прием варфарина до 6 недель беременности. Некоторые врачи предпочитают прекращать прием варфарина, когда пациент начинает попытки зачать ребенка, заменяя его НФГ или НМГ. Если пациентка достигает 6 месяцев антикоагуляции во время беременности, целесообразно рассмотреть возможность снижения степени антикоагуляции (например, до профилактического НФГ или НМГ), особенно при подготовке к эпидуральной анестезии. После родов прием НФГ или НМГ следует перезапустить и подключить к варфарину.
О послеродовой терапии гепарином, поскольку кесарево сечение считается риском ВТЭ (96, 107). Рекомендации по тромбопрофилактике (132, 133) предполагают, что этим женщинам во время госпитализации следует проводить тромбопрофилактику с профилактическими НМГ или НФГ или механическую профилактику с помощью компрессионных устройств нижних конечностей. Пациенты с низким и средним риском, получающие НМГ, могут быть переведены на НФГ (из-за его более короткого периода полувыведения) на сроках от 36 до 37 недель, чтобы повысить вероятность эпидуральной анестезии в случае преждевременных родов.Пациентам следует сообщить, что при подозрении на самопроизвольные роды прием гепарина следует прекратить. Для индукционного или планового кесарева сечения прием гепарина в скорректированной дозе и НМГ в промежуточных дозах следует прекратить за 24 часа до запланированного приема.
Профилактический прием гепарина следует прекратить как минимум за 12 часов. Для пациентов из группы высокого риска разумные варианты включают снижение дозы гепарина до 5000 единиц подкожно дважды в день или использование разумно применяемой непрерывной инфузии гепарина во время родов с прекращением, когда роды предполагаются через 1-2 часа.В большинстве случаев гепарин следует возобновить через 6-8 часов после родов или кесарева сечения. Что касается пациентов из группы высокого риска, непрерывную инфузию следует возобновить после родов, когда риск кровотечения снизился (обычно через 2–4 часа после родов). Американское общество региональной анестезии (ASRA) дало рекомендации относительно антикоагуляции и регионарной анестезии. Регионарная анестезия противопоказана пациентам менее чем через 24 часа после приема последней дозы НМГ, принимаемой дважды в день. Для профилактики НМГ регионарная анестезия может быть применена через 10–12 часов после последней дозы гепарина НМГ.Нейроаксиальный катетер следует удалить за 2 часа до первой дозы НМГ. Внутривенное введение гепарина можно начать через 1 час после нейроаксиальной анестезии с удалением катетера через 2–4 часа после последней дозы гепарина. П / к гепарин, вводимый дважды в день с общей дозой менее 10 000 единиц НФГ в день, не является противопоказанием к нейроаксиальной анестезии. Однако безопасная нейроаксиальная анестезия в дозах более 10 000 единиц UFH или дозировка с частотой более двух раз в день не была признана безопасной (135).Терапия (включая аспирин и гепарин) может снизить скорость потери плода до 25%, как описано Cowchock et al. (114).
Чтобы снизить риск послеродового тромбоза глубоких вен, всем женщинам с антифосфолипидным синдромом, с предшествующим тромбозом или без него, рекомендуется антитромботическая терапия в послеродовой период (132). Как правило, женщинам с тромбозом в анамнезе требуется длительная антикоагулянтная терапия, и большинство экспертов предпочитают переключить лечение на варфарин, как только пациент станет клинически стабильным после родов, чтобы ограничить дальнейший риск гепарин-индуцированного остеопороза и перелома костей.Пациентам без предшествующего тромбоза рекомендуется назначать профилактическую дозу гепарина или низкомолекулярный гепарин в течение 4-6 недель после родов (132), хотя варфарин является вариантом. И гепарин, и варфарин безопасны для кормящих матерей (136). Ретроспективное исследование последующего тромбоза у 65 пациенток с предшествующими событиями беременности, которые обычно не получали профилактику после ближайшего послеродового периода, показало, что у таких пациенток частота тромбозов в течение 10 лет наблюдения составляет 59%; однако у пациентов, которые продолжали принимать аспирин в низких дозах, частота составила 10% (58).
Основываясь на этих данных, текущая рекомендация может быть низкой дозой аспирина в послеродовом периоде на неопределенный срок.
Что касается других осложнений беременности, данные метаанализа (137) показали их значительное снижение у женщин с высоким риском преэклампсии, которым давали антиагреганты (в основном аспирин). Во всех клинических исследованиях исходы беременности у матери и плода и новорожденного при сроке беременности более 20 недель были доброкачественными, а частота гибели плода, преэклампсии, тяжелой плацентарной недостаточности и ятрогенных преждевременных родов была близка к таковой в общей акушерской популяции.Результаты рандомизированных исследований не определяют оптимальное лечение женщин со смертью плода (срок беременности> 10 недель) или предшествующими ранними родами (срок беременности <34 недель) из-за тяжелой преэклампсии или плацентарной недостаточности. Большинство экспертов рекомендуют низкие дозы аспирина и гепарин в профилактических или промежуточных дозах (75, 115, 132). Антагонисты витамина К обладают тератогенным действием, и их следует избегать на сроке от 6 до 12 недель беременности.
Из-за риска последующего кровотечения у плода (132, 136) варфарин после 12 недель беременности следует назначать только в исключительных случаях.
Вероятно, существует связь АПЛ с бесплодием, но до сих пор это оставалось спорным. Хотя распространенность антител к aPL увеличивается у пациентов, подвергающихся экстракорпоральному оплодотворению (ЭКО), недавнее проспективное исследование показало, что лечение аспирином и гепарином пациентов ЭКО с положительными антителами к aPL и неудачными циклами ЭКО в анамнезе не улучшает исход цикла ЭКО (138).
Будущие методы лечения
Появляется несколько потенциальных новых терапевтических подходов к APS (таблица).
Таблица 6
— Возможные будущие методы лечения антифосфолипидного синдрома.
Но большинство этих возможных будущих методов лечения (клопидогрель, ривароксабан, статины, ритуксимаб и другие новые антикоагулянты) предназначены для небеременных пациенток. Единственными новыми препаратами от APS, которые могут использовать беременные женщины, являются дипиридамол и гидроксихлорохин.
Комбинированное лечение аспирином и дипиридамолом показало более высокую эффективность, чем только аспирин, у пациентов с инсультом. Такая комбинация может быть рассмотрена у отдельных пациентов с антифосфолипидным синдромом, у которых варфарин не эффективен или безопасен.Наблюдательные исследования показали антитромботический эффект гидроксихлорохина у пациентов с антифосфолипидными антителами, большинство из которых страдают системной красной волчанкой (49, 139, 140).
Кроме того, результаты фундаментальных исследований показали дозозависимое снижение гидроксихлорохином активации тромбоцитов и свертывания крови, вызванного антифосфолипидными антителами (141, 142). Гидроксихлорохин напрямую ингибирует связывание комплексов антифосфолипидное антитело-2-гликопротеин-1 с фосфолипидными поверхностями (143).Дополнительная и ранее неизвестная роль гидроксихлорохина в предотвращении невынашивания беременности подтверждается описанием его защитного действия — экрана аннексина A5, образованного над бислоями фосфолипидов, от повреждений, вызванных антифосфолипидными антителами (144). Ввиду отличного профиля безопасности, включая отсутствие каких-либо побочных эффектов для плода-новорожденного (145) и отсутствие связанного кровотечения, гидроксихлорохин следует рассматривать в качестве адъювантного антитромботического средства у пациентов с системной красной волчанкой, которые положительный на антифосфолипидные антитела.Пациенты с первичным антифосфолипидным синдромом и рецидивирующим тромбозом, несмотря на адекватную антикоагулянтную терапию, которые испытывают трудности с поддержанием адекватной интенсивности антикоагуляции или имеют профиль высокого риска обширного кровотечения, также могут получить пользу от лечения гидроксихлорохином.
Более того, недавние данные экспериментальной модели потери беременности, вызванной антителом aPL, у мышей (33) предполагают, что терапевтический эффект гепарина при заболевании может быть обусловлен ингибированием комплемента, а не его ингибированием коагуляции.Эти данные, если их можно обобщить на потери беременности у людей, связанные с АФС, открывают интригующую возможность новых неантикоагулянтных подходов к лечению.
современное состояние
Реферат
Акушерские осложнения — отличительная черта антифосфолипидного синдрома. Рецидивирующий выкидыш, ранние роды, маловодие, недоношенность, ограничение внутриутробного развития, дистресс плода, тромбоз плода или новорожденного, преэклампсия / эклампсия, HELLP-синдром, артериальный или венозный тромбоз и плацентарная недостаточность являются наиболее серьезными осложнениями, связанными с APS, для беременных женщин.Антифосфолипидные антитела способствуют активации эндотелиальных клеток, моноцитов и тромбоцитов, вызывая перепроизводство тканевого фактора и тромбоксана А2. Активация комплемента может иметь центральную патогенетическую роль. Эти факторы, связанные с типичными изменениями в системе гемостаза при нормальной беременности, приводят к состоянию гиперкоагуляции. Это является причиной тромбоза, который, как предполагается, вызывает многие осложнения беременности, связанные с APS. Акушерский уход основан на комбинированном акушерско-медико-акушерском управлении и лечении с применением аспирина и гепарина.Этот обзор направлен на определение современного состояния APS путем изучения достижений знаний последних лет, чтобы обеспечить наиболее подходящее диагностическое и терапевтическое лечение беременных женщин, страдающих этим синдромом.
Ключевые слова: Антифосфолипид, тромбофилия, гиперкоагуляция, тромбопрофилактика
Введение
Антифосфолипидный синдром (АФС) — это аутоиммунное тромбофильное состояние, которое характеризуется наличием в крови фосфолипидных белков, которые скорее распознают и распознают в крови антитела. чем сам фосфолипид (1).Клинические проявления APS включают тромбоз сосудов и осложнения беременности (2), особенно повторяющиеся самопроизвольные выкидыши и, реже, тромбоз матери (3). Возможны многие другие клинические проявления (4, 55).
Наличие одного только антифосфолипидного антитела (aPL) при отсутствии типичных клинических осложнений не указывает на диагноз APS; Существуют длительно бессимптомные пациенты с aPL-положительным статусом. При диагностировании у пациентов с основным аутоиммунным заболеванием (обычно системной красной волчанкой или СКВ) APS называют вторичным APS; у здоровых людей это называется первичным АФС.Катастрофический антифосфолипидный синдром (CAPS) представляет собой тяжелый конец спектра множественных тромбозов органов за короткий период времени. Мультиорганная недостаточность была описана во время беременности Эшерсоном (6) и послеродовым периодом Коченуром (7).
Клинический спектр этого синдрома расширился (8, 9), благодаря значительному прогрессу в изучении его патогенеза и клинического ведения за последние несколько лет.
Материалы и методы
В этой работе мы стремились предложить современный взгляд на основные патофизиологические, клинические, диагностические и терапевтические достижения в области антифосфолипидного синдрома.
Литературный поиск проводился с 2006 по 2011 год, уделяя больше внимания последним исследованиям. База данных PubMed использовалась с терминами медицинских предметных заголовков «антифосфолипидный синдром» ИЛИ «антитела, антифосфолипиды» ИЛИ «волчаночный антикоагулянт». Был проведен поиск в Кокрановской базе данных систематических обзоров по ключевому слову «антифосфолипид». Мы получили дополнительные статьи из справочных разделов выбранных рукописей. Мы уделили особое внимание систематическим обзорам, рандомизированным клиническим испытаниям, согласованным документам и обзорным статьям, посвященным диагностике и терапии антифосфолипидного синдрома.Были также включены более старые статьи, чтобы привлечь внимание к патогенетическим, клиническим и эпидемиологическим вопросам.
Обсуждение
Этиология и патогенез
Как и другие аутоиммунные заболевания, APS не имеет известной этиологии. Существует несколько гипотез, объясняющих возможную причину (10):
Пассивный перенос материнских антител опосредует аутоиммунные нарушения у плода и новорожденного. Механизм избыточной продукции аутоантител и образования иммунных комплексов не совсем понятен, хотя текущие исследования сосредоточены на аномальных функциях регулятора и возможности медленной вирусной инфекции.
Сообщалось о семейном возникновении aPL, и предполагаемые генетические ассоциации включают HLA-DR4, DR7, DRw53 и нулевой аллель C4 (11).
Молекулы PL вездесущи по своей природе и присутствуют на внутренней поверхности клетки и в микроорганизмах. Следовательно, при инфекционных заболеваниях, включая вирусные (например, ВИЧ, вирус Эпштейна-Барра [EBV], цитомегаловирус [CMV], аденовирусы), бактериальные (например, бактериальный эндокардит, туберкулез, микоплазменная пневмония), спирохетальные (например, сифилис, лептоспироз). , Болезнь Лайма) и паразитарные (например, малярийная инфекция), разрушение клеточных мембран может происходить во время повреждения клеток.PL высвобождают и стимулируют антитела к aPL.
Антифосфолипидные антитела можно в целом разделить на те антитела, которые продлевают фосфолипид-зависимые анализы коагуляции, известные как волчаночные антикоагулянты (LA) или антикардиолипиновые антитела (aCL), которые нацелены на молекулярный конгенер кардиолипина (сердечный белок крупного рогатого скота). Волчаночные антикоагулянты (LA) снижают коагулянтный потенциал плазмы и увеличивают время свертывания в тестах на коагуляцию, основанных на активированном частичном тромбопластиновом времени (12).
Консенсусные рекомендации рекомендуют скрининг на LA с помощью 2 или более тестов на фосфолипид-зависимую коагуляцию (13). Антикоагулянтная терапия может помешать выявлению ЛА (14). Антикардиолипиновые антитела (aCL) обладают общей аффинностью связывания in vitro с кардиолипином и могут быть обнаружены с помощью иммуноферментных анализов. Тесты иммуноферментного анализа на aCL плохо стандартизированы, а тестирование aCL показало плохое соответствие между лабораториями (12). И LA, и aCL могут демонстрировать специфичность в отношении 2-гликопротеина I (2GPI) (15, 16).Фактически, даже если описаны многие другие антигенные мишени, включая белки C и S, протромбин (17) и аннексин V (18), основным антигеном, распознаваемым аутоантителами к фосфолипидам (aPL), является 2-гликопротеин I, также известный как аполипопротеин H, член суперсемейства белка контроля комплемента или короткого консенсусного повтора (SCR). Белок имеет форму рыболовного крючка и связывается с анионными фосфолипидными бислоями через катионные и гидрофобные аминокислоты в пятом из его 5 SCR-доменов, около карбоксиконца (19).Недавние данные показали, что субнабор антител против aPL ( Anti-2-гликопротеин I антител ) (20, 21), связанных с повышенным риском тромбоза и эмболии, распознает эпитоп в домене I 2GPI, который состоит из Gly40-Arg43. (22, 23). Было высказано предположение, что опосредованная антителами димеризация и пентамеризация 2GPI увеличивают аффинность / авидитность иммунных комплексов антитело-2GPI к фосфолипиду и что это увеличение может быть ответственно за патогенные эффекты антител против aPL (23).Лабораторный анализ этих антител не стандартизирован, что затрудняет сравнение исследований (16). Есть некоторые свидетельства того, что эти антитела более специфичны для APS (24).
Антифосфолипидные антитела с активностью против 2-гликопротеина-1 действуют по множеству механизмов (25, 26):
—
APL активируют эндотелиальные клетки (27), и они экспрессируют молекулы адгезии (такие как молекула межклеточной адгезии 1, молекула адгезии сосудистых клеток-1, Е-селектин) и (подобно моноцитам) повышают выработку тканевого фактора (28).
—
APL активирует моноциты и индуцирует их повышенную экспрессию тканевого фактора (29).
—
APL активирует тромбоциты, которые увеличивают экспрессию гликопротеина 2b-3a и синтез тромбоксана A2. Активация эндотелиальных клеток, моноцитов и тромбоцитов антифосфолипидными антителами, что ведет к усиленному синтезу тканевого фактора и тромбоксана A2. вызывают прокоагулянтное состояние (30, 31).
—
Активация каскада комплемента может закрыть петлю7 и спровоцировать тромбоз и потерю плода (32-35).Часто это происходит при втором ударе (36). Традиционные факторы риска сердечно-сосудистых заболеваний, такие как табак, воспаление или эстрогены, могут играть важную роль на этом этапе, на самом деле такие факторы риска присутствуют более чем у 50% пациентов с антифосфолипидным синдромом. Чтобы подтвердить роль комплемента, исследования показывают, что фрагменты C4d и C3b откладываются в плаценте пациентов с антифосфолипидным синдромом (37).
—
Кроме того, взаимодействие антифосфолипидных антител с белками, участвующими в регуляции свертывания, такими как протромбин, фактор X, протеины C и S (38) и плазмин (39), ингибитор пути тканевого фактора (40), может препятствуют инактивации прокоагулянтных факторов и препятствуют фибринолизу (28, 36).
Взаимодействие с аннексином А5, природным антикоагулянтом, который связывается с фосфатидилсерином, воздействующим на формирование синцития трофобласта, может способствовать более прямому воздействию на структуры плаценты, способствуя тромбозу плаценты и потере плода (18, 28, 41).
В качестве доказательства того, что тромбоз является причиной многих акушерских осложнений, были описаны нарушения плацентации при невынашивании беременности, связанные с антифосфолипидными антителами (42). 2-гликопротеин 1 напрямую связывается с культивируемыми клетками цитотрофобласта и впоследствии распознается антителами к 2-гликопротеину 1 (43).Более того, антифосфолипидные антитела могут вызывать воспалительный ответ, опосредованный путем TLR4 / MyD88, что приводит к повреждению трофобласта (44).
Эпидемиология aPL
Сообщалось, что распространенность aCL и LAC в нормальных здоровых популяциях колеблется от 1,0% до 5,6% и от 1,0% до 3,6%, соответственно (45–47). Распространенность повышенных антител к aPL также может увеличиваться с возрастом (48). Около одной трети пациентов с СКВ имеют aCL-положительный результат. Распространенность ЛП у пациентов с СКВ составляет около 15%.Положительный LA более специфичен для APS, чем повышенный aCL. Сила связи между aPL и тромбозом варьируется. В первую очередь, aCL не являются таким сильным фактором риска тромбоза, как LA. Волчаночный антикоагулянт неизменно является наиболее сильным предиктором тромбоза (49–51).
Около 40% пациентов с системной красной волчанкой имеют антифосфолипидные антитела (52), но менее 40% из них в конечном итоге будут иметь тромботические события (49, 53). Однако тромботический антифосфолипидный синдром считается основным неблагоприятным прогностическим фактором у пациентов с волчанкой (53).Важны титр и изотип: aCL IgG сильнее связаны с клиническими проявлениями, чем aCL IgM, и риск тромбоза увеличивается с более высокими титрами (> 40 U). Иммуноглобулин A aCL и низкие титры IgG и IgM aCL реже связаны с осложнениями (54).
APL составляют значительную долю тромбозов в общей популяции (55-57).
Наличие дополнительных факторов протромботического риска у aPL-положительных лиц, вероятно, влияет на риск тромбоза.Согласно принятой в настоящее время гипотезе «второго удара», второе триггерное событие — например, курение сигарет, оральные контрацептивы, хирургические процедуры, длительная иммобилизация или генетическое протромботическое состояние — может повысить вероятность того, что у пациента с положительным АФЛ развивается сосудистая патология. мероприятие. Женщины, у которых только наступила беременность, имеют высокую вероятность развития тромбоза в более поздние годы (58).
Диагностика APS
Критерии
В 1998 г. предварительные критерии классификации антифосфолипидного синдрома были предложены в Саппоро, Япония (60).Для классификации этого синдрома необходимо наличие по крайней мере одного клинического проявления вместе с положительными тестами на циркулирующие антифосфолипидные антитела, включая волчаночный антикоагулянт или антикардиолипин, или и то, и другое, при средних или высоких значениях, обнаруживаемых не менее двух раз в течение 6 недель. В 2006 г. критерии классификации были обновлены (61) и перечислены в таблице.
Таблица 1
— Краткое изложение Сиднейского консенсуса по критериям классификации расследований для APS (61).
По существу, клинические критерии остались неизменными; однако были внесены два важных изменения: время, прошедшее между двумя положительными определениями, было увеличено до 12 недель, чтобы гарантировать обнаружение только стойких антител; и анти-2-гликопротеин 1, как IgG, так и IgM, были добавлены к лабораторным критериям.Средние титры антикардиолипина или анти-2-гликопротеина 1 были определены как более 40 GPL или MPL или выше 99-го процентиля. Примечательно, что изотипы IgA, антипротромбиновые антитела и антитела, направленные против фосфатидилсерин-протромбинового комплекса, остались исключенными из критериев. Эти модификации подверглись критике (63), и дискуссия о клинических последствиях различных антифосфолипидных антител все еще остается открытой.
Вы можете распознать различные типы APS. См. Таблицу.
Таблица 2
— Типы пациентов, у которых есть антифосфолипидные (aPL) антитела.
Обзор лабораторных тестов
Лабораторные тесты, которые часто используются для диагностики этого состояния, показаны в таблице.
Таблица 3
— Тесты, используемые для диагностики антифосфолипидного синдрома.
Первым тестом, который идентифицировал это состояние, был тест на биологический ложноположительный (BFP) сифилис, который фактически сообщил о распознавании аутоантителами фосфолипид-связывающих белков, в первую очередь 2GPI (в отличие от истинно-положительных тестов на сифилис, в которых антитела распознают фосфолипид напрямую).Тест на сифилис BFP был сначала доработан до количественного иммуноанализа на антикардиолипин (64), а затем включал иммуноанализы, в которых использовались другие фосфолипиды, такие как фосфатидилсерин, и иммуноанализы, которые выявляли антитела против предполагаемых антигенов, в первую очередь 2GPI. Второй способ диагностического тестирования, проводимого для тестов, которые сообщают о влиянии на фосфолипид-зависимые реакции коагуляции, вызывая увеличенное время свертывания крови с помощью любого из следующих тестов: активированное частичное тромбопластиновое время (АЧТВ), разбавленное время яда гадюки Рассела (dRVVT), каолин время свертывания, время свертывания плазмы.Это продление должно быть подтверждено смешиванием исследований с нормальной плазмой (время свертывания остается увеличенным с LA) или тестом нейтрализации тромбоцитов.
Высокоаффинные (авидные) комплексы фосфолипид-связывающее антитело-кофакторфосфолипид являются вероятной основой феномена LA. Оба подхода — иммуноферментный анализ и исследование LA — можно рассматривать как эмпирически полученные суррогатные тесты для синдрома. Чувствительность и специфичность тестов различны, и один отрицательный тест не может исключить диагноз пациента.Обычно рекомендуется провести ряд тестов, чтобы попытаться исключить диагноз. Специфический ELISA для антител, направленных против домена 1 2-гликопротеина, является одним из новых ожидаемых тестов, которые потребуют оценки (65).
Наличие более одного класса антифосфолипидных антител увеличивает риск тромбоза (20). Пациенты с положительными результатами всех трех основных анализов — положительный LAC, повышенный уровень антикардиолипиновых антител и повышенный уровень антител против 2GPI (так называемый «тройной положительный результат»), имеют значительно повышенный риск тромбоза (66-68) и осложнений беременности. (69).
Эти тесты бесполезны для скрининга бессимптомных общих медицинских или акушерских групп. В настоящее время тестирование на антитела к aPL обычно должно быть ограничено пациентами, у которых был тромбоз, эмболия или осложнения беременности, которые могут быть связаны с APS, и пациентами с SLE, даже если у них не было ни одного из вышеперечисленных проявлений. Всегда необходимо проводить ряд анализов.
Акушерские осложнения
Антифосфолипидный синдром вызывает несколько клинических проявлений.См. Таблицу.
Таблица 4
— Клинические проявления антифосфолипидного синдрома.
Акушерские осложнения — еще одна отличительная черта антифосфолипидного синдрома.
Риск тромбоза у женщин с антифосфолипидными антителами может быть повышен (58). Предполагается, что тромбоз является причиной многих осложнений беременности, связанных с АФС. Наиболее частым акушерским проявлением этого синдрома является повторный выкидыш. Рецидивирующий выкидыш происходит примерно у 1% населения в целом, пытающегося иметь детей (70).Около 10-15% женщин с повторным невынашиванием беременности диагностируют антифосфолипидный синдром (71, 72). Потеря плода (≥10 недель беременности) сильнее связана с АФЛ, чем потеря плода на более ранней стадии (73). Волчаночный антикоагулянт тесно связан с повторным невынашиванием беременности до 24-й недели беременности (74). В целом, примерно половина случаев потери беременности, связанной с aPL, происходит в первом триместре (преэмбриональная и эмбриональная потеря, <10 недель беременности) (75). Диагноз APS следует ставить только при трех или более последовательных потерях при отсутствии другой идентифицируемой этиологии.Двумя наибольшими факторами риска потери плода являются высокий титр aCL IgG и предыдущая потеря плода в анамнезе. У таких пациенток риск невынашивания беременности составляет до 80% (76). Как IgG, так и IgM антикардиолипины связаны с повышенным риском выкидыша, хотя и в меньшей степени, чем волчаночный антикоагулянт (74). Клиническая значимость антител против 2-гликопротеина I также не ясна; в трех систематических обзорах (16, 50, 74). у других эти антитела не были связаны ни с тромбозом, ни с повторным ранним выкидышем (23, 77, 78).они показали повышенный риск акушерских осложнений и тромбозов. Также риск потери плода среди бессимптомных женщин, у которых есть антифосфолипидные антитела, по-видимому, повышен (58, 79-82). Хотя гибель плода связана с антифосфолипидным синдромом (83), общий вклад этого синдрома неясен, отчасти из-за влияния других возможных способствующих факторов, таких как лежащая в основе гипертония или ранее существовавшие сопутствующие заболевания, такие как системная красная волчанка или заболевание почек. .
Акушерские проявления APS не ограничиваются потерей плода (8, 58,75, 84-86). Текущие критерии APS включают ранние роды, маловодие, неонатальные осложнения (такие как недоношенность оценивается в 30-60% и чаще встречается у пациентов с СКВ, задержка внутриутробного развития — IUGR -, дистресс плода (60) и редко тромбоз плода или новорожденного) (87 ), сопутствующие акушерские осложнения у матери (такие как преэклампсия / эклампсия и HELLP-синдром — гемолитическая анемия, повышенные ферменты печени и низкое количество тромбоцитов, артериальный или венозный тромбоз) и другие осложнения, связанные с aPL (плацентарная недостаточность) (75).Связь между антифосфолипидными антителами и риском преждевременных родов из-за эклампсии или преэклампсии и ограничения внутриутробного развития остается спорной; исследования, предоставляющие данные в этой области, как правило, небольшие, ретроспективные и дают противоречивые результаты (88, 89). Кроме того, токсичность методов лечения, оцениваемых в этих исследованиях, может способствовать потере или осложнению беременности и может затруднять связь между антифосфолипидными антителами и неблагоприятными исходами беременности (90).
Скрининг здоровых беременных не показан (91).
Хотя и aCL, и LA предсказывают потерю плода, соответствие неполное, поэтому при подозрении на APS необходимо провести тестирование обоих. Другие APL не так полезны для прогнозирования риска. Фактически, антитела, направленные против других фосфолипидов, таких как антифосфатидилсерин или антифосфатидилэтаноламин, обычно не позволяют идентифицировать дополнительных пациентов (92). Неясно, добавляют ли анти-2GPI антитела значительную прогностическую ценность aCL и LA при выявлении пациентов с риском потери плода (93), хотя иногда пациенты могут иметь только эти антитела.Исключение сопутствующих условий важно у пациенток с АФЛ-положительными заболеваниями во время беременности.
Гинекологические состояния могут включать аномалии матки, гормональный дисбаланс (например, дефект лютеиновой фазы), аномалии материнского и отцовского кариотипа или генетические аномалии плода. Кроме того, наличие наследственного прокоагулянтного состояния, такого как фактор V Лейдена, может имитировать APS (94).
Тяжелым осложнением беременности, которое значительно увеличивает риск АФС, является ВТЭ.
Беременность и послеродовой период фактически несут повышенный риск ВТЭ с частотой от 0,61 до 1,72 на 1000 родов (95, 96). По сравнению с небеременными женщинами вероятность развития ВТЭ у беременных и женщин в послеродовом периоде примерно в 4–5 раз выше (97).
Триада Вирхова описывает 3 элемента, которые способствуют развитию тромбоза: (а) застой, (б) сосудистая травма и (в) гиперкоагуляция. Все эти элементы присутствуют во время беременности и в послеродовой период.Венозный застой нижних конечностей был продемонстрирован во время беременности (98). Скорость венозного кровотока уменьшается по мере продвижения беременности и ниже в левой конечности по сравнению с правой нижней конечностью. Когда ТГВ проявляется во время беременности, он, скорее всего, находится в левой нижней конечности (9, 99). Преобладание образования сгустка левой нижней конечности может быть связано с компрессией левой общей подвздошной вены увеличивающейся беременной маткой (100). Кроме того, было продемонстрировано расширение вен, что может привести к повреждению эндотелия и протромботическим изменениям эндотелия (101).Скорость венозного кровотока в нижних конечностях увеличилась, а диаметр сосудов уменьшился между 4 и 42 днями после родов (102). Скорость и диаметр венозного кровотока вернулись к уровням, наблюдаемым на ранних сроках беременности на 42-дневном измерении (101, 102). Помимо механического сжатия вен таза, повышенный уровень циркулирующего эстрогена и местная выработка простациклина и оксида азота увеличивают емкость глубоких вен во время беременности (103). Более того, нормальная беременность сопровождается изменениями в системе гемостаза, которые могут привести к гиперкоагуляции для предотвращения кровотечения во время родов:
—
Факторы II, VII, VIII, IX, XII, и увеличение фактора фон Виллебранда (104).
—
Уровни фибриногена повышаются до уровней, которые почти в два раза выше, чем в небеременном состоянии (104, 105).
—
Снижение уровней антигена свободного и общего белка S, а также снижение активности происходит на очень ранних сроках беременности.
—
Хотя уровни протеина C остаются неизменными (104, 106), общее повышение устойчивости к активированному протеину C присутствует, причем степень устойчивости зависит от нескольких модификаторов, включая наличие лейденской мутации фактора V ( FVLM), образование тромбина и наличие антифосфолипидных антител (107).Снижается фибринолиз, в основном из-за снижения активности тканевого активатора плазминогена.
—
Другие маркеры состояния гиперкоагуляции включают увеличение комплексов тромбин-антитромбин, фрагменты протромбина 1 и 2, пиковое образование тромбина и повышенные уровни D-димера (104-106).
Во время беременности может также произойти травма сосудов в виде повреждения эндотелия из-за расширения вен (101) или может возникнуть при таких состояниях, как преэклампсия, когда присутствует активация эндотелия сосудов (108).
Во время нормальных родов может возникнуть венозное сжатие.
Считается, что оперативные и вспомогательные роды способствуют травме сосудов, а также, возможно, повышают риск тромбоза в послеродовом периоде; особенно это касается кесарева сечения.
Тестирование на антифосфолипидный синдром (с помощью волчаночного антикоагулянта, антикардиолипина и анти-2-гликопротеина I) является обычной практикой при первом эпизоде ВТЭ, поскольку пациенты с антифосфолипидным синдромом должны рассматриваться для длительной антикоагуляции (109).Важно исключить антифосфолипидный синдром, так как этот диагноз может изменить уход за беременными, а также будет показанием для применения гепарина.
Ведение и антитромботическое лечение APS во время беременности
При правильном ведении более 70% беременных женщин с антифосфолипидным синдромом родят жизнеспособного живого ребенка (110). В идеале предварительное консультирование дает врачу возможность понять конкретный контекст каждой пациентки с синдромом и обозначить риски беременности и лечения.Всем женщинам с тяжелой легочной гипертензией следует препятствовать беременности из-за высокого риска материнской смерти (111), и ее следует отложить на фоне неконтролируемой гипертензии или недавних тромботических событий, особенно инсульта (111). Перед планированием беременности должен быть доступен полный профиль антифосфолипидных антител, включая повторные антикардиолипиновые и волчаночные антикоагулянты. Однако эти тесты не нужно повторять во время беременности, поскольку последующие отрицательные результаты (после диагностических, повторно положительных тестов) не устраняют риск осложнений (111).
Пациентов следует консультировать во всех случаях относительно симптомов тромбоза и тромбоэмболии, а также информировать и часто обследовать на предмет признаков или симптомов тромбоза или тромбоэмболии, тяжелой преэклампсии или снижения подвижности плода. Мы рекомендуем частые дородовые посещения, по крайней мере, каждые 2-4 недели до середины беременности и каждые 1-2 недели после этого.
Значения хорионического гонадотропина человека (ХГЧ) в первом триместре можно отслеживать для оценки жизнеспособности беременности.Если уровень ХГЧ повышается нормально (то есть удваивается каждые 2 дня) в первый месяц беременности, успешный результат прогнозируется в 80-90% случаев. Однако, когда увеличение является ненормальным (т. Е. Более медленным), плохой результат прогнозируется в 70-80% случаев. Пациентам с плохим акушерским анамнезом, признаками преэклампсии или признаками задержки роста плода рекомендуется ультразвуковое исследование каждые 3-4 недели, начиная с 18-20 недель беременности. Целями пренатальной помощи во втором и третьем триместрах являются тщательное наблюдение за материнской гипертензией, протеинурией и другими признаками преэклампсии, частое обследование пациентов, акушерское ультразвуковое исследование для оценки роста плода и объема околоплодных вод, а также соответствующее обследование плода.Надзорное тестирование следует начинать на сроке гестации 32 недели или раньше, если есть подозрение на клиническую ситуацию недостаточности плаценты, и проводить его, по крайней мере, каждую неделю до родов. Рекомендуется регулярная и скоординированная консультация врача каждые 2-4 недели, особенно женщинам с системной красной волчанкой. Пациентам с неосложненным АФС рекомендуется ультразвуковое исследование на сроке беременности 30-32 недели для оценки роста плода. Задержка роста плода может отражать маточно-плацентарную недостаточность у пациентов с АФС (10).Допплерография матки и пупочной артерии широко используется в Европе для оценки риска преэклампсии, плацентарной недостаточности и задержки роста плода после 20-й недели гестации, а обычные обследования имеют высокую отрицательную прогностическую ценность (112).
Целями лечения беременных женщин с антифосфолипидным синдромом являются улучшение исходов у матери и плода-неонат путем сведения к минимуму рисков признанных осложнений заболевания, включая тромбоз у матери, потерю плода, преэклампсию, плацентарную недостаточность и внутриутробное развитие плода. ограничение роста и необходимость ятрогенных преждевременных родов (75).
Оптимальное лечение беременных женщин антифосфолипидными антителами и одной или более гибелью плода после 10 недель беременности без тромбоза является спорным (113).
Самым ранним методом лечения повторяющейся потери беременности, связанной с АФЛ, была комбинация высоких доз преднизона и низких доз аспирина, с успешным исходом в 75% пролеченных беременностей. Однако это привело к высокой заболеваемости матери и плода, включая гестационный диабет, гипертензию и преждевременный разрыв плодных оболочек.Рандомизированное контролируемое исследование преднизона и аспирина по сравнению с гепарином и аспирином показало, что подкожное введение низких доз гепарина с низкими дозами аспирина одинаково эффективно при меньшей заболеваемости (114). Более того, Кокрановский анализ показал, что внутривенные иммуноглобулины были связаны с повышенным риском потери беременности или преждевременных родов по сравнению с гепарином и низкими дозами аспирина (115).
Затем исследования, сфокусированные на эффективности терапии НФГ, НМГ и низкими дозами аспирина и их возможной связи, привели к противоречивым результатам.В двух исследованиях (116, 117) доля успешных беременностей существенно улучшилась при добавлении нефракционированного гепарина к низким дозам аспирина. Два других рандомизированных испытания (118,119), в которых использовался низкомолекулярный гепарин, оказались отрицательными. Кроме того, в двух исследованиях не было зарегистрировано различий в исходах беременности при сравнении нефракционированного гепарина с низкомолекулярным гепарином в сочетании с аспирином (120, 121). Более того, низкие дозы нефракционированного гепарина подкожно (5000 единиц два раза в день) оказываются столь же эффективными, как и высокие дозы гепарина (10000 единиц два раза в день) (117, 122).Наконец, в нескольких обсервационных исследованиях сообщается, что при применении только низких доз аспирина частота успешных беременностей составляет 79–100% (123–129). Другие доступные исследования показали, что аспирин (50–81 мг / сут) по сравнению с плацебо или обычным лечением не снижает частоту выкидышей (130, 131). Несмотря на очевидные противоречия, возникшие в результате этих исследований, в систематическом обзоре Кокрейна 2005 г. сделан вывод о том, что женщинам с повторным невынашиванием беременности и антифосфолипидным синдромом следует вводить комбинацию гепарина 5000 МЕ подкожно два раза в день и аспирина в низких дозах (115).Руководства экспертов рекомендуют комбинацию аспирина с низкими дозами гепарина или низкомолекулярным гепарином (132).
Гепарин — препарат выбора во время беременности (133). Гепарин не проникает через плаценту и считается безопасным для эмбриона. Из 2 клинически доступных форм препараты низкомолекулярного гепарина (НМГ) обладают некоторыми преимуществами перед нефракционированным гепарином (НФГ). И НФГ, и НМГ действуют, прежде всего, путем связывания с антитромбином, катализируя связывание молекулы с прокоагулянтами сериновой протеазы и изменяя их активность.НФГ усиливает активность антитромбина в отношении фактора Ха и тромбина, тогда как преобладающий эффект НМГ проявляется через опосредованную антитромбином активность против фактора Ха. У НФГ сложная фармакокинетика, которая в конечном итоге приводит к несколько непредсказуемому антикоагулянтному ответу. Кроме того, биодоступность НФГ после подкожной (п / к) инъекции снижается по сравнению с внутривенной инфузией.
НМГ, напротив, с меньшей вероятностью неспецифически связывается с различными циркулирующими белками или поверхностями клеток и, таким образом, имеет улучшенную фармакокинетику и биодоступность при подкожном введении.Кроме того, НМГ с меньшей вероятностью, чем НФГ, вызывают гепарин-индуцированную тромбоцитопению (ГИТ) и остеопороз, хотя последний нечасто (1-2% случаев) у женщин, получающих лечение во время беременности (100, 103). Важно проконсультировать пациента относительно возможных побочных эффектов гепарина.
Исследования плотности костной ткани следует рассматривать у пациентов, получающих антикоагулянтную терапию с гепарином, или НМГ могут быть важны для женщин, которые получали лечение во время предыдущей беременности или планируют беременность. По большей части более длительный период полувыведения НМГ рассматривается как преимущество, поскольку он позволяет использовать режимы дозирования один или два раза в день.
Беременных с антифосфолипидным синдромом можно классифицировать по:
• Пациенты с антифосфолипидным синдромом без предшествующего тромботического события (диагностированного из-за акушерского события:
(a) пациенты с рецидивирующим ранним (преэмбриональным) или эмбриональный) выкидыш и отсутствие других признаков антифосфолипидного синдрома, или
(b) с одной или более предшествующей внутриутробной смертью (при сроке беременности более 10 недель) или предшествующими ранними родами (при сроке менее 34 лет). недель беременности) из-за тяжелой преэклампсии или плацентарной недостаточности.
• Пациенты с острой ВТЭ в течение нескольких месяцев после зачатия или во время беременности или рецидивирующей ВТЭ (2 или более предшествующих ВТЭ).
В таблице приведены рекомендуемые методы лечения для этих групп.
Таблица 5
— Предлагаемые схемы лечения антифосфолипидного синдрома при беременности.
Таким образом, в Руководстве по доказательной клинической практике Американского колледжа грудных врачей (132) предполагается, что женщины с антифосфолипидными антителами и в анамнезе 2 или более выкидышей на ранних сроках или 1 или более случаев выкидышей на поздних сроках, не имевшие в анамнезе тромбозов, получают лечение комбинацией аспирина и гепарина (нефракционированного или низкомолекулярного) во время беременности.Аспирин (81 мг / сут) следует начинать с попытки зачатия; Большинство исследователей фактически рекомендуют аспирин до зачатия из-за его возможного положительного воздействия на ранних стадиях имплантации (123). Гепарин (5000-10 000 единиц каждые 12 часов) или низкомолекулярный гепарин в профилактических дозах (эноксапарин 40 мг подкожно каждые 24 часа) следует начинать при подтверждении жизнеспособной внутриутробной беременности и продолжать до конца третьего триместра (134 ). Пациенты с тромбозом в анамнезе должны получать полную антикоагулянтную терапию с использованием схемы НФГ или НМГ с отрегулированными дозами (НФГ подкожно каждые 12 ч или эноксапарин 1 мг / кг подкожно каждые 12 часов) в течение как минимум 6 месяцев с момента первоначального обращения с ВТЭ.Женщинам, принимающим варфарин, следует прекратить прием варфарина до 6 недель беременности. Некоторые врачи предпочитают прекращать прием варфарина, когда пациент начинает попытки зачать ребенка, заменяя его НФГ или НМГ. Если пациентка достигает 6 месяцев антикоагуляции во время беременности, целесообразно рассмотреть возможность снижения степени антикоагуляции (например, до профилактического НФГ или НМГ), особенно при подготовке к эпидуральной анестезии. После родов прием НФГ или НМГ следует перезапустить и подключить к варфарину.
О послеродовой терапии гепарином, поскольку кесарево сечение считается риском ВТЭ (96, 107). Рекомендации по тромбопрофилактике (132, 133) предполагают, что этим женщинам во время госпитализации следует проводить тромбопрофилактику с профилактическими НМГ или НФГ или механическую профилактику с помощью компрессионных устройств нижних конечностей. Пациенты с низким и средним риском, получающие НМГ, могут быть переведены на НФГ (из-за его более короткого периода полувыведения) на сроках от 36 до 37 недель, чтобы повысить вероятность эпидуральной анестезии в случае преждевременных родов.Пациентам следует сообщить, что при подозрении на самопроизвольные роды прием гепарина следует прекратить. Для индукционного или планового кесарева сечения прием гепарина в скорректированной дозе и НМГ в промежуточных дозах следует прекратить за 24 часа до запланированного приема.
Профилактический прием гепарина следует прекратить как минимум за 12 часов. Для пациентов из группы высокого риска разумные варианты включают снижение дозы гепарина до 5000 единиц подкожно дважды в день или использование разумно применяемой непрерывной инфузии гепарина во время родов с прекращением, когда роды предполагаются через 1-2 часа.В большинстве случаев гепарин следует возобновить через 6-8 часов после родов или кесарева сечения. Что касается пациентов из группы высокого риска, непрерывную инфузию следует возобновить после родов, когда риск кровотечения снизился (обычно через 2–4 часа после родов). Американское общество региональной анестезии (ASRA) дало рекомендации относительно антикоагуляции и регионарной анестезии. Регионарная анестезия противопоказана пациентам менее чем через 24 часа после приема последней дозы НМГ, принимаемой дважды в день. Для профилактики НМГ регионарная анестезия может быть применена через 10–12 часов после последней дозы гепарина НМГ.Нейроаксиальный катетер следует удалить за 2 часа до первой дозы НМГ. Внутривенное введение гепарина можно начать через 1 час после нейроаксиальной анестезии с удалением катетера через 2–4 часа после последней дозы гепарина. П / к гепарин, вводимый дважды в день с общей дозой менее 10 000 единиц НФГ в день, не является противопоказанием к нейроаксиальной анестезии. Однако безопасная нейроаксиальная анестезия в дозах более 10 000 единиц UFH или дозировка с частотой более двух раз в день не была признана безопасной (135).Терапия (включая аспирин и гепарин) может снизить скорость потери плода до 25%, как описано Cowchock et al. (114).
Чтобы снизить риск послеродового тромбоза глубоких вен, всем женщинам с антифосфолипидным синдромом, с предшествующим тромбозом или без него, рекомендуется антитромботическая терапия в послеродовой период (132). Как правило, женщинам с тромбозом в анамнезе требуется длительная антикоагулянтная терапия, и большинство экспертов предпочитают переключить лечение на варфарин, как только пациент станет клинически стабильным после родов, чтобы ограничить дальнейший риск гепарин-индуцированного остеопороза и перелома костей.Пациентам без предшествующего тромбоза рекомендуется назначать профилактическую дозу гепарина или низкомолекулярный гепарин в течение 4-6 недель после родов (132), хотя варфарин является вариантом. И гепарин, и варфарин безопасны для кормящих матерей (136). Ретроспективное исследование последующего тромбоза у 65 пациенток с предшествующими событиями беременности, которые обычно не получали профилактику после ближайшего послеродового периода, показало, что у таких пациенток частота тромбозов в течение 10 лет наблюдения составляет 59%; однако у пациентов, которые продолжали принимать аспирин в низких дозах, частота составила 10% (58).
Основываясь на этих данных, текущая рекомендация может быть низкой дозой аспирина в послеродовом периоде на неопределенный срок.
Что касается других осложнений беременности, данные метаанализа (137) показали их значительное снижение у женщин с высоким риском преэклампсии, которым давали антиагреганты (в основном аспирин). Во всех клинических исследованиях исходы беременности у матери и плода и новорожденного при сроке беременности более 20 недель были доброкачественными, а частота гибели плода, преэклампсии, тяжелой плацентарной недостаточности и ятрогенных преждевременных родов была близка к таковой в общей акушерской популяции.Результаты рандомизированных исследований не определяют оптимальное лечение женщин со смертью плода (срок беременности> 10 недель) или предшествующими ранними родами (срок беременности <34 недель) из-за тяжелой преэклампсии или плацентарной недостаточности. Большинство экспертов рекомендуют низкие дозы аспирина и гепарин в профилактических или промежуточных дозах (75, 115, 132). Антагонисты витамина К обладают тератогенным действием, и их следует избегать на сроке от 6 до 12 недель беременности.
Из-за риска последующего кровотечения у плода (132, 136) варфарин после 12 недель беременности следует назначать только в исключительных случаях.
Вероятно, существует связь АПЛ с бесплодием, но до сих пор это оставалось спорным. Хотя распространенность антител к aPL увеличивается у пациентов, подвергающихся экстракорпоральному оплодотворению (ЭКО), недавнее проспективное исследование показало, что лечение аспирином и гепарином пациентов ЭКО с положительными антителами к aPL и неудачными циклами ЭКО в анамнезе не улучшает исход цикла ЭКО (138).
Будущие методы лечения
Появляется несколько потенциальных новых терапевтических подходов к APS (таблица).
Таблица 6
— Возможные будущие методы лечения антифосфолипидного синдрома.
Но большинство этих возможных будущих методов лечения (клопидогрель, ривароксабан, статины, ритуксимаб и другие новые антикоагулянты) предназначены для небеременных пациенток. Единственными новыми препаратами от APS, которые могут использовать беременные женщины, являются дипиридамол и гидроксихлорохин.
Комбинированное лечение аспирином и дипиридамолом показало более высокую эффективность, чем только аспирин, у пациентов с инсультом. Такая комбинация может быть рассмотрена у отдельных пациентов с антифосфолипидным синдромом, у которых варфарин не эффективен или безопасен.Наблюдательные исследования показали антитромботический эффект гидроксихлорохина у пациентов с антифосфолипидными антителами, большинство из которых страдают системной красной волчанкой (49, 139, 140).
Кроме того, результаты фундаментальных исследований показали дозозависимое снижение гидроксихлорохином активации тромбоцитов и свертывания крови, вызванного антифосфолипидными антителами (141, 142). Гидроксихлорохин напрямую ингибирует связывание комплексов антифосфолипидное антитело-2-гликопротеин-1 с фосфолипидными поверхностями (143).Дополнительная и ранее неизвестная роль гидроксихлорохина в предотвращении невынашивания беременности подтверждается описанием его защитного действия — экрана аннексина A5, образованного над бислоями фосфолипидов, от повреждений, вызванных антифосфолипидными антителами (144). Ввиду отличного профиля безопасности, включая отсутствие каких-либо побочных эффектов для плода-новорожденного (145) и отсутствие связанного кровотечения, гидроксихлорохин следует рассматривать в качестве адъювантного антитромботического средства у пациентов с системной красной волчанкой, которые положительный на антифосфолипидные антитела.Пациенты с первичным антифосфолипидным синдромом и рецидивирующим тромбозом, несмотря на адекватную антикоагулянтную терапию, которые испытывают трудности с поддержанием адекватной интенсивности антикоагуляции или имеют профиль высокого риска обширного кровотечения, также могут получить пользу от лечения гидроксихлорохином.
Более того, недавние данные экспериментальной модели потери беременности, вызванной антителом aPL, у мышей (33) предполагают, что терапевтический эффект гепарина при заболевании может быть обусловлен ингибированием комплемента, а не его ингибированием коагуляции.Эти данные, если их можно обобщить на потери беременности у людей, связанные с АФС, открывают интригующую возможность новых неантикоагулянтных подходов к лечению.
современное состояние
Реферат
Акушерские осложнения — отличительная черта антифосфолипидного синдрома. Рецидивирующий выкидыш, ранние роды, маловодие, недоношенность, ограничение внутриутробного развития, дистресс плода, тромбоз плода или новорожденного, преэклампсия / эклампсия, HELLP-синдром, артериальный или венозный тромбоз и плацентарная недостаточность являются наиболее серьезными осложнениями, связанными с APS, для беременных женщин.Антифосфолипидные антитела способствуют активации эндотелиальных клеток, моноцитов и тромбоцитов, вызывая перепроизводство тканевого фактора и тромбоксана А2. Активация комплемента может иметь центральную патогенетическую роль. Эти факторы, связанные с типичными изменениями в системе гемостаза при нормальной беременности, приводят к состоянию гиперкоагуляции. Это является причиной тромбоза, который, как предполагается, вызывает многие осложнения беременности, связанные с APS. Акушерский уход основан на комбинированном акушерско-медико-акушерском управлении и лечении с применением аспирина и гепарина.Этот обзор направлен на определение современного состояния APS путем изучения достижений знаний последних лет, чтобы обеспечить наиболее подходящее диагностическое и терапевтическое лечение беременных женщин, страдающих этим синдромом.
Ключевые слова: Антифосфолипид, тромбофилия, гиперкоагуляция, тромбопрофилактика
Введение
Антифосфолипидный синдром (АФС) — это аутоиммунное тромбофильное состояние, которое характеризуется наличием в крови фосфолипидных белков, которые скорее распознают и распознают в крови антитела. чем сам фосфолипид (1).Клинические проявления APS включают тромбоз сосудов и осложнения беременности (2), особенно повторяющиеся самопроизвольные выкидыши и, реже, тромбоз матери (3). Возможны многие другие клинические проявления (4, 55).
Наличие одного только антифосфолипидного антитела (aPL) при отсутствии типичных клинических осложнений не указывает на диагноз APS; Существуют длительно бессимптомные пациенты с aPL-положительным статусом. При диагностировании у пациентов с основным аутоиммунным заболеванием (обычно системной красной волчанкой или СКВ) APS называют вторичным APS; у здоровых людей это называется первичным АФС.Катастрофический антифосфолипидный синдром (CAPS) представляет собой тяжелый конец спектра множественных тромбозов органов за короткий период времени. Мультиорганная недостаточность была описана во время беременности Эшерсоном (6) и послеродовым периодом Коченуром (7).
Клинический спектр этого синдрома расширился (8, 9), благодаря значительному прогрессу в изучении его патогенеза и клинического ведения за последние несколько лет.
Материалы и методы
В этой работе мы стремились предложить современный взгляд на основные патофизиологические, клинические, диагностические и терапевтические достижения в области антифосфолипидного синдрома.
Литературный поиск проводился с 2006 по 2011 год, уделяя больше внимания последним исследованиям. База данных PubMed использовалась с терминами медицинских предметных заголовков «антифосфолипидный синдром» ИЛИ «антитела, антифосфолипиды» ИЛИ «волчаночный антикоагулянт». Был проведен поиск в Кокрановской базе данных систематических обзоров по ключевому слову «антифосфолипид». Мы получили дополнительные статьи из справочных разделов выбранных рукописей. Мы уделили особое внимание систематическим обзорам, рандомизированным клиническим испытаниям, согласованным документам и обзорным статьям, посвященным диагностике и терапии антифосфолипидного синдрома.Были также включены более старые статьи, чтобы привлечь внимание к патогенетическим, клиническим и эпидемиологическим вопросам.
Обсуждение
Этиология и патогенез
Как и другие аутоиммунные заболевания, APS не имеет известной этиологии. Существует несколько гипотез, объясняющих возможную причину (10):
Пассивный перенос материнских антител опосредует аутоиммунные нарушения у плода и новорожденного. Механизм избыточной продукции аутоантител и образования иммунных комплексов не совсем понятен, хотя текущие исследования сосредоточены на аномальных функциях регулятора и возможности медленной вирусной инфекции.
Сообщалось о семейном возникновении aPL, и предполагаемые генетические ассоциации включают HLA-DR4, DR7, DRw53 и нулевой аллель C4 (11).
Молекулы PL вездесущи по своей природе и присутствуют на внутренней поверхности клетки и в микроорганизмах. Следовательно, при инфекционных заболеваниях, включая вирусные (например, ВИЧ, вирус Эпштейна-Барра [EBV], цитомегаловирус [CMV], аденовирусы), бактериальные (например, бактериальный эндокардит, туберкулез, микоплазменная пневмония), спирохетальные (например, сифилис, лептоспироз). , Болезнь Лайма) и паразитарные (например, малярийная инфекция), разрушение клеточных мембран может происходить во время повреждения клеток.PL высвобождают и стимулируют антитела к aPL.
Антифосфолипидные антитела можно в целом разделить на те антитела, которые продлевают фосфолипид-зависимые анализы коагуляции, известные как волчаночные антикоагулянты (LA) или антикардиолипиновые антитела (aCL), которые нацелены на молекулярный конгенер кардиолипина (сердечный белок крупного рогатого скота). Волчаночные антикоагулянты (LA) снижают коагулянтный потенциал плазмы и увеличивают время свертывания в тестах на коагуляцию, основанных на активированном частичном тромбопластиновом времени (12).
Консенсусные рекомендации рекомендуют скрининг на LA с помощью 2 или более тестов на фосфолипид-зависимую коагуляцию (13). Антикоагулянтная терапия может помешать выявлению ЛА (14). Антикардиолипиновые антитела (aCL) обладают общей аффинностью связывания in vitro с кардиолипином и могут быть обнаружены с помощью иммуноферментных анализов. Тесты иммуноферментного анализа на aCL плохо стандартизированы, а тестирование aCL показало плохое соответствие между лабораториями (12). И LA, и aCL могут демонстрировать специфичность в отношении 2-гликопротеина I (2GPI) (15, 16).Фактически, даже если описаны многие другие антигенные мишени, включая белки C и S, протромбин (17) и аннексин V (18), основным антигеном, распознаваемым аутоантителами к фосфолипидам (aPL), является 2-гликопротеин I, также известный как аполипопротеин H, член суперсемейства белка контроля комплемента или короткого консенсусного повтора (SCR). Белок имеет форму рыболовного крючка и связывается с анионными фосфолипидными бислоями через катионные и гидрофобные аминокислоты в пятом из его 5 SCR-доменов, около карбоксиконца (19).Недавние данные показали, что субнабор антител против aPL ( Anti-2-гликопротеин I антител ) (20, 21), связанных с повышенным риском тромбоза и эмболии, распознает эпитоп в домене I 2GPI, который состоит из Gly40-Arg43. (22, 23). Было высказано предположение, что опосредованная антителами димеризация и пентамеризация 2GPI увеличивают аффинность / авидитность иммунных комплексов антитело-2GPI к фосфолипиду и что это увеличение может быть ответственно за патогенные эффекты антител против aPL (23).Лабораторный анализ этих антител не стандартизирован, что затрудняет сравнение исследований (16). Есть некоторые свидетельства того, что эти антитела более специфичны для APS (24).
Антифосфолипидные антитела с активностью против 2-гликопротеина-1 действуют по множеству механизмов (25, 26):
—
APL активируют эндотелиальные клетки (27), и они экспрессируют молекулы адгезии (такие как молекула межклеточной адгезии 1, молекула адгезии сосудистых клеток-1, Е-селектин) и (подобно моноцитам) повышают выработку тканевого фактора (28).
—
APL активирует моноциты и индуцирует их повышенную экспрессию тканевого фактора (29).
—
APL активирует тромбоциты, которые увеличивают экспрессию гликопротеина 2b-3a и синтез тромбоксана A2. Активация эндотелиальных клеток, моноцитов и тромбоцитов антифосфолипидными антителами, что ведет к усиленному синтезу тканевого фактора и тромбоксана A2. вызывают прокоагулянтное состояние (30, 31).
—
Активация каскада комплемента может закрыть петлю7 и спровоцировать тромбоз и потерю плода (32-35).Часто это происходит при втором ударе (36). Традиционные факторы риска сердечно-сосудистых заболеваний, такие как табак, воспаление или эстрогены, могут играть важную роль на этом этапе, на самом деле такие факторы риска присутствуют более чем у 50% пациентов с антифосфолипидным синдромом. Чтобы подтвердить роль комплемента, исследования показывают, что фрагменты C4d и C3b откладываются в плаценте пациентов с антифосфолипидным синдромом (37).
—
Кроме того, взаимодействие антифосфолипидных антител с белками, участвующими в регуляции свертывания, такими как протромбин, фактор X, протеины C и S (38) и плазмин (39), ингибитор пути тканевого фактора (40), может препятствуют инактивации прокоагулянтных факторов и препятствуют фибринолизу (28, 36).
Взаимодействие с аннексином А5, природным антикоагулянтом, который связывается с фосфатидилсерином, воздействующим на формирование синцития трофобласта, может способствовать более прямому воздействию на структуры плаценты, способствуя тромбозу плаценты и потере плода (18, 28, 41).
В качестве доказательства того, что тромбоз является причиной многих акушерских осложнений, были описаны нарушения плацентации при невынашивании беременности, связанные с антифосфолипидными антителами (42). 2-гликопротеин 1 напрямую связывается с культивируемыми клетками цитотрофобласта и впоследствии распознается антителами к 2-гликопротеину 1 (43).Более того, антифосфолипидные антитела могут вызывать воспалительный ответ, опосредованный путем TLR4 / MyD88, что приводит к повреждению трофобласта (44).
Эпидемиология aPL
Сообщалось, что распространенность aCL и LAC в нормальных здоровых популяциях колеблется от 1,0% до 5,6% и от 1,0% до 3,6%, соответственно (45–47). Распространенность повышенных антител к aPL также может увеличиваться с возрастом (48). Около одной трети пациентов с СКВ имеют aCL-положительный результат. Распространенность ЛП у пациентов с СКВ составляет около 15%.Положительный LA более специфичен для APS, чем повышенный aCL. Сила связи между aPL и тромбозом варьируется. В первую очередь, aCL не являются таким сильным фактором риска тромбоза, как LA. Волчаночный антикоагулянт неизменно является наиболее сильным предиктором тромбоза (49–51).
Около 40% пациентов с системной красной волчанкой имеют антифосфолипидные антитела (52), но менее 40% из них в конечном итоге будут иметь тромботические события (49, 53). Однако тромботический антифосфолипидный синдром считается основным неблагоприятным прогностическим фактором у пациентов с волчанкой (53).Важны титр и изотип: aCL IgG сильнее связаны с клиническими проявлениями, чем aCL IgM, и риск тромбоза увеличивается с более высокими титрами (> 40 U). Иммуноглобулин A aCL и низкие титры IgG и IgM aCL реже связаны с осложнениями (54).
APL составляют значительную долю тромбозов в общей популяции (55-57).
Наличие дополнительных факторов протромботического риска у aPL-положительных лиц, вероятно, влияет на риск тромбоза.Согласно принятой в настоящее время гипотезе «второго удара», второе триггерное событие — например, курение сигарет, оральные контрацептивы, хирургические процедуры, длительная иммобилизация или генетическое протромботическое состояние — может повысить вероятность того, что у пациента с положительным АФЛ развивается сосудистая патология. мероприятие. Женщины, у которых только наступила беременность, имеют высокую вероятность развития тромбоза в более поздние годы (58).
Диагностика APS
Критерии
В 1998 г. предварительные критерии классификации антифосфолипидного синдрома были предложены в Саппоро, Япония (60).Для классификации этого синдрома необходимо наличие по крайней мере одного клинического проявления вместе с положительными тестами на циркулирующие антифосфолипидные антитела, включая волчаночный антикоагулянт или антикардиолипин, или и то, и другое, при средних или высоких значениях, обнаруживаемых не менее двух раз в течение 6 недель. В 2006 г. критерии классификации были обновлены (61) и перечислены в таблице.
Таблица 1
— Краткое изложение Сиднейского консенсуса по критериям классификации расследований для APS (61).
По существу, клинические критерии остались неизменными; однако были внесены два важных изменения: время, прошедшее между двумя положительными определениями, было увеличено до 12 недель, чтобы гарантировать обнаружение только стойких антител; и анти-2-гликопротеин 1, как IgG, так и IgM, были добавлены к лабораторным критериям.Средние титры антикардиолипина или анти-2-гликопротеина 1 были определены как более 40 GPL или MPL или выше 99-го процентиля. Примечательно, что изотипы IgA, антипротромбиновые антитела и антитела, направленные против фосфатидилсерин-протромбинового комплекса, остались исключенными из критериев. Эти модификации подверглись критике (63), и дискуссия о клинических последствиях различных антифосфолипидных антител все еще остается открытой.
Вы можете распознать различные типы APS. См. Таблицу.
Таблица 2
— Типы пациентов, у которых есть антифосфолипидные (aPL) антитела.
Обзор лабораторных тестов
Лабораторные тесты, которые часто используются для диагностики этого состояния, показаны в таблице.
Таблица 3
— Тесты, используемые для диагностики антифосфолипидного синдрома.
Первым тестом, который идентифицировал это состояние, был тест на биологический ложноположительный (BFP) сифилис, который фактически сообщил о распознавании аутоантителами фосфолипид-связывающих белков, в первую очередь 2GPI (в отличие от истинно-положительных тестов на сифилис, в которых антитела распознают фосфолипид напрямую).Тест на сифилис BFP был сначала доработан до количественного иммуноанализа на антикардиолипин (64), а затем включал иммуноанализы, в которых использовались другие фосфолипиды, такие как фосфатидилсерин, и иммуноанализы, которые выявляли антитела против предполагаемых антигенов, в первую очередь 2GPI. Второй способ диагностического тестирования, проводимого для тестов, которые сообщают о влиянии на фосфолипид-зависимые реакции коагуляции, вызывая увеличенное время свертывания крови с помощью любого из следующих тестов: активированное частичное тромбопластиновое время (АЧТВ), разбавленное время яда гадюки Рассела (dRVVT), каолин время свертывания, время свертывания плазмы.Это продление должно быть подтверждено смешиванием исследований с нормальной плазмой (время свертывания остается увеличенным с LA) или тестом нейтрализации тромбоцитов.
Высокоаффинные (авидные) комплексы фосфолипид-связывающее антитело-кофакторфосфолипид являются вероятной основой феномена LA. Оба подхода — иммуноферментный анализ и исследование LA — можно рассматривать как эмпирически полученные суррогатные тесты для синдрома. Чувствительность и специфичность тестов различны, и один отрицательный тест не может исключить диагноз пациента.Обычно рекомендуется провести ряд тестов, чтобы попытаться исключить диагноз. Специфический ELISA для антител, направленных против домена 1 2-гликопротеина, является одним из новых ожидаемых тестов, которые потребуют оценки (65).
Наличие более одного класса антифосфолипидных антител увеличивает риск тромбоза (20). Пациенты с положительными результатами всех трех основных анализов — положительный LAC, повышенный уровень антикардиолипиновых антител и повышенный уровень антител против 2GPI (так называемый «тройной положительный результат»), имеют значительно повышенный риск тромбоза (66-68) и осложнений беременности. (69).
Эти тесты бесполезны для скрининга бессимптомных общих медицинских или акушерских групп. В настоящее время тестирование на антитела к aPL обычно должно быть ограничено пациентами, у которых был тромбоз, эмболия или осложнения беременности, которые могут быть связаны с APS, и пациентами с SLE, даже если у них не было ни одного из вышеперечисленных проявлений. Всегда необходимо проводить ряд анализов.
Акушерские осложнения
Антифосфолипидный синдром вызывает несколько клинических проявлений.См. Таблицу.
Таблица 4
— Клинические проявления антифосфолипидного синдрома.
Акушерские осложнения — еще одна отличительная черта антифосфолипидного синдрома.
Риск тромбоза у женщин с антифосфолипидными антителами может быть повышен (58). Предполагается, что тромбоз является причиной многих осложнений беременности, связанных с АФС. Наиболее частым акушерским проявлением этого синдрома является повторный выкидыш. Рецидивирующий выкидыш происходит примерно у 1% населения в целом, пытающегося иметь детей (70).Около 10-15% женщин с повторным невынашиванием беременности диагностируют антифосфолипидный синдром (71, 72). Потеря плода (≥10 недель беременности) сильнее связана с АФЛ, чем потеря плода на более ранней стадии (73). Волчаночный антикоагулянт тесно связан с повторным невынашиванием беременности до 24-й недели беременности (74). В целом, примерно половина случаев потери беременности, связанной с aPL, происходит в первом триместре (преэмбриональная и эмбриональная потеря, <10 недель беременности) (75). Диагноз APS следует ставить только при трех или более последовательных потерях при отсутствии другой идентифицируемой этиологии.Двумя наибольшими факторами риска потери плода являются высокий титр aCL IgG и предыдущая потеря плода в анамнезе. У таких пациенток риск невынашивания беременности составляет до 80% (76). Как IgG, так и IgM антикардиолипины связаны с повышенным риском выкидыша, хотя и в меньшей степени, чем волчаночный антикоагулянт (74). Клиническая значимость антител против 2-гликопротеина I также не ясна; в трех систематических обзорах (16, 50, 74). у других эти антитела не были связаны ни с тромбозом, ни с повторным ранним выкидышем (23, 77, 78).они показали повышенный риск акушерских осложнений и тромбозов. Также риск потери плода среди бессимптомных женщин, у которых есть антифосфолипидные антитела, по-видимому, повышен (58, 79-82). Хотя гибель плода связана с антифосфолипидным синдромом (83), общий вклад этого синдрома неясен, отчасти из-за влияния других возможных способствующих факторов, таких как лежащая в основе гипертония или ранее существовавшие сопутствующие заболевания, такие как системная красная волчанка или заболевание почек. .
Акушерские проявления APS не ограничиваются потерей плода (8, 58,75, 84-86). Текущие критерии APS включают ранние роды, маловодие, неонатальные осложнения (такие как недоношенность оценивается в 30-60% и чаще встречается у пациентов с СКВ, задержка внутриутробного развития — IUGR -, дистресс плода (60) и редко тромбоз плода или новорожденного) (87 ), сопутствующие акушерские осложнения у матери (такие как преэклампсия / эклампсия и HELLP-синдром — гемолитическая анемия, повышенные ферменты печени и низкое количество тромбоцитов, артериальный или венозный тромбоз) и другие осложнения, связанные с aPL (плацентарная недостаточность) (75).Связь между антифосфолипидными антителами и риском преждевременных родов из-за эклампсии или преэклампсии и ограничения внутриутробного развития остается спорной; исследования, предоставляющие данные в этой области, как правило, небольшие, ретроспективные и дают противоречивые результаты (88, 89). Кроме того, токсичность методов лечения, оцениваемых в этих исследованиях, может способствовать потере или осложнению беременности и может затруднять связь между антифосфолипидными антителами и неблагоприятными исходами беременности (90).
Скрининг здоровых беременных не показан (91).
Хотя и aCL, и LA предсказывают потерю плода, соответствие неполное, поэтому при подозрении на APS необходимо провести тестирование обоих. Другие APL не так полезны для прогнозирования риска. Фактически, антитела, направленные против других фосфолипидов, таких как антифосфатидилсерин или антифосфатидилэтаноламин, обычно не позволяют идентифицировать дополнительных пациентов (92). Неясно, добавляют ли анти-2GPI антитела значительную прогностическую ценность aCL и LA при выявлении пациентов с риском потери плода (93), хотя иногда пациенты могут иметь только эти антитела.Исключение сопутствующих условий важно у пациенток с АФЛ-положительными заболеваниями во время беременности.
Гинекологические состояния могут включать аномалии матки, гормональный дисбаланс (например, дефект лютеиновой фазы), аномалии материнского и отцовского кариотипа или генетические аномалии плода. Кроме того, наличие наследственного прокоагулянтного состояния, такого как фактор V Лейдена, может имитировать APS (94).
Тяжелым осложнением беременности, которое значительно увеличивает риск АФС, является ВТЭ.
Беременность и послеродовой период фактически несут повышенный риск ВТЭ с частотой от 0,61 до 1,72 на 1000 родов (95, 96). По сравнению с небеременными женщинами вероятность развития ВТЭ у беременных и женщин в послеродовом периоде примерно в 4–5 раз выше (97).
Триада Вирхова описывает 3 элемента, которые способствуют развитию тромбоза: (а) застой, (б) сосудистая травма и (в) гиперкоагуляция. Все эти элементы присутствуют во время беременности и в послеродовой период.Венозный застой нижних конечностей был продемонстрирован во время беременности (98). Скорость венозного кровотока уменьшается по мере продвижения беременности и ниже в левой конечности по сравнению с правой нижней конечностью. Когда ТГВ проявляется во время беременности, он, скорее всего, находится в левой нижней конечности (9, 99). Преобладание образования сгустка левой нижней конечности может быть связано с компрессией левой общей подвздошной вены увеличивающейся беременной маткой (100). Кроме того, было продемонстрировано расширение вен, что может привести к повреждению эндотелия и протромботическим изменениям эндотелия (101).Скорость венозного кровотока в нижних конечностях увеличилась, а диаметр сосудов уменьшился между 4 и 42 днями после родов (102). Скорость и диаметр венозного кровотока вернулись к уровням, наблюдаемым на ранних сроках беременности на 42-дневном измерении (101, 102). Помимо механического сжатия вен таза, повышенный уровень циркулирующего эстрогена и местная выработка простациклина и оксида азота увеличивают емкость глубоких вен во время беременности (103). Более того, нормальная беременность сопровождается изменениями в системе гемостаза, которые могут привести к гиперкоагуляции для предотвращения кровотечения во время родов:
—
Факторы II, VII, VIII, IX, XII, и увеличение фактора фон Виллебранда (104).
—
Уровни фибриногена повышаются до уровней, которые почти в два раза выше, чем в небеременном состоянии (104, 105).
—
Снижение уровней антигена свободного и общего белка S, а также снижение активности происходит на очень ранних сроках беременности.
—
Хотя уровни протеина C остаются неизменными (104, 106), общее повышение устойчивости к активированному протеину C присутствует, причем степень устойчивости зависит от нескольких модификаторов, включая наличие лейденской мутации фактора V ( FVLM), образование тромбина и наличие антифосфолипидных антител (107).Снижается фибринолиз, в основном из-за снижения активности тканевого активатора плазминогена.
—
Другие маркеры состояния гиперкоагуляции включают увеличение комплексов тромбин-антитромбин, фрагменты протромбина 1 и 2, пиковое образование тромбина и повышенные уровни D-димера (104-106).
Во время беременности может также произойти травма сосудов в виде повреждения эндотелия из-за расширения вен (101) или может возникнуть при таких состояниях, как преэклампсия, когда присутствует активация эндотелия сосудов (108).
Во время нормальных родов может возникнуть венозное сжатие.
Считается, что оперативные и вспомогательные роды способствуют травме сосудов, а также, возможно, повышают риск тромбоза в послеродовом периоде; особенно это касается кесарева сечения.
Тестирование на антифосфолипидный синдром (с помощью волчаночного антикоагулянта, антикардиолипина и анти-2-гликопротеина I) является обычной практикой при первом эпизоде ВТЭ, поскольку пациенты с антифосфолипидным синдромом должны рассматриваться для длительной антикоагуляции (109).Важно исключить антифосфолипидный синдром, так как этот диагноз может изменить уход за беременными, а также будет показанием для применения гепарина.
Ведение и антитромботическое лечение APS во время беременности
При правильном ведении более 70% беременных женщин с антифосфолипидным синдромом родят жизнеспособного живого ребенка (110). В идеале предварительное консультирование дает врачу возможность понять конкретный контекст каждой пациентки с синдромом и обозначить риски беременности и лечения.Всем женщинам с тяжелой легочной гипертензией следует препятствовать беременности из-за высокого риска материнской смерти (111), и ее следует отложить на фоне неконтролируемой гипертензии или недавних тромботических событий, особенно инсульта (111). Перед планированием беременности должен быть доступен полный профиль антифосфолипидных антител, включая повторные антикардиолипиновые и волчаночные антикоагулянты. Однако эти тесты не нужно повторять во время беременности, поскольку последующие отрицательные результаты (после диагностических, повторно положительных тестов) не устраняют риск осложнений (111).
Пациентов следует консультировать во всех случаях относительно симптомов тромбоза и тромбоэмболии, а также информировать и часто обследовать на предмет признаков или симптомов тромбоза или тромбоэмболии, тяжелой преэклампсии или снижения подвижности плода. Мы рекомендуем частые дородовые посещения, по крайней мере, каждые 2-4 недели до середины беременности и каждые 1-2 недели после этого.
Значения хорионического гонадотропина человека (ХГЧ) в первом триместре можно отслеживать для оценки жизнеспособности беременности.Если уровень ХГЧ повышается нормально (то есть удваивается каждые 2 дня) в первый месяц беременности, успешный результат прогнозируется в 80-90% случаев. Однако, когда увеличение является ненормальным (т. Е. Более медленным), плохой результат прогнозируется в 70-80% случаев. Пациентам с плохим акушерским анамнезом, признаками преэклампсии или признаками задержки роста плода рекомендуется ультразвуковое исследование каждые 3-4 недели, начиная с 18-20 недель беременности. Целями пренатальной помощи во втором и третьем триместрах являются тщательное наблюдение за материнской гипертензией, протеинурией и другими признаками преэклампсии, частое обследование пациентов, акушерское ультразвуковое исследование для оценки роста плода и объема околоплодных вод, а также соответствующее обследование плода.Надзорное тестирование следует начинать на сроке гестации 32 недели или раньше, если есть подозрение на клиническую ситуацию недостаточности плаценты, и проводить его, по крайней мере, каждую неделю до родов. Рекомендуется регулярная и скоординированная консультация врача каждые 2-4 недели, особенно женщинам с системной красной волчанкой. Пациентам с неосложненным АФС рекомендуется ультразвуковое исследование на сроке беременности 30-32 недели для оценки роста плода. Задержка роста плода может отражать маточно-плацентарную недостаточность у пациентов с АФС (10).Допплерография матки и пупочной артерии широко используется в Европе для оценки риска преэклампсии, плацентарной недостаточности и задержки роста плода после 20-й недели гестации, а обычные обследования имеют высокую отрицательную прогностическую ценность (112).
Целями лечения беременных женщин с антифосфолипидным синдромом являются улучшение исходов у матери и плода-неонат путем сведения к минимуму рисков признанных осложнений заболевания, включая тромбоз у матери, потерю плода, преэклампсию, плацентарную недостаточность и внутриутробное развитие плода. ограничение роста и необходимость ятрогенных преждевременных родов (75).
Оптимальное лечение беременных женщин антифосфолипидными антителами и одной или более гибелью плода после 10 недель беременности без тромбоза является спорным (113).
Самым ранним методом лечения повторяющейся потери беременности, связанной с АФЛ, была комбинация высоких доз преднизона и низких доз аспирина, с успешным исходом в 75% пролеченных беременностей. Однако это привело к высокой заболеваемости матери и плода, включая гестационный диабет, гипертензию и преждевременный разрыв плодных оболочек.Рандомизированное контролируемое исследование преднизона и аспирина по сравнению с гепарином и аспирином показало, что подкожное введение низких доз гепарина с низкими дозами аспирина одинаково эффективно при меньшей заболеваемости (114). Более того, Кокрановский анализ показал, что внутривенные иммуноглобулины были связаны с повышенным риском потери беременности или преждевременных родов по сравнению с гепарином и низкими дозами аспирина (115).
Затем исследования, сфокусированные на эффективности терапии НФГ, НМГ и низкими дозами аспирина и их возможной связи, привели к противоречивым результатам.В двух исследованиях (116, 117) доля успешных беременностей существенно улучшилась при добавлении нефракционированного гепарина к низким дозам аспирина. Два других рандомизированных испытания (118,119), в которых использовался низкомолекулярный гепарин, оказались отрицательными. Кроме того, в двух исследованиях не было зарегистрировано различий в исходах беременности при сравнении нефракционированного гепарина с низкомолекулярным гепарином в сочетании с аспирином (120, 121). Более того, низкие дозы нефракционированного гепарина подкожно (5000 единиц два раза в день) оказываются столь же эффективными, как и высокие дозы гепарина (10000 единиц два раза в день) (117, 122).Наконец, в нескольких обсервационных исследованиях сообщается, что при применении только низких доз аспирина частота успешных беременностей составляет 79–100% (123–129). Другие доступные исследования показали, что аспирин (50–81 мг / сут) по сравнению с плацебо или обычным лечением не снижает частоту выкидышей (130, 131). Несмотря на очевидные противоречия, возникшие в результате этих исследований, в систематическом обзоре Кокрейна 2005 г. сделан вывод о том, что женщинам с повторным невынашиванием беременности и антифосфолипидным синдромом следует вводить комбинацию гепарина 5000 МЕ подкожно два раза в день и аспирина в низких дозах (115).Руководства экспертов рекомендуют комбинацию аспирина с низкими дозами гепарина или низкомолекулярным гепарином (132).
Гепарин — препарат выбора во время беременности (133). Гепарин не проникает через плаценту и считается безопасным для эмбриона. Из 2 клинически доступных форм препараты низкомолекулярного гепарина (НМГ) обладают некоторыми преимуществами перед нефракционированным гепарином (НФГ). И НФГ, и НМГ действуют, прежде всего, путем связывания с антитромбином, катализируя связывание молекулы с прокоагулянтами сериновой протеазы и изменяя их активность.НФГ усиливает активность антитромбина в отношении фактора Ха и тромбина, тогда как преобладающий эффект НМГ проявляется через опосредованную антитромбином активность против фактора Ха. У НФГ сложная фармакокинетика, которая в конечном итоге приводит к несколько непредсказуемому антикоагулянтному ответу. Кроме того, биодоступность НФГ после подкожной (п / к) инъекции снижается по сравнению с внутривенной инфузией.
НМГ, напротив, с меньшей вероятностью неспецифически связывается с различными циркулирующими белками или поверхностями клеток и, таким образом, имеет улучшенную фармакокинетику и биодоступность при подкожном введении.Кроме того, НМГ с меньшей вероятностью, чем НФГ, вызывают гепарин-индуцированную тромбоцитопению (ГИТ) и остеопороз, хотя последний нечасто (1-2% случаев) у женщин, получающих лечение во время беременности (100, 103). Важно проконсультировать пациента относительно возможных побочных эффектов гепарина.
Исследования плотности костной ткани следует рассматривать у пациентов, получающих антикоагулянтную терапию с гепарином, или НМГ могут быть важны для женщин, которые получали лечение во время предыдущей беременности или планируют беременность. По большей части более длительный период полувыведения НМГ рассматривается как преимущество, поскольку он позволяет использовать режимы дозирования один или два раза в день.
Беременных с антифосфолипидным синдромом можно классифицировать по:
• Пациенты с антифосфолипидным синдромом без предшествующего тромботического события (диагностированного из-за акушерского события:
(a) пациенты с рецидивирующим ранним (преэмбриональным) или эмбриональный) выкидыш и отсутствие других признаков антифосфолипидного синдрома, или
(b) с одной или более предшествующей внутриутробной смертью (при сроке беременности более 10 недель) или предшествующими ранними родами (при сроке менее 34 лет). недель беременности) из-за тяжелой преэклампсии или плацентарной недостаточности.
• Пациенты с острой ВТЭ в течение нескольких месяцев после зачатия или во время беременности или рецидивирующей ВТЭ (2 или более предшествующих ВТЭ).
В таблице приведены рекомендуемые методы лечения для этих групп.
Таблица 5
— Предлагаемые схемы лечения антифосфолипидного синдрома при беременности.
Таким образом, в Руководстве по доказательной клинической практике Американского колледжа грудных врачей (132) предполагается, что женщины с антифосфолипидными антителами и в анамнезе 2 или более выкидышей на ранних сроках или 1 или более случаев выкидышей на поздних сроках, не имевшие в анамнезе тромбозов, получают лечение комбинацией аспирина и гепарина (нефракционированного или низкомолекулярного) во время беременности.Аспирин (81 мг / сут) следует начинать с попытки зачатия; Большинство исследователей фактически рекомендуют аспирин до зачатия из-за его возможного положительного воздействия на ранних стадиях имплантации (123). Гепарин (5000-10 000 единиц каждые 12 часов) или низкомолекулярный гепарин в профилактических дозах (эноксапарин 40 мг подкожно каждые 24 часа) следует начинать при подтверждении жизнеспособной внутриутробной беременности и продолжать до конца третьего триместра (134 ). Пациенты с тромбозом в анамнезе должны получать полную антикоагулянтную терапию с использованием схемы НФГ или НМГ с отрегулированными дозами (НФГ подкожно каждые 12 ч или эноксапарин 1 мг / кг подкожно каждые 12 часов) в течение как минимум 6 месяцев с момента первоначального обращения с ВТЭ.Женщинам, принимающим варфарин, следует прекратить прием варфарина до 6 недель беременности. Некоторые врачи предпочитают прекращать прием варфарина, когда пациент начинает попытки зачать ребенка, заменяя его НФГ или НМГ. Если пациентка достигает 6 месяцев антикоагуляции во время беременности, целесообразно рассмотреть возможность снижения степени антикоагуляции (например, до профилактического НФГ или НМГ), особенно при подготовке к эпидуральной анестезии. После родов прием НФГ или НМГ следует перезапустить и подключить к варфарину.
О послеродовой терапии гепарином, поскольку кесарево сечение считается риском ВТЭ (96, 107). Рекомендации по тромбопрофилактике (132, 133) предполагают, что этим женщинам во время госпитализации следует проводить тромбопрофилактику с профилактическими НМГ или НФГ или механическую профилактику с помощью компрессионных устройств нижних конечностей. Пациенты с низким и средним риском, получающие НМГ, могут быть переведены на НФГ (из-за его более короткого периода полувыведения) на сроках от 36 до 37 недель, чтобы повысить вероятность эпидуральной анестезии в случае преждевременных родов.Пациентам следует сообщить, что при подозрении на самопроизвольные роды прием гепарина следует прекратить. Для индукционного или планового кесарева сечения прием гепарина в скорректированной дозе и НМГ в промежуточных дозах следует прекратить за 24 часа до запланированного приема.
Профилактический прием гепарина следует прекратить как минимум за 12 часов. Для пациентов из группы высокого риска разумные варианты включают снижение дозы гепарина до 5000 единиц подкожно дважды в день или использование разумно применяемой непрерывной инфузии гепарина во время родов с прекращением, когда роды предполагаются через 1-2 часа.В большинстве случаев гепарин следует возобновить через 6-8 часов после родов или кесарева сечения. Что касается пациентов из группы высокого риска, непрерывную инфузию следует возобновить после родов, когда риск кровотечения снизился (обычно через 2–4 часа после родов). Американское общество региональной анестезии (ASRA) дало рекомендации относительно антикоагуляции и регионарной анестезии. Регионарная анестезия противопоказана пациентам менее чем через 24 часа после приема последней дозы НМГ, принимаемой дважды в день. Для профилактики НМГ регионарная анестезия может быть применена через 10–12 часов после последней дозы гепарина НМГ.Нейроаксиальный катетер следует удалить за 2 часа до первой дозы НМГ. Внутривенное введение гепарина можно начать через 1 час после нейроаксиальной анестезии с удалением катетера через 2–4 часа после последней дозы гепарина. П / к гепарин, вводимый дважды в день с общей дозой менее 10 000 единиц НФГ в день, не является противопоказанием к нейроаксиальной анестезии. Однако безопасная нейроаксиальная анестезия в дозах более 10 000 единиц UFH или дозировка с частотой более двух раз в день не была признана безопасной (135).Терапия (включая аспирин и гепарин) может снизить скорость потери плода до 25%, как описано Cowchock et al. (114).
Чтобы снизить риск послеродового тромбоза глубоких вен, всем женщинам с антифосфолипидным синдромом, с предшествующим тромбозом или без него, рекомендуется антитромботическая терапия в послеродовой период (132). Как правило, женщинам с тромбозом в анамнезе требуется длительная антикоагулянтная терапия, и большинство экспертов предпочитают переключить лечение на варфарин, как только пациент станет клинически стабильным после родов, чтобы ограничить дальнейший риск гепарин-индуцированного остеопороза и перелома костей.Пациентам без предшествующего тромбоза рекомендуется назначать профилактическую дозу гепарина или низкомолекулярный гепарин в течение 4-6 недель после родов (132), хотя варфарин является вариантом. И гепарин, и варфарин безопасны для кормящих матерей (136). Ретроспективное исследование последующего тромбоза у 65 пациенток с предшествующими событиями беременности, которые обычно не получали профилактику после ближайшего послеродового периода, показало, что у таких пациенток частота тромбозов в течение 10 лет наблюдения составляет 59%; однако у пациентов, которые продолжали принимать аспирин в низких дозах, частота составила 10% (58).
Основываясь на этих данных, текущая рекомендация может быть низкой дозой аспирина в послеродовом периоде на неопределенный срок.
Что касается других осложнений беременности, данные метаанализа (137) показали их значительное снижение у женщин с высоким риском преэклампсии, которым давали антиагреганты (в основном аспирин). Во всех клинических исследованиях исходы беременности у матери и плода и новорожденного при сроке беременности более 20 недель были доброкачественными, а частота гибели плода, преэклампсии, тяжелой плацентарной недостаточности и ятрогенных преждевременных родов была близка к таковой в общей акушерской популяции.Результаты рандомизированных исследований не определяют оптимальное лечение женщин со смертью плода (срок беременности> 10 недель) или предшествующими ранними родами (срок беременности <34 недель) из-за тяжелой преэклампсии или плацентарной недостаточности. Большинство экспертов рекомендуют низкие дозы аспирина и гепарин в профилактических или промежуточных дозах (75, 115, 132). Антагонисты витамина К обладают тератогенным действием, и их следует избегать на сроке от 6 до 12 недель беременности.
Из-за риска последующего кровотечения у плода (132, 136) варфарин после 12 недель беременности следует назначать только в исключительных случаях.
Вероятно, существует связь АПЛ с бесплодием, но до сих пор это оставалось спорным. Хотя распространенность антител к aPL увеличивается у пациентов, подвергающихся экстракорпоральному оплодотворению (ЭКО), недавнее проспективное исследование показало, что лечение аспирином и гепарином пациентов ЭКО с положительными антителами к aPL и неудачными циклами ЭКО в анамнезе не улучшает исход цикла ЭКО (138).
Будущие методы лечения
Появляется несколько потенциальных новых терапевтических подходов к APS (таблица).
Таблица 6
— Возможные будущие методы лечения антифосфолипидного синдрома.
Но большинство этих возможных будущих методов лечения (клопидогрель, ривароксабан, статины, ритуксимаб и другие новые антикоагулянты) предназначены для небеременных пациенток. Единственными новыми препаратами от APS, которые могут использовать беременные женщины, являются дипиридамол и гидроксихлорохин.
Комбинированное лечение аспирином и дипиридамолом показало более высокую эффективность, чем только аспирин, у пациентов с инсультом. Такая комбинация может быть рассмотрена у отдельных пациентов с антифосфолипидным синдромом, у которых варфарин не эффективен или безопасен.Наблюдательные исследования показали антитромботический эффект гидроксихлорохина у пациентов с антифосфолипидными антителами, большинство из которых страдают системной красной волчанкой (49, 139, 140).
Кроме того, результаты фундаментальных исследований показали дозозависимое снижение гидроксихлорохином активации тромбоцитов и свертывания крови, вызванного антифосфолипидными антителами (141, 142). Гидроксихлорохин напрямую ингибирует связывание комплексов антифосфолипидное антитело-2-гликопротеин-1 с фосфолипидными поверхностями (143).Дополнительная и ранее неизвестная роль гидроксихлорохина в предотвращении невынашивания беременности подтверждается описанием его защитного действия — экрана аннексина A5, образованного над бислоями фосфолипидов, от повреждений, вызванных антифосфолипидными антителами (144). Ввиду отличного профиля безопасности, включая отсутствие каких-либо побочных эффектов для плода-новорожденного (145) и отсутствие связанного кровотечения, гидроксихлорохин следует рассматривать в качестве адъювантного антитромботического средства у пациентов с системной красной волчанкой, которые положительный на антифосфолипидные антитела.Пациенты с первичным антифосфолипидным синдромом и рецидивирующим тромбозом, несмотря на адекватную антикоагулянтную терапию, которые испытывают трудности с поддержанием адекватной интенсивности антикоагуляции или имеют профиль высокого риска обширного кровотечения, также могут получить пользу от лечения гидроксихлорохином.
Более того, недавние данные экспериментальной модели потери беременности, вызванной антителом aPL, у мышей (33) предполагают, что терапевтический эффект гепарина при заболевании может быть обусловлен ингибированием комплемента, а не его ингибированием коагуляции.Эти данные, если их можно обобщить на потери беременности у людей, связанные с АФС, открывают интригующую возможность новых неантикоагулянтных подходов к лечению.
Антифосфолипидный синдром (APS) — Лечение
Лечение антифосфолипидного синдрома (APS) направлено на снижение риска развития большего количества тромбов.
Лекарство
В рамках лечения вам будут прописаны антикоагулянты, например варфарин, или антиагрегантные препараты, например аспирин в низких дозах.
Они работают, прерывая процесс образования тромбов. Это означает, что сгустки крови с меньшей вероятностью образуются, когда они не нужны.
Ваш план лечения
Большинству людей с APS необходимо ежедневно принимать антикоагулянты или антитромбоцитарные препараты до конца своей жизни.
Если анализы крови показывают, что у вас аномальные антифосфолипидные антитела, но в анамнезе нет тромбов, обычно рекомендуются таблетки аспирина в низких дозах.
Если вы не можете принимать аспирин, вам могут назначить альтернативную антиагрегантную таблетку, называемую клопидогрелом.
ТаблеткиВарфарин обычно рекомендуются, если у вас есть АФС и тромбы в анамнезе, например, ранее перенесенный тромбоз глубоких вен (ТГВ) или инсульт.
Но это необходимо изменить, если вы забеременели или планируете беременность. Сообщите своему врачу, если это так.
Если у вас образовался тромб или ваши симптомы внезапно стали серьезными, могут потребоваться инъекции антикоагулянта, называемого гепарином.
Эти инъекции можно делать в больнице, или вас могут научить делать их самостоятельно.
Побочные эффекты
Побочные эффекты этих лекарств необычны и обычно легки, например несварение желудка или тошнота (тошнота).
Но есть риск, что нарушение способности крови к свертыванию может вызвать чрезмерное кровотечение (кровотечение).
Симптомы чрезмерного кровотечения могут включать:
- кровь в моче или фекалиях
- черный пу
- сильный синяк
- длительное носовое кровотечение (продолжительностью более 10 минут)
- кровь в рвоте
- кашляет кровью
Немедленно обратитесь к терапевту, если у вас возникнут какие-либо из этих симптомов во время приема антикоагулянта.
Если это невозможно, позвоните в местную службу в нерабочее время или в NHS 111.
Лечение во время беременности
Женщинам с диагнозом АФС настоятельно рекомендуется планировать любую будущую беременность.
Это связано с тем, что лечение для улучшения исхода беременности наиболее эффективно, когда оно начинается как можно раньше после попытки зачать ребенка.
Некоторые лекарства, используемые для лечения APS, также могут нанести вред нерожденному ребенку.
Если вы не планируете беременность, может пройти несколько недель, прежде чем вы поймете, что беременны.
Это может увеличить риск неудачного лечения для защиты от беременности.
Лечение во время беременности включает ежедневный прием аспирина или гепарина или их комбинации.
Это зависит от того, были ли у вас в анамнезе сгустки крови и предыдущие осложнения во время беременности.
Варфарин не рекомендуется во время беременности, поскольку он несет небольшой риск возникновения врожденных дефектов.
Лечение аспирином или гепарином, или обоими препаратами, обычно начинается в начале беременности и может продолжаться в течение 1–6 недель после родов.
Изменения образа жизни
Если вам поставили диагноз APS, важно предпринять все возможные шаги, чтобы снизить риск образования тромбов.
К числу эффективных способов достижения этого относятся:
Последняя проверка страницы: 21 августа 2018 г.
Срок следующего рассмотрения: 21 августа 2021 г.
Антифосфолипидный синдром (APS) | Tommy’s
Что такое антифосфолипидный синдром (АФС)?
Антифосфолипидный синдром — это заболевание иммунной системы, повышающее риск образования тромбов.Иногда его называют синдромом Хьюза.
Если у вас APS, у вас более высокий риск развития:
- Тромбоз глубоких вен (ТГВ), тромб, который обычно образуется в ноге
- артериальный тромбоз (сгусток в артерии), который может вызвать инсульт или сердечный приступ
- тромб в головном мозге, что может привести к проблемам с равновесием, подвижностью, зрением, речью и памятью.
Как антифосфолипидный синдром может повлиять на беременность?
APS также был связан с осложнениями беременности, в том числе:
Звучит пугающе, но не забывайте, что APS поддается лечению.При правильном лечении и уходе у большинства женщин с АФС наступает успешная беременность. APS также является одной из наиболее поддающихся лечению причин повторного выкидыша.
Если вам нужна эмоциональная поддержка
Не скрывайте своих чувств и не страдайте молча. Ты не одинок. Расскажите партнеру, семье или друзьям о своих чувствах. Ваш терапевт может помочь вам получить любую необходимую профессиональную поддержку, и благотворительная организация APS Support UK также может помочь.
Вы также можете бесплатно поговорить с акушеркой Томми по телефону 0800 014 7800 (с понедельника по пятницу, с 9:00 до 17:00) или написать нам по адресу [электронная почта защищена].
Как лечится АФС при беременности?
К сожалению, лекарства от APS нет. Лечение во время беременности направлено на поддержание здоровья вас и вашего ребенка за счет максимального снижения риска осложнений.
Если вам не был поставлен диагноз APS
Если у вас были повторные или поздние выкидыши, вы можете пройти обследование, чтобы попытаться выяснить причину. Это может включать тест на APS.
Ваш врач расскажет вам о вашей истории болезни.Они спросят, было ли у вас:
- 1 или более подтвержденных тромбов
- 1 или более поздних невынашиваний по необъяснимой причине на 10 неделе беременности или после нее
- 1 или более преждевременных родов на 34 неделе беременности или ранее
- 3 или более невынашивания беременности по необъяснимым причинам до 10 недели беременности.
У вас также будет анализ крови на наличие аномальных антифосфолипидных антител, повышающих риск образования тромбов. Если у вас есть два отклоняющихся от нормы результата анализа крови с промежутком не менее 12 недель между ними, вам будет поставлен диагноз АФС.
Если вам был поставлен диагноз АФС до беременности
Лучшее, что вы можете сделать, — это поговорить со своим терапевтом или специалистом до того, как вы забеременеете. Это связано с тем, что лечение, необходимое для обеспечения наилучших шансов на успешную беременность, наиболее эффективно, когда оно начинается как можно раньше. Некоторые лекарства, используемые для лечения APS, также могут нанести вред нерожденному ребенку, поэтому ваш врач может пересмотреть ваш прием лекарств, прежде чем вы забеременеете. Не прекращайте прием лекарств до посещения врача.
Иногда дела идут не по плану. Если у вас есть APS, и вы не разговаривали со своим лечащим врачом перед беременностью, постарайтесь не беспокоиться. Как можно скорее поговорите со своим терапевтом или специалистом.
Ваш уход во время беременности
Из-за риска таких осложнений, как преэклампсия и задержка внутриутробного развития, вы должны находиться под тщательным наблюдением на протяжении всей беременности.
Вы будете рассматриваться как беременная с высоким риском, и вам будет предоставлен индивидуальный уход, основанный на вашем личном медицинском анамнезе, истории беременности и факторах риска.
Вам будет оказываться медицинская помощь под руководством врача, хотя акушерская бригада по-прежнему будет оказывать вам помощь. Скорее всего, у вас будет больше проверок крови, мочи и артериального давления, чем обычно. У вас также будет дополнительное сканирование, чтобы проверить рост ребенка, а также кровоток через плаценту и пуповину к ребенку.
При неосложненной беременности проходить больше анализов и посещать дородовых врачей может быть сложно. Но этот дополнительный уход поможет вашим медицинским работникам убедиться, что у вас безопасная и успешная беременность.
Лекарства
Вам будет предложено принимать ежедневные дозы аспирина или гепарина или их комбинации. Эти лекарства снижают вероятность свертывания крови, и их можно безопасно принимать во время беременности.
Варфарин не рекомендуется во время беременности, поскольку он несет небольшой риск возникновения врожденных дефектов. Однако, если вы принимаете варфарин для предотвращения свертывания крови, прекращать прием небезопасно. Его необходимо заменить на альтернативный препарат против свертывания крови, которым обычно является гепарин. Как можно скорее поговорите со своим терапевтом или специалистом, чтобы можно было безопасно сменить лекарство.
Снижение риска образования тромбов при беременности
Есть несколько вещей, которые вы можете сделать, чтобы снизить риск образования тромбов и повысить ваши шансы на здоровую беременность и ребенка. К ним относятся:
Поскольку у вас повышенный риск, вас будут регулярно проверять на предмет преэклампсии и сгустков крови.
Симптомы тромба включают:
- пульсирующая или схваткообразная боль, отек, покраснение и тепло в ноге или руке (может ощущаться как горячее пятно)
- внезапная одышка, резкая боль в груди (может усиливаться при вдохе) и кашель или кашель с кровью.
Немедленно обратитесь к акушерке, врачу или в службу NHS 111, если вы считаете, что у вас есть тромб.
Движения вашего ребенка и APS
Поскольку существует более высокий риск мертворождения, также важно знать, как ребенок шевелится во время беременности. У вашего ребенка будет собственный паттерн движений, который вам следует усвоить. Вы должны продолжать чувствовать, как ваш ребенок шевелится, вплоть до начала схваток и во время родов.
Немедленно обратитесь к акушерке или родильному отделению, если вы считаете, что движения вашего ребенка замедлились, остановились или изменились.
Может ли APS повлиять на то, как я рожаю?
Если вы и ваш ребенок здоровы, роды возможны через естественные родовые пути. Ваша медицинская бригада может порекомендовать использовать электронный мониторинг плода (EFM). Это предполагает подключение к монитору, который постоянно отслеживает сердцебиение вашего ребенка и ваши схватки.
Если есть какие-либо опасения по поводу вашего здоровья или здоровья вашего ребенка, вам может потребоваться кесарево сечение.
После родов, если у вас АПС
Возможно, вам придется продолжать принимать лекарства в течение нескольких недель после родов, чтобы предотвратить образование тромбов.
Грудное вскармливание и APS
Гепарин безопасен для приема, если вы кормите грудью. Вам могут предложить варфарин после родов. Обычно вы можете принимать варфарин во время грудного вскармливания, но сначала вам следует обсудить это со своим специалистом, врачом или акушеркой.
Ваша фертильность после рождения
Вы можете забеременеть через 3 недели после родов, даже если вы кормите грудью и месячные больше не начались.
Если вы хотите завести еще одного ребенка, лучше всего поговорить со своим терапевтом или специалистом о том, когда вам лучше всего начинать попытки.Важно использовать противозачаточные средства каждый раз, когда вы занимаетесь сексом, пока вы не поговорите со своим лечащим врачом.
Не все противозачаточные средства подходят для всех женщин после родов. Поскольку вы подвержены риску образования тромбов, вы не должны использовать следующее, по крайней мере, через шесть недель после рождения:
- таблетка комбинированная
- кольцо вагинальное
- противозачаточный пластырь.
Обратитесь к акушерке, терапевту или патронажной сестре за дополнительной информацией.
Дополнительная поддержка и информация
APS Support UK предоставляет поддержку всем, кто пострадал от APS в Великобритании.Их веб-сайт включает информационные бюллетени о жизни с APS и подробную информацию о специалистах в вашем районе (все направления должны проходить через вашего терапевта).
Антифосфолипидный синдром (APS) | Симптомы, лечение
Важно понимать симптомы и влияние APS, а также знать, когда обращаться за помощью. У вас должна быть возможность связаться со своей командой специалистов за советом, когда он вам понадобится.
Если вы принимаете лекарства, например варфарин, вам следует избегать контактных видов спорта и занятий, которые могут привести к травмам.
Разжижающие кровь препараты могут вызвать очень сильные синяки. Поскольку они увеличивают время, необходимое для свертывания крови, может быть трудно остановить кровотечение, если вы порежетесь.
Если вы беременны, вам также необходимо сообщить своему акушеру-консультанту о любых изменениях в вашем здоровье.
Снижение риска образования тромбов
Есть несколько лекарств, которые могут помочь предотвратить образование тромбов. Есть также способы снизить риск образования тромбов в крови, в том числе:
Отказ от курения
Курение сгущает кровь, затвердевает и сужает артерии, что увеличивает риск образования тромбов.Он также повышает кровяное давление и частоту сердечных сокращений, увеличивая риск сердечных заболеваний, инсультов и необратимого повреждения вен и артерий. Если ты сможешь остановиться, это поможет. Ваш врач может помочь вам найти лучший способ бросить курить.
Будьте осторожны с алкоголем
Алкоголь обладает антикоагулянтным действием, что означает, что он может сделать вашу кровь более жидкой и может замедлить способность вашей печени перерабатывать варфарин, что влияет на ваш уровень INR. Правительственные директивы рекомендуют не употреблять более 14 единиц в течение недели.Однако из-за того, что он влияет на ваш уровень INR, ваш ревматолог может порекомендовать вам меньше этого пить.
Оставайтесь гидратированными
Пейте много жидкости, особенно воды, чтобы не обезвоживаться.
Избегайте эстрогеновых контрацептивов и ЗГТ
Старайтесь избегать контрацептивов или заместительной гормональной терапии (ЗГТ), содержащей эстроген, так как это может увеличить риск образования тромбов. Спросите своего врача о других типах контрацепции, таких как таблетки или инъекции, содержащие только прогестагены, установка спирали Мирены или барьерные методы.Кожные пластыри при ЗГТ считаются более безопасными, чем таблетки, потому что они не делают кровь такой липкой и несут меньший риск образования тромбов в венах. Существуют также негормональные методы лечения, которые могут помочь с некоторыми симптомами, такими как приливы.
Двигайтесь вокруг
Старайтесь не сидеть слишком долго в одном положении. Например, если вы собираетесь в длительное путешествие на автобусе или дальний рейс, постарайтесь спланировать заранее и забронировать место у прохода или место с дополнительным пространством для ног, чтобы вы могли размяться и двигать ногами.Если вы путешествуете в машине, вам также необходимо регулярно останавливаться, чтобы размять ноги. Некоторые люди рекомендуют носить эластичные чулки во время долгого путешествия, чтобы снизить риск образования тромбов в нижней части ног. Спросите своего специалиста, подойдет ли это вам. Даже когда вы сидите за своим столом или дома, старайтесь вставать и двигаться как можно чаще.
Прочие условия
Беременность увеличивает риск образования тромбов, поэтому за вами следует внимательно наблюдать и назначать медикаментозное лечение, чтобы уменьшить осложнения.Такие заболевания, как диабет, высокое кровяное давление или холестерин, также могут увеличить ваш риск, постарайтесь не упустить их, регулярно проходя медицинские осмотры. Если у вас есть семейная история сгустков крови, выкидышей или других аутоиммунных заболеваний, таких как волчанка или проблемы с щитовидной железой, это также может подвергнуть вас большему риску. У некоторых людей также могут образовываться тромбы, если у них есть инфекция, например, боль в горле. Это все, что вам может посоветовать врач.
Упражнение
Хотя нет никаких упражнений, которые могли бы помочь конкретно с этим заболеванием, регулярные упражнения поддерживают вашу форму, поддерживают здоровье сердца и помогают предотвратить образование тромбов.
Йога, ходьба, плавание и тайцзи — это хорошие виды упражнений с малой нагрузкой, которые могут помочь вам физически и морально. Тайцзи также помогает при любых проблемах с равновесием.
Поговорите с членом вашей медицинской бригады, прежде чем вносить какие-либо изменения в свой обычный распорядок дня.
Диета
Вы должны стремиться регулярно придерживаться здоровой, сбалансированной диеты, содержащей хорошее сочетание углеводов, белков, фруктов, овощей и нежирных молочных продуктов.
Важно убедиться, что в вашем рационе есть продукты, содержащие витамин К. Витамин К влияет на способность крови к свертыванию и может повлиять на работу варфарина. Слишком мало витамина К в вашем рационе может повысить уровень МНО, а слишком много — снизить его. Витамин К в основном содержится в листовых зеленых овощах, таких как:
- шпинат
- капуста
- брокколи
- спаржа
- салат-латук.
Его также можно найти в:
- нут
- печень
- Яичные желтки
- крупы цельнозерновые
- зрелый сыр и сыр с плесенью
- авокадо
- оливковое масло.
Хотя важно, чтобы в вашем рационе были эти овощи, вам необходимо сбалансировать количество, которое вы едите каждый день. Слишком большое количество может увеличить риск свертывания крови и повлиять на уровень МНО, но слишком мало — вредно для здоровья. Поговорите со своим врачом о количестве витамина К в вашем рационе и о том, как он может повлиять на дозу варфарина.
Некоторые травы и специи также влияют на кровоток и время, необходимое для свертывания крови.
На антикоагулянтный эффект варфарина также могут влиять:
- клюквенный сок
- грейпфрутовый сок
- Гранатовый сок
- чеснок
- Донг Квай
- даншен (красный шалфей)
- дьявольский коготь
- Корейский женьшень
- зеленый чай.
Член вашей медицинской бригады сможет посоветовать вам правильную здоровую диету, которая не помешает вашему лечению.
Увеличение количества незаменимых жирных кислот в вашем рационе, особенно жирных кислот омега-3, может помочь снизить риск образования тромбов. Они содержатся в жирной рыбе. Однако клинических испытаний, подтверждающих это, нет.
Если вы пытаетесь завести ребенка, лучше избегать добавок рыбьего жира, так как они содержат большое количество витамина А, который может быть вредным.
Дополнительные и альтернативные методы лечения
В настоящее время не существует дополнительных лекарств, которые показали бы свою эффективность при APS.
Помимо витамина К, такие добавки, как витамин С, витамин Е, коэнзим Q10, а также лекарственные средства «Дьявольский коготь» и зверобой также могут изменить реакцию организма на варфарин.
Поговорите со своим врачом, фармацевтом или медицинским работником, прежде чем пробовать какое-либо новое лечение.
Усталость
APS может вызвать сильную усталость как физически, так и морально, но есть способы справиться с этой усталостью.
Здоровая сбалансированная диета и регулярные физические упражнения улучшат ваше общее физическое здоровье, а также улучшат настроение и уровень стресса. Придерживаясь обычного ночного режима, вы также можете улучшить качество и количество сна.
Старайтесь не делать слишком много всего за один раз — планируйте свои домашние дела, задачи или работу с учетом того, сколько энергии они будут использовать. Успокойтесь и постарайтесь не «взлетать и падать». Это когда вы пытаетесь сделать как можно больше за короткое время, прежде чем у вас закончится энергия.
Старайтесь сочетать легкую работу с той, которая требует больше энергии, с отдыхом между ними.
Стресс и проблемы с памятью
Люди с APS могут испытывать эпизоды потери памяти, беспокойства и замешательства.
Сделайте ваши дни и занятия более рутинными, чтобы уменьшить влияние этих периодов, так же как и средства для запоминания и обучение методам релаксации.
Пазлы, доски для запоминания, календари и общение — все это может помочь уменьшить последствия стресса и сохранить активность вашего ума, а также улучшить вашу память.
Это может помочь поговорить с друзьями и семьей о своем состоянии и объяснить, как оно влияет на вас. Некоторые люди также обнаруживают, что когнитивно-поведенческая терапия (КПТ) помогает им справляться с некоторыми проблемами, вызывающими стресс, плохой сон и плохое настроение.
Ваш врач может поговорить с вами о КПТ. Они также должны иметь возможность связать вас с местной группой поддержки для людей с хроническими заболеваниями — многие из них оказывают аналогичное влияние на жизнь людей.
Вы также можете получить помощь и совет через сообщество благотворительной организации APS Support UK.
Как лечить женщину при беременности антифосфолипидными антителами?
Постоянное присутствие в плазме от средних до высоких уровней антикардиолипиновых антител класса IgG и / или IgM (aCL) и / или волчаночного антикоагулянта (LAC) связано как с «повторяющейся потерей беременности», так и с венозным и артериальным тромбозом1. Клинико-серологическое заболевание, впервые описанное в начале 80-х годов у пациентов с системной красной волчанкой, было названо антифосфолипидным синдромом (APS) .1 , 2 Признание того, что APS также встречается у здоровых людей, привело к появлению термина «первичный антифосфолипидный синдром».3 Классические лабораторные маркеры APS, aCL и LAC относятся к семейству так называемых антифосфолипидных антител (aPL). Клинические исследования показывают, что APL связаны как с потерей беременности на ранних сроках, так и с гибелью плода на поздних сроках беременности, и что тромбоз плаценты и инфаркт являются частыми проявлениями внутриутробной смертности плода, связанной с APL.4 Исследования APS на животных моделях подтверждают причинную роль APL в потере беременности. .5 Проспективные клинические исследования подтвердили, что aPL являются факторами риска потери беременности как у пациенток с системной красной волчанкой (60% против 13% выкидышей) 6, так и у здоровых первородящих женщин (16% против 7% выкидышей).7 У женщин, у которых в анамнезе было три или более выкидышей подряд, стойкие положительные результаты тестов на aPL обнаруживаются у 15% 8, и у них частота последующей потери плода достигает 60–90% без специального лечения8. , 9 Помимо того, что APL являются факторами риска гибели плода, они связаны с высокой частотой преэклампсии, задержкой внутриутробного развития, патологическим состоянием плода и преждевременными родами.9 , 10
Лабораторные тесты
aCL выявляются с помощью иммуноферментных анализов (ELISA), в которых отрицательно заряженный фосфолипидный кардиолипин наносится на пластиковые планшеты, тогда как LAC относится к антителам, которые продлевают время свертывания фосфолипид-зависимых тестов коагуляции, конкурируя с коагуляцией. факторы для связывания с каталитической фосфолипидной матрицей.11 aCL и антитела, вызывающие LAC, реагируют не с самими фосфолипидами, а с фосфолипид-связывающими белками плазмы (кофакторами). Установленными кофакторами являются β 2 гликопротеин I для aCL ELISA, а также β 2 гликопротеин I и протромбин для антител, вызывающих LAC.11 Это объясняет более ранние представления о том, что aCL и LAC относятся к родственным, но не обязательно схожим антителам. Чтобы классифицировать пациента как имеющего APS, необходимо провести тесты как на aCL, так и на LAC2. Важно отметить, что разные лаборатории часто используют разные критерии для определения положительного результата теста на aCL или LAC.Специализированные лаборатории могут прийти к разумному соглашению по классификации выбранных образцов на нормальные, низкие, средние и высокие положительные для уровней aCL, 12 но ситуация хуже в повседневной практике, когда используются разные пороговые значения для положительности и часто отмечаются серьезные межлабораторные различия. .13 , 14 Есть надежда, что по крайней мере часть методологических проблем с aCL ELISA будет решена, когда стабильные стандарты для измерения aCL, такие как недавно описанные конструкции химерных антител, 15 найдут универсальное применение.Для выявления LAC доступны международно признанные руководящие принципы, которые касаются сбора и обработки тестовой плазмы с низким содержанием тромбоцитов, а также этапов скрининга и подтверждения в тестах на коагуляцию, 16 но многие лаборатории не соблюдают их.17 Текущая ситуация такова, что разные лаборатории часто используют другой тест для скрининга первой линии на LAC, и что эти тесты широко различаются по чувствительности к действию антител. Очевидно, что неоднородная классификация пациентов как положительных или отрицательных по APL затрудняет сравнение результатов различных клинических исследований и способствует расхождению в выводах о связи между APL и исходом беременности, а также к широкому разбросу регистрируемых частот APL в разных популяциях. .1 , 18
Номенклатура потери беременности
Наряду с этими методологическими техническими проблемами интерпретации литературы по APL и потере беременности также препятствуют различные определения потери беременности и различия в сопутствующих заболеваниях и акушерских анамнезах в исследуемых популяциях. Последнее важно, поскольку предыдущая потеря беременности является независимым фактором риска последующей потери6. Традиционно в США потери беременности до 20 недель беременности группируются вместе как «аборты», а смерть в утробе матери после этого — как «мертворождение» или «внутриутробное развитие плода». смерть », тогда как европейские акушеры использовали триместры, где гибель плода до 16 недель беременности называется« абортом », а потери после этого -« внутриутробной смертью ».19 «Рецидивирующая потеря беременности» определяется неоднородно в опубликованных отчетах по APS, частично из-за этой разной терминологии. В будущих исследованиях это должно быть преодолено путем использования недавно введенной новой акушерской номенклатуры, которая придает авторитет текущим знаниям в области репродуктивной биологии, отделяя потери в (до) эмбриональном периоде от гибели плода. , 19 Преэмбриональный период длится от зачатия до трех недель беременности (примерно пять недель с первого дня последней менструации), за ним следует эмбриональный период, который продолжается до конца девятой недели беременности. беременность.До 12% нормальных беременностей заканчиваются потерей до 10 недель беременности (так называемые (пре-) эмбриональные потери), и их наиболее частая причина — хромосомная аномалия плода. В новой номенклатуре период от 10 недель до родов называется периодом плода и потерей в этот период гибелью плода. Несомненно, что концептус вступил в эту стадию, когда длина плода составляет не менее 30 мм (макроскопически или с помощью ультразвука), или когда сердечная деятельность плода обнаруживается на сроке беременности 10 недель или позже.19 У здоровых женщин смерть плода (потеря после гестации ≥10 недель) встречается редко и обычно не связана с хромосомными аномалиями. активность проявляется на сроке беременности 8–10 недель или позже20.
Лечение
Лечение беременных женщин с положительным АФЛ для улучшения исхода беременности является полностью эмпирическим. В 1983 году Lubbe и др. показали, что пять из шести женщин с LAC и плохим акушерским анамнезом родили живых младенцев, когда их лечили во время беременности преднизоном (40–60 мг в день) и аспирином в низких дозах (75 мг в день). .21 С тех пор такое лечение стало применяться во многих вариантах по всему миру, при этом о рождении живого ребенка сообщалось от 30 до 100% беременностей, леченных таким образом.1 Основанием для использования преднизона было подавление уровней АФЛ, тогда как аспирин может быть полезным за счет необратимо блокирует действие циклооксигеназы в тромбоцитах, тем самым подавляя синтез тромбоксана тромбоцитов A 2 и предотвращая тромбоз сосудов плаценты. Однако кортикостероиды, применяемые в течение длительного периода беременности, обладают значительными побочными эффектами, такими как диабет, гипертония, остеопороз, (пре-) эклампсия и преждевременные роды, вторичные по отношению к преждевременному разрыву плодных оболочек, как показано Cowchock et al. 22 Последнее исследование представляло собой рандомизированное исследование, в котором сравнивали преднизон (40 мг) с нефракционированным гепарином (оба в сочетании с низкими дозами аспирина). Оба лечения привели к 75% живорождений, но в группе, получавшей гепарин, было значительно меньше осложнений. С 1992 г. гепарин в сочетании с аспирином в низких дозах заменил преднизон для лечения беременных женщин с положительной реакцией на АФЛ во многих центрах. Недавнее проспективное исследование, в котором беременным женщинам с положительной реакцией на АФЛ, у которых было по крайней мере три спонтанных последовательных выкидыша, поочередно назначались только низкие дозы аспирина или аспирин плюс подкожный гепарин два раза в день, было обнаружено 44% живорождений у женщин, получавших только аспирин, и 80% — у тех, кто принимал только аспирин. лечится комбинацией.23 Рандомизированное, но в остальном сопоставимое исследование также показало, что только аспирин уступает аспирину плюс гепарин (42% против 71% живорождений) .24 Примером неоднородного определения aPL в литературе является то, что исследование Kutteh исключало женщин с LAC, 23 тогда как в исследовании Rai и соавт. 80% пациентов имели LAC в отсутствие aCL.24 Сомнения в том, всегда ли нужен гепарин, возникли из неконтролируемого проспективного исследования25, в котором 91% живорожденных принимали только низкие дозы аспирина в aPL-положительные беременные женщины с минимум двумя самопроизвольными абортами и только 6% живорожденных в анамнезе.Вероятно, различия в критериях включения и исключения, используемых в разных исследованиях, являются основной причиной таких противоречивых результатов.
Хотя безопасность низких доз аспирина во время первого триместра беременности все еще является предметом споров, 26 лечение аспирином начинается у беременных с положительным результатом АФЛ до зачатия, 10 , 23 , 25 или при положительном результате теста на беременность.24 Лечение гепарином начинают при положительном результате теста на беременность, 10 , 23 или сердечная деятельность плода.24 Во всех проспективных исследованиях эффективности гепарина при беременностях, связанных с АФЛ, использовался нефракционированный гепарин.Однако за последние несколько лет был накоплен большой опыт использования низкомолекулярного гепарина, назначаемого во время беременности, для профилактики и лечения венозного тромбоза или для улучшения исхода беременности у женщин с положительной реакцией на АФЛ (27). , 28 По сравнению с нефракционированным гепарином, низкомолекулярный гепарин более удобен для пациента, поскольку обычно требуется только одна подкожная инъекция в день. Кроме того, это связано с меньшей потерей костной массы и меньшим риском кровотечения и тромбоцитопении, вызванной гепарином.Однако опыт использования высоких доз низкомолекулярного гепарина во время беременности все еще ограничен27.
Тромбоз
Несколько отчетов о случаях и небольшие серии случаев предполагают, что лечение женщин с АФС во время беременности высокими дозами внутривенного иммуноглобулина снижает частоту осложнений беременности, связанных с АФС. Однако недавно опубликованное уникальное рандомизированное двойное слепое исследование не выявило улучшенных акушерских или неонатальных исходов, кроме тех, которые были достигнуты при лечении гепарином и низкими дозами аспирина.29 Это явный аргумент против использования этого дорогостоящего лечения в лечении беременностей, связанных с APL.
Беременность и послеродовой период являются тромбогенными периодами. В общей популяции венозные тромбоэмболические события происходят во время беременности и в послеродовой период в количестве одного и двух на 1000 родов, соответственно.30 Ишемический инсульт, наиболее частое проявление тромбообразования в области артерии во время беременности, встречается у 4–5 на 100000 человек. родов и нередко связано с (пре-) эклампсией.31 Вероятно, наличие aPL у беременной женщины дополнительно увеличивает риск венозного и артериального тромбоза, поскольку aPL являются фактором риска как тромбоза, так и (пре-) эклампсии.9 , 10 Тем не менее, степень, в которой APL увеличивают эти риски, не оценивалась в контролируемых исследованиях.
Многие пациенты с тромбозом, связанным с АФЛ, получают лечение вне беременности пероральными антикоагулянтами в течение длительных периодов времени для предотвращения рецидивов.32 У пациентов, которым необходима антикоагулянтная терапия во время беременности, обычной практикой является переход с пероральных антикоагулянтов на гепарин до зачатия или самое позднее в течение двух лет. недель пропущенного периода, поскольку пероральные антикоагулянты проникают через плаценту, обладают тератогенным действием при сроке беременности от 6 до 12 недель и могут вызвать внутричерепное кровотечение у плода.Опубликованных проспективных данных об исходах беременности у женщин с положительным результатом на АФЛ и тромботическим анамнезом нет, и на вопрос о том, увеличивает ли тромботический анамнез дополнительно риск неблагоприятного исхода беременности у женщин с положительным результатом на АФЛ, нет ответа.
Рекомендации
Ввиду несовершенных данных, доступных в настоящее время, невозможно дать основанные на доказательствах рекомендации о том, как следует лечить пациенток с APL во время беременности. Целесообразно рассматривать беременность с АФЛ как группу высокого риска осложнений и предлагать тщательное наблюдение командой врачей разных специальностей.Лечение должно быть индивидуальным, с учетом акушерского анамнеза, наличия или отсутствия в личном или семейном анамнезе тромбоэмболических событий, сопутствующих заболеваний, применяемых лекарственных препаратов и факторов риска тромботических заболеваний, отличных от APL. В случаях повторной (пре-) эмбриональной гибели всегда следует исключать генетические, анатомические и другие причины. Имея личный анамнез тромбоэмболических событий, следует учитывать их количество, характер и тяжесть, а также обстоятельства, при которых такие события произошли.
Рекомендации по лечению
В качестве рекомендаций по лечению беременных с aPL мы предлагаем следующее:
- 1
- aPL-положительные пациенты без тромботической истории
Всегда проводите профилактическое лечение низкомолекулярными препаратами. взвешивайте гепарин в течение шести недель в послеродовом периоде для предотвращения венозных тромбоэмболий.
Если в анамнезе не более двух необъяснимых (пре-) эмбриональных потерь, нет необходимости в лечении во время беременности.
При наличии в анамнезе трех или более последовательных (пре-) эмбриональных потерь или по крайней мере одной гибели плода (с нормальной морфологией) начните прием аспирина и профилактической дозы низкомолекулярного гепарина при подтверждении беременности. Обоснование использования гепарина состоит в том, что этот препарат, помимо его антикоагулянтного действия, по-видимому, способствует успешной имплантации на ранних сроках беременности.24 Объяснение этого наблюдения может заключаться в том, что гепарин связывает aPL и, таким образом, предотвращает aPL, снижая физиологическое покрытие клеток трофобласта. с мощным антикоагулянтным белком аннексином V, но это еще предстоит установить.24 , 33
При длительном применении гепарина рассмотрите возможность дополнительной пероральной дозы кальция (1000 мг / день) и регулярного контроля количества тромбоцитов.
Не давайте низкомолекулярный гепарин по крайней мере за 12 часов до и через четыре часа после спинальной или эпидуральной анальгезии.
- 2
- aPL-положительные пациенты с тромботическим анамнезом
Всегда проводите профилактическое лечение низкомолекулярным гепарином в течение шести недель в послеродовой период, чтобы предотвратить венозные тромбоэмболии.Если есть показания для длительной пероральной антикоагуляции до текущей беременности, это лечение следует возобновить.
При наличии в анамнезе венозных тромбоэмболических событий: назначить профилактическую антикоагулянтную терапию во время беременности. Это стандартная профилактическая доза низкомолекулярного гепарина для большинства пациентов. Подробная информация о личном тромботическом анамнезе и наличии дополнительных факторов риска венозных тромбоэмболических событий может привести к использованию более высоких доз низкомолекулярного гепарина.Акушерский анамнез определит использование аспирина.
При наличии в анамнезе тромбоза артерий дать общий совет невозможно. Тип профилактического лечения, используемого вне беременности (аспирин или антикоагулянтная терапия с определенной интенсивностью), и акушерский анамнез определяют, будет ли аспирин или низкомолекулярный гепарин, или оба вместе, или антикоагулянты высокой интенсивности, наиболее подходящими.



 J Thromb Haemost. 2009;7:501-502.
J Thromb Haemost. 2009;7:501-502. При этом у плода отсутстуют признаки анатомических аномалий.
При этом у плода отсутстуют признаки анатомических аномалий.