Апластическая анемия — Причины, Симптомы, Диагностика и Лечение
Апластическая анемия — это заболевание, которое характеризуется периферической панцитопенией. То есть, это такое состояние при котором костный мозг человека перестает производить достаточное количество клеток крови.
При апластической анемии возникает дефицит всех типов клеток: эритроцитов, лейкоцитов и тромбоцитов.
Костный мозг — это своеобразная структура, которая находится в костном канале. Он отвечает за образование всех клеток крови, для того чтобы снабжать организм кислородом, бороться с инфекцией и обеспечивать свертываемость крови. И если в его работе возникают сбои, или клетки костного мозга повреждаются различными факторами, они перестают производить новые кровяные клетки и развивается апластическая анемия.
Чаще всего развивается в молодом и детском возрасте, от 10 до 20 лет. Но иногда отмечается еще один пик развития болезни в 60 лет. Распространенность между мужчинами и женщинами примерно одинакова.
(https://www.cinj.org/sites/cinj/files/documents/December%20National%20Aplastic%20Anemia%20Awareness%20Month%202018.pdf)
Впервые апластическую анемию описал немецкий ученый врач Поль Эрлих, в 1888 году. Он проводил исследования причины смерти беременной женщины, молодого возраста, что достаточно скоропостижно умерла. На вскрытии, врач увидел, что во внутрикожном пространстве, нормальная ткань отсутствует. Она была замещена жировой. Тогда он и предположил, что это одно из самых тяжелых заболеваний гемопоэза. Правда, термин “апластическая анемия”был применен только в 1904 году, французским гематологом А. М. Шоффаром
Этиология апластической анемии
Чаще всего, это приобретенное заболевание, которое возникает в течение жизни, а не передается по наследству.
Точную причину развития апластической анемии найти достаточно сложно, так как в повседневной жизни мы сталкиваемся с многими факторами, которые могут влиять на работу костного мозга.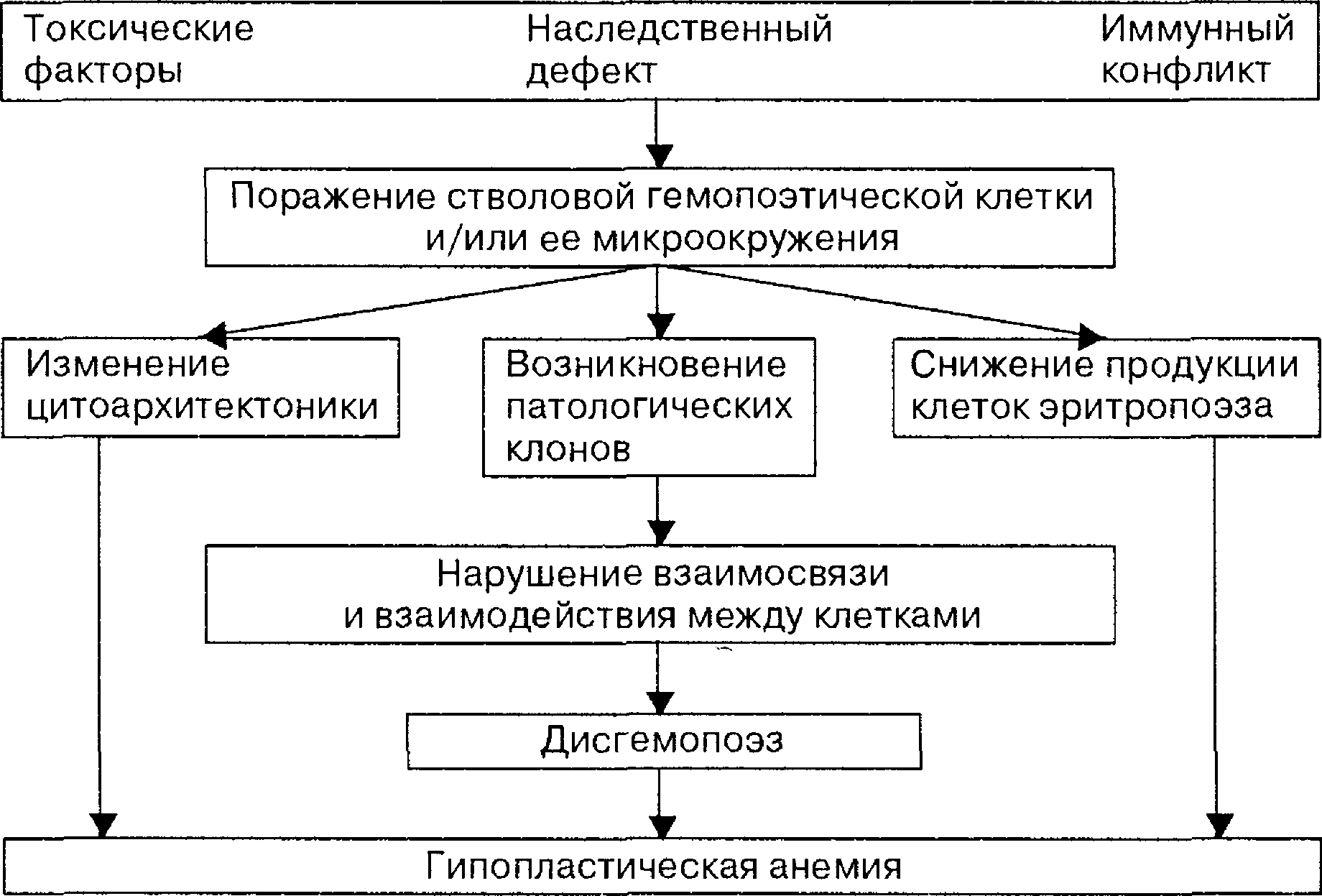
Ученые выделяют основные триггеры, что могут стать пусковым механизмом:
* Воздействие различных химикатов. Некоторые вещества, что используются в пестицидах, бензол, хлоры, нитраты, могут повреждать костный мозг.
* Различные излучения. Радиационные, магнитные и прочее плохо влияет на работу всего организма и может привести к тому, что и костный мозг не сможет справиться с нагрузкой.
* Наличие вирусных заболеваний. Около 2% больных на вирусный гепатит, страдают от апластической анемии. Также сюда относят цитомегаловирус, ВИЧ, Эпштейн-Барр и парвовирусы. https://www.nejm.org/doi/full/10.1056/nejm199705083361906
* Фармакологические препараты и некоторые методы лечения. Например, некоторые сильные антибиотики, химиопрепараты и радиационная терапия.
* Аутоиммунные заболевания. Это патологическое состояние, когда собственная иммунная система начинает атаковать клетки своего организма. В большинстве случаев, страдает и костный мозг
Одним из факторов риска развития, является отягощенный наследственный анамнез. Собственно, если в семье были случаи апластической анемии, то под действием триггеров, она может развиваться.
Собственно, если в семье были случаи апластической анемии, то под действием триггеров, она может развиваться.
Симптоматика апластической анемии
Конкретных, специфических симптомов у апластической анемии нет. Врачи оценивают все жалобы в комплексе и только потом могут заподозрить болезнь.
Так как при апластической анемии отсутствует полноценное количество всех клеток крови, то и симптомы проявляются в результате невыполнения их функций.
Отсутствие эритроцитов приводит к тому, что организм не получает необходимые микроэлементы, и что более важно — кислорода. Это приведет к:
— Постоянной слабости, усталости и потери трудоспособности;
— Головной боли и головокружению;
— Бледности кожи;
— Одышке;
— Постоянной тахикардии.
Потеря лейкоцитов приведет к снижению иммунной защиты, а значит может проявляться:
— Частыми инфекционными заболеваниями;
— — лихорадкой;
А при уменьшении количества тромбоцитов теряется функция свертываемости крови, и симптомами этого будет:
— Появления синяков, даже при малейшем физическом воздействии;
— Появления петехий;
— Наличие красной сыпи по телу;
— Длительное кровотечение из небольших ран, что трудно остановить;
— Кровоподтеки с десен во время чистки зубов или приема пищи.
Болезнь может развиваться довольно долго. Гемопоэз не отключается полностью, его функция снижается постепенно. И по началу, пациент не чувствует никаких симптомов, так как организм компенсирует и работает нормально, хоть и с меньшим количеством клеток. Но со временем, запасы и депо клеток истощаются, а костный мозг продолжает терять свою функцию и тогда симптомы начинают нарастать. Иногда, люди не понимают что именно происходит и занимаются домашним самолечением, что только приводит к усугублению состояния. А при критически низком уровни клеток, возникают неотложные состояния.
Диагностические мероприятия
Диагностика апластической анемии не такая уж и сложная. Большинство случаев находят во время профилактических осмотров. Достаточно сдачи одного общего анализа крови, чтобы заподозрить наличие апластической анемии.
Тогда врач начинает детальный сбор жалоб пациента, анамнез, отмечает характерные для апластической анемии симптомы.
И тогда уже врач назначает более детальные исследования для точной постановки диагноза, определения степени сложности.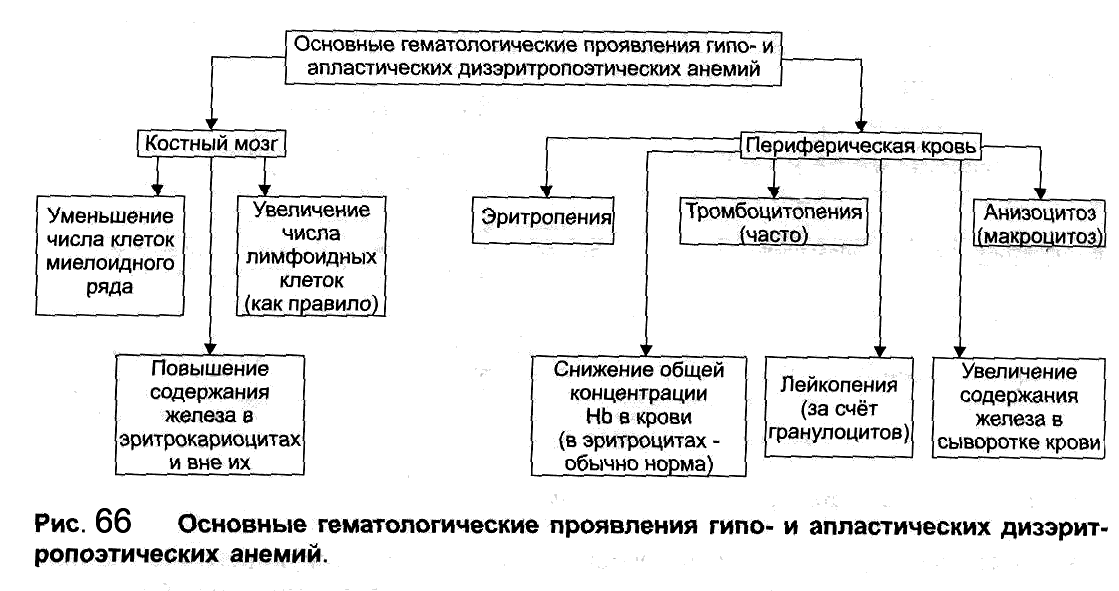
Так при подозрении на АА врач назначает аспирацию костного мозга. Далее костный мозг осматривают под микроскопом, оценивают наличие и состояние клеток крови еще на стадии их развития. При апластической анемии костный мозг обеднен всеми клеточными ростками. Основным диагностическим методом при АА является трепанобиопсия костного мозга, которая позволяет наиболее точно оценить состояние кроветворения.
Также Врач назначает:
— Серологические исследования на гепатит и другие вирусные образования;
— Лабораторные анализы для исследования функции почек и печени;
— Ультразвуковую диагностику. Прицельно могут осматривать увеличенные лимфоузлы.
— Анализ на антитела к инфекциям;
— число ретикулоцитов
— наличие PNG-клона ;
Иногда необходимо пройти и другие исследования для уточнения диагноза и установления причины развития апластической анемии.
Хотя, довольно часто, причина остается неизвестной, из-за большого количества факторов и триггеров, что могут спровоцировать ее.
https://www.cinj.org/sites/cinj/files/documents/December%20National%20Aplastic%20Anemia%20Awareness%20Month%202018.pdf
Лечение апластической анемии
После всех исследований врач определяет курс терапии. Если во время диагностики все таки удалось установить причину развития, то в первую очередь необходимо избавиться от триггера, который повреждает стволовые клетки костного мозга.
Для полноценного лечения апластической анемии необходимы комплексный подход, то есть применение фармакологии и специфических манипуляций.
Пересадка костного мозга.
Трансплантация стволовых клеток для восстановления костного мозга стволовыми клетками от донора может быть единственным успешным вариантом лечения для людей с тяжелой апластической анемией.
https://www.mayoclinic.org/diseases-conditions/aplastic-anemia/diagnosis-treatment/drc-20355020
Методами лечения АА считаются иммуносупрессивная терапия и аллогенная пересадка костного мозга.
Конечно, для реципиента эта процедура достаточно опасна, так как организм может не принять трансплантат, а собственных клеток не будет. Поэтому, для избежания такого состояния, пациенту выписываются препараты, который помогут предотвратить отторжение.
Стоит учитывать, что при использовании родственных доноров(братьев или сестер), показатель успешности вырастет, чем неродственных.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3418715/
К фармакологическим методам лечения относится применение:
- Иммунодепрессантов. Это препараты, которые подавляют иммунную систему пациента. применяется когда у пациента с тяжелой формой АА нет родственного донора. Таким образом, иммунная система перестает атаковать костный мозг, он может восстановиться и начать создавать здоровые клетки.

Для этого используют такие препараты:
— Антитимоцитарный иммуноглобулин
— циклоспорин А;
Также дополнительно назначаются кортикостероиды.
https://emedicine.medscape.com/article/198759-overview
2 Иногда в качестве симптоматической терапии используются стимуляторы костного мозга. Эти препараты помогают организму заставить костный мозг генерировать новые клетки. К ним относят филграстим, пэгфилграстим и другие.
- Дополнительные медикаменты. Так как апластическая анемия может сопровождаться большим количеством других заболеваний, которые возникли на фоне отсутствия клеток крови, то для полноценной терапии используют:
— Антибиотики или противовирусные. Для подавления бактерий и вирусов, которые атакуют организм из-за отсутствия лейкоцитов;
— Противовоспалительные. Для утоления головной боли, снятия жара.
— Противотошнотные. Их применяют, когда проводят пересадку костного мозга.
Переливание компонентов крови
Иногда апластическая анемия приводит к тому, что дефицит клеток крови настолько большой, что может угрожать жизни пациенту. Это может быть кровотечение, что не останавливается, тяжелая анемия. В таком случае врачи назначают переливание компонентов крови:
Это может быть кровотечение, что не останавливается, тяжелая анемия. В таком случае врачи назначают переливание компонентов крови:
— Эритроцитарная масса
— Тромбоцитарный концентрат.
Одним из плюсов переливания крови, считается скорость действия, ведь эффект виден уже через несколько часов и почти неограниченное количество. Но существует большой риск развития осложнений от большого количества чужеродной крови. А также, переливание крови не считается методом лечения апластической анемии. Это исключительно симптоматическое лечение, которое требует немедленного восстановления количества клеток.
Своевременное и современное лечения с помощью медикаментов и пересадки костного мозга апластической анемии повышает выживаемость на протяжении пяти лет, в 42%. При этом, в молодом возрасте, этот показатель в разы больше, чем в старшем.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3138728/
Гематология: Анемия — диагностика и лечение в СПб, цена
Анемия — это состояние, при котором снижается количество гемоглобина и эритроцитов (красных кровяных клеток) в единице объема крови. Анемии вследствие кровопотери еще называют «постгеморрагическими» (от латинского post— «после» и греческого haimorrhagia — «кровотечение»).
Анемии вследствие кровопотери еще называют «постгеморрагическими» (от латинского post— «после» и греческого haimorrhagia — «кровотечение»).
Симптомы анемии
- слабость,
- головокружение,
- утомляемость,
- зябкость,
- сонливость,
- «мушки» перед глазами,
- сердцебиение,
- одышка при привычной физической нагрузке,
- бледность кожи и слизистых оболочек.
У пожилых людей могут возникать и учащаться приступы стенокардии, у молодых женщин — нарушения менструального цикла. Объяснения подобному находят привычные: «устала», «стрессы в семье и на работе», «недосыпаю», «переработал». Между тем, довольно часто — это признаки анемии.
Есть критерии анемии, принятые ВОЗ (Всемирной Организацией Здравоохранения). Они очень просты. Диагноз «анемия» ставится при снижении концентрации гемоглобина: у мужчин — ниже 130 г/л, у женщин — ниже 120 г/л, у беременных женщин — ниже 110 г/л.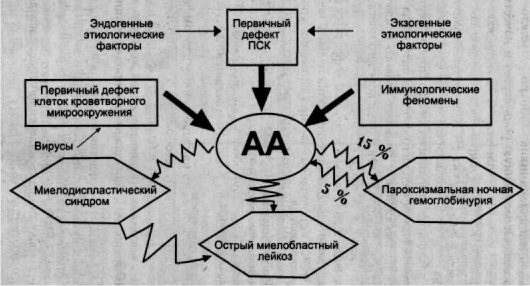
Гемоглобин – это безальтернативный переносчик кислорода ко всем клеткам и тканям человеческого организма. При снижении количества гемоглобина страдает доставка кислорода, отсюда и все признаки этого заболевания.
Существуют разные группы анемий, их различают в основном по причинам развития.
Наиболее частые причины
- Обильные или затяжные менструации.
- Кровоточащий геморрой.
- Желудочно-кишечные кровотечения.
- Носовые кровотечения.
Лечение
Поскольку данные анемии не являются самостоятельными заболеваниями, то необходимо устранить вызвавшую их причину: удалить геморроидальный узел, проводить лечение язвенной болезни и т. п. При прекращении кровотечений, как правило, прекращается и развитие анемии. В тяжелых случаях иногда бывает необходимо переливание крови.
Железодефицитные анемии
Развиваются при недостаточном поступлении в организм железа, что приводит к нехватке строительного материала для гемоглобина.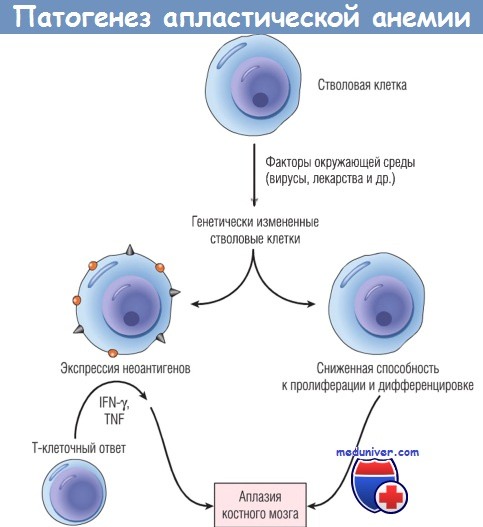
Этот вид анемий является самым распространенным. По данным ВОЗ, железодефицитные анемии составляют в мире в среднем около 80% (в России этот показатель еще выше — более 90%).Наиболее часто болеют маленькие дети и женщины в детородном возрасте.
Причины железодефицитных анемий
- повышенная потребность в железе вследствие ускоренного роста организма (у детей и подростков),
- беременность и кормление грудью,
- недостаточное поступление железа с пищей при вегетарианстве и голодании (несбалансированные диеты),
- нарушение усвоения железа в желудке при гастрите с пониженной кислотностью, после операций на желудке.
Лечение
Лечение назначается только после проведения полного обследования. Следует соблюдать специальную диету, основу которой составляют продукты, богатые железом. Но одного лишь изменения режима питания недостаточно, поэтому врачи назначают различные препараты железа: для приема внутрь в таблетках, капсулах, драже, а иногда и в виде внутримышечных инъекций или внутривенных капельных введений. В тяжелых случаях может понадобиться переливание компонентов крови.
В тяжелых случаях может понадобиться переливание компонентов крови.
В
12 — дефицитные анемииРазвиваются при недостатке в организме витамина В12 (цианокобаламина). Для образования эритроцитов требуются витамин В12 и фолиевая кислота. Витамин В12 поступает в организм с пищей. Для его всасывания необходим внутренний фактор —вещество, которое вырабатывается в слизистой оболочке желудка. При дефиците витамина В12 нарушается нормальный обмен соединений фолиевой кислоты, в результате чего в костном мозге вырабатываются чрезмерно крупные и перегруженные гемоглобином эритроциты. Эти сверхкрупные клетки легко разрушаются при движении по кровеносным сосудам.
Причины В
12 — дефицитных анемий- уменьшение выработки в желудке внутреннего фактора (атрофический гастрит, резекция желудка),
- генетические (наследственные) факторы,
- аутоиммунные заболевания щитовидной железы и сахарный диабет,
- онкологические заболевания желудочно-кишечного тракта,
- наличие паразитов (глистов).

Лечение
- инъекции препаратов витамина В12,
- прием фолиевой кислоты,
- назначение специальной диеты,
- переливание крови (в тяжелых случаях),
- курс лечения глистогонными средствами (при паразитарных заболеваниях).
Гемолитические анемии
Это большая группа наследственных и приобретенных анемий, обусловленных повышенным разрушением эритроцитов (гемолизом).
1. Приобретенные гемолитические анемии
- Иммунные. Развиваются вследствие сбоя в иммунитете, когда начинают вырабатываться антитела не к болезнетворным микроорганизмам, а к своим собственным клеткам — эритроцитам.
- Гемолитическая болезнь новорожденных. Развивается при резус-конфликте матери и плода.
- Анемии при механическом повреждении эритроцитов (протезирование клапанов сердца, гемолиз при хроническом гемодиализе — «искусственная почка»).
 При многократном контакте эритроцита с механическим препятствием разрушается его мембрана, и клетка просто изнашивается.
При многократном контакте эритроцита с механическим препятствием разрушается его мембрана, и клетка просто изнашивается. - Анемии при инфекциях (малярия, токсоплазмоз). Эритроциты разрушаются болезнетворными микроорганизмами.
- Анемии при воздействии внешних факторов: физических (ожоги), химических агентов, ядов (свинец).
2. Наследственные гемолитические анемии
Развиваются при врожденном дефекте мембраны эритроцитов, что ведет к нарушению формы и размеров красных кровяных клеток. Срок жизни таких эритроцитов укорачивается. При наследственной гемолитической анемии довольно часто в молодом возрасте обнаруживаются камни в желчном пузыре.
Симптомы гемолитической анемии очень сходны с признаками заболевания печени (гепатита):
- Желтушная окраска кожи и слизистых оболочек. Повышение уровня билирубина крови.При повышенном содержании в крови билирубин становится токсичным и вызывает тот же комплекс симптомов, что и при гепатите: тошноту, отсутствие аппетита, сухость во рту, общую слабость.

- Увеличение селезенки. Сопровождается тяжестью и болью в левом подреберье.
- Потемнение мочи за счет выделения билирубина и продуктов его разрушения.
Лечение
Лечение при гемолитической анемии проводится только в условиях стационара, поскольку признаки заболевания во многом сходны с симптомами гепатита и цирроза печени, и правильно поставить диагноз очень трудно. При запоздалом лечении может развиться гемолитический криз — угрожающее жизни состояние. Вследствие быстро развивающейся анемии резко нарастает сердечная слабость, усиливается сердцебиение, падает артериальное давление.
Назначаются высокие дозы гормонов — глюкокортикостероидов. При рецидивирующем течении болезни приходится удалять селезенку.
Апластическая анемия
Это заболевание, при котором происходит значительное уменьшение количества клеток всех видов в крови в результате снижения выработки их в костном мозге. Признаки апластической анемии сходны с проявлениями лучевой болезни. Анемия сопровождается развитием сердечно-сосудистой недостаточности. Вследствие снижения количества тромбоцитов у больных имеется склонность к кровотечениям, кровоизлияниям, кровоточивости.
Признаки апластической анемии сходны с проявлениями лучевой болезни. Анемия сопровождается развитием сердечно-сосудистой недостаточности. Вследствие снижения количества тромбоцитов у больных имеется склонность к кровотечениям, кровоизлияниям, кровоточивости.
Снижение количества лейкоцитов вызывает ослабление иммунитета и, как следствие, различные инфекционные осложнения: пневмонии, бронхиты, ангины, генерализованные грибковые поражения, а в наиболее тяжелых случаях — сепсис (заражение крови). Само заболевание обычно начинается с инфекционного процесса. Именно поэтому, если температура тела повышена более 3 суток, необходимо сделать анализ крови.
Лечение
В связи с тем, что апластическая анемия — один из наиболее тяжелых видов анемии, она требует обследования и лечения в специализированном стационаре. Лечение ее включает трансплантацию стволовых клеток, иммуносупрессивную терапию (введение антилимфоцитарного иммуноглобулина, циклоспорина А). Используются также переливание компонентов крови, профилактика и лечение инфекционных осложнений. Назначаются антибиотики, больных стараются оградить от всех контактов, поскольку любая инфекция может вызывать самые серьезные осложнения.
Используются также переливание компонентов крови, профилактика и лечение инфекционных осложнений. Назначаются антибиотики, больных стараются оградить от всех контактов, поскольку любая инфекция может вызывать самые серьезные осложнения.
Клиника высоких медицинских технологий им. Н. И. Пирогова располагает лабораторными и техническими возможностями для диагностики всех видов анемий. Ни в коем случае не следует лечиться с помощью «гуглотерапии», т. е. методом самостоятельного подбора лекарств на основании сведений из поисковых систем. Эксперименты со своим здоровьем могут привести к потере драгоценного времени. При появлении тревожных признаков нужно обратиться за помощью к специалистам.
Апластическая анемия — причины, симптомы, диагностика и лечение
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Общие сведения
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
Апластическая анемия
Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др.
 , обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
, обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными. - Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках.
 Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Экхимозы на коже при апластической анемии
Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследование пунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.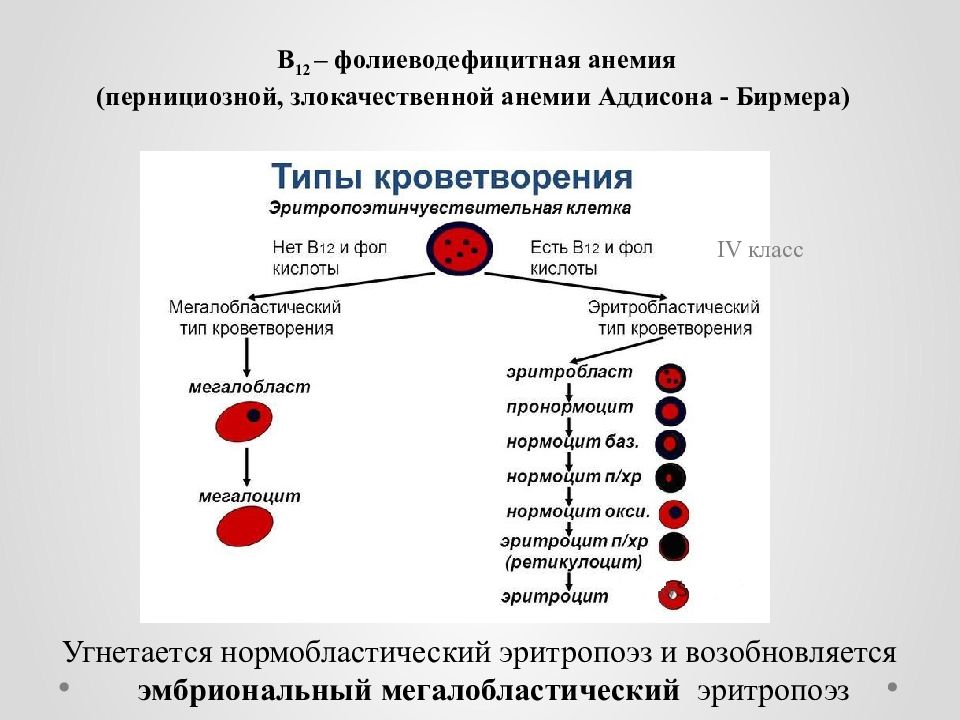
Миелограмма: слева — апластическая анемия, справа — нормальный костный мозг
Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза.
 Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом. - Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
Публикации в СМИ
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r) •• Группа В (тип 2, *227660, дефект гена FA2, r) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r) •• Группа D (тип 4, *227646, дефект гена FA4, r).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
Клиническая картина
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5´109/л, тромбоциты 100´109/л, мегакариоциты меньше 80´109/л) и тяжёлую (в периферической крови гранулоциты менее 0,5´109/л, тромбоциты менее 20´109/л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Дифференциальная диагностика • Транзиторная эритробластопения у детей • Миелодиспластический синдром • Пароксизмальная ночная гемоглобинурия • Острый лейкоз • Волосатоклеточный лейкоз • СКВ • Диссеминированная инфекция • Гиперспленизм • Анемии при гипотиреозе, гипопитуитаризме и заболеваниях печени.
ЛЕЧЕНИЕ
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
Консервативное лечение
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100´109/л, гранулоцитов более 1,5´109/л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100´109/л, гранулоцитов 0,5–1,5´109/л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30´109/л (без проведения трансфузий).
Течение и прогноз • Приобретённая анемия. Течение и прогноз прямо пропорциональны возрасту больного. При отсутствии своевременной и адекватной терапии 80% пациентов погибают в течение 3 мес от манифестации заболевания. С внедрением в клиническую практику циклоспорина шансы на продление жизни больного увеличились. При предполагаемой трансплантации костного мозга во избежание сенсибилизации в предоперационный период желательно избегать переливаний препаратов крови (в особенности от родственников) • Анемия Фанкони. Выживаемость не превышает 4 лет при изолированной заместительной терапии. Прогноз значительно благоприятнее при эффективности андрогенов или трансплантации костного мозга.
Синонимы: Для анемии Фанкони — синдром Фанкони.
МКБ-10 • D60 Приобретённая чистая красноклеточная аплазия [эритробластопения] • D61 Другие апластические анемии
Примечания • Аплазия костного мозга — врождённое или приобретённое тяжёлое состояние, проявляющееся панцитопенией. Врождённая форма сочетается с фенотипическими и цитогенетическими аномалиями, что облегчает диагностику • Панцитопения — снижение количества эритроцитов, лейкоцитов и тромбоцитов. Характерны бледность и сонливость, инфекции, обусловленные нейтропенией; геморрагический диатез вследствие тромбоцитопении. Для дифференциальной диагностики необходимо исследование костного мозга (аплазия [чаще гипоплазия] костного мозга, вытеснение ростков костного мозга бластными клетками, аутоиммунное разрушение клеток крови — синдром Эванса) • Конституциональными называют врождённые и иногда идиопатические типы анемий.
Апластическая анемия — это… Что такое Апластическая анемия?
Апластическая анемия — заболевание кроветворной системы, относящееся к категории миелодисплазий и выражающееся в резком угнетении или прекращении роста и созревания всех трёх клеточных линий в костном мозгу, или так называемом панмиелофтизе.
Для апластических анемий характерна выраженная панцитопения — анемия, лейкопения, тромбоцитопения и лимфопения.
История заболевания
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21 летней женщины. Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжелых растройств гемопоэза с летальностью превышающей 80 %. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения. В настоящее время заболевание с названием «апластическая анемия» выделяют как самостоятельную нозологическую единицу — и четко разграничивают его от синдрома гипоплазии кроветворения, являющегося проявлением ряда известных самостоятельных заболеваний костного мозга.
Этиология
Причинами апластической анемии могут быть:
- Химические вещества (мышьяк, соли тяжёлых металлов).
- Ионизирующее излучение. (см. Мария Склодовская-Кюри)
- Лекарственные препараты (НПВС, цитостатики, мерказолил, анальгин).
- Инфекционные агенты (вирусы, м/о).
- Аутоимунные процессы (СКВ, синдром Ширена).
Патогенез
Апластическая анемия может развиться при воздействии ряда миелотоксических факторов: ионизирувщего излучения, химических веществ — бензола, солей золота, мышьяка; лекарственных средств — хлорамфеникола (левомицетина), фенил-бутазона (бутадион), хлорпромазина (аминозин), мепро-бамата, дилантина, антиметаболитов (б-меркаптопурина, метотрексата), алкилирующих (циклофосфана, хлорбути-на) и некоторых других средств. Миелотоксический эффект от воздействия одних факторов (ионизирующее излучение, антиметаболиты) возникает всегда при достаточно большой дозе, других — проявляется индивидуально. Причина индивидуальной чувствительности, в частности к некоторым лекарственным средствам не всегда ясна, но может быть связана с генетическими дефектами кроветворных клеток. Это относится, например, к хлорамфениколу и фенилбутазону, которые вызывают супрессию (в зависимости от дозы) эритропоэза с частотой соответственно 1:24000 и 1:40000 лиц, их принимающих. Наследственный характер индивидуальной чувствительности эритропоэтических клеток к данным лекарственным веществам подтверждается развитием аплазии костного мозга у разных членов одной семьи и у однояйцевых близнецов. В других случаях вероятна связь индуцированного лекарственными веществами угнетения кроветворения с иммунными механизмами появлением антител к эритроцитарным предшественникам. Описаны случаи возникновения апластической анемии после острого вирусного гепатита (возможно, вследствие способности вируса гепатита изменять кариотип клеток, что было прослежено на культуре лейкоцитов), перенесенной инфекции вирусом Эпстайна — Барра, пар-вовирусом.
Существует и наследственная форма апластической анемии — анемия Фанкони.
Более чем у половины больных не удается выявить какие-либо причинные факторы — это так называемая идиопатическая апластическая анемия. Механизмы, лежащие в основе идиопатической формы анемии, неясны. Возможен аутоиммунный механизм, связанный с воздействием на клетки костного мозга аутоантител при участии иммунных лимфоцитов. Показано, что лимфоциты (Т-супрессоры) больных тормозят образование эритроцитных колоний костного мозга донора и могут нарушать дифференциацию и пролиферацию гематопоэтических предшественников.
Предполагают также, что основой апластической анемии может быть поражение (внутренний дефект) стволовой клетки, о чём свидетельствует восстановление кроветворения у больных после трансплантации им аллогенного костного мозга, содержащего нормальные стволовые клетки. Существуют экспериментальные данные, свидетельствующие о значении для развития апластического процесса и нарушений микроокружения — первичного дефекта стромальных клеток костного мозга. Однако суть этих клеточных дефектов остается неясной, так же как и их первичность. Возможно, что при разных формах апластической анемии патогенетические механизмы неодинаковы.
Клиника
- Анемический синдром.
- Геморагический синдром.
- Инфекционные осложнения.
Диагностика
Картина периферической крови представлена трицитопенией. Снижение гемоглобина значительно и может достигать критического уровня 20 — 30 г/л. Цветовой показатель обычно равен единице, но в ряде случаев может быть гиперхромия и макроцитоз эритроцитов. Количество ретикулоцитов резко снижено. Характерна выраженная лейкопения (агранулоцитоз). Абсолютное содержание лимфоцитов не изменено или снижено. Количество тромбоцитов всегда снижено, в некоторых случаях не удается обнаружить их вообще. В большинстве случаев увеличивается СОЭ (до 40 — 60 мм/час).
Клиническая картина заболевания позволяет сформировать первичное представление о патологии системы крови. Отправной точкой диагностического поиска является клиническое исследование крови с подсчетом количества ретикулоцитов и тромбоцитов. Выявление би- или трицитопении при исследовании периферической крови служит основанием для выполнения морфологического исследования костного мозга.
Диагноз АА устанавливают на основании типичной гистологической картины костного мозга, получаемого методом трепанобиопсии гребня подвздошной кости. Для получения качественного (информативного) биоптата используются трепаны, выпускаемые промышленным способом (Sherwood medical).
При гистологическом исследовании костного мозга обнаруживается большое количество жировой ткани, содержание которой может достигать 90 %. Среди доминирующей жировой ткани встречаются стромальные и лимфоидные элементы. Гематогенные клетки представлены крайне скудно: в небольшом количестве встречаются эритроидные и гранулоцитарные предшественники. Мегакариоциты отсутствуют.
Лечение
Лечение апластической анемии представляет собой очень сложную задачу. Основным и единственным патогенетическим методом лечения апластической анемии, позволяющим рассчитывать на спасение жизни больного, является трансплантация костного мозга от совместимого донора.
При невозможности подобрать донора проводится палиативная терапия. Она строится по следующей схеме. В качестве базисного препарата используется иммунодепресант циклоспорин А. У больных нетяжелой апластической анемией использование данного препарата позволяет рассчитывать в ряде случаев на успех. Кроме того использование циклоспорина А целесообразно и с тех позиций, что глюкокортикоиды, андрогены и антилимфоцитарный глобулин способны улучшить состояние гемопоэза у больных нетяжелой апластической анемией, но, однако, при этом следует принимать во внимание повышенный риск развития в последующем клональных заболеваний костного мозга. Применение циклоспорина А сводит такой риск к минимуму. Следует также отметить, что у части больных нетяжелой апластической анемией, преодолевших 6-месячный порог выживаемости, может наступить спонтанное улучшение даже если им не проводилось никакой иммуносупрессивной терапии. Эффект от иммуносупрессивной терапии у больных тяжелой и крайне тяжелой апластической анемией сомнителен.
Все больные апластической анемией нуждаются в заместительной трансфузионной терапии эритроцитарной и/или тромбоцитарной массой. Объём трансфузионной терапии определяется показателями периферической крови и клиническими проявлениями заболевания. Кроме того проводится антибактериальная и микостатическая терапия с целью профилактики или лечения инфекционных осложнений.
Прогноз
Примечания
Ссылки
Лечение апластической анемии в Испании
Доктор Вадим БережнойОснователь платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Апластическая анемия – редкое, но опасное заболевание крови, которое поражает костный мозг. Оно встречается в 6 случаях на миллион. Тяжелая анемия без надлежащего лечения может снизить качество жизни или даже привести к летальному исходу. Благодаря современным методам терапии, это заболевание бывает полностью излечимо в 70-80% случаев. Из этой статьи вы можете узнать о том, как проходит лечение апластической анемии в испанских клиниках, почему следует выбрать именно эту страну, и какие у пациентов есть возможности сэкономить на стоимости лечения.
Что такое апластическая анемия?
Апластическая анемия – заболевание, при котором организм не производит достаточного количества кровяных телец. В норме костный мозг вырабатывает красные и белые кровяные тельца, а также тромбоциты. Благодаря им организм обеспечивается кислородом, защищает себя от заболеваний и кровотечений.
При анемии стволовые клетки, которые находятся в костном мозге, повреждены и не могут выполнять свою функцию. Это состояние называется гипоплазия. Состояние, когда стволовые клетки отсутствуют совсем, называется аплазией.
Апластическая анемия бывает острой или хронической.
При небольшом поражении костного мозга апластическая анемия может проходить бессимптомно. Если урон более существенный, больной замечает такие признаки:
Апластическая анемия может возникать от разных причин, как последствие аутоиммунных заболеваний или перенесенных инфекций, побочный эффект лечения от рака или отравления химическими веществами. Иногда анемия возникает во время беременности.
Диагностика апластической анемии в Испании
Провести диагностику апластической анемии можно в любой из многопрофильных клиник Испании. На то, чтобы пройти весь комплекс процедур, уйдет только 1-2 дня без необходимости поступать в стационар. Сразу после постановки диагноза врачи могут приступить к лечению.
Анализ крови
Во время анализа крови врач измеряет количество красных и белых кровяных телец, а также тромбоцитов. Показатели зависят от пола и возраста пациента, а также его общего состояния здоровья. Различные заболевания влияют на результат теста. При апластической анемии будет cнижено количество всех частиц крови.
Цена общего анализа крови в Испании – от €300.
Биопсия костного мозга
Основной метод подтверждения диагноза “апластическая анемия” – это биопсия. С помощью специальной иголки врач извлекает частицу костного мозга, обычно – из бедренной кости пациента. Процедура проводится под местной анестезией. Полученный образец осматривается под микроскопом. Если у больного действительно анемия, врач увидит меньшее количество кровяных клеток. Кроме того, этот метод позволяет исключить другие заболевания, которые могут вызывать подобные симптомы.
Цена биопсии костного мозга в Испании – от €2,500.
Если доктора подтвердят диагноз, они могут назначить дополнительные анализы для того, чтобы определить причину заболевания. Это может быть серологический тест на инфекцию или периферический хромосомный анализ.
Лечение апластической анемии в Испании
Курс лечения, назначенный врачом, зависит от стадии заболевания, возраста больного и его общего состояния. Срочная госпитализация необходима только при тяжелой апластической анемии, когда нормально работает менее 25% костного мозга.
В качестве лечения доктор может предложить лекарства, переливание крови или пересадку костного мозга. В большинстве случаев, если анемия не хроническая – например, вызванная беременностью или химиотерапией – со временем она проходит сама. Врач подберет оптимальное лечение в зависимости от тяжести симптомов.
Переливание крови | Переливание крови не способно полностью вылечить апластическую анемию. Однако, с его помощью возможно устранить симптомы болезни и избежать крупных кровотечений.
Во время процедуры пациенту переливают донорскую кровь из банка крови. Это позволяет временно восполнить нехватку клеток крови в организме, однако со временем полученные клетки отмирают, и симптомы возвращаются.
Хотя формально не существует ограничений на частоту проведения процедуры, слишком много переливаний могут вызвать побочные эффекты. Полученные красные кровяные тельца, которые содержат железо, могут накапливаться в организме и наносить урон жизненно важным органам. Чтобы избежать этого, врачи прописывают лекарства, которые помогают телу избавиться от излишка железа.
Со временем иммунитет может начать выделять антитела к донорским клеткам крови. Из-за этого эффективность процедуры снижается. Если это происходит, врачи прописывают специальные препараты – иммуносупрессоры. Они ослабляют иммунитет.
Больным с тяжелой апластической анемией может понадобиться переливание крови чаще, чем раз в неделю. |
Медикаментозная терапия | В зависимости от причины возникновения апластической анемии, врачи назначают различные препараты.
При анемии, вызванной аутоиммунным заболеванием, используются иммуносупрессоры. Они позволяют ослабить иммунитет. Благодаря этому костный мозг получает возможность восстановиться и нормально функционировать. Однако, от этих лекарств человек становится более уязвимым к инфекционным заболеваниям. Кроме того, если перестать их принимать, анемия может вернуться.
Стимуляторы костного мозга помогают стволовым клеткам вырабатывать необходимые клетки крови. Их могут использовать как самостоятельный способ лечения, так и вместе с иммуносупрессорами.
Так как люди с апластической анемией часто болеют, врачи прописывают антибиотики и антивирусные препараты. Для пациентов с анемией обычная инфекция может оказаться фатальной, поэтому так важна медикаментозная терапия. |
Пересадка костного мозга | Это – главный метод лечения апластической анемии у детей и молодых людей. В Испании костный мозг могут пересадить от совместимого родственника или из базы доноров.
Перед процедурой больной должен пройти курс радио- или химиотерапии. Это делается для того, чтобы трансплантат мог прижиться. После этого здоровые стволовые клетки, изъятые у донора, вводятся пациенту в кровоток.
После пересадки костного мозга пациенту нужно 5-6 недель провести в больнице. Для того, чтобы трансплантат прижился, в этот период пациенту вводят препараты, которые ослабляют иммунитет. На период реабилитации больной остается уязвимым к инфекциям, поэтому ему нужно пребывать в стерильных больничных условиях под постоянным присмотром врачей и медсестер. |
В каких больницах Испании можно пройти лечение апластической анемии?
Университетская клиника Кирон в Мадриде
Университетская клиника Кирон в Мадриде – многопрофильный медицинский центр, один из лидеров в Испании и Европе. Клиника аккредитована по стандартам ISO.
В 2019 году 21 специалиста из больницы Кирон Мадрид попали в список “100 лучших врачей Испании” по версии журнала FORBES.
В клинике Кирон, лечение каждого пациента проводится опытными специалистами, которые придерживаются принципов индивидуального подхода и мультидисциплинарности. При центре есть Банк Крови, что сокращает время ожидания для больных, которым необходимо проводить переливание.
Среди пациентов, которые регулярно пользуются услугами клиники Кирон – спортсмены, звезды и политики с мировым именем.
Лечением апластической анемии у детей в больнице Кирон Мадрид занимается доктор Луиз Мадеро Лопез. Он возглавляет отделение педиатрической гематоонкологии. Также он руководит исследовательским проектом по изучению и лечения стволовыми клетками при институте “La Princesa”.
Пересадка костного мозга от неродственного донора в клинике Кирон стоит от €160,000.
Клиника Текнон
Клиника Текнон – один из ведущих медицинских центров Барселоны. Это учреждение имеет аккредитацию JCI, почетный сертификат Женералитета Каталонии, и знак качества European Foundation for Quality Management. Международный Журнал Медицинского Туризма признал клинику Текнон лучшей в Испании.
Врачи клиники Текнон входят в список “ТОП-100 докторов Испании” по версии журнала FORBES.
При клинике работает Институт Регенеративной Медицины, где занимаются разработкой и внедрением методов лечения стволовыми клетками. С 2003 года, когда было открыто это учреждение, лечение успело пройти 1,300 пациентов.
В этой клинике пересадка костного мозга от родственного донора будет стоить от €120,000.
Университетская клиника Наварры
Университетская клиника Наварры – одна из самых популярных в стране. 95% пациентов, которые проходили в ней лечение, остались довольны результатом. Больница активно сотрудничает с зарубежными институтами и международными исследовательскими программами. В 2004 году клиника получила аккредитацию JCI.
В отличие от отечественных больниц, диагностика и лечение в университетской клинике Наварры проходит быстро и эффективно. За 24 часа пациент может полностью пройти все необходимые исследования и получить диагноз, а за 72 – оптимальную схему лечения.
Пересадку костного мозга в этой больнице проводят уже более 20 лет. Здесь успешно оперируют на пациентах возрастом от 3,5 лет.
Цена пересадки костного мозга от неродственного донора – от €152,000.
Отзыв пациента о пересадке костного мозга в Испании
Валентина: “В Памплуне нас встретили предстваители клиники, поселили в гостинницу, предварительно договорились и согласовали о консультации с доктором, который в дальнейшем проводил мое лечение. В клинике современное высококачественное диагностическое оборудование, комфортабельные палаты, доброжелательный и отзывчивый медперсонал, который находился 24/7. Хочу выразить благодарность моему лечащему врачу, доктору Рифону, и его команде. Трансплантация костного мозга прошла успешно. Спустя 5 месяцев я вернулась домой. “
Сравнение цен на лечение апластической анемии в разных странах
Лечение в Испанских клиниках проводится по европейским стандартам и с соответствующими ценами. Однако, в сравнении с такими лидерами сферы, как Германия, Великобритания, США или Израиль, цена на лечение апластической анемии в Испании окажется ниже. При этом меньшая стоимость не обязательно говорит о низшем качестве. Клиники Испании используют такие же технологии, протоколы, и имеют такие же международные сертификаты, как и более дорогие медицинские центры.
| Процедура | Германия | Испания | Израиль |
|---|---|---|---|
| Пересадка костного мозга от родственного донора | от €200,000 | от €120,000 | от $160,000 |
| Пересадка костного мозга от неродственного донора | от €250,000 | от €160,000 | от $178,000 |
Особенности лечения апластической анемии в клиниках Испании
Успешность лечения апластической анемии в Испании составляет 90%.
Медицинские туристы выбирают Испанию в связи с доступом к международному банку доноров (WMDA). Такая возможность ежегодно спасает жизни сотням пациентов, несовместимых с родственниками. База данных банка – свыше 700,000 доноров.
Еще одно преимущество лечения в Испании – качественная реабилитация. В отличие от отечественных клиник, в Испании процессу выздоровления уделяется значительное внимание. Больной может рассчитывать на внимательный уход со стороны медсестер, личную программу реабилитации, разработанную врачами разных направлений и высоко комфортабельные условия пребывания. Палата, в которой остается пациент после пересадки костного мозга, содержится в максимальной стерильности и оснащена HEPA-фильтрами для снижения риска заражения инфекцией.
Кроме того, на скорость реабилитации влияет теплый морской климат. Многие медицинские туристы выбирают Испанию не в последнюю очередь из-за ее природы и архитектуры. Лечебные центры страны находятся в сердце городской жизни – Мадриде, Барселоне, Наварре. Пациенты и их сопровождающие могут насладиться туристическими преимуществами этой страны.
Лайфхаки от специалистов MediGlobus
Лечение в Испании находится в той же ценовой категории, что и в других странах Европы. Однако, для медицинских туристов существуют возможности сэкономить на затратах:
Перелет обойдется дешевле, если брать билеты на нетуристический сезон – с ноября по февраль. Более доступны рейсы поздно ночью и посреди недели, особенно у лоукост-компаний. Кроме того, следует обратить внимание на возможные акции и скидки.
Диагностику, которые были проведены дома, не обязательно повторять. Достаточно будет перевести документы на испанский или английский язык. Некоторые клиники предлагают услуги перевода медицинской документации за дополнительную оплату. Если пациент сомневается в результатах отечественных лабораторий, возможно провести гистологическую ревизию, что будет стоить дешевле, чем повторный анализ.
Можно значительно сэкономить на проживании, отказавшись от размещения сопровождающего лица в больнице. Конечно, в случае болезни ребенка, наличие родителей рядом очень важно. Но в остальных случаях возможны альтернативы. Часто можно недорого снять номер в отеле или квартиру недалеко от клиники.
Если пациент владеет английским языком на среднем уровне, то он сможет обойтись без услуг личного переводчика. Врачи, которые работают в клиниках Испании, получили европейское образование, и они легко смогут общаться с пациентом на простом и понятном языке, без злоупотребления сложными медицинскими терминами.
Если вас или ваших родных интересует диагностика и лечение апластической анемии, оставьте свою завяку на сайте, нажав кнопку “Получить бесплатную консультацию”. Один из наших врачей-координаторов перезвонит вам и поможет подобрать клинику для лечения, а также ответит на все вопросы и поможет с организацией поездки.
Получить бесплатную консультацию
Доктор Вадим Бережной
Основатель платформы MediGlobus. Медицинский эксперт, Заведующий отделением врачей-координаторов.
Занимается медицинским копирайтингом с 2019 года. Имеет образование в сфере клинической психологии. С 2010 года изучает медицину, окончила подготовительные курсы медшколы. Свободное время посвящает изучению современного положения медицинской сферы в мире и научных инноваций. В сферу интересов входят нейронауки, биология, генетика, физиология, медтехнологии. Свободно владеет украинским, английским и русским, изучает немецкий.
Похожие посты
Анемия Апластические анемии
Апластическая анемия — состояние, при котором имеет место панцитопения, сочетающаяся со снижением кроветворения в костном мозге, без признаков гемобластоза. Апластическую анемию следует рассматривать как синдром, и уже сейчас из этой группы выделяют отдельные нозологические формы, патогенез которых уточнен. В ряде случаев апластические анемии выявляются после приема некоторых лекарств и химических веществ, обладающих миелотоксическим действием. У 6ольшинства больных апластическая анемия возникает без воздействия явных токсических факторов. Часть случаев такой идиопатической апластической анемии, по всей вероятности, служит проявлением аутоагрессии против антигена клеток костного мозга. Можно предполагать, что те формы апластической анемии, которые протекают с признаками повышенного гемолиза, с увеличенной селезенкой, небольшим ретикулоцитозом, раздражением красного ростка костного мозга и четким эффектом от применения больших доз глюкокортикоидных гормонов, относятся к аутоиммунной панцитопении. Лимфоциты костного мозга больных апластической анемией могут нарушать дифференциацию гранулоцитов и пролиферацию клеток костного мозга. Имеется ряд описаний апластической анемии, возникшей после острого гепатита. В культуре лейкоцитов была установлена способность вируса гепатита вызывать хромосомные аномалии. Возможно, что одной из причин апластической анемии является уменьшение количества стволовых клеток.
В 1927 г. Fanconi описал трех братьев с апластической анемией и множественными наследственными нарушениями. В дальнейшем сообщалось о различных случаях синдрома Фанкони как с явной семейной патологией, так и единичных случаях в семье с большим количеством братьев и сестер. В настоящее время анемию Фанкони рассматривают как синдром, характеризующийся аплазией костного мозга, возникшей до 10 лет, часто семейной, сочетающейся с рядом других нарушений, таких, как темная пигментация кожи, гипоплазия почек, отсутствие или гипоплазия большого пальца руки, лучевой кости, микроцефалия и иногда умственное или половое недоразвитие, множественные хромосомные нарушения.
Клиническая картина
Идиопатической апластической анемии может быть разной. Чаще всего болезнь начинается исподволь, больной адаптируется к анемии и обращается к врачу уже тогда, когда выраженность панцитопении значительная. Клиническая картина депрессии кроветворения складывается из анемии различной выраженности, тромбоцитопении со всеми клиническими проявлениями тромбоцитопенического синдрома (кровоподтеки, петехиальные высыпания на коже, носовые кровотечения, меноррагии). Нередко отмечается: значительная выраженность нейтропении, следствием которой являются частые пневмонии, отиты, пиелиты и другие воспалительные процессы. Анемия связана как с нарушение образования эритроцитов, так и с кровотечениями. При осмотре обращают на себя внимание выраженная бледность, кожные геморрагии. Характерны воспалительные изменения на слизистой оболочке рта и прямой кишки. При выслушивании сердца нередко выявляется систолический шум на верхушке. При идиопатической форме болезни селезенка не пальпируется. Ее увеличение может иметь место при аутоиммунной форме и при гемосидерозе, развивающемся в результате массивных трансфузий крови. В одних случаях болезнь прогрессирует быстро и приводит к смерти. В других случаях она протекает сравнительно нетяжело, с периодическими ремиссиями, и иногда наступает полное выздоровление.
Картина крови
Выраженность анемии бывает большая, содержание гемоглобина снижается иногда до 20 — 30 г/л. Анемия чаще всего нормохромная, макроцитарная. Содержание ретикулоцитов от 0 до 5 %, ретикулоцитоз чаще свидетельствует об иммунной форме болезни. Эритрокариоциты в периферической крови появляются редко. Характерна выраженная гранулоцитопения. Иногда количество гранулоцитов снижается до 200 в 1 мкл, сопровождаясь развитием инфекционных осложнений. Иногда имеет место снижение абсолютного количества моноцитов. Уровень лимфоцитов в большинстве случаев остается нормальным. Количество тромбоцитов снижается иногда до нуля. При этом удлиняется время кровотечения, развивается геморрагический синдром. У большинства больных возрастает СОЭ до 30 — 50 мм/ч. В костном мозге чаще всего уменьшено количество миелокариоцитов, главным образом за счет предшественников клеток миелоидного ряда. Бывает иногда раздражение красного ростка. Увеличено количество лимфоцитов, плазматических клеток, тучных клеток. Мегакариоциты могут полностью отсутствовать. В костном мозге резко увеличено количество железа, однако большая его часть находится вне эритрокариоцитов. При гистологическом исследовании костного мозга, в одних случаях имеет место почти полное исчезновение костномозговых элементов и замещение их жировой тканью, в других случаях наблюдаются небольшие очаги кроветворения на фоне значительного опустошения костного мозга. Содержание железа сыворотки у большинства больных увеличено, процент насыщения трансферрина приближается к 100. При исследовании феррокинетики при помощи радиоактивного железа выявляется удлинение времени выведения железа из плазмы и снижение количества железа, включенного в эритроциты. Продолжительность жизни эритроцитов, измеренная при помощи радиоактивного хрома, обычно несколько укорачивается. Иногда увеличивается уровень фетального гемоглобина.
Диагноз
Апластической анемии ставят на основании не только обнаружения панцитопении в периферической крови, но и тщательного цитологического и гистологического исследования костного мозга, что необходимо прежде всего для исключения гемобластозов. При периферической панцитопении возникает необходимость исключения группы анемий, связанных с нарушением синтеза ДНК и РНК (мегалобластных анемий). У пожилых людей — это в первую очередь В12 — дефицитные анемии, у детей — фолиеводефицитные анемии. При этом имеет место гиперплазия костного мозга, выявляемая при трепанобиопсии, в костном мозге обнаруживаются мегалобласты. Наличие признаков внутрисосудистого гемолиза (обнаружение гемосидерина в моче, увеличение свободного гемоглобина плазмы, повышение ретикулоцитов, раздражение красного ростка костного мозга) может говорить либо в пользу болезни Маркиафавы — Микели, что может быть подтверждено положительной сахарозной пробой и пробой Хема, либо в пользу аутоиммунной панцитопении, которая может быть особенно вероятна при наличии положительной агрегатгемагглютинационной пробы.
Лечение
Апластической анемии зависит во многом от генеза болезни. При подозрении на связь апластической анемии с индивидуальной непереносимостью лекарств необходима отмена лекарства. При выраженной анемии с заместительной целью применяют трансфузии эритроцитной массы. При трансфузионных реакциях эритроциты подбирают по непрямой пробе Кумбса. Для профилактики гемотрансфузионных реакций иногда эффективно тщательное отмывание эритроцитов, использование замороженных эритроцитов с последующим их тщательным отмыванием. Для профилактики посттрансфузионного гемосидероза показано введение десферала. Это целесообразно и в связи исходным высоким уровнем железа у больных апластической анемией. Кортикостероидные гормоны, в частности преднизолон, должны быть применены для лечения у всех больных апластическим синдромом, так как в части случаев применение их оказывает хороший терапевтический эффект. При этом дозы преднизолона должны быть достаточно велики (60 — 100 мг в сутки). При неэффективности данного препарата, он должен быть сравнительно быстро отменен. Однако в тех случаях, когда преднизолон оказывает определенное действие на степень кровоточивости, но не сказывается на тромбоцитопении, лейкопении и анемии, препарат следует применять в небольшой дозе вплоть до спленэктомии. Спленэктомия широко применяется для лечения апластического синдрома. Эффект спленэктомии, по всей вероятности, связан с тем, что селезенка — основной лимфоидный орган. В ней вырабатываются антитела, содержатся лимфоциты, участвующие в клеточных цитотоксических реакциях. Эффект спленэктомии при апластическом синдроме наступает не сразу и не более чем у половины больных. Доза преднизолона в операционный период должна быть значительно увеличена по сравнению с исходной (в 2 — 3 раза). Для профилактики кровотечений в день операции целесообразно введение больших количеств концентратов тромбоцитов (более 3 доз). Широко применяют для лечения апластического синдрома анаболические гормоны (неробол). Анаполон (оксиметалон) следует применять в дозе 200 мг в течение3 — 4 месяцев. Эффект наступает не у всех больных. В настоящее время применяют трансплантацию костного мозга, подобранного по системам HL-A и MLc. Ремиссию получают у половины больных (лимфоциты больных апластической анемией тормозят образование эритроидных колоний донорского костного мозга). Для профилактики отторжения применяют большие дозы циклофосфана, тотальное облучение, антилимфоцитарный глобулин.
Прогноз
Ремиссию удается получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых. Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезенки и хотя бы небольшой, но четкий эффект от кортикостероидных гормонов. В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
Апластическая анемия: основы практики, предыстория, этиология
Breakey VR, Meyn S, Ng V, Allen C, Dokal I, Lansdorp PM, et al. Апластическая анемия, ассоциированная с гепатитом, проявляющаяся как синдром семейной недостаточности костного мозга. J Педиатр Hematol Oncol . 2009 31 ноября (11): 884-7. [Медлайн].
Gonzalez-Casas R, Garcia-Buey L, Jones EA, Gisbert JP, Moreno-Otero R. Систематический обзор: гепатит-ассоциированная апластическая анемия — синдром, связанный с аномальной иммунологической функцией. Алимент Фармакол Тер . 2009 г., 1. 30 (5): 436-43. [Медлайн].
Miano M, Dufour C. Диагностика и лечение апластической анемии: обзор. Инт Дж. Гематол . 2015 июн.101 (6): 527-35. [Медлайн].
McCormack PL. Эльтромбопаг: обзор его использования у пациентов с тяжелой апластической анемией. Наркотики . 2015 Апрель 75 (5): 525-31. [Медлайн].
[Рекомендации] Киллик С.Б., Баун Н., Кавенаг Дж., Докал И., Фуканели Т., Хилл А. и др.Рекомендации по диагностике и лечению апластической анемии у взрослых. Br J Haematol . 2016 Январь 172 (2): 187-207. [Медлайн]. [Полный текст].
[Рекомендации] Самарасингхе С., Вейс П., Вора А., Винн Р. Педиатрическая поправка к рекомендациям BSH для взрослых по апластической анемии. Br J Haematol . 2018 января 180 (2): 201-205. [Медлайн]. [Полный текст].
[Рекомендации] Бароне А., Лукарелли А., Онофрилло Д., Верзегнаси Ф., Бонаноми С. и др.Диагностика и лечение приобретенной апластической анемии в детском возрасте. Рекомендации группы исследования недостаточности костного мозга Итальянской ассоциации педиатрической гемато-онкологии (AIEOP). клеток крови Mol Dis . 2015 июн. 55 (1): 40-7. [Медлайн].
Мур Калифорния, Кришнан К. Апластическая анемия. 2020 Январь [Medline]. [Полный текст].
Wu Y, Yu J, Zhang L, Luo Q, Xiao JW, Liu XM и др. [Поддержка кроветворения мезенхимальных стволовых клеток у детей с апластической анемией]. Чжунго Данг Дай Эр Кэ За Чжи . 2008 10 августа (4): 455-9. [Медлайн].
Scopes J, Daly S, Atkinson R, Ball SE, Gordon-Smith EC, Gibson FM. Апластическая анемия: данные о дисфункциональных клетках-предшественниках костного мозга и корректирующем эффекте колониестимулирующего фактора гранулоцитов in vitro. Кровь . 1996 15 апреля. 87 (8): 3179-85. [Медлайн].
Молодой Н.С. Патофизиологические механизмы приобретенной апластической анемии. Образовательная программа по гематологии и соц. Гематол .2006. 72-7. [Медлайн].
Luzzatto L, Risitano AM. Успехи в понимании патогенеза приобретенной апластической анемии. Br J Haematol . 2018 5 июля. [Medline].
Лю Х., Михара К., Кимура А., Танака К., Камада Н. Индукция апоптоза в клетках CD34 + сыворотками пациентов с апластической анемией. Hiroshima J Med Sci . 1999 июн. 48 (2): 57-63. [Медлайн].
Callera F, Falcão RP.Увеличение количества апоптотических клеток в биоптатах костного мозга пациентов с апластической анемией. Br J Haematol . 1997 июл.98 (1): 18-20. [Медлайн].
Scopes J, Bagnara M, Gordon-Smith EC, Ball SE, Gibson FM. Гемопоэтические клетки-предшественники уменьшаются при апластической анемии. Br J Haematol . 1994 Февраль 86 (2): 427-30. [Медлайн].
Марш Дж. Долгосрочные посевы костного мозга при апластической анемии. евро J Haematol Suppl .1996. 60: 75-9. [Медлайн].
Марш Дж. К., Чанг Дж., Теста Н. Г., Хоус Дж. М., Декстер TM. Дефект кроветворения при апластической анемии оценивается с помощью длительного посева костного мозга. Кровь . 1990, 1. 76 (9): 1748-57. [Медлайн].
Solomou EE, Keyvanfar K, Young NS. T-bet, фактор транскрипции Th2, активируется в Т-клетках пациентов с апластической анемией. Кровь . 2006 15 мая. 107 (10): 3983-91. [Медлайн]. [Полный текст].
Socié G, Rosenfeld S, Frickhofen N, Gluckman E, Tichelli A.Поздние клональные заболевания пролеченной апластической анемии. Семин Гематол . 2000, январь, 37 (1): 91-101. [Медлайн].
Накао С. Иммунный механизм апластической анемии. Инт Дж. Гематол . 1997 августа 66 (2): 127-34. [Медлайн].
Frickhofen N, Kaltwasser JP, Schrezenmeier H, Raghavachar A, Vogt HG, Herrmann F, et al. Лечение апластической анемии антилимфоцитарным глобулином и метилпреднизолоном с циклоспорином или без него. Немецкая группа по изучению апластической анемии. N Engl J Med . 1991, 9 мая. 324 (19): 1297-304. [Медлайн].
Passweg JR, Pérez WS, Eapen M, Camitta BM, Gluckman E, Hinterberger W и др. Трансплантация костного мозга от несоответствующих и неродственных доноров при тяжелой апластической анемии. Пересадка костного мозга . 2006 апр. 37 (7): 641-9. [Медлайн].
Бачигалупо А., Бренд Р, Онето Р., Бруно Б., Сосье Дж., Пассвег Дж. И др. Лечение приобретенной тяжелой апластической анемии: трансплантация костного мозга по сравнению с иммуносупрессивной терапией — опыт Европейской группы по трансплантации крови и костного мозга. Семин Гематол . 2000, январь, 37 (1): 69-80. [Медлайн].
Hirano N, Butler MO, Von Bergwelt-Baildon MS, Maecker B., Schultze JL, O’Connor KC, et al. Аутоантитела часто обнаруживаются у пациентов с апластической анемией. Кровь . 2003 15 декабря. 102 (13): 4567-75. [Медлайн].
Solomou EE, Gibellini F, Stewart B, Malide D, Berg M, Visconte V и др. Мутации гена перфорина у больных приобретенной апластической анемией. Кровь .2007 15 июня. 109 (12): 5234-7. [Медлайн]. [Полный текст].
Solomou EE, Rezvani K, Mielke S, Malide D, Keyvanfar K, Visconte V и др. Дефицит CD4 + CD25 + FOXP3 + Т-регуляторных клеток при приобретенной апластической анемии. Кровь . 2007 сен 1. 110 (5): 1603-6. [Медлайн]. [Полный текст].
Сакагути Х., Нишио Н., Хама А., Кавасима Н., Ван Х, Нарита А. и др. Длина теломер лимфоцитов периферической крови как предиктор ответа на иммуносупрессивную терапию при апластической анемии у детей. Haematologica . 2014 Август 99 (8): 1312-6. [Медлайн]. [Полный текст].
Брюммендорф TH, Maciejewski JP, Mak J, Young NS, Lansdorp PM. Длина теломер в субпопуляциях лейкоцитов пациентов с апластической анемией. Кровь . 2001 15 февраля. 97 (4): 895-900. [Медлайн]. [Полный текст].
Шейнберг П., Купер Дж. Н., Слоанд Е. М., Ву Колорадо, Каладо Р. Т., Янг Н. С.. Связь длины теломер лейкоцитов периферической крови с гематопоэтическим рецидивом, злокачественной трансформацией и выживаемостью при тяжелой апластической анемии. JAMA . 2010 22 сентября. 304 (12): 1358-64. [Медлайн].
Александр В.С., Робертс А.В., Никола Н.А., Ли Р., Меткалф Д. Дефицит клеток-предшественников нескольких гематопоэтических клонов и дефектный мегакариоцитопоэз у мышей, лишенных тромбопоэтического рецептора c-Mpl. Кровь . 1996 15 марта. 87 (6): 2162-70. [Медлайн].
Кимура С., Робертс А.В., Меткалф Д., Александр В.С. Дефицит гемопоэтических стволовых клеток у мышей, лишенных c-Mpl, рецептора тромбопоэтина. Proc Natl Acad Sci U S A . 1998 г. 3. 95 (3): 1195-200. [Медлайн]. [Полный текст].
Фен Х, Шейнберг П., Ву КО, Самсель Л., Нуньес О., Принц С. и др. Сигнатуры цитокинов при приобретенной апластической анемии и миелодиспластических синдромах. Haematologica . 2011 Апрель 96 (4): 602-6. [Медлайн]. [Полный текст].
Переделать БП. Апластическая анемия, педиатрические аспекты. Онколог . 1996. 1 (6): 361-366. [Медлайн].
Вуллиами Т., Маррон А., Докал И., Мейсон П.Дж.Связь апластической анемии с мутациями теломеразной РНК. Ланцет . 22 июня 2002 г. 359 (9324): 2168-70. [Медлайн].
Ротбаум Р., Перро Дж., Влахос А., Чиполли М., Альтер Б.П., Берроуз С. и др. Синдром Швахмана-Даймонда: отчет с международной конференции. J Педиатр . 2002 Август 141 (2): 266-70. [Медлайн].
Dyment DA, O’Donnell-Luria A, Agrawal PB, et al. Альтернативные геномные диагнозы для людей с клиническим диагнозом синдрома Дубовица. Am J Med Genet A . 2021 января 185 (1): 119-133. [Медлайн].
Доэрти Л., Шин М.Р., Влахос А., Чусмель В., О’Донохью М.Ф., Клинтон С. и др. Гены рибосомных белков RPS10 и RPS26 обычно мутируют при анемии Даймонда-Блэкфана. Am J Hum Genet . 2010 12 февраля. 86 (2): 222-8. [Медлайн]. [Полный текст].
Alshaibani A, Dufour C, Risitano A, de Latour R., Aljurf M. Апластическая анемия, связанная с гепатитом. Hematol Oncol Stem Cell Ther .2020 10 ноября. [Medline]. [Полный текст].
Чжан Дж., Ян Т. [Мета-анализ связи между фосфорорганическими пестицидами и апластической анемией]. Чжунхуа Лю Син Бин Сюэ За Чжи . 2015 Сентябрь, 36 (9): 1005-9. [Медлайн].
Young NS, Maciejewski JP, Sloand E, Chen G, Zeng W., Risitano A, et al. Связь апластической анемии и ПНГ. Инт Дж. Гематол . 2002, авг., 76, приложение 2: 168-72. [Медлайн].
Кауфман Д.В., Келли Дж. П., Леви М., Шапиро С. Лекарственная этиология агранулоцитоза и апластической анемии . Нью-Йорк: издательство Оксфордского университета; 1991.
Issaragrisil S, Sriratanasatavorn C, Piankijagum A, Vannasaeng S, Porapakkham Y, Leaverton PE, et al. Заболеваемость апластической анемией в Бангкоке. Группа изучения апластической анемии. Кровь . 1991 15 мая. 77 (10): 2166-8. [Медлайн].
Ахмед П., Чаудхри КУН, Сатти Т.М., Махмуд С.К., Гафур Т., Шахбаз Н. и др. Эпидемиология апластической анемии: исследование 1324 случаев. Гематология . 2020 25 декабря (1): 48-54. [Медлайн].
Янг Н.С., Шимамура А. Синдромы приобретенной недостаточности костного мозга. Ханден Р.И., Люкс SE, Штоссель Т.П. Кровь: принципы и практика гематологии . 2-е изд. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2003. 297.
Locasciulli A, Oneto R, Bacigalupo A, Socié G, Korthof E, Bekassy A, et al. Результаты лечения пациентов с приобретенной апластической анемией, получавших первую линию трансплантации костного мозга или иммуносупрессивного лечения за последнее десятилетие: отчет Европейской группы трансплантации крови и костного мозга (EBMT). Haematologica . 2007 Январь 92 (1): 11-8. [Медлайн].
Чан К.В., Макдональд Л., Лим Д., Гримли М.С., Грейсон Г., Уолл Д.А. Трансплантация неродственной пуповинной крови детям с тяжелой идиопатической апластической анемией. Пересадка костного мозга . 2008 г., ноябрь 42 (9): 589-95. [Медлайн].
Бунин Н., Апленк Р., Ианноне Р., Лихи А., Групп С., Монос Д. и др. Трансплантация неродственного донорского костного мозга детям с тяжелой апластической анемией: минимальная РТПХ и длительное приживление с частичным истощением Т-лимфоцитов. Пересадка костного мозга . 2005 Февраль, 35 (4): 369-73. [Медлайн].
Канг Х.Дж., Шин Х.Й., Чой Х.С., Ан Х.С. Схема кондиционирования флударабина, циклофосфамида и тимоглобулина для неродственной трансплантации костного мозга при тяжелой апластической анемии. Пересадка костного мозга . 2004 Декабрь 34 (11): 939-43. [Медлайн].
Бродский Р.А., Сенсенбреннер Л.Л., Смит Б.Д., Дорр Д., Симан П.Дж., Ли С.М. и др. Устойчивая ремиссия без лечения после терапии высокими дозами циклофосфамида по поводу ранее нелеченой тяжелой апластической анемии. Энн Интерн Мед. . 2001, 2 октября. 135 (7): 477-83. [Медлайн].
Горовиц ММ. Современное состояние аллогенной трансплантации костного мозга при приобретенной апластической анемии. Семин Гематол . 2000, январь, 37 (1): 30-42. [Медлайн].
Кайто К., Кобаяси М., Катаяма Т., Масуока Х., Шимада Т., Нишиваки К. и др. Длительное введение G-CSF при апластической анемии тесно связано с ранним развитием МДС с моносомией 7 у взрослых. Br J Haematol . 1998 ноябрь 103 (2): 297-303. [Медлайн].
Piaggio G, Podestà M, Pitto A, Sessarego M, Figari O, Fugazza G и др. Сосуществование нормального и клонального гемопоэза у пациентов с апластической анемией, получавших иммуносупрессивную терапию. Br J Haematol . 1999 декабрь 107 (3): 505-11. [Медлайн].
Рости В. Молекулярные основы пароксизмальной ночной гемоглобинурии. Haematologica . 2000, январь, 85 (1): 82-7.[Медлайн].
Орази А, Чадер МБ. Миелодиспластические синдромы. Ам Дж. Клин Патол . 2009 август 132 (2): 290-305. [Медлайн].
Kulasekararaj AG, Jiang J, Smith AE, Mohamedali AM, Mian S, Gandhi S, et al. Соматические мутации определяют подгруппу пациентов с апластической анемией, которые прогрессируют до миелодиспластического синдрома. Кровь . 2014 18 августа [Medline].
Араи Й, Кондо Т., Ямадзаки Х., Такенака К., Сугита Дж., Кобаяши Т. и др.Аллогенная трансплантация неродственного костного мозга от пожилых доноров приводит к худшему прогнозу у реципиентов с апластической анемией. Haematologica . 2016 8 февраля [Medline].
Vajdic CM, Mayson E, Dodds AJ, O’Brien T., Wilcox L, Nivison-Smith I, et al. Второй риск рака и поздняя смертность у взрослых австралийцев, получающих аллогенную трансплантацию гемопоэтических стволовых клеток: популяционное когортное исследование. Пересадка костного мозга Biol . 2016 фев 6.[Медлайн].
Девале Б., Мюлье Ф, Шатлен Б., Догне Дж. М., Шатлен С. Патофизиология, диагностика и лечение пароксизмальной ночной гемоглобинурии: обзор. евро J Haematol . 2015 Сентябрь 95 (3): 190-8. [Медлайн].
Бродский Р.А., Мухина Г.Л., Ли С., Нельсон К.Л., Чиурацци П.Л., Бакли Дж. Т. и др. Улучшение выявления и характеристики пароксизмальной ночной гемоглобинурии с использованием флуоресцентного аэролизина. Ам Дж. Клин Патол .2000 Сентябрь 114 (3): 459-66. [Медлайн].
Krauss JS. Лабораторная диагностика пароксизмальной ночной гемоглобинурии (ПНГ): обновление 2010 г. Lab Medicine . 2012. 43: 20-4. [Полный текст].
Kulasekararaj AG, Jiang J, Smith AE, Mohamedali AM, Mian S, Gandhi S, et al. Соматические мутации определяют подгруппу пациентов с апластической анемией, которые прогрессируют до миелодиспластического синдрома. Кровь . 2014 г. 23 октября. 124 (17): 2698-https: // www.ncbi.nlm.nih.gov/pmc/articles/pmid/25139356/. [Медлайн].
Хосокава К., Кадзигая С., Фенг Х, Десьерто М.Дж., Фернандес Ибанез, доктор медицины, Риос О. и др. Сигнатура микроРНК плазмы в качестве биомаркера приобретенной апластической анемии. Haematologica . 2017 Январь 102 (1): 69-78. [Медлайн]. [Полный текст].
Fang J, Lin L, Wang Y, Lin D, Liu C, Sunlong Q и др. Регуляторные Т-клетки и В-клетки CD20 + при очень тяжелой апластической анемии у детей: возможные клинические маркеры для оценки терапевтической эффективности и прогноза. Гематология . 2018 11. 1-5 июля. [Медлайн]. [Полный текст].
Бродский Р.А. Приобретенная апластическая анемия. Грир Дж. П., Арбер Д. А., Глэдер Б., Список А. Ф., Средство РТ младший, Параскевас Ф, Роджерс Г. М., ред. Клиническая гематология Винтроба . 13-е изд. Филадельфия, Пенсильвания: Уолтерс Клувер / Липпинкотт Уильямс и Уилкинс; 2014. 965-74.
Matcuk GR Jr, Siddiqi I, Cen S, Hagiya A, Isaacson R, Brynes R. Расчет МРТ клеточности костного мозга и корреляция с биопсией костного мозга. Clin Imaging . 2016 май-июнь. 40 (3): 392-7. [Медлайн].
Camitta BM, Thomas ED, Nathan DG, Gale RP, Kopecky KJ, Rappeport JM, et al. Проспективное исследование андрогенов и трансплантации костного мозга для лечения тяжелой апластической анемии. Кровь . 1979 г., 53 (3): 504-14. [Медлайн].
Вальдес Дж. М., Шейнберг П., Янг Н. С., Уолш Т. Дж. Инфекции у больных апластической анемией. Семин Гематол . 2009 июл.46 (3): 269-76. [Медлайн].
Jancel T, Пензак СР. Противовирусная терапия у пациентов с гематологическими злокачественными новообразованиями, трансплантацией и апластической анемией. Семин Гематол . 2009 Июль 46 (3): 230-47. [Медлайн].
Pournaras S, Iosifidis E, Roilides E. Достижения в области антибактериальной терапии против появляющихся бактериальных патогенов. Семин Гематол . 2009 Июль 46 (3): 198-211. [Медлайн].
Ди Бона Э, Родегьеро Ф, Бруно Б., Габбас А., Фоа П., Локациулли А. и др.Антитимоцитарный глобулин кролика (r-ATG) плюс циклоспорин и гранулоцитарный колониестимулирующий фактор являются эффективным средством лечения пациентов с апластической анемией, не отвечающих на первый курс интенсивной иммуносупрессивной терапии. Gruppo Italiano Trapianto di Midollo Osseo (GITMO). Br J Haematol . 1999 ноябрь 107 (2): 330-4. [Медлайн].
Bacigalupo A, Broccia G, Corda G, Arcese W, Carotenuto M, Gallamini A, et al. Антилимфоцитарный глобулин, циклоспорин и гранулоцитарный колониестимулирующий фактор у пациентов с приобретенной тяжелой апластической анемией (SAA): пилотное исследование Рабочей группы EBMT SAA. Кровь . 1995 г. 1. 85 (5): 1348-53. [Медлайн].
Dufour C, Ferretti E, Bagnasco F, Burlando O, Lanciotti M, Ramenghi U и др. Изменения цитокинового профиля до и после иммуносупрессии при приобретенной апластической анемии. Haematologica . 2009 декабрь 94 (12): 1743-7. [Медлайн]. [Полный текст].
Schrezenmeier H, Passweg JR, Marsh JC, Bacigalupo A, Bredeson CN, Bullorsky E, et al. Более неблагоприятный исход и более выраженная РТПХ с клетками-предшественниками периферической крови по сравнению с костным мозгом при трансплантации HLA-сопоставимых донорских трансплантатов для молодых пациентов с тяжелой приобретенной апластической анемией. Кровь . 2007 15 августа. 110 (4): 1397-400. [Медлайн]. [Полный текст].
Кумар Р., Кимура Ф., Ан К.В., Ху Чж., Кувацука Ю. и др. Сравнение результатов с костным мозгом или стволовыми клетками периферической крови в качестве источника трансплантата для трансплантатов от родственных братьев и сестер при тяжелой апластической анемии в разных экономических регионах. Пересадка костного мозга Biol . 2016 18 января [Medline].
Локателли Ф., Бруно Б., Зекка М., Ван-Линт М.Т., Макканн С., Арсез В. и др.Циклоспорин А и краткосрочный метотрексат в сравнении с циклоспорином А в качестве профилактики болезни трансплантат против хозяина у пациентов с тяжелой апластической анемией, получавших аллогенную трансплантацию костного мозга от HLA-идентичного брата или сестры: результаты рандомизированного исследования GITMO / EBMT. Кровь . 2000 сентября 1. 96 (5): 1690-7. [Медлайн].
Джордж Б., Мэтьюз В., Висвабандия А., Кавита М.Л., Шривастава А., Чанди М. Схемы кондиционирования с пониженной интенсивностью (RIC) на основе флударабина и циклофосфамида снижают отторжение и улучшают исход у индийских пациентов, перенесших трансплантацию аллогенных стволовых клеток по поводу тяжелой апластической анемии. Пересадка костного мозга . 2007 июл. 40 (1): 13-8. [Медлайн].
Андерлини П., Ву Дж, Герстен И., Юэлл М., Толар Дж., Антин Дж. Х. и др. Кондиционирование циклофосфамида у пациентов с тяжелой апластической анемией, которым была проведена неродственная трансплантация костного мозга: исследование деэскалации дозы 1-2 фазы. Ланцет Гематол . 2015 Сентябрь 2 (9): e367-75. [Медлайн].
Kekre N, Zhang Y, Zhang MJ, Carreras J, Ahmed P, Anderlini P и др. Влияние источника антитимоцитарного глобулина на результаты трансплантации костного мозга при тяжелой апластической анемии. Haematologica . 24 марта 2017 г. [Medline]. [Полный текст].
Maury S, Balère-Appert ML, Chir Z, Boiron JM, Galambrun C, Yakouben K, et al. Трансплантация неродственных стволовых клеток при тяжелой приобретенной апластической анемии: улучшенный результат в эпоху сопоставления HLA с высоким разрешением между донором и реципиентом. Haematologica . 2007 май. 92 (5): 589-96. [Медлайн].
Yagasaki H, Takahashi Y, Hama A, et al. Сравнение BMT родственного брата и неродственного донора у детей и подростков с приобретенной тяжелой апластической анемией. Пересадка костного мозга . 2010 Октябрь 45 (10): 1508-13. [Медлайн].
Толар Дж., Диг Х. Дж., Араи С., Хорвиц М., Антин Дж. Х., Маккарти Дж. М. и др. Кондиционирование на основе флударабина для трансплантации костного мозга от неродственных доноров при тяжелой апластической анемии: первые результаты исследования деэскалации дозы циклофосфамида показывают опасные для жизни нежелательные явления при заранее определенных уровнях доз циклофосфамида. Пересадка костного мозга Biol . 2012 июл.18 (7): 1007-11. [Медлайн].
Sheth VS, Potter V, Gandhi SA, Kulasekararaj AG, de Lavallade H, Muus P, et al. Аналогичные результаты трансплантации гемопоэтических клеток на основе алемтузумаба для пациентов с SAA старше или моложе 50 лет. Blood Adv . 2019 22 октября 3 (20): 3070-3079. [Медлайн]. [Полный текст].
Хамад Н., Дель Бел Р., Месснер Х.А., Ким Д., Курувилла Дж., Липтон Дж. Х. и др. Результаты трансплантации гемопоэтических клеток у взрослых пациентов с приобретенной апластической анемией с использованием кондиционирования на основе промежуточных доз на основе алемтузумаба. Пересадка костного мозга Biol . 2014 10 июля. [Medline].
Самарасингхе С., Стюард С., Хиваркар П., Саиф М.А., Хаф Р., Уэбб Д. и др. Превосходный результат трансплантации совместимого неродственного донора при детской апластической анемии после неэффективности иммуносупрессивной терапии: многоцентровый ретроспективный опыт Соединенного Королевства. Br J Haematol . 2012 май. 157 (3): 339-46. [Медлайн].
Clay J, Kulasekararaj AG, Potter V, Grimaldi F, McLornan D, Raj K и др.Немиелоаблативная гаплоидентичная трансплантация стволовых клеток периферической крови при рефрактерной тяжелой апластической анемии. Пересадка костного мозга Biol . 2014 10 июля. [Medline].
Эль-Гохари Г., Эль-Факих Р., де Латур Р., Ризитано А., Марш Дж., Шрезенмайер Х. и др. Гаплоидентичная трансплантация гемопоэтических стволовых клеток при апластической анемии: систематический обзор и метаанализ клинических результатов от имени рабочей группы по тяжелой апластической анемии Европейской группы трансплантации крови и костного мозга (SAAWP EBMT). Пересадка костного мозга . 2020 Октябрь, 55 (10): 1906-1917. [Медлайн].
Du S, He W, Yang Y, Gao X, Ding J. Трансплантация неродственной пуповинной крови при тяжелой апластической анемии с использованием усиленного режима иммуноаблативного кондиционирования, ведущего к высокому приживлению трансплантата и выживаемости. Пересадка костного мозга . 2020 Август 55 (8): 1677-1680. [Медлайн]. [Полный текст].
Peffault de Latour R, et al; Франкоязычное общество трансплантации костного мозга и клеточной терапии.Несвязанная трансплантация пуповинной крови пациентам с идиопатической рефрактерной тяжелой апластической анемией: общенациональное исследование фазы 2. Кровь . 2018 16 августа. 132 (7): 750-754. [Медлайн]. [Полный текст].
Schrezenmeier H, Korper S, Hochsmann B. Стандартная иммуносупрессия первой линии при приобретенной тяжелой апластической анемии у взрослых. Curr Drug Targets . 2015, 30 июня. [Medline].
Бачигалупо А. Как я лечу приобретенную апластическую анемию. Кровь . 2017 16 марта. 129 (11): 1428-1436. [Медлайн]. [Полный текст].
Тичелли А., де Латур Р.П., Пассвег Дж., Кнол-Бут C, Сосье Дж., Марш Дж. И др. Долгосрочные результаты рандомизированного контролируемого исследования у пациентов с недавно диагностированной тяжелой апластической анемией, получавших антитимоцитарный глобулин и циклоспорин, с или без гранулоцитарного колониестимулирующего фактора: исследование рабочей группы по тяжелой апластической анемии Европейской группы трансплантации крови и костного мозга. Haematologica . 2020 май. 105 (5): 1223-1231. [Медлайн]. [Полный текст].
Шейнберг П., Нуньес О., Вайнштейн Б. и др. Лошадь против антитимоцитарного глобулина кролика при приобретенной апластической анемии. N Engl J Med . 2011 авг. 4. 365 (5): 430-8. [Медлайн].
Хаякава Дж., Канда Дж., Акахоши Ю., Харада Н., Камеда К., Угай Т. и др. Метаанализ лечения апластической анемии кроличьим и конским антитимоцитарными глобулинами. Инт Дж. Гематол .2017 г. 11 января [Medline].
Bacigalupo A, Oneto R, Schrezenmeier H, Hochsmann B, Dufour C, Kojima S, et al. Лечение первой линии апластической анемии тимоглобулином в Европе и Азии: результаты лечения 955 пациентов, 2001-2012 гг. Ам Дж. Гематол . 2018 май. 93 (5): 643-648. [Медлайн]. [Полный текст].
Машан А., Богачева Н., Крыьяновский О., Шнейдер М., Литвинов Д., Митюшкина Т. и др. Результаты в едином центре иммуносупрессии циклоспорином А у 66 детей с апластической анемией. Br J Haematol . 1999 Сентябрь 106 (4): 967-70. [Медлайн].
Мандал П.К., Баул С., Долай Т.К., Де Р., Чакрабарти П. Результат монотерапии циклоспорином у пациентов с апластической анемией: опыт больницы третичного ухода в Восточной Индии. Indian J Hematol Blood Transfus . 2017 марта 33 (1): 144-147. [Медлайн].
Doney K, Dahlberg SJ, Monroe D, Storb R, Buckner CD, Thomas ED. Терапия тяжелой апластической анемии с помощью античеловеческого тимоцитарного глобулина и андрогенов: эффект HLA-гаплоидентичной инфузии костного мозга. Кровь . 1984 Февраль 63 (2): 342-8. [Медлайн].
Marsh JC, Hows JM, Bryett KA, Al-Hashimi S, Fairhead SM, Gordon-Smith EC. Выживаемость после лечения апластической анемией антилимфоцитарными глобулинами зависит от тяжести заболевания. Кровь . 1987 Октябрь 70 (4): 1046-52. [Медлайн].
Means RT Jr, Krantz SB, Dessypris EN, Lukens JN, Niblack GD, Greer JP, et al. Повторное лечение апластической анемии антитимоцитарным глобулином или антилимфоцитарной сывороткой. Am J Med . 1988 апр. 84 (4): 678-82. [Медлайн].
Schrezenmeier H, Marin P, Raghavachar A, McCann S, Hows J, Gluckman E, et al. Рецидив апластической анемии после иммуносупрессивного лечения: отчет Рабочей группы SAA Европейской группы трансплантации костного мозга. Br J Haematol . 1993 Октябрь 85 (2): 371-7. [Медлайн].
Schrezenmeier H, Hertenstein B, Wagner B, Raghavachar A., Heimpel H. Патогенетическая связь между апластической анемией и пароксизмальной ночной гемоглобинурией подтверждается высокой частотой пациентов с апластической анемией с дефицитом фосфатидилинозитол-гликанового анхо-фосфатного белка. Опыт Гематол . 1995 23 января (1): 81-7. [Медлайн].
Stein RS, Means RT Jr, Krantz SB, Flexner JM, Greer JP. Лечение апластической анемии исследуемой антилимфоцитарной сывороткой, приготовленной на кроликах. Am J Med Sci . 1994 Декабрь 308 (6): 338-43. [Медлайн].
Tichelli A, Passweg J, Nissen C, Bargetzi M, Hoffmann T, Wodnar-Filipowicz A, et al. Повторное лечение конским антилимфоцитарным глобулином при тяжелой апластической анемии. Br J Haematol . 1998 Февраль 100 (2): 393-400. [Медлайн].
Ким С.Ю., Ле Радемахер Дж., Антин Дж. Х., Андерлини П., Аяс М., Баттивалла М. и др. Миелодиспластический синдром, развивающийся из апластической анемии, леченной иммуносупрессивной терапией: эффективность трансплантации гемопоэтических стволовых клеток. Haematologica . 2014 декабрь 99 (12): 1868-75. [Медлайн].
Тисдейл Дж. Ф., Данн Д. Е., Геллер Н. и др. Высокие дозы циклофосфамида при тяжелой апластической анемии: рандомизированное исследование. Ланцет . 2000, 4 ноября. 356 (9241): 1554-9. [Медлайн].
Olnes MJ, Scheinberg P, Calvo KR, Desmond R, Tang Y, Dumitriu B, et al. Эльтромбопаг и улучшение кроветворения при рефрактерной апластической анемии. N Engl J Med . 2012 июл 5. 367 (1): 11-9. [Медлайн]. [Полный текст].
Промакта (элтромбопаг) информация о назначении [листок-вкладыш]. Парк Исследований Треугольника, Северная Каролина 27709: GlaxoSmithKline. Август 2014 г. Доступно в [Полный текст].
Таунсли Д.М., Шейнберг П., Винклер Т., Десмонд Р., Думитриу Б., Риос О. и др. Эльтромбопаг добавлен к стандартной иммуносупрессивной терапии апластической анемии. N Engl J Med . 2017 20 апреля. 376 (16): 1540-1550. [Медлайн]. [Полный текст].
Geng W, Kearney S, Nelson S. Первоначальная монотерапия элтромбопагом вызывает стабильную гематологическую ремиссию у педиатрических пациентов с нетяжелой идиопатической апластической анемией. Рак крови у детей . 2018 22 июн.23 (7): e27290. [Медлайн].
Дополнение об утверждении. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу https://www.accessdata.fda.gov/drugsatfda_docs/appletter/2018/022291Orig1s021ltr.pdf. 16 ноября 2018 г .; Доступ: 14 января 2019 г.
Ли Дж. У., Ли С. Е., Юнг К. В., Парк С., Кета Х, Парк С. К. и др. Ромиплостим у пациентов с рефрактерной апластической анемией, ранее получавших иммуносупрессивную терапию: исследование фазы 2 по подбору дозы и долгосрочному лечению. Ланцет Гематол . 6 (11) ноября 2019 г .: e562-e572.
Хосокава К., Ямазаки Х., Танабе М. и др. Высокие дозы ромиплостима ускоряют гематологическое восстановление у пациентов с апластической анемией, резистентной к элтромбопагу. Лейкемия . 2020. [Полный текст].
Патофизиология апластической анемии — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]; Заместитель главного редактора: Приямвада Сингх, М.D. [2] Назия Фуад, доктор медицины.
Пожалуйста, помогите WikiDoc, добавив сюда содержание. Это просто! Щелкните здесь, чтобы узнать о редактировании.
Обзор
Костный мозг — это губчатая ткань, находящаяся в губчатых или губчатых частях костей. Он сильно васкуляризован и богат иннервируется. Костный мозг является основным местом кроветворения и состоит из кроветворных клеток, жировой ткани костного мозга и стромальных клеток. Наиболее важным признаком патофизиологии апластической анемии является потеря гемопоэтических стволовых клеток.Это может быть нарушение кроветворения или иммуноопосредованная деструкция костного мозга. Лекарства, химические вещества, вирусы и различные мутации изменяют иммунологический вид HSC, что приводит к аутоиммунному разрушению клеток костного мозга. АК может постепенно перерасти в другое гематологическое заболевание, которое включает пароксизмальную ночную гемоглобинурию [ПНГ], миелодиспластические синдромы [МДС] и острый миелоидный лейкоз [ОМЛ]). Клональная эволюция при АК может происходить из-за мутаций или цитогенетических аномалий.Обычно мутировавшие гены: DMNT3A, ASXL1, BCOR, BCORL1, PIGA .
Патофизиология
Физиология
Нормальную физиологию костного мозга можно понять следующим образом: [1]
.
Патогенез
Наиболее важным признаком патофизиологии апластической анемии является потеря гемопоэтических стволовых клеток. [2] [3]
Патофизиологические механизмы, которые приводят к потере HSC и вызывают апластическую анемию, включают:
Кроветворная недостаточность
Иммуноопосредованное Т-клеточное разрушение костного мозга
- Лекарства, химические вещества, вирусы и различные мутации изменяют иммунологический вид HSC, что приводит к аутоиммунному разрушению клеток костного мозга. [4]
- У пациентов с приобретенной апластической анемией лимфоциты ответственны за разрушение кроветворных клеток.
- Эти Т-клетки продуцируют фактор ингибирования, интерфероны, фактор некроза опухоли и интерлейкин-2, что приводит к гибели гемопоэтических клеток в результате апоптоза. У этих пациентов наблюдается дефицит
- CD4 + CD25 + FOXP3 + регуляторных Т-клеток, аналогично тому, что наблюдается при других аутоиммунных состояниях.
- Дефицит этих регуляторных Т-клеток приводит к увеличению уровня белка T-bet в Т-клетках, увеличению интерферона (IFN) -γ2 и разрушению стволовых клеток.
- Повышенный иммунный ответ, включая фактор некроза опухоли -α, IFNγ и интерлейкин-6, также очень часто встречается у пациентов с АА.
Клональная эволюция
- AA может постепенно развиваться в другое гематологическое заболевание, которое включает [3]
- Гены, которые обычно оказываются мутированными, это
- DMNT3A
- ASXL1
- BCOR
- BCORL1
- PIGA
Генетика
Гены, участвующие в патогенезе апластической анемии, включают: [3]
- HLA-DR15
- CD4 + CD25 + FOXP3 + регуляторные Т-клетки
- STAT3
- ТЕРТ
- TERC
Сопутствующие условия
Апластическая анемия связана со следующими состояниями: [4]
Макропатология
Апластическая анемия не имеет макроскопической патологии.
Микроскопическая патология
При апластической анемии микроскопия костного мозга выявляет гипо- и даже бесклеточность, жировую ткань и бледную строму. [3]
Список литературы
Патофизиология и лечение апластической анемии | Гематология
В этой книге учтены самые последние результаты лабораторных исследований и клинических испытаний, чтобы предоставить исчерпывающий и актуальный справочник по патофизиологии, эпидемиологии, диагностике и лечению приобретенной и наследственной апластической анемии. Помимо подробного обзора патофизиологии заболевания, международная группа авторов охватывает все аспекты лечения, включая устоявшиеся подходы к трансплантации костного мозга и иммуносупрессивное лечение, новые подходы, такие как использование гемопоэтических факторов роста и усиление иммуносупрессии. и спорные вопросы, такие как трансплантация стволовых клеток.Также включен важный международный согласованный документ по лечению, а последний раздел посвящен наследственному синдрому анемии Фанкони. Приведены подробные рекомендации по лечению, что делает этот ресурс основным ресурсом для гематологов и других клиницистов, участвующих в ведении и поддерживающем уходе за пациентами с апластической анемией. Ученые, интересующиеся недостаточностью костного мозга, также найдут в этом бесценную справочную информацию.
«Эта книга содержит исчерпывающие и современные концепции патофизиологии, эпидемиологии, диагностики и лечения приобретенной и наследственной апластической анемии.Книга отличная и приятная для чтения. Любитель, удовлетворенный уверенностью, извлечет из нее больше, чем беспристрастный профессиональный поиск и вызов. Для большинства врачей, и особенно для гематологов, книга пользуется успехом как пример принципа «прежде всего не навреди». Апластическая анемия — это супер-учебник, который должен быть в библиотеке каждого ученого, интересующегося этой темой. Я бы также посоветовал книгу студентам-медикам ». Пио Конти, Международный журнал иммунопатологии и фармакологии
«Книга актуальна и дает четкую информацию о патогенезе… эта книга настоятельно рекомендуется, и она будет оставаться ценной на долгие годы.’ Джилл Хоус, гематологическая онкология,
Апластическая анемия будет полезным справочником для врачей, которые имеют дело с этим заболеванием, и хорошим источником исходной информации для тех, кто проводит фундаментальные исследования механизмов ». Журнал Королевского медицинского общества
«В настоящее время этот справочник является наиболее актуальным специализированным справочником по этому вопросу. Он будет интересен и должен быть прочитан стажерами как детской, так и взрослой гематологии и онкологии.’ Doody’s Health Book Review Journal
«Апластическая анемия (АА) — это редкое, сложное и часто смертельное заболевание, которое с помощью соответствующей терапии сегодня имеет высокий уровень излечения. Эта книга — отличный обзор этого заболевания с особым акцентом на различных терапевтических методах. Его необходимо прочитать всем стипендиатам в области гематологии / онкологии, а также другим врачам, лечащим пациентов с АА или анемией Фанкони. Это также важный источник информации, который будет служить справочным пособием в новом столетии.’ Brynjar Vidarsson, Oncology / Karger
(PDF) Патогенез апластической анемии
[3] Akram Z, Ahmed P, Kajigaya S, et al. Эпидемиологическая,
клиническая и генетическая характеристика апластической анемии
пациентов в Пакистане. Ann Hematol. 2019; 98: 301–312.
[4] Li SS, Hsu YT, Chang C, et al. Заболеваемость и лечение
исход апластической анемии на Тайване, реальные данные
на основе опыта одного института и общенациональная база данных на основе населения
.Ann Hematol. 2019; 98: 29–
39.
[5] Накагава М.М., Ратинам CV. Конститутивная активация
канонического пути NF-kappaB приводит к отказу костного мозга
и индукции эритроидной сигнатуры в
гематопоэтических стволовых клетках. Cell Rep.2018; 25: 2094–2109.
е2094.
[6] Wilson A, Laurenti E, Oser G, et al. Гематопоэтические стволовые клетки
обратимо переходят из состояния покоя в самообновление
во время гомеостаза и восстановления.Клетка. 2008; 135: 1118–
1129.
[7] Серторио М., Ду В., Амарачинта С. и др. Скрининг in vivo RNAi
раскрывает PPARgamma как регулятор гомеостаза гемато-
поэтических стволовых клеток. Stem Cell Rep.
2017; 8: 1242–1255.
[8] Maciejewski JP, Selleri C., Sato T, et al. Тяжелый и сопутствующий дефицит костного мозга и циркулирующие примитивные топоэтические клетки гема-
(клетки, инициирующие длительное культивирование) в
приобрели апластическую анемию.Кровь. 1996; 88: 1983–1991.
[9] Scopes J, Daly S, Atkinson R, et al. Апластическая анемия: доказательство наличия дисфункциональных клеток-предшественников костного мозга
и корректирующий эффект фактора стимуляции колоний гранулоцитов
in vitro. Кровь. 1996. 87: 3179–3185.
[10] de Bruin AM, Demirel O, Hooibrink B, et al. Интерферон-
гамма нарушает пролиферацию гемопоэтических стволовых клеток
у мышей. Кровь. 2013; 121: 3578–3585.
[11] Исмаил М., Гибсон Ф.М., Гордон-Смит Э.С. и др.Bcl-2 и
Экспрессия Bcl-x в CD34 + клетках апластической анемии
пациентов: связь с повышенным апоптозом и повышением регуляции
антигена Fas. Br J Haematol.
2001; 113: 706–712.
[12] Maciejewski JP, Selleri C., Sato T, et al. Повышена экспрессия
антигена Fas на CD34 +
клетках костного мозга пациентов с апластической анемией. Br J Haematol.
1995; 91: 245–252.
[13] Callera F, Falcao RP.Повышенное количество апоптотических клеток в костной ткани
биоптатов костного мозга пациентов с апластической анемией.
Br J Haematol. 1997; 98: 18–20.
[14] Scopes J, Bagnara M, Gordon-Smith EC, et al.
Гемопоэтические клетки-предшественники уменьшаются при апластической анемии
. Br J Haematol. 1994; 86: 427–430.
[15] Timeus F, Crescenzio N, Doria A, et al. Проточная цитометрия
оценка количества циркулирующих CD34 + клеток и частоты апопто-
тиков у детей с приобретенной апластической анемией и
миелодисплазией.Exp Hematol. 2005; 33: 597–604.
[16] Холмберг Л.А., Зайдель К., Лейзенринг В. и др. Апластическая анемия
: анализ функции стромальных клеток в долгосрочных культурах костного мозга
. Кровь. 1994; 84: 3685–3690.
[17] Комори Т., Яги Х., Номура С. и др. Целенаправленное разрушение
Cbfa1 приводит к полному отсутствию костеобразования
из-за остановки созревания остеобластов. Клетка.
1997; 89: 755–764.
[18] Calvi LM, Adams GB, Weibrecht KW, et al.Остеобластические клетки
регулируют нишу гемопоэтических стволовых клеток.
Природа. 2003; 425: 841–846.
[19] Кунисаки Ю., Брунс И., Шейерманн С. и др. Артериолярные
ниши поддерживают покой гемопоэтических стволовых клеток.
Природа. 2013; 502: 637–643.
[20] Юн К.А., Чо Х.С., Шин Х.И. и др. Дифференциальная регуляция
CXCL5 с помощью FGF2 в клетках остеобластов и эндотелия ниш
поддерживает миграцию гемопоэтических стволовых клеток.
Stem Cells Dev.2012; 21: 3391–3402.
[21] Wu L, Mo W, Zhang Y, et al. Нарушение гематопоэ-
ниш тиковых стволовых клеток у пациентов с апластической анемией. Int J
Hematol. 2015; 102: 645–653.
[22] Dominici M, Le Blanc K, Mueller I, et al. Минимальные критерии
для определения мультипотентных мезенхимальных стромальных клеток.
Позиция международного общества клеточной терапии
заявление. Цитотерапия. 2006; 8: 315–317.
[23] Majumdar MK, Thiede MA, Haynesworth SE, et al.
Мезенхимальные стволовые клетки костного мозга человека
(МСК) экспрессируют гемопоэтические цитокины и поддерживают
долговременный гемопоэз при дифференцировании на
стромальных и остеогенных клонов. J Hematother Stem
Cell Res .. 2000; 9: 841–848.
[24] Гао Ф, Чиу С.М., Мотан Д.А. и др. Мезенхимальные стволовые клетки
и иммуномодуляция: текущее состояние и перспективы
на будущее. Cell Death Dis. 2016; 7: e2062.
[25] Бачигалупо А., Валле М., Подеста М. и др.Подавление Т-клеток
, опосредованное мезенхимальными стволовыми клетками, является недостаточным
у пациентов с тяжелой апластической анемией. Exp Hematol.
2005; 33: 819–827.
[26] Chao YH, Peng CT, Harn HJ, et al. Низкий потенциал пролиферации и дифференцировки про-
в мезенх-
костномозговых стволовых клетках, полученных от детей с тяжелой апластической анемией
. Ann Hematol. 2010. 89: 715–723.
[27] Chao YH, Tsai C, Peng CT, et al. Котрансплантация
МСК пуповины для усиления приживления гемо-
топоэтических стволовых клеток у пациентов с тяжелой апластической анемией
.Пересадка костного мозга. 2011; 46: 1391–1392.
[28] Gonzaga VF, Wenceslau CV, Lisboa GS, et al.
Положительные эффекты мезенхимальных стволовых клеток наблюдаются при поражении костей
недостаточность костного мозга и приобретенная апластическая анемия. Шток
Cells Int. 2017; 2017: 8076529.
[29] Янг Н.С., Каладо Р.Т., Шейнберг П. Современные концепции патофизиологии и лечения апластической анемии в
.
Кровь. 2006; 108: 2509–2519.
[30] Chen J, Desierto MJ, Feng X и др.Иммуноопосредованная недостаточность костного мозга
у мышей C57BL / 6. Exp Hematol.
2015; 43: 256–267.
[31] Янг Н.С. Разрушение кроветворных клеток иммунными
механизмами приобрело апластическую анемию. Семин
Гематол. 2000; 37: 3–14.
[32] Locasciulli A, Oneto R, Bacigalupo A, et al. Исход
пациентов с приобретенной апластической анемией, получавших первую линию
трансплантации костного мозга или иммуносупрессивного лечения
за последнее десятилетие: отчет
европейской группы по трансплантации крови и костного мозга
(EBMT).Haematologica. 2007; 92: 11–18.
[33] Chuncharunee S, Wong R, Rojnuckarin P, et al. Эффективность антитимоцитарного глобулина кролика
в качестве терапии первой линии тяжелой апластической анемии
: азиатское многоцентровое ретроспективное исследование. Int J Hematol. 2016; 104: 454–461.
[34] Grossmayer GE, Munoz LE, Gaipl US, et al. Удаление
умирающих клеток и системной красной волчанки. Мод
Ревматол. 2005; 15: 383–390.
[35] Liu C, Li Z, Sheng W, et al.Нарушения количества
и функций естественных киллеров при тяжелой апластической анемии
. Иммунол Инвест. 2014; 43: 491–503.
[36] Barnes DW, Mole RH. Апластическая анемия у
облученных сублетально мышей, получавших аллогенные клетки лимфатических узлов. Br J
Haematol. 1967; 13: 482–491.
[37] Hinterberger W, Rowlings PA, Hinterberger-Fischer M,
et al. Результаты трансплантации костного мозга от генетически идентичных близнецов
пациентам с апластической анемией.
Ann Intern Med. 1997. 126: 116–122.
564 L. WANG AND H. LIU
Апластическая анемия | Johns Hopkins Medicine
Что такое апластическая анемия?
Апластическая анемия возникает, когда костный мозг не вырабатывает достаточно красных и белых кровяных телец и тромбоцитов. Меньшее количество эритроцитов вызывает падение гемоглобина.
Гемоглобин — это часть крови, которая переносит кислород через ваше тело. Чем меньше лейкоцитов, тем выше вероятность заражения.А меньшее количество тромбоцитов делает кровь слишком жидкой. Это означает, что ваша кровь не может свертываться должным образом.
Что вызывает апластическую анемию?
Апластическая анемия имеет множество причин. Иногда это происходит по неизвестной причине. Другие причины связаны с предыдущим заболеванием или расстройством. Приобретенные причины могут включать:
История некоторых инфекционных заболеваний (таких как гепатит, ВИЧ, вирус Эпштейна-Барра, ЦМВ или паравирус B19)
История приема некоторых лекарств, таких как антибиотики и противосудорожные препараты
Воздействие определенных токсинов, таких как тяжелые металлы
Воздействие радиации
История аутоиммунного заболевания, такого как волчанка
Унаследованное состояние
Апластическая анемия
Апластическая анемия возникает, когда костный мозг не вырабатывает достаточно красных и белых кровяных телец и тромбоцитов.Иммунная система организма сбивается с толку и начинает атаковать эти критически важные клетки.
Кто подвержен риску апластической анемии?
Апластическая анемия может возникнуть в любом возрасте. Но это чаще встречается у подростков, молодых людей и пожилых людей. Ваш риск увеличивается, если вы:
Каковы симптомы апластической анемии?
Симптомы у каждого человека могут отличаться. Симптомы могут включать:
Головная боль
Головокружение
Расстройство желудка (тошнота)
Одышка
Ушиб
Недостаток энергии или легкая утомляемость (утомляемость)
Аномальная бледность или отсутствие цвета кожи
Кровь в стуле
Носовые кровотечения
Кровоточивость десен
Лихорадка
Болезнь носовых пазух
Увеличенная печень или селезенка
Белые пятна во рту (молочница во рту)
Эти симптомы могут быть похожи на другие заболевания крови или проблемы со здоровьем.Всегда обращайтесь к своему врачу за диагнозом.
Как диагностируется апластическая анемия?
Ваш лечащий врач изучит вашу историю болезни и проведет медицинский осмотр. У вас также могут быть такие тесты, как:
Анализы крови. Это может включать биохимический анализ крови, оценку функций печени и почек и генетические исследования.
Аспирация или биопсия костного мозга. Это включает взятие небольшого количества жидкости костного мозга (аспирация) или твердой ткани костного мозга (так называемая центральная биопсия).Обычно их берут с тазобедренных костей. Их проверяют на количество, размер и зрелость клеток крови или аномальных клеток.
Как лечится апластическая анемия?
Ваш лечащий врач создаст план обслуживания на основе:
Ваш возраст, общее состояние здоровья и история болезни
Как вы больны
Насколько хорошо вы справляетесь с определенными лекарствами, процедурами или терапией
Ожидаемый срок действия состояния
Ваше мнение или предпочтение
Апластическая анемия — серьезное заболевание.Лечение обычно зависит от основной причины. По определенным причинам вы можете выздороветь после лечения. Но состояние может вернуться. Для лечения низких показателей крови раннее лечение может включать:
Переливание крови (как эритроцитов, так и тромбоцитов)
Профилактическая антибактериальная терапия
Соблюдение правил гигиены во избежание заражения
Особая осторожность при приготовлении пищи (например, употребление только хорошо приготовленных продуктов)
Избегать строительных площадок, которые могут быть источником определенных грибов
Лекарства, стимулирующие выработку клеток костным мозгом
Лечение для снижения реакции иммунной системы
Гормональная терапия
У некоторых людей трансплантат костного мозга может вылечить апластическую анемию.
Жизнь с апластической анемией
Управление апластической анемией включает тесное сотрудничество с вашим лечащим врачом и соблюдение вашего плана лечения. Обязательно сообщите своему врачу о любых симптомах, которые у вас есть. Вы подвержены большему риску заражения, поэтому вам следует:
Держитесь подальше от больных
Избегайте больших скоплений людей
Часто мойте руки
Избегайте продуктов, которые не были полностью приготовлены
Регулярно чистите зубы
Сделайте ежегодную прививку от гриппа
Разработайте план физической подготовки вместе со своим врачом
Основные сведения об апластической анемии
Апластическая анемия возникает, когда костный мозг не вырабатывает достаточно красных и белых кровяных телец и тромбоцитов.
Это состояние может вызывать у вас чувство усталости, повышать риск инфекций, а также вызывать у вас синяки или кровотечение.
Для лечения низких показателей крови раннее лечение предполагает ослабление симптомов.
Лечение может включать переливание крови, антибиотики, лекарства для стимуляции выработки костного мозга и другие методы лечения.
В некоторых случаях трансплантат костного мозга может вылечить апластическую анемию.
Апластическая анемия Артикул
[1]
Ding SX, Chen T., Wang T, Liu CY, Lu WL, Fu R, Риск клональной эволюции гранулоцитарного колониестимулирующего фактора для приобретенной апластической анемии: систематический обзор и метаанализ. Acta haematologica. 2018 [PubMed PMID: 30253387]
[2]
Georges GE, Doney K, Storb R, Тяжелая апластическая анемия: аллогенная трансплантация костного мозга в качестве лечения первой линии.Кровь наступает. 14 августа 2018 г. [PubMed PMID: 30108110]
[3]
Шаллис Р.М., Ахмад Р., Зейдан А.М., Апластическая анемия: этиология, молекулярный патогенез и новые концепции. Европейский журнал гематологии. 2018 декабрь [PubMed PMID: 30055055]
[4]
Gadalla SM, Aubert G, Wang T, Haagenson M, Spellman SR, Wang L, Katki HA, Savage SA, Lee SJ, Длина теломер донора и причины смерти после трансплантации неродственных гемопоэтических клеток у пациентов с недостаточностью костного мозга.Кровь. 24 мая 2018 г. [PubMed PMID: 29632022]
[5]
Li SS, Hsu YT, Chang C, Lee SC, Yen CC, Cheng CN, Chen JS, Lin SH, Chang KC, Chen TY, Заболеваемость и исход лечения апластической анемии на Тайване — реальные данные из опыта одного института и общенациональная база данных по населению. Анналы гематологии. 2018 г., 3 сентября [PubMed PMID: 30178191]
[6]
Vaht K, Göransson M, Carlson K, Isaksson C, Lenhoff S, Sandstedt A, Uggla B, Winiarski J, Ljungman P, Brune M, Andersson PO, Заболеваемость и исход приобретенной апластической анемии: реальные данные пациентов с диагнозом Швеция с 2000 по 2011 гг.Haematologica. Октябрь 2017 г. [PubMed PMID: 28751565]
[7]
Schoettler ML, Nathan DG, Патофизиология приобретенной апластической анемии: пересмотр современных концепций. Гематологические / онкологические клиники Северной Америки. 2018 авг [PubMed PMID: 30047412]
[8]
Ямазаки Х. [Приобретенная апластическая анемия: последние достижения в патофизиологии и лечении].[Риншо кэцуэки] Японский журнал клинической гематологии. 2018 [PubMed PMID: 29973449]
[9]
Gnanaraj J, Parnes A, Francis CW, Go RS, Takemoto CM, Hashmi SK, Подход к панцитопении: диагностический алгоритм для клинических гематологов. Отзывы о крови. 2018 сен [PubMed PMID: 29555368]
[10]
Bluteau O, Sebert M, Leblanc T, Peffault de Latour R, Quentin S, Lainey E, Hernandez L, Dalle JH, Sicre de Fontbrune F, Ленглин E, Itzykson R, Clappier E, Boissel N, Vasquez N, Da Costa M , Masliah-Planchon J, Cuccuini W, Raimbault A, De Jaegere L, Adès L, Fenaux P, Maury S, Schmitt C, Muller M, Domenech C, Blin N, Bruno B, Pellier I, Hunault M, Blanche S, Petit A, Leverger G, Michel G, Bertrand Y, Baruchel A, Socié G, Soulier J, Пейзаж мутаций зародышевой линии в когорте пациентов с наследственной недостаточностью костного мозга.Кровь. 2018 15 февраля [PubMed PMID: 29146883]
[11]
Йошида Н., Кодзима С. Обновленные рекомендации по лечению приобретенной апластической анемии у детей. Текущие онкологические отчеты. 30 июня 2018 г. [PubMed PMID: 29961134]
[12]
Samarasinghe S, Veys P, Vora A, Wynn R, Педиатрическая поправка к рекомендациям BSH для взрослых по апластической анемии.Британский гематологический журнал. 2018 янв. [PubMed PMID: 29285764]
[13]
Zakaria Z, Kaliaperumal C, Crimmins D, Caird J, Нейрохирургическое лечение детей с кровоточащим диатезом: аудит неврологического исхода. Журнал нейрохирургии. Педиатрия. 2018, янв [PubMed PMID: 243]
[14]
Dietz AC, Mehta PA, Vlachos A, Savage SA, Bresters D, Tolar J, Boulad F, Dalle JH, Bonfim C, de la Fuente J, Duncan CN, Baker KS, Pulsipher MA, Lipton JM, Wagner JE, Alter BP , Текущие знания и приоритеты будущих исследований поздних эффектов трансплантации гемопоэтических клеток для наследственных синдромов недостаточности костного мозга: согласованное заявление второй Международной конференции Консорциума по трансплантации крови и костного мозга у детей по поздним эффектам трансплантации гемопоэтических клеток у детей.Биология трансплантации крови и костного мозга: журнал Американского общества трансплантации крови и костного мозга. 2017 г., май [PubMed PMID: 28115275]
[15]
Rice C, Eikema DJ, Marsh JCW, Knol C, Hebert K, Putter H, Peterson E, Deeg HJ, Halkes S, Pidala J, Anderlini P, Tischer J, Kroger N, McDonald A, Antin JH, Schaap NP, Hallek M, Einsele H, Mathews V, Kapoor N, Boelens JJ, Mufti GJ, Potter V, Pefault de la Tour R, Eapen M, Dufour C, Трансплантация аллогенных гемопоэтических клеток пациентам в возрасте 50 лет и старше с тяжелой апластической анемией.Биология трансплантации крови и костного мозга: журнал Американского общества трансплантации крови и костного мозга. Март 2019 г. [PubMed PMID: 30194027]
[16]
Шейнберг П., Последние достижения и долгосрочные результаты лечения приобретенной апластической анемии: излечены ли пациенты? Гематологические / онкологические клиники Северной Америки. 2018 авг [PubMed PMID: 30047414]
Апластическая анемия: патофизиология и лечение.
Иммунная основа для большинства пациентов с апластическим анемия (AA) является основанием для иммуносупрессивной терапии (IST), с использованием антитмиоцитарного глобулина и циклоспорина в качестве одного терапевтического средства модальность; гематологический ответ наблюдается у 75% пациентов. Недавние успехи в понимании патогенеза АА выявили: дефектное обслуживание теломер как важное объяснение начала недостаточности костного мозга, рецидива и клональной эволюции после IST, в некоторых пациенты с АА.Обнаружение наследственных мутаций теломеразы генный комплекс у пациентов с очевидным приобретенным АА имеет важное значение. значение для клинического ведения. Гематопоэтические стволовые клетки трансплантация (HSCT) приобретенного AA, будь то из HLA , идентичного брат или сестра неродственный донор дает прекрасные шансы на долгосрочное излечивать. Текущие проблемы с ТГСК включают отторжение трансплантата, хроническую РТПХ. и плохой результат у пожилых пациентов.




 При многократном контакте эритроцита с механическим препятствием разрушается его мембрана, и клетка просто изнашивается.
При многократном контакте эритроцита с механическим препятствием разрушается его мембрана, и клетка просто изнашивается.
 , обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
, обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.