АФП при беременности по неделям: что означает, норма
Отклонения в развитии ребенка во внутриутробном периоде ранее можно было выявить лишь после появления малыша на свет. Позже появилось УЗИ, которое давало достаточно информации о грубых аномалиях развития плода, начиная с 10-14 недели беременностью. Достойным подспорьем инструментальному методу исследования будущих мам стал лабораторный анализ на альфа-фетопротеин. АПФ при беременности считается довольно востребованной процедурой, позволяющей уже в самом начале девятимесячного пути выявить и по возможности предотвратить опасные для ребенка и его матери последствия.
Что означает анализ АПФ при беременности?
В медицине принято для обозначения многих сложных слов и понятий использовать аббревиатуру. Обычно это первые буквы разных составляющих определенного понятия. Например, буквосочетанием АПФ принято обозначать специфический белок, выявляемый в крови любой беременной женщины. Он носит название альфа-фетопротеин.
Нужно сказать, что альфа-фетопротеин не является для человека чужеродным веществом, он вырабатывается в пищеварительной системе (преимущественно в печени) мужчин и женщин. Правда, его выработка минимальна и у здорового человека не превышает 10 МЕ на мл крови.
Показатель содержания АФП в пределе 0,5-10 МЕ/мл считается нормой для небеременных. По своей сути гликопротеин АФП является противоопухолевым компонентом и при наличии в печени или мочеполовой системе активного пролиферативного процесса, свойственного раковым опухолям, организм в ответ включает своеобразную самозащиту, начиная вырабатывать большее количество противоопухолевого белка. Именно этот момент интересует онкологов, ведь он позволяет выявлять опухолевые процессы в печени, половых органах, молочных железах.
Повышение концентрации АПФ могут вызывать любые серьезные заболевания печени, например, гепатит или цирроз, которые по своей сути являются воспалительным и некротически процессом в тканях органа.
Но это касается лишь не беременных. У будущих мам стабильное последовательное повышение АПФ считается нормальным и в большинстве случаев говорит о том, что ребенок развивается.
Но как связано развитие ребенка и повышение уровня АФП? Женский организм устроен необычным образом. В нем предусмотрено все для продолжения рода, чтобы женщина могла выносить и воспроизвести свою маленькую копию. После разрыва фолликула и выхода яйцеклетки в организме женщины формируется временная эндокринная железа – желтое тело, задачей которой является выработка гормонов, сохраняющих и поддерживающих беременность.
Если зачатия не происходит, желтое тело погибает, поскольку в нем нет необходимости. При состоявшейся беременности временная железа, продуцирующая эстроген и прогестерон, существует до того времени, пока не произойдет полного созревания детского места.
Пока существует желтое тело концентрация АПФ в организме беременной и небеременной женщины приблизительно одинакова. А вот приблизительно с 5 недели беременности, когда у плода формируется печень и появляются зачатки органов пищеварения, уровень АФП начинает поступательно расти, ведь выработка альфа-фетопротеина происходит преимущественно в печени и кишечнике человеческого эмбриона.
В начале 2 триместра беременности, когда закончено формирование пищеварительной системы малыша, и в околоплодные воды начинают активно поступать продукты его жизнедеятельности, включающие и белок АФП, изменяется и анализ крови женщины, посредством которой и происходит выведение ненужных веществ из организма женщины и околоплодной жидкости.
По мере развития малыша увеличивается и содержание АФП в крови матери. Начиная с 33 недели беременности формирование органов и систем ребенка сменяется периодом роста, и уровень АПФ до самых родов в норме остается стабильным.
Начиная с 33 недели беременности формирование органов и систем ребенка сменяется периодом роста, и уровень АПФ до самых родов в норме остается стабильным.
Но какую роль играет белок альфа-фетопротеин в развитии малыша, ведь не зря он так активно вырабатывается в детском организме в периоде внутриутробного развития? Рассмотрим ряд основных его функций:
- АФП является разновидностью транспортных белков, благодаря которым белки и полиненасыщенные жирные кислоты, необходимые для построения клеточных мембран и тканей малыша, из крови матери поступают в кровь плода. Это необходимо для нормального роста и развития эмбриона, особенно в первых двух семестрах беременности.
- Транспортировка важных ненасыщенных жиров важна и на последнем месяце беременности, ведь жиры участвуют в образовании сурфактантного альвеолярного комплекса – соединения, обеспечивающего возможность самостоятельного дыхания ребенка после рождения.
- АФП защищает организм ребенка от негативного влияния женского гормона эстрогена, превышение уровня которого может вызывать неприятные отдаленные последствия в виде опухолевых процессов в половой системе повзрослевшего ребенка.

- Способствует поддержанию стабильного давления крови в кровеносной системе плода.
- АФП является своеобразной защитой ребенка от агрессивного воздействия иммунной системы матери, которая может воспринимать эмбрион как чужеродное тело. Белок уменьшает синтез антител в организме женщины, что способствует вынашиванию беременности и снижает риск самопроизвольного выкидыша.
Как видим, белок альфа-фетопротеин является важным показателем развития и здоровья ребенка, а также свидетельством того, как протекает беременность. При этом настораживающим моментом является как повышение уровня АФП по отношению к нормальным показателям, так и слишком низкие показатели. В первом случае речь может идти о проблемах со здоровьем как у матери, так и у ребенка, а во втором есть большой риск серьезного отставания в развитии плода и раннего прерывания беременности.
Аббревиатурой АФП врачи зачастую называют не только сам исследуемый белок, но и сам лабораторный анализ, назначаемый при беременности.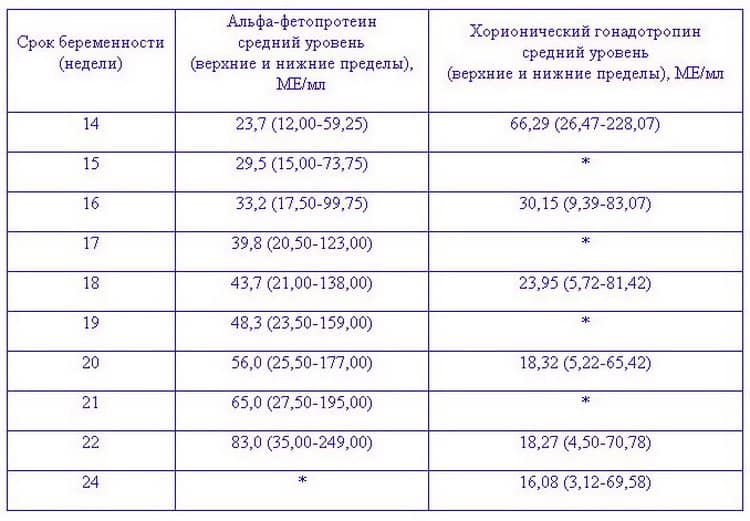 Об особенностях его проведения и результатах исследования мы и поговорим далее.
Об особенностях его проведения и результатах исследования мы и поговорим далее.
Низкий АФП при беременности — причины, методы определения
Во время беременности, требуется сдавать большое количество анализов. Одним из таких важных показателей является альфа-фетопротеин. Низкий АФП при беременности может говорить об аномальном развитии ребенка. Рассмотрим, что это такое, для чего назначается анализ и как проводится.
Что это такое
Аббревиатурой АФП переводится как белок альфа-фетопротеин. Данный элемент появляется в плазме уже на начальных стадиях развития эмбриона.
Анализ альфа-фетопротеин, что это такое? Показатель во второй половине ХХ века использовался для выявления раковых опухолей. Но не так давно врачи обнаружили некую закономерность – вещество находится в крови у беременных. При этом у них не было выявлено онко-маркеров.
У будущего ребенка, данный белок заменяет альбумин и берет на себя его функции. Разносит по растущему организму с кровью все нужные для роста витамины, микроэлементы.
К основным функциям фетопротеина относится подавление иммунной системы женщины. Из-за угнетения иммунитета возможно отторжение эмбриона, который только на 50% является родным для организма.
Некоторые ученые полагают, что белок имеет отношение к подавлению иммунной системы малыша. В обратной ситуации будущий ребенок мог бы негативно реагировать на новые клеточные соединения.
На первых неделях гестации, белок вырабатывается желтым телом. Через 3-4 недели после оплодотворения, клетки эмбриона начинают самостоятельно производить нужные вещества. Затем проникает в околоплодные воды вместе с мочой ребенка, а оттуда – в кровь женщины, чтобы выделиться наружу.
Анализ
Анализ на АФП и ХГЧ рекомендуется сдать в промежутке 15-20 недели гестации. На этом этапе, доктор получить максимальную информацию о возможных хромосомных заболеваниях малыша.
Как подготовиться к забору крови? Лечащий врач обязан заранее предупредить о необходимости сдать плазму на определение уровня вещества.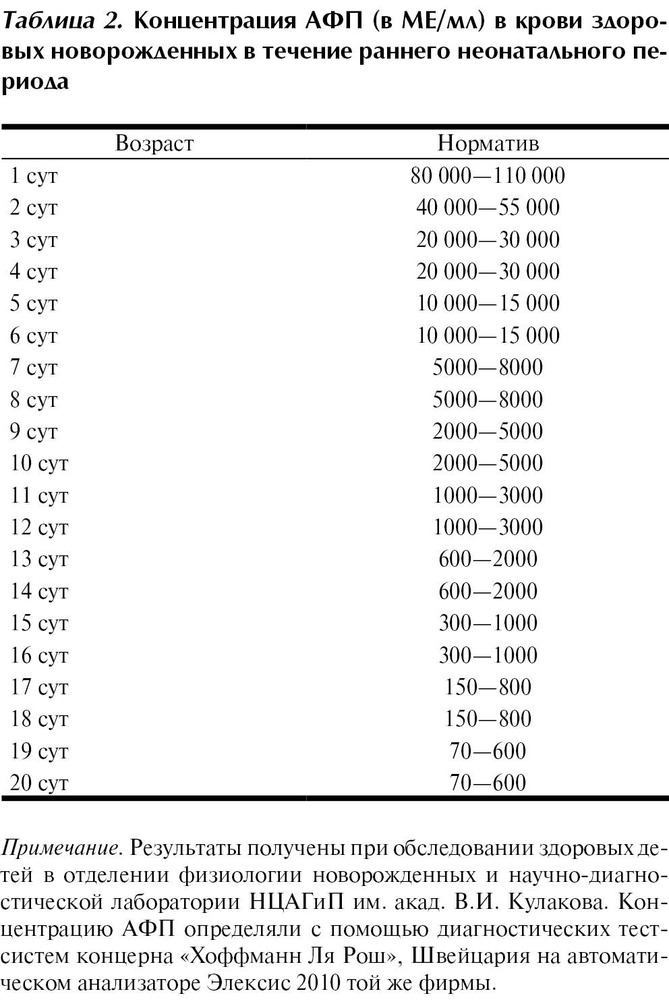 Если на сроке 10-13 недель женщина сдавала анализ РАРР-А, то от даты исследования отчитывают ровно 3 недели. И тогда доктор может назначить повторный забор материала на альфа-фетопротеин.
Если на сроке 10-13 недель женщина сдавала анализ РАРР-А, то от даты исследования отчитывают ровно 3 недели. И тогда доктор может назначить повторный забор материала на альфа-фетопротеин.
Для исследования требуется венозная кровь из локтевого сгиба. Сдача биоматериала происходит утром натощак. На концентрацию белка может повлиять даже напиток, поэтому не стоит пить даже чай без сахара.
Допускается обычная фильтрованная вода без газа. Крайний прием пищи должен быть не менее чем за 8 часов.
За несколько дней до исследования не стоит придерживаться определенной диеты, за сутки не рекомендуется сильно жаренная и жирная еда. До забора материала разрешается принимать лекарственные средства.
Перед сдачей не стоит переживать, нужно успокоиться. Эмоциональные нагрузки вызывают перестройки в плазме, что сказывается на результатах.
Нормы и пониженные результаты
Нормы альфа-фетопротеина в крови при беременности представлены в таблице:
| Срок гестации в неделях | Уровень концентрации белка в ед/мл |
| Первый триместр до двенадцати недель | До 15 |
| 13-15 | 15-60 |
| 15-19 | 16-95 |
| 20-24 | 27-125 |
| 25-27 | 52-140 |
| 28-30 | 67-150 |
| 31-33 | 100-250 |
| С 33 | Наблюдается постепенный спад |
Пониженный АФП может говорить о следующих хромосомных отклонениях.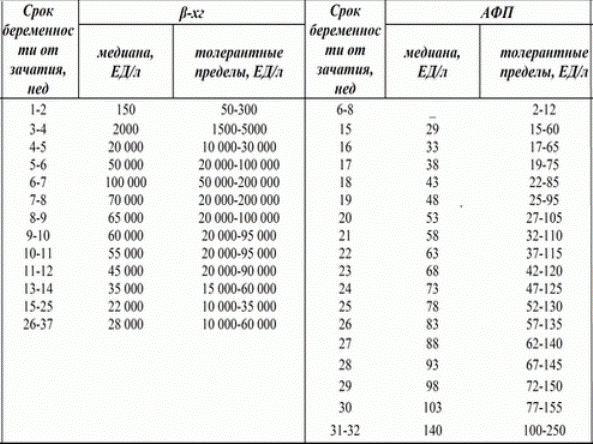
Синдром Дауна
Пониженный альфа-фетопротеин часто говорит о синдроме Дауна. Это хромосомная патология характеризуется наличием одной лишней 47 хромосомы. Исследование материала анализируется совместно с данными полученными на ультразвуковом обследовании плода. По результатам УЗИ в такой ситуации обычно наблюдается аномальное строение воротниковой складки или носовой кости.
Синдром Эдвардса
Пониженный уровень фетопротеина может указывать на синдром Эдвардса. Патология характеризуется серьезными хромосомными нарушениями. Дети появляются на свет с нарушениями строения черепа и низкой массой.
Диагностируется большое количество пороков больших кровеносных сосудов, сердечной мышцы. Из-за этого новорожденные изначально рождаются нежизнеспособными.
Пузырный занос
В данном случае плод отстает в развитии или вовсе не развивается, а ворсины хориона формируют образования в виде пузырей. Девушка ощущает признаки беременности.
Возникает риск повышения артериального давления и образования токсикоза , а потом гестоза. Редко развиваются метастазы в органах.
Редко развиваются метастазы в органах.
Что делать
Расшифровка значений – это дело врача. При определении отклонений в анализе, нужно сделать ультразвуковое исследование для постановки точного срока гестации. УЗИ также может определить наличие врожденных пороков у плода.
Отклонение АФП в любую из сторон помогают установить степень риска внутриутробных патологий. Для точной диагностики рекомендуют пройти сложные инвазивные методы, позволяющие определить хромосомный набор будущего ребенка. Для 100% диагностики на сроке 17-20 недель делают амниоцентез.
Если патологий не было выявлено, а белок имеет отклонения от нормы, по определенной форме делают оценку степени риска гипотрофии ребенка. Амниоцентез информативен только до 24 недели беременности. Для точной диагностики применяют дополнительную оценку кровотока в маточных артериях, толщину плаценты и кровоток в аорте ребенка.
Если общий индекс больше 7 баллов, врачи говорят о плацентарной недостаточности.
Назначается прием витаминов, лекарственных средств улучшающих кроваток.
Можно ли вылечить
Отклонения от нормы фетопротеина не поддаются медикаментозной корректировке. В таких случаях доктора определяют проблему и назначают лечение. Когда терапия невозможна из-за особенностей развития плода, беременной рекомендуется аборт по медицинским показаниям.
Прогноз для малыша
Когда результаты анализа показывают, что концентрация АФП понижена, то это может свидетельствовать о:
Согласно официальным данным, около 5% от всего количества беременных, которые проходят исследования, получают неутешительный диагноз. При этом более 90% этих же женщин в конце рожают совершенно здоровых деток.
Исследование плазмы для определения уровня АФП требуется чтобы выявить возможные патологические процессы. Отклонения от нормы не всегда свидетельствуют о серьезных патологиях малыша, поэтому не стоит отчаиваться раньше времени.
норма по неделям, расшифровка, причины отклонений, АФП + ХГЧ / Mama66.ru
Анализ АФП при беременности помогает контролировать внутриутробное развитие плода, наличие дефектов внутренних органов, аномалий строения нервной трубки. Преимущество методики – возможность обнаружения патологий на ранних сроках вынашивания ребенка.
Объект для выполнения анализа АФП — венозная кровь. Исследование делается быстро, но для получения достоверных данных нужно подготовиться к скринингу и грамотно расшифровать результаты.
Что такое АФП и почему он важен
АФП (альфа-фетопротеин) — своеобразный маркер нормального течения беременности. Это высокомолекулярный белок, который в первом месяце после зачатия вырабатывает желтое тело, а затем печень и желудочно-кишечный тракт эмбриона.
Альфа-фетопротеин выполняет несколько функций в организме беременной:
- контролирует иммунную систему;
- участвует в транспортировке питательных и биоактивных веществ;
- влияет на гормональный фон, преимущественно — на эстрогены.
Максимальная выработка АФП отмечается на 31 неделе беременности. Как только малыш появляется на свет, уровень белка постепенно снижается и достигает значений нормы к концу первого года жизни.
Анализ крови АФП при беременности помогает оценить влияния иммунитета матери на организм плода, обнаружить наличие хромосомных отклонений — синдрома Дауна, Шерешевского-Тернера и других генетических мутаций.
Читайте также:
Показания для анализа
Забор крови для анализа на АФП рекомендуется выполнять во 2 триместре беременности. Но перинатальная диагностика может быть проведена и раньше, на 10–12 неделе, при подозрении на патологии плода.
В каких случаях анализ на АФП является обязательным:
- прием женщиной лекарственных средств, которые противопоказаны при беременности;
- воздействие рентгеновского излучения;
- ожидание ребенка, зачатого кровными родственниками;
- первая беременность у женщины старше 35 лет;
- генетические аномалии у плода при предыдущей беременности;
- патологическое невынашивание или мертворождение;
- пункция амниотической оболочки с целью получения околоплодных вод на ранних сроках.
Гинекологи рекомендуют сделать анализ на АФП женщинам, у которых в 1 триместре был контакт с ядами или другими токсичными веществами.
Практикуется также двойное перинатальное исследование. Помимо уровня альфа-фетопротеина, определяют количественное содержание ХГЧ (хорионического гонадотропина человека). Процедура помогает выяснить, входит ли женщина в группу риска по развитию у плода трисомий (неправильное количество хромосом).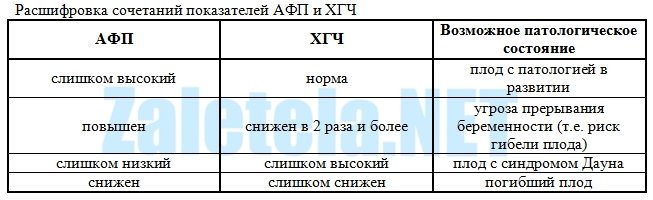
Читайте также:
Подготовка и процедура
Правильная подготовка поможет избежать повторного исследования из-за получения сомнительных результатов.
В чем она заключается:
- За 2 недели до анализа АФП нужно отказаться от приема любых лекарств. Если это невозможно, о назначенном лечении нужно сообщить врачу-диагносту.
- За сутки исключить из рациона жирную и копченую пищу.
- За 8 часов отказаться от еды.
- В течение суток не подвергать организм физическим нагрузкам.
Забор крови проводится из локтевой вены, утром. Желательно прийти на анализ немного раньше, чтобы расслабиться и отдохнуть.
В лаборатории кровь центрифугируют для отделения кровяного сгустка и получения плазмы. Затем добавляют реагенты, устраняющие фактор свертывания. Результатом манипуляций становится сыворотка, которую исследуют методом хемилюминесцентного иммуноанализа. Его суть заключается в образовании альфа-фетопротеином специфических комплексов с внесенными антителами, мечеными ферментами.
Расшифровка анализа АФП при беременности
Для выполнения анализа АФП и расшифровки данных требуется несколько часов. Результаты выдают женщине через день после забора биоматериала или направляют гинекологу.
По мере развития плода уровень альфа-фетопротеина растет. Поэтому на ранних сроках беременности анализ выявляет меньшие показатели АПФ, чем во 2 триместре. После 32–34 недели данные уже малоинформативны.
Таблица: верхние и нижние границы нормы анализа АПФ при беременности по неделям (с ХГЧ):
| Срок вынашивания беременности, в неделях | Нижняя граница нормы АФП, МЕ/мл | Верхняя граница нормы АФП, МЕ/мл | Значения ХГЧ, МЕ/мл |
|---|---|---|---|
| до 12 | 0 | 15 | 25–90000 (в зависимости от недели) |
| 13–15 | 15 | 60 | 15000–60000 |
| 15–19 | 15 | 95 | 10000–35000 |
| 20–24 | 27 | 125 | |
| 25–27 | 52 | 140 | 10000–60000 |
| 28–30 | 67 | 150 | |
| 31–32 | 100 | 250 |
В таблице указаны значения нормы альфа-фетопротеина в МЕ/мл. Практикуется также измерение уровня АФП в МоМ, или Multiple of Median, что означает «кратный медиане». Это усредненные данные анализа, соответствующие определенному сроку беременности. Норма — АФП от 0,5 до 2,0 МоМ.
Практикуется также измерение уровня АФП в МоМ, или Multiple of Median, что означает «кратный медиане». Это усредненные данные анализа, соответствующие определенному сроку беременности. Норма — АФП от 0,5 до 2,0 МоМ.
Причины отклонений
При расшифровке результатов АФП врач учитывает многоплодную беременность, при которой уровень белка в крови выше. Причиной отклонений иногда становятся ошибки при заборе и хранении биоматериала. Они обязательно выявляются при повторном анализе.
Читайте также:
Пониженный уровень
Низкий уровень АФП в крови нередко свидетельствует о хромосомной аномалии плода — синдроме Дауна, Эдвардса или Патау. Чтобы исключить или подтвердить мутации, будущей матери рекомендуют пройти процедуру инвазивной диагностики — амниоцентез или кордоцентез.
Но это всего лишь рекомендация. От исследования можно отказаться. Менее травматичный способ диагностики — сделать тест ДНК.
Концентрация белка резко уменьшается, если эмбрион погибает или развивается патология плодного яйца. В этом случае потребуются дополнительные исследования: УЗИ, другие анализы крови, возможно обращение в медико-генетический центр.
В этом случае потребуются дополнительные исследования: УЗИ, другие анализы крови, возможно обращение в медико-генетический центр.
Повышенный уровень
При беременности основной причиной повышенного уровня АФП является одна из аномалий внутриутробного развития.
Чаще всего обнаруживаются следующие пороки:
- дефект образования, включая расщепление позвоночника и анэнцефалию;
- несовершенный остеогенез – болезнь «хрустального человека»;
- гидроцефалия;
- кистозная гигрома – киста с жидкостью;
- фетальная тератома – опухоль;
- гастрошизис – расщелина в брюшной полости;
- атрезия (заращение) пищевода и кишечника;
- нарушения формирования одного из органов мочевыделительной системы.
В акушерской практике повышенные значения анализа на АФП дают основания заподозрить плацентарную патологию и направить женщину на прерывание беременности до 22 недель гестации.
Насколько точен анализ
Интерпретация анализа проходит с учетом многих факторов, которые могут исказить полученные данные.
Вот самые распространенные:
- вес женщины — при хрупком телосложении маркер часто повышен;
- раса будущей матери — у европеоидов уровень АФП стабильно ниже;
- болезни матери, особенно сахарный диабет;
- влагалищные кровотечения;
- рождение детей от предыдущих беременностей с дефектом нервной трубки.
В большинстве случаев анализ высокоинформативен и помогает с высокой точностью диагностировать внутриутробные аномалии. В любом случае неблагоприятный результат будет перепроверен, в том числе с помощью инструментальных исследований, других анализов крови, УЗИ.
Анализ на АФП ― скрининговое исследование, необходимое в перинатальной диагностике. Не стоит отказываться от его проведения, если врач настаивает на тестировании. Современная медицина накопила огромный опыт коррекции внутриутробных аномалий. Главное — обнаружить их вовремя.
Фото: ru.freepik.com
Полезное видео об АФП при беременности
Список источников:
- Second Trimester Maternal Serum Screening (American Association for Clinical Chemistry). External Health Links: https://labtestsonline.org/tests/maternal-serum-screening-second-trimester.
- Биохимическое исследование маркеров заращения нервной трубки плода у женщин во втором триместре беременности. Джаманкулова Ф. С. Монография / под ред. Н.Б. Амирова. Казань: КГМУ, 2015. — 194 с. 2. 2018 // Вестник современной клинической медицины.
- Альфа2-фетопротеин при неосложненной беременности и гестозе. Левченко В. Г., Зорина В. Н., Архипова С. В., Мальцева Н. В. 2004 // Сибирский научный медицинский журнал.
Автор портала Mama66. ru
ru
Анализ АФП
Показания к тестированию
Исследование величины альфа-фетопротеина должны проходить все без исключения женщины в положении. 12-я неделя – оптимальный период для сдачи крови. С учетом полученных данных врач порекомендует повторное тестирование. Особенно это касается тех беременных, чьи результаты были неудовлетворительными.
Основанием для анализа АФП служит:
- Зачатие ребенка в результате близости между кровными родственниками.
- Наличие у женщины малыша, страдающего отклонениями или от каких-либо заболеваний, имеющих наследственный характер.
- Наступление беременности после 35.
- Контакт с химвеществами, которые крайне негативно влияют на организм.
- Выкидыши, мертворожденные, лечение от бесплодия в анамнезе будущей матери.

- Прием медпрепаратов, которые являются для плода токсичными.
- Хромосомные патологии, генные мутации, заболевания наследственного характера.
- Рентгеновское облучение в начале беременности.
Перед сдачей крови необходимо выполнить несколько условий:
- минимум за 14 дней до теста следует отказаться от любых лекарств;
- разрешаются диетические блюда за сутки до анализа;
- физические нагрузки запрещены за день-два до процедуры;
- с момента принятия пищи должно пройти минимум 5 часов, но можно перед тестом выпить стакан воды.
Отклонение от нормы при беременности
Любые отклонения по содержанию белка от нормальных показателей являются важным критерием наблюдения протекания беременности. В этом случае для лечащего врача появляется возможность назначить дополнительные исследования, в ходе которых будет подтвержден или опровергнут тот или иной диагноз.
Стоит только заметить, что беременность можно прервать не позднее 20-й недели. Незадолго до этого срока проводится УЗИ в качестве контрольной меры
Незадолго до этого срока проводится УЗИ в качестве контрольной меры
Помимо этого важно проверить уровень содержания ХГЧ ( хорионический гонадотропин человека ). Если все проведенные исследования подтверждают тот факт, что ребенок с высокой вероятностью может родиться с патологией, бремя принятия ответственного решения лежит на самой женщине
Нормы анализа на АФП и причины отклонения при беременности
Любые медицинские лаборатории пользуются своими способами и реактивами для определения АФП в венозной крови матери. Поэтому очень часто показатели могут немного различаться между собой.
Уровень показателя белка в зависимости от недель беременности:
- до 15 ЕД/мл на 5-11 неделях;
- до 15-62 ЕД/мл на 13-15 неделях;
- до 15-92 ЕД/мл на 15-19 неделях;
- до 28-125 ЕД/мл на 20-25 неделях;
- до 50-140 ЕД/мл на 25-27 неделях;
- до 68-150 ЕД/мл на 28-31 неделях;
- до 100-250 ЕД/мл на 32-34 неделях.
На 16-18 неделях развития плода женщинам рекомендуется сдать второй биохимический скрининг. Следовательно в это момент уровень АФП будет варьировать от 15-95 Ед/мл. Отклонения от нормы в большую или меньшую сторону могут свидетельствовать о различных заболеваниях плода или будущей матери.
Следовательно в это момент уровень АФП будет варьировать от 15-95 Ед/мл. Отклонения от нормы в большую или меньшую сторону могут свидетельствовать о различных заболеваниях плода или будущей матери.
Повышенный уровень:
- пупочная грыжа плода;
- водянка головного мозга;
- аномальное развитие нервной трубки;
- почечная или печёночная недостаточность плода;
- хромосомные отклонения;
- большой вес ребёнка;
- неточный срок беременности.
Заниженный уровень:
- угроза самопроизвольного выкидыша;
- хромосомная аномалия;
- задержка в развитии;
- замерший плод;
- пузырный занос;
- отсутствие беременности;
- повышенный сахар в крови матери.
Если норма альфа-фенолпротеина имеет отклонения от международных стандартов, то это ещё точно не говорит о наличие каких-либо заболеваний. Чтобы опровергнуть или подтвердить аномалии в развитии и проблемы со здоровьем матери и плода, необходимо пересдать анализы в той же лаборатории и пройти ультразвуковое исследование.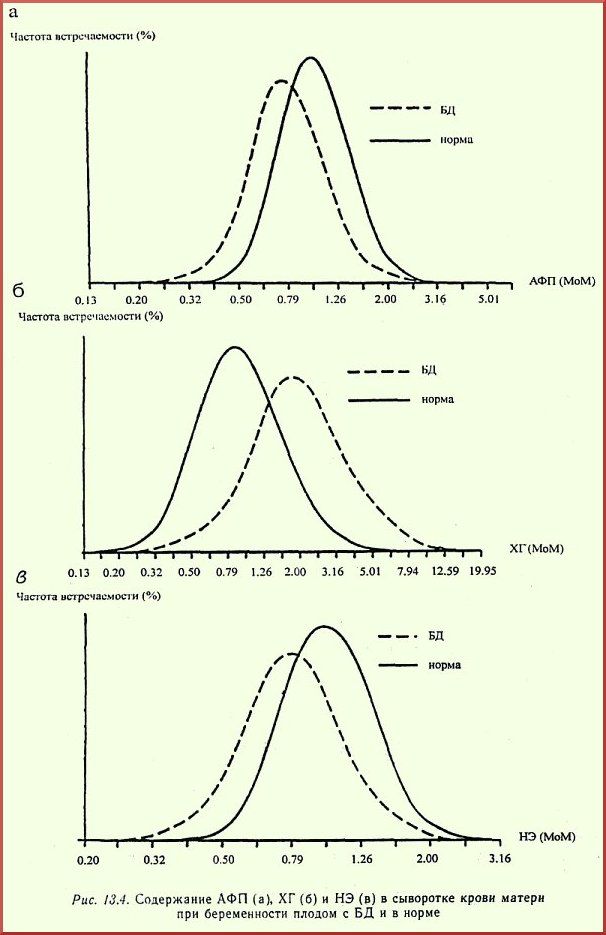
Если шанс обнаружения серьёзных заболеваний велик, то лечащий врач назначает исследование околоплодных вод. Это даёт возможность определить уровень АФП, который вырабатывает плод и предупредить проблемы с развитием малыша.
Нередки случаи, когда при незначительных отклонениях белка, беременность проходит спокойно, и рождается абсолютно здоровый малыш.
Подготовка к сдаче анализа на АФП
Для получения достоверного ответа, необходимо соблюдать определенные требования по проведению исследования. Для получения информации об уровне маркера АФП используют венозную кровь, забор которой проводят обычно утром.Специфической подготовки для исследования нет, однако стоит помнить о том, что любой забор крови для анализа должен соблюдаться выполнением следующих правил:
- анализ сдается натощак, за 6-8 часов необходимо исключить прием пищи. При этом за сутки рекомендуют следить за рационом и не принимать жареную, копченную еду.
- за сутки до исследования не рекомендуется принимать алкоголь;
- в день исследования стоит воздержаться от курения;
- при прохождении медикаментозного курса лечения необходимо проконсультироваться с лечащим врачом и отменить препараты за сутки;
- В день исследования не стоит допускать физического напряжения;
- В день забора крови следует прийти в лабораторию заблаговременно, чтобы иметь возможность посидеть в спокойной атмосфере, и снизить уровень стресса.

Причины отклонения
Здесь мы не будем подробно перечислять различные аномалии плода, к которым могут относиться самые разные заболевания, протекающие с повышением АФП. Это и патология плаценты, и фетальная тератома, и пороки развития. Однако в практике принято, что альфа-фетопротеин, который повышается в значительной степени, свидетельствует с очень высокой степенью о вероятности развития дефектов нервной трубки плода. Это расщепление позвоночника, тяжелые, несовместимые с жизнью пороки, такие, как анэнцефалия (отсутствие головного мозга). Однако, его концентрация может и падать, и это тоже очень плохой признак.
Низкий альфа-фетопротеин на небольшом сроке беременности (до 15 недель) может говорить об угрозе выкидыша, о риске преждевременных родов, если срок более поздний. Низкий показатель свидетельствует о том, что рост плода задерживается, беременность может быть замершей, или развился пузырный занос.
С высокой частотой вероятности низкий альфа-фетопротеин свидетельствует о хромосомных аномалиях развития. Это такие заболевания, как синдром Дауна, Патау или Эдвардса. Но иногда он просто свидетельствует об ожирении беременной.
Это такие заболевания, как синдром Дауна, Патау или Эдвардса. Но иногда он просто свидетельствует об ожирении беременной.
Но для того, чтобы биохимическими методами более точно узнать о вероятности того или иного наследственного заболевания, необходимо совместно проводить тройной анализ, когда кроме альфа-фетопротеина исследуется еще и ХГЧ. В крайнем случае, как минимум — двойной анализ: ХГЧ и альфа-фетопротеин. Например, если оба показатели очень высокие, то это говорит о наличии открытых дефектов плода, а если оба показателя низкие – о тяжёлой форме фетоплацентарной недостаточности.
Причины отклонений
У многих женщин при расшифровке данных теста выявляется повышенный уровень АФП при беременности. Подобное отклонение наблюдается в 70% случаев, но не исключена и возможность снижения уровня данного специфического белка.
Каковы причины отклонений? Давайте разберемся в них детальнее.
Возможные причины скачка уровня АФП
Если повышен АФП при беременности, не во всех случаях это должно настораживать. Часто скачок данного вещества говорит о том, что у нее родится двойня, или даже тройня. В этом случае концентрация вещества будет в 2 или 3 раза превышать общепринятые показатели.
Как правило, уже задолго до следующего исследования пациентка будет знать о своей многоплодной беременности. По этой причине увеличенные показатели альфафетопротеина не станут для нее неожиданным сюрпризом.
Иногда альфафетопротеин при беременности повышается по причине крупных размеров плода. В этой ситуации волноваться тоже нет причин.
Но, увы, не всегда факторы, приводящие к увеличению концентрации вещества, столь безобидны. И какими бы они ни были, женщина должна о них знать, ведь зачастую они затрагивают плод, и могут быть опасными для его жизни. К основным причинам того, почему альфа фетопротеин повышен при беременности, относят:
- некротические процессы в печеночных тканях ребенка;
- вирусные заболевания матери, передавшиеся плацентарным путем к плоду;
- плодную неразвитость;
- образование пупочной грыжи у малыша;
- неспособность брюшной стенки к срастанию;
- аномалии развития мочевыделительной и мочеобразующей систем у плода;
- развитие болезней головного мозга у будущего ребенка;
- гидроцефалию;
- микроцефалию;
- аномалии развития органов ЖКТ.
Альфафетопротеин повышен у беременных женщин при:
- артериальной гипертензии;
- возникновении сахарного диабета;
- чрезмерном наборе веса;
- тяжелой форме позднего токсикоза (эклампсии).
Почему снижается АФП?
Что такое низкий АФП при беременности, знает меньше 30% пациенток, поскольку такое отклонение – большая редкость. Но, все же, оно случается, и, как и в предыдущем случае, причины его могут быть крайне серьезными.
Так, АФП понижен при беременности, если:
- существует вероятность самопроизвольного аборта или преждевременных родов;
- имеют место аномалии развития будущего ребенка;
- случилось замирание плода;
- у ребенка развиваются хромосомные заболевания.
Альфа фетопротеин понижен у будущих мам и при пузырном заносе – аномалии, при которой ворсинки хориона разрастаются, приобретая вид заполненных жидкостью пузырей. Такое состояние опасно для здоровья женщины, и требует незамедлительного врачебного вмешательства.
АФП при беременности – это специфическое вещество, белок, который необходим организму будущей матери на протяжении всего периода беременности. Его роль трудно переоценить, ведь именно благодаря анализу, показывающему его содержание в крови, судят о здоровье малыша.
Поэтому каждая будущая мама должна обязательно проходить тест для измерения уровня АФП. Своевременно выявленные отклонения дают гарантии на успешное вынашивание плода и рождение здорового малыша.
Что может повлиять на анализ
Кроме правильной подготовки важно учесть, что некоторые факторы могут исказить анализ АФП при беременности. Норма при этом достигается, если соблюсти несложные правила
За ужином лучше всего воздержаться от употребления пищи с разными специями, а также жирных, копчёных и жареных продуктов.
Такие физиотерапевтические процедуры, как УЗИ и массаж, а также инструментальные методы наподобие рентгенографии, МРТ, компьютерной томографии тоже могут влиять на анализ. Поэтому их не рекомендуется делать в один день с исследованием АФП. Что касается алкогольных напитков, то с их употреблением тоже следует повременить. По крайне мере до окончания анализа.
Замечено также, что у представителей негроидной расы более высокая концентрация АФП, в то время как у монголоидной нации она гораздо ниже
Еще следует принимать во внимание наличие какого-нибудь эндокринного заболевания наподобие сахарного диабета или вирусных болезней в прошлом
Норма АФП у беременных и остальных
Для сравнения, у мужчин и небеременных женщин, а также у всех детей старше 1 года показатель альфа-фетопротеина колеблется в референсных значения от 0,9 и до 6,67 МЕ/мл, то есть, показатель независим от пола и возраста. У младенцев в возрасте от 1 месяца и до года количество альфа-фетопротеина колеблется от 0,5 и до 23 единиц у мальчиков и до 64 единиц у девочек.
Примечание: Некоторые лаборатории применяют анализатор Cobas 8000, лаборатории Roche Diagnostics, и для него норма верхнего значения по методике твердофазного хемилюминесцентного ИФА составляет 5,8 МЕ/мл.
Что касается нормы АФП при беременности, то для оценки его концентрации существует таблица альфа-фетопротеина:
- 1-12-я неделя 0,5 -15 МЕ/мл
- 12-15-я неделя 15 — 60 МЕ/мл
- 15-19-я неделя 15 — 95 МЕ/мл
- 19-24-я неделя 27 — 125 МЕ/мл
- 24-28-я неделя 52 — 140 МЕ/мл
- 28-30-я неделя 67 — 150 МЕ/мл
- 30-32-я неделя 100 — 250 МЕ/мл
АФП анализ (Альфа-фетопротеин) при беременности
Что такое Альфа-фетопротеин и с какой целью делается анализ в период вынашивания ребеночка?
Что такое Альфа-фетопротеин?
Специфический белок, который вырабатывается внутренними органами будущего малыша и желтым телом материнского организма. Он синтезируется в пищеварительной системе плода, попадая в амниотическую жидкость, распространяется по всему материнскому организму с кровью. Начиная с 10 недели беременности, концентрация данного белка возрастает, на 32 неделе прекращает расти его уровень, и после рождения снижается к нормальному.Какие функции выполняет Альфа-фетопротеин?
К основным функциям данного белка относятся:- Способность сбалансировать иммунную систему плода и матери таким образом, чтобы беременность сохранилась, плод нормально развивался.
- Регуляция кровяного давления у плода.
- Защита организма будущего малыша от негативного влияния женских гормонов матери.
- Транспортировка жиров, которые участвуют в образовании клеток, а так же на последнем сроке созревания плода помогает формировать сурфактант, который необходим для нормального дыхания новорожденного после появления на свет.
Показания к проведению анализа
Рекомендуется проводить анализ всем беременным женщинам. Возможно понадобится повторное исследование, если первое показало нарушения. В обязательном порядке необходимо сделать анализ в таких случаях:- Рентгеновское исследование при беременности в первом триместре.
- Токсическое отравление в период вынашивания малыша.
- Генетические нарушения у одного или обоих родителей.
- Лечение лекарственными средствами на ранних сроках беременности.
- Замирание плода, выкидыши.
- Первая беременность в возрасте после 35.
- Наличие патологии в старших детей.
Когда сдавать анализ АФП во время беременности
Чаще всего анализ проводится на втором триместре вынашивания малыша, примерно на 15-20 неделе. Проводится с целю выявления у будущего ребенка различных генетических отклонений.Проводится забор образцов крови в утреннее время на голодный желудок. Примерно за 12 часов до начала процедуры кушать уже не рекомендуется. При этом желательно отказаться от алкоголя и курения. Для анализа нужна венозная кровь.
Нормы АФП по неделям беременности
Нормой считается если концентрация в МЕ на мл следующая:- С 1 по 13 неделю — от 0,5 до 15.
- С 14 по 16 неделю — от 15 до 60.
- С 17 до 20 недели — от 15 до 95.
- С 21 до 24 недели — от 27 до 125.
- С 25 до 28 неделю — от 52 до 140.
- С 29 до 30 недели — от 67 до 150.
- С 31 по 32 неделю — от 100 до 150.
Повышенная концентрация АФП, причины
Достаточно часто встречающееся нарушение — повышенное содержание АФП. Возникает по таким причинам:- Угроза выкидыша.
- Токсикоз или гестоз в тяжелой форме.
- Ожирение.
- Эндокринные нарушения.
- Гипертония.
- Генетические отклонения в виде синдрома Дауна, Эдвардса и т. п.
- Гидроцефалия.
- Наличие патологий в пищеварительной системе малыша.
- Неправильное формирование нервной трубки у плода.
- Нарушения в формировании мочеполовой системы.
Влияние на организм
В первую очередь повышение концентрации белка АФП в крови матери может свидетельствовать о том, что жизнь плода под угрозой. Однако следует обращать внимание только на существенные отклонения, небольшое отклонения говорят о том, что либо неправильно определен срок беременности, либо ошибки в показаниях по другим причинам и следует повторить исследование.Пониженная концентрация АФП, причины
Реже бывает сниженный уровень Афп в крови будущей матери. Случается из-за:- Генетических заболеваний.
- Замершей беременности.
- Задержки развития малыша внутри утробы.
- Пузырного заноса.
Влияние на организм
Если повторные исследования подтверждают то, что в крови матери недостаточное количество Альфа-фетопротеина, то принимается решение о лечении в пользу сохранения беременности или ее прерывания. Все зависит от дополнительного обследования.Анализ на Альфа-фетопротеин необходимый в первую очередь для того, чтобы определить наличие патологических процессов в развитии будущего ребеночка. Негативные показатели не всегда говорят о страшном диагнозе, важно не отчаиваться и повторить исследование.
кровь в 16 недель, что это такое, нормы
АФП, ХГЧ — это первичное обследование с целью обнаружения неполноценности у эмбриона. Процедуру проводят на 16 неделе беременности. Изменение образования гликопротеинов свидетельствует о нарушении формирования и функционирования плаценты.
Зачем делают анализ
Анализы АФП И ХГЧ входят в состав специального исследования для установления риска появления у плода различных патологий. ХГЧ (хорионический гонадотропин) образуется после присоединения зародыша к стенке матки. Белок АФП присутствует у пациентки, не имеющей в организме злокачественной опухоли.
Альфа-фетопротеин обладает свойствами белка, доставляет ребенку необходимые полезные вещества. Гликопротеин влияет на иммунитет беременной, предотвращает отторжение зародыша. Анализы, проведенные во время беременности, позволяют предупредить развитие осложнений и генетических уродств.
Анализы входят в состав «тройного теста», который проводят во время 2 перинатального обследования.
Подготовка и проведение
Анализ АФП позволяет определить такую патологию, как:
- синдром Дауна;
- заболевания печени и почек.
Чтобы результаты исследования были достоверными, необходимо правильно подготовиться к процедуре. Кровь на АФП и ХГЧ сдают натощак. Исследование проводят до 12 часов дня.
Процедуру проводят во 2 триместре. Показатели альфа-фетопротеина наиболее информативны на 15 неделе.
Биохимическое исследование гемолимфы на ХГЧ определяет патологию в формировании зародыша. Женщину интересует вопрос, как правильно провести подготовку к процедуре сдачи биологической жидкости на ХГЧ.
Гемолимфу берут из вены в количестве 5 мл. Анализ делают в 8 часов утра, если процедура проводится после 12 часов дня, больная не принимает пищу в течение 5 часов до начала исследования.
Необходимо отказаться от употребления жирных и соленых блюд. Врач определяет диагноз не только по результатам анализов, но также учитывает клиническую картину заболевания.
Нормальные показатели по неделям
Норма ХГЧ в каждом триместре в мЕд/мл:
- наименьшее значение в первые 14 суток — 25-300;
- во втором — 10000-35000;
- перед родами — 10000-60000.
Количество гонадотропина возрастает к 42 суткам, затем снижается. Если беременность многоплодная, ХГЧ увеличивается в геометрической прогрессии.
Отклонение показаний на 20% указывает на аномалию в развитии плода.
АФП и ХГЧ во 2 триместре позволяют выявить беременных из группы риска, у которых могут появиться уродства плода. Изменение количества гормонов проверяют в течение нескольких недель.
Норму АФП устанавливают в 1 триместре. За 2 недели до родов показатели имеют максимальное значение, затем — уменьшаются. Норма гормона измеряется в MOM или Ед/мл. Стандартной считается величина от 0,5 до 2 MoM.
Уровень показателей АФП постоянно меняется, каждая неделя имеет свое значение:
- 1 триместр составляет 15 ЕД/мл;
- 16 недель — в пределах 15-62 ЕД/мл;
- 3 триместр имеет максимальную величину 100-251 ЕД/мл.
Вторичное исследование врач назначает на 18 неделе, нормальные показатели АФП 15-95 ЕД/мл им 0,5-2,0 MoM
Причины отклонений и что делать
Анализы могут иметь различные результаты. Превышение нормы альфа-фетопротеина предполагает развитие следующей патологии:
- пупочной грыжи;
- дефекта нервной трубки;
- заболевания печени;.
- хромосомного нарушения;
- избыточного веса плода.
Низкие значения предполагают выкидыш, неправильный набор хромосом, замерший плод, пузырный занос, ложную беременность, сахарный диабет.
Анализ АФП не является доказательством 100% патологии, женщине необходимо пройти УЗИ. Для определения альфа-фетопротеина изучают околоплодные воды.
Исследование позволяет предупредить патологию развития плода. В 5% случаев анализ обнаруживает отклонения от нормального течения беременности. Анализ на гликопротеин необходимо сдать во 2 триместре. В случае сомнительного результата врач принимает меры для сохранения беременности.
Отклонение в нормальном уровне хорионического гонадотропина, его высокий уровень свидетельствуют о развивающемся токсикозе, вероятности появления судорог, повышении содержания белка в моче.
Образование ХГЧ связано с хромосомными нарушениями, в 1 триместре количество свободного гормона повышается быстро. При трисомии 21 количество ХГЧ в крови повышено в 1 триместре. Синдром Эдвардса дает низкие значения эндогенного белка с гормональной активностью.
Неблагоприятный прогноз появляется в случае пониженной или повышенной гиперсекреции гормонов АФП и ХГЧ при беременности. Возможны такие осложнения, как: ФПН, гестоз, преждевременные роды. У женщин с высоким альфа-фетопротеином выявляют нарушение прикрепления плаценты. В 30% наблюдают внутриутробную гибель плода.
Фетопротеин — что вам нужно знать
- CareNotes
- Альфа-фетопротеин
Этот материал нельзя использовать в коммерческих целях, в больницах или медицинских учреждениях. Несоблюдение может повлечь судебный иск.
Что это?
- Альфа-фетопротеин (al-fa-FETO-pro-teen) может быть обнаружен с помощью анализа крови и также называется AFP. AFP — важный белок сыворотки плода (FEE-tal), который исчезает вскоре после рождения.Возвращается у беременных. Он также может выступать в качестве онкомаркера у других взрослых. Онкомаркеры — это анализы крови, используемые для обнаружения различных видов рака.
- AFP также является одним из основных эмбриональных белков (em-bree-ON-ic). Эмбриональный означает ранние стадии роста ребенка. Это время от зачатия (cun-SEP-shun) до конца второго месяца беременности. С третьего месяца до рождения развивающийся эмбрион называется плодом (FEE-tus) или плодом.
Зачем мне это нужно?
- У взрослых AFP помогает отличить первичную гепатому (hep-uh-TOE-mah) от доброкачественных (be-NINE) заболеваний печени.Гепатома — это рак печени. Доброкачественные — это состояния, не относящиеся к раку. Высокий уровень AFP может указывать на некоторые из следующих состояний:
- Рак клеток печени.
- Рак яичников (o-VAIR-e-un).
- Рак поджелудочной железы (pan-kree-AT-ik).
- Рак желудка.
- Рак яичка (tes-TIK-u-ler).
- Во время беременности тесты на АФП могут проводиться для обнаружения или наблюдения за дефектами развивающегося плода. Уровень АФП в крови матери выше нормы может означать:
- Мозг ребенка не развивается (дефекты нервной трубки).
- У ребенка могут быть физические дефекты, такие как карликовость (DWORF-izm).
- Кишечник ребенка находится за пределами живота (живота).
- У ребенка могут быть проблемы с сердцем.
- Позвоночник ребенка развивается неправильно.
- Уровень АФП ниже нормы может означать, что у плода синдром Дауна. Попросите вашего опекуна объяснить различные состояния, которые могут быть у вашего ребенка, если результаты этого теста ненормальны.
Как мне подготовиться к тесту?
Ваш опекун скажет вам, когда сдавать анализ крови.Анализ крови можно сделать до или после еды.
Как собирают образец?
Лицо, осуществляющее уход, обернет вам руку широким резиновым ремешком и затянет его. Ваша кожа будет очищена спиртом. Маленькая игла, прикрепленная к специальной пробирке, будет введена в вену на руке или руке. Трубка имеет отсос, чтобы втягивать кровь. Когда трубка заполнится, резиновую ленту, иглу и трубку удаляют. Лицо, осуществляющее уход, нажимает на кусок хлопка в том месте, где была удалена игла.Возможно, вас попросят подержать вату на месте в течение нескольких минут, чтобы остановить кровотечение. Затем можно накинуть ленту на вату на руке.
Что мне делать после теста?
Вы можете удалить ленту и вату примерно за 20–30 минут. Позвоните своему опекуну, чтобы узнать результаты теста. Ваш опекун объяснит, что для вас значат результаты вашего теста. Следуйте инструкциям вашего опекуна.
Соглашение об уходе
Вы имеете право участвовать в планировании вашего лечения.Чтобы помочь с этим планом, вы должны узнать о своих лабораторных тестах. Затем вы можете обсудить результаты со своими опекунами. Поработайте с ними, чтобы решить, какие услуги вам могут быть предоставлены. Вы всегда имеете право отказаться от лечения.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Frontiers | Эндокринные факторы, модулирующие иммунные ответы при беременности
Введение
Говорят, что беременность у млекопитающих нарушает иммунологические правила, потому что полуаллогенный концептус скорее переносится, чем отвергается.Таким образом, это увлекательное явление и цель многих иммунологических исследований. Однако беременность — это естественное явление, обеспечивающее выживание видов и существующее миллионы лет. В отличие от трансплантации, где эмпирические наблюдения привели к определению иммунологических правил, это искусственный процесс, который был впервые описан в 1905 году. Таким образом, понимание того, как действует естественная толерантность, может помочь в создании новых стратегий для обеспечения толерантности в других моделях. В частности, из-за того, что первоначальное аллораспознавание чужеродных антигенов плода иммунной системой матери выгодно для успешной беременности, механизмы гестационной толерантности представляют интерес для других дисциплин.Местное подавление аллореактивных иммунных ответов на отцовские антигены является предпосылкой для принятия плода. Стероидные гормоны, такие как прогестерон (P4) и эстрадиол (E2), а также гонадотропины, такие как хорионический гонадотропин человека (ХГЧ), в основном участвуют в регуляции менструального цикла, а также в установлении и поддержании беременности (1, 2). Связывая свои специфические рецепторы, экспрессируемые иммунными клетками, и / или действуя через медиаторы, эти гормоны поддерживают толерантность плода, подавляя деструктивные иммунные ответы и индуцируя пути толерантности.В этом обзоре подчеркивается влияние гормонов, связанных с беременностью, на различные типы иммунных клеток, с особым акцентом на P4, E2 и ХГЧ.
Прогестерон
P4 является членом семейства стероидных гормонов и был описан как «гормон беременности» из-за его незаменимой роли в поддержании беременности (3). Во время менструального цикла уровни P4 относительно низкие во время преовуляторной фазы, повышаются после овуляции и повышаются во время лютеиновой фазы (4). Если наступает беременность, ХГЧ изначально поддерживает уровень P4, индуцируя его производство желтым телом .После лютеино-плацентарного сдвига плацента берет на себя производство P4 (5). P4 подготавливает матку к имплантации, поскольку он вызывает дифференцировку стромальных клеток в децидуальные клетки (децидуализацию) и снижает сократимость гладкомышечных клеток матки (6, 7). Кроме того, отмена P4 связана с началом родов (8). Было показано, что P4 влияет на иммунитет, в основном при беременности. Эти эффекты в основном опосредуются внутриклеточными рецепторами P4 (PR), PR-A и PR-B, которые действуют как факторы транскрипции, хотя сообщалось о негеномных эффектах активации PR (9).Кроме того, P4 опосредует свою иммунорегулирующую функцию через посредников, таких как прогестерон-индуцированный блокирующий фактор (PIBF) и гликоделин A (10, 11).
Эстрадиол
Как и прогестерон, эстрогены относятся к стероидным гормонам. У женщин описаны три основных встречающихся в природе эстрогена, а именно эстрон (E1), эстрадиол (E2) и эстриол (E3). Среди них E2 является преобладающим эстрогеном, вырабатываемым в репродуктивном возрасте. Высокие уровни E2 вырабатываются яичниками, в то время как меньшие количества также вырабатываются корой надпочечников и предшественниками E2 в жировых тканях (12).В нормальном менструальном цикле уровни E2 повышаются по мере развития фолликулов, на короткое время снижаются при овуляции и снова повышаются во время лютеиновой фазы до второго пика. В конце лютеиновой фазы уровень E2 падает до менструального уровня, если не наступила беременность (13). Во время беременности уровень E2 постоянно увеличивается до срока беременности из-за продукции растущей плаценты (14). Для E2 описано несколько важных функций. Во время менструального цикла E2 вызывает выброс лютеинизирующего гормона (ЛГ), что приводит к овуляции.После овуляции, в лютеиновой фазе, E2 в сочетании с P4 подготавливает эндометрий к имплантации. Показано, что во время беременности E2 способствует кровотоку в матке, росту миометрия, стимулирует рост груди и, в срок, способствует размягчению шейки матки и экспрессии рецепторов миометрия. Кроме того, было высказано предположение, что E2 влияет на различные популяции иммунных клеток по их количеству и функциям и тем самым способствует толерантности плода. Эти эффекты опосредуются связыванием E2 с его внутриклеточными рецепторами, рецепторами эстрогена альфа (ERα) и бета (ERβ), которые, в свою очередь, модулируют экспрессию многих генов (15).Оба рецептора экспрессируются в различных клетках лимфоидной ткани, а также в лимфоцитах, макрофагах и дендритных клетках (ДК) (16, 17).
Хорионический гонадотропин человека
Хорионический гонадотропин человека представляет собой гетеродимерный плацентарный гликопротеин приматов. Сообщалось о четырех различных вариантах ХГЧ, а именно общем ХГЧ, гипергликозилированном ХГЧ (ХГЧ-Н), свободной β-субъединице и ХГЧ гипофиза, каждый из которых продуцируется разными клетками с разными биологическими функциями (18). У людей после наступления беременности общий уровень ХГЧ быстро увеличивается в течение первого триместра, достигает пика между 9-й и 12-й неделями беременности, а затем снижается, пока женщина не родит, хотя остается выше, чем у небеременной женщины (19).ХГЧ продуцируется дифференцированными синцитиотрофобластами, и его основная функция состоит в том, чтобы стимулировать выработку P4 желтым телом (20). Более того, ХГЧ поддерживает беременность, облегчая инвазию трофобластов (21–23), способствуя ангиогенезу и обеспечивая питание плода (24–26). У грызунов аналогичные функции опосредуются высокогомологичным ЛГ. В последние годы появляется все больше доказательств того, что ХГЧ и ЛГ участвуют в механизмах иммунной толерантности, ведущих к выживанию плода.Было показано, что оба гонадотропина влияют на иммунные клетки путем связывания с рецептором LH / CG, экспрессируемым несколькими типами иммунных клеток. Более того, ХГЧ также действует через рецептор маннозы.
Альфа-фетопротеин
Альфа-фетопротеин (AFP) — это гликопротеин, который вырабатывается желточным мешком и печенью плода во время беременности (27). Это самый распространенный белок плазмы, обнаруженный у плода человека, действующий как транспортный белок плода. Уровни АФП повышаются у 4-недельного плода, достигают пика между 12-й и 16-й неделями и остаются низкими после рождения.Хотя несколько исследований предоставляют доказательства иммунного регуляторного потенциала AFP (28–32), до сих пор не изучено, способствует ли AFP успешной беременности путем модуляции иммунных ответов.
Влияние гормонов на иммунные клетки во время беременности
Влияние гормонов беременности на макрофаги
Моноциты и макрофаги являются основными представителями врожденной иммунной системы в циклической и беременной матке млекопитающих. Несколько исследований предоставляют доказательства того, что рекрутирование моноцитов, дифференцировка в макрофаги и функция в репродуктивном тракте регулируются гормонами, связанными с беременностью (33).Гормональное влияние может быть достигнуто путем прямого связывания с соответствующими рецепторами гормонов, экспрессируемых на макрофагах человека и мыши (16, 34, 35), или косвенно, путем модуляции уровней цитокинов и факторов роста, которые нацелены на резидентные макрофаги и влияют на их секреторный профиль. Хант и его коллеги сообщили, что P4 снижает миграцию макрофагов в матку мыши (36), в то время как Китцмиллер и его коллеги показали, что E2, P4 и ХГЧ не влияют на миграцию макрофагов у морских свинок (37).Дифференцировке моноцитов в макрофаги препятствовал гликоделин А, медиатор P4, за счет индукции апоптоза в моноцитах человека. Однако после дифференцировки гликоделин А не смог изменить фагоцитарную способность макрофагов (11). Макрофаги являются важными регуляторами активности трофобластов, которые способствуют ремоделированию тканей и ангиогенезу (38). В связи с этим было продемонстрировано, что E2, hCG и LH увеличивают продукцию фактора роста эндотелия сосудов (VEGF) в макрофагах человека (39, 40), поддерживая образование сосудов в плаценте.Кроме того, P4 снижает способность макрофагов человека и мыши продуцировать мощные эффекторные молекулы, такие как оксид азота и IL-1, которые, как было доказано, пагубно влияют на успешный исход беременности (36, 41, 42). Более того, P4 подавляет запускаемую toll-подобным рецептором активацию макрофагов мыши, регулируя экспрессию miR-155 (43). Мензис и его коллеги недавно предположили участие P4 в регуляции генов, связанных с альтернативной активацией макрофагов (44). Напротив, обработка ХГЧ макрофагов, примированных IFN-γ человека и мыши, привела к увеличению продукции оксида азота, активных форм кислорода, IL-6 и IL-12p40 и усилению фагоцитоза апоптотических клеток (45, 46).Однако обработка ХГЧ макрофагов, примированных IFN-γ мыши, не влияла на индукцию пролиферации аллогенных Т-клеток (45). Интересно, что макрофаги регулируют избыток ХГЧ, который, как известно, является тератогенным для тканей плода. Здесь предполагается, что человеческие макрофаги включают и разлагают ХГЧ зависимым от времени образом, что защищает гонадогенез плода от избытка ХГЧ (47, 48). Точнее, Катабучи и его коллеги недавно продемонстрировали, что ХГЧ индуцирует временное образование вакуолей в моноцитах человека, морфологически имитируя клетки Хофбауэра.Авторы предполагают, что клетки Хофбауэра и особенно их вакуоли участвуют в защите тканей плода от большого количества материнского ХГЧ (49). Предполагается, что помимо эффекта стероидных гормонов и гонадотропинов на моноциты и макрофаги, AFP влияет на оба типа клеток врожденного иммунитета. Было продемонстрировано, что AFP значительно подавляет продукцию TNFα и IL-1β и вызывает быстрое подавление экспрессии поверхностного MHC класса II в стимулированной клеточной линии моноцитов человека (29, 31).Более того, Лу и его коллеги показали, что AFP подавляет экспрессию на клеточной поверхности антигенов Ia на макрофагах, но не влияет на жизнеспособность макрофагов (50). Гормональные эффекты на макрофаги представлены на Рисунке 1.
Рисунок 1. Гипотетический сценарий влияния гормонов, связанных с беременностью, на врожденный иммунитет . Сценарий предполагает несколько механизмов, с помощью которых E2, P4 и ХГЧ влияют на клетки врожденного иммунитета и тем самым способствуют успеху беременности.ER, рецептор эстрогена; GR, рецептор глюкокортикоидов; IDO, индоламин-2,3-диоксигеназа; ИЛ-1, интерлейкин-1; ИЛ-10, интерлейкин-10; LH / CG-R, рецептор лютеинизирующего гормона / хорионического гонадотропина; NO, оксид азота; PIBF, фактор блокировки, вызванный прогестероном; PR, рецептор прогестерона; VEGF, фактор роста эндотелия сосудов.
Влияние гормонов беременности на естественные киллерные клетки
NK-клетки и, в частности, NK-клетки матки (uNK) представляют особый интерес при анализе механизмов, лежащих в основе нормальной беременности.Это становится очевидным, если принять во внимание, что клетки uNK являются преобладающей популяцией лимфоцитов в поздней секреторной фазе менструального цикла и в матке на ранних этапах беременности, составляя около 70% всех лейкоцитов в децидуальной ткани. uNK-клетки отличаются от периферических NK-клеток экспрессией их рецепторного репертуара и экспрессией некоторых генов, индуцированной гормональной средой. Основная функция uNK-клеток — регулирование ремоделирования сосудистой сети матки матери (51).Таким образом, на мышиной системе было продемонстрировано, что клетки uNK продуцируют проангиогенные факторы, такие как VEGF и факторы роста, и обеспечивают местный IFN-γ для инициации образования спиральной артерии (52-54). Их происхождение или распространение остается предметом обсуждения. Они могут мигрировать с периферии, дифференцируясь от предшественников NK-клеток под контролем различных факторов, включая стероидные гормоны (55), и / или путем рекрутирования периферических NK-клеток в матку (56–58) или размножаться in situ после беременность установлена (59).Qu и его коллеги продемонстрировали P4-зависимую экспрессию остеопонтина в децидуальных клетках стромы человека и человеческих uNK-клетках и предположили роль остеопонтина в накоплении uNK-клеток в ткани матки (60). Более того, рекрутирование человеческих uNK-клеток из периферической крови в матку, по-видимому, благоприятствует повышению уровней E2 и LH и ограничивается увеличением количества P4 (61). Интересно, что зрелые uNK клетки человека и грызунов не экспрессируют стероидные рецепторы (55, 62–64). Таким образом, предполагается, что, по крайней мере, для P4 эффекты опосредованы рецептором глюкокортикоидов (GR), который, как было доказано, экспрессируется на мышиных uNK-клетках (65).Помимо отсутствия стероидных рецепторов, uNK также не имеют классического рецептора LH / CG. Таким образом, было высказано предположение, что ХГЧ индуцирует пролиферацию uNK-клеток человека через рецептор маннозы (66). Что касается функции uNK-клеток, было показано, что они содержат большое количество перфорина, но проявляют только низкую цитотоксическую активность. Несколько исследований показали, что P4 и его медиатор PIBF ингибируют активность человеческих NK-клеток посредством блока дегрануляции (67–70). В соответствии с этим, E2 увеличивал количество NK-клеток человека и мыши, но снижал их цитотоксичность (71, 72).Напротив, Китайя и его коллеги, а также Курасиге и его коллеги обнаружили, что ни P4, ни E2 не оказывают значительного влияния на пролиферацию, цитолитическую активность и секрецию цитокинов NK-клетками эндометрия человека (73, 74). То же самое было и с AFP (73). В отличие от этих результатов, было показано, что применение ХГЧ и ЛГ у девственных мышей приводило к усилению активности NK-клеток (75, 76), что свидетельствует о том, что гормоны беременности по-разному регулируют функцию NK-клеток. Более того, противоречивые результаты между людьми и мышами относительно влияния гормонов беременности на различные популяции иммунных клеток отражают ограничения животных моделей в понимании механизмов, уникальных для человеческой беременности.Наконец, ХГЧ не только влияет на NK-клетки, но также вырабатывается и секретируется ими во время беременности (77). Гормональные эффекты на NK-клетки представлены на рисунках 1 и 2.
Рис. 2. Гипотетический сценарий, представляющий влияние гормональных изменений, происходящих во время репродуктивного цикла, на распределение популяций клеток врожденного и адаптивного иммунитета в матке . В верхней части сценария показано накопление различных популяций иммунных клеток в ткани матки, коррелированное с различными фазами менструального цикла человека и цикла течки мышей.В нижней части сценария показаны гормональные изменения, происходящие во время репродуктивных циклов как у людей, так и у мышей.
Влияние гормонов беременности на тучные клетки
Тучные клетки (ТК) наиболее известны своей эффекторной функцией при аллергических заболеваниях. После связывания аллергенспецифического IgE с его рецептором (FcεRI) предварительно сформированные и вновь синтезированные медиаторы, хранящиеся в MC, высвобождаются, чтобы вызвать воспалительные иммунные ответы (78). Помимо этой хорошо задокументированной функции MC, недавние данные предполагают, что MC являются критическими регуляторами адаптивных иммунных ответов (79).Кроме того, недавно мы обнаружили критическую роль МС в успехе беременности. Чтобы изучить важность MC в беременности мышей, мы использовали модель мышей с дефицитом MC. Мы обнаружили, что MC (UMC) матки имеют уникальный фенотип. Число uMC увеличивается каждый раз, когда женщина становится восприимчивой, и быстро увеличивается после наступления беременности. При отсутствии MC имплантация серьезно нарушена, и ремоделирование спиральной артерии оказалось недостаточным. Предполагается, что это приводит к задержке роста плода (80).Мы также предложили роль uMCs в выживании трофобластов, плацентации и росте плода. Благотворная роль MC при беременности мышей опосредована, по крайней мере частично, галектином-1 (80). Колебания количества uMCs во время репродуктивного цикла у людей (81) и мышей (82), по-видимому, по крайней мере частично регулируются гормонами. Несколько исследований продемонстрировали, что P4 и E2 влияют на плотность MC крыс и мышей в разных тканях, включая молочные железы и ткань матки (82–85). Мы дополнительно предположили функцию обоих гормонов в рекрутировании мышиных ТК с периферии в матку, а также влияние на активность ТК (86).В согласии с этим, несколько исследований подтвердили основной эффект P4 и E2 на активацию MC крыс, мышей и человека (83, 87–90). Напротив, в двух других исследованиях не наблюдали изменений в количестве гранулированных или дегранулированных ТК крыс и мышей после лечения P4 или E2 (91, 92). Хант и его коллеги обнаружили, что E2 влияет на экспрессию iNOS и TNF-α в uMC мыши (93). Можно предположить, что наблюдаемые эффекты P4 и E2 на MC отчасти имеют прямую природу, поскольку было доказано, что MC разных видов экспрессируют рецепторы P4 и E2 (85–87, 89, 94).Исследования, анализирующие влияние ХГЧ на МК, редко встречаются в литературе. В одном исследовании изучали содержание гистамина в МК на модели индуцированной гиперстимуляции яичников у кроликов. Однако применение ХГЧ, по-видимому, не изменило содержание гистамина в ТК (95). Гормональные эффекты на MC представлены на рисунках 1 и 2.
Влияние гормонов беременности на дендритные клетки
Как профессиональные антиген-презентирующие клетки, DC находятся на границе между врожденной и адаптивной иммунной системой; следовательно, их активация и модуляция имеют решающее значение для результата иммунного ответа.В зависимости от своего статуса активации, DC либо секретируют про-, либо противовоспалительные цитокины, тем самым вызывая иммунные ответы или подавляя их, соответственно. Во время нормальной беременности большинство децидуальных ДК человека и мышей имеют незрелый (толерогенный) фенотип и в основном продуцируют IL-10, что способствует созданию благоприятной для плода местной среды (96, 97). В соответствии с этим, самопроизвольные аборты у людей и мышей связаны с увеличением количества зрелых, продуцирующих IL-12 DC (98, 99).Более того, важность DCs для правильной децидуализации и имплантации была хорошо продемонстрирована Plaks и его коллегами на модели мыши (100). Данные о влиянии гормонов, связанных с беременностью, на функцию ДК широко распространены и противоречивы. Было показано, что ДК, полученные из предшественников костного мозга или моноцитов, а также ДК из селезенки или децидуальной оболочки по-разному реагируют на гормональную стимуляцию. Это может предложить возможное объяснение того, как эндокринная система поддерживает иммунную систему беременной в переносе полуаллогенного плода, в то же время осознавая патогены; эти клетки являются плейотропными, и неудивительно, что у них есть механизм, позволяющий по-разному реагировать в зависимости от ситуации.ДК очень чувствительны к гормональной стимуляции за счет экспрессии рецепторов P4, E2, ХГЧ и ЛГ (101–103). Гормональная стимуляция активированных ДК костного мозга (BMDC) привела в большинстве исследований к нарушению повышающей регуляции молекул MHCII и костимулирующих молекул, связанных с пониженной способностью секретировать провоспалительные цитокины (101, 104). Это означает, что при гормональной стимуляции они приобретают фенотип, скорее благоприятный для беременности. Конкретное влияние P4 на секрецию IL-10 активированными BMDC крысы и мыши обсуждалось по-разному и требует дальнейшей оценки (101, 104, 105).В соответствии с гормонально-опосредованной индукцией толерогенного фенотипа в активированных BMDC их способность к стимуляции Т-клеток была снижена. Это говорит о том, что обработанные гормонами ДК обладают защитным эффектом от беременности, подавляя ответы аллореактивных Т-клеток (101, 104, 105). Однако результаты, полученные после добавления P4, E2 и hCG к моноцитарным ДК (moDC) из периферической крови человека, отличаются от результатов, полученных после гормональной стимуляции BMDC. Здесь два исследования показали, что комбинации P4, E2 и hCG не изменяют экспрессию маркеров созревания moDC или их стимулирующую способность Т-клеток (106, 107).Сегерер и его коллеги продемонстрировали, по крайней мере, для ХГЧ положительный эффект при беременности на экспрессию HLA-DR, связанный со значительным снижением способности стимулировать Т-клетки (108). Большой интерес представляет тот факт, что в большинстве опубликованных исследований наблюдалась значительная повышающая регуляция продукции IL-10 человеческими ДК после лечения гормонами беременности (106, 107, 109). Уэмура и его коллеги дополнительно предложили индукцию дифференцировки Т-клеток в Th3 (107), фенотип, который, как сообщается, благоприятен для беременности.Анализ гормонального воздействия на ДК селезенки проводился на нескольких моделях мышей, включая модели аутоиммунных заболеваний и беременности. На мышиной модели рассеянного склероза, а именно экспериментального аутоиммунного энцефаломиелита (EAE), лечение E2 оказалось защитным. Здесь E2 не влияет на экспрессию маркеров активации и костимуляторных молекул DC, но ингибирует их способность стимулировать пролиферацию Т-клеток и секрецию цитокинов Th2 и Th3. Было высказано предположение, что снижение стимулирующей способности Т-клеток связано с повышенной экспрессией индоламин-2,3-диоксигеназы (IDO) в DC после обработки E2 (110, 111).Соответственно, было также доказано, что hCG активирует IDO в DC на мышиной модели аутоиммунного диабета (112). Что касается E2, сообщалось, что P4, по-видимому, влияет на соотношение Th2-промотирующих DEC-205 + DC и Th3-промотирующих DC 33D1 + DC во время беременности, способствуя преобладанию 33D1 + DC. Потребность в DC 33D1 + для успешной беременности является результатом наблюдения, что истощение этой специфической подгруппы DC во время перинатального периода у мышей вызвало значительную потерю плода, вероятно, опосредованную повышением регуляции Th2 посредством временной секреции IL-12 (113).Мы недавно исследовали влияние ХГЧ и ЛГ на количество и фенотип периферических и локальных ДК на мышиной модели нарушенной толерантности к полуаллогенному плоду. Мы обнаружили, что применение in vivo обоих гормонов предотвращало отторжение плода, и это было связано с уменьшением количества общих и зрелых ДК как на периферии, так и в децидуальной оболочке. Кроме того, мы доказали, что обработанные ХГЧ децидуальные ДК обладают повышенной способностью индуцировать регуляторные T (Treg) -клетки (103).Это подтверждает защитное влияние обоих гонадотропинов на беременность посредством модуляции адаптивных иммунных ответов. Влияние AFP на различные субпопуляции DC во время беременности практически неизвестно. Доказательства опосредованной AFP индукции толерогенных ДК получены на модели опухоли, где было продемонстрировано, что AFP индуцирует толерогенные ДК, способные подавлять опухолеспецифические цитотоксические Т-лимфоциты CD8 + в опухоли (114). Гормональные эффекты на ДК представлены на рисунках 1 и 2.
Влияние гормонов беременности на В-клетки
B-лимфоцитов выделяются адаптивной иммунной системе, и они наиболее известны своей способностью секретировать антитела.Однако В-клетки не просто производят антитела. Они эффективно презентируют антигены и модулируют функцию Т-клеток и ДК, продуцируя цитокины (115, 116). Предполагается, что во время беременности различные субпопуляции В-клеток по-разному влияют на исход беременности [см. (117)]. По сути, B-клетки можно разделить на две основные популяции, а именно B-клетки B1 и B2. Эти две популяции различаются по своему происхождению, экспрессии поверхностных маркеров и функции (118). Затем B-клетки B1 подразделяются на B-клетки B1a и B1b на основе экспрессии поверхностного маркера CD5 (119).Интересно, что B-клетки B1a продуцируют специфический тип антител, так называемые естественные антитела (120). Предполагается, что из-за своей полиреактивной природы природные антитела вызывают аутореактивность и, таким образом, участвуют в возникновении аутоиммунных заболеваний (121). Предполагается, что даже во время беременности В-клетки B1a, продуцирующие естественные антитела, оказывают пагубное влияние на исход беременности. Недавно мы показали, что количество B-клеток B1a значительно снижается в третьем триместре у здоровых беременных женщин, но остается повышенным у пациентов с преэклампсией (122).Поскольку у пациентов, страдающих преэклампсией, уровень ХГЧ в сыворотке повышен по сравнению с нормальными беременными женщинами, мы предположили, что ХГЧ может быть ответственным за увеличение количества B-клеток B1a. Это предположение дополнительно подтверждается тем фактом, что почти все B-клетки B1a экспрессируют рецептор LH / CG и увеличивают in vitro на при стимуляции hCG (122). Однако было показано, что ХГЧ ингибирует образование антител мышиных В-клеток (123, 124). Однако эти два упомянутых исследования фокусировались не на B-клетках B1a, а на B-клетках в целом.Возникает соблазн предположить, что ХГЧ может по-разному влиять на фенотип клеток и выработку антител в разных субпопуляциях В-клеток. В отличие от пагубного воздействия естественных антител на исход беременности, асимметричные антитела (ААБ) из-за их структурной аномалии способствуют успеху беременности за счет снижения аллореактивных иммунных ответов (125). AAB увеличивается во время беременности, и их недостаток связан с прерыванием беременности у человека (126, 127). Секреция AAB, по-видимому, по крайней мере частично регулируется гормонами.P4, но не E2, вызывают секрецию AAB (128). Таким образом, P4 опосредует свою функцию посредством индукции PIBF (129). Помимо влияния на образование и секрецию антител, гормоны беременности также регулируют развитие В-клеток и секрецию цитокинов. Введение только E2 или в комбинации с P4 предпочтительно подавляло реагирующие на IL-7 клетки и их потомство в костном мозге (130). В отличие от P4 и E2, стимуляция В-клеток человека с помощью ХГЧ, по-видимому, сильно зависит от доз ХГЧ и чистоты препаратов ХГЧ (131–133).Недавно мы предложили другой защитный эффект ХГЧ от беременности, а именно его способность увеличивать регулирующую функцию регуляторных В-клеток человека (Breg или B10), которые, как было показано, вносят вклад в выживание плода. Breg экспрессируют рецептор LH / CG и увеличивают продукцию IL-10 в ответ на лечение hCG (134). Гормональные эффекты на В-клетки обобщены на Рисунке 3.
Рисунок 3. Гипотетический сценарий влияния гормонов, связанных с беременностью, на адаптивный иммунитет .Сценарий предполагает несколько механизмов, с помощью которых E2, P4 и ХГЧ влияют на адаптивные иммунные клетки и тем самым поддерживают успешную беременность. AAB, асимметричные антитела; ER, рецептор эстрогена; IDO, индоламин-2,3-диоксигеназа; ИЛ-10, интерлейкин-10; LH / CG-R, рецептор лютеинизирующего гормона / хорионического гонадотропина; PIBF, фактор блокировки, вызванный прогестероном; PR, рецептор прогестерона.
Влияние гормонов беременности на Т-клетки
Т-клетки являются ключевыми регуляторами как антител, так и клеточно-опосредованных ветвей адаптивной иммунной системы и могут быть разделены на две подкатегории: Т-хелперные клетки, экспрессирующие CD4, и цитотоксические Т-клетки, экспрессирующие CD8.В соответствии с их паттерном секреции цитокинов они обычно подразделяются на клетки Th2, Th3 и Th4, хотя хорошо известно, что эта классификация упрощена, поскольку были описаны дополнительные подмножества, такие как Th9 и Th27. Т-клетки опосредуют свою функцию либо путем прямого межклеточного контакта, либо опосредованно путем секреции цитокинов, определяя местную среду как провоспалительную или противовоспалительную. Нормальная беременность связана с провоспалительным профилем Th2 на ранних и поздних стадиях беременности, что важно для правильной имплантации бластоцисты и начала родов соответственно.В середине беременности профиль противовоспалительного Th3 гарантирует толерантность к чужеродным антигенам плода. Дисбаланс цитокиновых профилей был связан с осложнениями беременности у человека (135), что предполагает основную роль Т-клеток в толерантности плода, регулируя местную цитокиновую среду. Сообщается, что стероидные гормоны участвуют в модуляции секреции цитокинов различными субпопуляциями Т-клеток. Предполагается, что P4 и E2 влияют на баланс Th2 / Th3, способствуя преобладанию Th3 на границе плод-мать у людей и мышей (136–144).Гормональные эффекты в основном опосредуются их классическими рецепторами, экспрессируемыми Т-клетками человека и мыши (16, 103, 143, 145, 146). Однако Чиен и его коллеги предоставляют доказательства того, что P4 может действовать через неклассические стероидные рецепторы, вызывая иммунную модуляцию и подавление активации Т-клеток во время беременности (147). Помимо регуляции секреции цитокинов Т-клетками, стероидные гормоны и их медиаторы (например, гликоделин А) индуцируют апоптоз эффекторных Т-клеток (148–150) и увеличивают экспрессию молекул, защищающих беременность, таких как фактор ингибирования лейкемии (LIF ), как известно, модулирует иммунные ответы на ранних сроках беременности человека и мыши (151, 152).В соответствии с этим предполагается, что ХГЧ поддерживает выживание плода путем модуляции активности и функции мышиных Т-клеток (153, 154). Точнее, Хил и его коллеги продемонстрировали, что ХГЧ предотвращает развитие болезни на мышиной модели аутоиммунного диабета. Здесь обработка ХГЧ эффективно подавляла продукцию IFN-γ, но увеличивала продукцию IL-10 и TGF-β в спленоцитах. Применение ХГЧ также подавляло продукцию TNF-α (155). Напротив, AFP, по-видимому, не оказывает прямого действия на Т-лимфоциты.Т-клетки, стимулированные AFP, сохраняют свою полную способность отвечать в смешанной культуре лимфоцитов (MLC) и клеточно-опосредованном лимфолизе. Однако AFP вызывает серьезные изменения функционального статуса обогащенной моноцитами популяции клеток, стимулирующих MLC. Эта обогащенная моноцитами популяция индуцирует Т-супрессорные клетки и в то же время подавляет генерацию цитотоксических Т-клеток (156–158).
Гормоны, связанные с беременностью, не только влияют на обычные Т-клетки, но также, как было показано, поддерживают образование и функцию Treg-клеток.Treg-клетки представляют собой специализированное подмножество внутри компартмента Т-клеток с уникальными свойствами. Во время беременности они в основном участвуют в подавлении аллореактивных иммунных ответов, и, таким образом, их отсутствие приводит к худшему исходу беременности как у людей (159), так и у мышей (160). Присутствие Treg-клеток в матке до беременности также имеет большое значение. Сниженная экспрессия в эндометрии их основного фактора транскрипции Foxp3 связана с бесплодием у женщин (161), в то время как истощение Treg-клеток в мышиной модели, полученной во враждебном микроокружении матки, препятствует имплантации эмбриона (162).Во время репродуктивного цикла количество Treg-клеток колеблется (162–164), и предполагается, что это происходит под действием гормонов (165). Это можно интерпретировать как гормоны, подготавливающие мать и особенно ткани к беременности. Уже в 80-е годы считалось, что ХГЧ индуцирует супрессорные Т-лимфоциты человека и мыши (166–168). В настоящее время предполагается, что стероидные гормоны и гонадотропины регулируют несколько аспектов биологии Treg-клеток, включая образование, распространение, миграцию и подавляющую функцию как у людей, так и у мышей (103, 145, 169–176).Однако некоторые исследования предоставляют доказательства того, что P4 и E2 вызывают снижение количества Treg-клеток или не вызывают изменений количества Treg-клеток (177–179). Таким образом, эти противоречивые результаты могут зависеть от маркеров, используемых для определения Treg-клеток, момента времени анализа и используемой модели. Следовательно, необходимы дополнительные исследования, чтобы понять, в какой момент времени и через какие механизмы гормоны беременности влияют на функцию Treg-клеток. Гормональные эффекты на Т-клетки представлены на рисунках 2 и 3.
Терапевтический потенциал гормонов, связанных с беременностью, в вспомогательных репродуктивных технологиях
Иммунологические расстройства были предложены как одна из основных причин необъяснимого бесплодия, неудач имплантации и повторяющихся выкидышей.Обсуждалось, что изменение количества и функции популяций иммунных клеток во время репродуктивного цикла и на ранних стадиях беременности может привести к неспособности забеременеть и ухудшению исхода беременности. У женщин, подвергающихся вспомогательным репродуктивным методам (ВРТ), часто возникают повторяющиеся неудачи имплантации после оплодотворения in vitro, оплодотворения (ЭКО) и переноса эмбриона (ЭТ). Было показано, что гормональное лечение стероидными гормонами и гонадотропинами до и после АРТ способствует успешной имплантации и, таким образом, улучшает частоту наступления беременности (26, 180–182).Основываясь на данных, обсуждаемых здесь, можно предположить, что гормональное лечение при АРТ противодействует иммунологическим расстройствам и, следовательно, может, по крайней мере, частично объяснить улучшение показателей беременности. Предполагается, что, воздействуя на популяции иммунных клеток и их продукты, гормоны влияют на местную среду и тем самым поддерживают оптимальную имплантацию эмбриона (3). Лукассен и его коллеги показали, что гормональная стимуляция для лечения ЭКО положительно влияет на соотношение CD56 bright / CD56 dim в эндометрии за счет относительного снижения цитотоксических CD56 dim CD16 + NK-клеток.Более того, те же авторы наблюдали увеличение В-клеток и макрофагов, и эти эффекты были ограничены эндометрием и не могли наблюдаться в периферической крови (183). Поступая таким образом, гормоны могут способствовать ремоделированию тканей и ангиогенезу, что приводит к надлежащей плацентации и питанию плода. Положительный эффект ХГЧ на ВРТ подтверждается исследованием Mansour и коллег, которые показали, что внутриматочная инъекция ХГЧ перед ЭТ у пациенток, перенесших ЭКО, значительно улучшила частоту имплантации и беременности (180).К сожалению, авторы не анализировали количество и активность Treg-клеток, хотя увеличение частоты наступления беременности после ЭКО было связано с повышенным количеством Treg-клеток в периферической крови (184). Интересно, что, основываясь на наших наблюдениях, что ХГЧ эффективно привлекает Treg-клетки к трофобластам (145), Египетский центр ЭКО-ЭТ провел клиническое испытание, изучающее влияние внутриматочной инъекции ХГЧ на Treg-клетки эндометрия. Предстоящие результаты покажут, может ли лечение ХГЧ во время имплантации повышать уровни эндогенных Treg-клеток эндометрия и тем самым способствовать процессу имплантации.
Заключение
В целом, исчерпывающий анализ литературы указывает на решающую роль половых гормонов в различных популяциях иммунных клеток, создавая сложную сеть взаимодействий между эндокринной и иммунной системами. Раздражение в этом точно регулируемом балансе может привести к неудаче имплантации и нежелательному исходу беременности. Таким образом, дальнейшие исследования иммуномодулирующих функций гормонов, связанных с беременностью, улучшат наше понимание эндокринно-иммунных взаимодействий до и во время беременности и могут помочь в разработке избирательных стратегий лечения бесплодия и осложнений беременности.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Чемберс С.П., Кларк А.Г. Измерение веса тимуса, веса поясничного узла и уровней прогестерона у сингенно беременных, аллогенно беременных и псевдобеременных мышей. J Reprod Fertil (1979) 55 (2): 309–15.DOI: 10.1530 / jrf.0.0550309
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
2. Стюарт Д. Р., Оверстрит Дж. У., Накадзима СТ, Ласли Б.Л. Повышенная секреция стероидов яичниками перед имплантацией на ранних сроках беременности человека. J Clin Endocrinol Metab (1993) 76 (6): 1470–6. DOI: 10.1210 / jcem.76.6.8501152
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
3.Секерес-Барто Дж., Балаш Дж. Прогестагенная терапия при повторном невынашивании беременности. Обновление репродукции человека (2008) 14 (1): 27–35. DOI: 10.1093 / humupd / dmm035
CrossRef Полный текст
4. Norwitz ER, Schust DJ, Fisher SJ. Имплантация и выживание на ранних сроках беременности. N Engl J Med (2001) 345 (19): 1400–8. DOI: 10.1056 / NEJMra000763
CrossRef Полный текст
5.Costea DM, Gunn LK, Hargreaves C, Howell RJ, Chard T. Задержка лютео-плацентарного сдвига выработки прогестерона при беременности ЭКО. Int J Gynaecol Obstet (2000) 68 (2): 123–9. DOI: 10.1016 / S0020-7292 (99) 00177-0
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
9. Ковалик М.К., Рекавецки Р., Котвица Дж. Предполагаемая роль ядерных и мембраносвязанных рецепторов прогестерона в женских половых путях. Reprod Biol (2013) 13 (4): 279–89. DOI: 10.1016 / j.repbio.2013.09.001
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
10. Szekeres-Bartho J, Wilczynski JR, Basta P, Kalinka J. Роль прогестерона и прогестиновой терапии при угрозе прерывания беременности и преждевременных родах. Front Biosci (2008) 13 : 1981–90. DOI: 10.2741 / 2817
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
11.Алок А, Мухопадхьяй Д., Каранде АА. Гликоделин А, иммуномодулирующий белок эндометрия, подавляет пролиферацию и индуцирует апоптоз в моноцитарных клетках. Int J Biochem Cell Biol (2009) 41 (5): 1138–47. DOI: 10.1016 / j.biocel.2008.10.009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
14. Паскуалини-младший. Ферменты, участвующие в образовании и трансформации стероидных гормонов в отделах плода и плаценты. J Стероид Biochem Mol Biol (2005) 97 (5): 401–15. DOI: 10.1016 / j.jsbmb.2005.08.004
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
16. Салем М.Л. Эстроген, палка о двух концах: модуляция Th2- и Th3-опосредованных воспалений путем дифференциальной регуляции выработки цитокинов Th2 / Th3. Curr Drug Targets Inflamm Allergy (2004) 3 (1): 97–104. DOI: 10.2174 / 1568010043483944
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
17.Мао А., Пахаркова-Вачкова В., Харди Дж., Миллер М.М., Ковац С. Эстроген избирательно способствует дифференцировке дендритных клеток с характеристиками клеток Лангерганса. J Immunol (2005) 175 (8): 5146–51. DOI: 10.4049 / jimmunol.175.8.5146
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
19. Браунштейн Г.Д., Расор Дж., Данцер Х., Адлер Д., Уэйд М.Э. Уровни хорионического гонадотропина человека в сыворотке крови на протяжении нормальной беременности. Am J Obstet Gynecol (1976) 126 (6): 678–81.
Pubmed Аннотация | Pubmed Полный текст
20. Handschuh K, Guibourdenche J, Tsatsaris V, Guesnon M, Laurendeau I., Evain-Brion D, et al. Экспрессия хорионического гонадотропина человека в трофобластах человека из ранней плаценты: сравнительное исследование между ворсинчатыми и вневорсинчатыми трофобластическими клетками. Плацента (2007) 28 (2–3): 175–84. DOI: 10.1016 / j.плацента.2006.01.019
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
21. Fluhr H, Bischof-Islami D, Krenzer S, Licht P, Bischof P, Zygmunt M. Хорионический гонадотропин человека стимулирует матриксные металлопротеиназы-2 и -9 в цитотрофобластных клетках и снижает тканевый ингибитор металлопротеиназ-1, -2 и — 3 в децидуализированных стромальных клетках эндометрия. Fertil Steril (2008) 90 (4): 1390–5. DOI: 10.1016 / j.fertnstert.2007.08.023
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
22. Környei JL, Lei ZM, Rao CV. Клетки гладких мышц миометрия человека являются новыми мишенями прямой регуляции хорионического гонадотропина человека. Biol Reprod (1993) 49 (6): 1149–57. DOI: 10.1095 / biolreprod49.6.1149
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
23.Kayisli UA, Selam B, Guzeloglu-Kayisli O, Demir R, Arici A. Хорионический гонадотропин человека способствует материнской иммунотолерантности и апоптозу эндометрия, регулируя лигандную систему Fas-Fas. J Immunol (2003) 171 (5): 2305–13. DOI: 10.4049 / jimmunol.171.5.2305
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
24. Berndt S, Perrier d’Hauterive S, Blacher S, Péqueux C, Lorquet S, Munaut C и др.Ангиогенная активность хорионического гонадотропина человека за счет активации рецептора ЛГ на эндотелиальных и эпителиальных клетках эндометрия. FASEB J (2006) 20 (14): 2630–2. DOI: 10.1096 / fj.06-5885fje
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
25. Zygmunt M, Herr F, Keller-Schoenwetter S, Kunzi-Rapp K, Münstedt K, Rao CV, et al. Характеристика хорионического гонадотропина человека как нового ангиогенного фактора. J Clin Endocrinol Metab (2002) 87 (11): 5290–6. DOI: 10.1210 / jc.2002-020642
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
26. Фудзимото А., Осуга Ю., Фудзивара Т., Яно Т., Цуцуми О., Момоеда М. и др. Хорионический гонадотропин человека в сочетании с прогестероном для лютеиновой поддержки улучшает частоту наступления беременности у пациенток с низким уровнем эстрадиола в позднем и среднем ягодичном цикле в циклах ЭКО. J Assist Reprod Genet (2002) 19 (12): 550–4.DOI: 10.1023 / A: 1021207014429
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
27. Лафуст П., Роберт Б., Мондон Ф., Данан Дж. Л., Росси Б., Дюк-Гойран П. и др. Экспрессия гена альфа-фетопротеина в раннем и доношенном трофобласте человека. Плацента (2002) 23 (8–9): 600–12. DOI: 10.1053 / plac.2002.0816
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
28.Tomasi TB. Структура и функция альфа-фетопротеина. Annu Rev Med (1977) 28 : 453–65. DOI: 10.1146 / annurev.me.28.020177.002321
CrossRef Полный текст
29. Laan-Pütsep K, Wigzell H, Cotran P, Gidlund M. Человеческий альфа-фетопротеин (AFP) вызывает селективную понижающую регуляцию молекул MHC класса II моноцитов без изменения других индуцированных или неиндуцированных маркеров или функций моноцитов в линиях моноцитоидных клеток. Cell Immunol. (1991) 133 (2): 506–18.DOI: 10.1016 / 0008-8749 (91)
-R
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
31. Ван В., Альперт Э. Подавление продукции фактора некроза опухоли-альфа и интерлейкина-1 бета, индуцированного форбол-12-миристат-13-ацетатом, и экспрессии генов в моноцитарных клетках человека альфа-фетопротеином человека. Гепатология (1995) 22 (3): 921–8. DOI: 10.1002 / hep.1840220333
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
32.Эм Ш., Малхолл С., Алиса А., Айвз А.Р., Карани Дж., Уильямс Р. и др. Альфа-фетопротеин нарушает функцию APC и вызывает их апоптоз. J Immunol (2004) 173 (3): 1772–8. DOI: 10.4049 / jimmunol.173.3.1772
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
34. Чжан Ю.М., Рао К.В., Лей З.М. Макрофаги в репродуктивных тканях человека содержат рецепторы лютеинизирующего гормона / хорионического гонадотропина. Am J Reprod Immunol (2003) 49 (2): 93–100.DOI: 10.1034 / j.1600-0897.2003.00013.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
35. Буковский А., Индрапихат К., Фудзивара Х., Чеканова М., Аяла М.Э., Домингес Р. и др. Множественные варианты белка рецептора лютеинизирующего гормона (LHR), межвидовая реактивность клона 3B5 mAb против LHR, субклеточная локализация LHR в плаценте, тазовом дне и головном мозге человека и возможная роль LHR в развитии патологической беременности, нарушений тазового дна и болезни Альцгеймера. болезнь. Репрод Биол Эндокринол (2003) 1 : 46. DOI: 10.1186 / 1477-7827-1-46
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
36. Хант Дж. С., Миллер Л., Платт Дж. С.. Гормональная регуляция макрофагов матки. Dev Immunol (1998) 6 (1-2): 105-10. DOI: 10.1155 / 1998/87527
CrossRef Полный текст
37. Китцмиллер JL, Rocklin RE.Отсутствие подавления продукции MIF лимфоцитов эстрадиолом, прогестероном и хорионическим гонадотропином человека. J Reprod Immunol (1980) 1 (5–6): 297–306. DOI: 10.1016 / 0165-0378 (80)
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
38. Cervar M, Blaschitz A, Dohr G, Desoye G. Паракринная регуляция различных функций трофобластов in vitro плацентарными макрофагами. Cell Tissue Res (1999) 295 (2): 297–305.DOI: 10.1007 / s004410051236
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
40. Гимера М., Моралес-Руис М., Хименес В., Балаш Дж. Стимуляция ЛГ / ХГЧ VEGF и продукции адреномедуллина макрофагами фолликулярной жидкости и лютеинизированными клетками гранулезы. Reprod Biomed Online (2009) 18 (6): 743–9. DOI: 10.1016 / S1472-6483 (10) 60021-1
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
41.Polan ML, Kuo A, Loukides J, Bottomly K. Культивированные лютеиновые периферические моноциты человека секретируют повышенные уровни интерлейкина-1. J Clin Endocrinol Metab (1990) 70 (2): 480–4. DOI: 10.1210 / jcem-70-2-480
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
42. Ким Х.М., Мун Й.Х. Хорионический гонадотропин человека индуцирует мРНК синтазы оксида азота в перитонеальных макрофагах мыши. Biochem Biophys Res Commun (1996) 229 (2): 548–52.DOI: 10.1006 / bbrc.1996.1841
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
43. Sun Y, Cai J, Ma F, Lü P, Huang H, Zhou J. miR-155 опосредует подавляющий эффект прогестерона на TLR3, TLR4-запускаемый иммунный ответ. Immunol Lett (2012) 146 (1–2): 25–30. DOI: 10.1016 / j.imlet.2012.04.007
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
44.Мензис FM, Энрикес Флорида, Александр Дж., Робертс CW. Селективное ингибирование и усиление альтернативной активации макрофагов прогестероном. Иммунология (2011) 134 (3): 281–91. DOI: 10.1111 / j.1365-2567.2011.03488.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
45. Ван Х., Верснел М.А., Чунг В.Й., Линен П.Дж.М., Хан Н.А., Беннер Р. и др. Хорионический гонадотропин может повышать врожденный иммунитет, стимулируя функцию макрофагов. J Leukoc Biol (2007) 82 (4): 926–33. DOI: 10.1189 / jlb.0207092
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
46. Абу Альшамат Э., Аль-Окла С., Соккарие С.Х., Квейдер М. Хорионический гонадотропин человека (ХГЧ) усиливает иммунитет против L. tropica , стимулируя функции макрофагов человека. Parasite Immunol (2012) 34 (10): 449–54. DOI: 10.1111 / j.1365-3024.2012.01368.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
47. Сонода Н., Катабучи Х., Таширо Х., Охба Т., Нишимура Р., Минегиси Т. и др. Экспрессия вариантных рецепторов лютеинизирующего гормона / хорионического гонадотропина и деградация хорионического гонадотропина в хорионических ворсинчатых макрофагах человека. Плацента (2005) 26 (4): 298–307. DOI: 10.1016 / j.placenta.2004.07.001
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
48.Катабучи Х., Охба Т. Хорионические ворсинчатые макрофаги человека как биологический щит плода от хорионического гонадотропина матери. Разница в росте разработчиков (2008) 50 (5): 299–306. DOI: 10.1111 / j.1440-169X.2008.01030.x
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
49. Ямагути М., Охба Т., Таширо Х., Ямада Г., Катабучи Х. Хорионический гонадотропин человека побуждает макрофаги человека образовывать внутрицитоплазматические вакуоли, имитирующие клетки Хофбауэра в ворсинах хориона человека. Клетки Тканевые органы (2013) 197 (2): 127–35. DOI: 10.1159 / 000342806
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
50. Лу CY, Changelian PS, Unanue ER. Альфа-фетопротеин подавляет экспрессию антигенов Ia макрофагами. J Immunol (1984) 132 (4): 1722-7.
Pubmed Аннотация | Pubmed Полный текст
51. Хатта К., Картер А.Л., Чен З., Лено-Дюран Э., Руис-Руис Ч., Оливарес Э.Г. и др.Экспрессия вазоактивных белков AT1, AT2 и ANP индуцированными беременностью естественными клетками-киллерами матки мышей. Reprod Sci (2011) 18 (4): 383–90. DOI: 10.1177 / 1933719110385136
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
52. Ван С., Умесаки Н., Накамура Х., Танака Т., Накатани К., Сакагути И. и др. Экспрессия фактора роста эндотелия сосудов гранулированными клетками метриальной железы в матке беременных мышей. Cell Tissue Res (2000) 300 (2): 285–93. DOI: 10.1007 / s004410000198
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
53. Tayade C, Hilchie D, He H, Fang Y, Moons L, Carmeliet P и др. Генетическая делеция фактора роста плаценты у мышей изменяет NK-клетки матки. J Immunol (2007) 178 (7): 4267–75. DOI: 10.4049 / jimmunol.178.7.4267
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
54.Ашкар А.А., Крой Б.А. Функции естественных клеток-киллеров матки опосредуются продуцированием гамма-интерферона во время беременности мышей. Semin Immunol (2001) 13 (4): 235–41. DOI: 10.1006 / smim.2000.0319
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
55. Borzychowski AM, Chantakru S, Minhas K, Paffaro VA, Yamada AT, He H, et al. Функциональный анализ мышиного ut
Тройной скрининг материнской сыворотки крови при беременности
J.КРИСТОФЕР ГРЕЙВЗ, доктор медицины, и КАРЛ Э. МИЛЛЕР, доктор медицины, Медицинский колледж Университета Теннесси (Мемфис) — Подразделение Чаттануга, Чаттануга, Теннесси
АНЖЕЛА Д. ПРОДАВЦОВ, доктор медицины, Баксли, Джорджия
Am Famician. 1 марта 2002 г .; 65 (5): 915-921.
Раздаточный материал для пациентов
По данным Американского колледжа акушеров и гинекологов, в дородовой уход стало стандартом предлагать скрининговые тесты на дефекты нервной трубки и генетические аномалии.За последние несколько лет в рекомендуемый метод пренатального скрининга были внесены некоторые изменения, и продолжаются исследования по улучшению показателей выявления с помощью более эффективных комбинаций аналитов материнской сыворотки. Перед врачами стоят проблемы, связанные с чувствительностью и специфичностью нескольких комбинаций аналитов сыворотки. В настоящее время в большинстве областей используются аналиты материнской сыворотки: альфа-фетопротеин (АФП), хорионический гонадотропин человека (ХГЧ) и неконъюгированный эстриол. Одно только измерение АФП может выявить подавляющее большинство дефектов нервной трубки и небольшую часть беременностей с трисомией 21 у пациенток любого возраста.Добавление ХГЧ и неконъюгированного эстриола к этому скринингу увеличивает скорость обнаружения трисомий 21 и 18. Консультирование пациентов о рисках и преимуществах такого скрининга важно для обеспечения сбалансированного обсуждения вопросов скрининга.
Пренатальный скрининг — проблема, которая стала более важной в последние несколько лет. Большинство элементов стандартной дородовой помощи относительно просты и легки для понимания и принятия пациентом, но скрининг и диагностическое тестирование хромосомных аномалий остаются запутанными, эмоционально заряженными и сопряженными с неопределенными рисками.Наиболее часто используемым тестом для генетической диагностики является амниоцентез, но частота спонтанной потери плода, связанная с амниоцентезом, составляет в среднем примерно одну из каждых 200 процедур.1 Из-за этого риска анализ аналитов сыворотки стал важным, неинвазивным первым шагом в выявлении пациентов в риск врожденных аномалий. Текущий скрининг аналитов материнской сыворотки помогает выявить женщин с риском дефектов нервной трубки (NTD), трисомии 21 и трисомии 18.
NTD являются одними из наиболее распространенных серьезных пороков развития плода, уступая только сердечным дефектам.2 Частота NTD составляет 1,2 на каждые 1000 родов.1 Эти дефекты включают анэнцефалию, расщелину позвоночника и энцефалоцеле. Расщелина позвоночника занимает третье место среди всех врожденных аномалий в течение жизни.3
Трисомия 21 (синдром Дауна) связана с умственной отсталостью, пороками развития сердца, желудочно-кишечного тракта, глаз и ушей и ранней болезнью Альцгеймера1. пораженный плод — один из 1000 живорожденных. Риск во втором триместре составляет один из 270 у женщин в возрасте от 35 до 40 лет и один из 100 у женщин старше 40 лет.1 Давно признано, что женщинам в возрасте 35 лет и старше на момент родов следует предложить пренатальную диагностику с помощью амниоцентеза или биопсии ворсин хориона.4 Хотя риск трисомии 21 увеличивается с возрастом матери, по оценкам, 75 процентов пораженных плодов рождаются от матерей моложе 35 лет1. Из-за этого риска важно предоставить беременным женщинам моложе 35 лет неинвазивный скрининг на эту трисомию.
Трисомия 18 (синдром Эдвардса) встречается у каждого из 6000 рождений и связана с низкой массой тела при рождении, умственной отсталостью и пороками развития черепа, сердца и почек.5 Большинство младенцев, пораженных этой трисомией, умирают в течение первого года жизни. 6
Скрининговые тесты на аналиты материнской сыворотки
За последнее десятилетие многие аналиты сыворотки были изучены в качестве скрининговых тестов на аномалии плода. В текущем тестировании материнской сыворотки используются три различных аналита для скрининга синдромов трисомии у пациентов с низким риском, включая обнаружение NTD. Тестируемые гормоны представляют собой альфа-фетопротеин (AFP), хорионический гонадотропин человека (ХГЧ) и неконъюгированный эстриол.
АЛЬФА-ФЕТОПРОТЕИН
AFP был впервые признан специфическим для плода глобулином в 1956 году. Он синтезируется в желточном мешке, желудочно-кишечном тракте и печени плода. Уровни в плазме плода достигают пика на 10–13 неделе беременности и постепенно снижаются до срока 7, в то время как уровни у матери достигают пика в третьем триместре 2. Лабораторные измерения уровней АФП представлены как кратные медиане (MOM). Врачам необходимо понимать, как их справочные лаборатории сообщают результаты ОВП.
Существуют различные причины и синдромы, связанные с повышенным или пониженным уровнем AFP (таблицы 1 и 2) .2 Наиболее частой причиной аномального уровня AFP является неточная оценка гестационного возраста. Используя AFP в сочетании с ультрасонографией для подтверждения дат, 21 процент беременностей с трисомией 21 и 5 процентов нормальных беременностей будут выбраны для амниоцентеза.8 AFP лучше при обнаружении NTD, чем ультрасонография, и это единственный маркер на тройном экране, полезный для Обнаружение NTD.Он может выявить 90 процентов анэнцефальных беременностей и 80 процентов случаев расщелины позвоночника.2 Заметно повышенные уровни AFP указывают на то, что покровы плода не повреждены.6 MOM от 2,0 до 2,5 или выше для гестационного возраста показывает повышенный риск NTD и заслуживает дальнейшей оценки с помощью ультразвукового исследования или повторных измерений АФП.2 Если имеется NTD, уровень будет продолжать расти.6
Просмотр / печать таблицы
ТАБЛИЦА 1Причины повышенного уровня альфа-фетопротеина в материнской сыворотке
Гестационный возраст моложе расчетного | ||||||||||||||||||||||||||||||
Расщелина позвоночника | ||||||||||||||||||||||||||||||
Анэнцефалия | ||||||||||||||||||||||||||||||
Врожденные кожные дефекты | ||||||||||||||||||||||||||||||
Желудочно-кишечные дефекты | 90 580||||||||||||||||||||||||||||||
Непроходимость | ||||||||||||||||||||||||||||||
Некроз печени | ||||||||||||||||||||||||||||||
Клоакальная экстрофия | ||||||||||||||||||||||||||||||
5 | ||||||||||||||||||||||||||||||
Непроходимость мочевыводящих путей | ||||||||||||||||||||||||||||||
Поликистоз почки | ||||||||||||||||||||||||||||||
Отсутствие почки | ||||||||||||||||||||||||||||||
Низкий вес при рождении | ||||||||||||||||||||||||||||||
Олигогидрамнион | ||||||||||||||||||||||||||||||
Многоплодная беременность | ||||||||||||||||||||||||||||||
Уменьшение веса матери 5 905 ABLE 1 | ||||||||||||||||||||||||||||||
Гестационный возраст моложе расчетного | |||
Spina bifida | |||
Пилонидальные кисты | |||
Дефекты брюшной стенки | |||
Желудочно-кишечные дефекты | |||
| 9057 | Экстрофия клоаки | ||
Кистозная гигрома | |||
Крестцово-копчиковая тератома | |||
Почечные аномалии 09 | |||
Поликистозная почка | |||
Отсутствие почки | |||
Врожденный нефроз | |||
Олигогидрамнион | |||
Преобразование альфа-фетопротеина (AFP) в мкг / л, нг / л, нг / дл, нг / 100 мл, нг%, нг / мл, МЕ / мл.Онлайн-конвертер условных единиц в единицы СИ
Альфа1-фетопротеин, альбуминоподобный гликопротеин с молекулярной массой 70000 дальтон, образуется в желточном мешке, недифференцированных клетках печени и желудочно-кишечном тракте плода. 70‑95% пациентов с первичной гепатоцеллюлярной карциномой имеют повышенные значения АФП.
Чем позже стадия несеминоматозных опухолей половых клеток, тем выше значения AFP. Хорионический гонадотропин человека (ХГЧ) и АФП являются важными параметрами для оценки выживаемости пациентов с запущенными, несеминоматозными опухолями половых клеток.
Никакой корреляции между концентрацией AFP и размером опухоли, ростом опухоли, стадией или степенью злокачественности пока не продемонстрировано. Сильно повышенные значения АФП обычно указывают на первичную клеточную карциному печени. При метастазах в печень значения АФП обычно ниже 350-400 МЕ / мл. Поскольку значения AFP повышаются во время регенерации печени, умеренно повышенные значения обнаруживаются при алкогольном циррозе печени и остром вирусном гепатите, а также у носителей HBsAg. Однако определение AFP для скрининга населения на рак не рекомендуется.Повышенные концентрации АФП в материнской сыворотке или амниотической жидкости во время беременности могут указывать на расщелину позвоночника, анэнцефалию, атрезию пищевода или многоплодную беременность.
Измерение AFP вносит вклад в оценку риска трисомии 21 (синдром Дауна) во втором триместре беременности вместе с ХГЧ + β и другими параметрами, такими как точный срок беременности и вес матери. При трисомии 21 беременности концентрация АФП в сыворотке крови матери снижена, тогда как концентрация ХГЧ + β в сыворотке крови матери примерно вдвое выше нормальной медианы.Риск трисомии 21 при беременности во втором триместре может быть рассчитан с помощью подходящего программного обеспечения (см. Раздел «Необходимые, но не предоставленные материалы») с использованием алгоритма, описанного Уолдом 13, и соответствующих параметров анализа.
Симптомы, гормоны и развитие ребенка
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы покупаете по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
На 20 неделе беременности вы и ваш ребенок будете расти.
Во время ультразвукового исследования вы можете узнать, мальчик у вас или девочка. Вы также можете рассмотреть вопрос о генетическом тестировании для выявления возможных аномалий.
Эта статья является частью серии статей о беременности. Взгляните на другие статьи этой серии:
Первый триместр: оплодотворение, имплантация, неделя 5, неделя 6, неделя 7, неделя 8, неделя 9, неделя 10, неделя 11, неделя 12.
Вторая триместр: неделя 13, неделя 14, неделя 15, неделя 16, неделя 17, неделя 18, неделя 19.
С этого момента ваша шишка будет увеличиваться примерно на полдюйма каждую неделю.
Вы можете заметить следующие симптомы:
- ногти, которые растут быстрее и могут быть сильнее, хотя некоторые женщины считают, что они более ломкие
- более густая голова и, возможно, больше волос на вашем теле
- продолжающееся несварение и изжога
- продолжающиеся головные боли, особенно при нахождении в жарких и душных помещениях
- обморок и головокружение, особенно в теплой среде
- судороги ног
- опухшие ступни и лодыжки из-за задержки воды
Ваш пупок может выступать сейчас и до конца беременности.
Гормональные колебания приводят к изменениям груди на протяжении всей беременности.
Во втором триместре грудь будет менее чувствительной, но она будет расти по мере роста молочных желез и увеличения жировых отложений.
Кожа на сосках и вокруг них может потемнеть.
Маленькие шишки или белые пятна также могут возникать вокруг сосков. Это железы Монтгомери. Они производят маслянистую субстанцию, которая не дает соскам высыхать.
Из сосков может протекать молозиво, желтоватая жидкость.Это первое появление «молока», которое ваш ребенок будет есть после рождения. Он будет содержать высокую концентрацию необходимых питательных веществ и антител.
Ваш ребенок теперь размером с дыню, размером примерно 6-6,5 дюймов от макушки до крупа и весит почти 10 унций.
К изменениям, которые происходят примерно на 20 неделе беременности, относятся следующие:
- Мозг быстро растет.
- Хрящ превращается в кость, скелет затвердевает, костный мозг начинает производить клетки крови.
- Брови формируются.
- Формируются матка и яичники, развиваются яйца или опускаются яички.
- Руки и ноги пропорциональны телу.
- К концу 19–21 недели ребенок сможет глотать.
Мать может чувствовать, как ребенок двигается, и ребенок слышит звуки.
На этом этапе сканирование может показать, мальчик у вас или девочка.
Амниоцентез также может выявить пол ребенка, но врач предложит эту процедуру только в том случае, если плод сталкивается с высоким риском развития заболевания.Процедура представляет небольшой риск для ребенка.
Поговорите со своим лечащим врачом, чтобы определить, подходят ли вам генетическое тестирование и другие формы пренатального скрининга, особенно если в семейном анамнезе имеется генетическое заболевание.
Врач может диагностировать ряд заболеваний еще до рождения, в том числе:
Обследования на серповидноклеточную анемию и талассемию можно проводить с 10 недели.
Обследования включают:
- УЗИ
- Тест на альфа-фетопротеин (AFP )
- Взятие пробы ворсин хориона (CVS)
- амниоцентез
- чрескожный забор пуповинной крови
Некоторые тесты более надежны, чем другие.
Ранняя диагностика врожденной болезни может помочь в подготовке к родам и учесть любые особые медицинские потребности.
В некоторых случаях это может позволить врачам назначить лечение до родов, например, у плодов с расщелиной позвоночника.
По мере роста шишки вы можете начать чувствовать себя неуклюже, чем обычно. Следите за осанкой, чтобы избежать боли в спине.
По мере того, как ваша одежда стягивается, вам, возможно, придется подумать о том, чтобы приобрести новую одежду для беременных. В Интернете или в магазинах можно приобрести одежду для беременных.
Доступны поддерживающие бюстгальтеры для беременных, их также можно использовать в качестве бюстгальтеров для кормления грудью после родов. Их также можно приобрести в Интернете.
Другие проблемы
Если у вас есть вопросы относительно беременности, обязательно обратитесь к своему врачу.
Позвоните своему врачу, если вы испытываете следующие симптомы:
- вагинальное кровотечение или отхождение тканей
- утечка вагинальной жидкости
- слабость или головокружение
- низкое кровяное давление
- ректальное давление
- боль в плече
- сильная тазовая боль боль или спазмы
Женщины имеют более высокий риск инфицирования мочевыводящих путей во время беременности.Если вы подозреваете инфекцию, поговорите с врачом о лечении.
Альфа-фетопротеин Информация | Гора Синай
Выберите Failure SpecialtyAddiction MedicineAddiction PsychiatryAdolescent MedicineAdvanced сердца и TransplantAllergy и ImmunologyAlzheimer в DiseaseAnatomic Патология и клиническая PathologyAnesthesiologyBariatric SurgeryBlood Banking / Переливание MedicineBody ImagingBreast Рак — грудиПластика ImagingCancer (онкология) CardiologyCardiovascular компьютерной TomographyCardiovascular DiseaseCardiovascular SurgeryCerebrovascular Болезни / StrokeChild NeurologyChild и подростковая PsychiatryColon и ректальной хирургии / ProctologyCornea, Внешние болезни и Рефракционная хирургияМедицина критических состоянийКлиническая медицина — АнестезиологияСтоматологическая онкологияСтоматологияДерматологияДерматопатология — ДерматологияУхо, нос, горло / ОтоларингологияЭхокардиографияЭлектродиагностическая медицинаЭкологическая медицинаЭндокринная медицина, диабет и болезни костейГенеривологическая медицинаГенотерапевтическая медицина necologic OncologyHand SurgeryHead & шеи SurgeryHeadache MedicineHematology-OncologyHospital MedicineInfectious DiseaseInternal MedicineInterventional CardiologyInterventional NeuroradiologyInterventional RadiologyIntestinal TransplantationKidney / Поджелудочная TransplantationLiver MedicineLiver SurgeryLiver TransplantationMaternal и фетальный MedicineMetabolism / DiabetesNephrologyNeuro-OphthalmologyNeurocritical CareNeurologyNeuropsychologyNeuroradiologyNeurosurgeryNewborn MedicineNuclear CardiologyNuclear MedicineObesity MedicineObstetrics и GynecologyOccupational MedicineOcular OncologyOphthalmic PathologyOphthalmic Пластиковые SurgeryOphthalmologyOptometryOral / челюстно SurgeryOrthopedics & Ортопедические SurgeryPain ManagementPediatric & Подростков Гинекология, Детская аллергия и иммунология врачебный GastroenterologyPediatric Гематология-OncologyPediatric HepatologyPediatric Инфекционного DiseasesPediatric нефрология и HypertensionPediatric NeurologyPediatric NeurosurgeryPediatric OphthalmologyPediatric PulmonologyPediatric RadiologyPediatric RheumatologyPediatric Спорт MedicinePediatric SurgeryPediatric UrologyPediatricsPlastic и реконструктивная SurgeryPodiatryPrimary CarePsychiatryPsychologyPublic здоровье и общий Профилактический MedicinePulmonary MedicineRadiation OncologyRadiologyRehabilitation и физической MedicineReproductive EndocrinologyRetina — Medical & SurgicalRheumatologyShoulder & Elbow SurgerySleep MedicineSpinal шнур Травма MedicineSpine SurgerySports медицина ( Реабилитация) КосоглазиеХирургияХирургическая реанимацияХирургическая онкологияТоракальная хирургияТрансплантацияУрогинекологияУрологияУвеитСосудистая хирургия
.


 Назначается прием витаминов, лекарственных средств улучшающих кроваток.
Назначается прием витаминов, лекарственных средств улучшающих кроваток.
