Зачем нужен анализ мутаций в генах BRCA
Зачем нужен анализ мутаций в генах BRCA
Известно, что 5-10% случаев рака молочной железы и 10% случаев рака яичников являются наследственными и обусловлены мутациями в определенных генах. Мутации, наиболее тесно связанные с возникновением рака молочной железы и яичников, обнаружены в генах BRCA1 и BRCA2 (производное от полного названия на английском BReast CAncer Suspectibility Gene) . Женщины, являющиеся носителями мутаций в генах предрасположенности к раку молочной железы и яичников, попадают в группу высокого риска развития заболевания. Своевременное обнаружение мутаций в этих генах позволяет женщине и ее близким принять необходимые профилактические меры.
Ген BRCA1 (Gen breast cancer 1, в переводе с английского ген рака молочной железы 1) расположен на длинном плече 17-ой хромосомы (17q21.
У носительниц мутаций в гене BRCA1 риск рака молочной железы составляет 50-85%, рака яичников — 15-45%. Кроме того, мутации в этом гене ассоциированы с повышенным риском развития некоторых форм рака желудочно-кишечного тракта (рак поджелудочной железы) и других форм злокачественных образований. Одной из наиболее частых мутаций в гене BRCA1 среди жителей России является инсерция цитозина (5382insC), приводящая к сдвигу рамки считывания и образованию укороченного белка BRCA1, который не может выполнять полноценно свою функцию.
Заподозрить семейную ф
Анализ мутаций в генах BRCA1 и BRCA2. Анализ на рак груди и яичников
Метод исследования: Определение нуклеотидной последовательности соответствующих генетических локусов методом пиросеквенирования с использованием реагентов и оборудования фирмы Qiagen (Германия).
Рак молочной железы (РМЖ) — самое частое онкологическое заболевание, диагностируемое среди женщин. Рак яичников (РЯ) — основная причина смертельных исходов онкогинекологии вследствие бессимптомного течения заболевания на ранних стадиях (до 80% случаев РЯ обнаруживается на III-IV стадии болезни, когда эффективность лечения крайне низка).
Одним из эффективных подходов, способствующих раннему выявлению РМЖ и РЯ, является молекулярно-генетическое определение их наследственных форм. Данное исследование позволяет подтвердить наличие наследственной предрасположенности к раку и сформировать группы повышенного риска развития РМЖ и РЯ для патогенетически обоснованной профилактики рака и/или ранней диагностики рака на начальном этапе развития. Это позволяет существенно снизить заболеваемость и улучшить результаты своевременно предпринятого лечения.
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Семейный анамнез (заболевание было выявлено у ближайших родственников).

- Заболевание в раннем (до 40 лет) возрасте.
- Атипичные или множественные формы опухоли в одном органе.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Результат исследования: если мутация не обнаружена, в графе «Результат» вносят «Не обнаружено», в случае детекции мутации – «Обнаружено».
Пример результата исследования. Наследственный рак молочной железы и яичников.
| Параметр | Результат |
|---|---|
| Мутация в гене BRCA1 185delAG | Не обнаружено |
| Мутация в гене BRCA1 300T>G (C61G) | Не обнаружено |
| Мутация в гене BRCA1 2080delA | Не обнаружено |
| Мутация в гене BRCA1 4153delA | Не обнаружено |
| Мутация в гене BRCA1 5382insC | Не обнаружено |
| Мутация в гене BRCA2 6174delT | Не обнаружено |
Комментарий к генетическому исследованию: Мутация — изменение последовательности ДНК, которое нарушает закодированную в ней информацию. Обнаружение данной мутации — патологический признак, имеющий свое клиническое значение. Для интерпретации результатов исследования необходима консультация врача-специалиста. Обнаружение данной мутации — патологический признак, имеющий свое клиническое значение. Для интерпретации результатов исследования необходима консультация врача-специалиста.
|
|
Информационное приложение к результату.
Внимание!
- При необходимости по результатам исследований оформляется заключение врачом-генетиком (код услуги 181011).
- Заключение врача-генетика проводится только для услуг, выполняемых в лаборатории CMD.
- Врач-генетик описывает результат в течение 10 календарных дней после готовности генетического исследования
- Заключение врача-генетика включает объяснение значения выявленного генотипа, возможные патогенетические механизмы, связанные с развитием тех или иных состояний, индивидуальные риски развития патологических состояний и рекомендации по предотвращению, диагностике и возможным подходам ведения пациента (по согласованию с лечащим врачом).

Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Расчёт риска развития рака груди онлайн по модели Гейла (Gail Model 2)
Калькулятор основан на статистической модели Гейла, подходит для женщин:
- в возрасте от 35 до 85 лет,
- европеоидной расы,
- без диагностированного рака молочной железы,
- без мутаций генов BRCA1 и BRCA2,
- без диагностированной протоковой карциномы in situ (DCIS) и лобулярной карциномы in situ (LCIS),
- не проходивших лучевую терапию для лечения лимфомы Ходжкина.
Калькулятор сломался! Мы уже разбираемся в проблеме.
— среднее значение для белых женщин в возрасте
Значение больше 1.7% означает повышенный риск развития рака груди по версии National Comprehensive Cancer Network. Проконсультируйтесь с вашим врачом.
в течение жизниЗначение больше 20% означает повышенный риск развития рака груди по версии National Comprehensive Cancer Network. Проконсультируйтесь с вашим врачом.
Проконсультируйтесь с вашим врачом.
Помимо модели Гейла существует как минимум четыре модели, принятые международным онкологическим сообществом. В центре мы рассчитываем риск по самой точной модели Тайрер-Кузик. Модель сложная, поэтому расчёт должен проводить специалист.
Для специалистов
Гайдлайны NCCN от 17 мая 2019 г. по скринингу и диагностике рака груди на первом этапе рекомендуют проводить тестирование по модели Гейла. Если 5-летний риск превышает 1.7% или пожизненный риск превышает 20% — для таких пациентов разработан отдельный алгоритм.
Если 5-летний риск превышает 1.7% или пожизненный риск превышает 20% — для таких пациентов разработан отдельный алгоритм.
Тестирование по модели Тайрера-Кузика или аналогичной рекомендуется применять для пациентов с фамильной историей рака.
Рекомендации Российского общества онкомаммологов:
Кратко о модели Гейла
Доктор Митчелл Гейл разработал модель расчёта риска развития рака молочной железы в 1989 году. Для построения модели он использовал данные 16 692 человек, собранные в 1973 — 1980 годах в рамках исследования Breast Cancer Detection Demonstration Project Follow-up Study.
Доктор Митчелл Гейл
В дальнейшем модель доработали математики и статистики. Именно доработанная версия лежит в основе калькулятора.
Именно доработанная версия лежит в основе калькулятора.
В 1999 году оригинальная и доработанная модели были проверены на данных исследования Breast Cancer Prevention Trial. В исследовании приняло участие 5969 женщин в возрасте от 35 лет.
Научные источники
- Projecting individualized probabilities of developing breast cancer for white females who are being examined annually, M H Gail, L A Brinton, D P Byar, D K Corle, S B Green, C Schairer, J J Mulvihill, doi: 10.1093/jnci/81.24.1879.
- Validation studies for models projecting the risk of invasive and total breast cancer incidence, J P Costantino, M H Gail, D Pee, S Anderson, C K Redmond, J Benichou, H S Wieand, doi: 10.1093/jnci/91.18.1541.
- Breast cancer risk assessment across the risk continuum: genetic and nongenetic risk factors contributing to differential model performance, Anne S Quante, Alice S Whittemore, Tom Shriver, Konstantin Strauch, Mary B Terry, doi: 10.
 1186/bcr3352.
1186/bcr3352. - Evaluation of breast cancer risk assessment packages in the family history evaluation and screening programme, E Amir, D G Evans, A Shenton, F Lalloo, A Moran, C Boggis, M Wilson, A Howell, doi: 10.1136/jmg.40.11.807.
- Validation of the Gail et al. model of breast cancer risk prediction and implications for chemoprevention, B Rockhill, D Spiegelman, C Byrne, D J Hunter, G A Colditz, doi: 10.1093/jnci/93.5.358.
Онкомаркер молочной железы: какие сдавать, расшифровка, норма
Рак – бич общества 21 века. Медицина не стоит на месте, ежегодно находятся и разрабатываются новые лекарства и методики лечения от различных болезней. Препарат, безвозвратно останавливающий рост опухоли, гарантирующий полное излечение, не придумали. Над созданием лекарства или вакцины от рака бьются учёные многих стран мира. Стадию исследования проходит американское лекарство, снижающее генетические мутации, отвечающие за появление патологического процесса в организме людей.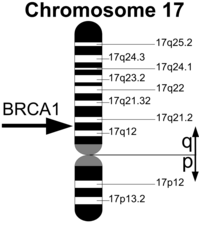
Статистика
Исследования ВОЗ говорят о ежегодном пополнении рядов онкобольных с разновидностью рака груди на 1,5 миллиона человек в мире. Примерно 400 тысяч заканчиваются летальным исходом. Россия занимает восьмую строчку рейтинга печально известного заболевания, ежегодно добавляя 54 тысячи больных раком молочных желёз.
По прогнозам в ближайшее время каждая восьмая женщина окажется вынуждена пройти курс лечения от патологий груди, среди мужчин только 1 из 800. Нередки случаи выявления рака молочных желёз в молодом возрасте 20 – 39 лет (благоприятный детородный возраст). Эти женщины могли бы родить и воспитать миллионы детей.
Выделяются колоссальные бюджеты для поиска медицинского средства, на профилактику населения от рака, чтобы раньше диагностировать это заболевание. Своевременно проходя диспансеризацию (в России проводится раз в четыре года), после 35-летия ежегодно посещая гинеколога, маммолога, женщина способна избежать рака, установить его наличие в самом начале, при вероятности полного излечения.
Среди разновидностей онкологии в первых рядах у женского населения земного шара стоит рак груди. На болезнь приходится максимальное количество смертей среди людей с онкологией. Риску подвержены женщины пожилого возраста, за 65-66 лет. Настораживает, что в развитых странах рак груди не уменьшается, а, наоборот, постоянно растёт. Количество молодых пациентов также увеличивается. Рак груди молодеет – масса заболевших среди женщин моложе 55 (45, 50), есть 35 летние.
Излечим ли рак груди
Как остальные разновидности злокачественной опухоли, онкология груди разделяется на пять стадий. Соответственно, чем выше стадия, тем хуже прогнозы. Полное излечение зависит от времени обнаружения, здоровья, возраста пациента, наличия, вида метастазирования (одиночное, множественное), подверженности лечению метастатических органов, поражённости лимфатической и кровеносной систем.
При ранней диагностике, правильно подобранном лечении остаётся возможность продлить жизнь больного от пяти лет и выше. Отсутствие своевременного лечения, помощи медицинских сотрудников гарантирует продолжительность не более 3-5 лет всего 15% от числа заболевших. В процентном соотношении дольше пяти лет после перенесенных операций проживут более 90%, порядка десяти – 80%, пятнадцати – 75%.
Отсутствие своевременного лечения, помощи медицинских сотрудников гарантирует продолжительность не более 3-5 лет всего 15% от числа заболевших. В процентном соотношении дольше пяти лет после перенесенных операций проживут более 90%, порядка десяти – 80%, пятнадцати – 75%.
В зависимости от стадий, прогнозы выглядят подобным образом:
- 1-ая, когда очаг поражения небольшой, выживают до 95%;
- 2-ая, очаг единственный, увеличен в два раза – 80%;
- 3-я и 4-я, резкий рост опухоли; множественные метастазы соседних, дальних органов; поражение лимфатических узлов – соответственно 30 и 10%.
Причины, приводящие к развитию рака молочной железы
Ежегодное ухудшение экологической составляющей, совместно с употреблением нездоровой пищи с высоким содержанием канцерогенов (эмульгаторы, стимуляторы, заменители, красители) плюс генетическая предрасположенность пополняет ряды женщин, заболевших раком. Злокачественная опухоль молочной железы специально не выбирает жертву, но вычислены причины, увеличивающие шансы в разы:
- Сознательный отказ от беременности, родов (предохранение, прерывание), бесплодие.

- Злоупотребление сигаретами с пубертатного периода.
- Раннее половое созревание (до 12 лет).
- Позднее угасание репродуктивной функции (после 55 лет).
- Раковая генетика (онкология у близких кровных родственников влечёт предрасположенность).
- Развитие в анамнезе опухолей женской половой системы (как доброкачественных, так и злокачественных).
- Сильная полнота и склонность к ожирению (повышенный ве
| A27.30.138 | Молекулярно-генетическое исследование микроделеций в в гене AZF | НИИ Урологии | Кровь | 14 | 3 700,00 ₽ | |||
| A27.05.036.001 | Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) | НИИ Урологии | Кровь | 7 | 3 800,00 ₽ | |||
| A27.30.107 | Молекулярно-генетическое исследование Анализ длины CAG-повтора в гене AR | НИИ Урологии | Кровь | 7 | 4 200,00 ₽ | |||
A27.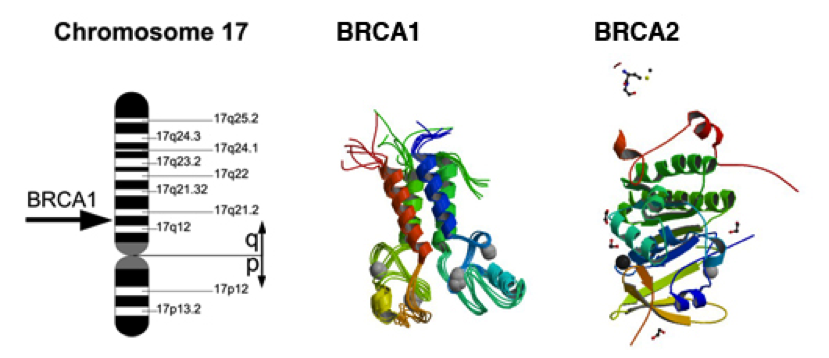 05.053.001 05.053.001 | Молекулярно-генетическое исследование мутаций в гене VHL | НИИ Урологии | Кровь | 14 | 6 500,00 ₽ | |||
| A27.05.052.001 | Молекулярно-генетическое исследование мутаций в гене RET | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 14 | 8 800,00 ₽ | |
| A27.05.040.001 | 29023 | Молекулярно-генетическое исследование мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 7 | 6 000,00 ₽ |
| A27.05.046.001 | Молекулярно-генетическое исследование мутаций в гене CHEK2 | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 7 | 4 500,00 ₽ | |
| A27.30.015.001 | Определение полиморфизма гена UGT1A1 | НИИ Урологии | Кровь | 14 | 4 400,00 ₽ | |||
A27. 30.108 30.108 | Молекулярно-генетическое исследование мутаций в гене DPYD | НИИ Урологии | Кровь | 7 | 5 900,00 ₽ | |||
| A27.30.109 | Анализ полиморфизма гена TPMT | НИИ Урологии | Кровь | 7 | 5 800,00 ₽ | |||
| A27.30.016.001 | 29013 | Молекулярно-генетическое исследование мутаций в гене EGFR | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 8 500,00 ₽ | |
| A27.30.110 | Молекулярно-генетическое исследование мутаций в генах KRAS, NRAS и BRAF при колоректальном раке | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 12 700,00 ₽ | ||
| A27.30.006.001 | Молекулярно-генетическое исследование мутаций в гене KRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 7 000,00 ₽ | ||
A27. 30.007.001 30.007.001 | Молекулярно-генетическое исследование мутаций в гене NRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 8 000,00 ₽ | ||
| A27.30.009 | 29012 | Молекулярно-генетическое исследование мутации V600 BRAF | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 5 050,00 ₽ | |
| A27.30.008.001 | Молекулярно-генетическое исследование мутаций в гене BRAF | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 6 100,00 ₽ | ||
| A27.30.111 | Молекулярно-генетическое исследование мутаций в гене PIK3CA | НИИ Урологии | МРНЦ | Блоки (срезы) | 21 | 7 000,00 ₽ | ||
| A27.30.112 | 29015 | Определение микросателлитной нестабильности (MSI) | НИИ Урологии | МРНЦ | Блоки (срезы) + кровь | 12 | 6 800,00 ₽ | |
A27.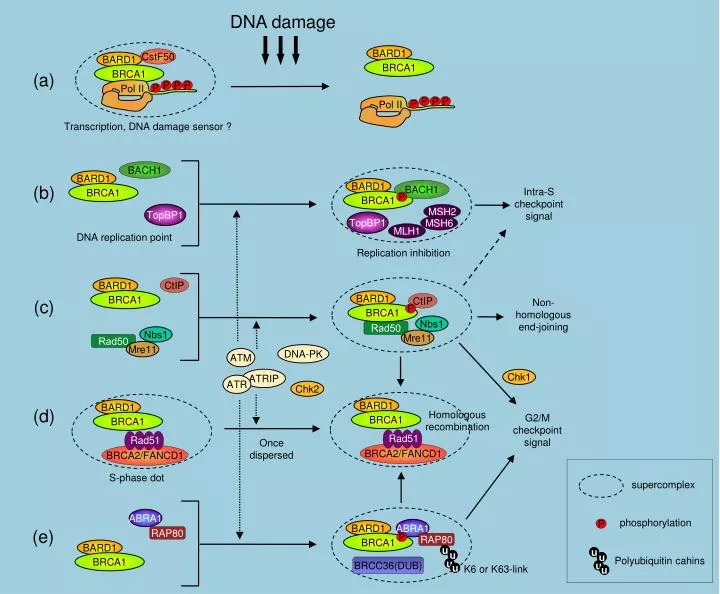 30.112.001 30.112.001 | Определение микросателлитной нестабильности (MSI) по 9 маркерам | НИИ Урологии | Блоки (срезы) + кровь | 14 | 13 500,00 ₽ | |||
| A27.30.113 | Молекулярно-генетическое исследование мутаций в гене TERT | НИИ Урологии | Блоки (срезы) | Моча | 7 | 6 500,00 ₽ | ||
| A27.30.114 | Молекулярно-генетическое исследование мутаций в гене FGFR3 | НИИ Урологии | Блоки (срезы) | Моча | 7 | 8 100,00 ₽ | ||
| A09.28.087 | Исследование уровня антигена рака простаты 3 (PCA3) в моче | НИИ Урологии | Моча | Блоки (срезы) | 14 | 7 400,00 ₽ | ||
| A27.05.048.001 | Молекулярно-генетическое исследование мутаций в гене TP53 | НИИ Урологии | Блоки (срезы) | 14 | 9 100,00 ₽ | |||
A27.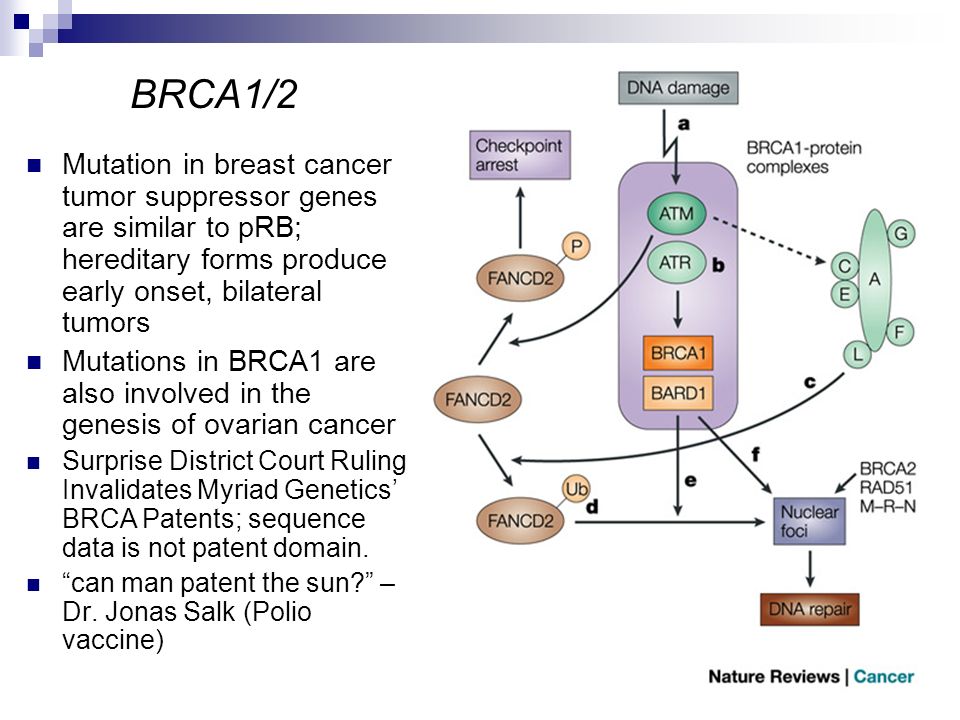 30.115 30.115 | Молекулярно-генетическое исследование мутаций в гене GNAS | НИИ Урологии | Блоки (срезы) | 7 | 5 000,00 ₽ | |||
| A27.30.012.001 | Молекулярно-генетическое исследование мутаций в гене c-KIT | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 7 800,00 ₽ | ||
| A27.30.116 | 29016 | Молекулярно-генетическое исследование мутаций в генах KIT и PDGFRA | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 10 600,00 ₽ | |
| A27.30.117 | Молекулярно-генетическое исследование мутаций в гене ERBB2 | НИИ Урологии | Блоки (срезы) | 7 | 5 000,00 ₽ | |||
| A27.30.118 | Молекулярно-генетическое исследование мутаций в гене HRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 14 | 7 050,00 ₽ | ||
A27. 30.085.001 30.085.001 | Молекулярно-генетическое исследование мутаций в гене CTNNB1 методом секвенирования | НИИ Урологии | Блоки (срезы) | 14 | 4 800,00 ₽ | |||
| A27.30.119 | Молекулярно-генетическое исследование мутаций в гене h4F3A методом секвенирования | НИИ Урологии | Блоки (срезы) | 14 | 4 800,00 ₽ | |||
| A27.30.051.001 | Молекулярно-генетическое исследование мутаций в гене IDh2 | НИИ Урологии | Блоки (срезы) | 14 | 5 000,00 ₽ | |||
| A27.30.120 | Молекулярно-генетическое исследование мутаций в гене WT1 при Синдроме Дениса-Драша | НИИ Урологии | Кровь | 14 | 7 700,00 ₽ | |||
| A27.30.121 | Молекулярно-генетическое исследование мутаций в гене WT1 при Синдроме Фразера | НИИ Урологии | Кровь | 7 | 4 400,00 ₽ | |||
A27. 30.122 30.122 | Молекулярно-генетическое исследование мутаций в гене PTPN11 при Синдроме Нунан | НИИ Урологии | Кровь | 14 | 7 000,00 ₽ | |||
| A27.30.123 | Молекулярно-генетическое исследование мутаций в гене TTR при наследственном амилоидозе | НИИ Урологии | Кровь | 14 | 6 500,00 ₽ | |||
| A27.30.124 | Молекулярно-генетическое исследование мутаций в генах F2, F5 (Предрасположенность к тромбофилии) | НИИ Урологии | Кровь | 7 | 3 300,00 ₽ | |||
| A27.30.125 | Молекулярно-генетическое исследование мутаций в гене FH методом секвенирования | НИИ Урологии | Кровь | 21 | 13 400,00 ₽ | |||
| A27.30.126 | Молекулярно-генетическое исследование мутаций в гене FLCN при Синдроме Берта-Хогга-Дьюба | НИИ Урологии | Кровь | 21 | 13 400,00 ₽ | |||
A27. 30.127 30.127 | Молекулярно-генетическое исследование мутаций в гене MET при наследственной папиллярной карциноме 1-го типа | НИИ Урологии | Кровь | 21 | 10 000,00 ₽ | |||
| A27.30.128 | Молекулярно-генетическое исследование мутаций в гене SMARCB1 при Синдроме рабдоидных опухолей | НИИ Урологии | Кровь | 14 | 13 300,00 ₽ | |||
| A27.30.129 | Молекулярно-генетическое исследование мутаций в гене AGXT при наследственной гипероксалурии I типа | НИИ Урологии | Кровь | 21 | 14 700,00 ₽ | |||
| A27.30.130 | Молекулярно-генетическое исследование аллельного дисбаланса по STR-маркерам при дифференциальной диагностике между хромофобной карциномой и онкоцитомой почки | НИИ Урологии | Блоки (срезы) + кровь | 14 | 22 000,00 ₽ | |||
A27. 05.012 05.012 | Молекулярно-генетическое исследование мутации в гене V617F (замена 617-ой аминокислоты с валина на фенилаланин) JAK2 (янус тирозин-киназа второго типа) в крови | МРНЦ | Кровь | 14 | 3 150,00 ₽ | |||
| A27.05.021 | Молекулярно-генетическое исследование маркеров Ph-негативных миелопролиферативных заболеваний (мутации в генах Jak2, MPL и CALR) | МРНЦ | Кровь | 7 | 5 500,00 ₽ | |||
| А27.05.021.001 | Молекулярно-генетическое исследование мутаций в гене кальретикулина (CALR) | МРНЦ | Кровь | 7 | 3 700,00 ₽ | |||
| А27.05.021.002 | Молекулярно-генетическое исследование мутаций в гене рецептора тромбопоэтина (MPL-1) | МРНЦ | Кровь | 7 | 3 700,00 ₽ | |||
| А27.05.041.001 | Типирование генов гистосовместимости человека (HLA) II класса методом амплификации ДНК | МРНЦ | Кровь | 7 | 4 950,00 ₽ | |||
А27.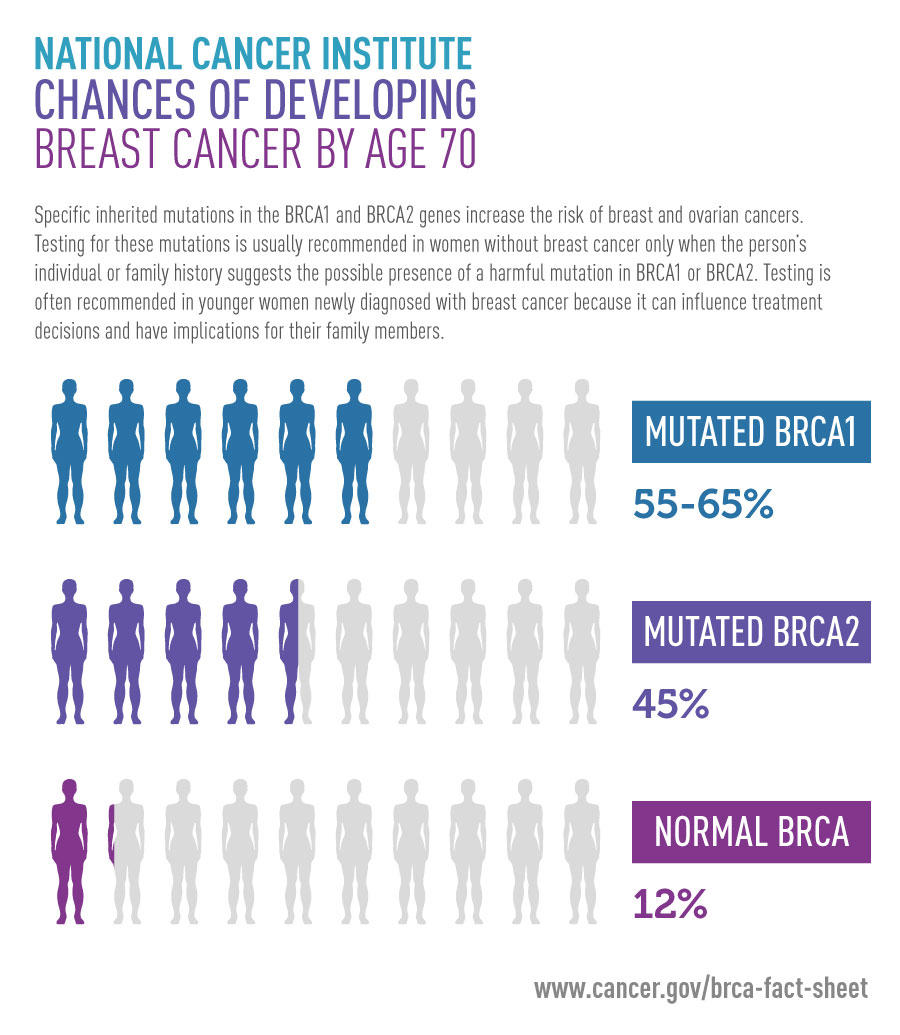 30.069.001 30.069.001 | Определение экспрессии мРНК BCR-ABLp210 | МРНЦ | Кровь | 10 | 3 900,00 ₽ | |||
| А26.05.011 | Молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein — Barr virus) | МРНЦ | Кровь | 5 | 560,00 ₽ | |||
| A27.30.131 | Комплексная Мужкая ПЦР диагностика ИППП (хламидия, микоплазма(Mycoplasma hominis), микоплазма(Mycoplasma genitalium), уреаплазма (Ureaplasma species), гонорея, вирус простого герпеса 1 и 2 типа, цитомегаловирус, трихомонада, возбудитель кандидоза, гарднерелла (Gardnerella vaginalis)) — соскобы | НИИ Урологии | Соскоб | 5 | 3 000,00 ₽ | |||
| A27.30.132 | Комплексная Женская ПЦР диагностика ИППП (хламидия, микоплазма(Mycoplasma hominis), микоплазма(Mycoplasma genitalium), уреаплазма (Ureaplasma species), гонорея, вирус простого герпеса 1 и 2 типа, цитомегаловирус, трихомонада, возбудитель кандидоза, вирус папилломы человека ВКР, гарднерелла (Gardnerella vaginalis)) — соскобы | НИИ Урологии | Соскоб | 5 | 3 500,00 ₽ | |||
A26. 01.024.001 01.024.001 | Определение ДНК вируса простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в везикулярной жидкости, соскобах с высыпаний методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 400,00 ₽ | ||
| A26.01.024.002 | Определение ДНК вируса простого герпеса 6 типа (Herpes simplex virus type 6) в везикулярной жидкости, соскобах с высыпаний методом ПЦР | НИИ Урологии | Соскоб | 5 | 470,00 ₽ | |||
| A26.08.058.001 | 28211 | Определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 610,00 ₽ | |
| A26.20.009.004 | Определение ДНК и типа вируса папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР | НИИ Урологии | Соскоб | 5 | 790,00 ₽ | |||
A26. 20.009.010 20.009.010 | 28211 | Определение ДНК вирусов папилломы человека (Papilloma virus) 16 и 18 типов методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.08.066.002 | 28211 | Определение ДНК хламидии трахоматис (Chlamydia trachomatis) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.028.001 | 28211 | Определение ДНК микоплазмы хоминис (Mycoplasma hominis) в отделяемом слизистых оболочек женских половых органов методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.027.003 | 28211 | Определение ДНК микоплазмы гениталиум (Mycoplasma genitalium) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.029.003 | 28211 | Определение ДНК уреаплазм (Ureaplasma spp. ) методом ПЦР, качественное исследование ) методом ПЦР, качественное исследование | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
| A26.21.023.002 | 28211 | Определение ДНК уреаплазм (Ureaplasma urealyticum, Ureaplasma parvum) методом ПЦР | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
| A26.20.030.002 | 28211 | Определение ДНК гарднереллы вагиналис (Gadnerella vaginalis) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.21.038.001 | 28211 | Определение ДНК гонококка (Neisseria gonorrhoeae) в секрете простаты методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.28.016.001 | 28211 | Определение ДНК трихомонас вагиналис (Trichomonas vaginalis) в моче методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
A26. 21.044.002 21.044.002 | 28211 | Определение ДНК грибов рода кандида (Candida spp.) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.21.044.003 | Определение ДНК энтеробактерий, стафилококков и стрептококков методом ПЦР | НИИ Урологии | Соскоб | 5 | 1 000,00 ₽ | |||
| A26.05.038.003 | 28211 | Определение ДНК Pseudomonas aeruginosa методом ПЦР | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
| A26.05.038.004 | 28211 | Определение ДНК уропатогенной Escherichia coli методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
| A26.05.038.005 | 28211 | Определение ДНК Klebsiella pneumoniae методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
A26. 05.038.006 05.038.006 | 28211 | Определение ДНК Proteus mirabilis методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
| A26.05.038.007 | Определение ДНК метициллин-резистентных стафилококков методом ПЦР | НИИ Урологии | Биоматериал | 5 | 1 200,00 ₽ | |||
| A26.05.038.008 | Определение ДНК антибиотико-резистентных микроорганизмов методом ПЦР | НИИ Урологии | Биоматериал | 5 | 1 400,00 ₽ | |||
| A27.30.134 | Анализ герминальных мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | Кровь | 60 | 39900 | |||
| A27.30.135 | Анализ соматических мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | Блоки (срезы) | 60 | 39900 | |||
A27. 30.136 30.136 | Секвенирование по Сэнгеру 1 пцр продукта (без учета выделения ДНК) | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 14 | 3 000,00 ₽ | |
| A27.30.137 | Выделение ДНК из цельной крови | НИИ Урологии | МРНЦ | Кровь | 4 | 1 500,00 ₽ | ||
| A27.30.139 | Выделение ДНК из парафинового блока | НИИ Урологии | МРНЦ | Блоки (срезы) | 4 | 2 000,00 ₽ | ||
| 29014 | Определение мутаций в экзонах 2-4 генов KRAS и NRAS методом Сэнгера (ОМС) См комментарий (для медворка) | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 |
Реалии ДНК-«аномалии»
Статья на конкурс «био/мол/текст»: ДНК — двойная спираль? Не всегда. Отдельные островки наших молекул наследственности могут по ошибке принимать довольно экзотические формы. Например, сворачиваться в спирали из четырех полигуаниновых нитей — вопреки классическим принципам молекулярной биологии. Но действительно ли подобные аномалии возникают «по ошибке»? Или природа давно уже «оседлала» эту странность нуклеиновых кислот, поставив её себе на службу? Можно ли считать четверные G-спирали рабочими «деталями» сложнейшей машины геномной регуляции? И случайна ли их причастность к процессам старения и канцерогенеза?
Например, сворачиваться в спирали из четырех полигуаниновых нитей — вопреки классическим принципам молекулярной биологии. Но действительно ли подобные аномалии возникают «по ошибке»? Или природа давно уже «оседлала» эту странность нуклеиновых кислот, поставив её себе на службу? Можно ли считать четверные G-спирали рабочими «деталями» сложнейшей машины геномной регуляции? И случайна ли их причастность к процессам старения и канцерогенеза?
Обратите внимание!
Эта работа заняла первое место в номинации «Лучшая статья о механизмах старения и долголетия» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
В мистическом фильме Д. Аронофски «Фонтан» присутствует весьма интересный образ. Конкистадор, отправившийся по велению испанской королевы на поиски древа вечной жизни (далекими прототипами героев здесь, по-видимому, послужили первооткрыватель Флориды Понсе де Леон и король Испании Фердинанд), находит его в храме индейцев Майя в Южной Америке. Однако, вкусив млечного сока этого древа, герой понимает, что что-то пошло не так. Вместо того чтобы обрести бессмертие, он начинает прорастать цветущей травой и полностью становится субстратом для этой буйной, паразитической по сути, растительности. Иными словами, у человека и у природы могут быть разные, если можно так выразиться, представления о жизненной силе и долголетии. И, возможно, именно поэтому в поисках путей продления жизни, мы постоянно натыкаемся на опасность канцерогенеза. Будь это исследования в области стволовых клеток, попытки преодолеть так называемый предел Хейфлика с помощью фермента теломеразы либо иные способы борьбы с клеточным старением. Всякий раз геронтология и онкология идут «рука об руку», теснейшим образом переплетаясь.
Аронофски «Фонтан» присутствует весьма интересный образ. Конкистадор, отправившийся по велению испанской королевы на поиски древа вечной жизни (далекими прототипами героев здесь, по-видимому, послужили первооткрыватель Флориды Понсе де Леон и король Испании Фердинанд), находит его в храме индейцев Майя в Южной Америке. Однако, вкусив млечного сока этого древа, герой понимает, что что-то пошло не так. Вместо того чтобы обрести бессмертие, он начинает прорастать цветущей травой и полностью становится субстратом для этой буйной, паразитической по сути, растительности. Иными словами, у человека и у природы могут быть разные, если можно так выразиться, представления о жизненной силе и долголетии. И, возможно, именно поэтому в поисках путей продления жизни, мы постоянно натыкаемся на опасность канцерогенеза. Будь это исследования в области стволовых клеток, попытки преодолеть так называемый предел Хейфлика с помощью фермента теломеразы либо иные способы борьбы с клеточным старением. Всякий раз геронтология и онкология идут «рука об руку», теснейшим образом переплетаясь. И одной из точек сопряжения этих двух областей можно считать удивительные структурные аномалии ДНК, носящие название G-квадруплексов…
И одной из точек сопряжения этих двух областей можно считать удивительные структурные аномалии ДНК, носящие название G-квадруплексов…
ДНК не по канону
Мы привыкли думать о ДНК как о двойной спирали, в которой азотистые основания нуклеотидов на противоположных цепях однозначно соответствуют друг другу: аденин — тимину, гуанин — цитозину. Эта, безусловно, фундаментальная особенность нуклеиновых кислот лежит в основе механизмов наследственности. Именно благодаря ей становятся возможными удвоение и корректирование ДНК, а также реализация генетической информации в структуре РНК и белков.
Однако на деле наши молекулы наследственности оказываются куда гибче, подвижнее и причудливее, нежели это было некогда описано легендарными нобелевскими лауреатами Дж. Уотсоном и Ф. Криком. Например, подобно РНК, ДНК может формировать так называемые шпильки, которые на двойной спирали приобретают вид крестообразных структур (рис. 1). Эти «аномальные» образования принимают активное участие в регуляции работы с генетической информацией и задействованы как в копировании ДНК (репликации) [1], так и в переносе информации с ДНК на РНК (транскрипции) [2].
Рисунок 1. Формирование крестоообразных структур ДНК. Рисунок с сайта www.physoc.org.
Конечно, «крестами» и шпильками дело не ограничивается. К числу возможных конформаций ДНК относятся также тройные (рис. 2Б) и даже четверные спирали (рис. 2В), возникающие в результате неканонических связей между азотистыми основаниями [3]. В течение последнего десятилетия заметно возросло внимание к так называемым G-квадруплексам — структурам, представляющим собой спирали из четырех нитей ДНК или РНК, соединенных одними только гуанинами. Постепенно выясняется, что эти образования играют весьма важную роль в регуляции активности генов, в генетической изменчивости и в функционировании теломер [4].
Рисунок 2. Двойная (а), тройная (б) и четверная (в) спирали ДНК. Рисунок с сайта www.konan-fiber.jp.
Рисунок 3. «G-ДНК». а. Строение G-тетрады; М+ — одновалентный катион. б. Формирование G-квадруплекса из 1) одной, 2) двух и 3) четырех нитей ДНК. Рисунок с сайта www.chem.cmu.edu.
б. Формирование G-квадруплекса из 1) одной, 2) двух и 3) четырех нитей ДНК. Рисунок с сайта www.chem.cmu.edu.
Способность гуанина к самоассоциации была обнаружена еще в конце 19 века. И только в 1962 году удалось установить, что в растворах он образует агрегаты из четырех молекул (называемых G-квартетом, или G-тетрадой) [5]. Такие тетрады скрепляются между собой неканоническими (то есть, не предусмотренными в модели Уотсона — Крика) водородными связями, называемыми «хугстиновскими» — по фамилии их первооткрывателя [6]. При этом входящие в них гуанины располагаются в одной плоскости и нуждаются в стабилизации моновалентными катионами (например, K+ или Na+) (рис. 3а).
Содержащие гуанин нуклеиновые кислоты в растворе могут образовывать такие структуры из одной, двух или четырех различных нитей (рис. 3б). Однако стабильными они будут лишь в том случае, когда три и более G-тетрады сгруппируются в плотную «стопку», «подперев» друг друга межплоскостными стекинг-взаимодействиями и сформировав тем самым G-квадруплекс (G4-структуру). А для этого, в свою очередь, необходима «счастливая встреча» четырех полигуаниновых участков (GGGn), находящихся либо на одной, либо на разных молекулах ДНК или РНК [7].
А для этого, в свою очередь, необходима «счастливая встреча» четырех полигуаниновых участков (GGGn), находящихся либо на одной, либо на разных молекулах ДНК или РНК [7].
Правда, на каждое правило есть свои исключения. Здесь можно привести в пример синдром ломкой X-хромосомы, возникающий вследствие экспансии многочисленных (более 200) повторов (CGG) в гене FMR1, необходимом для развития нервной системы. Матричная РНК такого мутантного гена способна формировать вполне стабильные четверные спирали даже из двухгуаниновых мотивов. То есть, в нашей «стопке» будет всего лишь две G-тетрады (рис. 4) [10].
«Значит, это кому-нибудь нужно?» © В. Маяковский
Рисунок 4. «Двуслойный» квадруплекс, формирующийся из четырех мотивов (GG) на РНК гена FMR1 при синдроме ломкой X-хромосомы. Рисунок с сайта www.computer.org.
Разумеется, то, что возможно в пробирке, далеко не всегда имеет место в живой клетке. Однако последние годы было убедительно показано, что G-квадруплексы действительно образуются in vivo в хромосомах живых организмов [11, 12]. И, кроме того, методами биоинформатики в геноме человека обнаружено порядка 376 тысяч районов, в которых потенциально могут возникать эти четырехспиральные образования. Интересно, что такие участки, как правило, находятся в составе регуляторных генетических элементов (промоторов, терминаторов, нетранслируемых последовательностей матричной РНК), теломер, рибосомных РНК и интронов, то есть последовательностей, не кодирующих структуру белка. Тогда как кодирующие фрагменты ДНК (экзоны) преимущественно «очищены» от подобных нуклеотидных мотивов [13, 14]. И неудивительно! Ведь, забегая вперед, нельзя не отметить, что такие гуаниновые «узелки» способны становиться очагами генетической нестабильности, провоцируя появление серьезных мутаций. Поэтому направленность естественного отбора в данном случае вполне понятна.
И, кроме того, методами биоинформатики в геноме человека обнаружено порядка 376 тысяч районов, в которых потенциально могут возникать эти четырехспиральные образования. Интересно, что такие участки, как правило, находятся в составе регуляторных генетических элементов (промоторов, терминаторов, нетранслируемых последовательностей матричной РНК), теломер, рибосомных РНК и интронов, то есть последовательностей, не кодирующих структуру белка. Тогда как кодирующие фрагменты ДНК (экзоны) преимущественно «очищены» от подобных нуклеотидных мотивов [13, 14]. И неудивительно! Ведь, забегая вперед, нельзя не отметить, что такие гуаниновые «узелки» способны становиться очагами генетической нестабильности, провоцируя появление серьезных мутаций. Поэтому направленность естественного отбора в данном случае вполне понятна.
Однако почему-то всё тот же естественный отбор способствовал заметному скоплению потенциальных G4-структур в области генных промоторов, то есть, участков ДНК, определяющих производительность данного гена и позволяющих её регулировать [13]. Причем особенно ярко это выражено в группе онкогенов, повышенная активность которых необходима для возникновения и развития раковых опухолей. Тогда как, к примеру, встречаемость вероятных G-квадруплексов в промоторах генов — супрессоров раковых опухолей (призванных подавлять канцерогенез) значительно ниже, чем в среднем по геному [15, 16]. Более того, последовательности многих промоторов и интронов, особо обогащенных потенциальными G4-структурами, достаточно консервативны, то есть несут общие черты у целого ряда эукариотических организмов [17, 18].
Причем особенно ярко это выражено в группе онкогенов, повышенная активность которых необходима для возникновения и развития раковых опухолей. Тогда как, к примеру, встречаемость вероятных G-квадруплексов в промоторах генов — супрессоров раковых опухолей (призванных подавлять канцерогенез) значительно ниже, чем в среднем по геному [15, 16]. Более того, последовательности многих промоторов и интронов, особо обогащенных потенциальными G4-структурами, достаточно консервативны, то есть несут общие черты у целого ряда эукариотических организмов [17, 18].
Картину дополняет то обстоятельство, что живые системы не пожалели времени и сил на выработку специальных белков, способных связываться с G-квадруплексами, либо формируя и стабилизируя их, либо «разворачивая», «расплетая» или просто разрезая [19]. Бесполезным или «не существующим» в клетке структурам (каковыми их вплоть до недавнего времени считали многие исследователи) эволюция столько внимания не уделяет. Как отметил более 30 лет назад нобелевский лауреат Аарон Клуг: «Если G-квадруплексы так легко формируются in vitro, природа, должно быть, нашла путь применения их in vivo» [4]. С каждым годом мы получаем всё больше подтверждений этому прозорливому высказыванию.
Из двойной спирали — в четверную
Чтобы сформировать в ДНК такую крупную структуру, как G-квадруплекс, необходимо предварительно подвергнуть плавлению (разъединить) соответствующий участок классической двойной спирали. Длина таких участков может составлять несколько десятков нуклеотидов. К примеру, общая формула для поиска потенциальных G4-структур в геноме, использованная в работах исследователей из Кэмбриджского университета, выглядела как (G3+N1—7G3+N1—7G3+N1—7G3) — то есть, предполагала длину квадруплекса от 15 до 33 пар оснований [13] (хотя это далеко не единственный вариант [14]). Теоретически G-квадруплексы могут возникнуть практически в любом месте генома— при условии образования достаточно длинного однонитевого ДНК-фрагмента [16]. Другое дело, что по показателям стабильности они будут существенно проигрывать.
Наиболее благоприятные условия для высвобождения протяженных кусочков одноцепочечной ДНК создаются, прежде всего, во время репликации. И действительно: количество G4-структур в клетке заметно (приблизительно в пять раз) возрастает именно при удвоении хромосом [20]. В идеале, по завершении копирования наследственного материала все гуаниновые «узелки» (и старые, и новые) должны удаляться, поскольку в это время клетка буквально «причесывает» свою ДНК. Однако, как показывает практика, часть G-квадруплексов остается и присутствует в геноме на протяжении всего клеточного цикла [11, 12, 20]. Более того, по-видимому, сам процесс репликации нуждается в наличии G4-структур. В частности, они входят в состав ориджинов (геномных районов, с которых начинается репликация) позвоночных животных и, по одной из версий, определяют направление движения ДНК-полимеразы — «копировальной машины» ДНК [21, 22].
Образованию четверных гуаниновых спиралей могут способствовать не только репликация, но и транскрипция (считывание гена), а также репарация (починка) хромосом [23]. Кроме того, в ядре возможно спонтанное плавление двойной спирали ДНК, возникающее в результате тех или иных молекулярных эффектов [24, 25]. В конце концов, появление G4-структур может быть обусловлено целенаправленным воздействием на ДНК специальных белков — шаперонов, призванных формировать квадруплексы там, где это положено [19].
Куда легче дело обстоит с РНК, однонитевыми по своей природе молекулами. Исключительная гибкость и отсутствие «обременения» в виде второй комплементарной цепочки позволяет им свободно принимать самые разнообразные конформации. И не случайно потенциальные G4-спирали нашлись в нетранслируемых (то есть, входящих в состав матричной РНК, но структуру белка не кодирующих) областях более чем 3000 человеческих генов [26, 27]. Кроме того, в последние годы перспективным представляется исследование гибридных квадруплексов, состоящих из ДНК и РНК. Интересно, что для их формирования достаточно не четырех, а всего лишь двух полигуаниновых участков на ДНК (два других автоматически будут присутствовать на считываемой с гена РНК) [28].
На самом краю хромосомы
А теперь — всё внимание таким удивительным ядерным структурам, как теломеры [29]! Располагаясь на концах линейных хромосом ядерных организмов, они призваны защищать генетический материал от разрушения. Структуры всех эукариотических теломер удивительно консервативны: они представляют собой цепочку из многократно повторяющихся нуклеотидных мотивов. В человеческом геноме это мотив (TTAGGG) (обратим внимание читателя на тройной гуанин), воспроизведенный 1000–2000 раз [30]! Не правда ли, идеальная среда для возникновения многочисленных G-квадруплексов? Но и это еще не всё: на конце теломер человека и других теплокровных животных располагается довольно протяженный, 30–300 нуклеотидов, участок однонитевой ДНК со свободным 3’-концом [31]. Состоит он из всё тех же повторов (ТТАGGG). И уж здесь-то образованию гуаниновых узелков ничто не мешает.
Теломерные последовательности, будучи извлеченными из ядра или синтезированными, действительно массово формируют G-квадруплексы [4]. Однако доказательство их наличия в клетке требует куда более тонких подходов. С помощью меченых антител, специфически связывающихся с G4-структурами, было показано, что последние действительно образуются на концах хромосом (правда, не всех). По крайней мере, около 20% всех сигналов были зафиксированы именно там [20]. Возникают ли обнаруженные квадруплексы собственно в теломерах либо в близлежащих областях хромосом, по этим данным сказать трудно, поскольку разрешение метода сильно ограничено. Однако нам достоверно известно, что многие теломерные белки действительно взаимодействуют с G4-структурами (либо формируя их, либо разрушая), и это один из главных аргументов в пользу их полноценного участия в жизни теломер [19]. А уж о том, что эта «жизнь» чрезвычайно важна для нас в контексте вопроса о здоровье и долголетии, говорить не приходится.
Судя по всему, G-квадруплексы задействованы в формировании защитного колпачка, или кэпа, на конце теломеры. В клетках человека такое «кэпирование» осуществляется шелтерином — комплексом из шести белков. Он предохраняет линейную хромосому от излишнего внимания клеточных «контролёров», считающих, что конец цепочки ДНК — это повреждение, требующее соответствующих методов «лечения». А в области теломер такое «лечение» оборачивается катастрофическими последствиями: «сшивкой» разных хромосом и, в итоге, гибелью клетки либо запуском канцерогенеза [32].
С G4-структурами взаимодействуют такие шелтериновые белки, как TRF2 и POT1. При этом TRF2 связывает и стабилизирует квадруплексы на однонитевом 3’-фрагменте, тогда как POT1 обусловливает распад гуаниновых четверных спиралей [19]. Иными словами, квадруплексы при образовании «кэпа» нужны, но дозированно.
Предполагаются самые разнообразные варианты участия G4 ДНК в «кэпировании» хромосом [33]. G-квадруплекс может быть необходим для образования специфической теломерной структуры, именуемой T-петлей (теломерной петлей) (рис. 5, 6а). Он возникает либо при простом запетливании однонитевого 3’-фрагмента (рис. 6б), либо при его внедрении в двойную спираль теломерной ДНК (рис. 6в) [34]. Таким образом осуществляется маскировка свободного 3’-конца (в общем случае распознаваемого клеткой как сигнал тревоги) [33].
Рисунок 5. Т-петля на конце теломеры под электронным микроскопом. Фото с сайта web.pdx.edu.
Рисунок 6. Различные виды Т-петель. а. T-петля без квадруплекса; б. T-петля с квадруплексом, замыкающим однонитевой 3’-фрагмент теломеры на себя; в. T-петля, образующая квадруплекс при внедрении однонитевого 3’-конца в двойную спираль теломерной ДНК. Рисунок с сайта pubs.rsc.org.
Помимо этого, обсуждаются альтернативные T-петле способы «кэпирования» хромосом. По одной из версий, одноцепочечная 3’-ДНК формирует плотный ряд G-квадруплексов, стабилизирующих однонитевой фрагмент и предохраняющих его от деградации особо ретивыми клеточными белками (рис. 7) [35]. Вероятно, подобный способ защиты теломеры используется в тех случаях, когда полноценного шелтерина на конце хромосомы не образуется [36].
Рисунок 7. Защита теломеры с помощью серии G-квадруплексов, образующихся на однонитевом 3’-конце. Рисунок из [4].
Не исключено, что в клетках человека в той или иной мере реализуются оба способа «обороны» теломеры с участием G4-образований. Иное дело, что такая «оборона» может оборачиваться для нас рядом неприятных моментов.
Точка обратного отсчета
Согласно наиболее популярной точке зрения, именно в теломерах спрятан ключ (по крайней мере, один из главных таких ключей) к пониманию процесса старения и ограниченной продолжительности нашей жизни. Линейные хромосомы, в отличие от циклических, коими могут похвастаться большинство доядерных организмов, как правило, не способны удваиваться вечно. Каждый цикл репликации, в силу особенностей организации этого ферментативного механизма, приводит к укорочению одной из дочерних нитей ДНК на 50–100 нуклеотидов. В итоге, после 50–60 раундов копирования наследственного материала потери в длине теломеры становятся неприемлемыми, поэтому клетка запускает процесс своего старения (сенесценции) либо гибнет [30, 37]. Правда, всем известные стволовые клетки являются ярким исключением из этого общего правила [38, 39]. (А еще — клетки растений, меняющие длину теломер в зависимости от времени года [40].)
Исследуя механизмы старения человека, невозможно обойти вниманием такое наследственное заболевание как синдром Вернера. Проявляется оно в ускоренном старении организма и сопровождается всеми сопутствующими эффектами: снижением иммунитета, повышением риска раковых заболеваний, многочисленными физиологическими нарушениями, характерными для людей преклонного возраста. Причиной этого синдрома оказалось нарушение структуры белка — геликазы WRN, основной функцией которого является расплетание теломерных квадруплексов. В результате во время репликации синтез дочерней цепи ДНК тормозится и обрывается в месте образования G4-структуры. Это приводит к галопирующему укорочению теломер и, соответственно, раннему запуску клеточного старения [41]. Аналогичного эффекта в культурах клеток можно добиться искусственным путем, повышая стойкость квадруплексов за счет их связывания со специальными химическими веществами [42].
Можно спорить по поводу применимости модели наследственного заболевания в деле расшифровки механизмов нормального, не патологичного старения. Однако совершенно не исключено, что не расплетенные вовремя теломерные квадруплексы задействованы и в этом случае. Вспомним, к примеру, как долгое время считалось, что синдром прогерии Хатчинсона-Гилфорда, связанный с преждевременным старением у детей, не имеет отношения к старению как таковому. В дальнейшем же было показано, что вызывающий эту болезнь прогерин образуется и в коже обычных пожилых людей [43].
Помимо этого, не секрет, что одной из вероятных причин старения является накопление в геноме повреждений, вызванных окислением свободными радикалами [44]. Причем существенная часть из них концентрируется именно на теломерах [45]. Возможных объяснений такому предпочтительному поражению кончиков хромосом довольно много. По-видимому, в этом виновны и сниженная (силами шелтериновых белков) активность ферментов «ремонта» ДНК, и особенности нуклеотидной последовательности теломерной ДНК. И здесь опять имеет смысл вспомнить про наши G-квадруплексы! Ведь они, помимо всего прочего, оказываются особенно чувствительными к окислительным повреждениям [46].
Смертельно опасная «вечная» жизнь
Говоря о теломерных G4-структурах, нельзя обойти вниманием тот интригующий факт, что, располагаясь на концах 3’-выступа, они блокируют работу теломеразы. А ведь это тот самый широко популяризованный фермент, на который возлагалось столько надежд, и за изучение которого в 2009 году была вручена Нобелевская премия по физиологии и медицине! Теломераза наращивает 3’-концы теломер и таким образом нивелирует их естественное укорочение. Иными словами — продлевает активную жизнь хромосомам и, соответственно, клетке [29]. Однако G-квадруплексы не просто мешают теломеразе делать свое дело — помимо этого, они, располагаясь в области промотора гена TERT, подавляют ее синтез в клетке [47]. И, конечно, этот эффект можно было бы счесть за негативный, если бы не один весьма печальный факт. Дело в том, что избыточная активность теломеразы создает весьма благоприятную среду для перерождения нормальных клеток в раковые. От работы этого фермента сильно зависят порядка 90% всех злокачественных опухолей, ведь он позволяет перерожденным клеткам делиться бесконечно долго [47].
Блокирование работы теломеразы составляет одну из функций гена BRCA1. BRCA1 — широко известный супрессор раковых опухолей, то есть ген — «борец» с канцерогенезом. Он является важным компонентом системы исправления ошибок в ДНК и контролирует активность целого ряда генов, в том числе задействованных в образовании опухолей [48]. Поэтому мутации в BRCA1 зачастую приводят к развитию рака груди и яичников [49], а в России они — в «лидерах» генетических причин возникновения онкозаболеваний [50]. Интересно, что подавление теломеразы этим (весьма немаловажным, как мы убедились) белком осуществляется не только за счет регуляции активности кодирующего её гена TERT [51], но и за счет прямого вмешательства в её работу на теломерах. В частности, предполагают, что BRCA1 связывается с теломерными квадруплексами и стабилизирует их, в результате чего наш «фермент молодости» остаётся не у дел [19].
Как было отмечено выше, TERT — отнюдь не единственный регулируемый G-квадруплексами ген, благоприятствующий развитию злокачественных опухолей [15]. Помимо него в этом ряду фигурируют c-MYC, c-KIT, BLC2, VEGF, HIF-1a и целый ряд других известных онкогенов [52]. Разумеется, такая закономерность не могла не привлечь внимания ученых, занятых поиском средств против рака. Сегодня существует целый ряд работ, посвященных влиянию тех или иных квадруплекс-связывающих веществ на рост и развитие раковых клеток. И, по результатам этих исследований, искусственное укрепление G-квадруплексов представляется чрезвычайно перспективным путем лечения онкологических заболеваний [47, 52].
По лезвию бритвы
Как гласит известная легенда, Будда Шакьямуни обрел просветление, услышав фразу учителя музыки, адресованную его ученику: «Если ты ослабишь струну, музыка не зазвучит, а если ты перетянешь её, она порвется». И этот принцип в полной мере относится ко множеству, если не ко всем биологическим процессам.
Те же самые G4-структуры, которые столь перспективны в рамках лечения раковых опухолей, могут сами по себе становиться провокаторами канцерогенных заболеваний. Вспомним вышеупомянутый синдром преждевременного старения Вернера. Возникает он на фоне недееспособности геликазы WRN, в норме «развязывающей» гуаниновые «узелки» на теломерах. В наших клетках существует целый спектр таких белков, призванных тем или иным способом удалять G-квадруплексы, дабы освободить дорогу ферментам репликации. Если же этого не происходит, то копирование ДНК стопорится в месте образования G4-структуры. В результате запускается целый ряд процессов, приводящих к разрывам ДНК, хромосомным перестройкам и мутациям наследственного материала [36, 41].
Так, например, при повреждении гена специализированной на G-квадруплексах геликазы BLM возникает синдром Блума. Проявляется он в низкорослости и ранней предрасположенности к целому ряду онкозаболеваний. Нарушение функции геликазы FANJ приводит к развитию анемии Фалькони, сопровождающейся повышенной хрупкостью хромосом и склонностью к лейкозам. Аналогичным образом мутации в гене геликазы RETL1 увеличивают чувствительность организма к некоторым видам рака. Этот список можно было бы продолжить целым рядом наследственных заболеваний, провоцирующих канцерогенез. И все они связаны с генетической и теломерной нестабильностью, вызванной «стойкими» ДНК- и РНК-квадруплексами [41].
Иными словами, чтобы «музыка», исполняемая оркестром генных и теломерных G-квадруплексов, звучала, необходима тонкая настройка их жесткости. По-видимому, мы имеем дело с чрезвычайно широкой и сложной сетью структурных ДНК-аномалий. Возникающих как спонтанно, так и при помощи специальных белков. Чувствительных как к молекулярному окружению, так и к физико-химическим условиям среды. Способных как предотвращать раковые заболевания, так и провоцировать их. Принимающих участие как в защите теломер, так и в процессах клеточного старения.
- Pearson C.E., Zorbas H., Price G.B., Zannis-Hadjopoulos M. (1996). Inverted repeats, stem-loops, and cruciforms: significance for initiation of DNA replication. J. Cell Biochem. 63, 1–22;
- Wadkins R.M. (2000). Targeting DNA secondary structures. Curr. Med. Chem. 7, 1–15;
- Франк-Каменецкий М. (2015). Необычные формы ДНК. Портал «ПостНаука»;
- Rhodes D. and Lipps H.J. (2015). G-quadruplexes and their regulatory roles in biology. Nucl. Acids Res. 43, 8627–8637;
- Gellert M., Lipsett M.N., Davies D.R. (1962). Helix formation by guanylic acid. Proc. Natl. Acad. Sci. USA. 48, 2013–2018;
- Hoogsteen K. (1963). The crystal and molecular structure of a hydrogen-bonded complex between 1-methylthymine and 9-methyladenine. Acta Cryst. 16, 907–916;
- Burge S., Parkinson G.N., Hazel P., Todd A.K, Neidle S. (2006). Quadruplex DNA: sequence, topology and structure. Nucl. Acids Res. 34, 5402–5415;
- Kotlyar A.B., Borovok N., Molotsky T., Cohen H., Shapir E., Porath D. (2005). Long, monomolecular guanine-based nanowires. Adv. Mat. 17, 1901–1905;
- Ngo V.A., Felice R.D., Haas S. (2014). Is the G-quadruplex an effective nanoconductor for ions? J. Phys. Chem. B. 118, 864–872;
- Kettania A., Kumara A.R., Patela D.J. (2014). Solution structure of a DNA quadruplex containing the fragile X syndrome triplet repeat. J. Mol. Biol. 254, 638–656;
- Lam E.Y., Beraldi D., Tannahill D., Balasubramanian S. (2013). G-quadruplex structures are stable and detectable in human genomic DNA. Nat. Commun. 4, 1796–1780;
- Rodriguez R., Miller K.M., Forment J.V., Bradshaw C.R., Nikan M., Britton S. et al. (2012). Small-molecule-induced DNA damage identifies alternative DNA structures in human genes. Nat. Chem. Biol. 8, 301–310;
- Huppert J.L. and Balasubramanian S. (2005). Prevalence of quadruplexes in the human genome. Nucl. Acids Res. 33, 2908–2916;
- Todd A.K., Johnston M., Neidle S. (2005). Highly prevalent putative quadruplex sequence motifs in human DNA. Nucl. Acids Res. 33, 2901–2907;
- Eddy J. and Maizels N. (2006). Gene function correlates with potential for G4 DNA formation in the human genome. Nucl. Acids Res. 34, 3887–3896;
- Maizels N. and Gray L.T. (2013). The G4 Genome. PLoS Genet. 9, e1003468;
- Fernando H., Reszka A.P., Huppert J., Ladame S., Rankin S., Venkitaraman A.R. et al. (2006). A conserved quadruplex motif located in a transcription activation site of the human c-kit oncogene. Biochem. 45, 7854–7860;
- Eddy J. and Maizels N. (2008). Conserved elements with potential to form polymorphic G-quadruplex structures in the first intron of human genes. Nucl. Acids Res. 36, 1321–1333;
- Brazda V., Haronikova L., Liao J.C., Fojta M. (2014). DNA and RNA quadruplex-binding proteins. Int. J. Mol. Sci. 15, 17493–17517;
- Biffi G., Tannahill D., McCafferty J., Balasubramanian S. (2013). Quantitative visualization of DNA G-quadruplex structures in human cells. Nat. Chem. 5, 182–186;
- Leonard A.C. and Mechali M. (2013). DNA replication origins. Cold Spring Harb. Perspect. Biol. 5, a010116;
- Valton A.L., Hassan-Zadeh V., Lema I., Boggetto N., Alberti P., Saintome C. et al. (2014). G4 motifs affect origin positioning and efficiency in two vertebrate replicators. EMBO J. 33, 732–746;
- Li W., Wu P., Ohmichi T., Sugimoto N. (2002). Characterization and thermodynamic properties of quadruplex/duplex competition. FEBS Lett. 526, 77–81;
- Miyoshi D., Karimata H., Sugimoto N. (2006). Hydration regulates thermodynamics of G-quadruplex formation under molecular crowding conditions. J. Am. Chem. Soc. 128, 7957–7963;
- Nikolova E.N., Kim E., Wise A.A., O’Brien P.J., Andricioaei I., Al-Hashimi H.M. (2011). Transient Hoogsteen base pairs in canonical duplex DNA. Nature. 470, 498–502;
- Bugaut A. and Balasubramanian S. (2012). 5′-UTR RNA G-quadruplexes: translation regulation and targeting. Nucl. Acids Res. 40, 4727–4741;
- Beaudoin J.D. and Perreault J.P. (2013). Exploring mRNA 3′-UTR G-quadruplexes: evidence of roles in both alternative polyadenylation and mRNA shortening. Nucl. Acids Res. 41, 5898–5911;
- Xiao S., Zhang J.Y., Zheng K.W., Hao Y.H., Tan Z. (2013). Bioinformatic analysis reveals an evolutional selection for DNA:RNA hybrid G-quadruplex structures as putative transcription regulatory elements in warm-blooded animals. Nucl. Acids Res. 41, 10379–10390;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Старение — плата за подавление раковых опухолей?;
- Makarov V.L., Hirose Y., Langmore J.P. (1997). Long G tails at both ends of human chromosomes suggest a C strand degradation mechanism for telomere shortening. Cell. 88, 657–666;
- Sfeir A. and Lange T. (2012). Removal of shelterin reveals the telomere end-protection problem. Science. 336, 593–597;
- Galati A., Micheli E., Cacchione S. (2013). Chromatin Structure in Telomere Dynamics. Front. Oncol. 3, 46;
- Табу в науке: лаборатория, задававшая неправильные вопросы;
- Bochman M.L., Paeschke K., Zakian V.A. (2012). DNA secondary structures: stability and function of G-quadruplex structures. Nat. Rev. Genet. 13, 770–780;
- Brosh R.M. Jr. (2011). Put on your thinking cap: G-quadruplexes, helicases, and telomeres. Aging (Albany NY). 3, 332–335;
- Levy M.Z., Allsopp R.Z., Futcher A.B., Greider C.W., Harley C.B. (1992). Telomere end-replication problem and cell aging. J. Mol. Biol. 225, 951–960;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Длина теломер и времена года;
- Brosh R.M. Jr. (2013). DNA helicases involved in DNA repair and their roles in cancer. Nat. Rev. Cancer. 13, 542–558;
- Incles C.M., Schultes C.M., Kempski H., Koehler H., Kelland L.R., Neidle S. (2004). A G-quadruplex telomere targeting agent produces p16-associated senescence and chromosomal fusions in human prostate cancer cells. Mol. Cancer Ther. 3, 1201;
- Burtner C.R. and Kennedy B.K. (2010). Progeria syndromes and ageing: what is the connection? Nat. Rev. Mol. Cell Biol. 11, 567–578;
- Wickens A.P. (2001). Ageing and the free radical theory. Respir. Physiol. 128, 379–391;
- Sun L., Tan R., Xu J., LaFace J., Gao Y., Xiao Y. et al. (2015). Targeted DNA damage at individual telomeres disrupts their integrity and triggers cell death. Nucl. Acids Res. 43, 6334–6347;
- Clark D.W., Phang T., Edwards M.G., Geraci M.W., Gillespie M.N. (2012). Promoter G-quadruplex sequences are targets for base oxidation and strand cleavage during hypoxia-induced transcription. Free Radic. Biol. Med. 53, 51–59;
- Patel D.J., Phan A.T., Kuryavyi V. (2007). Human telomere, oncogenic promoter and 5′-UTR G-quadruplexes: diverse higher order DNA and RNA targets for cancer therapeutics. Nucl. Acids Res. 35, 7429–7455;
- Rosen E.M. (2013). BRCA1 in the DNA damage response and at telomeres. Front. Genet. 4, 85;
- Рак молочной железы с семейной историей;
- Любченко Л.Н. Наследственный рак молочной железы и/или яичников: ДНК-диагностика, индивидуальный прогноз, лечение и профилактика: дис. … д-ра мед. наук. — Москва, 2009;
- Xiong J., Fan S., Meng Q., Schramm L., Wang C., Bouzahza B. et al. (2003). BRCA1 inhibition of telomerase activity in cultured cells. Mol. Cell Biol. 23, 8668–8690;
- Balasubramanian S., Hurley L.H., Neidle S. (2011). Targeting G-quadruplexes in gene promoters: a novel anticancer strategy? Nat. Rev. Drug Discov. 10, 261–275..
Гены BRCA1 и BRCA2: риск рака груди и яичников
Перейти к основному содержанию Мемориальный онкологический центр им. Слоуна Кеттеринга- Институт Слоана Кеттеринга
- Давать
- Локации
- Врачи
- Назначения
- Связаться с нами
- Взрослые пациенты
▼
- Обзор взрослых пациентов
- Онкологическая помощь
- Типы рака
- Оценка рисков и скрининг
- Диагностика и лечение
- Клинические испытания
- Ваш опыт
- Стать пациентом
- Поддержка пациентов
- Поддержка пациентов
- Наши офисы
- Нью-Джерси
- Нью-Йорк
- Штат Нью-Йорк
- Страхование и помощь
- Информация о страховании
- Финансовая помощь
- Найти врачаЗаписать на прием 5 MS Информация о визите Пациенты-дети и подростки ▼
- Обзор пациентов-детей и подростков
- Детское онкологическое лечение
BRCA1 i BRCA2 | WP abcZdrowie
Skrótem BRCA1 и BRCA2 oznaczane są geny, których mutacja, czyli zmiana właściwości, prowadzi do niekontrolowanego, nadmiernego podziału komórek i w efekcie do rozwojka ska raka.Mutacja w genie BRCA1 i / lub BRCA2 może być odziedziczona i przez to zwiększać prawdopodobieństwo rozwoju raka sutka lub raka jajnika u potomstwa.
Фильм Зобач: «Dlaczego warto wykonywać badania profilaktyczne?»
1. Кто может быть носителем mutacji genów BRCA?
Należy jednak pamiętać, że większość kobiet, u których w rodzinie rozpoznano raka piersi, nie jest nosicielkami zmutowanych genów, jak również większość kobiezłjónSzacuje się, e od 5 do 10 proc. wszystkich raków sutka jest dziedziczonych, a za ich wystąpienie odpowiada mutacja w BRCA1 i / lub BRCA2.
Geny BRCA1 и BRCA2 należą do tzw. genów supresorowych. W zdrowej komórce odpowiadają za odpowiednią liczbę podziałów komórki, blokują wystąpienie podziałów dodatkowych. Jeżeli gen supresorowy zostanie zmutowany to traci swoją funkcję «strażnika» podziałów komórki. W efekcie komórka zaczyna dzielić się w sposób niekontrolowany, prowadząc do wzrostu liczby komórek potomnych.Komórki potomne także zawierają mutację i również dzielą się w sposób szybki i niekontrolowany. Efektem końcowym jest rozwój guza. Oprócz genów BRCA1 и BRCA 2 istnieją inne, których mutacja prawdopodobnie również odpowiada za rozwój raka sutka lub jajnika. Jednak są one rzadkie i nie będą tu omawiane.
2. Testy genetyczne wykrywające BRCA1 i BRCA2
Testy genetyczne przeprowadzone w kierunku wykrycia obecności zmutowanego genu BRCA1 czy BRCA2 są obecnie dostępne w ośrodkach specjalistycznych.Celem wykonania takiego testu jest znalezienie mutacji a następnie na podstawie obecności pozostałych czynników ryzyka dla raka sutka czy jajnika, oszacowanie jakie jest kzy ky jajnika, oszacowanie jakie jest kzy kyy jajnika, oszacowanie jakie jest kyy jajnika, oszacowanie jakie jest kzy kz. Jednakże, testy genetyczne wykrywające mutacje genów BRCA są nadal niedoskonałe, a wyniku nigdy nie należy interptować samodzielnie.
Badanie genetyczne nie jest procurą, którą wykonuje się w trybie pilnym. Decyzję o wykonaniu badania podejmuje lekarz indywidualnie dla każdej osoby.Badanie polega na pobraniu próbki krwi w ośrodku zdrowia lub szpitalu i przesłaniu jej do licencjonowanego labratorium, gdzie zostaną przeprowadzone badania genetyczne.
3. Wskazania do testu genetycznego BRCA
Mutacje genów BRCA występują w około 0,1 proc. przypadków raka tj. u 1 na 1000 osób. Jednakże w niektórych grupach etnicznych są one spotykane dużo częściej. Przykładem może być populacja Żydów Aszkenazyjskich, w której częstość występowania mutacji w genach BRCA wynosi około 2 proc.. W tej populacji mutacja genu BRCA odpowiada za 12-30 proc. raków sutka, podczas gdy dla pozostałych populacji jest to częstość około 5 proc ..
Mutacje genów BRCA są stosunkowo rzadkie , często też wynik badania może nie być jednoznaczny, dlatego test przeprowadza się u kobiet z wysokim ryzykiem wystąpienka jednoznaczny. Badanie genetyczne nie powinno być przeprowadzane u wszystkich kobiet, które miały w rodzinie osoby chorujące na raka sutka czy jajnika. Należy pamiętać, że wykrycie mutacji genu BRCA ma nie tylko implikacje medyczne, ale również psychoologiczne, może zmienić nastawienie pacjenta do choroby, wywołać fobię przed rakiemze i nest.Dlatego ostateczna decyzja o przeprowadzeniu testu powinna być głęboko rozważona i skonsultowana dokładanie z lekarzem prowadzącym leczenie. Często przed decyzją o teście pacjentka wypełnia formularz — ankietę, na postawie której określa się wstępne ryzyko raka. Jeżeli oszacowane ryzyko jest wyższe niż 10 proc. zwykle pacjentce proponuje się wykonanie testu. Według niektórych autorów granica 10 proc. nie powinna być stosowana dla wszystkich pacjentów.
Kobiety, u których rak piersi wystąpił przed osiągnięciem 50 roku ycia, mają większe prawdopodobieństwo obecności mutacji w genie BRCA niż kobiety, u których raksutka wycia.Ryzyko nosicielstwa mutacji w genie BRCA rośnie dramatycznie u młodych kobiet z rakiem sutka, które mają także członków rodziny z tym nowotworem. Należy pamiętać, że z punktu widzenia lekarza, występowanie raka sutka w rodzinie po stornie ojca jest tak samo istotne jak występowanie raka w rodzinie matki.
Jeżeli wynik testu genetycznego jest pozytywny, czyli dodatni to badanie genetyczne powinno być także przeprowadzone u bliskich krewnych chorej, zarówno mężczyzn, jak i kobiet.
4.Wyniki testu genetycznego na BRCA
Wynik badania nie jest zawsze łatwy do интерпретации. Wynik negatywny testu, czyli ujemny oznacza, że mutacja w genie nie występuje, gen jest «zdrowy» co nie gwarantuje, że osoba badana nie będzie miała raka piersi czy jajzniko w przys. Podobnie wynik dodatni czyli pozytywny świadczy o obecności mutacja w genie BRCA ale nie daje stuprocentowej pewności, że pacjentka rozwinie raka piersi czy jajnika. Interpretacja jest nieco prostsza, gdy test dodatni występował u innych członków rodziny, dodatkowo rodzaj mutacji w genie BRCA musi być taki sam.Kobiety z mutacją w obrębie genu BRCA1 lub BRCA2 maja podwyższone ryzyko rozwoju raka piersi lub jajnika, jednak dokładanie nie zostało ono określone. W jednej z analiz podano, e ryzyko rozwoju raka piersi u kobiet do 70 roku życia wynosi miedzy 47 a 66 proc. w przypadku obecności mutacji genu BRCA1 i 40-57 proc. w przypadku obecności mutacji w genie BRCA2. Inne dane wskazują, e ryzyko to może być nawet wyższe i sięgać do 85 proc. zarówno dla mutacji w obrębie BRCA1 jak i BRCA2. Ryzyko rozwoju raka jajnika jest łatwiejsze do oszacowania.У особи из определенных изменений с заменой BRCA1 на 40-50 процессах, натощак для изменений BRCA2 на 15-25 процессах ..
5. Leczenie nosicieli mutacji w geneach BRCA
Pacjentki oraz pacjenci, którzy są nosicielami mutacji w genach BRCA1 i / lub BRCA2 są kierowani pod opiekę poradni specjalistycznych, onkologicznych. Pacjenci są poddawani częstym badaniom kontrolnym, aby wykryć raka w jego możliwie najwcześniejszym стадион. Wybranych przypadkach nosicielom mutacji z bardzo wysokim prawdopodobieństwem rozwoju raka sutka lub jajnika proponuje się przeprowadzenie profilaktycznej mastektomęú czyli i amputacji usaiersi.Innym postępowaniem jest stosowanie chemioprofilaktyki. Wskazania do stosowania leków zapobiegających rozwojowi raka są bardzo ograniczone do wąskiej grupy pacjentów, ze względu na działania niepodane i szkodliwe tych preperatów.
BRCA1 и BRCA2 Генетические мутации и риск рака: Центр груди Джона Хопкинса
BRCA1 и BRCA2 — это гены, обнаруженные в каждой клетке тела, которые функционируют для поддержания здоровья других генов.Некоторые люди унаследовали поврежденные копии генов BRCA1 или BRCA2. Это увеличивает риск рака груди и яичников у женщин и риск рака груди и простаты у мужчин. Примерно от пяти до десяти процентов случаев рака груди связано с мутацией в BRCA1, BRCA2 или других генах предрасположенности к раку груди. Положительный результат теста на эту генетическую мутацию — не то же самое, что диагноз рака. Напротив, эта информация полезна для принятия решительных мер по ограничению повышенного риска развития рака.Для многих женщин это включает в себя упреждающие, агрессивные шаги:
- Профилактическая / профилактическая мастэктомия
- Удаление яичников, также известное как ооферэктомия (женщины с положительным результатом теста на эти генетические мутации часто имеют более высокий риск развития рака яичников. )
Как мне узнать, нужно ли мне проходить тестирование на BRCA1 или BRCA2?
Вам следует тщательно обдумать, следует ли проходить тестирование на генетическую мутацию BRCA1 или BRCA2, и спросить себя, что вы будете делать, если результат будет положительным.Готовы ли вы и способны к активным и агрессивным действиям? Не вызовет ли информация слишком много беспокойства и у вас, и у ваших близких? Это действительно важные вопросы, над которыми вы должны проработать, прежде чем проходить тестирование.
Центр груди Джонса Хопкинса предлагает генетическое тестирование и другие формы оценки риска рака груди. Мы поощряем серьезное обсуждение с консультантом по рискам и врачами, которые специализируются на консультировании женщин из группы высокого риска. Оценка рисков и консультирование являются предпосылками генетического тестирования.Это простой анализ крови, получение результатов занимает примерно две недели.
Если результат анализа окажется положительным, как мне решить, делать ли мастэктомию и, возможно, удалить яичники?
МИФ: Если я дал положительный результат на мутацию гена BRCA1 или BRCA2, мне необходимо сделать двустороннюю мастэктомию. Получите факты.
Не спешите принимать решение по столь щекотливому вопросу. Мы призываем пациентов с положительным результатом теста на генетическую мутацию BRCA1 или BRCA2 уделить время для сбора информации и обсуждения всех вариантов со своими врачами и семьей.Прежде чем принять решение, многие женщины решают записаться в клинику высокого риска, например, в программу Службы наблюдения за грудью и яичниками Джонса Хопкинса (BOSS).
Я дал положительный результат на генетическую мутацию. Следует ли проверять моих дочерей?
В нашем маммологическом центре мы не поощряем тестирование детей. Фактически, мы твердо убеждены в том, что женщины должны быть совершеннолетними, чтобы они могли участвовать в процессе принятия решений, касающихся тестирования, и возможных вариантов выбора, зная, что одна из них является носителем мутации.Мы действительно рекомендуем, чтобы за женщинами с сильным семейным анамнезом рака груди наблюдали опытные специалисты по груди в клинике высокого риска, чтобы они могли составить план скрининга и тестирования.
Узнайте больше о генетическом тестировании на рак груди в Johns Hopkins Medicine.
Разница между BRCA1 и BRCA2
В организме человека много генов, и два из наиболее известных генов, связанных с раком груди, — это BRCA1 и BRCA2. Об этих генах часто говорят и тестируют одновременно, но важно помнить, что это разные гены и не идентичны.Чтобы лучше понять тестирование генов BRCA1 и BRCA2, важно узнать о различиях каждого из них. Это часть вашего здоровья, которой вы должны интересоваться, потому что, как известно, она спасает жизни. Простая осведомленность о генах BRCA1 и BRCA2 может иметь огромное влияние на ваше общее состояние здоровья.
Что такое BRCA1 и BRCA2?
BRCA1 и BRCA2 оба являются человеческими генами, но это разные гены, встречающиеся в организме.Оба эти гена выполняют функцию внутри организма, производя белки, предназначенные для подавления роста опухолей. Это означает, что оба гена BRCA1 и BRCA2 выполняют функцию восстановления ДНК, но эта функция может быть нарушена, если эти гены изменены или мутированы каким-либо образом. Это означает, что вы можете подвергаться риску мутировавших клеток и роста рака из-за повреждения ДНК. Вот почему тестирование генов BRCA1 и BRCA2 стало настолько важным. Эти гены выполняют одинаковые функции в организме, но они не одинаковы.
Наследственность и BRCA1 Гены BRCA2
Установлено, что рак груди передается по наследству от одного поколения к другому. Это связано с тем, что некоторые гены BRCA1 и BRCA2 более подвержены мутации, чем другие. Унаследовав мутировавшие гены BRCA1 и BRCA2, вы подвергаетесь гораздо большему риску рака груди. Эти мутировавшие BRCA! А гены BRCA2 могут быть унаследованы от одного или обоих родителей. Также было обнаружено, что мутировавшие гены BRCA2 также связаны с раком яичников.Мутировавшие гены BRCA1 могут вызывать рак яичников, но не так часто, как измененные гены BRCA2.
Знания и тестирование
Поскольку гены BRCA1 и BRCA2 имеют сильную связь с раком груди и яичников, генное тестирование стало обычной практикой в качестве профилактического лечения. Это означает, что люди с мутировавшими генами BRCA1 и BRCA2 будут подвергаться профилактическим мерам, чтобы избежать этих видов рака.
| Ген BRCA2 был открыт в 1994 году. [34] [16] [35] Ген был впервые клонирован учеными Myriad Genetics, Endo Recherche, Inc., HSC Research & Development Limited Partnership и Пенсильванский университет. [36] Методы диагностики вероятности развития рака у пациента с мутациями в BRCA1 и BRCA2 защищены патентами, принадлежащими Myriad Genetics или контролируемыми ею. [37] [38] Бизнес-модель Myriad, предусматривающая эксклюзивное предложение диагностических тестов, вела от начала Myriad как стартапа в 1994 году до публичной компании с 1200 сотрудниками и годовой выручкой около 500 миллионов долларов в 2012 году; [39] это также привело к спорам по поводу высоких цен на тесты и недоступности вторичных заключений других диагностических лабораторий, что, в свою очередь, привело к знаменательному иску Association for Molecular Patology против Myriad Genetics . [40] Мутации BRCA2 зародышевой линии и эффект основателя []Все мутации BRCA2 зародышевой линии, идентифицированные на сегодняшний день, являются унаследованными, что предполагает возможность большого эффекта «основателя», при котором определенная мутация является общей для четко определенной группы населения и теоретически может быть прослежена до общего предка. Учитывая сложность скрининга мутаций BRCA2, эти общие мутации могут упростить методы, необходимые для скрининга мутаций в определенных популяциях.Анализ мутаций, которые происходят с высокой частотой, также позволяет изучить их клиническое проявление. [41] Яркий пример мутации-основателя обнаружен в Исландии, где одна мутация BRCA2 (999del5) является причиной практически всех семейств рака груди / яичников. [42] [43] Эта мутация со сдвигом рамки считывания приводит к сильно усеченному белку. В большом исследовании, в котором изучались сотни больных раком и контрольная группа, эта мутация 999del5 была обнаружена у 0.6% от общей численности населения. Следует отметить, что в то время как 72% пациентов, которые были признаны носителями, имели умеренный или сильный семейный анамнез рака груди, 28% имели небольшой семейный анамнез заболевания или его отсутствие. Это убедительно свидетельствует о наличии модифицирующих генов, которые влияют на фенотипическое выражение этой мутации, или, возможно, на взаимодействие мутации BRCA2 с факторами окружающей среды. Дополнительные примеры мутаций-основателей в BRCA2 приведены в таблице ниже.
Мейоз []В растении Arabidopsis thaliana потеря гомолога BRCA2 AtBRCA2 вызывает серьезные дефекты как в мужском мейозе, так и в развитии женских гаметоцитов. [59] Белок AtBRCA2 необходим для правильной локализации синаптонемного сложного белка AtZYP1 и рекомбиназ AtRAD51 и AtDMC1. Кроме того, AtBRCA2 необходим для правильного мейотического синапса. Таким образом, AtBRCA2, вероятно, важен для мейотической рекомбинации. Похоже, что AtBRCA2 действует во время мейоза, чтобы контролировать стадии однонитевой инвазии, опосредованные AtRAD51 и AtDMC1, происходящие во время мейотической гомологичной рекомбинационной репарации повреждений ДНК. [59] Гомологи BRCA2 также необходимы для мейоза у гриба Ustilago maydis , [60] червь Caenorhabditis elegans , [61] [62] 15 Drosophly Меланогастер . [63] Мыши, продуцирующие усеченные версии BRCA2, жизнеспособны, но бесплодны. [64] крысы с мутантом BRCA2 обладают фенотипом ингибирования роста и бесплодия у обоих полов. [65] Асперматогенез у этих мутантных крыс происходит из-за нарушения гомологичного синапсиса хромосом во время мейоза. Последовательности повторов BRC []DMC1 (ДНК-мейотическая рекомбиназа 1) является мейоз-специфическим гомологом RAD51 , который опосредует обмен цепей во время гомологичной рекомбинационной репарации.DMC1 способствует образованию продуктов инвазии цепи ДНК (совместных молекул) между гомологичными молекулами ДНК. DMC1 человека напрямую взаимодействует с каждой из серии повторяющихся последовательностей в белке BRCA2 (называемых повторами BRC), которые стимулируют образование совместной молекулы с помощью DMC1. [66] повторов BRC соответствуют мотиву, состоящему из последовательности примерно из 35 высококонсервативных аминокислот, которые хотя бы один раз присутствуют во всех BRCA2-подобных белках. BRCA2 BRC-повторы стимулируют образование совместных молекул, способствуя взаимодействию одноцепочечной ДНК (оцДНК) с DMC1. [66] ОцДНК в комплексе с DMC1 может спариваться с гомологичной оцДНК из другой хромосомы на стадии синопсиса мейоза с образованием объединенной молекулы, центральной стадии гомологичной рекомбинации. Таким образом, последовательности повторов BRC BRCA2, по-видимому, играют ключевую роль в рекомбинационной репарации повреждений ДНК во время мейотической рекомбинации. В целом, похоже, что гомологичная рекомбинация во время мейоза выполняет функцию восстановления повреждений ДНК, [необходима ссылка ] и что BRCA2 играет ключевую роль в выполнении этой функции. Нейрогенез []BRCA2 необходим мышам для нейрогенеза и подавления медуллобластомы. [67] Утрата ‘’ BRCA2 ’’ глубоко влияет на нейрогенез, особенно во время эмбрионального и постнатального нервного развития. Эти неврологические дефекты возникают из-за повреждения ДНК. [67] Эпигенетический контроль []Эпигенетические изменения в экспрессии BRCA2 (вызывающие чрезмерную или недостаточную экспрессию) очень часто встречаются при спорадических формах рака (см. Таблицу ниже), тогда как мутации в BRCA2 встречаются редко. [68] [69] [70] При немелкоклеточном раке легкого BRCA2 эпигенетически репрессируется гиперметилированием промотора. [71] В этом случае гиперметилирование промотора в значительной степени связано с низкой экспрессией мРНК и низкой экспрессией белка, но не с потерей гетерозиготности гена. При спорадическом раке яичников наблюдается противоположный эффект. Промотор BRCA2 и области 5′-UTR содержат относительно мало или совсем не содержат метилированных динуклеотидов CpG в опухолевой ДНК по сравнению с неопухолевой ДНК, и обнаружена значительная корреляция между гипометилированием и> 3-кратной сверхэкспрессией BRCA2. [72] Это указывает на то, что гипометилирование промотора BRCA2 и областей 5′-UTR приводит к сверхэкспрессии мРНК BRCA2. Одно сообщение указывает на некоторый эпигенетический контроль экспрессии BRCA2 с помощью микроРНК miR-146a и miR-148a. [73] Экспрессия BRCA2 при раке []У эукариот белок BRCA2 играет важную роль в гомологичной рекомбинационной репарации. У мышей и людей BRCA2 в первую очередь опосредует упорядоченную сборку RAD51 на одноцепочечной (ss) ДНК, форме, которая активна для гомологичного спаривания и инвазии цепи. [74] BRCA2 также перенаправляет RAD51 от двухцепочечной ДНК и предотвращает диссоциацию от оцДНК. [74] Кроме того, четыре паралога RAD51, состоящие из RAD51B (RAD51L1), RAD51C (RAD51L2), RAD51D (RAD51L3), XRCC2, образуют комплекс, называемый комплексом BCDX2 (см. Рисунок: Рекомбинационная репарация ДНК). Этот комплекс участвует в наборе или стабилизации RAD51 в местах повреждения. [26] Комплекс BCDX2, по-видимому, действует, облегчая сборку или стабильность нуклеопротеинового филамента RAD51.RAD51 катализирует перенос цепи между нарушенной последовательностью и ее неповрежденным гомологом, чтобы обеспечить повторный синтез поврежденной области (см. Модели гомологичной рекомбинации). Некоторые исследования рака сообщают о сверхэкспрессии BRCA2 , тогда как другие исследования сообщают о недостаточной экспрессии BRCA2 . По крайней мере, в двух сообщениях была обнаружена избыточная экспрессия в некоторых спорадических опухолях груди и недостаточная экспрессия в других спорадических опухолях молочной железы. [75] [76] (см. Таблицу). Многие виды рака имеют эпигенетические недостатки в различных генах репарации ДНК (см. Частоты эпимутаций в генах репарации ДНК при раке).Эти дефекты репарации, вероятно, вызывают увеличение нереставрированных повреждений ДНК. Сверхэкспрессия BRCA2 , наблюдаемая при многих формах рака, может отражать компенсаторную сверхэкспрессию BRCA2 и повышенную гомологичную рекомбинационную репарацию, чтобы, по крайней мере, частично бороться с такими избыточными повреждениями ДНК. Egawa et al. [77] предполагают, что повышенная экспрессия BRCA2 может быть объяснена нестабильностью генома, часто наблюдаемой при раке, которая индуцирует экспрессию мРНК BRCA2 из-за повышенной потребности в BRCA2 для репарации ДНК. Недостаточная экспрессия BRCA2 сама может приводить к увеличению нерепарированных повреждений ДНК. Ошибки репликации после этих повреждений (см. Синтез трансфузии) могут привести к увеличению мутаций и раку.
Взаимодействия []BRCA2 взаимодействует с
Доменная архитектура []BRCA2 содержит ряд из 39 аминокислотных повторов, которые имеют решающее значение для связывания с RAD51 (ключевой белок в рекомбинационной репарации ДНК) и устойчивости к обработке метилметансульфонатом. [96] [103] [104] [112] Спиральный домен BRCA2 имеет спиральную структуру, состоящую из четырехспирального кластерного ядра (альфа 1, альфа 8, альфа 9, альфа 10) и две последовательные бета-шпильки (от бета 1 до бета 4).Сегмент из приблизительно 50 аминокислот, содержащий четыре короткие спирали (от альфа 2 до альфа 4), извивается вокруг поверхности сердцевины. В BRCA2 спирали альфа 9 и альфа 10 упаковываются с доменом BRCA2 OB1 посредством ван-дер-ваальсовых контактов с участием гидрофобных и ароматических остатков, а также через водородные связи в боковой и основной цепи. Этот домен связывает 70-аминокислотный белок DSS1 (удаленный при синдроме расщепленной руки / расщепленной стопы), который первоначально был идентифицирован как один из трех генов, которые отображаются на 1.Локус 5-Mb удален при синдроме наследственного порока развития. [110] Домен BRCA OB1 предполагает складку OB, которая состоит из сильно изогнутого пятицепочечного бета-листа, который замыкается на себя, образуя бета-ствол. OB1 имеет неглубокую бороздку, образованную одной стороной изогнутого листа, и ограничен двумя петлями, одна между бета 1 и бета 2, а другая между бета 4 и бета 5, что обеспечивает слабое связывание однонитевой ДНК. Этот домен также связывает белок DSS1 из 70 аминокислот (удаленный при синдроме расщепленной руки / расщепленной стопы). [110] Домен BRCA OB3 предполагает складку OB, которая состоит из сильно изогнутого пятицепочечного бета-листа, который замыкается на себя, образуя бета-ствол. OB3 имеет ярко выраженную бороздку, образованную одной стороной изогнутого листа, и разграничен двумя петлями, одна между бета 1 и бета 2, а другая между бета 4 и бета 5, что делает возможным сильное связывание оцДНК. [110] Домен Tower имеет вторичную структуру, состоящую из пары длинных антипараллельных альфа-спиралей (стержень), которые поддерживают трехспиральный пучок (3HB) на своем конце.3HB содержит мотив спираль-поворот-спираль и аналогичен ДНК-связывающим доменам бактериальных сайт-специфичных рекомбиназ, а также факторов транскрипции Myb и гомеодомена эукариот. Домен Tower играет важную роль в супрессорной функции опухоли BRCA2 и необходим для соответствующего связывания BRCA2 с ДНК. [110] Патенты, исполнение, судебные разбирательства и разногласия []Заявка на патент изолированного гена BRCA1 и мутаций, способствующих развитию рака, а также методов диагностики вероятности развития рака груди, была подана Университетом штата Юта, Национальным институтом наук об окружающей среде (NIEHS) и Myriad Genetics в г. 1994; [37] В течение следующего года Myriad в сотрудничестве с другими исследователями выделила и секвенировала ген BRCA2 и идентифицировала соответствующие мутации, и первый патент на BRCA2 был подан в США.S. by Myriad и другими организациями в 1995 году. [36] Myriad является эксклюзивным лицензиатом этих патентов и применяет их в США в отношении клинических диагностических лабораторий. [40] Эта бизнес-модель привела к тому, что Myriad из стартапа в 1994 году превратилась в публичную компанию с 1200 сотрудниками и годовым доходом около 500 миллионов долларов в 2012 году; [39] это также привело к спорам по поводу высоких цен и невозможности получить второе мнение от других диагностических лабораторий, что, в свою очередь, привело к выдающемуся решению Association for Molecular Patology v.Судебный процесс Myriad Genetics. [40] [113] Срок действия патентов истекает в 2014 году. Питер Мелдрам, генеральный директор Myriad Genetics, признал, что Myriad имеет «другие конкурентные преимущества, которые могут сделать такое [патентное] обеспечение ненужным» в Европе. [114] Судебные решения, касающиеся патентов BRCA1 и BRCA2, повлияют на сферу генетического тестирования в целом. [115] В июне 2013 г. в деле Association for Molecular Pathology v.Myriad Genetics (№ 12-398), Верховный суд США единогласно постановил, что «природный сегмент ДНК является продуктом природы и не подлежит патенту только потому, что он был изолирован», что аннулирует патенты Myriad на BRCA1 и BRCA2. гены. Однако Суд также постановил, что манипулирование геном с целью создания чего-то, чего не встречается в природе, по-прежнему может иметь право на патентную защиту. [116] Федеральный суд Австралии пришел к противоположному выводу, подтвердив законность австралийского патента Myriad Genetics на ген BRCA1 в феврале 2013 года, [117] , но это решение обжаловано, и апелляция будет включать рассмотрение постановления Верховного суда США. Танигучи Т., Гарсия-Игера I., Андреассен П.Р., Грегори Р.С., Громпе М., Д’Андреа А.Д. (2002). «Специфичное для S-фазы взаимодействие белка анемии Фанкони, FANCD2, с BRCA1 и RAD51». Кровь . 100 (7): 2414–20. DOI: 10.1182 / blood-2002-01-0278 |
Czy Masz Mutację Genu BRCA1 I BRCA2?
Laboratoria Synevo zapraszają na analizę zmiany zaburzeń w genie BRCA1 / BRCA2 w rónych poziomach i układach.Właściwe postępowanie u nosicielek tych mutacji zmniejsza ryzyko zgonu z powodu raka piersi do ok. 10% и рака jajnika do około 5%.
Gen BRCA1 i 2 jest głównym stranikiem w tkankach piersi i jajnika . Dlatego osoby będące nosicielami mutacji są bardziej zagrożone wystąpieniem raka piersi lub / i jajników — ryzyko zachorowania wynosi ok. 80% na raka piersi i 40% na raka jajnika-jajowodu-otrzewnej.
Mutację tego genu, która zwiększa ryzyko zachorowania, można zbadać robiąc odpowiednie badanie krwi .W Laboratoriach Synevo w całej Polsce można wykonać taki test.
Według szacunkowych danych ш Polsce шуткой Okolo 200.000 nosicieli (kobiet я mężczyzn) mutacji Genu BRCA1 я 2.Podstawowym wskazaniem делать wykonania badania Genu BRCA1 я 2 шуткой Identyfikacja zwiększonego ryzyka (ш stosunku делать ryzyka populacyjnego) zachorowania на nowotwór Piersi i / lub nowotwór jajnika.
KTO POWINIEN ZBADAĆ MUTACJĘ GENU BRCA?
Test należy szczególnie zalecić kobietom, które:
- miały w rodzinie (trzy pokolenia wstecz) co najmniej 2 przypadki zachorowań na raka piersi lub raka piersz jajnika (niezależnie од wieku),
- doświadczyły nietypowej postaci choroby (RAK obustronny, wczesny, Rak Piersi у spokrewnionego mężczyzny),
- stwierdzono histologiczną postać Raka rdzeniastego,
- oprócz Raka Piersi Miały krewnych г rakiem простаты, krtani LUB czerniakiem,
- miały zdiagnozowane niezłośliwe zmiany, takie jak np.torbiele w piersiach lub jajnikach, zwłaszcza jeśli planują lub już stosują гормональная терапия zastępczą,
- mają w rodzinie osoby, u których rozpoznano mutację NAZ 15 BRCA1?
Wczesne wykrycie predyspozycji do rozwoju raka piersi umożliwia podjęcie właściwych i odpowiednio wczesnych działań profilaktycznych, maksymalne ograniczającygonu ryzyjent załykoza.
JAK ZMNIEJSZYĆ RYZYKO ZACHOROWANIA?
U osób, у których stwierdzi się mutacje ш genach odpowiedzialnych ZA rozwój nowotworu należy można zmniejszyć ryzyko zachorowania poprzez:
- Jak najdłuższe karmienie piersią
- opóźnienie менархе poprzez wysiłek fizyczny
- właściwe stosowanie antykoncepcji hormonalnej (unikanie Przed 30 rokiem życia, krótkotrwałe zastosowanie po 30 roku)
- inne modyfikacje stylu ycia (masa ciała, używki, suplementacja diety).
Osobnym zagadnieniem jest odpowiedni dobór diagnostyki obrazowej dla kobiet nosicielek mutacji w tych genach, jak również stosowanie odmiennego podejścia do terapii.




 1186/bcr3352.
1186/bcr3352.