Искусственный иммунитет: виды, особенности, способы приобретения
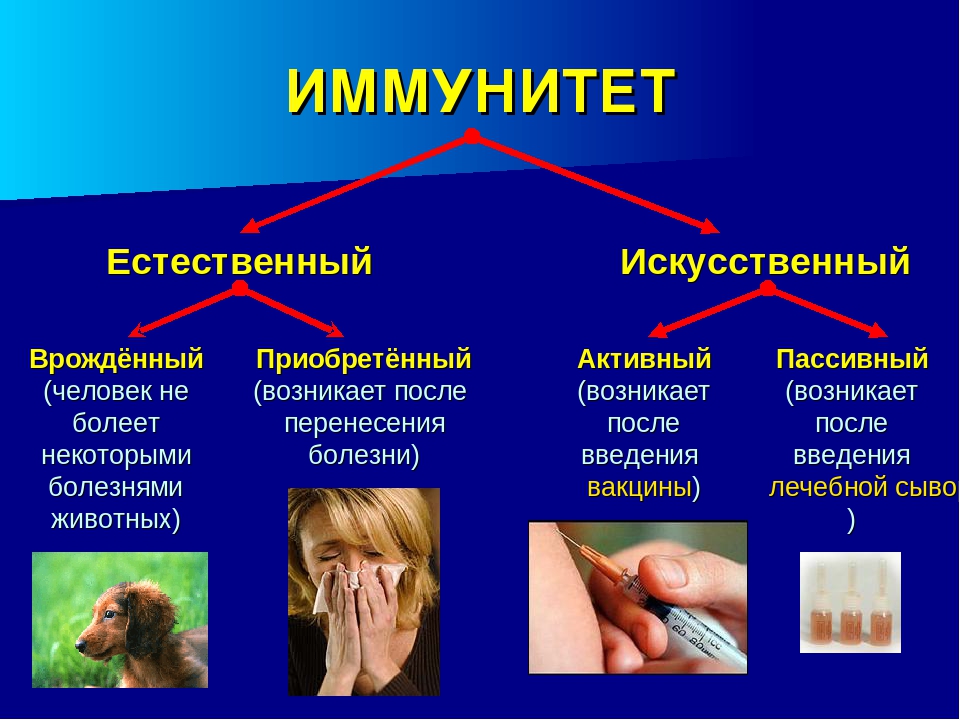
Иммунная защита организма является важнейшей составляющей его полноценного функционирования. Она ежедневно борется с внешними и внутренними патологическими факторами, успешно предотвращает развитие новообразований и препятствует началу многих инфекционно-воспалительных процессов. В современной иммунологии принято делить понятие иммунитет на два главных вида: врожденный и приобретенный. Первый формируется при рождении, во время прохождения материнских антител к плоду через плаценту, а также при грудном вскармливании. Второй, в свою очередь, делится на естественный и искусственный. Естественный возникает после перенесенного заболевания, так как после полного выздоровления в крови остаются циркулировать выработанные антитела. Ярким примером служит ветряная оспа, переболев которой, повторное заражение практически невозможно.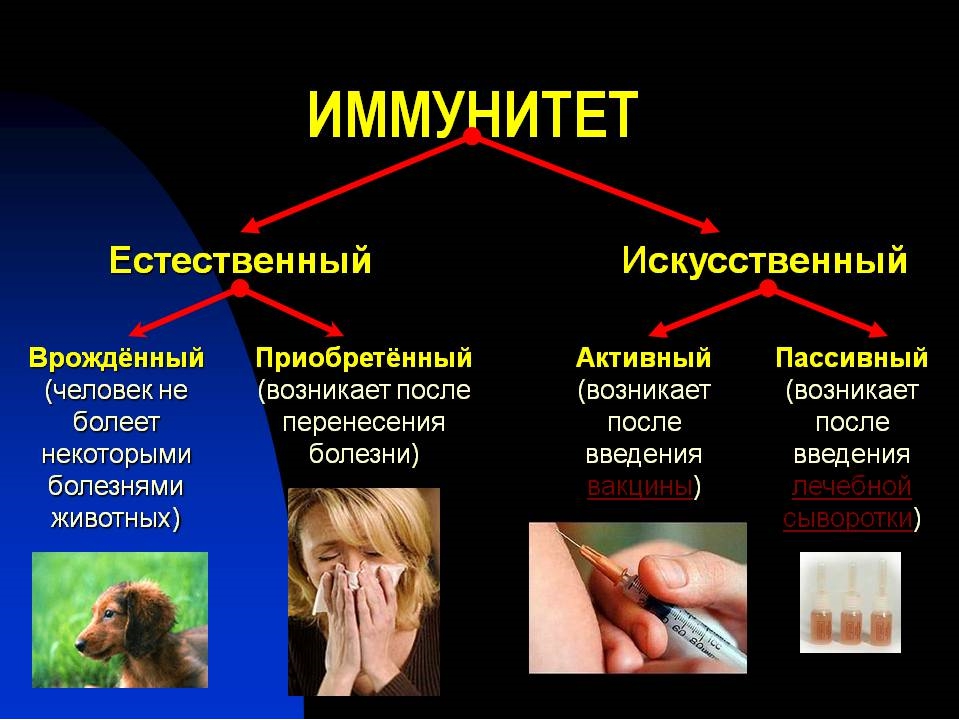
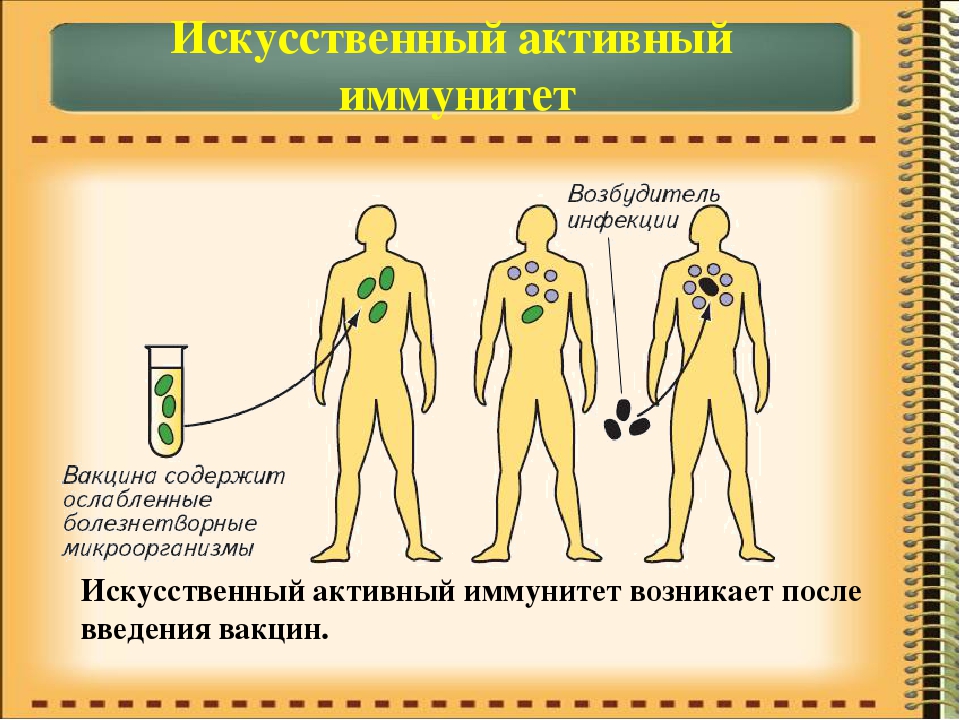
Что такое искусственный иммунитет?
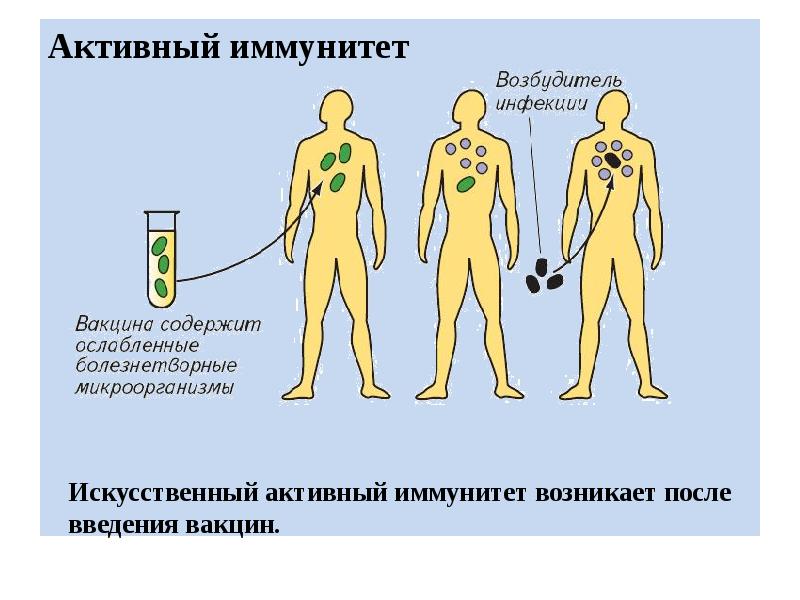
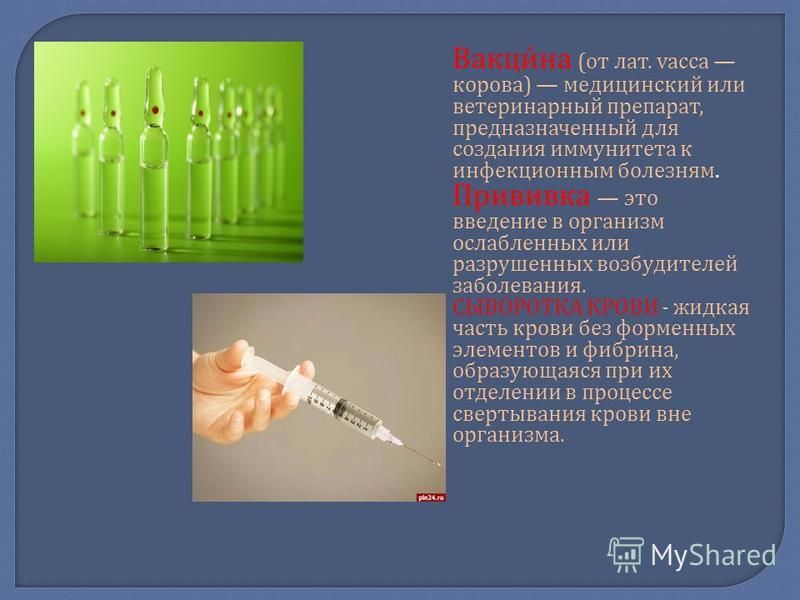
Искусственный иммунитет — это иммунная защита, которая формируется под действием искусственной стимуляции. Для его формирования используется введение в организм определенных вакцин или сывороток. Нередко на их создание уходят годы и даже десятилетия. А некоторые в неизменном виде используются с момента их создания (например, антистолбнячная сыворотка, создание которой позволило навсегда прекратить страшную пандемию столбняка). В них присутствуют готовые иммунные частички, которые противостоят конкретного типу антигена. Важно понимать, что созданная защита формирует барьер, который функционирует в течение 2-3 недель. Антитела обладают непродолжительным сроком жизни, но в достаточно короткие сроки создают отличную сопротивляемость всего организма
. Их выработка начинается сразу после попадания инфекционного агента внутрь. При этом наблюдается повышение температуры тела, больной человек чувствует слабость, быструю утомляемость и общее недомогание. Как только чужеродный микроорганизм уничтожен, лимфоциты считывают его данные и при повторной встрече начинают выработку антител.
Их выработка начинается сразу после попадания инфекционного агента внутрь. При этом наблюдается повышение температуры тела, больной человек чувствует слабость, быструю утомляемость и общее недомогание. Как только чужеродный микроорганизм уничтожен, лимфоциты считывают его данные и при повторной встрече начинают выработку антител. Для формирования пассивного искусственного иммунитета человеку могут сделать инъекцию антисыворотки — суспензии частиц антител из крови гомогенизированных домашних питомцев. Такой же принцип действует после укуса змеи, когда пострадавшему вводят определенное количество яда, выступающего в качестве противоядия.
Подавляющее большинство прививок проводится перед тем, как ребенок идет в детский сад и школу. В период школьного обучения осуществляется ревакцинация, которая необходима для закрепления полученного результата. Смеха иммунизации содержит в себе ряд правил и сроков, регламентирующих правильную вакцинацию населения.
Виды искусственного иммунитета
В медицинской практике принято делить искусственный иммунитет на два основных вида:
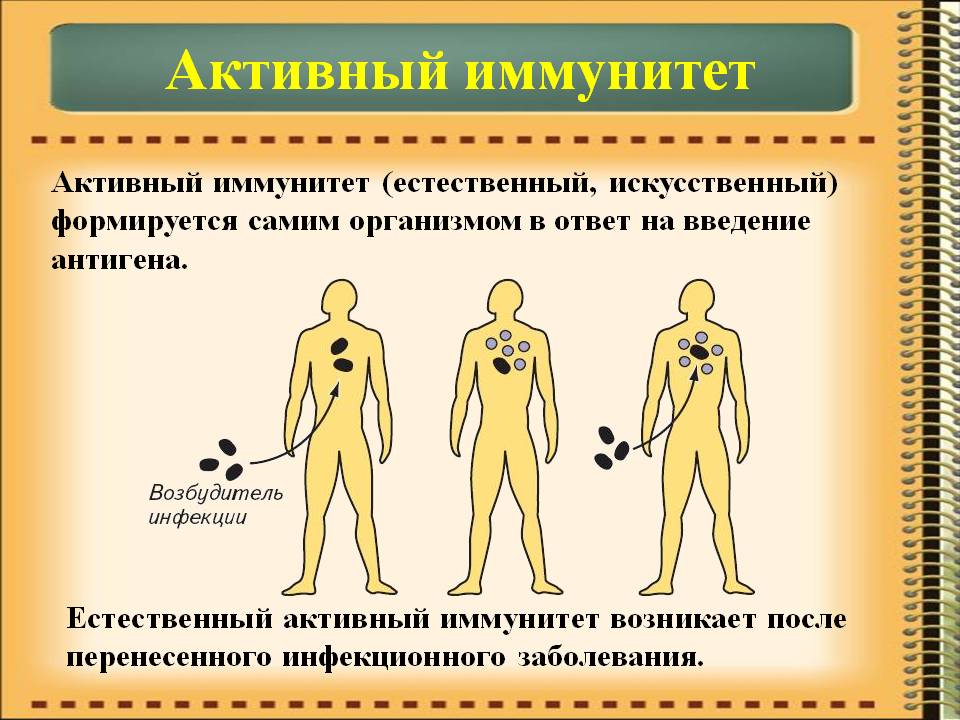
Активный искусственный иммунитет
Формируется после совершения предотвращающих развитие определенного заболевания прививок. Когда в организм человека вводится вакцина или ослабленный возбудитель конкретной болезни (“живая вакцина”), или токсины — продукты жизнедеятельности патогенетических микроорганизмов (“убитая вакцина”).
Её тип напрямую зависит от медицинских противопоказаний и индивидуальных особенностей каждого человека. Например, ослабленная разновидность противопоказана лицам, страдающим от иммунодефицитных состояний (ВИЧ, онкозаболевания и т. д.), так как ослабленная иммунная защита не сможет полноценно справиться с патогеном. В ответ на поступление вакцины происходит подобие заражения человека. Однако патология протекает в более легкой, бессимптомной форме. Ответной реакцией организма становится активное выделение защитных антител.
д.), так как ослабленная иммунная защита не сможет полноценно справиться с патогеном. В ответ на поступление вакцины происходит подобие заражения человека. Однако патология протекает в более легкой, бессимптомной форме. Ответной реакцией организма становится активное выделение защитных антител.
Несмотря на то, что активный искусственный иммунитет появляется сразу после введения вакцины, он отличается высокой прочностью и длительность (на долгие годы, иногда даже пожизненно). Если состав вакцинного иммунопрепарат максимально прилежен к натуральному инфекционному возбудителю, то его иммуногенные способности значительно повышаются.
Однако стоит уточнить, что высокая степень очищения вакцины заметно снижает риск развития нежелательных побочных реакций со стороны организма.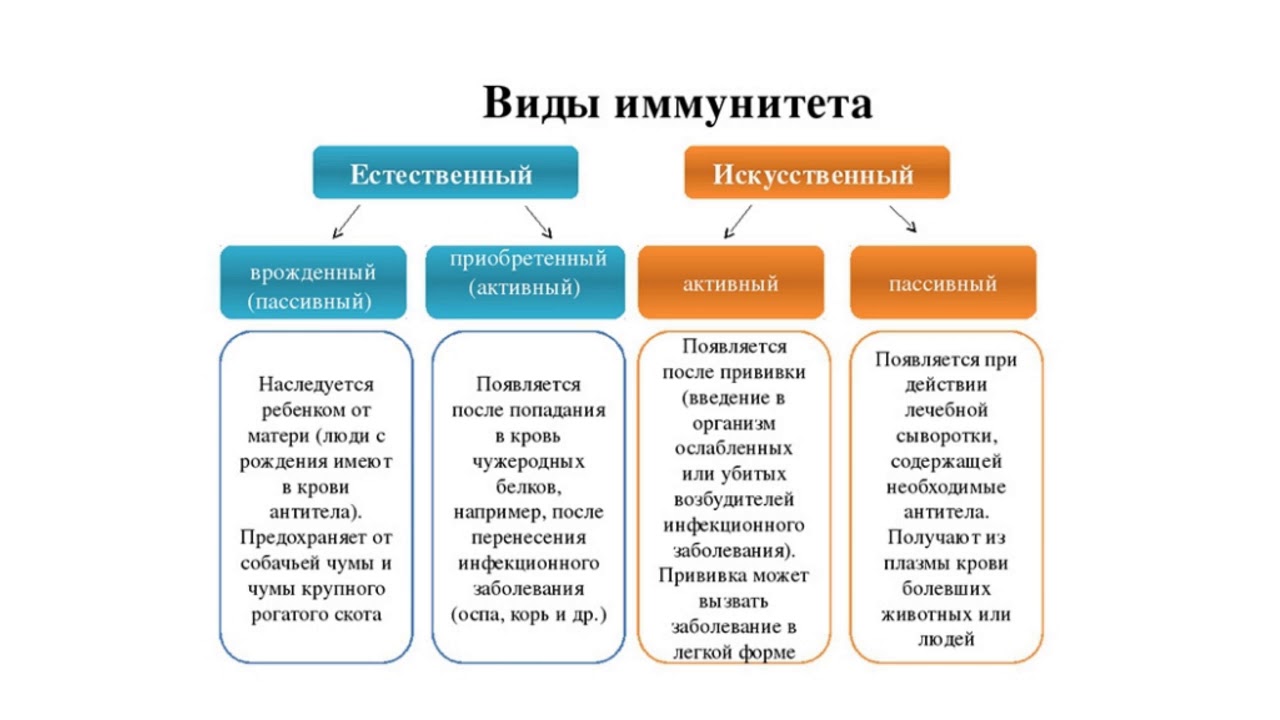 Наиболее ярким примером активного искусственного иммунитета является прививки от полиомиелита, коклюша и дифтерии. Их открытие помогло практически нейтрализовать случаи заболеваемости этими грозными болезнями.
Наиболее ярким примером активного искусственного иммунитета является прививки от полиомиелита, коклюша и дифтерии. Их открытие помогло практически нейтрализовать случаи заболеваемости этими грозными болезнями.
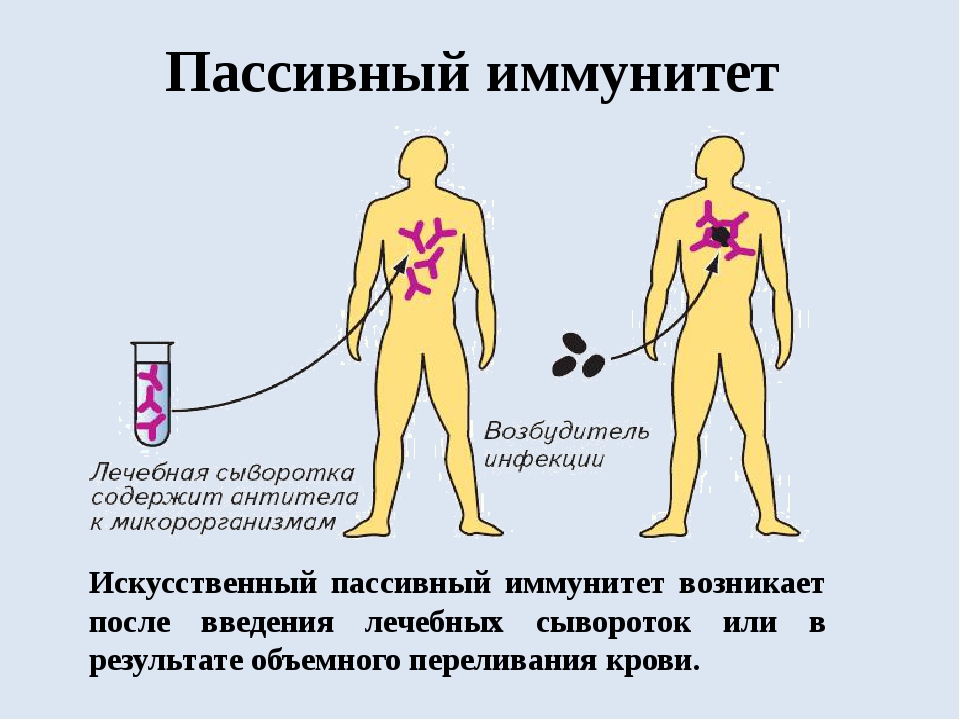
Пассивный искусственный иммунитет
Формируется после введения в организм сыворотки. Она представляет собой дефибринированную плазму крови, которая уже содержит в себе антитела к конкретному заболеванию. Сыворотка может создавать как из крови людей, которые уже излечились от нужной патологии, так и из крови животных
. В последнем случае привходит специальное прививание патологии, что приводит к образованию специфичных антител, которые можно вводить человеку.Отличительной особенностью пассивного искусственного иммунитета является его быстрое появление. Он возникает практически сразу после поступления внутрь сыворотки, однако введение антитела по своей природе являются чужеродными агентами, поэтому со временем организм начинает подавлять их активность.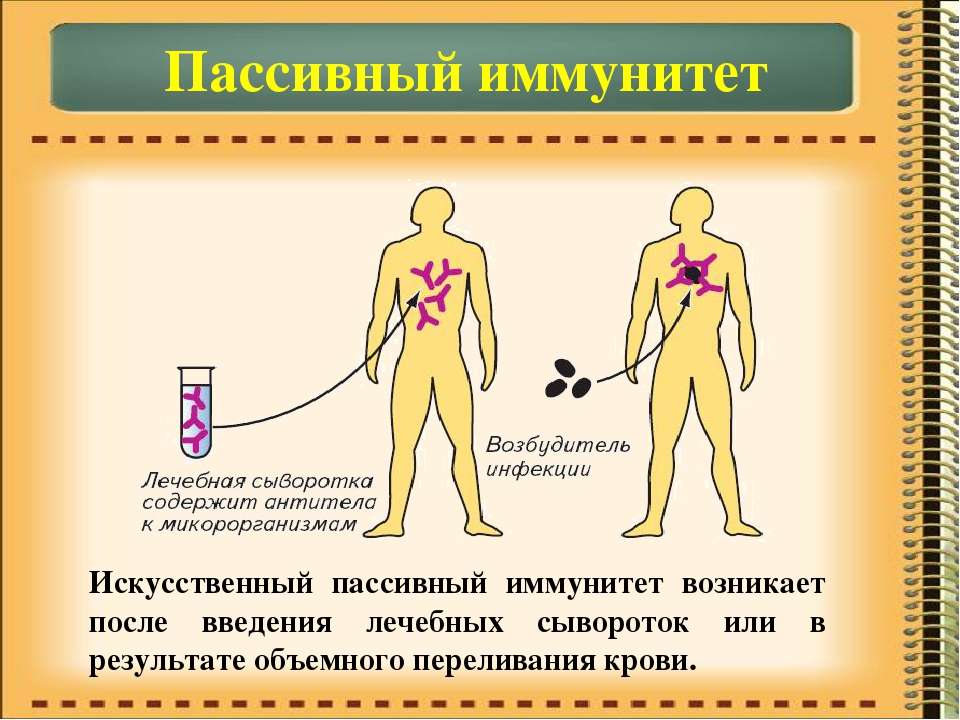 С этим связано ещё одна характеристика этой разновидности иммунной защиты — нестойкость и непродолжительность. Срок его действия, как правило, составляет от 4 до недель. Самым ярким представителем пассивного искусственного иммунитета является сыворотка против столбняка и бешенства.
С этим связано ещё одна характеристика этой разновидности иммунной защиты — нестойкость и непродолжительность. Срок его действия, как правило, составляет от 4 до недель. Самым ярким представителем пассивного искусственного иммунитета является сыворотка против столбняка и бешенства.
Видео по теме:
Тест по теме «Иммунитет»
Тест по теме «Иммунитет»
1 вариант
1. Что происходит в организме человека после предохранительной прививки?
1) вырабатываются ферменты
2) кровь свертывается, образуется тромб
3) образуются антитела
4) нарушается постоянство внутренней среды
2. Какой вирус нарушает работу иммунной системы человека:
Какой вирус нарушает работу иммунной системы человека:
1) полиомиелита 2) оспы 3) гриппа 4) ВИЧ
3. Невосприимчивость организма к воздействию возбудителя заболевания обеспечивается:
1) обменом веществ 2) иммунитетом 3) ферментами 4) гормонами
4. В экстренных случаях больному вводят лечебную сыворотку, в которой содержится:
1) ослабленные возбудители болезни
2) ядовитые вещества, выделяемые микроорганизмами
3) готовые антитела против возбудителя данного заболевания
4) погибшие возбудители заболевания
5. Предупредительные прививки защищают человека от:
1) любых заболеваний
2) ВИЧ — инфекции и СПИДа
3) хронических заболеваний
4) большинства инфекционных заболеваний
6. Защиту организма человека от чужеродных тел и микроорганизмов осуществляют
1) лейкоциты, или белые кровяные клетки
2) эритроциты, или красные кровяные клетки
3) тромбоциты, или кровяные пластинки
4) жидкая часть крови — плазма
7. Введение в кровь сыворотки, содержащей антитела против возбудителей определённого заболевания, приводит к формированию иммунитета
Введение в кровь сыворотки, содержащей антитела против возбудителей определённого заболевания, приводит к формированию иммунитета
1) активного искусственного
2) пассивного искусственного
3) естественного врожденного
4) естественного приобретённого
8. Лейкоциты участвуют в
1) свертывании крови
2) переносе кислорода
3) переносе конечных продуктов обмена
4) уничтожении чужеродных тел и веществ
9. Вакцинация населения — это
1) лечение инфекционных заболеваний антибиотиками
2) укрепление иммунной системы стимуляторами
3) введение здоровому человеку ослабленных возбудителей болезни
4) введение заболевшему человеку антител к возбудителю заболевания
10. Молоко матери защищает грудных детей от инфекционных заболеваний, так как оно содержит:
1) ферменты
2) гормоны
3) антитела
4) соли кальция
Тест по теме «Иммунитет»
2 вариант
1. Пассивный искусственный иммунитет возникает у человека, если ему в кровь вводят:
Пассивный искусственный иммунитет возникает у человека, если ему в кровь вводят:
1) ослабленных возбудителей болезни
2) готовые антитела
3) фагоциты и лимфоциты
4) эритроциты и тромбоциты
2. Вакцина содержит
1) только яды, выделяемые возбудителями
2) ослабленных или убитых возбудителей или их яды
3) готовые антитела
4) неослабленных возбудителей в небольших количествах
3. Какие вещества обезвреживают в организме человека и животных чужеродные тела и их яды
1) ферменты 2) антитела 3) антибиотики 4) гормоны
4. Никакие вакцины не содержат
1) яды, выделяемые возбудителями
2) ослабленных возбудителей
3) готовые антитела
4) убитых возбудителей
5. Клеточную теорию иммунитета создал
1) И. П. Павлов
2) И. М Сеченов
3) И. И. Мечников
4) Н. И. Пирогов
6. Препараты, приготовленные из ослабленных микробов или их ядов, —
1) лечебные сыворотки 2) антитела 3) вакцины 4) антибиотики
7. Защитой от чужеродных веществ и организмов служит
Защитой от чужеродных веществ и организмов служит
1) иммунная система
2) эндокринная система
3) нервная система
4) пищеварительная система
8. При попадании кишечной палочки в кровоток активизируется
1) кровеносная система
2) пищеварительная система
3) иммунная система
4) эндокринная система
9. Предупредительные прививки защищают человека от
1) любых заболеваний
2) ВИЧ-инфекции и СПИДа
3) хронических заболеваний
4) большинства инфекционных заболеваний
10. После введения сыворотки возникает иммунитет
1) искусственный активный
2) искусственный пассивный
3) естественный активный
4) естественный пассивный
Тест по теме «Иммунитет»
3 вариант
1. Что представляют собой антитела?
1) красные клетки крови
2) белки
3) белые клетки крови
4) гормоны
2. Микроорганизмы, попавшие во внутреннюю среду организма человека, обезвреживаются
Микроорганизмы, попавшие во внутреннюю среду организма человека, обезвреживаются
1) эритроцитами 2) тромбоцитами 3) лейкоцитами 4) фибриногеном
3. Уничтожение попавших в организм человека бактерий, вирусов и чужеродных веществ путём их захватывания лейкоцитами — процесс
1) фагоцитоза
2) образования тромба
3) кроветворения
4) пластического обмена
4. Грудное вскармливание предохраняет детей от инфекционных болезней, так как в молоке матери содержатся
1) антитела 2) ферменты 3) гормоны 4) питательные вещества
5. Пассивный иммунитет формируется у человека при
1) использовании антибиотиков
2) наличии в плазме белка фибриногена
3) введении лечебных сывороток
4) избытке витаминов группы С
6. Какова функция антител при иммунном ответе?
1) усиливают размножение лимфоцитов
2) повышают температуру тела
3) переваривают патоген
4) участвуют в узнавании патогенна
7. После предупредительной прививки в организме человека и животных
После предупредительной прививки в организме человека и животных
1) активизируется деятельность поджелудочной железы
2) происходит образование антител
3) вырабатывается пассивный иммунитет
4) разрушаются эритроциты
8. Антитела, содержащиеся в крови человека, выполняют функцию
1) транспортную
2) дыхательную
3) выделительную
4) защитную
9. Клетками, обеспечивающими иммунитет человека, являются
1) эритроциты
2) миоциты
3) лейкоциты
4) остеоциты
10. Наиболее важной функцией лимфоцитов является
1) разложение органических соединений
2) транспорт газов
3) синтез органических соединений
4) иммунная защита организма
Проверочная работа по теме «Иммунитет»
Проверочная работа по теме: «ИММУНИТЕТ»
ВАРИАНТ 1.
1. Что является компонентом внутренней среды организма человека?
1) желчь 2) слюна 3) лимфа 4) желудочный сок
2. Кровеносная система человека
Кровеносная система человека
1) незамкнутая, сердце четырёхкамерное 2) замкнутая, сердце трёхкамерное
3) незамкнутая, сердце трёхкамерное 4) замкнутая, сердце четырёхкамерное
3. Какую функцию выполняют лейкоциты крови?
1) транспортируют газы 2) обеспечивают иммунитет
3) переносят питательные вещества 4) обеспечивают свёртываемость крови
4. Способ предупреждения заболевания коровьей оспой впервые предложил
1) И. Мечников 2) И. Павлов 3) Э. Дженнер 4) Л. Пастер
5. Как называют препарат, содержащий ослабленные микробы, который вводят человеку в целях выработки иммунитета?
1) физиологический раствор 2) вакцина 3) плазма 4) сыворотка
6. Подавляющее большинство людей в детстве болеют ветрянкой (ветряной оспой). Какой иммунитет возникает после перенесения человеком этого инфекционного заболевания?
Какой иммунитет возникает после перенесения человеком этого инфекционного заболевания?
1) естественный врождённый 2) искусственный активный
3) естественный приобретённый 4) искусственный пассивный
7. Кому и для чего необходимо носить марлевую маску, закрывающую рот и нос?
1) здоровому человеку в общественных местах, чтобы не заразиться от окружающих
2) здоровому человеку всё время, чтобы не заразиться находящимися в воздухе вирусами
3) больному человеку в общественных местах, чтобы не заражать окружающих
4) больному человеку всё время, чтобы не увеличивать количество находящихся в воздухе вирусов
8. Если температура тела держится на уровне 37,5 °С несколько дней, необходимо
1) замотать горло шарфом 2) сделать йодную сеточку на груди
3) принять сильнодействующие антибиотики 4) обратиться к врачу
9. Верны ли суждения о видах иммунитета у человека?
Верны ли суждения о видах иммунитета у человека?
А. При вакцинировании в кровь человека поступают убитые или ослабленные возбудители болезни, лечебная сыворотка содержит готовые антитела, образованные в крови животных.
Б. Под действием вакцины в организме человека вырабатывается пассивный искусственный иммунитет, под действием сыворотки – активный.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
10. При укусе насекомого в кровь человека могут попасть возбудители
1) малярии 2) гриппа 3) дизентерии 4) туберкулёза
11. Опасность ВИЧ заключается в том, что он
1) генетически наследуется 2) передаётся воздушно-капельным путём
3) может привести к потере иммунитета 4) заразен при рукопожатии
12.![]() Людям, заболевшим дифтерией, назначают
Людям, заболевшим дифтерией, назначают
1) болеутоляющие средства 2) ослабленную вакцину
3) лечебную сыворотку 4) промывание желудка
13. Увеличение числа лейкоцитов в крови свидетельствует о
1) повышении скорости свёртывания крови 2) понижении давления крови
3) наличии воспалительного процесса 4) развивающемся малокровии
14. Загрязнение царапин и ран смертельно опасно, потому что
1) нарушается процесс свёртывания крови
2) могут проникнуть возбудители столбняка
3) в рану могут проникнуть яйца глистов
4) может нарушится питание тканей
15. Пострадавшему от укуса бешеной собаки вводят
1) готовые антитела 2) антибиотики
3) ослабленных возбудителей болезни 4) обезболивающие лекарства
16. Обеззараживание чужеродных тел и веществ в организме человека обеспечивают
1) ионы плазмы 2) витамины 3) антитела 4) ферменты
17*. Какой фактор может стать причиной возникновения СПИДа? Выберите три верных ответа и запишите цифры, под которыми они указаны.
Какой фактор может стать причиной возникновения СПИДа? Выберите три верных ответа и запишите цифры, под которыми они указаны.
1) нанесение татуировки 2) плавание в бассейне
3) прокалывание ушей 4) уход за больным СПИДом
5) незащищённые половые связи 6) обучение с учащимся – носителем вируса
18*. Установите соответствие между фактором и видом иммунитета человека, с которым этот фактор связан: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ФАКТОР
А) введение ослабленных
микроорганизмов
Б) воздействие лечебных сывороток
В) перенесение болезни
Г) введение убитых микроорганизмов
Д) передача иммунитета по наследству
Е) вскармливание грудным молоком
ВИД ИММУНИТЕТА
1) естественный
2) искусственный
19*. Прочитайте текст и выполните задание.
Прочитайте текст и выполните задание.
МЕХАНИЗМ ИММУНИТЕТА
Иммунология – это наука о механизмах защитных реакций организма. У её истоков стояли Л. Пастер, И.И. Мечников, П. Эрлих. Л. Пастер применил вакцинацию для предупреждения инфекционных заболеваний. И.И. Мечников разработал клеточную (фагоцитарную) теорию иммунитета. П. Эрлих создал гуморальную теорию, согласно которой невосприимчивость к инфекциям обусловлена выработкой защитных белковых веществ – антител.
В настоящее время иммунитет подразделяют на неспецифический и специфический. Неспецифическая клеточная защита осуществляется фагоцитами крови, которые поглощают из крови чужеродные элементы – бактериальные клетки, белковые молекулы и другие мельчайшие частицы.
Специфический иммунитет образуется на конкретный антиген, и при повторном заражении организм реагирует только на него. В специфических иммунных реа
Тест с ответами: «Иммунитет и иммунная система»
1. Что такое иммунитет?
Что такое иммунитет?
1) Функция защиты организма исключительно от вирусных инфекций.
2) Функция защиты организма от агентов, несущих чужеродную генетическую информацию. +
3) Функция защиты организма исключительно от простудных заболеваний.
2. Что выделяют антитела?
1) лимфоциты+
2) эпителиальные клетки
3) эритроциты
4) тромбоциты
3. К формированию какого типа иммунитета относится следующее высказывание:
«Введение в кровь сыворотки, содержащей антитела против возбудителей определенного заболевания»
1) активного искусственного
2) пассивного искусственного+
3) естественного врожденного
4) естественного приобретенного
4. Выыбирите верные виды иммунитета:
1) естественный и искусственный+
2) естественный и врожденный
3) искусственный и приобретенный
4) искусственный и врожденный
5. В чем состоит центральная задача иммунитета?
1) Обеспечение генетической целостности организма. +
2) Обеспечение противоинфекционной защиты.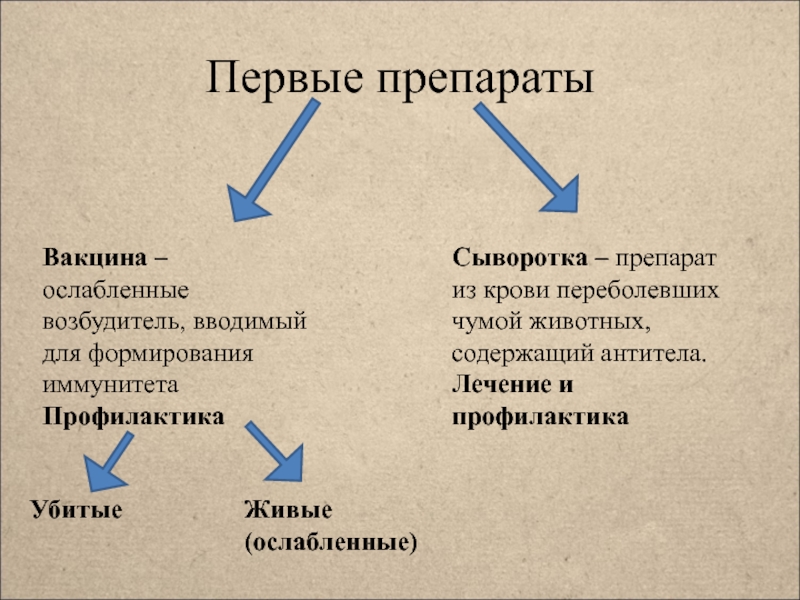
3) Отторжение пересаженных клеток, тканей и органов.
4) Реализация запрограммированной клеточной смерти (апоптоза).
5) Обеспечение состояния толерантности к «своему».
6. Как вид иммунитета передается по наследству?
1) естественный+
2) искусственный
3) активный
4) пассивный
7. Кто открыл процесс фагоцитоза?
1) И.П. Павлов
2) И.И. Мечников+
3) И.М. Сеченов
4) А.А. Ухтомский
8. На какие два вида можно разделить искусственный иммунитет?
1) активный и пассивный+
2) врожденный и активный
3) врожденный и пассивный
4) активный и поствакцинальный
9. Что необходимо ввести человеку заболевшему дифтерией:
1) вакцину
2) сыворотку+
3) антигены
4) физиологический раствор
10. Кто сделал первую прививку от оспы?
1) Э. Дженнер+
2) И. И. Мечников
3) Л. Пастер
4) И. П. Павлов
11. Какими функциями определяется состояние иммунитета?
1) Центральной нервной системы
2) Эндокринной системы
3) Кроветворной системы
4) Лимфоидной системы. +
+
12. Какие белки представляют собой антитела?
1) иммуноглобулины+
2) агглютиногены
3) гемоглобины
4) фибриногены
13. Что содержит вакцина?
1) яды, выделяемые возбудителями
2) ослабленных возбудителей+
3) готовые антитела
4) убитых возбудителей
14. Каким может быть естественный иммунитет?
1) врожденным и приобретенным+
2) врожденным и активным
3) приобретенным и пассивным
15. При введении в кровь чего возникает пассивный искусственный иммунитет?
1) ослабленных возбудителей болезни
2) готовые антитела+
3) фагоциты и лимфоциты
4) вещества, вырабатываемые возбудителями
16. Чем отличается система иммунитета от других система организма?
1) Множественность органов. +
2) Миграция и рециркуляция клеток. +
3) Образование растворимых биологически активных факторов.
4) Взаимодействие и кооперация клеток+.
5) Специфичность функций. +
17. Отметьте основной принцип организации системы иммунитета:
1) Органный.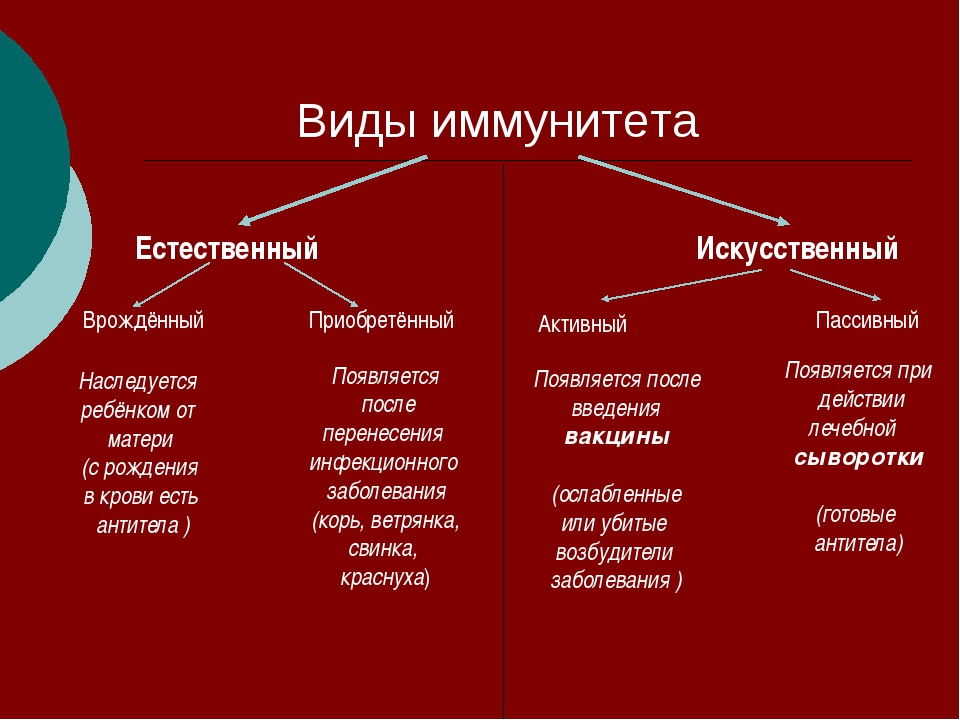
2) Миграционный.
3) Циркуляторный.
4) Органно-миграционный.
5) Органно-циркуляторный. +
18. Что входит в состав иммунной системы?
1) Печень. +
2) Поджелудочная железа.
3) Лёгкие.
4) Периферическая кровь. +
факторы, лечебные препараты, врожденные и приобретенные свойства : Labuda.blog
Что такое противовирусный иммунитет? Это механизм защиты организма, который обеспечивает бесперебойную работу внутренней среды и вступает во взаимодействие с патогенным инфекционным агентом. В современной иммунологии этот раздел занимает преимущественную часть теоретического курса. Его изучение имеет первостепенное значение для будущих иммунологов.
Что такое вирус и как на него реагирует иммунитет
В природе инфекционных микроорганизмов вирусам отводится уникальный статус: все возбудители различных заболеваний, известные современной науке, имеют молекулярную неклеточную организацию. Вирус – это своего рода внутриклеточный паразит, который обладает специфическим механизмом репродукции и взаимодействия с клетками организма. Благодаря многообразию вирусных инфекций ученым удалось определить тип патогенеза заболеваний, вызываемых ими, и характер иммунологической реакции.
Благодаря многообразию вирусных инфекций ученым удалось определить тип патогенеза заболеваний, вызываемых ими, и характер иммунологической реакции.
Основной задачей микробиологии противовирусного иммунитета является создание эффективных лекарственных препаратов, которые должны помогать организму бороться с инфекцией и наладить эффективный защитный механизм в случае повторной вирусной атаки. Для этого важно определить степень устойчивости патогена к воздействию естественных и искусственных противовирусных комплексов, которые формируются после излечения от инфекции.
Сформированный организмом противовирусный иммунитет может иметь разную напряженность и продолжительность. Также стоит уточнить, что иммунологическая реакция в ответ на инфицирование возникает не во всех случаях. Невосприимчивость к болезнетворным агентам отдельных видов заложена на генетическом уровне. Главным условием формирования таких механизмов противовирусного иммунитета является отсутствие в клетках специфических субстратов. Без них не происходит взаимодействия с инфекцией и блокируется ее размножение. Из-за невозможности репродукции вируса в организме заболевание не развивается.
Без них не происходит взаимодействия с инфекцией и блокируется ее размножение. Из-за невозможности репродукции вируса в организме заболевание не развивается.
Общие физиологические факторы формирования иммунной защиты
Врожденный противовирусный иммунитет есть у каждого человека. Главным условием его выработки является наличие неспецифических факторов, которые обеспечивают защиту клеток и молекул от воздействия инфекции. Чтобы спровоцировать развитие заболевания, патоген должен пройти несколько естественных барьеров в организме человека. Каждый из них и является тем самым неспецифическим фактором противовирусного иммунитета.
Первый этап – это кожно-слизистые ткани. На них приходится первая атака патогенных микроорганизмов. Крепким противовирусным иммунитетом обладают неповрежденные кожные покровы и слизистые оболочки, служащие не только механическим, но и стерилизующим препятствием. В противном случае вирус проникает далее вглубь организма. К инфицированному участку начинают активно прибывать фагоциты, которые ограничивают пораженную область от остальных здоровых тканей и ограничивают распространение инфекции.
К особенностям противовирусного иммунитета относится повышение температуры тела. При умеренной лихорадке (до 40 °С), с которой многие активно борются, активизируется иммуногенез, запускается метаболизм и увеличивается продуцирование интерферона – естественного противовирусного вещества. При высокой температуре тела возникает непосредственная инактивация внеклеточного агента, а его репродукция подавляется за счет снижения рН внеклеточной и внутриклеточной среды. В кислой среде инфекция погибает быстрее.
В отличие от бактерий, большинство вирусов легко проходят почечную систему, нисколько не отражаясь на функциональности органов. Буквально через час после заражения вирусы появляются в моче, что способствует скорейшему восстановлению относительного постоянства внутренней среды организма. Именно поэтому при вирусной инфекции пациенту рекомендуется пить как можно больше жидкости. При этом возбудители выделяются не только почками, но и слюнными железами, кишечником.
Вирус в крови: роль иммуноглобулинов, макрофагов, гормонов
К неспецифическим факторам противовирусного иммунитета относится гамма-глобулин, который содержится в сыворотке крови и участвует в процессе естественной нейтрализации вирусов.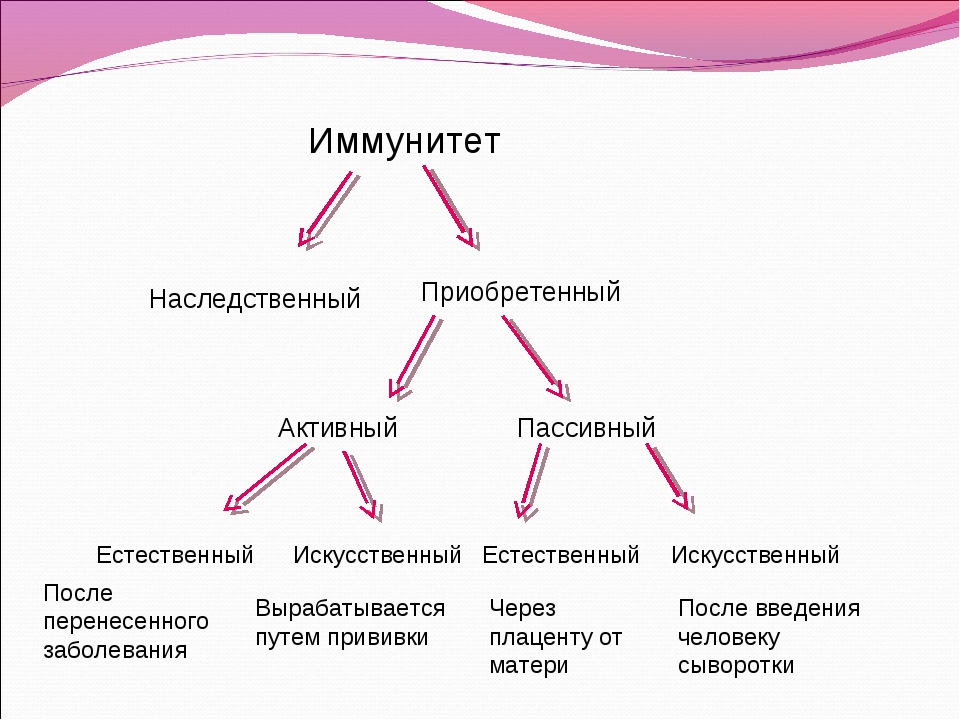 Похожую функцию выполняют и ингибиторы – неспецифические противовирусные белки, присутствующие в секрете эпителия слизистой органов дыхания и желудочно-кишечного тракта. Все эти элементы противовирусного иммунитета в микробиологии считаются основными факторами, подавляющими активность патогенов. Вирусы находятся вне чувствительной клетки, а именно в крови и других жидких тканях.
Похожую функцию выполняют и ингибиторы – неспецифические противовирусные белки, присутствующие в секрете эпителия слизистой органов дыхания и желудочно-кишечного тракта. Все эти элементы противовирусного иммунитета в микробиологии считаются основными факторами, подавляющими активность патогенов. Вирусы находятся вне чувствительной клетки, а именно в крови и других жидких тканях.
Защитные функции ингибиторов такие же, как и у антител, что зависит от типа вирусной инфекции и его количественной нагрузки на организм. На активность ингибиторов и гамма-глобулина влияют индивидуальные и возрастные особенности. Противовирусный иммунитет выше при низком содержании ингибиторов, поскольку они имеют свойство освобождаться и восстанавливать свою активность. У людей зрелого возраста ингибиторов становится больше, но нейтрализованный ими вирус впоследствии становится объектом влияния других иммунологических факторов.
На резистентности к вирусной инфекции сказывается баланс гормонального фона. Так, например, увеличение концентрации кортизона в организме снижает защитные функции, а в малых дозах – повышает. Отдельного внимания среди факторов противовирусного иммунитета заслуживают макрофаги – клетки, фагоцитирующие чужеродные частицы при попадании последних в кровоток. Защищают организм от вирусов такие макрофаги:
Так, например, увеличение концентрации кортизона в организме снижает защитные функции, а в малых дозах – повышает. Отдельного внимания среди факторов противовирусного иммунитета заслуживают макрофаги – клетки, фагоцитирующие чужеродные частицы при попадании последних в кровоток. Защищают организм от вирусов такие макрофаги:
Все эти элементы участвуют в процессах образования антител, кооперируясь с Т- и В-лимфоцитами. Вирусный агент адсорбируется и поглощается лейкоцитами, но в дальнейшем его разрушение не происходит и процесс приостанавливается на этапе фагоцитоза. В завершении этого процесса нет явной необходимости. Макрофаги не способны переваривать вирусы, а это главный принцип защиты, поэтому фагоцитозу отведена второстепенная роль в иммунологии. Противовирусный иммунитет в данном случае больше зависит от интерференции организма.
Интерферон лейкоцитарный человеческий
Если инфекция преодолевает вышеуказанные общие физиологические и гуморальные факторы, ей удается проникнуть в чувствительную клетку. После этого запускается процесс внутриклеточного развития вируса, но в некоторых случаях проникновение инфекции не всегда сопровождается внутриклеточным поражением. Морфологически клетка не меняется, никаких деструктивных процессов в ней не происходит, поэтому в дальнейшем она становится устойчивой к штаммам этого вируса.
После этого запускается процесс внутриклеточного развития вируса, но в некоторых случаях проникновение инфекции не всегда сопровождается внутриклеточным поражением. Морфологически клетка не меняется, никаких деструктивных процессов в ней не происходит, поэтому в дальнейшем она становится устойчивой к штаммам этого вируса.
Противовирусный иммунитет, выработанный в результате вирусной интерференции, считается самым сильным. В его материальной основе лежит продуцирование особого вещества – интерферона. Этот белок образуется как ответная реакция на проникновение патогена в клетку. Интерферон обладает противовирусными, антипролиферативными и иммуномодулирующими свойствами и теряет свою активность, но не погибает при низких температурах. Разрушить его можно воздействием ультрафиолета и высоких температур (выше 60 °С).
В крови интерферон появляется спустя 1-2 часа после проникновения вируса и максимальной концентрации достигает через 4-8 ч. Белок возникает как реакция в ответ не только на проникновение вирусов, но и бактерий, продуктов их жизнедеятельности, являясь основным элементом противовирусного иммунитета.
Интерферон присутствует в крови, моче, спинномозговой жидкости, секрете носоглотки, в почках, легких и в соединительной ткани организма. Его вырабатывают практически все клетки, но в большей степени этот белок продуцируется селезенкой и лейкоцитами. Принцип действия интерферона состоит в подавлении функции размножения вируса при полном сохранении жизнедеятельности клетки.
Отличие приобретенного иммунитета от врожденного
Иммунная система защиты организма от патогенных микроорганизмов бывает двух видов – врожденной и приобретенной. С точки зрения иммунологии предназначение приобретенного иммунитета, который появляется у человека в течение жизни, заключается в поддержке врожденного. В отличие от врожденного иммунитета, который имеется от рождения и активизируется при вторжении чужеродного микроорганизма, приобретенный иммунитет формируется только после контакта с инфекцией и активизируется в случае ее повторной атаки.
Один из способов получить приобретенный иммунитет к тому или иному вирусу – пройти вакцинацию. При первоначальном контакте с чужеродным агентом запускается несколько действий, которые приводят к запуску работы лимфоцитов и синтезу белков, обладающих повышенной реактивностью против чужеродных частиц. В результате этого процесса организм приобретает защитную систему, которая уверенно противостоит последующим атакам.
При первоначальном контакте с чужеродным агентом запускается несколько действий, которые приводят к запуску работы лимфоцитов и синтезу белков, обладающих повышенной реактивностью против чужеродных частиц. В результате этого процесса организм приобретает защитную систему, которая уверенно противостоит последующим атакам.
Люди, которым удалось выжить при течении смертельно опасных эпидемий бубонной чумы и оспы, в последующем проявляли большую устойчивость к инфекции, чем те, кто ни разу не встречался с болезнью. Открывателем приобретенного противовирусного иммунитета считают англичанина Э. Дженнера.
В конце XVIII века этот врач провел научно-практический эксперимент, за который сегодня был бы лишен лицензии и попал под суд. Дженнер ввел ребенку ничтожную дозу гноя, изъятого из очага поражения у женщины, болевшей коровьей оспой. Таким образом, он попытался намеренно заразить ребенка, но эксперимент прошел успешно: заболевание так и не возникло, несмотря на контакт с возбудителем.
История вакцинации
После проведенного эксперимента по выработке у ребенка приобретенного иммунитета к коровьей оспе многие ученые озадачились созданием теории иммунизации. Но о вакцинации в широких массах стало известно лишь через сотню лет после эксперимента Дженнера. Кроме того, исследователи смогли установить, что иммунитет формируется не только к вирусам и бактериям, но и к продуктам их жизнедеятельности.
Сегодня доказанным фактом является то, что иммунная защита возникает в отношении бесчисленного множества естественных и искусственных элементов, включая металлы, химические соединения с низкой молекулярной массой, белки, углеводы, нуклеотиды и другие антигены, в ответ на которые возникает иммунная реакция.
Основные средства для укрепления иммунитета
Для усиления свойств противовирусного иммунитета, необходимых для борьбы с различными инфекциями, фармакологическая отрасль занимается разработкой лекарственных препаратов, относящихся к категории противовирусных и иммуностимулирующих. Вне зависимости от причины ослабления иммунитета, выбор такого медикамента следует доверять врачу-иммунологу. На сегодняшний день выпускаются иммуномодулирующие средства в различных лекарственных формах для взрослых и детей.
Вне зависимости от причины ослабления иммунитета, выбор такого медикамента следует доверять врачу-иммунологу. На сегодняшний день выпускаются иммуномодулирующие средства в различных лекарственных формах для взрослых и детей.
Классифицируют их следующим образом:
В раннем возрасте
Лекарства, укрепляющие противовирусный иммунитет и повышающие защитные свойства организма у детей, важно выбирать с учетом индивидуальных особенностей развития ребенка. Необходимости в назначении иммуномодуляторов детям младше шестимесячного возраста, как правило, не возникает, потому что с самого рождения надежную защиту детскому организму обеспечивает материнский иммунитет. После полугода наступает период перехода иммунной защиты на продуцирование собственных иммуноглобулинов.
После полугода наступает период перехода иммунной защиты на продуцирование собственных иммуноглобулинов.
Детям, не достигшим трех лет, для повышения иммунного статуса врачи назначают препараты из серии интерферонов. В более старшем возрасте эффективнее применять растительные средства либо медикаменты с нуклеиновой кислотой.
Иммуномодуляторы на натуральной основе
Одним из самых популярных растений, которые используются в медицине для повышения тонуса иммунной системы, считается эхинацея. Препараты, содержащие этот компонент, выпускают в форме таблеток, настоек, капель. Для детей и взрослых, часто болеющих ОРВИ, врачи назначают «Иммунал» – препарат на основе эхинацеи. Лекарство содержит сок этого полезного растения и обогащен минеральными веществами. В форме таблеток «Иммунал» назначается взрослым и детям с 12 лет. Пациентам младше этого возраста назначают капли.
Помимо эхинацеи, используются и другие средства для повышения иммунитета. Противовирусными свойствами обладают не менее эффективные:
 Лекарство не просто укрепляет организм, но и придает жизненных сил, бодрости.
Лекарство не просто укрепляет организм, но и придает жизненных сил, бодрости.Препараты с бактериями, повышающие иммунитет
Чтобы повысить устойчивость к заражению, применяются особые стимуляторы для иммунитета. Противовирусные средства такого типа содержат ничтожное количество микробов, частицы их структур. В результате попадания веществ в организм возникает ответная реакция. К бактериальным препаратам с иммуностимулирующими свойствами, относятся:
Лекарства с интерфероном
Сомнений в том, насколько высока эффективность интерферонов, у врачей нет. Препараты этой группы назначают при первых симптомах простудных заболеваний, а также в период обострения хронических вирусных инфекций. Противовирусные препараты для иммунитета позволяют остановить развитие симптомов болезни, повысить общую сопротивляемость организма. Однако в профилактических целях интерферон не используется.
Однако в профилактических целях интерферон не используется.
Самый дешевый, распространенный и универсальный вариант лечения – это использование ампул «Интерферон лейкоцитарный». Выпускается средство в форме сухого порошка, которое перед использованием необходимо разбавлять водой. Готовый раствор можно капать в нос или делать с ним ингаляции.
Еще один препарат с интерфероном – это «Виферон», который выпускают в форме ректальных суппозиториев и мази. Ограничений в применении этого лекарства нет: его назначают и взрослым, и детям, и беременным женщинам.
«Анаферон» – гомеопатическое средство, которое укрепляет клеточный и гуморальный иммунитет. Таблетированный препарат выпускается отдельно для взрослых и для детей, быстро купирует симптоматику вирусных инфекций. Кроме того, «Анаферон» иногда назначают с целью профилактики вторичного бактериального заражения.
К препаратам интерферона относят также индукторы интерферона, содержащие нуклеиновые кислоты – «Ридостин», «Деринат», «Полудан». Эти препараты помогают укрепить как врожденный, так приобретенный иммунитет.
Эти препараты помогают укрепить как врожденный, так приобретенный иммунитет.
Другие иммуностимуляторы
К противовирусным препаратам, повышающим иммунитет, относятся биогенные средства наподобие экстракта алоэ, каланхоэ в ампулах, «ФиБС» и пр. Они действуют в отношении всего организма, активизируя синтез главных действующих компонентов для ответа на негативное влияние инфекционного агента.
Помимо биогенных стимуляторов, также стоит отметить иммуномодулирующие свойства препаратов вилочковой железы («Тимозин», «Вилозен», «Спленин»). Их производят из экстракта тимуса крупного рогатого скота. Такие лекарства применяют в качестве внутримышечных инъекций, интраназальных капель или сублингвальных таблеток для рассасывания.
В категорию искусственных стимуляторов неспецифического действия включены витаминно-минеральные комплексы, содержащие коферменты – низкомолекулярные соединения белков со структурами небелкового типа.
Скрытые свойства для повышения терапевтической эффективности лекарств Наноносители
За последние несколько десятилетий наноносители для доставки лекарств превратились в мощные инструменты с неоспоримым потенциалом для повышения терапевтической эффективности противоопухолевых препаратов. Многие коллоидные системы доставки лекарств недостаточно развиты, чтобы улучшить локальную специфичность действия лекарства и уменьшить системные побочные эффекты. Благодаря небольшому размеру их можно вводить внутривенно и помещать в ткани-мишени, где они высвобождают лекарство.Наноносители активно взаимодействуют с окружающей средой, а именно с сосудами эндотелия, а также клетками и белками крови. Следовательно, они быстро удаляются из кровотока, в основном, системой мононуклеарных фагоцитов. Чтобы придать наносистемам свойства длительной циркуляции, были разработаны новые технологии, направленные на модификацию поверхности их физико-химических свойств. В частности, наноносители-невидимки могут быть получены путем полимерного покрытия. В этой статье представлена основная концепция, подчеркивающая «скрытные» свойства наноносителей лекарственных средств, параметры, влияющие на характеристики полимерного покрытия с точки зрения взаимодействия опсонинов / макрофагов с коллоидной поверхностью, наиболее часто используемые материалы для процесса нанесения покрытия и результаты этого особые процедуры подробно обсуждаются.
Многие коллоидные системы доставки лекарств недостаточно развиты, чтобы улучшить локальную специфичность действия лекарства и уменьшить системные побочные эффекты. Благодаря небольшому размеру их можно вводить внутривенно и помещать в ткани-мишени, где они высвобождают лекарство.Наноносители активно взаимодействуют с окружающей средой, а именно с сосудами эндотелия, а также клетками и белками крови. Следовательно, они быстро удаляются из кровотока, в основном, системой мононуклеарных фагоцитов. Чтобы придать наносистемам свойства длительной циркуляции, были разработаны новые технологии, направленные на модификацию поверхности их физико-химических свойств. В частности, наноносители-невидимки могут быть получены путем полимерного покрытия. В этой статье представлена основная концепция, подчеркивающая «скрытные» свойства наноносителей лекарственных средств, параметры, влияющие на характеристики полимерного покрытия с точки зрения взаимодействия опсонинов / макрофагов с коллоидной поверхностью, наиболее часто используемые материалы для процесса нанесения покрытия и результаты этого особые процедуры подробно обсуждаются.
1. Введение
Рак является ведущей причиной смерти во всем мире, поскольку в 2008 г. на его долю приходилось 7,6 миллиона смертей (около 13% всех смертей) (источник: Информационный бюллетень ВОЗ № 297, февраль 2012 г.). Около 70% всех случаев смерти от рака приходятся на страны с низким и средним уровнем доходов. Прогнозируется, что в 2030 году количество смертей от рака превысит 13,1 миллиона (Globocan, 2008, IARC, 2010).
Тем не менее, за последние несколько десятилетий в фундаментальной биологии рака были достигнуты значительные успехи, позволившие значительно улучшить диагностику и терапию рака.Помимо разработки новых лекарств с сильным и избирательным действием, нанотехнологии предлагают новые возможности для борьбы с раком, предоставляя адекватные инструменты для раннего обнаружения и индивидуального лечения.
За последние десятилетия для тераностических целей был разработан ряд различных транспортных средств с длительным обращением. Эти носители имеют размер нанометрового диапазона, и большинство из них были предназначены для доставки противораковых препаратов в ткани, пораженные этой патологией.
Целью данной статьи является изучение особенностей «скрытых» длинно циркулирующих наноносителей и фармакокинетических последствий скрытности, а также будут продемонстрированы наиболее изученные подходы, обеспечивающие длительное распространение наноносителей, созданных на поверхности.
2. Процесс опсонизации
Селективная и контролируемая доставка противоопухолевых препаратов к пораженным тканям является необходимым условием для предотвращения системной токсичности, улучшения фармакологических профилей и улучшения комплаентности пациента, что, в свою очередь, способствует улучшению противоопухолевой терапии.
Из-за протекающей сосудистой сети и слабого лимфодренажа солидные опухоли представляют собой неустойчивую динамику жидкости и молекулярного транспорта. Эти особенности могут привести к специфическому накоплению систем доставки коллоидных противораковых лекарств в опухолевую ткань за счет усиленного эффекта проницаемости и удерживания (EPR) [1]. Однако для того, чтобы использовать физиопатологические и анатомические особенности опухолевых тканей, нановым средствам требуется длительная циркуляция в кровотоке, в идеале более 6 часов [2].
На постоянство кровотока нано-транспортных средств сильно влияют физические взаимодействия со специфическими компонентами циркулирующей крови, опсонинами. Эти компоненты преимущественно включают белки комплемента, такие как C3, C4 и C5, ламинин, фибронектин, C-реактивный белок, коллаген I типа и иммуноглобулины [3].
Поверхностная опсонизация способствует удалению частиц из кровообращения в течение от секунд до минут через мононуклеарную фагоцитарную систему (MPS), также известную как ретикулоэндотелиальная система (RES), и клетками Купфера, фагоцитарными макрофагами, постоянно расположенными в печени [4].Естественная роль опсонинов — способствовать приближению бактерий и вирусов фагоцитарными клетками, причем обе системы имеют одинаковый отрицательный заряд, который подавляет взаимодействие между бактериями / вирусами и фагоцитами из-за отталкивания зарядов [5]. После бактериального и вирусного покрытия опсонины претерпевают конформационные перестройки, которые вызывают биораспознавание фагоцитами через специфические мембранные рецепторы. Опсонизация ксеночастиц белками комплемента, более 30 растворимыми и мембраносвязанными белками, вызывает активацию комплемента через каскад физиологических событий.Опсонизация в конечном итоге способствует процессу удаления фагоцитами [4].
Комплемент — ключевой компонент врожденного иммунитета, который естественным образом контролирует захватчиков-хозяев с помощью трех различных путей активации, описанных на Рисунке 1 [6].
Классический путь активируется после фиксации белков C1q к антителам или рецепторам C1q на поверхности клетки. Альтернативный путь самопроизвольно активируется путем связывания фрагментов C3 с поверхностью патогена.Лектиновый путь активируется связыванием маннозо-связывающего лектина с маннозой, содержащейся на поверхности короны бактерий и вирусов. Хотя было предложено несколько гипотез для объяснения существования дополнительных путей активации, они не были полностью выяснены.
Независимо от пути активации ферментативный каскад активации комплемента приводит к образованию общего фермента, C3-конвертазы, который расщепляет центральный белок системы комплемента, третий компонент C3 [7].Фрагмент C3b из C3 является критически важным активным компонентом, который запускает расщепление множества белков комплемента (C5 – C9). Сборка этих белков способствует образованию комплекса атаки на мембрану (MAC), который способен дестабилизировать бактерии, вирусы и наноносители для доставки лекарств. C3b и его неактивный фрагмент iC3b могут распознаваться специфическими рецепторами на фагоцитарных клетках, что приводит к поглощению опсонизированных частиц и их удалению из кровотока.
Кроме того, активация комплемента запускает каскад воспалительных и неблагоприятных сложных реакций, называемых псевдоаллергией, связанной с активацией комплемента (CARPA), которые отражаются в симптомах преходящего сердечно-легочного расстройства.Эти эффекты подробно описаны в литературе [8–11].
Система комплемента также тонко регулируется присутствием белков-ингибиторов, таких как C1 INH, фактор I и H [12].
Хотя естественная роль опсонизации направлена на защиту организма от ксеногенных наносистем, этот процесс способствует удалению циркулирующих наноносителей лекарств. Это представляет собой серьезное препятствие для достижения адекватных системных и местных терапевтических концентраций лекарственных средств.
2.1. Стерические экранирующие и скрытые свойства наноносителей
В кровотоке опсонины взаимодействуют с наночастицами за счет ван-дер-ваальсовых, электростатических, ионных и гидрофобных / гидрофильных сил. Следовательно, поверхностные особенности наноносителей играют ключевую роль в процессе опсонизации. Гидрофобные и заряженные частицы подвергаются более высокой опсонизации по сравнению с гидрофильными и нейтрально заряженными частицами [13–16].
В последние десятилетия были предприняты различные теории для описания фармакокинетических профилей наноразмерных систем доставки лекарств, а именно липосом и полимерных наночастиц.В настоящее время признано, что наноносители с длинной циркуляцией, «стелс-системы», могут быть получены путем покрытия поверхности гидрофильными полимерами, предотвращающими процесс опсонизации [17–19]. Следствием отказа от опсонизации является продление стабильности липосом и частиц в кровотоке с нескольких секунд до нескольких часов [17, 20, 21].
Пеппас описал влияние гидрофильной полимерной оболочки на поверхность наночастиц с точки зрения сил упругости. Он сосредоточил внимание на ПЭГ, который является наиболее представительным из материалов, используемых для создания стелс-наноносителей.В соответствии с их гидрофильным и гибким характером цепи ПЭГ могут приобретать протяженную конформацию на поверхности частиц. Опсонины, привлеченные к поверхности частицы, сжимают протяженные цепи ПЭГ, которые переходят в более конденсированную и более высокоэнергетическую конформацию. Как следствие, силы отталкивания уравновешивают силы притяжения между опсонинами и поверхностью частицы [22].
При низкой плотности полимера на поверхности частицы, когда полимерные цепи не могут взаимодействовать с окружающими цепями и могут свободно схлопываться на поверхности, полимерные цепи обеспечивают стерическое отталкивание на расстоянии h согласно уравнению
В уравнении — стерическая сила отталкивания, относящаяся к модели «гриба» (), — это протяженность полимера над поверхностью =, — это среднее расстояние между соседними точками прививки, — это размер сегмента и — степень полимеризации.
При высокой плотности полимера полимерные цепи расширяются и взаимодействуют друг с другом, создавая стерическую силу отталкивания, описанную в модели «щетки» (br):
Эти уравнения описывают явления отталкивания, возникающие на плоских поверхностях. Однако их можно должным образом разработать для получения информации об отталкивающих стерических барьерах, создаваемых адсорбированными полимерами на искривленных поверхностях стелс-наночастиц [23].
2.2. Полимеры, используемые для покрытия наноносителей
Длинные циркулирующие наноносители обычно получают путем покрытия поверхности полимером, которое придает системам скрытные свойства [24].В доставке лекарств термин «незаметность», переводимый с «малозаметной технологии», применяемой к военной тактике, относится к нано-транспортным средствам, которые невидимы для биологической системы, участвующей в удалении частиц из кровотока, а именно, RES и клеток Купфера.
До сих пор было сделано много усилий для получения скрытых продуктов путем модификации поверхностных свойств наноносителей с помощью полимеров, которые предотвращают опсониновые взаимодействия [25] и последующий клиренс фагоцитов [26–28].
Полимеры, используемые для придания скрытных свойств наночастицам и нанопузырькам, имеют несколько основных общих характеристик: высокую гибкость и высокую гидрофильность.Для этих целей использовались либо природные и полусинтетические полисахариды, либо синтетические полимеры. Декстран (Dex), полисиаловая кислота (PSA), гиалуроновая кислота (HA), хитозан (CH) и гепарин являются наиболее часто используемыми природными полисахаридами. Синтетические полимеры включают поливинилпирролидон (ПВП), поливиниловый спирт (ПВС), полиакриламид (ПАМ), поли (этиленгликоль) (ПЭГ) и сополимеры на основе ПЭГ, такие как полоксамеры, полоксамины и полисорбаты.
2.2.1. PEG
Поли (этиленгликоль) (PEG) — предпочтительный полимер для производства невидимых наноносителей.Этот нейтральный, гибкий и гидрофильный материал может фактически правильно создавать поверхностные барьерные слои, которые уменьшают адгезию опсонинов, присутствующих в сыворотке крови, к наночастицам, делая их «невидимыми» для фагоцитирующих клеток. Отталкивание белков, управляемое ПЭГ, также было визуализировано с помощью просвечивающей электронной микроскопии при замораживании-разрушении (ПЭМ) [29].
Было принято несколько физических протоколов для покрытия наночастиц ПЭГ [22], даже несмотря на то, что эти процедуры влекут за собой риск десорбции полимера в крови с последующей потерей полезного вклада полимера [30].Для решения этой проблемы были разработаны протоколы ковалентного конъюгации с ПЭГ [31, 32]. Биоразлагаемые наночастицы с ковалентно связанным с поверхностью ПЭГ были получены с использованием производных ПЭГ поли (молочной кислоты), поли (молочной кислоты- и -гликолевой кислоты) [33] или поли (алкилцианоакрилатов) [34]. Наночастицы получают по протоколам эмульсии, осаждения или диспергирования в водной среде. Эти процедуры позволяют ориентировать ПЭГ в сторону водной фазы, в то время как фракция биоразлагаемого гидрофобного полимера физически запутана во внутренней матрице наночастиц [22].Альтернативно, цепи ПЭГ могут быть ковалентно конъюгированы с предварительно сформированными наночастицами через поверхностные функциональные группы [35, 36].
2.2.2. Полоксамин и полоксамер
Полоксамины (Tetronics) и полоксамеры (Pluronics) представляют собой амфифильные блок-сополимеры, состоящие из гидрофильных блоков этиленоксида (EO) и гидрофобных блоков мономерных единиц пропиленоксида (PO). Полоксамеры представляют собой триблок-сополимеры aba-типа (PEO-PPO-PEO), в то время как полоксамины представляют собой тетраблок-сополимеры PEO-PPO, соединенные через этилендиаминные мостики [(PEO-PPO) 2 –N – CH 2 –CH 2 –N– (ППО-ПЭО) 2 ] [37–39].
Эти полимеры могут физически адсорбироваться на поверхности наноносителя через гидрофобную фракцию ППО [22].
После внутривенной инъекции мышам и крысам поли (фосфазен) с длиной волны менее 200 нм, покрытый полоксамером или полоксамином [40], наночастицы PLGA [41] и липосомы [42, 43] не показали более продолжительного времени циркуляции по сравнению с аналоги без покрытия. Такое неожиданное поведение было приписано десорбции полимеров с поверхности наноносителя [30], а также способности полимера адсорбировать опсонины [44].Действительно, было обнаружено, что полимерная композиция влияет на опсонизацию частиц, поскольку опсонины могут связываться с фракцией гидрофобного полимера, которая может частично экспонироваться на поверхности частицы [45, 46]. Этот возможный эффект может дополнительно способствовать очищению наноносителей с полимерным покрытием.
Для данного триблочного полимера было обнаружено, что как поверхностная плотность полимера, так и толщина слоя покрытия зависят от размера частиц: более мелкие частицы (менее 100 нм) адсорбируют меньше молекул полимера на единицу площади, чем более крупные частицы.Следовательно, поверхностная плотность полимера уменьшается с уменьшением размера частиц. Кроме того, адсорбция Плюроника на более крупных частицах относительно слабее, чем на более мелких, что может влиять на скорость и степень вытеснения адсорбированных полимеров компонентами крови [47].
Эффективность поверхностной адсорбции и стабильность полимерного покрытия строго связаны с полимерным составом, а именно, молярным соотношением PO / EO и длиной цепи PPO и PEO [44].
Pluronic F-108 NF (полоксамер 338) имеет более объемный центральный гидрофобный блок и более длинные боковые гидрофильные ответвления (122 мономера PEO; 56 мономеров PPO) по сравнению с Pluronic F-68 NF (76 мономеров PEO; 30 мономеров PEO). ППО).Соответственно, Pluronic F-108 NF образует более стабильные слои покрытия, чем Pluronic F-68 NF. In vivo наночастицы, модифицированные Pluronic F-68 NF, накапливаются в печени в количестве 74% от дозы за 1 ч, в то время как накопление в печени наночастиц, модифицированных Pluronic F-108 NF, составляло 67% [48].
2.2.3. Декстран
Декстран — полисахарид, широко используемый в биомедицинских целях, в том числе для украшения систем доставки лекарств в виде наночастиц [49].
Было обнаружено, что покрытие из декстрана придает липосомам свойства длительной циркуляции [50].Подобно ПЭГ стерическая кисть декстрана на поверхности везикулы снижает адсорбцию белка. Этот эффект приводит к повышенной стабильности липосом в крови [50], которая зависит от плотности молекул декстрана.
Интересно, что покрытие из декстрана 70 кДа также снижает всплеск высвобождения лекарственного средства из липосом [50].
Декстран был использован для покрытия суперпарамагнитных наночастиц оксида железа для магнитно-резонансной томографии [51, 52]. Частицы размером от 4 до 5 нм были покрыты 20-30 цепями декстрана, организованными в «щеткообразные» структуры, что уменьшало удаление из кровотока клетками Купфера и макрофагами селезенки.Период полувыведения из циркуляции был увеличен до 3-4 часов [52]. Незначительное распознавание макрофагами суперпарамагнитных наночастиц оксида железа, покрытых декстраном, было приписано опсонизации антидекстрановых антител.
2.2.4. Производные сиаловой кислоты для имитации природы
Производные сиаловой кислоты вызвали значительный интерес как потенциальные материалы, придающие наночастицам скрытые свойства для приложений доставки лекарств. Сиаловая кислота является компонентом поверхности эукариотических клеток и играет важную роль в предотвращении удаления собственной ткани за счет низкого уровня активации комплемента альтернативным путем.Десиалирование мембран эритроцитов приводит к снижению связывания фактора H на их мембране, что переключает их с неактиваторов на активаторы альтернативного пути комплемента [53, 54]. Фактор плазменной циркуляции H, адсорбированный на бактериях или на поверхности коллоидных систем, физиологически ингибирует их разрушение, опосредованное комплементом. Этот результат можно приписать действию фактора H как кофактора инактивации фактора комплемента C3b и конвертазы альтернативного пути [55].Следовательно, фактор H ведет себя как дизопсонин.
Surolia и Bachhawat продемонстрировали, что липосомы, покрытые производными сиаловой кислоты, плохо распознаются макрофагами, поскольку они имитируют поверхность клеток млекопитающих [56].
Наноносители Stealth были получены с использованием различных производных полисиаловой кислоты, включая ганглиозиды [57–61], производные ганглиозидов и гликофорин [62–64]. Напротив, покрытие оросомукоидным белком, богатым сиаловой кислотой, не давало скрытых наночастиц поли (изобутилцианоакрилата).Этот эффект был приписан низкой плотности сиаловой кислоты на поверхности частицы, которая не позволяет обеспечить надлежащее покрытие, или неэффективной конформации кластерных гликанов [65].
Липосомное покрытие с моносиалоганглиозидом GM1 (рис. 2), моносиалоганглиозидом, происходящим из ткани мозга, ингибирует альтернативный путь комплемента, способствуя ассоциации фактора H с фактором C3b на поверхности везикул [66]. У мышей украшение липосом с помощью 5-7 мол.% GM1, как было обнаружено, увеличивает стабильность везикул и ингибирует каскад активации комплемента, что приводит к длительному постоянству кровообращения [67].По мере увеличения молярного соотношения GM1 в липосомах ингибирование поглощения макрофагами увеличивается до 90% с 10 мол.% GM1 [64].
В нескольких исследованиях постулируется, что экранирование отрицательных зарядов GM1 объемными нейтральными гидрофильными частицами сахара имеет первостепенное значение для его скрытной активности [58]. Тем не менее, другие исследования показали, что макромолекулы, несущие неэкранированные отрицательные заряды, а именно ганглиозид GM3, синтетическое производное сиаловой кислоты и полусинтетическое соединение GM1, увеличивают время циркуляции крови липосом размером менее 200 нм у мышей [63].Таким образом, можно сделать вывод, что стерическая организация остатков ганглиозидов в первую очередь отвечает за предотвращение опсонизации липосом, содержащих гликолипиды.
Интересно, что исследования, проведенные на мышах и крысах, показали, что ганглиозиды обладают специфической активностью. Действительно, украшение GM1 было эффективным у мышей, в то время как оно не оказало никакого положительного влияния на время циркуляции липосом у крыс [63].
2.2.5. Цвиттерионные полимеры
Было показано, что производные цвиттерионных фосфолипидов снижают активацию комплемента, индуцированную липосомами [68].
На основании этих данных синтетические цвиттерионные полимеры использовались для создания скрытых систем доставки лекарств. Эти материалы связывают молекулы воды сильнее, чем полимеры, образующие водородные мостики, такие как ПЭГ. Кроме того, они обеспечивают электростатически индуцированную гидратацию [69], что снижает скорость адсорбции белков, клеток и бактерий на поверхностях [70, 71]. В отличие от амфифильных полимеров, а именно ПЭГ, который может частично внедряться в липидный бислой липосом [72, 73], цвиттерионные полимеры усиливают гидратацию областей полярных групп липидов на поверхности липосом и не нарушают стабильность липидного бислоя [ 74].
Липосомы, покрытые поли (цвиттерионным) 2 и 5 кДа поли (карбоксибетаином) -1,2-дистеароил- sn -глицеро-3-фосфоэтаноламин (поли (карбоксибетаин) -DSPE) (рис. 3), обладают такой же стабильностью, что и ПЭГилированный липосомы. После 4 дней инкубации при 37 ° C агрегации не наблюдалось. Повышенная гидратация и текучесть липосомальной мембраны, обеспечиваемая поли (цвиттерионным) компонентом, снижает ее проницаемость и объясняет пролонгированное высвобождение лекарственного средства по сравнению с пегилированными аналогами.In vivo, поли (цвиттерионный) полимер и липосомы, покрытые ПЭГ, показали сходные фармакокинетические профили, что позволяет предположить, что первый может использоваться в качестве альтернативы ПЭГ [75].
Поли (карбоксибетаин) более химически стабилен, чем ПЭГ, и имеет меньшее взаимодействие с белками в течение короткого и длительного времени [76]. Этот материал использовался для покрытия различных наночастиц, включая диоксид кремния [77], золото [78], оксид железа [79], PLGA [80] и наночастицы гидрогеля [81, 82]. В сыворотке наночастицы с покрытием продемонстрировали превосходную устойчивость к агрегации, что указывает на незначительную опсонизацию по сравнению с другими скрытыми частицами [83].Такое поведение выражается в исключительно низком неспецифическом поглощении клетками. Например, интернализация сшитых наногелей поли (карбоксибетаин) / оксида железа клетками HUVEC и макрофагами практически не обнаруживалась [79].
2.2.6. Полиглицерины
Полиглицерины (PG) — это биосовместимые и гибкие гидрофильные алифатические простые полиэфирполиолы с противообрастающим эффектом, сравнимым с PEG [84]. Благодаря своей поливалентности, которая позволяет конъюгацию нацеливающих агентов, лекарств, меток и физических модификаторов [85], эти полимеры широко изучались в качестве носителей лекарств.
Липосомы, украшенные PGs, демонстрируют увеличенное время циркуляции крови и сниженное поглощение печенью и селезенкой [86].
Самособирающиеся монослои (SAM) дендритных PG осаждались на поверхности золота через дисульфидную линкерную группу (тиоктовая кислота). Измерения поверхностного плазмонного резонанса (SPR) показали, что монослои PG эффективно предотвращают адсорбцию белков. Был сделан вывод, что дендритные PG ведут себя как антиопсонические материалы, потому что они сочетают в себе характерные структурные особенности нескольких устойчивых к белкам материалов: гибкую структуру алифатического полиэфира, гидрофильные поверхностные группы и сильно разветвленную архитектуру [84].Ингибирование адсорбции белков гиперразветвленным полиглицерином было более эффективным, чем линейный ПЭГ аналогичной молекулярной массы [87] и декстран. Кроме того, PG обладают повышенной устойчивостью к нагреванию и окислительному стрессу по сравнению с PEG, что делает их потенциальными кандидатами для биомедицинского применения [84].
2.2.7. Полиакриловые и поливиниловые полимеры
Для покрытия липосом были приготовлены синтетические полиакриловые и поливиниловые полимеры, содержащие гидрофобные части. Гидрофобная функция позволяет полимеру закрепляться на поверхности частицы.
Было обнаружено, что производные поли (акриламида) (PAA), поли (винилпирролидона) (PVP) и поли (акрилоилморфолина) (PAcM) оказывают сравнимые скрытые эффекты на концевых пальмитоил- или фосфатидилэтаноламинах (PE-) липосомы in vivo. Это поведение зависит от длины гидрофобной алкильной функции, молекулярной массы полимера и его поверхностной плотности [88, 89].
Сравнительные исследования, проведенные с PAA, PVP и PEG, функционализированными пальмитоилом или PE 6-8 кДа, показали, что производное PEG имеет несколько лучшие характеристики по сравнению с другими полимерами.Макромолекулы, содержащие более короткие гидрофобные фрагменты, чем пальмитоил- или фосфатидилэтаноламин-, а именно додецилалкильные цепи или полимер с более высокой молекулярной массой (12-15 кДа), показали меньшее влияние на время циркуляции липосом. Короткие гидрофобные фрагменты не могут эффективно закрепить полимер на поверхности липосом, поскольку энергия движения полимерной цепи выше, чем энергия взаимодействия закрепляющей алкильной цепи с липосомным фосфолипидным бислоем [88, 90]. Чем выше молекулярная масса полимера, тем выше свободная энергия открытых полимерных цепей.Следовательно, полимер может отщепляться in vivo, вызывая опсонизацию липосом и удаление посредством RES [91].
Толщина слоя поливинилового спирта (6, 9 и 20 кДа ПВС), дериватизированного с C 16 H 33 –S– в качестве гидрофобного якоря (PVA-R) на поверхности липосом, была прямо пропорциональна молекулярной массе полимера и концентрации раствора полимера, используемого для нанесения покрытия. Кроме того, было обнаружено, что плотность PVA-R на поверхности липосом увеличивается по мере уменьшения молекулярной массы полимера.PVA-R на липосомах не отделялся при разведении или в присутствии сыворотки, предотвращая адсорбцию белков плазмы. In vivo липосомы, покрытые PVA-R, показали длительную постоянство в кровотоке, которое увеличивалось по мере увеличения молекулярной массы PVA. Время циркуляции липосом, покрытых 1,3% моль 20 кДа PVA-R, было сопоставимо со временем циркуляции липосом, покрытых 8% моль 2 кДа PEG-1,2-дистеароил- sn -глицеро-3-фосфоэтаноламин (PEG- DSPE). Подробные исследования показали, что повышенная стабильность в кровотоке была строго связана со стабильностью PVA-R на поверхности липосом, которая была выше по сравнению с PEG-DSPE [92].
2.3. Требования к поверхности для создания длинных циркулирующих наноносителей
Способность гидрофильных полимеров отталкивать белки строго зависит от полимерного состава, молекулярной массы полимера, плотности на поверхности носителя, толщины покрытия, конформации, гибкости и архитектуры цепей. . Кроме того, эта способность зависит также от физико-химических свойств закрепляющих фрагментов, которые позволяют прикреплять полимер к поверхности частицы.
2.3.1. Архитектура и молекулярный вес производных ПЭГ
Длина полимерных цепей на поверхности скрытых частиц должна превышать диапазон сил Ван-дер-Ваальсова притяжения с растворимыми белками в основной массе и фагоцитарными клетками [93]. В случае ПЭГ молекулярная масса 2 кДа считается нижним порогом, гарантирующим предотвращение макрофагов. По мере увеличения молекулярной массы полимера период полураспада ПЭГилированных частиц в кровотоке увеличивается [34, 94].Исследование, проведенное с наночастицами, собранными с использованием блок-сополимера PEG-PLA, продемонстрировало, что PEG 5 кДа обладает максимальной способностью снижать адсорбцию белка, которая уступает поглощению фагоцитарными клетками [33, 95].
Высокочувствительная дифференциальная сканирующая калориметрия была использована для оценки влияния размера ПЭГ и длины ацильной цепи конъюгата ПЭГ-фосфолипид на физическую стабильность липосом [96]. Исследование проводилось с липосомами, полученными с использованием ПЭГ-дипальмитоилфосфатидилэтаноламина (PEG-DPPE) и дипальмитоилфосфатидилхолина (DPPC).Смешанная ламеллярная / мицеллярная фаза была получена с композициями, содержащими более 7% моль ПЭГ-ДППЭ 1-3 кДа, в то время как полное превращение в мицеллы было достигнуто при концентрации ПЭГ-ДППЭ более 17% молей. Производные ПЭГ-ДПФЭ с высокой молекулярной массой (ПЭГ-ДПФЭ 12 кДа) не могут быть включены в бислой ДПФХ при всех концентрациях. ПЭГ-ДПФЭ 5 кДа, имеющий промежуточную молекулярную массу, частично смешивался с ДПФХ при концентрациях ниже 7% мол. Разделение фаз происходило выше 7% моль 5 кДа PEG-DPPE, тогда как переход в мицеллярное состояние выше 11% наблюдался вместе с разделением фаз.В заключение, стабильные скрытые липосомы могут быть получены с низким соотношением 3–5 кДа ПЭГ-ДППЭ.
Что касается гидрофобного закрепляющего фрагмента, более длинные алкильные цепи, чем DPPE, дают нестабильные липосомы. ПЭГ-ДСПЭ, внедренный в липосомный бислой дистеароилфосфатидилхолина (ДСПХ), способствовал разделению фаз даже при низком молярном соотношении ПЭГ-ДСПЭ (5%). Это можно приписать стерическому ограничению фрагмента DSPE внутри бислоя из-за высоких сил сцепления Ван-дер-Ваальса, которые ограничивают его подвижность.Это резко усиливает взаимодействия цепь / цепь PEG, которые приводят к высокой энергии смешивания и способствуют расслоению PEG-DSPE, сопровождаемому структурными перестройками бислоя. Разделение липидной фазы приводит к образованию доменов на поверхности липосом с низкой плотностью ПЭГ-ДСПЭ, что приводит к негомогенному покрытию ПЭГ и плохой стерической стабильности с быстрым опсонин-опосредованным клиренсом. Разделение фаз также может привести к утечке инкапсулированного лекарственного средства. С другой стороны, короткие алкильные цепи фосфолипидов, а именно, ПЭГ-димиристоилфосфатидилэтаноламин (ПЭГ-ДМФЭ), внедренные в липосомный бислой димиристоилфосфатидилхолина (ДМФХ), немного задерживают образование смешанных ламелл / мицелл при более высоком молярном соотношении ПЭГ-ДМФЭ (молярное отношение ПЭГ-ДМФЭ выше 10 %), чем ПЭГ-ДППЭ.Степень расслоения ПЭГ-фосфолипида из бислоев уменьшается по мере уменьшения алкильной цепи фосфолипида в порядке C18: 0> C16: 0> C14: 0.
2.3.2. Плотность ПЭГ
Плотность полимера на поверхности наноносителя так же важна, как и молекулярная масса полимера. Немногие авторы показали, что высокая поверхностная плотность полимера может компенсировать низкую молекулярную массу полимера при получении стелс-частиц [25, 95, 97]. Vittaz et al. исследовали потребление комплемента наночастиц ПЭГилированного PLA.Авторы пришли к выводу, что расстояние между двумя цепями 2 кДа ПЭГ 2,2 нм, соответствующее 0,2 молекулам ПЭГ / нм 2 может обеспечить эффективное покрытие частиц размером 100 нм с минимальным потреблением комплемента [98]. Исследования, проведенные с использованием человеческих фагоцитов, показали, что расстояние 1,4 нм между цепями ПЭГ-5 кДа оптимально давало скрытые наночастицы ПЭГ-ПЛА размером 190–270 нм [33]. Однако стоит отметить, что порог плотности полимера зависит от ряда параметров, включая размер частиц и кривизну поверхности.
Исследования, проведенные путем декорирования покрытых золотом частиц диоксида кремния с 750 и 2000 Да метокси-ПЭГ, показали, что плотность полимера 0,5 цепи / нм 2 является критическим порогом для предотвращения адсорбции белков плазмы [99].
Низкое потребление комплемента наблюдалось в случае нанокапсул 26 нм, покрытых стеаратом 1,5 кДа. Было обнаружено, что отталкивание белков зависит от плотности полимера, а не от длины полимерной цепи [25, 100]. Поверхность нанокапсулы покрыта одним ПЭГ-1.Молекула 5 кДа-стеарата оценивается как примерно 2,8 нм 2 , что соответствует расстоянию примерно 1,7 нм между двумя цепями PEG, что хорошо согласуется с результатами, описанными выше. В результате низкой опсонизации и потребления комплемента эти наночастицы продемонстрировали более продолжительное время пребывания в крови, при этом 20% дозы все еще присутствовало в крови через 24 часа после инъекции [101].
Однородное поверхностное полимерное покрытие вместе с плотностью полимера является ключевым параметром для получения невидимых частиц.Исследование показало, что 30% ПЭГилированного полистирола нано
От бактерицидного действия к победе
Нейтрофил является основным фагоцитом и конечной эффекторной клеткой врожденного иммунитета, играющей главную роль в очищении от внеклеточных патогенов. Используя широкий спектр цитокинов, внеклеточных ловушек и эффекторных молекул в качестве гуморального рычага, нейтрофилы играют решающую роль в защите хозяина от инфекций патогенными микроорганизмами. С другой стороны, патоген обладает способностью преодолевать опосредованную нейтрофилами защиту хозяина, чтобы установить инфекцию, вызывающую заболевание человека.Патогены, такие как S. aureus , обладают потенциалом препятствовать хемотаксису и фагоцитозу нейтрофилов и, таким образом, предотвращают гибель нейтрофилов. Кроме того, S. aureus , выживающее в нейтрофилах, способствует цитолизу нейтрофилов, что приводит к высвобождению производных от хозяина молекул, которые способствуют местному воспалению. Здесь мы предоставляем подробный обзор механизмов, с помощью которых нейтрофилы убивают внеклеточные патогены, и как патогены избегают деградации нейтрофилов.Этот обзор предоставит информацию, которая может быть полезна для разработки новых методов лечения инфекций, вызываемых устойчивыми к антибиотикам патогенами.
1. Введение
Иммунная система защищает организм от микробов, которые вторгаются и причиняют вред хозяину. У человека около 100 миллиардов нейтрофилов входят и покидают циркулирующую кровь каждый день [1] и составляют доминирующую популяцию лейкоцитов в кровотоке, опосредуют самые ранние врожденные иммунные реакции на инфекцию и играют ключевую роль в разрешении микробных инфекций.Нейтропения, приобретенная или наследственная нейтропения и нарушение функции нейтрофилов приводят к повторяющимся, опасным для жизни инфекциям, вызванным бактериями [2].
Нейтрофилы образуются и созревают в костном мозге, а затем высвобождаются в периферическую сосудистую сеть. После того, как патоген преодолевает эпителиальные барьеры, нейтрофилы являются первыми клетками врожденного иммунитета, которые быстро привлекаются из кровотока к участкам инфекции. Проникновение патогенов и их репликация в тканях хозяина приводят к высвобождению экзогенных продуктов, таких как формилпептиды, липопротеины или пептидогликан.Более того, инвазивный патоген может также повреждать ткани организма, которые производят воспалительные сигналы, например, хемоаттрактанты и цитокины [3]. Эти патогенные продукты и воспалительные сигналы обнаруживаются нейтрофилами через Toll-подобные рецепторы (TLR), рецепторы, связанные с G-белком (GPCR), и родственные иммунные рецепторы. Чувствуя сигнал рецептора, нейтрофилы будут реагировать на эти стимулы, выходить из кровеносных сосудов и мигрировать к месту инфекции, чтобы фагоцитировать патогены. Этот многоступенчатый процесс включает скользящую адгезию нейтрофилов к эндотелиальным клеткам, прочную адгезию нейтрофилов, экстравазацию через эндотелий, хемотаксическую миграцию и последующее уничтожение вторгающихся бактериальных патогенов.После миграции к месту инфицирования и фагоцитоза нейтрофилы имеют в своем распоряжении целый набор антимикробных препаратов для выполнения этой функции [4]. Нейтрофилы используют комбинацию реактивных форм кислорода (АФК), производных НАДФН-оксидазы, цитотоксических гранулярных компонентов, антимикробных пептидов и внеклеточных ловушек нейтрофилов (NET) для создания высоколетальной среды, необходимой для эффективного уничтожения и разложения микробов [5, 6] .
С другой стороны, многие патогены разработали эффективные стратегии, позволяющие перехитрить оружие нейтрофилов.Основные стратегии можно разделить на пять категорий: предотвращение экстравазации и хемотаксиса, предотвращение опсонизации и фагоцитоза, выживание внутри нейтрофила, индукция гибели клеток и предотвращение убийства в NET [7, 8]. В этом обзоре мы выделим набор механизмов, используемых нейтрофилами для устранения бактериальных инфекций, и соответствующую контратаку, осуществляемую бактериальными патогенами.
2. Фагоцитоз патогенных микроорганизмов, опосредованный нейтрофилами
Первоначальное уничтожение вторгшихся патогенных микроорганизмов из тканей человека опосредуется профессиональными фагоцитами.Для эффективного фагоцитоза нейтрофилы сначала должны покинуть кровоток и достичь места инфекции, что называется рекрутированием нейтрофилов. Кроме того, для инициации фагоцитоза требуется украшение бактерий опсонинами, которые распознаются специфическими поверхностными рецепторами, и этот процесс называется опсонизацией микробов. Наконец, нейтрофилы экспрессируют многочисленные рецепторы, которые распознают микроб посредством связывания его специфических молекул и белков-хозяев (таких как IgG и комплемент), что называется распознаванием патогенов.
2.1. Нейтрофилы мигрируют из кровотока в очаг инфекции
При нарушении патогенными микроорганизмами эпителия, нейтрофилы, первыми реагируя на микробную инвазию, покидают кровоток и перемещаются в очаг инфекции. Этот процесс рекрутирования состоит из трех основных этапов: начало присоединения к активированным эндотелиальным клеткам и перекатывание, остановка нейтрофилов, вызванная прочным прикреплением к эндотелию, и, наконец, миграция через эндотелиальный барьер к месту инфекции.
Начальный этап происходит через взаимодействие между гликопротеином P-селектин-гликопротеин-лигандом-1 (PSGL-1) нейтрофилов и P-селектином / E-селектином эндотелиальных клеток [9] (Рисунок 1 (a)). Благодаря этой слабой адгезии нейтрофилы могут катиться по эндотелиальным клеткам. Второй этап зависит от взаимодействия между β 2 интегринами (такими как LFA-1 и Mac-1), присутствующими на поверхности нейтрофилов, и молекулой межклеточной адгезии 1 (ICAM-1), присутствующей на эндотелиальных клетках (Рисунок 1 (a )).Последний шаг запускается хемокинами, выделяемыми клетками-хозяевами и бактериальными продуктами. Хемокин, производный от хозяина, такой как IL8, GRO- α , хемотаксический белок 2 гранулоцитов и компонент комплемента C5a / C3a, являются мощными провоспалительными медиаторами, которые используются для привлечения дополнительных нейтрофилов в области инфекции. Кроме того, миграция нейтрофилов также может быть вызвана хемокинами бактериального происхождения, такими как липотейхоевая кислота или N-формилпептиды (fMLP).
2.2. Фагоцитоз нейтрофилов зависит от опсонизации микробов
Инициирование фагоцитоза нейтрофилов зависит от опсонизации целевых микробов, которые распознаются специфическими поверхностными рецепторами нейтрофилов.Компоненты комплемента и иммуноглобулины (Ig) являются преобладающим фактором в сыворотке, который обеспечивает эффективную опсонизацию. Система комплемента человека состоит из более чем 30 белков и активируется одним из трех путей: классическим путем, лектиновым путем и альтернативным путем (рис. 2). Система комплемента использует три независимых пути, чтобы отличить бактерии от клеток-хозяев, а затем может быстро распознавать и опсонизировать бактерии или непосредственно убивать грамотрицательные бактерии путем образования комплекса мембранной атаки [10].Все три пути сходятся в сборке C3-конвертазы, которая представляет собой ферментные комплексы, состоящие из C4b2a и C3bBb (C4b2a для классического и лектинового путей и C3bBb для альтернативного пути). Конвертаза C3 катализирует ключевую реакцию активации комплемента: расщепление белка C3 комплемента приводит к высвобождению анафилактических агентов C3a и C3b. Большая часть C3b далее перерабатывается в iC3b с помощью фактора комплемента H и фактора комплемента I (рисунок 2). При высоких локальных концентрациях C3b конвертаза C3 превращается в конвертазу C5, которая расщепляет C5, что приводит к высвобождению сильнодействующих хемоаттрактантов C5a и C5b, которые инициируют литический путь при нанесении на грамотрицательные бактерии, тем самым усиливая опсонизацию. процесс.
Ig, которые являются вторым по распространенности белком в сыворотке / плазме, играют важную роль в опсонизации бактерий и последующем распознавании специфическим рецептором Fc, присутствующим на поверхности нейтрофилов. Несколько подтипов Ig (IgG, IgM и IgA) играют роль в контроле микробной инфекции (рис. 2). Различные подклассы Ig демонстрируют отчетливые различия в активации комплемента и рецептора Fc γ (Fc γ R). Нормальные нейтрофилы человека экспрессируют два основных Fc γ Rs, Fc γ RII и Fc γ RIIIB и не экспрессируют Fc γ R1 [11].IgG может активировать классический путь комплемента и нейтрализовать токсины или другие факторы вирулентности бактерий. IgM, благодаря своей полимерной природе, особенно эффективен при активации и опсонизации комплемента. В отличие от IgG и IgM, IgA не активирует систему комплемента.
2.3. Опосредованное рецептором распознавание патогенов и фагоцитоз
Как только нейтрофилы мигрируют к месту инфекции, опсонизированный патоген может быть распознан и фагоцитизирован посредством опосредованного рецептором захвата в вакуоль внутри клетки.Подобно другим фагоцитам, таким как макрофаги, нейтрофилы экспрессируют большое количество рецепторов, включая рецепторы распознавания образов (PRR), рецепторы, связанные с G-белком (GPCR) и опсонические рецепторы. Эти рецепторы могут распознавать связанные с микробами молекулярные структуры (MAMP) и белки-хозяева (такие как IgG и комплемент), которые использовались для опсонизации микроба (рис. 1 (b)). PRR могут распознавать патоген-ассоциированные молекулярные структуры (PAMP), такие как бактериальная ДНК, липополисахарид, пептидогликан и липотейхоевые кислоты.Основные типы PRR на нейтрофилах включают Dectin-1 (распознающий β -глюкан грибов), запускающий рецептор, экспрессируемый на миелоидных клетках-1 (TREM-1, распознающий бактерии и грибы) [12], и толл-подобные рецепторы (TLRs). , распознавая липиды, углеводы и пептиды). GPCR, которые экспрессируются на поверхности нейтрофилов, могут распознавать бактериальные продукты, а также эндогенные молекулы, высвобождаемые во время воспаления. Рецепторы формилового пептида 1 (FPR1) и его гомолог FPR2 принадлежат к семейству GPCR, распознают N-формилированные белки и пептиды (fMLP) и, следовательно, индуцируют и потенцируют хемотаксис, фагоцитоз и генерацию окислительного всплеска в нейтрофилах (Рисунок 1 ( б)).Инвазивные бактериальные патогены опсонизируются комплементом (например, C3b) и антителом (например, IgG), распознаются опсоническими рецепторами, включая Fc , γ Rs и рецепторы комплемента (CR), соответственно. Активация опсонических рецепторов быстро увеличивает эффективность фагоцитоза и имеет решающее значение для опосредованного нейтрофилами уничтожения патогенов [13].
3. Уничтожение патогенов нейтрофилами
Нейтрофилы — это первая линия клеток врожденного иммунитета, попадающих в место посева бактерий, где они задействуют различные противомикробные механизмы для предотвращения распространения патогенов в обычно стерильные участки.Процесс, с помощью которого нейтрофилы убивают вторгшиеся патогены, зависит от трех основных механизмов [14]: производство высокотоксичных активных форм кислорода (АФК) в вакуоли, содержащей патоген; слияние нейтрофильных гранул, содержащих различные антимикробные медиаторы, с вакуолью; Формирование NETs. Эти этапы также могут способствовать воспалительным заболеваниям, при которых лиганды откладываются на тканевых компонентах.
3.1. Фагоцитарное поглощение бактерий запускает производство ROS
Одновременно с фагоцитозом бактерий нейтрофилы производят окислительный всплеск, приводящий к быстрому высвобождению высоких уровней бактерицидных реактивных химических соединений при катализе НАДФН-оксидазы, миелопероксидазы (МПО) или оксида азота ( NO) синтетазы [15].НАДФН-оксидаза отвечает за образование АФК, таких как супероксид-анион (), пероксид водорода (H 2 O 2 ) и гидроксильные радикалы (HO ∙ ). НАДФН-оксидаза функционирует, перемещая электроны через фагосомную мембрану от цитозольного НАДФН к молекулярному кислороду для производства. Под действием супероксиддисмутазы (SOD) супероксид-анион легко превращается в пероксид водорода. H 2 O 2 и может объединяться для создания высокореактивного HO ∙ через th
Системы доставки лекарств, защита ЦНС и барьер для мозга
В настоящем обзоре рассматриваются различные системы доставки лекарств, используемые для доставки фармацевтических агентов, главным образом антибиотиков, противоопухолевых агентов, нейропептидов и других терапевтических веществ через эндотелиальные капилляры (BBB) для лечения ЦНС.Кроме того, было объяснено использование ультразвука для доставки терапевтических агентов / биомолекул, таких как богатые пролином пептиды, пролекарства, радиофармпрепараты, белки, иммуноглобулины и химерные пептиды, к целевым сайтам в глубоких тканях внутри опухолевых участков мозга. Кроме того, с их недавними достижениями обсуждались терапевтические применения различных типов наночастиц, таких как наномеры на основе хитозана, дендримеры, углеродные нанотрубки, ниосомы, носители бета-циклодекстрина, опосредованные холестерином катионные твердые липидные наночастицы, коллоидные носители лекарственных средств, липосомы и мицеллы.Акцент был сделан на необходимости физиологической и терапевтической оптимизации существующих способов доставки лекарств и их носителей для доставки терапевтического количества лекарства в мозг для лечения различных неврологических заболеваний и расстройств. Кроме того, даны строгие рекомендации по разработке наноразмерных носителей / носителей лекарств и неинвазивных терапевтических альтернатив традиционных методов для лучшего лечения заболеваний, связанных с ЦНС. Следовательно, существует острая необходимость в разработке нетоксичных биосовместимых лекарств и неинвазивных методов доставки для проверки клинических летальных исходов после лечения у невропатентов, которые происходят из-за существующих высокотоксичных инвазивных препаратов и методов лечения.
1. Введение
Мозг — это высокочувствительная и хрупкая система нейронных органов, которая нуждается в регулярном снабжении топливом, газами и питательными веществами для поддержания гомеостаза и других жизненно важных функций. Но ГЭБ — сосудистая сеть центральной нервной системы — действует как физический барьер и создает различные препятствия. Он подавляет доставку терапевтических агентов в ЦНС [1] и создает препятствия для доставки большого количества лекарств, включая антибиотики, противоопухолевые препараты и нейропептиды, для прохождения через эндотелиальные капилляры в мозг.Хотя для лечения заболеваний, связанных с ЦНС, было разработано несколько методов и стратегий доставки лекарств, большинство из них оказались инвазивными и не обладают целевой специфичностью. Более того, все традиционные методы доставки лекарств основаны на пробах и ошибках. Они неизменно применяются для доставки нескольких выбранных лекарств, которые имеют соответствующие отношения структура-активность или взаимодействия лекарство-рецептор, и его отношения структура-транспорт не нарушены [2]. Однако поддержание нормальных функций организма и транспорт различных биологических веществ, включая терапевтические агенты, через биологические мембраны крайне важны [3].Лишь немногие из существующих методов позволяют лекарствам подходить и успешно проходить через мембрану. Более того, новые методы доставки лекарств разрабатываются на основе рационального дизайна лекарств и использования высокопроизводительного скрининга взаимодействий рецептор-лиганд, чтобы найти подходящее лекарство среди тысяч новых соединений. Кроме того, для снижения токсичности лекарств после доставки были разработаны неинвазивные и менее токсичные лекарства и способы доставки. Следовательно, лекарство не следует выбирать только после обнаружения высокой аффинности связывания с рецептором при сквозном скрининге, но оно должно быть найдено подходящим на основе взаимосвязи структура-активность, связывания рецептора-мишени и его поведения в системе животных.Хотя возможно, что он может неизменно демонстрировать плохую проницаемость через мембрану in vivo , такие лекарства будут подвергаться незначительному транспорту через эндотелий капилляров головного мозга, который составляет гематоэнцефалический барьер (ГЭБ) in vivo [4].
Есть так много факторов, которые влияют на доставку лекарства или его способность преодолевать гематоэнцефалический барьер. Следовательно, возможно, что лекарство может связываться с нетранспортерами в большем количестве, что делает его неэффективным.Во-вторых, он кажется теоретически / ложно активным, но на самом деле он может показать неспособность пройти через гематоэнцефалический барьер с прилипшим белком. Следовательно, такие лекарства не могут быть доступны для мозга, потому что они не могут транспортироваться и доставляться через гематоэнцефалический барьер. Кроме того, действие фермента также делает лекарство неактивным или превращает его в нетерапевтическое промежуточное соединение. Однако из-за соображений растворимости мембранные барьеры не пропускают более крупные молекулы, в то время как молекулы меньшего размера переносятся в мозг.Точно так же заряженные молекулы быстро попадают в мозг [5]. Следовательно, липофильность не кажется необходимым или единственным фактором, который может способствовать безопасному проникновению препарата в мозг. Однако, по-видимому, существует роль множества факторов или сложных молекулярных свойств, которые делают лекарство способным проходить через ГЭБ. В более исключительных случаях проницаемость барьера также связана с мембраной или просветной поверхностью капилляра головного мозга, составом CSF или ISF, функциональными группами и изменениями на молекулярных и ионных поверхностях или присутствием заряженных остатков молекул [6].Кроме того, поверхностная активность молекул, их относительный размер и специфическое связывание с белками-переносчиками и энергетически управляемыми кассетами, а также открытие и закрытие ионных каналов из-за ионной концентрации являются ключевыми факторами, которые играют важную роль в доставке лекарств [7].
BBB неселективен для передачи лекарств путем диффузии или активного транспорта и создает серьезные препятствия для успешной разработки лекарств для ЦНС. Но это правда, что такие молекулы, как глюкоза и жиро / липидорастворимые препараты, могут быстро проникать в мозг.В отличие от этого, доставка многих типов лекарств в мозг очень затруднена из-за их нерастворимости в жирах. Помимо плохой проницаемости через мембрану, незначительный транспорт происходит через эндотелий капилляров головного мозга, что влияет на доступность лекарственного средства в теоретически значимой концентрации [8]. Основными причинами терапевтических неудач являются более медленное действие лекарства, меньшая абсорбция нейронами и другими клетками мозга, превращение молекулы лекарства в невзаимодействующий метаболит и ассоциация молекулы лекарства с другими лигандами, в основном с белками, которые не являются транспортными по природе.Хотя лекарство остается терапевтически доступным в биологической системе, оно становится неэффективным или приобретает некоторую активную молекулярную форму или преобразуется в высокоактивное молекулярное состояние в мозге. Это основная причина, по которой, когда лекарство проходит через барьер, оно может прилипать к нежелательному белку в больших количествах [9]. Кроме того, проблема может быть создана из-за присутствия в тканях мозга некоторых катаболических ферментов, которые могут изменить нативную форму лекарства или расщепить его до неактивной молекулы.Существует вероятность того, что активное лекарство может превратиться в медленно действующую молекулу лекарства, которая может разрушиться, как только попадет в ткань мозга, или каталитическая активность фермента сделает его бесполезным. Следовательно, активное проникновение, защита структуры-активности, доступность, диспергирование и действие лекарственного средства в целевой области крайне необходимы для лечения различных нарушений и заболеваний ЦНС. Кроме того, взаимодействия лекарственного средства с нейрональным рецептором, отношения структура-активность и отношения структура-транспорт; то есть проницаемость мембраны должна быть оценена для доставки любого лекарства в мозг.
Однако для введения лекарственного средства в мозг или спинномозговую жидкость или интраназальной доставки используется несколько подходов для прямой доставки лекарств или прямой доставки с усилением конвекции. Эти методы крайне небезопасны, инвазивны локально, метаболизируются или непродолжительны. В противоположность этому существуют безопасные методы доставки лекарственного средства через сосуды, которые проникают и распространяются в большей части мозга. Следовательно, для терапевтических целей крайне необходим активный перенос лекарства. Для этого очень важно более безопасное разрушение ГЭБ или его расшатывание для доставки препарата в мозг [10].Следовательно, для успешной доставки лекарств разрушение или открытие гематоэнцефалического барьера выполняется с помощью ультразвука и в основном используется в качестве внутриартериальной инфузионной терапии. Это позволяет как химиотерапевтическим агентам, так и антителам проникать через гематоэнцефалический барьер [11]. Следовательно, дисфункция ГЭБ может иметь большое терапевтическое значение в условиях, при которых повреждение нейронов является вторичным или усугубляется повреждением ГЭБ. Однако в терапевтических целях BBB может быть насильственно разрушен или разрушен ультразвуковыми звуковыми волнами для безопасной доставки лекарств или любого терапевтического агента в ЦНС.Но это принудительное открытие может привести к структурному повреждению ГЭБ и позволить неконтролируемое прохождение лекарств [12]. Кроме того, хорошо известно, что в некоторых областях мозга ГЭБ очень тонкий, или предполагается, что он рыхлый или слабый, откуда лекарство может легко попасть в мозг. Эти области также обеспечивают более свободный проход важных метаболических веществ в мозг. Они обнаруживаются в шишковидной железе, нейрогипофизе и области постремы. Следовательно, за счет уменьшения, остановки или изменения структуры и функции ГЭБ могут быть разработаны новые методы доставки химиотерапевтических агентов в случае опухоли головного мозга.Однако при любых обстоятельствах как состав лекарства, так и способы его доставки [13] должны учитываться для создания эффективных лекарственных форм для лечения заболеваний ЦНС [8].
К настоящему времени разработано много различных методов доставки лекарств. Некоторые из них доставляются неврологически инвазивными способами и считаются небезопасными для доставки лекарств. Это прямые неврологические инъекции или структурное нарушение ГЭБ с помощью ультразвука. Другими методами, которые демонстрируют широкий спектр и доставляют широкий спектр лекарств в ЦНС, являются фармакологические и физиологические методы, которые являются достаточно безопасными и неинвазивными (Рисунок 1, Таблица 1).Более конкретно нейрохирургические стратегии включают нарушение ГЭБ осмотическим дисбалансом или с использованием вазоактивных соединений, внутрижелудочковой инфузии лекарств и интрацеребральных имплантатов. В фармакологических методах для доставки лекарства используются липидный носитель или липосомы. За физиологическими стратегиями следует применение эндогенных транспортных механизмов с использованием либо опосредованного носителем транспорта питательных веществ, либо опосредованного рецептором транспорта пептидов. Клинические исследования подтверждают, что физиологические стратегии и потенциальные способы доставки являются более эффективными из-за более широкого покрытия безопасности, обеспечиваемого транспортировкой лекарств.Кроме того, следует улучшить обычные стратегии для безопасной доставки различных лекарств в ЦНС (рис. 2). К ним относятся липосомы, коллоидные носители лекарственных средств, мицеллы, технология химерных пептидов, интраназальный и обонятельный путь введения и нанотехнологии. В частности, системы доставки с наноактивами предлагают многообещающее решение для улучшения поглощения и адресной доставки лекарств в мозг.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DF: диффузия, ** RMT: трансцитоз, опосредованный рецепторами, *** сфокусированный ультразвук с усиленным микропузырьком, флуоресцентный белок $ , радиофармпрепараты # и TM: механизм транспорта. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
После доставки терапевтических биоматериалов / фармацевтических препаратов в мозг необходимо их физиологическое накопление, которое играет решающую роль в лечении патогенеза, связанного с заболеваниями нейронов [14]. Другим важным фактором доставки лекарств является растворимость в липидах молекул / соединений лекарств, которые могут перемещаться через гематоэнцефалический барьер путем простой диффузии. Есть несколько соединений, которые могут увеличить проницаемость ГЭБ за счет ослабления плотных контактов между эндотелиальными клетками [15].Большинство психоактивных препаратов увеличивают проницаемость ГЭБ и уменьшают физическую ограниченность эндотелиальных плотных контактов и позволяют большинству терапевтических молекул проходить через ГЭБ в больших количествах (рис. 3). Но эти препараты очень инвазивны, и их следует применять только в контролируемой среде из-за риска множественных эффектов. Более того, избыточное количество молекул в головном мозге вызывает осмотический дисбаланс и в значительной степени влияет на проницаемость мембран и блокирует или ограничивает нормальное поступление питательных веществ.Во-вторых, как только плотные контакты ослабляются, гомеостаз мозга нарушается, что приводит к судорогам и нарушению функций мозга [15]. Однако для лечения заболеваний ЦНС, таких как опухоли мозга, транспортный белок, пептиды, радиофармпрепараты и другие макромолекулы могут проходить через гематоэнцефалический барьер в контролируемой концентрации. Для этой цели методы доставки наночастиц оказались более перспективными, чем любые другие доступные методы. Это наиболее удобные и неинвазивные методы, которые оказались намного лучше любых других традиционных методов, используемых для лечения неврологических заболеваний [16].Следовательно, срочно необходимы менее токсичные, биологически обратимые производные пролекарств, нейрохилеры и фармакологические агенты. Это может обеспечить безопасную доставку различных лекарств, включая противоопухолевые, антинейродегенеративные и противовирусные препараты. В частности, для лечения опухолей головного мозга, вирусных и нейродегенеративных заболеваний и расстройств требуются более сложные инструменты на основе наночастиц. Настоящая обзорная статья направлена на то, чтобы подчеркнуть различные применения неинвазивных методов доставки лекарств с последними разработками, которые произошли в нанотерапевтических средствах для защиты ЦНС.Следовательно, особое внимание было уделено разработке нетоксичных средств доставки и хорошо растворимых, проницаемых биосовместимых противоопухолевых препаратов [17] и липосомальных носителей для снижения токсических эффектов и летальных исходов после лечения в случае рака и опухолей головного мозга [17, 18]. Кроме того, клеточный механизм доставки лекарств, такой как рецептор-опосредованный эндоцитоз, сфокусированный ультразвук, усиленный микропузырьками, богатые пролином пептиды, наночастицы на основе хитозана, носители бета-циклодекстрина, система доставки наночастиц катионных твердых липидов, опосредованная холестерином, система доставки Si RA, коллоидные носители лекарств, липосомы и мицеллы обсуждались в связи с их недавними достижениями.Кроме того, были даны предложения по разработке гораздо более безопасных нетоксичных средств доставки и биосовместимых лекарств для преодоления проблемы клинических неудач и летальных исходов после лечения [19].
2. Рак и терапия опухолей
Подобно гематоэнцефалическому барьеру, микрососуды / капилляры опухоли головного мозга также ограничивают доставку лекарств в опухоли, образуя физический барьер [20]. Нет сомнений в том, что TBB более проницаем, чем гематоэнцефалический барьер [20, 21], но он значительно ограничивает доставку противоопухолевых препаратов и препятствует систематическому химиотерапевтическому лечению опухолей головного мозга [22].Это приводит к отказу от лекарственного препарата и чрезвычайно затрудняет процесс лечения солидных опухолей в головном мозге. Это основная причина клинических неудач многих эффективных и потенциальных противоопухолевых препаратов. Обычно это происходит не из-за недостаточной активности лекарства, а из-за того, что лекарство не попадает в мозг и опухоли [23]. В отличие от этого, существует несколько фармацевтических препаратов, которые используются в опухолеспецифической терапии, но которых оказалось недостаточно для проверки аберрантных сигнальных путей в опухолях мозга [24].Это делает химиотерапевтическое лечение неэффективным, и необходимое количество препарата не может попасть в мозг после доставки [25]. Следовательно, весьма вероятно, что высокотоксичные противоопухолевые химиотерапевтические препараты не следует вводить в достаточной концентрации обычными методами доставки, поскольку не было доказано, что эти методы очень полезны для определения долгосрочной выживаемости пациентов с опухолями головного мозга и большинства клинических случаев опухоли головного мозга оказываются фатальными [25]. Однако необходимо разработать новые хорошо продуманные более безопасные терапевтические стратегии, которые могут обеспечить соответствующую терапевтическую концентрацию противоопухолевого препарата.Они должны лучше реагировать на доставку за счет применения более безопасных систем или методов доставки лекарств, преодолевая любые физические и физиологические препятствия, существующие в головном мозге [26].
Однако для того, чтобы сделать легкую и успешную доставку лекарств, чтобы спасти жизнь пациентов с опухолями / раком, было разработано много потенциальных методов [23]. Эти подходы включают внутривенную химиотерапию, внутриартериальную доставку лекарств, местную доставку лекарств с помощью имплантированных полимеров или катетеров, разрушение ГЭБ и биохимическую модуляцию лекарственного средства [26].Некоторые другие методы доставки лекарств, такие как интрацеребровентрикулярная доставка с усилением конвекции, также оказались очень полезными. Кроме того, для повышения проницаемости БТБ терапевтические молекулы, ускоренные через клеточный вазомодулятор, могут проходить через него. Таким образом, модуляция проницаемости возможна без нарушения BBB / BTB [27]. Интересно, что K (Ca) каналы оказались потенциальными мишенями для биохимической модуляции проницаемости БТБ, что избирательно увеличивает доставку противоопухолевых лекарств к опухолям мозга [22].Аналогичным образом, BTB, нацеленные на специфические белки, также используются для увеличения доставки противоопухолевых лекарств к опухолям головного мозга [27]. Он ускоряется за счет образования пиноцитарных пузырьков, которые помогают транспортировать лекарства через ЖТБ. Это также ускоряется с помощью активаторов каналов [21]. Точно так же инфузионный миноксидилсульфат (MS), селективный активатор K (ATP) каналов, попадает через BTB в опухоль головного мозга и облегчает доставку определенных макромолекул, главным образом, антитела Her-2, аденовирусного зеленого флуоресцентного белка и карбоплатина к опухолям мозга [22].Это значительно увеличило выживаемость крыс с опухолью головного мозга. Таким образом, модели опухолей головного мозга крыс предназначены для тестирования улучшенной доставки лекарств в мозг после внутрикаротидного введения доноров брадикинина (Bk), оксида азота (NO) или агонистов растворимой гуанилатциклазы (SGC) и кальций-зависимых калиевых K (Ca) каналов [ 21]. Таким образом, модуляция этих каналов специфическими агонистами и агентами, которые продуцируют NO и цГМФ in situ , по существу требуется. Более того, избирательное открытие гематоэнцефалического барьера донором оксида азота увеличивает выживаемость крыс [28] и влияет на церебральный кровоток при внутримозговых глиомах C6 [29].Напротив, водорастворимые соединения ограничены площадью поверхности / проницаемостью капилляров опухоли [30]. Поэтому в новых методах проводятся манипуляции с ГЭБ для безопасной доставки лекарства в мозг. Эти методы неинвазивны и используются в целенаправленной молекулярной терапии. Кроме того, было обнаружено, что магнитно-резонансная томография многофункциональных магнитных наночастиц является очень успешным методом лечения рака [31].
3. Использование пролекарств
Из-за наличия физических препятствий, создаваемых ГЭБ, только небольшое количество лекарства проходит через барьер и достигает головного мозга.Однако отсутствие подходящего белка-переносчика замедляет поступление лекарства в мозг. Следовательно, чтобы сделать нормальные лекарственные препараты активными с медицинской точки зрения, добавляются липофильные молекулы, которые позволяют лекарству проходить через барьер. Таким образом, лекарство попадает в мозг в исходной и активной форме. Однако неактивные препараты могут активироваться после добавления липофильных молекул. Кроме того, ферменты за счет каталитического действия удаляют липофильную группу, высвобождая лекарство в его активную форму. Чаще лекарства, которые не могут проходить через гематоэнцефалический барьер, могут доставляться в мозг, не нарушая структурного барьера, путем создания пролекарств.Они в основном используются для лечения нейрональных заболеваний [32]. Таким образом, пролекарства могут повышать терапевтическую эффективность лекарств и / или уменьшать побочные эффекты с помощью различных механизмов, включая повышенную растворимость, улучшенную проницаемость и биодоступность, увеличенный период полужизни и нацеленную доставку в ткани [33]. Следовательно, для доставки лекарств в мозг используются различные системы пролекарств, такие как липофильные носители и рецепторно-опосредованные системы доставки пролекарств, а также ген-ориентированные ферментные пролекарственные системы [34]. Кроме того, пролекарства, которые не обладают биологической активностью или обладают низкой биологической активностью, химически модифицируются для получения фармакологически активного агента, который должен подвергнуться трансформации in vivo для высвобождения активного лекарства [35].Таким образом, активное пролекарство может проходить через барьер, а затем повторно проходить через барьер, никогда не высвобождая лекарство в его активной форме.
Пролекарства — это биологически обратимые производные молекул лекарств, которые подвергаются ферментативной и / или химической трансформации in vivo с высвобождением активного исходного лекарственного средства. Это фармакологически активные агенты, которые преодолевают препятствия на пути к применению лекарства. После доставки в целевой сайт пролекарства оказывают желаемый фармакологический эффект [36].Более конкретно, неактивные лекарственные средства или терапевтические соединения становятся активными за счет добавления липофильных групп. Эти активные формы препарата лучше проникают через гематоэнцефалический барьер. Они разработаны с использованием наиболее распространенных функциональных групп, которые могут обеспечить проницаемость лекарственного средства через физическое или любое структурное барьерное устройство [36]. Пролекарства используются в терапии рака, включая антитело-направленную ферментную пролекарственную терапию (ADEPT) и ген-направленную ферментную пролекарственную терапию (GDEPT) [35]. Другими важными применениями стратегии пролекарств являются способность улучшать всасывание при пероральном приеме и растворимость в воде, повышать липофильность и активный транспорт, а также достигать сайт-селективной доставки [35].Эти наиболее благоприятные параметры по существу необходимы при открытии и разработке лекарств [36]. В настоящее время около 7–10% лекарств являются пролекарствами; доказано, что они являются эффективным средством улучшения физико-химических, биофармацевтических или фармакокинетических свойств фармакологически активных агентов. Кроме того, улучшения в базовой конструкции пролекарств могут быть сделаны с учетом функциональных групп в метаболизме лекарственного средства с участием ферментов цитохрома P450. Это повысит растворимость в воде, биодоступность, проницаемость и устойчивость к нацеливанию на опухоли.Это также поможет в разработке новых противовоспалительных средств против ВИЧ. Таким образом, используя транспортеры и гены опосредованного рецепторами эндоцитоза, ферменты и активированные пролекарства могут быть доставлены в раковые клетки и метастатические ткани [37].
4. Пептидная маскировка
Кроме того, основным препятствием для воздействия на мозг терапевтических средств в целом (в том числе P / P-лекарств) является наличие различных барьеров. Как известно, гематоэнцефалический барьер (ГЭБ) контролирует концентрацию и поступление растворенных веществ в ЦНС.Однако для успешной проницаемости P / P лекарственного средства требуется липофильность, которая может быть достигнута путем добавления холестерильной группы, которая делает их способными проходить через BBB. Их можно доставить после внутрижелудочкового введения или любым другим неинвазивным методом. Однако для безопасной перевозки фармацевтических препаратов другим полезным способом является маскировка лекарств путем преобразования их химического состава в жирорастворимое лекарство. Однако за счет объединения с другими молекулярными группами основные характеристики пептида маскируются, и добавление липофильной группы делает его более вероятным для прохождения через гематоэнцефалический барьер.Следовательно, молекула холестерина используется вместо холестерина из-за ее липофильной природы. Он служит для сокрытия водорастворимых характеристик лекарственного средства, и такой тип маскировки помогает лекарству преодолевать гематоэнцефалический барьер. Подобная маскировка лекарственного пептида от ферментов, разлагающих пептиды, также происходит в мозге [32]. Однако более короткие пептиды с хорошим поверхностным зарядом могут связываться с рецепторами на одной стороне и маскировать отсутствие прохождения более крупных молекул. Однако целевая молекула может быть присоединена к лекарству; которые могут легко передать препарат через ГЭБ.Это может увеличить усвоение наркотиков мозгом. Кроме того, он может разложиться таким образом, что лекарство не сможет пройти обратно через мозг. Таким образом, для полного запрета обратного транспорта лекарственного средства его необходимо превратить в нетранспортную форму и сконцентрировать в мозге для лучшего терапевтического действия [32]. Кроме того, лекарство должно быть ферментативно разлагаемым, чтобы предотвратить передозировку ткани головного мозга, или его удаление могло бы минимизировать чрезмерное действие лекарства на нервную ткань. Следовательно, как дозировка, так и действие лекарства требуют тщательного мониторинга [32].Точно так же тиоэфиры C-концевого пептида также способствуют маскированию пептидов. Они также влияют на аминолиз пептидов вторичными аминами, используемыми для удаления группы Fmoc. Однако для их синтеза следует стратегия амидного линкера основной цепи (BAL), в которой функциональность сложного тиоэфира маскируется в виде сложного эфира тритиоорто на протяжении всего синтеза [38]. Это повысило бы эффективность и доставку лекарства. Это двойное маскирование дополнительной терапии альбутеролом используется для пациентов с рассеянным склерозом.Аналогичным образом, лечение глатирамера ацетатом и альбутеролом хорошо переносится и улучшает клинические исходы у пациентов с рассеянным склерозом. Но холестерин маскирует мембранные гликосфинголипидные ассоциированные с опухолью антигены, чтобы уменьшить их иммунное обнаружение в биоптатах рака человека [39]. В отличие от этого, разоблачение посредством проницаемой, но неотрывной обработки холестерин-связывающими детергентами дигитонином и эдельфозином сравнивается с оксидом фениларсина ПАО и перекрывает его [40]. Однако истощение поверхностных сайтов агонистами Y2, обрезанными на N-конце, указывает на большую доступность короткого высокоспирального пептида.Он показывает наличие динамического замаскированного пула, включающего большинство рецепторов Y2 на клеточной поверхности в прикрепленных клетках СНО [40]. Однако, несмотря на их потенциал, многие существующие пептидные и белковые препараты (P / P-препараты) оказываются неэффективными при лечении из-за их неспособности доставляться и устойчивости в мозге. Для обеспечения высокой доступности маскирующие молекулы должны иметь низкую молекулярную массу 400–500 Да, чтобы они могли легко пересекать ГЭБ и доставлять лекарство в фармакологически значимых количествах [32, 41, 42].
5. Защита ЦНС
5.1. Интраназальная доставка лекарств
Существует очень много лекарств, которые достигают ЦНС после назального введения в различных моделях на животных, а также у людей [43] (рис. 2). Однако обнаружено, что для доставки значительного количества лекарственного средства в мозг интраназальное введение нейропротективных агентов оказывается более полезным для лечения ишемического повреждения мозга. Это предпочтительный метод лечения местных заболеваний, таких как холодный кашель, ринит и т. Д. [44].Кроме того, для ускорения действия лекарственного средства коллоидные наночастицы слизистой оболочки или опухолевого барьера применяют интраназальный способ доставки, чтобы отправить их в различные части мозга. Но доставка пептидов и белков, кажется, очень трудна для их системного использования через нос [44]. Более того, для доставки пептида и белков требуются различные более подходящие наночастицы [44]. Когда назальный лекарственный состав доставляется глубоко и достаточно высоко в полость носа, он достигает обонятельной слизистой оболочки и транспортируется в мозг и / или спинномозговую жидкость через нейроны обонятельного рецептора.Он должен вызывать хороший иммунный ответ за счет преимущественного взаимодействия с лимфоидной тканью носовой полости (NALT). Тем не менее, транспорт лекарств через обонятельный эпителий [45] должен работать как канал для передачи лекарств в ЦНС, но при переносе лекарств у животных соотношение обонятельного и респираторного эпителия существенно отличается от отношения людей [46]. Более того, два возможных пути, то есть путь обонятельного нерва (аксональный транспорт) и путь обонятельного эпителия [47], по которым лекарства попадают в мозг.Более того, вскоре после назальной доставки лекарство сначала достигает респираторного эпителия, где абсорбируется в системный кровоток за счет трансклеточного и параклеточного пассивного всасывания, трансцитоза или эндоцитоза [47, 48]. Однако абсорбция через респираторный эпителий является основным путем переноса лекарств, вводимых через нос. Это может представлять собой потенциально экономящий время способ введения определенных системных препаратов, доставляемых в протоколах крионического лечения (например,g., адреналин или вазопрессин). Но иногда опосредованное ГЭБ исключение терапевтических агентов для мозга также остается безуспешным, и обнаруживается, что лекарство распространяется в нежелательных областях. Следовательно, для решения этой проблемы создаются гели на основе карбопола для назальной доставки биофармацевтических препаратов [49].
Однако обнаружено, что интраназальное введение NAD + оказывает нейропротекторное действие, поскольку снижает транзиторную фокальную ишемию [50]. Точно так же интраназальное введение ингибитора PARG галлотаннина также снижает ишемическое повреждение мозга у крыс [51].Такие агенты отменяют активацию поли (АДФ-рибоза) полимеразы-1 (PARP-1), которая играет важную роль в ишемическом повреждении головного мозга. Кроме того, наблюдалось, что НАД + снижает образование инфаркта на 86% даже при введении через 2 часа после начала ишемии [51]. Точно так же интраназальное введение антипортеров или блокаторов рецепторов NMDA обеспечивает нейрозащиту от более ранних событий глобальной ишемии, таких как деполяризация мембраны и эксайтотоксичность [52]. Точно так же назальное введение ЭПО (эритропоэтина) является потенциальным новым нейротерапевтическим подходом в лечении острого ишемического инсульта у людей [53].Это один из наиболее успешных методов, демонстрирующих нейропротекторную способность при лечении пациентов с острым инсультом и другими нейродегенеративными расстройствами. Несомненно, что этот новый терапевтический подход может произвести революцию в лечении нейродегенеративных расстройств в 21 веке [53].
Кроме того, мозг имеет два пути прохождения наркотиков для транспортировки веществ; один — аксональный транспорт, который колеблется от 20–400 мм / день до более медленного 0,1–4 мм / день [54]. Считается, что это медленный путь, посредством которого агент проникает в обонятельный нейрон через эндоцитотические или пиноцитотические механизмы и перемещается в обонятельную луковицу, используя те же механизмы антероградного аксонального транспорта.По этому механизму клетка транспортирует эндогенные вещества в мозг [47]. Эпителиальный путь является значительно более быстрым путем прямой передачи от носа к головному мозгу, при этом соединения проходят парацеллюлярно через обонятельный эпителий в периневральное пространство, которое непрерывно с субарахноидальным пространством и находится в прямом контакте с CSF. Затем молекулы могут диффундировать в ткань головного мозга или выводиться потоком спинномозговой жидкости в лимфатические сосуды, а затем в системный кровоток [45, 55].Точно так же метод назального спрея может увеличить количество VIP (вазоактивного кишечного пептида), поступающего в мозг, и защитить центральную нервную систему. Следовательно, препараты, вводимые интраназальным путем, вызывают незначительное раздражение, которое проходит спонтанно в течение недели по окончании лечения [56]. Чаще интраназальная доставка является неинвазивным, безопасным (рис. 2, таблица 1) и альтернативным подходом, который быстро нацелен на доставку молекул в мозг при минимальном системном воздействии [57].
5.2. Внутрижелудочковая доставка лекарств
Внутрижелудочковая доставка лекарства используется для обезболивания, и лекарство доставляется в спинномозговой жидкости цистерны (позвонок C1-2) и внутричерепных желудочков. Этот метод в основном используется для доставки анальгетиков пациентам с опухолями головы, лица и шеи. Чаще он используется в церебральном нацеливании лекарств [63] путем прямого введения лекарств. Он требует меньшего количества лекарства и вызывает меньше побочных эффектов, чем пероральные препараты.В этих методах используется пластиковый резервуар, который подкожно имплантируется в кожу головы и соединяется с желудочками головного мозга выходным катетером. Таким образом, лекарство доставляется через этот имплантированный катетер, подключенный к насосу, который может быть программируемым и имплантированным или внешним. Например, инсулин напрямую направляется в мозг посредством интрацеребровентрикулярной (ICV) или интрапаренхимальной доставки (рис. 2). Это инвазивный метод со значительным риском, требующий повторного хирургического вмешательства и обеспечивающий возможность системной гипогликемии [57].Этот метод помогает в клинической терапии ассоциированных нейродегенеративных и сосудисто-нервных расстройств (рис. 1) [57].
Точно так же внутрижелудочковая доставка ритуксимаба активирует комплементы C3 и C5b-9 в спинномозговой жидкости. Он показывает повышенную эффективность внутрижелудочковой иммунотерапии как за счет модуляции врожденного иммунного ответа, так и за счет инноваций в доставке лекарств [64]. Точно так же внутрижелудочковые инъекции фолатных рецепторов α -положительных и -отрицательных экзосом в мозг мышей демонстрируют зависящую от фолатных рецепторов α доставку экзосом в паренхиму мозга [57].Кроме того, фактор роста эндотелия сосудов способствует покрытию перицитами капилляров головного мозга, что улучшает церебральный кровоток во время последующей фокальной церебральной ишемии и сохраняет метаболическую полутень [65]. Он также усиливает церебральный кровоток во время последующих эпизодов ишемии, что приводит к стабилизации энергетического состояния мозга. Возможно, он вызывает образование новых сосудов и улучшает выживаемость тканей мозга [66]. Точно так же нейротрофический фактор гипоталамического нейрона действует как новый фактор, который модулирует аппетит, потребление пищи, массу тела, повышенную экспрессию мРНК гипоталамуса Pomc и Mc4r [67].Важно отметить, что подавляющий аппетит эффект NENF был отменен у мышей с ожирением, получавших диету с высоким содержанием жиров, демонстрируя зависимую от диеты модуляцию функции NENF [68]. Аналогичным образом, фактор, производный от антиангиогенного пигментного эпителия (PEDF), многофункциональный секретируемый гликопротеин массой 50 кДа, способствует стволу за счет активации. Более того, внутрижелудочковая инъекция PEDF способствует обновлению стволовых клеток, а инъекция VEGF инициирует дифференцировку и нейрогенез в субвентрикулярной зоне [69]. Следовательно, усиление экспрессии PEDF в стволовых клетках имеет многообещающие терапевтические последствия, поскольку этот белок обладает несколькими биоактивностями почти во всех нормальных системах органов.Это будет важный компонент в разработке и внедрении новых методов лечения на основе стволовых клеток для борьбы с болезнями [68].
Аналогичным образом, внутрижелудочковая доставка ванкомицина используется для лечения менингита, вентрикулита и инфекций, связанных с ЦНС. Однако размещение ванкомицина в ЦНС способствует улучшению патофизиологических состояний, инсультов и травм, что будет способствовать лучшему пониманию влияния нейроактивных препаратов на фармакокинетические и фармакодинамические параметры у взрослых [68].Кроме того, исследованиями флуоресцентной микроскопии доказано, что FITC-D3 накапливается в вакуолярных отсеках клеток и может быть обнаружен в различных структурах и популяциях клеток после инъекции в мозг. Точно так же доставка с усилением конвекции в ядро скорлупы [70], ОАП, поддержка давлением, терапия сурфактантами, введение инотропных лекарств, вагинальные роды, реанимация новорожденных и антенатальная кортикостероидная терапия могут более эффективно использоваться в случаях с ВЖК (внутрижелудочковое кровоизлияние) [71].Он в основном используется для лечения болезни гиалиновых мембран и преэклампсии у матери [60]. Аналогичным образом, внутривенное, интрацеребровентрикулярное или интраназальное введение миРНК в нейроны, глию и эндотелиальные клетки головного мозга (BCEC) используется для лечения неврологических заболеваний [72]. Терапия сайленсинга генов также используется для доставки короткой интерферирующей РНК (siRNA) в центральную нервную систему (ЦНС), в то время как дендримеры полилизина D3 и D5 [73] и сополимеры на основе HPMA-олиголизина с привитым мелиттином также используются для доставки генов [73].Точно так же полиплексы, содержащие мелиттин, также оказались многообещающими биоматериалами для доставки генов в мозг [73]. Более того, диффузия Gd-DTPA в глиомах может помочь в мониторинге в реальном времени интерстициальной доставки лекарств и количественной оценке биофизических структурных изменений в пораженной ткани [73]. Кроме того, паттерны распределения дендримеров G4 PAMAM в ЦНС могут облегчить разработку специализированных наноматериалов в свете будущих клинических применений. Он не вызывает апоптотической гибели нервных клеток в субмикромолярном диапазоне концентраций и вызывает низкую активацию микроглии в ткани мозга через неделю [74].
5.3. Использование пептидных радиофармпрепаратов
Радиоактивно меченные рецептор-связывающие пептиды и белки возникли как важный класс радиофармацевтических препаратов, которые изменили радионуклидную визуализацию в клинической практике. Они увеличили диагностический потенциал технологии нейровизуализации и оказались более сложным диагностическим инструментом для сканирования мозга на предмет болезни Альцгеймера. Что еще более важно, при визуализации мозга используются низкомолекулярные радиоактивные химические вещества, которые связываются с системами нейротрансмиттеров моноаминов или аминокислот.Например, было обнаружено, что радиофармпрепараты пептида эпидермального фактора роста (EGF) являются потенциальными кандидатами для нейровизуализации, которые используются для раннего обнаружения злокачественных глиом или опухолей головного мозга [75, 76]. Точно так же ПЭТ-визуализация также используется для обнаружения нейроэндокринных опухолей [77], в которых гетеродимерная молекула используется для покрытия первичного и рецидивирующего рака простаты. Эти два рецептора могут улучшить диагностическую чувствительность и терапевтическую эффективность [78]. Аналогичным образом, F-радиофармацевтические препараты на основе пептидов (18) (таблица 1) используются для диагностических целей с помощью позитронно-эмиссионной томографии (ПЭТ) в клинических испытаниях [73].Кроме того, индивидуализированная биоконъюгация галлия (III) также широко используется в доклинической визуализации Ga-68-PET [79].
Однако для нейровизуализации было разработано множество стратегий для радиоактивной метки пептидов и белков с помощью фтора-18. Это более простой подход, основанный на хелатировании фторида алюминия (1,4,7-триазациклононан-1,4,7-триуксусной кислотой). Таким образом, использование технологии мечения Al (18) F позволило оптимизировать выход, удельную активность и потенциал нейровизуализации пептидов [80]. NOPO-функционализированные пептиды обеспечивают подходящую фармакокинетику in vivo [81].Кроме того, клик-химия Дильса-Альдера с обратным электронным потреблением используется для разработки новых радиофармацевтических препаратов [82]. Точно так же хемоселективное мечение пептида интегринового лиганда-c (RGDyK) было разработано на основе реакции конъюгации, катализируемой Cu (I). Более того, метод нуклеофильной очистки и твердофазной экстракции с фтором обеспечивает простой способ реализации подхода для получения 2 — [(18) F] фторэтилазида [83]. Точно так же разработка радиофармацевтического препарата пептида A β в сочетании с наноносителем работает как молекулярный троян и имеет более широкое применение. in vivo, амилоидная визуализация при болезни Альцгеймера [84].Аналогичным образом, молекулярный зонд (99 m) Tc-пептид-ZHER2: 342 является многообещающим индикатором, используемым для визуального обнаружения рака [85]. Сходным образом малый пептид (131) I-tRRL, поскольку он специфически связывается с эндотелиальными клетками опухолевого происхождения [62]. Более того, Tc-EDDA / HYNIC-E- [c (RGDfK)] 2, полученный из составов набора, показал высокое поглощение опухолью у пациентов со злокачественными поражениями. Это многообещающий маркер визуализации, который используется для нацеливания на сайт-специфический рак груди [86]. Более того, (18) пептиды F-глико-RGD используются в ПЭТ-визуализации экспрессии, модуляции и биораспределения интегрина.В последнее время интегрины становятся все более привлекательными мишенями для молекулярной визуализации ангиогенеза с помощью позитронно-эмиссионной томографии или однофотонной эмиссионной компьютерной томографии, но надежное производство радиофармацевтических препаратов остается сложной задачей [87].
Очень сложно отобразить функциональную связь отдельных типов клеток в интактном мозге млекопитающих во время поведения. Карты дизайнерских рецепторов на основе типов клеток, подготовленные исключительно на основе наблюдения за их взаимодействием с использованием технологии дизайнерских наркотиков (DREADD), могут четко различать функции мозга в нормальном и болезненном состояниях.Следовательно, визуализация поведения с помощью ПЭТ мкм и фтордезоксиглюкозы (ФДГ) может генерировать метаболические карты целого мозга клеточно-специфических функциональных цепей во время бодрствования и состояния свободного движения. Чаще DREAMM может выявить дискретные поведенческие проявления и одновременное участие различных кортиколимбических сетей, связанных с нарушением регуляции Pdyn и Penk в MSN NAcSh. DREAMM — это высокочувствительный молекулярный подход к количественной визуализации с высоким разрешением, который может устранить любое заболевание мозга [88].ПЭТ-изображение опухолей с меченным 64Cu аминовым лигандом макробициклического каркаса, привязанным к Tyr3-октреотату. MeCOSar — многообещающий бифункциональный хелатор для Tyr3-октреотата, который можно применять для комбинированной визуализации. Таким образом, терапевтический режим может быть составлен с использованием комбинации (64) Cu- и (67) и комплексов CuSarTATE, благодаря улучшенному соотношению опухоль / нецелевой орган по сравнению с (64) CuDOTATATE в более длительные моменты времени [89]. ПЭТ с 62Cu-ATSM и 62Cu-PTSM является полезным инструментом визуализации гипоксии и перфузии при поражениях легких [58].Кроме того, количество поглощенного (18) F-FDG определяется наличием метаболизма глюкозы, гипоксии и ангиогенеза [90, 91].
5.4. Использование белковых нейротерапевтических агентов
BBB ограничивает проникновение многих потенциально терапевтических агентов (PNA) в мозг. Но недавно несколько нейроактивных белков, имеющих потенциальную терапевтическую ценность, выявили острую необходимость в эффективных и безопасных методах транскапиллярной доставки в мозг. Однако наиболее многообещающая доставка лекарств возможна за счет увеличения пиноцитотических пузырьков через капилляры головного мозга.Это клеточный механизм, который помогает доставлять большие молекулы с нейротерапевтическим потенциалом в конъюгированной форме, такой как пептидомиметические лиганды. Позже эти молекулы связываются с выбранными пептидными рецепторами, которые интернализуются и транспортируют (PNA) в небольших пузырьках через цитоплазматический капиллярный барьер мозга. Было обнаружено, что эти конъюгаты функционально активны и эффективны на животных моделях неврологических заболеваний. Фактически, все малые нейрозащитные молекулы не смогли вылечить инсульт в клинических испытаниях, потому что либо эти молекулы имеют неблагоприятные профили безопасности, либо лекарства не проникают через ГЭБ.При правильном применении они обеспечивают нейрозащиту до 3 часов после инсульта, в течение которых ГЭБ остается неизменным [92]. Эти короткие пептиды показали благоприятные профили безопасности в мозге после пересечения BBB [93]. Например, нейротрофин, нейротрофический фактор головного мозга (BDNF), переработан для обеспечения транспорта ГЭБ. Сходным образом химерный пептид BDNF оказался нейропротекторным после отсроченного внутривенного введения при регионарной или глобальной ишемии мозга [92–96]. Точно так же эритропоэтин, новый нейротерапевтический агент [97], также является первичным физиологическим регулятором эритропоэза [97], оказывает эффект путем связывания с рецепторами клеточной поверхности и играет гормональную роль.Он вырабатывается почками в ответ на гипоксический стресс и сигнализирует костному мозгу об увеличении количества циркулирующих эритроцитов [98]. Кроме того, как эритропоэтин, так и его рецептор, обнаруженный в коре головного мозга человека, астроцитах и нейронах, которые являются членами суперсемейства цитокинов, опосредуют различные функции в негематопоэтических тканях. Он проявляет нейропротекторную активность, которая усиливается после гипоксических стимулов. Точно так же на животных моделях было доказано, что экзогенный рекомбинантный эритропоэтин человека полезен при лечении глобальной и очаговой церебральной ишемии и уменьшении воспаления нервной системы у экспериментальных животных [99].Эритропоэтин резко снижает постинфарктное воспаление и оказывает лечебное действие на головной мозг и восстанавливает повреждения спинного мозга, такие как механическая травма, экспериментальный аутоиммунный энцефалит или субарахноидальное кровоизлияние. Он непосредственно модулирует возбудимость нейронов и действует как трофический фактор для нейронов in vivo и in vitro . Он проявляет дозозависимые эффекты и очень полезен при эпилептических или дегенеративных неврологических заболеваниях [100], поскольку эритропоэтин оказывает потенциальное влияние на биораспределение лекарства и демонстрирует механизм быстрого действия при прохождении через ГЭБ [100].Следовательно, фармакологическое использование эритропоэтических агентов может обеспечить терапевтический эффект при дисфункции ЦНС [100]. Однако доставка антрахинон-2-сульфоновой кислоты (AQ2S) действует как новый нейротерапевтический агент против церебральной ишемии, который защищает мозг от инсультов и неврологических заболеваний [59, 101].
Кроме того, нейропротекторные соединения моноклональные антитела также используются в качестве новых нейротерапевтических агентов для восстановления повреждений ЦНС, вызванных травмой или гипертермией [102].При таких повреждениях повышается уровень серотонина (5-HT), динорфина A (Dyn A 1-17), синтазы оксида азота (NOS) и фактора некроза опухоли- α (TNF- α ), который также действует как потенциальные нейродеструктивные сигналы при повреждении ЦНС. Таким образом, для нейтрализации этих агентов моноклональные антитела, направленные против 5-HT, NOS, Dyn A (1–17) и TNF- α in vivo могут быть использованы для нейропротекции и для усиления нейрорепарации после травм [102] . Сходным образом активация связанного с ядерным фактором E2 фактора 2 / элемента антиоксидантного ответа является нейрозащитным после повреждения спинного мозга [103].Точно так же Epo и рецептор Epo (EpoR) играют решающую роль в развитии нервной системы, нейрорегуляции и нейропротекции. Он улучшает и предотвращает повреждение нейронов, а также проявляет нейропротекторный, антиапоптотический, противовоспалительный, антиоксидантный, ангиогенный, нейрогенный и нейротрофический эффекты на клеточных культурах и на животных моделях [98].
Точно так же металлотионеины (МТ) представляют собой суперсемейство высококонсервативных низкомолекулярных полипептидов, которые характеризуются высоким содержанием цистеина (серы) и металлов.Это внутриклеточные металлсвязывающие белки, которые играют важную роль в регуляции основных металлов [104]. Как в центральной, так и в периферической нервной ткани, MT-I и MT-II играют нейропротекторную роль, которая также индуцируется обработкой экзогенным MT-I и / или MT-II. И MT-I, и MT-II могут обеспечивать нейротерапевтические мишени, предлагая защиту от повреждения и дегенерации нейронов [104]. Кроме того, металлокомплексы, образующиеся внутри мозга, могут обладать достаточным потенциалом для лечения нейродегенеративных заболеваний [105].Точно так же тестостерон оказывает нейрозащитное действие на морфологию как у мужчин, так и у женщин. Он также действует как нейротерапевтический агент в поврежденной нервной системе [106]. Подобно тестостерону, андроген также регулирует уровни мРНК нейритина в модели in vivo усиленной стероидами регенерации периферических нервов [107]. Аналогичным образом, нанокапсулы с липидным ядром, нагруженные индометацином, уменьшают повреждение, вызванное A β 1–42 в моделях болезни Альцгеймера, и это блокирование нейровоспаления, вызванного A β , участвует в нейрозащитных эффектах IndOH-LNC.Это многообещающий подход для лечения БА [108].
5.5. Использование химерных пептидов
Однако транспорт терапевтических пептидов через BBB остается проблемой для доставки пептидного лекарственного средства в центральную нервную систему (ЦНС) (таблица 1). Однако химерные пептиды переносят лекарство в мозг к целевым участкам, хотя оно не переносится через ГЭБ. Для этого препарат конъюгируют с вектором, нацеленным на лекарство в мозг [109]. Эти химерные белки легко проходят через ГЭБ, и присутствие этих пептидных препаратов внутри клетки может быть обнаружено с помощью иммунофлуоресцентных маркеров.Химерный белок состоит из представляющего интерес белка, ковалентно связанного с естественно флуоресцентными белками, что позволяет биологам отображать движения промышленных белков в живых клетках. Однако с помощью технологии рДНК можно получить химеру любого желаемого интересующего белка, связанного с естественным флуоресцентным белком и экспрессирующегося внутри клетки или организма.
Однако слитый белок рецептор фактора некроза опухоли-IgG готовится для направленной доставки лекарства через гематоэнцефалический барьер человека.Рецептор фактора некроза опухоли-альфа (TNFR) содержит внеклеточный домен (ECD), который можно использовать в нейротерапии инсульта, травмы головного мозга или хронической нейродегенерации [101, 110]. Поскольку формирующийся TNFR ECD представляет собой большую терапевтическую молекулу, которая не проникает через гематоэнцефалический барьер (BBB), она была переработана путем слияния рецепторного белка с карбоксильным концом химерного моноклонального антитела (mAb) к рецептору инсулина человека (HIR). . Это слияние позволяет ему перехватывать рецептор, переносимый через ГЭБ человека [110].Аналогичным образом был приготовлен метаболически стабильный опиоидный пептид DALDA (Tyr-DArg-Phe-Lys-NH 2 ), который используется в качестве модельного лекарственного препарата, который транспортируется через ГЭБ во внеклеточную жидкость мозга [111]. Однако при синтезе таких «химерных пептидов» используются расщепляемые дисульфидные линкеры. Очень важно сохранить неповрежденный и стабильный S-S-мостик во время трансцитоза. Однако расщепление внутри эндотелиальных клеток может привести к секвестрации лекарственной части вместо прохождения через ГЭБ [111].Его монобиотинилировали с помощью расщепляемого биотинового реагента сульфосукцинимидил 2- (биотинамидо) этил-дитиопропионата (NHS-SS-биотин) с получением био-DALDA. Затем биотинилированный пептид связывается с вектором для доставки в мозг после внутривенной инъекции крысам, ковалентным конъюгатом стрептавидина и моноклональным антителом к рецептору трансферрина, OX26. Более того, наиболее распространенная стратегия лечения умеренной и сильной боли заключается в активации опиоидных рецепторов в головном мозге.Следовательно, разработка активных аналогов опиоидных пептидов в качестве потенциальных анальгетиков требует соединений с высокой устойчивостью к ферментативной деградации и способностью проникать через ГЭБ.
Более того, нейротрофический фактор, полученный из моноклональных антител и глии, слитый белок, проникает через гематоэнцефалический барьер у мышей. Точно так же большинство слитых белков трансцитозируются через ГЭБ с проникновением в паренхиму мозга. Это было подтверждено анализом истощения капилляров головного мозга [112].Аналогичным образом, аналоги тетрапептидов типа H-Dmt1-Xxx2-Yyy3-Gly4-NH 2 транспортируются в мозг после внутривенного и подкожного введения и способны более эффективно активировать опиоидные рецепторы μ — и δ и более длительные периоды времени, чем морфин [113]. Точно так же терапевтическое повышение уровня GDNF также может быть достигнуто в головном мозге мышей при внутривенном введении слитого белка cTfRMAb-GDNF [112]. Более того, был сконструирован проникающий в мозг слитый белок IgG-эритропоэтин, который проявляет нейропротекторные эффекты после внутривенного лечения болезни Паркинсона у мышей [114].Болезнь Паркинсона (БП) вызывается окислительным стрессом, а эритропоэтин (ЭПО) снижает окислительный стресс в головном мозге. Однако для того, чтобы заставить ЭПО преодолевать гематоэнцефалический барьер (ГЭБ), была разработана форма человеческого ЭПО, проникающая в мозг. EPO слит с химерным моноклональным антителом (MAb) против рецептора трансферрина мыши (TfR), который обозначен как слитый белок cTfRMAb-EPO. TfRMAb действует как молекулярный троянский конь, транспортирующий слитый ЕРО в мозг посредством транспорта на BBB TfR [114].Точно так же авидин (AV) слит с карбоксильным концом тяжелой цепи химерного моноклонального антитела (mAb), созданного с помощью генной инженерии, против рецептора трансферрина мыши (TfR). TfRMAb связывает эндогенный TfR на гематоэнцефалическом барьере (BBB), который запускает транспорт в мозг из крови. Этот слитый белок cTfRMAb-AV представляет собой новую систему доставки лекарств, которая может нацеливаться на монобиотинилированный пептид мозга мыши или антисмысловые радиофармацевтические препараты [114]. Более конкретно, слитый белок IgG-авидин способствует доставке пептидного радиофармпрепарата в мозг [114].
Таким образом, как рекомбинантные гибридные пептиды, так и белки используются в качестве лекарств, которые показали большую терапевтическую эффективность против различных нейродегенеративных заболеваний. Но транспорт этих молекул (препаратов P / P) через гематоэнцефалический барьер (BBB) по-прежнему представляет собой серьезную проблему из-за их большего размера [115]. В отличие от этого лекарственные препараты меньшего размера не были эффективными нейропротективными средствами ни при остром лечении инсульта, такого как очаговая ишемия мозга, ни при хроническом лечении нейродегенерации, даже после их большей проницаемости через ГЭБ [93].Чаще крупномолекулярные препараты, такие как рекомбинантные нейротрофины и нейротрофины, не проникают через эндотелиальную стенку капилляров головного мозга, но оказываются более эффективными, чем препараты меньшего размера. Следовательно, чтобы сделать нейротрофины транспортабельными через ГЭБ, создаются химерные пептиды, в которых нейротрофин переформулируется путем слияния с транспортным вектором. Транспортный вектор представляет собой пептид или пептидомиметическое моноклональное антитело, которое претерпевает опосредованный рецептором трансцитоз через BBB и действует как молекулярный троянский конь [93].Точно так же нейротрофический фактор глиального происхождения (GDNF) представляет собой нейротрофин, который может быть разработан как средство для лечения болезни Паркинсона, инсульта и болезни двигательных нейронов [61]. Следовательно, путем реинжиниринга GDNF нейротрофин стал переносимым через ГЭБ человека путем слияния зрелого белка GDNF с карбоксильным концом химерного моноклонального антитела (MAb) к рецептору инсулина человека (HIR) [61]. Однако пептиды или терапевтические белки могут быть доставлены в мозг с использованием стратегии химерных пептидов.Однако для того, чтобы стратегия химерных пептидов была успешной, важными этапами являются разработка вектора и связывание лекарств с вектором и высвобождение биологически активных пептидов после расщепления связи связи [116]. Кроме того, было доказано, что система авидин / биотин является более предпочтительной при выполнении этих критериев для успешных линкерных стратегий. Однако моноклональные антитела OX26 используются в системе авидин / биотин, а аналог вазоактивного кишечного пептида (VIP) слит, чтобы сделать его пригодным для монобиотинилирования и сохранения биологической активности после расщепления [116].Кроме того, в способе доставки химерного пептида белки, такие как катионизированный альбумин или моноклональное антитело OX26, используются в качестве транспортных векторов и связываются с рецептором трансферрина. Эти белки претерпевают опосредованный абсорбцией и опосредованный рецептором трансцитоз через ГЭБ, соответственно (Таблица 1) [116].
Кроме того, также используются эндогенный пептид, модифицированный белок или пептидомиметическое моноклональное антитело (mab), которое подвергается RMT (быстрый метаболический перенос) через BBB на эндогенные рецепторные системы, такие как рецептор инсулина или TfR.Интересно, что эти пептидомиметические mab связываются с экзофациальными эпитопами на рецепторе BBB, который удаляется из сайта связывания эндогенного лиганда и перемещается через BBB. Лекарство монобиотинилируется и сливается с белком слияния вектор / авидин или вектор / стрептавидин (SA) [109]. Из-за чрезвычайно высокой аффинности связывания авидина или SA с биотином происходит мгновенный захват биотинилированного нейротерапевтического агента, продуцируемого слитым белком вектор / avid in или вектор / SA [117]. Кроме того, слитые гены моноклональное антитело / авидин и mab / SA и слитые белки получают с использованием методов генной инженерии, которые, как доказано, являются хорошими методами доставки у людей [118].
5.6. Нарушение ГЭБ с помощью сфокусированного ультразвука
Для быстрого действия лекарства очень важны его успешная доставка в мозг и его правильное распределение. Кроме того, для безопасного и неинвазивного распространения лекарственного средства обратимо в целевых местах необходимо нарушение гематоэнцефалического барьера (ГЭБ). Это разрушение ГЭБ вызывается импульсным ультразвуком в присутствии предварительно сформированных пузырьков газа. С ним нужно работать очень осторожно, потому что сверхвысокий звук может повредить ткани мозга.Следовательно, обработка ультразвуком должна осуществляться контролируемым образом, чтобы сделать неинвазивным и обратимым доставлять лекарство в намеченные места, не вызывая существенного повреждения сосудов (Таблица 1). Поскольку ультразвук приводит к ишемической или апоптотической гибели нейронов [119], он стал важной диагностической технологией, которая используется для локализованного и обратимого разрушения ГЭБ в лечебных целях [1]. Он имеет более широкое применение в молекулярной нейроонкологии [24]. Аналогичным образом, вызванное ультразвуком разрушение ГЭБ под контролем МРТ также может быть возможным для доставки лекарств в мозг [1].Точно так же несколько других стратегий также находятся в стадии разработки, например, импульсное ультразвуковое исследование, которое выполняется в присутствии ультразвукового контрастного агента, который также разрушает ГЭБ, используя акустические волны в выбранной области мозга. HRP, введенный в мозг, проходит через индуцированное МРТ разрушение ГЭБ при амплитуде давления от 0,4 МПа до 1,4 МПа [120]. Кроме того, ЭМ, которая продемонстрировала прохождение HRP через стенки сосудов как через трансэндотелиальный, так и через параэндотелиальный пути, доказывает нарушение. Это гораздо более безопасный метод адресной доставки лекарств, чем любой другой конвекционный метод, используемый для доставки лекарств [120, 121].Оба эти метода превратились в неинвазивные методы. Несомненно, диагностическая технология, основанная на МРТ (магнитно-резонансной томографии), помогает контролировать терапевтические агенты, их распределение и кинетику в нейрональных тканях (Таблица 1) [122].
Некоторые другие стратегии, такие как лучевая терапия или химиотерапия, используются для лечения опухолей, которые не обеспечивают хороший прогноз, контроль прогрессирования опухоли или улучшение выживаемости пациентов [122]. Кроме того, временное разрушение ГЭБ путем воздействия сфокусированного ультразвука с микропузырьками (FUS) может увеличить проницаемость крови ЦНС, обеспечивая новое многообещающее направление увеличения концентрации терапевтических агентов в головном мозге для контроля образования опухолей, некроза и инвазивности тканей.Он не проявляет долгосрочных побочных эффектов и обеспечивает долголетие пациентам. Далее, для расщепления ГЭБ раствор маннита вводится в артерии шеи, что приводит к высокому поглощению сахара капиллярами головного мозга, которые также забирают воду из эндотелиальных клеток, сужают их и открывают плотные соединения. Этот эффект длится 20–30 минут, за это время свободно распространяются лекарства, которые обычно не проходят через ГЭБ. Этот метод позволял вводить химиотерапевтические препараты пациентам с церебральной лимфомой, злокачественной глиомой и диссеминированными опухолями половых клеток ЦНС [117, 123].Кроме того, нарушение или повреждение эндотелия может способствовать экспрессии эндотелиальных рецепторов, которые обычно подавляются, открывая новые петли связи между эндотелием, перицитами, астроцитами и микроглией. Они также играют важную роль в восстановлении барьера. Физиологический стресс, временное повышение внутричерепного давления и нежелательная доставка противоопухолевых агентов к нормальным тканям мозга — это нежелательные побочные эффекты, наблюдаемые у человека.
5.7. Усиленный сфокусированный ультразвук с микропузырьками
Помимо описанных выше методов, гематоэнцефалический барьер можно временно и локально открыть сфокусированным ультразвуком в присутствии циркулирующих микропузырьков [124].Микропузырьки — это маленькие «пузыри» монолипидов, которые могут проходить через гематоэнцефалический барьер. Они образуют липофильный пузырек, который легко преодолевает барьер [119]. Ультразвук увеличивает проницаемость гематоэнцефалического барьера, создавая помехи в плотных контактах в определенных областях. Таким образом, комбинированный эффект микропузырьков и ультразвукового звука позволяет лекарству попасть в очень специфическую область с диффузией микропузырьков. Чаще микропузырьки диффундируют только там, где ультразвук разрушает барьер.Сфокусированный ультразвук также используется для доставки целевых клеток NK-92 в мозг с использованием модели метастатического рака груди [125]. Таким образом, загрузка микропузырька активным лекарством для диффузии через барьер и нацеливания на конкретную область увеличивает полезность и действие лекарственного средства [119]. Также было обнаружено, что это более осуществимо для направленного переноса генов в центральную нервную систему с помощью Фокусированного ультразвукового исследования под контролем МРТ, вызванного нарушением гематоэнцефалического барьера [126]. Точно так же была разработана технология микропузырьков, содержащих доксорубицин, которая разрушает опухоли с помощью сфокусированного ультразвука и создает фрагменты.Дальнейшие образующиеся наночастицы способны выходить через протекающую сосудистую сеть опухоли, способствуя накоплению лекарственного средства в интерстиции [127]. Таким образом, микропузырьки, нагруженные гидрофильным лекарственным средством, доксорубицином и паклитакселом, используются для доставки лекарств, запускаемой ультразвуком [127]. Аналогичным образом, UCA (полимерные ультразвуковые агенты), нагруженные гидрофобным лекарственным средством паклитакселом, запускаемые сфокусированным ультразвуком, показали огромный потенциал для направленной и устойчивой доставки лекарственного средства в опухоли [127]. Вместо размера микропузырька необходимо определить его путь и стабильность для доставки лекарств к конкретным участкам мозга (таблица 1) [119].
Аналогичным образом, для более безопасной и эффективной доставки лекарств НЧ (наночастицы) используются в качестве одного из основных потенциальных средств доставки для переноса лекарства и его распределения в различных частях человеческого тела различными путями. Следовательно, стратегии, которые могут успешно переносить наночастицы в мозг, могут значительно повысить эффективность нейропротективных препаратов при мозговом инсульте [128] и нейродегенеративных заболеваниях [129]. Их также можно использовать для снятия окислительного стресса, возникающего после патогенеза [130], хотя мозг имеет высокий метаболизм кислорода, но не имеет механизма антиоксидантной защиты [130].Однако оксидативный стресс, связанный с анализом экспрессии генов, может предоставить эффективную информацию для понимания нейровоспаления и нейродегенерации, связанных с NPS [130]. Таким образом, дисфункция гематоэнцефалического барьера (ГЭБ) будет способствовать доставке лекарства и доставить его к основным мишеням патологических участков [131]. Он также увеличивает концентрацию лекарственного средства, а его терапевтическое действие способствует лечению заболеваний, нарушений и расстройств, связанных с ЦНС, которые, по-видимому, очень трудно поддаются лечению [129].Кроме того, и рецептор, и место действия лекарственного средства на ГЭБ требуют более совершенных разработок лекарств, которые могли бы не только повысить его активность и селективность, но также значительно повысить терапевтический индекс лекарственного средства [129] (Таблица 1).
Кроме того, размер молекулы лекарства, по-видимому, является основным определяющим фактором в терапии ЦНС. Вне зависимости от того, всасывается ли вещество и проходит через носовой респираторный эпителий и / или транспортируется по обонятельному пути, ему нужен идеальный меньший размер [132].Другие факторы, влияющие на доставку лекарства в мозг, включают степень диссоциации и липофильность. Однако более высокая липофильность может привести к лучшей транспортировке терапевтических агентов. Как только лекарство переносится в мозг, на него в дальнейшем влияют системы переносчиков оттока ГЭБ, такие как P-гликопротеин (P-gp) [133]. Его захват в мозг может быть увеличен, если лекарства вводить в сочетании с ингибитором оттока P-gp, рифампицином [48, 134]. Кроме того, не существует эффективных терапевтических вмешательств, разработанных для проверки цереброваскулярной токсичности наркотиков, вызывающих злоупотребление, таких как метамфетамин [135].Точно так же для повышения антиоксидантной способности микрососудов головного мозга интенсивные физические упражнения могут защитить от нарушения гематоэнцефалического барьера, вызванного МЕТН [135]. Однако везикулы, заключенные в фосфолипиды, высвобождаемые как эукариотами, так и прокариотами в окружающую среду, удаляют вредные молекулы с помощью грузов везикул. Их можно использовать для обмена биомолекул путем нагрузки на трансмембранные рецепторы. Они также доставляют генетическую информацию одним и тем же путем и тем же механизмом [136]. Эти везикулы защищают клетку от накопления отходов и лекарств внутри клетки.Микровезикулы имеют множество химических применений и используются в качестве биомаркеров в терапии рака [136]. Эти везикулы легко проходят через гематоэнцефалический барьер и действуют как естественные липосомы, а содержащиеся в них лекарства могут переноситься в мозг и сохраняться в течение более длительного периода. Таким образом, длительное употребление лекарств защищает мозг от вирусной инфекции, травм [136], рака и некоторых эпилепсий [137]. Более того, необходимо установить равновесие между цереброваскулярной проницаемостью, когда лекарство передается через систему кровообращения для терапии нейродегенеративных заболеваний.Однако, чтобы избежать различного барьера, препятствующего проникновению терапевтических веществ в ЦНС, были разработаны различные методы доставки лекарств, такие как химическая доставка лекарств и доставка лекарств, опосредованная носителем [129].
Кроме того, ультразвуковое исследование микропузырьков с контрастным усилением — это неинвазивный метод, который используется для оценки поражений груди [138]. Они обнаруживаются до появления более крупных пузырьков после декомпрессии [139]. Микропузырьки газа очень обширны, но микропузырьки, покрытые фосфолипидом, вызывают большие изменения резонансной частоты.Они используются для измерения небольших изменений артериального давления в глубоких кровеносных сосудах [139] и абсолютного артериального давления в поверхностных органах [139]. Однако микропузырьки с липидной оболочкой и микропузырьки с оболочкой из альбумина используются для доставки лекарств к клеткам рака груди [140]. Точно так же биотинилированные микропузырьки [141] и метиленовые микропузырьки используются в двойном режиме ультразвука и активируемой фотоакустической визуализации [142], а также в сонотромболизе [143]. Таким образом, для лечения остаточной болезни используется ультразвуковая стимуляция доставки лекарств [144].Точно так же улучшение перфузии лекарственного средства в тканях может быть достигнуто за счет постоянного потока, вызванного колеблющимися микропузырьками [145]. Кроме того, усиленная доставка микро-РНК, имитирующая кардиомиоциты, с использованием микропузырьков, реагирующих на ультразвук, выявляет гипертрофию в модели in vitro [146]. Однако комбинация пузырьковых липосом и высокоинтенсивного сфокусированного ультразвука и доставки лекарств под контролем микропузырьков [147] используется для удаления опухолей [147, 148]. Таким образом, использование вызванного ультразвуком разрушения и микропузырьков может успешно передать наночастицы в мозг; что может значительно улучшить нейропротекторную эффективность лекарств при мозговом инсульте [129] и нейродегенеративных заболеваниях [130].
6. Способы доставки лекарств
6.1. Пептиды, богатые пролином, как средства доставки
Некоторые пептиды, богатые пролином, которые проходят через гематоэнцефалический барьер, используются для лечения церебральных инфекций [149]. Лучшим примером является онкоцин, который после попадания в мозг 80% его задерживается в эндотелиальных клетках, в то время как другие пептиды, такие как дрозоцин и апидецин Api 137, проникают в клетки паренхимы и обнаруживаются стабильными в плазме и мозге [149]. Бриостатин, мощный активатор протеинкиназы c (PKC), показал терапевтическую эффективность в отношении мозга [150].Сходным образом, dolichyl-P увеличивает трансэндотелиальный перенос Rhodamine 123 (Rh 123) и Ab 42 из апикального компартмента в базолатеральный компартмент [14]. Таким образом, его накопление в головном мозге играет важную роль в подавлении p-gp в BBB и способствует функции насоса в BBB при AD. Аналогичным образом, антоцианы, обнаруженные в ягодах, являются активными фитохимическими веществами, которые показывают реверсию возрастных когнитивных нарушений и защищают от нейродегенеративных расстройств [151]. Следовательно, более вероятно, что механизм нейропротекторного действия антоциана может заключаться в модуляции процессов передачи сигнала и / или экспрессии генов в ткани мозга [151].Точно так же CFC-C показал значительный нейропротекторный эффект, поскольку он содержал различные компоненты в отношении белков, связанных с апоптозом. Однако флавоноидные и полисахаридные компоненты в формуле Jiawei Wuzi Yanzong могут проходить через гематоэнцефалический барьер и в некоторой степени защищать нейроны от нейронов, индуцированных бета-амилоидным белком [138].
Аналогичная нейрональная защитная эффективность также наблюдается у Astragali radix (AR) при пероральном введении против инфекции вируса японского энцефалита (JEV) у мышей.Однако у мышей, получавших АР, количество клеток перитонеального экссудата (PEV) или макрофагов увеличивалось, и была получена высокая продукция активного кислорода [152]. Он показывает значительное увеличение выживаемости в группах животных с РА, и было обнаружено, что этот эффект зависит от неспецифического механизма во время ранней фазы инфекции [152]. Точно так же пероральная жидкость Quin Wen защищает экспериментальных кроликов от геморрагической лихорадки [153]. Это задерживает инкубационный период, снижая фебрильный индекс и контекст PGE.Он улучшает гемореологию и усиливает клеточный иммунитет в спинномозговой жидкости [153]. Аналогичным образом было показано, что аргиназа 1 защищает двигательные нейроны от лишения трофических факторов. Это позволяет сенсорным нейронам преодолевать подавление роста нейритов белками миелина. Точно так же даидзеин, потребляемый с соевыми продуктами, преодолевает гематоэнцефалический барьер и кажется безопасным и эффективным без какой-либо предварительной обработки. Он может быть разработан как идеальный кандидат для разработки терапевтических препаратов для лечения травм или ударов спинного мозга.Аналогичным образом было обнаружено, что антагонисты глутамата очень полезны и используются для защиты нервных тканей от ишемии. Антагонисты, такие как магний, МК 801 и комбинация магния и МК 801, уменьшают отек мозга и восстанавливают проницаемость ГЭБ после экспериментального диффузного повреждения [154]. Точно так же оксимы используются для смягчения повреждения нейронов, вызванного О. Они перезапускают или повторно активируют ингибированный органофосфатный локальный AChE [155]. Точно так же субфрагменты бета-амилоидов, по-видимому, защищают нейроны от болезни Альцгеймера [156].Более того, микросферы хитозана используются для улавливания лекарства и формирования наноносителя для его проникновения через ГЭБ. Это новый метод, который в основном используется для доставки нановакцин [157]. Его можно использовать для доставки лекарств для лечения вирусной инфекционной деменции [158] и нейрокогнитивных расстройств (таблица 1) [159]. Это также используется для активации ингибиторов ангиотензинпревращающего фермента (AE), которые проникают через гематоэнцефалический барьер [159]. Точно так же эритропоэтин (ЭПО) также действует как нейропротектор, который используется при интраназальной доставке [45, 157].Это неинвазивный метод, который преодолевает гематоэнцефалический барьер (ГЭБ) для доставки терапевтических агентов в мозг [157]. Более конкретно, N-ацетилцистеинамид (NACA) защищает гематоэнцефалический барьер (BBB) от повреждений, вызываемых окислительным стрессом, у животных, получавших gp 120 Tat и метамфетамин [160]. Таким образом, он может стать жизнеспособным терапевтическим вариантом для пациентов с деменцией, связанной с ВИЧ-1 (HAD) [160]. Кроме того, антиретровирусное лечение предотвращает дисфункцию центральной нервной системы за счет снижения вирусной нагрузки мозга и уровня интерферона альфа [159].
6.2. Наночастицы как средство доставки лекарств
Наночастицы представляют собой полимерные частицы наноразмерного размера, состоящие из природных или искусственных полимеров. Они имеют размер от 10 до 1000 нм (1 мм). Они взаимодействуют с биологическими барьерами, легко проходят через них и используются для контролируемого нацеливания лекарственных средств и биораспределения фармацевтических препаратов. Лекарства могут связываться в форме твердого раствора или дисперсии, адсорбироваться на поверхности или химически присоединяться к наночастицам, поддерживающим загрузку носителя (рис. 4).Кроме того, полимер, используемый при создании наночастиц, улучшает их стабильность в биологической среде. Он также помогает опосредовать биораспределение активных соединений, загрузку лекарства, нацеливание лекарства, транспорт, высвобождение и взаимодействие с биологическими барьерами. Но в обычных случаях использование нанополимеров оказывается инвазивным и токсичным, поскольку продукты их разложения создают серьезные проблемы для ЦНС. Однако цитотоксичность, вызванная наночастицами или продуктами их разложения, остается серьезной проблемой при разработке лекарств.Однако действительно необходимы улучшения в биосовместимости; следовательно, это должно стать главной задачей будущих фармацевтических исследований [161].
Наночастицы имеют огромное медицинское применение и стали основным инструментом в наномедицине, чем традиционные методы доставки лекарств [162]. Это дает огромные преимущества в отношении нацеливания, доставки и высвобождения лекарств. Кроме того, их дополнительный потенциал может быть использован для сочетания диагностики и терапии, что будет работать как многие полезные новые инструменты в наномедицине [163].Доказано, что они являются лучшими средствами доставки лекарств в биологические системы для более безопасного лечения различных нейродегенеративных и вирусных заболеваний. Это высокоэффективные системы доставки лекарств, которые потенциально могут использоваться для многих приложений, в основном в противоопухолевой терапии, генной терапии, терапии СПИДа и лучевой терапии. Они также используются для доставки белков, антибиотиков, виростатиков и вакцин и используются в качестве носителей или везикул для прохождения гематоэнцефалического барьера [162, 163].Кроме того, эти системы доставки лекарств потенциально могут использоваться для переноса молекулярных и иммунологических агентов в биологическую систему. Они используются для доставки генов и для получения рекомбинантных терапевтических пептидов, синтезируемых путем слияния новых генов с клетками. Он может эффективно переносить нейротрофические агенты для устранения нейродегенеративных заболеваний. Таким образом, проницаемость наночастиц обеспечивает безопасное и длительное высвобождение лекарства в целевом участке через 1-2 недели после инъекции [164]. В частности, наночастицы находят более широкое применение в терапии опухолей головного мозга и лечении рака и болезни Альцгеймера [165].
Существует две основные категории наночастиц: неорганические и органические. Они указаны в таблице 2. Неорганические наночастицы в основном бывают магнитными, металлическими, нанооболочками и керамическими. Магнитные наночастицы — это суперпарамагнитные частицы оксида железа, которые проявляют большие магнитные моменты в магнитном поле. Они биоконкурентоспособны, несовместимы, химически стабильны и просты в производстве. Они в основном используются для адресной доставки лекарств / генов и используются в термотерапии. Следующая категория наночастиц — это металлические наночастицы, которые содержат наночастицы золота или серебра или меди и железа.Они меньше по размеру (<50 нм), имеют большую площадь поверхности, несут высокие дозы лекарств, но они демонстрируют плохую биосовместимость и не имеют определенной функции при использовании in vivo . Они используются для контролируемого высвобождения лекарств, белков и ДНК, инкапсулированных в полые ядра металлических оболочек в желаемых местах. Они широко используются в катализе, зондировании, визуализации и доставке лекарств. Наночастицы кремнезема — это нанооболочки, которые обладают таким же визуализирующим / терапевтическим потенциалом, как и кванты. Они менее токсичны и имеют относительно большой размер по сравнению с квантовыми точками.Они используются для фототермической абляции опухоли. Они образуют иммуноконъюгаты, которые очень подходят для биотеста иммуноглобулинов. Керамические наночастицы состоят из неметаллических материалов, которые дешевы и стабильны. Они могут быть образованы неорганическими биосовместимыми материалами, диоксидом кремния, диоксидом титана и оксидом алюминия. Они меньшего размера (<100). Они относительно гибки, просты в производстве, растворимы в воде и биологически стабильны. Они могут образовывать покрытия и создавать объемные материалы при низких температурах.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клетки, ткани, функции и болезни
Наша иммунная система необходима для нашего выживания.Без иммунной системы наши тела были бы открыты для атак бактерий, вирусов, паразитов и многого другого. Именно наша иммунная система поддерживает наше здоровье, пока мы дрейфуем сквозь море патогенов.
Эта обширная сеть клеток и тканей постоянно ищет захватчиков, и как только враг обнаружен, начинается комплексная атака.
Иммунная система распространяется по всему телу и включает в себя множество типов клеток, органов, белков и тканей. Что особенно важно, он может отличить нашу ткань от чужеродной — собственную от чужой.Мертвые и поврежденные клетки также распознаются и удаляются иммунной системой.
Если иммунная система сталкивается с патогеном, например, бактерией, вирусом или паразитом, у нее возникает так называемый иммунный ответ. Позже мы объясним, как это работает, но сначала мы познакомим вас с некоторыми из основных персонажей иммунной системы.
Поделиться на PinterestЛейкоцит (желтый), атакующий бактерии сибирской язвы (оранжевый). Белая линия внизу составляет 5 микрометров.Изображение предоставлено: Фолькер Бринкманн
Лейкоциты также называют лейкоцитами.Они циркулируют в организме в кровеносных и лимфатических сосудах, которые проходят параллельно венам и артериям.
Белые кровяные тельца постоянно патрулируют и ищут патогены. Когда они находят цель, они начинают размножаться и посылать сигналы другим типам клеток, чтобы сделать то же самое.
Наши лейкоциты хранятся в разных частях тела, которые называются лимфоидными органами. К ним относятся следующие:
- Тимус — железа между легкими и чуть ниже шеи.
- Селезенка — орган, фильтрующий кровь. Он находится в верхнем левом углу живота.
- Костный мозг — находится в центре костей, он также производит эритроциты.
- Лимфатические узлы — небольшие железы, расположенные по всему телу и связанные лимфатическими сосудами.
Есть два основных типа лейкоцитов:
1. Фагоциты
Эти клетки окружают и поглощают патогены и разрушают их, эффективно поедая их.Существует несколько типов, в том числе:
- Нейтрофилы — это наиболее распространенный тип фагоцитов, который имеет тенденцию атаковать бактерии.
- Моноциты — это самый крупный тип, выполняющий несколько функций.
- Макрофаги — они патрулируют патогены, а также удаляют мертвые и умирающие клетки.
- Тучные клетки — они выполняют множество функций, включая помощь в заживлении ран и защите от патогенов.
2. Лимфоциты
Лимфоциты помогают организму запоминать предыдущих захватчиков и распознавать их, если они снова атакуют.
Лимфоциты начинают свою жизнь в костном мозге. Некоторые остаются в костном мозге и развиваются в В-лимфоциты (В-клетки), другие направляются в тимус и становятся Т-лимфоцитами (Т-лимфоцитами). Эти два типа клеток имеют разные роли:
- B-лимфоцитов — они вырабатывают антитела и помогают предупреждать Т-лимфоциты.
- Т-лимфоциты — они разрушают поврежденные клетки в организме и помогают предупреждать другие лейкоциты.
Иммунная система должна уметь отличать себя от чужого.Он делает это, обнаруживая белки, которые находятся на поверхности всех клеток. Он учится игнорировать свои собственные или собственные белки на ранней стадии.
Антиген — это любое вещество, которое может вызвать иммунный ответ.
Во многих случаях антигеном является бактерия, грибок, вирус, токсин или инородное тело. Но это также может быть одна из наших собственных ячеек, неисправная или мертвая. Первоначально ряд типов клеток работают вместе, чтобы распознавать антиген как захватчика.
Роль В-лимфоцитов
Как только В-лимфоциты обнаруживают антиген, они начинают секретировать антитела («антиген» — это сокращение от «генераторы антител»).Антитела — это особые белки, которые связываются со специфическими антигенами.
Каждая В-клетка вырабатывает одно специфическое антитело. Например, один может создать антитело против бактерий, вызывающих пневмонию, а другой может распознать вирус простуды.
Антитела являются частью большого семейства химических веществ, называемых иммуноглобулинами, которые играют множество ролей в иммунном ответе:
- Иммуноглобулин G (IgG) — маркирует микробы, чтобы другие клетки могли распознавать их и бороться с ними.
- IgM — специалист по уничтожению бактерий.
- IgA — накапливается в жидкостях, таких как слезы и слюна, где он защищает ворота в организм.
- IgE — защищает от паразитов, а также вызывает аллергию.
- IgD — остается связанным с В-лимфоцитами, помогая им запустить иммунный ответ.
Антитела фиксируют антиген, но не убивают его, а лишь отмечают смерть. Убийство — это работа других клеток, таких как фагоциты.
Роль Т-лимфоцитов
Существуют различные типы Т-лимфоцитов:
Т-хелперные Т-клетки (Th-клетки) — они координируют иммунный ответ. Некоторые связываются с другими клетками, а некоторые стимулируют В-клетки производить больше антител. Другие привлекают больше Т-клеток или фагоцитов, поедающих клетки.
Т-киллеры (цитотоксические Т-лимфоциты) — как следует из названия, эти Т-клетки атакуют другие клетки. Они особенно полезны для борьбы с вирусами.Они работают, распознавая небольшие части вируса снаружи инфицированных клеток и уничтожая инфицированные клетки.
Иммунная система каждого человека разная, но, как правило, она становится сильнее в зрелом возрасте, поскольку к этому времени мы подвергаемся воздействию большего количества патогенов и развиваем больший иммунитет.
Именно поэтому подростки и взрослые болеют реже, чем дети.
После того, как антитело было произведено, его копия остается в организме, так что, если тот же антиген появится снова, с ним можно будет справиться быстрее.
Вот почему при некоторых заболеваниях, таких как ветряная оспа, вы получаете их только один раз, поскольку в организме есть антитела к ветряной оспе, готовые и ждущие, чтобы уничтожить их в следующий раз, когда они появятся. Это называется иммунитетом.
У людей есть три типа иммунитета, которые называются врожденным, адаптивным и пассивным:
Врожденный иммунитет
Мы все рождаемся с некоторым уровнем иммунитета к захватчикам. Иммунная система человека, как и иммунная система многих животных, будет атаковать иностранных захватчиков с первого дня.Этот врожденный иммунитет включает внешние барьеры нашего тела — первую линию защиты от патогенов, например кожу и слизистые оболочки горла и кишечника.
Этот ответ более общий и не конкретный. Если патогену удается увернуться от врожденной иммунной системы, срабатывает адаптивный или приобретенный иммунитет.
Адаптивный (приобретенный) иммунитет
Эта защита от патогенов развивается по мере того, как мы идем по жизни. Когда мы подвергаемся болезням или вакцинируемся, мы создаем библиотеку антител к различным патогенам.Иногда это называют иммунологической памятью, потому что наша иммунная система помнит предыдущих врагов.
Пассивный иммунитет
Этот тип иммунитета «позаимствован» из другого источника, но не действует бесконечно. Например, ребенок получает антитела от матери через плаценту до рождения и с грудным молоком после рождения. Этот пассивный иммунитет защищает ребенка от некоторых инфекций в первые годы его жизни.
Иммунизация
Иммунизация вводит человеку антигены или ослабленные патогены таким образом, чтобы человек не заболел, но все еще вырабатывал антитела.Поскольку в организме сохраняются копии антител, оно защищено, если угроза снова появится в более позднем возрасте.
Поскольку иммунная система очень сложна, существует множество потенциальных причин, по которым она может пойти не так. Типы иммунных расстройств делятся на три категории:
Иммунодефициты
Они возникают, когда одна или несколько частей иммунной системы не функционируют. Иммунодефицит может быть вызван разными причинами, включая возраст, ожирение и алкоголизм. В развивающихся странах недоедание — частая причина.СПИД — это пример приобретенного иммунодефицита.
В некоторых случаях иммунодефицит может передаваться по наследству, например, при хронической гранулематозной болезни, когда фагоциты не функционируют должным образом.
Аутоиммунитет
При аутоиммунных состояниях иммунная система ошибочно нацелена на здоровые клетки, а не на чужеродные патогены или дефектные клетки. В этом сценарии они не могут отличить себя от чужого.
Аутоиммунные заболевания включают целиакию, диабет 1 типа, ревматоидный артрит и болезнь Грейвса.
Гиперчувствительность
При гиперчувствительности иммунная система чрезмерно реагирует, повреждая здоровые ткани. Примером может служить анафилактический шок, когда организм реагирует на аллерген настолько сильно, что это может быть опасно для жизни.
Иммунная система невероятно сложна и чрезвычайно важна для нашего выживания. Несколько различных систем и типов клеток работают в идеальной синхронности (большую часть времени) по всему телу, чтобы бороться с патогенами и удалять мертвые клетки.
Определение, типы, заболевания, профилактика и многое другое
Патогены — это организмы, которые могут вызывать заболевания.Различные типы патогенов и тяжесть вызываемых ими заболеваний очень разнообразны.
В этой статье мы рассмотрим различные патогены, их влияние на людей и болезни, которые они вызывают. Мы также объясняем, как распространяются патогены и как снизить риск заражения.
Патоген приносит болезнь своему хозяину. Другое название возбудителя — инфекционный агент, так как они вызывают инфекции. Как и в случае с любым организмом, патогены отдают приоритет выживанию и воспроизводству.
Иммунная система человека действует как защита от патогенов.Организм может легко бороться с некоторыми патогенами, но другие потенциально смертельны.
Существует пять основных типов патогенов:
Бактерии
Бактерии — это микроскопические патогены, которые быстро размножаются после попадания в организм. Они могут выделять токсины, которые повреждают ткани и вызывают болезни.
Врачи обычно назначают антибиотики для лечения бактериальных инфекций, но некоторые бактерии становятся устойчивыми к этим препаратам.
Однако не все бактерии являются патогенными.В организме существует множество типов безвредных бактерий, некоторые из которых могут даже поддерживать основные функции организма.
Вирусы
Вирус, который меньше бактерий, проникает в клетку-хозяин. Затем он реплицируется, производя сотни и тысячи новых вирусов, которые продолжают заражать другие клетки-хозяева. Вирусы могут передаваться от человека к человеку различными путями, в том числе:
- через респираторные капли, которые перемещаются по воздуху
- при контакте с кровью человека с инфекцией
- через контакт с жидкостями организма человека, инфицированного инфекцией
Грибы
Существуют тысячи видов грибов, некоторые из которых вызывают болезни у людей.Распространенные грибковые заболевания кожи включают микоз стопы и стригущий лишай. Эти состояния заразны и могут передаваться от человека к человеку.
Исследование, проведенное в Trends in Microbiology , показало, что у грибковых патогенов развивается способность к памяти. Они могут использовать сигналы в теле, чтобы предвидеть неминуемую угрозу своему выживанию, к которой они затем могут подготовиться.
Протисты
Эти одноклеточные организмы вызывают болезни у своего хозяина. Они заражают другие организмы, чтобы выжить и размножаться.
Патогены простейших поражают растения и продовольственные культуры. Продукты, содержащие простейшие, могут вызвать дизентерию — инфекцию кишечника, вызывающую диарею.
Патогены простейших также могут быть паразитическими и жить в других организмах, таких как комары. Протисты вызывают малярию через укусы комаров.
Паразитические черви
Паразитические черви, также известные как гельминты, достаточно велики, чтобы люди могли видеть их невооруженным глазом, и они могут жить во многих частях тела.Некоторые черви включают:
- Плоские черви: К ним относятся ленточные черви, которые обитают в кишечнике.
- Черви с шипами на голове: Этот вид червей обитает в кишечнике.
- Круглые черви: Эти черви могут выжить в желудочно-кишечном тракте и лимфатической системе.
Патогены могут вызывать множество различных заболеваний, некоторые из которых более серьезны, чем другие. Человеческие тела богаты питательными веществами и могут обеспечить патогену идеальную среду для роста и размножения.
Степень тяжести инфекций, вызываемых патогенами, может быть разной. Некоторые инфекции могут быть легкими, в то время как другие могут быть опасными для жизни. Например, простуда — это легкая вирусная инфекция по сравнению со смертельной болезнью, вызванной вирусом Эбола.
К болезням, вызываемым бактериальными патогенами, относятся:
Некоторые ученые считают, что вирусы не являются живыми организмами. Вот некоторые причины:
- у них нет клеток
- они не могут воспроизводиться без вторжения в живую клетку
- они не реагируют активно на изменения в окружающей среде
К вирусным инфекциям относятся:
Около 300 видов грибов патогенны для человека.Как и бактерии и вирусы, они могут оказывать значительное влияние на здоровье человека.
Грибки вызывают множество различных типов заболеваний, в том числе:
- астму
- инфекции кожи и ногтей
- инфекции легких, такие как пневмония
- инфекции кровотока
- менингит
Простейшие вызывают большинство простейших заболеваний. Простейшие — это одноклеточные микроорганизмы, которые питаются другими микроорганизмами, органическими тканями и мусором.К протистским болезням относятся:
- дизентерия
- малярия
- Африканский трипаносомоз или сонная болезнь
Паразитические черви вызывают множество болезней, в том числе:
Патогены могут распространяться различными путями. Например, прямой контакт кожа к коже во время секса может привести к инфекциям, передаваемым половым путем (ИППП).
При кашле или чихании болезнетворные микроорганизмы могут распространяться через крошечные капельки в воздухе. Эти капли могут содержать микроорганизмы, которыми дышат другие люди.
Микроорганизмы также могут попадать прямо в кишечник, когда человек употребляет зараженную пищу или воду.
Укусы инфицированных насекомых также могут распространять болезнь. Например, клещи с бактериальной инфекцией могут вызвать болезнь Лайма, если кого-то укусили, а комары с вирусной инфекцией могут вызвать болезнь, вызванную вирусом Зика.
Помимо поддержания хорошего общего состояния здоровья, человек может предпринять определенные шаги для снижения риска заражения патогенами. К ним относятся:
- Регулярное мытье и сушка рук: Регулярное мытье рук имеет решающее значение для предотвращения распространения болезней.Люди должны мыть их не менее 20 секунд водой с мылом или дезинфицирующим средством на спиртовой основе. Это особенно важно после занятий на открытом воздухе, прикосновений к животным, посещения туалета, ухода за больными, чихания или кашля.
- Будьте в курсе рекомендованных вакцин: Вакцины против инфекционных заболеваний, таких как грипп, коклюш и корь, доступны для младенцев, детей и взрослых. Вакцины стимулируют иммунную систему распознавать патогены, уничтожать их и предотвращать будущие инфекции.
- Содержание поверхностей в чистоте: Загрязненные поверхности или предметы могут передавать болезни. Исследование, проведенное в аэропорту Финляндии, обнаружило вирусное заражение в нескольких местах на поверхностях, к которым люди часто прикасаются.
- Уборка кухонь и ванных комнат: Очень важно содержать в чистоте столешницы и кухонные поверхности, особенно перед приготовлением пищи. В ванной также может быть высокая концентрация инфекционных агентов.
- Оставаться дома в случае болезни: Люди с инфекциями должны избегать посещения школы, работы или тесного контакта с другими людьми, чтобы снизить вероятность распространения патогена.
- Как избежать укусов насекомых: Люди могут сделать это, надев репеллент от насекомых и подходящую одежду, такую как рубашки с длинными рукавами, брюки и шляпу, в местах, где они могут встретить насекомых.
- Практика безопасного секса: Практика безопасного секса, включая использование презервативов и регулярные проверки сексуального здоровья, может снизить вероятность ИППП.
- Получение медицинской консультации: Человек может поговорить с медицинским работником, если есть признаки инфекции или лечение не работает.
Патогены поражают все живые организмы и вызывают болезни людей множеством различных способов.
Они могут повреждать ткани или клетки, производя токсины по мере их размножения.
В то время как некоторые патогены вызывают легкие проблемы, другие могут быть опасными для жизни. Медицинские эксперты продолжают изучать болезни, вызываемые патогенами, чтобы больше узнать об их причинах и способах их лечения.
Симптомы, лечение, причины и профилактика
Брюшной тиф — это бактериальная инфекция, которая может вызвать высокую температуру, диарею и рвоту.Это может быть фатальным. Вызывается бактериями Salmonella typhi.
Инфекция часто передается через зараженную пищу и питьевую воду, и она более распространена в местах, где мыть руки реже. Он также может передаваться носителями, которые не знают, что являются переносчиками бактерий.
Ежегодно в Соединенных Штатах регистрируется около 5700 случаев заболевания, 75 процентов из которых начинаются во время международных поездок. Ежегодно во всем мире брюшным тифом болеют около 21,5 миллиона человек.
Если брюшной тиф обнаружен на ранней стадии, его можно успешно лечить антибиотиками; если его не лечить, брюшной тиф может быть смертельным.
Краткие сведения о брюшном тифе
- Брюшной тиф — распространенная бактериальная инфекция в странах с низким уровнем доходов.
- Если не лечить, это приводит к летальному исходу примерно в 25% случаев.
- Симптомы включают высокую температуру и желудочно-кишечные проблемы.
- Некоторые люди переносят бактерии без развития симптомов
- Большинство случаев заболевания, зарегистрированных в Соединенных Штатах, зарегистрировано за границей
- Единственное лечение брюшного тифа — антибиотики
Брюшной тиф — инфекция, вызываемая бактерией Salmonella typhimurium (S. typhi) .
Бактерия обитает в кишечнике и кровотоке человека. Он распространяется между людьми при прямом контакте с фекалиями инфицированного человека.
Ни одно животное не является переносчиком этой болезни, поэтому всегда передается от человека человеку.
При отсутствии лечения примерно 1 из 5 случаев брюшного тифа может быть смертельным. При лечении менее 4 из 100 случаев заканчиваются летальным исходом.
С.typhi проникает через рот и проводит в кишечнике от 1 до 3 недель. После этого он проникает через стенку кишечника в кровоток.
Из кровотока распространяется в другие ткани и органы. Иммунная система хозяина мало что может сделать, чтобы дать отпор, потому что S. typhi может жить в клетках хозяина, в безопасности от иммунной системы.
Брюшной тиф диагностируется путем обнаружения S. typhi в образцах крови, стула, мочи или костного мозга.
Симптомы обычно появляются через 6–30 дней после контакта с бактериями.
Два основных симптома брюшного тифа — лихорадка и сыпь. Тифозная лихорадка особенно высока, постепенно повышаясь в течение нескольких дней до 104 градусов по Фаренгейту, или от 39 до 40 градусов по Цельсию.
Сыпь, которая встречается не у всех пациентов, состоит из пятен розового цвета, особенно на шее и животе.
Другие симптомы могут включать:
В редких случаях симптомы могут включать спутанность сознания, диарею и рвоту, но обычно они не являются серьезными.
В серьезных, нелеченных случаях кишечник может перфорироваться. Это может привести к перитониту — инфекции ткани, выстилающей внутреннюю часть живота, которая считается смертельной в 5–62 процентах случаев.
Другая инфекция, паратиф, вызывается Salmonella enterica . Он имеет симптомы, аналогичные симптомам брюшного тифа, но с меньшей вероятностью летальный исход.
Единственное эффективное лечение брюшного тифа — это антибиотики. Чаще всего используются ципрофлоксацин (для небеременных взрослых) и цефтриаксон.
Помимо антибиотиков, для регидратации важно пить достаточное количество воды.
В более тяжелых случаях, когда кишечник перфорирован, может потребоваться операция.
Тифозная устойчивость к антибиотикам
Как и в случае с рядом других бактериальных заболеваний, в настоящее время существует озабоченность по поводу растущей устойчивости антибиотиков к S. typhi.
Это влияет на выбор доступных лекарств для лечения брюшного тифа. Например, в последние годы брюшной тиф стал устойчивым к триметоприм-сульфаметоксазолу и ампициллину.
Ципрофлоксацин, одно из основных лекарств от брюшного тифа, также испытывает аналогичные трудности. Некоторые исследования показали, что уровень устойчивости Salmonella typhimurium составляет около 35 процентов.
Брюшной тиф вызывается бактериями S. typhi и распространяется через пищу, напитки и питьевую воду, зараженные инфицированными фекалиями. При мытье фруктов и овощей зараженная вода может распространиться.
Некоторые люди являются бессимптомными носителями брюшного тифа, что означает, что они являются носителями бактерий, но не страдают от побочных эффектов.Другие продолжают нести бактерии после исчезновения симптомов. Иногда болезнь может появиться снова.
Людям с положительным результатом в качестве носителей может быть отказано в работе с детьми или пожилыми людьми до тех пор, пока медицинские тесты не подтвердят их чистоту.
Страны с ограниченным доступом к чистой воде и средствам для стирки обычно имеют большее количество случаев брюшного тифа.
Вакцинация
Поделиться на Pinterest Если вы путешествуете по региону, где распространен брюшной тиф, рекомендуется вакцинация.Перед поездкой в зону повышенного риска рекомендуется сделать прививку от брюшного тифа.
Это может быть достигнуто путем перорального приема лекарств или одноразовой инъекции:
- Перорально: живая аттенуированная вакцина. Состоит из 4 таблеток, по одной через день, последнюю — за 1 неделю до поездки.
- Прививка — инактивированная вакцина, вводимая за 2 недели до поездки.
Вакцины не эффективны на 100%, поэтому при приеме пищи и питье следует соблюдать осторожность.
Вакцинацию не следует начинать, если человек в настоящее время болеет или ему меньше 6 лет. Людям с ВИЧ не следует принимать живую пероральную дозу.
Вакцина может иметь побочные эффекты. У каждого 100 человек поднимется температура. После пероральной вакцины могут возникнуть проблемы с желудочно-кишечным трактом, тошнота и головная боль. Однако тяжелые побочные эффекты при использовании любой вакцины редки.
Существует два типа вакцины против брюшного тифа, но все же требуется более мощная вакцина.Живая пероральная версия вакцины — самая сильная из двух. Спустя 3 года он по-прежнему защищает людей от инфекции в 73 процентах случаев. Однако у этой вакцины больше побочных эффектов.
Существующие вакцины не всегда эффективны, и, поскольку брюшной тиф широко распространен в более бедных странах, необходимо провести дополнительные исследования, чтобы найти более эффективные способы предотвращения его распространения.
Устранение брюшного тифа
Даже после того, как симптомы брюшного тифа прошли, бактерии могут оставаться носителями.
Это затрудняет искоренение болезни, потому что носители, симптомы которых исчезли, могут быть менее осторожны при мытье пищи или общении с другими людьми.
Людям, путешествующим в Африке, Южной Америке и Азии, в частности в Индии, следует проявлять бдительность.

