Феринжект инструкция по применению: показания, противопоказания, побочное действие – описание Ferinject р-р д/в/в введения 50 мг/1 мл: фл. 2 мл 1 или 5 шт., 10 мл 1, 2 или 5 шт. (29503)
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000), очень редко (<1/10000, включая отдельные случаи), частота неизвестна.
Сообщалось о следующих нежелательных реакциях, выявленных в ходе проведения клинических исследований, в рамках которых лекарственный препарат Феринжект® принимали более 8000 пациентов, а также реакциях, сообщения о которых были получены в постмаркетинговый период.
Со стороны иммунной системы: нечасто — гиперчувствительность; редко — анафилактические/анафилактоидные реакции.
Со стороны обмена веществ: часто — гипофосфатемия.
Со стороны нервной системы:
Нарушения психики: редко — тревога2.
Со стороны сердечно-сосудистой системы: часто — «прилив» крови к лицу, артериальная гипертензия; нечасто — тахикардия, артериальная гипотензия; редко — флебит, обморок2, предобморочное состояние2; частота неизвестна — синдром Коуниса1.
Со стороны дыхательной системы: нечасто — одышка; редко — бронхоспазм2.
Со стороны пищеварительной системы: часто — тошнота; нечасто — рвота, диспепсия, боль в животе, запор, диарея; редко — вздутие живота.
Со стороны кожи и подкожных тканей: нечасто — кожный зуд, крапивница, эритема, кожная сыпь3; редко — ангионевротический отек2, бледность2; частота неизвестна — отек лица1.
Со стороны костно-мышечной системы: нечасто — миалгия, боль в спине, боль в суставах, боль в конечностях, судороги мышц.
Общие расстройства и нарушения в месте введения: часто — реакции в области инъекции/инфузии4; нечасто — лихорадка, слабость, боль в груди, периферические отеки, озноб; редко — недомогание, гриппоподобное состояние (может возникнуть через промежуток времени, варьирующийся от нескольких часов до нескольких дней)2.
Лабораторные и инструментальные данные: нечасто — повышение активности АЛТ в крови, повышение активности АСТ в крови, повышение активности ГГТ в крови, повышение активности ЛДГ в крови, повышение активности ЩФ в крови.
Наиболее частой нежелательной реакцией является тошнота, встречающаяся у 2.9% пациентов, за которой следуют реакции в месте инъекции/инфузии, гипофосфатемия, головная боль, приливы крови, головокружение и гипертензия. Реакции в месте инъекции/инфузии включают несколько нежелательных реакций, которые по отдельности являются нечастыми или редкими.
Для участников клинических испытаний, которые показали снижение уровня фосфора в сыворотке, минимальные значения были получены примерно через 2 недели, а в большинстве случаев возвращались к исходным значениям через 12 недель после лечения препаратом Феринжект®.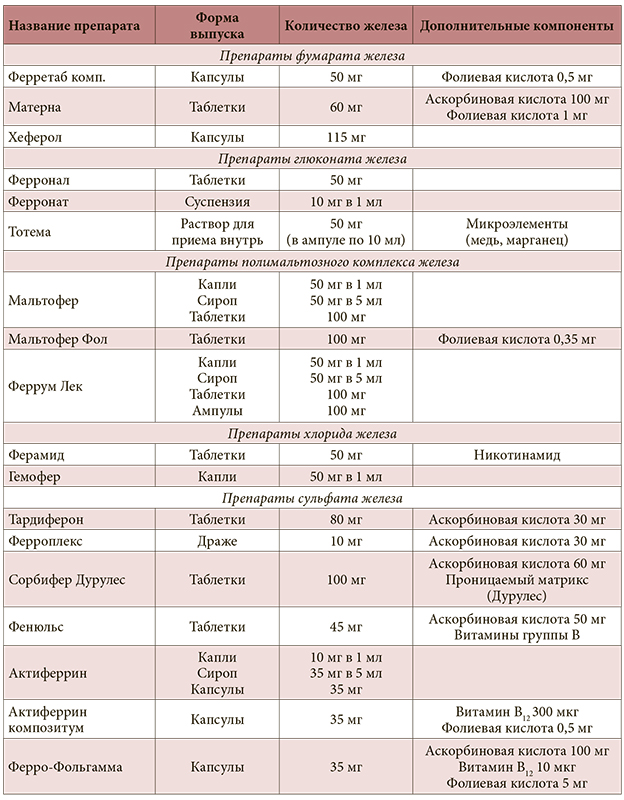 Наиболее серьезными нежелательными реакциями являются анафилактоидные/анафилактические реакции, частота встречаемости которых оценивается как редкая (см. раздел «Особые указания»).
Наиболее серьезными нежелательными реакциями являются анафилактоидные/анафилактические реакции, частота встречаемости которых оценивается как редкая (см. раздел «Особые указания»).
1 Нежелательные реакции, которые отмечались исключительно в постмаркетинговый период: частота встречаемости оценивается как редкая.
2 Нежелательные реакции, которые отмечались как в постмаркетинговый период, так и в клинических исследованиях.
3 Включая нежелательные реакции, обозначаемые следующими предпочтительными терминами: кожная сыпь (индивидуальная частота этой нежелательной реакции оценивается как нечастая) и эритематозная сыпь, генерализованная, макулезная, макуло-папулезная, зудящая (индивидуальная частота всех нежелательных реакций оценивается как редкая).
Введение в/в железа при анемии у беременных в СПб
Причины железодефицитной анемии у беременных
Снижение гемоглобина возникает в результате:
- Потери крови по разным причинам ― маточные кровотечения, из пищеварительного канала, носа, почек, легких, десен. Они возникают в результате травм или хирургических операций, удаления зубов, донорства, лечебного кровопускания, патологических менструаций, язвы желудка и двенадцатиперстной кишки, гастрита, геморроя, опухолей, генетических заболеваний, инфекций.
- Дефицита железа из пищи ― часто наблюдается у вегетарианцев, при лечебном голодании, диетах, однообразном и нерегулярном питании.
- Нарушения его всасывания ― из-за дефицита хлористоводной кислоты в желудочном соке, воспалений, рубцов, атрофических изменений, при преобладании молочных продуктов, недостатке витаминов, глистной инвазии.
- Проблем с транспортировкой ― железо, накопленное в слизистых оболочках и печени, не может абсорбироваться, т.
 к. возникла мутация гена.
к. возникла мутация гена. - Недостаточного уровня до беременности, часто возникающее с рождения ― при предлежании плаценты, ее травмах, кесаревом сечении, ЖДА у матери, преждевременных родах, многоплодной беременности, слишком ранней перевязке пуповины.
В некоторых случаях проблемы связаны с полученными ожогами, которые вызывают нарушение обменных процессов при нормальном уровне показателя.
Симптомы железодефицитной анемии у беременных
Как проявляется ЖДА, зависит от степени и скорости разрастания. К основным симптомам относят:
- общая слабость;
- недомогание;
- падение трудоспособности;
- изменение вкуса;
- сухость во рту;
- жжение на языке;
- ощущение комка в горле;
- учащенное сердцебиение;
- сбившийся ритм дыхания;
- заеды на губах;
- сухие волосы, отсутствие блеска, ломкость, истончение, поредение, седина;
- раздражение вульвы;
- ломкие, матовые, плоские, расслаивающиеся ногти;
- невозможность сосредоточиться;
- беспричинная усталость;
- раздражительность;
- бледность, зеленоватый оттенок кожи, шелушение, трещины, дряблость;
- плохой аппетит;
- постоянно клонит в сон.

Когда нехватка железа скрытая, признаки выражены слабее.
Диагностика железодефицитной анемии у беременных
Заболеванию присвоен код по МКБ-10 (Международной классификации болезней) О99.0. Для постановки диагноза при беременности назначаются анализ крови, мочи и дифференциальная диагностика. В первом случае проводят клиническое и биохимическое исследование.
Анализ на содержание гемоглобина в крови показывает падение его уровня и уменьшение размера эритроцитов. Анемию диагностируют, если железосодержащий белок составляет меньше 110 г/л в первом триместре, 105 ― во втором и третьем. Значение ниже 70 г/л характеризуют тяжелую степень. Клинические рекомендации ВОЗ рекомендуют использовать для диагностики объем красных кровяных клеток (гематокрит), если он составляет меньше 33%.
Дифференциальная диагностика позволяет отличить железодефицитную анемию от других. Для ЖДА характерно:
- снижение цветового показателя крови меньше, чем 0,86;
- количество молодых эритроцитов (ретикулоцитов) менее 0,5%;
- падение ферритина;
- снижение концентрации сывороточного железа;
- повышение общей железосвязывающей способности;
- снижение насыщенности железом трансферрина.

По показаниям могут проводиться стернальная пункция, трепанобиопсия, эзофагогастродуоденскопия, УЗИ внутренних органов, исследование уровня фолиевой кислоты и В12 в сыворотке. Это позволяет разработать рекомендации для эффективной терапии.
Лечение железодефицитной анемии при беременности
По протоколу начать необходимо с питания, богатого белком и железом. Однако из пищи всасывается не больше 20% этого вещества, поэтому основной упор делается на медикаменты. При необходимости быстро восполнить дефицит
Феринжект используют в такой дозировке: при разовом введении не больше 15 мг железа на 1 кг веса женщины для внутривенных инъекций и 20 мг для внутривенных инфузий. За неделю суммарно вводят до 20 мл Феринжекта. Применение средства должно проходить по рекомендации и под контролем врача после комплекса необходимых анализов.
Применение средства должно проходить по рекомендации и под контролем врача после комплекса необходимых анализов.
Железодефицитная анемия характеризуется неприятными последствиями, но хорошо подается лечению при условии правильной и своевременной диагностики.
Способ применения и дозировка Аргеферр раствор для внутривенных инъекций 20 мг/мл 5мл Введение: Аргеферр вводится только внутривенно (медленно струйно или капельно), а также в венозный участок диализной системы, и не предназначен для внутримышечного введения. Недопустимо одномоментное введение полной терапевтической дозы препарата. Перед введением первой терапевтической дозы необходимо ввести тест-дозу. Если в течение периода наблюдения возникли явления непереносимости, введение препарата следует немедленно прекратить. 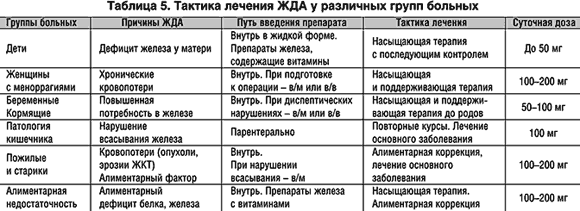 После инъекции, больному рекомендуется на некоторое время зафиксировать руку в вытянутом положении.
Аргеферр возможно вводить непосредственно в венозный участок диализной системы, строго соблюдая правила, описанные для внутривенной инъекции.
Доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме, по формуле:
Общий дефицит железа (мг) — масса тела (кг) х (Hb в норме — Hb больного) (г/л) х 0,24 + депонированное железо (мг).
Коэффициент 0,24 = 0,0034 х 0,07 х 1000 (содержание железа в гемоглобине = 0,34%; объем крови = 7 % от массы тела; коэффициент 1000 = перевод «г» в «мг»).
Для больных с массой тела менее 35 кг: Hbв норме = 130 г/л, количество депонированного железа = 15 мг/кг массы тела.
Для больных с массой тела более 35 кг: Hb в норме =150 г/л, количество депонированного железа = 500 мг.
Общий объем (кумулятивная терапевтическая доза) препарата Аргеферр, который необходимо ввести (в мл) для восполнения дефицита железа в организме, равен: общий дефицит железа (мг)/20 мг/мл. После инъекции, больному рекомендуется на некоторое время зафиксировать руку в вытянутом положении.
Аргеферр возможно вводить непосредственно в венозный участок диализной системы, строго соблюдая правила, описанные для внутривенной инъекции.
Доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме, по формуле:
Общий дефицит железа (мг) — масса тела (кг) х (Hb в норме — Hb больного) (г/л) х 0,24 + депонированное железо (мг).
Коэффициент 0,24 = 0,0034 х 0,07 х 1000 (содержание железа в гемоглобине = 0,34%; объем крови = 7 % от массы тела; коэффициент 1000 = перевод «г» в «мг»).
Для больных с массой тела менее 35 кг: Hbв норме = 130 г/л, количество депонированного железа = 15 мг/кг массы тела.
Для больных с массой тела более 35 кг: Hb в норме =150 г/л, количество депонированного железа = 500 мг.
Общий объем (кумулятивная терапевтическая доза) препарата Аргеферр, который необходимо ввести (в мл) для восполнения дефицита железа в организме, равен: общий дефицит железа (мг)/20 мг/мл. Данные отображены следующим образом: уровень гемоглобина (Hb)- масса тела (кг)/дефицит железа (мг)/объем препарата Аргеферр (мл), соответственно:
Hb 60 г/л – 5/160/8; 10/320/16; 15/480/24; 20/640/32; 25/800/40; 30/960/48; 35/1260/63; 40/1360/68; 45/1480/74; 50/1580/79; 55/1680/84; 60/1800/90; 65/1900/95; 70/2020/101; 75/2120/106; 80/2220/111; 85/2340/117; 90/2440/122.
Hb 75 г/л – 5/140/7; 10/280/14; 15/420/21; 20/560/28; 25/700/35; 30/840/42; 35/1140/57; 40/1220/61; 45/1320/66; 50/1400/70; 55/1500/75; 60/1580/79; 65/1680/84; 70/1760/88; 75/1860/93; 80/1940/97; 85/2040/102; 90/2120/106.
Hb 90 г/л – 5/120/6; 10/240/12; 15/380/19; 20/500/25; 25/620/31; 30/740/37; 35/1000/50; 40/1080/54; 45/1140/57; 50/1220/61; 55/1300/65; 60/1360/68; 65/1440/72; 70/1500/75; 75/1580/79; 80/1660/83; 85/1720/86; 90/1800/90.
Hb 105 г/л – 5/100/5; 10/20/11; 15/320/16; 20/420/21; 25/520/26; 30/640/32; 35/880/44; 40/940/47; 45/980/49; 50/1040/52; 55/1100/55; 60/1140/57; 65/1200/60; 70/1260/63; 75/1320/66; 80/1360/68; 85/1420/71; 90/1480/74.
Данные отображены следующим образом: уровень гемоглобина (Hb)- масса тела (кг)/дефицит железа (мг)/объем препарата Аргеферр (мл), соответственно:
Hb 60 г/л – 5/160/8; 10/320/16; 15/480/24; 20/640/32; 25/800/40; 30/960/48; 35/1260/63; 40/1360/68; 45/1480/74; 50/1580/79; 55/1680/84; 60/1800/90; 65/1900/95; 70/2020/101; 75/2120/106; 80/2220/111; 85/2340/117; 90/2440/122.
Hb 75 г/л – 5/140/7; 10/280/14; 15/420/21; 20/560/28; 25/700/35; 30/840/42; 35/1140/57; 40/1220/61; 45/1320/66; 50/1400/70; 55/1500/75; 60/1580/79; 65/1680/84; 70/1760/88; 75/1860/93; 80/1940/97; 85/2040/102; 90/2120/106.
Hb 90 г/л – 5/120/6; 10/240/12; 15/380/19; 20/500/25; 25/620/31; 30/740/37; 35/1000/50; 40/1080/54; 45/1140/57; 50/1220/61; 55/1300/65; 60/1360/68; 65/1440/72; 70/1500/75; 75/1580/79; 80/1660/83; 85/1720/86; 90/1800/90.
Hb 105 г/л – 5/100/5; 10/20/11; 15/320/16; 20/420/21; 25/520/26; 30/640/32; 35/880/44; 40/940/47; 45/980/49; 50/1040/52; 55/1100/55; 60/1140/57; 65/1200/60; 70/1260/63; 75/1320/66; 80/1360/68; 85/1420/71; 90/1480/74. Кратность введения определяется врачом, но не чаще, чем через день.
Стандартная доза: Взрослые, в том числе пожилые (старше 65 лет) больные: 5-10 мл Аргеферра (100-200 мг железа) 1 -3 раза в неделю в зависимости от уровня гемоглобина.
Дети: имеются лишь ограниченные данные о применении препарата у детей. В случае необходимости рекомендуется вводить не более 0,15 мл препарата Аргеферр (3 мг железа) на кг массы тела 1-3 раза в неделю в зависимости от уровня гемоглобина. Максимально переносимая разовая доза:
Взрослые, в том числе пожилые (старше 65 лет) больные:
Для струйного введения: 10 мл препарата Аргеферр (200 мг железа), продолжительность введения не менее 10 минут.
Для капельного введения: в зависимости от показаний разовая доза может достигать 500 мг железа. Максимально допустимая разовая доза составляет 7 мг железа на кг массы тела и вводится один раз в неделю, но она не должна превышать 500 мг железа. В случае, когда общая терапевтическая доза превышает максимальную допустимую разовую дозу, рекомендуется дробное введение препарата. Если спустя 1 -2 недели после начала лечения препаратом Аргеферр не происходит улучшения гематологических показателей, необходимо пересмотреть первоначальный диагноз.
Как правило, большие дозы ассоциируются с более высокой частотой нежелательных явлений.
Расчет дозы для восполнения содержания железа после кровопотери или сдачи аутологичной крови:
Доза препарата Аргеферр, необходимая для компенсации дефицита железа, рассчитываете по следующей формуле:
Если количество потерянной крови известно:
внутривенное введение 200 мг железа (= 10 мл препарата Аргеферр) приводит к такому же повышению концентрации Hb, как и переливание 1 единицы крови (= 400 мл с концентрат ей Hb 150 г/л).
Количество железа, которое необходимо восполнить (мг) = количество единиц потерянно крови х 200 или необходимый объем препарата Аргеферр (мл) = количество единиц потерянной крови х 10. При снижении содержания Hb: используйте предыдущую формулу при условии, что депо железа пополнять не требуется.
Количество железа, которое нужно восполнить [мг] = масса тела [кг] х 0,24 х (Hb в норме — Hb больного) (г/л),
Например: масса тела 60 кг, дефицит НЬ =10 г/л — необходимое количество железа примерно150 мг необходимый объем препарата Аргеферр равен 7,5 мл.
Лечение больных с хроническими почечными заболеваниями, находящихся на гемодиализе и получающих дополнительное лечение эритропоэтином. Препарат вводится строго внутривенно. Инъекция проводится как можно медленнее, продолжительность введения увеличивается по мере повышения дозы. Процедура не представляет особой сложности для больных, находящихся на гемодиализе, так как у них обычно имеется подходящий внутривенный доступ. Препарат вводится в 0,9 % растворе натрия хлорид в течение не менее 15 минут в течение 2 последних часов сеанса гемодиализа. При абсолютном дефиците железа (фаза коррекции анемии) необходимо 30-50 мг железа/сеанс диализа или 1000 мг железа в течение 6 — 10 недель. В фазе поддерживающей терапии назначаются различные дозы в различных режимах: 10-25 мг железа/сеанс диализа или 100 мг железа/1 раз в месяц (в зависимости от концентрации ферритина сыворотки). В фазе коррекции гемоглобина 150 мг железа для повышения концентрации на 10 г/л.
Кратность введения определяется врачом, но не чаще, чем через день.
Стандартная доза: Взрослые, в том числе пожилые (старше 65 лет) больные: 5-10 мл Аргеферра (100-200 мг железа) 1 -3 раза в неделю в зависимости от уровня гемоглобина.
Дети: имеются лишь ограниченные данные о применении препарата у детей. В случае необходимости рекомендуется вводить не более 0,15 мл препарата Аргеферр (3 мг железа) на кг массы тела 1-3 раза в неделю в зависимости от уровня гемоглобина. Максимально переносимая разовая доза:
Взрослые, в том числе пожилые (старше 65 лет) больные:
Для струйного введения: 10 мл препарата Аргеферр (200 мг железа), продолжительность введения не менее 10 минут.
Для капельного введения: в зависимости от показаний разовая доза может достигать 500 мг железа. Максимально допустимая разовая доза составляет 7 мг железа на кг массы тела и вводится один раз в неделю, но она не должна превышать 500 мг железа. В случае, когда общая терапевтическая доза превышает максимальную допустимую разовую дозу, рекомендуется дробное введение препарата. Если спустя 1 -2 недели после начала лечения препаратом Аргеферр не происходит улучшения гематологических показателей, необходимо пересмотреть первоначальный диагноз.
Как правило, большие дозы ассоциируются с более высокой частотой нежелательных явлений.
Расчет дозы для восполнения содержания железа после кровопотери или сдачи аутологичной крови:
Доза препарата Аргеферр, необходимая для компенсации дефицита железа, рассчитываете по следующей формуле:
Если количество потерянной крови известно:
внутривенное введение 200 мг железа (= 10 мл препарата Аргеферр) приводит к такому же повышению концентрации Hb, как и переливание 1 единицы крови (= 400 мл с концентрат ей Hb 150 г/л).
Количество железа, которое необходимо восполнить (мг) = количество единиц потерянно крови х 200 или необходимый объем препарата Аргеферр (мл) = количество единиц потерянной крови х 10. При снижении содержания Hb: используйте предыдущую формулу при условии, что депо железа пополнять не требуется.
Количество железа, которое нужно восполнить [мг] = масса тела [кг] х 0,24 х (Hb в норме — Hb больного) (г/л),
Например: масса тела 60 кг, дефицит НЬ =10 г/л — необходимое количество железа примерно150 мг необходимый объем препарата Аргеферр равен 7,5 мл.
Лечение больных с хроническими почечными заболеваниями, находящихся на гемодиализе и получающих дополнительное лечение эритропоэтином. Препарат вводится строго внутривенно. Инъекция проводится как можно медленнее, продолжительность введения увеличивается по мере повышения дозы. Процедура не представляет особой сложности для больных, находящихся на гемодиализе, так как у них обычно имеется подходящий внутривенный доступ. Препарат вводится в 0,9 % растворе натрия хлорид в течение не менее 15 минут в течение 2 последних часов сеанса гемодиализа. При абсолютном дефиците железа (фаза коррекции анемии) необходимо 30-50 мг железа/сеанс диализа или 1000 мг железа в течение 6 — 10 недель. В фазе поддерживающей терапии назначаются различные дозы в различных режимах: 10-25 мг железа/сеанс диализа или 100 мг железа/1 раз в месяц (в зависимости от концентрации ферритина сыворотки). В фазе коррекции гемоглобина 150 мг железа для повышения концентрации на 10 г/л.
|
Железодефицитная анемия во время беременности — профилактика и лечение
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
М.А. ВИНОГРАДОВА, к.м.н., Т.А. ФЁДОРОВА, д.м.н., профессор, Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова Минздрава России
Данный обзор посвящен проблеме профилактики и лечения анемии во время беременности. Железодефицитная анемия (ЖДА) является самым распространенным дефицитным состоянием и наиболее частой формой анемии у беременных женщин. Клинические последствия ее крайне важны, т. к. неблагоприятные эффекты железодефицита затрагивают не только организм женщины, но и способны влиять на исходы беременности и здоровье новорожденных. Первая линия терапии железодефицита — это препараты железа, предназначенные для приема внутрь, наиболее эффективной и безопасной формой которых в настоящее время считается железо-полимальтозный комплекс. При недостаточной эффективности и тяжелой форме анемии предпочтительным альтернативным методом является внутривенное введение препарата железа. Своевременная диагностика и адекватная терапия позволяют в кратчайшие сроки восстановить показатели обмена железа у беременной женщины и не допустить развития осложнений.
Введение
Известно, что недостаток железа является наиболее распространенным пищевым дефицитным состоянием в мире [1] и наиболее распространенной причиной анемии у беременных (до 75%) [2]. По определению Всемирной организации здравоохранения, анемией при беременности считается снижение гемоглобина крови менее 110 г/л [1], а во втором триместре — менее 105 г/л [3]. Известно, что при беременности в организме женщины происходит ряд физиологических изменений, в том числе и со стороны крови. Общий объем плазмы увеличивается до 50% от исходного, а глобулярный объем возрастает только на 25% [4, 5]. Вследствие этого повышается потребность в микроэлементах и витаминах, необходимых для синтеза гемоглобина и обеспечения нормального развития плода и плаценты. При отсутствии адекватного восполнения возрастающих потребностей развивается дефицит микроэлементов, в первую очередь железа, и, как следствие, анемия. Обусловлено это множеством факторов: нередко беременность наступает при исходно сниженном уровне гемоглобина или недостаточных запасах железа в организме, которые могут быть обусловлены особенностями диеты, хроническими заболеваниями желудочно-кишечного тракта или длительными обильными менструациями. Железо является важнейшим микроэлементом для человека. Во время беременности адекватный статус железа является значимой предпосылкой для нормального развития плода и зрелости новорожденного. Показано, что тяжелая анемия со снижением гемоглобина менее 90 г/л может способствовать осложнениям беременности и неблагоприятно влиять на ее исходы [6]. Существуют доказательства того, что дефицит железа, даже при отсутствии железодефицитной анемии (ЖДА), может оказывать негативное влияние и на небеременных женщин, например, по отношению к когнитивным способностям и физической работоспособности. Кроме того, ЖДА во время беременности связана с риском преждевременных родов и низкого веса новорожденного [7].
Оценка статуса железа в организме
Для адекватной оценки показателей обмена железа и своевременного выявления железодефицита необходимо применение ряда лабораторных тестов. Кроме общего анализа крови, дающего представление об уровне гемоглобина и характеристиках эритроцитов, статус железа может быть оценен в первую очередь с помощью исследования ферритина сыворотки. Дополнительные тесты включают исследование насыщения трансферрина и сывороточного «растворимого» рецептора трансферрина (sTfR). Железо сыворотки не является надежным диагностическим параметром, поэтому его исследования недостаточно для уточнения причины анемии. Изолированное исследование уровня гемоглобина не подходит для оценки анемии во время беременности в связи с наличием у пациенток различной степени гемодилюции [8]. Ферритин предоставляет информацию о полноте запасов железа в организме, sTfR и насыщение трансферрина — информацию о развитии дефицита железа на клеточном уровне, а гемоглобин дает информацию о дефиците железа на функциональном уровне. Для практических целей общий анализ крови и сывороточный ферритин являются достаточным объемом обследования для оценки статуса железа и диагностики ЖДА у большинства женщин. Важно, что при наличии воспалительного процесса значение ферритина может быть недостоверно высоким. В таком случае повышение С-реактивного белка (СРБ) является подтверждением воспалительного процесса, требующего лечения. Диагностический алгоритм при выявлении анемии представлен на рисунке 1 [9].
Потребность в железе во время беременности
Потребность в железе во время беременности возрастает от 0,8 мг/день в первом триместре до 7,5 мг/день в третьем триместре беременности (в среднем 4,4 мг/день). В среднем при нормальной беременности необходимо дополнительно около 1,240 мг железа [10, 11]. Исследования показали, что многие небеременные женщины имеют сниженные запасы железа: у 42% ферритин сыворотки менее 30 мкг/л, и только у 14—20% из них содержание ферритина превышает 70 мкг/л, [12], т. е. запасы железа уравновешивают потребности нормальной беременности [10].
Можно выделить группы беременных женщин, которые имеют более высокий риск развития дефицита железа: многоплодная беременность, несколько беременностей с коротким интергравидарным интервалом, доноры крови, вегетарианцы, женщины с низким социально-экономическим статусом, пациенты с хроническими заболеваниями желудочно-кишечного тракта [13]. Доказано, что существуют значимые различия между уровнем гемоглобина у женщин, получающих дополнительно железо во время беременности и не получающих [14]. Кроме того, гемодилюция вызывает физиологические колебания уровня гемоглобина во время беременности [15]. У женщин, получающих во время беременности препараты с добавлением железа, по концентрации гемоглобина отображается устойчивое снижение с конца первого триместра из-за гемодилюции, достигнув минимума в 25 недель беременности. Впоследствии, гемоглобин повышается в течение оставшегося периода беременности, чтобы достичь пикового уровня незадолго до родов.
Профилактика железодефицита
Плацебо-контролируемые исследования неизменно показывают, что беременные женщины, употребляющие железо в виде добавок, имеют значительно более высокий запас железа по сравнению с женщинами, принимающими плацебо [16]. Следовательно, женщины, принимающие железо, имеют более низкую частоту анемии.
Ранее в качестве профилактики железодефицита у беременных применялись высокие дозы двухвалентного железа в диапазоне 100—200 мг/день. Доза 100 мг двухвалентного железа в сутки индуцирует максимальный рост гемоглобина, а 200 мг железа в день увеличивает ферритин и гемоглобин при родах также, как у небеременных женщин. Тем не менее результаты работы подчеркнули потенциальные негативные эффекты применения таких доз железа [14], и, следовательно, были начаты исследования по изучению эффективности меньших доз железа с попытками определить наименьшую эффективную дозу [17]. Результаты европейских исследований показали, что добавление 45—66 мг двухвалентного железа в сутки на сроке от 12—20 недель беременности до родов достаточно, чтобы предотвратить ЖДА у здоровых беременных женщин. Даже меньшие дозы 20—27 мг двухвалентного железа в сутки оказывают благоприятное влияние на статус железа [16]. Главные выводы из этих исследований, во-первых, что 30—40 мг двухвалентного железа в день является достаточным для предотвращения ЖДА, и, во-вторых, что низкие дозы препаратов железа в диапазоне 20—27 мг/день лучше, чем отсутствие добавок, тогда как исследования ежедневного употребления поливитаминных препаратов, содержащих 14—18 мг двухвалентного железа, показали отсутствие влияния на статус железа у женщин [13]. В настоящее время с целью профилактики железодефицита у беременных женщин рекомендовано применение препарата железа внутрь в дозе 30-40 мг/день с начала беременности до родов [14].
Таким образом, в настоящее время рекомендован индивидуальный подход к профилактике ЖДА, который основывается на оценке запасов железа (ферритин плазмы) до и в начале беременности. Женщинам с уровнем ферритина более 70 мкг/л не показаны препараты железа; при значениях ферритина 30—70 мкг/л следует принимать 30—40 мг двухвалентного железа в сутки и при показателях ферритина менее 30 мкг/л необходимо принимать 80—100 мг двухвалентного железа в сутки [14].
Лечение анемии
В случае выявления ЖДА должно быть произведено восполнение дефицита пероральным или внутривенным введением препаратов железа. Внутримышечное введение железа в настоящее время фактически не применимо в связи с ограничением дозы железа, вводимой за инъекцию, и высокой частотой болезненных местных реакций.
Препараты железа для приема внутрь
Всасывание железа регулируется в соответствии с запасами железа в организме и интенсивностью эритропоэза. Доказано, что в случае истощения запасов железа в организме увеличивается кишечная абсорбция железа [18]. Кроме того, повышенный эритропоэтин-индуцированный эритропоэз во втором и третьем триместре [19] стимулирует абсорбцию железа.
Такая сочетанная стимуляция всасывания железа была подтверждена в исследованиях, показавших, что с увеличением срока беременности происходит повышение поглощения железа, причем наиболее выраженно это происходит после 20 недель беременности. Способность усвоения через желудочно-кишечный тракт значительного количества железа благоприятна для лечения ЖДА таблетированными препаратами железа у беременных женщин. В связи с этим назначение препаратов железа внутрь является терапией первой линии, особенно в течение первого и второго триместров беременности [20]. При нетяжелой анемии с гемоглобином 90—105 г/л рекомендуемая доза составляет 100—200 мг элементарного железа в день. После перорального лечения препаратами железа в течение 2 нед. следует оценить эффект. Если гемоглобин увеличился более чем на 10 г /л, терапию следует продолжать в течение оставшегося периода беременности с последующим контролем гемоглобина и ферритина [13].
Рефрактерность анемии к терапии может быть следствием несоблюдения режима приема препарата вследствие субъективных причин, желудочно-кишечных побочных эффектов, нарушения всасывания железа из-за ахлоргидрии или воспалительного заболевания кишечника или скрыто продолжающегося кровотечения с потерями железа. Желудочно-кишечные нарушения, такие как колики, тошнота, рвота, диарея, возникают примерно у 6—12% пациентов, принимающих препараты железа [21]. Наиболее широко до последнего времени применялись внутрь соли железа. Однако их использование ограничено низким и неравномерным усвоением, в частности зависимым от пищевых продуктов [22]. Соединения трехвалентного железа были созданы, чтобы избежать этих проблем. В первом триместре беременности выраженность дефицита железа, с одной стороны, и достаточный запас времени — с другой, позволяют осуществить плавную коррекцию железодефицитных состояний с помощью наиболее безопасных препаратов перорального железа.
Железо-полимальтозный комплекс был разработан в качестве молекулы, которая растворяется при нейтральном рН. Препарат содержит железо в виде полимальтозного комплекса гидроксида железа (III) (ПКЖ), например Мальтофер. Этот комплекс стабилен и не выделяет железо в виде свободных ионов в кишечник. Структура препарата схожа с ферритином. Благодаря такому сходству железо (III) поступает из кишечника в кровь путем активного всасывания. Железо, входящее в состав ПКЖ, не имеет прооксидантных свойств, присущих простым солям железа. Исследования для оценки эффективности и безопасности полимальтозных препаратов в сравнении с сульфатом железа у беременных женщин показали их несомненное преимущество. Полимальтозный комплекс железа был разработан таким образом, что элементарная форма железа находится в неионогенном состоянии. Это гарантирует, что его применение не вызывает раздражение слизистой оболочки желудка. Кроме того, высокое содержание железа исключает необходимость частой дозировки и, следовательно, улучшает соблюдение графика приема. Полимальтозный комплекс (препарат Мальтофер) следует принимать во время или сразу же после приема пищи, что также повышает удобство применения. Интересные данные были получены в эксперименте применения солей железа и ПКЖ у беременных крыс. Все методы лечения были эффективны в отношении коррекции анемии. Однако в результате применения солей железа отмечены признаки повреждения печени и окислительного стресса при исследовании состояния плода и плаценты. ПКЖ восстанавливает нормальную экспрессию TNF-α и IL-6 в плаценте, в то время как в случае применения сульфата железа наблюдались самые высокие уровни цитокинов, предполагая местную воспалительную реакцию. Большинство негативных эффектов, связанных с ЖДА, были решены назначением ПКЖ. Исходы беременности при использовании солей железа были хуже в случае назначения ПКЖ [23].
Изучение применения различных препаратов железа у взрослых людей проводилось многократно. Исследование Badhwar и коллег [24] с участием как женщин, так и мужчин с ЖДА продемонстрировали эквивалентную эффективность и лучшую биодоступность ПКЖ в сравнении с фумаратом железа. Тем не менее это исследование было проведено у небеременных женщин. Исследование Pakar и коллег [25] также продемонстрировало эффективность и безопасность ПКЖ как у беременных, так и у небеременных женщин.
Важные результаты получены в рандомизированном двойном слепом контролируемом исследовании применения ПКЖ во время беременности [26].
Частота побочных эффектов была значительно выше в группе, получавшей соли железа, чем в группе ПКЖ (78 против 31%, р < 0,001). Увеличение числа случаев неблагоприятных эффектов приема солей железа может быть связано с высвобождением свободных радикалов, что приводит к повреждению и гибели клеток [27], тогда как ПКЖ не освобождает свободные радикалы. Снижение частоты побочных эффектов улучшает соблюдение пациентами режима приема и обеспечивает регулярное лечение. Кроме того, лучшая переносимость крайне важна для обеспечения длительной терапии во время беременности. ПКЖ является эффективным терапевтическим подходом в лечении ЖДА у беременных женщин. Улучшенный профиль переносимости в сравнении с препаратами солей железа и эквивалентный профиль эффективности убедительно свидетельствуют, что ПКЖ является предпочтительной формой железа для приема внутрь при лечении ЖДА во время беременности. Значимо лучшая переносимость ПКЖ в сравнении с быстро насыщающими, но хуже переносимыми препаратами неорганических солей железа обеспечивает более высокую комплаентность пациенток, способствуя формированию положительного стереотипа ежедневного приема лекарственного средства вплоть до конца беременности, что является принципиально необходимым.
Препараты железа для внутривенного введения
Лечение внутривенным препаратом железа превосходит пероральные препараты железа по быстроте восстановления гемоглобина и пополнения запасов железа в организме. Однако безопасность таких препаратов в I триместре недостаточно доказана, поэтому они могут быть рекомендованы к применению со II или III триместра беременности. Внутривенное железо уменьшает потребность в переливании крови и является альтернативой трансфузиям при тяжелой ЖДА. В настоящее время наиболее эффективным терапевтическим подходом, позволяющим в кратчайшие сроки безопасно получить максимальный эффект, является применение карбоксимальтозата железа [28]. Это комплекс, не содержащий декстран, который может быть использован в максимальных дозах (до 1000 мг на одно внутривенное введение) в короткий промежуток времени (на одну инфузию требуется 15—30 мин). Повторные инфузии проводятся еженедельно из расчета 15 мг железа на кг массы тела. По данным Cochrane Database [29], из препаратов для внутривенного применения именно карбоксимальтозат железа является препаратом выбора терапии ЖДА при беременности. Внутривенные препараты железа считаются безопасными во втором и третьем триместрах беременности [30], и тем не менее внутривенные инфузии препаратов железа должен осуществлять персонал медицинского учреждения во избежание возможных аллергических или других реакций. Лечение препаратами внутривенного железа показано в случаях неэффективности железо-содержащих средств для приема внутрь (отсутствие повышения гемоглобина на 10 г/л в течение 2 нед.), при тяжелой ЖДА (гемоглобин <90 г/л на сроках беременности более 14 нед., а также в качестве терапии первой линии ЖДА в третьем триместре. На данном сроке остается недостаточно времени, чтобы препараты для пероральной терапии могли быть эффективны. Это важно, чтобы снизить проявления ЖДА и пополнить запасы железа до родов в целях предотвращения анемии в родах и избежать переливания крови. Доза внутривенного железа должна быть достаточной для достижения уровня гемоглобина более 105 г/л. У большинства женщин суммарная доза 1 000—1 250 мг внутривенного железа является адекватной. При достижении уровня гемоглобина 105 г/л осуществляется перевод на поддерживающую терапию препаратом железа внутрь 100 мг/день до конца беременности.
Заключение
Железодефицитная анемия является наиболее частой формой анемии у беременных женщин (до 95%). Диагноз ЖДА основывается на выявлении снижения гемоглобина крови и уровня сывороточного ферритина. Среди небеременных женщин репродуктивного возраста до 40% имеют недостаточные запасы железа по отношению к предстоящей беременности, поэтому вопросы своевременной коррекции дефицита железа до развития анемии крайне важны при планировании беременности. С этой целью применяются комплексные препараты, содержащие от 30 до 80 мг железа в зависимости от значений сывороточного ферритина. Учитывая возрастающие потребности в железе во время беременности, диетические меры являются недостаточными для коррекции железодефицита. Лечение ЖДА во время беременности должно проводиться с применением препаратов для приема внутрь, наиболее предпочтительным из которых является полимальтозный комплекс гидроксида железа (III) и препаратов железа для внутривенного введения. При ЖДА с уровнем гемоглобина более 90 г/л первой линией терапии является ПКЖ в дозе 100—200 мг/день. Показаниями для назначения внутривенного препарата железа является анемия с уровнем гемоглобина менее 90 г/л, недостаточный эффект от терапии пероральными препаратами (гемоглобин менее 100 г/л в течение 2 нед.) либо плохая переносимость. Своевременное выявление и эффективная терапия, безопасная для беременных, позволяет в кратчайшие сроки нормализовать уровень гемоглобина и улучшить показатели запасов железа, что, в свою очередь, улучшает качество жизни женщин и предотвращает развитие осложнений беременности. Принимая во внимание неизбежность развития той или иной степени железодефицита в период гестации у абсолютного большинства беременных и учитывая негативные отдаленные последствия недостатка железа на анте- и постнатальное развитие ребенка, наиболее оправданной следует признать тактику раннего начала терапии анемии.
Литература
1. WHO Iron Deficiency Anaemia: Assessment, Prevention and Control. WHO/NHD/01.3, World Health Organization, 2001, Geneva, Switzerland.
2. Sifakis S and Pharmakides G. Anemia in pregnancy. Ann. N. Y. Acad. Sci., 2000, 900: 125–36.
3. Ramsey M, James D & Steer P. Normal Values in Pregnancy, 2nd edn. WB Saunders, London, 2000.
4. Coad J, Conlon C. Iron deficiency in women: assessment, causes and consequences. Current opinion in clinical nutrition and metabolic care. 2011, 14, 625-634.
5. Friedman AJ et al. Iron deficiency anemia in women across the life span. Journal of women’s health, 2012, 21: 1282-1289.
6. The Obstetric Hematology Manual edited by Sue Pavord, Beverley Hunt. Cambridge University Press 2010. P. 13-27.
7. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z (2007). Low first trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet, 98: 124–128.
8. Koller O (1982). The clinical significance of hemodilution during pregnancy. Obstet Gynecol Surv, 37:649–652.
9. Breymann Сh et al. Diagnosis and treatment of iron-deficiency anaemia during pregnancy and postpartum. Arch Gynecol Obstet , 2010, 282: 577-580.
10. Milman N (2006). Iron and pregnancy — a delicate balance. Ann Hematol, 85: 559–565.
11. Bothwell TH (2000). Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr, 72: 257–264.
12. Milman N, Byg K-E, Ovesen L (2000). Iron status in Danes updated 1994. II. Prevalence of iron deficiency and iron overload on 1319 women aged 40–70 years. Influence of blood donation, alcohol intake, and iron supplementation. Ann Hematol, 79: 612–621.
13. Milman N. Prepartum anaemia: prevention and treatment. Ann Hematol, 2008, 87: 949–959.
14. Milman N (2006). Iron prophylaxis in pregnancy—general or individual and in which dose? Ann Hematol, 85: 821–828 doi:10.1007/s00277-006-0145-x.
15. Milman N, Bergholdt T, Byg K-E, Eriksen L, Hvas A-M (2007). Reference intervals for haematological variables during normal pregnancy and postpartum in 433 healthy Danish women. Eur J Haematol, 79: 39–46.
16. Makrides M, Crowther CA, Gibson RA, Gibson RS, Skeaff CM (2003). Efficacy and tolerability of low-dose iron supplements during pregnancy: a randomised controlled trial. Am J Clin Nutr, 78: 145–153.
17. Milman N, Bergholt T, Eriksen L, Byg K-E, Graudal N, Pedersen P, Hertz J (2005). Iron prophylaxis during pregnancy — how much iron is needed? A randomised, controlled study of 20 to 80 mg ferrous iron daily to pregnant women. Acta Obstet Gynecol Scand, 84: 238–247.
18. Skikne B, Baynes RD (1994). Iron absorption. In: Brock JH, Halliday JW, Pippard MJ, Powell LW (eds) Iron metabolism in health and disease. Saunders, London, pp 151–187.
19. Milman N, Graudal N, Nielsen OJ, Agger AO (1997). Serum erythropoietin during normal pregnancy: relationship to hemoglobin and iron status markers and impact of iron supplementation in a longitudinal, placebo-controlled study on 118 women. Int J Hematol, 66: 159–168.
20. Beris P, Maniatis A on behalf of the NATA working group on intravenous iron therapy (2007). Guidelines on intravenous iron supplementation in surgery and obstetrics/gynecology. TATM transfus Altern Transfus Med 9 (Suppl 1): 29.
21. Adamson JW. Fauci AS. Kasper DL, et al. Iron deficiency and other hypoproliferative anaemias. In: Braunwald E, editor; Harrison’s Principles of Internal Medicine.15th edition. Mc Graw Hill; 2001. pp 660–66.
22. Sharma N. Iron absorption: IPC therapy is superior to conventional iron salts. Obstet Gynecol., 2001: 515–19.
23. Toblli JE, Cao G, Oliveri L, Angerosa M. Effects of iron polymaltose complex, ferrous fumarate and ferrous sulfate treatments in anemic pregnant rats, their fetuses and placentas. Inflamm Allergy Drug Targets, 2013, 12(3): 190-8.
24. Badhwar VR, Rao S, Fonseca MM. Comparative efficacy and safety of iron polymaltose+folic acid and oral ferrous fumarate in the treatment of adult patients with iron deficiency anemia. Indian Med Gazette, 2003, 136: 296–301.
25. Patkar VD, Patkar S, Khandeparker PS, Dingankar NS, Shetty RS. Evaluation of efficacy and tolerability of iron (III) – hydroxide polymaltose complex tablets in the treatment of iron deficiency anaemia in women. Indian Med Gazette, 2001, 135: 306–309.
26. Saha L, Pandhi P, Gopalan S, Malhotra S and Saha PK. Comparison of Efficacy, Tolerability, and Cost of Iron Polymaltose Complex With Ferrous Sulphate in the Treatment of Iron Deficiency Anemia in Pregnant Women. MedGenMed, 2007, 9(1): 1.
27. McCord JM. Iron, free radicals, and oxidative injury. Semin Hematol., 1998, 35: 5–12.
28. Christoph P, Schuller C, Studer H et al. Intravenous iron treatment in pregnancy: comparison of high-dose ferric carboxymaltose vs. iron sucrose. J Perinat Med, 2012, 13, 40(5), 469-474.
29. Reveiz L, Gyte GML, Cuervo LG, Casasbuenas A. Treatments for iron-deficiency anaemia in pregnancy (Review), Cochrane library, 2011.
30. Beris P, Maniatis A, on behalf of the NATA working group on intravenous iron therapy (2007) Guidelines on intravenous iron supplementation in surgery and obstetrics/gynecology. TATM transfus Altern Transfus Med 9 (Suppl 1): 29.
Источник: Медицинский совет, № 9, 2015
Препараты железа. Выбор препарата и пути введения для коррекции железодефицита
Коррекция железодефицита при своей относительной простоте часто вызывает вопросы, начиная от пути введения препарата, заканчивая формой и типом соли железа. На эти и другие вопросы отвечает врач-гематолог Анна Борисовна Хлавно Выбор пути введения препаратов железа Выбор пути зависит от ответов на следующие вопросы:- Есть ли заболевания желудочно-кишечного тракта, делающие проблематичным прием препаратов железа внутрь: язвенная болезнь желудка или 12-перстной кишки, неспецифический язвенный колит или болезнь Крона, синдром раздраженного кишечника и т.п.
- Как быстро нам надо восполнить дефицит железа (например, на послезавтра запланирована операция, или ЭКО и т.д.)
- Есть ли возможность осуществления внутривенного введения и как часто: «хорошие» или «плохие» вены, больной находится в стационаре или дома, далеко ли живет от процедурного кабинета, мобилен или малоподвижен….
- Финансовые возможности пациента (таблетки или капсулы дешевле, препараты для внутривенного лечения – существенно дороже)
- Желание пациента: «не хочу принимать таблетки», или «не хочу ходить в больницу», или «боюсь уколов»…
Если есть известные заболевания ЖКТ или есть предшествующий опыт развития нежелательных явлений при приеме таблетированных препаратов железа или их неэффективность – это показание к выбору парентерального пути введения.
ВАЖНО: внутримышечно препараты вводить не целесообразно. Их эффективность мало отличается от таблеток, но возможны нежелательные эстетические, и не только, последствия.
Если же известных противопоказаний к применению таблетированных препаратов железа нет, то это основание определить потенциальную эффективность таблеток. С этой целью выполняется тест на всасывание железа с желаемым препаратом: определяется концентрация железа сыворотки натощак и повторно — через 1 час после приема 100 мг препарата железа. Нарастание концентрации не менее чем в 3 раза говорит о том, что всасывание препарата из кишечника не страдает и можно применять препарат внутрь. Если по мере приема развиваются боли в животе, запоры, поносы с которыми не удается справиться — это показание к коррекции режима приема, например, суточную дозу разделить на несколько приемов или выбору в пользу внутривенного пути введения.
Препараты для приема внутрь
Препараты двухвалентного железа
- Железа сульфат: Сорбифер (таблетки), Актиферрин (таблетки и капли), Фенюльс (таблетки)
- Железа фумарат: Ферретаб (капсулы)
- Железа хлорид: Гемофер (капли)
- Железа глюконат: Тотема (раствор)
- Железа сукцинилат: Ферлатум (раствор)
- Железа полимальтозат: Феррум-лек, Мальтофер (таблетки, сироп, капли), Фенюльс (сироп)
- противопоказаний к применению препаратов железа внутрь
- не корректируемых нежелательных явлений при приеме препаратов внутрь
- неэффективности препаратов для применения внутрь
- необходимости экстренного восполнения дефицита железа
- желания пациента
Препараты железа для внутривенного введения
В РФ зарегистрированы следующие варианты препаратов железа для введения внутривенно:
Дозировка и кратность введения: 200 мг внутривенно, струйно, через день, до введения суммарной расчетной дозы. Это удобно в том случае если пациент находится в стационаре, или живет недалеко от больницы и мобилен, никуда не торопится, а также имеет «хорошие вены». И, что немаловажно — это наиболее бюджетный вариант из всех парентаральных. Железа (III) гидроксид декстран: Космофер. На сегодняшний день в РФ отсутствует, но должен скоро появиться.
Дозировка и кратность: наряду с упомянутым выше для сахаратов режимом введения — декстран железа может быть введен в виде высокодозной инфузии в дозе 20 мг/кг за 3-4 часа инфузии. При необходимости (суммарный дефицит железа более чем 20 мг/кг либо продолжающаяся кровопотеря) введение можно повторить через 10-14 дней в том же режиме. Этот вариант удобен для амбулаторных пациентов, маломобильных, с проблематичным венозным доступом и тех, кому требуется быстрое восполнение дефицита железа. Железа (III) карбоксимальтозат: Феринжект. Все характеристики сходны с таковыми у декстрана железа, но допустимо более быстрое капельное введение большой дозы 20 мг/кг: 1000 мг за 15 минут. Повторное введение большой дозы не ранее чем через 7 дней.
Железа (III) полиизомальтозат: Монофер. Препарат по своим параметрам аналогичен карбоксимальтозату, рекомендовано введение 20 мг/кг за 60 минут 1 раз в неделю.
Последнее, о чем хотелось бы сказать. Большинство нежелательных реакций, регистрирующихся при применении препаратов железа не являются аллергическими, а в случае развития аллергической реакции на разные соли железа, чаще всего, нет перекрестной аллергии, и, соответственно, в большинстве случаев непереносимости препаратов железа специалист сможет подобрать подходящий для данного пациента препарат железа и способ его введения.
Внутривенное введение железа
Обзор
Что такое железо?
Железо — один из минералов в организме человека. Это один из компонентов гемоглобина, вещества в красных кровяных тельцах, которое помогает крови переносить кислород по всему телу.
Если у вас недостаточно железа, ваше тело не может вырабатывать гемоглобин, и у вас может развиться анемия. Это называется железодефицитной анемией, наиболее распространенным типом анемии.
Факторы, снижающие поступление железа в организм, включают:
- Кровопотеря (вызванная язвами, некоторыми видами рака и другими состояниями; у женщин — во время месячных)
- Диета, в которой недостаточно железа
- Прием лекарств, нарушающих способность организма усваивать железо
- Повышение потребности организма в железе (например, у женщин во время беременности)
Каковы симптомы анемии?
Есть несколько симптомов, которые могут возникать при всех типах анемии.Их:
У кого наиболее высока вероятность развития железодефицитной анемии?
Железодефицитная анемия может развиться у любого человека, хотя следующие группы имеют более высокий риск:
- Женщины: потеря крови во время месячных и при родах может привести к анемии
- Люди старше 65 лет, которые с большей вероятностью будут придерживаться диеты с низким содержанием железа
- Люди, принимающие препараты для разжижения крови, такие как аспирин, Плавикс®, Кумадин® или гепарин
- Люди с почечной недостаточностью (особенно если они находятся на диализе), потому что у них проблемы с выработкой красных кровяных телец
- Люди, плохо усваивающие железо
Кто получает препараты железа внутривенно?
Пациенты, получающие железо внутривенно, обычно делают это, потому что не могут принимать пероральное железо.К ним относятся следующие:
- Пациенты с кровотечением в желудочно-кишечном тракте (кишечнике), которым необходимо быстро восполнить железо. (Железо, вводимое внутривенно, усваивается организмом быстрее, чем пероральное железо).
- Пациенты с воспалительным заболеванием кишечника (заболевания кишечника, вызывающие боль, диарею и потерю веса), которые не могут принимать пероральное железо, потому что оно нарушает их работу желудочно-кишечного тракта.
- Пациенты, находящиеся на диализе почек, часто теряющие кровь во время диализа. Кроме того, эти пациенты обычно принимают средство, стимулирующее эритропоэтин (ЭСС), и им может потребоваться дополнительное количество железа.
- Пациенты с железодефицитной анемией, перенесшие операцию по большой кровопотере (> 500 мл) в течение следующих 2 месяцев и нуждающиеся в быстрой замене железа. (Железо, вводимое внутривенно, усваивается организмом быстрее, чем пероральное железо).
- Пациенты с глютеновой болезнью (непереносимость глютена).
- Больные раком, страдающие анемией и принимающие ЭСС.
Детали процедуры
Как диагностируется анемия?
Ваш лечащий врач может провести анализ крови, чтобы определить, есть ли у вас анемия.Тип и количество анализов крови будут зависеть от того, какой тип анемии у вас может быть, по мнению врача.
Анализы крови позволят определить уровень гемоглобина и количество железа в организме. Если эти уровни низкие, врач может поставить диагноз анемии.
Как лечится анемия?
Ваш лечащий врач примет решение о правильном лечении в зависимости от типа анемии и ее причины.
Ваш врач должен сначала выяснить, вызвана ли анемия неправильным питанием или более серьезной проблемой со здоровьем.После этого вы сможете лечить как анемию, так и ее причину.
Один из способов лечения железодефицитной анемии — употребление в пищу продуктов с высоким содержанием железа. Следующие продукты являются хорошими источниками железа:
- Устрицы
- Фасоль
- Печень говяжья
- Тофу
- Говядина (жаркое из курицы, нежирный говяжий фарш)
- Нога индейки
- Хлеб из цельной пшеницы
- Тунец
- Яйца
- Креветки
- Арахисовое масло
- Баранья ножка
- Коричневый рис
- Изюмовые отруби (обогащенные)
Другой способ лечения анемии — пероральный (внутрь) прием железосодержащих добавок (таблеток).Пациенту также может потребоваться прием средств, стимулирующих эритропоэтин (ЭСС). ЭСС работают, помогая производить больше эритроцитов. Затем эти клетки попадают из костного мозга в кровоток. ЭСС вводятся путем инъекции (укола) или внутривенно.
В случаях, когда пациент не может принимать пероральные добавки железа, ему или ей, возможно, придется вводить добавку железа внутривенно. Как и в случае с любыми другими лекарствами, не принимайте никаких добавок без совета и указания врача.
Что такое добавка железа для внутривенного введения?
Внутривенное введение железа — это метод введения железа в вену путем инфузии иглой.(Лекарства, вводимые внутривенно, называются парентеральной терапией.)
Как вводится внутривенное железо?
Внутривенное железо вводится в вену пациента через иглу. Процедура проходит в кабинете врача или в клинике и может занять до нескольких часов, в зависимости от того, какое лечение назначил врач. Пациент обычно получает инъекции железа в течение нескольких посещений, пока его или ее уровень железа не станет правильным.
Риски / преимущества
Каковы побочные эффекты внутривенного введения железа?
Побочные эффекты внутривенного введения железа обычно минимальны, но могут включать следующее:
- Вздутие или припухлость лица, рук, кистей, голеней или ступней
- Головокружение, обморок или дурноту при внезапном вставании из положения лежа или сидя
- Боли желудочно-кишечные, включая тошноту и судороги
- Проблемы с дыханием
- Проблемы с кожей, включая сыпь
- Боль в груди
- Низкое артериальное давление
- Анафилаксия (тяжелая реакция, которая может включать затрудненное дыхание, зуд или сыпь по всему телу)
Насколько эффективно внутривенное введение железа?
Когда вам станет лучше, зависит от вашей конкретной ситуации.Обычно после приема добавки железа может пройти от недели до месяца, прежде чем вы почувствуете себя лучше. Продолжайте следить за своими симптомами и обращайте внимание на побочные эффекты, которые могут быть вызваны добавками. Если у вас есть какие-либо вопросы или проблемы, поговорите со своим врачом.
Внутривенная терапия добавками железа — ScienceDirect
Внутривенные инфузии железа превратились из малоэффективного и опасного вмешательства в безопасный краеугольный камень в лечении дефицита железа.Современные составы железа представляют собой композитные наночастицы, состоящие из оксигидроксидов железа и углеводов. Декстран железа, дерисомальтоза железа (ранее известная как изомальтозид железа 1000), карбоксимальтоза железа, феррумокситол, сахароза железа и глюконат натрия трехвалентного железа могут вводиться в различных дозах и позволяют корректировать общий дефицит железа однократными или повторными дозами через 1-2 недели в зависимости от конкретная формулировка. Все препараты железа связаны с риском тяжелых инфузионных реакций. В недавних проспективных клинических исследованиях риск развития инфузионных реакций от умеренной до тяжелой степени был сопоставим для всех современных препаратов, поражающих <1% пациентов.
Следовательно, внутривенная терапия железом предназначена для пациентов с железодефицитной анемией с непереносимостью или отсутствием реакции на пероральное введение железа. Согласно европейской маркировке лекарств, внутривенное введение железа также может быть предпочтительным, когда требуется быстрая коррекция дефицита железа. У пациентов с воспалением дефицит железа также следует подозревать как причину анемии, когда насыщение трансферрина низкое, поскольку ферритин сыворотки может быть ложно нормальным. Основная цель лечения в.в. железо — это улучшение качества жизни, суррогатным маркером которого является гемоглобин.
Возникающим осложнением, поражающим 50–74% пациентов, получавших карбоксимальтозу железа в проспективных клинических исследованиях, является гипофосфатемия — или, точнее, синдром 6H (гиперфосфатурическая гипофосфатемия, вызванная высоким фактором роста фибробластов 23, вызывающим гиповитаминоз D, гипокальциемию и вторичный гиперпаратизм). Эти биохимические изменения могут вызвать серьезные и потенциально необратимые клинические осложнения, такие как боль в костях, остеомаляция и переломы. Индивидуальный подбор подходящей терапии железом и оценка ответа на лечение являются обязательными для безопасного достижения улучшенного результата с помощью внутривенной терапии железом.
[97] Внутривенное (IV) железо при тяжелой недостаточности железа
Немия поражает около одной трети людей; Наиболее частой причиной является дефицит железа (Fe). 1 В Канаде (2009-11 гг.) Дефицит, определяемый как сывороточный ферритин <15 мкг / л, по оценкам, поражал 13% женщин в возрасте 12-19 лет и 9% женщин в возрасте 20-49 лет. 2 Эта оценка, вероятно, занижена, поскольку ограничение по ферритину произвольно и не включает жителей резерваций коренных народов, где питание часто хуже, чем в остальной части Канады.Железо необходимо для транспорта кислорода гемоглобином (Hb), а также для энергетического метаболизма, включая митохондриальную цепь переноса электронов. Дефицит без анемии может вызывать неспецифические симптомы (например, усталость, нарушение концентрации внимания, слабость) и признаки (например, выпадение волос, изменения ногтей и слизистых оболочек), но на удивление мало доказательств того, является ли лечение полезным. 3,4,5 Выявление причины всегда важно. Лечение пероральным приемом железа и / или диета обычно просты, хотя абсорбируется лишь малая часть поступившего внутрь элементарного железа. 6,7
Однако иногда железо необходимо вводить парентерально. Внутривенное введение железа может спасти пациентов, которые не могут переносить или усваивать пероральное железо или быстро теряют кровь. Примеры включают обильные менструации, целиакию, обходной желудочный анастомоз, воспалительное заболевание кишечника и желудочно-кишечное кровотечение. Когда восполнение запасов железа необходимо срочно, внутривенное введение экономит время, переливание крови и деньги и используется недостаточно. 8,9 В этом письме не обсуждаются разногласия по поводу внутривенного введения железа пациентам, находящимся на гемодиализе. 10
3 случая иллюстрируют правильное использование
- Меноррагия: студентка университета 20 лет страдала одышкой при физической нагрузке из-за анемии, вызванной хронической менструальной кровопотерей. Ее пульс в состоянии покоя составлял 126, Hb 70 г / л (120-155), средний объем клеток (MCV) 55 мкг / л (82-98), ферритин 2 мкг / л (10-150). Она собиралась поехать за границу и получила 1 г декстрана железа внутривенно в течение 4 часов вместо эритроцитов. В течение 24 дней ее гемоглобин составил 117 г / л, MCV 71 мкг / л, ферритин 28 мкг / л.Ее симптомы исчезли, и ее меноррагия была устранена.
- Хроническое кровотечение из верхних отделов ЖКТ и недоедание: Бездомный мужчина 56 лет страдал шизофренией и алкоголизмом. Он был госпитализирован после рвоты кровью и потерял сознание на улице. Его исходный гемоглобин составлял 36 г / л, MCV 78 мкг / л, ферритин 20 мкг / л. При эндоскопии пролечили большую язву желудка, и он получил 3 единицы эритроцитов. В картах скорой помощи выявлена хроническая железодефицитная анемия в течение как минимум 7 лет. Во время госпитализации ему в течение 2 дней вводили 2 г декстрана железа внутривенно.Два месяца спустя его гемоглобин повысился до 123 г / л, а MCV — до 95 фл.
- Хроническое кровотечение из нижних отделов ЖКТ и ограниченное всасывание железа: у мальчика 14 лет с тяжелым язвенным колитом был ежедневный кровянистый стул. Сопутствующая целиакия ограничивает всасывание железа из вегетарианской диеты. Его гемоглобин составлял 44 г / л, (MCV) 58 мкл, а ферритин плазмы <1 мкг / л. Пробная доза декстрана железа вызвала хрипы, боли в спине и животе, но после 25 мг дифенгидрамина внутривенно он переносил 600 мг сахарозы железа. Семь недель спустя его гемоглобин составлял 120 г / л, а MCV 79 фЛ.Дополнительное количество сахарозы железа компенсировало продолжающееся кровотечение из нижних отделов ЖКТ, и его Hb достиг пика 143 г / л с ферритином 89 мкг / л.
Показания и дозировка
Тяжелый дефицит железа плюс неспособность переносить или усваивать пероральное железо является основным показанием. В условиях продолжающейся кровопотери или срочного хирургического вмешательства внутривенное введение железа лечит анемию намного быстрее, чем пероральное введение железа. В организме хорошо питающихся людей содержится около 4-5 граммов элементарного железа, половина из которых циркулирует в эритроцитах. Остальное хранится в костном мозге, печени и селезенке.Взрослым пациентам с глубоким дефицитом железа требуется не менее 1 грамма элементарного железа для пополнения запасов в организме. Для коррекции анемии требуется еще 200 мг на 10 г / л прироста гемоглобина. Удобство пополнения запасов железа зависит от политики больницы в отношении администрации, включая наличие предварительно распечатанных заказов. 11
Преимущества
Мета-анализ сообщает об умеренном увеличении гемоглобина и сокращении трансфузий для внутривенного (и перорального) железа, но не вызывает убедительного вреда. 12-14 Скромные преимущества объясняются испытаниями, в которых участвовали пациенты с относительно легким дефицитом железа или с хроническими состояниями, ограничивающими кроветворение.
Хармс
Ранние препараты декстрана железа вызывали частую анафилаксию и некоторые смертельные случаи. Хотя сейчас это случается редко, монографии предупреждают о возможной анафилаксии и против использования во время активной инфекции, а для использования декстрана железа требуется присутствие врача во время приема тестовой дозы. В течение 2013-2015 гг. Европейское агентство по лекарственным средствам потребовало усиленных предупреждений о смертельной анафилаксии для всех препаратов железа для парентерального введения. 15 Министерство здравоохранения Канады и FDA США ужесточили предупреждения о ферумокситоле, который официально противопоказан людям с любой лекарственной аллергией. 16 Последующее снижение использования привело к прекращению доступности ферумокситола в Канаде в январе 2016 года.
Невозможно установить сравнительную безопасность декстранового железа по сравнению с недекстрановым железом, поскольку рандомизированные контролируемые клинические испытания (РКИ) слишком малы для надежного сравнения редких серьезных нежелательных явлений. включая смерть. РКИ, сравнивающие глюконат железа, сахарозу железа или ферумокситол, не установили различий в частоте анафилаксии. 17
Наблюдательные исследования не продемонстрировали убедительного общего преимущества в отношении безопасности какого-либо продукта. 18,19 Новый ретроспективный анализ FDA 688 183 реципиентов без диализа в США, получавших внутривенное введение железа в период 2003-2013 гг. (Декстран, сахароза, глюконат или ферумокситол), выявил 274 случая анафилаксии при первом воздействии и еще 170 эпизодов при повторных дозах. . Вероятность анафилактической реакции при восполнении 1000 мг Fe была наименьшей с сахарозой железа (21: 100 000) и наибольшей с декстраном железа (82: 100 000). 20 Однако количество смертей в тот же день, что и инфузия железа, не различалась между препаратами (см. Таблицу 2).Приблизительная частота смерти в численном отношении предпочтительнее декстрана железа (4: 100 000), чем сахарозы железа (7-9: 100 000), глюконата железа (6-12: 100 000) или ферумокситола (7: 100 000). 21 У диализных пациентов частота фатальных или опасных для жизни побочных эффектов от декстрана железа оценивалась FDA в пределах от 2 до 300 на миллион воздействий. 22 Риск причинения вреда при переливании эритроцитов схож по частоте. 23
Неаллергическая токсичность включает местные реакции на инфузат, отсроченные боли в мышцах и суставах, преходящую гипотензию и лихорадку.Обычно это самоограничение.
О долгосрочной токсичности ничего не известно. Повышенный риск инфицирования после в / в введения железа не установлен.
Повышает ли безопасность премедикация или внутримышечная инъекция?
Премедикация не требуется и, как известно, предотвращает опасную гиперчувствительность. Дифенгидрамин внутривенно 25 мг предсказуемо вызывает седативный эффект. 24 Внутримышечная инъекция железа не безопаснее, но имеет недостатки, заключающиеся в местной боли и отсроченном улучшении.
Составы для парентерального введения железа
В таблице 1 показаны продукты, доступные в Канаде по состоянию на февраль 2016 г., и их утвержденные показания. 25 Несмотря на то, что препараты железа официально не одобрены для инфузии полной дозы, они широко используются в Канаде для быстрого восполнения запасов железа.
IV предпочтительнее внутримышечного (IM) введения, потому что внутримышечные инъекции болезненны и абсорбция неполная.
Выводы
- Внутривенное введение железа приносит ощутимую пользу соответствующим образом отобранным людям с хроническим тяжелым дефицитом железа.
- Редкие, но потенциально смертельные реакции происходят со всеми продуктами железа, вводимыми внутривенно.Это требует введения в условиях, когда доступно немедленное лечение, включая адреналин.
- Ни один препарат не является более безопасным, чем другие. Внутривенное введение железа предпочтительнее, чем внутримышечное введение.
Таблица 1: Продукты из железа для внутривенного введения, доступные в Канаде, и их утвержденные показания
| Продукт (торговая марка) | Утвержденные показания | Частота гиперчувствительности, указанная в монографии * | Концентрация | Цена за 100 мг Fe ** |
|---|---|---|---|---|
| декстран железа (Дексирон) | Дефицит железа при пероральном недостаточном количестве железа | оценка не предоставлена | 50 мг / мл | $ 27.50 |
| глюконат натрия и железа (Феррлецит) | железодефицитная анемия гемодиализа | 3,3 на миллион до не менее 6 промилле | 12,5 мг / мл | 44,29 $ |
| сахароза железа (Венофер) | железодефицитная анемия при ХБП | 23 на миллион | 20 мг / мл | 38,15 $ |
* эти цифры нельзя сравнивать напрямую, так как они частично основаны на спонтанных отчетах ADR.
** Больница Ванкувера и аптека Центра медицинских наук, январь 2016 г.
Таблица 2: Показатели смертности в день введения железа после инцидента IV среди населения, не получающего диализ *
| IV Утюг 2003-2013 | # Deaths | # Новые пользователи | Уровень заболеваемости на 100000 человек (95% ДИ) |
|---|---|---|---|
| Декстран железа | 10 | 247 500 | 4,0 (1,9, 7.4) |
| Глюконат железа | 11 | 94 400 | 11,7 (5,8, 20,8) |
| Сахароза железа | 19 | 264 166 | 7,2 (4,3, 11,2) |
| 2010-2013 Декстран железа | 3 | 77 935 | 3,8 (0,8, 11,2) |
| Глюконат железа | 2 | 34 029 | 5.9 (0,7, 21,2) |
| Сахароза железа | 12 | 134 836 | 8,9 (4,6, 15,5) |
| Ферумокситол | 6 | 82,117 | 7,3 (2,7, 15,9) |
* Предоставлено доктором Канлин Ван, FDA США, личное сообщение, январь 2016 г.
Черновик этого терапевтического письма был представлен на рассмотрение 70 экспертам и врачам первичного звена, чтобы исправить любые неточности и обеспечить краткость и актуальность информации для клиницистов.
The терапевтическая инициатива финансируется Министерством здравоохранения Британской Колумбии через грант Университета Британской Колумбии. Therapeutics Initiative предоставляет основанные на фактах советы по лекарственной терапии и не несет ответственности за формулирование или принятие решений провинциальной политики в отношении лекарственных средств.
Список литературы
- Kassebaum NJ, Jasrasaria R, Naghavi M et al. Систематический анализ глобального бремени анемии с 1990 по 2010 гг. Кровь. 2014; 123 (5): 615-24. DOI: 10.1182 / кровь-2013-06-508325.
- Cooper M, Greene-Finestone, L, Lowell H et al. Железная обеспеченность канадцев. Отчеты о состоянии здравоохранения Статистического управления Канады. 23 (4), ноябрь 2012 г. http://www.statcan.gc.ca/pub/82-003-x/2012004/article/11742-eng.htm
- Pratt JJ, Хан KS. Неанемический дефицит железа — заболевание, требующее распознавания диагноза: систематический обзор. Наша гематология J 2015; DOI: 10.1111 / ejh.12645.
- Фаврат Б., Бальк К., Брейманн С. и др. Оценка однократной дозы карбоксимальтозы железа (III) у утомленных женщин с дефицитом железа — ПРЕДПОЧТИТЕ рандомизированное плацебо-контролируемое исследование.PLoS ONE [Электронный ресурс] 2014; 9 (4): e94217. DOI: 10.1371 / journal.pone.0094217.
- Авни Т., Лейбовичи Л., Гафтер-Гвили А. Добавки железа для лечения хронической сердечной недостаточности и дефицита железа: систематический обзор и метаанализ. Eur J Heart Fail 2012; 14 (4): 423-9. DOI: 10.1093 / eurjhf / hfs017.
- г. до н.э. Консультативный комитет по руководствам и протоколам. Дефицит железа — исследование и управление. BC Guidelines.ca 15 июня 2010 г. http://www2.gov.bc.ca/gov/content/health/practitioner-professionalresources/bc-guidelines/iron-deficiency
- Камашелла К.Железодефицитная анемия. N Engl J Med 2015; 372 (19): 1832-43. DOI: 10.1056 / NEJMra1401038.
- Ауэрбах М., Адамсон Дж., Бирчер А. и др. Доказательства безопасности внутривенного введения железа важнее предположений. Haematologica, май 2015 г .; 100 (5): e214-5. DOI: 10.3324 / haematol.2014.121004.
- Каллум Дж, Лин И, Химмель В., Киллиан М. и Хелман А. IV. Железо для лечения анемии в неотложной медицине. Подкаст «Скорая медицинская помощь». Эпизод 65; Май 2015 г. http://emergencymedicinecases.com/iv-iron-foranemia-in-emergency-medicine/
- Charytan DM, Pai AB, Chan CT et al.Соображения и проблемы при определении оптимального использования железа при гемодиализе. J Am Soc Nephron 2015; 26 (6): 1238-47. DOI: 10.1681 / ASN.20140
.
- Саннибрук Центр медицинских наук. Назначения врача: Внутривенное введение железа (Венофер, Ферахема) в амбулаторных условиях. PR 50006; 2015, 18 февраля. Http://emergencymedicinecases.com/wpcontent/uploads/filebase/pdf/IV_Iron_Outpatient_Orders_Form_PR50006.pdf
- Gurusamy KS, Nagendran M, Broadhurst JF et al. Терапия железом у взрослых с анемией без хронической болезни почек (обзор).Кокрановская библиотека, 2014 г., выпуск 12. Артикул: CD010640. DOI: 10.1002 / 14651858.CD010640.pub2.
- Авни Т., Бибер А., Гроссман А. и др. Безопасность внутривенных препаратов железа: систематический обзор и метаанализ. Mayo Clin Proc 2015; 90 (1): 12-23. DOI: 10.1016 / j.mayocp.2014.10.007.
- Litton E, Xiao J, Ho KM. Безопасность и эффективность внутривенной терапии железом в снижении потребности в аллогенном переливании крови: систематический обзор и метаанализ рандомизированных клинических испытаний.BMJ 2013; 347: f4822. DOI: 10.1136 / bmj.f4822.
- Европейское агентство по лекарственным средствам. Отчет об оценке: железосодержащие препараты для внутривенного (в / в) введения. 2013; www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/IV_iron_31/WC500150771.pdf
- Министерство здравоохранения Канады. Письмо уважаемого специалиста в области здравоохранения: Министерство здравоохранения Канады одобрило важную информацию о безопасности препарата FERAHEME (ферумокситол). Важная информация по безопасности RA-42607, 21 ноября 2014 г. http://healthycanadians.gc.ca/recall-alertrappel-avis/hc-sc/2014/42607a-eng.php
FDA. Информация о безопасности лекарств: FDA усиливает предупреждения и изменяет инструкции по назначению, чтобы снизить риск серьезных аллергических реакций на лекарство от анемии Feraheme (ферумокситол). MedWatch 30 марта 2015 г. http://www.fda.gov/Drugs/DrugSafety/ucm440138.htm - Macdougall IC, Strauss WE, McLaughlin J et al. Рандомизированное сравнение ферумокситола и сахарозы железа для лечения железодефицитной анемии у пациентов с ХБП. Clin J Am Soc Nephron 2014; 9 (4): 704-12. DOI: 10.2215 / CJN.05320513.
- Brookhart, MA, Freburger JK, Ellis AR et al. Сравнительная краткосрочная безопасность глюконата натрия и железа с сахарозой у пациентов, находящихся на гемодиализе. Am J. Kidney Dis. 2016; 67 (1): 119-27. DOI: 10.1053 / j.ajkd.2015.07.026.
- Эйри М., Мандаям С., Митани А.А. и др. Сравнительные результаты преобладающего использования ферумокситола на уровне учреждения по сравнению с другими внутривенными препаратами железа у пациентов, находящихся на гемодиализе. Трансплантация циферблата нефрона 2015; 30 (12): 2068-75. DOI: 10.1093 / ndt / gfv305.
- Wang C, Graham DJ, Kane RC et al. Сравнительный риск анафилактических реакций, связанных с внутривенными препаратами железа. ДЖАМА. 2015; 314 (19): 2062-8. DOI: 10.1001 / jama.2015.15572.
- Wang, C. FDA США. Личное сообщение, январь 2016 г. См. Таблицу 2 в html-версии настоящего Письма.
- Wysowski DK, Swartz L, Borders-Hemphill BV и др. Использование препаратов железа для парентерального введения и серьезные реакции анафилактического типа. Am J Hematol 2010; 85 (9): 650-4. DOI: 10.1002 / ajh.21794.
- Callum JL, Lin Y, Pinkerton PH et al. Bloody Easy 3: Переливание крови, альтернативы крови и реакции на переливание. Руководство по трансфузионной медицине (третье издание). Региональная координационная сеть по крови Онтарио, 2011 г. http://transfusionontario.org/en/cmdownloads/categories/bloody_easy/
- Barton JC, Barton EH, Bertoli LF et al. Внутривенная терапия декстраном железа у пациентов с дефицитом железа и нормальной функцией почек, которые не реагировали на пероральные добавки железа или не переносили их.Am J Med. 2000; 109 (1): 27-32.
- База данных по лекарственным препаратам Министерства здравоохранения Канады. Монографии по продукту:
— Декстран железа (Дексирон): http://webprod5.hc-sc.gc.ca/dpd-bdpp/itemiteme.do?pm-mp=00018869
— Глюконат натрия и железа (Феррлецит): http: / /webprod5.hc-sc.gc.ca/dpdbdpp/item-iteme.do?pm-mp=00019077
— Сахароза железа (Venofer): http://webprod5.hc-sc.gc.ca/dpd-bdpp/ itemiteme.do?pm-mp=00018889
Влияние внутривенных добавок железа на усталость и общее состояние здоровья доноров крови без анемии с дефицитом железа: рандомизированное плацебо-контролируемое исследование превосходства
ВОЗ. Безопасность и доступность крови. https://www.who.int/news-room/fact-sheets/detail/blood-safety-and-availability (2019).
Бриттенхэм, Г. М. Дефицит железа у доноров цельной крови. Переливание. 51 , 458–561. https://doi.org/10.1111/j.1537-2995.2011.03062.x (2011).
Артикул PubMed PubMed Central Google ученый
Салвин, Х. Э., Пасрича, С. Р., Маркс, Д.C. & Speedy, J. Дефицит железа у доноров крови: национальное перекрестное исследование. Переливание 54 , 2434–2344. https://doi.org/10.1111/trf.12647 (2014).
CAS Статья PubMed Google ученый
Ригас, А. С., Педерсен, О. Б., Магнуссен, К., Эрикструп, К. и Уллум, Х. Дефицит железа у доноров крови: опыт датского исследования доноров крови и Копенгагенской схемы мониторинга ферритина. Transfus. Med. 29 , 23–27. https://doi.org/10.1111/tme.12477 (2019).
Артикул PubMed Google ученый
Cable, R.G. et al. Дефицит железа у доноров крови: исследование REDS-II Donor Iron Status Evaluation (RISE). Переливание 52 , 702–711. https://doi.org/10.1111/j.1537-2995.2011.03401.x (2012).
CAS Статья PubMed Google ученый
Радтке, Х., Тегтмайер, Дж., Рокер, Л., Салама, А. и Кизеветтер, Х. Суточные дозы 20 мг элементарного железа компенсируют потерю железа у обычных доноров крови: рандомизированное, двойное слепое, плацебо -контролируемое исследование. Переливание 44 , 1427–1432. https://doi.org/10.1111/j.1537-2995.2004.04074.x (2004).
CAS Статья PubMed Google ученый
Росвик, А.С., Хервиг, Т., Вентцель-Ларсен, Т.И Ульвик, Р. Дж. Влияние добавок железа на статус железа в течение первой недели после сдачи крови. Vox Sang 98 , e249 – e256. https://doi.org/10.1111/j.1423-0410.2009.01270.x (2010).
CAS Статья PubMed Google ученый
O’Meara, A. et al. Значение рутинного измерения ферритина у доноров крови. Переливание 51 , 2183–2188. https: // doi.org / 10.1111 / j.1537-2995.2011.03148.x (2011).
Артикул PubMed Google ученый
Pittori, C. et al. Пилотная программа заместительной терапии железом у женщин-доноров крови с дефицитом железа без анемии. Vox Sang 100 , 303–311. https://doi.org/10.1111/j.1423-0410.2010.01427.x (2011).
CAS Статья PubMed Google ученый
Smith, G.A., Fisher, S.A., Doree, C., Di Angelantonio, E. & Roberts, D.J. Пероральные или парентеральные добавки железа для уменьшения отсрочки, дефицита железа и / или анемии у доноров крови. Кокрановская база данных Syst. Ред. https://doi.org/10.1002/14651858.CD009532.pub (2014).
Артикул PubMed PubMed Central Google ученый
Pasricha, S. R. et al. Постдональная замена железа для поддержания запасов железа у женщин-доноров цельной крови в повседневной донорской практике: результаты двух технико-экономических обоснований в Австралии. Переливание 57 , 1922–1929. https://doi.org/10.1111/trf.14173 (2017).
CAS Статья PubMed Google ученый
Cable, R.G. et al. Операционные последствия поведения доноров после регистрации в программе «Стратегии снижения дефицита железа у доноров крови» (STRIDE). Переливание. 57 , 2440–2448. https://doi.org/10.1111/trf.14226 (2017).
CAS Статья PubMed PubMed Central Google ученый
Cable, R.G. et al. Влияние добавок железа на запасы железа и общее количество железа в организме после сдачи цельной крови. Переливание 56 , 2005–2012. https://doi.org/10.1111/trf.1365 (2016).
CAS Статья PubMed PubMed Central Google ученый
Di Angelantonio, E. et al. Эффективность и безопасность варьирования частоты сдачи цельной крови (ИНТЕРВАЛ): рандомизированное исследование с участием 45 000 доноров. Ланцет 390 , 2360–2371. https://doi.org/10.1016/S0140-6736(17)31928-1 (2017).
Артикул PubMed PubMed Central Google ученый
Поповский М.А. Анемия, истощение запасов железа и донор крови: пора работать от имени донора. Переливание 52 , 688–692. https://doi.org/10.1111/j.1537-2995.2012.03562.x (2012).
CAS Статья PubMed Google ученый
Transfusion EC on B. Руководство по подготовке, использованию и контролю качества компонентов крови, 18 изд. (Европейское управление качества медицины и здравоохранения (EDQM), Совет Европы, Страсбург, Франция, 2015 г.).
Vuk, T. et al. Международный форум: исследование статуса железа у доноров крови. Переливание крови. 15 , 20–41. https://doi.org/10.2450/2016.0101-16 (2017).
Артикул PubMed PubMed Central Google ученый
Акрелл, Б.А., Магуайр, Дж. Дж., Даллман, П. Р. и Кирни, Е. Б. Влияние дефицита железа на сукцинат- и НАДН-убихинон оксидоредуктазы в митохондриях скелетных мышц. J. Biol. Chem. 259 , 10053–10059 (1984).
CAS PubMed Google ученый
Бирд, Дж. Л. Биология железа в иммунной функции, метаболизме мышц и функционировании нейронов. J. Nutr. 131 , 568С-579С.https://doi.org/10.1093/jn/131.2.568S (2001) ( обсуждение 580S ).
CAS Статья PubMed Google ученый
Савада Т., Кономи А. и Йокои К. Дефицит железа без анемии связан с гневом и усталостью у молодых японских женщин. Biol. Trace Elem. Res. 159 , 22–31. https://doi.org/10.1007/s12011-014-9963-1 (2014).
CAS Статья PubMed Google ученый
Verdon, F. et al. Добавки железа для лечения необъяснимой усталости у женщин без анемии: двойное слепое рандомизированное плацебо-контролируемое исследование. BMJ 326 , 1124. https://doi.org/10.1136/bmj.326.7399.1124 (2003).
CAS Статья PubMed PubMed Central Google ученый
Паттерсон, А. Дж., Браун, У. Дж., Пауэрс, Дж. Р. и Робертс, Д. К. Дефицит железа, общее состояние здоровья и усталость: результаты Австралийского лонгитюдного исследования здоровья женщин. Qual. Life Res. 2000 (9), 491–497. https://doi.org/10.1023/a:1008978114650 (2000).
Артикул Google ученый
Grondin, M.A. et al. Распространенность дефицита железа и связанное со здоровьем качество жизни среди студенток. J. Am. Coll. Nutr. 27 , 337–341. https://doi.org/10.1080/07315724.2008.10719709 (2018).
Артикул Google ученый
Хаас, Дж. Д. и Браунли, Т. 4-й Дефицит железа и снижение работоспособности: критический обзор исследования для определения причинно-следственной связи. J. Nutr. 131 , 676S-688S. https://doi.org/10.1093/jn/131.2.676S (2001) ( обсуждение 688S-690S ).
CAS Статья PubMed Google ученый
Брунер, А. Б., Иоффе, А., Дагган, А. К., Казелла, Дж. Ф. и Брандт, Дж. Рандомизированное исследование когнитивных эффектов приема добавок железа у девочек-подростков, не страдающих железодефицитной анемией. Ланцет 348 , 992–996. https://doi.org/10.1016/S0140-6736(96)02341-0 (1996).
CAS Статья PubMed Google ученый
Мюррей-Колб, Л. Э. и Берд, Дж. Л. Лечение железом нормализует когнитивные функции у молодых женщин. Am. J. Clin. Nutr. 85 , 778–787. https://doi.org/10.1093/ajcn/85.3.778 (2007).
CAS Статья PubMed Google ученый
Falkingham, M. et al. Влияние пероральных добавок железа на познавательные способности у детей старшего возраста и взрослых: систематический обзор и метаанализ. Nutr. J. 9 , 4. https://doi.org/10.1186/1475-2891-9-4 (2010).
CAS Статья PubMed PubMed Central Google ученый
Шейх М., Хантушзаде С., Шариат М., Фарахани З. и Эбрахиминасаб О. Эффективность раннего приема препаратов железа при послеродовой депрессии, рандомизированное двойное слепое плацебо-контролируемое исследование. Eur. J. Nutr. 56 , 901–908. https://doi.org/10.1007/s00394-015-1140-6 (2015).
CAS Статья PubMed Google ученый
Spencer, B.R. et al. Синдром беспокойных ног, пика и содержание железа у доноров крови. Переливание 53 , 1645–1652. https://doi.org/10.1111/trf.12260 (2013).
Артикул PubMed PubMed Central Google ученый
Newman, B.H., Pichette, S., Pichette, D. & Dzaka, E. Неблагоприятные эффекты у доноров крови после донорства цельной крови: исследование 1000 доноров крови, опрошенных через 3 недели после сдачи цельной крови. Переливание 43 , 598–603. https://doi.org/10.1046/j.1537-2995.2003.00368.x (2003).
Артикул PubMed Google ученый
Birgegard, G., Schneider, K. & Ulfberg, J. Высокая частота истощения запасов железа и синдрома беспокойных ног (RLS) у регулярных доноров крови: внутривенное замещение железа сахарозой более эффективно, чем пероральное введение железа. Vox Sang 99 , 354–361. https://doi.org/10.1111/j.1423-0410.2010.01368.x (2010).
CAS Статья PubMed Google ученый
Waldvogel, S. et al. Клиническая оценка эффективности лечения железом среди доноров крови женщин, не страдающих анемией, но с дефицитом железа: рандомизированное контролируемое исследование. BMC Med. 10 , 8. https://doi.org/10.1186/1741-7015-10-8 (2012).
CAS Статья PubMed PubMed Central Google ученый
Ehn, L., Liedén, G. & Oldfelt, C.O. Потребность в железе у доноров крови. Lakartidningen. 65 , 687–697 (1968).
CAS PubMed Google ученый
Gybel-Brask, M., Seeberg, J., Thomsen, L. & Johannsson, PJ Внутривенное введение изомальтозида железа улучшает концентрацию гемоглобина и запасы железа у женщин-доноров крови с дефицитом железа: рандомизированное двойное слепое плацебо. контролируемое клиническое испытание. Переливание 58 , 974–981. https://doi.org/10.1111/trf.14521 (2018).
CAS Статья PubMed Google ученый
Rigas, A. S. et al. Отсутствует связь между статусом железа и качеством жизни, связанным со здоровьем, у 16 375 датских доноров крови: результаты датского исследования доноров крови. Переливание 55 , 1752–1756. https://doi.org/10.1111/trf.13085 (2015).
CAS Статья PubMed Google ученый
Vaucher, P., Druais, P.-L., Waldvogel, S. & Favrat, B. Влияние добавок железа на усталость у неанемичных менструирующих женщин с низким содержанием ферритина: рандомизированное контролируемое исследование. CMAJ 184 , 1247–1254. https://doi.org/10.1503/cmaj.110950 (2012).
Артикул PubMed PubMed Central Google ученый
Krayenbuehl, P.-A., Battegay, E., Breymann, C., Furrer, J. & Schulthess, G. Внутривенное введение железа для лечения усталости у неанемичных женщин в пременопаузе с низкой концентрацией ферритина в сыворотке. Кровь 118 , 3222–3227. https://doi.org/10.1182/blood-2011-04-346304 (2011).
CAS Статья PubMed Google ученый
Favrat, B. et al. Оценка однократной дозы карбоксимальтозы железа (III) у утомленных женщин с дефицитом железа. PREFER — рандомизированное плацебо-контролируемое исследование. PLoS ONE 9 , e94217. https://doi.org/10.1371/journal.pone.0094217 (2014).
ADS Статья PubMed PubMed Central Google ученый
Petzschner, F.H., Weber, L.A.E., Gard, T. & Stephan, K.E. Biol. Психиатрия 82 , 421–430. https://doi.org/10.1016/j.biopsych.2017.05.012 (2017).
Артикул PubMed Google ученый
Stephan, K. E. et al. Аллостатическая самоэффективность: метакогнитивная теория усталости и депрессии, вызванных дисомеостазом. Перед. Гм. Neurosci. 10 , 550. https://doi.org/10.3389/fnhum.2016.00550 (2016).
Артикул PubMed PubMed Central Google ученый
Beutler, E., Larsh, S. E. и Gurney, C. W. Терапия железом у хронически усталых женщин без анемии: двойное слепое исследование. Ann. Междунар. Med. 52 , 378–394. https://doi.org/10.7326/0003-4819-52-2-378 (1960).
CAS Статья PubMed Google ученый
Arcani, R. et al. Эффективность внутривенной терапии железом у не анемичных железодефицитных пациентов с усталостью. Neth. J. Med. 78 , 34–36 (2020).
CAS PubMed Google ученый
Штейн, К. Д., Якобсен, П. Б., Бланшар, К. М. и Торс, К. Дальнейшее подтверждение краткой формы многомерного перечня симптомов усталости. J. Управление болевыми симптомами. 27 , 14–23. https://doi.org/10.1016/j.jpainsymman.2003.06.003 (2004).
Артикул Google ученый
Lukas, P. S. et al. Связь усталости и психологического стресса с качеством жизни у пациентов с предыдущим венозным тромбоэмболическим событием. Тромб. Гемост. 102 , 1219–1226. https://doi.org/10.1160/TH09-05-0316 (2009 г.).
CAS Статья PubMed Google ученый
Hardt, J., Egle, U. T. & Brähler, E. Контрольный список симптомов-27 в Германии. Psychother. Психосом. Med. Psychol. 56 , 276–284. https://doi.org/10.1055/s-2006-932577 (2006).
Артикул PubMed Google ученый
Дженкинс, К. Д., Стэнтон, Б. А., Нимкрик, С. Дж. И Роуз, Р. М. Шкала для оценки проблем со сном в клинических исследованиях. J. Clin. Эпидемиол. 41 , 313–321. https://doi.org/10.1016/0895-4356(88)
CAS Статья PubMed Google ученый
Kudielka, B. M., von Känel, R., Gander, M.-L. & Фишер, Дж. Э. Дисбаланс между усилиями и вознаграждением, чрезмерные обязательства и сон у работающего населения. Рабочее напряжение 18 , 167–178. https://doi.org/10.1080/02678370410001731785 (2004).
Артикул Google ученый
Рабин Р. и де Чарро Ф. EQ-5D: показатель состояния здоровья по группе EuroQol. Ann. Med. 33 , 337–343. https://doi.org/10.3109/0785389010
CAS Статья PubMed Google ученый
Trotti, A. et al. CTCAE v3.0: разработка комплексной системы оценки побочных эффектов лечения рака. Семин. Radiat. Онкол. 13 , 176–181. https://doi.org/10.1016/S1053-4296(03)00031-6 (2003).
Артикул PubMed Google ученый
Nüesch, E. et al. Эффекты исключения пациентов из анализа в рандомизированных контролируемых испытаниях: метаэпидемиологическое исследование. BMJ 339 , b3244. https://doi.org/10.1136/bmj.b3244 (2009 г.).
Артикул PubMed PubMed Central Google ученый
Sterne, J. A. C. et al. Множественное вменение недостающих данных в эпидемиологических и клинических исследованиях: возможности и подводные камни. BMJ 338 , b2393. https://doi.org/10.1136/bmj.b2393 (2009 г.).
Артикул PubMed PubMed Central Google ученый
Клиническое применение железа для внутривенного введения: введение, эффективность и безопасность | Гематология, Образовательная программа ASH
В этом разделе рассматриваются история, фармакология, введение, эффективность и токсичность внутривенного железа.Внутривенное введение железа дает преимущества перед пероральным приемом железа для лечения железодефицитной анемии при широком диапазоне болезненных состояний, связанных с абсолютным и функциональным дефицитом железа. Однако остаются опасения по поводу острых профилей безопасности доступных препаратов и возможности долгосрочной токсичности при их повторном применении. Доступны семь препаратов железа для внутривенного введения. Существует множество заблуждений относительно относительной токсичности различных составов. Обсуждаются сходства и различия.Восполнение запасов железа связано с неблагоприятными исходами при инфекциях. Рассматривается взаимосвязь, если таковая имеется, между внутривенным введением железа и инфекциями. Выделены потенциальные преимущества инфузии общей дозы (TDI), полного восстановления за один прием. Представлена новая парадигма заместительной терапии железом при железодефицитной анемии.
Железо используется для лечения анемии более 300 лет.В обзоре лечения хлороза в 1893 году Стокман приписывает первое применение перорального железа Сиденхему в 1681 году. что пероральная терапия железом стала стандартным лечением того, что сейчас известно как железодефицитная анемия (ЖДА). Однако пероральный прием железа не является идеальным лечением, поскольку желудочно-кишечная токсичность встречается у> 35–59% пациентов, 3,4 и длительный курс необходим для устранения анемии и пополнения запасов.Несоблюдение предписанного курса перорального приема железа является обычным явлением, и даже у приверженных ему пациентов плохая кишечная абсорбция не может компенсировать потребность в железе при наличии продолжающихся кровопотерь.
Хотя внутривенное введение железа способно обойти все эти проблемы, сохраняются опасения по поводу острых профилей безопасности доступных продуктов и потенциального долгосрочного вреда от повторного введения железа.Хотя любое внутривенное введение железа может вызывать острые тяжелые реакции, частота и тяжесть реакций ниже, чем могут оценить врачи, 5 , а дозы, обычно вводимые в клинической практике, недостаточны для того, чтобы привести к повреждению паренхиматозного органа. Точно так же опасения по поводу внутривенной терапии железом, потенциально повышающей риск инфекций и сердечно-сосудистых заболеваний, не были подтверждены в проспективных исследованиях или клинических испытаниях и остаются в значительной степени недоказанными гипотезами. В этой статье будут рассмотрены способы применения, показания и профили безопасности доступных внутривенных препаратов железа в развитых странах.Тем не менее, целесообразно проанализировать историю инъекционного железа, чтобы лучше понять нынешнее нежелание применять рутинную терапию препаратами железа внутривенно.
Парентеральное железо впервые было введено в начале 20-х годов -х годов века 6 (Рисунок 1). Растворы гидроксида железа вводили подкожно и внутримышечно пациентам с гипохромной анемией, и наблюдаемые приросты гемоглобина были пропорциональны количеству введенного железа.Отсутствие углеводной оболочки привело к немедленному высвобождению железа и серьезным токсическим реакциям, которые привели к тому, что использование этой терапии было рекомендовано только в чрезвычайных обстоятельствах.
Рисунок 1.
Всего на миллион доз 100 мг сообщалось о серьезных побочных эффектах. Изменено с разрешения Chertow et al. 19
Рис. 1.
Всего зарегистрированных серьезных нежелательных явлений на миллион доз 100 мг.Изменено с разрешения Chertow et al. 19
В 1947 году Nissim 7 ввел сахарид железа для внутривенной инъекции и пришел к выводу, что эта форма железа более безопасна и больше подходит для парентерального введения. В 1954 году Бэрд и Подмор 8 представили Имферон (высокомолекулярный декстран железа [HMW ID], Fisons plc, Homes Chapel England, Ипсвич, Великобритания; продаваемый Merrill Pharmaceuticals в США) для внутримышечного (IM) и внутривенного применения. .Декстран покрывает ядро оксида железа, уменьшая высвобождение свободного железа во время инфузии, что объясняет низкую частоту побочных реакций. Биодоступность железа происходит за счет поглощения частиц декстрана железа ретикулоэндотелиальной системой с последующей деградацией. Наблюдались быстрые гематологические реакции с низкой частотой побочных эффектов. Однако у пациентов могут развиваться или иметься предварительно сформированные антидекстрановые антитела, и, в частности, более крупные молекулы декстрана могут вызывать анафилаксию, как описано при введении HMW ID.Несмотря на то, что эти реакции относительно редки, эти реакции побуждали избегать парентерального введения железа, за исключением случаев, когда наблюдались экстремальные клинические условия и другие варианты недоступны. HMW ID был единственным препаратом для парентерального введения железа, доступным до 1990-х годов.
Хотя опубликованные в мировой литературе статьи 9,10 подтверждают полезность внутривенного введения железа в лечении ЖДА, только в 1980 г. появилось первое проспективное исследование клинического применения внутривенного железа в США. 11 Четыреста семьдесят один пациент с ЖДА получали внутривенное введение железа в различных дозах. Все пациенты ответили на лечение, но у трех из них были выявлены «анафилактоидные» реакции с симптомами и признаками, включая остановку дыхания, гипотензию, пурпуру, цианоз, одышку, обморок, хрипы и крапивницу. В сериале не было смертей. Авторы пришли к выводу, что внутривенное введение железа следует применять для тех состояний, при которых нельзя использовать пероральное железо. HMW ID оставался в фармакопее и был второстепенным продуктом до появления в 1989 году рекомбинантного человеческого эритропоэтина (эпоэтина альфа), первого агента, стимулирующего эритропоэз (ESA).
Эпоэтин впервые был использован для лечения анемии у пациентов, находящихся на диализе почек. Хотя большинство пациентов ответили на эпоэтин, некоторые — нет. 12 Было найдено несколько объяснений субоптимального ответа, но обычно было показано, что неудача связана с абсолютным или функциональным дефицитом железа, поскольку введение железа внутривенно восстанавливает ответную реакцию. 13 Функциональный дефицит железа (железо-ограниченный эритропоэз) рассматривается в другом месте этого занятия.Впоследствии парентеральная терапия железом стала важным дополнением к получению и поддержанию адекватных уровней гемоглобина у пациентов с терминальной стадией почечной недостаточности и другими болезненными состояниями.
Несмотря на то, что это было относительно редко, наблюдались тяжелые реакции острой гиперчувствительности на HMW ID. Предупреждение о черном ящике было помещено во вкладыш в упаковку, и требовалась пробная доза. В 1991 году зараженная партия привела к отзыву продукта во всем мире.По счастливой случайности, в то же время низкомолекулярный декстран железа (LMW ID) (INFeD, Schein Pharmaceuticals, теперь Watson Pharmaceuticals, Inc, Морристаун, Нью-Джерси) завершал регистрационные испытания в Соединенных Штатах и выпущен для клинического использования в 1992 году. blueprinting, Фисонс определил, что этот продукт содержал декстран с более низкой молекулярной массой и меньшей вариабельностью среди боковых цепей. Первоначальная форма HMW ID была снята с американского рынка в 1991 году, а его производство прекратилось в 1992 году.Использование ESA и LMW ID было обычным явлением у пациентов на диализе и еще больше увеличилось в 1997 году с принятием руководящих принципов по клинической практике, продвигающих рутинное использование обоих агентов для достижения целевого уровня гемоглобина от 11 до 12 г / дл.
В 1996 году еще один HMW ID (Dexferrum, American Regent Pharmaceuticals, Ширли, Нью-Йорк) был одобрен Управлением по контролю за продуктами и лекарствами (FDA), хотя LMW ID сохранил большую часть рынка диализа.Оба декстрана железа требовали тестовой дозы и имели предупреждения о черном ящике.
В 1999 году глюконат железа (FG) (Ferrlecit, Schein, затем Watson Pharmaceuticals, теперь Sanofi-Aventis), после того как он был доступен в Европе в течение многих лет, был представлен на американском рынке как более безопасная альтернатива декстрану железа. Исторический обзор использования ФГ в Европе и декстранов железа в США не выявил смертей, связанных с ФГ, но по крайней мере 31 смерть от декстрана железа, и пришел к выводу, что ФГ более безопасен из-за отсутствия декстрановой оболочки. 14 Двойное слепое плацебо-контролируемое перекрестное исследование однократного введения ФГ у 2338 гемодиализных пациентов выявило только одну серьезную аллергическую реакцию без летального исхода. 15,16 Они также сообщили, что у пациентов, ранее чувствительных к декстрану железа, реакции на ФГ были необычными, но также в 7 раз чаще, чем у пациентов без чувствительности к железу. 16 Практически все 2338 пациентов ранее получали декстраны железа. В ноябре 2000 г. сахароза железа (IS) (Venofer, America Regent Pharmaceuticals) была одобрена в США.Он также давно используется в Европе, не имеет декстранового покрытия и, как сообщается, имеет профиль безопасности, аналогичный FG. 17 Предупреждения о черном ящике не появляются на вкладышах в упаковке FG или IS, и тестовая доза не рекомендуется. Впоследствии FG и IS в значительной степени заменили использование декстранов железа у диализных пациентов в США.
В ретроспективном обзоре более 30 миллионов доз железа внутривенно Chertow et al 18 показали, что воздействие HMW ID было связано со значительно более высоким риском нежелательных явлений (AE) по сравнению с LMW ID (Рисунок 2 18 ).В ходе последующего анализа авторы пришли к выводу, что НЯ были относительно низкими в целом, с более низкими показателями среди LMW ID, FG и IS. 19 Однако два небольших проспективных исследования и один метаанализ, сравнивающие эффективность и безопасность LMW ID и IS, не показали никакой разницы. 20–22
Рисунок 2.
Всего сообщалось о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
Рисунок 2.
Всего сообщили о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
За последние 18 месяцев было выпущено три новых соединения железа для внутривенного введения для лечения пациентов с анемией или хронической болезнью почек (ХБП). Два в настоящее время одобрены для использования в Европе (карбоксимальтоза железа [FC], Ferrinject, ViforPharma, Санкт-Галлен, Швейцария, и изомальтозид железа [II], Monofer, Pharmacosmos, Holbaek, Дания) и один в США (ферумокситол, Feraheme , AMAG Pharmaceuticals, Inc, Лексингтон, Массачусетс).Все три соединения обещают предложить полную замещающую дозу железа за 15 минут или меньше.
Самые ранние препараты железа были связаны с неприемлемой острой токсичностью в результате высвобождения биоактивного свободного железа. Сегодня все препараты железа для внутривенного введения представляют собой комплексы или коллоиды железо-углевод, основанные на небольших сфероидальных железо-углеводных частицах. Каждая частица состоит из ядра, сделанного из оксигидроксигелевого железа, окруженного оболочкой из углеводов, которая стабилизирует гель, замедляет высвобождение железа и сохраняет полученные частицы в коллоидной суспензии. 23 Все одобренные в настоящее время утюги для внутривенного введения имеют такую структуру, но отличаются друг от друга размером сердцевины, а также характером и плотностью окружающего углевода. Характеристики семи соединений железа показаны в таблице 1. Сильные стороны комплекса железа влияют на фармакокинетические характеристики утюгов для внутривенного введения, имеющих отношение к терапевтическому применению. Скорость высвобождения биоактивного железа обратно пропорциональна силе комплекса — чем сильнее комплекс, тем медленнее высвобождение железа. 24 Токсикологическое значение зависимости размера комплекса от времени высвобождения заключается в том, что более сильные комплексы имеют более низкий потенциал насыщения трансферрина с последующей токсичностью свободного железа по сравнению с более слабыми комплексами. 25
После инъекции все разные препараты разделяют схожую метаболическую судьбу. Комплексы железо-углевод смешиваются с плазмой и фагоцитируются в ретикулоэндотелиальной системе, при этом углеводная оболочка разрушается, а железо хранится в виде ферритина или транспортируется из клетки с помощью единственного известного белка, экспортирующего железо, ферропортина.Экспортируемое железо связывается с внеклеточным связывающим белком, трансферрином, который доставляет железо к рецепторам трансферрина на поверхности предшественников эритроидов, поддерживая гемоглобинизацию.
IM-маршрут считается более безопасной альтернативой IV. Никакие опубликованные данные не подтверждают этот вывод, поскольку частота нежелательных явлений схожа при обоих способах введения. Кроме того, внутримышечные инъекции болезненны, вызывают необратимое изменение цвета кожи и связаны с ягодичными саркомами. 26,27 Следует отказаться от внутримышечных инъекций. 5
Введение любого из доступных препаратов может быть связано с острой стесненностью в груди и спине без сопутствующей гипотензии, хрипов, стридора или периорбитального отека. В случае декстранов железа это обычно наблюдается после введения тестовой дозы. 5 Это нечастое событие редко повторяется при повторном вызове. Эти явления более вероятны у пациентов с аллергическим диатезом. 28 Важно не слишком остро реагировать на эти незначительные НЯ. У пациентов с повышенным риском развития НЯ предварительное лечение кортикостероидами может быть полезным. 29
В обзоре терапии LMW ID у пациентов с дефицитом железа и нормальной функцией почек, у которых была непереносимость перорального приема железа, Barton et al. 3 предположили, что предварительная обработка антигистаминными препаратами была ответственна за большинство предполагаемых реакций на декстран железа.Поскольку нет опубликованных доказательств того, что антигистаминные препараты полезны для уменьшения реакций острой гиперчувствительности к внутривенному введению железа, рекомендуется не проводить предварительное лечение в плановом порядке.
В нескольких публикациях упоминается о проблемах безопасности при использовании этого препарата. 18,19,30–35 В течение короткого периода в 1997 году, когда LMW ID стал недоступен, HMW ID был единственным доступным составом.За этот период количество спонтанных сообщений в FDA о побочных эффектах, связанных с внутривенным введением железа, увеличилось в 11 раз (получено автором через Freedom of Information). Многочисленные публикации предостерегали от использования HMW ID. 30 Национальная комплексная онкологическая сеть 31 и журнал медсестер Американского нефрологического общества 32 запретили его использование. Он был удален из формуляров всех больниц Администрации ветеранов США и их протекторатов и недоступен в Европе.Несмотря на это, некоторые больничные фармацевты продолжают рассматривать все продукты с декстраном железа как равные, и многие врачи не осведомлены о различиях между двумя декстранами железа. Центры услуг Medicare и Medicaid в настоящее время присваивают идентичные J-коды для выставления счетов, что еще больше сбивает с толку лиц, назначающих лекарства.
В 2002 г. Мамула и др. 33 опубликовали свой опыт инфузии общей дозы (TDI) у детей с воспалительным заболеванием кишечника и сообщили о 9-кратном увеличении частоты НЯ при HMW ID по сравнению с LMW ID.В обзоре предполагаемых НЯ декстрана железа Fletes et al 34 отметили, что НЯ были в 8,1 раза более вероятны при HMW ID, и пришли к выводу, что серьезные НЯ, связанные с внутривенным введением декстрана железа, были редкими и, по-видимому, зависели от конкретной рецептуры препарата. В / в декстран железа. Сходные результаты наблюдались McCarthy et al. 35 в исследовании, посвященном НЯ у пациентов, находящихся на хроническом гемодиализе, получающих декстран железа внутривенно. В первом исследовании, продемонстрировавшем преимущество внутривенного введения железа в синергизме с ЭСС при лечении анемии, вызванной химиотерапией, 81 из 157 пациентов получали декстран железа в виде болюса или ТДИ.Из 79 пациентов, получивших LMW ID, значительных НЯ не наблюдалось, тогда как у одного из двух пациентов, получивших HMW ID, в течение короткого периода, когда LMW ID не было доступно, развилась анафилаксия. 36 Через четыре месяца после выздоровления этот пациент получил LMW ID без осложнений, как и ранее опубликованный опыт. 32,33 В недавнем исследовании 25 пациентов с синдромом беспокойных ног, получавших 1000 мг HMW ID в течение нескольких часов, Ondo 37 сообщил о высокой скорости улучшения симптомов; однако у двух пациентов развилась анафилаксия.Тем не менее, в публикации ретроспективного анализа 48 059 диализных пациентов, из которых 20 213 не получали железо, из базы данных Gambril US Healthcare, Уолтерс и Ван Вик 38 обнаружили, что пациенты, получившие HMW ID, не более склонны к тяжелой болезни. AE, чем те, кто получил LMW ID.
Недавно FDA выпустило предупреждение, чтобы отметить «различия в химических характеристиках и клинических эффектах препаратов декстрана железа, чтобы свести к минимуму потенциальную путаницу между доступными продуктами в формуляре».Увеличение числа зарегистрированных серьезных НЯ с HMW ID предполагает, что при рассмотрении этого препарата следует проявлять осторожность.
Учитывая текущее состояние знаний, это предпочтительный состав декстрана железа. В отличие от солей железа, FG и IS, этот состав можно вводить в виде болюса внутривенно или TDI (одобренный метод введения в Европе, но не в Соединенных Штатах). Eschbach et al., , 12, , были первыми, кто продемонстрировал преимущество декстрана железа в усилении ответа на эритропоэтин у пациентов с анемией при ХБП, находящихся на диализе.Впоследствии было показано, что заметное снижение дозировки ESA может быть достигнуто при добавлении декстрана железа. 39
После выпуска LMW ID в 1991 г. для лечения диализной анемии, он стал стандартом для дополнения ESA. Первоначальный обзор безопасности был опубликован в 1996 году. Авторы пришли к выводу, что НЯ с LMW ID были редкими, и только история аллергии предсказывала очень редкие НЯ. 28 Кроме того, TDI особенно полезен при оказании помощи пациентам, находящимся на поддерживающем перитонеальном диализе или гемодиализе на дому, которым в противном случае потребовалось бы частое посещение амбулаторных учреждений для завершения терапии. 40 Этот метод введения пациентам, находящимся на гемодиализе, сравнивался с болюсным в многоцентровом рандомизированном открытом исследовании и показал его одинаковую безопасность и эффективность при значительной экономии средств. 41
Недавно мы представили данные о 226 инфузиях 1 грамма LMW ID в течение 1 часа у 187 последовательных, неотобранных пациентов с дефицитом железа и без недавнего внутривенного введения железа (Таблица 2).Только два пациента получили премедикацию — метилпреднизолон — из-за аллергического анамнеза. Существенной токсичности не наблюдалось (таблица 3). Все пациенты, у которых развилась крапивница, кроме одного, получили полную дозу. 42
Таблица 2.диагнозов у 187 пациентов, получавших 1 грамм внутривенного LMWID в течение 1 часа lang = FR
Таблица 3.Нежелательные явления после 1 грамма внутривенного введения LMW ID в течение 1 часа
Гипофосфатемия (сывороточный фосфат <2 мг / дл) наблюдалась после введения IS и FC. Мы исследовали до- и постинфузионные уровни фосфатов после LMW ID и не обнаружили изменений при медиане наблюдения в течение 2 недель (среднее изменение от исходного уровня фосфатов составило 0,0 мг / дл (95% ДИ, от -0,1 до 0,2; P = 0,537) (Таблица 4).
Таблица 4.Уровни фосфатов до и после инфузии в соответствии с LMW ID
Пациентам с раком или заболеванием почек, требующим еженедельных или более частых посещений, короткие инфузии любого из доступных препаратов, за исключением, возможно, HMW ID, могут быть сделаны без значительного риска. Однако, если большие дозы железа вводятся внутривенно в амбулаторных условиях, предпочтительным методом является TDI. Этот метод особенно полезен в следующих клинических ситуациях: домашний перитонеальный диализ или гемодиализ, дефицит железа из-за беременности, менометроррагия, хирургическая кровопотеря, операция обходного желудочного анастомоза, наследственные геморрагические телеангиэктазии (Osler-Weber-Rendu), ангиодисплазия, вызванная другими причинами, воспалительные процессы. заболевания кишечника (ВЗК), синдромы мальабсорбции и у тех пациентов с неосложненным дефицитом железа, которые не соблюдают или не переносят пероральное введение железа.Этот метод введения особенно полезен Свидетелям Иеговы, которые отказываются от всех препаратов крови.
После его одобрения для использования у гемодиализных пациентов в 2002 году, FG (и позже IS) быстро заменили декстран железа в качестве предпочтительного препарата железа для внутривенного введения. Были введены миллионы доз, причем НЯ почти всегда были незначительными реакциями на инфузию. Несмотря на то, что НЯ были зарегистрированы при применении всех в / в утюгов, НЯ с этим составом, когда избегают высоких доз, встречаются редко. 15,16 Введение FG снижает потребность в ЭСС у гемодиализных пациентов с повышенным уровнем ферритина, 43 улучшает анемию без ЭСС у железодефицитных пациентов с ХБП, 44 и корректирует анемию у диализных пациентов с высоким уровнем ферритина. сывороточный ферритин и низкое насыщение трансферрина. 45
Хотя максимальная рекомендуемая доза ФГ составляет 125 мг в виде болюса или короткой инфузии, сообщается, что 250 мг безопасно вводятся в течение 1 часа. 46 Более высокие дозы связаны с вазоактивными реакциями, включающими гипотензию, острое начало диареи и отек конечностей, поэтому их следует избегать. Если не вводить дозы, превышающие рекомендуемые, значительные НЯ с ФГ возникают нечасто.
На сегодняшний день самый большой опыт в опубликованной литературе связан с этой формулировкой. В 1994 г. Aronoff et al., , 47, , продемонстрировали безопасность заместительных и поддерживающих схем ИИ у пациентов, находящихся на гемодиализе.Эти данные были подтверждены Charytan et al., 48 , которые показали безопасность ИИ у гемодиализных пациентов, в том числе у пациентов с непереносимостью других парентеральных препаратов железа. В рандомизированном контролируемом исследовании по сравнению внутривенного введения ИИ с пероральным приемом железа у пациентов с анемией и недиализно-зависимой ХБП Van Wyck et al. , 49, показали, что ИС в дозе 1000 мг в разделенных дозах более эффективен, чем пероральный прием железа. В исследовании пациентов с анемией и ХБП с отсутствием гемосидерина костного мозга и высоким уровнем ферритина в сыворотке, Gotloib et al 50 показали, что внутривенное введение ИС с ЭСС и без них привело к повышению уровня гемоглобина и достижению целевого гемоглобина 12 г / г. дл.
Было показано, чтоIS улучшает ответ гемоглобина при лечении анемии у пациентов с ВЗК, когда пероральное железо потенциально опасно для кишечного эпителия. 51,52 FG, LMW ID и FC также оказались полезными для этих пациентов. 53 В обзоре эффективности и безопасности внутривенного введения ИИ в качестве альтернативы переливанию крови в хирургии авторы пришли к выводу, что внутривенное введение ИС было безопасным, ускоряло выздоровление от анемии и уменьшало потребность в переливании крови. 54 Внутривенное введение ИС было показано в обсервационных исследованиях для снижения потребности в переливании крови при замене суставов, кардиохирургии и хирургии колоректального рака. Сводка данных по внутривенному введению железа в хирургии представлена в таблице 5. Эти данные рассмотрены в недавней публикации. 55
Таблица 5.Исследования внутривенного введения железа в хирургии
IS можно безопасно вводить в виде 2-минутного болюса или в виде короткой инфузии в дозах до 300 мг, но более высокие дозы запрещены. 56 .При введении более высоких доз, даже при продолжительности инфузии в течение 2 часов, наблюдаются гипотония, тошнота и боли в пояснице. 57 Если не вводятся дозы, превышающие рекомендуемые, значительные НЯ возникают нечасто.
Эта форма внутривенного введения железа была первым из новых агентов, одобренных для более быстрого введения больших доз. ФК можно вводить в виде инфузии по 500-1500 мг за 15 минут; однако в настоящее время утверждены только дозы до 1000 мг.Тестовая доза не требуется. FC одобрен в Европе, Азии и Австралии.
В январе 2010 г. Anker et al. 58 опубликовали свой опыт применения болюсов FC 200 мг у пациентов с фракцией выброса левого желудочка 45% или меньше. Они пришли к выводу, что лечение IV ФК у пациентов с хронической сердечной недостаточностью и дефицитом железа, с анемией или без нее, улучшает симптомы, функциональные возможности и качество жизни с приемлемым профилем побочных эффектов.
В проспективном исследовании 200 пациентов с ВЗК, получавших ФК в виде инфузии 1000 мг за 15 минут, Кульнигг и др. 59 пришли к выводу, что ФК безопасен и не уступает пероральному сульфату железа при лечении пациентов с дефицитом железа, что привело к быстрое повышение гемоглобина и пополнение запасов железа. В недавно опубликованном клиническом исследовании Covic et al. 60 изучали 163 гемодиализных пациентов с ЖДА, которые получали болюсы FC от 100 до 200 мг в день диализа, и пришли к выводу, что препарат хорошо переносится и эффективен в коррекции гемоглобина. уровни и склады железа.
В исследовании 477 женщин с ЖДА, рандомизированных для приема ≤1000 мг ФК в течение 15 минут или перорального приема сульфата железа, Ван Вик и др. 61 показали улучшение реакции гемоглобина, физической функции и утомляемости по сравнению с пероральным приемом железа. Существенной токсичности не наблюдалось.
Однако в феврале 2008 г. FDA не одобрило FC для распространения в США из-за необъяснимой гипофосфатемии после инфузии пациентам с ХБП, увеличения числа неблагоприятных сердечных событий и несбалансированности показателей смертности в группе лечения по сравнению с с рычагом управления.Ожидаются результаты текущих и достаточно мощных испытаний безопасности этого агента.
Этот состав был одобрен FDA в июне 2009 г. для заместительной терапии железом у пациентов с ЖДА и ХБП. Тестовая доза не требуется. Этот продукт уникален тем, что его можно вводить в виде относительно большой дозы (510 мг, эксклюзивный размер флакона) менее чем за 20 секунд. Нет данных о более высоких дозах. Опубликованный профиль безопасности соответствует LMW ID, FG и IS.
В исследовании 230 пациентов, из которых 116 получали ферумокситол и 114 перорально железо, Provenzano и др. Пришли к выводу, что две быстрые (17 секунд) инъекции 510 мг ферумокситола, введенные в течение 1 недели, привели к большему увеличению гемоглобина по сравнению с пероральное железо с сопоставимой переносимостью. Никаких значительных НЯ не наблюдалось. 62 В перекрестном исследовании с участием 750 пациентов с ЖДА и ХБП, не находящихся на диализе, Singh et al. 63 вводили 510 мг ферумокситола или плацебо за 17 секунд дважды за 1 неделю 711 пациентам или плацебо 713 пациентам.Одно значимое НЯ (анафилаксия) наблюдалось в группе лечения у пациента с историей множественной лекарственной аллергии. Пациент выздоровел. Авторы пришли к выводу, что ферумокситол хорошо переносится и имеет профиль безопасности, аналогичный плацебо, у пациентов с анемией и ХБП.
Ферумокситол может способствовать замещению железа, если профиль безопасности остается неизменным в других группах пациентов. В настоящее время он не одобрен в Европе.Мы с нетерпением ждем дополнительных данных о безопасности и дозировке этого нового агента на постмаркетинговом рынке у пациентов с анемией, вызванной ХБП, а также в других клинических условиях.
Нет никаких проспективных данных об отдаленных результатах при использовании внутривенного железа. Самый большой опыт использования внутривенного железа получен в нефрологическом сообществе, при этом большая часть опубликованных данных поступает из исследований на диализных пациентах. Наиболее всесторонняя работа по этому вопросу была проделана Kalantar-Zadeh et al, 65 , которые исследовали зависящие от времени ассоциации между внутривенным введением железа и смертностью от всех причин и сердечно-сосудистой смертности у пациентов на поддерживающем гемодиализе.Были проанализированы проспективно собранные данные (2001–2003 гг.) Из исторической когорты из более чем 58 000 пациентов, представляющих практически все диализные клиники DaVita в США. Исследователи сообщили, что после обширной зависящей от времени и многовариантной корректировки для набора случаев, введенных внутривенных доз железа и эритропоэтина и суррогатов нутритивного статуса и воспаления самый низкий риск смерти от всех причин и сердечно-сосудистых заболеваний был связан со следующими параметрами железа: сывороткой уровни ферритина от 200 до 1200 нг / мл, насыщение трансферрина от 30% до 50% и уровни сывороточного железа от 60 до 120 мкг / мл.Они также обнаружили, что по сравнению с теми, кто не получал внутривенное введение железа, поддерживающие дозы до 400 мг в месяц были связаны с улучшением выживаемости. 65
В ретроспективном анализе смертности от всех причин в когорте из 32 566 пациентов, находящихся на гемодиализе с 1996 г. по середину 1998 г., Feldman et al. 66 не обнаружили отрицательного влияния на 2-летнюю выживаемость при дозах до 1000 мг в течение 6 лет. -месячный период, но повышенная смертность при дозах от 1000 до 1800 мг.Однако, используя многомерные модели для учета изменяющихся во времени показателей заболеваемости и введения железа, авторы не обнаружили статистически значимой связи между любым уровнем введения железа и смертностью. В результате этого наблюдения они пришли к выводу, что ранее наблюдаемые связи между введением железа и более высокой смертностью могут быть искажены, и предоставили осторожную поддержку безопасности разумного введения кумулятивных доз железа> 1000 мг в течение 6-месячного периода, если это необходимо для поддержания целевые гемоглобины у пациентов, находящихся на гемодиализе
Beguin et al. 67 опубликовали единственное онкологическое исследование, посвященное изучению отдаленных результатов после внутривенного введения железа.Авторы исследовали 127 пациентов с трансплантацией аутологичных стволовых клеток с анемией и лимфопролиферативными злокачественными новообразованиями, получавших дарбепоэтин с внутривенным введением железа или без него. На сроке> 1500 дней аналогичные результаты наблюдались для обеих групп. 67
Железо является прооксидантом, важным питательным веществом для многих бактерий, и у лабораторных животных было показано, что оно обостряет сепсис. В то время как исследования на людях показали временное увеличение маркеров окислительного стресса при применении всех форм железа, вводимого внутривенно, о каких-либо клинических отрицательных результатах, связанных с увеличением этих маркеров, никогда не сообщалось. 68
Восполнение запасов железа пероральным приемом железа связано с неблагоприятными исходами при некоторых инфекциях. В исследовании 137 сомалийских кочевников с дефицитом железа, 67 из которых получали плацебо, а 71 — пероральное железо, Мюррей и др. 69 отметили семь эпизодов инфекции в группе плацебо и 36 в группе, получавшей железо. Хотя внутривенное введение железа теоретически считается причиной увеличения числа инфекций. 70,71 Hoen et al 72 проспективно обследовали 985 диализных пациентов, получающих внутривенное введение железа в рамках схемы диализ-ассоциированной анемии, и обнаружили, что, хотя центральные венозные катетеры, история бактериемии, артериовенозные трансплантаты и иммуносупрессия были связаны с повышенного риска инфекций, уровня ферритина и общей дозы в / в введения железа не было. Кроме того, в исследовании Anker у пациентов с сердечной недостаточностью (группа относительно высокого риска), в том числе примерно 40% с ХБП в 6-месячном плацебо-контролируемом исследовании, отмечалось улучшение качества жизни и функционального статуса без увеличения числа инфекций. . 58 Текущее состояние литературы, касающейся приема железа и риска инфицирования, не позволяет делать однозначных выводов. Риск, если таковой имеется, внутривенного введения железа, вызывающего инфекцию и связанную с этим заболеваемость и смертность, вероятно, очень мал. Клиницисты должны сопоставить эту информацию с хорошо известными преимуществами эффективного лечения железом и коррекции анемии, включая снижение заболеваемости и улучшение качества жизни.
Учитывая продемонстрированную безопасность и эффективность внутривенного введения железа при широком спектре заболеваний, связанных с ЖДА, нынешняя парадигма, согласно которой пероральное железо является терапией первой линии, должна быть пересмотрена.Кроме того, внутривенное введение железа является предпочтительным методом замещения железа в качестве дополнения к ЭСС у пациентов с диализной и недиализно-ассоциированной ХБП, у пациентов с ВЗК и у онкологических пациентов, получающих ЭСС по поводу анемии, вызванной химиотерапией. Внутривенное введение железа можно вводить в виде нескольких болюсов IS, FG, FC (только для Европы), II (только для Европы) или LMW ID до тех пор, пока не будет достигнута желаемая доза: две быстрые инъекции ферумокситола (только для США) от 2 до 3 дней. отдельно или TDI LMW ID (обычно 1 грамм) примерно за 1 час (одобрено только в Европе).В Европе ТДИ FC (1000 мг) и II (20 мг / кг) разрешены для приема за 15 минут. Премедикации следует избегать, если в анамнезе нет гиперчувствительности. В нашей практике мы обычно вводим 1000 мг LMW ID в 250 мл физиологического раствора в течение 1 часа без премедикации. Пробная доза от 10 до 25 мг вводится в течение 3-5 минут. Если острой реакции не наблюдается, оставшийся раствор настаивают в течение 1 часа. Тем, у кого в анамнезе была лекарственная аллергия, аллергический диатез или воспалительный артрит в анамнезе, когда было показано, что как парентеральное, так и пероральное железо усугубляет симптомы, перед тестовой дозой вводят 125 мг метилпреднизолона.
Хотя безопасность внутривенного введения железа была продемонстрирована в исследованиях с участием тысяч пациентов с многочисленными клиническими проявлениями, связанными с дефицитом железа, проблемы безопасности все еще существуют. Все препараты железа могут вызвать гиперчувствительность или другие реакции, некоторые из которых будут тяжелыми. За исключением ретроспективных обзоров спонтанно сообщаемых событий, сравнительная частота реакций остается неизвестной. Однако до тех пор, пока реальная частота НЯ не будет известна более точно, можно рассмотреть возможность отказа от HMW ID на основании преобладающих опубликованных данных.Общепринятое определение НЯ должно быть продвинуто и принято FDA, чтобы можно было рассчитать типы событий. Отчетность в центральное агентство должна быть обязательной, а данные должны регулярно проверяться. Пока не станут доступны надежные сравнительные данные, один продукт не может и не должен считаться лучшим с точки зрения профиля безопасности. Как гематологи, мы должны знакомиться с частотой, клиническим характером и значением реакций на существующие препараты. Как специалисты по заболеваниям крови, мы обязаны лучше познакомиться с этой важной терапией наиболее распространенной анемии, с которой мы сталкиваемся.
Клиническое применение железа для внутривенного введения: введение, эффективность и безопасность | Гематология, Образовательная программа ASH
В этом разделе рассматриваются история, фармакология, введение, эффективность и токсичность внутривенного железа. Внутривенное введение железа дает преимущества перед пероральным приемом железа для лечения железодефицитной анемии при широком диапазоне болезненных состояний, связанных с абсолютным и функциональным дефицитом железа.Однако остаются опасения по поводу острых профилей безопасности доступных препаратов и возможности долгосрочной токсичности при их повторном применении. Доступны семь препаратов железа для внутривенного введения. Существует множество заблуждений относительно относительной токсичности различных составов. Обсуждаются сходства и различия. Восполнение запасов железа связано с неблагоприятными исходами при инфекциях. Рассматривается взаимосвязь, если таковая имеется, между внутривенным введением железа и инфекциями.Выделены потенциальные преимущества инфузии общей дозы (TDI), полного восстановления за один прием. Представлена новая парадигма заместительной терапии железом при железодефицитной анемии.
Железо используется для лечения анемии более 300 лет. В обзоре лечения хлороза в 1893 году Стокман приписывает первое применение перорального железа Сиденхему в 1681 году. что пероральная терапия железом стала стандартным лечением того, что сейчас известно как железодефицитная анемия (ЖДА).Однако пероральный прием железа не является идеальным лечением, поскольку желудочно-кишечная токсичность встречается у> 35–59% пациентов, 3,4 и длительный курс необходим для устранения анемии и пополнения запасов. Несоблюдение предписанного курса перорального приема железа является обычным явлением, и даже у приверженных ему пациентов плохая кишечная абсорбция не может компенсировать потребность в железе при наличии продолжающихся кровопотерь.
Хотя внутривенное введение железа способно обойти все эти проблемы, сохраняются опасения по поводу острых профилей безопасности доступных продуктов и потенциального долгосрочного вреда от повторного введения железа.Хотя любое внутривенное введение железа может вызывать острые тяжелые реакции, частота и тяжесть реакций ниже, чем могут оценить врачи, 5 , а дозы, обычно вводимые в клинической практике, недостаточны для того, чтобы привести к повреждению паренхиматозного органа. Точно так же опасения по поводу внутривенной терапии железом, потенциально повышающей риск инфекций и сердечно-сосудистых заболеваний, не были подтверждены в проспективных исследованиях или клинических испытаниях и остаются в значительной степени недоказанными гипотезами. В этой статье будут рассмотрены способы применения, показания и профили безопасности доступных внутривенных препаратов железа в развитых странах.Тем не менее, целесообразно проанализировать историю инъекционного железа, чтобы лучше понять нынешнее нежелание применять рутинную терапию препаратами железа внутривенно.
Парентеральное железо впервые было введено в начале 20-х годов -х годов века 6 (Рисунок 1). Растворы гидроксида железа вводили подкожно и внутримышечно пациентам с гипохромной анемией, и наблюдаемые приросты гемоглобина были пропорциональны количеству введенного железа.Отсутствие углеводной оболочки привело к немедленному высвобождению железа и серьезным токсическим реакциям, которые привели к тому, что использование этой терапии было рекомендовано только в чрезвычайных обстоятельствах.
Рисунок 1.
Всего на миллион доз 100 мг сообщалось о серьезных побочных эффектах. Изменено с разрешения Chertow et al. 19
Рис. 1.
Всего зарегистрированных серьезных нежелательных явлений на миллион доз 100 мг.Изменено с разрешения Chertow et al. 19
В 1947 году Nissim 7 ввел сахарид железа для внутривенной инъекции и пришел к выводу, что эта форма железа более безопасна и больше подходит для парентерального введения. В 1954 году Бэрд и Подмор 8 представили Имферон (высокомолекулярный декстран железа [HMW ID], Fisons plc, Homes Chapel England, Ипсвич, Великобритания; продаваемый Merrill Pharmaceuticals в США) для внутримышечного (IM) и внутривенного применения. .Декстран покрывает ядро оксида железа, уменьшая высвобождение свободного железа во время инфузии, что объясняет низкую частоту побочных реакций. Биодоступность железа происходит за счет поглощения частиц декстрана железа ретикулоэндотелиальной системой с последующей деградацией. Наблюдались быстрые гематологические реакции с низкой частотой побочных эффектов. Однако у пациентов могут развиваться или иметься предварительно сформированные антидекстрановые антитела, и, в частности, более крупные молекулы декстрана могут вызывать анафилаксию, как описано при введении HMW ID.Несмотря на то, что эти реакции относительно редки, эти реакции побуждали избегать парентерального введения железа, за исключением случаев, когда наблюдались экстремальные клинические условия и другие варианты недоступны. HMW ID был единственным препаратом для парентерального введения железа, доступным до 1990-х годов.
Хотя опубликованные в мировой литературе статьи 9,10 подтверждают полезность внутривенного введения железа в лечении ЖДА, только в 1980 г. появилось первое проспективное исследование клинического применения внутривенного железа в США. 11 Четыреста семьдесят один пациент с ЖДА получали внутривенное введение железа в различных дозах. Все пациенты ответили на лечение, но у трех из них были выявлены «анафилактоидные» реакции с симптомами и признаками, включая остановку дыхания, гипотензию, пурпуру, цианоз, одышку, обморок, хрипы и крапивницу. В сериале не было смертей. Авторы пришли к выводу, что внутривенное введение железа следует применять для тех состояний, при которых нельзя использовать пероральное железо. HMW ID оставался в фармакопее и был второстепенным продуктом до появления в 1989 году рекомбинантного человеческого эритропоэтина (эпоэтина альфа), первого агента, стимулирующего эритропоэз (ESA).
Эпоэтин впервые был использован для лечения анемии у пациентов, находящихся на диализе почек. Хотя большинство пациентов ответили на эпоэтин, некоторые — нет. 12 Было найдено несколько объяснений субоптимального ответа, но обычно было показано, что неудача связана с абсолютным или функциональным дефицитом железа, поскольку введение железа внутривенно восстанавливает ответную реакцию. 13 Функциональный дефицит железа (железо-ограниченный эритропоэз) рассматривается в другом месте этого занятия.Впоследствии парентеральная терапия железом стала важным дополнением к получению и поддержанию адекватных уровней гемоглобина у пациентов с терминальной стадией почечной недостаточности и другими болезненными состояниями.
Несмотря на то, что это было относительно редко, наблюдались тяжелые реакции острой гиперчувствительности на HMW ID. Предупреждение о черном ящике было помещено во вкладыш в упаковку, и требовалась пробная доза. В 1991 году зараженная партия привела к отзыву продукта во всем мире.По счастливой случайности, в то же время низкомолекулярный декстран железа (LMW ID) (INFeD, Schein Pharmaceuticals, теперь Watson Pharmaceuticals, Inc, Морристаун, Нью-Джерси) завершал регистрационные испытания в Соединенных Штатах и выпущен для клинического использования в 1992 году. blueprinting, Фисонс определил, что этот продукт содержал декстран с более низкой молекулярной массой и меньшей вариабельностью среди боковых цепей. Первоначальная форма HMW ID была снята с американского рынка в 1991 году, а его производство прекратилось в 1992 году.Использование ESA и LMW ID было обычным явлением у пациентов на диализе и еще больше увеличилось в 1997 году с принятием руководящих принципов по клинической практике, продвигающих рутинное использование обоих агентов для достижения целевого уровня гемоглобина от 11 до 12 г / дл.
В 1996 году еще один HMW ID (Dexferrum, American Regent Pharmaceuticals, Ширли, Нью-Йорк) был одобрен Управлением по контролю за продуктами и лекарствами (FDA), хотя LMW ID сохранил большую часть рынка диализа.Оба декстрана железа требовали тестовой дозы и имели предупреждения о черном ящике.
В 1999 году глюконат железа (FG) (Ferrlecit, Schein, затем Watson Pharmaceuticals, теперь Sanofi-Aventis), после того как он был доступен в Европе в течение многих лет, был представлен на американском рынке как более безопасная альтернатива декстрану железа. Исторический обзор использования ФГ в Европе и декстранов железа в США не выявил смертей, связанных с ФГ, но по крайней мере 31 смерть от декстрана железа, и пришел к выводу, что ФГ более безопасен из-за отсутствия декстрановой оболочки. 14 Двойное слепое плацебо-контролируемое перекрестное исследование однократного введения ФГ у 2338 гемодиализных пациентов выявило только одну серьезную аллергическую реакцию без летального исхода. 15,16 Они также сообщили, что у пациентов, ранее чувствительных к декстрану железа, реакции на ФГ были необычными, но также в 7 раз чаще, чем у пациентов без чувствительности к железу. 16 Практически все 2338 пациентов ранее получали декстраны железа. В ноябре 2000 г. сахароза железа (IS) (Venofer, America Regent Pharmaceuticals) была одобрена в США.Он также давно используется в Европе, не имеет декстранового покрытия и, как сообщается, имеет профиль безопасности, аналогичный FG. 17 Предупреждения о черном ящике не появляются на вкладышах в упаковке FG или IS, и тестовая доза не рекомендуется. Впоследствии FG и IS в значительной степени заменили использование декстранов железа у диализных пациентов в США.
В ретроспективном обзоре более 30 миллионов доз железа внутривенно Chertow et al 18 показали, что воздействие HMW ID было связано со значительно более высоким риском нежелательных явлений (AE) по сравнению с LMW ID (Рисунок 2 18 ).В ходе последующего анализа авторы пришли к выводу, что НЯ были относительно низкими в целом, с более низкими показателями среди LMW ID, FG и IS. 19 Однако два небольших проспективных исследования и один метаанализ, сравнивающие эффективность и безопасность LMW ID и IS, не показали никакой разницы. 20–22
Рисунок 2.
Всего сообщалось о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
Рисунок 2.
Всего сообщили о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
За последние 18 месяцев было выпущено три новых соединения железа для внутривенного введения для лечения пациентов с анемией или хронической болезнью почек (ХБП). Два в настоящее время одобрены для использования в Европе (карбоксимальтоза железа [FC], Ferrinject, ViforPharma, Санкт-Галлен, Швейцария, и изомальтозид железа [II], Monofer, Pharmacosmos, Holbaek, Дания) и один в США (ферумокситол, Feraheme , AMAG Pharmaceuticals, Inc, Лексингтон, Массачусетс).Все три соединения обещают предложить полную замещающую дозу железа за 15 минут или меньше.
Самые ранние препараты железа были связаны с неприемлемой острой токсичностью в результате высвобождения биоактивного свободного железа. Сегодня все препараты железа для внутривенного введения представляют собой комплексы или коллоиды железо-углевод, основанные на небольших сфероидальных железо-углеводных частицах. Каждая частица состоит из ядра, сделанного из оксигидроксигелевого железа, окруженного оболочкой из углеводов, которая стабилизирует гель, замедляет высвобождение железа и сохраняет полученные частицы в коллоидной суспензии. 23 Все одобренные в настоящее время утюги для внутривенного введения имеют такую структуру, но отличаются друг от друга размером сердцевины, а также характером и плотностью окружающего углевода. Характеристики семи соединений железа показаны в таблице 1. Сильные стороны комплекса железа влияют на фармакокинетические характеристики утюгов для внутривенного введения, имеющих отношение к терапевтическому применению. Скорость высвобождения биоактивного железа обратно пропорциональна силе комплекса — чем сильнее комплекс, тем медленнее высвобождение железа. 24 Токсикологическое значение зависимости размера комплекса от времени высвобождения заключается в том, что более сильные комплексы имеют более низкий потенциал насыщения трансферрина с последующей токсичностью свободного железа по сравнению с более слабыми комплексами. 25
После инъекции все разные препараты разделяют схожую метаболическую судьбу. Комплексы железо-углевод смешиваются с плазмой и фагоцитируются в ретикулоэндотелиальной системе, при этом углеводная оболочка разрушается, а железо хранится в виде ферритина или транспортируется из клетки с помощью единственного известного белка, экспортирующего железо, ферропортина.Экспортируемое железо связывается с внеклеточным связывающим белком, трансферрином, который доставляет железо к рецепторам трансферрина на поверхности предшественников эритроидов, поддерживая гемоглобинизацию.
IM-маршрут считается более безопасной альтернативой IV. Никакие опубликованные данные не подтверждают этот вывод, поскольку частота нежелательных явлений схожа при обоих способах введения. Кроме того, внутримышечные инъекции болезненны, вызывают необратимое изменение цвета кожи и связаны с ягодичными саркомами. 26,27 Следует отказаться от внутримышечных инъекций. 5
Введение любого из доступных препаратов может быть связано с острой стесненностью в груди и спине без сопутствующей гипотензии, хрипов, стридора или периорбитального отека. В случае декстранов железа это обычно наблюдается после введения тестовой дозы. 5 Это нечастое событие редко повторяется при повторном вызове. Эти явления более вероятны у пациентов с аллергическим диатезом. 28 Важно не слишком остро реагировать на эти незначительные НЯ. У пациентов с повышенным риском развития НЯ предварительное лечение кортикостероидами может быть полезным. 29
В обзоре терапии LMW ID у пациентов с дефицитом железа и нормальной функцией почек, у которых была непереносимость перорального приема железа, Barton et al. 3 предположили, что предварительная обработка антигистаминными препаратами была ответственна за большинство предполагаемых реакций на декстран железа.Поскольку нет опубликованных доказательств того, что антигистаминные препараты полезны для уменьшения реакций острой гиперчувствительности к внутривенному введению железа, рекомендуется не проводить предварительное лечение в плановом порядке.
В нескольких публикациях упоминается о проблемах безопасности при использовании этого препарата. 18,19,30–35 В течение короткого периода в 1997 году, когда LMW ID стал недоступен, HMW ID был единственным доступным составом.За этот период количество спонтанных сообщений в FDA о побочных эффектах, связанных с внутривенным введением железа, увеличилось в 11 раз (получено автором через Freedom of Information). Многочисленные публикации предостерегали от использования HMW ID. 30 Национальная комплексная онкологическая сеть 31 и журнал медсестер Американского нефрологического общества 32 запретили его использование. Он был удален из формуляров всех больниц Администрации ветеранов США и их протекторатов и недоступен в Европе.Несмотря на это, некоторые больничные фармацевты продолжают рассматривать все продукты с декстраном железа как равные, и многие врачи не осведомлены о различиях между двумя декстранами железа. Центры услуг Medicare и Medicaid в настоящее время присваивают идентичные J-коды для выставления счетов, что еще больше сбивает с толку лиц, назначающих лекарства.
В 2002 г. Мамула и др. 33 опубликовали свой опыт инфузии общей дозы (TDI) у детей с воспалительным заболеванием кишечника и сообщили о 9-кратном увеличении частоты НЯ при HMW ID по сравнению с LMW ID.В обзоре предполагаемых НЯ декстрана железа Fletes et al 34 отметили, что НЯ были в 8,1 раза более вероятны при HMW ID, и пришли к выводу, что серьезные НЯ, связанные с внутривенным введением декстрана железа, были редкими и, по-видимому, зависели от конкретной рецептуры препарата. В / в декстран железа. Сходные результаты наблюдались McCarthy et al. 35 в исследовании, посвященном НЯ у пациентов, находящихся на хроническом гемодиализе, получающих декстран железа внутривенно. В первом исследовании, продемонстрировавшем преимущество внутривенного введения железа в синергизме с ЭСС при лечении анемии, вызванной химиотерапией, 81 из 157 пациентов получали декстран железа в виде болюса или ТДИ.Из 79 пациентов, получивших LMW ID, значительных НЯ не наблюдалось, тогда как у одного из двух пациентов, получивших HMW ID, в течение короткого периода, когда LMW ID не было доступно, развилась анафилаксия. 36 Через четыре месяца после выздоровления этот пациент получил LMW ID без осложнений, как и ранее опубликованный опыт. 32,33 В недавнем исследовании 25 пациентов с синдромом беспокойных ног, получавших 1000 мг HMW ID в течение нескольких часов, Ondo 37 сообщил о высокой скорости улучшения симптомов; однако у двух пациентов развилась анафилаксия.Тем не менее, в публикации ретроспективного анализа 48 059 диализных пациентов, из которых 20 213 не получали железо, из базы данных Gambril US Healthcare, Уолтерс и Ван Вик 38 обнаружили, что пациенты, получившие HMW ID, не более склонны к тяжелой болезни. AE, чем те, кто получил LMW ID.
Недавно FDA выпустило предупреждение, чтобы отметить «различия в химических характеристиках и клинических эффектах препаратов декстрана железа, чтобы свести к минимуму потенциальную путаницу между доступными продуктами в формуляре».Увеличение числа зарегистрированных серьезных НЯ с HMW ID предполагает, что при рассмотрении этого препарата следует проявлять осторожность.
Учитывая текущее состояние знаний, это предпочтительный состав декстрана железа. В отличие от солей железа, FG и IS, этот состав можно вводить в виде болюса внутривенно или TDI (одобренный метод введения в Европе, но не в Соединенных Штатах). Eschbach et al., , 12, , были первыми, кто продемонстрировал преимущество декстрана железа в усилении ответа на эритропоэтин у пациентов с анемией при ХБП, находящихся на диализе.Впоследствии было показано, что заметное снижение дозировки ESA может быть достигнуто при добавлении декстрана железа. 39
После выпуска LMW ID в 1991 г. для лечения диализной анемии, он стал стандартом для дополнения ESA. Первоначальный обзор безопасности был опубликован в 1996 году. Авторы пришли к выводу, что НЯ с LMW ID были редкими, и только история аллергии предсказывала очень редкие НЯ. 28 Кроме того, TDI особенно полезен при оказании помощи пациентам, находящимся на поддерживающем перитонеальном диализе или гемодиализе на дому, которым в противном случае потребовалось бы частое посещение амбулаторных учреждений для завершения терапии. 40 Этот метод введения пациентам, находящимся на гемодиализе, сравнивался с болюсным в многоцентровом рандомизированном открытом исследовании и показал его одинаковую безопасность и эффективность при значительной экономии средств. 41
Недавно мы представили данные о 226 инфузиях 1 грамма LMW ID в течение 1 часа у 187 последовательных, неотобранных пациентов с дефицитом железа и без недавнего внутривенного введения железа (Таблица 2).Только два пациента получили премедикацию — метилпреднизолон — из-за аллергического анамнеза. Существенной токсичности не наблюдалось (таблица 3). Все пациенты, у которых развилась крапивница, кроме одного, получили полную дозу. 42
Таблица 2.диагнозов у 187 пациентов, получавших 1 грамм внутривенного LMWID в течение 1 часа lang = FR
Таблица 3.Нежелательные явления после 1 грамма внутривенного введения LMW ID в течение 1 часа
Гипофосфатемия (сывороточный фосфат <2 мг / дл) наблюдалась после введения IS и FC. Мы исследовали до- и постинфузионные уровни фосфатов после LMW ID и не обнаружили изменений при медиане наблюдения в течение 2 недель (среднее изменение от исходного уровня фосфатов составило 0,0 мг / дл (95% ДИ, от -0,1 до 0,2; P = 0,537) (Таблица 4).
Таблица 4.Уровни фосфатов до и после инфузии в соответствии с LMW ID
Пациентам с раком или заболеванием почек, требующим еженедельных или более частых посещений, короткие инфузии любого из доступных препаратов, за исключением, возможно, HMW ID, могут быть сделаны без значительного риска. Однако, если большие дозы железа вводятся внутривенно в амбулаторных условиях, предпочтительным методом является TDI. Этот метод особенно полезен в следующих клинических ситуациях: домашний перитонеальный диализ или гемодиализ, дефицит железа из-за беременности, менометроррагия, хирургическая кровопотеря, операция обходного желудочного анастомоза, наследственные геморрагические телеангиэктазии (Osler-Weber-Rendu), ангиодисплазия, вызванная другими причинами, воспалительные процессы. заболевания кишечника (ВЗК), синдромы мальабсорбции и у тех пациентов с неосложненным дефицитом железа, которые не соблюдают или не переносят пероральное введение железа.Этот метод введения особенно полезен Свидетелям Иеговы, которые отказываются от всех препаратов крови.
После его одобрения для использования у гемодиализных пациентов в 2002 году, FG (и позже IS) быстро заменили декстран железа в качестве предпочтительного препарата железа для внутривенного введения. Были введены миллионы доз, причем НЯ почти всегда были незначительными реакциями на инфузию. Несмотря на то, что НЯ были зарегистрированы при применении всех в / в утюгов, НЯ с этим составом, когда избегают высоких доз, встречаются редко. 15,16 Введение FG снижает потребность в ЭСС у гемодиализных пациентов с повышенным уровнем ферритина, 43 улучшает анемию без ЭСС у железодефицитных пациентов с ХБП, 44 и корректирует анемию у диализных пациентов с высоким уровнем ферритина. сывороточный ферритин и низкое насыщение трансферрина. 45
Хотя максимальная рекомендуемая доза ФГ составляет 125 мг в виде болюса или короткой инфузии, сообщается, что 250 мг безопасно вводятся в течение 1 часа. 46 Более высокие дозы связаны с вазоактивными реакциями, включающими гипотензию, острое начало диареи и отек конечностей, поэтому их следует избегать. Если не вводить дозы, превышающие рекомендуемые, значительные НЯ с ФГ возникают нечасто.
На сегодняшний день самый большой опыт в опубликованной литературе связан с этой формулировкой. В 1994 г. Aronoff et al., , 47, , продемонстрировали безопасность заместительных и поддерживающих схем ИИ у пациентов, находящихся на гемодиализе.Эти данные были подтверждены Charytan et al., 48 , которые показали безопасность ИИ у гемодиализных пациентов, в том числе у пациентов с непереносимостью других парентеральных препаратов железа. В рандомизированном контролируемом исследовании по сравнению внутривенного введения ИИ с пероральным приемом железа у пациентов с анемией и недиализно-зависимой ХБП Van Wyck et al. , 49, показали, что ИС в дозе 1000 мг в разделенных дозах более эффективен, чем пероральный прием железа. В исследовании пациентов с анемией и ХБП с отсутствием гемосидерина костного мозга и высоким уровнем ферритина в сыворотке, Gotloib et al 50 показали, что внутривенное введение ИС с ЭСС и без них привело к повышению уровня гемоглобина и достижению целевого гемоглобина 12 г / г. дл.
Было показано, чтоIS улучшает ответ гемоглобина при лечении анемии у пациентов с ВЗК, когда пероральное железо потенциально опасно для кишечного эпителия. 51,52 FG, LMW ID и FC также оказались полезными для этих пациентов. 53 В обзоре эффективности и безопасности внутривенного введения ИИ в качестве альтернативы переливанию крови в хирургии авторы пришли к выводу, что внутривенное введение ИС было безопасным, ускоряло выздоровление от анемии и уменьшало потребность в переливании крови. 54 Внутривенное введение ИС было показано в обсервационных исследованиях для снижения потребности в переливании крови при замене суставов, кардиохирургии и хирургии колоректального рака. Сводка данных по внутривенному введению железа в хирургии представлена в таблице 5. Эти данные рассмотрены в недавней публикации. 55
Таблица 5.Исследования внутривенного введения железа в хирургии
IS можно безопасно вводить в виде 2-минутного болюса или в виде короткой инфузии в дозах до 300 мг, но более высокие дозы запрещены. 56 .При введении более высоких доз, даже при продолжительности инфузии в течение 2 часов, наблюдаются гипотония, тошнота и боли в пояснице. 57 Если не вводятся дозы, превышающие рекомендуемые, значительные НЯ возникают нечасто.
Эта форма внутривенного введения железа была первым из новых агентов, одобренных для более быстрого введения больших доз. ФК можно вводить в виде инфузии по 500-1500 мг за 15 минут; однако в настоящее время утверждены только дозы до 1000 мг.Тестовая доза не требуется. FC одобрен в Европе, Азии и Австралии.
В январе 2010 г. Anker et al. 58 опубликовали свой опыт применения болюсов FC 200 мг у пациентов с фракцией выброса левого желудочка 45% или меньше. Они пришли к выводу, что лечение IV ФК у пациентов с хронической сердечной недостаточностью и дефицитом железа, с анемией или без нее, улучшает симптомы, функциональные возможности и качество жизни с приемлемым профилем побочных эффектов.
В проспективном исследовании 200 пациентов с ВЗК, получавших ФК в виде инфузии 1000 мг за 15 минут, Кульнигг и др. 59 пришли к выводу, что ФК безопасен и не уступает пероральному сульфату железа при лечении пациентов с дефицитом железа, что привело к быстрое повышение гемоглобина и пополнение запасов железа. В недавно опубликованном клиническом исследовании Covic et al. 60 изучали 163 гемодиализных пациентов с ЖДА, которые получали болюсы FC от 100 до 200 мг в день диализа, и пришли к выводу, что препарат хорошо переносится и эффективен в коррекции гемоглобина. уровни и склады железа.
В исследовании 477 женщин с ЖДА, рандомизированных для приема ≤1000 мг ФК в течение 15 минут или перорального приема сульфата железа, Ван Вик и др. 61 показали улучшение реакции гемоглобина, физической функции и утомляемости по сравнению с пероральным приемом железа. Существенной токсичности не наблюдалось.
Однако в феврале 2008 г. FDA не одобрило FC для распространения в США из-за необъяснимой гипофосфатемии после инфузии пациентам с ХБП, увеличения числа неблагоприятных сердечных событий и несбалансированности показателей смертности в группе лечения по сравнению с с рычагом управления.Ожидаются результаты текущих и достаточно мощных испытаний безопасности этого агента.
Этот состав был одобрен FDA в июне 2009 г. для заместительной терапии железом у пациентов с ЖДА и ХБП. Тестовая доза не требуется. Этот продукт уникален тем, что его можно вводить в виде относительно большой дозы (510 мг, эксклюзивный размер флакона) менее чем за 20 секунд. Нет данных о более высоких дозах. Опубликованный профиль безопасности соответствует LMW ID, FG и IS.
В исследовании 230 пациентов, из которых 116 получали ферумокситол и 114 перорально железо, Provenzano и др. Пришли к выводу, что две быстрые (17 секунд) инъекции 510 мг ферумокситола, введенные в течение 1 недели, привели к большему увеличению гемоглобина по сравнению с пероральное железо с сопоставимой переносимостью. Никаких значительных НЯ не наблюдалось. 62 В перекрестном исследовании с участием 750 пациентов с ЖДА и ХБП, не находящихся на диализе, Singh et al. 63 вводили 510 мг ферумокситола или плацебо за 17 секунд дважды за 1 неделю 711 пациентам или плацебо 713 пациентам.Одно значимое НЯ (анафилаксия) наблюдалось в группе лечения у пациента с историей множественной лекарственной аллергии. Пациент выздоровел. Авторы пришли к выводу, что ферумокситол хорошо переносится и имеет профиль безопасности, аналогичный плацебо, у пациентов с анемией и ХБП.
Ферумокситол может способствовать замещению железа, если профиль безопасности остается неизменным в других группах пациентов. В настоящее время он не одобрен в Европе.Мы с нетерпением ждем дополнительных данных о безопасности и дозировке этого нового агента на постмаркетинговом рынке у пациентов с анемией, вызванной ХБП, а также в других клинических условиях.
Нет никаких проспективных данных об отдаленных результатах при использовании внутривенного железа. Самый большой опыт использования внутривенного железа получен в нефрологическом сообществе, при этом большая часть опубликованных данных поступает из исследований на диализных пациентах. Наиболее всесторонняя работа по этому вопросу была проделана Kalantar-Zadeh et al, 65 , которые исследовали зависящие от времени ассоциации между внутривенным введением железа и смертностью от всех причин и сердечно-сосудистой смертности у пациентов на поддерживающем гемодиализе.Были проанализированы проспективно собранные данные (2001–2003 гг.) Из исторической когорты из более чем 58 000 пациентов, представляющих практически все диализные клиники DaVita в США. Исследователи сообщили, что после обширной зависящей от времени и многовариантной корректировки для набора случаев, введенных внутривенных доз железа и эритропоэтина и суррогатов нутритивного статуса и воспаления самый низкий риск смерти от всех причин и сердечно-сосудистых заболеваний был связан со следующими параметрами железа: сывороткой уровни ферритина от 200 до 1200 нг / мл, насыщение трансферрина от 30% до 50% и уровни сывороточного железа от 60 до 120 мкг / мл.Они также обнаружили, что по сравнению с теми, кто не получал внутривенное введение железа, поддерживающие дозы до 400 мг в месяц были связаны с улучшением выживаемости. 65
В ретроспективном анализе смертности от всех причин в когорте из 32 566 пациентов, находящихся на гемодиализе с 1996 г. по середину 1998 г., Feldman et al. 66 не обнаружили отрицательного влияния на 2-летнюю выживаемость при дозах до 1000 мг в течение 6 лет. -месячный период, но повышенная смертность при дозах от 1000 до 1800 мг.Однако, используя многомерные модели для учета изменяющихся во времени показателей заболеваемости и введения железа, авторы не обнаружили статистически значимой связи между любым уровнем введения железа и смертностью. В результате этого наблюдения они пришли к выводу, что ранее наблюдаемые связи между введением железа и более высокой смертностью могут быть искажены, и предоставили осторожную поддержку безопасности разумного введения кумулятивных доз железа> 1000 мг в течение 6-месячного периода, если это необходимо для поддержания целевые гемоглобины у пациентов, находящихся на гемодиализе
Beguin et al. 67 опубликовали единственное онкологическое исследование, посвященное изучению отдаленных результатов после внутривенного введения железа.Авторы исследовали 127 пациентов с трансплантацией аутологичных стволовых клеток с анемией и лимфопролиферативными злокачественными новообразованиями, получавших дарбепоэтин с внутривенным введением железа или без него. На сроке> 1500 дней аналогичные результаты наблюдались для обеих групп. 67
Железо является прооксидантом, важным питательным веществом для многих бактерий, и у лабораторных животных было показано, что оно обостряет сепсис. В то время как исследования на людях показали временное увеличение маркеров окислительного стресса при применении всех форм железа, вводимого внутривенно, о каких-либо клинических отрицательных результатах, связанных с увеличением этих маркеров, никогда не сообщалось. 68
Восполнение запасов железа пероральным приемом железа связано с неблагоприятными исходами при некоторых инфекциях. В исследовании 137 сомалийских кочевников с дефицитом железа, 67 из которых получали плацебо, а 71 — пероральное железо, Мюррей и др. 69 отметили семь эпизодов инфекции в группе плацебо и 36 в группе, получавшей железо. Хотя внутривенное введение железа теоретически считается причиной увеличения числа инфекций. 70,71 Hoen et al 72 проспективно обследовали 985 диализных пациентов, получающих внутривенное введение железа в рамках схемы диализ-ассоциированной анемии, и обнаружили, что, хотя центральные венозные катетеры, история бактериемии, артериовенозные трансплантаты и иммуносупрессия были связаны с повышенного риска инфекций, уровня ферритина и общей дозы в / в введения железа не было. Кроме того, в исследовании Anker у пациентов с сердечной недостаточностью (группа относительно высокого риска), в том числе примерно 40% с ХБП в 6-месячном плацебо-контролируемом исследовании, отмечалось улучшение качества жизни и функционального статуса без увеличения числа инфекций. . 58 Текущее состояние литературы, касающейся приема железа и риска инфицирования, не позволяет делать однозначных выводов. Риск, если таковой имеется, внутривенного введения железа, вызывающего инфекцию и связанную с этим заболеваемость и смертность, вероятно, очень мал. Клиницисты должны сопоставить эту информацию с хорошо известными преимуществами эффективного лечения железом и коррекции анемии, включая снижение заболеваемости и улучшение качества жизни.
Учитывая продемонстрированную безопасность и эффективность внутривенного введения железа при широком спектре заболеваний, связанных с ЖДА, нынешняя парадигма, согласно которой пероральное железо является терапией первой линии, должна быть пересмотрена.Кроме того, внутривенное введение железа является предпочтительным методом замещения железа в качестве дополнения к ЭСС у пациентов с диализной и недиализно-ассоциированной ХБП, у пациентов с ВЗК и у онкологических пациентов, получающих ЭСС по поводу анемии, вызванной химиотерапией. Внутривенное введение железа можно вводить в виде нескольких болюсов IS, FG, FC (только для Европы), II (только для Европы) или LMW ID до тех пор, пока не будет достигнута желаемая доза: две быстрые инъекции ферумокситола (только для США) от 2 до 3 дней. отдельно или TDI LMW ID (обычно 1 грамм) примерно за 1 час (одобрено только в Европе).В Европе ТДИ FC (1000 мг) и II (20 мг / кг) разрешены для приема за 15 минут. Премедикации следует избегать, если в анамнезе нет гиперчувствительности. В нашей практике мы обычно вводим 1000 мг LMW ID в 250 мл физиологического раствора в течение 1 часа без премедикации. Пробная доза от 10 до 25 мг вводится в течение 3-5 минут. Если острой реакции не наблюдается, оставшийся раствор настаивают в течение 1 часа. Тем, у кого в анамнезе была лекарственная аллергия, аллергический диатез или воспалительный артрит в анамнезе, когда было показано, что как парентеральное, так и пероральное железо усугубляет симптомы, перед тестовой дозой вводят 125 мг метилпреднизолона.
Хотя безопасность внутривенного введения железа была продемонстрирована в исследованиях с участием тысяч пациентов с многочисленными клиническими проявлениями, связанными с дефицитом железа, проблемы безопасности все еще существуют. Все препараты железа могут вызвать гиперчувствительность или другие реакции, некоторые из которых будут тяжелыми. За исключением ретроспективных обзоров спонтанно сообщаемых событий, сравнительная частота реакций остается неизвестной. Однако до тех пор, пока реальная частота НЯ не будет известна более точно, можно рассмотреть возможность отказа от HMW ID на основании преобладающих опубликованных данных.Общепринятое определение НЯ должно быть продвинуто и принято FDA, чтобы можно было рассчитать типы событий. Отчетность в центральное агентство должна быть обязательной, а данные должны регулярно проверяться. Пока не станут доступны надежные сравнительные данные, один продукт не может и не должен считаться лучшим с точки зрения профиля безопасности. Как гематологи, мы должны знакомиться с частотой, клиническим характером и значением реакций на существующие препараты. Как специалисты по заболеваниям крови, мы обязаны лучше познакомиться с этой важной терапией наиболее распространенной анемии, с которой мы сталкиваемся.
Безопасность и эффективность внутривенной терапии железом в снижении потребности в переливании аллогенной крови: систематический обзор и метаанализ рандомизированных клинических исследований
- Эдвард Литтон, штатный клинический старший преподаватель12,
- Цзин Сяо, регистратор1,
- Квок М Хо , штатный специалист доцент 13
- 1 Отделение интенсивной терапии, Королевская больница Перта, Перт, Западная Австралия 6000
- 2 Школа медицины и фармакологии, Университет Западной Австралии, Перт, Западная Австралия , 6009
- 3 Школа здоровья населения, Университет Западной Австралии, Перт, Западная Австралия, 6009
- Для корреспонденции: E Litton, Отделение интенсивной терапии, Королевская больница Перта, Перт, Западная Австралия 6000 изд.litton {at} health.wa.gov.au
Реферат
Цели Оценить эффективность и безопасность внутривенного введения железа, уделяя особое внимание его влиянию на гемоглобин, потребность в переливании крови и риск инфекции.
Дизайн Систематический обзор и метаанализ рандомизированных контролируемых испытаний, посвященных изучению безопасности и эффективности внутривенной терапии железом.
Источники данных Рандомизированные контролируемые испытания из Medline, Embase и Кокрановского центрального реестра контролируемых испытаний с 1966 по июнь 2013 года, без языковых ограничений.
Критерии отбора для отбора исследований Подходящие испытания представляли собой рандомизированные контролируемые испытания внутривенного введения железа в сравнении с отсутствием железа или перорального железа. Перекрестные и наблюдательные исследования были исключены.
Основные критерии оценки Изменение концентрации гемоглобина и риск переливания аллогенных эритроцитов (эффективность) и риск инфекции (безопасность).
Результаты Из 75 испытаний, отвечающих критериям включения, 72 исследования, включающие 10 605 пациентов, предоставили количественные данные о результатах для метаанализа.Внутривенное введение железа было связано с увеличением концентрации гемоглобина (стандартизованная разница средних 6,5 г / л, 95% доверительный интервал от 5,1 г / л до 7,9 г / л) и снижением риска потребности в переливании эритроцитов (отношение рисков 0,74, 95 % доверительный интервал от 0,62 до 0,88), особенно когда внутривенное введение железа использовалось с эритроид-стимулирующими агентами (ЭСС) или у пациентов с более низкой исходной концентрацией ферритина в плазме. Не было значительных взаимодействий между эффективностью внутривенного введения железа и типом или введенной дозой.Однако внутривенное введение железа было связано со значительным повышением риска инфекции (относительный риск 1,33, 95% доверительный интервал от 1,10 до 1,64) по сравнению с пероральным приемом добавок железа или без него. Результаты остались схожими, когда анализировались только испытания высокого качества.
Выводы Внутривенная терапия железом эффективна для повышения концентрации гемоглобина и снижения риска переливания аллогенных эритроцитов и может иметь широкое применение в различных условиях оказания неотложной помощи.Эта потенциальная польза уравновешивается потенциально повышенным риском заражения.
Введение
Железо необходимо для производства красных кровяных телец и является наиболее распространенным дефицитом питания во всем мире, как в развитых, так и в развивающихся странах.1 Хотя переливание аллогенных эритроцитов может спасти жизнь при лечении острой тяжелой кровопотери, существует растущая обеспокоенность. о связанных с ними серьезных нежелательных явлениях, затратах и дефиците.2 Срочно необходимы безопасные и эффективные стратегии по сокращению числа таких переливаний.
Коррекция железодефицитной анемии пероральным приемом железа ограничена желудочно-кишечной абсорбцией и особенно неэффективна при сопутствующих острых или хронических заболеваниях.3 Согласно лабораторным результатам, внутривенная терапия железом играет важную роль в лечении железодефицитной анемии. когда пероральные препараты неэффективны или не могут быть использованы.4 Недавние достижения в понимании метаболизма железа и связи между переливанием аллогенных эритроцитов и неблагоприятными исходами повысили интерес к использованию внутривенного железа для снижения потребности в переливании эритроцитов в различные острые клинические состояния.5 6 Хотя старые препараты железа для внутривенного введения были связаны с риском анафилаксии, новые препараты в значительной степени облегчили эту проблему. 7 Тем не менее, остается неясным, связано ли внутривенное введение железа с другими важными побочными эффектами, в частности с теоретическим риском инфекции. 10
В этом систематическом обзоре и метаанализе, проведенном в соответствии с рекомендациями PRISMA 11, мы оценили безопасность и эффективность внутривенного введения железа, сосредоточив внимание прежде всего на его влиянии на потребность в переливании крови и риск инфекции.
Методы
Критерии отбора
Мы провели поиск рандомизированных контролируемых испытаний, в которых внутривенное введение железа сравнивалось с пероральным приемом железа или отсутствием добавок железа. Исследования были исключены, если они были рандомизированы, но с перекрестным дизайном, наблюдательным, не сообщали об интересующем исходе, не давали данных для сообщения об исходах или не содержали группу или подгруппу, в которых мог бы быть независимый эффект внутривенного введения железа. оценен.Основными представляющими интерес исходами были изменение концентрации гемоглобина и риск переливания (эффективность) и риск инфекции (безопасность). Вторичные результаты, представляющие интерес, включали нежелательные явления и серьезные нежелательные явления, определенные в первичных исследованиях, анафилаксию, смертность, продолжительность пребывания в больнице, стоимость и экономическую эффективность.
Стратегия поиска
Первичный поиск проводился с помощью Medline, Embase и Кокрановского центрального реестра контролируемых исследований для рандомизированных исследований с использованием терминов «железо» и «соединения трехвалентного железа» и «внутривенное введение».«Поиск охватывал период с 1966 года по июнь 2013 года и проводился без языковых ограничений. Мы провели поиск в списках литературы всех включенных исследований, а также в соответствующих обзорных статьях и материалах конференций. К производителям препаратов железа для внутривенного введения также обращались с просьбой предоставить доступ к неопубликованным данным испытаний.
Два автора (EL и JX) независимо друг от друга провели первичный поиск. Когда мы были не уверены в праве на участие или нам потребовались дополнительные данные о конечных точках, мы связались с соответствующим автором, чтобы запросить дополнительную информацию.
Выбор исследования
Два автора (EL и JX) извлекли потенциально релевантные заголовки для полнотекстового обзора и переписали данные из подходящих исследований в заранее заданную проформу. Были исключены исследования, опубликованные только в абстрактной форме. Разногласия по поводу включения в исследование или конечных точек были разрешены третьим автором (KMH).
Анализ данных
Наши основные результаты представляли интерес: эффективность (изменение концентрации гемоглобина и доля пациентов, которым требуется переливание аллогенных эритроцитов) и безопасность (все они вызывают инфекцию).Когда исследования включали группы сравнения перорального железа и отсутствие железа, мы предпочтительно сравнивали внутривенное железо с пероральным железом. Для категориальных данных риск исхода определялся как количество пациентов с событием по сравнению с количеством пациентов с событием и без него. Для непрерывных данных мы использовали среднее значение, стандартное отклонение и номер участника. Данные исследований, соответствующих критериям отбора, были объединены для метаанализа с моделью случайных эффектов. Были включены исследования без явлений в одной из исследуемых групп, поскольку было показано, что это дает более достоверную оценку истинного эффекта лечения.12 Мы рассчитали стандартизированную разницу средних значений и отношение рисков с 95% доверительным интервалом для непрерывных и категориальных исходов, соответственно, и P <0,05 был принят как значимый. Неоднородность оценивалась по статистике I 2 , а I 2 > 40% считалась значительной неоднородностью. Мета-регрессия была предпринята для изучения влияния внутривенной дозы железа и исходного уровня железа на связь между внутривенным введением железа и первичными исходами.
Мы провели анализ чувствительности результатов эффективности (переливание) и безопасности (инфекция), исключив исследования с высоким риском систематической ошибки для одной или нескольких ключевых областей, используя инструмент Кокрановского сотрудничества для оценки риска систематической ошибки.13 Систематическая ошибка публикации оценивалась с помощью воронкообразного графика, на котором отношение шансов для доли перелитых крови отображалось в сравнении со стандартной ошибкой логарифмического отношения шансов. Статистический анализ проводился с помощью Stata (Intercooled Version 11.2, StataCorp, College Station, TX, США) и комплексного метаанализа (версия 2.2.034, Biostat, США, 2006).
Результаты
Первоначальный электронный поиск дал 1815 ссылок. После изучения названий и аннотаций мы отобрали 126 для более детального изучения.В общей сложности 75 исследований, включающих 10 879 участников, соответствовали критериям включения и были включены в систематический обзор (приложение 1) 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 Из включенных исследований 72, в том числе 10 605 участников, предоставили достаточные количественные данные о результатах для включения в первичный метаанализ.На рисунке 1 показаны детали включения исследования⇓.
Рис. 1 Блок-схема выбора исследований по внутривенной терапии железом
Характеристики исследования и оценка достоверности
Количество участников во включенных исследованиях варьировалось от 25 до 507, исследования проводились в широком диапазоне клинических специальностей (почечный n = 19, акушерский n = 19, хирургический n = 11, онкология / гематология n = 11, кардиология n = 4, гастроэнтерология n = 4, другие n = 7).Исходная концентрация гемоглобина (средний диапазон 60-145 г / л) и концентрация ферритина (средний диапазон ферритина 70-7610 нг / мл) у включенных пациентов также варьировались между исследованиями. Наиболее распространенным препаратом железа для внутривенного введения, используемым во включенных исследованиях, была сахароза железа (n = 42), затем следовали глюконат железа (n = 10) и карбоксимальтоза железа (n = 10). Декстрановое железо использовалось в семи исследованиях; в шести дальнейших исследованиях использовались другие препараты железа. Об исходах эффективности, включая изменение концентрации гемоглобина и переливание крови, сообщалось по-разному, как и исходы безопасности, включая инфекцию, смертность, серьезные побочные эффекты и анафилаксию.В Приложении 1 приведены характеристики включенных исследований.
В целом риск систематической ошибки был низким для 18 исследований и высоким для 57 исследований. Общий высокий риск систематической ошибки объясняется тем, что в большинстве исследований не учитывались участники или исследовательский персонал (n = 56).
Авторы девяти исследований предоставили дополнительные данные для включения в систематический обзор. В Приложении 2 представлены результаты оценки валидности.
Количественный синтез данных
Изменение концентрации гемоглобина и доли пациентов, нуждающихся в переливании аллогенных эритроцитов
Всего в 59 исследованиях с 7610 участниками сообщалось об изменении концентрации гемоглобина до и после лечения (приложение 3).Когда данные были объединены, внутривенное введение железа было связано со значительным увеличением стандартизованной средней концентрации гемоглобина (6,5 г / л, 95% доверительный интервал от 5,1 г / л до 7,9 г / л) по сравнению с пероральным приемом железа или отсутствием добавок железа (рис. ). Между исследованиями наблюдалась значительная неоднородность (I 2 = 87,7%, P <0,01).
Рис. 2 Стандартизованная разница средних значений гемоглобина (г / л) у пациентов, получавших внутривенное введение железа, по сравнению с пероральным приемом железа и без него.Веса взяты из анализа случайных эффектов
Всего в 22 исследованиях с участием 3321 участника сообщалось о риске необходимости переливания аллогенных эритроцитов. Внутривенная терапия железом была связана со значительным снижением риска (отношение рисков 0,74, 95% доверительный интервал от 0,62 до 0,88) без значительной гетерогенности (I 2 = 9%, P = 0,3; рис. 3⇓).
Рис. 3 Риск переливания эритроцитов у пациентов, получавших внутривенное железо, по сравнению с пероральным железом и без железа.Веса взяты из анализа случайных эффектов
Существовала потенциальная взаимосвязь между использованием эритроид-стимулирующих агентов и эффектом внутривенной терапии железом, при этом более сильное влияние внутривенного железа на снижение риска потребности в переливании крови при одновременном применении эритроид-стимулирующих агентов (наклон линии регрессии 0,32, 95%). доверительный интервал от 0,02 до 0,63; P = 0,04; рис. 4⇓). Точно так же более низкая исходная концентрация ферритина была связана с большим терапевтическим эффектом в плане снижения соотношения риска необходимости переливания эритроцитов после внутривенной терапии железом (наклон линии регрессии 0.002, 95% доверительный интервал от 0,002 до 0,004; P = 0,04). Однако не было взаимодействия между исходным уровнем насыщения трансферрина и риском необходимости переливания эритроцитов после внутривенной терапии железом.
Рис. 4 Регрессия эритроид-стимулирующего агента по логарифмическому коэффициенту риска переливания эритроцитов. Наклон линии регрессии 0,32, 95% доверительный интервал 0,02–0,63; P = 0,04)
Влияние внутривенного введения железа на все инфекции
После того, как мы исключили три исследования, в которых не было событий как в группе вмешательства, так и в группе сравнения, 45 69 74 24 исследования (n = 4400) представили данные о риске инфекции после внутривенного введения железа по сравнению с пероральным приемом железа или без добавления железа (приложение 3).Внутривенное введение железа было связано со значительным увеличением риска инфекции на 1,33 (95% доверительный интервал от 1,10 до 1,64; рисунок 5⇓) без значительной гетерогенности (I 2 = 22,7%, P = 0,2).
Рис. 5 Риск инфицирования пациентов, получавших внутривенное введение железа. Веса взяты из анализа случайных эффектов
Повышенный риск инфицирования наблюдался в исследованиях, сравнивающих внутривенное введение железа с пероральным и в исследованиях, сравнивающих внутривенное введение железа с отсутствием железа.Не было взаимодействия между исходным уровнем ферритина, насыщением трансферрина, железом на дозу или эритроид-стимулирующими агентами и риском инфекции.
Влияние внутривенной терапии железом на другие конечные точки безопасности
Не было значительных различий в смертности (отношение рисков 1,1, 95% доверительный интервал 0,8–1,5) или серьезных побочных эффектах (1,1, 0,9–1,2) при внутривенной терапии железом в 20 и 19 испытаниях, соответственно. Неблагоприятные события также существенно не различались между внутривенной терапией железом и пероральным приемом железа или отсутствием дополнительных препаратов железа (0.9, от 0,8 до 1,1). Из 32 исследований, посвященных анафилаксии, было восемь случаев у участников, получавших железо внутривенно (n = 2186).
Анализ чувствительности и предвзятость публикации
Исключение исследований с высоким риском систематической ошибки в соответствии с инструментом Кокрановского сотрудничества для оценки риска систематической ошибки13 ограничило метаанализ риска трансфузии только пятью исследованиями (n = 901), 34, 43, 57, 72, 78, и это не повлияло на результаты. Направление связи между внутривенным введением железа и риском необходимости переливания аллогенных эритроцитов, но эта связь больше не была значимой (отношение рисков 0.8, 95% доверительный интервал от 0,6 до 1,1; P = 0,66). Анализ чувствительности к риску инфекции ограничил метаанализ восемью исследованиями20 21 35 39 49 61 72 78 и существенно не изменил направление и величину связи между внутривенной терапией железом и риском инфекции (1,4, 1,0 до 1,8; P = 0,03). В объединенных исследованиях не было доказательств предвзятости публикации в требованиях к сообщению о переливании аллогенных эритроцитов (рис. 6⇓).
Рис. 6 Отношение шансов переливания к стандартной ошибке логарифмического отношения шансов
Обсуждение
В этом большом систематическом обзоре и метаанализе, посвященном оценке безопасности и эффективности у пациентов многих специальностей, мы показали, что внутривенное введение железа эффективно для повышения концентрации гемоглобина и снижения риска переливания аллогенных эритроцитов, но связано с повышенным риском всех заболеваний. вызвать инфекцию.Внутривенное введение железа все чаще используется для лечения анемии с целью снижения потребности в переливании аллогенных эритроцитов; однако риски и преимущества внутривенного введения железа остаются неопределенными.
Снижение потребности в переливании аллогенных эритроцитов
Аллогенное переливание эритроцитов связано с повышенным риском серьезных побочных эффектов, включая смертность.89 В этом метаанализе мы подтвердили, что внутривенное введение железа эффективно снижает потребность в переливании эритроцитов и тем самым снижает связанный с этим риск.Это преимущество казалось постоянным для разных категорий заболеваний и препаратов железа для внутривенного введения и присутствовало независимо от того, сравнивали ли внутривенное введение железа с пероральным или без железа. Эти результаты согласуются с последними достижениями в понимании метаболизма железа; внутривенное железо более эффективно, чем пероральное железо, особенно в условиях острого или хронического воспаления, за счет обхода эффектов гепсидина — ингибитора всасывания железа в желудочно-кишечном тракте.90 Таким образом, внутривенное железо может играть важную роль в лечении пациентов как часть стратегии по снижению потребности в переливании аллогенных эритроцитов для многих пациентов в больнице.
Кроме того, мы показали, что влияние внутривенного железа на риск необходимости переливания аллогенных красных кровяных телец может быть дополнительно усилено сопутствующим применением агентов, стимулирующих эритроиды. Ни одно из исследований, включенных в метаанализ трансфузий, не проводилось у пациентов с хронической почечной недостаточностью, у которых использование эритроид-стимулирующих средств является стандартным. Использование только этих агентов могло вызвать состояние функционального дефицита железа и было постулировано как потенциальный механизм отрицательных результатов предыдущих исследований использования агентов, стимулирующих эритроиды, в интенсивной терапии.91 92 Является ли добавление внутривенного железа к эритроидным стимуляторам полезным, требует дальнейшего изучения.
Железо и риск заражения
Уменьшение количества переливаний аллогенных эритроцитов необходимо учитывать вместе с нашим открытием повышенного риска всех инфекций после внутривенной терапии железом. Было показано, что свободное железо усиливает рост бактерий in vitro.8 Однако клинические данные о связи между внутривенной терапией железом и инфекцией неубедительны, при этом не наблюдалось увеличения инфекции при внутривенной терапии железом у пациентов, находящихся на диализе, или у пациентов после операции. или в мышиной модели анемии интенсивной терапии.9 93 94 Это несоответствие может быть объяснено низкими концентрациями свободного железа, связанными с новыми внутривенными препаратами железа. 95 96 Наше открытие также может быть ложноположительным результатом. Инфекция не была предопределенной конечной точкой во многих объединенных исследованиях, и возможно, что отсутствующие данные могли создать неизмеримую ошибку в нашем анализе. Кроме того, мы не смогли найти значимой связи между дозой железа и риском инфекции, и, в целом, серьезные побочные эффекты и смертность не были значительно увеличены у тех, кто получал внутривенное железо, по сравнению с пероральным приемом железа или без него.До тех пор, пока не будут доступны рандомизированные контролируемые испытания внутривенного введения железа с достаточной мощностью для исходов, ориентированных на пациента, включая стандартизированные определения инфекции, может быть предпочтительнее использовать внутривенные препараты железа, связанные с относительно низкими концентрациями свободного железа.
Несмотря на то, что это был обширный комплексный систематический обзор, следует учитывать несколько ограничений. Во-первых, данные по всем исходам не были доступны для каждого исследования, а дозы и препараты железа для внутривенного введения, использованные в объединенных исследованиях, различались.Тем не менее гетерогенность риска необходимости переливания крови и инфекции была низкой, а количество доступных исследований было достаточным для проведения нескольких мета-регрессионных анализов для оценки взаимодействия между различными предикторами и эффективности внутривенной терапии железом в повышении концентрации гемоглобина. Предыдущие более мелкие систематические обзоры внутривенной терапии железом не могли предоставить достаточно данных для оценки важных исходов, таких как риск инфекции, или для оценки влияния различных предикторов на эффективность.97 98 Во-вторых, качество включенных исследований было различным, и общий риск систематической ошибки во включенных исследованиях был высоким, несмотря на исключение исследований, которые не были опубликованы полностью. Наконец, мета-регрессия характеристик испытания с характеристиками на уровне участников, такими как исходная концентрация ферритина, может привести к смещению агрегации и может оказаться недостаточной для выявления истинных различий, таких как влияние типа и дозы внутривенного железа.99 Мы включили большое количество количество исследований и проведенная мета-регрессия только тогда, когда неоднородность была низкой на лесном участке на основе априори определенного критерия незначительной неоднородности (I 2 <40%), который снижает, но не может полностью исключить риск систематической ошибки.
Заключение
Внутривенная терапия железом связана со значительным снижением риска необходимости переливания аллогенных эритроцитов. Эти данные свидетельствуют о том, что внутривенное введение железа может иметь широкое применение для многих пациентов в больницах, у которых часто встречается анемия. Это преимущество уравновешивается потенциально повышенным риском заражения. Необходимы дальнейшие рандомизированные контролируемые исследования внутривенного введения железа, чтобы определить, следует ли его использовать в качестве терапии первой линии для уменьшения количества переливаний аллогенных эритроцитов у пациентов в больнице.Такие испытания должны включать четко определенные конечные точки инфекции и иметь достаточную мощность для важных конечных точек, ориентированных на пациента, включая смертность и серьезную заболеваемость.
Что уже известно по этой теме
Что добавляет это исследование
Внутривенная терапия железом может эффективно снизить потребность в переливании эритроцитов в различных учреждениях неотложной помощи
Преимущество внутривенного введения железа в повышении концентрации гемоглобина было замечено при сравнении как перорального приема железа, так и отсутствия добавок железа, и было более эффективным при использовании с эритроид-стимулирующими агентами и у пациентов с более низкими исходными концентрациями ферритина в плазме
Внутривенная терапия железом была связана с повышенным риском инфицирования
Банкноты
Укажите это как: BMJ 2013; 347: f4822
Сноски
Мы благодарим всех авторов, чьи работы внесли вклад в эту рукопись; особенно те, кто предоставил дополнительные данные исследования, L Bastit, L Grote, M Hedenus, A Khalafallah, PA Krayenbuehl, S. Kulnigg, S. Lindgren, JA Serrano-Trenas и DP Steensma.
Соавторов: EL разработал концепцию исследования, EL и KMH разработали исследование, EL JX и KMH провели анализ, интерпретацию данных и составили рукопись. EL, JX и KMH одобрили окончательную версию для публикации. EL является гарантом.
Финансирование: Это исследование не получало специального гранта от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах.
Конкурирующие интересы: Все авторы заполнили единую форму раскрытия информации ICMJE на сайте www.icmje.org/coi_disclosure.pdf (доступен по запросу от соответствующего автора) и заявляем, что EL получила поставку препарата железа для внутривенного введения от Vifor Pharma для предстоящего исследования.
Этическое разрешение: Не требуется.
Обмен данными: Нет дополнительных данных.


 к. возникла мутация гена.
к. возникла мутация гена.

 Перед вскрытием ампулы необходимо осмотреть на наличие осадка и повреждения. Можно использовать только коричневый раствор без осадка.
Капельное введение: Аргеферр предпочтительнее вводить при помощи капельной инфузии для того, чтобы уменьшить риск выраженного снижения артериального давления и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией препарат Аргеферр нужно развести 0,9 % раствором натрия хлорида в соотношении 1:20 [например, 1 мл (20 мг железа) в 20 мл 0,9 % раствора натрия хлорида]. Полученный раствор вводится со следующей скоростью: 100 мг железа — не менее чем за 15 минут; 200 мг железа — в течение 30 минут; 300 мг железа — в течение 1,5 часов; 400 мг железа — в течение 2,5 часов; 500 мг железа — в течение 3,5 часов. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг массы тела, следует производить в течение минимум 3,5 часов, независимо от общей дозы препарата. Перед первым капельным введением терапевтической дозы препарата необходимо ввести тест-дозу: 1 мл препарата (20 мг) железа взрослым и детям с массой тела более 14 кг и половину дневной дозы (1,5 мг железа/кг) детям, имеющим массу тела менее 14 кг, в течение 15 минут.
Перед вскрытием ампулы необходимо осмотреть на наличие осадка и повреждения. Можно использовать только коричневый раствор без осадка.
Капельное введение: Аргеферр предпочтительнее вводить при помощи капельной инфузии для того, чтобы уменьшить риск выраженного снижения артериального давления и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией препарат Аргеферр нужно развести 0,9 % раствором натрия хлорида в соотношении 1:20 [например, 1 мл (20 мг железа) в 20 мл 0,9 % раствора натрия хлорида]. Полученный раствор вводится со следующей скоростью: 100 мг железа — не менее чем за 15 минут; 200 мг железа — в течение 30 минут; 300 мг железа — в течение 1,5 часов; 400 мг железа — в течение 2,5 часов; 500 мг железа — в течение 3,5 часов. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг массы тела, следует производить в течение минимум 3,5 часов, независимо от общей дозы препарата. Перед первым капельным введением терапевтической дозы препарата необходимо ввести тест-дозу: 1 мл препарата (20 мг) железа взрослым и детям с массой тела более 14 кг и половину дневной дозы (1,5 мг железа/кг) детям, имеющим массу тела менее 14 кг, в течение 15 минут.