| Айронгард | Р-р д/в/в введения 20 мг/мл: амп. 2 мл или 5 мл 5 шт. рег. №: ЛП-005775 от 05.09.19 | |||
| Айрондекст |  5 шт. рег. №: ЛП-004509
от 25.10.17 5 шт. рег. №: ЛП-004509
от 25.10.17 | |||
| Актиферрин | Капли д/приема внутрь 4.72 г+3.56 г/100 мл: фл. 30 мл с пробкой-капельницей рег. №: П N015041/03 от 10.10.08 Дата перерегистрации: 03.08.17 | Произведено:
MERCKLE
(Германия)
контакты: ТЕВА (Израиль) | ||
| Актиферрин |  42 г+2.58 г/100 мл: фл. 1 шт. рег. №: П N015041/01
от 13.10.08
Дата перерегистрации: 10.07.17 42 г+2.58 г/100 мл: фл. 1 шт. рег. №: П N015041/01
от 13.10.08
Дата перерегистрации: 10.07.17 | Произведено: MERCKLE (Германия) | ||
| АлвиферГем | Р-р д/в/в введения 20 мг/мл: 5 мл амп. | |||
| Аргеферр | Р-р д/в/в введения 100 мг/5 мл: амп. 5 шт. | |||
| Бинноферум® | Р-р д/в/в введения 20 мг/мл: амп. | |||
| Биофер | Таб. жевательные 100 мг+350 мкг: 30 шт. рег. №: ЛСР-002336/09 от 16.04.12 | |||
| Велферрум® |  5 мл 5 шт. рег. №: ЛП-002843
от 26.01.15 5 мл 5 шт. рег. №: ЛП-002843
от 26.01.15 | |||
| Венофер® | Р-р д/в/в введения 20 мг/1 мл: амп. 2 мл 5 шт. рег. №: П N014041/01 от 14.08.08 | Фасовка и упаковка: ALTANA PHARMA (Германия) | ||
| Венофер® | Р-р д/в/в введения 20 мг/1 мл: амп. | Фасовка и упаковка: ALTANA PHARMA (Германия) | ||
| Виалфер | Р-р д/в/в введения 20 мг/мл: амп. | |||
| БАД | Вивация Ультра Комплекс с железом | Капс.: 60 шт. рег. №: AM.01.07.01.003.R. 000458.12.20 от 25.12.20 | Произведено: MARYVERY (Великобритания) | |
| БАД | Витрум® Центури Плюс | Таб. | ||
| БАД | Гематоген — Форте с аскорбинкой | Плитки рег. №: 77.99.23.3.У.5738. 6.09 от 10.06.09 | ||
| БАД | Гематоген — Форте с грецким орехом | Плитки рег. №: 77.99.23.3.У.6160. 6.09
от 19.06.09 №: 77.99.23.3.У.6160. 6.09
от 19.06.09 | ||
| БАД | Гематоген — Форте с изюмом | Плитки рег. №: 77.99.23.3.У.6161. 6.09 от 19.06.09 | ||
| БАД | Гематоген — Форте с кедровым орехом | Плитки рег. №: 77.99.23.3.У.6162. 6.09
от 19.06.09 №: 77.99.23.3.У.6162. 6.09
от 19.06.09 | ||
| БАД | Гематоген — Форте с кокосом | Плитки рег. №: 77.99.23.3.У.6163. 6.09 от 19.06.09 | ||
| БАД | Гематоген — Форте с миндалем | Плитки рег. №: 77.99.23.3.У.6164. 6.09
от 19.06.09 №: 77.99.23.3.У.6164. 6.09
от 19.06.09 | ||
| БАД | Гематоген детский | Плитки: 25 или 50 г рег. №: RU.77.99.11.003.Е. 005167.06.13 от 26.08.13 | ||
| БАД | Гематоген сироп | Сироп: 100 или 250 г фл. | ||
| Гино-Тардиферон® | Таб. с модифицир. высвобождением, покр. пленочной оболочкой, 256.3 мг+350 мкг: 30 шт. рег. №: ЛС-000300 от 26.07.10 Дата перерегистрации: 30.11.20 | |||
| Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: 2 мл или 5 мл амп. | |||
| Железа (III) гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. 5 мл 5 или 10 шт. рег. №: ЛП-006554 от 09.11.20 | |||
| Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. | |||
| Железа (III) Гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: амп. 5 мл 5 шт. рег. №: ЛП-006141 от 12.03.20 | |||
| Железа [III] гидроксид сахарозный комплекс | Р-р д/в/в введения 20 мг/мл: 2 мл или 5 мл амп. | |||
| Железа [III] гидроксид сахарозный комплекс APC | Р-р д/в/в введения 20 мг/мл: 5 мл амп. 3 или 5 шт. рег. №: ЛП-004176 от 03.03.17 | |||
| Ликферр 100® | Р-р д/в/в введения 20 мг/1 мл: амп. | |||
| Ликферр 100® | Р-р д/в/в введения 20 мг/1 мл: амп. 5 мл 3, 5, 6 или 24 шт.; фл. 5 мл 1, 3 или 5 шт. рег. №: ЛСР-008006/10 от 12. 08.10
Дата перерегистрации: 23.05.14 08.10
Дата перерегистрации: 23.05.14 | |||
| Ликферр100® | Сироп 50 мг/5 мл: фл. 100 мл в компл. с мерн. ложкой рег. №: ЛСР-000094 от 31.05.07 Дата перерегистрации: 28.04.15 | |||
| Мальтофер® | Капли д/приема внутрь 50 мг/1 мл: фл. | Произведено: VIFOR (Швейцария) | ||
| Мальтофер® | Р-р д/в/м введения 50 мг/1 мл: амп. | Произведено: BIPSO (Германия) | ||
Лекарства от анемии (препараты с железом)
Заказать лекарство от анемии
Сеть аптек 36,6 – это более 1200 аптек в Москве и Санкт-Петербурге, Московской и Ленинградской областях, в которых представлен широкий ассортимент
лекарственных препаратов. Простой поиск на сайте позволит подобрать лекарство от анемии по содержащимся компонентам, производителям, цене или форме выпуска.
На веб-ресурсе можно быстро и легко найти и заказать аналоги препаратов. Лекарства, представленные на странице, сертифицированы.
Акции, бонусные программы и скидки позволят совершить выгодную покупку.
Показания
Анемия – это заболевание, которому свойственна пониженная концентрация гемоглобина, обычно в сочетании со снижением количества эритроцитов [1].
Анемия является симптомом различных заболеваний. При выявлении патологии чаще всего лечащим врачом назначаются препараты железа при анемии.
Правильный подбор лекарственного средства и установление причин анемии ускоряют процесс излечения.
Список основных показаний, при которых назначаются железосодержащие средства:
- необходимость быстрого восполнения железа в организме;
- лечение железодефицитной анемии;
- профилактические действия, направленные на восстановление баланса железа во время беременности;
- профилактика дефицита железа у подростков, кормящих матерей и детей.

На сайте представлены различные препараты, среди которых можно быстро подобрать необходимое лекарство для взрослых, для детей и для беременных женщин.
Противопоказания
Противопоказано принимать лекарства от анемии людям, которые имеют в анамнезе:
- повышенную чувствительность к веществам в составе препарата;
- тем, чей организм перегружен железом из-за гемохроматоза или гемосидероза;
- анемию, вызванную отравлением свинцом;
- сидероахрестическую анемию;
- талассемия;
- мегалобластную анемию из-за нехватки витамина B12;
- в некоторых случаях детям, не достигшим 12-летнего возраста.
Формы выпуска
Таблетки от анемии, представленные на сайте, можно разделить на:
- капли;
- капсулы;
- растворы;
- сиропы;
- таблетки.
Ознакомиться со свойствами и особенностями препаратов определенной формы выпуска можно непосредственно на сайте.
Страны изготовители
Сеть аптек 36,6 предлагает железосодержащие препараты ведущих фармацевтических компаний:
- Словении;
- Беларуси;
- Швейцарии;
- Испании;
- Великобритании.

Также представлен огромный выбор препаратов российского производства. Закажите препарат на сайте и быстрее, чем через сутки, вы уже будете оплачивать его в кассе ближайшей аптеки.
ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТОВ НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ПО ПРИМЕНЕНИЮ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Список литературы:
- [i] Демидова, А. В. Анемии / А.В. Демидова. — Москва: Мир, 2009.
Мальтофер (раствор для внутримышечного введения) по низкой цене. Инструкция по применению, описание, состав, дозировки, побочные действия
Препарат вводят в/м.
Перед первым введением терапевтической дозы необходимо провести в/м тест: взрослым вводят от 1/4 до 1/2 дозы препарата (от 25 до 50 мг железа (0.5-1 мл)), детям с 4 месяцев — половину суточной дозы. При отсутствии побочных реакций в течение 15 мин после введения можно вводить оставшуюся часть начальной дозы препарата.
Во время инъекции необходимо обеспечить наличие средств для оказания неотложной помощи при развитии анафилактического шока.
Доза препарата рассчитывается индивидуально и адаптируется в соответствии с общим дефицитом железа по следующей формуле:
Общий дефицит железа (мг) = масса тела (кг) × (нормальный уровень Нb — уровень Нb больного) (г/л) × 0.24* + железо запасов (мг)
При массе тела менее 35 кг: нормальный Нb = 130 г/л, что соответствует депонированному железу = 15 мг/кг массы тела
При массе тела более 35 кг: нормальный уровень Нb = 150 г/л, что соответствует депонированному железу = 500 мг
* Фактор 0.24 = 0.0034×0.07×1000 (содержание железа в гемоглобине = 0.34%/объем крови =7% от массы тела/фактор 1000 = перевод из г в мг)
Общее количество ампул для введения = общий дефицит железа (мг)/100 мг.
| Масса тела (кг) | Общее количество ампул для введения | |||
| Нb 60 г/л | Нb 75 г/л | Нb 90 г/л | Нb 105 г/л | |
| 5 | 1. 5 5 | 1.5 | 1.5 | 1 |
| 10 | 3 | 3 | 2.5 | 2 |
| 15 | 5 | 4.5 | 3.5 | 3 |
| 20 | 6.5 | 5.5 | 5 | 4 |
| 25 | 8 | 7 | 6 | 5.5 |
| 30 | 9.5 | 8.5 | 7.5 | 6.5 |
| 35 | 12.5 | 11.5 | 10 | 9 |
| 40 | 13.5 | 12 | 11 | 9.5 |
| 45 | 15 | 13 | 11.5 | 10 |
| 50 | 16 | 14 | 12 | 10.5 |
| 55 | 17 | 15 | 13 | 11 |
| 60 | 18 | 16 | 13.5 | 11.5 |
| 65 | 19 | 16.5 | 14.5 | 12 |
| 70 | 20 | 17.5 | 15 | 12.5 |
| 75 | 21 | 18.5 | 16 | 13 |
| 80 | 22. 5 5 | 19.5 | 16.5 | 13.5 |
| 85 | 23.5 | 20.5 | 17 | 14 |
| 90 | 24.5 | 21.5 | 18 | 14.5 |
Если необходимая доза превышает максимальную суточную дозу, то введение препарата должно быть дробным.
Взрослым назначают по 1 ампуле ежедневно (2.0 мл = 100 мг железа).
Для детей с 4 месяцев доза определяется в зависимости от массы тела.
Максимально допустимые суточные дозы:
| Дети с массой тела до 6 кг | 1/4 ампулы (0.5 мл = 25 мг железа) |
| Дети с массой тела от 5 до 10 кг | 1/2 ампулы (1.0 мл = 50 мг железа) |
| Дети с массой тела от 10 до 45 кг | 1 ампула (2.0 мл = 100 мг железа) |
| Взрослые | 2 ампулы (4.0 мл = 200 мг железа) |
Если терапевтический ответ со стороны гематологических параметров отсутствует через 1-2 недели (например, увеличение уровня Нb примерно на 0. 1 г/дл в день), то первоначальный диагноз следует пересмотреть. Общая доза препарата на курс лечения не должна превышать рассчитанное количество ампул.
1 г/дл в день), то первоначальный диагноз следует пересмотреть. Общая доза препарата на курс лечения не должна превышать рассчитанное количество ампул.
Техника проведения инъекции
Техника инъекции имеет решающее значение. В результате неправильного введения препарата могут возникнуть болевые ощущения и окрашивание кожи в месте инъекции. Описанная ниже методика вентро-ягодичной инъекции рекомендована вместо общепринятой (в верхний наружный квадрант большой ягодичной мышцы).
Длина иглы должна быть не менее 5-6 см. Просвет иглы не должен быть широким. Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше.
Инструменты дезинфицируются обычным методом.
img_maltofer_1.tif|png
В соответствии с рекомендациями Hochstetter, место инъекции определяется следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению, зафиксировать точку А. Если больной лежит на правом боку, то следует расположить средний палец левой руки в точке А. Отставить указательный палец от среднего так, чтобы он находился под линией подвздошного гребня в точке B.
Отставить указательный палец от среднего так, чтобы он находился под линией подвздошного гребня в точке B.
Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции.
Прежде чем ввести иглу, следует сдвинуть кожу примерно на 2 см для того, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи.
Расположить иглу вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава.
После инъекции медленно извлечь иглу и прижимать пальцем участок кожи, прилегающий к месту инъекции, примерно в течение 5 мин.
После инъекции пациенту необходимо подвигаться.
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
| |||
|
Терапия » Сравнительная оценка хронической перегрузки железом при применении препаратов железа в субтоксических дозах
Сравнительная оценка хронической перегрузки железом при применении препаратов железа в субтоксических дозах
О.А. Назаренко, О.А. Громова, В.И. Демидов, И.Ю. Торшин, И.К. Томилова, Е.Л. Алексахина
ФГБОУ ВО «Ивановская государственная медицинская академия», 1 кафедра фармакологии и клинической фармакологии, 2 научно-исследовательский центр, 4 кафедры химии, г. Иваново 3 ФГБОУ ВО «Московский физико-технический институт (государственный университет)», кафедра интеллектуальных систем, г. Долгопрудный
Используемые для терапии железодефицитной анемии препараты железа отличаются различной безопасностью. В отличие от органических солей железа такие неорганические соединения железа, как оксиды, гидроксиды и сульфаты не обладают высокой биодоступностью и существенно увеличивают нагрузку тканей нерастворимыми окислами железа. В настоящей работе проведено экспериментальное исследование препаратов железа на основе гидроксида железа в составе полимальтозного комплекса (Мальтофер®) и сульфата железа. Пероральный прием сульфата железа в течение 2 мес вызывал хроническую перегрузку железом (системный гемосидероз), проявляющуюся как гистологическим повреждением гемосидерином паренхимы печени, почек и головного мозга, так и повышением уровня аланинаминотрансферазы в крови и уровней белка в моче. По сравнению с сульфатом железа Мальтофер имеет преимущества при длительном применении: отсутствовали отложения гемосидерина в тканях почек и мозга; в печени небольшие отложения гемосидерина были отмечены только во внутридольковых синусовых капиллярах, но не в гепатоцитах.
Литература
Об авторах / Для корреспонденции
Назаренко Ольга Анатольевна, к.м.н., доцент кафедры фармакологии и клинической фармакологии ФГБОУ ВО «Ивановская государственная медицинская академия». Адрес: 153012, г. Иваново, Шереметевский пр., д. 8. Телефон: (4932) 41-65-25
Громова Ольга Алексеевна, д.м.н., профессор кафедры фармакологии и клинической фармакологии ФГБОУ ВО «Ивановская государственная медицинская академия». Адрес: 153012, г. Иваново, Шереметевский пр., д. 8. Телефон: (4932) 41-65-25. E-mail: [email protected]
Демидов Вадим Игоревич, к.м.н., с.н.с. Научно-исследовательского центра ФГБОУ ВО «Ивановская государственная медицинская академия». Адрес: 153012, г. Иваново, Шереметевский пр., д. 8. Телефон: (4932) 41-65-25
Торшин Иван Юрьевич, к.ф-м.н., доцент кафедры интеллектуальных систем ФГБОУ ВО «Московский физико-технический институт (государственный университет)». Адрес: 141701, Московская обл., г. Долгопрудный, Институтский пер., 9. Телефон: (499) 135-24-89
Алексахина Елена Львовна, к.х.н., научный консультант Научно-исследовательского центра, доцент кафедры химии ФГБОУ ВО «Ивановская государственная медицинская академия». Адрес: 153012, г. Иваново, Шереметевский пр., д. 8. Телефон: (4932) 41-65-25
Томилова Ирина Константиновна, д.м.н., зав. кафедрой химии ФГБОУ ВО «Ивановская государственная медицинская академия». Адрес: 153012, г. Иваново, Шереметевский пр., д. 8. Телефон: (4932) 41-65-25
ФАРМАТЕКА » Внутривенные препараты железа в лечении железодефицитной анемии
Показания к внутривенному введению препаратов железа для лечения железодефицитной анемии (ЖДА) включают в себя неэффективность или плохую переносимость пероральных препаратов железа, тяжелую степень анемии, ЖДА в предоперационном периоде, ЖДА при воспалительных заболеваниях кишечника, сопровождающихся нарушением всасывания, также существуют рекомендации комплексной терапии со стимуляторами эритропоэза. В ряде клинических исследований проанализированы результаты внутривенного введения препаратов железа в разных режимах для лечения ЖДА.
По данным экспертов Всемирной организации здравоохранения, в мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения [1]. Значительная доля случаев анемии связана с дефицитом железа [2], который может быть следствием недостаточного поступления его с пищей, в частности при хроническом алкоголизме, повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), хронической кровопотере, нарушениях всасывания (например, при воспалительных заболеваниях кишечника) [3]. При функциональном дефиците железа, например при лечении стимуляторами эритропоэза, нормальное или даже повышенное общее содержание его в организме оказывается недостаточным на фоне увеличения потребности в железе костного мозга [4]. В регуляции обмена железа принимает участие гепсидин, который синтезируется в печени и подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5]. Повышение концентрации гепсидина способствует развитию анемии при хронических заболеваниях, нефрогенной анемии с возможной резистентностью к стимуляторам эритропоэза [6].
Анемия встречается у трети женщин репродуктивного возраста, а во время беременности ее частота достигает 23–52% [2]. У женщин железодефицитная анемия (ЖДА) чаще всего развивается при обильных и длительных менструациях (более 5 дней), дисфункциональных маточных кровотечениях, миоме матки [7]. При низком потреблении железа анемия может развиваться даже при относительной небольшой кровопотере [8]. Высокая встречаемость анемии во время беременности отражает значительное увеличение потребности в железе в связи с усилением эритропоэза у женщины и ростом плода [9].
При ЖДА увеличение потребления железа с пищей не позволяет компенсировать его дефицит, т.к. предельное всасывание железа составляет всего 2,5–3 мг/сут [9]. В связи с этим основной метод лечения ЖДА – пероральное или внутривенное введение препаратов железа.
Внутривенные препараты железа и показания к их применению
Для внутривенного введения используют железоуглеводные соединения (карбоксимальтозат, сахарат, глюконат и декстран железа). Углеводная оболочка стабилизирует комплекс и замедляет высвобождение железа в крови. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей [26]. Значительная часть дозы подобных препаратов выводится через почки в первые 4 часа после приема препарата и не используется для эритропоэза. Недостатком декстрана железа, который обладает высокими молекулярной массой и стабильностью, является повышенный риск аллергических реакций [26]. Карбоксимальтозат железа (Феринжект) представляет собой стабильный высокомолекулярной комплекс, который обеспечивает медленное и физиологичное высвобождение железа. Он обладает меньшим иммуногенным потенциалом и в отличие от сахарата и глюконата железа может вводиться в высокой дозе [10].
В рандомизированном контролируемом исследовании карбоксимальтозат железа сравнивали с декстраном железа у 160 больных ЖДА [11]. По эффективности два препарата существенно не различались, однако реакции гиперчувствительности не были зарегистрированы ни у одного из больных в группе карбоксимальтозата железа и отмечались среди 10,3% больных в группе сравнения (р=0,003). Частота кожных реакций также была достоверно ниже при лечении карбоксимальтозатом железа (7,3 и 24,4% соответственно; р=0,004).
При применении карбоксимальтозата железа 1000 мг железа можно ввести внутривенно капельно в течение 15 минут, в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 3,5 часа, а длительность инфузии декстрана железа достигает 6 часов, согласно инструкциям по медицинскому применению. Причем в двух последних случаях перед началом инфузии необходимо ввести пробную дозу. Максимальные рекомендуемые однократные дозы большинства препаратов железа для внутривенного введения ниже таковой карбоксимальтозата железа, поэтому для восполнения запасов железа необходимо многократное их введение, в то время как при применении карбоксимальтоза железа кратность инфузий, соответственно, меньше.
При легкой анемии препараты железа чаще всего назначают внутрь. Основное преимущество пероральных препаратов железа перед внутривенными – удобство применения, хотя оно нивелируется высокой частотой (10–40%) побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ [10]) и необходимостью в длительном лечении. Внутривенное введение препаратов железа позволяет быстро восполнять его запасы в организме для восстановления концентрации гемоглобина (Hb). Данный эффект имеет особое значение при более тяжелой анемии, особенно для пациентов с сердечно-сосудистыми заболеваниями, а также при предоперационной анемии, когда оперативное вмешательство не может быть отложено [12]. Следует учитывать, что предоперационная анемия (в т.ч. легкая) не только часто встречается в клинической практике, но и ассоциируется с достоверным увеличением риска смерти и других осложнений в течение 30 дней после оперативного вмешательства [13]. По данным систематизированного обзора 24 рандомизированных и 15 нерандомизированных исследований [14], внутривенное введение препаратов железа при предоперационной анемии давало более быстрый и надежный эффект, чем их пероральный прием. Внутривенное введение железа используют пациенты, получающие лечение препаратами, стимулирующими эритропоэз, больные хронической болезнью почек, воспалительными заболеваниями кишечника, злокачественными опухолями [15]. Причиной дефицита железа у онкологических больных могут быть не только кровотечение или нарушение поступления железа при анорексии или после резекции опухолей ЖКТ, но и другие факторы, в частности увеличение секреции гепсидина, который подавляет всасывание железа в кишечнике и его высвобождение из депо и макрофагов [5, 15]. В нескольких рандомизированных клинических исследованиях внутривенное введение препаратов железа позволило увеличить частоту ответа на лечение эпоэтинами у онкологических больных с 25–70 до 68–93% [16], в то время как пероральные препараты для таких больных были малоэффективными или неэффективными. Переход на внутривенное введение препаратов железа показан также больным, для которых лечение пероральными препаратами оказывается малоэффективным или плохо переносится [17].
Сегодня мировым врачебным сообществом обсуждается также возможность применения препаратов железа и при его латентном дефиците, который не сопровождается анемией, но может быть причиной утомляемости. В многоцентровое рандомизированное плацебо-контролируемое исследование PREFER были включены 290 женщин с утомляемостью (индекс по шкале Piper Fatigue Scale [PFS] score ≥5), дефицитом железа (ферритин <50 мкг/л и степенью насыщения трансферрина <20% или ферритин <15 мкг/л) и нормальным или пограничным уровнем Hb (≥11,5 г/дл), которым однократно вводили карбоксимальтозат железа (1000 мг железа) или физиологический раствор [18]. Утомляемость уменьшилась у 65,3% женщин, получавших карбоксимальтозат железа, и у 52,7% пациенток группы плацебо (р=0,03), а индекс PFS снизился по крайней мере в два раза у 33,3 и 16,4% женщин соответственно (p<0,001). Введение карбоксимальтозата железа привело к более значительному улучшению индексов психического состояния и когнитивной функции. Таким образом, результаты данного исследования показали, что внутривенное введение препарата железа женщинам с дефицитом железа может приводить к уменьшению утомляемости и улучшению показателей качества жизни и когнитивной функции даже в отсутствие анемии. В России на сегодняшний день карбоксимальтозат железа применяется, согласно утвержденной инструкции, только при ЖДА.
Выбор дозы внутривенных препаратов железа
Перед началом лечения внутривенными препаратами железа следует определить оптимальную кумулятивную дозу препарата, которую не следует превышать. Кумулятивную дозу, необходимую для восстановления уровня Hb в крови и восполнения запасов железа в организме, традиционно вычисляют по формуле Ганзони: кумулятивный дефицит железа (мг)=масса тела [кг]×(15-фактический Hb) [г/дл]×2,4+500 [мг] [19]. Для перевода уровня Hb в ммоль/л показатель в г/дл следует умножить на 1,61145 [10]. В инструкциях по применению некоторых препаратов, например Феринжекта, Венофера и Космофера, приведены таблицы, которые позволяют рассчитывать требуемую дозу с учетом фактического содержания Hb и массы тела больного. На практике суммарная доза железа, вводимого внутривенно, обычно составляет около 1000 мг [19]. Фактически некоторым пациентам с ЖДА может потребоваться более высокая суммарная доза на весь курс.
Выраженность дефицита железа у пациентов с ЖДА, которым в клинических исследованиях вводили внутривенные препараты железа, и потенциальная польза увеличения их суммарной дозы были изучены в работе T. Koch и соавт. [19]. Далее мы рассмотрим результаты 7 исследований, в которые включены пациенты с ЖДА различного происхождения, включая женщин с послеродовой анемией или анемией, развившейся после тяжелого маточного кровотечения, пациенты с желудочно-кишечными заболеваниями и нефрогенной анемией [11, 20–25]. Во всех исследованиях применяли карбоксимальтозат железа, который сравнивали с пероральными или другими внутривенными препаратами железа. В двух исследованиях специально изучали эффективность и безопасность карбоксимальтозата железа в более высокой суммарной дозе – 1500 мг. В этих исследованиях пациенты групп сравнения получали стандартную терапию (пероральные или внутривенные препараты железа по выбору исследователей) [24] или внутривенно сахарат железа в дозе 1000 мг [25].
Степень дефицита железа рассчитывали по формуле Ганзони/модифицированной формуле Ганзони. У пациентов с исходной степенью насыщения трансферрина >20% и концентрацией ферритина >50 нг/мл при расчете дефицита железа не учитывали 500 мг, необходимых для восполнения запасов железа [19]. Средние кумулятивные дозы потребления железа в 5 клинических исследованиях потребление карбоксимальтозата железа представлено в табл. 1.
J. Onken и соавт. изучали эффективность и безопасность двух инфузий карбоксимальтозата железа по 750 мг с интервалом в неделю по сравнению с пероральным приемом препарата железа 1011 пациентами с ЖДА различного происхождения, которых разделили на две когорты [24]. Первую когорту составили 507 больных, для которых лечение пероральными препаратами железа в течение 14 дней не привело к существенному росту концентрации Hb (на величину до 10 г/л). В этой когорте сравнивали карбоксмальтозат железа в режиме двукратной инфузии (группа А) и пероральный препарат железа в дозе 325 мг/сут в течение 14 дней (группа В). Через 35 дней концентрация Hb в двух группах увеличилась в среднем на 15,7 и 8,0 г/л соответственно (p=0,001), а доля пациентов, у которых она достигла по крайней мере 120 г/л, составила 57,0 и 29,1% соответственно (р=0,001) (рис. 1). Во вторую когорту были включены 504 пациента, которые не переносили пероральные препараты железа. В этой когорте применяли карбоксимальтозат железа (группа С) или другие внутривенные препараты железа (группа D). Суммарная доза железа в двух группах составила в среднем 1432 и 813 мг соответственно. Средняя концентрация Hb через 35 дней после введения карбоксимальтозата железа в более высокой дозе увеличилась на 29,0 г/л, а при введении других препаратов железа – на 21,6 г/л (р=0,001). Преимущества более высокой дозы железа были показаны и при анализе числа пациентов, достигших концентрации Hb по крайней 120 г/л, их численность составила 50,6 и 24,5% в двух группах соответственно (р=0,001). Таким образом, в этом исследовании было показано, что две инфузии карбоксимальтозата железа по 750 мг с интервалом в одну неделю, – эффективные и безопасные методы лечения ЖДА при недостаточной эффективности или плохой переносимости пероральных препаратов железа.
В исследовании REPAIR-IDA сравнивали эффективность и безопасность внутривенного введения карбоксимальтозата железа (две инфузии по 750 мг с интервалом в неделю) и сахарата железа (до 5 инфузий по 200 мг в течение 14 дней) 2584 больным ЖДА и додиализными стадиями хронической болезни почек (ХБП) [25]. Первичным показателем эффективности было среднее изменение концентрации Hb через 56 дней по сравнению с исходным, а композитной первичной конечной точкой безопасности – частота смертей от любых причин, нефатальных инфаркта миокарда и инсульта, нестабильной стенокардии, хронической сердечной недостаточности, аритмий, эпизодов повышения давления и гипотонии. Суммарная доза железа составила 1464 мг в группе карбоксимальтозата железа и 963 мг в группе сравнения. Исходная концентрация Hb была сопоставимой в двух группах (103,1 и 103,2 г/л соответственно).
Содержание Hb увеличилось в среднем на 11,3 г/л при введении карбоксимальтозата железа в дозе 750 мг двукратно с интервалом в неделю и на 9,2 г/л при введении сахарата железа в суммарной дозе для 5 инъекций – 1000 мг. Доля пациентов, у которых через 56 дней концентрация Hb после введения карбоксимальтозата железа увеличилась более чем на 10 г/л, была выше, чем после введения сахарата железа (48,6 и 41,0%). При этом доля пациентов, которым потребовалось повторное внутривенное введение препарата железа через 56–90 дней, в основной группе была значительно ниже, чем в группе сравнения (5,6 и 11,1% соответственно; p<0,001; рис. 2) [19].
Достоверные преимущества внутривенного введения более высокой дозы препарата железа были выявлены и при анализе числа больных, у которых концентрация Hb в течение 56 дней увеличилась до 110 и 120 г/л или по крайней мере на 10 г/л (табл. 2) [19]. Время до указанных изменений концентрации Hb было короче в группе карбоксимальтозата железа (рис. 3) [19]. Безопасность двух режимов внутривенного введения железа существенно не различалась.
День 56-й был последним в исследовании. По решению исследователя допускалось повторное введение препарата железа с 56-го по 90-й день [19].
Заключение
В клинической практике врачи обычно обсуждают возможность внутривенного введения препаратов железа больным ЖДА при неэффективности или плохой переносимости пероральных препаратов железа, хотя во многих ситуациях внутривенное введение железа является методом выбора. Примером могут служить тяжелая или предоперационная анемии, когда необходимо добиваться прогрессивного увеличения концентрации Hb, чтобы избежать неблагоприятных исходов или не откладывать оперативное вмешательство.
Пероральные препараты железа могут быть недостаточно эффективными в лечении ЖДА у больных воспалительными заболеваниями кишечника, онкологическими заболеваниями и ХБП. Анализ расчетного дефицита железа в клинических исследованиях больных ЖДА показал, что в среднем он может составлять около 1500 мг. Таким образом, общая доза железа, которая нередко не превышает 1000 мг, может оказаться недостаточной для некоторых пациентов с ЖДА. Результаты рандомизированных клинических исследований свидетельствуют о том, что внутривенное введение препарата железа до кумулятивной дозы 1500 мг позволяет добиваться более быстрого значительного повышения концентрации Hb и увеличить срок до повторных инфузий препаратов железа по сравнению с таковыми при введении дозы 1000 мг.
Для введения высоких доз железа может быть использован карбоксимальтозат железа, однократная доза которого может составлять 1000 мг. Соответственно, бóльшую дозу можно вводить путем повторных инфузий препарата с интервалом в одну неделю, в то время как при применении сахарата железа для введения аналогичной дозы потребуется большее число инфузий.
С.В. Моисеев – д.м.н., проф. кафедры внутренних, профессиональных болезней и пульмонологии ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, проф. кафедры внутренних болезней ФФМ МГУ им. М.В. Ломоносова, Москва; e-mail: [email protected]
Феррум Лек раствор ампулы 2 мл 5 шт
Характеристики
| Способ применения | Внутримышечно |
| Количество в упаковке | 5 шт |
| Максимальная допустимая температура хранения, °С | 25 °C |
| Срок годности | 60 мес |
| Условия хранения | В сухом месте |
| Форма выпуска | Раствор |
| Объем | 2 мл |
| Страна-изготовитель | Словения |
| Порядок отпуска | По рецепту |
| Действующее вещество | Железа (III)-гидроксид полиизомальтозат (Ferric(III)-hydroxide polyisomaltosate) |
| Сфера применения | Гематотропные средства |
| Фармакологическая группа | B03AB Препараты железа (трехвалентного) для приема внутрь |
| Зарегистрировано как | Лекарственное средство |
Инструкция по применению
Действующие вещества
Железа (III) гидроксид полимальтозанФорма выпуска
Раствор для инъекций
Состав
Действующее вещество: железа (III) гидроксид полиизомальтозатКонцентрация действующего вещества (мг): 100 мг
Фармакологический эффект
Антианемический препарат.в препарате железо находится в виде комплексного соединения железа (iii) гидроксид полиизомальтозат. этот макромолекулярный комплекс стабилен и не выделяет железо в виде свободных ионов. комплекс сходен по структуре с естественным соединением железа — ферритином. железа (iii) гидроксид полиизомальтозат не обладает прооксидантными свойствами, которые присущи солям железа (ii).железо, входящее в состав препарата быстро восполняет недостаток этого элемента в организме (в т.ч. при железодефицитной анемии), восстанавливает уровень гемоглобина (hb).при применении препарата происходит постепенная регрессия клинических (слабость, утомляемость, головокружение, тахикардия, болезненность и сухость кожных покровов) и лабораторных симптомов дефицита железа.
Фармакокинетика
После в/м введения препарата железо быстро поступает в кровоток: 15% дозы — через 15 мин, 44% дозы — через 30 мин.Железо в комплексе с трансферрином переносится к клеткам организма, где используется для синтеза гемоглобина, миоглобина и некоторых ферментов.
Показания
Железодефииитные анемии (снижение содержания гемоглобина в крови вследствие нарушения поступления, усвоения или выделения железа) различной этиологии (причины).
Противопоказания
Гемохроматоз (нарушение обмена железосодержащих пигментов) и гемосидероз (отложение темно-желтого железосодержащего пигмента в коже), а также анемии (снижение содержания гемоглобина в крови), не связанные с дефицитом железа.
Меры предосторожности
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С; не замораживать.
Применение при беременности и кормлении грудью
Парентеральное введение препарата противопоказано в I триместре беременности. Во II и III триместрах беременности и в период грудного вскармливания препарат назначают только в случае, если ожидаемая польза для матери превышает потенциальный риск для плода или младенца.
Способ применения и дозы
Глубоко внутримышечно через день по 2 мл. Максимальная суточная доза при внутримышечном введении для взрослых — 4 мл, для детей с массой тела до 5 кг — 0,5 мл, массой тела 5-10 кг — 1 мл. Внутривенно взрослым: в 1-й день — 2,5 мл (!/2 ампулы), 2-й день — 5 мл (1 ампула) и 3-й — 10 мл (2 ампулы), далее 2 раза в неделю по 10 мл.
Побочные действия
После первой инъекции рекомендуется наблюдать за больными с целью выявления реакции на препарат.
Передозировка
Симптомы: Передозировка препаратов железа может приводить к острой перегрузке железом и гемосидерозу.Лечение: симптоматическая терапия. В качестве антидота вводится в/в медленно (15 мг/кг/ч) дефероксамина в зависимости от степени тяжести передозировки, но не более 80 мг/кг/сут. Гемодиализ неэффективен.
Взаимодействие с другими препаратами
Феррум Лек для в/м инъекций не следует применять одновременно с препаратами железа для приема внутрь.Одновременное применение препарата Феррум Лек с ингибиторами АПФ может вызвать усиление системных эффектов парентеральных препаратов железа.
Особые указания
Препарат следует применять только в условиях стационара.При назначении Феррум Лек обязательно проведение лабораторных анализов: общий клинический анализ крови и определение сывороточного уровня ферритина; необходимо исключить нарушение абсорбции железа.Лечение пероральными формами железосодержащих препаратов следует начинать не ранее, чем спустя 5 суток после последней инъекции Феррум Лек.Содержимое ампул не следует смешивать с другими препаратами.
Отпуск по рецепту
Да
Препараты железа, Устная монография для профессионалов
Класс: Препараты железа
Номер CAS: 1332-96-3
Бренды: Feosol, Feostat, Feratab, Fer-Gen-Sol, Fergon, Fer-In-Sol, Ferrex, таблетки сульфата железа EC, Fe-Tinic, Hemocyte, Hytinic, Icar Pediatric, Ircon, Mol-Iron, Nephro-Fer, Niferex, Slow FE
Введение
Фумарат железа, глюконат железа, сульфат железа, карбонильное железо и комплекс полисахарид-железо используются перорально для профилактики и лечения дефицита железа.
Применение препаратов железа для перорального применения
Профилактика и лечение дефицита железа
Профилактика и лечение дефицита железа. Не показан для лечения анемии, вызванной другими причинами, кроме дефицита железа.
Препараты железа, пероральная дозировка и введение
Администрация
Устное введение
Принимать перорально между приемами пищи (например, за 1 час до или через 2 часа после еды).
Пациентам, которые плохо переносят пероральные добавки железа, назначают меньшие, более частые дозы; начните с более низкой дозы и постепенно увеличивайте ее до целевой; попробуйте другую форму или препарат; или принимать во время или после еды или перед сном.
Дозировка
Дозировка в единицах элементарного железа. (См. Таблицу 1.)
Не превышайте рекомендованную дозировку.
Карбонильное железо — это элементарное железо, а не соль железа.
Лекарство | Элементальное железо |
|---|---|
Пирофосфат железа | 120 мг / г |
Глюконат железа | 120 мг / г |
Сульфат железа | 200 мг / г |
Сульфат железа, сушеный | 300 мг / г |
Фумарат железа | 330 мг / г |
Карбонат железа безводный | 480 мг / г |
Карбонильное железо | 1000 мг / г |
Пациенты педиатрического профиля
Железодефицитная анемия
Профилактика
УстныйНедоношенные дети или дети с низкой массой тела при рождении: 2–4 мг / кг в день, предпочтительно начиная с 1 месяца, но не менее чем до 2 месяцев.Не превышайте 15 мг в день.
Нормальные доношенные дети, которые не находятся на грудном вскармливании или находятся на частичном грудном вскармливании: 1 мг / кг в день, предпочтительно в виде смеси, обогащенной железом, начиная с рождения и продолжая в течение первого года жизни. Не превышайте 15 мг в день.
Детям в возрасте ≥10 лет, у которых начался период полового созревания, может потребоваться ежедневный прием добавок железа в дозе 2 или 5 мг в день для мужчин или женщин, соответственно.
Исходя из необходимости поддерживать нормальную функциональную концентрацию железа, но с минимальными запасами, RDA составляет цель для диетического потребления людьми.
Установлено для младенцев в возрасте до 6 месяцев на основе наблюдаемого среднего потребления железа младенцами, которых кормили главным образом грудным молоком.
Возраст | RDA (мг / день) | AI (мг / день) |
|---|---|---|
Младенцы в возрасте 0–6 месяцев | 0,27 | |
Младенцы 7–12 месяцев | 11 | |
Дети 1–3 лет | 7 | |
Дети 4–8 лет | 10 | |
Дети 9–13 лет | 8 | |
Дети 14–18 лет | Мальчики: 11 Девочек: 15 |
Лечение
УстныйДети: 3–6 мг / кг ежедневно в 3 приема.
Если удовлетворительный ответ не отмечен после 3 недель пероральной терапии железом, следует рассмотреть возможность несоблюдения пациентом режима лечения, одновременной кровопотери, дополнительных осложняющих факторов или неправильного диагноза.
Взрослые
Железодефицитная анемия
Профилактика
УстныйRDA для здоровых мужчин всех возрастов (≥19 лет) составляет 8 мг в день.
RDA для здоровых женщин в возрасте 19–50 лет составляет 18 мг в день, а RDA для здоровых женщин в возрасте ≥51 года составляет 8 мг в день.
Лечение
УстныйОбычная терапевтическая дозировка: 50–100 мг 3 раза в день. Меньшие дозировки (например, 60–120 мг в день) также рекомендуются, если пациенты не переносят пероральное введение железа, но следует учитывать возможность того, что запасы железа будут пополняться медленнее.
Если удовлетворительный ответ не отмечен после 3 недель пероральной терапии железом, рассмотрите возможность несоблюдения пациентом режима лечения, одновременной кровопотери, дополнительных осложняющих факторов или неправильного диагноза.
Нормальные значения гемоглобина обычно достигаются через 2 месяца, если кровопотеря не продолжается. При тяжелой недостаточности продолжайте терапию железом примерно 6 месяцев.
Особые группы населения
Почечная недостаточность
Железодефицитная анемия
Анемия хронической почечной недостаточности у гемодиализных пациентов, получающих эпоэтин альфа
УстныйДети: 2–3 мг / кг в день в 2 или 3 приема.
Взрослые: ≥200 мг в день в 2 или 3 приема.
Беременные
RDA для беременных женщин в возрасте 14–50 лет составляет 27 мг в день.
Кормящие женщины
RDA для кормящих женщин 14–18 или 19–50 лет составляет 10 или 9 мг в день, соответственно.
Предупреждения о препаратах железа, орально
Противопоказания
Предупреждения и меры предосторожности
Предупреждения
Детям младше 12 лет, беременным или кормящим женщинам перед применением железосодержащих препаратов следует проконсультироваться с врачом.
Случайная передозировка
Возможное смертельное отравление у детей младше 6 лет; хранить железосодержащие препараты в недоступном для детей месте.
При случайной передозировке немедленно обратитесь к врачу или в токсикологический центр.
Чувствительность Реакция
Аллергические реакции
Возможные аллергические реакции (например, бронхиальная астма) на таблетки Fergon по 225 мг, содержащие краситель тартразин (желтый № 5 FD&C). Используйте с осторожностью, особенно у пациентов, чувствительных к аспирину.
Основные токсические вещества
Избыточные склады железа
Возможно избыточное хранение железа при вторичном гемохроматозе; не рекомендуется для лечения гемолитической анемии (если также не существует железодефицитного состояния) или для пациентов, получающих повторные переливания крови.
Не применять в течение> 6 месяцев, за исключением пациентов с продолжающимся кровотечением, меноррагией или повторной беременностью.
Общие меры предосторожности
Инфекционные осложнения
Возможная повышенная патогенность некоторых микроорганизмов, включая возможные неблагоприятные воздействия на прогноз у ВИЧ-инфицированных; не рекомендуется для людей без подтвержденного дефицита железа.
Использование фиксированной комбинации
При использовании в фиксированной комбинации с другими агентами следует учитывать предостережения, меры предосторожности и противопоказания, связанные с сопутствующими агентами.
Конкретные группы населения
Лактация
Распространен в молоко.
Общие побочные эффекты
Запор, диарея, темный стул, тошнота, боль в эпигастрии.
Взаимодействия для препаратов железа, орально
Специальные лекарства, продукты питания и лабораторные тесты
Наркотики, продукты питания или тесты | Взаимодействие | Комментарий |
|---|---|---|
Антациды или алюминийсодержащие фосфатсвязывающие вещества | Может снизить абсорбцию железа | Вводите эти препараты как можно дальше друг от друга |
Кальциевые добавки | Фармакокинетическое (снижение абсорбции железа) взаимодействие | Управлять с интервалом не менее 2 часов |
Хлорамфеникол | Возможный отсроченный ответ на терапию железом | Избегайте одновременного употребления |
Еда | Поглощение железа может ингибироваться полифенолами (например,г., из некоторых овощей), дубильные вещества (например, из чая), фитаты (например, из отрубей) и кальций (например, из молочных продуктов) | Принимать за 1 час до или через 2 часа после еды |
H 2 антагонисты рецепторов | Повышение pH желудочного сока и, возможно, снижение абсорбции GI пероральных препаратов железа, растворение и абсорбция которых зависит от кислотности желудочного сока | Ввести пероральное введение железа не менее чем за 1 час до приема антагонистов рецепторов H 2 |
Железо парентеральное | Токсичность для железа | Одновременное применение не рекомендуется |
Метилдопа | Фармакокинетические (снижение всасывания метилдопы при пероральном приеме) и фармакологические (снижение гипотензивного эффекта) взаимодействия | Монитор BP |
Пеницилламин | Может уменьшать медноуретический эффект пеницилламина, вероятно, за счет уменьшения его абсорбции. | Управлять с интервалом не менее 2 часов |
Хинолоновые противоинфекционные препараты | Фармакокинетическое взаимодействие (железо может препятствовать абсорбции хинолона) | Управлять с интервалом не менее 2 часов |
Тесты на обнаружение скрытой крови в стуле | Возможные ложноположительные результаты гваякового теста | Используйте вместо бензидинового теста |
Тетрациклины | Фармакокинетическое взаимодействие (снижение перорального всасывания железа и тетрациклинов) | Ввести тетрациклин через 3 часа после или за 2 часа до перорального приема железа |
Тиреоидные агенты | Возможное фармакокинетическое взаимодействие (снижение всасывания тироксина) | Администрирование с интервалом не менее 2 часов и мониторинг функции щитовидной железы |
Витамин C | Повышенное всасывание железа из желудочно-кишечного тракта (с содержанием витамина С> 200 мг на 30 мг элементарного железа) | Одновременное применение может быть полезным, особенно у младенцев |
Препараты железа, оральная фармакокинетика
Поглощение
Биодоступность
Всасывание зависит от формы вводимого железа (например,g., более легко усваивается форма железа), доза, степень эритропоэза, диета и запасы железа. У людей с дефицитом железа увеличивается всасывание железа в желудочно-кишечном тракте.
Пероральная биодоступность железа может варьироваться от <1% до> 50%, и основным фактором, контролирующим абсорбцию железа в ЖКТ, является количество железа, хранящегося в организме.
Начало
Симптомы анемии обычно улучшаются в течение нескольких дней; нормальные значения гемоглобина обычно достигаются через 2 месяца, если кровопотеря не продолжается.
Еда
Еда снижает всасывание неорганического железа. (См. Еда в разделе «Взаимодействия».)
Распределение
Протяженность
Существует у человека почти исключительно в виде комплекса с белком или молекулами гема.
Пересекает плаценту и попадает в молоко.
Ликвидация
Метаболизм
Встречается в практически закрытой системе.
Маршрут ликвидации
Большая часть железа, высвобождаемого в результате разрушения гемоглобина, сохраняется и повторно используется организмом.Кровопотеря значительно увеличивает потерю железа.
Устойчивость
Хранилище
Устный
Капсулы, растворы, суспензии, таблетки
Комнатная температура (15–30 ° C). Беречь от чрезмерного тепла и влаги.
Действия
Корректирует нарушения эритропоэза, вызванные дефицитом железа.
Не стимулирует эритропоэз и не корректирует нарушения гемоглобина, не вызванные дефицитом железа.
Рекомендации пациентам
Риск смертельного отравления у детей младше 6 лет; важность хранения железосодержащих продуктов в недоступном для детей месте.
Важность информирования женщин своих врачей о том, что они беременны или планируют забеременеть или планируют кормить грудью.
Важность информирования врачей о существующей или предполагаемой сопутствующей терапии, включая рецептурные и безрецептурные препараты, а также о любых сопутствующих заболеваниях.
Важность информирования пациентов о другой важной информации о мерах предосторожности. (См. Предостережения.)
Препараты
Наполнители в имеющихся в продаже лекарственных препаратах могут иметь клинически важные эффекты у некоторых людей; для получения подробной информации обратитесь к маркировке конкретного продукта.
За информацией о нехватке одного или нескольких из этих препаратов обращайтесь в Ресурсный центр по нехватке лекарств ASHP.
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
оральный | Подвеска | 15 мг (железа) на 1 штуку.25 мл | Icar Педиатрический | Боярышник |
Таблетки | 45 мг (железа) | Feosol Каплеты | GlaxoSmithKline | |
Таблетки жевательные | 15 мг (железа) | Icar Педиатрический | Боярышник |
* доступно у одного или нескольких производителей, дистрибьюторов и / или переупаковщиков под общим (непатентованным) названием
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
оральный | Таблетки | 200 мг (66 мг железа) | Ircon | Kenwood |
324 мг (106 мг железа) * | Гемоцит | Фармацевтическая промышленность США | ||
325 мг (107 мг железа) * | Таблетки фумарата железа | CMC | ||
350 мг (115 мг железа) | Нефро-Фер | Научно-исследовательские лаборатории | ||
Таблетки жевательные | 100 мг (33 мг железа) | Феостат | Лес |
* доступно у одного или нескольких производителей, дистрибьюторов и / или переупаковщиков под общим (непатентованным) названием
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
оральный | Капсулы расширенного выпуска | 150 мг (50 мг железа) с докузатом натрия 100 мг * | Фумарат железа с DSS Капсулы с ограничением по времени | Vita-Rx |
Таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой | 150 мг (50 мг железа) с докузатом натрия 100 мг | Ferro-DSS Каплеты | Ограничения времени | |
Ферро-сиквелы (с повидоном) | Инвернесс |
* доступно у одного или нескольких производителей, дистрибьюторов и / или переупаковщиков под общим (непатентованным) названием
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
навалом | Порошок | |||
оральный | Таблетки | 225 мг (27 мг железа) | Фергон (с тартразином) | Байер |
Таблетки глюконата железа | IVAX, United Research | |||
300 мг (35 мг железа) | Таблетки глюконата железа | Апшер-Смит | ||
320 мг (37 мг железа) * | ||||
325 мг (38 мг железа) * |
* доступно у одного или нескольких производителей, дистрибьюторов и / или переупаковщиков под общим (непатентованным) названием
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
навалом | Порошок | |||
оральный | Решение | 220 мг (44 мг железа) на 5 мл * | Эликсир сульфата железа | Alpharma, IVAX, United Research |
300 мг (60 мг железа) на 5 мл | Раствор сульфата железа | Pharmaceutical Associates | ||
125 мг (25 мг железа) на мл * | Fer-Gen-Sol Капли | IVAX | ||
Fer-In-Sol Капли (с содержанием спирта 0.02%) | Мид Джонсон | |||
Таблетки | 195 мг (39 мг железа) * | Mol-Iron (с бутилпарабеном и повидоном) | Schering-Plough | |
300 мг (60 мг железа) * | Feratab | Апшер-Смит | ||
325 мг (65 мг железа) * | ||||
Таблетки с энтеросолюбильным покрытием | 325 мг (65 мг железа) * | Таблетки сульфата железа EC | IVAX, Загон | |
Таблетки, покрытые пленочной оболочкой | 325 мг (65 мг железа) | Таблетки сульфата железа | United Research |
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
оральный | Капсулы | 190 мг (60 мг железа) | ||
Таблетки | 200 мг (65 мг железа) | Феосол | GlaxoSmithKline | |
Таблетки расширенного выпуска | 160 мг (50 мг железа) | Медленный FE | Новартис |
Маршруты | Лекарственные формы | Сильные стороны | Торговые марки | Производитель |
|---|---|---|---|---|
оральный | Капсулы | 150 мг (железа) | Феррекс -150 | Брекенридж |
железо-железо 150 | Ethex | |||
Hytinic | Хайрекс | |||
Niferex -150 (с бензиловым спиртом и парабенами) | Ther-Rx | |||
Решение | 100 мг (железа) на 5 мл | Niferex Эликсир (с содержанием спирта 10%) | Ther-Rx | |
Таблетки, покрытые пленочной оболочкой | 50 мг (железа) | Ниферекс | Ther-Rx |
Оральные препараты железа также коммерчески доступны в сочетании с витаминами и минералами и оральными контрацептивами.
AHFS DI Essentials ™. © Авторское право 2021 г., избранные изменения, 23 октября 2017 г. Американское общество фармацевтов систем здравоохранения, Inc., 4500 East-West Highway, Suite 900, Bethesda, Maryland 20814.
Показать ссылки на статьи
Заявление об отказе от ответственности
Фармакокинетика и фармакодинамика препаратов железа
Резюме
Стандартные подходы не подходят при оценке фармакокинетики добавок железа из-за повсеместного распространения эндогенного железа, участков его действия и сложности метаболизма железа.Первичным местом действия железа является эритроцит, и, в отличие от обычных лекарств, взаимодействия лекарство-рецептор не происходит. Примечательно, что процесс эритропоэза, , т.е. , образования новых эритроцитов занимает 3-4 недели. Соответственно, концентрация железа в сыворотке и площадь под кривой (AUC) не имеют клинического значения для оценки утилизации железа. Железо можно вводить внутривенно в форме полиядерных комплексов гидроксида железа (III) с углеводными лигандами или перорально в виде солей железа (II) (двухвалентного) или комплексов железа (III) (трехвалентное).Для изучения фармакодинамики железа после перорального приема использовалось несколько подходов. Количественная оценка поглощения железа из радиоактивно меченных препаратов всем организмом или эритроцитами является оптимальной, но в качестве альтернативы общий перенос железа можно рассчитать на основе известных скоростей выведения и внутренней реактивности отдельных препаратов. Кинетика разложения и, следовательно, безопасность препаратов железа для парентерального введения напрямую связаны с молекулярной массой и стабильностью комплекса.Высокие пероральные дозы железа или быстрое высвобождение железа из внутривенных препаратов железа могут привести к насыщению системы транспорта железа, что приведет к окислительному стрессу с неблагоприятными клиническими и субклиническими последствиями. Соответствующие фармакокинетические и фармакодинамические анализы в значительной степени помогут нам понять вероятный вклад новых препаратов в лечение анемии.
Ключевые слова: железо, фармакокинетика, фармакодинамика, комплекс железа, метаболизм, выведение, кинетика, эффективность, безопасность
1.Введение
Железо — важный компонент каждой клетки тела. Хотя железо наиболее известно своей важной ролью в транспортировке и хранении кислорода (в гемоглобине и миоглобине соответственно), в большом количестве ферментов железо также действует как переносчик электронов, катализатор оксигенации, гидроксилирования и необходимо для клеточного рост и распространение. Добавки железа широко применяются для лечения железодефицитной анемии, особенно при хронических заболеваниях, таких как заболевание почек [1], сердечная недостаточность [2] или воспалительное заболевание кишечника [3].Без достаточного количества железа невозможно синтезировать гемоглобин и поддерживать количество эритроцитов в крови на адекватном уровне [4]. Однако из-за повсеместного распространения железа, его отдельных участков действия и сложного метаболизма обычные измерения фармакокинетики, такие как концентрация в сыворотке, в значительной степени не имеют значения при оценке биодоступности и эффективности препаратов железа [5]. Таким образом, фармакокинетические и фармакодинамические оценки препаратов железа не могут основываться на стандартных принципах, применимых к неэндогенным лекарствам.
Понимание метаболизма железа лежит в основе любого рассмотрения его фармакологии (). Железо обычно существует в двухвалентном (Fe 2+ ) или трехвалентном (Fe 3+ ) состоянии, но поскольку Fe 2+ легко окисляется до Fe 3+ , который в нейтральных водных растворах быстро гидролизуется до нерастворимого гидроксиды железа (III), железо транспортируется и хранится связанным с белками. Эффективное связывание железа важно не только для обеспечения его доступности там и тогда, когда это необходимо, но и потому, что Fe 2+ может катализировать образование активных форм кислорода, которые вызывают окислительный стресс, повреждая клеточные компоненты.Три ключевых белка регулируют транспортировку и хранение железа. Трансферрин транспортирует железо в плазме и внеклеточной жидкости. Рецептор трансферрина , экспрессируемый клетками, которым требуется железо, и присутствующий в их мембранах, связывает комплекс трансферрина дихелеса и интернализует его в клетку. Ферритин — это белок, запасающий железо, который изолирует железо, сохраняя его в легкодоступной форме. Около 60% железа содержится в эритроцитах в составе гемоглобина [6], белка, переносящего кислород.Остальная часть находится в миоглобине в мышцах, во множестве различных ферментов («гем» и «негем») и в форме хранения. Большая часть железа хранится в форме ферритина, который содержится в печени, костном мозге, селезенке и мышцах. Сывороточное железо (, т. Е. , железо, связанное с трансферрином) составляет лишь очень небольшую долю от общего железа в организме (<0,2%) [7]. Более того, взаимосвязь между физиологическими компартментами железа очень динамична: эритроциты разрушаются в печени и селезенке, а в костном мозге образуются новые эритроциты.Общий пул сывороточного железа составляет примерно 4 мг, но нормальный дневной оборот не превышает 30 мг [7], так что незначительные изменения уровня сывороточного железа из-за введения экзогенного железа не имеют клинического значения. В этом случае обычные измерения концентрации железа в сыворотке не дают никакой информации о доступности функционального железа для физиологических процессов, и необходимо применять другие стратегии оценки.
Схематическое изображение метаболизма железа. В нормальных условиях железо в организме находится в динамическом равновесии между различными отделениями (сплошные стрелки).Из примерно 10 мг железа, поступающего с пищей, 1-2 мг абсорбируются энтероцитами двенадцатиперстной кишки и такое же количество теряется, например, при отшелушивании кожи. В кровотоке железо связывается с трансферрином ( около 3 мг), который безопасно транспортирует его, например, в костный мозг для синтеза гемоглобина. Примерно две трети железа в организме содержится в форме гемоглобина, в красных кровяных тельцах (1800 мг) и в предшественниках эритроидов в костном мозге (300 мг), тогда как 10-15% присутствует в миоглобине и в множество различных незаменимых ферментов.Железо хранится в паренхимных клетках печени ( около ,1000 мг). Ретикулоэндотелиальные макрофаги временно хранят железо, переработанное из стареющих эритроцитов (600 мг), в легкодоступной форме. Эритропоэтин, вырабатываемый почками, регулирует всасывание железа двенадцатиперстной кишки и эритропоэз (пунктирные линии). По материалам Crichton, 2008 [7].
2. Фармакокинетика железа
Основной целью фармакокинетических анализов является определение биодоступности, определяемой Европейским агентством по лекарственным средствам как «скорость и степень, в которой активное вещество или активный компонент абсорбируется из фармацевтической формы и становится доступным. на месте действия »[8].Обычно биодоступность оценивается на основе сывороточной концентрации вводимого продукта. Однако эта модель применима только в том случае, если существует классическое взаимодействие лекарственного средства с рецептором на клеточных мембранах, так что эффективность хорошо коррелирует с концентрацией лекарственного средства в сыворотке. В случае железа первичным местом действия является эритроцит, а участки хранения железа имеют второстепенное значение.
Было предложено несколько определений биодоступности железа (см. Обзор Wienk et al. [9]), но по общему мнению, это должна быть количественная мера доли общего количества железа, которое абсорбируется и метаболизируется, то есть , которое включается в гемоглобин [9]. Как следствие, концентрация в сыворотке не имеет значения. Примечательно, что процесс эритропоэза занимает 3-4 недели [4], так что утилизация железа с момента введения достигает пика примерно через 2-3 недели [10] и кратковременная площадь под кривой (AUC) значений сывороточного железа (например, более 8 часов) имеют гораздо меньшее значение, чем долгосрочные (например,g., 3 месяца) значения поглощения железа эритроцитами. Количество железа в сыворотке представляет собой лишь небольшую часть железа, которая переносится к месту действия, которая не пропорциональна пиковой концентрации в сыворотке (C max ) или величине AUC, а скорости передачи. и выведение в сыворотку и из нее. Таким образом, очевидно, что необходимы другие подходы к оценке фармакокинетики железа [11-13].
2.1. Фармакокинетика железа после внутривенного введения
Железо вводится внутривенно в виде углеводных комплексов железа, состоящих из минерального ядра, состоящего из полиядерного гидроксида железа (III), окруженного углеводным лигандом [14].Основная функция лиганда — стабилизировать комплекс и защитить его от дальнейшей полинуклеаризации. Примеры включают Venofer ® (сахароза железа), Ferinject ® (карбоксимальтоза трехвалентного железа), Ferrlecit ® (глюконат натрия и железа в сахарозе для инъекций) и различные препараты декстрана железа. Комплексы углеводов железа этого типа ведут себя как пролекарства, поскольку железо должно высвобождаться из ядра гидроксида железа (III). Согласно предложенному механизму, после введения стабильные комплексы, такие как карбоксимальтоза железа и декстран железа, поглощаются эндоцитозом макрофагами ретикулоэндотелиальной системы (RES) [14].На следующем этапе эндосома сливается с лизосомой, и кислая и восстанавливающая среда в эндолизосоме приводит к отщеплению железа от комплекса. Генерированный Fe 2+ транспортируется переносчиком двухвалентного металла 1 (DMT1) через эндолизосомную мембрану, чтобы попасть в пул лабильного железа в цитоплазме макрофагов. Оттуда он может быть включен в ферритин и временно сохраняться в макрофаге или может транспортироваться из макрофага с помощью трансмембранного белка ферропортина (как Fe 2+ ).Экспортируемый Fe 2+ немедленно окисляется церулоплазмином до Fe 3+ , который секвестрируется трансферрином для транспортировки в сыворотке к участкам утилизации, например, в костном мозге для синтеза гемоглобина или в печени для хранения в ферритин.
Однако в случае менее стабильных препаратов этот строго регулируемый процесс высвобождения железа из углеводных комплексов может быть нарушен. Здесь высвобождение значительных количеств лабильного железа из комплекса может привести к насыщению трансферрина и, таким образом, к значительным количествам несвязанного трансферрина железа (NTBI), особенно при введении высоких доз.Этот слабо связанный Fe 3+ легко нерегулируемым образом поглощается клетками эндокринной системы, сердца и печени, где он может вызывать окислительный стресс, катализируя перекисное окисление липидов и образование активных форм кислорода [15].
В целом, комплексы можно классифицировать как лабильные или устойчивые (кинетическая изменчивость, , т.е. , как быстро могут быть обменены лиганды, координированные с железом), так и слабые или сильные (термодинамическая изменчивость, , т.е. , насколько сильно лиганды связаны с железом). железо, и, следовательно, сколько энергии требуется для диссоциации лиганда от железа) или в любом промежуточном состоянии () [7].Реакционная способность каждого комплекса обратно пропорциональна его молекулярной массе, т.е. более крупных комплексов менее склонны к высвобождению значительных количеств лабильного железа или непосредственному взаимодействию с трансферрином [14,17]. Комплексы типа I, такие как препараты декстрана железа (Имферон ® , Cosmofer ® , InFeD ® , Dexferrum ® ) или карбоксимальтоза железа (Ferinject ® ) имеют высокую молекулярную массу и высокую структурную однородность, и , таким образом, доставлять железо из комплекса к трансферрину регулируемым образом посредством эндоцитоза макрофагов и последующего контролируемого экспорта [7,10].Такие комплексы можно вводить внутривенно, и они клинически хорошо переносятся даже в высоких дозах [17]. Комплексы типа II (комплексы железа с сахарозой, такие как Venofer ® ) являются полуустойчивыми и умеренно сильными и выделяют большие количества слабосвязанного железа в кровь. Таким образом, большее количество железа поглощается непосредственно трансферрином и другими белками, и только ядро железа захватывается посредством эндоцитоза макрофагами ретикулоэндотелиальной системы. Несмотря на более низкую молекулярную массу и стабильность комплекса по сравнению с комплексами типа I, комплексы типа II по-прежнему подходят для внутривенного введения.Тем не менее, максимальные разовые дозы значительно ниже, а время введения значительно больше. Комплексы типа III и IV, включая глюконат натрия и железа (Ferrlecit ® ) и железо (III) -цитрат + железо (III) -сорбитол + декстрин железа (Jectofer ® ), содержат различные количества низкомолекулярных компонентов (< 18000 Дальтон), и они обычно лабильны и слабы [17]. Как правило, внутривенное применение препаратов, содержащих большое количество комплексов с молекулярной массой ниже 18 000 Дальтон, следует проводить с осторожностью [17].Эти типы комплексов железа могут генерировать большие количества NTBI, которые затем могут связываться с различными типами белков - только если они вводятся в малых дозах, железо поглощается в основном макрофагами (эндоцитоз). Более того, все комплексы железа с молекулярной массой ниже 18 000 Дальтон подвержены нежелательному вымыванию почками [17].
Таблица 1.
Классификация препаратов комплекса углеводов железа для внутривенного введения [17].
| Тип I | Тип II | Тип III | Тип IV | |||
|---|---|---|---|---|---|---|
| Пример | Ферро-карбоксимальсодержащий сахар | Ферро-карбоксималь- | Железо декстрановое железо Натрия трехвалентное глюконат Железо (III) -цитрат Железо (III) -сорбитол | Железо (III) -цитрат + железо (III) -сорбитол + железо декстрин Глюконат натрия трехвалентного + железо сахароза | ||
| Препараты | Ferinject ® * InFeD ® Cosmofer ® Imferon ® Dexferrum ® Feraheme ® | Je1478 Venofer ®| Venofer ® | Ferrlecit ® | |||
| Характеристики | Прочный Прочный | Полуустойчивый Модер достаточно сильный | Лабильный слабый | Смеси, содержащие не менее двух различных комплексов железа | ||
| Молекулярная масса (дальтон) | > 100000 | 30 000–100 000 | <50 000 | <50 000 | ||
| In vitro кинетика разложения (k × 10 3 / мин при θ = 0.5) [16] | 15–50 | 50–100 | > 100 | > 100 | ||
| In vitro процентное содержание железа в трансферрине (%) [18] | 2,4 — 3,4 (декстран железа ) | 4,5 (Venofer ® ) | Недоступно | 5,8 (Ferrlecit ® ) | ||
| LD 50 (мг железа / кг) | 1013 (декстран железа) | 359 (Venofer ® ) | Недоступно | 155 (Ferrlecit ® ) |
иллюстрирует результаты исследования in vitro , в котором сравнивается относительная реакционная способность Ferinject ® , Venofer 914 и Ferrlecit ®. в сторону апотрансферрина.В этом эксперименте апотрансферрин инкубировали с различными количествами трех внутривенных препаратов железа в конечной концентрации, эквивалентной концентрации, ожидаемой в сыворотке крови взрослого пациента после инъекции ~ 200 или ~ 2000 мг железа. Примечательно, что Ferinject ® имеет значительно более низкую реакционную способность, чем два других комплекса. Даже при дозе, эквивалентной ~ 2000 мг железа, Ferinject ® не вызывает полного насыщения трансферрина. Слабо связанные низкомолекулярные компоненты приводят к насыщению трансферрина, и последующий окислительный стресс, вызванный NTBI, приводит к побочным эффектам, таким как гипотония, тошнота, рвота, боли в животе и пояснице, периферические отеки и металлический привкус [19].
In vitro реактивность Ferinject ® , Venofer ® и Ferrlecit ® с апотрансферрином. Электрофорез в полиакриламидном геле мочевины (PAGE) трансферрина, инкубированного с различными количествами различных внутривенных препаратов железа. Apo-Tf, трансферрин без железа; Fe-Tf, трансферрин с одним занятым сайтом связывания железа; Fe 2 -Tf, трансферрин, в котором оба сайта связывания железа заняты [голотрансферрин]. Реактивность по отношению к апотрансферрину была самой низкой с наиболее стабильным комплексом i.е. Ferinject ® . При концентрациях, эквивалентных тем, которые ожидаются в сыворотке крови взрослого человека после терапевтической дозы ∼200 или ∼2000 мг железа, насыщение трансферрина наблюдалось с Ferrlecit ® и Venofer ® , но не с Ferinject ® (Техническое сообщение , Vifor Pharma — Vifor International Inc).
Молекулярная масса внутривенных углеводных комплексов железа сильно влияет не только на скорость высвобождения железа из ядра, но и на скорость выведения из плазмы [14].Фактически, комплексы типа I имеют длительный период полувыведения, например, Ferinject ® 7–12 часов и декстран железа 1–3,5 дня (в зависимости от дозы) по сравнению с периодом полувыведения 5–6 часов. для сахарозы железа (Venofer ® ) [20] и <4 часов для типов III и IV [7] (например, Ferrlecit ® 1–1,5 часа [21]). Параметры фармакокинетики различных препаратов железа для внутривенного введения были измерены в отдельных исследованиях фазы I в аналогичных условиях [20–22,24,25].Основываясь на этих параметрах, мы рассчитали нормализованную AUC после внутривенного введения дозы 100 мг железа для различных комплексов углеводов железа (). Результаты ясно показывают, что на AUC сильно влияет скорость конечного выведения, которая зависит от молекулярной массы комплекса, а не от дозы (). Более того, приведенные на фигуре стандартизованные кривые выведения, рассчитанные на основе значений скоростей конечного выведения, приведенных в, ясно показывают отрицательную корреляцию между AUC и константами скорости выведения.
Нормализованная симулированная однократная кинетика выведения первого порядка для различных внутривенных препаратов железа, отображаемая как доля общего сывороточного железа с течением времени. Значения конечных скоростей выведения, приведенные в, использовали для расчета общей кинетики первого порядка и значений t 1/2 . Рисунок ясно показывает, что AUC отрицательно коррелирует с константами скорости выведения.
Таблица 2.
Параметры фармакокинетики препаратов железа для внутривенного введения.
| Параметр | Феррлецит ® Глюконат натрия и железа | Венофер ® Железо сахароза | Ферринджект 14 ® Ферринджект 14 Железо Феррич декстран USP / BP | Feraheme ® Ферумокситол | |||
|---|---|---|---|---|---|---|---|
| Молекулярная масса (Дальтон) | 37,500 1 200,000 2 | 9 9 215000 2 9 21152 9 1 103,000 1 410,000 2 | 185,000 1 731,000 2 | ||||
| Реакция с трансферрином | Низкая | Низкая | Низкая | Низкая | |||
| Дозировка, используемая для следующих PK характеристики, мг Fe | 125 3 | 100 4 | 100/1000 5 | 500–2000 6 | 316 7 | ||
| клемма k el , h -1 | 0.488 | 0,145 | 0,094 / 0,074 | 0,024 6 | 0,048 | ||
| k 0 , мг Fe / L * h | — | 0,1 8 | Не наблюдается 10–20 9 | Не наблюдается | |||
| клемма t 1/2 , h | 1,42 | 5,3 | 7,4 / 9,4 | 27–30 10 | 14,7 | ||
| C макс , мг Fe / л | 20.6 | 35,3 | 37/331 | — | 130 | ||
| AUC, мг Fe / л * ч | 43,7 | 83,3 | 333/6 277 | 6,853 11 57 | 6,853 11 | ||
| AUC, стандартизованная для дозы 100 мг Fe, мг Fe / л * ч | 35,0 | 83,3 | 333 / 627,7 | 1,371 | 922 | ||
| MRT, h | 5.5 | 11.2 / 16,5 | — | — | |||
| CL, л / ч | 2,99 | 1,23 | 0,26 / 0,16 | — | 0,11 | ||
| V c , L | 6,02 | 3,2 | 2,7 / 2,1 | 3,0 | 2,3 | ||
| Перенос железа, мг Fe / день | Не рассчитано | 31,0 | Недоступно | 240–480 9 | Недоступно |
Таким образом, средняя сывороточная концентрация и AUC не увеличиваются линейно с дозой введенного железа, а обратно коррелируют со скоростью выведения [22,26].Изучение кривых общей концентрации железа в сыворотке после внутривенного введения показало, что выведение железа из сыворотки можно объяснить перекрытием (наложением) нулевого порядка (постоянная скорость) и функции выведения первого порядка [14,20, 24]. Эта модель объясняет нелинейную зависимость между введенной дозой и значением AUC [12]. Используя открытую двухкомпонентную модельную систему с базовым уровнем, а также с основным термином Михаэлиса-Ментен, уровень сывороточного железа можно рассчитать по следующей формуле [20]:
C (t) = ae −αt + be −βt + C B — k 0 t
где C (t) — зависящая от времени концентрация железа в сыворотке крови, a, b, α и β — гибридные константы, C B — уровень железа перед введением, а k 0 t — термин Михаэлиса-Ментен.Окончательный объем распределения обычно составляет около 3 литров на человека весом 70 кг. С помощью k 0 можно рассчитать количество железа, захваченного макрофагами, и / или железа, перенесенного трансферрином в другие компартменты. По дозе (D) и разнице между первым постдозовым уровнем C 0 и уровнем C B до введения дозы можно определить объем распределения в центральном отсеке V c .
2.2. Фармакокинетика железа после перорального применения
Абсорбция железа из кишечника тщательно регулируется.Поскольку после попадания в кровоток железа не происходит активного выведения, контроль над уровнем железа в организме осуществляется на уровне энтероцитов. Железо в пище в форме Fe 3+ восстанавливается до Fe 2+ дуоденальным цитохромом b (Dcyt b ) в мембране энтероцита, а затем доставляется DMT1 в цитоплазму энтероцита, где он может либо храниться в виде ферритина, либо экспортироваться в сыворотку через базолатеральный транспортный белок ферропортин [27].Этот экспортный белок связан с мульти-медными оксидазами (гефестин в мембране или церулоплазмин в сыворотке), которые окисляют Fe 2+ до Fe 3+ , который, наконец, прочно связывается с трансферрином [27]. Механизм поглощения гемового железа, полученного из мяса, изучен недостаточно. Было высказано предположение, что мембрана энтероцитов также содержит белок, который может транспортировать гемовое железо из просвета кишечника в цитозоль (HCP1) [28]. Однако позже было показано, что этот же белок отвечает за транспорт фолиевой кислоты в кишечнике со значительно более высокой аффинностью [29–31].В энтероците Fe 2+ высвобождается из гема в процессе, катализируемом гемоксигеназой [32], и входит в тот же цитозольный пул, что и негемовое железо.
Типичная диета содержит примерно 10–20 мг железа в день, но физиологический путь усвоения с фиксированной скоростью позволяет усваивать только до 5 мг за раз [13,33]. Таким образом, терапевтическая доза перорального железа, составляющая, например, 100 мг, значительно превышает количество, которое может быть поглощено посредством активного пути всасывания. Из-за физико-химических свойств солей двухвалентного железа пассивное поглощение происходит параклеточным путем [33], так что часть Fe 2+ в кишечнике всасывается непосредственно кровью.В нормальных условиях трансферрин в крови насыщен примерно на треть [7]. Однако под давлением пассивной диффузии трансферрин насыщается, и NTBI циркулирует в плазме, поглощается через нерегулируемый механизм эндокринными и сердечными клетками, что приводит к реакциям окислительного стресса в этих тканях. У быстро всасываемых препаратов NTBI можно наблюдать даже до того, как трансферрин полностью насыщается.
иллюстрирует количественное определение NTBI в образцах сыворотки взрослых добровольцев с нормальными запасами железа после перорального приема 100 мг железа в форме солей двухвалентного железа [34].Концентрации NTBI до 9 мкМ наблюдались в течение первых четырех часов после введения дозы, даже если насыщение трансферрина (TSAT) было ниже 100%. Значительные уровни NTBI были обнаружены даже при более низких дозах, например, 10 мг железа в виде аскорбата железа или сульфата глицина железа [34]. В том же исследовании сообщалось, что железо (III) -полимальтоза в дозе 150 мг железа приводила к максимальной концентрации NTBI всего 0,7 мкМ, что близко к пределу обнаружения использованного анализа [34]. Интересно, что подобное исследование показало, что значительные уровни NTBI также образуются при приеме пероральных препаратов железа на основе солей двухвалентного железа с пищей [35].По мере того как доза железа, вводимая в форме солей двухвалентного железа, увеличивается, доля железа, абсорбированного пассивным параклеточным путем, увеличивается, так что повышается NTBI [34], что согласуется с дозозависимым характером побочных эффектов, связанных с пероральной терапией железом [36]. ]. Однако даже пассивная абсорбция может стать такой насыщенной, что постоянно увеличивающиеся дозы перорального железа не приводят к пропорционально более высокой AUC, что было продемонстрировано Экенведом и его коллегами после введения 25, 50 и 100 мг железа в виде раствора сульфата железа (2). [37].Поэтому модель линейной фармакокинетики может быть исключена [13]. Таким образом, максимальное увеличение сывороточного железа, например, на 20 мкмоль / л, может соответствовать абсорбции железа в кишечнике от 3,5 до 17 мг [37,38].
Концентрация железа, не связанного с трансферрином (NTBI), и процентное насыщение трансферрина (TSAT) в сыворотке крови после приема однократной пероральной дозы 100 мг железа в форме трех различных солей двухвалентного железа здоровым взрослым добровольцам. Пунктирные синие линии указывают процент насыщения трансферрина (правая ось).Сплошные красные линии показывают концентрацию NTBI (левая ось). Показанные значения являются средними ± стандартное отклонение. Изменено из Dresow et al. 2008 [34].
Повышение концентрации железа в сыворотке после введения 25, 50 и 100 мг двухвалентного железа у 6 здоровых субъектов [37]. Данные представлены как среднее ± стандартная ошибка среднего. Данные ясно показывают, что нет линейной зависимости между увеличением сывороточного железа (C max и AUC) и дозой.
Если использовать результаты других исследований, эта дисперсия увеличится еще больше [39].Напротив, Heinrich et al. [40] сообщил о некоторой лучшей корреляции между абсорбцией железа и концентрацией железа в сыворотке, измеренной через 3 часа после приема 100 мг железа натощак. Однако авторы пришли к выводу, что измерение сывороточного железа дает только полуколичественную информацию о биодоступности терапевтических препаратов железа [40]. Примечательно, что Генрих и его коллеги включили в свое исследование препараты железа (III) (цитрат железа и железо (III) -полимальтоза), несмотря на то, что известно, что абсорбция этих препаратов до семи раз лучше при приеме с food [41], и поэтому их нельзя сравнивать в одинаковых условиях (например,г., пустой желудок).
Концентрация железа в сыворотке крови после перорального приема сильно зависит от кинетики инвазии и выведения. Как и при внутривенном введении, выведение железа после перорального приема железа может иметь функцию нулевого порядка [13]. Более быстрое всасывание из данного препарата приводит к большей сывороточной AUC и более высокой максимальной концентрации сывороточного железа, поскольку AUC сильно зависит от кинетики инвазии, поскольку скорость выведения нулевого порядка является лимитирующей стадией [13].Поскольку скорость переноса и время восстановления сывороточного железа до исходного уровня постоянны, значения AUC не отражают истинную степень абсорбции железа, а AUC не коррелирует с поглощением эритроцитами после перорального введения железа [42]. Поскольку высокая концентрация железа в сыворотке крови может приводить к NTBI с сопутствующим риском окислительного стресса и связанных с ним побочных эффектов, более высокая скорость абсорбции фактически является невыгодной.
В попытке уменьшить побочные эффекты солей двухвалентного железа были разработаны препараты с более медленным всасыванием.Фумарат железа, наименее токсичное соединение железа (II), вызывает меньше побочных эффектов из-за его низкой растворимости и медленной скорости растворения после перорального приема [7]. Фактически, скорость высвобождения ионов двухвалентного железа из фумарата железа ниже, чем из хорошо растворимого сульфата двухвалентного железа.
Одним из доступных на рынке составов фумарата железа является капсулы Ferrum Hausmann ® . Geisser et al. изучил фармакокинетику и биодоступность стандартного фумарата двухвалентного железа и этого препарата с замедленным высвобождением в рандомизированном исследовании с участием 20 здоровых добровольцев с истощенными запасами железа.Результаты показали, что два препарата были биоэквивалентными, несмотря на более медленное всасывание железа и более низкие значения AUC с препаратом с медленным высвобождением [13]. Kaltwasser et al. подтвердили, что стандартные препараты или препараты с замедленным высвобождением (в данном случае сульфат железа) обладают сходной биодоступностью железа [43].
Фармакокинетический профиль железа после перорального приема комплекса железо (III) -полимальтоза сильно отличается от профиля солей двухвалентного железа. Комплекс железо (III) -полимальтоза состоит из неионного железа (III) в форме полиядерного гидроксида железа (III) и полимальтозных лигандов.Полученный комплекс стабилен. Находясь в неионогенной форме, железо не взаимодействует с компонентами пищи и не вызывает образование активных форм кислорода.
Фармакокинетика препарата полимальтозы железа (III) Мальтофер ® была тщательно изучена. В течение первых шести часов после введения Мальтофера ® наблюдается лишь незначительное увеличение концентрации железа в сыворотке крови, , то есть , как и ожидалось, исходя из размера комплекса, пассивная диффузия через межклеточные пространства практически отсутствует [44].Тем не менее, через 2–3 недели после применения Мальтофера ® включение железа в эритроциты существенно не отличается от такового с солями двухвалентного железа [44]. Подобная биодоступность железа после введения Мальтофера ® , сульфата железа или фумарата железа была подтверждена другими авторами [45], а также сопоставимое повышение гемоглобина при использовании Мальтофера ® или сульфата железа в той же дозе (100 мг железа два раза в день) [46]. Интересно, что всасывание железа из Мальтофера ® , по-видимому, усиливается в присутствии пищи, в отличие от ситуации с пероральными солями двухвалентного железа, где абсорбция снижается.Как и в случае с более простыми препаратами, нет корреляции между AUC и биодоступностью, измеренной по поглощению железа эритроцитами [42], и, таким образом, измерения AUC сывороточного железа не имеют отношения к оценке эффективности перорального комплекса железо (III) -полимальтоза.
2.3. Фармакокинетика железа: выводы
Обширный фармакокинетический анализ и понимание путей доставки железа в соответствующие физиологические компартменты демонстрируют, что концентрация железа в сыворотке или AUC, измеренная после приема добавок железа, не может использоваться для оценки эффективности препаратов железа.В частности, кинетика абсорбции железа зависит от типа перорального препарата железа: соединения, которые всасываются медленно, неизбежно приводят к более низкому максимальному увеличению железа в плазме, меньшему AUC и, как следствие, к неверной интерпретации результатов [9]. Таким образом, в случае терапии железом эти обычные фармакокинетические маркеры не дают достоверной оценки биодоступности с точки зрения железа, используемого в эритроците для синтеза гемоглобина, или количества железа, включенного в запасной белок ферритин.
Быстрая абсорбция железа и / или высокие дозы пероральных препаратов могут привести к насыщению регулируемых механизмов активной абсорбции в кишечнике, что приведет к пассивной абсорбции, насыщению транспортного белка (трансферрина) и образованию слабосвязанного Fe 3+ (NTBI) , который может вызвать окислительный стресс. Это очень важно, так как во время пероральной терапии железом пациенты обычно принимают 2–3 таблетки в день в течение нескольких месяцев и, таким образом, подвергаются окислительному стрессу ежедневно в течение длительного времени.
3. Фармакодинамика железа
Фармакокинетические профили препаратов железа могут предоставить полезную информацию о реактивности с трансферрином, риске побочных эффектов и предложить рекомендации по возможному режиму дозирования. Однако для понимания и прогнозирования биодоступности таких препаратов требуется более подробное исследование. Несколько экспериментальных подходов к фармакодинамическому анализу позволяют оценивать и сравнивать абсорбцию железа и, таким образом, эффективность различных препаратов [9].
Методы радиомечения
Измерение поглощения радиоактивных изотопов (например, 59 Fe) во всем теле или только в эритроцитах представляет собой эталонный метод оценки биодоступности железа [9]. Подсчет всего тела определяет общее количество меченого железа, удерживаемого в организме, включая железо, временно хранящееся в ретикулоэндотелиальной системе или депонированное в ферритине печени, и как таковое является наиболее полным измерением использования железа.Подсчет эритроцитов является хорошей мерой того, сколько введенного железа используется для эритропоэза. У людей с анемией с сильным дефицитом железа практически все абсорбированное железо будет доставлено в эритроциты, и, таким образом, для этой популяции подсчет эритроцитов дает хорошую оценку использования железа (). Оценка на 14 день после введения меченого соединения с поправкой на радиоактивный распад дает время для включения изотопа в эритроциты [47]. Таким образом, утилизация железа эритроцитами обычно выражается как процентная доля железа, восстановленного в клеточной массе на 14 день после приема.Действительно, Potgieter et al. подтвердили, что существует тесная корреляция (r 2 = 0,91) между поглощением 59 Fe эритроцитами и всем телом после перорального приема железо (III) -полимальтозы (Мальтофер ® ) [42] .
Использование железа после однократного внутривенного введения радиоактивно меченой сахарозы железа (Venofer ® ) пациенту с железодефицитной анемией (изменено из Beshara et al. 1999 [10]).
Jacobs et al. Компания разработала метод двойного изотопа для сравнения биодоступности двух разных препаратов железа, при котором каждый индивидуум получает два препарата, меченных разными изотопами железа ( 55 Fe или 59 Fe), и действует как самоконтроль [45,48 ]. Используя этот метод, группа показала, что доступность железа эквивалентна после перорального приема либо сульфата железа, либо полимальтозы железа (III) (Мальтофер ® ) как в физиологических, так и в терапевтических дозах [45].
Методы маркировки стабильных изотопов
Из-за этических проблем, связанных с использованием радиоактивно меченных изотопов, в частности у детей, стабильные изотопы железа ( 57 Fe или 58 Fe) часто используются для оценки биодоступности препаратов железа. Количество поглощенного меченого железа можно рассчитать по изменению содержания изотопов железа в крови после включения в эритроциты, примерно через 14 дней после введения. Различные изотопы железа можно измерить с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) [49,50].
Расчет общего переноса железа
После перорального приема препаратов железа общее количество железа, перенесенного на метаболический путь железа (, т.е. , истинная биодоступность), можно рассчитать по концентрации железа в сыворотке, поскольку кинетика выведения железа в первую очередь следует функция нулевого порядка, а не функция первого порядка из-за фиксированной скорости реакции с трансферрином. Открытая двухкомпонентная модельная система с базовым уровнем, а также с основным термином Михаэлиса-Ментена (ММ) может применяться следующим образом [7]:
C (t) = a (1 — e −kin * t ) −k 0 t
где C (t) — концентрация сывороточного железа в момент времени t, a — постоянная величина, k в — константа скорости абсорбции железа из конкретного соединения, а k 0 — константа скорости выведения ( i.е. процесс переноса насыщенного железа). Таким образом, k 0 t — член ММ. Поскольку трансферрин легко насыщается железом (, т.е. кинетика нулевого порядка) и поскольку концентрация железа в сыворотке до введения дозы статистически значимо не отличается от измеренной через 24 часа после инъекции, показатель MM v max (максимальная скорость выведения ) можно рассматривать как эквивалент k 0 t, где v max отражает максимальную скорость переноса трансферрином.Исходя из этого термина, можно рассчитать общее количество железа, транспортируемого трансферрином за 24-часовой период наблюдения [20].
Данные исследований фумарата двухвалентного железа [13] и сульфата двухвалентного железа [43] подтвердили, что существует тесная корреляция между измеренным переносом железа в эритроциты и значением, рассчитанным по кривой, основанной на этом уравнении, для стандартных препаратов или препаратов с замедленным высвобождением. ().
Иллюстрация средней измеренной концентрации сывороточного железа (красные линии) и расчетной кривой (зеленые линии) на основе следующего уравнения: C (t) = a (1 − e −kin * t ) — k 0 t, где C (t) — концентрация железа в сыворотке крови в момент времени t, a — константа, k в — константа скорости абсорбции железа, а k 0 — константа скорости выведения.Данные взяты из открытого рандомизированного перекрестного исследования биоэквивалентности однократной дозы с участием 20 здоровых женщин-добровольцев, получавших стандартный пероральный фумарат железа или фумарат железа с медленным высвобождением в дозе, эквивалентной 100 мг железа на прием (модифицировано из Geisser et al. , 2009 [13]).
Поскольку железо демонстрирует кинетику вторжения первого порядка и элиминации нулевого порядка, общий перенос железа можно затем оценить (, т.е. биодоступность) на основе констант скорости выведения (), используя следующее уравнение [13]:
Общий перенос железа (ммоль) = k 0 (ммоль / л / ч) × tω (ч) × V d (L)
, где k 0 — константа MM удаления, tω — время для достижения общего сывороточного железа исходного уровня после введения (что является конечным временем в случае элиминации нулевого порядка), а V d — это объем распределения.Это уравнение гораздо более информативно относительно биодоступности железа, чем значение AUC в сыворотке, поскольку оно позволяет рассчитать перенос железа в компартменты (особенно в эритроциты) на основе концентрации железа в сыворотке с течением времени, исходя из предположения, что все железо, транспортируемое трансферрином, доставляется. к эритроцитам. Эксперименты с радиоактивно меченным железом показали, что перенос железа, рассчитанный по этому уравнению, близко соответствует измеренной концентрации радиоактивно меченого железа, поглощаемого эритроцитами [43,51].Kaltwasser et al. оценил фармакокинетику железа и доступность железа в эритроцитах с использованием стабильного 54 Fe у здоровых добровольцев мужского пола, получавших 160 и 150 мг железа в день в форме стандартного и медленного высвобождения перорального препарата фумарата железа [43]. Основываясь на их данных, общий перенос железа, рассчитанный по приведенной выше формуле, составляет 21 и 22% от введенной дозы (31 и 34 мг соответственно) — очень похоже на 22 и 23%, измеренные по поглощению радиоактивно меченного железа эритроцитами [ 13].Надежность уравнения полного переноса железа также была продемонстрирована при применении к данным поглощения железа, полученным Hallberg et al. [51]. Здесь рассчитанный перенос железа составил 7,26 мг железа по сравнению с 6,93 мг на основе измерения радиоактивно меченного железа в эритроцитах [13].
Надежность расчета переноса означает, что там, где невозможно провести измерения дорогостоящим изотопным методом, можно сделать точную оценку количества железа, перенесенного из перорального препарата в компартменты, на основе данных об общем содержании железа в сыворотке с течением времени после введения стандартного препарата. высвобождение или составы с замедленным высвобождением.Однако этот подход нельзя применить к Maltofer ® , поскольку уровни сывороточного железа слишком низкие, чтобы их можно было точно измерить.
Метод интеграла свертки
Метод интеграла свертки был предложен для расчета абсорбции железа в кишечнике, с помощью которого одновременное введение пероральных и внутривенных доз железа с разными метками используется для расчета скорости поступления железа в плазму и скорости оттока. из плазмы, из которой можно суммировать совокупное кишечное всасывание [52].Эта стратегия позволяет оценить биодоступность железа только для однократных доз и менее точна, чем расчет переноса.
Мониторинг фекалий
Этот метод основан на сравнении всего потребления пищевого и лекарственного железа и общего количества железа в стуле за фиксированный период времени. Этот период должен составлять не менее двух недель из-за накопления железа в стенке кишечника, что может продлить выведение перорально введенного железа. В отличие от многих лекарств, поскольку нет активного пути выведения железа, потеря железа ограничивается калом, если исключено кровотечение из всех источников.Из-за присущих этому подходу практических трудностей и неточности, а также очень небольшой разницы в потреблении железа и экскреции , результаты фекального мониторинга сомнительны, и этот подход используется редко [11].
Восполнение запасов гемоглобина
При тяжелой железодефицитной анемии почти все железо в сыворотке крови переносится в костный мозг для синтеза гемоглобина и практически ничего не сохраняется в запасном белке ферритине. В этих условиях биодоступность железа можно оценить по увеличению концентрации гемоглобина в крови, используя фиксированное содержание железа, равное 3.47 мг железа / г гемоглобина [11]. Эта оценка может считаться даже приблизительно надежной, однако, если нет обнаруживаемого запасного железа (концентрация ферритина в сыворотке <10 нг / мл) и гемоглобин перед лечением составляет <10 г / дл с добавкой железа> 50 мг железа / день. в течение 2–4 недель, и если нет кровопотери или других потерь железа — условия, которые, скорее всего, будут соблюдаться нечасто.
4. Безопасность препаратов железа
Если трансферрин насыщен из-за быстрого высвобождения большого количества железа из внутривенных препаратов или пероральной терапии высокими дозами железа с солями двухвалентного железа, NTBI (слабосвязанное Fe 3+ ) в сыворотке быстро поглощается эндокринными клетками и клетками сердца неконтролируемым образом и в этих тканях легко участвует в реакциях, которые катализируют образование активных форм кислорода и, таким образом, способствуют перекисному окислению липидов, разрушению мембран, инактивации ферментов, окислению сульфгидрила и разрыву цепи ДНК и, в конечном итоге, нарушение функции органа [7,15,53].Как следствие, могут развиться системные побочные эффекты, включая гипотензию, тошноту, боль в животе и пояснице, периферические отеки и металлический привкус [19], и они могут возникать после перорального приема добавок железа с солями двухвалентного железа или внутривенного введения низкомолекулярных комплексов железа. Кроме того, местные реакции в кишечнике, вызванные реактивными формами кислорода, вызванными реакциями, инициированными и катализируемыми ионами двухвалентного железа, могут вызывать такие симптомы, как рвота, диспепсия, диарея и изжога, у ~ 20% пациентов [36,54].Наконец, также было показано, что железо (например, в форме цитрата трехвалентного железа) подавляет экспрессию CD4 на поверхности Т-лимфоцитов [55,56], что приводит к временному нарушению иммунологической защиты.
4.1. Безопасность препаратов железа для внутривенного введения
Для препаратов для внутривенного введения скорость и степень высвобождения слабосвязанного железа обратно пропорциональны размеру молекулы, причем скорость разложения постепенно увеличивается от декстрана железа до карбоксимальтозы железа (Ferinject ® ) сахароза железа (Venofer ® ) и глюконат натрия и железа (Ferrlecit ® ) [17].Препараты типа I, такие как декстран железа и карбоксимальтоза трехвалентного железа, прочно связывают железо в виде неионного полиядерного гидроксида железа (III) и не выделяют большие количества ионов железа в кровь. Таким образом, они клинически хорошо переносятся даже при введении в высоких дозах. В объединенном анализе 10 рандомизированных исследований с участием примерно 2800 пациентов с железодефицитной анемией, серьезных нежелательных явлений, связанных с лечением, не наблюдалось среди пациентов, получавших Ferinject ® , а частота нежелательных явлений была заметно ниже, чем у пероральных препаратов железа ( в первую очередь сульфат железа): 15.3% против 26,1% соответственно [57]. В недавнем рандомизированном исследовании 459 железодефицитных пациентов (с анемией и без нее) с хронической сердечной недостаточностью наблюдалась аналогичная частота нежелательных явлений, а также серьезных нежелательных явлений в когортах Ferinject ® и плацебо [58], результат, который отражает стабильность комплекса карбоксимальтозы трехвалентного железа.
Более того, все комплексы железа, содержащие декстран, могут приводить к индуцированным декстраном потенциально смертельным анафилактическим реакциям из-за специфического взаимодействия с декстрановыми антителами [59].Об анафилаксии сообщалось у 0,60% пациентов, получавших декстран железа внутривенно [60]. Такие реакции могут происходить даже при получении железа с дериватизированными декстрановыми лигандами или низкомолекулярными декстрановыми лигандами (1000–7000 дальтон), хотя и реже [7,61]. Действительно, сообщалось о редких случаях (0,2%) анафилаксии или анафилактоидных реакций при применении ферумокситола (Feraheme ® ), нового препарата железа для внутривенного введения с карбоксиметилированным декстраном [62]. Примечательно, что недавний случай выявил риск анафилаксии после лечения ферумокситолом у пациентов с гиперчувствительностью к декстрану железа в анамнезе [63].Напротив, анафилактические реакции крайне маловероятны с комплексами, содержащими декстрин или сахарозу, такими как карбоксимальтоза железа и сахароза железа, поскольку декстрин и сахароза не реагируют специфически с антителами к декстрану. Действительно, не сообщалось об анафилаксии при введении карбоксимальтозы трехвалентного железа.
Более низкая молекулярная масса препаратов типа II-IV может считаться преимуществом по сравнению с комплексами типа I с точки зрения потенциальных анафилактических реакций. Поскольку препараты типа II не содержат биологических полимеров, можно ожидать, что серьезные побочные реакции будут менее частыми, чем с декстраном железа.Действительно, крупномасштабные постмаркетинговые данные по сахарозе железа сообщают только о 4,2 нежелательных явлениях на миллион эквивалентов дозы 100 мг железа (по сравнению с 29,2 для декстрана железа) [60]. Истинные анафилактические реакции не могут возникать при применении сахарозы железа или глюконата натрия и железа, хотя очень редко сообщалось о побочных эффектах, вызванных слабосвязанным железом [59], особенно при введении доз, превышающих рекомендуемые. Однако более мелкие и более лабильные комплексы железа III и IV типов со значительными количествами компонентов с молекулярной массой <18 000 Да не могут считаться клинически безопасными при внутривенном применении [7].Доклинические исследования показали, что глюконат натрия и железа даже в относительно низких дозах приводит к тяжелому и длительному паренхиматозному некрозу печени, вторичному по отношению к перекисному окислению липидов, индуцированному железом [17]. Частота нежелательных явлений, сообщаемых Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) у пациентов, получающих глюконат натрия и железа, примерно вдвое выше, чем у пациентов с сахарозой железа [60]. Цитрат железа (III) и сорбит железа (III) очень быстро выводятся почками, так что лишь небольшие количества откладываются в печени.Однако доклинические исследования показывают, что перегрузка железом обнаруживается в ткани почек в течение ограниченного времени после введения [17].
Долгосрочная безопасность внутривенных препаратов железа является предметом обсуждения. Однако недавние всесторонние обзоры пришли к выводу, что, особенно в отношении новых препаратов железа для внутривенного введения, эти опасения необоснованны [64]. Одна потенциальная проблема безопасности связана с возможным долгосрочным хранением комплексов из-за неполного использования железа из внутривенных препаратов.Это беспокойство основано на наблюдении, что, скорее всего, из-за очень высокой стабильности комплексов декстрана железа утилизация железа из этих препаратов не является количественной [65]. Напротив, всесторонние эксперименты по утилизации, проведенные с радиоактивно меченным железом в форме сахарозы [10] и карбоксимальтозы железа [47], показали, что у пациентов с железодефицитной анемией утилизация железа из этих комплексов является по существу количественной. Подробные исследования в этой форме недоступны для глюконата натрия и ферумокситола, для которых вопрос количественного использования остается без ответа.
4.2. Безопасность пероральных препаратов железа
Различные пероральные препараты демонстрируют разные профили безопасности, при этом сульфат железа — самая дешевая и наиболее часто назначаемая пероральная добавка железа — демонстрирует быстрое повышение как концентрации железа в сыворотке, так и NTBI [35], а также наибольшую частоту побочных эффектов. [36,54]. В целом, при пероральном приеме солей железа (II) наблюдается больший окислительный стресс, чем при пероральном введении комплексов железа (III) из-за более быстрого высвобождения ионов железа. Toumainen et al.Компания провела шестимесячное двойное слепое исследование с участием 45 мужчин с низкими запасами железа, получавших либо сульфат железа (180 мг железа в день), либо железо (III) -полимальтозу (Мальтофер ® , 200 мг железа в день). [66]. Окислительная восприимчивость, измеренная липопротеинами низкой плотности, была на 12,8% выше в группе сульфата железа по сравнению с группой Maltofer ® ; количество продуктов перекисного окисления липидов было на 13,8% больше.
Эти данные согласуются с результатами одноцентрового открытого рандомизированного многодозового исследования, в котором эквивалентные дозы (100 мг железа два раза в день в течение 12 недель) комплекса железо (III) -полимальтоза (Мальтофер ® ) и сульфат железа вводили добровольцам-донорам, страдающим анемией [46].В конце испытания улучшение концентрации гемоглобина было сопоставимым в двух группах. Однако побочные эффекты в этой группе встречались значительно реже (12,5% пациентов по сравнению с 44,7% в группе сульфата железа). В ряде исследований наблюдалась более низкая частота прерывания лечения комплексом железо (III) -полимальтоза (Мальтофер ® ), чем солями железа, обычно в результате меньшего количества побочных эффектов со стороны верхних отделов желудочно-кишечного тракта [67]. Таким образом, учитывая аналогичную биодоступность Мальтофера ® и солей двухвалентного железа, более медленное всасывание железа из неионогенного комплекса железо (III) -полимальтоза предпочтительнее пероральных препаратов стандартного высвобождения с точки зрения баланса эффективность / токсичность.
Фармакокинетика и фармакодинамика препаратов железа
Резюме
Стандартные подходы не подходят при оценке фармакокинетики добавок железа из-за повсеместного распространения эндогенного железа, участков его действия и сложности метаболизма железа. Первичным местом действия железа является эритроцит, и, в отличие от обычных лекарств, взаимодействия лекарство-рецептор не происходит. Примечательно, что процесс эритропоэза, г.е. , образование новых эритроцитов занимает 3–4 недели. Соответственно, концентрация железа в сыворотке и площадь под кривой (AUC) не имеют клинического значения для оценки утилизации железа. Железо можно вводить внутривенно в форме полиядерных комплексов гидроксида железа (III) с углеводными лигандами или перорально в виде солей железа (II) (двухвалентного) или комплексов железа (III) (трехвалентное). Для изучения фармакодинамики железа после перорального приема использовалось несколько подходов. Количественная оценка поглощения железа из радиоактивно меченных препаратов всем организмом или эритроцитами является оптимальной, но в качестве альтернативы общий перенос железа можно рассчитать на основе известных скоростей выведения и внутренней реактивности отдельных препаратов.Кинетика разложения и, следовательно, безопасность препаратов железа для парентерального введения напрямую связаны с молекулярной массой и стабильностью комплекса. Высокие пероральные дозы железа или быстрое высвобождение железа из внутривенных препаратов железа могут привести к насыщению системы транспорта железа, что приведет к окислительному стрессу с неблагоприятными клиническими и субклиническими последствиями. Соответствующие фармакокинетические и фармакодинамические анализы в значительной степени помогут нам понять вероятный вклад новых препаратов в лечение анемии.
Ключевые слова: железо, фармакокинетика, фармакодинамика, комплекс железа, метаболизм, выведение, кинетика, эффективность, безопасность
1. Введение
Железо является важным компонентом каждой клетки организма. Хотя железо наиболее известно своей важной ролью в транспортировке и хранении кислорода (в гемоглобине и миоглобине соответственно), в большом количестве ферментов железо также действует как переносчик электронов, катализатор оксигенации, гидроксилирования и необходимо для клеточного рост и распространение.Добавки железа широко применяются для лечения железодефицитной анемии, особенно при хронических заболеваниях, таких как заболевание почек [1], сердечная недостаточность [2] или воспалительное заболевание кишечника [3]. Без достаточного количества железа невозможно синтезировать гемоглобин и поддерживать количество эритроцитов в крови на адекватном уровне [4]. Однако из-за повсеместного распространения железа, его отдельных участков действия и сложного метаболизма обычные измерения фармакокинетики, такие как концентрация в сыворотке, в значительной степени не имеют значения при оценке биодоступности и эффективности препаратов железа [5].Таким образом, фармакокинетические и фармакодинамические оценки препаратов железа не могут основываться на стандартных принципах, применимых к неэндогенным лекарствам.
Понимание метаболизма железа лежит в основе любого рассмотрения его фармакологии (). Железо обычно существует в двухвалентном (Fe 2+ ) или трехвалентном (Fe 3+ ) состоянии, но поскольку Fe 2+ легко окисляется до Fe 3+ , который в нейтральных водных растворах быстро гидролизуется до нерастворимого гидроксиды железа (III), железо транспортируется и хранится связанным с белками.Эффективное связывание железа важно не только для обеспечения его доступности там и тогда, когда это необходимо, но и потому, что Fe 2+ может катализировать образование активных форм кислорода, которые вызывают окислительный стресс, повреждая клеточные компоненты. Три ключевых белка регулируют транспортировку и хранение железа. Трансферрин транспортирует железо в плазме и внеклеточной жидкости. Рецептор трансферрина , экспрессируемый клетками, которым требуется железо, и присутствующий в их мембранах, связывает комплекс трансферрина дихелеса и интернализует его в клетку. Ферритин — это белок, запасающий железо, который изолирует железо, сохраняя его в легкодоступной форме. Около 60% железа содержится в эритроцитах в составе гемоглобина [6], белка, переносящего кислород. Остальная часть находится в миоглобине в мышцах, во множестве различных ферментов («гем» и «негем») и в форме хранения. Большая часть железа хранится в форме ферритина, который содержится в печени, костном мозге, селезенке и мышцах. Сывороточное железо (, т. Е. , железо, связанное с трансферрином) составляет лишь очень небольшую долю от общего железа в организме (<0.2%) [7]. Более того, взаимосвязь между физиологическими компартментами железа очень динамична: эритроциты разрушаются в печени и селезенке, а в костном мозге образуются новые эритроциты. Общий пул сывороточного железа составляет примерно 4 мг, но нормальный дневной оборот не превышает 30 мг [7], так что незначительные изменения уровня сывороточного железа из-за введения экзогенного железа не имеют клинического значения. В этом случае обычные измерения концентрации железа в сыворотке не дают никакой информации о доступности функционального железа для физиологических процессов, и необходимо применять другие стратегии оценки.
Схематическое изображение метаболизма железа. В нормальных условиях железо в организме находится в динамическом равновесии между различными отделениями (сплошные стрелки). Из примерно 10 мг железа, поступающего с пищей, 1-2 мг абсорбируются энтероцитами двенадцатиперстной кишки и такое же количество теряется, например, при отшелушивании кожи. В кровотоке железо связывается с трансферрином ( около 3 мг), который безопасно транспортирует его, например, в костный мозг для синтеза гемоглобина. Примерно две трети железа в организме содержится в форме гемоглобина, в красных кровяных тельцах (1800 мг) и в предшественниках эритроидов в костном мозге (300 мг), тогда как 10-15% присутствует в миоглобине и в множество различных незаменимых ферментов.Железо хранится в паренхимных клетках печени ( около ,1000 мг). Ретикулоэндотелиальные макрофаги временно хранят железо, переработанное из стареющих эритроцитов (600 мг), в легкодоступной форме. Эритропоэтин, вырабатываемый почками, регулирует всасывание железа двенадцатиперстной кишки и эритропоэз (пунктирные линии). По материалам Crichton, 2008 [7].
2. Фармакокинетика железа
Основной целью фармакокинетических анализов является определение биодоступности, определяемой Европейским агентством по лекарственным средствам как «скорость и степень, в которой активное вещество или активный компонент абсорбируется из фармацевтической формы и становится доступным. на месте действия »[8].Обычно биодоступность оценивается на основе сывороточной концентрации вводимого продукта. Однако эта модель применима только в том случае, если существует классическое взаимодействие лекарственного средства с рецептором на клеточных мембранах, так что эффективность хорошо коррелирует с концентрацией лекарственного средства в сыворотке. В случае железа первичным местом действия является эритроцит, а участки хранения железа имеют второстепенное значение.
Было предложено несколько определений биодоступности железа (см. Обзор Wienk et al. [9]), но по общему мнению, это должна быть количественная мера доли общего количества железа, которое абсорбируется и метаболизируется, то есть , которое включается в гемоглобин [9]. Как следствие, концентрация в сыворотке не имеет значения. Примечательно, что процесс эритропоэза занимает 3-4 недели [4], так что утилизация железа с момента введения достигает пика примерно через 2-3 недели [10] и кратковременная площадь под кривой (AUC) значений сывороточного железа (например, более 8 часов) имеют гораздо меньшее значение, чем долгосрочные (например,g., 3 месяца) значения поглощения железа эритроцитами. Количество железа в сыворотке представляет собой лишь небольшую часть железа, которая переносится к месту действия, которая не пропорциональна пиковой концентрации в сыворотке (C max ) или величине AUC, а скорости передачи. и выведение в сыворотку и из нее. Таким образом, очевидно, что необходимы другие подходы к оценке фармакокинетики железа [11-13].
2.1. Фармакокинетика железа после внутривенного введения
Железо вводится внутривенно в виде углеводных комплексов железа, состоящих из минерального ядра, состоящего из полиядерного гидроксида железа (III), окруженного углеводным лигандом [14].Основная функция лиганда — стабилизировать комплекс и защитить его от дальнейшей полинуклеаризации. Примеры включают Venofer ® (сахароза железа), Ferinject ® (карбоксимальтоза трехвалентного железа), Ferrlecit ® (глюконат натрия и железа в сахарозе для инъекций) и различные препараты декстрана железа. Комплексы углеводов железа этого типа ведут себя как пролекарства, поскольку железо должно высвобождаться из ядра гидроксида железа (III). Согласно предложенному механизму, после введения стабильные комплексы, такие как карбоксимальтоза железа и декстран железа, поглощаются эндоцитозом макрофагами ретикулоэндотелиальной системы (RES) [14].На следующем этапе эндосома сливается с лизосомой, и кислая и восстанавливающая среда в эндолизосоме приводит к отщеплению железа от комплекса. Генерированный Fe 2+ транспортируется переносчиком двухвалентного металла 1 (DMT1) через эндолизосомную мембрану, чтобы попасть в пул лабильного железа в цитоплазме макрофагов. Оттуда он может быть включен в ферритин и временно сохраняться в макрофаге или может транспортироваться из макрофага с помощью трансмембранного белка ферропортина (как Fe 2+ ).Экспортируемый Fe 2+ немедленно окисляется церулоплазмином до Fe 3+ , который секвестрируется трансферрином для транспортировки в сыворотке к участкам утилизации, например, в костном мозге для синтеза гемоглобина или в печени для хранения в ферритин.
Однако в случае менее стабильных препаратов этот строго регулируемый процесс высвобождения железа из углеводных комплексов может быть нарушен. Здесь высвобождение значительных количеств лабильного железа из комплекса может привести к насыщению трансферрина и, таким образом, к значительным количествам несвязанного трансферрина железа (NTBI), особенно при введении высоких доз.Этот слабо связанный Fe 3+ легко нерегулируемым образом поглощается клетками эндокринной системы, сердца и печени, где он может вызывать окислительный стресс, катализируя перекисное окисление липидов и образование активных форм кислорода [15].
В целом, комплексы можно классифицировать как лабильные или устойчивые (кинетическая изменчивость, , т.е. , как быстро могут быть обменены лиганды, координированные с железом), так и слабые или сильные (термодинамическая изменчивость, , т.е. , насколько сильно лиганды связаны с железом). железо, и, следовательно, сколько энергии требуется для диссоциации лиганда от железа) или в любом промежуточном состоянии () [7].Реакционная способность каждого комплекса обратно пропорциональна его молекулярной массе, т.е. более крупных комплексов менее склонны к высвобождению значительных количеств лабильного железа или непосредственному взаимодействию с трансферрином [14,17]. Комплексы типа I, такие как препараты декстрана железа (Имферон ® , Cosmofer ® , InFeD ® , Dexferrum ® ) или карбоксимальтоза железа (Ferinject ® ) имеют высокую молекулярную массу и высокую структурную однородность, и , таким образом, доставлять железо из комплекса к трансферрину регулируемым образом посредством эндоцитоза макрофагов и последующего контролируемого экспорта [7,10].Такие комплексы можно вводить внутривенно, и они клинически хорошо переносятся даже в высоких дозах [17]. Комплексы типа II (комплексы железа с сахарозой, такие как Venofer ® ) являются полуустойчивыми и умеренно сильными и выделяют большие количества слабосвязанного железа в кровь. Таким образом, большее количество железа поглощается непосредственно трансферрином и другими белками, и только ядро железа захватывается посредством эндоцитоза макрофагами ретикулоэндотелиальной системы. Несмотря на более низкую молекулярную массу и стабильность комплекса по сравнению с комплексами типа I, комплексы типа II по-прежнему подходят для внутривенного введения.Тем не менее, максимальные разовые дозы значительно ниже, а время введения значительно больше. Комплексы типа III и IV, включая глюконат натрия и железа (Ferrlecit ® ) и железо (III) -цитрат + железо (III) -сорбитол + декстрин железа (Jectofer ® ), содержат различные количества низкомолекулярных компонентов (< 18000 Дальтон), и они обычно лабильны и слабы [17]. Как правило, внутривенное применение препаратов, содержащих большое количество комплексов с молекулярной массой ниже 18 000 Дальтон, следует проводить с осторожностью [17].Эти типы комплексов железа могут генерировать большие количества NTBI, которые затем могут связываться с различными типами белков - только если они вводятся в малых дозах, железо поглощается в основном макрофагами (эндоцитоз). Более того, все комплексы железа с молекулярной массой ниже 18 000 Дальтон подвержены нежелательному вымыванию почками [17].
Таблица 1.
Классификация препаратов комплекса углеводов железа для внутривенного введения [17].
| Тип I | Тип II | Тип III | Тип IV | |||
|---|---|---|---|---|---|---|
| Пример | Ферро-карбоксимальсодержащий сахар | Ферро-карбоксималь- | Железо декстрановое железо Натрия трехвалентное глюконат Железо (III) -цитрат Железо (III) -сорбитол | Железо (III) -цитрат + железо (III) -сорбитол + железо декстрин Глюконат натрия трехвалентного + железо сахароза | ||
| Препараты | Ferinject ® * InFeD ® Cosmofer ® Imferon ® Dexferrum ® Feraheme ® | Je1478 Venofer ®| Venofer ® | Ferrlecit ® | |||
| Характеристики | Прочный Прочный | Полуустойчивый Модер достаточно сильный | Лабильный слабый | Смеси, содержащие не менее двух различных комплексов железа | ||
| Молекулярная масса (дальтон) | > 100000 | 30 000–100 000 | <50 000 | <50 000 | ||
| In vitro кинетика разложения (k × 10 3 / мин при θ = 0.5) [16] | 15–50 | 50–100 | > 100 | > 100 | ||
| In vitro процентное содержание железа в трансферрине (%) [18] | 2,4 — 3,4 (декстран железа ) | 4,5 (Venofer ® ) | Недоступно | 5,8 (Ferrlecit ® ) | ||
| LD 50 (мг железа / кг) | 1013 (декстран железа) | 359 (Venofer ® ) | Недоступно | 155 (Ferrlecit ® ) |
иллюстрирует результаты исследования in vitro , в котором сравнивается относительная реакционная способность Ferinject ® , Venofer 914 и Ferrlecit ®. в сторону апотрансферрина.В этом эксперименте апотрансферрин инкубировали с различными количествами трех внутривенных препаратов железа в конечной концентрации, эквивалентной концентрации, ожидаемой в сыворотке крови взрослого пациента после инъекции ~ 200 или ~ 2000 мг железа. Примечательно, что Ferinject ® имеет значительно более низкую реакционную способность, чем два других комплекса. Даже при дозе, эквивалентной ~ 2000 мг железа, Ferinject ® не вызывает полного насыщения трансферрина. Слабо связанные низкомолекулярные компоненты приводят к насыщению трансферрина, и последующий окислительный стресс, вызванный NTBI, приводит к побочным эффектам, таким как гипотония, тошнота, рвота, боли в животе и пояснице, периферические отеки и металлический привкус [19].
In vitro реактивность Ferinject ® , Venofer ® и Ferrlecit ® с апотрансферрином. Электрофорез в полиакриламидном геле мочевины (PAGE) трансферрина, инкубированного с различными количествами различных внутривенных препаратов железа. Apo-Tf, трансферрин без железа; Fe-Tf, трансферрин с одним занятым сайтом связывания железа; Fe 2 -Tf, трансферрин, в котором оба сайта связывания железа заняты [голотрансферрин]. Реактивность по отношению к апотрансферрину была самой низкой с наиболее стабильным комплексом i.е. Ferinject ® . При концентрациях, эквивалентных тем, которые ожидаются в сыворотке крови взрослого человека после терапевтической дозы ∼200 или ∼2000 мг железа, насыщение трансферрина наблюдалось с Ferrlecit ® и Venofer ® , но не с Ferinject ® (Техническое сообщение , Vifor Pharma — Vifor International Inc).
Молекулярная масса внутривенных углеводных комплексов железа сильно влияет не только на скорость высвобождения железа из ядра, но и на скорость выведения из плазмы [14].Фактически, комплексы типа I имеют длительный период полувыведения, например, Ferinject ® 7–12 часов и декстран железа 1–3,5 дня (в зависимости от дозы) по сравнению с периодом полувыведения 5–6 часов. для сахарозы железа (Venofer ® ) [20] и <4 часов для типов III и IV [7] (например, Ferrlecit ® 1–1,5 часа [21]). Параметры фармакокинетики различных препаратов железа для внутривенного введения были измерены в отдельных исследованиях фазы I в аналогичных условиях [20–22,24,25].Основываясь на этих параметрах, мы рассчитали нормализованную AUC после внутривенного введения дозы 100 мг железа для различных комплексов углеводов железа (). Результаты ясно показывают, что на AUC сильно влияет скорость конечного выведения, которая зависит от молекулярной массы комплекса, а не от дозы (). Более того, приведенные на фигуре стандартизованные кривые выведения, рассчитанные на основе значений скоростей конечного выведения, приведенных в, ясно показывают отрицательную корреляцию между AUC и константами скорости выведения.
Нормализованная симулированная однократная кинетика выведения первого порядка для различных внутривенных препаратов железа, отображаемая как доля общего сывороточного железа с течением времени. Значения конечных скоростей выведения, приведенные в, использовали для расчета общей кинетики первого порядка и значений t 1/2 . Рисунок ясно показывает, что AUC отрицательно коррелирует с константами скорости выведения.
Таблица 2.
Параметры фармакокинетики препаратов железа для внутривенного введения.
| Параметр | Феррлецит ® Глюконат натрия и железа | Венофер ® Железо сахароза | Ферринджект 14 ® Ферринджект 14 Железо Феррич декстран USP / BP | Feraheme ® Ферумокситол | |||
|---|---|---|---|---|---|---|---|
| Молекулярная масса (Дальтон) | 37,500 1 200,000 2 | 9 9 215000 2 9 21152 9 1 103,000 1 410,000 2 | 185,000 1 731,000 2 | ||||
| Реакция с трансферрином | Низкая | Низкая | Низкая | Низкая | |||
| Дозировка, используемая для следующих PK характеристики, мг Fe | 125 3 | 100 4 | 100/1000 5 | 500–2000 6 | 316 7 | ||
| клемма k el , h -1 | 0.488 | 0,145 | 0,094 / 0,074 | 0,024 6 | 0,048 | ||
| k 0 , мг Fe / L * h | — | 0,1 8 | Не наблюдается 10–20 9 | Не наблюдается | |||
| клемма t 1/2 , h | 1,42 | 5,3 | 7,4 / 9,4 | 27–30 10 | 14,7 | ||
| C макс , мг Fe / л | 20.6 | 35,3 | 37/331 | — | 130 | ||
| AUC, мг Fe / л * ч | 43,7 | 83,3 | 333/6 277 | 6,853 11 57 | 6,853 11 | ||
| AUC, стандартизованная для дозы 100 мг Fe, мг Fe / л * ч | 35,0 | 83,3 | 333 / 627,7 | 1,371 | 922 | ||
| MRT, h | 5.5 | 11.2 / 16,5 | — | — | |||
| CL, л / ч | 2,99 | 1,23 | 0,26 / 0,16 | — | 0,11 | ||
| V c , L | 6,02 | 3,2 | 2,7 / 2,1 | 3,0 | 2,3 | ||
| Перенос железа, мг Fe / день | Не рассчитано | 31,0 | Недоступно | 240–480 9 | Недоступно |
Таким образом, средняя сывороточная концентрация и AUC не увеличиваются линейно с дозой введенного железа, а обратно коррелируют со скоростью выведения [22,26].Изучение кривых общей концентрации железа в сыворотке после внутривенного введения показало, что выведение железа из сыворотки можно объяснить перекрытием (наложением) нулевого порядка (постоянная скорость) и функции выведения первого порядка [14,20, 24]. Эта модель объясняет нелинейную зависимость между введенной дозой и значением AUC [12]. Используя открытую двухкомпонентную модельную систему с базовым уровнем, а также с основным термином Михаэлиса-Ментен, уровень сывороточного железа можно рассчитать по следующей формуле [20]:
C (t) = ae −αt + be −βt + C B — k 0 t
где C (t) — зависящая от времени концентрация железа в сыворотке крови, a, b, α и β — гибридные константы, C B — уровень железа перед введением, а k 0 t — термин Михаэлиса-Ментен.Окончательный объем распределения обычно составляет около 3 литров на человека весом 70 кг. С помощью k 0 можно рассчитать количество железа, захваченного макрофагами, и / или железа, перенесенного трансферрином в другие компартменты. По дозе (D) и разнице между первым постдозовым уровнем C 0 и уровнем C B до введения дозы можно определить объем распределения в центральном отсеке V c .
2.2. Фармакокинетика железа после перорального применения
Абсорбция железа из кишечника тщательно регулируется.Поскольку после попадания в кровоток железа не происходит активного выведения, контроль над уровнем железа в организме осуществляется на уровне энтероцитов. Железо в пище в форме Fe 3+ восстанавливается до Fe 2+ дуоденальным цитохромом b (Dcyt b ) в мембране энтероцита, а затем доставляется DMT1 в цитоплазму энтероцита, где он может либо храниться в виде ферритина, либо экспортироваться в сыворотку через базолатеральный транспортный белок ферропортин [27].Этот экспортный белок связан с мульти-медными оксидазами (гефестин в мембране или церулоплазмин в сыворотке), которые окисляют Fe 2+ до Fe 3+ , который, наконец, прочно связывается с трансферрином [27]. Механизм поглощения гемового железа, полученного из мяса, изучен недостаточно. Было высказано предположение, что мембрана энтероцитов также содержит белок, который может транспортировать гемовое железо из просвета кишечника в цитозоль (HCP1) [28]. Однако позже было показано, что этот же белок отвечает за транспорт фолиевой кислоты в кишечнике со значительно более высокой аффинностью [29–31].В энтероците Fe 2+ высвобождается из гема в процессе, катализируемом гемоксигеназой [32], и входит в тот же цитозольный пул, что и негемовое железо.
Типичная диета содержит примерно 10–20 мг железа в день, но физиологический путь усвоения с фиксированной скоростью позволяет усваивать только до 5 мг за раз [13,33]. Таким образом, терапевтическая доза перорального железа, составляющая, например, 100 мг, значительно превышает количество, которое может быть поглощено посредством активного пути всасывания. Из-за физико-химических свойств солей двухвалентного железа пассивное поглощение происходит параклеточным путем [33], так что часть Fe 2+ в кишечнике всасывается непосредственно кровью.В нормальных условиях трансферрин в крови насыщен примерно на треть [7]. Однако под давлением пассивной диффузии трансферрин насыщается, и NTBI циркулирует в плазме, поглощается через нерегулируемый механизм эндокринными и сердечными клетками, что приводит к реакциям окислительного стресса в этих тканях. У быстро всасываемых препаратов NTBI можно наблюдать даже до того, как трансферрин полностью насыщается.
иллюстрирует количественное определение NTBI в образцах сыворотки взрослых добровольцев с нормальными запасами железа после перорального приема 100 мг железа в форме солей двухвалентного железа [34].Концентрации NTBI до 9 мкМ наблюдались в течение первых четырех часов после введения дозы, даже если насыщение трансферрина (TSAT) было ниже 100%. Значительные уровни NTBI были обнаружены даже при более низких дозах, например, 10 мг железа в виде аскорбата железа или сульфата глицина железа [34]. В том же исследовании сообщалось, что железо (III) -полимальтоза в дозе 150 мг железа приводила к максимальной концентрации NTBI всего 0,7 мкМ, что близко к пределу обнаружения использованного анализа [34]. Интересно, что подобное исследование показало, что значительные уровни NTBI также образуются при приеме пероральных препаратов железа на основе солей двухвалентного железа с пищей [35].По мере того как доза железа, вводимая в форме солей двухвалентного железа, увеличивается, доля железа, абсорбированного пассивным параклеточным путем, увеличивается, так что повышается NTBI [34], что согласуется с дозозависимым характером побочных эффектов, связанных с пероральной терапией железом [36]. ]. Однако даже пассивная абсорбция может стать такой насыщенной, что постоянно увеличивающиеся дозы перорального железа не приводят к пропорционально более высокой AUC, что было продемонстрировано Экенведом и его коллегами после введения 25, 50 и 100 мг железа в виде раствора сульфата железа (2). [37].Поэтому модель линейной фармакокинетики может быть исключена [13]. Таким образом, максимальное увеличение сывороточного железа, например, на 20 мкмоль / л, может соответствовать абсорбции железа в кишечнике от 3,5 до 17 мг [37,38].
Концентрация железа, не связанного с трансферрином (NTBI), и процентное насыщение трансферрина (TSAT) в сыворотке крови после приема однократной пероральной дозы 100 мг железа в форме трех различных солей двухвалентного железа здоровым взрослым добровольцам. Пунктирные синие линии указывают процент насыщения трансферрина (правая ось).Сплошные красные линии показывают концентрацию NTBI (левая ось). Показанные значения являются средними ± стандартное отклонение. Изменено из Dresow et al. 2008 [34].
Повышение концентрации железа в сыворотке после введения 25, 50 и 100 мг двухвалентного железа у 6 здоровых субъектов [37]. Данные представлены как среднее ± стандартная ошибка среднего. Данные ясно показывают, что нет линейной зависимости между увеличением сывороточного железа (C max и AUC) и дозой.
Если использовать результаты других исследований, эта дисперсия увеличится еще больше [39].Напротив, Heinrich et al. [40] сообщил о некоторой лучшей корреляции между абсорбцией железа и концентрацией железа в сыворотке, измеренной через 3 часа после приема 100 мг железа натощак. Однако авторы пришли к выводу, что измерение сывороточного железа дает только полуколичественную информацию о биодоступности терапевтических препаратов железа [40]. Примечательно, что Генрих и его коллеги включили в свое исследование препараты железа (III) (цитрат железа и железо (III) -полимальтоза), несмотря на то, что известно, что абсорбция этих препаратов до семи раз лучше при приеме с food [41], и поэтому их нельзя сравнивать в одинаковых условиях (например,г., пустой желудок).
Концентрация железа в сыворотке крови после перорального приема сильно зависит от кинетики инвазии и выведения. Как и при внутривенном введении, выведение железа после перорального приема железа может иметь функцию нулевого порядка [13]. Более быстрое всасывание из данного препарата приводит к большей сывороточной AUC и более высокой максимальной концентрации сывороточного железа, поскольку AUC сильно зависит от кинетики инвазии, поскольку скорость выведения нулевого порядка является лимитирующей стадией [13].Поскольку скорость переноса и время восстановления сывороточного железа до исходного уровня постоянны, значения AUC не отражают истинную степень абсорбции железа, а AUC не коррелирует с поглощением эритроцитами после перорального введения железа [42]. Поскольку высокая концентрация железа в сыворотке крови может приводить к NTBI с сопутствующим риском окислительного стресса и связанных с ним побочных эффектов, более высокая скорость абсорбции фактически является невыгодной.
В попытке уменьшить побочные эффекты солей двухвалентного железа были разработаны препараты с более медленным всасыванием.Фумарат железа, наименее токсичное соединение железа (II), вызывает меньше побочных эффектов из-за его низкой растворимости и медленной скорости растворения после перорального приема [7]. Фактически, скорость высвобождения ионов двухвалентного железа из фумарата железа ниже, чем из хорошо растворимого сульфата двухвалентного железа.
Одним из доступных на рынке составов фумарата железа является капсулы Ferrum Hausmann ® . Geisser et al. изучил фармакокинетику и биодоступность стандартного фумарата двухвалентного железа и этого препарата с замедленным высвобождением в рандомизированном исследовании с участием 20 здоровых добровольцев с истощенными запасами железа.Результаты показали, что два препарата были биоэквивалентными, несмотря на более медленное всасывание железа и более низкие значения AUC с препаратом с медленным высвобождением [13]. Kaltwasser et al. подтвердили, что стандартные препараты или препараты с замедленным высвобождением (в данном случае сульфат железа) обладают сходной биодоступностью железа [43].
Фармакокинетический профиль железа после перорального приема комплекса железо (III) -полимальтоза сильно отличается от профиля солей двухвалентного железа. Комплекс железо (III) -полимальтоза состоит из неионного железа (III) в форме полиядерного гидроксида железа (III) и полимальтозных лигандов.Полученный комплекс стабилен. Находясь в неионогенной форме, железо не взаимодействует с компонентами пищи и не вызывает образование активных форм кислорода.
Фармакокинетика препарата полимальтозы железа (III) Мальтофер ® была тщательно изучена. В течение первых шести часов после введения Мальтофера ® наблюдается лишь незначительное увеличение концентрации железа в сыворотке крови, , то есть , как и ожидалось, исходя из размера комплекса, пассивная диффузия через межклеточные пространства практически отсутствует [44].Тем не менее, через 2–3 недели после применения Мальтофера ® включение железа в эритроциты существенно не отличается от такового с солями двухвалентного железа [44]. Подобная биодоступность железа после введения Мальтофера ® , сульфата железа или фумарата железа была подтверждена другими авторами [45], а также сопоставимое повышение гемоглобина при использовании Мальтофера ® или сульфата железа в той же дозе (100 мг железа два раза в день) [46]. Интересно, что всасывание железа из Мальтофера ® , по-видимому, усиливается в присутствии пищи, в отличие от ситуации с пероральными солями двухвалентного железа, где абсорбция снижается.Как и в случае с более простыми препаратами, нет корреляции между AUC и биодоступностью, измеренной по поглощению железа эритроцитами [42], и, таким образом, измерения AUC сывороточного железа не имеют отношения к оценке эффективности перорального комплекса железо (III) -полимальтоза.
2.3. Фармакокинетика железа: выводы
Обширный фармакокинетический анализ и понимание путей доставки железа в соответствующие физиологические компартменты демонстрируют, что концентрация железа в сыворотке или AUC, измеренная после приема добавок железа, не может использоваться для оценки эффективности препаратов железа.В частности, кинетика абсорбции железа зависит от типа перорального препарата железа: соединения, которые всасываются медленно, неизбежно приводят к более низкому максимальному увеличению железа в плазме, меньшему AUC и, как следствие, к неверной интерпретации результатов [9]. Таким образом, в случае терапии железом эти обычные фармакокинетические маркеры не дают достоверной оценки биодоступности с точки зрения железа, используемого в эритроците для синтеза гемоглобина, или количества железа, включенного в запасной белок ферритин.
Быстрая абсорбция железа и / или высокие дозы пероральных препаратов могут привести к насыщению регулируемых механизмов активной абсорбции в кишечнике, что приведет к пассивной абсорбции, насыщению транспортного белка (трансферрина) и образованию слабосвязанного Fe 3+ (NTBI) , который может вызвать окислительный стресс. Это очень важно, так как во время пероральной терапии железом пациенты обычно принимают 2–3 таблетки в день в течение нескольких месяцев и, таким образом, подвергаются окислительному стрессу ежедневно в течение длительного времени.
3. Фармакодинамика железа
Фармакокинетические профили препаратов железа могут предоставить полезную информацию о реактивности с трансферрином, риске побочных эффектов и предложить рекомендации по возможному режиму дозирования. Однако для понимания и прогнозирования биодоступности таких препаратов требуется более подробное исследование. Несколько экспериментальных подходов к фармакодинамическому анализу позволяют оценивать и сравнивать абсорбцию железа и, таким образом, эффективность различных препаратов [9].
Методы радиомечения
Измерение поглощения радиоактивных изотопов (например, 59 Fe) во всем теле или только в эритроцитах представляет собой эталонный метод оценки биодоступности железа [9]. Подсчет всего тела определяет общее количество меченого железа, удерживаемого в организме, включая железо, временно хранящееся в ретикулоэндотелиальной системе или депонированное в ферритине печени, и как таковое является наиболее полным измерением использования железа.Подсчет эритроцитов является хорошей мерой того, сколько введенного железа используется для эритропоэза. У людей с анемией с сильным дефицитом железа практически все абсорбированное железо будет доставлено в эритроциты, и, таким образом, для этой популяции подсчет эритроцитов дает хорошую оценку использования железа (). Оценка на 14 день после введения меченого соединения с поправкой на радиоактивный распад дает время для включения изотопа в эритроциты [47]. Таким образом, утилизация железа эритроцитами обычно выражается как процентная доля железа, восстановленного в клеточной массе на 14 день после приема.Действительно, Potgieter et al. подтвердили, что существует тесная корреляция (r 2 = 0,91) между поглощением 59 Fe эритроцитами и всем телом после перорального приема железо (III) -полимальтозы (Мальтофер ® ) [42] .
Использование железа после однократного внутривенного введения радиоактивно меченой сахарозы железа (Venofer ® ) пациенту с железодефицитной анемией (изменено из Beshara et al. 1999 [10]).
Jacobs et al. Компания разработала метод двойного изотопа для сравнения биодоступности двух разных препаратов железа, при котором каждый индивидуум получает два препарата, меченных разными изотопами железа ( 55 Fe или 59 Fe), и действует как самоконтроль [45,48 ]. Используя этот метод, группа показала, что доступность железа эквивалентна после перорального приема либо сульфата железа, либо полимальтозы железа (III) (Мальтофер ® ) как в физиологических, так и в терапевтических дозах [45].
Методы маркировки стабильных изотопов
Из-за этических проблем, связанных с использованием радиоактивно меченных изотопов, в частности у детей, стабильные изотопы железа ( 57 Fe или 58 Fe) часто используются для оценки биодоступности препаратов железа. Количество поглощенного меченого железа можно рассчитать по изменению содержания изотопов железа в крови после включения в эритроциты, примерно через 14 дней после введения. Различные изотопы железа можно измерить с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) [49,50].
Расчет общего переноса железа
После перорального приема препаратов железа общее количество железа, перенесенного на метаболический путь железа (, т.е. , истинная биодоступность), можно рассчитать по концентрации железа в сыворотке, поскольку кинетика выведения железа в первую очередь следует функция нулевого порядка, а не функция первого порядка из-за фиксированной скорости реакции с трансферрином. Открытая двухкомпонентная модельная система с базовым уровнем, а также с основным термином Михаэлиса-Ментена (ММ) может применяться следующим образом [7]:
C (t) = a (1 — e −kin * t ) −k 0 t
где C (t) — концентрация сывороточного железа в момент времени t, a — постоянная величина, k в — константа скорости абсорбции железа из конкретного соединения, а k 0 — константа скорости выведения ( i.е. процесс переноса насыщенного железа). Таким образом, k 0 t — член ММ. Поскольку трансферрин легко насыщается железом (, т.е. кинетика нулевого порядка) и поскольку концентрация железа в сыворотке до введения дозы статистически значимо не отличается от измеренной через 24 часа после инъекции, показатель MM v max (максимальная скорость выведения ) можно рассматривать как эквивалент k 0 t, где v max отражает максимальную скорость переноса трансферрином.Исходя из этого термина, можно рассчитать общее количество железа, транспортируемого трансферрином за 24-часовой период наблюдения [20].
Данные исследований фумарата двухвалентного железа [13] и сульфата двухвалентного железа [43] подтвердили, что существует тесная корреляция между измеренным переносом железа в эритроциты и значением, рассчитанным по кривой, основанной на этом уравнении, для стандартных препаратов или препаратов с замедленным высвобождением. ().
Иллюстрация средней измеренной концентрации сывороточного железа (красные линии) и расчетной кривой (зеленые линии) на основе следующего уравнения: C (t) = a (1 − e −kin * t ) — k 0 t, где C (t) — концентрация железа в сыворотке крови в момент времени t, a — константа, k в — константа скорости абсорбции железа, а k 0 — константа скорости выведения.Данные взяты из открытого рандомизированного перекрестного исследования биоэквивалентности однократной дозы с участием 20 здоровых женщин-добровольцев, получавших стандартный пероральный фумарат железа или фумарат железа с медленным высвобождением в дозе, эквивалентной 100 мг железа на прием (модифицировано из Geisser et al. , 2009 [13]).
Поскольку железо демонстрирует кинетику вторжения первого порядка и элиминации нулевого порядка, общий перенос железа можно затем оценить (, т.е. биодоступность) на основе констант скорости выведения (), используя следующее уравнение [13]:
Общий перенос железа (ммоль) = k 0 (ммоль / л / ч) × tω (ч) × V d (L)
, где k 0 — константа MM удаления, tω — время для достижения общего сывороточного железа исходного уровня после введения (что является конечным временем в случае элиминации нулевого порядка), а V d — это объем распределения.Это уравнение гораздо более информативно относительно биодоступности железа, чем значение AUC в сыворотке, поскольку оно позволяет рассчитать перенос железа в компартменты (особенно в эритроциты) на основе концентрации железа в сыворотке с течением времени, исходя из предположения, что все железо, транспортируемое трансферрином, доставляется. к эритроцитам. Эксперименты с радиоактивно меченным железом показали, что перенос железа, рассчитанный по этому уравнению, близко соответствует измеренной концентрации радиоактивно меченого железа, поглощаемого эритроцитами [43,51].Kaltwasser et al. оценил фармакокинетику железа и доступность железа в эритроцитах с использованием стабильного 54 Fe у здоровых добровольцев мужского пола, получавших 160 и 150 мг железа в день в форме стандартного и медленного высвобождения перорального препарата фумарата железа [43]. Основываясь на их данных, общий перенос железа, рассчитанный по приведенной выше формуле, составляет 21 и 22% от введенной дозы (31 и 34 мг соответственно) — очень похоже на 22 и 23%, измеренные по поглощению радиоактивно меченного железа эритроцитами [ 13].Надежность уравнения полного переноса железа также была продемонстрирована при применении к данным поглощения железа, полученным Hallberg et al. [51]. Здесь рассчитанный перенос железа составил 7,26 мг железа по сравнению с 6,93 мг на основе измерения радиоактивно меченного железа в эритроцитах [13].
Надежность расчета переноса означает, что там, где невозможно провести измерения дорогостоящим изотопным методом, можно сделать точную оценку количества железа, перенесенного из перорального препарата в компартменты, на основе данных об общем содержании железа в сыворотке с течением времени после введения стандартного препарата. высвобождение или составы с замедленным высвобождением.Однако этот подход нельзя применить к Maltofer ® , поскольку уровни сывороточного железа слишком низкие, чтобы их можно было точно измерить.
Метод интеграла свертки
Метод интеграла свертки был предложен для расчета абсорбции железа в кишечнике, с помощью которого одновременное введение пероральных и внутривенных доз железа с разными метками используется для расчета скорости поступления железа в плазму и скорости оттока. из плазмы, из которой можно суммировать совокупное кишечное всасывание [52].Эта стратегия позволяет оценить биодоступность железа только для однократных доз и менее точна, чем расчет переноса.
Мониторинг фекалий
Этот метод основан на сравнении всего потребления пищевого и лекарственного железа и общего количества железа в стуле за фиксированный период времени. Этот период должен составлять не менее двух недель из-за накопления железа в стенке кишечника, что может продлить выведение перорально введенного железа. В отличие от многих лекарств, поскольку нет активного пути выведения железа, потеря железа ограничивается калом, если исключено кровотечение из всех источников.Из-за присущих этому подходу практических трудностей и неточности, а также очень небольшой разницы в потреблении железа и экскреции , результаты фекального мониторинга сомнительны, и этот подход используется редко [11].
Восполнение запасов гемоглобина
При тяжелой железодефицитной анемии почти все железо в сыворотке крови переносится в костный мозг для синтеза гемоглобина и практически ничего не сохраняется в запасном белке ферритине. В этих условиях биодоступность железа можно оценить по увеличению концентрации гемоглобина в крови, используя фиксированное содержание железа, равное 3.47 мг железа / г гемоглобина [11]. Эта оценка может считаться даже приблизительно надежной, однако, если нет обнаруживаемого запасного железа (концентрация ферритина в сыворотке <10 нг / мл) и гемоглобин перед лечением составляет <10 г / дл с добавкой железа> 50 мг железа / день. в течение 2–4 недель, и если нет кровопотери или других потерь железа — условия, которые, скорее всего, будут соблюдаться нечасто.
4. Безопасность препаратов железа
Если трансферрин насыщен из-за быстрого высвобождения большого количества железа из внутривенных препаратов или пероральной терапии высокими дозами железа с солями двухвалентного железа, NTBI (слабосвязанное Fe 3+ ) в сыворотке быстро поглощается эндокринными клетками и клетками сердца неконтролируемым образом и в этих тканях легко участвует в реакциях, которые катализируют образование активных форм кислорода и, таким образом, способствуют перекисному окислению липидов, разрушению мембран, инактивации ферментов, окислению сульфгидрила и разрыву цепи ДНК и, в конечном итоге, нарушение функции органа [7,15,53].Как следствие, могут развиться системные побочные эффекты, включая гипотензию, тошноту, боль в животе и пояснице, периферические отеки и металлический привкус [19], и они могут возникать после перорального приема добавок железа с солями двухвалентного железа или внутривенного введения низкомолекулярных комплексов железа. Кроме того, местные реакции в кишечнике, вызванные реактивными формами кислорода, вызванными реакциями, инициированными и катализируемыми ионами двухвалентного железа, могут вызывать такие симптомы, как рвота, диспепсия, диарея и изжога, у ~ 20% пациентов [36,54].Наконец, также было показано, что железо (например, в форме цитрата трехвалентного железа) подавляет экспрессию CD4 на поверхности Т-лимфоцитов [55,56], что приводит к временному нарушению иммунологической защиты.
4.1. Безопасность препаратов железа для внутривенного введения
Для препаратов для внутривенного введения скорость и степень высвобождения слабосвязанного железа обратно пропорциональны размеру молекулы, причем скорость разложения постепенно увеличивается от декстрана железа до карбоксимальтозы железа (Ferinject ® ) сахароза железа (Venofer ® ) и глюконат натрия и железа (Ferrlecit ® ) [17].Препараты типа I, такие как декстран железа и карбоксимальтоза трехвалентного железа, прочно связывают железо в виде неионного полиядерного гидроксида железа (III) и не выделяют большие количества ионов железа в кровь. Таким образом, они клинически хорошо переносятся даже при введении в высоких дозах. В объединенном анализе 10 рандомизированных исследований с участием примерно 2800 пациентов с железодефицитной анемией, серьезных нежелательных явлений, связанных с лечением, не наблюдалось среди пациентов, получавших Ferinject ® , а частота нежелательных явлений была заметно ниже, чем у пероральных препаратов железа ( в первую очередь сульфат железа): 15.3% против 26,1% соответственно [57]. В недавнем рандомизированном исследовании 459 железодефицитных пациентов (с анемией и без нее) с хронической сердечной недостаточностью наблюдалась аналогичная частота нежелательных явлений, а также серьезных нежелательных явлений в когортах Ferinject ® и плацебо [58], результат, который отражает стабильность комплекса карбоксимальтозы трехвалентного железа.
Более того, все комплексы железа, содержащие декстран, могут приводить к индуцированным декстраном потенциально смертельным анафилактическим реакциям из-за специфического взаимодействия с декстрановыми антителами [59].Об анафилаксии сообщалось у 0,60% пациентов, получавших декстран железа внутривенно [60]. Такие реакции могут происходить даже при получении железа с дериватизированными декстрановыми лигандами или низкомолекулярными декстрановыми лигандами (1000–7000 дальтон), хотя и реже [7,61]. Действительно, сообщалось о редких случаях (0,2%) анафилаксии или анафилактоидных реакций при применении ферумокситола (Feraheme ® ), нового препарата железа для внутривенного введения с карбоксиметилированным декстраном [62]. Примечательно, что недавний случай выявил риск анафилаксии после лечения ферумокситолом у пациентов с гиперчувствительностью к декстрану железа в анамнезе [63].Напротив, анафилактические реакции крайне маловероятны с комплексами, содержащими декстрин или сахарозу, такими как карбоксимальтоза железа и сахароза железа, поскольку декстрин и сахароза не реагируют специфически с антителами к декстрану. Действительно, не сообщалось об анафилаксии при введении карбоксимальтозы трехвалентного железа.
Более низкая молекулярная масса препаратов типа II-IV может считаться преимуществом по сравнению с комплексами типа I с точки зрения потенциальных анафилактических реакций. Поскольку препараты типа II не содержат биологических полимеров, можно ожидать, что серьезные побочные реакции будут менее частыми, чем с декстраном железа.Действительно, крупномасштабные постмаркетинговые данные по сахарозе железа сообщают только о 4,2 нежелательных явлениях на миллион эквивалентов дозы 100 мг железа (по сравнению с 29,2 для декстрана железа) [60]. Истинные анафилактические реакции не могут возникать при применении сахарозы железа или глюконата натрия и железа, хотя очень редко сообщалось о побочных эффектах, вызванных слабосвязанным железом [59], особенно при введении доз, превышающих рекомендуемые. Однако более мелкие и более лабильные комплексы железа III и IV типов со значительными количествами компонентов с молекулярной массой <18 000 Да не могут считаться клинически безопасными при внутривенном применении [7].Доклинические исследования показали, что глюконат натрия и железа даже в относительно низких дозах приводит к тяжелому и длительному паренхиматозному некрозу печени, вторичному по отношению к перекисному окислению липидов, индуцированному железом [17]. Частота нежелательных явлений, сообщаемых Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) у пациентов, получающих глюконат натрия и железа, примерно вдвое выше, чем у пациентов с сахарозой железа [60]. Цитрат железа (III) и сорбит железа (III) очень быстро выводятся почками, так что лишь небольшие количества откладываются в печени.Однако доклинические исследования показывают, что перегрузка железом обнаруживается в ткани почек в течение ограниченного времени после введения [17].
Долгосрочная безопасность внутривенных препаратов железа является предметом обсуждения. Однако недавние всесторонние обзоры пришли к выводу, что, особенно в отношении новых препаратов железа для внутривенного введения, эти опасения необоснованны [64]. Одна потенциальная проблема безопасности связана с возможным долгосрочным хранением комплексов из-за неполного использования железа из внутривенных препаратов.Это беспокойство основано на наблюдении, что, скорее всего, из-за очень высокой стабильности комплексов декстрана железа утилизация железа из этих препаратов не является количественной [65]. Напротив, всесторонние эксперименты по утилизации, проведенные с радиоактивно меченным железом в форме сахарозы [10] и карбоксимальтозы железа [47], показали, что у пациентов с железодефицитной анемией утилизация железа из этих комплексов является по существу количественной. Подробные исследования в этой форме недоступны для глюконата натрия и ферумокситола, для которых вопрос количественного использования остается без ответа.
4.2. Безопасность пероральных препаратов железа
Различные пероральные препараты демонстрируют разные профили безопасности, при этом сульфат железа — самая дешевая и наиболее часто назначаемая пероральная добавка железа — демонстрирует быстрое повышение как концентрации железа в сыворотке, так и NTBI [35], а также наибольшую частоту побочных эффектов. [36,54]. В целом, при пероральном приеме солей железа (II) наблюдается больший окислительный стресс, чем при пероральном введении комплексов железа (III) из-за более быстрого высвобождения ионов железа. Toumainen et al.Компания провела шестимесячное двойное слепое исследование с участием 45 мужчин с низкими запасами железа, получавших либо сульфат железа (180 мг железа в день), либо железо (III) -полимальтозу (Мальтофер ® , 200 мг железа в день). [66]. Окислительная восприимчивость, измеренная липопротеинами низкой плотности, была на 12,8% выше в группе сульфата железа по сравнению с группой Maltofer ® ; количество продуктов перекисного окисления липидов было на 13,8% больше.
Эти данные согласуются с результатами одноцентрового открытого рандомизированного многодозового исследования, в котором эквивалентные дозы (100 мг железа два раза в день в течение 12 недель) комплекса железо (III) -полимальтоза (Мальтофер ® ) и сульфат железа вводили добровольцам-донорам, страдающим анемией [46].В конце испытания улучшение концентрации гемоглобина было сопоставимым в двух группах. Однако побочные эффекты в этой группе встречались значительно реже (12,5% пациентов по сравнению с 44,7% в группе сульфата железа). В ряде исследований наблюдалась более низкая частота прерывания лечения комплексом железо (III) -полимальтоза (Мальтофер ® ), чем солями железа, обычно в результате меньшего количества побочных эффектов со стороны верхних отделов желудочно-кишечного тракта [67]. Таким образом, учитывая аналогичную биодоступность Мальтофера ® и солей двухвалентного железа, более медленное всасывание железа из неионогенного комплекса железо (III) -полимальтоза предпочтительнее пероральных препаратов стандартного высвобождения с точки зрения баланса эффективность / токсичность.
Фармакокинетика и фармакодинамика препаратов железа
Резюме
Стандартные подходы не подходят при оценке фармакокинетики добавок железа из-за повсеместного распространения эндогенного железа, участков его действия и сложности метаболизма железа. Первичным местом действия железа является эритроцит, и, в отличие от обычных лекарств, взаимодействия лекарство-рецептор не происходит. Примечательно, что процесс эритропоэза, г.е. , образование новых эритроцитов занимает 3–4 недели. Соответственно, концентрация железа в сыворотке и площадь под кривой (AUC) не имеют клинического значения для оценки утилизации железа. Железо можно вводить внутривенно в форме полиядерных комплексов гидроксида железа (III) с углеводными лигандами или перорально в виде солей железа (II) (двухвалентного) или комплексов железа (III) (трехвалентное). Для изучения фармакодинамики железа после перорального приема использовалось несколько подходов. Количественная оценка поглощения железа из радиоактивно меченных препаратов всем организмом или эритроцитами является оптимальной, но в качестве альтернативы общий перенос железа можно рассчитать на основе известных скоростей выведения и внутренней реактивности отдельных препаратов.Кинетика разложения и, следовательно, безопасность препаратов железа для парентерального введения напрямую связаны с молекулярной массой и стабильностью комплекса. Высокие пероральные дозы железа или быстрое высвобождение железа из внутривенных препаратов железа могут привести к насыщению системы транспорта железа, что приведет к окислительному стрессу с неблагоприятными клиническими и субклиническими последствиями. Соответствующие фармакокинетические и фармакодинамические анализы в значительной степени помогут нам понять вероятный вклад новых препаратов в лечение анемии.
Ключевые слова: железо, фармакокинетика, фармакодинамика, комплекс железа, метаболизм, выведение, кинетика, эффективность, безопасность
1. Введение
Железо является важным компонентом каждой клетки организма. Хотя железо наиболее известно своей важной ролью в транспортировке и хранении кислорода (в гемоглобине и миоглобине соответственно), в большом количестве ферментов железо также действует как переносчик электронов, катализатор оксигенации, гидроксилирования и необходимо для клеточного рост и распространение.Добавки железа широко применяются для лечения железодефицитной анемии, особенно при хронических заболеваниях, таких как заболевание почек [1], сердечная недостаточность [2] или воспалительное заболевание кишечника [3]. Без достаточного количества железа невозможно синтезировать гемоглобин и поддерживать количество эритроцитов в крови на адекватном уровне [4]. Однако из-за повсеместного распространения железа, его отдельных участков действия и сложного метаболизма обычные измерения фармакокинетики, такие как концентрация в сыворотке, в значительной степени не имеют значения при оценке биодоступности и эффективности препаратов железа [5].Таким образом, фармакокинетические и фармакодинамические оценки препаратов железа не могут основываться на стандартных принципах, применимых к неэндогенным лекарствам.
Понимание метаболизма железа лежит в основе любого рассмотрения его фармакологии (). Железо обычно существует в двухвалентном (Fe 2+ ) или трехвалентном (Fe 3+ ) состоянии, но поскольку Fe 2+ легко окисляется до Fe 3+ , который в нейтральных водных растворах быстро гидролизуется до нерастворимого гидроксиды железа (III), железо транспортируется и хранится связанным с белками.Эффективное связывание железа важно не только для обеспечения его доступности там и тогда, когда это необходимо, но и потому, что Fe 2+ может катализировать образование активных форм кислорода, которые вызывают окислительный стресс, повреждая клеточные компоненты. Три ключевых белка регулируют транспортировку и хранение железа. Трансферрин транспортирует железо в плазме и внеклеточной жидкости. Рецептор трансферрина , экспрессируемый клетками, которым требуется железо, и присутствующий в их мембранах, связывает комплекс трансферрина дихелеса и интернализует его в клетку. Ферритин — это белок, запасающий железо, который изолирует железо, сохраняя его в легкодоступной форме. Около 60% железа содержится в эритроцитах в составе гемоглобина [6], белка, переносящего кислород. Остальная часть находится в миоглобине в мышцах, во множестве различных ферментов («гем» и «негем») и в форме хранения. Большая часть железа хранится в форме ферритина, который содержится в печени, костном мозге, селезенке и мышцах. Сывороточное железо (, т. Е. , железо, связанное с трансферрином) составляет лишь очень небольшую долю от общего железа в организме (<0.2%) [7]. Более того, взаимосвязь между физиологическими компартментами железа очень динамична: эритроциты разрушаются в печени и селезенке, а в костном мозге образуются новые эритроциты. Общий пул сывороточного железа составляет примерно 4 мг, но нормальный дневной оборот не превышает 30 мг [7], так что незначительные изменения уровня сывороточного железа из-за введения экзогенного железа не имеют клинического значения. В этом случае обычные измерения концентрации железа в сыворотке не дают никакой информации о доступности функционального железа для физиологических процессов, и необходимо применять другие стратегии оценки.
Схематическое изображение метаболизма железа. В нормальных условиях железо в организме находится в динамическом равновесии между различными отделениями (сплошные стрелки). Из примерно 10 мг железа, поступающего с пищей, 1-2 мг абсорбируются энтероцитами двенадцатиперстной кишки и такое же количество теряется, например, при отшелушивании кожи. В кровотоке железо связывается с трансферрином ( около 3 мг), который безопасно транспортирует его, например, в костный мозг для синтеза гемоглобина. Примерно две трети железа в организме содержится в форме гемоглобина, в красных кровяных тельцах (1800 мг) и в предшественниках эритроидов в костном мозге (300 мг), тогда как 10-15% присутствует в миоглобине и в множество различных незаменимых ферментов.Железо хранится в паренхимных клетках печени ( около ,1000 мг). Ретикулоэндотелиальные макрофаги временно хранят железо, переработанное из стареющих эритроцитов (600 мг), в легкодоступной форме. Эритропоэтин, вырабатываемый почками, регулирует всасывание железа двенадцатиперстной кишки и эритропоэз (пунктирные линии). По материалам Crichton, 2008 [7].
2. Фармакокинетика железа
Основной целью фармакокинетических анализов является определение биодоступности, определяемой Европейским агентством по лекарственным средствам как «скорость и степень, в которой активное вещество или активный компонент абсорбируется из фармацевтической формы и становится доступным. на месте действия »[8].Обычно биодоступность оценивается на основе сывороточной концентрации вводимого продукта. Однако эта модель применима только в том случае, если существует классическое взаимодействие лекарственного средства с рецептором на клеточных мембранах, так что эффективность хорошо коррелирует с концентрацией лекарственного средства в сыворотке. В случае железа первичным местом действия является эритроцит, а участки хранения железа имеют второстепенное значение.
Было предложено несколько определений биодоступности железа (см. Обзор Wienk et al. [9]), но по общему мнению, это должна быть количественная мера доли общего количества железа, которое абсорбируется и метаболизируется, то есть , которое включается в гемоглобин [9]. Как следствие, концентрация в сыворотке не имеет значения. Примечательно, что процесс эритропоэза занимает 3-4 недели [4], так что утилизация железа с момента введения достигает пика примерно через 2-3 недели [10] и кратковременная площадь под кривой (AUC) значений сывороточного железа (например, более 8 часов) имеют гораздо меньшее значение, чем долгосрочные (например,g., 3 месяца) значения поглощения железа эритроцитами. Количество железа в сыворотке представляет собой лишь небольшую часть железа, которая переносится к месту действия, которая не пропорциональна пиковой концентрации в сыворотке (C max ) или величине AUC, а скорости передачи. и выведение в сыворотку и из нее. Таким образом, очевидно, что необходимы другие подходы к оценке фармакокинетики железа [11-13].
2.1. Фармакокинетика железа после внутривенного введения
Железо вводится внутривенно в виде углеводных комплексов железа, состоящих из минерального ядра, состоящего из полиядерного гидроксида железа (III), окруженного углеводным лигандом [14].Основная функция лиганда — стабилизировать комплекс и защитить его от дальнейшей полинуклеаризации. Примеры включают Venofer ® (сахароза железа), Ferinject ® (карбоксимальтоза трехвалентного железа), Ferrlecit ® (глюконат натрия и железа в сахарозе для инъекций) и различные препараты декстрана железа. Комплексы углеводов железа этого типа ведут себя как пролекарства, поскольку железо должно высвобождаться из ядра гидроксида железа (III). Согласно предложенному механизму, после введения стабильные комплексы, такие как карбоксимальтоза железа и декстран железа, поглощаются эндоцитозом макрофагами ретикулоэндотелиальной системы (RES) [14].На следующем этапе эндосома сливается с лизосомой, и кислая и восстанавливающая среда в эндолизосоме приводит к отщеплению железа от комплекса. Генерированный Fe 2+ транспортируется переносчиком двухвалентного металла 1 (DMT1) через эндолизосомную мембрану, чтобы попасть в пул лабильного железа в цитоплазме макрофагов. Оттуда он может быть включен в ферритин и временно сохраняться в макрофаге или может транспортироваться из макрофага с помощью трансмембранного белка ферропортина (как Fe 2+ ).Экспортируемый Fe 2+ немедленно окисляется церулоплазмином до Fe 3+ , который секвестрируется трансферрином для транспортировки в сыворотке к участкам утилизации, например, в костном мозге для синтеза гемоглобина или в печени для хранения в ферритин.
Однако в случае менее стабильных препаратов этот строго регулируемый процесс высвобождения железа из углеводных комплексов может быть нарушен. Здесь высвобождение значительных количеств лабильного железа из комплекса может привести к насыщению трансферрина и, таким образом, к значительным количествам несвязанного трансферрина железа (NTBI), особенно при введении высоких доз.Этот слабо связанный Fe 3+ легко нерегулируемым образом поглощается клетками эндокринной системы, сердца и печени, где он может вызывать окислительный стресс, катализируя перекисное окисление липидов и образование активных форм кислорода [15].
В целом, комплексы можно классифицировать как лабильные или устойчивые (кинетическая изменчивость, , т.е. , как быстро могут быть обменены лиганды, координированные с железом), так и слабые или сильные (термодинамическая изменчивость, , т.е. , насколько сильно лиганды связаны с железом). железо, и, следовательно, сколько энергии требуется для диссоциации лиганда от железа) или в любом промежуточном состоянии () [7].Реакционная способность каждого комплекса обратно пропорциональна его молекулярной массе, т.е. более крупных комплексов менее склонны к высвобождению значительных количеств лабильного железа или непосредственному взаимодействию с трансферрином [14,17]. Комплексы типа I, такие как препараты декстрана железа (Имферон ® , Cosmofer ® , InFeD ® , Dexferrum ® ) или карбоксимальтоза железа (Ferinject ® ) имеют высокую молекулярную массу и высокую структурную однородность, и , таким образом, доставлять железо из комплекса к трансферрину регулируемым образом посредством эндоцитоза макрофагов и последующего контролируемого экспорта [7,10].Такие комплексы можно вводить внутривенно, и они клинически хорошо переносятся даже в высоких дозах [17]. Комплексы типа II (комплексы железа с сахарозой, такие как Venofer ® ) являются полуустойчивыми и умеренно сильными и выделяют большие количества слабосвязанного железа в кровь. Таким образом, большее количество железа поглощается непосредственно трансферрином и другими белками, и только ядро железа захватывается посредством эндоцитоза макрофагами ретикулоэндотелиальной системы. Несмотря на более низкую молекулярную массу и стабильность комплекса по сравнению с комплексами типа I, комплексы типа II по-прежнему подходят для внутривенного введения.Тем не менее, максимальные разовые дозы значительно ниже, а время введения значительно больше. Комплексы типа III и IV, включая глюконат натрия и железа (Ferrlecit ® ) и железо (III) -цитрат + железо (III) -сорбитол + декстрин железа (Jectofer ® ), содержат различные количества низкомолекулярных компонентов (< 18000 Дальтон), и они обычно лабильны и слабы [17]. Как правило, внутривенное применение препаратов, содержащих большое количество комплексов с молекулярной массой ниже 18 000 Дальтон, следует проводить с осторожностью [17].Эти типы комплексов железа могут генерировать большие количества NTBI, которые затем могут связываться с различными типами белков - только если они вводятся в малых дозах, железо поглощается в основном макрофагами (эндоцитоз). Более того, все комплексы железа с молекулярной массой ниже 18 000 Дальтон подвержены нежелательному вымыванию почками [17].
Таблица 1.
Классификация препаратов комплекса углеводов железа для внутривенного введения [17].
| Тип I | Тип II | Тип III | Тип IV | |||
|---|---|---|---|---|---|---|
| Пример | Ферро-карбоксимальсодержащий сахар | Ферро-карбоксималь- | Железо декстрановое железо Натрия трехвалентное глюконат Железо (III) -цитрат Железо (III) -сорбитол | Железо (III) -цитрат + железо (III) -сорбитол + железо декстрин Глюконат натрия трехвалентного + железо сахароза | ||
| Препараты | Ferinject ® * InFeD ® Cosmofer ® Imferon ® Dexferrum ® Feraheme ® | Je1478 Venofer ®| Venofer ® | Ferrlecit ® | |||
| Характеристики | Прочный Прочный | Полуустойчивый Модер достаточно сильный | Лабильный слабый | Смеси, содержащие не менее двух различных комплексов железа | ||
| Молекулярная масса (дальтон) | > 100000 | 30 000–100 000 | <50 000 | <50 000 | ||
| In vitro кинетика разложения (k × 10 3 / мин при θ = 0.5) [16] | 15–50 | 50–100 | > 100 | > 100 | ||
| In vitro процентное содержание железа в трансферрине (%) [18] | 2,4 — 3,4 (декстран железа ) | 4,5 (Venofer ® ) | Недоступно | 5,8 (Ferrlecit ® ) | ||
| LD 50 (мг железа / кг) | 1013 (декстран железа) | 359 (Venofer ® ) | Недоступно | 155 (Ferrlecit ® ) |
иллюстрирует результаты исследования in vitro , в котором сравнивается относительная реакционная способность Ferinject ® , Venofer 914 и Ferrlecit ®. в сторону апотрансферрина.В этом эксперименте апотрансферрин инкубировали с различными количествами трех внутривенных препаратов железа в конечной концентрации, эквивалентной концентрации, ожидаемой в сыворотке крови взрослого пациента после инъекции ~ 200 или ~ 2000 мг железа. Примечательно, что Ferinject ® имеет значительно более низкую реакционную способность, чем два других комплекса. Даже при дозе, эквивалентной ~ 2000 мг железа, Ferinject ® не вызывает полного насыщения трансферрина. Слабо связанные низкомолекулярные компоненты приводят к насыщению трансферрина, и последующий окислительный стресс, вызванный NTBI, приводит к побочным эффектам, таким как гипотония, тошнота, рвота, боли в животе и пояснице, периферические отеки и металлический привкус [19].
In vitro реактивность Ferinject ® , Venofer ® и Ferrlecit ® с апотрансферрином. Электрофорез в полиакриламидном геле мочевины (PAGE) трансферрина, инкубированного с различными количествами различных внутривенных препаратов железа. Apo-Tf, трансферрин без железа; Fe-Tf, трансферрин с одним занятым сайтом связывания железа; Fe 2 -Tf, трансферрин, в котором оба сайта связывания железа заняты [голотрансферрин]. Реактивность по отношению к апотрансферрину была самой низкой с наиболее стабильным комплексом i.е. Ferinject ® . При концентрациях, эквивалентных тем, которые ожидаются в сыворотке крови взрослого человека после терапевтической дозы ∼200 или ∼2000 мг железа, насыщение трансферрина наблюдалось с Ferrlecit ® и Venofer ® , но не с Ferinject ® (Техническое сообщение , Vifor Pharma — Vifor International Inc).
Молекулярная масса внутривенных углеводных комплексов железа сильно влияет не только на скорость высвобождения железа из ядра, но и на скорость выведения из плазмы [14].Фактически, комплексы типа I имеют длительный период полувыведения, например, Ferinject ® 7–12 часов и декстран железа 1–3,5 дня (в зависимости от дозы) по сравнению с периодом полувыведения 5–6 часов. для сахарозы железа (Venofer ® ) [20] и <4 часов для типов III и IV [7] (например, Ferrlecit ® 1–1,5 часа [21]). Параметры фармакокинетики различных препаратов железа для внутривенного введения были измерены в отдельных исследованиях фазы I в аналогичных условиях [20–22,24,25].Основываясь на этих параметрах, мы рассчитали нормализованную AUC после внутривенного введения дозы 100 мг железа для различных комплексов углеводов железа (). Результаты ясно показывают, что на AUC сильно влияет скорость конечного выведения, которая зависит от молекулярной массы комплекса, а не от дозы (). Более того, приведенные на фигуре стандартизованные кривые выведения, рассчитанные на основе значений скоростей конечного выведения, приведенных в, ясно показывают отрицательную корреляцию между AUC и константами скорости выведения.
Нормализованная симулированная однократная кинетика выведения первого порядка для различных внутривенных препаратов железа, отображаемая как доля общего сывороточного железа с течением времени. Значения конечных скоростей выведения, приведенные в, использовали для расчета общей кинетики первого порядка и значений t 1/2 . Рисунок ясно показывает, что AUC отрицательно коррелирует с константами скорости выведения.
Таблица 2.
Параметры фармакокинетики препаратов железа для внутривенного введения.
| Параметр | Феррлецит ® Глюконат натрия и железа | Венофер ® Железо сахароза | Ферринджект 14 ® Ферринджект 14 Железо Феррич декстран USP / BP | Feraheme ® Ферумокситол | |||
|---|---|---|---|---|---|---|---|
| Молекулярная масса (Дальтон) | 37,500 1 200,000 2 | 9 9 215000 2 9 21152 9 1 103,000 1 410,000 2 | 185,000 1 731,000 2 | ||||
| Реакция с трансферрином | Низкая | Низкая | Низкая | Низкая | |||
| Дозировка, используемая для следующих PK характеристики, мг Fe | 125 3 | 100 4 | 100/1000 5 | 500–2000 6 | 316 7 | ||
| клемма k el , h -1 | 0.488 | 0,145 | 0,094 / 0,074 | 0,024 6 | 0,048 | ||
| k 0 , мг Fe / L * h | — | 0,1 8 | Не наблюдается 10–20 9 | Не наблюдается | |||
| клемма t 1/2 , h | 1,42 | 5,3 | 7,4 / 9,4 | 27–30 10 | 14,7 | ||
| C макс , мг Fe / л | 20.6 | 35,3 | 37/331 | — | 130 | ||
| AUC, мг Fe / л * ч | 43,7 | 83,3 | 333/6 277 | 6,853 11 57 | 6,853 11 | ||
| AUC, стандартизованная для дозы 100 мг Fe, мг Fe / л * ч | 35,0 | 83,3 | 333 / 627,7 | 1,371 | 922 | ||
| MRT, h | 5.5 | 11.2 / 16,5 | — | — | |||
| CL, л / ч | 2,99 | 1,23 | 0,26 / 0,16 | — | 0,11 | ||
| V c , L | 6,02 | 3,2 | 2,7 / 2,1 | 3,0 | 2,3 | ||
| Перенос железа, мг Fe / день | Не рассчитано | 31,0 | Недоступно | 240–480 9 | Недоступно |
Таким образом, средняя сывороточная концентрация и AUC не увеличиваются линейно с дозой введенного железа, а обратно коррелируют со скоростью выведения [22,26].Изучение кривых общей концентрации железа в сыворотке после внутривенного введения показало, что выведение железа из сыворотки можно объяснить перекрытием (наложением) нулевого порядка (постоянная скорость) и функции выведения первого порядка [14,20, 24]. Эта модель объясняет нелинейную зависимость между введенной дозой и значением AUC [12]. Используя открытую двухкомпонентную модельную систему с базовым уровнем, а также с основным термином Михаэлиса-Ментен, уровень сывороточного железа можно рассчитать по следующей формуле [20]:
C (t) = ae −αt + be −βt + C B — k 0 t
где C (t) — зависящая от времени концентрация железа в сыворотке крови, a, b, α и β — гибридные константы, C B — уровень железа перед введением, а k 0 t — термин Михаэлиса-Ментен.Окончательный объем распределения обычно составляет около 3 литров на человека весом 70 кг. С помощью k 0 можно рассчитать количество железа, захваченного макрофагами, и / или железа, перенесенного трансферрином в другие компартменты. По дозе (D) и разнице между первым постдозовым уровнем C 0 и уровнем C B до введения дозы можно определить объем распределения в центральном отсеке V c .
2.2. Фармакокинетика железа после перорального применения
Абсорбция железа из кишечника тщательно регулируется.Поскольку после попадания в кровоток железа не происходит активного выведения, контроль над уровнем железа в организме осуществляется на уровне энтероцитов. Железо в пище в форме Fe 3+ восстанавливается до Fe 2+ дуоденальным цитохромом b (Dcyt b ) в мембране энтероцита, а затем доставляется DMT1 в цитоплазму энтероцита, где он может либо храниться в виде ферритина, либо экспортироваться в сыворотку через базолатеральный транспортный белок ферропортин [27].Этот экспортный белок связан с мульти-медными оксидазами (гефестин в мембране или церулоплазмин в сыворотке), которые окисляют Fe 2+ до Fe 3+ , который, наконец, прочно связывается с трансферрином [27]. Механизм поглощения гемового железа, полученного из мяса, изучен недостаточно. Было высказано предположение, что мембрана энтероцитов также содержит белок, который может транспортировать гемовое железо из просвета кишечника в цитозоль (HCP1) [28]. Однако позже было показано, что этот же белок отвечает за транспорт фолиевой кислоты в кишечнике со значительно более высокой аффинностью [29–31].В энтероците Fe 2+ высвобождается из гема в процессе, катализируемом гемоксигеназой [32], и входит в тот же цитозольный пул, что и негемовое железо.
Типичная диета содержит примерно 10–20 мг железа в день, но физиологический путь усвоения с фиксированной скоростью позволяет усваивать только до 5 мг за раз [13,33]. Таким образом, терапевтическая доза перорального железа, составляющая, например, 100 мг, значительно превышает количество, которое может быть поглощено посредством активного пути всасывания. Из-за физико-химических свойств солей двухвалентного железа пассивное поглощение происходит параклеточным путем [33], так что часть Fe 2+ в кишечнике всасывается непосредственно кровью.В нормальных условиях трансферрин в крови насыщен примерно на треть [7]. Однако под давлением пассивной диффузии трансферрин насыщается, и NTBI циркулирует в плазме, поглощается через нерегулируемый механизм эндокринными и сердечными клетками, что приводит к реакциям окислительного стресса в этих тканях. У быстро всасываемых препаратов NTBI можно наблюдать даже до того, как трансферрин полностью насыщается.
иллюстрирует количественное определение NTBI в образцах сыворотки взрослых добровольцев с нормальными запасами железа после перорального приема 100 мг железа в форме солей двухвалентного железа [34].Концентрации NTBI до 9 мкМ наблюдались в течение первых четырех часов после введения дозы, даже если насыщение трансферрина (TSAT) было ниже 100%. Значительные уровни NTBI были обнаружены даже при более низких дозах, например, 10 мг железа в виде аскорбата железа или сульфата глицина железа [34]. В том же исследовании сообщалось, что железо (III) -полимальтоза в дозе 150 мг железа приводила к максимальной концентрации NTBI всего 0,7 мкМ, что близко к пределу обнаружения использованного анализа [34]. Интересно, что подобное исследование показало, что значительные уровни NTBI также образуются при приеме пероральных препаратов железа на основе солей двухвалентного железа с пищей [35].По мере того как доза железа, вводимая в форме солей двухвалентного железа, увеличивается, доля железа, абсорбированного пассивным параклеточным путем, увеличивается, так что повышается NTBI [34], что согласуется с дозозависимым характером побочных эффектов, связанных с пероральной терапией железом [36]. ]. Однако даже пассивная абсорбция может стать такой насыщенной, что постоянно увеличивающиеся дозы перорального железа не приводят к пропорционально более высокой AUC, что было продемонстрировано Экенведом и его коллегами после введения 25, 50 и 100 мг железа в виде раствора сульфата железа (2). [37].Поэтому модель линейной фармакокинетики может быть исключена [13]. Таким образом, максимальное увеличение сывороточного железа, например, на 20 мкмоль / л, может соответствовать абсорбции железа в кишечнике от 3,5 до 17 мг [37,38].
Концентрация железа, не связанного с трансферрином (NTBI), и процентное насыщение трансферрина (TSAT) в сыворотке крови после приема однократной пероральной дозы 100 мг железа в форме трех различных солей двухвалентного железа здоровым взрослым добровольцам. Пунктирные синие линии указывают процент насыщения трансферрина (правая ось).Сплошные красные линии показывают концентрацию NTBI (левая ось). Показанные значения являются средними ± стандартное отклонение. Изменено из Dresow et al. 2008 [34].
Повышение концентрации железа в сыворотке после введения 25, 50 и 100 мг двухвалентного железа у 6 здоровых субъектов [37]. Данные представлены как среднее ± стандартная ошибка среднего. Данные ясно показывают, что нет линейной зависимости между увеличением сывороточного железа (C max и AUC) и дозой.
Если использовать результаты других исследований, эта дисперсия увеличится еще больше [39].Напротив, Heinrich et al. [40] сообщил о некоторой лучшей корреляции между абсорбцией железа и концентрацией железа в сыворотке, измеренной через 3 часа после приема 100 мг железа натощак. Однако авторы пришли к выводу, что измерение сывороточного железа дает только полуколичественную информацию о биодоступности терапевтических препаратов железа [40]. Примечательно, что Генрих и его коллеги включили в свое исследование препараты железа (III) (цитрат железа и железо (III) -полимальтоза), несмотря на то, что известно, что абсорбция этих препаратов до семи раз лучше при приеме с food [41], и поэтому их нельзя сравнивать в одинаковых условиях (например,г., пустой желудок).
Концентрация железа в сыворотке крови после перорального приема сильно зависит от кинетики инвазии и выведения. Как и при внутривенном введении, выведение железа после перорального приема железа может иметь функцию нулевого порядка [13]. Более быстрое всасывание из данного препарата приводит к большей сывороточной AUC и более высокой максимальной концентрации сывороточного железа, поскольку AUC сильно зависит от кинетики инвазии, поскольку скорость выведения нулевого порядка является лимитирующей стадией [13].Поскольку скорость переноса и время восстановления сывороточного железа до исходного уровня постоянны, значения AUC не отражают истинную степень абсорбции железа, а AUC не коррелирует с поглощением эритроцитами после перорального введения железа [42]. Поскольку высокая концентрация железа в сыворотке крови может приводить к NTBI с сопутствующим риском окислительного стресса и связанных с ним побочных эффектов, более высокая скорость абсорбции фактически является невыгодной.
В попытке уменьшить побочные эффекты солей двухвалентного железа были разработаны препараты с более медленным всасыванием.Фумарат железа, наименее токсичное соединение железа (II), вызывает меньше побочных эффектов из-за его низкой растворимости и медленной скорости растворения после перорального приема [7]. Фактически, скорость высвобождения ионов двухвалентного железа из фумарата железа ниже, чем из хорошо растворимого сульфата двухвалентного железа.
Одним из доступных на рынке составов фумарата железа является капсулы Ferrum Hausmann ® . Geisser et al. изучил фармакокинетику и биодоступность стандартного фумарата двухвалентного железа и этого препарата с замедленным высвобождением в рандомизированном исследовании с участием 20 здоровых добровольцев с истощенными запасами железа.Результаты показали, что два препарата были биоэквивалентными, несмотря на более медленное всасывание железа и более низкие значения AUC с препаратом с медленным высвобождением [13]. Kaltwasser et al. подтвердили, что стандартные препараты или препараты с замедленным высвобождением (в данном случае сульфат железа) обладают сходной биодоступностью железа [43].
Фармакокинетический профиль железа после перорального приема комплекса железо (III) -полимальтоза сильно отличается от профиля солей двухвалентного железа. Комплекс железо (III) -полимальтоза состоит из неионного железа (III) в форме полиядерного гидроксида железа (III) и полимальтозных лигандов.Полученный комплекс стабилен. Находясь в неионогенной форме, железо не взаимодействует с компонентами пищи и не вызывает образование активных форм кислорода.
Фармакокинетика препарата полимальтозы железа (III) Мальтофер ® была тщательно изучена. В течение первых шести часов после введения Мальтофера ® наблюдается лишь незначительное увеличение концентрации железа в сыворотке крови, , то есть , как и ожидалось, исходя из размера комплекса, пассивная диффузия через межклеточные пространства практически отсутствует [44].Тем не менее, через 2–3 недели после применения Мальтофера ® включение железа в эритроциты существенно не отличается от такового с солями двухвалентного железа [44]. Подобная биодоступность железа после введения Мальтофера ® , сульфата железа или фумарата железа была подтверждена другими авторами [45], а также сопоставимое повышение гемоглобина при использовании Мальтофера ® или сульфата железа в той же дозе (100 мг железа два раза в день) [46]. Интересно, что всасывание железа из Мальтофера ® , по-видимому, усиливается в присутствии пищи, в отличие от ситуации с пероральными солями двухвалентного железа, где абсорбция снижается.Как и в случае с более простыми препаратами, нет корреляции между AUC и биодоступностью, измеренной по поглощению железа эритроцитами [42], и, таким образом, измерения AUC сывороточного железа не имеют отношения к оценке эффективности перорального комплекса железо (III) -полимальтоза.
2.3. Фармакокинетика железа: выводы
Обширный фармакокинетический анализ и понимание путей доставки железа в соответствующие физиологические компартменты демонстрируют, что концентрация железа в сыворотке или AUC, измеренная после приема добавок железа, не может использоваться для оценки эффективности препаратов железа.В частности, кинетика абсорбции железа зависит от типа перорального препарата железа: соединения, которые всасываются медленно, неизбежно приводят к более низкому максимальному увеличению железа в плазме, меньшему AUC и, как следствие, к неверной интерпретации результатов [9]. Таким образом, в случае терапии железом эти обычные фармакокинетические маркеры не дают достоверной оценки биодоступности с точки зрения железа, используемого в эритроците для синтеза гемоглобина, или количества железа, включенного в запасной белок ферритин.
Быстрая абсорбция железа и / или высокие дозы пероральных препаратов могут привести к насыщению регулируемых механизмов активной абсорбции в кишечнике, что приведет к пассивной абсорбции, насыщению транспортного белка (трансферрина) и образованию слабосвязанного Fe 3+ (NTBI) , который может вызвать окислительный стресс. Это очень важно, так как во время пероральной терапии железом пациенты обычно принимают 2–3 таблетки в день в течение нескольких месяцев и, таким образом, подвергаются окислительному стрессу ежедневно в течение длительного времени.
3. Фармакодинамика железа
Фармакокинетические профили препаратов железа могут предоставить полезную информацию о реактивности с трансферрином, риске побочных эффектов и предложить рекомендации по возможному режиму дозирования. Однако для понимания и прогнозирования биодоступности таких препаратов требуется более подробное исследование. Несколько экспериментальных подходов к фармакодинамическому анализу позволяют оценивать и сравнивать абсорбцию железа и, таким образом, эффективность различных препаратов [9].
Методы радиомечения
Измерение поглощения радиоактивных изотопов (например, 59 Fe) во всем теле или только в эритроцитах представляет собой эталонный метод оценки биодоступности железа [9]. Подсчет всего тела определяет общее количество меченого железа, удерживаемого в организме, включая железо, временно хранящееся в ретикулоэндотелиальной системе или депонированное в ферритине печени, и как таковое является наиболее полным измерением использования железа.Подсчет эритроцитов является хорошей мерой того, сколько введенного железа используется для эритропоэза. У людей с анемией с сильным дефицитом железа практически все абсорбированное железо будет доставлено в эритроциты, и, таким образом, для этой популяции подсчет эритроцитов дает хорошую оценку использования железа (). Оценка на 14 день после введения меченого соединения с поправкой на радиоактивный распад дает время для включения изотопа в эритроциты [47]. Таким образом, утилизация железа эритроцитами обычно выражается как процентная доля железа, восстановленного в клеточной массе на 14 день после приема.Действительно, Potgieter et al. подтвердили, что существует тесная корреляция (r 2 = 0,91) между поглощением 59 Fe эритроцитами и всем телом после перорального приема железо (III) -полимальтозы (Мальтофер ® ) [42] .
Использование железа после однократного внутривенного введения радиоактивно меченой сахарозы железа (Venofer ® ) пациенту с железодефицитной анемией (изменено из Beshara et al. 1999 [10]).
Jacobs et al. Компания разработала метод двойного изотопа для сравнения биодоступности двух разных препаратов железа, при котором каждый индивидуум получает два препарата, меченных разными изотопами железа ( 55 Fe или 59 Fe), и действует как самоконтроль [45,48 ]. Используя этот метод, группа показала, что доступность железа эквивалентна после перорального приема либо сульфата железа, либо полимальтозы железа (III) (Мальтофер ® ) как в физиологических, так и в терапевтических дозах [45].
Методы маркировки стабильных изотопов
Из-за этических проблем, связанных с использованием радиоактивно меченных изотопов, в частности у детей, стабильные изотопы железа ( 57 Fe или 58 Fe) часто используются для оценки биодоступности препаратов железа. Количество поглощенного меченого железа можно рассчитать по изменению содержания изотопов железа в крови после включения в эритроциты, примерно через 14 дней после введения. Различные изотопы железа можно измерить с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) [49,50].
Расчет общего переноса железа
После перорального приема препаратов железа общее количество железа, перенесенного на метаболический путь железа (, т.е. , истинная биодоступность), можно рассчитать по концентрации железа в сыворотке, поскольку кинетика выведения железа в первую очередь следует функция нулевого порядка, а не функция первого порядка из-за фиксированной скорости реакции с трансферрином. Открытая двухкомпонентная модельная система с базовым уровнем, а также с основным термином Михаэлиса-Ментена (ММ) может применяться следующим образом [7]:
C (t) = a (1 — e −kin * t ) −k 0 t
где C (t) — концентрация сывороточного железа в момент времени t, a — постоянная величина, k в — константа скорости абсорбции железа из конкретного соединения, а k 0 — константа скорости выведения ( i.е. процесс переноса насыщенного железа). Таким образом, k 0 t — член ММ. Поскольку трансферрин легко насыщается железом (, т.е. кинетика нулевого порядка) и поскольку концентрация железа в сыворотке до введения дозы статистически значимо не отличается от измеренной через 24 часа после инъекции, показатель MM v max (максимальная скорость выведения ) можно рассматривать как эквивалент k 0 t, где v max отражает максимальную скорость переноса трансферрином.Исходя из этого термина, можно рассчитать общее количество железа, транспортируемого трансферрином за 24-часовой период наблюдения [20].
Данные исследований фумарата двухвалентного железа [13] и сульфата двухвалентного железа [43] подтвердили, что существует тесная корреляция между измеренным переносом железа в эритроциты и значением, рассчитанным по кривой, основанной на этом уравнении, для стандартных препаратов или препаратов с замедленным высвобождением. ().
Иллюстрация средней измеренной концентрации сывороточного железа (красные линии) и расчетной кривой (зеленые линии) на основе следующего уравнения: C (t) = a (1 − e −kin * t ) — k 0 t, где C (t) — концентрация железа в сыворотке крови в момент времени t, a — константа, k в — константа скорости абсорбции железа, а k 0 — константа скорости выведения.Данные взяты из открытого рандомизированного перекрестного исследования биоэквивалентности однократной дозы с участием 20 здоровых женщин-добровольцев, получавших стандартный пероральный фумарат железа или фумарат железа с медленным высвобождением в дозе, эквивалентной 100 мг железа на прием (модифицировано из Geisser et al. , 2009 [13]).
Поскольку железо демонстрирует кинетику вторжения первого порядка и элиминации нулевого порядка, общий перенос железа можно затем оценить (, т.е. биодоступность) на основе констант скорости выведения (), используя следующее уравнение [13]:
Общий перенос железа (ммоль) = k 0 (ммоль / л / ч) × tω (ч) × V d (L)
, где k 0 — константа MM удаления, tω — время для достижения общего сывороточного железа исходного уровня после введения (что является конечным временем в случае элиминации нулевого порядка), а V d — это объем распределения.Это уравнение гораздо более информативно относительно биодоступности железа, чем значение AUC в сыворотке, поскольку оно позволяет рассчитать перенос железа в компартменты (особенно в эритроциты) на основе концентрации железа в сыворотке с течением времени, исходя из предположения, что все железо, транспортируемое трансферрином, доставляется. к эритроцитам. Эксперименты с радиоактивно меченным железом показали, что перенос железа, рассчитанный по этому уравнению, близко соответствует измеренной концентрации радиоактивно меченого железа, поглощаемого эритроцитами [43,51].Kaltwasser et al. оценил фармакокинетику железа и доступность железа в эритроцитах с использованием стабильного 54 Fe у здоровых добровольцев мужского пола, получавших 160 и 150 мг железа в день в форме стандартного и медленного высвобождения перорального препарата фумарата железа [43]. Основываясь на их данных, общий перенос железа, рассчитанный по приведенной выше формуле, составляет 21 и 22% от введенной дозы (31 и 34 мг соответственно) — очень похоже на 22 и 23%, измеренные по поглощению радиоактивно меченного железа эритроцитами [ 13].Надежность уравнения полного переноса железа также была продемонстрирована при применении к данным поглощения железа, полученным Hallberg et al. [51]. Здесь рассчитанный перенос железа составил 7,26 мг железа по сравнению с 6,93 мг на основе измерения радиоактивно меченного железа в эритроцитах [13].
Надежность расчета переноса означает, что там, где невозможно провести измерения дорогостоящим изотопным методом, можно сделать точную оценку количества железа, перенесенного из перорального препарата в компартменты, на основе данных об общем содержании железа в сыворотке с течением времени после введения стандартного препарата. высвобождение или составы с замедленным высвобождением.Однако этот подход нельзя применить к Maltofer ® , поскольку уровни сывороточного железа слишком низкие, чтобы их можно было точно измерить.
Метод интеграла свертки
Метод интеграла свертки был предложен для расчета абсорбции железа в кишечнике, с помощью которого одновременное введение пероральных и внутривенных доз железа с разными метками используется для расчета скорости поступления железа в плазму и скорости оттока. из плазмы, из которой можно суммировать совокупное кишечное всасывание [52].Эта стратегия позволяет оценить биодоступность железа только для однократных доз и менее точна, чем расчет переноса.
Мониторинг фекалий
Этот метод основан на сравнении всего потребления пищевого и лекарственного железа и общего количества железа в стуле за фиксированный период времени. Этот период должен составлять не менее двух недель из-за накопления железа в стенке кишечника, что может продлить выведение перорально введенного железа. В отличие от многих лекарств, поскольку нет активного пути выведения железа, потеря железа ограничивается калом, если исключено кровотечение из всех источников.Из-за присущих этому подходу практических трудностей и неточности, а также очень небольшой разницы в потреблении железа и экскреции , результаты фекального мониторинга сомнительны, и этот подход используется редко [11].
Восполнение запасов гемоглобина
При тяжелой железодефицитной анемии почти все железо в сыворотке крови переносится в костный мозг для синтеза гемоглобина и практически ничего не сохраняется в запасном белке ферритине. В этих условиях биодоступность железа можно оценить по увеличению концентрации гемоглобина в крови, используя фиксированное содержание железа, равное 3.47 мг железа / г гемоглобина [11]. Эта оценка может считаться даже приблизительно надежной, однако, если нет обнаруживаемого запасного железа (концентрация ферритина в сыворотке <10 нг / мл) и гемоглобин перед лечением составляет <10 г / дл с добавкой железа> 50 мг железа / день. в течение 2–4 недель, и если нет кровопотери или других потерь железа — условия, которые, скорее всего, будут соблюдаться нечасто.
4. Безопасность препаратов железа
Если трансферрин насыщен из-за быстрого высвобождения большого количества железа из внутривенных препаратов или пероральной терапии высокими дозами железа с солями двухвалентного железа, NTBI (слабосвязанное Fe 3+ ) в сыворотке быстро поглощается эндокринными клетками и клетками сердца неконтролируемым образом и в этих тканях легко участвует в реакциях, которые катализируют образование активных форм кислорода и, таким образом, способствуют перекисному окислению липидов, разрушению мембран, инактивации ферментов, окислению сульфгидрила и разрыву цепи ДНК и, в конечном итоге, нарушение функции органа [7,15,53].Как следствие, могут развиться системные побочные эффекты, включая гипотензию, тошноту, боль в животе и пояснице, периферические отеки и металлический привкус [19], и они могут возникать после перорального приема добавок железа с солями двухвалентного железа или внутривенного введения низкомолекулярных комплексов железа. Кроме того, местные реакции в кишечнике, вызванные реактивными формами кислорода, вызванными реакциями, инициированными и катализируемыми ионами двухвалентного железа, могут вызывать такие симптомы, как рвота, диспепсия, диарея и изжога, у ~ 20% пациентов [36,54].Наконец, также было показано, что железо (например, в форме цитрата трехвалентного железа) подавляет экспрессию CD4 на поверхности Т-лимфоцитов [55,56], что приводит к временному нарушению иммунологической защиты.
4.1. Безопасность препаратов железа для внутривенного введения
Для препаратов для внутривенного введения скорость и степень высвобождения слабосвязанного железа обратно пропорциональны размеру молекулы, причем скорость разложения постепенно увеличивается от декстрана железа до карбоксимальтозы железа (Ferinject ® ) сахароза железа (Venofer ® ) и глюконат натрия и железа (Ferrlecit ® ) [17].Препараты типа I, такие как декстран железа и карбоксимальтоза трехвалентного железа, прочно связывают железо в виде неионного полиядерного гидроксида железа (III) и не выделяют большие количества ионов железа в кровь. Таким образом, они клинически хорошо переносятся даже при введении в высоких дозах. В объединенном анализе 10 рандомизированных исследований с участием примерно 2800 пациентов с железодефицитной анемией, серьезных нежелательных явлений, связанных с лечением, не наблюдалось среди пациентов, получавших Ferinject ® , а частота нежелательных явлений была заметно ниже, чем у пероральных препаратов железа ( в первую очередь сульфат железа): 15.3% против 26,1% соответственно [57]. В недавнем рандомизированном исследовании 459 железодефицитных пациентов (с анемией и без нее) с хронической сердечной недостаточностью наблюдалась аналогичная частота нежелательных явлений, а также серьезных нежелательных явлений в когортах Ferinject ® и плацебо [58], результат, который отражает стабильность комплекса карбоксимальтозы трехвалентного железа.
Более того, все комплексы железа, содержащие декстран, могут приводить к индуцированным декстраном потенциально смертельным анафилактическим реакциям из-за специфического взаимодействия с декстрановыми антителами [59].Об анафилаксии сообщалось у 0,60% пациентов, получавших декстран железа внутривенно [60]. Такие реакции могут происходить даже при получении железа с дериватизированными декстрановыми лигандами или низкомолекулярными декстрановыми лигандами (1000–7000 дальтон), хотя и реже [7,61]. Действительно, сообщалось о редких случаях (0,2%) анафилаксии или анафилактоидных реакций при применении ферумокситола (Feraheme ® ), нового препарата железа для внутривенного введения с карбоксиметилированным декстраном [62]. Примечательно, что недавний случай выявил риск анафилаксии после лечения ферумокситолом у пациентов с гиперчувствительностью к декстрану железа в анамнезе [63].Напротив, анафилактические реакции крайне маловероятны с комплексами, содержащими декстрин или сахарозу, такими как карбоксимальтоза железа и сахароза железа, поскольку декстрин и сахароза не реагируют специфически с антителами к декстрану. Действительно, не сообщалось об анафилаксии при введении карбоксимальтозы трехвалентного железа.
Более низкая молекулярная масса препаратов типа II-IV может считаться преимуществом по сравнению с комплексами типа I с точки зрения потенциальных анафилактических реакций. Поскольку препараты типа II не содержат биологических полимеров, можно ожидать, что серьезные побочные реакции будут менее частыми, чем с декстраном железа.Действительно, крупномасштабные постмаркетинговые данные по сахарозе железа сообщают только о 4,2 нежелательных явлениях на миллион эквивалентов дозы 100 мг железа (по сравнению с 29,2 для декстрана железа) [60]. Истинные анафилактические реакции не могут возникать при применении сахарозы железа или глюконата натрия и железа, хотя очень редко сообщалось о побочных эффектах, вызванных слабосвязанным железом [59], особенно при введении доз, превышающих рекомендуемые. Однако более мелкие и более лабильные комплексы железа III и IV типов со значительными количествами компонентов с молекулярной массой <18 000 Да не могут считаться клинически безопасными при внутривенном применении [7].Доклинические исследования показали, что глюконат натрия и железа даже в относительно низких дозах приводит к тяжелому и длительному паренхиматозному некрозу печени, вторичному по отношению к перекисному окислению липидов, индуцированному железом [17]. Частота нежелательных явлений, сообщаемых Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) у пациентов, получающих глюконат натрия и железа, примерно вдвое выше, чем у пациентов с сахарозой железа [60]. Цитрат железа (III) и сорбит железа (III) очень быстро выводятся почками, так что лишь небольшие количества откладываются в печени.Однако доклинические исследования показывают, что перегрузка железом обнаруживается в ткани почек в течение ограниченного времени после введения [17].
Долгосрочная безопасность внутривенных препаратов железа является предметом обсуждения. Однако недавние всесторонние обзоры пришли к выводу, что, особенно в отношении новых препаратов железа для внутривенного введения, эти опасения необоснованны [64]. Одна потенциальная проблема безопасности связана с возможным долгосрочным хранением комплексов из-за неполного использования железа из внутривенных препаратов.Это беспокойство основано на наблюдении, что, скорее всего, из-за очень высокой стабильности комплексов декстрана железа утилизация железа из этих препаратов не является количественной [65]. Напротив, всесторонние эксперименты по утилизации, проведенные с радиоактивно меченным железом в форме сахарозы [10] и карбоксимальтозы железа [47], показали, что у пациентов с железодефицитной анемией утилизация железа из этих комплексов является по существу количественной. Подробные исследования в этой форме недоступны для глюконата натрия и ферумокситола, для которых вопрос количественного использования остается без ответа.
4.2. Безопасность пероральных препаратов железа
Различные пероральные препараты демонстрируют разные профили безопасности, при этом сульфат железа — самая дешевая и наиболее часто назначаемая пероральная добавка железа — демонстрирует быстрое повышение как концентрации железа в сыворотке, так и NTBI [35], а также наибольшую частоту побочных эффектов. [36,54]. В целом, при пероральном приеме солей железа (II) наблюдается больший окислительный стресс, чем при пероральном введении комплексов железа (III) из-за более быстрого высвобождения ионов железа. Toumainen et al.Компания провела шестимесячное двойное слепое исследование с участием 45 мужчин с низкими запасами железа, получавших либо сульфат железа (180 мг железа в день), либо железо (III) -полимальтозу (Мальтофер ® , 200 мг железа в день). [66]. Окислительная восприимчивость, измеренная липопротеинами низкой плотности, была на 12,8% выше в группе сульфата железа по сравнению с группой Maltofer ® ; количество продуктов перекисного окисления липидов было на 13,8% больше.
Эти данные согласуются с результатами одноцентрового открытого рандомизированного многодозового исследования, в котором эквивалентные дозы (100 мг железа два раза в день в течение 12 недель) комплекса железо (III) -полимальтоза (Мальтофер ® ) и сульфат железа вводили добровольцам-донорам, страдающим анемией [46].В конце испытания улучшение концентрации гемоглобина было сопоставимым в двух группах. Однако побочные эффекты в этой группе встречались значительно реже (12,5% пациентов по сравнению с 44,7% в группе сульфата железа). В ряде исследований наблюдалась более низкая частота прерывания лечения комплексом железо (III) -полимальтоза (Мальтофер ® ), чем солями железа, обычно в результате меньшего количества побочных эффектов со стороны верхних отделов желудочно-кишечного тракта [67]. Таким образом, учитывая аналогичную биодоступность Мальтофера ® и солей двухвалентного железа, более медленное всасывание железа из неионогенного комплекса железо (III) -полимальтоза предпочтительнее пероральных препаратов стандартного высвобождения с точки зрения баланса эффективность / токсичность.
Сравнительное исследование пероральных препаратов железа с использованием модели кишечника человека
Sci Pharm. 2013 октябрь-декабрь; 81 (4): 1123–1139.
Мохаммед Гулрез Заривала
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
Сатьянараяна Сомаварапу
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
Себастьян Фарно
3 Департамент наук о жизни, Бедфордширский университет, Парк-сквер, Лутон, LU1 3JU, Великобритания.
Дерек Реншоу
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
3 Департамент естественных наук, Университет Бедфордшира, Парк-сквер, Лутон, LU1 3JU, Великобритания.
§ Эти авторы внесли равный вклад.
Поступило 4 апреля 2013 г .; Принято 21 июня 2013 г.
Copyright © Zariwala et al. ; лицензиат Österreichische Apotheker-Verlagsgesellschaft m. б. H., Вена, Австрия. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 3.0 /), который разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.Abstract
Дефицит железа и связанная с ним железодефицитная анемия (ЖДА) являются наиболее распространенными нарушениями питания во всем мире. Стандартное лечение включает добавление твердых или жидких препаратов железа, обычно на основе соли двухвалентного железа, такой как сульфат железа, фумарат железа или глюконат железа.В настоящем исследовании мы сравнили поглощение и абсорбцию железа из различных твердых и жидких препаратов железа, доступных в настоящее время в Соединенном Королевстве, с использованием хорошо охарактеризованной линии клеток эпителиальной аденокарциномы человека Caco-2. Образование внутриклеточного белка ферритина клеткой Caco-2 считалось индикатором поглощения и абсорбции клеточного железа. Мы исследовали влияние ингредиентов рецептуры при определенном pH на поглощение и абсорбцию железа и разработали новый двухэтапный протокол растворения-абсорбции, имитирующий физиологические условия.Наши эксперименты выявили большие различия в скорости растворения между различными твердыми препаратами железа. Таблетки двухвалентного железа с обычным высвобождением растворялись быстро (от 48 ± 4 минут до 64 ± 4 минут), тогда как таблетки и капсулы с модифицированным высвобождением требовали значительно больше времени для полного растворения (от 274 ± 8 до 256 ± 8 минут). Среди твердых препаратов железа таблетки сульфата двухвалентного железа с обычным высвобождением продемонстрировали самое высокое всасывание железа, тогда как препараты двухвалентного железа с модифицированным высвобождением продемонстрировали равномерно низкое всасывание железа по сравнению с контролем (P <0.05). Взятые вместе, наши результаты демонстрируют, что существуют широкие вариации времени растворения и поглощения железа из пероральных препаратов железа, причем ключевую роль играют физические характеристики препарата, а также форма железа.
Ключевые слова: Анемия, растворение, Caco-2, ферритин, добавки железа
Введение
Железо является важным минеральным питательным веществом, которое играет ключевую физиологическую роль и требуется для многих функций, таких как транспорт кислорода, выработка АТФ и т. Д. Репликация ДНК.У нормальных здоровых людей основным источником потери железа является отшелушивание кожи и отшелушенные клетки слизистой оболочки желудочно-кишечного тракта [1]. У мужчин это составляет примерно 1 мг / день, тогда как у женщин он выше из-за кровопотери, связанной с менструацией. Железо не может быть синтезировано в организме человека и поэтому поступает в основном из пищевых источников. При нормальном питании человека ежедневно потребляется 12–18 мг железа, в основном в форме трехвалентного железа (Fe 3+ ) [2]. Из-за физиологических, а также диетических факторов, только 1-2 мг этого количества абсорбируются через кишечные энтероциты и становятся доступными в большой круг кровообращения [2].
Во время переваривания пищи в желудке связанное железо высвобождается из его матрикса за счет комбинации факторов, включая кислотность желудочного сока, ферментативное действие и вспенивающее действие мышц желудка, создаваемое специализированным косым мышечным слоем, который является уникальным. в желудок [3]. Освободившееся железо затем доступно для абсорбции, которая происходит преимущественно в двенадцатиперстной кишке тонкой кишки [4].
Большая часть пищевого негемного железа находится в нерастворимой трехвалентной форме, которая сначала восстанавливается до двухвалентного железа с помощью трехвалентного железа DcytB (дуоденальный цитохром b), расположенного на поверхности щеточной каймы энтероцитов двенадцатиперстной кишки [5].Двухвалентный протон-связанный переносчик металлического железа (DMT1) затем транспортирует двухвалентное железо через апикальную мембрану в энтероцит, где оно либо образует комплекс с запасным белком ферритином, либо транспортируется в кровоток через базолатеральную мембрану через трансмембранный переносчик ферропортина (Ireg1) [ 6]. Поглощение железа гемом происходит по еще не выясненному механизму, который может включать фолатный канал HCP1 [7]. Процесс абсорбции чувствителен к различным факторам, диетическим и другим, которые могут препятствовать этому процессу, что приводит к недостаточному всасыванию и, как следствие, дефициту железа [8].
По данным ВОЗ, дефицит железа является наиболее распространенным нарушением питания, которым страдает до 20% населения мира [9]. Он возникает, когда потребности организма в железе не удовлетворяются за счет пищевого железа. Снижение доставки железа к участкам-мишеням, таким как паренхима печени, костный мозг и мышечный миоглобин, приводит к нарушению железозависимых функций, таких как эритропоэз [1]. Уменьшение количества эритроцитов также может характеризоваться меньшим средним размером клеток (микроцитарная анемия) [10].Конечным результатом является снижение способности переносить кислород и, как следствие, гипоксия тканей. Истощение запасов и дефицит железа в его самой легкой форме не особенно пагубно, однако прогрессирование до железодефицитной анемии (ЖДА) или сидеропенической анемии может иметь серьезные физиологические последствия [11]. ЖДА во время беременности имеет особенно тяжелые последствия и ассоциируется с преждевременными родами, перинатальной смертностью, послеродовой депрессией у матери и нарушением умственного развития и когнитивных способностей потомства [12].
Лечение дефицита железа и ЖДА обычно осуществляется с помощью пероральных добавок железа. Дополнительную терапию также можно прописать в определенных случаях с профилактической целью, например. для беременных женщин, пациентов, находящихся на гемодиализе, и младенцев с низкой массой тела при рождении. Внутривенное введение железа проводится в крайних случаях, таких как значительная кровопотеря или серьезное недоедание [13]. Препараты для перорального приема железа доступны в виде лицензированных препаратов, отпускаемых по рецепту практикующего врача, а также в виде безрецептурных препаратов, либо в виде диетических или пищевых добавок.Сульфат железа (FeSO 4 ), наряду с солями железа, фумаратом железа и глюконатом железа, являются наиболее распространенной формой добавок железа, используемых в настоящее время [14]. В Соединенном Королевстве (Великобритания) таблетки сульфата железа (200 мг), обычно содержащие 65 мг элементарного железа, чаще всего являются препаратами первого выбора для лечения железодефицитной анемии [14]. Добавки железа представлены в виде твердых или жидких препаратов с несколькими возможными вариациями.
В этом исследовании мы использовали модифицированную модель абсорбции растворением in vitro , разработанную в нашей лаборатории, которая использует человеческие кишечные клетки Caco-2 для сравнения абсорбции железа из различных твердых и жидких добавок железа, доступных в настоящее время.Насколько нам известно, подобное исследование ранее не проводилось.
Материалы и методы
Материалы
Все химические вещества имели наивысший доступный уровень чистоты или класс клеточных культур и были закуплены у Sigma-Aldrich (Дорсет, Великобритания), если не указано иное. Клетки Caco-2 были приобретены из Европейской коллекции клеточных культур (№ по каталогу 001, ECACC, Солсбери, Великобритания). Наборы для ELISA ферритина (код продукта S-22) были от Ramco (ATI Atlas, Чичестер, Великобритания) и набор для анализа белка BCA (продукт №23225) был получен от Pierce (Thermo Fisher Scientific, Нортумберленд, Великобритания). Смесь ингибиторов протеазы (PIC, каталожный № P8340) была от Sigma-Aldrich (Дорсет, Великобритания). Среды для культивирования клеток, эмбриональная телячья сыворотка (FCS) и реагенты были от Invitrogen (Лафборо, Великобритания) и Lonza (Слау, Великобритания). Планшеты для клеточных культур (6-луночные и 96-луночные) и колбы были от Nunc (Роскилле, Дания). Все остальные пластиковые изделия для клеточных культур были поставлены Corning (Амстердам, Нидерланды). Препараты твердого и жидкого железа из Великобритании были приобретены в розничной аптеке Boots (Лондон, Великобритания).Сводка всех протестированных образцов представлена в. Все используемые реагенты были приготовлены с использованием сверхчистой воды (удельное сопротивление 18,2 МОм · см). Перед использованием всю стеклянную посуду и посуду вымачивали в 10% -ной соляной кислоте (HCl) и ополаскивали сверхчистой водой для удаления любых возможных следов остаточных минералов.
Табл. 1
Список пероральных препаратов с добавками железа, сравниваемых при тестировании растворения и абсорбции железа. Образцы для испытаний включают твердые и жидкие препараты, доступные в настоящее время в Соединенном Королевстве.
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Elemental Fe / доза (мг) | Категория | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | Сульфат железа | Таблетка | NA | 81 Таблетка Al | 65 | Лицензионный / непатентованный | |||
| 2 | Фумарат железа | Таблетка | Ферсамал Goldshield | 68 | Лицензированный / непатентованный | ||||
| 3 | 942 глюконат35 | Лицензионный / собственный | |||||||
| 4 | Сульфат железа плюс аскорбиновая кислота | Таблетка с контролируемым высвобождением | Ferrograd C Teopharma | 105 | 95700 фумарат плюс минералы и витамины | 94 200 Капсула с замедленным высвобождением Ферроглобин B12 Витабиотики | 24 | Без рецепта | |
| 6 | Глюконат железа плюс фолиевая кислота | Сироп | Ферроглобин Витабиотики | 7.5 | Без рецепта | ||||
| 7 | Глюконат железа плюс аскорбиновая кислота | Сироп | Floradix Salus | 10 | Без рецепта |
Методы
Культура клеток
Клетки Caco-2 были получены при пассаже 20 и использовались экспериментально между пассажами с 30 по 35. Исходные культуры поддерживали в 75 см колбах для культур ткани 2 в полной среде (среда Игла, модифицированная Дульбекко (DMEM) — Glutamax®, pH 7.4 с добавлением 10% FCS, 1% раствора антибиотика / антимикотика и 25 мМ HEPES). Клетки культивировали в инкубаторе при 37 ° C в атмосфере 95% воздуха и 5% CO 2 при постоянной влажности, заменяя среду каждые два дня. Клетки высевали на 6-луночные планшеты при начальной плотности посева 1 × 10 4 клеток / см 2 для эксперимента по поглощению растворением. Аналогичным образом засевали параллельные 6-луночные планшеты для оценки жизнеспособности клеток до начала эксперимента по поглощению и после его завершения.Клетки Caco-2 дифференцировались до полностью созревшего фенотипа желудочно-кишечного тракта на 14-15 день после посева, когда начинались эксперименты по поглощению железа.
Растворение in vitro
Условия растворения были смоделированы in vitro для максимально точного воспроизведения физиологических условий. Препараты железа были либо твердыми (таблетки или капсулы), либо жидкими (растворы на основе сиропа) лекарственными формами. Таблетки и капсулы были дополнительно классифицированы как с обычным высвобождением или модифицированным высвобождением в соответствии с характеристиками препарата.0,1 М HCl (pH 1,2), предварительно нагретую до 37 ° C, использовали для моделирования условий желудка, а фосфатный буфер доведен до pH 5,8 с помощью 2- ( N -морфолино) этансульфоновой кислоты (10 мМ), предварительно нагретой до 37 ° C. ° C использовали для моделирования кишечных условий. В день эксперимента твердые лекарственные формы помещали в стеклянные стаканы, содержащие 50 мл имитированной желудочной или кишечной жидкости, и осторожно перемешивали со скоростью 25 оборотов в минуту (об / мин) для имитации перистальтических движений в желудочно-кишечном тракте. Температура поддерживалась постоянной на уровне 37 ° C.Жидкие лекарственные формы также добавляли к раствору среды растворения и подвергали воздействию аналогичных условий. Аликвоты из среды растворения отбирали после полного растворения (определяемого визуальным контролем) и использовали для эксперимента по поглощению железа.
Высвобождение железа in vitro
Высвобождение железа из лекарственных форм определяли путем проведения экспериментов по растворению в условиях, указанных в Ph.Eur.4 / USP 26. Среда для растворения (37 ° C, pH 1,2) была приготовлена, как описано в предыдущий раздел.Высвобождение железа оценивали путем отбора аликвот по 1 мл с заданными интервалами отбора проб (15, 30, 60, 90, 120 минут) и замены эквивалентным объемом свежей среды для растворения. Аликвоты образцов центрифугировали при 13000 об / мин в течение 10 минут при 4 ° C, и супернатанты анализировали на содержание железа.
Количественное определение железа
Высвобождение железа было количественно определено с использованием модифицированного анализа феррозина (15), разработанного в нашей лаборатории. Вкратце, аликвоты образцов (10 мкл) добавляли в микроцентрифужные пробирки, содержащие 300 мкл HCl (0.5 М). Стандарты железа готовили с использованием FeSO 4 чистоты. Реагент для обнаружения (500 мкл, содержащий 2 мМ феррозина, 2 мМ неокупроина) добавляли во все пробирки. Пробирки закрывали алюминиевой фольгой и инкубировали в темноте в течение 60 минут, после чего равные объемы (280 мкл) тестовых и стандартных образцов пипеткой переносили в 96-луночный микропланшет в трех экземплярах. Поглощение считывали при 562 нм с помощью микропланшетного ридера (VersaMax, Molecular devices, США), а содержание железа в тестируемых образцах рассчитывали по стандартной кривой, построенной для стандартов железа.Высвобождение железа (% содержания железа согласно заявлению на этикетке) из лекарственных форм определяли по этим значениям.
Поглощение и абсорбция железа клетками Caco-2
На 13-й день после посева ростовую среду аспирировали, клетки трижды промывали промывочным раствором (140 мМ NaCl, 5 мМ KCl, 10 мМ буфер PIPES, pH 6,7, 37 ° C), а затем инкубировали в бессывороточной среде MEM в течение 24 часов. В день экспериментов по поглощению тестовые среды готовили титрованием MEM 0,1 М HCl или 0,1 М NaOH до pH 5.8 (представитель физиологического pH в двенадцатиперстной кишке). Затем тестируемую среду стерилизовали фильтрованием с использованием фильтрующего элемента 0,2 мкм и затем забуферивали 2- ( N -морфолино) этансульфоновой кислотой (MES, 10 мМ). Раствор FeSO 4 использовался в качестве эталона и был приготовлен растворением сверхчистого порошка FeSO 4 в 0,1 М HCl. Среда (14 мл) была разделена на аликвоты в отдельные пробирки сокола и различные объемы образцов из растворенного теста и контрольных препаратов были добавлены к тестовой среде для достижения конечной концентрации элементарного железа 20 мкМ для каждого условия.PH среды для образцов, обогащенной железом, измеряли снова и при необходимости доводили до 5,8. Анализ исключения трипанового синего проводили в параллельных 6-луночных планшетах до начала экспериментов по оценке жизнеспособности клеток Caco-2. Вкратце, клетки окрашивали красителем трипановым синим, который избирательно окрашивает мертвые клетки; затем их подсчитывали под микроскопом и рассчитывали процент жизнеспособности. Клетки Caco-2 в тестовых планшетах трижды промывали промывочным раствором, а затем инкубировали с обогащенной железом тестовой средой (2 мл на лунку, три лунки на условие) в течение 2 часов при 37 ° C в инкубаторе для планшетов, осторожно покачивающем при 25 ° C. об / мин.Затем тестовую среду аспирировали, и клетки дважды промывали промывочным раствором и, наконец, раствором для удаления (промывочный раствор плюс 5 мкМ гидросульфита натрия и 1 мкМ дисульфоната батофенантролина) для удаления любого поверхностно связанного железа [16]. Затем клетки Caco-2 инкубировали со свежим MEM в течение следующих 24 часов в инкубаторе для клеточных культур (37 ° C, 95% воздуха и 5% CO 2 ). Параллельные 6-луночные планшеты также инкубировали с тестовой средой (приготовленной, как описано выше) и подвергали аналогичным условиям (одна лунка на условие).Жизнеспособность клеток Caco-2 в этих планшетах оценивали по завершении эксперимента с использованием анализа исключения красителя трипанового синего.
Сбор клеток Caco-2
Культуральную среду аспирировали через 24 часа после инкубации и клетки Caco-2 дважды промывали промывочным буфером. Клетки собирали добавлением 350 мкл буфера для лизиса (50 мМ NaOH с добавлением 1 мкг / мл коктейля ингибиторов протеазы) на лунку в течение 40 минут при осторожном покачивании на шейкере для планшетов (6 об / мин). Температура была стандартизирована на уровне 4 ° C на протяжении всего протокола лизиса.Затем клетки собирали, используя стерильный скребок для клеток, и полученный лизат переносили пипеткой в 0,5 мл микроцентрифужные пробирки. Каждый образец лизата пропустили шесть раз через шприц объемом 1 мл, снабженный иглами калибра 25, чтобы снизить вязкость и облегчить работу с образцом. Образцы разделяли на две равные партии и сразу хранили при -20 ° C до дальнейшего анализа.
Аналитические методы (ферритин ELISA и BCA)
Общую концентрацию ферритина в клеточных лизатах определяли с использованием спектрофотометрического набора ELISA, следуя протоколу производителя с небольшими изменениями.Лизаты замороженных клеток центрифугировали в течение 10 минут (13226 g , 4 ° C), и полученный супернатант измеряли в анализе. Стандартная кривая была построена с использованием предоставленных стандартов (0, 6, 20, 60, 200 нг стандарта / мл). Образцы и стандарты (30 мкл каждый) были загружены в трех экземплярах на 96-луночный планшет, и этапы инкубации были выполнены, как описано в протоколе. Абсорбцию определяли при 490 и 630 нм с помощью микропланшет-ридера (VersaMax, Molecular devices, США). Содержание белка в клетках Caco-2 определяли с использованием набора Pierce BCA, следуя протоколу производителя, используя исходный бычий сывороточный альбумин (BSA) (2 мг / мл), входящий в набор, в качестве стандарта.Все образцы анализировали в двух экземплярах. Концентрацию ферритина стандартизировали относительно общей концентрации белка, и нг ферритина / мг белка использовали в качестве индикатора поглощения и абсорбции железа клетками Caco-2.
Статистический анализ
Эксперименты по поглощению железа проводили дважды независимо, при этом каждое условие обработки выполнялось в трех повторностях. Для каждого лечения рассчитывали среднее значение в шести повторах. Данные представлены в виде среднего значения ± стандартная ошибка среднего, и различия между образцами были проанализированы с помощью однофакторного дисперсионного анализа Тьюки с последующим апостериорным тестом Тьюки с использованием программного обеспечения Graphpad Prism (версия 5.0). Результаты считались значимыми, если P <0,05.
Результаты
В этом исследовании мы сравнили поглощение железа из различных пероральных препаратов железа, используя модель in vitro , которая пыталась имитировать физиологические условия. Были оценены наиболее часто назначаемые классические препараты железа.
Сначала мы провели эксперимент, чтобы сравнить скорости растворения различных испытуемых препаратов. Поскольку мы исследовали препараты с обычным, а также с модифицированным высвобождением, эксперименты по растворению проводили при pH 1.2 для воссоздания среды желудка, а также при pH 5,8 для воссоздания среды в тонком кишечнике. В нулевой момент времени таблетки или капсулы по каплям помещали в среду растворения, и опыты растворения для каждого препарата проводили в трех экземплярах. Все препараты были взяты как минимум из двух разных партий. Сосуды для растворения постоянно контролировались для наблюдения за профилями растворения тестируемых препаратов. За конечную точку эксперимента принимали полное растворение таблетки или капсулы, наблюдаемое визуально.Результаты экспериментов по растворению показаны на.
Табл. 2
Среднее время растворения для пероральных препаратов железа. Время растворения (мин) твердых пероральных препаратов железа тестировали в условиях искусственного желудка (0,1 M HCL, pH 1,2, 37 ° C) и кишечных (фосфатный буфер, pH 5,8, 37 ° C). Значения являются средними ± SEM (n = 3).
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Время растворения (мин, n = 3) | |
|---|---|---|---|---|---|
| pH 1.2 | pH 5,8 | ||||
| 1 | Сульфат железа | Таблетка | NA Almus | 48 ± 4 | 362 ± 16 |
| 2 | Таблетка Fumarate железа | Goldshield | 57 ± 6 | 85 ± 9 | |
| 3 | Глюконат железа | Таблетка | NA Zanza | 64 ± 4 | 208 ± 12 |
| 4 | Сульфат железа | Таблетка с контролируемым высвобождением | Ферроград С Теофарма | 256 ± 8 | — |
| 5 | Фумарат железа плюс минералы и витамины | Капсула с замедленным высвобождением | Ферроглобин B12 | 404 9007 388 ± 11 | |
При pH 1.2, таблетки с обычным высвобождением демонстрируют высокую скорость растворения, тогда как таблетки и капсулы с модифицированным высвобождением растворяются постепенно и переменно. Таблетки сульфата железа (без марочного обозначения / Almus) растворялись быстрее всех (48 ± 4 мин), за ними следовали фумарат железа (Fersamal / Goldshield, 57 ± 6 мин) и таблетки глюконата железа (безымянного производителя / Zanza 64 ± 4 мин). Самую медленную скорость растворения продемонстрировали капсулы с замедленным высвобождением фумарата железа (Feroglobin / Vitabiotics, 274 ± 8 минут) и таблетки с контролируемым высвобождением сульфата железа (Ferrograd C / Teopharma, 256 ± 8 минут).В смоделированных кишечных условиях (pH 5,8) самое быстрое время растворения наблюдалось для таблеток фумарата железа (85 ± 9 минут), тогда как таблетки с контролируемым высвобождением фумарата железа (Ferrograd C / Teopharma) не растворялись полностью даже через 24 часа. Капсулы с замедленным высвобождением фумарата железа (Ferroglobin B12 / Vitabiotics) продемонстрировали среднее время растворения 388 ± 11 минут при pH 5,8. Мы также исследовали зависящие от времени характеристики высвобождения железа из тестируемых препаратов, выполнив отдельную серию экспериментов по растворению в смоделированных желудочных условиях.Препараты для испытания формы высвобождения железа в различные моменты времени (15, 30, 60, 90, 180 минут) были количественно определены с использованием колориметрического анализа. Результаты показаны ниже в. Первоначальное высвобождение железа в первый момент времени (15 мин) было самым высоким для таблеток фумарата двухвалентного железа (38,5%), тогда как высвобождение железа в конечный момент времени (180 мин) было самым высоким для таблеток глюконата двухвалентного железа (66,46%; см.).
Высвобождение железа из пероральных препаратов железа, доступных в Соединенном Королевстве. Лекарственные формы подвергали растворению in vitro, (0.1M HCl pH 1,2, 37 ° C) и аликвоты отбирают через фиксированные интервалы. Содержание железа в аликвотах образцов определяли с помощью колориметрического количественного анализа железа и использовали для расчета% высвобождения железа. Показанные значения являются средними из трех показаний для каждого тестового образца.
После исследований растворения и высвобождения мы провели эксперименты по поглощению железа. Метод исключения трипанового синего использовали для исследования жизнеспособности клеток Caco-2 до начала экспериментов по поглощению, а также после их завершения, чтобы изучить любые пагубные эффекты наполнителей композиции на клетки Caco-2.Жизнеспособность выше 90% наблюдалась во всех случаях (данные не показаны).
Наша цель состояла в том, чтобы сравнить широкий спектр препаратов, доступных в настоящее время в Великобритании, с использованием определенного и единообразного набора условий. Три наиболее часто используемых соли двухвалентного железа; Сульфат двухвалентного железа, глюконат двухвалентного железа и фумарат двухвалентного железа были протестированы в форме таблеток с обычным высвобождением. Сульфат железа плюс аскорбиновая кислота (Ферроград C) и глюконат железа плюс минералы и витамины (Фероглобин B12) были включены в качестве типичных препаратов с модифицированным высвобождением и поливитаминов.Глюконат железа плюс фолиевая кислота (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс) были включены в качестве типичных жидких препаратов на основе сиропа. Эти образцы включают как рецептурные, так и безрецептурные препараты железа. Порошок сверхчистого FeSO 4 был включен в качестве эталона, и результаты абсорбции были стандартизированы для FeSO 4 (считающегося 100%). Результаты показаны в.
Абсорбция железа из пероральных препаратов железа, доступных в Соединенном Королевстве.Клетки Caco-2 инкубировали с 20 мкМ железа из каждого из тестируемых препаратов. Абсорбцию железа в пересчете на ферритин (нг / мг общего белка) определяли с помощью ELISA. Результаты выражаются в процентах от контроля сульфата железа, который считается 100%. Результаты представляют собой средние значения ± SEM для 6 образцов для каждого условия (P <0,05). Значения представляют три независимых эксперимента.
Абсорбция железа из таблеток сульфата железа с обычным высвобождением была значительно выше, чем у любого из оцениваемых препаратов (P <0.05), что эквивалентно 41% от стандарта FeSO 4 . Оба препарата с модифицированным высвобождением, содержащие сульфат двухвалентного железа плюс аскорбиновую кислоту (Ферроград С) и глюконат двухвалентного железа плюс минералы и витамины (Фероглобин В12), продемонстрировали низкое всасывание железа. Препараты в виде сиропа, содержащие глюконат железа и фолиевую кислоту (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс), также продемонстрировали относительно низкую абсорбцию железа. Таким образом, сульфат двухвалентного железа с обычным высвобождением продемонстрировал в целом самый высокий уровень поглощения железа, тогда как самый низкий уровень поглощения железа был от таблеток с модифицированным высвобождением сульфата двухвалентного железа плюс аскорбиновая кислота (Ферроград С).
Обсуждение
Добавки железа считаются эффективной стратегией борьбы с анемией, а препараты железа являются одними из наиболее часто назначаемых лекарств [17]. Соли железа, впервые использованные в XIX веке, остались основой терапии железом [1, 18]. Основными преимуществами являются низкая стоимость единицы продукции, что делает их широко доступными. Однако соли двухвалентного железа имеют высокую склонность вызывать побочные эффекты, которые обычно приводят к плохому соблюдению пациентом режима лечения. Диарея и запор обычно встречаются примерно у 6% пациентов, тогда как 6–12% пациентов жалуются на тошноту, рвоту и желудочные расстройства [19].Большинство этих побочных эффектов связано с тем, что часть железа остается неабсорбированной после приема внутрь и остается локализованной в просвете кишечника. Некоторые авторы связывают эти побочные эффекты с раздражением слизистой оболочки желудочно-кишечного тракта за счет катализа свободных радикалов из свободного железа, не связанного с трансферрином [20].
В настоящем исследовании мы сравнили абсорбцию железа среди нескольких имеющихся в продаже препаратов железа. В нашем исследовании оценивались репрезентативные продукты наиболее часто используемых препаратов железа в Великобритании.Мы сосредоточили внимание на них, поскольку препараты, доступные в Великобритании, проходят обширные нормативные процедуры и также представляют собой большинство препаратов железа, доступных во всем мире. Однако очень немногие исследования in vivo, или in vitro, сравнивали абсорбцию железа из пероральных лекарственных форм, и, насколько нам известно, ни в одном исследовании не использовался двухэтапный протокол растворения-абсорбции in vitro .
Абсорбция железа происходит в основном в двенадцатиперстной кишке тонкой кишки, и линия клеток кишечника человека Caco-2 хорошо охарактеризована как модель для изучения абсорбции железа in vitro [21].Клетки Caco-2 обладают морфологическими характеристиками зрелых энтероцитов и экспрессируют большинство рецепторов, участвующих в абсорбции железа, включая DMT-1, DcytB и Ireg1 (ферропортин), IRE1 и IRE2. Несколько исследований ранее сравнивали поглощение железа из солей железа, цельных продуктов, фруктовых соков и детских смесей с использованием модели количественного определения Caco-2-ферритина [22–26]. Однако большинство пероральных препаратов железа в виде добавок вводят в виде лекарственных форм (таблеток, капсул, сиропов или растворов) и включают ряд активных и неактивных ингредиентов (например,г. связующие вещества, разбавители, разрыхлители), необходимые для препарата, которые потенциально могут влиять на поглощение и абсорбцию железа. Активные ингредиенты могут включать другие минералы и витамины, такие как аскорбиновая кислота (витамин С), которая часто включается в комбинации с железом, поскольку обычно считается усилителем всасывания железа [27]. В условиях, которые отражают потребность в заместительной терапии, например, во время беременности и недоедания, эксперты также рекомендуют железо в сочетании с другими микронутриентами, такими как фолиевая кислота и витамин B12 [28].В случае жидких препаратов, таких как сиропы, также добавляются добавки, такие как ароматизаторы и красители, для улучшения внешнего вида и вкусовых качеств. Некоторые препараты железного сиропа, раствора и эликсира содержат фруктовые и растительные соки или экстракты. Фруктовые соки и овощные экстракты богаты полифенолами; известные ингибиторы абсорбции железа [29–31]. Поэтому мы хотели исследовать комбинированный эффект физической формы препарата в сочетании с источником железа.
После проглатывания твердые пероральные составы растворяются под воздействием кислого pH желудка, чему способствует перистальтическое движение и сегментация желудочно-кишечных мышц.Растворение является этапом, определяющим скорость всасывания различных пероральных препаратов, и скорость растворения широко варьируется в зависимости от природы препарата [32]. Быстрорастворимые таблетки быстро выделяют железо; однако это может привести к побочным эффектам из-за избыточной локализации / накопления свободного железа и последующего химического раздражения слизистой оболочки желудочно-кишечного тракта [33]. Чтобы противостоять этому, были созданы таблетки с замедленным или модифицированным высвобождением. Таблетки или капсулы с модифицированным высвобождением представляют собой фармацевтические стратегии для поддержания медленного и постепенного высвобождения активного ингредиента после приема внутрь, исходя из того, что железо, высвобождаемое таким образом, лучше переносится, поскольку это позволит избежать чрезмерного накопления и его побочных эффектов.Обычно это достигается покрытием таблетки пленкой или захватом активного ингредиента полимерной матрицей, что приводит к его медленному и постепенному высвобождению. Такие препараты железа относительно дороже обычных таблеток [33]. Физиологический процесс опорожнения желудка ограничивает относительное время, в течение которого таблетки и другие твердые лекарственные формы могут полностью раствориться. Время опорожнения желудка для взрослых людей составляет от 3 до 6 часов [34], и поэтому, если таблетка не подвергнется полному растворению в течение этого периода, остаточная нерастворенная фракция будет перемещена в толстую кишку для последующего вывода из организма.Это будет означать потерю значительной части лекарственной формы до того, как активный ингредиент сможет полностью высвободиться и стать доступным для абсорбции [35]. Регулирующие органы, такие как Национальная служба здравоохранения Великобритании (NHS), рекомендовали не использовать препараты железа с модифицированным высвобождением [33].
В настоящее время не существует теста на растворение, указанного для препаратов железа в соответствии с Британской фармакопеей (BP), в то время как Фармакопея США (USP) определяет тест на растворение только для таблеток и капсул с глюконатом железа [36].Мы разработали двухэтапный протокол растворения-абсорбции, который нацелен на воспроизведение температуры, pH, кислотности и механических условий, с которыми лекарственные формы встречаются в желудке человека. В нашем протоколе учитывается влияние времени растворения, вспомогательных веществ и изменений pH на абсорбцию железа из пероральных препаратов.
Перед нашими экспериментами мы провели исследования по оптимизации, чтобы оценить время растворения для всех тестируемых твердых препаратов. HCL (0,1 М, pH 1.2) использовался для моделирования желудочного сока, чтобы имитировать рН среды желудка, а фосфатный буфер (рН 5,8) был использован для моделирования кишечной жидкости, чтобы учесть характер растворения препаратов с модифицированным высвобождением. Было обнаружено, что обычные таблетки с быстрым высвобождением полностью растворяются в течение ~ 2 часов (в условиях pH желудочного сока), тогда как таблетки с модифицированным высвобождением занимают значительно больше времени (~ 4 часа). В условиях рН кишечника лекарственные формы с модифицированным высвобождением демонстрировали переменные скорости растворения, при этом таблетка с контролируемым высвобождением Ферроград С не могла полностью растворяться даже через 24 часа.Наши данные согласуются с исследованием Bannerman и его коллег, в котором сравнивались профили растворения различных твердых пероральных препаратов железа [36].
Мы также исследовали высвобождение железа из лекарственных форм в процессе растворения, и результаты соответствовали нашим данным по растворению. Наши результаты показали, что препараты железа, по-видимому, следуют прогнозируемой схеме высвобождения лекарственного средства в соответствии с конструкцией их лекарственной формы, то есть таблетка с обычным высвобождением демонстрирует быстрое высвобождение железа, в то время как композиции с контролируемым и замедленным высвобождением демонстрируют схему постепенного высвобождения в течение более длительного периода. .
После растворения препаратов железа отбирали аликвоты, эквивалентные конечной концентрации 20 мкМ Fe, и использовали их для экспериментов по поглощению железа. Эта концентрация была выбрана на основе экспериментов по оптимизации, проведенных в нашей лаборатории, и согласуется с несколькими предыдущими исследованиями, которые показали, что эта концентрация является оптимальной для исследований поглощения железа [25, 37].
Вспомогательные вещества, как известно, играют облегчающую или ингибирующую роль в абсорбции лекарств [38]; поэтому мы не фильтровали образцы, что позволило нам изучить влияние вспомогательных веществ на поглощение железа клетками Caco-2.PH лечебной среды был доведен до pH 5,8, что является типичным показателем pH в дистальном отделе двенадцатиперстной кишки и был оптимизирован другими [39]. Эксперименты по поглощению были стандартизированы для 2 часов, что представляет собой физиологическое время прохождения через тонкий кишечник [40].
Мы измерили внутриклеточную концентрацию ферритина как меру поглощения железа клетками Caco-2. Этот метод очень чувствителен, хорошо охарактеризован и хорошо коррелирует с усвоением человеком.Клетки Caco-2 синтезируют ферритин в зависимости от своего статуса железа, а также уровня железа в окружающей среде [37]. Поэтому мы культивировали клетки в среде, содержащей минимальное количество железа, за 24 часа до эксперимента, чтобы гарантировать минимальное образование клеточного ферритина до экспериментов по поглощению. В этих условиях клетки Caco-2 демонстрируют максимальное поглощение железа, и поэтому незначительные изменения поглощения железа между различными образцами могут быть точно измерены с точки зрения образования ферритина [21].Исследования поглощения железа также можно проводить путем измерения общего внутриклеточного поглощения железа с помощью атомно-абсорбционной спектроскопии или радиоактивно меченного железа. Эти методы требуют использования сложных контрольно-измерительных приборов и специализированных средств. Некоторые соединения и комплексы железа нельзя пометить ни внутренне, ни внешне радиоизотопами железа. Измерение ферритина позволяет избежать этих проблем, а также избежать проблемы неспецифического связывания свободного железа с поверхностью клетки, которое может привести к неточному количественному определению общего клеточного железа.
Наше исследование показало, что среди различных протестированных препаратов железа обычные таблетки сульфата двухвалентного железа с быстрым высвобождением демонстрируют самое высокое всасывание железа, тогда как таблетки железа с модифицированным высвобождением равномерно имеют самое низкое всасывание железа. Это согласуется с другими исследованиями, которые также показали, что препараты с модифицированным высвобождением или препараты железа имеют низкую биодоступность [36, 40]. В наших экспериментах по поглощению использовались равные дозы элементарного железа (20 мкм) из каждого препарата, таким образом, различия в абсорбции железа между различными препаратами не могут быть объяснены различиями в содержании железа в каждом составе.Возможное объяснение вариабельности абсорбции железа между образцами может быть связано с характеристиками препарата формы препарата железа. Таблетки железа с обычным высвобождением созданы для быстрого высвобождения железа и содержат меньше вспомогательных веществ. Препараты с модифицированным высвобождением являются относительно более сложными препаратами и включают несколько вспомогательных веществ и добавок. Некоторые вспомогательные вещества включены для улучшения абсорбции активного ингредиента [41]. Однако вспомогательные вещества также могут оказывать пагубное влияние на поглощение и абсорбцию, улавливая активный ингредиент в матрице, тем самым делая его недоступным для клеточного поглощения [42, 43].Тестируемые препараты жидкого железа также содержат множество вспомогательных веществ, главным образом для улучшения вкусовых качеств и внешнего вида. Известно, что некоторые добавки, присутствующие в этих препаратах, ингибируют абсорбцию железа. Например, жидкий препарат Floradix изготовлен на основе сиропа, который включает 29% фруктового сока, включая виноградный и вишневый сок, которые могут ингибировать абсорбцию железа из-за высокого содержания в них полифенолов [31]. Свободный раствор FeSO 4 , включенный в качестве эталона в наши эксперименты, продемонстрировал самое высокое поглощение железа.Таким образом, наши результаты показывают, что физические формы препарата, а также форма железа влияют на поглощение и абсорбцию железа из пероральных лекарственных форм.
Сравнение абсорбции железа из пероральных лекарственных форм может быть ценным инструментом при оценке эффективности пероральных препаратов железа. Добавки железа считаются удобной и экономичной мерой для борьбы с дефицитом железа и его последствиями, и широкий выбор твердых и жидких препаратов железа доступен как по рецепту, так и без рецепта.Это исследование не ставило своей целью оспаривать фундаментальную стратегию, а скорее исследовать любые различия в высвобождении и поглощении железа, которые могут существовать между различными препаратами, которые могут привести к менее благоприятным результатам терапии добавками железа. Мы полагаем, что это исследование дает важную информацию о физиологическом процессе абсорбции железа из пероральных препаратов железа и, следовательно, может помочь в разработке новых препаратов, которые доставляют необходимое количество железа, ограничивая при этом побочные эффекты.Наши будущие исследования будут определять абсорбцию железа из пероральных препаратов в присутствии пищевых веществ и оценивать корреляцию с клиническими данными.
Выражение признательности
Д-р М. Гулрез Заривала получил грант на начало карьеры от Общества эндокринологов Великобритании. Авторы выражают благодарность д-ру Нилуфару Моради-Бидхенди за вычитку рукописи.
Сокращения
| DMT1 | Двухвалентный протон-связанный переносчик металлического железа |
| Dcytb | Дуоденальный цитохром b |
| IDA | Железодефицитная анемия |
| Национальная служба NHS | |
| OTC | без рецепта |
Сноски
Заявление авторов
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
12. Уша Р., редактор. Пищевые анемии. CRC Press, Taylor & Francis Group; 2000. Функциональные последствия пищевой анемии во время беременности и раннего детства; С. 43–68. [Google Scholar] 21. Fairweather-Tait S, Lynch S, Hotz C, Hurrell R, Abrahamse L, Beebe S, Bering S, Bukhave K, Glahn R, Hambidge M, Hunt J, Lonnerdal B, Miller D, Mohktar N, Nestel P, Reddy M, Sandber AS, Sharp P, Teucher B, Trinidad TP. Полезность моделей in vitro для прогнозирования биодоступности железа и цинка: консенсусное заявление экспертной консультации HarvestPlus.Int J Vitam Nutr Res. 2005. 75: 371–374. http://dx.doi.org/10.1024/0300-9831.75.6.371. [PubMed] [Google Scholar] 25. Пералес С., Барбера Р., Лагарда М.Дж., Фарре Р. Доступность железа из молочных смесей и фруктовых соков, содержащих молоко и злаки, оценивается методами in vitro (растворимость, диализируемость), а также поглощение и перенос клетками Caco-2. Food Chem. 2007. 102: 1296–1303. http://dx.doi.org/10.1016/j.foodchem.2006.07.019. [PubMed] [Google Scholar] 26. Forbes AL, Arnaud MJ, Chichester CO, Cook JD, Harrison BN, Hurrell RF, Kahn SG, Morris ER, Tanner JT, Whittaker P и др.Сравнение in vitro, животных и клинических определений биодоступности железа: отчет Рабочей группы Международной консультативной группы по пищевой анемии о биодоступности железа. Am J Clin Nutr. 1989. 49: 225–238. http://www.ncbi.nlm.nih.gov/pubmed/2644802. [PubMed] [Google Scholar] 33. Объединенный формулярный комитет. Британский национальный формуляр. 63-е издание. Лондон: Британская медицинская ассоциация и Королевское фармацевтическое общество Великобритании; 2012. [Google Scholar] 42. Сингх П., Гиллори Дж. К., Соколоски Т. Д., Бенет Л. З., Бхатия В. Н..Влияние инертных ингредиентов таблеток на всасывание лекарств. I. Влияние полиэтиленгликоля 4000 на всасывание в кишечнике четырех барбитуратов. J Pharm Sci. 1966; 55: 63–68. http://dx.doi.org/10.1002/jps.2600550114. [PubMed] [Google Scholar]Сравнительное исследование препаратов перорального железа с использованием модели кишечника человека
Sci Pharm. 2013 октябрь-декабрь; 81 (4): 1123–1139.
Мохаммед Гулрез Заривала
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
Сатьянараяна Сомаварапу
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
Себастьян Фарно
3 Департамент наук о жизни, Бедфордширский университет, Парк-сквер, Лутон, LU1 3JU, Великобритания.
Дерек Реншоу
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
3 Департамент естественных наук, Университет Бедфордшира, Парк-сквер, Лутон, LU1 3JU, Великобритания.
§ Эти авторы внесли равный вклад.
Поступило 4 апреля 2013 г .; Принята к печати 21 июня 2013 г.
Авторские права © Zariwala et al. ; лицензиат Österreichische Apotheker-Verlagsgesellschaft m. б. H., Вена, Австрия. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение в на любом носителе, при условии, что оригинальная работа процитирована должным образом. Эта статья цитировалась в других статьях в PMC.Abstract
Дефицит железа и связанная с ним железодефицитная анемия (ЖДА) являются наиболее распространенными нарушениями питания во всем мире.Стандартное лечение включает добавление твердых или жидких препаратов железа, обычно на основе соли двухвалентного железа, такой как сульфат железа, фумарат железа или глюконат железа. В настоящем исследовании мы сравнили поглощение и абсорбцию железа из различных твердых и жидких препаратов железа, доступных в настоящее время в Соединенном Королевстве, с использованием хорошо охарактеризованной линии клеток эпителиальной аденокарциномы человека Caco-2. Образование внутриклеточного белка ферритина клеткой Caco-2 считалось индикатором поглощения и абсорбции клеточного железа.Мы исследовали влияние ингредиентов рецептуры при определенном pH на поглощение и абсорбцию железа и разработали новый двухэтапный протокол растворения-абсорбции, имитирующий физиологические условия. Наши эксперименты выявили большие различия в скорости растворения между различными твердыми препаратами железа. Таблетки двухвалентного железа с обычным высвобождением растворялись быстро (от 48 ± 4 минут до 64 ± 4 минут), тогда как таблетки и капсулы с модифицированным высвобождением требовали значительно больше времени для полного растворения (от 274 ± 8 до 256 ± 8 минут).Среди твердых препаратов железа таблетки сульфата двухвалентного железа с обычным высвобождением продемонстрировали самое высокое всасывание железа, тогда как препараты двухвалентного железа с модифицированным высвобождением продемонстрировали равномерно низкое всасывание железа по сравнению с контролем (Р <0,05). Взятые вместе, наши результаты демонстрируют, что существуют широкие вариации времени растворения и поглощения железа из пероральных препаратов железа, причем ключевую роль играют физические характеристики препарата, а также форма железа.
Ключевые слова: Анемия, растворение, Caco-2, ферритин, добавки железа
Введение
Железо является важным минеральным питательным веществом, которое играет ключевую физиологическую роль и требуется для многих функций, таких как транспорт кислорода, выработка АТФ и т. Д. Репликация ДНК. У нормальных здоровых людей основным источником потери железа является отшелушивание кожи и отшелушенные клетки слизистой оболочки желудочно-кишечного тракта [1]. У мужчин это составляет примерно 1 мг / день, тогда как у женщин он выше из-за кровопотери, связанной с менструацией.Железо не может быть синтезировано в организме человека и поэтому поступает в основном из пищевых источников. При нормальном питании человека ежедневно потребляется 12–18 мг железа, в основном в форме трехвалентного железа (Fe 3+ ) [2]. Из-за физиологических, а также диетических факторов, только 1-2 мг этого количества абсорбируются через кишечные энтероциты и становятся доступными в большой круг кровообращения [2].
Во время переваривания пищи в желудке связанное железо высвобождается из его матрикса за счет комбинации факторов, включая кислотность желудочного сока, ферментативное действие и вспенивающее действие мышц желудка, создаваемое специализированным косым мышечным слоем, который является уникальным. в желудок [3].Освободившееся железо затем доступно для абсорбции, которая происходит преимущественно в двенадцатиперстной кишке тонкой кишки [4].
Большая часть пищевого негемного железа находится в нерастворимой трехвалентной форме, которая сначала восстанавливается до двухвалентного железа с помощью трехвалентного железа DcytB (дуоденальный цитохром b), расположенного на поверхности щеточной каймы энтероцитов двенадцатиперстной кишки [5]. Двухвалентный протон-связанный переносчик металлического железа (DMT1) затем транспортирует двухвалентное железо через апикальную мембрану в энтероцит, где оно либо образует комплекс с запасным белком ферритином, либо транспортируется в кровоток через базолатеральную мембрану через трансмембранный переносчик ферропортина (Ireg1) [ 6].Поглощение железа гемом происходит по еще не выясненному механизму, который может включать фолатный канал HCP1 [7]. Процесс абсорбции чувствителен к различным факторам, диетическим и другим, которые могут препятствовать этому процессу, что приводит к недостаточному всасыванию и, как следствие, дефициту железа [8].
По данным ВОЗ, дефицит железа является наиболее распространенным нарушением питания, которым страдает до 20% населения мира [9]. Он возникает, когда потребности организма в железе не удовлетворяются за счет пищевого железа.Снижение доставки железа к участкам-мишеням, таким как паренхима печени, костный мозг и мышечный миоглобин, приводит к нарушению железозависимых функций, таких как эритропоэз [1]. Уменьшение количества эритроцитов также может характеризоваться меньшим средним размером клеток (микроцитарная анемия) [10]. Конечным результатом является снижение способности переносить кислород и, как следствие, гипоксия тканей. Истощение запасов и дефицит железа в его самой легкой форме не особенно пагубно, однако прогрессирование до железодефицитной анемии (ЖДА) или сидеропенической анемии может иметь серьезные физиологические последствия [11].ЖДА во время беременности имеет особенно тяжелые последствия и ассоциируется с преждевременными родами, перинатальной смертностью, послеродовой депрессией у матери и нарушением умственного развития и когнитивных способностей потомства [12].
Лечение дефицита железа и ЖДА обычно осуществляется с помощью пероральных добавок железа. Дополнительную терапию также можно прописать в определенных случаях с профилактической целью, например. для беременных женщин, пациентов, находящихся на гемодиализе, и младенцев с низкой массой тела при рождении. Внутривенное введение железа проводится в крайних случаях, таких как значительная кровопотеря или серьезное недоедание [13].Препараты для перорального приема железа доступны в виде лицензированных препаратов, отпускаемых по рецепту практикующего врача, а также в виде безрецептурных препаратов, либо в виде диетических или пищевых добавок. Сульфат железа (FeSO 4 ), наряду с солями железа, фумаратом железа и глюконатом железа, являются наиболее распространенной формой добавок железа, используемых в настоящее время [14]. В Соединенном Королевстве (Великобритания) таблетки сульфата железа (200 мг), обычно содержащие 65 мг элементарного железа, чаще всего являются препаратами первого выбора для лечения железодефицитной анемии [14].Добавки железа представлены в виде твердых или жидких препаратов с несколькими возможными вариациями.
В этом исследовании мы использовали модифицированную модель абсорбции растворением in vitro , разработанную в нашей лаборатории, которая использует человеческие кишечные клетки Caco-2 для сравнения абсорбции железа из различных твердых и жидких добавок железа, доступных в настоящее время. Насколько нам известно, подобное исследование ранее не проводилось.
Материалы и методы
Материалы
Все химические вещества имели наивысший доступный уровень чистоты или класс клеточных культур и были закуплены у Sigma-Aldrich (Дорсет, Великобритания), если не указано иное.Клетки Caco-2 были приобретены из Европейской коллекции клеточных культур (№ по каталогу 001, ECACC, Солсбери, Великобритания). Наборы для ELISA ферритина (код продукта S-22) были от Ramco (ATI Atlas, Чичестер, Великобритания), а набор для анализа белка BCA (продукт № 23225) был от Pierce (Thermo Fisher Scientific, Нортумберленд, Великобритания). Смесь ингибиторов протеазы (PIC, каталожный № P8340) была от Sigma-Aldrich (Дорсет, Великобритания). Среды для культивирования клеток, эмбриональная телячья сыворотка (FCS) и реагенты были от Invitrogen (Лафборо, Великобритания) и Lonza (Слау, Великобритания).Планшеты для клеточных культур (6-луночные и 96-луночные) и колбы были от Nunc (Роскилле, Дания). Все остальные пластиковые изделия для клеточных культур были поставлены Corning (Амстердам, Нидерланды). Препараты твердого и жидкого железа из Великобритании были приобретены в розничной аптеке Boots (Лондон, Великобритания). Сводка всех протестированных образцов представлена в. Все используемые реагенты были приготовлены с использованием сверхчистой воды (удельное сопротивление 18,2 МОм · см). Перед использованием всю стеклянную посуду и посуду вымачивали в 10% -ной соляной кислоте (HCl) и ополаскивали сверхчистой водой для удаления любых возможных следов остаточных минералов.
Табл. 1
Список пероральных препаратов с добавками железа, сравниваемых при тестировании растворения и абсорбции железа. Образцы для испытаний включают твердые и жидкие препараты, доступные в настоящее время в Соединенном Королевстве.
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Elemental Fe / доза (мг) | Категория | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | Сульфат железа | Таблетка | NA | 81 Таблетка Al | 65 | Лицензионный / непатентованный | |||
| 2 | Фумарат железа | Таблетка | Ферсамал Goldshield | 68 | Лицензированный / непатентованный | ||||
| 3 | 942 глюконат35 | Лицензионный / собственный | |||||||
| 4 | Сульфат железа плюс аскорбиновая кислота | Таблетка с контролируемым высвобождением | Ferrograd C Teopharma | 105 | 95700 фумарат плюс минералы и витамины | 94 200 Капсула с замедленным высвобождением Ферроглобин B12 Витабиотики | 24 | Без рецепта | |
| 6 | Глюконат железа плюс фолиевая кислота | Сироп | Ферроглобин Витабиотики | 7.5 | Без рецепта | ||||
| 7 | Глюконат железа плюс аскорбиновая кислота | Сироп | Floradix Salus | 10 | Без рецепта |
Методы
Культура клеток
Клетки Caco-2 были получены при пассаже 20 и использовались экспериментально между пассажами с 30 по 35. Исходные культуры поддерживали в 75 см колбах для культур ткани 2 в полной среде (среда Игла, модифицированная Дульбекко (DMEM) — Glutamax®, pH 7.4 с добавлением 10% FCS, 1% раствора антибиотика / антимикотика и 25 мМ HEPES). Клетки культивировали в инкубаторе при 37 ° C в атмосфере 95% воздуха и 5% CO 2 при постоянной влажности, заменяя среду каждые два дня. Клетки высевали на 6-луночные планшеты при начальной плотности посева 1 × 10 4 клеток / см 2 для эксперимента по поглощению растворением. Аналогичным образом засевали параллельные 6-луночные планшеты для оценки жизнеспособности клеток до начала эксперимента по поглощению и после его завершения.Клетки Caco-2 дифференцировались до полностью созревшего фенотипа желудочно-кишечного тракта на 14-15 день после посева, когда начинались эксперименты по поглощению железа.
Растворение in vitro
Условия растворения были смоделированы in vitro для максимально точного воспроизведения физиологических условий. Препараты железа были либо твердыми (таблетки или капсулы), либо жидкими (растворы на основе сиропа) лекарственными формами. Таблетки и капсулы были дополнительно классифицированы как с обычным высвобождением или модифицированным высвобождением в соответствии с характеристиками препарата.0,1 М HCl (pH 1,2), предварительно нагретую до 37 ° C, использовали для моделирования условий желудка, а фосфатный буфер доведен до pH 5,8 с помощью 2- ( N -морфолино) этансульфоновой кислоты (10 мМ), предварительно нагретой до 37 ° C. ° C использовали для моделирования кишечных условий. В день эксперимента твердые лекарственные формы помещали в стеклянные стаканы, содержащие 50 мл имитированной желудочной или кишечной жидкости, и осторожно перемешивали со скоростью 25 оборотов в минуту (об / мин) для имитации перистальтических движений в желудочно-кишечном тракте. Температура поддерживалась постоянной на уровне 37 ° C.Жидкие лекарственные формы также добавляли к раствору среды растворения и подвергали воздействию аналогичных условий. Аликвоты из среды растворения отбирали после полного растворения (определяемого визуальным контролем) и использовали для эксперимента по поглощению железа.
Высвобождение железа in vitro
Высвобождение железа из лекарственных форм определяли путем проведения экспериментов по растворению в условиях, указанных в Ph.Eur.4 / USP 26. Среда для растворения (37 ° C, pH 1,2) была приготовлена, как описано в предыдущий раздел.Высвобождение железа оценивали путем отбора аликвот по 1 мл с заданными интервалами отбора проб (15, 30, 60, 90, 120 минут) и замены эквивалентным объемом свежей среды для растворения. Аликвоты образцов центрифугировали при 13000 об / мин в течение 10 минут при 4 ° C, и супернатанты анализировали на содержание железа.
Количественное определение железа
Высвобождение железа было количественно определено с использованием модифицированного анализа феррозина (15), разработанного в нашей лаборатории. Вкратце, аликвоты образцов (10 мкл) добавляли в микроцентрифужные пробирки, содержащие 300 мкл HCl (0.5 М). Стандарты железа готовили с использованием FeSO 4 чистоты. Реагент для обнаружения (500 мкл, содержащий 2 мМ феррозина, 2 мМ неокупроина) добавляли во все пробирки. Пробирки закрывали алюминиевой фольгой и инкубировали в темноте в течение 60 минут, после чего равные объемы (280 мкл) тестовых и стандартных образцов пипеткой переносили в 96-луночный микропланшет в трех экземплярах. Поглощение считывали при 562 нм с помощью микропланшетного ридера (VersaMax, Molecular devices, США), а содержание железа в тестируемых образцах рассчитывали по стандартной кривой, построенной для стандартов железа.Высвобождение железа (% содержания железа согласно заявлению на этикетке) из лекарственных форм определяли по этим значениям.
Поглощение и абсорбция железа клетками Caco-2
На 13-й день после посева ростовую среду аспирировали, клетки трижды промывали промывочным раствором (140 мМ NaCl, 5 мМ KCl, 10 мМ буфер PIPES, pH 6,7, 37 ° C), а затем инкубировали в бессывороточной среде MEM в течение 24 часов. В день экспериментов по поглощению тестовые среды готовили титрованием MEM 0,1 М HCl или 0,1 М NaOH до pH 5.8 (представитель физиологического pH в двенадцатиперстной кишке). Затем тестируемую среду стерилизовали фильтрованием с использованием фильтрующего элемента 0,2 мкм и затем забуферивали 2- ( N -морфолино) этансульфоновой кислотой (MES, 10 мМ). Раствор FeSO 4 использовался в качестве эталона и был приготовлен растворением сверхчистого порошка FeSO 4 в 0,1 М HCl. Среда (14 мл) была разделена на аликвоты в отдельные пробирки сокола и различные объемы образцов из растворенного теста и контрольных препаратов были добавлены к тестовой среде для достижения конечной концентрации элементарного железа 20 мкМ для каждого условия.PH среды для образцов, обогащенной железом, измеряли снова и при необходимости доводили до 5,8. Анализ исключения трипанового синего проводили в параллельных 6-луночных планшетах до начала экспериментов по оценке жизнеспособности клеток Caco-2. Вкратце, клетки окрашивали красителем трипановым синим, который избирательно окрашивает мертвые клетки; затем их подсчитывали под микроскопом и рассчитывали процент жизнеспособности. Клетки Caco-2 в тестовых планшетах трижды промывали промывочным раствором, а затем инкубировали с обогащенной железом тестовой средой (2 мл на лунку, три лунки на условие) в течение 2 часов при 37 ° C в инкубаторе для планшетов, осторожно покачивающем при 25 ° C. об / мин.Затем тестовую среду аспирировали, и клетки дважды промывали промывочным раствором и, наконец, раствором для удаления (промывочный раствор плюс 5 мкМ гидросульфита натрия и 1 мкМ дисульфоната батофенантролина) для удаления любого поверхностно связанного железа [16]. Затем клетки Caco-2 инкубировали со свежим MEM в течение следующих 24 часов в инкубаторе для клеточных культур (37 ° C, 95% воздуха и 5% CO 2 ). Параллельные 6-луночные планшеты также инкубировали с тестовой средой (приготовленной, как описано выше) и подвергали аналогичным условиям (одна лунка на условие).Жизнеспособность клеток Caco-2 в этих планшетах оценивали по завершении эксперимента с использованием анализа исключения красителя трипанового синего.
Сбор клеток Caco-2
Культуральную среду аспирировали через 24 часа после инкубации и клетки Caco-2 дважды промывали промывочным буфером. Клетки собирали добавлением 350 мкл буфера для лизиса (50 мМ NaOH с добавлением 1 мкг / мл коктейля ингибиторов протеазы) на лунку в течение 40 минут при осторожном покачивании на шейкере для планшетов (6 об / мин). Температура была стандартизирована на уровне 4 ° C на протяжении всего протокола лизиса.Затем клетки собирали, используя стерильный скребок для клеток, и полученный лизат переносили пипеткой в 0,5 мл микроцентрифужные пробирки. Каждый образец лизата пропустили шесть раз через шприц объемом 1 мл, снабженный иглами калибра 25, чтобы снизить вязкость и облегчить работу с образцом. Образцы разделяли на две равные партии и сразу хранили при -20 ° C до дальнейшего анализа.
Аналитические методы (ферритин ELISA и BCA)
Общую концентрацию ферритина в клеточных лизатах определяли с использованием спектрофотометрического набора ELISA, следуя протоколу производителя с небольшими изменениями.Лизаты замороженных клеток центрифугировали в течение 10 минут (13226 g , 4 ° C), и полученный супернатант измеряли в анализе. Стандартная кривая была построена с использованием предоставленных стандартов (0, 6, 20, 60, 200 нг стандарта / мл). Образцы и стандарты (30 мкл каждый) были загружены в трех экземплярах на 96-луночный планшет, и этапы инкубации были выполнены, как описано в протоколе. Абсорбцию определяли при 490 и 630 нм с помощью микропланшет-ридера (VersaMax, Molecular devices, США). Содержание белка в клетках Caco-2 определяли с использованием набора Pierce BCA, следуя протоколу производителя, используя исходный бычий сывороточный альбумин (BSA) (2 мг / мл), входящий в набор, в качестве стандарта.Все образцы анализировали в двух экземплярах. Концентрацию ферритина стандартизировали относительно общей концентрации белка, и нг ферритина / мг белка использовали в качестве индикатора поглощения и абсорбции железа клетками Caco-2.
Статистический анализ
Эксперименты по поглощению железа проводили дважды независимо, при этом каждое условие обработки выполнялось в трех повторностях. Для каждого лечения рассчитывали среднее значение в шести повторах. Данные представлены в виде среднего значения ± стандартная ошибка среднего, и различия между образцами были проанализированы с помощью однофакторного дисперсионного анализа Тьюки с последующим апостериорным тестом Тьюки с использованием программного обеспечения Graphpad Prism (версия 5.0). Результаты считались значимыми, если P <0,05.
Результаты
В этом исследовании мы сравнили поглощение железа из различных пероральных препаратов железа, используя модель in vitro , которая пыталась имитировать физиологические условия. Были оценены наиболее часто назначаемые классические препараты железа.
Сначала мы провели эксперимент, чтобы сравнить скорости растворения различных испытуемых препаратов. Поскольку мы исследовали препараты с обычным, а также с модифицированным высвобождением, эксперименты по растворению проводили при pH 1.2 для воссоздания среды желудка, а также при pH 5,8 для воссоздания среды в тонком кишечнике. В нулевой момент времени таблетки или капсулы по каплям помещали в среду растворения, и опыты растворения для каждого препарата проводили в трех экземплярах. Все препараты были взяты как минимум из двух разных партий. Сосуды для растворения постоянно контролировались для наблюдения за профилями растворения тестируемых препаратов. За конечную точку эксперимента принимали полное растворение таблетки или капсулы, наблюдаемое визуально.Результаты экспериментов по растворению показаны на.
Табл. 2
Среднее время растворения для пероральных препаратов железа. Время растворения (мин) твердых пероральных препаратов железа тестировали в условиях искусственного желудка (0,1 M HCL, pH 1,2, 37 ° C) и кишечных (фосфатный буфер, pH 5,8, 37 ° C). Значения являются средними ± SEM (n = 3).
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Время растворения (мин, n = 3) | |
|---|---|---|---|---|---|
| pH 1.2 | pH 5,8 | ||||
| 1 | Сульфат железа | Таблетка | NA Almus | 48 ± 4 | 362 ± 16 |
| 2 | Таблетка Fumarate железа | Goldshield | 57 ± 6 | 85 ± 9 | |
| 3 | Глюконат железа | Таблетка | NA Zanza | 64 ± 4 | 208 ± 12 |
| 4 | Сульфат железа | Таблетка с контролируемым высвобождением | Ферроград С Теофарма | 256 ± 8 | — |
| 5 | Фумарат железа плюс минералы и витамины | Капсула с замедленным высвобождением | Ферроглобин B12 | 404 9007 388 ± 11 | |
При pH 1.2, таблетки с обычным высвобождением демонстрируют высокую скорость растворения, тогда как таблетки и капсулы с модифицированным высвобождением растворяются постепенно и переменно. Таблетки сульфата железа (без марочного обозначения / Almus) растворялись быстрее всех (48 ± 4 мин), за ними следовали фумарат железа (Fersamal / Goldshield, 57 ± 6 мин) и таблетки глюконата железа (безымянного производителя / Zanza 64 ± 4 мин). Самую медленную скорость растворения продемонстрировали капсулы с замедленным высвобождением фумарата железа (Feroglobin / Vitabiotics, 274 ± 8 минут) и таблетки с контролируемым высвобождением сульфата железа (Ferrograd C / Teopharma, 256 ± 8 минут).В смоделированных кишечных условиях (pH 5,8) самое быстрое время растворения наблюдалось для таблеток фумарата железа (85 ± 9 минут), тогда как таблетки с контролируемым высвобождением фумарата железа (Ferrograd C / Teopharma) не растворялись полностью даже через 24 часа. Капсулы с замедленным высвобождением фумарата железа (Ferroglobin B12 / Vitabiotics) продемонстрировали среднее время растворения 388 ± 11 минут при pH 5,8. Мы также исследовали зависящие от времени характеристики высвобождения железа из тестируемых препаратов, выполнив отдельную серию экспериментов по растворению в смоделированных желудочных условиях.Препараты для испытания формы высвобождения железа в различные моменты времени (15, 30, 60, 90, 180 минут) были количественно определены с использованием колориметрического анализа. Результаты показаны ниже в. Первоначальное высвобождение железа в первый момент времени (15 мин) было самым высоким для таблеток фумарата двухвалентного железа (38,5%), тогда как высвобождение железа в конечный момент времени (180 мин) было самым высоким для таблеток глюконата двухвалентного железа (66,46%; см.).
Высвобождение железа из пероральных препаратов железа, доступных в Соединенном Королевстве. Лекарственные формы подвергали растворению in vitro, (0.1M HCl pH 1,2, 37 ° C) и аликвоты отбирают через фиксированные интервалы. Содержание железа в аликвотах образцов определяли с помощью колориметрического количественного анализа железа и использовали для расчета% высвобождения железа. Показанные значения являются средними из трех показаний для каждого тестового образца.
После исследований растворения и высвобождения мы провели эксперименты по поглощению железа. Метод исключения трипанового синего использовали для исследования жизнеспособности клеток Caco-2 до начала экспериментов по поглощению, а также после их завершения, чтобы изучить любые пагубные эффекты наполнителей композиции на клетки Caco-2.Жизнеспособность выше 90% наблюдалась во всех случаях (данные не показаны).
Наша цель состояла в том, чтобы сравнить широкий спектр препаратов, доступных в настоящее время в Великобритании, с использованием определенного и единообразного набора условий. Три наиболее часто используемых соли двухвалентного железа; Сульфат двухвалентного железа, глюконат двухвалентного железа и фумарат двухвалентного железа были протестированы в форме таблеток с обычным высвобождением. Сульфат железа плюс аскорбиновая кислота (Ферроград C) и глюконат железа плюс минералы и витамины (Фероглобин B12) были включены в качестве типичных препаратов с модифицированным высвобождением и поливитаминов.Глюконат железа плюс фолиевая кислота (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс) были включены в качестве типичных жидких препаратов на основе сиропа. Эти образцы включают как рецептурные, так и безрецептурные препараты железа. Порошок сверхчистого FeSO 4 был включен в качестве эталона, и результаты абсорбции были стандартизированы для FeSO 4 (считающегося 100%). Результаты показаны в.
Абсорбция железа из пероральных препаратов железа, доступных в Соединенном Королевстве.Клетки Caco-2 инкубировали с 20 мкМ железа из каждого из тестируемых препаратов. Абсорбцию железа в пересчете на ферритин (нг / мг общего белка) определяли с помощью ELISA. Результаты выражаются в процентах от контроля сульфата железа, который считается 100%. Результаты представляют собой средние значения ± SEM для 6 образцов для каждого условия (P <0,05). Значения представляют три независимых эксперимента.
Абсорбция железа из таблеток сульфата железа с обычным высвобождением была значительно выше, чем у любого из оцениваемых препаратов (P <0.05), что эквивалентно 41% от стандарта FeSO 4 . Оба препарата с модифицированным высвобождением, содержащие сульфат двухвалентного железа плюс аскорбиновую кислоту (Ферроград С) и глюконат двухвалентного железа плюс минералы и витамины (Фероглобин В12), продемонстрировали низкое всасывание железа. Препараты в виде сиропа, содержащие глюконат железа и фолиевую кислоту (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс), также продемонстрировали относительно низкую абсорбцию железа. Таким образом, сульфат двухвалентного железа с обычным высвобождением продемонстрировал в целом самый высокий уровень поглощения железа, тогда как самый низкий уровень поглощения железа был от таблеток с модифицированным высвобождением сульфата двухвалентного железа плюс аскорбиновая кислота (Ферроград С).
Обсуждение
Добавки железа считаются эффективной стратегией борьбы с анемией, а препараты железа являются одними из наиболее часто назначаемых лекарств [17]. Соли железа, впервые использованные в XIX веке, остались основой терапии железом [1, 18]. Основными преимуществами являются низкая стоимость единицы продукции, что делает их широко доступными. Однако соли двухвалентного железа имеют высокую склонность вызывать побочные эффекты, которые обычно приводят к плохому соблюдению пациентом режима лечения. Диарея и запор обычно встречаются примерно у 6% пациентов, тогда как 6–12% пациентов жалуются на тошноту, рвоту и желудочные расстройства [19].Большинство этих побочных эффектов связано с тем, что часть железа остается неабсорбированной после приема внутрь и остается локализованной в просвете кишечника. Некоторые авторы связывают эти побочные эффекты с раздражением слизистой оболочки желудочно-кишечного тракта за счет катализа свободных радикалов из свободного железа, не связанного с трансферрином [20].
В настоящем исследовании мы сравнили абсорбцию железа среди нескольких имеющихся в продаже препаратов железа. В нашем исследовании оценивались репрезентативные продукты наиболее часто используемых препаратов железа в Великобритании.Мы сосредоточили внимание на них, поскольку препараты, доступные в Великобритании, проходят обширные нормативные процедуры и также представляют собой большинство препаратов железа, доступных во всем мире. Однако очень немногие исследования in vivo, или in vitro, сравнивали абсорбцию железа из пероральных лекарственных форм, и, насколько нам известно, ни в одном исследовании не использовался двухэтапный протокол растворения-абсорбции in vitro .
Абсорбция железа происходит в основном в двенадцатиперстной кишке тонкой кишки, и линия клеток кишечника человека Caco-2 хорошо охарактеризована как модель для изучения абсорбции железа in vitro [21].Клетки Caco-2 обладают морфологическими характеристиками зрелых энтероцитов и экспрессируют большинство рецепторов, участвующих в абсорбции железа, включая DMT-1, DcytB и Ireg1 (ферропортин), IRE1 и IRE2. Несколько исследований ранее сравнивали поглощение железа из солей железа, цельных продуктов, фруктовых соков и детских смесей с использованием модели количественного определения Caco-2-ферритина [22–26]. Однако большинство пероральных препаратов железа в виде добавок вводят в виде лекарственных форм (таблеток, капсул, сиропов или растворов) и включают ряд активных и неактивных ингредиентов (например,г. связующие вещества, разбавители, разрыхлители), необходимые для препарата, которые потенциально могут влиять на поглощение и абсорбцию железа. Активные ингредиенты могут включать другие минералы и витамины, такие как аскорбиновая кислота (витамин С), которая часто включается в комбинации с железом, поскольку обычно считается усилителем всасывания железа [27]. В условиях, которые отражают потребность в заместительной терапии, например, во время беременности и недоедания, эксперты также рекомендуют железо в сочетании с другими микронутриентами, такими как фолиевая кислота и витамин B12 [28].В случае жидких препаратов, таких как сиропы, также добавляются добавки, такие как ароматизаторы и красители, для улучшения внешнего вида и вкусовых качеств. Некоторые препараты железного сиропа, раствора и эликсира содержат фруктовые и растительные соки или экстракты. Фруктовые соки и овощные экстракты богаты полифенолами; известные ингибиторы абсорбции железа [29–31]. Поэтому мы хотели исследовать комбинированный эффект физической формы препарата в сочетании с источником железа.
После проглатывания твердые пероральные составы растворяются под воздействием кислого pH желудка, чему способствует перистальтическое движение и сегментация желудочно-кишечных мышц.Растворение является этапом, определяющим скорость всасывания различных пероральных препаратов, и скорость растворения широко варьируется в зависимости от природы препарата [32]. Быстрорастворимые таблетки быстро выделяют железо; однако это может привести к побочным эффектам из-за избыточной локализации / накопления свободного железа и последующего химического раздражения слизистой оболочки желудочно-кишечного тракта [33]. Чтобы противостоять этому, были созданы таблетки с замедленным или модифицированным высвобождением. Таблетки или капсулы с модифицированным высвобождением представляют собой фармацевтические стратегии для поддержания медленного и постепенного высвобождения активного ингредиента после приема внутрь, исходя из того, что железо, высвобождаемое таким образом, лучше переносится, поскольку это позволит избежать чрезмерного накопления и его побочных эффектов.Обычно это достигается покрытием таблетки пленкой или захватом активного ингредиента полимерной матрицей, что приводит к его медленному и постепенному высвобождению. Такие препараты железа относительно дороже обычных таблеток [33]. Физиологический процесс опорожнения желудка ограничивает относительное время, в течение которого таблетки и другие твердые лекарственные формы могут полностью раствориться. Время опорожнения желудка для взрослых людей составляет от 3 до 6 часов [34], и поэтому, если таблетка не подвергнется полному растворению в течение этого периода, остаточная нерастворенная фракция будет перемещена в толстую кишку для последующего вывода из организма.Это будет означать потерю значительной части лекарственной формы до того, как активный ингредиент сможет полностью высвободиться и стать доступным для абсорбции [35]. Регулирующие органы, такие как Национальная служба здравоохранения Великобритании (NHS), рекомендовали не использовать препараты железа с модифицированным высвобождением [33].
В настоящее время не существует теста на растворение, указанного для препаратов железа в соответствии с Британской фармакопеей (BP), в то время как Фармакопея США (USP) определяет тест на растворение только для таблеток и капсул с глюконатом железа [36].Мы разработали двухэтапный протокол растворения-абсорбции, который нацелен на воспроизведение температуры, pH, кислотности и механических условий, с которыми лекарственные формы встречаются в желудке человека. В нашем протоколе учитывается влияние времени растворения, вспомогательных веществ и изменений pH на абсорбцию железа из пероральных препаратов.
Перед нашими экспериментами мы провели исследования по оптимизации, чтобы оценить время растворения для всех тестируемых твердых препаратов. HCL (0,1 М, pH 1.2) использовался для моделирования желудочного сока, чтобы имитировать рН среды желудка, а фосфатный буфер (рН 5,8) был использован для моделирования кишечной жидкости, чтобы учесть характер растворения препаратов с модифицированным высвобождением. Было обнаружено, что обычные таблетки с быстрым высвобождением полностью растворяются в течение ~ 2 часов (в условиях pH желудочного сока), тогда как таблетки с модифицированным высвобождением занимают значительно больше времени (~ 4 часа). В условиях рН кишечника лекарственные формы с модифицированным высвобождением демонстрировали переменные скорости растворения, при этом таблетка с контролируемым высвобождением Ферроград С не могла полностью растворяться даже через 24 часа.Наши данные согласуются с исследованием Bannerman и его коллег, в котором сравнивались профили растворения различных твердых пероральных препаратов железа [36].
Мы также исследовали высвобождение железа из лекарственных форм в процессе растворения, и результаты соответствовали нашим данным по растворению. Наши результаты показали, что препараты железа, по-видимому, следуют прогнозируемой схеме высвобождения лекарственного средства в соответствии с конструкцией их лекарственной формы, то есть таблетка с обычным высвобождением демонстрирует быстрое высвобождение железа, в то время как композиции с контролируемым и замедленным высвобождением демонстрируют схему постепенного высвобождения в течение более длительного периода. .
После растворения препаратов железа отбирали аликвоты, эквивалентные конечной концентрации 20 мкМ Fe, и использовали их для экспериментов по поглощению железа. Эта концентрация была выбрана на основе экспериментов по оптимизации, проведенных в нашей лаборатории, и согласуется с несколькими предыдущими исследованиями, которые показали, что эта концентрация является оптимальной для исследований поглощения железа [25, 37].
Вспомогательные вещества, как известно, играют облегчающую или ингибирующую роль в абсорбции лекарств [38]; поэтому мы не фильтровали образцы, что позволило нам изучить влияние вспомогательных веществ на поглощение железа клетками Caco-2.PH лечебной среды был доведен до pH 5,8, что является типичным показателем pH в дистальном отделе двенадцатиперстной кишки и был оптимизирован другими [39]. Эксперименты по поглощению были стандартизированы для 2 часов, что представляет собой физиологическое время прохождения через тонкий кишечник [40].
Мы измерили внутриклеточную концентрацию ферритина как меру поглощения железа клетками Caco-2. Этот метод очень чувствителен, хорошо охарактеризован и хорошо коррелирует с усвоением человеком.Клетки Caco-2 синтезируют ферритин в зависимости от своего статуса железа, а также уровня железа в окружающей среде [37]. Поэтому мы культивировали клетки в среде, содержащей минимальное количество железа, за 24 часа до эксперимента, чтобы гарантировать минимальное образование клеточного ферритина до экспериментов по поглощению. В этих условиях клетки Caco-2 демонстрируют максимальное поглощение железа, и поэтому незначительные изменения поглощения железа между различными образцами могут быть точно измерены с точки зрения образования ферритина [21].Исследования поглощения железа также можно проводить путем измерения общего внутриклеточного поглощения железа с помощью атомно-абсорбционной спектроскопии или радиоактивно меченного железа. Эти методы требуют использования сложных контрольно-измерительных приборов и специализированных средств. Некоторые соединения и комплексы железа нельзя пометить ни внутренне, ни внешне радиоизотопами железа. Измерение ферритина позволяет избежать этих проблем, а также избежать проблемы неспецифического связывания свободного железа с поверхностью клетки, которое может привести к неточному количественному определению общего клеточного железа.
Наше исследование показало, что среди различных протестированных препаратов железа обычные таблетки сульфата двухвалентного железа с быстрым высвобождением демонстрируют самое высокое всасывание железа, тогда как таблетки железа с модифицированным высвобождением равномерно имеют самое низкое всасывание железа. Это согласуется с другими исследованиями, которые также показали, что препараты с модифицированным высвобождением или препараты железа имеют низкую биодоступность [36, 40]. В наших экспериментах по поглощению использовались равные дозы элементарного железа (20 мкм) из каждого препарата, таким образом, различия в абсорбции железа между различными препаратами не могут быть объяснены различиями в содержании железа в каждом составе.Возможное объяснение вариабельности абсорбции железа между образцами может быть связано с характеристиками препарата формы препарата железа. Таблетки железа с обычным высвобождением созданы для быстрого высвобождения железа и содержат меньше вспомогательных веществ. Препараты с модифицированным высвобождением являются относительно более сложными препаратами и включают несколько вспомогательных веществ и добавок. Некоторые вспомогательные вещества включены для улучшения абсорбции активного ингредиента [41]. Однако вспомогательные вещества также могут оказывать пагубное влияние на поглощение и абсорбцию, улавливая активный ингредиент в матрице, тем самым делая его недоступным для клеточного поглощения [42, 43].Тестируемые препараты жидкого железа также содержат множество вспомогательных веществ, главным образом для улучшения вкусовых качеств и внешнего вида. Известно, что некоторые добавки, присутствующие в этих препаратах, ингибируют абсорбцию железа. Например, жидкий препарат Floradix изготовлен на основе сиропа, который включает 29% фруктового сока, включая виноградный и вишневый сок, которые могут ингибировать абсорбцию железа из-за высокого содержания в них полифенолов [31]. Свободный раствор FeSO 4 , включенный в качестве эталона в наши эксперименты, продемонстрировал самое высокое поглощение железа.Таким образом, наши результаты показывают, что физические формы препарата, а также форма железа влияют на поглощение и абсорбцию железа из пероральных лекарственных форм.
Сравнение абсорбции железа из пероральных лекарственных форм может быть ценным инструментом при оценке эффективности пероральных препаратов железа. Добавки железа считаются удобной и экономичной мерой для борьбы с дефицитом железа и его последствиями, и широкий выбор твердых и жидких препаратов железа доступен как по рецепту, так и без рецепта.Это исследование не ставило своей целью оспаривать фундаментальную стратегию, а скорее исследовать любые различия в высвобождении и поглощении железа, которые могут существовать между различными препаратами, которые могут привести к менее благоприятным результатам терапии добавками железа. Мы полагаем, что это исследование дает важную информацию о физиологическом процессе абсорбции железа из пероральных препаратов железа и, следовательно, может помочь в разработке новых препаратов, которые доставляют необходимое количество железа, ограничивая при этом побочные эффекты.Наши будущие исследования будут определять абсорбцию железа из пероральных препаратов в присутствии пищевых веществ и оценивать корреляцию с клиническими данными.
Выражение признательности
Д-р М. Гулрез Заривала получил грант на начало карьеры от Общества эндокринологов Великобритании. Авторы выражают благодарность д-ру Нилуфару Моради-Бидхенди за вычитку рукописи.
Сокращения
| DMT1 | Двухвалентный протон-связанный переносчик металлического железа |
| Dcytb | Дуоденальный цитохром b |
| IDA | Железодефицитная анемия |
| Национальная служба NHS | |
| OTC | без рецепта |
Сноски
Заявление авторов
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
12. Уша Р., редактор. Пищевые анемии. CRC Press, Taylor & Francis Group; 2000. Функциональные последствия пищевой анемии во время беременности и раннего детства; С. 43–68. [Google Scholar] 21. Fairweather-Tait S, Lynch S, Hotz C, Hurrell R, Abrahamse L, Beebe S, Bering S, Bukhave K, Glahn R, Hambidge M, Hunt J, Lonnerdal B, Miller D, Mohktar N, Nestel P, Reddy M, Sandber AS, Sharp P, Teucher B, Trinidad TP. Полезность моделей in vitro для прогнозирования биодоступности железа и цинка: консенсусное заявление экспертной консультации HarvestPlus.Int J Vitam Nutr Res. 2005. 75: 371–374. http://dx.doi.org/10.1024/0300-9831.75.6.371. [PubMed] [Google Scholar] 25. Пералес С., Барбера Р., Лагарда М.Дж., Фарре Р. Доступность железа из молочных смесей и фруктовых соков, содержащих молоко и злаки, оценивается методами in vitro (растворимость, диализируемость), а также поглощение и перенос клетками Caco-2. Food Chem. 2007. 102: 1296–1303. http://dx.doi.org/10.1016/j.foodchem.2006.07.019. [PubMed] [Google Scholar] 26. Forbes AL, Arnaud MJ, Chichester CO, Cook JD, Harrison BN, Hurrell RF, Kahn SG, Morris ER, Tanner JT, Whittaker P и др.Сравнение in vitro, животных и клинических определений биодоступности железа: отчет Рабочей группы Международной консультативной группы по пищевой анемии о биодоступности железа. Am J Clin Nutr. 1989. 49: 225–238. http://www.ncbi.nlm.nih.gov/pubmed/2644802. [PubMed] [Google Scholar] 33. Объединенный формулярный комитет. Британский национальный формуляр. 63-е издание. Лондон: Британская медицинская ассоциация и Королевское фармацевтическое общество Великобритании; 2012. [Google Scholar] 42. Сингх П., Гиллори Дж. К., Соколоски Т. Д., Бенет Л. З., Бхатия В. Н..Влияние инертных ингредиентов таблеток на всасывание лекарств. I. Влияние полиэтиленгликоля 4000 на всасывание в кишечнике четырех барбитуратов. J Pharm Sci. 1966; 55: 63–68. http://dx.doi.org/10.1002/jps.2600550114. [PubMed] [Google Scholar]Сравнительное исследование препаратов перорального железа с использованием модели кишечника человека
Sci Pharm. 2013 октябрь-декабрь; 81 (4): 1123–1139.
Мохаммед Гулрез Заривала
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
Сатьянараяна Сомаварапу
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
Себастьян Фарно
3 Департамент наук о жизни, Бедфордширский университет, Парк-сквер, Лутон, LU1 3JU, Великобритания.
Дерек Реншоу
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
1 Департамент наук о человеке и здоровье, Школа наук о жизни, Вестминстерский университет, 115 Нью-Кавендиш-стрит, Лондон, W1W 6UW, Великобритания.
2 Департамент фармацевтики, Школа фармацевтики UCL, 29–39 Brunswick Square, Лондон, WC1N 1AX, UK.
3 Департамент естественных наук, Университет Бедфордшира, Парк-сквер, Лутон, LU1 3JU, Великобритания.
§ Эти авторы внесли равный вклад.
Поступило 4 апреля 2013 г .; Принята к печати 21 июня 2013 г.
Авторские права © Zariwala et al. ; лицензиат Österreichische Apotheker-Verlagsgesellschaft m. б. H., Вена, Австрия. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http://creativecommons.org/licenses/by/3.0/), которая разрешает неограниченное использование, распространение и воспроизведение в на любом носителе, при условии, что оригинальная работа процитирована должным образом. Эта статья цитировалась в других статьях в PMC.Abstract
Дефицит железа и связанная с ним железодефицитная анемия (ЖДА) являются наиболее распространенными нарушениями питания во всем мире.Стандартное лечение включает добавление твердых или жидких препаратов железа, обычно на основе соли двухвалентного железа, такой как сульфат железа, фумарат железа или глюконат железа. В настоящем исследовании мы сравнили поглощение и абсорбцию железа из различных твердых и жидких препаратов железа, доступных в настоящее время в Соединенном Королевстве, с использованием хорошо охарактеризованной линии клеток эпителиальной аденокарциномы человека Caco-2. Образование внутриклеточного белка ферритина клеткой Caco-2 считалось индикатором поглощения и абсорбции клеточного железа.Мы исследовали влияние ингредиентов рецептуры при определенном pH на поглощение и абсорбцию железа и разработали новый двухэтапный протокол растворения-абсорбции, имитирующий физиологические условия. Наши эксперименты выявили большие различия в скорости растворения между различными твердыми препаратами железа. Таблетки двухвалентного железа с обычным высвобождением растворялись быстро (от 48 ± 4 минут до 64 ± 4 минут), тогда как таблетки и капсулы с модифицированным высвобождением требовали значительно больше времени для полного растворения (от 274 ± 8 до 256 ± 8 минут).Среди твердых препаратов железа таблетки сульфата двухвалентного железа с обычным высвобождением продемонстрировали самое высокое всасывание железа, тогда как препараты двухвалентного железа с модифицированным высвобождением продемонстрировали равномерно низкое всасывание железа по сравнению с контролем (Р <0,05). Взятые вместе, наши результаты демонстрируют, что существуют широкие вариации времени растворения и поглощения железа из пероральных препаратов железа, причем ключевую роль играют физические характеристики препарата, а также форма железа.
Ключевые слова: Анемия, растворение, Caco-2, ферритин, добавки железа
Введение
Железо является важным минеральным питательным веществом, которое играет ключевую физиологическую роль и требуется для многих функций, таких как транспорт кислорода, выработка АТФ и т. Д. Репликация ДНК. У нормальных здоровых людей основным источником потери железа является отшелушивание кожи и отшелушенные клетки слизистой оболочки желудочно-кишечного тракта [1]. У мужчин это составляет примерно 1 мг / день, тогда как у женщин он выше из-за кровопотери, связанной с менструацией.Железо не может быть синтезировано в организме человека и поэтому поступает в основном из пищевых источников. При нормальном питании человека ежедневно потребляется 12–18 мг железа, в основном в форме трехвалентного железа (Fe 3+ ) [2]. Из-за физиологических, а также диетических факторов, только 1-2 мг этого количества абсорбируются через кишечные энтероциты и становятся доступными в большой круг кровообращения [2].
Во время переваривания пищи в желудке связанное железо высвобождается из его матрикса за счет комбинации факторов, включая кислотность желудочного сока, ферментативное действие и вспенивающее действие мышц желудка, создаваемое специализированным косым мышечным слоем, который является уникальным. в желудок [3].Освободившееся железо затем доступно для абсорбции, которая происходит преимущественно в двенадцатиперстной кишке тонкой кишки [4].
Большая часть пищевого негемного железа находится в нерастворимой трехвалентной форме, которая сначала восстанавливается до двухвалентного железа с помощью трехвалентного железа DcytB (дуоденальный цитохром b), расположенного на поверхности щеточной каймы энтероцитов двенадцатиперстной кишки [5]. Двухвалентный протон-связанный переносчик металлического железа (DMT1) затем транспортирует двухвалентное железо через апикальную мембрану в энтероцит, где оно либо образует комплекс с запасным белком ферритином, либо транспортируется в кровоток через базолатеральную мембрану через трансмембранный переносчик ферропортина (Ireg1) [ 6].Поглощение железа гемом происходит по еще не выясненному механизму, который может включать фолатный канал HCP1 [7]. Процесс абсорбции чувствителен к различным факторам, диетическим и другим, которые могут препятствовать этому процессу, что приводит к недостаточному всасыванию и, как следствие, дефициту железа [8].
По данным ВОЗ, дефицит железа является наиболее распространенным нарушением питания, которым страдает до 20% населения мира [9]. Он возникает, когда потребности организма в железе не удовлетворяются за счет пищевого железа.Снижение доставки железа к участкам-мишеням, таким как паренхима печени, костный мозг и мышечный миоглобин, приводит к нарушению железозависимых функций, таких как эритропоэз [1]. Уменьшение количества эритроцитов также может характеризоваться меньшим средним размером клеток (микроцитарная анемия) [10]. Конечным результатом является снижение способности переносить кислород и, как следствие, гипоксия тканей. Истощение запасов и дефицит железа в его самой легкой форме не особенно пагубно, однако прогрессирование до железодефицитной анемии (ЖДА) или сидеропенической анемии может иметь серьезные физиологические последствия [11].ЖДА во время беременности имеет особенно тяжелые последствия и ассоциируется с преждевременными родами, перинатальной смертностью, послеродовой депрессией у матери и нарушением умственного развития и когнитивных способностей потомства [12].
Лечение дефицита железа и ЖДА обычно осуществляется с помощью пероральных добавок железа. Дополнительную терапию также можно прописать в определенных случаях с профилактической целью, например. для беременных женщин, пациентов, находящихся на гемодиализе, и младенцев с низкой массой тела при рождении. Внутривенное введение железа проводится в крайних случаях, таких как значительная кровопотеря или серьезное недоедание [13].Препараты для перорального приема железа доступны в виде лицензированных препаратов, отпускаемых по рецепту практикующего врача, а также в виде безрецептурных препаратов, либо в виде диетических или пищевых добавок. Сульфат железа (FeSO 4 ), наряду с солями железа, фумаратом железа и глюконатом железа, являются наиболее распространенной формой добавок железа, используемых в настоящее время [14]. В Соединенном Королевстве (Великобритания) таблетки сульфата железа (200 мг), обычно содержащие 65 мг элементарного железа, чаще всего являются препаратами первого выбора для лечения железодефицитной анемии [14].Добавки железа представлены в виде твердых или жидких препаратов с несколькими возможными вариациями.
В этом исследовании мы использовали модифицированную модель абсорбции растворением in vitro , разработанную в нашей лаборатории, которая использует человеческие кишечные клетки Caco-2 для сравнения абсорбции железа из различных твердых и жидких добавок железа, доступных в настоящее время. Насколько нам известно, подобное исследование ранее не проводилось.
Материалы и методы
Материалы
Все химические вещества имели наивысший доступный уровень чистоты или класс клеточных культур и были закуплены у Sigma-Aldrich (Дорсет, Великобритания), если не указано иное.Клетки Caco-2 были приобретены из Европейской коллекции клеточных культур (№ по каталогу 001, ECACC, Солсбери, Великобритания). Наборы для ELISA ферритина (код продукта S-22) были от Ramco (ATI Atlas, Чичестер, Великобритания), а набор для анализа белка BCA (продукт № 23225) был от Pierce (Thermo Fisher Scientific, Нортумберленд, Великобритания). Смесь ингибиторов протеазы (PIC, каталожный № P8340) была от Sigma-Aldrich (Дорсет, Великобритания). Среды для культивирования клеток, эмбриональная телячья сыворотка (FCS) и реагенты были от Invitrogen (Лафборо, Великобритания) и Lonza (Слау, Великобритания).Планшеты для клеточных культур (6-луночные и 96-луночные) и колбы были от Nunc (Роскилле, Дания). Все остальные пластиковые изделия для клеточных культур были поставлены Corning (Амстердам, Нидерланды). Препараты твердого и жидкого железа из Великобритании были приобретены в розничной аптеке Boots (Лондон, Великобритания). Сводка всех протестированных образцов представлена в. Все используемые реагенты были приготовлены с использованием сверхчистой воды (удельное сопротивление 18,2 МОм · см). Перед использованием всю стеклянную посуду и посуду вымачивали в 10% -ной соляной кислоте (HCl) и ополаскивали сверхчистой водой для удаления любых возможных следов остаточных минералов.
Табл. 1
Список пероральных препаратов с добавками железа, сравниваемых при тестировании растворения и абсорбции железа. Образцы для испытаний включают твердые и жидкие препараты, доступные в настоящее время в Соединенном Королевстве.
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Elemental Fe / доза (мг) | Категория | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | Сульфат железа | Таблетка | NA | 81 Таблетка Al | 65 | Лицензионный / непатентованный | |||
| 2 | Фумарат железа | Таблетка | Ферсамал Goldshield | 68 | Лицензированный / непатентованный | ||||
| 3 | 942 глюконат35 | Лицензионный / собственный | |||||||
| 4 | Сульфат железа плюс аскорбиновая кислота | Таблетка с контролируемым высвобождением | Ferrograd C Teopharma | 105 | 95700 фумарат плюс минералы и витамины | 94 200 Капсула с замедленным высвобождением Ферроглобин B12 Витабиотики | 24 | Без рецепта | |
| 6 | Глюконат железа плюс фолиевая кислота | Сироп | Ферроглобин Витабиотики | 7.5 | Без рецепта | ||||
| 7 | Глюконат железа плюс аскорбиновая кислота | Сироп | Floradix Salus | 10 | Без рецепта |
Методы
Культура клеток
Клетки Caco-2 были получены при пассаже 20 и использовались экспериментально между пассажами с 30 по 35. Исходные культуры поддерживали в 75 см колбах для культур ткани 2 в полной среде (среда Игла, модифицированная Дульбекко (DMEM) — Glutamax®, pH 7.4 с добавлением 10% FCS, 1% раствора антибиотика / антимикотика и 25 мМ HEPES). Клетки культивировали в инкубаторе при 37 ° C в атмосфере 95% воздуха и 5% CO 2 при постоянной влажности, заменяя среду каждые два дня. Клетки высевали на 6-луночные планшеты при начальной плотности посева 1 × 10 4 клеток / см 2 для эксперимента по поглощению растворением. Аналогичным образом засевали параллельные 6-луночные планшеты для оценки жизнеспособности клеток до начала эксперимента по поглощению и после его завершения.Клетки Caco-2 дифференцировались до полностью созревшего фенотипа желудочно-кишечного тракта на 14-15 день после посева, когда начинались эксперименты по поглощению железа.
Растворение in vitro
Условия растворения были смоделированы in vitro для максимально точного воспроизведения физиологических условий. Препараты железа были либо твердыми (таблетки или капсулы), либо жидкими (растворы на основе сиропа) лекарственными формами. Таблетки и капсулы были дополнительно классифицированы как с обычным высвобождением или модифицированным высвобождением в соответствии с характеристиками препарата.0,1 М HCl (pH 1,2), предварительно нагретую до 37 ° C, использовали для моделирования условий желудка, а фосфатный буфер доведен до pH 5,8 с помощью 2- ( N -морфолино) этансульфоновой кислоты (10 мМ), предварительно нагретой до 37 ° C. ° C использовали для моделирования кишечных условий. В день эксперимента твердые лекарственные формы помещали в стеклянные стаканы, содержащие 50 мл имитированной желудочной или кишечной жидкости, и осторожно перемешивали со скоростью 25 оборотов в минуту (об / мин) для имитации перистальтических движений в желудочно-кишечном тракте. Температура поддерживалась постоянной на уровне 37 ° C.Жидкие лекарственные формы также добавляли к раствору среды растворения и подвергали воздействию аналогичных условий. Аликвоты из среды растворения отбирали после полного растворения (определяемого визуальным контролем) и использовали для эксперимента по поглощению железа.
Высвобождение железа in vitro
Высвобождение железа из лекарственных форм определяли путем проведения экспериментов по растворению в условиях, указанных в Ph.Eur.4 / USP 26. Среда для растворения (37 ° C, pH 1,2) была приготовлена, как описано в предыдущий раздел.Высвобождение железа оценивали путем отбора аликвот по 1 мл с заданными интервалами отбора проб (15, 30, 60, 90, 120 минут) и замены эквивалентным объемом свежей среды для растворения. Аликвоты образцов центрифугировали при 13000 об / мин в течение 10 минут при 4 ° C, и супернатанты анализировали на содержание железа.
Количественное определение железа
Высвобождение железа было количественно определено с использованием модифицированного анализа феррозина (15), разработанного в нашей лаборатории. Вкратце, аликвоты образцов (10 мкл) добавляли в микроцентрифужные пробирки, содержащие 300 мкл HCl (0.5 М). Стандарты железа готовили с использованием FeSO 4 чистоты. Реагент для обнаружения (500 мкл, содержащий 2 мМ феррозина, 2 мМ неокупроина) добавляли во все пробирки. Пробирки закрывали алюминиевой фольгой и инкубировали в темноте в течение 60 минут, после чего равные объемы (280 мкл) тестовых и стандартных образцов пипеткой переносили в 96-луночный микропланшет в трех экземплярах. Поглощение считывали при 562 нм с помощью микропланшетного ридера (VersaMax, Molecular devices, США), а содержание железа в тестируемых образцах рассчитывали по стандартной кривой, построенной для стандартов железа.Высвобождение железа (% содержания железа согласно заявлению на этикетке) из лекарственных форм определяли по этим значениям.
Поглощение и абсорбция железа клетками Caco-2
На 13-й день после посева ростовую среду аспирировали, клетки трижды промывали промывочным раствором (140 мМ NaCl, 5 мМ KCl, 10 мМ буфер PIPES, pH 6,7, 37 ° C), а затем инкубировали в бессывороточной среде MEM в течение 24 часов. В день экспериментов по поглощению тестовые среды готовили титрованием MEM 0,1 М HCl или 0,1 М NaOH до pH 5.8 (представитель физиологического pH в двенадцатиперстной кишке). Затем тестируемую среду стерилизовали фильтрованием с использованием фильтрующего элемента 0,2 мкм и затем забуферивали 2- ( N -морфолино) этансульфоновой кислотой (MES, 10 мМ). Раствор FeSO 4 использовался в качестве эталона и был приготовлен растворением сверхчистого порошка FeSO 4 в 0,1 М HCl. Среда (14 мл) была разделена на аликвоты в отдельные пробирки сокола и различные объемы образцов из растворенного теста и контрольных препаратов были добавлены к тестовой среде для достижения конечной концентрации элементарного железа 20 мкМ для каждого условия.PH среды для образцов, обогащенной железом, измеряли снова и при необходимости доводили до 5,8. Анализ исключения трипанового синего проводили в параллельных 6-луночных планшетах до начала экспериментов по оценке жизнеспособности клеток Caco-2. Вкратце, клетки окрашивали красителем трипановым синим, который избирательно окрашивает мертвые клетки; затем их подсчитывали под микроскопом и рассчитывали процент жизнеспособности. Клетки Caco-2 в тестовых планшетах трижды промывали промывочным раствором, а затем инкубировали с обогащенной железом тестовой средой (2 мл на лунку, три лунки на условие) в течение 2 часов при 37 ° C в инкубаторе для планшетов, осторожно покачивающем при 25 ° C. об / мин.Затем тестовую среду аспирировали, и клетки дважды промывали промывочным раствором и, наконец, раствором для удаления (промывочный раствор плюс 5 мкМ гидросульфита натрия и 1 мкМ дисульфоната батофенантролина) для удаления любого поверхностно связанного железа [16]. Затем клетки Caco-2 инкубировали со свежим MEM в течение следующих 24 часов в инкубаторе для клеточных культур (37 ° C, 95% воздуха и 5% CO 2 ). Параллельные 6-луночные планшеты также инкубировали с тестовой средой (приготовленной, как описано выше) и подвергали аналогичным условиям (одна лунка на условие).Жизнеспособность клеток Caco-2 в этих планшетах оценивали по завершении эксперимента с использованием анализа исключения красителя трипанового синего.
Сбор клеток Caco-2
Культуральную среду аспирировали через 24 часа после инкубации и клетки Caco-2 дважды промывали промывочным буфером. Клетки собирали добавлением 350 мкл буфера для лизиса (50 мМ NaOH с добавлением 1 мкг / мл коктейля ингибиторов протеазы) на лунку в течение 40 минут при осторожном покачивании на шейкере для планшетов (6 об / мин). Температура была стандартизирована на уровне 4 ° C на протяжении всего протокола лизиса.Затем клетки собирали, используя стерильный скребок для клеток, и полученный лизат переносили пипеткой в 0,5 мл микроцентрифужные пробирки. Каждый образец лизата пропустили шесть раз через шприц объемом 1 мл, снабженный иглами калибра 25, чтобы снизить вязкость и облегчить работу с образцом. Образцы разделяли на две равные партии и сразу хранили при -20 ° C до дальнейшего анализа.
Аналитические методы (ферритин ELISA и BCA)
Общую концентрацию ферритина в клеточных лизатах определяли с использованием спектрофотометрического набора ELISA, следуя протоколу производителя с небольшими изменениями.Лизаты замороженных клеток центрифугировали в течение 10 минут (13226 g , 4 ° C), и полученный супернатант измеряли в анализе. Стандартная кривая была построена с использованием предоставленных стандартов (0, 6, 20, 60, 200 нг стандарта / мл). Образцы и стандарты (30 мкл каждый) были загружены в трех экземплярах на 96-луночный планшет, и этапы инкубации были выполнены, как описано в протоколе. Абсорбцию определяли при 490 и 630 нм с помощью микропланшет-ридера (VersaMax, Molecular devices, США). Содержание белка в клетках Caco-2 определяли с использованием набора Pierce BCA, следуя протоколу производителя, используя исходный бычий сывороточный альбумин (BSA) (2 мг / мл), входящий в набор, в качестве стандарта.Все образцы анализировали в двух экземплярах. Концентрацию ферритина стандартизировали относительно общей концентрации белка, и нг ферритина / мг белка использовали в качестве индикатора поглощения и абсорбции железа клетками Caco-2.
Статистический анализ
Эксперименты по поглощению железа проводили дважды независимо, при этом каждое условие обработки выполнялось в трех повторностях. Для каждого лечения рассчитывали среднее значение в шести повторах. Данные представлены в виде среднего значения ± стандартная ошибка среднего, и различия между образцами были проанализированы с помощью однофакторного дисперсионного анализа Тьюки с последующим апостериорным тестом Тьюки с использованием программного обеспечения Graphpad Prism (версия 5.0). Результаты считались значимыми, если P <0,05.
Результаты
В этом исследовании мы сравнили поглощение железа из различных пероральных препаратов железа, используя модель in vitro , которая пыталась имитировать физиологические условия. Были оценены наиболее часто назначаемые классические препараты железа.
Сначала мы провели эксперимент, чтобы сравнить скорости растворения различных испытуемых препаратов. Поскольку мы исследовали препараты с обычным, а также с модифицированным высвобождением, эксперименты по растворению проводили при pH 1.2 для воссоздания среды желудка, а также при pH 5,8 для воссоздания среды в тонком кишечнике. В нулевой момент времени таблетки или капсулы по каплям помещали в среду растворения, и опыты растворения для каждого препарата проводили в трех экземплярах. Все препараты были взяты как минимум из двух разных партий. Сосуды для растворения постоянно контролировались для наблюдения за профилями растворения тестируемых препаратов. За конечную точку эксперимента принимали полное растворение таблетки или капсулы, наблюдаемое визуально.Результаты экспериментов по растворению показаны на.
Табл. 2
Среднее время растворения для пероральных препаратов железа. Время растворения (мин) твердых пероральных препаратов железа тестировали в условиях искусственного желудка (0,1 M HCL, pH 1,2, 37 ° C) и кишечных (фосфатный буфер, pH 5,8, 37 ° C). Значения являются средними ± SEM (n = 3).
| № | Препарат | Дозировка из | Торговое наименование / Производитель | Время растворения (мин, n = 3) | |
|---|---|---|---|---|---|
| pH 1.2 | pH 5,8 | ||||
| 1 | Сульфат железа | Таблетка | NA Almus | 48 ± 4 | 362 ± 16 |
| 2 | Таблетка Fumarate железа | Goldshield | 57 ± 6 | 85 ± 9 | |
| 3 | Глюконат железа | Таблетка | NA Zanza | 64 ± 4 | 208 ± 12 |
| 4 | Сульфат железа | Таблетка с контролируемым высвобождением | Ферроград С Теофарма | 256 ± 8 | — |
| 5 | Фумарат железа плюс минералы и витамины | Капсула с замедленным высвобождением | Ферроглобин B12 | 404 9007 388 ± 11 | |
При pH 1.2, таблетки с обычным высвобождением демонстрируют высокую скорость растворения, тогда как таблетки и капсулы с модифицированным высвобождением растворяются постепенно и переменно. Таблетки сульфата железа (без марочного обозначения / Almus) растворялись быстрее всех (48 ± 4 мин), за ними следовали фумарат железа (Fersamal / Goldshield, 57 ± 6 мин) и таблетки глюконата железа (безымянного производителя / Zanza 64 ± 4 мин). Самую медленную скорость растворения продемонстрировали капсулы с замедленным высвобождением фумарата железа (Feroglobin / Vitabiotics, 274 ± 8 минут) и таблетки с контролируемым высвобождением сульфата железа (Ferrograd C / Teopharma, 256 ± 8 минут).В смоделированных кишечных условиях (pH 5,8) самое быстрое время растворения наблюдалось для таблеток фумарата железа (85 ± 9 минут), тогда как таблетки с контролируемым высвобождением фумарата железа (Ferrograd C / Teopharma) не растворялись полностью даже через 24 часа. Капсулы с замедленным высвобождением фумарата железа (Ferroglobin B12 / Vitabiotics) продемонстрировали среднее время растворения 388 ± 11 минут при pH 5,8. Мы также исследовали зависящие от времени характеристики высвобождения железа из тестируемых препаратов, выполнив отдельную серию экспериментов по растворению в смоделированных желудочных условиях.Препараты для испытания формы высвобождения железа в различные моменты времени (15, 30, 60, 90, 180 минут) были количественно определены с использованием колориметрического анализа. Результаты показаны ниже в. Первоначальное высвобождение железа в первый момент времени (15 мин) было самым высоким для таблеток фумарата двухвалентного железа (38,5%), тогда как высвобождение железа в конечный момент времени (180 мин) было самым высоким для таблеток глюконата двухвалентного железа (66,46%; см.).
Высвобождение железа из пероральных препаратов железа, доступных в Соединенном Королевстве. Лекарственные формы подвергали растворению in vitro, (0.1M HCl pH 1,2, 37 ° C) и аликвоты отбирают через фиксированные интервалы. Содержание железа в аликвотах образцов определяли с помощью колориметрического количественного анализа железа и использовали для расчета% высвобождения железа. Показанные значения являются средними из трех показаний для каждого тестового образца.
После исследований растворения и высвобождения мы провели эксперименты по поглощению железа. Метод исключения трипанового синего использовали для исследования жизнеспособности клеток Caco-2 до начала экспериментов по поглощению, а также после их завершения, чтобы изучить любые пагубные эффекты наполнителей композиции на клетки Caco-2.Жизнеспособность выше 90% наблюдалась во всех случаях (данные не показаны).
Наша цель состояла в том, чтобы сравнить широкий спектр препаратов, доступных в настоящее время в Великобритании, с использованием определенного и единообразного набора условий. Три наиболее часто используемых соли двухвалентного железа; Сульфат двухвалентного железа, глюконат двухвалентного железа и фумарат двухвалентного железа были протестированы в форме таблеток с обычным высвобождением. Сульфат железа плюс аскорбиновая кислота (Ферроград C) и глюконат железа плюс минералы и витамины (Фероглобин B12) были включены в качестве типичных препаратов с модифицированным высвобождением и поливитаминов.Глюконат железа плюс фолиевая кислота (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс) были включены в качестве типичных жидких препаратов на основе сиропа. Эти образцы включают как рецептурные, так и безрецептурные препараты железа. Порошок сверхчистого FeSO 4 был включен в качестве эталона, и результаты абсорбции были стандартизированы для FeSO 4 (считающегося 100%). Результаты показаны в.
Абсорбция железа из пероральных препаратов железа, доступных в Соединенном Королевстве.Клетки Caco-2 инкубировали с 20 мкМ железа из каждого из тестируемых препаратов. Абсорбцию железа в пересчете на ферритин (нг / мг общего белка) определяли с помощью ELISA. Результаты выражаются в процентах от контроля сульфата железа, который считается 100%. Результаты представляют собой средние значения ± SEM для 6 образцов для каждого условия (P <0,05). Значения представляют три независимых эксперимента.
Абсорбция железа из таблеток сульфата железа с обычным высвобождением была значительно выше, чем у любого из оцениваемых препаратов (P <0.05), что эквивалентно 41% от стандарта FeSO 4 . Оба препарата с модифицированным высвобождением, содержащие сульфат двухвалентного железа плюс аскорбиновую кислоту (Ферроград С) и глюконат двухвалентного железа плюс минералы и витамины (Фероглобин В12), продемонстрировали низкое всасывание железа. Препараты в виде сиропа, содержащие глюконат железа и фолиевую кислоту (Фероглобин B12) и глюконат железа плюс аскорбиновая кислота (Флорадикс), также продемонстрировали относительно низкую абсорбцию железа. Таким образом, сульфат двухвалентного железа с обычным высвобождением продемонстрировал в целом самый высокий уровень поглощения железа, тогда как самый низкий уровень поглощения железа был от таблеток с модифицированным высвобождением сульфата двухвалентного железа плюс аскорбиновая кислота (Ферроград С).
Обсуждение
Добавки железа считаются эффективной стратегией борьбы с анемией, а препараты железа являются одними из наиболее часто назначаемых лекарств [17]. Соли железа, впервые использованные в XIX веке, остались основой терапии железом [1, 18]. Основными преимуществами являются низкая стоимость единицы продукции, что делает их широко доступными. Однако соли двухвалентного железа имеют высокую склонность вызывать побочные эффекты, которые обычно приводят к плохому соблюдению пациентом режима лечения. Диарея и запор обычно встречаются примерно у 6% пациентов, тогда как 6–12% пациентов жалуются на тошноту, рвоту и желудочные расстройства [19].Большинство этих побочных эффектов связано с тем, что часть железа остается неабсорбированной после приема внутрь и остается локализованной в просвете кишечника. Некоторые авторы связывают эти побочные эффекты с раздражением слизистой оболочки желудочно-кишечного тракта за счет катализа свободных радикалов из свободного железа, не связанного с трансферрином [20].
В настоящем исследовании мы сравнили абсорбцию железа среди нескольких имеющихся в продаже препаратов железа. В нашем исследовании оценивались репрезентативные продукты наиболее часто используемых препаратов железа в Великобритании.Мы сосредоточили внимание на них, поскольку препараты, доступные в Великобритании, проходят обширные нормативные процедуры и также представляют собой большинство препаратов железа, доступных во всем мире. Однако очень немногие исследования in vivo, или in vitro, сравнивали абсорбцию железа из пероральных лекарственных форм, и, насколько нам известно, ни в одном исследовании не использовался двухэтапный протокол растворения-абсорбции in vitro .
Абсорбция железа происходит в основном в двенадцатиперстной кишке тонкой кишки, и линия клеток кишечника человека Caco-2 хорошо охарактеризована как модель для изучения абсорбции железа in vitro [21].Клетки Caco-2 обладают морфологическими характеристиками зрелых энтероцитов и экспрессируют большинство рецепторов, участвующих в абсорбции железа, включая DMT-1, DcytB и Ireg1 (ферропортин), IRE1 и IRE2. Несколько исследований ранее сравнивали поглощение железа из солей железа, цельных продуктов, фруктовых соков и детских смесей с использованием модели количественного определения Caco-2-ферритина [22–26]. Однако большинство пероральных препаратов железа в виде добавок вводят в виде лекарственных форм (таблеток, капсул, сиропов или растворов) и включают ряд активных и неактивных ингредиентов (например,г. связующие вещества, разбавители, разрыхлители), необходимые для препарата, которые потенциально могут влиять на поглощение и абсорбцию железа. Активные ингредиенты могут включать другие минералы и витамины, такие как аскорбиновая кислота (витамин С), которая часто включается в комбинации с железом, поскольку обычно считается усилителем всасывания железа [27]. В условиях, которые отражают потребность в заместительной терапии, например, во время беременности и недоедания, эксперты также рекомендуют железо в сочетании с другими микронутриентами, такими как фолиевая кислота и витамин B12 [28].В случае жидких препаратов, таких как сиропы, также добавляются добавки, такие как ароматизаторы и красители, для улучшения внешнего вида и вкусовых качеств. Некоторые препараты железного сиропа, раствора и эликсира содержат фруктовые и растительные соки или экстракты. Фруктовые соки и овощные экстракты богаты полифенолами; известные ингибиторы абсорбции железа [29–31]. Поэтому мы хотели исследовать комбинированный эффект физической формы препарата в сочетании с источником железа.
После проглатывания твердые пероральные составы растворяются под воздействием кислого pH желудка, чему способствует перистальтическое движение и сегментация желудочно-кишечных мышц.Растворение является этапом, определяющим скорость всасывания различных пероральных препаратов, и скорость растворения широко варьируется в зависимости от природы препарата [32]. Быстрорастворимые таблетки быстро выделяют железо; однако это может привести к побочным эффектам из-за избыточной локализации / накопления свободного железа и последующего химического раздражения слизистой оболочки желудочно-кишечного тракта [33]. Чтобы противостоять этому, были созданы таблетки с замедленным или модифицированным высвобождением. Таблетки или капсулы с модифицированным высвобождением представляют собой фармацевтические стратегии для поддержания медленного и постепенного высвобождения активного ингредиента после приема внутрь, исходя из того, что железо, высвобождаемое таким образом, лучше переносится, поскольку это позволит избежать чрезмерного накопления и его побочных эффектов.Обычно это достигается покрытием таблетки пленкой или захватом активного ингредиента полимерной матрицей, что приводит к его медленному и постепенному высвобождению. Такие препараты железа относительно дороже обычных таблеток [33]. Физиологический процесс опорожнения желудка ограничивает относительное время, в течение которого таблетки и другие твердые лекарственные формы могут полностью раствориться. Время опорожнения желудка для взрослых людей составляет от 3 до 6 часов [34], и поэтому, если таблетка не подвергнется полному растворению в течение этого периода, остаточная нерастворенная фракция будет перемещена в толстую кишку для последующего вывода из организма.Это будет означать потерю значительной части лекарственной формы до того, как активный ингредиент сможет полностью высвободиться и стать доступным для абсорбции [35]. Регулирующие органы, такие как Национальная служба здравоохранения Великобритании (NHS), рекомендовали не использовать препараты железа с модифицированным высвобождением [33].
В настоящее время не существует теста на растворение, указанного для препаратов железа в соответствии с Британской фармакопеей (BP), в то время как Фармакопея США (USP) определяет тест на растворение только для таблеток и капсул с глюконатом железа [36].Мы разработали двухэтапный протокол растворения-абсорбции, который нацелен на воспроизведение температуры, pH, кислотности и механических условий, с которыми лекарственные формы встречаются в желудке человека. В нашем протоколе учитывается влияние времени растворения, вспомогательных веществ и изменений pH на абсорбцию железа из пероральных препаратов.
Перед нашими экспериментами мы провели исследования по оптимизации, чтобы оценить время растворения для всех тестируемых твердых препаратов. HCL (0,1 М, pH 1.2) использовался для моделирования желудочного сока, чтобы имитировать рН среды желудка, а фосфатный буфер (рН 5,8) был использован для моделирования кишечной жидкости, чтобы учесть характер растворения препаратов с модифицированным высвобождением. Было обнаружено, что обычные таблетки с быстрым высвобождением полностью растворяются в течение ~ 2 часов (в условиях pH желудочного сока), тогда как таблетки с модифицированным высвобождением занимают значительно больше времени (~ 4 часа). В условиях рН кишечника лекарственные формы с модифицированным высвобождением демонстрировали переменные скорости растворения, при этом таблетка с контролируемым высвобождением Ферроград С не могла полностью растворяться даже через 24 часа.Наши данные согласуются с исследованием Bannerman и его коллег, в котором сравнивались профили растворения различных твердых пероральных препаратов железа [36].
Мы также исследовали высвобождение железа из лекарственных форм в процессе растворения, и результаты соответствовали нашим данным по растворению. Наши результаты показали, что препараты железа, по-видимому, следуют прогнозируемой схеме высвобождения лекарственного средства в соответствии с конструкцией их лекарственной формы, то есть таблетка с обычным высвобождением демонстрирует быстрое высвобождение железа, в то время как композиции с контролируемым и замедленным высвобождением демонстрируют схему постепенного высвобождения в течение более длительного периода. .
После растворения препаратов железа отбирали аликвоты, эквивалентные конечной концентрации 20 мкМ Fe, и использовали их для экспериментов по поглощению железа. Эта концентрация была выбрана на основе экспериментов по оптимизации, проведенных в нашей лаборатории, и согласуется с несколькими предыдущими исследованиями, которые показали, что эта концентрация является оптимальной для исследований поглощения железа [25, 37].
Вспомогательные вещества, как известно, играют облегчающую или ингибирующую роль в абсорбции лекарств [38]; поэтому мы не фильтровали образцы, что позволило нам изучить влияние вспомогательных веществ на поглощение железа клетками Caco-2.PH лечебной среды был доведен до pH 5,8, что является типичным показателем pH в дистальном отделе двенадцатиперстной кишки и был оптимизирован другими [39]. Эксперименты по поглощению были стандартизированы для 2 часов, что представляет собой физиологическое время прохождения через тонкий кишечник [40].
Мы измерили внутриклеточную концентрацию ферритина как меру поглощения железа клетками Caco-2. Этот метод очень чувствителен, хорошо охарактеризован и хорошо коррелирует с усвоением человеком.Клетки Caco-2 синтезируют ферритин в зависимости от своего статуса железа, а также уровня железа в окружающей среде [37]. Поэтому мы культивировали клетки в среде, содержащей минимальное количество железа, за 24 часа до эксперимента, чтобы гарантировать минимальное образование клеточного ферритина до экспериментов по поглощению. В этих условиях клетки Caco-2 демонстрируют максимальное поглощение железа, и поэтому незначительные изменения поглощения железа между различными образцами могут быть точно измерены с точки зрения образования ферритина [21].Исследования поглощения железа также можно проводить путем измерения общего внутриклеточного поглощения железа с помощью атомно-абсорбционной спектроскопии или радиоактивно меченного железа. Эти методы требуют использования сложных контрольно-измерительных приборов и специализированных средств. Некоторые соединения и комплексы железа нельзя пометить ни внутренне, ни внешне радиоизотопами железа. Измерение ферритина позволяет избежать этих проблем, а также избежать проблемы неспецифического связывания свободного железа с поверхностью клетки, которое может привести к неточному количественному определению общего клеточного железа.
Наше исследование показало, что среди различных протестированных препаратов железа обычные таблетки сульфата двухвалентного железа с быстрым высвобождением демонстрируют самое высокое всасывание железа, тогда как таблетки железа с модифицированным высвобождением равномерно имеют самое низкое всасывание железа. Это согласуется с другими исследованиями, которые также показали, что препараты с модифицированным высвобождением или препараты железа имеют низкую биодоступность [36, 40]. В наших экспериментах по поглощению использовались равные дозы элементарного железа (20 мкм) из каждого препарата, таким образом, различия в абсорбции железа между различными препаратами не могут быть объяснены различиями в содержании железа в каждом составе.Возможное объяснение вариабельности абсорбции железа между образцами может быть связано с характеристиками препарата формы препарата железа. Таблетки железа с обычным высвобождением созданы для быстрого высвобождения железа и содержат меньше вспомогательных веществ. Препараты с модифицированным высвобождением являются относительно более сложными препаратами и включают несколько вспомогательных веществ и добавок. Некоторые вспомогательные вещества включены для улучшения абсорбции активного ингредиента [41]. Однако вспомогательные вещества также могут оказывать пагубное влияние на поглощение и абсорбцию, улавливая активный ингредиент в матрице, тем самым делая его недоступным для клеточного поглощения [42, 43].Тестируемые препараты жидкого железа также содержат множество вспомогательных веществ, главным образом для улучшения вкусовых качеств и внешнего вида. Известно, что некоторые добавки, присутствующие в этих препаратах, ингибируют абсорбцию железа. Например, жидкий препарат Floradix изготовлен на основе сиропа, который включает 29% фруктового сока, включая виноградный и вишневый сок, которые могут ингибировать абсорбцию железа из-за высокого содержания в них полифенолов [31]. Свободный раствор FeSO 4 , включенный в качестве эталона в наши эксперименты, продемонстрировал самое высокое поглощение железа.Таким образом, наши результаты показывают, что физические формы препарата, а также форма железа влияют на поглощение и абсорбцию железа из пероральных лекарственных форм.
Сравнение абсорбции железа из пероральных лекарственных форм может быть ценным инструментом при оценке эффективности пероральных препаратов железа. Добавки железа считаются удобной и экономичной мерой для борьбы с дефицитом железа и его последствиями, и широкий выбор твердых и жидких препаратов железа доступен как по рецепту, так и без рецепта.Это исследование не ставило своей целью оспаривать фундаментальную стратегию, а скорее исследовать любые различия в высвобождении и поглощении железа, которые могут существовать между различными препаратами, которые могут привести к менее благоприятным результатам терапии добавками железа. Мы полагаем, что это исследование дает важную информацию о физиологическом процессе абсорбции железа из пероральных препаратов железа и, следовательно, может помочь в разработке новых препаратов, которые доставляют необходимое количество железа, ограничивая при этом побочные эффекты.Наши будущие исследования будут определять абсорбцию железа из пероральных препаратов в присутствии пищевых веществ и оценивать корреляцию с клиническими данными.
Выражение признательности
Д-р М. Гулрез Заривала получил грант на начало карьеры от Общества эндокринологов Великобритании. Авторы выражают благодарность д-ру Нилуфару Моради-Бидхенди за вычитку рукописи.
Сокращения
| DMT1 | Двухвалентный протон-связанный переносчик металлического железа |
| Dcytb | Дуоденальный цитохром b |
| IDA | Железодефицитная анемия |
| Национальная служба NHS | |
| OTC | без рецепта |
Сноски
Заявление авторов
Конкурирующие интересы
Авторы заявляют об отсутствии конфликта интересов.


 5 или 10 шт.
5 или 10 шт. 5 мл 5 или 10 шт.
5 мл 5 или 10 шт. 5 мл 5 шт.
5 мл 5 шт. 5 мл 5 шт.
5 мл 5 шт.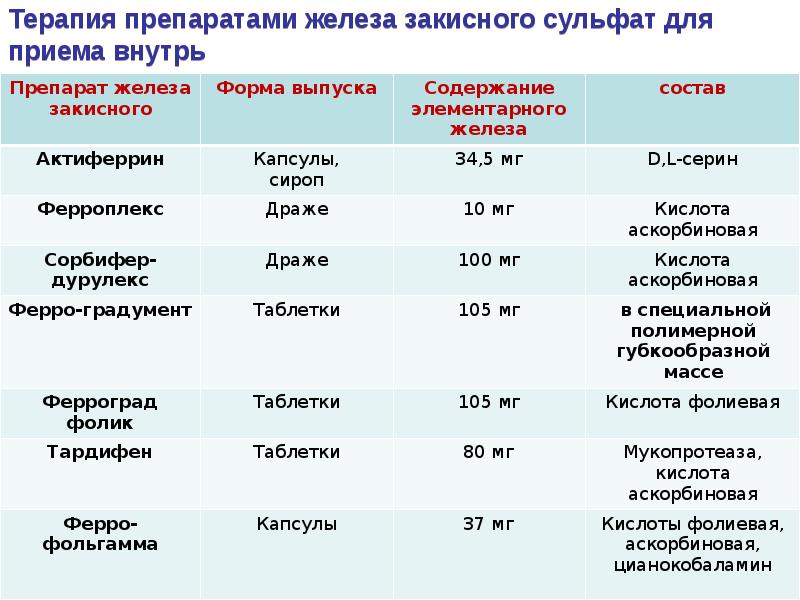 , покр. пленочной оболочкой: 30, 60, 100, 120 или 130 шт.
, покр. пленочной оболочкой: 30, 60, 100, 120 или 130 шт.
 10 шт.
10 шт. 5 мл 5 шт.
5 мл 5 шт. 5 шт.
5 шт. 5 мл 3, 5, 6 или 24 шт.; , фл. 5 мл 1, 3 или 5 шт.
5 мл 3, 5, 6 или 24 шт.; , фл. 5 мл 1, 3 или 5 шт. 10 мл или 30 мл с дозатором, контейнеры 10 мл или 30 мл с дозатором
10 мл или 30 мл с дозатором, контейнеры 10 мл или 30 мл с дозатором 2 мл 5 шт.
2 мл 5 шт.

 Вспомогательное вещество: вода для инъекций. Для доведения значения рН раствора используют натрия гидроксид в виде 6 М раствора или кислоту хлористоводородную концентрированную.
Вспомогательное вещество: вода для инъекций. Для доведения значения рН раствора используют натрия гидроксид в виде 6 М раствора или кислоту хлористоводородную концентрированную. д.(Словения)
д.(Словения) Препарат должен вводиться в условиях стационара и только специально обученным персоналом, умеющим распознавать и купировать признаки начинающегося анафилактического шока, в условиях доступности средств реанимации и возможности проведения комплекса противошоковых мероприятий. Пациент должен наблюдаться по крайней мере в течение 30 минут после каждой инъекции с целью выявления признаков реакции гиперчувствительности. Дозу препарата Феррум Лек необходимо подбирать индивидуально в соответствии с общим дефицитом железа, который рассчитывается по следующей формуле:
Общий дефицит железа (мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л) х 0,24 + депонированное железо (мг). Масса тела до 35 кг: расчетный уровень гемоглобина = 130 г/л и депонированное железо = 15 мг/кг массы тела. Масса тела свыше 35 кг: расчетный уровень гемоглобина = 150 г/л и депонированное железо = 500 мг *Фактор 0,24 = 0,0034 х 0,07 х 1000: (Содержание железа = 0,34%; общий объем крови = 7% массы тела; фактор 1000 = перевод из г/л в мг/л).
Препарат должен вводиться в условиях стационара и только специально обученным персоналом, умеющим распознавать и купировать признаки начинающегося анафилактического шока, в условиях доступности средств реанимации и возможности проведения комплекса противошоковых мероприятий. Пациент должен наблюдаться по крайней мере в течение 30 минут после каждой инъекции с целью выявления признаков реакции гиперчувствительности. Дозу препарата Феррум Лек необходимо подбирать индивидуально в соответствии с общим дефицитом железа, который рассчитывается по следующей формуле:
Общий дефицит железа (мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л) х 0,24 + депонированное железо (мг). Масса тела до 35 кг: расчетный уровень гемоглобина = 130 г/л и депонированное железо = 15 мг/кг массы тела. Масса тела свыше 35 кг: расчетный уровень гемоглобина = 150 г/л и депонированное железо = 500 мг *Фактор 0,24 = 0,0034 х 0,07 х 1000: (Содержание железа = 0,34%; общий объем крови = 7% массы тела; фактор 1000 = перевод из г/л в мг/л). Если необходимая доза препарата Феррум Лек превышает максимальную суточную дозу, введение препарата должно быть дробным (в течение нескольких дней). Если спустя 1-2 недели после начала лечения гематологические параметры не меняются, следует провести дополнительное обследование с целью уточнения поставленного диагноза. Расчет общей дозы для возмещения железа вследствие кровопотери: Необходимое количество препарата для компенсации постгеморрагического железодефицита рассчитывается по следующей формуле: Если известно количество потерянной крови: введение 200 мг
внутримышечно (2 ампулы препарата Феррум Лек) приводит к увеличению концентрации гемоглобина, которое эквивалентно 1 единице крови (400 мл крови с содержанием гемоглобина 150 г/л). Железо, которое следует возместить (мг) = число потерянных единиц крови х 200 или Необходимое число ампул препарата Феррум Лек = число потерянных единиц крови х 2.
Если известен конечный уровень гемоглобина: используйте следующую формулу, учитывая то, что депонированное железо возмещать не нужно.
Если необходимая доза препарата Феррум Лек превышает максимальную суточную дозу, введение препарата должно быть дробным (в течение нескольких дней). Если спустя 1-2 недели после начала лечения гематологические параметры не меняются, следует провести дополнительное обследование с целью уточнения поставленного диагноза. Расчет общей дозы для возмещения железа вследствие кровопотери: Необходимое количество препарата для компенсации постгеморрагического железодефицита рассчитывается по следующей формуле: Если известно количество потерянной крови: введение 200 мг
внутримышечно (2 ампулы препарата Феррум Лек) приводит к увеличению концентрации гемоглобина, которое эквивалентно 1 единице крови (400 мл крови с содержанием гемоглобина 150 г/л). Железо, которое следует возместить (мг) = число потерянных единиц крови х 200 или Необходимое число ампул препарата Феррум Лек = число потерянных единиц крови х 2.
Если известен конечный уровень гемоглобина: используйте следующую формулу, учитывая то, что депонированное железо возмещать не нужно. Железо, которое следует возместить (мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л) х 0,24. Стандартные дозы: Детям: 0,06 мл/кг массы тела/сутки (3 мг железа/кг/сутки).
Взрослым: 1 — 2 ампулы препарата Феррум Лек (100 — 200 мг железа), в зависимости от содержания гемоглобина.
Максимальные суточные дозы:
Детям: 0,14 мл/кг массы тела в сутки (7 мг железа/кг/сутки).
Взрослым: 4 мл (2 ампулы препарата Феррум Лек) в сутки.
Техника инъекции: Техника инъекции имеет решающее значение. В результате неправильного введения препарата могут возникнуть болевые ощущения и окрашивание кожи в месте инъекции. Описанная ниже техника вентро-ягодичной инъекции рекомендована вместо общепринятой — в верхний наружный квадрант большой ягодичной мышцы.
1. Длина иглы должна быть не менее 5-6 см. Просвет иглы не должен быть слишком широким. Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше. 2. Место инъекции определяется следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению зафиксируйте точку (точка А).
Железо, которое следует возместить (мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л) х 0,24. Стандартные дозы: Детям: 0,06 мл/кг массы тела/сутки (3 мг железа/кг/сутки).
Взрослым: 1 — 2 ампулы препарата Феррум Лек (100 — 200 мг железа), в зависимости от содержания гемоглобина.
Максимальные суточные дозы:
Детям: 0,14 мл/кг массы тела в сутки (7 мг железа/кг/сутки).
Взрослым: 4 мл (2 ампулы препарата Феррум Лек) в сутки.
Техника инъекции: Техника инъекции имеет решающее значение. В результате неправильного введения препарата могут возникнуть болевые ощущения и окрашивание кожи в месте инъекции. Описанная ниже техника вентро-ягодичной инъекции рекомендована вместо общепринятой — в верхний наружный квадрант большой ягодичной мышцы.
1. Длина иглы должна быть не менее 5-6 см. Просвет иглы не должен быть слишком широким. Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше. 2. Место инъекции определяется следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению зафиксируйте точку (точка А). Если пациент лежит на правом боку, расположите средний палец левой руки в точке А. Отставьте указательный палец от среднего так, чтобы он находился под линией подвздошного гребня (точка В). Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции. 3. Инструменты дезинфицируют обычным методом. Прежде чем ввести иглу, сдвиньте кожу примерно на 2 см для того, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи. 4. Расположите иглу вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава. 5. После инъекции медленно извлеките иглу и прижимайте пальцем участок кожи, прилегающий к месту инъекции, примерно в течение одной минуты. 6. После инъекции пациенту необходимо подвигаться. Препарат вводят по очереди в правую и левую ягодичные мышцы. Вскрытую ампулу необходимо использовать немедленно.
Если пациент лежит на правом боку, расположите средний палец левой руки в точке А. Отставьте указательный палец от среднего так, чтобы он находился под линией подвздошного гребня (точка В). Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции. 3. Инструменты дезинфицируют обычным методом. Прежде чем ввести иглу, сдвиньте кожу примерно на 2 см для того, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи. 4. Расположите иглу вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава. 5. После инъекции медленно извлеките иглу и прижимайте пальцем участок кожи, прилегающий к месту инъекции, примерно в течение одной минуты. 6. После инъекции пациенту необходимо подвигаться. Препарат вводят по очереди в правую и левую ягодичные мышцы. Вскрытую ампулу необходимо использовать немедленно.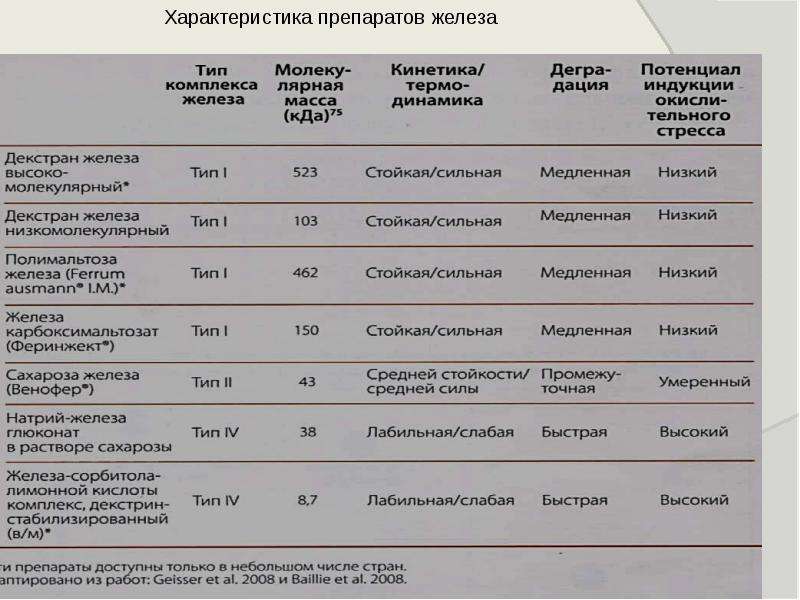
 Инфекционный гепатит.
С осторожностью: Бронхиальная астма, аллергическая экзема или другая атопическая аллергия. Хронический полиартрит. Сердечно-сосудистая недостаточность. Низкая способность связывать железо и/или дефицит фолиевой кислоты.
Детский возраст до 4-х месяцев. Заболевания печени.
Острые и хронические инфекционные заболевания. Применение при беременности и в период грудного вскармливания:
Препарат противопоказан в первом триместре беременности.
Во втором и третьем триместрах и в период грудного вскармливания применение препарата возможно только в случае, если предполагаемая польза для матери превышает потенциальный вред для плода или младенца.
Инфекционный гепатит.
С осторожностью: Бронхиальная астма, аллергическая экзема или другая атопическая аллергия. Хронический полиартрит. Сердечно-сосудистая недостаточность. Низкая способность связывать железо и/или дефицит фолиевой кислоты.
Детский возраст до 4-х месяцев. Заболевания печени.
Острые и хронические инфекционные заболевания. Применение при беременности и в период грудного вскармливания:
Препарат противопоказан в первом триместре беременности.
Во втором и третьем триместрах и в период грудного вскармливания применение препарата возможно только в случае, если предполагаемая польза для матери превышает потенциальный вред для плода или младенца.
 Железо, входящее в состав препарата, быстро восполняет недостаток этого элемента в организме (в частности, при железодефицитных анемиях), восстанавливает содержание гемоглобина. При лечении препаратом наблюдается постепенное уменьшение как клинических симптомов (слабость, утомляемость, головокружение, тахикардия, болезненность и сухость кожных покровов), так и лабораторных показателей дефицита железа. Фармакокинетика: После внутримышечного введения препарата железо быстро поступает в кровоток: 15% дозы — через 15 мин, 44% — через 30 мин. Биологический период полувыведения составляет 3-4 суток. Железо в комплексе с трансферрином переносится к клеткам организма, где используется для синтеза гемоглобина, миоглобина и некоторых ферментов. Комплекс гидроксида железа (III) с декстраном достаточно велик и поэтому не выводится через почки.
Железо, входящее в состав препарата, быстро восполняет недостаток этого элемента в организме (в частности, при железодефицитных анемиях), восстанавливает содержание гемоглобина. При лечении препаратом наблюдается постепенное уменьшение как клинических симптомов (слабость, утомляемость, головокружение, тахикардия, болезненность и сухость кожных покровов), так и лабораторных показателей дефицита железа. Фармакокинетика: После внутримышечного введения препарата железо быстро поступает в кровоток: 15% дозы — через 15 мин, 44% — через 30 мин. Биологический период полувыведения составляет 3-4 суток. Железо в комплексе с трансферрином переносится к клеткам организма, где используется для синтеза гемоглобина, миоглобина и некоторых ферментов. Комплекс гидроксида железа (III) с декстраном достаточно велик и поэтому не выводится через почки. Лечение передозировки следует проводить с применением хелатирующего средства для связывания железа или в соответствии со стандартами медицинской практики.
Лечение передозировки следует проводить с применением хелатирующего средства для связывания железа или в соответствии со стандартами медицинской практики. Препарат Феррум Лек предназначен только для внутримышечного введения. Вводимые парентерально препараты железа могут вызывать реакции гиперчувствительности, включая анафилактоидные реакции, которые могут быть потенциально опасными для жизни, поэтому должны быть доступны соответствующие средства для проведения сердечно-легочной реанимации. Реакции гиперчувствительности отмечались после предшествовавших неосложненных введений парентеральных препаратов железа. Риск развития анафилактоидных реакций повышен у пациентов с аллергией в анамнезе (в том числе лекарственной), у пациентов с тяжелой бронхиальной астмой в анамнезе, экземой или другими аллергическими проявлениями, а также у пациентов с иммунно-воспалительными заболеваниями (например, системная красная волчанка, ревматоидный артрит). У пациентов с нарушением функции печени применение парентерального железа должно осуществляться только после тщательной оценки соотношения польза/риск. Парентерального введения железа следует избегать у пациентов с нарушением функции печени, где перегрузка железом может явиться патогенетическим фактором развития нежелательных реакций (в частности поздней кожной порфирии).
Препарат Феррум Лек предназначен только для внутримышечного введения. Вводимые парентерально препараты железа могут вызывать реакции гиперчувствительности, включая анафилактоидные реакции, которые могут быть потенциально опасными для жизни, поэтому должны быть доступны соответствующие средства для проведения сердечно-легочной реанимации. Реакции гиперчувствительности отмечались после предшествовавших неосложненных введений парентеральных препаратов железа. Риск развития анафилактоидных реакций повышен у пациентов с аллергией в анамнезе (в том числе лекарственной), у пациентов с тяжелой бронхиальной астмой в анамнезе, экземой или другими аллергическими проявлениями, а также у пациентов с иммунно-воспалительными заболеваниями (например, системная красная волчанка, ревматоидный артрит). У пациентов с нарушением функции печени применение парентерального железа должно осуществляться только после тщательной оценки соотношения польза/риск. Парентерального введения железа следует избегать у пациентов с нарушением функции печени, где перегрузка железом может явиться патогенетическим фактором развития нежелательных реакций (в частности поздней кожной порфирии). Рекомендуется тщательный контроль концентрации железа. Внутримышечные инъекции больших доз карбогидратов железа в экспериментах на животных приводили к развитию саркомы у крыс, мышей, кроликов, и, возможно, хомяков, но не у морских свинок. Совокупная информация и независимая оценка показывают, что риск развития саркомы у человека минимален. Содержимое ампул препарата Феррум Лек не следует смешивать с другими препаратами. Лечение пероральными формами железосодержащих препаратов следует начинать не ранее, чем через 5 суток после последней инъекции препарата Феррум Лек. При неправильном хранении препарата возможно выпадение осадка, использование таких ампул недопустимо. После каждой инъекции препарата Феррум Лек за всеми пациентами следует наблюдать на предмет отсутствия нежелательных явлений в течение как минимум 30 минут.
При слишком быстром внутривенном введении возможно резкое снижение артериального давления. Препараты железа для парентерального введения следует применять с осторожностью при наличии острой или хронической инфекции. Пациентам с бактериемией рекомендуется прекратить применение препарата Феррум Лек. У пациентов с хронической инфекцией перед применением препарата следует провести оценку соотношения риска и пользы. Влияние на способность управлять транспортными средствами, механизмами: Данных о влиянии на способность управлять транспортными средствами или работать с другими механизмами не имеется. Однако некоторые нежелательные реакции (такие, как головокружение, спутанность сознания и прочие) могут оказывать негативное влияние на способность управлять транспортными средствами или работать с другими механизмами. Пациентам, у которых отмечаются данные нежелательные реакции, рекомендовано воздержаться от управления транспортными средствами или работы с другими механизмами до полного исчезновения данных симптомов.
Рекомендуется тщательный контроль концентрации железа. Внутримышечные инъекции больших доз карбогидратов железа в экспериментах на животных приводили к развитию саркомы у крыс, мышей, кроликов, и, возможно, хомяков, но не у морских свинок. Совокупная информация и независимая оценка показывают, что риск развития саркомы у человека минимален. Содержимое ампул препарата Феррум Лек не следует смешивать с другими препаратами. Лечение пероральными формами железосодержащих препаратов следует начинать не ранее, чем через 5 суток после последней инъекции препарата Феррум Лек. При неправильном хранении препарата возможно выпадение осадка, использование таких ампул недопустимо. После каждой инъекции препарата Феррум Лек за всеми пациентами следует наблюдать на предмет отсутствия нежелательных явлений в течение как минимум 30 минут.
При слишком быстром внутривенном введении возможно резкое снижение артериального давления. Препараты железа для парентерального введения следует применять с осторожностью при наличии острой или хронической инфекции. Пациентам с бактериемией рекомендуется прекратить применение препарата Феррум Лек. У пациентов с хронической инфекцией перед применением препарата следует провести оценку соотношения риска и пользы. Влияние на способность управлять транспортными средствами, механизмами: Данных о влиянии на способность управлять транспортными средствами или работать с другими механизмами не имеется. Однако некоторые нежелательные реакции (такие, как головокружение, спутанность сознания и прочие) могут оказывать негативное влияние на способность управлять транспортными средствами или работать с другими механизмами. Пациентам, у которых отмечаются данные нежелательные реакции, рекомендовано воздержаться от управления транспортными средствами или работы с другими механизмами до полного исчезновения данных симптомов.